Область техники, к которой относится изобретение
Настоящее изобретение относится к применению форболовых эфиров для лечения цитопении. В частности, настоящее изобретение относится к применению форболовых эфиров, таких как 10-О-тетрадеканоилфорбол-13-ацетат (ТФА) или форбол-12-миристат (ФМА), и Г-КСФ в лечении и уменьшении нейтропении и тромбоцитопении у пациентов с неопластическим заболеванием. Настоящее изобретение также относится к применению форболовых эфиров, таких как ТФА, и эритропоэтина (ЭПО) для лечения анемии у пациентов.
Предшествующий уровень техники
Растения исторически применяются для многих медицинских целей. Всемирная организация здравоохранения (ВОЗ) установила, что 4 миллиарда людей, 80% от мирового населения, в настоящее время применяют лекарственные препараты растительного происхождения для некоторых видов первичной медицинской помощи (Информационный бюллетень ВОЗ №134, декабрь 2008). Однако трудно выделить специфическое соединение, обеспечивающее медицинский эффект, и воспроизвести его в коммерческом масштабе. Кроме того, хотя из растения можно выделить активные соединения, другие части растения, такие как минералы, витамины, эфирные масла, гликозиды, алкалоиды, биофлаваноиды и другие вещества, могут также принимать участие в функционировании активного ингредиента или обеспечении медицинского эффекта, известного для растения, что затрудняет применение, очистку или коммерциализацию фармацевтических агентов на основе растений.
Форбол представляет собой натуральное органическое соединение растительного происхождения, относящееся к тиглиановому семейству дитерпенов. Он был впервые выделен в 1934 как продукт гидролиза кротонового масла из семян Croton tiglium (Кротона слабительного), лиственного растения семейства Euphorbiaceae (Молочайные), происходящего из Юго-Восточной Азии. Разнообразные сложные эфиры форбола обладают важными биологическими свойствами, в том числе сообщалось, что они способны имитировать свойства диацилглицеринов и активировать протеинкиназу С (PKC); и модулировать нисходящие сигнальные пути клетки, включая пути с участием митоген-активируемой протеинкиназы (MAPK). Помимо этого считается, что сложные эфиры форбола связывают химерины, а именно активатор Ras RasGRP и везикулярный праймер, белок Munc-13 (Brose N, Rosenmund C., J Cell Sci; 115: 4399-411 (2002)). Некоторые сложные эфиры форбола также индуцируют ядерный каппа-фактор В (NF-кВ). Наиболее примечательным физиологическим свойством сложных эфиров форбола является то, что они, как сообщалось, способны выступать в качестве активаторов развития опухолей (Blumberg, 1988; Goel, G et al., Int. Journal of Toxicology 26, 279-288 (2007)).
12-O-тетрадеканоилфорбол-13-ацетат (TФA), также называемый форбол-12-миристат-13-ацетатом (ФMA), представляет собой сложный эфир форбола, применяемый в моделях канцерогенеза в качестве индуктора дифференцировки и/или апоптоза в многочисленных линиях клеток и в зародышевых клетках. Также сообщалось, что TФA вызывает увеличение количества лейкоцитов и нейтрофилов в кровяном русле у пациентов со снижением функции костного мозга после химиотерапии (Han Z.Т. et al. Proc. Natl. Acad. Sci. 95, 5363-5365 (1998)). Однако с учетом многообразных факторов, включая раздражение при контакте с кожей и проблемы возможной токсичности, TФA не был рекомендован в качестве эффективного адъюванта для химиотерапии. Действительно, поскольку форболовые эфиры играют ключевую роль в активации протеинкиназы С, которая запускает различные клеточные ответы, приводящие к воспалительному ответу и развитию опухолей (Goel et al., Int. Journal of Toxicology 26, 279-288 (2007)); то форболовые эфиры, как правило, исключались из возможных кандидатов для лечения новообразований, включая рак.
Рак является одной из основных причин смерти в мире, составляя 7,67 миллионов случаев смерти (примерно 13% от всех случаев смерти) в 2008 (GLOBOCAN 2008 (IARC) ( Section of Cancer Information (8/12/2011)). В 2008 во всем мире было диагностировано 12,662,600 новых случаев рака (2008 (GLOBOCAN 2008 (IARC). Только в США в 2011 году было выявлено 1,596,670 новых случаев рака (Cancer Facts & Figures – 2011, American Cancer Society (ACS), Атланта, Джорджия).
Лечение рака обычно включает комбинацию хирургии, химиотерапии, гормональной терапии и/или радиотерапии для удаления неопластических клеток у пациента. Однако современные средства лечения новообразований имеют ряд недостатков, включая недостаточную активность, и непереносимые побочные эффекты. Операция, например, может быть противопоказана из-за состояния здоровья пациента. К тому же бывает трудно обозначить точные границы опухоли, что приводит к тому, что часть неопластической ткани остается не удаленной, что обуславливает повышенный риск рецидива заболевания.
Как правило, средства химиотерапии убивают клетки, которые быстро делятся, что является одним из главных свойств большинства раковых клеток. Однако они также повреждают нормальные клетки, которые делятся быстро, такие как клетки костного мозга, пищеварительного тракта и волосяных фолликулов. Они часто оказывают значительные побочные эффекты, включая сильную тошноту, снижение функции костного мозга и иммуносупрессию.
Ионизирующее облучение действует за счет повреждения ДНК облучаемой ткани. Однако, хотя и будучи направленным, оно повреждает нормальные клетки так же, как и новообразования, и может вызывать такие побочные эффекты, как анемия, тошнота и рвота, нарушение аппетита, потеря массы тела, запор, диарея, выпадение волос и бесплодие.
Для многих пациентов токсические побочные эффекты современных лечебных средств нарушают их качество жизни до такой степени, что они просто прекращают принимать медикаменты. Для других пациентов режим лечения является настолько сложным и неудобным, что соблюдение режима лечения ограничивается. У других пациентов вначале наблюдаются отличные результаты, но затем происходят рецидивы, несмотря на полное соблюдение режима лечения. Имеется явная потребность в новых и более эффективных средствах лечения новообразований и контроля побочных эффектов современных способов лечения новообразований, включая рак.
Сущность изобретения
Настоящее изобретение относится к композициям, включающим форболовые эфиры, и к способам применения форболовых эфиров формулы I в комбинации с Г-КСФ. Композиции и способы, описанные в настоящей заявке, эффективны в лечении и снижении продолжительности нейтропении и тромбоцитопении у пациентов с неопластическими заболеваниями.
В одном варианте осуществления настоящее изобретение относится к способу лечения цитопении, включающему введение млекопитающему субъекту, нуждающемуся в этом, форболового эфира формулы I (как описано в настоящей заявке), его фармацевтически приемлемой соли, изомера, энантиомера, сольвата, гидрата, полиморфа или пролекарства, где R1 и R2 выбраны из группы, состоящей из водорода, гидроксила, 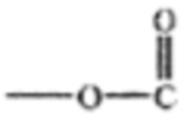 - алкила,
- алкила, 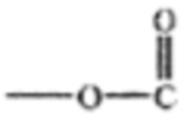 - низшего алкенила,
- низшего алкенила, 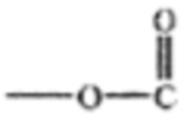 - фенила,
- фенила,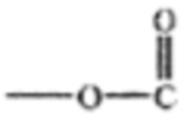 - бензила и их замещенных производных, R3 выбран из водорода или
- бензила и их замещенных производных, R3 выбран из водорода или 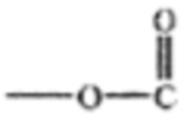 - низшего алкила и его замещенных производных, в комбинации с гранулоцитарным колониестимулирующим фактором (Г-КСФ).
- низшего алкила и его замещенных производных, в комбинации с гранулоцитарным колониестимулирующим фактором (Г-КСФ).
В частном варианте осуществления настоящее изобретение относится к способу лечения нейтропении и/или тромбоцитопении, включающему введение млекопитающему субъекту, нуждающемуся в этом, комбинации форболового эфира формулы I, его фармацевтически приемлемой соли, изомера, энантиомера, сольвата, гидрата, полиморфа или пролекарства; в комбинации с гранулоцитарным колониестимулирующим фактором (Г-КСФ).
В другом варианте осуществления настоящее изобретение относится к способу лечения цитопении, включающему введение млекопитающему субъекту, нуждающемуся в этом, комбинации форболового эфира формулы I, его фармацевтически приемлемой соли, изомера, энантиомера, сольвата, гидрата, полиморфа или пролекарства; в комбинации с эритропоэтином (ЭПО).
В частном варианте осуществления настоящее изобретение относится к способу лечения анемии, включающему введение млекопитающему субъекту, нуждающемуся в этом, форболового эфира формулы I, его фармацевтически приемлемой соли, изомера, энантиомера, сольвата, гидрата, полиморфа или пролекарства; в комбинации с эритропоэтином (ЭПО).
В способах по настоящему изобретению R1 или R2 из формулы I представляет собой 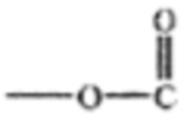 - С1-С15-алкил, второй из R1 и R2 представляет собой
- С1-С15-алкил, второй из R1 и R2 представляет собой 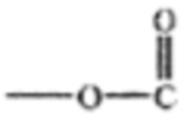 - низший алкил, а R3 из формулы I представляет собой водород.
- низший алкил, а R3 из формулы I представляет собой водород.
В частности, в способах по настоящему изобретению форболовым эфиром является форбол-13-бутират, форбол-12-деканоат, форбол-13-деканоат, форбол-12,13-диацетат, форбол-13,20-диацетат, форбол-12,13-дибензоат, форбол-12,13-дибутират, форбол-12,13-дидеканоат, форбол-12,13-дигексаноат, форбол-12,13-дипропионат, форбол-12-миристат, форбол-13-миристат, форбол-12,13,20-триацетат, 12-дезоксифорбол-13-ангелат, 12-дезоксифорбол-13-ангелат-20-ацетат, 12-дезоксифорбол-13-изобутират, 12-дезоксифорбол-13-изобутират-20-ацетат, 12-дезоксифорбол-13-фенилацетат, 12-дезоксифорбол-13-фенилацетат-20-ацетат, 12-дезоксифорбол-13-тетрадеканоат, форбол-12-тиглиат-13-деканоат, 12-дезоксифорбол-13-ацетат, форбол-12-ацетат, или форбол-13-ацетат.
В предпочтительном варианте осуществления форболовым эфиром является 12-О-тетрадеканоилфорбол-13-ацетат (ТФА).
Способы по настоящему изобретению могут дополнительно включать применение по меньшей мере одного вторичного или вспомогательного терапевтического агента.
В некоторых вариантах осуществления настоящего изобретения Г-КСФ применяют у указанного субъекта в координированном протоколе применения, одновременно, до или после применения указанного форболового эфира формулы I.
В некоторых вариантах осуществления настоящего изобретения ЭПО применяют у указанного субъекта в координированном протоколе применения, одновременно, до или после применения указанного форболового эфира формулы I.
Способы по настоящему изобретению включают применение форболового эфира формулы I в эффективном количестве, включающем примерно от 10 до 1500 мкг указанного форболового эфира формулы I каждый день или раз в два дня.
В некоторых вариантах осуществления способы по настоящему изобретению включают применение форболового эфира формулы I в эффективном количестве, включающем примерно от 150 до 500 мкг указанного форболового эфира или производного соединения формулы I каждый день или раз в два дня.
В предпочтительном варианте осуществления настоящего изобретения комбинация форболового эфира формулы I и Г-КСФ повышает абсолютное количество нейтрофилов (АКН) у млекопитающего субъекта до более 1500/мм3.
В другом предпочтительном варианте осуществления настоящего изобретения комбинация форболового эфира формулы I и Г-КСФ повышает уровень тромбоцитов у млекопитающего субъекта до более 100,000/мкл.
В одном предпочтительном варианте осуществления настоящего изобретения комбинация форболового эфира формулы I и ЭПО повышает результаты общего анализа крови (ОАК) по меньшей мере на 10%.
В другом предпочтительном варианте осуществления комбинация форболового эфира формулы I и ЭПО повышает уровень гемоглобина у млекопитающего субъекта до превышения нормального уровня гемоглобина.
В предпочтительном варианте осуществления способы по настоящему изобретению включают лечение или снижение цитопении, такой как нейтропения, тромбоцитопения и/или анемия, у индивидуума с острым миелоидным лейкозом (ОМЛ).
В другом варианте осуществления настоящее изобретение относится к композициям, содержащим форболовый эфир формулы I и Г-КСФ.
В предпочтительном варианте осуществления форболовый эфир формулы I присутствует в эффективном количестве, достаточном для лечения или уменьшения продолжительности цитопении, такой как нейтропения и/или тромбоцитопения.
В предпочтительном варианте осуществления композиции по настоящему изобретению содержат ТФА в качестве форболового эфира, а ТФА и Г-КСФ присутствуют в эффективном количестве для лечения или уменьшения продолжительности цитопении, такой как нейтропения и/или тромбоцитопения. В особо предпочтительном варианте осуществления эффективное количество может быть синергетически эффективным количеством для лечения или снижения продолжительности нейтропении и/или тромбоцитопении.
Настоящее изобретение также относится к композициям, содержащим форболовый эфир формулы I и ЭПО.
В предпочтительном варианте осуществления форболовый эфир формулы I присутствует в эффективном количестве, достаточном для лечения или снижения продолжительности цитопении, такой как анемия.
В предпочтительном варианте осуществления композиции по настоящему изобретению содержат ТФА в качестве форболового эфира, а ТФА и ЭПО присутствуют в эффективном количестве для лечения или уменьшения продолжительности цитопении, такой как анемия. В особо предпочтительном варианте осуществления эффективное количество может быть синергетически эффективным количеством для лечения или снижения продолжительности анемии.
В другом варианте осуществления нейтропения, тромбоцитопения и/или анемия связаны с лечением новообразования. Такие новообразования могут быть злокачественными или доброкачественными. В некоторых вариантах осуществления новообразования могут быть солидным или несолидным раком. В других вариантах осуществления новообразования могут быть рецидивами. В других вариантах осуществления новообразования могут быть резистентными.
Примеры новообразований включают злокачественные заболевания крови/заболевания костного мозга, включая, без ограничения, лейкоз, включая острый миелоидный лейкоз (ОМЛ), хронический миелоидный лейкоз (ХМЛ), бластный криз хронического миелоидного лейкоза, миелодисплазию и миелопролиферативный синдром; лимфому, включая ходжкинскую и неходжкинскую лимфому; подкожную аденокарциному; тератокарциному яичников, рак печени, рак молочной железы, злокачественные опухоли костей, рак легких, рак поджелудочной железы, немелкоклеточный рак легких и рак простаты, но не ограничиваются ими. Другие неопластические состояния, подходящие для лечения с применением способов и композиций, как описано в настоящей заявке, включают другие онкологические заболевания и состояния, включая солидные опухоли различных типов.
В другом варианте осуществления форболовые эфиры и производные форболовых эфиров, как описано в настоящей заявке, можно применять для модулирования сигнального каскада в клетке. Такое модулирование может иметь многообразные последствия; например, в некоторых вариантах осуществления применение композиций, содержащих форболовые эфиры и производные форболовых эфиров, может увеличивать у млекопитающих субъектов количество лейкоцитов. В другом варианте осуществления композиции, содержащие форболовые эфиры и/или производные форболовых эфиров, могут изменять у млекопитающих субъектов высвобождение цитокинов Th1. Еще в одном варианте осуществления композиции, содержащие форболовые эфиры и/или производные форболовых эфиров, у млекопитающих субъектов могут влиять на высвобождение интерлейкина 2 (ИЛ-2). Еще в одном варианте осуществления композиции, содержащие форболовые эфиры и/или производные форболовых эфиров, у млекопитающих субъектов могут влиять на высвобождение интерферона. В еще одном варианта осуществления композиции, содержащие форболовые эфиры и/или производные форболовых эфиров, у млекопитающих субъектов могут изменять степень фосфорилирования ERK (внеклеточно регулируемой киназы).
Изобретение достигает вышеизложенных целей, решает дополнительные задачи и имеет дополнительные преимущества, предлагая новые и неожиданно эффективные способы и композиции, приемлемые для лечения или снижения продолжительности цитопении, такой как нейтропения, тромбоцитопения и анемия.
Описание чертежей
Патент или заявка содержит по меньшей мере один цветной чертеж. Копии этого патента или патентной заявки с цветным чертежом (чертежами) обеспечиваются Бюро по запросу и при оплате необходимой пошлины.
Фигура 1 иллюстрирует синергетический эффект, достигаемый комбинацией ТФА и Г-КСФ. ТФА стимулирует дифференцировку стволовых клеток на ранней стадии развития в более зрелые стволовые клетки, в то время как Г-КСФ стимулирует более зрелые стволовые клетки. ТФА также стимулирует более зрелые стволовые клетки. Нейтрофилы являются одним из типов гранулоцитов.
Фигура 2 показывает, что комбинация ТФА и Г-КСФ обеспечивает более сильные стимулирующие эффекты, чем ТФА или Г-КСФ по отдельности. Нижеприведенные сокращения используются на фигуре 2 и на протяжении настоящего описании по отношению к следующей терминологии.
Вышеизложенные и другие цели, характеристики, аспекты и преимущества настоящего изобретения станут очевидными из последующего подробного описания.
Подробное описание изобретения
Определения
Для удобства перед дополнительным описанием настоящего изобретения здесь собраны некоторые термины, применяемые в описании, примерах и формуле изобретения. Эти определения нужно рассматривать в свете остального описания и понимать, как принято для специалистов в данной области техники. Если не указано иное, все технические и научные термины, используемые в настоящей заявке, имеют то же самое значения, как понятно для рядового специалиста в данной области техники.
«Г-КСФ» или «ГКСФ» известен как гранулоцитарный колониестимулирующий фактор или колониестимулирующий фактор 3 («КСФ3»), и эти обозначения могут применяться в настоящей заявке взаимозаменяемо. «Г-КСФ», «ГКСФ» или «КСФ3» является гликопротеином, который стимулирует костный мозг к выработке гранулоцитов и стволовых клеток, и к высвобождению их в кровоток.
«ЭПО» известен как эритропоэтин, который является гликопротеиновым гормоном, контролирующим эритропоэз, или продукцию эритроцитов.
«Терапия первой линии» в настоящей заявке означает первую фазу лечения заболевания, как правило, рака. Например, целью терапии первой линии острого миелоидного лейкоза является достижение полной ремиссии в костном мозге и возвращение к нормальному количеству клеток крови.
«Консолидирующая терапия» в настоящей заявке означает лечение, назначаемое после того, как рак исчезает после терапии первой линии, и проводимое для профилактики рецидива рака. Консолидирующую терапию применяют для уничтожения любых раковых клеток, которые могут оставаться в организме.
«Цитопения» в настоящей заявке означает снижение числа клеток крови, и включает низкое количество эритроцитов (анемию), низкое количество лейкоцитов (лейкопению или нейтропению), низкое количество тромбоцитов (тромбоцитопению), или их комбинацию (панцитопению), и низкое количество гранулоцитов (гранулоцитопению).
Количество эритроцитов (RBC) является числом эритроцитов, способных переносить гемоглобин в мм3 крови. Нормальный уровень RBC для мужчин составляет от 4,5 до 6 млн./мм3, а для женщин - от 4 до 5,5 млн./мм3. См. cytopenia-cancertype.blogspot.ca/2007/12/diagnosis-of-cytopenia.html.
Количество лейкоцитов (WBC) является общим количеством всех пяти типов лейкоцитов. Нормальное число WBC для мужчин и женщин составляет от 5,000 до 10,000 на мм3 крови. См. cytopenia-cancertype.blogspot.ca/2007/12/diagnosis-of-cytopenia.html.
Термины единственного числа применяются в настоящей заявке для обозначения одного или более одного (т.е. по меньшей мере одного) грамматического объекта. В качестве примера, «элемент» означает один элемент или более одного элемента.
Термины «содержать» и «содержащий» применяются во включающем, открытом смысле, что означает, что могут быть включены дополнительные элементы.
Термин «состоящий по существу из» применяется для ограничения элементов теми, которые указаны, и теми, которые не оказывают материального влияния на основные и новые характеристики материалов или этапов.
Термин «включающий» означает «включающий, но не ограничивающийся». «Включающий» и «включающий, но не ограничивающийся» применяются взаимозаменяемо.
«Пациент», «субъект» или «хозяин» для лечения посредством предмета обсуждения может означать либо такое млекопитающее, как человек, либо млекопитающее, не являющееся человеком.
Термин «фармацевтически приемлемый носитель» является термином, применяемым в данной области техники, и означает фармацевтически приемлемый материал, композицию или носитель, такой как жидкость или твердый наполнитель, разбавитель, вспомогательное вещество, растворитель или инкапсулирующий материал. Такой носитель должен быть «приемлемым» в смысле совместимости с обсуждаемой композицией и её компонентами, и отсутствия время для пациента. Примеры включают связующие агенты, наполнители, любриканты, эмульгаторы, суспендирующие агенты, подсластители, ароматизаторы, консерванты, буферы, увлажняющие агенты, дезинтегранты, шипучие агенты и другие обычные вспомогательные вещества и добавки, но не ограничиваются ими.
Термин «лечение» является термином, признанным в данной области техники, и означает излечение, а также смягчение или уменьшение по меньшей мере одного симптома какого-либо состояния или заболевания.
Термин «терапевтический агент» или «лекарство» является термином, признанным в данной области техники, и означает любой химический компонент, который является биологически, физиологически или фармакологически активным веществом, действующим местно или системно у субъекта. Например, терапевтические агенты или лекарства описаны в «Merck Index», «Тhe Physicians' Desk Reference» («Настольный справочник врача», и «The Pharmacological Basis of Therapeutics» («Фармакологические основы лекарственных средств»).
Термин «эффективное количество» означает терапевтически эффективное, в однодозовой или многодозовой лекарственной форме. Эффективное количество является количеством, достаточным для обеспечения терапевтического эффекта у млекопитающего, включая человека. Например, эффективное количество может быть количеством, достаточным для измеряемого лечения или снижения/сокращения продолжительности нейтропении и/или тромбоцитопении у субъекта. Другим примером эффективного количества является количество, достаточное для измеряемого лечения или снижения/сокращения продолжительности анемии. Уровни дозировки или количества конкретного терапевтического агента или лекарства, используемого для обеспечения терапевтически эффективного количества, меняются в зависимости от факторов, включающих возраст, массу тела, пол, медицинское состояние млекопитающего/человека, и способ применения, но не ограничивающихся ими. Эффективные количества форболового эфира, или родственного или производного соединения формулы I (например, стандартная доза, включающая эффективную концентрацию/количество ТФА, или выбранной фармацевтическим приемлемой соли, изомера, энантиомера, сольвата, полиморфа и/или пролекарства ТФА), Г-КСФ или ЭПО могут быть легко определены рядовым специалистом в данной области техники, в зависимости от клинических и специфических для пациента факторов. Терапевтически эффективное количество в соответствии с настоящим изобретением может включать синергетически эффективное количество.
Цитопения традиционно классифицируется как цитопения, связанная с недостаточностью (например, пищевой или гормональной недостаточностью), иммуно-опосредованная, связанная с нарушением функции костного мозга, или идиопатическая цитопения. См. Valent, P., Hematology: 485-491 (2012), раскрытие которого включено посредством ссылки во всей полноте.
Диагноз цитопении у больного раком требует развернутого анализа крови (СВС) и идентификации каких-либо нарушений крови и костного мозга, таких как анемия, нейтропения или тромбоцитопения. См. cytopenia-cancertype.blogspot.ca/2007/12/diagnosis-of-cytopenia.html.
Агенты для химиотерапии оказывают побочное влияние на костномозговые клетки, и перед каждым лечением необходим развернутый анализ крови (СВС) Влияние на костный мозг является временным, и нормальная функция обычно восстанавливается за 4-10 дней, но лейкоциты имеют продолжительность жизни 1-3 дня; так что хотя число WBC в циркуляции остается неизменным, медленная продукция новых лейкоцитов создает период повышенного риска инфекции. См. cytopenia-cancertype.blogspot.ca/2007/12/diagnosis-of-cytopenia.html. Если продукция лейкоцитов не восстанавливается перед следующим лечением, лечение задерживают до тех пор, пока количество клеток не увеличится в достаточной степени. Зрелые эритроциты имеют относительно долгую жизнь (120 суток), продукция клеток обычно возобновляется до того, как развиваются симптомы недостаточности.
Анемия является недостаточностью эритроцитов, при которой снижается количество кислорода, поступающего к клеткам в организме, так что нарушается функция всех тканей и органов. Анемия вызывает симптомы, включающие выраженную утомляемость, спутанность сознания, головокружение, дурноту, потерю сосредоточенности, бледность (бледную кожу, ногтевые ложа, десны, слизистую оболочку век), частое сердцебиение (тахикардию), и частое дыхание (одышку). См. cytopenia-cancertype.blogspot.ca/2007/12/cytopenia-signs-and-symptoms.html. Индивидуумам, страдающим анемией, рекомендуют покой и потребление пищи, богатой железом, а лечение может включать медикаменты, способствующие восстановлению запаса эритроцитов (такие, как эритропоэтин), и переливание консервированных эритроцитов. См. cytopenia-cancertype.blogspot.ca/2007/12/cytopenia-treatment.html. Управление контроля продуктов питания и лекарственных средств (FDA) в Марте 2007 издало предупреждение об этих медикаментах в ответ на исследования, показавшие, что они могут повышать риск образования тромбов, инсульта и сердечных приступов у некоторых пациентов (например, пациентов с заболеванием почек).
Нейтропения является недостаточностью лейкоцитов с симптомами, включающими редкие и/или тяжелые бактериальные, вирусные и/или грибковые инфекции; жар, и язвы полости рта и глотки. См. cytopenia-cancertype.blogspot.ca/2007/12/cytopenia-signs-and-symptoms.html. Колониестимулирующий фактор (КСФ) может быть рекомендован для ускорения развития лейкоцитов и сокращения периода восприимчивости к инфекции. См. cytopenia-cancertype.blogspot.ca/2007/12/cytopenia-treatment.html.
Тромбоцитопения является недостаточностью тромбоцитов, которая вызывает у пациентов склонность к образованию гематом и кровоточивости, и характеризуется симптомами, включающими кровоизлияния в слизистых оболочках, выстилающих полость рта, носа, кишечника и влагалища. См. cytopenia-cancertype.blogspot.ca/2007/12/cytopenia-signs-and-symptoms.html. Она характеризуется снижением числа тромбоцитов ниже нормы от 15,000 до 300,000 на мл, и риском повышенной кровоточивости, обычно достигающим пика спустя 10-14 дней после проведения курса химиотерапии. Устойчивое снижение числа тромбоцитов можно лечить переливанием тромбоцитов. См. cytopenia-cancertype.blogspot.ca/2007/12/cytopenia-treatment.html.
Факторы роста (такие, как эритропоэтин альфа (Procrit®, Epogen®), Г-КСФ (гранулоцитарный колониестимулирующий фактор, например, филграстим (Neupogen®), и ГМ-КСФ (гранулоцитарно-макрофагальный колониестимулирующий фактор) являются синтетическими вариантами веществ, участвующих в стимуляции продукции эритроцитов и лейкоцитов; однако соблюдается осторожность при назначении этих медикаментов пациентам с опухолями, связанными с костным мозгом, поскольку факторы роста могут стимулировать рост злокачественных клеток. См. cytopenia-cancertype.blogspot.ca/2007/12/cytopenia-treatment.html. Побочные эффекты, связанные с этими факторами роста, включают жар, утомляемость, головокружение, диарею, тошноту, рвоту, слабость и парестезию (ощущение покалывания) (для эритропоэтина альфа) и боль в костях (для Г-КСФ).
И химиотерапия, и радиотерапия снижает число кроветворных стволовых клеток у онкологических больных, но агенты для химиотерапии оказывают большее побочное влияние, поскольку они подавляют функцию костного мозга несколькими путями, и степень повреждения связана с конкретным лекарством (лекарствами) и применяемой дозой. См. cytopenia-cancertype.blogspot.ca/2007/12/cytopenia-causes-and-risk-factors.html.
Недостаточности типов клеток крови могут быть вызваны агентами для химиотерапии, которые повреждают кроветворные стволовые клетки, подавляют выработку в почках эритропоэтина (гормона, стимулирующего продукцию клеток крови), и стимулируют разрушение эритроцитов (гемолиз) за счет индукции иммунного ответа, который заставляет организм ошибочно идентифицировать эритроциты как чужеродные тела и разрушать их. См. cytopenia-cancertype.blogspot.ca/2007/12/cytopenia-causes-and-risk-factors.html. Однако анемия, тромбоцитопения и нейтропения, вызванные лечением рака, обычно проходят, когда курс лечения завершается. См. cytopenia-cancertype.blogspot.ca/2007/12/cytopenia-treatment.html.
Злокачественные опухоли могут тоже вызывать анемию и другие цитопении, когда они напрямую поражают костный мозг и подавляют его функцию. См. cytopenia-cancertype.blogspot.ca/2007/12/cytopenia-causes-and-risk-factors.html.
Композиции и способы, описанные в настоящей заявке, можно применять для лечения и/или сокращения продолжительности анемии, нейтропении и/или тромбоцитопении у млекопитающих субъектов, включая людей. В некоторых вариантах осуществления млекопитающим субъектом является человек, страдающий неопластическим заболеванием.
Композиции и способы применения форболового эфира формулы I, приведенные ниже:
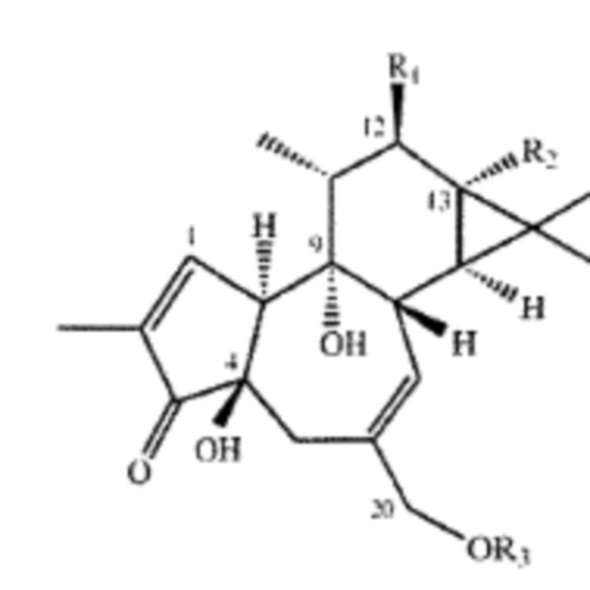 Формула I,
Формула I,
где R1 и R2 могут быть водородом; гидроксилом; 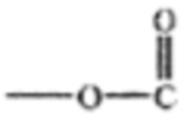 - алкилом, где алкильная группа содержит от 1 до 15 атомов углерода;
- алкилом, где алкильная группа содержит от 1 до 15 атомов углерода; 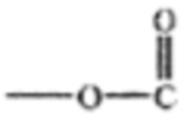 - низшим алкенилом, где низшая алкенильная группа содержит от 1 до 7 атомов углерода;
- низшим алкенилом, где низшая алкенильная группа содержит от 1 до 7 атомов углерода; 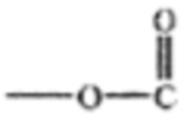 - фенилом;
- фенилом;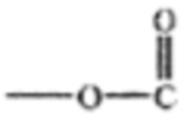 - бензилом; и их замещенными производными. R3 может быть водородом или
- бензилом; и их замещенными производными. R3 может быть водородом или 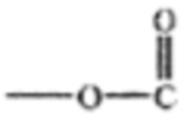 - низшим алкилом и их замещенными производными; в комбинации с Г-КСФ для лечения цитопении, включающей нейтропению и/или тромбоцитопению, но не ограничивающейся ими. Способы и композиции по настоящему изобретению дополнительно включают любые фармацевтические соли, энантиомеры, изомеры, полиморфы, пролекарства, гидраты и сольваты композиций формулы I; в комбинации с Г-КСФ для лечения нейтропении и/или тромбоцитопении. Например, комбинация форболового эфира формулы I с Г-КСФ также приемлема для снижения или сокращения продолжительности нейтропении и/или тромбоцитопении.
- низшим алкилом и их замещенными производными; в комбинации с Г-КСФ для лечения цитопении, включающей нейтропению и/или тромбоцитопению, но не ограничивающейся ими. Способы и композиции по настоящему изобретению дополнительно включают любые фармацевтические соли, энантиомеры, изомеры, полиморфы, пролекарства, гидраты и сольваты композиций формулы I; в комбинации с Г-КСФ для лечения нейтропении и/или тромбоцитопении. Например, комбинация форболового эфира формулы I с Г-КСФ также приемлема для снижения или сокращения продолжительности нейтропении и/или тромбоцитопении.
Композиции и способы применения форболового эфира формулы I, приведенного ниже:
 Формула I,
Формула I,
где R1 и R2 могут быть водородом; гидроксилом; 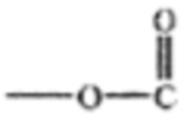 - алкилом, где алкильная группа содержит от 1 до 15 атомов углерода;
- алкилом, где алкильная группа содержит от 1 до 15 атомов углерода; 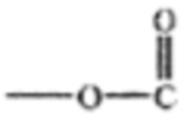 - низшим алкенилом, где низшая алкенильная группа содержит от 1 до 7 атомов углерода;
- низшим алкенилом, где низшая алкенильная группа содержит от 1 до 7 атомов углерода; 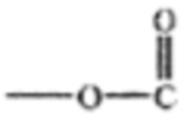 - фенилом;
- фенилом;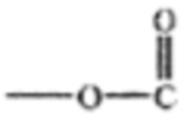 - бензилом; и их замещенными производными. R3 может быть водородом или
- бензилом; и их замещенными производными. R3 может быть водородом или 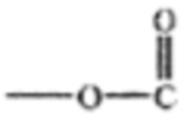 - низшим алкилом и их замещенными производными; в комбинации с ЭПО для лечения цитопении, включающей анемию, но не ограничивающейся ей. Способы и композиции по настоящему изобретению дополнительно включают любые фармацевтические соли, энантиомеры, изомеры, полиморфы, пролекарства, гидраты и сольваты композиций формулы I; в комбинации с ЭПО для лечения анемии. Например, комбинация форболового эфира формулы I с ЭПО также приемлема для снижения или сокращения продолжительности анемии.
- низшим алкилом и их замещенными производными; в комбинации с ЭПО для лечения цитопении, включающей анемию, но не ограничивающейся ей. Способы и композиции по настоящему изобретению дополнительно включают любые фармацевтические соли, энантиомеры, изомеры, полиморфы, пролекарства, гидраты и сольваты композиций формулы I; в комбинации с ЭПО для лечения анемии. Например, комбинация форболового эфира формулы I с ЭПО также приемлема для снижения или сокращения продолжительности анемии.
В некоторых вариантах осуществления по меньшей мере один из R1 или R2 является иным, чем водород, а R3 является водородом или 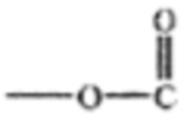 - низшим алкилом, и его замещенными производными. В другом варианте осуществления R1 или R2 представляет собой
- низшим алкилом, и его замещенными производными. В другом варианте осуществления R1 или R2 представляет собой 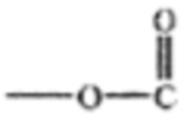 - С1-С15-алкил, второй из R1 и R2 представляет собой
- С1-С15-алкил, второй из R1 и R2 представляет собой 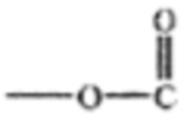 - низший алкил, где низший алкил содержит от 1 до 7 атомов углерода; а R3 представляет собой водород.
- низший алкил, где низший алкил содержит от 1 до 7 атомов углерода; а R3 представляет собой водород.
Алкильные, алкенильные, фенильные и бензильные группы в формулах в настоящей заявке могут быть не замещенными или замещенными галогенами, предпочтительно хлором, фтором или бромом; нитро; амино; и/или радикалами подобного типа.
Композиции и способы с их применением включают комбинацию форболового эфира формулы II, такого как 12-О-тетрадеканоилфорбол-13-ацетат (ТФА):
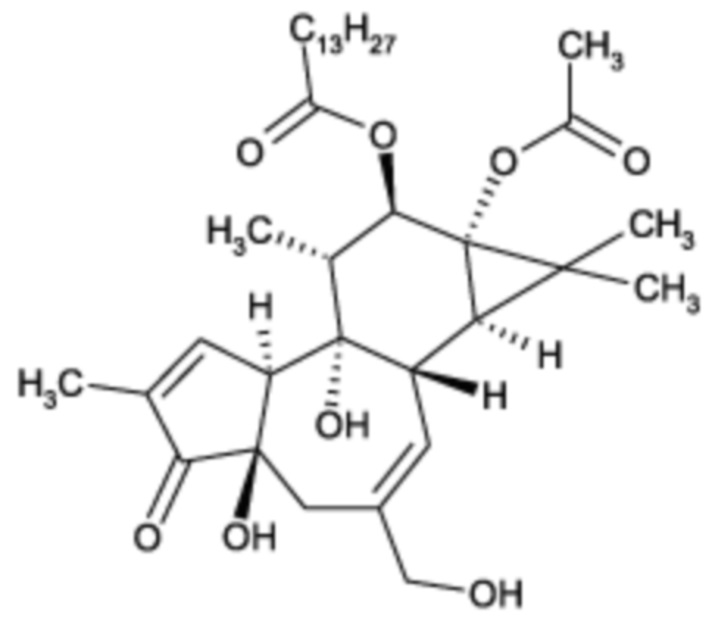 Формула II,
Формула II,
с Г-КСФ, для лечения цитопении, включая нейтропению и/или тромбоцитопению, но не ограничиваясь ими. Например, комбинация ТФА и Г-КСФ также приемлема для снижения или сокращения продолжительности нейтропении и/или тромбоцитопении.
Композиции и способы с их применением включают комбинацию форболового эфира формулы II, такого как 12-О-тетрадеканоилфорбол-13-ацетат (ТФА):
 Формула II,
Формула II,
с ЭПО, для лечения цитопении, включая анемию, но не ограничиваясь ей. Например, комбинация ТФА с ЭПО также приемлема для снижения или сокращения продолжительности анемии.
Приемлемые форболовые эфиры формулы I и родственные соединения и производные в пределах композиций и способов по настоящему изобретению включают другие фармацевтическим приемлемые активные соли указанных соединений, а также активные изомеры, энантиомеры, полиморфы, гликозилированные производные, сольваты, гидраты, и/или пролекарства указанных соединений, но не ограничиваются ими. Примерные формы форболовых эфиров для применения в композициях и способах по настоящему изобретению включают форбол-13-бутират, форбол-12-деканоат, форбол-13-деканоат, форбол-12,13-диацетат, форбол-13,20-диацетат, форбол-12,13-дибензоат, форбол-12,13-дибутират, форбол-12,13-дидеканоат, форбол-12,13-дигексаноат, форбол-12,13-дипропионат, форбол-12-миристат, форбол-13-миристат, форбол-12-миристат-13-ацетат (также известный как ТФА или ФМА), форбол-12,13,20-триацетат, 12-дезоксифорбол-13-ангелат, 12-дезоксифорбол-13-ангелат-20-ацетат, 12-дезоксифорбол-13-изобутират, 12-дезоксифорбол-13-изобутират-20-ацетат, 12-дезоксифорбол-13-фенилацетат, 12-дезоксифорбол-13-фенилацетат-20-ацетат, 12-дезоксифорбол-13-тетрадеканоат, форбол-12-тиглиат-13-деканоат, 12-дезоксифорбол-13-ацетат, форбол-12-ацетат, и форбол-13-ацетат, но не ограничиваются ими.
Широкий ряд млекопитающих субъектов, включая человеческих индивидуумов, пригоден для лечения с применением композиций и способов по настоящему изобретению. Эти субъекты включают, без ограничения, индивидуумов, страдающих заболеваниями или состояниями, включая неопластические заболевания, побочные эффекты химиотерапии, побочные эффекты радиотерапии, гипертрофию простаты, недержание мочи, миастению гравис, и заболевание почек, но не ограничиваясь ими.
Млекопитающие субъекты, приемлемые для лечения форболовыми эфирами формулы I, или производными форболовых эфиров формулы I, в частности ТФА, в комбинации с Г-КСФ или ЭПО, в соответствии со способами по настоящему изобретению, включают субъектов, страдающих анемией, нейтропенией и/или тромобоцитопенией. Такие субъекты, подходящие для лечения форболовыми эфирами формулы I, в частности, ТФА, в комбинации с Г-КСФ или ЭПО, включают субъектов, страдающих симптомами заболеваний или расстройств, включая неопластические заболевания или эффекты, вызванные лечением неопластических заболеваний, но не ограничиваясь ими.
Дополнительные млекопитающие субъекты, включая людей, приемлемые для лечения композициями и способами, как описано в настоящей заявке, в частности, ТФА, в соответствии со способами по настоящему изобретению, включают субъектов или индивидуумов с заболеваниями или состояниями, связанными с анемией, включая анемию, связанную с недостаточностью или заболеванием почек; анемию, связанную с беременностью; анемию, связанную с плохим питанием; пернициозную анемию; серповидно-клеточную анемию; талассемию; алкоголизм; анемию, ассоциированную с заболеваниями костного мозга (такую, как при лейкозе или лимфоме); апластическую анемию (при вирусных инфекциях); анемию, вызванную приемом медикаментов (таких, как медикаменты для лечения рака, ВИЧ, судорог, подавляющие отторжение трансплантата, для лечения малярии, антибиотики, противогрибковые средства и антигистаминные средства); гемолитическую анемию; анемию, связанную с заболеваниями щитовидной железы; анемию, связанную с заболеваниями печени; и с аутоиммунным заболеванием (таким, как системная красная волчанка); но не ограничиваясь ими.
Дополнительные млекопитающие субъекты, включая людей, приемлемые для лечения композициями и способами, как описано в настоящей заявке, в частности, ТФА, в соответствии со способами по настоящему изобретению, включают субъектов или индивидуумов с заболеваниями или состояниями, связанными с нейтропенией, включая врожденную нейтропению (такую, как синдром Костмана), циклическую нейтропению, идиопатическую нейтропению, аутоиммунную нейтропению, и медикаментозную нейтропению (такую, как при приеме противораковых средств), но не ограничиваясь ими.
Дополнительные млекопитающие субъекты, включая людей, приемлемые для лечения композициями и способами, как описано в настоящей заявке, в частности, ТФА, в соответствии со способами по настоящему изобретению, включают субъектов или индивидуумов с заболеваниями или состояниями, включая вирусные инфекции (такие как парвовирус, краснуха, свинка, ветрянка, гепатит С, вирус Эпштейна-Барра и ВИЧ), тяжелые инфекции или сепсис; тромбоцитопению, индуцированную лекарствами (такими, как противораковые средства, тиазид, сульфонамидные антибиотики, карбамазепин, дигоксин, хинин, хинидин, ацетаминофен, гепарин и рифампицин), трансфузионные реакции, ревматологические состояния (такие, как системная красная волчанка), и идиопатическую тромбоцитопеническую пурпуру, но не ограничиваясь ими. Эти и другие субъекты получают эффективное профилактическое и/или терапевтическое лечение, путем применения у субъекта эффективного количества форболового эфира формулы I или производного форболового эфира формулы I, достаточного для лечения и/или снижения продолжительности анемии, нейтропении и/или тромбоцитопении у млекопитающих субъектов с неопластическими заболеваниями.
Химиотерапия является лечением рака антинеопластическим лекарством или комбинацией таких лекарств. Химиотерапия действует путем нарушения воспроизведения быстро делящихся клеток, что является свойством, обычным для раковых клеток. Однако она не делает различия между здоровыми клетками, которые также быстро делятся, и раковыми клетками, и имеет ряд побочных эффектов, таких как нейтропения, анемия и тромбоцитопения, но не ограничиваясь ими.
Млекопитающие субъекты, подходящие для лечения форболовыми эфирами формулы I, в частности, ФМА, в соответствии со способами по настоящему изобретению, дополнительно включают млекопитающих субъектов, подвергающихся химиотерапии, но не ограничиваются ими.
Млекопитающие субъекты, страдающие неопластическим заболеванием, включают страдающих злокачественными неопластическими заболеваниями, такими как солидные и не-солидные злокачественные опухоли. Не-солидные злокачественные опухоли могут включать гематологические онкозаболевания/заболевания костного мозга, включая лейкоз, в т.ч. острый миелоидный лейкоз (ОМЛ), хронический миелоидный лейкоз (ХМЛ), бластный криз хронического миелоидного лейкоза, миелодисплазию, миелопролиферативный синдром, но не ограничиваясь ими. Солидные злокачественные опухоли могут включать лимфому, в т.ч. ходжкинскую и неходжкинскую лимфому, подкожную аденокарциному, тератокарциному яичников, рак легкого, рак кости, рак молочной железы, рак печени, рак поджелудочной железы, рак полости рта, немелкоклеточный рак легкого и рак простаты, но не ограничиваясь ими.
Терапевтически приемлемые способы и композиции по настоящему изобретению эффективно применяют форболовый эфир формулы I в различных формах, как упоминалось выше, фармацевтически приемлемые соли указанных соединений, а также активные изомеры, энантиомеры, полиморфы, сольваты, гидраты, пролекарства, и/или их комбинации. ТФА из формулы II применяют в качестве иллюстративного варианта осуществления изобретения в примерах, приведенных ниже.
В дополнительных аспектах настоящего изобретения обеспечиваются комбинированные композиции и способы, которые применяют эффективное количество форболового эфира формулы I в комбинации с одним или несколькими вторичными или вспомогательными активными агентами, которые комбинированно содержатся в композиции или согласованно применяются с соединением форболового эфира формулы I для получения эффективного ответа у субъекта.
Форболовый эфир формулы I или производное соединение форболового эфира формулы I применяют в комбинации с Г-КСФ. В частности, Г-КСФ применяют в комбинации с форболовым эфиром, например, ТФА.
Форболовый эфир формулы I или производное соединение форболового эфира формулы I применяют в комбинации с ЭПО. В частности, ЭПО применяют в комбинации с ТФА.
Форболовый эфир формулы I или производное соединение форболового эфира формулы I применяют в комбинации с Г-КСФ. В частности, Г-КСФ применяют в комбинации с ТФА.
Композиции, как описано в настоящей заявке, включают Г-КСФ и форболовый эфир формулы I или производное форболового эфира формулы I, включая их фармацевтически приемлемые соли, энантиомеры, изомеры, полиморфы, пролекарства, гидраты и сольваты, в эффективном количестве для лечения или снижения продолжительности нейтропении и/или тромбоцитопении.
Композиции, как описано в настоящей заявке, включают ЭПО и форболовый эфир формулы I или производное форболового эфира формулы I, включая их фармацевтически приемлемые соли, энантиомеры, изомеры, полиморфы, пролекарства, гидраты и сольваты, в эффективном количестве для лечения или снижения продолжительности анемии.
Композиции по настоящему изобретению содержат Г-КСФ и форболовый эфир формулы I или производное форболового эфира формулы I, включая их фармацевтически приемлемые соли, энантиомеры, изомеры, полиморфы, пролекарства, гидраты и сольваты, в синергетически эффективном количестве или синергетической комбинации, эффективной для лечения или снижения продолжительности нейтропении и/или тромбоцитопении. Композиции по настоящему изобретению являются синергетически эффективными в лечении или снижении продолжительности нейтропении и/или тромбоцитопении у человека и других млекопитающих субъектов с неопластическим заболеванием. «Синергетически эффективное количество», как применяется к композициям по настоящему изобретению, содержащим Г-КСФ и форболовый эфир формулы I или производное форболового эфира формулы I, включая их фармацевтически приемлемые соли, энантиомеры, изомеры, полиморфы, пролекарства, гидраты и сольваты, эффективно для сокращения продолжительности нейтропении и/или тромбоцитопении, которое эффективно для лечения или уменьшения продолжительности нейтропении и/или тромбоцитопении. Эффект, обеспечиваемый комбинацией по настоящему изобретению, приводит к большему ответу, чем Г-КСФ или форболовый эфир формулы I или производное форболового эфира формулы I, по отдельности или в сумме их индивидуальных эффектов.
Синергетически эффективное количество форболового эфира формулы I (такого, как ТФА), с Г-КСФ, или синергетически эффективное количество комбинации форболового эфира формулы I (такого, как ТФА) с ЭПО, можно применять у млекопитающего в виде единственной дозы или множества доз, одновременно или последовательно, в комбинированном составе или в отдельных составах, с одним или несколькими вторичными агентами, или с одним или несколькими вспомогательными терапевтическими агентами; посредством перорального применения (такого, как с капсулами, в жидкой форме, с таблетками, и т.д.), парентерального применения (такого, как путем парентеральной инъекции), или посредством любых других способов, известных в области техники, приемлемых для применения лекарств у млекопитающих.
Композиции по настоящему изобретению содержат ЭПО и форболовый эфир формулы I или производное форболового эфира формулы I, включая их фармацевтически приемлемые соли, энантиомеры, изомеры, полиморфы, пролекарства, гидраты и сольваты, в синергетически эффективном количестве или синергетической комбинации, эффективных для лечения или снижения продолжительности анемии. В частности, композиции по настоящему изобретению являются синергетически эффективными в лечении или снижении продолжительности анемии у людей или других млекопитающих субъектов с неопластическим заболеванием.
Композиции по настоящему изобретению содержат эффективное количество или лекарственную форму форболового эфира формулы I или производного форболового эфира формулы I, и Г-КСФ, которое может оставлять композицию с одним или несколькими фармацевтически приемлемыми носителями, вспомогательными веществами, растворителями, эмульгаторами, стабилизаторами, консервантами, буферами, и/или другими добавками, которые могут повышать стабильность, доставку, абсорбцию, время полужизни, эффективность, фармакокинетику, и/или фармакодинамику, снижать побочные эффекты, или обеспечивать другие преимущества для фармацевтического применения.
Эффективность композиций и способов по настоящему изобретению может быть продемонстрирована посредством снижения продолжительности анемии, нейтропении и/или тромбоцитопении.
Композиции по настоящему изобретению могут координированным образом применяться (одновременно или последовательно, в комбинированных или отдельных составах), с одним или несколькими вторичными агентами для лечения рака, или другими указанными или вспомогательными терапевтическими агентами, включая доксорубицин, витамин Д3, цитарабин, цитозин арабинозид, даунорубицин, циклофосфамид, гемтузумаб озогамицин, идарубицин, меркаптопурин, митоксантрон, тиогуанид, альдеслейкин, аспарагиназу, карбоплатин, этопозида фосфат, флударабин, метотрексат, этопозид, дексаметазон, и холина магния трисалицилат, но не ограничиваясь ими.
В способах и композициях по настоящему изобретению форболовый эфир(ы) формулы I (такой, как ТФА), как раскрыто в настоящей заявке, эффективно объединяют в композиции или применяют с Г-КСФ для лечения нейтропении, тромбоцитопении и/или связанных с ними заболеваний. В примерных вариантах осуществления с целью иллюстрации показано, что ТФА является эффективным агентом в фармацевтических композициях и терапевтических способах, в комбинации с Г-КСФ. В настоящем описании также обеспечены дополнительные фармацевтически приемлемые форболовые эфиры (такие, как ТФА) в форме натурального или синтетического соединения, включая комплексы, производные, соли, сольваты, изомеры, энантиомеры, полиморфы, и пролекарства соединений, раскрытые в настоящей заявке, и их комбинации, которые являются эффективными в качестве терапевтических агентов в способах и композициях по настоящему изобретению.
Композиции по настоящему изобретению могут включать форболовый эфир формулы I (такой, как ТФА), инкапсулированный для доставки, по отдельности или вместе с Г-КСФ или ЭПО, в микрокапсулах, микрочастицах или микросферах, приготовленных, например, посредством методик коацервации или межфазной полимеризации, например, гидроксиметилцеллюлозы или желатиновых микрокапсул и поли(метилметакрилатных) микрокапсул, соответственно; в коллоидных системах доставки лекарств (например, липосомах, альбуминовых микросферах, микроэмульсиях, наночастицах и нанокапсулах); или в макроэмульсиях.
Как упоминалось выше, в некоторых вариантах осуществления способов и композиций по настоящему изобретению могут применяться фармацевтически приемлемые соли, например, соли добавления кислот или оснований вышеуказанных форболовых эфиров формулы I и/или родственных или производных соединений (таких, как ТФА), Примеры фармацевтически приемлемых солей добавления включают соли добавления неорганических или органических кислот. Подходящие соли добавления кислот образуются из кислот, образующих нетоксичные соли, например, гидрохлоридные, гидробромидные, гидройодидные, сульфатные, гидросульфатные, нитратные, фосфатные, и гидрофосфатные соли. Дополнительные фармацевтически приемлемые соли включают соли металлов, такие как натриевые соли, калиевые соли, цезиевые соли и тому подобные; соли щелочноземельных металлов, такие как кальциевые соли, магниевые соли и тому подобные; соли органических аминов, такие как триэтиламиновые соли, пиридиновые соли, пиколиновые соли, этаноламиновые соли, триэтаноламиновые соли, дициклогексиламиновые соли, N,N’-дибензилэтилендиаминовые соли и тому подобные; соли органических кислот, такие как ацетатные, цитратные, лактатные, сукцинатные, тартратные, малеатные, фумаратные, миндалятные, ацетатные, дихлорацетатные, трифторацетатные, оксалатные и формиатные соли; сульфонаты, такие как метансульфонатные, бензолсульфонатные и п-толуолсульфонатные соли; и аминокислотные соли, такие как аргинатные, аспарагинатные, глутаматные, тартратные и глюконатные соли, но не ограничиваются ими. Подходящие основные соли образованы из оснований, формирующих нетоксичные соли например, соли алюминия, кальция, лития, магния, калия, натрия, цинка и диэтаноламина.
Другие подробные варианты осуществления, способы и композиции по настоящему изобретению применяют пролекарства форболовых эфиров формулы I. Пролекарства считаются ковалентно связанными носителями, высвобождающими активное исходное лекарство in vivo. Примеры пролекарств, приемлемых в настоящем изобретении, включают сложные эфиры или амиды с гидроксиалкилом или аминоалкилом в качестве заместителя, и они могут быть приготовлены путем реакции таких соединений, как описано выше, с ангидридами, такими как янтарный ангидрид.
Например, в современном режиме лечения ОМЛ, Г-КСФ является обычным адъювантным лекарством для снижения продолжительности нейтропении, но не тромбоцитопении, после химиотерапии. Настоящее изобретение указывает, что Г-КСФ в комбинации с форболовыми эфирами, такими как ТФА, может лечить или снижать продолжительность нейтропении и/или тромбоцитопении посредством двух следующих механизмов.
(1) ТФА стимулирует стволовые клетки на ранней стадии к дифференцировке в стволовые клетки на более поздней стадии. ТФА также стимулирует стволовые клетки на поздней стадии дифференцировки. Г-КСФ стимулирует только стволовые клетки на поздней стадии дифференцировки.
(2) ТФА стимулирует рост стромальных клеток, которые питают стволовые клетки.
Например, продолжительность нейтропении после высокодозовой химиотерапии и лечения Г-КСФ составляет, например, около 24±3 дня. Комбинация ТФА и Г-КСФ снижает продолжительность нейтропении примерно до 15±3 дней, или примерно на 25-50% от продолжительности нейтропении.
Комбинация ТФА и Г-КСФ может приводить примерно к 15-70% снижению продолжительности цитопении, включая нейтропению, тромбоцитопению и/или анемию, но не ограничиваясь ими, по сравнению с лечением Г-КСФ или ТФА по отдельности. Более предпочтительно, комбинация приводит примерно к 20-60% снижению продолжительности цитопении, и наиболее предпочтительно, комбинация приводит примерно к 25-50% снижению продолжительности цитопении.
Подобным образом, комбинация ТФА и ЭПО может приводить примерно к 15-70% снижению продолжительности цитопении, включая нейтропению, тромбоцитопению и/или анемию, но не ограничиваясь ими, по сравнению с лечением ЭПО или ТФА по отдельности. Более предпочтительно, комбинация приводит примерно к 20-60% снижению продолжительности цитопении, и наиболее предпочтительно, комбинация приводит примерно к 25-50% снижению продолжительности цитопении.
Изобретение достигает неожиданно синергетического эффекта путем стимуляции стволовых клеток на ранней стадии к дифференцировке в стволовые клетки на поздней стадии, как показано на фигуре 1.
Альтернативно, эффективность композиций и способов по настоящему изобретению может также быть продемонстрирована, например, путем повышения количества эритроцитов, лейкоцитов, нейтрофилов, и/или тромбоцитов до нормальных уровней. Например, эффективность композиций и способов по настоящему изобретению может быть продемонстрирована путем снижения нейтропении, анемии и/или тромбоцитопении.
Эффективность может быть продемонстрирована, например, с развернутым анализом крови (СВС). Анализы, проводимые при СВС, включают определение количества лейкоцитов (WBC), эритроцитов (RBC), ширину распределения эритроцитов по объему, гематокрит, и количество гемоглобина. Эффективное количество композиции по настоящему изобретению повышает измеренные уровни для развернутого анализа крови на 10%, 20%, 30%, 50% или больше, до 75-90%, или до 95% или больше. Эффективные количества также изменяют уровень белков крови индивидуума до оптимальной категории для каждого типа белка.
Нормальное количество эритроцитов (RBC) составляет от 4,0x1012/л до 5,2x1012/л (у женщин) и от 4,4x1012/л до 5,7x1012/л (у мужчин). Эффективность композиций и способов повышает уровни RBC до нормального диапазона.
Нормальный уровень гемоглобина, как правило, составляет от 130 г/л до 175 г/л. Как правило, нормальный уровень гемоглобина составляет от 140 г/л до 180 г/л у мужчин, и от 120 г/л до 160 г/л у женщин. Анемия является снижением количества RBC или гемоглобина в крови. Анемия у мужчин проявляется уровнем гемоглобина меньше 130-140 г/л (13-14 г/дл), а у женщин - меньше 120-130 г/л (12-13 г/дл). Эффективность композиций и способов из настоящей заявки повышает уровень гемоглобина до нормального уровня.
Нормальный уровень гематокрита составляет от 0,370 до 0,460 (у женщин) и от 0,420 до 0,520 (у мужчин). Эффективность композиций и способов в настоящей заявке повышает уровень гематокрита до нормального уровня.
Нормальное количество WBC составляет от 4,0x109/л до 10,0x109/л. Эффективность композиций и способов из настоящей заявки повышает количество WBC до нормального диапазона.
Эффективность композиций и способов из настоящей заявки можно оценить с применением абсолютного количества нейтрофилов (ANC). Нормальное значение ANC составляет от 1,500 до 8,000/мм3. Индивидуумы, страдающие нейтропенией, имеют ANC ниже 1500/мм3, и уровни могут даже достигать даже значений ниже 500/мм3. Эффективные количества композиций и способы по настоящему изобретению повышают у индивидуумов значение ANC на 10%, 20%, 30%, 50% или больше, до 75-90%, или 95% или больше. Эффективные количества могут повышать уровни ANC выше 1500/мм3.
Эффективность композиций и способов из настоящей заявки можно также оценить, например, по количеству тромбоцитов. Количество тромбоцитов в норме составляет от 150,000 до 450,000 тромбоцитов на микролитр (х 10-6/литр). Индивидуумы, страдающие тромбоцитопенией, могут иметь количество тромбоцитов ниже 100,000 на микролитр (100,000/мкл). Эффективные количества композиций и способов в настоящей заявке повышают количество тромбоцитов у индивидуума на 10%, 20%, 30%, 50% или больше, до 75-90%, или 95% или больше. Эффективные количества могут повышать уровни тромбоцитов выше 100,000 на микролитр.
Эффективность композиций и способов из настоящей заявки можно также оценить, например, путем измерения числа миелобластов. Миелобласты в норме представляют менее 5% от клеток в костном мозге, но не должны присутствовать в циркулирующей крови. Эффективные количества композиций и способов из настоящей заявки снижают количество миелобластов на 10%, 20%, 30%, 50% или больше, до 75-90%, 96% или больше. Эффективные количества могут снижать количество миелобластов до менее 5%.
Эффективность композиций и способов из настоящей заявки можно также оценить путем анализа миелобластов на присутствие телец Ауэра. Эффективные количества композиций по настоящему изобретению снижают количество видимых телец Ауэра на 10%, 20%, 30%, 50% или больше, до 75-90%, 96% или больше, до полного исчезновения телец Ауэра.
Эффективность композиций и способов по настоящему изобретению можно продемонстрировать по снижению симптомов, сопровождающих цитопению, включая нейтропению, анемию и/или тромбоцитопению, но не ограничиваясь ими.
Эффективные количества форболового эфира или родственного соединения формулы I (например, стандартной дозы, содержащей эффективную концентрацию/количество ТФА, или его выбранной фармацевтически приемлемой соли, изомера, энантиомера, сольвата, полиморфа и/или пролекарства ТФА) могут быть легко определены рядовым специалистом в данной области техники, в зависимости от клинических и специфических для пациента факторов. Подходящие эффективные количества стандартной дозы активных соединений для применения у млекопитающих, включая человека, могут находиться в диапазоне примерно от 10 до 1500 мкг, примерно от 20 до 1000 мкг, примерно от 25 до 750 мкг, примерно от 50 до 500 мкг, примерно от 150 до 500 мкг, примерно от 125 мкг до 500 мкг, примерно от 180 до 500 мкг, примерно от 190 до 500 мкг, примерно от 220 до 500 мкг, примерно от 240 до 500 мкг, примерно от 260 до 500 мкг, примерно от 290 до 500 мкг. В некоторых вариантах осуществления лечащая заболевание эффективная доза форболового эфира или родственного или производного соединения формулы I может быть выбрана в более узких диапазонах, например, от 10 до 25 мкг, 30-50 мкг, 75-100 мкг, 100-300 мкг, или 150-500 мкг. Эти и другие количества эффективной дозы могут применяться в виде единственной дозы, или в форме множества доз, недельных или месячных доз, например, в режиме приема дозы, включающем от 1 до 5, или от 2 до 3 доз в сутки, в неделю или в месяц. В одном примерном варианте осуществления дозы от 10 до 30 мкг, от 30 до 50 мкг, от 50 до 100 мкг, от 100 до 300 мкг, или от 300 до 500 мкг применяют один, два, три, четыре или пять раз в сутки. В более подробных вариантах осуществления дозы 50-100 мкг, 100-300 мкг, 300-400 мкг, или 400-600 мкг применяют один или два раза в сутки. В другом варианте осуществления дозы 50-100 мкг, 100-300 мкг, 300-400 мкг, или 400-600 мкг применяют один раз в два дня. В альтернативных вариантах осуществления дозы рассчитывают на основе массы тела, и их могут применять, например, в количествах примерно от 0,5 мкг/м2 до 300мкг/м2 в сутки, примерно от 1 мкг/м2 до 200 мкг/м2, примерно от 1 мкг/м2 до 187,5 мкг/м2 в сутки, примерно от 1 мкг/м2 в сутки до 175 мкг/м2 в сутки, примерно от 1 мкг/м2 в сутки до 157 мкг/м2 в сутки, примерно от 1 мкг/м2 до 125 мкг/м2 в сутки, примерно от 1 мкг/м2 до 75 мкг/м2 в сутки, от 1 мкг/м2 до примерно 50/ мкг/м2 в сутки, от 2 мкг/m2 до примерно 50 мкг/м2 в сутки, от 2 мкг/м2 до примерно 30 мкг/м2 в сутки, или от 3 мкг/м2 до примерно 30 мкг/м2 в сутки.
В других вариантах осуществления дозы могут применяться менее часто, например, от 0,5 мкг/м2 до примерно 300мкг/м2 один раз в два дня, примерно от 1 мкг/м2 до 200 мкг/м2, примерно от 1 мкг/м2 до 187,5 мкг/м2 один раз в два дня, примерно от 1 мкг/м2 до 175 мкг/м2 один раз в два дня, примерно от 1 мкг/м2 в сутки до 157 мкг/м2 один раз в два дня, примерно от 1 мкг/м2 до 125 мкг/м2 один раз в два дня, примерно от 1мкг/м2 до 75 мкг/м2 один раз в два дня, от 1 мкг/м2 до примерно 50мкг/м2 один раз в два дня, от 2 мкг/м2 до примерно 50 мкг/м2 один раз в два дня, от 2 мкг/м2 до примерно 30 мкг/м2 в сутки, или от 3 мкг/м2 до примерно 30 мкг/м2 в сутки. В дополнительных вариантах осуществления дозы могут применяться 3 раза в неделю, 4 раза в неделю, 5 раз в неделю, только по будним дням, только совместно с другими режимами лечения, в последующие дни, или в любом подходящем режиме лечения, в зависимости от клинических и специфических для пациента факторов.
Эритропоэтин является гликозилированным белковым гормоном и гемопоэтическим фактором роста, продуцируемым главным образом в почках, и для клинического применения получаемым путем технологии рекомбинантной ДНК; и для такого материала часто применяют наименование эпоэтин. См. noblood.org/forum/content/179-erythropoietin_-28epo-29. Эпоэтин-альфа, эпоэтин-бета, эпоэтин-гамма, эпоэтин-омега и эпоэтин-дзета являются рекомбинантными человеческими эритропоэтинами, полученными из клонированного гена человеческого эритропоэтина; все они имеют одну и ту же последовательности из 165 аминокислот, но различаются по характеру гликозилирования. Эпоэтин-дельта является рекомбинантный человеческим эритропоэтином, полученным из генно-инженерной стабильной клеточной линии, и имеет ту же самую аминокислотную последовательность и характер гликозилирования, как человеческий эритропоэтин.
ЭПО, такой как EPOETIN®, можно применять путем внутривенного либо подкожного введения, как описано в inceptapharma[dot] com/epoetin/submenu_page_view.php?menu_id=86&submenu_id=223&fs, раскрытие которого настоящим включено посредством ссылки во всей полноте. Например, дозу можно применять у каждого пациента для достижения и поддержки уровней гемоглобина от 10 до 12 г/дл. Например, если уровень гемоглобина повышается и достигает 12 г/дл, доза может быть уменьшена примерно на 25%; если уровень гемоглобина продолжает повышаться, дозу можно временно не применять, пока уровень гемоглобина не начнет снижаться, а затем повторно начать с дозой примерно на 25% ниже предыдущей дозы; или если гемоглобин повышается больше чем на 1 г/дл в двухнедельный период, доза может быть снижена примерно на 25%. Если повышение гемоглобина составляет меньше 1 г/дл в течение 4 недель, и запасы железа являются адекватными, дозу EPOETIN® можно повысить примерно на 25% от предыдущей дозы. Дополнительные повышения можно осуществлять с 4-недельными интервалами, пока не будет достигнут указанный уровень гемоглобина.
Доза ЭПО может быть оттитрована для каждого пациента при химиотерапии, или у пациента, прошедшего химиотерапию, для достижения и сохранения наименьшего уровня гемоглобина, достаточного, чтобы избежать необходимости гемотрансфузии и не превышать верхний безопасный уровень 12 г/дл. См. inceptapharma[dot] com/epoetin/submenu_page_view.php?menu_id=86&submenu_id=223&fs. Исходная рекомендуемая доза ЭПО у взрослых составляет 150 Единиц/кг п/к два раза в неделю или 40,000 Единиц п/к один раз в неделю, и исходная рекомендуемая доза ЭРО у педиатрических пациентов составляет 600 Единиц/кг в/в один раз в неделю.
Подходящие количества эффективной дозы эритропоэтина могут зависеть от нескольких факторов, и определяются по усмотрению лечащего врача субъекта. Например, некоторые пациенты могут быть более или менее чувствительными к соединениям или композициям, описанным в настоящей заявке, и для таких пациентов могут быть предпочтительными композиции, обеспечивающие более высокие или низкие значения в плазме или сыворотке. Кроме того, некоторые субъекты могут метаболизировать соединение, или могут метаболизировать его с различной скоростью, и таким образом, дозировки и/или альтернативные лекарственные формы могут быть необходимыми для обеспечения необходимой концентрации в сыворотке или в плазме. Специалистам в данной области техники понятно, что специфические дозировки ЭПО в композициях по настоящему изобретению могут быть отрегулированы, в зависимости от условий заболевания, возраста, массы тела, общего состояния здоровья, пола и питания субъекта, интервала приема доз, пути применения, скорости выведения, и комбинаций активных соединений.
Режим применения для ЭПО может включать такие дозы, как от 75 до 150 МЕ на кг (Ед./кг) массы тела в сутки или один раз в два дня, 600 Ед./кг один раз в неделю; или 300 Ед./кг три или четыре раза в неделю; как описано на noblood.org/forum/content/179-erythropoietin_-28epo-29, предлагается инструкция к применению, раскрытие которой настоящим включено посредством ссылки во всей полноте. Например, для пациента с массой тела 70 кг можно применять 60,000 МЕ в неделю.
Подходящие эффективные количества лекарственной формы ЭПО могут включать диапазон от 450 МЕ/кг до 900 МЕ/кг в сутки или один раз в два дня, или один раз, два раза, три раза или четыре раза в неделю. См. noblood.org/forum/content/179-erythropoietin_-28epo-29.
Подходящие эффективные количества лекарственной формы ЭПО-бета могут включать 1000 МЕ/0,3 мл, 2000 МЕ/0,3 мл, 3000МЕ/0,3 мл, 4000 МЕ/0,3 мл, 5000 МЕ/0,3 мл, 6000 МЕ/0,3 мл, 10,000 МЕ/0,6 мл, и 30,000 МЕ/0,6 мл растворов; и содержать мочевину, натрия хлорид, натрия фосфат и воду в предварительно заполненных шприцах для инъекций. См. noblood.org/forum/content/179-erythropoietin_-28epo-29.
Эпоэтин-альфа может применяться посредством инъекции 1 мл раствора на основе воды, который может содержать единственную дозу 2000, 3000, 4000, 10,000, или 40,000 единиц эпоэтина-альфа на дозу, вместе с другими ингредиентами, включая альбумин, на основе режимов лечения и массы тела пациента. См. noblood.org/forum/content/179-erythropoietin_-28epo-29. Кроме того, многодозовые инъекции можно также применять с 10,000 единицами или 20,000 единицами на 1 мл раствора для инъекций. Это применяют и к другим формам ЭПО. Хронические заболевания, такие как почечная недостаточность, болезнь сердца, диабет и воспалительные заболевания, такие как ревматоидный артрит, вносят вклад в анемию и вызывают снижение ответа на ЭПО, и во всех таких случаях дозу ЭПО нужно увеличить.
Дозы ЭПО-альфа (rch) или EPREX® можно применять, как описано на medsafe.govt.nz/profs/datasheet/e/eprexinj.pdf, раскрытие которого настоящим включено посредством ссылки во всей полноте. Например, ЭПО-альфа можно применять подкожно с 150 Ед./кг 3 раза в неделю, или 400,000 единиц один раз в неделю, и/или 300 Ед./кг 3 раза в неделю или 60,000 единиц один раз в неделю. См. drugs.com/ppa/epoetin-alfa-erythropoietin-epo.html, раскрытие которого настоящим включено посредством ссылки во всей полноте.
Доза ЭПО может включать высокие дозы, как описано в патенте США №7,232,797, раскрытие которого настоящим включено посредством ссылки. Например, патент США №7,232,797 описывает дозы ЭПО 5000 МЕ/кг в неделю или 17,000-25,000 МЕ/кг (раз в две недели или раз в три недели).
Доза ЭПО может включать низкие дозы, как описано в CA2418531, раскрытие которого настоящим включено посредством ссылки. Например, патент CA2418531 описывает дозу ЭПО примерно от 1 до 90 МЕ/кг в неделю; а также в качестве исходной дозы лечения примерно 75-120 МЕ/кг в неделю, и в качестве поддерживающей дозы примерно от 20 до 75 МЕ/кг в неделю. Кроме того, CA2418531 описывает применение рекомбинантного Эпоэтина-омега в дозе 5-150 МЕ/кг, один-три раза в неделю.
Эффективную дозу или многодозовый режим лечения для срочного лечения заболевания (альтернативно, «стимуляции нейтрофилов», «стимуляции эритропоэза», или «стимуляции тромбоцитов») для составов из настоящего изобретения обычно выбирают для приближения к режиму минимальной дозы, которая необходима и достаточна для существенного излечения или снижения/сокращения продолжительности анемии, нейтропении и/или тромбоцитопении у субъекта. Дозировка и протокол применения часто включают повторение приема дозы в течение нескольких дней или даже одной или нескольких недель или лет. Эффективный режим лечения может также включать профилактические дозы, применяемые на основе одной дозы в день или множества доз в сутки, в течение ряда дней, недель, месяцев или даже лет.
Эффективность композиций и способов из настоящего изобретения может также быть продемонстрирована путем снижения симптомов у субъектов, страдающих неопластическим заболеванием, включая анемию, хроническую утомляемость, избыточную кровоточивость или склонность к кровотечению, такому как кровотечение из носа, десен и под кожей; склонность к образованию гематом, в частности, гематом без явной причины; частое дыхание; петехии; периодический жар; отек десен; медленное заживление порезов; дискомфорт костей и суставов; рецидивирующие инфекции; снижение массы тела; жжение; ночной пот; набухание лимфоузлов; жар; боль и дискомфорт в животе; нарушение зрения; кашель; потерю аппетита; боль в груди; затруднение при глотании; отек лица, шеи и верхних конечностей; частые позывы к мочеиспусканию, особенно ночью; затруднения при мочеиспускании или задержка мочи; слабый или прерывистый поток мочи; болезненность или жжение при мочеиспускании; затруднение эрекции; болезненную эякуляцию; кровь в моче или семени; частые боли или скованность в пояснице, бедрах, или верхней части бедер; и/или слабость; но не ограничиваясь ими.
Эффективность композиций и способов по настоящему изобретению в лечении ревматоидного артрита может быть продемонстрирована изменением скорости осаждения эритроцитов. Эффективное количество композиций по настоящему изобретению снижает уровни скорости осаждения эритроцитов на 10%, 20%, 30%, 50% или больше, до 75-90%, 96% или больше, по сравнению с исходными диагностированными уровнями скорости осаждения эритроцитов. Эффективность может также быть продемонстрирована по изменению уровней ревматоидного фактора и антител к циклическому цитруллинированному пептиду.
Соединения и композиции, описанные в настоящей заявке, могут быть выполнены в виде фармацевтически приемлемых композиций, которые могут включать один или несколько фармацевтически приемлемых носителей. Такие композиции могут быть приготовлены путем смешивания одного или нескольких соединений или композиций, описанных в настоящей заявке, включая, например, их фармацевтически приемлемые соли или стереоизомеры, с фармацевтически приемлемыми носителями, вспомогательными веществами, связующими агентами, разбавителями или тому подобными, для лечения или снижения продолжительности цитопении, такой как нейтропения, тромбоцитопения, и/или анемия.
Настоящие композиции могут быть приготовлены для различных способов применения, например, посредством перорального, трансдермального, парентерального, ректального, назального, вагинального применения, или посредством имплантированного резервуара или другого устройства, такого как стент. Такие имплантаты могут использовать известные инертные материалы, такие как силиконовые и биодеградируемые полимеры. Они также могут быть обеспечены в комбинации со средствами доставки, такими как мицеллы и липосомы, или посредством какой-либо другой технологии инкапсулирования. Парентеральное или системное применение включает подкожное, внутривенное, интраперитонеальное, внутримышечное, интратекальное, интракраниальное и интрацеребровентрикулярное введение, но не ограничивается ими.
Для перорального, буккального и сублингвального применения подходящими твердыми лекарственными формами являются порошки, суспензии, гранулы, таблетки, пилюли, капсулы, желатиновые капсулы и капсуловидные таблетки. Они могут быть приготовлены, например, путем смешивания одного или нескольких соединений, описанных в настоящей заявке, или их фармацевтически приемлемых солей или стереоизомеров, по меньшей мере с одной добавкой, включая сахарозу, лактозу, сахар из целлюлозы, маннитол, мальтитол, декстран, крахмал, агар, альгинаты, хитины, хитозаны, пектины, камедь трагаканта, аравийскую камедь, желатины, коллагены, казеин, альбумин, синтетические или полусинтетические полимеры и глицериды, но не ограничиваясь ими. При необходимости, пероральные лекарственные формы могут содержать другие ингредиенты для применения, такие как неактивный разбавитель; любриканты, такие как магния стеарат; консерванты, такие как парабен или сорбиновая кислота; антиоксиданты, такие как аскорбиновая кислота, токоферол или цистеин; дезинтегрант, связующие агенты, загустители, буферы, подсластители, вкусоароматические агенты или парфюмерные агенты. Таблетки и пилюли могут быть дополнительно покрыты оболочкой из покрывающих материалов, известных в данной области техники.
Жидкие лекарственные формы для перорального применения могут быть в форме фармацевтически приемлемых эмульсий, сиропов, эликсиров, суспензий и растворов, которые могут содержать неактивный разбавитель, такой как вода. Фармацевтические составы и медикаменты могут быть приготовлены в виде жидких суспензий или растворов с применением стерильной жидкости, включая масло, воду, спирт, и их комбинации, но не ограничиваясь ими. Фармацевтически приемлемые сурфактанты, суспендирующие агенты, эмульгирующие агенты могут быть добавлены для перорального или парентерального применения.
Лекарственные формы для инъекций включают водные суспензии или масляные суспензии, которые могут быть приготовлены с применением подходящего диспергента или увлажняющего агента и суспендирующего агента. Формы для инъекций могут быть в растворенной фазе или в форме суспензии, которую готовят с растворителем или разбавителем, включая стерилизованную воду, раствор Рингера, или изотонический водный солевой раствор, но не ограничиваясь ими. Для инъекций фармацевтический состав и/или медикамент может быть порошком, приемлемым для восстановления подходящим раствором, и может при необходимости содержать стабилизаторы, модификаторы рН, сурфактанты, модификаторы биодоступности, и их комбинации. Примеры таких подходящих порошков включают лиофилизированные, высушенные ротационной или распылительной сушкой порошки, аморфные порошки, гранулы, осадки, или взвеси, но не ограничиваются ими.
Соединения и композиции, описанные в настоящей заявке, можно также применять для легких путем ингаляции через нос или рот. Подходящие фармацевтические составы для ингаляции включают водные и неводные аэрозоли, растворы, спреи, сухие порошки, но не ограничиваются ими; или аэрозоли, содержащие любые подходящие растворители и при необходимости другие соединения, такие как стабилизаторы, антимикробные агенты, антиоксиданты, модификаторы рН, сурфактанты, модификаторы биодоступности, и их комбинации, но не ограничиваясь ими. Составы для применения посредством ингаляции могут содержать наполнители, включая лактозу, полиоксиэтилен-9-лаурил эфир, гликохолат и дезоксихолат, но не ограничиваясь ими. Водный аэрозоль готовят путем объединения водного раствора или суспензии соединения или композиции с обычными фармацевтически приемлемыми носителями и стабилизаторами, включающими неионные сурфактанты (Твины, Плюроники, или полиэтиленгликоль), нетоксичные белки, такие как сывороточный альбумин, сорбитановые сложные эфиры, олеиновую кислоту, лецитин, аминокислоты, такие как глицин, буферы, соли, сахара или сахароспирты, но не ограничиваясь ими. Аэрозоли могут быть приготовлены из изотоничных растворов, или неводной суспензии (например, во фторуглеродном пропелленте), которые также можно применять в вариантах осуществления доставки соединений и композиций, описанных в настоящей заявке.
Соединения и композиции по настоящему изобретению могут быть обеспечены в виде спрея, капель для носа или аэрозоля, содержащего подходящий растворитель(и) и при необходимости другие соединения, такие как стабилизаторы, антимикробные агенты, антиоксиданты, модификаторы рН, сурфактанты, модификаторы биодоступности, и их комбинации, но не ограничиваясь ими; для назального применения.
Соединения и композиции по настоящему изобретению могут быть обеспечены для пролонгированного или немедленного высвобождения. Лекарственные формы для пролонгированного высвобождения контролируют скорость высвобождения, и могут поддерживать эффективную концентрацию композиции на протяжении времени, таким образом, обеспечивая у реципиента терапевтический эффект с увеличенной продолжительностью. Фармацевтическая композиция является лекарственной формой, выбранной из группы, состоящей из таблетки, жидкости для перорального применения, перорального спрея, интраназального спрея, состава для ингаляции, пилюли, геля, твердого вещества, капсулы, мультидисперсного вещества, трансдермального пластыря, имплантируемой формы, и раствора для инъекций, включающего внутривенную капельницу (включая лиофилизированную и восстановленную форму); а также лекарственные формы, которые набухают или развертываются так, чтобы лекарственная форма сохранялась в желудке или верхней части тонкой кишки в течение периода времени по меньшей мере 1 час, по меньшей мере 2 часа, по меньшей мере 3 часа, по меньшей мере 4 часа, по меньшей мере 5 часов, по меньшей мере 6 часов, или в течение периода времени более 6 часов. Примеры патентов, описывающий композиции для пролонгированного высвобождения, включают патент США № 7,438,927, патент США № 7,413,751, патент США № 7,405,238, патент США № 6,723,340, патент США № 6,682,759, патент США № 6,635,280, патент США № 6,488,962, патент США № 6,451,808, патент США № 6,340,475, патент США № 5,972,389, патент США № 5,582,837 и патент США № 5,007,790, но не ограничиваются ими.
Следующие не ограничивающие примеры приведены просто для иллюстрации различных аспектов или вариантов осуществления настоящего изобретения.
Примеры
Пример 1
Исследование in vitro ТФА и Г-КСФ на колониеобразующих клетках
Комбинация ТФА и Г-КСФ обеспечивает более сильные стимулирующие эффекты в отношении колониеобразующих клеток, чем ТФА или Г-КСФ по отдельности, как показано на фигуре 2.
Миелосупрессия является наиболее частой побочной реакций у онкологических больных, у которых применяют средства химиотерапии; тяжелая супрессия костного мозга часто затрудняет запланированное продолжение химиотерапии, может привести к осложнениями, может угрожать жизни. В последнее время рекомбинантный человеческий Г-КСФ и ЭПО широко применяют для лечения лейкопении или анемии, вызванных химиотерапией и радиотерапией. Но только рчГ-КСФ, ЭПО не могут восстанавливать медуллярный гемопоэз в короткие сроки у тех, кто получает высокоинтенсивную или многократную химиотерапию, особенно у больных лейкозом, поскольку средства химиотерапии могут повреждать нормальные гемопоэтические клетки и микроокружение в костном мозге, когда они уничтожают раковые клетки. При этом рчГ-КСФ, ЭПО играют роль в гемопоэзе на поздних стадиях развития клеток. Так, Г-КСФ влияет на стадии миелоидных клеток-предшественников, стимулируя их пролиферацию, дифференцировку, и индуцируя высвобождение зрелых нейтрофилов в периферическую кровь. ЭПО играет роль на стадии эритроидных клеток-предшественников, стимулируя эритропоэз, повышая число эритроцитов в периферической крови. Но они не оказывают влияния на микроокружение костного мозга. Таким образом, важно найти путь для быстрого восстановления гемопоэза в костном мозге. Сообщалось, что 12-О-тетрадеканоилфорбол-13-ацетат, который называю форболовым эфиром (ТФА), не только может индуцировать ряд лейкозных клеток к переходу в нормальные клетки, но также оказывает определенное влияние на костномозговые гемопоэтические клетки, и может повышать количество лейкоцитов.
Изучали влияние ТФА по отдельности или в комбинации с рчГ-КСФ на пролиферацию и колониеобразующую способность костномозговых гемопоэтических клеток у пациентов с острым миелоидным лейкозом (ОМЛ) в период супрессии костного мозга in vitro, и наблюдали влияние ТФА на пролиферацию или ингибирования стромальных клеток костного мозга (КМСК) от пациентов с ОМЛ в период миелосупрессии и у здоровых лиц.
Методы:
1) Человеческие костномозговые клетки от больного ОМЛ после химиотерапии культивировали на метилцеллюлозной полутвердой среде для культивирования. Группы: Контроль, ТФА (10 нг/мл), Г-КСФ (50 нг/мл), ТФА (10 нг/мл) + Г-КСФ (50 нг/мл). Эксперименты повторяли 4 раза.
2) Стромальные клетки костного мозга от здорового человека и больного ОМЛ после химиотерапии культивировали на метилцеллюлозной полутвердой среде для культивирования. Добавляли различные концентрации ТФА. Группы: Контроль, ТФА (0,1 нг/мл), ТФА (1,0 нг/мл), ТФА (5 нг/мл), ТФА (10 нг/мл), ТФА (20 нг/мл), ТФА (30 нг/мл).
3) Культивировали КМСК от здоровых лиц и больных ОМЛ в фазе супрессии костного мозга in vitro, добавляли различные концентрации ТФА 0,1 нг/мл, 1,0 нг/мл, 5 нг/мл, 10 нг/мл, 20 нг/мл, 30 нг/мл, и устанавливали контроль для выявления пролиферации или ингибирования клеток методом ССК8.
Результаты и вывод
1) При сравнении клонов из четырех групп в неполной среде, в контрольной группе мелкие клеточные кластеры можно было видеть спустя 24-72 часа, но клетки погибали при увеличении времени. При культивировании в течение 14 суток в контрольной группе не отмечено образования клонов, в группе Г-КСФ преобладали ГМ-КОЕ, ТФА по отдельности и в комбинации с Г-КСФ группой приводил к образованию миелоидных колоний, БОЕ-Э и КОЕ-ГЭММ. Для группы Г-КСФ, ТФА по отдельности и в комбинации с Г-КСФ повышал общее число клонов, по сравнению с контрольной группой (в обеих Р<0,05), при этом клоны для ТФА по отдельности и в комбинации с Г-КСФ формировались больше, чем в группе Г-КСФ (в обеих Р<0,05); клоны в комбинированной группе формировались больше, чем в ТФА группе (Р<0,001).
2) При сравнении клонов при стимуляции ТФА в различных концентрациях в неполной среде, было больше клонов во всех группах 5 нг/мл, 10 нг/мл, 20 нг/мл, чем в других группах, в том числе в группе 10 нг/мл число было наивысшим, при статистической достоверности (P<0,05). При этом снижение или повышение концентрации ТФА не повышало числа колоний. Наилучшая концентрация ТФА для стимуляции образования колоний составила 5 ~ 20 нг/мл. При культивировании в течение 14 суток, за исключением КОЕ-ГМ, КОЕ-ГЭММ наблюдались в группе 1 нг/мл, 5 нг/мл, 10 нг/мл, 20 нг/мл, и отмечалось меньше БОЕ-Э в группах 5 нг/мл, 10 нг/мл, 20 нг/мл, в то время как в группах с другой концентрацией не отмечалось эритроидных клонов.
3) Сравнивали клоны при стимуляции различными концентрациями ТФА и Г-КСФ (50 нг/мл) в неполной среде. В комбинации с Г-КСФ наилучшая концентрация ТФА составила 1 ~ 10 нг/мл (P<0,05). В комбинации с Г-КСФ наилучшая концентрация ТФА составила 5 нг/мл и 1 нг/мл для КОЕ-ГМ и КОЕ-ГЭММ. Главным типом клонов были миелоидные колонии, КОЕ-ГМ, также отмечены КОЕ-ГЭММ и БОЕ-Э.
4) При сравнении клонов из четырех групп в полной среде, можно видеть клоны в четырех группах, включающие КОЕ-ГМ, КОЕ-ГЭММ, БОЕ-Э, КОЕ-Э. Клоны в группе ТФА с Г-КСФ были наибольшими, по сравнению с группой ТФА, группой Г-КСФ и контрольной группой, разница была статистически достоверной (P<0,05). При этом в группе ТФА и группе Г-КСФ число клонов не имело статистически достоверной разницы (P = 0,577).
5) Эксперименты показали, что ТФА стимулирует пролиферацию стромальных клеток костного мозга здоровых лиц в концентрации 5~10 нг/мл (число клеток 2 x 105/мл). Показано, что снижение или повышение концентрации ТФА ингибировало КМСК. При этом ТФА стимулировал пролиферацию стромальных клеток костного мозга больных ОМЛ в концентрации 5~30 нг/мл (число клеток 2 х 105/мл). 5 нг/мл ТФА является наилучшей концентрацией для стимуляции пролиферации, а Г-КСФ не оказывал влияния на рост КМСК здоровых лиц или больных ОМЛ.
Вывод
ТФА по отдельности стимулирует образование клонов гемопоэтических клеток, главным образом КОЕ-ГМ, в костном мозге больных ОМЛ в период супрессии костного мозга in vitro; наилучшей концентрацией является 10 нг/мл. ТФА стимулирует образование КОЕ-ГМ, КОЕ-ГЭММ и БОЕ-Э на разных стадиях.
ТФА и Г-КСФ обладают синергетическими эффектами в отношении стимуляции образования костномозговых миелоидных клонов, кроме того, стимулируют образование КОЕ-ГЭММ и БОЕ-Э; наилучшей концентрацией ТФА является 5 нг/мл. Г-КСФ стимулирует образование КОЕ-ГМ, но не оказывает влияния на КОЕ-ГЭММ и БОЕ-Э.
ТФА стимулирует рост стромальных клеток костного мозга (КМСК) здорового человека и больного ОМЛ после химиотерапии, в фазе супрессии костного мозга in vitro. Оптимальные концентрации составили 5 нг/мл и 10 нг/мл.
Как показано на фигуре 1, ТФА стимулирует стволовые клетки на ранних стадиях к дифференцировке в стволовые клетки на поздних стадиях. Г-КСФ стимулирует только стволовые клетки на поздней стадии дифференцировки. ТФА также стимулирует стволовые клетки на поздней стадии дифференцировки. Нейтрофилы являются одним типом гранулоцитов.
Пример 2
Проект ТФА (PD616) для ОМЛ
- Механизм действия: Активатор протеинкиназы С (ПКС)
- Показания:
1) современный протокол: консервативная терапия ОМЛ после рецидива
2) новая стратегия: поддерживающая терапия ОМЛ после терапии первой линии/консолидирующей химиотерапии для восстановления числа лейкоцитов и тромбоцитов.
- Обоснование:
1) Активация протеинкиназы С облегчает восстановление гемопоэтических клеток.
2) Протеинкиназа С индуцирует дифференцировку лейкозных клеток.
Активность ТФА при ОМЛ
- Для усиления восстановления костного мозга в 1л ОМЛ после терапии первой линии и консолидирующей химиотерапии.
- Хорошо изученный механизм действия путем активации протеинкиназы С.
- Хорошо известный профиль переносимой токсичности из предшествующих клинических испытаний.
- Данные по сильной эффективности у больных ОМЛ с возможным сокращением продолжительности нейтропении и тромбоцитопении от 20 до 12 суток.
- Сокращение пребывания в больнице
- Минимизация вероятности инфекции
- Снижение потребности в продуктах крови
- Уменьшение затрат на лечение больных ОМЛ
ТФА в качестве поддерживающей терапии для восстановления количества лейкоцитов и тромбоцитов после химиотерапии ОМЛ.
- Проблемы стандартного лечения (СЛ): Г-КСФ или ГМ-КСФ не действуют на гемопоэтические клетки-предшественники на ранних стадиях, и обладают ограниченной эффективностью в отношении сокращения продолжительности нейтропении и тромбоцитопении после терапии первой линии или консолидирующей терапии.
- Не имеется эффективного подхода для облегчения восстановления тромбоцитов после химиотерапии при терапии первой линии/консолидирующей терапии ОМЛ.
- ТФА усиливает рост клеток-предшественников на ранних стадиях, и возможно, способствует сокращению продолжительности нейтропении и тромбоцитопении.
- Ежегодная частота ОМЛ составляет 14000 случаев, и 80% получают агрессивную химиотерапию, с развивающейся длительной нейтропенией.
- Цель:
- сокращение продолжительности нейтропении и пребывания в больнице от 20 до 12 суток,
- снижение потребности в продуктах крови (эритромассе и тромбоцитах), благодаря облегчению восстановления тромбоцитов,
- Уменьшение инфекционных осложнений,
- Отсутствие отрицательного влияния на эффективность, показатель полного ответа или продолжительность ответа.
Критерии
Сокращение продолжительности нейтропении и тромбоцитопении у больных ОМЛ после терапии первой линии или консолидирующей терапии. Сокращение продолжительности нейтропении и тромбоцитопении.
Применение
ТФА в/в 3 раза в неделю (понедельник-среда-пятница) до достижения АКН более 1000 и тромбоцитов более 20,000 в течение по меньшей мере 2 суток с 0,125 мг/м2 в качестве одного курса, начиная спустя 24-48 часов после завершения химиотерапии, в то время как в качестве СЛ остается поддерживающее лечение.
Эффективность
Снижение продолжительности нейтропении на 40%, от 20 суток до 12 суток. Уменьшение средней продолжительности госпитализации на 40%. Снижение потребности в продуктах крови на 40%.
Безопасность
Все явления токсичности не вызывали существенного ухудшения, по сравнению с общей токсичностью, ассоциированной со стандартной химиотерапией ОМЛ.
Конкуренция
Г-КСФ и ГМ-КСФ, но не очень эффективная.
- Неконтролируемое исследование 2 фазы на 12 пациентах, ТФА начиная спустя 24-48 часов после завершения стандартной химиотерапии (6 для терапии первой линии 3+7 и 6 для консолидирующей терапии с 2+5 или высокими дозами цитарабина). ТФА в/в 3 раза в неделю (П-С-П) до АКН более 1000 и тромбоцитов более 20,000 устойчиво в течение 2 и более суток, при проведении другого поддерживающего лечения, такого же, как при СЛ.
- Двойное слепое рандомизированное испытание 2 фазы, ТФА + Г-КСФ против Г-КСФ в 1:1. 20 пациентов, объем выборки с ~90% активностью и альфа 0,1, для детекции снижения продолжительности нейтропении и тромбоцитопении на 40% (от 20 суток до 12 суток).
- Первичные конечные точки: Продолжительность нейтропении, применение продуктов крови и время госпитализации, все снижены на 40%.
- Достигается намеченная цель 40% снижение, и не отмечено явных неблагоприятных эффектов при лечении лейкоза.
Дополнительный протокол ОМЛ включает начало ТФА спустя 24-48 часов после завершения химиотерапии, и наблюдение продолжительности нейтропении и тромбоцитопении.
Рандомизированное испытание 2 фазы в двух группах. Одна группа для терапии первой линии, другая группа для консолидирующей химиотерапии. Показано снижение продолжительности нейтропении на 40%.
Пример 3
Этот протокол является терапией первой линии, и не включает консолидации. Эта адъювантная терапия объединяет ТФА и Г-КСФ (гранулоцитарный колониестимулирующий фактор).
Оно является неконтролируемым открытым исследованием. Десять (10) пациентов получали стандартную химиотерапию первой линии идарубицином (12 мг/м2/сутки) или даунорубицином (60 мг/м2) на 1, 2, 3 дни и постоянную инфузию цитарабина (100-200 мг/м2/сутки) на 1-7 день. На 8 день или спустя 24 часа после завершения всех запланированных инфузий цитарабина, начинали введение ТФА в дозе 0,125 мг/м2 в/в один раз в два дня, в дополнение к Г-КСФ (400 мкг подкожно раз в день), до достижения абсолютного количества нейтрофилов (АКН) выше 1000/мкл в течение двух последующих дней.
Исследование 2 фазы для форболового эфира по сокращению продолжительности нейтропении и тромбоцитопении при остром миелоидном лейкозе у пациентов, получающих химиотерапию первой линии. Форболовый эфир (12-О-тетрадеканоилфорбол-13-ацетат, ТФА) является агонистом протеинкиназы С; и было показано, что он повышает количество ранних гемопоэтических клеток-предшественников в исследованиях in vitro. В предшествующих исследованиях 1 фазы с увеличением дозы ТФА отмечалось, что ТФА способен сокращать продолжительности нейтропении после химиотерапии у пациентов с острым миелоидным лейкозом (ОМЛ). Рекомендованная доза при исследованиях 2 фазы 0,125 мг/м2 в сутки до 5 дней в неделю в течение 2 недель хорошо переносилась, лишь с минимальными побочными реакциями, такими как частое дыхание, протеинурия, жар, озноб и раздражение вены в участке инфузии. Исследование было разработано для оценки эффективности ТФА в качестве агента поддерживающей терапии для усиления восстановления костного мозга у больных ОМЛ после химиотерапии первой линии.
Задачи исследования:
1) Оценить безопасности и переносимость ТФА у больных ОМЛ после химиотерапии первой линии.
2) Оценить первичную эффективность в сокращении продолжительности нейтропении и тромбоцитопении у больных ОМЛ после химиотерапии первой линии.
3) Оценить предварительный уровень полной ремиссии (ПР) после химиотерапии первой линии с поддержкой ТФА после терапии первой линии.
Приемлемость
Критерии включения были следующими:
1. Пациенты с диагнозом ОМЛ или прогрессирующим миелодиспластическим синдромом (МДС, таким как рефрактерная анемия с избытком бластов (РАИБ), или РАИБ с трансформацией), если число бластов в костном мозге у них превышает 20%.
2. ОМЛ должен быть классифицирован по классификации FAB, и все подтипы разрешены и зарегистрированы при включении в исследование, за исключением пациентов с М3 или острым промиелоцитарным лейкозом.
3. Пациенты с ОМЛ или прогрессирующим МДС, у которых считается приемлемым применение 3+7 химиотерапии первой линии (антрациклина и цитарабина).
4. Возраст 18-70 лет.
5. Показатель по шкале ECOG 0-2.
6. Нет признаков дисфункции жизненно важных органов, по результатам определения креатинина ≤ 2 мг/дл, АсАТ/АлАТ ≤ 5 × верхней границы нормы, билирубин ≤ 2 мг/дл, и нет тяжелых сердечнососудистых нарушений, таких как недавний острый инфаркт миокарда или инсульт в пределах 6 месяцев от включения в исследование.
7. Пациенты с адекватной сердечной функцией без истории застойно сердечной недостаточности тяжелее 1 класса в соответствии с Американской кардиологической ассоциацией (Пациенты с болезнью сердца, не приводящей к ограничению физической активности. Обычная физическая активность не вызывает чрезмерной утомляемости, сердцебиения, одышки или стенокардической боли).
8. Пациенты, способные дать согласие на участие в исследовании.
Критерии исключения были следующими:
1. Пациенты с иными онкологическими заболеваниями, чем ОМЛ, в пределах последних 24 месяцев, за исключением тех, которые считаются излечимыми, такие как вылеченная базальноклеточная карцинома кожи, подвергнутые резекции новообразования на ранней стадии, такие как протоковая карцинома молочной железы in situ, и другие вылеченные виды рака.
2. Пациенты с клинически активной или хронической инфекцией, и для которых не приемлема стандартная 3+7 терапия первой линии ОМЛ.
3. Пациенты с недавним значительны кровотечением, операцией и другими значительными медицинскими проблемами в пределах 6 месяцев, для которых не приемлема стандартная 3+7 терапия первой линии ОМЛ.
4. Пациенты с хронической обструктивной болезнью легких, которым требуется хроническое снабжение кислородом для поддержки пульсового насыщения кислородом выше 92%.
5. Кормящие грудью и беременные женщины.
6. Пациенты с наличием ранее установленной положительной реакции на ВИЧ.
Дизайн исследования
Это неконтролируемое, открытое испытание. Десять (10) пациентов получали стандартную химиотерапию первой линии с идарубицином (12 мг/м2) или даунорубицином (60 мг/м2) на 1, 2, 3 день и с постоянными инфузиями цитарабина (100-200 мг/м2/сутки) на 1-7 день. На 9 день или спустя 24 часа после завершения всех запланированных инфузий цитарабина, начинали введение ТФА 0,125 мг/м2 в/в каждое утро в течение 5 дней с 2-дневным перерывом. Тот же самый цикл применения ТФА в течение 5 дней с последующим перерывом в течение 2 дней повторяли до достижения абсолютного количества нейтрофилов у пациентов (АКН) выше 1000/мкл в течение двух последовательных дней. Применение Г-КСФ в дозе 400 мкг подкожно или внутривенно начинали в тот же самый день, когда впервые применяли ТФА, но его применяли во второй половине дня, или примерно спустя 8 часов после утренней дозы ТФА. Г-КСФ также прекращали применять, когда абсолютное количество нейтрофилов (АКН) у пациента достигало более 1000/мкл в течение двух последовательных дней. Этот подход с последовательным применением ТФА, а затем Г-КСФ разработан на основе стимуляции ТФА ранних предшественников, таких как КОЕ-ГМ и КОЕ-ГЭММ; в то время как Г-КСФ стимулирует пролиферацию более поздних предшественников, главным образом КОЕ-ГМ или КОЕ-Г. Без экспансии популяции ранних предшественников Г-КСФ не будет иметь целевой популяции клеток, и не сможет эффективно повысить выход нормальных лейкоцитов.
Все другие поддерживающие виды лечения, такие как в/в антибиотики широкого спектра действия, противовирусные средства (такие, как противогерпетические агенты), и противогрибковые средства (такие, как агенты против кандидоза), применяли в соответствии стандартным практическим руководством по терапии первой линии ОМЛ. Применение продуктов крови также осуществляли в соответствии с руководством по стандартной практике переливания эритромассы, когда гематокрит составлял менее 30, а количество тромбоцитов ниже 10,000, если не было клинических признаков кровотечения (или 50,000 при наличии клинических признаков кровотечения). Всех пациентов госпитализировали на весь индукционный период, пока АКН и тромбоциты не восстанавливались до адекватного уровня без признаков острой инфекции. Применяли стандартную помощь при нейтропении.
Продолжительность исследования
После восстановления пациентов после терапии первой линии пациенты могли быть выписаны из госпиталя и вернуться позже для последующей дополнительной химиотерапии, такой как с высокими дозами цитарабина, или для трансплантации костного мозга, по решению лечащего врача, на основе факторов риска. Пациенты покидали исследование после возвращения для повторного анализа костного мозга для оценки эффективности терапии первой линии. Вся последующая консолидирующая терапия не считается частью исследования.
Оценка безопасности
Анализ безопасности проводили на основе Общих терминологических критериев оценки нежелательных явлений (CTCAE), версия 4.0. Обычно наблюдаемые побочные реакции включают частое дыхание, жар, озноб и протеинурию. Связанный с лечением жар и озноб согласуются с повышением цитокинов после в/в инфузии исследуемого медикамента, но обычно был временным и снижался спустя 24 часа. Применяли ацетаминофен для симптоматического лечения жара при необходимости.
Анализ эффективности
Оценку нейтропении и тромбоцитопении после химиотерапии первой линии проводили посредством ежедневных гематологических анализов, включая общий анализ крови и определение лейкоцитарной формулы. На 14 день проводили рутинный анализ костного мозга, в соответствии с указаниями по стандартной клинической практике, для оценки наличия остаточных бластов спустя 7 дней после завершения терапии первой линии. Проводили проточную цитометрию аспирированного образца костного мозга для дифференцировки восстановленных нормальных клеток-предшественников и остаточных бластов. Продолжительность нейтропении и тромбоцитопении оценивали по отдельности, и строили диаграмму АКН и количества тромбоцитов для каждого пациента.
Статистический анализ
Исследование определяет продолжительность нейтропении и тромбоцитопении после стандартной 3+7 терапии первой линии у больных ОМЛ. Обычно у 80% больных ОМЛ продолжительность нейтропении/тромбоцитопении составляет 20 ± 3 дня (т.е. АКН или количество тромбоцитов восстанавливается на 24-30 день, если химиотерапию начинали на 1 день), и затем их выписывают из больницы, если нет признаков инфекции. В этом исследовании ТФА значительно сокращает продолжительность нейтропении и тромбоцитопении. Продолжительность нейтропении или тромбоцитопении для пациентов, леченных ТФА, снижается на 12 дней (АКН или количество тромбоцитов восстанавливается на 14-24 день), со среднеквадратическим отклонением 5 дней, размер выборки 10 пациентов обеспечивает 90% мощность для выявления разницы и отказа от нулевой гипотезы.
Пример 4
Мужчина, возраст 25 лет, с диагнозом ОМЛ (М2). Число миелобластов и промиелоцитов в костном мозге пациента составило примерно 60%. После получения одного стандартного курса ДЦ режима (7 цитарабин + 3 даунорубицин), число лейкоцитов в периферической крови снизилось до 0,8×109/л. Затем у него применяли 150 мкг Г-КСФ каждый день. После химиотерапии прошло 12 дней (продолжительность нейтропении и тромбоцитопении) до возврата его количества тромбоцитов и лейкоцитов, включая количество нейтрофилов, к нормальному уровню. Количество миелобластов плюс промиелоцитов в его костном мозге составило примерно 40%, оставаясь выше нормального значения (0~5%). Затем он получал второй стандартный курс ДЦ режима. После второго курса ДЦ режима количество лейкоцитов и тромбоцитов в периферической крови снизилось до 0,6×109/л и 80×109/л, соответственно. Затем применяли ТФА плюс Г-КСФ (150 мкг ТФА, затем 150 мкг Г-КСФ) каждый день в 1 день и 2 день. На 4 день и 5 день применяли только ТФА, по 150 мкг каждый день. В качестве уточнения, число лейкоцитов и процент нейтрофилов* составили 1,8×109/л (39%) на 3 день, 6,5×109/л (72%) на 7 день, и 5,7×109/л (77%) на 14 день. Расчетная продолжительность нейтропении после химиотерапии сократилась примерно на 5 дней. Количество тромбоцитов составило 330 x 109/л на 3 день, 715×109/л на 7 день, и 568×109/л на 14 день. Расчетная продолжительность тромбоцитопении после химиотерапии сократилась до менее 3 дней. После еще одного курса ДЦ с последующим лечением ТФА плюс Г-КСФ, количество миелобластов плюс промиелоцитов в костном мозге пациента составило 2%, снизившись до нормального значения.
*Нейтрофилы обычно составляют от 60 до 70% от циркулирующих лейкоцитов.
Пример 5
Мужчина, возраст 33 года, с диагнозом миелодиспластический синдром (MDS5q-). Получал лечение, включающее ЭПО, Г-КСФ, талидомид, и тестостерон, в течение 7 месяцев без какого-либо улучшения. Гемопоэтическая функция была очень низкой, особенно эритропоэз. Уровень гемоглобина составил 40 г/л без переливания крови. Помимо приема медикаментов, ему также переливали кровь каждый месяц. После переливания крови уровень гемоглобина достигал 70-80 г/л. Спустя две недели он падал до 60 г/л. В конце месяца он падал до 40 г/л. Необходимо было снова переливать кровь. Отмечалась потеря работоспособности и неспособность нормальной жизни. Применяли лечение ТФА+Г-КСФ+ЭПО (ТФА:150-180 мкг, в/в инфузия + Г-КСФ: 150 мкг в/м + ЭПО: 5000 Ед. в/м) 5 раз. Каждый раз ЭПО и Г-ККС вводили спустя 5 часов после введения ТФА. После 5-кратного применения ТФА+ Г-КСФ с ЭПО поддерживался уровень гемоглобина 70 г/л без переливания крови. При этом переливания крови были прекращены. Уровень гемоглобина продолжал постепенно повышаться в следующие два месяца, и достиг 120 г/л за 3 месяца после лечения ТФА+Г-КСФ+ЭПО, близко к нормальному уровню гемоглобина (130-175 г/л). Количество лейкоцитов, эритроцитов и тромбоцитов также постепенно повышалось до уровней, близких к нормальным уровням. Он вернулся к повседневной работе и нормальной жизни.
Пример 6
Лечение медикаментозной цитопении ТФА
Девяносто (90) взрослых мышей произвольно распределяли в 9 групп (по 10 мышей на группу). В контрольной группе не применяли лекарств. В модельной группе применяли даунорубицин (ДНР) (6 мг/кг) + цитарабин (Ара-С) (150 мг/кг) в 0 день. В остальных 7 группах применяли ДНР (6 мг/кг) + Ара-С 9150 мг/кг) на 0 день, и в каждой группе на 7 день, 8 день и 9 день применяли одно из следующих лекарств: Г-КСФ (10 мкг/кг), ЭПО (500 МЕ/кг), ТФА (12,5 мкг/кг), ТФА (25 мкг/кг), ТФА (50 мкг/кг), ТФА (12,5 мкг/кг)+Г-КСФ (10 мкг/кг), или ТФА (12,5 мкг/кг)+ЭПО (500 МЕ/кг).
Экспериментальная модель (3 дня после ДНР + Ара-С).
Таблица 1. Сравнение количества клеток крови в каждой группе (n=10)
Примечание: Представленные данные означают ОСКО. «*» P<0,05, «**» P<0,01, по сравнению с контрольной группой.
Таблица 2. Сравнение количества клеток крови в каждой группе (n=10) (Спустя 6 дней после ДНР+Ара-С)
Примечание: представленные данные означают ОСКО. «*» P<0,05, «**» P<0,01, по сравнению с контрольной группой.
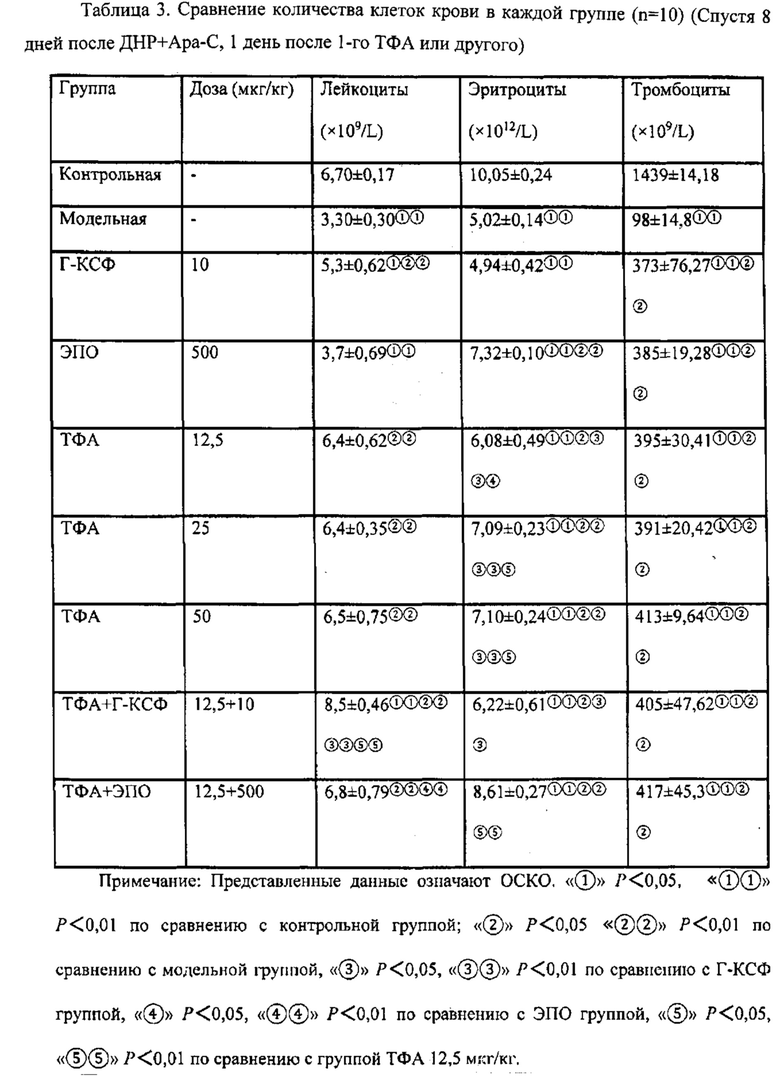
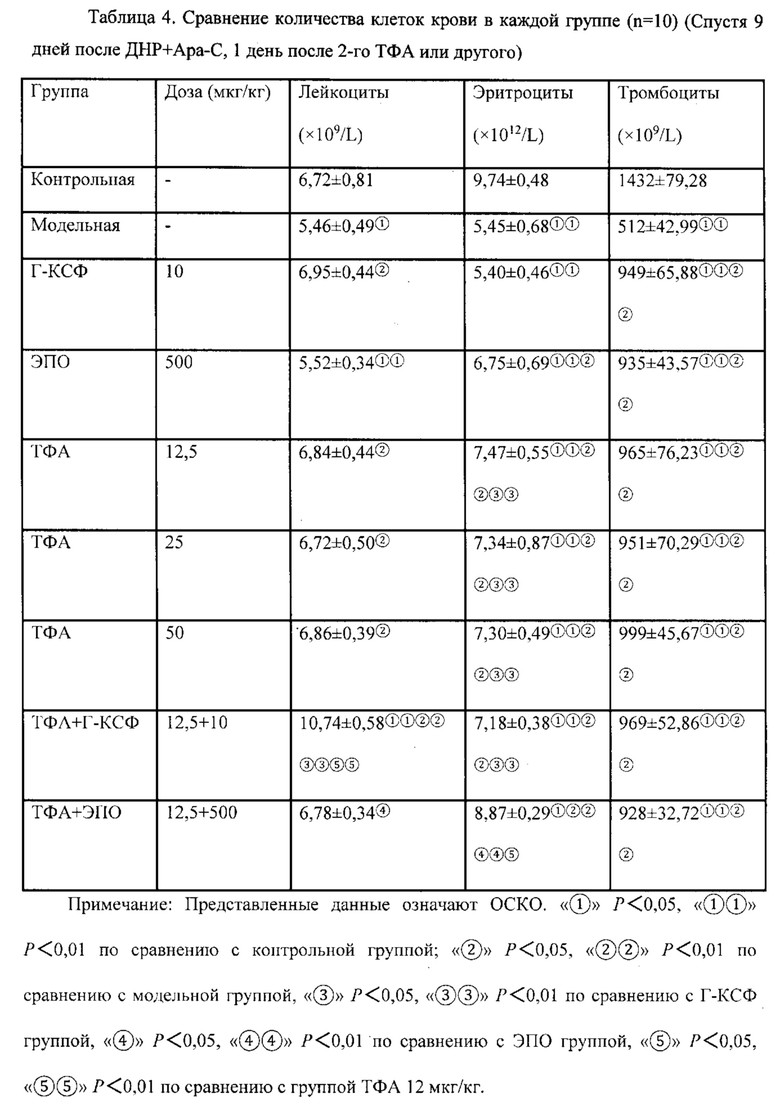
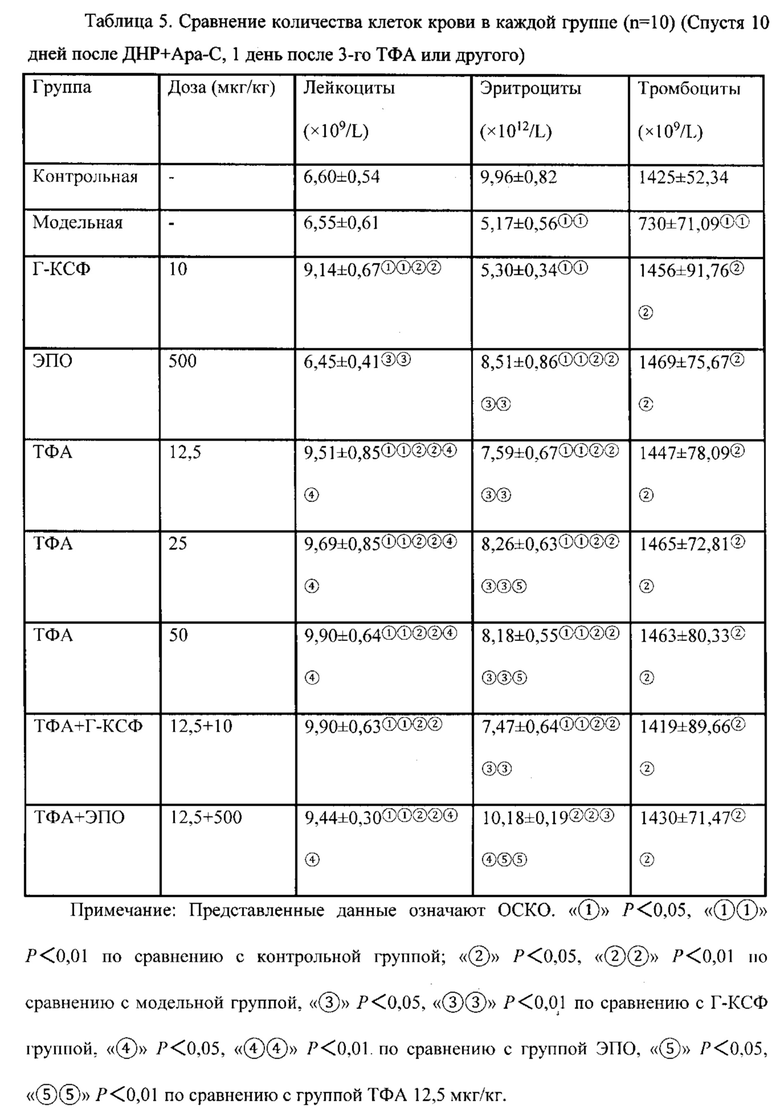
Вывод
1) ТФА стимулирует продукцию лейкоцитов, эритроцитов и тромбоцитов. Его можно применять для лечения различных форм цитопении, такой как анемия, лейкопения, нейтропения, тромбоцитопения, гранулоцитопения, панцитопения и гемоцитопения (см. en.wikipedia.org/wiki/Cytopenia).
2) ТФА в комбинации с Г-КСФ обладает синергетическим эффектом в стимуляции продукции лейкоцитов.
3) ТФА в комбинации с ЭПО обладает синергетическим эффектом в стимуляции продукции эритроцитов.
4) ТФА может стимулировать гемопоэз на различных этапах, от ранних стадий развития миелоидных стволовых клеток до дифференцировки в стволовые клетки на более поздних стадиях, а затем дополнительную дифференцировку от стволовых клеток на поздних стадиях до различных клеток крови.
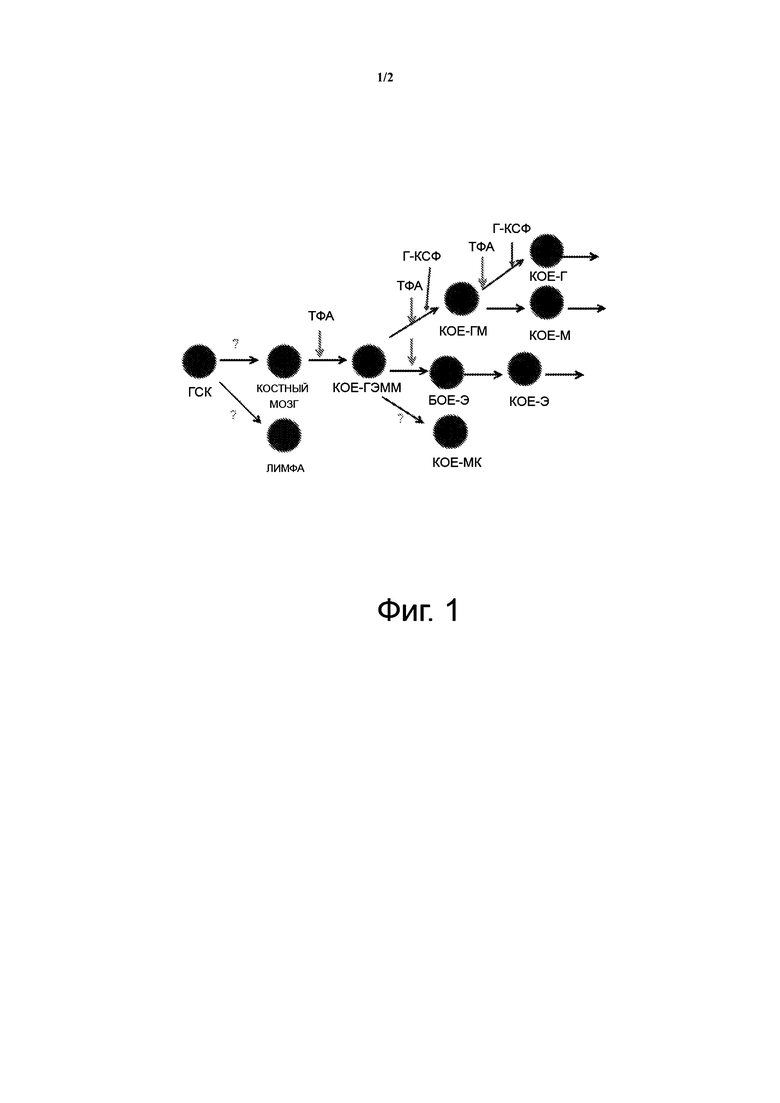
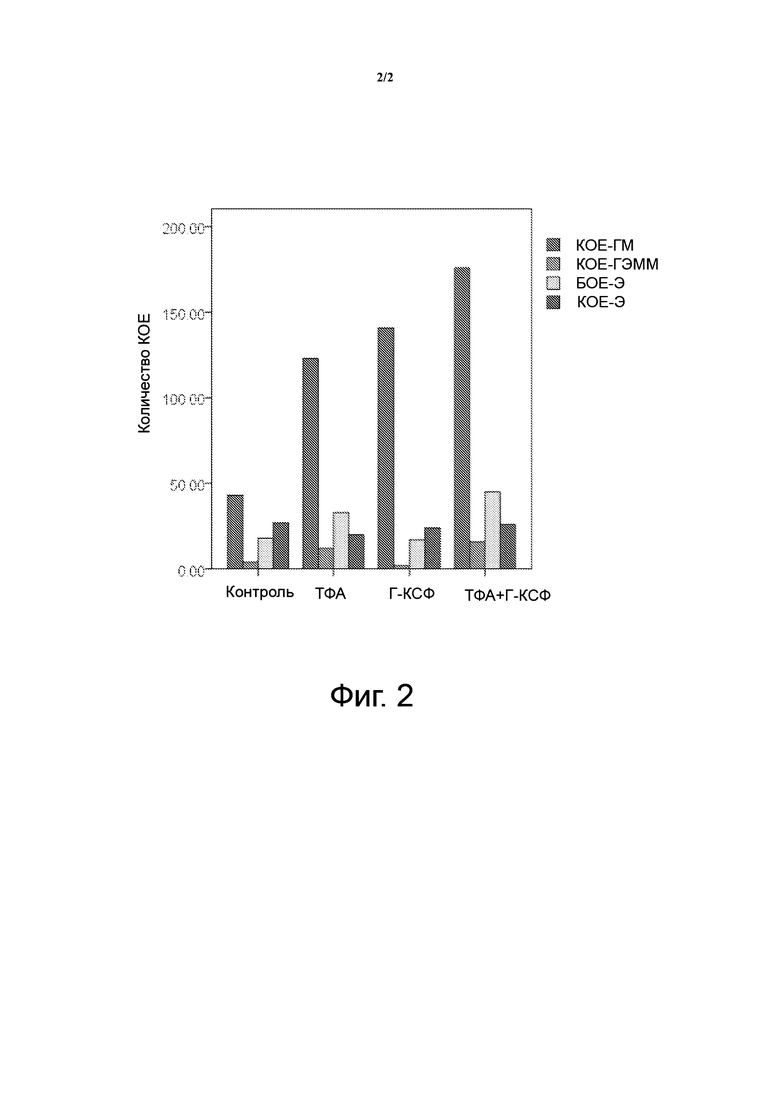
Группа изобретений относится к медицине и касается способа лечения цитопении, включающего введение млекопитающему субъекту, нуждающемуся в этом, эффективного количества форболового эфира формулы II, его фармацевтически приемлемой соли, изомера, энантиомера, сольвата или гидрата в комбинации с гранулоцитарным колониестимулирующим фактором (Г-КСФ) в эффективном количестве от 150 мкг до 400 мкг. Группа изобретений также касается способа лечения цитопении, включающего введение млекопитающему субъекту, нуждающемуся в этом, эффективного количества форболового эфира формулы II, его фармацевтически приемлемой соли, изомера, энантиомера, сольвата или гидрата в комбинации с эритропоэтином (ЭПО) в эффективном количестве, выбранным из группы, включающей количество от 75 МЕ/кг до 900 МЕ/кг ЭПО, количество от 2,000 до 40,000 единиц ЭПО и количество от 40,000 до 60,000 единиц ЭПО; композиции для лечения цитопении, содержащей эффективное количество форболового эфира формулы II, его фармацевтически приемлемую соль, изомер, энантиомер, сольват или гидрат и гранулоцитарный колониестимулирующий фактор (Г-КСФ) в эффективном количестве от 150 мкг до 400 мкг. Группа изобретений обеспечивает снижение продолжительности цитопении. 6 н. и 16 з.п. ф-лы, 5 табл., 6 пр., 2 ил.
1. Способ лечения цитопении, включающий введение млекопитающему субъекту, нуждающемуся в этом, эффективного количества форболового эфира формулы II, его фармацевтически приемлемой соли, изомера, энантиомера, сольвата или гидрата
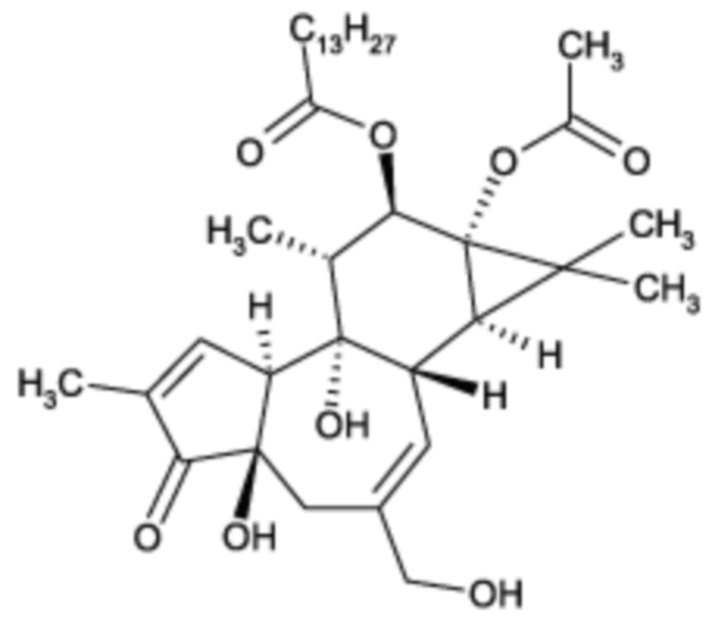 Формула II
Формула II
в комбинации с гранулоцитарным колониестимулирующим фактором (Г-КСФ) в эффективном количестве от 150 мкг до 400 мкг.
2. Способ лечения нейтропении и/или тромбоцитопении, включающий введение млекопитающему субъекту, нуждающемуся в этом, форболового эфира формулы II, его фармацевтически приемлемой соли, изомера, энантиомера, сольвата или гидрата
 Формула II
Формула II
в комбинации с гранулоцитарным колониестимулирующим фактором (Г-КСФ) в эффективном количестве от 150 мкг до 400 мкг.
3. Способ лечения цитопении, включающий введение млекопитающему субъекту, нуждающемуся в этом, эффективного количества форболового эфира формулы II, его фармацевтически приемлемой соли, изомера, энантиомера, сольвата или гидрата
 Формула II
Формула II
в комбинации с эритропоэтином (ЭПО) в эффективном количестве, выбранным из группы, включающей количество от 75 МЕ/кг до 900 МЕ/кг ЭПО, количество от 2,000 до 40,000 единиц ЭПО и количество от 40,000 до 60,000 единиц ЭПО.
4. Способ лечения анемии, включающий введение млекопитающему субъекту, нуждающемуся в этом, эффективного количества форболового эфира формулы II или его производного, фармацевтически приемлемой соли, изомера, энантиомера, сольвата или гидрата
 Формула II
Формула II
в комбинации с эритропоэтином (ЭПО) в эффективном количестве, выбранным из группы, включающей количество от 75 МЕ/кг до 900 МЕ/кг ЭПО, количество от 2,000 до 40,000 единиц ЭПО и количество от 40,000 до 60,000 единиц ЭПО.
5. Способ по п. 1, 2, 3 или 4, дополнительно включающий введение по меньшей мере одного вторичного или вспомогательного терапевтического агента.
6. Способ по п. 1 или 2, где Г-КСФ вводят указанному субъекту в протоколе координированного применения, одновременно, до или после введения указанного форболового эфира формулы II.
7. Способ по п. 3 или 4, где ЭПО вводят указанному субъекту в протоколе координированного применения, одновременно, до или после введения указанного форболового эфира формулы II.
8. Способ по п. 1, 2, 3 или 4, где указанный форболовый эфир формулы II вводят в эффективном количестве, составляющем примерно от 10 до 1500 мкг указанного форболового эфира формулы II каждый день или один раз в два дня.
9. Способ по п. 1, 2, 3 или 4, где указанный форболовый эфир формулы II вводят в эффективном количестве, составляющем примерно от 150 до 500 мкг указанного форболового эфира формулы II каждый день или один раз в два дня.
10. Способ по п. 1 или 2, где комбинация повышает абсолютное количество нейтрофилов (АКН) у млекопитающего субъекта примерно до 1500/мм3.
11. Способ по п. 1 или 2, где комбинация повышает уровень тромбоцитов у млекопитающего субъекта до более 100,000/мкл.
12. Способ по пп. 3 или 4, где комбинация повышает уровень при измерении общего анализа крови (СВС) по меньшей мере на 10%.
13. Способ по п. 3 или 4, где комбинация повышает уровень гемоглобина у млекопитающего субъекта до уровня выше нормального уровня гемоглобина.
14. Способ по п. 1, 2, 3 или 4, где млекопитающий субъект является человеком, страдающим острым миелоидным лейкозом.
15. Композиция для лечения цитопении, содержащая эффективное количество форболового эфира формулы II, его фармацевтически приемлемую соль, изомер, энантиомер, сольват или гидрат
 Формула II
Формула II
и гранулоцитарный колониестимулирующий фактор (Г-КСФ) в эффективном количестве от 150 мкг до 400 мкг.
16. Композиция для лечения цитопении, содержащая эффективное количество форболового эфира формулы II, его фармацевтически приемлемую соль, изомер, энантиомер, сольват или гидрат
 Формула II
Формула II
и эффективное количество эритропоэтина (ЭПО).
17. Композиция по п. 15, где форболовый эфир формулы II и Г-КСФ присутствуют в эффективном количестве, достаточном для лечения или уменьшения продолжительности цитопении.
18. Композиция по п. 17, где цитопения является нейтропенией и/или тромбоцитопенией.
19. Композиция по п. 16, где форболовый эфир формулы II и ЭПО присутствуют в эффективном количестве для лечения или снижения продолжительности цитопении.
20. Композиция по п. 19, где цитопения является анемией.
21. Композиция по п. 15 или 16, где указанное эффективное количество форболового эфира формулы II составляет примерно от 10 до 1500 мкг.
22. Композиция по п. 15 или 16, где указанное эффективное количество форболового эфира формулы II составляет примерно от 150 до 500 мкг.
| US 2014206762 A1, 24.07.2014 | |||
| US 20140017194 A1, 16.01.2014 | |||
| SCHOLZ M., et al., Effectiveness of cytopenia prophylaxis for different filgrastim and pegfilgrastim schedules in a chemotherapy mouse model.Biologics | |||
| Колосоуборка | 1923 |
|
SU2009A1 |
| Колосоуборка | 1923 |
|
SU2009A1 |
| SPIVAK JL., et al., Tumor-promoting phorbol esters support the in vitro proliferation of murine | |||
Авторы
Даты
2020-08-26—Публикация
2015-11-03—Подача