Изобретение относится к соединениям, обладающим активностью в отношении сердечно-сосудистой системы, в частности к производным 2-амино-1,2,3,4-тетрагидронафталина, и к их применению в области терапии.
Известно, что некоторые гидроксилированные 2-амино-1,2,3,4-тетрагидронафталины являются агонистами дофаминергических рецепторов, и было проведено несколько исследований, посвященных изучению зависимости их активности от строения с целью выявления структурных характеристик, определяющих наиболее высокую дофаминергическую активность и в то же время не оказывающих нежелательных воздействий, свойственных дофамину.
Представляющий интерес обзор этих исследований обобщен в статье, опубликованной Н.Е. Katerinopoulos и D.I. Schuster в Drugs of the Future, том 12 (3), стр. 223-253 (1987).
Однако, несмотря на различные исследования, топология дофаминергических рецепторов до сих пор еще не выяснена полностью, и в последние десять лет был предложен ряд моделей этих рецепторов.
Среди соединений, структурно схожих с дофамином и/или с 2-амино-1,2,3,4-тетрагидронафталином, некоторые исследователи обнаружили, что наличие C3-C4-алкильной группы на функциональной аминогруппе является одним из необходимых требований для проявления дофаминергической активности, в то время как структурные требования ко второму заместителю на аминогруппе не установлены.
Однако из литературы известно несколько примеров, свидетельствующих о том, что структурные особенности двух заместителей на практике могут в значительной степени варьироваться и что небольшие изменения молекулы могут как количественно, так и качественно соответствующим образом влиять на фармакологическую активность.
Ниже представлены некоторые наиболее важные из этих примеров.
В заявке на европейский патент 72061 (Fisons PLC) приведены среди прочих дофамины и аминотетрагидронафталины, имеющие моно- или дизамещенную часть формулы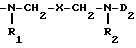
где X обозначает цепь -(CH2)n-, необязательно замещенную гидроксигруппой; n обозначает целое число от 1 до 7; R1 и R2 имеют одинаковые или различные значения и обозначают водород, алкил или фенил; D2 обозначает водород, алкил, фенил; алкил, замещенный одной или несколькими гидроксигруппами, пиридилом, фенилом; алкил, замещенный фенилом, который в свою очередь замещен галогеном, алкилом, амино-, алкокси- или нитрогруппой; или же D2 может представлять собой фенилэтильный или тетрагидронафтильный фрагмент, необязательно моно- или дизамещенный гидроксигруппой.
Среди соединений, представленных в заявке на Европейский патент 72061, соединение формулы
международное незарегистрированное название которого дофексамин (The Merck Index, изд. XI, N 3418, стр. 538), является единственным соединением, насколько это известно авторам настоящего изобретения, которое было разработано и применялось для экстренного лечения недостаточности.
Важно при этом, что дофексамин, несмотря на то что он был отобран из нескольких соединений, описанных и приведенных в качестве примера в заявке на европейский патент 72061, является менее активным агонистом дофаминергических рецепторов, чем дофамин, и подобно самому дофамину он не абсорбируется при введении оральным путем [A. Fitton и P. Benfield, Drugs, 39(2), 308-330, (1990)].
В заявке на европейский патент 142283 (Fisons PLC) приведен класс соединений, которые являются аналогами дофексамина и в которых, однако, аминогруппа фрагмента дофамина является вторичной.
Из литературы известно несколько соединений со структурой катехоламина, для которых характерно сохранение благоприятных свойств дофексамина, в том числе и при введении оральным путем, или повышение избирательности по отношению к дофаминергическим рецепторам.
Среди соединений, приведенных в заявке на европейский патент 321968 (SIMES Societa Italiana Medicinali e Sintetici S.p.A.), особый интерес представляют соединения, имеющие следующую общую формулу: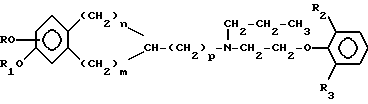
где R и R1 имеют одинаковые или различные значения и обозначают водород или ацильный радикал, являющийся производным алифатической, ароматической либо гетероароматической карбоновой кислоты, угольной либо карбаминовой кислоты или фосфорной кислоты; n и p обозначают целые числа, выбранные из 0 и 1; m обозначает целое число, выбранное из 1, 2, 3 и 4, причем эти значения выбирают таким образом, чтобы сумма n + p равнялась 1, а сумма m + n равнялась 2, 3 или 4; R2 и R3 имеют одинаковые или различные значения и обозначают водород, галоген, алкил или алкокси. Эти соединения являются агонистами D1- и D2-дофаминергических рецепторов, они одновременно обладают α 1-антагонистическим действием, не взаимодействуют с другими рецепторными системами, однако для того чтобы они могли проявлять активность при оральном введении, их необходимо преобразовывать в соответствующие пролекарства.
Соединения, описанные в международной заявке WO 93/19036 (Zambon Group S.р.A.), которые являются более активными дофаминергическими агонистами, чем дофамин, и не обладают селективностью по отношению к любому специфическому подтипу рецептора, которые не взаимодействуют с другими рецепторными системами и которые в то же время не обладают ни побочным действием, ни терапевтически неблагоприятными свойствами дофамина, представляют еще больший интерес.
Соединения, описанные в указанной выше международной заявке, имеют следующую общую формулу:
где R1 и R2 имеют одинаковые или различные значения и обозначают атомы водорода или OY'-группы;
Y и Y' имеют одинаковые или различные значения и обозначают атомы водорода или ацильные группы, являющиеся производными алифатической, ароматической либо гетероароматической карбоновой кислоты, угольной либо карбаминовой кислоты или фосфорной кислоты; m равно 1 или 2; n обозначает целое число 3 или 7; R3 обозначает водород или C1-C4-алкил; R4 и R5 имеют одинаковые или различные значения и обозначают водород, галоген, C1-C3-алкил или алкокси.
В международной заявке WO 95/07885 (Zambon Group S.p.A.), опубликованной 23 марта 1995 г. и имеющей приоритет в Италии М193А00973 от 14 сентября 1993 г., описаны дофаминергические агонисты формулы
где R обозначает атом водорода или OY-группу; R1 обозначает атом водорода или OY'-группу; R2 обозначает атом водорода или OY''-группы; при условии, что по крайней мере один из R, R1 и R2 обозначает водород, но R, R1 и R2 одновременно не обозначают атомы водорода и R1 и R2 одновременно не обозначают OY'- или OY''-группы соответственно; Y, Y' и Y'' имеют одинаковые или различные значения и обозначают атом водорода или ацильную группу, являющуюся производной необязательно замещенной алифатической, ароматической либо гетероароматической карбоновой кислоты, необязательно замещенной угольной либо карбаминовой кислоты или фосфорной кислоты; m равно 1 или 2; n обозначает целое число 3 или 8; p обозначает целое число 2 или 4; R3 обозначает водород или C1-C4-алкил; R4 обозначает фенил, необязательно замещенный галогеном, C1-C3-алкилом или алкоксигруппой, или обозначает 5- или 6-членный гетероарил, содержащий один или несколько гетероатомов, выбранных из кислорода, азота и серы, и необязательно замещенный галогеном, гидрокси-, C1-C3-алкильной или алкоксигруппами; X обозначает CH2, NH, S, SO, SO2, CO, CF2, O и, когда R4 обозначает 5- или 6-членный гетероарил, X также может обозначать простую связь; при условии, что, когда X обозначает O, R4 имеет значение, отличное от фенила или пиридила.
Согласно настоящему изобретению были обнаружены агонисты дофаминергических рецепторов, которые более активны по сравнению с дофамином и другими описанными выше известными соединениями, которые практически не взаимодействуют с другими рецепторными системами и которые могут быть абсорбированы при оральном пути введения и обладают продолжительным действием.
Таким образом, предметом настоящего изобретения являются соединения формулы
где m представляет собой целое число, выбранное из 4, 5, 6, 7 и 8;
R, R' и R'' обозначают атомы водорода или OH-группы при условии, что по крайней мере один из радикалов R, R' и R'' обозначает атом водорода, но все радикалы R, R' и R'' одновременно не обозначают атомы водорода и R' и R'' оба одновременно не обозначают OH-группы; или
один из R' и R'' обозначает NHCHO, NHCH3, NHSO2CH3, CH2ОН или CH3-группу, а другой обозначает водород;
R1 и R2 имеют одинаковые или различные значения и обозначают атомы водорода, C1-C3-алкильные группы или вместе с атомом углерода, с которым они связаны, образуют циклопропил;
n представляет собой целое число, выбранное из 0, 1, 2, 3 и 4;
p представляет собой целое число, выбранное из 0 и 1;
R3 обозначает атом водорода или C1-C4-алкильную группу;
Y обозначает S, О, N(R7)CO, CO(R7)N или N(R7);
X обозначает N(R8), О, S, SO, SO2, CO или простую связь;
R4, R5 и R6 имеют одинаковые или различные значения и обозначают водород, ОН, галоген, C1-C4-алкил, C1-C4-алкокси, нитро, C1-C4-алкилтио, NH2, моно- или ди-C1-C4-алкиламино, SH, C1-C4-алкилсульфонил, C1-C4-алкоксикарбонил, NHCHO, C1-C4-алкилкарбониламино, NHCONH2, C1-C4-алкилсульфониламино, C1-C4-алкиламиносульфонил, SO2NH2, NHSO2NH2, COOH, SO3H, CONH2, CH2ОН или фенил; или
R4 и R5 в ортоположении один относительно другого вместе образуют необязательно ненасыщенную цепь, состоящую из трех или четырех групп, выбранных из CR'''RIV, CO, S, O и NRV, где R''' обозначает атом водорода или C1-C4-алкильную группу, RIV обозначает атом водорода, C1-C4-алкильную группу или аминогруппу и RV обозначает атом водорода или C1-C4-алкильную группу; или R''' вместе с соседним R''' либо с RV образует простую связь, или RV вместе с соседним R''' либо с RV образует простую связь;
R7 обозначает атом водорода или C1-C4-алкильную группу;
R8 обозначает атом водорода; или
R7 и R8 вместе образуют -CH2- или цепь -CH2-CH2-; или
R4, когда он находится в ортоположении относительно X, образует с R7 простую связь или -CH2- либо цепь -CH2-CH2-; или же,
когда X обозначает О, то
R4, когда он находится в ортоположении относительно X, образует с R3 цепь -CH2-О-;
звездочка * обозначает асимметричный атом углерода;
при условии, что, когда p равно 1, X обозначает группу N(R8); и при условии, что, когда R и R' или R'' обозначают OH-группы, R1 и R2 обозначают атомы водорода и
а) когда Y обозначает N(R7), R7 обозначает водород или алкил и R3 обозначает водород, то по крайней мере один из R4, R5 и R6 не обозначает водород, галоген, C1-C4-алкил и C1-C4-алкокси;
б) когда Y обозначает N(R7), R7 обозначает водород или алкил, R3 обозначает водород и X обозначает простую связь, то по крайней мере один из R4, R5 и R6 не обозначает водород, галоген, NH2, C1-C4-алкил, C1-C4-алкокси и нитро;
в) когда Y обозначает N(R7), R7 обозначает водород или алкил, n равно 1, R3 обозначает водород и X обозначает простую связь, то по крайней мере один из R4, R5 и R6 не обозначает водород и OH-группу;
и их фармацевтически приемлемые соли.
Условие а) исключает из формулы I соединения, подпадающие под объем указанных выше международных заявок WO 93/19036 и WO 95/07885.
Условия б) и в) исключают из формулы I соединения, подпадающие под объем указанной выше заявки на европейский патент 72061.
Соединения формулы I имеют по крайней мере один асимметричный центр, помеченный звездочкой, и они могут существовать в виде стереоизомеров. Предметом настоящего изобретения являются соединения формулы I в виде смесей стереоизомеров, а также в виде отдельных стереоизомеров.
Соединения формулы I являются агонистами дофаминергических рецепторов, проявляющими активность также и при оральном пути введения и обладающими продолжительным действием, и они пригодны в области сердечно-сосудистой терапии, в частности для лечения артериальной гипертензии и сердечной недостаточности, почечной недостаточности, для лечения периферических артериопатий, цереброваскулярных недостаточностей и ишемической кардиопатии.
В контексте настоящего изобретения понятие галоген обозначает атом фтора, хлора, брома или йода.
Конкретные примеры алкильных или алкоксигрупп включают метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, метокси, этокси, н-пропокси, изопропокси, н-бутокси и изобутокси.
Конкретными примерами необязательно ненасыщенных цепей, состоящих из 3 или 4 групп, выбранных из CR'''RIV, CO, S, O и NRV, являются следующие группы: -O-CHR'''-O-, -S-CO-NRV-, -CHR'''-CO-NRV-, -S-CRIV=N-, -O-CO-NRV-, -CO-NRV-NRV-, -NRV-CO-NRV-.
Предпочтительными соединениями формулы I являются соединения, в которых R' обозначает атом водорода, R и R'' обозначают OH-группы, а атом углерода, помеченный звездочкой, имеет S-конфигурацию.
Еще более предпочтительными являются соединения, в которых R', R1 и R2 обозначают атомы водорода, R и R'' обозначают OH-группы, m равно 6 и атом углерода, помеченный звездочкой, имеет S-конфигурацию.
Среди значений заместителей R4, R5 и R6 предпочтительными являются водород, ОН, метокси, метил, нитро, хлор, метилсульфонил, NH2, SO2NH2, метилсульфониламино, NHCONH2, метоксикарбонил, ацетиламино, CONH2, CH2ОН, SO3H и метилендиокси или, когда R4 и R5 в ортоположении один относительно другого образуют цепь, труппа формулы -S-CO- NRV-, где RV обозначает атом водорода.
Конкретными примерами соединений формулы I являются:
(S)-N-пропил-N-[6-[(1,4- бенздиоксан-2-ил)метиламино] гексил] -5,6-дигидрокси-1,2,3,4- тетрагидро-2-нафтиламин,
(S)-N-пропил-N-[6-[2-(3- метилсульфонилфенил)этиламино] гексил]-5,6-дигидрокси-1,2,3,4- тетрагидро-2-нафтиламин,
(S)-N-пропил-N-[6-[2-(3,4- метилендиоксифенил)этиламино]гексил]-5,6-дигидрокси-1,2,3,4- тетрагидро-2-нафтиламин,
(S)-N-пропил-N-(5,6-дигидрокси-1,2,3,4- тетрагидро-2-нафтил)-N'-метил-N'-[2-(2-оксо-3H-1,3-бензтиазол-6- ил)этил]-1,6-гександиамин,
(S)-N-пропил-N-[6-[4-(2- метоксифенил)пиперазин-1-ил] гексил] -5,6-дигидрокси-1,2,3,4- тетрагидро-2-нафтиламин,
(R)-N-пропил-N-[6-[2-(2-оксо-3H-1,3- бензтиазол-6-ил)этиламино] гексил] -6-гидрокси-7-формиламино- 1,2,3,4-тетрагидро-2-нафтиламин,
(S)-N-пропил-N-[6-[2-(2- нитрофенокси)этиламино] гексил] -5,6-дигидрокси-1,2,3,4- тетрагидро-2-нафтиламин,
(R)-N-пропил-N-[6-[2-(3-хлор-4- гидроксифенил)этиламино]гексил]-6-гидрокси-7-формиламино- 1,2,3,4-тетрагидро-2-нафтиламин,
(S)-N-пропил-N-[6-[2-(4- нитрофенокси)этиламино] гексил] -5,6-дигидрокси-1,2,3,4 - тетрагидро-2-нафтиламин,
(R)-N-пропил-N-[6-(2- фенилэтиламино)гексил]-6-гидрокси-7-формиламино-1,2,3,4- тетрагидро-2-нафтиламин,
(S)-N-пропил-N-[6-[2-(4- метилсульфонилфенокси)этиламино]гексил]-5,6-дигидрокси-1,2,3,4- тетрагидро-2-нафтиламин,
(R)-N-пропил-N-[6-[2-(4- метилсульфонилфенил)этиламино]гексил]-6-гидрокси-7- формиламино-1,2,3,4-тетрагидро-2-нафтиламин,
(S)-N-пропил-N- [6-[(2-метоксифенокси)ацетиламино]гексил]-5,6-дигидрокси- 1,2,3,4-тетрагидро-2-нафтиламин,
(S)-N-пропил-N-[7-[2-(2-оксо- 3H-1,3-бензтиазол-6-ил)этиламино] гептил] -5,6-дигидрокси-1,2,3,4- тетрагидро-2-нафтиламин,
(S)-N-пропил-N-[6-[2-(4- гидроксифенилтио)этиламино] гексил]-5,6-дигидрокси-1,2,3,4- тетрагидро-2-нафтиламин,
(S)-N-пропил-N-[5-[2-(2-оксо-3H-1,3- бензтиазол-6-ил)этиламино] пентил] -5,6-дигидрокси-1,2,3,4- тетрагидро-2-нафтиламин,
(S)-N-пропил-N-[6-[3-(4- гидроксифенил)пропиламино] гексил] -5,6-дигидрокси-1,2,3,4- тетрагидро-2-нафтиламин,
(S)-N-пропил-N-[6-[2-(4- формиламинофенил)этиламино] гексил]-5,6-дигидрокси-1,2,3,4- тетрагидро-2-нафтиламин,
(S)-N-пропил-N-[6-(6,7-дигидрокси- 1,2,3,4-тетрагидроизохинолин-2-ил)гексил]-5,6-дигидрокси-1,2,3,4- тетрагидро-2-нафтиламин,
(S)-N-пропил-N-[5-[2-(2,3-дигидро-2- оксо-3-метил-1,3-бензтиазол-6-ил)этиламино]гексил]-5,6- дигидрокси-1,2,3,4-тетрагидро-2-нафтиламин,
(S)-N-пропил-N-[6- [2-(3-хлор-4-гидроксифенил)этиламино]гексил]-5,6-дигидрокси- 1,2,3,4-тетрагидро-2-нафтиламин,
(S)-N-пропил-N-[6-оксо-6-[2- (2-оксо-3H-1,3-бензтиазол-6-ил)этиламино] гексил]-5,6-дигидрокси- 1,2,3,4-тетрагидро-2-нафтиламин,
(S)-N-пропил-N-[6-[2-(3- нитро-4-гидроксифенил)этиламино]гексил]-5,6-дигидрокси-1,2,3,4- тетрагидро-2-нафтиламин,
(R)-N-пропил-N-[6-[2-(4- метилсульфонилфенил)этиламино]гексил]-6,7-дигидрокси-1,2,3,4- тетрагидро-2-нафтиламин,
(S)-N-пропил-N-[6-[3-(3,4- дигидроксифенил)пропиламино]гексил]-5,6-дигидрокси-1,2,3,4- тетрагидро-2-нафтиламин,
(S)-N-пропил-N-[6-[2-(2,3-дигидро-3-оксо- 1H-индазол-5-ил)этиламино] гексил]-5,6-дигидрокси-1,2,3,4- тетрагидро-2-нафтиламин,
(S)-N-пропил-N-[6-[2-(3-метил-4- гидроксифенил)этиламино] гексил]-5,6-дигидрокси-1,2,3,4- тетрагидро-2-нафтиламин,
(S)-N-пропил-N-[6-[2-(2,3-дигидро-2- оксо-1H-бензимидазол-5-ил)этиламино]гексил]-5,6-дигидрокси- 1,2,3,4-тетрагидро-2-нафтиламин,
(S)-N-пропил-N-[6-[4-(4- гидроксифенилметил)пиперазин-1-ил] гексил] -5,6-дигидрокси- 1,2,3,4-тетрагидро-2-нафтиламин,
(S)-N-пропил-N-[6-[2-(2,3- дигидро-2-оксо-3H-бензоксазол-6-ил)этиламино] гексил]-5,6- дигидрокси-1,2,3,4-тетрагидро-2-нафтиламин,
(S)-N-пропил-N-[6-[3-(2-гидроксифенил)пропиламино]гексил] -5,6-дигидрокси-1,2,3,4-тетрагидро-2-нафтиламин,
(S)-N-пропил-N- [6-[2-(4-аминофенил)этиламино] гексил]-5,6-дигидрокси-1,2,3,4- тетрагидро-2-нафтиламин,
(S)-N-пропил-N-[6-[2-(3,5-дигидрокси- 4-метилфенил)этиламино] гексил]-5,6-дигидрокси-1,2,3,4-тетрагидро- 2-нафтиламин,
(S)-N-пропил-N-[6-(2-фенилэтиламино)гексил] -6- гидрокси-5-гидроксиметил-1,2,3,4-тетрагидро-2-нафтиламин,
(S)-N-пропил-N-[6-[2-(2-оксо-3H-1,3-бензтиазол-6-ил)этиламино] гексил] - 5,6-дигидрокси-1,2,3,4-тетрагидро-2-нафтиламин,
(S)-N-пропил-N-[6-(2-фенилэтиламино)гексил] -5-формиламино-6-гидрокси -1,2,3,4-тетрагидро-2-нафтиламин,
(S)-N-пропил-N-[6-[2-(2-оксо-3H- 1,3-бензтиазол-5-ил)этиламино] гексил] -5,6-дигидрокси-1,2,3,4- тетрагидро-2-нафтиламин,
(S)-N-пропил-N-[6-(2- фенилэтиламино)гексил] -6-гидрокси-5-метилсульфониламино-1,2,3,4- тетрагидро-2-нафтиламин,
(S)-N-пропил-N-[6-[2-(2-оксо-3H-1,3- бензтиазол-6-ил)этиламино] гексил] -5-гидрокси-1,2,3,4- тетрагидро-2-нафтиламин,
(S)-N-пропил-N-[6-(2- фенилэтиламино)гексил] -5,6-дигидрокси-4-метил-1,2,3,4-тетрагидро- 2-нафтиламин,
(S)-N-пропил-N-[6-[2-(3-хлор-5- гидроксифенил)этиламино]гексил]-5,6-дигидрокси-1,2,3,4- тетрагидро-2-нафтиламин,
(S)-N-пропил-N-[6-(2-фенилэтиламино)гексил] -6-гидрокси-5-метил- 1,2,3,4-тетрагидро-2-нафтиламин,
(S)-N-пропил-N-[6-[2-(4- метилсульфонилфенил)этиламино] гексил]-5,6-дигидрокси-1,2,3,4- тетрагидро-2-нафтиламин,
(S)-N-пропил-N-[6-(2- фенилэтиламино)гексил] -6-гидрокси-5-метиламино-1,2,3,4- тетрагидро-2-нафтиламин,
(S)-N-пропил-N-[6-(2,3-дигидроиндол-1- ил)гексил] -5,6-дигидрокси-1,2,3,4- тетрагидро-2-нафтиламин,
(S)-N-пропил-N-[6-[2-(3-хлор-4-гидроксифенил)этиламино]гексил]- 6-гидрокси-5-гидроксиметил-1,2,3,4-тетрагидро-2-нафтиламин,
(S)-N-пропил-N-[6-[2-(4-гидроксифенокси)этиламино]гексил] -5,6-дигидрокси-1,2,3,4-тетрагидро-2-нафтиламин,
(S)-N-пропил-N-[6-[2-(3-хлор-4-гидроксифенил)этиламино]гексил] -5-формиламино-6-гидрокси-1,2,3,4-тетрагидро-2-нафтиламин,
(S)-N-пропил-N-[6-[2-(3,4-дигидроксифенил)этокси]гексил]-5,6-дигидрокси- 1,2,3,4-тетрагидро-2-нафтиламин,
(S)-N-пропил-N-[6-[2-(3-хлор-4- гидроксифенил)этиламино] гексил]-5-гидрокси-6- метилсульфониламино-1,2,3,4-тетрагидро-2-нафтиламин,
(S)-N-пропил-N-[6-[2-(3-метокси-4-гидроксифенил)этиламино] гексил] - 5,6-дигидрокси-1,2,3,4-тетрагидро-2-нафтиламин,
(S)-N-пропил-N-[6-[2-(3-хлор-4-гидроксифенил)этиламино] гексил] -5,6-дигидрокси-4-метил-1,2,3,4-тетрагидро-2-нафтиламин,
(S)-N-пропил-N-[6-[2- (3-гидрокси-4-метоксифенил)этиламино] гексил] -5,6-дигидрокси- 1,2,3,4-тетрагидро-2-нафтиламин,
(S)-N-пропил-N-[6-[2-(3-хлор-4- гидроксифенил)этиламино] гексил]-6-гидрокси-5-метил-1,2,3,4- тетрагидро-2-нафтиламин,
(S)-N-пропил-N-[6-[2-(3,4- дигидроксифенил)этилтио] гексил] -5,6-дигидрокси-1,2,3,4- тетрагидро-2-нафтиламин,
(S)-N-пропил-N-[6-[2-(3-хлор-4- гидроксифенил)этиламино]гексил]-6-гидрокси-5-метиламино- 1,2,3,4-тетрагидро-2-нафтиламин,
(S)-N-пропил-N-[6-[2-(3- амино-4-гидроксифенил)этиламино] гексил]-5,6-дигидрокси- 1,2,3,4-тетрагидро-2-нафтиламин,
(S)-N-пропил-N-[6-[2-(4- метилсульфонилфенил)этиламино] гексил] -6-гидрокси-5-гидроксиметил- 1,2,3,4-тетрагидро-2-нафтиламин,
(S)-N-пропил-N-[6-[2-(4- сульфамоилфенил)этиламино] гексил] -5,6-дигидрокси-1,2,3,4- тетрагидро-2-нафтиламин,
(S)-N-пропил-N-[6-[2-(4- метилсульфонилфенил)этиламино] гексил] -5-формиламино-6- гидрокси-1,2,3,4-тетрагидро-2-нафтиламин,
(S)-N-пропил-N-[6-[2-(4-метилсульфониламинофенил)этиламино] гексил] -5,6-дигидрокси-1,2,3,4-тетрагидро-2-нафтиламин,
(S)-N-пропил-N-[6-[2-(4-метилсульфонилфенил)этиламино] гексил] -6-гидрокси-5-метилсульфониламино-1,2,3,4-тетрагидро-2-нафтиламин,
(S)-N-пропил-N-[6-[2-(4- аминокарбониламинофенил)этиламино] гексил] -5,6-дигидрокси- 1,2,3,4-тетрагидро-2-нафтиламин,
(S)-N-пропил-N-[6-[2-(4- метилсульфонилфенил)этиламино] гексил]-5,6-дигидрокси-4-метил- 1,2,3,4-тетрагидро-2-нафтиламин,
(S)-N-пропил-N-[6-[2-(4- ацетиламинофенил)этиламино] гексил]-5,6-дигидрокси-1,2,3,4- тетрагидро-2-нафтиламин,
(S)-N-пропил-N-[6-[2-(4- метилсульфонилфенил)этиламино] гексил] -6-гидрокси-5-метил- 1,2,3,4-тетрагидро-2-нафтиламин,
(S)-N-пропил-N-[6-[(3,4- дигидроксифенил)ацетиламино]гексил]-5,6-дигидрокси-1,2,3,4- тетрагидро-2-нафтиламин,
(S)-N-пропил-N-[6-[2-(4- метилсульфонилфенил)этиламино] гексил] -6-гидрокси-5-метиламино- 1,2,3,4-тетрагидро-2-нафтиламин,
(S)-N-пропил-N-[6-[2-(4- метоксикарбонилфенил)этиламино] гексил] -5,6-дигидрокси-1,2,3,4- тетрагидро-2-нафтиламин,
(S)-N-пропил-N-[6-[2-(4- гидроксиметилфенил)этиламино]гексил]-5,6-дигидрокси -1,2,3,4- тетрагидро-2-нафтиламин,
(S)-N-пропил-N-[6-[2-(4- карбамоилфенил)этиламино] гексил] -5,6-дигидрокси-1,2,3,4- тетрагидро-2-нафтиламин,
(S)-N-пропил-N-[6-[2-(4- карбоксифенил)этиламино] гексил]-5,6-дигидрокси-1,2,3,4- тетрагидро-2-нафтиламин,
(S)-N-пропил-N-[6-[2-(4- сульфофенил)этиламино]гексил]-5,6-дигидрокси-1,2,3,4-тетрагидро- 2-нафтиламин,
(S)-N-пропил-N-[6-[2-(2-амино-1,3-бензтиазол-6- ил)этиламино] гексил]-5,6-дигидрокси-1,2,3,4-тетрагидро-2- нафтиламин.
Фармацевтически приемлемые соли соединений формулы I представляют собой соли органических и неорганических кислот, например, таких как, соляная, бромисто-водородная, йодисто-водородная, азотная, серная, фосфорная, уксусная, бензойная, малеиновая, фумаровая, янтарная, винная, лимонная, аспарагиновая, метансульфоновая и 3,7-ди-трет-бутилнафталин-1,5- дисульфоновая кислота (дибудиновая кислота).
Соединения формулы I могут быть получены в соответствии со способом синтеза, приведенным ниже в данном описании.
Этот способ включает взаимодействие соединения формулы
где R1 и R2 имеют указанные выше значения;
R9, R10 и R11 обозначают атомы водорода или OZ-группы, где Z обозначает атом водорода или защитную группу, выбранную, например, из метила, бензила, бензоила и 4-метоксибензоила, при условии, что по крайней мере один из R9, R10 и R11 обозначает атом водорода, но R9, R10 и R11 все одновременно не обозначают атомы водорода и R10 и R11 оба одновременно не обозначают OZ-группы; или
один из R10 и R11 обозначает группу NHCHO, NHCH3, NHSO2CH3, CH2ОН или CH3, а другой обозначает водород;
с кислотой формулы
где m, p, R4, R5, R6, X и Y имеют указанные выше значения; W обозначает группу CH2 или CO; Q обозначает группу формулы
CO-(CH2)n-1-CHR3,
где R3 имеет указанные выше значения, когда n равно 1, 2, 3 или 4; или Q обозначает группу CHR3 или CO, где R3 имеет указанные выше значения, когда n равно 0;
или с ее реакционноспособным производным, таким как ацилгалогенид или смешанный ангидрид, который необязательно может быть получен in situ, в инертном растворителе и в присутствии основания, такого как карбонат либо бикарбонат щелочного металла или третичный амин,
с получением промежуточного соединения формулы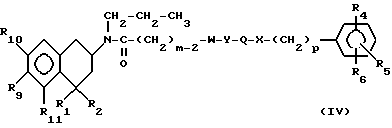
где m, p, W, Y, Q, X, R1, R2, R4, R5, R6, R9, R10 и R11 имеют указанные выше значения; и восстановление полученных соединений до или после необязательного удаления гидроксизащитных групп с получением соединения формулы I.
Восстановление соединений формулы IV может быть осуществлено с помощью электрофильных восстановителей, в частности диборана, необязательно используемого в виде комплекса с диметилсульфидом, тетрагидрофураном, алифатическими аминами, такими как триэтиламин, или ароматическими аминами, такими как N,N-диэтиланилин или пиридин.
В альтернативном варианте восстановление может быть осуществлено с помощью нуклеофильных восстановителей, таких как гидриды металлов, например алюмогидрид лития.
Реакцию восстановления осуществляют в пригодном растворителе, таком как, например, тетрагидрофуран, диэтиловый эфир или 1,2-диметоксиэтан.
Необязательное удаление гидроксизащитных групп осуществляют в соответствии со стандартными методами, такими как гидролиз или гидрогенолиз.
Соединения формулы II являются известными или легко могут быть получены в соответствии с известными способами (патент Великобритании 1509454, The Wellcome Foundation Ltd.).
Соединения формулы III также являются известными или легко могут быть получены в соответствии со стандартными способами.
В альтернативном варианте соединения формулы I, в которых Y обозначает N(R7), могут быть получены с помощью другого способа.
Сначала осуществляют реакцию конденсации между соединением формулы II и пригодным реакционноспособным производным кислоты формулы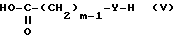
где Y обозначает группу N (R7); m и R7 имеют указанные выше значения; с последующим необязательным восстановлением, используя описанную выше методику, с получением промежуточного продукта формулы
где Y обозначает группу N(R7); m, W, R1, R2, R7, R9, R10 и R11 имеют указанные выше значения.
Затем промежуточный продукт формулы VI подвергают взаимодействию с пригодным для этой цели реакционноспособным производным кислоты формулы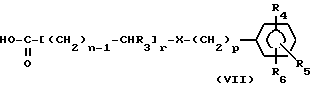
где n, p, R3, R4, R5, R6 и X имеют указанные выше значения; r равно 0 или 1; с получением соответствующих промежуточных продуктов формулы IV.
Последующее восстановление до или после необязательного удаления гидроксизащитных групп приводит к получению соединений формулы I, в которых Y обозначает группу N(R7), являющихся предметом настоящего изобретения.
Другой альтернативный вариант получения соединений формулы I, в которых Y обозначает группу N(R7), состоит прежде всего во взаимодействии соединения формулы II с пригодным реакционноспособным производным бикарбоновой кислоты формулы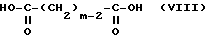
где m имеет указанные ранее значения;
с получением промежуточного продукта формулы
где m, R1, R2, R9, R10 и R11 имеют указанные выше значения.
Последующая конденсация с амином формулы
где Y обозначает группу N(R7); n, p, X, R3, R4, R5, R6 и R7 имеют указанные выше значения; приводит к получению соответствующих промежуточных продуктов формулы IV.
Последующее восстановление до или после необязательного удаления гидроксизащитных групп дает возможность получить соединения формулы I, в которых Y обозначает группу N(R7), являющихся предметом настоящего изобретения.
Некоторые соединения формулы I, которые необязательно являются защищенными, также могут применяться в качестве промежуточных продуктов для синтеза других соединений формулы I путем превращения определенных функциональных групп, присутствующих в молекуле.
Так, например, соединения формулы I, в которых один или несколько радикалов R4, R5 и R6 обозначают нитрогруппу или алкоксикарбонильную группу, могут быть превращены в соответствующие соединения формулы I, в которых один или несколько радикалов R4, R5 и R6 обозначают амино- или карбоксильную группу, путем соответственно восстановления или гидролиза. В свою очередь соединения формулы I, в которых один или несколько радикалов R4, R5 и R6 обозначают аминогруппу или карбоксильную группу, могут быть превращены в соответствующие соединения формулы I, в которых один или несколько радикалов R4, R5 и R6 обозначают алкилкарбониламино- или CH2-группу, путем соответственно ацилирования или восстановления.
Аналогичным образом может быть осуществлено такое же превращение промежуточных продуктов формулы IV.
Соединения формулы I в оптически активной форме получают путем оптического разделения или путем стереоспецифического или стереоселективного синтеза.
Получение солей формулы I осуществляют в соответствии со стандартными методами.
Соединения формулы I являются агонистами D1- и D2-дофаминергических рецепторов, обладающими большим сродством, чем дофамин и чем дофексамин, как было установлено в опытах по связыванию in vitro (пример 98).
Кроме того, их активность по крайней мере сравнима с таковой, выявленной для соединений, описанных в международной заявке WO 93/19036.
Результаты, полученные в опытах in vitro, также были подтверждены функциональными исследованиями на выделенных тканях, которые являются моделями для выявления активности in vivo, такими как тест с использованием сонной артерии кролика (САК) и тест с использованием ушной артерии кролика (УАК) (пример 99).
Активность in vivo соединений формулы I, которые являются предметом настоящего изобретения, оценивали путем внутривенного и орального введения крысам (пример 100).
Опыты по взаимодействию с другими рецепторными системами показали, что соединения формулы I не проявляют существенного взаимодействия с ними и, следовательно, обладают высокой специфичностью.
Было установлено, что соединения формулы I также не обладают активностью по отношению к центральной нервной системе после орального введения, что является дополнительной положительной характеристикой, обычно не свойственной другим соединениям, имеющим такое же строение, как и катехоламин.
Очевидно, что эти характеристики селективности и рецепторной специфичности наряду с отсутствием воздействия на центральную нервную систему делают соединения формулы I особенно пригодными для лечения сердечно-сосудистых заболеваний и прежде всего для антигипертензивной терапии и сердечной недостаточности, почечной недостаточности, для лечения периферических артериопатий, цереброваскулярных недостаточностей и ишемической кардиопатии.
В дополнение к уже указанной выше фармакологической активности еще одной особенностью, характерной для соединений формулы I, которые составляют предмет изобретения, является их способность абсорбироваться при оральном введении и их пролонгированная активность.
Вследствие этого при практическом применении в области терапии соединения формулы I могут быть введены парентерально, равно как и энтерально, что отличает их от дофамина и от дофексамина.
Терапевтические дозы обычно составляют от 5 мг до 1 г в день и от 1 до 300 мг при оральном введении для каждого разового введения.
Кроме того, предметом настоящего изобретения являются фармацевтические композиции, содержащие терапевтически эффективное количество соединений формулы I или их фармацевтически приемлемых солей в смеси с пригодным носителем.
Фармацевтические композиции, являющиеся предметом изобретения, могут быть жидкими, пригодными для энтерального или парентерального введения, и предпочтительно твердыми, например в виде таблеток, капсул, гранул, пригодных для орального введения.
Получение фармацевтических композиций, являющихся предметом изобретения, может быть осуществлено в соответствии со стандартными методами.
Несмотря на то что соединения формулы I также являются активными при оральном введении, с целью удовлетворить некоторые определенные терапевтические или фармацевтические требования может оказаться целесообразным превратить их в соответствующие пролекарства.
В соответствии с методами, применяемыми в области химии производных фенола и катехола, соответствующие пролекарства получают путем этерификации одной или двух гидроксильных групп с фармацевтически приемлемыми солями.
Конкретными примерами пролекарств соединений формулы I являются ацетокси-производные, в которых гидроксильные группы этерифицируют уксусной кислотой, и моно- или дифосфонаты, в которых одну или обе гидроксильные группы этерифицируют фосфорной кислотой.
Настоящее изобретение также включает соединения формулы I в форме соответствующих пролекарств, в частности соединения, получаемые путем этерификации гидроксильных групп фенола или одной либо обеих гидроксильных групп катехола фармацевтически приемлемыми кислотами, а также фармацевтические композиции, содержащие соединение формулы I в виде соответствующего пролекарства и прежде всего содержащие соединение формулы I, в котором гидроксильные группы фенола или одна либо обе гидроксильные группы катехола этерифицированы фармацевтически приемлемыми кислотами.
Ниже настоящее изобретение проиллюстрировано на примерах.
Хроматографическую очистку осуществляли на колонках с силикагелем (230-400 меш).
Масс-спектрометрию, если не указано иное, осуществляли в следующих условиях: химическая ионизация, изобутан, положительные ионы.
Использованы следующие аббревиатуры: ДМФ для N,N-диметилформамида, ТГФ для тетрагидрофурана и ДМСО для диметилсульфоксида.
Пример 1
Получение 6-[(4-метоксифенилтио)ацетиламино]капроновой кислоты (промежуточный продукт 1)
К раствору, содержащему (4-метоксифенилтио)уксусную кислоту (2 г; 10,1 ммоля), полученную согласно J. Org. Chem., 56 (18), 5346-8 (1991), в CH2Cl2 (20 мл), при перемешивании и при комнатной температуре добавляли ДМФ (50 мкл) и тионилхлорид (1,8 г; 15,1 ммоля). Через 1 час растворитель выпаривали при пониженном давлении и образовавшееся масло растворяли в CH2Cl2 (3 мл). Полученный раствор и раствор 4 н. NaOH (3 мл) одновременно добавляли по каплям при интенсивном перемешивании к раствору, содержащему 6-аминокапроновую кислоту (1,3 г; 9,9 ммоля) и NaOH (0,4 г; 10 ммолей) в воде (5 мл). Реакционную смесь выдерживали при перемешивании и при комнатной температуре в течение 2 часов. После разделения фаз водную фазу промывали CH2Cl2 (5 мл), подкисляли 37%-ной HCl до pH 1 и затем экстрагировали CH2Cl2 (20 мл). Органическую фазу сушили над Na2SO4. После охлаждения до 0oC и фильтрации образовавшегося твердого вещества получали промежуточный продукт 1 (2,4 г).
1H-ЯМР (200 МГц; ДМСО-d6): δ (част./млн): 1,15-1,62 (m, 6H); 2,15 (t, 2H); 3,00 (m, 2H); 3,56 (s, 2H); 3,73 (s, 3H); 6,85-7,18 (m, 4H); 7,95 (bt, 1H).
МС: 312 [M+1].
Аналогично описанной выше методике были получены следующие соединения.
6-[(4-фенилметоксифенокси)ацетиламино] капроновая кислота (промежуточный продукт 2) с использованием в качестве исходного продукта (4-фенилметоксифенокси)уксусной кислоты, полученной согласно J. Med. Chem., 15(9), 940-4 (1972).
1H-ЯМР (200 МГц; ДМСО-d6): δ (част./млн): 1,10-1,56 (m, 6H); 2,17 (t, 2H); 3,07 (m, 2H); 4,36 (s, 2H); 5,02 (s, 2H); 6,82-6,98 (m, 4H); 7,24-7,45 (m, 5H); 8,01 (bt, 1H); 12,00 (bs, 1H).
МС: 372 [M+1];
6-[3-(4-метоксифенил)пропиониламино] капроновая кислота (промежуточный продукт 3) с использованием в качестве исходного продукта 3-(4-метоксифенил)пропионовой кислоты (фирма Aldrich).
1H-ЯМР (200 МГц; CDCl3): δ (част./млн): 1,15-1,67 (m, 6H); 2,30 (t, 2H); 2,41 (t, 2H); 2,87 (t, 2H); 3,18 (m, 2H); 3,76 (s, 3H); 5,43 (bt, 1H); 6,75-7,14 (m, 4H).
МС: 294 [M+1].
6-[(3,4-метилендиоксифенил)ацетиламино]капроновая кислота (промежуточный продукт 4) с использованием в качестве исходного продукта (3,4-метилендиоксифенил)уксусной кислоты (фирма Aldrich).
1H-ЯМР (200 МГц; CDCl3): δ (част./млн): 1,17-1,68 (m, 6H); 2,31 (t, 2H); 3,19 (m, 2H); 3,46 (s, 2H); 5,47 (bt, 1H); 5,95 (s, 2H); 6,62-6,80 (m, 3H).
МС: 294 [M+1].
6-[(1,4-бенздиоксан-2-ил)карбониламино]капроновая кислота (промежуточный продукт 5) с использованием в качестве исходного продукта 2-карбокси-1,4-бенздиоксана, полученного согласно J. Am. Chem. Soc., 77, 5373 (1955).
1H-ЯМР (200 МГц; ДМСО-d6): δ (част./млн): 1,21-1,69 (m, 6H); 2,32 (t, 2H); 3,31 (m, 2H); 4,16 (dd, 1H); 4,49 (dd, 1H); 4,66 (dd, 1H); 6,57 (bt, 1H); 6,81-6,98 (m, 4H).
МС: 294 [M+1].
6-[3-(2-метоксифенил)пропиониламино] капроновая кислота (промежуточный продукт 6) с использованием в качестве исходного продукта 3-(2-метоксифенил)пропионовой кислоты (фирма Aldrich).
1H-ЯМР (300 МГц; CDCl3): δ (част./млн): 1,15-1,67 (m, 6H); 2,30 (t, 2H); 2,46 (t, 2H); 2,91 (t, 2H); 3,18 (m, 2H); 3,81 (s, 3H); 5,55 (bt, 1H); 6,79-7,25 (m, 4H).
МС: 294 [M+1].
6-[(2-нитрофенокси)ацетиламино]капроновая кислота (промежуточный продукт 7) с использованием в качестве исходного продукта (2-нитрофенокси)уксусной кислоты, полученной согласно J. Med. Chem., 27, 967-78 (1984).
1H-ЯМР (200 МГц; CDCl3): δ (част./млн): 1,30-1,74 (m, 6H); 2,33 (t, 2H); 3,30-3,42 (m, 2H); 4,62 (s, 2H); 7,27 (bt, 1H); 7,00- 8,04 (m, 4H).
МС: 311 [M+1].
6-[(4 -нитрофенокси)ацетиламино] капроновая кислота (промежуточный продукт 8) с использованием в качестве исходного продукта (4-нитрофенокси)уксусной кислоты, полученной согласно J. Med. Chem., 27, 967-78 (1984).
1H-ЯМР (200 МГц; ДМСО-d6): δ (част./млн): 1,10-1,55 (m, 6H); 2,16 (t, 2H); 3,09 (m, 2H); 4,62 (s, 2H); 7,13 (m, 2H); 8,14-8,26 (m, 3H).
МС: 311 [M+1].
6-[(4-метилсульфонилфенокси)ацетиламино] капроновая кислота (промежуточный продукт 9) с использованием в качестве исходного продукта (4-метилсульфонилфенокси) уксусной кислоты, полученной согласно J. Med. Chem., 27, 967-78 (1984).
1H-ЯМР (200 МГц; ДМСО-d6): δ (част./млн): 1,12-1,56 (m, 6H); 2,17 (t, 2H); 3,02-3,15 (m, 2H); 3,14 (s, 3H); 4,59 (s, 2H); 7,13 (m, 2H); 7,85 (m, 2H); 8,16 (bt, 1H); 12,01 (bs, 1H).
МС: 344 [M+1].
6-[(4-нитрофенил)ацетиламино] капроновая кислота (промежуточный продукт 10) с использованием в качестве исходного продукта (4-нитрофенил)уксусной кислоты (фирма Aldrich).
1H-ЯМР (200 МГц; ДМСО-d6): δ (част./млн): 1,12-1,57 (m, 6H); 2,17 (t, 2H); 2,96-3,10 (m, 2H); 3,55 (s, 2H); 7,47-7,57 (m, 2H); 8,07- 8,20 (m, 3H).
МС: 295 [M+1].
Пример 2
Получение 6-(6,7-диметокси- 1,2,3,4-тетрагидроизохинолин-2-ил)-6-оксокапроновой кислоты (промежуточный продукт 11)
Раствор монометилового эфира хлорангидрида гександиовой кислоты (3,6 г; 20,2 ммоля) в CH2Cl2 (10 мл) добавляли при комнатной температуре и при перемешивании к раствору, содержащему гидрохлорид 6,7-диметокси-1,2,3,4-тетрагидроизохинолина (3,1 г; 13,5 ммоля) (фирма Aldrich) и триэтиламин (3,7 г; 37,1 ммоля) в CH2Cl2 (50 мл). Через 2 часа добавляли воду (50 мл) и разделяли фазы. Органическую фазу промывали водным раствором 0,2 н. HCl и затем насыщенным раствором NaCl2. После сушки над Na2SO4 и упаривания досуха при пониженном давлении остаток растворяли в метаноле (10 мл). К образовавшемуся раствору по каплям при комнатной температуре и при перемешивании добавляли раствор NaOH (1,1 г; 27,5 ммоля) в воде (5 мл) и реакционную смесь выдерживали при перемешивании в течение 2 часов. После выпаривания метанола при пониженном давлении добавляли воду (10 мл), CH2Cl2 (20 мл) и 37%-ную HCl до pH 1. После разделения фаз водную фазу вновь экстрагировали CH2Cl2 (20 мл). Объединенные органические фазы сушили над Na2SO4, получая после выпаривания растворителя промежуточный продукт 11 (3,6 г) в виде масла.
1H-ЯМР (200 МГц; CDCl3): δ (част./млн): 1,54-1,80 (m, 4H); 2,27-2,49 (m, 4H); 2,69-2,85 (m, 2H); 3,65 и 3,79 (2t, 2H); 3,84 (s, 6H); 4,53 и 4,64 (2s, 2H); 6,58 и 6,61 (2s, 2H).
МС: 322 [M+1].
Аналогично описанной выше методике были получены следующие соединения.
6-[4-(2-метоксифенил)пиперазин-1- ил]-6-оксокапроновая кислота (промежуточный продукт 12) с использованием в качестве исходного продукта 4-(2-метоксифенил)пиперазина (фирма Aldrich).
1H-ЯМР (200 МГц; ДМСО-d6): δ (част./млн): 1,42-1,59 (m, 4H); 2,13-2,40 (m, 4H); 2,81-3,00 (m, 4H); 3,50-3,61 (m, 4H); 3,78 (s. 3H); 6,82-7,01 (m, 4H).
МС (химическая ионизация, метан, положительные ионы): 321 [M+1].
6-(2,3-дигидроиндол-1-ил)-6-оксокапроновая кислота (промежуточный продукт 13) с использованием в качестве исходного продукта 2,3-дигидроиндола (фирма Aldrich).
1H-ЯМР (200 МГц; CDCl3): δ (част./млн): 1,69-2,00 (m, 4H); 2,32-2,66 (m, 4H); 3,23 (t, 2H); 4,10 (t, 2H); 6,97-8,31 (m, 4H).
МС: 248 [M+1].
Пример 3
Получение 6-[2-[3,4-ди(фенилметокси)фенил] этокси] капроновой кислоты (промежуточный продукт 14)
К раствору, содержащему 2-[3,4-ди(фенилметокси)фенил]этанол (9 г; 26,9 ммоля), полученный согласно J. Med. Chem., 28(9), 1269-73 (1985), и 1,5-дибромпентан (12,4 г; 53,9 ммоля) в ТГФ (200 мл) и ДМФ (20 мл), в атмосфере азота при комнатной температуре добавляли NaH (0,7 г; 29,2 ммоля). Реакционную смесь кипятили с обратным холодильником при перемешивании в течение 5 часов и затем сливали в водный раствор 1 н. HCl (500 мл). После экстракции этиловым эфиром (2х200 мл) органическую фазу промывали водой, сушили над Na2SO4 и упаривали досуха при пониженном давлении. Неочищенный продукт очищали с помощью хроматографии (элюент петролейный эфир:этилацетат = 75:25), получая этиловый эфир 5-бромпентил-2- [3,4-ди(фенилметокси)фенила] (4 г) в виде масла.
1H-ЯМР (200 МГц; CDCl3): δ (част./млн): 1,37-1,65 (m, 4H); 1,76-1,92 (m, 2H); 2,77 (t, 2H); 3,38 (t, 2H); 3,39 (t, 2H); 3,55 (t, 2H); 5,12 (s, 2H); 5,13 (s, 2H); 6,68-6,88 (m, 3H); 7,23-7,49 (m, 10H).
МС: 483 и 485 [M+1].
К суспензии магниевой стружки (0,2 г; 8,3 ммоля) в ТГФ (5 мл) в атмосфере азота при комнатной температуре добавляли йод (20 мг) и через десять минут по каплям раствор этилового эфира 5-бромпентил-2-[3,4- ди(фенилметокси)фенила] (3,8 г; 7,9 ммоля) в ТГФ (25 мл). Реакционную смесь кипятили с обратным холодильником при перемешивании в течение 5 часов, затем охлаждали до комнатной температуры и сливали в колбу, содержащую сухой лед. После нагревания до комнатной температуры добавляли этиловый эфир и водный раствор 1 н. HCl. Фазы разделяли и органическую фазу сушили над Na2SO4. После упаривания досуха при пониженном давлении неочищенный продукт очищали с помощью хроматографии (элюент CH2Cl2:CH3OH:50%-ная HCOOH = 95:5:0,5), получая промежуточный продукт 14 (2 г) в виде белого твердого вещества.
1H-ЯМР (200 МГц; CDCl3): δ (част./млн): 1,24-1,71 (m, 6H); 2,32 (t, 2H); 2,77 (t, 2H); 3,35-3,66 (m, 4H); 5,12 (s, 2H); 5,13 (s, 2H); 6,68-6,89 (m, 3H); 7,22-7,49 (m, 10H).
МС: 449 [M+1].
Пример 4
Получение 1-(4-метоксифенилметил)пиперазина (промежуточный продукт 15)
К раствору, содержащему пиперазин (21,5 г; 250 ммолей), триэтиламин (3 г; 30 ммолей) и йодид калия (4,1 г; 25 ммолей) в ДМФ (150 мл), добавляли 4-метоксифенилметилхлорид (3,9 г; 25 ммолей) (фирма Aldrich). Через 5 часов реакционную смесь сливали на воду и 3 раза экстрагировали этиловым эфиром. Водную фазу концентрировали до небольшого объема, выпаривая растворители при пониженном давлении, и вновь 3 раза экстрагировали этиловым эфиром. Органические фазы объединяли с полученными ранее, сушили над Na2SO4 и упаривали досуха при пониженном давлении. Неочищенный продукт очищали с помощью хроматографии (элюент CH2Cl2:CH3OH:30%-ный аммиак = 90:10:1), получая промежуточный продукт 15 (4,4 г) в виде масла.
1H-ЯМР (200 МГц; CDCl3): δ (част./млн): 1,74 (s, 1H); 2,36 (m, 4H); 2,84 (m, 4H); 3,40 (s, 2H); 3,77 (s, 3H); 6,82 (m, 2H); 7,20 (m, 2H).
МС: 207 [M+1].
Пример 5
Получение трет-бутилдиметилсилилового эфира (3-хлор-4-трет- бутилдиметилсилилокси)фенилуксусной кислоты (промежуточный продукт 16)
К раствору, содержащему (3-хлор-4-гидрокси)фенилуксусную кислоту (1 г; 5,3 ммоля) (фирма Aldrich) и трет-бутилдиметилсилилхлорид (2 г; 13,3 ммоля) в ДМФ (6 мл), в атмосфере азота при комнатной температуре добавляли имидазол (1,8 г; 26,4 ммоля). Реакционную смесь выдерживали при перемешивании и при комнатной температуре в течение 5 часов, затем сливали на водный раствор 5%-ного Na2CO3 (25 мл) и экстрагировали гексаном (2х30 мл). Органическую фазу сушили над Na2SO4 и растворитель выпаривали при пониженном давлении, получая промежуточный продукт 16 (2,2 г) в виде масла.
1H-ЯМР (200 МГц; CDCl3): δ (част./млн): 0,19 (s, 6H); 0,21 (s, 6H); 0,85 (s, 9H); 1,00 (s, 9H); 3,50 (s, 2H); 6,81 (d, 1H); 6,99 (dd, 1H), 7,24 (d, 1H).
МС: 415 [M+1].
Аналогично описанной выше методике были получены следующие соединения.
трет-Бутилдиметилсилиловый эфир (3-нитро-4-трет-бутилдиметилсилилокси) фенилуксусной кислоты (промежуточный продукт 17) с использованием в качестве исходного продукта (3-нитро-4-гидрокси) фенилуксусной кислоты (фирма Aldrich).
1H-ЯМР (200 МГц; CDCl3): δ (част./млн): 0,22 (s, 6H); 0,23 (s, 6H); 0,85 (s, 9H); 0,99 (s, 9H); 3,59 (s, 2H); 6,91 (d, 1H), 7,32 (dd, 1H), 7,70 (d, 1H).
МС: 426 [M+1].
трет-Бутилдиметилсилиловый эфир (3-метокси-4-трет-бутилдиметилсилилокси)фенилуксусной кислоты (промежуточный продукт 18)с использованием в качестве исходного продукта (3-метокси-4-гидрокси)фенилуксусной кислоты (фирма Aldrich).
1H-ЯМР (200 МГц; CDCl3): δ (част./млн): 0,11 (s, 6H); 0,20 (s, 6H); 0,82 (s, 9H); 0,96 (s, 9H); 3,50 (s.2H); 3,77 (s, 3H), 6,64-6,79 (m, 3H).
МС: 411 [M+1].
Пример 6
Получение 6-[2-[3,4-ди(фенилметокси)фенил] этилтио] капроновой кислоты (промежуточный продукт 19)
Раствор брома (9,6 г; 60,0 ммолей) в безводном ДМФ (50 мл) добавляли по каплям при перемешивании к раствору 2-[3,4-ди(фенилметокси)фенил]этанола (20,0 г; 59,8 ммоля) и трифенилфосфина (17,2 г; 65,6 ммоля) в безводном ДМФ (200 мл), выдерживая в атмосфере азота при 0oC. Реакционную смесь нагревали до комнатной температуры и перемешивали в течение 1,5 ч, затем сливали на воду и лед и дважды экстрагировали этиловым эфиром. Объединенные органические фазы сушили над Na2SO4 и растворитель удаляли при пониженном давлении. Остаток очищали с помощью хроматографии (элюент петролейный эфир:этилацетат = 95:5), получая 2-[3,4-ди(фенилметокси)фенил]-1-бромэтан (16,3 г) в виде белого твердого вещества.
1H-ЯМР (200 МГц; CDCl3): δ (част./млн): 3,04 (t, 2H); 3,47 (t, 2H); 5,13 (s, 2H); 5,14 (s, 2H); 6,70 (dd, 1H); 6,78 (d, 1H), 6,87 (d, 1H), 7,25-7,48 (m, 10H).
МС: 397, 399 [M+1].
Раствор 2-[3,4-ди(фенилметокси)фенил]-1- бромэтана (13,9 г; 35,0 ммолей) и тиомочевины (3,5 г; 46,0 ммолей) в абсолютном этаноле (50 мл) кипятили при перемешивании с обратным холодильником в течение 16 часов в атмосфере азота. Растворитель удаляли при пониженном давлении и добавляли водный раствор 1,4 н. NaOH (50 мл). Смесь кипятили с обратным холодильником в течение 1,5 ч, затем сливали на воду и лед. Добавляли концентрированную HCl до pH 1 и смесь дважды экстрагировали этиловым эфиром. Объединенные органические фазы промывали водой, сушили над Na2SO4 и растворитель удаляли при пониженном давлении, получая 2-[3,4-ди(фенилметокси)фенил]этанэтиол (12,0 г) в виде масла.
1H-ЯМР (200 МГц; CDCl3): δ (част./млн): 1,29 (t, 1H); 2,61-2,86 (m, 4H); 5,12 (s, 3H); 5,14 (s, 2H); 6,69 (dd, 1H); 6,77 (d, 1H), 6,85 (d, 1H), 7,25-7,48 (m, 10H).
МС: 351 [M+1].
К раствору 2-[3,4-ди(фенилметокси)фенил]этанэтиола (12,2 г; 34,8 ммоля) и этил-6-бромгексаноата (15,5 г; 69 ммолей) в бензоле (140 мл) при комнатной температуре и при перемешивании добавляли воду (90 мл), Aliquat 336® (триоктилметиламмонийхлорид) (0,28 г; 0,7 ммоля) и по каплям раствор NaOH (1,7 г; 42,5 ммоля) в воде (20 мл). Смесь перемешивали в течение 1,5 ч при комнатной температуре. Органическую фазу промывали водой, сушили над Na2SO4 и растворитель удаляли при пониженном давлении. Остаток растворяли в этаноле (110 мл) и по каплям добавляли раствор NaOH (4,1 г; 102,5 ммоля) в воде (20 мл). Смесь перемешивали в течение 1 часа при комнатной температуре. Растворители удаляли при пониженном давлении, затем добавляли этиловый эфир (100 мл), воду (50 мл) и концентрированную HCl до pH 1. Водную фазу экстрагировали дважды этиловым эфиром (100 мл), органические фазы объединяли, промывали водой и сушили над Na2SO4. После удаления растворителя при пониженном давлении получали промежуточный продукт 19 (15,5 г) в виде белого твердого вещества.
1H-ЯМР (200 МГц; CDCl3): δ (част./млн): 1,35-1,75 (m, 6H); 2,47 (t, 2H); 2,51 (t, 2H); 2,63-2,87 (m, 4H); 5,15 (s, 2H); 5,17 (s, 2H), 6,72 (dd, 1H), 6,82 (d, 1H), 6,89 (d, 1H); 7,25-7,50 (m, 10H).
МС: 465 [M+1].
Пример 7
Получение гидрохлорида 5-(2-аминоэтил)-1,3- бензтиазол-2(3H)-она (промежуточный продукт 20)
Трифторуксусный ангидрид (45,9 г; 218,7 ммоля) добавляли по каплям при комнатной температуре и при перемешивании к суспензии тирамина (10,0 г; 72,9 ммоля) в этиловом эфире (100 мл). Реакционную смесь перемешивали в течение 1 часа, а затем концентрировали при пониженном давлении. Остаток растворяли в метаноле (150 мл) и растворитель удаляли при пониженном давлении. Полученный 4-(2-трифторацетиламиноэтил)фенол (16,7 г; 71,6 ммоля) растворяли в этиловом эфире (350 мл) и медленно добавляли при комнатной температуре и при интенсивном перемешивании к раствору нитрата натрия (6,1 г; 71,7 ммоля) и гексагидрата нитрата церия (0,3 г; 0,7 ммоля) в 6 н. HCl (120 мл). Реакционную смесь перемешивали в течение 5 часов при комнатной температуре, затем добавляли CH2Cl2 (350 мл) и разделяли фазы. Органическую фазу сушили над Na2SO4 и растворители удаляли при пониженном давлении. Полученный 2-(4-гидрокси-3-нитрофенил)-N- трифторацетилэтиламин (19,1 г; 68,6 ммоля) растворяли в пиридине (200 мл). При комнатной температуре добавляли N,N-диметилтиокарбамоилхлорид (16,9 г; 137,3 ммоля), а затем реакционную смесь нагревали до 55oC и выдерживали при перемешивании в течение 5 часов. Растворитель выпаривали при пониженном давлении, добавляли хлороформ (200 мл) и вновь удаляли растворитель. Остаток растворяли в CH2Cl2 (200 мл) и раствор промывали 1 н. HCl (100 мл), а затем водой (50 мл). Органическую фазу сушили над Na2SO4 и растворитель удаляли при пониженном давлении. Остаток очищали с помощью хроматографии (элюент CH2Cl2:CH3OH = 99:1), получая О-[2-нитро-4-(2- трифторацетиламиноэтил)фенил]-N,N-диметилтиокарбамат (19,8 г) в виде желтого твердого вещества.
1H-ЯМР (200 МГц; CDCl3): δ (част./млн): 2,99 (t, 2H); 3,38 (s, 3H); 3,45 (s, 3H); 3,59-3,61 (m, 2H); 6,41-6,59 (bs, 1H); 7,21 (d, 1H), 7,48 (dd, 1H), 7,94 (d, 1H).
МС: 366 [M+1].
Чистый O-[2-нитро-4-(2- трифторацетиламиноэтил)фенил]-N,N-диметилтиокарбамат (19,8 г; 54,2 ммоля) выдерживали при 205oC в течение 0,5 ч. После охлаждения до комнатной температуры добавляли CH2Cl2 (200 мл), нерастворимую часть отфильтровывали и упаривали растворитель при пониженном давлении, в результате чего образовывался остаток, который очищали с помощью хроматографии (элюент CH2Cl2: CH3OH = 98:2), получая S-[2-нитро-4-(2-трифторацетиламиноэтил)фенил] -N, N-диметилтиокарбамата (17,5 г) в виде светло-желтого твердого вещества.
1H-ЯМР (200 МГц; CDCl3): δ (част./млн): 2,89 (t, 2H); 2,99 и 3,11 (2bs, 6H); 3,40-3,57 (m, 2H); 7,04 (bt, 1H); 7,35 (dd, 1H); 7,61 (d, 1H), 7,72 (d, 1H).
МС: 366 [M+1].
При перемешивании суспензию S-[2-нитро-4-(2- трифторацетиламино-этил)фенил] -N, N-диметилтиокарбамата (13,2 г; 36,1 ммоля) в воде (85 мл) и уксусной кислоте (3,5 мл) кипятили с обратным холодильником. В течение 30 минут порциями добавляли железный порошок (14,0 г) и затем реакционную смесь интенсивно перемешивали в течение 2 часов при температуре дефлегмации. После охлаждения добавляли метанол (50 мл), смесь фильтровали для удаления нерастворимой части и растворители выпаривали при пониженном давлении. Остаток очищали с помощью хроматографии (элюент CH2Cl2:CH3OH = 98:2). Полученное твердое вещество растворяли в метаноле и раствор подкисляли до pH 1, добавляя раствор HCl в этиловом эфире (15% в отношении массы к объему (мас. /об. )). Таким путем получали гидрохлорид S-[2-амино-4-(2- трифторацетиламиноэтил)фенил] -N,N-диметилтиокарбамата (7,1 г) в виде светло-желтого твердого вещества.
1H-ЯМР (200 МГц; ДМСО-d6): δ (част./млн): 2,75 (t, 2H); 2,91 и 3,05 (2bs, 6H); 3,30-3,48 (m, 2H); 4,77 (bs, 3H); 6,71 (dd, 1H); 6,88 (d, 1H), 7,21 (d, 1H), 9,58 (bt, 1H).
МС: 336 [M+1].
При перемешивании суспензию гидрохлорида S-[2-амино-4-(2-трифторацетиламиноэтил)фенил]-N,N-диметилтиокарбамата (3,5 г; 9,5 ммоля) в воде (118 мл) кипятили с обратным холодильником в течение 4 часов. После фильтрации охлажденной реакционной смеси и промывки твердого продукта водой получали 5-(2-трифторацетиламиноэтил)-1,3-бензтиазол-2-(3H)-он (2,3 г) в виде белого твердого продукта, 5-(2-трифторацетиламиноэтил)-1,3-бензтиазол-2(3H)-он (1,7 г) растворяли в этаноле (17 мл) и 6 н. HCl (17 мл). Реакционную смесь кипятили с обратным холодильником в течение 5 часов и растворители удаляли при пониженном давлении, получая промежуточный продукт 20 (1,3 г) в виде светло-серого твердого вещества.
1H-ЯМР (200 МГц; D2O): δ (част. /млн): 2,83 (t, 2H); 3,09 (t, 2H); 6,89-6,97 (m, 2H); 7,29 (d, 1H).
МС: 195 [M+1].
Пример 8
Получение гидробромида 6-(2-аминоэтил)-1,3-бензтиазол-2(3H)- она (промежуточный продукт 21)
Трифторуксусный ангидрид (21,8 г; 103,6 ммоля) добавляли по каплям при комнатной температуре и при перемешивании к суспензии гидрохлорида 2-(4-нитрофенил)этиламина (10,5 г; 51,8 ммоля) (фирма Aldrich) в CH2Cl2 (100 мл). Реакционную смесь выдерживали при перемешивании в течение 1 часа, а затем концентрировали при пониженном давлении. Остаток растворяли в метаноле (150 мл) и растворитель удаляли при пониженном давлении. Полученный 2-(4-нитрофенил)-N-трифторацетилэтиламин (13,3 г) растворяли в этаноле (250 мл) и в концентрированной HCl (5,1 мл). Добавляли 10%-ный Pd на древесном угле (50% воды) (1,3 г) и реакционную смесь выдерживали при перемешивании под давлением водорода (2,7 атм) при комнатной температуре в течение 1 часа. Путем фильтрации и выпаривания растворителей при пониженном давлении получали гидрохлорид 4-(2-трифторацетилэтиламино)этиланилина (13,4 г). При перемешивании раствор гидрохлорида 4-(2-трифторацетилэтиламино)этиланилина (13,1 г; 48,8 ммоля) и тиоцианата калия (11,9 г, 122,4 ммоля) в хлорбензоле (150 мл) выдерживали при 110oC в течение 7 часов, после охлаждения реакционную смесь перемешивали при комнатной температуре в течение 16 часов и затем при пониженном давлении удаляли растворитель. К остатку добавляли этиловый эфир (100 мл) и суспензию перемешивали при комнатной температуре в течение 30 минут. После фильтрации твердый продукт суспендировали при перемешивании в воде (100 мл) и при 50oC в течение 10 минут, затем фильтровали и добавляли CH2Cl2 (40 мл). Суспензию выдерживали при перемешивании при комнатной температуре в течение 15 минут, получая после фильтрации 4-(2-трифторацетиламиноэтил) фенилтиомочевину (11,5 г) в виде светло-коричневого твердого вещества.
1H-ЯМР (200 МГц; ДМСО-d6): δ (част./млн): 2,76 (t, 2H); 3,32-3,47 (m, 2H); 7,11-7,35 (m, 4H); 7,02-7,75 (bs, 2H); 9,49 (bt, 1H); 9,63 (s, 1H).
МС: 292 [M+1].
При перемешивании к суспензии 4-(2-трифторацетиламиноэтил)фенилтиомочевины (11,1 г; 38,1 ммоля) в хлороформе (150 мл) по каплям при 10oC добавляли бром (12,9 г; 80,7 ммоля). Реакционную смесь выдерживали при перемешивании при комнатной температуре в течение 30 минут, затем кипятили с обратным холодильником в течение 1 часа. После охлаждения смеси и фильтрации получали желтый твердый продукт, который промывали небольшим количеством ацетона и суспендировали в воде (200 мл). Добавляли насыщенный раствор NaHCO3 до завершения подщелачивания. С помощью фильтрации получали 2-амино-6-[(2-трифторацетиламино)этил] -1,3-бензтиазол (8,6 г) в виде белого твердого продукта.
1H-ЯМР (200 МГц; ДМСО-d6): δ (част./млн): 2,79 (t, 2H); 3,30-3,45 (m, 2H); 7,02 (dd, 1H); 7,24 (d, 1H); 7,38 (bs, 2H); 7,48 (d, 1H); 9,49 (bs, 1H).
МС: 290 [M+1].
При перемешивании к раствору 2-амино-6-[(2- трифторацетиламино)этил]-1,3-бензтиазола (4,1 г; 14,2 ммоля) в 85%-ной фосфорной кислоте (94 мл) по каплям в течение 2 часов при -5oC добавляли раствор нитрита натрия (2,9 г; 42,7 ммоля) в воде (4,6 мл). После перемешивания в течение еще 40 минут смесь в течение 40 минут при -5oC и при перемешивании добавляли к раствору пентагидрата сульфата меди (28,4 г; 113,7 ммоля) и хлорида натрия (35,5 г; 607,5 ммоля) в воде (124 мл). Реакционную смесь перемешивали при -5oC в течение 1 часа, а затем в течение ночи давали нагреться до комнатной температуры. Суспензию дважды экстрагировали CH2Cl2 (2х100 мл), органическую фазу последовательно промывали водой, насыщенным NaHCO3 и соляным раствором, затем сушили над Na2SO4 и растворитель удаляли при пониженном давлении. Остаток очищали с помощью хроматографии (элюент петролейный эфир:этилацетат = 8:2), получая 2-хлор-6-[(2- трифторацетиламино)этил]-1,3-бензтиазол (2,7 г) в виде белого твердого продукта.
1H-ЯМР (200 МГц; CDCl3): δ (част./млн): 3,00 (t, 2H); 3,59- 3,61 (m, 2H); 6,35-6,63 (bs, 1H); 7,28 (dd, 1H); 7,59 (d, 1H); 7,84 (d, 1H).
МС: 309 [M+1].
При перемешивании к раствору 2-хлор-6-[(2- трифторацетиламино)этил]-1,3-бензтиазола (2,1 г; 6,8 ммоля) в метаноле (24 мл) при комнатной температуре добавляли раствор 5,4 М метоксида натрия в метаноле (2,7 мл). Реакционную смесь выдерживали при 80oC в течение 5 часов, затем добавляли воду (3,5 мл) и нагревание продолжали в течение 2 часов. Растворители выпаривали при пониженном давлении и затем к остатку добавляли воду и CH2Cl2. Фазы разделяли и органическую фазу промывали соляным раствором, сушили над Na2SO4 и растворитель удаляли при пониженном давлении. Полученный 6-(2-аминоэтил)-2-метокси-1,3-бензтиазол (1,3 г) растворяли в 48%-ной HBr (9 мл) и реакционную смесь перемешивали при температуре дефлегмации в течение 1 часа. После охлаждения до 0oC и фильтрации получали промежуточный продукт 21 (1,3 г) в виде светло-коричневого твердого вещества.
1H-ЯМР (200 МГц; D2O): δ (част./млн): 2,82 (t, 2H); 3,10 (t. 2H); 6,94 (d, 1H); 7,05 (dd, 1H); 7,21 (d, 1H).
МС: 195 [M+1].
Пример 9
Получение дигидрохлорида 2-амино-6-(2-аминоэтил)-1,3-бензтиазола (промежуточный продукт 22)
При перемешивании к раствору 2-амино-6-[(2-трифторацетиламино)этил]-1,3-бензтиазола (0,96 г; 3,3 ммоля), полученного согласно примеру 8, в абсолютном этаноле (20 мл) добавляли при комнатной температуре 6 н. HCl (20 мл). Реакционную смесь кипятили с обратным холодильником в течение 24 часов, затем растворители выпаривали при пониженном давлении, получая промежуточный продукт 22 (0,84 г) в виде белого твердого вещества.
1H-ЯМР (200 МГц; ДМСО-d6 + D2O): δ (част./млн): 2,86-3,09 (m, 4H); 7,32 (dd, 1H); 7,45 (d, 1H); 7,75 (d, 1H).
МС: 194 [M+1].
Пример 10
Получение 2-(3-хлор-5-метоксифенил)этиламина (промежуточный продукт 23)
Раствор 3-хлор-5-метоксибензилового спирта (3,4 г; 19,7 ммоля), полученного согласно J. Chem. Soc., Perkin Trans. 1, 4, 1095-8 (1982), и ДМФ (76 мкл) в CH2Cl2 (20 мл), добавляли по каплям в атмосфере азота при комнатной температуре и при перемешивании к раствору тионилхлорида (2,5 г; 21,0 ммоля) в CH2Cl2 (30 мл). Реакционную смесь кипятили с обратным холодильником в течение 4 часов, после чего добавляли муравьиную кислоту (50 мкл) и смесь перемешивали еще в течение 30 минут. Затем добавляли воду (30 мл) и разделяли фазы, органическую фазу промывали 10%-ным KHCO3, затем водой и сушили над Na2SO4. Путем выпаривания растворителя при пониженном давлении получали 3- хлор-5-метоксибензилхлорид (3,5 г; 18,3 ммоля), который растворяли в безводном ДМСО (35 мл) в атмосфере азота. Добавляли цианид натрия (1,5 г; 30,6 ммоля) и реакционную смесь перемешивали при комнатной температуре в течение 1 часа, а затем сливали на воду и лед и экстрагировали этилацетатом. Органическую фазу промывали водой, сушили над Na2SO4 и растворитель удаляли при пониженном давлении. Полученный 3-хлор-5-метоксифенилацетонитрил (3,2 г; 17,6 ммоля) растворяли в безводном ТГФ (100 мл) в атмосфере азота. Медленно при перемешивании и при комнатной температуре добавляли комплекс боран-диметилсульфид (2,6 г; 33,7 ммоля). Реакционную смесь кипятили с обратным холодильником в течение 3 часов. После охлаждения до 5oC медленно добавляли раствор концентрированной HCl (2 мл) в метаноле (20 мл). Реакционную смесь кипятили с обратным холодильником в течение 2 часов, после чего растворители выпаривали при пониженном давлении. К остатку добавляли воду и этилацетат и разделяли фазы. Водную фазу подщелачивали 30%-ным NH4OH и экстрагировали этилацетатом. Органическую фазу промывали водой, сушили над Na2SO4 и растворитель удаляли при пониженном давлении, получая промежуточный продукт 23 (2,6 г) в виде масла.
1H-ЯМР (200 МГц; CDCl3): δ (част./млн): 1,51 (bs, 2H); 2,68 (t, 2H); 2,94 (t, 2H); 3,77 (s, 3H); 6,60-6,79 (m, 3H).
МС: 186 [M+1].
Пример 11
Получение (S)-N-пропил-N-[(6-амино-1- оксо)гексил] -5,6-диметокси-1,2,3,4-тетрагидро-2-нафтиламина (промежуточный продукт 24)
Триэтиламин (12,7 г; 126,1 ммоля) и затем раствор хлорангидрида 6-фталимидокапроновой кислоты (15,5 г; 55,5 ммоля) в CH2Cl2 (120 мл) добавляли к суспензии гидрохлорида (S)-N-пропил-5,6-диметокси-1,2,3,4-тетрагидро-2-нафтиламина (14,4 г; 50,4 ммоля) в CH2Cl2 (150 мл), которую выдерживали при перемешивании при комнатной температуре. Реакционную смесь выдерживали при перемешивании и при комнатной температуре в течение 1,5 ч. После добавления воды (250 мл) и разделения фаз органическую фазу промывали водой (150 мл), сушили над Na2SO4 и растворитель выпаривали при пониженном давлении. Остаток очищали с помощью хроматографии (элюент петролейный эфир:этилацетат = 6:4), получая (S)-N-пропил-N-[(6- фталимидо-1-оксо)гексил] -5,6-диметокси-1,2,3,4-тетрагидро-2- нафтиламин (24,1 г).
1H-ЯМР (200 МГц; CDCl3): δ (част./млн): 0,80-0,94 (2t, 3H); 1,30-2,02 (m, 10H); 2,26-2,38 (m, 2H); 2,59- 3,22 (m, 6H); 3,60-3,72 (m, 2H); 3,75-3,84 (4s, 6H), 3,85-4,66 (m, 1H); 6,66-6,82 (m, 2H); 7,64-7,85 (m, 4H).
МС: 493 [М+1].
Раствор (S)-N-пропил-N-[(6-фталимидо-1-оксо)гексил] -5,6-диметокси- 1,2,3,4-тетрагидро-2-нафтиламина (24,1 г; 48,9 ммоля) в 33%-ном растворе метиламина в этаноле (240 мл) выдерживали при перемешивании и при комнатной температуре в течение 20 часов. Реакционную смесь сушили досуха при пониженном давлении и остаток очищали с помощью хроматографии (элюент CH2Cl2: CH3OH:30%-ный аммиак = 90:10:1), получая промежуточный продукт 24 (11,9 г) в виде масла.
1H-ЯМР (200 МГц; CDCl3): δ (част./млн): 0,80-0,93 (2t, 3H); 1,20-2,04 (m, 10H); 2,25-2,48 (m, 2H); 2,58-3,21 (m, 8H); 3,72-3,81 (4s, 6H); 3,82-4,64 (m, 1H); 6,66-6,80 (m, 2H).
МС: 363 [М+1].
Пример 12
Получение дигидрохлорида (S)-N-пропил-N-[(6-амино)гексил]-5,6- диметокси -1,2,3,4- тетрагидро-2-нафтиламина (промежуточный продукт 25)
Боран-диметилсульфидный комплекс (3 г, 37 ммолей) медленно добавляли при комнатной температуре и при перемешивании в атмосфере азота к раствору промежуточного продукта 24 (2,3 г; 6,34 ммоля), полученного согласно примеру 11, в ТГФ (40 мл). По окончании добавления реакционную смесь кипятили с обратным холодильником в течение 2 часов. После охлаждения до 5oC добавляли раствор 37%-ной HCl (1,5 мл) в метаноле (12 мл). Реакционную смесь вновь кипятили с обратным холодильником в течение 1 часа, а затем концентрировали путем отгонки растворителей при атмосферном давлении и высушивания досуха при пониженном давлении. Остаток растворяли в метаноле (30 мл) и растворитель отгоняли при пониженном давлении, вновь добавляли метанол (30 мл) и растворитель выпаривали досуха. Неочищенный продукт очищали с помощью хроматографии (элюент CH2Cl2:CH3OH:50%-ная HCOOH = 85:15:1). Полученный твердый продукт растворяли в абсолютном этаноле и добавляли раствор HCl в этиловом эфире (15% мас. /об. ) до выраженно кислого значения pH. Путем выпаривания растворителей при пониженном давлении получали промежуточный продукт 25 (1,9 г) в виде аморфного белого твердого вещества.
1H-ЯМР (200 МГц; D2O): δ (част./млн): 0,80 (t, 3H); 1,19-1,32 (m, 4H); 1,40-2,20 (m, 8H); 2,44-3,17 (m, 10H); 3,46-3,63 (m, 1H); 3,59 (s, 3H); 3,68 (s, 3H); 6,76-6,85 (2d, 2H).
МС: 349 [M+1].
Пример 13
Получение дигидробромида (S)-N-пропил-N-[(6-амино)гексил]-5,6- дигидрокси-1,2,3,4-тетрагидро-2-нафтиламина (промежуточный продукт 26)
Раствор промежуточного продукта 25 (1,2 г; 2,87 ммоля), полученного согласно примеру 12, в 48%-ной HBr (10 мл) кипятили с обратным холодильником в атмосфере азота в течение 5 часов. Затем реакционную смесь высушивали досуха при пониженном давлении и к образовавшемуся остатку добавляли абсолютный этанол (20 мл). После выпаривания растворителя добавляли этилацетат (20 мл) и вновь выпаривали растворитель. Полученный неочищенный продукт очищали путем кристаллизации из смеси абсолютный этанол/этилацетат, получая промежуточный продукт 26 (1,2 г) в виде белого твердого вещества.
1H-ЯМР (200 МГц; D2O): δ (част./млн): 0,80 (t, 3H); 1,21-2,19 (m, 12H); 2,39-3,11 (m, 10H); 3,44-3,60 (m, 1H); 6,50 (d, 1H); 6,62 (d, 1H).
МС: 321 [M+1].
Пример 14
Получение гидрохлорида (S)-N-пропил-5,6- ди(фенилметокси)-1,2,3,4-тетрагидро-2-нафтиламина (промежуточный продукт 27)
Раствор ди-трет-бутилдикарбоната (14,5 г; 66,2 ммоля) в ДМФ (28 мл) добавляли при перемешивании и при комнатной температуре в атмосфере азота к раствору дигидробромида (S)-N-пропил-5,6-дигидрокси-1,2,3,4-тетрагидро-2-нафтиламина (20 г; 66 ммолей) и триэтиламина (6,7 г; 66 ммолей) в ДМФ (160 мл). Реакционную смесь выдерживали при перемешивании в течение 3 часов, затем сливали на смесь воды, льда и этилового эфира. После добавления 1 н. HCl до получения выраженно кислого значения pH разделяли фазы. Органическую фазу дважды промывали водой, сушили над Na2SO4 и упаривали досуха при пониженном давлении. Остаток растворяли в ДМФ (250 мл) и к образовавшемуся раствору добавляли при перемешивании и при комнатной температуре карбонат калия (34,4 г; 248,9 ммоля) и бензилбромид (26,6 г; 155,5 ммоля). Реакционную смесь выдерживали при 60oC в течение 7 часов, затем выдерживали при комнатной температуре и при перемешивании в течение 16 часов и в завершение сливали на смесь воды и этилового эфира. После разделения фаз органическую фазу промывали водой, сушили над Na2SO4 и растворитель выпаривали при пониженном давлении. Остаток очищали с помощью хроматографии (элюент петролейный эфир: этилацетат = 93:7), получая (S)-N-трет-бутоксикарбонил- N-пропил-5,6-ди(фенилметокси)-1,2,3,4-тетрагидро-2-нафтиламин (23 г) в виде масла.
1H-ЯМР (200 МГц; CDCl3): δ (част./млн): 0,86 (t, 3H); 1,46 (s, 9H); 1,49-1,98 (m, 4H); 2,52-3,16 (m, 6H); 3,80-4,32 (bs, 1H); 4,99 (s, 2H); 5,10 (s, 2H); 6,74 (d, 1H); 6,81 (d, 1H); 7,25-7,47 (m, 10H).
МС: 502 [M+1].
Раствор HCl в этилацетате (13% мас./об.) (250 мл) добавляли при перемешивании и при комнатной температуре к раствору (S)-N-трет-бутоксикарбонил-N-пропил-5,6-ди(фенилметокси)- 1,2,3,4-тетрагидро-2-нафтиламина (23 г; 45,8 ммоля) в этилацетате (100 мл). Через 30 минут осадок отфильтровывали, промывали этилацетатом и сушили под вакуумом при 50oC в течение 10 часов, получая промежуточный продукт 27 (16,4 г) в виде белого твердого вещества.
1H-ЯМР (200 МГц; CDCl3): δ (част./млн): 0,87 (t, 3H); 1,71-2,54 (m, 4H); 2,28-3,23 (m, 7H); 4,85 (s, 2H); 4,95 (s, 2H); 6,60 (d, 1H); 6,68 (d, 1H); 7,12-7,33 (m, 10H).
МС: 402 [M+1].
Пример 15
Получение (S)-N-пропил-N-[(6-амино-1-оксо)гексил]-5,6-ди(фенил-метокси)- 1,2,3,4-тетрагидро-2-нафтиламина (промежуточный продукт 28)
Раствор хлорангидрида 6-фталимидокапроновой кислоты (11,2 г; 40,2 ммоля) в CH2Cl2 (60 мл) добавляли при перемешивании и при комнатной температуре к раствору, содержащему промежуточный продукт 27 (16 г; 36,5 ммоля), полученный согласно примеру 14, и триэтиламин (9,2 г; 91,3 ммоля) в CH2Cl2 (130 мл). Реакционную смесь выдерживали при перемешивании и при комнатной температуре в течение 1 часа. После добавления воды и разделения фаз органическую фазу промывали водой (100 мл), сушили над Na2SO4 и растворитель выпаривали при пониженном давлении. Остаток растворяли в 33%-ном растворе метиламина в этаноле (240 мл) и реакционную смесь выдерживали при перемешивании и при комнатной температуре в течение 6 часов. После выпаривания растворителя при пониженном давлении остаток очищали с помощью хроматографии (элюент CH2Cl2: CH3OH: 30%-ный аммиак = 90:10:1), получая промежуточный продукт 28 (10,9 г).
1H-ЯМР (200 МГц; CDCl3): δ (част./млн): 0,81-0,95 (2t, 3H); 1,23-2,02 (m, 10H); 2,26-3,38 (m, 2H); 2,51-3,21 (m, 8H); 3,80-4,61 (m, 1H); 4,99 (2s, 2H); 5,09 (2s, 2H); 6,69-6,87 (m, 2H); 7,25-7,47 (m, 10H).
МС: 515 [M+1].
Пример 16
Получение (S)-N-пропил-N-(5,6-диметокси-1,2,3,4- тетрагидро-2-нафтил)-5-карбоксипентанамида (промежуточный продукт 29)
Раствор монометилового эфира хлорангидрида гександиовой кислоты (5,9 г; 33,3 ммоля) в CH2Cl2 (10 мл) добавляли при перемешивании и при комнатной температуре к раствору, содержащему гидробромид (S)-N-пропил-5,6-диметокси-1,2,3,4-тетрагидро-2-нафтиламина (10 г; 30,3 ммоля) и триэтиламин (7,6 г; 75,3 ммоля) в CH2Cl2 (80 мл). Через 2 часа добавляли воду (100 мл) и разделяли фазы. Органическую фазу промывали водным раствором 0,2 н. HCl, затем водой, сушили над Na2SO4 и упаривали досуха при пониженном давлении. Остаток растворяли в метаноле (50 мл) и к образовавшемуся раствору при перемешивании и при комнатной температуре по каплям добавляли раствор NaOH (3,3 г; 82,5 ммоля) в воде (17 мл). Реакционную смесь выдерживали при перемешивании в течение 3 часов. После выпаривания растворителей при пониженном давлении остаток растворяли в воде (40 мл). Раствор промывали этиловым эфиром (40 мл), затем подкисляли 37%-ной HCl до pH 1 и экстрагировали CH2Cl2 (100 мл). После сушки органической фазы над Na2SO4 и выпаривания растворителя получали промежуточный продукт 29 (11,4 г) в виде масла.
1H-ЯМР (200 МГц; CDCl3): δ (част./млн): 0,87 и 0,91 (2t, 3H); 1,48-2,07 (m, 8H); 2,29-2,46 (m, 4H); 2,60-3,27 (m, 6H); 3,77 и 3,80, и 3,82, и 3,83 (4s, 6H); 3,84-4,05 и 4,48-4,67 (2m, 1H); 6,69 (d, 1H); 6,79 (d, 1H).
МС: 378 [M+1].
Аналогично описанной выше методике были получены следующие соединения.
(S)-N-пропил-N-[5,6-ди(фенилметокси)-1,2,3,4-тетрагидро-2-нафтил] -5- карбоксипентанамид (промежуточный продукт 30) с использованием в качестве исходного вещества промежуточного продукта 27, полученного согласно примеру 14.
1H-ЯМР (200 МГц; CDCl3): δ (част./млн): 0,87 и 0,91 (2t, 3H); 1,47-2,06 (m, 8H); 2,28-2,46 (m, 4H); 2,51-3,27 (m, 6H); 3,82-4,01 и 4,46-4,65 (2m, 1H); 4,98 и 5,01 (2s, 2H); 5,09 и 5,11 (2s, 2H); 6,69-6,88 (m, 2H); 7,25-7,48 (m, 10H).
МС: 530 [M+1].
(S)-N-пропил-N-[5- метокси-1,2,3,4-тетрагидро-2-нафтил] -5-карбоксипентанамид (промежуточный продукт 31) с использованием в качестве исходного вещества (S)-N-пропил-5-метокси-1,2,3,4-тетрагидро-2- нафтиламина, полученного согласно J. Med. Chem. 29, 912 (1986).
1H-ЯМР (200 МГц; CDCl3): δ (част./млн): 0,88 и 0,91 (2t, 3H); 1,49-2,10 (m, 8H); 2,28-2,46 (m, 4H); 2,48-3,31 (m, 6H); 3,78 и 3,80 (2s, 3H); 3,87-4,07 и 4,49-4,69 (2m, 1H); 6,60-7,17 (m, 3H).
МС: 348 [M+1].
Пример 17
Получение 4-нитрофенил-(S)-N-пропил-N- [5,6-ди(фенилметокси)-1,2,3,4- тетрагидро-2-нафтил]-6-амино-6-оксогексаноата (промежуточный продукт 32)
При перемешивании к раствору промежуточного продукта 30 (3,4 г; 6,4 ммоля), полученного согласно примеру 16, в CH2Cl2 (18 мл), в атмосфере азота при комнатной температуре добавляли ДМФ (25 мкл) и тионилхлорид (1,2 г; 10,1 ммоля). После выдержки в течение 30 минут при комнатной температуре реакционную смесь упаривали досуха при пониженном давлении. Образовавшийся остаток растворяли в CH2Cl2 (10 мл) и этот раствор по каплям в атмосфере азота добавляли при перемешивании к раствору 4-нитрофенола (0,82 г; 5,9 ммоля) и триэтиламина (1,2 г; 11,9 ммоля) в CH2Cl2 (16 мл) и ДМФ (1 мл). Смесь перемешивали при комнатной температуре в течение 2,5 ч, а затем добавляли воду (30 мл) и CH2Cl2 (50 мл). Органическую фазу промывали водой, сушили над Na2SO4 и растворитель выпаривали при пониженном давлении. Остаток очищали с помощью хроматографии (элюент CH2Cl2:CH3OH = 99:1), получая промежуточный продукт 32 (3,5 г) в виде масла.
1H-ЯМР (200 МГц; CDCl3): δ (част./млн): 0,88 и 0,91 (2t, 3H); 1,45-2,02 (m, 8H); 2,26-2,49 (m, 2H); 2,50-3,32 (m, 8H); 3,81-4,00 и 4,44-4,65 (2m, 1H); 4,99 и 5,01 (2s, 2H); 5,09 и 5,11 (2s, 2H); 6,68-6,88 (m, 2H); 7,19-7,48 (m, 12H); 8,18-8,30 (m, 2H).
МС: 651 [M+1].
Пример 18
Получение дигидрохлорида (S)-N-пропил-N-[6-[2-(4- метоксифенилтио)этиламино] гексил] -5,6-диметокси-1,2,3,4- тетрагидро-2-нафтиламина (промежуточный продукт 33)
Тионилхлорид (1,4 г; 11,7 ммоля) добавляли при перемешивании и при комнатной температуре к суспензии промежуточного продукта 1 (2,4 г; 7,7 ммоля), полученного согласно примеру 1, в CH2Cl2 (20 мл). Через 1 ч растворитель выпаривали при пониженном давлении с получением масла, которое растворяли в CH2Cl2 (10 мл). Раствор добавляли по каплям при перемешивании и при комнатной температуре к суспензии, полученной после добавления триэтиламина (2,1 г; 21 ммоль) к суспензии гидробромида (S)-N-пропил-5,6-диметокси- 1,2,3,4-тетрагидро-2-нафтиламина (2,3 г; 7 ммолей) в CH2Cl2 (30 мл). Реакционную смесь выдерживали при перемешивании и при комнатной температуре в течение 1 часа. После добавления воды (40 мл) и разделения фаз органическую фазу промывали подкисленной водой, сушили над Na2SO4 и упаривали досуха при пониженном давлении. Остаток растворяли в атмосфере азота в ТГФ (20 мл). К образовавшемуся раствору медленно добавляли при перемешивании и при комнатной температуре комплекс боран-диметилсульфид (3,2 г; 40,8 ммоля). По завершении добавления реакционную смесь кипятили с обратным холодильником в течение 1,5 ч. После охлаждения до 5oC добавляли раствор 37%-ной соляной кислоты (1,3 мл) в метаноле (11 мл). Реакционную смесь вновь кипятили с обратным холодильником в течение 1 часа, затем концентрировали путем отгонки растворителей при атмосферном давлении и высушивали досуха при пониженном давлении. Остаток растворяли в метаноле (20 мл) и растворитель выпаривали при пониженном давлении. После дополнительного добавления метанола (20 мл) и выпаривания растворителя досуха образовавшийся неочищенный продукт очищали с помощью хроматографии (элюент CH2Cl2:CH3OH:50%-ная HCOOH = 90:10:1). Полученный продукт растворяли в абсолютном этаноле (20 мл). После добавления раствора HCl в этиловом эфире (15% мас./об.) до получения выраженно кислого значения pH и выпаривания растворителей при пониженном давлении получали промежуточный продукт 33 (2,1 г) в виде аморфного белого твердого вещества.
1H-ЯМР (200 МГц; D2O): δ (част./млн): 0,80 (t, 3H); 1,08-2,21 (m, 12H); 2,42-3,21 (m, 14H); 3,41-3,60 (m, 1H); 3,58 (s, 3H); 3,63 (s, 3H); 3,68 (s, 3H); 6,76-7,34 (m, 6H).
МС: 515 [M+1].
Аналогично описанной выше методике были получены следующие соединения.
Дигидрохлорид (S)-N-пропил-N-[6-[3-(4- метоксифенил)пропиламино]гексил] -5,6-диметокси-1,2,3,4- тетрагидро-2-нафтиламина (промежуточный продукт 34) с использованием в качестве исходного вещества промежуточного продукта 3.
1H-ЯМР (200 МГц; D2O): δ (част./млн): 0,81 (t, 3H); 1,12-2,22 (m, 14H); 2,44-3,56 (m, 15H); 3,59 (s, 3H); 3,65 (s, 3H); 3,69 (s, 3H); 6,76-7,12 (m, 6H).
МС (термоспрей): 497 [M+1].
Дигидрохлорид (S)-N-пропил-N-[6-(6,7-диметокси-1,2,3,4- тетрагидроизохинолин-2-ил)гексил] -5,6-диметокси-1,2,3,4- тетрагидро-2-нафтиламина (промежуточный продукт 35) с использованием в качестве исходного вещества промежуточного продукта 11.
1H-ЯМР (200 МГц; CDCl3): δ (част./млн): 0,98 (t, 3H); 1,33-2,57 (m, 12H); 2,58-3,71 (m, 15H); 3,76 (s, 3H); 3,81 (s, 3H); 3,82 (s, 3H); 3,83 (s. 3H): 4,11-4,43 (m, 2H); 6,58 (s, 1H); 6,70 (s, 1H); 6,74 (d, 1H); 6,82 (d, 1H).
МС: 525 [M+1].
Дигидрохлорид (S)-N-пропил-N-[6-(2,3-дигидроиндол-1-ил)гексил] -5,6- диметокси-1,2,3,4-тетрагидро-2-нафтиламина (промежуточный продукт 36) с использованием в качестве исходного вещества промежуточного продукта 13.
1H-ЯМР (200 МГц; CDCl3): δ (част./млн): 0,93 (t, 3H); 1,15-2,31 (m, 12H); 2,41-3,94 (m, 15H); 3,82 (s, 3H); 3,86 (s, 3H); 6,43-7,16 (m, 6H).
МС: 451 [M+1].
Пример 19
Получение дигидрохлорида (S)-N-пропил-N-[6-[2-(4-нитрофенил)этиламино] гексил]-5,6- ди(фенилметокси)-1,2,3,4-тетрагидро-2-нафтиламина (промежуточный продукт 37)
Работая по методике, аналогичной описанной в примере 18, но используя вместо гидробромида (S)-N-пропил-5,6-диметокси-1,2,3,4-тетрагидро-2- нафтиламина и промежуточного продукта 1 соответственно промежуточный продукт 27, полученный согласно примеру 14, и промежуточный продукт 10, полученный согласно примеру 1, получали промежуточный продукт 37.
1H-ЯМР (200 МГц; ДМСО-d6): δ (част./млн): 0,91 (t, 3H); 1,20-2,41 (m, 12H); 2,53- 3,25 (m, 14H); 3,40-3,51 (m, 1H); 4,93 (s, 2H); 5,14 (s, 2H); 6,85 (d, 1H); 7,01 (d, 1H); 7,27-7,50 (m, 10H); 7,51-7,61 (m, 2H); 8,16-8,25 (m, 2H).
МС: 650 [M+1].
Пример 20
Получение дигидрохлорида (S)-N-пропил-N-[6-[2-(4-фенилметоксифенокси) этиламино]гексил]-5,6-дигидрокси-1,2,3,4-тетрагидро-2- нафтиламина (промежуточный продукт 38)
Тионилхлорид (3 г; 25,2 ммоля) добавляли в атмосфере азота при комнатной температуре к суспензии промежуточного продукта 2 (6,4 г; 17,2 ммоля), полученного согласно примеру 1, в CH2Cl2 (52 мл). Через 1 ч растворитель выпаривали при пониженном давлении с получением масла, которое растворяли в CH2Cl2 (17 мл). Тетраборат натрия (5,3 г; 26,3 ммоля) добавляли в атмосфере азота к раствору гидробромида (S)-N-пропил-5,6-дигидрокси-1,2,3,4-тетрагидро-2- нафтиламина (4 г; 13,2 ммоля) в воде (80 мл). После нагревания до 70oC для завершения растворения и охлаждения до комнатной температуры добавляли CH2Cl2 (10 мл), карбонат калия (14,2 г; 102,7 ммоля) и при интенсивном перемешивании полученный выше раствор в CH2Cl2. После выдержки в течение 1 ч при комнатной температуре реакционную смесь подкисляли до pH 1 с помощью 37%-ной HCl и разделяли фазы. Водную фазу экстрагировали CH2Cl2 (50 мл). Объединенные органические фазы промывали соляным раствором, слегка подкисленным HCl, сушили над Na2SO4 и упаривали досуха при пониженном давлении. Образовавшийся остаток растворяли в атмосфере азота при комнатной температуре в ТГФ (40 мл). К образовавшемуся раствору медленно добавляли при перемешивании и при комнатной температуре комплекс боран-диметилсульфид (6,2 г; 78,9 ммоля). По завершении добавления реакционную смесь кипятили с обратным холодильником в течение 1,5 ч. После охлаждения до 5oC добавляли раствор 37%-ной соляной кислоты (3 мл) в метаноле (27 мл). Реакционную смесь вновь кипятили с обратным холодильником в течение 1 часа, затем концентрировали путем отгонки растворителей при атмосферном давлении и высушивали досуха при пониженном давлении. Остаток растворяли в метаноле (50 мл) и растворитель выпаривали при пониженном давлении. После дополнительного добавления метанола (50 мл) и выпаривания растворителя досуха образовавшийся остаток растворяли в абсолютном этаноле (50 мл). После добавления раствора HCl в этиловом эфире (15% мас. /об.) и выпаривания растворителей при пониженном давлении неочищенный продукт очищали с помощью хроматографии (элюент CH2Cl2:CH3OH:50%-ная HCOOH = 90:10:1). Полученный твердый продукт растворяли в абсолютном этаноле (50 мл) и после добавления раствора HCl в этиловом эфире (15% мас./об.) до получения выраженно кислого значения pH и выпаривания растворителей при пониженном давлении получали промежуточный продукт 38 (4 г) в виде аморфного белого твердого вещества.
1H-ЯМР (200 МГц; D2O): δ (част./млн): 0,81 (t, 3H); 1,15-2,20 (m, 12H); 2,34-3,15 (m, 10H); 3,25-3,32 (m, 2H); 3,39-3,59 (m, 1H); 4,05-4,13 (m, 2H); 4,91 (s, 2H); 6,49 (d, 1H); 6,63 (d, 1H); 6,71-6,89 (m, 4H); 7,21-7,33 (m, 5H).
МС: 547 [M+1].
Аналогично описанной выше методике были получены следующие соединения.
Гидрохлорид (S)-N-пропил-N-[6-[2- [3,4-ди(фенилметокси)фенил] этокси] гексил] -5,6-дигидрокси- 1,2,3,4-тетрагидро-2-нафтиламина (промежуточный продукт 39) с использованием в качестве исходного вещества промежуточного продукта 14.
МС: 638 [M+1].
Дигидрохлорид (S)-N-пропил-N-[6-[3- (2-метоксифенил)пропиламино]гексил] -5,6-дигидрокси-1,2,3,4- тетрагидро-2-нафтиламина (промежуточный продукт 40) с использованием в качестве исходного вещества промежуточного продукта 6.
1H-ЯМР (300 МГц; D2O): δ (част./млн): 0,78 (t, 3H); 1,16-2,17 (m, 14H); 2,52 (t, 2H); 2,37-3,18 (m, 12H); 3,43-3,58 (m, 1H); 3,66 (s, 3H): 6,48 (d, 1H); 6,61 (d, 1H); 6,76-7,16 (m, 4H).
МС: 469 [M+1].
Гидрохлорид (S)-N-пропил-N-[6-[2-[3,4- ди(фенилметокси)фенил] этилтио] гексил] -5,6-дигидрокси-1,2,3,4- тетрагидро-2-нафтиламина (промежуточный продукт 41) с использованием в качестве исходного вещества промежуточного продукта 19.
1H-ЯМР (200 МГц; CDCl3 + D2O): δ (част./млн): 0,95 (t, 3H); 1,15-2,56 (m, 16H); 2,57-3,47 (m, 11H); 5,07 (s, 2H); 5,09 (s, 2H); 6,65-6,88 (m, 5H); 7,21-7,45 (m, 10H).
МС: 654 [M+1].
Пример 21
Получение дигидрохлорида (S)-N-пропил-N-[6-[2-(3-хлор-4- гидроксифенил)этиламино] гексил] -5,6-диметокси-1,2,3,4-тетрагидро- 2-нафтиламина (промежуточный продукт 42)
ДМФ (2 капли) и оксалилхлорид (0,8 г; 6,3 ммоля) добавляли в атмосфере азота при 0oC к раствору промежуточного продукта 16 (2,2 г; 5,3 ммоля), полученного согласно примеру 5, в CH2Cl2 (4 мл). Реакционную смесь выдерживали при 0oC и при перемешивании в течение 1,5 ч, после чего давали возможность самопроизвольно нагреться до комнатной температуры. После выпаривания растворителя при пониженном давлении образовавшийся остаток растворяли в CH2Cl2 (5 мл). Раствор добавляли по каплям в атмосфере азота при комнатной температуре к раствору промежуточного продукта 24 (1,9 г; 5,3 ммоля), полученного согласно примеру 11, и триэтиламина (1,6 г; 16 ммолей) в CH2Cl2 (5 мл). Через 3 часа добавляли воду (10 мл), фазы разделяли и водную фазу экстрагировали CH2Cl2 (10 мл). Объединенные органические фазы сушили над Na2SO4 и растворитель выпаривали при пониженном давлении. Остаток растворяли в этиловом эфире (20 мл) и к раствору добавляли тригидрат тетрабутиламмонийфторида (3,4 г; 10,8 ммоля). После выдержки в течение 2 ч при перемешивании и при комнатной температуре растворитель выпаривали под пониженным давлением и остаток распределяли между водой и CH2Cl2. Органическую фазу сушили над Na2SO4 и растворитель выпаривали при пониженном давлении. Образовавшийся неочищенный продукт очищали с помощью хроматографии (элюент CH2Cl2:CH3OH = 98: 2), получая (S)-N-пропил-N-[6-[(3-хлор-4-гидроксифенил)ацетиламино]-1- оксогексил] -5,6-диметокси-1,2,3,4-тетрагидро-2-нафтиламин (1,7 г) в виде масла.
1H-ЯМР (200 МГц; CDCl3): δ (част./млн): 0,86 и 0,91 (2t, 3H); 1,17-2,07 (m, 10H); 2,24-2,42 (m, 2H); 2,58-3,30 (m, 8H); 3,42 (s, 2H); 3,76 и 3,80, и 3,81, и 3,82 (4s, 6H); 3,83-4,04 и 4,46-4,66 (2m, 1H); 5,89 (bt, 1H); 6,43 (bs, 1H); 6,70 (d, 1H); 6,80 (d, 1H); 6,88-7,26 (m, 3H).
МС: 531 [M+1].
Аналогично описанной выше методике с использованием промежуточного продукта 17 в качестве исходного вещества получали (S)-N-пропил-N-[6-[(3- нитро-4-гидроксифенил)ацетиламино] -1-оксогексил] -5,6-диметокси- 1,2,3,4-тетрагидро-2-нафтиламин.
1H-ЯМР (200 МГц; CDCl3): δ (част./млн): 0,87 и 0,91 (2t, 3H); 1,21-2,08 (m, 10H); 2,27-2,41 (m, 2H); 2,57-3,35 (m, 8H); 3,48 и 3,49 (2s, 2H); 3,76 и 3,79, и 3,80, и 3,82 (4s, 6H); 3,85-4,05 и 4,43-4,65 (2m, 1H); 6,37 и 6,42 (2bt, 1H); 6,70 (d, 1H); 6,80 (d, 1H); 7,02-8,02 (m, 3H); 10,47 (bs, 1H).
МС: 542 [M+1].
Комплекс боран-диметилсульфид (1,6 г; 20,3 ммоля) медленно добавляли при перемешивании в атмосфере азота к раствору (S)-N-пропил-N-[6- [(3-хлор-4-гидроксифенил)ацетиламино] -1-оксогексил] -5,6- диметокси-1,2,3,4-тетрагидро-2-нафтиламина (1,7 г; 3,2 ммоля) в ТГФ (10 мл). По завершении добавления реакционную смесь кипятили с обратным холодильником в течение 1,5 ч. После охлаждения до 5oC добавляли раствор 37%-ной HCl (0,8 мл) в метаноле (7 мл). Реакционную смесь вновь кипятили с обратным холодильником в течение 1 часа, затем концентрировали путем отгонки растворителей при атмосферном давлении и высушивали досуха при пониженном давлении. Остаток растворяли в метаноле (15 мл) и растворитель выпаривали при пониженном давлении. После дополнительного добавления метанола (15 мл) и выпаривания растворителя досуха образовавшийся остаток растворяли в абсолютном этаноле (15 мл). После добавления раствора HCl в этиловом эфире (15% мас./об.) (0,5 мл) и выпаривания растворителей при пониженном давлении неочищенный продукт очищали с помощью хроматографии (элюент CH2Cl2: CH3OH: 50%-ная HCOOH = 85:15:1). Полученный твердый продукт растворяли в абсолютном этаноле (20 мл) и после добавления раствора HCl в этиловом эфире (15% мас./об.) до получения выраженно кислого значения pH и выпаривания растворителей при пониженном давлении получали промежуточный продукт 42 (1,4 г) в виде аморфного белого твердого вещества.
1H-ЯМР (200 МГц; D2O): δ (част./млн): 0,82 (t, 3H); 1,17-1,32 (m, 4H); 1,39-2,24 (m, 8H); 2,46-3,18 (m, 14H); 3,46-3,65 (m, 1H); 3,61 (s, 3H); 3,70 (s, 3H); 6,79-7,18 (m, 5H).
МС: 503 [M+1].
Аналогично описанной выше методике были получены следующие соединения.
Дигидрохлорид (S)-N-пропил-N-[6-[2-(3- нитро-4-гидроксифенил)этиламино] гексил]-5,6-диметокси-1,2,3,4- тетрагидро-2-нафтиламина (промежуточный продукт 43) с использованием в качестве исходного продукта (S)-N-пропил-N-[6- [(3-нитро-4-гидроксифенил)ацетиламино] -1-оксогексил] -5,6- диметокси-1,2,3,4-тетрагидро-2-нафтиламина.
1H-ЯМР (200 МГц; D2O): δ (част./млн): 0,82 (t, 3H); 1,17-2,23 (m, 12H); 2,47-3,24 (m, 14H); 3,47-3,66 (m, 1H); 3,60 (s, 3H); 3,69 (s, 3H); 6,81-7,06 (m, 5H).
МС: 514 [M+1].
Пример 22
Получение дигидрохлорида (S)-N-пропил-N-[6-[2-(3-метокси-4- гидроксифенил)этиламино] гексил] -5,6-ди(фенилметокси)-1,2,3,4- тетрагидро-2-нафтиламина (промежуточный продукт 44)
ДМФ (2 капли) и оксалилхлорид (0,7 г; 5,5 ммоля) добавляли в атмосфере азота при 0oC к раствору промежуточного продукта 18 (1,8 г; 4,4 ммоля), полученного согласно примеру 5, в CH2Cl2 (3 мл). Реакционную смесь выдерживали при 0oC и при перемешивании в течение 1,5 ч, после чего давали возможность самопроизвольно нагреться до комнатной температуры. После выпаривания растворителя при пониженном давлении образовавшийся остаток растворяли в CH2Cl2 (3 мл). Раствор добавляли по каплям в атмосфере азота при комнатной температуре к раствору промежуточного продукта 28 (2,3 г; 4,4 ммоля), полученного согласно примеру 15, и триэтиламина (1,3 г; 13,1 ммоля) в CH2Cl2 (3 мл). Через 4 часа добавляли воду (10 мл), фазы разделяли и водную фазу экстрагировали CH2Cl2 (10 мл). Объединенные органические фазы сушили над Na2SO4 и растворитель выпаривали при пониженном давлении. Остаток растворяли в этиловом эфире (15 мл) и к раствору добавляли тригидрат тетрабутиламмонийфторида (2,8 г; 8,9 ммоля). После выдержки в течение 2 ч при перемешивании и при комнатной температуре растворитель выпаривали при пониженном давлении и остаток распределяли между водой и CH2Cl2. Органическую фазу сушили над Na2SO4 и растворитель выпаривали при пониженном давлении. Образовавшийся неочищенный продукт очищали с помощью хроматографии (элюент CH2Cl2:CH3OH = 98: 2), получая (S)-N-пропил-N-[6-[(3- метокси-4-гидроксифенил)ацетиламино] -1-оксогексил]-5,6- ди(фенилметокси)-1,2,3,4-тетрагидро-2-нафтиламин (2,8 г) в виде масла.
1H-ЯМР (200 МГц; CDCl3): δ (част./млн): 0,86 и 0,91 (2t, 3H); 1,16-2,00 (m, 10H); 2,22-2,36 (m, 2H); 2,51-3,27 (m, 8H); 3,45 и 3,46 (2s, 2H); 3,85 и 3,86 (2s, 3H); 3,75-3,98 и 4,41-4,63 (2m, 1H); 4,98 и 5,01 (2s, 2H); 5,09 и 5,11 (2s, 2H); 5,61 (bt, 1H); 6,67-6,88 (m, 5H); 7,24-7,48 (m, 10H).
МС: 679 [M+1].
Комплекс боран-диметилсульфид (1,9 г; 24,2 ммоля) медленно добавляли при перемешивании в атмосфере азота к раствору (S)-N-пропил-N-[6-[(3- метокси-4-гидроксифенил)ацетиламино] -1-оксогексил] -5,6- ди(фенилметокси)-1,2,3,4-тетрагидро-2-нафтиламина (2,8 г; 4,1 ммоля) в ТГФ (25 мл). По завершении добавления реакционную смесь кипятили с обратным холодильником в течение 1,5 ч. После охлаждения до 5oC добавляли раствор 37%-ной HCl (0,9 мл) в метаноле (8 мл). Реакционную смесь вновь кипятили с обратным холодильником в течение 1 часа, затем концентрировали путем отгонки растворителей при атмосферном давлении и высушивали досуха при пониженном давлении. Остаток растворяли в метаноле (20 мл) и растворитель выпаривали при пониженном давлении. После дополнительного добавления метанола (20 мл) и выпаривания растворителя досуха образовавшийся остаток растворяли в абсолютном этаноле (20 мл). После добавления раствора HCl в этиловом эфире (15% мас./об.) (0,5 мл) и выпаривания растворителей при пониженном давлении неочищенный продукт очищали с помощью хроматографии (элюент CH2Cl2: CH3OH: 50%-ная HCOOH = 90:10:1). Полученный твердый продукт растворяли в абсолютном этаноле (20 мл) и после добавления раствора HCl в этиловом эфире (15% мас./об.) до получения выраженно кислого значения pH и выпаривания растворителей при пониженном давлении получали промежуточный продукт 44 (1,5 г) в виде аморфного белого твердого вещества.
1H-ЯМР (200 МГц; ДМСО-d6): δ (част./млн): 0,91 (t, 3H); 1,18-2,39 (m, 12H); 2,51-3,65 (m, 15H); 3,75 (s, 3H); 4,93 (s, 2H); 5,16 (s, 2H); 6,58-7,04 (m, 5H); 7,26-7,50 (m, 10H); 8,88 (bs, 1H); 9,08 (bs, 2H); 10,47 (bs, 1H).
МС: 651 [M+1].
Пример 23
Получение дигидрохлорида (S)-N-пропил-N-[6-[3- (3,4-диметоксифенил)пропиламино] гексил] -5,6- диметокси-1,2,3,4-тетрагидро-2-нафтиламина (промежуточный продукт 45)
ДМФ (2 капли) и тионилхлорид (1,2 г; 10,1 ммоля) добавляли в атмосфере азота при комнатной температуре к раствору 3-(3,4-диметоксифенил)пропионовой кислоты (1,4 г; 6,6 ммоля) (фирма Aldrich) в CH2Cl2 (10 мл). Через 1 час растворитель выпаривали при пониженном давлении с получением масла, которое растворяли в CH2Cl2 (5 мл). Триэтиламин (0,8 г; 7,9 ммоля) и полученный выше раствор в CH2Cl2 добавляли при комнатной температуре и при перемешивании к раствору промежуточного продукта 24 (2 г; 5,5 ммоля), полученного согласно примеру 11, в CH2Cl2 (15 мл). Реакционную смесь выдерживали при перемешивании и при комнатной температуре в течение 3 часов. После добавления воды (30 мл) и разделения фаз органическую фазу сушили над Na2SO4 и растворитель выпаривали при пониженном давлении. Образовавшийся остаток растворяли в ТГФ (15 мл). К образовавшемуся раствору при перемешивании в атмосфере азота и при комнатной температуре медленно добавляли комплекс боран-диметилсульфид (2,6 г; 32,5 ммоля). По завершении добавления реакционную смесь кипятили с обратным холодильником в течение 1,5 ч. После охлаждения до 5oC добавляли раствор 37%-ной HCl (1 мл) в метаноле (7,5 мл). Реакционную смесь вновь кипятили с обратным холодильником в течение 1 часа, затем концентрировали путем отгонки растворителей при атмосферном давлении и высушивали досуха при пониженном давлении. Остаток растворяли в метаноле (30 мл) и растворитель выпаривали при пониженном давлении. После дополнительного добавления метанола (30 мл) и выпаривания растворителя досуха образовавшийся остаток растворяли в абсолютном этаноле (30 мл). После добавления раствора HCl в этиловом эфире (15% мас./об.) (1 мл) и выпаривания растворителей при пониженном давлении неочищенный продукт очищали с помощью хроматографии (элюент CH2Cl2: CH3ОН: 50%-ная HCOOH = 90: 10:1). Полученный твердый продукт растворяли в абсолютном этаноле и после добавления раствора HCl в этиловом эфире (15% мас./об.) до получения выраженно кислого значения pH и выпаривания растворителей при пониженном давлении получали промежуточный продукт 45 (1,3 г) в виде аморфного белого твердого вещества.
1H-ЯМР (200 МГц; D2O): δ (част./млн): 0,82 (t, 3H); 1,15-2,21 (m, 14H); 2,50 (t, 2H); 2,47-3,20 (m, 12H); 3,43-3,61 (m, 1H); 3,59 (s, 3H); 3,66 (s, 3H); 3,68 (s, 3H); 3,69 (s, 3H); 6,65-6,86 (m, 5H).
МС: 527 [M+1].
Аналогично описанной выше методике были получены следующие соединения.
Дигидрохлорид (S)-N-пропил-N-[6-[2-(3-метил-4- метоксифенил)этиламино] гексил]-5,6-диметокси-1,2,3,4- тетрагидро-2-нафтиламина (промежуточный продукт 46) с использованием в качестве исходного вещества (3-метил-4- метоксифенил)уксусной кислоты, полученной согласно Chem. Pharm. Bull., 30(7), 2440-6 (1982).
1H-ЯМР (200 МГц; D2O): δ (част./млн): 0,83 (t, 3H); 1,13-2,25 (m, 12H); 2,04 (s, 3H); 2,48-3,22 (m,14H); 3,45-3,65 (m, 1H); 3,62 (s, 3H); 3,69 (s, 3H); 3,71 (s, 3H); 6,80-7,03 (m, 5H).
МС: 497 [M+1].
Дигидрохлорид (S)-N-пропил-N-[6-[2-(3,5-диметокси-4-метилфенил) этиламино] гексил] -5,6-диметокси-1,2,3,4-тетрагидро-2-нафтиламина (промежуточный продукт 47) с использованием в качестве исходного вещества (3,5-диметокси-4-метилфенил)уксусной кислоты, полученной согласно J. Chem. Res. Synop., (5), 149 (1981).
1H-ЯМР (200 МГц; D2O): δ (част./млн): 0,81 (t, 3H); 1,13-2,20 (m, 12H); 1,82 (s, 3H); 2,42-3,19 (m,14H); 3,52 (m, 1H); 3,57 (s, 3H); 3,65 (s, 6H); 3,67 (s, 3H); 6,48 (s, 2H); 6,75 (d, 1H); 6,81 (d, 1H).
МС: 527 [M+1].
Дигидрохлорид (S)-N-пропил-N-[6-[2-(4- метокси-3-фенилметоксифенил)этиламино]гексил]-5,6- ди(фенилметокси)-1,2,3,4-тетрагидро-2-нафтиламина (промежуточный продукт 48) с использованием в качестве исходных веществ промежуточного продукта 28 и (4-метокси-3-фенилметоксифенил) уксусной кислоты, полученной согласно J. Org. Chem., 49(26), 5243-6 (1984).
1H-ЯМР (200 МГц; ДМСО-d6): δ (част./млн): 0,92 (t, 3H); 1,20-2,42 (m, 12H); 2,52-3,65 (m, 15H); 3,72 (s, 3H); 4,93 (s, 2H); 5,06 (s, 2H); 5,15 (s, 2H); 6,74-7,04 (m, 5H); 7,27-7,51 (m, 15H): 9,10-9,35 (bs, 2H); 10,50-10,71 (bs, 1H).
МС: (термоспрей) 741 [M+1].
Пример 24
Получение тригидрохлорида (S)-N-пропил-N-[6-[4-(4-метоксифенилметил)пиперазин-1-ил] гексил]-5,6-диметокси-1,2,3,4-тетрагидро-2-нафтиламина (промежуточный продукт 49)
Тионилхлорид (1,1 г; 9,2 ммоля) добавляли в атмосфере азота при комнатной температуре к раствору промежуточного продукта 29 (2,3 г; 6,1 ммоля), полученному согласно примеру 16, в CH2Cl2 (15 мл). Через 1 час растворитель выпаривали при пониженном давлении с получением масла, которое растворяли в CH2Cl2 (5 мл). Полученный выше раствор в CH2Cl2 добавляли при комнатной температуре и при перемешивании к раствору промежуточного продукта 15 (1,2 г; 5,8 ммоля), полученного согласно примеру 4, и триэтиламина (0,8 г; 7,9 ммоля) в CH2Cl2 (15 мл). Реакционную смесь выдерживали при перемешивании и при комнатной температуре в течение 2 часов. После добавления воды (30 мл) и разделения фаз водную фазу экстрагировали CH2Cl2 (20 мл). Объединенные органические фазы промывали водой, сушили над Na2SO4 и растворитель выпаривали при пониженном давлении. Образовавшийся остаток растворяли в ТГФ (15 мл). К образовавшемуся раствору при перемешивании в атмосфере азота и при комнатной температуре медленно добавляли комплекс боран-диметилсульфид (3,3 г; 42 ммоля). По завершении добавления реакционную смесь кипятили с обратным холодильником в течение 1,5 ч. После охлаждения до 5oC добавляли раствор 37%-ной HCl (1,4 мл) в метаноле (12 мл). Реакционную смесь вновь кипятили с обратным холодильником в течение 1 часа, затем концентрировали путем отгонки растворителей при атмосферном давлении и высушивали досуха при пониженном давлении. Остаток растворяли в метаноле (30 мл) и растворитель выпаривали при пониженном давлении. После дополнительного добавления метанола (30 мл) и выпаривания растворителя досуха образовавшийся остаток растворяли в абсолютном этаноле (30 мл). После добавления раствора HCl в этиловом эфире (15% мас./об.) (1 мл) выпаривали растворители, получая промежуточный продукт 49 (2,5 г) в виде аморфного белого твердого вещества.
1H-ЯМР (200 МГц; D2O): δ (част./млн): 0,82 (t, 3H); 1,18-2,24 (m, 12H); 2,46-3,23 (m, 10H); 3,31-3,65 (m, 9H); 3,61 (s, 3H); 3,70 (s, 6H); 4,24 (s, 2H); 6,84 (s, 2H); 6,90-7,36 (m, 4H).
МС: 538 [М+1].
Аналогично описанной выше методике были получены следующие соединения.
Дигидрохлорид (S)-N-пропил-N-[6-[2-(2- оксо-3H-1,3-бензтиазол-6-ил)этиламино] гексил] -5,6-диметокси- 1,2,3,4-тетрагидро-2-нафтиламина (промежуточный продукт 50) с использованием в качестве исходного вещества промежуточного продукта 21.
1H-ЯМР (200 МГц; D2O): δ (част./млн): 0,80 (t, 3H); 1,13-2,20 (m, 12H); 2,40-3,20 (m, 14H); 3,42-3,61 (m, 1H); 3,57 (s, 3H); 3,66 (s, 3H); 6,74 (d, 1H); 6,78 (d, 1H); 6,95-7,26 (m, 3H).
МС: 526 [М+1].
Дигидрохлорид (S)-N-пропил-N-[6-[2- (2-оксо-3H-1,3-бензтиазол-5-ил)этиламино] гексил] -5,6-диметокси- 1,2,3,4-тетрагидро-2-нафтиламина (промежуточный продукт 51) с использованием в качестве исходного вещества промежуточного продукта 20.
1H-ЯМР (200 МГц; ДМСО-d6): δ (част./млн): 0,93 (t, 3H); 1,15-2,42 (m, 12H); 2,52-3,65 (m, 15H); 3,68 (s, 3H); 3,76 (s, 3H); 6,83 (d, 1H); 6,90 (d, 1H); 7,00-7,08 (m, 2H); 7,52 (d, 1H); 9,02-9,30 (bs, 2H); 10,34-10,54 (bs, 1H); 12,04 (s, 1H).
МС: 526 [M+1].
Тригидрохлорид (S)-N-пропил-N-[6-[2-(2-амино-1,3-бензтиазол-6- ил)этиламино] гексил] -5,6-диметокси-1,2,3,4-тетрагидро-2-нафтиламина (промежуточный продукт 52) с использованием в качестве исходного вещества промежуточного продукта 22.
1H-ЯМР (200 МГц; D2O): δ (част./млн): 0,80 (t, 3H); 1,14-2,22 (m, 12H); 2,41-3,22 (m, 14H); 3,44-3,64 (m, 1H); 3,57 (s, 3H); 3,67 (s, 3H); 6,80 (s, 2H); 7,23 (dd, 1H); 7,30 (d, 1H); 7,50 (d, 1H).
МС (термоспрей): 525 [M+1].
Дигидрохлорид (S)-N-пропил-N-[6-[2-(3- хлор-5-метоксифенил)этиламино]гексил] -5,6-диметокси-1,2,3- тетрагидро-2-нафтиламина (промежуточный продукт 53) с использованием в качестве исходного вещества промежуточного продукта 23.
1H-ЯМР (200 МГц; CDCl3): δ (част./млн): 0,86 (t, 3H); 1,18-2,09 (m, 12H); 2,38-3,13 (m, 15H); 3,76 (s, 3H); 3,77 (s, 3H); 3,81 (s, 3H); 6,60-6,82 (m, 5H).
МС: 517 [M+1].
Дигидрохлорид (S)-N-пропил-N-[6-[2-(2-оксо-3H-1,3-бензтиазол-6- ил)этиламино]гексил]-5-метокси-1,2,3,4-тетрагидро-2-нафтиламина (промежуточный продукт 54) с использованием в качестве исходных веществ промежуточного продукта 21 и промежуточного продукта 31.
1H-ЯМР (200 МГц; ДМСО-d6): δ (част./млн): 0,93 (t, 3H); 1,19-2,45 (m, 12H); 2,68-3,32 (m, 14H); 3,50-3,68 (m, 1H); 3,76 (s, 3H); 6,67-7,51 (m, 6H); 9,25 (bs, 2H); 10,60 (bs, 1H).
МС: 496 [M+1].
Пример 25
Получение (S)-N-пропил-N-[6-[(3,4- диметоксифенил)ацетиламино]гексил]-5,6-диметокси-1,2,3,4- тетрагидро-2-нафтиламина (промежуточный продукт 55)
ДМФ (2 капли) и тионилхлорид (0,8 г; 6,7 ммоля) добавляли в атмосфере азота при комнатной температуре к раствору (3,4-диметоксифенил)уксусной кислоты (0,8 г; 4,1 ммоля) (фирма Aldrich) в CH2Cl2 (7 мл). Через 1 час растворитель выпаривали при пониженном давлении с получением масла, которое растворяли в CH2Cl2 (5 мл). Полученный выше раствор в CH2Cl2 добавляли при комнатной температуре и при перемешивании к раствору промежуточного продукта 25 (1,4 г; 3,3 ммоля), полученного согласно примеру 12, и триэтиламина (1,2 г; 11,9 ммоля) в CH2Cl2 (14 мл). Реакционную смесь выдерживали при перемешивании и при комнатной температуре в течение 3 часов и затем сливали на воду (25 мл). После разделения фаз водную фазу экстрагировали CH2Cl2 (25 мл) и объединенные органические фазы промывали водой, сушили над Na2SO4 и растворитель выпаривали при пониженном давлении. Образовавшийся неочищенный продукт очищали с помощью хроматографии (элюент CH2Cl2:CH3OH:30%-ный аммиак = 95: 5:0,5), получая промежуточный продукт 55 (0,6 г) в виде масла.
1H-ЯМР (200 МГц; CDCl3): δ (част./млн): 0,86 (t, 3H); 1,14-2,12 (m, 12H); 2,38-3,23 (m, 10H); 3,49 (s, 2H); 3,76 (s, 3H); 3,81 (s, 3H); 3,85 (s, 6H); 5,44 (bs, 1H); 6,68-6,86 (m, 5H).
МС: 527 [М+1].
Пример 26
Получение (S)-N-пропил-N-[5,6-ди(фенилметокси)-1,2,3,4- тетрагидро-2-нафтил]-N'-[2-(4-метоксикарбонилфенил)этил]-1,6- гександиамида (промежуточный продукт 56)
Тионилхлорид (1,25 г; 10,5 ммоля) добавляли в атмосфере азота к раствору промежуточного продукта 30 (3,7 г; 7,0 ммолей), полученного согласно примеру 16, в CH2Cl2. После выдержки при комнатной температуре в течение 2 часов реакционную смесь упаривали досуха при пониженном давлении. Образовавшийся остаток растворяли в CH2Cl2 (5 мл) и раствор добавляли по каплям в атмосфере азота при перемешивании к раствору метил-4-(2- аминоэтил)бензоата (1,5 г; 7,0 ммолей), полученного согласно Berichte, 71, 59 (1938), и триэтиламина (1,8 г; 17,5 ммоля) в CH2Cl2 (40 мл). После выдержки при комнатной температуре в течение 2 часов добавляли воду (30 мл) и разделяли фазы. Водную фазу экстрагировали CH2Cl2 (20 мл) и объединенные органические фазы промывали водой, сушили над Na2SO4, фильтровали и растворитель удаляли при пониженном давлении. Образовавшийся неочищенный продукт очищали с помощью хроматографии (элюент CH2Cl2:CH3OH = 95:5), получая промежуточный продукт 56 (4,0 г) в виде аморфного твердого вещества.
1H-ЯМР (200 МГц; CDCl3): δ (част./млн): 0,87 и 0,90 (2t, 3H); 1,44-2,03 (m, 8H); 2,09-2,39 (m, 4H); 2,51-3,23 (m, 8H); 3,44-3,58 (m, 2H); 3,79-3,99 и 4,41-4,60 (2m, 1H); 3,87 (s, 3H); 4,98 и 5,01 (2s, 2H); 5,09 и 5,10 (2s, 2H); 6,15-6,29 (m, 1H); 6,70-6,87 (m, 2H); 7,20-7,47 (m, 12H); 7,95 (dd, 1H).
МС: 691 [M+1].
Пример 27
Получение (S)-N-пропил-N-[6-[2-(4-метоксикарбонилфенил)этиламино] гексил] -5,6-ди(фенилметокси)-1,2,3,4-тетрагидро-2-нафтиламина (промежуточный продукт 57)
Комплекс боран-диметилсульфид (2,0 г; 25,6 ммоля) медленно добавляли при перемешивании в атмосфере азота и при комнатной температуре к раствору промежуточного продукта 56 (4,4 г; 6,4 ммоля), полученного согласно примеру 26, в ТГФ (100 мл). По завершении добавления реакционную смесь кипятили с обратным холодильником в течение 1,5 ч. После охлаждения до 5oC медленно добавляли раствор концентрированной HCl (1,4 мл) в метаноле (10 мл). Реакционную смесь вновь кипятили с обратным холодильником в течение 2 часов, а затем концентрировали путем отгонки растворителей при атмосферном давлении и высушивали досуха при пониженном давлении. Остаток растворяли в метаноле (30 мл) и растворитель выпаривали при пониженном давлении. Добавляли метанол (30 мл) и растворитель вновь выпаривали. Добавляли этилацетат (50 мл), воду (30 мл) и 30%-ный водный NH4OH до получения значения pH 14. Водную фазу экстрагировали этилацетатом (30 мл), а затем органические фазы объединяли, промывали водой и сушили над Na2SO4. После выпаривания растворителей при пониженном давлении получали неочищенный продукт, который очищали с помощью хроматографии (элюент CH2Cl2:CH3OH:30%-ный NH4ОН = 90:10:0,5), получая промежуточный продукт 57 (3,0 г) в виде масла.
1H-ЯМР (200 МГц; CDCl3): δ (част./млн): 0,86 (t, 3H); 1,18-2,06 (m, 13H); 2,38-3,16 (m, 15H); 3,89 (s, 3H); 4,98 (s, 2H); 5,09 (s, 2H); 6,76 (d, 1H); 6,81 (d, 1H); 7,23-7,48 (m, 12H); 7,91-7:99 (m, 2H).
МС: 663 [M+1].
Пример 28
Получение (S)-N-пропил-N-[5,6-ди(фенилметокси)- 1,2,3,4-тетрагидро-2-нафтил] -N'-[2-(4-карбоксифенил)этил] -1,6- гександиамида (промежуточный продукт 58)
Водный раствор 4 н. NaOH (2 мл) добавляли по каплям при комнатной температуре и при перемешивании к раствору промежуточного продукта 56 (2,0 г; 2,9 ммоля), полученного согласно примеру 26, в метаноле (10 мл). Реакционную смесь кипятили с обратным холодильником при перемешивании в течение 2 часов. Растворители удаляли при пониженном давлении, а затем добавляли CH2Cl2 (20 мл), воду (20 мл) и концентрированную HCl до получения значения pH 1. Водную фазу экстрагировали CH2Cl2 (20 мл), затем объединяли органические фазы, промывали водой и сушили над Na2SO4. После удаления растворителя при пониженном давлении получали промежуточный продукт 58 (1,9 г) в виде белого аморфного твердого вещества.
1H-ЯМР (200 МГц; CDCl3): δ (част./млн): 0,87 и 0,90 (2t, 3H); 1,45-2,06 (m, 8H); 2,10-2,47 (m, 4H); 2,50-3,32 (m, 8H); 3,43-3,59 (m, 2H); 3,80-4,00 и 4,41-4,61 (2m, 1H); 4,98 и 5,00 (2s, 2H); 5,09 и 5,10 (2s, 2H); 6,27-6,45 (m, 1H); 6,68-6,87 (m, 2H); 7,21-7,47 (m, 12H); 7,94 (d, 1H).
МС: 677 [M+1].
Пример 29
Получение дигидрохлорида (S)-N-пропил-N-[6-[2-(4- сульфофенил)этиламино] гексил]-5,6-ди(фенилметокси)-1,2,3,4- тетрагидро-2-нафтиламина (промежуточный продукт 59)
Раствор 4-(2-аминоэтил)бензилсульфоновой кислоты (1,7 г; 8,5 ммоля) (фирма Aldrich) в воде (51 мл) добавляли по каплям при комнатной температуре и при перемешивании к раствору промежуточного продукта 32 (3,5 г; 5,4 ммоля), полученного согласно примеру 17, в пиридине (210 мл). Реакционную смесь нагревали до 70oC и выдерживали при перемешивании в течение 2 часов. Растворители удаляли при пониженном давлении, добавляли метанол (30 мл) и затем удаляли его при пониженном давлении. Остаток очищали с помощью хроматографии (элюент CH2Cl2:CH3OH:50%-ная HCOOH = 85:15:1). Очищенный продукт растворяли в атмосфере азота в безводном ТГФ (30 мл), а затем медленно добавляли при перемешивании и при комнатной температуре комплекс боран-диметилсульфид (1,5 г; 19,0 ммолей). Реакционную смесь кипятили с обратным холодильником в течение 2 часов. После охлаждения до 5oC медленно добавляли раствор концентрированной HCl (0,7 мл) в метаноле (7 мл). Смесь кипятили с обратным холодильником в течение 2 часов, концентрировали путем отгонки растворителей при атмосферном давлении и высушивали досуха при пониженном давлении. Остаток растворяли в метаноле (20 мл), растворитель отгоняли при пониженном давлении, добавляли метанол (20 мл) и растворитель удаляли вновь. Добавляли абсолютный этанол (20 мл) и раствор HCl в этиловом эфире (15% мас./об.) (1 мл). После выпаривания растворителей при пониженном давлении получали неочищенный продукт, который очищали с помощью хроматографии (элюент CH2Cl2: CH3OH: 50%-ная HCOOH = 85:15:1). Образовавшийся твердый продукт растворяли в абсолютном этаноле, раствор подкисляли до pH 1, добавляя раствор HCl в этиловом эфире (15% мас./об.), и растворители удаляли при пониженном давлении. С помощью кристаллизации из метанола получали промежуточный продукт 59 (1,4 г) в виде белого твердого вещества.
1H-ЯМР (200 МГц; ДМСО-d6): δ (част./млн): 0,91 (t, 3H); 1,20-2,34 (m, 12H); 2,51-3,30 (m, 14H).; 3,42-3,67 (m, 1H); 4,93 (s, 2H): 5,16 (s, 2H); 6,86 (d, 1H); 7,02 (d, 1H); 7,17-7,23 (m, 2H); 7,25-7,50 (m, 10H); 7,51-7,59 (m, 2H) 8,69-8,90 (bs, 2H); 9,81-9,98 (bs, 1H).
МС (термоспрей): 685 [M+1].
Пример 30
Получение (S)-N-пропил-N-[5,6- ди(фенилметокси)-1,2,3,4-тетрагидро-2-нафтил] -N'- фенилметоксикарбонил-N'-[2-(4-метоксикарбоксифенил)этил] -1,6- гександиамина (промежуточный продукт 60)
Бензилхлорформиат (0,8 г; 4,7 ммоля) добавляли по каплям при комнатной температуре и при перемешивании к раствору промежуточного продукта 57 (2,7 г; 4,1 ммоля), полученного согласно примеру 27, и триэтиламина (0,5 г; 5,0 ммолей) в CH2Cl2 (70 мл). Смесь перемешивали при комнатной температуре в течение 1 часа и затем добавляли водный раствор 1 н. HCl (20 мл). Фазы разделяли и органическую фазу промывали 10%-ным водным раствором KHCO3 (20 мл), сушили над Na2SO4 и растворитель удаляли при пониженном давлении. Промежуточный продукт 60 (3,1 г) получали в виде аморфного твердого вещества.
1H-ЯМР (200 МГц; CDCl3): δ (част./млн): 0,86 (t, 3H); 1,16-2,07 (m, 12H); 2,37-3,51 (m, 15H); 3,89 (s, 3H); 4,99 (s, 2H); 5,09 (s, 2H); 5,08 и 5,12 (2s, 2H); 6,77 (d, 1H); 6,81 (d, 1H); 7,08-7,48 (m, 17H); 7,90-7,98 (m, 2H).
МС (термоспрей): 797 [M+1].
Аналогично описанной выше методике были получены следующие соединения.
(S)-N-пропил-N-[5,6-ди(фенилметокси)-1,2,3,4- тетрагидро-2-нафтил]-N'-фенилметоксикарбонил-N'-[2-(4- нитрофенил)этил]-1,6-гександиамин (промежуточный продукт 61) с использованием в качестве исходного вещества промежуточного продукта 37.
1H-ЯМР (200 МГц; CDCl3; 60oC): δ (част./млн): 0,87 (t, 3H); 1,21-2,22 (m, 12H); 2,38-3,23 (m, 13H); 3,48 (t, 2H); 5,00 (s, 2H); 5,09 (2s, 4H); 6,73 (d, 1H); 6,81 (d, 1H); 7,19-7,45 (m, 17H); 8,02-8,11 (m, 2H).
МС: 784 [M+1].
(S)-N-пропил-N-[5,6-ди(фенилметокси)-1,2,3,4- тетрагидро-2-нафтил]-N'-фенилметоксикарбонил-N'-[2-(4- сульфофенил)этил]-1,6-гександиамин (промежуточный продукт 62) с использованием в качестве исходного вещества промежуточного продукта 59.
1H-ЯМР (200 МГц; CDCl3; 60oC): δ (част. /млн): 0,32-2,02 (m, 15H); 2,20-3,75 (m, 15H); 5,01 (s, 2H); 5,09 (s, 2H); 5,17 (s, 2H); 6,75-6,91 (m, 2H); 7,00-7,11 (m, 2H); 7,24-7,46 (m, 15H); 7,72-7,83 (m, 2H); 10,25-10,50 (bs, 1H).
МС (термоспрей): 819 [M+1].
Пример 31
Получение (S)-N-пропил-[5,6-ди(фенилметокси)-1,2,3,4-тетрагидро-2- нафтил]-N'-фeнилмeтoкcикapбoнил-N'-[2-(4-карбамоилфенил)этил]-1,6- гександиамина (промежуточный продукт 63)
Водный раствор 32%-ного NaOH (3 мл) добавляли по каплям при комнатной температуре и при перемешивании к раствору промежуточного продукта 60 (3,1 г; 3,9 ммоля), полученного согласно примеру 30, в диоксане (30 мл) и метаноле (3 мл). Реакционную смесь нагревали до 80oC и выдерживали при перемешивании в течение 1 часа. Растворители удаляли при пониженном давлении и затем добавляли этилацетат (50 мл), воду (30 мл) и концентрированную HCl до получения значения pH 1. Водную фазу экстрагировали этилацетатом (20 мл), затем объединяли органические фазы, промывали водой и сушили над Na2SO4. После удаления растворителя при пониженном давлении получали остаток, который растворяли в CH2Cl2 (40 мл). В атмосфере азота при перемешивании и при комнатной температуре добавляли тионилхлорид (0,6 г; 5,0 ммолей). После выдержки в течение 1 часа при комнатной температуре реакционную смесь упаривали досуха при пониженном давлении. Образовавшийся остаток растворяли в CH2Cl2 (10 мл) и раствор добавляли по каплям в атмосфере азота к перемешанному раствору аммиака в 0,65 М ТГФ (80 мл). Растворители удаляли при пониженном давлении, а затем добавляли CH2Cl2 (40 мл) и воду (20 мл). Органическую фазу промывали водой и сушили над Na2SO4. Остаток очищали с помощью хроматографии (элюент CH2Cl2: CH3OH: 30%-ный NH4OH = 90:10:0,5), получая промежуточный продукт 63 (2,5 г) в виде аморфного твердого вещества.
1H-ЯМР (200 МГц; CDCl3): δ (част./млн): 0,96 (t, 3H); 1,15-2,07 (m, 12H); 2,36-3,51 (m, 15H); 4,99 (s, 2H); 5,09 (s, 2H); 5,08 и 5,11 (2s, 2H); 5,56-6,28 (bs, 2H); 6,77 (d, 1H); 6,81 (d, 1H); 7,08-7,47 (m, 17H); 7,61-7,77 (m, 2H).
МС: 782 [M+1].
Пример 32
Получение (S)-N-пропил-[5,6-ди(фенилметокси)-1,2,3,4- тетрагидро-2-нафтил]-N'-фенилметоксикарбонил-N'-[2-(4- аминофенил)этил]-1,6-гександиамина (промежуточный продукт 64)
Железный порошок (0,65 г) добавляли в течение 30 минут при перемешивании к суспензии промежуточного продукта 61 (1,1 г; 1,4 ммоля), полученного согласно примеру 30, в воде (6 мл) и уксусной кислоте (0,3 мл) при температуре дефлегмации. Реакционную смесь кипятили с обратным холодильником в течение 6 часов и затем добавляли воду (10 мл) и этилацетат (30 мл). Смесь фильтровали через Celite® и разделяли фазы. Органическую фазу промывали водой и затем водным раствором KHCO3, сушили над Na2SO4 и растворитель выпаривали при пониженном давлении. Остаток очищали с помощью хроматографии (элюент CH2Cl2: CH3OH = 9:1), получая промежуточный продукт 64 (0,7 г) в виде масла.
1H-ЯМР (200 МГц; CDCl3): δ (част./млн): 0,87 (t, 3H); 1,12-2,07 (m, 12H); 2,37-3,46 (m, 17H); 4,99 (s, 2H); 5,09 (s, 2H); 5,10 (bs, 2H); 6,52-6,64 (m, 2H); 6,77 (d, 1H); 6,81 (d, 1H); 6,82-7,03 (m, 2H); 7,26-7,48 (m, 15H).
МС: 754 [M+1].
Пример 33
Получение (S)-N-пропил-[5,6-ди(фенилметокси)-1,2,3,4-тетрагидро-2- нафтил] -N'-фенилметоксикарбонил-N'-[2-(4-ацетиламинофенил)этил] -1,6- гександиамина (промежуточный продукт 65)
К раствору промежуточного продукта 64 (0,7 г; 0,9 ммоля), полученного согласно примеру 32, и триэтиламина (0,14 г; 1,4 ммолей) в CH2Cl2 (7 мл) по каплям при комнатной температуре в атмосфере азота и при перемешивании добавляли ацетилхлорид (0,08 г; 1,0 ммоль). Через 2 часа добавляли воду (10 мл) и CH2Cl2 (10 мл), разделяли фазы и органическую фазу сушили над
Na2SO4. Растворитель выпаривали при пониженном давлении, получая промежуточный продукт 65 (0,7 г) в виде масла.
1H-ЯМР (200 МГц; CDCl3): δ (част./млн): 0,89 (t, 3H); 1,13-2,12 (m, 12H); 2,02 и 2,09 (2s, 3H); 2,36-3,53 (m, 15H); 5,01 (s, 2H); 5,10 (s, 2H); 5,11 и 5,15 (2s, 2H); 6,79 (d, 1H); 6,83 (d, 1H); 6,97-7,20 (m, 2H); 7,23-7,49 (m, 17H); 7,95-8,09 (bs, 1H).
МС: 796 [M+1].
Пример 34
Получение (S)-N-пропил-[5,6-ди(фенилметокси)- 1,2,3,4-тетрагидро-2-нафтил] -N'-фенилметоксикарбонил-N'-[2-(4- метилсульфониламинофенил)этил]-1,6-гександиамина (промежуточный продукт 66)
К раствору промежуточного продукта 64 (3,0 г; 4,0 ммоля), полученного согласно примеру 32, и триэтиламина (0,4 г; 4,0 ммоля) в CH2Cl2 (50 мл) по каплям при 0oC в атмосфере азота и при перемешивании добавляли метансульфоновый ангидрид (0,7 г; 4,0 ммоля). Реакционную смесь нагревали до 40oC и выдерживали при перемешивании в течение 2 часов, затем охлаждали до 0oC и вновь добавляли метансульфоновый ангидрид (0,35 г; 2,0 ммоля). Реакционную смесь нагревали до 40oC и выдерживали при перемешивании в течение 2 часов, добавляли воду (25 мл) и фазы разделяли. Органическую фазу сушили над Na2SO4 и растворитель выпаривали при пониженном давлении. Остаток очищали с помощью хроматографии (элюент CH2Cl2:CH3OH:30%-ный NH4OH = 95:5:0,5), получая промежуточный продукт 66 (3,1 г) в виде масла.
1H-ЯМР (200 МГц; CDCl3): δ (част./млн): 0,87 (t, 3H); 1,11-2,08 (m, 12H); 2,33-3,49 (m, 15H); 2,93 (s, 3H); 4,99 (s, 2H); 5,10 (s, 2H); 5,10 и 5,12 (2s, 2H); 6,76 (d, 1H); 6,81 (d, 1H); 7,00-7,21 (m, 4H); 7,25-7,47 (m, 15H).
МС: 832 [M+1].
Пример 35
Получение (S)-N-пропил-[5,6-ди(фенилметокси)- 1,2,3,4-тетрагидро-2-нафтил] -N'-фeнилмeтoкcикapбoнил-N'-[2-(4- aминoкapбoнилaминoфeнил)этил] -1,6-гександиамина (промежуточный продукт 67)
Концентрированную HCl (0,7 г; 7,1 ммоля) и цианат натрия (0,38 г; 5,8 ммоля) добавляли при комнатной температуре в атмосфере азота и при перемешивании к раствору промежуточного продукта 64 (2,2 г; 2,9 ммоля), полученного согласно примеру 32, в хлорбензоле (20 мл). Реакционную смесь нагревали до 110oC и выдерживали при перемешивании в течение 1 часа. Растворители выпаривали при пониженном давлении, а затем добавляли воду (30 мл) и этилацетат (50 мл). Фазы разделяли, органическую фазу сушили над Na2SO4 и растворитель удаляли при пониженном давлении. Остаток очищали с помощью хроматографии (элюент CH2Cl2:CH3OH:30%-ный NH4OH = 90:10:0,5), получая промежуточный продукт 67 (1,9 г) в виде масла.
1H-ЯМР (200 МГц; CDCl3): δ (част./млн): 0,91 (t, 3H); 1,01-2,22 (m, 12H); 2,44-3,48 (m, 15H); 4,99 (s, 2H); 5,06 (bs, 2H); 5,10 (2s, 4H); 6,76 (d, 1H); 6,81 (d, 1H); 6,89-7,11 (m, 2H); 7,20-7,46 (m, 17H); 7,81-8,08 (bs, 1H).
МС: 797 [M+1].
Пример 36
Получение дигидрохлорида (S)-N-пропил-[6-[2-(4- метилсульфонилфенил) этиламино]гексил]-5,6-диметокси-1,2,3,4-тетрагидро-2-нафтиламина (промежуточный продукт 68)
1,1'-карбонилдиимидазол (0,76 г; 4,7 ммоля) добавляли при перемешивании к суспензии (4-метилсульфонил)фенилуксусной кислоты (1,0 г; 4,7 ммоля), полученной согласно J. Chem. Soc., 1501-6 (1948), в CH2Cl2 (25 мл). Смесь выдерживали при перемешивании в течение 1,5 ч при комнатной температуре, а затем добавляли триэтиламин (0,48 г; 4,7 ммоля) и раствор промежуточного продукта 24 (1,7 г; 4,7 ммоля), полученного согласно примеру 11, в CH2Cl2 (20 мл). Через 1 час добавляли воду (30 мл) и CH2Cl2 (30 мл), фазы разделяли и органическую фазу сушили над Na2SO4. Растворитель удаляли при пониженном давлении и остаток растворяли в безводном ТГФ (25 мл) в атмосфере азота. При перемешивании и при комнатной температуре медленно добавляли комплекс боран-диметилсульфид (2,1 г; 26,6 ммоля). Реакционную смесь кипятили с обратным холодильником в течение 1,5 ч. После охлаждения до 5oC медленно добавляли раствор концентрированной HCl (1,1 мл) в метаноле (11 мл). Реакционную смесь кипятили с обратным холодильником в течение 1 часа, концентрировали путем отгонки растворителей при атмосферном давлении и затем высушивали досуха при пониженном давлении. Остаток растворяли в метаноле (30 мл), растворитель отгоняли при пониженном давлении, добавляли метанол (30 мл) и растворитель вновь удаляли. Добавляли абсолютный этанол (30 мл) и раствор HCl в этиловом эфире (15% мас./об.) (1 мл), а затем при пониженном давлении выпаривали растворители, получая неочищенный продукт, который очищали с помощью хроматографии (элюент CH2Cl2:CH3OH:30%-ная HCOOH = 85:15:1). Образовавшееся твердое вещество растворяли в абсолютном этаноле и раствор подкисляли до pH 1, добавляя раствор HCl в этиловом эфире (15% мас./об.). После выпаривания растворителей при пониженном давлении получали промежуточный продукт 68 (2,3 г) в виде аморфного белого твердого вещества.
1H-ЯМР (200 МГц; D2O): δ (част./млн): 0,83 (t, 3H); 1,16-2,25 (m, 12H); 2,47-3,28 (m, 14H); 3,11 (s, 3H); 3,49-3,68 (m, 1H); 3,61 (s. 3H); 3,70 (s, 3H); 6,84 (s, 2H); 7,40-7,48 (m, 2H); 7,75-7,83 (m, 2H).
МС (термоспрей): 531 [M+1].
Пример 37
Получение (S)-N-пропил-[5,6- ди(фенилметокси)-1,2,3,4-тетрагидро-2-нафтил] -N'- фенилметоксикарбонил-N'-[2-(4-сульфамоилфенил)этил]-1,6- гександиамина (промежуточный продукт 69)
ДМФ (15 мкл) и тионилхлорид (0,65 г; 5,5 ммоля) добавляли при комнатной температуре в атмосфере азота и при перемешивании к раствору промежуточного продукта 59 (3,0 г; 3,7 ммоля), полученного согласно примеру 29, в толуоле (60 мл). Реакционную смесь нагревали до 80oC и выдерживали при перемешивании в течение 4 часов и затем при пониженном давлении удаляли растворитель. Остаток растворяли в ТГФ (30 мл) и раствор добавляли по каплям при 0oC в атмосфере азота к 0,65 М раствору аммиака в ТГФ (28 мл). Реакционной смеси давали возможность самопроизвольно нагреться до комнатной температуры в течение ночи, а затем при пониженном давлении удаляли растворитель и к остатку добавляли воду (30 мл) и CH2Cl2 (50 мл). Фазы разделяли, органическую фазу сушили над Na2SO4 и удаляли растворитель при пониженном давлении. Остаток очищали с помощью хроматографии (элюент CH2Cl2:CH3OH = 95:5), получая промежуточный продукт 69 (1,6 г) в виде масла.
1H-ЯМР (200 МГц; CDCl3): δ (част./млн): 0,89 (t, 3H); 1,08-2,12 (m, 14H); 2,33-3,53 (m, 15H); 4,99 (s, 2H); 5,09 (2s, 4H); 6,76 (d, 1H); 6,81 (d, 1H); 7,11-7,23 (m, 2H); 7,25-7,48 (m, 15H); 7,71-7,85 (m, 2H).
МС (термоспрей): 818 [M+1].
Пример 38
Получение дигидрохлорида (S)-N-пропил-N-[6-[(1,4- бенздиоксан-2-ил)метиламино] гексил] -5,6-дигидрокси-1,2,3,4- тетрагидро-2-нафтиламина (соединение 1)
Работая по методике, аналогичной описанной в примере 20, но используя промежуточный продукт 5 вместо промежуточного продукта 2, получали соединение 1.
1H-ЯМР (200 МГц; D2O): δ (част./млн): 0,80 (t, 3H); 1,18-1,68 (m, 10H); 1,63-2,20 (m, 2H); 2,38-3,27 (m, 12H); 3,42-3,60 (m, 1H); 3,95 (dd, 1H); 4,18 (dd, 1H); 4,44-4,54 (m, 1H); 6,50 (d, 1H); 6,62 (d, 1H); 6,75-6,85 (m, 4H).
МС (химическая ионизация, аммиак, положительные ионы): 469 [M+1].
Аналогичным образом были получены следующие соединения.
Дигидрохлорид (S)-N-пропил-N-[6- [2-(3,4-метилендиоксифенил)этиламино] гексил] -5,6-дигидрокси- 1,2,3,4-тетрагидро-2-нафтиламина (соединение 2) с использованием в качестве исходного вещества промежуточного продукта 4.
1H-ЯМР (200 МГц; D2O): δ (част./млн): 0,83 (t, 3H); 1,21-2,19 (m, 12H); 2,40-3,15 (m, 14H); 3,43-3,60 (m, 1H); 5,79 (s, 2H); 6,49-6,73 (m, 5H).
МС: 469 [M+1].
Тригидрохлорид (S)-N-пропил-N-[6- [4-(2-метоксифенил)пиперазин-1-ил]гексил] -5,6-дигидрокси- 1,2,3,4-тетрагидро-2-нафтиламина (соединение 3) с использованием в качестве исходного вещества промежуточного продукта 12.
1H-ЯМР (200 МГц; D2O): δ (част./млн): 0,79 (t, 3H); 1,22-1,78 (m, 10H); 1,52-2,18 (m, 2H); 2,37-3,64 (m, 19H); 3,69 (s, 3H); 6,48 (d, 1H); 6,60 (d, 1H); 6,80-7,09 (m, 4H).
МС (термоспрей): 496 [M+1].
Дигидрохлорид (S)-N-пропил-N-[6-[2-(2- нитрофенокси)этиламино]гексил]-5,6-дигидрокси-1,2,3,4-тетрагидро- 2-нафтиламина (соединение 4) с использованием в качестве исходного вещества промежуточного продукта 7.
1H-ЯМР (200 МГц; D2O): δ (част./млн): 0,80 (t, 3H); 1,23-2,19 (m, 12H); 2,36-3,11 (m, 10H); 3,33-3,58 (m, 3H); 4,29-4,34 (m, 2H); 6,46 (d, 1H); 6.58 (d, 1H); 6,96-7,74 (m, 4H).
МС: 486 [M+1].
Дигидрохлорид (S)-N- пропил-N-[6-[2-(4-нитрофенокси)этиламино]гексил]-5,6- дигидрокси-1,2,3,4-тетрагидро-2-нафтиламина (соединение 5) с использованием в качестве исходного вещества промежуточного продукта 8.
1H-ЯМР (200 МГц; D2O): δ (част./млн): 0,80 (t, 3H); 1,21-1,68 (m, 10H); 1,62-2,15 (m, 2H); 2,34-3,08 (m, 10H); 3,33-3,38 (m, 2H); 3,40-3,56 (m, 1H); 4,23-4,27 (m, 2H); 6,45 (d, 1H); 6,58 (d, 1H); 6,88-8,06 (m, 4H).
МС: 486 [M+1].
Дигидрохлорид (S)-N-пропил-N-[6-[2-(4-метилсульфонилфенокси) этиламино] гексил]-5,6-дигидрокси-1,2,3,4-тетрагидро-2-нафтиламина (соединение 6) с использованием в качестве исходного вещества промежуточного продукта 9.
1H-ЯМР (200 МГц; D2O): δ (част./млн): 0,84 (t, 3H); 1,30-2,21 (m, 12H); 2,42-3,16 (m, 10H); 3,10 (s, 3H); 3,38-3,42 (m, 2H); 3,47-3,63 (m, 1H); 4,26-4,31 (m, 2H); 6,53 (d, 1H); 6,66 (d, 1H); 7,05-7,80 (m, 4H).
МС (химическая ионизация, аммиак, положительные ионы): 519 [M+1].
Пример 39
Получение гидрохлорида (S)-N-пропил-N-[6-[2-(2- метоксифенокси)ацетиламино] гексил] -5,6-дигидрокси-1,2,3,4- тетрагидро-2-нафтиламина (соединение 7)
ДМФ (2 капли) и тионилхлорид (0,6 г; 5 ммолей) добавляли в атмосфере азота при комнатной температуре к суспензии (2-метоксифенокси) уксусной кислоты (0,6 г; 3,3 ммоля), полученной согласно Cesk. Farm. 1968, 17(1), 28-33 (Chemical Abstracts 69:67041g), в CH2Cl2 (10 мл). Через 3 часа растворитель выпаривали при пониженном давлении с получением масла, которое растворяли в CH2Cl2 (5 мл). Тетраборат натрия (1 г; 5 ммолей) добавляли в атмосфере азота к раствору промежуточного продукта 26 (1,2 г; 2,5 ммоля), полученного согласно примеру 13, в воде (15 мл). После нагревания до 70oC до полного растворения и охлаждения до комнатной температуры добавляли CH2Cl2 (2 мл), карбонат калия (2,7 г; 19,5 ммоля) и при интенсивном перемешивании полученный выше раствор в CH2Cl2. После выдержки в течение 1 часа при комнатной температуре реакционную смесь подкисляли 37%-ной HCl до pH 1 и разделяли фазы. Водную фазу экстрагировали CH2Cl2 (15 мл). Объединенные органические фазы промывали соляным раствором, слегка подкисленным HCl, сушили над Na2SO4 и упаривали досуха при пониженном давлении. Образовавшийся остаток очищали с помощью хроматографии (элюент CH2Cl2: CH3OH: 50%-ная HCOOH = 85:15:1). Полученный твердый продукт растворяли в абсолютном этаноле. После добавления раствора HCl в этиловом эфире (15% мас./об.) до получения выраженно кислого значения pH растворители выпаривали при пониженном давлении, получая соединение 7 (0,9 г) в виде аморфного белого твердого продукта.
1H-ЯМР (200 МГц; D2O): δ (част./млн): 0,79 (t, 3H); 0,96-2,09 (m, 12H); 2,28-3,10 (m, 10H); 3,26-3,42 (m, 1H); 3,63 (m, 3H); 4,35 и 4,36 (2s, 2H); 6,43 (d, 1H); 6,58 (d, 1H); 6,64-6,80 (m, 4H).
МС: 485 [M+1].
Пример 40
Получение дигидробромида (S)-N-пpoпил-N-[6-[2-(4-гидpoкcифeнилтио) этиламино] гексил] -5,6-дигидрокси-1,2,3,4-тетрагидро-2- нафтиламина (соединение 8)
Раствор промежуточного продукта 33 (1,9 г; 3,2 ммоля), полученного согласно примеру 18, в 48%-ной HBr (19 мл) кипятили с обратным холодильником в атмосфере азота в течение 5 часов. Затем реакционную смесь упаривали досуха при пониженном давлении и к образовавшемуся остатку добавляли абсолютный этанол (40 мл). После выпаривания растворителя и добавления этилацетата (40 мл) растворитель выпаривали вновь. Образовавшийся остаток очищали с помощью хроматографии (элюент CH2Cl2: CH3ОН:50%-ная HCOOH = 85:15:1), получая соединение 8 (0,8 г) в виде аморфного белого твердого продукта.
1H-ЯМР (200 МГц; D2O): δ (част./млн): 0,78 (t, 3H); 1,17-2,14 (m, 12H); 2,35-3,06 (m, 14H); 3,38-3,56 (m, 1H); 6,46 (d, 1H); 6,58 (d, 1H); 6,65-7,26 (m, 4H).
МС: 473 [M+1].
Аналогично описанной выше методике были получены следующие соединения.
Дигидробромид (S)-N-пропил-N-[6- [3-(4-гидроксифенил)пропиламино]гексил] -5,6-дигидрокси-1,2,3,4- тетрагидро-2-нафтиламина (соединение 9) с использованием в качестве исходного вещества промежуточного продукта 34.
1H-ЯМР (200 МГц; D2O): δ (част./млн): 0,80 (t, 3H); 1,15-2,15 (m, 14H); 2,33-3,11 (m. 14H); 3,34-3,51 (m, 1H); 6,45 (d, 1H); 6,59 (d, 1H); 6,63-6,98 (m, 4H).
МС: 455 [M+1].
Дигидробромид (S)-N-пропил-N-[6-(6,7-дигидрокси-1,2,3,4- тетрагидроизохинолин-2-ил)гексил] -5,6-дигидрокси-1,2,3,4-тетрагидро-2- нафтиламина (соединение 10) с использованием в качестве исходного вещества промежуточного продукта 35.
1H-ЯМР (200 МГц; D2O): δ (част./млн): 0,82 (t, 3H); 1,28-2,16 (m, 12H); 2,38-3,59 (m, 15H); 4,08 (bs, 2H); 6,49 и 6,57 (2s, 2H); 6,49 (d, 1H); 6,61 (d, 1H).
МС (термоспрей): 469 [M+1].
Дигидробромид (S)-N-пропил-N-[6-[2-(3-хлор-4-гидроксифенил) этиламино] гексил] -5,6-дигидрокси-1,2,3,4-тетрагидро-2-нафтиламина (соединение 11) с использованием в качестве исходного вещества промежуточного продукта 42.
1H-ЯМР (200 МГц; D2O): δ (част./млн): 0,82 (t, 3H); 1,19-2,19 (m, 12H); 2,38-3,14 (m, 14H); 3,42-3,57 (m, 1H); 6,49 (d, 1H); 6,62 (d, 1H); 6,80 (d, 1H); 6,94 (dd, 1H): 7,15 (d, 1H).
МС: 475 [M+1].
Дигидробромид (S)-N-пропил-N-[6-[2-(3- нитро-4-гидроксифенил)этиламино] гексил] -5,6-дигидрокси-1,2,3,4- тетрагидро-2-нафтиламина (соединение 12) с использованием в качестве исходного вещества промежуточного продукта 43.
1H-ЯМР (200 МГц; D2O): δ (част./млн): 0,82 (t, 3H); 1,17-2,25 (m, 12H); 2,40-3,23 (m, 14H); 3,47-3,65 (m, 1H); 6,52 (d, 1H); 6,64 (d, 1H); 6,83-7,10 (m, 3H).
Дигидробромид (S)-N-пропил-N-[6- [3-(3,4-дигидроксифенил)пропиламино] гексил] -5,6-дигидрокси- 1,2,3,4-тетрагидро-2-нафтиламина (соединение 13) с использованием в качестве исходного вещества промежуточного продукта 45.
1H-ЯМР (200 МГц; D2O): δ (част./млн): 0,81 (t, 3H); 1,17-2,17 (m, 14H); 2,42 (t, 2H); 2,37-3,10 (m, 12H); 3,44-3,60 (m, 1H); 6,48- 6,71 (m, 5H).
МС (термоспрей): 471 [M+1].
Дигидробромид (S)-N-пропил-N-[6-[2-(3-метил-4-гидроксифенил) этиламино] гексил] -5,6-дигидрокси-1,2,3,4-тетрагидро-2-нафтиламина (соединение 14) с использованием в качестве исходного вещества промежуточного продукта 46.
1H-ЯМР (200 МГц; D2O): δ (част./млн): 0,82 (t, 3H); 1,20-2,19 (m, 12H); 2,02 (s, 3H); 2,40-3,13 (m, 14H); 3,44-3,60 (m, 1H); 6,51 (d, 1H); 6,64 (d, 1H); 6,67-6,95 (m, 3H).
МС (термоспрей): 455 [M+1].
Тригидробромид (S)-N-пропил-N-[6-[4-(4- гидроксифенилметил)пиперазин-1-ил] гексил] -5,6-дигидрокси- 1,2,3,4-тетрагидро-2-нафтиламина (соединение 15) с использованием в качестве исходного вещества промежуточного продукта 49.
1H-ЯМР (200 МГц; D2O): δ (част./млн): 0,80 (t, 3H); 1,20-2,20 (m, 12H); 2,39-3,15 (m, 10H); 3,35-3,59 (m, 9H); 4,19 (s, 2H); 6,50 (d, 1H); 6,62 (d, 1H); 6,76-7,25 (m, 4H).
МС (химическая ионизация, аммиак, положительные ионы): 496 [M+1].
Дигидробромид (S)-N-пропил-N-[6-[3-(2- гидрокси(фенил)пропиламино]гексил]-5,6-дигидрокси-1,2,3,4- тетрагидро-2-нафтиламина (соединение 16) с использованием в качестве исходного вещества промежуточного продукта 40.
1H-ЯМР (200 МГц; D2O): δ (част./млн): 0,79 (t, 3H); 1,18-2,18 (m, 14H); 2,48-2,55 (m, 2H); 2,38-3,09 (m, 12H); 3,43-3,60 (m, 1H); 6,49 (d, 1H); 6,61 (d, 1H); 6,71-7,05 (m, 4H).
МС: 455 [M+1].
Дигидробромид (S)-N-пропил-N-[6-[2-(3,5-дигидрокси-4-метилфенил) этиламино]гексил]-5,6-дигидрокси-1,2,3,4-тетрагидро-2- нафтиламина (соединение 17) с использованием в качестве исходного вещества промежуточного продукта 47.
1H-ЯМР (200 МГц; D2O): δ (част./млн): 0,85 (t, 3H); 1,20-2,24 (m, 12H); 1,90 (s, 3H); 2,44-3,17 (m, 14H); 3,48-3,63 (m, 1H); 6,29 (s, 2H); 6,55 (d, 1H); 6,67 (d, 1H).
МС: 471 [M+1].
Дигидробромид (S)-N-пропил-N-[6-[2- (2-оксо-3H-1,3-бензтиазол-6-ил)этиламино] гексил] -5,6-дигидрокси- 1,2,3,4-тетрагидро-2-нафтиламина (соединение 18) с использованием в качестве исходного вещества промежуточного продукта 50.
1H-ЯМР (200 МГц; D2O): δ (част./млн): 0,80 (t, 3H); 1,17-2,17 (m, 12H); 2,34-3,18 (m, 14H); 3,38-3,54 (m, 1H); 6,45 (d, 1H); 6,58 (d, 1H); 6,96-7,24 (m, 3H).
МС: 498 [M+1].
Дигидробромид (S)-N-пропил-N-[6-[2-(2-оксо-3H-1,3-бензтиазол-5-ил) этиламино] гексил] -5,6-дигидрокси-1,2,3,4-тетрагидро-2-нафтиламина (соединение 19) с использованием в качестве исходного вещества промежуточного продукта 51.
1H-ЯМР (200 МГц; D2O; 60oC): δ (част./млн): 1,20 (t, 3H); 1,60-2,56 (m, 12H); 2,78-3,61 (m, 14H); 3,83-3,96 (m, 1H); 6.90 (d, 1H); 7,02 (d, 1H); 7,35-7,40 (m, 2H); 7,75 (d, 1H).
МС: 498 [M+1].
Дигидробромид (S)-N-пропил-N-[6-[2-(2-оксо-3H-1.3- бензтиазол-6-ил)этиламино]гексил]-5-гидрокси-1,2,3,4-тетрагидро- 2-нафтиламина (соединение 20) с использованием в качестве исходного вещества промежуточного продукта 54.
1H-ЯМР (200 МГц; ДМСО-d6): δ (част./млн): 0,93 (t, 3H); 1,20-2,31 (m, 12H); 2,84-3,25 (m, 14H); 3,56-3,71 (m, 1H); 6,55-7,48 (m, 6H); 8,50 (bs, 2H); 9,14 (bs, 1H); 9,40 (bs, 1H).
МС: 482 [M+1].
Дигидробромид (S)-N-пропил-N-[6-[2-(3-хлор-5- гидроксифенил)этиламино] гексил] -5,6-дигидрокси-1,2,3,4- тетрагидро-2-нафтиламина (соединение 21) с использованием в качестве исходного вещества промежуточного продукта 53.
1H-ЯМР (200 МГц; D2O): δ (част./млн): 0,79 (t, 3H); 1,18-2,17 (m, 12H); 2,38-3,15 (m, 14H); 3,44-3,59 (m, 1H); 6,48 (d, 1H); 6,61 (d, 1H); 6,54-6,72 (m, 3H).
Дигидробромид (S)-N-пропил-N-[6- [2-(4-метилсульфонилфенил)этиламино] гексил] -5,6-дигидрокси- 1,2,3,4-тетрагидро-2-нафтиламина (соединение 22) с использованием в качестве исходного вещества промежуточного продукта 68.
1H-ЯМР (200 МГц; D2O): δ (част./млн): 0,79 (t, 3H); 1,11-2,14 (m, 12H); 2,36-3,21 (m, 14H); 3,07 (s, 2H); 3.39-3,56 (m, 1H); 6,48 (d, 1H); 6,60 (d, 1H); 7,36-7,77 (m, 4H).
МС (термоспрей): 503 [M+1].
Дигидробромид (S)-N-пропил-N-[6-(2,3-дигидроиндол-1- ил)гексил]-5,6-дигидрокси-1,2,3,4-тетрагидро-2-нафтиламина (соединение 23) с использованием в качестве исходного вещества промежуточного продукта 36.
1H-ЯМР (200 МГц; D2O): δ (част./млн): 0,85 (t, 3H); 1,27-2,22 (m, 12H); 2,43-3,61 (m, 13H); 3,83 (t, 2H); 6,54 (d, 1H); 6,67 (d, 1H); 7,33-7,39 (m, 4H).
МС: 423 [M+1].
Пример 41
Получение дигидрохлорида (S)-N-пропил-N-[6-[2-(4- гидроксифенокси)этиламино] гексил] -5,6-дигидрокси-1,2,3,4- тетрагидро-2-нафтиламина (соединение 24)
К раствору промежуточного продукта 38 (3,4 г; 5,5 ммоля), полученного согласно примеру 20, в абсолютном этаноле (100 мл) добавляли 37%-ную HCl (1 мл) и 10%-ный Pd на угле (50% в воде) (0,7 г). Смесь гидрировали в аппарате Парра (2,7 атм) в течение 3 часов. Катализатор отфильтровывали и раствор упаривали досуха при пониженном давлении. Остаток очищали с помощью хроматографии (элюент CH2Cl2:CH3OH:50%-ная HCOOH = 85:15:2). Образовавшийся твердый продукт растворяли в абсолютном этаноле (40 мл). После добавления раствора HCl в этиловом эфире (15% мас./об.) до выраженно кислого значения pH и выпаривания растворителей при пониженном давлении получали соединение 24 (2,5 г) в виде аморфного белого твердого продукта.
1H-ЯМР (200 МГц; D2O): δ (част./млн): 0,83 (t, 3H); 1,22-2,16 (m, 12H); 2,39-3,13 (m, 10H); 3,27-3,32 (m, 2H); 3,42-3,57 (m, 1H); 4,06-4,11 (m, 2H); 6,50 (d, 1H); 6,64 (d, 1H); 6,65-6,80 (m, 4H).
МС (термоспрей): 457 [M+1].
Аналогично описанной выше методике были получены следующие соединения.
Гидрохлорид (S)-N-пропил-N-[6-[2-(3,4- дигидроксифенил)этокси]гексил]-5,6-дигидрокси-1,2,3,4- тетрагидро-2-нафтиламина (соединение 25) с использованием в качестве исходного вещества промежуточного продукта 39.
1H-ЯМР (200 МГц; ДМСО-d6): δ (част./млн): 0,91 (t, 3H); 1,29-2,32 (m, 12H); 2,60 (t, 2H); 2,42-3,20 (m, 8H); 3,35 (t, 2H); 3,45 (t, 2H); 3,40-3,60 (m, 1H); 6,38-6,63 (m, 5H); 8,31 и 8,67 и 8,73 и 9,08 (4s, 4H); 10,05 (bs, 1H).
МС (термоспрей): 458 [M+1].
Дигидрохлорид (S)-N-пропил-N-[6-[2-(3-метокси-4-гидроксифенил) этиламино] гексил] -5,6-дигидрокси-1,2,3,4-тетрагидро-2- нафтиламина (соединение 26) с использованием в качестве исходного вещества промежуточного продукта 44.
1H-ЯМР (200 МГц; D2O): δ (част./млн): 0,83 (t, 3H); 1,20-2,20 (m, 12H); 2,42-3,17 (m, 14H); 3,46-3,65 (m, 1H); 3,71 (s, 3H); 6,50-6,82 (m, 5H).
МС: 471 [M+1].
Дигидрохлорид (S)-N-пропил-N-[6-[2-(3- гидрокси-4-метоксифенил)этиламино] гексил] -5,6-дигидрокси- 1,2,3,4-тетрагидро-2-нафтиламина (соединение 27) с использованием в качестве исходного вещества промежуточного продукта 48.
1H-ЯМР (200 МГц; D2O): δ (част./млн): 0,80 (t, 3H); 1,16-2,18 (m, 12H); 2,38-3,11 (m, 14H); 3,43-3,59 (m, 1H); 3,66 (s, 3H); 6,49 (d. 1H); 6,62 (d, 1H); 6,64-6,86 (m, 3H).
МС: 471 [M+1].
Гидрохлорид (S)-N-пропил-N-[6-[2-(3,4-дигидроксифенил)этилтио] гексил] -5,6-дигидрокси-1,2,3,4-тетрагидро-2-нафтиламина (соединение 28) с использованием в качестве исходного вещества промежуточного продукта 41.
1H-ЯМР (200 МГц; ДМСО-d6): δ (част./млн): 0,91 (t, 3H); 1,26-2,29 (m, 12H); 2,45-3,22 (m, 14H); 3,46-3,62 (m, 1H); 6,38-6,63 (m, 5H); 8,28 (s, 1H); 8,68 (s, 1H); 8,72 (s, 1H); 9,06 (s, 1H); 9,44 (bs, 1H).
Тригидрохлорид (S)-N-пропил-N-[6-[2-(3-амино-4- гидроксифенил)этиламино] гексил] -5,6-дигидрокси-1,2,3,4- тетрагидро-2-нафтиламина (соединение 29) с использованием в качестве исходного вещества промежуточного продукта 12.
1H-ЯМР (200 МГц; D2O): δ (част./млн): 0,80 (t, 3H); 1,20-2,20 (m, 12H); 2,39-3,15 (m, 14H); 3,45-3,61 (m, 1H); 6.50 (d, 1H); 6,62 (d, 1H); 6,82-7,05 (m, 3H).
МС (термоспрей): 456 [M+1].
Дигидрохлорид (S)-N-пропил-N-[6-[2-(4-сульфамоилфенил)этиламино] гексил] -5,6-дигидрокси-1,2,3,4-тетрагидро-2-нафтиламина (соединение 30) с использованием в качестве исходного вещества промежуточного продукта 69.
1H-ЯМР (200 МГц; D2O): δ (част./млн): 0,80 (t, 3H); 1,22-2,16 (m, 12H); 2,38-3,21 (m, 14H); 3,44-3,57 (m, 1H); 6,49 (d, 1H); 6,61 (d, 1H); 7,32-7,72 (m, 4H).
МС: 504 [M+1].
Дигидрохлорид (S)-N-пропил-N-[6-[2-(4- метилсульфониламинофенил)этиламино] гексил] -5,6-дигидрокси- 1,2,3,4-тетрагидро-2-нафтиламина (соединение 31) с использованием в качестве исходного вещества промежуточного продукта 66.
1H-ЯМР (200 МГц; D2O): δ (част./млн): 0,81 (t, 3H); 1,23-2,17 (m, (12H); 2,91 (s, 3H); 2,38-3,17 (m, 14H); 3,44-3,59 (m, 1H); 6,50 (d, 1H); 6,63 (d, 1H); 7,07-7,20 (m, 4H).
МС (термоспрей): 518 [M+1].
Дигидрохлорид (S)-N-пропил-N-[6-[2-(4- аминокарбониламинофенил)этиламино] гексил] -5,6-дигидрокси-1,2,3,4- тетрагидро-2-нафтиламина (соединение 32) с использованием в качестве исходного вещества промежуточного продукта 67.
1H-ЯМР (200 МГц; D2O): δ (част./млн): 0,80 (t, 3H); 1,21-2,15 (m, 12H); 2,36-3,15 (m, 14H); 3,40-3,55 (m, 1H); 6,48 (d, 1H); 6,61 (d, 1H); 7,09 (s, 4H).
МС (термоспрей): 483 [M+1].
Дигидрохлорид (S)-N-пропил-N-[6-[2-(4-ацетиламинофенил) этиламино]гексил] -5,6-дигидрокси-1,2,3,4-тетрагидро-2-нафтиламина (соединение 33) с использованием в качестве исходного вещества промежуточного продукта 65.
1H-ЯМР (200 МГц; D2O): δ (част./млн): 0,80 (t, 3H); 1,21-2,17 (m, 12H); 1,98 (s, 3H); 2,38-3,17 (m, 14H); 3,43-3,60 (m, 1H); 6,49 (d, 1H); 6,62 (d, 1H); 7,11-7,23 (m, 4H).
МС (термоспрей): 482 [M+1].
Пример 42
Получение гидробромида (S)-N-пропил-N-[6- [(3,4-дигидроксифенил)ацетиламино] гексил] -5,6-дигидрокси - 1,2,3,4-тетрагидро-2-нафтиламина (соединение 34)
1 М раствор трибромида бора в CH2Cl2 (4,7 мл) добавляли в атмосфере азота при 0oC к раствору промежуточного продукта 55 (0,6 г; 1,1 ммоля), полученного согласно примеру 25, в CH2Cl2 (8 мл). Реакционной смеси давали самопроизвольно нагреться до комнатной температуры. После выдержки при комнатной температуре в течение 3 часов добавляли метанол (5 мл) и образовавшийся раствор упаривали досуха при пониженном давлении. Неочищенный продукт очищали с помощью хроматографии (элюент CH2Cl2:CH3OH:50%-ная HCOOH = 85:15: 1), получая соединение 34 (0,6 г) в виде белого аморфного твердого продукта.
1H-ЯМР (200 МГц; D2O): δ (част./млн): 0,81 (t, 3H); 1,10-2,14 (m, 12H); 2,38-3,07 (m, 10H); 3,24 (s, 2H); 3,38-3,53 (m, 1H); 6,48-6,68 (m, 5H).
МС (термоспрей): 471 [M+1].
Пример 43
Получение дигидрохлорида (S)-N-пропил-N-[6-[2-(4- метоксикарбонилфенил)этиламино] гексил] -5,6-дигидрокси- 1,2,3,4-тетрагидро-2-нафтиламина (соединение 35)
К раствору промежуточного продукта 56 (1,9 г; 2,7 ммоля), полученного согласно примеру 26, в метаноле (50 мл) добавляли 10%-ный Pd на угле (50% в воде) (0,4 г). Смесь выдерживали при перемешивании и при 40oC под давлением водорода (2,7 атм) в течение 6 часов. Катализатор отфильтровывали и растворитель выпаривали при пониженном давлении. Остаток растворяли в ТГФ (50 мл) в атмосфере азота и медленно добавляли при перемешивании и при комнатной температуре комплекс боран-диметилсульфид (1,1 г; 13,7 ммоля). Реакционную смесь кипятили с обратным холодильником в течение 2 часов. После охлаждения до 5oC медленно добавляли раствор концентрированной HCl (0,5 мл) в метаноле (4 мл). Реакционную смесь кипятили с обратным холодильником в течение 2 часов, затем концентрировали путем отгонки растворителей при атмосферном давлении, после чего высушивали досуха при пониженном давлении. Остаток растворяли в метаноле (20 мл), растворитель отгоняли при пониженном давлении, добавляли метанол (20 мл) и растворитель вновь удаляли. Добавляли абсолютный этанол (20 мл) и раствор HCl в этиловом эфире (15% мас./об.) (1 мл) и при пониженном давлении выпаривали растворители, получая неочищенный продукт, который очищали с помощью хроматографии (элюент CH2Cl2:CH3OH:50%-ная HCOOH = 85:15:2). Образовавшийся твердый продукт растворяли в абсолютном этаноле и раствор подкисляли до pH 1, добавляя раствор HCl в этиловом эфире (15% мас./об.). После выпаривания растворителей при пониженном давлении получали соединение 35 (0,6 г) в виде аморфного белого твердого вещества.
1H-ЯМР (200 МГц; D2O): δ (част./млн): 0,80 (t, 3H); 1,19-2,19 (m, 12H); 2,39-3,22 (m, 14H); 3,43-3,59 (m, 1H); 3,75 (s, 3H); 6,49 (d, 1H); 6,62 (d, 1H); 7,24-7,85 (m, 4H).
МС: 483 [M+1].
Аналогично описанной выше методике было получено следующее соединение.
Дигидрохлорид (S)-N-пропил-N-[6- [2-(4-гидроксиметилфенил)этиламино] гексил] -5,6-дигидрокси- 1,2,3,4-тетрагидро-2-нафтиламина (соединение 36) с использованием в качестве исходного вещества промежуточного продукта 58.
1H-ЯМР (200 МГц; D2O): δ (част./млн): 0,80 (t, 3H); 1,19-2,19 (m, 12H); 2,40-3,18 (m, 14H); 3,45-3,60 (m, 1H); 4,44 (s, 2H); 6,50 (d, 1H); 6,63 (d, 1H); 7,13-7,24 (m, 4H).
МС: 455 [M+1].
Пример 44
Получение дигидрохлорида (S)-N-пропил-N-[6-[2-(4- карбамоилфенил)этиламино] гексил] -5,6-дигидрокси-1,2,3,4- тетрагидро-2-нафтиламина (соединение 37)
К раствору промежуточного продукта 63 (2,4 г; 3,1 ммоля), полученного согласно примеру 31, в этаноле (70 мл) добавляли концентрированную HCl (0,7 мл) и 10%-ный Pd на угле (0,50 г). Смесь выдерживали при перемешивании и при комнатной температуре под давлением водорода (2,7 атм) в течение 36 часов. Катализатор отфильтровывали и растворители выпаривали при пониженном давлении. Неочищенный продукт очищали с помощью хроматографии (элюент CH2Cl2: CH3OH: 50%-ная HCOOH = 80:20:2). Образовавшийся твердый продукт растворяли в абсолютном этаноле и раствор подкисляли до pH 1, добавляя раствор HCl в этиловом эфире (15% мас. /об.). После выпаривания растворителей при пониженном давлении получали соединение 37 (0,7 г) в виде аморфного белого твердого вещества.
1H-ЯМР (200 МГц; D2O): δ (част./млн): 0,79 (t, 3H); 1,18-2,17 (m, 12H); 2,38-3,20 (m, 14H); 3,43-3,59 (m, 1H); 6,49 (d, 1H); 6,61 (d, 1H); 7,23-7,63 (m, 4H).
МС (термоспрей): 468 [M+1].
Пример 45
Получение дигидрохлорида (S)-N-пропил-N-[6-[2-(4-карбоксифенил)этиламино] гексил] -5,6- дигидрокси-1,2,3,4-тетрагидро-2-нафтиламина (соединение 38)
Раствор соединения 35 (1,0 г; 1,8 ммоля), полученного согласно примеру 43, в диоксане (10 мл) и концентрированную HCl (5 мл) кипятили с обратным холодильником при перемешивании в течение 6 часов. Растворители удаляли при пониженном давлении и остаток очищали с помощью хроматографии (элюент CH2Cl2: CH3OH: 50%-ная HCOOH = 80: 20: 2). Образовавшийся твердый продукт растворяли в абсолютном этаноле и раствор подкисляли до pH 1, добавляя раствор HCl в этиловом эфире (15% мас./об.). После выпаривания растворителей при пониженном давлении получали соединение 38 (0,6 г) в виде аморфного белого твердого вещества.
1H-ЯМР (200 МГц; D2O): δ (част./млн): 0,81 (t, 3H); 1,20-2,20 (m, 12H); 2,40-3,23 (m, 14H); 3,44-3,60 (m, 1H); 6,50 (d, 1H); 6,63 (d, 1H); 7,25-7,84 (m, 4H).
МС: 469 [M+1].
Пример 46
Получение дигидрохлорида (S)-N-пропил-N-[6-[2-(4- сульфофенил)этиламино] гексил]-5,6-дигидрокси-1,2,3,4-тетрагидро- 2-нафтиламина (соединение 39)
К суспензии промежуточного продукта 59 (0,9 г; 1,2 ммоля), полученного согласно примеру 29, в 95%-ном этаноле (240 мл) добавляли концентрированную HCl (2 мл) и 10%-ный Pd на угле (50% в воде) (0,6 г). Смесь выдерживали при перемешивании и при комнатной температуре под давлением водорода (2,7 атм) в течение 16 часов, а затем добавляли воду (250 мл) и катализатор отфильтровывали и на фильтре промывали водой. Растворители удаляли при пониженном давлении, получая соединение 39 (0,6 г) в виде аморфного белого твердого вещества.
1H-ЯМР (200 МГц; D2O): δ (част./млн): 0,78 (t, 3H); 1,14-2,16 (m, 12H); 2,34-3,17 (m, 14H); 3,39-3,54 (m, 1H); 6,46 (d, 1H); 6,59 (d, 1H); 7,20-7,58 (m, 4H).
МС (термоспрей): 505 [M+1].
Пример 47
Получение тригидрохлорида (S)-N-пропил-N-[6-[2-(2-амино-1,3- бензтиазол-6-ил)этиламино] гексил] -5,6-дигидрокси-1,2,3,4-тетрагидро-2- нафтиламина (соединение 40)
К раствору промежуточного продукта 52 (0,9 г; 1,4 ммоля), полученного согласно примеру 24, в хлороформе (44 мл) добавляли по каплям при -35oC в атмосфере азота и при перемешивании 1 М раствор трихлорида бора в CH2Cl2 (27 мл). Реакционную смесь выдерживали при перемешивании при -30oC в течение 15 минут, затем нагревали до 50oC и выдерживали при перемешивании в течение 4 часов. Добавляли метанол (30 мл) и растворители удаляли при пониженном давлении. Остаток очищали с помощью хроматографии (элюент CH2Cl2:CH3OH: 50%-ная HCOOH = 80:20:1). Образовавшийся твердый продукт растворяли в абсолютном этаноле и раствор подкисляли до pH 1, добавляя раствор HCl в этиловом эфире (15% мас./об.). После выпаривания растворителей при пониженном давлении получали соединение 40 (0,54 г) в виде аморфного белого твердого вещества.
1H-ЯМР (200 МГц; D2O): δ (част./млн): 0,80 (t, 3H); 1,19-2,17 (m, 12H); 2,36-3,19 (m, 14H); 3,42-3,57 (m, 1H); 6,47 (d, 1H); 6,60 (d, 1H); 7,20-7,48 (m, 3H).
МС: 497 [M+1].
Пример 48
Получение 4-(2,3-диметоксифенил)-2-оксопентановой кислоты
К смеси йодида меди (7,62 г; 40 ммолей) в безводном этиловом эфире (76 мл) при 0oC в атмосфере азота в течение 10 минут при перемешивании добавляли 1,6 н. эфирный раствор (37,5 мл) метиллития (60 ммолей). Раствор выдерживали при перемешивании в течение 5 минут, а затем медленно добавляли раствор 4-(2,3-диметоксифенил)-2-оксо-3-бутеновой кислоты (4,72 г; 20 ммолей), полученной в соответствии с методом, описанном в заявке на европейский патент 0534536 (Zambon Group S.p.A.), в безводном ТГФ (40 мл). Смесь перемешивали в течение ночи при 0oC в атмосфере азота и затем при 0oC сливали на интенсивно перемешиваемый 1,2 н. раствор HCl (0,5 л). Смесь экстрагировали этилацетатом (4х100 мл). Органические слои сушили и упаривали при пониженном давлении, получая коричневое масло (5 г). Путем очистки с помощью хроматографии (элюент CH2Cl2: CH3OH:CH3COOH = 95:5:0,5) получали 4-(2,3-диметоксифенил)-2-оксопентановую кислоту (3,84 г; выход 76%) в виде желтого масла, которое затвердевало после обработки н-гексаном.
1H-ЯМР (200 МГц; CDCl3): δ (част./млн): 1,31 (d, 3H); 3,66-3,82 (m, 1H); 3,80 и 3,82 (2s, 6H); 6,31-6,70 (bs, 1H); 6,75-7,05 (m, 3H).
МС: 253 [M+1].
Пример 49
Получение 2-гидроксиимино-4-(2,3-диметоксифенил)пентановой кислоты
К раствору 4-(2,3-диметоксифенил)-2-оксопентановой кислоты (0,5 г; 2 ммоля), полученной согласно примеру 48, в безводном этаноле (20 мл) при перемешивании и при комнатной температуре в атмосфере азота добавляли безводный пиридин (0,52 мл). Двумя порциями добавляли гидрохлорид гидроксиламина (0,17 г; 2,4 ммоля), поддерживая температуру ниже 10oC. Раствор перемешивали в течение 2 часов при комнатной температуре, сливали на смесь вода-лед (100 мл), подкисляли концентрированной соляной кислотой (pH 1) и дважды экстрагировали этилацетатом. Объединенные органические слои промывали водой, сушили и концентрировали под вакуумом, получая 2-гидроксиимино-4-(2,3- диметоксифенил)пентановую кислоту (0,52 г; выход 97%) в виде бесцветного масла, которое затвердевало при выстаивании.
1H-ЯМР (200 МГц; CDCl3): δ (част./млн): 1,22 (d, 3H); 2,86-3,03 (m, 2H); 3,80 и 3,82 (2s, 6H); 3,66-3,85 (m, 1H); 6,72-7,05 (m, 3H).
МС (метиловый эфир из реакции с диазометаном): 281 [M].
Пример 50
Получение 2-амино-4-(2,3-диметоксифенил)пентановой кислоты
Раствор хлорида ртути (92,3 г; 0,34 ммоля) в воде (1850 мл), охлажденный до 0oC, при перемешивании обрабатывали алюминиевой фольгой (45,9 г, 1,7 ммоля). После выдержки при комнатной температуре в течение 1 часа алюминиевую амальгаму отфильтровывали, промывали этанолом и суспендировали в воде (300 мл). При перемешивании добавляли раствор 2-гидроксиимино-4-(2,3- диметоксифенил)пентановой кислоты (34,63 г; 0,13 моля), полученной согласно примеру 49, в метаноле (300 мл), поддерживая температуру ниже 25oC. После перемешивания в течение ночи при комнатной температуре смесь выдерживали при 45oC в течение 5 часов, подкисляли концентрированной HCl до завершения растворения, а затем очищали с помощью хроматографии на ионообменной смоле Amberlite IR-120® (300 г), элюируя смесью H2O:CH3OH = 1:1, водой и затем 2,5%-ным гидроксидом аммония. Объединенные фракции упаривали в вакууме, получая 2-амино-4-(2,3-диметоксифенил)пентановую кислоту (17,5 г; выход 53%) в виде белого твердого продукта.
tпл > 200oC.
1H-ЯМР (200 МГц; DCl 1H): δ (част./млн): 1,40-1,50 (m, 3H); 2,20-2,50 (m, 2H); 3,45-3,60 (m, 1H); 3,95 и 4,05 (2s, 6H); 3,80-4,20 (m, 1H); 7,08-7,41 (m, 3H).
МС: 254 [М+1]
Пример 51
Получение N-(1,2,3,4-тетрагидро-5,6-диметокси-4- метил-1-оксо-2-нафтил)трифторацетамида
К раствору 2-амино-4-(2,3- диметоксифенил)пентановой кислоты (17,5 г; 69 ммолей), полученной согласно примеру 50, в трифторуксусной кислоте (200 мл), охлажденному до -5oC, при перемешивании добавляли в атмосфере азота трифторуксусный ангидрид (36,33 г; 173 ммоля). Раствор выдерживали при перемешивании в течение 1 часа при 0oC и в течение ночи при комнатной температуре, разбавляли метанолом, концентрировали при пониженном давлении и растворяли в этилацетате. Органический слой, промытый водным бикарбонатом натрия и водой, сушили и упаривали досуха, получая коричневое масло. Неочищенный продукт очищали с помощью быстрой хроматографии (элюент н-гексан:этилацетат = 9:1), получая N-(1,2,3,4-тетрагидро- 5,6-диметокси-4-метил-1-оксо-2-нафтил)трифторацетамид (18 г; выход 79%) в виде светло-оранжевого твердого продукта.
tпл 83-85oC.
1H-ЯМР (200 МГц; CDCl3): δ (част./млн): 1,45-1,52 (m, 3H); 2,00-2,70 (m, 2H); 3,40-3,60 (m, 1H); 3,85 и 3,95 (2s, 6H); 4,80-4,95 (m, 1H); 6,90 (d, 1H); 7,40 (bs, 1H); 7,82 (d, 1H).
МС: 332 [M+1].
Пример 52
Получение 1,2,3,4-тетрагидро-5,6-диметокси-4-метил-2- нафтиламина
Раствор N-(1,2,3,4-тетрагидро-5,6-диметокси-4-метил- 1-оксо-2-нафтил)трифторацетамида (6,2 г; 18,7 ммоля), полученного аналогично примеру 51, в этаноле (250 мл), подкисленный 70%-ной перхлорной кислотой (0,37 мл), гидрировали в шейкере Парра в течение ночи (4,08 атм) при 60oC в присутствии 10%-ного Pd на угле (0,6 г) в качестве катализатора. По завершении гидрирования катализатор отфильтровывали и промывали этанолом. Органическую фазу наполовину упаривали в вакууме и оставшийся раствор перемешивали в течение ночи при 50oC с 32%-ным водным раствором NaOH (5,25 мл; 56,1 ммоля). Смесь концентрировали, растворяли в воде и дважды экстрагировали этилацетатом. Объединенные органические слои промывали 10%-ной HCl, водную фазу подщелачивали NaOH и экстрагировали этилацетатом. Органические экстракты сушили и упаривали досуха, получая 1,2,3,4-тетрагидро-5,6-диметокси-4-метил-2-нафтиламин (3,44 г; выход 83%) в виде желтого масла, которое использовали в последующей реакции без дополнительной очистки.
1H-ЯМР (200 МГц; CDCl3): δ (част./млн): 1,23 и 1,32 (2d, 3H); 1,48 (bs, 2H); 1,50-3,35 (m, 6H); 3,77-3,83 (3s, 6H); 6,68-6,80 (m, 2H).
МС: 222 [M+1].
Пример 53
Получение 1,2,3,4-тетрагидро-5,6-диметокси-4- метил-2-нафтилпропанамида
К раствору 1,2,3,4-тетрагидро-5,6- диметокси-4-метил-2-нафтиламина (3,7 г; 16,7 ммоля), полученного согласно примеру 52, в безводном CH2Cl2, охлажденному до 0oC, добавляли в атмосфере азота триэтиламин (2,8 мл; 20,2 ммоля) и медленно добавляли пропионилхлорид (1,64 мл; 18,4 ммоля), растворенный в CH2Cl2 (10 мл). Раствор выдерживали при перемешивании и при комнатной температуре в атмосфере азота в течение ночи, а затем упаривали досуха при пониженном давлении, растворяли в этилацетате и промывали насыщенным водным раствором NaHCO3, 5%-ной HCl и соляным раствором. Органическую фазу сушили над Na2SO4 и концентрировали, получая 1,2,3,4-тетрагидро-5,6- диметокси-4-метил-2-нафтилпропанамид (4,58 г; количественный выход) в виде белого твердого продукта.
1H-ЯМР (200 МГц; CDCl3): δ (част./млн): 1,09-1,18 (m, 3H); 1,26-1,33 (m, 3H); 1,59-1,93 (m, 2H); 2,12-3,38 (m, 5H); 3,78 и 3,81 и 3,83 (3s, 6H); 3,00-4,43 (m, 1H); 5,37-5,48 (m, 1H); 6,68-6,77 (m, 2H).
МС: 276 [M+1].
Пример 54
Получение гидрохлорида N-пропил-1,2,3,4-тетрагидро-5,6-диметокси-4- метил-2-нафтиламина
Работая по методике, аналогичной описанной в примере 12, но используя в качестве исходного продукта 1,2,3,4-тетрагидро-5,6-диметокси-4- метил-2-нафтилпропанамид, полученный согласно примеру 53, получали гидрохлорид N-пропил-1,2,3,4-тетрагидро-5,6-диметокси-4-метил-2-нафтиламина в виде белого твердого вещества с количественным выходом.
1H-ЯМР (200 МГц; D2O): δ (част./млн): 0,82 и 0,83 (2t, 3H); 1,04 и 1,15 (2d, 3H); 1,23-2,00 (m, 4H); 2,25-3,55 (m, 6H); 3,61 и 3,64 и 3,68 (3s, 6H); 6,81 (bs, 2H).
МС: 300 [M+1].
Пример 55
Работая по методике, аналогичной описанной в примере 18, получали следующие соединения.
Дигидрохлорид N-пропил-N-[6-(2- фенилэтиламино)гексил]-4-метил-5,6-диметокси-1,2,3,4-тетрагидро- 2-нафтиламина (промежуточный продукт 70) в виде аморфного твердого вещества (выход 93%).
1H-ЯМР (200 МГц; D2O): δ (част./млн): 0,81 (t, 3H); 1,02-2,33 (m, 15H); 2,71-3,77 (m, 20H); 6,80 (bs, 2H); 7,14-7,28 (m, 5H).
МС: 467 [M+1].
Дигидрохлорид N-пропил-N- [6-[2-(4-метилсульфонилфенил)этиламино]гексил] -4-метил- 5,6-диметокси-1,2,3,4-тетрагидро-2-нафтиламина (промежуточный продукт 71) в виде желтого аморфного твердого вещества (количественный выход).
1H-ЯМР (200 МГц; D2O-CDCl3): δ (част./млн): 0,95-1,03 (m, 3H); 1,21-2,55 (m, 15H); 3,01 (s, 3H); 2,81-3,48 (m, 13H); 3,59-3,70 (m, 1H); 3,79 и 3,81 и 3,83 (3s, 6H); 6,70-6,84 (m, 2H); 7,42-7,86 (m, 4H).
МС: 545 [M+1].
Дигидрохлорид N-пропил-N-[6-[2-(3-хлор-4- метоксифенил)этиламино]гексил] -4-метил-5,6-диметокси-1,2,3,4- тетрагидро-2-нафтиламина (промежуточный продукт 72) в виде белой пены (выход 97%).
1H-ЯМР (200 МГц; ДМСО-d6): δ (част./млн): 0,88-0,96 (m, 3H); 1,16-2,18 (m, 15H); 2,77-3,80 (m, 14H); 3,70-3,82 (4s, 9H); 6,80-7,35 (m, 5H); 9,26 (bs, 2H); 10,70 (bs, 1H).
МС: 532 [M+1].
Дигидрохлорид N-пропил-N-[6-[2-(3-хлор-4- метоксифенил)этиламино]гексил] -4-метил-5-метокси-1,2,3,4- тетрагидро-2-нафтиламина (промежуточный продукт 73) в виде белого аморфного твердого вещества (выход 100%).
1H-ЯМР (200 МГц; CDCl3): δ (част./млн): 0,98-1,05 (m, 3H); 1,42-2,69 (m, 12H); 2,88-3,33 (m, 14H); 3,50-3,69 (m, 1H); 3,77 и 3,83 (2s, 6H); 6,62-7,26 (m, 6H); 9,78 (bs, 2H); 10,93 (bs, 1H).
МС: 561 [M+1].
Дигидрохлорид N-пропил-N- [6-[2-(4-метилсульфонилфенил)этиламино]гексил] -4-метил-5- метокси-1,2,3,4-тетрагидро-2-нафтиламина (промежуточный продукт 74) в виде белого аморфного твердого вещества (выход 100%).
1H-ЯМР (200 МГц; CDCl3): δ (част./млн): 0,98-1,06 (m, 3H); 1,44-2,64 (m, 12H); 3,01 (s, 3H); 2,90-3,47 (m, 14H); 3,54-3,69 (m, 1H); 3,78 (s, 3H); 6,44-7,14 (m, 3H); 7,47-7,85 (m, 4H); 9,87 (bs, 2H); 10,74 (bs, 1H).
МС: 574 [M+1].
Пример 56
Работая по методике, аналогичной описанной в примере 13, получали следующие соединения.
Дигидробромид N-пропил-N-[6-(2-фенилэтиламино)гексил] -4-метил-5,6 -дигидрокси-1,2,3,4-тетрагидро-2-нафтиламина (соединение 41) в виде розового твердого вещества (выход 62%).
1H-ЯМР (200 МГц; D2O): δ (част./млн): 0,77-0,86 (m, 3H); 1,07 и 1,18 (2d, 3H); 1,15-2,36 (m, 12H); 2,67-3,33 (m, 13H); 3,60-3,77 (m, 1H); 6,47-6,65 (m, 2H); 7,12-7,29 (m, 5H).
МС: 439 [M+1].
Дигидробромид N-пропил-N-[6-[2-(4- метилсульфонилфенил)этиламино]гексил] -4-метил-5,6- дигидрокси-1,2,3,4-тетрагидро-2-нафтиламина (соединение 42) в виде розового твердого вещества (выход 42%).
1H-ЯМР (200 МГц; D2O): δ (част./млн): 0,77-0,86 (m, 3H); 1,07 и 1,18 (2d, 3H); 1,21-1,97 (m, 12H); 3,08 (s, 3H); 2,69-3,33 (m, 13H); 3,61-3,78 (m, 1H); 6,49 (d, 1H); 6,59-6,65 (m, 1H); 7,40-7,78 (m, 4H).
МС: 517 [M+1].
Дигидробромид N-пропил-N-[6-[2-(3-хлор-4- гидроксифенил)этиламино]гексил] -4-метил-5,6-дигидрокси-1,2,3,4- тетрагидро-2-нафтиламина (соединение 43) в виде бежевого твердого вещества (выход 48%).
1H-ЯМР (200 МГц; ДМСО-d6): δ (част./млн): 0,89-0,97 (m, 3H); 1,17-2,08 (m, 15H); 2,77-3,42 (m, 13H); 3,63-3,80 (m, 1H); 6,38-6,64 (m, 2H); 6,88-7,25 (m, 3H).
МС: 490 [M+1].
Дигидробромид (S)-N-пропил-N-[6-[2-(3-хлор-4- гидроксифенил)этиламино] гексил] -5-гидрокси-1,2,3,4-тетрагидро- 2-нафтиламина (соединение 44) в виде твердого вещества цвета слоновой кости (выход 69%).
1H-ЯМР (200 МГц; ДМСО-d6): δ (част./млн): 0,93 (t, 3H); 1,30-2,33 (m, 12H); 2,42-3,27 (m, 14H); 3,55-3,69 (m, 1H); 6,55-7,25 (m, 6H); 8,52 (bs, 2H); 9,21 (bs, 1H); 9,38 (s, 1H); 10,06 (s, 1H).
МС: 459 [M+1].
Дигидробромид (S)-N-пропил-N-[6-[2-(4-метилсульфонилфенил) этиламино] гексил] -5-гидрокси-1,2,3,4-тетрагидро-2-нафтиламина (соединение 45) в виде твердого вещества цвета слоновой кости (выход 67%).
1H-ЯМР (200 МГц; D2O): δ (част./млн): 0,82 (t, 3H); 1,21-2,21 (m, 12H); 3,09 (s, 3H); 2,36-3,24 (m, 14H); 3,48-3,64 (m, 1H); 6,58-6,99 (m, 3H); 7,40-7,79 (m, 4H).
МС: 487 [M+1].
Пример 57
Получение (S)-N-(5-гидрокси-6-метокси-1,2,3,4- тетрагидро-2-нафтил)пропанамида
К раствору (S)-N-(5,6-диметокси- 1,2,3,4-тетрагидро-2-нафтил)пропанамида (79 г; 0,3 моля), полученного в соответствии с методом, описанном в международной заявке WO 93/19036 (Zambon Group S.p.A.), в CHCl3 (800 мл) в атмосфере сухого азота добавляли йодтриметилсилан (143 мл; 1,05 моля). Раствор оставляли на ночь, промывали 10%-ным водным раствором тиосульфата натрия и упаривали досуха. Путем кристаллизации из изопропанола получали (S)-N-(5-гидрокси-6- метокси-1,2,3,4-тетрагидро-2-нафтил)пропанамид (72,4 г; выход 96,8%) в виде белого твердого вещества.
tпл 163-165oC.
1H-ЯМР (200 МГц; CDCl3): δ (част./млн): 1,12 (t, 3H); 1,67-2,08 (m, 2H); 2,17 (q, 2H); 2,50-3,10 (m, 4H); 3,84 (s, 3H); 4,18-4,36 (m, 1H); 5,38-5,49 (m, 1H); 5,70 (s, 1H); 6,57 (d, 1H); 6,69 (d, 1H).
МС: 250 [M+1].
Пример 58
Получение (S)-N-(5-трифторметилсульфонилокси-6-метокси-1,2,3,4- тетрагидро-2-нафтил)пропанамида
Смесь, содержащую (S)-N-(5-гидрокси-6- метокси-1,2,3,4-тетрагидро-2-нафтил)пропанамид (60,8 г; 0,24 моля), полученный согласно примеру 57, K2CO3 (67,5 г; 0,48 моля) и N-фенилбис(трифторметилсульфонимид) (95,9 г; 0,264 моля) в ТГФ (750 мл), перемешивали в течение ночи. После упаривания остаток растворяли в воде и CH2Cl2, органическую фазу упаривали и кристаллизовали из этилацетата/петролейного эфира, получая (S)-N-(5-трифторметилсульфонилокси-6-метокси-1,2,3,4-тетрагидро-2 -нафтил)пропанамид (81,7 г; выход 89,2%) в виде белого твердого вещества.
tпл 126-127oC.
1H-ЯМР (200 МГц; CDCl3): δ (част./млн): 1,14 (t, 3H); 1,65-2,10 (m, 2H); 2,19 (q, 2H); 2,51-3,16 (m, 4H); 3,84 (s, 3H); 4,16-4,34 (m, 1H); 5,33-5,45 (m, 1H); 6,72 (d, 1H); 7,02 (d, 1H).
МС: 382 [M+1].
Пример 59
Получение метилового эфира (S)-2-метокси-6-(1-оксопропил)амино- 5,6,7,8-тетрагидронафтил-1-карбоновой кислоты
Раствор (S)-N-(5-трифторметилсульфонилокси-6-метокси-1,2,3,4-тетрагидро -2-нафтил)пропанамида (22 г; 0,058 моля), полученного согласно примеру 58, триэтиламина (17,7 мл; 0,128 моля), метанола (30 мл), ацетата палладия (0,5 г; 2,23 ммоля) и 1,3-бис(дифенилфосфин)пропана (1 г; 2,42 ммоля) в ДМСО (50 мл) перемешивали при комнатной температуре в течение 15 минут. Через раствор в течение 4-5 минут пропускали струю CO и затем реакционный сосуд помещали в атмосферу CO под давлением 6 атм. Температуру повышали до 75oC. Через 24 часа реакционной смеси давали охладиться до комнатной температуры. Добавляли воду (400 мл) и смесь экстрагировали CH2Cl2. После упаривания остаток кристаллизовали из ацетонитрила, получая метиловый эфир (S)-2-метокси-6-(1-оксопропил)амино-5,6,7,8-тетрагидронафтил-1- карбоновой кислоты (10 г) в виде белого твердого вещества. Дополнительное количество продукта (4,7 г) получали из маточных растворов с помощью хроматографии (элюент CH2Cl2:CH3OH = 98:2).
Общий выход: 87,3%.
tпл 151-152oC.
1H-ЯМР (200 МГц; CDCl3): δ (част./млн): 1,12 (t, 3H); 1,64-2,05 (m, 2H); 2,15 (q, 2H); 2,48-3,09 (m, 4H); 3,78 и 3,88 (2s, 6H); 4,16-4,33 (m, 1H); 5,45 (bd, 1H); 6,72 (d, 1H); 7,03 (d, 1H).
МС: 292 [M+1].
Пример 60
Получение (S)-2-метокси-6-(1-оксопропил)амино-5,6,7,8- тетрагидро-нафтил-1-карбоновой кислоты
Раствор метилового эфира (S)-2-метокси-6-(1-оксопропил)амино-5,6,7,8-тетрагидронафтил-1- карбоновой кислоты (9 г; 0,031 моля), полученного согласно примеру 59, в метаноле (90 мл) и 40%-ном NaOH (13,8 мл) выдерживали при 65oC в течение 72 часов и затем упаривали. Остаток растворяли в воде, экстрагировали простым эфиром и подкисляли HCl. Кислотный осадок экстрагировали горячим этилацетатом. После упаривания получали (S)-2-метокси-6-(1-оксопропил)амино-5,6,7,8- тетрагидронафтил-1-карбоновую кислоту (7,4 г; выход 86,1%) в виде белого твердого вещества.
1H-ЯМР (200 МГц; ДМСО-d6): δ (част./млн): 0,95 (t, 3H); 1,43-1,98 (m, 2H); 2,07 (q, 2H); 2,43-2,97 (m, 4H); 3,73 (s, 3H); 3,78-3,96 (m, 1H); 6,84 (d, 1H); 7,07 (d, 1H); 7,82 (d, 1H); 12,90 (bs, 1H).
МС: 278 [M+1].
Пример 61
Получение метилового эфира (S)-2-метокси-6-(1- оксопропил)амино-5,6,7,8-тетрагидронафтил-1-карбаминовой кислоты
Смесь, содержащую (S)-2-метокси-6-(1-оксопропил)амино-5,6,7,8- тетрагидронафтил-1-карбоновую кислоту (7,7 г; 0,0278 моля), полученную согласно примеру 60, дифенилфосфорилазид (6,6 мл; 0,0306 моля) и триэтиламин (5,8 мл; 0,0417 моля) в диоксане (75 мл), кипятили с обратным холодильником в течение ночи. Добавляли метанол (18,5 мл) и кипячение с обратным холодильником продолжали в течение 2 часов. После упаривания остаток растворяли в CHCl3, промывали водой, соляной кислотой, бикарбонатом натрия и в завершение сушили над Na2SO4. После выпаривания хлороформа получали неочищенный продукт (7,7 г), который кристаллизовали из ацетонитрила, получая метиловый эфир (S)-2-метокси-6-(1-оксопропил) амино-5,6,7,8-тетрагидронафтил-1-карбаминовой кислоты (6,5 г; выход 76%) в виде белого твердого вещества.
tпл 226-227oC.
1H-ЯМР (200 МГц; CDCl3): δ (част./млн): 1,12 (t, 3H); 1,62-2,04 (m, 2H); 2,17 (q, 2H); 2,48-3,10 (m, 4H); 3,82 и 3,88 (2s, 6H); 4,16-4,34 (m, 1H); 5,50-5,61 (m, 1H); 6,09 (bs, 1H); 6,72 (d, 1H); 6,94 (d, 1H).
МС: 307 [M+1].
Пример 62
Получение гидрохлорида метилового эфира (S)-2-метокси-6-пропиламино -5,6,7,8-тетрагидронафтил-1-карбоновой кислоты
Комплекс боран-диметилсульфид (5,73 мл; 0,0605 моля) добавляли по каплям в атмосфере азота к раствору метилового эфира (S)-2-метокси-6-(1- оксопропил)амино-5,6,7,8-тетрагидронафтил-1-карбоновой кислоты (8 г; 0,0275 моля), полученного согласно примеру 59, в ТГФ (65 мл). Смесь кипятили с обратным холодильником в течение 1 часа и упаривали. Осторожно добавляли метанол (50 мл) и концентрированную HCl (2,5 мл) и раствор кипятили с обратным холодильником в течение 2 часов. После упаривания добавляли метанол и упаривали вновь, получая гидрохлорид метилового эфира (S)-2-метокси-6-пропиламино-5,6,7,8-тетрагидронафтил- 1-карбоновой кислоты (8,5 г; выход 98,5%) в виде аморфного твердого вещества.
1H-ЯМР (200 МГц; ДМСО-d6): δ (част./млн): 0,93 (t, 3H); 1,58-2,29 (m, 4H); 2,61-3,22 (m, 6H); 3,31-3,46 (m, 1H); 3,73 и 3,78 (2s, 6H); 6,93 (d, 1H); 7,18 (d, 1H); 9,06-9,29 (bm, 2H).
МС: 278 [M+1].
Аналогично описанной выше методике было получено следующее соединение.
Метиловый эфир (S)-2-метокси-6-пропиламино-5,6,7,8- тетрагидронафтил-1-карбаминовой кислоты в виде белого твердого вещества (выход 49,3%).
1H-ЯМР (200 МГц; CDCl3): δ (част./млн): 0,92 (t, 3H); 1,42-2,07 (m, 4H); 2,45-3,02 (m, 7H); 3,72 и 3,77 (2s, 6H); 6,05 (bs, 1H); 6,70 (d, 1H); 6,96 (d, 1H).
МС: 293 [M+1].
Пример 63
Получение метилового эфира (S)-2-метокси-6-[[6- (фенилацетиламино)-1-оксогексил] пропиламино] -5,6,7,8- тетрагидронафтил-1-карбаминовой кислоты (промежуточный продукт 75)
К смеси, содержащей метиловый эфир (S)-2-метокси-6-пропиламино- 5,6,7,8-тетрагидронафтил-1-карбаминовой кислоты (731 мг; 2,5 ммоля), полученный согласно примеру 62, в CH2Cl2 (10 мл) добавляли триэтиламин (0,7 мл; 5 ммолей), а затем раствор хлорангидрида 6-(фенилацетиламино)капроновой кислоты (736 г; 2,75 ммоля) в CH2Cl2 (10 мл). Реакционную смесь выдерживали при перемешивании и при комнатной температуре в течение 2 часов, промывали разбавленной HCl, бикарбонатом натрия, водой и сушили над Na2SO4. После упаривания при пониженном давлении получали промежуточный продукт 75 (1,25 г; выход 95,5%) в виде аморфного твердого вещества.
1H-ЯМР (200 МГц; CDCl3): δ (част./млн): 0,82-0,92 (m, 3H); 1,16-1,95 (m, 10H); 2,23-2,33 (m, 2H); 2,72-3,25 (m, 8H); 3,52 и 3,54 (2s, 2H); 3,71 и 3,74, и 3,77, и 3,79 (4s, 6H); 3,88-4,57 (m, 1H); 5,58-5,70 (m, 1H); 6,04-6,19 (m, 1H); 6,66-6,98 (m, 2H); 7,21-7,36 (m, 5H).
МС: 524 [M+1].
Аналогично описанной выше методике было получено следующее соединение.
Метиловый эфир (S)-2-метокси-6-[[6- (фенилацетиламино)-1-оксогексил] пропиламино] -5,6,7,8- тетрагидронафтил-1-карбоновой кислоты (промежуточный продукт 76) в виде вязкого масла (выход 80%).
1H-ЯМР (200 МГц; CDCl3): δ (част./млн): 0,82-0,93 (m, 3H); 1,20-1,66 (m, 8H); 1,82-1,96 (m, 2H); 2,23-2,31 (m, 2H); 2,69-3,25 (m, 8H); 3,53 (s, 2H); 3,76-3,79 (m, 3H); 3,86-3,89 (m, 3H); 3,89-4,63 (m, 1H); 5,44-5,66 (m, 1H); 6,67-6,77 (m, 1H); 6,98-7,09 (m, 1H); 7,19-7,36 (m, 5H).
МС: 509 [M+1].
Пример 64
Получение (S)-N-[[6-(5-амино-6- метокси-1,2,3,4-тетрагидро-2-нафтил)пропиламино]-6-оксогексил] бензолацетамида (промежуточный продукт 77)
Раствор промежуточного продукта 75 (2,4 г; 4,58 ммоля), полученного согласно примеру 63, в 48%-ной HBr (40 мл) выдерживали при перемешивании в течение ночи. После упаривания остаток растворяли в этилацетате и промывали бикарбонатом натрия. После упаривания органической фазы получали промежуточный продукт 77 (2,1 г; выход 100%) в виде желтого масла.
1H-ЯМР (200 МГц; CDCl3): δ (част./млн): 0,83-0,94 (m, 3H); 1,19-2,04 (m, 10H); 2,24-2,32 (m, 2H); 2,44-3,25 (m, 8H); 3,52 и 3,53 (2s, 2H); 3,59-4,65 (m, 6H); 5,67-5,76 (m, 1H); 6,42-6,69 (m, 2H); 7,19-7,35 (m, 5H).
МС: 466 [M+1].
Пример 65
Получение (S)-N-[[2-метокси-6-[6-(фенилацетиламино)-1- оксогексил]пропиламино]-5,6,7,8-тетрагидро-1-нафтил] метансульфонамида (промежуточный продукт 78)
Промежуточный продукт 78 получали в виде аморфного твердого вещества (выход 94,4%) аналогично методике, описанной в примере 63, используя в качестве исходных веществ промежуточный продукт 77, полученный согласно примеру 64, и метансульфонилхлорид.
1H-ЯМР (200 МГц; CDCl3): δ (част./млн): 0,80-0,95 (m, 3H); 1,20-2,37 (m, 12H); 2,70-3,52 (m, 13H); 3,80-4,51 (m, 7H); 5,05-5,70 (m, 1H); 5,97 (d, 1H); 6,69-7,05 (m, 2H); 7,20-7,38 (m, 5H).
МС: 544 [M+1].
Пример 66
Работая по методике, аналогичной описанной в примере 12, получали следующие соединения.
(S)-N-пропил-N-[[6-(2- фенилэтил)амино] гексил] -5-метил-6-метокси-1,2,3,4-тетрагидро-2- нафтиламин (соединение 79) в виде желтого масла (выход 54%)с использованием в качестве исходного вещества промежуточного продукта 76.
1H-ЯМР (200 МГц; CDCl3): δ (част./млн): 0,86 (t, 3H); 1,24-2,06 (m, 12H); 2,08 (s, 3H); 2,41-2,93 (m, 15H); 3,77 (s, 3H); 6,67 (d, 1H); 690 (d, 1H); 7,14-7,32 (m, 5H).
МС: 437 [M+1].
Трихлорид (S)-2-метокси-N1-метил-N6-[[6-(2- фенилэтил)амино] гексил]-N6-пропил-5,6,7,8-тетрагидронафтил-1,6- диамина (промежуточный продукт 80) в виде белого аморфного твердого вещества (выход 77%)с использованием в качестве исходного вещества промежуточного продукта 75.
1H-ЯМР (200 МГц; D2O): δ (част./млн): 0,81 (t, 3H); 1,20-2,27 (m, 12H); 2,65-3,19 (m, 14H); 3,54-3,68 (m, 1H); 3,77 (s, 3H); 6,92 (d, 1H); 7,12-7,29 (m, 6H).
МС: 452 [M+1].
(S)-[2-метокси-6-[[6-(2-фенилэтил)амино]гексил]пропиламино]-5,6,7,8- тетрагидро-1-нафтил]метансульфонамид (промежуточный продукт 81) в виде светло-желтого масла (выход 55%) с использованием в качестве исходного вещества промежуточного продукта 78.
1H-ЯМР (200 МГц; CDCl3): δ (част./млн): 0,84 (t, 3H); 1,22-2,02 (m, 12H); 2,94 (s, 3H); 2,39-3,28 (m, 15H); 3,82 (s, 3H); 6,71 (d, 1H); 7,00 (d, 1H); 7,14-7,31 (m, 5H).
МС: 516 [M+1].
Пример 67
Работая по методике, аналогичной описанной в примере 13, получали следующие соединения.
Дигидробромид (S)-N-пропил-N-[[6- (2-фенилэтил)амино]гексил]-5-метил-6-гидрокси-1,2,3,4- тетрагидро-2-нафтиламина (соединение 46) в виде аморфного орехово-коричневого твердого вещества (выход 45%) с использованием в качестве исходного вещества промежуточного продукта 79.
1H-ЯМР (200 МГц; D2O): δ (част./млн): 0,81 (t, 3H); 1,91 (s, 3H); 1,22- 2,19 (m, 12H); 2,44-3,18 (m, 14H); 3,44-3,77 (m, 1H); 6,60 (d, 1H); 6,77 (d, 1H); 7,13-7,29 (m, 5H).
МС: 423 [M+1].
Тригидробромид (S)-N-пропил-N-[[6-(2-фенилэтил)амино] гексил] -5- метиламино-6-гидрокси-1,2,3,4-тетрагидро-2-нафтиламина (соединение 47) в виде оранжевого твердого вещества (выход 65%) с использованием в качестве исходного вещества промежуточного продукта 80.
1H-ЯМР (200 МГц; D2O): δ (част./млн): 0,82 (t, 3H); 1,24-2,26 (m, 12H); 2,84 (s, 3H); 2,65-3,19 (m, 14H); 3,55-3,68 (m, 1H); 6,77 (d, 1H); 7,02 (d, 1H); 7,13-7,30 (m, 5H).
МС: 438 [M+1].
Пример 68
Работая по методике, аналогичной описанной в примере 42, получали следующее соединение.
Дигидробромид (S)-[2-гидрокси-6-[[6-(2-фенилэтил)амино] гексил] пропиламино]-5,6,7,8-тетрагидро-1-нафтил]амин]метансульфониламида (соединение 48) в виде орехово-коричневого твердого вещества (выход 53%)с использованием в качестве исходного вещества промежуточного продукта 81.
1H-ЯМР (200 МГц; D2O): δ (част./млн): 0,81 (t, 3H); 1,19-2,19 (m, 12H); 2,53-3,20 (m, 17H); 3,50-3,66 (m, 1H); 6,72 (d, 1H); 6,93 (d, 1H); 7,15-7,30 (m, 5H).
МС: 502 [M+1].
Пример 69
Получение (R)-N-пропионил-6-метокси-7-нитро- 1,2,3,4-тетрагидро-2-нафтиламина
Раствор 100%-ной азотной кислоты (0,81 мл; 19,3 ммоля) в трифторуксусной кислоте (2 мл) добавляли по каплям при перемешивании и при 0oC к раствору (R)-N-пропионил-6-метокси-1,2,3,4-тетрагидро-2-нафтиламина (4,5 г; 19,3 ммоля), полученного в соответствии с методом, описанным в заявке на европейский патент 74903, в трифторуксусной кислоте (20 мл). Через 30 минут растворитель выпаривали при пониженном давлении и при комнатной температуре. К остатку добавляли воду (30 мл) и метиленхлорид (50 мл), слои разделяли и органический слой промывали раствором бикарбоната натрия, сушили над Na2SO4 и упаривали досуха при пониженном давлении. Остаток очищали с помощью хроматографии (элюент петролейный эфир:этилацетат в соотношении, постоянно увеличивающемся от 1: 1 до 1: 4), получая (R)-N-пропионил-6-метокси-7-нитро-1,2,3,4-тетрагидро-2-нафтиламин (2,4 г) в виде светло-желтого твердого вещества.
1H-ЯМР (200 МГц; CDCl3): δ (част./млн): 1,14 (t, 3H); 1,62-2,15 (m, 2H); 2,19 (q, 2H); 2,48-3,13 (m, 4H); 3,90 (s, 3H); 4,15-4,35 (m, 1H); 5,39-5,56 (bd, 1H); 6,76 (s, 1H); 7,59 (s, 1H).
МС: 279 [M+1].
Пример 70
Получение гидрохлорида (R)-N-пропил-6-метокси-7-нитро-1,2,3,4- тетрагидро-2-нафтиламина
Комплекс боран-диметилсульфид (1,6 г, 20,0 ммолей) медленно добавляли при перемешивании и при комнатной температуре к раствору (R)-N-пропионил-6-метокси-7-нитро-1,2,3,4- тетрагидро-2-нафтиламина (2,2 г; 7,9 ммоля), полученного согласно примеру 69, в ТГФ (30 мл). По завершении добавления реакционную смесь кипятили с обратным холодильником в течение 1,5 ч. После охлаждения до 5oC добавляли раствор концентрированной соляной кислоты (0,8 мл) в метаноле (8 мл). Реакционную смесь вновь кипятили с обратным холодильником в течение 1,5 ч, а затем концентрировали при атмосферном давлении. Добавляли метанол (20 мл), растворитель отгоняли при пониженном давлении, вновь добавляли метанол (20 мл) и растворитель выпаривали досуха. Остаток растворяли в этилацетате. После фильтрации твердого продукта и сушки под вакуумом при 50oC получали гидрохлорид (R)-N-пропил-6-метокси-7- нитро-1,2,3,4-тетрагидро-2-нафтиламина (2,3 г) в виде бежевого твердого вещества.
1H-ЯМР (200 МГц; D2O): δ (част./млн): 0,83 (t, 3H); 1,46-2,24 (m, 4H); 2,62-3,18 (m, 6H); 3,33-3,53 (m, 1H); 3,78 (s, 3H); 6,92 (s, 1H); 7,67 (s, 1H).
МС: 265 [M+1].
Пример 71
Получение 4-(2-карбоксиэтил)фенилтиомочевины
Тиоцианат калия (257 г; 2,64 моля) добавляли при перемешивании и при 50oC к раствору 4-аминофенилуксусной кислоты (200 г; 1,32 моля) в воде (1000 мл) и концентрированной HCl (130 г; 1,32 моля). Реакционную смесь выдерживали при 100oC в течение 16 часов, затем охлаждали до 0oC и фильтровали. К твердому веществу добавляли абсолютный этанол (600 мл) и смесь кипятили с обратным холодильником в течение 1 часа. После охлаждения до 0oC, фильтрации и сушки твердого вещества под вакуумом при 60oC получали 4-(2-карбоксиэтил)фенилтиомочевину (173 г) в виде твердого вещества.
1H-ЯМР (200 МГц; ДМСО-d6): δ (част./млн): 3,52 (s. 2H); 7,16-7,35 (m, 4H); 7,20-7,70 (bs, 2H); 9,64 (s, 1H); 12,30 (bs, 1H).
МС: 211 [M+1].
Пример 72
Получение 2-хлор-6-(2-карбоксиэтил)-1,3-бензтиазола
К суспензии 4-(2-карбоксиэтил)фенилтиомочевины (172 г; 0,82 моля), полученной согласно примеру 71, в хлороформе (1,7 л) медленно добавляли при перемешивании и при 0oC бром (261 г; 1,64 моля). Через 30 минут реакционную смесь кипятили с обратным холодильником в течение 1 часа, затем охлаждали до 0oC и фильтровали. Твердое вещество промывали ацетоном и растворяли в воде (2,5 мл), а затем при перемешивании и при комнатной температуре добавляли 10,8 н. водный раствор NaOH (67 мл). Через 1 час твердое вещество отфильтровывали и промывали водой. После сушки под вакуумом при 60oC получали 2-амино-6-(2-карбоксиэтил)- 1,3-бензтиазол (129 г).
1H-ЯМР (200 МГц; ДМСО-d6): δ (част./млн): 3,55 (s, 2H); 7,08 (dd, 1H); 7,25 (d, 1H); 7,41 (bs, 2H); 7,52 (d, 1H); 12,11-12,45 (bs, 1H).
МС: 209 [M+1].
Раствор нитрита натрия (104 г; 1,5 моля) в воде (155 мл) добавляли по каплям в течение 2 часов при перемешивании и при 0oC к раствору 2-амино-6-(2-карбоксиэтил)-1,3-бензтиазол (104 г; 0,5 моля) в 85%-ной фосфорной кислоте (1145 мл). Через 1 час смесь в течение 1 часа при перемешивании и при 0oC добавляли к раствору CuSO4•5H2O (500 г; 2,0 моля) и хлорида натрия (584 г; 10,0 молей) в воде (2 л). Реакционной смеси давали нагреться до комнатной температуры в течение ночи и после фильтрации твердое вещество промывали водой и сушили в вакууме при 60oC, получая 2-хлор-6-(2-карбоксиэтил)-1,3-бензтиазола (104 г).
1H-ЯМР (200 МГц; ДМСО-d6): δ (част./млн): 3,73 (s, 2H); 7,44 (dd, 1H); 7,89 (d, 1H); 7,99 (d, 1H); 12,42 (bs, 1H).
МС: 228 [M+1].
Пример 73
Получение 2-метокси-6-(2-карбоксиэтил)-1,3- бензтиазола (промежуточный продукт 82)
Металлический натрий (17,8 г) добавляли порциями при перемешивании к метанолу (800 мл). После полного растворения добавляли 2-хлор-6-(2-карбоксиэтил)-1,3-бензтиазол (80 г; 0,35 моля), полученный согласно примеру 72, и реакционную смесь кипятили с обратным холодильником в течение 3 часов. Растворитель выпаривали и к остатку добавляли воду (640 мл), метанол (160 мл) и при перемешивании и при комнатной температуре концентрированную HCl (44 мл). После охлаждения до 0oC и фильтрации твердое вещество сушили в вакууме при 60oC, получая промежуточный продукт 82 (71 г) в виде бежевого твердого вещества.
1H-ЯМР (200 МГц; ДМСО-d6): δ (част./млн): 3,64 (s, 2H); 4,13 (s, 3H); 7,28 (dd, 1H); 7,61 (d, 1H); 7,76 (d, 1H); 12,37 (s, 1H).
МС: 224 [M+1].
Пример 74
Получение 6-(2-метокси-1,3-бензтиазол-6-ил)ацетиламинокапроновой кислоты (промежуточный продукт 83)
К раствору промежуточного продукта 82 (2,0 г; 9,0 ммолей), полученного согласно примеру 73, и N-гидроксисукцинимида (1,0 г; 9,0 ммолей) в диоксане (15 мл) при перемешивании и при комнатной температуре добавляли N,N'-дициклогексилкарбодиимид (1,85 г; 9,0 ммолей). Через 1 час добавляли этиловый эфир (15 мл) и реакционную смесь фильтровали. Раствор упаривали досуха и образовавшийся остаток растворяли в диоксане (10 мл) и ДМФ (5 мл). Образовавшийся раствор при перемешивании и при комнатной температуре добавляли к раствору 6-аминокапроновой кислоты (1,2 г; 9,0 ммолей) и дициклогексиламина (1,6 г; 9,0 ммолей) в воде (6 мл) и этаноле (6 мл). Через 1 час растворители выпаривали при пониженном давлении, добавляли воду (20 мл) и при перемешивании раствор бисульфата калия (1,3 г; 9,6 ммолей) в воде (6 мл). Через 30 минут осадок отфильтровывали и сушили под вакуумом при 60oC, получая промежуточный продукт 83 (2,8 г) в виде белого твердого вещества.
1H-ЯМР (200 МГц; ДМСО-d6): δ (част./млн): 1,12-1,56 (m, 6H); 2,16 (t, 2H); 2,94-3,08 (m, 2H); 3,44 (s, 2H); 4,13 (s, 3H); 7,26 (dd, 1H); 7,58 (d, 1H); 7,71 (d, 1H); 8,03 (t, 1H).
МС: 337 [M+1].
Пример 75
Получение дигидрохлорида (S)-N-пропил-N-[6-[2- (3-метилсульфонилфенил)этиламино] гексил] -5,6-диметокси- 1,2,3,4-тетрагидро-2-нафтиламина (промежуточный продукт 84)
Работая по методике, аналогичной описанной в примере 36, получали промежуточный продукт 84.
1H-ЯМР (200 МГц; D2O): δ (част./млн): 0,82 (t, 3H); 1,16-2,22 (m, 12H); 2,45-3,26 (m, 14H); 3,08 (s, 3H); 3,49-3,68 (m, 1H); 3,59 (s, 3H); 3,68 (s, 3H); 6,81 (s, 2H); 7,42-7,58 (m, 2H); 7,64-7,75 (m, 2H).
МС: 531 [M+1].
Пример 76
Получение дигидробромида (S)-N-пропил-N-[6-[2- (3-метилсульфонил-фенил)этиламино] гексил] -5,6-дигидрокси-1,2,3,4- тетрагидро-2-нафтиламина (соединение 49)
Работая по методике, аналогичной описанной в примере 40, и используя в качестве исходного вещества промежуточный продукт 84, полученный согласно примеру 75, получали соединение 49.
1H-ЯМР (200 МГц; D2O): δ (част./млн): 0,81 (t, 3H); 1,20-2,18 (m, (12H); 2,38-3,23 (m, 14H); 3,09 (s, 3H); 3,42-3,59 (m, 1H); 6,49 (d, 1H); 6,62 (d, 1H); 7,44-7,73 (m, 4H).
МС: 503 [M+1].
Пример 77
Работая по методике, аналогичной описанной в примере 16, получали следующие соединения.
(S)-N-пропил-N-(5,6-диметокси-1,2,3,4-тетрагидро-2-нафтил)- 6-карбоксигексанамид (промежуточный продукт 85)
1H-ЯМР (200 МГц; CDCl3): δ (част./млн): 0,87 и 0,91 (2t, 3H); 1,27-2,08 (m, 10H); 2,26-2,41 (m, 4H); 2,59-3,30 (m, 6H); 3,77 и 3,79 и 3,81 и 3,82 (4s, 6H); 3,85-4,04 и 4,46-4,68 (2m, 1H); 6,70 (d, 1H); 6,79 (d, 1H).
МС: 392 [M+1].
(S)-N-пропил-N-(5,6-диметокси-1,2,3,4- тетрагидро-2-нафтил)-4-карбоксибутанамид (промежуточный продукт 86)
1H-ЯМР (200 МГц; CDCl3): δ (част./млн): 0,86 и 0,91 (2t, 3H); 1,49-2,08 (m, 6H); 2,37-2,53 (m, 4H); 2,57-3,29 (m, 6H); 3,77 и 3,79 и 3,81 и 3,82 (4s, 6H); 3,85-4,05 и 4,45-4,65 (2m, 1H); 6,70 (d, 1H); 6,79 (d, 1H).
МС: 364 [M+1].
Пример 78
Получение дигидрохлорида (S)-N-пропил-N-[(7- амино)гептил]-5,6-диметокси-1,2,3,4-тетрагидро-2- нафтиламина (промежуточный продукт 87)
К раствору промежуточного продукта 85 (2,6 г; 6,6 ммоля), полученного согласно примеру 77, в метиленхлориде (40 мл) при перемешивании и при комнатной температуре добавляли тионилхлорид (0,87 г; 7,3 ммоля). Через 2 часа реакционную смесь упаривали досуха. Остаток растворяли в метиленхлориде (40 мл) и образовавшийся раствор добавляли по каплям при перемешивании и при 0oC к раствору аммиака в 0,65 М ТГФ (40 мл). Через 1 час растворители выпаривали при пониженном давлении, добавляли воду и этилацетат и разделяли фазы. Органический слой промывали раствором бикарбоната калия, а затем водой и сушили над Na2SO4. После выпаривания растворителя образовавшийся остаток растворяли в ТГФ (80 мл). К раствору медленно добавляли при перемешивании и при комнатной температуре комплекс боран-диметилсульфид (3,8 г; 49,2 ммоля). По завершении добавления реакционную смесь кипятили с обратным холодильником в течение 1,5 ч. После охлаждения до 5oC добавляли раствор концентрированной HCl (6 мл) в метаноле (30 мл). Реакционную смесь вновь кипятили с обратным холодильником в течение 1 часа, а затем концентрировали путем отгонки растворителей при атмосферном давлении и высушивали досуха при пониженном давлении. Остаток растворяли в метаноле (30 мл), растворитель отгоняли при пониженном давлении, добавляли метанол (30 мл) и растворитель вновь выпаривали досуха. Остаток очищали с помощью хроматографии (элюент CH2Cl2:CH3OH: 50%-ная HCOOH = 85:15:2) и образовавшийся продукт растворяли в абсолютном этаноле (20 мл). Добавляли раствор HCl в этиловом эфире (15% мас./об.) до получения выраженно кислого значения pH и растворители выпаривали при пониженном давлении, получая промежуточный продукт 87 (1,8 г) в виде аморфного твердого вещества.
1H-ЯМР (200 МГц; D2O): δ (част./млн): 0,81 (t, 3H); 1,12-2,24 (m, 14H); 2,46-3,25 (m, 10H); 3,47-3,67 (m, 1H); 3,60 (s, 3H); 3,69 (s, 3H); 6,82 (s, 2H).
МС: 363 [M+1].
Аналогично описанной выше методике были получены следующие соединения.
Дигидрохлорид (S)-N-пропил-N-[(5- амино)пентил]-5,6-диметокси-1,2,3,4-тетрагидро-2-нафтиламина (промежуточный продукт 88) с использованием в качестве исходного вещества промежуточного продукта 86.
1H-ЯМР (200 МГц; D2O): δ (част./млн): 0,83 (t, 3H); 1,21-2,25 (m, 10H); 2,47-3,26 (m, 10H); 3,47-3,67 (m, 1H); 3,61 (s, 3H); 3,70 (s, 3H); 6,83 (s, 2H).
МС: 335 [М+1].
Дигидрохлорид (S)-N-пропил-N-[(6- метиламино)гексил] -5,6-диметокси-1,2,3,4-тетрагидро-2-нафтиламина (промежуточный продукт 89) с использованием в качестве исходного вещества промежуточного продукта 29 и с использованием метиламина вместо аммиака.
1H-ЯМР (200 МГц; D2O): δ (част./млн): 0,81 (t, 3H); 1,16-2,22 (m, 12H); 2,52 (s, 3H); 2,45-3,23 (m, 10H); 3,46-3,66 (m, 1H); 3,59 (s, 3H); 3,68 (s, 3H); 6,81 (s, 2H).
МС: 363 [M+1].
Пример 79
Работая по методике, аналогичной описанной в примере 23, получали следующие соединения.
Дигидрохлорид (S)-N-пропил-N-[7-[2-(2-оксо-3H-1,3-бензтиазол-6-ил) этиламино]гептил]-5,6-диметокси-1,2,3,4-тетрагидро-2-нафтиламина (промежуточный продукт 90) с использованием в качестве исходных веществ промежуточного продукта 87, полученного согласно примеру 78, и промежуточного продукта 82, полученного согласно примеру 73.
1H-ЯМР (200 МГц; D2O): δ (част./млн): 0,81 (t, 3H); 1,09-2,21 (m, 14H); 2,42-3,21 (m, 14H); 3,43-3,64 (m, 1H); 3,58 (s, 3H); 3,67 (s, 3H); 6,76 (d, 1H); 6,80 (d, 1H); 7,01 (d, 1H); 7,09 (dd, 1H); 7,28 (d, 1H).
МС (термоспрей): 540 [M+1].
Дигидрохлорид (S)-N-пропил-N-[5-[2-(2-оксо-3H-1,3-бензтиазол-6-ил) этиламино]пентил]-5,6-диметокси-1,2,3,4-тетрагидро-2-нафтиламина (промежуточный продукт 91) с использованием в качестве исходного вещества промежуточного продукта 88, полученного согласно примеру 78.
1H-ЯМР (200 МГц; D2O): δ (част./млн): 0,81 (t, 3H); 1,17-2,22 (m, 10H); 2,43-3,21 (m, 14H); 3,45-3,64 (m, 1H); 3,58 (s, 3H); 3,66 (s, 3H); 6,75 (d, 1H); 6,79 (d, 1H); 7,01 (d, 1H); 7,08 (dd, 1H); 7,27 (d, 1H).
МС (термоспрей): 512 [M+1].
Дигидрохлорид (S)-N-метил-N-[2-(2-оксо-3H-1.3- бензтиазол-6-ил)этил]-N'-пропил-N'-(5,6-диметокси-1,2,3,4- тетрагидро-2-нафтил)-1,6-гександиамина (промежуточный продукт 92) с использованием в качестве исходного вещества промежуточного продукта 89, полученного согласно примеру 78.
1H-ЯМР (200 МГц; D2O): δ (част./млн): 0,79 (t, 3H); 1,09-2,16 (m, 12H); 2,29-3,63 (m, 15H); 2,72 (s, 3H); 3,48 (s, 3H); 3,57 (s, 3H); 6,55-6,70 (m, 2H); 6,82 (dd, 1H); 6,99 (d, 1H); 7,12 (d, 1H).
МС (термоспрей): 540 [M+1].
Пример 80
Работая по методике, аналогичной описанной в примере 40, получали следующие соединения.
Дигидробромид (S)-N-пропил-N-[7-[2-(2-оксо-3H-1,3-бензтиазол-6-ил)этиламино] гептил] -5,6-дигидрокси-1,2,3,4-тетрагидро-2-нафтиламина (соединение 50) с использованием в качестве исходного вещества промежуточного продукта 90, полученного согласно примеру 79.
1H-ЯМР (200 МГц; D2O): δ (част./млн): 0,79 (t, 3H); 1,13-2,15 (m, 14H); 2,34-3,15 (m, 14H); 3,39-3,54 (m, 1H); 6,45 (d, 1H); 6,58 (d, 1H); 6,98 (d, 1H); 7,07 (dd, 1H); 7,24 (d, 1H).
МС: 512 [M+1].
Дигидробромид (S)-N-пропил-N-[5-[2-(2-оксо-3H-1,3- бензтиазол-6-ил)этиламино] пентил] -5,6-дигидрокси-1,2,3,4- тетрагидро-2-нафтиламина (соединение 51) с использованием в качестве исходного вещества промежуточного продукта 91, полученного согласно примеру 79.
1H-ЯМР (200 МГц; D2O): δ (част./млн): 0,79 (t, 3H); 1,20-2,11 (m, 10H); 2,26-3,18 (m, 14H); 3,33-3,48 (m, 1H); 6,35-6,52 (m, 2H); 6,89 (d, 1H); 7,02 (dd, 1H); 7,18 (d, 1H).
МС (термоспрей): 484 [M+1].
Дигидробромид (S)-N-метил-N-[2-(2-оксо-3H-1,3- бензтиазол-6-ил)этил]-N'-пропил-N'-(5,6-дигидрокси-1,2,3,4- тетрагидро-2-нафтил)-1,6-гександиамина (соединение 52) с использованием в качестве исходного вещества промежуточного продукта 92, полученного согласно примеру 79.
1H-ЯМР (200 МГц; D2O): δ част./млн): 0,81 (t, 3H); 1,16-2,16 (m, 12H); 2,74 (s, 3H); 2,33-3,36 (m, 14H); 3,41-3,55 (m, 1H); 6,42-6,59 (m, 2H); 6,99 (d, 1H); 7,09 (dd, 1H); 7,28 (d, 1H).
МС: 512 [M+1].
Пример 81
Получение гидрохлорида (S)-N-пропил-N-(5- метоксикарбонил)пентил-5,6-диметокси-1,2,3,4-тетрагидро-2- нафтиламина (промежуточный продукт 93)
Раствор монометилового эфира хлорангидрида гександиовой кислоты (2,4 г; 13,3 ммоля) в CH2Cl2 (5 мл) при перемешивании и при комнатной температуре добавляли к раствору гидробромида (S)-N-пропил-5,6-диметокси- 1,2,3,4-тетрагидро-2-нафтиламина (4,0 г; 12,1 ммоля) и триэтиламина (3,0 г; 30,0 ммолей) в CH2Cl2 (40 мл). Через 2 часа добавляли воду (50 мл) и разделяли фазы. Органическую фазу промывали 0,2 н. водным раствором HCl, а затем водой, сушили над Na2SO4 и упаривали досуха при пониженном давлении. Остаток растворяли в ТГФ (30 мл). К раствору медленно добавляли при перемешивании в атмосфере азота при комнатной температуре комплекс боран-диметилсульфид (1,7 г; 21,7 ммоля). По завершении добавления реакционную смесь кипятили с обратным холодильником в течение 2 часов. После охлаждения до 5oC добавляли раствор 37%-ной HCl (1,5 мл) в метаноле (12 мл). Реакционную смесь вновь кипятили с обратным холодильником в течение 1 часа, затем концентрировали путем отгонки растворителей при атмосферном давлении и высушивали досуха при пониженном давлении. Остаток растворяли в метаноле (30 мл) и растворитель отгоняли при пониженном давлении, вновь добавляли метанол (30 мл) и растворитель выпаривали досуха. Остаток очищали с помощью хроматографии (элюент CH2Cl2: CH3OH:50%-ная HCOOH = 90:10:1). Образовавшийся твердый продукт растворяли в абсолютном этаноле и добавляли раствор HCl в этиловом эфире (15% мас. /об. ) до получения выраженно кислого значения pH. Путем выпаривания растворителей при пониженном давлении получали промежуточный продукт 93 (2,7 г) в виде аморфного твердого вещества.
1H-ЯМР (200 МГц; ДМСО-d6): δ (част./млн): 0,91 (t, 3H); 1,20-2,39 (m, 10H); 2,31 (t, 2H); 2,52-3,27 (m, 8H); 3,44-3,65 (m, 1H); 3,58 (s, 3H); 3,67 (s, 3H); 3,76 (s, 3H); 6,83 (d, 1H); 6,88 (d, 1H); 10,28 (bs, 1H).
МС: 378 [M+1].
Пример 82
Получение гидрохлорида (S)-N-пропил-N-(5-карбокси)пентил-5,6- диметокси-1,2,3,4-тетрагидро-2-нафтиламина (промежуточный продукт 94)
Раствор NaOH (1,1 г; 2,75 ммоля) в воде (3 мл) добавляли по каплям при перемешивании и при комнатной температуре к раствору промежуточного продукта 93 (2,6 г; 6,3 ммоля), полученного согласно примеру 81, в метаноле (13 мл). Через 2 часа реакционную смесь упаривали досуха. Остаток растворяли в воде и раствор подкисляли концентрированной HCl до pH 1, а затем экстрагировали этилацетатом. Органическую фазу сушили над Na2SO4 и растворитель выпаривали при пониженном давлении, получая промежуточный продукт 94 (1,8 г) в виде аморфного твердого вещества.
1H-ЯМР (200 МГц; ДМСO-d6): δ (част./млн): 0,92 (t, 3H); 1,19-2,39 (m, 10H); 2,22 (t, 2H); 2,51-3,65 (m, 9H); 3,68 (s, 3H); 3,76 (s, 3H); 6,84 (d, 1H); 6,89 (d, 1H); 10,12 (bs, 1H); 12,03 (bs, 1H).
МС: 364 [M+1].
Пример 83
Получение (S)-N-пропил-N- [6-оксо-[6-[2-(2-оксо-3H-1,3-бензтиазол-6-ил)этиламино] гексил] ] -5,6-диметокси-1,2,3,4-тетрагидро-2-нафтиламина (промежуточный продукт 95)
1,1'-карбонилдиимидазол (0,73 г; 4,5 ммоля) добавляли при перемешивании и при комнатной температуре к раствору промежуточного продукта 94 (1,8 г; 4,5 ммоля), полученного согласно примеру 82, и триэтиламина (0,46 г; 4,5 ммоля) в ТГФ (10 мл) и ДМФ (8 мл). Через 1 час добавляли раствор промежуточного продукта 21 (1,2 г; 4,5 ммоля), полученного согласно примеру 8, и триэтиламина (0,46 г; 4,5 ммоля) в ДМФ (20 мл). После выдержки в течение ночи смесь сливали на воду и этилацетат. Фазы разделяли и органическую фазу сушили над Na2SO4 и упаривали досуха при пониженном давлении. Остаток очищали с помощью хроматографии (элюент CH2Cl2:CH3OH:аммиак = 90:10:0,5), получая промежуточный продукт 95 (1,1 г) в виде аморфного твердого вещества.
1H-ЯМР (200 МГц; CDCl3): δ (част./млн): 0,87 (t, 3H); 1,17-2,20 (m, 10H); 2,13 (t, 2H); 2,38-3,14 (m, 11H); 3,40-3,56 (m, 2H); 3,78 (s, 3H); 3,81 (s, 3H); 5,52 (bt, 1H); 6,71 (d, 1H); 6,78 (d, 1H); 6,98 (d, 1H); 7,04 (dd, 1H); 7,19 (d, 1H).
МС: 540 [M+1].
Пример 84
Работая по методике, аналогичной описанной в примере 42, получали следующее соединение.
Гидробромид (S)-N-пропил-N-[6-оксо-[6-[2-(2-оксо- 3H-1,3-бензтиазол-6-ил)этиламино] гексил] ] -5,6-дигидрокси- 1,2,3,4-тетрагидро-2-нафтиламина (соединение 53) с использованием в качестве исходного вещества промежуточного продукта 95, полученного согласно примеру 83.
1H-ЯМР (200 МГц; D2O): δ (част./млн): 0,80 (t, 3H); 0,87-2,10 (m, 10H); 1,99 (t, 2H); 2,32-3,12 (m, 10H); 3,26-3,48 (m, 3H); 6,44 (d, 1H); 6,58 (d, 1H); 6,91-7,12 (m, 3H).
МС: 512 [M+1].
Пример 85
Аналогично описанной в примере 1 методике было получено следующее соединение.
[6-(4-метилсульфонилфенил)ацетиламино] капроновая кислота (промежуточный продукт 96) с использованием в качестве исходного вещества (4-метилсульфонилфенил)уксусной кислоты, полученной согласно J. Chem. Soc., 1501-6 (1948).
1H-ЯМР (200 МГц; ДМСО-d6): δ (част./млн): 1,18-1,56 (m, 6H); 2,17 (t, 2H); 2,97-3,08 (m, 2H); 3,18 (s, 3H); 3,52 (s, 2H); 7,70-7,85 (m, 4H); 8,14 (t, 1H); 12,00 (bs, 1H).
МС: 328 [M+1].
Пример 86
Получение гидрохлорида (R)-N-пропил-6,7-диметокси- 1,2,3,4-тетрагидро-2-нафтиламина
К раствору (R)-6,7-диметокси-1,2,3,4-тетрагидро-2-нафтиламина (2,0 г; 9,6 ммоля), полученного согласно J. Org. Chem., 50, 3619-22 (1985), и триэтиламина (1,1 г; 10,8 ммолей) в CH2Cl2 (20 мл) добавляли при перемешивании и при комнатной температуре пропионилхлорид (1,0 г; 10,8 ммоля). Через 1 час смесь сливали на воду, подкисленную HCl. Фазы разделяли и органическую фазу промывали водой, сушили над Na2SO4 и упаривали досуха при пониженном давлении. Остаток растворяли в ТГФ (75 мл) в атмосфере азота. К раствору медленно добавляли при перемешивании и при комнатной температуре комплекс боран-диметилсульфид (2,9 г; 37,0 ммолей). По завершении добавления реакционную смесь кипятили с обратным холодильником в течение 2 часов. После охлаждения до 5oC добавляли раствор концентрированной HCl (1,7 мл) в метаноле (14 мл). Реакционную смесь вновь кипятили с обратным холодильником в течение 2 часов, а затем концентрировали путем отгонки растворителей при атмосферном давлении и высушивали досуха при пониженном давлении. Остаток растворяли в метаноле (30 мл), растворитель отгоняли при пониженном давлении, добавляли метанол (30 мл) и растворитель вновь выпаривали досуха, получая гидрохлорид (R)-N-пропил-6,7-диметокси-1,2,3,4-тетрагидро-2- нафтиламина (2,6 г) в виде белого твердого вещества.
1H-ЯМР (200 МГц; ДМСО-d6): δ (част./млн): 0,94 (t, 3H); 1,57-2,31 (m, 4H); 2,59-3,17 (m, 6H); 3,23-3,46 (m, 1H); 3,69 (s, 6H); 6,66 (s, 2H); 8,93-9,26 (bs, 2H).
МС: 250 [M+1].
Пример 87
Работая по методике, аналогичной описанной в примере 18, но используя в качестве исходных веществ гидрохлорид (R)-N-пропил-6,7-диметокси-1,2,3,4-тетрагидро-2-нафтиламина, полученный согласно примеру 86, и промежуточный продукт 96, полученный согласно примеру 85, получали следующее соединение:
(R)-N-пропил-N-[6-[2-(4-метилсульфонилфенил)этиламино] гексил] - 5,6-диметокси-1,2,3,4-тетрагидро-2-нафтиламин (промежуточный продукт 97)
1H-ЯМР (200 МГц; CDCl3): δ (част./млн): 0,87 (t, 3H); 1,20-2,04 (m, 13H); 2,38-2,99 (m, 15H); 3,01 (s, 3H); 3,80 (s, 6H); 6,54 (s, 2H); 7,33-7,88 (m, 4H).
МС: 531 [М+1].
Пример 88
Работая по методике, аналогичной описанной в примере 40, но используя в качестве исходного вещества промежуточный продукт 97, полученный согласно примеру 87, получали следующее соединение:
дигидробромид (R)-N-пропил-N-[6-[2-(4-метилсульфонилфенил)этиламино] гексил]-5,6-дигидрокси-1,2,3,4-тетрагидро-2-нафтиламина (соединение 54).
1H-ЯМР (200 МГц; D2O): δ (част./млн): 0,81 (t, 3H); 1,23-2,10 (m, 12H); 3,09 (s, 3H); 2,58-3,24 (m, 14H); 3,47-3,62 (m, 1H); 6,52 (s, 2H); 7,40-7,79 (m, 4H).
МС: 503 [М+1].
Пример 89
Получение (R)-N-пропил-N-[6-[(4- метилсульфонилфенил)ацетиламино] -1-оксогексил]-6-метокси-7- нитро-1,2,3,4-тетрагидро-2-нафтиламина (промежуточный продукт 98)
К суспензии промежуточного продукта 96 (0,84 г; 2,56 ммоля), полученного согласно примеру 85, в метиленхлориде (10 мл) добавляли при перемешивании и при комнатной температуре ДМФ (10 мкл) и тионилхлорид (0,45 г; 3,8 ммоля). Через 1,5 ч растворитель и избыток тионилхлорида выпаривали при пониженном давлении с получением масла, которое растворяли в метиленхлориде (4 мл). Раствор добавляли по каплям при перемешивании и при комнатной температуре к суспензии гидрохлорида (R)-N-пропил-6-метокси-7-нитро-1,2,3,4-тетрагидро-2-нафтиламина (0,7 г; 2,3 ммоля), полученного согласно примеру 70, и триэтиламина (0,7 г; 7,0 ммолей) в CH2Cl2 (10 мл). Через 2 часа добавляли воду (10 мл), фазы разделяли и органическую фазу промывали водой, подкисленной HCl, сушили над Na2SO4 и упаривали досуха при пониженном давлении. Образовавшийся остаток очищали с помощью хроматографии (элюент CH2Cl2:CH3OH = 98: 2), получая промежуточный продукт 98 (0,93 г) в виде аморфного твердого вещества.
1H-ЯМР (200 МГц; CDCl3): δ (част./млн): 0,82-0,97 (2t, 3H); 1,21-1,72 (m, 8H); 1,83-2,10 (m, 2H); 2,28-2,39 (m, 2H); 2,71-3,33 (m, 8H); 3,02 (s, 3H); 3,60 (s, 2H); 3,90 и 3,91 (2s, 3H); 3,89-4,09 и 4,37-4,58 (2m, 1H); 6,06-6,29 (2t, 1H); 6,76 и 6,78 (2s, 1H); 7,42-7,91 (m, 4H); 7,59 и 7,62 (2s, 1H).
МС: 574 [M+1].
Пример 90
Получение дигидрохлорида (R)-N-пропил-N-[6-[2-(4- метилсульфонил-фенил)этиламино] гексил]-6-метокси-7- метилсульфониламино-1,2,3,4-тетрагидро-2-нафтиламина (промежуточный продукт 99)
Раствор промежуточного продукта 98 (0,7 г; 1,2 ммоля), полученного согласно примеру 89, в абсолютном этаноле (50 мл) гидрировали в аппарате Парра (3,4 атм) в течение 7 часов в присутствии Pd на угле (50% в воде) (0,3 г). После отфильтровывания катализатора и выпаривания растворителя при пониженном давлении образовавшийся остаток растворяли в CH2Cl2 (6 мл). К раствору добавляли триэтиламин (0,13 г; 1,3 ммоля) и по каплям при перемешивании и при комнатной температуре метансульфонилхлорид (0,15 г; 1,3 ммоля). После выдержки в течение 4 часов при комнатной температуре добавляли воду (10 мл), фазы разделяли и органическую фазу промывали 10%-ным раствором HCl, а затем раствором NaHCO3. Органическую фазу сушили над Na2SO4 и растворитель выпаривали при пониженном давлении. Образовавшийся остаток растворяли в ТГФ (10 мл) в атмосфере азота. К раствору медленно добавляли при перемешивании и при комнатной температуре комплекс боран-диметилсульфид (0,48 г; 6,1 ммоля). По завершении добавления реакционную смесь кипятили с обратным холодильником в течение 1,5 ч. После охлаждения до 5oC добавляли раствор концентрированной HCl (0,25 мл) в метаноле (2,5 мл). Реакционную смесь вновь кипятили с обратным холодильником в течение 1 часа, а затем концентрировали путем отгонки растворителей при атмосферном давлении и высушивали досуха при пониженном давлении. Остаток растворяли в метаноле (10 мл), растворитель отгоняли при пониженном давлении, добавляли метанол (10 мл) и растворитель вновь выпаривали досуха. Остаток очищали с помощью хроматографии (элюент CH2Cl2: CH3OH: 50%-ная HCOOH = 90:10:1). Образовавшийся продукт растворяли в абсолютном этаноле (20 мл). Добавляли раствор HCl в этиловом эфире (15% мас. /об. ) до получения выраженно кислого значения pH и растворители выпаривали при пониженном давлении, получая промежуточный продукт 99 (0,34 г) в виде аморфного твердого вещества.
1H-ЯМР (200 МГц; D2O): δ (част./млн): 0,81 (t, 3H); 1,13-2,19 (m, 12H); 2,61-3,27 (m, 14H); 2,90 (s, 3H); 3,09 (s, 3H); 3,50-3,71 (m, 1H); 3,69 (s, 3H); 6,76 (s, 1H); 6,96 (s, 1H); 7,39-7,82 (m, 4H).
МС: 594 [M+1].
Пример 91
Получение дигидрохлорида (R)-N-пропил-N-[6-[2-(4- метилсульфонилфенил)этиламино] гексил] -6-гидрокси-7- метилсульфониламино-1,2,3,4-тетрагидро-2-нафтиламина (соединение 55)
К раствору промежуточного продукта 99 (0,27 г; 0,4 ммоля), полученного согласно примеру 90, в воде (1 мл) добавляли метиленхлорид (2 мл) и до получения щелочного значения pH водный раствор K2CO3. Фазы разделяли и органическую фазу сушили над Na2SO4 и упаривали досуха. Образовавшийся остаток растворяли в CHCl3 (5 мл) и к раствору при перемешивании и при -30oC добавляли 1 М раствор BCl3 в CH2Cl2 (2,3 мл; 2,3 ммоля). По завершении добавления реакционной смеси давали нагреться до комнатной температуры. После выдержки при комнатной температуре в течение 15 часов добавляли метанол (10 мл) и растворители выпаривали при пониженном давлении. Остаток очищали с помощью хроматографии (элюент CH2Cl2: CH3OH:50%-ная HCOOH = 85:15:1), получая продукт, который растворяли в абсолютном этаноле (5 мл). Добавляли раствор HCl в этиловом эфире (15% мас./об.) до получения выраженно кислого значения pH и растворители выпаривали при пониженном давлении, получая соединение 55 (0,22 г) в виде аморфного твердого вещества.
1H-ЯМР (200 МГц; D2O): δ част./млн): 0,81 (t, 3H); 1,19-2,13 (m, 12H); 2,92 (s, 3H); 3,09 (s, 3H); 2,57-3,24 (m, 14H); 3,51-3,68 (m, 1H); 6,63 (s, 1H); 6,94 (s, 1H); 7,40-7,79 (m, 4H).
МС: 580 [M+1].
Пример 92
Получение дигидрохлорида (R)-N-пропил-N-[6-(2- фенилэтиламино)гексил]-6-гидрокси-7-нитро-1,2,3,4-тетрагидро-2- нафтиламина (промежуточный продукт 100)
К раствору 6-(фенилацетиламино)капроновой кислоты (1,1 г; 4,4 ммоля) в CH2Cl2 (12 мл) добавляли при перемешивании и при комнатной температуре ДМФ (20 мкл) и тионилхлорид (0,57 г; 4,8 ммоля). Через 1 час растворитель и избыток тионилхлорида выпаривали при пониженном давлении с получением масла, которое растворяли в CH2Cl2 (5 мл). Раствор добавляли по каплям при перемешивании и при комнатной температуре к суспензии гидрохлорида (R)-N-пропил-6- метокси-7-нитро-1,2,3,4-тетрагидро-2-нафтиламина (1,2 г; 4,0 ммоля), полученного согласно примеру 70, и триэтиламина (1,0 г; 10,0 ммолей) в метиленхлориде (15 мл). Через 3 часа добавляли воду (15 мл), фазы разделяли и органическую фазу промывали водой, подкисленной HCl, сушили над Na2SO4 и упаривали досуха при пониженном давлении. Образовавшийся остаток растворяли в ТГФ (20 мл) в атмосфере азота. К раствору медленно добавляли при перемешивании и при комнатной температуре комплекс боран-диметилсульфид (1,9 г; 24,0 ммоля). По завершении добавления реакционную смесь кипятили с обратным холодильником в течение 1,5 ч. После охлаждения до 5oC добавляли раствор концентрированной HCl (1 мл) в метаноле (10 мл). Реакционную смесь вновь кипятили с обратным холодильником в течение 1 часа, а затем концентрировали путем отгонки растворителей при атмосферном давлении и высушивали досуха при пониженном давлении. Остаток растворяли в метаноле (30 мл), растворитель отгоняли при пониженном давлении, добавляли метанол (30 мл) и растворитель вновь выпаривали досуха. Остаток очищали с помощью хроматографии (элюент CH2Cl2: CH3OH: 50%-ная HCOOH = 90:10:1) с получением продукта, который растворяли в абсолютном этаноле (20 мл). Добавляли раствор HCl в этиловом эфире (15% мас. /об. ) до получения выраженно кислого значения pH и растворители выпаривали при пониженном давлении, получая промежуточный продукт 100 (1,8 г) в виде аморфного твердого вещества.
1H-ЯМР (200 МГц; D2O): δ (част./млн): 0,82 (t, 3H); 1,11-2,21 (m, 12H); 2,67-3,21 (m, 14H); 3,52-3,72 (m, 1H); 3,75 (s, 3H); 6,90 (s, 1H); 7,09-7,29 (m, 5H); 7,62 (s, 1H).
МС (термоспрей): 467 [M+1].
Пример 93
Получение (R)-N-пропил-N-[6-(2- метокси-1,3-бензтиазол-6-ил)ацетил-амино-1-оксогексил] -6-метокси- 7-нитро-1,2,3,4-тетрагидро-2-нафтиламина (промежуточный продукт 101)
К раствору промежуточного продукта 83 (2,5 г; 7,4 ммоля), полученного согласно примеру 74, и триэтиламина (0,75 г; 7,4 ммоля) в ТГФ (44 мл) добавляли при перемешивании и при -10oC изобутилхлорформиат (1,0 г, 7,4 ммоля). Через 15 минут также при - 10oC добавляли триэтиламин (0,69 г; 6,8 ммоля) и гидрохлорид (R)-N-пропил-6-метокси-7-нитро-1,2,3,4-тетрагидро-2-нафтиламина (2,0 г; 6,7 ммоля), полученного согласно примеру 70. Через 1 ч реакционной смеси давали нагреться до комнатной температуры. Через 15 часов при комнатной температуре добавляли этилацетат (150 мл) и воду (50 мл), фазы разделяли и органическую фазу промывали 1%-ным раствором HCl, раствором NaHCO3 и затем насыщенным раствором NaCl. Органическую фазу сушили над Na2SO4 и растворитель выпаривали при пониженном давлении. Остаток очищали с помощью хроматографии (элюент CH2Cl2: CH3OH = 97:3), получая промежуточный продукт 101 (3,3 г) в виде аморфного твердого вещества.
1H-ЯМР (200 МГц; CDCl3): δ (част./млн): 0,82-0,97 (2t, 3H); 1,19-1,71 (m, 8H); 1,83-2,06 (m, 2H); 2,23-2,36 (m, 2H); 2,71-3,29 (m, 8H); 3,58 (s, 2H); 3,89 и 3,91 (2s, 3H); 3,90-4,08 и 4,39-4,59 (2m, 1H); 4,18 (s, 3H); 5,57-5,75 (bs, 1H); 6,75 и 6,78 (2s, 1H); 7,21 и 7,24 (2s, 1H); 7,52-7,65 (m, 3H).
МС: 583 [M+1].
Пример 94
Получение дигидрохлорида (R)-N-пропил-N-[6-[2-(2- оксо-3H-1,3-бензтиазол-6-ил)этиламино] гексил] -6-метокси-7-нитро- 1,2,3,4-тетрагидро-2-нафтиламина (промежуточный продукт 102)
К раствору промежуточного продукта 101 (3,2 г; 5,5 ммоля), полученного согласно примеру 93, в диоксане (40 мл) при перемешивании и при комнатной температуре добавляли концентрированную HCl (1 мл). Через 4 часа растворители выпаривали при пониженном давлении и к остатку добавляли воду и метиленхлорид. Фазы разделяли и органическую фазу промывали раствором NaHCO3, сушили над Na2SO4 и упаривали досуха при пониженном давлении. Образовавшийся остаток растворяли в ТГФ (30 мл) в атмосфере азота. К раствору медленно добавляли при перемешивании и при комнатной температуре комплекс боран-диметилсульфид (2,6 г; 33,2 ммоля). По завершении добавления реакционную смесь кипятили с обратным холодильником в течение 1,5 ч. После охлаждения до 5oC добавляли раствор концентрированной HCl (1,4 мл) в метаноле (14 мл). Реакционную смесь вновь кипятили с обратным холодильником в течение 1 часа, а затем концентрировали путем отгонки растворителей при атмосферном давлении и высушивали досуха при пониженном давлении. Остаток растворяли в метаноле (30 мл), растворитель отгоняли при пониженном давлении, добавляли метанол (30 мл) и растворитель вновь выпаривали досуха. Остаток очищали с помощью хроматографии (элюент CH2Cl2:CH3OH:50%-ная HCOOH = 85:15:1) с получением продукта, который растворяли в абсолютном этаноле (20 мл). Добавляли раствор HCl в этиловом эфире (15% мас./об.) до получения выраженно кислого значения pH и растворители выпаривали при пониженном давлении, получая промежуточный продукт 102 (2,2 г) в виде аморфного твердого вещества.
1H-ЯМР (200 МГц; D2O; 60oC): δ (част./млн): 1,21 (t, 3H); 1,49-2,61 (m, 12H); 2,91-3,62 (m, 14H); 3,84-4,08 (m, 1H); 4,10 (s, 3H); 7,21 (s, 1H); 7,30-7,60 (m, 3H); 7,90 (s, 1H).
МС: 541 [M+1].
Пример 95
Получение дигидрохлорида (R)-N-пропил-N-[6-(2- фенилэтиламино)гексил]-6-гидрокси-7-амино-1,2,3,4-тетрагидро-2- нафтиламина (промежуточный продукт 103)
К раствору промежуточного продукта 100 (1,8 г; 3,3 ммоля), полученного согласно примеру 92, в CHCl3 (20 мл) добавляли при перемешивании и при -50oC 1 М раствор BCl3 в CH2Cl2 (16,5 мл; 16,5 ммоля). По завершении добавления реакционной смеси давали нагреться до комнатной температуры, а затем выдерживали при 50oC в течение 5 часов. После дополнительной выдержки при комнатной температуре в течение 15 часов добавляли метанол (20 мл) и растворители выпаривали при пониженном давлении. Остаток растворяли в метаноле и растворитель вновь выпаривали при пониженном давлении, добавляли этанол (20 мл) и образовавшийся раствор гидрировали в аппарате Парра (3,4 атм) в течение 1 часа в присутствии Pd на угле (50% в воде) (0,7 г). После отфильтровывания катализатора и выпаривания растворителя при пониженном давлении получали промежуточный продукт 103 (1,6 г) в виде аморфного твердого вещества.
1H-ЯМР (200 МГц; CDCl3; свободное основание): δ (част./млн): 0,85 (t, 3H); 1,16-2,00 (m, 13H); 2,38-2,99 (m, 15H); 3,40-3,73 (bs, 3H); 6,73 (s, 1H); 6,42 (s, 1H); 7,12-7,32 (m, 5H).
МС: 424 [M+1].
Аналогично описанной выше методике было получено следующее соединение.
Дигидрохлорид (R)-N-пропил-N-[6-[2-(2-оксо-3H-1,3-бензтиазол-6- ил)этиламино] гексил] -6-гидрокси-7-амино-1,2,3,4-тетрагидро-2- нафтиламина (промежуточный продукт 104) с использованием в качестве исходного вещества промежуточного продукта 102.
1H-ЯМР (200 МГц; D2O): δ (част./млн): 0,80 (t, 3H); 1,18-2,10 (m, 12H); 2,57-3,19 (m, 14H); 3,44-3,59 (m, 1H); 6,47 (s, 3H); 6,53 (s, 1H); 7,00-7,28 (m, 3H).
МС: 497 [M+1].
Пример 96
Получение моногидрохлорида моноформиата (R)-N-пропил-N-[6-(2- фенилэтиламино)гексил] -6-гидрокси-7-формиламино-1,2,3,4-тетрагидро- 2-нафтиламина (соединение 56)
Раствор промежуточного продукта 103 (0,9 г; 1,8 ммоля), полученного согласно примеру 95, и уксусного ангидрида (0,28 г; 2,7 ммоля) в муравьиной кислоте (5,5 мл) выдерживали при перемешивании и при 0oC в течение 30 минут, а затем выдерживали при 50oC в течение 1 часа. После дополнительной выдержки при комнатной температуре в течение 15 часов добавляли уксусный ангидрид (0,07 г; 0,7 ммоля) и реакционную смесь вновь выдерживали при 50oC в течение 4 часов. Добавляли этиловый эфир (20 мл) и растворители выпаривали при пониженном давлении. Образовавшийся остаток очищали с помощью хроматографии (элюент CH2Cl2:CH3OH:50%-ная HCOOH = 85:15:1), получая соединение 56 (0,4 г) в виде аморфного твердого вещества.
1H-ЯМР (200 МГц; ДМСО-d6): δ (част./млн): 0,90 (t, 3H); 1,28-2,25 (m, 12H); 2,56-3,50 (m, 15H); 6,61 (s, 1H); 7,19-7,37 (m, 5H); 7,83 (s, 1H); 8,14 (s, 1H); 8,22 (d, 1H); 9,51 (d, 1H).
МС: 452 [M+1].
Аналогично описанной выше методике было получено следующее соединение.
Диформиат (R)-N-пропил-N-[6-[2-(2-оксо-3H-1,3-бензтиазол-6-ил) этиламино] гексил] -6-гидрокси-7-формиламино-1,2,3,4-тетрагидро-2-нафтиламина (соединение 57) с использованием в качестве исходного вещества промежуточного продукта 104.
1H-ЯМР (200 МГц; ДМСО-d6): δ (част./млн): 0,90 (t, 3H); 1,29-2,24 (m, 12H); 2,62-3,60 (m, 15H); 6,60 (s, 1H); 7,05 - 7,47 (m, 3H); 7,88 (s, 1H); 8,14 (s, 2H); 8,22 (d, 1H); 9,51 (d, 1H).
МС: 525 [M+1].
Пример 97
Получение тригидрохлорида (R)-N-пропил-N-[6-(2- фенилэтиламино)гексил] -6-гидрокси-7-метиламино-1,2,3,4- тетрагидро-2-нафтиламина (соединение 58)
Комплекс боран-диметилсульфид (0,11 г; 1,5 ммоля) медленно добавляли при перемешивании и при комнатной температуре в атмосфере азота к суспензии соединения 56 (0,2 г; 0,38 ммоля), полученного согласно примеру 96, в ТГФ (5 мл). По завершении добавления реакционную смесь кипятили с обратным холодильником в течение 3,5 ч. После охлаждения до 5oC добавляли раствор концентрированной HCl (60 мкл) в метаноле (0,6 мл). Реакционную смесь вновь кипятили с обратным холодильником в течение 1,5 ч, а затем концентрировали путем отгонки растворителей при атмосферном давлении и высушивали досуха при пониженном давлении. Остаток растворяли в метаноле (5 мл), растворитель отгоняли при пониженном давлении, добавляли метанол (5 мл) и растворитель вновь выпаривали досуха. Остаток очищали с помощью хроматографии (элюент CH2Cl2: CH3OH: 50%-ная HCOOH = 85:15:1) с получением продукта, который растворяли в абсолютном этаноле (5 мл). Добавляли раствор HCl в этиловом эфире (15% мас. /об. ) до получения выраженно кислого значения pH и растворители выпаривали при пониженном давлении, получая соединение 58 (0,13 г) в виде аморфного твердого вещества.
1H-ЯМР (200 МГц; D2O): δ (част./млн): 0,81 (t, 3H); 1,19-2,14 (m, 12H); 2,86 (s, 3H); 2,70-3,19 (m, 14H); 3,43-3,69 (m, 1H); 6,70 (s, 1H); 7,02 (s, 1H); 7,12-7,30 (m, 5H).
МС: 438 [M+1].
Пример 98
Оценка сродства по отношению к D1- и D2-рецепторам
Связывание с рецептором
Выделяли мозг у самцов крыс Sprague-Dawley (массой 200-250 г) и мембраны полосатой ткани подготавливали в соответствии с методом, описанным у Billard и др. , в Life Sciences, 35, 1885, (1984). Ткань гомогенизировали в 50 мМ Трис/HCl-буфере с pH 7,4 (1:100 масса/объем). Гомогенат центрифугировали и дебрис ресуспендировали, повторно центрифугировали и ресуспендировали вновь в 50 мМ Трис/HCl-буфере с pH 7,4, содержащем 120 мМ NaCl, 5 мМ KCl, 2 мМ CaCl2 и 1 мМ MgCl2.
Сродство по отношению к D1-рецептору и D2-рецептору оценивали с использованием в качестве меченых лигандов [3H]-SCH23390 [гидрохлорид R(+)-8-хлор-2,3,4,5-тетрагидро-3-метил-5-фенил-1H-3- бензазепин-7-ола] и [3H]-домперидона (The Merck Index, изд. XI, N 3412, стр. 537) соответственно.
В качестве контрольных соединений применяли дофамин, дофексамин и дигидрохлорид (S)-N-пропил-N-[6-[2-(2- метоксифенокси)этиламино]гексил]-5,6-дигидрокси-1,2,3,4- тетрагидро-2-нафтиламина (сравн. А), описанный в примере 6 международной заявки WO 93/19036.
Условия стандартной инкубации (объем 1000 мкл) для опыта, в котором использовали [3H]-SCH23390, были следующими: 50 мМ Трис/HCl-буфер (pH 7,4), 0,2 нМ [3H] -SCH23390, препарат мембраны, содержащий 130-140 мкг протеинов/мл.
Смесь инкубировали с различными концентрациями исследуемых соединений при 37oC в течение 20 минут, фильтровали в вакууме через фильтры типа Whatman GF/C и затем промывали 4 раза 5 мл охлажденного на льду 50 мМ Трис/HCl-буфера (pH 7,4).
Для изучения сродства по отношению к D2-рецептору [3H]-домперидон (0,3 нМ) инкубировали в объеме 1000 мкл, содержащем буфер и препарат мембраны, как описано выше. Кроме того, добавляли бычий сывороточный альбумин (БСА) (0,01%).
Для каждой концентрации испытываемых соединений смесь инкубировали при 37oC в течение 30 минут.
Полученные результаты, выраженные в виде K1 (нМ), для соединений 1-10, 13, 15-16, 24-25 и 34, сравн. А, дофамина и дофексамина представлены ниже в таблице 1.
Соединения, являющиеся предметом настоящего изобретения, проявляют высокое сродство к обоим подтипам рецептора, обладая существенно большим сродством по отношению как к D1-, так и к D2-рецептору, чем дофамин и дофексамин, и по крайней мере таким же сродством, которое сопоставимо с таковым для сравн. А.
Пример 99
Дофаминергические функциональные исследования на выделенных тканях
Оценка D1-подобной активности в опыте с использованием селезеночной артерии кролика (САК)
Артериальные кольца готовили в соответствии с методом Semeraro и др., Naunyn. Schmied. Arch. Pharmacol., 1990, 342, 539. Артериальные препараты сокращали с помощью U46619 (9,11-дидезокси- 11α,9α -эпоксиметанопростагландин F2α ) в субмаксимальной концентрации 0,1 мкМ.
Исследуемые соединения вводили кумулятивным образом.
В качестве контрольного вещества использовали сравн. А.
В таблице 2 приведены данные об агонистической активности, которую оценивали по максимальному эффекту и выражали в виде отношения эффективностей (EC50 сравн. А/EC50 исследуемого соединения).
Оценка D2-подобной активности в тесте с использованием ушной артерии кролика (УАК)
Артериальные кольца готовили в соответствии с методом, описанном у Steinsland и др., Science, 1978, 443, 199, модифицированным следующим образом. Самцов ново-зеландских кроликов массой 2,5-3 кг умерщвляли путем внутривенной инъекции избыточной дозы пентобарбитала натрия и обескровливали. Отрезали оба уха и центральную ушную артерию рассекали на кольца длиной 3 мм. Эти препараты погружали в ванну для органов объемом 25 мл, содержащую раствор Кребса (мМ/л): NaCl 118, KCl 4,7, CaCl2 2,5, MgSO4 1,2, NaHCO3 25, KH2PO4 1,2, глюкоза 11,1, уравновешенный 95% O2/5% CO2, и выдерживали при температуре 35±1oC. Раствор Кребса насыщали ЭДТК (10 мкм) с целью предотвратить окисление катехоламина и дезипрамином (0,1 мкм) и кортикостероном (30 мкм) с целью блокировать нейронное и экстранейронное поглощение катехоламина. Препараты стимулировали электрическим током (10 Гц, 1 мс, 40-80 мА, продолжительность 500 мс) с 5-минутными интервалами.
Исследуемые соединения вводили кумулятивным образом.
В качестве контрольного вещества использовали сравн. А.
В таблице 2 приведены данные об агонистической активности, которую оценивали по максимальному эффекту и выражали в виде отношения эффективностей (EC50 сравн. А/EC50 исследуемого соединения).
Приведенные данные свидетельствуют о том, что соединения формулы I, являющиеся предметом настоящего изобретения, обладают очень высокой дофаминергической активностью, которая для некоторых соединений превышает таковую для сравн. А приблизительно в 100 раз.
Пример 100
Гипертензивная активность in vivo
Использовали самцов крыс (Charles River) возрастом более 14 недель с самопроизвольной гипертензией. Катетеры вживляли в правую сонную артерию и в левую гиугулярную вену под анестезией барбитуратом. Животным давали возможность в течение ночи вернуться в нормальное состояние.
Исследуемые соединения вводили в левую гиугулярную вену путем быстрого внутривенного введения большого объема препарата. Контрольным животным вводили такой же объем носителя. Индуцируемую реакцию непрерывно регистрировали в течение 4 часов. Базовые уровни среднего кровяного давления (СКД) находились в диапазоне 190-200 мм рт.ст.
Данные об антигипертензивной активности соединения 22, выраженные в виде снижения СКД, по сравнению с антигипертензивной активностью сравн. А приведены в таблице 3.
Антигипертензивную активность оценивали также после орального введения крысам с самопроизвольной гипертензией.
Данные об антигипертензивной активности соединения 22, выраженной в виде снижения СКД, по сравнению с антигипертензивной активностью сравн. А приведены в таблице 4.
Для испытаний использовалась фармацевтическая композиция, которая представляет собой водный раствор тестируемого соединения 22, содержащий 0,1 мас.% Na2S2O5 в качестве оксиданта.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРОИЗВОДНЫЕ 2-АМИНО-1,2,3,4-ТЕТРАГИДРОНАФТАЛИНА ИЛИ ИХ ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫЕ СОЛИ И КОМПОЗИЦИЯ, ОБЛАДАЮЩАЯ КАРДИОВАСКУЛЯРНОЙ АКТИВНОСТЬЮ | 1993 |
|
RU2120435C1 |
| 9-О-ОКСИМОВЫЕ ПРОИЗВОДНЫЕ ЭРИТРОМИЦИНА А И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ | 1995 |
|
RU2152951C1 |
| ПРОИЗВОДНОЕ РЕЗОРЦИНА В КАЧЕСТВЕ ИНГИБИТОРА HSP90 | 2016 |
|
RU2697703C2 |
| 9А-АЗАЛИДЫ С ПРОТИВОВОСПАЛИТЕЛЬНОЙ АКТИВНОСТЬЮ | 2003 |
|
RU2320668C2 |
| ПРОИЗВОДНЫЕ МАННОЗЫ ДЛЯ ЛЕЧЕНИЯ БАКТЕРИАЛЬНЫХ ИНФЕКЦИЙ | 2014 |
|
RU2678327C2 |
| ИНГИБИТОРЫ КИНАЗЫ | 2013 |
|
RU2637944C2 |
| Производные тетрагидротриазолопиримидина в качестве ингибиторов нейтрофильной эластазы человека | 2012 |
|
RU2622643C2 |
| СПОСОБЫ ПОЛУЧЕНИЯ РАЦЕМИЧЕСКОГО АМИНОЗАМЕЩЕННОГО 5,6,7,8-ТЕТРАГИДРОХИНОЛИНА ИЛИ РАЦЕМИЧЕСКОГО АМИНОЗАМЕЩЕННОГО 5,6,7,8-ТЕТРАГИДРОИЗОХИНОЛИНА, СПОСОБЫ ИХ РАЗДЕЛЕНИЯ И РАЦЕМИЗАЦИИ, СПОСОБ ПОЛУЧЕНИЯ КЕТОЗАМЕЩЕННОГО 5,6,7,8-ТЕТРАГИДРОХИНОЛИНА ИЛИ КЕТОЗАМЕЩЕННОГО 5,6,7,8-ТЕТРАГИДРОИЗОХИНОЛИНА, СПОСОБ ПОЛУЧЕНИЯ ЭНАНТИОМЕРА КОНДЕНСИРОВАННОГО БИЦИКЛИЧЕСКОГО КОЛЬЦА, ЗАМЕЩЕННОГО ПЕРВИЧНЫМ АМИНОМ, ПРОИЗВОДНЫЕ 5,6,7,8-ТЕТРАГИДРОХИНОЛИНА | 2002 |
|
RU2308451C2 |
| ПРОИЗВОДНЫЕ МАННОЗЫ ДЛЯ ЛЕЧЕНИЯ БАКТЕРИАЛЬНЫХ ИНФЕКЦИЙ | 2013 |
|
RU2667060C2 |
| ЗАМЕЩЕННЫЙ 2-АМИНОПИРИДИН В КАЧЕСТВЕ ИНГИБИТОРА ПРОТЕИНКИНАЗЫ | 2014 |
|
RU2671212C2 |
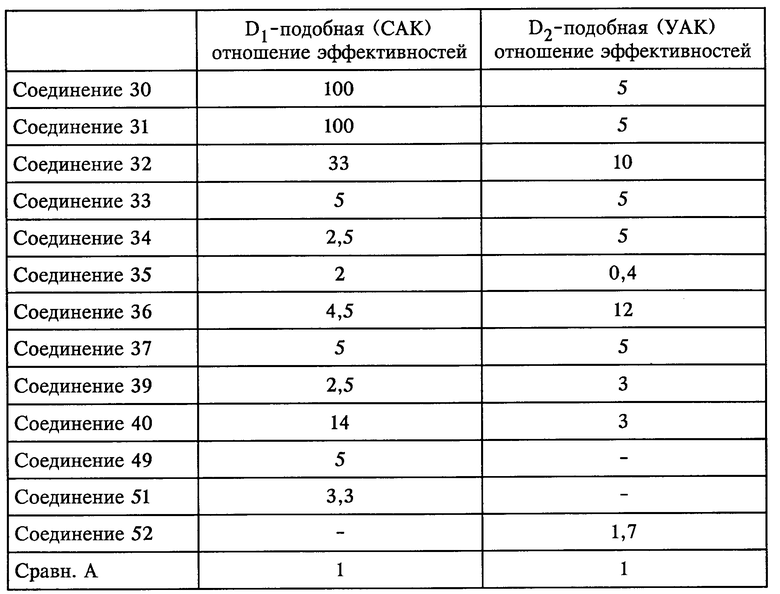

Описываются новые соединения, представляющие собой производные 2-амино-1,2,3,4-тетрагидронафталина формулы I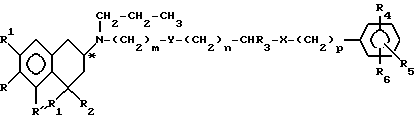
предназначенные для лечения артериальной гипертензии, миокардиальной недостаточности, почечной недостаточности, периферических артериопатий или цереброваскулярных недостаточностей. Данные соединения обладают высокой активностью и продолжительным действием, а также способностью абсорбироваться при оральном введении. 2 с. и 4 з.п.ф-лы, 4 табл.

где m представляет собой целое число, выбранное из 4, 5, 6, 7 и 8;
R, R' и R'' обозначают атомы водорода или OH-группы, при условии, что по крайней мере один из радикалов R, R' и R'' обозначает атом водорода, но все радикалы R, R' и R'' одновременно не обозначают атомы водорода и R' и R'' оба одновременно не обозначают OH-группы, или один из R' и R'' обозначает NHCHO, NHCH3 и NHSO2CH3, а другой обозначает водород;
R1 и R2 имеют одинаковые или различные значения и обозначают атомы водорода, C1-C3-алкильные группы;
n представляет собой целое число, выбранное из 0, 1, 2, 3 и 4;
p представляет собой целое число, выбранное из 0 и 1;
R3 обозначает атом водорода;
Y обозначает S, O, N(R7)CO, CO(R7)N или N(R7);
X обозначает N(R8), O, S, SO, SO2, CO или простую связь;
R4, R5 и R6 имеют одинаковые или различные значения и обозначают водород, OH, галоген, C1-C4-алкил, C1-C4-алкокси, нитро, NH2, C1-C4-алкилсульфонил, C1-C4-алкоксикарбонил, NHCHO, C1-C4-алкилкарбониламино, NHCONH2, C1-C4-алкилсульфониламино, SO2NH2, COOH,
SO3H, CONH2, CH2OH или фенил; или R5 и R6 в ортоположении один относительно другого вместе образуют насыщенную цепь из трех или четырех групп, выбранные из CR'''RIV, CO, S, O и NRV, где R''' обозначает атом водорода, RIV обозначает атом водорода или аминогруппу и RV обозначает атом водорода;
R7 обозначает атом водорода или C1-C4-алкильную группу;
R8 обозначает атом водорода или R7 и R8 вместе образуют -CH2-, либо цепь -CH2-CH2-;
или когда X обозначает O, то R4, когда он находится в ортоположении относительно X, может образовывать с R3 цепь -CH2-O-;
звездочка * обозначает асимметричный атом углерода;
при условии, что когда p = 1, X обозначает группу N(R8); и при условии, что, когда R и R' или R'' обозначают OH-группы, R1 и R2 обозначают атомы водорода и а) когда Y обозначает N(R7), R7 обозначает водород или алкил и R3 обозначает водород, то по крайней мере один из R4, R5 и R6 не обозначает водород, галоген, C1-C4-алкил и C1-C4-алкокси; б) когда Y обозначает N(R7), R7 обозначает водород или алкил, R3 обозначает водород и X обозначает простую связь, то по крайней мере один из R4, R5 и R6 не обозначает водород, галоген, NH2, C1-C4-алкил и C1-C4-алкокси и нитро; в) когда Y обозначает N(R7), R7 обозначает водород или алкил, n = 1, R3 обозначает водород и X обозначает простую связь, то по крайней мере один из R4, R5 и R6 не обозначает водород и OH-группу,
и его фармацевтически приемлемые соли и пролекарства.
| Способ получения производных 2-амино-1,2,3,4-тетрагидронафталина или их солей | 1977 |
|
SU927110A3 |
| Способ получения желатины | 1940 |
|
SU72061A1 |
| Домовый номерной фонарь, служащий одновременно для указания названия улицы и номера дома и для освещения прилежащего участка улицы | 1917 |
|
SU93A1 |
| ЭЛЕКТРОМАГНИТ | 0 |
|
SU321968A1 |
Авторы
Даты
2000-05-20—Публикация
1995-09-11—Подача