Изобретение относится к лактамам. Точнее, настоящее изобретение относится к азетидиналкиллактамным производным и к способам получения таких производных, к промежуточным соединениям, применяемым при получении таких производных, к композициям, содержащим такие производные, и их применению.
Азетидиналкиллактамные производные по настоящему изобретению являются антагонистами тахикининов, в том числе, NKA, NKB и вещества P, действуя на рецептор человеческого нейрокинина-1 (NK1), нейрокинина-2 (NK2) или нейрокинина-3 (NK3), или на их сочетание. Поэтому упомянутые производные являются пригодными для предупреждения или лечения воспалительных заболеваний, таких как артрит, псориаз, астма или воспалительные заболевания кишечника, расстройств центральной нервной системы (ЦНС), таких как страх, депрессия, деменция или психоз, желудочно-кишечных (GI) расстройств, таких как функциональная болезнь кишечника, синдром раздраженной толстой кишки, гастроэзофагеальный рефлюкс, недержание кала, колит или болезнь Крона, нарушений в мочеполовых путях, таких как недержание, гиперрефлексия или цистит, легочных нарушений, таких как хроническая обструкция дыхательных путей, аллергий, таких как экзема, контактный дерматит или ринит, аллергических болезней, таких как вызываемые сумахом, сосудопастических заболеваний, таких как стенокардия или болезнь Рейно, фиброзных или коллагеновых болезней, таких как склеродермия или эозинофильный фасциолез, симпатической дистрофии, такой как плечевой синдром, наркотических нарушений, таких как алкоголизм, связанных со стрессом соматических расстройств, периферийных невропатий, таких как диабетическая невропатия, невралгия, каузалгия, болезненная невропатия, ожоги, невралгия при опоясывающем лишае или после опоясывающего лишая, невропатологических нарушений, таких как болезнь Альцгеймера или рассеянный склероз, заболеваний, связанных с усилением или подавлением иммунитета, таких как системная красная волчанка, ревматических заболеваний, таких как фиброз, или рвоты, кашля, острой или хронической боли или мигрени.
Производные по настоящему изобретению являются особенно мощными и селективными антагонистами тахикининов, включая NKA, NKB и вещество P, действуя на человеческий NK2-рецептор. Они особенно пригодны для лечения или предупреждения воспалительных заболеваний, таких как артрит, псориаз, астма или воспалительные заболевания кишечника, нарушений центральной нервной системы (ЦНС), таких как страх, депрессия, деменция или психоз, желудочно-кишечных расстройств, таких как функциональная болезнь кишечника, синдром раздраженной толстой кишки, гастроэзофагеальный рефлюкс, недержание кала, колит или болезнь Крона, нарушений в мочеполовых путях, таких как недержание или цистит, легочных нарушений, таких как хроническая обструкция дыхательных путей, аллергий, таких как экзема, контактный дерматит или ринит, аллергических болезней, таких как вызываемые сумахом, периферийных невропатий, таких как диабетическая невропатия, невралгия, каузалгия, болезненная невропатия, ожоги, невралгия при опоясывающем лишае или после опоясывающего лишая, кашля или хронической боли.
Настоящее изобретение относится к соединениям общей формулы (I):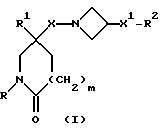
и их фармацевтически приемлемым солям, при этом в приведенной формуле
R представляет собой (C3-C7)-циклоалкил, арил или (C1-C6)-алкил, причем упомянутый (C1-C6)-алкил является, необязательно, замещенным фтором, -COOH, -COO((C1-C4)-алкилом), (C3-C7)-циклоалкилом, адамантилом, арилом или гет1(het1), и упомянутый (C3-C7)-циклоалкил, необязательно, замещен 1 или 2 заместителями, каждый из которых выбирается, независимо, среди (C1-C4)-алкила, (C3-C7)-циклоалкила, (C1-C4)-алкоксигруппы, гидроксильной группы, фтора, фтор(C1-C4)-алкила и фтор(C1-C4)-алкоксигруппы;
R1 представляет собой фенил, тиенил, бензотиенил или индолил, каждый из которых является, необязательно, замещенным 1 или 2 заместителями, каждый из которых выбирается, независимо, среди (C1-C4)-алкила, (C1-C4)-алкоксигруппы, галогена и трифторметила;
R2 представляет собой -CO2H, -CONR3R4, -CONR5((C3-C7)-циклоалкил), -NR5((C2-C5)-алканоил), -NR3R4, -NR5CONR5R6, ((C3-C7)-циклоалкил- (C1-C4)-алкил)R5N-, ((C3-C7)-циклоалкил- (C1-C4)-алкил)2N-, -NR5COCF3,
-NR5SO2CF3, -NR5(SO2(C1-C4)- алкил), -NR5SO2NR5R6, -NR5(SO2-арил), -N(арил)(SO2(C1-C4)- алкил), -OR5, -O((C3-C7)-циклоалкил), -SO2NR5R6, гет3(het3) или группу, изображаемую одной из формул: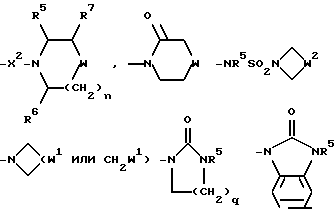
R3 и R4, каждый и независимо, выбираются среди H и (C1-C4)-алкила, необязательно замещенного гидроксильной группой, (C1-C4)-алкоксигруппой, -S(O)p((C1-C4)-алкилом), аминогруппой, -NH((C1-C4)-алкилом), -N((C1-C4)-алкил)2 или гет2(het2);
R5 и R6, каждый и независимо, выбираются среди H, (C1-C4)-алкила и (C3-C7)-циклоалкил- (C1-C4)-алкила, причем упомянутые (C1-C4)-алкил и (C3-C7)-циклоалкил- (C1-C4)-алкил замещены, необязательно, фтором;
R7 представляет собой H, (C1-C4)-алкил, гидроксильную группу, фтор (C1-C4)-алкил или фенил, причем упомянутый фенил, необязательно, замещен 1 или 2 заместителями, каждый из которых, независимо, выбирается среди (C1-C4)-алкила, фтор(C1-C4)-алкила, галогена, (C1-C4)-алкоксигруппы и фтор (C1-C4)-алкоксигруппы;
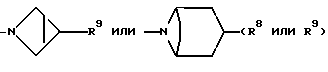
R8 представляет собой H, фтор, гидроксильную группу, (C1-C4)-алкоксигруппу, (C2-C5)-алканоил или (C2-C5)-алканоилоксигруппу; R9 представляет собой -NR5R6, -NR5COR, -NR5SO2CF3, -NR5(SO2(C1-C4)-алкил),
-NR5SO2NR5R6, NR5COO((C1-C4)-алкил), -NR5CONR5R6, -NR5-(SO2-морфолиногруппу), -NR5(SO2-арил), -N(арил)(SO2((C1-C4)-алкил) или группу формулы: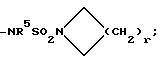
X представляет собой (C1-C4)-алкилен;
X1 представляет собой направленную связь или (C1-C6)-алкилен;
X2 представляет собой направленную связь, CO, SO2 или NR5CO;
W представляет собой метилен, CO, CH(OH), C(OH)2, CH((C1-C4)-алкоксигруппу), CHCO2H, CHCO2((C1-C4)-алкил), CHCONR5R6, CHF,
CF2, CH(азетидин-1-ил), CH(пирролидин-1-ил), CH-(морфолиногруппу), CH(бензоксазол-2-ил), CHR9, O, S(O)p, NR5, N((C3-C7)-циклоалкил, NSO2((C1-C4)-алкил), NSO2((C1-C4)-алкил), NSO2NR5R6, NSO2CF3, NSO2(морфолиногруппу), NSO2-арил, CH(пиперидин-1-ил),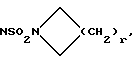
NCONR5R6, NCOR5, NCO(арил) или NCO2((C1-C4)-алкил);
W1 представляет собой метилен, CO, CH(OH), C(OH)2, CH((C1-C4)-алкоксигруппу), CHCO2H, CHCO2((C1-C4)-алкил), CHCONR5R6, CHF,
CF2, CH(азетидин-1-ил), CH(пирролидин-1-ил), CH(пиперидин-1-ил), CH(морфолиногруппу) или CHR9;
W2 представляет собой W1, -CH2W1-, -CH2WCH2- или - CH2CH2WCH2-;
m = 0, 1 или 2;
n = 1 или 2, когда W является иным, чем метилен, и n = 0, 1 или 2, когда W - метилен;
p = 0, 1 или 2;
q = 1 или 2;
r = 1, 2, 3 или 4;
термин "арил", использованный при определении R, R2, R9 и W, означает нафтил или фенил, каждый из которых, необязательно, замещен (C1-C4)-алкилом, галогеном, -OR5 фтор(C1-C4)-алкилом, (C2-C5)-алканоилом, -CONR5R6, -SO2CONR5R6 или фенилом;
термин "гет1", использованный при определении R, означает тиенил или 5- или 6-членную циклическую гетероарильную группу, содержащую 1, либо 2 гетероатома азота, или один гетероатом азота и один гетероатом кислорода или серы, и каждый, необязательно, замещен 1 или 2 заместителями, каждый из которых, независимо, выбирается среди (C1-C4)-алкила, (C1-C4)-алкоксигруппы, галогена, фтор(C1-C4)-алкила и фтор-(C1-C4)-алкоксигруппы;
термин "гет2", использованный при определении R3 и R4, означает 4-7-членную кольцевую неароматическую гетероциклическую группу, содержащую 1 или 2 гетероатома, каждый из которых, независимо, выбирается среди атомов азота, кислорода и S(O)p, причем упомянутая группа, необязательно, является C-замещенной 1 или 2 заместителями, каждый из которых, независимо, выбирается среди (C1-C4)-алкила, (C1-C4)-алкоксигруппы и фтор(C1-C4)-алкила, и причем упомянутый кольцевой гетероатом азота, необязательно, несет, в качестве заместителя, H, (C1-C4)-алкил, (C2-C5)-алканоил, -CON-R5R6 или SO2NR5R6; и термин "гет3", использованный при определении R2, означает необязательно сконденсированную с бензольным кольцом, N-присоединенную 5-членную циклическую гетероарильную группу, содержащую от 1 до 4 гетероатомов азота, необязательно замещенную, в том числе, в бензольной части, 1 или 2 заместителями, каждый из которых, независимо, выбирается среди (C1-C4)-алкила, фтора и фтор (C1-C4)-алкила.
В приведенных выше определениях термин "галоген" означает фтор, хлор, бром или иод, и алкильные, алкиленовые и алкоксильные группы, содержащие три или большее число атомов углерода, и алканоильные группы, содержащие четыре или большее число атомов углерода, могут быть линейными или разветвленными.
Предпочтительно, R представляет собой (C1-C6)-алкил, необязательно замещенный -COOH, -COO((C1-C4)-алкилом), (C3-C7)-циклоалкилом, арилом или гет1, причем упомянутый циклоалкил, необязательно, замещен 1 или 2 заместителями, каждый из которых, независимо, выбирается среди (C1-C4)-алкила и фтора.
Предпочтительнее, R представляет собой (C1-C6)-алкил, необязательно замещенный -COOH, -COO((C1-C4)-алкилом), (C3-C7)-циклоалкилом, необязательно замещенным 1 или 2 заместителями, каждый из которых, независимо, выбирается среди (C1-C4)-алкила и фтора, фенилом, необязательно замещенным 1 или 2 заместителями, каждый из которых, независимо, выбирается среди (C1-C4)-алкила, галогена, (C1-C4)-алкоксигруппы, фтор(C1-C4)-алкила, (C2-C5)-алканоила, SO2N((C1-C4)-алкил)2 и фенила, или 5- или 6-членной циклической гетероарильной группой, содержащей 1 или 2 гетероатома азота.
Еще предпочтительнее, R представляет собой (C1-C6)-алкил, необязательно замещенный -COOH, -COO((C1-C4)-алкилом), (C3-C7)-циклоалкилом, необязательно замещенным 1 или 2 заместителями, каждый из которых, независимо, выбирается среди метила и фтора, фенилом, необязательно замещенным 1 или 2 заместителями, каждый из которых, независимо, выбирается среди метила, фтора, хлора, метоксигруппы, трифторметила, ацетила, -SO2N((CH3)2 и фенила, или пиридинилом.
И еще предпочтительнее, R представляет собой 5-карбоксипентил, 5-трет-бутилоксикарбонилпентил, циклопропилметил, дициклопропилметил, циклобутилметил, циклопентилметил, циклогексилметил, 2-метилциклогексилметил, 4,4-дифторциклогексилметил, 2-циклопропилэтил, 2,2-дициклопропилэтил, 1-циклогексилэтил, 2-циклогексилэтил, циклогептилметил, бензил, 2-метилбензил, 3-метилбензил, 4-метилбензил, 4-фторбензил, 2,4-дихлорбензил, 3-метоксибензил, 2-трифторметилбензил, 3,5-ди(трифторметил)бензил, 3-ацетилбензил, 3-(N,N-диметилсульфамоил)бензил, 4-фенилбензил, 1-фенилэтил, 2-пиридинилметил, 3-пиридинилметил или 4-пиридинилметил.
Наиболее предпочтительно, R представляет собой циклопропилметил, дициклопропилметил, 2-циклопропилэтил, 2,2-дициклопропилэтил, циклогексилметил, 4,4-дифторциклогексилметил, циклогептилметил или бензил.
Предпочтительно, R1 представляет собой фенил, необязательно замещенный 1 или 2 галогеновыми заместителями.
Предпочтительнее, R1 представляет собой фенил, необязательно замещенный 1 или 2 заместителями, каждый из которых, независимо, выбирается среди фтора и хлора.
Еще предпочтительнее, R1 представляет собой фенил, 3,4-дифторфенил, 3-хлорфенил, 4-хлорфенил или 3,4-дихлорфенил.
Наиболее предпочтительно, R1 представляет собой 3,4-дифторфенил, 4-хлорфенил или 3,4-дихлорфенил.
Предпочтительно, R2 представляет собой -CONR3R4, -CONR5(C3-C7)-циклоалкил), -NR3R4, гет3 или группу формулы: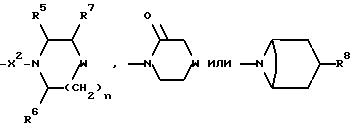
где R3 и R4, каждый и независимо, выбираются среди (C1-C4)-алкила и (C1-C4)-алкила, замещенного гидроксильной группой или (C1-C4)-алкоксигруппой, и R5 и R6, каждый и независимо, выбираются среди H, (C1-C4)-алкила, необязательно замещенного фтором, и (C3-C7)-циклоалкил-(C1-C4)-алкила, R7 представляет собой H, гидроксильную группу или фенил, R8 представляет собой гидроксильную группу или (C2-C5)-алканиолоксигруппу, W представляет собой метилен, CH(OH), CH((C1-C4)-алкоксигруппу), CHCO2H, CHCO2((C1-C4)-алкил), CH(бензоксазол-2-ил), CHNR5R6, CHNR5COR5, CHNR5(SO2(C1-C4)-алкил), CHNR5COO((C1-C4)-алкил), O, S(O)p, NR5, NSO2 ((C1-C4)-алкил), NSO2NR5R6, NSO2(морфолиногруппу), NCONR5R6, NCOR5, NCO(арил) или NCO2((C1-C4)-алкил), n = 1 или 2, когда W является иным, чем метилен, и n = 0 или 1, когда W - метилен, и p = 0, 1 или 2.
Предпочтительнее, R2 представляет собой -CONR3R4, -CONR5((C3-C7)-циклоалкил), -NR3R4, N-присоединенную 5-членную циклическую гетероарильную группу, содержащую 1 или 2 гетероатома азота, группу формулы: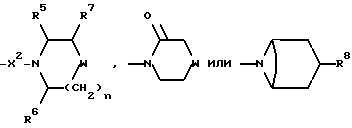
где R3 и R4, каждый и независимо, выбираются среди метила и (C1-C4)-алкила, замещенного гидроксильной группой или метоксигруппой, R5 и R6, каждый и независимо, выбираются среди H, метила, трифторметила и циклопропилметила, R7 представляет собой H, гидроксильную группу или фенил, R8 представляет собой гидроксильную группу или ацетилоксигруппу, W представляет собой метилен, CH(OH), CHOCH3, CHOCH2CH3, CHO(CH2)2CH3, CHOC(CH3)3, CHCO2H, CHCO2CH3, CHCO2CH2CH3, CH(бензоксазол-2-ил), CHNH2, NCOCH3, CHNHCH2(циклопропил), CHNHCOCH3, CHNHSO2CH3, CHNHCO2C(CH3)3, O, S(O)p, NH, NCH3, NCH2(циклопропил), NSO2CH3, NSO2NH2, NSO2NHCH3, NSO2N(CH3)2, NSO2-(морфолиногруппу), NCONH2, NCONHCH3, NCOCF3, NCO(фенил) или NCO2C(CH3)3, n = 1 или 2, когда W является иным, чем метилен, n = 0 или 1, когда W - метилен, и p = 0, 1 или 2.
Еще предпочтительнее, когда R2 представляет собой N-(2-метоксиэтил)-N-метилкарбамоил, N-циклогексилкарбамоил, N-(2-гидроксиэтил)-N-метиламиногруппу, N-(2-гидрокси-2-метилпропил)-N-метиламиногруппу, N-(2-метоксиэтил)-N-метиламиногруппу, имидазол-1-ил, 3-гидроксипирролидин-1-ил, пиперидин-1-ил, 2,6-диметилпиперидин-1-ил, 3-гидроксипиперидин-1-ил, 4-гидроксипиперидин-1-ил, 4-метоксипиперидин-1-ил, 4-этоксипиперидин-1-ил, 4-(н-пропокси)-пиперидин-1-ил, 4-(трет-бутокси)-пиперидин-1-ил, 4-карбоксипиперидин-1-ил, 4-метоксикарбонилпиперидин-1-ил, 4-этоксикарбонилпиперидин-1-ил, 4-(бензоксазол-2-ил)пиперидин-1-ил, 4-аминопиперидин-1-ил, 4-циклопропилметиламинопиперидин-1-ил, 4-ацетоамидопиперидин-1-ил, 4-метансульфонамидопиперидин-1-ил, 4-(трет-бутоксикарбониламино)пиперидин-1-ил, морфолиногруппу, 2-фенилморфолиногруппу, гомоморфолиногруппу, тиоморфолиногруппу, 1-оксотиоморфолиногруппу, 1,1-диоксотиоморфолиногруппу, пиперазин-1-ил, 4-метилпиперазин-1-ил, 4-циклопропилметилпиперазин-1-ил, 4-метансульфонилпиперазин-1-ил, 4-аминосульфонилпиперазин-1-ил, 4-метиламиносульфонилпиперазин-1-ил, 4-диметиламиносульфонилпиперазин-1-ил, 4-морфолиносульфонилпиперазин-1-ил, 4-карбамоилпиперазин-1-ил, 4-N-метилкарбамоилпиперазин-1-ил, 4-ацетилпиперазин-1-ил, 4-трифторацетилпиперазин-1-ил, 4-бензоилпиперазин-1-ил, 4-(трет. бутоксикарбонил)пиперазин-1-ил, пирролидин-1-илкарбонил, пиперидин-1-илкарбонил, 3-оксоморфолиногруппу, 3-гидрокси-8-азабицикло-[3,2,1]окт-8-ил или 3-ацетилокси-8-азабицикло[3,2,1]окт-8-ил.
Наиболее предпочтительно, когда R2 представляет собой 4-аминопиперидин-1-ил, 4-карбоксипиперидин-1-ил, 4-гидроксипиперидин-1-ил, морфолиногруппу, 1-оксотиоморфолиногруппу, 4-аминосульфонилпиперазин-1-ил, 4-метансульфонилпиперазин-1-ил, 4-метиламиносульфонилпиперазин-1-ил или 4-морфолиносульфонилпиперазин-1-ил.
Другие предпочтительные примеры R2 включают 4-фторпиперидин-1-ил, 4,4-дифторпиперидин-1-ил, 4-оксопиперидин-1-ил, 4-(пентафторфенилсульфонил)пиперазин-1-ил и 4-(4-фторфенилсульфонил)-пиперазин-1-ил.
X, предпочтительно, представляет собой этилен или пропилен.
Наиболее предпочтительно, когда X представляет собой этилен.
X1, предпочтительно, представляет собой направленную связь.
X2 предпочтительно представляет собой направленную связь или CO.
Наиболее предпочтительно, когда X2 представляет собой направленную связь.
Предпочтительно, когда m = 1.
Фармацевтически приемлемые соли соединений формулы (I) включают их соли присоединения кислот и оснований.
Подходящие соли присоединения кислот образуются с кислотами, которые образуют нетоксичные соли, и примерами таких солей являются гидрохлориды, гидробромиды, гидройодиды, сульфаты, гидросульфаты, нитраты, фосфаты, гидрофосфаты, ацетаты, малеаты, фумараты, лактаты, тартраты, цитраты, глюконаты, сукцинаты, бензоаты, метансульфонаты, бензолсульфонаты и п-толуолсульфонаты.
Подходящие соли оснований образуются с основаниями, которые образуют нетоксичные соли, и примерами таких солей являются алюминиевые, кальциевые, литиевые, магниевые, калиевые, натриевые, цинковые соли и соли диэтаноламина.
Обзор подходящих солей см. в Berge et al. J. Pharm. Sci., 66, 1-19 (1977).
Соединение формулы (I) может содержать один или несколько асимметричных атомов углерода и может, следовательно, существовать в двух или большем числе стереоизомерных форм. Настоящее изобретение включает отдельные стереоизомеры соединений формулы (I) и их смеси.
Разделение диастереоизомеров может быть осуществлено обычными способами, например, фракционной кристаллизацией, хроматографией или ВЭЖХ смеси стереоизомеров соединения формулы (I) или его подходящей соли или его производного. Отдельный энантиомер соединения формулы (I) также может быть получен из соответствующего оптически чистого промежуточного соединения или посредством расщепления, такого как с помощью ВЭЖХ, соответствующего рацемата, с использованием подходящих оптически активных кислоты или основания.
Предпочтительные соединения формулы (I) и их соли, в которых X представляет собой -CH2CH2-, обладают (S)-стереохимией в положении присоединения групп X и R1 к лактамному кольцу.
Предпочтительными примерами соединения формулы (I) являются соединения, в которых
(I) R представляет собой циклопропилметил, R1 представляет собой 3,4-дихлорфенил, R2 представляет собой морфолиногруппу, X представляет собой -CH2CH2-, X1 представляет собой направленную связь, и m = 1;
(II) R представляет собой 4,4-дифторциклогексилметил, R1 представляет собой 3,4-дихлорфенил, R2 представляет собой морфолиногруппу, X представляет собой -CH2CH2-, X1 представляет собой направленную связь, и m = 1;
(III) R представляет собой 4,4-дифторциклогексилметил, R1 представляет собой 3,4-дихлорфенил, R2 представляет собой 4-аминопиперидин-1-ил, X представляет собой -CH2CH2-, X1 представляет собой направленную связь, и m = 1;
(IV) R представляет собой циклопропилметил, R1 представляет собой 3,4-дихлорфенил, R2 представляет собой 4-аминосульфонилпиперазин-1-ил, X представляет собой -CH2CH2-, X1 представляет собой направленную связь, и m = 1;
(V) R представляет собой 4,4-дифторциклогексилметил, R1 представляет собой 3,4-дихлорфенил, R2 представляет собой 4-гидроксипиперидин-1-ил, X представляет собой -CH2CH2-, X1 представляет собой направленную связь, и m = 1;
(VI) R представляет собой 2-циклопропилэтил, R1 представляет собой 3,4-дихлорфенил, R2 представляет собой морфолиногруппу, X представляет собой -CH2CH2-, X1 представляет собой направленную связь, и m = 1;
(VII) R представляет собой 2-циклопропилэтил, R1 представляет собой 3,4-дихлорфенил, R2 представляет собой 4-метансульфонилпиперазин-1-ил, X представляет собой -CH2CH2-, X1 представляет собой направленную связь, и m = 1;
(VIII) R представляет собой циклопропилметил, R1 представляет собой 3,4-дихлорфенил, R2 представляет собой 4-фторпиперидин-1-ил, X представляет собой -CH2CH2-, X1 представляет собой направленную связь, и m = 1;
(IX) R представляет собой 4,4-дифторциклогексилметил, R1 представляет собой 3,4-дихлорфенил, R2 представляет собой 4-оксопиперидин-1-ил, X представляет собой -CH2CH2-, X1 представляет собой направленную связь, и m = 1;
(X) R представляет собой циклопропилметил, R1 представляет собой 3,4-дихлорфенил, R2 представляет собой 4-карбоксипиперидин-1-ил, X представляет собой -CH2CH2-, X1 представляет собой направленную связь, и m = 1; или
(XI) R представляет собой циклогексилметил, R1 представляет собой 3,4-дихлорфенил, R2 представляет собой 4-карбоксипиперидин-1-ил, X представляет собой -CH2CH2-, X1 представляет собой направленную связь, и m = 1;
или любое такое соединение с (S)-стереохимией в положении присоединения групп X и R1 к лактамному кольцу, или любая их фармацевтически приемлемая соль.
Соединения формулы (I) по настоящему изобретению могут быть получены способами, перечисленными далее.
1) Соединения формулы (I), в которых X представляет собой ((C0-C3)-алкилен)CH2-, метиленовая группа которых связана с атомом азота азетидина, и R, R1, R2, X1 и m имеют значения, установленные ранее для соединения формулы (I), могут быть получены гидроаминированием при использовании в качестве исходных соединений соединения формулы (II):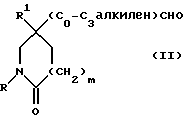
где R, R1, и m имеют значения, установленные ранее для соединения формулы (I), и соединения формулы: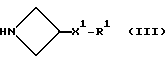
или его соли присоединения кислоты, в которых R2 и X1 имеют значения, установленные ранее для соединения формулы (I). Реакцию осуществляют, предпочтительно, в присутствии подходящей кислоты, например уксусной кислоты.
Реакция протекает через образование, сначала, промежуточной соли иминия формулы (IIIA):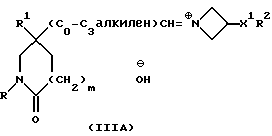
которая может быть устойчивой и которую можно выделить. Реакцию осуществляют, предпочтительно, без выделения промежуточного соединения формулы (IIIA), и в этом случае это соединение восстанавливается in situ и дает соединение формулы (I).
При типичной процедуре альдегид формулы (II) сначала вводят во взаимодействие с азетидином формулы (III) в подходящем растворителе, например, в тетрагидрофуране, и смесь затем обрабатывают подходящим восстановителем, например, триацетоксиборогидридом натрия или цианоборогидридом натрия, в присутствии подходящей кислоты, например уксусной кислоты, и получают требуемый продукт. Если в качестве исходного вещества используют соль присоединения кислоты азетидина формулы (III), перед добавлением восстановителя можно добавить подходящий акцептор кислоты, например, триэтиламин.
Реакцию осуществляют, как правило, при комнатной температуре.
Исходные альдегиды формулы (II) могут быть получены по способу, показанному на схеме I.
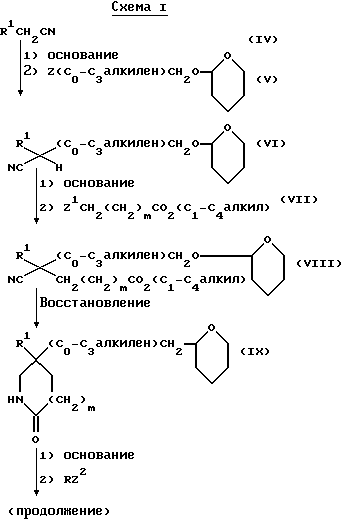
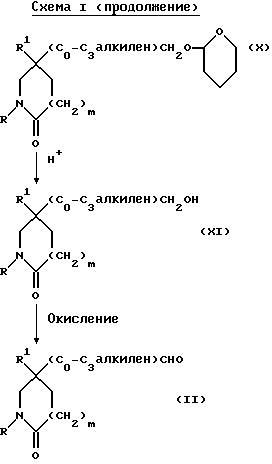
Здесь в формулах R, R1 и m имеют значения, установленные ранее для соединения формулы (I), и Z, Z1 и Z2 каждый и независимо, представляют собой подходящие отщепляющиеся группы, например, хлор-, бром-, I-, метансульфонилокси-, п-толуолсульфонилокси- или трифторметилсульфонилоксигруппу.
При типичной процедуре арилметилнитрил формулы (IV) сначала депротонируют, используя подходящее основание, например, гидрид натрия, и затем алкилируют in situ алкилирующим агентом формулы (V), в которой Z представляет собой бром. Реакцию осуществляют, как правило, в подходящем растворителе, например, в тетрагидрофуране, при температуре около 0oC для депротонирования, и при комнатной температуре для алкилирования. Реакцию также можно осуществить в условиях фазового переноса, используя подходящее основание, например, гидрооксид натрия, подходящий катализатор фазового переноса, например, хлорид тетра-н-бутиламмония, и подходящий растворитель, например, циклогексан, н-пентан или толуол.
Ацетонитрильное производное формулы (VI), которое получают, затем сначала депротонируют, используя подходящее основание, например, диизопропиламид лития, а затем алкилируют in situ соединением формулы (VII), где Z1 представляет собой, предпочтительно, бром. Реакцию осуществляют, как правило, в подходящем растворителе, например, в тетрагидрофуране, при -70oC, нагревая реакционную смесь до комнатной температуры, чтобы завершить реакцию. После добавления соединения формулы (VII) к реакционной смеси можно добавить, для увеличения скорости реакции, иодид тетра-н-бутил-аммония.
Полученное соединение формулы (VIII) затем восстанавливают и при подходящих условиях циклизуют в лактам формулы (IX), используя, например, никель Ренея, в атмосфере водорода, при атмосферном давлении и комнатной температуре, используя в качестве растворителя аммиачный этанол.
Затем лактам формулы (IX) сначала депротонируют, используя подходящее основание, например, гидрид натрия, и затем алкилируют in situ соединением формулы RZ2, где Z2 представляет собой, предпочтительно, бром, метансульфонилоксигруппу или п-толуолсульфонилоксигруппу. Реакцию осуществляют, как правило, в подходящем растворителе, например, в диметилформамиде, и при комнатной температуре.
Полученный лактам формулы (X) затем обрабатывают насыщенным раствором хлористого водорода в подходящем (C1-C4)-спирте, например, в метаноле, при комнатной температуре, для удаления тетрагидропирановой защитной группы. Отщепление защитной группы можно также осуществить, используя подходящую ионообменную смолу, например, Amberlyst 15 (торговая марка), и в подходящем растворителе, например, в метаноле.
Полученный спирт формулы (XI) при подходящих условиях окисляют до альдегида формулы (II), например, при условиях окисления по Swern (оксалилхлорид, диметилсульфоксид, триэтиламин, и применение в качестве растворителя дихлорметана).
Исходные азетидины формулы (III) могут быть получены обычными способами.
2) Соединения формулы (I), в которых X, X1, R, R1, R2 и m имеют значения, установленные ранее для соединения формулы (I), за исключением тех соединений, в которых R представляет собой трифторметил, -CF2((C1-C5)-алкил, необязательно замещенный фтором) или арил, могут быть получены алкилированием N-депротонированного соединения формулы (XII):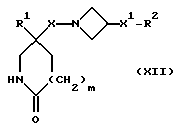
в которой X, X1, R1, R2 и m имеют значения, установленные ранее для соединения формулы (I), соединением формулы RZ2, где R имеет значения, установленные ранее при описании этого способа, и Z2 представляет собой подходящую отщепляющуюся группу, например, хлор-, бром-, иод-, метансульфонилокси-, п-толуолсульфонилокси- или трифторметилсульфонилоксигруппу.
При типичной процедуре соединение формулы (XII) сначала депротонируют подходящим основанием, например, гидридом натрия, и затем алкилируют in situ соединением формулы: RZ2, где Z2 представляет собой, предпочтительно, хлор, бром или метансульфонилоксигруппу. Реакцию осуществляют, как правило, в подходящем растворителе, например, в диметилформамиде, при температуре от комнатной до 50oC.
Альтернативно, реакцию можно осуществить путем взаимодействия исходных веществ формул (XII) и RZ2, вместе, в присутствии подходящего основания, например, гидроксида калия, и в подходящем растворителе, например, в диметилсульфоксиде, при комнатной температуре. Если используют соединение формулы; RZ2, в котором Z2 представляет собой хлор, для увеличения скорости реакции можно также добавить иодид калия.
Исходные вещества формулы (XII) могут быть получены обычными способами, приспособив, например, препаративный способ, описанный в способе (1) и на схеме I (т. е. , опустив стадию N-алкилирования для образования соединений формулы (X)).
Исходные соединения формулы: RZ2, могут быть получены обычными способами.
3) Все соединения формулы (I), в которых X, X1, R, R1, R2 и m имеют значения, установленные ранее для соединения формулы (I), могут быть получены путем взаимодействия соединения формулы (XIII):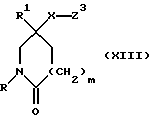
в которой X, R, R1 и m имеют значения, установленные ранее для соединения формулы (I), и Z3 представляет собой подходящую отщепляющуюся группу, например, хлор-, бром-, иод-, метансульфонилокси-, трифторметансульфонилокси- или п-толуолсульфонилоксигруппу, с соединением формулы: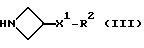
где R2 имеет значения, установленные ранее для соединения формулы (I).
При типичной процедуре соединение формулы (XIII), в котором Z3 представляет собой, предпочтительно, метансульфонилоксигруппу, вводят во взаимодействие с соединением формулы (III) в присутствии подходящего акцептора кислоты, например, триэтиламина или карбоната калия или их сочетания, в подходящем растворителе, например, в ацетонитриле, и при температуре вблизи его температуры кипения с обратным холодильником.
Соединение формулы (III) может быть получено in situ из его соли присоединения кислоты при использовании молярного избытка акцептора кислоты.
Исходные вещества формулы (XIII) могут быть получены обычными способами, такими как трансформация функциональной гидроксильной группы спиртов формулы (XI), например, когда Z3 представляет собой метансульфонилоксигруппу, путем взаимодействия спирта формулы (XI) с метансульфонилхлоридом в присутствии подходящего акцептора кислоты, такого как триэтиламин.
4) Соединения формулы (I), в которых R1 представляет собой фенил, и X, X1, R, R2 и m имеют значения, установленные ранее для соединения формулы (I), могут быть получены гидрогенолизом соединений формулы (I), в которых R1 представляет собой фенил, замещенный хлором, бромом или иодом, и X, X1, R, R2 и m имеют значения, установленные ранее для соединения формулы (I).
При типичной процедуре гидрогенолиз осуществляют в аммиачном этаноле, используя подходящий катализатор, например, никель Ренея, или, предпочтительно, палладий-на-угле, при 50oC, и в атмосфере водорода при давлении 345 кПа (50 ф/д2).
5) Соединения формулы (I), в которых R2 представляет собой группу формулы: -NHR4, ((C3-C7)-циклоалкил- (C1-C4)-алкил)NH-,
R9 представляет собой -NHR5, W представляет собой NH или CHNHR5, W1 представляет собой CHNHR5, W2 представляет собой W1, -CH2W1-, -CH2WCH2- или -CH2CH2WCH2-, и X, X1, X2, R, R1, R5 R6, R7, m и n имеют значения, установленные ранее для соединения формулы (I), могут быть получены отщеплением защитной группы от соединения формулы: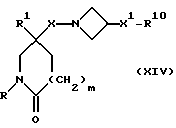
гдеR10представляетсобойгруппуформулы:-NZ4R4,((C3-C7)-циклоалкил-(C1-C4)-алкил)Z4N-,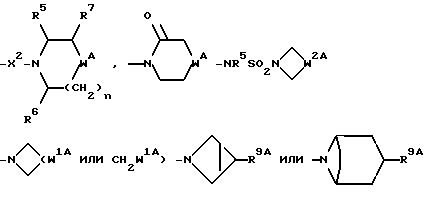
соответственно, R9A представляет собой -NZ4R5, WA представляет собой NZ4 или CHNZ4R5, W1A представляет собой CHNZ4R5, W2A представляет собой W1A, -CH2W1A-, -CH2WACH2- или -CH2CH2WACH2-, X, X1, X2, R, R1, R4, R5, R6, R7, m и n имеют значения, установленные ранее для соединения формулы (I), и Z4 представляет собой подходящую защитную группу, например, трет-бутоксикарбонил (например, соединения формулы (I), в котором W представляет собой NCO2C-(CH3)3, или R9 представляет собой -NR5CO2C(CH3)3), или бензилоксикарбонил.
Подходящие защитные группы, которые могут использоваться при этом способе, как и способы отщепления защитной группы, хорошо известны специалистам в этой области техники, см., например, Greene et al., "Protective Groups in Organic Synthesis", Second Edition, 1991, Wiley-Interscience.
При типичной процедуре, когда Z4 представляет собой третбутокси-карбонил, отщепление защитной группы может быть осуществлено с использованием трифторуксусной кислоты в подходящем растворителе, например, в дихлорметане, при комнатной температуре.
Исходные вещества формулы (XIV) могут быть получены обычными способами, такие как описанные здесь способы получения соединений формулы (I), с соответствующей адаптацией.
6) Соединения формулы (I), в которых R2 представляет собой группу формулы: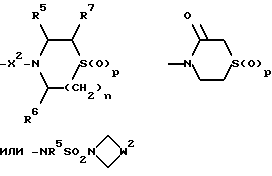
где p = 1 или 2, W2 представляет собой -CH2S(O)pCH2- или -CH2CH2S(O)pCH2-, и X, X1, X2, R, R1, R5, R6, R7, m и n имеют значения, установленные для соединения формулы (I), могут быть получены окислением соответствующего соединения формулы (I), в котором R2 представляет собой группу формулы: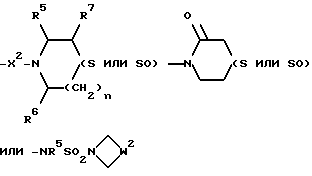
в котором W2 представляет собой -CH2(S или SO)CH2- или -CH2CH2(S или SO)CH2-, и X, X1, X2, R, R1, R5, R6, R7, m и n имеют значения, установленные ранее для соединения формулы (I). Окисление осуществляют по крайней мере одним молярным эквивалентом подходящего окислителя, когда сульфоксид превращают в сульфон, по крайней мере двумя молярными эквивалентами подходящего окислителя, когда сульфид превращают в сульфон, и, по существу, одним молярным эквивалентом подходящего окислителя при превращении сульфида в сульфоксид.
Подходящими для этой цели окислителями и условиями окисления являются водный раствор пероксида водорода в щелочной среде (например, ацетонитрил, в присутствии карбоната калия, и использование в качестве растворителя метанола) или м-хлорпербензойная кислота в подходящем растворителе, например, в дихлорметане.
7) Соединения формулы (I), в которых R2 представляет собой группу формулы: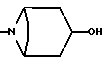
и X, X1, R, R1 и m имеют значения, установленные ранее для соединения формулы (I), могут быть получены путем отщепления защитной группы от соединения формулы (XV):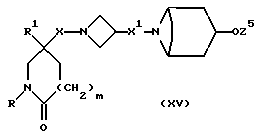
где Z5 представляет собой подходящую защитную группу, например, ацетил (т. е. , соединение формулы (I), в котором R8 представляет собой ацетилоксигруппу) или тетрагидропиран-2-ил, и X, X1, R, R1 и m имеют значения, установленные ранее для соединения формулы (I).
Подходящие защитные группы, которые могут использоваться для этого способа, как и способы отщепления защитной группы, хорошо известны специалистам в этой области техники, см., например, Greene et al., "Protective Groups in Organic Synthesis", Second Edition, 1991, Wiley-Interscience.
При типичной процедуре, когда Z5 представляет собой ацетил, отщепление защитной группы может быть осуществлено с использованием водноспиртового раствора подходящего сильного основания, например, гидроксида натрия. Реакцию осуществляют, как правило, в водном метаноле при комнатной температуре.
Исходные вещества формулы (XV) могут быть получены обычными способами, такими, как описанные здесь способы получения соединений формулы (I), с соответствующей адаптацией.
8) Соединения формулы (I), в которых X, X1, R, R1, R2 и m имеют значения, установленные ранее для соединения формулы (I), за исключением соединений, в которых R2 представляет собой -CO2H, R представляет собой (C1-C6)-алкил, замещенный -COOH, W представляет собой CHCO2H, или W1 представляет собой CHCO2H, могут быть получены внутримолекулярной дегидратацией соединения формулы (XVI):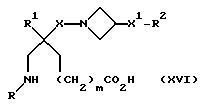
где X, X1, R, R1, R2 и m имеют значения, установленные ранее для этого способа.
При типичной процедуре дегидратацию осуществляют при условиях по Дину-Старку, в подходящем растворителе, например, в толуоле, и в присутствии подходящей кислоты, например, п-толуолсульфоновой кислоты. Альтернативно, дегидратацию можно осуществить путем перемешивания раствора соединения формулы (XIV) в подходящем растворителе, например, в дихлорметане, в присутствии силикагеля.
Исходные вещества формулы (XVI) могут быть получены обычными способами.
9) Соединения формулы (I), в которых X, X1, R, R1, R2 и m имеют значения, установленные ранее для соединения формулы (I), за исключением соединений, в которых R2 представляет собой -CO2H, R представляет собой (C1-C6)-алкил, замещенный -COOH, W представляет собой CHCO2H, или W1 представляет собой CHCO2H, могут быть получены путем циклизации соединения формулы (XVII):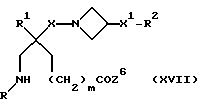
где X, X1, R, R1, R2 и m имеют значения, установленные ранее для этого способа, и Z6 представляет собой подходящую отщепляющуюся группу, например, (C1-C4)-алкоксигруппу, бензилоксигруппу, имидазол-1-ил или бензотриазол-1-илоксигруппу.
При типичных процедурах,
(I) когда Z6 представляет собой (C1-C4)-алкоксигруппу или бензилоксигруппу, раствор соединения формулы (XVII) в подходящем растворителе, например, в метаноле или этаноле, нагревают до температуры кипения растворителя с обратным холодильником;
(II) когда Z6 представляет собой имидазол-1-ил, соединение формулы (XVII) получают путем взаимодействия соединений формулы (XVI) с 1,1-карбонилдиимидазолом в подходящем растворителе, например, в дихлорметане, и циклизация in situ промежуточного имидазола дает требуемый продукт; и
(III) когда Z6 представляет собой бензотриазол-1-илоксигруппу, соединение формулы (XVII) получают in situ путем взаимодействия соединения формулы (XVI) с 1-гидроксибензотриазолом в присутствии подходящего водоотнимающего агента, например, 1,3-дициклогексилкарбодиимида, и в подходящем растворителе, например, в дихлорметане, и циклизация in situ дает требуемый продукт.
Исходные вещества формулы (XVII) могут быть получены обычными способами, например, из соединения формулы (XVI), методами, примеры которых описаны выше.
10) Соединения формулы (I), в которых X1 представляет собой непосредственную связь, и R2 представляет собой -NR3R4, ((C3-C7)-циклоалкил- (C1-C4)-алкил)R5N-, ((C3-C7)-циклоалкил- (C1-C4)-алкил)2N- или группу формулы: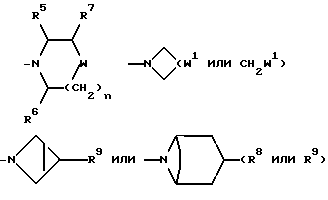
и X, W, W1, R, R1, R3, R4, R5, R6, R7, R8, R9, m и n имеют значения, установленные ранее для соединения формулы (I), могут быть получены путем взаимодействия соединения формулы (XVIII):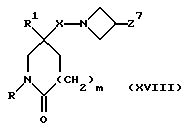
в которой X, R, R1 и m имеют значения, установленные ранее для соединения формулы (I), и Z7 представляет собой подходящую отщепляющуюся группу, например, метансульфонилоксигруппу или п-толуолсульфонилоксигруппу, с соединением формулы:
-NR3R4, ((C3-C7)-циклоалкил- (C1-C4)-алкил)R5NH-, ((C3-C7)-циклоалкил- (C1-C4)-алкил)2NH,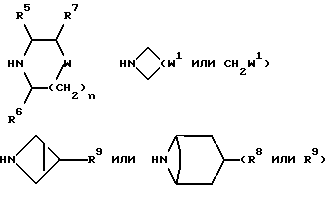
соответственно, W, W1, R3 R4, R5, R6, R7, R8, R9 и n имеют значения, установленные ранее для соединения формулы (I).
При типичной процедуре реакцию осуществляют, используя избыток амина, в подходящем растворителе, например, в ацетонитриле или дихлорметане, и при температуре кипения растворителя с обратным холодильником. С другой стороны, к реакционной смеси может быть добавлен дополнительный акцептор кислоты, например, карбонат калия.
Исходные амины могут быть получены обычными способами.
Исходные вещества формулы (XVIII) могут быть также получены обычными способами, такими как гидроаминирование, с использованием в качестве исходных веществ соединения формулы (II) и аммиака для получения соответствующего первичного амина, взаимодействия амина с эпихлоргидрином или 1,3-дихлорпропан-2-олом для получения соответствующего азетидин-3-ольного производного, с последующей взаимной конверсией функциональной гидроксильной группы с образованием соединения формулы (XVIII).
11) Соединения формулы (I), в которых X, X1, R, R1, R2 и m имеют значения, установленные ранее для способа (10), могут быть получены путем гидроаминирования с использованием в качестве исходных веществ соединения формулы (XIX):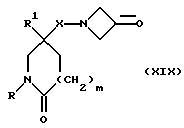
в которой X, R, R1 и m имеют значения, установленные ранее для соединения формулы (I), и подходящего соединения формулы:
-NR3R4, ((C3-C7)-циклоалкил- (C1-C4)-алкил)R5NH-, ((C3-C7)-циклоалкил- (C1-C4)-алкил)2NH,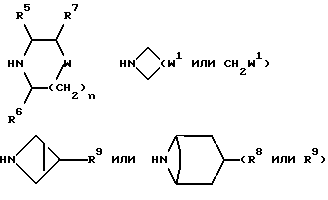
или его соли присоединения кислоты, где W, W1, R3, R4, R5, R6, R7, R8, R9 и n имеют значения, установленные ранее для соединения формулы (I). Реакцию осуществляют, предпочтительно, в присутствии подходящей кислоты, например, уксусной кислоты.
Типичная процедура может быть такой, какая описана в способе (1).
Если используется первичный амин, реакция протекает через образование промежуточного амина. Если используется вторичный амин, реакция протекает через образование промежуточной соли иминия (сравн. соединение формулы (IIIA). Как имин, так и соли иминия могут быть устойчивыми и допускающими их выделение. Реакцию, предпочтительно, осуществляют без выделения промежуточного имина или соли иминия, и в этом случае промежуточное соединение восстанавливается in situ с образованием соединения формулы (I).
Исходные вещества формулы (XIX) могут быть получены путем окисления соответствующих азетидин-3-ольных производных (получение которых описано при получении исходных веществ для способа (10)) при подходящих условиях, например, с использованием в качестве окислителя хлорхромата пиридиния или перрутината тетрапропиламмония.
12) Соединения формулы (I), в которых R2 представляет собой морфолиногруппу, и X, X1, R, R1 и m имеют значения, установленные ранее для соединения формулы (I), могут быть получены путем взаимодействия соединения формулы (I), в котором R2 представляет собой -NH2, и X, X1, R, R1 и m имеют значения, установленные ранее для соединения формулы (I), с бис(2-хлорэтиловым) эфиром.
При типичной процедуре соединение формулы (I), в котором R2 представляет собой -NH2, вводят во взаимодействие с бис(2-хлорэтиловым) эфиром в присутствии подходящего акцептора кислоты, например, триэтиламина, и в подходящем растворителе, например, в дихлорметане.
Некоторые из исходных аминопроизводных, например, производные 3-аминоазетидина, могут быть получены взаимодействием соединения формулы (XVIII), в котором Z7 представляет собой подходящую отщепляющуюся группу, например, метаносульфонилоксигруппу, с подходящим азидом, например, с азидом натрия или триметилсилилазидом, с образованием соответствующего 3-азидоазетидинового производного, и последующим восстановлением полученного производного, например, с использованием борогидрида натрия, что дает требуемое производное 3-аминоазетидина (см. также способ (10)).
13) Соединения формулы (I), в которых X, X1, R, R1, R2 и m имеют значения, установленные ранее для соединения формулы (I), за исключением соединений, в которых R2 представляет собой -CO2H, R представляет собой (C1-C6)-алкил, замещенный -COOH, W представляет собой CHCO2H, или W1 представляет собой CHCO2H, могут быть получены восстановительной циклизацией соединения формулы (XX):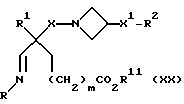
где X, X1, R, R1, R2 и m имеют значения, установленные ранее для этого способа, и R11 представляет собой подходящую эфирообразующую группу, например, (C1-C4)-алкил, предпочтительно, метил или этил, или бензил.
При типичной процедуре соединение формулы (XX) сначала получают in situ путем взаимодействия соединения формулы (XXI):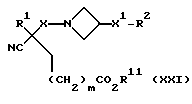
где X, X1, R1, R2, R11 и m имеют значения, установленные ранее для соединения формулы (XX), с соединением формулы: RNH2, в которой R имеет значения, установленные ранее для этого способа, а последующая восстановительная циклизация облегчается, благодаря присутствию подходящего восстановителя, например, никеля Ренея. Реакцию осуществляют в подходящем растворителе, например, в метаноле или этаноле, и в атмосфере водорода.
Исходные вещества формулы (XXI) могут получены обычными способами.
14) Некоторые соединения формулы (I) могут быть получены путем образования производных некоторых аминов формулы (I). Например, соединение формулы (I), в котором R2 представляет собой: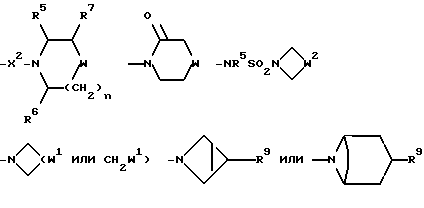
при этом W представляет собой NH или CHNHR5, W1 представляет собой CHNHR5, W2 представляет собой W1, -CH2W1-, -CH2WCH2- или -CH2CH2WCH2-, или R9 представляет собой -NHR5, и X, X1, X2, R, R1, R5, R6, R7, m и n имеют значения, установленные ранее для соединения формулы (I), может быть превращено в следующие соединения.
a) В соединение формулы (I), в котором W представляет собой NR5 или CHNR5R6, W1 представляет собой CHNR5R6, или R9 представляет собой -NHR5, или в его соль присоединения кислоты, как требуется, при этом R5 и R6 имеют значения, установленные ранее для соединения формулы (I), при условии, что R5 не представляет собой H, и имеет метиленовую группу, связанную с атомом азота, путем гидроаминирования с альдегидом формулы: ((C1-C3)-алкил)CHO или ((C3-C7)-циклоалкил-(C1-C3)-алкил)CHO, причем упомянутые (C1-C3)-алкил и (C3-C7)-циклоалкил-(C1-C4)-алкил замещены, необязательно, фтором.
Условия, подходящие для такой конверсии, описаны в способе (1).
b) В соединение формулы (I), в котором W представляет собой NCONHR6 или CHNR5CONHR6, W1 представляет собой CHNR5CONHR6, или R9 представляет собой -NR5CONHR6, как требуется, при этом R5 и R6 имеют значения, установленные ранее для соединения формулы (I), при условии, что R6 не представляет собой H, путем взаимодействия с изоцианатом формулы R6NCO, в которой R6 имеет значения, установленные ранее для этого способа.
Реакцию осуществляют, как правило, с использованием подходящего растворителя, например, дихлорметана или тетрагидрофурана.
c) В соединение формулы (I), в котором W представляет собой NSO2CF3 или CHNR5SO2CF3, W1 представляет собой CHNR5SO2CF3, или R9 представляет собой -NR5SO2CF3, как требуется, при этом R5 имеет значения, установленные ранее для соединения формулы (I), путем взаимодействия с трифторметансульфонилхлоридом или с ангидридом трифторметансульфоновой кислоты, в присутствии, необязательно, подходящего акцептора кислоты, например, триэтиламина, пиридина или карбоната калия. Реакцию осуществляют, как правило, в подходящем органическом растворителе, например, в дихлорметане или в ацетонитриле.
d) В соединение формулы (I), в котором W представляет собой NSO2((C1-C4)-алкил), NSO2NR5R6, NSO2(морфолиногруппу), NSO2(арил), CHNR5(SO2(C1-C4)-алкил) или CHNR5SO2NR5R6, W1 представляет собой CHNR5(SO2(C1-C4)-алкил) или CHNR5SO2NR5R6, или R9 представляет собой -NR5(SO2(C1-C4)-алкил) или NR5SO2NR5R6, как требуется, при этом R5 и R6 имеют значения, установленные ранее для соединения формулы (I), путем взаимодействия с (C1-C4)-алкансульфонилхлоридом или с бромидом, ангидридом (C1-C4)-алкансульфоновой кислоты или соединением формулы; R5R6NSO2(Cl или Br), (морфолино)SO2(Cl или Br) или (арил)SO2(Cl или Br), как требуется, в присутствии, необязательно, подходящего акцептора кислоты, например, триэтиламина.
Реакцию осуществляют, как правило, в подходящем органическом растворителе, например, в дихлорметане, при температуре от 0oC до комнатной.
e) В соединение формулы (I), в котором W представляет собой NCOR6 или CHNR5COR6, W1 представляет собой CHNR5COR6, или R9 представляет собой -NR5COR6, как требуется, при этом R5 и R6 имеют значения, установленные ранее для соединения формулы (I), при условии, что R6 не является H, путем взаимодействия с соединением формулы: R6CO(Cl или Br) или (R6CO)2O, при этом R6 имеет значения, установленные ранее для этого способа, в присутствии, необязательно, подходящего акцептора кислоты, например, триэтиламина.
Реакцию осуществляют, как правило, в подходящем органическом растворителе, например, в дихлорметане, при температуре от 0oC до комнатной.
f) В соединение формулы (I), в котором W, W1 или R9 имеют значения, установленные ранее способа 14(e), как требуется, путем конденсации с соединением формулы: R6CO2H, при этом R6 имеет значения, установленные ранее для этого способа. Реакция может быть осуществлена при обычных условиях, например, с использованием 1,1-карбонилдиимидазола или 1-гидроксибензотриазола/1,3-дициклогексилкарбодиимида (см. , например, способ (9)) для получения активированных промежуточных соединений.
g) В соединение формулы (I), в котором W представляет собой NSO2NR5R6 или CHNR5SO2NR5R6, W1 представляет собой CHNR5SO2NR5R6 или R9 представляет собой -NR5SO2NR5R6, как требуется, при этом R5 и R6 имеют значения, установленные ранее для соединения формулы (I), путем взаимодействия с соединением формулы: R5R6NSO2NH2.
Реакцию осуществляют, как правило, при повышенной температуре в подходящем органическом растворителе, например, в 1,4-диоксане.
15) Соединения формулы (I), в которых R2 представляет собой: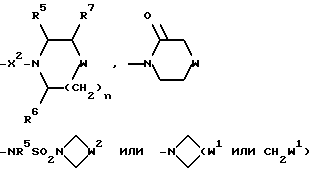
при этом W и W1 представляют собой CHCO2H, и W2 представляет собой W1, -CH2W1-, -CH2WCH2- или -CH2CH2WCH2-, и X, X1, X2, R, R1, R5, R6, R7, m и n имеют значения, установленные ранее для соединения формулы (I), могут быть получены гидролизом соединения формулы (I), в котором W и W1 представляют собой CHCO2((C1-C4)-алкил), W2 представляет собой W1, -CH2W1-, -CH2WCH2- или -CH2CH2WCH2-, и X, X1, X2, R, R1, R5, R6, R7, m и n имеют значения, установленные ранее для соединения формулы (I). Предпочтительно, W и W1 представляют собой CHCO2CH3 или CH2CO2CH2CH3.
Гидролиз осуществляют, как правило, используя водный раствор подходящей кислоты или основания, например, неорганической кислоты, такой как хлористоводородная или серная кислота, или основания, такого как гидроксид натрия или калия, в присутствии, необязательно, подходящего органического сорастворителя, например, метанола или этанола.
16) Соединения формулы (I), в которых R2 представляет собой: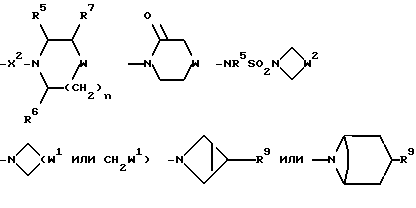
при этом W и W1 представляют собой CHNR5R6, W2 представляет собой W1, -CH2W1-, -CH2WCH2- или -CH2CH2WCH2-, R9 представляет собой -NR5R6, и X, X1, X2, R, R1, R5, R6, R7, m и n имеют значения, установленные ранее для соединения формулы (I), могут быть получены путем взаимодействия соединения формулы (XXII):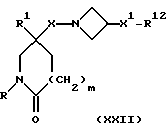
где R12 представляет собой: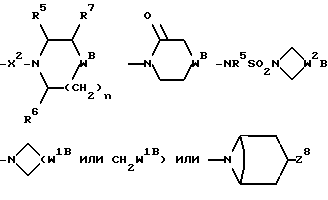
при этом WB и W1B представляют собой CHZ8, и W2B представляет собой W1B, -CH2W1B-, -CH2W1BCH2- или -CH2CH2WBCH2-, Z8 представляет собой подходящую отщепляющуюся группу, например, галоген (предпочтительно, хлор или бром), метансульфонилоксигруппу, трифторметансульфонилоксигруппу или п-толуолсульфонилоксигруппу, и X, X1, X2 R, R1, R5, R6, R7, m и n имеют значения, установленные ранее для соединения формулы (I), с соединением формулы: HNR5R6, при этом R5 и R6 имеют значения, установленные ранее для соединения формулы (I), в присутствии, необязательно, подходящего акцептора кислоты, например, триэтиламина или карбоната калия.
Реакцию осуществляют, как правило, в подходящем растворителе, таком как ацетонитрил.
17) Соединения формулы (I), в которых R2 представляет собой: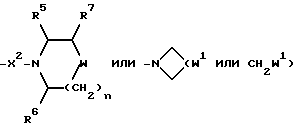
при этом W и W1 представляют собой CHNR5R6, и X, X1, X2, R, R1, R5, R6, R7, m и n имеют значения, установленные ранее для соединения формулы (I), могут быть получены путем гидроаминирования с использованием в качестве исходных веществ соединения формулы (I), в котором R2 представляет собой: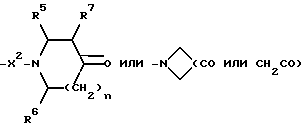
и X, X1, X2, R, R1, R5, R6, R7, m и n имеют значения, установленные ранее для соединения формулы (I), и соединения формулы: HNR5R6, при этом R5 и R6 имеют значения, установленные ранее для соединения формулы (I).
Используя обычные условия, такие, какие описаны в способе (1). И снова, образовавшиеся промежуточные имин или соль иминия могут быть устойчивыми и допускающими их выделение. Реакцию, предпочтительно, осуществляют без выделения промежуточного соединения, которое, в таком случае, восстанавливается in situ с образованием формулы (I).
18) Все соединения формулы (I) могут быть получены внутримолекулярной циклизацией соединения формулы (XXIII):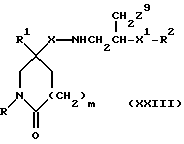
в котором X, X1, R, R1, R2 и m имеют значения, установленные ранее для соединения формулы (I), и Z9 представляет собой подходящую отщепляющуюся группу, например, галоген (предпочтительно, хлор или бром), метансульфонилоксигруппу или п-толуолсульфонилоксигруппу, в присутствии, необязательно, подходящего акцептора кислоты, например, триэтиламина.
Реакцию осуществляют, как правило, в подходящем растворителе, например, в дихлорметане.
19) Все соединения формулы (I), за исключением соединений, в которых m = 0, могут быть получены путем катализированной с добавлением карбонила циклизации соединения формулы (XXIV);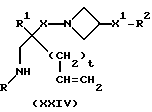
при этом t = 0 или 1, и X, X1, R, R1 и R2 имеют значения, установленные ранее для соединения формулы (I).
Реакцию осуществляют, как правило, в атмосфере монооксида углерода, используя подходящий катализатор, например, тетракистрифенилфосфинпалладий (0), подходящее основание, например, триэтиламин, и в подходящем органическом растворителе, например, в тетрагидрофуране, при комнатной температуре.
Все упомянутые выше реакции и способы получения новых исходных веществ, используемых в описанных способах, являются традиционными, и соответствующие случаю реагенты и условия осуществления реакций или получения, так же, как и методы выделения нужных продуктов, станут хорошо известны специалистам в этой области техники при обращении к соответствующей литературе и приведенным здесь примерам и препаративным примерам.
Фармацевтически приемлемую соль присоединения кислоты или основания соединения формулы (I) можно легко получить путем смешивания растворов соединения формулы (I) и нужной кислоты или основания, в зависимости от требования. Соль можно осадить из раствора и собрать фильтрацией, или ее можно извлечь посредством испарения растворителя.
Сродство соединений формулы (I) и их солей к человеческому NK1-рецептору может быть проверена in vitro путем проверки их способности ингибировать связывание [3H] -вещества P с мембранами, полученными из линии человеческих клеток IM9, экспрессирующих человеческий NK1-рецептор, пользуясь модифицированным способом, описанным в McLean, S., et al., J. Pharm. Exp. Ther., 267, 472-9 (1993), при котором используют целые клетки.
Сродство соединений формулы (I) и их солей к человеческому NK1-рецептору может быть проверена in vitro путем проверки их способности конкурировать со связыванием [3H]-вещества P или [125I]NKA (нейрокинин A) с мембранами, полученными из клеток яичника китайского хомяка, экспрессирующих клонированный человеческий NK2-рецептор. При этом способе промытые клеточные мембраны яичника китайского хомяка получают так, как описано в предыдущем случае, когда использовали клетки IM9. Мембраны инкубируют (90 мин, 25oC) с [125I]NKA и с проверяемым соединением в интервале концентрацией. Неспецифическое связывание определяют в присутствии 10 мкМ NKA.
Антагонистическая NK2-рецепторная активность соединений формулы (I) может быть проверена, in vitro, путем проверки из способности противодействовать сократительному действию селективного NK2-рецепторного агониста [βAla8] NKA(4-10) в кроличьей легочной артерии, используя способ Patacchini и Maqqi, Eur. J. Pharmacol, 236, 31-37 (1993).
Соединения формулы (I) и их соли можно проверить на антагонистическую NK2-рецепторную активность, in vivo, посредством проверки их способности ингибировать бронхостеноз, индуцированный [β Ala8]NKA(4-10) у находящейся под наркозом морской свинки, используя способ, описанный в Murai et al., J. Pharm. Exp. Ther., 262, 403-408 (1992), или Metcalfe et al., Br. J. Pharmacol., 112, 563P (1994).
Соединения формулы (I) и их соли можно проверить на антагонистическую NK3-рецепторную активность, in vitro, посредством проверки их способности противодействовать сократительному действию селективного NK3-рецепторного агониста сенктида в подвздошной кишке морской свинки, используя способ Maqqi et al., Br. J. Pharmacol., 996-1000 (1990).
При применении для человека, соединения формулы (I) и их соли могут вводиться одни, но, как правило, они будут вводиться в смеси с фармацевтически приемлемым разбавителем или носителем, выбираемым с учетом предназначенного способа введения и общепринятой фармацевтической практики. Например, их можно вводить перорально, в том числе, под язык, в форме таблеток, содержащих такие эксципиенты, как крахмал или лактоза, или в форме капсул или облаток, либо одни, либо в смеси с эксципиентами, или в форме эликсиров, растворов или суспензий, содержащих корригенты или красители. Их можно вводить парентеральными инъекциями, например, внутривенно, внутримышечно или подкожно. Для парентерального введения их лучше всего использовать в форме стерильных водных растворов, которые могут содержать другие вещества, например, соли или глюкозу в количестве, достаточном, чтобы сделать раствор изотоническим с кровью.
Для орального и парентерального введения людям уровень суточной дозы соединений формулы (I) и их солей будет составлять от 0,001 до 20 мг/кг, предпочтительно - от 0,01 до 20 мг/кг, предпочтительнее - от 0,5 до 5 мг/кг и наиболее предпочтительно - от 1 до 2 мг/кг (в виде однократных или разделенных доз). Таблетки или капсулы с соединениями будут содержать от 0,1 до 500 мг, предпочтительно - от 50 до 200 мг, активного соединения для одновременного приема одной, двух или большего их числа, как требуется. В любом случае фактическую дозу, которая будет наиболее подходящей для отдельного пациента, будет определять лечащий врач, и она будет изменяться в зависимости от возраста, массы и реакции конкретного пациента. Приведенные выше дозы являются примерами усредненного случая; и возможно, что в отдельных случаях заслуживают внимания более широкие или более узкие интервалы дозировки, и таковые входят в объем настоящего изобретения.
С другой стороны, соединения формулы (I) могут вводиться путем ингаляции или в форме суппозиториев или вагинальных суппозиториев, или они могут применяться местно в форме лосьонов, растворов, кремов, мазей или присыпок. Альтернативным способом трансдермального введения является применение кожного пластыря. Например, их можно включить в крем, состоящий из водной эмульсии полиэтиленгликолей или вазелинового масла; или их можно ввести, при концентрации от 1 до 10%, в мазь, состоящую из белого воска или бесцветного мягкого парафина, как основы, с такими стабилизаторами, какие могут потребоваться.
Следует заметить, что обращение к лечению включает профилактику, а также облегчение установленных симптомов заболевания.
Таким образом, настоящее изобретение относится
I) к фармацевтической композиции, содержащей соединение формулы (I), или его фармацевтически приемлемую соль, вместе с фармацевтически приемлемым разбавителем или носителем;
II) к соединению формулы (I), или к его фармацевтически приемлемой соли, или к их композиции, для использования в качестве лекарственного средства;
III) к применению соединения формулы (I), или его фармацевтически приемлемой соли, или их композиции, для производства лекарственного средства для лечения заболевания путем антагонистического действия на тахикинин, действующий в человеческом NK1-, NK2- или NK3-рецепторе или в их сочетании;
IV) к применению в (III), когда заболевание представляет собой воспалительное заболевание, такое как артрит, псориаз, астма или воспалительное заболевание кишечника, расстройство центральной нервной системы (ЦНС), такое как страх, депрессия, деменция или психоз, желудочно-кишечное (GI) нарушение, такое как функциональная болезнь кишечника, синдром раздраженной толстой кишки, гастроэзофагеальный рефлюкс, недержание кала, колит или болезнь Крона, заболевание мочеполовых путей, такое как недержание, гиперрефлексия или цистит, легочное нарушение, такое как хроническая обструкция дыхательных путей, аллергию, такую как экзема, контактный дерматит или ринит, аллергическое расстройство, такое как вызванное сумахом, периферическую невропатию, такую как диабетическая невропатия, невралгия, каузалгия, болезненная невропатия, ожог, невралгия при опоясываюшем лишае или после опоясывающего лишая, кашель или острую или хроническую боль;
V) к способу лечения человека, при котором болезнь лечится за счет антагонистического действия на тахикинин, действующий в человеческом NK1-, NK2- или NK3-рецепторе или в сочетании, который включает лечение упомянутого человека эффективным количеством соединения формулы (I), или его фармацевтически приемлемой соли, или их композиции;
VI) к способу (V), когда заболевание представляет собой воспалительное заболевание, такое как артрит, псориаз, астма или воспалительное заболевание кишечника, расстройство центральной нервной системы (ЦНС), такое как страх, депрессия, деменция или психоз, желудочно-кишечное (GI) нарушение, такое как функциональная болезнь кишечника, синдром раздраженной толстой кишки, гастроэзофагеальный рефлюкс, недержание кала, колит или болезнь Крона, заболевание мочеполовых путей, такое как недержание, гиперрефлексия или цистит, легочное нарушение, такое как хроническая обструкция дыхательных путей, аллергию, такую как экзема, контактный дерматит или ринит, аллергическое расстройство, такое как вызванное сумахом, периферическую невропатию, такую как диабетическая невропатия, невралгия, каузалгия, болезненная невропатия, ожог, невралгия при опоясывающем лишае или после опоясывающего лишая, кашель или острую или хроническую боль;
VII) к соединению формулы (II), (IIIA), (XII), (XIV), (XV), (XVI) (XVII), (XVIII), (XIX), (XX), (XXI), (XXII), (XXIII) или (XXIV).
Ниже приводятся примеры получения соединений формулы (I).
(Ссылочный) пример 1
5-(3,4-Дихлорфенил)-5-(2-[-морфолиноазетидин-1-ил]этил)-2(1H)- пиперидон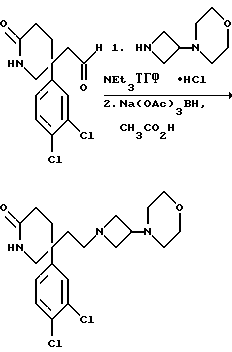
К раствору альдегида (см. препаративный пример 6) (150 мг, 0,52 ммоль) и гидрохлорида 3-морфолиноазетидина (см. препаративный пример 56) (103 мг, 1,1 мол. экв. ) в тетрагидрофуране (7,5 мл) в атмосфере азота добавляют триэтиламин (0,08 мл, 1,1 мол. экв.). Через 1 час добавляют триацетоксиборогидрид натрия (171 мг, 1,5 мол. экв.), после чего сразу же добавляют ледяную уксусную кислоту (0,03 мл), и смесь перемешивают в течение 2 часов. Затем добавляют воду (1 мл), после чего добавляют насыщенный водный раствор бикарбоната натрия (10 мл). Смесь экстрагируют дихлорметаном (3 х 20 мл), и объединенные органические слои сушат над сульфатом магния. Раствор фильтруют, растворитель удаляют из фильтрата при пониженном давлении и остаток сначала хроматографируют на силикагеле, элюируя с градиентом растворителя метанола с этилацетатом (от 1 : 9 до 1 : 4, по объему), чтобы удалить примеси, и затем повторно хроматографируют, используя силикагель, элюируя смесью метанола с дихлорметаном (1 : 9, по объему), и получают названное в заголовке соединение (78 мг).
ТХС Rf = 0,27 (диоксид кремния, метанол : дихлорметан, 1 : 9, по объему). МСНР (LRMS - масс-спектрометрия низкого разрешения) m/z = 411 (m+1)+. Элем. анализ: найдено: C - 57,57; H - 6,76; N - 9,78. Для C20H27Cl2N3O2• 0,05CH2Cl2 вычислено: C - 57,81; H - 6,56; N - 10,09%.
1H ЯМР (CDCl3): δ = 1,60-1,70 (м, 1H), 1,80-1,85 (м, 1H), 2,00-2,40 (м, 10H), 2,65-2,75 (м, 2H), 2,85-2,90 (м, 1H), 3,35-3,40 (м, 3H), 3,65-3,75 (м, 5H), 6,20 (с, ш, 1H), 7,15-7,50 (м, 3H) ppm.
Примеры со 2 по 59
Соединения общей формулы: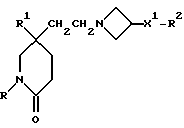
примеров, перечисленных ниже в табл. 1, получают способом, подобным способу примера 1, используя в качестве исходных веществ соответствующий альдегид (см. препаративные примеры 39-43, 137-140 и 187-191) и азетидин (см. препаративные примеры 56, 61, 65, 66, 67, 70, 77-80, 82, 84, 85, 87, 89, 107-118, 121, 134, 154, 180 и 181).
Подстрочные примечания
1. Используют по крайней мере 2 мол. экв. триэтиламина.
2. Другой способ получения см. в примере 103.
3. При реакции в качестве сорастворителя используют дихлорэтан.
4. Дигидрохлорид 3-(1H-имидазол-1-ил) азетидина, используемый в качестве исходного вещества, получают путем обработки 1-(третбутоксикарбонил)-3-(1H-имдазол-1-ил)азетидина хлористым водородом в дихлорметане по способу, описанному в публикации международного патента N ВОИС 93/19059.
5. Получают (S)-энантиомер.
6. Чтобы довести реакцию до конца, позднее добавляют дополнительные количества исходного азетидина (приблизит. 1 мол. экв. ), триэтиламина (приблизит. 2 мол. экв.) и тетрагидрофурана, после чего добавляют триацетоксиборогидрид натрия (приблизит. 1,5 мол. экв.) и ледяную уксусную кислоту.
В качестве элюента для колонки используют метанол с дихлорметаном.
7. Осуществляют элюирование с градиентом, используя в качестве элюента дихлорметан, а затем дихлорметан с метанолом.
8. Элюирование с градиентом осуществляют, используя сначала в качестве элюента этилацетат, а затем этилацетат с метанолом, и на последних стадиях эту смесь заменяют на смесь дихлорметана с метанолом.
9. В качестве исходного вещества используют бистрифторацетат 3-(4-аминосульфонилпиперазин-1-ил)азетидина (см. препаративный пример 154).
10. Сырой продукт реакции очищают в виде соли трифторуксусной кислоты посредством хроматографии на силикагеле, элюируя смесью дихлорметана с метанолом и 0,880 водным раствором аммиака (89:10:1, по объему). Очищенную соль обрабатывают 10% водным раствором карбоната калия, и водный слой несколько раз экстрагируют этилацетатом. Объединенные органические слои сушат (Na2SO4) и концентрируют при пониженном давлении, и получают нужный продукт.
11. Очищают хроматографией с обращенной фазой, используя гель MCI (торговая марка) (высокопористый полистирол CHP 20P [75-150 мкм]), используя в качестве элюента метанол, а затем метанол с водой.
12. Получают (R)-энантиомер.
13. В качестве исходного вещества используют дитрифторацетат азетидина.
14. Пример только для сравнения.
15. В качестве исходного вещества используют дигидрохлорид азетидина.
16. Элюирование с градиентом осуществляют, используя в качестве элюента дихлорметан, а затем дихлорметан с метанолом и концентрированным водным раствором аммиака.
17. [α]
Пример 60
5-(3,4-Дихлорфенил)-1-(3-метоксибензил)-5-(2-[3-морфолиноазетидин- 1-ил] этил)-2-пиперидон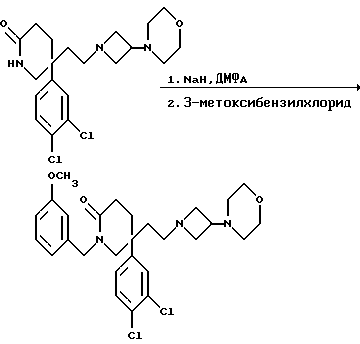
К раствору пиперидона (см. пример 1) (350 мг, 0,85 ммоль) в сухом N,N-диметилформамиде (5 мл) в атмосфере азота добавляют 60% (в/в) дисперсию гидрида натрия в масле (37 мг, 1,05 мол. экв.), и смесь перемешивают при комнатной температуре в течение 30 минут. После этого добавляют 3-метоксибензилхлорид (0,13 мл, 1,05 мол. экв.), и смесь перемешивают в течение 5 минут. Затем добавляют воду (1 мл), и после этого добавляют насыщенный водный раствор бикарбоната натрия (20 мл) и насыщенный водный раствор хлорида аммония (20 мл). Смесь экстрагируют этилацетатом (2 х 20 мл), и объединенные органические слои промывают насыщенным водным раствором хлорида аммония (2 х 20 мл) и затем сушат над сульфатом магния. После фильтрации и удаления из фильтра растворителя при пониженном давлении получают смолу, которую хроматографируют на силикагеле, элюируя с градиентом растворителя метанола с дихлорметаном (от 1: 19 до 1:9, по объему). Получают названное в заголовке соединение (140 мг).
ТХС Rf = 0,45 (диоксид кремния, метанол : дихлорметан, 1:9, по объему). МСНР m/z = 532 (m)+. Элем. анализ: найдено: C - 62,07; H - 6,74; N - 7,19. Для C28H35Cl2N3O3• 0,1CH2Cl2 вычислено: C - 62,39; H - 6,56; N - 7,77%.
1H ЯМР (CDCl3): δ = 1,50-2,90 (м, 16H), 3,25-3,80 (м, 7H), 3,80 (с, 3H), 4,30 (д, 1H), 6,80-6,90 (м, 4H), 7,05 (д, 1H), 7,25-7,30 (м, 2H) ppm.
Примеры с 61 по 75
Соединения общей формулы: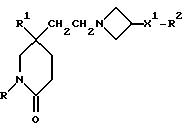
примеров, перечисленных ниже в табл. 2, получают способом, подобным способу примера 60 (с нагреванием реакционной смеси, при необходимости), используя в качестве исходных веществ соответствующий пиперидон (см. пример 1) и хлор-, бром- или метансульфонилоксиалкановые производные.
Подстрочные примечания
1. Две пары энантиомеров в продукте, полученном после обработки, разделяют хроматографией на силикагеле, элюируя с градиентом растворителя метанола с дихлорметаном (от 1: 19 до 1:9, по объему). Сначала элюируется энантиомерная пара А, а затем более полярная энантиомерная пара B.
2. В качестве исходного вещества используют хлоралкановое производное.
3. В качестве исходного вещества используют бромалкановое производное.
4. В качестве исходного вещества используют метансульфонилоксиалкановое производное.
Пример 76
1-Циклогептилметил-5-(3,4-дихлорфенил)-5-(2-[3-морфолиноазетидин- 1-ил] этил)-2-пиперидон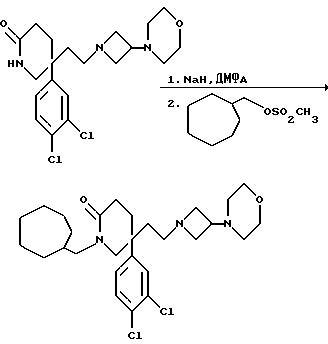
К раствору пиперидона (см. пример 1) (200 мг, 0,49 моль) в сухом N,N-диметилформамиде (3,5 мл), при 0oC и в атмосфере азота добавляют 60% (в/в) дисперсию гидрида натрия в масле (21 мг, 1,1 мол. экв.), и смеси позволяют нагреваться до комнатной температуры в течение 1 часа. После этого добавляют раствор метансульфонилоксиметилциклогептана (см. препаративный пример 13) (120 мг, 1,2 мол. экв. ) в сухом N,N-диметилформамиде (0,5 мл), и смесь нагревают до 50oC. Для осуществления полного взаимодействия исходного пиперидона смесь охлаждают, затем добавляют дополнительные порции гидрида натрия (0,5 мол. экв.) и исходного мезилата 0,5 мол. экв.), и реакционную смесь греют при 50oC в течение 2 часов. Реакционную смесь охлаждают до 0oC, добавляют воду (1 мл) и удаляют диметилформамид при пониженном давлении. Остаток экстрагируют этилацетатом (3 х 20 мл), и объединенные экстракты сушат над сульфатом магния. После фильтрации и удаления из фильтрата растворителя при пониженном давлении получают пену, которую хроматографируют, используя силикагель, элюируя с градиентом растворителя дихлорметана с метанолом (от 100:0 до 85:15, по объему), и получают названное в заголовке соединение (120 мг).
ТХС Rf = 0,45 (диоксид кремния, метанол:дихлорметан, 1:9, по объему). МСНР m/z = 522 (m+1)+. Элем. анализ: найдено: C - 62,11; H - 7,63; N - 7,55. Для C28H41Cl2N3O2• 0,2CH2Cl2 вычислено: C - 62,78; H - 7,73; N - 7,79%.
1H ЯМР (CDCl3): δ = 1,1-1,3 (м, 2H), 1,35-1,8 (м, 11H), 1,8-1,95 (м, 2H), 1,95-2,1 (м, 1H), 2,1-2,35 (м, 7H), 2,35-2,5 (м, 1H), 2,75-2,95 (м, 2H), 2,95-3,0 (м, 2H), 3,05-3,2 (м, 2H), 3,25-3,45 (м, 2H), 3,45-3,6 (м, 2H), 3,6-3,75 (м, 4H), 7,05-7,1 (м, 1H), 7,3-7,35 (м, 1H), 7,4-7,45 (м, 1H) ppm.
Пример 77
5-(3,4-Дихлорфенил)-5-(2-[3-морфолиноазетидин-1-ил] этил)-1-(4- фенилбензил)-2-пиперидон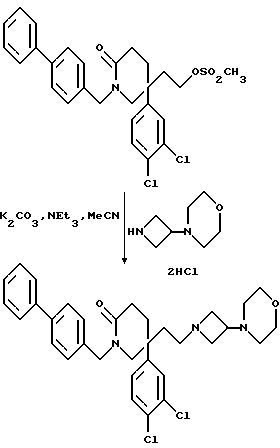
К раствору мезилата (см. препаративный пример 35) (290 мг, 0,55 ммоль) в сухом ацетонитриле (10 мл) добавляют дигидрохлорид 3-морфолиноазетидина (см. препаративный пример 56) (200 мг, 2,0 мол. экв.), после чего добавляют триэтиламин (0,15 мл, 2 мол. экв.) и карбонат калия (150 мг, 2 мол. экв.). Смесь кипятят с обратным холодильником в течение 4 часов. После этого реакционную смесь охлаждают, добавляют воду (1 мл), смесь упаривают досуха при пониженном давлении, и остаток обрабатывают смесью дихлорметана (10 мл) и воды (10 мл). Органическую фазу отделяют, промывают солевым раствором (10 мл), сушат над сульфатом магния, фильтруют и из фильтрата при пониженном давлении удаляют растворитель. Получают смолу, которую хроматографируют на силикагеле, элюируя с градиентом растворителя метанола с дихлорметаном (от 1: 19 до 1:9, по объему, и получают названное в заголовке соединение (85 мг).
ТХС Rf = 0,47 (диоксид кремния, метанол:дихлорметан, 1:9, по объему), т. пл. 72-82oC. МСНР m/z = 578 (m+1)+. Элемен. анализ: найдено: C - 67,56; H - 6,27; N - 7,24. Для C33H37Cl2N3O2• 0,13CH2Cl2 вычислено: C - 67,53; H - 6,37; N - 7,13%.
1H ЯМР (CDCl3): δ = 1,5-1,8 (м, 3H), 1,95-2,3 (м, 8H), 2,4-2,55 (м, 1H), 2,6-2,75 (м, 2H), 2,8-2,9 (м, 1H), 3,3-3,35 (м, 3H), 3,55-3,7 (м, 5H), 4,4 (д, 1H), 4,9 (д, 1H), 6,85-6,9 (м, 1H), 7,1 (с, 1H), 7,25-7,7 (м, 10H) ppm.
Примеры с 78 по 96
Соединения общей формулы: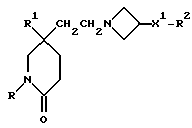
примеров, перечисленных ниже в табл. 3, получают способом, подобным способу примера 77, используя в качестве исходных веществ соответствующий мезилат (см. препаративные примеры 33, 34, 36, 37 и 38) и соответствующий азетидин (см. препаративные примеры 56, 68, 77, 81, 82, 83, 86, 87, 88, 119, 134, 154, 179 и 181).
Подстрочные примечания
1. В реакции используют 3 мол. экв. производного азетидина, как исходного вещества, и 3 мол. экв. триэтиламина.
2. В качестве исходного вещества используют дитрифторацетат азетидина.
3. Вместо триэтиламина в качестве акцептора кислоты используют 10 мол. экв. карбоната калия.
4. Вместо триэтиламина в качестве акцептора кислоты используют 2,5 мол. экв. карбоната калия.
5. В качестве исходного вещества используют дигидрохлорид азетидина.
Пример 97
1-Бензил-5-(2-[3-морфолиноазетидин-1-ил]этил)-5-фенил-2-пиперидон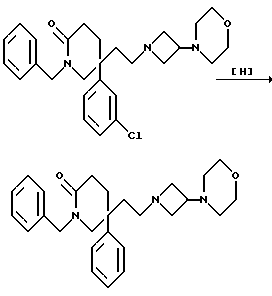
Пиперидон (см. пример 18) (95 мг, 0,2 ммоль) растворяют в этаноле, который насыщен аммиаком (20 мл), и добавляют никель Ренея (10 мг). Затем смесь перемешивают при 50oC в атмосфере водорода при давлении 345 кПа (50 ф/д2) в течение 10 часов. Катализатор затем удаляют фильтрацией и добавляют 5% палладий-на-угле (10 мг). Смесь затем перемешивают еще в течение 16 часов при 50oC и давлении 345 кПа в атмосфере водорода. Затем катализатор удаляют фильтрацией, фильтрат концентрируют при пониженном давлении, и остаток хроматографируют, используя силикагель, элюируя с градиентом растворителя метанола с дихлорметаном (от 0:100 до 9:91, по объему), и получают названное в заголовке соединение (19 мг).
ТХС Rf = 0,3 (диоксид кремния, метанол:дихлорметан, 1:9, по объему). МСНР m/z = 434 (m)+. Элем. анализ: найдено: C - 66,22; H - 8,26; N - 8,60. Для C27H35N3O2• 3H2O вычислено: C - 66,50; H - 8,47; N - 8,62%.
1H ЯМР (CDCl3: δ = 0,8-1,0 (д, 2H), 1,1-1,4 (м, 1H), 1,9-2,6 (м, 12H), 2,6-2,8 (м, 1H), 3,2-3,4 (м, 2H), 3,5-3,8 (м, 5H), 4,5 (д, 1H), 4,8 (д, 1H), 6,95-7,1 (м, 2H), 7,2-7,4 (м, 8H) ppm.
Пример 98
1-Бензил-5-(3,4-дихлорфенил)-5-(2-[3-пиперазиноазетидин-1-ил] этил- 2-пиперидон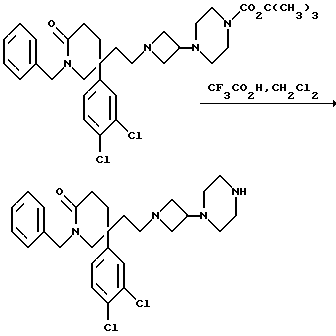
К раствору пиперазина (см. пример 7) (101 мг, 0,16 ммоль) в сухом дихлорметане (3,5 мл), в атмосфере водорода и при комнатной температуре быстро добавляют трифторуксусную кислоту (3,5 мл, 45 ммоль). Реакционную смесь перемешивают еще в течение 20 минут и затем при пониженном давлении испаряют растворитель. Чтобы удалить избыток трифторуксусной кислоты из реакционной смеси, реакционную смесь дважды подвергают азеотропной отгонке, используя дихлорметан (50 мл). Реакционную смесь подщелачивают (pH 9), используя насыщенный водный раствор карбоната натрия (30 мл), и водную фазу экстрагируют этилацетатом (4 х 50 мл). Органические экстракты объединяют, сушат над безводным сульфатом магния и упаривают досуха при пониженном давлении. Полученную в результате пену растворяют в дихлорметане (0,25 мл), фильтруют раствор и удаляют растворитель из фильтрата при пониженном давлении. Получают названное в заголовке соединение (88 мг).
ТХС Rf = 0,16 (диоксид кремния, метанол : дихлорметан : коyц. водн. раствор аммиака, 9:90:1, по объему). МСНР m/z = 467 (m)+. Элем. анализ: найдено: C - 55,15; H - 5,74; N - 6,84. Для C27H34N4Cl2O•0,125CH2Cl2 вычислено: C - 54,42; H - 5,93; N - 8,90%.
1H ЯМР (CDCl3): δ = 1,2-1,3 (м, 1H), 1,4-1,6 (м, 2H), 1,9-2,3 (м, 6H), 2,3-2,5 (м, 4H), 2,7-2,8 (м, 2H), 2,9-3,25 (м, 2H), 3,25 (д, 1H), 3,3-3,5 (м, 2H), 3,55 (д, 1H), 4,4 (д, 1H), 4,8 (д, 1H), 6,8 (д, 1H), 7,05 (с, 1H), 7,2-7,4 (м, 6H) ppm.
Пример 99
1-(2,4-Дихлорбензил)-5-(3,4-дихлорфенил)-5-(2-[3-морфолиноазетидин- 1-ил]этил)-2-пиперидон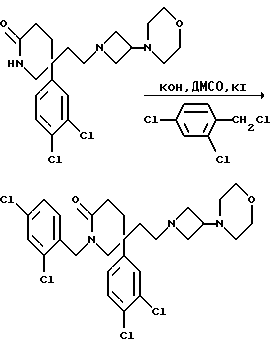
К раствору измельченного в порошок гидроксида калия (110 мг, 4 мол. экв. ) в сухом диметилсульфоксиде (4 мл), при перемешивании, добавляют раствор пиперидона (см. пример 1) (200 мг, 0,49 ммоль) в сухом диметилсульфоксиде (4 мл) и затем добавляют 2,4-дихлорбензилхлорид (0,068 мл, 1 мол. экв.) и иодид калия (8 мг, 0,1 мол. экв.). Затем смесь перемешивают при комнатной температуре в течение 16 часов. Затем добавляют этилацетат (50 мл), смесь промывают водой (3 х 50 мл) и органическую фазу сушат над безводным сульфатом магния. Затем раствор фильтруют, растворитель из фильтрата удаляют при пониженном давлении, остаток хроматографируют, используя силикагель, элюируя с градиентом растворителя этилацетата с метанолом и диэтиламином (от 100:0:0 до 100:5:1, по объему).
Получают названное в заголовке соединение (49 мг).
МСНР m/z = 572 (m+1)+.
1H ЯМР (CDCl3): δ = 1,55-1,8 (м, 2H), 1,95-2,3 (м, 10H), 2,4-2,5 (м, 1H), 2,65-2,7 (м, 1H), 2,85-2,9 (м, 1H), 3,3-3,4 (м, 3H), 3,6-3,7 (м, 5H), 4,6 (д, 1H), 4,85 (д, 1H), 6,9-6,95 (м, 1H), 7,05 (м, 1H), 7,2-7,4 (м, 4H) ppm.
Пример 100
5-(3,4-Дихлорфенил)-1-(4-фторбензил)-5-(2-[3-морфолиноазетидин- 1-ил]этил)-2-пиперидон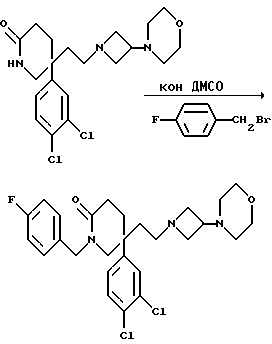
К сухому диметилсульфоксиду (3 мл) при комнатной температуре добавляют порошкообразный гидроксид калия (104 мг, 4 мол. экв.), и смесь перемешивают при комнатной температуре в течение 5 минут. Затем добавляют раствор пиперидона (см. пример 1) (240 мг, 0,46 ммоль) в диметилсульфоксиде (5 мл), и после этого добавляют 4-фторбензилбромид (0,058 мл, 1 мол. экв.), и смесь перемешивают при комнатной температуре в течение 50 минут. Затем реакционную смесь выливают в этилацетат (40 мл), промывают водой (3 х 40 мл), и органическую фазу сушат над безводным сульфатом магния. Затем раствор фильтруют, из фильтрата при пониженном давлении удаляют растворитель, и остаток хроматографируют на силикагеле, элюируя с градиентом растворителя этилацетата с метанолом и диэтиламином (от 100:0:0 до 10:1:2 и до 20:3:1, по объему). Получают названное в заголовке соединение (100 мг).
МСНР m/z = 521 (m+1)+. TXC Rf = 0,4 (диоксид кремния, этилацетат:метанол: диэтиламин 20: 30:1, по объему). Элем. анализ: найдено: C - 61,46; H - 6,27; N - 7,55. Для C27H32Cl2N3O2F вычислено: C - 62,31; H - 6,20; N - 8,07%.
1H ЯМР (CDCl3): δ = 1,5-1,85 (м, 4H), 1,95-2,2 (м, 8H), 2,6-2,75 (м, 2H), 2,8-2,9 (м, 1H), 3,15-3,35 (м, 4H), 3,65-3,75 (м, 4H), 4,3 (д, 1H), 4,8 (д, 1H), 6,8-7,3 (м, 7H) ppm.
Примеры 101 и 102
Соединения двух следующих сведенных в табл. 4 примеров, имеющие общую формулу: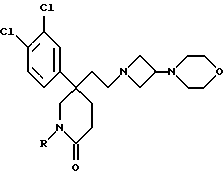
получают способом, подобным способу примера 100, используя в качестве исходных соединений тот же пиперидон и 3,5-ди-(трифторметил)бензобромид или 2-метансульфонилоксиэтил-циклопропан (см. препаративный пример 157), соответственно.
Пример 103
1-Бензил-5-(3,4-дихлорфенил)-5-(2-[3-(1-оксотиоморфолино)- азетидин-1-ил]этил)-2-пиперидон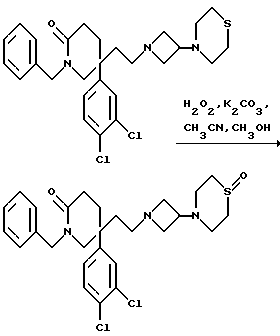
К охлажденному льдом раствору метанола (7 мл), тиоморфолина (см. пример 2) (0,76 мл, 1,0 мол. экв.), ацетонитрила (0,09 г, 1,5 мол. экв.) и карбоната калия (0,147 г, 0,72 мол. экв.) добавляют, в течение 30 минут, 30% (в/о) раствор пероксида водорода в воде (0,175 г, 1,05 мол. экв.) в метаноле (5 мл). Реакционную смесь перемешивают при 0oC в течение 2 часов и затем позволяют нагреваться до комнатной температуры и перемешивают еще в течение 16 часов. Затем удаляют большую часть растворителя при пониженном давлении при комнатной температуре. Добавляют насыщенный водный раствор бикарбоната натрия (20 мл), и смесь экстрагируют этилацетатом (3х50 мл). Объединенные органические слои сушат над сульфатом магния и упаривают при пониженном давлении. Полученное масло очищают колоночной флэш-хроматографией на силикагеле, элюируя метанолом с дихлорметаном (1:9, по объему), и получают названное в заголовке соединение (121 мг).
ТХС Rf= 0,10 (диоксид кремния, метанол: дихлорметан, 1 : 9, по объему). МСНР m/z = 534 (m+1)+. Элем. анализ: найдено: С - 57,91; Н - 5,77; N - 7,58. Для C27H33N3Cl2O2S • 0,37CH2Cl2 вычислено: C - 58,05; H - 6,01; N - 7,42%.
1H ЯМР (CDCl3): δ = 1,1 - 1,3 (м, 1Н), 1,4-1,8 (м, 1Н), 1,9-2,3 (м, 5Н), 2,4 - 2,6 (м, 5Н), 2,6 - 2,7 (м, 6Н), 2,7 - 2,9 (м, 1Н), 2,9 - 3,1 (м, 1H), 3,2 - 3,4 (м, 2H), 3,4 - 3,6 (м, 1H), 4,4 (д, 1H), 4,8 (д, 1H), 6,8 (д, 1H), 7,1 (с, 1H), 7,3 - 7,4 (м, 6Н) ppm.
Пример 104
1-Бензил-5-(3,4-дихлорфенил)-5-(2-[3-(эндо-3-гидрокси-8- азабицикло[3,2,1] окт-8-ил)-азетидин-1-ил]этил)-2-пиперидон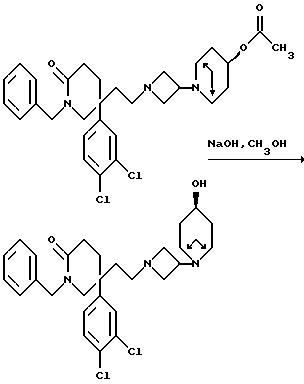
Смесь пиперидона (см. пример 24) (78 мг), 6N водного раствора гидроксида натрия (0,5 мл) и метанола (1,5 мл) перемешивают при комнатной температуре в течение 16 часов. Раствор концентрируют при пониженном давлении, и затем добавляют воду (5 мл) и дихлорметан (10 мл). Слои разделяют, и водную фазу затем экстрагируют дихлорметаном (2х10 мл). Объединенные органические слои сушат над безводным сульфатом натрия и затем фильтруют. Удаляют растворитель из фильтрата при пониженном давлении, и получают названное в заголовке соединение в виде белой пены (67 мг).
МСНР m/z = 543 (m+1)+. Элем. анализ: найдено: C - 62,15; Н - 6,11; N - 7,43. Для C30H39Cl2N3O • 0,56CH2Cl2 вычислено: C - 62,40; H - 6,87; N - 7,16%.
1Н ЯМР (CDCl3): δ = 1,5 - 2,2 (м, 18Н), 2,4 - 2,5 (м, 1Н), 2,6 - 2,7 (м, 2H), 2,95 (ш, с, 2Н), 3,1 - 3,2 (м, 1Н), 3,25 - 3,35 (м, 3H), 3,5 - 3,6 (м, 1H), 3,95 - 4,05 (м, 1H), 4,2 (д, 1H), 4,8 (д, 1H), 6,75-6,8 (м, 1Н), 7,1 (д, 1Н), 7,2 - 7,4 (м, 6Н) ppm.
Пример 105
5(S)-1-Циклопропилметил-5-(3,4-дихлорфенил)-5-(2-[3-(пиперазин-1-ил) азетидин-1-ил]этил)-2-пиперидон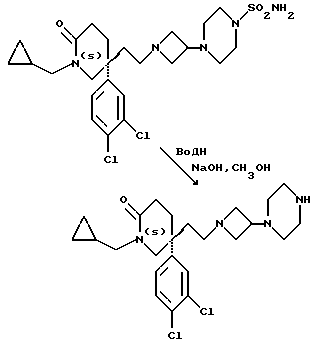
К раствору соединения примера 32 (1,36 г, 2,5 ммоль) в метаноле (15 мл) добавляют 10% (в/в) водный раствор гидроксида натрия (5,44 мл). Смесь кипятят с обратным холодильником в течение 48 часов. Затем удаляют метанол испарением при пониженном давлении, и остаток подкисляют до pH 7, используя 2N водный раствор хлористоводородной кислоты. Смесь экстрагируют дихлорметаном (2х40 мл). Объединенные органические экстракты упаривают досуха при пониженном давлении, и получают названное в заголовке соединение в виде белой пены (0,5 г).
ТХС Rf = 0,1 (диоксид кремния, конц. водн. раствор аммиака : метанол : дихлорметан, 20 : 80 : 320, по объему). МСНР m/z = 465 (m)+.
1H ЯМР (CDCl3): δ = 0,2 - 0,4 (м, 2Н), 0,5 - 0,7 (м, 2Н), 1,0 - 1,1 (м, 1H), 1,6 - 2,6 (м, 17H), 2,7 - 2,8 (м, 2H), 2,9 - 3,05 (м, 2H), 3,1 - 3,2 (м, 1H), 3,4 - 3,6 (м, 3Н), 3,7 - 3,85 (м, 1H), 7,1 - 7,2 (м, 1H), 7,3 - 7,5 (м, 2H) ppm.
Пример 106
5(S)-1-(2- Циклопропилэтил)-5-(2-[3-(4-циклопропилметил- аминопиперидин-1-ил)азетидин-1-ил]этил)-5-(3,4-дихлорфенил)-2- пиперидон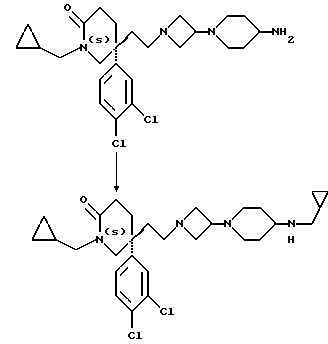
К раствору соединения примера 115 (0,1 г, 0,11 ммоль) в тетрагидрофуране (3 мл) в атмосфере азота добавляют циклопропилкарбоксальдегид (8 мг) и триэтиламин (0,017 мл). После перемешивания в течение 5 минут добавляют триацетоксиборогидрид натрия (32 мг) и ледяную уксусную кислоту (0,007 мл), и реакционную смесь перемешивают при комнатной температуре в течение 16 часов. Реакционную смесь концентрируют при пониженном давлении, и остаток распределяют между дихлорметаном (12 мл) и 10% (в/в) водным раствором карбоната натрия (4 мл). Слои разделяют, и водную фазу экстрагируют дихлорметаном (2х10 мл). Объединенные органические экстракты сушат над безводным сульфатом магния, фильтруют и удаляют растворитель из фильтрата путем испарения при пониженном давлении. Остаток хроматографируют на силикагеле, элюируя дихлорметаном с метанолом и концентрированным раствором аммиака (89 : 10 : 1, по объему). Получают названное в заголовке соединение (37 мг).
ТХС Rf = 0,18 (диоксид кремния, дихлорметан : метанол : конц. раствор аммиака, 89 : 10 : 1, по объему). МСНР m/z = 547 (m+1)+.
1H ЯМР (CDCl3): δ = 0,1 - 0,15 (м, 4Н), 0,4 - 0,5 (м, 4Н), 0,6 - 0,7 (м, 1H), 0,9 - 1,0 (м, 1Н), 1,25 - 1,4 (м, 2H), 1,45 - 1,7 (м, 4Н), 1,75 - 1,9 (м, 5H), 1,95 - 2,2 (м, 5H), 2,3 - 2,45 (м, 4Н), 2,6 - 2,7 (м, 4Н), 2,8 - 2,9 (м, 1H), 3,3 - 3,4 (м, 4Н), 3,5 - 3,7 (м, 2H), 7,0 - 7,4 (м, 3H) ppm.
Примеры 107 и 108
Соединения двух следующих, сведенных в табл. 5 примеров, имеющие общую формулу: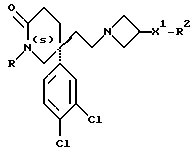
получают способом, подобным способу примера 106, используя в качестве исходных соединений соответствующий амин (см. примеры 105 и 113) и циклопропилкарбоксальдегид.
Пример 109
Дитрифторацетат 5(S)-5-(2-[3-(4-аминосульфонилпиперазин-1- ил)азетидин-1-ил]этил)-1-(5-карбоксипентил)-5-(3,4-дихлорфенил)-2- пиперидона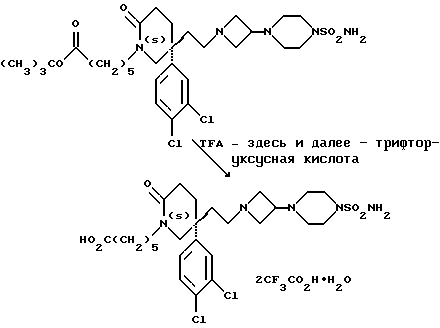
К раствору соединения примера 57 (30 мг, 0,045 ммоль) в дихлорметане (1 мл), при 0oC и в атмосфере азота, добавляют трифторуксусную кислоту (0,05 мл). Смесь перемешивают в течение 2 часов при комнатной температуре. Растворитель дихлорметан удаляют при пониженном давлении, и получают смолу, которая кристаллизуется после обработки диэтиловым эфиром, и после фильтрации получают названное в заголовке соединение в виде белого твердого вещества (20 мг).
ТХС Rf = 0,48 (диоксид кремния, метанол : дихлорметан, 1 : 9, по объему). МСНР m/z = 604 (m+1)+. Элем.анализ: найдено: C - 42,47; Н - 4,73; N - 7,90. Для C26H39Cl2N5O5S • 2CF3CO2H • H2O вычислено: C - 42,46; Н - 4,88; N - 8,25%.
Пример 110
5-(2-[3-(4-Карбоксипиперидин-1-ил)-азетидин-1-ил] этил)-1- циклогексилметил-5-(3,4-дихлорфенил)-2-пиперидон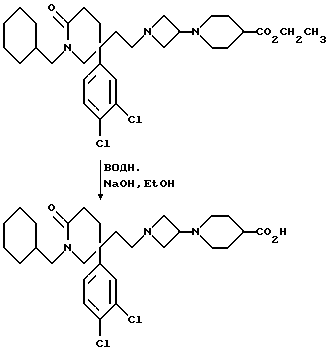
К раствору соединения примера 95 в этаноле (1 мл) добавляют 1N водный раствор гидроксида натрия (0,24 мл), и смесь перемешивают при комнатной температуре в течение 16 часов. Этанол удаляют при пониженном давлении, и к остатку добавляют воду (1 мл). Доводят pH раствора до 5, используя 2N водный раствор хлористоводородной кислоты, и получают масло, которое кристаллизуется при царапании. Получающееся в результате твердое вещество отфильтровывают, обрабатывают водой (2х3 мл) и затем диэтиловым эфиром (3х3 мл), затем сушат при пониженном давлении при 70oC и получают названное в заголовке соединение (40 мг).
МСНР m/z = 550 (m+1)+. Элем. анализ: найдено: C - 55,80; Н - 7,14; N - 6,44. Для C29H41N3Cl2O3 • 0,75H2O • NaCl вычислено: C - 55,95; Н - 6,88; N - 6,75%.
Пример 111
5-(S)-(2-[3-(4-Карбоксипиперидин-1-ил)-азетидин-1-ил] этил)-1-циклопропилметил-5-(3,4-дихлорфенил)-2-пиперидон
Это соединение получают способом, подобным способу примера 110, используя в качестве исходного вещества соответствующий метиловый эфир (см. пример 59) и 3,8 мол. экв. водного раствора гидроксида натрия. МСНР m/z = 508 (m)+.
Пример 112
Тритрифторацетат 5(S)-5-(2-[3-(4-аминопиперидин-1-ил)-азетидин-1- ил]этил)-1-циклопропилметил-5-(3,4-дихлорфенил)-2-пиперидона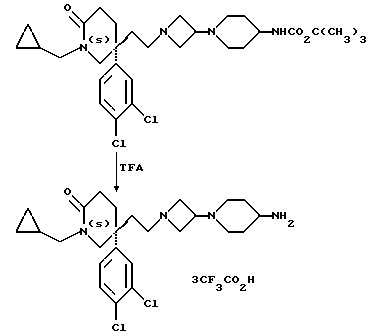
К раствору соединения примера 48 (1,4 г, 24,1 ммоль) в дихлорметане (20 мл), при +4oC и в атмосфере азота, добавляют трифторуксусную кислоту (6,6 мл), и реакционную смесь перемешивают при комнатной температуре в течение 1 часа. Растворитель и избыток трифторуксусной кислоты удаляют при пониженном давлении, и получают названное в заголовке соединение (907 мг). МСНР m/z = 479 (m+1)+.
Примеры со 113 по 115
Соединения приведенных ниже, сведенных в табл. 6 примеров, имеющие общую формулу: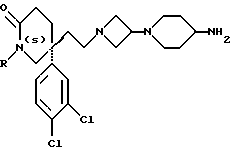
получают способом, подобным способу примера 112, используя соответствующий, защищенный трет-бутоксикарбонилом амин (см. примеры 46, 51 и 54) и трифторуксусную кислоту.
Пример 116
Тритрифторацетат 5-(2-[3-(4-аминопиперидин-1-ил)-азетидин-1-ил] этил)-1-циклогексилметил-5-(3,4-дихлорфенил)-2 пиперидона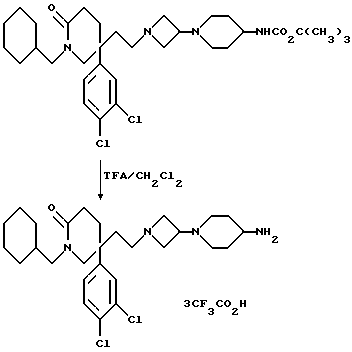
К раствору соединения примера 96 (0,53 г, 0,85 ммоль) в дихлорметане (5 мл), при 0oC и в атмосфере азота, постепенно добавляют трифторуксусную кислоту, и раствор перемешивают при комнатной температуре в течение 1 часа. Избыток трифторуксусной кислоты и дихлорметан удаляют при пониженном давлении, остаток обрабатывают дихлорметаном (5 мл) и удаляют растворитель при пониженном давлении. Остаток обрабатывают диэтиловым эфиром, фильтруют, и полученное твердое вещество быстро промывают диэтиловым эфиром, затем сушат при пониженном давлении при 70oC и получают названное в заголовке соединение (580 мг). МСНР m/z = 522 (m+1)+.
H1 ЯМР (CDCl3)/ d6-ДМСО: δ = 0,75 - 0,9 (м, 2Н), 0,95 - 1,1 (м, 3Н), 1,35 - 4,0 (м, 32Н), 6,95 -7,0 (м, 1H), 7,15- 7,20 (м, 1H), 7,30 - 7,35 (м, 1H), 8,35 (ш, с, 2Н) ppm.
Пример 117
1-Циклогексилметил-5-(3,4-дихлорфенил)-5-(2-[3- (4-метансульфонамидопиперидин-1-ил)азетидин-1-ил]этил)-2-пиперидон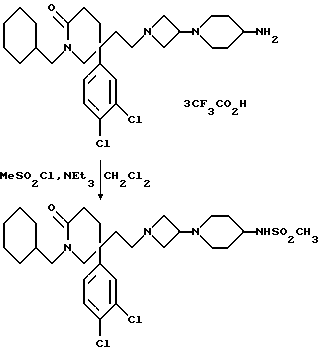
К раствору соединения примера 116 (0,29 г, 0,34 ммоль) и триэтиламина (0,23 мл) в дихлорметане (6 мл), при 0oC и в атмосфере азота, добавляют метансульфонилхлорид (0,035 мл). Смесь перемешивают при комнатной температуре в течение 16 часов. Дихлорметан удаляют при пониженном давлении, остаток растворяют в этилацетате (30 мл) и промывают 1% (в/в) водным раствором бикарбоната натрия (5 мл). Органическую фазу сушат, используя безводный сульфат магния, фильтруют, и удаляют растворитель из фильтрата при пониженном давлении, и получают масло. Это масло хроматографируют на силикагеле, элюируя метанолом с дихлорметаном (1 : 9, по объему), и получают названное в заголовке соединение (85 мг).
ТХС Rf = 0,25 (диоксид кремния, метанол : дихлорметан, 1 : 9, по объему).
1H ЯМР (CDCl3): δ = 0,9 - 1,1 (м, 2Н), 1,15 - 1,30 (м, 3H), 1,45 - 2,25 (м, 19H), 2,30 - 2,40 (м, 1H), 2,55 - 2,7 (м, 4H), 3,8 - 3,9 (м, 1H), 2,95 (с, 3H), 3,1- 3,2 (м, 1H), 3,3 - 3,4 (м, 5H), 3,5-3,6 (м, 1H), 4,1-4,15 (м, 1H), 7,1-7,15 (м, 1H), 7,3 - 7,45 (м, 2H) ppm.
Пример 118
5(S)-1-Циклопропилметил-5-(3,4-дихлорфенил)-5-(2-[3-( 4-метансульфонамидопиперидин-1-ил)азетидин-1-ил]этил)-2-пиперидон
Названное в заголовке соединение получают способом, подобным способу примера 117, используя в качестве исходного вещества соответствующий аминопиперидин (см. пример 112).
МСНР m/z = 557 (m+1)+.
1H ЯМР (CDCl3): δ = 0,25 - 0,35 (м, 2Н), 0,5 - 0,65 (м, 2Н), 0,8 - 1,1 (м, 3H), 1,2 - 1,35 (м, 3H), 1,5 - 1,7 (м, 3Н), 1,8 - 2,4 (м, 9Н), 2,6 - 2,8 (м, 3H), 2,85 - 3,0 (м, 3H), 3,1 - 3,2 (м, 1H), 3,25 - 3,5 (м, 4H), 3,7 - 3,8 (м, 1H), 4,15 - 4,2 (м, 1H), 7,1 - 7,4 (м, 3H) ppm.
Пример 119
5(S)-5-(2-[3-(4-Карбамоилпиперазин-1-ил)азетидин-1-ил] этил)-1-(циклопропилметил)-5-(3,4-дихлорфенил)-2 пиперидон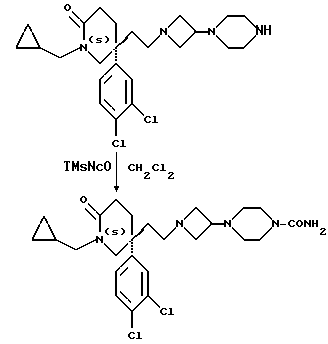
К раствору соединения примера 105 (100 мг, 0,2 ммоль) в дихлорметане (3 мл), при комнатной температуре и в атмосфере азота, добавляют триметилсилилизоцианат (0,032 мл), и смесь перемешивают при комнатной температуре в течение 16 часов. Растворитель удаляют при пониженном давлении, и продукт очищают колоночной хроматографией, используя силикагель, элюируя дихлорметаном с метанолом и концентрированным раствором аммиака (89 : 10 : 1, по объему). Получают названное в заголовке соединение (69 мг).
ТХС Rf = 0,25 (диоксид кремния, дихлорметан : метанол : конц. раствор аммиака, 89 : 10 : 1, по объему). МСНР m/z = 508 (m+1)+.
1H ЯМР (CDCl3): δ = 0,25 - 0,4 (м, 2Н), 0,55 - 0,7 (м, 2Н), 0,95 - 1,1 (м, 1H), 1,6-1,9 (м, 2Н), 1,95 - 2,4 (м, 10Н), 2,7 - 2,75 (м, 2Н), 2,9 - 2,95 (м, 1H), 3,1- 3,2 (м, 1H), 3,35 - 3,5 (м, 8Н), 3,7 - 3,8 (м, 1H), 4,4 (ш, с, 2Н), 7,1 - 7,4 (м, 3Н) ppm.
Пример 120
5(S)-5-(2-[3-(4-Ацетамидопиперидин-1-ил)азетидин-1-ил]этил)-1- циклопропилметил-5-(3,4-дихлорфенил)-2-пиперидон
К раствору соединения примера 112
(300 мг, 3,65 ммоль) и триэтиламина (255 мкл) в дихлорметане (40 мл), при комнатной температуре и в атмосфере азота, добавляют уксусный ангидрид (4 мкл), и реакционную смесь перемешивают в течение 18 часов. Затем добавляют дополнительную порцию уксусного ангидрида (80 мкл), и перемешивание продолжают в течение 1 часа. Реакционную смесь промывают водой (2х30 мл), а затем солевым раствором (30 мл). Объединенные органические слои сушат, используя безводный сульфат магния, и затем упаривают при пониженном давлении, и получают желтое масло. Это масло растворяют в этилацетате (40 мл) и экстрагируют 2N раствором соляной кислоты (2х100 мл). Объединенные кислые водные экстракты подщелачивают насыщенным водным раствором бикарбоната натрия, и водный слой экстрагируют, используя этилацетат (2х100 мл). Объединенные органические слои сушат, используя безводный сульфат натрия. Растворитель удаляют при пониженном давлении, и получают названное в заголовке соединение (53 мг).
ТХС Rf = 0,1 (диоксид кремния, метанол : дихлорметан, 1 : 9, по объему). МСНР m/z = 629 (m)+.
1H ЯМР (CDCl3): δ = 0,2 - 0,4 (м, 2Н), 0,5 - 0,7 (м, 2Н), 0,95 - 1,05 (м, 1Н), 1,3 - 1,4 (м, 2Н), 1,5 - 1,7 (м, 1 Н), 1,75 -2,2 (м, 13H), 2,3 - 2,4 (м, 1H), 2,5- 2,7 (м, 4H), 2,95 (т, 1H), 3,05 - 3,1 (м, 1H), 3,4 - 3,6 (м, 4H), 3,8 (д, 2Н), 5,2 (с, 1H), 7,1 (д, 1H), 7,35 - 7,4 (м, 2Н) ppm.
Примеры 121 и 122
Соединения двух следующих сведенных в табл. 7 примеров, имеющие общую формулу: -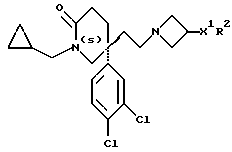
получают способом, подобным способу примера 120, используя в качестве исходного вещества соответствующий пиперазин (см. пример 105) и соответствующий ацилирующий агент.
Подстрочные примечания
1. Очищают колоночной хроматографией, используя силикагель, элюируя дихлорметаном с метанолом (90 : 10, по объему).
2. В качестве ацилирующего агента используют ацетилхлорид.
3. В качестве ацилирующего агента используют ангидрид трифторуксусной кислоты.
Пример 123
5(S)-5-(2-[3-(4-Аминосульфонилпиперазин-1-ил)азетидин-1-ил] этил)-1-циклопропилметил-5-(3,4-дихлорфенил)-2-пиперидон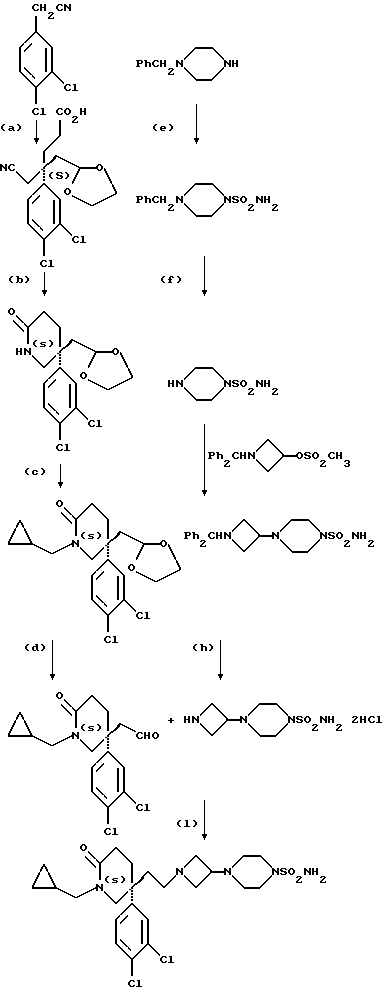
(а) 4(S)-4-Циано-4-(3,4-дихлорфенил)-5-(1,3-диоксолан-2-ил) пентан-1-овая кислота
К 1,0 М раствору гексаметилдисилилазида лития в тетрагидрофуране (4,69 л), при 5oC и в атмосфере азота, добавляют по каплям, в течение 45 минут, раствор 3,4-дихлорфенилацетонитрила (750 г, 4,28 моль) в тетрагидрофуране (750 мл). Реакционную смесь перемешивают в течение 2 часов. Реакционную смесь снова охлаждают до 5oC и по каплям, в течение 50 минут, добавляют раствор 2-бромметил-1,3-диоксолана (782 г) в тетрагидрофуране (780 мл). Добавляют, порциями, иодид тетра-н-бутиламмония (75 г), и смеси дают возможность нагреваться до комнатной температуры и перемешивают в течение 14 часов. Затем реакционную смесь охлаждают до 5oC и добавляют по каплям 1,0 М раствор гексаметилдисилилазида лития в тетрагидрофуране (4,69 л). Смесь перемешивают в течение 5 часов при комнатной температуре. Раствор охлаждают до 5oC и по каплям, в течение 50 минут, добавляют раствор 3-бромпропаноата (840,5 г) в тетрагидрофуране (840 мл). Реакционную смесь перемешивают в течение 14 часов. Реакционную смесь охлаждают до 5oC и добавляют 1,5 М водный раствор гидроксида натрия (содержащий 255 г гидроксида натрия), и смесь перемешивают в течение 14 часов. Добавляют воду (5 л), и смесь экстрагируют этилацетатом (2х3 л). Объединенные органические экстракты промывают водой (2х5 л). Водные фазы объединяют и подкисляют до pH 1, используя 5N соляную кислоту, и затем экстрагируют этилацетатом (2 х 3 л). Объединенные органические экстракты концентрируют при пониженном давлении до концентрации приблизительно 3 мл/г продукта (теоретический выход).
Вышеописанную экспериментальную процедуру затем повторяют в идентичном масштабе.
К объединенным органическим растворам от обеих реакций добавляют (S)-(-)-альфа-метилбензиламин (1,13 кг), и смесь перемешивают в течение 14 часов. Густую суспензию затем перемешивают при охлаждении на ледяной бане в течение 2 часов, фильтруют, твердое вещество промывают этилацетатом (2х1 л), и затем сушат при пониженном давлении при 35oC, и получают 1,85 кг вещества.
Часть этого вещества (1,34 кг) растворяют в смеси бутанона (2 л) и воды (503 мл) при кипячении с обратным холодильником. Добавляют дополнительное количество бутанона (4,7 л), и раствор постепенно охлаждают до комнатной температуры в течение ночи. Получающееся в результате твердое вещество отфильтровывают (фильтрат используют в препаративном примере 192), промывают бутаноном (2х1 л) и сушат при пониженном давлении при 35oC в течение 10 часов. Получают 563 г вещества (степень чистоты (е.е.) 93,8%). Дополнительная перекристаллизация из бутанона и воды дает названное в заголовке соединение в виде соли (S)-(-)-альфа-метилбензиламина с е.е. 99,8%. К раствору этой соли в этилацетате и воде, при перемешивании, добавляют 5N соляную кислоту до достижения pH 1. Смесь перемешивают еще в течение 30 минут, слои разделяют, и водную фазу экстрагируют этилацетатом. Объединенные органические слои промывают водой, и удаляют растворитель испарением при пониженном давлении. Получают названное в заголовке соединение.
1H ЯМР (CDCl3): δ = 2,05 - 2,35 (м, 4Н), 2,4 - 2,65 (м, 2Н), 3,7 - 4,0 (м, 4Н), 4,75 - 4,85 (м, 1Н), 7,25 - 7,55 (м, 3Н), 9,9 (с, ш, 1Н, кислота) ррm.
(b) 5(S)-5-(3,4-Дихлорфенил-5-(1,3-диоксолан-2-илметил)-2(1Н)- пиперидон
К раствору соединения примера 123(а) (13,5 г, 39,22 ммоль) в ледяной уксусной кислоте (130 мл) добавляют оксид платины (1,21 г), и смесь перемешивают в атмосфере водорода при 414 кПа (60 ф/д2) и при комнатной температуре в течение 17 часов. Катализатор удаляют фильтрацией, и добавляют дополнительную порцию оксида платины (1,21 г). Реакционную смесь затем перемешивают в атмосфере водорода при 414 кПа (60 ф/д2) и при комнатной температуре в течение 48 часов. Катализатор удаляют фильтрацией, и концентрируют раствор при пониженном давлении. Остаток растворяют в этилацетате (80 мл) и промывают насыщенным водным раствором бикарбоната натрия (2 х 75) мл. Затем органическую фазу отделяют, и удаляют растворитель при пониженном давлении. Получающееся в результате твердое вещество перемешивают в растворе гексана (20 мл) и этилацетата (20 мл) в течение 2 часов при 0oC, затем отфильтровывают, и получают названное в заголовке соединение (8,15 г).
1H ЯМР (CDCl3): δ = 1,85 - 1,95 (м, 1Н), 2,0 - 2,25 (м, 4Н), 2,35 - 2,4 (м, 1Н), 3,45 - 3,55 (м, 1 Н), 3,65 - 3,75 (м, 2Н), 3,8 - 3,9 (м, 3H), 4,35 - 4,4 (м, 1Н), 6,15 (с, ш, 1Н), 7,2-7,45 (м, 3Н) ppm.
(с) 5(S)-1-Циклопропилметил-5-(3,4-дихлорфенил-5-(1,3-диоксолан- 2-илметил)-2-пиперидон
К раствору соединения примера 123 (b) (38,6 г, 117 ммоль) в диметилсульфоксиде (190 мл) добавляют гидроксид калия (19,7 г), и смесь перемешивают при комнатной температуре в течение 20 минут. Затем в течение 20 минут добавляют бромметилциклопропан (17,37 г), и реакционную смесь перемешивают еще в течение 140 минут. Реакционную смесь выливают в смесь льда (100 г) с водой (900 мл), и смесь экстрагируют дихлорметаном (2х400 мл). Объединенные органические слои промывают водой (400 мл), и удаляют растворитель при пониженном давлении. Получают названное в заголовке соединение (45,4 г).
1H ЯМР (CDCl3): δ 0,3 - 0,4 (м, 2Н), 0,55 - 0,65 (м, 2Н), 1,05-1,15 (м, 1Н), 1,9 - 1,95 (м, 1H), 2,0 - 2,25 (м, 4Н), 2,35 - 2,45 (м, 1H), 3,15 - 3,2 (м, 1Н), 3,5 - 3,55 (м, 2H), 3,65 - 3,75 (м, 2H), 3,9 - 4,0 (м, 3H), 4,35 - 4,4 (м, 1H), 7,2 - 7,5 (м, 3H) ppm.
(d) 5(S)-1-Циклопропилметил-5-(3,4-дихлорфенил)-5-формилметил- 2-пиперидон
К раствору соединения примера 123 (с) (73,16 г, 190 ммоль) в тетрагидрофуране (730 мл) при 5oC в течение 20 минут добавляют 5N соляную кислоту (730 мл). Реакционную смесь перемешивают при комнатной температуре в течение 17 часов. Тетрагидрофуран удаляют при пониженном давлении, остаток разбавляют водой (200 мл) и экстрагируют этилацетатом (2х500 мл). Объединенные органические слои затем промывают водой (500 мл), и удаляют растворитель при пониженном давлении. Получают названное в заголовке соединение (62,1 г).
1H ЯМР (CDCl3): δ = 0,25 - 0,35 (м, 2Н), 0,55 - 0,65 (м, 2H), 1,05 - 1,1 (м, 1H), 2,15 - 2,25 (м, 3H), 2,35 - 2,5 (м, 1Н), 2,65 - 2,75 (м, 1H), 2,95 - 3,05 (м, 1H), 3,15 - 3,2 (м, 1Н), 3,45 - 3,6 (м, 2H), 3,95 - 4,0 (м, 1Н), 7,2 - 7,45 (м, 3H), 9,5 (с, 1H) ppm.
(e) 1-Аминосульфонил-4-бензилпиперазин
Раствор 1-бензилпиперазина (5 г, 28,4 ммоль) и сульфамида (2, 77 г) в 1,4-диоксане (25 мл) кипятят с обратным холодильником в течение 24 часов. Раствор охлаждают и выливают в воду (100 мл). Твердое вещество отфильтровывают, промывают толуолом (100 мл) и сушат при пониженном давлении. Получают названное в заголовке соединение (4,75 г).
1H ЯМР (d6-ДМСО): δ = 2,41 - 2,5 (м, 4Н), 2,95 - 3,0 (м, 4Н), 3,5 (с, 2Н), 6,75 (с, 2Н), 7,25 - 7,35 (м, 5Н) ppm.
(f) 1-Аминосульфонилпиперазин
Смесь соединения примера 123 (e) (20 г, 78,3 ммоль) и 10% (в/в) палладия-на-угле (4 г) в этаноле (140 мл) перемешивают в атмосфере водорода при 345 кПа (50 ф/д2) и при 50oC в течение 23 часов. Катализатор удаляют фильтрацией и промывают этанолом (100 мл). Фильтрат концентрируют при пониженном давлении до объема приблизительно 40 мл, и суспензию выдерживают при 0-5oC в течение 12 часов. Твердое вещество отфильтровывают и получают первую порцию соединения (2 г). Ранее отделенный катализатор кипятят с обратным холодильником в этаноле (150 мл). Смесь фильтруют в горячем состоянии, и прокладку промывают этанолом (50 мл). Растворитель удаляют при пониженном давлении. Твердое вещество перемешивают с ацетоном (100 мл) и отфильтровывают, получают вторую порцию названного в заголовке соединения (8 г).
1H ЯМР (d6-ДМСО): δ = 2,3 - 2,9 (м, 9Н), 6,65 (с, ш, 1Н) ppm.
(g) 1-Аминосульфонил-4-(1-дифенилметилазетидин-3-ил)-пиперазин
Раствор 1-дифенилметил-3-метансульфонилоксиазетидина (см. препаративный пример 54) (4,8 г, 15,1 ммоль) и 1-аминосульфонилпиперазина (см. пример 123 (f) (5 г) в ацетонитриле (50 мл) кипятят с обратным холодильником в течение 4 часов. Реакционную смесь охлаждают, твердое вещество отфильтровывают и промывают ацетонитрилом (50 мл). Фильтрат концентрируют при пониженном давлении, и остаток промывают горячим толуолом (50 мл), охлаждают, твердое вещество отфильтровывают и промывают толуолом (50 мл), затем продукт дополнительно очищают, перемешивая с горячим этилацетатом (3 мл), охлаждая и отфильтровывая, и получают названное в заголовке соединение (0,47 г).
1H ЯМР (d6-ДМСО): δ 2,25 - 2,3 (м, 4Н), 2,7 - 2,75 (м, 2Н), 2,85 - 2,95 (м, 3Н), 3,05 - 3,1 (м, 2Н), 3,2 - 3,25 (м, 2Н), 4,4 (м, 1Н), 6,7 (м, 2Н), 7,15 - 7,4 (м, 10Н) ppm.
(h) Дигидрохлорид 1-аминосульфонил-4-(азетидин-3-ил)-пиперазина
К раствору соединения примера 123 (g) (15 г) в метаноле (50 мл) добавляют 10% водную соляную кислоту (9,4 мл) и катализатор Pearlman ((20% (в/в Pd(ОН)2-на-угле) (0,6 г). Смесь встряхивают в атмосфере водорода, используя качалку Парра, в течение 14 часов. После этого катализатор удаляют фильтрацией, фильтрат возвращают на качалку Парра, и добавляют дополнительные 0,6 г катализатора Pearlman. Реакционную смесь встряхивают в атмосфере водорода в течение 14 часов. Катализатор удаляют фильтрацией и промывают водой (100 мл). Фильтрат концентрируют при пониженном давлении. Остаток перемешивают с ацетонитрилом (50 мл) в течение 1 часа, и смесь оставляют стоять в течение 14 часов. Твердое вещество отфильтровывают и сушат при пониженном давлении. Получают названное в заголовке соединение (3,28 г).
1H ЯМР (d6-ДМСО): δ = 2,35 - 2,45 (м, 5Н), 2,9 - 3,0 (м, 4Н), 3,25 - 3,35 (м, 1Н), 3,75 - 3,9 (м, 4Н), 6,8 (с, ш, 2Н) ppm.
i) 5(S)-5-(2-[3 (4-Аминосульфонилпиперазин-1-ил) азетидин-1-ил]этил)-1-циклопропилметил-5-(3,4-дихлорфенил)-2-пиперидон
К раствору соединения примера 123 (h) (18,97 г) в тетрагидрофуране (140 мл) при комнатной температуре добавляют триэтиламин (18 мл), и смесь перемешивают в течение 30 минут. Затем добавляют раствор соединения примера 123 (d) (20 г) в тетрагидрофуране (60 мл). Через 2 часа раствор охлаждают до 2oC, и добавляют порциями триацетоксиборогидрид натрия (17,44 г), после чего добавляют уксусную кислоту (3,37 мл), и реакционной смеси дают возможность нагреваться до комнатной температуры и перемешивают в течение 2 часов. Реакционную смесь выливают в воду (50 мл), и добавляют 10% (в/в) водный раствор бикарбоната натрия до достижения pH 9. Добавляют этилацетат (200 мл), и слои разделяют. Водную фазу экстрагируют этилацетатом (50 мл), объединенные органические экстракты промывают 10% (в/в) водным раствором бикарбоната натрия (100 мл), и удаляют растворитель при пониженном давлении. Получают названное в заголовке соединение (28,27 г).
1H ЯМР - как для соединения примера 32.
Фармакологические результаты
Выбранные представители соединений примеров проверяются in vitro на их аффинность к человеческому NK2-рецептору путем проверки их способности конкурировать с [125I] NKA при связывании с мембранами, полученными из клеток яичника китайского хомяка, экспрессирующих клонированный человеческий NK2-рецептор (способ А), и по их способности противодействовать сократительному действию [β Ala8] NKA(4-10) в легочной артерии кролика (способ В), в соответствии со способами, описанными на сс. 46 и 48 описания.
Результаты приведены в табл. 8.
Приведенные далее препаративные примеры иллюстрируют получение некоторых исходных веществ, применяемых при синтезе соединений предшествующих примеров.
Препаративный пример 1
2-(3,4-Дихлорфенил)-4-(тетрагидропиран-2-илокси)бутаннитрил
К смеси 60% (в/в) дисперсии гидрида натрия в масле (19,24 г, 1,05 мол. экв.) в сухом тетрагидрофуране (450 мл), при 0oC и в атмосфере азота, добавляют по каплям, в течение 40 минут, раствор 3,4-дихлорфенилацетонитрила (89,5 г, 1 мол. экв.) в сухом тетрагидрофуране (450 мл). Еще через 30 минут добавляют раствор 2-бромэтокситетрагидропирана (100 г, 1 мол. экв.) в тетрагидрофуране (100 мл), и смеси позволяют нагреваться до комнатной температуры и перемешивают в течение 14 часов. Добавляют 30% водный раствор хлорида аммония (500 мл), и смесь экстрагируют диэтиловым эфиром (2х400 мл). Органические слои объединяют и промывают водой (2х400 мл), сушат над сульфатом магния, и удаляют растворитель при пониженном давлении. Остаток затем хроматографируют, используя силикагель, элюируя с градиентом растворителя диэтилового эфира с гексаном (от 1 : 9 до 1 : 1, по объему), и получают названное в заголовке соединение (51 г).
ТХС Rf = 0,55 (диоксид кремния, метилтретбутиловый эфир : гексан, 1 : 1, по объему). МСНР m/z = 333 (m+NH4)+.
1H ЯМР (CDCl3): δ = 1,5 - 1,9 (м, 6Н), 2,05 - 2,3 (м, 2Н), 2,4 - 2,65 (м, 2Н), 2,8 - 2,95 (м, 2Н), 4,0 - 4,1 (м, 1Н), 4,5 - 4,6 (м, 1Н), 7,2 - 7,25 (м, 1Н), 7,25 - 7,5 (м, 2Н) ppm.
Препаративный пример 2
Этил-4-циано-4-(3,4-дихлорфенил)-6-(тетрагидропиран-2-ил-окси) гексаноат
К раствору диизопропиламина (15 мл, 0,77 мол. экв.) в тетрагидрофуране (80 мл), при -78oC и в атмосфере азота, добавляют н-бутиллитий (77,3 мл 2,5 М раствора в гексане, 1,4 мол. экв.), и затем позволяют раствору нагреваться до комнатной температуры в течение 2 часов. Раствор охлаждают до -78oC, и постепенно добавляют раствор соединения препаративного примера 1 (43,9 г, 138 ммоль) в тетрагидрофуране (180 мл). Получающемуся в результате раствору дают возможность постепенно, в течение 2 часов, нагреваться до комнатной температуры. Затем раствор охлаждают до -78oC, и добавляют по каплям раствор этил-3-бромпропаноата (22,36 мл, 1,3 мол. экв.) в тетрагидрофуране (70 мл). Затем добавляют иодид тетра-н-бутиламмония (50 г, 1 мол. экв.), и реакционной смеси дают возможность нагреваться до комнатной температуры и перемешивают в течение 14 часов. Затем добавляют воду (10 мл), и раствор концентрируют при пониженном давлении. Добавляют воду (400 мл) и солевой раствор (400 мл), и смесь экстрагируют этилацетатом (2х500 мл). Объединенные органические слои промывают водой (2х300 мл), сушат над сульфатом магния, и удаляют растворитель при пониженном давлении. Хроматография с использованием силикагеля и элюированием диэтиловым эфиром с гексаном (1 : 1, по объему) дает названное в заголовке соединение (35 г).
ТХС Rf = 0,30 (диоксид кремния, диэтиловый эфир : гексан, 1 : 1, по объему).
1H ЯМР (CDCl3): δ = 1,25 (т, 3Н), 1,35 - 1,8 (м, 6Н), 2,05 - 2,55 (м, 6Н), 3,3 - 3,45 (м, 2Н), 3,65 - 3,8 (м, 2Н), 4,0 - 4,1 (м, 2H), 4,4 - 4,5 (м, 1H), 7,2 - 7,55 (м, 3Н), ppm.
Препаративный пример 3
5-(3,4-Дихлорфенил)-5-(2-[тетрагидропиран-2-ил-окси] этил)-2(1Н)- пиперидон
Соединение препаративного примера 2 (18,7 г, 45,2 моль) растворяют в насыщенном этанольном растворе аммиака (500 мл), который содержит никель Ренея (3,5 г). Смесь перемешивают в атмосфере водорода при атмосферном давлении в течение 7 часов. Затем катализатор удаляют фильтрацией, этанол удаляют при пониженном давлении, и остаток хроматографируют, используя силикагель, элюируя сначала диэтиловым эфиром, а затем метанолом с дихлорметаном (1 : 9, по объему). Получают названное в заголовке соединение (10,4 г).
ТХС Rf = 0,45 (диоксид кремния, метанол : дихлорметан, 1 : 9, по объему). МСНР m/z = 372 (m+1)+.
1H ЯМР (CDCl3): δ = 1,4 - 1,8 (м, 6H), 1,9 - 2,1 (м, 5H), 2,3 - 2,45 (м, 1H), 3,0 - 3,2 (м, 1H), 3,0 - 3,2 (м, 1H), 3,35 - 3,85 (м, 4Н), 4,35 - 4,4 (м, 1H), 6,05 (с, ш, 1Н), 7,15 - 7,45 (м, 3Н) ppm.
Препаративный пример 4
5-(3,4-Дихлорфенил)-5-(2-гироксиэтил)-2(1Н)-пиперидон
К насыщенному раствору хлористого водорода в метаноле (350 мл) при комнатной температуре добавляют соединение препаративного примера 3 (10,4 г, 28 ммоль), затем через раствор при перемешивании пропускают газообразный хлористый водород в течение 40 минут, и затем реакционную смесь оставляют стоять при комнатной температуре в течение 14 часов. Растворитель удаляют при пониженном давлении. Добавляют насыщенный водный раствор бикарбоната натрия (300 мл), и водную фазу экстрагируют этилацетатом (4х300 мл). Объединенные органические слои сушат над сульфатом магния, фильтруют, и удаляют растворитель при пониженном давлении. Получают белое твердое вещество. Это вещество кристаллизуют из этилацетата, и получают названное в заголовке соединение (5,5 г).
ТХС Rf = 0,23 (диоксид кремния, метанол : дихлорметан, 1 : 9, по объему). Т. пл. 167-168oC. МСНР m/z = 288 (m+1)+. Элем. анализ: найдено: C - 54,02; Н - 5,03; N - 4,52. Для C13H15Cl2NO2 вычислено: C - 54,18; Н - 5,25; N - 4,84%.
1H ЯМР (d6-ДМСО): δ = 1,7 - 2,2 (м, 6Н), 3,1 - 3,15 (м, 2Н), 3,25 - 3,3 (м, 1Н), 3,6 - 3,7 (м, 1 Н), 4,3 - 4,35 (м, 1H), 7,35 - 7,65 (м, 4Н) ppm.
Препаративный пример 5
5-(3,4-Дихлорфенил)-5-(2-метансульфонилоксиэтил)-2(1H)-пиперидон
К насыщенному раствору соединения препаративного примера 4 (5,44 г, 18,9 ммоль) в сухом дихлорметане (100 мл) добавляют триэтиламин (3,95 мл, 1,5 мол. экв.), и раствор охлаждают до 0oC. Затем добавляют метансульфонилхлорид (1,9 мл, 1,3 мол. экв.), и реакционной смеси дают возможность нагреваться до комнатной температуры и перемешивают в течение 2,5 часов. Реакционную смесь промывают водой (3х200 мл), сушат над сульфатом магния, фильтруют, и удаляют растворитель при пониженном давлении. Получают названное в заголовке соединение (7,1 г).
ТХС Rf = 0,24 (диоксид кремния, метанол : дихлорметан, 1 : 19, по объему).
1H ЯМР (CDCl3): δ = 2,0 - 2,5 (м, 6Н), 2,9 (с, 3Н), 3,45 - 4,1 (м, 4Н), 6,7 (с, ш, 1Н), 7,2 - 7,5 (м, 3Н) ppm.
Препаративный пример 6
5-(3,4-Дихлорфенил)-5-формилметил-2(1Н)-пиперидон
К раствору оксалилхлорида (1,6 мл, 1,1 мол. экв.) в сухом дихлорметане (200 мл) при -78oC добавляют по каплям сухой диметилсульфоксид (3,0 мл, 2,4 мол. экв.), и раствор перемешивают в течение 1 часа. Затем добавляют по каплям, в течение 15 минут, раствор соединения препаративного примера 4 (5 г) в смеси дихлорметана (100 мл) и сухого диметилсульфоксида (10 мл), и смесь перемешивают при -78oC в течение 1 часа. Затем добавляют триэтиламин (12 мл, 5 мол. экв.), и смеси дают возможность нагреваться до комнатной температуры в течение 4 часов. Добавляют воду (25 мл), и смесь экстрагируют дихлорметаном (3х100 мл). Объединенные органические слои сушат над сульфатом магния, фильтруют, и удаляют растворитель при пониженном давлении. Получают смолу, которую хроматографируют, используя силикагель, элюируя с градиентом растворителя метанола с дихлорметаном (от 1 : 49 до 1 : 5, по объему), и получают названное соединение (1,09 г).
1H ЯМР (CDCl3): δ = 2,05 - 2,2 (м, 2Н), 2,35 - 2,5 (м, 1Н), 2,7 - 2,75 (м, 1Н), 2,95 - 3,0 (м, 1Н), 3,45 - 3,6 (м, 2Н), 3,85 - 3,9 (м, 1Н), 6,0 (с, ш, 1Н), 7,2 - 7,45 (м, 3Н), 9,5 (м, 1Н) ppm.
Препаративный пример 7
5-(3,4-Дихлорфенил)-1-(4-фенилбензил)-5-(2-[тетрагидропиран-2- окси] этил)-2-пиперидон
К раствору соединения препаративного примера 3 (500 мг, 1,34 ммоль) в сухом диметилформамиде (10 мл), при комнатной температуре и в атмосфере азота, добавляют 60% (в/в) дисперсию гидрида натрия в масле (54 мг, 1,05 мол. экв.), и смесь перемешивают при комнатной температуре в течение 1 часа. Затем добавляют по каплям раствор 4-фенилбензилбромида (365 мг, 1,1 мол. экв. ) в диметилформамиде (1 мл), и смесь перемешивают при комнатной температуре в течение 2 часов. Затем добавляют воду (2 мл), и после нее добавляют насыщенный водный раствор бикарбоната натрия (10 мл) и насыщенный раствор хлорида аммония (10 мл), затем смесь экстрагируют этилацетатом (3х50 мл), и объединенные органические слои промывают насыщенным водным раствором хлорида аммония (2х50 мл). Органическую фазу сушат над сульфатом магния, фильтруют и удаляют растворитель при пониженном давлении. Получают белую пену. Этот сырой продукт затем хроматографируют, используя силикагель, элюируя этилацетатом, и получают названное в заголовке соединение (456 мг).
ТХС Rf = 0,47 (диоксид кремния, этилацетат).
1H ЯМР (CDCl3): δ = 1,5 - 1,8 (м, 6Н), 1,8 - 2,05 (м, 2Н), 2,05 - 2,2 (м, 3Н), 2,4 - 2,55 (м, 1Н), 2,85 - 3,1 (м, 1Н), 3,3 - 3,75 (м, 4Н), 3,75 - 3,85 (м, 1Н), 4,2 - 4,4 (м, 2Н), 5,0 - 5,1 (д, 1H), 6,8-6,9 (т, 1Н), 7,05 - 7,1 (д, 1Н), 7,2 - 7,3 (м, 1Н), 7,3 - 7,5 (м, 5Н), 7,55 - 7,65 (м, 4Н) ppm.
Препаративный пример 8
5-(4-Хлорфенил)-1-(циклогексилметил)-5-(2-гидроксиэтил)-2-пиперидон
К метанольному раствору (20 мл) соединения препаративного примера 51 (1 г, 1 мол. экв.) добавляют ионообменную смолу Amberlyst Н-15 (торговая марка) (0,33 г, 0,33 мол. экв. в/в), и реакционную смесь перемешивают в течение 20 часов при комнатной температуре. Смолу удаляют фильтрацией, и метанол удаляют из фильтрата при пониженном давлении. Остаток растворяют в этилацетате (20 мл), и смесь промывают водой (5 мл) и солевым раствором (5 мл). Органический слой сушат, используя безводный сульфат магния, фильтруют и упаривают фильтрат досуха при пониженном давлении. Получают названное в заголовке соединение в виде белого твердого вещества (0,81 г), которое используют без дополнительной очистки.
ТХС Rf = 0,7 (диоксид кремния, метанол : дихлорметан, 1 : 9, по объему). МСНР m/z = 350 (m+1)+.
Препаративный пример 9
Этил-4,4-дифторциклогексанкарбоксилат
К раствору трифторида диэтиламиносульфида (7,76 мл, 2 мол. экв.) в четыреххлористом углероде (75 мл) при 0oC добавляют по каплям этил-4-оксоциклогексанкарбоксилат (5 г, 29,4 ммоль), и смесь перемешивают при комнатной температуре в течение 14 часов. Затем осторожно добавляют воду (50 мл). Органическую фазу промывают водой (3х50 мл), сушат над безводным сульфатом магния, фильтруют и удаляют растворитель при пониженном давлении. Получают названное в заголовке соединение в виде желтого масла (1,96 г), которое очищают перегонкой.
1H ЯМР (CDCl3): δ = 1,2 - 1,3 (т, 3Н), 1,65 - 1,9 (м, 4Н), 1,95 - 2,2 (м, 3Н), 2,2 - 2,45 (м, 2Н), 4,05 - 4,2 (к, 2Н) ppm.
Препаративный пример 10
4,4-Дифторциклогексилметанол
К суспензии алюмогидрида лития (350 мг) в сухом диэтиловом эфире (30 мл), при 0oC и в атмосфере азота, при перемешивании добавляют по каплям раствор соединения препаративного примера 9 (1,96 г) в сухом диэтиловом эфире (15 мл). Затем смесь перемешивают в течение 1 часа. Затем добавляют воду (0,5 мл), а после нее добавляют 2N водный раствор гидроксида натрия (0,5 мл) и затем воду (0,5 мл). Неорганические твердые вещества удаляют фильтрацией, и фильтрат концентрируют при пониженном давлении. Получают названное в заголовке соединение в виде бесцветного масла (1,59 г).
1H ЯМР (CDCl3): δ = 1,15 - 1,4 (м, 2Н), 1,4 - 1,5 (м, 2Н), 1,5 - 1,7 (м, 1 Н), 1,7 - 2,0 (м, 3Н), 2,0-2,3 (м, 2Н), 3,45 - 3,6 (м, 2Н) ppm.
Препаративный пример 11
4,4-Дифтор-1-(4-метилфенилсульфонилоксиметил)циклогексан
К раствору соединения препаративного примера 10 (500 мг, 3,33 ммоль) в дихлорметане (10 мл) при комнатной температуре добавляют триэтиламин (0,62 мл, 1,5 мол. экв.), после чего добавляют п-толуолсульфонилхлорид (570 мг, 1 мол. экв. ), и реакционную смесь перемешивают в течение 14 часов. Затем добавляют воду (25 мл), слои разделяют, органическую фазу промывают водой (2х25 мл), и органический слой сушат над безводным сульфатом магния. Раствор фильтруют, и удаляют растворитель при пониженном давлении. Затем сырой продукт пропускают через небольшой слой силикагеля, элюируя диэтиловым эфиром с гексаном (1 : 4, по объему). Растворитель удаляют из элюированной фракции при пониженном давлении, и продукт кристаллизуют посредством порошкования с гексаном. Получают названное в заголовке соединение в виде белого твердого вещества (100 мг).
1H ЯМР (CDCl3): δ = 1,2 - 2,35 (м, 2H), 1,55 - 1,7 (м, 1Н), 1,7 - 1,85 (м, 4Н), 2,0 - 2,15 (м, 2Н), 2,45 - 2,5 (с, 3Н), 3,85 - 3,9 (д, 2Н), 7,3 - 7,4 (д, 2Н), 7,75 - 8,0 (д, 2Н) ppm.
Препаративный пример 12
5-(3,4-Дихлорфенил)-1-(4,4-дифторциклогексилметил)-5-(2- [тетрагидропиран-2-окси]этил)-2-пиперидон
К раствору соединения препаративного примера 3 (121 мг, 0,33 ммоль) в сухом диметилформамиде (3 мл) в атмосфере азота добавляют 60% (в/в) дисперсию гидрида натрия в масле (14 мг), и смеси дают возможность перемешиваться при комнатной температуре в течение 45 минут. К этой смеси добавляют соединение препаративного примера 10 (99 мг, 1 мол.экв.), и смесь нагревают при 50oC в течение 5 часов. Для осуществления более полной реакции добавляют дополнительную порцию 60% (в/в) дисперсии гидрида натрия в масле (7 мг, 0,5 мол. экв.), и реакционную смесь греют при 50oC еще в течение 3 часов. Затем добавляют воду (1 мл), и смесь упаривают досуха при пониженном давлении. Затем остаток растворяют в этилацетате (20 мл), и органическую фазу промывают водой (2х20 мл). Затем органическую фазу сушат над безводным сульфатом магния, фильтруют, и удаляют растворитель при пониженном давлении. Получают смолу. Эту смолу очищают колоночной хроматографией, используя силикагель, элюируя с градиентом растворителя дихлорметана с метанолом (от 100 : 1 до 9 : 1, по объему). Получают названное в заголовке соединение (80 мг).
МСНР m/z = 506 (m+1)+.
1H ЯМР (CDCl3): δ = 1,15 - 1,6 (м, 8Н), 1,6 - 1,9 (м, 5Н), 1,9 - 2,3 (м, 7Н), 2,4 - 2,5 (м, 1Н), 3,03 - 3,3 (м, 2Н), 3,3 - 3,6 (м, 4Н), 3,6 - 3,8 (м, 2Н), 4,3 - 4,4 (м, 1Н), 7,05 - 7,15 (д, 1Н), 7,3 - 7,4 (с, 1Н), 7,4 - 7,45 (д, 1Н) ppm.
Препаративный пример 13
Метансульфонилоксиметилциклогептан
К раствору циклогептилметанола (1,0 г, 7,81 ммоль) в дихлорметане (20 мл), при 0oC и в атмосфере азота, добавляют триэтиламин (1,63 мл, 1,5 мол. экв. ). Добавляют по каплям метансульфонилхлорид (0,73 мл, 1,2 мол. экв.), и реакционной смеси дают возможность перемешиваться в течение 2 часов при комнатной температуре. Добавляют воду (50 мл) и дихлорметан (50 мл). Органическую фазу отделяют, промывают водой (2х50 мл) и затем сушат над безводным сульфатом магния. Затем раствор фильтруют, и удаляют растворитель при пониженном давлении. Получают названное в заголовке соединение в виде масла (1, 66 г).
1H ЯМР (CDCl3): δ = 1,15 - 1,3 (м, 2H), 1,4 - 1,6 (м, 6H), 1,6 - 1,8 (м, 4H), 1,85-2,0 (м, 1Н), 2,95 - 3,0 (с, 3Н), 3,95 - 4,05 (д, 2Н) ppm.
Препаративные примеры с 14 по 16
Соединения следующих, сведенных в табл. 9 препаративных примеров, имеющие общую формулу:
получают способом, подобным способу препаративного примера 1, используя в качестве исходных веществ соответствующие ацетонитрильные производные.
Препаративные примеры с 17 по 19
Соединения следующих, сведенных в табл. 10 препаративных примеров, имеющие общую формулу;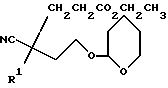
получают способом, подобным способу препаративного примера 2, используя в качестве исходных веществ соответствующие бутаннитрильные производные (см. препаративные примеры 14-16).
Препаративные примеры с 20 по 22
Соединения следующих, сведенных в табл. 11 препаративных примеров, имеющих общую формулу;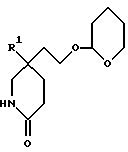
получают способом, подобным способу препаративного примера 3, используя в качестве исходных веществ соответствующие бутаноатные производные (см. препаративные примеры 17-19).
Подстрочные замечания
1. Реакцию осуществляют при давлении 414 кПа (60 ф/д2) и 50oC.
2. Реакцию осуществляют при 50oC.
Препаративные примеры с 23 по 32
Соединения следующих, сведенных в табл. 12 препаративных примеров, имеющие общую формулу: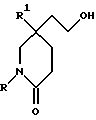
получают способом, подобным способу препаративного примера 4, используя в качестве исходных веществ соответствующие тетрагидропирановые производные (см. препаративные примеры 7, 12, 44-50 и 52).
Препаративные примеры с 33 по 38
Соединения следующих, сведенных в табл. 13 препаративных примеров, имеющие общую формулу;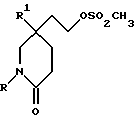
получают способом, подобным способу препаративного примера 5, используя в качестве исходных веществ соответствующие этанольные производные (см. препаративные примеры 8, 27-30 и 32).
Препаративные примеры с 39 по 43
Соединения следующих, сведенных в табл. 14 препаративных примеров, имеющие общую формулу;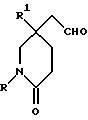
получают способом, подобным способу препаративного примера 6, используя в качестве исходных веществ соответствующие этанольные производные (см. препаративные примеры 23-26 и 31).
Препаративные примеры с 44 по 52
Соединения следующих, сведенных в табл. 15 препаративных примеров, имеющие общую формулу;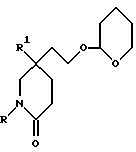
получают способом, подобным способу препаративного примера 7, используя в качестве исходных веществ соответствующие производные 2(1Н)-пиперидона (см. препаративные примеры 3, 20, 21 и 22) и алкилбромиды.
Подстрочное замечание
1. К реакционной смеси добавляют иодид калия, и затем смесь нагревают при 50oC в течение 4 часов.
Препаративный пример 53
1-Дифенилметилазетидин-3-ол
Раствор бензгидриламина (200 мл, 1,16 моль) и эпихлоргидрина (186 мл, 1 мол. экв. ) в метаноле (600 мл) перемешивают при комнатной температуре в течение 5 суток и затем нагревают при 40oC в течение 2 суток. Затем удаляют растворитель при пониженном давлении, остаток растворяют в изопропиловом спирте (500 мл), и раствор кипятят с обратным холодильником в течение 6 часов. Раствор охлаждают до комнатной температуры, и отфильтровывают выпавший осадок. Твердое вещество обрабатывают дихлорметаном (400 мл) и насыщенным водным раствором бикарбоната натрия (500 мл). Водную фазу экстрагируют дихлорметаном (2х400 мл), и объединенные органические фазы сушат над сульфатом магния. Затем раствор фильтруют, и из фильтрата при пониженном давлении удаляют растворитель. Получают названное в заголовке соединение (86 г) в виде твердого кристаллического вещества.
1H ЯМР (CDCl3): δ = 1,8 - 2,3 (с, ш, 1Н), 2,85 - 2,9 (м, 2Н), 3,5 - 3,55 (м, 2Н), 4,35 (с, 1Н), 4,4 - 4,5 (м, 1Н), 7,15 - 7,4 (м, 10Н) ppm.
Препаративный пример 54
1-Дифенилметил-3-метансульфонилоксиазетидин
К раствору 1-дифенилметилазетидин-3-ола (см. препаративный пример 53) (65,9 г, 275,7 ммоль) в сухом дихлорметане (700 мл), при 0oC и в атмосфере азота, добавляют триэтиламин (57 мл, 1,5 мол. экв.). Через 5 минут добавляют метансульфонилхлорид (25,6 мл, 1,2 мол. экв.), и смесь перемешивают в течение 1 часа. Затем добавляют воду (300 мл), и смесь экстрагируют дихлорметаном (3х300 мл). Объединенные органические слои сушат над сульфатом магния. Затем раствор фильтруют, и из фильтрата при пониженном давлении удаляют растворитель. Остаток хроматографируют, используя силикагель, элюируя метанолом с дихлорметаном (1 : 49, по объему), и получают названное в заголовке соединение (73,4 г) в виде твердого вещества.
1H ЯМР (CDCl3): δ = 2,95 (с, 3Н), 3,15 - 3,25 (м, 2Н), 3,6 - 3,65 (м, 2Н), 4,4 (с, 1Н), 5,05 - 5,15 (м, 1Н), 7,15 - 7,4 (м, 10H) ppm.
Препаративный пример 55
1-Дифенилметил-3-морфолиноазетидин
Раствор 1-дифенилметил-3-метансульфонилоксиазетидина (см. препаративный пример 54) (24,46 г, 7,72 ммоль), карбоната калия (32 г, 3 мол. экв.) и морфолина (7,34 мл, 1,09 мол. экв.) в ацетонитриле (200 мл) кипятят с обратным холодильником в течение 4 часов. Затем раствор охлаждают до комнатной температуры, добавляют воду (50 мл), и смесь концентрируют при пониженном давлении. Остаток распределяют между этилацетатом (400 мл) и водой (400 мл), и органическую фазу отделяют и промывают водой (2х400 мл). Органическую фазу сушат над сульфатом магния, фильтруют, и из фильтрата при пониженном давлении удаляют растворитель. Остаток затем хроматографируют, используя силикагель, элюируя гексаном с диэтиловым эфиром (1 : 1, по объему), и получают названное в заголовке соединение (16,5 г).
1H ЯМР (CDCl3): δ = 2,25 - 2,3 (м, 4Н), 2,85 - 3,05 (м, 3Н), 3,35 - 3,4 (м, 2Н), 3,7 - 3,75 (м, 4Н), 4,45 (с, 1Н), 7,15 - 7,45 (д, 10H) ppm.
Препаративный пример 56
Дигидрохлорид 3-морфолиноазетидина
Смесь 1-дифенилметил-3-морфолиноазетидина (см. препаративный пример 55) (18,6 г, 60,4 ммоль), гидроксида палладия (2 г), этанола (200 мл) и 1N соляной кислоты (52 мл) перемешивают в атмосфере водорода при давлении 345 кПа (50 ф/д2) в течение 3 суток. Затем катализатор удаляют фильтрацией, и фильтрат упаривают досуха. Добавление дихлорметана (100 мл) к остатку и порошкование дают твердое вещество, которое перекристаллизовывают из метанола, и получают названное в заголовке соединение (10,2 г) в виде твердого кристаллического вещества. МСНР m/z = 179 (m+1)+. (Примечание. Моногидрохлорид, применяемый в некоторых реакциях вместо дигидрохлорида, можно получить подобным образом, используя в реакции один молярный эквивалент хлористого водорода.)
Препаративный пример 57
3-Циано-1-(дифенилметил)азетидин
К раствору соединения препаративного примера 54 (10 г, 31,5 ммоль) в диметилформамиде (100 мл) пятью порциями, в течение 2 минут, добавляют раствор цианида натрия (4,63 г, 3 мол. экв.) в воде (50 мл). Смесь затем нагревают при 70oC в течение 16 часов. Реакционную смесь охлаждают до комнатной температуры и затем выливают в смесь воды со льдом (300 мл).
Образовавшееся при этом твердое коричневое вещество извлекают фильтрацией, растворяют в дихлорметане и раствор сушат над безводным сульфатом магния. Раствор фильтруют, и при пониженном давлении удаляют из фильтрата растворитель. Остаток затем хроматографируют, используя силикагель, элюируя этилацетатом с гексаном (1 : 3, по объему), и получают названное в заголовке соединение (5,9 г).
1H ЯМР (CDCl3): δ = 3,2 - 3,35 (м, 3Н), 3,45 - 3,5 (м, 2Н), 4,4 (с, 1Н), 7,15 - 7,45 (м, 10H) ppm.
Препаративный пример 58
1-(Дифенилметил)азетидин-3-карбоновая кислота
К суспензии соединения препаративного примера 57 (5,9 г, 23,8 ммоль) в н-бутаноле (60 мл) по каплям, в течение 3 минут, добавляют раствор гидроксида калия (4,8 г) в воде (9 мл). Смесь затем нагревают при 90 - 100oC в течение 20 часов. Реакционную смесь охлаждают до комнатной температуры и удаляют растворитель при пониженном давлении. Остаток выливают в этилацетат (100 мл) и воду (100 мл). Водный слой отделяют и фильтруют, затем подкисляют до pH 4, используя 2N раствор соляной кислоты. Выпавшее в осадок белое твердое вещество отфильтровывают, промывают этилацетатом (15 мл) и сушат при пониженном давлении. Получают названное в заголовке соединение (3,5 г). МСНР m/z = 268 (m+1)+.
1H ЯМР (d6-ДМСО): δ = 3,1 - 3,3 (м, 5Н), 4,4 (ш, с, 1Н), 7,15 - 7,4 (м, 10Н), 12,3 (ш, с, 1Н) ppm.
Препаративный пример 59
1-Дифенилметил-3-(N-[2-гидроксиэтил]-N-метилкарбамоил)-азетидин
Смесь 1-дифенилметилазетидин-3-карбоновой кислоты (см. препаративный пример 58) (1,8 г, 6,73 ммоль), 2-метиламиноэтанола (0,76 г, 1,5 мол. экв.), гидрохлорида 1-[3-диметиламинопропил] -3-этилкарбодиимида (1,27 г, 1,1 мол. экв. ), гидрата 1-гидроксибензотриазола (1,08 г, 1,05 мол. экв.) и N-метилморфолина (1,5 г, 2,2 мол. экв.) в сухом дихлорметане (50 мл) перемешивают при комнатной температуре в течение 16 часов. Растворитель удаляют при пониженном давлении, и остаток распределяют между этилацетатом (50 мл) и насыщенным водным раствором бикарбоната натрия (50 мл). Слои разделяют и водный слой дополнительно экстрагируют этилацетатом (30 мл). Объединенные органические слои сушат над безводным сульфатом натрия. Раствор фильтруют, при пониженном давлении из фильтрата удаляют растворитель, и остаток хроматографируют, используя силикагель, элюируя метанолом с дихлорметаном (7 : 93, по объему). Получают названное в заголовке соединение (1,76 г).
ТСХ Rf = 0,3 (диоксид кремния, метанол : дихлорметан 7 : 93, по объему). МСНР m/z = 325 (m+1)+. Элем. анализ: найдено: C - 71,99; Н - 7,60; N - 8,47. Для C20H24N2O2 • 0,13CH2Cl2 вычислено: C - 72,14; Н - 7,30; N - 8,36%.
1H ЯМР (CDCl3): δ = 2,85 - 2,95 (м, 5Н), 3,2 - 3,35 (м, 2Н), 3,45 - 3,55 (м, 4Н), 3,65 - 3,8 (м, 2Н), 4,4 (с, 1Н), 7,15 - 7,45 (м, 10H) ppm.
Препаративный пример 60
1-Дифенилметил-3-(N-[2-метоксиэтил]-N-метилкарбамоил)-азетидин
К раствору соединения препаративного примера 59 (0,93 г, 2,87 ммоль) в тетрагидрофуране (12 мл), при 0oC и в атмосфере азота, добавляют, в два приема, 60% (в/в) дисперсию гидрида натрия в масле (0,126 г, 1,1 мол. экв.). После 30-минутного перемешивания добавляют метилиодид (0,197 мл, 1,1 мол. экв.), и смесь перемешивают в течение 16 часов.
Растворитель удаляют при пониженном давлении, и остаток обрабатывают этилацетатом (50 мл) и насыщенным водным раствором бикарбоната натрия (50 мл). Органический слой сушат над безводным сульфатом натрия, фильтруют, и удаляют растворитель при пониженном давлении. Получают масло. Этот сырой продукт реакции очищают колоночной хроматографией, используя силикагель, элюируя метанолом (1 : 19, по объему), и получают названное в заголовке соединение (0,95 г).
ТСХ Rf = 0,45 (диоксид кремния, метанол : дихлорметан 1 : 19, по объему). МСНР m/z = 339 (m+1)+. Элем. анализ: найдено: C - 72,42; Н - 7,60; N - 7,89. Для C21H26N2O2 • 13CH2Cl2 вычислено: C - 72,69; Н - 7,58; N - 8,03%.
1H ЯМР (CDCl3): δ = 2,9 - 2,95 (м, 3Н), 3,2 - 3,35 (м, 6Н), 3,4 - 3,55 (м, 6Н), 4,4 (с, 1Н), 7,15 - 7,45 (м, 10H) ppm.
Препаративный пример 61
Дигидрохлорид N-(2-метоксиэтил)-N-метилкарбамоилазетидина
К раствору соединения препаративного примера 60 (473 мг, 1,4 ммоль) в дихлорметане (5 мл), при 0oC и в атмосфере азота, по каплям добавляют альфа-хлорэтилхлорформиат (0,22 мл, 1,1 мол. экв.). Через 20 минут добавляют другую порцию альфа-хлорэтилхлорформиата (0,1 мл, 0,5 мол. экв.), и реакционной смеси дают возможность нагреваться до комнатной температуры в течение 20 минут. После этого растворитель удаляют при пониженном давлении, остаток растворяют в метаноле (7,5 мл) и добавляют карбонат калия (620 мг, 3 мол. экв. ). Затем смесь кипятят с обратным холодильником в течение 1 часа. Реакционную смесь охлаждают до комнатной температуры, фильтруют, и подкисляют фильтрат до pH 3, используя эфирный раствор HCl. Твердое вещество удаляют фильтрацией. Растворитель из фильтрата удаляют при пониженном давлении, и получают смолу, которую промывают несколько раз диэтиловым эфиром и сушат при пониженном давлении. Получают названное в заголовке соединение как сырой продукт (0,35 г), который используют непосредственно.
Препаративные примеры с 62 по 64
Соединения следующих, сведенных в табл. 16 препаративных примеров, имеющие общую формулу;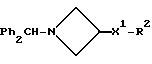
получают способом, подобным способу препаративного примера 59, используя в качестве исходных веществ 1-дифенилметилазетидин-3-карбоновую кислоту и соответствующий амин.
Препаративные примеры с 65 по 68
Соединения следующих, сведенных в табл. 17 препаративных примеров, имеющих общую формулу:
получают способом, подобным способу препаративного примера 61, используя в качестве исходных веществ соответствующие азетидины (см. препаративные примеры 62-64 и 105).
Подстрочные примечания
1. Сырой продукт используют непосредственно на следующей стадии.
2. Используют только 1,05 мол. экв. альфа-хлорэтилхлорформиата, и при обработке карбонат калия не добавляют.
Препаративный пример 69
1-(трет-Бутоксикарбонил)-3-(3-гидроксипиперидил)азетидин
Смесь 1-(трет-бутоксикарбонил)-3-метансульфонилоксиазетидина (см. публикацию заявки на международный патент ВОИС93/19059) (1,5 г, 4,78 ммоль) и 3-гидроксипиперидина (1,9 г, 4 мол. экв.) греют при 110oC в течение 16 часов. Смесь охлаждают до комнатной температуры и распределяют между этилацетатом (100 мл) и 5% водным раствором бикарбоната натрия (100 мл). Слои разделяют, и водную фазу экстрагируют другой порцией этилацетата (100 мл). Объединенные органические слои сушат над безводным сульфатом магния. Раствор фильтруют, растворитель из фильтрата удаляют при пониженном давлении, и сырой продукт очищают колоночной хроматографией, используя силикагель, элюируя метанолом с дихлорметаном (1 : 9, по объему). Получают названное в заголовке соединение (1,4 г).
ТСХ Rf = 0,3 (диоксид кремния, метанол : дихлорметан 1 : 9, по объему).
1H ЯМР (CDCl3): δ = 1,45 (с, 9Н), 1,5 - 1,85 (м, 6Н), 2,15 - 2,45 (м, 4Н), 3,05 - 3,15 (м, 1Н), 3,25 - 3,95 (м, 4Н) ppm.
Препаративный пример 70
Бистрифторацетат 3-(3-гидроксипиперидил)азетидина
К раствору соединения препаративного примера 69 (1,4 г, 5,8 ммоль) в дихлорметане (10 мл), при 0oC и в атмосфере азота, по каплям добавляют трифторуксусную кислоту (5 мл). Затем смеси дают возможность нагреваться до комнатной температуры и перемешивают в течение 1 часа. Смесь концентрируют при пониженном давлении, получающуюся в результате смолу промывают диэтиловым эфиром, и получают названное в заголовке соединение в виде белого твердого вещества (1,2 г).
Элем. анализ: найдено: C - 37,32; Н - 4,73; N - 7,03. Для C8H16N2O • 2CF3CO2H вычислено: C - 37,51; Н - 4,72; N - 7,29%.
Препаративные примеры с 71 по 76
Соединения следующих, сведенных в табл. 18 препаративных примеров, имеющие общую формулу;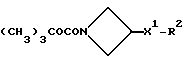
получают, используя способ, подобный способу препаративного примера 69, используя в качестве исходных веществ 1-(трет-бут-оксикарбонил)-3-метансульфонилоксиазетидин и соответствующие амины.
Подстрочное примечание.
1. При обработке реакционную смесь охлаждают и удаляют избыток пиперазина при пониженном давлении. Сырой продукт используют непосредственно.
Препаративные примеры с 77 по 89
Соединения следующих, сведенных в табл. 19 препаративных примеров, имеющие общую формулу;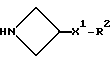
получают, используя способ, подобный способу препаративного примера 70, используя в качестве исходных веществ соответствующие азетидиновые производные (см. препаративные примеры 71, 72, 74, 76, 90, 170 и 172-178).
Подстрочные примечания
1. Получают в виде трифторацетата.
2. Получают в виде бистрифторацетата.
3. На стадии обработки используют конечное порошкование с этилацетатом.
Препаративный пример 90
1-(трет-Бутоксикарбонил)-3-(2-оксоморфолино)азетидин
К суспензии гидрида натрия (60% (в/в) дисперсия в минеральном масле, 0,29 г, 1 мол. экв.) в толуоле (20 мл), при комнатной температуре и в атмосфере азота, при перемешивании добавляют, по частям, соединение препаративного примера 75 (1,57 г, 1 мол. экв.). Реакционную смесь перемешивают в течение 30 минут и затем охлаждают до 0oC. Затем, в течение 15 минут, добавляют этилхлорацетат (0,78 мл, 1 мол. экв.), реакционную смесь перемешивают еще в течение 1 часа при комнатной температуре и затем кипятят с обратным холодильником в течение 90 минут. Раствор охлаждают, разбавляют диэтиловым эфиром (20 мл) и промывают насыщенным водным раствором бикарбоната натрия (30 мл). Органический слой сушат над безводным сульфатом натрия. Удаляют органический растворитель при пониженном давлении и остаток очищают колоночной флэш-хроматографией на силикагеле, элюируя метанолом с дихлорметаном (4 : 96, по объему). Получают названное в заголовке соединение (0,8 г).
ТСХ Rf = 0,23 (диоксид кремния, метанол : дихлорметан 4 : 96, по объему).
1H ЯМР (CDCl3): δ = 1,4 (с, 9Н), 3,5 - 3,6 (м, 2Н), 3,9 - 4,0 (м, 4Н), 4,1 - 4,2 (м,4Н), 5,2 - 5,4 (м, 1Н) ppm.
Препаративный пример 91
1-Дифенилметил-3-(2,6-диметилпиперидинил)азетидин
Нагревают вместе 1-дифенилметил-3-метансульфонилоксиазетидин (см. препаративный пример 54) (2 г, 1 мол. экв.) и 2,6-диметилпиперидин (6,79 мл, 3 мол. экв.) при 110oC, в атмосфере азота, в течение 6 часов. Добавляют насыщенный водный раствор бикарбоната натрия (60 мл), и смесь экстрагируют этилацетатом (3х40 мл). Объединенные органические экстракты сушат над сульфатом магния. Органический растворитель удаляют при пониженном давлении, и остаток очищают колоночной флэш-хроматографией на силикагеле, элюируя метанолом с дихлорметаном (1: 9, по объему), и получают названное в заголовке соединение (0,48 г).
ТСХ Rf = 0,39 (диоксид кремния, метанол : дихлорметан 1 : 93, по объему). МСНР m/z = 335 (m+1)+. Элем. анализ: найдено: C - 80,29; Н - 9,00; N - 8,14. Для C23H30N2O • 0,125CH2Cl2 вычислено: C - 80,48; Н - 8,84; N - 8,12%.
1H ЯМР (CDCl3): δ = 1,0 (с, 6Н), 1,4 - 1,8 (м, 6Н), 2,7 - 2,9 (м, 4Н), 3,35 - 3,4 (м, 2Н), 3,7 (с, 1Н), 4,4 (с, 1Н), 7,1 - 7,4 (м, 10Н) ppm.
Препаративные примеры 92 и 93
Соединения двух следующих, сведенных в табл. 20 препаративных примеров имеют общую формулу: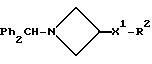
(где Ph = фенил) получают способом, подобным способу препаративного примера 91, используя в качестве исходных веществ 1-дифенилметил-3-метансульфонилоксиазетидин и соответствующие амины.
Препаративный пример 94
1-Дифенилметил-3-(пиперидин-1-ил) азетидин
Смесь 1-дифенилметил-3-метансульфонилоксиазетидина (см. препаративный пример 54) (1,5 г, 1 мол. экв.), пиперидина (0,6 г, 1,5 мол. экв.) и карбоната калия (1,31 г, 2 мол. экв.) в ацетонитриле (20 мл) кипятят с обратным холодильником в атмосфере азота в течение 4 часов. Добавляют насыщенный водный раствор бикарбоната натрия и солевой раствор, и смесь экстрагируют этилацетатом (2х40 мл). Органические экстракты объединяют и сушат, используя сульфат магния. Органический растворитель удаляют при пониженном давлении, и остаток очищают колоночной флэш-хроматографией на силикагеле, элюируя метанолом с дихлорметаном (1 : 9, по объему), и получают названное в заголовке соединение (0,65 г).
ТСХ Rf = 0,5 (диоксид кремния, метанол : дихлорметан 1 : 9, по объему). МСНР m/z = 307 (m+1)+. Элем. анализ: найдено: C - 81,50; Н - 8,51; N - 9,02. Для C21H26N2 • 0,06CH2Cl2 вычислено: C - 81,14; Н - 8,45; N - 8,99%.
1H ЯМР (CDCl3): δ = 1,4 - 1,5 (м, 2Н), 1,5 - 1,6 (м, 5Н), 2,1 - 2,3 (м, 4Н), 2,9 - 3,0 (м, 2Н), 3,4 - 3,5 (м, 2Н), 4,4 (с, 1Н), 7,1 - 7,3 (м, 6Н), 7,35 - 7,5 (м, 4Н) ppm.
Препаративные примеры с 95 по 106
Соединения следующих, сведенных в табл. 21 препаративных примеров, имеющие общую формулу: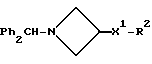
(где Ph = фенил) получают способом, подобным способу препаративного примера 94, используя в качестве исходных веществ 1-дифенилметил-3-метансульфонилоксиазетидин и соответствующие амины.
Подстрочные примечания
1. В качестве исходного амина используют гидрохлорид гомоморфолина (см. препаративный пример 127).
2. Перед кипячением с обратным холодильником доводят pH реакционной смеси до 9, используя N-метилморфолин.
Препаративный пример 107
Дигидрохлорид 3-(пиперидин-1-ил)азетидина
К раствору соединения препаративного примера 94 (0,64 г) в сухом дихлорметане (7 мл), при 0oC и в атмосфере азота, добавляют (α-хлор-этилхлорформиат (0,3 мл, 1 мол. экв.), и реакционную смесь перемешивают в течение 30 минут. Растворитель удаляют при пониженном давлении, и остаток снова растворяют в метаноле (10 мл) и кипятят с обратным холодильником в течение 45 минут. Затем удаляют растворитель при пониженном давлении, и полученную смолу порошкуют с диэтиловым эфиром (5 мл). Получают названное в заголовке соединение в виде бежевого порошка (0,14 г).
МСНР m/z = 141 (m+1)+.
1H ЯМР (d6-ДМСО): δ = 1,3 - 1,4 (м, 1Н), 1,7 - 1,9 (м, 5Н), 2,7 - 2,9 (м, 2Н), 3,3 - 3,5 (м, 2Н), 4,1 - 4,2 (м, 3Н), 4,4 - 4,6 (м, 2Н), 9,15 (с, ш, 1Н), 9,7 (с, ш, 1Н), 12,0 (с, ш, 1Н) ppm.
Препаративные примеры со 108 по 119
Соединения следующих, сведенных в табл. 22 препаративных примеров, имеющие общую формулу: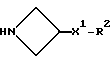
получают, используя способ, подобный способу препаративного примера 107, используя в качестве исходных веществ соответствующие азетидиновые производные (см. препаративные примеры 91, 92, 95, 96, 98 - 103, 104 и 120).
Подстрочные примечания
1. Получают в виде дигидрохлорида.
2. Получают в виде гидрохлорида.
Препаративный пример 120
1-Дифенилметил-3(N-[2-метоксиэтил]-N-метиламино)азетидин
К раствору соединения препаративного примера 93 (0,85 г, 1 мол. экв.) в тетрагидрофуране (12 мл), при 0oC и в атмосфере азота, добавляют 60% (в/в) дисперсию гидрида натрия в масле (0,126 г, 1,1 мол. экв.), и реакционную смесь перемешивают при комнатной температуре в течение 1 часа. Затем добавляют метилиодид (0,448 г, 1,1 мол. экв.), и реакционную смесь перемешивают еще в течение 2 часов. Часть растворителя (10 мл) удаляют при пониженном давлении, добавляют насыщенный водный раствор бикарбоната натрия (25 мл), и смесь экстрагируют этилацетатом (3х35 мл). Объединенные органические экстракты сушат над сульфатом магния. Органический растворитель удаляют при пониженном давлении, и остаток очищают колоночной флэш-хроматографией на силикагеле, элюируя метанолом с дихлорметаном (4 : 96, по объему). Получают названное в заголовке соединение (0,64 г).
ТСХ Rf = 0,3 (диоксид кремния, метанол : дихлорметан 4 : 96, по объему). МСНР m/z = 311 (m+1)+
1H ЯМР (CDCl3): δ = 2,1 (с, 3Н), 2,4 (т, 2Н), 2,85 - 2,95 (м, 2Н), 3,0 - 3,1 (м, 1Н), 3,3 (с, 3H), 3,4 - 3,45 (м, 4Н), 4,4 (с, 1Н), 7,15 - 7,3 (м, 6Н), 7,4 - 7,45 (м, 4Н) ppm.
Препаративный пример 121
Гидрохлорид 3-(4-трет-бутоксикарбонилпиперазинил)азетидина
Соединение препаративного примера 97 (1,471 г, 1 мол. экв.) растворяют в смеси 1М соляной кислоты (4 мл) и этанола (16,6 мл), и добавляют 10% палладий-на-угле (14,7 мг). Смесь перемешивают в атмосфере водорода при давлении 345 кПа (50 ф/д2) в течение 16 часов. Затем катализатор отфильтровывают, и растворитель удаляют при пониженном давлении, и последние следы воды удаляют азеотропной перегонкой с этанолом. Получают названное в заголовке соединение в виде твердого вещества кремового цвета (0,83 г), которое используют без дополнительной очистки.
ТСХ Rr = 0,84 (диоксид кремния, этилацетат : гексан, 1 : 2, по объему). МСНР m/z = 242 (m+1)+. Элем. анализ: найдено: C - 50,30; Н - 8,33; N - 14,39. Для C12H23N3O2 • HCl вычислено: C - 50,25; H - 8,79; N - 14,65%.
1H ЯМР (d6-ДМСО): δ = 1,4 (с, 9Н), 2,3 - 2,5 (м, 4Н), 3,4 - 3,5 (м, 6Н), 3,9 - 4,2 (м, 4Н), 9,7 (с, ш, 1Н) ppm.
Препаративный пример 122
4-Ацетил-1-(трет-бутоксикарбонил)пиперазин
К раствору N-трет-бутоксикарбонилпиперазина (7 г, 1 мол. экв.) в дихлорметане (140 мл), при 0oC и в атмосфере азота, добавляют триэтиламин (6,29 мл, 1,2 мол. экв.). Реакционную смесь энергично перемешивают, и добавляют по каплям ацетилхлорид (3,21 мл, 1,2 мол. экв.). Смесь перемешивают в течение 24 часов. Реакционную смесь промывают насыщенным водным раствором бикарбоната натрия (30 мл), и органический слой сушат, используя сульфат магния. Органический растворитель удаляют при пониженном давлении, и остаток очищают колоночной флэш-хроматографией на силикагеле, элюируя метанолом с этилацетатом (1 : 19, по объему). Получают названное в заголовке соединение (8,19 г).
ТСХ Rr = 0,33 (диоксид кремния, метанол : этилацетат 1 : 19, по объему). МСНР m/z = 229 (m+1)+. Элем. анализ: найдено: C - 57,83; Н - 8,83; N - 12,27. Для C11H20N2O3 вычислено: C - 57,87; Н - 8,92; N - 12,14%.
1H ЯМР (CDCl3): δ = 1,4 (с, 9Н), 2,1 (с, 3Н), 3,3 - 3,4 (м, 6Н), 3,5 - 3,6 (м, 2Н) ppm.
Препаративный пример 123
Трифторацетат N-ацетилпиперазина
К раствору соединения препаративного примера 122 (8,2 г, 1 мол. экв.) в дихлорметане (78 мл), при 0oC и в атмосфере азота, добавляют трифторуксусную кислоту (39 мл). Затем смесь нагревают до комнатной температуры и перемешивают еще в течение 30 минут. Затем удаляют растворитель при пониженном давлении, и получающееся в результате масло подвергают азеотропной перегонке с дихлорметаном (30 мл), и получают названное в заголовке соединение в виде смолы (11,7 г).
МСРР m/z = 129 (m+1)+.
1H ЯМР (CDCl3): δ = 2,0 (с, 3Н), 3,0 - 3,2 (м, 4Н), 3,5 - 3,7 (м, 4Н), 8,8 - 9,0 (с, ш, 2Н) ppm.
Препаративный пример 124
Оксим пиран-4-она
К раствору (240 мл) гидрохлорида гидроксиламина (60,53 г, 4 мол. экв.) в воде (240 мл) осторожно добавляют 3,6 М водный раствор гидроксида натрия (240 мл). В течение 5 минут добавляют пиран-4-он (20 г, 1 мол. экв.). Смесь кипятят с обратным холодильником в течение 1,5 часов, охлаждают и затем перемешивают еще в течение 18 часов при комнатной температуре. Реакционную смесь экстрагируют дихлорметаном (4х50 мл), и объединенные экстракты сушат над сульфатом магния. Удаление растворителя при пониженном давлении дает названное в заголовке соединение в виде белого твердого вещества (18,86 г).
1H ЯМР (CDCl3): δ = 2,4 (т, 2Н), 2,7 (т, 2Н), 3,7 - 3,9 (м, 4Н), 7,35 (с, 1Н) ppm.
Препаративный пример 125
Гомоморфолин-5-он
К метансульфоновой кислоте (228,8 мл, 27 мол. экв.) в атмосфере азота добавляют, частями, в течение 5 минут, пентоксид фосфора (37,72 г, 2 мол. экв. ). Раствор перемешивают при комнатной температуре в течение 2 часов, и затем добавляют порциями, в течение 10 минут, оксим пиран-4-она (см. препаративный пример 124) (14,97 г, 1 мол. экв.). Смесь постепенно нагревают до 100oC и перемешивают в течение 1 часа при этой температуре. Реакционную смесь затем перемешивают еще в течение 18 часов при комнатной температуре. Смесь медленно добавляют в воду (500 мл) и добавляют частями бикарбонат натрия до тех пор, пока смесь не станет щелочной (pH 9). Смесь фильтруют, и прокладку несколько раз промывают дихлорметаном (3х50 мл). Фильтрат экстрагируют дихлорметаном (7х60 мл). Объединенные экстракты сушат над сульфатом магния, фильтруют и упаривают фильтрат при пониженном давлении. Получающееся в результате твердое вещество порошкуют с диэтиловым эфиром и получают названное в заголовке соединение в виде белой пены (2,1 г).
МСНР m/z = 116 (m+1)+.
1H ЯМР (CDCl3): δ = 2,6 - 2,8 (м, 2Н), 3,3 - 3,4 (м, 2Н), 3,7 - 3,9 (м, 4Н), 6,2 (с, ш, 1Н) ppm.
Препаративный пример 126
4-(трет-Бутоксикарбонил) гомоморфолин
К суспензии алюмогидрида лития (777 мг, 2 мол. экв.) в тетрагидрофуране (87 мл), в атмосфере азота при температуре кипения, при перемешивании, постепенно, в течение 30 минут, добавляют раствор гомоморфолин-5-она (см. препаративный пример 125) (1,1 г, 1 мол. экв.) в тетрагидрофуране (37 мл). Смесь кипятят с обратным холодильником в течение 210 минут, охлаждают до комнатной температуры и постепенно, в течение 10 минут, добавляют раствор тетрагидрофурана в воде, 1 : 1 (о/о), (25 мл), после чего добавляют 1М водный раствор гидроксида натрия (1,24 мл). Смесь охлаждают до 0oC и в течение 15 минут добавляют раствор дитретбутилдикарбоната (2,46 г, 1,1 мол. экв.) в дихлорметане (25 мл). Реакционной смеси затем позволяют нагреваться до комнатной температуры и перемешивают в течение 16 часов. К смеси при энергичном перемешивании добавляют сульфат натрия (25 г). Получающееся в результате в виде гранул белое твердое вещество отфильтровывают и несколько раз промывают сухим дихлорметаном. Объединенные фильтраты и промывочные жидкости затем упаривают при пониженном давлении, и остаток растворяют в дихлорметане (50 мл). Раствор сушат над сульфатом магния, фильтруют, и фильтрат упаривают при пониженном давлении, и получают масло. Это масло очищают, используя колоночную флэш-хроматографию на силикагеле, элюируя этилацетатом с гексаном (1 : 1, по объему), и получают названное в заголовке соединение (1,7 г).
ТСХ Rf = 0,5 (диоксид кремния, этилацетат : гексан 1 : 1, по объему).
1H ЯМР (CDCl3): δ = 1,5 (с, 9Н), 1,8-2,0 (м, 2Н), 3,45 - 3,6 (м, 4Н), 3,7 - 3,8 (м, 4Н) ppm.
Препаративный пример 127
Гидрохлорид гомоморфолина
Соединение препаративного примера 126 (1,7 г) растворяют в этилацетате (51 мл), и раствор охлаждают до 0oC. Затем через смесь в течение 30 минут пропускают сухой газообразный хлористый водород, и реакционную смесь перемешивают еще в течение 30 минут. Затем через раствор в течение 16 часов пропускают азот. В течение этого времени в осадок выпадает твердое белое вещество, которое отфильтровывают и затем промывают холодным этилацетатом (5 мл). Затем белое твердое вещество сушат при пониженном давлении в течение 4 часов, и получают названное в заголовке соединение (0,92 г).
1H ЯМР (CDCl3): δ = 2,25 - 2,4 (м, 2H), 3,25 - 3,45 (м, 4Н), 3,9 (т, 2Н), 3,95 - 4,0 (м, 2Н), 9,75 (с, ш, 2H) ppm.
Препаративный пример 128
4-Бензилоксикарбонилтиоморфолин
К раствору тиоморфолина (5 г, 1 мол. экв.) и триэтиламина (5,4 г, 1,1 мол. экв.) в дихлорметане (200 мл), при 0oC и в атмосфере азота, постепенно, в течение 15 минут, добавляют бензилхлорформиат (8,68 г, 1,05 мол. экв.), затем реакционной смеси позволяют нагреваться до комнатной температуры и перемешивают в течение еще 16 часов. Реакционную смесь промывают насыщенным водным раствором бикарбоната натрия. Органический слой сушат, используя сульфат магния, фильтруют, и удаляют растворитель при пониженном давлении. Остаток очищают колоночной флэш-хроматографией на силикагеле, элюируя дихлорметаном, и получают названное в заголовке соединение (10 г).
ТСХ Rf = 0,3 (диоксид кремния, дихлорметан). Элем. анализ: найдено: C - 59,24; Н - 6,49; N - 5,78. Для C12H15NO2S вычислено: C - 59,12; Н - 6,23; N - 5,70%.
2Н ЯМР (CDCl3): δ = 2,5 - 2,75 (м, 4Н), 3,7 - 3,9 (м, 4Н), 5,15 (с, 2Н), 7,2 - 7,4 (м, 5Н) ppm.
Препаративный пример 129
4-Бензилоксикарбонилтиоморфолин-1,1-диоксид
К раствору 4-бензилоксикарбонилтиоморфолина (см. препаративный пример 128) (4,11 г, 1 мол. экв.) в дихлорметане (240 мл) в атмосфере азота добавляют мета-хлорбензойную кислоту (11,96 г, 2,2 мол. экв.), и реакционную смесь перемешивают в течение 16 часов при комнатной температуре. Образовавшееся при этом твердое вещество отфильтровывают, и фильтрат промывают насыщенным водным раствором карбоната натрия. Органический слой сушат над сульфатом магния, фильтруют и упаривают досуха при пониженном давлении. Полученное в результате твердое вещество затем очищают колоночной флэш-хроматографией на силикагеле, элюируя дихлорметаном с метанолом (95 : 5, по объему), и получают названное в заголовке соединение (0,83 г).
ТСХ Rf = 0,75 (диоксид кремния, метанол : дихлорметан, 1 : 19, по объему). Элем. анализ: найдено: C - 53,21; Н - 5,68; N - 5,14. Для C12H15NO4S вычислено: C - 53,51; Н - 5,61; N - 5,20%.
1H ЯМР (CDCl3): δ = 2,9 - 3,1 (м, 4Н), 3,9 - 4,05 (м, 4Н), 5,15 (с, 2Н), 7,35 - 7,5 (м, 5Н) ppm.
Препаративный пример 130
Тиоморфолин-1,1-диоксид
Соединение препаративного примера 129 (3,5 г, 1 моль. экв.) растворяют в метаноле (120 мл), и добавляют 10% палладий-на-угле (0,4 г). Затем смесь перемешивают в атмосфере водорода при атмосферном давлении в течение 4,5 часов. Катализатор отфильтровывают, и растворитель удаляют при пониженном давлении, причем остаточные следы метанола удаляют азеотропной перегонкой с дихлорметаном. Получают названное в заголовке соединение в виде масла, которое используют без дополнительной очистки (1,6 г).
ТСХ Rf = 0,3 (диоксид кремния, гидроксид аммония : метанол : дихлорметан, 1 : 10 : 90, по объему). МСНР m/z = 136 (m+1)+.
1H ЯМР (CDCl3): δ = 2,95 - 3,05 (м, 4Н), 3,35 - 3,45 (м, 5Н) ppm.
Препаративный пример 131
1-(трет-Бутоксикарбонил)-4-метансульфонилпиперазин
К раствору 1-(трет-бутоксикарбонил)пиперазина (7 г 1 мол. экв.) в дихлорметане, при 0oC и в атмосфере азота, добавляют триэтиламин (6,29 мл, 1,2 мол. экв. ). Смесь энергично перемешивают, добавляя по каплям метансульфонилхлорид (3,49 мл, 1,2 мол. экв.). Затем смесь перемешивают в течение 24 часов. Реакционную смесь промывают насыщенным водным раствором бикарбоната натрия (30 мл), и органический слой сушат, используя сульфат магния. Органический растворитель удаляют при пониженном давлении, и остаток очищают колоночной флэш-хроматографией на силикагеле, элюируя этилацетатом с гексаном (1 : 2, по объему), и получают названное в заголовке соединение (6,93 г).
ТСХ Rf = 0,37 (диоксид кремния, этилацетат : гексан, 1 : 2, по объему). МСНР m/z = 282 (m+NH4)+. Элем. анализ: найдено: C - 45,25; Н - 7,68; N - 10,49. Для C10H20N2SO4 вычислено: C - 45,43; Н - 7,63; N - 10,60%.
1H ЯМР (CDCl3): δ = 1,4 (с, 9Н), 2,8 (с, 3Н), 3,15 - 3,2 (м, 4Н), 3,5 - 3,6 (м, 4Н) ppm.
Препаративный пример 132
Трифторацетат 1-метансульфонилпиперазин
К раствору соединения препаративного примера 131 (6,9 г, 1 мол. экв.) в дихлорметане (78 мл), при 0oC и в атмосфере азота, добавляют трифторуксусную кислоту (28 мл). Смесь затем нагревают до комнатной температуры и перемешивают еще в течение 30 минут. Растворитель удаляют при пониженном давлении, и получающееся в результате масло азеотропно перегоняют с дихлорметаном (30 мл). Полученную смолу обрабатывают диэтиловым эфиром (10 мл), и получают названное в заголовке соединение в виде белого твердого вещества (7 г).
МСНР m/z = 164 (m)+ Элем. анализ: найдено: C - 30,10; Н - 4,80; N - 10,00. Для C5H12N2SO2 • CF2CO2H, вычислено: C - 30,21; Н - 4,71; N - 10,07%.
1H ЯМР (d6-ДМСО): δ = 2,9 (c, 3H), 3,1 - 3,3 (м, 4Н), 3,3 - 3,4 (м, 4Н), 9,0 - 9,2 (с, ш, 2Н) ppm.
Препаративный пример 133
1-Дифенилметил-3-(4-метансульфонилпиперазин-1-ил)азетидин
Раствор соединения препаративного примера 54 (1,5 г, 1 мол. экв.), N, N-диизопропилэтиламина (7,4 мл, 9 мол. экв.) и 1-метансульфонилпиперазина (см. препаративный пример 113) (1,97 г, 1,5 мол. экв.) в ацетонитриле (20 мл) в атмосфере азота перемешивают и кипятят с обратным холодильником в течение 18 часов. Добавляют насыщенный раствор бикарбоната натрия (45 мл), и смесь экстрагируют этилацетатом (3х60 мл). Органический растворитель удаляют при пониженном давлении, и остаток очищают колоночной флэш-хроматографией на силикагеле, элюируя сначала диэтиловым эфиром, а затем метанолом с этилацетатом (1 : 9, по объему). Получают названное в заголовке соединение (0,38 г).
ТСХ Rf = 0,51 (диоксид кремния, метанол : этилацетат, 1 : 9, по объему). МСНР m/z = 350 (m+1)+.
1H ЯМР (CDCl3): δ = 2,3 - 2,4 (м, 4Н), 2,7 (с, 3Н), 2,9 - 3,0 (м, 2Н), 3,0 - 3,2 (м, 1Н), 3,2 - 3,3 (м, 4Н), 3,4 - 3,5 (м, 2Н), 4,4 (с, 1Н), 7,2 - 7,4 (м, 6Н), 7,4 - 7,5 (м, 4Н) ppm.
Препаративный пример 134
Дигидрохлорид 3-(4-метансульфонилпиперазин-1-ил)азетидина
К раствору соединения препаративного примера 133 (0,350 г, 1 мол. экв.) в дихлорметане (5 мл), при 0oC, добавляют α-хлорэтилхлорформиат (0,15 мл, 1,5 мол. экв.), и реакционную смесь перемешивают в течение 24 часов. Растворитель удаляют при пониженном давлении, остаток растворяют в метаноле (10 мл) и кипятят с обратным холодильником в течение 1 часа. Затем pH смеси доводят до 3, используя насыщенный раствор хлористого водорода в диэтиловом эфире, и фильтруют. Фильтрат упаривают досуха при пониженном давлении, и полученную в результате смолу обрабатывают диэтиловым эфиром (5 мл). Получают названное в заголовке соединение в виде белого твердого вещества (0,12 г). МСНР m/z = 219 (m)+.
Препаративный пример 135
Эндо-3-ацетокси-8-метил-8-азабицикло [3,2,1] октан
Смесь тропина (20 г), уксусного ангидрида (20 мл) и пиридина (1 мл) перемешивают при комнатной температуре в течение 24 часов в атмосфере азота. Затем смесь выливают на лед, добавляют 4 капли концентрированной соляной кислоты, и дают раствору стоять в течение 30 минут. Часть растворителя удаляют при пониженном давлении, и смесь обрабатывают насыщенным водным раствором бикарбоната натрия (20 мл) и этилацетатом (50 мл). Слои разделяют, и водный слой дополнительно экстрагируют этилацетатом (2х50 мл). Органические экстракты объединяют и сушат (MgSO4). Растворитель удаляют при пониженном давлении, и получают названное в заголовке соединение (4 г).
ТСХ Rf = 0,2 (диоксид кремния, гидроксид аммония : метанол : дихлорметан, 1 : 9 : 90, по объему).
1H ЯМР (CDCl3): δ 1,6-1,7 (м, 2Н), 1,9 - 2,2 (м, 7Н), 2,05 - 2,15 (м, 2H), 2,25 (м, 2Н), 3,1-3,2 (м, 2Н), 5,1 (т, 1Н) ppm.
Препаративный пример 136
Гидрохлорид эндо-3-ацетокси-8-азабицикло [3,2,1] октана
К раствору соединения препаративного примера 135 (3,8 г, 1 мол. экв.) в сухом 1,2-дихлорэтане (40 мл), при 0oC и в атмосфере азота, добавляют α хлорэтилхлорформиат (2,37 мл, 1 мол. экв.), и реакционную смесь перемешивают в течение 30 минут. Затем удаляют растворитель при пониженном давлении, и остаток растворяют в метаноле (50 мл) и кипятят с обратным холодильником в течение 1 часа. Затем удаляют растворитель при пониженном давлении, и полученную в результате смолу обрабатывают диэтиловым эфиром (10 мл) и этилацетатом (5 мл), и получают названное в заголовке соединение в виде желтого порошка (3,7 г).
1H ЯМР (d6 - ДМСО): δ = 1,8-2,4 (м, 11H), 3,8-4,0 (м, 2H), 4,9-5,0 (м, 1H), 8,9-9,4 (м, 2H) ppm.
Препаративный пример 137
5(S)-1-Циклопропилметил-5-(3,4-дихлорфенил)-5- формилметил-2-пиперидон
В раствор соединения препаративного примера 141 (0,763 г, 1 мол. экв.) в метаноле (24 мл), в атмосфере азота при -78oC, в течение 30 минут пропускают озон со скоростью 50 мл/мин (используя заряд 1,5 А для генерации озона из кислорода). После этого снижают силу тока до нуля, и через реакционную смесь в течение 2 минут пропускают кислород со скоростью 5 мл/мин. Затем прекращают пропускать кислород, и через реакционную смесь в течение 20 минут пропускают азот. После этого осторожно, по каплям, добавляют раствор диметилсульфида (1,7 мл, 10 мол. экв.) в метаноле (3,5 мл), и реакционную смесь оставляют нагреваться до комнатной температуры в течение 18 часов. Растворитель удаляют при пониженном давлении, и реакционную смесь обрабатывают этилацетатом (20 мл) и водой (15 мл). Органический слой отделяют, и водный слой дополнительно экстрагируют этилацетатом (2х20 мл). Органические слои затем объединяют, сушат, используя сульфат натрия, фильтруют, и упаривают фильтрат досуха при пониженном давлении. Получают названное в заголовке соединение (0,69 г), которое используют без дополнительной очистки.
ТСХ Rf = 0,31 (диоксид кремния, этилацетат). МСНР m/z = 340 (m)+.
1H ЯМР (CDCl3): δ = 0,2 - 0,4 (м, 2H), 0,5 - 0,7 (м, 2H), 1,0 - 1,15 (м, 1H), 2,0 - 2,25 (м, 2H), 2,3 - 2,45 (м, 1H), 2,6 - 2,8 (м, 1H), 2,9 - 3,05 (м, 1H), 3,1 - 3,2 (м, 1H), 3,4 - 3,6 (м, 2H), 3,9 - 4,0 (м, 1H), 4,05 - 4,15 (м, 1H), 7,15 - 7,2 (м, 1H), 7,3 - 7,5 (м, 2H), 9,5 (с, 1H) ppm.
Препаративные примеры со 138 по 140
Соединения следующих, сведенных в табл. 23 препаративных примеров, имеющие общую формулу: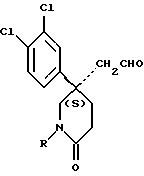
получают способом, подобным способу препаративного примера 137, используя соответствующие исходные аллилпиперидоны (см. препаративные примеры 142-144).
Подстрочное примечание
1. Очищают колоночной флэш-хроматографией, элюируя с градиентом растворителя этилацетата с гексаном (от 60 : 40 до 100 : 0, по объему).
Препаративный пример 141
5(S)-5-Аллил-1-циклопропилметил-5-(3,4-дихлорфенил)-2-пиперидон
Гидроксид калия (0,78 г, 1 мол. экв.) в атмосфере азота добавляют порциями к диметилсульфоксиду, и смесь перемешивают в течение 15 минут при комнатной температуре. К этому раствору добавляют раствор соединения препаративного примера 145 (0,982 г, 1 мол. экв.) и циклопропилметилбромида (0,37 мл, 1,1 мол. экв.) в диметилсульфоксиде (20 мл). Реакционную смесь перемешивают при комнатной температуре в течение 18 часов. Реакционную смесь обрабатывают этилацетатом (50 мл) и водой (20 мл), и удаляют водный слой. Органический слой затем промывают водой (3х20 мл), сушат, используя сульфат натрия, фильтруют и упаривают досуха при пониженном давлении. Получающуюся в результате смолу очищают колоночной флэш-хроматографией на силикагеле, элюируя метанолом с дихлорметаном (1 : 19, по объему), и получают названное в заголовке соединение (0,763 г).
ТСХ Rf = 0,33 (диоксид кремния, метанол : дихлорметан, 1 : 19, по объему).
МСНР m/z = 338 (m)+.
1H ЯМР (CDCl3): δ = 0,2 - 0,4 (м, 2Н), 0,5 - 0,7 (м, 2Н), 1,0 - 1,15 (м, 1Н), 2,0 - 2,25 (м, 3Н), 2,3 - 2,6 (м, 3Н), 3,1 - 3,25 (м, 1Н), 3,4 - 3,6 (м, 2Н), 3,65 - 3,8 (м, 1Н), 5,0 - 5,05 (м, 2Н), 5,2 - 5,5 (м, 1Н), 7,15 - 7,2 (м, 1Н), 7,4 - 7,5 (м, 2Н) ppm.
Препаративные примеры со 142 по 144
Соединения следующих, сведенных в табл. 24 препаративных примеров, имеющие общую формулу;
получают способом, подобным способу препаративного примера 141, используя в качестве исходных веществ тот же пиперидон и соответствующее бром- или п-толуолсульфонилоксиалкановое производное.
Подстрочные примечания
1. В качестве исходного вещества используют бромалкановое производное.
2. В качестве исходного вещества используют п-толуолсульфонилоксиалкановое производное.
Препаративный пример 145
5(S)-5-Аллил-5-(3,4-дихлорфенил)-2(1Н)-пиперидон
Раствор соединения препаративного примера 146 (120 мг) в этаноле (5 мл) кипятят с обратным холодильником с концентрированной серной кислотой (0,4 мл) в течение 24 часов. Реакционную смесь разбавляют водой (5 мл) и подщелачивают, используя карбонат натрия. Раствор экстрагируют этилацетатом (2х10 мл). Объединенные органические слои сушат, используя безводный сульфат магния, фильтруют, и фильтрат упаривают досуха при пониженном давлении. Остаток хроматографируют на силикагеле, элюируя с градиентом растворителя дихлорметана с метанолом (от 100 : 0 до 97 : 3 и до 95 : 5, по объему). Получают названное в заголовке соединение (10 мг).
МСНР m/z = 284 (m+1)+. ТСХ Rf = 0,4 (диоксид кремния, CH2Cl2 : CH3OH, 95 : 5 по объему).
[α]
1H ЯМР (CDCl3): δ = 2,0 - 2,2 (м, 3Н), 2,3 - 2,5 (м, 2Н), 2,5 - 2,6 (м, 1Н), 3,4 (д, 1Н), 3,6 (д, 1Н), 4,9 - 5,05 (м, 2Н), 5,25 - 5,4 (м, 1Н), 6,0 (с, ш, 1Н), 7,15 - 7,2 (м, 1H), 7,4 - 7,5 (м, 2Н) ppm.
Препаративный пример 146
Гидрохлорид 2-(3-(S)-3-аминометил-3-(3,4-дихлорфенил) гекс-5-ен-1-ил)-4-(S)-4-изопропилоксазолина
Раствор соединения препаративного примера 147 (1 г, 1 мол. экв.) в диэтиловом эфире (200 мл), при 0oC и атмосфере азота, добавляют при перемешивании, по каплям, в течение 1 часа, к суспензии алюмогидрида лития (3,7 г, 1 мол. экв. ) в диэтиловом эфире (200 мл). Реакционную смесь перемешивают в течение 1 часа при 0oC. Добавляют воду (3,7 мл), а затем добавляют 15% (в/в) водный раствор гидроксида натрия (3,7 мл) и еще воду (11,1 мл). Смесь перемешивают в течение 15 минут, фильтруют, и фильтрат упаривают досуха при пониженном давлении. Получают масло, которое после стояния в течение 18 часов дает желатинообразную смолу. Смолу обрабатывают этилацетатом (200 мл) и 2N соляной кислотой (100 мл). Органическую часть отделяют, сушат, используя безводный сульфат магния, фильтруют, и при пониженном давлении удаляют из фильтрата растворитель. Полученное твердое вещество хроматографируют на силикагеле, элюируя с градиентом растворителя дихлорметана с метанолом (от 100 : 1 до 95 : 5 и до 90 : 10, по объему), и получают названное в заголовке соединение (21,4 г).
МСНР m/z = 369 (m)+.
1H ЯМР (CDCl3): δ = 0,7-0,8 (м, 3Н), 0,9 - 1,0 (м, 3Н), 1,6 - 1,8 (м, 1Н), 1,95 - 2,2 (м, 3Н), 2,2 - 2,4 (м, 1Н), 2,4 - 2,55 (м, 1Н), 2,8 - 3,0 (м, 1Н), 3,3 - 3,5 (м, 2Н), 3,6 - 4,0 (м, 3Н), 4,9 - 5,1 (м, 2Н), 5,3 - 5,45 (м, 1Н), 7,1 (д, 1Н), 7,3 - 7,7 (м, 2H), 8,9 (д, ш, 1Н), 9,4 (д, ш, 1Н), 10,1 (с, ш, 1Н) ppm.
Препаративный пример 147
2-(3 (S)-3-Циано-3-(3,4-дихлорфенил) гекс-5-ен-1-ил)-4 (S)-4-изопропилоксазолин
Раствор соединения препаративного примера 148 (3 г, 1 мол. экв.) и S-валинола (1,04 г, 1 мол. экв.) в толуоле (30 мл) кипятят с обратным холодильником в условиях по Дину-Старку в течение 18 часов. Затем еще добавляют толуол, и реакционную смесь кипятят с обратным холодильником еще в течение 48 часов. Затем толуол удаляют испарением при пониженном давлении, и остаток хроматографируют на силикагеле, элюируя с градиентом растворителя гексана с диэтиловым эфиром (от 100 : 0 до 80 : 20 и до 60 : 40, по объему), и получают названное в заголовке соединение (1 г).
МСНР m/z = 365 (m)+.
1H ЯМР (CDCl3): δ = 0,8 (д, 3Н), 0,95 (м, 3Н), 1,6 - 1,8 (м, 1Н), 2,05 - 2,3 (м, 2Н), 2,4 - 2,55 (м, 2Н), 2,6 - 2,8 (м, 2Н), 3,8 - 4,0 (м, 2Н), 4,15 - 4,2 (м, 1Н), 5,1 - 5,2 (м, 2Н), 5,5 - 5,7 (м, 1Н), 7,2 - 7,25 (м, 1Н), 7,5 - 7,55 (м, 2Н) ppm.
Препаративный пример 148
4(S)-4-Циано-4-(3,4-дихлорфенил)гепт-6-еновая кислота
К раствору соединения препаративного примера 149 (5,5 г) в дихлорметане (100 мл) при перемешивании добавляют 1N соляную кислоту (100 мл). Затем удаляют водный слой, а органическую часть промывают 1N соляной кислотой (70 мл). Органический слой сушат, используя безводный сульфат магния, фильтруют, и фильтрат упаривают досуха при пониженном давлении. Получают названное в заголовке соединение (3,6 г).
МСНР m/z = 316 (m+NH4)+.
1H ЯМР (CDCl3): δ = 2,15 - 2,8 (м, 6Н), 5,1 - 5,25 (м, 2Н), 5,55 - 5,7 (м, 1Н), 7,2 - 7,25 (м, 1Н), 7,5 - 7,55 (м, 2Н) ppm.
Препаративный пример 149
(R)-(+)-1-(1-Нафтил) этиламиновая соль 4(S)-4-циано-4-(3,4-дихлорфенил)гепт-6-еновой кислоты
К раствору соединения препаративного примера 150 (16 г) в этилацетате (50 мл) добавляют R-(+)-1-(1-нафтил) этиламин (4,8 г). Раствор перемешивают в течение 30 минут при комнатной температуре, и затем при пониженном давлении удаляют растворитель, и получают смолу. Смолу частично растворяют в гексане с диэтиловым эфиром (4 : 1, по объему, 150 мл) и скребут со стенки колбы, чтобы вызвать кристаллизацию. Полученное таким образом белое твердое вещество отфильтровывают и три раза кристаллизуют из этилацетата. Получают названное в заголовке соединение (4,9 г), т.пл. 153-154oC.
[α]
1H ЯМР (CDCl3): δ = 1,6 (д, 3Н), 2,0 - 2,2 (м, 2Н), 2,25 - 2,5 (м, 2Н), 2,5 - 2,7 (м, 2Н), 3,8 - 4,1 (с, ш, 3Н), 5,0 - 5,2 (м, 3Н), 5,5 - 5,7 (м, 1Н), 7,15 - 7,25 (м, 1Н), 4,7 - 4,6 (м, 6Н), 7,75 (д, 1Н), 7,9 (д, 1Н) ppm.
Препаративный пример 150
4-Циано-4-(3,4-дихлорфенил) гепт-6-еновая кислота
К суспензии 60% (в/в) дисперсии гидрида натрия (231 г) в дитетрагидрофуране (17 л), при -10oC и в атмосфере азота, добавляют при перемешивании, по каплям, в течение 3 часов, раствор 3-бромпропановой кислоты (806,5 г) в тетрагидрофуране (6 л). Реакционной смеси позволяют нагреваться до комнатной температуры в течение 22 часов. Затем реакционную смесь охлаждают до -10oC. Одновременно, в атмосфере азота и при -10oC, при перемешивании, по каплям, в течение 2 часов, раствор соединения препаративного примера 151 (1633,5 г) в тетрагидрофуране (2,5 л) добавляют к тетрагидрофурановой суспензии (2,5 л) 60% (в/в) дисперсии гидрида натрия в масле (221 г) в 2,5 л тетрагидрофурана. Когда добавление закончится, этой второй реакционной смеси позволяют нагреваться до комнатной температуры в течение 18 часов. Затем эту реакционную смесь охлаждают до - 10oC, и в течение 3 часов канюлируют в вышеупомянутую смесь натриевой соли 3-бромпропановой кислоты. Реакционную смесь в течение 5 часов греют при 50oC. Затем реакционную смесь охлаждают, выливают в воду (8 л) и подщелачивают до pH 9,3, используя водный раствор бикарбоната натрия. Эту смесь промывают дихлорметаном (5х2 л), и водную часть подкисляют до pH 1,0, используя концентрированную соляную кислоту. Водный раствор экстрагируют дихлорметаном (4х2,5 л), и органические слои объединяют, сушат, используя безводный сульфат магния, фильтруют, и фильтрат концентрируют при пониженном давлении. Получают желтое масло. Это масло затем обрабатывают гексаном (1,5 л), и получают названное в заголовке соединение в виде твердого вещества кремового цвета (1155,3 г), которое используют без какой-либо дополнительной очистки.
ТСХ Rf = 0,42 (диоксид кремния, метанол : дихлорметан, 1 : 9, по объему). МСНР m/z = 316 (m+NH4)+.
1H ЯМР (CDCl3): δ = 2,15 - 2,8 (м, 6Н), 5,1 - 5,25 (м, 2Н), 5,55 - 5,7 (м, 1H), 7,2 - 7,25 (м, 1H), 7,5 - 7,55 (м, 2Н) ppm.
Препаративный пример 151
2-(3,4-Дихлорфенил)пент-4-еннитрил
К раствору 3,4-дихлорфенилацетонитрила (800 г, 4,3 мол. экв.) в циклогексане (16 л) при комнатной температуре, при перемешивании, осторожно добавляют водный раствор гидроксида натрия (1600 г гидроксида натрия в 8 л воды). Добавление вызывает повышение температуры реакционной смеси до 50oC. Затем добавляют аллилбромид (572 г, 1,1 мол. экв.) и гидрат тетра-н-бутиламмонийхлорида (40 г, 0,03 мол. экв.), и реакционную смесь перемешивают в течение 1 часа при 50oC. Водную фазу удаляют, органический слой промывают водой (10 л). Органическую фазу фильтруют через силикагель (1 кг) при пониженном давлении, и получают фильтрат - раствор желтого цвета. Из фильтрата при пониженном давлении удаляют растворитель, и получают названное в заголовке соединение в виде масла (960 г) 70%-ной чистоты, которое используют без какой-либо дополнительной очистки.
ТСХ Rf = 0,71 (диоксид кремния, диэтиловый эфир : гексан, 1 : 1, по объему). МСНР m/z = 266 (m)+.
1H ЯМР (CDCl3): δ = 2,6 - 2,75 (м, 2Н), 3,85 (т, 1H), 5,1 - 5,25 (м, 2Н), 5,7 - 5,9 (м, 1H), 7,2 - 7,25 (м, 2Н), 7,5 - 7,55 (м, 2Н) ppm.
Препаративный пример 152
Метансульфонат 1-(трет-бутоксикарбонил)-3- (пиперазин-1-ил)-азетидина
Расплавляют пиперазин (149,2 г, 8 мол. экв.) и затем добавляют 1-(трет-бутоксикарбонил)-3-метансульфонилоксиазетидин (см. публикацию заявки на международный патент ВОИС93/19059) (54,5 г, 217 ммоль). Затем смесь нагревают при 115oC в течение 24 часов. Реакционную смесь охлаждают, и избыток пиперазина удаляют при пониженном давлении. Остаток очищают колоночной флэш-хроматографией на силикагеле, используя в качестве элюента метанол с дихлорметаном (5 : 95, по объему), и получают названное в заголовке соединение (51 г).
МСНР m/z = 242 (m+1)+.
1H ЯМР (CDCl3): δ = 1,4 (м, 9Н), 2,5 - 2,6 (м, 4Н), 3,1 - 3,25 (м, 5Н), 3,7 - 3,8 (м, 2Н), 3,9 - 3,95 (м, 2Н), 4,6 (ш, с, 1Н) ppm.
Препаративный пример 153
3-(4-Аминосульфонилпиперазин-1-ил)-1-(трет-бутоксикарбонил)- азетидин
Раствор соединения препаративного примера 152 (50 г, 132,6 ммоль) и сульфамида (88 г, 6,9 мол. экв.) в 1,4-диоксане (1300 мл) кипятят с обратным холодильником в течение 55 часов. Раствор охлаждают, и удаляют растворитель при пониженном давлении. Остаток очищают колоночной флэш-хроматографией на силикагеле, используя в качестве элюента метанол с дихлорметаном (5 : 95, по объему), и получают названное в заголовке соединение (50 г).
1H ЯМР (CDCl3): δ = 1,45 (с, 9Н), 2,4 - 2,5 (м, 4Н), 3,1 - 3,2 (м, 1Н), 3,25 - 3,3 (м, 4Н), 3,75 - 3,8 (м, 2Н), 3,85 - 3,9 (м, 2Н), 4,3 (ш, с, 2Н) ppm.
Препаративный пример 154
Бистрифторацетат 3-(4-аминосульфонилпиперазин-1-ил) азетидина
К раствору соединения препаративного примера 153 (364 мг, 1,14 ммоль) в дихлорметане (6 мл), в атмосфере азота и при 0oC, постепенно добавляют трифторуксусную кислоту (3 мл, 35 мол. экв.) и реакционной смеси позволяют нагреваться до комнатной температуры в течение 2 часов. Затем при пониженном давлении удаляют растворитель, и остаток подвергают азеотропной перегонке с дихлорметаном (3х10 мл). Получающееся в результате масло обрабатывают диэтиловым эфиром, и получают названное в заголовке соединение (379 мг), которое используют без дополнительной очистки.
1H ЯМР (CDCl3): δ = 2,4 - 2,6 (м, 4Н), 2,95 - 3,15 (м, 4Н), 3,35 - 3,5 (м, 1H), 3,8 - 4,1 (м, 4Н), 6,6 - 6,8 (м, 2Н), 8,6 - 8,85 (м, 3Н) ppm.
Препаративный пример 155
1,1-Дициклопропилэтен
К суспензии метилтрифенилфосфонийбромида (133,5 мг, 3 мол. экв.) в диметилсульфоксиде (200 мл), в атмосфере азота, по каплям, в течение 15 минут, при перемешивании добавляют раствор третбутоксида калия (42 г, 3 мол. экв.) в диметилсульфоксиде (200 мл). Добавляют дициклопропилкетон (13,8 г, 0,125 моль), и раствор нагревают при 60oC в течение 1 часа, а затем перемешивают в течение 16 часов при комнатной температуре. Реакционную смесь выливают в 20% (в/в) водный раствор хлорида натрия (900 мл), и добавляют лед (200 г). Смесь экстрагируют диэтиловым эфиром (2 л), и органический экстракт промывают водой (2х1,5 л), сушат, используя безводный сульфат магния, и фильтруют. Затем из фильтрата при пониженном давлении удаляют растворитель, и остаток встряхивают со смесью диэтилового эфира (50 мл) и гексана (50 мл).
Смесь фильтруют, удаляют из фильтрата растворитель при пониженном давлении, и остаток встряхивают со смесью гексана и диэтилового эфира (50 мл, 9: 1, по объему). Смесь фильтруют, удаляют из фильтрата растворитель при пониженном давлении, и получают названное в заголовке соединение (4,5 г).
1H ЯМР (CDCl3): δ = 0,55 - 0,7 (м, 8Н), 1,3 - 1,45 (м, 2Н), 4,6 (с, 2Н) ppm.
Препаративный пример 156
2,2-Дициклопропилэтанол
К раствору соединения препаративного примера 155 (1 г, 9,24 ммоль) в тетрагидрофуране (15 мл), в атмосфере азота, добавляют 9-борабицикло[3.3.1] нонан (18,5 мл 0,5М раствора в тетрагидрофуране, 1 мол. экв.), и раствор перемешивают в течение 18 часов. Добавляют гидроксид натрия (3,08 мл 3М водного раствора, 1 мол. экв.) и затем этанол (5 мл). Реакционную смесь охлаждают до 5oC, и добавляют пероксид водорода (3,14 мл 30% (в/в) водного раствора, 3 мол. экв.). Реакционную смесь перемешивают при комнатной температуре в течение 1 часа. Реакционную смесь обрабатывают этилацетатом (50 мл) и водой (50 мл), органическую фазу отделяют и сушат, используя безводный сульфат магния. Раствор фильтруют, и растворитель из фильтрата удаляют при пониженном давлении. Получают масло, которое хроматографируют на силикагеле, элюируя диэтиловым эфиром с гексаном (2 : 1, по объему), и получают названное в заголовке соединение (160 мг).
1H ЯМР (CDCl3): δ = 0,1 - 0,35 (м, 4Н), 0,4 - 0,55 (м, 4Н), 0,6 - 0,8 (м, 2Н), 1,65 (т, 1Н), 3,7 (т, 2Н) ppm.
Препаративный пример 157
2-Метансульфонилоксиэтилциклопропан
Названное в заголовке соединение получают способом, подобным способу препаративного примера 13, за исключением того, что используют 1,2 мол. экв. триэтиламина и 1,3 мол. экв. метансульфонилхлорида. МСНР m/z = 182 (m+NH4)+.
1H ЯМР (CDCl3): δ = 0,1 - 0,15 (м, 2Н), 0,5 - 0,55 (м, 2Н), 0,7 - 0,8 (м, 1Н), 1,6 - 1,7 (м, 2Н), 3,00 (с, 3Н), 4,25 - 4,3 (м, 2Н) ppm.
Препаративный пример 158
2,2-Дициклопропил-1-метансульфонилоксиэтан
К раствору соединения препаративного примера 156 (1 г, 7,9 ммоль) в дихлорметане (20 мл), при 5oC и в атмосфере азота, добавляют триэтиламин (1,32 мл, 1,2 мол. экв.), после чего добавляют метансульфонилхлорид (0,67 мл, 1,1 мол. экв.), и реакционную смесь перемешивают в течение 2 часов. Раствор концентрируют при пониженном давлении, и остаток обрабатывают этилацетатом (100 мл) и водой (100 мл). Органический слой отделяют, сушат, используя безводный сульфат магния, фильтруют, и из фильтрата удаляют растворитель при пониженном давлении. Остаток хроматографируют на силикагеле, элюируя диэтиловым эфиром с гексаном (2 : 1, по объему), и получают названное в заголовке соединение (1,5 г).
1H ЯМР (CDCl3): δ = 0,1 - 0,15 (м, 4Н), 0,2 - 0,3 (м, 5Н), 0,35 - 0,4 (м, 2Н), 3,00 (с, 3Н), 4,15 (д, 2Н) ppm.
Препаративный пример 159
N-Метилсульфамоилхлорид
К раствору хлористого сульфурила (35,7 мл, 3 мол. экв.) в ацетонитриле (30 мл) в атмосфере азота добавляют гидрохлорид метиламина (10 г, 148 ммоль), а затем ацетонитрил (30 мл). Реакционную смесь кипятят с обратным холодильником в течение 20 часов. Реакционную смесь охлаждают до комнатной температуры, и смесь концентрируют при пониженном давлении. Получают названное в заголовке соединение (20,51 г), которое используют без дополнительной очистки.
1H ЯМР (CDCl3): δ = 3,0 (д, 3Н), 5,7 (с, ш, 1Н) ppm.
Препаративные примеры 160 и 161
Соединения двух следующих, сведенных в табл. 25 примеров получают способом, подобным способу препаративного примера 159, используя хлористый сульфурил и соответствующие амины.
Препаративный пример 162
трет-Бутил-6-бромгексаноат
К раствору 6-бромгексановой кислоты (9 г, 0,046 моль) в дихлорметaнe (50 мл) при -78oC добавляют дымящую серную кислоту (0,5 мл). К этому раствору добавляют по каплям жидкий изобутилен (50 мл). Реакционной смеси затем позволяют нагреваться до комнатной температуры и перемешивают в течение 18 часов. Смесь выливают в охлажденный льдом насыщенный водный раствор карбоната натрия. Смесь экстрагируют дихлорметаном (2х40 мл), и объединенные экстракты промывают солевым раствором (40 мл). Органический слой сушат, используя сульфат магния. Смесь фильтруют, и растворитель из фильтрата удаляют при пониженном давлении. Получают названное в заголовке соединение в виде желтого масла, которое используют без дополнительной очистки.
ТСХ Rf = 0,25 (диоксид кремния, метанол : дихлорметан, 1 : 9, по объему). МСНР m/z = 267,8 (m+18)+.
1H ЯМР (CDCl3): δ = 1,3 - 1,45 (м, 11Н), 1,45 - 1,6 (м, 2Н), 1,7 - 1,85 (т, 2Н), 3,35 (т, 2Н) ppm.
Препаративный пример 163
4-(2-Бензооксазолил) пиперидин
Смесь 2-аминофенола (20 г, 183 ммоль), изонипекотиновой кислоты (23,7 г, 1 мол. экв.) и полифосфорной кислоты (50 мл) нагревают при перемешивании в течение 2 часов, реакционную смесь охлаждают, выливают на лед (400 г), и добавляют твердый гидроксид натрия (85 г) до достижения pH 8. Твердое вещество отфильтровывают, суспендируют в воде (500 мл) и фильтруют, получают названное в заголовке соединение (4,5 г).
Вторую порцию названного в заголовке соединения получают путем экстракции вышеупомянутого фильтрата дихлорметаном (4х200 мл). Объединенные органические экстракты сушат, используя безводный сульфат магния, фильтруют, и удаляют из фильтрата растворитель при пониженном давлении. Получают названное в заголовке соединение (9 г).
1H ЯМР (CDCl3): δ = 1,9 - 2,1 (м, 3Н), 2,15 - 2,3 (м, 2H), 2,8 - 2,9 (м, 2Н), 3,1 - 3,3 (м, 3Н), 7,3 - 7,35 (м, 2Н), 7,5 - 7,55 (м, 1Н), 7,7 - 7,75 (м, 1Н) ppm.
Препаративный пример 164
1-Бензил-4-(трет-бутоксикарбониламино) пиперидин
К раствору 4-амино-1-бензилпиперидина (10 г, 53 ммоль) в дихлорметане (200 мл) при 0oC добавляют ди-трет-бутилкарбонат (12,6 г, 1,1 мол. экв.), и смесь перемешивают при комнатной температуре в течение 16 часов.
Сырую реакционную смесь промывают 2% (в/в) водным раствором бикарбоната натрия (300 мл), сушат, используя безводный сульфат магния, и раствор фильтруют. Удаление из фильтрата растворителя при пониженном давлении дает твердое вещество бежевого цвета, которое очищают колоночной хроматографией на силикагеле, элюируя дихлорметаном с метанолом (95 : 5, по объему). Получают названное в заголовке соединение (13,1 г).
ТСХ Rf = 0,3 (дихлорметан : метанол, 95 : 5, по объему).
1H ЯМР (CDCl3): δ = 1,35 - 1,5 (м, 11Н), 1,85 - 1,95 (м, 2Н), 2,05 - 2,15 (м, 2Н), 2,75 - 2,8 (м, 2Н), 3,4 - 3,5 (м, 3Н), 4,4 (с, ш, 1Н), 7,2 - 7,3 (м, 5Н) ppm.
Препаративный пример 165
4-(трет-Бутоксикарбониламино)пиперидин
К раствору соединения препаративного примера 164 (13,1 г, 45,1 ммоль) в этаноле (135 мл) добавляют 10% (в/в) палладий-на-угле (0,6 г), и смесь перемешивают в атмосфере водорода при 414 кПа (60 ф/д2) в течение 16 часов. После этого добавляют еще 0,6 г катализатора, и смесь перемешивают в атмосфере водорода при 414 кПа (60 ф/д2) еще в течение 72 часов. Затем реакционную смесь фильтруют через фильтр на целлюлозной основе, и фильтрат концентрируют при пониженном давлении, и получают твердое вещество. Это твердое вещество порошкуют с диэтиловым эфиром (50 мл), фильтруют, и полученное твердое вещество сушат при пониженном давлении. Получают названное в заголовке соединение (8,1 г).
1H ЯМР (CDCl3): δ = 1,15 - 1,3 (м, 2Н), 1,35 - 1,5 (м, 10Н), 1,9 - 1,95 (м, 2Н), 2,6 - 2,7 (м, 2Н), 3,0 - 3,1 (м, 2Н), 3,5 (с, ш, 1Н), 4,4 (с, ш, 1Н) ppm.
Препаративный пример 166
1-Бензилоксикарбонил-4-гидроксипиперидин
К раствору 4-гидроксипиперидина (4,2 г, 41 ммоль) в дихлорметане (50 мл), при 0oC и в атмосфере азота, постепенно добавляют бензилхлорформиат (7,7 мл, 1,3 мол. экв.), после чего добавляют триэтиламин (6,94 мл, 1,2 мол. экв.). Реакционную смесь перемешивают при комнатной температуре в течение 15 часов. Реакционную смесь промывают насыщенным раствором бикарбоната натрия (2х50 мл), и органический слой сушат, используя безводный сульфат магния, фильтруют, и упаривают фильтрат при пониженном давлении досуха. Сырой продукт очищают флэш-хроматографией на силикагеле, элюируя метанолом с дихлорметаном (1 : 20, по объему), и получают названное в заголовке соединение (9,24 г).
ТСХ Rf = 0,68 (диоксид кремния, метанол : дихлорметан, 1 : 10, по объему). МСНР m/z = 236 (m+1)+.
1H ЯМР (CDCl3): δ = 1,35 - 1,55 (м, 2Н), 1,75 (м, 1Н), 1,8 - 2,0 (м, 2Н), 3,1 - 3,2 (м, 2Н), 3,8 - 4,0 (м, 3Н), 5,15 (с, 2Н), 7,35 (с, 5Н) ppm.
Препаративный пример 167
1-Бензилоксикарбонил-(4-трет-бутилокси) пиперидин
К раствору соединения препаративного примера 166 (9,24 г) в циклогексане с дихлорметаном (120 мл, 3 : 1, по объему), при 0oC и в атмосфере азота, добавляют трет-бутилтрихлорацетимидат (14,1 мл, 2 мол. экв. ) и эфират трифторида бора (0,8 мл, 0,16 мол. экв.). Реакционной смеси позволяют нагреваться до комнатной температуры и перемешивают в течение 48 часов.
Растворитель из реакционной смеси удаляют испарением при пониженном давлении. Реакционную смесь растворяют в этилацетате (50 мл) и промывают насыщенным раствором бикарбоната натрия (30 мл). Водный слой экстрагируют этилацетатом (2х30 мл). Органические слои объединяют, сушат, используя безводный сульфат магния, фильтруют, и упаривают фильтрат при пониженном давлении досуха. Остаток затем очищают колоночной флэш-хроматографией на силикагеле, элюируя метанолом с дихлорметаном (3: 97, по объему), а затем второй раз колоночной хроматографией на силикагеле, элюируя метанолом с дихлорметаном (1 : 5, по объему). Получают названное в заголовке соединение (9 г).
ТСХ Rf = 0,56 (диоксид кремния, метанол : дихлорметан, 1 : 20, по объему). МСНР m/z = 292 (m+1)+.
1H ЯМР (CDCl3): δ = 1,2 (с, 9Н), 1,4 - 1,55 (м, 2Н), 1,65 - 1,8 (м, 2Н), 3,1 - 3,25 (м, 2Н), 3,6 - 3,7 (м, 1Н), 3,8 - 4,0 (м, 2Н), 5,15 (с, 2Н), 7,4 (с, 5Н) ppm.
Препаративный пример 168
4-(трет-Бутилокси) пиперидин
Соединение препаративного примера 167 (8,41 г, 28,8 ммоль) растворяют в этаноле (100 мл) и добавляют 10% (в/в) палладий-на-угле (0,34 г). Смесь перемешивают в атмосфере водорода при давлении 414 кПа (60 ф/д2) в течение 24 часов. Катализатор отфильтровывают, и растворитель из фильтрата удаляют при пониженном давлении. Получающееся в результате масло очищают колоночной хроматографией на силикагеле, элюируя смесью концентрированного водного раствора аммиака с метанолом и дихлорметаном (1 : 10 : 89, по объему). Получают названное в заголовке соединение (2,48 г).
ТСХ Rf = 0,23 (диоксид кремния, конц. водн. р-р аммиака : метанол : дихлорметан, 1 : 10 : 89, по объему). МСНР m/z = 158 (m+1)+.
Препаративный пример 169
1-(трет-Бутоксикарбонил)-3-(1-пиперазинил) азетидин
Расплавляют пиперазин (23,69 г, 8 мол. экв.), и добавляют 1-(трет-бутоксикарбонил)-3-метансульфонилоксиазетидин (см. публикацию заявки на международный патент ВОИС93/19059) (8,64 г, 34,4 ммоль). Смесь нагревают при 120oC в течение 15 часов в атмосфере азота. Реакционную смесь охлаждают до комнатной температуры, и избыток пиперазина удаляют при пониженном давлении. Остаток затем хроматографируют на силикагеле, используя градиент элюирования (метанол : дихлорметан, изменение от 1 : 19 до 1 : 4, по объему), и получают названное в заголовке соединение (6,32 г).
МСНР m/z = 242 (m+1)+.
1H ЯМР (CDCl3): δ = 1,35 (с, 9Н), 2,4 - 2,5 (м, 4Н), 3,0 - 3,1 (м, 5Н), 3,2 - 4,2 (м, ш, 5Н) ppm.
Препаративный пример 170
4-(трет-Бутоксикарбонил)-3-(4-метилсульфонилпиперазин- 1-ил)-азетидин
К раствору соединения препаративного примера 169 (8,06 г, 21,3 ммоль) в дихлорметане (160 мл) добавляют триэтиламин (13,4 мл). Раствор выдерживают в атмосфере азота и охлаждают до 0oC. Добавляют по каплям, в течение 30 минут, метансульфонилхлорид (5,25 мл, 7,77 г, 3 мол. экв.). Реакционной смеси позволяют нагреваться до комнатной температуры в течение 2,5 часов и затем перемешивают еще в течение 18 часов. Реакционную смесь промывают водой (3х50 мл), а затем солевым раствором (2х30 мл). Органический слой сушат, используя безводный сульфат магния. Затем смесь фильтруют, и удаляют растворитель из фильтрата при пониженном давлении. Остаток хроматографируют на силикагеле, элюируя смесью концентрированного водного раствора аммиака с метанолом и дихлорметаном (1 : 10 : 89, по объему). Продукт после этой стадии хроматографии снова подвергают колоночной хроматографии на силикагеле, элюируя метанолом с этилацетатом (1 : 10, по объему). Получают названное в заголовке соединение (0,9 г).
ТСХ Rf = 0,6 (диоксид кремния, конц. водн. р-р аммиака : метанол : дихлорметан, 1 : 10 : 89, по объему). МСНР m/z = 320 (m+1)+.
1H ЯМР (CDCl3): δ = 1,4 (с, 9Н), 2,45 (т, 9Н), 3,8 (с, 3Н), 3,1 - 3,2 (м, 1H), 3,2 - 3,3 (м, 4Н), 3,75 - 3,8 (м, 2Н), 3,9 - 4,0 (м, 2Н) ppm.
Препаративный пример 171
3-(4-Бензоилпиперазин-1-ил)-1-(трет-бутоксикарбонил)-азетидин
К раствору соединения препаративного примера 169 (3,3 г) в дихлорметане (70 мл), при комнатной температуре и в атмосфере азота, добавляют триэтиламин (4,06 мл) и бензоилхлорид (2,30 мл). Смесь перемешивают при комнатной температуре в течение 16 часов. Реакционную смесь промывают водой (3х100 мл) и солевым раствором (3х100 мл), сушат, используя безводный сульфат магния, фильтруют, и удаляют растворитель из фильтрата при пониженном давлении. Остаток подвергают колоночной хроматографии на силикагеле, элюируя этилацетатом, и получают названное в заголовке соединение (2,3 г).
Препаративный пример 172
1-(трет-Бутоксикарбонил)-3-(4-метилкарбамоилпиперазин-1-ил)-азетидин
К раствору соединения препаративного примера 169 (3,3 г) в дихлорметане (70 мл) добавляют метилизоцианат, и смесь перемешивают при комнатной температуре в течение 72 часов. После этого удаляют дихлорметан, пропуская через раствор азот. Остаток растворяют в дихлорметане (100 мл) и промывают 10% (в/в) водным раствором бикарбоната натрия (100 мл), а затем солевым раствором (100 мл). Органический слой сушат, используя безводный сульфат магния, фильтруют, и удаляют растворитель из фильтрата при пониженном давлении. Остаток хроматографируют на силикагеле, элюируя дихлорметаном с метанолом (95 : 5, по объему), и получают названное в заголовке соединение (1,8 г).
МСНР m/z = 299 (m+1)+.
1H ЯМР (CDCl3): δ = 1,40 (c, 9H), 2,25 - 2,35 (м, 4Н), 2,8 - 2,85 (м, 3H), 3,0 - 3,1 (м, 1Н), 3,35 - 3,4 (м, 4Н), 3,75 - 3,85 (м, 2H), 3,9 - 3,95 (м, 2Н), 4,4 (с, ш, 1H) ppm.
Препаративный пример 173
1-(трет-Бутоксикарбонил)-3-(4-метиламиносульфонилпиперазин- 1-ил)-азетидин
К раствору соединения препаративного примера 169 (500 мг, 2,07 ммоль) в ацетонитриле (5 мл) в атмосфере азота добавляют триэтиламин (0,43 мл, 1,5 мол. экв.). Добавляют по каплям раствор препаративного примера 159 (295 мг, 1,1 мол. экв.) в ацетонитриле (3 мл), и реакционную смесь нагревают при 90oC в течение 3 часов. Реакционную смесь охлаждают до комнатной температуры, и удаляют растворитель при пониженном давлении.
Остаток обрабатывают этилацетатом (50 мл) и водой (50 мл). Органический слой отделяют и промывают солевым раствором (50 мл), сушат, используя безводный сульфат магния, фильтруют, и удаляют растворитель из фильтрата при пониженном давлении. Остаток хроматографируют на силикагеле, элюируя метанолом с дихлорметаном (1 : 19, по объему), получают названное в заголовке соединение (374 мг).
ТСХ Rf = 0,73 (диоксид кремния, метанол : дихлорметан, 1 : 9, по объему). МСНР m/z = 335 (m+1)+.
1H ЯМР (CDCl3): δ = 1,4 (с, 9Н), 2,4 - 2,45 (м, 4Н), 2,7 - 2,75 (м, 3Н), 3,1 - 3,15 (м, 1H), 3,25 - 3,3 (м, 4Н), 3,75 - 3,9 (м, 4Н), 4,15 - 4,2 (м, 1H) ppm.
Препаративные примеры 174 и 175
Соединения следующих, сведенных в табл. 26 примеров, имеющие общую формулу: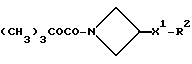
получают способом, подобным способу препаративного примера 173, используя в качестве исходных веществ тот же пиперазин и соответствующие сульфамоилхлориды (см. препаративные примеры 160 и 161).
Препаративный пример 176
1-(трет-Бутоксикарбонил)-3-(4-метоксипиперидин-1-ил)азетидин
К раствору соединения препаративного примера 71 (1 г, 4,12 ммоль) в тетрагидрофуране (12 мл), при 0oC и в атмосфере азота, добавляют, в два приема, 60% (в/в) дисперсию гидрида натрия в масле (0,198 мг, 1,2 мол. экв. ). После перемешивания в течение 30 минут добавляют метилиодид (0,282 мл, 1,1 мол. экв.), и смесь перемешивают еще в течение 16 часов.
Удаляют растворитель при пониженном давлении, и остаток обрабатывают этилацетатом (50 мл) и насыщенным водным раствором бикарбоната натрия (50 мл). Органический слой отделяют и сушат, используя безводный сульфат натрия. Смесь фильтруют, и из фильтрата при пониженном давлении удаляют растворитель, и получают масло. Этот сырой продукт очищают колоночной хроматографией на силикагеле, элюируя метанолом с дихлорметаном (3 : 97, по объему), и получают названное в заголовке соединение в виде бесцветного масла (0,84 г).
ТСХ Rf = 0,2 (диоксид кремния, метанол : дихлорметан, 3 : 97, по объему).
1H ЯМР (CDCl3): δ = 1,4 (м, 9Н), 1,55 - 1,7 (м, 2Н), 1,8 - 2,0 (м, 2Н), 2,0 - 2,15 (м, 2Н), 2,55 - 2,65 (м, 2Н), 3,0 - 3,1 (м, 1Н), 3,2 - 3,3 (м, 1Н), 3,35 (с, 3Н), 3,75 - 3,8 (м, 2Н), 3,9-4,0 (м, 2Н) ppm.
Препаративные примеры 177 и 178
Соединения следующих, сведенных в табл. 27 примеров, имеющие общую формулу: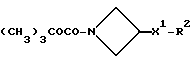
получают, используя способ, подобный способу препаративного примера 176, используя в качестве исходных веществ тот же пиперидинол и, в качестве аликилирующих агентов, соответственно, этилиодид или н-пропилиодид.
Препаративный пример 179
Бистрифторацетат 3-(4-бензоилпиперазин-1-ил) азетидина
К раствору соединения препаративного примера 171 (2,3 г) в дихлорметане (18 мл), при 0oC и в атмосфере азота, добавляют по каплям трифторуксусную кислоту (9 мл), и смесь перемешивают при комнатной температуре в течение 1 часа. Растворитель тщательно удаляют путем испарения при пониженном давлении, и остаток подвергают азеотропной перегонке с дихлорметаном (3х20 мл). Получающееся в результате масло промывают диэтиловым эфиром (3х20 мл). Затем добавляют этилацетат (50 мл), и выпавший осадок собирают фильтрацией и сушат. Получают названное в заголовке соединение (132 мг). Вторую порцию названного в заголовке соединения (186 мг) получают путем концентрации фильтрата при пониженном давлении, когда получают масло. Это масло обрабатывают диэтиловым эфиром и этилацетатом, и полученное твердое вещество собирают фильтрацией и сушат. Получают названное в заголовке соединение (0,32 г).
1H ЯМР (d6-ДМСО): δ = 2,3 - 2,45 (м, 4Н), 3,3 - 3,7 (м, 5Н), 3,8 - 4,05 (м, 5Н), 7,3 - 7,4 (м, 5Н), 8,65 (с, ш, 1Н) ppm.
Препаративный пример 180
Дигидрохлорид 3-(4-метоксикарбонилпиперидин-1-ил) азетидина
К раствору соединения препаративного примера 105 (7,5 г, 19,81 ммоль) в дихлорметане (100 мл), при 0oC и в атмосфере азота, добавляют α-хлорэтилхлорформиат (2,6 мл, 1,2 мол. экв.), и реакционную смесь нагревают до комнатной температуры в течение 1 часа. Затем добавляют метанол (150 мл) и карбонат калия (8,2 г, 3 мол. экв.), и реакционную смесь кипятят с обратным холодильником в течение 3 часов. Реакционную смесь охлаждают до комнатной температуры, фильтруют, и фильтрат подкисляют до pH 3 раствором хлористого водорода в метаноле. Смесь фильтруют, и удаляют растворитель испарением при пониженном давлении. Остаток промывают диэтиловым эфиром (3х100 мл) и затем порошкуют с диэтиловым эфиром.
Получают твердое вещество, которое отфильтровывают и сушат, и получают названное в заголовке соединение (5,1 г).
МСНР m/z = 199 (m+1)+.
Препаративный пример 181
Бистрифторацетат 3-(4-трет-бутоксикарбониламинопиперидин-1-ил) -азетидина
К раствору соединения препаративного примера 106 (6,8 г, 16,1 ммоль) в дихлорметане (70 мл), при 0oC и в атмосфере азота, добавляют альфа-хлорэтилхлорформиат (1,91 мл, 1,1 мол. экв.), и смесь перемешивают при комнатной температуре в течение 1 часа. После этого растворитель удаляют испарением при пониженном давлении, остаток растворяют в метаноле (80 мл), и добавляют карбонат калия (4,9 г, 2,2 мол. экв.), затем смесь кипятят с обратным холодильником в течение 1 часа. Реакционную смесь охлаждают до комнатной температуры, фильтруют, и фильтрат подкисляют до pH 5, добавляя по каплям трифторуксусную кислоту. Удаляют растворитель при пониженном давлении, и получают смолу, которую порошкуют с диэтиловым эфиром, и получают твердое вещество. Это твердое вещество собирают фильтрацией и сушат при пониженном давлении, и получают названное в заголовке соединение в виде сырого продукта, который используют непосредственно.
Препаративный пример 182
5(S)-5-(3,4-Дихлорфенил)-1-(4,4-дифторциклогексилметил)-5- (1,3-диоксолан-2-илметил)-2-пиперидон
К смеси диметилсульфоксида (50 мл) и гидроксида калия (2,1 г), при перемешивании при 0oC и в атмосфере азота, добавляют раствор соединения примера 123 (в) (3 г, 9,1 ммоль) в диметилсульфоксиде (50 мл), после чего добавляют соединение препаративного примера 11 (3,1 г), и смесь перемешивают при комнатной температуре в течение 16 часов. Добавляют воду (300 мл) и солевой раствор (300 мл), и смесь экстрагируют этилацетатом (3х300 мл). Объединенные органические экстракты промывают солевым раствором (300 мл), сушат, используя безводный сульфат магния, фильтруют, и удаляют из фильтрата растворитель при пониженном давлении. Остаток хроматографируют на силикагеле, элюируя с градиентом растворителя этилацетата с гексаном (изменение от 1 : 1 до 7 : 3, до 4 : 1 и до чистого этилацетата), и получают названное в заголовке соединение (3,3 г).
МСНР m/z = 462 (m+1)+.
1H ЯМР (CDCl3): δ = 1,3 - 1,45 (м, 2Н), 1,6 - 1,95 (м, 6Н), 2,1 - 2,2 (м, 6Н), 2,4 - 2,55 (м, 1Н), 3,2 - 3,3 (м, 1Н), 3,4 - 3,5 (м, 2Н), 3,65 - 3,75 (м, 3Н), 3,85 - 3,95 (м, 2Н), 4,3 - 4,35 (м, 1Н), 7,1 - 7,4 (м, 3Н) ppm.
Препаративные примеры со 183 по 186
Соединения следующих, сведенных в табл. 28 препаративных примеров, имеющие общую формулу:
(* - асимметрический центр)
получают способом, подобным способу препаративного примера 182, используя соответствующий пиперидон (см. пример 123 (в) и препаративный пример 193) и соответствующие исходные мезилаты для препаративных примеров 183 и 184, и соответствующие исходные бромиды для препаративных примеров 185 и 186.
Подстрочные примечания
1. Получают (S)-энантиомер.
2. Получают (R)-энантиомер.
Препаративный пример 187
5(S)-5-(3,4-Дихлорфенил)-5-формилметил-2(1Н)-пиперидон
Раствор соединения примера 123 (в) (280 мг, 0,85 ммоль) в тетрагидрофуране (3 мл) и 5N соляную кислоту (3 мл) перемешивают при комнатной температуре в атмосфере азота в течение 4 часов. Реакционную смесь выливают в смесь этилацетата (20 мл) и насыщенного водного раствора бикарбоната натрия (20 мл). Органическую фазу отделяют, сушат, используя безводный сульфат магния, фильтруют, и удаляют растворитель испарением при пониженном давлении. Получают названное в заголовке соединение (283 мг), которое используют без дополнительной очистки.
ТСХ Rf = 0,26 (диоксид кремния, метанол : дихлорметан, 1 : 9, по объему).
Препаративные примеры со 188 по 191
Соединения следующих, сведенных в табл. 29 примеров, имеющие общую формулу:
(* - асимметрический центр)
получают способом, подобным способу препаративного примера 187, используя в качестве исходных веществ соответствующие диоксоланы (см. препаративные примеры 183-186).
Подстрочные примечания.
1. Продукт содержит в качестве примеси приблизит. 35% исходного диоксолана, по данным 1H ЯМР - спектроскопии.
2. Продукт содержит в качестве примеси приблизит. 6% исходного диоксолана, по данным 1H ЯМР - спектроскопии.
3. Получают (R)-энантиомер.
4. Получают (S)-энантиомер.
Препаративный пример 192
4(R)-4-Циано-4-(3,4-дихлорфенил)-5-(1,3-диоксолан-2-ил)-пентан-1-овая кислота
Фильтрат, полученный при фракционной кристаллизации солей (S)-(-)-альфа-метилбензиламина 4(R)- и 4(S)-4-циано (3,4-дихлорфенил)-5-(1,3-диоксолан-2-ил)пентан-1-овой кислоты (см. пример 123 (а)), упаривают досуха при пониженном давлении, и получают твердое вещество (800 г). Это твердое вещество растворяют в метилэтилкетоне (3 л) и воде (300 мл) при кипячении с обратным холодильником. Добавляют дополнительное количество (1 л) метилэтилкетона, и смесь охлаждают. Добавляют чистый затравочный кристалл нужного соединения. Кристаллизации не происходит, поэтому объем раствора уменьшают наполовину путем упаривания при пониженном давлении. Смесь оставляют стоять в течение 72 часов, при этом образуется твердое вещество, которое отфильтровывают и промывают метилэтилкетоном (2х200 мл). Это белое твердое вещество сушат при 35oC при пониженном давлении в течение 3 часов, и затем его растворяют в метилэтилкетоне (1,5 л) и воде (165 мл). Раствор кипятят с обратным холодильником в течение 1 часа. Добавляют метилэтилкетон (700 мл), и в смесь снова вводят затравочный кристалл требуемого соединения, и оставляют смесь стоять в течение 56 часов. Получающееся в результате твердое вещество отфильтровывают и промывают метилэтилкетоном (2х100 мл), затем сушат при пониженном давлении при 35oC в течение 4 часов, и получают (S)-(-)-альфа-метилбензиламиновую соль названного в заголовке соединения (133 г). ВЭЖХ (колонка Ultron ES-OVM, подвижная фаза = буфер 0,01М KH2PO4, pH 6,6 : ацетонитрил, 92 : 8, по объему, скорость потока = 1 мл/мин) показывает, что упомянутая соль присутствует в количестве 98,4%.
Эту соль превращают в названное в заголовке соединение способом, подобным способу, описанному в примере 123 (а) для его энантиомера.
1H ЯМР (CDCl3): δ = 2,05 - 2,35 (м, 4Н), 2,4 - 2,65 (м, 2Н), 3,7 - 4,0 (м, 4Н), 4,75 - 4,85 (м, 1Н), 7,25 - 7,55 (м, 3Н), 9,9 (с, ш, 1Н, кислота) ppm.
Препаративный пример 193
5(R)-5-(3,4-Дихлорфенил)-5-(1,3-диоксолан-2-илметил)-2-(1Н)- пиперидон
Названное в заголовке соединение получают способом, подобным способу примера 123 (в), за исключением того, что в качестве исходного вещества используют соединение препаративного примера 192.
1H ЯМР (CDCl3): δ = 1,85 - 1,95 (м, 1Н), 2,0 - 2,25 (м, 4Н), 2,35 - 2,4 (м, 1Н), 3,45 - 3,55 (м, 1Н), 3,65 - 3,75 (м, 2Н), 3,8 - 3,9 (м, 3Н), 4,35 - 4,4 (м, 1Н), 6,15 (с, ш, 1Н), 7,5 - 7,45 (м, 3Н) ppm.
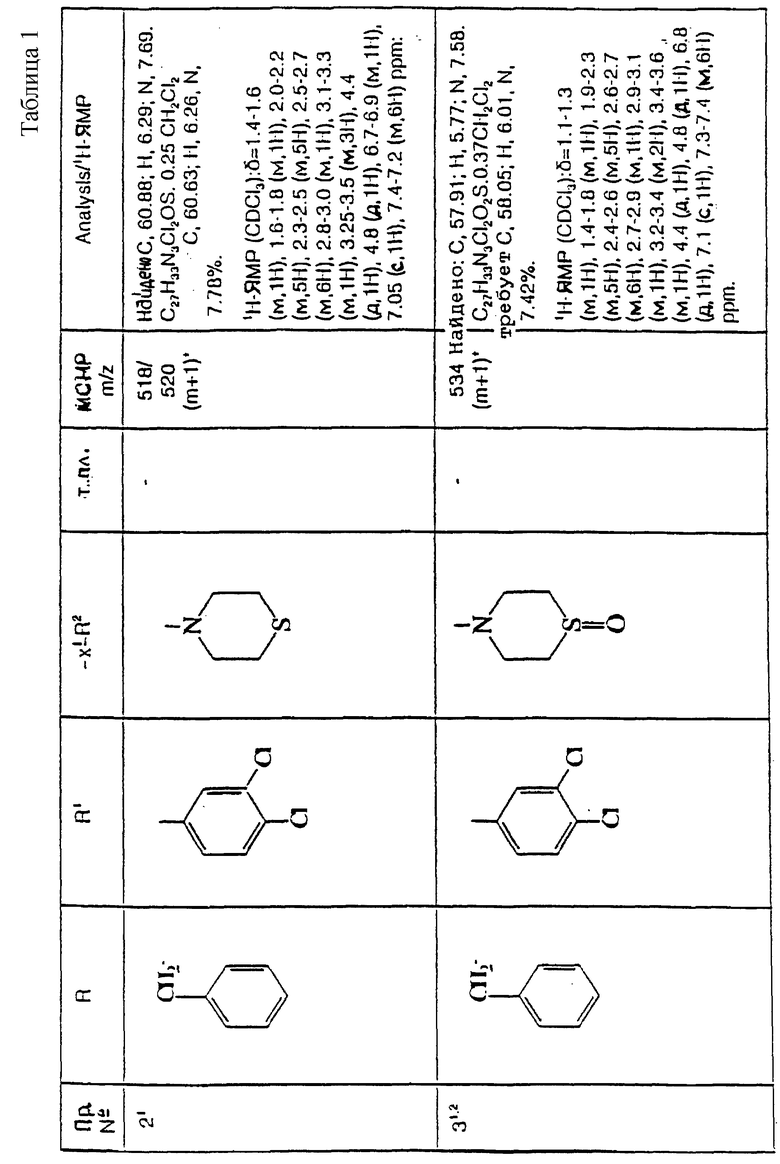
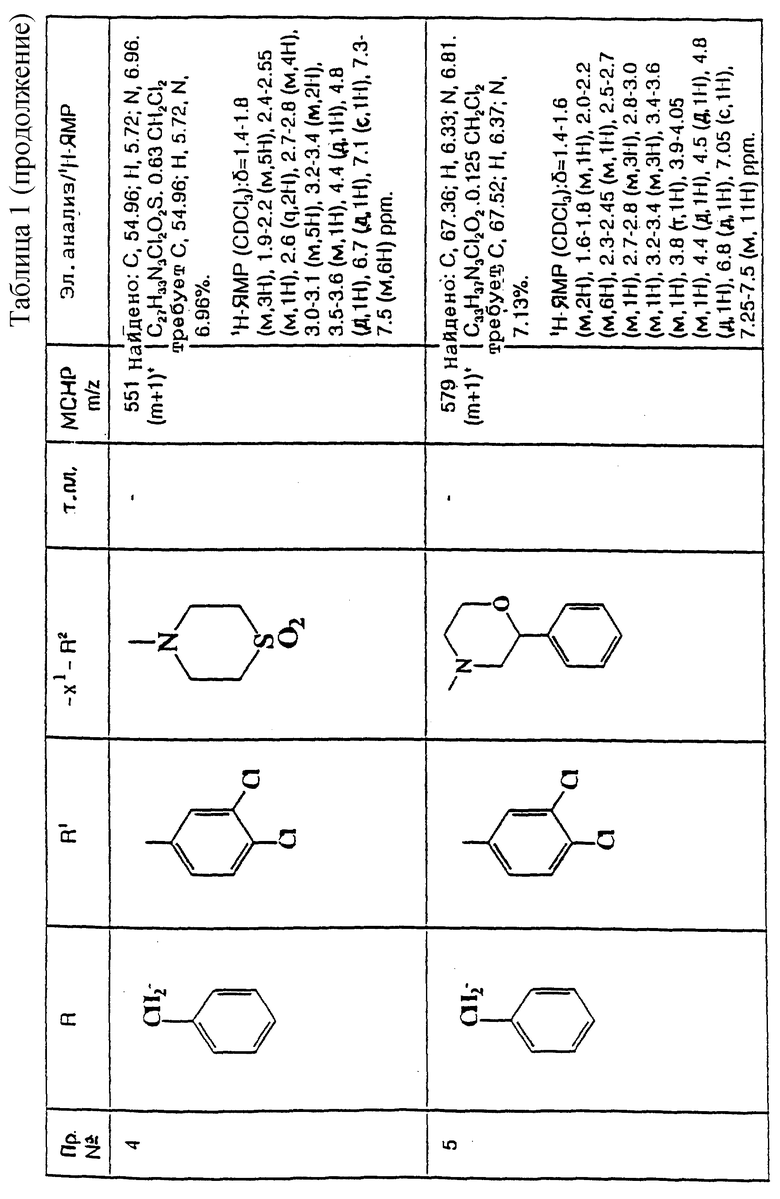
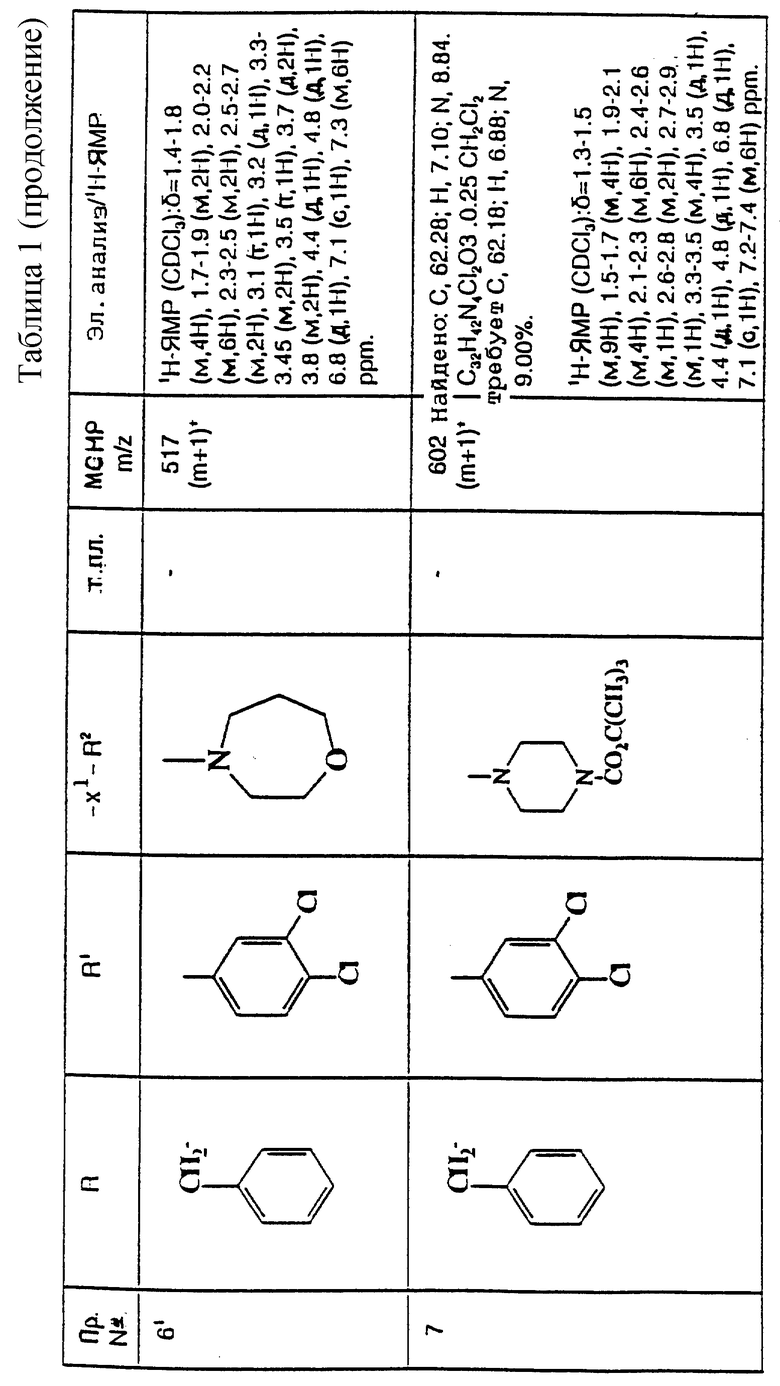
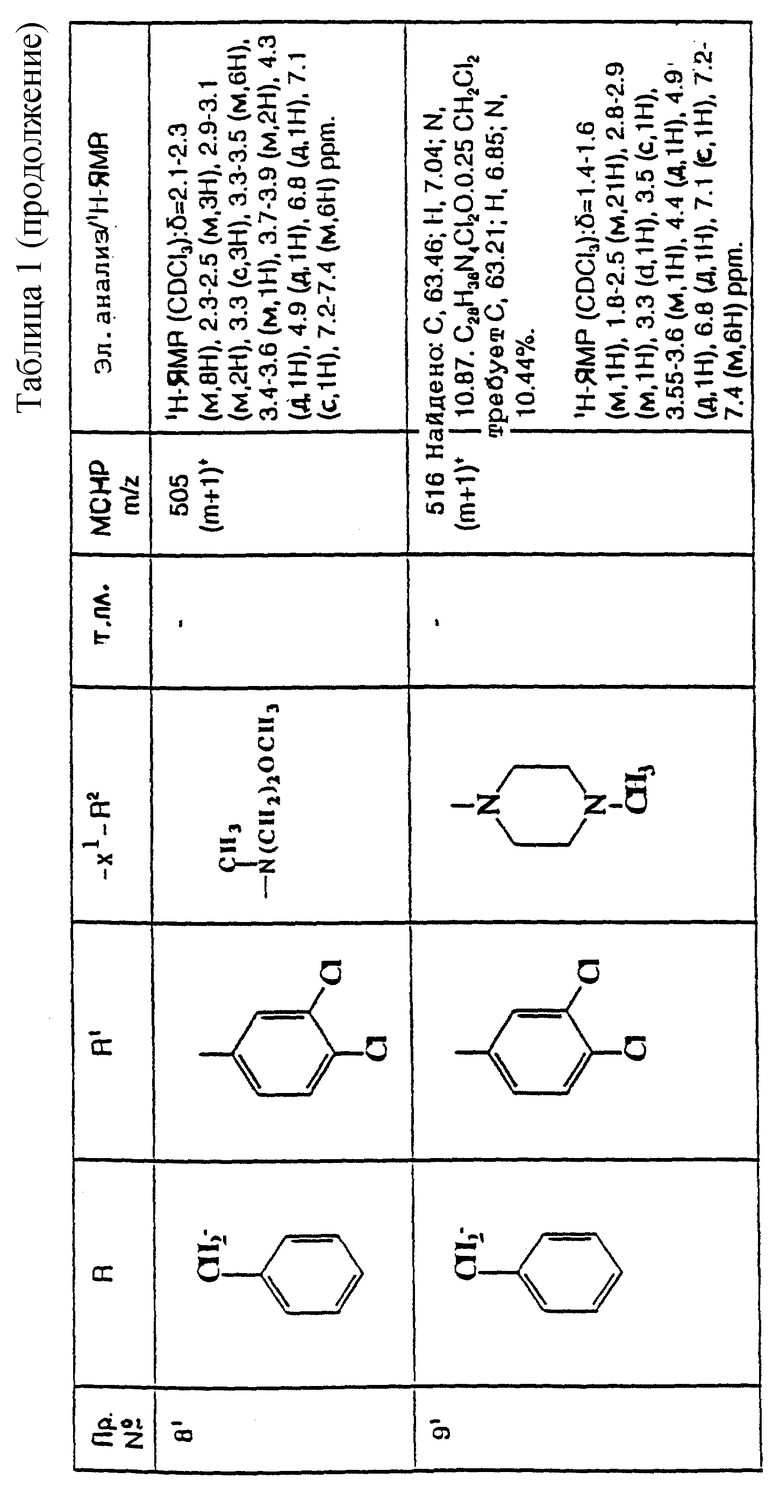
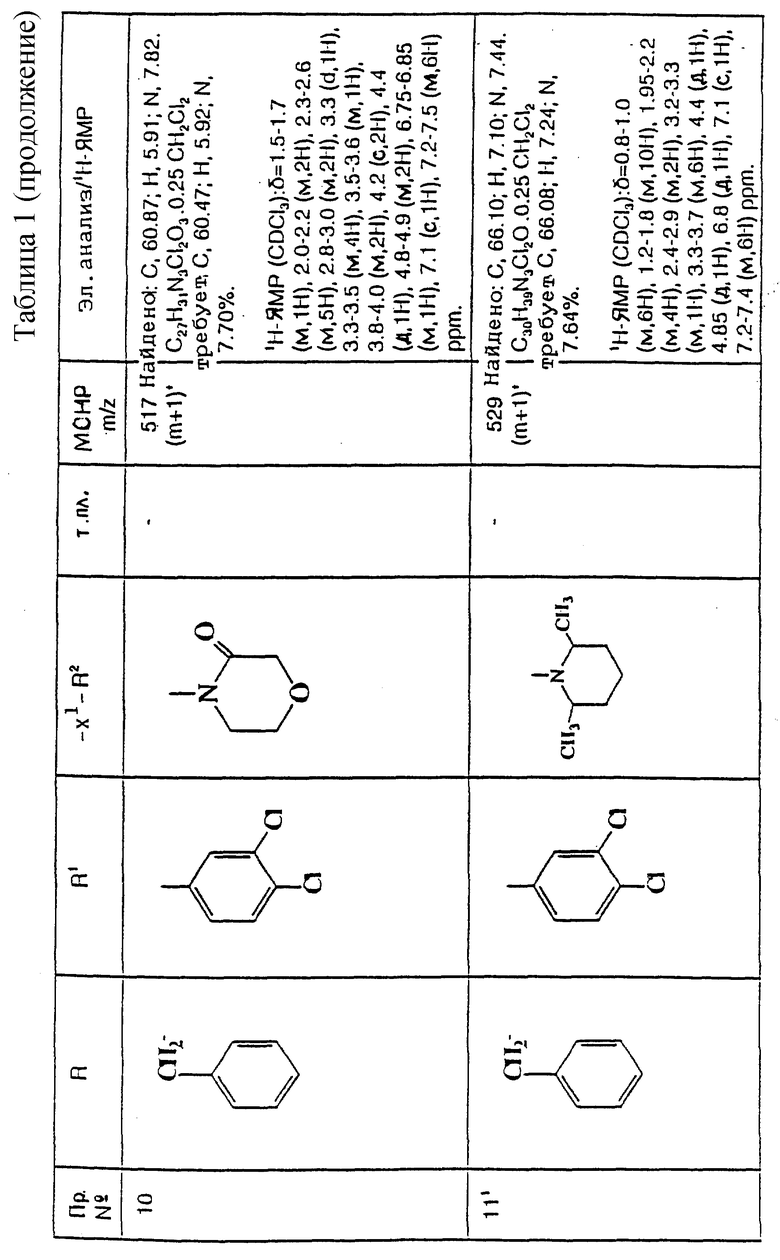
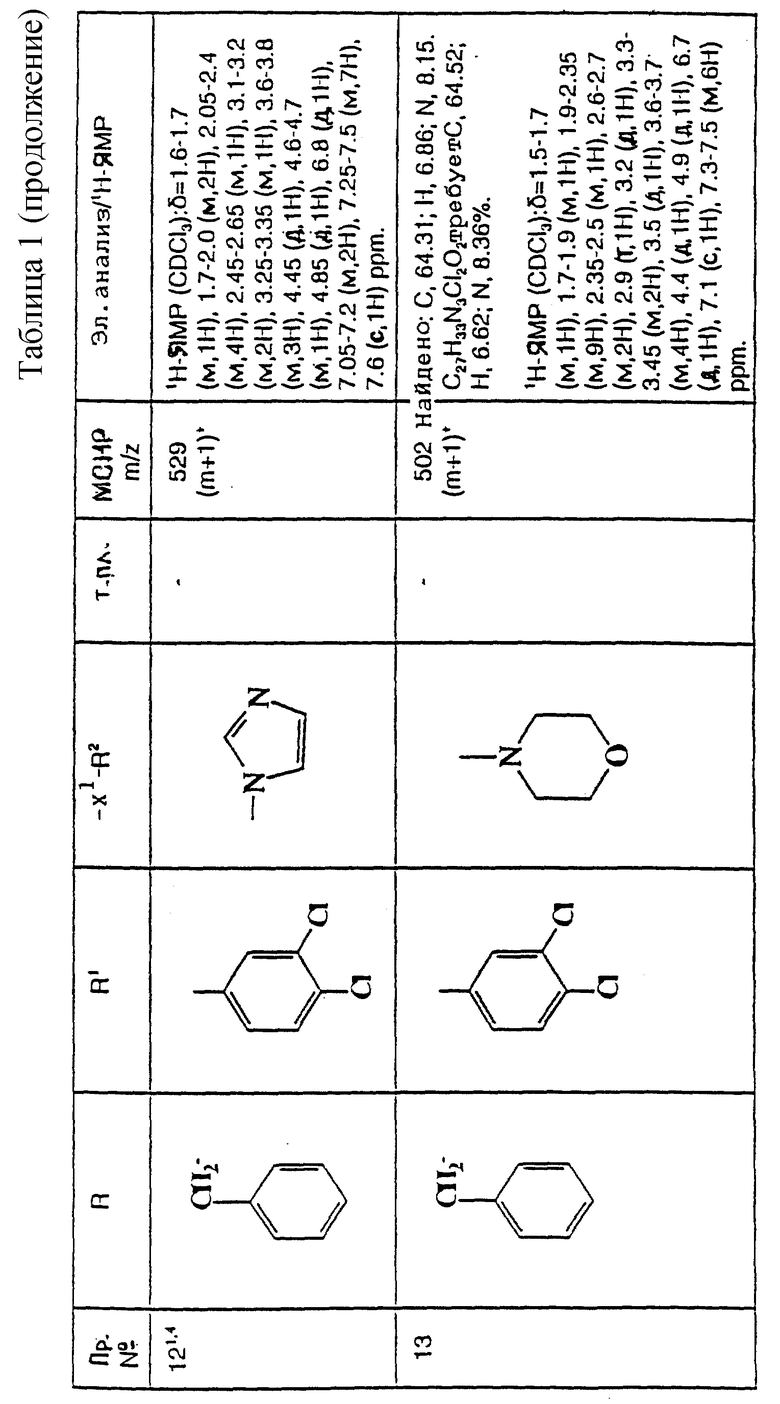
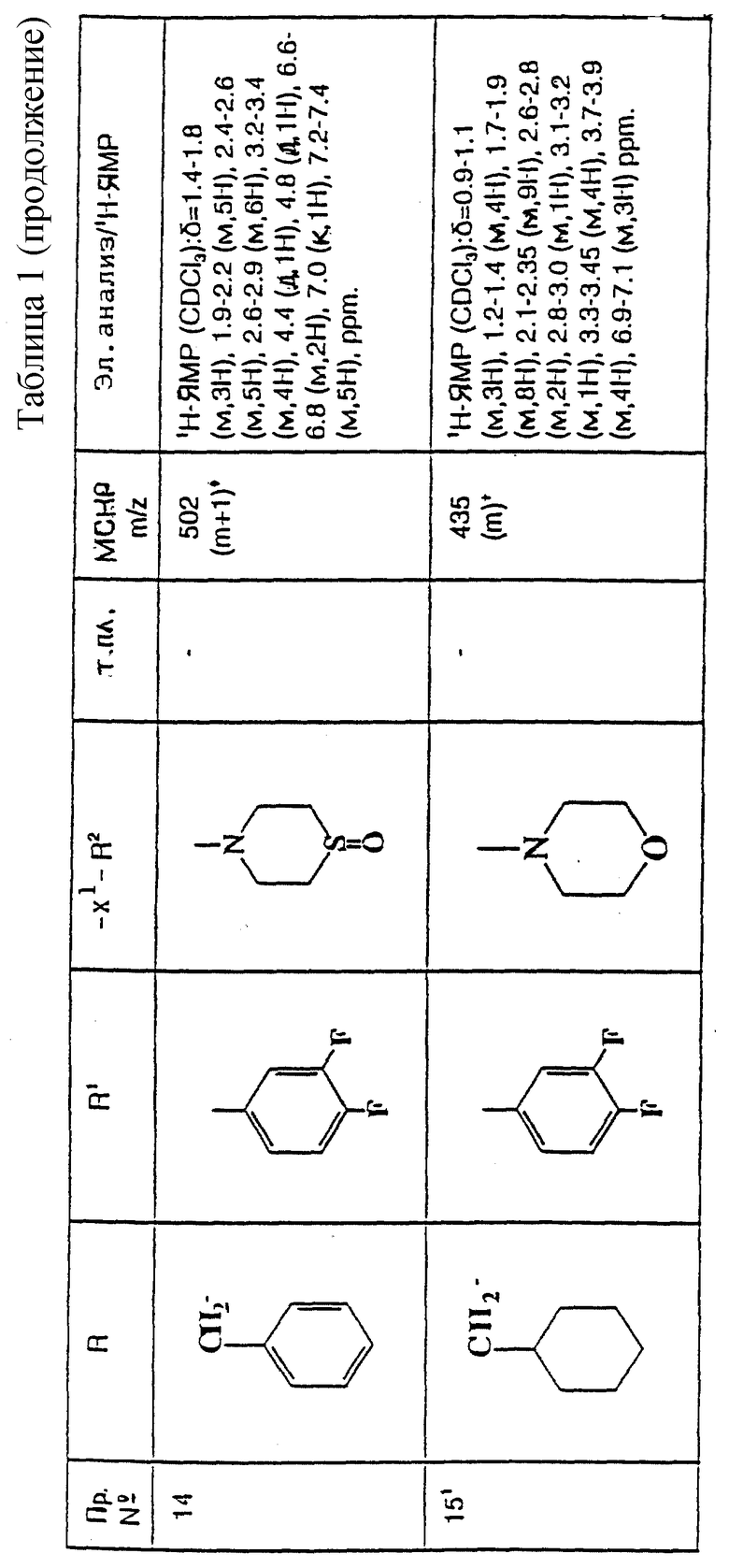
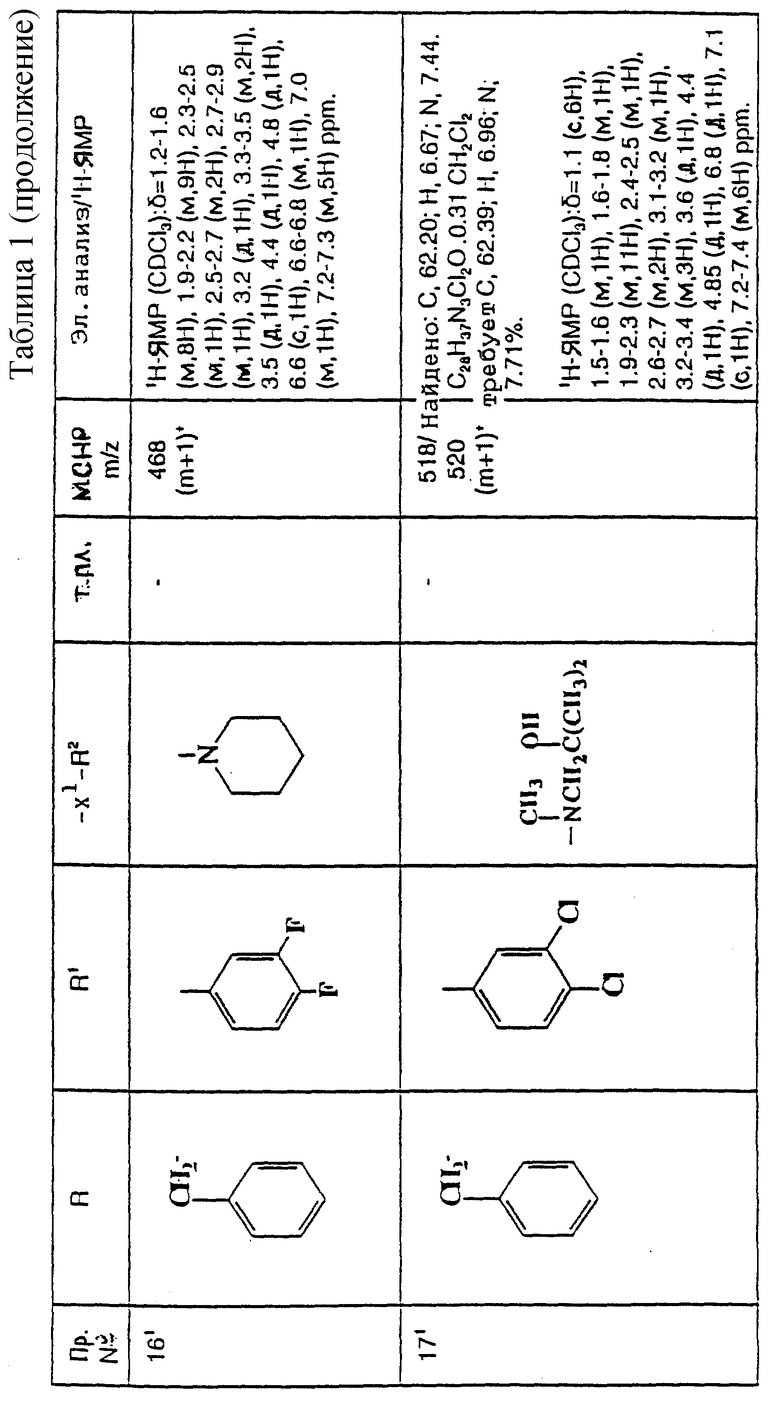
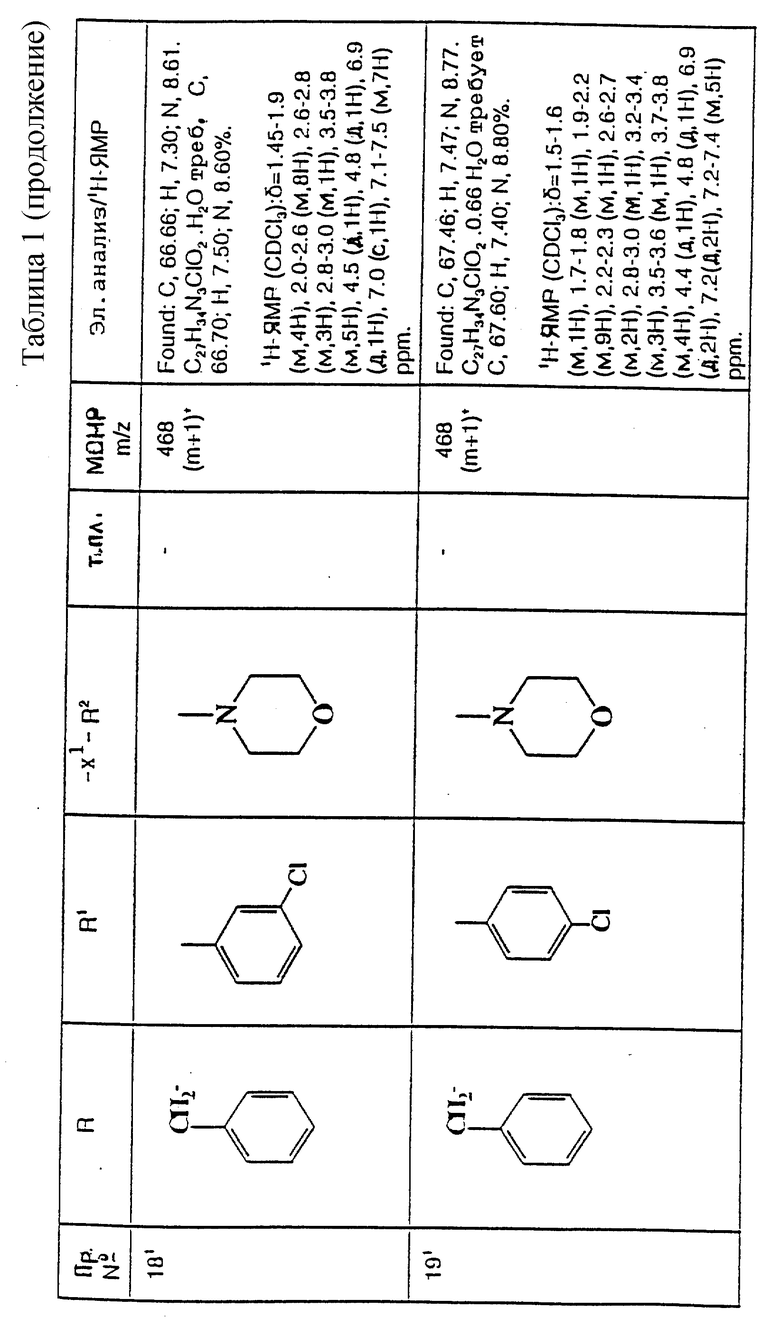
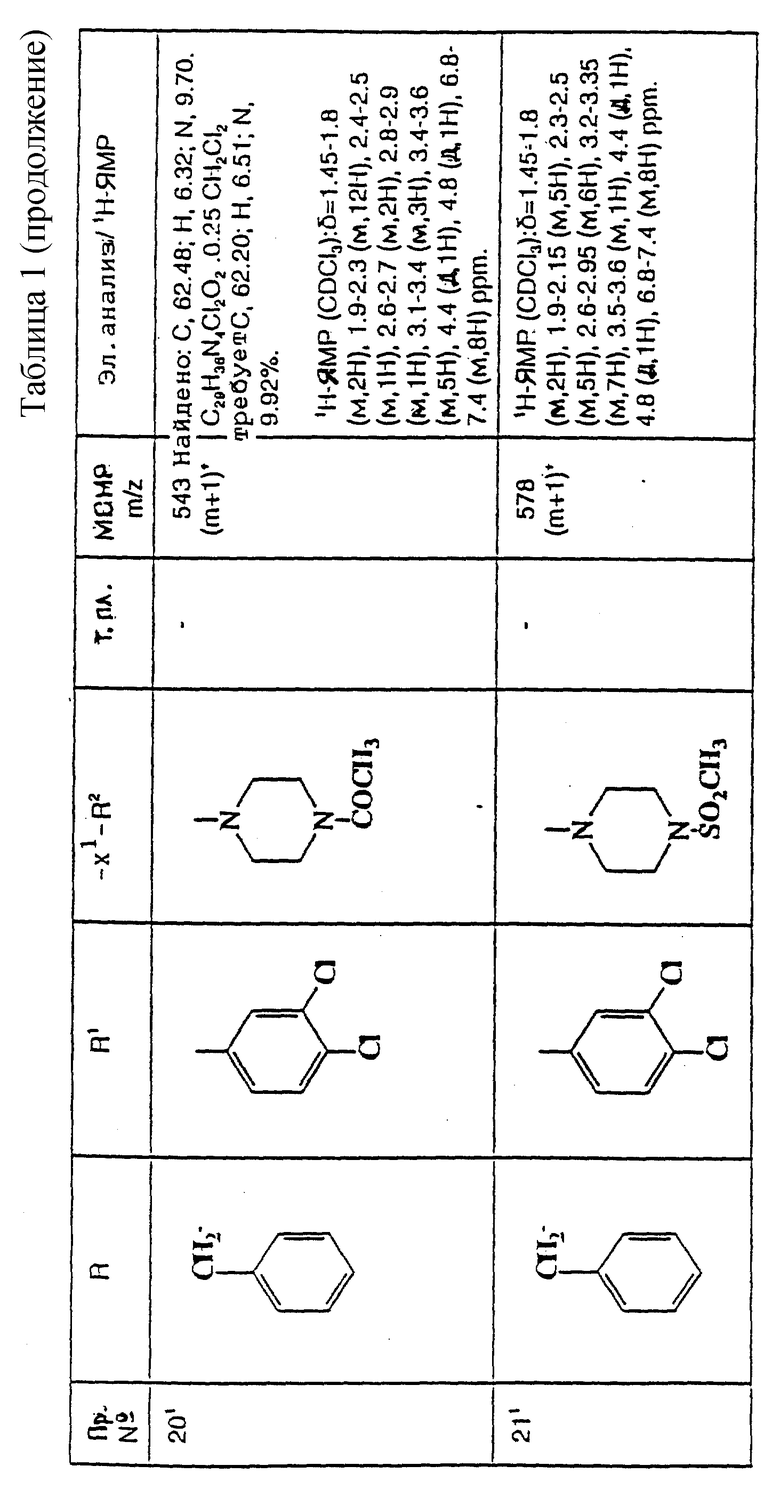
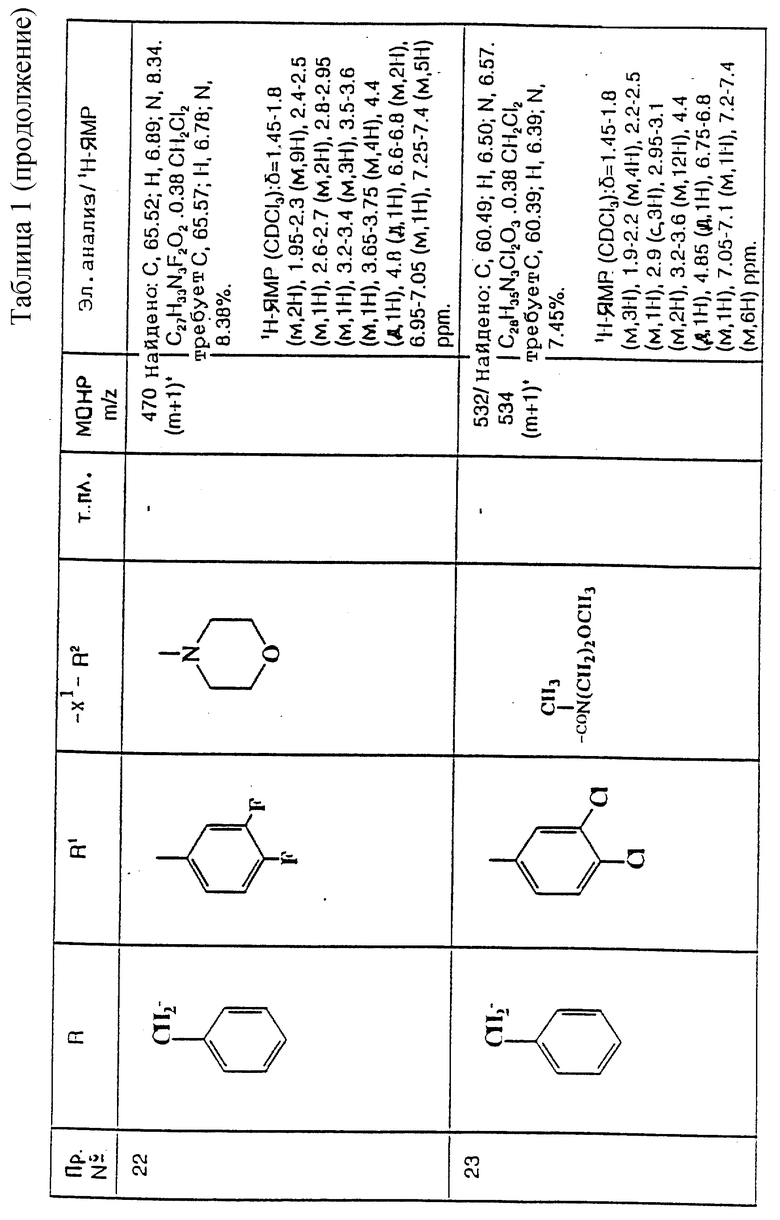
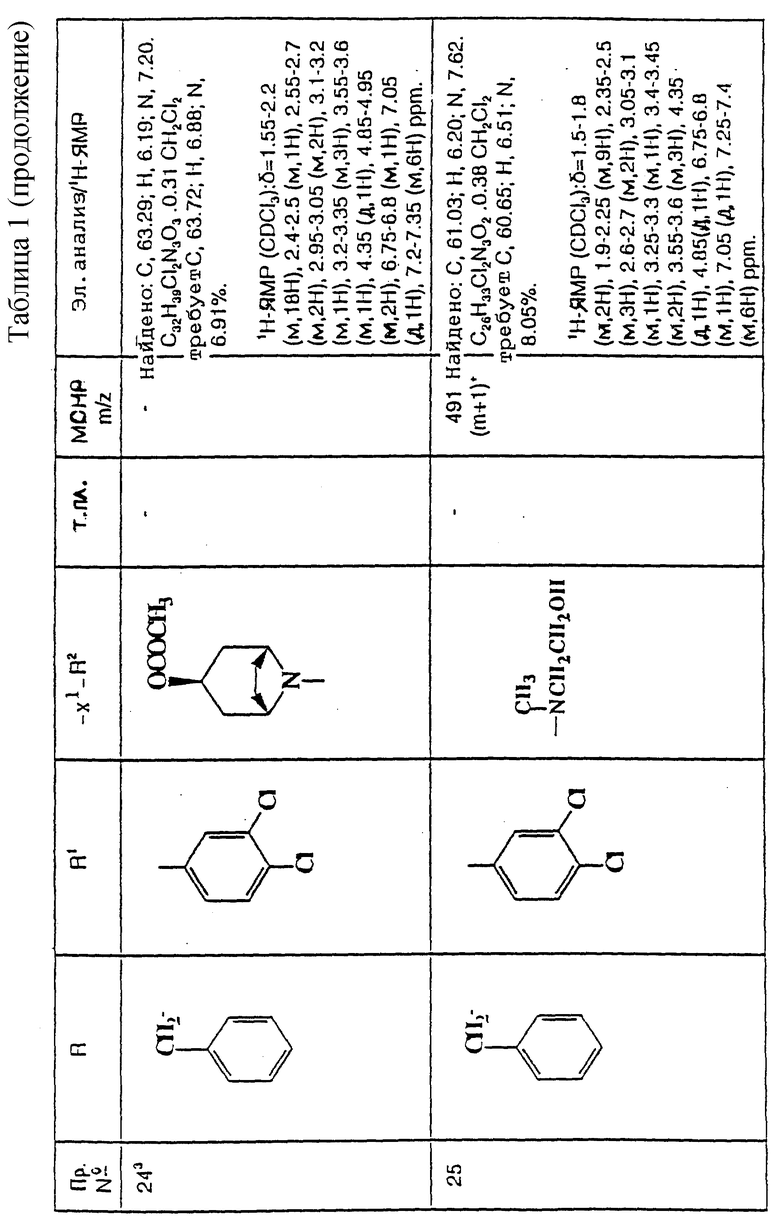
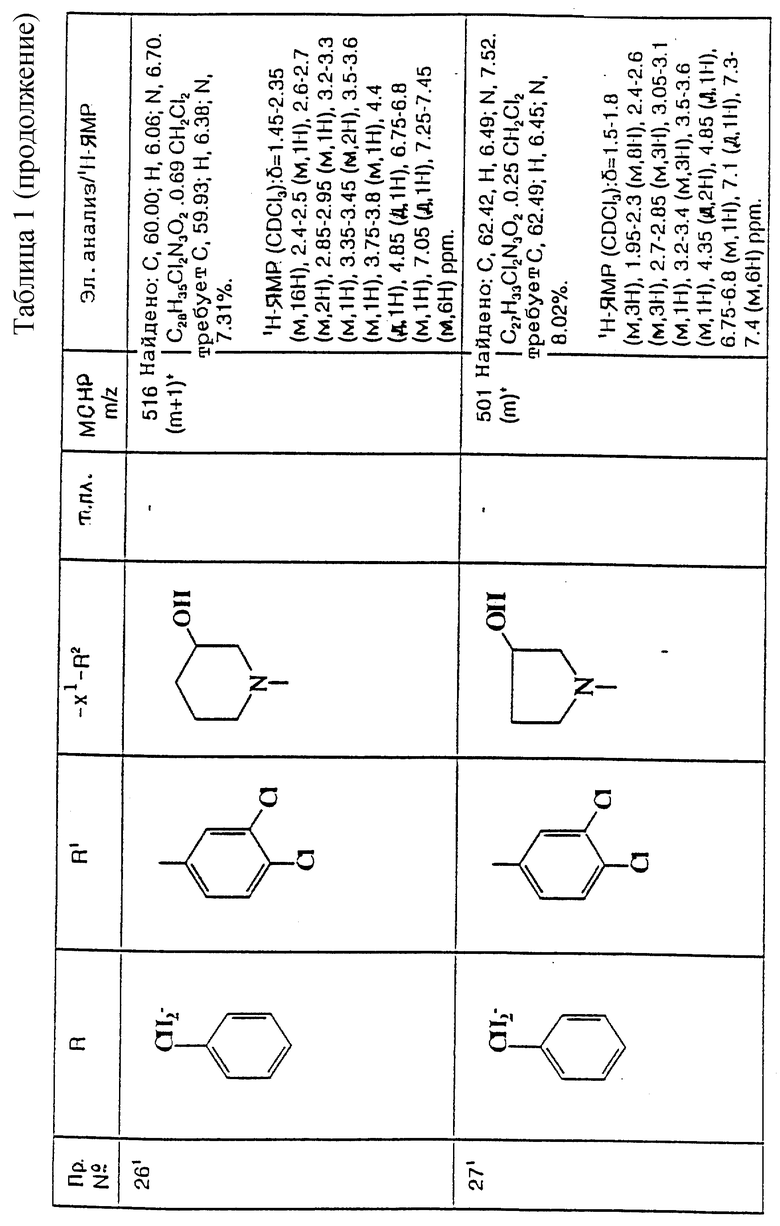
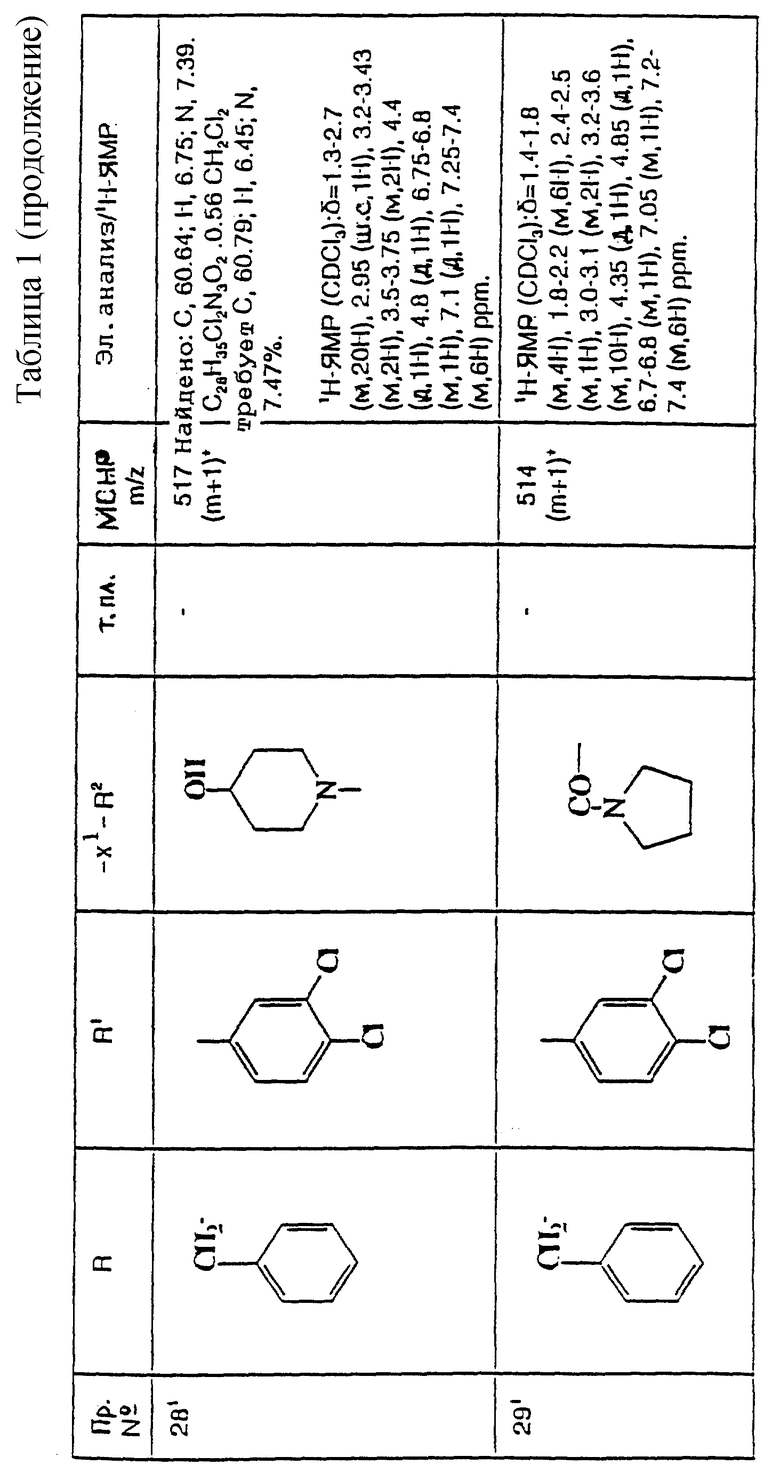
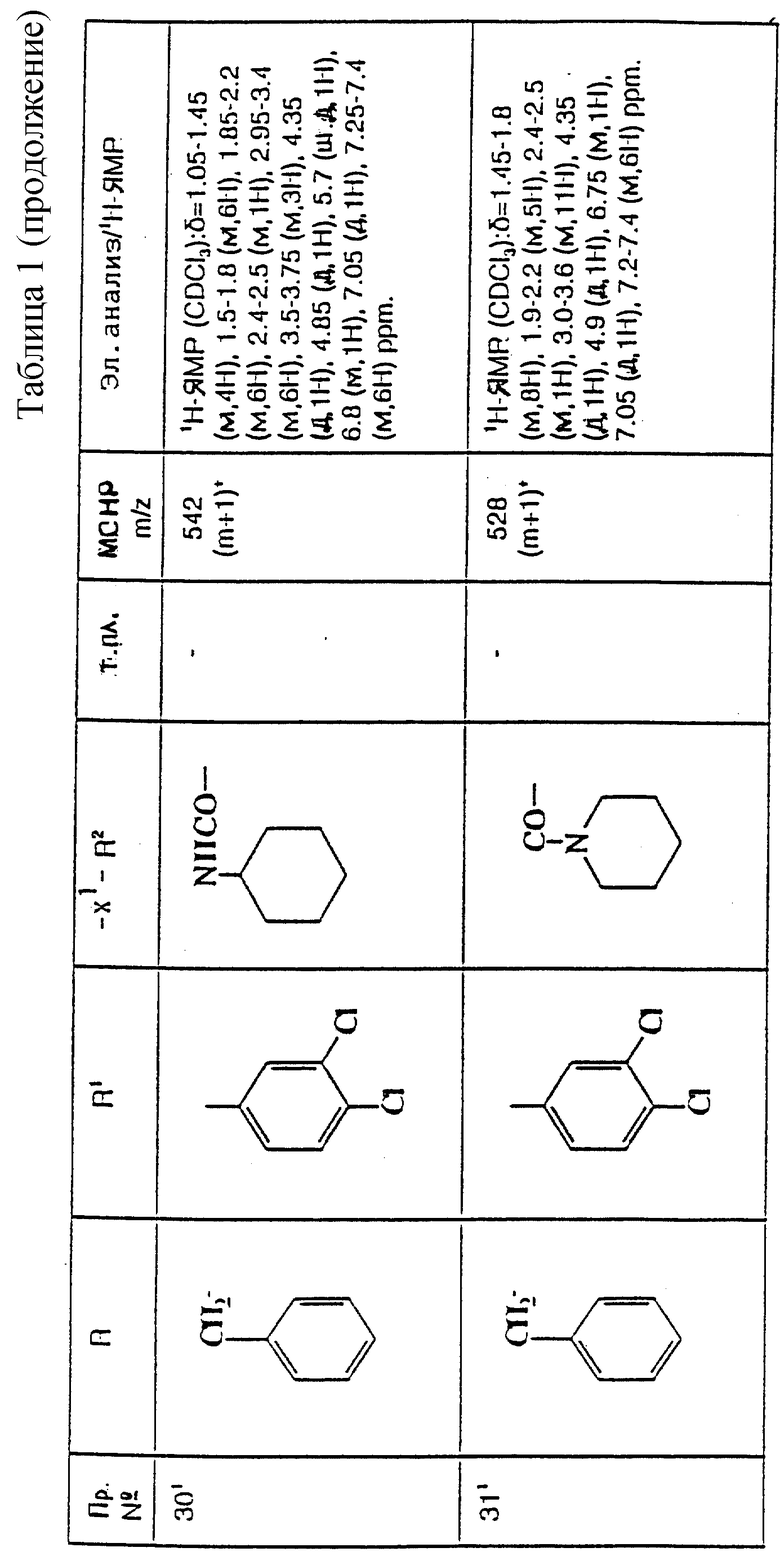
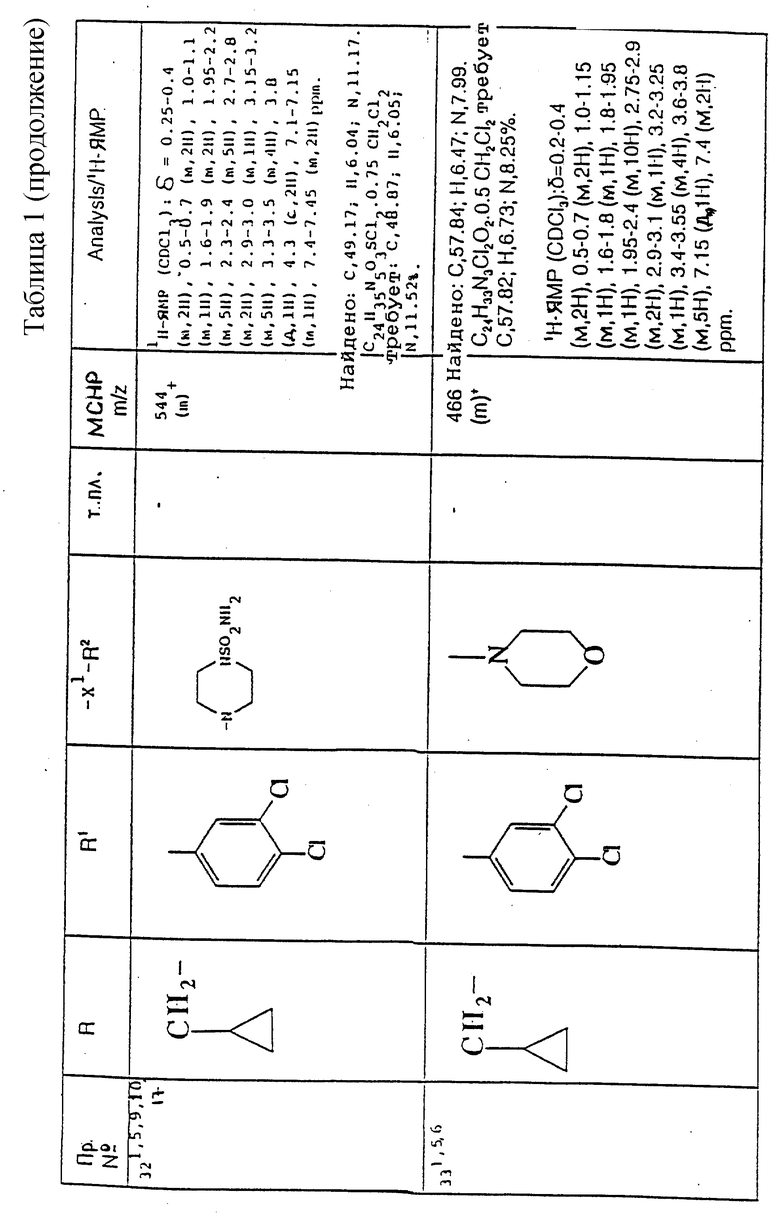
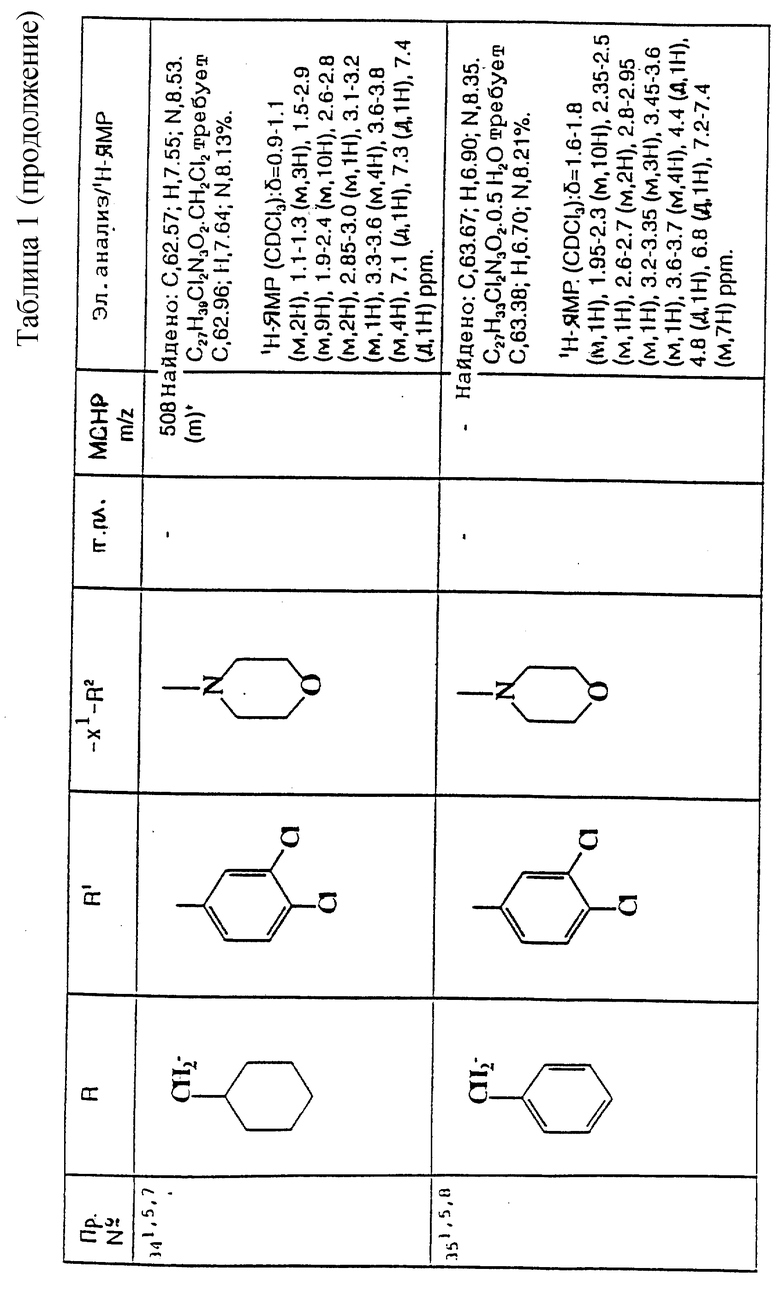
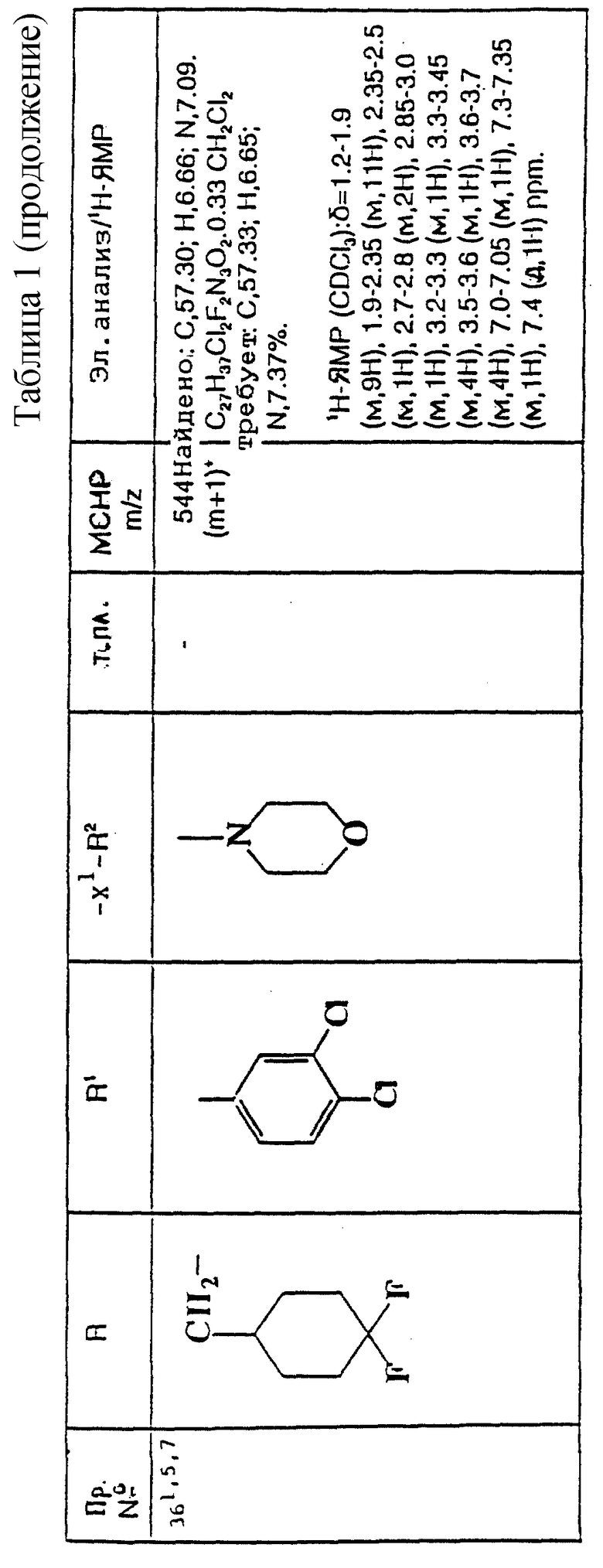
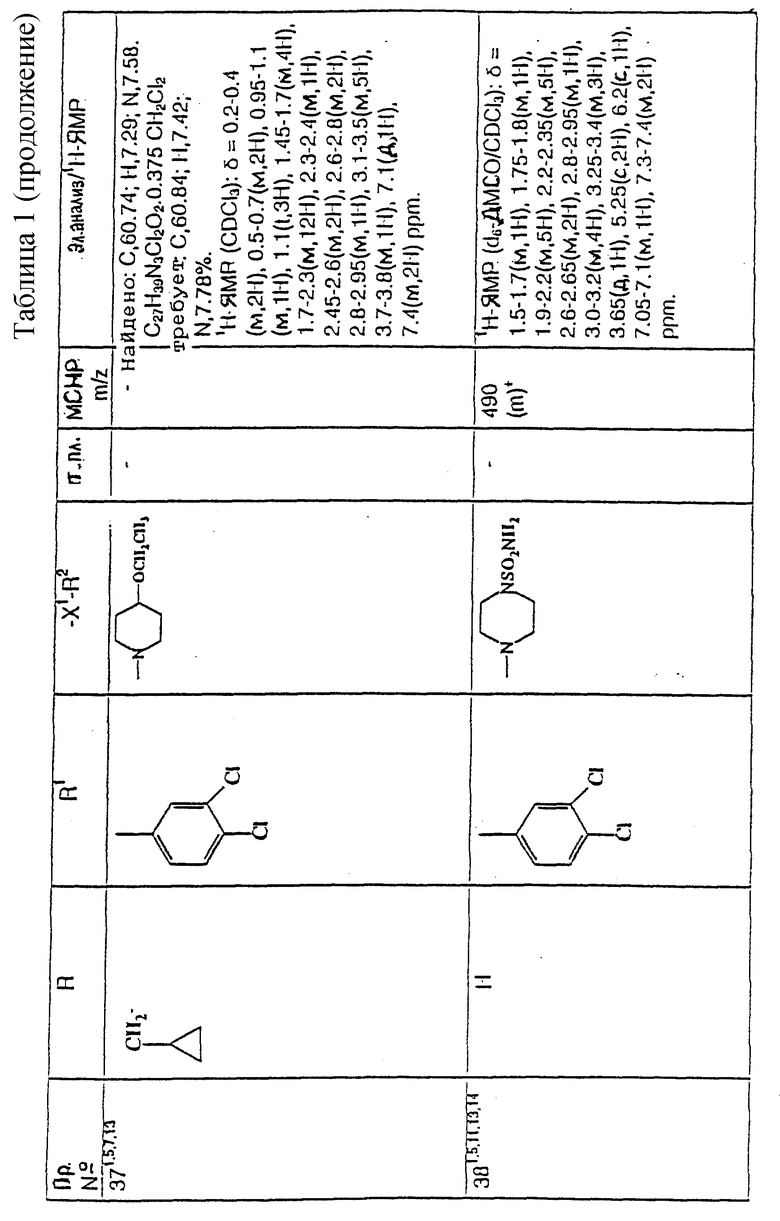
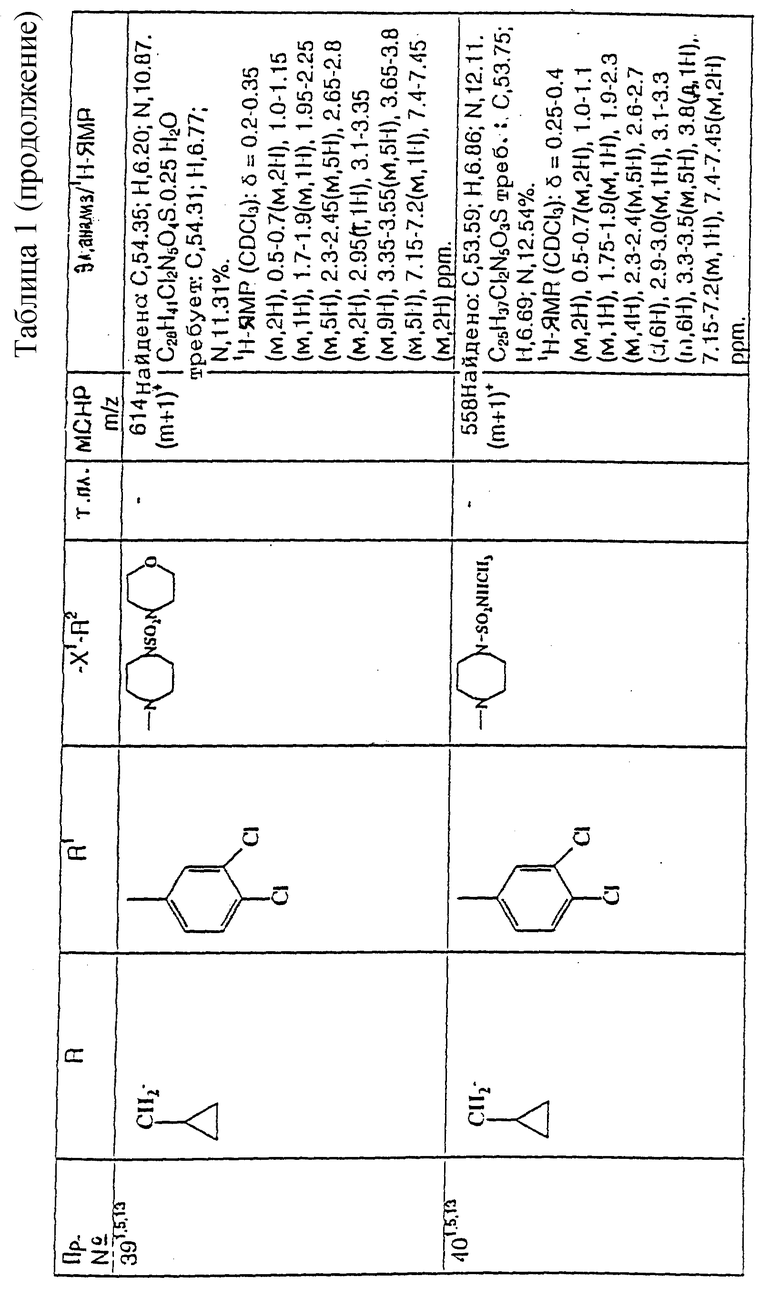
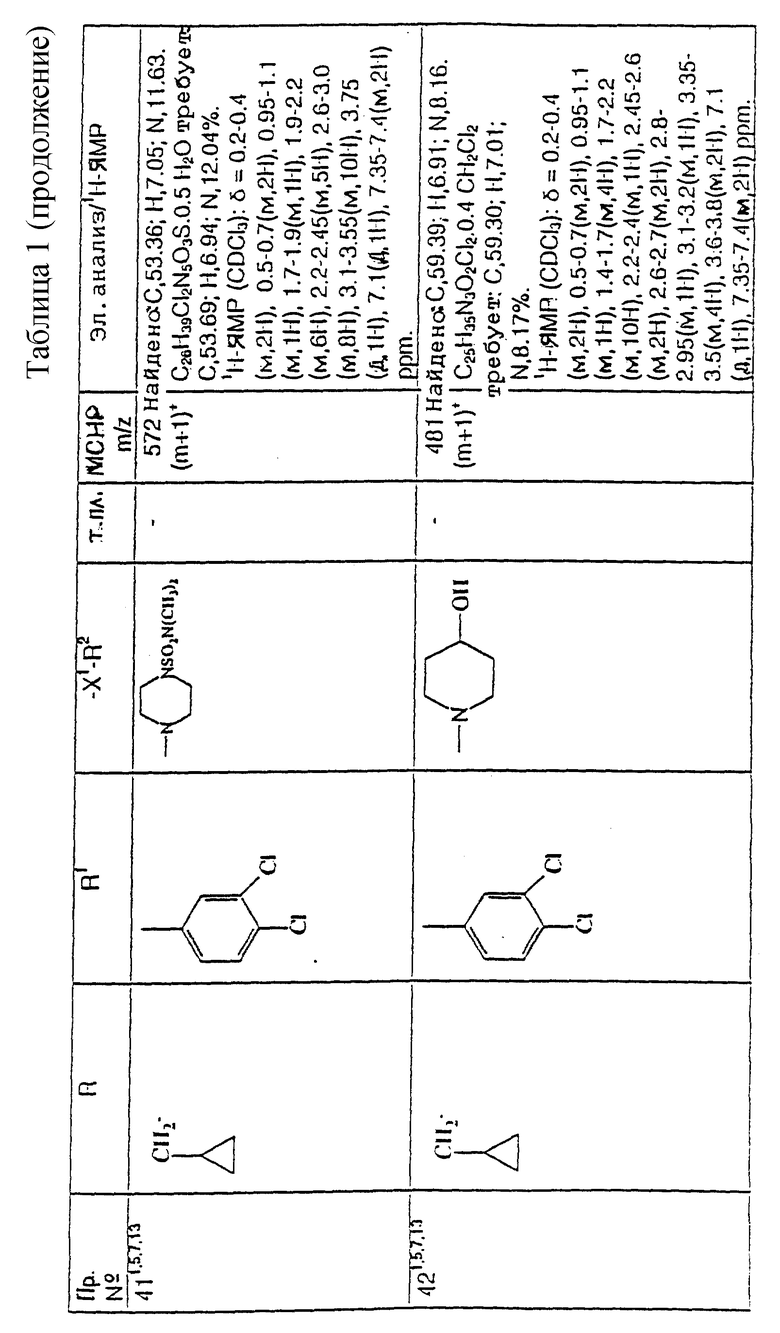
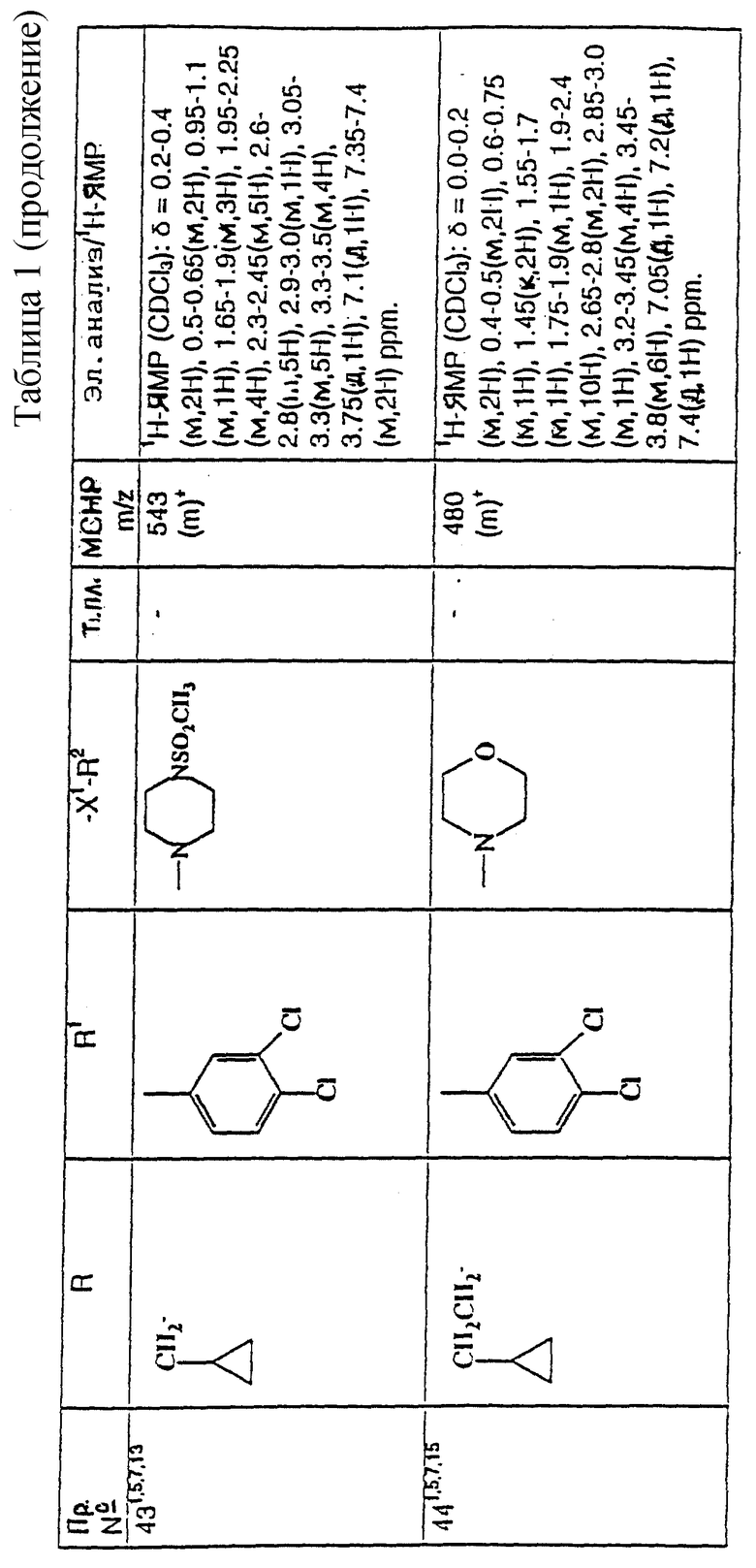
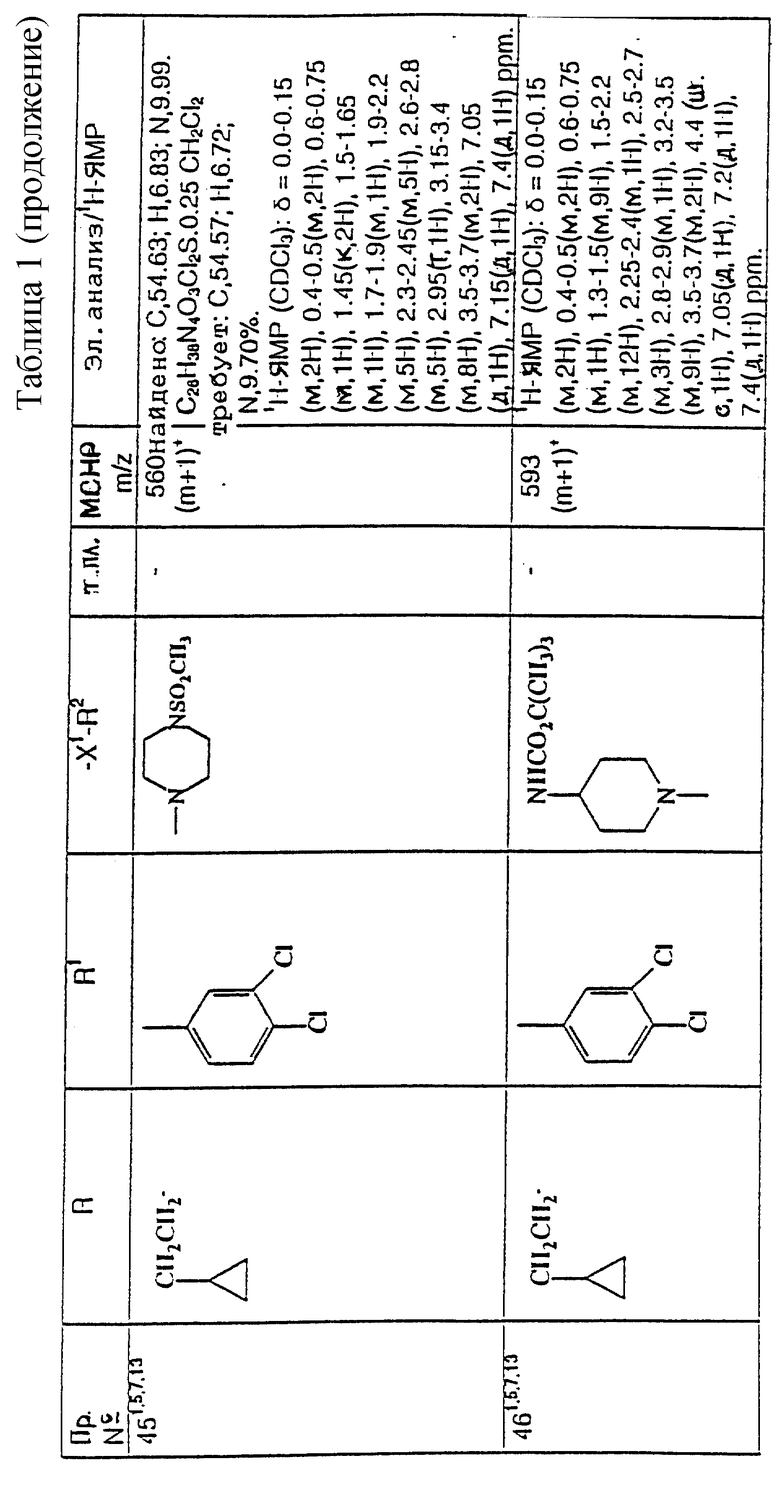
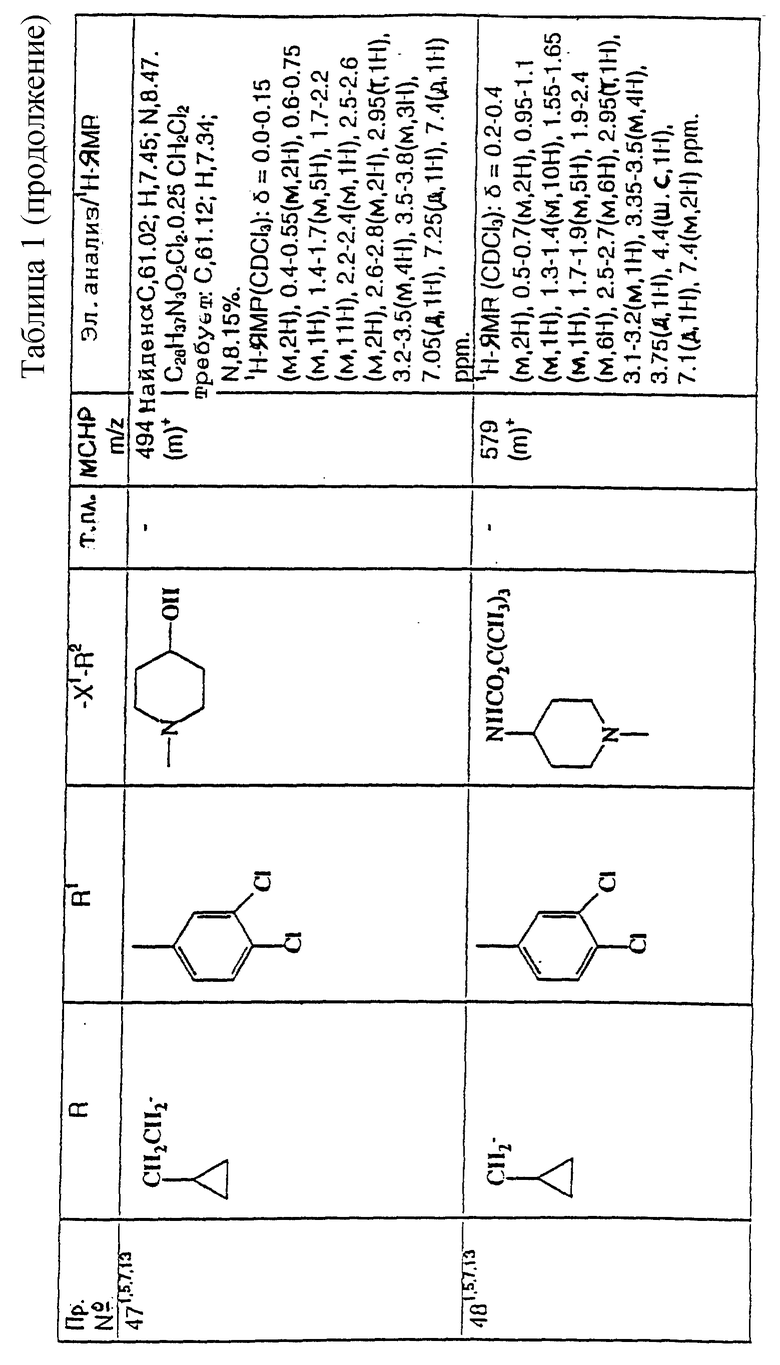
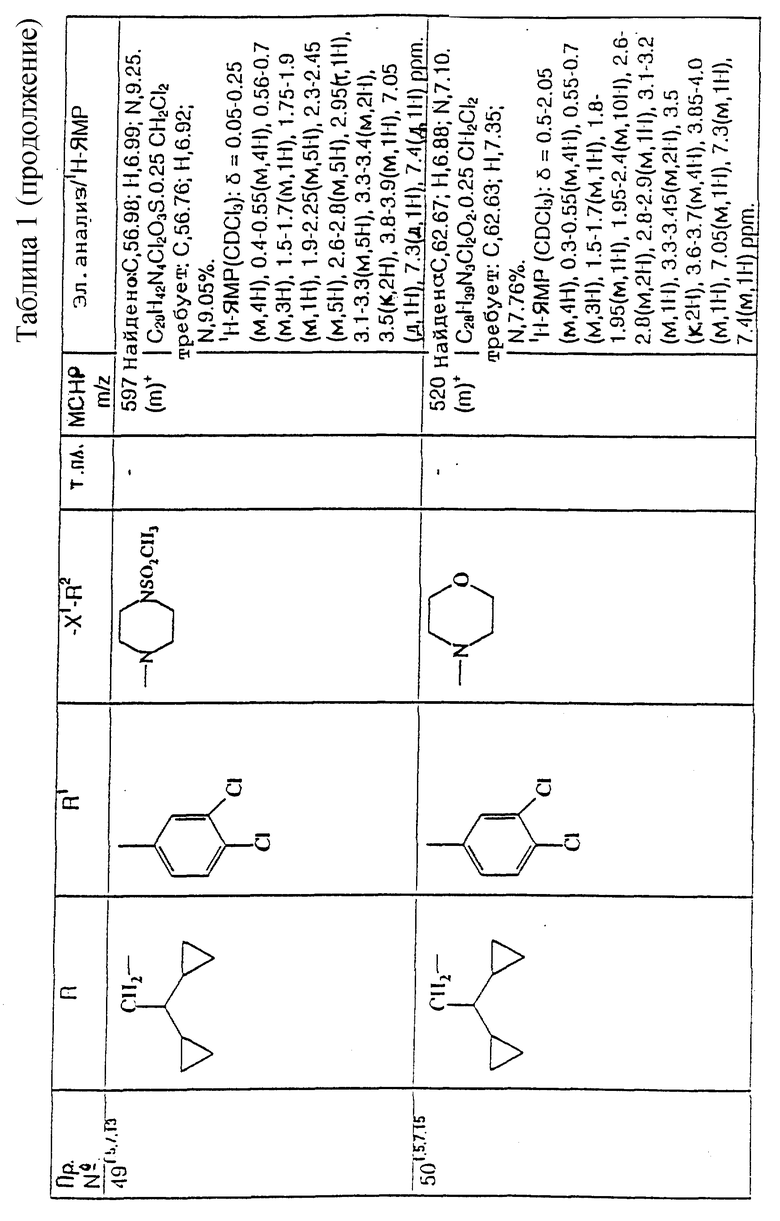
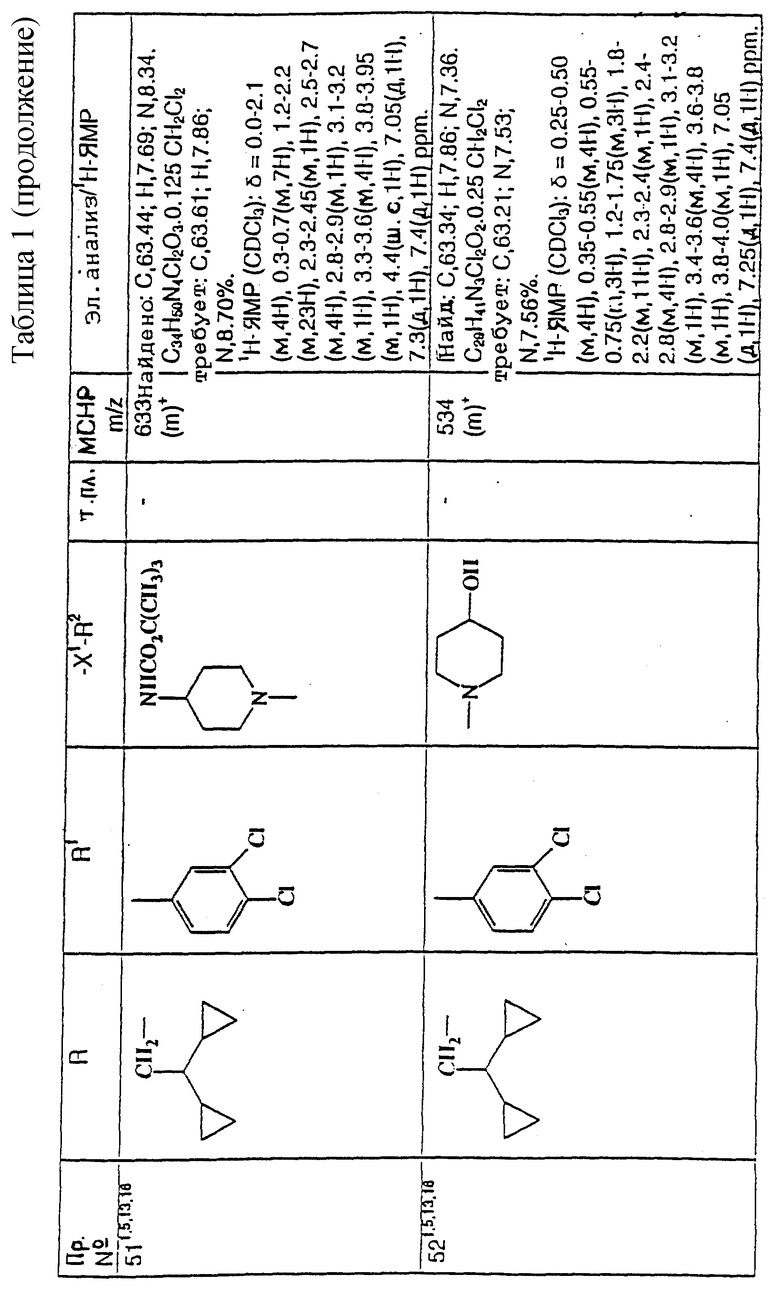
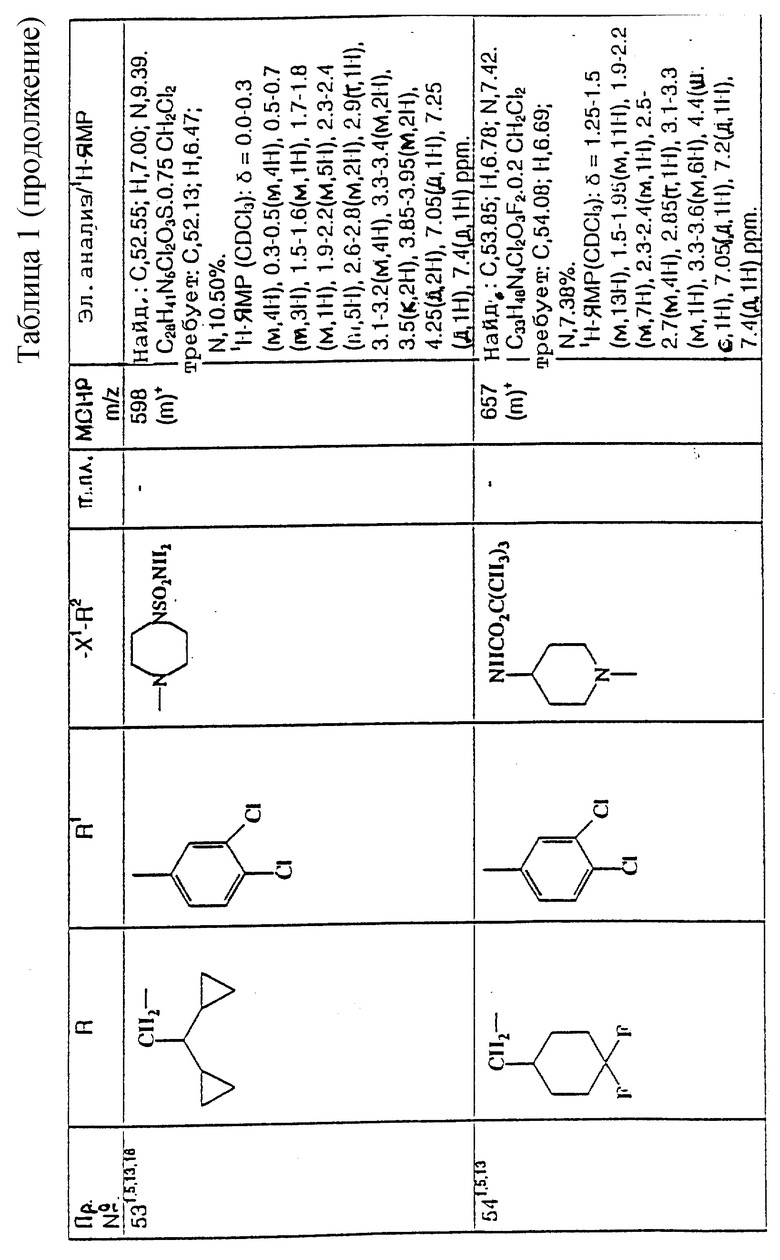
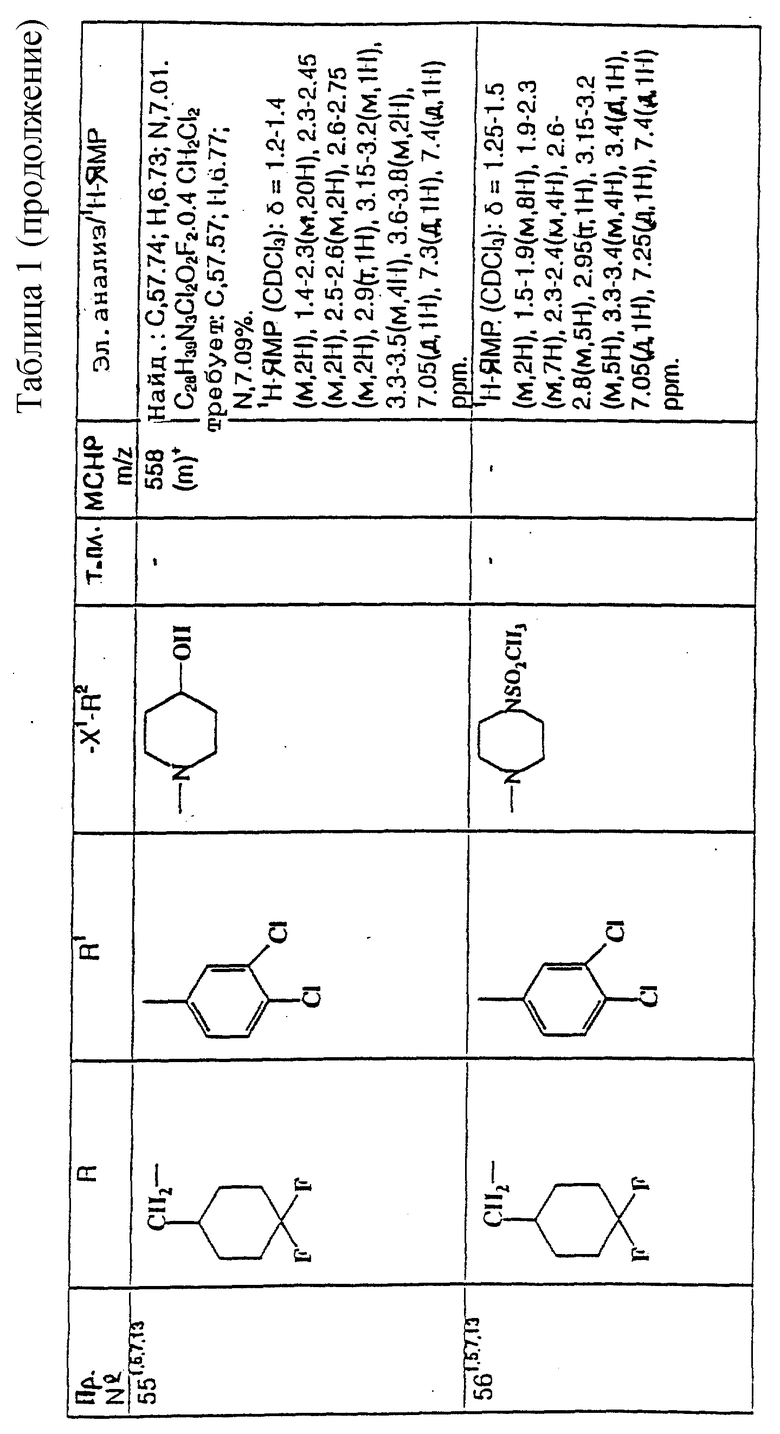
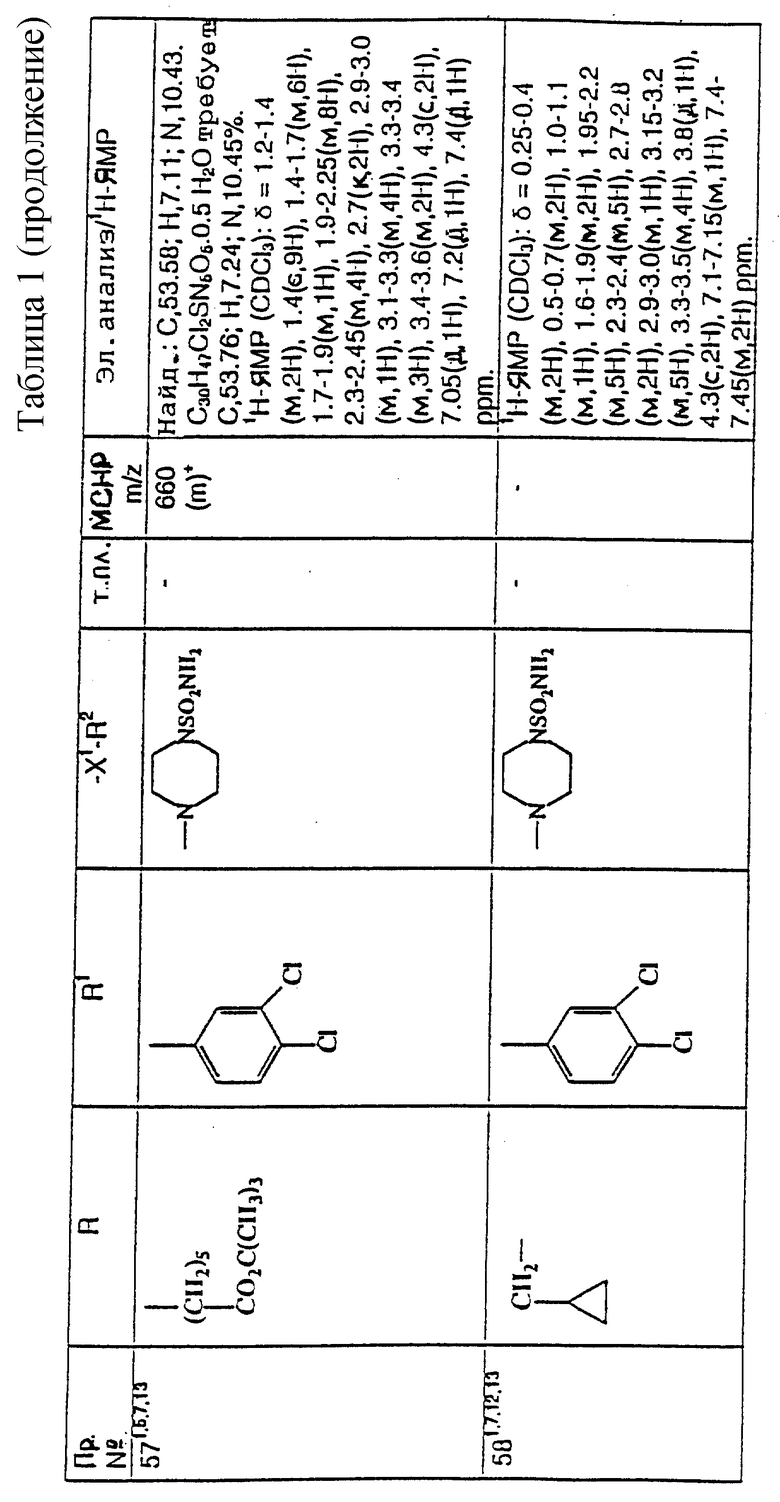
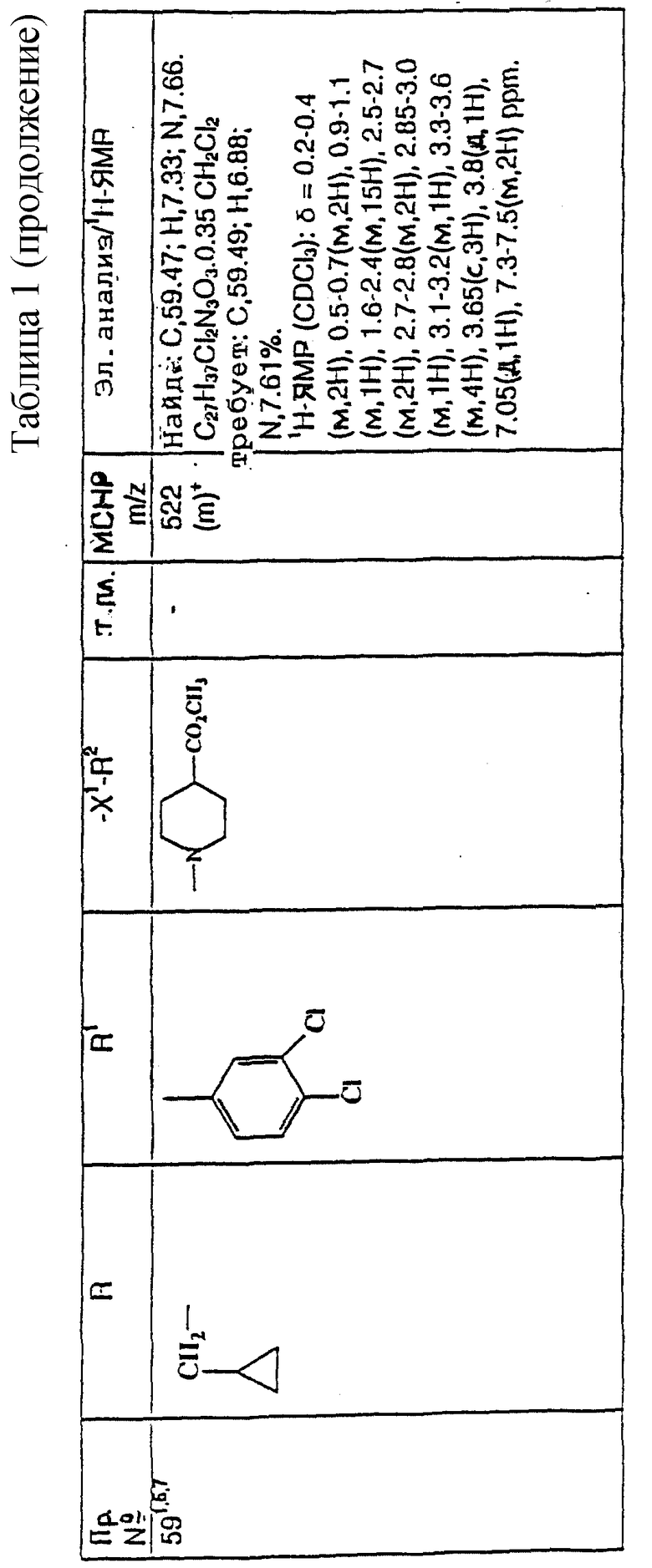
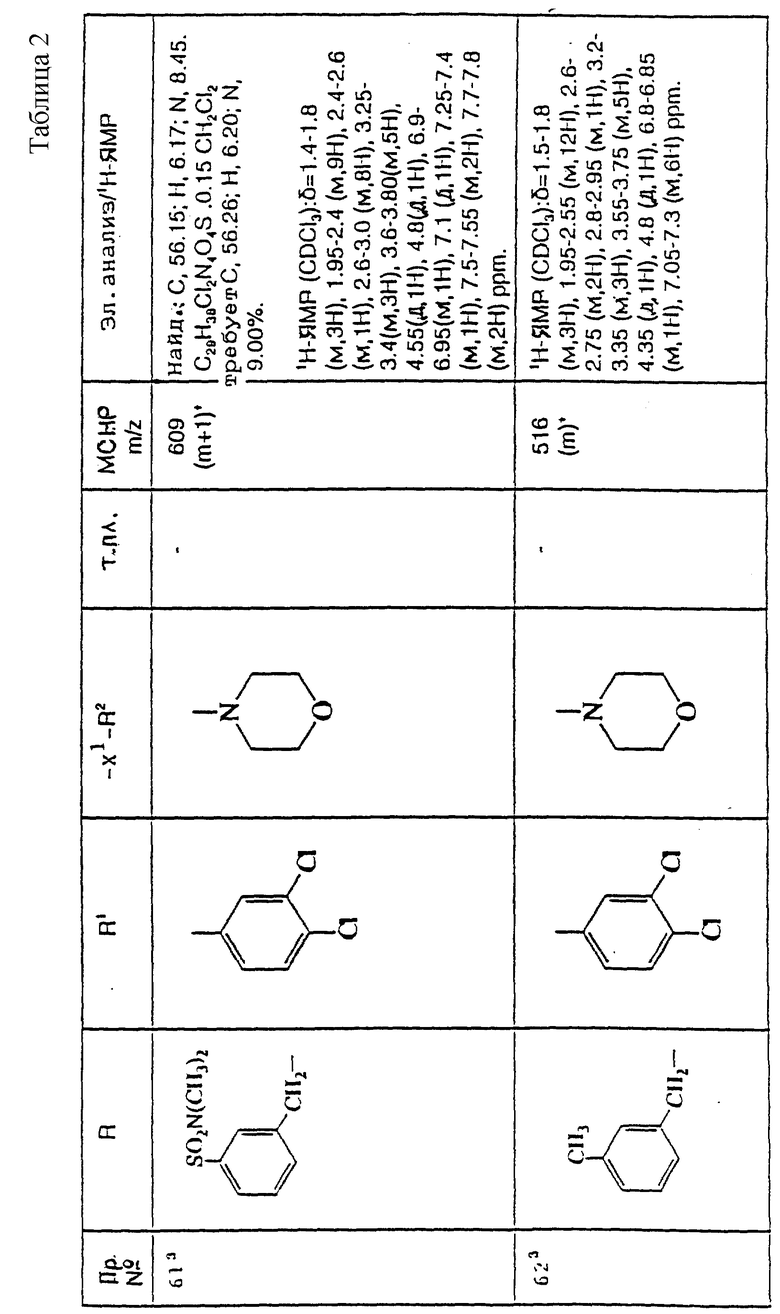
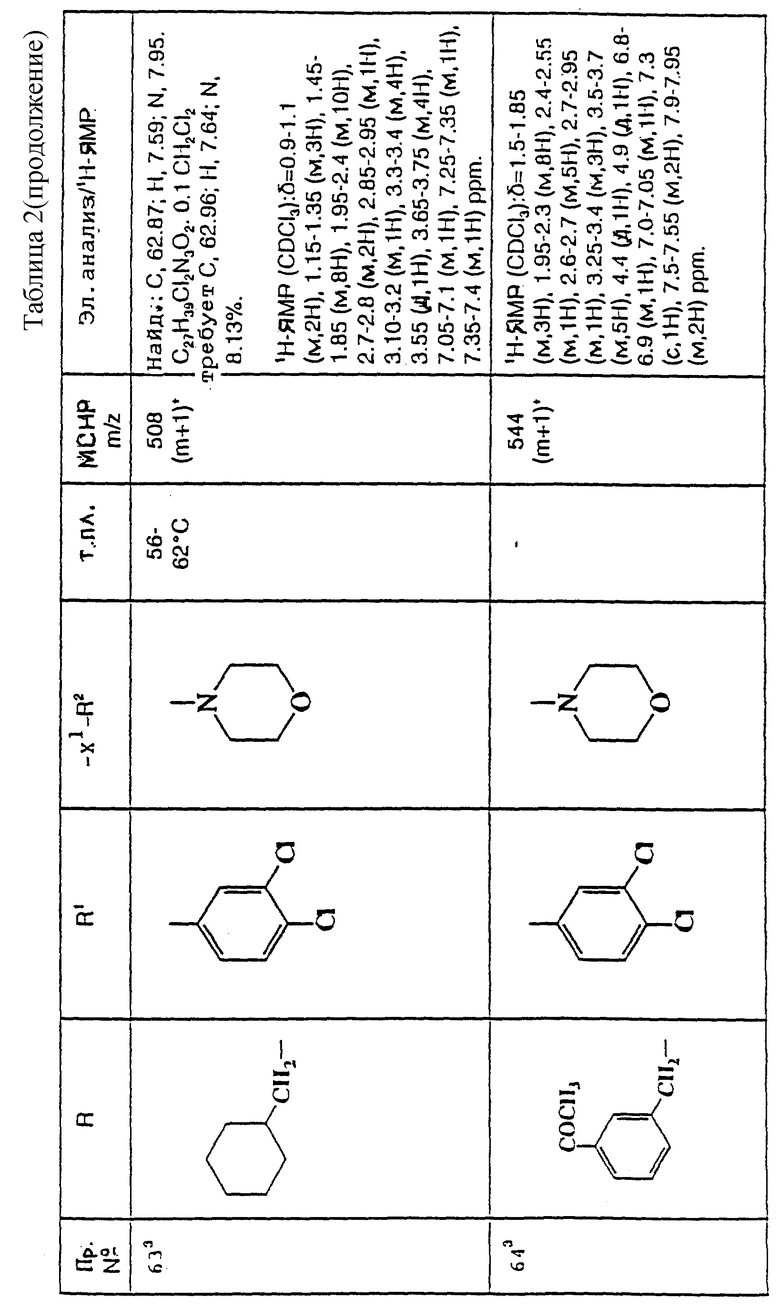
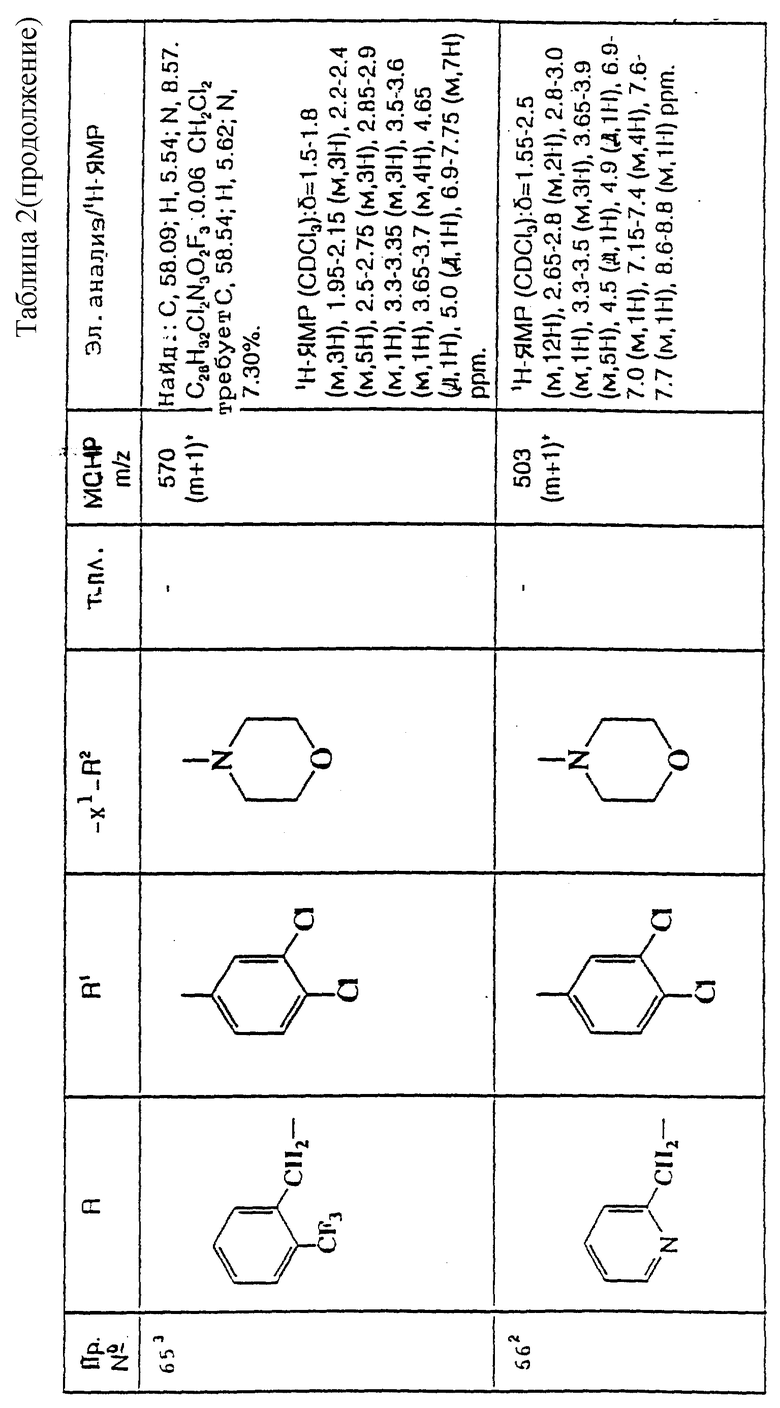
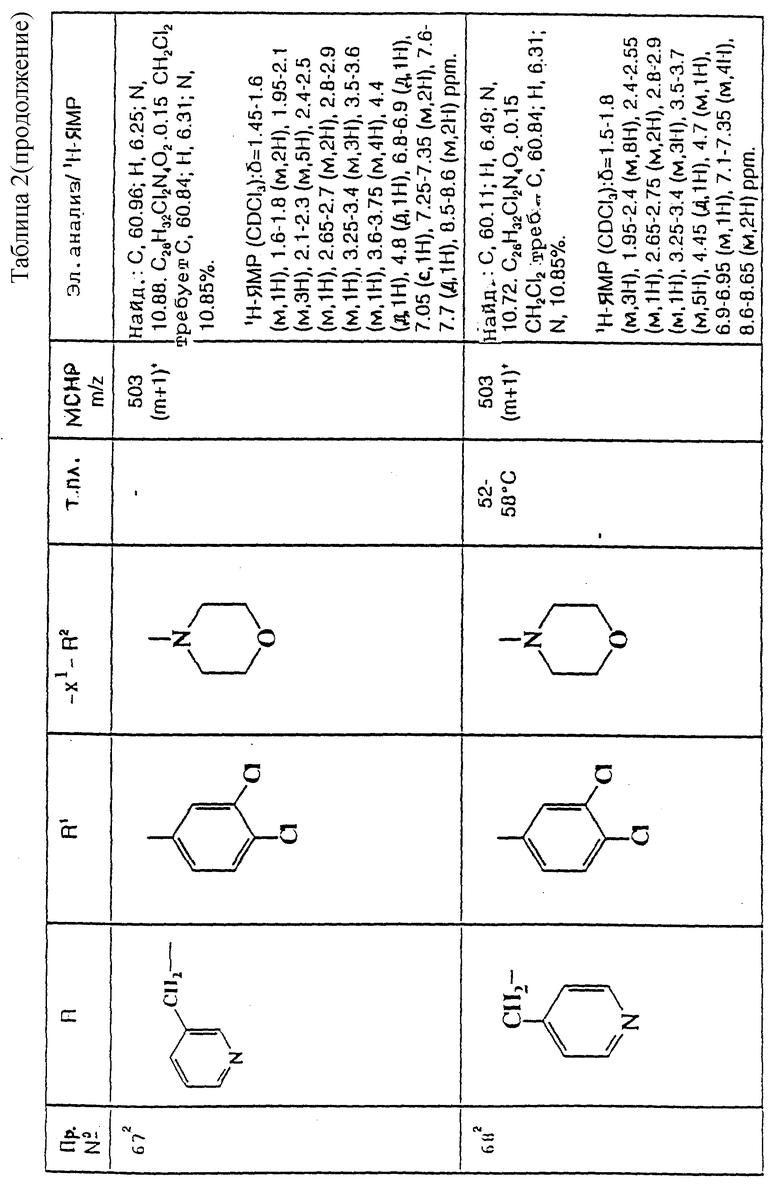
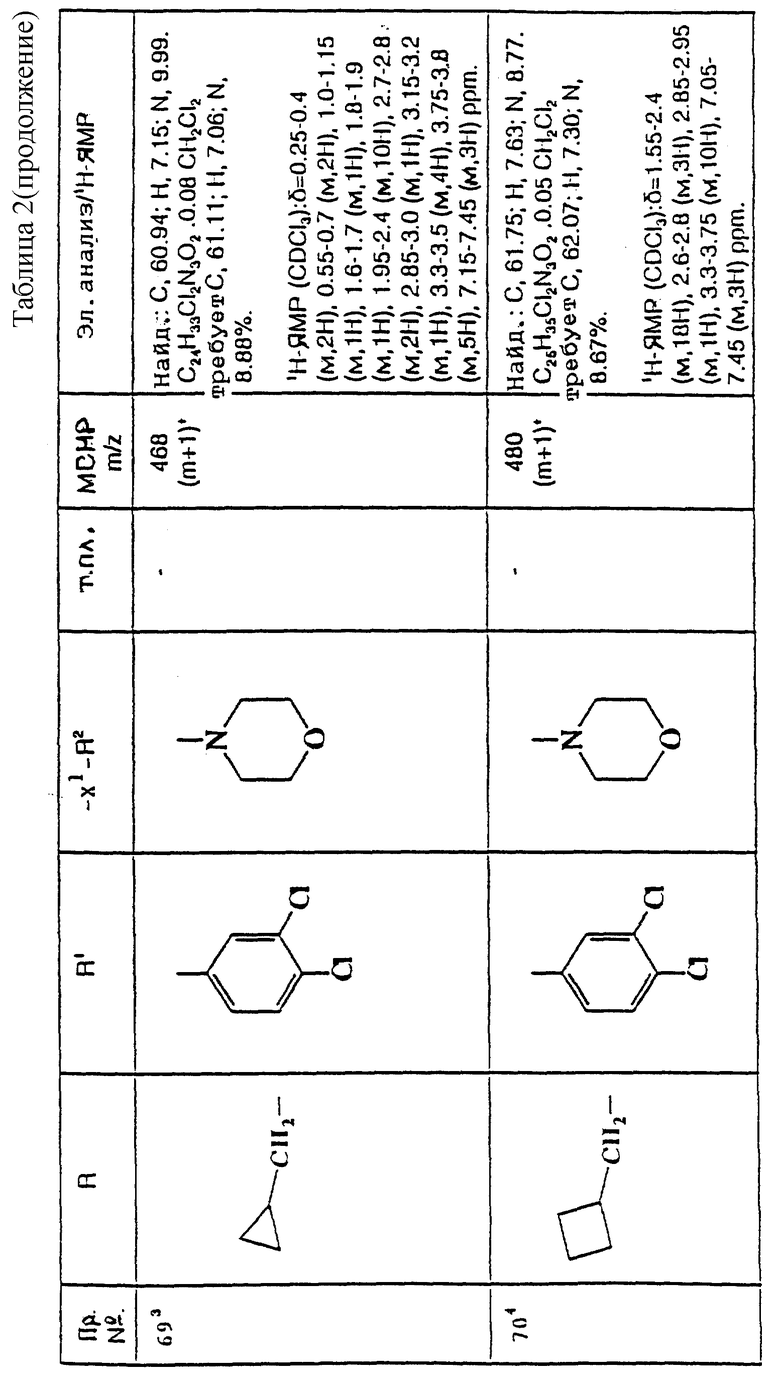
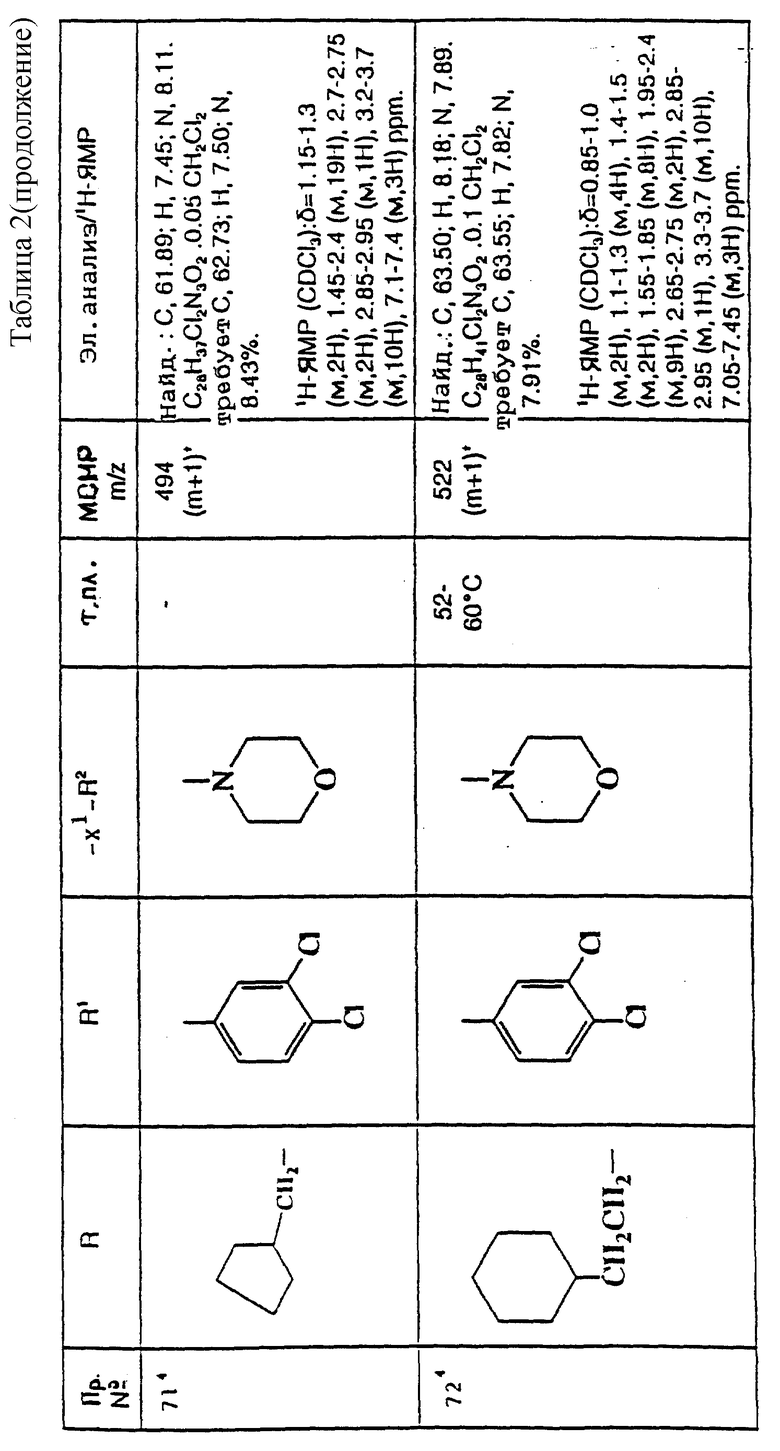
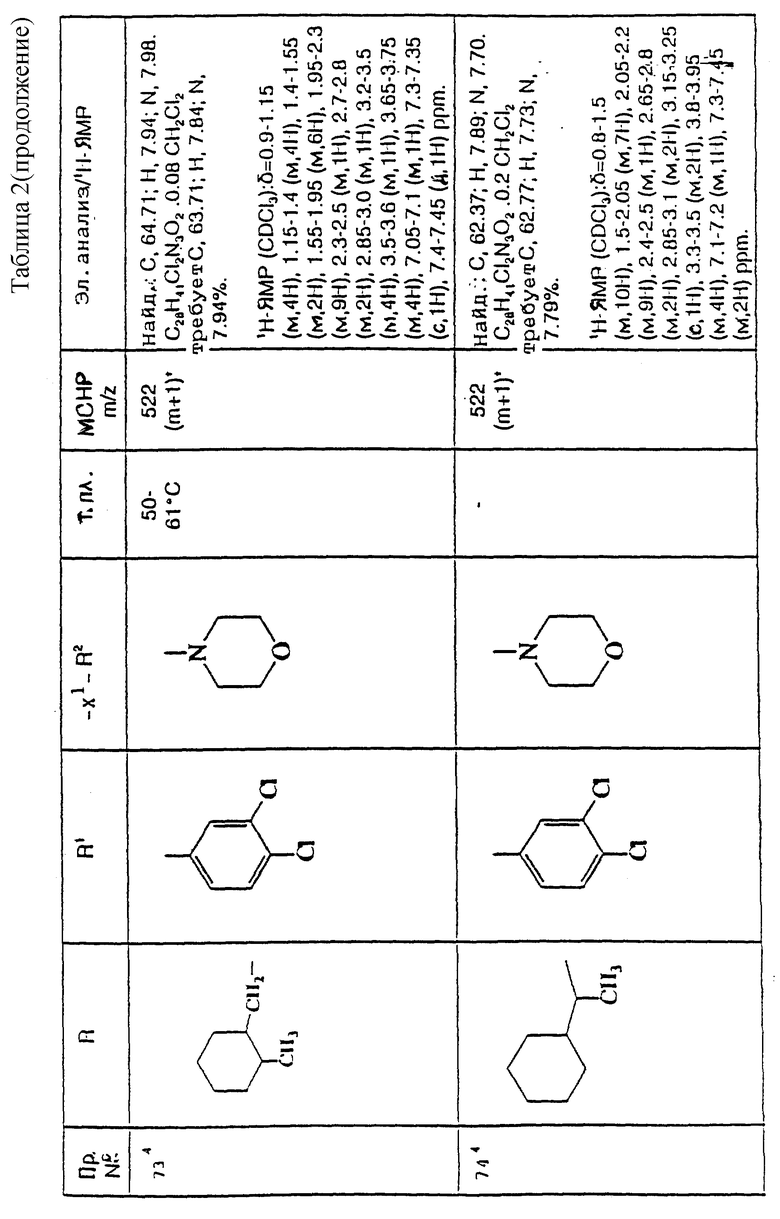
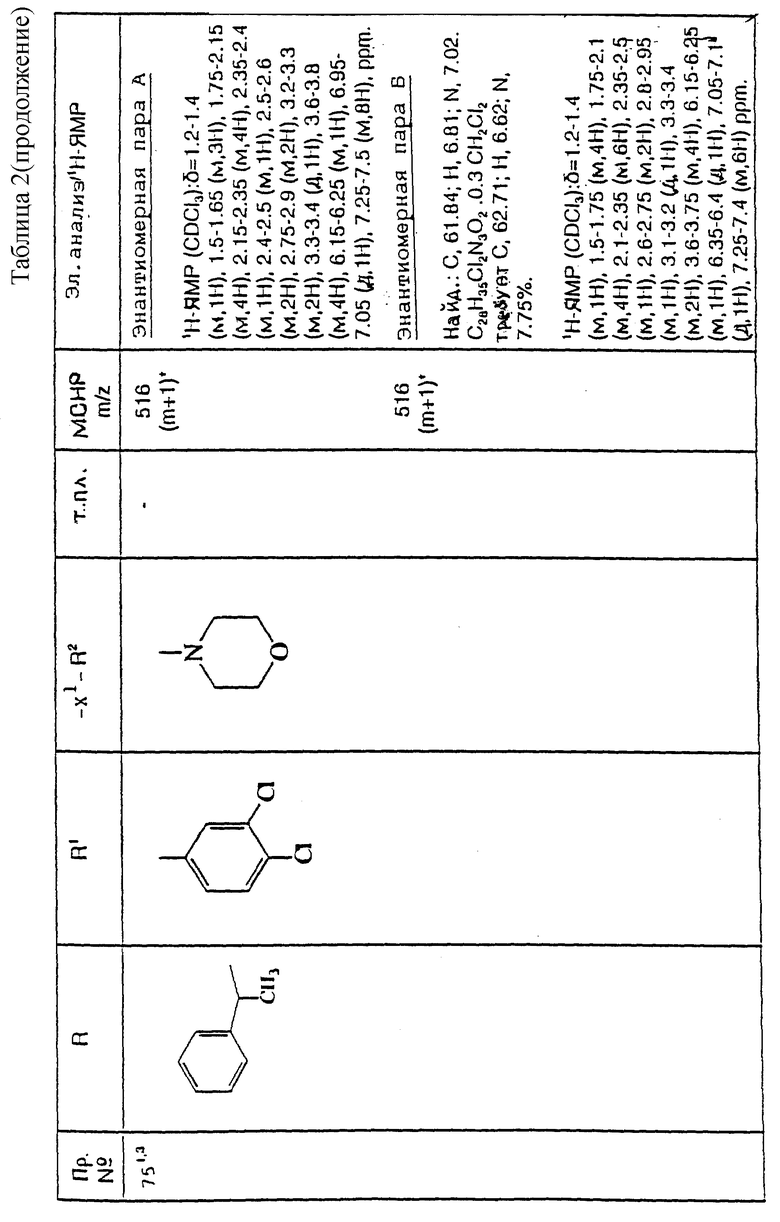
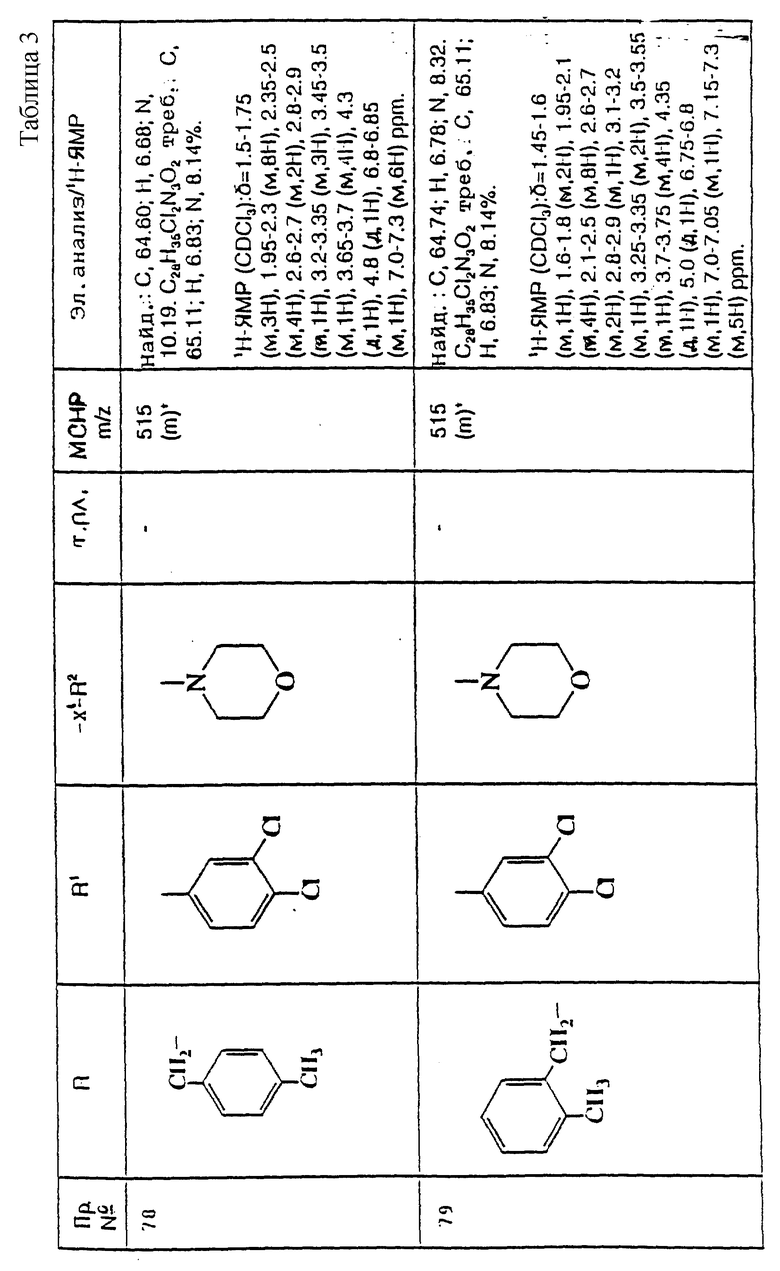
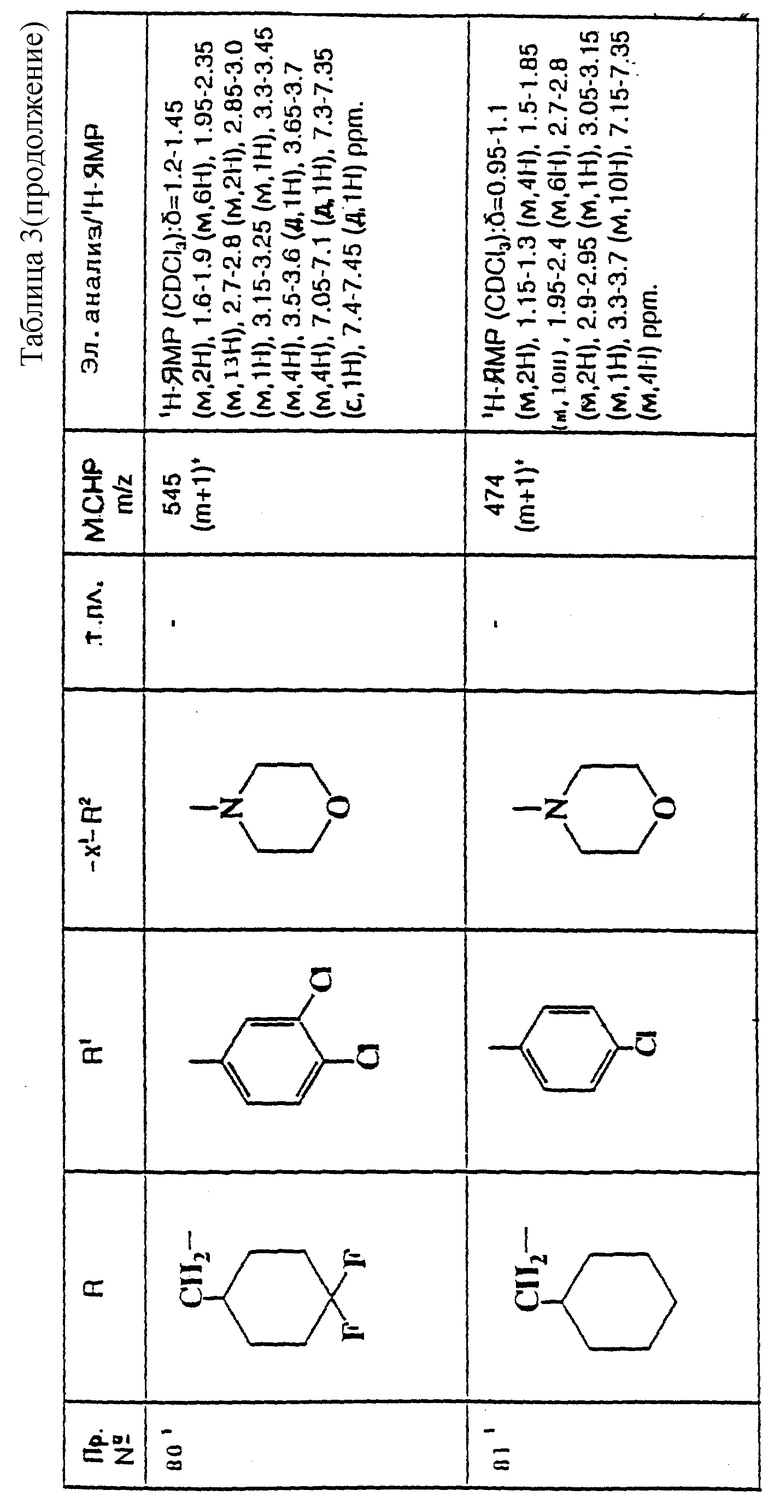
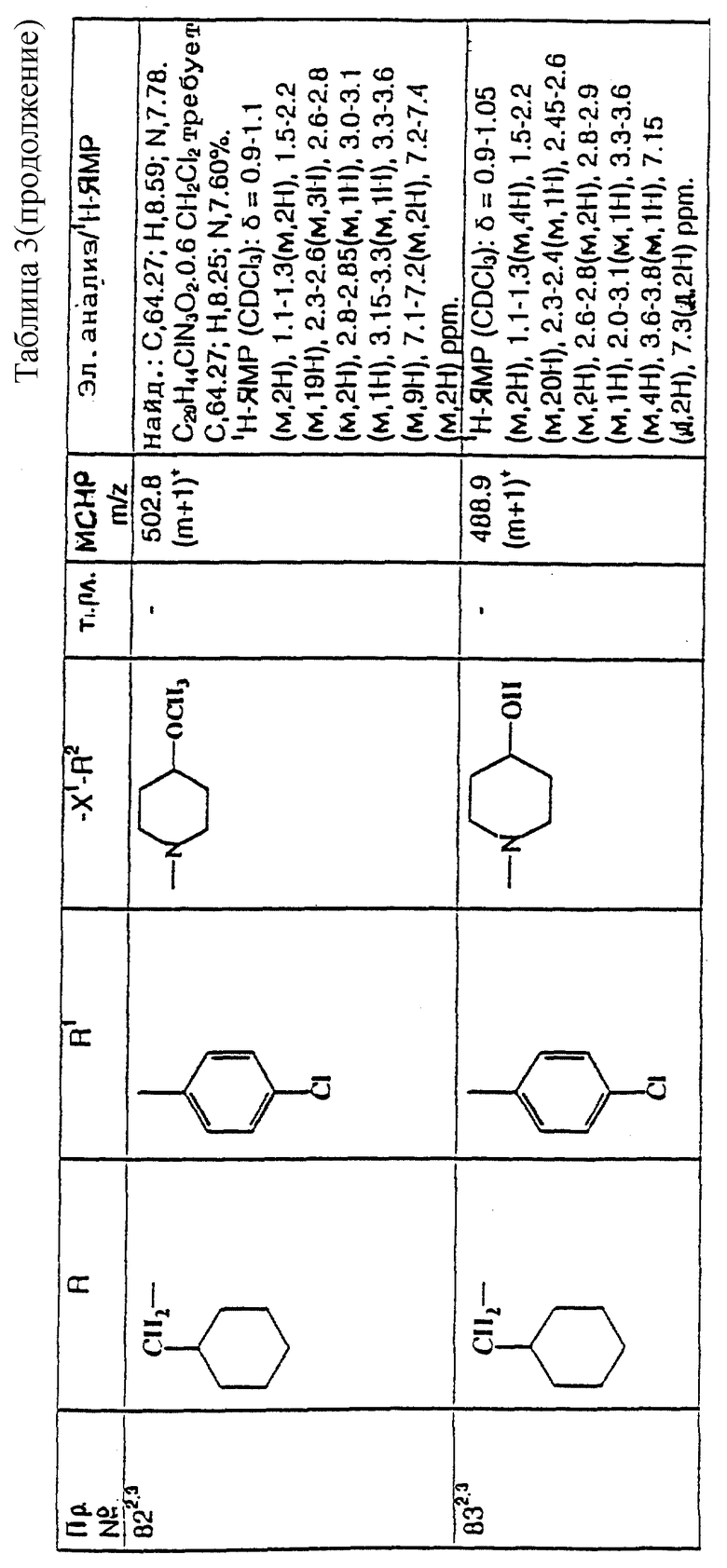
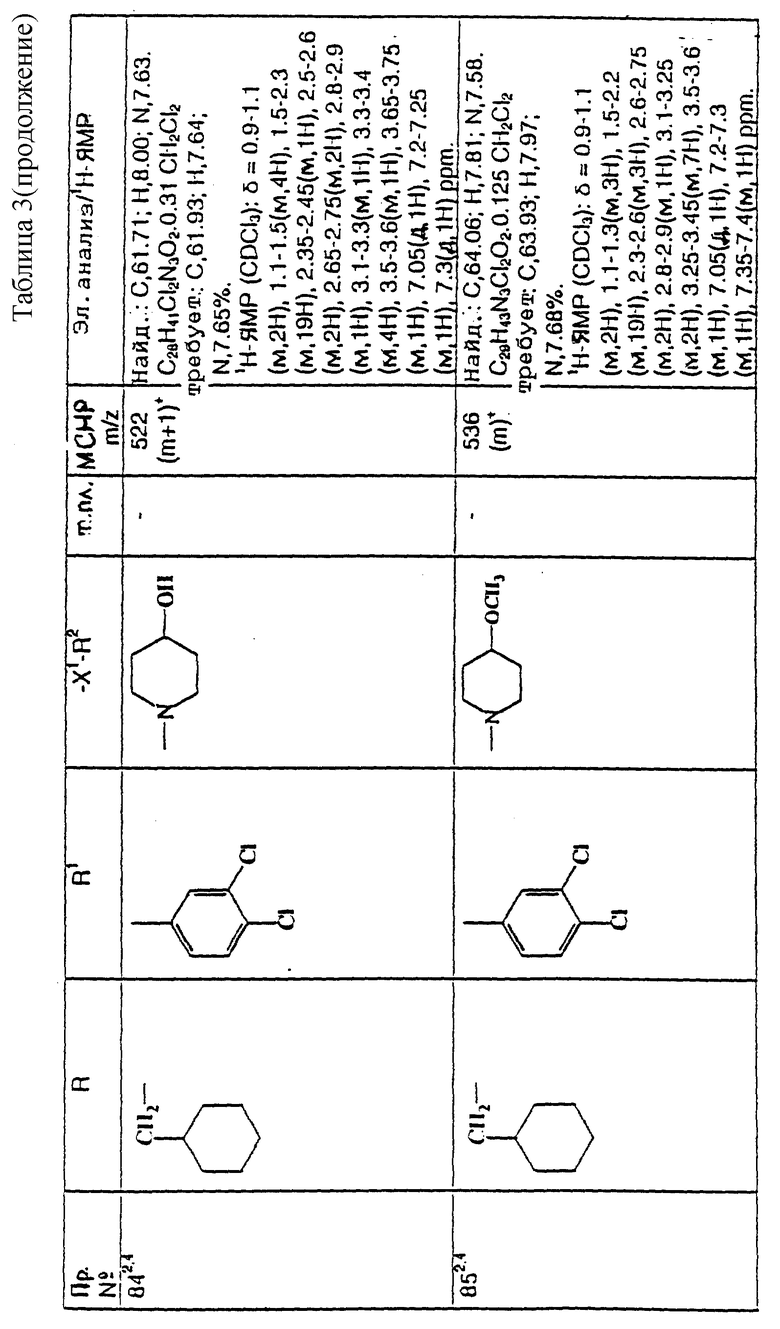
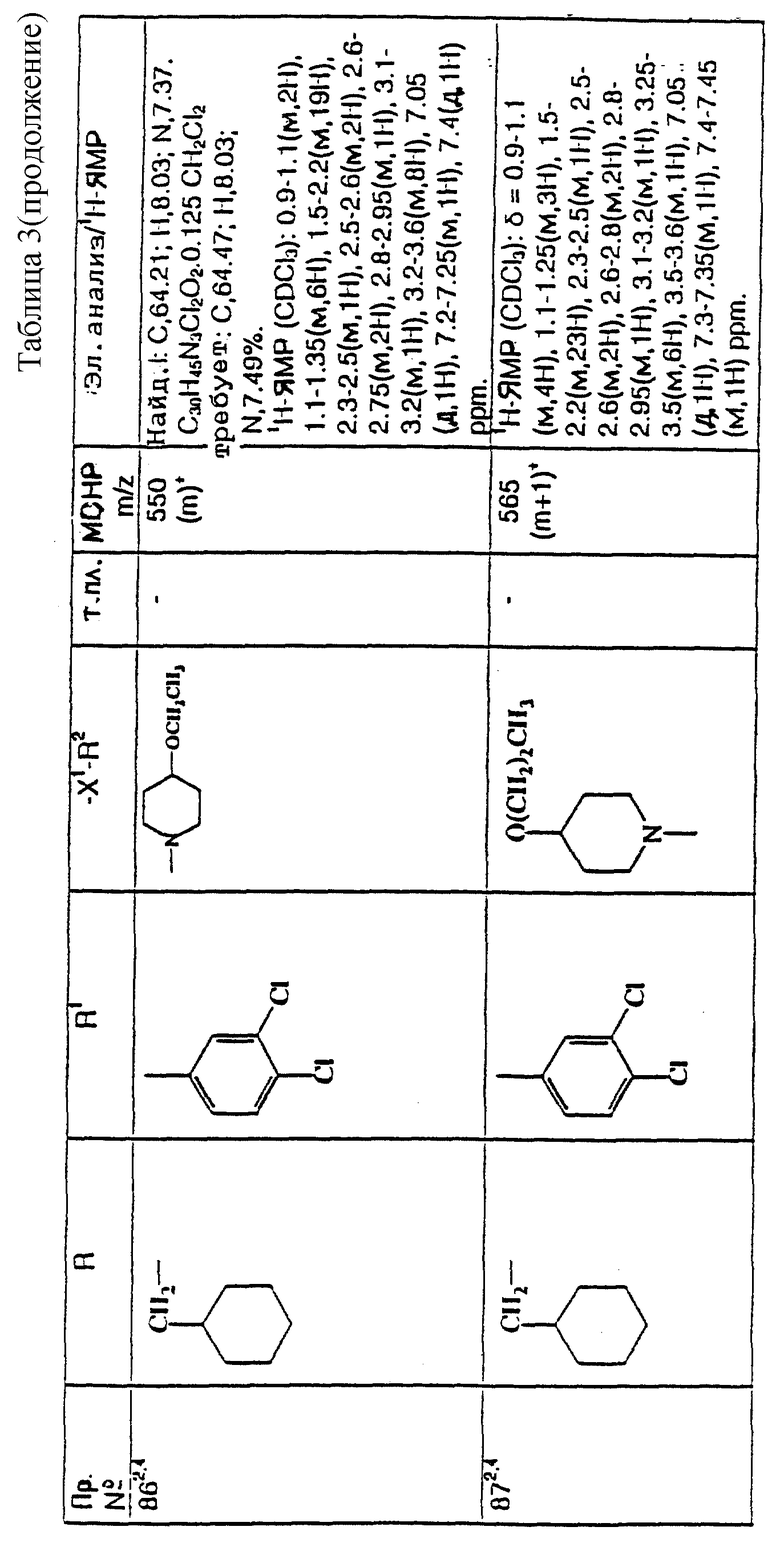
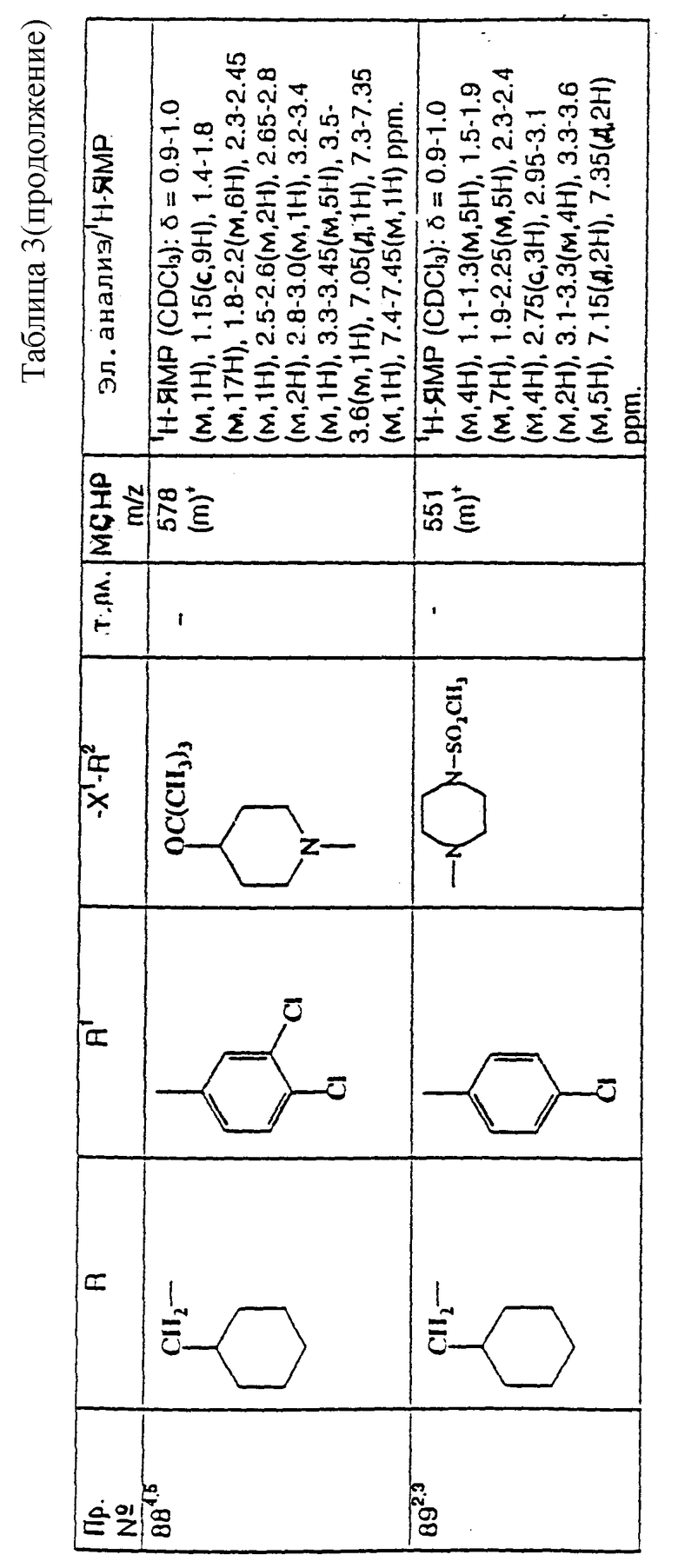
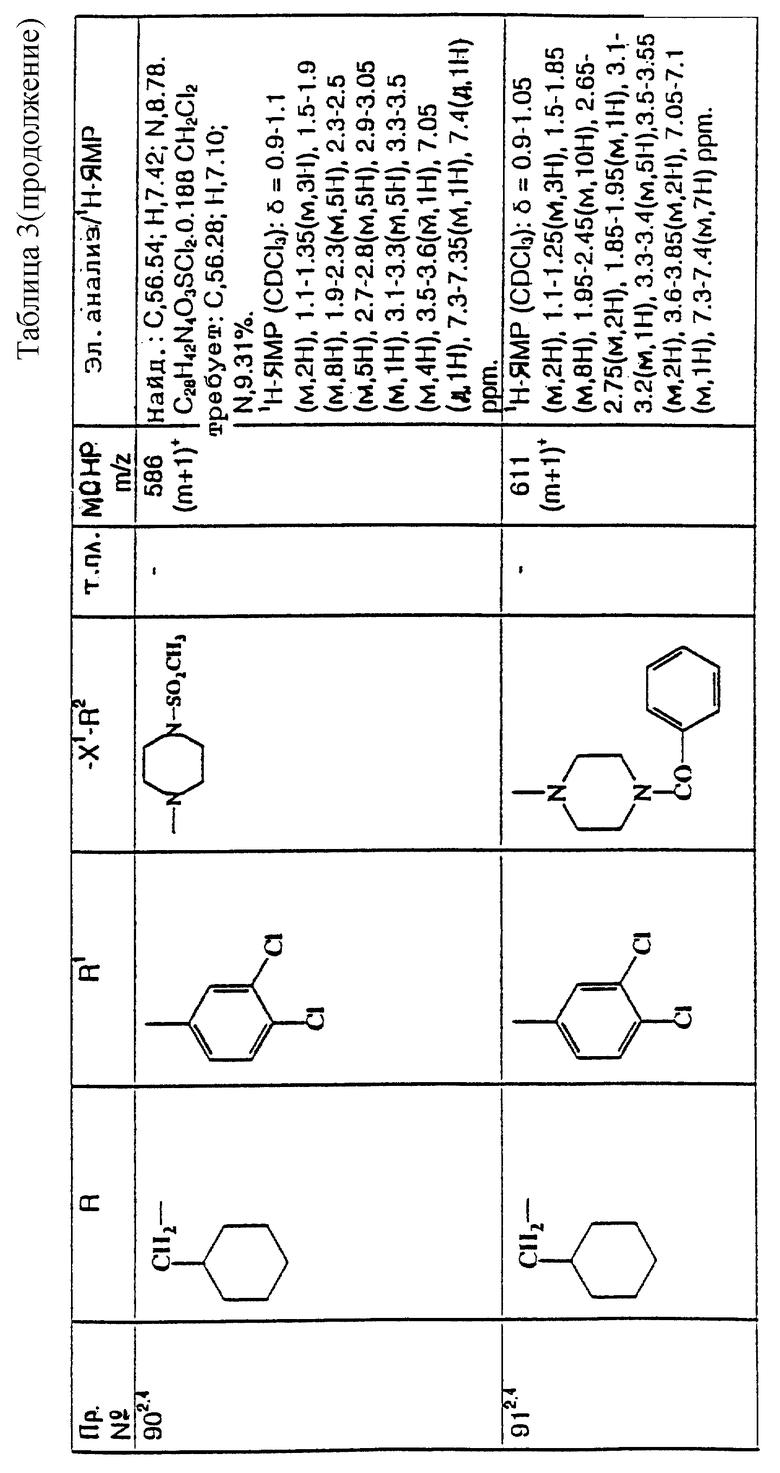
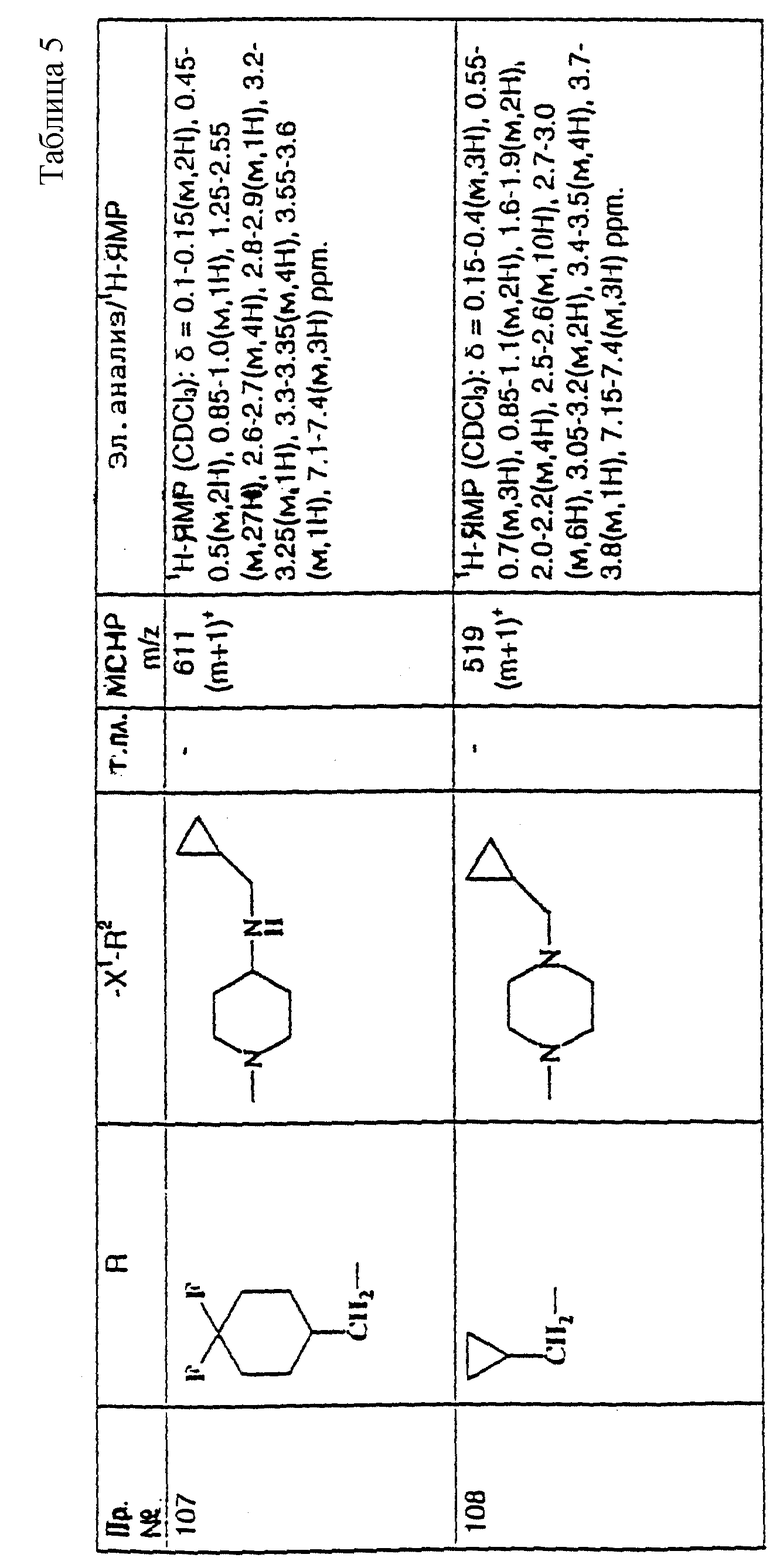
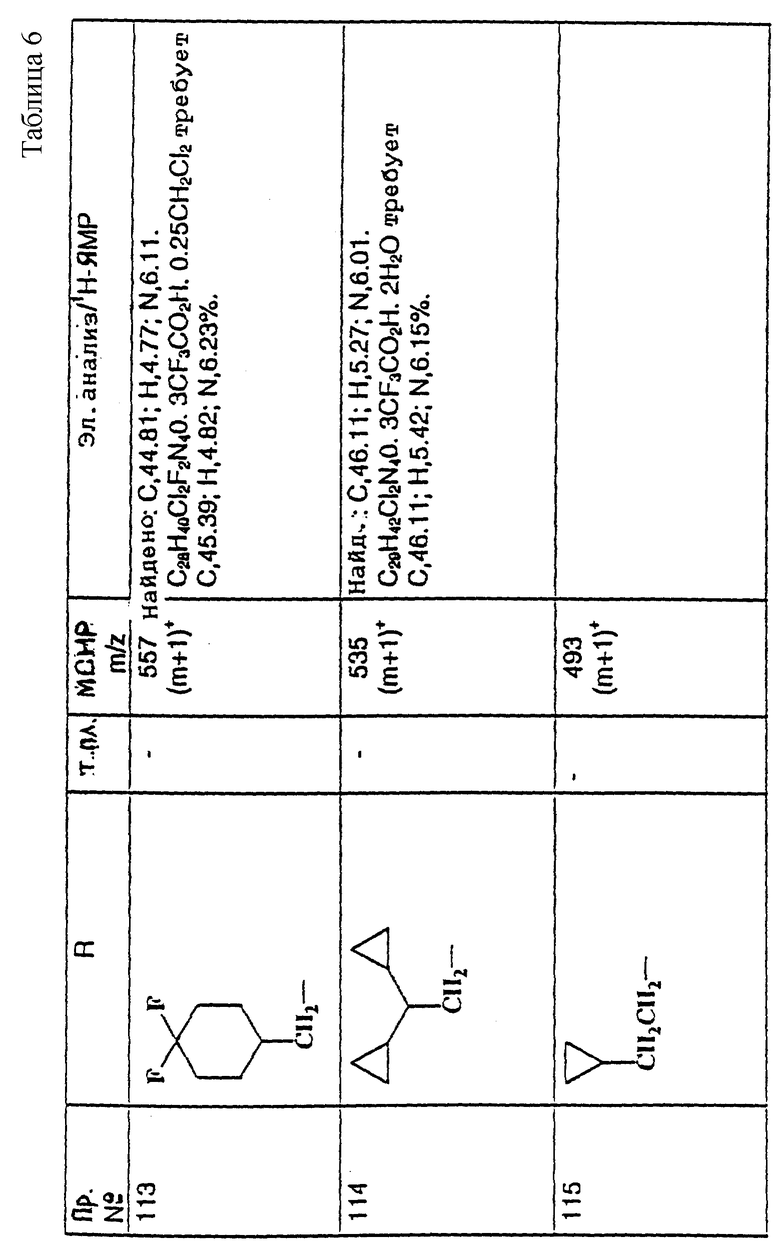
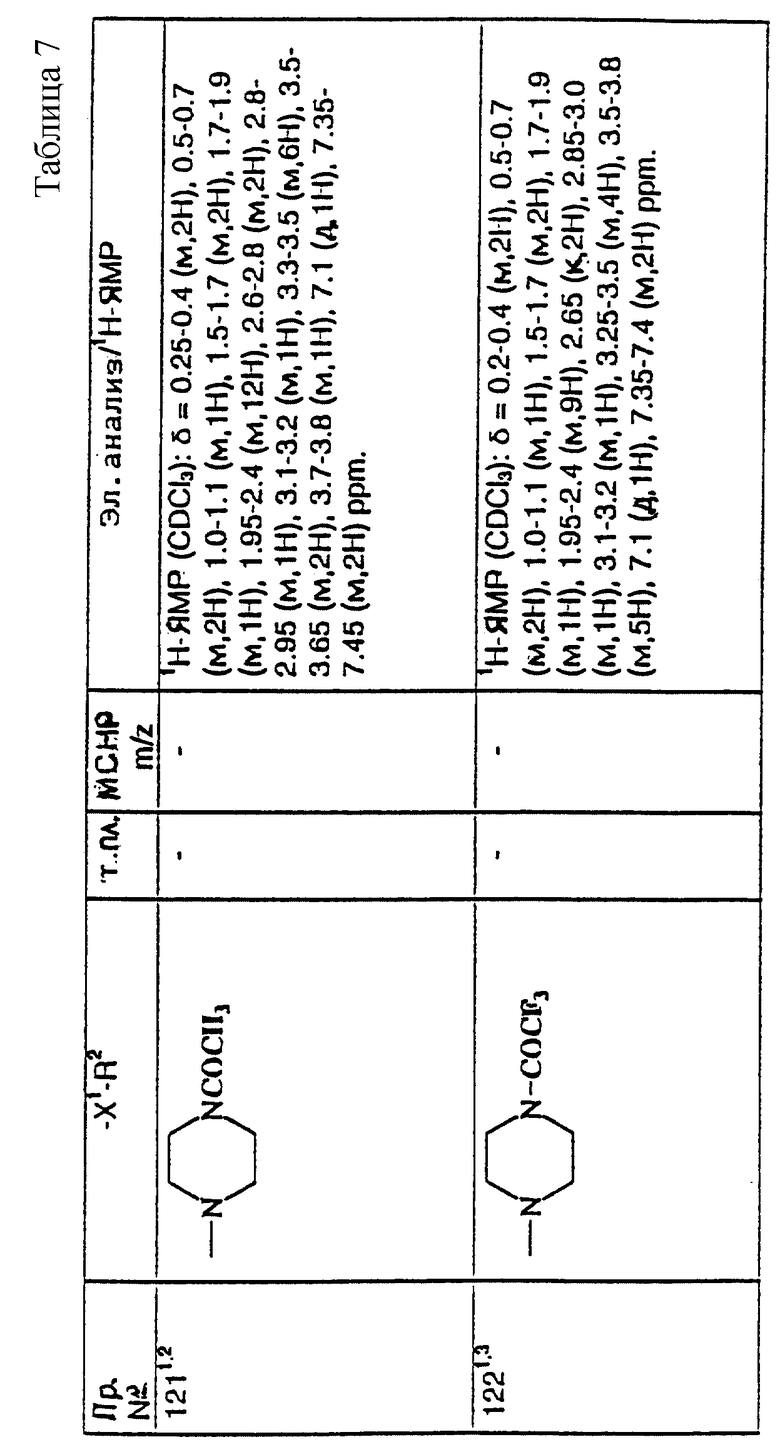
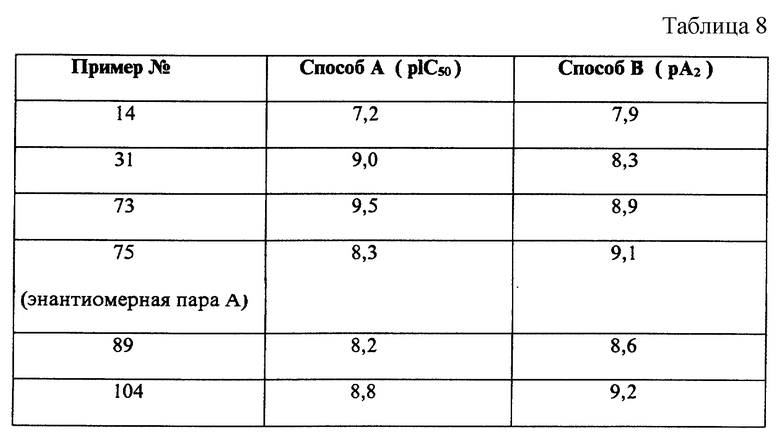
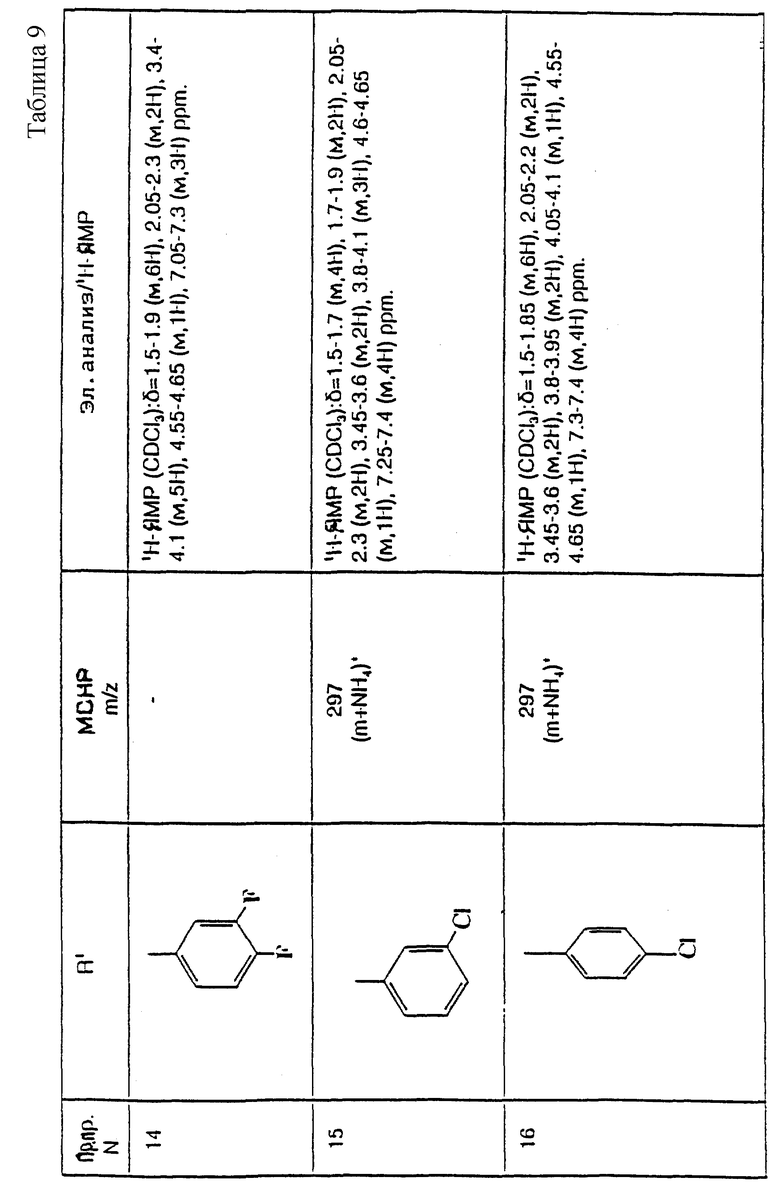
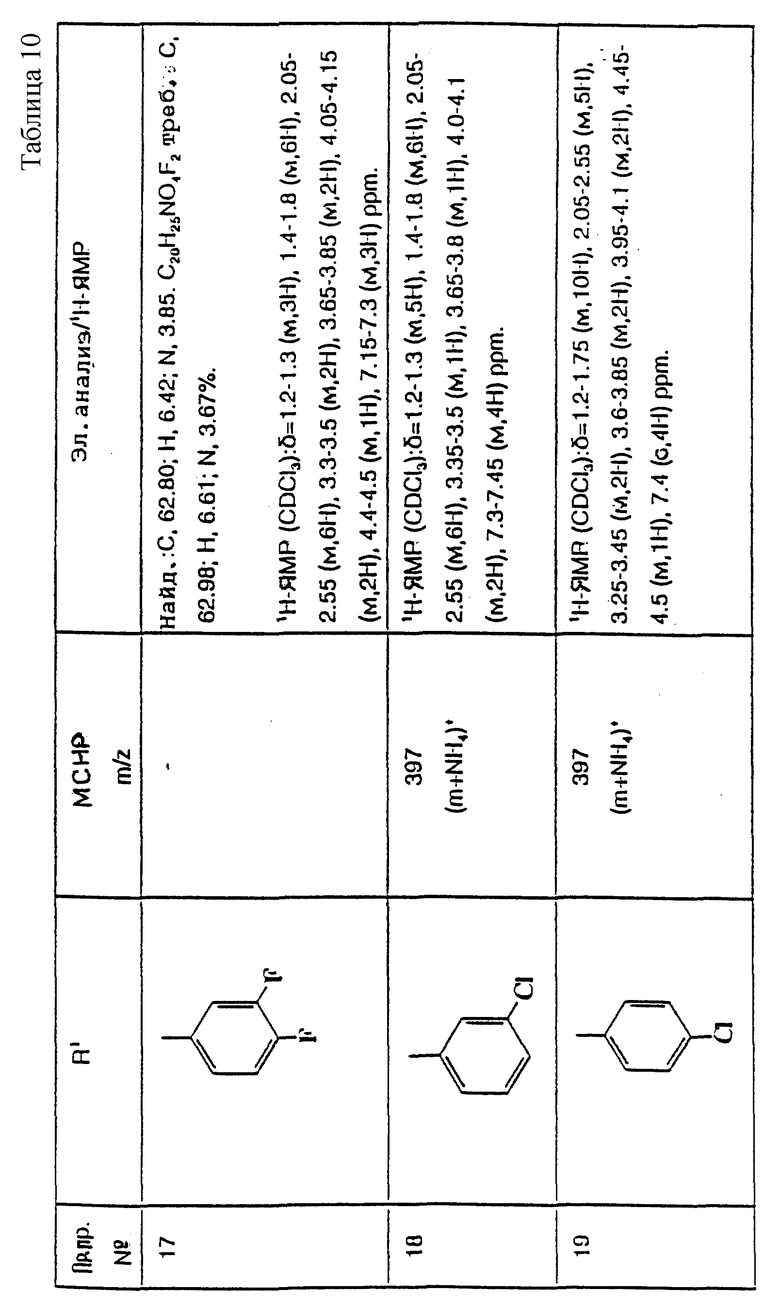

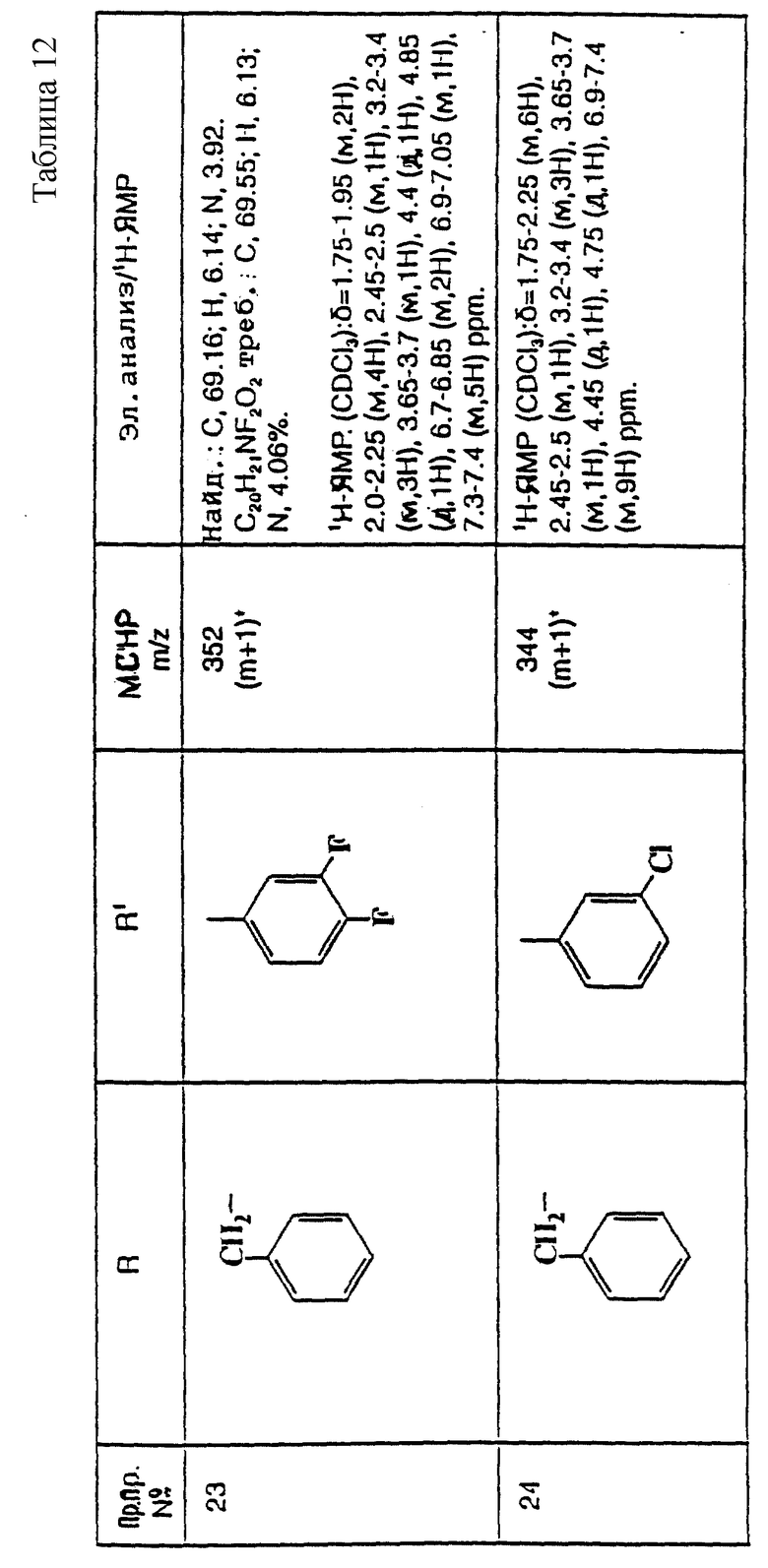
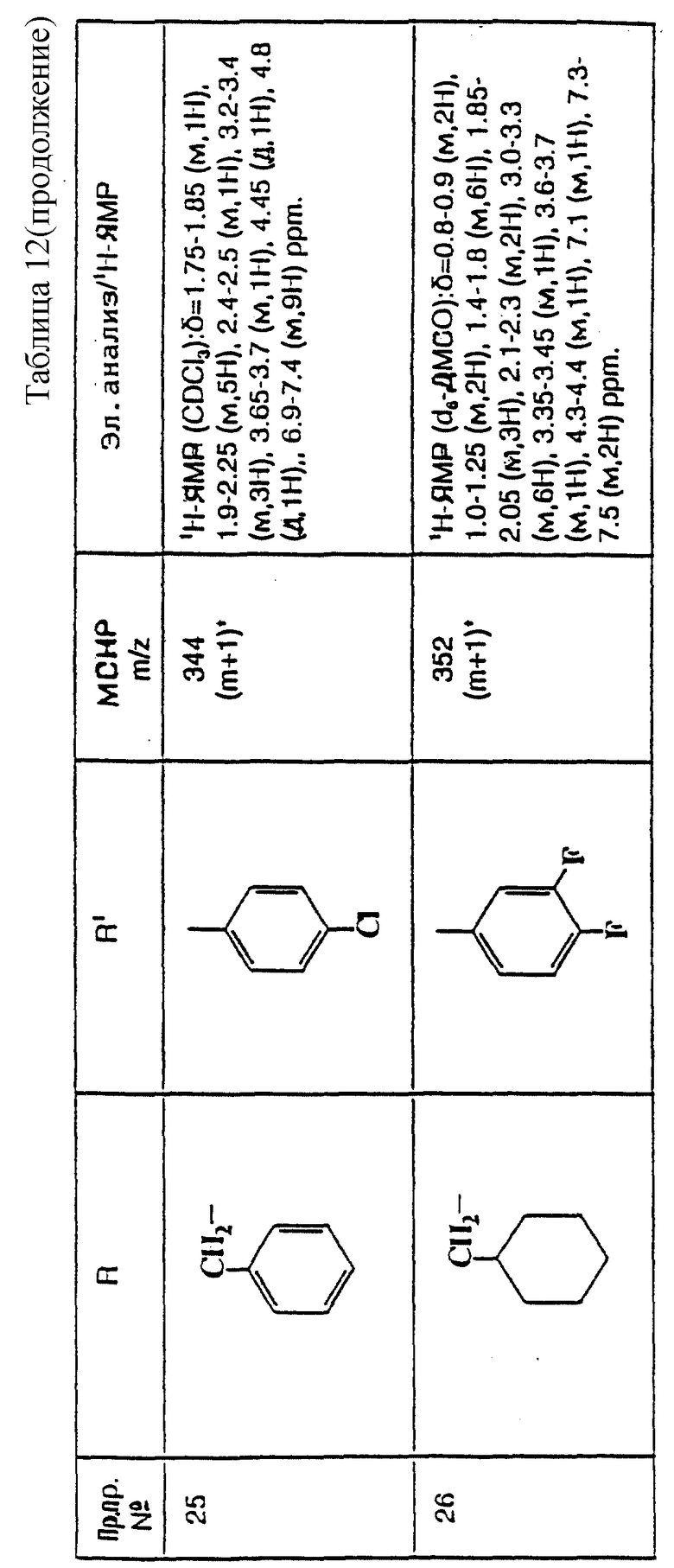
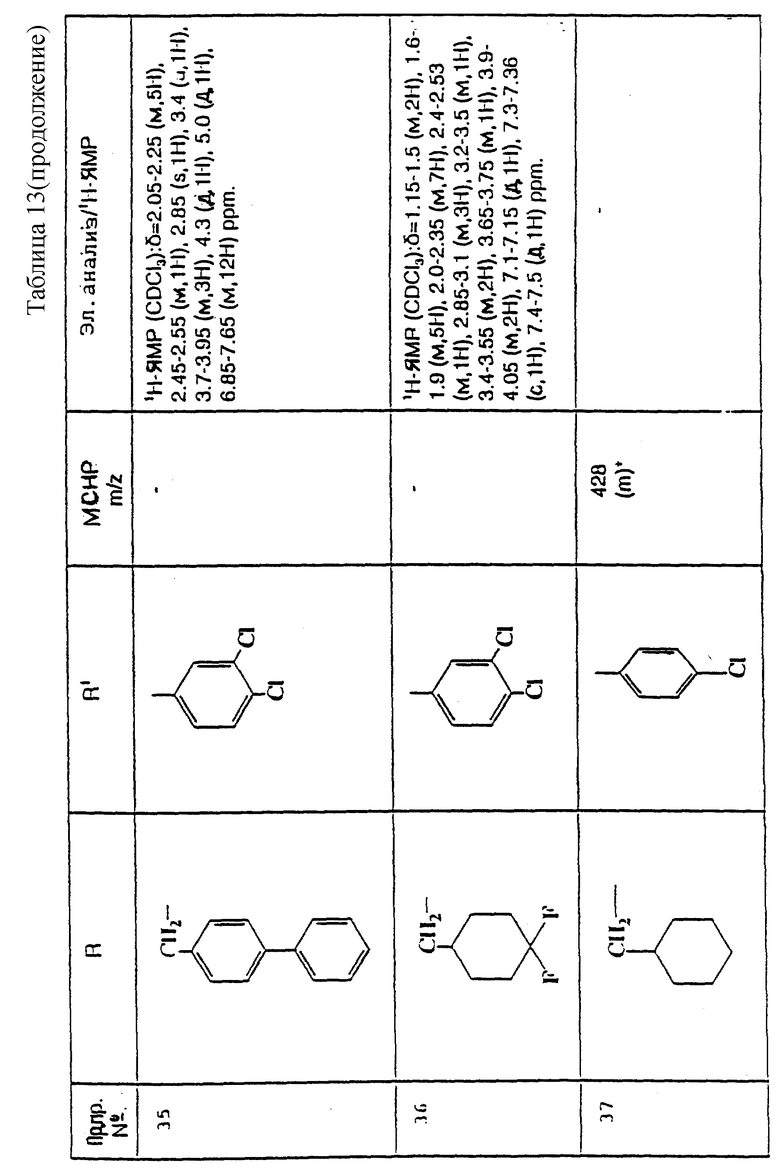
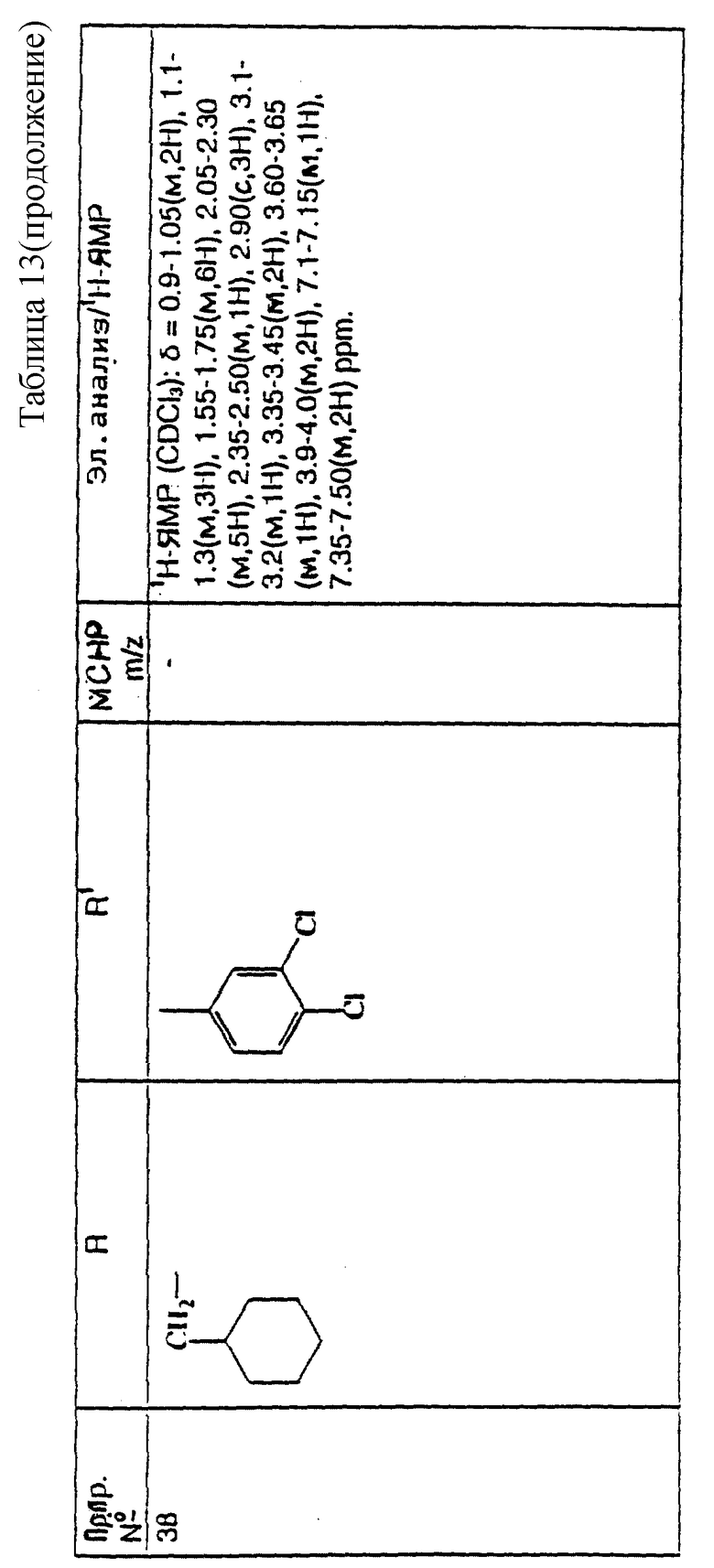
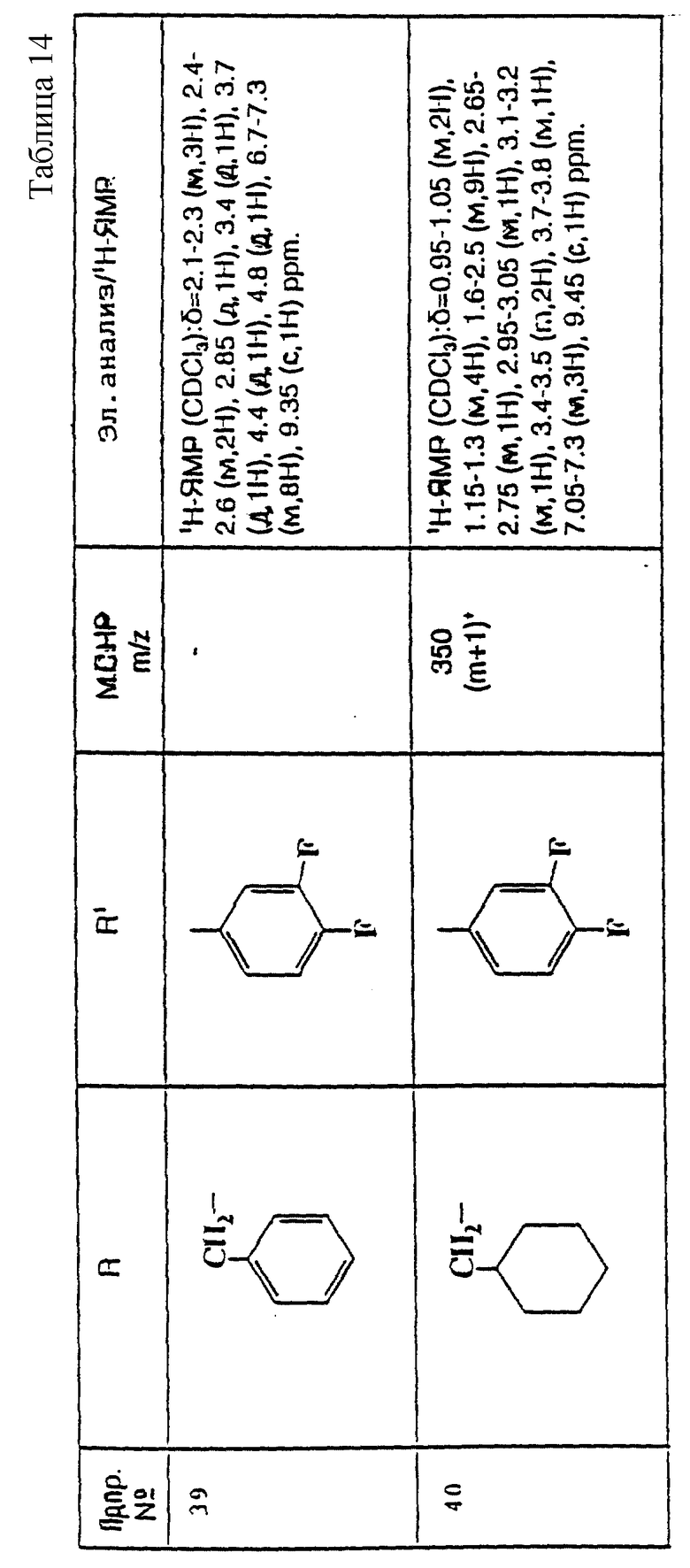
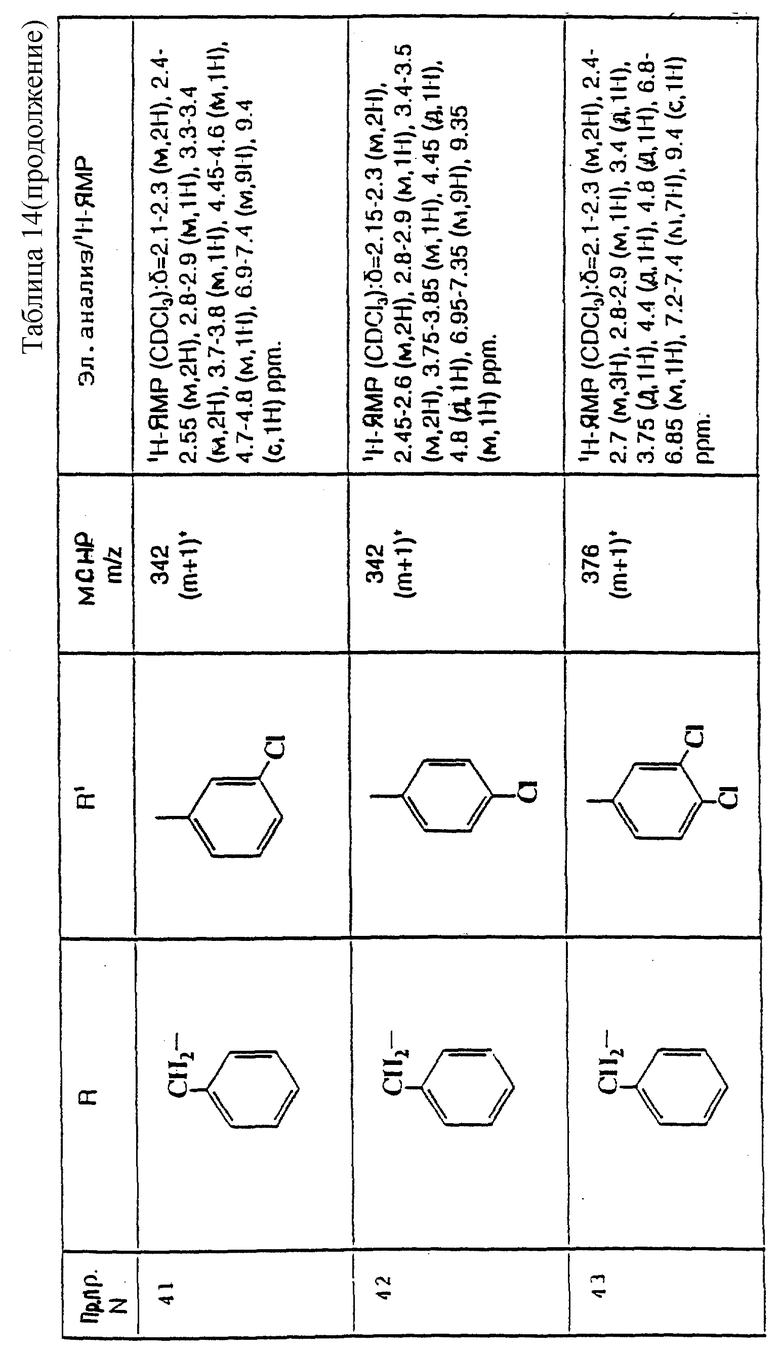
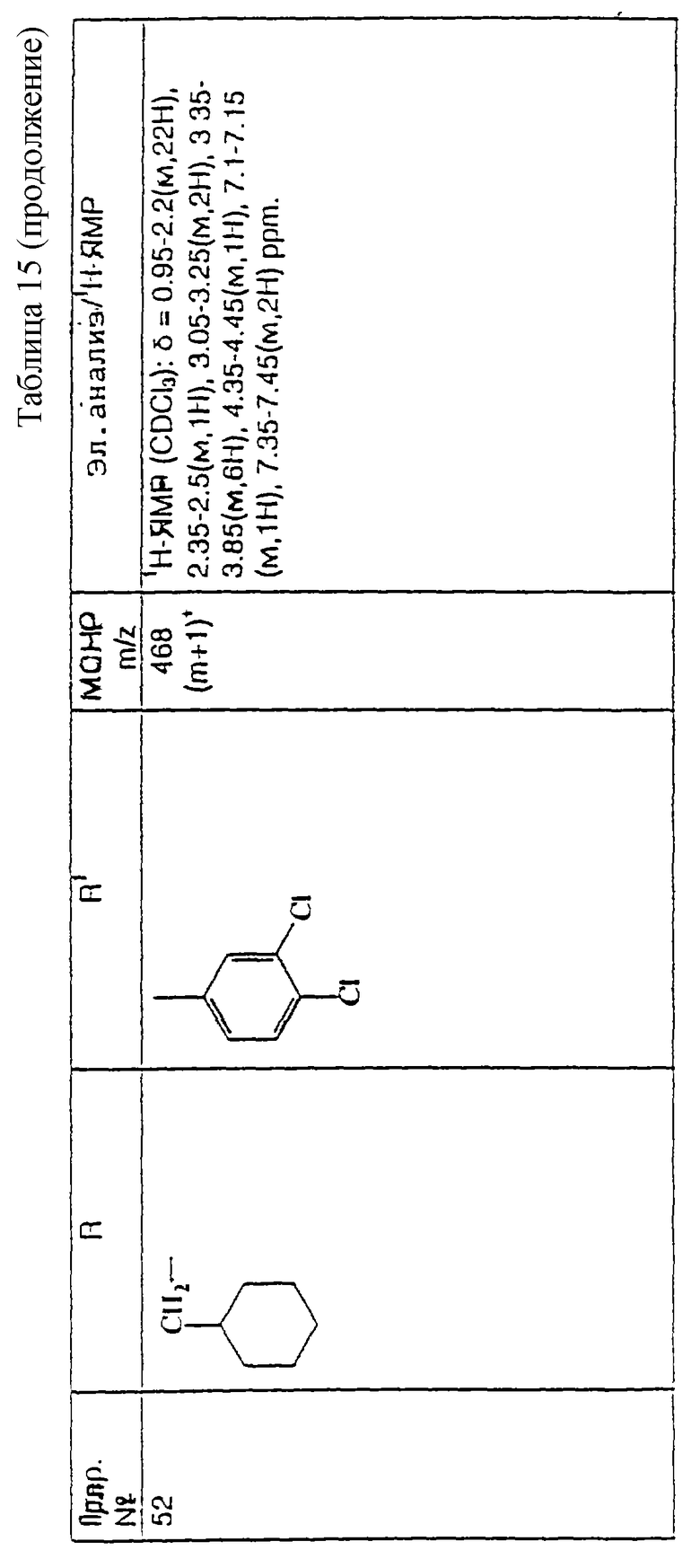
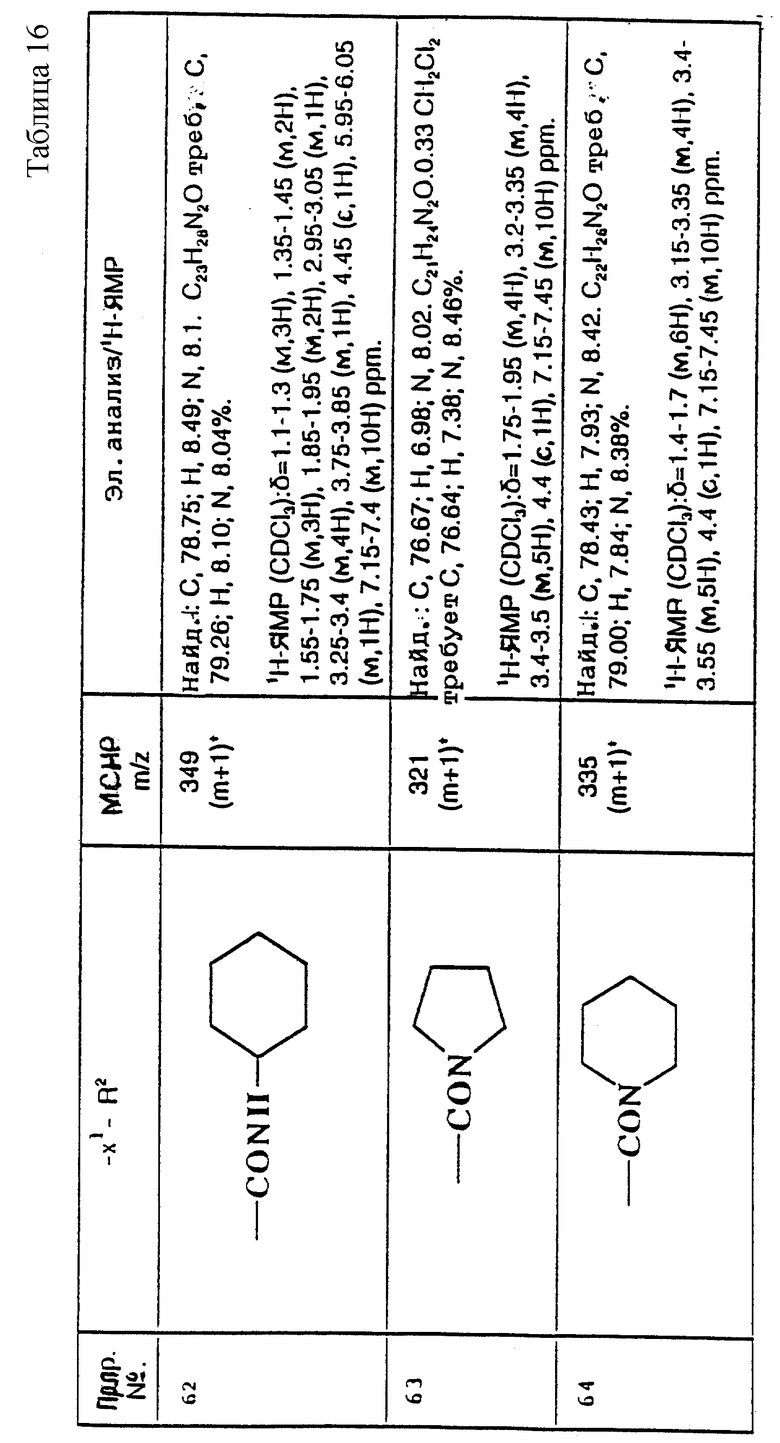
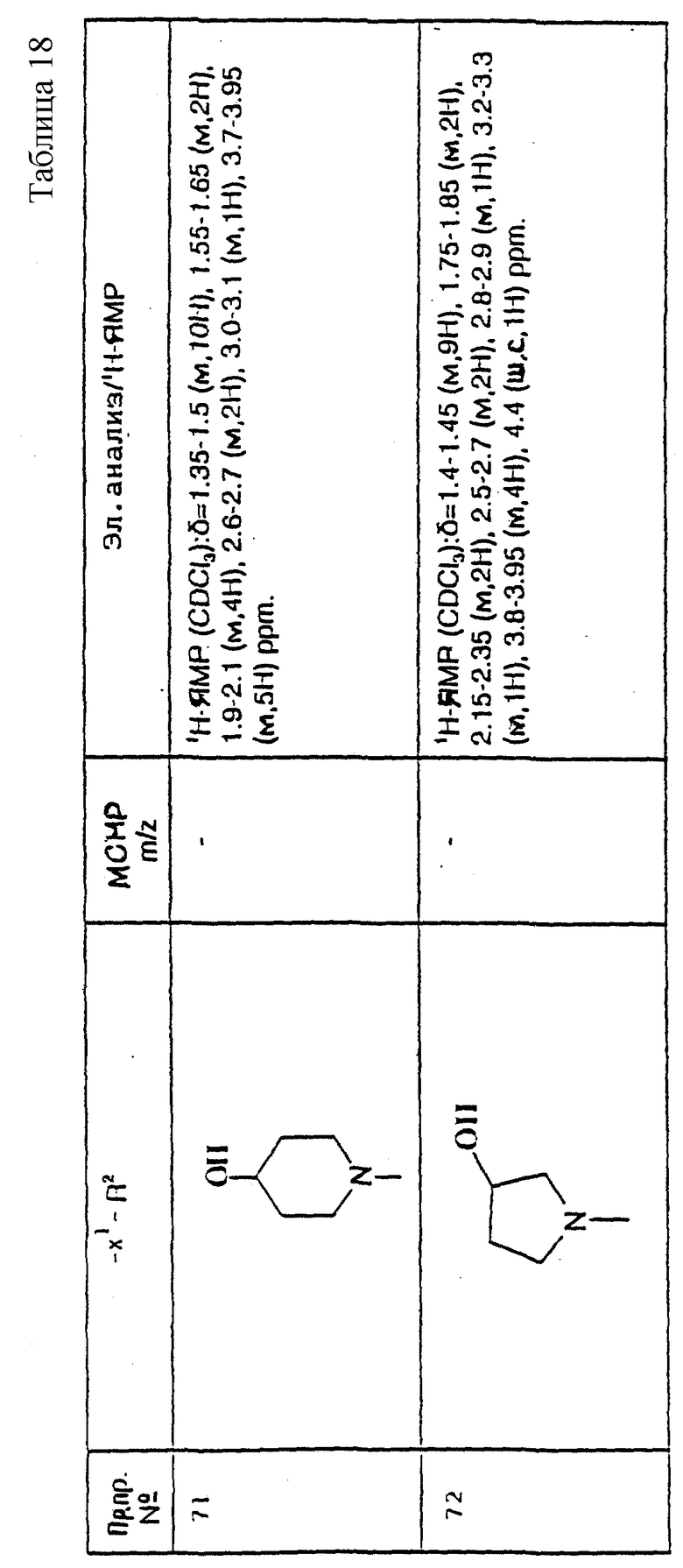
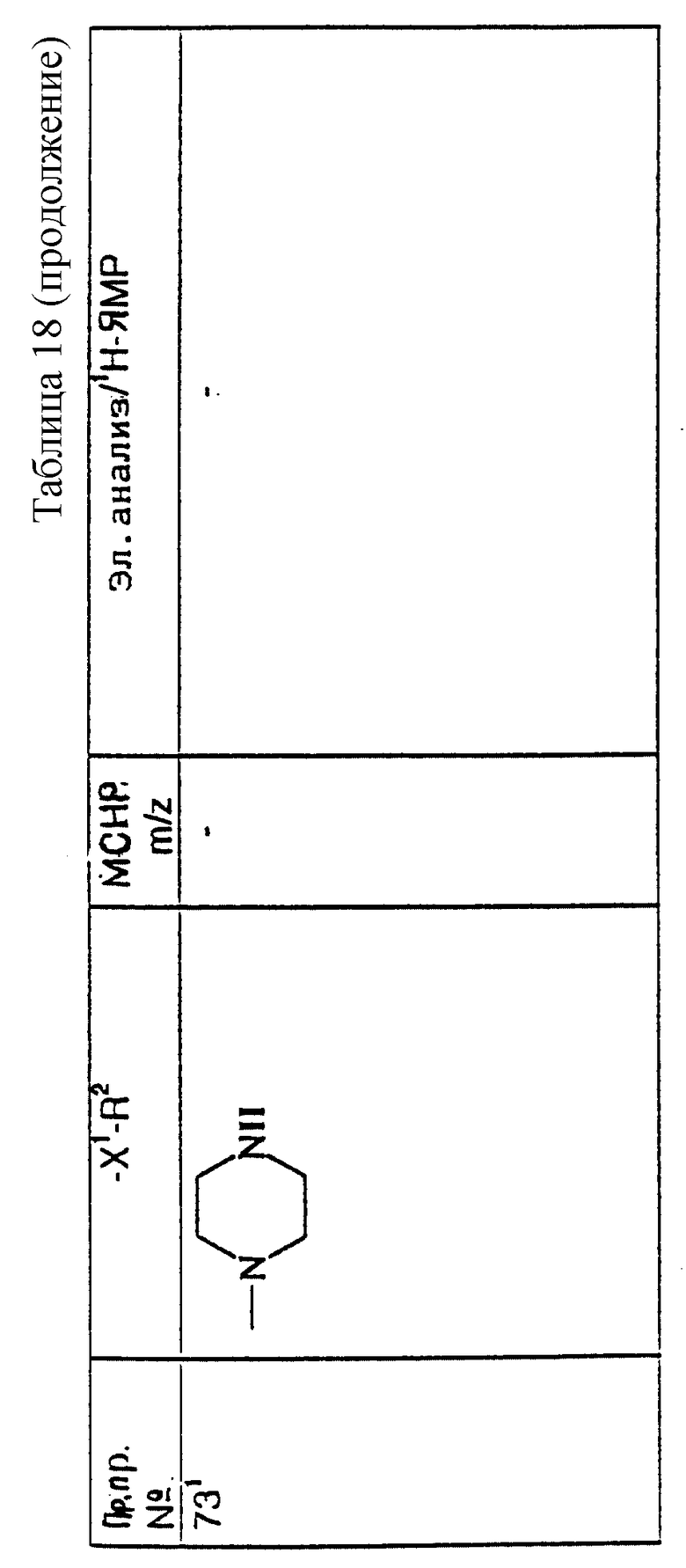
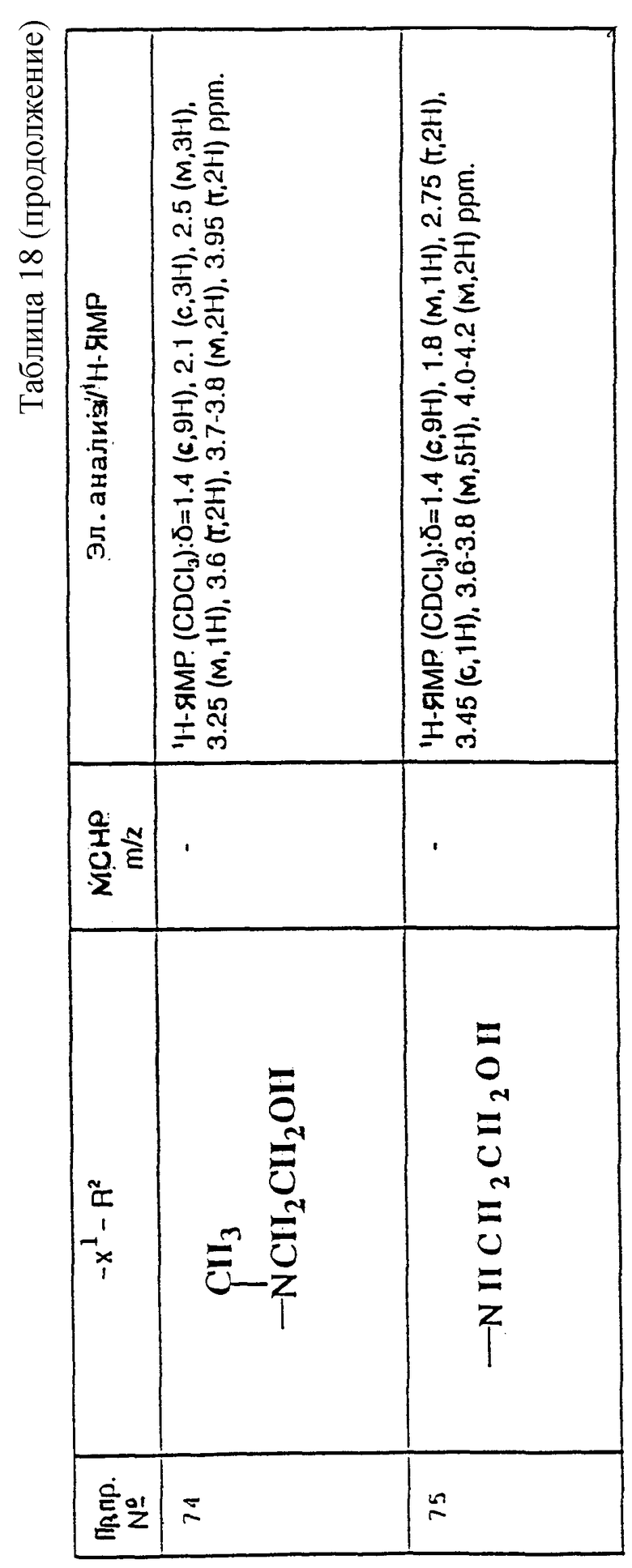
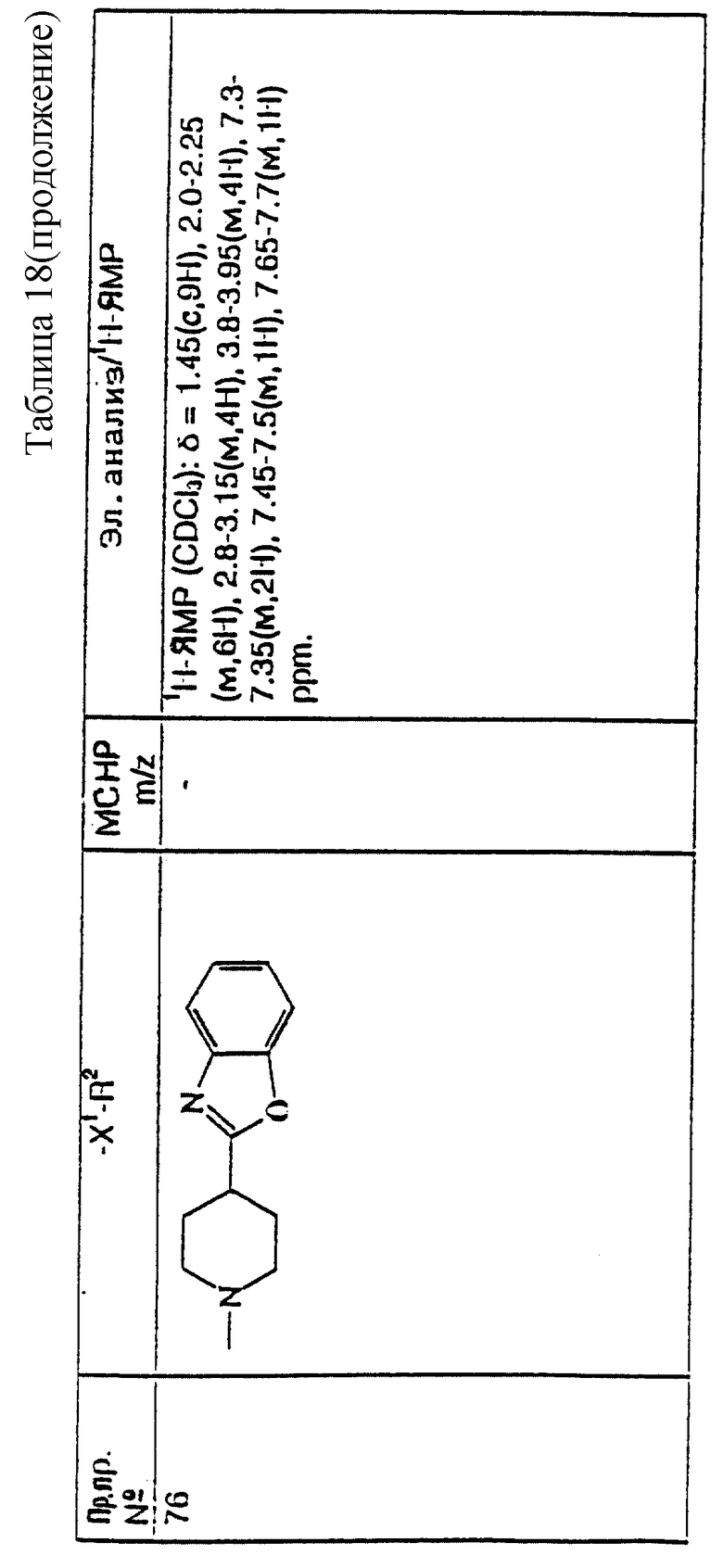
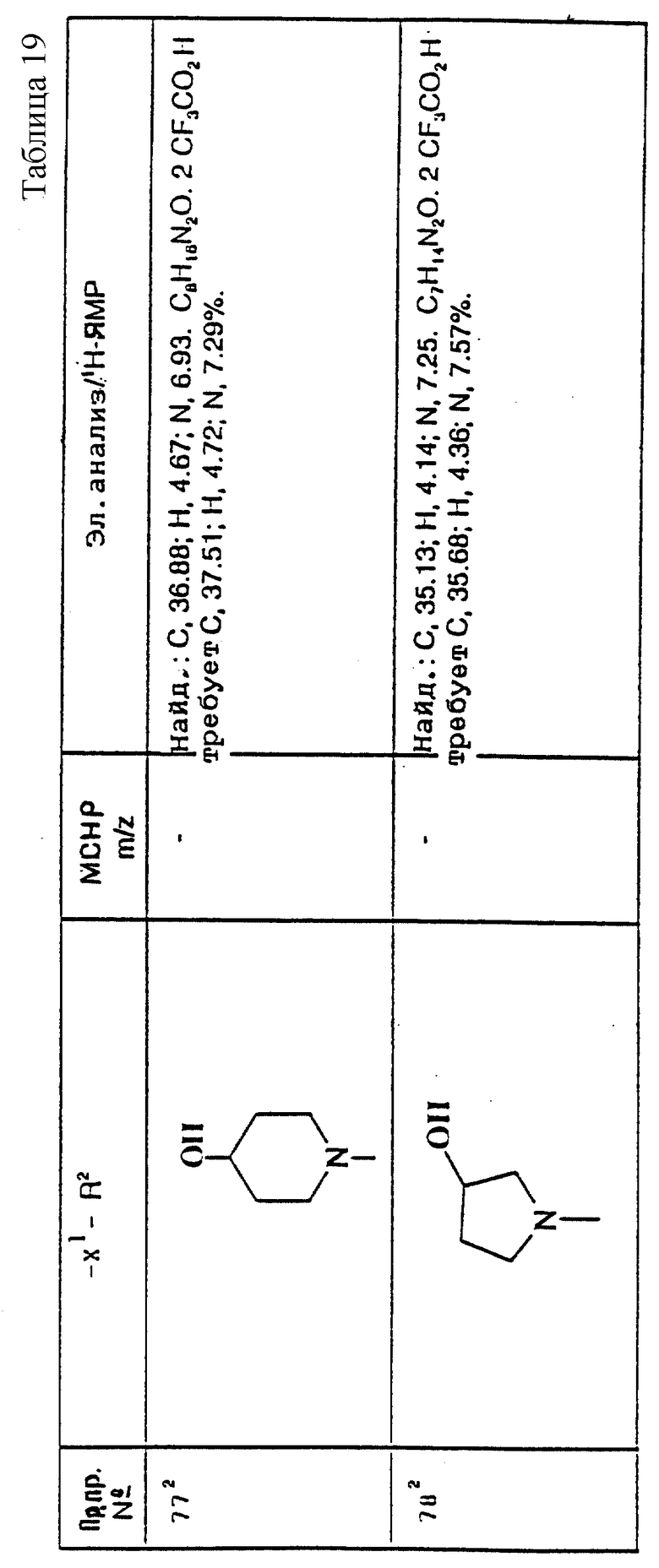
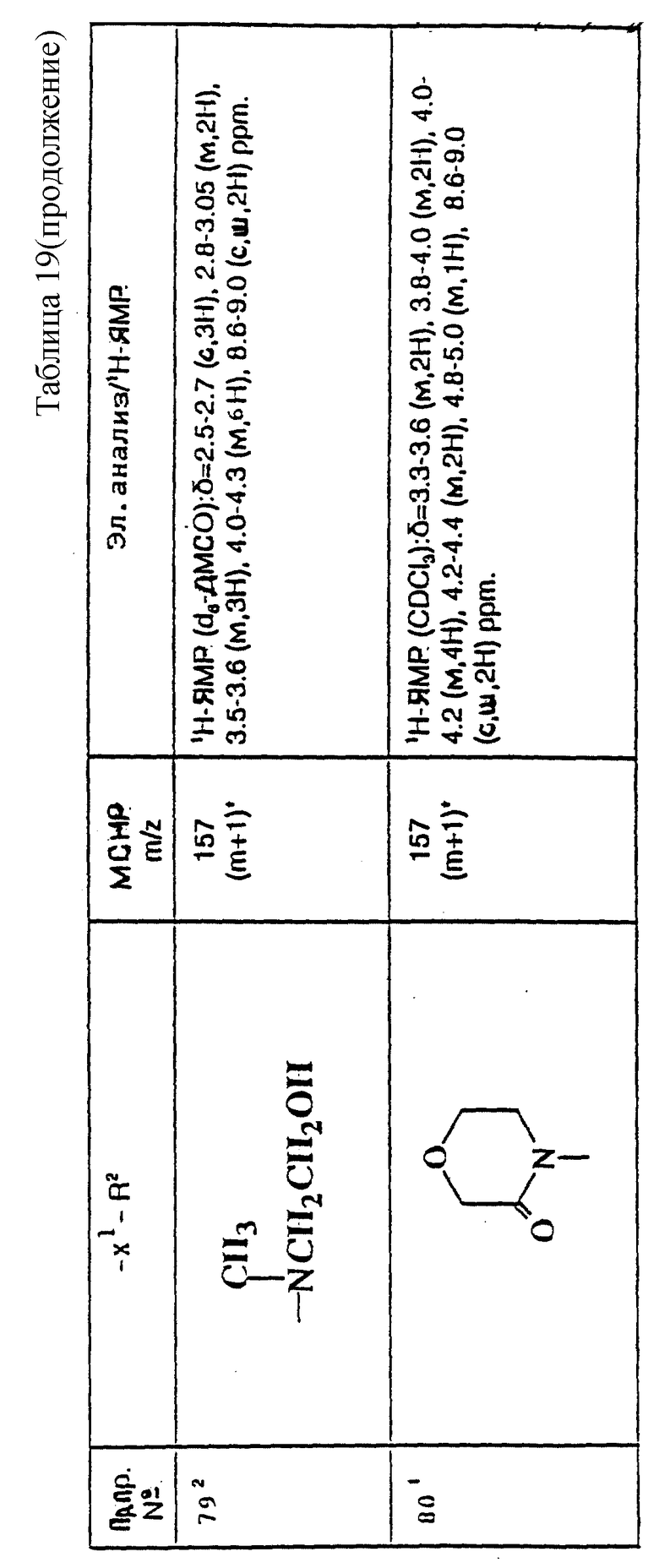
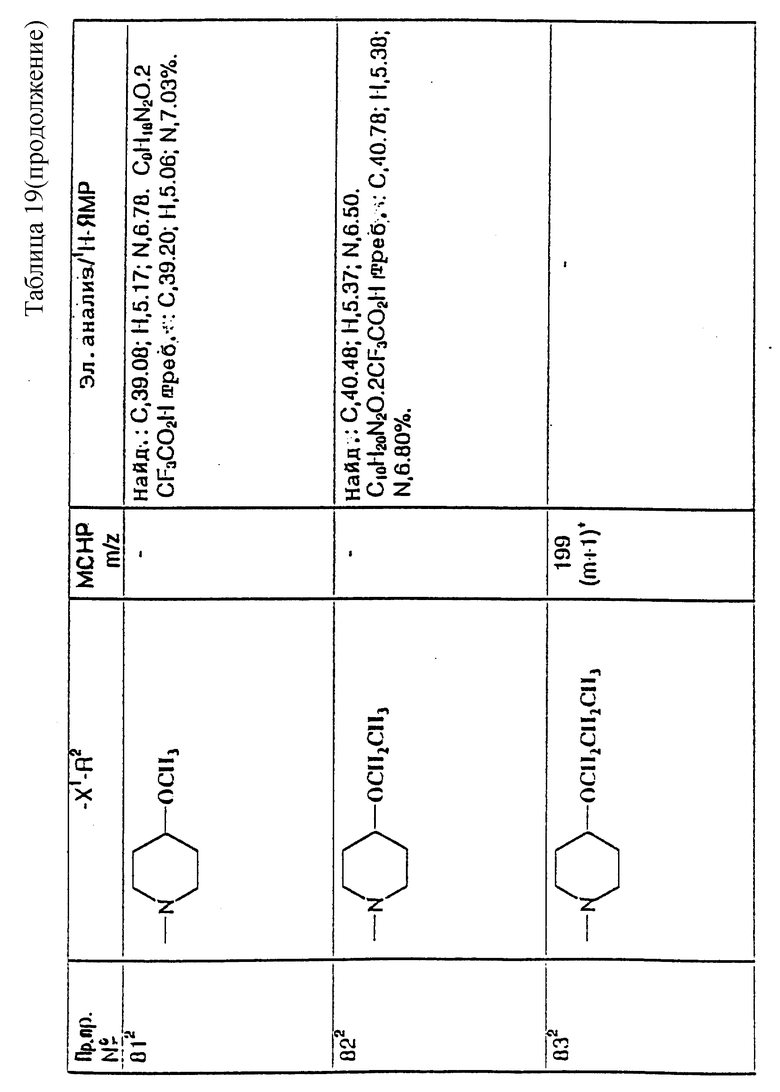
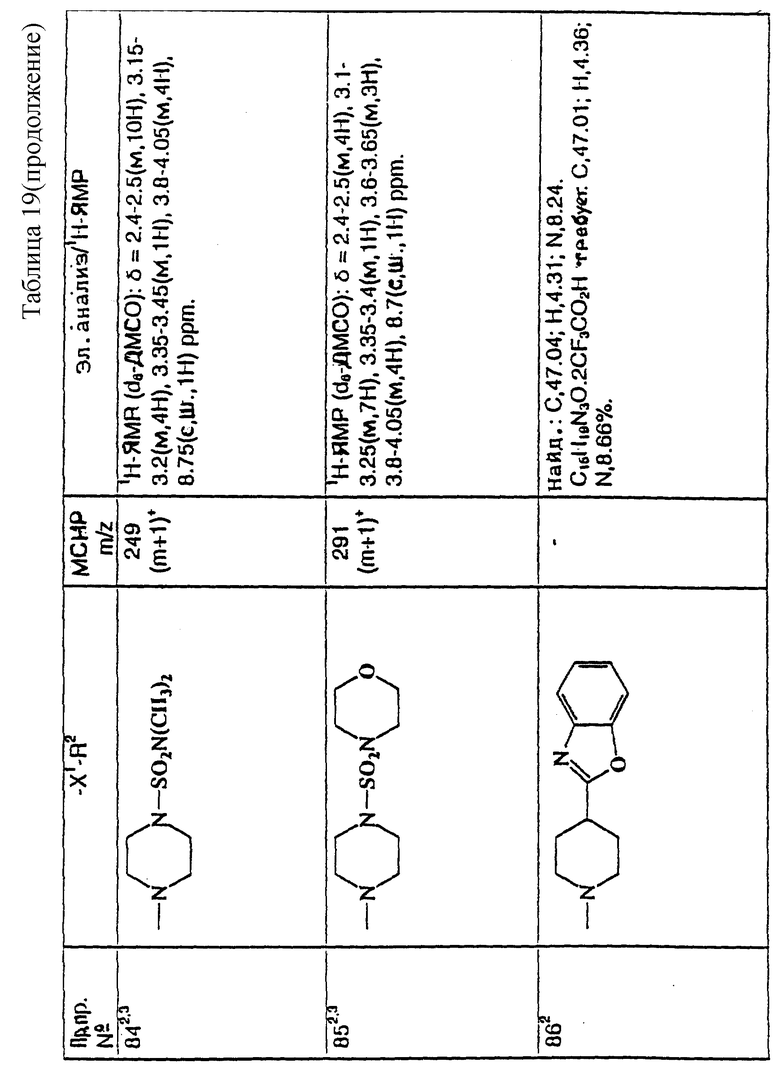

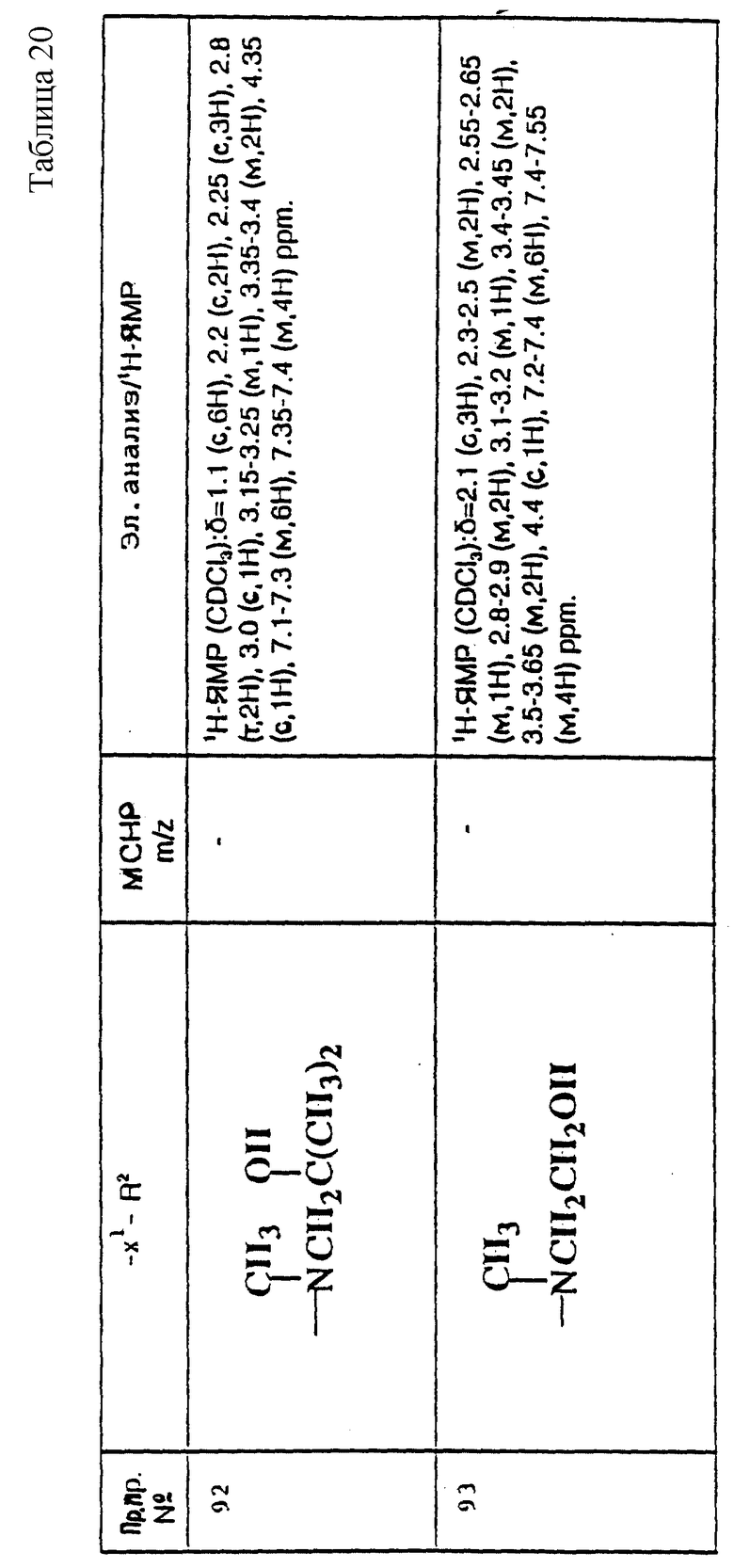
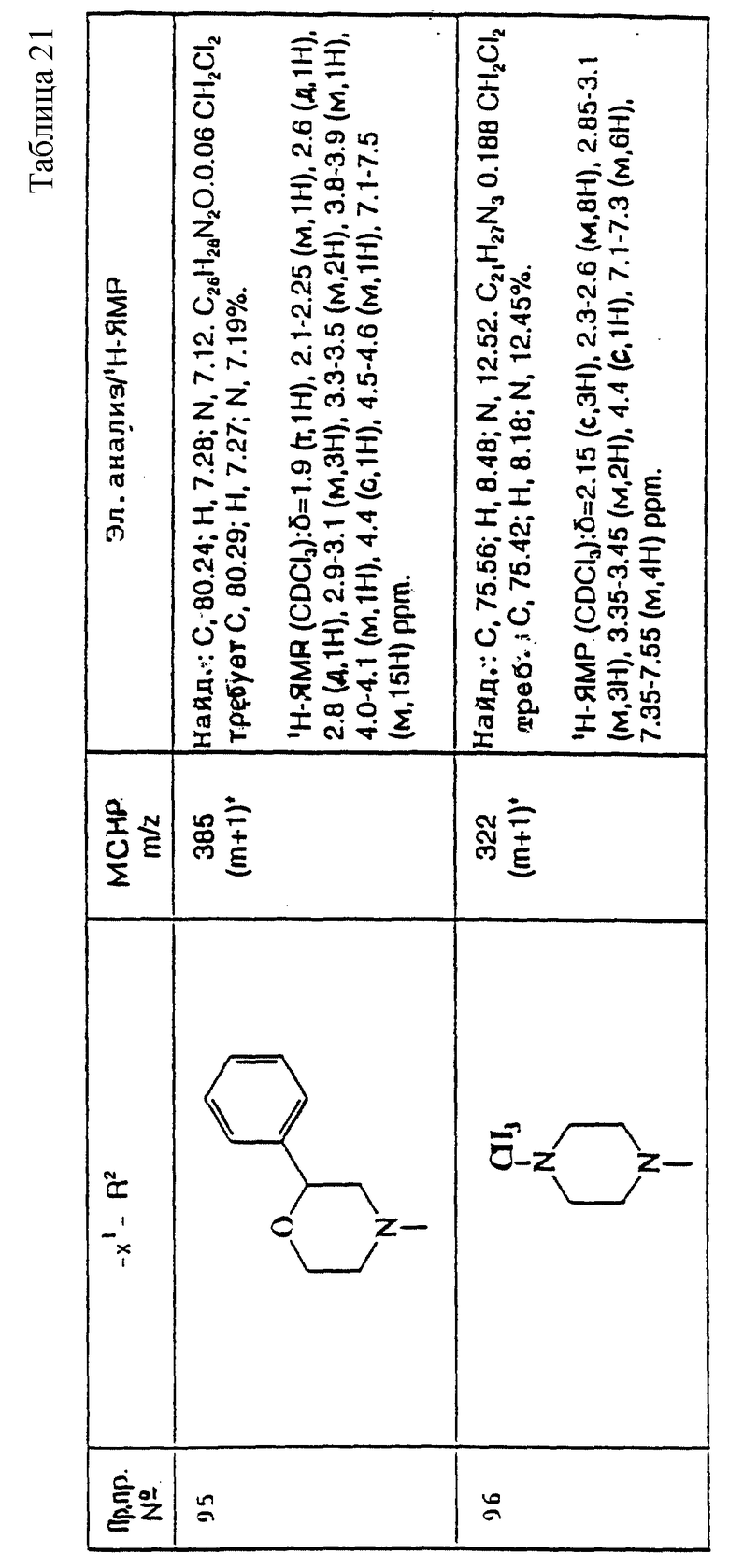
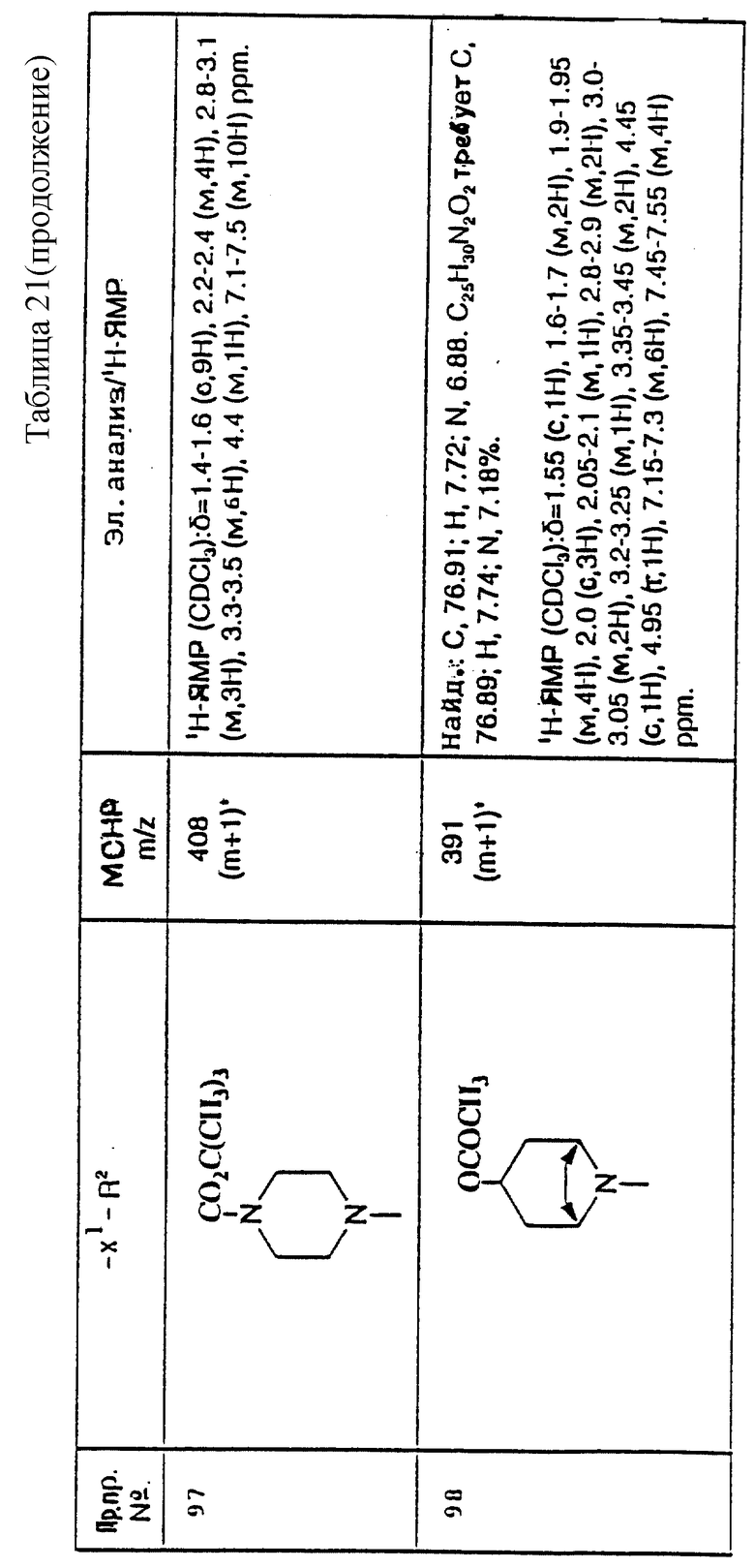
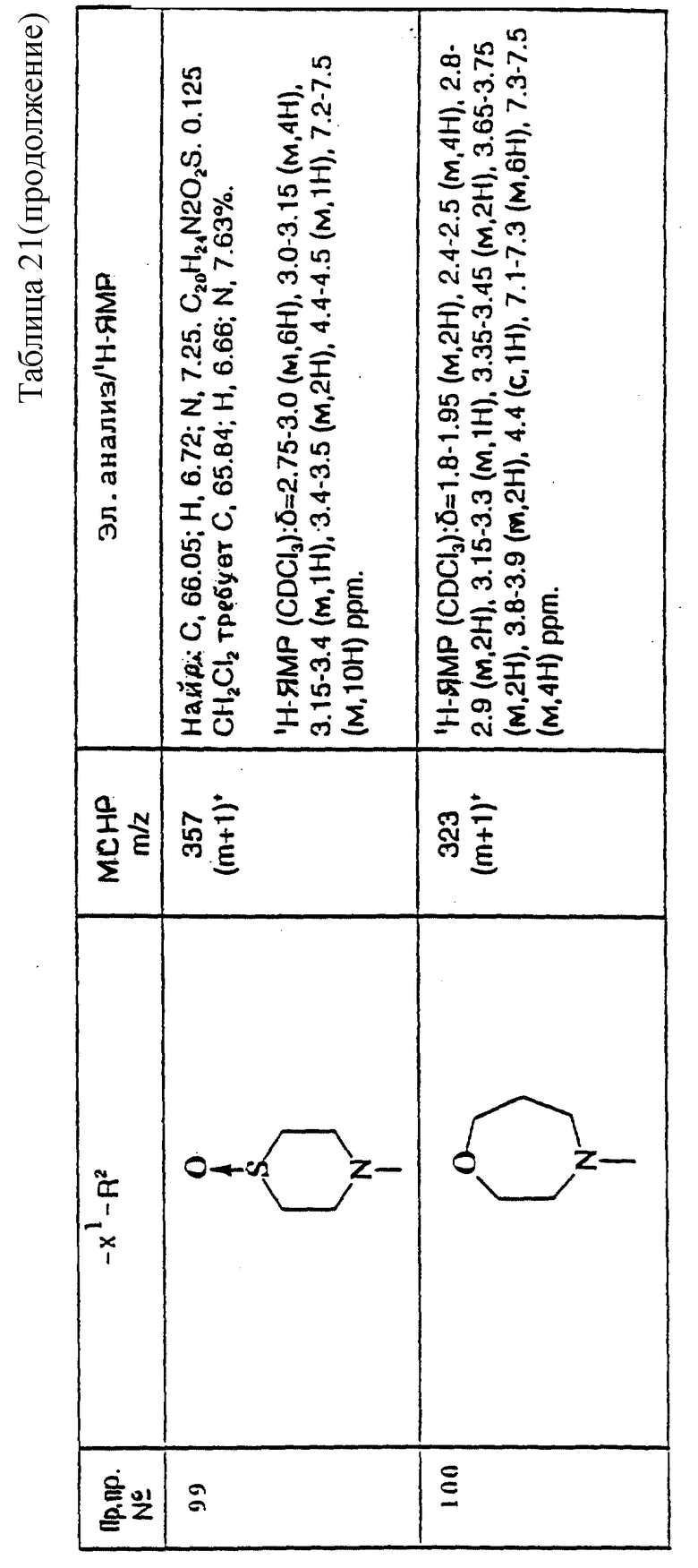
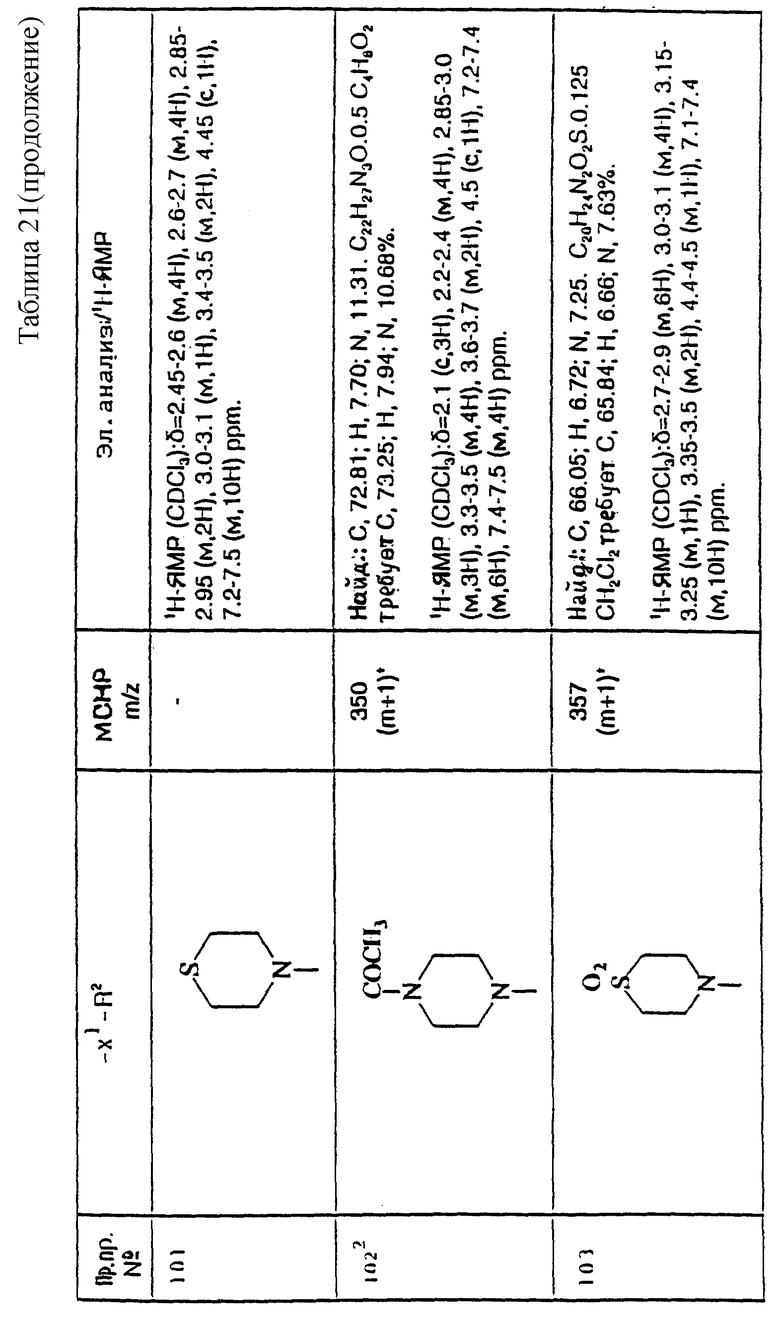
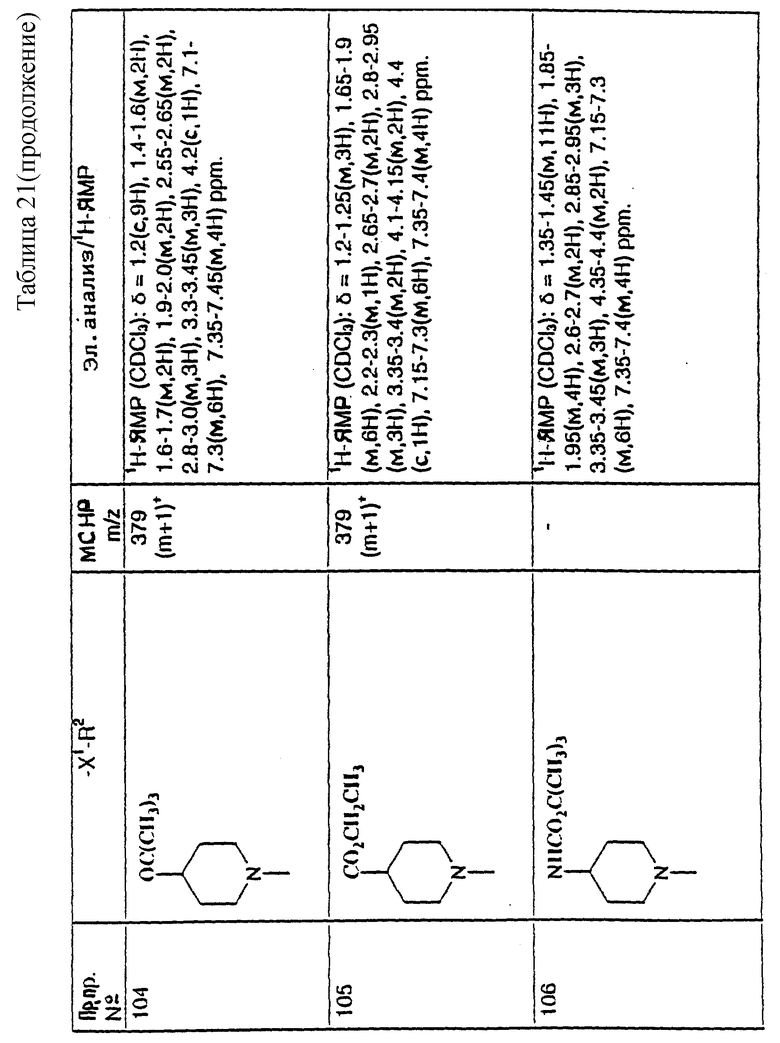
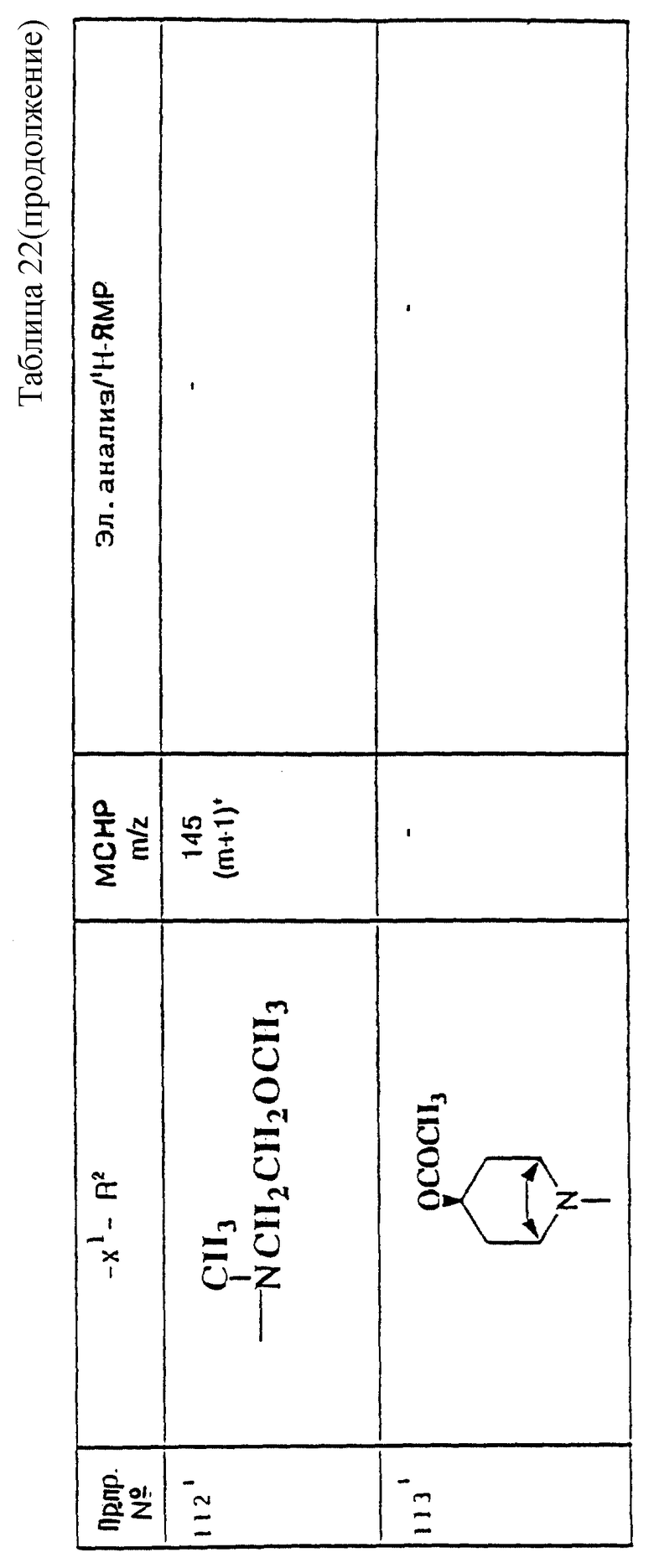
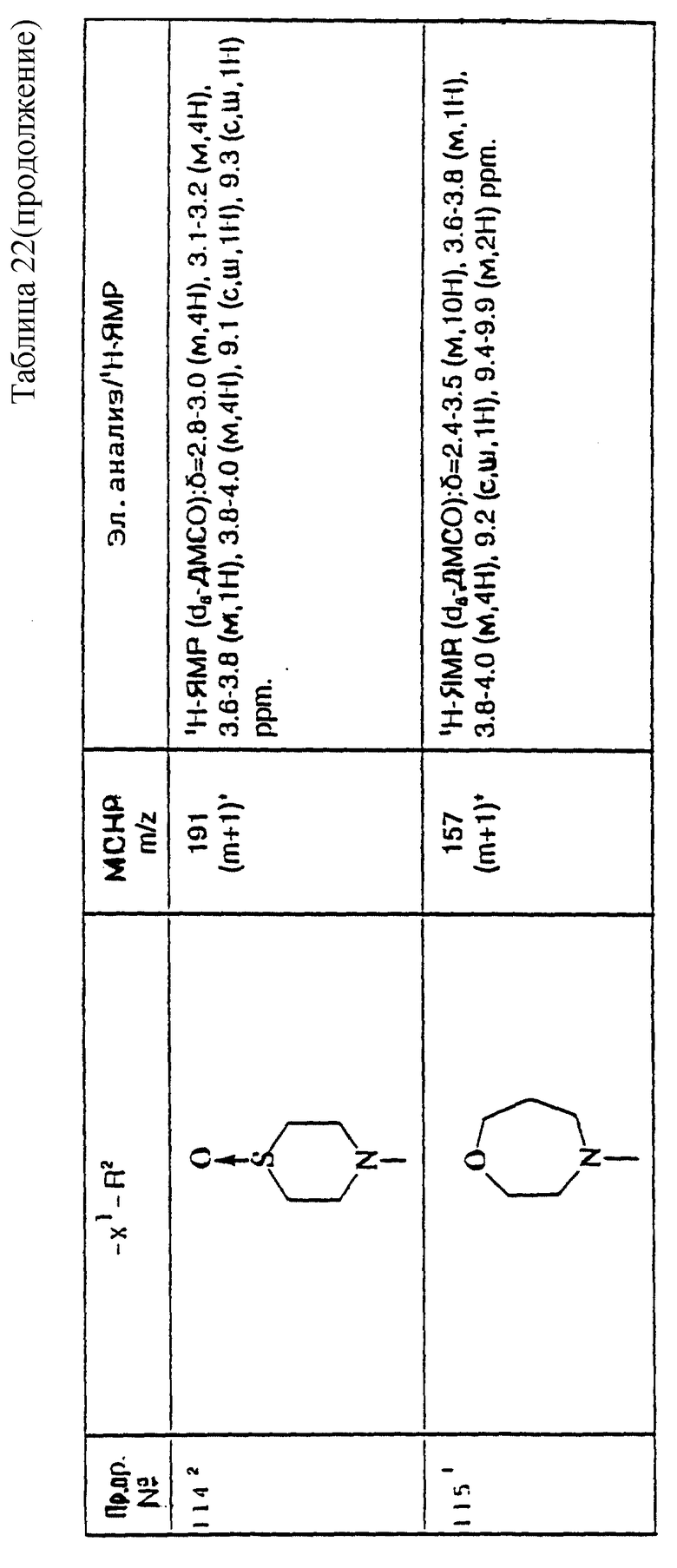
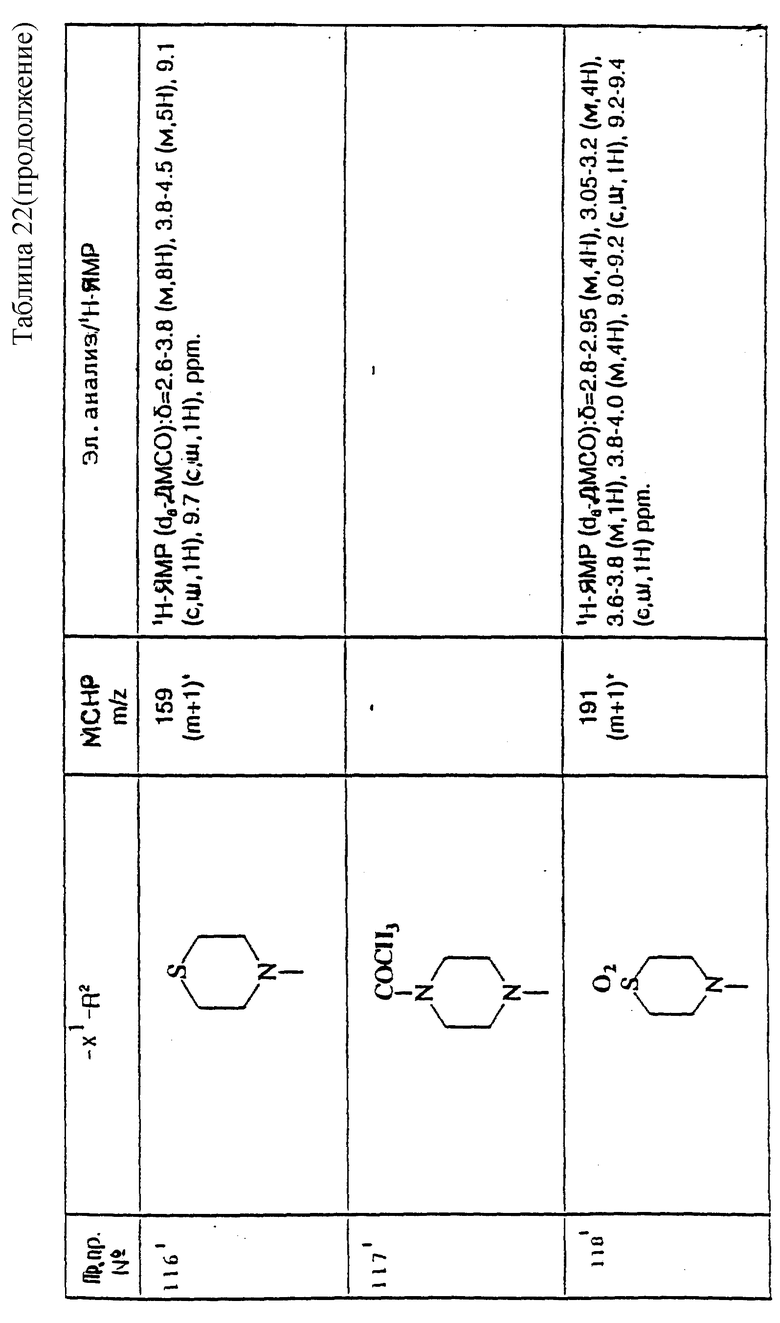
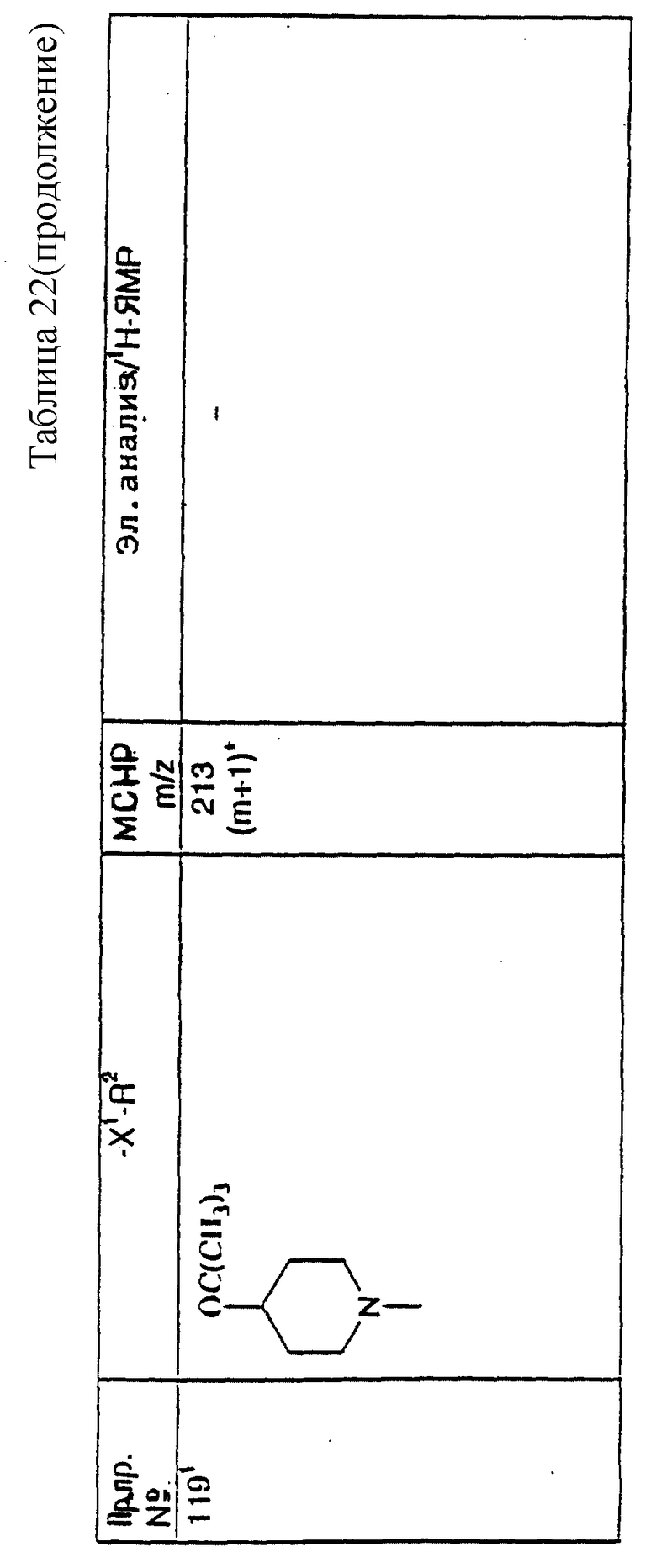
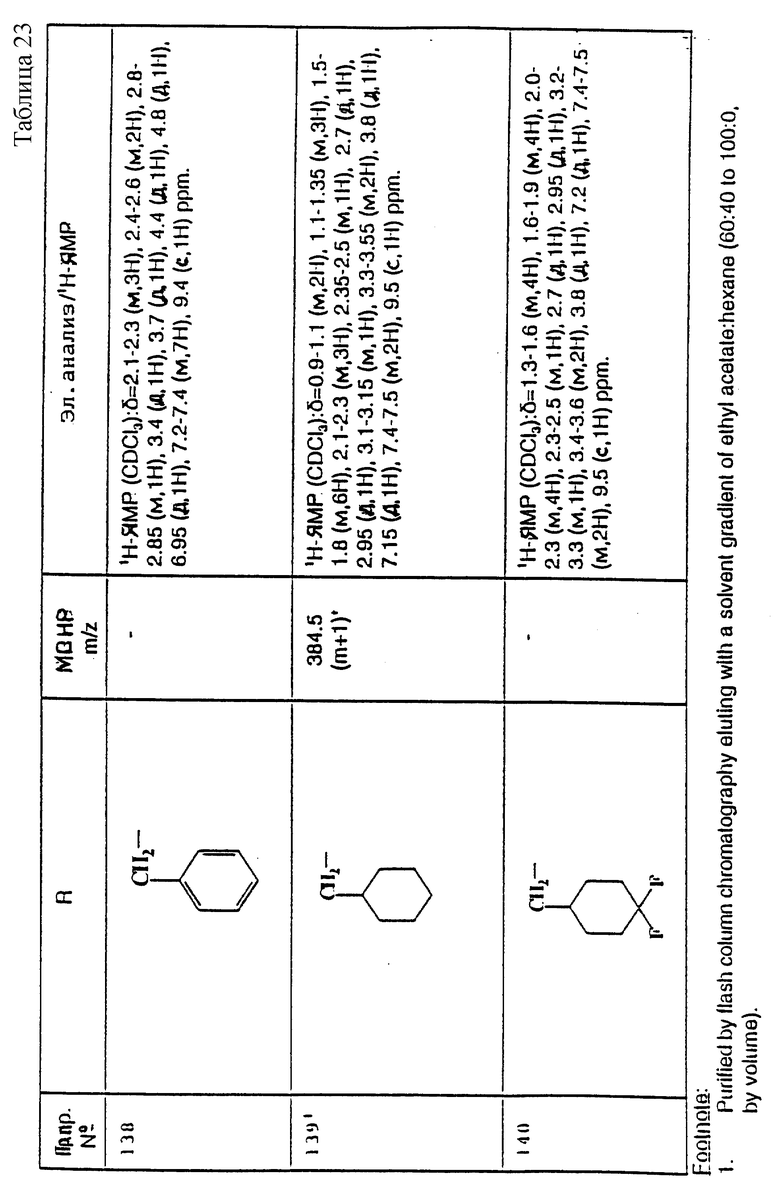
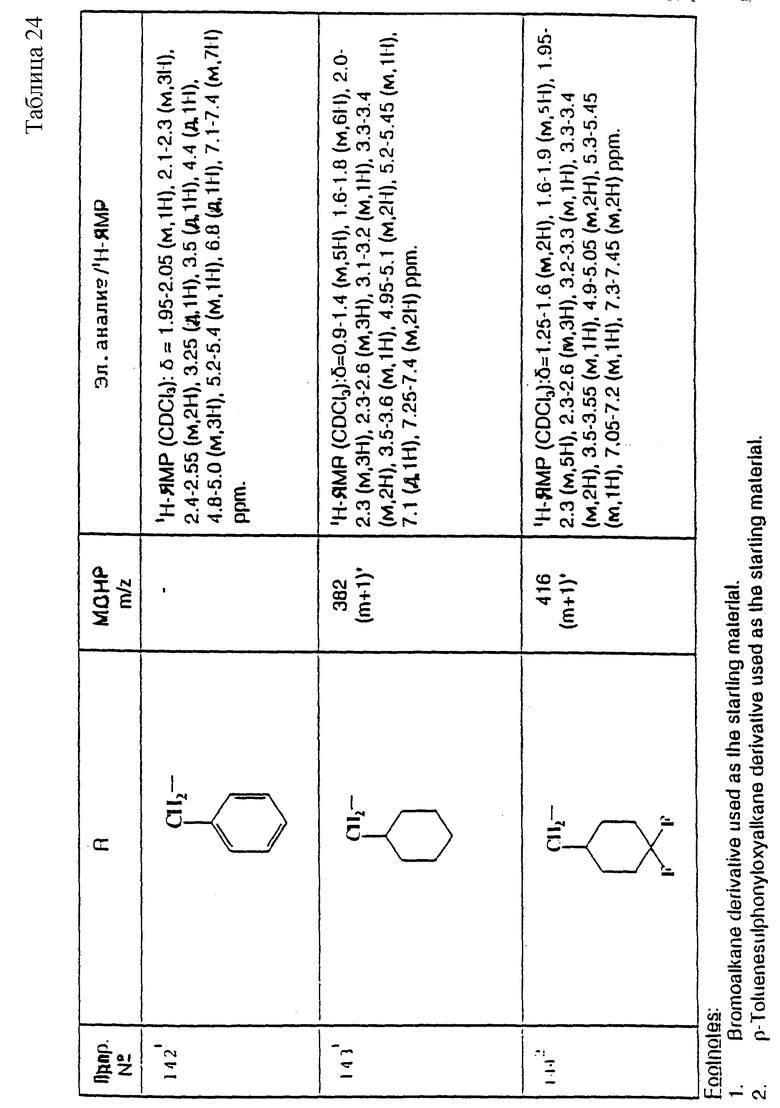
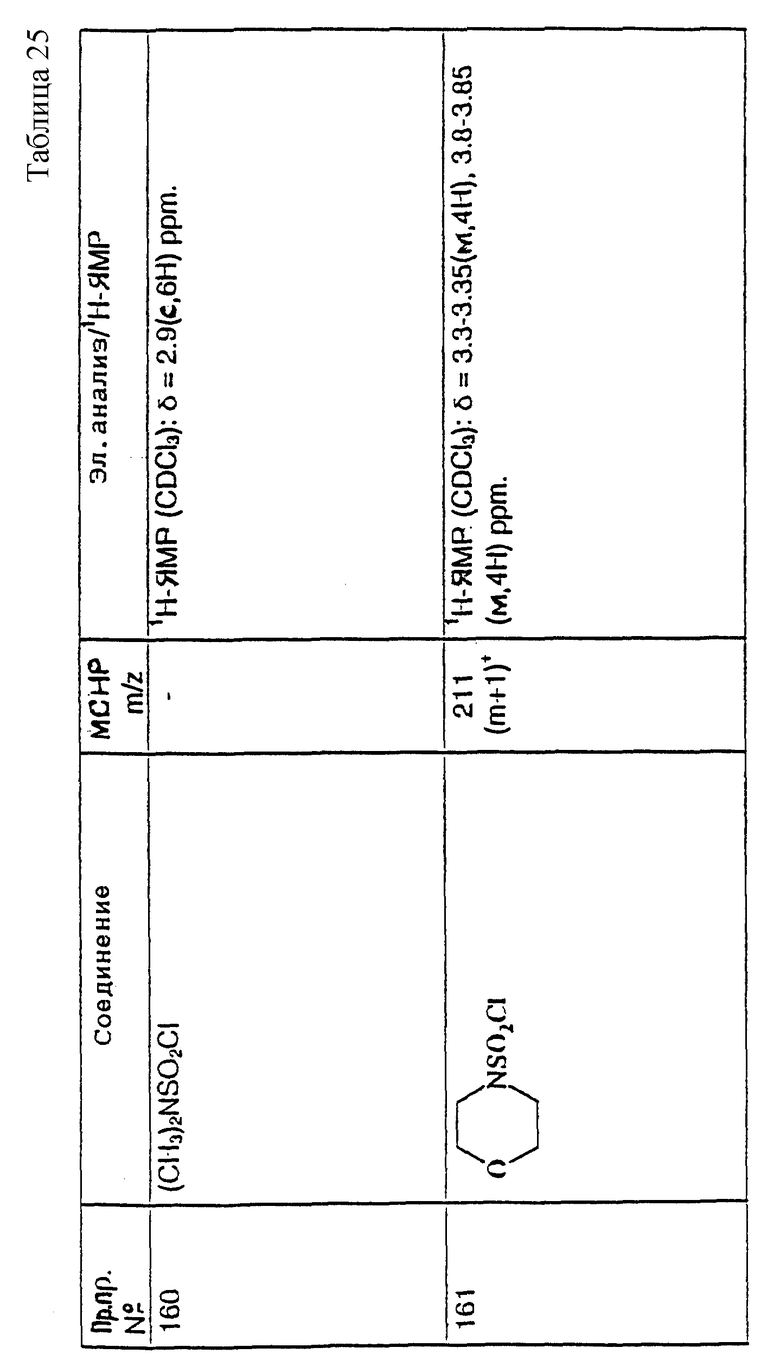
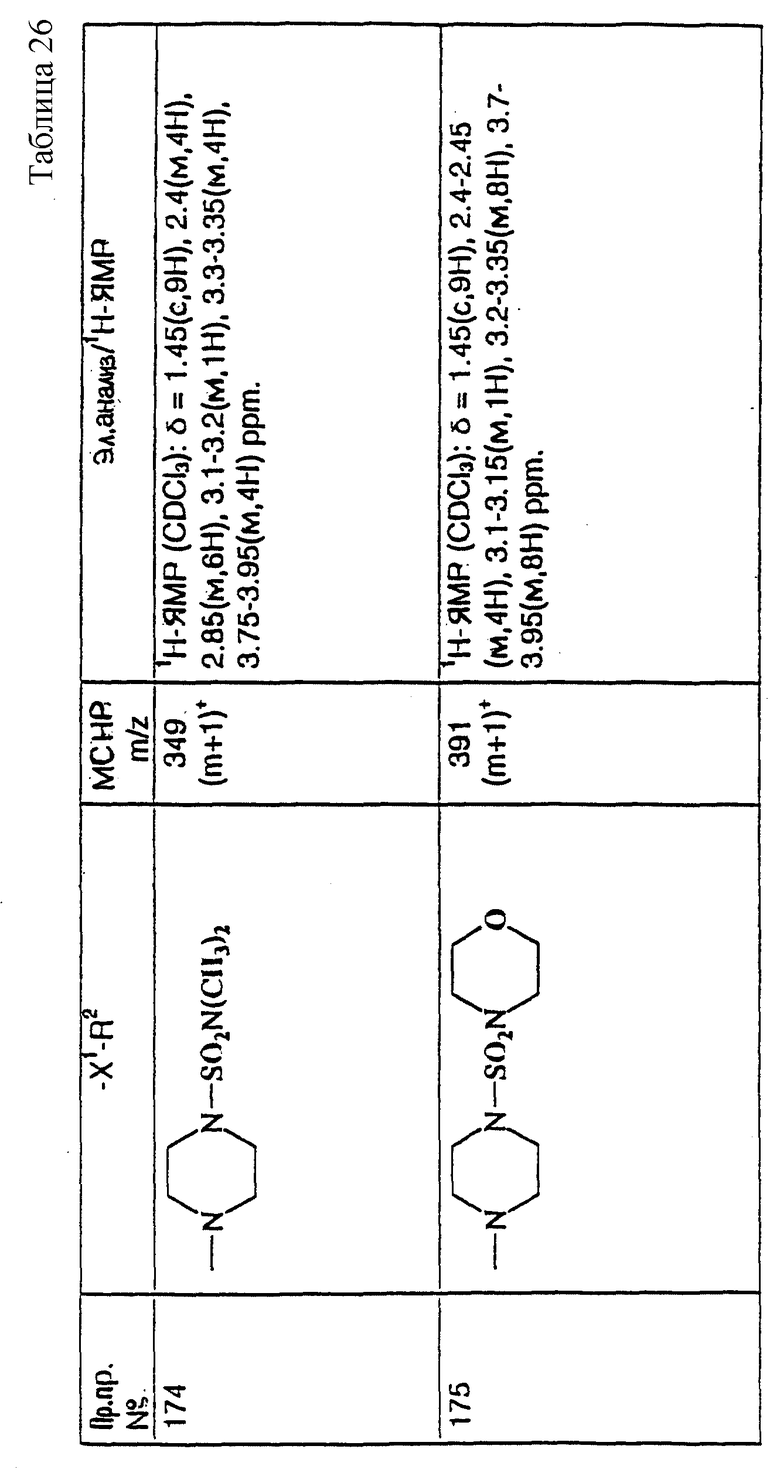
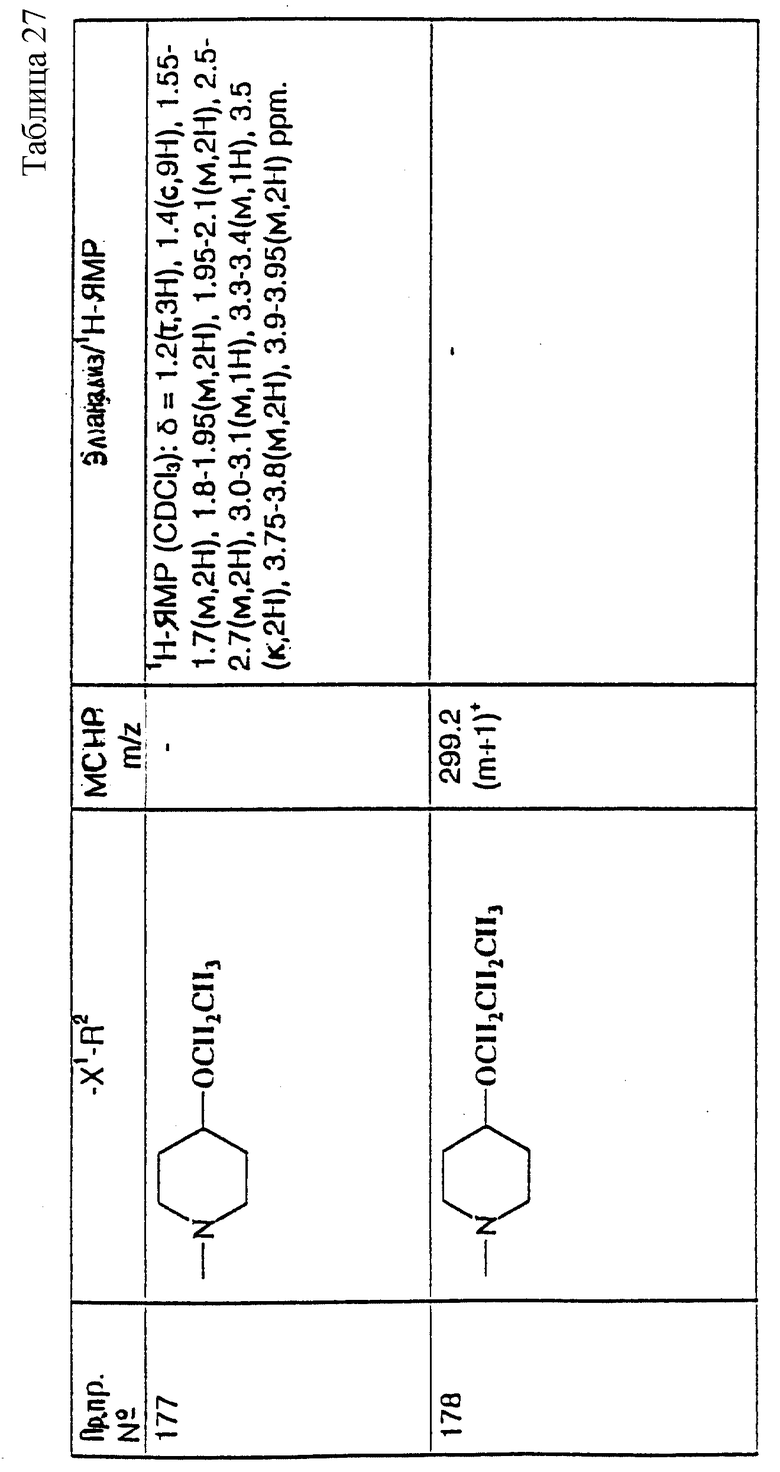
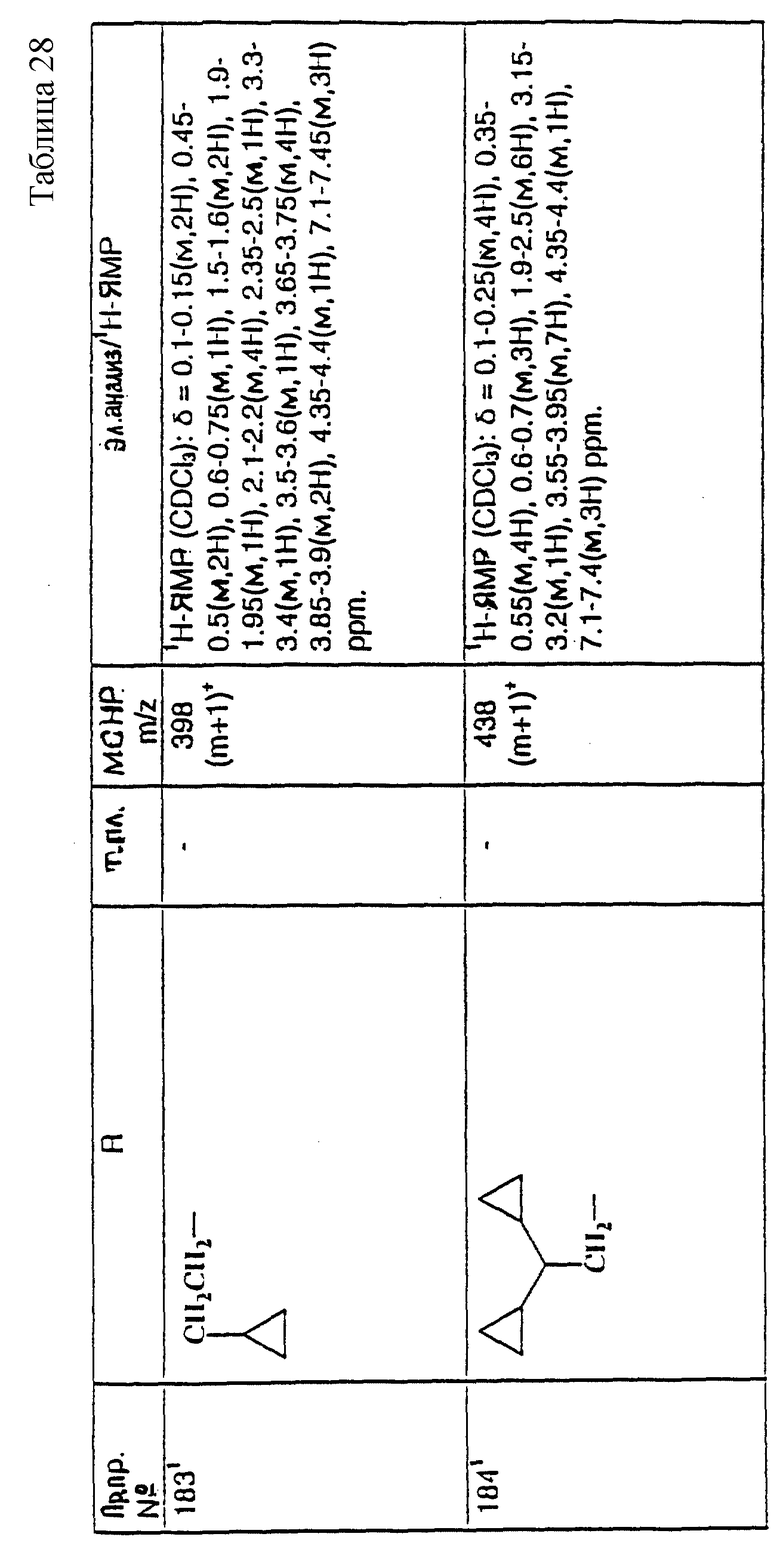


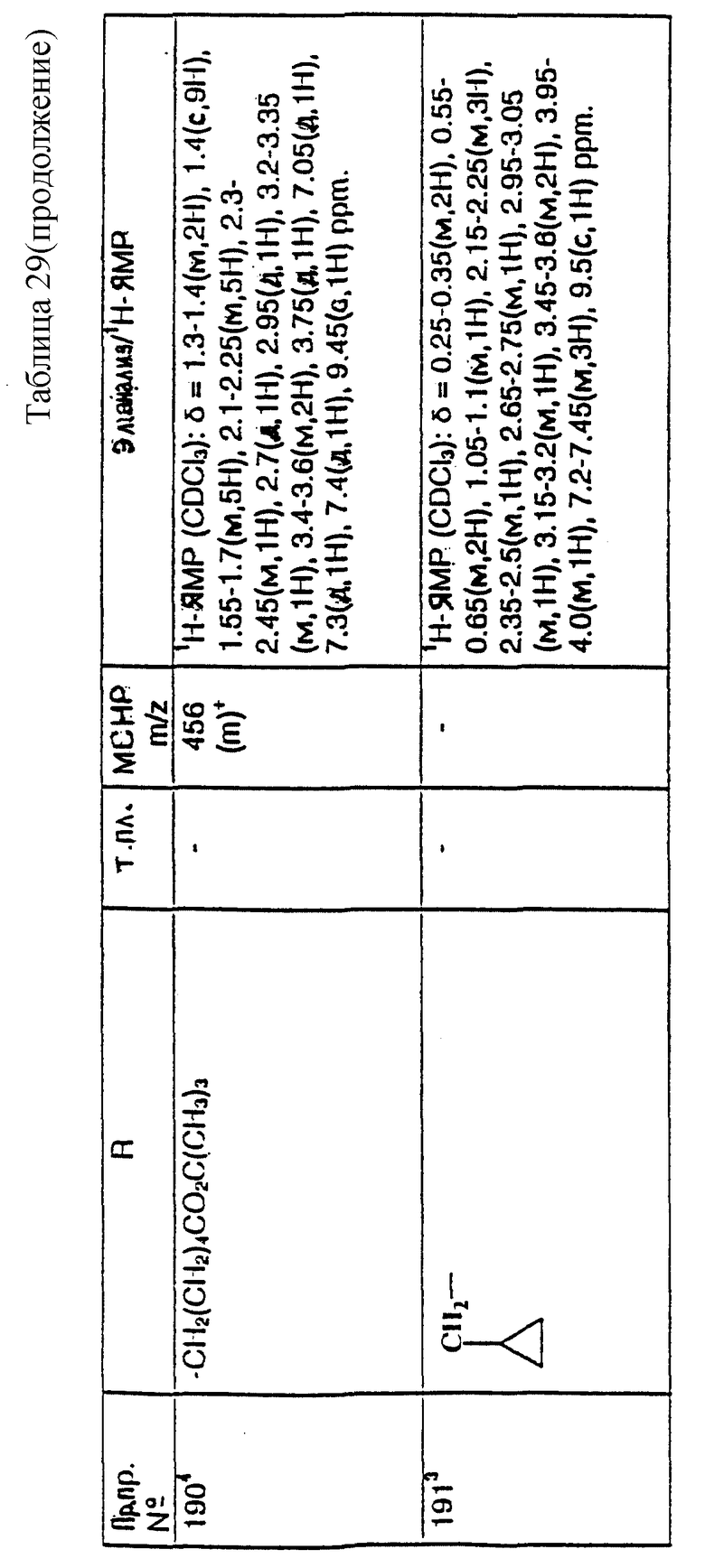
Изобретение относится к производным (азетидин-1-илалкил)лактамов формулы (I) и их фармацевтически приемлемым солям, где R - (C1-C6)-алкил, необязательно замещенный -COOH, -COO((C1-C4)-алкилом), (C3-C7)-циклоалкилом, арилом или гет1, и (C3-C7)-циклоалкил, необязательно замещенный 1-2 заместителями, выбранными из (C1-C4)-алкила и фтора; R1 - фенил, необязательно замещенный 1-2 галозаместителями; R2 - -CONR3R4, -CONR5((C3-C7)-циклоалкил), -NR3R4, гет3 или группа формул (а), (в), (с); X - (C1-C4)-алкилен; X1 - направленная связь, X2 - направленная связь или CO; m = 1; используемых при лечении заболеваний посредством продуцирования антагонистического действия на тахикинин, действующий в человеческом NK1-, NK2- и NK3-рецепторе или в их сочетаниях. Предложены также промежуточные соединения, используемые при их получении, фармацевтическая композиция и способ лечения. 4 с. и 11 з.п.ф-лы, 29 табл.
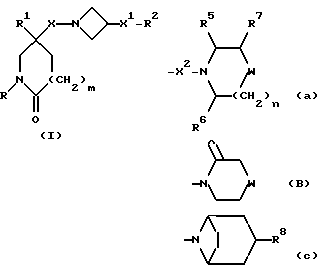
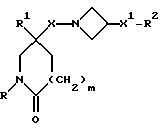
или их фармацевтически приемлемые соли,
где R - (C1 - C6)-алкил, необязательно замещенный COOH, -COO((C1 - C4)-алкилом), (C3 - C7)-циклоалкилом, арилом или Гет1, и (C3 - C7)-циклоалкил, необязательно замещенный 1 или 2 заместителями, каждый из которых выбирается независимо из (C1 - C4)-алкила и фтора;
R1 - фенил, необязательно замещенный 1 или 2 галозаместителями;
R2 - -CONR3R4, -CONR5(C3 - C7-циклоалкил), -NR3R4, Гет3 или группа формулы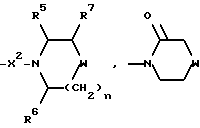
или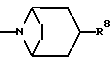
R3 и R4 - каждый и независимо выбирается среди H и (C1 - C4)-алкила, (C1 - C4)-алкила, замещенного гидроксильной группой или (C1 - C4)-алкоксигруппой;
R5 и R6 каждый и независимо выбирается среди H, (C1 - C4)-алкила, необязательно замещенного фтором, и (C3 - C7)-циклоалкил-(C1 - C4)-алкила;
R7 - H, гидроксильная группа или фенил;
R8 - гидроксильная группа или (C2 - C5)-алканоилоксигруппа;
X - (C1 - C4)-алкилен;
X1 - направленная связь;
X2 - направленная связь или CO;
W - метилен, CH((C1 - C4)-алкоксигруппа), CHCO2H, CHCO2((C1 - C4)-алкил), CH(бензоксазол-2-ил), CHNR5R6, CHNR5COR5, CHNR5(SO2 C1 - C4 алкил), CHNR5COO(C1 - C4 алкил), O, S(O)p, NR5, NSO2 (C1 - C4 алкил), NSO2NR5R6, NSO2 (морфолино)группа, CH(OH), NCONR5R6, NCOR5, NCO(арил) или NCO2((C1 - C4)-алкил);
m = 1;
n = 1 или 2, когда W является иным, чем метилен, и n = 0 или 1, когда W - метилен;
p = 0, 1 или 2;
термин "арил", использованный при определении R, W означает фенил, необязательно замещенный 1 или 2 заместителями, независимо выбранными из (C1 - C4)-алкила, галогена, -OR5, фтор (C1 - C4)-алкила, (C2 - C5)-алканоила, -SO2NR5R6 или фенила;
термин "Гет1", использованный при определении R, означает 5- или 6-членную циклическую гетероарильную группу, содержащую либо 1, либо 2 гетероатома азота;
термин "Гет3", использованный при определении R2, означает N-связанную 5-членную циклическую гетероарильную группу, содержащую 1 или 2 гетероатомов азота.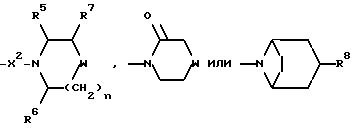
где R3 и R4 каждый и независимо выбирают среди (C1 - C4)-алкила и (C1 - C4)-алкила, замещенного гидроксильной группой или (C1 - C4)-алкоксигруппой; R5 и R6 каждый и независимо выбирают среди H, (C1 - C4)-алкила, необязательно замещенного фтором, и (C3 - C7)-циклоалкил-(C1 - C4)-алкила; R7 - H, гидроксильная группа или фенил; R8 - гидроксильная группа или (C2 - C5)-алканоилоксигруппа; W - метилен, CH(OH), CH((C1 - C4)-алкоксигруппа), CHCO2H, CHCO2((C1 - C4)алкил), CH(бензоксазол-2-ил), CHNR5R6, CHNR5COR5, CHNR5(SO2(C1 - C4)-алкил), CHNR5 COO (C1 - C4)-алкил), O, S(O)p, NR5, NSO2(C1 - C4)-алкил), NSO2NR5R6, NSO2(морфолиногруппа), NCONR5R6, NCOR5, NCO(арил) или NCO2((C1 - C4)-алкил); n = 1 или 2, когда W является иным, чем метилен, и n = 0 или 1, когда W представляет собой метилен, и p = 0, 1 или 2; и X, X1, X2, m, арил, Гет1 и Гет3 имеют значения по п.1.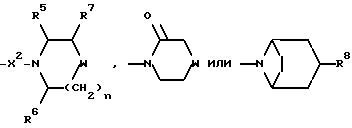
где R3 и R4 каждый и независимо выбирается среди метила и (C1 - C4)-алкила, замещенного гидроксильной группой или метоксигруппой; R5 и R6 каждый независимо выбирается среди H, метила, трифторметила и циклопропилметила; R7 - H, гидроксильная группа или фенил, R8 - гидроксильная группа или ацетилоксигруппа; W - метилен, CH(OH), CHOCH3, CHOCH2CH3, CHO(CH2)2CH3, CHOC(CH3)3, CHCO2H, CHCO2CH3, CHCO2CH2CH3, CH(бензоксазол-2-ил), CHNH2, CHNHCH2(циклопропил), CHNHCOCH3, CHNHSO2CH3, CHNHCO2C(CH3)3, O, S(O)p, NH, NCH3, NCH2(циклопропил), NSO2CH3, NSO2NH2, NSO2NHCH3, NSO2N(CH3)2,
NSO2(морфолиногруппа), NCONH2, NCONHCH3, NCOCH3, NCOCF3, NCO(фенил) или NCO2C(CH3)3; n = 1 или 2, когда W является иным, чем метилен, и n = 0 или 1, когда W - метилен, и p = 0, 1 или 2; и X, X1, X2 и m имеют значения по п.2.
(I) R - циклопропилметил, R1 - 3,4-дихлорфенил, R2 - морфолиногруппа, X - -CH2CH2-, X1 - направленная связь, m = 1;
(II) R - 4,4-дифторциклогексилметил; R1 3,4-дихлорфенил; R2 - морфолиногруппа; X - -CH2CH2-; X1 - направленная связь и m = 1;
(III) R - 4,4-дифторциклогексилметил, R1 - 3,4-дихлорфенил; R2 - 4-аминопиперидин-1-ил; X - -CH2CH2-, X1 - направленная связь и m = 1;
(IV) R - 4,4-дифторциклогексилметил; R1 - 3,4-дихлорфенил; R2 - 4-гидроксипиперидин-1-ил; X - -CH2CH2-; X1 - направленная связь и m = 1;
(V) R - 2-циклопропилэтил; R1 - 3,4-дихлорфенил; R2 - морфолиногруппа; X - -CH2CH2-; X1 - направленная связь и m = 1;
(VI) R - циклопропилметил; R1 - 3,4-дихлорфенил; R2 - 4-карбоксипиперидин-1-ил; X - -CH2CH2-; X1 - направленная связь и m = 1, или
(VII) R - циклогексилметил; R1 - 3,4-дихлорфенил; R2 - 4-карбоксипиперидин-1-ил; X - -CH2CH2-; X1 - направленная связь и m = 1;
или любое такое соединение с (S)-стереохимией в положении присоединения групп X и R1 к лактамному кольцу, или любая его фармацевтически приемлемая соль.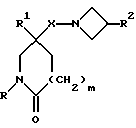
или его фармацевтически приемлемая соль,
где R - (C1 - C6)-алкил, необязательно замещенный (C3 - C7)-циклоалкилом, арилом или Гет1, причем упомянутый циклоалкил необязательно замещен 1 или 2 заместителями, каждый из которых выбирается независимо среди (C1 - C4)-алкила и фтора;
R1 - фенил, необязательно замещенный 1 или 2 галозаместителями;
R2 - -CONR3R4, -CONH((C3 - C7)-циклоалкил), -CON((C1 - C4)-алкил)-((C3 - C7)-циклоалкил), -NR3R4, Гет3 или группа формулы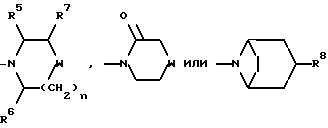
R3 и R4 каждый и независимо выбирается среди H, (C1 - C4)-алкила и (C1 - C4)алкила, замещенного гидроксильной группой или (C1 - C4)-алкоксигруппой;
R5 и R6 каждый и независимо выбирается среди H и (C1 - C4)-алкила, замещенного фтором;
R7 - H, гидроксигруппа или фенил;
R8 - гидроксильная группа или (C2 - C5)-алканоилоксигруппа;
X - (C1 - C4)-алкилен;
W - метилен, CH(OH), CH((C1 - C4)-алкоксигруппу), CHNH((C1 - C4)-алкил), CHN(C1 - C4)-алкил)2, CHNHSO2((C1 - C4)-алкил), CHN((C1 - C4)-алкил) (SO2((C1 - C4)-алкил)), O, S(O)p, NH, N((C1 - C4-алкил), NSO2((C1 - C4)-алкил), NSO2NH2, NSO2NH((C1 - C4)-алкил), NSO2N((C1 - C4)-алкил)2, NCONH2, NCONH((C1 - C4)-алкил), NCON((C1 - C4)-алкил)2 или NCO2((C1 - C4)-алкил);
m = 1;
n = 1 или 2, когда W является иным, чем метилен, и n = 0 или 1, когда W - метилен;
p = 0, 1 или 2;
термин "арил", использованный при определении R, W означает фенил, необязательно замещенный 1 или 2 заместителями, каждый из которых выбирается независимо среди (C1 - C4)-алкила, галогена, (C1 - C4)-алкоксигруппы, фтор(C1 - C4)-алкила, фтор(C1 - C4)-алкоксигруппы, (C2 - C5)-алканоила, -SO2NH2, -SO2NH((C1 - C4)-алкила), -SO2N((C1 - C4)-алкил)2 и фенила;
термин "Гет1", использованный при определении R, означает 5- или 6-членную циклическую гетероарильную группу, содержащую либо 1, либо 2 гетероатома азота;
термин "Гет3", использованный при определении R2, означает N-присоединенную 5-членную циклическую гетероарильную группу, содержащую 1 или 2 гетероатома азота.
(a)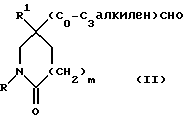
в которой R, R1 и m имеют значения по п.1;
(b)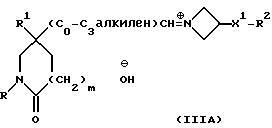
в которой X1, R, R1, R2 и m имеют значения по п.1;
(с)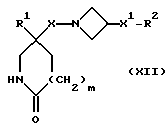
в которой X, X1, R1, R2 и m имеют значения по п.1;
(d)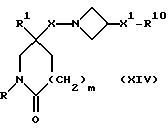
где R10 - группа формулы -NZ4R4,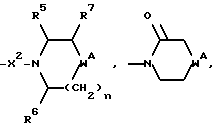
где WA - NZ4 или CHNZ4R5;
X, X1, X2, R, R1, R4 - R7, m и n имеют значения по п.1;
Z4 - защитная группа;
(e)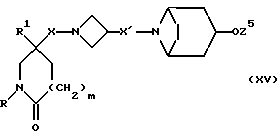
где Z5 - защитная группа;
X, X1, R, R1 и m имеют значения по п.1.
Приоритет по признакам и пунктам:
09.08.94 по пп.1 - 15 (кроме соединения, где R - циклопропилметил, R1 - 3,4-дихлорфенил, X - -CH2CH2-; -X1-R2 - 4-аминосульфонилпиперазин-1-ил; m = 1).
| Устройство для обработки поверхностей деталей | 1974 |
|
SU512901A2 |
| СПОСОБ ВУЛКАНИЗАЦИИ ЛИНЕЙНЫХ НИЗКОМОЛЕКУЛЯРНЫХ ПОЛИОРГАНОСИЛОКСАНОВ | 0 |
|
SU333174A1 |
| Способ получения производных 2-имидазолидинона | 1973 |
|
SU548211A3 |
| МАШКОВСКИЙ М.Д | |||
| Лекарственные средства | |||
| - М.: Медицина, 1985, ч | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Ускоритель для воздушных тормозов при экстренном торможении | 1921 |
|
SU190A1 |
| САТОСКАР Р.С | |||
| и др | |||
| Фармакология и фармакотерапия | |||
| - М.: Медицина, 1986, т | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Контрольный стрелочный замок | 1920 |
|
SU71A1 |
Авторы
Даты
2000-06-10—Публикация
1995-07-29—Подача