Изобретение относится к области медицины и может быть использовано как средство, стимулирующее функциональную активность нейронов, при заболеваниях и травмах центральной и периферической нервной системы.
Известны лекарственные средства - пирацетам, аминалон, пиридитол, пантогам, натрия оксибутират и другие (1), стимулирующие окислительно-восстановительные процессы, усиливающие утилизацию глюкозы, улучшающие регионарный кровоток в тканях мозга. Указанные эффекты приводят к повышению устойчивости нейронов к гипоксии.
Недостатком этих препаратов является то, что они только стимулируют синтез нейротрофических факторов, а сами не обладают нейротрофической активностью (2). Кроме этого, эти препараты не лишены побочных эффектов и противопоказаний. Поскольку потенциальные возможности внутриклеточного биосинтеза у поврежденных нейронов невелики, представляется более целесообразным стимулировать регенерацию путем введения естественных нейротрофических факторов.
Известен препарат церебролизин, представляющий собой безбелковый гидролизат мозга, состоящий из свободных аминокислот и низкомолекулярных пептидов (3).
Препарат повышает эффективность аэробного энергетического метаболизма, улучшает внутриклеточный синтез белка, обладает нейропротективным и нейротрофическим действием, оказывает положительное влияние при нарушениях когнитивных функций.
Недостатком этого препарата является то, что его нейротрофические эффекты менее выражены, чем у естественных нейротрофических факторов. Использование препарата не позволяет достигнуть существенного восстановления анатомической структуры и функциональной активности нейронов головного и спинного мозга после их повреждения (4, 5, 6). При применении церебролизина возможны побочные эффекты. Препарат противопоказан при острой почечной недостаточности.
Известны нейротрофические факторы, представляющие собой низкомолекулярные белки (15-30 кД) и синтезируемые клеточными элементами центральной нервной системы: фактор роста нейронов, производный из мозга нейротрофический фактор, нейротрофины -3, -4, -5, основной и кислый факторы роста фибробластов, эпидермальный фактор роста, астроцитарный фактор S-100; протеин, липопротеин (7, 8). Добавление малых доз этих веществ в культуры нейронов обеспечивает жизнедеятельность клеток, возможность образования и роста нейритов через стимуляцию биосинтеза РНК, ДНК, белка. Нейротрофические факторы необходимы как для выживания и дифференцировки нейронов во время эмбриогенеза, так и для поддержания морфофункциональных свойств зрелых клеток. Однако экспериментально установлено, что эффективность их применения ограничена нейропротективным действием, а нейротрофичеcкие эффекты проявляются в поздние сроки.
Известно, что в центральной нервной системе существуют эндогенные пептидные субстанции, которые служат несущими сигнал агентами в межнейрональной или нейроэффекторной передаче и могут функционировать как нейрогормоны, нейротрансмиттеры или нейромодуляторы (9, 10, 11). Эти эндогенные субстанции - нейропептиды - высвобождаются из коммуникационных нейрональных элементов таким образом, что структура-мишень воспринимает их как информацию. Установлено, что нейропептиды служат средством интегрального модулирования функций центральной нервной системы - репаративных процессов, памяти, двигательной активности, ощущения боли и удовольствия и др.
Заявляемое изобретение направлено на получение нового биологически активного соединения пептидной природы, способного стимулировать функциональную активность нейронов.
Заявляемое пептидное соединение - тетрапептид - структурных аналогов не имеет.
Согласно изобретению заявляется тетрапептид L-аланил-L-глутамил-L-аспарагил-L-пролин (L-Ala-L-Glu-L-Asp-L-Pro).
Тетрапептид L-аланил-L-глутамил-L-аспарагил-L-пролин со следующей аминокислотной последовательностью: L-Ala-L-Glu-L-Asp-L-Pro, отвечающий изобретению, проявляет биологическую активность, а именно стимулирует функциональную активность нейронов центральной и периферической нервной системы за счет нормализации метаболических процессов, стимуляции показателей системы антиоксидантной защиты, улучшения электрофизиологических характеристик.
Тетрапептид получают классическим методом пептидного синтеза в растворе (9).
Стимулирующее действие тетрапептида L-Ala-L-Glu-L-Asp-L-Pro на функциональную активность нейронов выявлено при его экспериментальном изучении. Изучение биологической активности проводили на эксплантатах нервной ткани, исследуя тканеспецифическое действие тетрапептида, на крысах, изучая показатели антиоксидантной защиты и метаболизм серотонина в головном мозге, церебропротекторное действие при токсических и травматических воздействиях.
Согласно изобретению, фармакологическое средство, стимулирующее функциональную активность нейронов, содержит в качестве активного начала эффективное количество тетрапептида формулы L-аланил-L-глутамил-L-аспарагил-L-пролин (L-Ala-L-Glu-L-Asp-L-Pro) или его солей.
Согласно изобретению фармакологическое средство, стимулирующее функциональную активность нейронов, может содержать соли по аминогруппе (ацетат, гидрохлорид, оксалат) или по карбоксильным группам (соли металлов - натрия, калия, кальция, лития, цинка, магния, а также других органических и неорганических катионов - аммония, триэтиламмония).
Согласно изобретению фармакологическое средство предназначено для парентерального, интраназального или перорального применения.
Заявляемое фармакологическое средство, стимулирующее функциональную активность нейронов, способно восстанавливать метаболизм и рост поврежденных структур нервной ткани.
Понятие "фармакологическое средство", используемое в данной заявке, подразумевает использование любой лекарственной формы, содержащей тетрапептид или его соли, которые могут найти профилактическое и/или лечебное применение в медицине в качестве средства для восстановления структурно-функциональной целостности нервной ткани.
Понятие "эффективное количество", используемое в данной заявке, подразумевает использование того количества активного начала, которое в соответствии с его количественными показателями активности и токсичности, а также на основании знаний специалиста должно быть эффективным в данной лекарственной форме.
Понятие "фармацевтическая композиция", используемое в данной заявке, подразумевает различные лекарственные формы препарата.
Для получения фармацевтических композиций, отвечающих изобретению, предлагаемый тетрапептид или его фармацевтически приемлемые производные смешиваются как активный ингредиент с фармацевтическим носителем согласно принятым в фармацевтике способам компаундирования.
Носитель может иметь различные формы, которые зависят от лекарственной формы препарата, желаемой для введения в организм, например парентерального, интраназального или перорального.
При изготовлении композиций в предпочтительной дозированной форме для перорального применения могут использоваться любые известные фармацевтические компоненты.
Для парентерального (интраназального) введения носитель обычно включает стерильную воду, хотя могут быть включены другие ингредиенты, способствующие стабильности, или для сохранения стерильности.
Согласно изобретению способ включает профилактическое или лечебное введение пациенту, заявляемого фармакологического средства в дозах 0,01 - 100 мкг/кг массы тела по крайней мере один раз в день в течение периода, необходимого для достижения терапевтического эффекта, 10-40 дней в зависимости от характера течения патологического процесса.
Согласно изобретению тетрапептид активен при введении его в дозах 0,01-100 мкг/кг массы тела, хотя могут быть использованы и более низкие (высокие) дозы в зависимости от характера течения патологического процесса.
Изобретение иллюстрируется примером синтеза тетрапептида формулы L-аланил-L-глутамил-L-аспарагил-L-пролин (L-Ala-L-Glu-L-Asp-L-Pro) (пример 1), примерами испытания токсичности и биологической активности тетрапептида (примеры 2, 3, 4, 5, 6, 7, 8, 9), а также примерами результатов клинического применения тетрапептида, демонстрирующими его фармакологические свойства и подтверждающими возможность достижения профилактического и/или лечебного эффекта (примеры 10, 11).
Пример 1. Синтез тетрапептида L-Ala-L-Glu-L-Asp-L-Pro.
1. Название соединения: L-аланил-L-глутамил-L-аспартил-L-пролин.
2. Структурная формула:
H-Ala-Glu-Asp-Pro-OH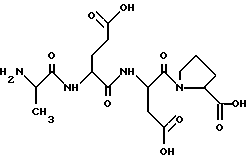
З.Брутто-формула без противоиона: C17H26N4O9.
4. Молекулярный вес без противоиона: 430,41.
5. Противоион: ацетат.
6. Внешний вид: белый аморфный порошок без запаха.
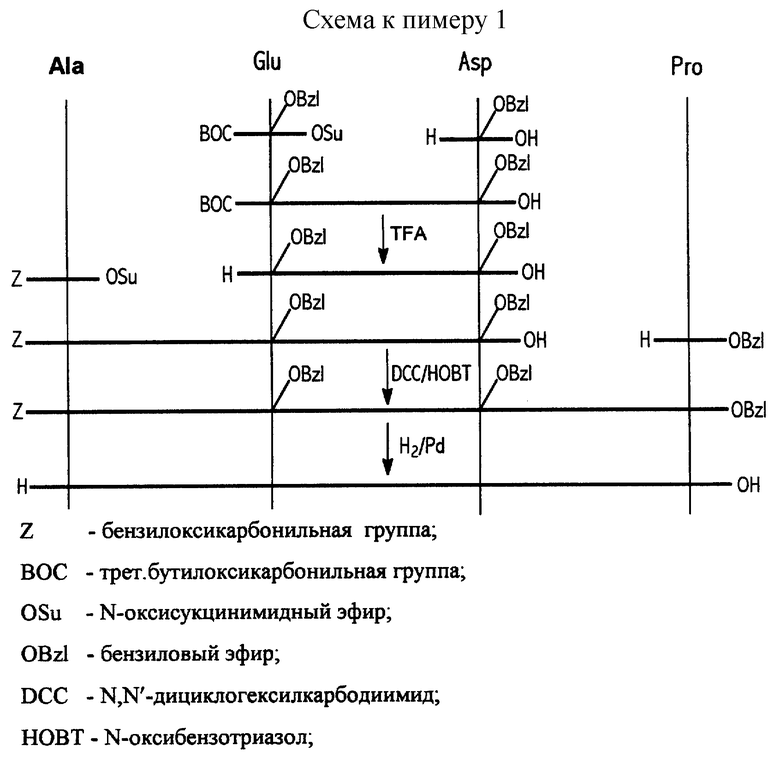
7. Способ синтеза: пептид получен классическим методом синтеза в растворе по схеме, приведенной в конце описания.
В качестве растворителя использовали N,N'-диметилформамид, при введении аспарагиновой кислоты использовали защиту α- COOH- группы солеобразованием с триэтиламином. Деблокирование ВОС-защитной группы проводили раствором трифторуксусной кислоты (TFA), Z-защитной группы каталитическим гидрогенолизом. Выделение и очистка препарата осуществлялись методом препаративной ВЭЖХ на колонке с обращенной фазой.
Характеристики готового препарата:
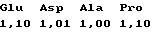
аминокислотный анализ:
содержание основного вещества 98,56% (по ВЭЖХ, 220 нм);
ТСХ - индивидуален, Rf=0,67 (ацетонитрил-уксусная кислота- вода 5:1:3);
содержание влаги 7%;
pH 0,001% раствора 4,24;
удельное оптическое вращение [α]
Пример синтеза.
1) BOC-Glu(OBzl)-Asp(OBzl)-OH (I), N-трет-бутилоксикарбонил-( γ- бензил)глутамил-( β- бензил)аспартат.
N-оксисукцинимидный эфир N-трет-бутилоксикарбонил-( γ- бензил)глутаминовой кислоты BOC-Glu(OBzl)-OSu 4,34 г (0,0100 моль) растворяют в 20 мл диметилформамида, добавляют триэтиламин 1,72 мл (0,0125 моль) и β- бензиласпартат 2,80 г (0,0125 моль). Перемешивают при комнатной температуре 24 час. Продукт высаживают 0,5 н. раствором серной кислоты (150 мл), экстрагируют в этилацетат (3х30 мл), промывают 0,5 н. раствором серной кислоты (2х20 мл), водой, 5%-ным раствором бикарбоната натрия (1х20 мл), водой, 0,5 н. раствором серной кислоты (2х20 мл), водой и сушат над безводным сульфатом натрия. Этилацетат фильтруют, упаривают в вакууме при 40oC, остаток сушат в вакууме над P2O5.
Получают масло 5,68 г (≈ 100%).
Rf = 0,42 (бензол-ацетон 2:1, пластинки ПТСХ-П-В-УФ Sorbfil, силикагель СТХ-1ВЭ 8-12 мкм, проявление УФ и хлор/бензидин).
2) TFA•H-Glu(OBzl)-Asp(OBzl)-OH (II), трифторацетат ( γ- бензил)глутамил-( β- -бензил)аспартата.
N-трет-бутилоксикарбонил-( γ- -бензил)глутамил-( β- бензил)аспартат (I) 5,68 г (≈ 0,01 моль) растворяют в 20 мл смеси дихлорметан-трифторуксусная кислота (3: 1). Через 2 часа растворитель упаривают в вакууме при 40oC, упаривание повторяют с новой порцией дихлорметана (2х10 мл), остаток сушат в вакууме над NaOH.
Получают масло 5,80 г (≈100%).
Rf=0,63 (н-бутанол-пиридин-уксусная кислота-вода, 15:10:3:12).
3) Z-Ala-Glu(OBzl)-Asp(OBzl)-OH (III), N-карбобензоксиаланил-( γ- бензил)глутамил-( β- бензил)аспартат.
Трифторацетат ( γ- бензил)глутамил-( β- бензил)аспартата (II) 5,65 г (0,01 моль) растворяют в 10 мл диметилформамида, добавляют триэтиламин 2,80 мл (0,02 моль) и N-оксисукцинимидный эфир N-карбобензоксиаланина 4,14 г (0,013 моль).
Смесь перемешивают 24 часа при комнатной температуре.
Продукт высаживают 0,5 н. раствором серной кислоты (150 мл), экстрагируют в этилацетат (3х30 мл), промывают 0,5 н. раствором серной кислоты (2х20 мл), водой, 5%-ным раствором бикарбоната натрия (1х20 мл), водой, 0,5 н. раствором серной кислоты (2х20 мл), водой и сушат над безводным сульфатом натрия. Этилацетат фильтруют, упаривают в вакууме при 40oC, остаток закристаллизовывают в системе этилацетат/гексан. Продукт отфильтровывают и сушат в вакууме над P2O5. Выход 4,10 г (66 %), т.пл. 154oC. Rf = 0,48 (бензол-ацетон, 1:1), Rf = 0,72 (н-бутанол-пиридин-уксусная кислота-вода, 15:10:3:12).
4) Z-Ala-Glu(OBzl)-Asp(OBzl)-Pro-OBzl (III), бензиловый эфир N-карбобензоксиаланил-( γ- -бензил)глутамил-( β- бензил)аспартилпролина.
HCl•H-Pro-OBzl, гидрохлорид бензилового эфира пролина 0,72 г (3 ммоль) суспендируют в 15 мл тетрагидрофурана и при перемешивании добавляют триэтиламин 0,4 мл (3 ммоль), далее через 5 мин N-карбобензоксиаланил-( γ- бензил)глутамил-( β- бензил)аспартат (III) 1,28 г (2 ммоль), N-оксибензотриазол 0,27 г (2 ммоль) и охлаждают смесь до 0oC. Затем добавляют охлажденный до 0oC раствор N,N'-дициклогексилкарбодиимида 0,42 г (2 ммоль) в 5 мл тетрагидрофурана, перемешивают смесь при этой температуре 2 часа и оставляют на ночь перемешиваться при комнатной температуре. Осадок дициклогексилмочевины отфильтровывают, растворитель упаривают в вакууме, остаток растворяют в 30 мл этилацетата и промывают раствор 1 н. раствором соляной кислоты, водой, 5%-ным раствором бикарбоната натрия, водой, 1 н. раствором соляной кислоты, водой и сушат над безводным сульфатом натрия. Растворитель упаривают в вакууме и продукт закристаллизовывают в системе этилацетат/гексан. Выход 1,50 г (90 %), т.пл. 125-128oC. Rf = 0,40 (бензол-ацетон, 2:1).
5) H-Ala-Glu-Asp-Pro-OH (IV), аланил-глутамил-аспартил-пролин.
Бензиловый эфир N-карбобензоксиаланил-( γ- бензил)глутамил-( β- бензил)аспартилпролина (III) 1,50 г гидрировали в системе метанол-вода-уксусная кислота (3:1:1) над катализатором Pd/C. Контроль за полнотой деблокирования вели в ТСХ-системах бензол-ацетон (2:1) и ацетонитрил-уксусная кислота-вода (5:1:3). По окончании реакции катализатор отфильтровывают, фильтрат упаривают в вакууме и остаток закристаллизовывают в системе вода/метанол. Продукт сушат в вакууме над KOH. Выход 0,66 г (86 %). Rf = 0,67 (ацетонитрил-уксусная кислота-вода, 5:1:3).
Для очистки 508 мг препарата растворяли в 4 мл 0,01%-ной трифторуксусной кислоты (pH пробы 2,23) и подвергали высокоэффективной жидкостной хроматографии на колонке с обращенной фазой 50х250мм Diasorb-130-C16T, 7 μ. Хроматограф Beckman System Gold, 126 Solvent Module, 168 Diode Array Detector Module. Условия хроматографирования A: 0,1% TFA; B: 50% MeCN/0,1% TFA, градиент B 0 ---> 16% за 240 мин. Объем пробы 5 мл, детекция при 215 нм, сканирование 190-600 нм, скорость потока 10 мл/мин. Отбирали фракцию 127-155 мин. Растворитель упаривали в вакууме при температуре не выше 40oC, упаривание многократно (5 раз) повторяли с 10 мл 10%-ного раствора уксусной кислоты. Окончательно остаток растворяли в 20 мл деионизованной воды и лиофилизовывали. Получено 303 мг очищенного препарата в виде аморфного белого порошка без запаха.
Для получения соответствующих солей по карбоксильным группам к свободному тетрапептиду добавляют рассчитанное количество водного раствора гидроокиси соответствующего металла (NaOH, КОН, Zn(OH)2, LiOH, Ca(OH)2, Mg(OH)2, NH4OH). Для получения триэтиламмониевой соли обработку проводят аналогичным образом, используя в качестве основания триэтиламин.
6) Анализ готового препарата.
Содержание основного вещества определяли методом ВЭЖХ на колонке Supelco LC-18-DB 4,6х250 mm, gard. LC-18-DB. A: 0,1% TFA; В: 50% MeCN/0,1% TFA; grad. В 0---> 20% за 30 мин. Скорость потока 1 мл/мин. Детекция при 220 нм, сканирование 190-600 нм, проба 20 μl. Содержание основного вещества 98,56%.
Аминокислотный анализ проводили на анализаторе ААА"Т-339" Prague. Гидролиз в 6 н. HCl при 125oC 24 час.
ТСХ: индивидуален, Rf = 0,67 (ацетонитрил-уксусная кислота-вода, 5:1:3, пластинки ПТСХ-П-В-УФ Sorbfil, силикагель СТХ-1ВЭ 8-12 мкм, проявление хлор/бензидин).
Содержание влаги: 7% (гравиметрически по потере массы при сушке 20 мг при 100oC).
pH 0,001%-ного раствора 4,24 (потенциометрически).
Удельное оптическое вращение [α]
Пример 2. Изучение токсичности тетрапептида L-Ala-L-Glu-L-Asp-L-Pro.
Изучение возможного токсического влияния на организм тетрапептида L-Ala-L-Glu-L-Asp-L-Pro проводилось в соответствии с "Методическими рекомендациями по изучению общетоксического действия фармакологических средств", утвержденных Управлением государственного контроля лекарственных средств и медицинской техники Минздрава России 29 декабря 1997 г.
Цель изучения состояла в определении переносимых токсических доз препарата, оценке степени и характера патологических изменений в различных органах и системах организма и выявлении зависимости токсических эффектов от дозы и длительности применения препарата.
Определение острой токсичности тетрапептида L-Ala-L-Glu-L-Asp-L-Pro проводили по методу Кербера. Исследование проведено на 66 белых беспородных мышах-самцах массой 20-23 г, содержавшихся на стандартном режиме и получавших стандартное питание в условиях вивария. Животные были разделены случайным распределением на 6 равных групп по 11 мышей в каждой. Препарат вводили животным однократно внутримышечно в объеме 0,25 мл в дозах 1 мг/кг, 2 мг/кг, 3 мг/кг, 4 мг/кг, 5 мг/кг (в несколько тысяч раз превышающих терапевтическую дозу, рекомендуемую для клинического изучения). Животным контрольной группы в том же объеме вводился физиологический раствор.
В течение 72 часов и далее через 14 суток ни в одной группе животных гибели мышей не обнаружено. Не отмечено каких-либо изменений общего состояния, поведения, двигательной активности, волосяного и кожного покрова, физиологических отправлений животных.
Таким образом, тетрапептид L-Ala-L-Glu-L-Asp-L-Pro в дозах, превышающих терапевтическую, рекомендуемую для клинических испытаний в несколько тысяч раз, не вызывает острых токсических реакций, что указывает на большую терапевтическую широту препарата.
Исследование подострой токсичности тетрапептида L-Ala-L-Glu-L-Asp-L-Pro проведено на 60 белых беспородных крысах массой 150-250 г. Ежедневно однократно животным опытных групп вводили препарат внутримышечно в течение 90 дней в дозах 1 мкг/кг, 0,3 мг/кг, 3 мг/кг в 0,5 мл физиологического раствора. Животным контрольной группы вводили в том же объеме физиологический раствор.
На протяжении всего периода исследования животные находились под ежедневным наблюдением. Отмечали поведение животных, потребление корма и воды, состояние волосяного покрова и слизистых оболочек. Проводили еженедельное взвешивание животных. До введения препарата, на 30, 60 и 90 сутки после начала введения препарата у животных исследовали морфологический состав и свойства периферической крови. При завершении эксперимента исследовали биохимические и коагулологические показатели крови.
Хроническую токсичность тетрапептида L-Ala-L-Glu-L-Asp-L-Pro, полученного заявляемым способом, изучали при длительном введении его крысам массой 150-250 г. Животным ежедневно вводили внутримышечно препарат в дозах 1 мкг/кг, 0,1 мг/кг, 1 мг/кг в 0,5 мл физиологического раствора в течение 6 месяцев. Отмечали поведение животных, потребление корма и воды, состояние волосяного покрова и слизистых оболочек. Взвешивание животных проводилось ежедневно в первые 3 месяца эксперимента, затем 1 раз в месяц. Через 3 месяца после начала введения и при завершении эксперимента проводили гематологические и биохимические исследования. Оценивали функции сердечно-сосудистой системы, печени, поджелудочной железы, почек и надпочечников. После окончания введения препарата часть животных подвергали патоморфологическому исследованию с целью оценки состояния различных отделов головного и спинного мозга, сердца, аорты, легких, печени, почек, органов эндокринной и иммунной систем.
При оценки общего состояния животных, морфологических и биохимических показателей периферической крови, морфологического состояния внутренних органов, состояния сердечно-сосудистой и дыхательной систем, функции печени и почек патологические изменения в организме не обнаружены.
Изучение подострой и хронической токсичности тетрапептида L-Ala-L-Glu-L-Asp-L-Pro свидетельствует об отсутствии побочных эффектов при длительном применении препарата в дозах, превышающих терапевтическую в 100-1000 раз.
Пример 3. Влияние тетрапептида L-Ala-L-Glu-L-Asp-L-Pro на развитие эксплантатов коры головного мозга.
Эксперименты проведены на 73 фрагментах коры головного мозга 10-11-суточных эмбрионов цыпленка. Питательная среда для культивирования эксплантатов состояла из 35% раствора Игла, 25% фетальной сыворотки теленка, 35% раствора Хенкса, 5% куриного эмбрионального экстракта, в среду добавляли глюкозу (0,6%), инсулин (0,5 ед./мл), пенициллин (100 ед./мл), глютамин (2 мМ). Фрагменты коры головного мозга помещали в эту среду и культивировали в чашках Петри в термостате при температуре 36,7oC в течение 2 суток. В экспериментальную среду добавляли тетрапептид L-Ala-L-Glu-L-Asp-L-Pro и церебролизин в концентрациях 0,5, 1, 2, 20, 50, 100, 200, 400, 800, 1000 нг/мл. Критерием биологической активности служил индекс площади (ИП) - соотношение площади всего эксплантата вместе с зоной роста и исходящей площади фрагмента коры. Достоверность различия сравниваемых средних значений ИП оценивали с помощью t-критерия Стьюдента. Значения ИП выражали в процентах, контрольное значение ИП принималось за 100%.
Зону роста контрольных эксплантатов коры составляли короткие нейриты, а также выселяющиеся клетки глии и фибробластоподобные клетки.
При исследовании непосредственного влияния препаратов на фрагменты коры головного мозга были поставлены следующие серии опытов.
В питательную среду эксплантатов коры головного мозга эмбрионов цыплят добавлялся церебролизин в различных концентрациях. На третьи сутки культивирования при концентрации 100 нг/мл наблюдалось достоверное повышение ИП эксплантатов на 30±2% по сравнению с контрольными значениями ИП. Достоверных значений ИП эксплантатов коры при действии других концентраций церебролизина не наблюдалось (см. фиг. 1). Отчетливая стимуляция развития эксплантатов коры головного мозга выявилась при действии тетрапептида L-Ala-L-Glu-L-Asp-L-Pro в концентрации 20 нг/мл, когда ИП опытных эксплантатов на 40±7% был выше ИП контрольных фрагментов коры.
При исследовании эксплантатов коры на более длительных сроках культивирования - 7 дней - выявились те же эффекты нейритстимулирующего действия, в тех же концентрациях. Иногда наблюдалось статистически недостоверное уменьшение ИП эксплантатов, видимо, за счет ретракции нервных волокон при увеличении сроков культивирования.
Таким образом, в отношении тканей головного мозга наблюдалось уменьшение порога эффективных концентраций для тетрапептида L-Ala-L-Glu-L-Asp-L-Pro, по сравнению с церебролизином. Так фрагменты культивируемой коры стимулировались при действии церебролизина в концентрации 100 нг/мл, а при действии тетрапептида - в концентрации 20 нг/мл. Это свидетельствует о более выраженном и направленном действии на нейроны коры головного мозга тетрапептида L-Ala-L-Glu-L-Asp-L-Pro.
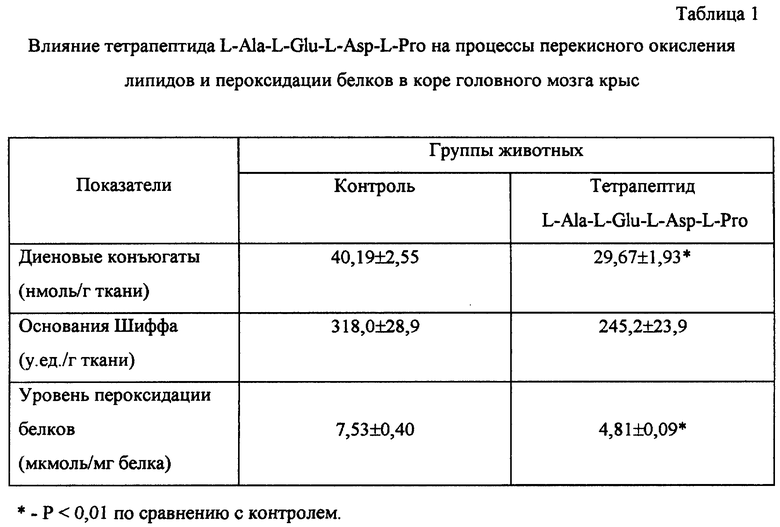
Пример 4. Влияние тетрапептида L-Ala-L-Glu-L-Asp-L-Pro на интенсивность реакций перекисного окисления липидов в коре головного мозга.
Об интенсивности перекисного окисления липидов (ПОЛ) судили по уровню содержания начальных продуктов ПОЛ - диеновых конъюгатов - и конечных продуктов - оснований Шиффа. Уровень пероксидации белков оценивали по содержанию карбонилпроизводных аминокислот в белках после взаимодействия с 2, 4-динитрофенилгидразином.
Исследование проведено на 20 белых беспородных крысах. Тетрапептид вводили животным внутрибрюшинно по 1 мкг однократно ежедневно в течение 5 дней.
Установлено, что исследуемый тетрапептид подавлял образование продуктов ПОЛ в коре головного мозга. Под влиянием тетрапептида статистически достоверно снижалось содержание диеновых конъюгатов и наблюдалась тенденция к снижению оснований Шиффа. Применение тетрапептида также ингибировало наряду с ПОЛ и пероксидацию белков (см. табл. 1).
Полученные данные свидетельствуют о том, что применение тетрапептида L-Ala-L-Glu-L-Asp-L-Pro подавляет образование продуктов перекисного окисления липидов и пероксидации белков в коре головного мозга.
Пример 5. Влияние тетрапептида L-Ala-L-Glu-L-Asp-L-Pro на токсические эффекты нейротропных веществ.
Проведено исследование влияния тетрапептида L-Ala-L-Glu-L-Asp-L-Pro на токсические эффекты нейротропных веществ различных фармакологических групп.
Через 1 час после внутримышечной инъекции физиологического раствора (контроль) или тетрапептида L-Ala-L-Glu-L-Asp-L-Pro (5 мкг/кг) крысам внутрибрюшинно вводили токсические дозы различных нейрофармакологических препаратов (апоморфин, галоперидол, никотин, кофеин) и регистрировали показатели вертикальной (тревожность) и горизонтальной (локомоторика) спонтанной двигательной активности.
Апоморфин оказывает рвотное действие за счет стимуляции хеморецепторной пусковой зоны продолговатого мозга. Кроме того, апоморфин способен взаимодействовать с дофаминовыми рецепторами и возбуждать дофаминергические структуры мозга. В экспериментах наблюдались гиперлокомоторика, гипертермия, "психоз", миотония. Тетрапептид L-Ala-L-Glu-L-Asp-L-Pro противодействовал апоморфину (снижал тревожность и локомоторику).
Галоперидол относится к группе нейролептиков, обладает слабой адренолитической активностью. В экспериментах вызывал снижение локомоторики, гипотермию, каталепсию, "депрессию" и миоплегию. Тетрапептид L-Ala-L-Glu-L-Asp-L-Pro действовал как фармакологический антагонист галоперидола (усиливал тревожность и локомоторику).
Никотин обладает н-холиномиметическим действием. В экспериментах вызывал повышение вертикальной и горизонтальной двигательной активности, а также мышечного тонуса. Под действием тетрапептида L-Ala-L-Glu-L-Asp-L-Pro наблюдалось снижение влияния никотина на тревожность животных.
Кофеин является психостимулятором, механизм его действия основан на подавлении активности фосфодиэстеразы и ассоциированным с ним повышении уровня сАМР. В экспериментах кофеин вызывал гиперлокомотомику и повышение зоосоциального контакта животных. Тетрапептид L-Ala-L-Glu-L-Asp-L-Pro снижал тревожность, вызываемую кофеином, но не влиял на локомоторику. Способность тетрапептида L-Ala-L-Glu-L-Asp-L-Pro подавлять токсические эффекты таких препаратов, как адреностимуляторы, нейролептики, холиномиметики и психостимуляторы, может быть использована в лечении отравлений нейротропными веществами.
Пример 6. Влияние тетрапептида L-Ala-L-Glu-L-Asp-L-Pro на метаболизм серотонина.
Исследование проведено на модели электроболевого стресса.
Крысам непосредственно перед или сразу после электроболевого воздействия вводили тетрапептид L-Ala-L-Glu-L-Asp-L-Pro в дозе 5 мкг/кг, через 1 час измеряли уровень серотонина и его метаболита - 5-оксииндолуксусной кислоты - в теменной и задней лобной областях головного мозга.
При эмоционально-болевом стрессе происходит стимуляция как синтеза, так и распада серотонина с быстрым истощением этих процессов. Стимуляция метаболизма серотонина носит компенсаторный характер и снижает эмоциональное восприятие болевого воздействия. Природным "недостатком" этого механизма является быстрый переход в состояние декомпенсации. В контроле (стресс без лечения) наблюдалось снижение уровня серотонина и повышение уровня 5-оксииндолуксусной кислоты (фаза истощения метаболизма).
Введение тетрапептида L-Ala-L-Glu-L-Asp-L-Pro после стресса вызывало повышение содержания в мозге серотонина и снижение содержания 5-оксииндолуксусной кислоты. Применение тетрапептида L-Ala-L-Glu-L-Asp-L-Pro перед стрессом вызывало аналогичные эффекты, которые, однако, не были достоверны.
Тетрапептид L-Ala-L-Glu-L-Asp-L-Pro не изменял уровни серотонина и его метаболита у интактных животных. Таким образом, введение тетрапептида L-Ala-L-Glu-L-Asp-L-Pro сразу после электроболевого стресса нормализовало уровни серотонина и его метаболита - 5-оксииндолуксусной кислоты - в головном мозге.
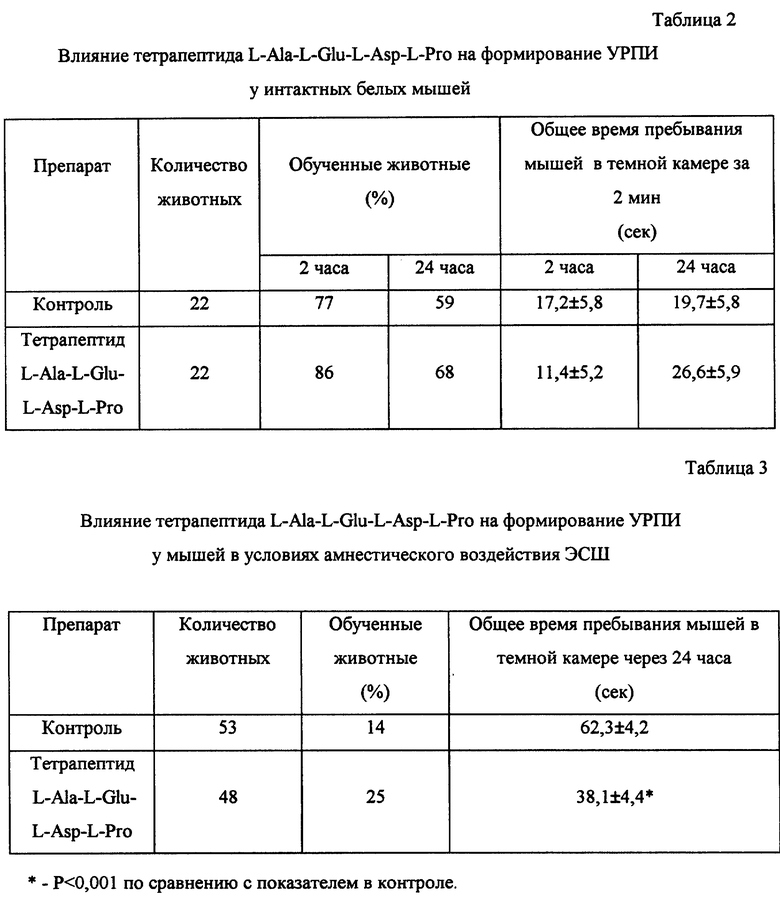
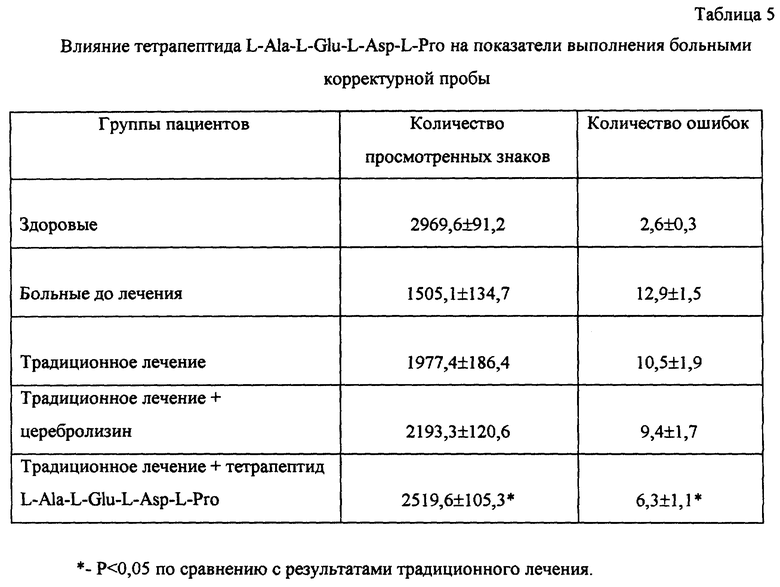
Пример 7. Влияние тетрапептида L-Ala-L-Glu-L-Asp-L-Pro на показатели памяти и обучения в условиях амнестических воздействий электросудорожного шока и интоксикации этиловым спиртом.
Проведено исследование ноотропной активности тетрапептида L-Ala-L-Glu-L-Asp-L-Pro с использованием условного рефлекса пассивного избегания (УРПИ) у интактных животных и в условиях амнестических воздействий (электросудорожный шок и интоксикация этанолом).
Эксперименты выполнены на мышах-самцах 20-24 г. Перед обучением в течение 2 мин регистрировали время пребывания каждого животного в темном и светлом отсеках камеры. В опытной группе использовали животных, время пребывания которых в светлой камере но превышало 40 сек. Обучение проводили посредством нанесения животному в предпочитаемом им темном отсеке электрического болевого раздражения, продолжающегося до выхода животного из этого отсека. Тетрапептид L-Ala-L-Glu-L-Asp-L-Pro вводили внутрибрюшинно за 60 минут до обучения. Тестирование осуществляли через 2 и 24 часа после обучения. Регистрировали время пребывания животного в светлом и темном отсеках камеры и число животных, не зашедших в темный отсек (обучившиеся животные).
Электросудорожный шок (ЭСШ) вызывали у мышей не позднее чем через 10 сек после обучения через корнеальные электроды электрическим разрядом силой 25 мА и продолжительностью 0,5 сек. Тетрапептид L-Ala-L-Glu-L-Asp-L-Pro вводили внутрибрюшинно за 60 мин до начала обучения. Тестирование проводили через 24 часа после обучения.
Этанол вводили мышам в виде 10%-ного раствора перорально в течение 13 дней. Обучение проводили дважды: на 14 день введения этанола и через 24 часа после первого обучения. Тетрапептид L-Ala-L-Glu-L-Asp-L-Pro вводили внутрибрюшинно за 30 мин до начала обучения. Тестирование осуществляли через 2 и 24 часа после первого и второго обучения.
Результаты экспериментов представлены в табл. 2-4.
Как следует из полученных данных, тетрапептид L-Ala-L-Glu-L-Asp-L-Pro не влияет на формирование УРПИ у интактных животных, однако улучшает показатели памяти и обучения в условиях действия амнестических агентов, что свидетельствует о ноотропной активности исследуемого препарата и его способности подавлять амнестическое действие ЭСШ и этанола.
Пример 8. Влияние тетрапептида L-Ala-L-Glu-L-Asp-L-Pro на репаративные процессы в головном мозге после черепно-мозговой травмы.
Влияние тетрапептида L-Ala-L-Glu-L-Asp-L-Pro на репаративные процессы в головном мозге оценивали на модели острой тяжелой черепно-мозговой травмы. Динамику восстановления функций центральной нервной системы определяли путем тестирования координации движений и мышечного тонуса животных, а также их способности к обучению и воспроизведению условно-рефлекторного навыка.
У крыс вызывали тяжелую компрессионную черепно-мозговую травму падающим свинцовым грузом. Через 1, 12, 48 и 96 час животным опытной группы вводили внутримышечно тетрапептид L-Ala-L-Glu-L-Asp-L-Pro. Во второй группе животные получали церебролизин.
Оценку способности крыс к обучению и воспроизведению навыков проводили с помощью теста условного рефлекса активного избегания (УРАИ). Для оценки мышечного тонуса и координации движений крыс вращали на стержне с возрастающей скоростью и измеряли время удерживания.
Через 48 часов все выжившие животные не были способны к обучению. Через 96 часов в группе крыс, получавших тетрапептид L-Ala-L-Glu-L-Asp-L-Pro, способных к обучению животных было в 2 раза больше, чем в контрольной группе. Через 30 суток показатели обучаемости у крыс, которым вводили тетрапептид L-Ala-L-Glu-L-Asp-L-Pro, были также выше, чем в контроле.
Тяжелая черепно-мозговая травма вызывала у животных выраженный астеноневротический синдром, снижение координации и мышечного тонуса. Исследование по методу "вращающегося стержня" показало, что тетрапептид L-Ala-L-Glu-L-Asp-L-Pro способствовал восстановлению координации движений и мышечного тонуса через 48 час после травмы (время удерживания на стержне было более чем в 2 раза выше, чем в контроле).
Церебролизин при тяжелой компрессионной черепно-мозговой травме у животных проявлял меньшую эффективность, чем тетрапептид L-Ala-L-Glu-L-Asp-L-Pro.
Таким образом, применение исследуемого тетрапептида приводит к значительному улучшению способности животных к обучению и воспроизведению условно-рефлекторного навыка, а также к нормализации мышечного тонуса и координации движений. Положительный эффект препарата отмечался уже на 4 сутки после травмы, а к 13 суткам показатели обучаемости животных были близки к нормальным величинам.
При острой тяжелой черепно-мозговой травме происходит повреждение и гибель популяций нейронов серого вещества головного мозга. Ускоренное восстановление функций центральной нервной системы в раннем посттравматическом периоде под действием тетрапептида L-Ala-L-Glu-L-Asp-L-Pro свидетельствует о том, что тетрапептид вызывает стимуляцию репаративных процессов в головном мозге.
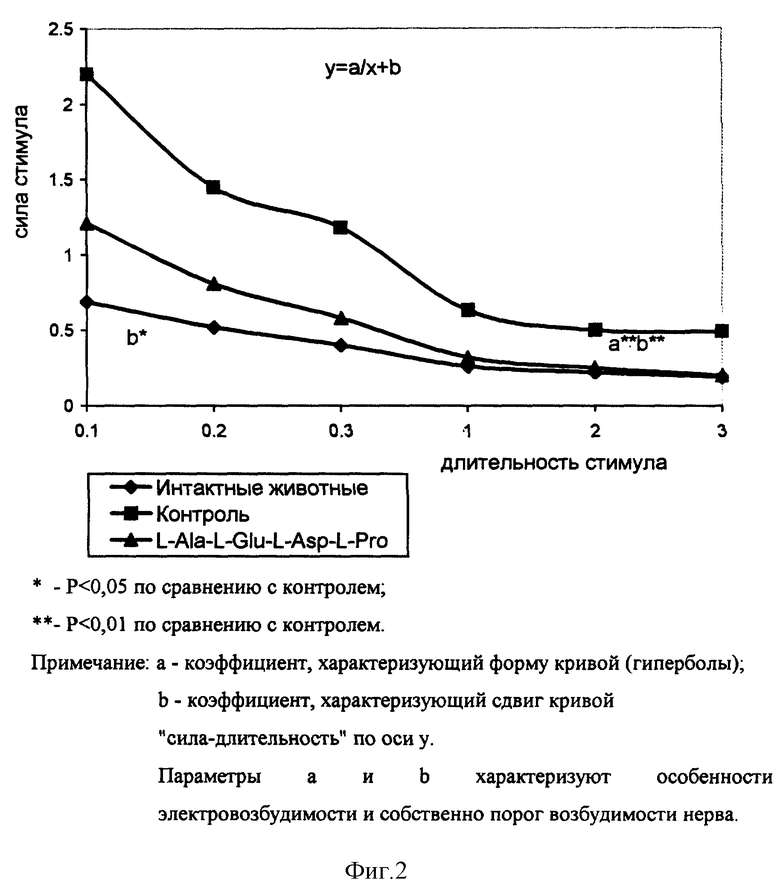
Пример 9. Влияние тетрапептида L-Ala-L-Glu-L-Asp-L-Pro на регенерацию передавленного периферического нерва.
Исследование выполнено на самцах белых нелинейных мышей массой 25-30 г. В экспериментах было использовано 22 животных (7 опытных и 15 контрольных).
Первый этап работы заключался в проведении хронических операций по передавливанию малоберцового нерва у мышей. Мышам под нембуталовым наркозом (60 мг/кг, внутрибрюшинно) пережимали малоберцовый нерв (n. peroneus communus) на расстоянии 8-9 мм от иннервируемой им мышцы - длинного разгибателя пальцев (m. extensor digitorum longus - EDL). Операцию проводили на левой задней лапе животного, в то время как соответствующие нерв и мышцу правой конечности оставляли интактными и использовали в дальнейшей работе в качестве интактного контроля.
Далее, начиная с третьих суток после пережатия нерва, мышам в течение 8 дней проводили ежедневные одноразовые внутрибрюшинные инъекции тетрапептида L-Ala-L-Glu-L-Asp-L-Pro в дозе 10 мкг/кг. Контрольным мышам вводили физиологический раствор в эквивалентном объеме.
На одиннадцатые сутки после операции по пережатию нерва (и спустя 24 часа после последней инъекции тетрапептида) у мышей in vivo под нембуталовым наркозом (60 мг/кг) проводили электрофизиологическое исследование ряда показателей функционального состояния уже проросшего нерва и реиннервируемых скелетных мышечных волокон (EDL).
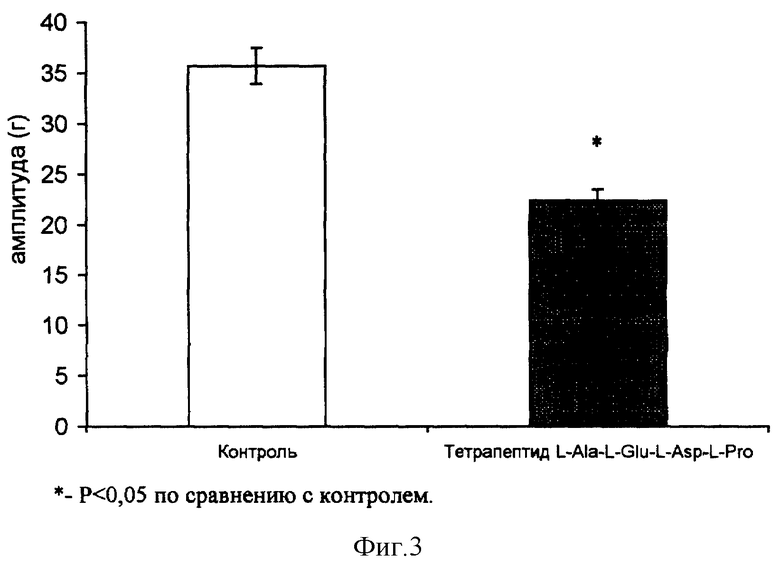
Полученные данные свидетельствуют о том, что под действием тетрапептида L-Ala-L-Glu-L-Asp-L-Pro на одиннадцатые сутки после передавливания нерва наблюдалось ускоренное восстановление такого показателя, как порог возбудимости и соответствующие изменения характера кривой "сила-длительность" у регенерирующего нервно-мышечного аппарата животных опытной группы (см. фиг. 2). Это означает, что введение тетрапептида достоверно и значительно (на 30-50%) улучшает один из важнейших функциональных показателей регенерирующего нерва - порог его электрической возбудимости, тем самым ускоряя во времени (на 1-2 суток) процесс его восстановления до нормальных значений.
Еще одним показателем, достоверно изменяющимся в периферической системе "нерв-мышца" на фоне введения тетрапептида оказался латентный период М-ответа. М-ответ мышцы представляет собой суммарную электрическую реакцию (суммарный потенциал действия мышцы), регистрируемый в ответ на раздражение двигательного нерва. Важно подчеркнуть что укорочение латентного периода М-ответа было более выраженным у интактного нервно-мышечного аппарата (на 89%) по сравнению с регенерирующим нервом (и мышцей) (на 59%). Латентный период М-ответа является интегральной характеристикой, отражающей скорость проведения возбуждения по аксонам, их тонким внутримышечным разветвлениям, а также скорость синаптической передачи в периферических моторных синапсах. Поскольку эффект тетрапептида L-Ala-L-Glu-L-Asp-L-Pro на латентный период М-ответа оказался более выраженным у интактных нерва и мышцы, по-видимому, эта особенность действия тетрапептида не имеет прямого отношения к собственно нейро- и миорегенераторным процессам, а, скорее, отражает способность исследуемого препарата оказывать влияние на периферические возбудимые структуры (нервные волокна, терминали, синапсы и т.п.) и приводить к ускорению проведения возбуждения в периферической нервно-мышечной системе.
На фоне введения мышам тетрапептида L-Ala-L-Glu-L-Asp-L-Pro обнаружена тенденция к уменьшению величины ацетилхолиновой контрактуры мышц (см. фиг. 3), обусловленной сохраняющейся (после денервации) остаточной внесинаптической холинорецепцией на поверхности мышечных волокон. Как известно, ацетилхолиновая контрактура мышц опосредуется внесинаптической холинорецепцией, которая, в свою очередь, является классическим показателем степени выраженности нейротрофических влияний на мышцу, в первую очередь со стороны мотонейрона. В связи с этим тенденция к значительному подавлению ацетилхолиновой контрактуры мышц на фоне введения тетрапептида может рассматриваться как результат усиления препаратом нейротрофических влияний мотонейронов на холинорецепцию мышечных волокон либо отражать эффект прямого трофического действия самого тетрапептида на мышечные волокна, имитирующего нейротрофические влияния мотонейронов.
Применение тетрапептида L-Ala-L-Glu-L-Asp-L-Pro ускоряет восстановление ряда важных функциональных показателей нерва, регенерирующего после передавливания. При этом тетрапептид стимулирует процесс регенерации как в нерве, так и в самой мышце и приближает их к состоянию, характерному для интактных "здоровых" двигательных единиц.
Таким образом, в результате экспериментального изучения установлено, что тетрапептид L-Ala-L-Glu-L-Asp-L-Pro не токсичен, стимулирует функциональную активность нейронов коры головного мозга, проявляющуюся в выраженном церебропротекторном действии, активизации обменных процессов и высокой нейротрофической активности.
Выявленные в результате экспериментального доклинического исследования свойства тетрапептида L-Ala-L-Glu-L-Asp-L-Pro позволяют считать показанным его лечебное и профилактическое применение при ряде заболеваний головного мозга. Перечень заболеваний и их коды приводятся в соответствии с международной классификацией заболеваний 1CD-9-CM (12).
Изобретение позволяет применять тетрапептид L-Ala-L-Glu-L-Asp-L-Pro как препарат, стимулирующий репаративные процессы в головном мозге и имеющий церебропротекторное действие, в качестве средства:
лечения и предупреждения поражения головного мозга при травмах (800-959), включая:
лечение поражения головного мозга при переломе свода черепа (1500), основания черепа (801), множественных переломах костей (804);
лечение поражения головного мозга при внутричерепной травме (850-854) [при сотрясении головного мозга (850), ранах головного мозга и контузии (851), субарахноидальном, субдуральном и экстрадуральном кровоизлиянии вследствие травмы (852)];
лечение и предупреждение травматического шока (958.4);
лечение поражения головного мозга вследствие воздействия радиации (990), пониженной температуры (991), тепли и света (992), воздушного давления (993), электротока и тока СВЧ;
лечение и предупреждение поздних эффектов переломов черепа (905.0);
лечение и предупреждение поздних эффектов внутричерепной травмы (907.0);
лечение и предупреждение поздних эффектов поражения головного мозга радиацией (909.2), осложнений хирургической и другой медицинской помощи (909.3).
Изобретение позволяет применять тетрапептид L-Ala-L-Glu-L-Asp-L-Pro как препарат, подавляющий токсические эффекты нейротропных веществ, стимулирующий репаративные процессы в головном мозге, имеющий церебропротекторное действие, в качестве средства лечения и предупреждения поражения головного мозга при отравлениях (960-999), включая:
лечение поражения головного мозга при отравлении лекарственными препаратами, медицинскими и биологическими веществами (960-979);
лечение поражения головного мозга веществами немедицинского происхождения (980-989);
лечение и предупреждение поздних эффектов поражения головного мозга вследствие отравления лекарствами (909.0) и немедикаментозными веществами (909.1).
Изобретение позволяет применять тетрапептид L-Ala-L-Glu-L-Asp-L-Pro как препарат, стимулирующий репаративные процессы в головном мозге, имеющий ноотропное действие, в качестве средства лечения и предупреждения дегенеративных заболеваний головного мозга (330-337), включая:
лечение и предупреждение детских дегенеративных заболеваний головного мозга (330);
лечение и предупреждение болезни Альцгеймера (331.0), болезни Пика (331.1), сенильной дегенерации головного мозга (331.2) и гидроцефалии (331.3-331.4);
лечение и предупреждение болезни Паркинсона (332) и других экстрапирамидных расстройств (333) [дегенеративных заболеваний базальных ганглиев (333.0), эссенциального тремора (333.1), миоклонуса (333.2), тиков органического генеза (333.3), хореи Гентингтона (333.4) и других хорей (333.5), торзионной дистонии (333.6-333.8)];
лечение и предупреждение спинно-мозжечковых заболеваний (334) [атаксии Фридриха (334.0), наследственной спастической параплегии (334.1), мозжечковой дегенерации (334.2-334.3) и мозжечковой атаксии при других заболеваниях (334.4)].
Изобретение позволяет применять тетрапептид L-Ala-L-Glu-L-Asp-L-Pro как препарат, имеющий ноотропное действие, стимулирующий репаративные процессы в головном мозге, в качестве средства лечения и предупреждения сенильных и пресенильных органических психотических заболеваний (290), включая:
лечение и предупреждение сенильной деменции (290.1), в том числе деменции при болезни Альцгеймера (331.0), болезни Крейтцфельдта-Якоба (046.0) и болезни Пика (331,1);
лечение и предупреждение неосложненной сенильной деменции (290,0);
лечение и предупреждение сенильной деменции с проявлениями бреда при депрессии (290.2);
лечение и предупреждение сенильной деменции с делирием (290.3);
лечение и предупреждение атеросклеротической деменции (290.4).
Изобретение позволяет применять тетрапептид L-Ala-L-Glu-L-Asp-L-Pro как препарат, имеющий ноотропное действие, стимулирующий репаративные процессы в головном мозге, в качестве средства лечения и предупреждения амнестических заболевании (294.0), включая:
лечение и предупреждение неалкогольного Корсаковского психоза (294.0);
лечение и предупреждение деменции при различных заболеваниях (294.1) [деменции при ВИЧ-инфекции (ВИЧ-энцефалопатия), церебральном липидозе (330.1), эпилепсии (345.0-345.9), сифилисе (094.1), гепатолентикулярной дегенерации (275.1), хорее Гентингтона (333.4), множественном склерозе (340) и узловатом полиартериите (446.0)];
лечение и предупреждение синдрома хронического недифференцированного органического поражения головного мозга (294.9), в том числе поражение головного мозга при СПИДе (042.9).
Изобретение позволяет применять тетрапептид L-Ala-L-Glu-L-Asp-L-Pro как препарат, стимулирующий репаративные процессы в головном мозге и имеющий церебропротекторное действие, в качестве средства лечения и предупреждения рассеянного склероза (340) и других демиелинезирующих заболеваний головного мозга (341).
Изобретение позволяет применять тетрапептид L-Ala-L-Glu-L-Asp-L-Pro как препарат, имеющий ноотропное действие, стимулирующий репаративные процессы в головном мозге, в качестве средства лечения и предупреждения умственной отсталости (317-319).
Изобретение позволяет применять тетрапептид L-Ala-L-Glu-L-Asp-L-Pro как препарат, стимулирующий репаративные процессы в головном мозге и двигательную активность, в качестве средства лечения и предупреждения паралитических синдромов (342-344), включая:
лечение и предупреждение гемиплегии (342); лечение и предупреждение детского церебрального паралича (343);
лечение и предупреждение других паралитических синдромов (344) [квадриплегии (344.0), параплегии (344.1), диплегии верхних конечностей (344.2), моноплегии нижних конечностей (344.3-344.4)].
Изобретение позволяет применять тетрапептид L-Ala-L-Glu-L-Asp-L-Pro как препарат, стимулирующий репаративные процессы в головном мозге, имеющий церебропротекторное действие, в качестве средства лечения и предупреждения поражения головного мозга при хромосомных аномалиях (758), включая синдром Дауна (758.0).
Изобретение позволяет применять тетрапептид L-Ala-L-Glu-L-Asp-L-Pro как препарат, стимулирующий репаративные процессы в головном мозге, имеющий церебропротекторное действие, в качестве средства лечения и предупреждения поражения головного мозга при воспалительных заболеваниях головного мозга (320-326), включая:
лечение и предупреждение поражения головного мозга при бактериальных менингитах (320), в том числе при криптококковом менингите при СПИДе;
лечение и предупреждение поражения головного мозга при небактериальных менингитах (321);
лечение и предупреждение поражения головного мозга при менингитах неясной этиологии (322);
лечение и предупреждение поражения головного мозга при энцефалитах, миелитах и энцефаломиелитах (323), в том числе при токсоплазмозе головного мозга при СПИДе;
лечение и предупреждение поражения головного мозга при внутричерепных абсцессах (324);
лечение и предупреждение поражения головного мозга при флебитах и тромбофлебитах внутричерепных венозных синусов (325);
лечение и предупреждение последствий внутричерепных абсцессов или гнойной инфекции (326).
Изобретение позволяет применять тетрапептид L-Ala-L-Glu-L-Asp-L-Pro как препарат, имеющий церебропротекторное и ноотропное действие, стимулирующий репаративные процессы в головном мозге, в качестве средства лечения и предупреждения поражения головного мозга при церебрально-сосудистых заболеваниях (430-438), включая:
лечение и предупреждение поражения головного мозга при субарахноидальном кровоизлиянии (430);
лечение и предупреждение поражения головного мозга при кровоизлиянии в головной мозг (431);
лечение и предупреждение поражения головного мозга при окклюзии и стенозе прецеребральных артерий (433);
лечение и предупреждение поражения головного мозга при окклюзии церебральных артерий (434);
лечение и предупреждение поражения головного мозга при преходящей церебральной ишемии (435);
лечение и предупреждение поражения головного мозга при других цереброваскулярных заболеваниях [при острых цереброваскулярных заболеваниях (436), церебральном атеросклерозе (437.0) и других генерализированных цереброваскулярных заболеваниях (437.1), при гипертензивной энцефалопатии (437.2), церебральной аневризме (472.3), церебральном артериите (472.4) и негнойном тромбозе внутричерепного венозного синуса (437.6)].
Изобретение позволяет применять тетрапептид L-Ala-L-Glu-L-Asp-L-Pro как препарат, имеющий церебропротекторное и ноотропное действие, стимулирующий репаративные процессы в головном мозге, в качестве средства лечения и предупреждения алкогольных психозов (291), включая:
лечение и предупреждение алкогольного делирия при синдроме отмены (291.0);
лечение и предупреждение алкогольного амнестического синдрома (291.1) и других алкогольных деменций (291.2);
лечение и предупреждение патологической алкогольной интоксикации (291.3);
лечение и предупреждение алкогольной паранойи и алкогольного психоза параноидного типа (291.5).
Изобретение позволяет применять тетрапептид L-Ala-L-Glu-L-Asp-L-Pro как препарат, имеющий церебропротекторное и ноотропное действие, стимулирующий репаративные процессы в головном мозге, в качестве средства лечения и предупреждения поражения головного мозга при алкоголизме (303).
Изобретение позволяет применять тетрапептид L-Ala-L-Glu-L-Asp-L-Pro как препарат, подавляющий токсические эффекты нейротропных веществ, имеющий ноотропное и церебропротекторное действие, в качестве средства лечения и предупреждения медикаментозных психозов (292), включая:
лечение и предупреждение синдрома отмены лекарственных препаратов (292.0);
лечение и предупреждение параноидных и/или галлюцинаторных состояний, вызванных лекарствами (292.1);
лечение и предупреждение патологической интоксикации лекарственными средствами (292.2);
лечение и предупреждение других, вызванных лекарствами психических нарушений (292.8) [делирия (292.81), деменции (292.82), амнестического синдрома (292.83) и органического аффективного синдрома (292.84)].
Изобретение позволяет применять тетрапептид L-Ala-L-Glu-L-Asp-L-Pro как препарат, подавляющий токсические эффекты нейротропных веществ, имеющий церебропротекторное действие, в качестве средства лечения и предупреждения лекарственной зависимости (304), включая:
лечение и предупреждение зависимости от опиоидов (304.1);
лечение и предупреждение зависимости от барбитуратов, седативных препаратов и транквилизаторов (304.1);
лечение и предупреждение зависимости от кокаина (304.2);
лечение и предупреждение зависимости от препаратов конопли (304.3);
лечение и предупреждение зависимости от амфетамина и других психостимуляторов (304.4);
лечение и предупреждение зависимости от галлюциногенов (304.5);
лечение и предупреждение поражения головного мозга при злоупотреблении препаратами без лекарственной зависимости (305) [при злоупотреблении алкоголем (305.0), табаком (305.1), коноплей (305.2), галлюциногенами (305.3), опиоидами (305.5), кокаином (305.6), психостимуляторами (305.7), антидепрессантами (305.8)].
Изобретение позволяет применять тетрапептид L-Ala-L-Glu-L-Asp-L-Pro в качестве средства лечения и предупреждения психогенных симптомов и синдромов (306-309), включая:
лечение и предупреждение психогенных физиологических нарушений (306);
лечение и предупреждение других психогенных симптомов и синдромов (307) [заикания и запинок (307.0), психогенной анорексии (307.1), тиков (307.2), повторяющихся стереотипных движений (307.3), расстройств сна неорганического генеза (308.4), психогенных расстройств питания (307.5), энуреза (307.6), психогенного запора (307.7), психальгии (307.8)];
лечение и предупреждение острой реакции на стресс (308);
лечение и предупреждение установочных реакций (309).
Изобретение позволяет применять тетрапептид L-Ala-L-Glu-L-Asp-L-Pro в качестве средства лечения и предупреждения неорганических психозов (295- 299), включая:
лечение и предупреждение шизофренических расстройств (295);
лечение и предупреждение аффективных психозов (296);
лечение и предупреждение параноидных состояний (297);
лечение и предупреждение других неорганических психозов (298) [психозов депрессивного типа (298.1) и возбужденного типа (298.2), реактивной спутанности (298.2), острых параноидных реакций (298.3), психогенических параноидных психозов (298.4) и недифференцированных психозов (298.9), в том числе психозов, связанных с поражением головного мозга при СПИДе (042.9)];
лечение и предупреждение детских психозов (299), в том числе инфантильного аутизма (299.1) и дезинтегративных психозов (299.2).
Изобретение позволяет применять тетрапептид L-Ala-L-Glu-L-Asp-L-Pro как препарат, стимулирующий репаративные процессы в головном мозге, имеющий церебропротекторное и ноотропное действие, в качестве средства лечения и предупреждения поражения головного мозга при других заболеваниях головного мозга (348), включая:
лечение и предупреждение поражения головного мозга при церебральных кистах (348.0);
лечение и предупреждение гипоксического повреждения мозга (348.1);
лечение и предупреждение поражения головного мозга при внутричерепной гипертензии (348.2);
лечение и предупреждение поражения головного мозга при энцефалопатии (348.3).
Изобретение позволяет применять тетрапептид L-Ala-L-Glu-L-Asp-L-Pro как препарат, стимулирующий репаративные процессы в головном мозге и двигательную активность, имеющий церебропротекторное, ноотропное действие, в качестве средства лечения и предупреждения симптомов и синдромов, встречающихся при различных заболеваниях головного мозга, включая:
лечение и предупреждение когнитивных нарушений, расстройств памяти и внимания (например, при амнестических заболеваниях, умственной отсталости, неорганических психозах и др.);
лечение и предупреждение афазии и апраксии (например, при амнестических заболеваниях, неорганических психозах, поражении головного мозга вследствие хромосомных аномалий и др.);
лечение и предупреждение эмоциональных расстройств (например, при неорганических психозах, демиелинезирующих заболеваниях головного мозга и др.);
лечение и предупреждение психопатологического синдрома (например, при преходящих органических психотических состояниях, медикаментозных психозах, лекарственной зависимости и др.);
лечение и предупреждение астенодепрессивного синдрома (например, при неорганических психозах, поражении головного мозга вследствие хромосомных аномалий и др.);
лечение и предупреждение бредового синдрома (например, при медикаментозных психозах и лекарственной зависимости, неорганических психозах и др.);
лечение и предупреждение расстройств сна (например, при опухолях головного мозга, преходящих органических психотических состояниях и др.);
лечение и предупреждение церебрально-очагового синдрома (очаговой патологической симптоматики) (например, при поражении головного мозга вследствие осложнений хирургической и другой медицинской помощи, при демиелинезирующих заболеваниях головного мозга и др.);
лечение и предупреждение синдрома двигательных расстройств (например, при опухолях головного мозга, поражении головного мозга вследствие отравлений и др.).
Клиническое применение тетрапептида L-аланил-L-глутамил-L-аспарагил-L-пролин (L-Ala-L-Glu-L-Asp-L-Pro) подтвердило данные экспериментального исследования о том, что препарат эффективен при заболеваниях и состояниях, вызванных или сопровождающихся повреждением или гибелью нейронов коры головного мозга.
Приведенные ниже примеры результатов клинического изучения заявляемого тетрапептида демонстрируют его фармакологические свойства и подтверждают возможность осуществления изобретения.
Пример 10. Эффективность применения тетрапептида L-Ala-L-Glu-L-Asp-L-Pro при последствиях черепно-мозговой травмы.
Исследование проведено на 35 пациентах с отдаленными последствиями черепно-мозговой травмы, которые были распределены на три группы: контроль (10 больных, традиционная терапия), исследуемая группа (15 больных, традиционная терапия + тетрапептид L-Ala-L-Glu-L-Asp-L-Pro внутримышечно ежедневно по 1 мкг в течение 10 дней) и группа сравнения (10 больных, традиционная терапия + церебролизин). Давность перенесенной ЧМТ у больных составляла 1-10 лет. У всех пациентов имела место декомпенсация посттравматического процесса, которая проявлялась ликвородинамическими нарушениями, вегетососудистой дистонией, церебрально-очаговым и психопатологическим синдромами.
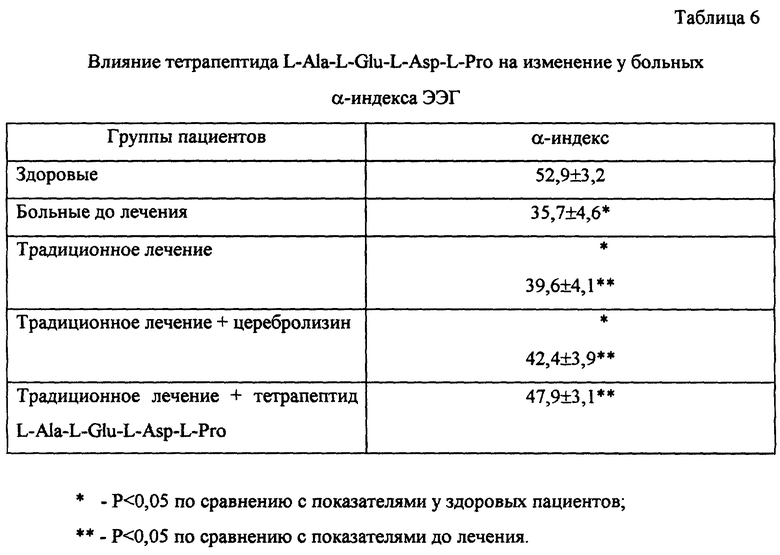
Влияние лечения с применением тетрапептида L-Ala-L-Glu-L-Asp-L-Pro на функцию внимания оценивалось по данным выполнения больными корректурной пробы до и после лечения. Обнаружено достоверное увеличение количества просмотренных знаков и уменьшение количества ошибок, что свидетельствует об усилении внимания и повышении устойчивости внимания под действием тетрапептида (см. табл. 5).
В группе больных, получавших лечение с применением тетрапептида, получены лучшие результаты при анализе динамики выполнения корректурной пробы до и после лечения сравнительно с больными других исследуемых групп. Это выражалось в отсутствии резких колебаний в количестве просмотренных знаков за равные отрезки времени, наличии периода "врабатываемости" к середине выполнения задания и постепенном снижении кривой к концу задания, что свидетельствует о большей устойчивости внимания после лечения препаратом.
Для оценки влияния тетрапептида L-Ala-L-Glu-L-Asp-L-Pro на биоэлектрическую активность головного мозга проводился визуальный анализ ЭЭГ с распределением их по типам и расчет α- индекса до и после лечения. ЭЭГ проводили выборочно больным разных групп с наиболее выраженными проявлениями патологических процессов.
До лечения у исследуемых больных в разных группах преобладали патологические (III, IV, V) типы ЭЭГ. III тип ЭЭГ характеризовался наличием так называемой бездоминантной кривой при низком амплитудном уровне (не выше 30-35 мкВ), наличием нерегулярной или даже отсутствием α- активности. Для IV типа ЭЭГ характерной была чрезвычайно подчеркнутая регулярность ритмов, стертость зональных различий. V тип ЭЭГ характеризовался наличием нерегулярной медленной активности амплитудой выше 35 мкВ, острых волн, пароксизмальных разрядов.
Наиболее выраженные изменения биоэлектрической активности головного мозга наблюдались у больных после лечения с применением тетрапептида. Это проявлялось на ЭЭГ, прежде всего, в более четкой модулированности и восстановлении зональных различий α- ритма, ослаблении выраженности ирритативных процессов, в отдельных случаях - исчезновении пароксизмальных разрядов.
Установлено, что под влиянием лечения произошло достоверное увеличение α- индекса у больных исследуемых групп. Однако степень изменения α- индекса у больных, получавших разное лечение, была неодинаковая. Достоверно выше было значение α- индекса в группе больных после лечения с применением исследуемого тетрапептида по сравнению с показателями в других группах.
Полученные данные свидетельствуют о достоверном повышении α- индекса во всех исследуемых группах при более значительном увеличении этого показателя в группах больных, получавших лечение с применением тетрапептида (см. табл. 6).
При сопоставлении субъективных показателей состояния больных до и после применения тетрапептида установлено, что в 71% случаев отмечалось улучшение памяти, сообразительности, уменьшение интенсивности и длительности головных болей, появление эмоциональной уравновешенности, волевых качеств, чувства отдыха после ночного сна.
Таким образом, обнаружены следующие эффекты применения тетрапептида L-Ala-L-Glu-L-Asp-L-Pro в периоде декомпенсации посттравматического процесса у пациентов, страдающих отдаленными последствиями черепно-мозговой травмы: улучшение когнитивных функций головного мозга, памяти и внимания, восстановление биоэлектрической активности мозга.
Пример 11. Эффективность применения тетрапептида L-Ala-L-Glu-L-Asp-L-Pro при сосудистых деменциях.
Исследование проведено на 12 пациентах в возрасте 69-76 лет (7 мужчин и 5 женщин), длительное время страдающих гипертонической болезнью и атеросклерозом сосудов головного мозга. У трех из них в анамнезе отмечались перенесенные инсульты. Контролем служили данные, полученные при обследовании этих же пациентов до лечения. Тетрапептид L-Ala-L-Glu-L-Asp-L-Pro вводили внутримышечно 1 раз в день по 3 мкг на инъекцию в течение 30 дней.
Оценку результатов лечения проводили после окончания терапии в сравнении с данными до лечения. На основании результатов обследования определяли изменения клинического состояния пациентов по следующим градациям: улучшение (выраженное, среднее или незначительное), ухудшение, без изменений.
При обследовании до лечения у всех пациентов обнаружены проявления интеллектуально-мнестического дефекта: нарушения памяти, ослабление интеллекта, афазия, апраксия и аграфические расстройства. У 9 больных отмечались явления дезориентировки в месте и времени. Эмоциональное состояние пациентов характеризовалось лабильностью, проявляющейся в периодической смене апатии и эйфории, благодушия и гневливости. По данным психологического исследования у пациентов отмечались выраженные нарушения памяти, способности к продуктивной интеллектуальной деятельности, афазия.
Улучшение клинического состояния наблюдалось с 4-5 дня лечения. Отмечалось усиление активности, появлялось стремление к деятельности, больные меньше времени проводили в постели, у них уменьшалась эмоциональная неустойчивость. С 5-7 дня нормализовался сон, уменьшалась усталость при выполнении заданий, больные начинали лучше ориентироваться в окружающей обстановке, уменьшалась выраженность амнезии, афазии и апраксии. При этом улучшалась как способность к воспроизведению прошлого опыта, так и память на текущие события. Изменения эмоционального состояния зависели от предшествующего эмоционального фона. Больные со сниженным настроением на фоне повышения общего тонуса и нормализации соматического состояния отмечали повышение настроения; больные с апатией проявляли большую активность. При наличии эмоциональной лабильности и повышенной раздражительности эмоциональное состояние пациентов в процессе лечения становилось более стабильным.
По данным нейро-психологического, психофизиологического исследования под действием тетрапептида наблюдалось улучшение оперативной памяти, концентрации внимания, увеличение объема запоминаемой информации. Кроме того, у пациентов сокращалось время выполнения арифметических действий, уменьшалось количество ошибок. После лечения у больных достоверно увеличивался объем внимания, улучшались показатели сложной сенсомоторной реакции с выбором.
Таким образом, предварительное клиническое исследование тетрапептида L-Ala-L-Glu-L-Asp-L-Pro при сосудистых деменциях демонстрирует выраженное лечебное действие препарата, поскольку у 74,8% больных в результате проведенного курса лечения с использованием низких дозировок наблюдалось обратное развитие симптомов заболевания.
Представленные данные свидетельствуют о высокой эффективности тетрапептида L-Ala-L-Glu-L-Asp-L-Pro при когнитивных нарушениях, расстройствах памяти и внимания, афазии, апраксии, эмоциональных расстройствах у больных с сосудистыми деменциями.
Источники информации
1. Машковский М.Д. Лекарственные средства. Пособие по фармакотерапии для врачей. В 2 ч. - Вильнюс, 1993. - ч.1.- с. 101-110.
2. Korsching S. The neurotrophic factor concept: a reexamination// Neuroscience.- 1993.- Vol. 13, N 7. - P. 2739.
3. Машковский М.Д. Лекарственные средства. Пособие по фармакотерапии для врачей. В 2 ч. - Вильнюс, 1993. - ч.2. - с. 84-88.
4. Кривицкая Г. Н., Гельфанд В.Б., Попова Э.Н. Деструктивные и репаративные процессы при очаговых поражениях головного мозга.- М.: Медицина, 1980. - 214 с.
5. Несмеянова Т. Н. Стимуляция восстановительных процессов при травме спинного мозга. - М.: Наука, 1971. - 255 с.
6. Крыжановский Г.Н., Карабань И.Н., Магаева С.В. и др. Компенсаторные и восстановительные процессы при паркинсонизме. - Киев: АМН Украины, 1995. - 186 с.
7. Ernfors P. , Ivanez C.F., Ebendal T. Molecular cloning and neurotrophic activities of a protein with structural similarities to nerve growth factor; developmental and topographical expression in the brain // Proc. Natl. Acad. Sci. USA. - 1990. - Vol. 87, N 9.- P. 5454-5458.
8. Elde R., Cao Y., Cintra A. Prominent expression of acidic fibroblast growth factor in motor and sensor neurons // Neuron. - 1991. - Vol. 7, N 8. - P. 349-364.
9. Якубке Х.-Д., Ешкайт X. Аминокислоты, пептиды, белки: Пер. с нем. - М.: Мир, 1985. - 456 с.
10. Теппермен Дж., Теппермен X. Физиология обмена веществ и эндокринной системы: Пер. с англ. - М.: Мир, 1989. - 656 с.
11. Бахарев В. Д. Клиническая нейрофизиология регуляторных пептидов. - Свердловск: Изд-во Урал. ун-та, 1989. - 136 с.
12. International Classification of Diseases, 9th Revision. - Вашингтон, 1989.

Изобретение относится к области медицины и может быть использовано как средство, стимулирующее функциональную активность нейронов, при заболеваниях и травмах нервной системы. Предлагается биологически активное соединение - тетрапептид L-аланил-L-глутамил-L-аспарагил-L-пролин общей формулы L-Ala-L-Glu-L-Asp-L-Pro, стимулирующее функциональную активность нейронов, и фармакологическое средство, содержащее в качестве активного начала эффективное количество тетрапептида формулы L-аланил-L-глутамил-L-аспарагил-L-пролин (L-Ala-L-Glu-L-Asp-L-Pro) или его солей, предназначенное для парентерального, интраназального и перорального применения. Согласно изобретению способ стимуляции функциональной активности нейронов включает профилактическое и/или лечебное введение пациенту фармакологического средства в дозах 0,01-100 мкг/кг массы тела по крайней мере один раз в день в течение периода, необходимого для достижения терапевтического эффекта. Технический результат: средство стимулирует функциональную активность нейронов, восстанавливает метаболизм и рост поврежденных структур нервной ткани. 4 с. и 6 з.п. ф-лы, 6 табл., 3 ил.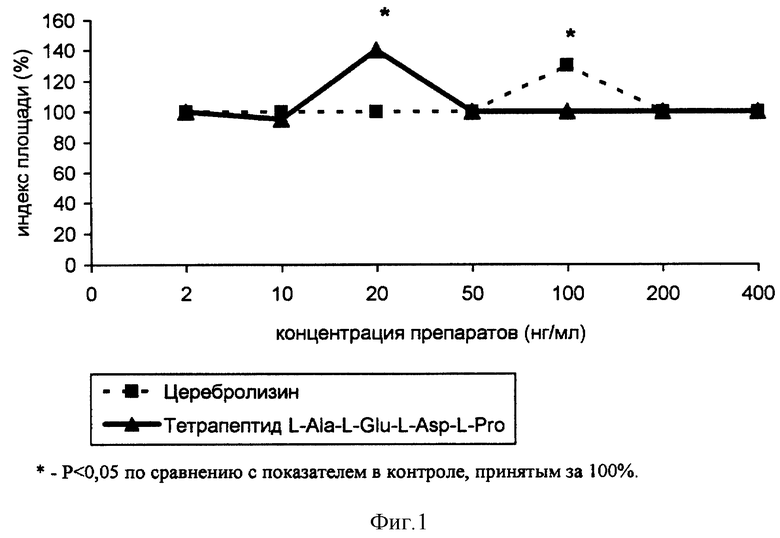
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| МАШКОВСКИЙ М.Д | |||
| Лекарственные средства | |||
| - Вильнюс, 1993, ч | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Приспособление для записи звуковых явлений на светочувствительной поверхности | 1919 |
|
SU101A1 |
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| ТЕТРАПЕПТИД, ОБЛАДАЮЩИЙ СПОСОБНОСТЬЮ ОПТИМИЗИРОВАТЬ ОБУЧЕНИЕ И ВОСПРОИЗВЕДЕНИЕ ИНФОРМАЦИИ В СТРЕССОВЫХ УСЛОВИЯХ | 1989 |
|
RU1826485C |
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| НЕЙТРОПЕПТИДЫ, ОБЛАДАЮЩИЕ ПОВЕДЕНЧЕСКОЙ АКТИВНОСТЬЮ | 1989 |
|
SU1623166A1 |
| Очаг для массовой варки пищи, выпечки хлеба и кипячения воды | 1921 |
|
SU4A1 |
| Огнетушитель | 0 |
|
SU91A1 |
| Кипятильник для воды | 1921 |
|
SU5A1 |
| КАМЕНСКИЙ А.А | |||
| и др | |||
| Избирательное воздействие тетрапептида тафцина на центральную нервную систему при его интраназальном введении | |||
| В: Журнал высш | |||
| нерв | |||
| деятельности, 1989, N 4, с | |||
| Подогреватель воды паром | 1924 |
|
SU767A1 |
Авторы
Даты
2000-08-27—Публикация
1999-10-20—Подача