Изобретение относится к фармацевтической промышленности и предназначено для получения пептидов, обладающих тканеспецифической активностью, и может быть применено в медицине с целью нормализации функций различных органов и тканей.
В настоящее время существуют различные способы получения пептидов с различной биологической активностью.
Известны способы получения комплексных пептидных препаратов, обладающих тканеспецифическим действием: тималина (1), эпиталамина (2), простатилена (3), кортексина (4), ретиналамина (5). Эти препараты представляют собой комплексы низкомолекулярных полипептидов, которые получают из органов и тканей животных путем экстракции 3%-ным раствором уксусной кислоты с добавлением хлористого цинка и обработкой надосадочной жидкости ацетоном (6). Указанный способ получения препаратов характеризуется значительной вариабельностью физико-химических свойств выделяемых пептидов, а также присутствием балластных компонентов. К недостаткам указанного способа получения комплексных пептидных препаратов следует также отнести ограниченные запасы необходимого органического сырья, трудоемкость и энергоемкость производства.
Известны способы получения пептидов классическим методом пептидного синтеза в растворе (7) на основе активных фракций, выделенных из тималина Glu-Trp (тимоген) (8), тимопоэтина II - Arg-Lys-Asp-Val-Tyr (тимопентин) (9), спленина - Arg-Lys-Glu-Val-Tyr (спленопентин) (10), иммуноглобулина G - Thr-Lys-Pro-Arg (тафцин) (II) и др. Однако вещества, полученные перечисленными способами, обладают преимущественно однонаправленным спектром биологической активности (иммунорегуляторной) и нестабильностью препаратов в растворе, а также большими применяемыми дозами.
Известны способы получения пептидов модифицированной структуры классическим методом пептидного синтеза в растворе (7): Arg- α- Asp-Lys-Val-Tyr-Arg (имунофан) (12), структура которого отличается от структуры тимопентина наличием аминокислотных замен с элонгированием цепи концевым аргинином, γ- Glu-Trp (бестим) (13), структура которого отличается от структуры тимогена γ- связью. Эти препараты также характеризуются узконаправленным иммунобиологическим действием и сложностью химического синтеза.
Известен также синтетический полимер (Сор 1), ингибирующий клеточный иммунитет (14).
Однако ни одно из известных решений не обладает строгой тканевой специфичностью.
Настоящим изобретением впервые поставлена и решена задача создания способа получения тканеспецифических пептидов и фармацевтических композиций на их основе, включающего проведение аминокислотного анализа уксуснокислых экстрактов ткани животного происхождения, выбор аминокислот, содержащихся в наибольшем количестве в исследуемой ткани, синтез центрального звена пептида, к обоим концам которого присоединяют аминокислоты, следующие по содержанию в исследуемых тканях в наибольшем количестве.
Согласно изобретению пептиды, полученные заявленным способом, оказывают действие на те ткани, аминокислотный состав которых служит основанием для их получения. Благодаря оригинальному подходу, изобретение позволяет выявить наиболее характерную для конкретного вида ткани животных или человека композицию аминокислот и создать фармацевтический состав, обладающий строгой специфичностью действия. Получаемые согласно изобретению фармацевтические композиции могут быть полезными для эффективного лечения широкого спектра заболеваний и состояний организма.
Поэтому настоящее изобретение никоим образом не ограничивается примерами иллюстрации способа, которые приведены в материалах настоящей заявки.
В частности, настоящим изобретением показано, что при аминокислотном анализе уксуснокислых экстрактов, например, эпифиза и коры головного мозга, центральное звено представлено глутаминовой кислотой (Glu) и аспарагиновой кислотой (Asp).
Фармацевтическая композиция, обладающая тканеспецифической активностью, содержит в качестве активного начала эффективное количество пептида, полученного заявляемым способом, и фармацевтически приемлемый носитель.
Носитель может иметь различные формы, которые зависят от лекарственной формы препаратов, желаемой для введения в организм, например, парентерального, интраназального или перорального.
При изготовлении композиций в предпочтительной дозированной форме для перорального применения могут использоваться любые известные фармацевтические компоненты.
Для парентерального (интраназального) введения носитель обычно включает стерильную воду, хотя могут быть включены другие ингредиенты, способствующие стабильности или для сохранения стерильности.
Заявляемое изобретение иллюстрируется следующими примерами:
аминокислотного анализа уксусно-кислых экстрактов тканей эпифиза и коры головного мозга (пример 1);
синтеза тетрапептида формулы (Ala-Glu-Asp-Gly) (пример 2);
влияние тетрапептида Ala-Glu-Asp-Gly на развитие эксплантатов подкорковых структур головного мозга (пример 3), наглядно демонстрирующее выявленные тканеспецифические свойства;
синтеза тетрапептида формулы (Ala-Glu-Asp-Pro) (пример 4);
влияние тетрапептида Ala-Glu-Asp-Pro на развитие эксплантатов коры головного мозга (пример 5), наглядно демонстрирующее выявленные тканеспецифические свойства;
Пример 1. Аминокислотный анализ уксусно-кислых экстрактов тканей эпифиза и коры головного мозга (см. таблицу в конце описания).
Пример 2. Синтез тетрапептида Ala-Glu-Asp-Gly
1. Название соединения: аланил-глутамил-аспартил-глицин.
2. Структурная формула:
H-Ala-Glu-Asp-Gly-OH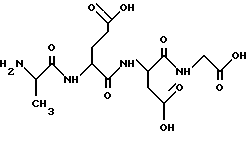
3. Брутто-формула без противоиона: C14H22N4O9.
4. Молекулярный вес без противоиона: 390,35.
5. Противоион: ацетат.
6. Внешний вид: белый аморфный порошок без запаха.
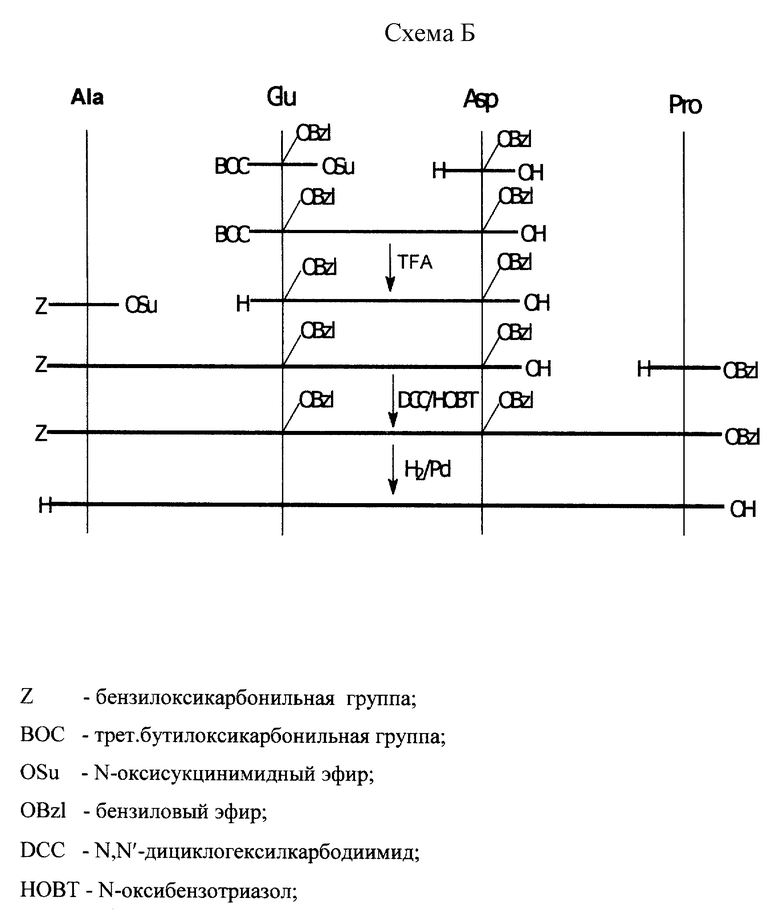
7. Способ синтеза: пептид получен классическим методом синтеза в растворе по схеме A (см. в конце описания).
В качестве растворителя использовали N,N'-диметилформамид, при введении аспарагиновой кислоты использовали защиту α- COOH группы солеобразованием с триэтиламином. Деблокирование ВОС- защитной группы проводили раствором трифторуксусной кислоты (TFA), Z-защитной группы каталитическим гидрогенолизом. Выделение и очистка препарата осуществлялись методом препаративной ВЭЖХ на колонке с обращенной фазой.
Характеристики готового препарата:
аминокислотный анализ
Glu Asp Ala Gly;
1,02 1,00 1,01 1,00;
содержание основного вещества 98,4% (по ВЭЖХ, 220 нм);
ТСХ - индивидуален, Rf= 0,73 (ацетонитрил-уксусная к-та-вода 5:1:3);
содержание влаги: 5%;
pH 0,001% раствора: 4,37;
удельное оптическое вращение [α]D22:-32° (с=1, H2O).
Пример синтеза:
1) BOC-Glu(OBzl)-Asp(OBzl)-OH (I), N-тpет. бутилоксикарбонил- γ- бензил)глутамил-(β- бензил)аспартат.
N-оксисукцинимидный эфир N-трет.бутилоксикарбонил- (γ- бензил)глутаминовой кислоты BOC-Glu(OBzl)-OSu 4,34 г (0,0100 моль) растворяют в 20 мл диметилформамида, добавляют триэтиламин 1,72 мл (0,0125 моль) и β- бензиласпартат 2,80 г (0,0125 моль). Перемешивают при комнатной температуре 24 час. Продукт высаживают 0,5 н. раствором серной кислоты (150 мл), экстрагируют в этилацетат (3х30 мл), промывают 0,5 н. раствором серной кислоты (2х20 мл), водой, 5% раствором бикарбоната натрия (1х20 мл), водой, 0,5 н. раствором серной кислоты (2х20 мл), водой и сушат над безводным сульфатом натрия. Этилацетат фильтруют, упаривают в вакууме при 40oC, остаток сушат в вакууме над P2О5. Получают масло 5,68 г (≈100%). Rf = 0,42 (бензол-ацетон 2: 1, пластинки ПТСХ-П-В-УФ Sorbfil, силикагель СТХ-1ВЭ 8-12 мкм, проявление УФ и хлор/бензидин).
2) TFA·H-Glu(OBzl)-Asp(OBzl)-OH (II), трифторацетат (γ- бензил)-глутамил-(β- бензил)аспартата.
N-трет. бутилоксикарбонил-(γ- бензил)глутамил-(β- бензил) аспартат (I) 5,68 г (≈0,01 моль) растворяют в 20 мл смеси дихлорметан-трифторуксусная кислота (3:1). Через 2 часа растворитель упаривают в вакууме при 40oC, упаривание повторяют с новой порцией дихлорметана (2х10 мл), остаток сушат в вакууме над NaOH. Получают масло 5,80 г (≈100%). Rf = 0,63 (н-бутанол-пиридин-уксусная кислота-вода, 15:10:3:12).
3) Z-Ala-Glu(OBzl)-Asp(OBzl)-OH (III), N-карбобензоксиаланил- (γ- бензил)глутамил-(β- бензил)аспартат.
Трифторацетат (γ- бензил) глутамил-(β- бензил)аспартата (II) 5,65 г (0,01 моль) растворяют в 10 мл диметилформамида, добавляют триэтиламин 2,80 мл (0,02 моль) и N-оксисукцинимидный эфир N-карбобензоксиаланина 4,14 г (0,013 моль). Смесь перемешивают 24 часа при комнатной температуре. Продукт высаживают 0,5 н. раствором серной кислоты (150 мл), экстрагируют в этилацетат (3х30 мл), промывают 0,5 н. раствором серной кислоты (2х20 мл), водой, 5% раствором бикарбоната натрия (1х20 мл), водой, 0,5 н. раствором серной кислоты (2х20 мл), водой и сушат над безводным сульфатом натрия. Этилацетат фильтруют, упаривают в вакууме при 40oC, остаток закристаллизовывают в системе этилацетат/гексан. Продукт отфильтровывают и сушат в вакууме над P2O5. Выход 4,10 г (66%). Тпл.= 154oC. Rf = 0,48 (бензол-ацетон, 1:1), Rf = 0,72 (н-бутанол-пиридин-уксусная кислота-вода, 15:10:3:12).
4) Z-Ala-Glu(OBzl)-Asp(OBzl)-Gly-OBzl (III), бензиловый эфир N-карбобензоксиаланил-(γ- бензил)глутамил-(β- бензил) аспартилглицина.
TosOH·H-Gly-OBzl, тозилат бензилового эфира глицина 1,01 г (3 ммоль) суспендируют в 15 мл тетрагидрофурана и при перемешивании добавляют триэтиламин 0,4 мл (3 ммоль), далее через 5 мин N-карбобензоксиаланил-(γ- бензил)глутамил-(β- бензил)аспартат (III) 1,28 г (2 ммоль), N-оксибензотри-азол 0,27 г (2 ммоль) и охлаждают смесь до 0oC. Затем добавляют охлажденный до 0oC раствор N, N'-дициклогексилкарбодиимида 0,42 г (2 ммоль) в 5 мл тетрагидрофурана, перемешивают смесь при этой температуре 2 часа и оставляют на ночь перемешиваться при комнатной температуре. Осадок дициклогексилмочевины отфильтровывают, растворитель упаривают в вакууме, остаток растворяют в 30 мл этилацетата и промывают раствор 1 н. раствором соляной кислоты, водой, 5%-ным раствором бикарбоната натрия, водой, 1 н. раствором соляной кислоты, водой и сушат над безводным сульфатом натрия. Растворитель упаривают в вакууме и продукт закристаллизовывают в системе этилацетат/гексан. Выход 1,30 г (82%). Тпл. = 146-148oC. Rf= 0,75 (бензол-ацетон, 2:1).
5) H-Ala-Glu-Asp-Gly-OH (IV), аланил-глутамил-аспартил-глицин.
Бензиловый эфир N-карбобензоксиаланил-(γ- бензил)глутамил- (β- бензил)аспартилглицина (III) 1,25 г гидрировали в системе метанол-вода-уксусная кислота (3:1:1) над катализатором Pd/C. Контроль за полнотой деблокирования в ТСХ системах бензол-ацетон (2:1) и ацетонитрил-уксусная кислота-вода (5:1: 3). По окончании реакции катализатор отфильтровывают, фильтрат упаривают в вакууме и остаток закристаллизовывают в системе вода/метанол. Продукт сушат в вакууме над КОН. Выход 520 мг (95%). Rf= 0,73 (ацетонитрил-уксусная кислота-вода, 5:1:3). Для очистки 390 мг препарата растворяли в 4 мл 0,01% трифторуксусной кислоты и подвергали высокоэффективной жидкостной хроматографии на колонке с обращенной фазой 50х250 мм Diasorb-130-C16T, 7 mkm. Хроматограф Beckman System Gold, 126 Solvent Module, 168 Diode Array Detector Module. Условия хроматографирования A: 0,1% TFA; В: 50% MeCN/0,1% TFA, градиент В 0 ---> 5% за 80 мин. Объем пробы 5 мл, детекция при 215 нм, сканирование 190-600 нм, скорость потока 10 мл/мин. Отбирали фракцию 54,0-66,0 мин. Растворитель упаривали в вакууме при температуре не выше 40oC, упаривание многократно (5 раз) повторяли с 10 мл 10% раствора уксусной кислоты. Окончательно остаток растворяли в 20 мл деионизованной воды и лиофилизовывали. Получено 290 мг очищенного препарата в виде аморфного белого порошка без запаха.
Полученный пептид в виде ацетата переводят в свободную форму обработкой анионитом IRA или аналогичным в (OH-) - форме. Далее получают соли по аминогруппе, прибавляя эквивалент соответствующей кислоты (соляной или щавелевой). Полученный водный раствор лиофилизуют и анализируют как готовый продукт.
Для получения соответствующих солей по карбоксильным группам к свободному тетрапептиду добавляют рассчитанное количество водного раствора гидроокиси соответствующего металла (NaOH, KOH, ZnOH2, LiOH, CaOH2, MgOH2, NH4OH). Для получения триэтиламмониевой соли обработку проводят аналогичным образом, используя в качестве основания триэтиламин.
6) Анализ готового препарата.
Содержание основного вещества определяли методом ВЭЖХ на колонке Supeilo LC-18-DB 4,6х250 mm, gard. LC-18-DB. A: 0,1% TFA; В: 50% MeCN/0,1% TFA; grad. В 0--->20% за 30 мин. Скорость потока 1 мл/мин. Детекция при 220 нм, сканирование 190-600 нм, проба 2 μ l. Содержание основного вещества 98,45%.
Аминокислотный анализ проводили на анализаторе ААА"Т-339" Prague. Гидролиз в 6 н. HCl; при 125oC 24 час.
Glu Asp Ala Gly
1,02 1,00 1,01 1,00
TCX: индивидуален, Rf= 0,73 (ацетонитрил-уксусная кислота-вода, 5:1:3 пластинки ПТСХ-П-В-УФ Sorbfil, силикагель СТХ-1ВЭ 8-12 мкм, проявление хлор/бензидин).
содержание влаги: 5% (гравиметрически по потере массы при сушке 20 мг при 100oC).
pH 0,001% раствора: 4,37 (потенциометрически).
Удельное оптическое вращение: [α]D22:-32° (с=1, H2O), "Polamat A", Carl Zeiss Jena.
Пример 3. Влияние тетрапептида Ala-Glu-Asp-Gly на развитие эксплантатов подкорковых структур головного мозга
Эксперименты проведены на 69 фрагментах подкорковых структур головного мозга 10-11-суточных эмбрионов цыпленка. Питательная среда для культивирования эксплантатов состояла из 35% раствора Игла, 25% фетальной сыворотки теленка, 35% раствора Хенкса, 5% куриного эмбрионального экстракта, в среду добавляли глюкозу (0,6%), инсулин (0,5 ед./мл), пенициллин (100 ед./мл), глютамин (2 мМ). Фрагменты подкорковых структур головного мозга помещали в эту среду и культивировали в чашках Петри, в термостате при температуре 36,7oC, в течение 2 суток. В экспериментальную среду добавляли тетрапептид Ala-Glu-Asp-Gly и эпиталамин в концентрациях 2, 10, 20, 50, 100, 200, 400 нг/мл. Критерием биологической активности служил индекс площади (ИП) - соотношение площади всего эксплантата вместе с зоной роста к исходящей площади фрагмента подкорковых структур. Достоверность различия сравниваемых средних значений ИП оценивали с помощью t-критерия Стъюдента. Значения ИП выражали в процентах, контрольное значение ИП принималось за 100%.
Зону роста контрольных эксплантатов подкорковых структур головного мозга составляли короткие нейриты, а также выселяющиеся клетки глии и фибробластоподобные клетки.
При исследовании непосредственного влияния препаратов на фрагменты подкорковых структур головного мозга были поставлены следующие серии опытов.
В питательную среду эксплантатов подкорковых структур головного мозга эмбрионов цыплят добавлялся эпиталамин в различных концентрациях. На 3-и сутки культивирования при концентрации 20 и 200 нг/мл наблюдалось достоверное повышение ИП эксплантатов на 20% и 26% соответственно, по сравнению с контрольными значениями ИП. Достоверных значений ИП эксплантатов подкорковых структур при действии других концентраций эпиталамина не наблюдалось (фиг. 1). Отчетливая стимуляция развития эксплантатов подкорковых структур головного мозга выявилась при действии тетрапептида Ala-Glu-Asp-Gly в концентрации 100 нг/мл, когда ИП опытных эксплантатов на 24% был выше ИП контрольных фрагментов подкорковых структур.
При исследовании эксплантатов подкорковых структур на более длительных сроках культивирования - 7 дней - выявились те же эффекты нейрит- стимулирующего действия, в тех же концентрациях. Иногда наблюдалось статистически недостоверное уменьшение ИП эксплантатов, видимо, за счет ретракции нервных волокон при увеличении сроков культивирования.
Пример 4. Синтез тетрапептида Ala-Glu-Asp-Pro
1. Название соединения: аланил-глутамил-аспартил-пролин.
2. Структурная формула:
H-Ala-Glu-Asp-Pro-OH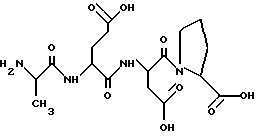
3. Брутто-формула без противоиона: C17H26N4O9.
4. Молекулярный вес без противоиона: 430,41.
5. Противоион: ацетат.
6. Внешний вид: белый аморфный порошок без запаха.
7. Способ синтеза: пептид получен классическим методом синтеза в растворе по схеме Б (см. в конце описания).
В качестве растворителя использовали N,N'-диметилформамид, при введении аспарагиновой кислоты использовали защиту 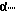 COOH группы солеобразованием с триэтиламином. Деблокирование BOC- защитной группы проводили раствором трифторуксусной кислоты (TFA), Z-защитной группы каталитическим гидрогенолизом. Выделение и очистка препарата осуществлялись методом препаративной ВЭЖХ на колонке с обращенной фазой.
COOH группы солеобразованием с триэтиламином. Деблокирование BOC- защитной группы проводили раствором трифторуксусной кислоты (TFA), Z-защитной группы каталитическим гидрогенолизом. Выделение и очистка препарата осуществлялись методом препаративной ВЭЖХ на колонке с обращенной фазой.
Характеристики готового препарата:
аминокислотный анализ
Glu Asp Ala Pro;
1,10 1,01 1,00 1,10;
содержание основного вещества: 98,56% (по ВЭЖХ, 220 нм);
ТСХ - индивидуален, Rf=0,67 (ацетонитрил-уксусная к-та- вода 5:1:3);
содержание влаги: 7%;
pH 0,001% раствора: 4,24;
удельное оптическое вращение: [α]D25:-78,9° (с=1.09, H2O), "Polamat A",
Carl Zeiss Jena.
Пример синтеза:
1) BOC-Glu(OBzl)-Asp(OBzl)-OH (I), N-трет.бутилоксикарбонил- (γ- бензил)глутамил-(β- бензил)аспартат.
N-оксисукцинимидный эфир N-трет.бутилоксикарбонил-(γ- бензил) глутаминовой кислоты BOC-Glu(OBzl)-OSu 4,34 г (0,0100 моль) растворяют в 20 мл диметилформамида, добавляют триэтиламин 1,72 мл (0,0125 моль) и β- бензиласпартат 2,80 г (0,0125 моль). Перемешивают при комнатной температуре 24 час. Продукт высаживают 0,5 н. раствором серной кислоты (150 мл), экстрагируют в этилацетат (3х30 мл), промывают 0,5 н. раствором серной кислоты (2х20 мл), водой, 5% раствором бикарбоната натрия (1х20 мл), водой, 0,5 н. раствором серной кислоты (2х20 мл), водой и сушат над безводным сульфатом натрия. Этилацетат фильтруют, упаривают в вакууме при 40oC, остаток сушат в вакууме над P2O5.
Получают масло 5,68 г (≈100%).
Rf = 0,42 (бензол-ацетон 2:1, пластинки ПТСХ-П-В-УФ Sorbfil, силикагель СТХ-1ВЭ 8-12 мкм, проявление УФ и хлор/бензидин).
2) TFA·H-Glu(OBzl)-Asp(OBzl)-OH (II), трифторацетат (γ- бензил)-глутамил-(β- бензил)аспартата.
N-трет.бутоксикарбонил-(γ- бензил)глутамил-(β- бензил) аспартат (I) 5,68 г (≈0,01 моль) растворяют в 20 мл смеси дихлорметан-трифторуксусная кислота (3: 1). Через 2 часа растворитель упаривают в вакууме при 40oC, упаривание повторяют с новой порцией дихлорметана (2х10 мл), остаток сушат в вакууме над NaOH. Получают масло 5,80 г (≈100%).
Rf= 0,63 (н-бутанол-пиридин-уксусная кислота-вода, 15:10:3:12).
3) Z-Ala-Glu(OBzl)-Asp(OBzl)-OH (III), N-карбобензоксиаланил- (γ- бензил)глутамил-(β- бензил)аспартат.
Трифторацетат (γ- бензил)глутамил-(β- бензил)аспартата (II) 5,65 г (0,01 моль) растворяют в 10 мл диметилформамида, добавляют триэтиламин 2,80 мл (0,02 моль) и N-оксисукцинимидный эфир N-карбобензоксиаланина 4,14г (0,013 моль). Смесь перемешивают 24 часа при комнатной температуре.
Продукт высаживают 0,5 н. раствором серной кислоты (150 мл), экстрагируют в этилацетат (3х30 мл), промывают 0,5 н. раствором серной кислоты (2х20 мл), водой, 5% раствором бикарбоната натрия (1х20 мл), водой, 0,5 н. раствором серной кислоты (2х20 мл), водой и сушат над безводным сульфатом натрия. Этилацетат фильтруют, упаривают в вакууме при 40oC, остаток закристаллизовывают в системе этилацетат/гексан. Продукт отфильтровывают и сушат в вакууме над P2O5. Выход 4,10 г (66%). Тпл.=154oC.
Rf= 0,48 (бензол-ацетон, 1:1), Rf= 0,72 (н-бутанол-пиридин-уксусная кислота-вода, 15:10:3:12).
4) Z-Ala-Glu(OBzl)-Asp(OBzl)-Pro-OBzl (III), бензиловый эфир N-карбобензоксиаланил-(γ- бензил)глутамил-(β- бензил)аспартилпролина.
HCl·H-Pro-OBzl, гидрохлорид бензилового эфира пролина 0,72 г (3 ммоль) суспендируют в 15 мл тетрагидрофурана и при перемешивании добавляют триэтиламин 0,4 мл (3 ммоль), далее через 5 мин. N-карбобензоксиаланил-(γ- бензил) глутамил-(β- бензил)аспартат (III) 1,28 г (2 ммоль), N-оксибензотри-азол 0,27 г (2 ммоль) и охлаждают смесь до 0oC. Затем добавляют охлажденный до 0oC раствор N,N'- дициклогексилкарбодиимида 0,42 г (2 ммоль) в 5 мл тетрагидрофурана, перемешивают смесь при этой температуре 2 часа и оставляют на ночь перемешиваться при комнатной температуре. Осадок дициклогексилмочевины отфильтровывают, растворитель упаривают в вакууме, остаток растворяют в 30 мл этилацетата и промывают раствор 1 н. раствором соляной кислоты, водой, 5%-ным раствором бикарбоната натрия, водой, 1 н. раствором соляной кислоты, водой и сушат над безводным сульфатом натрия. Растворитель упаривают в вакууме и продукт закристаллизовывают в системе этилацетат/гексан. Выход 1,50 г (90%). Тпл. = 125-128oC. Rf=0,40 (бензол-ацетон, 2:1).
5) H-Ala-Glu-Asp-Pro-OH (IV), аланил-глутамил-аспартил-пролин.
Бензиловый эфир N-карбобензоксиаланил-(γ- бензил)глутамил-(β- бензил)аспартилпролина (III) 1,50 г гидрировали в системе метанол- вода-уксусная кислота (3:1:1) над катализатором Pd/C. Контроль за полнотой деблокирования в ТСХ системах бензол-ацетон (2:1) и ацетонитрил-уксусная к-та-вода (5:1:3). По окончании реакции катализатор отфильтровывают, фильтрат упаривают в вакууме и остаток закристаллизовывают в системе вода/метанол. Продукт сушат в вакууме над KOH. Выход 0,66 г (86%).
Rf= 0, 67 (ацетонитрил-уксусная к-та-вода, 5:1:3).
Для очистки 508 мг препарата растворяли в 4 мл 0,01% трифторуксусной кислоты (pH пробы 2,23) и подвергали высокоэффективной жидкостной хроматографии на колонке с обращенной фазой 50х250 мм Diasorb-130-C16T, 7 μ. Хроматограф Beckman System Gold, 126 Solvent Module, 168 Diode Array Detector Module. Условия хроматографирования A: 0,1% TFA; В: 50% MeCN/0,1% TFA, градиент В 0 ---> 16% за 240 мин. Объем пробы 5 мл, детекция при 215 нм, сканирование 190-600 нм, скорость потока 10 мл/млн. Отбирали фракцию 127-155 мин.
Растворитель упаривали в вакууме при температуре не выше 40oC, упаривание многократно (5 раз) повторяли с 10 мл 10% раствора уксусной кислоты.
Окончательно остаток растворяли в 20 мл деионизованной воды и лиофилизовывали. Получено 303 мг очищенного препарата в виде аморфного белого порошка без запаха.
Для получения соответствующих солей по карбоксильным группам к свободному тетрапептиду добавляют рассчитанное количество водного раствора гидроокиси соответствующего металла (NaOH, KOH, ZnOH2, LiOH, CaOH2, MgOH2, NH4OH).
Для получения триэтиламмониевой соли обработку проводят аналогичным образом, используя в качестве основания триэтиламин.
б) Анализ готового препарата.
Содержание основного вещества определяли методом ВЭЖХ на колонке Supelco LC-18-DB 4,6х250 mm, gard. LC-18-DB. A: 0,1% TFA; В: 50% MeCN/0,1%TFA; grad. В 0--->20% за 30 мин. Скорость потока 1 мл/мин. Детекция при 220 нм, сканирование 190-600 нм, проба 20 μ l. Содержание основного вещества 98,56%.
Аминокислотный анализ проводили на анализаторе ААА "Т-339" Prague. Гидролиз в 6 н. HCl при 125oC 24 час.
Glu Asp Ala Pro
1,10 1,01 1,00 1,10
ТСХ: индивидуален, Rf= 0,67 (ацетонитрил-уксусная к-та-вода, 5:1:3 пластинки ПТСХ-П-В-УФ Sorbfil, силикагель СТХ-1ВЭ 8-12 мкм, проявление хлор/бензидин).
Содержание влаги: 7% (гравиметрически по потере массы при сушке 20 мг при 100oC).
pH 0,001% раствора: 4,24 (потенциометрически).
Удельное оптическое вращение: [α]D25:-78,9° (с=1.09, H2O), "Polamat A", Carl Zeiss Jena.
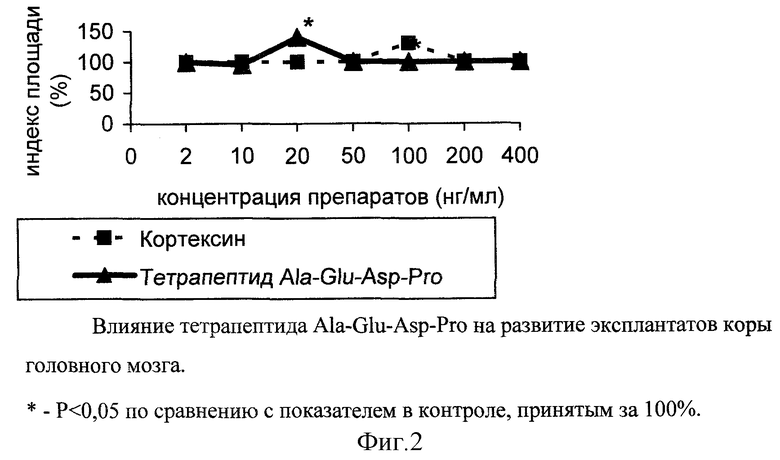
Пример 5. Влияние тетрапептида Ala-Glu-Asp-Pro на развитие эксплантатов коры головного мозга
Эксперименты проведены на 73 фрагментах коры головного мозга 10-11-суточных эмбрионов цыпленка. Питательная среда для культивирования эксплантатов состояла из 35% раствора Игла, 25% фетальной сыворотки теленка, 35% раствора Хенкса, 5% куриного эмбрионального экстракта, в среду добавляли глюкозу (0,6%), инсулин (0,5 ед./мл), пенициллин (100 ед./мл), глютамин (2 мМ). Фрагменты коры головного мозга помещали в эту среду и культивировали в чашках Петри, в термостате при температуре 36,7oC, в течение 2 суток. В экспериментальную среду добавляли тетрапептид Ala-Glu-Asp-Pro и кортексин в концентрациях 2, 10, 20, 50, 100, 200, 400 нг/мл. Критерием биологической активности служил индекс площади (ИП)-соотношение площади всего эксплантата вместе с зоной роста к исходящей площади фрагмента коры. Достоверность различия сравниваемых средних значений ИП оценивали с помощью t-критерия Стъюдента. Значения ИП выражали в процентах, контрольное значение ИП принималось за 100%.
Зону роста контрольных эксплантатов коры составляли короткие нейриты, а также выселяющиеся клетки глии и фибробластоподобные клетки.
При исследовании непосредственного влияния препаратов на фрагменты коры головного мозга были поставлены следующие серии опытов.
В питательную среду эксплантатов коры головного мозга эмбрионов цыплят добавлялся кортексин в различных концентрациях. На 3-и сутки культивирования при концентрации 100 нг/мл наблюдалось достоверное повышение ИП эксплантатов на 30±2%, по сравнению с контрольными значениями ИП. Достоверных значений ИП эксплантатов коры при действии других концентраций кортексина не наблюдалось (фиг. 2). Отчетливая стимуляция развития эксплантатов коры головного мозга выявилась при действии тетрапептида Ala-Glu- Asp-Pro в концентрации 20 нг/мл, когда ИП опытных эксплантатов на 40±7% был выше ИП контрольных фрагментов коры.
При исследовании эксплантатов коры на более длительных сроках культивирования - 7 дней - выявились те же эффекты нейрит-стимулирующего действия, в тех же концентрациях. Иногда наблюдалось статистически недостоверное уменьшение ИП эксплантатов, видимо, за счет ретракции нервных волокон при увеличении сроков культивирования.
Таким образом, в отношении тканей головного мозга наблюдалось уменьшение порога эффективных концентраций для тетрапептида Ala-Glu-Asp-Pro, по сравнению с кортексином. Так, фрагменты культивируемой коры стимулировались при действии кортексина в концентрации 100 нг/мл, а при действии тетрапептида - в концентрации 20 нг/мл. Это свидетельствует о более выраженном и направленном действии на нейроны коры головного мозга тетрапептида Ala-Glu-Asp-Pro.
Проведенные исследования и эксперименты позволяют сделать вывод о том, что пептиды, полученные заявляемым способом, и фармацевтические композиции, полученные на их основе, обладают тканеспецифической активностью, т.е. оказывают действие на те ткани, аминокислотный состав которых служит основанием для их получения.
ИСТОЧНИКИ ИНФОРМАЦИИ
1. Способ получения иммуностимулятора из тимуса. - Патент РФ N 1112606. - 1982.
2. Способ получения вещества, обладающего противоопухолевым действием. - Патент РФ N944191.-1980.
3. Патент РФ N 1417244, "Способ получения вещества, восстанавливающего функцию предстательной железы", 1986.
4. Способ получения из животного сырья комплекса биологически активных полипептидов, нормализующих функции головного мозга, фармакологическая композиция и ее применение. - Патент РФ N 2104702. - 1996.
5. Средство, восстанавливающее функцию сетчатой оболочки глаза. - Патент РФ N 2073518.- 1993.
6. Морозов В.Г., Хавинсон В.Х. Пептидные биорегуляторы (25-летний опыт экспериментального и клинического изучения). - СПб.: Наука, 1996. - 74 с.
7. Якубке Х.-Д., Ешкайт X. Аминокислоты, пептиды, белки: Пер. с нем. - М.: Мир, 1985. - 456 с.
8. Хавинсон В.Х., Жуков В.В., Дейгин В.И., Коротков А.М. Влияние тималина и синтетического пептида тимуса на активность ферментов метаболизма пуриновых нуклеотидов в тимоцитах // Тез. докл. науч. конф. "Биохимия - медицине". - Л., 1988. -С. 198-199.
9. Schlesinger D. H. , Goldstein G. The amino acid seguence of thymopoietin II // Cell. - 1975. - Vol. 5, N4.-P. 361-365.
10. Audhya Т., Scheid M.P., Goldstein G. Contrasting biological activities of thymopoietin and splenin, two closely related polypeptide products of thymus and spleen // Proc. Natl. Acad. Sci. USA. - 1984. - Vol. 81, N9. -P. 2847-2849.
11. Fridkin М. , Najjar V.A. Tuftsin: its chemistry, biology, and clinical potential // Crit. Rev. Biochem. Mol. Biol. - 1989. - Vol. 24, N1.-P. 1-40.
12. Покровский В. И., Сулейманов А.К., Лебедев В.В. и др. Иммунореабилитирующее действие тимогексина при лечении больных хроническим бруцеллезом // Терапевтический архив. - 1992. -Т. 64, N11.-С. 22-26.
13. Пигарева Н.В., Калинина Н.М., Симбирцев А.С. Характеристика иммуностимулирующего действия синтетического дипептида "бестим" // Медицинская иммунология. - 1999. -Т. 1, N 3- 4. - С. 127.
14. Teitelbaum D., Aharoni R., Arnon R., Sela M. Specific inhibition of the T-cell response to myelin basic protein by the synthetic copolymer Cop I // Proc. Natl. Acad. Sci. USA. - 1988. - Vol. 85, N 24. - P. 9724-9728.

Изобретение относится к медицине, в частности к фармакологии, а именно к способам получения лекарственных средств на основе пептидов, нормализующих функции различных органов и тканей. Способ получения пептидов заключается в том, что по результатам количественного аминокислотного анализа уксусно-кислых экстрактов тканей животного происхождения выбирают две аминокислоты, содержащиеся в наибольшем количестве в исследуемых тканях, и синтезируют из этих аминокислот центральное звено, к которому далее присоединяют аминокислоты, следующие из содержащихся в наибольшем количестве в исследуемых тканях. Технический результат: полученные пептиды, а также фармацевтические композиции, содержащие их в качестве активного начала, обладают тканеспецифической активностью. 2 с. и 4 з.п. ф-лы, 1 табл., 2 ил.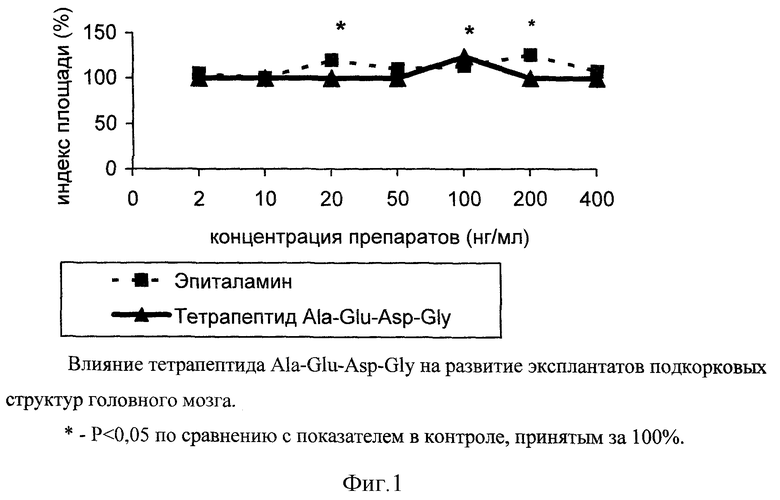
| Способ получения пептидов | 1986 |
|
SU1531858A3 |
| СПОСОБ ПОЛУЧЕНИЯ ПЕПТИДОВ, ОБЛАДАЮЩИХ АНТИГОНАДОТРОПНЫМ ДЕЙСТВИЕМ | 1997 |
|
RU2136296C1 |
| ПЕПТИДЫ И КОМПОЗИЦИЯ НА ИХ ОСНОВЕ, СПОСОБНАЯ РЕГУЛИРОВАТЬ ИММУННУЮ ФУНКЦИЮ МЛЕКОПИТАЮЩИХ | 1990 |
|
RU2036930C1 |
| ПОЛИПЕПТИДЫ, ОБЛАДАЮЩИЕ АКТИВНОСТЬЮ ЛЕГОЧНО-ПОВЕРХНОСТНО АКТИВНОГО ВЕЩЕСТВА, И ФАРМКОМПОЗИЦИЯ | 1995 |
|
RU2145611C1 |
| Способ прогнозирования гемодинамических нарушений при спинномозговой анестезии во время операции кесарево сечение у первородящих юного возраста | 2017 |
|
RU2657784C1 |
| СОПОЛИМЕРИЗУЕМЫЕ СЕРОСОДЕРЖАЩИЕ УСИЛИТЕЛИ АДГЕЗИИ И КОМПОЗИЦИИ, ИХ СОДЕРЖАЩИЕ | 2013 |
|
RU2624019C2 |
| KAIDASHEV I.P | |||
| Comparative study of chromatographic spectra of polypeptides extracted from pig spleen, liver, kidneys, thymus and periodontium | |||
| Ukr-Biokhim-Zn | |||
| Топка с качающимися колосниковыми элементами | 1921 |
|
SU1995A1 |
| Топка с качающимися колосниковыми элементами | 1921 |
|
SU1995A1 |
Авторы
Даты
2001-01-10—Публикация
2000-06-29—Подача