Изобретение относится к новым азотсодержащим гетероциклическим соединениям, обладающим пестицидной активностью, в частности к производным пиримидина.
Известны производные тиено[2,3-d]пиримидина, обладающие пестицидной активностью, в частности фунгицидной и инсекто-акарицидной активностью (см. заявку EP N 0447891 A1, C 07 D 495/04, A 01 N 49/00, 25.9.1991 г.).
Задачей изобретения является расширение ассортимента высокоактивных производных пиримидина, обладающих пестицидной активностью, в частности фунгицидной и инсекто-акарицидной активностью.
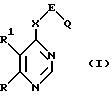
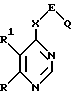
Поставленная задача решается предлагаемыми производными пиримидина общей формулы (I)
где R - алкил с 1 - 4 атомами углерода, алкооксиалкил с 1 - 4 атомами углерода в каждой алкильной части,
R1 - водород, алкил с 1 - 4 атомами углерода, алкокси с 1 -4 атомами углерода, галоген, или
R и R1 вместе с атомом углерода, с которым они связаны, образуют 5-, 6-членное ненасыщенное изоциклическое кольцо, или
R и R1 вместе с атомами углерода, с которыми они связаны, образуют 5-, 6- или 7-членное насыщенное изоциклическое кольцо,
X - группа NH или кислород,
E - прямая связь или неразветвленный или разветвленный алкандиил с 1 - 4 атомами углерода,
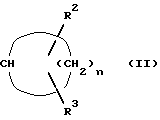
Q - циклоалкильная группа общей формулы (II)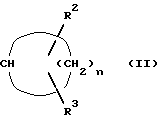
где n - целое число 2 - 7,
R2 и R3 одинаковы или различны и означают водород, алкил с 1 - 12 атомами углерода, циклоалкил с 3 - 8 атомами углерода, циклоалкокси с 3 - 8 атомами углерода, фенил, бензилокси, бензилоксиалкил с 1 - 4 атомами углерода в алкильной части или фенокси, причем фенильное кольцо незамещено или замещено одним или двумя одинаковыми или различными остатками из группы, включающей алкил с 1 - 8 атомами углерода, галоген, алкокси с 1 - 8 атомами углерода, алкокси-алкил с 1 - 4 атомами углерода в каждой алкильной части, группа H5C2-O-[CH2-CH2-O-] x, 2-(тетрагидро-2H-пиран-2-илокси)-этокси, бензилоксигруппа, фенильная часть которой может быть одно- или двукратно замещена одинаковым или различным алкилом с 1 - 4 атомами углерода, причем R2 и R3 одновременно не могут означать водород и в двух смежных заместителях, которые одинаковы или различны и выбраны из группы, включающей алкил с 1 - 8 атомами углерода и алкокси с 1 - 8 атомами углерода, один атом водорода может быть заменен связью C - C, связывающей оба заместителя, или
R2 и R3 вместе с циклоалкильной группой образуют 3 - 8-членную спироциклическую кольцевую систему, которая вместо одной или двух групп CH2 может содержать кислород, или же вместе с атомами углерода, с которыми они связаны, образуют 5- или 6-членный изоцикл,
x - 2, 3 или 4,
или
Q - группа общей формулы (III)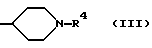
где R4 означает группу общей формулы Z-W, где Z означает прямую связь или карбонил, W - фенил, который может быть замещен одним или двумя одинаковыми или различными заместителями из группы, включающей алкил с 1 - 8 атомами углерода, галоген, алкокси с 1 - 4 атомами углерода, и их кислотно-аддитивными солями.
В первую группу предпочтительных производных пиримидина общей формулы (I) входят соединения, у которых
R - алкил с 1 - 4 атомами углерода или метил,
R1 - водород, алкил с 1 - 3 атомами углерода, метокси, этокси или галоген,
R и R1 вместе с атомами углерода, с которыми они связаны, образуют 5- или 6-членное ненасыщенное изоциклическое кольцо,
Q имеет указанное в п. 1 значение,
и их кислотно-аддитивные соли.
Во вторую группу предпочтительных производных пиримидина общей формулы (I) входят соединения, у которых
R - метил, этил или метоксиметил,
R1 - метил, этил, метокси, хлор или бром, или
R и R1 вместе с атомами углерода, с которыми они связаны, образуют хиназолиновую систему,
Q имеет указанное в п. 1 значение,
и их кислотно-аддитивные соли.
В третью группу предпочтительных производных пиримидина общей формулы (I) входят соединения, у которых
E - прямая связь,
R - метил, этил или метоксиметил,
R1 - хлор, бром или метокси,
R и R1 вместе с атомами углерода, с которыми они связаны, образуют хиназолиновую систему,
или
R и R1 вместе с пиримидиновым кольцом образуют 5,6,7,8-тетрагидрохиназолиновую систему,
Q имеет указанное в п. 1 значение,
и их кислотно-аддитивные соли.
В четвертую группу предпочтительных производных пиримидина общей формулы (I) входят соединения, у которых
R - метоксиметил и R1 метокси, или
R - метил или этил и R1 - хлор или бром, или
R и R1 вместе с атомами углерода, с которыми они связаны, образуют хиназолиновую систему, или 5,6,7,8-тетрагидрохиназолиновую систему,
Q - циклоалкильная группа общей формулы (II) по п. 1,
и их кислотно-аддитивные соли.
В пятую группу предпочтительных производных пиримидина общей формулы (I) входят соединения, у которых
E - прямая связь,
R - метоксиметил и R1 метокси, или
R - этил и R1 - хлор, или
R и R1 вместе с атомами углерода, с которыми они связаны, образуют хиназолин или 5,6,7,8-тетрагидрохиназолин,
Q - замещенный в положении 3 или 4 циклоалкил общей формулы (II) по п. 1, где
n - 4 или 5,
R2 - алкил с 1 - 2 атомами углерода, циклопентил циклогексил, фенил и фенокси, причем фенил и фенокси могут быть замещены одним или двумя одинаковыми или различными остатками из группы, включающей фтор, хлор, бром, алкил с 1 - 4 атомами углерода, алкокси с 1 - 4 атомами углерода,
R3 - водород,
и их кислотно-аддитивные соли.
В шестую группу предпочтительных производных пиримидина общей формулы (I) входят соединения, у которых
E - прямая связь,
R - метоксиметил и R1 - метокси, или
R - этил и R1 - хлор, или
R и R1 вместе с атомами углерода, с которыми они связаны, образуют хиназолиновую или 5,6,7,8-тетрагидрохиназолиновую систему,
Q означает замещенный в положении 4 циклогексил, при этом E и заместитель в 4-ом положении циклогексила расположены по отношению друг к другу в цис-положении,
и их кислотно-аддитивные соли.
Кислоты, которые можно применять для образования кислотно-аддитивных солей, представляют собой неорганические кислоты, такие как, например, соляная кислота, бромистоводородная кислота, азотная кислота, серная кислота, фосфорная кислота, или органические кислоты, такие как, например, муравьиная кислота, уксусная кислота, пропионовая кислота, малоновая кислота, щавелевая кислота, фумаровая кислота, адипиновая кислота, стеариновая кислота, масляная кислота, метансульфокислота, бензолсульфокислота или толуолсульфокислота.
Соединения формулы (I) могут иметь несколько асимметричных атомов углерода. Поэтому они могут иметься в виде рацематов и диастереомеров, в связи с чем в объем изобретения входят как чистые изомеры, так и смеси изомеров. Смеси диастереомеров можно разделять на отдельные компоненты обычными методами, например, путем избирательной кристаллизации из пригодных растворителей или путем хроматографии. Рацематы можно разделять на энантиомеры обычными методами, например, путем образования соли с оптически активной кислотой, разделения диастереомерных солей и выделения чистых энантиомеров путем обработки основанием.
Производные пиримидина формулы (I) можно получать, например, за счет того, что соединение формулы (IV)
где R и R1 имеют вышеуказанные значения и Z означает удаляемую группу, такую как, например, галоген, алкилтио, алкансульфонилокси, арилсульфонилокси, алкилсульфонил или арилсульфонил, подвергают взаимодействию с нуклеофильным соединением формулы (V)
HX-E-Q, (V)
где X, E и Q имеют вышеуказанные значения,
и получаемые при этом соединения формулы (I) можно подвергать хлорированию или бромированию у атома C5 пиримидина, если R1 означают водород.
Вышеописанная реакция в принципе известна. Удаляемую группу Z можно выбирать из большого числа возможных радикалов. Она может означать, например, атом галогена, как, например, атом фтора, хлора, и брома или йода, или алкилтио, как, например, метилтио или этилтио, алкансульфонилокси, как, например, метан-, трифторметан- или этансульфонилокси, арилсульфонилокси, как, например, бензолсульфонилокси или толуолсульфонилокси, алкилсульфонил, как, например, мета- или этилсульфонил, арилсульфонил, как, например, фенил- или толуолсульфонил.
Вышеупомянутую реакцию проводят при температуре 20 - 150oC, целесообразно в присутствии основания и в случае необходимости в среде инертного органического растворителя, такого, как, например, N,N-диметилформамид, N,N-диметилацетамид, диметилсульфоксид, N-метилпирролидин-2-он, диоксан, тетрагидрофуран, 4-метил-2-пентанон, метанол, этанол, бутанол, этиленгликоль, простой этилен-гликолдиметиловый эфир, толуол, хлорбензол или ксилол. Однако можно также использовать смеси этих растворителей.
Если X означает кислород, то пригодными основаниями являются, например, карбонаты, бикарбонаты, амиды или гидриды щелочных или щелочноземельных металлов, такие, как, например, карбонат натрия, бикарбонат натрия, карбонат калия, амид натрия или гидрид натрия. В случае, если X означает группу NH, то в качестве основания используют, например, карбонаты, бикарбонаты, гидроксиды, амиды или гидриды щелочных или щелочноземельных металлов, такие, как, например, карбонат натрия, бикарбонат натрия, карбонат калия, гидроокись натрия, амид натрия или гидрид натрия, или органические основания, такие, как, например, триэтиламин или пиридин. Кроме того, в качестве вспомогательного основания можно также использовать второй эквивалент амина формулы V.
Исходные соединения формулы (IV) можно получать известными способами-аналогами. В качестве исходных продуктов используют производные ацетуксусной кислоты, которые через соответствующие гидроксипиримидины переводят в галогенпиримидины согласно следующей реакционной схеме: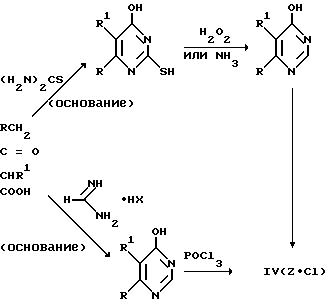
Исходные соединения формулы (IV) можно также получать известными способами-аналогами из сложных эфиров малоновой кислоты согласно следующей реакционной схеме:
Если X означает кислород, то необходимые в качестве исходных продуктов нуклеофильные соединения формулы (V) можно получать известными приемами, например, путем восстановления карбонильной группы пригодным восстанавливающим агентом, например, комплексным гидридом металла, или же в случае альдегида или кетона - также водородом в присутствии катализатора гидрирования. Дальнейшими возможностями являются реакция металлоорганических соединений с карбоксильной группой или оксираном. Для получения производных циклогексанола пригодные замещенные фонолы можно подвергать взаимодействию с водой в присутствии катализатора гидрирования.
Если X означает группу NH, то необходимые в качестве исходных продуктов нуклеофильные соединения формулы (V) можно также получать известными приемами, например, путем восстановления оксима или нитрила пригодным восстанавливающим агентом, например, комплексным гидридом металла или водородом в присутствии катализатора гидрирования, восстановительного аминирования или реакции по Лейкарту и Валлаху альдегида или кетона или реакции по Габриелу алкилгалогенида или алкилтозилата. Для получения производных циклогексиламина пригодные замещенные анилины можно подвергать взаимодействию с водородом в присутствии катализатора гидрирования.
Соединения формулы (I), где R1 означает галоген, можно получать галогенированием известными приемами согласно следующей реакционной схеме:
В случае получения производных 5-хлора можно использовать, например, элементарный хлор, гипохлорит натрия, сульфурилхлорид или N-хлорсукцинимид, а для бромирования особенно пригодны элементарный бром или N-бромсукцинимид. Пригодными растворителями являются, например, дихлорметан, хлороформ или ледяная уксусная кислота.
При хорошей переносимости растениями и выгодной токсичности теплокровных производные пиримидина формулы (I) и их кислотно-аддитивные соли пригодны для борьбы с животными вредителями, в частности с насекомыми, паукообразными животными, гельминтами, моллюсками, эндо- и эктопаразитами, особенно предпочтительно для борьбы с насекомыми и паукообразными животными, встречающимися в сельском хозяйстве, животноводстве, в лесах, при хранении продуктов на складе или при защите материала, а также в области гигиены. Они активны в отношении нормально чувствительных или устойчивых животных, а также в отношении отдельных или всех стадий развития животных.
Нижеследующие примеры иллюстрируют получение производных пиримидина формулы (I).
Пример 1
4-(4-трет.-бутилциклогексиламино)-5-хлор-6-этил-пиримидин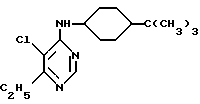
3,5 г (0,02 моль) 4,5-дихлор-6-этил-пиримидина и 7,8 г (0,05 моль) 4-трет. -бутилциклогексиламина нагревают до температуры 100oC в течение двух часов. После охлаждения до комнатной температуры к реакционной смеси добавляют смесь метиленхлорида и воды, органическую фазу сушат и сгущают. Для дальнейшей очистки и разделения цис- и транс-изомеров хроматографируют на силикагеле с применением в качестве элюента смеси петролейного эфира и этилацетата в соотношении 7 : 3.
Сначала элюируют транс-циклогексиламино-производное (0,8 г желтого масла, затвердевает, точка плавления: 94 - 96oC). После получения смешанной фракции, которую удаляют, получают цис-циклогексиламино-производное (3,0 г желтого масла).
Получение 4-трет.-бутилциклогексиламина
312 г 4-трет.-бутилциклогексанона гидрируют в 500 мл насыщенного аммиаком метанола в присутствии 10 г никеля Ренея при давлении 100 бар и температуре 100oC. После фильтрации катализатора сгущают и сырой продукт очищают на тонкослойном испарителе (100oC/0,5 мм). Получают 303 г бесцветной жидкости, представляющей собой смесь изомеров, которая в основном содержит цис-циклогексиламино-производное.
Пример 2
4-(цис-4-фенил-циклогексилокси)-5,6,7,8-тетрагидрохиназолин
К раствору 1,85 г (105 ммоль) цис-4-фенилциклогексанола в 30 мл абсолютного тетрагидрофурана добавляют порциями 0,5 г (16,7 ммоль) 80%-го гидрида натрия. Затем нагревают до температуры 50oC в течение одного часа и прикапывают 1,5 г (8,75 ммоль) 4-хлор-5,6,7,8-тетрагидрохиназолина, растворенного в 15 мл абсолютного тетрагидрофурана. Реакционную смесь нагревают с обратным холодильником в течение двух часов, после чего охлаждают до комнатной температуры, наливают на насыщенный раствор хлористого аммония, экстрагируют диэтиловым эфиром и объединенные органические фазы сушат над сульфатом магния. Растворитель упаривают в вакууме. Получают 2,7 r остатка, который очищают флеш-хроматографией на силикагеле с применением в качестве элюента смеси н-гексана и этилацетата в соотношении 2 : 1. После сгущения получают 1,5 г (50,2% теории) бесцветных кристаллов с точкой плавления 109oC.
Пример 3
4-(N-бензоил-пиперидил-4-окси)-5-метокси-6-метоксиметил-пиримидина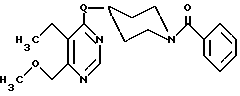
К суспензии 0,66 г (22 ммоль) 80%-го гидрида натрия в тетрагидрофуране добавляют 2,9 г (14,3 ммоль) N-бензоил-4-оксипиперидина (получаемого восстановлением бораном натрия N-бензоил-пиперидин-4-она). Затем нагревают до температуры 35 - 40oC в течение одного часа и добавляют 2,50 г (13,3 ммоль) 4-хлор-5-метокси-6-метоксиметилпиримидина. Реакционную смесь нагревают до температуры 40oC в течение пяти часов, наливают на насыщенный раствор хлористого аммония, взятого в небольшом количестве, и 5 раз экстрагируют этилацетатом. Объединенные органические фазы сушат над сульфатом магния. Получают 3,1 г остатка, который очищают путем флеш-хроматографии на силикагеле с применением в качестве элюента этилацетата. После сгущения получают 0,6 г (13% теории) желтого масла, nD 20 = 1,5825.
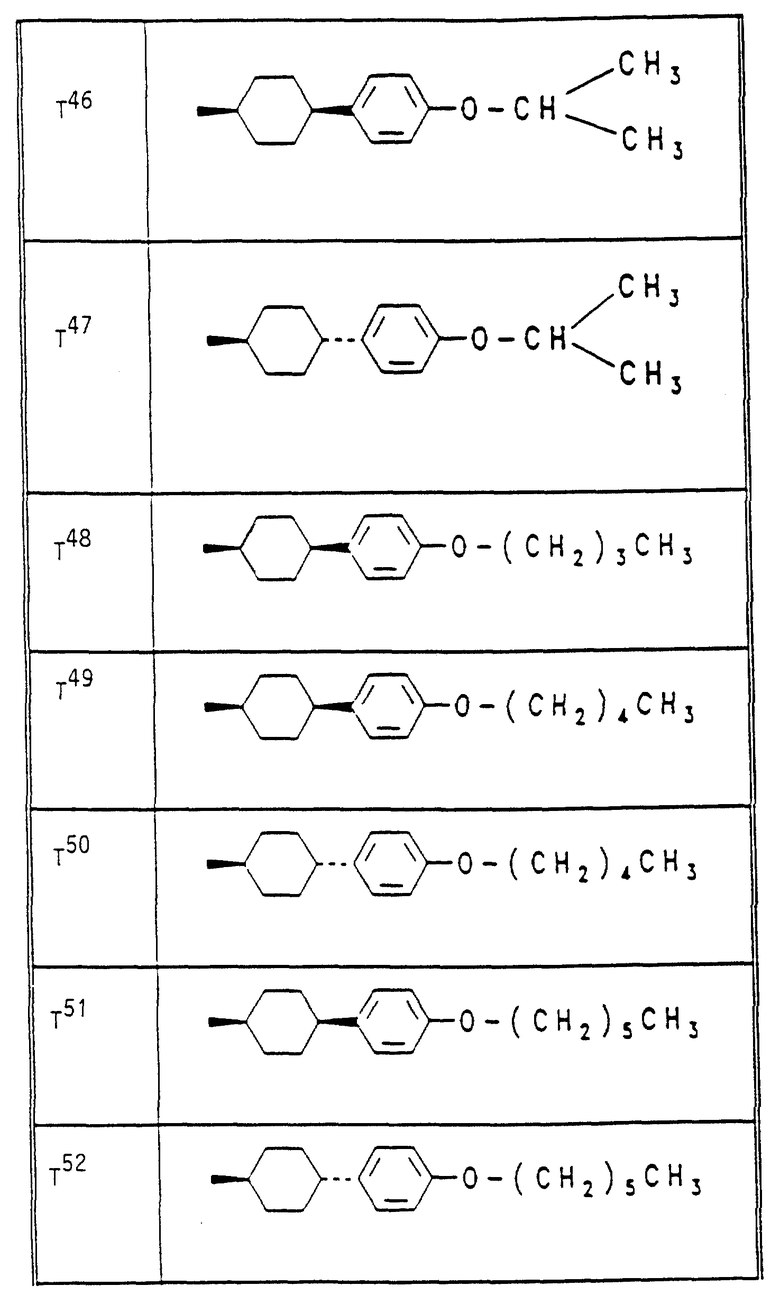
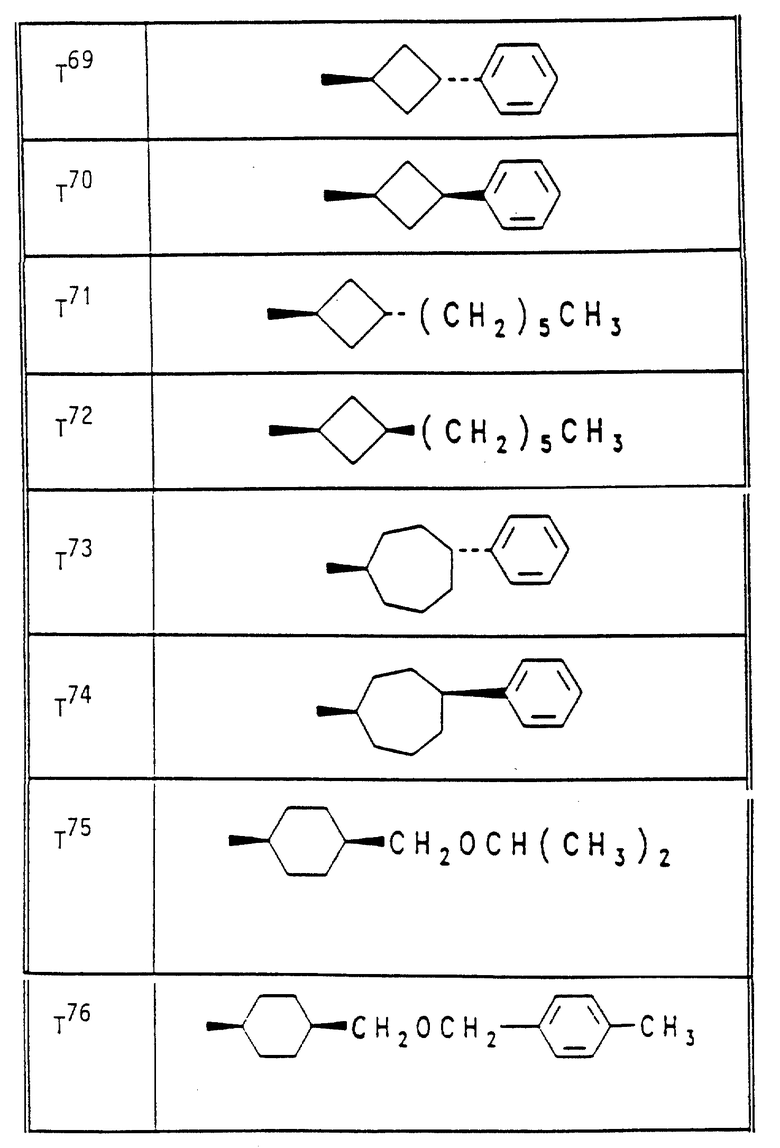
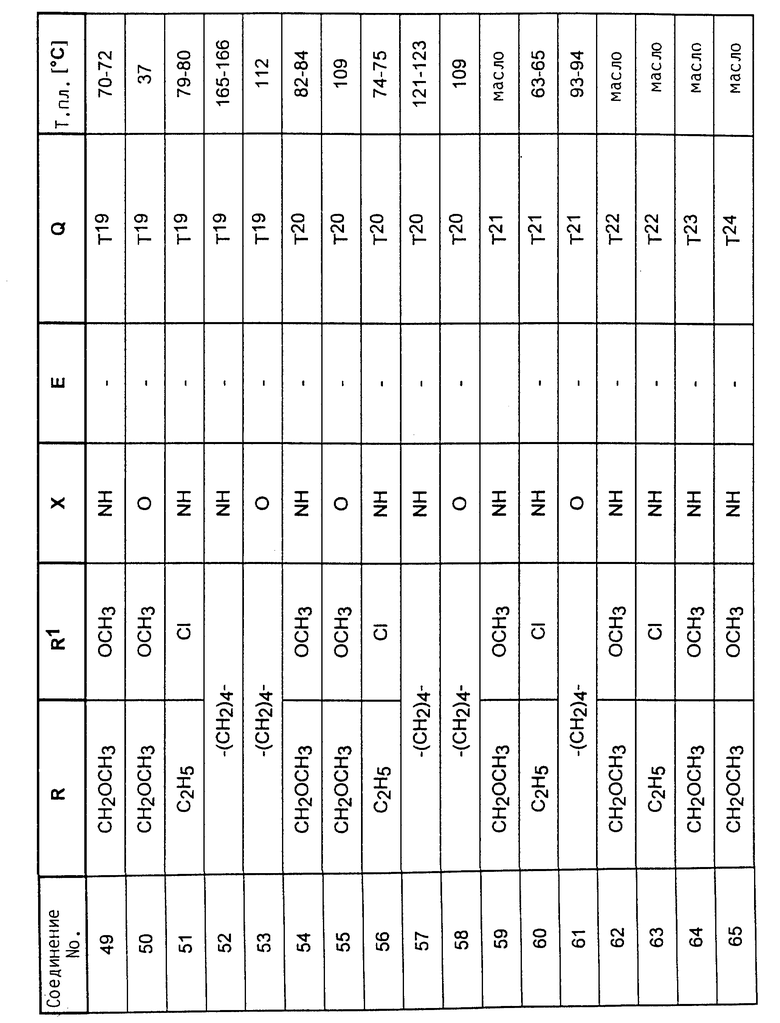
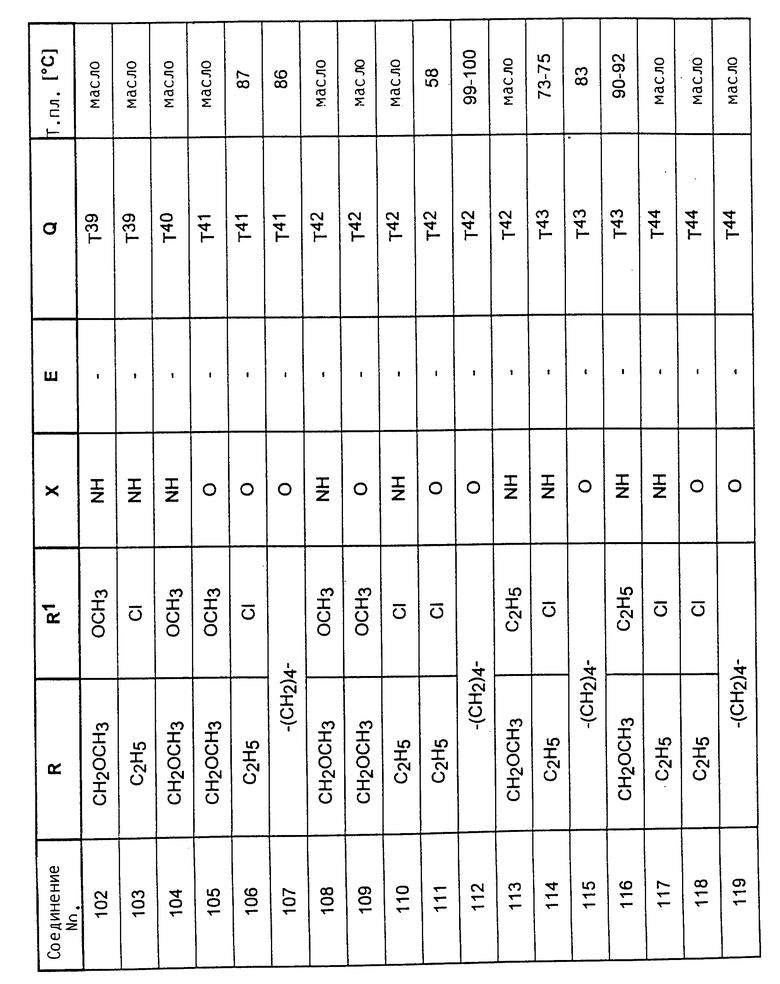
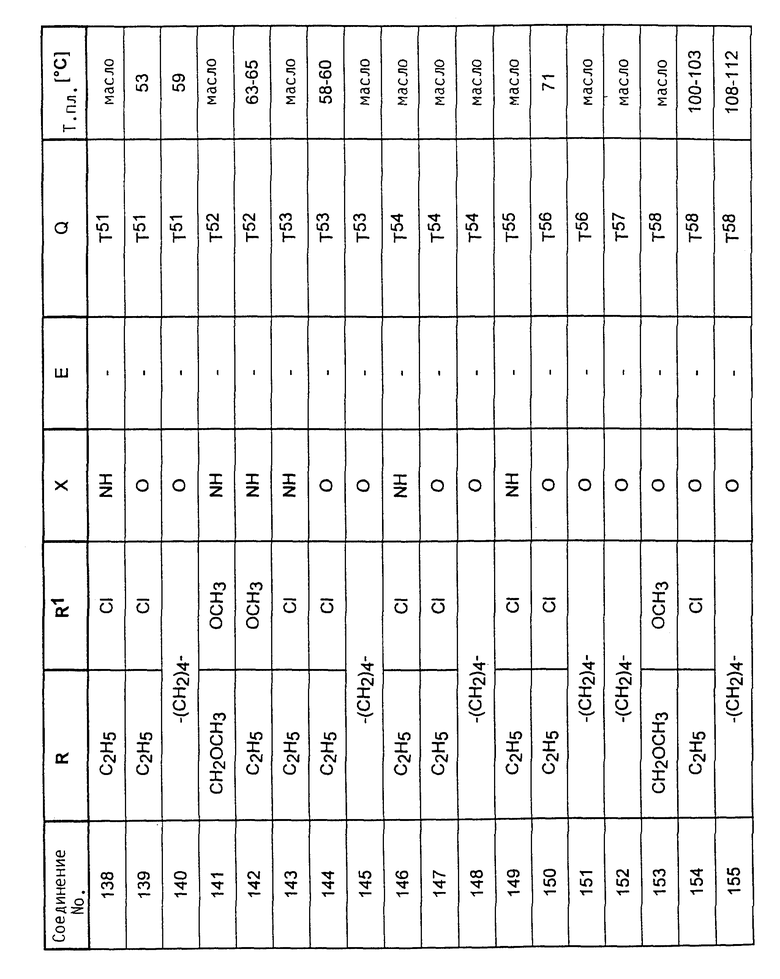
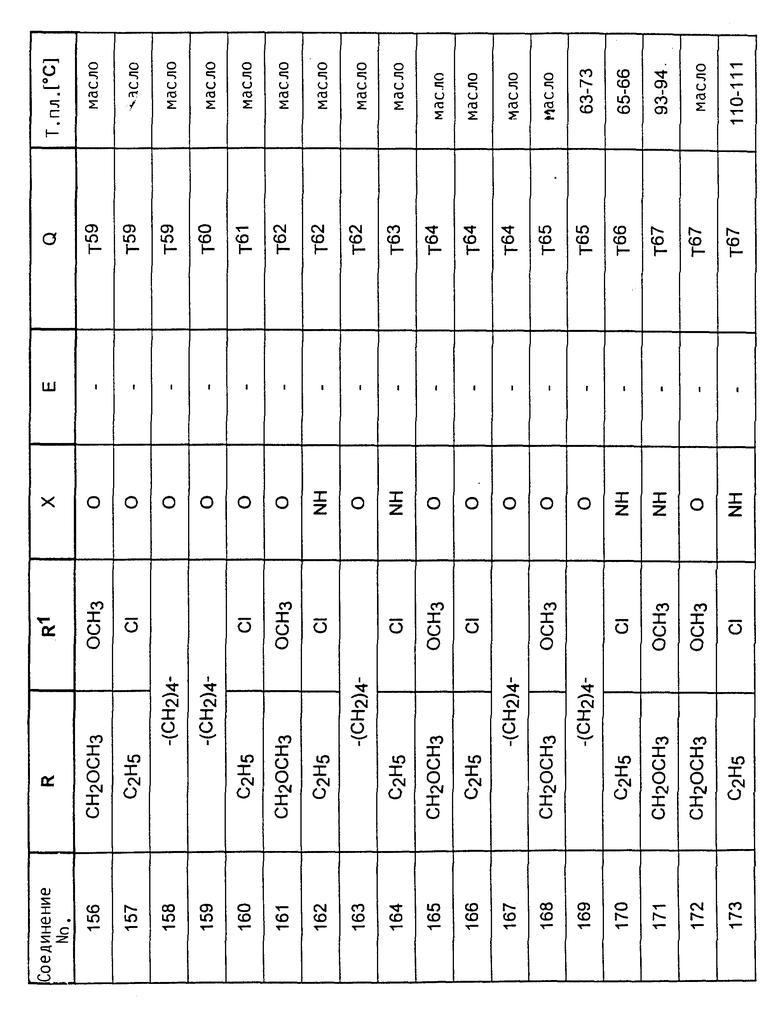
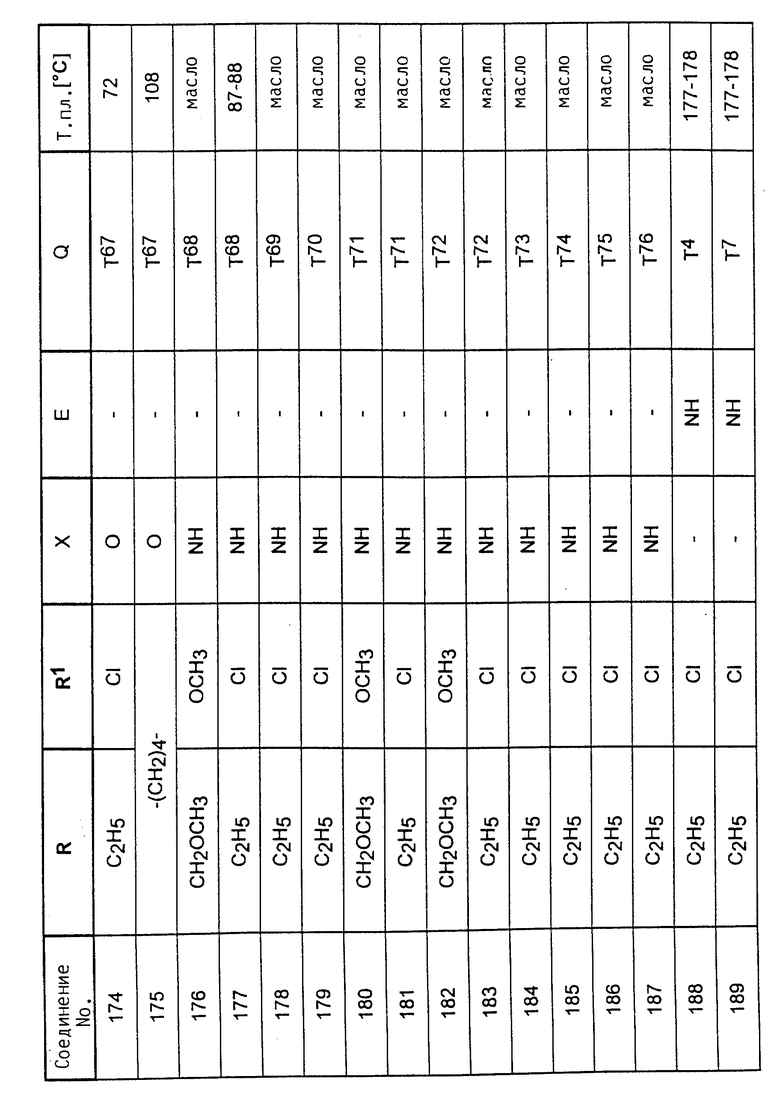
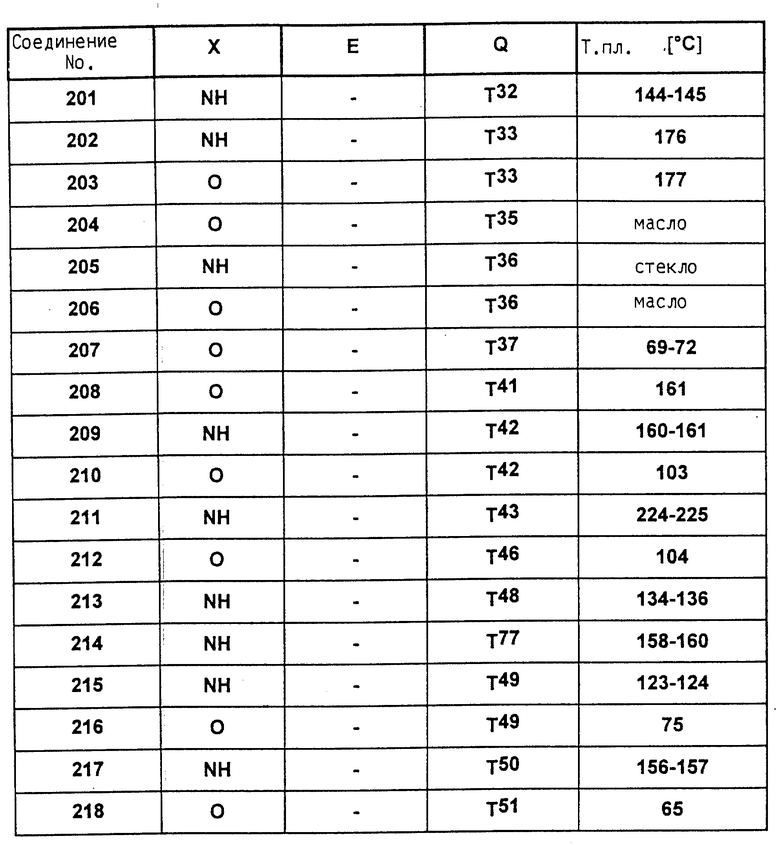
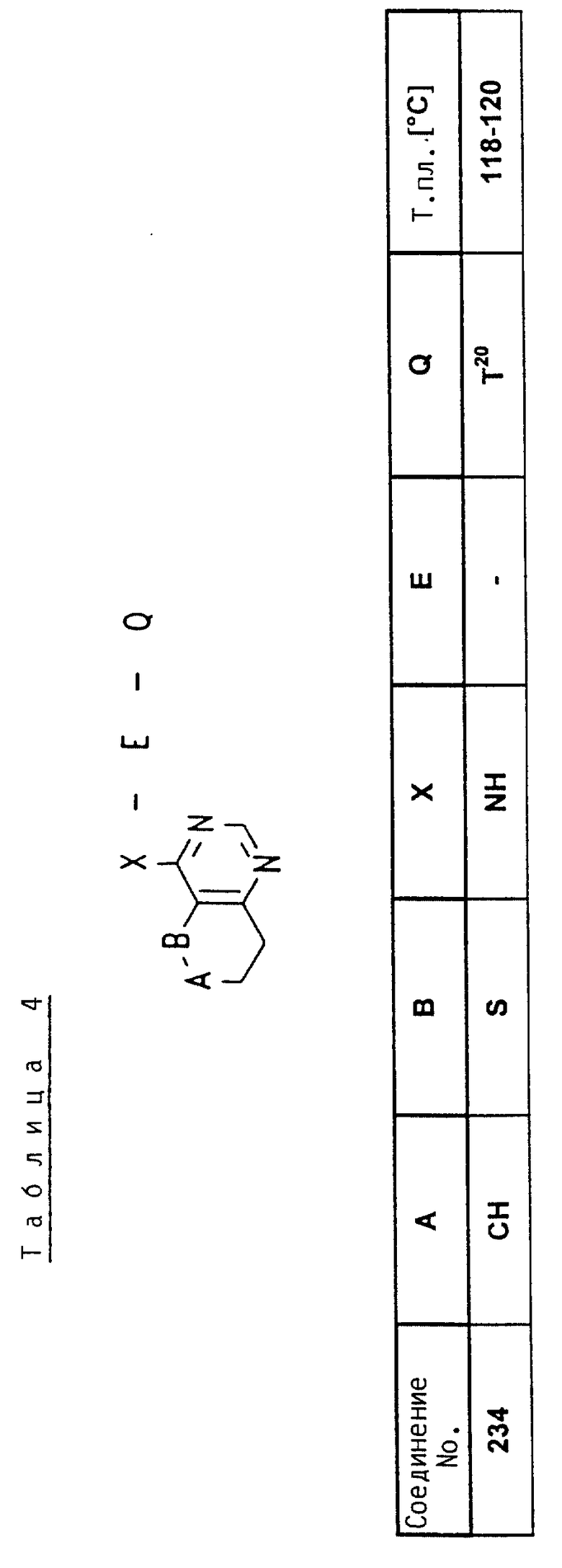
Аналогично вышеприведенным примерам и в соответствии с вышеприведенными общими данными по получению предлагаемых соединений получают сведенные в таблицах 2 - 5 соединения. В этих таблицах для радикала Q используют условные сокращения T1 - T76, значения которых сведены в таблице 1.
Нижеследующие примеры иллюстрируют биологическую активность производных общей формулы (I).
Пример 4
Растения ячменя на стадии развития трех листьев сильно инокулируют конидиями мучнистой росы ячменя (Erysiphe graminis f. sp. hordei) и помещают в теплицу при температуре 20oC и относительной влажности воздуха 90 - 95%. Через 24 часа после инокуляции растения равномерно увлажняют нижеприведенными соединениями, используемыми в виде раствора для опрыскивания, содержащего 500 мг/л активного вещества. После 10-дневней инкубации исследуют степень поражения растений мучнистой росой ячменя. При этом степень поражения выражают в % пораженной поверхности листьев, из расчета на необработанные, на 100% пораженные контрольные растения. В данном опыте исследуемые соединения N 6, 14, 20, 25, 34, 39, 48, 54, 55 полностью подавляют поражение растений.
Аналогичную активность проявляют остальные соединения, приведенные в таблицах 2 - 5.
Пример 5
Растения ячменя сорта "lgri" на стадии развития двух листьев опрыскивают до образования капель водной суспензией, содержащих 500 мг/л нижеприведенных соединений.
После присыхания водной суспензии растения инокулируют водной суспензией споров Pyrenophora teres и инкубируют в кондиционированной камере в течение 16 часов при 100%-ной относительной влажности воздуха. Затем пораженные растения далее выращивают в теплице при температуре 25oC и 80%-ной относительной влажности воздуха.
Через одну неделю после инокуляции определяют степень поражения на пораженной поверхности листьев по сравнению с необработанными, на 100% пораженными контрольными растениями. В данном опыте исследуемые соединения N 2, 6, 7, 10, 11, 14, 20, 34, 39, 48, 58 полностью подавляют поражение растений.
Пример 6
Пшеницу сорта "Jubilar" на стадии развития двух листьев опрыскивают до образования капель водной суспензией, содержащих 500 мг/л нижеприведенных соединений.
После присыхания растения инокулируют водной суспензией споров Puccinia recondita. Растения помещают на 16 часов в кондиционированную камеру при температуре 20oC и 100%-ной относительной влажности воздуха. Затем продолжают их выращивание в теплице при температуре 22 - 25oC и 50 - 70%-ной относительной влажности воздуха.
Примерно через два часа после инкубации споры грибка имеются на всей поверхности листьев необработанного контрольного растения (100%-ная инфекция), так что можно определить степень поражения подопытных растений. Степень поражения выражается в % пораженной поверхности листьев по сравнению с необработанными, пораженными контрольными растениями. В данном опыте исследуемые соединения N 2, 6, 9, 14, 20, 25, 39, 48, 54 полностью подавляют поражение.
Пример 7
Сильно пораженные свекловичными тлями (Aphis fabae) бобовые растения (Vicia faba) опрыскивают до стадии начала отекания капель водным рабочим препаратом смачивающегося порошка, содержащим 250 ч./милл активного вещества. Умерщвление тлей определяют после истечения трех дней. В данном опыте исследуемые соединения N 2, 6, 10, 14, 16, 20, 25, 34, 39, 48, 54, 58, 234, 235, 236 обеспечивают 100%-ное умерщвление.
Аналогичную активность проявляют остальные соединения, приведенные в таблицах 2 - 5.
Пример 8
Сильно пораженные паутинными клещами (Tetranychus urticae, полная популяция) бобовые растения (Phaseolus v) опрыскивают водным рабочим препаратом смачивающегося порошка, содержащим 250 ч./милл активного вещества. Через 7 дней определяют степень умерщвления клещей. В данном опыте исследуемые соединения N 2, 6, 7, 14, 16, 20, 25, 34, 39, 48, 49, 54, 58, 234 обеспечивают 100%-ное умерщвление.
Аналогичную активность проявляют остальные соединения, приведенные в таблицах 2 - 5.
Пример 9
Диски фильтровальной бумаги с находящимися на них яйцами хлопкового клопа (Oncopeltus fasciatus) обрабатывают 0,5 мл водного рабочего препарата, содержащего 250 ч./милл активного вещества. После присыхания налета закрывают чашку Петри и внутреннюю полость поддерживают на максимальной влажности воздуха. После хранения при комнатной температуре в течение 7 дней определяют действие активного вещества на яйца и личинок. В данном опыте исследуемые соединения N 2, 6, 7, 10, 14, 16, 20, 25, 34, 39, 48, 50, 54, 58, 88, 234, 235, 236 обеспечивают 100%-ное умерщвление.
Аналогичную активность проявляют остальные соединения, приведенные в таблицах 2 - 5.
Пример 10
На внутреннюю сторону крышки и днища чашки Петри равномерно наносят по 1 мл переведенной в рабочий препарат эмульсии в воде, содержащей 250 ч./милл активного вещества. После присыхания налета подают 10 домашних мух (Musca domestica). После закрытия чашки Петри хранят при комнатной температуре и через три часа определяют степень умерщвления подопытных животных. В данном опыте исследуемые соединения N 6, 7, 14, 15, 16, 20, 25, 34, 39, 48, 54, 58, 234, 236 обеспечивают 100%-ное умерщвление.
Пример 11
Влажные семена риса доводят до прорастания на вате в стеклянных емкостях. После достижения длины стеблей, равной 8 см, вместе с листьями подают в раствор, содержащий 250 ч./милл активного вещества. После отекания капель обработанные таким образом рисовые растения подают на выращивание в емкости, куда также подают 10 личинок вида Nilaparvata lugens. После хранения закрытых емкостей при температуре 21oC в течение 4 дней определяют степень умерщвления личинок. В данном опыте исследуемые соединения N 6, 20, 25, 48, 54 и 130, проявляют 100%-ную активность.
Пример 12
Семена пшеницы доводят до предварительного прорастания под водой, затем подают в стеклянные трубки емкостью 10 мл и перекрывают 2 мл почвы. После добавления 1 мл воды растения остаются в трубках при температуре 21oC до достижения высоты около 3 см. Затем в трубки на почву подают по 10 имеющих среднюю стадию развития личинок Diabrotica и через два часа пипеткой подают на поверхность почвы 1 мл жидкости, содержащей 250 ч./милл активного вещества.
Через 5 дней в лабораторных условиях (21oC) почву и корни проверяют на наличие в них личинок Diabrotica и определяют степень их умерщвления. В данном опыте исследуемые соединения N 2, 14, 16, 20, 48, 54 проявляют 100%-ную активность.
Пример 13
Опыт ин витро на тропических клещах Boophilus microplus
Для получения пригодного рабочего препарата активное вещество растворяют в смеси, состоящей из 85 г диметилформамида, 3 г нонилфенолполигликолевого эфира и 7 г оксэтилированного касторового масла, и получаемый таким образом эмульгируемый концентрат разбавляют водой до концентрации активного вещества, равной 500 ч/милл.
В эту рабочую жидкость погружают на 5 минут по 10 самок тропических клещей Boophilus. Затем клещи подают на фильтровальную бумагу и с целью откладки яиц закрепляют обратной стороной на клеевой пленке. Клещи хранят в термостате при температуре 28oC и относительной влажности воздуха 90%.
Для контроля самки клещей погружают лишь в воду. Через две недели после обработки активность определяют по степени задержки откладки яиц. При этом 100% означает, что ни один клещ не откладывал яиц, а 0%, что все клещи откладывали яйца.
В данном опыте исследуемые соединения N 7, 16, 25 и 58 обеспечивают 100%-ную задержку откладки яиц.
Аналогичную активность проявляют остальные соединения, приведенные в ытаблицах 2-5.
















Изобретение относится к новым производным пиримидина, которые проявляют пестицидную активность, в частности фунгицидную и инсекто-акарицидную активность. Описываемые производные пиримидина описываются общей формулой I, где R - алкил с 1-4 атомами углерода, алкоксиалкил с 1 -4 атомами углерода в каждой алкильной части; R1 - водород, алкил с 1-4 атомами углерода, алкокси с 1-4 атомами углерода, галоген или R и R1 вместе с атомами углерода, с которым они связаны, образуют 5- или 6-членное ненасыщенное изоциклическое кольцо, или R и R1 вместе с атомами углерода, с которыми они связаны, образуют 5-, 6-или 7-членное насыщенное изоциклическое кольцо; X - группа NH или кислород; E - прямая связь, или неразветвленный, или разветвленный алкандиил с 1 - 4 атомами углерода; Q - циклоалкильная группа общей формулы (II) или группа общей формулы (III), где n - целое число 2-7; R1 -R4 имеют значения, указанные в формуле изобретения. 6 з.п.ф-лы, 5 табл.

где R - алкил с 1 - 4 атомами углерода, алкоксиалкил с 1-4 атомами углерода в каждой алкильной части;
R1 - водород, алкил с 1-4 атомами углерода, алкокси с 1-4 атомами углерода, галоген,
или R и R1 вместе с атомом углерода, с которым они связаны, образуют 5- или 6-членное ненасыщенное изоциклическое кольцо,
или R и R1 вместе с атомами углерода, с которыми они связаны, образуют 5-, 6- или 7-членное насыщенное изоциклическое кольцо;
X - группа NH или кислород;
E - прямая связь или неразветвленный или разветвленный алкандиил с 1 - 4 атомами углерода;
Q - циклоалкильная группа общей формулы II
где n - целое число 2 - 7;
R2 и R3 одинаковы или различны и означают водород, алкил с 1-12 атомами углерода, циклоалкил с 3-8 атомами углерода, циклоалкокси с 3-8 атомами углерода, фенил, бензилокси, бензилоксиалкил с 1-4 атомами углерода в алкильной части или фенокси, причем фенильное кольцо незамещено или замещено одним или двумя одинаковыми или различными остатками из группы, включающей алкил с 1-8 атомами углерода, галоген, алкокси с 1-8 атомами углерода, алкокси-алкокси с 1-4 атомами углерода в каждой алкильной части, группу H5C2-O-[CH2-CH2-O-] x, 2-(тетрагидро-2H-пиран-2-илокси)-этокси, бензилоксигруппу, фенильная часть которой может быть одно- или двукратно замещена одинаковым или различным алкилом с 1-4 атомами углерода, причем R2 и R3 одновременно не могут означать водород и в двух смежных заместителях, которые одинаковы или различны и выбраны из группы, включающей алкил с 1-8 атомами углерода и алкокси с 1-8 атомами углерода, один атом водорода может быть заменен связью C - C, связывающей оба заместителя, или
R2 и R3 вместе с циклоалкильной группой образуют 3-8-членную спироциклическую кольцевую систему, которая вместо одной или двух групп CH2 может содержать кислород, или же вместе с атомами углерода, с которыми они связаны, образуют 5- или 6-членный изоцикл;
x = 2, 3 или 4,
или Q - группа общей формулы III
где R4 означает группу общей формулы Z - W, где Z означает прямую связь или карбонил, W - фенил, который может быть замещен одним или двумя одинаковыми или различными заместителями из группы, включающей алкил с 1-8 атомами углерода, галоген, алкокси с 1-4 атомами углерода,
и их кислотно-аддитивные соли.
| Автоматический огнетушитель | 0 |
|
SU92A1 |
| US 3470182 A, 30.09.1969 | |||
| US 4196207 A, 01.04.1980 | |||
| Кассета для магнитной ленты | 1973 |
|
SU447891A1 |
| РАБОЧЕЕ ВЕЩЕСТВО ЗОНДА-ИЗМЕРИТЕЛЯ НАПРЯЖЕННОСТИ ПОСТОЯННЫХ МАГНИТНЫХ ПОЛЕЙ | 0 |
|
SU323757A1 |
| EP 0452202 A1, 16.10.1991 | |||
| Гербицидное средство | 1974 |
|
SU568334A3 |
| Фунгицидная композиция | 1978 |
|
SU1111675A3 |
| DE 4008726 A, 26.09.1991 | |||
| ЗАМОК ВЫКЛЮЧАТЕЛЯ, ПРЕИМУЩЕСТВЕННО ЗАЖИГАНИЯ, С ФОТОЭЛЕКТРОННЫМ УПРАВЛЕНИЕМ ЭЛЕКТРОМАГНИТНЫМ СТОПОРОМ | 2001 |
|
RU2200678C2 |
Авторы
Даты
2000-09-10—Публикация
1993-03-10—Подача