Изобретение относится к технической области гербицидов и регуляторов роста растений, в частности гербицидов для избирательной борьбы с сорной растительностью в культурных растениях.
Известно, что гетероциклически замещенные фенилсульфонилмочевины, имеющие у фенильного кольца аминогруппу или функционализированную аминогруппу, обладают гербицидными и регулирующими рост растений свойствами (см. заявки ЕР N 115 и 116518; патенты US N 4892946; 4981509, 4664695 и 4632695).
Задачей изобретения является расширение ассортимента производных аминофенилсульфонилмочевины, обладающих биологической активностью, в частности гербицидной активностью.
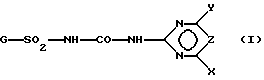
Представленная задача решается производными ацилированной аминофенилсульфонилмочевины общей формулы (I)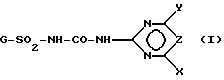
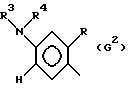
где G - замещенный N-ациламинофенил, выбранный из группы, включающей остатки G1 и G2 следующих формул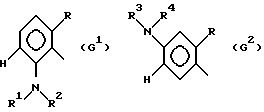
R - остаток формулы CO2R5, где R5 означает алкил с 1-5 атомами углерода, R1-алкил с 1-5 атомами углерода,
R2 - CO2-алкил с 1-5 атомами углерода,
R3 - водород, алкил с 1-5 атомами углерода,
R4 - формил или CO алкил с 1-5 атомами углерода, CO2-алкил с 1-5 атомами углерода, незамещенные или замещенные одним или несколькими галоидами, SO2-алкил с 1-4 атомами углерода, CO-NHR6, где R6-алкил с 1-4 атомами углерода, или CSNHR7, где R7-алкил с 1-4 атомами углерода,
X - алкоксил с 1-2 атомами углерода или диалкиламино с 1-2 атомами углерода в каждой алкильной части,
Y - галоген, алкил с 1 или 2 атомами углерода, алкоксил с 1 или 2 атомами углерода или галоидалкоксил с 1 или 2 атомами углерода,
X - группа CH или азот,
или их соли щелочных металлов.
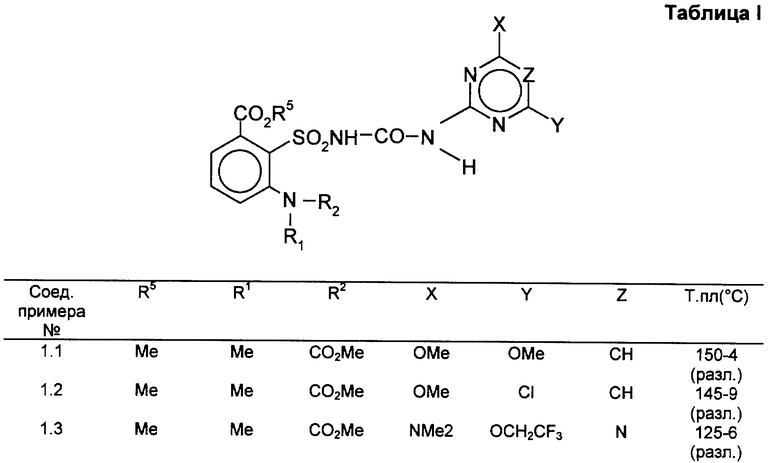
В первую группу предпочтительных производных ацилированной аминофенилсульфонилмочевины общей формулы (I) входят соединения, у которых
G - радикал формулы (G1),
R - остаток формулы CO2R5, где R5 означает алкил с 1-4 атомами углерода,
R1 - алкил с 1-4 атомами углерода,
R2 - группа CO2-алкил с 1-5 атомами углерода,
R3, R4, X, Y и Z имеют указанное значение, и их соли щелочных металлов. Во вторую группу предпочтительных производных ацилированной аминофенилсульфонилмочевины общей формулы (I) входят соединения, у которых
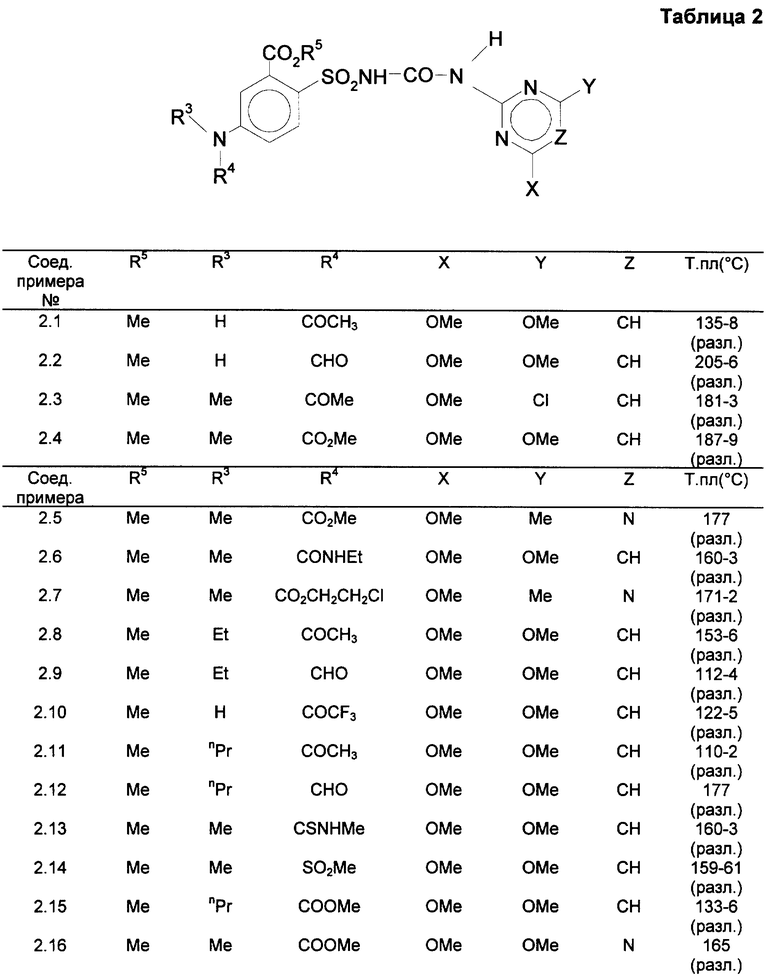
G - радикал формулы (G2),
R - группа CO2R5, где R5 означает алкил с 1-5 атомами углерода,
R3-водород, алкил с 1-4 атомами углерода,
R4-формил, CO-алкил с 1-4 атомами углерода, CO2-алкил с 1-4 атомами углерода, SO2-алкил с 1-4 атомами углерода, CO-NHR6, где R6 означает алкил с 1-4 атомами углерода,
X, Y и Z имеют указанное значение, и их соли щелочных металлов.
Дальнейшим объектом настоящего изобретения является способ получения предлагаемых соединений формулы (I) или их солей щелочных металлов, который заключается в том, что соединение формулы (II)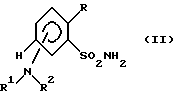
где R, R1, R2 имеют вышеуказанное значение,
подвергают взаимодействию с гетероциклическим карбаматом формулы (III),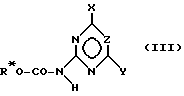
где X и Y имеют вышеуказанное значение, a R* означает незамещенный или замещенный фенил или алкил с 1-4 атомами углерода, с последующим выделением целевого продукта в свободном виде или в виде соли щелочных металлов.
Реакцию соединений формул (II) и (III) предпочтительно осуществляют в присутствии служащего в качестве катализатора основания в среде инертных растворителей, таких, как, например, дихлорметан, ацетонитрил, диоксан или тетрагидрофуран, при температурах от -10oC до точки кипения соответствующего растворителя. При этом в качестве оснований используют, например, органические аминооснования, такие, как, например, 1,8-диаза-бицикло[5.4.0]-ундец-7-ен, в частности при R* = (замещенный) фенил или триметил- или триэтилалюминий, в частности при R* = алкил.
Соединения формулы (III) можно получать, например, нижепредставленным способом.
Исходя из соединения формулы (IV), например, 2-метил-4-нитробензосульфоты, окисление метильной группы пригодными окислителями, например, перманганатом калия, приводят к соответствующим карбоновым кислотам [аналогично методу по Org. Syn. Coil., том 3, 740 (1955)], которые этерификацией соответствующими спиртами R5-OH в присутствии кислотного катализатора переводят в сложные эфиры формулы (V), что представлено схемой 1 (см. Tetrahedron, 36, 2409 (1980)).
Схема 1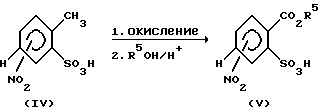
Сульфокислоты (V) можно переводить в N-трет-бутилсульфонамиды (VI) известными стандартными методами. Так, например, калиевые соли сульфокислот (V) подвергают взаимодействию с фосфороксихлоридом или тионилхлоридом в отсутствие или в среде инертных растворителей, как, например, ацетонитрил и/или тетраметилсульфон при нагревании с обратным холодильником (см. ХоубенВейль-Кламанн, "Methoden der organischen Chemie", 4-oe издание, том E XI/2, стр. 1067-1073, издательство Тиме, г. Штуттгарт, DE, 1985). Получаемые при этом сульфохлориды переводят взаимодействием с трет-бутиламином в сульфонамиды формулы (VI) (см. схему 2). Эту реакцию проводят, как правило, при температурах от -78oC до +80oC, предпочтительно от 0 до 30oC в среде растворителей, таких, как, например, дихлорметан, трихлорметан, тетрагидрофуран, диоксан, метанол или этанол.
Схема 2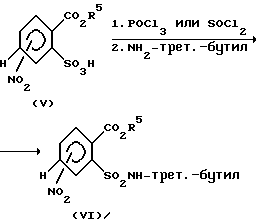
Нитрогруппу в соединении формулы (VI) затем переводят в аминогруппу (см. схему 3).
Восстановление можно осуществлять, например, с водородом в присутствии катализатора, такого, как палладий, или железом в уксуснокислой среде (см. Х. Берри, Г. Т. Нойхольд, Ф.С. Спринг, И. Хем. Сок. 1952, 2042; М. Фрайфельдер, "Catalytic Hydrogenation in Organic Synthesis: Procedures and Commentary", изд. Дж. Вайлей энд Сане, Нью-Йорк (1978), глава 5).
Схема 3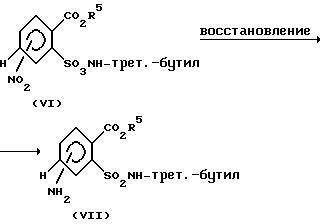
Получаемые анилины формулы (VII) подвергают дериватизации у аминогруппы путем моноалкилирования с последующим ацилированием (см. схему 4).
Схема 4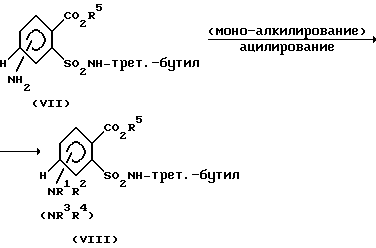
Моноалкилирование аминогруппы соединений (VII) можно легко осуществлять по методу C. Кришнамэртси [Tetrahedron Lett. 23, 3315 (1982)]. Взаимодействие с пригодными электрофильными соединениями, такими, как, например, хлорангидриды кислот, ангидриды кислот, изоцианаты, тиоизоцианаты, сульфохлориды, амидосульфохлориды до N-ацилированных соединений (VIII) можно проводить аналогично известными из литературы способами (см. А.Л.Дж. Бекнитер и Дж. Забицки, "The Chemistry of Amides", стр. 73-185, изд. Интерсайнс, Нью-Йорк, 1970; Е. Дх. Корей и др., "Tetrahedron Lett. 1978, 1051: Х. Дж. Саундерс, P. Дж. Слоукомб, Chem. Rev. 43, 203 (1948): С. Озаки, Chem. Rev. 72, 457, 469 (1972): Дж. Зольсс, Arzneim.-Forsch. 33, 2 (1983); Хоубен- Вейль-Хагеманн, Methoden der organioschen Chemie", 4-ое изд., том Е 4, стр. 282, издательство Тиме Ферлаг, г. Штуттгарт, DE, 1983; Дж. Голински, М. Мэхоша, Synthesis 1978, 823; Хоубен-Вейль-Мюллер, "Methoden der organischen Chemie", 4-ое издание, том IX, стр. 338 - 400 и 505 - 622, издательство Тиме Ферлаг, г. Штуттгарт, DE, 1955; Хоубен-Вейль-Кламанн, Methoden der organischen Chemie", 4-ое издание, том EII/2, стр. 1020 - 22, издательство Тиме Ферлаг, г. Штуттгарт, DE, 1985). Отщепление трет-бутиловой группы из соединений формулы (VIII) для получения сульфонамидов (II) осуществляют, например, сильными кислотами по следующей схеме 5.
Схема 5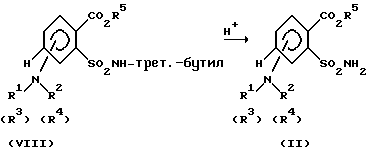
В качестве сильных кислот используют, например, минеральные кислоты, как, например, серную кислоту или соляную кислоту, или сильные органические кислоты, как, например, трифторуксусную кислоту. Реакцию осуществляют, например, при температурах от -20 до соответствующей температуры флегмы, предпочтительно при температуре 0-40oC, в среде инертного растворителя, такого, как, например, дихлорметан или трихлорметан. Но реакцию можно также проводить в отсутствие растворителя.
Другой способ получения соединений (II) представлен на нижеприведенной схеме 6.
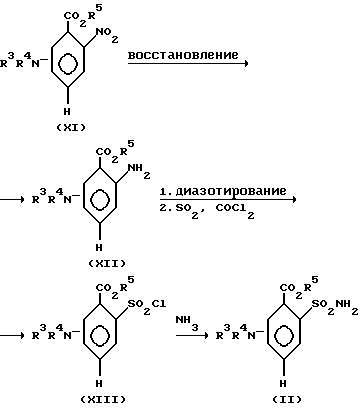
В амино-нитротолуол формулы (IX), например, 3-амино-2-метил-нитробензол вводят заместители R1 и R2 или R3 и R4 путем моноалкилирования и ацилирования (аналогично схеме 4). Получаемые таким образом соединения (X) подвергают окислению, например, перманганатом калия (аналогично схеме 1). Получаемые при этом производные бензойной кислоты подвергают этерификации известными стандартными способами (аналогично схеме 1). Получаемые ароматические сложные эфиры (XI) можно восстанавливать до анилинов формулы (XII) (аналогично схеме 3). После диазотирования анилинов (XII) и последующего взаимодействия с двуокисью серы получают сульфохлориды (XIII) (см. Хоубен-Вейль-Мюллер, "Methoden der organischen Chemie", 4-ое издание, том IX, стр. 563 и следующие, издательство Тиме Ферлагг, Штуттгарт, DE, 1955).
Аммонолиз сульфохлоридов (XIII) приводит к сульфонамидам (II). Эту реакцию осуществляют, например, при температурах от 0 до 40oC в присутствии органических растворителей, таких, как, например, тетрагидрофуран, диоксан, дихлорметан, трихлорметан, метанол, этанол и т.п.
Схема 6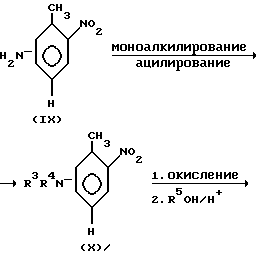
Альтернативный способ получения сульфохлоридов (XIII) представлен на нижеприведенной схеме 7.
Нитробензойные кислоты формулы (XIV), такие, как, например, 2-хлор-3-нитро- или 2-хлор-5-нитробензойная кислота, после этерификации (аналогично схеме 1, стадия 2) превращают до сульфидов формулы (XV) взаимодействием с солью пригодного меркаптана при температурах от 0 до 80oC в среде инертных растворителей, таких, как, например, ацетонитрил, метанол или этанол. В качестве солей меркаптанов пригодны, например, натриевые или калиевые соли бензилмеркаптана. После восстановления нитрогруппы соединения (XV), а также введения заместителей R1 и R2 или R3 и R4 (аналогично схеме 4) соединение формулы (XVI) подвергают взаимодействию с хлором или гипохлоритом в окислительных условиях с получением сульфонилхлоридов (XIII) (см., например, Р. Т. Ланглер, Can. J. Chem. 54, 498 (1976); справочник Хоубен-Вейль-Мюллер, "Methoden der organischen Chemie", 4-ое издание, том 9, стр. 580 - 583, издательство Тиме Ферлаг, г. Штуттгарт, 1955). Эту реакцию проводят при температурах от -10 до 60oC, предпочтительно от 0 до 15oC, в двухфазной системе. В качестве водной фазы пригодны, например, вода, растворы фосфатного буфера (pH 7) или соляная кислота, а в качестве органической фазы - например, ди- или трихлорметан.
Схема 7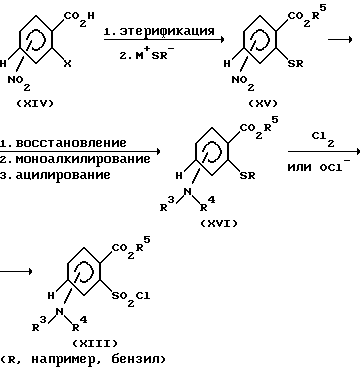
Необходимые для взаимодействия с соединениями (II) карбаматы формулы (III) известны из литературы или их можно получать аналогично известным способам.
Соли щелочных металлов соединений формулы (I) предпочтительно получают в среде инертных растворителей, таких, как, например, вода, метанол, ацетон, дихлорметан, тетрагидрофуран, толуол или гептан, при температурах от 0 до 100oC.
Предлагаемые соединения формулы (I) или их соли имеют очень хорошую гербицидную активность в отношении широкого спектра важных с экономической точки зрения моно- или диоктильных сорных растений.
Предлагаемые активные вещества также хорошо пригодны для борьбы с трудноуничтожаемыми многолетними сорняками, которые прорастают из ризом, корневищ или других многолетних органов. При этом не является важным используют ли вещества до высева, до или после всхода. При этом можно назвать, например, некоторые представители моно- и дикотильной сорной растительности, которые уничтожаются предлагаемыми соединениями (перечисление ни в коем случае не является ограничением уничтожаемых предлагаемыми соединениями сорных растений).
Соединения формулы (I) или их соли можно переводить в различного рода препараты в зависимости от заданных биологических и/или химико-физических параметров. Такими препаратами могут быть, например: смачивающиеся порошки, водорастворимые порошки, водорастворимые концентраты, эмульгируемые концентраты, эмульсии, как, например, эмульсии типров масла в воде и воды в масле, разбрызгиваемые растворы, суспензионные концентраты, дисперсии на основе масла или воды, смешиваемые с маслом растворы, заключенные в капсулы суспензии, протравливатели, разбрасываемые грануляты, грануляты для нанесения на почву, микрогрануляты, разбрызгиваемые грануляты, суспензионные грануляты и адсорбционные грануляты, вододиспергируемые грануляты, водорастворимые грануляты, препараты для распределения активного вещества в чрезвычайно низком объеме, микрокапсулы и воски. Указанные типы препаратов широко известны и они описаны, например, в справочнике Виннакер-Кюхлер, "Chemische Technologie", том 7, издательство К. Хаузер Ферлаг, г. Мюнхен, 4-ое издание, 1986, DE; Ваде фан Валькен-бург, "Pesticide Formulations", изд. Марсель Деккер, г. Нью-Йорк, 1973; К. Мартене, "Spray Drying", справочник, 3-е издание, 1979, US: изд. Г. Гудвин Лтд., г. Лондон, GB.
Перед применением вышеуказанные препараты, например, смачивающиеся порошки, эмульгируемые концентраты, дисперсии и диспергируемые в воде грануляты, можно разбавлять водой известными приемами, например, и получаемые при этом рабочие препараты наносят на растения, части растений или на почву, на которой растут растения, или на посевной материал. Пылевидные препараты, наносимые на почву грануляты или разбавляемые грануляты, а также разбрызгиваемые растворы до применения обычно не разбавляют дальнейшими инертными веществами.
Необходимый расход соединений формулы (I) зависит от внешних условий, таких, как, например, температура, влажность и вид применяемого гербицида. Он может колебаться в широких пределах, например от 0,01 до 10,0 кг/га или больше активного вещества, однако предпочтительно он составляет 0,005 - 5 кг/га.
А. Химические примеры
а) Сложный метиловый эфир 2-хлор-3-нитробензойной кислоты
25,50 г (0,127 моль) 2-Хлор-3-нитробензойной кислоты растворяют в 50 мл метанола и смешивают с 3 мл концентрированной серной колоты. Реакционную смесь нагревают до кипения в течение 4 часов. После добавления 10 мл сложного триметилового эфира ортоуксусной кислоты смесь далее кипятят в течение двух часов.
После охлаждения до температуры 0oC и отсасывания твердого вещества получают 26,4 г (96%) бесцветного сложного метилового эфира 2-хлор-3-нитробензойной кислоты c точкой плавления 68 - 70oC.
б) Сложный метиловый эфир 2-бензилмеркапто-3-нитробензойной кислоты
К смеси 50,0 г (0,23 моль) сложного метилового эфира 2-хлор-3-нитробензойной кислоты и 28,81 г (0,23 моль) бензилмеркаптана в 200 мл метанола прикапывают раствор 26,0 г (0,23 моль) трет-бутилата калия в 400 мл метанола. После 6-часового перемешивания при комнатной температуре и стояния в течение дальнейших 15 часов реакционную смесь сгущают. Остаток смешивают с этилацетатом и последовательно промывают насыщенным раствором бикарбоната натрия, водой и насыщенным раствором хлористого натрия. После высушивания над сульфатом магния раствор сгущают при пониженном давлении. Желтоватый маслянистый остаток (68,5 г; 97% от теории) используют без дальнейшей очистки на следующей стадии.
в) Сложный метиловый эфир 3-амино-2-бензилмеркапто-бензойной кислоты
К смеси 68,0 г (0,22 моль) сложного метилового эфира 2- бензилмеркапто-3-нитробензойной кислоты, 215 мл ледяной уксусной кислоты и 480 мл воды порциями добавляют 69,9 г порошкового железа. Затем реакционную смесь перемешивают при температуре 50 - 60oC в течение трех часов. После отделения твердого вещества путем фильтрации маточный раствор промывают водой и солевым раствором и затем сушат над сульфатом магния. После сгущения раствора при пониженном давлении получают 47,1 г желтого масла (77%);
1H-ЯМР (CDCl3, 80 МГц); δ = 3.8 (с, 3H, OCH3) 3,9 (с, 2H, SCH2фен), 5,9 (с, 2H, NH2), 6,6-7,3 (м 8H, Hаром).
г) Сложный метиловый эфир 2-бензилмеркапто-3-формиламино- бензойной кислоты
При температуре 0oC к 48,6 г (0,476 моль) ангидрида уксусной кислоты прикапывают 27,0 г (0,586 моль) муравьиной кислоты. После 2-часового перемешивания при температуре 50-60oC смесь охлаждают до температуры 0oC и смешивают с раствором 50,0 г (0,183 моль) сложного метилового эфира 3-амино-2-бензилмеркапто-бензойной кислоты в 150 мл тетрагидрофурана. Затем реакционный раствор перемешивают при комнатной температуре в течение 3 часов. Смесь сгущают при пониженном давлении (60oC, 0,1 торр). Получаемый маслянистый остаток (61,77 г) используют на следующей стадии без дальнейшей очистки.
д) Сложный метиловый эфир 2-бензилмеркапто-3-метиламино-бензойной кислоты
К раствору 61,5 г сложного метилового эфира 2-бензилмеркапто-3-формиламинобензойной кислоты (см. стадию г) в 100 мл хлороформа прикапывают при температуре 0oC 20 мл борандиметилсульфоксида. Затем нагревают до температуры 60oC в течение 2 часов, добавляют дальнейшие 20 мл борандиметилсульфоксида и смесь перемешивают при той же температуре в течение 2,5 часа. Затем прикапывают при температуре 0oC 30 мл метанола. Смесь переводят на делительную воронку, промывают водой и солевым раствором и затем сушат над сульфатом магния. После отгонки летучих компонентов получают 54,60 г сложного метилового эфира 2-бензилмеркапто-3-метиламино-бензойной кислоты в виде желтоватого масла;
1H-ЯМР (CDCl3, 80 МГц): δ = 2,6 (д, 3H, NH-CH3), 3,8 (c, 3H, OCH3), 3,9 (c, 2H, SCH2фен), 5,2 (с, шир, 1H, NH-мет), 6,5 (д, 1H, Hаром), 6,8 (д, 1H, Hаром) 7,0 - 7,4 (м, 6H, Hаром.).
е) Сложный метиловый эфир 2-бензилмеркапто-3-(N-метоксикарбонилметиламино)-бензойной кислоты
К суспензии 15,0 г (0,052 моль) сложного метилового эфира 2-бензилмеркапто-3-метиламино-бензойной кислоты и 5,88 г (0,07 моль) гидрокарбоната натрия в 100 мл ацетонитрила прикапывают 4,6 мл сложного метилового эфира хлормуравьиной кислоты. По истечении 5 часов отгоняют летучие компоненты (15 торр, 40oC). Остаток смешивают с этилацетатом и последовательно промывают 1 н. соляной кислотой и водой. После высушивания органической фазы над сульфатом магния растворитель отгоняют. Сложный метиловый эфир 2-бензилмеркапто-3-(N-метоксикарбонилметиламино)-бензойной кислоты получают в качестве желтоватого масла (14.8 г);
1H-ЯМР (CDCl3, 80 МГц): δ = 3,0 (с, 3H, N-CH3), 3,6 (с, 3H, O-CH3) 3,9 (с, 5H, OCH3 и SCH2фен), 7,1 - 7,6 (м, Hаром).
ж) Сложный метиловый эфир 2-хлорсульфонил-3-(N-метоксикарбонил- метиламино)-бензойной кислоты
В смесь 8,10 г сложного метилового эфира 2-бензилмеркапто-3-(N-метоксикарбонилметиламино)-бензойной кислоты в 50 мл хлористого метилена и 150 мл раствора первичного фосфата калия и вторичного фосфата динатрия (продукт фирмы Ридельде Хеэн АГ, pH 7) при температурах 0 - 5oC вводят хлор. По истечении 30 минут через реакционную аппаратуру пропускают аргон для удаления избыточного хлора. После разделения фаз органическую фазу сушат над сульфатом магния и затем сгущают при пониженном давлении. Путем кристаллизации из смеси этилацетата и гексана получают 4,5 г сложного метилового эфира 2-хлорсульфонил-3-(N-метоксикарбонил- метиламино)-бензойной кислоты. Точка плавления составляет 102-105oC.
з) N-[(4-диметиламино-6-трифторэтокси-триазин-2-ил)-аминокарбонил]- 2-метоксикарбонил-6-(N-метоксикарбонил-метиламино)-бензолсульфонамид (см. таблицу 1, пример 3)
К суспензии 0,25 г (0,0038 моль) цианата натрия, 0,6 мл пиридина и 12 мл ацетонитрила последовательно добавляют при комнатной температуре 0,71 г (0,003 моль) 2-амино-4-диметиламино-6-(2,2,2- трифторэтокси)-триазина и 1,0 г (0,003 моль) сложного метилового эфира 2-хлорсульфонил-3-(N-метоксикарбонил-метиламино)-бензойной кислоты. После перемешивания при комнатной температуре в течение 3,5 часа реакционную смесь выливают на ледяную воду. Для очистки продукта реакции осадившуюся сульфонил-мочевину размешивают в небольшом количестве метанола, отделяют посредством фильтрации и сушат. Сульфонилмочевину получают в качестве бесцветного твердого вещества (0,75 г). Точка плавления составляет 125 - 126oC.
и) N-[(4,6-диметоксипиримидин-2-ил)-аминокарбонил]-2- метоксикарбонил-6-(N-метоксикарбонил-метиламино)-бензолсульфонамид (см. таблицу 1, пример 1)
К суспензии 0,61 г цианата натрия, 0,8 мл пиримидина и 18 мл ацетонитрила последовательно добавляют при комнатной температуре 0,54 г 2- амино-4,6-диметоксипиримидина и 1,50 г сложного метилового эфира 2-хлорсульфонил-3-(N-метоксикарбонилметиламино)-бензойной кислоты. После перемешивания при комнатной температуре в течение 3,5 часов реакционную смесь выливают на ледяную воду. Для очистки продукта реакции осадившуюся сульфонилмочевину размешивают в малом количестве метанола, отделяют путем фильтрования и сушат. Получаемый таким образом N-[(4,6-диметоксипиримидин-2-ил)-аминокарбонил] -2-метоксикарбонил-6-(N- метоксикарбонил-метиламино)-бензолсульфонамид имеется в качестве бесцветного твердого вещества (1,35 г). Точка плавления составляет 150 - 154oC.
к) N-[(4,6-диметоксипиримидин-2-ил)-аминокарбонил]-2- метоксикарбонил-4-(N-метоксикарбонил-метиламино)-бензолсульфонамид (см. таблицу 2, пример 4)
К смеси 0,87 г 2-метоксикарбонил-4-(N-метоксикарбонилметиламино)- бензолсульфонамида и 0,90 г 4,6-диметокси-2-феноксикарбониламино-пиримидина в 10 мл ацетонитрила прикапывают при температуре 0oC 0,6 мл 1,8- диазабицикло[5.4.0] -ундец-7-ена. Затем реакционный раствор перемешивают при комнатной температуре в течение 6 часов. После отгонки растворителя остаток смешивают с водой и промывают диэтиловым эфиром. После подкисления водной фазы концентрированной соляной кислотой (pH 1) осадившуюся сульфонилмочевину размешивают в малом количестве метанола. После отделения бесцветного твердого вещества посредством фильтрации и высушивания получают 1,18 г N-[(4,6-диметоксипиримидин-2-ил)-аминокарбонил] -2-метоксикарбонил-4-(N- метоксикарбонил-метиламино)-бензолсульфонамида. Точка плавления составляет 184 - 186oC (разл. ). Данную стадию повторяют с той разницей, что используют 31,8 г бензолсульфонамида, 58,0 г пиримидина, 150 мл ацетонитрила и 39,4 мл 1,8-диазабицикло [5.4.0]-ундец-7-ена. После реакции при комнатной температуре в течение 4 часов и переработки реакционной смеси получают 45,0 г продукта с точкой плавления 187 - 189oC.
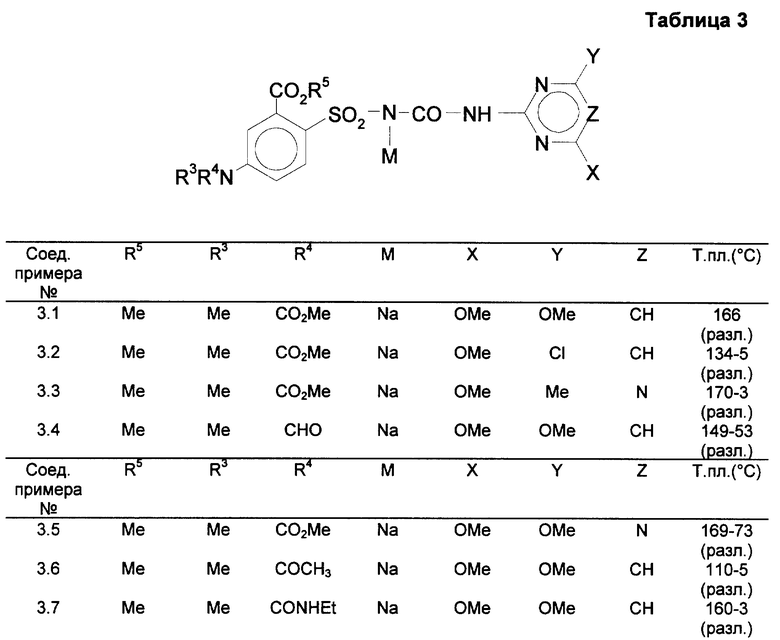
л) Натриевая соль N-[(4,6-диметокси-пиримидин-2-ил)-аминокарбонил]-2- метоксикарбонил-4-(N-метоксикарбонил-метиламино)бензолсульфонамида (см. таблицу 3, пример 1)
0,53 г N-[(4,6-диметилпиримидин-2-ил)-аминокарбонил] -2- метоксикарбонил-4-(N-метоксикарбонил-метиламино)-бензолсульфонамида размешивают в 50 мл хлористого метилена и 30 мл ацетонитрила, после чего смешивают с 1,1 мл 1 н. натрового щелока. После перемешивания в течение 2 часов реакционный раствор сгущают при пониженном давлении (50oC, 0,1 торр). Бесцветная соль (0,59 г) выпадает в качестве бесцветного твердого вещества. Точка плавления составляет 155 - 158oC. При использовании 15,0 г замещенного бензолсульфонамида, 120 ацетонитрила в качестве единственного растворителя и 30 мл 1 н. натрового щелока получают 16,2 г продукта с точкой плавления 166oC (разл.).
Сведенные в следующих таблицах 1 - 3 соединения получают согласно или аналогично примерам з) - л).
Используемые в нижеследующих таблицах условные сокращения:
Т.пл. = точка плавления
Et = этил
Me = метил
nPr = н-пропил
разл. = разложение
Б Примеры получения препаратов
а) Пылевидный препарат получают за счет того, что 10 вес. частей соединения формулы (I) смешивают с 90 вес. частями талька в качестве инертного вещества и получаемую смесь измельчают в ударной мельнице.
б) Легкодиспергируемый в воде, смачивающийся порошок получают за счет того, что 25 вес. частей соединения формулы (I) смешивают с 64 вес. частями содержащего каолин кварца в качестве инертного вещества, 10 вес. частями лигнинсульфокислого калия и 1 вес. частью олеилметилтауринкислого натрия в качестве смачивателя и диспергатора и получаемую смесь измельчают в стержневой мельнице.
в) Легкодиспергируемый в воде дисперсионный концентрат получают за счет того, что 20 вес. частей соединения формулы (I) смешивают с 6 вес. частями простого алкилфенолполигликолевого эфира (торговый продукт Triton X 207), 3 вес. частями простого изотридеканолполигликолевого эфира (содержащего 8 моль этиленоксида) и 71 вес. частью парафинового минерального масла (с пределами кипения около 255 - свыше 277oC) и получаемую смесь измельчают в шаровой мельнице до величины частиц ниже 5 микрон.
г) Эмульгируемый концентрат получают из 15 вес. частей соединения формулы (I), 75 вес. частей циклогексанона в качестве растворителя и 10 вес. частей оксэтилированного нонилфенола в качестве эмульгатора.
д) Диспергируемый в воде гранулят получают за счет того, что 75 вес. частей соединения формулы (I) смешивают с 10 вес. частями лигнинсульфокислого кальция, 5 вес. частями лаурилсульфата натрия и 3 вес. частями каолина, получаемую смесь измельчают при помощи стержневой мельницы и порошок гранулируют в псевдоожиженном слое путем впрыскивания в него воды.
е) Диспергируемый в воде гранулят получают также за счет того, что в коллоидной мельнице гомогенизуют и предварительно измельчают смесь 25 вес. частей соединения формулы (I), 5 вес. частей 2,2'-динафтилметан-6,6'- дисульфокислого натрия, 2 вес. частей олеилметилтауринкислого натрия, 1 вес. части поливинилового спирта и 50 вес. частей воды. Затем осуществляют помол до заданной величины частиц и получаемую суспензию распыляют и сушат в распылительной башне, снабженной одноканальным соплом.
В. Биологические примеры
1. Действие на сорняки после их довсходовой обработки
Семена или ризомные куски моно- и дикотильных сорняков вносят в песчаную глинистую почву в пластмассовых горшках и затем на почву наносят покровный слой той же земли. Имеющиеся в виде смачивающегося порошка или эмульсионного концентрата активные вещества разбавляют водой, взятой в количестве 600 - 800 г/га. Получаемые при этом водные суспензии или эмульсии наносят на поверхность покровной почвы в различных дозах.
После обработки горшки размещают в теплице и оставляют стоять там в условиях роста сорняков. Оптическую оценку повреждения растений осуществляют после всхода подопытных растений через 3-4 недель по сравнению с необработанными контрольными растениями. Как показывают результаты опытов, предлагаемые соединения проявляют хорошую гербицидную активность в отношении широкого спектра сорных трав и растений. Так, например, при расходе 0,3 кг и меньше активного вещества на гектар соединения примеров 1.1 - 1.3, 2.1 -2.16, 3.1 - 3.7, приведенных в таблицах 1 - 3, проявляют очень хорошую гербицидную активность в отношении таких сорных растений, как, например, Sinapis alba, Chrysanthemum segetum, Avena sativa, Stellaria media, Echinochloa crus-galli и Lolium multiflorum, которые подвергают довсходовой обработке.
2. Действие на сорняки после их всходовой обработки
Семена или ризомные куски моно- и дикотильных сорняков вносят в песчаную глинистую почву в пластмассовых горшках и затем на почву наносят покровный слой той же земли. Горшки размещают в теплице в условиях роста сорняков. Через три недели после высева подопытные растения, находящиеся в стадии развития трех листьев, обрабатывают гербицидами.
Имеющиеся в качестве смачивающегося порошка или эмульсионного концентрата активные вещества разбавляют водой, взятой в количестве 600 - 800 л/га. Получаемые при этом рабочие препараты наносят на зеленые части растений в различных дозах. Через 3-4 недели выращивания подопытных растений в теплице в оптимальных условиях оптически определяют активность препаратов по сравнению с необработанными контрольными растениями. И при послевсходовой обработке предлагаемые средства проявляют хорошую гербицидную активность в отношении широкого спектра важных с экономической точки зрения сорных трав и растений. Так, например, при расходе 0,3 кг и меньше активного вещества на гектар соединения примеров 1.1 - 1.3, 2.1 -2.16, 3.1 - 3.7, приведенных в таблицах 1 - 3, проявляют хорошую гербицидную активность в отношении сорных растений, таких, как, например, Sinapis alba, Stellaria media, Echinochloa crus- galli, Lolium multiflorum, Chrysanthemum segetum и Avena sativa.
3. Переносимость гербицидов культурными растениями
Для осуществления данных опытов семена ряда культурных и сорных растений высеивают в песчаную глинистую почву, которую покрывают слоем той же земли. Часть горшков сразу обрабатывают согласно данным по п.1, а остальные горшки размещают в теплице до развития двух или трех настоящих листьев у растений и затем обрабатывают согласно данным по п. 2, при этом предлагаемые соединения формулы (I) применяют в различных дозах. Через 4-5 недель после обработки и пребывания в теплице оптически определяют, что как при довсходовой, так и послевсходовой обработке предлагаемые соединения не оказывают никакого отрицательного действия на двудольные культуры, такие, как, например, соя, хлопок, рапс, сахарная свекла и картофель, даже если их применяют в высоких дозах. Кроме того, некоторые соединения также не оказывают никакого отрицательного действия на злаковые растения, как, например, ячмень, пшеницу, рожь, просо типа Sorghum, кукурузу или рис. Таким образом, соединения формулы (I) имеют высокую избирательность при борьбе с сорной растительностью в сельскохозяйственных культурах.
Описываются производные ацилированной аминофенилсульфонилмочевины общей формулы I, где значения G, Y, X, Z указаны в п.1 формулы изобретения, и их соли щелочных металлов. Они могут найти применение в качестве гербицидов для избирательной борьбы с сорной растительностью в культурных растениях. Описывается также способ их получения. 2 с. и 2 з.п. ф-лы, 3 табл.
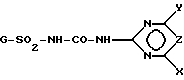
где G - замещенный N-ациламинофенил, выбранный из группы, включающей остатки G1 и G2 следующих формул: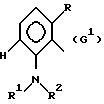
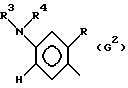
где R - остаток формулы CO2R5, где R5 означает алкил с 1 - 5 атомами углерода;
R1 - алкил с 1 - 5 атомами углерода;
R2 - CO2-алкил с 1 - 5 атомами углерода;
R3 - водород, алкил с 1 - 5 атомами углерода;
R4 - формил или CO алкил с 1 - 5 атомами углерода, CO2-алкил с 1 - 5 атомами углерода, незамещенные или замещенные одним или несколькими галоидами, SO2-алкил с 1 - 4 атомами углерода, CO-NHR6, где R6 - алкил с 1 - 4 атомами углерода, или CSNHR7, где R7 - алкил с 1 - 4 атомами углерода;
X - алкоксил с 1 - 2 атомами углерода или диалкиламино с 1 - 2 атомами углерода в каждой алкильной части;
Y - галоген, алкил с 1- или 2 атомами углерода, алкоксил с 1 или 2 атомами углерода или галоидалкоксил с 1 или 2 атомами углерода;
Z - группа CH или азот,
или их соли щелочных металлов.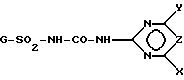
где G - замещенный N-ациламинофенил, выбранный из группы, включающей остатки G1 и G2 следующих формул: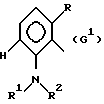
где R - остаток формулы CO2R5, где R5 означает алкил с 1 - 5 атомами углерода;
R1 - алкил с 1 - 5 атомами углерода;
R2 - CO2-алкил с 1 - 5 атомами углерода;
R3 - водород, алкил с 1 - 5 атомами углерода;
R4 - формил или CO алкил с 1 - 5 атомами углерода, CO2-алкил с 1 - 5 атомами углерода, незамещенные или замещенные одним или несколькими галоидами, SO2-алкил с 1 - 4 атомами углерода, CO-NHR6, где R6-алкил с 1 - 4 атомами углерода, или CSNHR7, где R7 - алкил с 1 - 4 атомами углерода;
X - алкоксил с 1 - 2 атомами углерода или диалкиламино с 1 - 2 атомами углерода в каждой алкильной части;
Y - галоген, алкил с 1- или 2 атомами углерода, алкоксил с 1 или 2 атомами углерода или галоидалкоксил с 1 или 2 атомами углерода;
Z - группа CH или азот,
отличающийся тем, что соединение формулы II
где R, R1, R2 имеют вышеуказанные значения,
подвергают взаимодействию с гетероциклическим карбаматом формулы III
где X и Y имеют вышеуказанные значения;
R* означает незамещенный или замещенный фенил или алкил с 1 - 4 атомами углерода,
с последующим выделением целевого продукта в свободном виде или в виде соли щелочных металлов.
| US 4892946 A, 1990 | |||
| Электронагревательная строительная панель | 1957 |
|
SU116518A1 |
| Гербицидный состав | 1977 |
|
SU860675A3 |
| Способ борьбы с нежелательной растительностью | 1981 |
|
SU1169516A3 |
| Способ борьбы с нежелательной растительностью | 1980 |
|
SU1482508A3 |
| Замещенные фенилсульфонилтриазинолмочевины или их диэтилэтаноламмониевые соли, обладающие гербицидной и ростостимулирующей активностью | 1987 |
|
SU1782974A1 |
Авторы
Даты
2000-04-20—Публикация
1994-06-28—Подача