Данное изобретение относится к ацилированию белков. В частности, изобретение относится к одностадийному способу селективного ацилирования ε-аминогруппы проинсулина, инсулина или инсулинового аналога в присутствии α-свободной аминогруппы.
Ацилирование аминогрупп представляет один из наиболее обычных способов, используемых для химической модификации белков. Обычные способы ацилирования изложены в Methods of Enzymology, 25: 494-499 (1972) и они включают использование активированных сложных эфиров, хлорангидридов или ангидридов кислот. Использование активированных сложных эфиров, в частности сложных эфиров N-гидроксисукцинимида жирных кислот, является особенно благоприятным способом ацилирования свободной аминокислоты жирной кислотой. Lapidot et al., J. of Lipid Res. 8: 142-145 (1967). Lapidot et al. описывают получение сложных эфиров N-гидроксисукцинимида и их использование для получения N-лауроил-глицина, N-лауроил-L-серина и N-лауроил-L-глутаминовой кислоты.
Ранние исследования селективного ацилирования аминогрупп инсулина описаны Lindsay et al., Biochem.J. 121: 737-745 (1971). Lindsay et al., описывают реакционную способность инсулина с N-сукцинимидил ацетатом при низкой концентрации реагента и близким к нейтральному pH, с получением двух монозамещенных продуктов, PheB1-ацетил-инсулина и GlyA1-ацетил инсулина. При pH 8,5 количество получаемого PheB1-ацетил-инсулина понижается и, кроме того, получается LysB29-ацетил-инсулин. Таким образом, Lindsay et al. сделали вывод, что при pH 6,9 порядок реакционной способности (аминогрупп инсулина) имеет вид Глицин (A1)= Фенилаланин (B1) >> Лизин (B29) и при pH 8,5 Глицин (A1) > Фенилаланин = Лизин (B29).
Lindsay et al., Пат. США 3 869 437, раскрывают ацилирование B1 аминокислоты ацильной группой, содержащей вплоть до семи углеродов, и необязательно блокирование A1- и/или B29- аминогруппы ацильной группой с вплоть до четырех углеродов. Сложные эфиры N-гидроксисукцинимида описаны как особенно полезные ацилирующие агенты. Для получения максимального выхода инсулина, ацилированного при B1-аминогруппе, количество ацилирующего агента является относительно низким (одна не более чем к двум молярным эквивалентам ацилирующего агента). Кроме того, максимальный выход монозамещенного B1-продукта получают при pH 7 или около pH 7. При pH 8,5 до 9,0, выход требуемого B1-ацилированного продукта значительно падает в пользу дополнительного замещения в положениях A1 и B29.
D. G. Smyth, в Пат. США 3 868 356 и Smyth et al., в Пат. США 3 868 357, раскрывает N-ацилированные, O-замещенные производные инсулина, в которых, по крайней мере, одну из A1, B1 или B29 аминокислотных аминогрупп превращают в блокированную аминогруппу. Ацилирование проводят при относительно малом избытке ацилирующего агента, например от 2 до 3 моля на аминогруппу, при нейтральном или умеренно щелочном pH, например 7,8. Реакция протекает с очень высоким выходом с образованием дизамещенного производного, получающегося при взаимодействии A1- и B1-аминогрупп. В присутствии избытка ацилирующего агента, например, вплоть до 10 молярного, реакция протекает дополнительно при B29-аминогруппе с образованием тризамещенного производного.
Чтобы селективно ацилировать инсулин, Muranishi and Kiso, в патентной заявке Японии 1-254 699, раскрывают пятистадийный синтез получения производных инсулина жирных кислот. На стадии один получают активированный сложный эфир жирной кислоты; на стадии два аминогруппы инсулина защищают п-метокси бензокси карбонил азидом (pMZ); на стадии три инсулин-pMZ подвергают взаимодействию со сложным эфиром жирной кислоты; на стадии четыре с ацилированного инсулина снимают защиту; и на стадии пять ацилированный инсулин выделяют и очищают. Самое замечательное, что селективное ацилирование аминогруппы достигается только при использовании pMZ блокирующей группы, которая защищает другие аминогруппы. Используя эту методологию, Muranishi and Kiso, получили следующие соединения: LysB29-пальмитоил инсулин (ацилирована ε-аминогруппа), PheB1-пальмитоил инсулин (ацилирована N-концевая α-аминогруппа B цепи), и PheB1, LysB29-дипальмитоил инсулин (ацилированы обе ε-аминогруппа и N-концевая α-аминогруппа).
Аналогично, Hashimoto et al. , in Pharmaceutical Research 6: 171-176 (1989), описывает четырехстадийный синтез получения N-пальмитоил инсулина. Синтез включает защиту и снятие защиты N-концевого A1-глицина и ε-аминогруппы B29-лизина с помощью pMZ. В условиях, описанных в ссылке, получают два основных ацилированных продукта, B1-монопальмитоил инсулин и B1, B29-дипальмитоил инсулин.
Таким образом, до настоящего изобретения селективное ацилирование B29-Nε-аминогруппы инсулина осуществляли путем защиты и затем снятия защиты α-аминогрупп.
Данное изобретение обеспечивает селективный одностадийный синтез ацилирования ε-аминогруппы проинсулина, инсулина и инсулиновых аналогов. Данное изобретение дает возможность селективно ацилировать ε-аминогруппу в одностадийном способе с высоким выходом. Таким образом, данное изобретение исключает необходимость защиты других аминогрупп белка и затем снятия с них защиты. Данное изобретение обеспечивает более эффективный и менее дорогостоящий способ получения производных инсулина, ацилированных по ε-аминогруппе.
Данное изобретение обеспечивает способ селективного ацилирования проинсулина или инсулинового аналога, имеющего свободную ε-аминогруппу и свободную α-аминогруппу, жирной кислотой, и этот способ включает взаимодействие ε-аминогруппы с растворимым активированным сложным эфиром жирной кислоты в полярном растворителе в щелочных условиях при pH 9,5-11,5.
Все используемые в этом описании аббревиатуры для аминокислот являются аббревиатурами, общепринятыми для Ведомства США по патентам и товарным знакам и изложенными в Кодексе Федеральных Правил США 37 C.F.R. $ 1.822 (B) (2).
Как указано выше, данное изобретение обеспечивает высоко селективное одностадийное ацилирование ε-аминогруппы проинсулина, инсулина или инсулинового аналога. Данное изобретение определяет условия, при которых предпочтительно ацилируется ε-аминогруппа по сравнению с α-аминогруппами. В общем, моноацилированная α-аминогруппа получается с менее чем 5% выходом.
Используемый здесь термин "инсулин" означает человеческий инсулин, свиной инсулин или бычий инсулин. Инсулин обладает тремя свободными аминогруппами: при B1-фенилаланине, A1-глицине и B29-лизине. Свободные аминогруппы в положениях A1 и B1 являются α-аминогруппами. Свободная аминогруппа в положении B29 является ε-аминогруппой.
Используемый здесь термин "проинсулин", соответственно, является сшитым белком формулы:
B-C-A
где:
A является A цепью инсулина или функциональным производным его;
B является B цепью инсулина или функциональным производным его, имеющей ε-аминогруппу; и
C представляет собой связывающий пептид проинсулина.
Предпочтительно проинсулин представляет A цепь человеческого инсулина, B цепь человеческого инсулина и C представляет собой природный связывающий пептид. Когда проинсулин является природной последовательностью, то проинсулин имеет три свободных аминогруппы: B1-Фенилаланин (α-аминогруппа), C64-Лизин (ε-аминогруппа) и B29-Лизин (ε-аминогруппа).
Используемый здесь термин "инсулиновый аналог", соответственно, представляет собой сшитый белок формулы:
A - B
где:
A представляет собой функциональное производное A цепи инсулина; и
B представляет собой функциональное производное В цепи инсулина, имеющее ε-аминогруппу.
Предпочтительные инсулиновые аналоги включают инсулин, где:
аминокислотный остаток в положении B29 представляет Asp, Lys, Leu, Val или Ala;
аминокислотный остаток в положении B29 представляет Lys или Pro;
аминокислотный остаток в положении B10 представляет His или Asp;
аминокислотный остаток в положении B1 представляет Phe, Asp или он удален один или в комбинации с удалением остатка в положении B2;
аминокислотный остаток в положении B30 представляет Thr, Ala или удален; и
аминокислотный остаток в положении B9 представляет Ser или Asp;
при условии, что либо положение B28, либо B29 представляет Lys.
В стандартных биохимических терминах, известных специалисту в данной области техники, предпочтительные аналоги инсулина представляют LysB28ProB29-человеческий инсулин (B28 представляет Lys; B29 представляет Pro); AspB28-человеческий инсулин (B28 представляет Asp); AspB1-человеческий инсулин, ArgB31,B32-человеческий инсулин, AspB10-человеческий инсулин, ArgA0-человеческий инсулин, AspB1, GluB13-человеческий инсулин, AlaB26-человеческий инсулин, дез(B30)-человеческий инсулин и GlyA21-человеческий инсулин.
Термин "ацилирование" означает введение одной или более ацильных групп, ковалентно связанных со свободными аминогруппами белка.
Термин "селективное ацилирование" означает предпочтительное ацилирование ε-аминогрупп(ы) по сравнению с α-аминогруппами. Обычно селективное ацилирование приводит к соотношению количества продукта с моноацилированной ε-аминогруппой к количеству продукта с моноацилированной α-аминогруппой, большему, чем приблизительно 5. Предпочтительно соотношение больше, чем приблизительно 10, и наиболее предпочтительно больше, чем приблизительно 50.
Термин "жирная кислота" означает насыщенную или ненасыщенную C6-C21 жирную кислоту. Термин "сложный эфир активированной жирной кислоты" означает жирную кислоту, которая активирована с использованием общих методик, описанных в Methods of Enzymology, 25, 494-499 (1972) и Lapidot et al., in J. Of Lipid Res. 8: 142-145 (1967). Предпочтительными жирными кислотами являются насыщенные и к ним относятся миристиновая кислота (C14), пентадециловая кислота (C15), пальмитиновая кислота (C16), гептадециловая кислота (C17) и стеариновая кислота (C18). Наиболее предпочтительной жирной кислотой является пальмитиновая кислота. Сложный эфир активированной жирной кислоты включает производные веществ, таких как гидроксибензотриазид (HOBT), N-гидроксисукцинимид и их производные. Предпочтительным активированным сложным эфиром является N-сукцинимидил пальмиат.
Термин "растворимый" указывает, что в жидкой фазе присутствует достаточное количество сложного эфира, чтобы ацилировать инсулин, аналог инсулина или проинсулин. Предпочтительно в жидкой фазе находится около 1-4 молярных эквивалентов активированного сложного эфира на моль инсулина.
Используемый здесь термин "щелочные условия" относится к основности реакции. Реакция должна осуществляться со всеми свободными аминогруппами, в основном, депротонированными. В водном растворителе или полуводной смеси растворителя термин "щелочные условия" означает, что реакцию выполняют при pH выше, чем 9,0. В неводном органическом растворителе реакцию осуществляют в присутствии щелочного соединения с основностью, эквивалентной величине pKa в воде, которая может превышать или быть равной 10,75.
Термин "сшитый" означает образование дисульфидных связей между остатками цистеина. Надлежащим образом сшитый проинсулин, инсулин или инсулиновый аналог содержит три дисульфидных мостика. Первый дисульфидный мостик образован между остатками цистеина в положениях 6 и 11 A-цепи. Второй дисульфидный мостик связывает остаток цистеина в положении 7 A-цепи с цистеином в положении 7 B-цепи. Третий дисульфидный мостик связывает цистеин в положении 20 A-цепи с цистеином в положении 19 B-цепи.
До настоящего изобретения специалист в данной области селективно ацилировал ε-аминогруппу путем использования защищающей группы в многостадийном синтезе. Muranishi and Kiso, заявка на Пат. Японии 1-254, 699, раскрывают пятистадийный синтез получения ацилированных производных инсулина. Аналогично, Hashimoto et al., в Pharmaceutical Research 6: 171-176 (1989), сообщают о четырехстадийном синтезе получения N-пальмитоил инсулина. Для селективного ацилирования инсулина обе ссылки указывают на использование pMZ защищающей группы.
Данное изобретение дает возможность получить Nε-ацилированный проинсулин, инсулин или инсулиновый аналог путем одностадийного синтеза с высоким выходом. Реакция допускает получение Nε-ацилированных белков без использования амино-защищающих групп. Ацилирование выполняют путем взаимодействия сложного эфира активированной жирной кислоты с ε-аминогруппой белка в щелочных условиях в полярном растворителе. В слабо щелочных условиях, все свободные аминогруппы являются не депротонированными и в результате происходит значительное ацилирование N-концевых аминогрупп. В водном растворителе или полуводной смеси растворителя щелочные условия означают, что реакцию проводят при pH более 9,0. Поскольку деградация белка имеет место в области pH свыше 12,0, то pH реакционной смеси предпочтительно находится в диапазоне от 9,5 до 11,5 и наиболее предпочтительно равен 10,5. Величина pH реакционной смеси в смешанном органическом и водном растворителе равна pH водной фазы до смешивания.
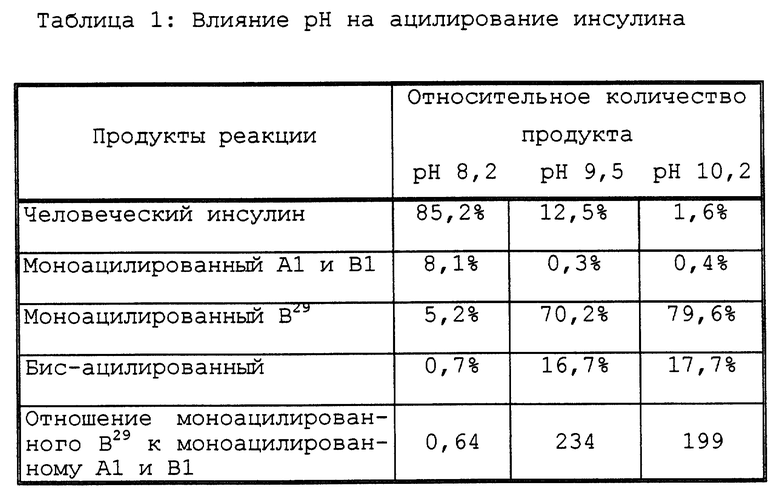
Данные в Таблице 1 демонстрируют влияние основности реакционной смеси на селективность реакции. Данные, представленные в Таблице 1, соответствуют человеческому инсулину, ацилированному двумя молярными эквивалентами N-сукцинимидилпальмитата в 50% смеси CH3CN/вода.
Таблица 1 демонстрирует, что ацилирование ε-аминогруппы зависит от основности реакции. При pH выше чем 9,0 в реакции селективно ацилируется ε-аминогруппа B29-лизина.
В неводном растворителе реакцию осуществляют в присутствии щелочного соединения с основностью, эквивалентной величине pKa, которая превышает или равна 10,75 в воде, для того чтобы в достаточной степени депротонировать ε-аминогруппу(ы). Т.е. это щелочное соединение должно быть, по крайней мере, таким же сильным, как триэтиламин. Предпочтительно, чтобы оно представляло тетраметилгуанидин (ТМГ), диизопропилэтиламин или тетрабутиламмоний гидроксид.
Выбор полярного растворителя сильно зависит от растворимости проинсулина, инсулина или аналога инсулина и сложного эфира жирной кислоты. Наиболее предпочтительно, когда растворитель полностью органический. Обычно приемлемые органические растворители включают ДМСО, ДМФ и т.п. Водный растворитель и смеси водного и органического растворителей также приемлемы. Выбор полярных растворителей ограничен только растворимостью реагентов. Предпочтительными растворителями и системами растворителей являются ДМСО; ДМФ; ацетонитрил и вода; ацетон и вода; этанол и вода; изопропиловый спирт и вода; изопропиловый спирт, этанол и вода; и этанол, пропанол и вода. Предпочтительным растворителем является смесь ацетонитрила и воды; наиболее предпочтителен 50%-ный ацетонитрил. Для специалиста в данной области очевидно, что приемлемы также и другие полярные растворители.
Отношение реагентов не является решающим. Обычно предпочитают, чтобы активированный сложный эфир жирной кислоты находился в молярном избытке. Предпочтительно реакцию проводят с 1-4 молярными эквивалентами, наиболее предпочтительно 1-2 молярными эквивалентами, сложного эфира. Однако для специалиста в данной области должно быть очевидно, что при очень высоких уровнях активированного сложного эфира бис- или три-ацилированный продукт будут получаться в значительном количестве.
Температура реакции также не является решающей. Реакцию проводят при температуре в диапазоне 0-40 градусов Цельсия и обычно она завершается в течение от 15 минут до 24 часов.
После ацилирования реакцию гасят и продукт очищают с помощью стандартных методов, таких как хроматография с обращенной фазой или гидрофобная хроматография. После этого продукт выделяют с помощью стандартных способов, таких как сушка вымораживанием или кристаллизация.
Проинсулин, инсулин или аналоги инсулина можно получить с помощью любой из целого ряда известных техник пептидного синтеза, включая классические (раствор) способы, твердофазные способы, полусинтетические способы, и более поздние способы с использованием рекомбинантной ДНК. Например, Chance et al. , заявка на Пат. США N 07/388 201, EPO номер публикации 383 472, Brange et al. , EPO 214 826, и Belagaje et al. Пат.США 5 304 473, раскрывают получение различного проинсулина и аналогов инсулина, на которые здесь ссылаются. A и B цепи аналогов инсулина данного изобретения можно получить через подобную проинсулину молекулу предшественника, используя технику рекомбинантных ДНК. Смотри Frank et al., Peptides: Synthesis-Structure-Function, Proc. Seventh Am. Pept. Symp., Eds. D. Rich and E. Gross (1981), на которую здесь ссылаются.
Следующие примеры предназначены только для дополнительной иллюстрации данного изобретения. Объем данного изобретения не следует истолковывать как только состоящий из нижеследующих примеров.
Пример 1
Ацилирование инсулина, используя N-сукцинимидилпальмитат в ДМСО.
Кристаллы биосинтетического человеческого инсулина (БЧИ, BHI) (71,9 мг) растворяют в 6,58 мл ДМСО. Раствор перемешивают при комнатной температуре до тех пор пока кристаллы полностью не растворятся при визуальном наблюдении. Раствор активированного сложного эфира (N-сукцинимидилпальмитат) получают путем добавления 20 мг твердого активированного сложного эфира к 2 мл ДМСО и энергичного перемешивания до тех пор, пока все частицы активированного сложного эфира не растворятся при визуальном наблюдении. В это время 1,1,3,3-тетраметилгуанидин (26,8 мкл) добавляют к 5 мл БЧИ (BHI) раствора, а затем добавляют ДМСО (94,4 мл) и предварительно полученный раствор активированного сложного эфира (400 мкл). Дают возможность протекать реакции при комнатной температуре (20 до 25oC) в течение приблизительно 60 минут. Пробу отбирают после 15 минут, разбавляют в 20 раз 1 N уксусной кислотой и анализируют ВЭЖХ (HPLC). Выход реакции, рассчитанный как количество B29-Nε-пальмитоил человеческий инсулина в погашенной пробе, деленное на начальное количество БЧИ, составлял 67,1%.
Пример 2
Ацилирование инсулина, используя N-сукцинимидил-пальмитат в смеси ацетонитрил/вода
Кристаллы биосинтетического человеческого инсулина (БЧИ, BHI) (199,5 мг) растворяют в 20 мл 50 мМ раствора борной кислоты при pH 2,5. pH раствора повторно доводят до 2,5, используя 10% HCl, и раствор перемешивают до тех пор, пока кристаллы полностью не растворятся при визуальном наблюдении. Пробу исходного вещества удаляют, и измеренное поглощение при 276 нм, составляло 10,55. Раствор активированного сложного эфира (N-сукцинимидилпальмитат) получают добавлением 24 г твердого активированного сложного эфира к 2,4 л ацетонитрила, предварительно нагретого до приблизительно 50oC, и энергичным перемешиванием до тех пор, пока все частицы активированного сложного эфира не растворятся при визуальном наблюдении. В это время pH БЧИ (BHI) раствора доводят до приблизительно 10,22 путем добавления 10% NaOH. Ацетонитрил (18 л) добавляют к pH-доведенному БЧИ раствору. Дают возможность протекать реакции при комнатной температуре (20 до 25oC) в течение 110 минут, затем гасят добавлением воды (123 л) и доведением pH полученного раствора до 2,1, используя 10% HCl и 10% NaOH. Выход реакции, рассчитанный как количество B29-Nε-пальмитоил человеческого инсулина в погашенной реакции, деленное на начальное количество БЧИ (BHI), составлял 73%.
Пример 3
Ацилирование LysB28-ProB29-человеческого инсулина, используя N-сукцинимидилпальмитат в смеси ацетонитрил/вода
Кристаллы LysB28 ProB29-человеческого инсулина (2,22 г) растворяют в 100 мл 50 мМ раствора борной кислоты при pH 2,5. pH раствора повторно доводят до 2,5, используя 10% HCl, и раствор перемешивают до тех пор пока кристаллы полностью не растворятся при визуальном наблюдении. Раствор активированного сложного эфира (N-сукцинимидилпальмитат) получают добавлением 270 мг твердого активированного сложного эфира к 27 мл ацетонитрила, предварительно нагретого до приблизительно 50oC, и энергичным перемешиванием до тех пор, пока все частицы активированного сложного эфира не растворятся при визуальном наблюдении. pH раствора доводят до приблизительно 10,22 путем добавления 10% NaOH и раствору дают возможность перемешиваться при 4oC в течение 15 минут. К pH-доведенному раствору добавляют ацетонитрил (73 мл), а затем предварительно полученный раствор активированного сложного эфира. Дают возможность протекать реакции при 4oC в течение 85 минут и гасят добавлением 1 N уксусной кислоты (600 мл), получая в результате pH 2,85. Выход реакции, рассчитанный как количество B28-Nε -пальмитоил LysB28 ProB29-человеческого инсулина в погашенной реакции, деленное на начальное количество LysB28 ProB29-человеческий инсулина, составлял 72,5%.
Пример 4
Ацилирование БЧИ, используя N-сукцинимидилпальмитат в смеси ацетонитрил/вода
Кристаллы биосинтетического человеческого инсулина (БЧИ, BHI) (3 г) растворяют в 300 мл 50 мМ раствора борной кислоты при pH 2,5. pH раствора повторно доводят, при необходимости, до 2,5, используя 10% HCl, и раствор перемешивают до тех пор, пока кристаллы полностью не растворятся при визуальном наблюдении. Раствор активированного сложного эфира (N-сукцинимидилпальмитат) получают добавлением 400 мг твердого активированного сложного эфира к 40 мл ацетонитрила и энергичным перемешиванием. В это время pH раствора БЧИ (BHI) кристаллов доводят до приблизительно 10,2 путем добавления 10% NaOH. Ацетонитрил (240 мл) добавляют к БЧИ раствору, а затем добавляют предварительно полученный раствор активированного сложного эфира. Реакции дают возможность протекать при комнатной температуре (20 до 25oC) в течение приблизительно 90 минут, затем гасят добавлением воды (1800 мл) и доведением pH полученного разбавленного раствора до приблизительно 2,5, используя 10% HCl. Выход реакции, рассчитанный как количество B29-Nε-пальмитоил человеческого инсулина, полученного в реакции, деленное на начальное количество БЧИ(BHI), составлял 75,7%.
Пример 5
Ацилирование проинсулина N-сукцинимидилпальмитатом в смеси ацетонитрил/вода
Водный раствор человеческого проинсулина (ЧПИ) (28,2 мг/мл) разбавляют 50 мМ раствором борной кислоты до конечного объема 100 мл при 16,2 мг/мл ЧПИ. Раствор активированного сложного эфира получают одновременно путем растворения 150 мг N-сукцинимидил-пальмитата в 15 мл ацетонитрила (АЦН, ACN) при быстром перемешивании. pH ЧПИ раствора доводят до 10,2 10% NaOH, а затем добавляют 88 мл АЦН. Реакцию инициируют добавлением 12 мл раствора активированного сложного эфира (2 х молярный избыток по отношению ЧПИ). Конечный реакционный объем составлял 200 мл, 8 мг/мл ЧПИ в 50% водном АЦН. Реакции дают возможность протекать при комнатной температуре (20 до 25oC) в течение приблизительно 60 минут, затем гасят добавлением эквивалентного объема (200 мл) 50 мМ глицина, pH 10,0.
Точные отношения ε-аминоацилированных производных к α-аминоацилированным производным не рассчитывали, сумма всех ε-аминоацилированных производных, рассчитанных по хроматограмме, составляла 87-90% общей площади, в то время как сумма всех родственных веществ (которая должна предположительно включать любые α-аминоацилированные производные) составляла менее 7% общей площади, для любого данного момента времени.
Пример 6
Ацилирование ArgB31, ArgB32 человеческого инсулина сложным эфиром гексаноил-N-гидрокси-сукцинимида
ArgB31, ArgB32 человеческий инсулин (1,3 мг) растворяют в 200 мкл 200 мМ (3-[Циклогексиламино] -1-пропансульфокислота) буфера при pH 10,4. Затем в раствор добавляют сложный эфир гексаноил-N-гидроксисукцинимида (0,3 мкмоль), растворенный в N,N-диметилформамиде (ДМФ), и перемешивают. Реакционную смесь перемешивают при температуре окружающей среды (20 до 25oC) в течение приблизительно четырех часов, затем гасят путем доведения pH до приблизительно 2,5, используя 0,1 N HCl. Желатинообразные частицы удаляют, пропуская смесь через 0,45 микронный фильтр до ВЭЖХ (HPLC) анализа. Отделение названного продукта от исходного вещества достигают на аналитической ВЭЖХ колонке с C4 обращенной фазой. Выход реакции, рассчитанный как количество B29-Nε-гексаноил-ArgB31, ArgB32-человеческого инсулина в погашенной реакции, деленное на начальное количество ArgB31, ArgB32-человеческого инсулина составлял 69,4%.
Пример 7
Ацилирование LeuB26-человеческого инсулина N-сукцинимидилпальмитатом в ДМСО.
LeuB26-человеческий инсулин (1,0 мг) растворяют в 1 мл 95% диметилсульфоксида (ДМСО), 5% триэтиламина (ТЭА). Затем в раствор добавляют N-сукцинимидил пальмитат (0,7 мкмоль), растворенный в N,N-диметилформамиде (ДМФ), и перемешивают. Реакционную смесь перемешивают при температуре окружающей среды (20 до 25oC) в течение приблизительно девяноста минут, затем гасят путем разбавления образца до 0,2 мг/мл 0,1 N HCl. Желатинообразные частицы удаляют, пропуская смесь через 0,45 микронный фильтр до ВЭЖХ (HPLC) анализа. Отделение названного продукта от исходного вещества достигают на аналитической ВЭЖХ колонке с C4 обращенной фазой. Выход реакции, рассчитанный как количество Nε-пальмитоил-LeuB26 человеческого инсулина в погашенной реакции, деленное на начальное количество LeuB26 человеческого инсулина, составлял 36,4%.
Пример 8
Ацилирование человеческого инсулина, используя N-сукцинимидилпальмитат в диметилсульфоксиде (ДМСО)
Раствор инсулина получают полным растворением кристаллов биосинтетического человеческого инсулина (1 г, 0,17 ммоль) в 20 мл ДМСО при комнатной температуре. В то же самое время получают раствор активированного сложного эфира путем растворения N-сукцинимидилпальмитата (0,0817 г, 0,23 ммоль) в 3 мл ДМСО при 50oC. К раствору инсулина, который энергично перемешивают, добавляют сначала 1,1,3,3-тетраметил-гуанидин (0,432 мл, 3,4 ммоль) и затем весь раствор активного сложного эфира. Через 30 минут реакцию гасят 120 мл 0,05 М HCl, предварительно охлажденной до 0oC. pH смеси составлял приблизительно 1,8. Анализ погашенной смеси с помощью ВЭЖХ (HPLC) с обращенной фазой показывает, что B29-Nε-пальмитоил инсулин составляет 72,2% общего элюированного белка и представляет 95% общего моноацилированного инсулина.
Всю реакционную смесь наносят на Vydac препаративную колонку с C4 обращенной фазой (5 х 25 см), предварительно уравновешенную смесью растворителя, содержащего 0,1% трифторуксусной кислоты, 20% ацетонитрила в воде. После нанесения колонку сначала промывают 500 мл того же самого растворителя и затем устанавливают скорость потока 4 мл/мин и промывают системой растворителя, состоящей из 0,1% трифторуксусной кислоты, ацетонитрила и воды, в которой концентрацию ацетонитрила увеличивают от 20 до 80% в 9 л. B29-Nε-пальмитоил инсулин элюировался этой системой растворителя, состоящей из приблизительно 53% ацетонитрила. После удаления растворителя лиофилизацией выход Nε-пальмитоил инсулина составил 414 мг (0,0684 ммоль) или 40,2% в расчете на исходное вещество.
Пример 9
Ацилирование LysB28-ProB29-человеческого инсулина сложным эфиром 1-октаноил-N-гидроксисукцинимида
Кристаллы Lys(B28)Pro(B29) человеческого инсулина (КРВ) (2,0 г) растворяют в 200 мл 50 мМ борной кислоты-буфера при pH 2,5. pH раствора повторно доводят до 2,5, используя 10% HCl, и раствор перемешивают до тех пор, пока кристаллы полностью не растворятся при визуальном наблюдении. Раствор активированного сложного эфира (сложный эфир 1-октаноил-N- гидроксисукцинимида) получают добавлением 175 мг твердого активированного сложного эфира к 25,62 мл ацетонитрила, и энергичным перемешиванием до тех пор, пока все частицы активированного сложного эфира не растворятся при визуальном наблюдении. pH КРВ раствора доводят до приблизительно 10,4 путем добавления 10% NaOH, и раствору дают возможность перемешиваться при температуре окружающей среды в течение около 5 минут. К pH-доведенному КРВ раствору добавляют ацетонитрил (176 мл), а затем предварительно полученный раствор активированного сложного эфира. Дают возможность протекать реакции при температуре окружающей среды в течение 90 минут и гасят добавлением 5,5 мл 10% HCl (2.75% об/об) и трех объемов (1200 мл) холодной H2O, получая в результате конечный pH 2,70. Выход реакции, рассчитанный как количество LysB29(C8)KPB в погашенной реакции, деленное на начальное количество БЧИ, составлял 75,5%. Этот раствор делят на две 800 мл аликвоты для очистки гидрофобной хроматографии (SP20SS). За колоночной хромотографией следует ультрафильтрация и лиофилизация.
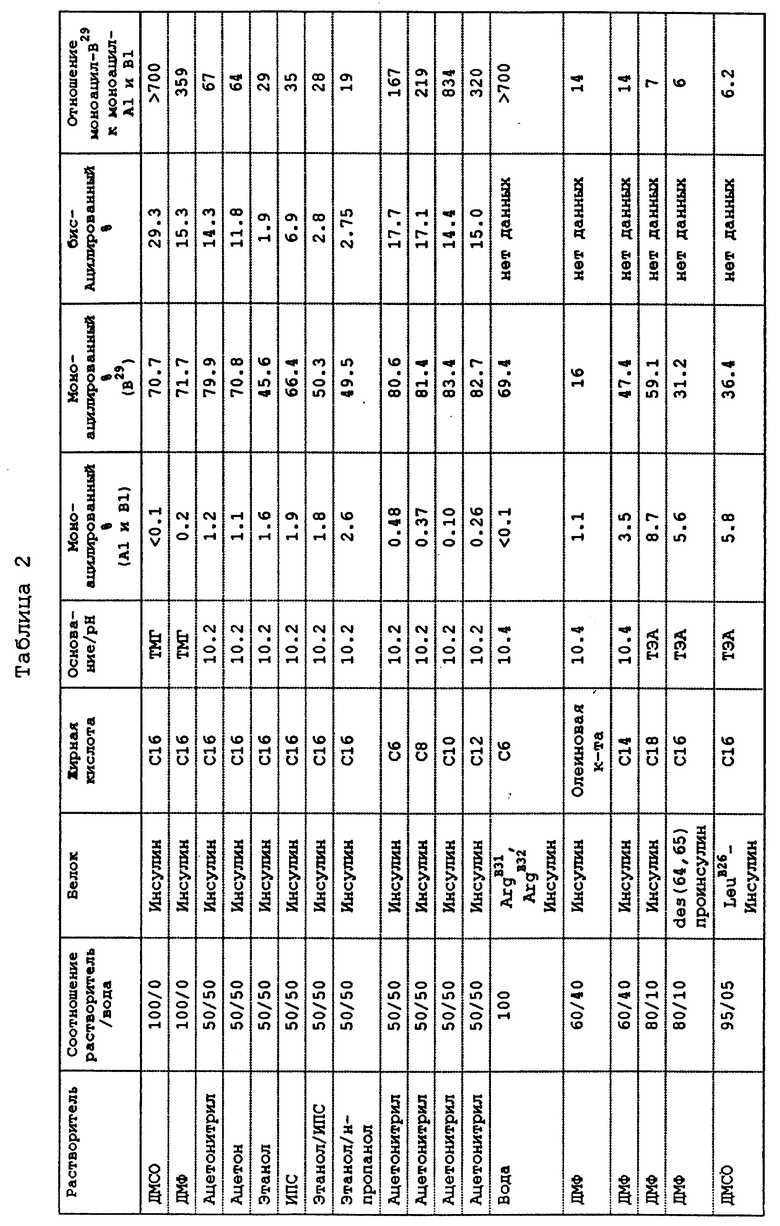
Данные в Таблице 2 демонстрируют селективное ацилирование инсулина, инсулиновых аналогов и проинсулина. Эксперименты проводят при комнатной температуре со сложными эфирами N-гидроксисукцинимида жирной кислоты. В Таблице 2 ТМГ и ТЭА представляют тетраметилгуанидин и триэтиламин соответственно. ND указывает на отсутствие данных.
Изобретение относится к ацилированию белков и может быть использовано в химической и медицинской промышленности. Сущность изобретения: описан одностадийный способ селективного ацилирования ε-аминогруппы проинсулина, инсулина или инсулинового аналога в присутствии свободной α-аминогруппы с использованием растворимого активированного сложного эфира жирной кислоты в полярном растворителе при рН 9,5-11,5. Технический результат - высокий выход целевого продукта и упрощение технологии получения производных инсулина. 4 з.п. ф-лы, 2 табл.
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| 0 |
|
SU385436A1 | |
| US 3868356 A, 25.02.1975 | |||
| US 3869437 A, 04.03.1975. | |||
Авторы
Даты
2000-09-10—Публикация
1995-11-14—Подача