Хрящи представляют собой аваскуляризованные ткани, и они были исследованы как потенциальные кандидаты, содержащие антиангиогенные факторы. Они также представляют собой ткани, которые относительно устойчивы к развитию опухолей. Из опухолей, связанных с хрящами, хондросаркома является наименее васкуляризованной из твердых опухолей. Ангиогенез является одним из важных факторов в развитии опухолей. Дискретные твердые опухолевые массы появляются в том случае, если опухолевые клетки могут спровоцировать распространение соседней сети сосудов для удовлетворения их собственных потребностей в питании. Поэтому проводились исследования роли факторов, участвующих в стимуляции ангиогенеза в развитии опухолей и антиангиогенных факторов, а также лекарственных препаратов, обладающих активностью в отношении ингибирования ангиогенеза, которые исследовались как средства, контролирующие рост или обеспечивающие регрессию опухолей.
Было обнаружено, что лопаточный хрящ у телят содержит вещество, которое ингибирует васкуляризацию твердых опухолей (Langer et al., 1976). Из-за его обнадеживающего потенциала в качестве антиопухолевого агента, были начаты поиски более обширных источников хрящей.
Акулы как раз и являются животными, представляющими собой потенциальный источник такого типа ингибиторов ангиогенеза, так как их эндоскелет состоит полностью из хряща (6% от веса тела по сравнению с 0,6% у телят). Акулы также отличаются интересным свойством - весьма малой предрасположенностью к развитию опухолей. Для объяснения такой малой предрасположенности к развитию опухолей у акул было выдвинуто множество гипотез. Marchalonis et al. (1990) обнаружили IgM антитела, способные быстро атаковать любые агрессивные агенты. McKinney et al. , (1990) показали, что у акул имеются макрофаги, способные дифференцировать нормальные клетки и неопластичные клетки и способные разрушать последние. Rosen and Woodhead (1980) предположили, что феномен редких случаев опухолей у elasmobranchs (группа, к которой относятся акулы и скаты), вероятно, связан с высокой ионной силой их тканей, что эквивалентно высокой температуре тела. Эти авторы считают, что в таких условиях иммунная система демонстрирует иммунологический контроль, близкий к 100%. Moore et al. (1993) обнаружили, что акулы продуцируют аминостерол, который обладает антибактериальными и антипротозойными свойствами. И, наконец, Lee and Langer (1983) и Folkman and Klagsbrun (1987) показали, что акулы продуцируют вещество, которое ингибирует неоваскуляризацию. Lee and Langer (op. cit) выделили это вещество, экстрагировав его из хрящей акулы в денатурирующих условиях (экстракция гуанидином). Однако такой способ экстракции весьма длителен (41 день) и позволяет получать экстракты с денатурированным фактором, а выход активных компонентов весьма далек от хорошего. Если активное вещество, выделенное из телят, имеет молекулярную массу около 16 килодальтон (кД), та же самая группа исследователей не сообщила точные значения молекулярной массы для активного вещества, обнаруженного в акулах. Определено лишь, что молекулярная масса этого вещества выше 3500 дальтон. Oikawa et al. (1990) использовали тот же самый способ экстрагирования, который был описан Lee and Langer, но гораздо менее длительный (2 дня вместо 41 дня). Антиангиогенное вещество, выделенное из хрящей акулы Oikawa et al., ограничено молекулярной массой в интервале от 1000 до 10000 дальтон. Schinitsky (патент США 4473551) описывает водный экстракт неочищенного порошка хряща акулы, фракция которого с молекулярной массой более 100000 дальтон обладает противовоспалительной активностью, взятая отдельно или в сочетании с глюкозамином. В этом патенте не выдвигается никаких предположений о наличии у компонентов этого экстракта антиангиогенной или противоопухолевой активности. Kuetner et al. (патент США 4746729) выделили полиморфоядерный нейтрофильный (PMN) ингибитор эластазы из бычьего хряща. Этот ингибитор был получен из водного экстракта хряща, из которого были удержаны молекулы с молекулярной массой менее 50000 дальтон. Фракционирование на Sephacryl S-200 позволило получить множество фракций, из которых были собраны фракции с молекулярной массой 10-40 кД, после того, как они продемонстрировали антиэластазную активность. Изоэлектрическая точка активного компонента составляет 9,5, и он может иметь молекулярную массу около 15000 дальтон. Kuetner et al. (патент США 4042457) показали также, что бычий хрящ содержит компонент с молекулярной массой менее 50000 дальтон, которая обладает активностью в отношении ингибирования клеточной пролиферации без какой-либо активности в отношении роста эндотелиальных клеток. Balassa et al. (патент США 4822607) получили экстракт хряща в водном растворе, причем этот экстракт обладал противоопухолевой активностью. Однако авторы изобретения не наблюдали никакой антиангиогенной активности в экстракте, полученном при воспроизведении способа Balassa. Spilburg et al. (патент США 4243582) выделили два гликопротеина с молекулярной массой 65 кД и p1 3,8 из бычьего хряща (экстрагирование гуанидином), которые демонстрируют антитрипсиновую активность, и активность в отношении ингибирования роста эндотелиальных клеток.
Хрящи телят и акул содержат ряд таких биологических активностей, как противовоспалительная активность, противовоспалительная активность, антиангиогенная активность, лизоцимная активность, промотирующая рост клеток активность, ингибирующая активность в отношении коллагеназы типов I и IV, эластазы и других протеаз, подобных трипсину, химотрипсину и плазмину. Однако никто до сих пор не получил экстракта хряща, который включал бы набор клинически ценных активных ингредиентов.
Антиангиогенный компонент (компоненты) хряща акулы были тестированы в анализе с роговичным карманом кролика или в анализе с хориоаллантоевой мембраной цыпленка (САМ). Вплоть до настоящего времени целиком порошок хряща тестировали непосредственно на опухолях in vivo на ксенотрансплантате меланомы человека, имплантированном голой мыши (патент США 5075112), а также тестировали в САМ тестах по его антиангиогенной активности. Даже если противоопухолевое действие оценивали как действие хрящевых экстрактов, этот эффект чаще всего приписывали антиангиогенному компоненту, который препятствует поступлению крови в опухоль. Вплоть до настоящего времени не существует доказательств того, что акулий хрящ оказывает непосредственное действие на пролиферацию опухолевых клеток.
Уже известно несколько способов получения экстрактов акульего хряща и его фракций. Некоторые из них приводят к получению порошка неочищенного хряща без какой-либо экстракции (патент США 5075112). В других используют такие денатурирующие агенты, как гуанидин (патент США 4243582). В других осуществляется предварительная обработка хряща за счет энзиматического переваривания, чтобы избавиться от любых мышечных, нервных или сосудистых структур, окружающих хрящи, причем после такой стадии предварительной обработки следует удаление жиров в органические растворители, а затем активные компоненты экстрагируют в жидкую фазу. (Balassa et al., патенты США 3478146, 4656137, 4350682 и 4822607). Влияние такой предварительной обработки на сохранность целостности биологически активных компонентов хряща неизвестно. При очень интенсивном энзимном переваривании активные протеиновые компоненты могут гидролизоваться. Способ Balassa не включает стадию фракционирования, которая обогатила бы экстракт активными компонентами. Другие авторы просто получают водные экстракты (в воде (патент США 4473551) или в солевых растворах (патент США 4746729)) хрящей путем удаления нерастворимых материалов. Среди последних, в частности, сохраняют для дальнейшего исследования и очистки конкретные фракции определенных молекулярных масс (см. предшествующее обсуждение).
Цитированные способы имеют ряд недостатков. При их использовании некоторые ценные компоненты могут подвергаться денатурированию. Если это и не происходит, недостатком является то, что эти способы слишком длительны, чтобы иметь практическое применение. Кроме того, длительность методов вовсе необязательно приводит к получению достаточных количеств активных компонентов, а среди выделенных компонентов некоторые вовсе не выделяются или выделяются с недостаточным выходом, чтобы продемонстрировать детектируемую активность, или некоторые не принимались во внимание, которое фокусировалось на получении конкретных активностей.
Ангиогенез вовлечен не только в развитие рака. Многие заболевания или состояния, влияющие на различные физиологические системы (указанные в собках), зависят от ангиогенеза. Среди них можно привести следующие примеры: артриты и атеросклеротические бляшки (кости и связки), диабетическая ретинопатия, неоваскулярная глаукома, трахома и неоваскуляризация трансплантата роговицы (глаз), псориаз, склеродерма, гемангиома и гипертрофированная скарификация (кожа), сосудистая адгезия и ангиофиброма (кровеносная система). Поэтому новый и эффективный антиангиогенный "фактор" может найти применение при лечении таких заболеваний, также как и при терапии раковых заболеваний, более того, поскольку многие из вышеуказанных заболеваний и состояний также сопровождаются воспалительным компонентом, новый и эффективный противовоспалительный "фактор" может найти применение при лечении таких заболеваний и состояний, также как и при лечении других воспалительных заболеваний или состояний. Кроме того, так как протеазы подобно коллагеназам участвуют в различных заболеваниях и состояниях, таких как рак и преждевременное старение, из-за их деградирующей коллаген активности, новый и эффективный антиколлагенолитический "фактор" может найти применение при лечении заболеваний или состояний с коллагенолитическим компонентом. Так как ангиогенез, воспаления и протеазы, подобные коллагеназам, могут быть вовлечены по отдельности или в сочетании в широкий круг заболеваний или состояний, большую терапевтическую ценность представлял бы продукт, способный противодействовать всем таким активностям, не нарушая нормальные функции организма.
Краткое описание изобретения
Настоящее изобретение предлагает новый способ получения экстрактов хрящей, преимуществом которых является содержание множества терапевтически ценных активностей. Среди них антиангиогенные, противовоспалительные, антиколлагенолитические, in vivo антиопухолево-пролиферирующие и непосредственно in vitro антиопухолево-пролиферирующие активности, как было подтверждено, присутствуют в удовлетворительных концентрациях в экстракте акульих хрящей. Другие активности ожидают идентификации и подтверждения. Эффект, который был получен на опухолевых клеточных линиях, указывает на то, что, помимо непосредственных антиопухолево-пролиферирующих активностей, по-видимому, присутствуют и цитотоксические активности. Все активности получены в жидких экстрактах акульих хрящей, и некоторые из них были получены или проверены в твердых экстрактах акульих хрящей.
Настоящее изобретение относится к новому способу получения жидкого экстракта хрящей, содержащего значительную часть биологически активных водорастворимых компонентов, присутствующих в интактных хрящах, который включает следующие стадии:
а) гомогенизацию хрящей в водном растворе в условиях, совместимых с сохранением целостности указанных биологически активных компонентов до тех пор, пока размеры частиц хряща не становятся менее или равными около 500 мкм, что приводит к получению смеси частиц и неочищенного жидкого экстракта, содержащего указанные биологически активные компоненты;
b) центрифугирование указанного гомогената для выделения частиц из неочищенного жидкого экстракта; и
с) дальнейшее выделение неочищенного жидкого экстракта с тем, чтобы получить в конце жидкий экстракт, содержащий молекулы хряща с молекулярной массой менее или равной примерно 500 килодальтон.
Этот новый способ отличается тем преимуществом, что является легким в осуществлении и эффективным. Получают высокие выходы экстракта хряща, причем этот экстракт, в конкретном случае полученный из хряща акулы, содержит, по крайней мере, все вышеуказанные биологические активности. Предпочтительно осуществлять этот способ при низкой температуре (от около 0 до 10oC), в неденатурирующих условиях (предпочтительно в чистой воде), при значениях pH, близких к нейтральным (от около 6 до 8), для того, чтобы максимизировать вероятность выделения соединений с неизвестными физико-химическими характеристиками. В соответствии с этим способом компоненты хряща можно экстрагировать в небольшом объеме раствора (столь низком, как 1 литр для 1 кг хряща) и после короткого периода гомогенизации (от 10 до 15 минут). Для выполнения твердого экстракта используют тот же способ, за исключением того, что осадок выделяют и лиофилизируют, удаляя надосадочную жидкость.
Настоящее изобретение относится к экстрактам хряща, в частности к экстрактам, полученным от elasmobranch видов, и, более конкретно, из акулы. Твердый экстракт демонстрирует активность. Он может содержать коллаген и нерастворимые в воде компоненты. Он может также содержать остаточную активность того, что было экстрагировано в полном жидком экстракте. Полный жидкий экстракт очень богат активностями. Его можно использовать как он есть, или он может быть сконцентрирован. Стадия концентрирования, которая благоприятствует сохранению биологических активностей, является особенно важной. Из осторожности избегали обращения к способам, которые могли бы повредить активные компоненты, таким как выпаривание при повышенной температуре. Для концентрирования жидкого экстракта настоящего изобретения использовали ультрафильтрацию на мембране с отсечением по молекулярной массе около 1 кДа. В результате был получен и тестирован концентрированный экстракт, содержащий молекулы с молекулярной массой от около 1 до около 500 кДа. Полный жидкий экстракт (от 0 до 500 кДа) далее фракционируют для получения характеристик его активных компонентов. Множество фракций было получено различными способами. Некоторые из них, тестированные на опухолевых клеточных линиях, тщательно характеризовали по их молекулярным массам и изоэлектрическим точкам. Другим приписывали активность, в частности антиколлагенолитическую или антиангиогенную активности. Эти фракции ждут полной характеризации и идентификации. Поэтому в полном жидком экстракте и его фракциях выделяют ценные активности, которые можно с успехом использовать Теперь, вместо введения больших количеств порошкообразного хряща можно использовать более удобный и обогащенный экстракт.
Настоящее изобретение относится также к любым терапевтическим или косметическим композициям, содержащим в качестве активного ингредиента один из вышеуказанных хрящевых экстрактов. Наибольший интерес вызвали композиции для местного нанесения для использования в дерматологии и косметологии. Этот интерес связан с наблюдаемыми активностями экстрактов хрящей. В этом плане наблюдаемые антиколлагенолитическая и противовоспалительная активности и антагонистическое действие в отношении клеточной дифференциации за счет индуцирования протеинкиназы С в кератиноцитах рассматривают как открывающийся путь к использованию экстрактов акульих хрящей в композициях и способах для снижения уменьшения воспалений, регуляции морщин или кожной атрофии, замедления преждевременного старения, уменьшения акне, улучшения функций кожного барьера, уменьшения воспалений и раздражения кожи и ее успокоения. Эти способы находятся в объеме изобретения. Кроме того, поскольку жидкий экстракт акульих хрящей был успешно тестирован в отношении рака, артритов, псориазов и случаев акне, композиции и способы лечения заболеваний или состояний, включающих один или более их компонентов, выбранных из группы, состоящей из пролиферации опухолей, ангиогенеза, воспалений и коллагенолиза, включены в объем настоящего изобретения.
Описание изобретения
Настоящее изобретение можно более легко понять на основании конкретных вариантов воплощения, представленных на прилагаемых чертежах, цель которых сводится к иллюстрации изобретения, а не к ограничению его объема.
Краткое описание чертежей
Фиг. 1 представляет ингибирующую активность возрастающих доз акульего хряща (твердый экстракт) на клетки ZR75-1 и MCF-7.
Фиг. 2 представляет зависимые от дозы кривые количества MCF-7 клеток, определенные по содержанию их ДНК в присутствии возрастающих концентраций эстрадиола с (или без) двумя концентрациями хрящевого лиофилизата.
Фиг 3a) и 3b) представляют сравнение срезов печени крыс с развитым раком молочной железы, которым через зонд вводили комбинацию хрящевого лиофилизата и надосадочной жидкости, и тех, которым вводили лишь воду.
Фиг. 4a) и 4b) представляют сравнение срезов почек крыс с развитым раком молочной железы, которым вводили через зонд комбинацию хрящевого лиофилизата и надосадочной жидкости, и тех, которым вводили лишь воду.
Фиг. 5a) и 5b) представляют сравнение срезов легких крыс с развитым раком молочной железы, которым вводили через зонд комбинацию хрящевого лиофилизата и надосадочной жидкости, и тех, которым вводили только воду.
Фиг. 6a) и 6b) представляют сравнение срезов молочной железы крыс с развитыми опухолями, которым вводили через зонд комбинацию лиофилизата хряща и надосадочной жидкости, и тех, которым вводили только воду.
Фиг. 7 представляет гистограмму, полученную из образцов, представленных на фиг. 6a) и 6b), иллюстрирующую действие хрящевого экстракта на участки кровеносных сосудов в опухоли.
Фиг. 8 представляет электрофоретический профиль в неденатурирующих условиях жидких фракций, выделенных на Rotofor; слева представлены маркеры молекулярных масс, за которыми следует образец неочищенного пермеата перед фракционированием, для сравнения с выделенными фракциями.
Фиг. 9a) и 9b) представляют значительное улучшение состояния двух пациентов, которые страдают псориазом, один с гиперкератозом 9a), а другой без гиперкератоза 9b), в результате обработки композицией для местного нанесения, содержащей эффективное количество концентрированного жидкого хрящевого экстракта (нижняя фотография) по сравнению с их начальным состоянием (верхняя фотография).
Фиг. 10 представляет характер миграции FPLC трех различных экстрактов акульих хрящей. На фиг. 10A DUP означает хрящевой жидкий экстракт в соответствии с настоящим изобретением. На фиг. 10В и фиг. 10С BAL и OIK означают экстракты прототипов, Balassa et al. и Oikawa et al., соответственно.
Фиг. 11 представляет характер миграции HPLC тех же экстрактов, что представлены на фиг. 10.
Фиг. 12 представляет результаты CAM-тестов, осуществленных с использованием различных концентрацией протамина, антиангиогенного сравнительного соединения, по сравнению с контролем.
Фиг. 13 представляет результаты САМ-тестов, осуществленных для двух фракций полного жидкого экстракта акульих хрящей настоящего изобретения (DUP), причем молекулярная масса одного ниже 10000 дальтон, а другого - выше 10000 дальтон.
Фиг. 14 представляет результаты САМ-тестов, проведенных на полном жидком экстракте настоящего изобретения (DUP) по сравнению с эквивалентной концентрацией продукта, полученного по способу Balassa (BAL).
Фиг. 15 представляет результаты САМ-тестов, осуществленных на полном жидком экстракте настоящего изобретения (DUP) по сравнению с образцом, полученным для равного количества сухой массы продукта, полученного по способу Oikawa (OIK).
Фиг. 16 демонстрирует действие ТРА на кератиноциты по сравнению c DMSO контролем, причем оба измерены в присутствии или в отсутствии полного жидкого экстракта акульего хряща, полученного в соответствии с настоящим изобретением.
Фиг. 17 представляет противовоспалительный эффект полного жидкого экстракта настоящего изобретения на модели с раздражением кожи.
Фиг. 18 представляет характер миграции HPLC фракции полного жидкого экстракта настоящего изобретения с молекулярной массой менее 10000 дальтон, причем эта фракция была сконцентрирована и разделена на 5 подфракций.
Фиг. 19 представляет антиколлагенолитическое действие каждой из подфракций, представленных на фиг. 18, для различных тестированных объемов.
В конкретном варианте воплощения хрящ был получен из здоровых акул Black Spine Dog Fish и Common Spiny Dog Fish. Все мышечные и соединительные ткани были удалены за счет соскребания обработанными этанолом скальпелем и ножницами. Затем хрящ был упакован в вакууме в пластиковые пакеты и заморожен до -20oC для дальнейшего использования. В способе настоящего изобретения можно использовать хрящи из любого источника. Акулий хрящ был выбран из соображений, изложенных в разделе предпосылки изобретения. Считают, что из хрящей elasmobranch видов (который включает акул и скатов как виды животных, относящихся к этой группе) можно получить почти эквивалентные продукты. Эти продукты наиболее вероятно будут отличаться при использовании от хрящей млекопитающих.
До стадии экстрагирования можно использовать любые варианты подготовки хрящей при условии, что они не будут существенно влиять на активность представляющего интерес продукта (например, полный жидкий экстракт или его конкретные фракции). Некоторые активные компоненты могут оказаться устойчивыми по отношению к протеолитическому перевариванию, (данные Balassa et al. , патент США 4822607), которое используют для удаления любых окружающих хрящ тканей, тогда как другие могут оказаться не устойчивыми в отношении такой обработки. Одной из активностей, которые, по-видимому, не устойчивы в отношении такой предварительной обработки, является антиангиогенная активность (фиг.15). Поэтому, если нужно получить жидкий экстракт, содержащий как можно больше всех растворимых в воде активных компонентов, которым приписывают различные активности, такую стадию переваривания следует избегать или тщательно контролировать, чтобы предотвратить интенсивный гидролиз или протеолиз.
Получение лиофилизированного хряща
Чистый хрящ использовали свежим или оттаивали до 4oC.
Затем хрящ пропускали несколько раз (чаще всего трижды) через поры обработанной этанолом мясорубки вместе с соответствующим объемом воды (равное количество (масса/объем) составляет минимальный объем, но его можно увеличить, не оказывая при этом никакого воздействия на выход выделяемых ценных компонентов). Малые объемы предпочтительны, так как при этом более удобно работать, нежели с излишне большими объемами, с чисто практической точки зрения. На практике воду очищали за счет обратного осмоса и фильтровали на 0,1 мкм фильтре. Вместо воды можно использовать множество водных растворов (например, содержащих соли). При выделении множества растворимых в воде активностей желательно работать при нейтральных значениях pH и в неденатурирующих условиях во избежание лизиса или денатурирования некоторых из компонентов хряща. Поведение неизвестных протеинов в водных растворителях непредсказуемо: некоторые чувствуют себя более "комфортно" при кислотных значениях pH, а другие при основных значениях pH. Кроме того, некоторые протеины могут оказаться экстрагируемыми в мягких условиях денатурирования, если такое денатурирование не приведет к необратимому влиянию на восстановление (ренатурирование) этих протеинов в водных растворах. Поэтому, учитывая все эти факторы, было показано, что осуществление процесса экстракции активных компонентов хряща в чистой воде является наилучшим способом выделения с очень хорошим выходом компонентов, обладающих неизвестной структурой и поведением.
Затем смесь хрящ/вода гомогенизировали, перемешивая с максимальной скоростью в кухонном смесителе при температуре около 4oC в течение десяти минут. Естественно, скорость перемешивания, так же как и объем водного раствора, могут влиять на время экстрагирования. Поэтому разумный интервал времени гомогенизирования должен быть не меньше десяти минут и не более 24 часов, предпочтительно, от около 10 до 60 минут. Температуру следует поддерживать ниже чем около 10oC, чтобы избежать какой-либо деградации активных компонентов за счет эндогенных энзимов, если при этом не используют никаких ингибиторов энзимов. Идеальной при этом считается температура, близкая к 0oC. Так как обычно такие эксперименты проводят в холодном помещении, где температуру можно поддерживать между 4 и 10oC, этот интервал температур является приемлемым для рассматриваемого процесса. Для большей четкости и краткости термин "около 4oC" здесь и далее используют для обозначения этого приемлемого интервала температур.
Ожижения полученного гомогената можно достичь далее, используя дезинтегратор Politron в течение 10 минут при 4oC, если имеющийся смеситель недостаточно снижает размер частиц. В другом варианте смесь можно просто гомогенизировать в более совершенном смесителе-дезинтеграторе, который был у авторов, что позволяет сэкономить 10 минут стадии ожижения. В конце завершенной стадии гомогенизации размер оставшихся частиц составляет менее чем около 500 мкм. Естественно, применимы также те же самые временные и температурные интервалы, которые обсуждались для первичного измельчения хряща. Размер частиц после гомогенизации вовсе необязательно должен быть очень маленьким. Поэтому можно избежать пульверизации хряща перед экстрагированием. Действительно, пульверизация хряща в форме порошка перед стадией экстрагирования может привести к денатурированию ценных активностей, если такую пульверизацию проводят в состоянии сушки замораживанием или в состоянии сушки при нагревании.
Полученный гомогенат центрифугировали при 13600xg в течение 15 минут при 4oC, причем эта стадия является единственным способом быстрого и эффективного отделения надосадочной жидкости от осадка. Варианты и подбор таких параметров хорошо знакомы специалистам и просто зависят от объема гомогената и используемого оборудования.
Полученный осадок лиофилизировали в течение 24-48 часов. Далее такую первую фракцию будут называть лиофилизат или твердый экстракт.
Надосадочную жидкость можно профильтровать при необходимости на фильтре Whatman 24 мкм для того, чтобы избавиться от частиц, которые могли бы повлиять на работу ультрафильтрационной колонки. Затем отфильтрованный материал подвергали ультрафильтрации при температуре около 4oC в фильтрационной колонке с тангенциальным потоком и с пористостью около 500000 дальтон, что позволяет получить первый неочищенный пермеат, состоящий из растворимых в воде молекул с молекулярной массой от 0 до около 500 кДа. Этот неочищенный пермеатный экстракт стерилизовали на фильтре 0,22 мкм и аликвоты отбирали в стерильные флаконы для дальнейшего использования. Эту фракцию далее именуют как неочищенный пермеат или полный жидкий экстракт. В другом варианте была разработана процедура высокоэффективного центрифугирования для получения осадка и надосадочной жидкости. Стадию центрифугирования при 13600xg в течение 15 минут с последующей фильтрацией на Ватманских фильтрах заменяли центрифугированием на CEPA центрифуге, снабженной нейлоновым карманом с пористостью 30 мкМ, при 3000-4000xg. 25 кг/25 л препарата можно центрифугировать, таким образом, в течение 30 минут и получить 29 л надосадочной жидкости. Получаемый водный объем выше исходного объема воды, что дает возможность предположить, что часть содержащейся в самих хрящах воды была удалена. Лиофилизат и полный жидкий экстракт могут иметь следующую примерную композицию, которая существенно учитывает варианты, наблюдаемые от одной партии к другой, в случае использования различных материалов:
Лиофилизат:
Липиды - 7,35%(1)
Протеины - 46,2%(2)
Влажность - 20,4%
Натрий - 4,16 мг/г(3)
Калий - 2,64 мг/г
Кальций - 114 мг/г
Магний - 1,49 мг/г
Цинк и железо - Следовые количества
Полный жидкий экстракт:
Липиды - 0,01-0,20%(1)
Протеины - 8-25 мг/мл(2)
Влажность - 97-99%
Натрий - 30-220 мг/100 г(3)
Калий - 30-40 мг/100 г
Кальций - 2,0 мг/100 г
Магний - 1 мг/100 г
Цинк и железо - Следовые количества
(1),(2) Измерения проведены в соответствии с указаниями, опубликованными в AOAC Official (1984) разделы 16.219-220 и 2.055, соответственно;
(3) Измерения в соответствии с SAA процедурой.
Содержание протеина оценивают по способу Kjeldahl, в котором определяют органический азот (N). Органический азот превращают в эквивалентный протеин, используя следующее уравнение:
Если углеводы не определяются, можно предположить, что они находятся в том или ином экстракте, но в форме протеогликанов и/или мукополисахаридов. Возможно, что эти соединения включены в определяемый уровень влажности. Лиофилизат содержит неожиданный уровень влажности, который определяют по содержанию -OH-групп. Поскольку 20% содержание воды близко к процентному содержанию углеводов, которые обычно находятся в хряще, тогда как влажность лиофилизата должна быть близко к 0%, эту гипотезу остается проверить.
Стерильность проверяли, используя спецификации USP XXlll (фармакопея США) согласно:
1) Laboratorire de genie sanitaire du Quebec Inc. 1090,
1' Escarbot, Centre Industriel St-Malo, Quebec GIN 4J4;
2) Northview Laboratories Inc. 1880, Holste Road, North-brook, IL, 60062 U.S.A. FDA registration N14-18028.
Анализ активности:
Лиофилизат:
In vitro анализы:
Эти анализы проводили на гормоно-зависимых раковых клеточных линиях MCF-7 и ZR75-1 (ATCC(R) номера 22-НТВ и 1500-CRL, соответственно).
Клетки ZR75-1;
Основная RPMI среда;
52 г RPMI 1640 без фенола красного (Sigma R8755), 17875 г Hepes (свободная кислота; Sigma H0763), 0,55 г пирувата натрия (Sigma P5280) и 10 г NaHCO3 смешивали в 5 л чистой воды и pH доводили до 7,40 за счет NaOH.
Если этот раствор не используют немедленно, его следует защитить от света, чтобы сохранить фотолабильные вещества. Этот раствор фильтровали, разливали в стерильные флаконы емкостью 500 мл и хранили при 4oC максимум в течение трех месяцев.
Среда, поддерживающая клеточную культуру:
Основную RPMI среду дополняли 10% (объем/объем) FBS (фетальная бычья сыворотка), 100 Ед. пенициллина G/50 мкг стрептомицинсульфата (Sigma P0906)/мл среды, 2 мМ L-глутамина (Sigma G1517) и 1 нМ E2 ( β- эстрадиол, Sigma E8875)
Экспериментальная среда:
Основную RPMI среду дополняли 5% FBSA (фетальная бычья сыворотка, адсорбированная на декстран-древесном угле), 2 мМ L-глутамина, 100 ед. пенициллина G/50 мкг стрептомицинсульфата/мл среды и 50 нг/мл инсулина (Sigma). К этой среде добавляли возрастающие концентрации вышеуказанного лиофилизата, а также различные концентрации эстрадиола (10-12 до 10-5М).
MCF-7 клетки:
Основная DME-F12 среда:
DME-F12 среду (без бикарбоната и без фенола красного; Sigma) воссоздавали в соответствии с указаниями изготовителей в чистой воде. На один литр добавляли 1,2 г бикарбоната натрия и pH доводили до 7,40 за счет NaOH/HCI. Этот раствор фильтровали, разливали в стерильные флаконы по 500 мл и хранили при 4oC максимум в течение трех месяцев.
Поддерживающая клеточную культуру среда:
Основную DME-F12 среду дополняли 10% (объем/объем) FBS (фетальная бычья сыворотка), 100 Ед. пенициллина G/50 мкг стрептомицинсульфата/мл среды, 2 мМ L-глутамина (Sigma) и 1 нМ E2 (эстрадиол).
Экспериментальная среда:
Основную DME-F12 среду дополняли 5% FBSA (фетальная бычья сыворотка адсорбированная на декстран-древесном угле), 2 мМ L-глутамина, 100 Ед пенициллин G/50 мкг стрептомицинсульфат/мл среды и 50 нг/мл инсулина (Sigma). Как было описано для клеток ZR75-1, лиофилизат и эстрадиол добавляли в той же самой концентрации.
Получение FBSA;
Фетальную бычью сыворотку смешивали с 1% (масса/объем) древесным углем (уголь, обесцвечивающий щелочь). Раствор декстрана Т70 добавляли к раствору древесный уголь-сыворотка до достижения концентрации 0,1% (масса/объем). Полученную смесь перемешивали в течение ночи при 4oC. После центрифугирования при 4oC в течение 30 минут при 10000xg сыворотку декантировали, смешивали снова в той же пропорции с древесным углем и декстраном, перемешивали при комнатной температуре в течение трех часов и снова центрифугировали. Затем сыворотку термоинактивировали при 56oC в течение 20 минут, фильтровали в условиях стерильности и отбирали аликвоты в стерильные конические ампулы Falcon.
Клетки ZR75-1 и MCF-7 культивировали до достижения плотности популяции в 20000 клеток/ячейку на пластинах с 24 ячейками, или 150000 клеток/ячейку на пластинах с 6 ячейками и обрабатывали в присутствии или в отсутствие различных концентраций полученного ранее лиофилизата. Для этого лиофилизат ресуспендируют в культуральной среде и фильтруют в стерильных условиях с тем, чтобы выделить его растворимые в воде компоненты и протестировать их. Все эксперименты осуществляли трижды. Затем культуральную среду сливали и заменяли свежей средой и так каждые два дня. Клетки выращивали в инкубаторе в атмосфере с постоянной влажностью, содержащей 5% CO2, при температуре 37oC в течение 17, 7, 3 или 3 дней, что соответствует первому, второму, третьему и четвертому эксперименту соответственно. Ингибирование клеточного роста определяли, непосредственно подсчитывая клетки или определяя полное содержание ДНК в ячейках.
Приведенные в табл. А (см. в конце описания) данные по ингибированию клеточного роста свидетельствуют о том, что лиофилизат может ингибировать дозозависимым образом рост клеток этих двух клеточных линий.
На фиг.1 показано, что дозы лиофилизата 50 и 100 мг/мл четко провоцируют гипоплазию на этих клеточных линиях уже после трех дней обработки.
Фиг. 2 демонстрирует, что в присутствии от 10-12 до 10-9M эстрадиола обработанные клетки реагируют подобно контрольным клеткам, будучи нестимулированы этими дозами гормонов. Однако выше 1 нМ контрольные клетки сильно стимулированы, и концентрация ДНК достигает 3,75 мкг в присутствии 107 эстрадиола (против 0,69 мкг в контроле без эстрадиола). В клетках, обработанных 30 и 50 мг/мл лиофилизата, ДНК, определенные при максимальной стимуляции, составляют 1,9 и 1,8 мкг соответственно.
Фиг. 2 демонстрирует, что постоянная сродства (Km) обработанных клеток для эстрадиола составляет величину, в 3 и в 16 раз более высокую (31,3 нМ и 174,0 нМ), нежели величина Km контрольных клеток (11,7 нМ), в присутствии 30 и 50 мг/мл соответственно. Это означает, что более высокие концентрации эстрадиола необходимы для достижения такого же роста клеток, если присутствует лиофилизированный твердый экстракт хряща. Поэтому этот экстракт уменьшает максимальную реакцию (90% ее ингибирования) и повышает постоянную сродства обработанных клеток в отношении эстрадиола.
In vivo анализы:
Четыреста сорокадневных самок крыс Sprague-Dawley (закупленных у Charles River Со., St-Constant, Quebec) адаптировали к условиям окружения в течение 12 дней. Затем через зонд вводили 20 мг DMBA/1 мл кукурузного масла (9,10-диметил-1,2-бензатрацен; от Sigma Chemical Co). Через три месяца после такой обработки отбирали 240 крыс, у которых развился рак молочной железы, и разделяли их на две группы. Первая группа состояла из 5 подгрупп крыс. Крысам обработанных групп вводили ежедневную дозу повышающихся концентраций экстракта лиофилизата в 3 мл воды в течение восьми недель, тогда как контрольная группа получала такое же количество воды. Вторая группа состояла из четырех подгрупп крыс. Крысам обработанных групп также вводили ежедневную дозу лиофилизата в 3 мл воды, с (или без) надосадочной жидкостью в течение 10 недель, тогда как контрольная группа получала тот же объем воды. Только одной подгруппе из второй группы крыс, обработанных концентрацией лиофилизата 3000 мг/кг/день и 3 мл надосадочной жидкости, вводили также внутрибрюшинно (i.p.) инъекции меньших доз надосадочной жидкости (около 8 мг протеина в 1 мл воды).
В начале двух экспериментов крысы весили 151-175 г и получали корм и воду ad libitum. У первой группы крыс опухоли имели средний диаметр 0,9 см, тогда как средний диаметр опухолей у второй группы крыс составлял 0,6 см.
Полученные результаты приведены в табл. В (см. в конце описания).
Полученные результаты демонстрируют, что лиофилизат содержит активный компонент, который абсорбируется в желудочно-кишечном тракте и который оказывает влияние на размер опухоли. Этот эффект может быть связан как с непосредственным воздействием на опухолевые клетки, так и с воздействием за счет антиангиогенеза.
Эти результаты показывают также, что надосадочная жидкость обладает активностью, которая отражается дополнительным уменьшением размера опухоли примерно на 5%.
Эти результаты дают возможность предположить, что лиофилизат может содержать активные компоненты, которые не растворяются в воде, и/или что он может содержать остатки растворимых в воде компонентов. Поэтому в последнем случае можно считать, что осадок нужно снова экстрагировать в водном растворе для максимального выделения растворимых в воде компонентов, если выход можно еще увеличить.
Гистопатология
Для оценки нетоксичности активных молекул экстракта хряща, животных, которых использовали в описанных in vivo экспериментах, умерщвляли путем обезглавливания и для анализа отбирали следующие ткани: почек, легких, печени, сердца, мозга, мышц и молочной железы. Из этих тканей удаляли жир, после чего их фиксировали в течение двух дней в жидкости Bouin. После обезвоживания в этаноле фиксированные ткани заключали в парафин. Получали срезы этих тканей и помещали на стеклянные пластины, окрашивали гематоксилином и визуально изучали под микроскопом.
Гистологическое исследование показало, что никаких вредных воздействий при использовании самых больших доз одного лиофилизата (данные не представлены), или при использовании лиофилизата в сочетании с надосадочной жидкостью (см. фиг. 3a и 3b, 4a и 4b, и 5a и 5b) не наблюдается.
Это дает возможность предположить, что лиофилизат и надосадочная жидкость обладают селективной, уменьшающей размеры опухоли активностью.
В раковой молочной железе (см.фиг.6a и 6b), наблюдается важное уменьшение зоны кровеносных сосудов. Антиангиогенный эффект этих активных молекул подтверждается далее результатами, проиллюстрированными и суммированными на фиг. 7.
Фиг. 7 демонстрирует, что если используют сочетание лиофилизата (р.о.) (перорально) надосадочной жидкости (p.o.+i.р) (перорально+внутрибрюшинно) (см. фиг.6а и бb), в опухоли наблюдается уменьшение зоны кровеносных сосудов на 55%.
Уменьшение размеров опухолей может быть связано со значительным уменьшением в них васкуляризации, с непосредственным воздействием на опухолевые клетки или с комбинацией этих двух явлений. Антиангиогенное действие этих экстрактов хорошо продемонстрировано ранее. Непосредственный гипоплазийный эффект наблюдался in vitro на гормонозависимых клетках, который остается подтвердить в экспериментах in vivo.
Так как приведенные выше результаты демонстрируют, что надосадочная жидкость обладает эффектом, значительно превосходящим действие лиофилизата на ZR75-1 клетки, проводилось дальнейшее исследование ее компонентов.
Получение жидких фракций, содержащих активные молекулы
Акульи хрящи выделяли и обрабатывали, как описано ранее. После центрифугирования осадок удаляли, а надосадочную жидкость обрабатывали описанным выше способом вплоть до получения стерильного фильтрата на 0,22 мкм фильтре.
Далее надосадочная жидкость будет упоминаться как неочищенный пермеат, т.е. продукт, полученный в результате ультрафильтрации.
Полученный таким образом неочищенный пермеат обрабатывали с помощью FPLC (быстрая жидкостная хроматография белков).
Условия проведения FPLC;
Колонка: Hiload 26 мм х 60 см Sephacryl S-300
FPLC система: от Pharmacia
Перед загрузкой в колонку все образцы фильтровали на
0,22 мкм фильтре. В качестве элюирующего буфера использовали фосфатный буферированный физиологический раствор (PBS), подвергнутый фильтрованию и дегазированию в течение 15 минут. Объем вводимого образца составлял обычно 3,2 мл (можно вплоть до 13 мл). Скорость потока составляла 1 мл/мин. Собирали фракции по 10 мл. Элюированные соединения детектировали по УФ поглощению на длине волны 280 нм. Калибровочные кривые были получены с использованием калибровочного набора MW-GF-1000 от Sigma, причем объем этих калибровочных образцов тот же, что и объем для вводимых в колонку для анализа образцов (3,2 мл). Объем элюирования образца рассчитывали, строя график зависимости молекулярного веса соединений калибровочного набора от их объема элюирования, из которого вычитали свободный объем колонки. Свободный объем получали, вводя декстран синий (М.М.=2000000).
Полученные фракции тестировали на ZR75-1 клетках в отношении их активности. Представляющие интерес фракции идентифицировали, и их характеристики были подтверждены дополнительными исследованиями (приводятся далее).
Дополнительную характеризацию активных компонент пермеата проводили на Rotofor (Biorad 170-2950; см.изоэлектрофокализацию далее) и на фильтрах с различными значениями отсечения до получения фракций с молекулярной массой между 10-30 кДа, 30-100 кДа и более 100 кДа.
Изоэлектрофокализация:
Препарат акульих хрящей (46 мл пермеата 1 кг/л) диализировали в течение ночи против 4 литров чистой воды, содержащей 5% глицерина при 4oC, используя мембрану Spectra pore N7 MWCO 3500 кДа (Spectrum 132110). Диализованный раствор смешивали с 2,75 мл амфолитов (Pharmacia N 80-1125-87) pH 3,5-10,0 и 0,5 г CHAPS (Sigma C3023; 3-[(3-холамидопропил)-диметиламмонио]-1-пропан-сульфонат). Объем доводили до 55 мл за счет чистой воды. Полученный раствор загружали в Rotofor. Изоэлектрофокализацию проводили при 4oC, при постоянной мощности 12 ватт (3000xi источник питания Biorad 165-0554) при постоянной циркуляции воды для обеспечения постоянства температуры. В начале процесса разделения напряжение равнялось 380 вольт при силе тока 31 мА. Когда силы тока стабилизировалась (на 14 мА), значение напряжения соответствовало 870 В. Изоэлектрификацию прекращали и собирали 20 фракций (см.табл.1).
Идентификация этих протеинов осуществлялась путем оценки их молекулярной массы с помощью электрофореза на геле (Laeimmli U.K. (1970) Nature (Lond) 227:680).
Эти фракции разбавляли в четыре раза загрузочным буфером (см. Laemmli) и аликвоты по 8 мкл подвергали электрофорезу в невосстанавливающих условиях.
На фиг. 8 представлены электрофоретические профили каждой фракции и материала перед изоэлектрофокализацией.
Все фракции разливали в стерильные флаконы при ламинарном потоке колпачка колонны, пропуская их через стерильный Millipack-60 фильтр с пористостью 0,22 мкм.
Содержание протеина во фракциях оценивали по дозовому методу Lowry. Растворы 1 кг/2 л (выраженные как вес неочищенного хряща на литр пермеата) тестировали на ZR75-1 клетках в различных концентрациях в культуральной среде. Полученные результаты суммированы следующим образом:
1-й тест:
Пермеат лиофилизировали, повторно суспендировали в PBS, и вводили в FPLS. Никакой гипоплазийной активности не детектировалось (данные не представлены).
2-й тест:
Тест осуществляли на Rotofor фракциях (пермеат концентрировали за счет выпаривания). Идентификация протеина - см. табл. 2.
3-й тест, осуществленный на FPLC фракциях (пермеат концентрировали за счет выпаривания):
Фракции - Молекулярная масса
6 и 7 - 1-2,5 кДа
4-й тест, осуществленный на 100 мкл фракциях, полученных на молекулярных фильтрах Amicon см. табл. 3.
FPLC фракции 6 и 7 содержат активные компоненты с очень маленькой молекулярной массой: от 1 до 2,5 кДа.
Гипоплазийный эффект фракций может оказаться даже в 33000 раз выше эффекта, который наблюдается для лиофилизата. Приведенные выше результаты показывают, что лиофилизация, по-видимому, вызывает некоторую потерю непосредственной противоопухолевой активности протеинов, содержащихся в элюате, тогда как такой потери не происходит при лиофилизации твердого экстракта.
Это предполагает, что активные компоненты, включенные в частицы хряща, по-видимому, находятся в таком окружении, что они менее чувствительны к денатурирующему действию лиофилизации. Поскольку гипоплазийная активность чувствительна к лиофилизации, будучи восстановлена в воде, можно предположить, что добавление стабилизаторов и защитных агентов к полному экстракту или к конкретным фракциям, содержащим эту активность, перед лиофилизацией, позволит существенно сохранить активность.
Дальнейшая идентификация активных компонентов элюата
Активные фракции (тестированные на ZR75-1 клетках) находятся в следующем интервале молекулярных масс, определенных по другому типу очистки, исходя из того же самого пермеата (1 кг/л), на колонке 10 мм диаметрах 30 см длины Superose-12, с использованием FPLC и Rotofor процедур, описанных ранее. Выбирали скорость потока 1 мл/мин. Собирали 45 фракций по 1 мл.
Фракции 20-21 - активности во фракциях, соответствующих молекулярной массе от 70 до 120 кДа;
Фракция 22 - активности во фракциях, соответствующих молекулярной массе от 60 до 70 кДа;
Фракции 29-32 - активности в перекрывающихся фракциях, соответствующих молекулярной массе от 35 до 46 кДа;
Фракции 34-35 - активности во фракциях, соответствующих молекулярной массе 29 кДа;
Фракции 38-39 - активности, соответствующие молекулярной массе от 1 до 2,5 кДа.
Специфичность
Для оценки специфичности активности на опухолевых клетках пермеат, полученный после ультрафильтрации, тестировали на других, полученных из мезенхимы клетках, TENON фибробластах человека (HTFs), которые представляют собой нормальные фибробласты.
В. In vitro
а. Пациенты
Используют только HTFs от двух пациентов (один с неоваскулярной глаукомой, NVG, а другой с первичной открытоугольной глаукомой, POAG).
b. Субкультивирование и сохранение
Каждую конфлюентную культуру пассировали, промывая и отделяя с 0,5 мл 0,05% трипсина 0,5 мМ ЕДТА (Cibco 610-5300 AG) в течение 5-10 минут при 37oC. Затем для нейтрализации трипсин/ЕДТА добавляли 1,5 мл ДМЕ/F-12 среды, содержащей 15% фетальной бычьей сыворотки (FBS).
Ассоциации клеток осуществляли путем тщательного растирания и переноса в 25 см2 Т-склянки, в которые добавляли дополнительную среду, содержащую 10% (FBS). После достижения конфлюентности, HTF переносили в 75 см2 и в итоге в 180 см2 Т-склянки. Когда достаточное количество клеток было получено, некоторые клетки использовали для описанных ниже экспериментов, а другие одновременно замораживали для сохранения идентичных пассажей для будущих экспериментов.
с. Экспериментальные протоколы
По достижении конфлюентности клетки от одного пациента, выращенные в двух или трех идентичных 180 см2 Т-склянках, диссоциировали описанным выше способом. После короткого высокоскоростного центрифугирования их подсчитывали, используя ZML Coulter Counter 216013, снабженный 256-Channelyzer.
Во всех последующих in vitro экспериментах примерно 50000 клеток инокулировали в 1 мл ДМЕ/F-12 среду, содержащую 1% FBS в каждой 16 мм чашке и 12-ячеечной пластине. Через 17 часов после посева добавляли 1 мл свежей идентичной среды, дополненной 1% FBS ("абсолютные" контроли). В зависимости от схемы эксперимента (см. ранее и далее) 1% FBS среду дополняли или не дополняли GF (факторы роста) или раствором пермеата 1 кг/2 л (масса хряща/объем воды) и стерильно фильтровали. В этот день (день О) некоторые образцы клеток также подсчитывали для определения эффективности посева (которая должна быть равна или быть более 95%).
Через 48 часов после начала экспериментов клетки промывали и диссоциировали путем описанной ранее процедуры и снова подсчитывали. Число клеток выражалось как % от тех, которые получены в "абсолютных" контролях.
Каждый "абсолютный" или позитивный контроль, содержащий 1% или 5% FBS соответственно, и каждая экспериментальная группа, дополненная 1% FBS, и с отдельным GF или пермеатом хряща, состояла из трех образцов.
Каждый эксперимент проводили на клетках одного или двух пациентов одновременно и повторяли, по крайней мере, дважды.
Стимуляцию пролиферации фибробластов за счет факторов роста (GFS) или пермеата хряща сравнивали со стимуляцией за счет 5% FBS.
В этих экспериментах GFs, свиной полученный из тромбоцитов фактор роста (pPDGF) и рекомбинантный основной фактор роста фибробластов человека (hr bFGF) (подарок Dr.P.Brazeau от Farmitalia Carlo Erba,Milan, Italy) добавляли в концентрациях от 10 до 100 нг/мл в 1% FBS, соответственно. Через 48 часов после начала эксперимента клетки диспергировали за счет Trypsin-ЕДТА и подсчитывали с помощью счетчика Coulter. Все полученные трижды значения (колонки 1, 2 и 3) оказываются ниже чем 1/20 от числа на ячейку (см. табл. 4).
Пациент В.: Глаукома; Пол: мужской. Возраст 53
HTF
День - 1: число клеток на ячейку: 46170
DME/F12 - 1% FBS - 1% Пен.Срепт.
День О: число клеток на ячейку: 65214
DME/F12 - 1% FBS - 1% Пен.Стерпт.
День 1: число клеток на ячейку: 62548
DME/F12 - 1% FBS - 1% Пен.Стрепт.
День 2: число клеток на ячейку:
DME/F12 - 1% FBS - 1% Пен.Стрепт.
Если факторы роста, подобные PDGF и bFGF демонстрируют стимулирующую активность в отношении HTFs, никакого эффекта: ни положительного, ни отрицательного не наблюдалось, когда эти клетки культивировались в присутствии пермеата хряща (1 кг/л). Не наблюдалось никакого гипоплазийного эффекта. Это предполагает, что пермеат обладает гипоплазийным или цитотоксическим действием, которое специфично в отношении опухолевых клеток, но не оказывает какого-либо заметного действия на нормальные клетки. Тот же самый хрящевой экстракт не действовал на другой тип фибробластных клеток, HSF (кожные фибробласты человека; (данные не представлены). Хотя тестирование и не проводилось, предполагается, что лиофилизат также не оказывает действия на нормальные клетки.
Сравнение с известными ранее продуктами
Поскольку авторы не были первыми, кто проявил большой интерес к хрящевым экстрактам, они проверили уникальный характер жидких экстрактов акульих хрящей, полученных способом настоящего изобретения, при параллельном сравнении с двумя продуктами, описанными и отслеженными в известных ранее исследованиях а именно, продуктами, полученными по способам Balassa (патент США 4822607) и Oikawa et al. (op.cit).
Oikawa et al. раскрывают способ, в котором получают две основные фракции, одна из которых содержит молекулы с молекулярной массой от 1 до 10 кДа, а другая с компонентами более 10 кДа. Они приписывают антиангиогенные свойства только первой фракции, другая же, как было сказано, лишена какой-либо антиангиогенной активности в тесте САМ. Для адекватного сравнения Oikawa продуктов авторы фракционировали свой полный жидкий экстракт на две соответствующие фракции, и сохранили одну с компонентами от 1 до 10 кДа. Так как Balassa раскрывает способ экстрагирования полного жидкого экстракта, было проведено сравнение полного жидкого экстракта хряща по способу настоящего изобретения (1-500 кДа) с продуктом, полученным при воспроизведении способа Balassa, заменяя телячий хрящ акульим хрящем в качестве исходного материала. Было предположено, что если Balassa и Oikawa раскрывают эквивалентные способы, характер картин, полученных при исследованиях с помощью FPLC и HPLC должен, в основном, совпадать, и что продукты, при тестировании в тесте САМ, должны демонстрировать активность, аналогичную активности продуктов настоящего изобретения. Все образцы доводили до конечной концентрации 12 мкг/мкл (сухая масса/объем раствора) перед проведением FPLC и HPLC хроматографических обработок. Продукт Oikawa центрифугировали и фильтровали перед хроматографированием, так как он содержал нерастворимый материал.
А) Условия FPLC: Superose 12 (Pharmacia); гель-проникающая колонка.
В) Условия HPLC: CS-S-гексил колонка 5 мкм, 25х0,94 см, CSC N 059-085; колонка с обращенной фазой.
Образцы акульих хрящей, экстрагированные тремя способами, были помечены (с определенным значением сухой массы на объем раствора) следующим образом:
1) DUP представляет препарат настоящего изобретения, фракцированный по содержанию молекул от 1 до 500 кДа (12 мкг/мкл);
2) BAL представляет препарат по способу Balassa et al. (12 мкг/мкл);
3) OIK представляет препарат фракции 3 в соответствии со способом Oikawa et al. (270 мкг/мкл). Все образцы доводили до конечной концентрации 12 мкг/мкл (сухая масса/объем) перед любым анализом. В образце OIK содержалось большое количество нерастворимого материала, который было легко осадить путем центрифугирования при 13200 об/мин или отфильтровать через 0,2 мкм мембраны. Фильтрование и концентрирование нерастворимого материала являлись существенными этапами перед FPLC и HPLC (А, В).
А) Суммирование результатов FPLC:
Образцы обрабатывали на гель-проникающей колонке Superose 12 (10/30) фосфатным буферированным физиологическим раствором (PBS) в качестве элюента при скорости 0,5 мл/мин (скорость записи 0,25 см/мин). Аликвоты в 100 мкл образцов установленной концентрации фильтровали через 0,2 мкм мембрану перед введением в колонку. Контроль по OD 280.
Колонку калибровали по следующим стандартам (ММ в дальтонах): каталаза (232000), альдолаза (158000), альбумин (56000), яичный альбумин (44000), химотрипсин (25700), рибонуклеаза (13700), инсулин (5700), инсулиновая В цепочка (3500), инсулиновая А цепочка (2500), бацитрацин (1450), витамин В-12 (1355). Молекулярная масса основных пиков рассчитывалась с использованием следующего уравнения: log10MM= 7,52-0,212 х RT, где RT = объем элюирования в мл. R2 =0,976. Полный объем колонки (VT) составлял 21,93 мл по данным, полученным с использованием цитидина (246 Да). Свободный объем (VO) был определен как 8,38 мл за счет декстрана синего (2х106 Да).
На фиг. 10a) образец авторов DUP имел первый основной пик (1), который элюировался при 18,76 мл, давая молекулярную массу 3500 Да. Последующие пики при 22,7 (2) и 27,3 мл (3) были за пределами полного объема колонки (21,93 мл по данным, полученным для цитидина). Эти пики, по-видимому, свидетельствуют о некотором сродстве в отношении матрицы колонки.
На фиг. 10b) образец Balassa BAL имел небольшой пик (1), элюируемый вблизи VO колонки (8,4 мл), пик (2) при 18,5 мл (4000 Да) и два пика, элюируемые после VT (3) 22,6 и (4) 28,2 мл.
На фиг. 10c, образец Oikawa OIK также имел небольшой пик (1) - при VО, пик (2) при 18,9 мл (3300 Да), пик (3) при 21,5 мл (1000 Да) и небольшой пик (4) при 27,3 мл.
При сравнении образцов отмечено, что помимо 3300 Да пика, основные пики DUP образца не наблюдались с той же интенсивностью в других образцах. Образец OIK действительно, имел небольшой пик при 27,3 мл. BAL образец имел небольшой пик при 28,2 мл, который может коррелироваться с одним из второстепенных пиков DUP образца.
В) Суммирование результатов HLPC:
Для HLPC на колонке с гексил-обращенной фазой, одновременно контролировали OD 210 и OD 280. Аликвоты по 50 мкл центрифугированных образцов (все по 12 мкг/мкл) вводили в колонку и элюировали 100% H2O. Пики на каждой хроматограмме в соответствии с OD 210 отмечены (напр. 1), и соответствующие OD 280 пики отмечены штрихом (например 1'). VO этой колонки составляет 5,5 мл (1,4 мин).
На фиг. 11a) DUP имел 3 основные пика, которые наблюдались на OD 210 (1, 2 и 3), и 2 небольших пика (4 и 5). Два боковых пика наблюдались вне пика 1, помечены как 1a и 1b. Значительное поглощение OD 280 связано с пиками 1, 1a, 1b и 3. При сравнении, соответствующее QD 280 поглощение для пика 2 гораздо меньше по отношению к OD 210.
На фиг. 11 b) BAL давал больше пиков на OD 210, но их интенсивности были меньше при сравнении с пиками DUP. Если только перекрывание пиков может служить показателем идентичности молекул, лишь пики 3 и 7 образца Balassa, по- видимому, коррелируют с временами удержания пиков в образце DUP (пики 1a или 1b и пик 4 соответственно).
На фиг. 11c) лишь три основных пика наблюдались (1, 2, 3) в OIK экстракте. Пики 1 и 3 могут коррелировать с пиками 1 и 3 образца DUP, но в OIK хроматограмме не наблюдается боковые пики возле пика 1. Высота пиков в OIК образце была ниже, чем в DUP. Даже несмотря на то, что FPLC и HPLC картины представляют характеристики отличающихся продуктов, авторы провели проверку антиангиогенных активностей этих трех продуктов в САМ тесте.
САМ тест
Вначале САН тест проводили, используя различные концентрации протамина (37, 75 и 150 мкг). Метилцеллюлозный диск, содержащий воду, и другой диск, содержащий протамин, в качестве позитивного контроля, помещали на хорлоаллантоевую мембрану эмбриона цыпленка (n=количество анализированных эмбрионов). О-кольцо помещали на каждый диск для облегчения их локализации. На следующий день оценивали уровень васкуляризации для каждого О-кольца (наблюдение проводилось парой ученых в обычном слепом тесте). Шкала оценок для САМ теста основана на оценках 1-2-3. Оценка 3. Нормальная васкуляризация при сравнении с противоположным горизонтальным квадрантом или соответствующим квадрантом контрольного эмбриона. Оценка 2. Кровеносные сосуды проникают в О-кольцо, но исчезают по середине. Основные кровеносные сосуды пересекают О-кольцо, но их траектории заметно нарушены. Уменьшение разветвлений, уменьшение сосудистой площади квадранта вблизи О-кольца. Оценка 1. Внутри О-кольца не наблюдается кровеносных сосудов или ответвлений кровеносных сосудов. Кровеносные сосуды не вырастают позади О-кольца за исключением того, что они огибают его и проходят позади него. Сосудистая площадь квадранта четко уменьшается вблизи О-кольца. На фиг. 12 значения над каждой из колонок указывают конечную оценку для каждого образца. Статистический тест Wilcoxon использовали для сравнения величин различий между двумя дисками, помещенными на одно и то же яйцо. Как и ожидалось, наблюдалось дозозависимое соотношение.
Фракции DUP экстракта с ММ ниже и выше 10 кДа тестировали в одинаковых условиях. Они демонстрировали одинаковую эффективность в ингибировании неоваскуляризации (фиг. 13).
Полный экстракт DUP сравнивали с продуктами, полученными в способе Balassa (BAL). В продукте, полученном по способу Balassa, не обнаружено заметной антиангиогенной активности (фиг.14).
DUP неочищенный экстракт сравнивают с фракцией 3% в Oikawa OIK. DUP и OIК оказались почти эквивалентными (фиг.15). Oikawa et al., тем не менее, излагали данные, далекие от настоящего изобретения, так как они указывали на отсутствие детектируемой активности во фракциях с молекулярной массой более 10 кДа, что находится в противоречии с результатами авторов (фиг. 13).
Поэтому, несмотря на сходство между способами Balassa и авторов изобретения, продукты, которые получают в результате обоих процессов, совсем не одинаковы.
Два продукта, которые были известны ранее как полученные способами, которые до сих пор считают классическими способами получения хрящевых экстрактов, были сравнены с продуктом настоящего изобретения. Приведенные выше результаты показывают, что продукты, полученные способом настоящего изобретения, отличаются неожиданно высокой активностью, если речь идет об антиангиогенной активности. Поскольку другие активности будут проверены далее, авторы предполагают, что способ настоящего изобретения действительно позволяет успешно выделять множество растворимых в воде активностей в едином экстракте.
Клинические исследования
Перед проведением предварительных клинических исследований неочищенный пермеат, полученный после ультрафильтрации, концентрировали в 2 и 20 раз, получая обогащенный активный пермеат. Эти уровни концентраций получали на фильтрационной колонке с тангенциальным потоком с пористостью 1000 дальтон, что уменьшило объем элюата в 2 и в 20 раз. Концентрированный пермеат фильтровали на фильтре Millipore с пористостью 0,22 мкм. Если хрящ обрабатывали альтернативным способом центрифугирования (используя СЕРА центрифугу с мембраной с пористостью 30 мкм) десятикратное концентрирование приводило к получению концентрированного экстракта с почти таким же уровнем протеинов, что и при указанном ранее 20-кратном концентрировании экстракта, например, около 12- 25 мг/мл (усовершенствованный способ) вместо около 8-12 мг/мл (лабораторный способ). Стерильный 10-кратно концентрированный пермеат распределяли в 7 мл аликвоты (около 85 мг протеина) в стерильные колбы, замораживали при -80oC в течение ночи, и затем хранили при -20oC до использования. Основное различие между неочищенным и концентрированным пермеатом состоит в концентрации в них протеинов. Следует отметить, что способ, который использовали для определения содержания протеинов, измеряет полное содержание азотных соединений, а не только протеинов (способ Kjeldahl). Это может объяснить, почему концентрация протеинов не возрастает пропорционально уровню объемной концентрации, как это обычно бывает в случае, когда содержание протеинов определяют по методу Lowry. Стадия концентрирования, таким образом, предполагает просачивание как воды, так и низкомолекулярных соединений азота.
Антиангиогенное действие
Концентрированный пермеат используют для лечения зависимых от ангиогенеза заболеваний. На практике на людях тестировали три различных типа зависимых от ангиогенеза заболеваний; первый тип - рак (рак простаты), второй тип - дерматологические расстройства (псориаз), и третий тип - артриты. Приводимые далее примеры иллюстрируют и показывают, что жидкий экстракт обладает, по крайней мере, антиангиогенной активностью.
Среди дерматологических заболеваний были выбраны случаи псориаза. Среди тестированных случаев псориаза заслуживает внимания различие между случаями псориаза, осложненными гиперкератозом и случаями без осложнений. Компонент кератоза состоит в образовании ороговевших чешуек в виде бляшек. Такие бляшки являются физическим барьером, который препятствует проникновению активных ингредиентов к кровеносным сосудам.
Пациент, страдающий раком простаты, добровольно испробовал 10-кратно сконцентрированный пермеат хряща. Этот пациент подвергался ряду успешных обычных терапевтических методов лечения, которые давали временный успех. В последнее время он начал принимать хрящевой экстракт после того, как его рак дал рецидив.
Другие добровольцы, страдающие артритом и ранее принимавшие лекарства (преднизон) или не принимавшие его, начали принимать концентрированный хрящевой экстракт. Их состояние улучшилось, о чем свидетельствовали уменьшение боли и жесткости в суставах.
Полученные результаты весьма обнадеживающи и предопределяют полезность неочищенного пермеата и его фракций при лечении всех зависимых от ангиогенеза заболеваний, а не только тех, которые были специально тестированы. При условии, что заболевание включает ангиогенный компонент, можно предположить, что хрящевой экстракт настоящего изобретения будет эффективен в этом плане при условии, что он входит в состав композиции, которая содержит эффективное его количество, и что эта композиция существует в форме, удобной для соответствующего введения. Поэтому следует учитывать, что настоящее изобретение не ограничено следующими конкретными композициями для использования при лечении ангиогенных заболеваний, так как специалисты смогут получить множество композиций, выбор которых диктуется способом их введения и больной тканью-мишенью. Композиции можно вводить различными способами, например, местно, перорально, под язык, ректально, внутривенно, внутримышечно, за счет диффузии и так далее.
Из-за рыбного вкуса и запаха хрящевого экстракта в эти композиции можно добавлять отдушки или вкусовые агенты для удобства пациентов.
Псориаз
Приготавливали следующую дерматологическую композицию, и проверяли ее эффективность на пациентах, страдающих псориазом:
- EMULGADETMCLB (масса/масса).
- 20 х неочищенный пермеат 69,5% (масса/масса)
- GERMABENTM11 1% (масса/масса) и
- Lavandula Angustifolia 0,5% (масса/масса)
EMULGADETM CLB смесь стеаратных сложных эфиров, жирных спиртов и неионных эмульгаторов (полученных от Henkel Canada Ltd.) нагревали при 65-70oC при перемешивании. Нагревание прекращали, продолжая перемешивать смесь. Когда температура смеси достигала 45oC, добавляли эссенцию масла Lavandula Angustifolia и консервирующие агенты GERMABENTM 11 (диазонидилмочевина 30%, метилпарабен 11%, пропилпарабен 3% и полиэтиленгликоль 56%; поставка от Sutton Laboratories NJ,U.S.A). Когда температура смеси достигала 30oC, добавляли хрящевой экстракт. Полученная таким образом композиция представляла собой однородный нежирный крем. Варьируя процентное содержание EMULGADETM можно получить другие формы дерматологических композиций с другими вязкостями в соответствии с указаниями изготовителей (молочко, лосьон, мазь). Для получения паст, гелей и других форм трансдермальных препаратов можно использовать другие носители или наполнители.
Полученную таким образом композицию давали дважды в день в течение 12 недель группе из 9 пациентов (местное нанесение) страдающих псориазом, которые реагировали на обычную терапию, но через некоторое время становились нечувствительными к ней. Для этих исследований выбирали пациентов по сходству и симметричной степени псориаза на обеих сторонах членов. Эти испытания проводили в двойном слепом эксперименте, причем ни дерматологи, ни пациенты не знали, какая из поврежденных сторон была обработана композицией, содержащей хрящевой экстракт, а какая была обработана контрольной композицией. У пяти пациентов, псориаз которых не был осложнен гиперкератозом, наблюдалось заметное улучшение. У тех, у которых был гиперкератоз, результаты были умеренно хорошими. Фотографии частей тел двух пациентов представлены на фиг. 9a) и 9b). На фиг. 9a) видно, что пациент с псориазом, осложненным гиперкератозом, тем не менее демонстрирует весьма заметное уменьшение эритемы, связанное с отсутствием зуда всего лишь после одного месяца лечения. Гиперкератоз, однако, остается важным. Фотография второго пациента, псориаз которого не был осложнен гиперкератозом, (фиг. 9b) демонстрирует гораздо большее улучшение после трехмесячного лечения. Поскольку псориаз является, по-видимому, многофакторным заболеванием, предполагают, что реакция пациентов зависит от степени важности таких вовлеченных компонентов как ангиогенез и воспаление в стабилизации и сохранении этого состояния. Антиангиогенная активность действительно присутствует в экстракте настоящего изобретения, на что указывают тесты с DMBA-обработанными крысами и САМ тесты. Противовоспалительная активность также была проверена (обсуждение далее). Вероятно, что можно достичь лучших результатов, если этот тип композиции дополнить другими терапевтическими агентами, направленными на другие участвующие факторы (кератолитические агенты, дополнительные противовоспалительные агенты, антигистаминные препараты, иммуносупрессоры и т.д.).
Такое дополнение может принимать форму изменения композиции так, чтобы она включала эффективное количество, например, кератолитического агента. Результата можно достичь также за счет раздельного введения такого дополнительного терапевтического агента одновременно или при чередовании с нанесением композиции для местного нанесения настоящего изобретения. Кроме того, нет необходимости вводить дополнительные лекарственные препараты тем же способом.
Вышеописанная композиция не демонстрирует никаких системных эффектов (ее действие ограничено обрабатываемой зоной) и никаких вторичных эффектов, несмотря на высокое содержание хрящевого экстракта.
Рак
Один пациент с раком простаты был подвергнут лечению 10-кратно концентрированным пермеатом. Аденосаркома была диагносцирована в 1986 г. В это время была проведена радиотерапия. В 1991 г. PSA (антиген сыворотки простаты) уровень составлял 138 мкг/л, тогда как нормальным уровнем считается 4 мкг/л. Затем пациент был подвергнут полностью отличной терапии за счет кастрации, совмещенной с антиандрогенной терапией (EUFLEXTM). Это лечение было эффективным в течение трех лет, после чего уровень PSA снова стал повышаться. С июня 1994 г. этот пациент потребляет 10 х пермеат (ежедневная доза под язык составляет около 75 мг протеинов) 7 мл экстракта, что эквивалентно около 1-1,5 мг/кг веса тела (день). Даже несмотря на то, что значительное количество этой дозы проглатывается, она, вероятно, абсорбируется в желудочно-кишечном тракте в значительной части, если полагаться на результаты, полученные на DMBA- обработанных животных (см. ранее). PSA уровни снижались постепенно с 12 до 0,9 мкг/л, т.е. до нормальных уровней PSA (последний результат был получен в мае 1995 г.). Такой дозовый режим можно также изменить при желании в соответствии со способом введения, биодоступностью активных ингредиентов и желательной степенью агрессивности, с которой необходимо контролировать данную патологию. К настоящему времени нетоксичность была проверена на крысах (см. примеры ранее) и на людях (данные не представлены).
В других in vivo экспериментах, проведенных на DMBA-обработанных крысах, величина дозы жидкого экстракта составляла около 190-220 мг протеинов/кг веса тела, что предположительно вносит значительный вклад в уменьшение зоны раковых кровеносных сосудов (55% при объединении с гораздо большими количествами протеина лиофилизата). Поэтому можно предположить, что доза от около 0,1 до около 200 мг/кг веса тела в день составляет приблизительно разумный интервал средних доз (ЕД50) для лечения рака, по крайней мере частично, за счет уменьшения или устранения ангиогенеза.
Артриты
Пациенты, страдающие артритом, на добровольных началах получали 1-2 единицы в 7 мл полного жидкого экстракта в день в течение нескольких месяцев. У этих пациентов наблюдалось улучшение их состояния за счет восстановления функции суставов, уменьшения боли и воспалений (вплоть до около 60%). Поскольку артриты включают ангиогенный и воспалительный компоненты, достигнутый эффект может быть приписан антиангиогенной и противовоспалительной активностям хрящевого экстракта.
Неантиангиогенное действие
Акне:
Хотя акне и не является с точки зрения авторов заболеванием или расстройством, которое включает ангиогенный компонент, тем не менее были предприняты попытки протестировать жидкий хрящевой экстракт на пациентах с таким заболеванием. Для эксперимента с хрящевым экстрактом на пациентах с акне приготовили гель следующего состава:
CAPBOPOLTM 1,2%
Очищенная вода 77,2%
NaOH 0,3%
PHENOXETOLTM 0,3%
TWEEN 80TM 0,3%
2 x хрящевой экстракт 20,0%
40 x экстракт алоэ 0,5%
Хрящевой экстракт 2 x содержит 9-12 мг/мл протеинов. Этот состав демонстрирует заметное улучшение состояния кожи пациентов, страдающих более или менее серьезными формами акне (inflammatory ache и kystic ache; данные не представлены).
Эти результаты могут быть связаны с антиангиогенным действием (удаляя тем самым ангиогенный компонент угрей), или они могут быть связаны с активными ингредиентами, которые обладают действием, отличным от ангиогенного (противовоспалительным, например, см.обсуждение далее).
Все результаты, полученные в вышеописанных клинических испытаниях, демонстрируют значительный потенциал жидкого хрящевого экстракта при печении заболеваний, зависящих от ангиогенеза, и/или воспалительных заболеваний. Количество хрящевого экстракта, а также его композиции могут варьироваться по желанию в соответствии с конкретной необходимостью.
Следует заметить, что на основе протеинового компонента композиции для местного нанесения и все другие композиции могут содержать широкий круг доз хрящевого экстракта. Среди трех конкретных категорий тестированных случаев были использованы очень различающиеся дозы и/или композиции. Для всех предполагаемых применений (от глазных капель до дерматологических и противораковых композиций) предполагается, что минимальная конечная концентрация протеина полного жидкого экстракта должна быть очень низкой (от около 0,1 мг/мл). Этот нижний предел доз зависит от доступности и от способности проникновения активных ингредиентов к месту действия, а также от эффективного удержания этих ингредиентов и чувствительности или реакции тканей на ингибиторы ангиогенеза. Верхний предел конечной концентрации протеинов в композициях для некоторых применений в настоящее время неизвестен. Наивысшей конечной концентрацией, которая была испытана, была концентрация протеинов около 9 мг/мл в композиции для случаев псориаза, и около 12 мг/мл в единичной дозе в 7 мл, вводившейся в случае рака простаты.
Как было указано ранее, жидкий экстракт хряща акулы может терять часть своей активности, если его лиофилизируют в водном растворе. Однако добавление стабилизаторов или консервантов перед лиофилизацией, как известно, может сохранить чувствительные активности и сделать возможным введение более высоких доз хрящевого экстракта в сухом виде.
Хрящевой экстракт в качестве антагониста событий, осуществляемых за счет протеинкиназы (РКС)
Недавние публикации показали, что РКС активация приводит к тому, что нормальные кератиноциты продуцируют повышение количества интерлейкина-8 (IL-8), медиатора воспалений (Chabot-Fletcher et al. (1994) J.Jnvest.Dermatol 103: 509-515). Более того, псориазные кератиноциты продуцируют очень высокие количества IL-8, которые в дальнейшем обеспечивают неоваскуляризацию в псориазных бляшках (Nickoloff et аl. (1994) Am.J.Pathol. 144:820-828). Так как было показано, что хрящевой экстракт весьма перспективен для лечения псориаза, его действие было тестировано в кератиноцитах, РКС которых активирована трифорболацетатом (ТРА), известным агонистом этой схемы клеточной трансдукции.
Фиг. 16 демонстрирует, что уровень дифференциации кератиноцитов повышен в 5 раз за счет ТРА. Сам по себе акулий хрящ не оказывает влияния на образование ороговевший чешуек. Однако добавление экстракта акульего хряща ингибирует ТРА-индуцированное образование ороговевшей оболочки более чем на около 60%. Неизвестно, имитирует ли ТРА-индукция псориазные кератиноциты. Если дело обстоит таким образом, эти результаты дают возможность предположить, что хрящ может не оказывать действие на нормальные кератиноциты in vivo, тогда как он может оказывать действие на псориазные (или активированные) кератиноциты. Ингибирование продуцирования IL-8 в ТРА-активированных кератиноцитах, также как и в псориазных бляшках или кератиноцитах за счет хрящевого экстракта остается проверить. Снижение уровней IL-8 должно быть ценным подтверждением противовоспалительного и антиангиогенного действий этого экстракта.
Противовоспалительная активность отличается от антиангиогенной активности в экстрактах акульего хряща.
Так как ангиогенез часто связан с воспалениями в случае множества заболеваний, было бы желательно оценить каждую из активностей в хрящевом экстракте отдельно. В этой связи была выбрана модель кожного раздражения, в которой не предполагается участие ангиогенеза, для тестирования экстракта в отношении его противовоспалительной и успокаивающей активности. Для исследований были выбраны девять добровольцев, в историях болезней которых была указана чувствительность к перуанскому бальзаму. Тестировались следующие соединения:
1. 1 х акулий хрящ 50% в D-MEM среде
2. 1 х акулий хрящ 20% в D-MEM среде
3. 1 х акулий хрящ 10% в D-MEM среде
4. Cola nitida (Indena) 10% вода-спирт 1:1
4 тестовых соединения наносили на внутренние предплечья испытуемых. Материалам давали впитаться в течение 20 минут, а затем раздражитель, перуанский бальзам, наносили на испытуемые участки. Кожное раздражение оценивали с точки зрения увеличения покраснения кожи. Степень покраснения определяли Minolta Chromameter и сравнивали с позитивным и негативным контролями. Позитивным контролем являлся цвет кожи, обработанный только перуанским бальзамом, а негативным контролем являлся участок кожи, обработанный раствором колы и оценивающийся подобно тестируемым продуктам. Статистическую значимость рассчитывали в Т-тесте с двусторонним критерием вероятности. Фиг. 17 демонстрирует, что кола при 10% концентрации оказывается активной на 70%. Акулий хрящ оказывается на 58% и 60% противораздражителем при концентрациях 20% и 10% соответственно. Не наблюдается дозозависимого эффекта. Эти результаты предполагают, что экстракт хряща содержит противовоспалительную и успокаивающую активности, которые существуют помимо антиангиогенного эффекта.
Антиколлагенолитическая активность
HPLC хроматография
980 мл образца жидкого экстракта (DUP) фильтровали через мембрану с отсечением по 10 кДа в ультрафильтрационной установке с тангенциальным потоком (PELLICONTM, Millipore). Установку промывали вначале 1 л воды. Конечный выход составлял 480 мл фракции с ММ более 10 кДа и 1,8 л фракции с ММ менее 10 кДа. Фракцию с ММ менее 10 кДа концентрировали за счет cold-finger выпаривания до 180 мл (< 10-10x). Восемь аликвот по 100 мкл < 10-10х помещали в СДС-S-гексил, 5 мкм HPLC колонку (25х0,94 см) и элюировали вначале 100% H2O со скоростью 4 мл/мин, затем 8,5 мл/мин с 100% MeOH. Собирали фракции, соответствующие ОД214 пикам.
Было собрано 5 фракций (фиг.18): Фр 1, Фр 2, Фр 3, Фр 4 и Фр 5. Первые три фракции включают, по крайней мере, основной пик.
Анализ с коллагеназой
Анализ с коллагеназой проводят на тех же образцах, используя рекомбинантную коллагеназу кожи человека, тип 1 (MMP1), используя флюорогенный пептидный субстрат (анализ 1) и коллагеновый субстрат (анализ 2).
Анализ 1
Этот анализ описан у Knight et al. (1991) FEBS Let.296, 263-266. В этом способе используют флюорогенный пептидный cyбcтрат(Mca-pro-leu-glu-leu-Dpa-ala-arg-NH2) имитирующий активный сайт металлопротеиназы. Этот субстрат содержит флюоресцентную группу (Mca) на одном конце, и гасящую флюоресценцию группу (Dpa) на другом. В интактном субстрате гасящая группа эффективно маскирует флюоресценцию. После энзимативного расщепления субстрата флюоресценция в тестовой ампуле возрастает.
Активизация колагеназы описана у Weingartcen et al. (1985) Biochemistry 24, 6730. 1 мкг разбавляли до 100 мкл 50 мМ Tris-HCI, 10 мМ CaCIa,pH 7,5, 1 мкл при 10 мг/мл раствора трипсина (в 1 мМ HCl) добавляли и инкубировали в течение 15 минут при 20oC. Активацию прекращали, добавляя 10 мкл ингибитора соевого трипсина (SBTI, 5 мг/мл). В каждую микрокювету добавляли:
25 или 50 мкл ингибитора (доводят до 50 мкл H2O;
40 мкл 50 мМ Tris-HCl, 200 мМ NaCI, 10 мМ CaCl2, pH 7,5;
8 мкл активированной коллагеназы (67 нг конечное); и
2 мкл субстрата (1 мМ исходный раствор в DMSO, 20 мкМ в конце).
Флюоресценцию регистрировали на λвозб.= 328 нм, λисп= 393 нм.
Полученные результаты показывают, что Фр1 является наиболее активной фракцией в отношении ингибирования коллагеназы (фиг.19). Более низкий уровень активности наблюдается во всех остальных фракциях. При тестировании на коллагеназе головастиков энзим значительно ингибируется экстрактом акульих хрящей (EC50 около 10-20 мкг/мл).
Анализ 2
Этот анализ описан у Welgus et al. (1979) JBS.256, 9511-9516. Для исследования расщепления коллагеназы, тип 1, (MMP1) используют метод SDS-РАСЕ. Коллагеназа типа 1 осуществляет один разрез в молекуле нативного коллагена, в результате чего получают два фрагмента размером 75% и 25% от исходного коллагена. После расщепления в течение нескольких часов реакцию контролируют, выделяя продукты из субстрата с помощью SDS-PAGE. Отношение коллагена расщепленного к нерасщепленному оценивают визуально после окрашивания гелей Comassie синим (или окрашивания серебром).
21 нг активированной коллагеназы (см.анализ 1) добавляли к 5 мкг коллагена шкуры теленка (Worthington) +/- ингибитор до конечного объема 20 мкл. Реакционные смеси инкубировали в течение 16 часов при 35oC, а затем прекращали, добавляя образец SDS-PAG с 40 мМ ЕДТА, кипятили и помещали на 8% гель.
Результаты представлены в таблице 5.
ЕДТА 40 мМ ингибирует коллагеназу. Полный жидкий экстракт DUP демонстрирует низкую антиколлагенолитическую активность. Фракции 1-5 оказываются активными; наивысшую активность проявляет фракция 1. Фракция с молекулярной массой выше 10 кДа демонстрирует отсутствие ингибирующей активности.
Косметическое применение и композиции
Вышеуказанные тесты и исследования показали, что экстракт хряща настоящего изобретения может найти множество медицинских применений. Среди различных активностей, обнаруженных в этом экстракте, антиколлагенолитический, противовоспалительный и ингибирующий эффект на РКС - индуцированную дифференциацию представляются наиболее желательными в косметических применениях. Так как хрящевой экстракт настоящего изобретения продемонстрировал антагонистический эффект в случае осуществляемых за счет РКС клеточных событий и поскольку такой антагонистический эффект рассматривается в косметологии как эффект, улучшающий восстановление функций кожного барьера, способ улучшения восстановления функций этого барьера в коже млекопитающих, который включает стадию нанесения на кожу композиции, которая содержит хрящевой экстракт и фармацевтически приемлемый носитель, и такие композиции включены в объем настоящего изобретения. Другие или аналогичные композиции могут также быть использованы для успокоения кожи или для уменьшения воспалений на коже млекопитающих. Воспаления могут быть вызваны различными агентами, такими как химические раздражители, физическая абразия и экспонирование ультрафиолетовой радиации. Композиции и способы ингибирования коллагеназы в коже также включены в объем изобретения. Коллагеназа и воспаления связаны с преждевременным старением (деградация коллагена), поэтому антагонистические активности, обнаруженные в хрящевом экстракте, также можно ввести в композиции и способы замедления преждевременного старения, и для регулирования морщин или атрофии на коже млекопитающих. Причинами, вызывающими появление морщин или атрофии, могут быть, например, возраст, экспонирование ультрафиолетового излучения или загрязнений окружающей среды. Композиции для местного нанесения могут содержать эффективное количество акульего хряща, которое следует определять для каждого конкретного применения. Обычно эти композиции могут содержать от около 0,1 до около 75 мас.% жидкого 1 х до 20 х экстракта хряща и от около 50 до 99,5 мас.% фармацевтически приемлемого носителя. Эти композиции могут содержать такой антиоксидант, как агент, который предотвращает образование липидных пероксидов в коже. Примерами таких антиоксидантов служат токоферол, производные токоферола, аскорбиновая кислота, производные аскорбиновой кислоты и ВНТ. Эти композиции можно дополнить противовоспалительными агентами, подобными ингибитору фосфолипазы А2, или ботанически полученными антиирритантами экстракта колы и зеленого чая. Композиции для местного применения могут принимать различные формы, например, формы растворов, суспензий, лосьонов, тинктур, гелей, кремов, спреев, эмульсий, карандашей, мазей или липосом (по крайней мере, часть жидкого хрящевого экстракта присутствует в липосомах).
Выводы
Способ настоящего изобретения продемонстрирован как способ, который обеспечивает получение хрящевых экстрактов, имеющих большое клиническое значение. Экстракты акульих хрящей, полученные этим новым способом, содержат множество активностей, которые выделены с хорошими выходами. Хрящевые экстракты, в частности жидкий экстракт и его фракции, обладают высоким потенциалом, так как они не токсичны в отношении нормальных клеток, в то же время они эффективны в широком круге заболеваний или состояний.
Необходимые материалы
- Холодильники
- Хирургические инструменты
- Мясорубка
- Пластиковые пакеты
- Промышленный смеситель (Waring 3-х скоростной смеситель от Fisher Scientific)
- Система очистки воды (обратный осмос и 0,1 мкм фильтрация; Continental Water System, модель PRE 2202, серийный номер 91089, Modulab Bioscience RQ/Polishing System от Fisher Scientific, Montreal, Quebec). Эта система обеспечивает апирогенную воду высокого качества.
- Прецизионные весы Mettler, серия АК от Fisher Scientific
- Центрифуга Sorvall RC-285 от DuPont Canada
- Центрифуга СЕРА
- Нейлоновый карман с пористостью 30 мкм
- Автоклав (автоматический паровой стерилизатор Sanyo, модель MAC 350Р).
- Nalgene 500 мл контейнеры, стерилизованные при 132oC в течение 10 минут, и высушенные в течение 35 минут.
- Конические фильтры с пористостью 24 мкм Whatman Reeve Angel
- Ультрафильтрационная колонка (отсечение по молекулярной массе:
500 кДа и 1 кДа; поверхность: 2,322 м2, поток: 130 л/мин; давление на входе: 2,11 кг/см2, давление на выходе: 0,352 кг/см2; от Koch Membrane Systems Inc., Wilmington, MA, USA)
- Медицинская центрифужная помпа (Monarch Industries, модель ACE-S100, тип a), обеспечивающая скорость потока 130 л/мин
- Стерильный бокс (бокс ламинарного потока NuAire от Inggram and Bell)
- Millipack-60 0,22 мкм стерильные фильтры
- Стерильные прозрачные или янтарного цвета стеклянные флаконы
- Концентратор DC-10 Amicon
- Rotofor Biorad 170-2950
- Фильтры Amicon SIOY10, SIOY30, и SIOY100 с отсечением по MM 10, 30 и 100 кДа, соответственно
- FPLC Pharmacia 216007 (компьютер Pharmacia 216014)
- Hilstand S-300 26 мм/60 см (Pharmacia)
- Superose S-12 10 мм/30 см (Pharmacia)
- Лиофилизатор Labconco 10273 A
Настоящее изобретение было описано выше, и следует учитывать, что оно может хорошо, в пределах способностей и знаний специалистов в этой области, не выходя за рамки этого раскрытия, обеспечить модификации путем замены некоторых элементов настоящего изобретения на практике их эквивалентами, что позволит достичь той же цели. Эти очевидные варианты входят в объем изобретения.
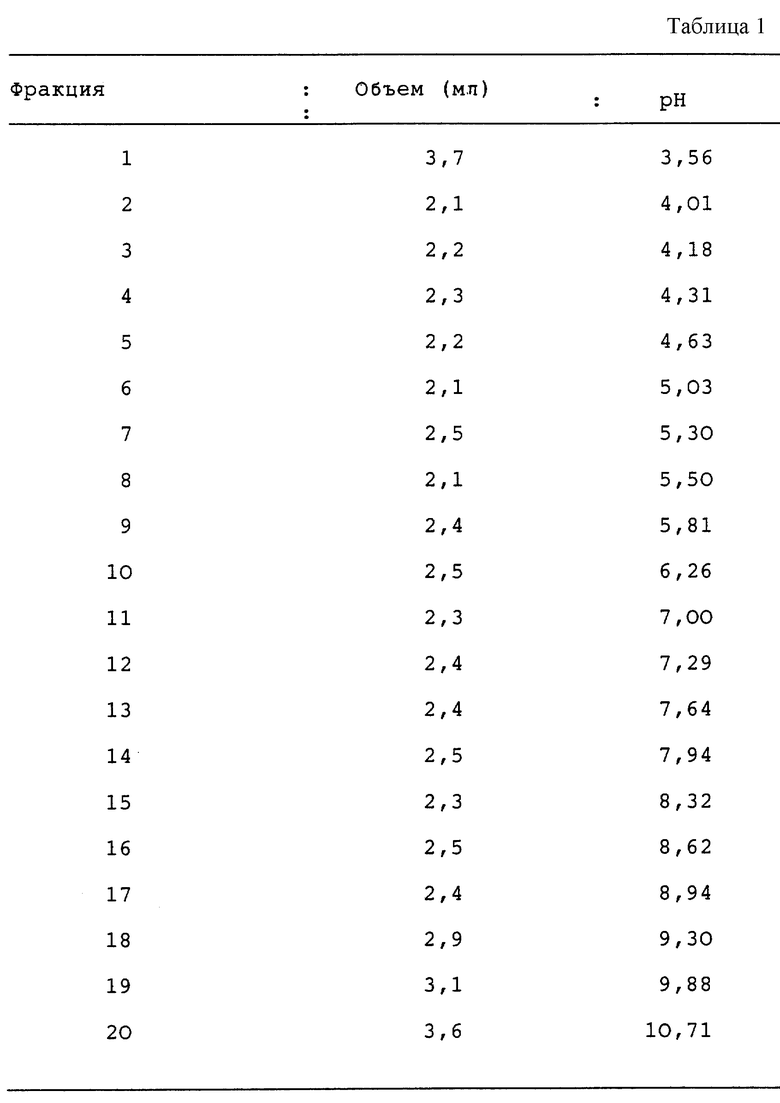

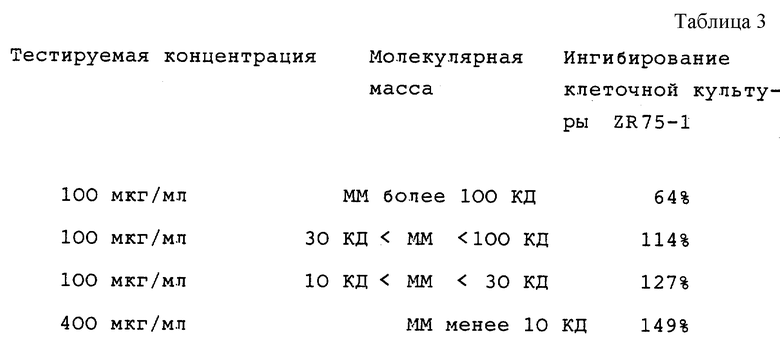

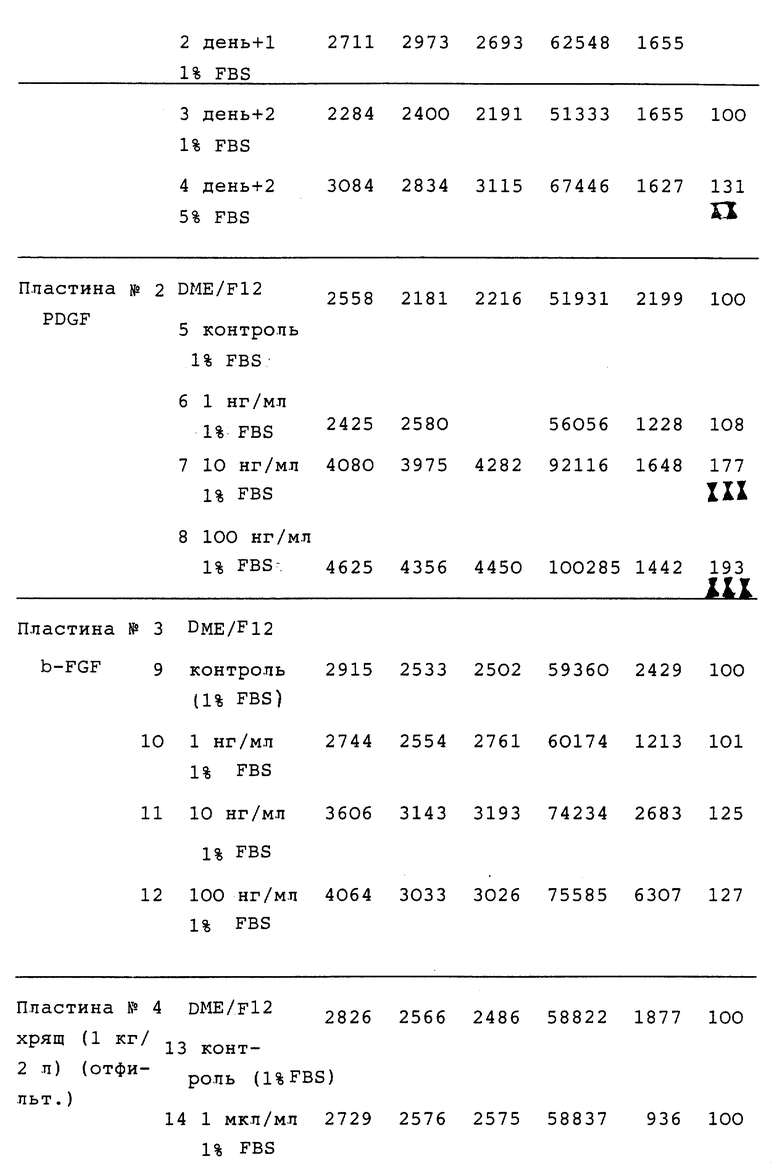

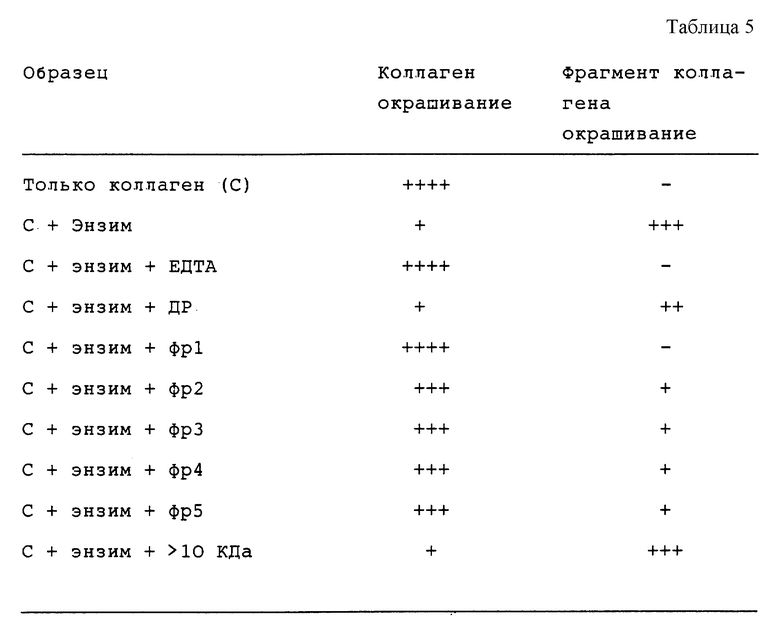


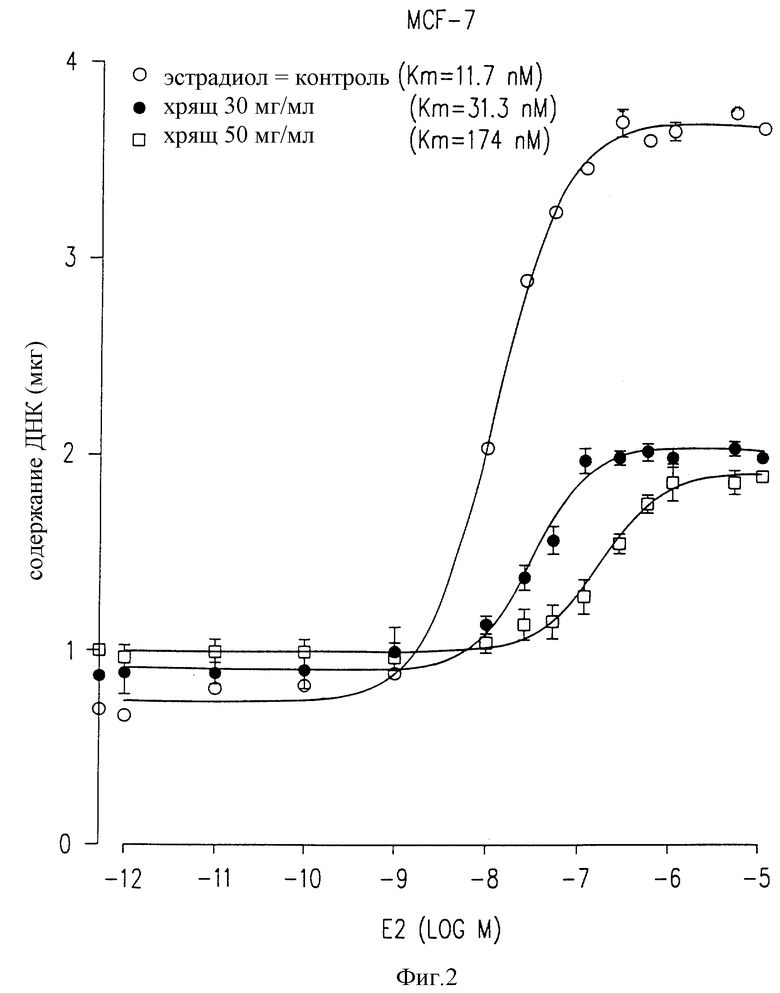
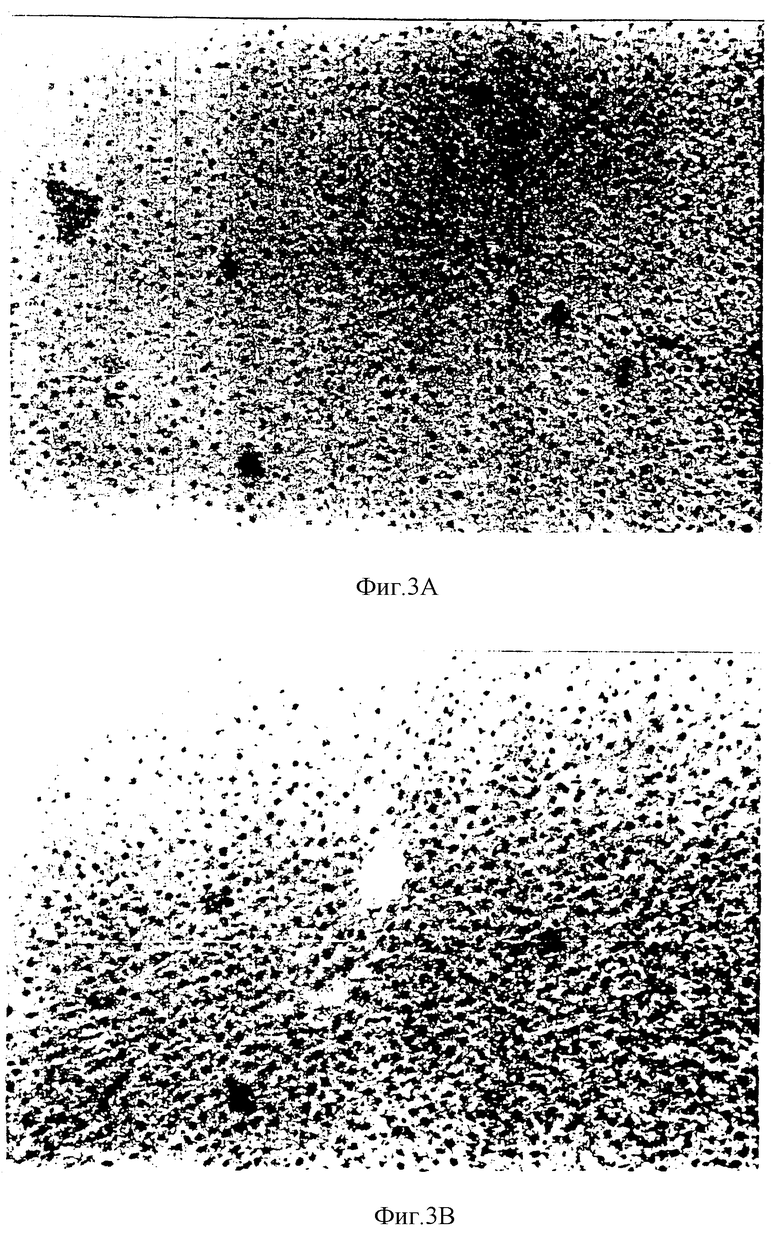

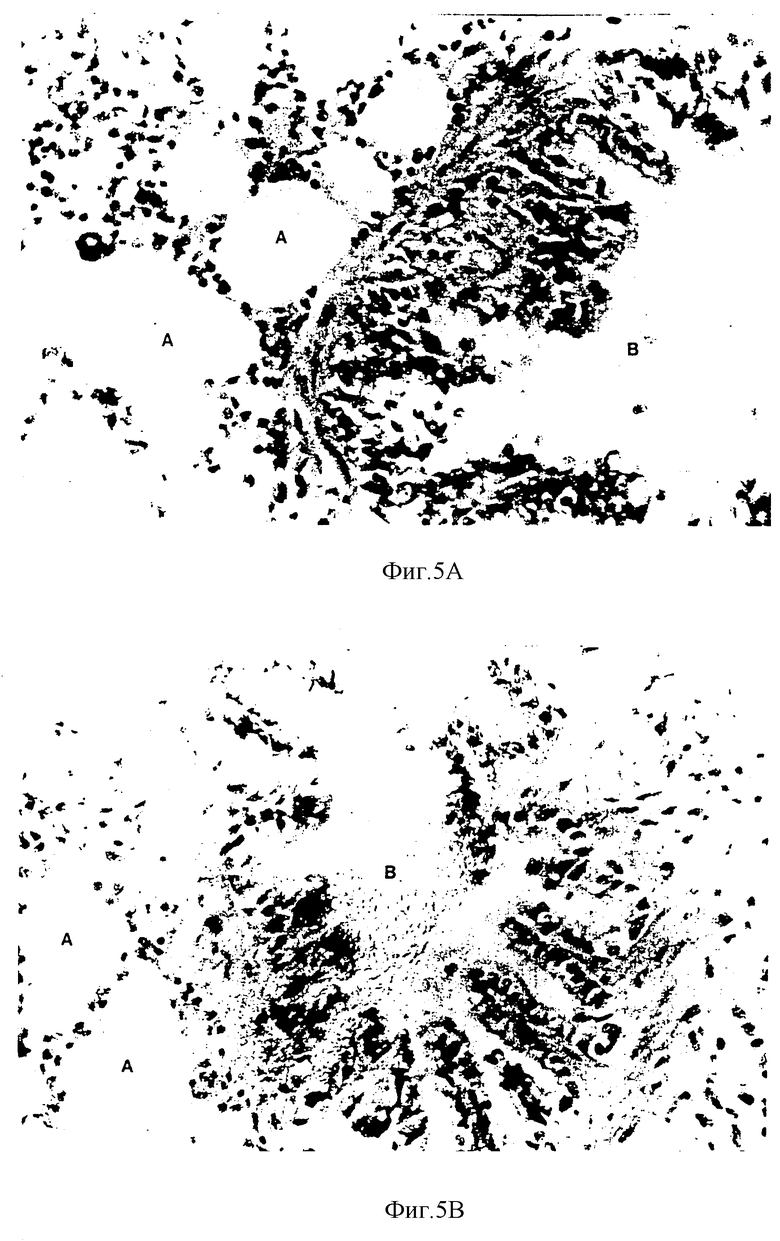
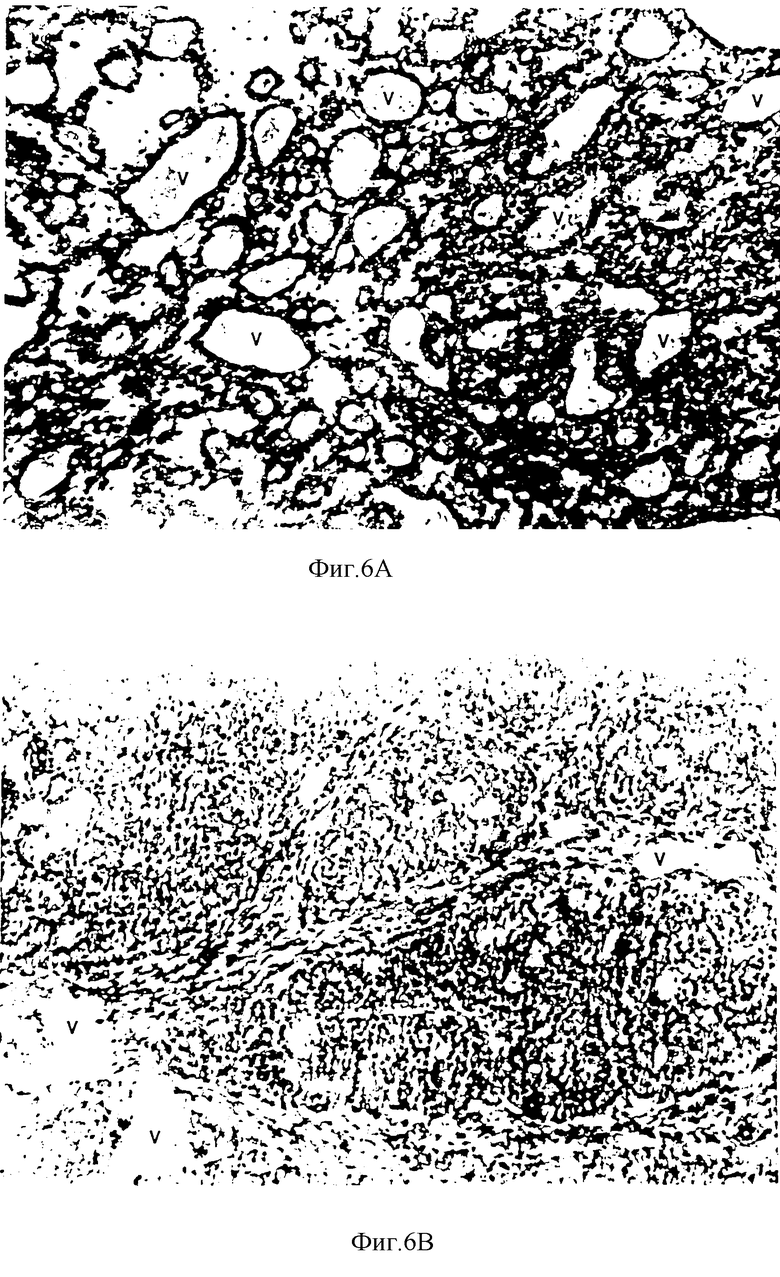
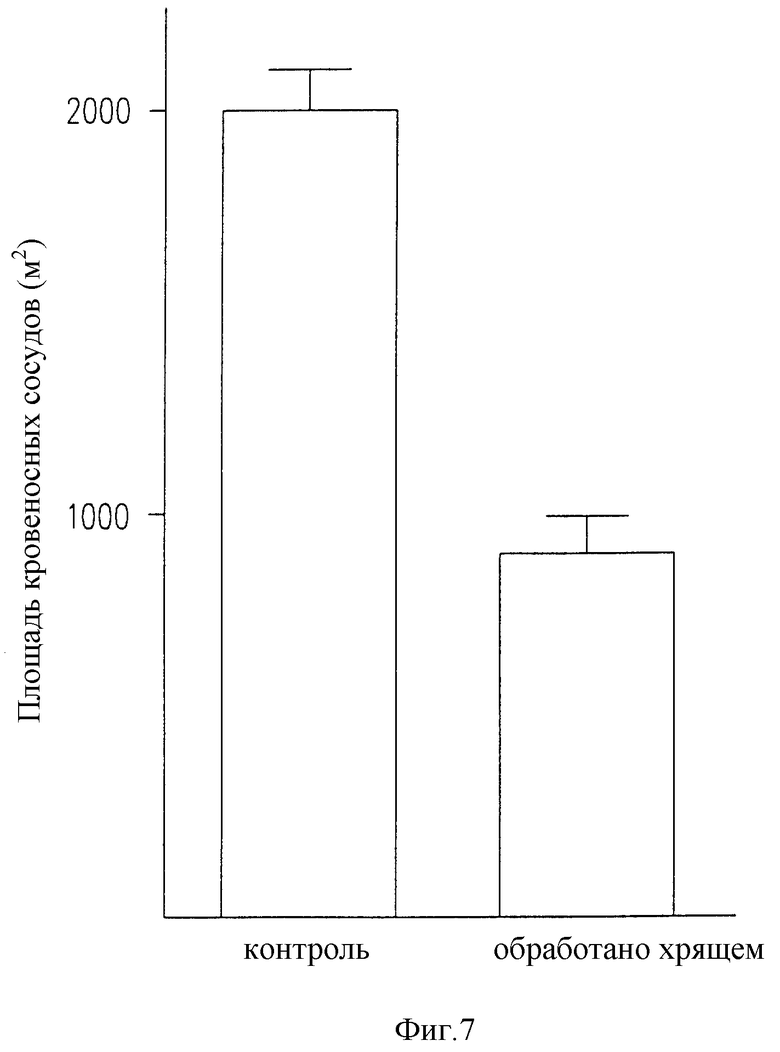
Изобретение относится к хрящевым экстрактам, к способу их получения. Экстракты хрящей акулы, обладающие антиангиогенной, непосредственной противоопухолевопролиферирующей, противовоспалительной и антиколлагенолитической активностями, были получены способом, включающим стадии получения гомогената хряща в водном растворе, центрифугирования этого гомогената и дальнейшего его фракционирования до получения полного экстракта, содержащего молекулы с мол.в. до 500 килодальтон. Дополнительное фракционирование экстракта привело к предварительной характеризации некоторых из его активных компонентов. Полный жидкий экстракт можно использовать для лечения ряда заболеваний или состояний, имеющих один или более этиологических компонентов, выбранных из опухолевой пролиферации, ангиогенеза, воспалений и коллагенолиза. Этот экстракт не оказывает никакого вредного воздействия на нормальные функции организма. Технический результат: повышение терапевтической эффективности экстракта акульих хрящей и упрощение способа их получения. 19 с. и 53 з.п. ф-лы, 7 табл., 19 ил.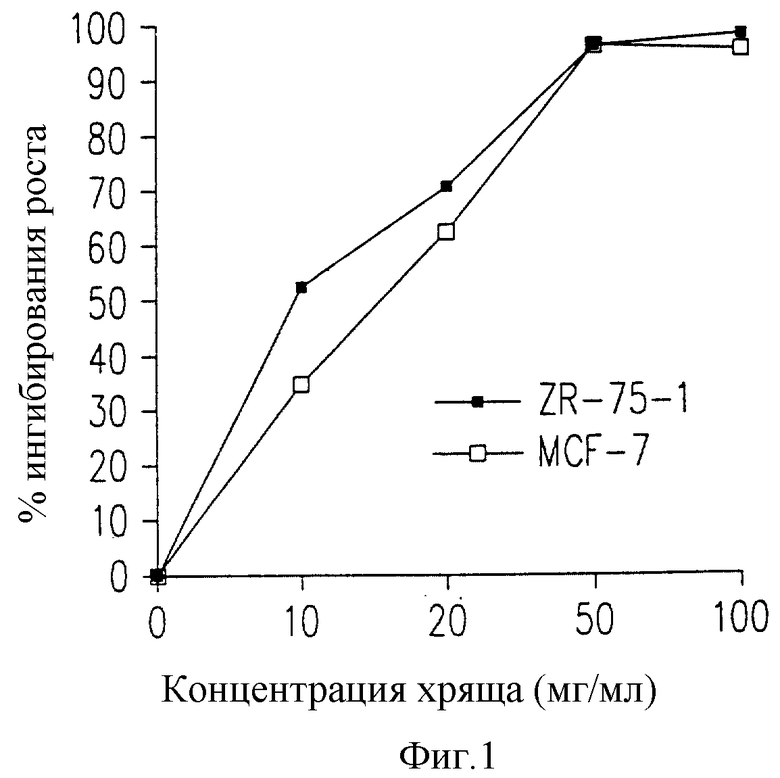
Липиды - 7,35%
Влажность - 20,4%
Протеины - 46,2%
Натрий - 4,16 мг/г
Калий - 2,64 мг/г
Кальций - 114 мг/г
Магний - 1,49 мг/г
Цинк и железо - Следовые количества
3. Жидкий экстракт, состоящий, главным образом, из фракции надосадочной жидкости, полученной после центрифугирования водного гомогената целого хряща акулы, причем указанная надосадочная жидкость фракционирована на мембране, имеющей номинальную пористость 500 килоДальтон, что обеспечивает получение указанного экстракта, состоящего из молекул с мол.м. менее 500 килоДальтон, причем указанный экстракт обладает антиангиогенной противоопухолевопролиферирующей, непосредственно противоопухолевой, антиколлагенолитической и противовоспалительной активностями.
Липиды - 0,01 - 0,20%
Протеины - 8 - 25 мг/мл
Влажность - 97 - 99%
Натрий - 30 - 220 мг/100 г
Калий - 30 - 40 мг/100 г
Кальций - 2,0 мг/100 г
Магний - 1,1 мг/100 г
Цинк и железо - Следовые количества
6. Жидкая фракция жидкого экстракта по п.3, отличающаяся тем, что ее мол. м. составляет от около 1 до около 2,5 килоДальтон по данным быстрой жидкостной хроматографии протеинов (FPLC).
| US 5075112 A, 24.12.1991 | |||
| СПОСОБ ЛЕЧЕНИЯ ПОДКОЖНОЙ ФИБРОСАРКОМЫ | 1993 |
|
RU2019173C1 |
| СРЕДСТВО ДЛЯ ЛЕЧЕНИЯ ПОДКОЖНОЙ ФИБРОСАРКОМЫ И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 1993 |
|
RU2019180C1 |
| Вычислительное устройство для экономического распределения активной нагрузки между электростанциями в энергосистеме | 1959 |
|
SU124984A1 |
| Автоматический огнетушитель | 0 |
|
SU92A1 |
Авторы
Даты
2000-10-20—Публикация
1995-10-30—Подача