Это изобретение относится к противоопухолевым терапевтическим средствам, включающим антинеопластические агенты и экстракт хряща, обладающий противоопухолевой активностью.
Известный уровень техники
Данные заявители уже описывали биологическую активность, выявленную в хрящевой ткани, а именно в хряще акулы. Способы получения экстрактов хряща и свойства самих экстрактов раскрыты в международных публикациях WO 95/32722, WO 96/23512 и WO 97/16197. Эти способы обычно включают стадии: гомогенизации и экстракции хряща акулы до получения смеси частиц хряща со средним размером приблизительно 500 мкм и неочищенного жидкого экстракта, отделения указанных частиц от указанного неочищенного жидкого экстракта и такого фракционирования указанного жидкого экстракта, при котором получают молекулы, имеющие молекулярный вес менее чем приблизительно 500 кДа. Эти способы применимы к экстракции биологически активных веществ из хряща любого происхождения.
Жидкие экстракты хряща акулы протестированы различными методами и они обладают антиангиогенной, антиколлагенолитической активностями, прямым антипролиферативным действием на опухолевые клетки и противовоспалительной активностью.
Эти экстракты хряща описаны как эффективные противоопухолевые средства и одновременно безвредные, так как у получавших его животных и больных не выявлено никаких серьезных побочных эффектов, прямо связанных с их пероральным введением. Жидкий экстракт хряща акулы и экстракт хряща из любого другого источника, имеющий эквивалентную противоопухолевую активность, входят в объем настоящего изобретения и будут обозначаться как "экстракты хряща".
Известен обширный спектр терапевтических агентов, применяемых для лечения рака. Противоопухолевые агенты включают, не ограничиваясь этим, следующие, представленные ниже элементы:
Алкилирующие агенты
Алкилсульфонаты: бусульфан.
Этиленимины: тиотепа.
Азотистые аналоги иприта: хлорамбуцил, циклофосфамид, эстрамустина фосфата натриевая соль, ифосфамид, меклоретамина гидрохлорид, мелфалан.
Производные нитрозомочевины: кармустин, ломустин, стрептозоцин.
Соединения, содержащие платину: карбоплатин, цисплатин.
Антиметаболиты
Аналоги фолиевой кислоты: метотрексат натрия.
Аналоги пурина: кладрибин, меркаптопурин, тиогуанин.
Аналоги пиримидина: цитарабин, фтороурацил.
Производные мочевины: гидроксимочевина.
Цитотоксические антибиотики
Антрациклины: даунорубицин, доксорубицина гидрохлорид, эпирубицина гидрохлорид, идарубицина гидрохлорид.
Актиномицины: дактиномицин.
Прочие цитотоксические антибиотики: блеомицина сульфат, митомицин, митотан, митоксантрона гидрохлорид.
Растительные алкалоиды и другие натуральные продукты
Эпиподофиллотоксины: этопозид, тенипозид.
Таксаны: доцетаксел, паклитаксел.
Алкалоиды барвинка и аналоги: винбластина сульфат, викристина сульфат, виндезина сульфат, винорелбина тартрат.
Прочие противоопухолевые средства: альтретамин, амсакрин, 1-аспарагиназа, дакарбазин, флударабина фосфат, порфимер натрия, прокарбазина гидрохлорид, третиноин (полная транс-форма ретиноевой кислоты), с системным введением.
Антиангиогенные средства: маримастат, сурамин, TNP 470, талидомид и лучевая терапия.
Большинство из этих актинеопластических или противоопухолевых агентов имеют ограничения в отношении безопасности, так как они высокотоксичны, например в эффективных дозах они вызывают тяжелые нежелательные эффекты.
Общеизвестным для медицины является тот факт, что нет идеальной противоопухолевой терапии. Фармакологи и онкологи всегда должны балансировать между максимально эффективной дозой и ее токсическими побочными эффектами. В результате этого эффективная доза антинеопластического агента может быть дана в виде субмаксимальной дозы, для того, чтобы избежать, насколько это возможно, слишком тяжелых токсических побочных эффектов. Таким образом, к сожалению, стремление избежать тяжелых побочных эффектов часто преобладает над стремлением достичь максимальной эффективности.
Экстракты хряща, которые заявители уже описали (цитируется выше), обладают антипролиферативной активностью в отношении опухолевых клеток in vivo, эта активность, вероятно, обусловлена по крайней мере сочетанием прямой противоопухолевой активности, антиколлагенолитической и антиангиогенной активностями. Этот экстракт обладает хорошо подтвержденной противоопухолевой активностью и лишен токсических побочных эффектов. Так как в настоящее время исследования в этой области направлены на создание такой противоопухолевой терапии, которая должна характеризоваться эффективностью, приближающейся к 100%, и токсичностью, приближающейся к 0%, то становится хорошо понятным, что противоопухолевые композиции, приближающиеся к этим золотым стандартам, будут всячески приветствоваться.
Поэтому существует необходимость в антинеопластических терапевтических средствах, сочетающих высокую эффективность противоопухолевого действия со слабыми токсическими побочными эффектами.
Краткое изложение существа изобретения
В настоящем изобретении предлагается усовершенствованная противоопухолевая терапия, включающая введение эффективного в отношении противоопухолевого действия количества антинеопластического агента и эффективного в отношении противоопухолевого действия количества экстракта хряща.
В целом преимущества, которые вносит экстракт хряща, заключаются в дополнительном увеличении эффективности противоопухолевого действия и в защите от токсических побочных эффектов.
Целью настоящего изобретения является, следовательно, обеспечение применения экстракта хряща, обладающего противоопухолевой активностью, для увеличения противоопухолевой активности антинеопластических агентов, в комбинированной противоопухолевой терапии больного, которому вводят эффективное в отношении противоопухолевого действия количество антинеопластического агента, и для защиты больного от увеличения токсических побочных эффектов, присущих введению антинеопластического агента.
Комбинированная противоопухолевая терапия может иметь две формы: 1) введение больному композиции антинеопластического агента и экстракта хряща и 2) раздельное введение больному антинеопластического агента и экстракта хряща, частично совпадающее по времени или одновременное (обычно обозначаемое как "сопутствующее лечение").
В конкретном осуществлении экстракт хряща представляет собой экстракт хряща акулы, полученный способом, включающим стадии: гомогенизации и экстракции хряща акулы до получения смеси частиц хряща со средним размером приблизительно 500 мкм и сырого жидкого экстракта, отделения указанных частиц от указанного сырого жидкого экстракта и такого фракционирования указанного жидкого экстракта, при котором получают молекулы, имеющие молекулярный вес менее чем приблизительно 500 кДа.
В первом предпочтительном варианте осуществления изобретения количество антинеопластического агента для противоопухолевого действия составляет его субоптимальную дозу, а количество экстракта хряща, вводимое в сочетании с ним, дополнительно усиливает эффективность противоопухолевого действия антинеопластического агента без увеличения, а лучше даже со снижением токсических побочных эффектов, присущих введению более высокой дозы антинеспластического агента, которая бы характеризовалась эффективностью противоопухолевого действия, эквивалентной комбинированной противоопухолевой терапии.
Во втором предпочтительном варианте осуществления изобретения количество антинеопластического агента для противоопухолевого действия составляет его оптимальную дозу, а количество экстракта хряща, вводимое в сочетании с ним, дополнительно усиливает эффективность противоопухолевого действия антинеопластического агента без увеличения, а лучше даже со снижением токсических побочных эффектов, присущих введению указанного антинеопластического агента.
Выбор субоптимальной или оптимальной дозы антинеопластического агента зависит исключительно от агрессивности опухоли, подвергаемой лечению, и тяжести побочных эффектов антинеопластического агента.
Антинеопластическим агентом может быть бусульфан, тиотепа, хлорамбуцил, циклофосфамид, эстрамустина фосфата натриевая соль, ифосфамид, меклоретамина гидрохлорид, мелфалан, кармустин, ломустин, стрептозоцин, карбоплатин, цисплатин, метотрексат натрия, кладриоин, меркаптопурин, тиогуанин, цитарабин, фтороурацил, гидроксимочевина, даунорубицин, доксорубицина гидрохлорид, эпирубицина гидрохлорид, идарубицина гидрохлорид, дактиномицин, блеомицина сульфат, митомицин, митотан, митоксантрона гидрохлорид, этопозид, тенипозид, доцетаксел, паклитаксел, винбластина сульфат, винкристина сульфат, виндезина сульфат, винорелбина тартрат, альтретамин, амсакрин, 1-аспарагиназа, дакарбазин, флударабина фосфат, порфимер натрия, прокарбазина гидрохлорид, третиноин (полная транс-форма ретиноевой кислоты), маримастат, сурамин, TNP 470, талидомид и лучевая терапия.
В конкретном варианте осуществления изобретения антинеопластическим агентом является цисплатин.
Другой целью настоящего изобретения является обеспечение продуктами, которые могут быть использованы для нового практического применения экстракта хряща.
Одним из продуктов является противоопухолевая композиция, включающая количество антинеопластического агента для противоопухолевого действия и количество экстракта хряща для противоопухолевого действия в подходящем фармацевтически приемлемом носителе.
Одним из других таких продуктов является набор для противоопухолевого лечения, который включает первый компонент, состоящий из антинеопластического агента в лекарственной дозе, эффективной в отношении противоопухолевого действия, и второй компонент, состоящий из экстракта хряща в лекарственной дозе, эффективной в отношении противоопухолевого действия.
Описание предпочтительных вариантов осуществления изобретения
Заявители протестировали действие комбинированной противоопухолевой терапии, включающей введение экстракта хряща и антинеопластического агента, в надежде обнаружить можно ли улучшить эффективность их совместного действия без какого-либо увеличения или лучше при снижении токсических побочных эффектов.
Настоящее изобретение будет описано с помощью предпочтительных вариантов его осуществления и с дополнительной ссылкой на следующие прилагаемые чертежи, целью которых является только иллюстрация изобретения, но не ограничение его объема.
Краткое описание чертежей
На фигуре 1 представлено снижение количества метастазов в LLC модели опухоли мышей. Мышам с LLC моделью опухоли перорально вводили увеличивающиеся дозы жидкого экстракта хряща (АЕ-Х), одного или в сочетании с цисплатином (CDDP). Тестировали также действие одного CDDP. Контролем служили мыши, получавшие солевой раствор.
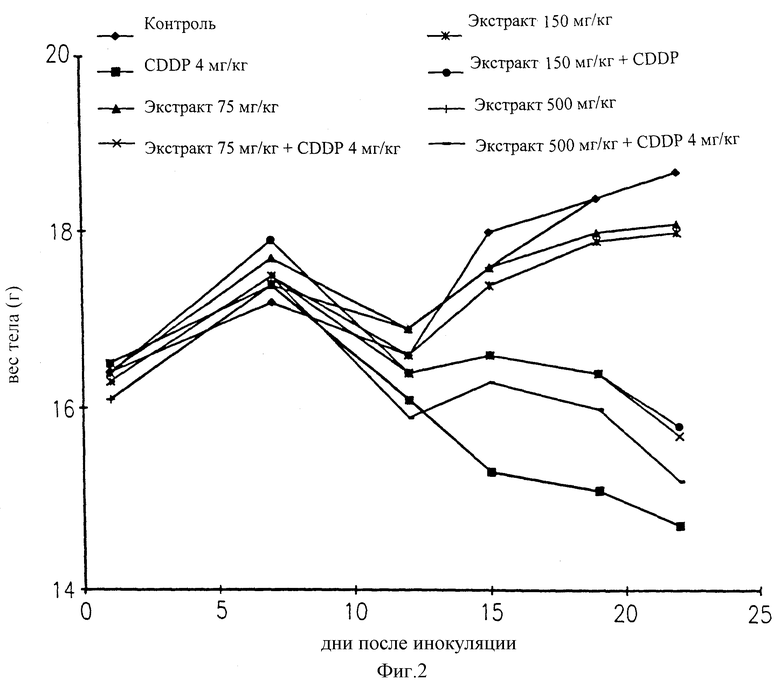
На фигуре 2 представлены изменения веса тела мышей с LLC моделью опухоли, обработанных цисплатином, увеличивающимися количествами жидкого экстракта хряща (АЕ-Х), одного или в сочетании с цисплатином CDDP, в сравнении с животными, обработанными солевым раствором (контроль).
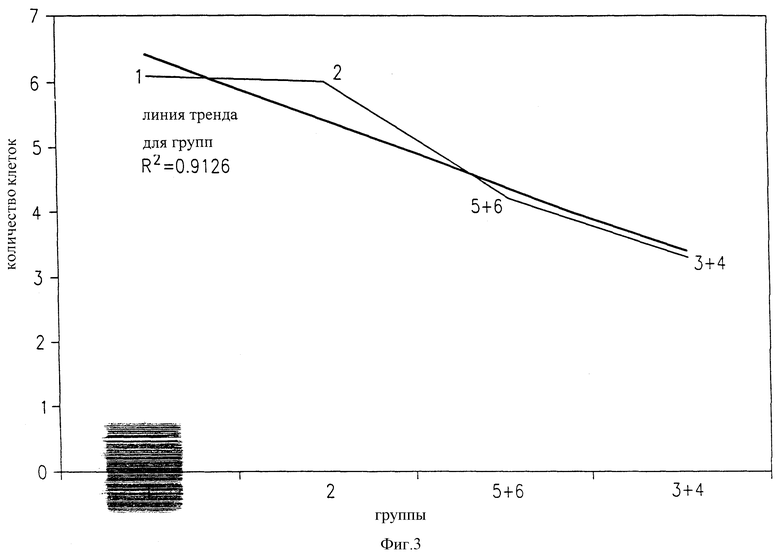
На фигуре 3 представлена корреляция между количеством лейкоцитов и эффективностью противоопухолевого лечения с учетом его токсичности.
Результаты
Заявители охарактеризовали некоторые ингредиенты из запатентованного жидкого экстракта хряща акулы (цитируется выше) и среди других компонентов обнаружили присутствие гипоксантина, его фуранозидного производного и его димеров в суммарной концентрации приблизительно 75 мкг/20 мг сухого веса суммарного жидкого экстракта хряща. Это количество гипоксантина не должно быть токсичным in vivo, хотя не исключено, что оно может быть эффективным в отношении противоопухолевого действия.
Гипоксантин является субстратом для фермента гипоксантингуанинфосфорибозилтрансферазы (HGPRT), фермента, переносящего пурины (Weber et а1., 1983). Гипоксантин образует инозинмонофосфат, который является ключевым промежуточным продуктом, участвующим в продукции аденилатов и гуанилатов. Хотя гипоксантин может в конечном итоге вести к включению пуриновых оснований в нуклеотиды и нуклеиновые кислоты, что должно благоприятствовать синтезу ДНК, многие системы клеток могут использовать пурины в различных внутриклеточных каскадах, одни из которых являются активирующими, в то время как другие - ингибирующими. Известно, что in vivo гипоксантин обладает антипролиферативной активностью в отношении опухолевых клеток, что предполагает, что в раковых клетках ингибирующие пути могут преобладать по отношению к активирующим.
У человека получены невероятные данные, показывающие, что больные, которых лечили одновременно экстрактом хряща и лучевой терапией или химиотерапией, восстанавливались более быстро и у них существенно улучшался общий вид и состояние ногтей и волос. С другой стороны, у тех пациентов, которые принимали только экстракт хряща, также наблюдалось улучшение общего самочувствия, в то время как опухоль регрессировала. Эти наблюдения указывают на то, что экстракт хряща не только эффективен сам по себе в плане торможения пролиферации клеток опухоли, но также противодействует неблагоприятным эффектам другой противораковой терапии и/или создает условия для более быстрого восстановления после ее действия.
Заявители подтвердили наличие противоопухолевой активности экстракта хряща in vivo на двух моделях животных.
- DA3 модели опухоли мышей с низким потенциалом метастазирования и
- LLC модели опухоли мышей с высоким потенциалом метастазирования.
DА3 модель:
Противоопухолевый потенциал экстракта хряща исследовали на модели аденокарциномы (аллотрансплантат) молочной железы мышей. DA3 клетки (1•106) инокулировали подкожно в правую боковую сторону живота взрослых мышей линии BALB/c. Эти клетки происходят из аденокарциномы молочной железы мышей, индуцированной 7,12-диметилбензантраценом (ДМБА). DA3 представляет собой аденокарциному молочной железы мышей, не дающую совсем или дающую малое количество метастазов (D.Medina, J.Nat1. Cancer Inst., 1969, 42: 303-310; ibid., 1976, 57: 1185-1189). Инокулированные клетки медленно растут in vivo и образуют солидную опухоль с прогнозом низкого метастазирования. Жизнеспособность DА3 клеток поддерживается в среде RPMI 1640 с добавкой 50 мкМ меркаптоэтанола, 0,2 мМ раствора Hepes буфера, 1 мМ пирувата Na, 2 мМ L-глутамина, 0,1 мМ заменимых аминокислот, 10 мМ витаминов, 10% околоплодной сыворотки телят и 1% пенициллин-стрептомицина. Клетки инкубировали при 37oС в атмосфере, содержащей 5% СО2. В этих условиях DA3 клетки пролиферируют, но не дифференцируются. Для индукции опухоли клетки выращивали в полной среде до 70% конфлуенции и затем собирали, применяя раствор трипсин-ЭДТА. Клетки центрифугировали, три раза промывали раствором фосфатного буфера (D-PBS без Са++ и Мg++) и ресуспендировали до разведения 1•107 клеток/мл. Мышам (n=15) проводили инокуляцию 0,1 мл суспензии и ежедневно перорально вводили экстракт хряща или плацебо (солевой раствор). Введение начинали в день инокуляции DАЗ клеток или 7-ю днями позже после рандомизации животных. Тестировали различные концентрации экстракта хряща. Величины доз экстракта хряща выражали в виде величины сухого веса введенного экстракта хряща на кг веса тела.
Каждый третий день проводили мониторинг роста опухоли. Измеряли длину и ширину опухоли и рассчитывали объем опухоли (см3) следующим образом (длина (см) • ширина2 (см2)/2). Мышей забивали на 54-й день после инокуляции опухоли, в этот момент опухоли удаляли и взвешивали.
При ежедневном введении мышам с DA3 моделью опухоли экстракта хряща в дозах (сухого веса) от 100 до 400 мг/кг после 48-дневной обработки выявлено снижение размеров опухоли более чем на 50% (данные не показаны).
LLC модель
Заявители подтвердили эффективность противоопухолевого действия и защитный эффект экстракта хряща с помощью тестирования действия различных концентраций жидкого экстракта хряща самого по себе или в сочетании с цисплатином (CDDP) на модели карциномы легких Lewis (LLC).
LLC клетки ресуспендировали в стерильном PBS (106 клеток/0,2 мл) и имплантировали мышам линии С57В1/6. После 11-дневного периода первичные опухоли достигали среднего объема в 1,0 см3 и удалялись хирургически. После операции мышей рандомизировали в группы по 15 животных и им ежедневно вводили путем перорального зондового питания контрольный (солевой) раствор и экстракт хряща в интервале доз, требуемом для 15-дневного периода лечения. На 16-й день после операции животных забивали, легкие фиксировали в 10% формамиде и подсчитывали количество метастазов в легких. Животных содержали в контролируемых условиях: температура 22oС, влажность от 40 до 50%, цикл светового дня 12 часов. Они получали пищу и питье аd libitum.
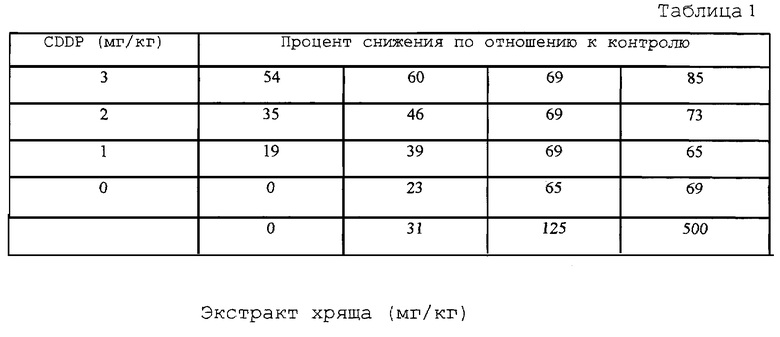
В первом эксперименте животные получали пять внутрибрюшинных инъекций CDDP через каждые три дня (1, 2 и 3 мг/кг). Экстракт хряща давали per os ежедневно (31, 125 и 500 мг/кг). В качестве контроля давали солевой раствор. Результаты представлены в таблице 1.
Обнаружено, что экстракт хряща не проявляет ни синергизма, ни антагонизма, но является аддитивным фактором по способности снижать количество легочных метастазов при LLC. CDDP сам по себе в дозе 3 мг/кг вызывает снижение количества метастазов на 54%, в то время как один экстракт хряща в дозах 125 и 500 мг/кг вызывает снижение на 65 и 69% соответственно. Результирующее снижение количества метастазов (85%), наблюдаемое при сочетании действия наиболее высоких доз (500 мг/кг/день) экстракта хряща и CDDP (3 мг), эквивалентно обнаруженному при действии одного CDDP в дозе 5 мг/кг, но без токсичности, выявляемой при этой более высокой дозе CDDP (данные не показаны). Таким образом, добавление экстракта хряща к субоптимальной, характеризующейся низкой токсичностью дозе CDDP ведет к поддержанию такой противометастазной активности, которая обычно наблюдается при действии более высоких доз CDDP.
Во втором независимом эксперименте CDDP давали в дозе 4 мг/кг. Экстракт хряща давали в дозах 75, 150 и 500 мг/кг. В качестве контроля опять давали солевой раствор. Результаты снижения количества метастазов представлены на фигуре 1. Введение одного CDDP снижало количество метастазов приблизительно на 71%.
В отношении снижения количества метастазов экстракт хряща был эффективен при всех применяемых дозах. Максимальный эффект в отношении снижения количества метастазов проявлялся при дозе 150 мг/кг или выше.
Комбинация двух наиболее высоких доз экстракта хряща (150 и 500 мг/кг) и CDDP дает сверхмаксимальный эффект (85-87%) по сравнению с максимальным эффектом, наблюдаемым при оптимальной дозе одного CDDP (приблизительно 71%).
Токсические побочные эффекты оценивали с помощью измерения веса тела. Результаты проиллюстрированы на фигуре 2.
В течение первой недели обработки вес тела возрастал у всех групп. Обработку начинали на 12-й день от начала эксперимента. Снижение веса тела, наблюдаемое между второй и третьей точкой времени по графику, возникает в результате операции (на 11-й день), необходимой для удаления первичной опухолевой массы LLC. Через 15 дней после инокуляции обнаружено, что один CDDP был очень токсичным, так как наступало снижение веса тела приблизительно на 16% по сравнению с группой, не обработанной CDDP.
Один экстракт хряща при всех дозах не влиял на снижение веса тела будучи в то же время эффективным в отношении снижения количества легочных метастазов. При комбинации с CDDP экстракт хряща проявляет защитный эффект путем снижения степени потери веса тела, индуцированной CDDP (дозы 75, 150 и 500 мг/кг жидкого экстракта хряща по сравнению с CDDP; р<0,05 для всего периода обработки).
Дозы, охватывающие 150-500 мг экстракта хряща, можно комбинировать с 3-4 мг CDDP для достижения сверхмаксимального эффекта без увеличения токсичности, даже при самой высокой дозе CDDP.
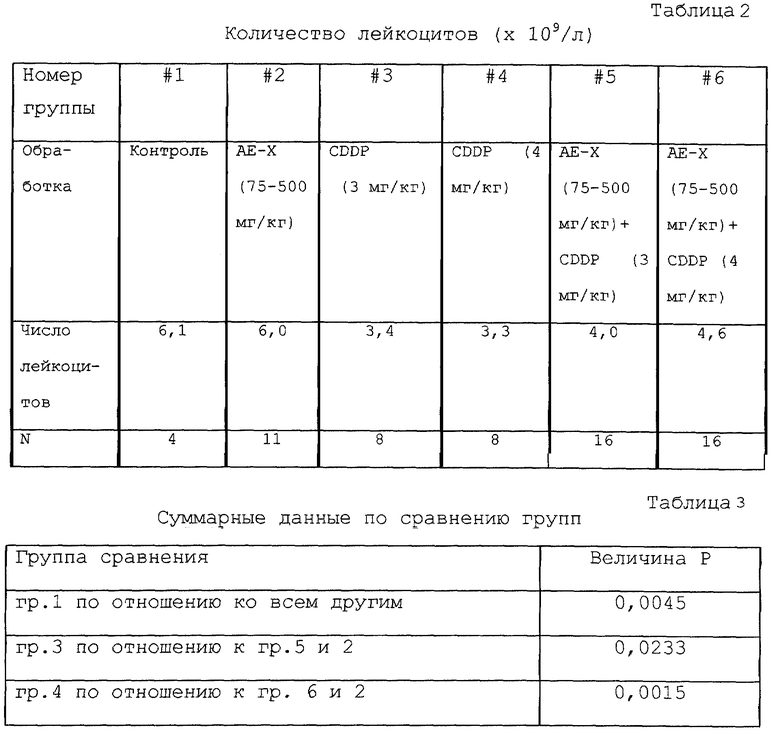
Токсичность у животных с раком оценивали по снижению веса тела. Заявители дополнительно охарактеризовали природу защитного эффекта, обеспечиваемого экстрактом хряща, путем оценки гематологических параметров, а именно количества лейкоцитов периферической крови. Нормальным мышам вводили (в/б) CDDP (3 и 4 мг/кг) на 1, 4, 7, 10 и 13 дни эксперимента. Экстракт хряща вводили перорально в дозе 75, 150 и 500 мг/кг/день. Животных забивали на 15-й день и отбирали образцы крови для подсчета клеток с применением автоматического анализатора клеток крови. Группы состояли из животных, получавших один CDDP, один экстракт хряща, комбинацию обоих или солевой раствор в качестве негативного контроля.
Введение CDDP вызывало значительное снижение числа лейкоцитов (таблицы 2 и 3). Введение экстракта хряща в дополнение к CDDP защищало против снижения числа лейкоцитов (хрящ по отношению к 3 мг/кг CDDP, р<0,05; хрящ по отношению к 5 мг/кг CDDP, р<0,01). Величины, полученные в индивидуальных группах, которые получали экстракт хряща, объединяли для увеличения статистической значимости. Среднее количество лейкоцитов наносили на график по отношению к группе, обработанной по определенной схеме (фигура 3). Линейность тренда указывала на чистый монотонный тренд (r2=0,9126) для снижения количества клеток в соответствии со строгостью схемы обработки. Это наблюдение находится в соответствии с защитным эффектом экстракта хряща в отношении популяции лейкоцитов, снижающейся в течение введения CDDP.
Основываясь на биологической активности, проявленной экстрактом хряща, в настоящее время ожидается, что экстракт хряща может быть применен в качестве дополнения к большому количеству антинеопластических агентов. Комбинации известных антинеопластических агентов с экстрактом хряща должны обеспечить огромные преимущества, являясь высоко эффективными без увеличения токсичности или даже при более низкой токсичности по сравнению с эффективным количеством одного антинеопластического агента. Таким образом, заявители предлагают способ лечения опухолей, который включает стадии введения комбинации противоопухолевого количества экстракта хряща и противоопухолевого количества антинеопластического агента, где указанная комбинация обеспечивает высокую эффективность и пониженные побочные эффекты, обусловленные указанным антинеопластическим агентом. Антинеопластические агенты не ограничиваются цисплатином. Действительно, те из них, которые представлены выше, все являются хорошими примерами кандидатов для комбинаций настоящего изобретения.
Пониженные токсические эффекты включают: улучшение качества волос и ногтей, уменьшение тошноты, увеличение аппетита и веса тела, снижение подавления активности костного мозга, торможение снижения числа лейкоцитов и общее снижение болезненного состояния и смертности.
Настоящее изобретение описано здесь выше со ссылкой на конкретные варианты его осуществления. Ясно, что специалисты в этой области способны создать модификации, не выходящие за пределы представленных выше указаний. Эти модификации входят в объем настоящего изобретения, как определяется в прилагаемой формуле изобретения.
Изобретение относится к медицине, а именно к получению лекарственных средств для противоопухолевой терапии. Описано новое применение жидкого экстракта хряща, содержащего молекулы с мол.м. до 500 кДа, в качестве средства для защиты больного от токсических побочных эффектов, присущих введению антинеопластических агентов. Экстракт хряща может применяться в составе фармацевтической композиции или набора для лечения, содержащих антинеопластический агент. Комбинированная терапия обеспечивает более высокую эффективность противоопухолевого действия за счет снижения побочных токсических эффектов. 3 с. и 3 з.п. ф-лы, 3 табл., 3 ил.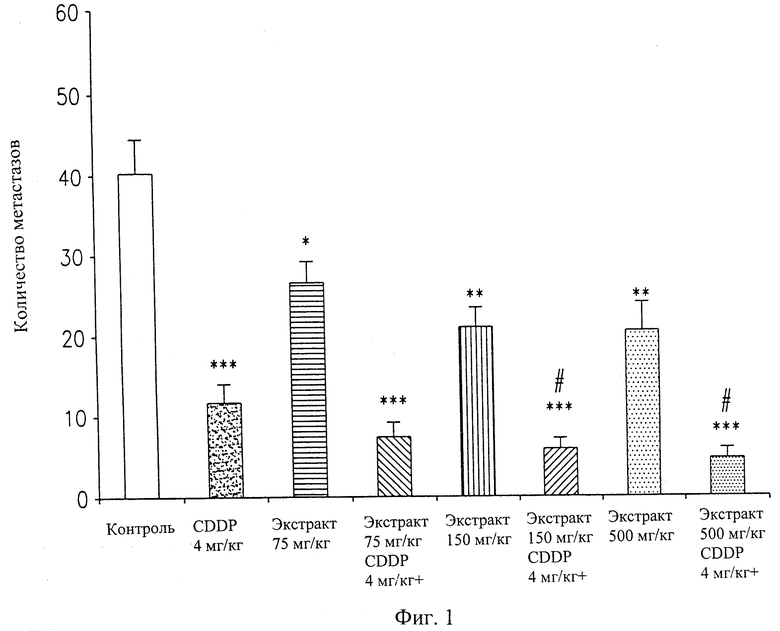
| RU 2066181 C1, 10.09.1996 | |||
| Способ соединения электрических проводов | 1931 |
|
SU28254A1 |
| US 4822607 А, 18.04.1989 | |||
| Прибор для очистки паром от сажи дымогарных трубок в паровозных котлах | 1913 |
|
SU95A1 |
| Приспособление в пере для письма с целью увеличения на нем запаса чернил и уменьшения скорости их высыхания | 1917 |
|
SU96A1 |
| Огнетушитель | 0 |
|
SU91A1 |
Авторы
Даты
2003-01-10—Публикация
1998-03-11—Подача