Изобретение относится к образованию новых материалов в форме алюмосиликатных производных и способам получения этих новых материалов, которые получают химической модификацией глиняных минералов и других алюминийнесущих минералов.
Производные этих глин или алюминийнесущих минералов характеризуются преобладанием тетраэдрически координированного Al+3, который возникает при химической модификации октаэдрически координированного Al+3 в исходном минерале. Это превращение структуры в атомной шкале делает доступными большее число способных к обмену мест, чем было обычно доступно в исходной глиняной структуре.
При модификации таких глин или алюминийнесущих минералов могут возникать два признака новых материалов: повышенная способность к обменным катионам из раствора (т.е. катионообменная способность) и/или увеличение доступной площади поверхности по сравнению со свойствами исходного начального минерала (например, глины или цеолита). Эти два признака весьма важны для эффективного по цене применения этих производных материалов в разных областях применения для катионного обмена (например, для удаления ионов токсичных металлов из водного и неводного растворов; удаления NH4 + из водного и неводного растворов, в качестве основных компонентов моющих средств и в качестве умягчителей воды), абсорбции (например, для удаления газов из окружающей среды, для абсорбции катионов из растворов), в качестве агентов для регулированного выделения нужных катионов в окружающую среду и в качестве субстратов для реакций катализа при модификации углеводородов и других химикатов.
Глиняные минералы являются частью наибольшего семейства минералов, называемых филлосиликатами или "слоистыми" силикатами. Эти глиняные минералы типично характеризуются двухмерными расположениями тетраэдрических и октаэдрических слоев, каждый с характерным элементным составом и кристаллографическими соотношениями, которые определяют минеральную группу. Следовательно, тетраэдрический слой может иметь состав T2O5 (где T, тетраэдрический катион, представляет собой Si, Al и/или Fe), а октаэдрический слой может, как правило, содержать катионы, такие как Mg, Al и Fe, но может также содержать и другие элементы, такие как Li, Ti, V, Cr, Mn, Co, Ni, Cu и Zn (Brindley and Brown, 1980, Crystal structures of clay minerals and their X-ray identification, Mineralogy Soc. , London). Каждую из этих глиняных минеральных групп можно классифицировать далее на триоктаэдрическую и диоктаэдрическую разновидности в зависимости от заполненности (заселенности) октаэдра в соответствующем расположении (ях) слоя. Некоторые специфические виды минералов могут показывать заполненность катионами, промежуточную между двумя разновидностями. Тем не менее, относительное расположение этих тетраэдрических и октаэдрических слоев также определяет основные минеральные группы, в которых совокупность молекул, которая связывает один тетраэдрический слой с октаэдрическим слоем, известна как слоистый минерал типа 1:1. Совокупность молекул, которая связывает два тетраэдрических слоя с одним октаэдрическим слоем, известна как слоистый минерал 2:1. Эта основная классификация минеральных видов, основанная на кристаллографических соотношениях определенных субъячеек, хорошо известна специалистам в области минералогии глин и образует основу описания данного изобретения.
Несмотря на кристаллографию этих субъячеек в глиняных минералах, алюмосиликатные производные настоящего изобретения также включают минералы, которые содержат тетраэдрический каркас атомов кислорода, окружающих либо кремний, либо алюминий, в расширенной трехмерной пространственной сетке. Например, разные цеолиты содержат различные комбинации связанных тетраэдрических колец, двойных колец или полиэдрических единиц, но они также ответственны за обеспечение алюмосиликатного производного изобретения ASD (далее называемого "АСП").
Получение аморфного производного, называемого "аморфное производное каолина" (АПК), из каолиновых глин, которые являются алюмосиликатами 1:1, описано в более раннем патенте (WO 95/00441). Это описание раскрывает получение АПК из исходного материала каолиновой глины реакцией каолиновой глины с галогенидом щелочного металла MX, где M - щелочной металл, и X - галогенид.
В данном описании ссылка на MX была единственным примером подходящего реагента, который мог преобразовать большую часть октаэдрически координированного алюминия в минерале каолиновой группы в тетраэдрически координированный алюминий. Однако, не приведено сведений о каком-либо возможном механизме, посредством которого явление происходило.
Однако, что удивительно, к настоящему времени обнаружено, что альтернативный реагент, такой как высокоосновный раствор в форме MOH, где M - катион щелочного металла, может обеспечивать подобный результат, при котором основная часть октаэдрически координированного алюминия может быть превращена в тетраэдрически координированный алюминий.
Не желая быть связанными теорией, гипотетически полагают, что реагент, который может дать этот особенный результат, может содержать соединение, которое диссоциирует на катионные частицы и анионные частицы так, что гидроксил-ионы присутствуют в концентрации, избыточной по сравнению с концентрацией ионов водорода. В дополнение к этому признаку или альтернативно, соединение вызывает образование гидроксил-ионов в полученном растворе вследствие взаимодействия с алюмосиликатным минералом в избыточной концентрации по сравнению с концентрацией ионов водорода.
При образовании избытка гидроксил-ионов, казалось бы, что такой избыток гидроксил-ионов приводит к перестройке связи катион-кислород в исходном материале так, что может быть образован стабильный аморфный материал с вышеупомянутыми желательными свойствами.
Опять же, безотносительно к теории, эта химическая трансформация или превращение может быть представлено следующим примером, в котором каолинит, содержащий Al и Si в октаэдрических и тетраэдрических положениях в структуре каолинита, соответственно, взаимодействует с галогенидом щелочного металла, в котором катион - ион K+ или аммония, в водном растворе так, что избыток галогенида (например, X) способен к легкому обмену с доступными гидроксилгруппами (OH-) в структуре каолинита. Этот обмен приводит к образованию высокоосновного раствора с избытком ионов OH-, которые могут вызывать перегруппировку октаэдрически координированного алюминия под действием этих ионов OH- на атомы кислорода, связанные водородом. Эта перегруппировка координации алюминия приводит, главным образом, к тетраэдрически координированному алюминию в этом образующемся стабильном материале. Следовательно, это обеспечивает подходящее объяснение, почему MX был подходящим реагентом в случае патента WO 95/00441.
Альтернативно, высокоосновный раствор можно получать, используя реагент, такой как соединение, диссоциирующее на катионные и анионные частицы. Анионы, присутствующие в избытке, могут вызывать также перегруппировку октаэдрически координированного алюминия в тетраэдрически координированный алюминий воздействием их на атомы кислорода, связанные водородом. Другие примеры такого типа химического превращения глин включают реакцию каолинита или монтмориллонита с каустическим (щелочным) реагентом (например, MOH, где M - катион, такой как K+, или Na+, или Li+), так что происходит перегруппировка октаэдрически координированного алюминия в тетраэдрически координированный алюминий при его действии на атомы кислорода, связанные водородом.
Настоящее изобретение обеспечивает способ получения алюмосиликатного производного, который включает взаимодействие соответствующего твердого исходного материала с MOH, где M представляет собой щелочной металл, с образованием аморфного алюмосиликатного производного (АСП).
Осуществление того, что можно использовать MOH в дополнение к MX, чтобы получить АСП, является полезным, поскольку в настоящее время понимают, что MOH может быть использован для получения АСП из любого соответствующего исходного материала. Это удивительно, поскольку аморфное производное сейчас может быть получено, например, из глин 2:1, включающих монтмориллониты и другие члены смектитной группы. Получение аморфного производного из глин 2:1 является удивительным, так как структура и химия этих минералов заметно отличаются от структуры и химии минералов каолиновой группы 1:1. Единичный слой глин каолиновой группы состоит из одного октаэдрического слоя и одного тетраэдрического слоя, так что оба слоя выходят в межслойное пространство - область, которая доступна для реагирующих частиц. Однако, глиняный минерал 2: 1 содержит один октаэдрический слой и два тетраэдрических слоя. Октаэдрический слой, содержащий октаэдрически координированный алюминий, размещается между тетраэдрическими слоями. Превращение этого октаэдрического слоя не является легко предсказуемым при использовании галогенидов металлов к подобным реагирующим частицам, так как межслойное пространство окружено тетраэдрическими слоями. Уместно также утверждать, что октаэдрический слой в глиняных минералах 2:1 не будет легко доступным для галогенида металла. По этой причине специалисты в данной области допускают, что частицы, реагирующие с глиняными минералами 2:1, будут давать продукты реакции, отличные от продуктов реакции, описанных в патенте WO 95/00441.
Скорость реакции и предпочтительные формы этих алюмосиликатных производных с желательными свойствами будут зависеть от точной температуры реакции в заданный период времени. В общем можно использовать температуру реакции меньше 200oC в течение периода времени от одной минуты до 100 часов. Более предпочтительно, температура составляет 50-200oC и время реакции составляет менее 24 часов. Во взаимодействии с этой перегруппировкой координации атома или атомов алюминия, присутствие дополнительного катиона (из реагента) вызывает стабилизацию разупорядоченной структуры через "присоединение" катиона к центру обмена, образованному в результате этой перегруппировки. В течение всего химического превращения может происходить потеря алюминия (а также малых количеств кремния) из алюмосиликатной структуры в высокоосновный раствор. Предпочтительный pH этого высокоосновного раствора во время реакции и в конце ее составляет, как правило, > 12, хотя реакция образования предпочтительных АСП может протекать в растворах с pH > 7,0.
Примеры алюмосиликатов, которые можно модифицировать способом или способами изобретения, включают монтмориллонит, каолин, природный цеолит (например, клиноптилолит/гейландит), а также иллит, палыгорскит и сапонит. АСП изобретения характеризуются преобладанием тетраэдрического Al+3, который был преобразован из исходного октаэдрически координированного состояния исходного минерала (например, глины). В случае, например, монтмориллонитовых глин, тетраэдрический Al+3 был преобразован из октаэдрически координированного Al+3 исходного минерала (например, глины). Дальнейшие разъяснения этого АСП, далее обозначенного M-АСП, где M - обмененный катион, полученный определенным способом образования, можно получить обычными методами исследования минералов, которые демонстрируют следующие свойства:
(1) "аморфная" природа (к диффракции рентгеновских лучей), т.е. без какого-либо очевидного дальнего порядка повторяющихся единиц;
(2) повышенная способность к обмену катионов (по сравнению с исходным начальным минералом) из раствора;
(3) увеличение доступной площади поверхности минерала (по сравнению с исходным начальным минералом), измеренной обычной изотермой БЭТ;
(4) повышенная способность (по сравнению с исходным начальным минералом) адсорбировать анионные частицы или сложные полианионы из раствора; и/или
(5) повышенная способность (по сравнению с исходным начальным минералом) абсорбировать масло и/или органические молекулы.
Что касается свойства (2), то его можно показать на примере АСП изобретения, обладающих катионообменной способностью 20-900 миллиэквивалентов на 100 г, измеренной путем обмена катионов аммония или металла из водного раствора. Наиболее предпочтительная катионообменная способность, измеренная посредством обмена аммония, составляет между примерно 300-450 миллиэквивалентов на 100 г.
Что касается свойства (3), то его можно показать на примере АСП изобретения, обладающих площадью поверхности меньше чем 400 м2/г, измеренной по изотерме БЭТ, и которая выше, чем у исходного глиняного минерала. Наиболее предпочтительная площадь поверхности по методу БЭТ составляет между 25 и 200 м2/г.
Свойства (4) и (5) демонстрируются далее в Примерах 15 и 16. В этих примерах адсорбция фосфат-ионов на M-АСП может быть увеличена больше чем в 2,5 раза, по сравнению с их содержанием в растворе. Это свойство можно применять для адсорбции многих других важных анионных частиц. Дополнительно, абсорбция масла на M-АСП, полученном таким образом, может быть выше по меньшей мере в два раза, чем абсорбция на начальном алюмосиликатном минерале.
Одна форма АСП изобретения имеет химический состав
МpAlqSi2Or(ОН)sXt•uH2О,
где M представляет собой катион аммония или способный обмениваться катион металла; X представляет собой галогенид; 0.5 ≤ p ≤ 2.0; 1.0 ≤ q ≤ 2.2; 4.5 ≤ r ≤ 8.0; 1.0 ≤ s ≤ 3.0; 0.0 ≤ t ≤ 1.0 и 0.0 ≤ u ≤ 3.0. В одной определенной форме АСП может содержать элемент калий, так что М = K.
АСП, обладающие вышеуказанным химическим составом, могут быть получены реакцией алюмосиликатного исходного материала, такого как глиняный минерал и цеолит, со смесью МОН и MX.
В особенно предпочтительной форме изобретения АСП имеют химический состав
МpAlqSi2Or(ОН)sXt•uH2О,
где M представляет собой катион аммония или способный обмениваться катион металла; 0.5 ≤ p ≤ 2.0; 1.0 ≤ q ≤ 2.2; 4.5 ≤ r ≤ 8.0; 1.0 ≤ s ≤ 3.0 и 0.0 ≤ u ≤ 3.0. АСП указанного выше химического состава могут быть получены способом, где исходный начальный алюмосиликат, такой как глиняный минерал, взаимодействует с одним только MOH.
В АСП, указанных выше, возможно обменивать, по меньшей мере частично, катион щелочного металла на любой катион, стабильный в водном растворе. Такие обменные катионы включают катионы других щелочных металлов, катионы щелочноземельных металлов, катионы переходных металлов, катионы лантанидов и актинидов, катионы тяжелых металлов и аммоний. В то время, как обмен не протекает полностью для всех катионов, есть много катионов переходных металлов (например, Mn+2, Cr+3, Co+2, Ni+2, Cu+2, Zn+2, Ag+), катионов лантанидов (например, La+3, Nd+3) и катионов тяжелых металлов (например, Pb+2, Cd+2, Hg+2), которые близки к этому. Для некоторых катионов обмен завершается через три часа при комнатной температуре (например, Pb+2, Cu+2, NH4 +, Na+, Ca+2, K+, Mg+2, Li+), в то время, как другие требуют более длительного времени и более высоких температур.
Такой катионный обмен по существу сохраняет аморфный для диффракции рентгеновских лучей (ДРЛ) характер необмененных АСП. Однако, удельная поверхность обмененных материалов, будучи все же выше удельной поверхности каолина, действительно увеличивается или уменьшается в зависимости от обменного катиона.
Например, в случае обмена Cu+2 из водного раствора образуется новый материал, называемый Cu-АСП, который, например, обладает высокой площадью поверхности, определенной по обычной изотерме БЭТ. Для различения, в общих формулах между новыми материалами АСП, образующимися непосредственно через превращение глины или других алюмосиликатов (как в Примерах 1-8 ниже), и материалами АСП, образованными прямым катионным обменом с непосредственно производными АСП, в описании используют следующую терминологию:
-M-АСП обозначает материал, непосредственно полученный посредством общих процессов, описанных в Примерах 1-8.
-M-АСП обозначает материал, впоследствии образованный катионным обменом с материалом M-АСП. Описания этого типа материала и способы его получения даны в Примерах 8, 12 и 13.
Ясно, что частично образованные АСП, в которых два катиона занимают центры (места) или в которых множество катионов обмениваются в результате ряда частичных реакций, являются возможными формами этого нового материала.
Термин "АСП", как его используют далее, включает в свой объем только алюмосиликатные производные.
Отношения реагентов, которые могут быть использованы в процессе, широко изменяются, как описано далее.
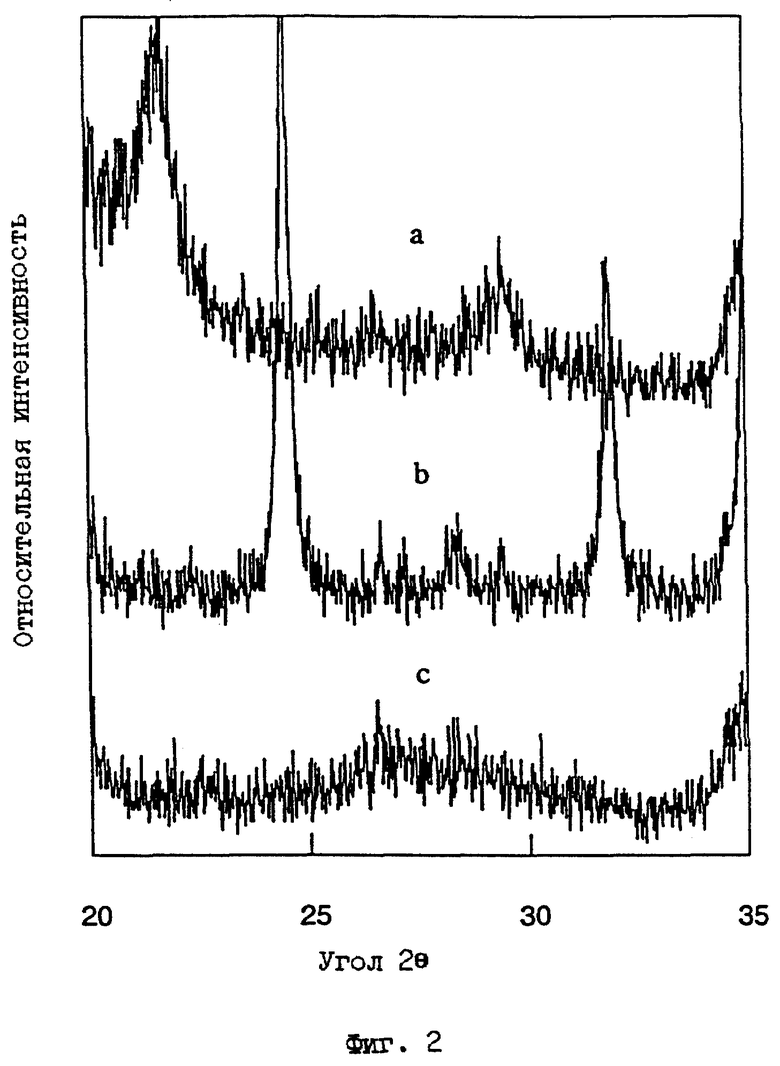
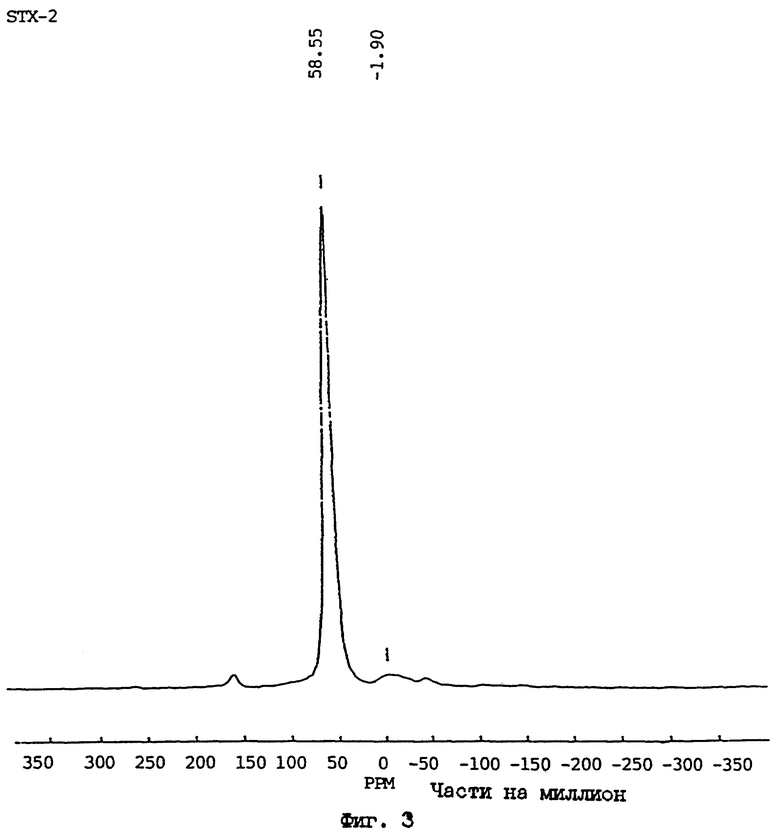
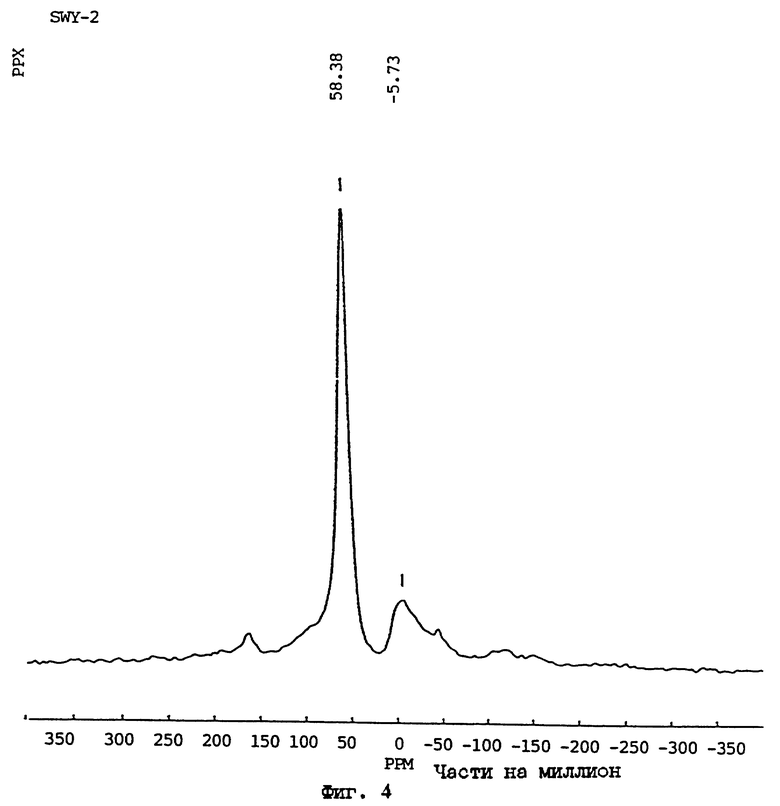
Первичными кристаллографическими методами установления материала АСП являются порошковая дифракция рентгеновских лучей (ДРЛ) и спектроскопия ядерного магнитного резонанса в твердом состоянии с вращением под магическим углом (ВМУ ЯМР, MAS NMR). В случае порошковой ДРЛ, образование M-АСП, в качестве первичного компонента реакции, обозначается потерей острых дифракционных пиков, соответствующих исходному начальному минералу (например, Ca-монтмориллониту), и соответствующему увеличению интенсивности широкого "горба" между 22o и 32o 2 θ при использовании Cu Kα излучения (см., например, фиг. 2с). В некоторых условиях обработки могут образовываться побочные продукты, такие как содалит или калиофиллит (например, как на фиг. 1b или 2b), хотя преобладающей присутствующей фазой является алюмосиликатное производное. Примеры типичных рентгенограмм для исходного монтмориллонита (STx-1) и соответствующих материалов М-АСП, полученных двумя различными способами (Примеры 1 и 3 даны ниже), приведены на фиг. 1а-1с и фиг. 2а-2с, соответственно. В случае спектроскопии ЯМР твердого состояния сигнал ВМУ ЯМР для ядер 27Al в материале M-АСП дает доминирующий пик при ~58 ppm (частей на миллион) (полная ширина на уровне полумаксимума (ПШПМ) ~16 частей на млн), обусловленный тетраэдрической координацией алюминия (как показано в фиг. 3). Как известно специалистам в данной области, монтмориллониты, такие как STx-1 и SWy-1, содержат октаэдрически координированные ионы алюминия. Этот кристаллографический признак можно продемонстрировать рядом методов, включая перерасчет данных химических анализов в виде формулы минералов и распределение атомов алюминия к октаэдрическим центрам в структуре монтмориллонита.
Указанные два первичных кристаллографических метода определяют расположение атомов решающих элементов в этом новом материале, названном алюмосиликатное производное, и образуют основу семейства минеральных производных, которые получают химической реакцией алюминийнесущих минералов, таких как глины и цеолиты. Существенными кристаллографическими признаками являются:
- превращение дальнего порядка в "аморфную" структуру, показывающую в рентгенограмме широкий "горб" или пик между 22o и 32o 2θ при использовании Cu Kα излучения; и
- присутствие, главным образом, тетраэдрически координированного алюминия.
Химический анализ можно проводить различными способами, но в этом описании иллюстрируется использование электронного микрозонда для определения количеств элементов с атомным номером больше чем 11 (т.е. Na или больше). Присутствие кислорода определяют согласно общим принципам микроанализа минералов, известным специалистам. В зависимости от природы реагента, катион, способный обмениваться, такой как Na или K, будет присутствовать в алюмосиликатном производном. Типичные примеры химических составов алюмосиликатных производных, полученных реакцией гидроксида калия с монтмориллонитом (полученным по методу Примеров 1 и 2), приведены в Таблице 1. Эти химические анализы показывают низкие суммарные величины, которые подразумевают присутствие воды гидратации, вероятность для материалов, полученных этими способами. В дополнение, типичные примеры химических составов алюмосиликатных производных, полученных реакцией гидроксида калия или гидроксида натрия с каолином (Примеры 5 и 6), приведены в Таблице 2.
Предпочтительной формулой этого типа производного является
MpAlqSi2Or(OH)sXt• uH2O,
в которой M представляет собой катион, обмененный из реагента (например, Na+, Li+ или K+), X представляет собой анион, происходящий из реагента (например, ОН-, или F-, или Cl- и т.д.). Относительное содержание этих элементов в М-АСП относительно друг друга включает следующие величины атомных соотношений, но не ограничивается ими:
0.2 ≤ p ≤ 2.0; 0.5 ≤ q ≤ 2.5; 4.0 ≤ r ≤ 12;
0.5 ≤ s ≤ 4.0; 0.0 ≤ t ≤ 1.0 и 0.0 ≤ u ≤ 6.0.
На объемные физические свойства этих алюмосиликатных производных, такие как площадь поверхности по БЭТ, катионообменная способность (КОС), абсорбция масла, степень основности и т.д., влияет природа обработки, использованная для получения АСП. В другом аспекте изобретения, это соотношение показывает, что определенные АСП могут больше подходить для одного применения (например, удаление следовых количеств двухвалентного катиона), чем для другого (например, абсорбции газов или масел), но что при относительном сравнении с глиняным минералом, используемым для получения АСП, каждое АСП имеет свойства, более пригодные для применения, чем глина.
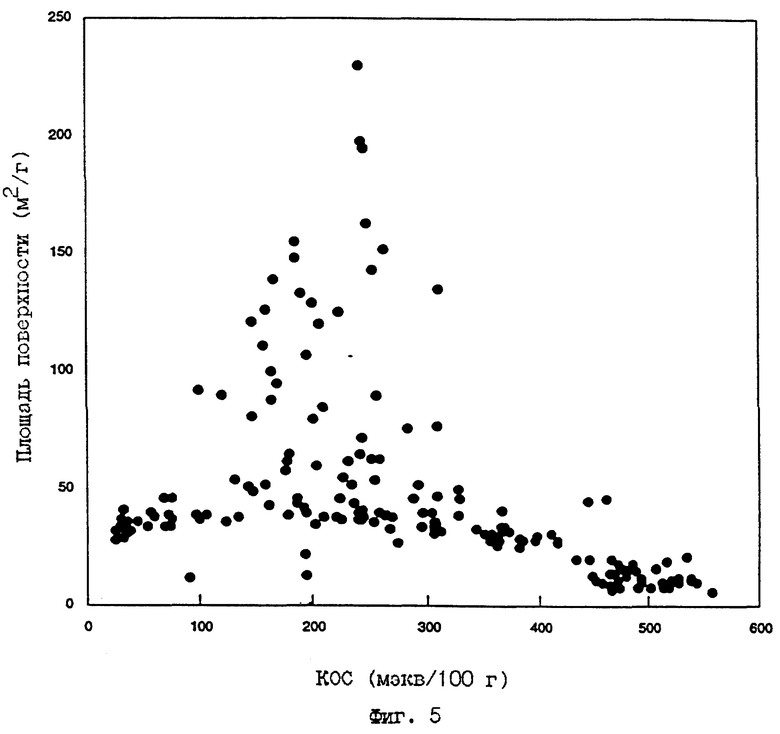
Например, можно получить широкий интервал величин КОС и величин площади поверхности для АСП, образуемых из каолинита, в зависимости от условий, используемых для отработки. Как описано далее, высокая концентрация гидроксил-ионов, присутствующих во время реакции для образования АСП, может быть получена путем использования разных реагентов и реакционных условий. Соответственно, фиг. 5 показывает график зависимости величин КОС, полученных по методике для обмена NH4 + Примера 10, от величин площади поверхности для более 150 отдельных реакций, включающих глиняные минералы и реагент, такой как гидроксид металла, который может быть в сочетании с галогенидом металла. Данные для условий, при которых реакции(я) не идут до завершения (т.е., в основном, глиняный минерал в продукте) или при которых другие фазы могут образовываться в качестве вторичных компонентов (например, калиофиллит или цеолит K-F), также включены на фиг. 5. График приблизительно определяет уровень предпочтительных свойств, обеспечивающих преобладание М-АСП в конечном продукте.
В патенте WO 95/00441 предпочтительную форму АСП называют каолиновое аморфное производное. Однако, другие каолиновые аморфные производные можно получать, используя реагенты, такие как гидроксиды щелочных металлов или комбинации галогенидов щелочных металлов и гидроксидов щелочных металлов. В этих примерах, предпочтительные признаки можно распространить на широкий интервал величин. Конечный продукт может включать различные побочные продукты в дополнение к продукту, описанному в WO 95/00441. Эти побочные продукты, такие как калиофиллит и цеолит K-F, встречаются в относительно низких отношениях с АСП и не влияют значительно на предпочтительные признаки полученного АСП.
АСП, как получено, например, по реакции с КОН, будет содержать высокий процент ионов К+ на способных к обмену центрах этого нового материала. Например, Таблица 1 указывает на ~10 мас.% K2O в случае М-АСП - производного монтмориллонита. В Таблице 2 количество K2O составляет от ~13 до ~20 мас.% для М-АСП - производного каолина, полученного по методу Примера 6. Как показано в Примерах 9 и 10, катионы, такие как Cu+2, Li+ или NH4 +, будут легко обмениваться с К+ или Na+ этих способных к обмену центров в М-АСП с образованием производного, богатого Cu, Li или NH4, соответственно. В этом примере Cu-АСП показывает высокую величину доступной площади поверхности (см. Таблицу 3), которая, при подходящей предварительной обработке, дает возможность использовать этот материал, например, в качестве катализатора реакций дегидрирования органических соединений. Так же, аммонийобмененный АСП или NH4-АСП обладает значительным потенциалом для использования в качестве удобрения или поставщика питательного вещества в сельском хозяйстве, садоводстве и сырьевой промышленности. Альтернативно, M-АСП (где M = K или Na) также можно использовать в сельском хозяйстве или садоводстве для обмена иона аммония на стабильном субстрате (например, с образованием NH4-АСП) для последующего легкого удаления или последующего использования.
Другие использования аммонийобменной способности АСП, такие как экстракция иона аммония из промышленного выходящего потока или из отработанных продуктов, легко усматриваются специалистами.
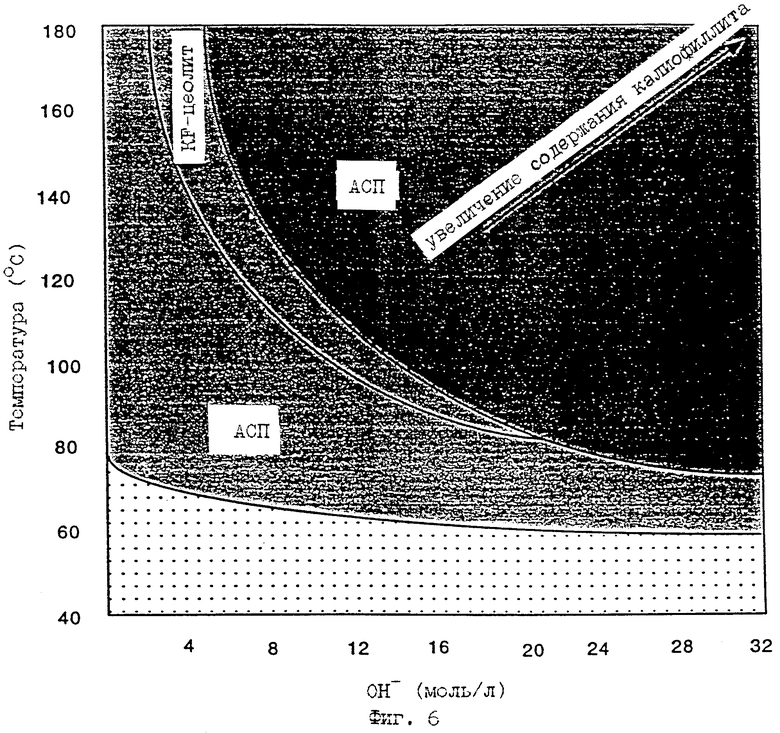
Общая диаграмма, показывающая состояние концентрации OH- (полученной предпочтительным методом, отмеченным выше) и температуры реакции, дана на фиг. 6. В этой диаграмме переход от одной формы продукта (например, АСП) к другой (например, цеолиту K-F) может не быть отмечен острыми границами, но переходная площадь означает изменение в относительном составе присутствующего продукта. Как отмечено, в диаграмме существует широкая область условий обработки, в которой преимущественно образуются АСП.
Следовательно, изобретение в дополнительном аспекте включает АСП, попадающие в затененную зону фиг.6. В этой широкой области образования могут быть получены АСП с характерной комбинацией предпочтительных свойств (см. фиг. 5).
Как отмечено выше, М-АСП могут быть получены рядом похожих процессов, которые включают следующие общие изменения структуры исходного минерала:
- атаку анионом или катионом реагента (например, OH-, F-, Cl- или K+, Na+ или Li+) таким образом, что часть связей Al-O и/или Si-O в структуре минерала ослабевает или разрушается;
- потерю периодичности дальнего порядка (иногда называемой "кристалличностью") в структуре минерала таким образом, что производный материал походит на исходную структуру только как разупорядоченный (с ближним порядком) ряд субъячеек (например, тетраэдр SiO4; тетраэдр AlO4 и вновь образующиеся "обменные центры", которые могут содержать или не содержать катион);
- потерю части атомов алюминия (и/или меньшего количества атомов кремния) из первоначального исходного минерала или минералов;
- добавление катиона реагента (например, K+, Na+ или Li+), а также, в меньшей степени, аниона реагента к структуре производного материала.
По мере протекания любого из этих процессов получения М-АСП, также происходят следующие общие изменения объемных физических свойств:
- реакция протекает с увеличением вязкости реакционной смеси до определенного максимального уровня, определяемого относительными составами и природой начальных реагентов;
- увеличение "диспергируемости" индивидуальных частиц, образующихся во время реакции - это допустимо, в частности, вследствие уменьшения размера индивидуальных алюмосиликатных частиц - по сравнению с диспергируемостью и/или размером первоначального исходного минерала (например, глины или цеолита);
- увеличение насыпного объема, занимаемого сухим порошком (например, "пушистый" или менее компактный порошок), по сравнению с объемом, занимаемым первоначальным исходным минералом (например, глиной или цеолитом).
На основе указанных выше общих изменений в первоначальном минерале и не желая быть связанными теорией, показано, что следующие категории условий реакций приводят к получению алюмосиликатного производного (М-АСП):
1. Глина плюс щелочь (например, каолин + КОН или монтмориллонит + NaOH);
2. Глина плюс галогенид металла плюс щелочь (например, каолин + KCl + KOH или монтмориллонит + KCl + KOH);
3. Цеолит плюс щелочь (например, гейландит/клиноптилолит + NaOH).
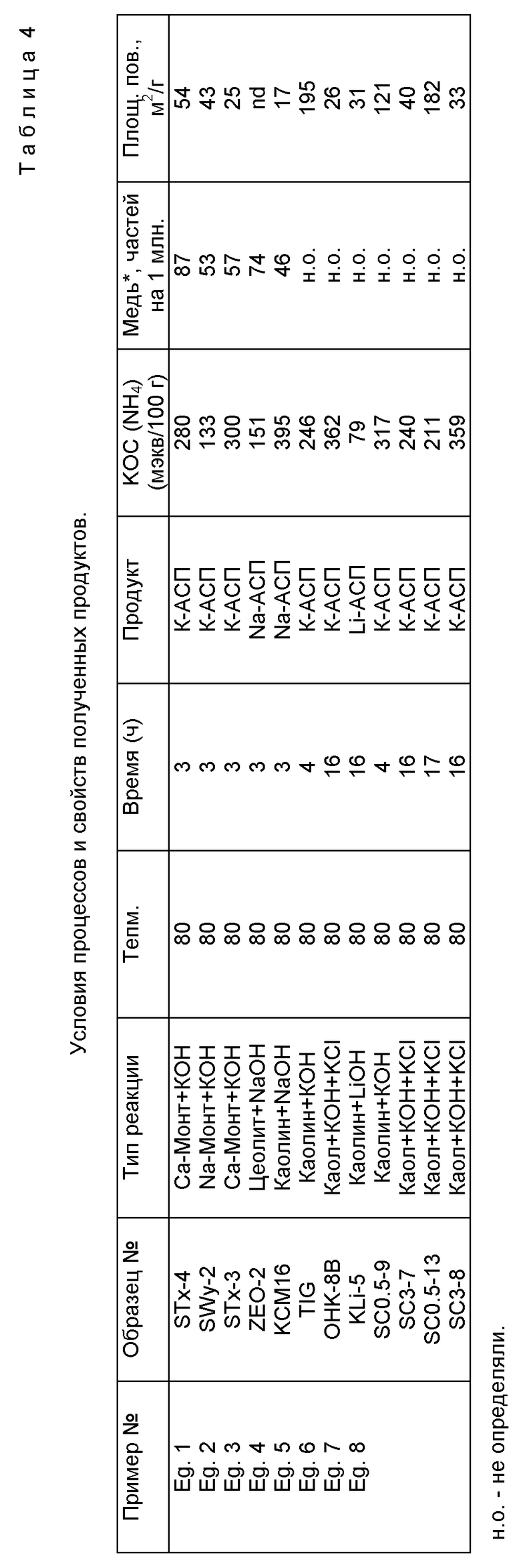
Обобщение этих категорий реакций, использующих различные комбинации концентраций реагентов, вместе с некоторыми свойствами продуктов приведены в Таблице 4. Во всех этих категориях реакций воду добавляют к реакционной смеси в различных количествах. Эти категории реакций перечислены для демонстрации разнообразия способов достижения образования алюмосиликатных производных с основными свойствами, указанными выше.
Характерные примеры образования алюмосиликатных производных приведены ниже.
Пример 1. Получение М-АСП из глины Ca-монтмориллонита
20 г источника глины монтмориллонита из Техаса (Образец N STx-1; van Olphen and Fripiat, 1979, Data handbook for clay materials and other non-metallic minerals, Pergamon Press, Oxford, 342 pp.) тщательно смешивают с 30 г гидроксида калия (KOH) и 40 мл дистиллированной воды в химическом стакане и затем нагревают при 80oC в течение 3 часов. Образующуюся суспензию промывают водой до тех пор, пока не будет удален любой избыток гидроксида калия. Порошок затем высушивают и подвергают ряду тестов для исследования, которые включают порошковую дифракцию рентгеновских лучей (фиг. 1с и 2с), спектроскопию твердого состояния ВМУ ЯМР (фиг.3), электронное микрозондирование (Таблица 1, колонка 1), аммонийобменную способность, обмен Cu+2 (Таблица 4), измерения площади поверхности по БЭТ (Таблица 4). Данные этих методов исследования указывают, что материал имеет расположение атомов (т.е. кристаллографические признаки), указанное выше. В общем, анализ ДРЛ показывает, что в этом типе реакций количество образующихся побочных продуктов является минимальным (иногда пренебрежимо малым) и что ≥ 90% продукта составляет материал М-АСП.
Пример 2. Получение М-АСП реакцией щелочи с глиной Na-монтмориллонит
20 г источника глины монтмориллонита из Wyoming (Образец N SWy-1; van Olphen and Fripiat, 1979, Data handbook for clay materials and other non-metallic minerals, Pergamon Press, Oxford, 342 pp.) тщательно смешивают с 30 г гидроксида калия (КОН) и 40 мл дистиллированной воды в химическом стакане и затем нагревают при 80oC в течение 3 часов. Образующуюся суспензию промывают водой до тех пор, пока не будет удален любой избыток гидроксида калия. Порошок затем высушивают и подвергают ряду тестов для исследования, которые включают порошковую дифракцию рентгеновских лучей, спектроскопию твердого состояния ВМУ ЯМР (фиг.4), электронное микрозондирование (Таблица 1, колонка 2), обменную способность катиона аммония (Таблица 4), обмен Cu+2 (Таблица 4), и измерения площади поверхности по БЭТ (Таблица 4). Данные этих методов исследования указывают, что материал имеет расположение атомов (т.е. , кристаллографические признаки), указанное выше. В общем, анализ ДРЛ показывает, что в этом типе реакции количество образующихся побочных продуктов является минимальным (иногда пренебрежимо малым) и что ≥ 90% продукта составляет материал М-АСП.
В обоих образцах глины монтмориллонита, указанных выше, присутствуют примесные минералы, такие как кварц, карбонаты и слабо определяемые минералы оксида кремния. Во всех случаях присутствие незначительных количеств примесных минералов существенно не влияет на природу этих реакций и/или образование алюмосиликатных производных.
Пример 3. Получение М-АСП из Ca-монтмориллонита с использованием NaOH
20 г источника глины монтмориллонита из Техаса (Образец N STx-1; van Olphen and Fripiat, 1979, Data handbook for clay materials and other non-metallic minerals, Pergamon Press, Oxford, 342 pp.) тщательно смешивают с 60 г гидроксида натрия (NaOH) и 60 мл дистиллированной воды в химическом стакане и затем нагревают при 80oC в течение 3 часов. Образующуюся суспензию промывают водой до тех пор, пока не будет удален любой избыток гидроксида натрия. Порошок затем высушивают и подвергают ряду тестов для исследования, которые включают порошковую дифракцию рентгеновских лучей (фиг. 1b и 2b), аммонийобменную способность (Таблица 4) и измерения площади поверхности по БЭТ (Таблица 4). Данные этих методов исследования указывают, что материал имеет расположение атомов (т.е. кристаллографические признаки), как определено выше. В общем, анализ ДРЛ показывает, что в этом типе реакций количество образующихся побочных продуктов является несколько большим, чем в Примерах 1 и 2, и что значительная часть побочного продукта является минералом содалит. Как показано ниже в Примере 10, удаление примесных фаз, образующихся по этой реакции или подобным реакциям, можно осуществить промывкой продуктов кислотой.
Пример 4. Получение М-АСП реакцией природного цеолита с NaOH
Образец природного цеолита, который содержит две определенные разновидности минералов, клиноптилолит и гейландит, получали из действующей шахты в Восточной Австралии. Как клиноптилолит, так и гейландит являются алюмосиликатами на основе Ca-Na (например, с химическим составом
(Ca, Na2)[Al2Si7O18] • 6H2O).
В этом случае 5 г природного цеолита (измельченного до фракции размером < 1 мм), 5 г NaOH и 20 мл дистиллированной воды тщательно смешивают в химическом стакане и затем нагревают при 80oC в течение 3 часов. Образующуюся суспензию промывают водой до тех пор, пока не будет удален любой избыток гидроксида натрия. Порошок затем высушивают и подвергают ряду тестов для исследования, которые включают порошковую дифракцию рентгеновских лучей (фиг. 7), аммонийобменную способность (Таблица 4), обмен Cu+2 (Таблица 4) и измерения площади поверхности по БЭТ. Данные этих методов исследования указывают, что материал имеет распределение атомов (т.е. кристаллографические признаки), как определено выше.
Пример 5. Получение М-АСП реакцией каолина с NaOH
10 г каолина, поставляемого Коммершиэл Минирэлс ("Микро-уайт каолин"), 10 г гидроксида натрия (NaOH) и 20 мл дистиллированной воды тщательно смешивают в химическом стакане и затем нагревают при 80oC в течение 3 часов. Образующуюся суспензию промывают водой до тех пор, пока не будет удален любой избыток гидроксида натрия. Порошок затем высушивают и подвергают ряду тестов для исследования, которые включают порошковую дифракцию рентгеновских лучей (фиг. 8b), аммонийобменную способность, обмен Cu+2 (Таблица 4) и измерения площади поверхности по БЭТ (Таблица 4). Данные этих методов исследования указывают, что материал имеет распределение атомов (т.е. кристаллографические признаки), как определено выше. В общем, анализ ДРЛ показывает, что в этом типе реакций количество образующихся побочных продуктов является несколько большим, чем в Примерах 1 и 2, и что значительная часть побочного продукта является минералом содалит. Как показано ниже в Примере 12 (и фиг. 14), удаление примесных фаз, образующихся по этой реакции или подобным реакциям, можно осуществить промывкой продуктов разбавленной кислотой.
Пример 6. Получение М-АСП реакцией каолина с КОН
5 г каолина, поставляемого Коммершиэл Минирэлс ("Микроуайт каолин"), тщательно смешивают с 26.88 г гидроксида калия (КОН) и 20 мл дистиллированной воды в химическом стакане и затем нагревают при 80oC в течение 4 часов. Образующуюся суспензию промывают водой до тех пор, пока не будет удален любой избыток гидроксида калия. Порошок затем высушивают и подвергают ряду тестов для исследования, которые включают порошковую дифракцию рентгеновских лучей (фиг. 8с), аммонийобменную способность (Таблица 4) и измерения площади поверхности по БЭТ (Таблица 4). Фиг. 9 показывает сигнал ЯМР твердого состояния 27Al для полученного таким образом М-АСП. Данные этих методов исследования указывают, что материал имеет распределение атомов (т.е. кристаллографические признаки), как определено выше. В общем, анализ ДРЛ показывает, что в этом типе реакций количество образующихся побочных продуктов является минимальным (иногда пренебрежимо малым) и что ≥ 90% продукта составляет материал М-АСП.
Как отмечено выше, образование М-АСП по реакции с КОН может протекать в интервале температур и/или концентраций гидроксида.
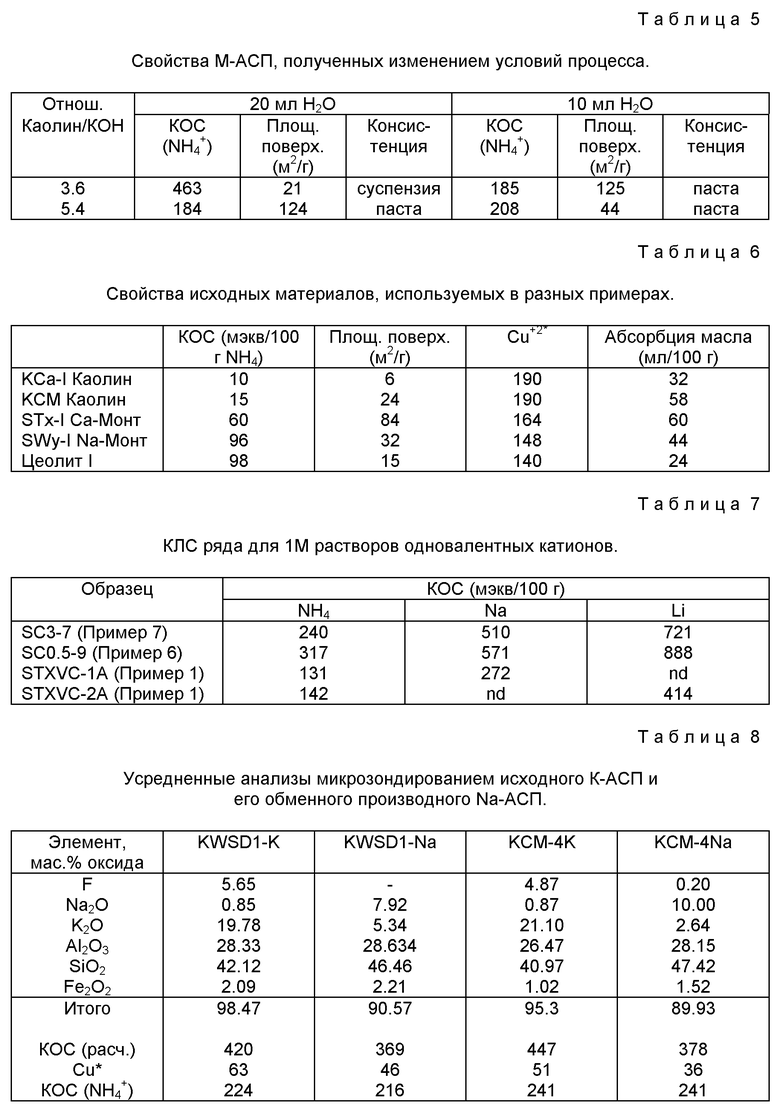
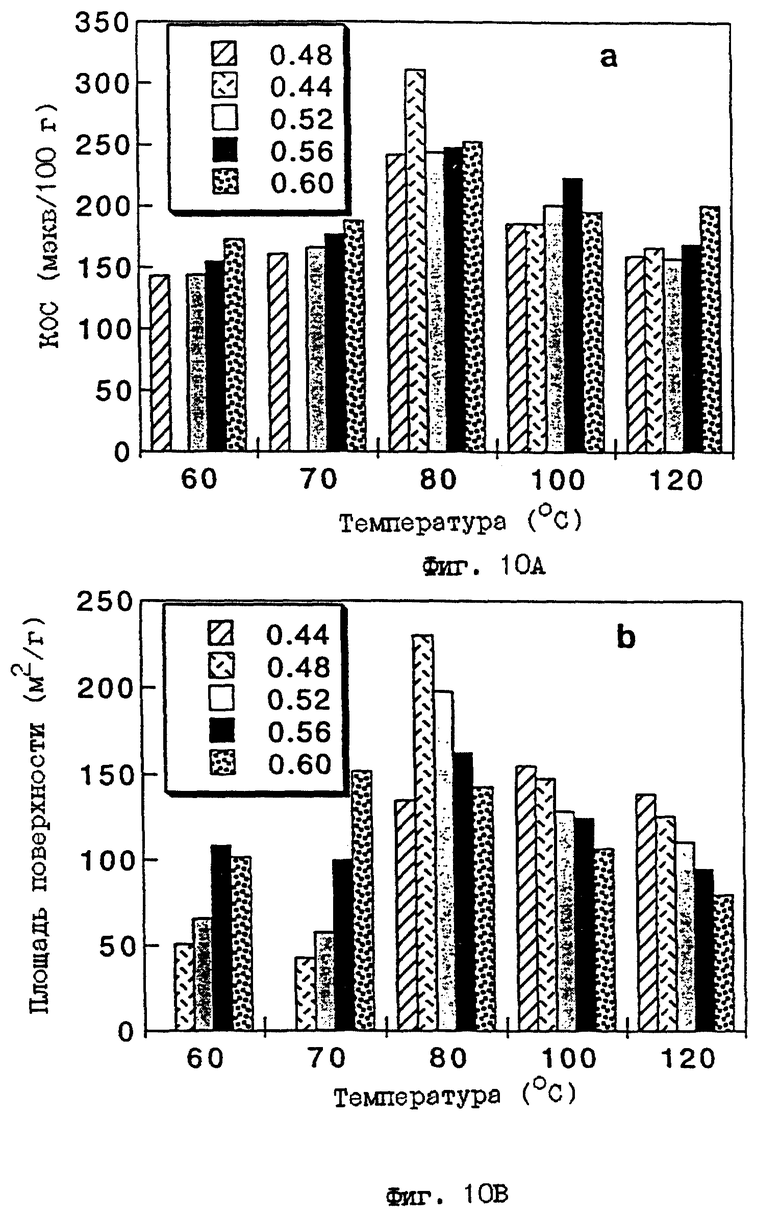
На фиг. 10 показано изменение целевых свойств этих М-АСП для реакций с каолином при различных концентрациях КОН и различных температурах реакции. Фиг. 10B показывает постепенное уменьшение площади поверхности по БЭТ с температурой реакции (для температур выше и ниже предпочтительной температуры 80oC) и с ростом концентрации KOH. Соответственно, фиг. 10A показывает, что относительные величины КОС (для обмена аммония) для различных М-АСП также постепенно уменьшаются с температурой реакции для температур выше и ниже предпочтительной температуры 80oC. Изменение величины КОС при повышенной концентрации КОН заметно меньше при этих условиях реакции. В дополнение, относительные количества воды, используемые в реакционном процессе, можно изменять в зависимости от концентрации (концентраций) гидроксида. Таблица 5 показывает достижение подобных величин КОС и ПП (площади поверхности) для М-АСП при использовании двух различных соотношений каолина к КОН при двух различных "консистенциях" раствора (например, определяемого количеством добавленной воды) при идентичных условиях температуры и времени реакции.
Пример 7. Получение М-АСП реакцией каолина с КОН и KCl
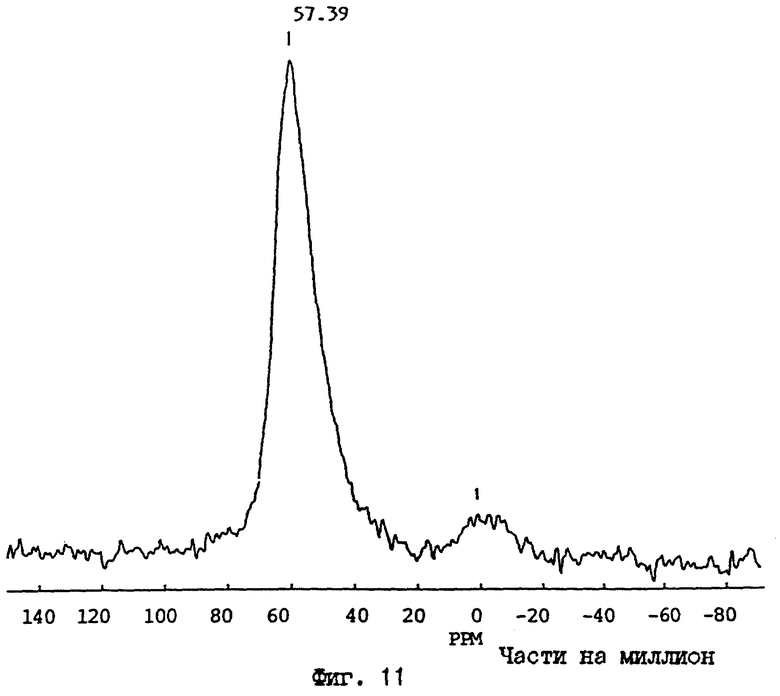
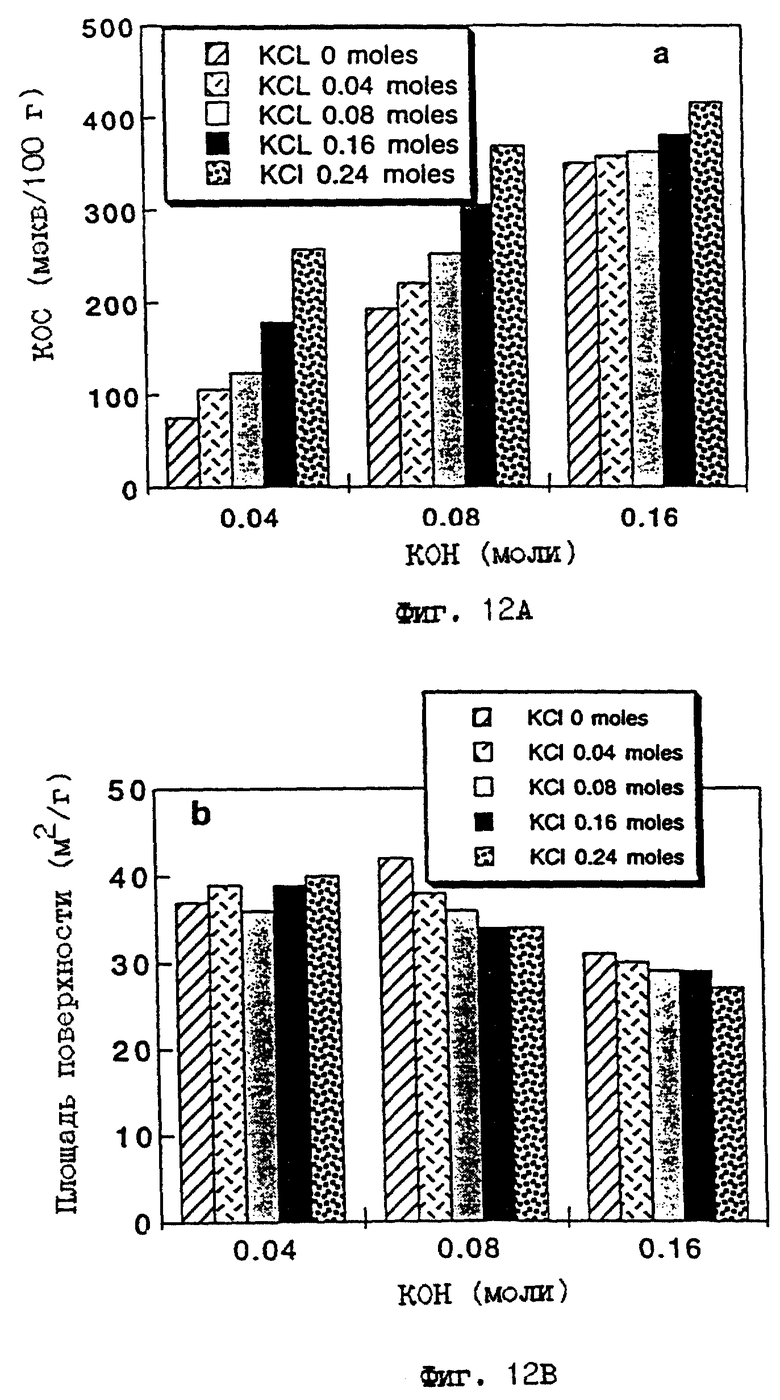
5 г каолина, поставляемого Коммершиэл Минирэлс ("Микроуайт каолин"), тщательно смешивают с 4.48 г КОН, 11.92 г KCl и 20 мл воды в химическом стакане и затем нагревают при 80oC в течение 16 часов. Образующуюся суспензию промывают водой до тех пор, пока не будет удален любой избыток гидроксида калия и хлорида калия. Порошок затем высушивают и подвергают ряду тестов для исследования, которые включают порошковую ДРЛ (фиг. 8D), 27Al ЯМР твердого состояния (фиг. 11), аммонийобменную способность и измерения площади поверхности по БЭТ (Таблица 4). Данные этих измерений указывают, что материал имеет расположение атомов (т.е. кристаллографические признаки), как определено выше. В общем, анализ ДРЛ показывает, что в этом типе реакций количество образующихся побочных продуктов является минимальным и что > 90% продукта составляет материал М-АСП. В этом случае, величины площади поверхности по БЭТ и КОС (NH4 +) для полученного таким образом М-АСП составляют 28 м2/г и 356 мэкв/100 г, соответственно. Указание средств, которыми могут быть достигнуты определенные целевые свойства с этими М-АСП, приведены на фиг. 12, которая показывает как величины КОС, так и площади поверхности по БЭТ для ряда М-АСП, полученных этим общим классом реакций для ограниченного набора концентраций КОН/KCl. На фиг. 12A величины КОС увеличиваются с ростом концентрации KCl при одинаковых условиях реакции (время и температура), а на фиг. 12B имеется незначительное, но измеримое, снижение площади поверхности с ростом концентрации KCl при тех же условиях реакции.
Пример 8. Получение М-АСП реакцией каолина с LiOH
5 г каолина, поставляемого Коммершиэл Минирэлс ("Микроуайт каолин"), тщательно смешивают с 20 г LiOH и 20 мл воды в химическом стакане и затем нагревают при 80oC в течение 16 часов. Образующуюся суспензию промывают водой до тех пор, пока не будет удален избыток гидроксида лития. Порошок затем высушивают и подвергают ряду тестов для исследования, которые включают порошковую ДРЛ (фиг. 8E), аммонийобменную способность и измерения площади поверхности по БЭТ (Таблица 4). Данные этих измерений указывают, что материал имеет распределение атомов (т.е. кристаллографические признаки), как определено выше. В этом случае величины площади поверхности по БЭТ и КОС (NH4 +) для полученного таким образом М-АСП составляют 31 м2/г и 79 мэкв/100 г, соответственно.
Пример 9. Поглощение Cu+2 из водного раствора с применением М-АСП и образование М-АСП
75 мг М-АСП, полученного общим способом, определенным в Примере 2, помещают в 0.1 М раствор NaNO3, содержащий 200 частей на миллион Cu+2 при pH ~ 5.6 и встряхивают в течение ночи приблизительно в течение 16 часов, поддерживая при комнатной температуре (~25oC) в течение этого времени. Образец центрифугируют и аликвоту раствора супернатанта анализируют на оставшиеся Cu+2. В этом опыте, концентрация оставшихся Cu+2 в водном растворе составляет 52.8 мкг/мл (или 52.8 частей на миллион). Этот результат указывает, что в этом определенном случае М-АСП, полученный по способу Примера 2, будет удалять 74% катионов Cu+2 из раствора Cu+2 с концентрацией 200 частей на миллион за период времени приблизительно 16 часов при комнатной температуре. Этот пример представляет один метод, используемый для оценки относительной способности этих новых материалов обменивать катионы Cu+2.
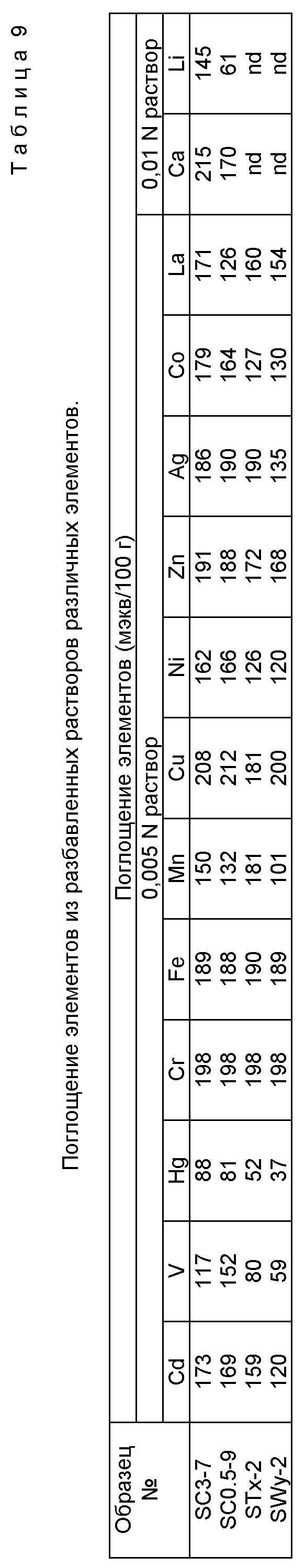
Таблица 4 приводит, для различных категорий условий обработки, используемых в этих реакциях, количество Cu+2, удаляемого из стандартного раствора определенным количеством М-АСП при указанных выше стандартных условиях. Данные по предпочтительным свойствам для ряда исходных глин или цеолитов приведены в Таблице 6. Эта Таблица содержит данные по КОС (NH4 +), площади поверхности, обмену Cu+2 и другим свойствам для сравнения с аналогичными данными для АСП в других Таблицах. Материалы, обеспечивающие величины остаточного Cu+2, которые меньше 100 мкг/мл, справедливо считаются коммерчески конкурентными материалами для обмена двухвалентных катионов. В общем, это составление таблицы по обменной способности Cu+2 рассматривается как руководство по относительной обменной способности для каждого М-АСП для широкого набора катионов, включающего Al+3, Mg+2, Ca+2, Fe+2, Cr+3, Mn+2, Ni+2, Co+2, Ag+, Zn+2, Sr+2, Nd+3, Hg+2, Cd+2, Pb+2 и UO2 +2.
Материал, образованный обменом с Cu+2 и обозначаемый Cu-АСП, сам является новым материалом, имеющим подобные структурные свойства с материалами, обозначаемыми в общем виде М-АСП, за исключением замещения, например, K (и/или Li и/или Na) медью на центрах обмена. Этот материал имеет высокие величины площади поверхности, в некоторых случаях значительно более высокие, чем зарегистрированные для исходного материала М-АСП до обмена с Cu+2. Перечень величин площади поверхности по БЭТ для выбранных медьобменных материалов АСП приведен в таблице 3.
Пример 10. Обмен NH4 + из водного раствора с использованием М-АСП и образование М-АСП. Определение КОС для различных катионов (например, Na+ и Li+).
0.5 г М-АСП, полученного модификацией глиняных минералов методами, указанными выше, помещают в склянку для центрифугирования, и добавляют 30 мл 1 M NH4Cl и позволяют прийти в равновесное состояние в течение ночи. Образец центрифугируют и надосадочную жидкость (супернатант) удаляют. Добавляют 30 мл свежего 1 М NH4Cl и образец встряхивают 2 часа. Процесс центрифугирования, удаления надосадочной жидкости и добавления 30 мл 1 М NH4Cl повторяют трижды. Любой захваченный NH4Cl удаляют промывкой этанолом. На этом этапе оставшийся материал является обмененным АСП, таким как NH4-АСП. Для определения величины КОС для определенного материала М-АСП к промытому образцу добавляют дополнительные 30 мл 1 М NH4Cl и позволяют прийти в равновесное состояние в течение ночи. Надосадочную жидкость затем собирают после центрифугирования, добавляют дополнительно 30 мл 1 М раствора KCl
и встряхивают два часа. Этот процесс центрифугирования, удаления надосадочной жидкости и добавления КС1 повторяют трижды. Наконец, добавляют дистиллированную воду до получения 100 мл раствора и количество присутствующего NH4 + измеряют ионоизбирательным электродом. Эта методика следует методике, приведенной Миллером и др., 1975, Soil Sci. Amer. Proc., 39, 372-373, для определения катионообменной способности и подобные методики применяют для определения КОС других катионов, таких как Na+ и Li+. Все величины КОС, приведенные в таблицах для ряда М-АСП, определяли по этой основной методике. Таблица 7 дает величины КОС для обмена NH4 +, Na+ и Li+ для ряда М-АСП, полученных способами, описанными выше.
Пример 11. Улучшение Cu+2-обменной способности для М-АСП предварительной обработкой
Образцы 2 г М-АСП, полученные общим процессом (глина + реагент) с использованием каолина, помещают в тигли из оксида алюминия и нагревают до различных температур (от 105 до 600oC через интервалы в 50oC) в течение двух часов. Каждый образец охлаждают до комнатной температуры и затем подвергают обмену Cu+2, как описано в Примере 9 выше. Относительный обмен Cu+2 по сравнению с необработанным М-АСП (25oC) приведен на фиг. 13. На этой фигуре количество Cu+2, обмененного из раствора, представлено для ряда различных температур обработок между 50 и 250oC. Как видно из фиг. 13, рост Cu+2-обменной способности имел место для образцов М-АСП, нагретых до температур между 100 и 200oC. В определенных случаях, показанных на фиг. 13, предварительная обработка дает относительный рост обменной способности примерно на 10%.
Пример 12. Удаление примесных побочных продуктов конечной обработкой разбавленной кислотой
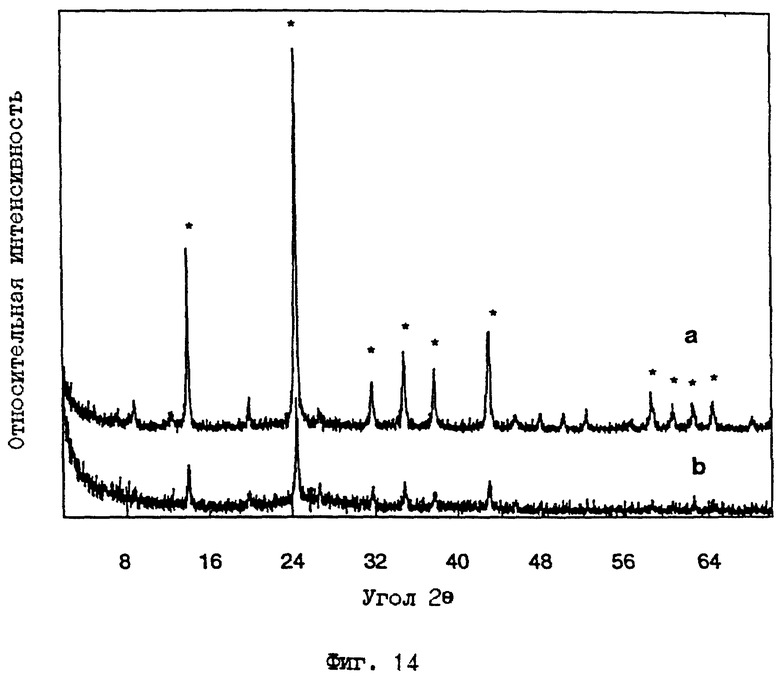
Как отмечено ранее, в тех случаях, когда глина или цеолит взаимодействуют с NaOH или, альтернативно, когда глина взаимодействует с высокой концентрацией КОН, в продукте присутствуют значительные количества (> 5% относительных) примесных фаз. В этом примере образцы, полученные реакцией каолина с щелочным реагентом (Примеры 3 и 5 выше), были последовательно обработаны для удаления примесных фаз, таких как содалит. 5 г продукта реакции смешивают с 50 мл 0.25 М HCl в пробирках для центрифугирования, встряхивают приблизительно в течение двух часов и затем промывают дистиллированной водой. После этой обработки ДРЛ высушенных порошков показывает, что примесные фазы удалены, а, если присутствуют, то составляют < 5% относительно всех фаз продукта. Фиг. 14 показывает рентгенограмму следов М-АСП, полученного по способу Примера 5 выше, до и после обработки кислотой, соответственно. Пики ДРЛ, соответствующие примесным фазам, присутствующим в образце М-АСП, обозначены звездочкой (*) на фиг. 14.
Пример 13. Превращение АПК в Na-АСП реакцией обмена
Для опыта выбраны два образца АПК и производные двух различных каолинов (каолин КСМ4 из Коммершиел Минералс "Микро-уайт", Таблица 4, и каолин KWSD1 от Комалко Минералс из Вейпа) и полученные методом, изложенным в WO 98/00441. В первом случае, образец КСМ4, 2 г материала были приведены в равновесие с 50 мл 1 М раствора NaOH. Во втором случае, образец KWSD1, 10 г материала были приведены в равновесие с 50 мл 1 М раствора NaOH. В каждом случае, надосадочную жидкость отбрасывают и добавляют дополнительные количества свежего 1 М NaOH трижды, чтобы гарантировать полный равновесный обмен при соответствующей концентрации. В заключение образцы промывают деионизированной водой, сушат до состояния порошка и анализируют объемный химический состав (электронное микрозондирование), обмен катиона Cu+2 (по способу Примера 9 выше) и кристаллическую структуру (ДРЛ).
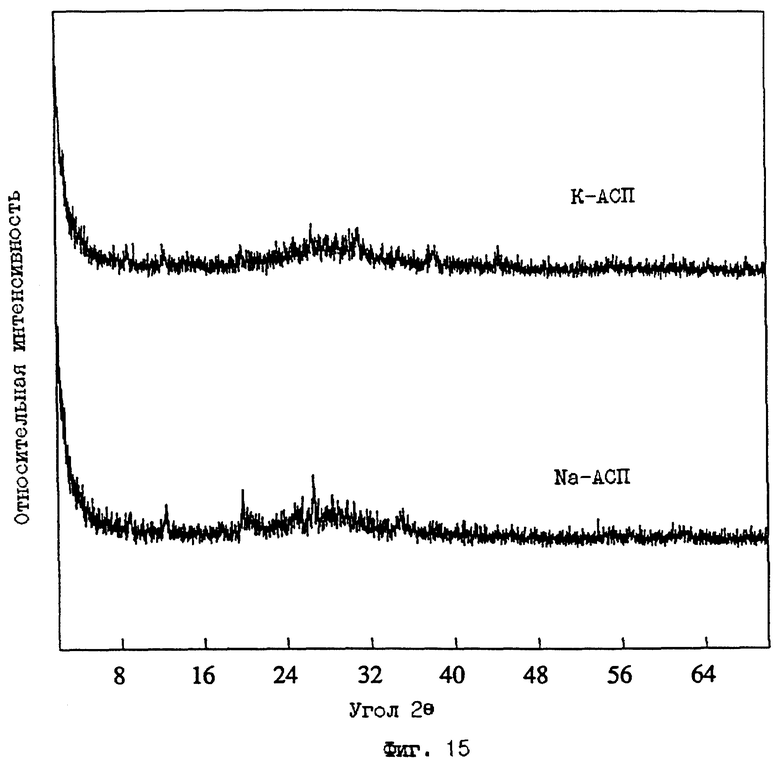
Таблица 8 обобщает данные, собранные как по исходным материалам АПК (КСМ4 и KWSD1), так и по материалам М-АСП, обозначенным как КСМ4-Na и KWSD1-Na, соответственно. Электронное микрозондирование позволяет рассчитать катионообменные способности (КОС), используя содержания K2O и Na2O и допуская, что все доступные ионы щелочных металлов занимают центры, способные к обмену. Сравнение величин, показанных в Таблице 8 для Na-АСП относительно АПК, предполагает, что небольшой процент анализированного калия может присутствовать как примесная фаза. Тем не менее, высокие величины, рассчитанные для КОС, показывают материалы, которые имеют большое значение для промышленного использования в качестве катионообменников. Величины КОС, определенные экспериментально (по методу Примера 10 выше) для этих образцов, также приведены в Таблице 8. В дополнение, количество Cu+2, удаленных из раствора, выше в случае материала Na-АСП приблизительно на 10-12% относительно материала К-АСП. Это улучшение в обмене Cu+2 возможно обусловлено более низким сродством Na к обменному центру алюмосиликатного производного. Порошковая рентгенограмма ДРЛ АПК и Na-АСП (фиг.15) показывает, что ближний порядок структуры существенно сохраняется в алюмосиликатном производном и, возможно случайно, что незначительные количества примесных фаз (например, содержащих F- и/или К+; см. анализ электронным микрозондированием в Таблице 8) также удаляются из материала.
Пример 14. Поглощение катионов металлов из растворов низкой концентрации
30 мл 0.005N раствора данного элемента (типичные примеры даны в Таблице 9) смешивают с 0.075 г М-АСП в пробирке для центрифугирования. Суспензии позволяют прийти в равновесие в течение 16 часов на роторном встряхивателе, затем суспензию центрифугируют и надосадочную жидкость анализируют для определения остаточной концентрации катиона металла. Количество элемента, поглощенного М-АСП, рассчитывают по разнице концентраций данного элемента до и после равновесия. В Таблице 9 это поглощение выражается в миллиэквивалентах на 100 г материала. В Таблице 9 приводятся данные для следующих элементов при 0.005N: Cu, Ni, Zn, Ag, Co, La, Cd, V, Hg, Fe и Mn. Данные для 0.01N Ca и Li также даны в этой Таблице.
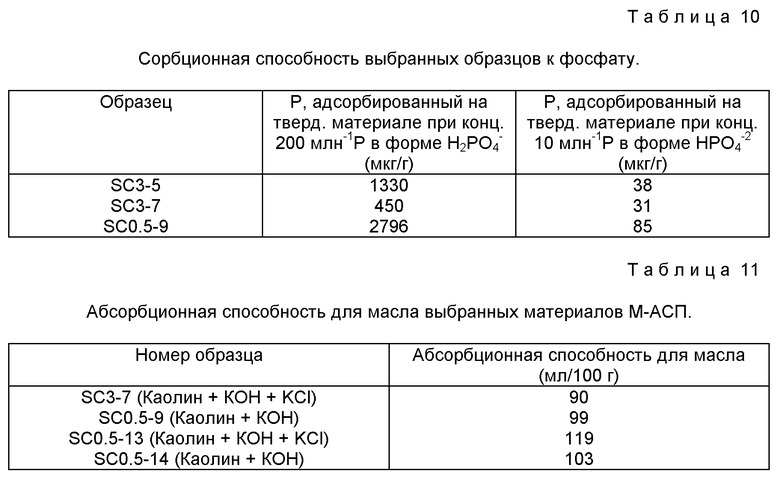
Пример 15. Поглощение фосфат-ионов из раствора
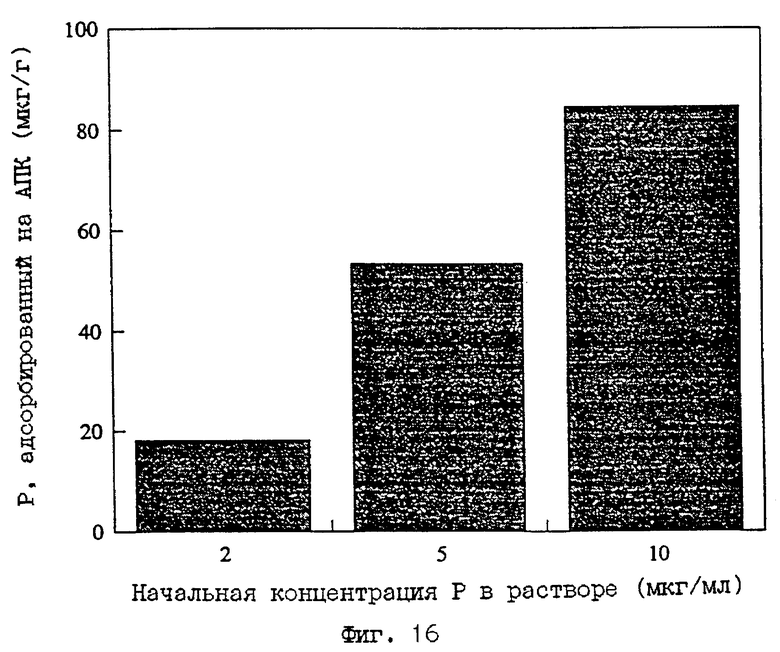
1.5 г М-АСП встряхивали с 30 мл 0.01М раствора CaCl2, содержащего Ca(H2PO4)2 при начальной концентрации P 200 частей на миллион. Образцам позволяли прийти в равновесие в течение 17 часов при встряхивании. После установления равновесия образцы центрифугируют и надосадочную жидкость анализируют на остаток P методом ICP. Количество адсорбированного P рассчитывали вычитанием остаточной концентрации из начальной. Эту методику адсорбции P также использовали для CaHPO4 при концентрации 10 частей на миллион в 0.01М CaCl2. Количество адсорбированного P для выбранных образцов приведено в Таблице 10. Подобные опыты по поглощению P из растворов с более низкой исходной концентрацией P показаны на фиг. 16. Количество P, адсорбированного М-АСП, зависит от исходных начальных концентраций.
Пример 16. Абсорбция масла
4 капли кипящего льняного масла из бюретки наносили на 5 г образца в центре стеклянной пластинки. При добавлении масла, по 4 капли, образец смешивают, используя шпатель. Добавление масла и перемешивание проводили до превращения образца в твердый, похожий на замазку, кусок. После этого момента масло добавляют по каплям. После каждого добавления масла массу перемешивают и отмечают точку, при которой одна капля придавала образцу способность наматываться в спираль вокруг шпателя. Если это было невозможно, то точку, сразу перед которой образец становился мягким при добавлении одной дополнительной капли кипящего льняного масла, считали конечной точкой. Масло, добавленное к образцу до достижения конечной точки, считалось абсорбированным. Эти данные, выраженные как абсорбированное количество на 100 г образца, приведены в Таблице 11.
ПОДПИСИ
ТАБЛИЦА 4.
nd - не определяли
* концентрация Cu в частях на миллион, оставшаяся в растворе от исходного значения 20 частей на миллион. Смотри Пример 9.
ТАБЛИЦА 7.
nd - не определяли
ТАБЛИЦА 8.
* концентрация Cu в частях на миллион, оставшаяся в растворе от исходного значения 20 частей на миллион. Смотри Пример 9.
ТАБЛИЦА 9.
nd - не определяли
ФИГ. 1.
Порошковая рентгенограмма ДРЛ для а) исходного материала - техасского монтмориллонита (STx-I) до реакции, b) продукта, полученного после реакции с NaOH (Пример 3) и с) продукта, полученного после реакции с КОН (Пример 1). Для фиг. 1, детальное увеличение области между 20o и 35o 2θ приведено на фиг. 2.
ФИГ.2.
Увеличения большего масштаба следов порошковой рентгенограммы ДРЛ, показанных на фиг.1, демонстрирующие область между 20o и 35o 2θ. Для фиг. 2с и 2d, соответствующих номерам образцов STx-4 и STx-5 в таблице 4, легко наблюдается присутствие широкого "горба" между 22o и 32o 2θ.
ФИГ. 3.
Спектр 27A1 ВМУ ЯМР продукта, полученного реакцией Ca-монтмориллонита с КОН (Образец N STx-2 в Таблице 4).
ФИГ.4.
Спектр 27A1 ВМУ ЯМР продукта, полученного реакцией Na-монтмориллонита с КОН (Образец N SWy-2 в Таблице 4).
ФИГ.5.
График КОС от площади поверхности для ряда образцов, полученных с использованием различных реакций, приведенных в Таблице 4. График показывает, что продукты с широким набором свойств могут быть получены этими реакциями.
ФИГ.6.
Диаграмма, показывающая продукты, которые могут быть получены при разных температурах и концентрациях КОН.
ФИГ.7.
Следы порошковой рентгенограммы ДРЛ для а) цеолитного исходного материала до реакции и b) продукта, полученного после реакции с NaOH (Образец N Zeo-1 в Таблице 4; Пример 5 в тексте). Пики рентгенограмм, соответствующие примесным фазам, таким как кварц, которые присутствуют в исходном материале, показаны на фиг. 5B. Заметим, что пики цеолита значительно уменьшаются в следах для продукта реакции.
ФИГ. 8.
Следы порошковой рентгенограммы ДРЛ для а) исходного каолина до реакции, b) продукта, полученного после реакции с NaOH (побочные продукты реакции обозначены *), как описано в Примере 5, с) продукта, полученного после реакции с КОН, как описано в Примере 6, d) продукта, полученного после реакции с КОН + KCl, как описано в Примере 7, и е) продукта, полученного после реакций с LiOH, как описано в Примере 8.
ФИГ. 9.
Спектр 27A1 ВМУ ЯМР продукта, полученного реакцией каолинита с КОН.
ФИГ. 10.
Графики КОС (а) и площади поверхности (b) продуктов, полученных при разных температурах и концентрациях КОН. Содержание КОН выражается в молях/20 мл воды.
ФИГ.11.
Спектр 27A1 ВМУ ЯМР продукта, полученного реакцией каолинита с КОН и KCl.
ФИГ.12.
Графики КОС (а) и площади поверхности (b) продуктов, полученных реакцией с КОН и KCl при 80oC. Концентрации КОН и KCl выражаются в молях/20 мл воды для 5 г глины, применяемой в реакциях.
ФИГ.13.
График количества Cu+2, обмененного из раствора, содержащего 200 частей на миллион Cu+2, для образца К-АСП после термической обработки в течение двух часов (Пример 11). Отметим рост обмена в Cu+2 для материала К-АСП, нагретого в интервале между 100 и 200oC.
ФИГ.14.
Следы порошковой рентгенограммы ДРЛ для образца КСМ-8 а) до и b) после обработки разбавленной кислотой (Пример 12). Заметим, что пики ДРЛ примесных фаз, видные на фиг. 14A (обозначенные *), отсутствуют на фиг. 14B.
ФИГ. 15.
Следы порошковой рентгенограммы ДРЛ для а) материала К-АСП, полученного реакцией с KF (Пример 4), и b) материала Na-АСП, полученного обменом в концентрированном растворе NaOH (Пример 13).
ФИГ.16.
Гистограммы, показывающие количество фосфора, адсорбированного при различных начальных концентрациях P в растворе. Количество адсорбированного P увеличивается с ростом концентрации P в растворе.





Способ получения аморфного алюмосиликатного производного включает реакцию твердого соответствующего исходного материала с МОН, где М - катион щелочного металла или аммония. Твердый соответствующий исходный материал может быть выбран из монтмориллонита, каолина, природного цеолита (например, клиноптилолит/гейландита), а также из иллита, палыгорскита и сапонита и дополнительного реагента MX, в котором Х - галогенид, может быть использован вместе с МОН. Изобретение также включает алюмосиликатные производные общей формулы MpAlqSi2Or(OH)sXt•uН2О, а также алюмосиликатные производные общей формулы MpAlqSi2Or(OH)s•uH2O. Изобретение позволяет получить производные с преобладанием тетраэдрически координированного алюминия, что повышает число способных к обмену мест. 3 с. и 10 з.п. ф-лы, 16 ил., 11 табл.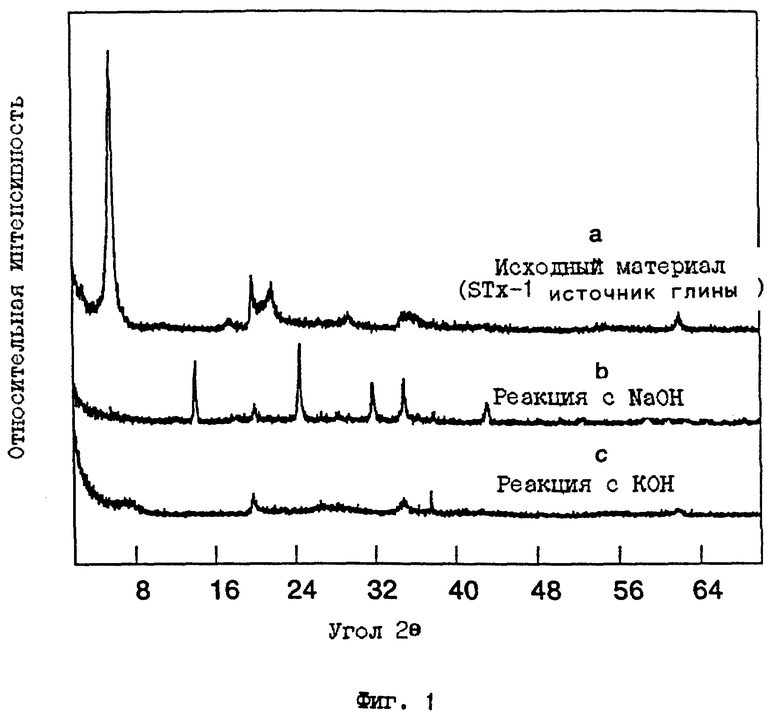
MpAlqSi2Or(OH)sXt•uH2O,
где М - ион аммония или катион щелочного металла;
Х - галогенид;
0,2 ≤ p ≤ 2,0;
0,5 ≤ q ≤ 2,5;
4,0 ≤ r ≤ 12;
0,5 ≤ s ≤ 4,0;
0,0 ≤ u ≤ 6,0;
0,0 ≤ t ≤ 1,0.
MpAlqSi2Or(OH)sXt•uH2O,
где 0,0 ≤ t ≤ 1,0.
MpAlqSi2Or(OH)sXt•uH2O,
где М - ион аммония или катион щелочного металла;
Х - галогенид;
0,2 ≤ p ≤ 2,0;
0,5 ≤ q ≤ 2,5;
4,0 ≤ r ≤ 12;
0,5 ≤ s ≤ 4,0;
0,0 ≤ t ≤ 1,0;
0,0 ≤ u ≤ 6,0.
MpAlqSi2Or(OH)s•uH2O,
где М - ион аммония или катион щелочного металла;
0,2 ≤ p ≤ 2,0;
0,5 ≤ q ≤ 2,5;
4,0 ≤ r ≤ 12;
0,5 ≤ s ≤ 4,0;
0,0 ≤ u ≤ 6,0.
| Способ получения сорбента на основе палыгорскита | 1988 |
|
SU1588437A1 |
| "Способ получения неорганического сорбента "Селекс - КМ" | 1991 |
|
SU1771426A3 |
| US 4902657 A, 20.02.1990 | |||
| US 4954468 A, 04.09.1990 | |||
| US 5141907 A, 28.09.1992 | |||
| 0 |
|
SU153879A1 | |
| US 5308812 A, 03.05.1994. | |||
Авторы
Даты
2000-12-27—Публикация
1995-10-23—Подача