Данное изобретение относится к производным минералов из группы каолинов и, в частности, касается таких производных, которые обладают высокими удельными поверхностями и/или высокой катионнобменной емкостью.
Минералы группы каолина включают каолинит, накрит, диккит и галлойсит, и являются наиболее распространенными в природе глинистыми минералами. Они имеют 1:1 слоистую структуру, то есть каждый слой состоит из одного тетраэдрального силикатного слоя и одного октаэдрального слоя, причем две трети октаэдральных центров содержат алюминий.
Каолинит, накрит и диккит, все имеют идеальный химический состав:
Al2Si2O5•(ОН)4
Они отличаются друг от друга только способом, которым накладываются друг на друга 1:1 слои.
Галлойсит в полностью гидратированной форме имеет идеальный химический состав:
Al2Si2O5(OH)4•2H2O
и отличается от остальных трех членов группы тем, что он содержит между слоями молекулярную воду.
Из минералов группы каолина каолинит является самым распространенным и нашел широкое применение благодаря его структуре, свойствам и промышленному использованию. Однако вследствие его большого сходства с вышеупомянутыми политипами многие свойства и области применения, описанные для каолинита, точно так же относятся к другим политипам. Соответственно, по соображениям целесообразности нижеследующее описание прежде всего будет ограничено каолинитом и галлойситом, но следует иметь в виду, что данное изобретение равным образом относится к накриту и диккиту.
Природные каолины обычно имеют частицы самого различного размера, обладают кристалличностью, содержат небольшое число элементов и характеризуются реакционноспособностью в реакциях интеркалирования. Каолины с размером частиц 0,5-2,0 мм обычно имеют удельную поверхность примерно 5 м2/г и катионную емкость 10 мэкв/100 г или менее. Эти и другие свойства, включая укрывистость и реологию, делают каолины пригодными для широкого использования, включая покрытия и наполнители для бумаги, изготовление керамики, фарфоровой посуды и предметов гигиены и наполнители для красок и каучуков. Эти свойства, однако, не позволяют использовать каолины для других целей, как описано ниже. Однако если их удельную поверхность и/или катионообменную емкость увеличить, их полезность возрастет и тогда их можно будет применять во многих других областях, включая применение в качестве катализаторов, агентов для очистки металлов, носителей и абсорбентов. Ввиду этого существует значительный и постоянно растущий интерес к созданию процесса расслоения или увеличения площади поверхности слоистого каолина, так как это позволило бы сделать доступными для реакции большие площади поверхности между слоями. До сих пор не удавалось достигнуть расслоения, несмотря на значительные исследования интеркалирования каолинита и его политипов. Последние исследования N.Lahav [(1990)] , Clays and Clay Minerals, 38, 219-222)] позволили получить стабильную суспензию расслоившегося каолинита, который был обработан диметилсульфоксидом и фторидом аммония в водном растворе. Результат предполагают на основании изменения размера частиц, при этом не было доказательства независимого существования продукта реакции каолинита.
Поэтому целью данного изобретения является получение производных минералов группы каолина, которые имеют увеличенные удельные поверхности и/или более высокие значения катионообменных емкостей, чем минералы группы каолина per se.
Согласно одному аспекту настоящего изобретения предлагается способ получения аморфного производного каолина, включающий взаимодействие минерала группы каолина с реагентом, который превращает большую часть октаэдрически координированного алюминия в минерале группы каолина в тетраэдрически координированный алюминий.
Предпочтительным реагентом является водный раствор галоидпроизводного щелочного металла, причем мольное отношение галоидпроизводного щелочного металла (MX) к минералу группы каолина (Al2Si2O5(OH)4) может быть от 5 до концентрации насыщения галоидпроизводного щелочного металла. Этот процесс не ограничивается гомогенным однофазным каолином, и каолин, который может содержать примеси, такие как анатаз, ильменит, геотит, кварц или кристобалит, после обработки тем же способом может также привести к получению материала, представляющего собой преимущественно аморфные производные каолина.
Каолины могут значительно отклоняться от идеальной стехиометрии, указанной выше, например, содержать до 2 вес.% окиси железа. Вышеописанный способ образования аморфного производного каолина также применим к каолинам, которые содержат значительные количества катионов, например, Fe2+ или Fe3+, в структуре или на поверхности индивидуальных кристаллов.
Предпочтительное мольное отношение галоидпроизводного щелочного металла к каолину находится в интервале 15-25.
Реакцию обычно проводят при повышенной температуре в течение промежутка времени, достаточного для превращения в аморфное производное каолина. Стандартного давления достаточно для реакции конверсии. Однако превращение соединения с преобладающей октаэдральной координацией алюминия в аморфное производное с преобладающей тетраэдральной координацией алюминия может происходить при подходящем сочетании температуры, давления и времени реакции для соответствующих реагентов. Например, в рамках данного изобретения, выраженного формулой изобретения, находится тот факт, что аморфное производное каолина может образоваться из каолина при взаимодействии с галоидпроизводным щелочного металла при температурах до 300oC в течение промежутка времени, составляющего до 100 ч. Помимо этого, каолин и галоидпроизводное щелочного металла могут реагировать в течение более короткого промежутка времени при повышенном давлении (до 1 кбар).
Предпочтительно, каолин реагирует при тщательном диспергировании в растворе галоидпроизводного щелочного металла и нагревании дисперсии до температуры между 70 и 150oC при атмосферном давлении в течение промежутка времени от 1 мин до 100 ч, пока не будет достигнута полная конверсия. Затем избыток галоидпроизводного щелочного металла удаляют из реакционной смеси промывкой водой, пока в промывной воде не перестанет обнаруживаться галоидпроизводное.
Полученное твердое вещество содержит смесь аморфного производного каолина и относительно нерастворимых галоидпроизводных побочных продуктов.
Галоидсодержащие побочные продукты удаляют промыванием твердого остатка гидроокисью щелочного металла с получением в основном чистого производного.
Условия реакции могут быть такими, что происходит только частичная модификация отдельных слоев каолина без их полного разрушения или растворения. Внутренние поверхности нескольких "слоев" остаются обнаженными после химической модификации, приводящей к значительному увеличению удельной поверхности по сравнению с непрореагировавшим каолином.
Высушенное аморфное производное каолина, полученное по вышеуказанному способу, представляет собой белый порошок, имеющий удельную поверхность в интервале 45-400 м2/г, многократно превышающую соответствующий показатель для исходного материала. Типичным химическим составом этого аморфного производного каолина является состав, полученный при использовании в качестве галоидпроизводного щелочного металла KF, определенный при помощи дисперсионной спектроскопии x-лучей и сканирующей электронной микроскопии как
K1,1Al1,33Si2O5,5(OH)2,0 F0,1•1,9H2O.
Состав аморфного производного каолина зависит от состава исходных материалов, от степени завершения реакции (т.е. сколько исходного каолина остается) и от степени удаления побочных продуктов реакции при промывке водой и гидроокисью щелочного металла.
Если мы предположим, что примеси в минералах, упомянутые выше, отсутствуют, и что продукт реакции был тщательно промыт, тогда состав аморфного производного каолина будет обычно соответствовать следующему:
MpAlqSi2Or(OH)sXt•u• H2O
где M - катион подвергающегося обмену щелочного металла, x - галоид,
0,5 ≤ p ≤ 2,0, 1,0 ≤ q ≤ 2,2, 4,5 ≤ r ≤ 8,0,
1,0 ≤ s ≤ 3,0, 0,0 ≤ t ≤ 1,0, 0,0 ≤ u ≤ 3,0
Подвергающийся обмену катион определяет катионнообменную емкость вышеуказанного состава, которая находится в пределах от 50 - 450 мэкв на 100 г и измерена путем обмена катионов аммония или металла из водного раствора. Более предпочтительна катионообменная емкость, равная примерно 300 мэкв/100 г.
Структуру и морфологию вышеуказанного аморфного производного каолина изучают методом ЯМР (ядерного магнитного резонанса), методом ДХЛ (дифракции x-лучей), методом сканирующей электронной микроскопии (СЭМ) и методом трансмиссионной электронной микроскопии (ТЭМ).
ЯМР для твердого состояния способен давать информацию о локальном химическом окружении магнитных ядер.
В частности, 27Al ЯМР чувствителен к координационному окружению, то есть дает информацию о том, является ли атом 4,5 или 6-координированным, в то время как для алюминосиликатов 29Si ЯМР также может дать информацию о числе и размещении соседних тетраэдрических центров, например, он может дать разрешение Si(nAl) n = 0-4.
27Al ЯМР спектр, полученный при вращении под магическим углом (MAS), для аморфного производного каолина, обычно характеризуется наличием доминантного пика, расположенного на ≈ 55 ppm (FWHM ≈ 16 ppm), (см. фигуру 1б), который интерпретируется как тетраэдрально координированный AL. В противоположность этому 27Al MAS ЯМР спектр каолинита показывает единственный резонанс при ≈ 0 ppm (FWHM ≈ 20 ppm), что соответствует октаэдрально координированному Al.
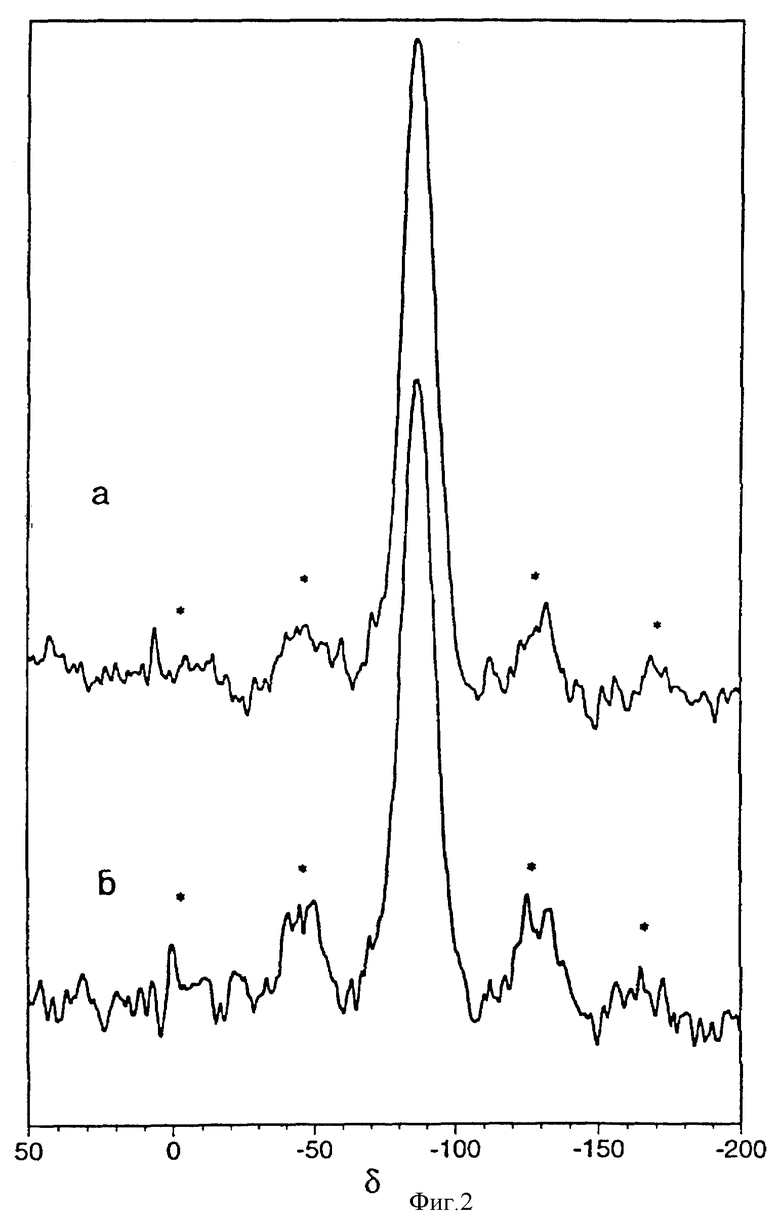
29Al MAS ЯМР спектр аморфного производного каолина вышеуказанного химического состава может содержать широкий (FWHM ≈ 13 ppm) сигнал, расположенный на -86 ppm (см. фигуру 2б). Это сравнимо с очень узким сигналом, наблюдавшимся для каолинита, расположенным на - 91,5 ppm (FWHM ≈ 1,4 ppm). Кроме расширения этого пика, которое, как ожидается, является результатом разрушения слоистой структуры, среднее химическое окружение является примерно таким же, как и в случае каолинита в качестве исходного материала.
Аморфное производное каолина обычно является аморфным по данным метода ДХЛ, то есть не обнаруживается никакого заметного структурного порядка. ДХЛ для аморфного производного каолина показывает широкий горб между 14 и 40oC 2θ для СuКα излучения. Не наблюдается никаких острых диффракционных пиков, за исключением тех, которые относятся к фазам примесей, таких как анатаз и кварц, источником происхождения которых может быть исходный каолин. Если аморфное производное каолина неполностью промыто водой, и затем водным раствором гидроокиси щелочного металла, трудно полностью избежать небольших количеств побочных продуктов реакции. Если галоидпроизводным щелочного металла является RbX или CsX, широкий диффракционный пик возникает в центре широкого горба, обусловленного аморфным производным каолина на диффракционной картине ДХЛ.
Сканирующая электронная микроскопия с высокой степенью увеличения и трансмиссионная электронная микроскопия свидетельствуют, что аморфное производное каолина может состоять из агрегатов очень маленьких частиц с примерным размером <50 нм. Следует отметить значительное изменение в морфологии от больших гексагональных пластинок каолинита размером порядка 1 мкм до анэдральных частиц размером порядка (≈ 40 нм), которые агрегируют с образованием больших комков (≈ 1 мкм).
Как указано выше, одна форма аморфного производного каолина имеет химический состав:
МpAlqSi2Or(OH)xxt• u• H2O
где М обозначает подвергающийся обмену катион щелочного металла, x означает галоид,
0,5 ≤ p ≤ 2,0, 1,0 ≤ q ≤ 2,2, 4,5 ≤ r ≤ 8,0,
1,0 ≤ s ≤ 3,0, 0,0 ≤ t ≤ 1,0, 0,0 ≤ u ≤ 3,0
В одной специфической форме аморфное производное каолина может содержать калий, тогда М=К. Ниже термин "КАД" используется для обозначения аморфного производного каолина, имеющего вышеуказанный химический состав.
В КАД можно осуществлять обмен, по меньшей мере частично, катиона щелочного металла и любого катиона, который является стабильным в водном растворе.
Такие подвергающиеся обмену катионы включают катионы других щелочных металлов, щелочноземельных металлов, переходных металлов, катионы лантанидов и актинидов, катионы тяжелых металлов и аммония. Хотя обмен не протекает полностью для всех катионов, существует много катионов переходных металлов (например, Mn+2, Cr3+, Co2+, Ni2+, Cu2+, Zn2+, Ag+), катионы лантанидов (например La3+, Nol3+-) и катионы тяжелых металлов (например, Pb2+, Cd2+, Hg2+), для которых он протекает полностью.
Для некоторых катионов обмен завершается через 3 ч при комнатной температуре (например, Pb2+, Cu2+), в то время как для других требуется большее время и более высокие температуры - до 110oC (например, для Zn2+).
Такой катионный обмен позволяет сохранить аморфный характер производного каолина, не подвергнутого обмену, о чем свидетельствует ДХЛ. Однако удельная поверхность материалов, подвергнутых обмену, хотя и превышает многократно соответствующий показатель для каолина, увеличивается или уменьшается в зависимости от катионного обмена. Примеры этого приведены ниже в таблице 1.
Таблица 1.
Сравнение величин удельных поверхностей для некоторых КАД, подвергнутых обмену металлов.
Образец - Площадь поверхности по БЭТ, м2г-1
Ni-КАД - 49
Ag-КАД - 129
K-КАД - 150
Co-КАД - 200
Cu-КАД - 230
Zn-КАД - 283
Скорость, с которой происходит этот катионный обмен, может быть изменена применением химических методик, используемых специалистами. Например, как показано на фигуре 3, скорость обмена Pb2+ и K+ увеличивается при температуре 50oC по сравнению с обменом при комнатной температуре. Кроме того, эта реакция обмена может быть обращена на подходящую обработку КАД, подвергнутого обмену (например, Cu-КАД). Пример такой обработки КАД, подвергнутого обмену на Cu, представляет собой применение раствора аммиака для получения растворимого комплекса амина.
В процессе этого обмена NH4 + замещает катионы Cu2+. Это свойство особенно пригодно при выделении переходных металлов или других катионов, которые были удалены из раствора или из суспензии при помощи КАД.
Значительно увеличенная удельная поверхность позволяет КАД стать заменителем обычных катализаторов, таких как используемые при перегруппировке и конверсии углеводородов, а также применять его в новых областях.
Другой областью применения является наполнение лантанидов и/или переходных металлов КАД в реакциях, катализируемых окислительно-восстановительными системами. Примером этого является дегидрирование метанола с образованием метилформиата.
Многие другие области применения являются очевидными для специалистов.
Ниже следуют конкретные примеры синтеза КАД из природных каолинов, а также описание реакций катионного обмена и катализа.
Пример 1. Получение КАД из каолинита.
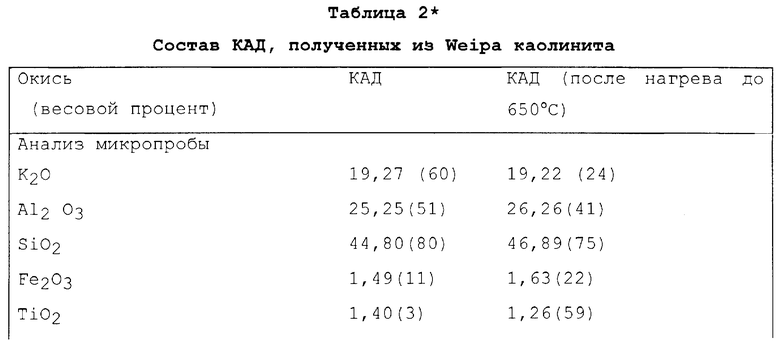
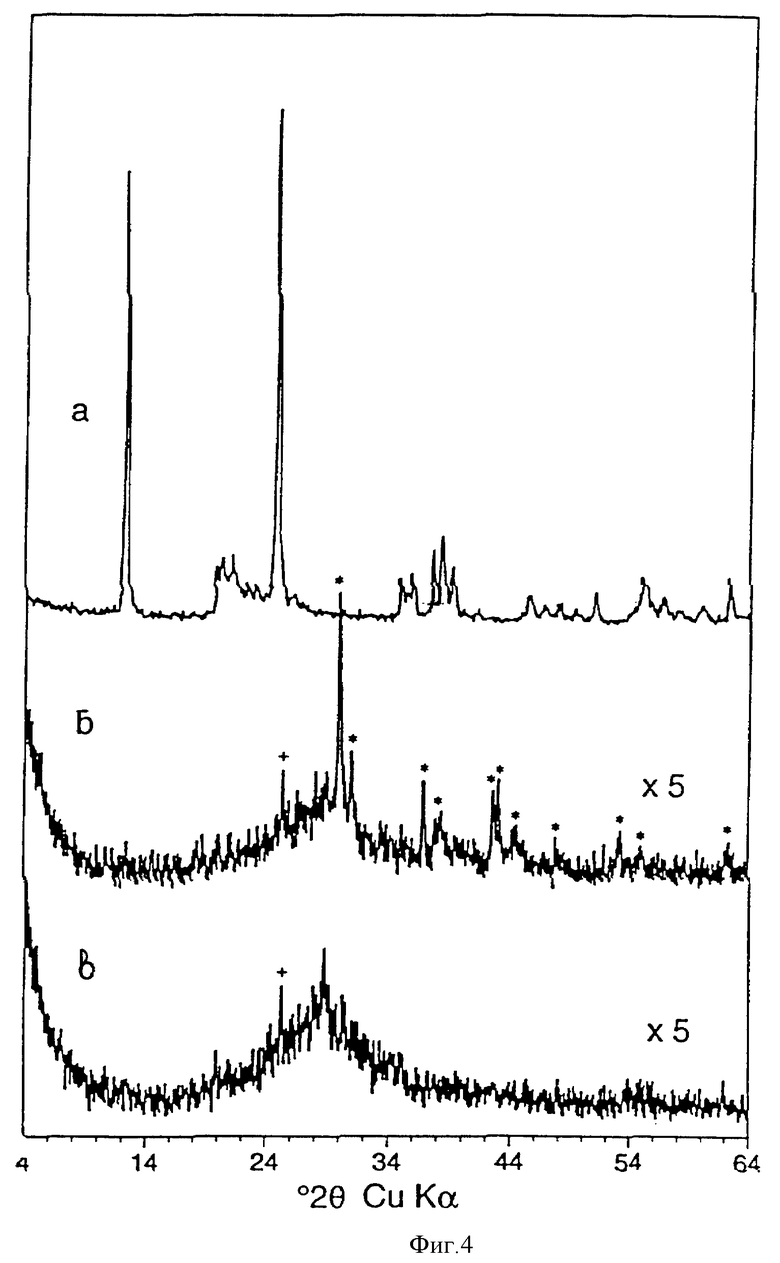
1,0 г каолинита, полученного из Weipa, Queensland Australia, и 4,5 г фторида калия тщательно смешивают с 2,0 мл воды. Смесь нагревают в печи при 100oC в течение 2,5 ч. Продукты реакции затем диспергируют в 100 мл дистиллированной воды и центрифугируют до тех пор, пока не произойдет полного осаждения твердой фракции. Элюат, содержащий избыток соли и небольшое количество слаборастворимого побочного фторсодержащего продукта, декантируют. Этот процесс промывки повторяют до тех пор, пока в элюате не перестанет обнаруживаться фторид при добавлении раствора нитрата серебра, обычно осуществляют 3-4 промывки. Остающийся твердый остаток сушат при 110oC на воздухе, он представляет собой смесь КАД и сравнительно нерастворимых фторсодержащих побочных продуктов, как свидетельствует ДХЛ (см. фигуру 4б). Общий вес смеси составляет 1,19 г.
Фторсодержащие побочные продукты удаляют диспергированием твердой смеси в 40 мл 0,02 М раствора гидроокиси калия (pH = 13) в течение 30 мин при комнатной температуре. Суспензию затем центрифугируют до тех пор, пока не произойдет полного осаждения твердой фракции. Щелочной элюат, содержащий растворенные фторсодержащие побочные продукты, декантируют. Остающийся осадок затем промывают холодной водой, пока pH элюата не снизится до 8. Твердый остаток высушивают при 110oC с получением выхода 0,95 г, он представляет собой КАД вместе с незначительной примесью анатаза, как свидетельствует ДХЛ (см. фигуру 4в).
Фигура 4а показывает ДХЛ для каолинита перед реакцией с образованием КАД.
Площадь поверхности по БЭТ, измеренная для этого КАД после предварительной обработки при 110oC в течение 4 ч, составляет 100(1)м2г-1.
Анализы состава были получены для образца в виде изготовленного соответствующим образом прессованного диска из порошка КАД, полученного из каолинита, а также из того же самого порошка КАД после нагревания до 650oC, с использованием электронной микропробы, данные анализа приведены в таблице 2 (см. в конце описания). В этой таблице цифры в скобках представляют собой рассчитанные стандартные отклонения от последней значительной цифры, обозначающей весовой процент окисей, рассчитанный в соответствии с обычными статистическими методами.
Пример 2. Получение КАД из галлойсита.
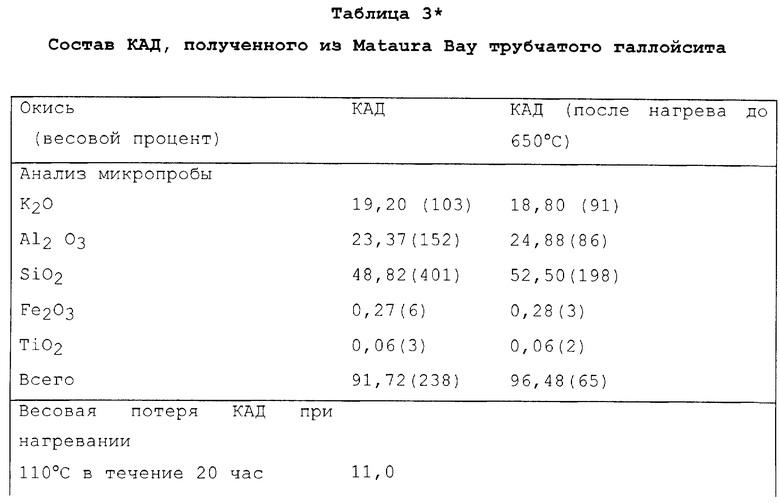
10 г галлойсита, полученного из Mataura Bay, Northland, New Zealand, и 42,0 г фторида калия тщательно смешивают с 20,0 мл воды. Смесь нагревают в печи при 95oC в течение 1 ч.
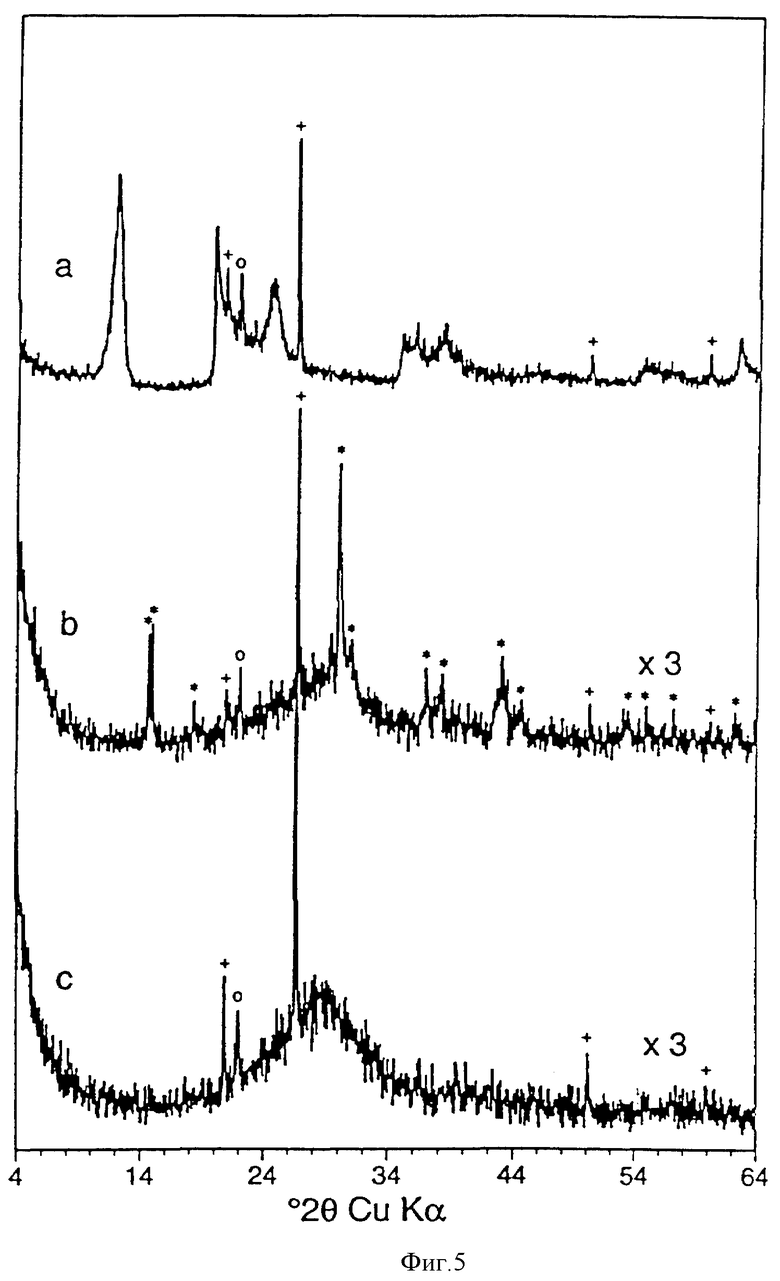
Затем продукты реакции диспергируют в 1 л дистиллированной воды и дают твердым частицам осаждаться в течение 2 ч. Элюат, содержащий избыток соли и небольшое количество плохо растворяющихся фторсодержащих побочных продуктов, декантируют. Этот процесс промывки повторяют до тех пор, пока в элюате не перестанет обнаруживаться фторид при добавлении раствора нитрата серебра, обычно пять раз. По окончании промывки суспензию центрифугируют до тех пор, пока не осадится полностью твердая фракция. Полученный твердый остаток высушивают при 110oC на воздухе, он представляет собой смесь КАД и относительно нерастворимых фторсодержащих побочных продуктов общим весом 13,9 г, что показывают данные ДХЛ (см. фигуру 5б).
Фторсодержащие побочные продукты удаляют диспергированием твердой смеси в 400 мл 0,02 М раствора гидроокиси калия (pH=13) в течение 30 мин при комнатной температуре. Затем суспензию центрифугируют, пока не осадится полностью твердая фракция. Щелочной элюат, содержащий растворенные фторсодержащие побочные продукты, декантируют. Оставшийся твердый остаток промывают холодной водой, пока pH элюата не снизится до 8. Твердый остаток сушат при 110oC с получением выхода, равного 9,7 г, он включает КАД вместе с незначительными примесями минералов кварца и кристобалита, что показывает ДХЛ (см. фигуру 5в). На фигуре 5а видно, что ДХЛ свидетельствует о следах галлойсита перед превращением в аморфное производное.
Измерение площади поверхности по БЭТ для этого КАД после предварительной обработки при 110oC в течение 4 ч показывает, что она равна 167 (1) м2/г.
Анализы состава проводят для полученного соответствующим образом отпрессованного диска из порошка КАД, приготовленного из галлойсита, а также для диска из того же самого КАД порошка после нагревания до 650oC, с использованием электронной микропробы, данные приведены в таблице 3 (см. в конце описания). В этой таблице цифры в скобках обозначают рассчитанные стандартные отклонения от последней значимой величины процентного содержания окислов в соответствии с обычными статистическими методами.
В водной суспензии КАД, в котором катион металла является катионом щелочного металла или аммония, имеет особенное сродство к некоторым другим катионам.
Катионы включают катионы щелочноземельных металлов Mg2+, Ca2+ и Sr2+, переходных металлов Cr3+, Mn2+, Co2+, Fe2+, Ni2+, Cu2+, Zn2+, Ag+, Cd2+ и Hg2+, а также Pb2+, лантанида Nd3+ и актинида UO2 2+. Благодаря сходному химическому поведению трехвалентных лантанидов полагают, что свойства, характерные для Nd3+, относятся ко всем трехвалентным лантанидам, включая Y3+.
Сродство КАД к этим катионам было показано путем измерения поглощения каждого из этих катионов в процентах из раствора, содержащего низкую концентрацию (10-100 ppm) анализируемого катиона, и сравнительно высокую концентрацию Na+ (0,1 М). Детали этих экспериментов вместе с результатами приведены в примере 10.
Селективность КАД по отношению к этим катионам практически не зависит от температуры, но скорость обмена значительно увеличивается при повышении температуры. Это увеличение скорости обмена показано в нижеследующем примере.
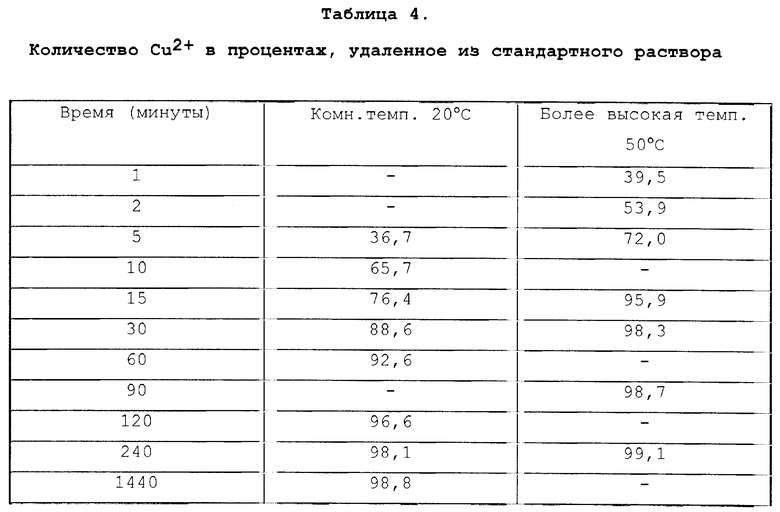
Пример 3. Кинетика Cu2+ обмена.
0,25 г КАД диспергируют в 100 мл 0,1 М раствора NaNo3 содержащего 100 ppm Cu2+. КАД подвергают перемешиванию в течение всего опыта и отбирают аликвотные количества раствора как функцию от времени. Аликвот сразу же центрифугируют для удаления суспендированного КАД, а в растворе определяют оставшийся Cu2+. Процентное содержание удаленного катиона Cu2+ в зависимости от времени при комнатной температуре (20oC) и при 50oC приведено в таблице 4 (см. в конце описания).
Пример 4. Кинетика Pb2+ обмена.
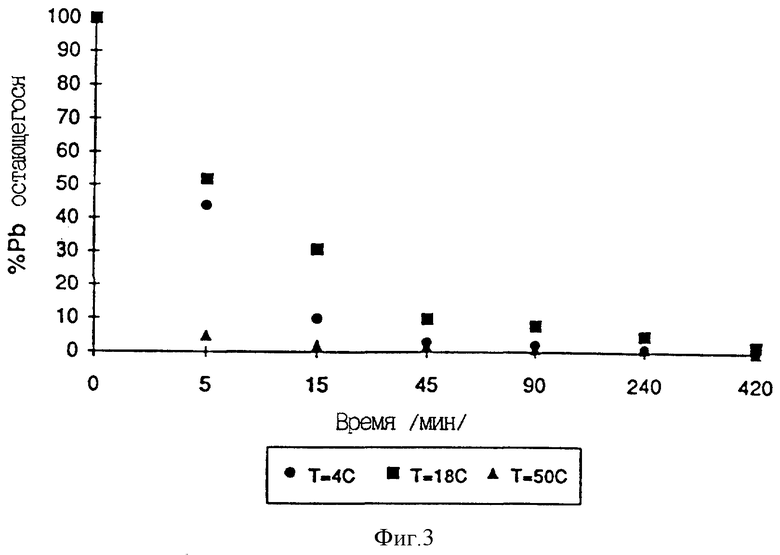
0,25 г КАД тщательно диспергируют в 100 мл 0,1М раствора NaNO3 который содержит 100 ppm Pb2+. Суспензию перемешивают в течение 3 ч при комнатной температуре и затем центрифугируют. Метод атомной абсорбционной спектроскопии (AAS) элюата показывает, что раствор, обработанный КАД, содержит только 1 ppm Pb2+, т.е. происходит 99%-ное уменьшение концентрации Pb2+ в обогащенном Na+ растворе. График, иллюстрирующий эту реакцию обмена при трех различных температурах раствора, приведен на фигуре 3.
Степень селективности КАД по отношению к этим различным катионам практически сохраняется в широком интервале pH. Особое значение имеет стабильность и сохранение селективности КАД при низком pH, так как при этих кислых условиях большинство катионов, упомянутых выше, обладает максимальной растворимостью. Это свойство особенно имеет значение в случае применения КАД для удаления и извлечения этих катионов из промышленных и рудных сточных вод.
В то время как КАД также стабилен в щелочных условиях (до pH 13), растворимость большинства вышеупомянутых катионов незначительна и, следовательно, селективность КАД нельзя определить.
Пример 5. Зависимость Pb2+ обмена от pH.
По 0,25 г КАД, в котором М является калием, диспергируют в 100 мл 0,1М раствора NaNO3 и в 100 мл 0,1 М раствора Ca(NO3)2, каждый из которых содержит 100 ppm Pb2+.
pH этих растворов устанавливают, используя разбавленную HNO3 или разбавленный NaOH, соответственно. Растворы перемешивают при комнатной температуре (20oC) в течение 24 ч, затем КАД удаляют на центрифуге и растворы анализируют на содержание остаточного Pb2+.
Этот анализ позволяет определить количество Pb2+, удаленного из раствора при конкретном значении pH. Условия этих экспериментов приведены ниже в таблице 5 (см. в конце описания).
Пример 6. Применение КАД в качестве мягчителя для воды или детергента при извлечении Ca2+ и Mg2+, более предпочтительном, чем извлечение Na+ в водном растворе.
80 мг порошка КАД диспергируют и перемешивают в 25 мл четырех различных растворов в течение 2 ч, после чего удаляют КАД из надосадочной жидкости. Надосадочную жидкость анализируют, определяя концентрации Mg2+ и Ca2+. Четыре различных водных раствора содержат: (i) 10 ppm Ca2+ и Mg2+ в дистиллированной воде при 18oC (контрольный образец), (ii) 10 ppm Ca2+ и Mg2+ в 0,1 М растворе NaCl при 18oC, (iii) 10 ppm Ca2+ и Mg2+ в 0,1 М растворе NaCl при 50oC и (iv) 100 ppm Ca2+ и Mg2+ в 0,1 М растворе NaCl при 18oC. Данные этих опытов приведены в таблице 6 (см. в конце описания).
Как указано в таблице 6, КАД обладает способностью извлекать Ca2+ и Mg2+ из раствора, что делает его пригодным в качестве детергента и мягчителя воды.
В некоторых областях, где должен использоваться КАД в качестве агента для селективного удаления катионов из водного раствора, может быть необходимым использовать КАД в форме, не являющейся дисперсным порошком.
КАД сразу же после его получения имеет очень мелкие частицы или агрегаты и легко диспергируется. В некоторых областях это свойство может затруднить использование обменных свойств, так как физическое отделение КАД, подвергшегося обмену, из обработанного водного раствора может быть затруднительным или дорогим.
Для областей, требующих механически стабильного монолитного тела различных форм, можно соединить КАД с органическим полимером или коллоидальной окисью кремния для того, чтобы произошло связывание самого КАД и тем самым значительно увеличился общий размер агрегатов, и уменьшились затруднения с физическим отделением КАД после обмена от обработанного раствора. Связанный материал затем можно отформовать в большие гранулы или другие агрегаты или же нанести его на субстрат, например, древесное волокно с получением селективной к катионам фильтровальной бумаги. Примеры способа получения гранул с использованием органического полимера или коллоидальной окиси кремния приведены ниже.
Пример 7. Способ связывания КАД с испольаованием поликарбоната.
0,012 г поликарбоната растворяют в 20 мл толуола 2,5 мл этого раствора добавляют к 0,2 г КАД, что эквивалентно добавлению 0,075 вес.% полимера. Полученная суспензия тщательно гомогенизируется с помощью ступки и пестика, затем ее сушат при 40oC в течение 30 мин. Из этого материала получают гранулы, используя пресс и применяя аксиальное давление около 500 кг/см2.
Пример 8. Способ связывания КАД с использованием коллоидальной окиси кремния.
0,0304 г Ludox AM (du Font) растворяют в 0,6 мл воды. 0,3 мл этой смеси добавляют к 0,25 г КАД, что эквивалентно добавлению 2 вес.% коллоидальной окиси кремния.
Затем добавляют еще 0,9 мл воды и гомогенизируют суспензию в ступке с пестиком, затем сушат при 85oC в течение 18 мин. Из этого материала при помощи пресса изготавливают таблетки под одноосным давлением около 500 кг/см2. Таблетки затем нагревают при 85oC в течение 1,25 ч.
КАД, который был связан с помощью органического полимера или коллоидальной двуокиси кремния, и из которого были получены монолитные таблетки или диски, сохраняет катионообменные свойства по отношению к вышеуказанным катионам. Это свойство КАД видно из нижеследующего примера.
Пример 9. Селективность КАД в виде таблеток по отношению к Cu2+.
Следующие опыты проводят таблетками КАД, изготовленными с применением поликарбонатной смолы и коллоидальной двуокиси кремния в качестве связывающих агентов.
2 x 0,015 г таблеток КАД помещают в 5 мл 0,1 М раствора NaNO3 содержащего 100 ppm Cu2+. Растворы перемешивают при комнатной температуре (20oC). Через 24 ч одну таблетку удаляют и 2,5 мл раствора отбирают для анализа на остающийся Cu2+. Оставшийся раствор перемешивают при комнатной температуре еще 2 дня, после чего удаляют вторую таблетку и оставшийся раствор снова анализируют. Результаты определения количества Cu2+, удаленного из раствора с применением таблеток КАД, приведены в таблице 7 (см. в конце описания).
Пример 10. Сравнение селективности КАД по отношению к различным катионам.
Проводят ряд опытов с применением образцов КАД, полученных как в примере 1 (из каолинита) и в примере 2 (из галлойсита). В каждом случае опыты по ионному обмену с другими катионами проводят в 0,1 М растворе NaNO3 в течение 16 час при комнатной температуре. Обычно в 30 мл растворе диспергируют 90 мг КАД.
Результаты этих опытов, в которых измеряют процентное измеряют процентное количество удаляемого катиона, приведены в таблице 8 (см. в конце описания). Если не указано иное, pH раствора был близок к нейтральному. Концентрации катионов до и после обмена определяют методом атомной абсорбционной спектроскопии, за исключением случаев, когда для Nd3+ и UO2 2+ используют УФ/видимую спектроскопию.
Пример 11. Синтез КАД при повышенном давлении и повышенной температуре.
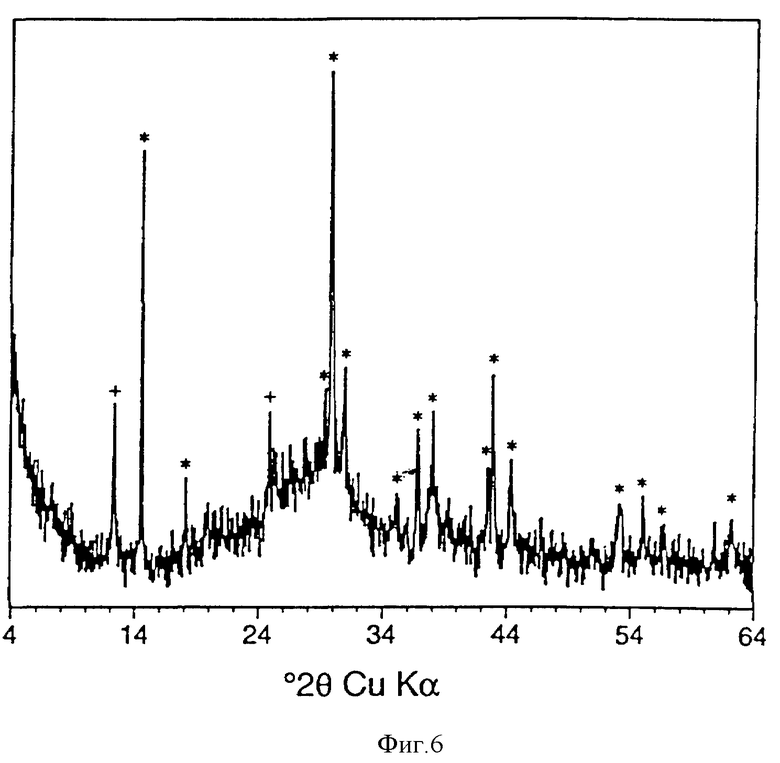
1,0 г каолинита из Weipa, Queensland, Australia, 4,0 г фторида калия тщательно перемешивают с 3 мл воды. Смесь помещают в герметизированный сосуд из тефлона, находящийся под давлением, и помещают в печь при 150oC. Через 5 мин температура в реакторе достигает 80oC и еще через 20 мин она становится равной 150oC. Сосуд выдерживают при этой температуре 5 мин, затем удаляют из печи и охлаждают до температуры ниже 80oC. Затем реакционные продукты диспергируют в 100 мл дистиллированной воды и подвергают центрифугированию, пока полностью не осадится твердая фракция. Элюат, содержащий избыток соли и небольшое количество слаборастворимых фторсодержащих побочных продуктов, декантируют. Этот процесс промывки продолжают, пока в элюате не перестанет обнаруживаться фтор при добавлении раствора нитрата серебра, обычно требуется 3-4 промывки. Твердый остаток высушивают при 110oC на воздухе, он состоит из смеси КАД, исходного каолинита и сравнительно нерастворимых фторсодержащих побочных продуктов, общим весом 1,25 г. На фигуре 6 показана ДХЛ картина для твердых продуктов реакции.
Пример 12. Синтез КАД с использованием NaF в качестве реагента.
0,25 г каолинита из Weipa, Queensland, Australia, и 1,25 г фторида натрия тщательно перемешивают с 5 мл воды, смесь помещают в герметизированный автоклав из тефлона и помещают в печь при 200oC на 20 ч. Затем продукты реакции диспергируют в 100 мл теплой (36-40oC) дистиллированной воды и подвергают центрифугированию до полного осаждения твердой фракции. Элюат, содержащий избыток соли и небольшое количество слаборастворимых фторсодержащих побочных продуктов, декантируют. Процесс промывки повторяют 6-8 раз, пока в элюате не перестанет обнаруживаться фтор.
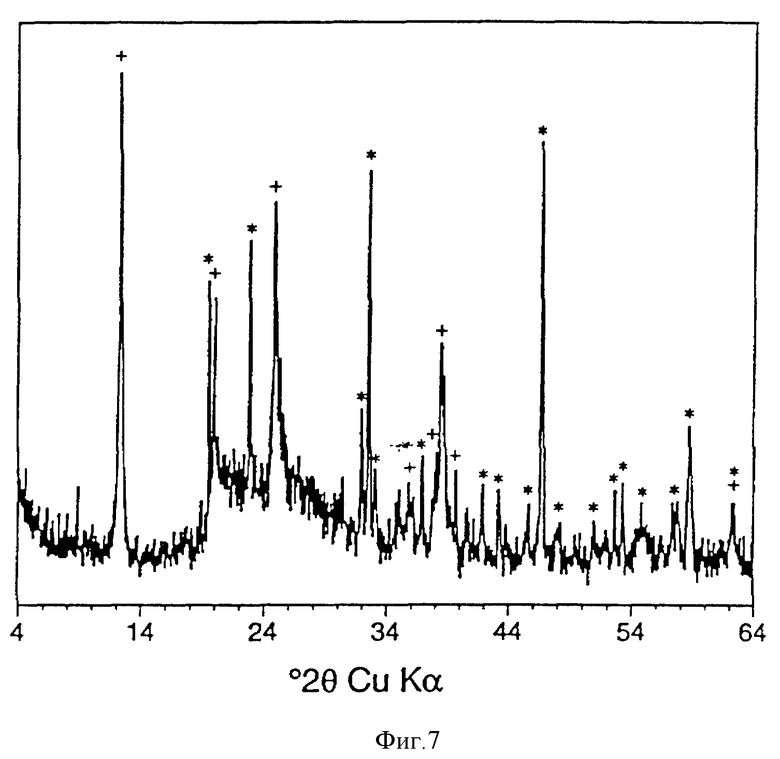
Твердый остаток сушат при 110oC на воздухе, он состоит из смеси Na-КАД, исходного каолинита и нерастворимых фторсодержащих побочных продуктов общим весом 0,39 г. На фигуре 7 показана ДХЛ картина твердых продуктов реакции.
Пример 13. Синтез КАД с применением RbF или CsF в качестве реагента.
0,5 г каолинита из Weipa, Queensland, Australia, и 5,0 г фторида рубидия или 7,0 г фторида цезия тщательно смешивают с 1 мл воды. Смесь нагревают в печи при 110oC в течение 3,5 ч. Продукты реакции затем диспергируют в 40 мл дистиллированной воды и подвергают центрифугированию до полного осаждения твердой фракции. Элюат, содержащий избыток соли и небольшое количество фторсодержащих побочных продуктов, декантируют. Этот процесс промывки повторяют 3-4 раза, пока в элюате не перестанет обнаруживаться фторид.
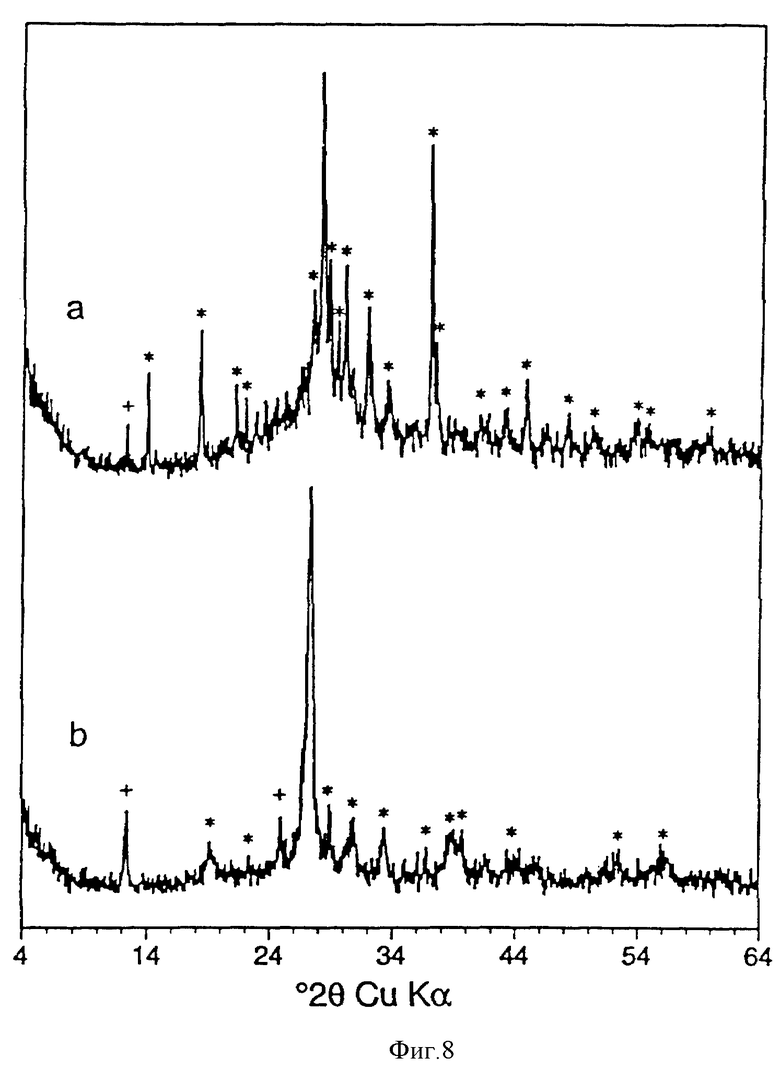
Твердый остаток сушат при 110oC на воздухе, он состоит из смеси КАД, где М является Pb или Cs, исходного каолинита, сравнительно нерастворимых фторсодержащих побочных продуктов общим весом 0,86 г в случае, когда М = Rb, и 0,85 г в случае, когда М = Cs. На фигуре 8 показана ДХЛ картина обоих продуктов реакции с использованием обеих солей. В случае КАД, полученного с применением RbF, наблюдается один размытый пик около центра широкого "горба", соответствующего d-расположению 3,16 (фигура 8а). В случае КАД, полученного с применением CsF, наблюдается похожая диффракционная картина, за исключением того, что широкий "горб" выражен слабее, и пик слегка сдвинут, соответствуя d-расположению 3,25 (фигура 8б).
КАД, которые подвергнуты обмену с переходными металлами или лантанидами с меньшей валентностью (например, Cu2 - Cu1 - Cu0, Ni2 - Ni0, Co2 - Co0), восстанавливают нагреванием в потоке газообразного водорода при 400-500oC. Хотя наблюдается некоторая степень выделения металла, наблюдаемая на ДХЛ картине, большая часть восстановленного металла остается связанной с КАД. Удельная поверхность КАД уменьшается только слегка при восстановлении при этих условиях. Эта последующая обработка КАД создает идеальное окружение для окислительно-восстановительных реакций, катализируемых металлами, с участием различных органических соединений. Конкретные примеры этого применения приведены ниже.
Пример 14. Дегидрирование метанола с получением метилформиата в присутствии Cu-КАД в качестве катализатора.
Cu-КАД активируют путем восстановления в течение ночи в атмосфере Н2 при 400oC. Над этим катализатором при 200-220oC в потоке азота пропускают пары метанола. Продукты реакции и непрореагировавший метанол улавливают при помощи ловушки с жидким азотом и сразу же анализируют с использованием 1H ЯМР спектроскопии. Мольное отношение фаз на основе ЯМР спектра - метанол: метилформиат: диметиловый эфир - составляет 74:19:7.
Пример 15. Дегидрирование этанола с получением ацетальдегида в присутствии Cu-КАД в качестве катализатора.
Cu-КАД активируют путем восстановления его в течение ночи в атмосфере H2 при 400oC. Пропускают пары этанола над катализатором при 300oC в потоке азота. Продукты реакции и непрореагировавший этанол улавливают, используя ловушку с жидким азотом, и сразу же анализируют методом 1H ЯМР спектроскопии. Мольное отношение фаз по данным ЯМР составляет этанол: ацетальдегид 56:44.
Хотя вышеописанное приведено для иллюстрации изобретения, специалисты могут осуществить различные модификации и изменения, не выходя за рамки данного изобретения.
Подписи к чертежам.
Фигура 1. 27Al ЯМР спектр, полученный при вращении под магическим углом, для КАД, полученного из Weipa каолинита в соответствии с примером 1, (а) после промывки водой и (б) после промывки КОН. Боковые полосы обозначены *.
Фигура 2. 29Si ЯМР спектр, полученный при вращении под магическим углом, для КАД, полученного из Weipa каолинита в соответствии с примером 1, (а) после промывки водой и (б) после промывки КОН. Боковые полосы обозначены *.
Фигура 3. График, показывающий скорость обмена Pb2+ с использованием КАД по примеру 4 для трех различных температур раствора. График показывает количество в процентах Pb2+, остающегося в растворе, в зависимости от времени.
Фигура 4. Диффракционные картины x-лучей для порошков (а) Weipa каолинита (б) КАД, полученного из Weipa каолинита по примеру 1, после промывки водой и (в) КАД после промывки КОН. Диффракционные пики, обусловленные наличием анатаза, который является примесью в исходном материале, указаны знаком +, а наличием слаборастворимых фторсодержащих побочных продуктов - знаком *.
Фигура 5. Диффракционные картины x-лучей для (а) галлойсита из Mataura Bay (б) КАД, полученного из галлойсита из Mataura Bay согласно примеру 2, после промывки водой и (в) КАД после промывки КОН. Диффракционные пики, обусловленные наличием анатаза, являющегося примесью в исходном материале, указаны знаком +, а наличием слаборастворимых побочных фторсодержащих продуктов - знаком *.
Фигура 6. Диффракционная картина x-лучей (CuK) для КАД, полученного из Weipa каолинита при повышенном давлении и 150oC с применением KF в качестве реагента по примеру 11, после промывки водой, но до промывки КОН. Диффракционные пики, обусловленные наличием непрореагировавшего каолинита, указаны знаком +, и наличием слаборастворимых фторсодержащих продуктов - знаком *.
Фигура 7. Диффракционная картина x-лучей (CuK) для КАД, полученного из Weipa каолинита с использованием NaF в качестве реагента по примеру 12, после промывки водой, но до промывки КОН. Диффракционные пики, обусловленные наличием непрореагировавшего каолинита, обозначены знаком +, наличием слаборастворимых фторсодержащих побочных продуктов - знаком *.
Фигура 8. Диффракционные картины x-лучей (CuK) для КАД, которые были получены из Weipa каолинита с использованием (a) RbF и (б) CsF в качестве реагентов по примеру 13, после промывки водой, но до промывки КОН. Диффракционные пики, обусловленные наличием непрореагировавшего каолинита, обозначены знаком +, наличием слаборастворимых фторсодержащих побочных продуктов - знаком *.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ АЛЮМОСИЛИКАТНЫХ ПРОИЗВОДНЫХ | 1995 |
|
RU2161065C2 |
| ПРОИЗВОДНЫЕ АЛЮМОСИЛИКАТОВ | 1995 |
|
RU2146651C1 |
| СПОСОБ МОДИФИЦИРОВАНИЯ ГЛИНЫ | 2009 |
|
RU2404921C1 |
| СПОСОБ ПОЛУЧЕНИЯ СОРБЕНТА ДЛЯ ОЧИСТКИ ВОДНЫХ РАСТВОРОВ ОТ ИОНОВ ТЯЖЕЛЫХ МЕТАЛЛОВ И СОРБЕНТ | 2014 |
|
RU2563011C1 |
| НЕЛЕКАРСТВЕННАЯ КОРМОВАЯ ДОБАВКА, ПРЕМИКС, КОРМ, СОДЕРЖАЩИЕ НЕЛЕКАРСТВЕННУЮ КОРМОВУЮ ДОБАВКУ, И СПОСОБ ПОВЫШЕНИЯ РОСТА ЖИВОТНЫХ | 2006 |
|
RU2417624C2 |
| СПОСОБ ПОЛУЧЕНИЯ РАСТВОРА ФЕРРОЦИАНИДА ЛИТИЯ | 2012 |
|
RU2512310C2 |
| БЕЗОБЖИГОВЫЕ МОНОЛИТЫ | 2018 |
|
RU2772194C2 |
| СПОСОБ ПОЛУЧЕНИЯ ЭПСИЛОН-КАПРОЛАКТАМА | 2002 |
|
RU2240312C1 |
| КОМПЛЕКСНОЕ СОЕДИНЕНИЕ ГИДРОКСАМОВОЙ КИСЛОТЫ И ГИДРОКСИДА МЕТАЛЛА, ЕГО ПРИГОТОВЛЕНИЕ И ПРИМЕНЕНИЕ | 2018 |
|
RU2782753C2 |
| СПОСОБ ПОЛУЧЕНИЯ БИОЦИДА | 2009 |
|
RU2429857C2 |




Изобретение относится к катионообменникам на основе минералов. Аморфные производные минералов группы каолина, характеризующиеся высокими значениями удельной поверхности и катионообменной емкости и 27Al ЯМР спектром, полученным при вращении под магическим углом, имеющим доминантный пик при примерно 55 ppm по отношению к Al(H2O)6 3+. Такие производные получают взаимодействием минерала группы каолина с реагентом, таким, как галоидпроизводное щелочного металла или аммония, которое приводит к превращению большей части октаэдрально координированного алюминия в минерале группы каолина в тетраэдрально координированный алюминий. Полученные производные проявляют высокую селективность при катионном обмене по отношению к металлам: Pb2+, Cu2+, Cd2+, Ni2+, Co2+, Cr3+, Sr2+, Zn2+, Nd3+ и UO2 2+. 2 с. и 14 з.п. ф-лы, 8 ил., 8 табл.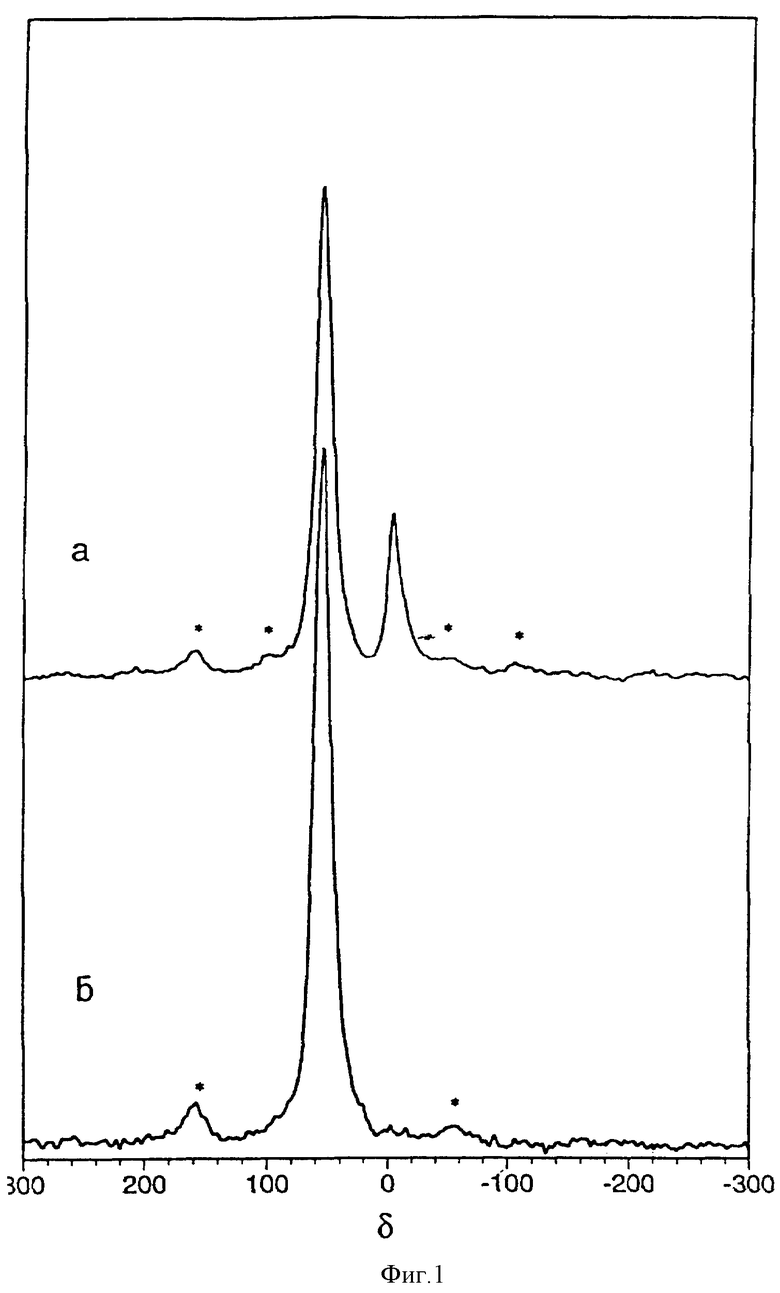
(а) сигнал рентгеновской дифракции аморфного производного каолина проявляется при использовании дифракции рентгеновских лучей на порошке в виде широкого максимума с углом 2θ 14 - 40o для излучения CuKα,-
(b) первоначально тетраэдального координированный А1 имеет полученный при вращении под магическим углом (MAS) спектр ядерного магнитного резонанса (ЯМР)27 Al MAS ЯМР, обладающий ярко выраженным пиком, расположенным ориентировочно на 55 ppm относительно Al(H2O)6 3+ -
(с) указанный материал имеет площадь поверхности 45 - 400 м2/г, измеренную по изотерме БЭТ,
(d) указанный материал имеет катионообменную емкость 50 - 450 мэкв на 100 г, измеренную при обмене катионов аммония или металла из водного раствора, - и
(е) указанный материал характеризуется спектром 29Si MAS ЯМР, имеющий широкий сигнал (FWHM около 13ppm), расположенный около 86 ppm.
щелочноземельных металлов - Mg2+, Ca2+, Sr2+ и Ba2+;
переходных металлов - Cr3+, Mn2+, Co2+, Ni2+, Cu2+, Zn2+, Ag+, Cd2+
и тяжелых металлов Hg2+, Pb2+;
лантанидов La3+ и Nd3+ или актинида UO2 2+
4. Материал по п.3, отличающийся тем, что обменные катионы Na+, K+, Li+, Rb+ или Cs+, по меньшей мере, частично замещены на Pb2+, Cu2+, Cd2+, Co2+, Cr3+, Sr2+, Zn2+, Nd3+ или UO2 2+
5. Материал по п.4, отличающийся тем, что катион Cu2+ по меньшей мере замещен частично на NH4 +.
| J.G | |||
| Thompson "Structural characterisation of kaolinite", Clay and Clay minerals, v.40, N 4, p.369-380, 1992 | |||
| Способ получения модифицированного каолина | 1973 |
|
SU623825A1 |
| Способ обработки каолина | 1986 |
|
SU1390185A1 |
| Способ получения сорбента для очистки сточных вод | 1991 |
|
SU1803178A1 |
| Способ получения сорбента из каолинсодержащего сырья | 1991 |
|
SU1803177A1 |
| Способ получения алюминий-каолинита | 1990 |
|
SU1724661A1 |
| US 4916092 A 10.04.90 | |||
| Вдовенко Н.А | |||
| Украинский химический журнал, т.50, N 10, c | |||
| ФИГУРНЫЕ КЛЮЧЕВИНЫ ДЛЯ ЗАМКОВ | 1924 |
|
SU1037A1 |
| Манк В.В | |||
| Украинский химический журнал, т.49, N 7, с | |||
| Способ восстановления электрических ламп накаливания с разрушенными нитями | 1921 |
|
SU693A1 |
Авторы
Даты
1999-09-10—Публикация
1994-06-16—Подача