Изобретение относится к новой композиции, содержащей кислотно-нестойкий бензимидазол, и к ее получению. Эта новая композиция наиболее подходит для орального употребления. Это изобретение также относится к способу получения этой композиции.
В литературе описаны многие вещества, имеющие фармацевтическую ценность, которые неустойчивы в кислой среде. В качестве примера могут быть приведены вещества, описанные в следующих патентах: ЕР 244380, US-P-4045563, EP 0005129, BE 898880, GB 2141429, EP 0146370, GB 2082580, EP A 0173664, EP A 0080602, EP 0127763, EP 0134400, EP 130729, EP 0150586, DE 3415971, GB 2082580, SE A 8504048-3 и US 182766. С другой стороны, омепразол, принадлежащий к семейству бензимидазолов, относится к противоязвенным веществам, используемым обычно для уменьшения секреции гастроинтестинальной кислоты, хорошо известен и особенно подробно обсуждался в шведской пат. заявке 78.04231 от 14 апреля 1978, а также во многих других патентах. Пантопразол и лансопразол, которые оба относятся к противоязвенным веществам из семейства омепразола, обсуждались особенно подробно в пат. US-P 4758579 и US-P 4628098 соответственно.
Химические вещества, которые легко разрушаются в кислой среде (что обозначено здесь термином "кислотно-нестойкий" и подразумевает химические вещества, которые неустойчивы в кислой среде), такие как бензимидазолы, и, в частности, омепразол, лансопразол и пантопразол, создают особенные проблемы для разработчиков рецептуры в тех случаях, когда необходимо создать фармацевтическую форму, предназначенную для орального употребления. Продукт неизбежно вступает в контакт с содержимым желудка, которое представляет собой сильнокислую среду, что ведет к разрушению этих химических веществ.
Для того чтобы предотвратить контакт между веществами и кислым желудочным соком, следующим за оральным употреблением вещества, обычно используют такую фармацевтическую форму, как капсула или таблетка, которая содержит сердцевину (таблетку, микрогранулу, гранулу и тому подобное), содержащую кислотно-нестойкое активное вещество, и внешний слой, который окружает эту сердцевину и состоит из композиции, устойчивой и растворимой в среде кишечника. В общем случае, покрывающий агент представляет собой соединение, которое нерастворимо в кислой среде, но растворимо в нейтральной или щелочной среде.
Для веществ, которые очень неустойчивы в кислой среде, но более стабильны в нейтральной или щелочной среде, таких как омепразол, пантопразол и лансопразол, необходимо добавлять в композицию инертное вещество, дающее щелочную реакцию, необходимую для повышения стабильности активного вещества в процессе производства и во время хранения фармацевтической формы.
В некоторых предшествующих документах описаны композиции, которые подходят для орального применения кислотно-нестойких веществ.
В пат. EP 0244380 описаны фармацевтические рецептуры, которые подходят для орального применения кислотно-нестойких веществ. Установлено, что эти кислотно-нестойкие вещества, предназначаемые для орального применения, должны быть защищены покрытием, растворимым в среде кишечника, но обычные покрытия кислотной природы, растворимые в среде кишечника, не подходят для этой цели. Если действительно покрыть кислотно-нестойкие вещества такими покрытиями, вещество будет быстро разрушено вследствие прямого или непрямого контакта с покрытием, что выразится в изменении его цвета и уменьшении содержания активного вещества с течением времени. Решение, предлагаемое в патенте, соответствует рецептурам, включающим: (а) сердцевину в форме мелких частиц, то есть гранул или спрессованного порошка, содержащих активное соединение вместе с соединением с щелочной реакцией, (б) один или несколько промежуточных слоев, содержащих инертный наполнитель для таблеток, которые растворимы и легко разрушаются в воде, водорастворимые пленкообразующие полимерные соединения, которые необязательно могут содержать щелочные соединения, действующие как pH-буфер между сердцевиной, имеющей щелочную реакцию, и внешним слоем, и (в) внешний слой, состоящий из композиции, растворимой в среде кишечника. Также установлено, что для того, чтобы улучшить стабильность при хранении, сердцевины, содержащие активное вещество, должны также содержать компоненты, имеющие щелочную реакцию, и что вода, которая проникает в результате диффузии, или желудочный сок, будут растворять часть сердцевины, близкую к покрытию, растворимому в среде кишечника, образуя щелочной раствор на этом уровне внутри покрытой формы, предназначенной для применения. В патенте сформулированы фармацевтические рецептуры, содержащие кислотно-нестойкие активные вещества с формулой 1 с заметным исключением омепразола.
В пат. EP-A 0247983, который относится к фармацевтическим рецептурам, подходящим для орального применения кислотно-нестойких веществ, использованы основные принципы, разработанные в пат. EP-A 0244380 для развития особенностей их приме нения в случае омепразола. Данный патент направлен на защиту омепразола со вспомогательным веществом с щелочной реакцией.
В пат. США 4786505 описаны новые стабильные препараты, содержащие омепразол, предназначенный для орального применения, способы их получения и способ лечения гастроинтестинальных болезней с использованием этих новых препаратов. Эти оральные фармацевтические препараты содержат: (а) сердцевину, содержащую омепразол и соединения с щелочной реакцией, щелочную соль омепразола и соединение с щелочной реакцией или одну щелочную соль омепразола; (б) по крайней мере, один инертный промежуточный слой, водорастворимый или быстро разрушающийся в воде; и (в) внешний слой, содержащий покрытие, растворимое в среде кишечника.
В пат. EP-A 0519365 описаны фармацевтические рецептуры, которые подходят для орального применения пантопразола, содержащие кислотно-нестойкое вещество. Для того, чтобы улучшить стабильность пантопразольных рецептур, в этом документе предложено использовать активные вещества в форме соли. Описанные фармацевтические рецептуры включают (а) сердцевину, содержащую активный препарат в форме соли, (б) по крайней мере, один водорастворимый промежуточный слой и (в) внешний слой, соответствующий покрытию, растворимому в среде кишечника. Установлено, что использование формы соли в сердцевине позволяет создать щелочное окружение, которое защищает активное вещество. Если соль не оказывает достаточного воздействия на pH, необходимо добавить в сердцевину компонент, который имеет щелочную реакцию.
В пат. EP-A 0519144 описан новый процесс получения стабильного препарата, содержащего омепразол, предназначенного для орального применения. В этом документе особое внимание уделено описанию процесса получения гранул, содержащих омепразол, в котором сердцевину, состоящую из инертных веществ, покрывают активным веществом в тонкоизмельченном виде и диспергируют в водном дисперсном буфере с pH 7.0, после чего наносят покрытие, растворимое в среде кишечника, причем конечный продукт помещают в капсулу.
В пат. США 5232706 описаны новые стабильные фармацевтические препараты, содержащие омепразол, предназначенные для орального применения. Описанные фармацевтические комбинации включают: (а) сердцевину, содержащую омепразол, и щелочную соль омепразола, смешанную с одним соединением с щелочной реакцией; (б) по крайней мере, один промежуточный слой, образованный инертным наполнителем и другим соединением с щелочной реакцией и (в) внешний слой, образованный покрытием, растворимым в среде кишечника. Установлено, что проблема слабой стабильности омепразола разрешима, во-первых, при увеличении продолжительности поведения сердцевины как основания либо при введении омепразола в форме соли щелочного или щелочноземельного металла или смеси омепразола с основным соединением или при комбинировании этих двух возможностей; и, во-вторых, "при введении промежуточного слоя между сердцевиной и покрытием, растворимым в среде кишечника, для предотвращения разрушения щелочной сердцевины покрытием, растворимым в среде кишечника".
В пат. FR-A 2692146 описаны стабильные композиции микрогранул гастро-защищенного омепразола, а также их получение. В этом документе, в частности, описана стабильная рецептура микрогранул омепразола, содержащая нейтральную сердцевину, состоящую из сахара и крахмала, покрытую активным слоем, состоящим из омепразола, растворенного в манните в равных количествах, и промежуточный слой, содержащий маннит; внешний слой, образованный покрытием, растворимым в среде кишечника, присутствует при необходимости. Отмечено, что омепразол используют в форме разбавленного порошка в количестве равном количеству маннита с целью защитить омепразол от контакта с растворителями и со следами воды, присутствующими в связывающих растворах, используемых для нанесения смеси омепразола и маннита на нейтральные зерна, состоящие из сахара и крахмала. Кроме того, согласно этому патенту, дополнительная защита омепразола, наносимого на нейтральные зерна, достигается за счет второго защитного слоя, состоящего из маннита и связывающего раствора и необходимого для того, чтобы окончательно изолировать сердцевину, на которую нанесены омепразол и маннит. Эта дополнительная защита изолирует омепразол от внешнего покрывающего слоя, который предназначен для усиления защиты активной сердцевины от влияния среды желудка.
В заявке WO 96/01624 (заявитель - ASTRA) описана таблетированная лекарственная форма, состоящая из индивидуальных покрытых растворимой в кишечнике оболочкой слоистых сердцевинных частиц, содержащих бензимидазольный ингредиент. Указанные индивидуальные покрытые растворимой в кишечнике оболочкой слоистые сердцевинные частицы смешаны с таблетками инертного наполнителя и спрессованы. Указанные таблетки инертного наполнителя могут быть, например, из микрокристаллической целлюлозы. Получающаяся таблетка способна противостоять кислотному окружению.
Сущность изобретения
Заявитель изучил возможные новые фармацевтические композиции, предназначенные для орального применения, из кислотно-нестойких веществ и особенно омепразола, пантопразола, лансопразола, леминопразола и парипразола, которые имеют отличную стабильность при хранении в сочетании со стабильностью в процессе их получения, и неожиданно обнаружил новые композиции, которые особенно стабильны, причем не содержат ни соединений с щелочной реакцией, ни маннита в значительных стехиометрических количествах - веществ, которые признаны существенными в предыдущих работах.
Таким образом, в настоящем изобретении предложена композиция, свободная от соединений с щелочной реакцией и содержащая:
(а) - сердцевину, содержащую кислотно-нестойкий бензимидазольный активный компонент, причем указанная сердцевина состоит из ядер и указанного активного ингредиента, смешанных и спрессованных вместе, а указанный активный компонент присутствует не в форме щелочной соли;
(б) - промежуточный слой; и
(в) - слой, растворимый в среде кишечника.
Согласно одному варианту воплощения изобретения, указанные ядра и указанный активный ингредиент гранулированы и спрессованы вместе.
Согласно предпочтительному варианту воплощения изобретения, ядра должны иметь размер частиц, в отсутствии активного компонента, от 80 до 500 мкм, предпочтительно от 150 до 300 мкм.
Согласно другому предпочтительному варианту воплощения изобретения, в композицию наряду с ядрами и активным ингредиентом входят фармацевтические инертные наполнители и присутствует, по крайней мере, одна смазка.
Согласно еще одному варианту воплощения изобретения, по крайней мере, одна смазка, выбранная из группы, включающей в себя: стеарилфумарат натрия, стеарат магния, глицерилбегенат и тальк, дополнительно присутствует наряду с указанными ядрами и указанным активным ингредиентом.
Согласно другому варианту воплощения изобретения, промежуточный слой содержит диоксид кремния.
Омепразол, лансопразол, пантопразол, леминопразол или парипразол представляют собой примеры кислотно-нестойких бензимидазольных активных компонентов.
Данное изобретение относится также к способу получения композиции, согласно настоящему изобретению, включающий стадии:
(а) смешения ядер с активным компонентом;
(б) прессования продукта со стадии (а) до получения сердцевины, содержащей активный компонент;
(в) покрытия указанной сердцевины промежуточным слоем; и
(г) покрытия продукта по стадии (в) слоем, растворимым в среде кишечника.
Согласно одному варианту воплощения изобретения, стадия (а) представляет собой гранулирование.
Согласно другому варианту воплощения изобретения, указанную стадию (а) осуществляют методом распыления среды, содержащей активный компонент, на ядра в грануляторе с псевдоожижением, после чего получаемый продукт подвергается сушке.
Предпочтительно, чтобы среда, содержащая активный компонент, была водной средой.
Согласно другому варианту воплощения, настоящий способ включает дополнительно стадию смешения ядер или продукта со стадии (а) с фармацевтически нейтральными наполнителями, предпочтительно, по крайней мере, с одной смазкой.
Далее изобретение будет подробно описано со ссылкой на прилагаемые рисунки, где:
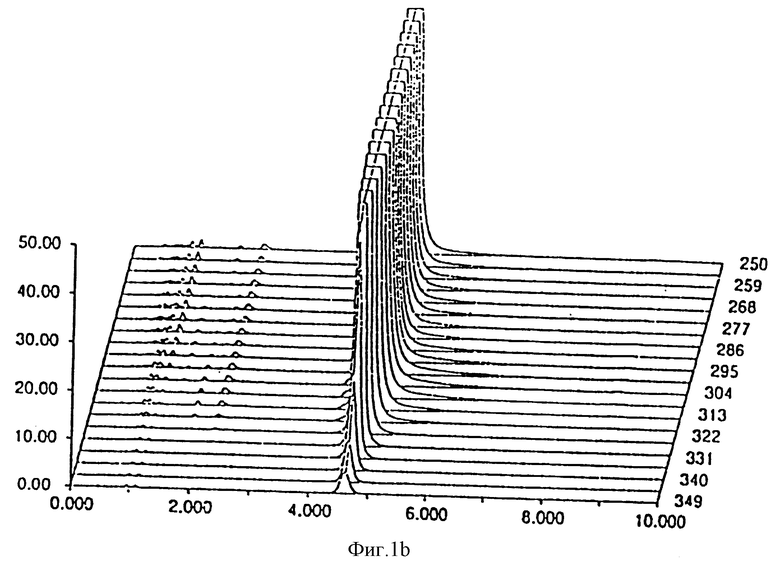
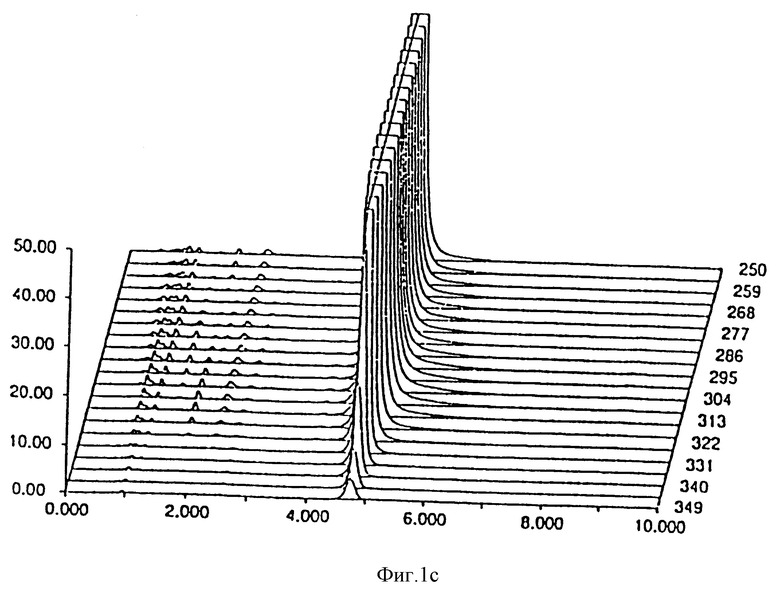
- фиг. 1 показывает стабильность композиции в примере 1;
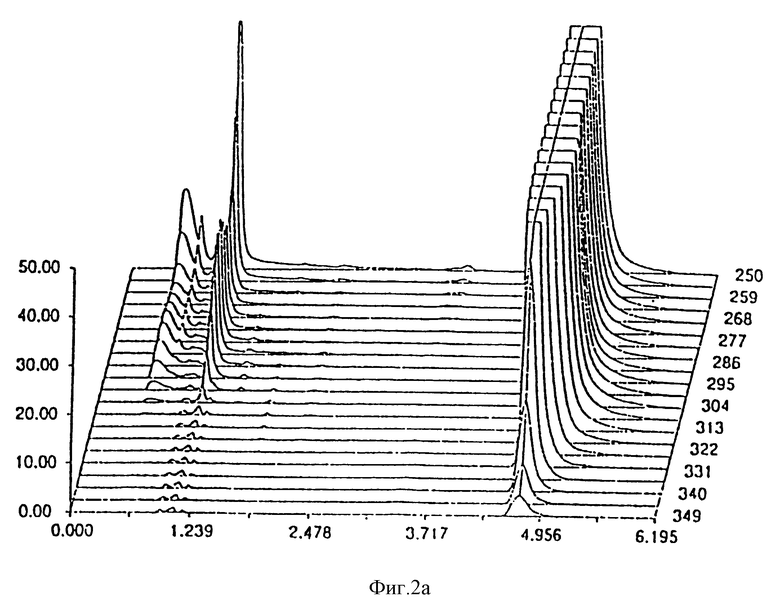
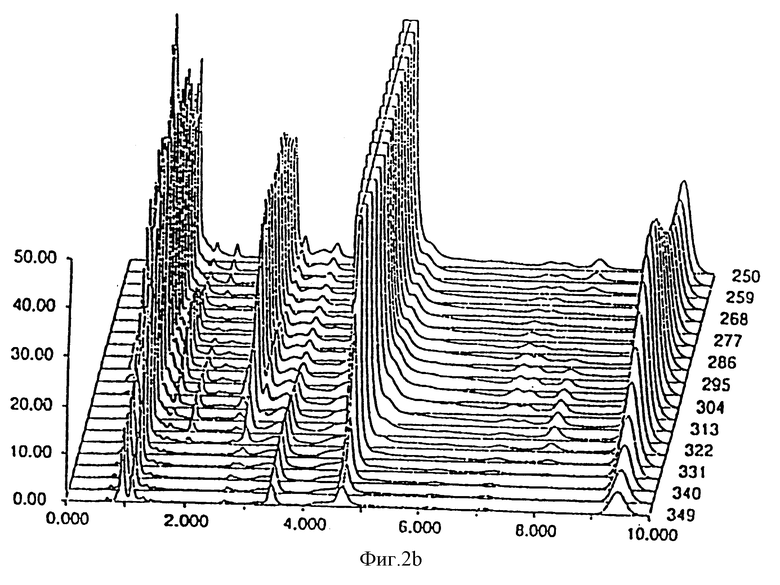
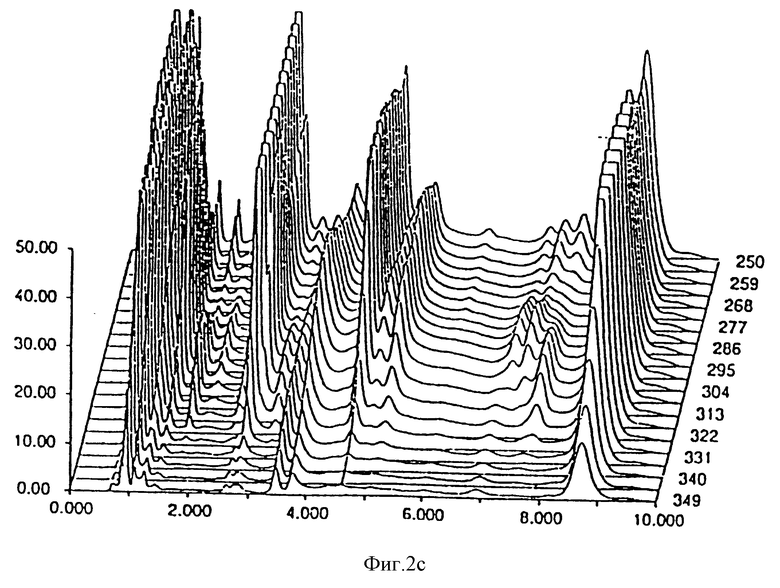
- фиг. 2 показывает стабильность композиции Prilosec® из известного уровня изобретения;
- фиг. 3 представляет собой фотографию гранул, полученных в грануляторе с псевдоожижением, согласно примерам.
Подробное описание
В данной работе выражение "кислотно-нестойкое вещество" принято для обозначения веществ, у которых период полураспада составляет менее 10 минут и/или от 10 минут до 65 часов в водных растворах, имеющих соответственно pH менее 4 и/или pH равное 7. Характерно, что в качестве примеров могут быть приведены активные вещества, описанные в пат. EP 244380, и, в частности, такие активные вещества как омепразол, пантопразол, лансопразол, леминопразол и парипразол.
В настоящем изобретении выражение "бензимидазольный активный компонент" принято для обозначения производных бензимидазола, которые имеют терапевтическое значение. Бензимидазольные активные компоненты, приведенные в настоящем описании, включают, в частности, омепразол, пантопразол, лансопразол, леминопразол и парипразол совместно с производными бензимидазола, описанными в пат. EP 244380, US-P-4 045563, EP-0005129, BE-898880, GB-2141429, EP-0146370, GB-2082580, EP-A-0173664, EP-A-0080602, EP-0127763, EP-0134400, EP-0130729, EP-0150586, DE-3415971, GB-2082580, SE-A-8504048-3 и US-4182766. В настоящем изобретении описаны предпочтительно вещества, которые классифицированы как предпочтительные в этом документе, и это, в частности, омепразол, пантопразол, лансопразол, леминопразол и парипразол; форма щелочной соли активных веществ, упомянутых выше, исключена. Также рассмотрены производные, такие как соли (гидраты и тому подобное), эфиры и подобные им (включая пропрепараты), поскольку они не имеют щелочной природы.
Предложены также смеси активных веществ, например смеси, содержащие бензимидазол в сочетании с другим активным веществом, или такие смеси, которые включают два бензимидазола.
В настоящей заявке выражение "не содержащий соединение с щелочной реакцией" принято для обозначения композиции, которая не содержит никакого соединения с щелочной реакцией, иными словами - композиции, в которой количество вещества с щелочной реакцией не является достаточным для того, чтобы создать щелочную микросреду вокруг активного вещества, когда оно оказывается в контакте с кислотой или нейтральной водной средой, например, микросреду с pH выше 7.
Согласно настоящему изобретению, сердцевина состоит из группы ядер на основе фармацевтически инертных наполнителей, с которыми активное кислотно-нестойкое вещество было смешано, то есть тщательно перемешано, отстояно, покрыто и спрессовано совместно.
Выражение "ядра и активный ингредиент, смешанные вместе и затем спрессованные" предполагает различные варианты воплощения.
Согласно одному варианту воплощения, способ, используемый для получения растворимой сердцевины, является гранулированием, предпочтительно гранулированием с псевдоожижением. Мастер своего дела полностью стоит за такую технологию. Интересные сведения по упомянутой технологии можно найти в публикации Schaefer & Worts. Arch. Pharm. Chemi.Sci., Ed. 5, 1977, 51-60. Согласно упомянутой технологии гранулирования ядра, например лактоза, псевдоожижают с помощью входящего воздуха, а связывающий раствор активного ингредиента распыляют на псевдоожиженный слой. При этом образуются гранулы из ядер и активного ингредиента; указанные гранулы хорошо видны на фиг. 3. Можно видеть, что раствор образует связующее, которое удерживает несколько ядер; агломерат образуют также ядра и/или частицы бензимидазола. Указанные гранулы, являющиеся промежуточным продуктом, спрессовывают.
Может быть использован альтернативный вариант воплощения изобретения, когда активный ингредиент присутствует в ядрах, которые затем спрессовывают вместе, или когда активный ингредиент и/или ядра (частично) должны быть спрессованы, и в этом случае спрессованные ядра и/или спрессованный активный ингредиент также прессуют вместе.
Другим способом, который можно использовать для получения, является технология с емкостью для нанесения покрытия, причем в этой емкости ядра вводят в раствор активного ингредиента и полученный продукт прессуют после необязательной предварительной стадии сушки.
Существует и другой путь реализации технологии получения ядер + активный ингредиент, его следует назвать "технологией нанесения покрытия", так как ряд возможных вариантов воплощения приводят к образованию продуктов, которые можно квалифицировать как "продукты с покрытием". Кроме того, в настоящем описании термин "стадия нанесения покрытия" можно употреблять вместо термина "стадия смешения".
Действительно, в макроскопическом масштабе, сердцевину можно рассматривать как сердцевину, содержащую активный ингредиент.
В настоящем изобретении выражение "фармацевтически приемлемый инертный наполнитель" подразумевает вещество, которое не вступает в химическую реакцию в рабочих условиях и которое не оказывает отрицательного воздействия на активное вещество.
Ядра могут быть из любого вещества, являющегося фармацевтически инертным по отношению к активному веществу и существующего в кристаллическом или аморфном состоянии. В общем случае, эти ядра могут быть из сахара, например из лактозы, сахарозы, кукурузного крахмала и так далее, или они могут быть из смеси некоторых из них. Активное вещество, которое при необходимости смешивают с фармацевтически инертными наполнителями, можно обрабатывать методом традиционной технологии нанесения покрытия, например, в надлежащей емкости для нанесения покрытия или, например, в грануляторе с псевдоожиженным слоем. Типичным является добавление Polysorbate 80 или лаурилсульфата натрия, смешанного с активным веществом. Предпочтительно добавлять смазку, а именно стеарилфумарат натрия, стеарат магния или глицерилбегенат (Ompritol 888 АТО) или (микронизированный) тальк после того, как активное вещество будет нанесено на инертные ядра. Любые традиционные инертные наполнители, используемые в фармацевтической и химической областях, которые совместимы с активным веществом, можно использовать в качестве связующих, наполнителей, пластификаторов, поверхностно-активных веществ, пигментов, расщепляющих агентов, смазок, смачивающих агентов и так далее, за исключением веществ с щелочной реакцией. В настоящем изобретении в качестве примеров приведены следующие рекомендуемые инертные наполнители: полисорбат 80 (Tween® 80), лаурилсульфат натрия, гидроксипропилцеллюлоза, гидроксипропилметилцеллюлоза, тальк, микрокристаллическая целлюлоза, коллоидный кремнезем, поливинилпирролидон, стеарилфумарат натрия, стеарат магния, диоксид титана и так далее.
Промежуточный слой, согласно настоящему изобретению, имеет по крайней мере один подслой. Он соответствует одному или нескольким инертным водорастворимым слоям или слоям, которые быстро разрушаются в водной среде, содержащие некислотные фармацевтически инертные наполнители. Этот слой содержит по крайней мере один полимер, традиционно применяемый в тех случаях, когда необходимо обеспечить покрытие пленкой: сахара, полиэтиленгликоль, поливинилпиролидон, поливиниловый спирт, гидроксипропилцеллюлозу, гидроксиметилцеллюлозу, гидроксипропилметилцеллюлозу и так далее. Промежуточный слой может содержать дополнительно какой-либо из традиционных фармацевтически инертных наполнителей, упоминавшихся в разделе, рассматривающем сердцевину, или смесь из них, например диоксид кремния.
Этот диоксид кремния присутствует в количестве от 2 до 45% по массе в пересчете на сухое вещество промежуточного слоя, предпочтительно от 5 до 18% по массе, например, около 9%. Этот промежуточный слой наносят на сердцевину по традиционной технологии нанесения покрытий в соответствующей емкости или в кипящем слое с применением соответствующих водных и/или органических растворителей, или с применением латексной суспензии указанных инертных наполнителей.
Согласно настоящему изобретению, слой, растворимый в среде кишечника, представляет собой слой, который растворим в среде кишечника и является гастроустойчивым. Для нанесения его на промежуточный слой используют традиционную технологию нанесения покрытия, такую как нанесение покрытия в емкости или в псевдоожиженном слое с применением растворов полимеров в воде или в соответствующих органических растворителях или с применением латексных суспензий этих полимеров. В качестве полимера можно использовать: ацетилфталат целлюлозы, фталат гидроксипропилметилцеллюлозы, поливинилфталатацетат, метиловые эфиры метакриловой кислоты/сополимеры метакриловой кислоты, такие как, например, соединения, известные под торговыми марками Eudragit® L12.5 или Eudragit® L100 (Rohm Pharma), или подобные вещества, обычно используемые для получения покрытий, растворимых в среде кишечника, а также их смеси.
Нанесение покрытия, растворимого в среде кишечника, может также быть осуществлено с использованием водных дисперсий полимеров, например Aquateric® (FMC Corporation), Eudragit® L100255 (Rohm Pharma), покрытия CE 5142 (BASF). Слой, растворимый в среде кишечника, может также содержать фармацевтически приемлемый пластифицирующий агент, такой как, например, кетанол, триацетин, эфиры лимонной кислоты, такие как известные под торговыми марками Citroflex® (Pfizer), эфиры фталевой кислоты, дибутиловый эфир янтарной кислоты или какой-либо другой пластифицирующий агент. Количество пластифицирующего агента в общем случае оптимизируют для каждого полимера и обычно оно составляет от 1 до 30% полимера, например, от 5 до 20%. В состав покрытия, растворимого в среде кишечника, могут входить дополнительные агенты, такие как тальк, пигменты, красящие агенты, отдушки, а также любой другой обычно используемый инертный наполнитель.
Композиции, согласно настоящему изобретению, обычно включают в себя сердцевину, представляющую 40-90% по массе, предпочтительно 60-70% по массе от общей массы композиции, промежуточный слой, представляющий 5-30% по массе, предпочтительно от 15 до 20% по массе от общей массы композиции и слой, растворимый в среде кишечника, представляющий от 5 до 30% по массе, предпочтительно 15-20% по массе от общей массы композиции. Сердцевина обычно содержит активный компонент в количестве от 2 до 50%, предпочтительно от 5 до 20% по массе.
Согласно предпочтительному варианту воплощения изобретения, композицию, являющуюся предметом настоящего изобретения, изготавливают в форме таблеток (одинарных, с делениями и т.п.).
Согласно другому предпочтительному варианту воплощения изобретения, предпочтительной формой композиции является форма микротаблеток, заключенных в капсулу, например желатиновую капсулу. Для этой цели может быть использована любая желатиновая капсула, обычно используемая для фармацевтических форм, такая как капсула из твердого желатина, известная как Capsugel, поставляемая Eli Lilly.
Композиции, являющиеся предметом настоящего изобретения, особенно подходят для орального применения активных компонентов и особенно подходят для лечения гастро-интестинальных болезней.
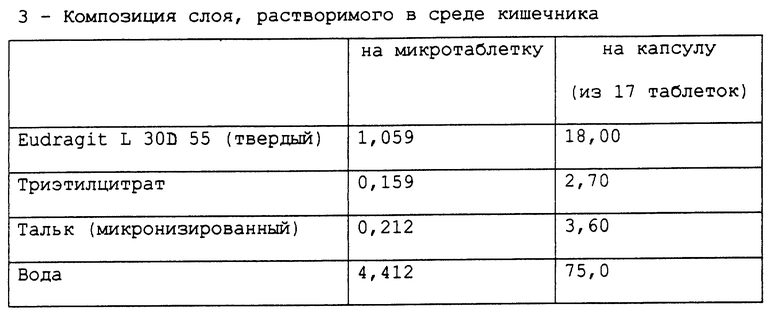
Согласно особому варианту воплощения изобретения, композиция, являющаяся предметом настоящего изобретения, принимает форму капсулы, содержащей 16 микротаблеток, имеющих следующий состав, выраженный в мг/на капсулу, начиная с сердцевины и по направлению к поверхности: лактоза 50-500, активный компонент 10-40, гидроксипропилметилцеллюлоза 1-100, полисорбат 80 или лаурилсульфат натрия 0,0-5,0, стеарилфумарат натрия или стеарат магния 0,8-8,0, кросповидон 0-50; промежуточный слой: тальк 0-20, диоксид титана 0-20, диоксид кремния 0-20, гидроксипропилметилцеллюлоза 3-50; слой, растворимый в среде кишечника: сополимер метакриловой кислоты, тип С 5-50, триэтилцитрат 0-15, тальк 0-30.
Количество воды, необходимой для получения каждого компонента, составляет от 30 до 1000 для сердцевины, 10-500 для промежуточного слоя и 0-1000 для слоя, растворимого в среде кишечника. Возможно, однако, использовать и другую среду, такую как водную, содержащую другой растворитель, такой как спирт.
Далее настоящее изобретение описано более детально на основании следующих примеров, которые приведены только как иллюстрации.
Пример 1. Приготовление фармацевтической композиции омепразола, предназначенной для орального применения.
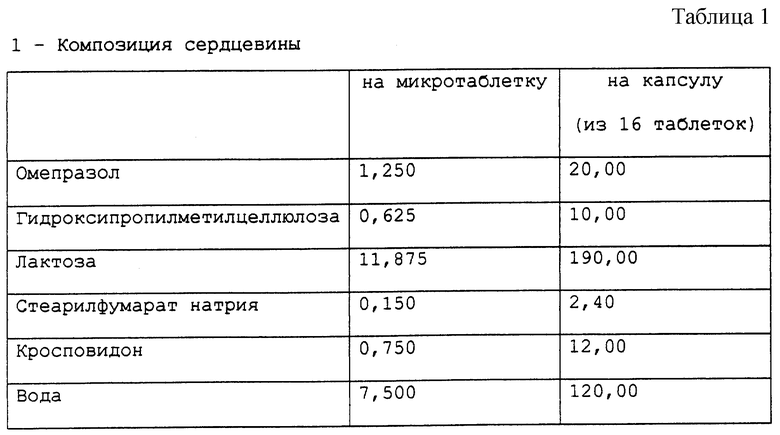
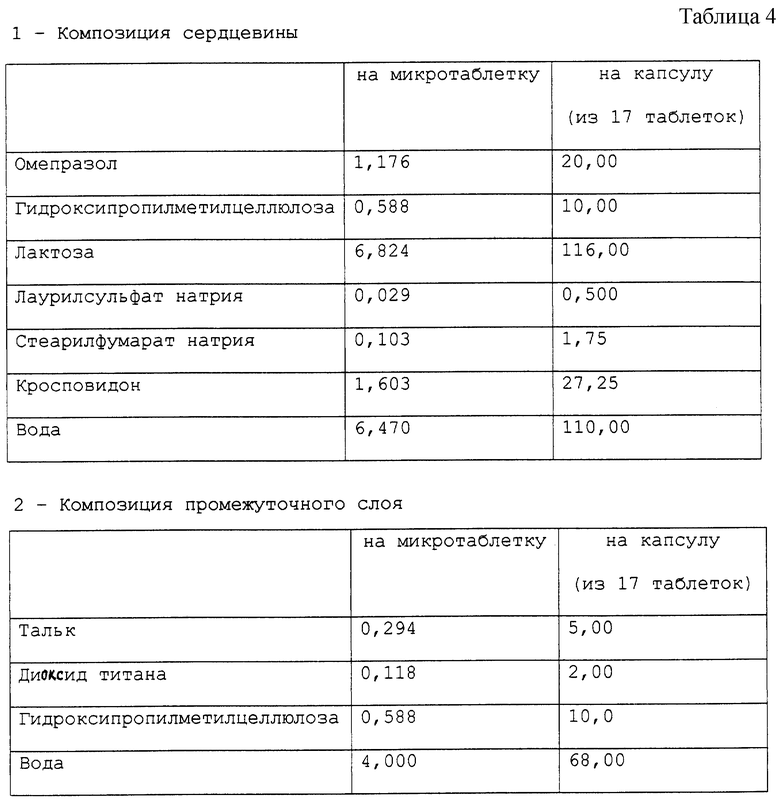
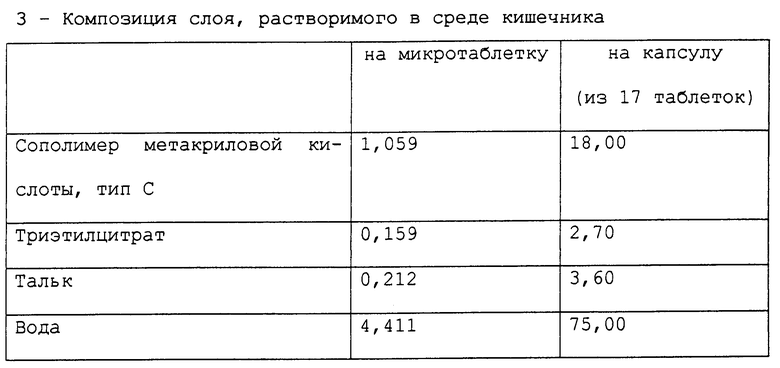
Приготовлена фармацевтическая композиция, согласно настоящему изобретению, в форме микротаблеток, помещенных в желатиновые капсулы, имеющая состав в мг, представленный в табл. 1.
Во-первых, готовят сердцевину, растворяя гидроксипропилметилцеллюлозу в воде с последующим добавлением омепразола и гомогенизацией получающейся суспензии. Суспензию омепразола, полученную таким образом, распыляют на ядра лактозы, имеющие размер частиц 250 мкм, желательно в грануляторе с псевдоожиженным слоем, таком как гранулятор, продаваемый компаниями Glatt, Aeromatic и т.д. По настоящему изобретению для этой стадии может быть использован любой гранулятор с псевдоожиженным слоем, обычно используемый для подобного процесса. После того, как вся суспензия распылена, ядра сушат обычным способом, используя, например псевдоожиженный слой, причем предпочтительно, чтобы температура продукта оставалась ниже 45oC. Затем к высушенным ядрам добавляют стеарилфумарат натрия и кросповидон и перемешивают. После этого проводят прессование полученной смеси с целью получить микротаблетки диаметром около 2,5 мм (обычно от 2 до 4 мм); в качестве альтернативы проводят прессование полученной смеси для получения таблеток обычных размеров. Микротаблетки и таблетки содержат соответствующие количества активного компонента.
Промежуточный слой, который получают растворением гидроксипропилметилцеллюлозы в воде с последующим добавлением талька и диоксида титана и следующей за этим гомогенизацией, наносят распылением на микротаблетки. Эту операцию можно проводить с помощью любого устройства для покрытия, позволяющего регулировать пленку, которая должна быть получена, например с помощью устройства для покрытия Glatt с колонкой типа Wurster.
Слой, растворимый в среде кишечника, который готовят растворением триэтилцитрата в порции воды с добавлением к водной дисперсии сополимера метакриловой кислоты типа С (Eudragit L 30D-55) с последующим перемешиванием полученной смеси в течение 30 минут и заключительным добавлением суспензии талька, которую готовят параллельно гомогенизацией талька в порции оставшейся воды, наносят распылением на таблетки, покрытые промежуточным слоем. Для того, чтобы проверить стабильность микротаблеток, приготовленных в соответствии с описанным выше процессом, приготовленные микротаблетки тестируют на хранение при 45oC при относительной влажности 75%. Также тестировали композицию, являвшуюся предметом предшествующей работы и продаваемую под названием Prilosec®. Эта композиция, являвшаяся предметом предшествующей работы, содержит агенты, имеющие щелочную реакцию. Количество омепразола, присутствующего в микротаблетках, в конце периода хранения определяли следующим методом:
Количество омепразола определяли методом гельпроникающей хроматографии на колонках Nucleosil C18 5 мкм 150 х 4,6 мм, используя в качестве подвижной фазы: буфер (8,9 г Na2HPO4, 2H2O в 1000 мл очищенной воды; pH доведена до 7,6 с использованием H3PO4) в количестве 73% к ацетонитрилу в количестве 27%. Определение заключалось в определении поглощения на 280 нм.
Раствор исследуемого образца готовили следующим образом. Точно взвешенное количество микротаблеток, соответствующее теоретическому количеству омепразола, 20 мг помещали в мерную 50 мл колбу. После добавления подвижной фазы эту колбу помещали в ультразвуковую баню на 5 минут. После того, как раствор был вновь доведен до комнатной температуры, содержимое колбы доводили до объема 250 мл добавлением подвижной фазы.
Концентрацию омепразола, Cd, выраженную в мг/теоретическая масса микротаблеток, определяют по формуле:
Cd=(Aech/Aet)·(Pet/Pech)·(Vd ech/Vd et)·Pth,
где Aech = площади пика раствора образца; Aet = площади пика раствора стандарта, причем этот раствор готовили при тех же условиях, что и раствор образца, но из определенного количества омепразола (20 мг); Pet = массе стандартного вещества; Pech = массе образца; Vd eсh = фактору растворимости образца; Vd et = фактору растворимости стандарта; Pth = теоретической массе тестируемого образца, микротаблеток (теоретически соответствующему 20 мг омепразола).
Результаты, полученные через 0 дней, 14 дней и 30 дней, соответственно даны на фиг. 1 и 2 для композиции, являющейся предметом настоящего изобретения и Prilosec® соответственно. Кривые 1a и 2a представляют исходное состояние, причем соответствующие доли в процентах площадей пика омепразола равны 99,67% и 97,51% для композиции, являющейся предметом настоящего изобретения Prilosec® соответственно. Кривые 1b и 2b показывают ситуацию через 14 дней, причем доли в процентах равны 99,56% и 75,09% соответственно. Кривые 1c и 2c показывают состояние через 30 дней, причем доли в процентах равны 99,38% и 15,89% соответственно.
Пример 2. Приготовление фармацевтической композиции омепразола, предназначенной для орального применения.
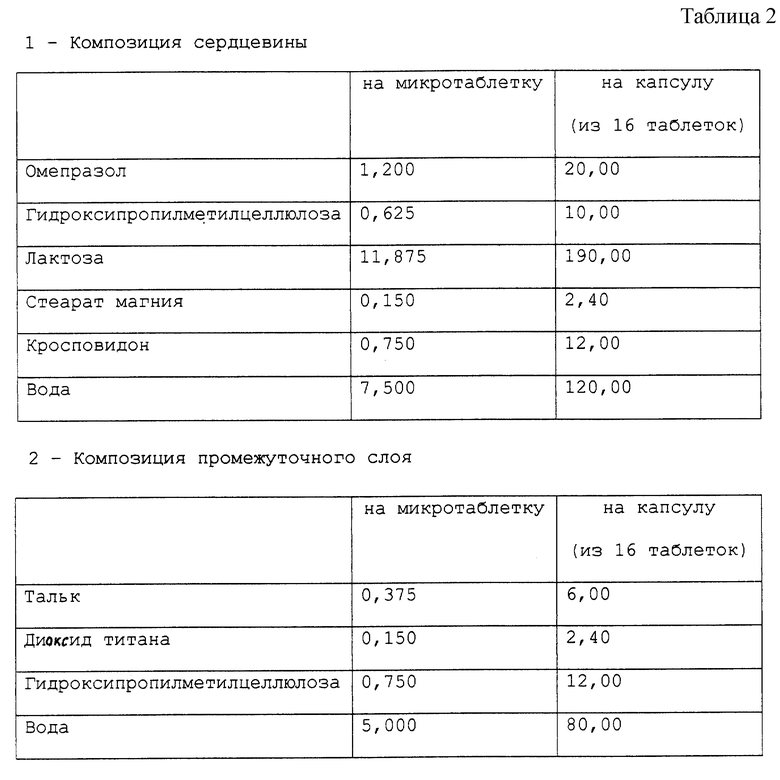
Приготовлена фармацевтическая композиция, согласно настоящему изобретению, в форме микротаблеток, помещенных в желатиновые капсулы, имеющая состав в мг, представленный в табл. 2.
Фармацевтическая композиция приготовлена способом, описанным в примере 1, с тем исключением, что стерилфумарат натрия был заменен стеаратом магния.
Cтабильность полученных микротаблеток омепразола оценивали по методу, описанному в примере 1. Полученные результаты подтверждают результаты для композиции в примере 1, причем стабильность, выраженная в процентной доли омепразола в пике, через 30 дней оказывается выше 99%.
Пример 3. Приготовление фармацевтической композиции омепразола, предназначенной для орального применения.
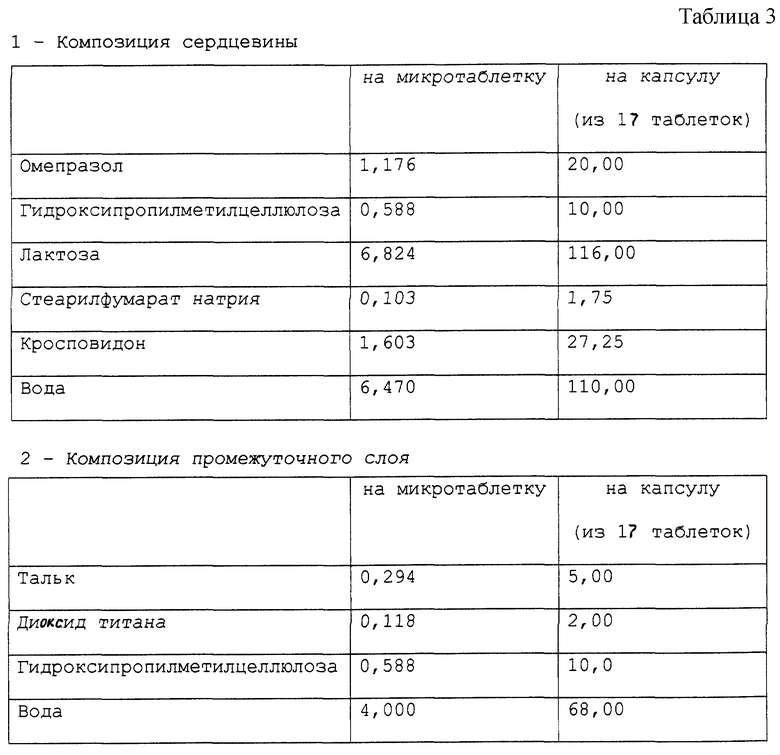
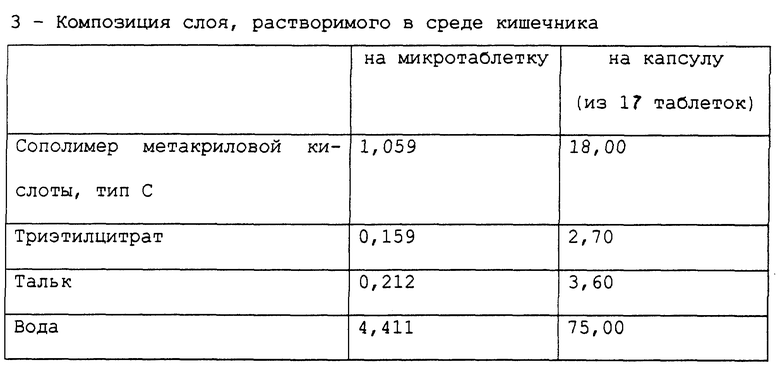
Приготовлена фармацевтическая композиция, согласно настоящему изобретению, в форме микротаблеток, помещенных в желатиновую капсулу, имеющая состав в мг, представленный в табл. 3.
Фармацевтическая композиция приготовлена методом, описанным в примере 1.
Стабильность полученных микротаблеток омепразола оценивали методом, описанным в примере 1. Полученные результаты подтверждают результаты для композиции в примере 1.
Пример 4. Приготовление фармацевтической композиции омепразола, предназначенной для орального применения. Получена фармацевтическая композиция, согласно настоящему изобретению, в форме микротаблеток, помещенных в желатиновую капсулу, имеющая состав в мг, представленный в табл. 4.
Фармацевтическая композиция приготовлена способом, описанным в примере 1, с тем исключением, что при подготовке сердцевины лаурилсульфат натрия был растворен в воде в то же время, что гидроксиметилпропилцеллюлоза, после чего омепразол суспензировали в этом растворе.
Стабильность полученных микротаблеток омепразола была определена методом, описанным в примере 1. Полученные результаты подтверждают результаты, полученные для композиции в примере 1.
Пример 5. Приготовление фармацевтической композиции омепразола, предназначенной для орального применения. Получена фармацевтическая композиция, согласно настоящему изобретению, в форме микротаблеток, помещенных в желатиновую капсулу, имеющая состав в мг, представленный в табл. 5.
Фармацевтическая композиция приготовлена способом, описанным в примере 1, с тем исключением, что при подготовке сердцевины полисорбат 80 был растворен в воде в то же время, что гидроксиметилпропилцеллюлоза, после чего омепразол суспензировали в этом растворе.
Стабильность полученных микротаблеток омепразола была определена методом, описанным в примере 1. Полученные результаты подтверждают результаты, полученные для композиции в примере 1.
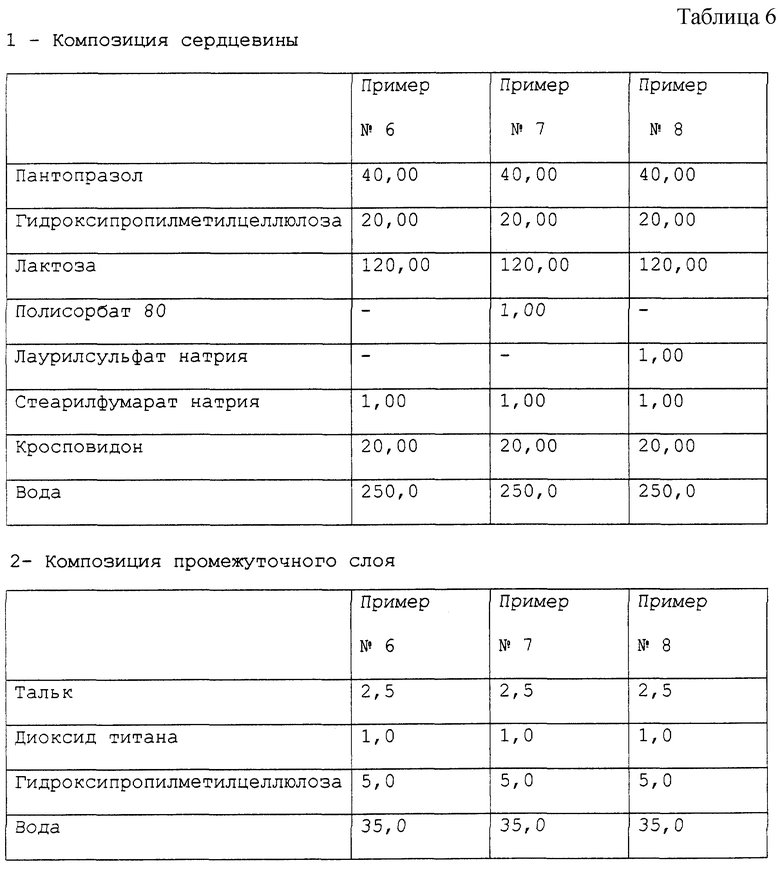
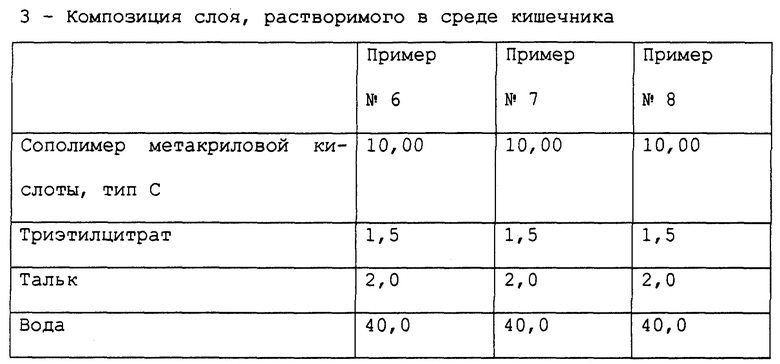
Примеры 6-8. Приготовление фармацевтической композиции пантопразола, предназначенной для орального применения. Получена фармацевтическая композиция, согласно настоящему изобретению, в форме отдельных таблеток, содержащих 40 мг активного компонента пантопразола, с составом, выраженным в мг/таблетка, представленным в табл. 6.
Фармацевтическая композиция приготовлена способом, описанным в примере 1, с теми исключениями, что, во-первых, при приготовлении сердцевины для композиции в примерах 7 и 8 Полисорбат 80 и, соответственно, лаурилсульфат натрия были растворены в воде в то же самое время, что и гидроксипропилметилцеллюлоза, после чего пантопразол был суспендирован в растворе и, во-вторых, - конечная композиция была получена в форме таблеток, а не в форме микротаблеток, помещенных в капсулу.
Стабильность полученных таблеток пантопразола была определена методом, описанным в примере 1. Полученные результаты подтверждают результаты, полученные для композиции в примере 1.
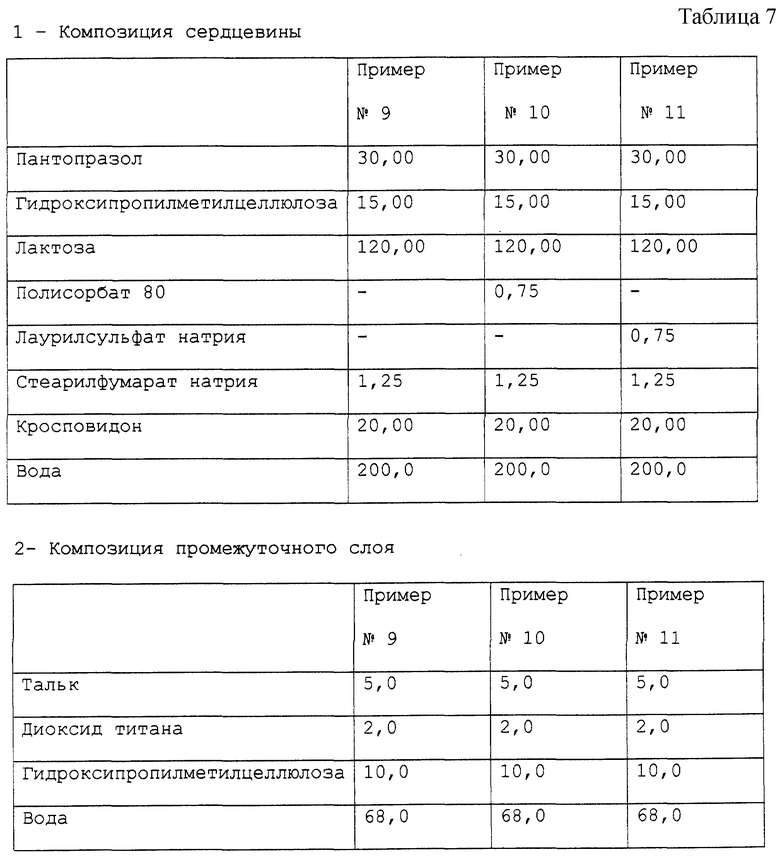
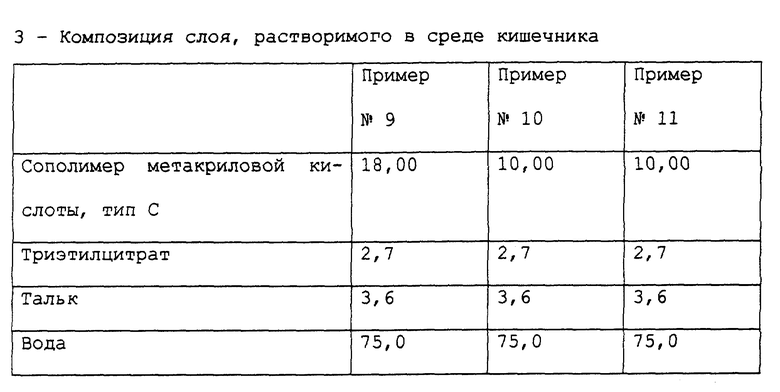
Примеры 9-11. Приготовление фармацевтической композиции лансопразола, предназначенной для орального применения.
Получены фармацевтические композиции, согласно настоящему изобретению, в форме микротаблеток, помещенных в желатиновую капсулу, с составом, выраженным в мг/капсула представленным в табл. 7.
Фармацевтическая композиция приготовлена способом, описанным в примере 1, с теми исключениями, что, во-первых, при приготовлении сердцевины композиции в примерах 10 и 11 Полисорбат 80 и, соответственно, лаурилсульфат натрия были растворены в воде в то же самое время, что и гидроксипропилметилцеллюлоза, после чего пантопразол был суспендирован в растворе.
Стабильность полученных таблеток пантопразола была определена методом, описанным в примере 1. Полученные результаты подтверждают результаты, полученные для композиции в примере 1.
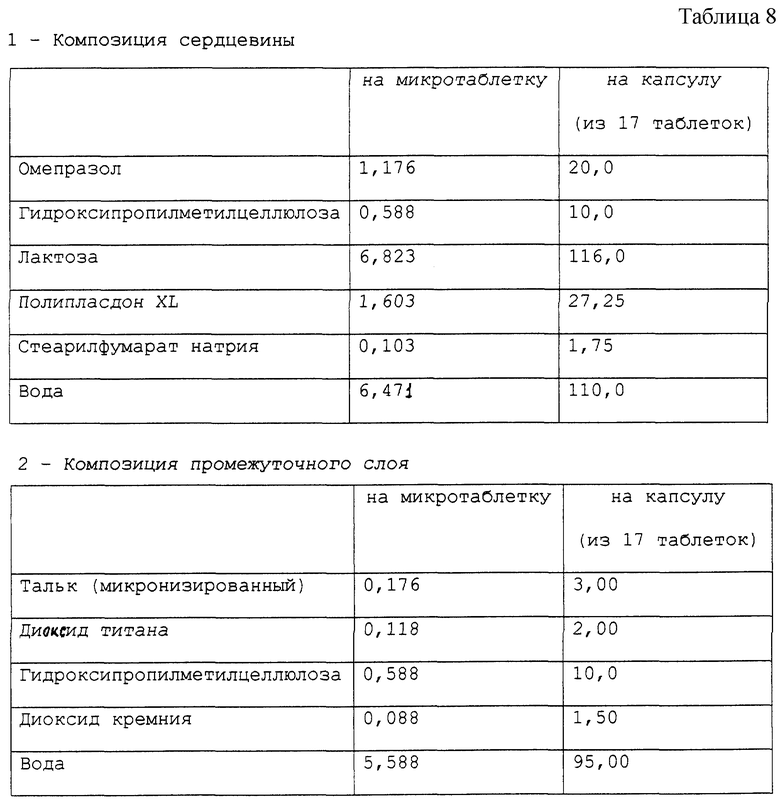
Пример 12. Приготовление фармацевтической композиции омепразола, предназначенной для орального применения.
Получена фармацевтическая композиция, согласно настоящему изобретению, в форме микротаблеток, помещенных в желатиновую капсулу, имеющая состав в мг, представленный табл. 8.
Фармацевтическая композиция приготовлена способом, описанным в вышеприведенных примерах.
Стабильность полученных микротаблеток омепразола была определена методом, описанным в примере 1. Полученные результаты подтверждают результаты, полученные для композиции в примере 1.
Пример 13. Приготовление фармацевтической композиции омепразола, предназначенной для орального применения.
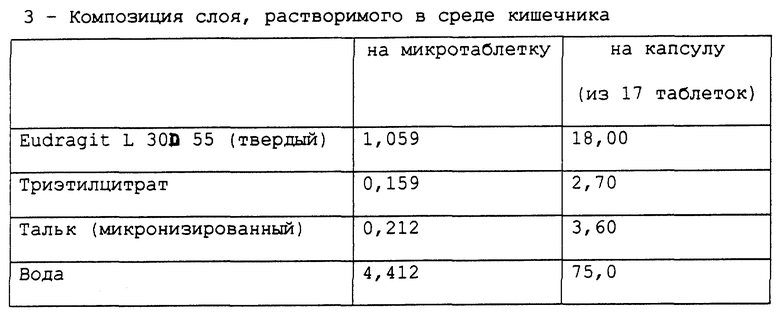
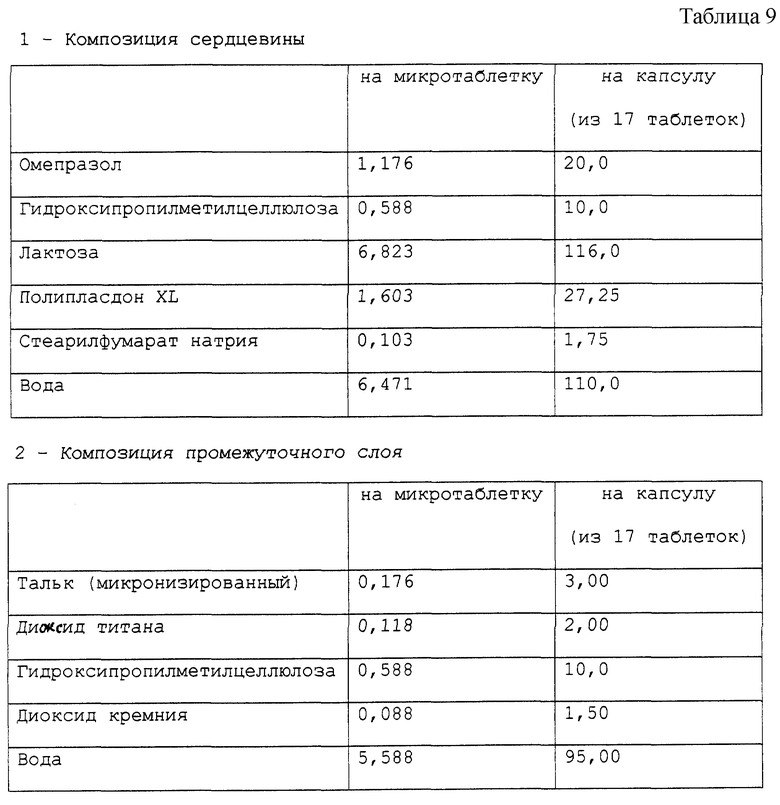
Получена фармацевтическая композиция, согласно настоящему изобретению, в форме микротаблеток, помещенных в желатиновую капсулу, имеющая состав в мг, представленный в табл. 9.
Фармацевтическая композиция приготовлена методом, описанным в вышеприведенных примерах.
Стабильность полученных микротаблеток омепразола (определенная так же, как в примере 1) подтверждает результаты, полученные для композиции в примере 1.
Пример 14. Приготовление фармацевтической композиции омепразола, предназначенной для орального применения.
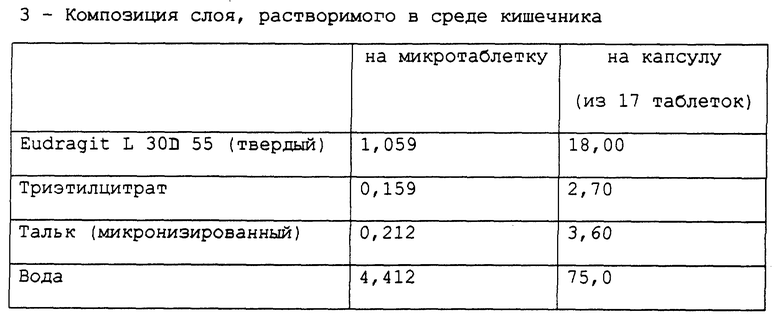
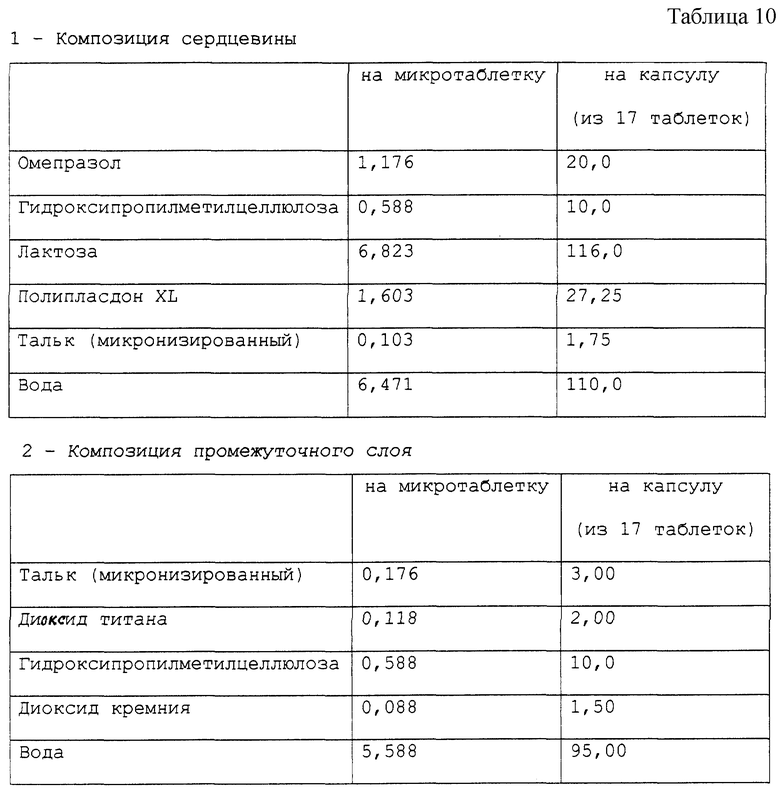
Получена фармацевтическая композиция, согласно настоящему изобретению, в форме микротаблеток, помещенных в желатиновую капсулу, имеющая состав в мг, представленный в табл. 10.
Фармацевтическая композиция приготовлена способом, описанным в вышеприведенных примерах.
Стабильность полученных микротаблеток омепразола (определена так же, как в примере 1) подтверждает результаты, полученные для композиции в примере 1.
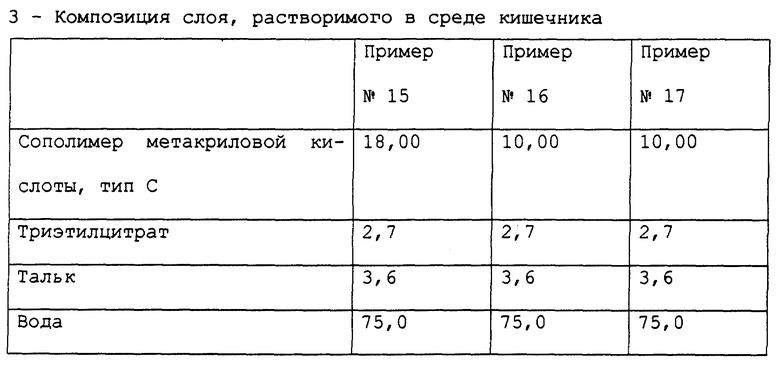
Примеры 15-17. Приготовление композиции лансопразола, предназначенной для орального применения.
Получены фармацевтические композиции, согласно настоящему изобретению, в форме микротаблеток, помещенных в желатиновую капсулу, с составом, выраженным в мг/капсула, представленным в табл. 11.
Фармацевтическая композиция приготовлена способом, описанным в примерах 9-11, с тем исключением, что при приготовлении сердцевины глицерилбегенат был применен вместо стеарилфумарата натрия.
Стабильность полученных микротаблеток лансопразола (определенная методом, описанным в примере 1) подтверждает результаты, полученные для композиции в примере 1.
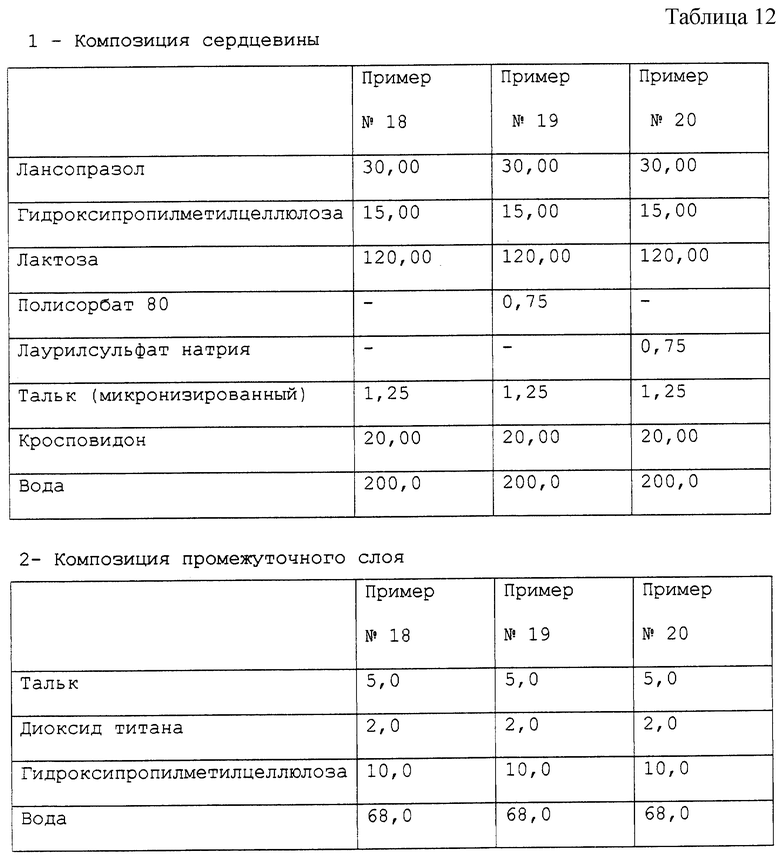
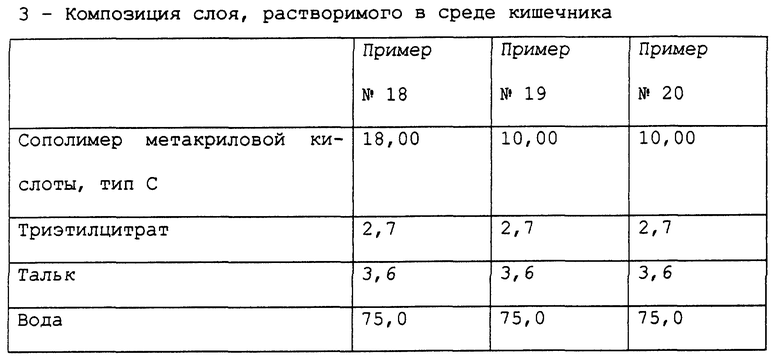
Примеры 18-20. Приготовление фармацевтической композиции лансопразола, предназначенной для орального применения.
Получены фармацевтические композиции, согласно настоящему изобретению, в форме микротаблеток, помещенных в желатиновую капсулу, с составом, выраженным в мг/капсула, представленным в табл. 12.
Фармацевтическая композиция приготовлена способом, описанным в примерах 9-11, с тем исключением, что при приготовлении сердцевины микронизированный тальк был применен вместо стеарилфумарата натрия.
Стабильность полученных микротаблеток лансопразола (определенная методом, описанным в примере 1) подтверждает результаты, полученные для композиции в примере 1.
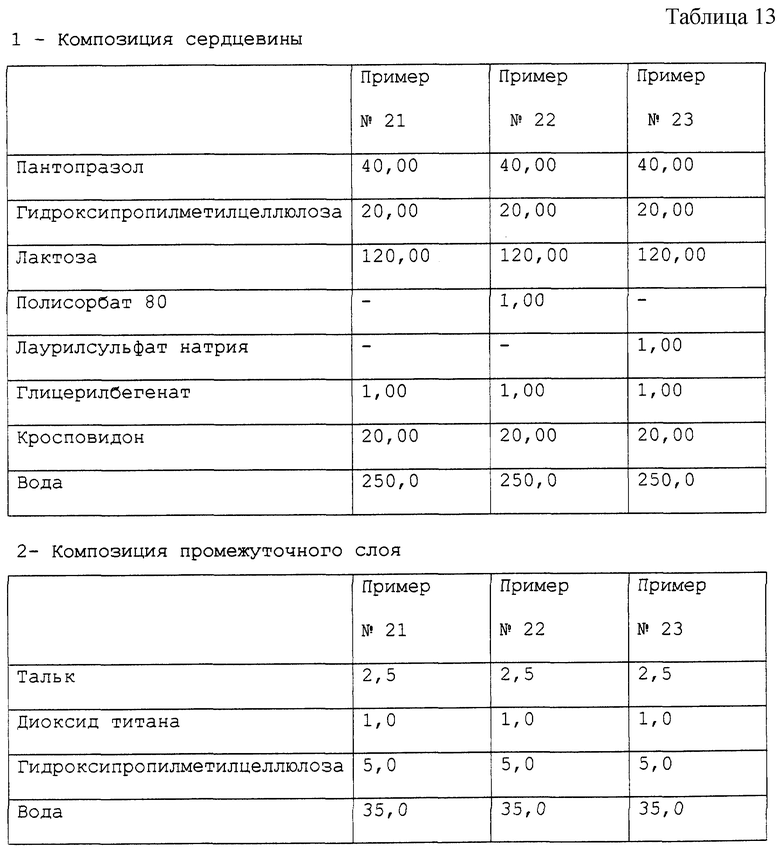
Примеры 21-23. Приготовление фармацевтической композиции пантопразола, предназначенной для орального применения.
Получены фармацевтические композиции, согласно настоящему изобретению, в форме отдельных таблеток, содержащих 40 мг активного компонента пантопразола с составом, выраженным в мг/таблетка, представленным в табл. 13.
Фармацевтическая композиция приготовлена способом, описанным в примерах 6-8, с тем исключением, что при приготовлении сердцевины глицерилбегенат был применен вместо стеарилфумарата натрия.
Стабильность полученных микротаблеток пантопразола (определенная так же, как в примере 1) подтверждает результаты, полученные для композиции в примере 1.
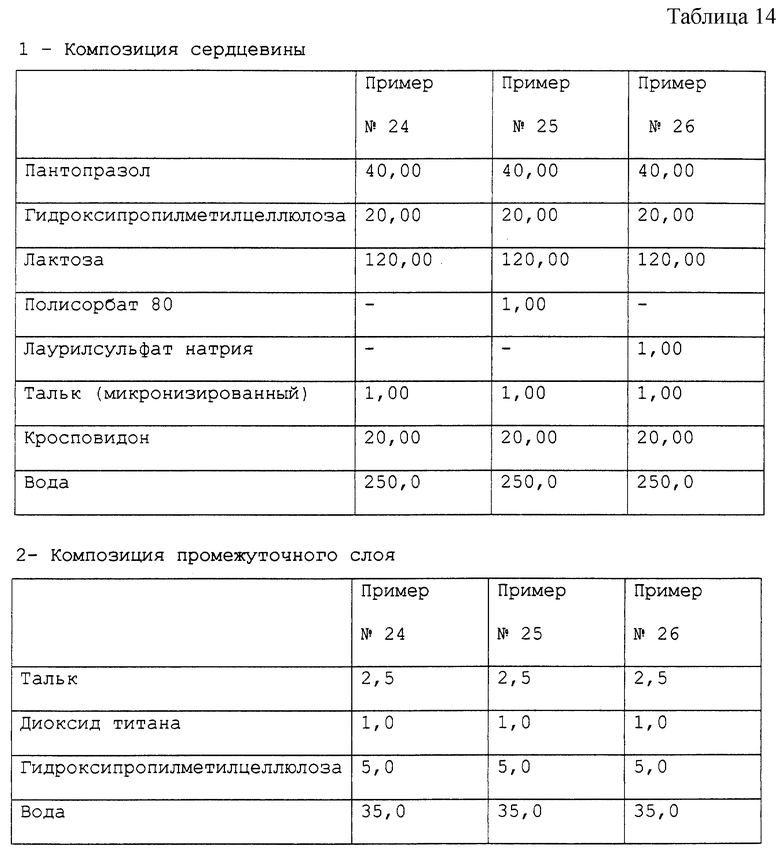
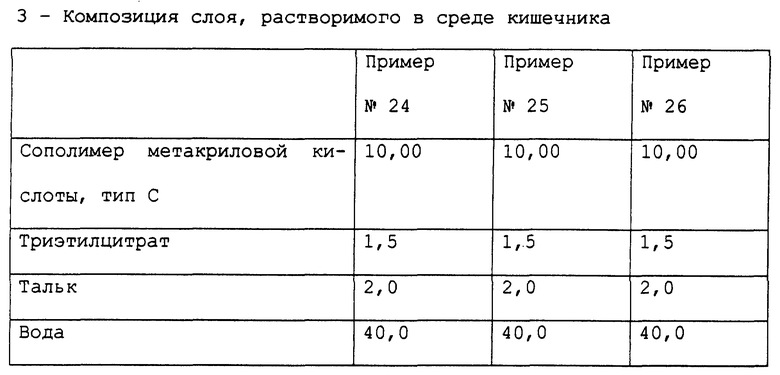
Примеры 24-26. Приготовление фармацевтических композиций пантопразола, предназначенных для орального применения.
Получены фармацевтические композиции, согласно настоящему изобретению, в форме отдельных таблеток, содержащих 40 мг активного компонента пантопразола с составом, выраженным в мг/таблетка, представленным в табл. 14.
Фармацевтическая композиция приготовлена способом, описанным в примерах б-8, с тем исключением, что при приготовлении сердцевины микронизированный тальк был применен вместо стеарилфумарата натрия.
Стабильность полученных микротаблеток пантопразола (определенная так же, как в примере 1) подтверждает результаты, полученные для композиции в примере 1.
Сравнительный пример
Растворимую микротаблетку по примеру 1 снова спрессовывают в микрокристаллической целлюлозной матрице по известному способу, описанному в пат. заявке WO 96/01624. На полученных таблетках видны трещины на поверхности, являющиеся следствием повторного прессования микротаблеток, являющихся предметом настоящего изобретения, по способу, описанному в пат. заявке WO 96/01624, который не подходит для получения таблеток требуемого качества.
Кроме того, указанные полученные таблетки протестировали на их растворимость в растворе 0,1N HCl по известному методу, описанному в пат. заявке WO 96/01624. Результаты показывают, что через 2 ч растворяется примерно 55%, что свидетельствует о том, что указанные полученные таблетки не могут противостоять кислой среде.
Понятно, что специальные фармацевтически инертные наполнители в композициях, описанных в примерах 1-26, могут быть заменены другими инертными наполнителями, имеющими ту же функцию и которые традиционно применяют при составлении рецептуры при условии их химической совместимости с активным компонентом.
Все подобные альтернативные варианты воплощения изобретения входят в рамки настоящего изобретения в той степени, при которой стабильность полученной фармацевтической композиции существенно не меняется.
Предмет настоящего изобретения может быть распространен на кислотно-нестойкие активные вещества, упомянутые во вводной части этого документа и, в частности, те, которые относятся к предпочтительным вариантам воплощения изобретения, а также к примерам предыдущего уровня изобретения. Стадию смешения (то есть нанесение покрытия, собственно смешение или гранулирование), согласно предлагаемому способу, можно осуществлять путем использования любой известной традиционной технологии, обычно применяемой для этой цели. В качестве примеров можно привести технологии нанесения покрытия путем погружения, сухого покрытия, сухого смешения, нанесения покрытия методом распыления, смешения методом распыления и так далее.
И, наконец, следует отметить, что можно добавлять дополнительные слои или подслои с целью придать аромат и/или цвет, и/или облегчить прием медикамента, и/или позволить отмечать прием препарата.
| название | год | авторы | номер документа |
|---|---|---|---|
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ОМЕПРАЗОЛА | 2012 |
|
RU2647472C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ ЛЕЧЕНИЯ ЯЗВЫ ЖЕЛУДКА И ДВЕНАДЦАТИПЕРСТНОЙ КИШКИ В ФОРМЕ ТВЕРДЫХ ЖЕЛАТИНОВЫХ КАПСУЛ, СОДЕРЖАЩАЯ РАБЕПРАЗОЛ ИЛИ ЕГО ПРОИЗВОДНЫЕ, И СПОСОБ ЕЕ ПОЛУЧЕНИЯ | 2007 |
|
RU2414889C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СПОСОБ ЕЕ ПОЛУЧЕНИЯ И СПОСОБ ЛЕЧЕНИЯ | 1993 |
|
RU2143899C1 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ С НАБУХАЮЩИМ ПОКРЫТИЕМ | 2004 |
|
RU2375048C2 |
| УСТОЙЧИВАЯ ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ ПЕРОРАЛЬНОГО ВВЕДЕНИЯ, СОДЕРЖАЩАЯ ЗАМЕЩЕННЫЙ ПИРИДИЛСУЛЬФИНИЛБЕНЗИМИДАЗОЛ | 1998 |
|
RU2216321C2 |
| ТВЕРДАЯ ЛЕКАРСТВЕННАЯ ФОРМА ДЛЯ ОРАЛЬНОГО ВВЕДЕНИЯ | 1992 |
|
RU2095054C1 |
| СОСТАВЫ И СПОСОБЫ ПОДАВЛЕНИЯ СЕКРЕЦИИ ЖЕЛУДОЧНОГО СОКА | 2005 |
|
RU2385154C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ ЛЕЧЕНИЯ ЯЗВЕННОЙ БОЛЕЗНИ ЖЕЛУДКА И/ИЛИ 12-ПЕРСТНОЙ КИШКИ | 2010 |
|
RU2448702C2 |
| ФАРМАЦЕВТИЧЕСКИЙ ПРЕПАРАТ, СОДЕРЖАЩИЙ ПРОИЗВОДНОЕ БЕНЗИМИДАЗОЛА, СМЕШАННОЕ С МИКРОКРИСТАЛЛИЧЕСКОЙ ЦЕЛЛЮЛОЗОЙ, И СПОСОБ ЕГО ИЗГОТОВЛЕНИЯ | 2003 |
|
RU2332237C2 |
| МИКРОГРАНУЛЫ ОМЕПРАЗОЛА И СПОСОБ ИХ ПОЛУЧЕНИЯ | 1993 |
|
RU2103995C1 |






Изобретение может быть использовано в фармации для получения лекарственных препаратов омепразола. Композиция содержит сердцевину, состоящую из ядер и кислотно-нестойкого омепразольного компонента, смешанных и спрессованных вместе. При этом указанный активный компонент присутствует не в форме щелочной соли. Сердцевина покрыта промежуточным слоем и слоем, растворимым в среде кишечника. Композиция не содержит компонентов с щелочной реакцией. Способ получения композиции включает следующие стадии: смешение ядер с активным компонентом, прессование смеси для получения сердцевины, покрытие ее промежуточным слоем и затем слоем, растворимым в среде кишечника. Новая композиция позволяет создать оральные лекформы, обеспечивающие стабильность активного вещества в процессе производства, хранения и приема. 2 с. и 12 з. п. ф-лы, 3 ил., 14 табл.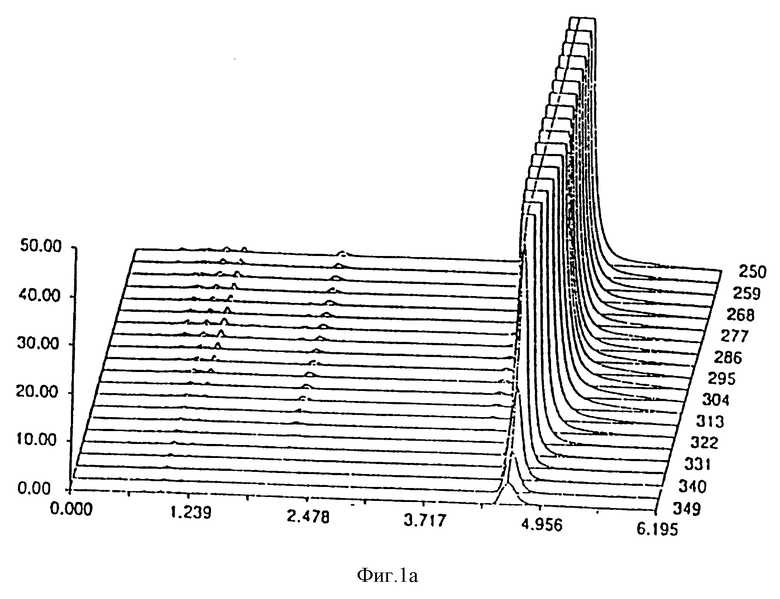
Приоритет по пунктам и признакам.
| US 5399700 A, 21.03.1995 | |||
| US 5133974 A, 28.07.1992 | |||
| US 5126145 A, 30.06.1992 | |||
| Способ получения капсул | 1987 |
|
SU1820837A3 |
Авторы
Даты
2001-01-10—Публикация
1996-09-23—Подача