Данная заявка является частичным продолжением заявки США серийный номер 08/306092, зарегистрированной 19 сентября 1994 г., которая является частичным продолжением заявки США серийный номер 08/216740 зарегистрированной 23 марта 1994 г., которая, в свою очередь, является частичным продолжением заявки США серийный номер 08/176746, зарегистрированной 3 января 1994 г.; все предыдущие заявки в их полноте включены здесь для сведения.
Настоящее изобретение касается соединений, обладающих ретиноидоподобной активностью. Более конкретно, соединения по настоящему изобретению пригодны для предупреждения и/или лечения различных заболеваний кожи, таких как - без ограничения лишь этими примерами - угри, псориаз и радиационные поражения. Кроме того, они обладают противоопухолевой и антиартритной активностью.
Ретиноевая кислота и ее натуральные и синтетические аналоги (ретиноиды) оказывают влияние на большое число биологических эффектов.
Как показано, они влияют на рост и дифференцировку клеток и являются перспективными медикаментами для лечения некоторых видов рака. Cм. Roberts, A. B. and Sporn, M. B. in "The Retinoids", Sporn, M.B., Roberts, A.B. and Goodman, D.S., eds, 1984, 2, pp. 209-286, Academic Press, New York; Lippman, S. M. , Kessler, J.F., and Meyskens, F.L., Cancer Treat. Rep., 1987, 71, p. 391; ibid. , p.493; Hong, W.K. et al., N. Engl. J.Med., 1990, 323, p. 795; Huang M. et al. Blood, 1988, 72, p. 567. Показано также, что ретиноиды пригодны для лечения ревматических заболеваний, см., например: J.W. Coffey et al. , Retinoids as Potential Antirheumatic Agents, Chemistry and Biology of Synthetic Retinoids, pp. 520-537, CRC press Inc., M.I. Dawson and W.H. Okamura Ed. (1990).
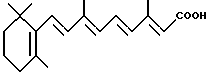
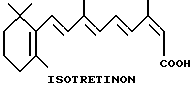
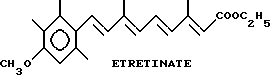
Некоторые ретиноиды уже находят клиническое применение при лечении дерматологических заболеваний, таких как угри и псориаз. Например, изотретиноин клинически используется для оральной терапии тяжелых форм угрей, а этретинат особенно пригоден для лечения псориаза. См. Orfanos, C.E., Ehlert, R. и Gollnick, H., Drugs, 1987, 34, pp. 459-503.
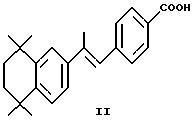
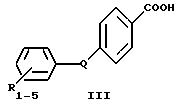
Другие примеры ретиноидных соединений включают аротиноид формулы II и ретинобензойную кислоту формулы III, в которой Q обозначает -NHCO-, -CONH-, -COCH=CH, -CH=CHCO-, -COCH2- и т.п.
См., например: Loeliger, P., Bollag, W. and Mayer, H., Eur. J.Med.Chem., 1980, 15, pp. 9-15; Kagechika, H. et al., J.Med.Chem., 1988, 31, N 11, pp. 2182-2192.
Настоящее изобретение касается соединений формулы I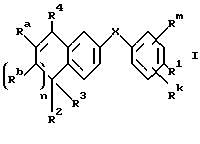
или их фармацевтически приемлемых солей, физиологически гидролизуемых эфиров или сольватов, где
X обозначает -O-CO-, -NH-CO-, -CS-NH-, -CO-O-, -CO-NH-, -COS-, -SCO-, -SCH2-, -CH2-CH2-, 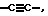 -CH2-NH-, -COCH2-, -NHCS-, -CH2S-, -CH2O-, -OCH2-, -NHCH2- или - CR5=CR6-;
-CH2-NH-, -COCH2-, -NHCS-, -CH2S-, -CH2O-, -OCH2-, -NHCH2- или - CR5=CR6-;
Rm и Rk обозначают независимо друг от друга: водород, галоген, C1-6 алкил, гидроксил, C1-6 алкоксил или нитро;
n равно нулю или единице;
R4 обозначает -(CH2)t-Y, C1-6 алкил или C3-6 циклоалкил;
R1 обозначает -CO2Z, C1-6 алкил, -CH2OH, -CONHRY или CHO;
R2 и R3 являются, независимо друг от друга, водородом или C1-6 алкилом;
Ra и Rb являются, независимо друг от друга, водородом или C1-6 алкилом; однако, когда n равно единице, Ra и Rb могут вместе образовывать радикал формулы
Y обозначает нафтил или фенил, причем оба радикала могут быть необязательно замещенными одинаковыми или различными заместителями, представляющими собой C1-6 алкил или галоген, в количестве от одного до трех;
Z представляет собой водород или C1-6 алкил;
R5, R6 и RY являются, независимо друг от друга, водородом или C1-6 алкилом; и
t равно от нуля до шести.
Настоящее изобретение также относится к способу профилактики и/или лечения опухолей, артритов и не имеющих злокачественного характера расстройств кожи, заключающемуся во введении млекопитающим соединения формулы I. Кроме того, предложен фармацевтический состав (композиция), содержащий соединение формулы I в смеси с фармацевтически приемлемым(и) наполнителем(лями).
Фиг. 1, 2 и 3 представляют собой кривые зависимости цитотоксичности от дозы для культуры клеток легкого линии L2987.
Фиг. 4 представляет собой кривую зависимости от дозы для индуцированного коллагеном артрита.
Настоящее изобретение касается соединений формулы I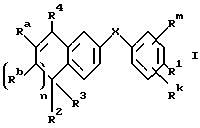
или их фармацевтически приемлемых солей, физиологически гидролизуемых эфиров или сольватов, где
X обозначает -O-CO-, -NH-CO-, -CS-NH-, -CO-O-, -CO-NH-, -COS-, -SCO-, -SCH2-, -CH2-CH2-, 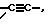 -CH2-NH-, -COCH2-, -NHCS-, -CH2S-, -CH2O-, -OCH2-, -NHCH2- или -CR5=CR6-;
-CH2-NH-, -COCH2-, -NHCS-, -CH2S-, -CH2O-, -OCH2-, -NHCH2- или -CR5=CR6-;
Rm и Rk обозначают независимо друг от друга: водород, галоген, C1-6 алкил, гидроксил, C1-6 алкоксил или нитро;
n равно нулю или единице;
R4 обозначает -(CH2)t-Y, C1-6 алкил или C3-6 циклоалкил;
R1 обозначает -CO2Z, C1-6 алкил, -CH2OH, -CONHRY или CHO;
R2 и R3 являются, независимо друг от друга, водородом или C1-6 алкилом;
Ra и Rb являются, независимо друг от друга, водородом или C1-6 алкилом;
однако, когда n равно единице, Ra и Rb могут вместе образовывать радикал формулы
Y обозначает нафтил или фенил, причем оба радикала могут быть необязательно замещенными одинаковыми или различными заместителями, представляющими собой C1-6 алкил или галоген, в количестве от одного до трех;
Z представляет собой водород или C1-6 алкил;
R5, R6 и RY являются, независимо друг от друга, водородом или C1-6 алкилом; и
t равно от нуля до шести.
В данном описании числа в индексах после символа "С" обозначают количество атомов углерода, которое может содержать отдельная группа. Например, C1-6 алкил обозначает линейные и разветвленные алкильные группы с числом атомов углерода от одного до шести, и эти группы включают метил, этил, пропил, изопропил, н-бутил, трет-бутил, н-пентил, н-гексил, 3-метилпентил или подобные алкильные группы; C3-6 циклоалкил обозначает циклопропил, цикло-бутил, циклопентил или циклогексил; и галоген обозначает фтор, хлор, бром или йод. В данном описании все символы, будучи один раз определенными, сохраняют те же значения до тех пор, пока не указано иного.
Некоторые соединения формулы I могут также образовывать фармацевтически приемлемые соли металлов и аминов, в которых катион не вносит существенного вклада в токсичность или биологическую активность соли. Эти соли также являются частью настоящего изобретения. Подходящие соли металлов включают соли натрия, калия, кальция, бария, цинка и алюминия. Предпочтительными являются соли натрия или калия. Амины, которые способны образовывать группу стабильных солей, включают триалкиламины, такие как триэтиламин, прокаин, дибензиламин, N-бензил-β-фенетиламин, 1-эфенамин, N,N'-дибензилэтилендиамин, дегидроабиетиламин, N-этил-пиперидин, бензиламин, дициклогексиламин, или подобные им фармацевтически приемлемые амины.
В том случае, когда соединения формулы I содержат карбоксильные группы, они могут образовывать физиологически гидролизуемые сложные эфиры, которые служат в качестве пролекарств ввиду того, что они гидролизуются в организме с образованием собственно соединений формулы I. Они вводятся предпочтительно перорально, так как гидролиз во многих случаях происходит преимущественно под действием пищеварительных ферментов. Парентеральное введение может быть использовано в тех случаях, когда эфир активен сам по себе, или в тех случаях, когда гидролиз происходит в крови. Примеры физиологически гидролизуемых эфиров соединений формулы I включают C1-6 алкил, бензил, 4-метоксибензил, инданил, фталидил, метоксиметил, C1-6 алканоилокси- C1-6 алкил, например ацетоксиметил, пивалоилоксиметил или пропионилоксиметил, C1-6 алкоксикарбонил-окси-C1-6 алкил, например, метоксикарбонилоксиметил или этоксикарбонилоксиметил, глицилоксиметил, фенилглицилоксиметил, (5-метил-2-оксо -1-3-диоксолен-4-ил) метил и другие хорошо известные физиологически гидролизуемые эфиры, используемые, например, в технологии пенициллина и цефалоспорина. Такие эфиры получают по стандартным методикам, известным в технологии.
Предполагается, что структурные формулы, как они изображены в данной заявке, наилучшим образом представляют структуры соединений согласно настоящему изобретению. Однако некоторые соединения, входящие в объем изобретения, могут существовать в виде других таутомерных форм, в которых атомы водорода перемещаются в другие части молекулы, и поэтому химические связи между атомами в молекуле перегруппировываются. Следует учесть, что структурные формулы представляют все таутомерные формы, которые могут существовать.
Синтез соединения формулы I может быть осуществлен посредством большого числа способов с использованием стандартных исходных веществ и процессов. Следующие далее описания синтезов и конкретные примеры предназначены лишь для целей иллюстрации, и не могут быть истолкованы как ограничивающие каким-либо образом пути получения соединений по настоящему изобретению при помощи других способов.
Обычно соединение формулы I может быть получено путем использования одного из процессов или их очевидных модификаций, как показано на Схемах с I по XXII, приведенных в конце описания. Все стадии в Схемах с I по XXII являются стандартными процессами, которые легко могут быть практически реализованы квалифицированными специалистами. Конкретные примеры, которые приведены ниже, предназначены для того, чтобы проиллюстрировать конкретные условия, которые могут использоваться для проведения определенных стадий в Схемах, и не могут рассматриваться как ограничивающие каким-либо образом эти условия.
На схемах R7 обозначает стандартную группу для защиты карбоксила; предпочтительно она является C1-6 алкилом или фенилом; еще более предпочтительно R7 является фенилом, метилом, этилом или трет-бутилом. Когда радикал R7 является трет-бутилом, он может быть удален трифторуксусной кислотой.
На стадии (а) Схемы IV соединение формулы XVIII реагирует по крайней мере с двумя эквивалентами R5Li, где R5 определен как указано выше, но предпочтительно является первичным C1-6 алкилом. (Когда требуется соединение формулы XIX, в котором R5 является водородом, предпочтительным является использование восстановителя, который превращает остаток карбоновой кислоты в альдегид в составе соединения формулы XVIII. Многие такие восстановители хорошо известны в технологии.) Затем анион производного п-[(диэтоксифосфорил) метил]бензола формулы XX может быть подвергнут взаимодействию с соединением формулы XIX согласно обычной реакции Хорнера-Уодсворта-Эммонса (см.: Org. React., 25, 73-253 (1977); Stec, Асе.Chem.Res., 411-417 (1983)) с образованием дополнительных соединений формулы I5. Последующий гидролиз приводит к получению соединения формулы I6. Альтернативно, соединение в рамках формулы I6 может быть получено в соответствии с процессом по Схеме IVa. В Схеме V R8 обозначает защищающую фенольный гидроксил группу, как например трет-бутилдиметилсилил, который может быть удален при помощи фторида тетрабутиламмония (TBAF).
Исходные соединения общей формулы XVIII в Схемах III, IV, VI, VII, XI, XII и XIII могут быть получены большим числом способов с использованием стандартных исходных веществ и процессов. Синтезы некоторых соединений в рамках формулы XVIII показаны на Схемах с XIX по XXII.
ОПИСАНИЕ КОНКРЕТНЫХ ВАРИАНТОВ РЕАЛИЗАЦИИ
Конкретные примеры, которые следуют далее, иллюстрируют синтез характерных соединений по данному изобретению и не могут быть истолкованы как ограничивающие изобретение в его области или объеме. В методы могут быть внесены различные изменения, для того чтобы получить соединения, охватываемые настоящим изобретением, но конкретно не описанные. Кроме того, для квалифицированного специалиста будут также очевидны модификации методов, позволяющие получить те же соединения несколько иным образом.
Принимается, что все температуры выражены в градусах Цельсия (C), если не определено иначе. Спектральные характеристики ядерного магнитного резонанса (ЯМР) относятся к химическим сдвигам (δ), выраженным в миллионных долях (ppm) по отношению к тетраметилсилану как образцовому стандарту. Относительная площадь, приводимая для различных сдвигов в спектральных данных протонного ЯМР, соответствует числу атомов водорода определенного функционального типа в молекуле. Характер сдвигов в смысле их мультиплетности описывается следующим образом: уширенный синглет (ушир.с), уширенный дублет (ушир. д), уширенный триплет (ушир.т), уширенный квадруплет (ушир.кв), синглет (с), мультиплет (м), дублет (д), квадруплет (кв), триплет (т), дублет дублетов (дд), дублет триплетов (дт) и дублет квадруплетов (дкв). Растворителями, применяемыми для получения ЯМР-спектров, являются ДМСО-d6 (пердейтерированный диметилсульфоксид), D2O (тяжелая вода), CDCl3 (дейтерохлороформ) и другие стандартные дейтерированные растворители. Описание инфракрасных (ИК) спектров содержит только волновые числа полос поглощения (см-1), служащие для идентификации функциональных групп.
Целит является зарегистрированной торговой маркой для диатомовой земли фирмы Johns-Manville Products Corporation.
Используемые здесь сокращения являются стандартными сокращениями, широко применяемыми в соответствующей области. Некоторые из них таковы: MS - масс-спектрометрия; HRMS - масс-спектрометрия высокого разрешения; Ar - арил; DCI - десорбционная (или прямая) химическая ионизация; Hex - гексан(ы); tBu, трет-Bu - третичный бутил; h, ч - час(ы); min, мин - минуты; Ph - фенил; THF, ТГФ - тетрагидрофуран; Tf2O - ангидрид трифторметансульфоновой кислоты; SEMC1 - 2-(триметилсилил)этоксиметилхлорид.
ПРИМЕР 1
5,5-Диметил-дигидрофуран-2-он (IV)
Раствор этиллевулината (50,0 г, 0,345 моль) в безводном этиловом эфире (200 мл) и безводном бензоле (200 мл) обрабатывали добавлением по каплям бромида метилмагния (3,0 н. раствор в диэтиловом эфире, 121,0 мл, 0,365 моль) при 0oC на протяжении 30 минут. По истечении этого времени эфир удаляли медленной перегонкой и получившийся в результате бензольный раствор нагревали с обратным холодильником в течение 2 часов. Затем добавляли при 0oC охлажденный льдом 20% раствор фосфорной кислоты (500 мл) и этилацетат (500 мл). Органическую фазу затем отделяли, промывали насыщенным раствором соли (1 х 300 мл), сушили над безводным сульфатом магния, фильтровали и упаривали в вакууме. Полученное сырое (неочищенное) масло очищали перегонкой (Т.пл. 43oC, 46,7 Па), получая 26,0 г указанного в заголовке фуран-2-она (выход 66%); 1H-ЯМР (CDCl3): δ 2,62 (т, J=8,5 Гц, 2Н), 2,05 (т, J=8,5 Гц, 2Н), 1,42 (с, 6Н).
ПРИМЕР 2
4,4-Диметил-1-тетралон (V)
К раствору безводного хлорида алюминия (0,446 моль, 59,36 г) в безводном бензоле (94,0 мл) добавляли при 5oC на протяжении периода в 45 минут 5,5-диметил-дигидрофуран-2-он (0,149 моль, 17,0 г). Затем реакционную смесь медленно нагревали до 90-100oC. Спустя 3 часа смесь гасили ледяной водой, 1 н. HCl и этилацетатом при 0oC. Органическую фазу затем отделяли и упаривали в вакууме. Остаток хроматографировали (элюируя 3% этилацетатом в гексане) на силикагеле с получением 18,70 г (выход 72%) 4,4-диметил-1-тетралона; 1H-ЯМР (CDCl3): δ 8,01 (м, 1Н), 7,50 (м, 1Н), 7,41 (м, 1Н), 7,28 (м, 1Н), 2,72 (т, J= 7,0 Гц, 2Н), 2,02 (т, J=7,0 Гц, 2Н), 1,39 (с, 6Н); MS (DCI) m/e: 174 (MH+).
Расчетное содержание для C12H14O1: C, 81,77; H, 9,14. Найдено: C, 81,70, H 9,12.
ПРИМЕР 3
4,4-Диметил-7-нитро-1-тетралон (VI)
Указанное в заголовке соединение получали согласно методике Heck & Winstein, J. Org. Chem., Vol. 37, N 6, 1972, p. 825; 1H-ЯМР (CDCl3): δ 8,84 (д, J=2,5 Гц, 1H), 8,36 (дд, J=7,0 Гц, 2,5 Гц, 1H), 7,62 (д, J=7,0 Гц, 2Н), 2,80 (т, J=7,0 Гц, 3Н), 2,08 (т, J=7,0 Гц, 3Н), 1,45 (с, 6Н); MS (DCI) m/e: 220 (МН+).
ПРИМЕР 4
4,4-Диметил-7-амино-1-тетралон (VII)
Указанное в заголовке соединение получали согласно методике Heck & Winstein, J. Org. Chem., Vol. 37, N 6, 1972, p. 825; 1H-ЯМР (CDCl3): δ 7,28 (д, J=8,5 Гц, 1H), 7,21 (д, J=2,5 Гц, 1H), 6,86 (дд, J=8,5 Гц, 2,5 Гц, 1H), 3,73 (ушир.с, 2Н), 2,70 (т, J=7,0 Гц, 2Н), 1,97 (т, J=7,0 Гц, 2Н), 1,37 (с, 6Н); MS (DCI) m/e: 190 (МН+).
ПРИМЕР 5
Метиловый эфир 4-[[(5,6,7,8-тетрагидро-5,5-диметил-8-оксо-2- нафталенил)амино]карбонил]бензойной кислоты (IXa)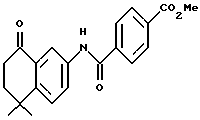
Раствор монометилтерефталата (VIIIa) (2,86 г, 15,89 ммоль) в тионилхлориде (50 мл) с 2 каплями N,N-диметилформамида перемешивали при комнатной температуре. Смесь становилась гомогенной в течение 30 минут, после чего ее упаривали в вакууме. Остаток помещали затем в 30 мл безводного пиридина и подвергали обработке 4,4-диметил-7-амино-1-тетралоном (3,0 г, 15,9 ммоль). После выдерживания в течение 16 часов при комнатной температуре к смеси добавляли 1 н. НС1. Смесь экстрагировали этилацетатом, промывали 1 н. HCl (4 х 200 мл) и промывали насыщенным бикарбонатом натрия (2 х 200 мл). Затем органическую фазу отделяли, сушили над сульфатом магния и упаривали в вакууме с получением 5,07 г (выход 91%) указанного в заголовке соединения; 1H-ЯМР (CDCl3): δ 8,27 (дд, J=8,7, 2,5 Гц, 1Н), 8,19 (ушир.с, 1Н), 8,14 (д, J=8,4 Гц, 2Н), 7,95 (д, J=8,4 Гц, 2Н), 7,91 (д, J=2,5 Гц, 1Н), 7,46 (д, J=8,7 Гц, 1Н), 3,94 (с, 3Н), 2,70 (т, J=7,0 Гц, 3Н), 2,00 (т, J=7,0 Гц, 3Н), 1,38 (с, 6Н); MS (DCI) m/e: 352 (МН+).
ПРИМЕР 6
Метиловый эфир N-[2-(триметилсилил) этоксиметил]-4- [[(5,6,7,8- тетрагидро-5,5-диметил-8-оксо-2- нафталенил)амино] карбонил] - бензойной кислоты (Xa)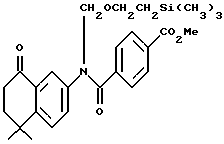
Раствор метилового эфира 4-[[(5,6,7,8-тетрагидро -5,5- диметил-8-оксо-2- нафталенил)амино] карбонил] бензойной кислоты (5,07 г, 14,4 ммоль) в безводном N,N-диметилформамиде (75 мл) подвергали обработке 80% гидридом натрия (477 мг, 15,9 ммоль). После прекращения выделения водорода медленно добавляли 2-(триметилсилил)этоксиметилхлорид (3,61 г, 21,7 моль). После выдерживания в течение 16 часов при комнатной температуре смесь разбавляли 10% бикарбонатом натрия и экстрагировали диэтиловым эфиром. Затем органическую фазу упаривали в вакууме и остаток хроматографировали (элюируя 20% этилацетатом в гексане) на кремнеземе с получением 4,24 г (выход 61%) указанного в заголовке соединения; Mg (DCI) m/e: 482 (МН+); 1H-ЯМР (CDCl3): δ 7,90 (д, J= 7,5 Гц 2H), 7,82 (с, 1H), 7,45 (д, J=7,5 Гц, 2H), 7,25 (м, 2Н), 5,22 (ушир. с, 2Н), 3,93 (с, 3Н), 3,67 (т, J=8,0 Гц, 2Н), 2,69 (т, J=7,0 Гц, 2Н), 1,98 (т, J=7,0 Гц, 2Н), 1,33 (с, 6Н); 0,96 (т, J=8,0 Гц, 2Н), 0,00 (с, 9Н).
ПРИМЕР 7
Метиловый эфир N-[2-(триметилсилил) этоксиметил]-4- [[(5,6,7,8 -тетрагидро-5,5-диметил -8-гидрокси-8-этил-2-нафталенил) амино]карбонил]бензойной кислоты (XIa)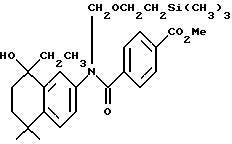
К раствору соединения Xa (1,07 г, 2,22 ммоль) в безводном тетрагидрофуране (15 мл) при -78oC добавляли бромид этилмагния (3,0 М раствор в диэтиловом эфире, 1,05 мл, 3,15 ммоль). По прошествии 10 минут реакционной смеси давали нагреться до комнатной температуры. После выдерживания в течение 3 часов при комнатной температуре реакционную смесь разбавляли этилацетатом (100 мл) и промывали водой (100 мл). Органическую фазу выпаривали и остаток хроматографировали на силикагеле (элюируя 20% этилацетатом в гексане) с получением 103 мг (выход 9%) указанного в заголовке продукта; 1H-ЯМР (CDCl3): δ 7,87 (м, 2Н), 7,40 (м, 2Н), 7,20 (м, 1Н), 7,10 (м, 2Н), 5,40 (м, 1Н), 5,20 (м, 1Н), 3,90 (с, 3Н), 3,75 (м, 2Н), 2,00 (м, 1Н), 1,78-1,42 (м, 5Н), 1,27 (с, 3Н), 1,25 (с, 3Н), 1,05 (т, J=8,0 Гц, 3H), 0,95 (м, 2Н), 0,00 (с, 9Н); MS (DCI) m/e: 494 (МН+).
ПРИМЕР 8
Метиловый эфир 4-[[(5,6-дигидро -5,5-диметил-8- этил-2-нафталенил)амино] карбонил]бензойной кислоты (I1a)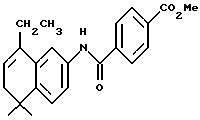
К раствору соединения XIa (169 мг, 0,33 ммоль) в толуоле (10 мл) добавляли несколько кристаллов моногидрата п-толуолсульфоновой кислоты (p-TsOH). После нагревания при 75oC в течение 5 минут реакционную смесь упаривали в вакууме и остаток хроматографировали на силикагеле (элюируя 15% этилацетатом в гексане) с получением 34 мг (выход 28%) указанного в заголовке соединения; 1H-ЯМР (CDCl3): δ 8,20 (д, J=8,5 Гц, 2Н), 7,95 (д, J=8,5 Гц, 2Н), 7,50 (м, 2Н), 7,35 (д, J=7,0 Гц, 1Н), 5,80 (т, J=4,4 Гц, 1Н), 3,95 (с, 3H), 2,50 (кв, J=7,0 Гц, 2Н), 2,20 (д, J=4,4 Гц, 2Н), 1,25 (с, 6Н); 1,10 (т, J=7,0 Гц, 3H).
ПРИМЕР 9
4-[[(5,6-Дигидро-5,5-диметил -8-этил-2-нафталенил)амино] карбонил]бензойная кислота (I2a)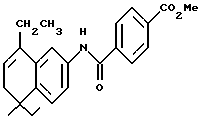
К перемешиваемому раствору соединения I1a (34 мг, 0,094 ммоль) в этаноле и тетрагидрофуране (5 мл, 1:1) добавляли 10 н. NaOH (1,0 ммоль, 0,1 мл) при комнатной температуре. После 72-часового выдерживания добавляли избыток 1 н. HCl. Осадок собирали при помощи фильтрации под вакуумом, промывали 1 н. HCl, водой, и сушили на воздухе с получением 21 мг (выход 64%) указанного в заголовке соединения; 1H-ЯМР (DMCO-d6): δ 10,32 (с, 1Н), 8,05 (с, 4Н), 7,67 (м, 2Н), 7,27 (д, J=9,0 Гц, 1Н), 5,78 (т, J=4,4 Гц, 1Н), 2,41 (кв, J=7,0 Гц, 2Н), 2,13 (д, J=4,4 Гц, 2Н), 1,18 (с, 6Н); 1,12 (т, J=7,0 Гц, 3H); 13C-ЯМР (ДМСО-d6): δ 166,79, 164,63, 164,55, 140,30, 138,64, 136,99, 136,75, 133,50, 133,26, 129,26, 127,84, 123,94, 122,48, 119,13, 115,43, 38,06, 32,86, 28,23, 25,13, 13,22; MS (DCI) m/e: 350 (МН+); ИК (KBr): 2962, 1700, 1652, 1532.
Расчетное содержание для C22H23O3N1 · 0,74H2O: C, 72,80; H, 6,80; N, 3,86. Найдено: C, 72,49, H 6,56; N, 3,74.
ПРИМЕР 10
Метиловый эфир N-[2-(триметилсилил) этоксиметил]-4- [[(5,6,7,8-тетрагидро- 5,5,8-триметил-8-гидрокси -2-нафталенил) амино] карбонил]бензойной кислоты (XIb)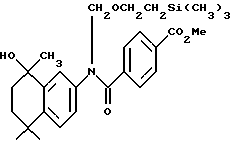
К раствору соединения Xa (438 мг, 0,91 ммоль) в безводном тетрагидрофуране (10 мл) при -78oC добавляли бромид метилмагния (3,0 М раствор в диэтиловом эфире, 0,43 мл, 1,30 ммоль). После выдерживания в течение 10 минут при -78oC реакционной смеси давали нагреться до комнатной температуры. После 3-часового выдерживания при комнатной температуре реакционную смесь разбавляли этилацетатом (100 мл) и промывали водой (100 мл). Органическую фазу выпаривали и остаток хроматографировали на силикагеле (элюируя 20% этилацетатом в гексане) с получением 90 мг (выход 20%) указанного в заголовке соединения; 1H-ЯМР (CDCl3): δ 7,90 (м, 2Н), 7,40 (м, 2Н), 7,25 (м, 2Н), 7,10 (м, 1Н), 5,25 (м, 2Н), 3,90 (с, 3H), 3,70 (м, 2Н), 1,90 (т, J=7,0 Гц, 2Н); 1,75 (т, J=7,0 Гц, 2Н); 1,30 (с, 3H), 1,29 (с, 3H), 1,27 (с, 3H), 1,00 (т, J=8,0 Гц, 3H), 0,00 (с, 9Н); MS (DCI) m/e: 480 (МН+ - H2O).
ПРИМЕР 11
Метиловый эфир 4-[[(5,6-дигидро-5,5,8 -триметил-2- нафталенил) амино] карбонил]бензойной кислоты (I1b)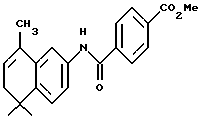
К раствору соединения XIb (218 мг, 0,44 ммоль) в толуоле (10 мл) добавляли моногидрат п-толуолсульфоновой кислоты (70 мг, 0,37 ммоль). После нагревания при 75oC в течение 15 минут реакционную смесь упаривали в вакууме и остаток хроматографировали на силикагеле (элюируя 20% этилацетатом в гексане) с получением 28 мг (выход 18%) указанного в заголовке продукта: 1H-ЯМР (CDCl3): δ 8,20 (д, J= 9,0 Гц, 2Н), 7,95 (д, J=9,0 Гц, 2Н), 7,90 (ушир. с, 1Н), 7,50 (м, 2Н), 7,35 (д, J=8,5 Гц, 1Н), 5,80 (м, 1Н), 3,95 (с, 3H), 2,25 (м, 2Н), 2,10 (д, J=l,4 Гц, 3H), 1,30 (с, 6Н); MS (DCI) m/e: 350 (МН+).
ПРИМЕР 12
4-[[(5,6-Дигидро-5,5,8-триметил -2-нафталенил)амино]карбонил] бензойная кислота (I2b)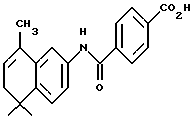
К перемешиваемому раствору соединения I1b (0,097 ммоль, 34 мг) в смеси 1: 1 этанола и тетрагидрофурана (5 мл) добавляли 10 н. NaOH (1,0 ммоль, 0,1 мл) при комнатной температуре. После 72-часового выдерживания добавляли избыток 1 н. HCl (20 мл). Осадок собирали при помощи фильтрации под вакуумом, промывали 1 н. HCl, водой и высушивали с получением 14 мг (выход 43%) указанного в заголовке соединения; 1H-ЯМР (ДМСО-d6): δ 10,32 (с, 1Н), 8,04 (с, 4Н), 7,66 (дд, J=8,3, 2,1 Гц, 1Н), 7,62 (д, J=2,1 Гц, 1Н), 7,27 (д, J= 8,3 Гц, 1Н), 5,80 (м, 1Н), 2,14 (м, 2Н), 2,01 (д, J=l,4 Гц, 3H), 1,18 (с, 6Н); 13C-ЯМР (ДМСО-d6): δ 166,79, 164,64, 139,95, 136,96, 134,15, 130,84, 129,27, 127,85, 124,41, 123,84, 119,30, 115,72, 38,25, 32,96, 28,42, 19,18; MS (DCI) m/e: 336 (МН+); ИК (KBr): 3422, 2962, 1700, 1652, 1532.
Расчетное содержание для C21H21N1O3 · 1,5H2O: C, 69,60; H, 6,68; N, 3,86. Найдено: C, 69,53, H 6,97; N, 3,76.
ПРИМЕР 13
Метиловый эфир N-[2-(триметилсилил) этоксиметил]-4- [[(5,6,7,8-тетрагидро- 5,5-диметил-8-фенил-8- гидрокси-2-нафталенил) амино] карбонил]бензойной кислоты (XIc)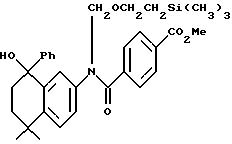
К раствору соединения Xa (595 мг, 1,24 ммоль) в безводном тетрагидрофуране при -78oC добавляли бромид фенилмагния (3,0 М раствор в диэтиловом эфире, 0,59 мл, 1,76 ммоль). После выдерживания в течение 10 минут при -78oC реакционную смесь разбавляли этилацетатом (100 мл) и промывали водой (100 мл). Органическую фазу выпаривали и остаток хроматографировали на силикагеле (элюируя 20% этилацетатом в гексане) с получением 449 мг (выход 67%) указанного в заголовке соединения; 1H-ЯМР (CDCl3): δ 7,85 (д, 2Н), 7,20-6,80 (м, 10Н), 5,20 (м, 2Н), 3,95 (с, 3H), 3,65 (м, 2Н), 2,20-2,00 (м, 2Н), 1,85 (м, 1Н), 1,50 (м, 1Н), 1,40 (с, 3H), 1,30 (с, 3H), 0,95 (м, 2Н), 0,00 (с, 9Н); MS (DCI) m/e: 542 (МН+ - H2O).
ПРИМЕР 14
Метиловый эфир 4-[[(5,6-дигидро-5,5-диметил-8- фенил-2-нафталенил)амино] карбонил]бензойной кислоты (I1c)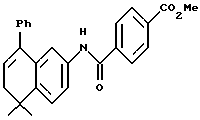
К раствору соединения XIc (в виде моногидрата, 449 мг, 0,83 ммоль) в толуоле (10 мл) добавляли п-толуолсульфоновую кислоту (190 мг, 1,0 ммоль). После нагревания при 75oC в течение 0,5 часа реакционную смесь разбавляли этилацетатом (100 мл) и промывали насыщенным раствором бикарбоната натрия (100 мл). Органическую фазу упаривали в вакууме и остаток хроматографировали на силикагеле (элюируя 15% этилацетатом в гексане) с получением 162 мг (выход 48%) указанного в заголовке соединения; 1H-ЯМР (CDCl3):  8,15 (д, J= 8,5 Гц, 2Н), 7,90 (д, J=8,5 Гц, 2Н), 7,90 (м, 1Н), 7,65 (м, 1Н), 7,40 (м, 5Н), 6,90 (м, 1Н), 6,05 (т, J=4,6 Гц, 1Н), 3,95 (с, 3H), 2,40 (д, J=4,6 Гц, 2Н), 1,40 (с, 6Н); MS (DCI) m/e: 412 (МН+).
8,15 (д, J= 8,5 Гц, 2Н), 7,90 (д, J=8,5 Гц, 2Н), 7,90 (м, 1Н), 7,65 (м, 1Н), 7,40 (м, 5Н), 6,90 (м, 1Н), 6,05 (т, J=4,6 Гц, 1Н), 3,95 (с, 3H), 2,40 (д, J=4,6 Гц, 2Н), 1,40 (с, 6Н); MS (DCI) m/e: 412 (МН+).
ПРИМЕР 15
4-[[(5,6-Дигидро-5,5- диметил-8-фенил-2- нафталенил)амино] карбонил] бензойная кислота (I2c)
К перемешиваемому раствору соединения I1c (0,21 ммоль, 86 мг) в смеси 1: 1 этанола и тетрагидрофурана (5 мл) добавляли 10 н. NaOH (2,1 ммоль, 0,21 мл) при комнатной температуре. После 72-часового выдерживания добавляли избыток 1 н. HCl (20 мл), осадок собирали при помощи фильтрации под вакуумом, промывали 1 н. HCl, водой и высушивали с получением 74 мг (выход 89%) указанного в заголовке соединения; 1H-ЯМР (ДМСО-d6): δ 10,29 (с, 1Н), 7,98 (м, 4Н), 7,76 (дд, J=8,4, 2,1 Гц, 1Н), 7,35 (м, 7Н), 5,97 (т, J=4,6 Гц, 1Н), 2,89 (д, J= 4,6 Гц, 2Н), 1,27 (с, 6Н); 13C-ЯМР (ДМСО-d6): 166,70, 164,58, 140,46, 140,33, 138,81, 138,62, 136,78, 133,39, 133,10, 129,16, 128,42, 128,35, 127,89, 127,18, 126,83, 124,04, 119,84, 118,03, 38,41, 32,99, 28,04; MS (DCI) m/e: 398 (МН+); ИК (KBr): 3056, 2958, 1700, 1652, 1532.
Расчетное содержание для C26H23O3N1 · 1,54H2O: C, 73,45; H, 5,81; N, 3,29. Найдено: C, 73,05, H 5,53; N, 3,22.
ПРИМЕР 16
4,4-Диметил-7-диазотетрафторборат-1-тетралон (XIII)
К 4,4-диметил-7-амино-1-тетралону (15,10 г, 79,89 ммоль) добавляли борофтористо-водородную кислоту (27,86 мл), разбавленную водой (27,86 мл) при 0oC. Медленно добавляли охлажденный раствор нитрата натрия (13,75 г, 199 ммоль) в воде (27,86 мл), поддерживая температуру около 10oC. Затем смесь охлаждали до 0oC, фильтровали и промывали 5% борофтористоводородной кислотой (200 мл) и высушивали в вакууме с получением 20,5 г (выход 89%) указанного в заголовке соединения; 1H-ЯМР (ДМСО-d6): δ 9,15 (д, J=2,5 Гц, 1Н), 8,75 (дд, J=8,5, 2,5 Гц, 1Н), 8,20 (д, J=8,5 Гц, 1Н), 2,87 (т, J=7,0 Гц, 2Н), 2,07 (д, J=7,0 Гц, 2Н), 1,43 (с, 6Н); MS (DCI) m/e: 193 (МН+ - N2BF4).
ПРИМЕР 17
4,4-Диметил-7-гидрокси-1-тетралон (XIV)
Соединение XIII (1,19 г, 4,13 ммоль) добавляли к уже кипящему раствору серной кислоты (3,0 мл) и воды (30 мл). После нагревания с обратным холодильником в течение 1 часа реакционную смесь охлаждали и экстрагировали этилацетатом (2 х 50 мл). Объединенные органические фазы упаривали в вакууме и остаток хроматографировали на силикагеле (элюируя 20% этилацетатом в гексане) с получением 690 мг (выход 88%) указанного в заголовке соединения; 1H-ЯМР (CDCl3): δ 7,48 (д, J=2,5 Гц, 1Н), 7,33 (д, J=8,5 Гц, 1Н), 7,05 (дд, J=8,5, 2,5 Гц, 1Н), 2,75 (т, J=7,0 Гц, 2Н), 2,00 (т, J=7,0 Гц, 2Н), 1,38 (с, 6Н).
ПРИМЕР 18
4,4-Диметил-7-трифторметансульфонат -1-тетралон (XV)
К раствору соединения XIV (690 мг, 3,63 ммоль) в безводном пиридине (10 мл) добавляли трифторметансульфоновый ангидрид (4,42 мл) при 0oC. Затем реакционной смеси давали нагреться до комнатной температуры. После 16-часового выдерживания добавляли 1 н. HCl (25 мл) и экстрагировали смесь этилацетатом (2 х 50 мл). Объединенные органические фазы сушили над безводным сульфатом магния и упаривали в вакууме с получением 1,17 г (выход 100%) указанного в заголовке соединения; 1H-ЯМР (CDCl3): δ 7,88 (д, J=2,8 Гц, 1Н), 7,52 (д, J= 8,7 Гц, 1Н), 7,40 (дд, J=8,7, 2,8 Гц, 1Н), 2,76 (т, J=7,0 Гц, 2Н), 2,04 (д, J=7,0 Гц, 2Н), 1,40 (с, 6Н); MS (DCI) m/e: 323 (МН+).
ПРИМЕР 19
Метиловый эфир 5,5-диметил-8-оксо-5,6,7,8-тетрагидро-нафталин- 2-карбоновой кислоты (XVIa)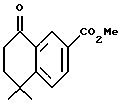
К раствору соединения XV (1,15 г, 3,57 ммоль) в метаноле (10,8 мл) и диметилсульфоксиде (10,8 мл) добавляли триэтиламин (1,09 мл, 7,82 ммоль), ацетат палладия (II) (24 мг, 0,11 ммоль) и 1,3-бис(дифенилфосфино)пропан (44 мг, 0,11 ммоль). Затем реакционную смесь насыщали моноксидом углерода при комнатной температуре и нагревали до 70oC в атмосфере моноксида углерода в продолжение 3 часов. После охлаждения до комнатной температуры реакционную смесь выливали в воду и экстрагировали этилацетатом. Органическую фазу затем упаривали в вакууме и остаток хроматографировали на силикагеле (элюируя 15% этилацетатом в гексане) с получением 692 мг (выход 93%) указанного в заголовке продукта; 1H-ЯМР (CDCl3): δ 8,66 (д, J=2,0 Гц, 1Н), 8,18 (дд, J=8,3, 2,0 Гц, 1Н), 7,52 (д, J=8,3 Гц, 1Н), 3,92 (с, 3H), 2,76 (т, J=7,0 Гц, 2Н), 2,04 (т, J=7,0 Гц, 2Н), 1,41 (с, 6Н); MS (DCI) m/e: 233 (МН+).
ПРИМЕР 20
Метиловый эфир 5,5-диметил-8-гидрокси-8-фенил- 5,6,7,8-тетрагидронафталин-2-карбоновой кислоты (XVIIa)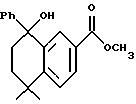
К раствору соединения XVIa (167 мг, 0,72 ммоль) в тетрагидрофуране (5 мл) при -78oC добавляли бромид фенилмагния (3,0 М раствор в диэтиловом эфире, 1,08 ммоль, 0,35 мл). После нагревания до комнатной температуры (2 часа) реакционную смесь упаривали и остаток хроматографировали на силикагеле (элюируя 10% этилацетатом в гексане) с получением 152 мг (выход 68%) указанного в заголовке продукта; 1H-ЯМР (CDCl3): δ 7,95 (дд, J=8,3, 2,0 Гц, 1Н), 7,85 (д, J=2,0 Гц, 1Н), 7,50 (д, J=8,3 Гц, 1Н), 7,25 (м, 5Н), 3,82 (с, 3H), 2,20 (м, 2Н), 1,85 (м, 1Н), 1,60 (м, 1Н), 1,43 (с, 3H), 1,38 (с, 3H); MS (DCI) m/e: 311 (МН+).
ПРИМЕР 21
5,5-Диметил-5,6-дигидро-8- фенилнафталин-2-карбоновая кислота (XVIIIa)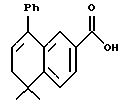
К раствору соединения XVIIa (150 мг, 0,484 ммоль) в толуоле (7 мл) добавляли несколько миллиграммов (2-4 мг) п-толуолсульфоновой кислоты. После нагревания при 70oC в течение 5 минут реакционную смесь охлаждали и упаривали в вакууме. Затем остаток растворяли в этиловом спирте (7 мл) и обрабатывали 10 н. NaOH (7,5 ммоль, 0,74 мл) при комнатной температуре. После 16-часового выдерживания добавляли избыток 1 н. HCl (30 мл) и собирали осадок при помощи фильтрации под вакуумом с получением 135 мг (выход 99%) указанного в заголовке соединения; 1H-ЯМР (ДМСО-d6): δ 7,95 (дд, J=2,0, 8,5 Гц, 1Н), 7,75 (д, J=2,0 Гц, 1Н), 7,38 (м, 5Н), 6,05 (т, J=4,6 Гц, 1Н), 2,40 (д, J=4,6 Гц, 2Н), 1,40 (с, 6Н); MS (DCI) m/e: 279 (МН+).
ПРИМЕР 22
Метиловый эфир 4-[[(5,6-дигидро-5,5- диметил-8-фенил-2- нафталенил)карбонил] амино]бензойной кислоты (I3a)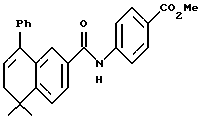
Раствор соединения (XVIIIa) (135 мг, 0,485 ммоль) в тионилхлориде (5 мл) с 2 каплями N, N-диметилформамида перемешивали при комнатной температуре. Смесь становилась гомогенной в течение 1 часа, после чего ее упаривали в вакууме. Затем остаток растворяли в безводном пиридине (5 мл), к которому был добавлен метил-4-аминобензоат (фирмы Aldrich, 0,534 ммоль, 81 мг). После выдерживания в течение 16 часов при комнатной температуре смесь разбавляли 1 н. HCl, экстрагировали этилацетатом (100 мл), промывали 1 н. HCl (3 х 100 мл) и промывали насыщенным бикарбонатом натрия (2 х 100 мл). Затем органическую фазу отделяли, сушили над сульфатом магния и упаривали в вакууме с получением 68 мг (выход 34%) указанного в заголовке соединения; 1H-ЯМР (CDCl3): δ 8,05 (д, J=7,0 Гц, 2Н), 7,75 (м, 2Н), 7,65 (д, J=7,0 Гц, 2Н), 7,50 (м, 1Н), 7,40 (м, 5Н), 6,08 (т, J=4,6 Гц, 1Н), 3,90 (с, 3H), 2,45 (т, J=4,6 Гц, 2Н), 1,40 (с, 6Н); MS (DCI) m/e: 412 (МН+).
ПРИМЕР 23
4-[[(5,6-Дигидро-5,5-диметил -8-фенил-2- нафталенил)карбонил] амино] бензойная кислота (I4a)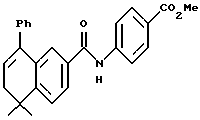
К перемешиваемому раствору соединения I3a (0,165 ммоль, 68 мг) в этаноле (5 мл) добавляли 10 н. NaOH (0,165 мл, 1,65 ммоль) при комнатной температуре. После 72-часового выдерживания добавляли избыток 1 н. HCl (30 мл). Осадок собирали при помощи фильтрации под вакуумом, промывали 1 н. HCl и водой, и сушили на воздухе с получением 45 мг (выход 69%) указанного в заголовке соединения; 1H-ЯМР (ДМСО-d6): δ 10,42 (с, 1Н), 7,83 (м, 5Н), 7,52 (д, J=8,0 Гц, 1Н), 7,38 (м, 6Н), 6,05 (т, J=4,6 Гц, 1Н), 2,33 (д, J=4,6 Гц, 2Н), 1,30 (с, 6Н); 13C-ЯМР (ДМСО-d6): 166,91, 166,00, 148,26, 143,25, 143,14, 139,86, 138,29, 133,36, 132,48, 130,17, 128,55, 128,31, 127,41, 127,31, 126,84, 125,40, 125,00, 123,95, 119,38, 119,30, 37,99, 33,52, 27,75; MS (DCI) m/e: 398 (МН+); ИК (KBr): 2958, 1688, 1596, 1522.
Расчетное содержание для C26H23N1O3 · 0,5H2O: C, 76,83; H, 5,95; N, 3,45. Найдено: C, 76,47; H, 6,00; N, 3,22.
ПРИМЕР 24
Метиловый эфир 5,5-диметил-8-гидрокси-8-этил- 5,6,7,8-тетрагидронафталин-2-карбоновой кислоты (XVIIb)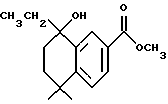
При использовании метода, аналогичного методу получения (8-фенил)-производного XVIIa, из 490 мг (2,11 ммоль) соединения XVIa получили 130 мг (выход 24%) указанного в заголовке соединения.
ПРИМЕР 25
5,6-Дигидро-8-этил-5,5-диметилнафталин-2-карбоновая (XVIIIb)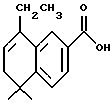
При использовании метода, аналогичного методу получения (8-фенил)-производного XVIIIa, из 130 мг (0,49 ммоль) соединения XVIIb получили 113 мг (выход 100%) указанного в заголовке продукта; 1H-ЯМР (ДМСО-d6): δ 7,98 (д, J= 2,0 Гц, 1Н), 7,95 (дд, J=8,5, 2,0 Гц, 1Н), 7,40 (д, J=8,5 Гц, 1Н), 5,83 (т, J=4,6 Гц, 1Н), 2,55 (кв, J=7,5 Гц, 2Н), 2,15 (д, J=4,6 Гц, 2Н), 1,27 (с, 6Н), 1,18 (т, J=7,5 Гц, 3H).
ПРИМЕР 26
Метиловый эфир 4-[[(5,6-дигидро-5,5-диметил-8-этил-2-нафталенил) карбонил]амино]бензойной кислоты (I3b)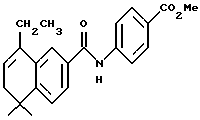
При использовании метода, аналогичного методу получения (8-фенил)-производного I3a, из 113 мг (0,491 ммоль) соединения XVIIIb получили 163 мг (выход 92%) указанного в заголовке соединения; 1H-ЯМР (CDCl3): δ 8,08 (д, J= 8,5 Гц, 2Н), 7,95 (ушир.с, 1Н), 7,79 (д, J=2,0, 1Н), 7,75 (д, J=8,5 Гц, 2Н), 7,65 (дд, J= 8,0, 2,0 Гц, 1Н), 7,40 (д, J=8,0 Гц, 1Н), 5,88 (т, J=4,6, Гц, 1Н), 3,90 (с, 3H), 2,55 (кв, J=7,5 Гц, 2Н), 2,25 (д, J=4,6 Гц, 2Н), 1,30 (с, 6Н), 1,18 (т, J=7,5 Гц, 3H); MS (DCI) m/e: 364 (МН+).
ПРИМЕР 27
4-[[(5,6-Дигидро-5,5-диметил-8-этил-2- нафталенил)карбонил] амино] бензойной кислоты (I4b)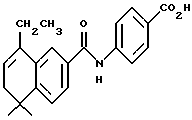
При использовании метода, аналогичного методу получения (8-фенил)-производного I4a, из 163 мг (0,45 ммоль) соединения I3b получили 128 мг (выход 92%) указанного в заголовке соединения; 1H-ЯМР (ДМСО-d6): δ 10,46 (с, 1Н), 7,91 (м, 4Н), 7,77 (м, 2Н), 7,45 (д, J=7,9 Гц, 1Н), 5,84 (т, J=4,6 Гц, 1Н), 2,52 (кв, J=7,4 Гц, 2Н), 2,17 (д, J=4,6 Гц, 2Н), 1,21 (с, 6Н), 1,11 (т, J= 7,4 Гц, 3H); 13C-ЯМР (ДМСО-d6): 166,97, 166,133, 148,61, 143,33, 136,36, 133,27, 132,54, 130,19, 126,72, 125,52, 123,95, 122,80, 122,11, 119,50, 119,41, 37,62, 33,42, 27,94, 24,65, 12,86; MS (DCI) m/e: 350 (МН+); ИК (KBr): 2964, 1690, 1596, 1524.
Расчетное содержание для C22H23O3N1 · 0,75 H2O: C, 72,81; H, 6,80; N, 3,86. Найдено: C, 72,84; H, 6,61; N, 3,86.
ПРИМЕР 28
Метиловый эфир 8-гидрокси-5,5,8-триметил-5,6,7,8- тетрагидро-нафталин-2-карбоновой кислоты (XVIIc)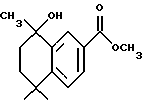
При использовании метода, аналогичного методу получения (8-фенил)-производного (XVIIa), из 292 мг (1,26 ммоль) соединения XVIa получили 188 мг (выход 60%) указанного в заголовке продукта; 1H-ЯМР (CDCl3): 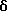 8,29 (д, J= 2,0 Гц, 1Н), 7,85 (дд, J=8,0, 2,0 Гц, 1Н), 7,38 (д, J=8,0 Гц, 1Н), 3,90 (с, 3H), 2,0 (т, J=7,0 Гц, 2Н); 1,87 (т, J=7,0 Гц, 2Н); 1,60 (д, J=l,3 Гц, 3H), 1,38 (с, 6Н).
8,29 (д, J= 2,0 Гц, 1Н), 7,85 (дд, J=8,0, 2,0 Гц, 1Н), 7,38 (д, J=8,0 Гц, 1Н), 3,90 (с, 3H), 2,0 (т, J=7,0 Гц, 2Н); 1,87 (т, J=7,0 Гц, 2Н); 1,60 (д, J=l,3 Гц, 3H), 1,38 (с, 6Н).
ПРИМЕР 29
5,6-Дигидро-5,5,8- триметилнафталин-2-карбоновая кислота (XVIIIc)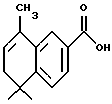
При использовании метода, аналогичного методу получения (8-фенил)-производного XVIIIa, из 188 мг (0,76 ммоль) соединения XVIIc получили 154 мг (выход 94%) указанного в заголовке соединения; 1H-ЯМР (ДМСО-d6): δ 7,96 (м, 2Н), 7,40 (д, J=8,0 Гц, 1Н), 5,87 (м, 1Н), 2,27 (м, 2Н), 2,17 (д, J=1,3 Гц, 3H), 1,27 (с, 6Н).
ПРИМЕР 30
Метиловый эфир 4-[[(5,6-дигидро-5,5,8-триметил-2-нафталенил) карбонил] амино]бензойной кислоты (I3c)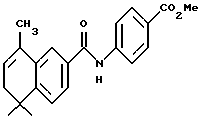
При использовании метода, аналогичного методу получения (8-фенил)-производного I3a, из 154 мг (0,713 ммоль) соединения XVIIIc получили 90 мг (выход 36%) указанного в заголовке соединения; 1H-ЯМР (CDCl3): δ 8,05 (д, J= 8,5 Гц, 2Н), 7,90 (ушир.с, 1Н), 7,75 (д, J=8,5 Гц, 2Н), 7,75 (д, J=2,0 Гц, 1Н), 7,65 (дд, J= 8,0, 2,0 Гц, 1Н), 7,43 (д, J=8,0 Гц, 1Н), 5,87 (м, 1Н), 3,92 (с, 3H), 2,27 (м, 2Н), 2,18 (д, J=l,3 Гц, 3H), 1,30 (с, 6Н); MS (DCI) m/e: 350 (МН+).
ПРИМЕР 31
4-[[(5,6-Дигидро-5,5,8-триметил-2-нафталенил) карбонил] амино]бензойная кислота (I4c)
При использовании метода, аналогичного методу получения (8-фенил)-производного I4a, из 90 мг (0,26 ммоль) соединения I3c получили 70 мг (выход 81%) указанного в заголовке соединения; 1H-ЯМР (ДМСО-d6): δ 12,72 (ушир.с, 1Н), 10,46 (с, 1Н), 7,89 (м, 5Н), 7,79 (дд, J=8,0, 2,0 Гц, 1Н), 7,72 (д, J= 2,0 Гц, 1Н), 7,45 (д, J=8,0 Гц, 1Н), 5,85 (м, 1Н), 2,17 (м, 1Н), 2,09 (д, J= 1,3 Гц, 3H), 1,22 (с, 6Н); MS (DCI) m/e: 336 (МН+); ИК (KBr): 2958, 1674, 1656, 1416; 13C-ЯМР: 166,93, 166,13, 148,21, 143,38, 133,98, 132,58, 130,63, 130,22, 126,89, 125,36, 124,90, 123,83, 122,48, 119,48, 119,39, 37,84, 33,54, 28,14, 19,12.
Расчетное содержание для C21H21N1O3: C, 75,20; H, 6,31; N, 4,1. Найдено: C, 74,90; H, 6,36; N, 3,99.
ПРИМЕР 32
1-(5,6-Дигидро-5,5-диметил-8 -фенил-нафтален-2-ил)этанон (XIXa)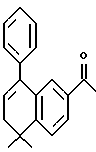
К перемешиваемому раствору соединения XVIIIa (816 мг, 2,94 ммоль) в диэтиловом эфире (15,0 мл) при -78oC добавляли метиллитий (1,4 М раствор в диэтиловом эфире, 4,19 мл, 5,88 ммоль). После выдерживания в течение 1 часа при комнатной температуре добавляли 1 н. HCl (50 мл). Органическую фазу отделяли, промывали насыщенным раствором соли (50 мл), 1 н. NaOH (50 мл), сушили над безводным сульфатом магния и упаривали с получением 600 мг (выход 74%) указанного в заголовке соединения; 1H-ЯМР (CDCl3): δ 7,83 (дд, J=8,0, 1,7 Гц, 1H), 7,63 (д, J=1,7 Гц, 1H), 7,46 (д, J=8,0 Гц, 1H), 7,37 (м, 5Н), 6,05 (т, J=4,7 Гц, 1H) 2,44 (с, 3H), 2,37 (д, J=4,7 Гц, 2Н) 1,35 (с, 6Н); MS (DCI) m/e: 277 (МН+).
ПРИМЕР 33
Этиловый эфир 4-(E,Z)-[2-(5,6 -дигидро-5,5-диметил- 8-фенил-2-нафталенил)-1 -пропенил]бензойной кислоты (I5a)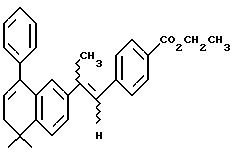
Метил-п-[(диэтоксифосфорил)метил] бензоат (1,02 г, 3,40 ммоль, получен согласно Liebigs Ann. Chem. 1985, 929) добавляли к 1 M раствору димсил-аниона в диметилсульфоксиде (3,09 мл, 3,09 ммоль, получен путем нагревания гидрида натрия в диметилсульфоксиде в течение 1 часа при 65oC). Через 30 минут смесь добавляли к раствору соединения XIXa (595 мг, 2,16 ммоль) в диметилсульфоксиде (6,50 мл) при комнатной температуре. После 3-часового выдерживания при комнатной температуре добавляли 2 М раствор этилата натрия в этаноле (1,74 мл, 3,48 ммоль). После выдерживания в течение 16 часов при комнатной температуре смесь разбавляли 5% бикарбонатом натрия (50 мл) и экстрагировали диэтиловым эфиром (50 мл х 3). Объединенные органические фазы упаривали в вакууме и остаток хроматографировали на силикагеле (5% этилацетат в гексане) с получением 159 мг (выход 18%) указанного в заголовке соединения. ЯМР показал наличие смеси изомеров (E:Z) (4:1).
ПРИМЕР 34
4-(E)-[2-(5,6-дигидро-5,5-диметил -8-фенил-2-нафталенил)-1-пропенил] бензойная кислота (I6a)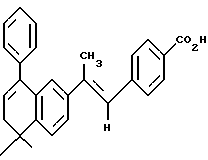
К перемешиваемому раствору соединения I5a (159 мг, 0,388 ммоль) в этаноле (15,0 мл) при комнатной температуре добавляли 10 н. раствор NaOH (0,39 мл, 3,90 ммоль). После 48-часового выдерживания смесь разбавляли избытком 1 н. HCl (40 мл) и затем фильтровали. После промывания водой и высушивания твердую фазу перекристаллизовывали из этанола, что давало 60 мг (выход 40%) указанного в заголовке соединения; 1H-ЯМР (ДМСО-d6): δ 7,91 (д, J=8,3 Гц, 2Н), 7,42 (м, 9Н), 7,06 (д, J=1,7 Гц, 1Н), 6,70 (с, 1Н), 6,03 (т, J=4,6 Гц, 1Н), 2,34 (д, J=4,6 Гц, 2Н), 2,12 (с, 3H); 1,31 (с, 6Н); 13C-ЯМР (ДМСО-d6): 144,42, 140,58, 140,14, 138,94, 138,72, 133,12, 129,26, 129,07, 128,47, 128,35, 127,32, 126,71, 125,89, 125,32, 124,07, 123,06, 38,25, 33,16, 27,94, 17,38; MS (DCI) m/e: 395 (МН+); ИК (KBr): 2958, 1680, 1602, 1292.
Расчетное содержание для C27H26O2: C, 84,78; H, 6,85. Найдено: C, 84,98, H, 6,66.
ПРИМЕР 35
4,4-Диметил-7-[(трет-бутилдиметилсилил) окси]-1-тетралон (XXIа)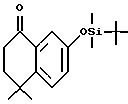
К раствору соединения XIV (2,00 г, 10,5 ммоль) в диметилформамиде (16 мл) добавляли трет-бутилдиметилсилил-хлорид (1,90 г, 12,6 ммоль) и имидазол (1,79 г, 26,3 ммоль) при комнатной температуре. Через 5 часов добавляли 5% NaHCO3 (50 мл) и смесь экстрагировали гексаном (2 х 75 мл). Объединенные органические фазы сушили над безводным сульфатом магния и упаривали в вакууме с получением 3,22 г (выход 99%) указанного в заголовке соединения; 1H-ЯМР (CDCl3): δ 7,44 (д, J=2,8 Гц, 1Н), 7,29 (д, J=8,7 Гц, 1Н), 7,01 (дд, J=8,7, 2,8 Гц, 1Н), 2,71 (т, J=7,0 Гц, 2Н), 1,99 (д, J=7,0 Гц, 2Н), 1,36 (с, 6Н), 0,98 (с, 9Н), 0,20 (с, 6Н); MS (DCI) m/e: 305 (МН+).
ПРИМЕР 36
2-[(трет-Бутилдиметилсилил)окси] -5,6-дигидро-5,5-диметил-8- трифторметансульфонилнафталин (XXIIа)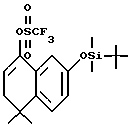
К раствору соединения XXIa (2,73 г, 8,98 ммоль) в тетрагидрофуране (80,0 мл) при -78oC добавляли бис(триметилсилил)амид натрия (1,0 М раствор в тетрагидрофуране, 9,88 ммоль, 9,88 мл) и N-(2-пиридил)имид трифторметансульфоновой кислоты (9,88 ммоль, 3,54 г). После перемешивания в течение 1 часа при -78oC и в течение 1,5 часов при комнатной температуре реакционную смесь упаривали в вакууме и остаток хроматографировали на силикагеле (элюируя 10% этилацетатом в гексане) с получением 2,26 г (выход 58%) указанного в заголовке продукта; 1H-ЯМР (CDCl3): δ 7,15 (д, J=8,4 Гц, 1Н), 6,85 (д, J=2,5 Гц, 1Н), 6,78 (дд, J=8,4 Гц, 2,5 Гц, 1Н), 5,94 (т, J=4,8 Гц, 1Н), 2,38 (д, J=4,8 Гц, 2Н), 1,27 (с, 6Н), 0,98 (с, 9Н), 0,20 (с, 6Н); MS (DCI) m/e: 437 (МН+).
ПРИМЕР 37
2-(трет-Бутилдиметилсилилокси) -5,6-дигидро-5,5-диметил-8-фенилнафталин (XXIIIa)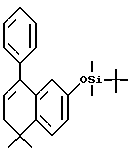
К раствору соединения XXIIa (2,26 г, 5,18 ммоль) в 1-метил-2-пирролидиноне (25,0 мл) при комнатной температуре добавляли трифениларсин (300 мг, 0,980 ммоль), трис(дибензилиденацетон)дипалладий(0) (147 мг, 0,16 ммоль) и трибутилфенилолово (4,18 г, 11,4 ммоль). После перемешивания при 85oC в течение 16 часов добавляли воду (50 мл) и этилацетат (50 мл). Органическую фазу отделяли и перемешивали над насыщенным водным раствором фторида калия в течение 30 минут. Органическую фазу снова отделяли, упаривали в вакууме и остаток хроматографировали на силикагеле (элюируя 100% гексаном) с получением 1,10 г (выход 58%) указанного в заголовке продукта; 1H-ЯМР (CDCl3): δ 7,10 (м, 5Н), 6,97 (д, J=8,4 Гц, 1Н), 6,41 (дд, J=8,4 Гц, 2,5 Гц, 1Н), 6,20 (д, J=2,5 Гц, 1Н), 5,68 (т, J=4,8 Гц, 1Н), 2,05 (д, J=4,8 Гц, 2Н), 1,02 (с, 6Н), 0,60 (с, 9Н), 0,00 (с, 6Н); MS (DCI) m/e: 365 (МН+).
ПРИМЕР 38
5,6-Дигидро-5,5-диметил -8-фенилнафталин-2-ол (XXVa)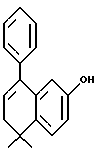
К раствору соединения XXIIIa (1,10 г, 3,02 ммоль) в тетрагидрофуране (10,0 мл) при комнатной температуре добавляли фторид тетрабутиламмония (1,0 М раствор в тетрагидрофуране, 3,32 мл, 3,32 ммоль). Через 5 минут реакционную смесь упаривали в вакууме и остаток хроматографировали на силикагеле (элюируя 10% этилацетатом в гексане) с получением 575 мг (выход 76%) указанного в заголовке продукта; 1H-ЯМР (CDCl3): δ 7,36 (m, 5Н), 7,23 (д, J=8,3 Гц, 1Н), 6,71 (дд, J=8,3, 2,7 Гц, 1Н), 6,49 (д, J=2,7 Гц, 1Н), 5,99 (т, J= 4,6 Гц, 1Н), 2,34 (д, J=4,6 Гц, 2Н), 1,32 (с, 6Н); MS (DCI) m/e: 251 (МН+).
ПРИМЕР 39
Ди-(трет-бутил)-терефталат (XXVI)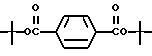
К раствору терефталоилхлорида (2,00 г, 9,85 ммоль) в безводном пиридине (25,0 мл) добавляли трет-бутиловый спирт (803 мг, 10,8 ммоль). После выдерживания в течение 16 часов добавляли воду (75 мл) и твердую фазу отфильтровывали. Твердую фазу растворяли в диэтиловом эфире (40 мл) и промывали насыщенным бикарбонатом натрия (2 х 75 мл). Органическую фазу затем сушили над безводным сульфатом магния и упаривали в вакууме с получением 1,15 г (выход 42%) указанного в заголовке соединения; 1H-ЯМР (CDCl3): δ 8,01 (с, 4Н), 1,60 (с, 18Н).
ПРИМЕР 40
Моно-(трет-бутил)-терефталат (XXVII)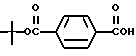
К раствору гидроксида калия (255 мг, 4,55 ммоль) в 4 мл трет-бутилового спирта с 0,5 мл воды, добавленной для растворимости, добавляли соединение XXVI (1,15 г, 4,14 ммоль) в трет-бутиловом спирте (5,5 мл). После выдерживания в течение 3 часов при 50oC добавляли диэтиловый эфир (35 мл) и реакционную смесь фильтровали. Твердую фазу растворяли в воде (35 мл), экстрагировали метиленхлоридом (2 х 50 мл) и затем подкисляли 1 н. HCl. Затем собирали осадок с получением 270 мг (выход 30%) указанного в заголовке соединения; 1H-ЯМР (CDCl3): 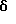 8,02 (м, 4Н), 1,56 (с, 9Н); MS (DCI) m/e: 223 (МН+).
8,02 (м, 4Н), 1,56 (с, 9Н); MS (DCI) m/e: 223 (МН+).
ПРИМЕР 41
Трет-бутиловый эфир 4-[[(5,6-дигидро- 5,5-диметил-8-фенил- 2-нафталенил)окси]карбонил]бензойной кислоты (I7a)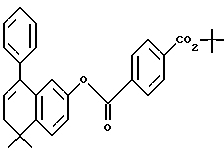
К раствору соединения XXVII (107 мг, 0,480 ммоль) в метиленхлориде (5 мл) при 0oC добавляли оксалилхлорид (0,15 мл) и диметилформамид (2 капли). После 2-часового выдерживания при комнатной температуре реакционную смесь упаривали в вакууме с получением хлорангидрида соответствующей кислоты (соединение XXIVa). К раствору соединения XXIVa (0,480 ммоль) в безводном пиридине (5 л) добавляли затем соединение XXVa (120 мг, 0,48 ммоль). После выдерживания в течение 16 часов при комнатной температуре смесь разбавляли 1 н. HCl, экстрагировали этилацетатом (100 мл), промывали 1 н. HCl (4 х 100 мл) и промывали насыщенным бикарбонатом натрия (2 х 100 мл). Затем органическую фазу отделяли, сушили над сульфатом магния и упаривали в вакууме с получением 137 мг (выход 63%) указанного в заголовке соединения; 1H-ЯМР (CDCl3): δ 8,16 (д, J=8,4 Гц, 2Н), 8,06 (д, J=8,4 Гц, 2Н), 7,35 (м, 6Н), 7,07 (дд, J=8,4 Гц, 2,4 Гц, 1Н), 6,84 (д, J=2,4 Гц, 1Н), 6,04 (т, J=4,6 Гц, 1Н), 2,38 (д, J=4,6 Гц, 2Н), 1,61 (с, 9Н), 1,36 (с, 6Н); MS (DCI) m/e: 455 (МН+).
ПРИМЕР 42
4-[[(5,6-Дигидро-5,5-диметил-8-фенил -2-нафталенил)окси] карбонил] бензойная кислота (I8a)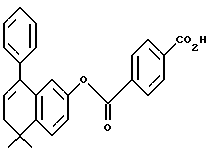
К раствору соединения I7a (137 мг, 0,30 ммоль) в метиленхлориде (5 мл) добавляли трифторуксусную кислоту (0,270 мл) при комнатной температуре. После 72-часового выдерживания добавляли 1 н. HCl (30 мл). Осадок собирали при помощи фильтрации под вакуумом, промывали 1 н. HCl и сушили на воздухе с получением 85 мг (выход 71%) указанного в заголовке соединения; 1H-ЯМР (CDCl3): δ 13,39 (ушир.с, 1Н), 8,15 (д, J=7,6 Гц, 2Н), 8,05 (д, J=7,6 Гц, 2Н), 7,38 (м, 6Н), 7,18 (д, J=8,4 Гц, 1Н), 6,73 (с, 1Н), 6,06 (т, J=4,2 Гц, 1Н), 2,35 (д, J=4,2 Гц, 2Н), 1,32 (с, 6Н); 13C-ЯМР (CDCl3): 166,48, 163,99, 148,51, 142,55, 139,77, 138,17, 135,24, 134,59, 132,45, 131,61, 130,01, 129,66, 129,48, 128,57, 128,28, 127,63, 127,41, 125,24, 120,74, 118,36, 67,39, 38,24, 38,07, 33,12, 28,37; MS (DCI) m/e: 399 (МН+); ИК (KBr): 2964, 1738, 1698, 1246.
Расчетное содержание для C24H22O4 · 0,5H2O: C, 76,64; H, 5,69. Найдено: C, 76,66, H, 5,89.
ПРИМЕР 43
Трет-бутиловый эфир 4-гидроксибензойной кислоты (XXVIIIa).
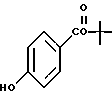
К раствору 4-гидроксибензойной кислоты (2,0 г, 14,5 ммоль) в 1,4-диоксане (10,0 мл), насыщенном изобутиленом при -78oC в металлической бомбе, добавляли концентрированную серную кислоту (0,150 мл). Бомбу герметизировали и нагревали до комнатной температуры. После выдерживания в течение 72 часов при комнатной температуре реакционную смесь охлаждали до -78oC, выливали в насыщенный бикарбонат натрия (30,0 мл) и экстрагировали диэтиловым эфиром (2 х 50,0 мл). Объединенные органические фазы упаривали и остаток хроматографировали на силикагеле (элюируя 5% метанолом в метиленхлориде) с получением 290 мг (выход 10%) указанного в заголовке продукта; 1H-ЯМР (CDCl3): δ 7,89 (д, J=8,8 Гц, 2Н), 6,83 (д, J=8,8 Гц, 2Н), 1,57 (с, 9Н).
ПРИМЕР 44
Трет-бутиловый эфир 4-[[(5,6-дигидро-5,5- диметил-8-фенил-2-нафталенил)карбонил] окси]бензойной кислоты (I9a)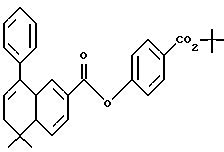
К перемешиваемому раствору соединения XVIIIa (200 мг, 0,720 ммоль) в безводном метиленхлориде (7,00 мл) при 0oC добавляли оксалилхлорид (0,075 мл) и диметилформамид (2 капли). После выдерживания в течение 2 часов при комнатной температуре смесь упаривали в вакууме. К остатку в безводном пиридине (5,00 мл) добавляли соединение XXVIIIa (154 мг, 0,792 ммоль). После выдерживания в течение 2 часов при комнатной температуре смесь разбавляли 1 н. НСl, экстрагировали этилацетатом (50 мл), промывали 1 н. HCl (4 х 100 мл) и промывали насыщенным бикарбонатом натрия (2 х 100 мл). Затем органическую фазу отделяли, упаривали в вакууме и остаток хроматографировали на силикагеле (элюируя 3% этилацетатом в гексане) с получением 203 мг (выход 61%) указанного в заголовке продукта; 1H-ЯМР (CDCl3): δ 8,05 (м, 3H), 7,85 (д, J= 1,7 Гц, 1Н), 7,51 (д, J=8,1 Гц), 7,38 (м, 6Н), 7,18 (д, J=8,6 Гц, 1Н), 6,07 (т, J= 4,6 Гц, 1Н), 2,40 (д, J=4,6 Гц, 2Н), 1,59 (с, 9Н), 1,38 (с, 6Н); MS (DCI) m/e: 455 (МН+).
ПРИМЕР 45
4-[[(5,6-Дигидро-5,5-диметил-8-фенил-2-нафталенил)карбонил] окси] бензойная кислота (I10a)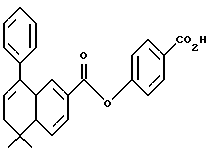
К раствору соединения I9a (203 мг, 0,480 ммоль) в метиленхлориде (5,00 мл) добавляли трифторуксусную кислоту (0,400 мл) при комнатной температуре. После 16-часового выдерживания добавляли 1 н. HCl (30 мл). Осадок собирали при помощи фильтрации под вакуумом, промывали 1 н. HCl и сушили на воздухе с получением 133 мг (выход 75%) указанного в заголовке соединения; 1H-ЯМР (ДМСО-d6): 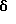 8,05-7,31 (м, 12Н), 6,10 (т, J=4,6 Гц, 1Н), 2,39 (д, J=4,6 Гц, 2Н), 1,34 (с, 6Н); ИК (KBr): 2962, 1742, 1684, 1602; MS (DCI) m/e: 399 (MH+).
8,05-7,31 (м, 12Н), 6,10 (т, J=4,6 Гц, 1Н), 2,39 (д, J=4,6 Гц, 2Н), 1,34 (с, 6Н); ИК (KBr): 2962, 1742, 1684, 1602; MS (DCI) m/e: 399 (MH+).
Расчетное содержание для C24H22O4 · 0,850H2O: C, 75,47; H, 5,77. Найдено: C, 75,52; H, 5,43.
ПРИМЕР 46
Метиловый эфир 5,5-диметил-8-гидрокси-8-(2- фторфенил)-5,6,7,8-тетрагидро-нафталин-2-карбоновой кислоты (XVIId)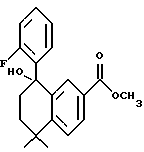
К раствору соединения XVIa (297 мг, 1,28 ммоль) в тетрагидрофуране (7,0 мл) при -78oC добавляли 2-фторфениллитий [0,35 М раствор в ТГФ, 1,93 ммоль, 5,50 мл; получен обработкой 2-фтор-бромбензола (552 мг, 3,15 ммоль) в тетрагидрофуране (5,0 мл) трет-бутиллитием (1,7 М раствор в пентане, 2,41 ммоль, 4,09 мл) при -78oC. После выдерживания в течение 5 минут при -78oC, 5,50 мл перемещали при помощи шприца в раствор соединения XVIa]. После нагревания до комнатной температуры (1 час) реакционную смесь упаривали и остаток хроматографировали на силикагеле (элюируя 10% этилацетатом в гексане) с получением 280 мг (выход 67%) указанного в заголовке продукта; 1H-ЯМР (CDCl3): δ (дд, J=8,4, 1,7 Гц 1Н), 7,72 (д, J=l,7, Гц, 1Н), 7,50 (м, 2Н), 7,18 (м, 1Н), 6,96 (м, 2Н), 3,80 (с, 3H), 2,50 (м, 1Н), 2,40 (д, J=2,8, Гц, 1Н), 2,05 (м, 2Н), 1,60 (м, 1Н), 1,43 (с, 3H), 1,35 (с, 3H); MS (DCI) m/e: 329 (МН+).
ПРИМЕР 47
5,5-Диметил-8-дигидро-8-(2-фторфенил)-нафталин-2-карбоновая кислота (XVIIId)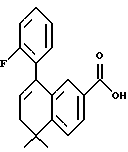
Используя метод, описанный для получения (8-фенил)-производного XVIIIa, из 280 мг (0,85 ммоль) соединения XVIId получили 209 мг (выход 83%) указанного в заголовке продукта: 1H-ЯМР (ДМСО-d6): δ 7,81 (дд, J=8,0, 1,7 Гц, 1Н), 7,55-7,25 (м, 6Н), 6,09 (т, J=4,5 Гц, 1Н), 2,38 (д, J=4,5 Гц, 2Н), 1,32 (с, 6Н); MS (DCI) m/e: 297 (МН+).
ПРИМЕР 48
Метиловый эфир 4-[[(5,6-дигидро-5,5-диметил-8- (2-фтор-фенил)-2-нафталенил)карбонил] амино]бензойной кислоты (I3g)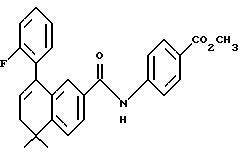
Раствор соединения XVIIId (200 мг, 0,676 ммоль) в безводном метиленхлориде (5,0 мл) обрабатывали оксалилхлоридом (0,20 мл, 2,29 ммоль) и 2 каплями N, N-диметилформамида при 0oC. Затем реакционную смесь перемешивали при комнатной температуре. Через 2 часа смесь упаривали в вакууме. Остаток растворяли в безводном пиридине (5,0 мл), к которому был добавлен метил-4-аминобензоат (фирмы Aldrich, 102 мг, 0,68 ммоль). После выдерживания в течение 2 часов при комнатной температуре смесь разбавляли 1 н. HCl, экстрагировали этилацетатом (100 мл), промывали 1 н. HCl (3 х 100 мл) и промывали насыщенным бикарбонатом натрия (2 х 100 мл). Затем органическую фазу отделяли и упаривали в вакууме. Остаток хроматографировали на силикагеле (элюируя 20% этилацетатом в гексане) с получением 226 мг (выход 78%) указанного в заголовке соединения; 1H-ЯМР (CDCl3): δ 8,02 (д, J=8,7 Гц, 1Н), 7,71 (м, 1H), 7,64 (д, J=8,7 Гц, 1Н), 7,48 (д, J=8,0 Гц, 1H), 7,40-7,10 (м, 7Н), 6,11 (т, J=4,5 Гц, 1H), 3,90 (с, 3H), 2,42 (д, J=4,5 Гц, 2Н), 1,39 (с, 6Н); MS (DCI) m/e: 430 (МН+).
ПРИМЕР 49
4-[[(5,6-Дигидро-5,5-диметил- 8-(2-фторфенил)- 2-нафталенил)карбонил]амино]бензойная кислота (I4g)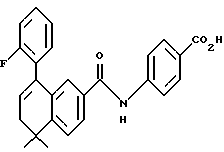
Используя метод, описанный для получения (8-фенил)-производного I4a, из 226 мг (0,527 ммоль) соединения I4a получали 180 мг (выход 82%) указанного в заголовке соединения; 1H-ЯМР (ДМСО-d6): δ 12,73 (с, 1Н), 10,43 (с, 1Н), 7,89-7,78 (м, 5Н), 7,53 (д, J=8,0 Гц, 1Н), 7,48-7,19 (м, 5Н), 6,10 (т, J=4,5 Гц, 1Н), 2,38 (д, J=4,5 Гц, 2Н), 1,33 (с, 6Н); 13C-ЯМР (ДМСО-d6): 166,89, 165,80, 161,12, 147,85, 143,24, 133,08, 138,17, 135,24, 132,95, 132,57, 131,54, 130,18, 129,93, 129,48, 126,91, 125,37, 124,88, 124,29, 123,86, 119,42, 119,33, 115,75, 115,46, 38,24, 37,89, 33,48, 27,75; MS (DCI) m/e: 416 (МН+); ИК (KBr): 2962, 1688, 1594, 1520.
Расчетное содержание для C26H22N1O3F1 · 0,25H2O: C, 74,36; H, 5,40; N, 3,34. Найдено: C, 74,50; H, 5,40; N, 3,17.
ПРИМЕР 50
Метиловый эфир 5,5-диметил-8-оксо-5,8-дигидронафталин-2- карбоновой кислоты (XXXa)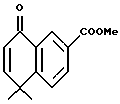
Смесь соединения формулы XVI (Схема XXI), в которой R7 представляет собой метил (2,00 г, 8,60 ммоль), хлортриметилсилана (TMS-Cl, 1,12 г, 10,3 ммоль) и 1,8-диазабицикло[5.4.0]ундека-7-ена (DBU, 1,70 г, 11,2 ммоль) в 10 мл безводного метиленхлорида перемешивали при нагревании с обратным холодильником в течение 1 часа. Смесь разбавляли 75 мл диэтилового эфира, промывали 20 мл 0,1 н. HCl, 20 мл воды и сушили над сульфатом магния. Растворитель выпаривали и остаток сушили в вакууме. К остатку добавляли 30 мл ацетонитрила и ацетат палладия (2,12 г, 9,50 ммоль). После перемешивания в продолжение 16 часов дополнительно добавляли ацетат палладия (1,06 г, 4,75 ммоль) и получившуюся в результате смесь перемешивали в течение 16 часов. Смесь фильтровали через пад из целита и промывали ацетонитрилом. Собранный фильтрат выпаривали и остаток разбавляли водой (30 мл) и экстрагировали эфиром (30 мл х 3). Объединенные экстракты сушили над сульфатом магния, фильтровали и выпаривали. Остаток очищали при помощи флэш-хроматографии на силикагеле (элюируя смесью EtOAc:гексан в соотношении от 1:20 до 1:5) с получением 1,42 г (выход 64%) указанного в заголовке соединения в виде твердой фазы; 1H-ЯМР (CDCl3): δ 1,50 (с, 6Н); 3,90 (с, 3H), 6,41 (д, J=10,2 Гц, 1Н), 6,94 (д, J= 10,2 Гц, 1Н), 7,62 (д, J=8,2 Гц, 1Н), 8,22 (дд, J=2,0, 8,2 Гц, 1Н), 8,82 (д, J=2,0 Гц, 1Н); MS (DCI) m/e: 321 (МН+).
ПРИМЕР 51
Метиловый эфир 5,5,6-триметил-8-оксо- 5,6,7,8- тетрагидро-нафталин-2-карбоновой кислоты (XXXIa)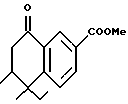
К суспензии цианида меди (I) (724 мг, 8,08 ммоль) в 40 мл безводного эфира медленно добавляли метиллитий (1,4 М в эфире, 11,5 мл, 16,2 ммоль) при -50oC. После перемешивания в течение 1 часа раствор охлаждали до -78oC и добавляли эфират трифторида бора (573 мг, 4,04 ммоль), с последующим медленным добавлением эфира енона XXXa (930 мг, 4,04 ммоль) в 10 мл эфира. После перемешивания в течение 45 мин реакционную смесь гасили насыщенным раствором хлорида аммония (30 мл). Смесь экстрагировали эфиром (30 мл х 3). Объединенные эфирные экстракты сушили над сульфатом магния, фильтровали и выпаривали. Остаток очищали при помощи флэш-хроматографии на силикагеле (элюируя смесью гексан:EtOAc в соотношении от 20:1 до 5:1) с получением 251 мг (выход 25%) указанного в заголовке соединения в виде твердой фазы; 1H-ЯМР (CDCl3): δ 1,05 (д, J=6,9 Гц, 3H), 1,30, 1,44 (с, 3H каждый); 2,15-2,30 (м, 1Н), 2,55 (дд, J=9,3, 17,5 Гц, 1Н), 2,81 (дд, J=4,5, 17,5 Гц, 1H), 3,93 (с, 3H), 7,55 (д, J=8,3 Гц, 1Н), 7,69 (дд, J=1,9, 8,3 Гц, 1Н), 8,66 (д, J=1,9 Гц, 1H); MS (DCI) m/e: 247 (MH+).
Расчетное содержание для C15H18O3: C, 73,15; H, 7,37. Найдено: C, 72,78; H, 7,31.
ПРИМЕР 52
Метиловый эфир 5,5,6-триметил-8-фенил- 5,6-дигидронафталин-2-карбоновой кислоты (XXXIIa)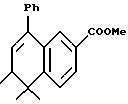
К раствору соединения XXXIa (390 мг, 1,58 ммоль) в 10 мл безводного тетрагидрофурана добавляли бромид фенилмагния (3,0 М раствор в эфире, 1,05 мл, 3,15 ммоль) при -30oC. После перемешивания в течение 10 минут температуру раствора повышали до 0oC и перемешивали в течение 20 мин Реакцию гасили 20 мл насыщенного раствора хлорида аммония и проводили экстракцию этилацетатом (25 мл х 3). Объединенные экстракты промывали водой (20 мл), сушили над сульфатом магния, фильтровали и выпаривали. К остатку добавляли 20 мл безводного бензола и п-толуолсульфоновую кислоту (50 мг). Раствор перемешивали при нагревании с обратным холодильником в течение 30 мин и затем выпаривали. Остаток очищали при помощи флэш-хроматографии на силикагеле (элюируя смесью EtOAc:гексан в соотношении от 1:20 до 1:10) с получением 380 мг (выход 78%) указанного в заголовке соединения в виде светло-желтого масла; 1H-ЯМР (CDCl3): δ 1,01 (д, J=7,1 Гц, 3H), 1,29, 1,36 (с, 3H каждый); 2,35-2,43 (м, 1Н), 3,82 (с, 3H), 5,94 (д, J=5,0 Гц, 1Н), 7,33-7,42 (м, 5Н), 7,43 (д, J= 8,1 Гц, 1Н), 7,69 (д, J=1,8 Гц, 1Н), 7,90 (дд, J=1,8, 8,1 Гц, 1Н); MS (DCI) m/e: 307 (МН+).
Расчетное содержание для C21H22O2: C, 82,32; H, 7,24. Найдено: C, 82,10; H, 7,32.
ПРИМЕР 53
5,5,6-Триметил-8-фенил-5,6 -дигидронафталин-2-карбоновая кислота (XVIIIe).
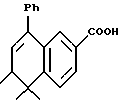
Раствор соединения XXXIIa (224 мг, 0,73 ммоль) и 2 н. NaOH (3,7 мл, 7,4 ммоль) в 7 мл тетрагидрофурана и 7 мл метанола перемешивали при 60oC в продолжение 1,5 часов. Смесь упаривали под пониженным давлением и подкисляли 10 мл 1 н. HCl, экстрагировали EtOAc (20 мл х 3). Объединенные экстракты промывали водой (10 мл), сушили над сульфатом магния, фильтровали и выпаривали. Остаток кристаллизовали из смеси эфира и гексана с получением 220 мг (количественный выход) указанного в заголовке соединения в виде твердого вещества; 1H-ЯМР (CDCl3): δ 1,02 (д, J=7,1 Гц, 3H), 1,31, 1,37 (с, 3H каждый); 2,35-2,45 (м, 1Н), 5,95 (д, J=5,1 Гц, 1Н), 7,30-7,40 (м, 5Н), 7,46 (д, J=8,1 Гц, 1Н), 7,73 (д, J=1,9 Гц, 1Н), 7,94 (дд, J=1,9, 8,1 Гц, 1Н); MS (DCI) m/e: 293 (МН+).
Расчетное содержание для C20H20O2 · 0,125H2O: C, 81,53; H, 6,93. Найдено: C, 81,68; H, 6,86.
ПРИМЕР 54
Метиловый эфир 4-[[(5,6-дигидро-5,5,6- триметил-8-фенил-2-нафталенил) карбонил]амино]бензойной кислоты (I3d)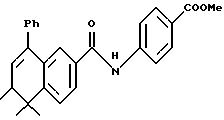
К раствору соединения XVIIIe (206 мг, 0,71 ммоль) в 4 мл метиленхлорида добавляли оксалилхлорид (179 мг, 1,41 ммоль) и 1 каплю диметилформамида при 0oC. Реакционную смесь перемешивали при 0oC в течение 2 часов и при комнатной температуре в течение 1 часа. Растворитель выпаривали и остаток сушили в вакууме. К остатку добавляли метил-п-аминобензоат (128 мг, 0,85 ммоль) и 4 мл безводного пиридина. Смесь перемешивали при комнатной температуре в продолжение 18 часов. Растворитель выпаривали и остаток разбавляли 1 н. HCl (20 мл) и экстрагировали EtOAc (20 мл х 3). Объединенные экстракты сушили над сульфатом магния, фильтровали и выпаривали. Остаток очищали при помощи флэш-хроматографии на силикагеле (элюируя смесью гексан: EtOAc в соотношении от 10:1 до 5:1) с получением 234 мг (выход 78%) указанного в заголовке соединения в виде пены; 1H-ЯМР (CDCl3): δ 1,03 (д, J=7,1 Гц, 3H), 1,30, 1,37 (с, 3H каждый); 2,35-2,45 (м, 1Н), 3,90 (с, 3H), 5,98 (д, J=5,0 Гц, 1Н), 7,30-7,40 (м, 5Н), 7,46 (д, J=8,1 Гц, 1Н), 7,51 (д, J=1,8 Гц, 1Н), 7,65 (д, J= 8,7 Гц, 1H), 7,72 (дд, J=1,8, 8,1 Гц, 1H), 7,97 и 8,00 (с поверх д, 8,7 Гц, 3Н); MS (DCI) m/e: 426 (МН+).
Расчетное содержание для C28H27NO3 · 0,5H2O: C, 77,39; H, 6,50; N, 3,22. Найдено: C, 77,34; H, 6,19; N, 3,33.
ПРИМЕР 55
4-[[(5,6-Дигидро-5,5,6-триметил-8-фенил-2- нафталенил)карбонил] амино] бензойная кисло (I4d)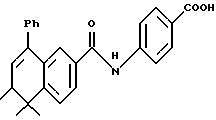
Смесь соединения I3d (224 мг, 0,53 ммоль) и 2 н. NaOH (2,65 мл, 5,30 ммоль) в 5 мл тетрагидрофурана и 5 мл метанола перемешивали при комнатной температуре в продолжение 1,5 часов. Получившийся раствор подкисляли 1 н. HCl и упаривали под пониженным давлением. Остаток разбавляли 20 мл воды и фильтровали. Собранную твердую фазу растирали в эфире с получением 127 мг (выход 59%) указанного в заголовке продукта в виде светло-желтого порошка; 1H-ЯМР (ДМСО-d6): δ 0,97 (д, J= 7,1 Гц, 3H), 1,26, 1,31 (с, 3H каждый); 2,37-2,41 (м, 1H), 5,98 (д, J=5,0 Гц, 1H), 7,31-7,45 (м, 6Н), 7,54 (д, J=8,1 Гц, 1Н), 7,79-7,89 (м, 6Н), 10,43 (с, 1H), 12,72 (с, 1H); MS (DCI) m/e: 411 (МН+).
Расчетное содержание для C27H25NO3 · 0,5H2O: C, 77,12; H, 6,23; N, 3,33. Найдено: C, 77,41; H, 6,05; N, 3,26.
ПРИМЕР 56
Метиловый эфир 5,5,7-триметил-8-оксо-5,6,7,8- тетрагидро-нафталин-2-карбоновой кислоты (XXXVa)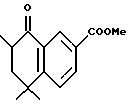
К раствору соединения формулы XVI (Схема XXII), в которой R7 представляет собой метил (0,60 г, 2,58 ммоль), в 10 мл безводного тетрагидрофурана и 1 мл гексаметилфосфорамида (НМРА) добавляли бис(триметилсилил)амид лития (LHMDS, 1 М в гексане, 2,71 мл, 2,71 ммоль) при -78oC в атмосфере азота. После перемешивания в течение 2 часов раствор нагревали до -40oC и добавляли метилйодид (0,73 г, 5,16 ммоль). Реакцию проводили при перемешивании в течение 2,5 часов и гасили насыщенным раствором хлорида аммония (20 мл). Смесь экстрагировали EtOAc (20 мл х 3) и объединенные экстракты сушили над сульфатом магния и выпаривали. Остаток очищали при помощи [флэш]хроматографии на силикагеле (элюируя смесью EtOAc: гексан в соотношении от 1:30 до 1:10) с получением 516 мг (выход 81%) указанного в заголовке продукта в виде твердого вещества белого цвета; 1H-ЯМР (CDCl3): δ 1,27 (д, J=6,6 Гц, 3H), 1,40, 1,45 (с, 3H каждый); 1,91 (д, J=2,0 Гц, 1Н), 1,94
(с, 1H), 2,78-2,91 (м, 1H), 3,93 (с, 3H), 7,50 (д, J=8,2 Гц, 1H), 8,16 (дд, J=1,9, 8,2 Гц, 1H), 8,64 (д, J=1,9 Гц, 1H); MS (DCI) m/e: 247.
Расчетное содержание для C15H18O3: C, 73,15; H, 7,37. Найдено: C, 73,15; H, 7,51.
ПРИМЕР 57
Метиловый эфир 5,5,7-триметил-8-фенил-5,6- дигидронафталин-2-карбоновой кислоты (XXXVIa)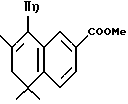
К раствору кетона XXXVa (500 мг, 2,03 ммоль) в 20 мл тетрагидрофурана медленно добавляли бромид фенилмагния (3,0 М раствор в эфире, 1,35 мл, 4,06 ммоль) при 0oC. Смесь красного цвета перемешивали при 0oC в течение 1 часа и гасили насыщенным раствором хлорида аммония (20 мл). Смесь экстрагировали EtOAc (25 мл х 3). Объединенные экстракты сушили над сульфатом магния и выпаривали. К остатку добавляли бензол (10 мл) и п-толуолсульфоновую кислоту (0,1 г), и перемешивали при нагревании с обратным холодильником в течение 30 мин. Растворитель выпаривали и остаток очищали при помощи флэш-хроматографии на силикагеле (элюируя смесью EtOAc: гексан в соотношении от 1:30 до 1:10) с получением 380 мг (выход 61%) указанного в заголовке продукта; 1H-ЯМР (CDCl3): δ 1,35 (с, 6Н), 1,73 (с, 3H); 2,31 (с, 2Н), 3,77 (с, 3H), 7,17 (д, J= 6,8 Гц, 2Н), 7,29-7,45 (м, 5Н), 7,80 (дд, J=1,8, 8,0 Гц, 1H); MS (DCI) m/e: 307 (МН+).
ПРИМЕР 58
5,5,7-Триметил-8-фенил-5,6 -дигидронафталин-2-карбоновая кислота (XVIIIf)
Раствор эфира XXXVIa (180 мг, 0,62 ммоль) и 1 н. NaOH (1,22 мл, 2 ммоль) в 5 мл тетрагидрофурана и 2 мл MeOH перемешивали при 60oC в продолжение 3 часов. Раствор упаривали под пониженным давлением до приблизительно 3 мл и разбавляли 1 н. HCl (10 мл), экстрагировали EtOAc (30 мл х 2). Объединенные экстракты промывали водой (10 мл), сушили над сульфатом магния и выпаривали с получением 150 мг (выход 83%) указанной в заголовке кислоты в виде твердого вещества; 1H-ЯМР (CDCl3): δ 1,35 (с, 6Н), 1,73 (с, 3H); 2,32 (с, 2Н), 7,15 (д, J=6,7 Гц, 2Н), 7,32 (д, J=1,6 Гц, 1Н), 7,35-7,45 (м, 4Н), 7,86 (дд, J=1,6, 8,0 Гц, 1H); MS (DCI) m/e: 293 (МН+).
Расчетное содержание для C20H20O5 · 0,25H2O: C, 80,91; H, 6,96. Найдено: C, 81,01; H, 6,82.
ПРИМЕР 59
Метиловый эфир 4-[[(5,6-дигидро-5,5,7 -триметил-8-фенил-2- нафталенил)карбонил]амино]бензойной кислоты (I3e)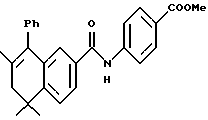
К раствору кислоты XVIIIf (171 мг, 0,59 ммоль) в 4 мл метиленхлорида добавляли оксалилхлорид (150 мг, 1,18 ммоль) и 1 каплю диметилформамида при 0oC. Реакционную смесь перемешивали при 0oC в течение 1 часа и при комнатной температуре в течение 16 часов. Растворитель выпаривали и остаток сушили в вакууме. К остатку добавляли метил-п-аминобензоат (98 мг, 0,65 ммоль) и 3 мл безводного пиридина. Смесь перемешивали при комнатной температуре в продолжение 18 часов. Растворитель выпаривали и остаток разбавляли 1 н. HCl (20 мл) и экстрагировали EtOAc (20 мл х 3). Объединенные экстракты сушили над сульфатом магния, фильтровали и выпаривали. Остаток очищали при помощи флэш-хроматографии на силикагеле (элюируя смесью гексан:EtOAc в соотношении от 20: 1 до 5:1) с получением 149 мг (выход 78%) указанного в заголовке соединения в виде масла; 1H-ЯМР (CDCl3): δ 1,37 (с, 6Н), 1,75 (с, 3H); 2,34 (с, 2Н), 3,90 (c, 3H), 7,09 (д, J=1,8 Гц, 1Н), 7,18 (ушир.д, J=6,8 Гц, 2Н), 7,33-7,46 (м, 4Н), 7,60 (д, J=8,8 Гц, 2Н), 7,65 и 7,67 (д поверх ушир.с, J= 1,9 Гц, 1Н), 8,00 (д, J=8,7 Гц, 2Н); MS (DCI) m/e: 426 (МН+).
ПРИМЕР 60
4-[[(5,6-Дигидро-5,5,7-триметил-8-фенил -2-нафталенил)карбонил] амино] бензойная кислота (I4e)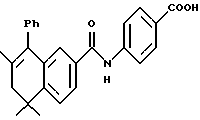
Смесь соединения I3e (97 мг, 0,23 ммоль) и 2 н. NaOH (1,15 мл, 2,30 ммоль) в 5 мл тетрагидрофурана и 5 мл MeOH перемешивали при комнатной температуре в продолжение 12 часов. Полученный раствор подкисляли 1 н. HCl и упаривали под пониженным давлением. Остаток разбавляли 10 мл воды и экстрагировали EtOAc (15 мл х 2). Объединенные экстракты сушили над сульфатом магния, фильтровали и выпаривали. Остаток растирали со смесью Et2O - гексан с получением 77 мг (выход 82%) указанного в заголовке продукта в виде твердого вещества белого цвета; 1H-ЯМР (ДМСО-d6): δ 1,33 (с, 6Н), 1,69 (с, 3H); 2,31 (с, 2Н), 7,02 (с, 1Н), 7,15 (д, J=7,9 Гц, 2Н), 7,33-7,49 (м, 4Н), 7,75 (д, J=8,4 Гц, 1Н), 7,79 (д, J=8,6 Гц, 2Н), 7,87 (д, J=8,6 Гц, 2Н); MS (DCI) m/e: 412 (МН+).
Расчетное содержание для C27H25NO3: C, 77,95; H, 6,18; N, 3,37. Найдено: C, 77,93; H, 6,01; N, 3,27.
ПРИМЕР 61
Метиловый эфир 10,10-диметил-9-оксо- 5,8,8а,9,10,10a-гексагидроантрацен-2-карбоновой кислоты (XXXVIIa)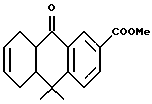
Раствор енона XXXa (500 мг, 2,17 ммоль) и хлорида алюминия (260 мг, 1,95 ммоль) в 10 мл безводного толуола насыщали 1,3-бутадиеном при -78oC. После перемешивания при комнатной температуре в течение 18 часов смесь разбавляли 20 мл 1 н. HCl и экстрагировали EtOAc (30 мл х 3). Объединенные экстракты промывали водой (20 мл), насыщенным хлоридом натрия и сушили над сульфатом магния. Растворитель выпаривали и остаток очищали при помощи флэш-хроматографии на силикагеле (элюируя смесью EtOAc:гексан в соотношении от 1:20 до 1: 5) с получением 638 мг (количественный выход) указанного в заголовке продукта в виде масла; 1H-ЯМР (CDCl3): δ 1,45, 1,49 (с, 3H каждый); 1,60-1,75 (м, 1Н), 2,10-2,30 (м, 3H), 2,99-3,06 (ушир.д, J=18 Гц, 1Н), 3,29 (ушир. с, 1Н), 3,91 (с, 3H), 5,53-5,58 (м, 1Н), 5,70-5,76 (м, 1Н), 7,46 (д, J= 8,2 Гц, 1Н), 8,16 (дд, J=1,8, 8,2 Гц, 1Н), 8,64 (д, J=1,8 Гц, 1Н); MS (DCI) m/e: 285 (МН+).
Расчетное содержание для C18H20O3: C, 76,03, H, 7,09. Найдено: C, 75,73; H, 7,25.
ПРИМЕР 62
Метиловый эфир 10,10-диметил-9 -фенил-5,8,10,10a- тетрагидроантрацен-2-карбоновой кислоты (XXXVIIIa)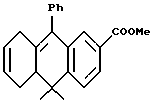
К раствору соединения XXXVIIa (600 мг, 2,11 ммоль) в 5 мл безводного тетрагидрофурана медленно добавляли бромид фенилмагния (3,0 М раствор в эфире, 1,76 мл, 5,28 ммоль) при -30oC. После перемешивания в течение 15 мин смесь медленно нагревали до 0oC за 20 мин. Реакцию гасили насыщенным раствором хлорида аммония (30 мл) и проводили экстракцию EtOAc (30 мл х 3). Объединенные экстракты сушили над сульфатом магния, фильтровали и выпаривали. Остаток частично очищали при помощи флэш-хроматографии на силикагеле (элюируя смесью EtOAc:гексан в соотношении от 1:20 до 1:5 с получением 520 мг сырого (неочищенного) спирта. К спирту добавляли безводный бензол (10 мл) и п-толуолсульфоновую кислоту (50 мг). Полученный раствор перемешивали при нагревании с обратным холодильником в течение 3 часов. Растворитель выпаривали и остаток очищали при помощи флэш-хроматографии на силикагеле (элюируя смесью EtOAc:гексан в соотношении от 1:20 до 1:5) с получением 265 мг (выход 36%) указанного в заголовке соединения в виде масла; 1H-ЯМР (CDCl3): δ 1,34, 1,44 (с, 3H каждый); 1,92-2,05 (м, 1Н), 2,25-2,45 (м, 2Н), 2,65-2,80 (м, 2Н), 3,78 (с, 3H), 5,55-5,78 (м, 2Н), 7,16 (д, J=6,8 Гц, 2Н), 7,31 (д, J=1,7 Гц, 1Н), 7,30-7,50 (м, 6Н), 7,82 (дд, J=1,7, 8,0 Гц, 1Н).
ПРИМЕР 63
10,10-Диметил-9-фенил-5,8,10,10a -тетрагидроантрацен-2- карбоновая кислота (XVIIIg)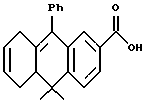
Раствор соединения XXXVIIIa (260 мг, 0,75 ммоль) и 3 н. NaOH (2,5 мл, 7,5 ммоль) в 10 мл метанола перемешивали при температуре 80oC в продолжение 3 часов. Растворитель упаривали и остаток подкисляли 1 н. HCl, экстрагировали EtOAc (30 мл х 3). Объединенные экстракты промывали водой (20 мл), сушили над сульфатом магния, фильтровали и выпаривали с получением 235 мг (выход 95%) указанного в заголовке соединения; 1H-ЯМР (CDCl3):  1,34, 1,44 (с, 3H каждый); 1,93-2,05 (м, 1Н), 2,25-2,37 (м, 3H), 2,41 (дд, J=5,0 11,9 Гц, 1Н), 2,65-2,80 (м, 2Н), 5,60-5,70 (м, 2Н), 7,14 (д, J=6,7 Гц, 2Н), 7,32 (д, J=1,8 Гц, 1Н), 7,36-7,46 (м, 4Н), 7,85 (дд, J=1,8, 8,0 Гц, 1Н), 8,64 (д, J=1,8 Гц, 1Н); MS (DCI) m/e: 331 (МН+).
1,34, 1,44 (с, 3H каждый); 1,93-2,05 (м, 1Н), 2,25-2,37 (м, 3H), 2,41 (дд, J=5,0 11,9 Гц, 1Н), 2,65-2,80 (м, 2Н), 5,60-5,70 (м, 2Н), 7,14 (д, J=6,7 Гц, 2Н), 7,32 (д, J=1,8 Гц, 1Н), 7,36-7,46 (м, 4Н), 7,85 (дд, J=1,8, 8,0 Гц, 1Н), 8,64 (д, J=1,8 Гц, 1Н); MS (DCI) m/e: 331 (МН+).
Расчетное содержание для C23H22O2: C, 83,61; H, 6,71. Найдено: C, 83,25, H, 6,86.
ПРИМЕР 64
Метиловый эфир 4-[[(5,8,10,10а-тетрагидро-10,10- диметил-9-фенил-2-антраценил)карбонил]амино]бензойной кислоты (I3f)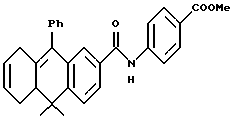
К раствору кислоты XVIIIg (225 мг, 0,68 ммоль) в 4 мл метиленхлорида добавляли оксалилхлорид (172 мг, 1,36 ммоль) и 1 каплю диметилформамида при 0oC. Раствор перемешивали при 0oC в течение 2 часов и при комнатной температуре в течение 1 часа. Растворитель выпаривали и остаток сушили в вакууме. К остатку добавляли метил-п-аминобензоат (122 мг, 0,81 ммоль) и 2 мл безводного пиридина. Смесь перемешивали при комнатной температуре в продолжение 16 часов. Растворитель выпаривали и остаток разбавляли 1 н. HCl (20 мл) и экстрагировали EtOAc (30 мл х 3). Объединенные экстракты сушили над сульфатом магния, фильтровали и выпаривали. Остаток очищали при помощи флэш-хроматографии на силикагеле (элюируя смесью гексан: EtOAc в соотношении от 20: 1 до 5:1) с получением 210 мг (выход 67%) указанного в заголовке соединения; 1H-ЯМР (CDCl3): δ 1,36, 1,45 (с, 3H каждый), 1,95-2,05 (м, 1Н), 2,33 (дт, J=4,6, 16,1 Гц, 1Н), 2,44 (дд, J=5,1, 12,0 Гц, 1Н), 2,65-2,82 (м, 2Н), 3,89 (с, 3H), 5,60-5,73 (м, 2Н), 7,09 (д, J=1,9 Гц, 1Н), 7,18 (ушир.д, J=6,7 Гц, 2Н), 7,33-7,47 (м, 4Н), 7,59-7,65 (м, 3H), 7,70 (ушир.с, 1Н), 8,00 (д, J=8,8 Гц, 2Н); MS (DCI) m/e: 464 (МН+).
ПРИМЕР 65
4-[[(5,8,10,10a-Тетрагидро-10,10-диметил-9-фенил- 2-антраценил)карбонил] амино]бензойная кислота (I4f)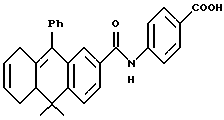
Раствор эфира I3f (210 мг, 0,45 ммоль) и оксида дибутилолова (228 мг, 0,92 ммоль) в 5 мл безводного толуола перемешивали при нагревании с обратным холодильником в продолжение 2 дней. К смеси добавляли 1 н. HCl (20 мл) и экстрагировали EtOAc (20 мл х 3). Объединенные экстракты промывали водой (10 мл) и упаривали приблизительно до 20 мл. Затем раствор перемешивали с 10 мл 20% раствора фторида калия в течение 30 мин. Смесь экстрагировали EtOAc (20 мл х 2). Объединенные экстракты сушили над сульфатом магния, фильтровали и выпаривали. Остаток очищали при помощи флэш-хроматографии на силикагеле (элюируя смесью MeOH: CH2Cl2 в соотношении от 1:100 до 1:5) с получением 72 мг (выход 35%) указанного в заголовке продукта в виде твердого вещества желтого цвета; 1H-ЯМР (ДМСО-d6): δ 1,30, 1,41 (с, 3H каждый); 1,85 (ушир.т, J= 12,1 Гц, 1Н), 2,28-2,35 (м, 1H), 2,41 (дд, J=5,0, 11,5 Гц, 1H), 2,55 (ушир. д, J= 19,1 Гц, 1H), 2,75 (ушир.д, J=19,1 Гц, 1H), 5,60-5,80 (м, 2Н), 7,02 (д, J=1,9 Гц, 1H), 7,12 (д, J=6,9 Гц, 2Н), 7,35-7,48 (м, 4Н), 7,73 (дд, J= 1,9, 8,2 Гц, 1H), 7,77 (д, J=8,8 Гц, 2Н), 7,86 (д, J=8,6 Гц, 2Н), 10,35 (с, 1H); MS (DCI) m/e: 450 (МН+).
Расчетное содержание для C23H27NO3: C, 77,81; H, 6,20; N, 3,02. Найдено: C, 78,09; H, 5,99; N, 3,14.
ПРИМЕР 66
4,4-Диметил-7-йод-1-тетралон (XXXIX)
К раствору 4,4-диметил-7-амино-1-тетралона (XII) (1,82 г, 10,0 ммоль) в концентрированной соляной кислоте (4,69 мл) добавляли смесь холодной воды со льдом (3,13 мл). Затем реакционную смесь охлаждали до 0oC в ледяной бане с солью. Затем реакционную смесь диазотировали путем добавления по каплям раствора нитрита натрия (0,76 г, 11,0 ммоль) в воде (3,13 мл), поддерживая температуру в интервале 0-5oC. После перемешивания в течение 15 минут реакционную смесь добавляли к раствору йодида калия (3,63 г, 21,9 ммоль) в воде (18,8 мл). После выдерживания в течение 30 минут темную смолу экстрагировали этилацетатом (1 х 100 мл). Затем органическую фазу упаривали в вакууме и остаток хроматографировали на силикагеле (элюируя 5% этилацетатом в гексане) с получением 1,56 г (выход 54%) указанного в заголовке продукта; 1H-ЯМР (CDCl3): δ 8,33 (д, J=2,0 Гц, 1H), 7,82 (дд, J=8,3, 2,0 Гц, 1H), 7,17 (д, J= 8,4 Гц, 1Н), 2,72 (т, J=6,8 Гц, 2Н), 2,01 (т, J=6,8 Гц, 2Н), 1,37 (с, 6Н); MS (DCI) m/e: 301 (MH+).
ПРИМЕР 67
Метил-4-винилбензоат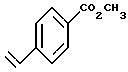
К раствору винилбензойной кислоты (Aldrich, 2,18 г, 14,7 ммоль) в безводном ацетонитриле (14,0 мл) добавляли 1,8-диазабицикло [5.4.0]ундека-7-ен (Aldrich, 2,46 г, 16,2 ммоль) и йодметан (Aldrich, 3,13 г, 22,1 ммоль) при 0oC. Реакционную смесь затем нагревали до комнатной температуры и давали ей перемешиваться в течение 3 часов. К смеси добавляли этилацетат (100 мл) и раствор промывали насыщенным раствором соли (50 мл). Затем органическую фазу отделяли и упаривали в вакууме. Остаток хроматографировали на силикагеле (элюируя 5% этилацетатом в гексане) с получением 1,05 г (выход 44%) указанного в заголовке продукта; 1H-ЯМР (CDCl3): δ 8,00 (д, J=8,4 Гц, 2Н), 7,47 (д, J= 8,4 Гц, 2Н), 6,76 (м, 1H), 5,87 (д, J=17,6 Гц, 1H), 5,38 (д, J=11,0 Гц, 1Н), 3,91 (с, 3H); MS (DCI) m/e: 163 (МН+).
ПРИМЕР 68
Метиловый эфир 4-[[(E)-(5,6,7,8-тетрагидро-5,5- диметил-8-оксо)-2-нафталенил]винил]бензойной кислоты (XLa)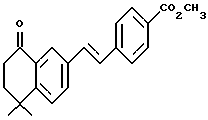
К раствору 4,4-диметил-7-йод-1-тетралона (XXXIX) (1,55 г, 5,17 ммоль) и метил-4-винилбензоата (1,67 г, 10,34 ммоль) в диметилформамиде (16,0 мл) добавляли ацетат палладия (II) (Aldrich, 58 мг, 0,259 ммоль), гидрат хлорида тетрабутиламмония (Aldrich, 1,49 г, 5,17 ммоль) и бикарбонат натрия (Mallinckrodt, 1,09 г, 12,9 ммоль). Реакционную смесь нагревали до 70oC в течение 4 ч и затем перемешивали при комнатной температуре в течение 16 ч. К смеси добавляли этилацетат (50 мл) и раствор промывали насыщенным раствором соли (50 мл). Органическую фазу упаривали в вакууме и остаток хроматографировали на силикагеле (элюируя 10% этилацетатом в гексане) с получением 1,29 г (выход 75%) указанного в заголовке соединения; 1H-ЯМР (CDCl3): δ 8,19 (д, J=1,7 Гц, 1Н), 8,04 (д, J=8,2 Гц, 2Н), 6,69 (дд J=8,1, 1,7 Гц, 1Н), 7,57 (д, J=8,2 Гц, 1Н), 7,45 (д, J=8,1 Гц, 1Н), 7,21 (с, 2Н), 3,93 (с, 3H), 2,76 (т, J= 6,8 Гц, 2Н), 2,05 (т, J=6,8 Гц, 2Н), 1,41 (с, 6Н); MS (DCI) m/e: 335 (МН+).
ПРИМЕР 69
Метиловый эфир 4-[[(E)-(5,6,7,8-тетрагидро-5,5-диметил-8-фенил- 8-гидрокси)-2-нафталенил]винил]бензойной кислоты (XLIa)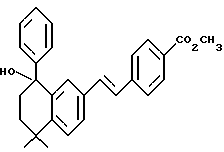
Используя метод получения (8-фенил)-производного XVIIa, из 1,29 г (3,86 ммоль) соединения XLa получили 1,39 г (выход 87%) указанного в заголовке соединения; 1H-ЯМР (CDCl3): δ 7,98 (д, J=8,1 Гц, 2Н), 7,48 (м, 5Н), 7,31 (с, 5Н), 7,03 (м, 2Н), 3,91 (с, 3H), 2,22 (м, 2Н), 1,85 (м, 1Н), 1,60 (м, 1Н), 1,40 (с, 3H), 1,35 (с, 3H).
ПРИМЕР 70
4-[[(E)-(5,6-Дигидро-5,5-диметил-8-фенил)-2-нафталенил] винил] бензойная кислота (I11a)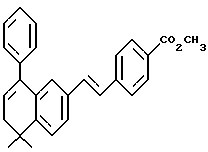
К раствору соединения XLIa (1,38 г, 3,35 ммоль) в толуоле (20,0 мл) добавляли п-толуолсульфоновую кислоту (п-TsOH, 20 мг). После нагревания при 70oC в течение 0,5 ч реакционную смесь охлаждали и упаривали в вакууме. Затем остаток растворяли в смеси 1:1 этилового спирта и тетрагидрофурана (20,0 мл) и обрабатывали 10 н. NaOH (33,7 ммоль, 3,37 мл) при комнатной температуре. Через 16 часов добавляли избыток 1 н. HCl (75 мл) и осадок собирали при помощи фильтрации под вакуумом с получением 1,23 г (выход 97%) указанного в заголовке соединения; 1H-ЯМР (ДМСО-d6):  12,87 (с, 1Н), 7,85 (д, J= 8,4 Гц, 2Н), 7,63 (д, J=8,4 Гц, 2Н), 7,58 (дд, J=8,1, 1,7 Гц, 1Н), 7,47-7,24 (м, 7Н), 7,07 (м, 2Н), 6,00 (т, J=4,5 Гц, 1Н), 2,30 (д, J=4,5 Гц, 2Н), 1,28 (с, 6Н); 13C-ЯМР (ДМСО-d6): 167,02, 145,09, 141,35, 140,16, 138,59, 134,22, 133,52, 130,96, 129,66, 129,23, 128,52, 128,33, 127,31, 126,87, 126,65, 126,45, 125,30, 124,69, 124,46, 38,23, 33,29, 27,89; MS (DCI) m/e: 381 (МН+); ИК (KBr): 2922, 2818, 1684, 1604 см-1.
12,87 (с, 1Н), 7,85 (д, J= 8,4 Гц, 2Н), 7,63 (д, J=8,4 Гц, 2Н), 7,58 (дд, J=8,1, 1,7 Гц, 1Н), 7,47-7,24 (м, 7Н), 7,07 (м, 2Н), 6,00 (т, J=4,5 Гц, 1Н), 2,30 (д, J=4,5 Гц, 2Н), 1,28 (с, 6Н); 13C-ЯМР (ДМСО-d6): 167,02, 145,09, 141,35, 140,16, 138,59, 134,22, 133,52, 130,96, 129,66, 129,23, 128,52, 128,33, 127,31, 126,87, 126,65, 126,45, 125,30, 124,69, 124,46, 38,23, 33,29, 27,89; MS (DCI) m/e: 381 (МН+); ИК (KBr): 2922, 2818, 1684, 1604 см-1.
Расчетное содержание для C27H24O2 · 0,65H2O: C, 82,69; H, 6,50. Найдено: C, 83,00; H, 6,41.
ПРИМЕР 71
4-[[[(5,6-Дигидро-5,5-диметил-8-фенил)-2- нафталенил] карбонил] сульфамил]бензойная кислота (I12a)
К раствору соединения XVIIIa (119 мг, 0,430 ммоль) в безводном метиленхлориде (5 мл) добавляли оксалилхлорид (0,13 мл, 1,5 ммоль) и 2 капли N, N-диметилформамида при 0oC. Реакционную смесь перемешивали при комнатной температуре в течение 2 часов. Затем реакционную смесь упаривали в вакууме. Полученный остаток растворяли в безводном пиридине (5,0 мл), к которому была добавлена 4-меркаптобензойная кислота (Apin, 66 мг, 0,43 ммоль). После выдерживания в течение 3 часов при комнатной температуре смесь разбавляли 1 н. HCl, экстрагировали этилацетатом (50 мл), промывали 1 н. HCl (3 х 50 мл) и промывали насыщенным бикарбонатом натрия (2 х 100 мл). Затем органическую фазу отделяли, упаривали в вакууме и остаток хроматографировали на силикагеле (элюируя 5% метанолом в метиленхлориде) с получением 40 мг (выход 23%) указанного в заголовке продукта; 1H-ЯМР (ДМСО-d6): δ 7,98 (д, J=8,3 Гц, 2Н), 7,91 (дд, J= 8,1, 2,0 Гц, 1Н), 7,62 (д, J=8,2 Гц, 1Н), 7,56 (д, J=8,2 Гц, 2Н), 7,48-7,27 (м, 6Н), 6,11 (т, J=4,5 Гц, 1Н), 2,38 (д, J=4,5 Гц, 2Н), 1,33 (с, 6Н); MS (DCI) m/e: 415 (МН+); ИК (KBr): 3440, 2962, 1684, 1594 см-1.
Расчетное содержание для C26H22O3S1 · 1,2H2O: C, 71,60; H, 5,64. Найдено: C, 71,65; H, 5,44.
ПРИМЕР 72
Трет-бутиловый эфир 4-[[[(5,6,7,8- тетрагидро-5,5-диметил-8-оксо)- 2-нафталенил]сульфамил]карбонил]бензойной кислоты (XLIVa)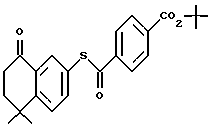
К раствору моно-трет-бутилтерефталата (122 мг, 0,550 ммоль) в безводном метиленхлориде (5,0 мл) добавляли оксалилхлорид (0,17 мл, 1,95 ммоль) и 2 капли N, N-диметилформамида при 0oC. После перемешивания при комнатной температуре в течение 2 часов смесь упаривали в вакууме. Остаток растворяли в безводном пиридине (5,0 мл), к которому был добавлен 4,4-диметил-7-меркапто-1-тетралон (XLIII) (113 мг, 0,550 ммоль). После выдерживания в течение 2 часов при комнатной температуре смесь разбавляли 1 н. HCl, экстрагировали этилацетатом (50 мл), промывали 1 н. HCl (3 х 50 мл) и промывали насыщенным бикарбонатом натрия (2 х 50 мл). Затем органическую фазу отделяли и упаривали в вакууме. Остаток хроматографировали на силикагеле (элюируя 10% этилацетатом в гексане) с получением 80 мг (выход 35%) указанного в заголовке продукта; 1H-ЯМР (CDCl3): δ 8,16 (д, J=1,8 Гц, 1Н), 8,11-8,03 (м, 4Н), 7,67 (дд, J= 8,3, 2,1 Гц, 1Н), 7,54 (д, J=8,5 Гц, 1Н), 2,77 (т, J=6,8 Гц, 2Н), 2,06 (т, J=6,8 Гц, 2Н), 1,63 (с, 9Н), 1,44 (с, 6Н); MS (DCI) m/e: 355 (М-C4H9 + H+).
ПРИМЕР 73
Трет-бутиловый эфир 4-[[[(5,6,7,8-тетрагидро-5,5-диметил- 8-фенил-8-гидрокси)-2-нафталенил]сульфамил]карбонил]бензойной кислоты (XLVa)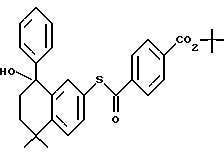
Используя метод получения (8-фенил)-производного XVIIa, из 80 мг (0,19 ммоль) соединения XLIVa получили 46 мг (выход 50%) указанного в заголовке продукта; 1H-ЯМР (CDCl3): δ 8,03 (м, 4Н), 7,52 (д, J=8,2 Гц, 1Н), 7,43 (дд, J= 8,2, 2,1 Гц, 1Н), 7,20 (м, 6Н), 2,30-2,10 (м, 3H), 1,90 (м, 1Н), 1,63 (с, 9Н), 1,45 (с, 3H), 1,37 (с, 3H); MS (DCI) m/e: 471 (МН+).
ПРИМЕР 74
4-[[[(5,6-Дигидро-5,5-диметил-8-фенил)-2-нафталенил] сульфамил]карбонил] бензойная кислота (I13a)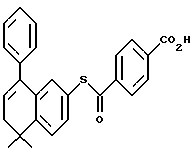
К раствору соединения XLVa (46 мг, 0,094 ммоль) в толуоле (5,0 мл) добавляли несколько миллиграммов (≈3 мг) п-толуолсульфоновой кислоты. После нагревания при 70oC в течение 0,5 ч реакционную смесь охлаждали и упаривали в вакууме. Затем остаток растворяли в метиленхлориде (2,0 мл), к которому была добавлена трифторуксусная кислота (0,08 мл), при комнатной температуре. Через 16 часов реакционную смесь разбавляли этилацетатом (20 мл) и промывали 1 н. HCl (20 мл) Органическую фазу отделяли, сушили над безводным сульфатом магния и упаривали в вакууме с получением 34 мг (выход 87%) указанного в заголовке продукта; 1H-ЯМР (ДМСО-d6): δ 8,03 (м, 4Н), 7,53 (д, J=8,1 Гц, 1Н), 7,43-7,30 (м, 6Н), 6,96 (д, J=1,9 Гц, 1Н), 6,07 (т, J=4,5 Гц, 1Н), 2,36 (д, J= 4,5 Гц, 2Н), 1,18 (с, 6Н); MS (DCI) m/e: 415 (МН+); ИК (KBr): 3432, 2962, 1680, 1202.
Расчетное содержание для C26H22O3S1 · 0,35H2O: C, 74,21; H, 5,44. Найдено: C, 74,18; H, 5,22.
ПРИМЕР 75
Этиловый эфир 4-[[(5,6-дигидро-5,5-диметил-8-фенил)-2-нафталенил] этил] бензойной кислоты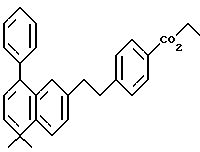
К перемешиваемому раствору соединения I15a (118 мг, 0,290 ммоль) в толуоле (7,0 мл) добавляли 5% палладий на карбонате кальция, отравленный свинцом (Aldrich, катализатор Линдлара, 15 мг) при давлении H2 310,3 кПа. Через 16 ч реакционную смесь фильтровали через пад из целита и фильтрат упаривали в вакууме с получением 60 мг (выход 50%) указанного в заголовке соединения; 1H-ЯМР (CDCl3):  7,93 (д, J=8,1 Гц, 2Н), 7,30 (м, 6Н), 7,18 (д, J=8,1 Гц, 2Н), 7,05 (дд J=7,9, 1,8 Гц, 1Н), 6,81 (д, J=1,8 Гц, 1Н), 5,97 (т, J=4,5 Гц, 1Н), 4,38 (кв, J=7,1 Гц, 2Н), 2,84 (м, 4Н), 2,34 (д, J=4,5 Гц, 2Н), 1,42 (т, J=7,1 Гц, 3H), 1,33 (с, 6Н); MS (DCI) m/e: 411 (МН+).
7,93 (д, J=8,1 Гц, 2Н), 7,30 (м, 6Н), 7,18 (д, J=8,1 Гц, 2Н), 7,05 (дд J=7,9, 1,8 Гц, 1Н), 6,81 (д, J=1,8 Гц, 1Н), 5,97 (т, J=4,5 Гц, 1Н), 4,38 (кв, J=7,1 Гц, 2Н), 2,84 (м, 4Н), 2,34 (д, J=4,5 Гц, 2Н), 1,42 (т, J=7,1 Гц, 3H), 1,33 (с, 6Н); MS (DCI) m/e: 411 (МН+).
ПРИМЕР 76
4-[[(5,6-Дигидро-5,5-диметил-8-фенил)-2-нафталенил] этил] бензойная кислота (I17a)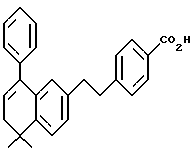
К раствору соединения - этилового эфира 4-[[(5,6- дигидро-5,5-диметил-8-фенил-2-нафталенил] этил]бензойной кислоты (60 мг, 0,146 ммоль) в этиловом спирте (5,0 мл) добавляли 10 н. NaOH (2,0 ммоль, 0,20 мл). Через 1 ч при 70oC добавляли избыток 1 н. HCl (20 мл) и осадок собирали при помощи фильтрации под вакуумом с получением 59 мг (выход 99%) указанного в заголовке продукта; 1H-ЯМР (ДМСО-d6): δ 7,79 (д, J=8,9 Гц, 2Н), 7,38-7,29 (м, 3H), 7,25 (д, J=8,2 Гц, 2Н), 7,21-7,10 (м, 4Н), 6,62 (д, J=1,7 Гц, 1Н), 5,93 (т, J= 4,5 Гц, 1Н), 2,78 (м, 4Н), 2,25 (д, J=4,5 Гц, 2Н), 1,24 (с, 6Н); MS (DCI) m/e: 383 (МН+); ИК (KBr): 2956, 1688, 1610, 1422 см-1.
Расчетное содержание для C27H26O2: C, 84,78; H, 6,85. Найдено C, 84,53; H, 6,81.
ПРИМЕР 77
Метиловый эфир 4-[[[(5,6-дигидро-5,5-диметил-8- фенил)-2-нафталенил]тиокарбонил]амино]бензойной кислоты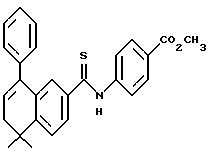
К раствору соединения I3a (285 мг, 0,693 ммоль) в тетрагидрофуране (6,0 мл) добавляли пентасульфид фосфора (Aldrich, 205 мг, 0,461 ммоль). После нагревания с обратным холодильником в течение 0,75 ч смесь упаривали, разбавляли метиленхлоридом (50 мл) и промывали 5% карбонатом натрия (2 х 50 мл). Затем органическую фазу упаривали в вакууме и остаток хроматографировали на силикагеле (элюируя 10% этилацетатом в гексане) с получением 88 мг (выход 30%) указанного в заголовке продукта; 1H-ЯМР (CDCl3): δ 8,92 (с, 1Н), 8,05 (д, J= 8,6 Гц, 2Н), 7,74 (дд, J=8,2, 1,8 Гц, 1Н), 7,43 (д, J=8,1 Гц, 1Н), 7,33 (м, 8Н), 6,07 (т, J=4,5 Гц, 1Н), 3,92 (с, 3H), 2,38 (д, J=4,5 Гц, 2Н), 1,36 (с, 6Н); MS (DCI) m/e: 428 (МН+).
ПРИМЕР 78
4-[[[(5,6-Дигидро-5,5-диметил-8-фенил)-2-нафталенил] тиокарбонил]амино] бензойная кислота (I18a)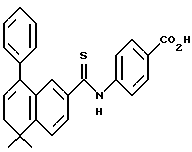
Используя метод получения (8-фенил)-производного I4a, из 80 мг (0,186 ммоль) метилового эфира 4-[[[(5,6-дигидро-5,5-диметил- 8-фенил-2-нафталенил] тиокарбонил] амино]бензойной кислоты получили 69 мг (выход 90%) указанного в заголовке у продукта; 1H-ЯМР (ДМСО-d6): δ 12,88 (с, 1Н), 11,89 (с, 1Н), 7,87 (м, 4Н), 7,60 (дд, J=8,0, 1,7 Гц, 1Н), 7,47 (д, J=8,1 Гц, 1Н), 7,35 (м, 6Н), 6,07 (т, J=4,5 Гц, 1Н), 2,35 (д, J=4,5 Гц, 2Н), 1,32 (с, 6Н); MS (DCI) m/e: 414 (МН+); ИК (KBr): 2922, 1688, 1606, 1514 см-1.
Расчетное содержание для C26H23O2N1S1 · 0,5H2O: C, 73,91; H, 5,73; N, 3,31. Найдено: C, 73,60; H, 5,76; N, 3,21.
ПРИМЕР 79
5,6-Дигидро-5,5-диметил-2-[1- (триметилсилил)окси] этенил- 8-фенилнафталин (LVIa)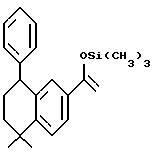
К раствору соединения XIXa из примера 32 (2,73 г, 9,89 ммоль) в безводном метиленхлориде (10,0 мл) добавляли 1,8-диазабицикло[5.4.0]ундека-7-ен (Aldrich, 1,80 г, 11,87 ммоль) и хлортриметилсилан (1,18 г, 10,9 ммоль). Реакционную смесь затем нагревали с обратным холодильником в мягких условиях в течение 2 часов и перемешивали при комнатной температуре в течение 16 часов. К смеси добавляли пентан (100 мл) и раствор промывали 0,1 н. HCl (50 мл) и разбавленным бикарбонатом натрия (50 мл). Затем органическую фазу сушили над безводным сульфатом магния и упаривали в вакууме с получением 3,17 г (выход 92%) указанного в заголовке продукта; 1H-ЯМР (CDCl3): δ 7,45 (дд, J= 8,0, 2,0 Гц, 1Н), 7,39-7,24 (м, 7Н), 5,99 (т, J=4,5 Гц, 1Н), 4,74 (д, J=1,6 Гц, 1Н), 4,30 (д, J=1,6 Гц, 1Н), 2,35 (д, J=4,5 Гц, 2Н), 1,34 (с, 6Н), 0,14 (с, 9Н).
ПРИМЕР 80
Метиловый эфир 4-[[[(5,6-дигидро-5,5-диметил-8- фенил)-2-нафталенил] карбонил]метил] бензойной кислоты (I22a)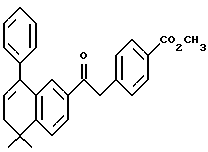
К раствору соединения LVIa (864 мг, 2,48 ммоль) и метил-4-бромбензоата (Aldrich, 355 мг, 1,65 ммоль) в безводном бензоле добавляли фторид трибутилолова (Aldrich, 806 мг, 2,61 ммоль) и PdCl2(P(о-CH3C6H4)3)2 [(59 мг, 0,074 ммоль), полученный из хлорида бис(ацетонитрил)-палладия(II) (Aldrich, 0,074 ммоль, 19,3 мг) и три-о-толилфосфина (Aldrich, 0,149 ммоль, 45,3 мг)]. После нагревания с обратным холодильником в течение 4 часов реакционную смесь разбавляли (50 мл) и промывали 1 н. NaOH (50 мл). Затем органическую фазу хроматографировали на силикагеле (элюируя 5% этилацетатом в гексане) с получением 265 мг (выход 39%) указанного в заголовке продукта; 1H-ЯМР (CDCl3):  7,92 (д, J=8,5 Гц, 2Н), 7,87 (дд, J=8,2, 2,0 Гц, 1Н), 7,63 (д, J=2,0 Гц, 1Н), 7,44 (д, J=8,2 Гц, 1Н), 7,41 (м, 3H), 7,29 (м, 2Н), 7,17 (д, J=8,0 Гц, 2Н), 6,03 (т, J=4,5 Гц, 1Н), 4,12 (с, 2Н), 3,90 (с, 3H), 2,37 (д, J=4,5 Гц, 2Н), 1,36 (с, 6Н); MS (DCI) m/e: 411(МН+).
7,92 (д, J=8,5 Гц, 2Н), 7,87 (дд, J=8,2, 2,0 Гц, 1Н), 7,63 (д, J=2,0 Гц, 1Н), 7,44 (д, J=8,2 Гц, 1Н), 7,41 (м, 3H), 7,29 (м, 2Н), 7,17 (д, J=8,0 Гц, 2Н), 6,03 (т, J=4,5 Гц, 1Н), 4,12 (с, 2Н), 3,90 (с, 3H), 2,37 (д, J=4,5 Гц, 2Н), 1,36 (с, 6Н); MS (DCI) m/e: 411(МН+).
ПРИМЕР 81
4-[[[(5,6-Дигидро-5,5-диметил-8-фенил)-2-нафталенил] карбонил]метил]бензойная кислота (I23a)
К раствору соединения I22a (200 мг, 0,488 ммоль) в безводном толуоле добавляли оксид дибутилолова (Aldrich, 364 мг, 1,46 ммоль). После нагревания с обратным холодильником в течение 16 часов смесь упаривали в вакууме и остаток хроматографировали на силикагеле (элюируя 5% метанолом в метиленхлориде) с получением 70 мг загрязненного продукта (содержащего побочные соединения олова). Повторная очистка при помощи препаративной тонкослойной хроматографии дала 10 мг (выход 5%) указанного в заголовке продукта; 1H-ЯМР (ДМСО-d6): δ 7,99 (дд, J=7,9, 1,9 Гц, 1Н), 7,82 (д, J=8,0 Гц, 2Н), 7,54 (д, J= 8,0 Гц, 1Н), 7,49 (с, 1Н), 7,42 (м, 3H), 6,05 (т, J=4,5 Гц, 1Н), 4,30 (с, 1Н), 4,28 (с, 1Н), 2,34 (д, J=4,5 Гц, 2Н), 1,31 (с, 6Н); MS (DCI) m/e: 397 (МН+); HRMS. Рассчитано: 397,1804. Найдено: 397,1816, отклонение 3,0 м.д.
ПРИМЕР 82
5,6-Дигидро-5,5-диметил -2-гидроксиметил-8- фенилнафталин (LVIIa)
Раствор 95% порошка литийалюминийгидрида (LAH, 40 мг, 1,0 ммоль) в безводном диэтиловом эфире (5,0 мл) нагревали с обратным холодильником до растворения большей части гидрида. Затем медленно добавляли раствор соединения XVIIIa (485 мг, 1,66 ммоль) в безводном диэтиловом эфире (5,0 мл). Через 0,5 ч добавляли этилацетат (20 мл) и 1 н. соляную кислоту (20 мл). Органическую фазу отделяли, сушили над безводным сульфатом магния и упаривали в вакууме с получением 368 мг (выход 84%) указанного в заголовке соединения; 1H-ЯМР (CDCl3): δ 7,36 (м, 6Н), 7,26 (м, 1Н), 7,02 (д, J=1,8 Гц, 1Н), 5,99 (т, J=4,5 Гц, 1Н), 4,55 (с, 2Н), 2,05 (д, J=4,5 Гц, 2Н), 1,34 (с, 6Н); MS (DCI) m/e: 247 (М+- ОН).
ПРИМЕР 83
5,6-Дигидро-5,5-диметил-2-бромметил-8-фенилнафталин (LVIIIa)
К раствору четырехбромистого углерода (Aldrich, 1,36 г, 4,09 ммоль) и трифенилфосфина (Aldrich, 1,07 г, 4,09 ммоль) в безводном диэтиловом эфире (20,0 мл) добавляли соединение LVIIa (900 мг, 3,41 ммоль). После выдерживания в течение 16 часов при комнатной температуре реакционную смесь фильтровали и фильтрат упаривали в вакууме. Остаток хроматографировали на силикагеле (элюируя 3% этилацетатом в гексане) с получением 790 мг (выход 71%) указанного в заголовке продукта; 1H-ЯМР (CDCl3): δ 7,39 (м, 6Н), 7,27 (дд, J=8,1, 1,8 Гц, 1Н), 7,04 (д, J=1,8 Гц, 1Н), 6,01 (т, J=4,5 Гц, 1Н), 4,39 (с, 2Н), 2,35 (д, J=4,5 Гц, 2Н), 1,34 (с, 6Н), MS (DCI) m/e: 327 (МН+).
ПРИМЕР 84
Этиловый эфир 4-[[[(5,6-дигидро-5,5 -диметил-8-фенил)-2-нафталенил] метил]окси]бензойной кислоты (I25a)
К раствору этил-4-гидроксибензоата (Aldrich, 152 мг, 0,917 ммоль) в диметиловом эфире этиленгликоля (6,0 мл) добавляли 60% гидрид натрия (1,05 ммоль, 43 мг) при комнатной температуре. Через 0,15 ч добавляли соединение LVIIIa. После выдерживания в течение 16 часов реакционную смесь разбавляли этилацетатом (50 мл) и промывали 1 н. соляной кислотой (2 х 50 мл). Органическую фазу упаривали в вакууме и остаток хроматографировали на силикагеле (элюируя 10% этилацетатом в гексане) с получением 64 мг (выход 17%) указанного в заголовке продукта; 1H-ЯМР (CDCl3): δ 7,97 (д, J=8,8 Гц, 2Н), 7,36 (м, 7Н), 7,06 (с, 1Н), 6,92 (д, J=8,8 Гц, 2Н), 6,01 (т, J-4,5 Гц, 1Н), 4,96 (с, 2Н), 4,34 (кв, J=7,2 Гц, 2Н), 2,36 (д, J=4,5 Гц, 2Н), 1,40 (т, J=7,2 Гц, 3H), 1,35 (с, 6Н); MS (DCI) m/e: 413 (МН+).
ПРИМЕР 85
4-[[[(5,6-Дигидро-5,5-диметил- 8-фенил)-2-нафталенил] метил] окси]бензойная кислота (I26а)
Используя описанный метод получения (8-фенил)-производного I4a, из 64 мг (0,155 ммоль) соединения I25a получили 50 мг (выход 84%) указанного в заголовке продукта; 1H-ЯМР (ДМСО-d6): 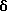 12,59 (с, 1Н), 7,83 (д, J=8,8 Гц, 2Н), 7,33 (м, 7Н), 6,97 (д, J=8,9 Гц, 2Н), 6,96 (с, 1Н), 5,99 (т, J=4,5 Гц, 1Н), 5,04 (с, 2Н), 2,30 (д, J=4,5 Гц, 2Н), 1,27 (с, 6Н); MS (DCI) m/e: 385 (МН+); ИК (KBr): 2958, 1682, 1604, 1252 см-1.
12,59 (с, 1Н), 7,83 (д, J=8,8 Гц, 2Н), 7,33 (м, 7Н), 6,97 (д, J=8,9 Гц, 2Н), 6,96 (с, 1Н), 5,99 (т, J=4,5 Гц, 1Н), 5,04 (с, 2Н), 2,30 (д, J=4,5 Гц, 2Н), 1,27 (с, 6Н); MS (DCI) m/e: 385 (МН+); ИК (KBr): 2958, 1682, 1604, 1252 см-1.
Расчетное содержание для C26H24O3 · 0,25H2O: C, 80,28; H, 6,35. Найдено: C, 80,41; H, 6,23.
ПРИМЕР 86
4-[[[(5,6-Дигидро-5,5-диметил-8-фенил)-2-нафталенил] окси] метил] бензойная кислота (I27a)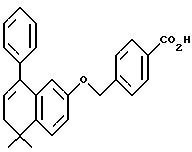
К раствору соединения XXVa из примера 38 (193 мг, 0,772 ммоль) в диметиловом эфире этиленгликоля (5,0 мл) добавляли 60% гидрид натрия (36 мг, 0,888 ммоль) при комнатной температуре. Через 15 минут добавляли метил-4-(бромметил)бензоат (Aldrich, 195 мг, 0,848 ммоль). После выдерживания в течение 16 ч при комнатной температуре снова добавляли 60% гидрид натрия (36 мг, 0,888 ммоль). После нагревания с обратным холодильником в течение 24 ч реакционную смесь разбавляли этилацетатом (50 мл) и промывали 1 н. соляной кислотой (2 х 50 мл). Органическую фазу упаривали в вакууме и остаток хроматографировали на силикагеле (элюируя 5% метанолом в метиленхлориде) с получением 170 мг загрязненного вещества. Сырое вещество растворяли в этиловом спирте (3 мл) и добавляли 1 н. HCl (20 мл). Осадок собирали при помощи фильтрации под вакуумом. Было выделено 50 мг (выход 16%) указанного в заголовке продукта; 1H-ЯМР (ДМСО-d6): δ 12,95 (с, 1Н), 7,89 (д, J=8,3 Гц, 2Н), 7,42 (д, J=8,3 Гц, 2Н), 7,39-7,21 (м, 6Н), 6,88 (дд, J=8,5, 2,7 Гц, 1Н), 6,44 (д, J=2,7 Гц, 1Н), 5,97 (т, J=4,5 Гц, 1Н), 5,04 (с, 2Н), 2,27 (д, J=4,5 Гц, 2Н), 1,24 (с, 6Н); MS (DCI) m/e: 385 (МН+); ИК (KBr): 3442, 1682, 1282 см-1.
Расчетное содержание для C26H24O3 · 0,5H2O: C, 80,59; H, 6,50. Найдено: C, 80,31; H, 6,26.
ПРИМЕР 87
Метиловый эфир 5,5-диметил-8-гидрокси-8- (2,4-диметил-фенил)- 5,6,7,8-тетрагидронафталин -2-карбоновой кислоты (XVIIe)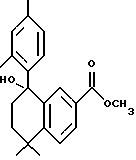
Используя описанный метод получения 8-(2-фторфенил)-производного XVIId, из 311 мг (1,34 ммоль) соединения XVIa получили 284 мг (выход 63%) указанного в заголовке соединения; 1H-ЯМР (CDCl3): δ 7,91 (дд, J=8,3, 1,8 Гц, 1Н), 7,66 (с, 1Н), 7,49 (д, J=8,3 Гц, 2Н), 7,02 (д, J=8,0 Гц, 1Н), 7,49 (с, 1Н), 6,93 (с, 1Н), 3,80 (с, 3H), 2,76 (м, 1Н), 2,34 (м, 1Н), 2,32 (с, 3H), 2,08 (м, 1Н), 1,63 (м, 1Н), 1,55 (с, 3H), 1,42 (с, 3H), 1,35 (с, 6Н); MS (DCI) m/e: 339 (МН+).
ПРИМЕР 88
5,5-Диметил-5,6-дигидро-8-гидрокси-8-(2,4- диметилфенил)-нафталин-2-карбоновая кислота (XVIIIh)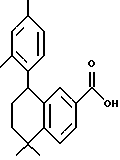
Используя описанный метод получения (8-фенил)-производного XVIIIe, из 311 мг (1,34 ммоль) соединения XVIIa получили 285 мг (выход 63%) указанного в заголовке продукта; 1H-ЯМР (CDCl3): δ 7,78 (дд, J=8,0, 1,7 Гц, 1Н), 7,48 (д, J=8,0 Гц, 1Н), 7,18 (д, J=1,6 Гц, 1Н), 7,06 (м, 3H), 5,86 (т, J=4,5 Гц, 1Н), 2,35 (м, 2Н), 2,33 (с, 3H), 1,99 (с, 3H), 1,39 (с, 3H), 1,28 (с, 3H); MS (DCI) m/e: 307 (MH+).
ПРИМЕР 89
Метиловый эфир 4-[[[[5,6-дигидро- 5,5-диметил-8-(2,4- диметилфенил)]-2-нафталенил] карбонил]амино]бензойной кислоты (I3h)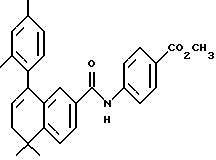
Используя описанный метод получения 8-(2-фторфенил)-производного I3g, из 221 мг (0,722 ммоль) соединения XVIIIh получили 67 мг (выход 21%) указанного в заголовке продукта; 1H-ЯМР (CDCl3): δ 8,00 (д, J=8,7 Гц, 2Н), 7,77 (с, 1Н), 7,68 (дд, J=8,2, 1,7 Гц, 1Н), 7,63 (д, J=8,7 Гц, 2Н), 7,47 (д, J=8,0 Гц, 1Н), 7,15 (д, J=1,7 Гц, 1Н), 7,06 (м, 3H), 5,93 (т, J=4,5 Гц, 1Н), 3,90 (с, 3H), 2,43 (м, 2Н), 2,36 (с, 3H), 2,08 (с, 3H), 1,45 (с, 3H); MS (DCI) m/e: 440 (МН+).
ПРИМЕР 90
4-[[[[5,6-Дигидро-5,5-диметил -8-(2,4-диметилфенил)] -2- нафталенил] карбонил] амино]бензойная кислота (I4h)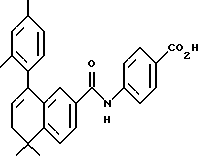
Используя описанный метод получения (8-фенил)-производного I4а, из 67 мг (0,153 ммоль) соединения I3h получили 61 мг (выход 94%) указанного в заголовке продукта; 1H-ЯМР (ДМСО-d6): δ 12,72 (с, 1Н), 10,40 (с, 1Н), 7,87 (д, J= 8,8 Гц, 2Н), 7,80 (м, 3H), 7,52 (д, J=8,0 Гц, 1Н), 7,04 (м, 4Н), 5,88 (т, J= 4,5 Гц, 1Н), 2,38 (м, 2Н), 2,31 (с, 3H), 1,99 (с, 3H), 1,41 (с, 3H), 1,29 (с, 3H); MS (DCI) m/e: 426 (МН+); ИК (KBr): 2960, 1688, 1594, 1518 см-1.
Расчетное содержание для C28H27N1O3 · 0,5H2O: C, 77,39; H, 6,50; N, 3,22. Найдено: C, 77,57; H, 6,50; N, 3,22.
ПРИМЕР 91
Метиловый эфир 5,5-диметил-8-гидрокси -8-(4-метилфенил)-5,6,7,8- тетрагидронафталин-2-карбоновой кислоты (XVIIf)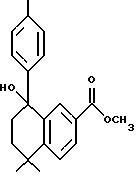
Используя описанный метод получения 8-(2-фторфенил)-производного XVIId, из 260 мг (1,12 ммоль) соединения XVIa получили 189 мг (выход 52%) указанного в заголовке продукта; 1H-ЯМР (CDCl3): δ 7,92 (дд, J=8,4, 1,7 Гц, 1Н), 7,84 (д, J=1,7 Гц, 1Н), 7,49 (д, J=8,4 Гц, 1Н), 7,10 (с, 4Н), 3,82 (с, 3H), 2,34 (с, 3H), 2,18 (м, 2Н), 1,80 (м, 1Н), 1,60 (м, 1Н), 1,39 (с, 3H), 1,34 (с, 3H); MS (DCI) m/e: 325 (МН+).
ПРИМЕР 92
5,5-Диметил-5,6-дигидро-8-(4-метилфенил) -нафталин-2-карбоновая кислота (XVIIIi)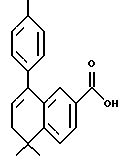
Используя описанный метод получения (8-фенил)-производного XVIIIa, из 189 мг (0,583 ммоль) соединения XVIIf получили 155 мг (выход 91%) указанного в заголовке продукта; 1H-ЯМР (CDCl3): δ 7,81 (дд, J=8,0, 1,7 Гц, 1H), 7,51 (д, J=1,7 Гц, 1H), 7,49 (д, J=8,0 Гц, 1H), 7,23 (м, 4Н), 6,00 (т, J=4,5 Гц, 1H), 2,35 (с, 3H), 2,33 (д, J=4,5 Гц, 1H), 1,30 (с, 6Н); MS (DCI) m/e: 293 (MH+).
ПРИМЕР 93
Метиловый эфир 4-[[[[5,6-дигидро-5,5 -диметил-8-(4-метилфенил)] -2- нафталенил]карбонил] амино]бензойной кислоты (I3i)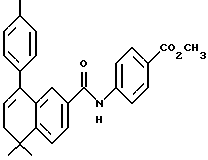
Используя описанный метод получения 8-(2-фторфенил)-производного I3g, из 155 мг (0,531 ммоль) соединения XVIIIi получили 143 мг (выход 63%) указанного в заголовке продукта; 1H-ЯМР (CDCl3): 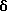 8,02 (д, J=8,8 Гц, 2Н), 7,74 (с, 1H), 7,72 (дд, J=8,0, 1,8 Гц, 1H), 7,66 (д, J=8,8 Гц, 2Н), 7,53 (д, J= 1,8 Гц, 1H), 7,49 (д, J=8,0 Гц, 1H), 7,23 (м, 4Н), 6,06 (т, J=4,5 Гц, 1H), 3,90 (с, 3H), 2,40 (м, 2Н), 2,39 (d, J=4,5 Гц, 2Н), 1,54 (с, 3H), 1,37 (с, 3H); MS (DCI) m/e: 426 (МН+).
8,02 (д, J=8,8 Гц, 2Н), 7,74 (с, 1H), 7,72 (дд, J=8,0, 1,8 Гц, 1H), 7,66 (д, J=8,8 Гц, 2Н), 7,53 (д, J= 1,8 Гц, 1H), 7,49 (д, J=8,0 Гц, 1H), 7,23 (м, 4Н), 6,06 (т, J=4,5 Гц, 1H), 3,90 (с, 3H), 2,40 (м, 2Н), 2,39 (d, J=4,5 Гц, 2Н), 1,54 (с, 3H), 1,37 (с, 3H); MS (DCI) m/e: 426 (МН+).
ПРИМЕР 94
4-[[[[5,6-Дигидро-5,5-диметил -8-(4-метилфенил)] -2-нафталенил)] карбонил]амино]бензойная кислота (I4i)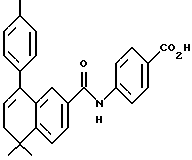
Используя описанный метод получения (8-фенил)-производного I4а, из 143 мг (0,336 ммоль) соединения I3i получили 123 мг (выход 89%) указанного в заголовке продукта; 1H-ЯМР (ДМСО-d6): δ 12,72 (с, 1Н), 10,42 (с, 1Н), 7,85 (м, 5Н), 7,52 (д, J=8,0 Гц, 1Н), 7,44 (д, J=1,8 Гц, 1Н), 7,21 (с, 4Н), 6,02 (т, J= 4,5 Гц, 1Н), 2,33 (с, 3H), 2,33 (d, J=4,5 Гц, 2Н), 1,31 (с, 6Н); 13C-ЯМР (ДМСО-d6): 166,90, 166,06, 148,77, 143,28, 138,16, 136,93, 136,60, 133,49, 132,48, 130,19, 129,12, 128,21, 126,75, 125,35, 125,03, 123,92, 119,38, 119,29, 37,98, 33,52, 27,75, 20,79; MS (DCI) m/e: 412 (МН+; ИК (KBr) 2960, 1688, 1594, 1518 см-1.
Расчетное содержание для C27H25N1O3 · 0,25H2O: C, 77,96; H, 6,18; N, 3,37. Найдено: C, 77,73; H, 6,09; N, 3,29.
ПРИМЕР 95
4,4-Диметил-7-бром-1-тетралон (XLVIII)
К охлажденному (10oC) перемешиваемому раствору нитрата натрия (2,18 г, 13,92 ммоль) в концентрированной серной кислоте (28,4 мл) и ледяной уксусной кислоте (26,27 мл) [получен добавлением нитрата натрия к охлажденной (10oC) концентрированной серной кислоте, нагреванием до растворения, повторным охлаждением и затем добавлением ледяной уксусной кислоты] добавляли раствор 4,4-диметил-7-амино-1-тетралона (XII) (5,0 г, 26,46 ммоль) в ледяной уксусной кислоте (89 мл) в течение 10 минут. Образовавшийся раствор медленно (в течение 10 минут) добавляли к нагретому (60oC) раствору бромида меди (I) (16,66 г) в концентрированной бромоводородной кислоте (159 мл). Смесь нагревали до 90oC в течение 10 минут, охлаждали, разбавляли водой (250 мл) и экстрагировали этилацетатом (2 х 200 мл). Объединенные органические фазы упаривали в вакууме и остаток хроматографировали на силикагеле (элюируя 3% этилацетатом в гексане) с получением 1,95 г (выход 29%) указанного в заголовке соединения; 1H-ЯМР (CDCl3): δ 8,13 (д, J=2,3 Гц, 1Н), 7,62 (дд, J=8,5, 2,3 Гц, 1Н), 7,31 (д, J=8,5 Гц, 1Н), 2,73 (т, J=7,0 Гц, 2Н), 2,01 (т, J=7,0 Гц, 2Н), 1,38 (с, 6Н); MS (DCI) m/e: 253 (МН+).
ПРИМЕР 96
4,4-Диметил-7-триметилсиланилэтинил-1-тетралон (IL)
К деаэрированному раствору соединения XLVIII (1,53 г, 6,04 ммоль), ацетата палладия (II) (Aldrich, 15,4 мг, 0,975 ммоль) и трифенилфосфина (31 мг, 0,118 ммоль) в безводном триэтиламине (30 мл) добавляли (триметилсилил) ацетилен (Aldrich, 3,0 мл, 21,23 ммоль) и нагревали до 100oC в течение 0,5 ч. После выдерживания при 100oC в течение 4 ч реакционную смесь охлаждали до комнатной температуры (16 ч). Затем реакционную смесь фильтровали и фильтрат упаривали в вакууме. Остаток хроматографировали на силикагеле (элюируя 3% этилацетатом в гексане) с получением 1,24 г (выход 76%) указанного в заголовке продукта; 1H-ЯМР (CDCl3): δ 8,11 (д, J=1,8 Гц, 1Н), 7,58 (дд, J=8,2, 1,8 Гц, 1Н), 7,36 (д, J=8,2 Гц, 1Н), 2,72 (т, J=7,0 Гц, 2Н), 2,01 (т, J=7,0 Гц, 2Н), 1,37 (с, 6Н), 0,24 (с, 9Н); MS (DCI) m/e: 271 (МН+).
ПРИМЕР 97
4,4-Диметил-7-этинил-1-тетралон (L)
К раствору соединения IL (1,24 г, 4,59 ммоль), в абсолютном этиловом спирте (8,0 мл) добавляли безводный карбонат калия (170 мг, 1,21 ммоль) при комнатной температуре. Через 2 ч реакционную смесь упаривали в вакууме, разбавляли насыщенным бикарбонатом натрия (25 мл) и экстрагировали метиленхлоридом (2 х 25 мл). Органические фазы объединяли, упаривали в вакууме и остаток хроматографировали на силикагеле (элюируя 5% этилацетатом в гексане) с получением 694 мг (выход 76%) указанного в заголовке продукта; 1H-ЯМР (CDCl3): δ 8,15 (д, J=1,9 Гц, 1Н), 7,62 (дд, J=8,2, 1,9 Гц, 1Н), 7,39 (д, J= 8,2 Гц, 1Н), 3,07 (с, 1H), 2,73 (т, J=7,0 Гц, 2Н), 2,02 (т, J=7,0 Гц, 2Н), 1,39 (с, 6Н); MS (DCI) m/e: 199 (МН+).
ПРИМЕР 98
Этиловый эфир 4-[[(5,6,7,8-тетрагидро -5,5-диметил-8-оксо)- 2-нафталенил]этинил] бензойной кислоты (LIa)
Раствор соединения L (153 мг, 0,773 ммоль), этил-4-йодбензоата (Lancaster, 160 мг, 0,58 ммоль), хлорида бис(трифенилфосфин) палладия (II) (Aldrich, 923 мг, 0,013 ммоль) и йодида меди (I) (Aldrich, 4,5 мг, 0,02 ммоль) в безводном триэтиламине (3,0 мл) перемешивали при комнатной температуре в течение 2 часов. Реакционную смесь разбавляли этилацетатом (25 мл) и промывали водой (1 х 25 мл). Органическую фазу упаривали в вакууме и остаток хроматографировали на силикагеле (элюируя 10% этилацетатом в гексане) с получением 183 мг (выход 91%) указанного в заголовке продукта; 1H-ЯМР (CDCl3): δ 8,20 (д, J=1,8 Гц, 1Н), 8,04 (д, J=8,3 Гц, 2Н), 7,67 (дд, J=8,2, 1,8 Гц, 1Н), 7,58 (д, J=8,3 Гц, 2Н), 4,39 (кв, J=7,1 Гц, 2Н), 2,76 (т, J=6,8 Гц, 2Н), 1,41 (т, J=7,1 Гц, 3H), 1,41 (с, 6Н); MS (DCI) m/e: 347 (МН+).
ПРИМЕР 99
Этиловый эфир 4-[[(5,6,7,8-тетрагидро -5,5-диметил-8-фенил-8- гидрокси)-2-нафталенил]этинил]бензойной кислоты (LIIa)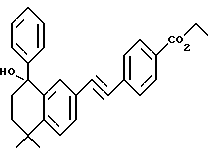
Используя метод получения (8-фенил)-производного XVIIa, из 183 мг (0,529 ммоль) соединения LIa получили 177 мг (выход 79%) указанного в заголовке соединения; 1H-ЯМР (CDCl3): δ 7,98 (д, J=8,3 Гц, 2Н), 7,50 (д, J=8,3 Гц, 2Н), 7,47-7,26 (м, 8Н), 4,37 (кв, J=7,0 Гц, 2Н), 2,20 (м, 2Н), 1,89 (м, 1H), 1,60 (м, 1H), 1,41 (s, 6H), 1,39 (т, J=7,0 Гц, 3H); MS (DCI) m/e: 425 (МН+).
ПРИМЕР 100
4-[[(5,6-Дигидро-5,5-диметил -8-фенил)-2-нафталенил] -этинил] бензойная кислота (I16a)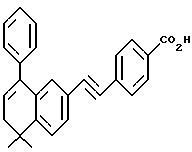
К раствору соединения LIIa (177 мг, 0,42 ммоль) добавляли несколько миллиграммов (≈10-20 мг) п-толуолсульфоновой кислоты. После нагревания при 70oC в течение 0,5 ч реакционную смесь охлаждали и упаривали в вакууме, что давало этиловый эфир 4-[[(5,6-дигидро -5,5-диметил-8-фенил) -2-нафталенил] этинил] бензойной кислоты (I15a). Затем остаток растворяли в этиловом спирте (5,0 мл) и обрабатывали 10 н. NaOH (6,5 ммоль, 0,65 мл) при 70oC. Через 0,5 ч добавляли избыток 1 н. HCl (20 мл) и осадок собирали при помощи фильтрации под вакуумом с получением 142 мг (выход 90%) указанного в заголовке продукта; 1H-ЯМР (ДМСО-d6): δ 13,13 (с, 1Н), 7,90 (д, J=8,4 Гц, 2Н), 7,58 (д, J= 8,4 Гц, 2Н), 7,39 (м, 6Н), 7,30 (д, J=6,6 Гц, 1Н), 6,99 (с, 1Н), 6,03 (т, J= 4,5 Гц, 1Н), 2,33 (д, J=4,5 Гц, 2Н), 1,29 (с, 6Н); 13C-ЯМР (ДМСО-d6): 166,64, 146,14, 139,79, 137,96, 133,75, 131,50, 130,98, 130,37, 129,48, 128,63, 128,38, 127,88, 127,60, 127,49, 126,54, 124,69, 119,23, 91,96, 88,11, 37,98, 33,40, 27,75; MS (DCI) m/e: 379 (MH+); ИК (KBr): 2958, 1684, 1604, 1420 см-1.
Расчетное содержание для C27H22O2 · 0,15H2O: C, 85,08; H, 5,90. Найдено: C, 85,06; H, 5,97.
ПРИМЕР 101
4,4-Диметил-7-[(диметиламино)тиокарбонилокси]-1-тетралон (XLII)
К раствору 4,4-диметил-7-гидрокси-1-тетралона (XIV) (3,07 г, 16,16 ммоль) в воде (10,77 мл), содержащему гидроксид калия (904 мг), охлажденному ниже 10oC добавляли N,N-диметилтиокарбамоилхлорид (2,67 г, 21,6 ммоль) в тетрагидрофуране (4,30 мл); температуру реакции поддерживали ниже 12oC. Через 10 минут реакционную смесь подщелачивали путем добавления 10% водного раствора KOH (5,39 мл). Продукт экстрагировали этилацетатом (2 х 50 мл), органические фазы упаривали в вакууме и остаток хроматографировали на силикагеле (элюируя 10% этилацетатом в гексане) с получением 3,74 г (выход 84%) указанного в заголовке продукта; 1H-ЯМР (CDCl3): δ 7,68 (д, J=2,6 Гц, 1Н), 7,45 (д, J= 8,5 Гц, 1Н), 7,27 (дд, J=8,5, 2,6 Гц, 1Н), 3,46 (с, 3H), 3,34 (с, 3H), 2,73 (т, J=6,8 Гц, 2Н), 2,04 (т, J=6,8 Гц, 2Н), 1,41 (с, 6Н); MS (DCI) m/e: 278 (МН+).
ПРИМЕР 102
4,4-Диметил-7-меркапто-1-тетралон (XLIII)
Соединение (XLII) (3,74 г, 13,50 ммоль) нагревали в атмосфере азота, при наличии выпускного отверстия для газа, при 270-275oC в течение 0,75 ч на солевой бане (1:1 моль смесь нитрата калия и нитрита натрия). После охлаждения к реакционной смеси добавляли гидроксид калия (1,13 г) в воде (1,35 мл) и этиленгликоль (10,0 мл) и нагревали смесь с обратным холодильником в течение 1 часа. Затем охлажденную реакционную смесь выливали на лед. Смесь промывали метиленхлоридом (2 х 50 мл), подкисляли 1 н. HCl и экстрагировали метиленхлоридом (2 х 50 мл). Органическую фазу упаривали в вакууме и остаток хроматографировали на силикагеле (элюируя 5% этилацетатом в гексане) с получением 1,22 г (выход 44%) указанного в заголовке продукта; 1H-ЯМР (CDCl3): δ 7,91 (д, J= 2,2 Гц, 1Н), 7,41 (дд, J=8,2, 2,2 Гц, 1Н), 7,30 (д, J=8,2 Гц, 1Н), 3,48 (с, 1Н), 2,71 (т, J=6,8 Гц, 2Н), 2,00 (т, J=6,8 Гц, 2Н), 1,37 (с, 6Н); MS (DCI) m/e: 207 (МН+).
ПРИМЕР 103
Метиловый эфир 4-[[[(5,6,7,8-тетрагидро -5,5-диметил-8-оксо)-2- нафталенил]сульфамил] метил]бензойной кислоты (XLVIa) 
Раствор 4,4-диметил-7-меркапто-1-тетралона (XLIII) (262 мг, 1,27 ммоль), метил-4-(бромметил)бензоата (Aldrich, 291 мг, 1,27 ммоль) и диизопропилэтиламина (Aldrich, 179 мг, 1,38 ммоль) в безводном метиленхлориде перемешивали при комнатной температуре. Через 1,5 часа реакционную смесь упаривали в вакууме и остаток хроматографировали на силикагеле (элюируя 5% этилацетатом в гексане) с получением 402 мг (выход 89%) указанного в заголовке продукта; 1H-ЯМР (CDCl3):  7,98 (д, J=2,1 Гц, 1Н), 7,95 (д, J=8,5 Гц, 2Н), 7,38 (дд, J=8,3, 2,1 Гц, 1H), 7,38 (д, J=8,5 Гц, 2Н), 7,29 (д, J=8,3 Гц, 1Н), 4,17 (с, 2Н), 3,90 (с, 3H), 2,71 (т, J=6,8 Гц, 2Н), 1,99 (т, J=6,8 Гц, 2Н), 1,36 (с, 6Н); MS (DCI) m/e: 355 (МН+).
7,98 (д, J=2,1 Гц, 1Н), 7,95 (д, J=8,5 Гц, 2Н), 7,38 (дд, J=8,3, 2,1 Гц, 1H), 7,38 (д, J=8,5 Гц, 2Н), 7,29 (д, J=8,3 Гц, 1Н), 4,17 (с, 2Н), 3,90 (с, 3H), 2,71 (т, J=6,8 Гц, 2Н), 1,99 (т, J=6,8 Гц, 2Н), 1,36 (с, 6Н); MS (DCI) m/e: 355 (МН+).
ПРИМЕР 104
Метиловый эфир 4-[[[(5,6,7,8-тетрагидро -5,5-диметил-8-фенил-8- гидрокси)-2-нафталенил]сульфамил] метил]бензойной кислоты (XLVIIa)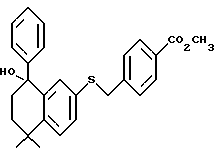
Используя метод получения (8-фенил)-производного XVIIa, из 400 мг (1,13 ммоль) соединения XLVIa получили 415 мг (выход 85%) указанного в заголовке соединения; 1H-ЯМР (CDCl3): δ 7,87 (д, J=8,2 Гц, 2Н), 7,30-7,18 (м, 9Н), 7,02 (д, J=2,0 Гц, 1Н), 3,97 (с, 2Н), 3,91 (с, 3H), 2,22-2,08 (м, 3H), 1,85 (м, 1Н), 1,36 (с, 3H), 1,28 (с, 3H); MS (DCI) m/e: 433 (МН+).
ПРИМЕР 105
4-[[[(5,6-Дигидро-5,5-диметил -8-фенил)-2-нафталенил] сульфамил] метил] бензойная кислота (I14а)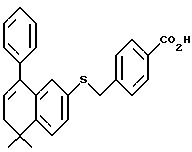
Используя метод получения 4-[(Е)-(5,6-дигидро -5,5-диметил-8- фенил)-2-нафталенил) винил] бензойной кислоты (I11a), из 415 мг (0,96 ммоль) соединения XLVIIa получили 365 мг (выход 95%) указанного в заголовке соединения; 1H-ЯМР (ДМСО-d6): δ 12,87 (с, 1Н), 7,78 (д, J=8,2 Гц, 2Н), 7,37 (м, 3H), 7,29 (с, 1H), 7,25 (д, J=8,2 Гц, 2Н), 7,25 (д, J=8,1 Гц, 1Н), 7,13 (м, 2Н), 6,67 (д, J=1,9 Гц, 1Н), 5,95 (т, J=4,5 Гц, 1H), 4,09 (с, 2Н), 2,27 (д, J= 4,5 Гц, 2Н), 1,24 (с, 6Н); MS (DCI) m/e: 401 (МН+); ИК (KBr): 2956, 1684, 1610, 1422, 1286 см-1.
Расчетное содержание для C26H24O2S1 · 0,5H2O: C, 76,25; H, 6,15. Найдено: C, 76,20; H, 6,15.
ПРИМЕР 106
N, O-Диметилгидроксиамид 5,5-диметил-5,6-дигидро-8-фенилнафталин- 2-карбоновой кислоты (LIIIa)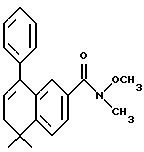
К раствору соединения XLIIIa (1,13 г, 3,74 ммоль) в безводном метиленхлориде (15,0 мл) добавляли оксалилхлорид (0,39 мл, 4,49 ммоль) и 2 капли N,N-диметилформамида при 0oC. Затем реакционную смесь перемешивали при комнатной температуре. Через 2 часа при 0oC добавляли гидроксихлорид N,O-диметилгидроксиламина (Aldrich, 401 мг, 4,11 ммоль) и безводный пиридин (650 мг, 0,665 мл). После выдерживания в течение 2 часов при комнатной температуре реакционную смесь упаривали в вакууме, разбавляли этилацетатом (50 мл), промывали водой с насыщенным раствором соли (2 х 50 мл), сушили над безводным сульфатом магния и упаривали в вакууме с получением 1,13 г (выход 94%) указанного в заголовке продукта; 1H-ЯМР (CDCl3): δ 7,55 (дд, J=8,0, 1,9 Гц, 1Н), 7,39 (д, J=8,0 Гц, 1Н), 7,37 (м, 5Н), 7,32 (д, J=1,8 Гц, 1Н), 6,01 (т, J= 4,5 Гц, 1Н), 3,49 (с, 3H), 3,27 (с, 3H), 2,37 (д, J=4,5 Гц, 2Н), 1,35 (с, 6Н); MS (DCI) m/e: 322 (МН+).
ПРИМЕР 107
5,5-Диметил-5,6-дигидро-2-формил-8-фенилнафталин (LIVa)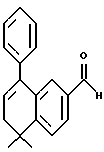
К раствору соединения LIIIa (1,13 г, 3,52 ммоль) в тетрагидрофуране (32 мл) при -78oC добавляли гидрид диизобутилалюминия (DIBAL, 1,0 М раствор в гексане, 5,28 ммоль, 5,28 мл). Через 1 ч реакционную смесь разбавляли 5% HCl в этиловом спирте (10 мл) и насыщенным раствором соли (10 мл). Затем смесь экстрагировали этилацетатом (2 х 40 мл). Органические фазы объединяли, сушили над безводным сульфатом магния и упаривали в вакууме с получением 720 мг (выход 78%) указанного в заголовке продукта; 1H-ЯМР (CDCl3): δ 9,86 (s, 1Н), 7,76 (дд, J= 8,0, 1,7 Гц, 1Н), 7,54-7,52 (м, 2Н), 7,52-7,26 (м, 5Н), 6,07 (т, J=4,5 Гц, 1Н), 2,40 (д, J=4,5 Гц, 2Н), 1,38 (с, 6Н); MS (DCI) m/e: 263 (МН+).
ПРИМЕР 108
Метиловый эфир 4-[[[(5,6-дигидро-5,5 -диметил-8-фенил)-2-нафталенил] метил]амино]бензойной кислоты (I20a)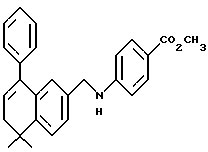
К раствору метил-4-аминобензоата (505 мг, 3,35 ммоль) в 1% растворе ледяной уксусной кислоты в метиловом спирте (6,0 мл) добавляли соединение LIVa (720 мг, 2,75 ммоль) в 1% растворе ледяной уксусной кислоты в метиловом спирте (6,0 мл). Затем добавляли цианоборгидрид натрия (174 мг, 2,75 ммоль) в течение одного часа (6 порциями по 29 мг через каждые 10 минут). После выдерживания в течение 16 часов при комнатной температуре реакционную смесь упаривали в вакууме и остаток хроматографировали на силикагеле (элюируя 10% этилацетатом в гексане) с получением 856 мг (выход 78%) указанного в заголовке продукта; 1H-ЯМР (CDCl3):  7,83 (д, J=8,9 Гц, 2Н), 7,34 (м, 6Н), 7,21 (дд, J= 7,8, 2,0 Гц, 1Н), 6,99 (д, J=2,0 Гц, 1Н), 6,52 (д, J=8,9 Гц, 2Н), 5,99 (т, J=4,5 Гц, 1Н), 4,37 (м, 1Н), 4,23 (д, J=5,5 Гц, 2Н), 3,84 (с, 3H), 2,35 (т, J=4,5 Гц, 2Н), 1,34 (с, 6Н); MS (DCI) m/e: 398 (МН+).
7,83 (д, J=8,9 Гц, 2Н), 7,34 (м, 6Н), 7,21 (дд, J= 7,8, 2,0 Гц, 1Н), 6,99 (д, J=2,0 Гц, 1Н), 6,52 (д, J=8,9 Гц, 2Н), 5,99 (т, J=4,5 Гц, 1Н), 4,37 (м, 1Н), 4,23 (д, J=5,5 Гц, 2Н), 3,84 (с, 3H), 2,35 (т, J=4,5 Гц, 2Н), 1,34 (с, 6Н); MS (DCI) m/e: 398 (МН+).
ПРИМЕР 109
Гидрохлорид 4-[[[(5,6-дигидро-5,5-диметил -8-фенил)-2-нафталенил] метил] амино]бензойной кислоты (I21a)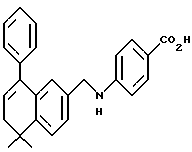
К раствору соединения I20а (197 мг, 0,496 ммоль) в этиловом спирте (5,0 мл) добавляли 10 н. NaOH (22,0 ммоль, 2,2 мл). После нагревания с обратным холодильником в течение 4 часов добавляли избыток 1 н. HCl (40 мл) и осадок собирали при помощи фильтрации под вакуумом с получением 175 мг (выход 92%) указанного в заголовке продукта; 1H-ЯМР (ДМСО-d6): δ 7,60 (д, J=8,8 Гц, 2 Н), 7,32 (м, 4Н), 7,20 (м, 3H), 6,90 (д, J=1,6 Гц, 1Н), 6,49 (д, J=8,8 Гц, 2Н), 5,96 (т, J=4,5 Гц, 1Н), 4,16 (с, 2Н), 2,27 (д, J=4,5 Гц, 2Н), 1,24 (с, 6Н); MS (DCI) m/e: 384 (МН+); ИК (KBr): 3418, 2960, 1672, 1602, 1176 см-1.
Расчетное содержание для C26H25O2N1 · 1,0HCl: C, 74,36; H, 6,24; N, 3,34. Найдено: C, 74,39; H, 6,19; N, 3,29.
ПРИМЕР 110
Метиловый эфир 4-[[[(5,6-дигидро-5,5 -диметил-8-фенил)-2-нафталенил] амино]тиокарбонил]бензойной кислоты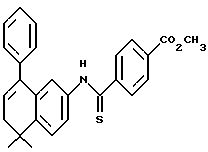
Используя описанный метод получения метилового эфира 4-[[[(5,6-дигидро -5,5-диметил-8-фенил)-2-нафталенил] тиокарбонил] -амино] бензойной кислоты (пример 77), из 190 мг (0,462 ммоль) соединения I1с получили 104 мг (выход 52%) указанного в заголовке продукта; 1H-ЯМР (CDCl3): δ 8,84 (с, 1Н), 8,05 (д, J= 8,2 Гц, 2Н), 7,91 (дд, J=8,8, 2,4 Гц, 1Н), 7,81 (д, J=8,2 Гц, 2Н), 7,44 (д, J=8,8 Гц, 1Н), 7,35 (м, 5Н), 7,13 (д, J=2,4 Гц, 1Н), 6,04 (т, J=4,5 Гц, 1Н), 3,94 (с, 3H), 2,38 (д, J=4,5 Гц, 2Н), 1,35 (с, 6Н); MS (DCI) m/e: 428 (МН+).
ПРИМЕР 111
4-[[[(5,6-Дигидро-5,5-диметил -8-фенил)-2-нафталенил] -амино] тиокарбонил]бензойная кислота (I19а)
Используя описанный метод получения (8-фенил)-производного I4а, из 104 мг (0,240 ммоль) метилового эфира 4-[[[(5,6-дигидро- 5,5-диметил-8-фенил)-2-нафталенил]амино]-тиокарбонил]бензойной кислоты получили 80 мг (выход 80%) указанного в заголовке продукта; 1H-ЯМР (ДМСО-d6): δ 11,80 (с, 1Н), 7,93 (д, J=8,4 Гц, 2Н), 7,77 (д, J=8,4 Гц, 2Н), 7,75 (с, 1Н), 7,43 (д, J=8,4 Гц, 1Н), 7,34 (м, 6Н), 6,02 (т, J=4,5 Гц, 1Н), 2,33 (д, J=4,5 Гц, 2Н), 1,30 (с, 6Н); MS (DCI) m/e: 414 (МН+); ИК (KBr): 2958, 1694, 1490, 1410 см-1.
Расчетное содержание для C26H23O2N1S1 · 0,5H2O: C, 73,91; H, 5,73; N, 3,31. Найдено: C, 73,78; H, 5,55; N, 3,22.
ПРИМЕР 112
Метил-4-меркаптобензоат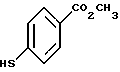
К раствору 4-меркаптобензойной кислоты (Apin, 1,72 г, 11,17 ммоль) в безводном метиловом спирте (20,0 мл) добавляли концентрированную серную кислоту (0,43 мл). Реакционную смесь затем нагревали с обратным холодильником в течение 16 ч, упаривали в вакууме, разбавляли этилацетатом (100 мл) и промывали насыщенным бикарбонатом натрия (2 х 100 мл). Затем органическую фазу отделяли, сушили над безводным сульфатом магния и упаривали в вакууме с получением 712 мг (выход 38%) указанного в заголовке продукта; 1H-ЯМР (CDCl3): δ 7,89 (д, J=8,7 Гц, 2Н), 7,29 (д, J=8,7 Гц, 2Н), 3,90 (с, 3H), 3,60 (с, 1Н).
ПРИМЕР 113
Метиловый эфир 4-[[[(5,6-дигидро-5,5 -диметил-8-фенил)-2-нафталенил] метил]сульфамил]бензойной кислоты (I24а)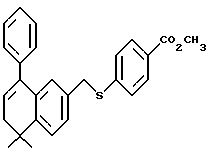
К раствору метил-4-меркаптобензоата из примера 112 (89 мг, 0,528 ммоль) в диметиловом эфире этиленгликоля (3,0 мл) добавляли 60% гидрид натрия (0,607 ммоль, 24 мг) при комнатной температуре. Через 0,15 ч добавляли соединение LVIIIa (190 мг, 0,581 ммоль). После выдерживания в течение 2 ч при комнатной температуре реакционную смесь разбавляли этилацетатом (50 мл) и промывали 1 н. соляной кислотой (2 х 50 мл). Органическую фазу упаривали в вакууме и остаток хроматографировали на силикагеле (элюируя 10% этилацетатом в гексане) с получением 30 мг (выход 13%) указанного в заголовке продукта; 1H-ЯМР (CDCl3): δ 7,88 (д, J=8,5 Гц, 2Н), 7,28 (м, 9Н), 6,98 (д, J=1,4 Гц, 1Н), 5,98 (т, J=4,5 Гц, 1Н), 4,07 (с, 2Н), 3,90 (с, 3H), 2,33 (д, J=4,5 Гц, 2Н), 1,32 (с, 6Н); MS (DCI) m/e: 415 (МН+).
ПРИМЕР 114
4-[[[(5,6-Дигидро-5,5-диметил -8-фенил)-2-нафталенил] метил] сульфамил] бензойная кислота (I34a)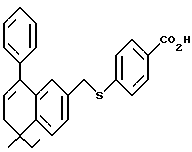
Используя описанный метод получения (8-фенил)-производного I4а, из 30 мг (0,07 ммоль) соединения I24а получили 21 мг (выход 72%) указанного в заголовке продукта; 1H-ЯМР (ДМСО-d6): δ 12,87 (с, 1Н), 7,77 (д, J=8,5 Гц, 2Н), 7,35 (м, 7Н), 7,28 (д, J=1,8 Гц, 1Н), 7,19 (дд, J=7,9, 1,8 Гц, 1Н), 6,90 (д, J=1,5 Гц, 1Н), 5,95 (т, J=4,5 Гц, 1Н), 4,19 (с, 2Н), 2,27 (д, J=4,5 Гц, 2Н), 1,24 (с, 6Н); MS (DCI) m/e: 401 (МН+); ИК (KBr): 3436, 2960, 1688, 1592 см-1.
Расчетное содержание для C26H24O2S1 · H2O: C, 76,93; H, 6,11. Найдено: C, 76,91; H, 6,03.
ПРИМЕР 115
1, 2-Дигидро-1,1-диметил-6- нитро-8-(трифторметансульфонилокси)- нафталин (LXI)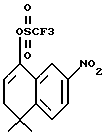
К раствору 4,4-диметил-7-нитро-1-тетралона (VI) (2,4 г, 10,96 ммоль) в тетрагидрофуране (10,0 мл) при -78oC добавляли бис(триметилсилил)амид лития (1,0 М раствор в гексане, 12,05 ммоль, 12,05 мл) и затем N-(2-пиридил)имид трифторметансульфоновой кислоты (12,05 ммоль, 4,30 г) при -78oC. После выдерживания в течение 0,5 ч при -78oC реакционную смесь разбавляли водой и экстрагировали этилацетатом (2 х 50 мл). Органические фазы объединяли и упаривали в вакууме. Остаток хроматографировали на силикагеле (элюируя 5% этилацетатом в гексане) с получением 2,68 г (выход 70%) указанного в заголовке продукта; 1H-ЯМР (CDCl3): δ 8,20 (м, 2Н), 7,49 (д, J=8,2 Гц, 1Н), 6,15 (т, J= 4,5 Гц, 1Н), 2,50 (д, J=4,5 Гц, 2Н), 1,37 (с, 6Н); MS (DCI) m/e: 352 (МН+).
ПРИМЕР 116
1,2-Дигидро-1,1-диметил-6-нитро-4-фенилнафталин (LXIIa)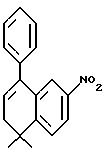
К раствору соединения LXI (2,68 г, 7,64 ммоль) в безводном 1-метил-2-пирролидиноне (30,0 мл) добавляли трифениларсин (442 мг, 1,44 ммоль), трис(дибензилиденацетон)-дипалладий (0) (217 мг, 0,237 ммоль) и трибутилфенилолово (6,17 г, 16,78 ммоль) в безводном 1-метил-2-пирролидиноне (5,0 мл). После выдерживания в течение 16 ч при 60oC смесь разбавляли водой и экстрагировали этилацетатом (2 х 100 мл). Органические фазы объединяли, перемешивали над насыщенным водным раствором фторида калия в течение 0,5 ч, отделяли и упаривали в вакууме. Остаток хроматографировали на силикагеле (элюируя 20% этилацетатом в гексане) с получением 1,93 г (выход 90%) указанного в заголовке продукта; 1H-ЯМР (CDCl3): δ 8,07 (дд, J=8,5, 2,5 Гц, 1Н), 7,87 (д, J=2,5 Гц, 1Н), 7,50 (д, J=8,5 Гц, 1Н), 7,36 (м, 5Н), 6,12 (т, J= 4,5 Гц, 1Н), 2,41 (д, J=4,5 Гц, 2Н), 1,39 (с, 6Н); MS (DCI) m/e: 280 (МН+).
ПРИМЕР 117
5,5-Диметил-8-фенил-5,6 -дигидро-нафтален-2-иламин (LXIIIa)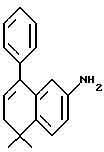
К раствору соединения LXIIa (1,75 г, 6,27 ммоль) в безводном бензоле (15,0 мл) добавляли хлорид железа (III) (33%, 2,94 мл) и воду (11,9 мл). Реакционную смесь нагревали с обратным холодильником и в течение 1,5 ч добавляли железо (3,50 г) четырьмя равными аликвотами. Затем получившуюся смесь нагревали с обратным холодильником в течение 16 ч. После охлаждения до комнатной температуры реакционную смесь фильтровали через пад из целита. Органическую фазу отделяли, сушили над безводным сульфатом магния и упаривали в вакууме с получением 1,56 г (выход 99%) указанного в заголовке продукта; 1H-ЯМР (CDCl3): δ 7,35 (м, 5Н), 7,15 (д, J=8,1 Гц, 1Н), 6,57 (дд, J= 8,1, 2,5 Гц, 1Н), 6,37 (д, J=2,5 Гц, 1Н), 5,95 (т, J=4,5 Гц, 1Н), 3,45 (ушир.с, 2Н), 2,31 (д, J=4,5 Гц, 2Н), 1,30 (с, 6Н); MS (DCI) m/e: 250 (МН+).
ПРИМЕР 118
Метиловый эфир 4-[[[(5,6-дигидро-5,5 -диметил-8-фенил)-2-нафталенил] амино]метил]бензойной кислоты (I28а)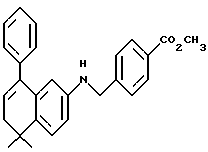
Используя метод получения метилового эфира 4-[[[(5,6-дигидро- 5,5-диметил-8-фенил)-2-нафталенил] метил] амино]бензойной кислоты I20а, из 1,35 г (5,38 ммоль) соединения LXIIIa и метил-4-формилбензоата (Aldrich, 723 мг, 4,41 ммоль) получили 1,38 г (выход 79%) указанного в заголовке продукта; 1H-ЯМР (CDCl3): δ 7,95 (д, J=8,5 Гц, 2Н), 7,29 (м, 7Н), 7,16 (д, J=8,3 Гц, 1Н), 6,47 (дд, J=8,3, 2,6 Гц, 1Н), 6,29 (д, J=2,6 Гц, 1Н), 5,94 (т, J=4,5 Гц, 1Н), 4,53 (с, 2Н), 3,91 (с, 3H), 2,30 (д, J=4,5 Гц, 2Н), 1,29 (с, 6Н); MS (DCI) m/e: 398 (МН+).
ПРИМЕР 119
4-[[[(5,6-Дигидро-5,5-диметил -8-фенил)-2-нафталенил] амино] метил] бензойная кислота (I29а)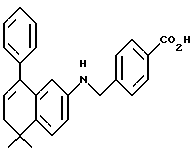
К раствору соединения I28а (1,38 г, 3,48 ммоль) в смеси этиловый спирт/тетрагидрофуран 1: 1 (15,0 мл) добавляли 10 н. NaOH (35,0 ммоль, 3,5 мл) при комнатной температуре. После выдерживания в течение 16 ч добавляли избыток 1 н. HCl (100 мл) и осадок собирали при помощи фильтрации под вакуумом с получением 1,28 г (выход 96%) указанного в заголовке продукта в виде его гидрохлоридной соли; 1H-ЯМР (ДМСО-d6): 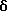 7,84 (д, J=8,2 Гц, 2Н), 7,36 (д, J=8,2 Гц, 1Н), 7,31 (м, 5Н), 7,15 (м, 4Н), 6,99 (ушир.с, 1Н), 6,36 (ушир. с, 1Н), 5,90 (т, J=4,5 Гц, 1Н), 4,32 (с, 2Н), 2,21 (д, J=4,5 Гц, 2Н), 1,19 (с, 6Н); MS (DCI) m/e: 384 (МН+); ИК (KBr): 3420, 2958, 1694, 1606 см-1.
7,84 (д, J=8,2 Гц, 2Н), 7,36 (д, J=8,2 Гц, 1Н), 7,31 (м, 5Н), 7,15 (м, 4Н), 6,99 (ушир.с, 1Н), 6,36 (ушир. с, 1Н), 5,90 (т, J=4,5 Гц, 1Н), 4,32 (с, 2Н), 2,21 (д, J=4,5 Гц, 2Н), 1,19 (с, 6Н); MS (DCI) m/e: 384 (МН+); ИК (KBr): 3420, 2958, 1694, 1606 см-1.
Расчетное содержание для C26H25N1O2 · 1,0HCl: C, 72,80; H, 6,34; N, 3,27. Найдено: C, 72,98; H, 6,09; N, 3,14.
ПРИМЕР 120
3,3-Диметил-6-нитроиндан-1-он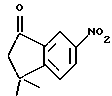
К раствору 3,3-диметилиндан-1-она (LXIV) (16,3 г, 50,9 ммоль) (Harms, W. M. and Eisenbraum, E. J. Org. Prep. Proc. Int., 1972, 4, 67-72) в 56 мл серной кислоты медленно добавляли 4,18 мл 70% азотной кислоты в 20 мл серной кислоты при 0-5oC. После перемешивания в течение 1 часа смесь выливали в 600 г льда. Осадок отфильтровывали и промывали водой. Собранную твердую фазу растворяли в 600 мл этилацетата и промывали NaHCO3 (80 мл х 2), сушили над сульфатом магния и выпаривали. Остаток растирали с метанолом с получением 22,2 г указанного в заголовке соединения в виде твердого вещества желтого цвета; 1H-ЯМР (CDCl3): δ 1,49 (с, 6Н), 2,71 (с, 2Н), 7,68 (д, J=8,4 Гц, 1Н), 8,48 (дд, J=2,0, 8,4 Гц, 1Н), 8,53 (д, J=2,0 Гц, 1Н); MS m/e: 206 (МН+).
Расчетное содержание для C11H11NO3: C, 64,38; H, 5,40; N, 6,83. Найдено: C, 64,33; H, 5,33; N, 6,86.
ПРИМЕР 121
6-Амино-3,3-диметилиндан-1-он (LXV)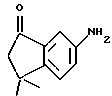
3,3-Диметил-6-нитроиндан-1-он (22,2 г, 54,1 ммоль) и оксид платины (0,44 г, 1,94 ммоль) в 30 мл этилацетата и 60 мл этанола гидрировали в вибраторе Парра в течение 40 мин. Смесь фильтровали через пад из целита. Фильтрат выпаривали и остаток растирали с гексаном с получением 18,4 г (выход 97%) указанного в заголовке продукта в виде твердого вещества желтого цвета; 1H-ЯМР (CDCl3): δ 1,38 (с, 6Н), 2,56 (с, 2Н), 6,98 (д, J=2,3 Гц, 1Н), 7,02 (дд, J=2,3, 8,2 Гц, 1Н), 7,30 (д, J=8,2 Гц, 1Н); MS m/e: 176 (МН+).
Расчетное содержание для C11H13N1O1: C, 75,40; H, 7,48; N, 7,99. Найдено: C, 75,07; H, 7,45; N, 7,94.
ПРИМЕР 122
6-Гидрокси-3,3-диметилиндан-1-он (LXVI)
Раствор нитрита натрия (14,8 г, 214 ммоль) в 30 мл воды медленно добавляли к раствору 6-амино-3,3-диметилиндан-1-она (14,0 г, 85,8 ммоль) в 30 мл 48% тетрафтороборной кислоты и 30 мл воды при 0-5oC. После перемешивания в течение 30 мин смесь фильтровали, и твердую фазу промывали холодной 5% тетрафтороборной кислотой и сушили в вакууме. Затем твердую фазу добавляли несколькими порциями в кипящий раствор 50 мл серной кислоты в 0,5 л воды. После нагревания с обратным холодильником в течение 1 часа раствор охлаждали до комнатной температуры и экстрагировали этилацетатом (100 мл х 3). Объединенные экстракты сушили над сульфатом магния и выпаривали. Остаток очищали при помощи флэш-хроматографии (EtOAc:гексан = от 1:10 до 1:2) с получением 7,60 г (выход 50%) указанного в заголовке соединения в виде твердого вещества; 1H-ЯМР (CDCl3): δ 1,40 (с, 6Н), 2,64 (с, 2Н), 7,13 (с, 1Н), 7,18 (д, J=8,2 Гц, 1Н), 7,39 (д, J=8,2 Гц, 1H); MS m/e: 177 (МН+).
Расчетное содержание для C11H12O2: C, 74,98; H, 6,86. Найдено: C, 74,81; H, 6,76.
ПРИМЕР 123
1,1-Диметил-3-оксоиндан-5-иловый эфир трифторметансульфоновой кислоты
К раствору 6-гидрокси-3,3-диметилиндан-1-она (4,01 г, 24,4 ммоль) и 4-диметиламинопиридина (DMAP, 5,97 г, 48,9 ммоль) в 30 мл метиленхлорида медленно добавляли ангидрид трифторметансульфоновой кислоты (9,65 г, 34,2 ммоль) при -78oC. После перемешивания в течение 1 часа при комнатной температуре смесь разбавляли метиленхлоридом (60 мл), промывали 1 н. HCl 10 мл х 2) и водой (10 мл), сушили над сульфатом магния и выпаривали. Остаток очищали при помощи флэш-хроматографии (EtOAc:гексан = от 1:10 до 1:5) с получением 5,58 г (выход 74%) указанного в заголовке соединения; 1H-ЯМР (CDCl3): δ 1,46 (с, 6Н), 2,67 (с, 2Н), 7,51 (дд, J=2,3, 8,4 Гц, 1Н), 7,57 (д, J=2,3 Гц, 1Н), 7,60 (д, J=8,4 Гц, 1Н); MS m/e: 309 (MH+).
Расчетное содержание для C12H11F3O4S: C, 46,75; H, 3,60. Найдено: C, 46,83; H, 3,58.
ПРИМЕР 124
Метиловый эфир 1,1-диметил-3-оксоиндан-5-карбоновой кислоты (LXVII)
Раствор 1,1-диметил-3-оксоиндан-5-илового эфира трифторметансульфоновой кислоты (3,08 г, 10,0 ммоль), триэтиламина (2,02 г, 20,0 ммоль), ацетата палладия (II) (0,11 г, 0,50 ммоль) и 1,3-бис(дифенилфосфино) пропана (dppp, 0,21 мг, 0,50 ммоль) в 30 мл безводного диметилсульфоксида и 20 мл метанола насыщали моноксидом углерода в течение 10 мин и затем перемешивали в атмосфере моноксида углерода при 65-70oC в продолжение 2 часов. Метанол выпаривали и образовавшийся раствор разбавляли 50 мл воды, экстрагировали этиловым эфиром (40 мл х 4). Объединенные экстракты сушили над сульфатом магния и выпаривали. Остаток очищали при помощи флэш-хроматографии (EtOAc:гексан = от 1: 20 до 1:5) с получением 1,98 г (выход 91%) указанного в заголовке соединения в виде твердого вещества светло-желтого цвета; 1H-ЯМР (CDCl3): δ 1,45 (с, 6Н), 2,65 (с, 2Н), 3,94 (с, 3H), 7,58 (дд, J= 8,1 Гц, 1Н), 8,30 (дд, J=1,6, 8,1 Гц, 1Н), 8,36 (д, J=1,6 Гц, 1Н); MS m/e: 219 (MH+).
Расчетное содержание для C13H14O3: C, 71,54; H, 6,47. Найдено: C, 71,71; H, 6,46.
ПРИМЕР 125
Метиловый эфир 1,1-диметил-3- (трифторметансульфонилокси)-1Н-инден- 5-карбоновой кислоты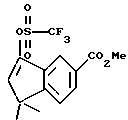
К раствору метилового эфира 1,1-диметил-3-оксоиндан-5-карбоновой кислоты (0,90 г, 4,12 ммоль) и 2,6-ди-третбутил-4-метилпиридина (1,10 г, 5,36 ммоль) в 10,0 мл метиленхлорида добавляли ангидрид трифторметансульфоновой кислоты (1,39 г, 4,94 ммоль) при -78oC. После перемешивания при комнатной температуре в течение 16 ч смесь разбавляли 70 мл этилового эфира, промывали 1 н. HCl (20 мл), сушили над сульфатом магния и выпаривали. Остаток очищали при помощи флэш-хроматографии (EtOAc:гексан = от 1:20 до 1:5) с получением 1,23 г (выход 85%) указанного в заголовке соединения; 1H-ЯМР (CDCl3): δ 1,41 (с, 6Н), 3,95 (с, 3H), 6,30 (с, 1Н), 7,44 (д, J= 7,8 Гц, 1Н), 7,99 (с, 1Н), 8,06 (д, J=7,8 Гц, 1Н); MS m/e: 351 (МН+).
ПРИМЕР 126
Метиловый эфир 1,1-диметил-3-фенил-1Н-инден-5-карбоновой кислоты (LXVIIIa)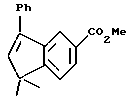
Метиловый эфир 1,1-диметил-3-(трифторметансульфонилокси)-1Н-инден-5- карбоновой кислоты (580 мг, 1,86 ммоль), трис(дибензилиденацетон)дипалладий (0) (Pd2dba3, 17 мг, 0,02 ммоль), трифениларсин (46 мг, 0,15 ммоль), хлорид лития (240 мг, 5,59 ммоль) и фенилтрибутилолово (680 мг, 1,86 ммоль) в 5 мл 2-метилпирролидинона перемешивали при 55oC в продолжение 1,5
дней. Смесь разбавляли водой и экстрагировали этиловым эфиром (30 мл х 3). Объединенные экстракты сушили над сульфатом магния и выпаривали. Остаток очищали при помощи флэш-хроматографии (EtOAc: гексан = от 1:20 до 1:5) с получением 0,43 г (выход 83%) указанного в заголовке соединения в виде твердого вещества белого цвета; 1H-ЯМР (CDCl3): δ 1,41 (с, 6Н), 3,91 (с, 3H), 6,48 (с, 1Н), 7,39-7,62 (м, 6Н), 7,99 (д, J=6,8 Гц, 1Н), 8,14 (с, 1H); MS m/e: 279 (МН+).
Расчетное содержание для C19H18O2 · 0,25H2O: C, 80,68; H, 6,49. Найдено: C, 80,76; H, 6,41.
ПРИМЕР 127
Метиловый эфир 4-[(1,1-диметил-3-фенил -1Н-инден- 5-карбонил) амино] бензойной кислоты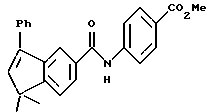
Метиловый эфир 1,1-диметил-3-фенил -1Н-инден-5-карбоновой кислоты (315 мг, 1,13 ммоль) перемешивали с 10 н. NaOH (1,1 мл, 11,0 ммоль) в 5 мл метанола и 10 мл тетрагидрофурана при 60oC в течение 1,5 часов. Смесь упаривали при пониженном давлении и подкисляли 1 н. HCl (15 мл), экстрагировали этилацетатом (15 мл х 3). Объединенные экстракты промывали водой (10 мл) сушили над сульфатом магния и выпаривали. Остаток сушили в вакууме и растворяли в 2,5 мл метиленхлорида. К раствору добавляли оксалилхлорид (348 мг, 2,74 ммоль) и 2 капли диметилформамида при 0oC. Затем раствор перемешивали при 0oC в течение 30 мин и при комнатной температуре в течение 30 мин. Смесь выпаривали и сушили в вакууме. Остаток перемешивали с метил-4-аминобензоатом (181 мг, 1,32 ммоль) в 2 мл безводного пиридина в продолжение 18 часов. Избыток пиридина выпаривали и остаток разбавляли 20 мл 2 н. HCl, экстрагировали этиловым эфиром (30 мл х 4). Объединенные экстракты промывали водой (10 мл), сушили над сульфатом магния и выпаривали. Остаток очищали при помощи флэш-хроматографии (EtOAc: гексан = от 1:20 до 1:5) с получением 372 мг (выход 85%) указанного в заголовке соединения в виде стеклообразной массы; 1H-ЯМР (CDCl3): δ 1,43 (с, 6Н), 3,91 (с, 3H), 6,52 (с, 1Н), 7,40-7,50 (м, 4Н), 7,59-7,61 (м, 2Н), 7,72-7,75 (м, 3H), 7,96 (с, 1Н), 8,00 (ушир.с, 1Н), 8,05 (д, J=8,7 Гц, 2Н); MS m/e: 398 (МН+).
Расчетное содержание для C26H23NO3 · 0,125H2O: C, 78,12; H, 5,93; N, 3,50. Найдено: C, 77,97; H, 5,50; N, 3,24.
ПРИМЕР 128
4-[(1,1-Диметил-3-фенил-1Н-инден -5-карбонил) амино] бензойная кислота (I30а)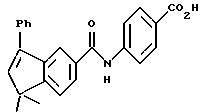
Метиловый эфир 4-[(1,1-диметил-3-фенил-1Н -инден-5- карбонил)амино] бензойной кислоты (359 мг, 0,90 ммоль) перемешивали с 4,5 мл 2 н. NaOH в 5 мл метанола и 5 мл тетрагидрофурана в течение 10 часов. Раствор подкисляли 1 н. HCl и упаривали при пониженном давлении. После добавления 15 мл воды смесь экстрагировали этилацетатом (15 мл х 3). Объединенные экстракты промывали водой (10 мл), сушили над сульфатом магния и выпаривали. Остаток растирали в смеси эфира с гексаном с получением 326 мг указанного в заголовке соединения в виде твердого вещества; 1H-ЯМР (ДМСО-d6): δ 1,39 (с, 6Н), 7,39-7,53 (м, 3H), 7,64-7,68 (м, 3H), 7,85-7,97 (м, 6Н), 10,54 (с, 1Н), 12,75 (ушир.с, 1H); MS m/e: 384 (МН+).
Расчетное содержание для C25H21NO3 · 0,25H2O: C, 77,39; H, 5,46; N, 3,61. Найдено: C, 77,26; H, 5,51; N, 3,52.
ПРИМЕР 129
1,1-диметил-5-нитро-3- (трифторметансульфонилокси)-1H-инден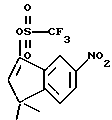
К раствору 3,3-диметил-6-нитроиндан-1-она (LXIX) (1,00 г, 4,65 ммоль) и 2,6-ди-трет-бутил-4-метилпиридина (1,19 г, 5,80 ммоль) в 10,0 мл метиленхлорида добавляли ангидрид трифторметансульфоновой кислоты (1,57 г, 5,58 ммоль) при -78oC. После перемешивания при комнатной температуре в течение 16 ч смесь разбавляли 1 н. HCl (20 мл) и экстрагировали этиловым эфиром (30 мл х 3). Объединенные экстракты промывали водой (20 мл), сушили над сульфатом магния и выпаривали. Остаток очищали при помощи флэш-хроматографии (EtOAc: гексан = от 1:20 до 1:10) с получением 1,37 г (выход 87%) указанного в заголовке соединения в виде масла; 1H-ЯМР (CDCl3): δ 1,45 (с, 6Н), 6,43 (с, 1Н), 7,53 (д, J= 8,3 Гц, 1Н), 8,15 (д, J=2,0 Гц, 1Н), 8,24 (дд, J=2,0, 8,3 Гц, 1Н); MS m/e: 338 (MH+).
Расчетное содержание для C12H10F3NO5S: C, 42,73; H, 2,99; N, 4,15. Найдено: C, 42,70; H, 2,80; N, 4,10.
ПРИМЕР 130
1,1-Диметил-5-нитро-3-фенил-1Н-инден (LXXa)
1,1-Диметил-5-нитро-3- (трифторметансульфонилокси)-1H-инден (1,32 г, 2,89 ммоль), трис(дибензилиденацетон)-дипалладий (0) (21 мг, 0,02 ммоль), трифениларсин (70 мг, 0,23 ммоль), хлорид лития (0,37 г, 8,67 ммоль) и фенилтрибутилолово (1,06 г, 2,89 ммоль) перемешивали при 60oC в продолжение 48 часов. Смесь разбавляли водой (30 мл) и экстрагировали этиловым эфиром (30 мл х 3). Объединенные экстракты сушили над сульфатом магния и выпаривали. Остаток очищали при помощи флэш-хроматографии (EtOAc:гексан = от 1:25 до 1: 5) с получением твердого вещества, которое перекристаллизовывали из гексана с получением 575 мг (выход 75%) указанного в заголовке соединения в виде светло-желтых кристаллов; 1H-ЯМР (CDCl3): δ 1,44 (с, 6Н), 6,58 (с, 1Н), 7,40-7,60 (м, 6Н), 8,18 (д, J=2,0, 8,2 Гц, 1Н), 8,32 (д, J=2,0 Гц, 1Н); MS m/e: 266 (МН+).
Расчетное содержание для C17H15NO2: C, 76,96; H, 5,70; N, 5,28. Найдено: C, 76,71; H, 5,69; N, 5,22.
ПРИМЕР 131
5-Амино-1,1-диметил-3-фенил-1H-инден (LXXIa)
К раствору 1,1-диметил-5-нитро-3-фенил-1Н-индена (LXXa) (0,56 г, 2,11 ммоль) в 5 мл бензола добавляли 33% хлорид железа (III) (1 мл) и 4 мл воды. Смесь перемешивали при нагревании с обратным холодильником и в течение 2 часов добавляли железо (1,00 г, 5,28 ммоль) четырьмя равными частями. Получившуюся смесь дополнительно перемешивали при нагревании с обратным холодильником в течение 18 ч. Смесь разбавляли 20 мл воды и 20 мл этилацетата и фильтровали через пад из целита. Фильтрат экстрагировали этилацетатом (20 мл х 3). Объединенные экстракты сушили над сульфатом магния с получением 0,49 г (выход 98%) сырого соединения, указанного в заголовке, которое не подвергали дальнейшей очистке и использовали в следующей реакции; 1H-ЯМР (CDCl3): δ 1,37 (с, 6Н), 6,40 (с, 1Н), 6,71 (дд, J=2,0, 7,9 Гц, 1Н); 6,93 (д, J= 2,0 Гц, 1Н), 7,19 (д, J=7,9 Гц, 1Н), 7,36-7,58 (м, 5Н); MS m/e: 236 (MH+).
ПРИМЕР 132
Метиловый эфир 4-[[(1,1-диметил-3-фенил -1Н-инден-5-ил)амино]-карбонил] бензойной кислоты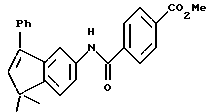
5-Амино-1,1-диметил-3-фенил-1Н-инден (0,49 г, 2,06 ммоль) и хлорангидрид монометилового эфира терефталевой кислоты (0,49 г, 2,47 ммоль) перемешивали в 5 мл пиридина в течение 18 часов. Растворитель выпаривали и остаток разбавляли 1 н. HCl (20 мл), экстрагировали этилацетатом (20 мл х 3). Объединенные экстракты промывали насыщенным раствором NaCl, сушили над сульфатом магния и выпаривали. Сырой продукт очищали при помощи флэш-хроматографии (EtOAc:гексан = от 1:10 до 1:5) с получением 772 мг (выход 94%) указанного в заголовке соединения, которое кристаллизовали из смеси EtOAc - гексан с получением 720 мг кристаллов; 1H-ЯМР (CDCl3): 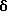 1,41 (с, 6Н), 3,96 (с, 3H), 6,47 (с, 1Н), 7,37-7,60 (м, 7Н), 7,68 (с, 1Н), 7,84 (с, 1Н), 7,94 (д, J=8,3 Гц, 2Н), 8,16 (д, J=8,3 Гц, 2Н); MS m/e: 398 (МН+).
1,41 (с, 6Н), 3,96 (с, 3H), 6,47 (с, 1Н), 7,37-7,60 (м, 7Н), 7,68 (с, 1Н), 7,84 (с, 1Н), 7,94 (д, J=8,3 Гц, 2Н), 8,16 (д, J=8,3 Гц, 2Н); MS m/e: 398 (МН+).
Расчетное содержание для C26H23NO3: C, 78,57; H, 5,83; N, 3,52. Найдено: C, 78,45; H, 5,76; N, 3,41.
ПРИМЕР 133
4-[[(1,1-Диметил-3-фенил -1Н-инден-5-ил) амино]карбонил]бензойная кислота (I31a)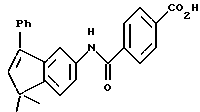
Метиловый эфир 4-[(1,1-диметил-3-фенил-1Н -инден-5-ил)амино] карбонил] бензойной кислоты (325 мг, 0,82 ммоль), 4,1 мл 2 н. NaOH в 10 мл тетрагидрофурана и 10 мл метанола перемешивали в течение 2 часов. Раствор упаривали и подкисляли 1 н. HCl (20 мл), экстрагировали этилацетатом (35 мл х 2). Объединенные экстракты промывали водой (10 мл), сушили над сульфатом магния и выпаривали. Остаток растирали в смеси эфира с гексаном с получением 246 мг (выход 78%) указанного в заголовке соединения в виде твердого вещества белого цвета; 1H-ЯМР (ДМСО-d6): δ твердого вещества; 1H-ЯМР (ДМСО-d6): δ 1,35 (с, 6Н), 6,58 (с, 1Н), 7,38-7,70 (м, 7Н), 7,73 (д, J=7,9 Гц, 1Н), 7,90 (с, 1Н), 8,04 (с, 4Н), 10,38 (ушир. с, 1Н); 13,25 (ушир.с, 1H); MS m/e: 384 (МН+).
Расчетное содержание для C25H21NO3 · 0,25H2O: C, 77,40; H, 5,59; N, 3,61. Найдено: C, 77,24; H, 5,33; N, 3,41.
ПРИМЕР 134
Метиловый эфир 4-(1,1-диметил-3-оксоиндан -5-илокси-метил)бензойной кислоты (LXXIIa)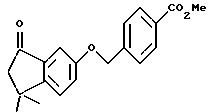
К 6-гидрокси-3,3-диметилиндан-1-ону (0,72 г, 4,37 ммоль) в 5 мл диметилформамида добавляли гидрид натрия (0,16 г, 6,55 ммоль) при 0oC. После перемешивания в течение 30 мин добавляли метил-4-бромметилбензоат (1,00 г, 4,37 ммоль). Полученную смесь перемешивали при 0oC в течение 1 часа и при комнатной температуре в течение 2 часов. Смесь охлаждали до 0oC и подкисляли 1 н. HCl. Растворитель выпаривали и остаток подкисляли 20 мл 1 н. HCl и экстрагировали этиловым эфиром (30 мл х 3). Объединенные экстракты сушили над сульфатом магния и выпаривали. Остаток очищали при помощи флэш-хроматографии (EtOAc: гексан = от 1:20 до 1:4) с получением 0,68 г (выход 48%) указанного в заголовке соединения в виде твердого вещества; 1H-ЯМР (CDCl3): δ 1,41 (с, 6Н), 2,61 (с, 2Н), 3,93 (с, 1Н), 5,15 (с, 2Н), 7,18 (д, J=2,5 Гц, 1Н), 7,30 (дд, J= 2,5, 8,4 Гц, 1Н), 7,42 (д, J=8,4 Гц, 1Н), 7,51 (д, J=8,3 Гц, 2Н), 8,07 (д, J=8,3 Гц, 2Н); MS m/e: 325 (МН+).
Расчетное содержание для C20H20O4: C, 74,06; H, 6,21. Найдено: C, 73,99; H, 6,24.
ПРИМЕР 135
Метиловый эфир 4-[1,1-диметил-3- (трифторметансульфонил-окси) 1Н-инден-5-илоксиметил] бензойной кислоты
К раствору метилового эфира 4-(1,1-диметил-3-оксоиндан-5- илоксиметил)бензойной кислоты (675 мг, 2,08 ммоль) и 2,6-ди-трет-бутил-4-метилпиридина (534 мг, 2,60 ммоль) в 5 мл метиленхлорида добавляли ангидрид трифторметансульфоновой кислоты (705 мг, 2,50 ммоль) при -78oC. После перемешивания при комнатной температуре в течение 16 ч смесь разбавляли 1 н. HCl (20 мл) и экстрагировали этиловым эфиром (20 мл х 3). Объединенные экстракты сушили над сульфатом магния и выпаривали. Остаток очищали при помощи флэш-хроматографии (EtOAc: гексан = от 1:20 до 1:10) с получением 849 мг (выход 95%) указанного в заголовке соединения в виде твердого вещества; 1H-ЯМР (CDCl3): δ 1,37 (с, 6Н), 3,93 (с, 1Н), 5,15 (с, 2Н), 6,24 (с, 1Н), 6,90-6,94 (м, 2Н), 7,25 (д поверх CHCl3, J=8,8 Гц, 1Н), 7,53 (д, J=8,7 Гц, 2Н), 8,08 (д, J=8,7 Гц, 2Н); MS m/e: 457 (МН+).
Расчетное содержание для C21H19F3O6S: C, 55,26; H, 4,20. Найдено: C, 55,39; H, 4,08.
ПРИМЕР 136
Метиловый эфир 4-[1,1-диметил-3-фенил-1Н- инден-5-илоксиметил]бензойной кислоты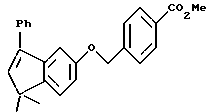
Метиловый эфир 4-[1,1-диметил -3-(трифторметан-сульфонилокси)-1Н- инден-5-илоксиметил] бензойной кислоты (838 мг, 1,84 ммоль), трис(дибензилиденацетон)дипалладий (0) (17 мг, 0,02 ммоль), трифениларсин (64 мг, 0,20 ммоль), хлорид лития (234 мг, 5,51 ммоль) и фенилтрибутилолово (676 мг, 1,84 ммоль) перемешивали при 60oC в продолжение 18 часов. Смесь разбавляли водой (30 мл) и экстрагировали этиловым эфиром (30 мл х 3). Объединенные экстракты сушили над сульфатом магния и выпаривали. Остаток очищали при помощи флэш-хроматографии (EtOAc:гексан = от 1:25 до 1:10) с получением твердого вещества, которое перекристаллизовывали из гексана с получением 454 мг (выход 64%) указанного в заголовке соединения в виде кристаллов; 1H-ЯМР (CDCl3): δ 1,38 (с, 6Н), 3,93 (с, 1Н), 5,13 (с, 2Н), 6,44 (с, 1Н), 6,86 (дд, J= 2,2, 8,1 Гц, 1Н), 7,11 (д, J=2,2 Гц, 1Н), 7,27-7,55 (м, 8Н), 8,06 (д, J= 8,1 Гц, 2Н); MS m/e: 385 (МН+).
Расчетное содержание для C26H24O3 · 0,125H2O: C, 80,75; H, 6,32. Найдено: C, 80,76; H, 6,19.
ПРИМЕР 137
4-[1,1-Диметил-3-фенил-1Н -инден-5-илоксиметил]бензойная кислота (I32a)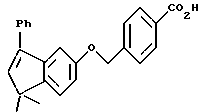
Метиловый эфир 4-[1,1-диметил-3-фенил-1Н -инден-5- илоксиметил]бензойной кислоты (300 мг, 0,78 ммоль) и 3,9 мл 2 н. NaOH в 5 мл тетрагидрофурана и 5 мл метанола перемешивали при комнатной температуре в течение 16 часов. Раствор упаривали и подкисляли 1 н. HCl (10 мл), экстрагировали этилацетатом (20 мл х 3). Объединенные экстракты промывали водой (10 мл), сушили над сульфатом магния и выпаривали. Остаток кристаллизовали из смеси эфира с гексаном с получением 247 мг (выход 85%) указанного в заголовке соединения в виде твердого вещества белого цвета; 1H-ЯМР (ДМСО-d6): δ 1,31 (с, 6Н), 5,20 (с, 2Н), 6,57 (с, 1Н), 6,89 (дд, J=1,1, 8,2 Гц, 1Н), 7,02 (д, J=1,1 Гц, 1Н), 7,36-7,57 (м, 8Н), 7,95 (д, J=8,3 Гц, 2Н), 12,94 (ушир.с, 1H); MS m/e: 371 (МН+).
Расчетное содержание для C25H22O3 · 0,25H2O: C, 80,08; H, 6,05. Найдено: C, 80,17; H, 5,86.
ПРИМЕР 138
6-Бром-3,3-диметилиндан-1-он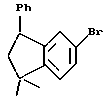
К хлориду алюминия (4,16 г, 31,2 ммоль) в колбе добавляли 3,3-диметилиндан-1-он (2,00 г, 12,5 ммоль) при 90-100oC. После перемешивания в течение 15 минут медленно добавляли бром (2,39 г, 15,0 ммоль). Смесь перемешивали при 100oC в течение 1 часа и затем гасили ледяной водой (200 г), экстрагировали этилацетатом (40 мл х 3). Объединенные экстракты сушили над сульфатом магния и выпаривали. Остаток очищали при помощи флэш-хроматографии (EtOAc: гексан = от 1:20 до 1:15) с получением сырого продукта, который перекристаллизовали из смеси MeOH-EtOAc с получением 1,23 г (выход 41%) указанного в заголовке соединения в виде бесцветных кристаллов; 1H-ЯМР (CDCl3):  1,42 (с, 6Н), 2,61 (с, 2Н), 7,39 (д, J=8,2 Гц, 1Н), 7,72 (дд, J=2,0, 8,2 Гц, 1Н), 7,82 (д, J=2,0 Гц, 1Н); MS m/e: 239 (MH+).
1,42 (с, 6Н), 2,61 (с, 2Н), 7,39 (д, J=8,2 Гц, 1Н), 7,72 (дд, J=2,0, 8,2 Гц, 1Н), 7,82 (д, J=2,0 Гц, 1Н); MS m/e: 239 (MH+).
Расчетное содержание для C11H11BrO3: C, 55,26; H, 4,64. Найдено: C, 55,19; H, 4,61.
ПРИМЕР 139
Метиловый эфир 4-[2-(1,1-диметил-3 -оксоиндан-5-ил)винил] бензойной кислоты (LXXVa)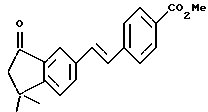
6-Бром-3,3-диметилиндан-1-он (1,20 г, 5,02 ммоль), метил-4-винилбензоат (1,63 г, 10,0 ммоль), ацетат палладия (56 мг, 0,25 ммоль), гидрат хлорида тетрабутиламмония (1,53 г, 5,52 ммоль) и бикарбонат натрия (1,05 г, 12,6 ммоль) перемешивали в 10 мл безводного N,N-диметилформамида при 80-100oC в течение 8 часов. Смесь разбавляли водой (100 мл) и экстрагировали метиленхлоридом (50 мл х 3). Объединенные экстракты сушили над сульфатом магния и выпаривали. Остаток очищали при помощи флэш-хроматографии (CH2Cl2:гексан = от 1: 1 до 1:0, затем CH2Cl2: EtOAc = 10:1) с получением 1,12 г (выход 70%) указанного в заголовке соединения в виде твердого вещества желтого цвета; 1H-ЯМР (CDCl3): δ 1,45 (с, 6Н), 2,64 (с, 2Н), 5,30 (с, 3H), 7,18 (д, J=16,5 Гц, 1Н); 7,52 (д, J=8,1 Гц, 1Н); 7,58 (д, J=8,5 Гц, 2Н); 7,78 (д, J=1,7, 8,1 Гц, 1Н), 7,86 (д, J=1,7 Гц, 1Н), 8,05 (д, J=8,5 Гц, 2Н); MS m/e: 321 (МН+).
Расчетное содержание для C21H20O3: C, 78,18; H, 6,32. Найдено: C, 78,22; H, 6,26.
ПРИМЕР 140
Метиловый эфир 4-[2-[1,1-диметил-3- (трифторметансульфонил-окси)-1Н-инден -5-ил]винил]бензойной кислоты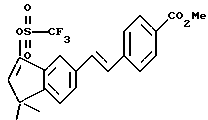
К раствору метилового эфира 4-[2-(1,1-диметил-3-оксоиндан-5- ил)винил] бензойной кислоты (450 мг, 1,40 ммоль) и 2,6-ди-трет-бутил-4-метилпиридина (345 мг, 1,68 ммоль) в 5 мл метиленхлорида добавляли ангидрид трифторметансульфоновой кислоты (434 мг, 1,54 ммоль) при -78oC. После перемешивания при комнатной температуре в течение 16 ч смесь разбавляли 1 н. HCl (20 мл) и экстрагировали этиловым эфиром (20 мл х 3). Объединенные экстракты сушили над сульфатом магния и выпаривали. Остаток очищали при помощи флэш-хроматографии (CH2Cl2: гексан = от 1:2 до 1:1) с получением 606 мг (выход 95%) указанного в заголовке соединения в виде твердого вещества; 1H-ЯМР (CDCl3): δ 1,41 (с, 6Н), 3,94 (с, 3H), 6,27 (с, 1Н), 7,15 (д, J=16,3 Гц, 1Н); 7,23 (д, J= 16,3 Гц, 1Н); 7,37 (д, J=8,2 Гц, 1H); 7,49 и 7,50 (д поверх с, J=8,2 Гц, 2Н), 7,59 (д, J=8,4 Гц, 2Н), 8,05 (д, J=8,4 Гц, 2Н); MS m/e: 453 (МН+).
Расчетное содержание для C22H19F3O5S: C, 58,40; H, 4,23. Найдено: C, 58,38; H, 4,00.
ПРИМЕР 141
Метиловый эфир 4-[2-(1,1-диметил-3-фенил -1Н-инден-5-ил)винил] бензойной кислоты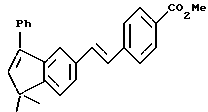
Метиловый эфир 4-[2-[1,1-диметил-3- (трифторметан- сульфонилокси)-1Н-инден-5-ил] винил]бензойной кислоты 590 мг, 1,30 ммоль), трис(дибензилиденацетон)дипалладий (0) (48 мг, 0,05 ммоль), трифениларсин (64 мг, 0,20 ммоль), хлорид лития (166 мг, 3,91 ммоль) и фенилтрибутилолово (525 мг, 1,43 ммоль) перемешивали при 95oC в продолжение 16 часов. Смесь разбавляли водой (75 мл), экстрагировали этилацетатом (20 мл х 2) и этиловым эфиром (20 мл х 2). Объединенные экстракты сушили над сульфатом магния и выпаривали. Остаток очищали при помощи флэш-хроматографии (EtOAc:гексан = от 1: 25 до 1:10) с получением продукта, который перекристаллизовывали из смеси EtOAc с гексаном с получением 311 мг (выход 63%) указанного в заголовке соединения в виде твердого вещества желтого цвета; 1H-ЯМР (CDCl3): δ 1,42 (с, 6Н), 3,93 (с, 3H), 6,45 (с, 1Н), 7,11 (д, J=16,3 Гц, 1Н), 7,29 (д, J=16,3 Гц, 1Н), 7,41-7,65 (м, 10H), 8,08 (д, J=8,4 Гц, 2Н).
ПРИМЕР 142
4-[2-(1,1-Диметил-3-фенил-1Н-инден -5-ил)винил]бензойная кислота (I33a)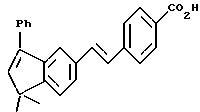
Метиловый эфир 4-[2-(1,1-диметил-3- фенил-1Н-инден-5-ил) винил]бензойной кислоты (294 мг, 0,77 ммоль) и 0,77 мл 10 н. NaOH в 7 мл тетрагидрофурана и 5 мл метанола перемешивали при нагревании с обратным холодильником в течение 1 часа. Смесь упаривали и подкисляли 1 н. HCl (10 мл), экстрагировали этилацетатом (30 мл х 2). Объединенные экстракты промывали водой (10 мл), сушили над сульфатом магния и выпаривали. Остаток растирали в горячем метаноле с получением 276 мг (выход 90%) указанного в заголовке соединения, которое содержит молекулу метанола; 1H-ЯМР (ДМСО-d6): δ 1,34 (с, 6Н), 3,14 (с, 3H), 6,58 (с, 1Н), 7,25 (д, J=16,4 Гц, 1Н), 7,37-7,71 (м, 11H), 7,90 (д, J=8,3 Гц, 2Н); MS m/e: 367 (МН+).
Расчетное содержание для C26H26O3· CH3OH: C, 81,38; H, 6,58. Найдено: C, 81,18; H, 6,78.
ПРИМЕР 143
N-(2-пиридил)имид трифторметансульфоновой кислоты (N(2-пиридил)трифлимид)
Указанное в заголовке соединение получали согласно методике Comins & Dehghani, Tetrahedron Lett., Vol. 33, N 42, 1992, p.6299. 1H-ЯМР (CDCl3): δ 8,66 (м, 1H), 7,95 (м, 1H), 7,56 (м, 1H), 7,48 (д, 1H); MS (DCI) m/e: 359 (MH+).
ПРИМЕР 144
Фениловый эфир 4-[[[(5,6-дигидро -5,5-диметил-8- фенил)-2-нафталенил] карбонил] амино]-2-гидроксибензойной кислоты (I3j)
Используя описанный метод получения 8-(2-фтор-фенил)-производного I3g, из 230 мг (0,83 ммоль) соединения XVIIIa и фенил-4-аминосалицилата (Aldrich, 190 мг, 0,83 ммоль) получили 193 мг (выход 48%) указанного в заголовке продукта; 1H-ЯМР (CDCl3):  8,03 (д, J=9,3 Гц, 1H), 7,75-7,71 (м, 2Н), 7,51-7,19 (м, 13H), 6,09 (т, J=4,5 Гц, IH), 2,40 (д, J=4,5 Гц, 2Н), 1,38 (с, 6Н); MS (DCI) m/e: 490 (МН+).
8,03 (д, J=9,3 Гц, 1H), 7,75-7,71 (м, 2Н), 7,51-7,19 (м, 13H), 6,09 (т, J=4,5 Гц, IH), 2,40 (д, J=4,5 Гц, 2Н), 1,38 (с, 6Н); MS (DCI) m/e: 490 (МН+).
ПРИМЕР 145
4-[[[(5,6-Дигидро-5,5-диметил -8-фенил)-2-нафталенил]- карбонил]амино]- 2-гидроксибензойная кислота (I4j)
Используя метод получения (8-фенил)-производного I4а, из 193 мг (0,39 ммоль) соединения I3j получили 135 мг (выход 83%) указанного в заголовке соединения; 1H-ЯМР (ДМСО-d6): δ 11,33 (ушир.с, 1Н), 10,38 (с, 1Н), 7,83 (дд, J= 8,0, 1,7 Гц, 1Н), 7,71 (д, J=8,7 Гц, 1Н), 7,54 (д, J=8,0 Гц, 1Н), 7,45-7,29 (м, 7Н), 7,24 (дд, J=8,7, 1,8 Гц, 1Н), 6,06 (т, J=4,5 Гц, 1Н), 2,35 (д, J= 4,5 Гц, 2Н), 1,32 (с, 6Н); MS (DCI) m/e: 400 (МН+); ИК (KBr): 2960, 1668, 1600, 1508 см-1.
Расчетное содержание для C26H23N1O4 · 0,5H2O: C, 73,92; H, 5,73; N, 3,32. Найдено: C, 73,91; H, 5,73; N, 2,99.
ПРИМЕР 146
2-Фтор-4-нитробензойная кислота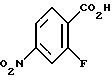
Раствор 2-фтор-4-нитротолуола (3,95 г, 25,5 ммоль, Janssen) в воде (200 мл) обрабатывали перманганатом калия (24,6 г, 0,15 ммоль), добавляя его порциями, при 80oC. Через 2 часа реакционную смесь фильтровали в горячем виде, подкисляли 5 н. соляной кислотой и экстрагировали этилацетатом (2 х 100 мл). Экстракт сушили над безводным сульфатом натрия и упаривали в вакууме с получением 1,15 г (выход 24%) указанного в заголовке соединения; 1H-ЯМР (ДМСО-d6): δ 8,21 (д, J=10,5 Гц, 1Н), 8,16-8,08 (м, 2Н); MS (DCI) m/e: 186 (МН+).
ПРИМЕР 147
Этиловый эфир 2-фтор-4-нитробензойной кислоты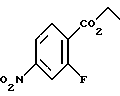
К раствору 2-фтор-4-нитробензойной кислоты (1,15 г, 6,22 ммоль) в абсолютном этиловом спирте (20 мл) добавляли моногидрат п-толуолсульфоновой кислоты (100 мг). После нагревания с обратным холодильником в течение 16 ч реакционную смесь упаривали в вакууме и остаток хроматографировали на силикагеле (элюируя 5% этилацетатом в гексане) с получением 770 мг (выход 58%) указанного в заголовке продукта; 1H-ЯМР (CDCl3): δ 8,16-8,00 (м, 3H), 4,45 (кв, J=7,1 Гц, 2Н), 1,43 (т, J=7,1 Гц, 3H). MS (DCI) m/e: 214 (МН+).
ПРИМЕР 148
Этиловый эфир 2-фтор-4-аминобензойной кислоты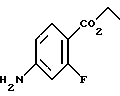
Раствор этилового эфира 2-фтор-4-нитробензойной кислоты (770 мг, 3,62 ммоль) в метиловом спирте (15 мл) обрабатывали оксидом платины (IV) (75 мг) при давлении водорода 275,8 кПа. Через 0,5 ч реакционную смесь фильтровали через целит и упаривали в вакууме с получением 700 мг (выход 99%) указанного в заголовке продукта; 1H-ЯМР (CDCl3): δ 7,76 (т, J=8,3 Гц, 1Н), 6,42 (д, J= 8,5 Гц, 1Н), 6,35 (д, J=12,9 Гц, 1Н), 4,33 (кв, J=7,1 Гц, 2Н), 4,20 (ушир.с, 2Н), 1,36 (т, J=7,1 Гц, 3H); MS (DCI) m/e: 184 (МН+).
ПРИМЕР 149
Этиловый эфир 4-[[[(5,6-дигидро-5,5 -диметил-8-фенил)-2- нафталенил] карбонил] амино]-2-фторбензойной кислоты (I3k)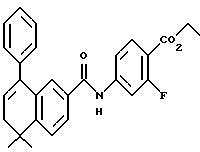
Используя описанный метод получения 8-(2-фторфенил)-производного I3g, из 250 мг (0,90 ммоль) соединения XVIIIa и этилового эфира 2-фтор-4-амино-бензойной кислоты (181 мг, 0,99 ммоль) получили 240 мг (выход 60%) указанного в заголовке продукта; 1H-ЯМР (CDCl3): δ 7,91 (т, J=8,5 Гц, 1Н), 7,72 (д, J=10,1 Гц, 1Н), 7,66 (д, J=1,8 Гц, 1Н), 7,51-7,48 (м, 1Н), 7,44-7,35 (м, 6Н), 7,20 (д, J= 8,6 Гц, 1Н), 6,08 (т, J=4,5 Гц, 1Н), 4,37 (кв, J=7,1 Гц, 2Н), 2,40 (д, J=4,5 Гц, 2Н), 1,38 (т, J=7,1 Гц, 3H), 1,37 (с, 6Н); MS (DCI) m/e: 444 (МН+).
ПРИМЕР 150
4-[[[(5,6-Дигидро-5,5- диметил-8-фенил)-2-нафталенил]- карбонил]амино]- 2-фторбензойная кислота (I4k)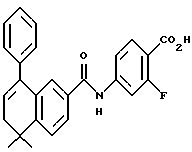
Используя описанный метод получения (8-фенил)-производного I4а, из 240 мг (0,54 ммоль) соединения I3k получили 175 мг (выход 78%) указанного в заголовке соединения; 1H-ЯМР (ДМСО-d6):  12,98 (ушир.с, 1Н), 10,58 (с, 1Н), 7,89-7,77 (м, 2Н), 7,73 (д, J=1,5 Гц, 1Н), 7,54 (д, J=8,1 Гц, 1Н), 7,44-7,30 (м, 7Н), 6,06 (т, J=4,5 Гц, 1Н), 2,34 (д, J=4,5 Гц, 2Н), 1,31 (с, 6Н); MS (DCI) m/e: 416 (МН+); ИК (KBr): 2960, 1692, 1596, 1526.
12,98 (ушир.с, 1Н), 10,58 (с, 1Н), 7,89-7,77 (м, 2Н), 7,73 (д, J=1,5 Гц, 1Н), 7,54 (д, J=8,1 Гц, 1Н), 7,44-7,30 (м, 7Н), 6,06 (т, J=4,5 Гц, 1Н), 2,34 (д, J=4,5 Гц, 2Н), 1,31 (с, 6Н); MS (DCI) m/e: 416 (МН+); ИК (KBr): 2960, 1692, 1596, 1526.
Расчетное содержание для C26H22N1O3F1 · 0,25H2O: C, 74,36; H, 5,40; N, 3,34. Найдено: C, 74,16; H, 5,74; N, 3,13.
ПРИМЕР 151
N-(4-Метил-3-нитрофенил)ацетамид
Раствор 4-метил-3-нитроанилина (3,60 г, 23,7 ммоль) в уксусном ангидриде (28 мл) перемешивали при комнатной температуре. Через 16 ч реакционную смесь упаривали в вакууме, разбавляли этилацетатом (25 мл), промывали насыщенным бикарбонатом натрия (2 х 50 мл), сушили над безводным сульфатом натрия и упаривали в вакууме с получением 4,20 г (выход 99%) указанного в заголовке соединения; 1H-ЯМР (CDCl3): δ 8,10 (д, J=1,7 Гц, 1Н), 7,75 (дд J=8,5, 1,7 Гц, 1Н), 7,38 (ушир.с, 2Н), 7,29 (д, J=8,5 Гц, 1Н), 2,56 (с, 3H), 2,21 (с, 3H); MS (DCI) m/e: 195 (МН+).
ПРИМЕР 152
4-Ацетиламино-2-нитробензойная кислота
Раствор N-(4-метил-3-нитрофенил)ацетамида (4,20 г, 23,6 ммоль) в воде (200 мл) обрабатывали перманганатом калия (22,77 г, 0,144 ммоль), добавляя его порциями, при 80oC. Через 2 часа реакционную смесь фильтровали в горячем виде, подкисляли 5 н. соляной кислотой и экстрагировали этилацетатом (2 х 100 мл). Экстракт сушили над безводным сульфатом натрия и упаривали в вакууме с получением 1,80 г (выход 34%) указанного в заголовке соединения; 1H-ЯМР (CDCl3): δ (выход 99%) указанного в заголовке соединения; 1H-ЯМР (CDCl3): δ 10,63 (с, 1Н), 8,19 (д, J=1,7 Гц, 1Н), 7,85 (д, J=8,5 Гц, 1Н), 7,78 (дд J=8,5, 1,7 Гц, 1Н), 2,10 (с, 3H); MS (DCI) m/e: 225 (МН+).
ПРИМЕР 153
Этиловый эфир 4-амино-2-нитробензойной кислоты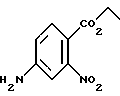
Раствор 4-ацетиламино-2-нитробензойной кислоты (1,80 г, 8,0 ммоль) в 12 н. соляной кислоте (14 мл) и абсолютном этиловом спирте (10 мл) нагревали до 90-100oC в течение 5 ч. Упаривали в вакууме, так чтобы удалить только этиловый спирт, доводили pH до 4 при помощи 1 н. гидроксида натрия и отфильтровывали осадок с получением 140 мг (выход 8%) указанного в заголовке соединения; 1H-ЯМР (CDCl3): δ 7,61 (д, J=8,5 Гц, 1Н), 6,82 (д, J=2,1 Гц, 1Н) 6,74 (дд, J= 8,5, 2,1 Гц, 1Н), 6,52 (ушир.с, 2Н), 4,17 (кв, J=7,1 Гц, 2H), 1,21 (т, J=7,1 Гц, 3H); MS (DCI) m/e: 211 (MH+).
ПРИМЕР 154
Этиловый эфир 4-[[[(5,6-дигидро-5,5 -диметил-8-фенил)-2- нафталенил]карбонил] амино]-2-нитробензойной кислоты (I3l).
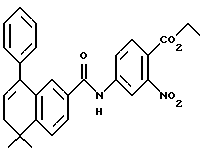
Используя описанный метод получения 8-(2-фторфенил)-производного I3g, из 199 мг (0,71 ммоль) соединения XVIIIa и 140 мг (0,78 ммоль) этилового эфира 4-амино-2-нитробензойной кислоты получили 155 мг (выход 46%) указанного в заголовке продукта; 1H-ЯМР (CDCl3): δ 8,15 (с, 1Н), 7,84 (с, 1Н), 7,79 (с, 1Н), 7,73 (дд, J= 8,1, 1,9 Гц, 1Н), 7,52-7,49 (м, 2Н), 7,41-7,26 (м, 5Н), 6,09 (т, J= 4,5 Гц, 1Н), 4,36 (кв, J=7,2 Гц, 2Н), 2,40 (д, J=4,5 Гц, 2Н), 1,37 (с, 6Н), 1,34 (т, J=7,2 Гц, 3H); MS (DCI) m/e: 471 (MH+).
ПРИМЕР 155
4-[[[(5,6-Дигидро-5,5-диметил-8- фенил)-2-нафталенил]-карбонил]амино]-2- нитробензойная кислота (I4l)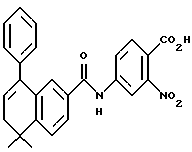
Используя описанный метод получения (8-фенил)-производного I4а, из 155 мг (0,33 ммоль) соединения I3l получили 105 мг (выход 72%) указанного в заголовке соединения; 1H-ЯМР (ДМСО-d6): δ 13,65 (ушир.с, 1Н), 10,76 (с, 1H), 8,31 (д, J= 1,7 Гц, 1H), 7,99 (дд, J=8,3, 1,7 Гц, 1Н), 7,90-7,84 (м, 2Н), 7,55 (д, J=8,3 Гц, 1H), 7,47 (д, J=1,7 Гц, 1H), 7,44-7,30 (м, 5Н), 6,07 (т, J= 4,5 Гц, 1H), 2,33 (д, J=4,5 Гц, 2Н), 1,31 (с, 6Н); MS (DCI) m/e: 443 (MH+); ИК (KBr): 2960, 1702, 1542, 1518.
Расчетное содержание для C26H22N2O5 · 0,5H2O: C, 69,17; H, 5,14; N, 6,20. Найдено: C, 69,55; H, 4,93; N, 5,94.
ПРИМЕР 156
Метиловый эфир 4-[[[(5,6-дигидро-5,5 -диметил-8-фенил)- 2-нафталенил] карбонил] амино]-2-метоксибензойной кислоты (I3m)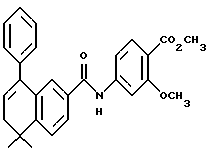
Используя метод получения 8-(2-фторфенил)-производного I3g, из 415 мг (1,49 ммоль) соединения XVIIIa и 297 мг (1,64 ммоль) метилового эфира 4-амино-2-метоксибензойной кислоты (Apin) получили 570 мг (выход 90%) указанного в заголовке продукта; 1H-ЯМР (CDCl3): 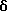 7,82 (д, J=8,5 Гц, 1Н), 7,77 (д, J=1,7 Гц, 1Н), 7,73 (с, 1Н), 7,70 (д, J=1,9 Гц, 1Н), 7,51 (м, 1Н), 7,51 (м, 1Н), 7,48 (с, 1Н), 7,41-7,33 (м, 4Н), 6,80 (дд, J=8,5, 1,9 Гц, 1Н), 6,08 (т, J=4,5 Гц, 1Н), 3,92 (с, 3H), 3,87 (с, 3H), 2,39 (д, J=4,5 Гц, 2Н), 1,38 (с, 6Н); MS (DCI) m/e: 442 (МН+).
7,82 (д, J=8,5 Гц, 1Н), 7,77 (д, J=1,7 Гц, 1Н), 7,73 (с, 1Н), 7,70 (д, J=1,9 Гц, 1Н), 7,51 (м, 1Н), 7,51 (м, 1Н), 7,48 (с, 1Н), 7,41-7,33 (м, 4Н), 6,80 (дд, J=8,5, 1,9 Гц, 1Н), 6,08 (т, J=4,5 Гц, 1Н), 3,92 (с, 3H), 3,87 (с, 3H), 2,39 (д, J=4,5 Гц, 2Н), 1,38 (с, 6Н); MS (DCI) m/e: 442 (МН+).
ПРИМЕР 157
4-[[[(5,6-Дигидро-5,5-диметил -8-фенил)-2-нафталенил] карбонил]амино]-2- метоксибензойная кислота (I4m)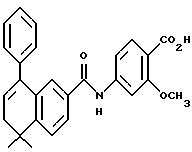
Используя описанный метод получения (8-фенил)-производного I4а, из 135 мг (0,31 ммоль) соединения I3m получили 100 мг (выход 77%) указанного в заголовке соединения; 1H-ЯМР (ДМСО-d6): δ 12,32 (ушир.с, 1Н), 10,36 (с, 1Н), 7,85 (дд, J=8,1, 1,7 Гц, 1Н), 7,79 (с, 1Н), 7,64 (д, J=1,7 Гц, 1Н), 7,53 (д, J=8,1 Гц, 1Н), 7,44-7,30 (м, 7Н), 6,06 (т, J=4,5 Гц, 1Н), 3,76 (с, 3H), 2,34 (д, J= 4,5 Гц, 2Н), 1,31 (с, 6Н); MS (DCI) m/e: 428 (МН+); ИК (KBr): 2960, 1718, 1592, 1524.
Расчетное содержание для C27H25N1O4 · 0,25H2O: C, 75,07; H, 5,95; N, 3,24. Найдено: C, 75,04; H, 5,86; N, 3,04.
ПРИМЕР 158
4-[[[(5,6-Дигидро-5,5-диметил -8-(2-нафталенил)-2- нафталенил]карбонил] амино]бензойная кислота (I4n)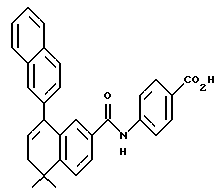
Исходя из соединения XVIa указанное в заголовке соединение было получено согласно методу, аналогичному методу получения 8-(2-фторфенил)-производного I4g; 1H-ЯМР (ДМСО-d6): δ 12,69 (с, 1Н), 10,41 (с, 1Н), 7,95-7,88 (м, 5Н), 7,85 (д, J=8,7 Гц, 2Н), 7,77 (д, J=8,7 Гц, 2Н), 7,57-7,40 (м, 5Н), 6,20 (т, J= 4,5 Гц, 1Н), 2,40 (д, J=4,5 Гц, 2Н), 1,35 (с, 6Н); MS (DCI) m/e: 448 (МН+); ИК (KBr): 2960, 1686, 1596, 1518.
Расчетное содержание для C30H25O3N1 · 0,90H2O: C, 77,70; H, 5,83; N, 3,02. Найдено: C, 78,10; H, 5,55; N, 3,13.
ПРИМЕР 159
4-[[(5,6-Дигидро-8-фенил-2- нафталенил)карбонил] амино]бензойная кислота (I4o)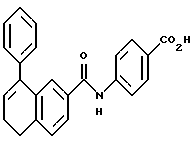
Исходя из 6-метокситетралона указанное в заголовке соединение было получено согласно методу, аналогичному методу получения 8-(2-фторфенил)-производного I4g; 1H-ЯМР (ДМСО-d6): δ 12,73 (с, 1Н), 10,42 (с, 1Н), 7,91-7,81 (м, 5Н), 7,55-7,25 (м, 7Н), 6,18 (т, J=4,5 Гц, 1Н), 2,86 (т, J=7,6 Гц, 2Н), 2,41-2,34 (м, 2Н); MS (DCI) m/e: 370 (МН+); ИК (KBr): 2950, 1680, 1648, 1518.
Расчетное содержание для C24H19N1O3: C, 78,03; H, 5,18; N, 3,79. Найдено: C, 77,61; H, 5,14; N, 3,81.
ПРИМЕР 160
Метиловый эфир 4-[[(5,6-дигидро-5,5 -диметил-8-фенил)-2- нафталенил)карбонил] амино]-3-фторбензойной кислоты (I3p)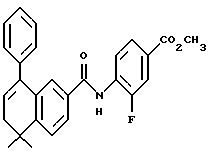
Используя описанный метод получения 8-(2-фторфенил)-производного I3g, из соединения XVIIIa (300 мг) и метилового эфира 3-фтор-4-аминобензойной кислоты (245 мг) получили 320 мг (выход 69%) указанного в заголовке соединения в виде стеклообразной массы; 1H-ЯМР (CDCl3): δ 1,38 (с, 6Н); 2,40 (д, J=4,7 Гц, 2Н), 3,90 (с, 3H), 6,08 (т, J=4,7 Гц, 1Н), 7,32-7,42 (м, 5Н), 7,49 (д, J=8,0 Гц, 1Н), 7,56 (д, J=1,9 Гц, 1Н), 7,73 (д, J=1,9, 8,0 Гц, 1Н), 7,74 (д, J= 1,8, 11,5 Гц, 1Н) 7,84 (дд, J=1,8, 8,5 Гц, 1Н), 8,11 (ушир.д, J=3,8 Гц, 1Н), 8,55 (т, J=8,5 Гц, 1Н).
ПРИМЕР 161
4-[[(5,6-Дигидро-5,5-диметил -8-фенил-2-нафталенил) карбонил]-амино]-3- фторбензойная кислота (I4p)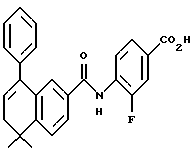
Используя тот же метод, что описан для получения (8-фенил)-производного I4а, из 310 мг соединения I3p получили 170 мг (выход 54%) указанного в заголовке соединения; 1H-ЯМР (CDCl3): δ 1,23 (с, 6Н), 2,39 (д, J=4,7 Гц, 2Н), 6,07 (т, J=4,7 Гц, 1Н), 7,30-7,42 (м, 5Н), 7,49 (д, J=8,1 Гц, 1Н), 7,52 (д, J= 2,0 Гц, 1Н), 7,72 (д, J=2,0, 8,1 Гц, 1Н), 7,79 (д, J=1,8, 11,4 Гц, 1H), 7,90 (д, J=8,5 Гц, 1Н), 8,06 (ушир.д, J=4,2 Гц, 1H), 8,59 (т, J=8,6 Гц, 1H); MS m/e: 416 (MH+).
Расчетное содержание для C26H22FNO3: C, 75,17; H, 5,34; N, 3,37. Найдено: C, 74,96; H, 5,53; N, 3,33.
ПРИМЕР 162
Метиловый эфир 4-[[(5,6-дигидро-5,5 -диметил-8-фенил)-2- нафталенил)карбонил] амино]-3-метилбензойной кислоты (I3q)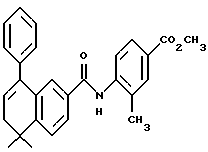
Используя описанный метод получения 8-(2-фторфенил)-производного I3g, из соединения XVIIIa (300 мг) и метилового эфира 3-метил-4-аминобензойной кислоты (319 мг) получили 305 мг (выход 66%) указанного в заголовке соединения в виде стеклообразной массы; 1H-ЯМР (CDCl3): δ 1,39 (с, 6Н); 2,20 (с, 3H), 2,41 (д, J=4,7 Гц, 2Н), 3,89 (с, 3H), 6,09 (т, J=4,7 Гц, 1H), 7,30-7,45 (м, 5Н), 7,48 (д, J=2,0 Гц, 1H), 7,51 (д, J=8,0 Гц, 1H), 7,68 (с, 1Н), 7,79 (д, J=2,0, 8,0 Гц, 1H), 7,85 (с, 1H), 7,91 (дд, J=2,0, 8,5 Гц, 1H), 8,31 (д, J=8,5 Гц, 1H); MS m/e: 426 (МН+).
Расчетное содержание для C28H27NO3 · 0,125H2O: C, 78,61; H, 6,42; N, 3,27. Найдено: C, 78,51; H, 6,46; N, 3,26.
ПРИМЕР 163
4-[[(5,6-Дигидро-5,5-диметил -8-фенил-2-нафталенил) карбонил]амино]-3- метилбензойная кислота (I4q)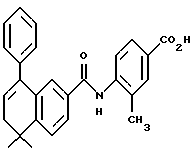
Используя тот же метод, что описан для получения (8-фенил)-производного I4а, из 280 мг соединения I3q получили 223 мг (выход 82%) указанного в заголовке соединения; 1H-ЯМР (CDCl3): δ 1,37 (с, 6Н); 2,20 (с, 3H), 2,39 (д, J=4,7 Гц, 2Н), 6,07 (т, J=4,7 Гц, 1Н), 7,30-7,42 (м, 5Н), 7,45 (д, J=2,0 Гц, 1Н), 7,51 (д, J=8,1 Гц, 1Н), 7,68 (с, 1Н), 7,78 (д, J=2,0, 8,1 Гц, 1Н), 7,80 (с, 1Н), 7,96 (дд, J=1,9, 8,6 Гц, 1Н), 8,36 (д, J=8,6 Гц, 1Н); MS m/e: 412 (МН+).
Расчетное содержание для C27H25NO3: C, 78,81; H, 6,12; N, 3,40. Найдено: C, 78,68; H, 6,12; N, 3,40.
Настоящее изобретение иллюстрируется далее следующими биологическими испытаниями, которые носят лишь иллюстративный характер.
ИССЛЕДОВАНИЯ НА РИНОМЫШАХ
Представители соединений формулы I исследовали на их воздействие на редукцию (уменьшение) утрикулы у риномышей и сравнивали непосредственно с полным трансизомером ретиноевой кислоты.
Испытания на редукцию утрикулы у риномышей
Самки безволосых риномышей (hrrh/hrrh) в возрасте от шести до девяти недель были выращены в колонии Bristol-Myers Squibb. Испытуемые ретиноиды в растворителе на основе этанола (50 мкл) наносили на спинную (дорсальную) область (приблизительно 1,5 х 3 см3) риномышей один раз в день в течение 5 дней (с понедельника по пятницу). Зависимость от дозы для различных ретиноидов была получена в диапазоне концентраций от 0,00033 мМ до 16,5 мМ. Животных усыпляли в следующий понедельник ингаляцией CO2. Из центральной части спинной области каждого животного брали перфорированием образец общей толщины 22,225 мм. Эпидермис на биопсию отделяли от дермиса после выдерживания в термостате в 0,5% уксусной кислоте в течение ночи при 4oC. Отделенный эпидермис затем фиксировали в формалине, дегидратировали этанолом и очищали в ксилоле. Для определения диаметра утрикулы каждый кусочек эпидермиса помещали на предметное стекло в ксилоле. Для каждого образца измеряли диаметр 40 утрикул при помощи системы анализа изображения (IBM PC, программа Image Measure и микроскоп типа Olympus с видеокамерой). % редукции утрикул рассчитывали как
Так как максимальный эффект, достигнутый в настоящих испытаниях, составил приблизительно 60% редукции утрикулы, активность различных испытанных соединений представлена в виде ED30, т.е. концентрации, при которой достигается 30% (половина от максимальной) редукция утрикул.
Соединение* - ED30 (мМ)
I4a - 1,25
I4d - 0,931
I4e - 0,311
I4f - 0,038
I30a - 2,35
I33a - 0,86
I4k - 3,12
* Следующие соединения неактивны в данном модельном эксперименте с риномышами I2c, I10a, I11a, I16а, I31a, I32a, I4p и I4q.
Следующий биологический тест показывает, что соединения по настоящему изобретению обладают цитотоксической активностью, обычно присущей ретиноидам. Следовательно, одним из аспектов изобретения является способ лечения различных опухолей.
Результаты испытаний на цитотоксичность
Испытания на цитотоксичность были проведены подобно испытаниям, осуществляемым Национальным Институтом Рака (National Cancer Institute) (D.A. Scudiero, et al., "Evaluation of a Soluble Tetrazolium/Formazan Assay for Cell Growth and Drug Sensitivity in Culture Using Human and Other Tumor Cell Lines", Cancer Research, 48, 4827-4833, Septemwer 1,1988; M.C. Alley, et al., "Feasibility of Drug Screening with Panels of Human Tumor Cell Lines Using a Microculture Tetrazolium Assay", Cancer Research, 48, 589-601, February 1, 1988), за исключением того, что для определения жизнеспособности клеток использовали новый витальный краситель alamarBlueTM. Коротко говоря, проведение испытаний включало посев 1000 клеток в расчете на лунку в объеме 120 мкл в 96-луночном плоскодонном планшете (Corning) на - 1-й день. Через двадцать четыре часа добавляли соединение формулы I подходящей степени разбавления в полной среде объема 30 мкл (конечный объем 150 мкл). Планшеты герметически опечатывали с помощью приспособления для оклейки планшетов (Dynatech Labs), чтобы предотвратить испарение. На 5-й день майларовую (из ПЭТФ) пленку удаляли и к каждой лунке добавляли 15 мл стерильного alamarBlue, и клетки выдерживали при 37oC в 5% CO2 в течение 2 часов. Оптическую плотность для каждой ячейки определяли при помощи Vmax планшет-ридера, вычитая OD570 из OD600. 100% сигнал был определен для клеток, выросших в полной среде, содержащей только 0,5% ДМСО. Измерения для каждой лунки проводились троекратно, и средние значения показаны на графиках фиг. 1, 2 и 3. Значения IC50 определены во втором эксперименте и представлены в таблице.
Испытание на антиартритные свойства
Для соединения I11а проводили также оценку в классической модели ревматоидного артрита на животных, т.е. в модели индуцированного коллагеном артрита (CIA), как описано Трентамом и сотр. (Trentham et al.) в "Collagen arthritis as a relevant model for rheumatoid arthritis. Evidence pro and con", Arthritis Rheum 25: 911-916 (1982); и "Autoimmunity to type II collagen: an experimental model of arthritis. ", J. Exp. Med 146: 857-868 (1977).
Согласно порядку проведения эксперимента применение препарата начинали за три дня до первой внутрикожной инъекции 100 мкг коллагена типа II в полном адъюванте Фрейнда. На 7-й день делали вторую инъекцию коллагена, усиливающую действие первой. Обычно симптомы артрита, такие как опухание суставов, начинали проявляться у животных приблизительно на 30-й день. Выполняли ежедневное внутрибрюшинное введение соединения I11а в концентрации 10 мг/кг и 30 мг/кг в объеме 10 мл/кг. Ежедневно определяли клинический показатель по балльной системе посредством визуальной оценки по трем ступеням (опухание, деформация суставов, анкилоз), определяя начало проявления симптомов. По окончании периода эксперимента (70-й день) животных усыпляли и оценивали гистологические изменения суставов. Эти изменения оценивались по следующей ступенчатой шкале: 1 - синовиальная гипертрофия, 2 - эрозия паннуса в суставе, 3 - эрозия паннуса в кости и 4 - утрата целостности сустава.
Как показано на фиг. 4, средний клинический показатель в расчете на одно животное остается нормальным вплоть до приблизительно 30-го дня. У животных, которым вводили носитель, клинический показатель линейно повышается до приблизительно 2,5 (максимально до 4) к 65-му дню, указывая на хорошо выраженный артрит у этих животных. В противоположность этому, у животных, подвергшихся лечению соединением I11a, отмечалось значительное снижение среднего клинического показателя за тот же период времени. На 65-й день средний показатель составлял 0,6 при наличии небольшого числа животных, у которых, как единственный несомненный клинический симптом, проявлялось лишь опухание суставов (ступень 1). Большая же часть конечностей, подвергавшихся оценке, была нормальной по внешнему виду.
Предварительные данные согласно этой модели в случае 30 мл/кг демонстрируют полное отсутствие заболевания на визуальном и гистологическом уровнях.
Соединения формулы I могут использоваться местно или системно в качестве противораковых средств и для лечения, снижения интенсивности или предупреждения тех расстройств кожи, в случае которых пригодны ретиноевая кислота и другие ретиноиды. В этом отношении они могут быть использованы для терапии у животных, включая человека, предраковых поражений клеток эпителия, в качестве профилактики против распространения опухоли в эпителиальных клетках и лечения дерматозов, таких как ихтиозы, фолликулярные расстройства, доброкачественные эпителиальные расстройства, и других пролиферативных заболеваний кожи (незлокачественное состояние кожи, которое характеризуется быстрым разрастанием эпидермальных клеток или неполной клеточной дифференцировкой), таких как угри, псориаз, экзема, атопический дерматит, неспецифический дерматит и тому подобное. Соединения формулы I могут быть также использованы для обращения развития и предотвращения эффектов радиационного повреждения кожи. Соединения формулы I могут быть также использованы для лечения ревматических заболеваний, включая, без ограничения указанными заболеваниями, ревматический артрит, псориатическую артропатию, болезнь Рейтера и кожные проявления красной волчанки. Соединения формулы I дополнительно применяются в лечении остеоартрита.
При использовании для вышеупомянутых курсов лечения соединения формулы I обычно составляют рецептуру вместе с фармацевтически приемлемым жидким, полутвердым или твердым носителем. Фармацевтически приемлемый носитель представляет собой вещество, которое нетоксично и, как правило, инертно и не влияет отрицательно на функциональные свойства активных ингредиентов. Такие вещества хорошо известны и включают такие вещества, иногда называемые разбавителями или наполнителями в технологии приготовления фармацевтических рецептур. По своей природе носитель может быть органическим или неорганическим. Примерами фармацевтически приемлемых носителей, которые могут быть использованы для получения составов с соединениями формулы I, являются вода, желатин, лактоза, крахмал, минеральное масло, шоколадное масло, декстроза, сахароза, сорбит, маннит, аравийская камедь, альгинаты, целлюлоза, тальк, стеарат магния, монолаурат полиоксиэтилен-сорбитана и другие обычно используемые фармацевтические носители. В дополнение к соединению формулы I и носителю рецептура может содержать малые количества добавок, таких как вкусовые добавки, красители, загустители или гелеобразователи, эмульгаторы, смачивающие агенты, буферы, стабилизаторы и консерванты, как например антиоксиданты.
Дозировки и режимы дозирования, согласно которым вводятся соединения формулы I могут изменяться в соответствии с формой дозировки, способом введения, состоянием и конкретными особенностями пациента, которого необходимо лечить. Соответственно, оптимальные терапевтические концентрации лучше всего определять в данный момент времени и в данном месте при помощи стандартных экспериментов.
При лечении дерматозов обычно будет предпочтительным вводить препарат местно, хотя в определенных случаях, как например лечение тяжелой формы кистозных угрей, может также использоваться пероральное введение. Если соединения согласно изобретению используются местно, то они, как установлено, проявляют хорошую активность в очень широком диапазоне разбавления; в частности, могут быть использованы концентрации активного соединения или соединений, изменяющиеся в диапазоне от 0,0005% до 2% по весу. Конечно, возможно использовать более высокие концентрации, если это будет необходимо для отдельных случаев применения; однако предпочтительная концентрация действующего начала составляет от 0,002% до 1% по весу.
Соединения формулы I для местного применения представлены подходящим образом в виде мазей, гелей, кремов, притираний, порошков, красящих составов, растворов, суспензий, эмульсий, лосьонов, аэрозолей, лейкопластырей и пропитанных подушечек. Соединения согласно изобретению могут быть смешаны с инертными нетоксичными, обычно жидкими или пастообразными, основами, подходящими для местного лечения. Приготовление таких составов для местного применения хорошо описано в технологии составления фармацевтических составов, как описано, например, в Remington's Pharmaceutical Science, Edition 17, Mack Publishing Company, Easton, Pa. В такие составы для местного применения могут быть добавлены другие медикаменты для таких вторичных целей, таких как лечение сухости кожи, обеспечение защиты от светового облучения, другие способы лекарственной терапии для лечения дерматозов, предотвращения инфекции, уменьшения раздражения, воспаления и тому подобное.
Соединения по изобретению могут также использоваться энтерально. При пероральном применении соединения согласно изобретению подходящим образом вводятся со скоростью от 2 мг до 100 мг на кг веса тела в день. Требуемая доза может быть введена одной или несколькими порциями. Подходящими формами для перорального введения являются, например, таблетки, пилюли, драже, сиропы, суспензии, эмульсии, растворы, порошки и гранулы; предпочтительный метод введения состоит в использовании пилюль, содержащих от 0,1 мг до приблизительно 1 мг активного вещества.
В патенте США N 4876381, изданном 24 октября 1989 года, Lang et al., приводятся примеры рецептур с соединениями ретиноидного типа, образующих гель, мазь, порошок, крем и т.д. Вышеупомянутый патент США может использоваться как руководство для составления рецептур с соединениями формулы I и в своей полноте упомянут здесь для сведения.
Изотретиноин (Accutane®) и этретинат (Tegison®) используют клинически для лечения тяжелой формы стойких кистозных угрей и тяжелой формы стойкого псориаза, включая эритродермические и обыкновенные пустулезные типы соответственно. Способы их применения в достаточной степени поясняются в издании Physician's Desk Reference, 47th Edition, 1993, опубликованном организацией Medical Economics Data. Соединения формулы I также могут использоваться для лечения тяжелых форм стойких кистозных угрей и стойкого псориаза. При этом соединения согласно настоящему изобретению могут использоваться подобным изотретиноину и этретинату способом; поэтому разделы в Physician's Desk Reference, относящиеся к изотретиноину и этретинату, могут служить в качестве подходящего руководства, которое может устранить необходимость в нежелательном проведении эксперимента.
Соединения по изобретению могут также вводиться парентерально в форме растворов или суспензий для внутривенных, внутрибрюшинных или внутримышечных перфузий или инъекций. В этом случае соединения согласно изобретению обычно вводятся со скоростью от 2 до 100 мг на кг веса тела в день; предпочтительный метод введения состоит в использовании растворов или суспензий, содержащих приблизительно от 0,01 мг до 1 мг активного вещества на мл.
Установлено, что некоторые ретиноиды обладают противоопухолевыми свойствами. См. Roberts, A.B. and Sporn, M.B. in "The Retinoids", Sporn, M. B. , Roberts, A.B., and Goodman, D.S., eds, 1984, 2, pp. 209-286, Academic Press, New York; Lippman, S.M., Kessler, J.F., and Meyskens, F.L., Cancer Treat. Rep., 1987, 71, p. 391; ibid., p. 493. Используемый термин "противоопухолевый" подразумевает здесь как химиопредупреждающее (профилактическое или тормозящее распространение опухоли), так и терапевтическое (лечебное) использование. Например, полный трансизомер ретиноевой кислоты может быть использован для лечения острого промиелоцитного лейкоза. См. Huang, М. et al., Blood, 1988, 72, р. 567. Показано, что изотретиноин применим для предотвращения первичной множественности опухолей при плоскоклеточном раке головы и шеи. См. Hong, W.K. et al., N. Engl. J. Med., 1990, 323, p. 795.
Соединения формулы I также могут использоваться по существу подобным ретиноидам образом для лечения (как химиопрофилактически, так и терапевтически) различных опухолей. Для соединений согласно настоящему изобретению противоопухолевая доза, которую необходимо ввести, будь то разовая доза, многократная доза или дневная доза, будет, разумеется, изменяться в зависимости от конкретного применяемого соединения в связи с различной эффективностью соединений, выбранного способа введения, размера реципиента, типа опухоли и характера состояния пациента. Дозировка, которую следует ввести, не находится в определенных границах, однако обычно она должна представлять собой эффективное количество, или эквивалент, в молярном выражении, фармакологически активной свободной формы, образующейся в процессе метаболического выделения активного медикамента из дозы рецептуры, необходимой для достижения желаемых фармакологических и физиологических эффектов. Для онколога - специалиста в области лечения рака - будет возможным, не прибегая к нежелательному эксперименту, установить распорядок введения соединений согласно настоящему изобретению таким путем, как обращение к ранее опубликованным работам по ретиноидам, как установлено, обладающим противоопухолевыми свойствами. Например, для предотвращения первичной множественности опухолей соединениями формулы I в случае плоскоклеточного рака головы и шеи онколог может обратиться к работе Hong, W.K. et al., N.Engl.J.Med., 1990, 323, p. 795. Для лечения острого промиелоцитного лейкоза можно обратиться к работе Huang, М. et al., Blood, 1988, 72, р. 567.

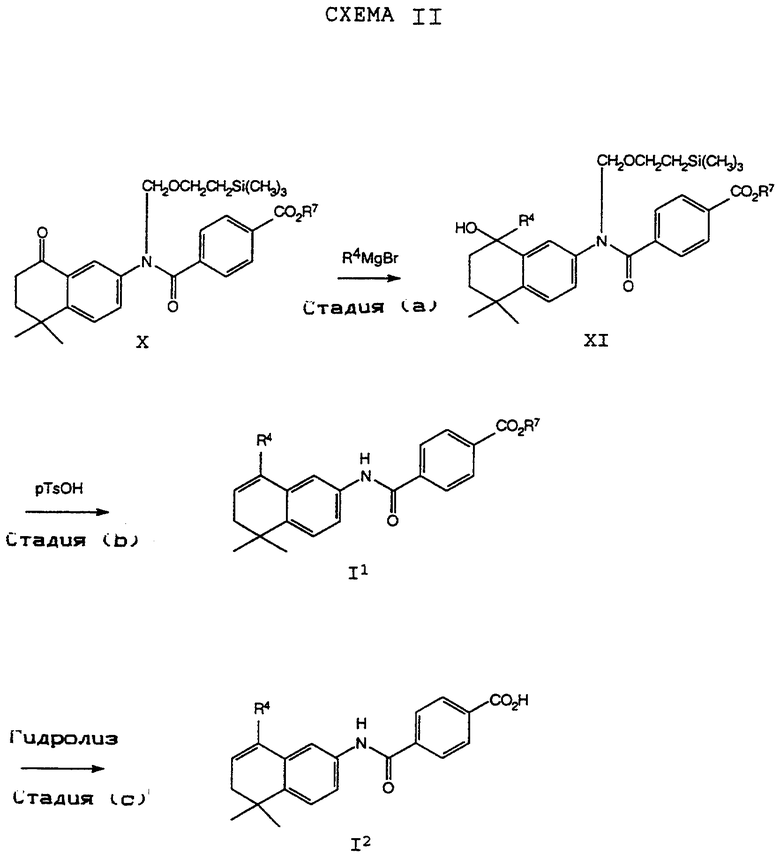
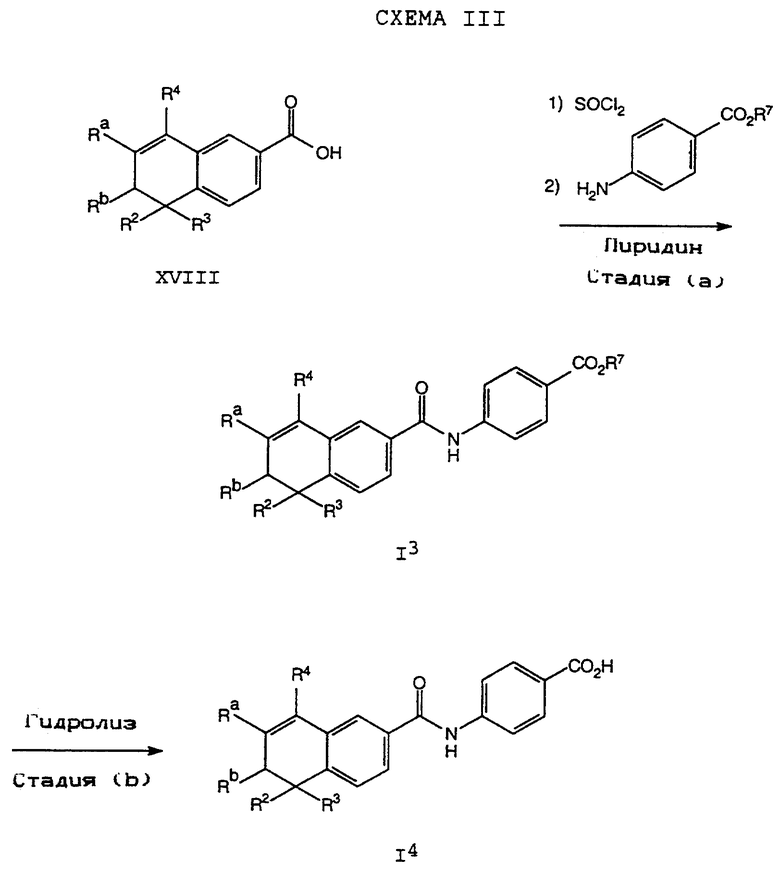
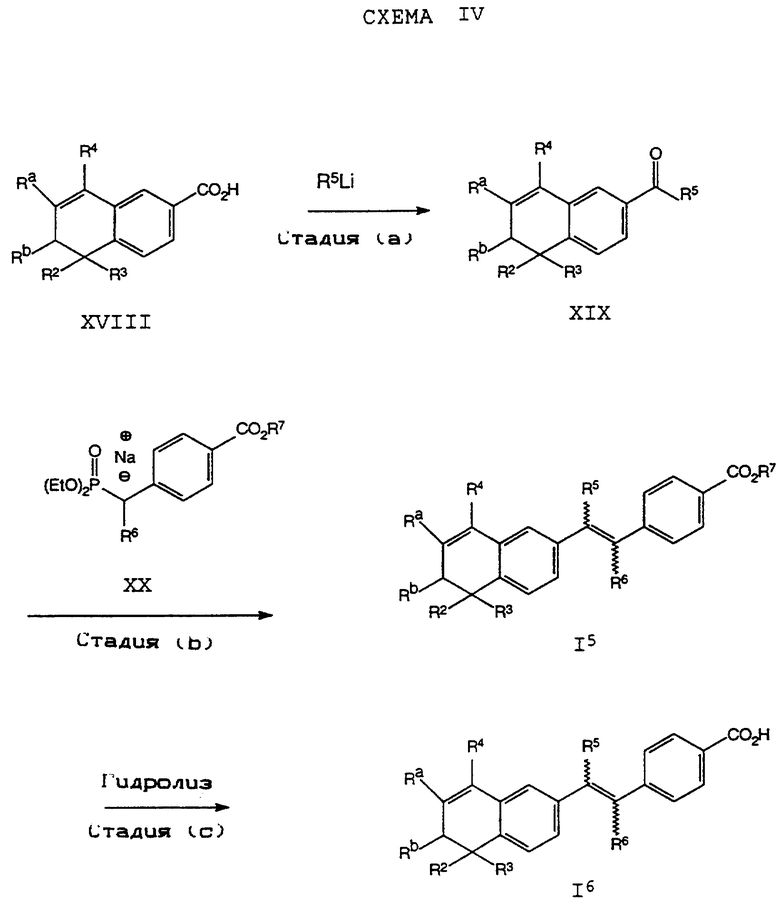
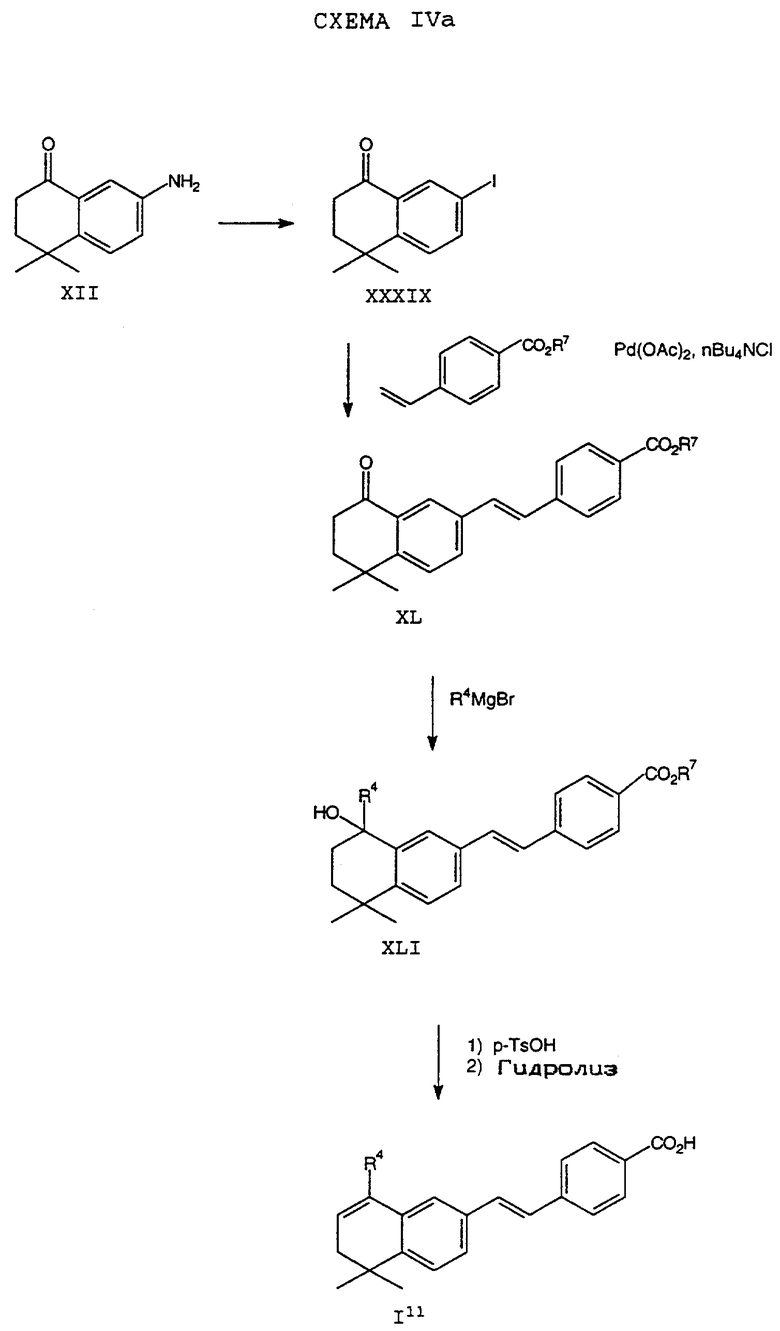
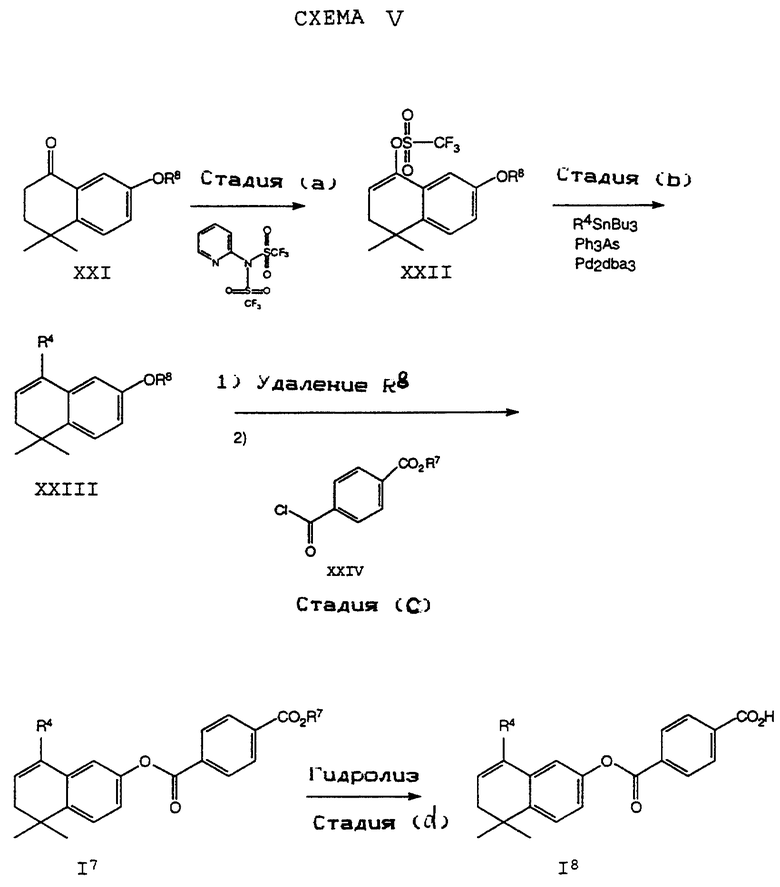
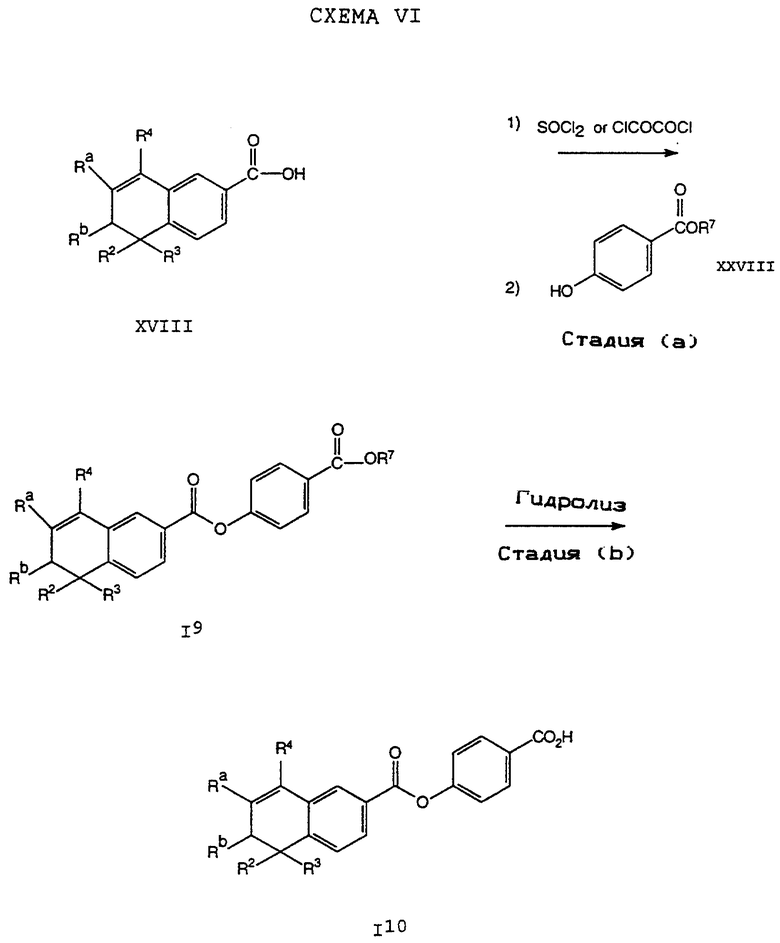
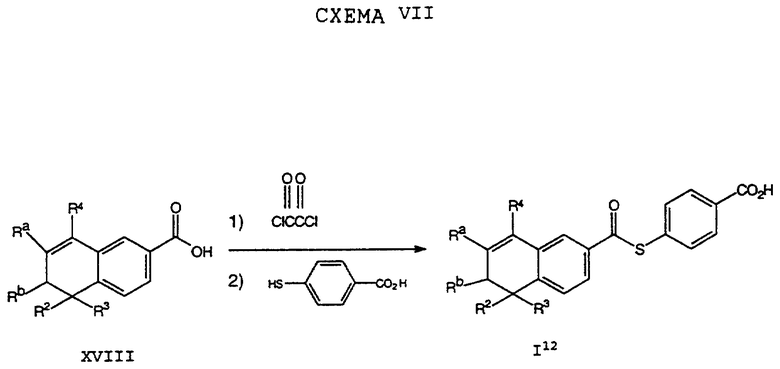
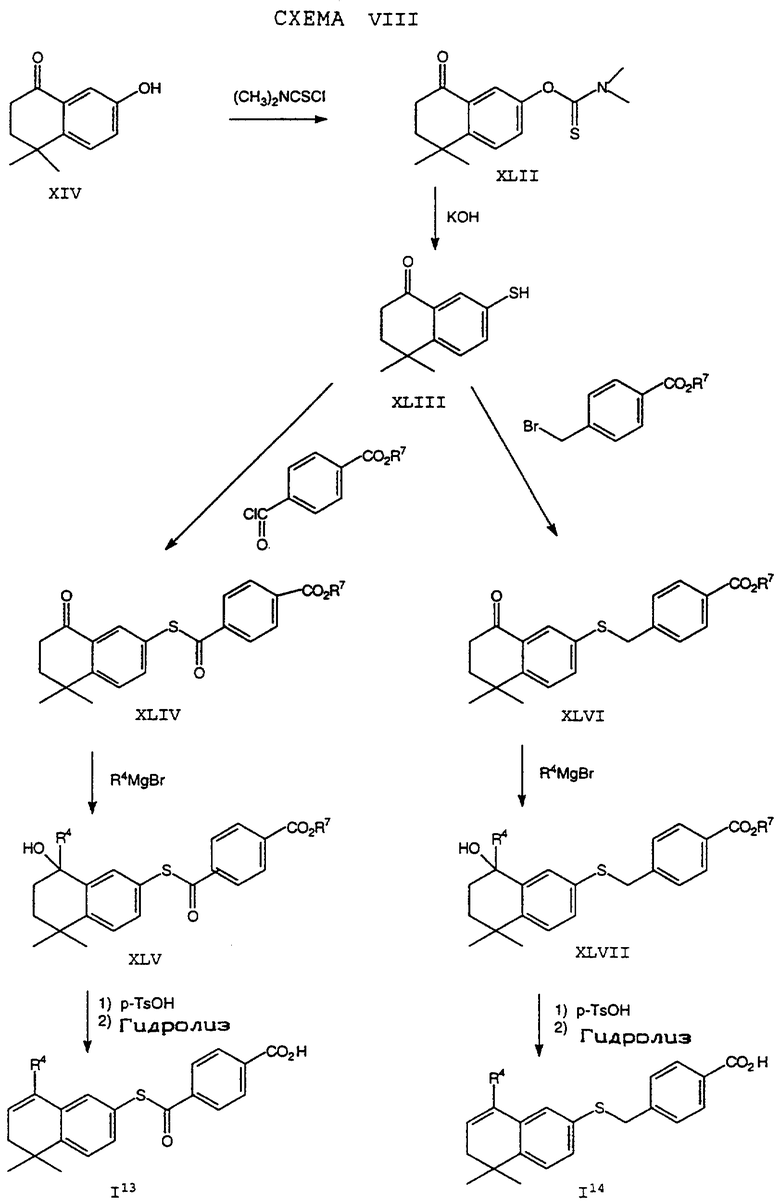
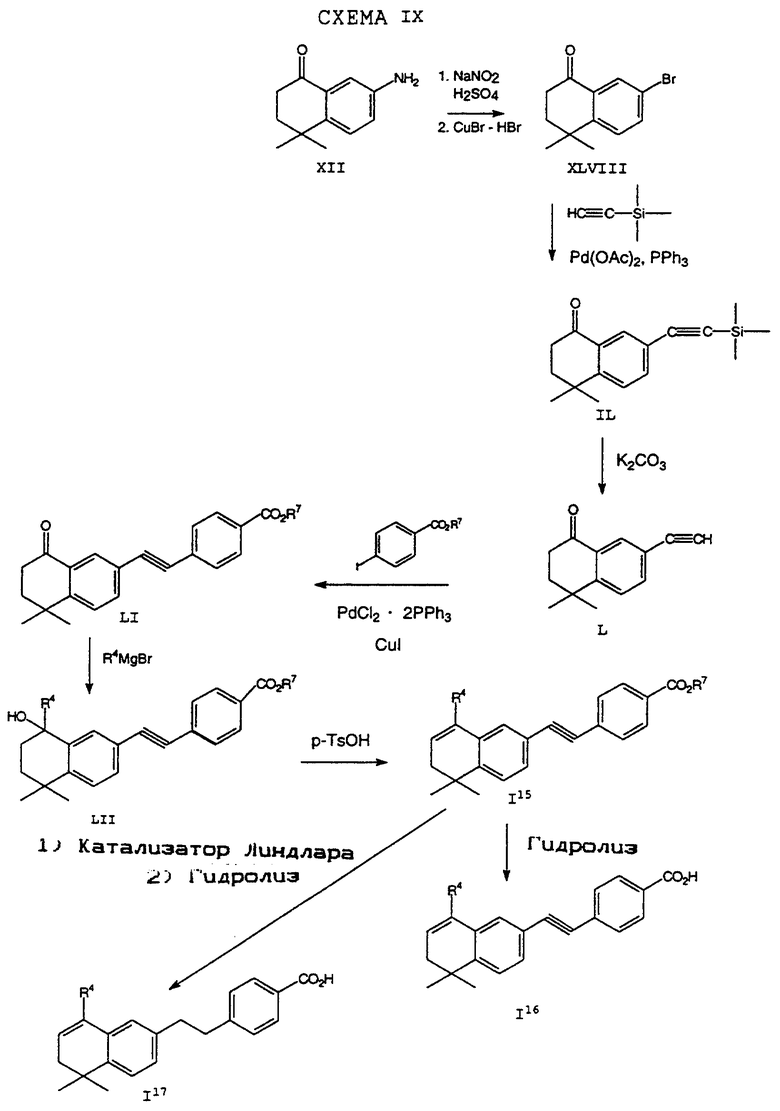
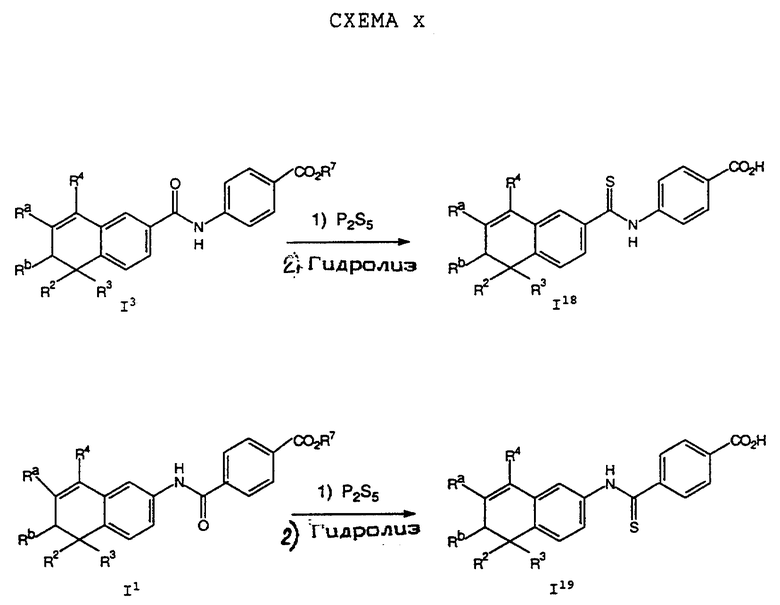
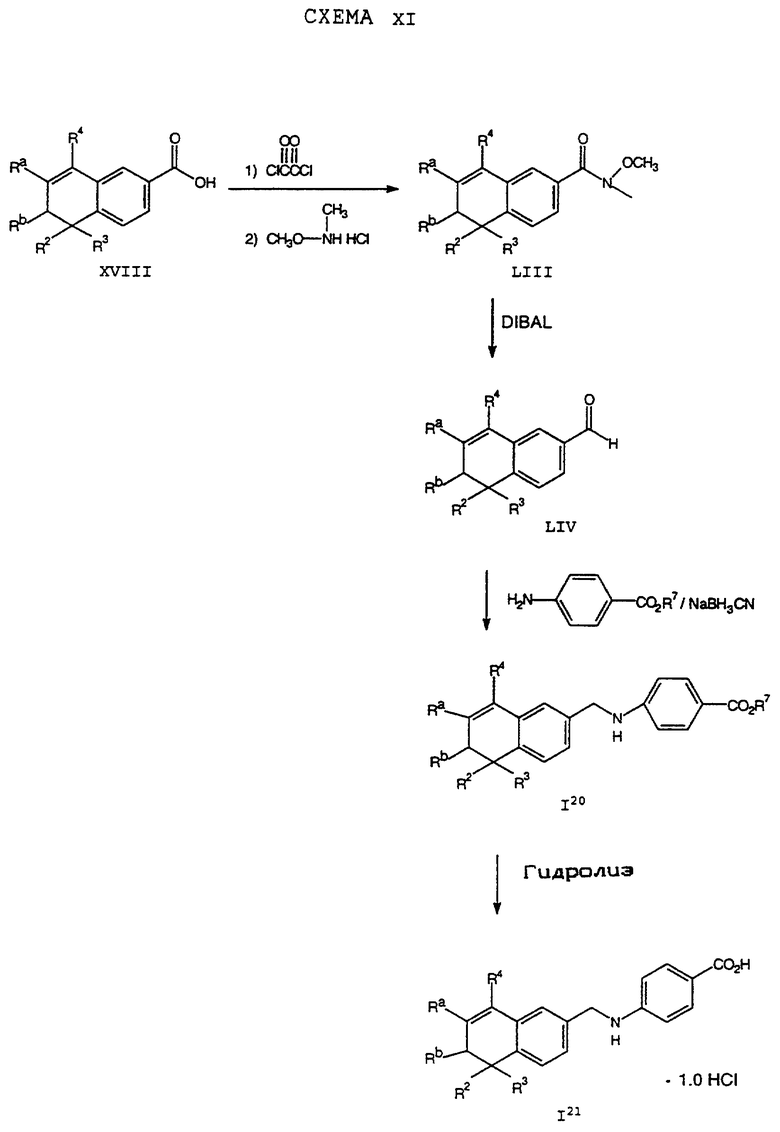
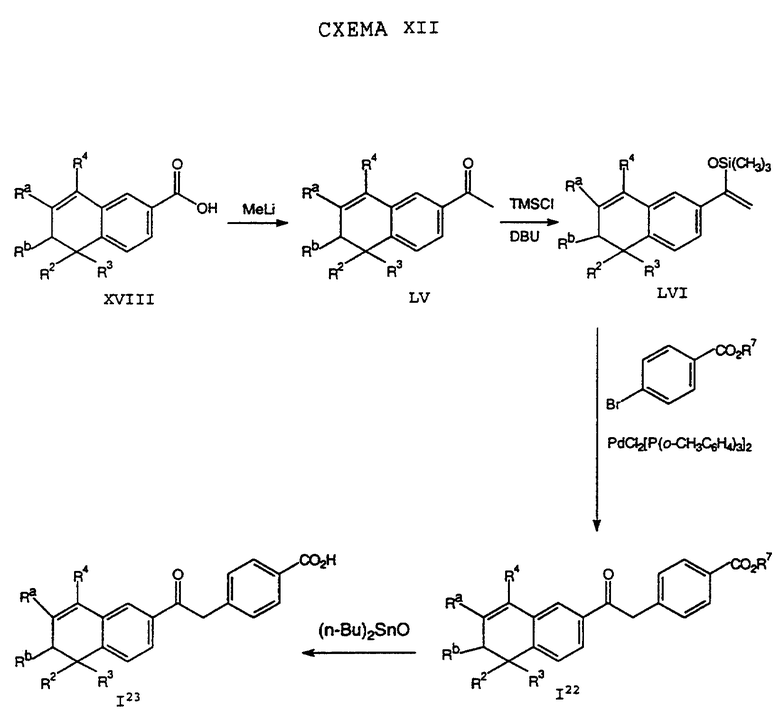
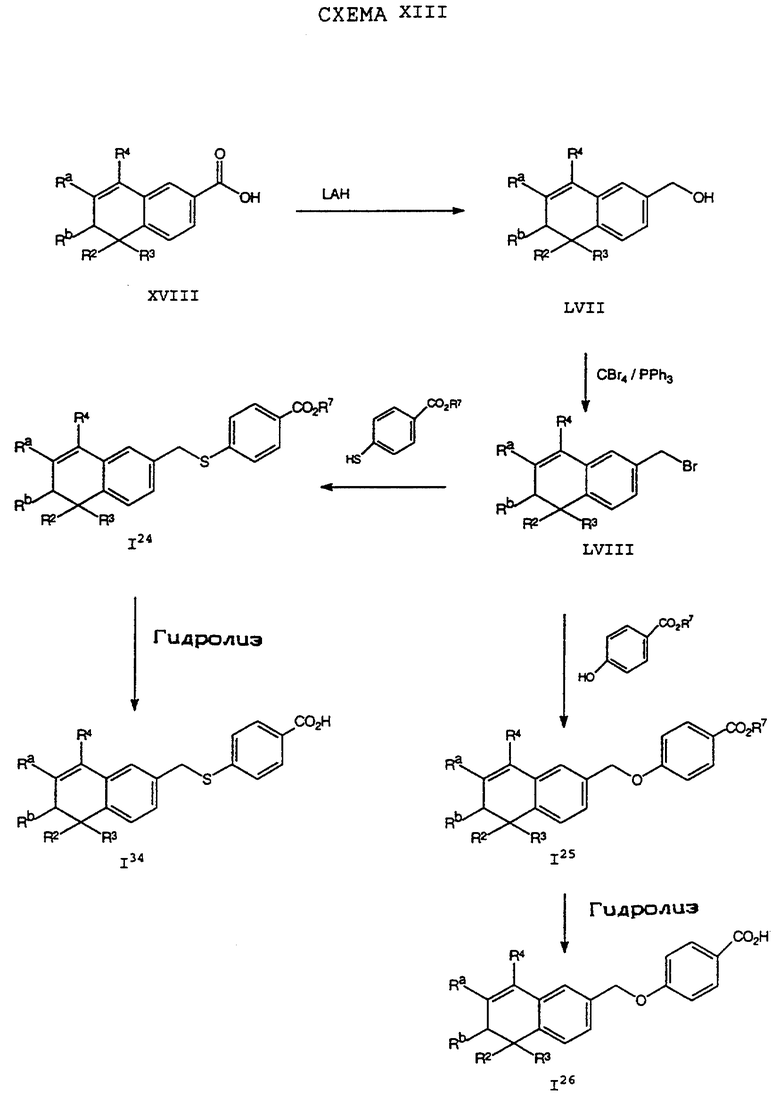
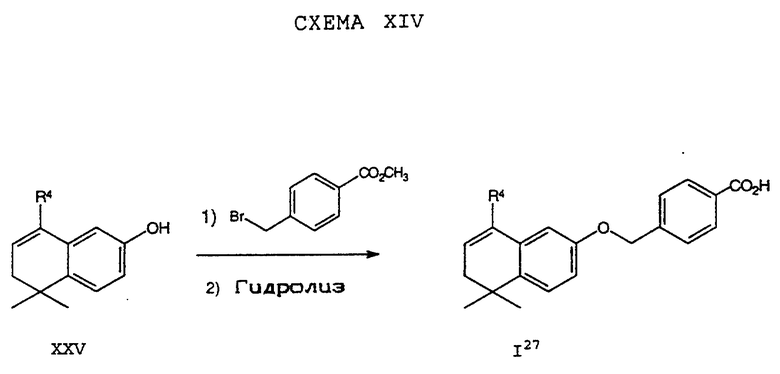
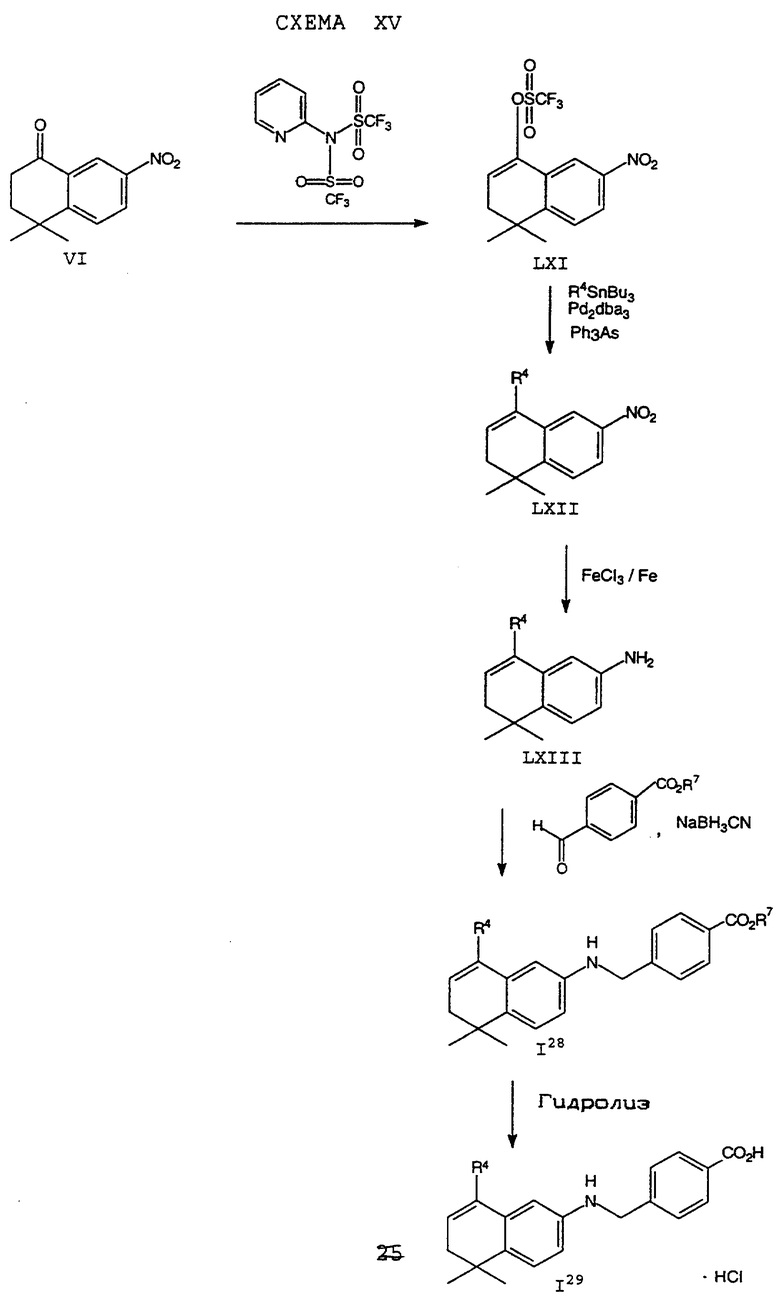
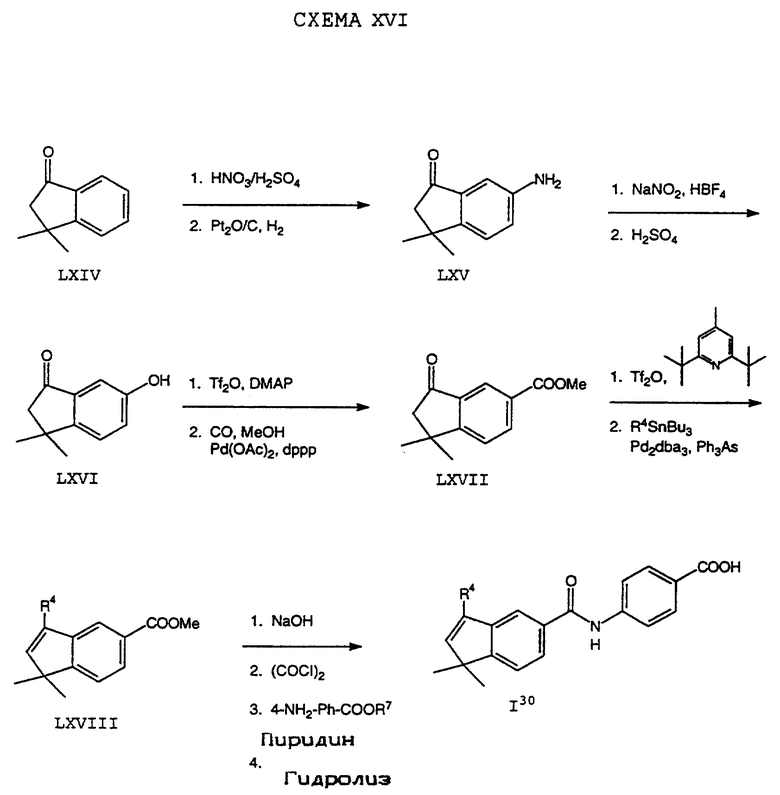
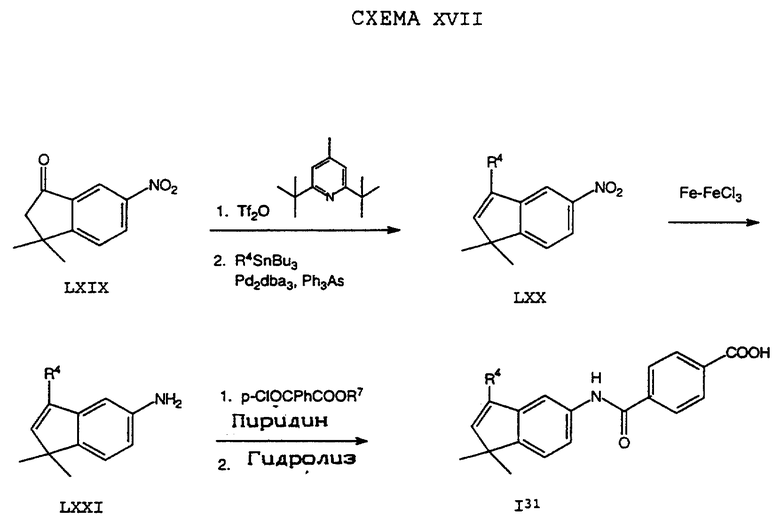
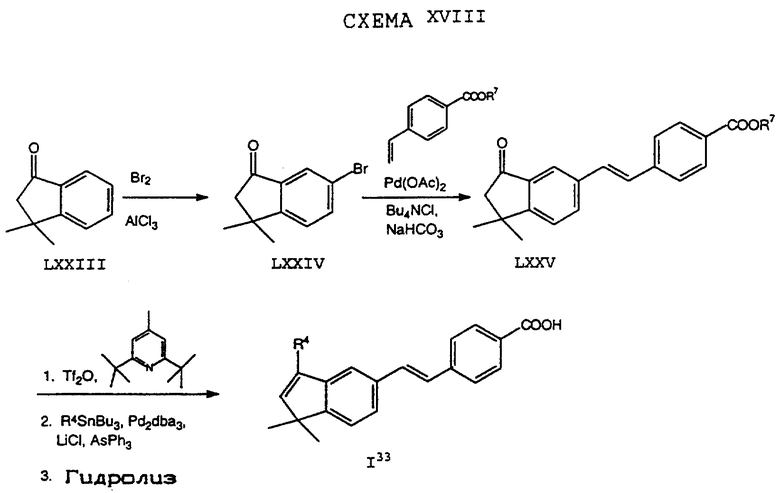
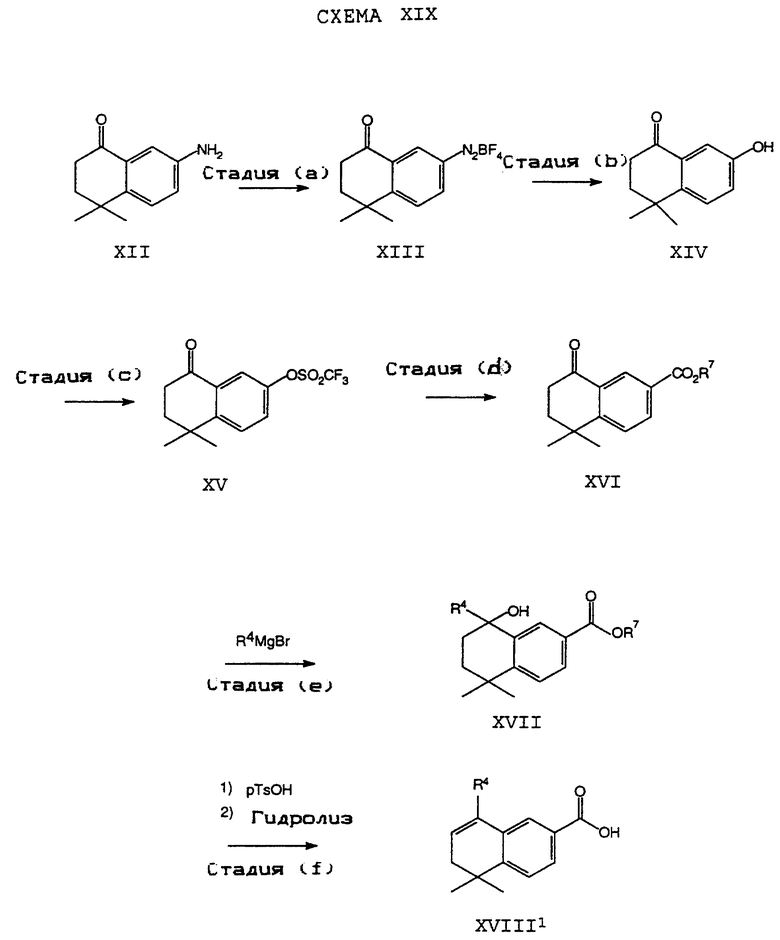
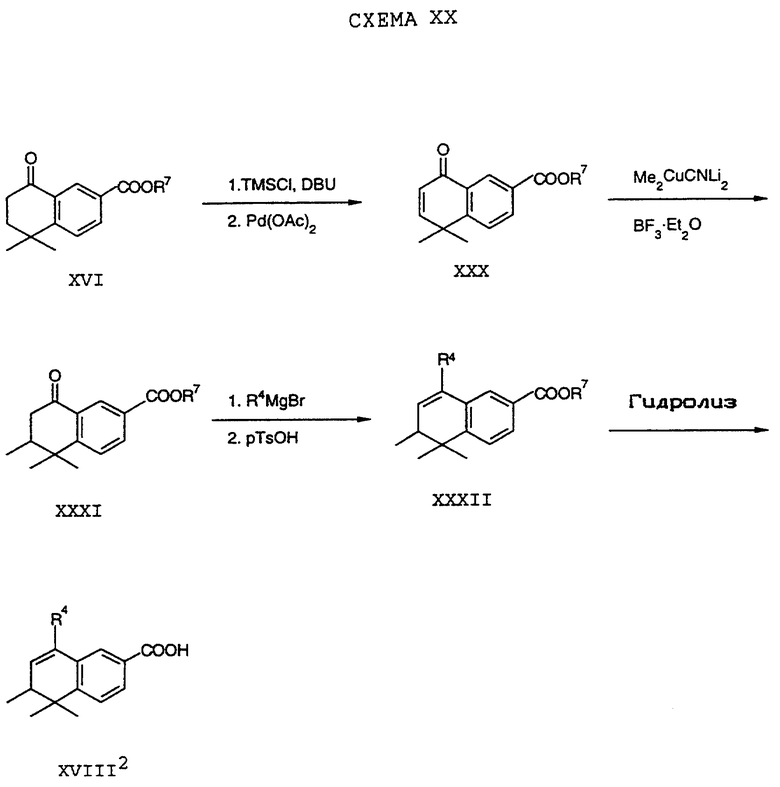
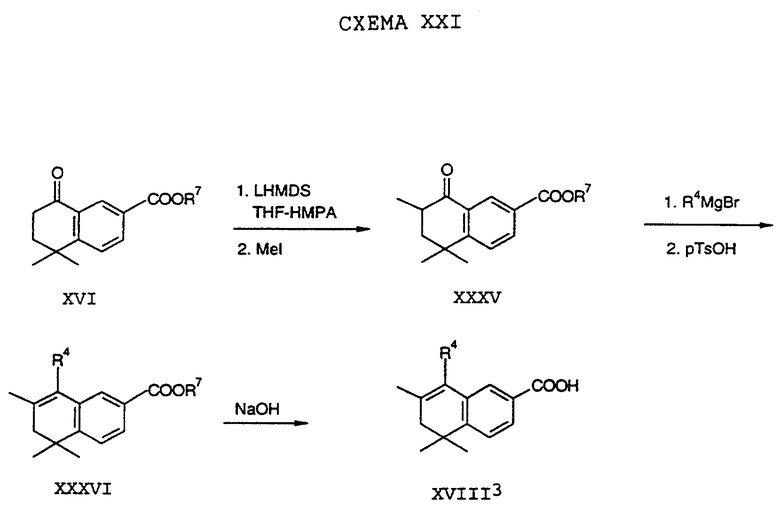
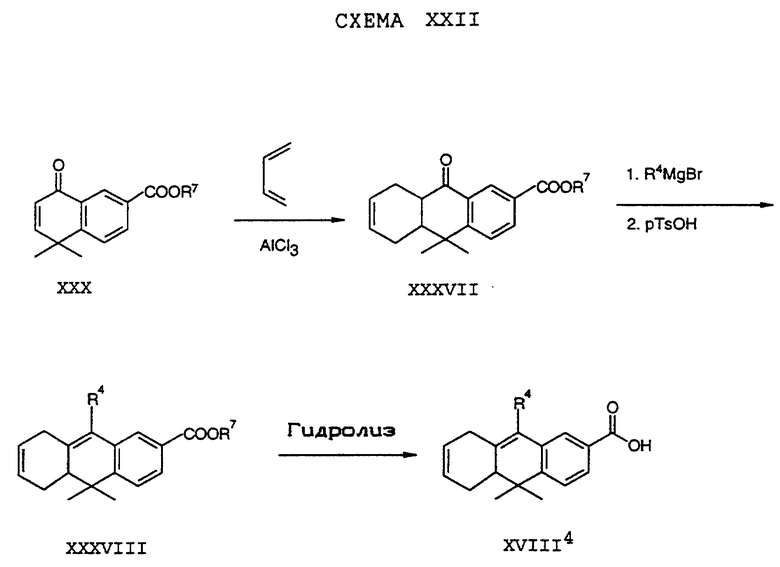
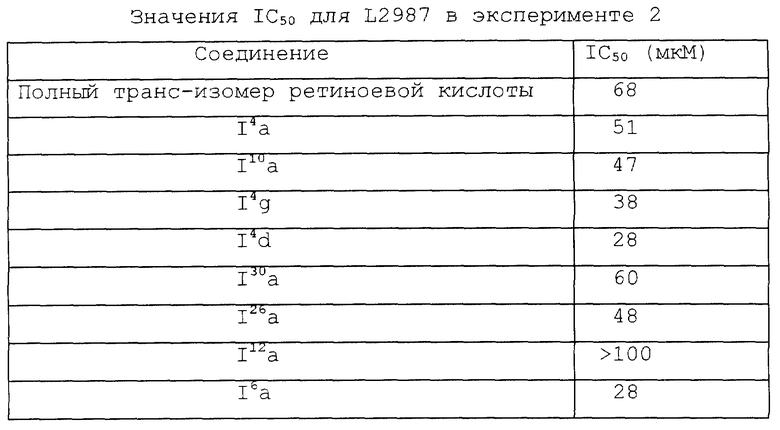
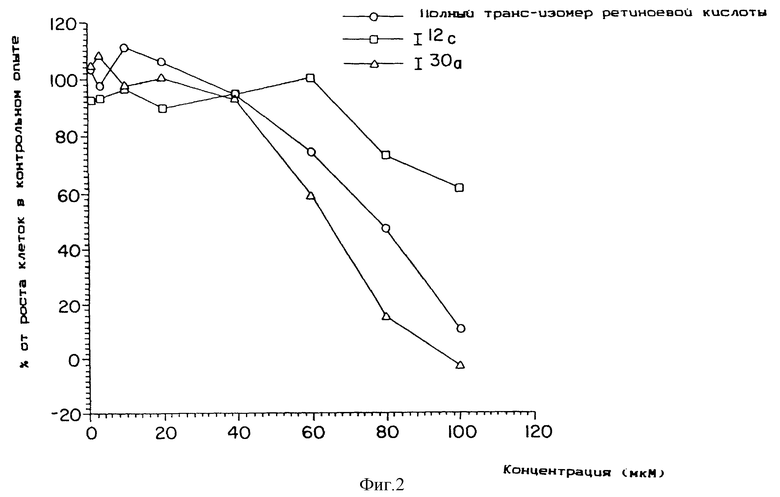
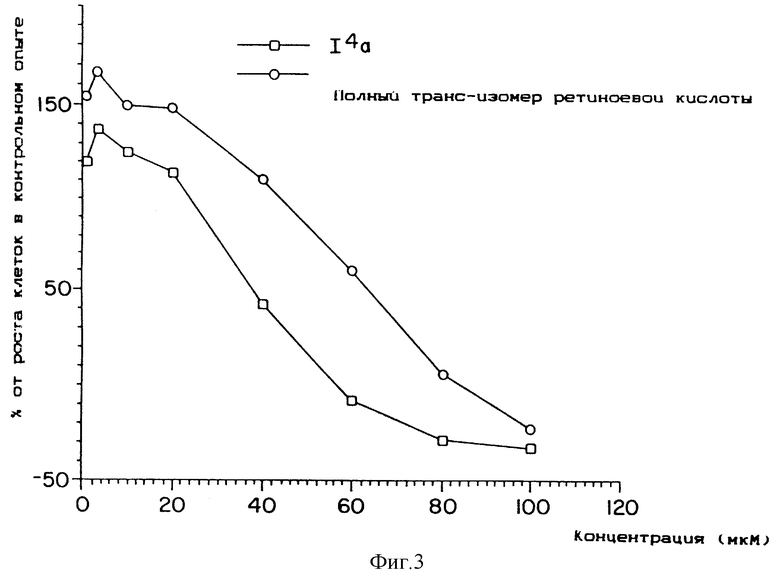
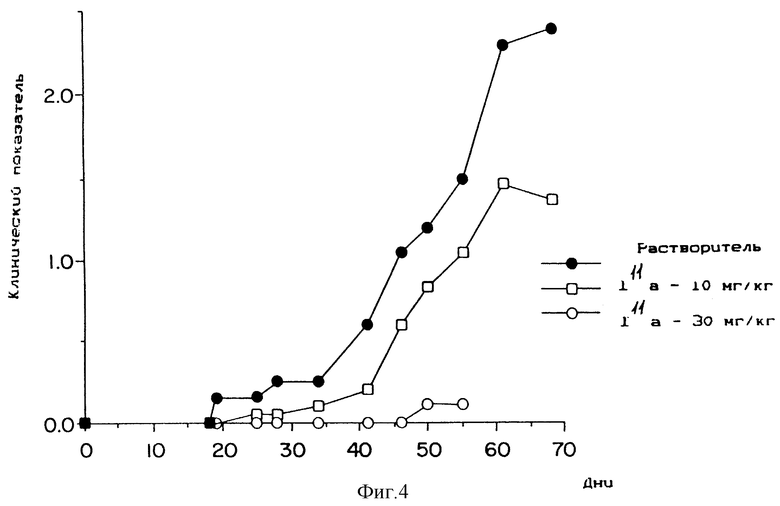
Настоящее изобретение касается соединения формулы I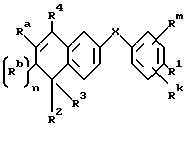
или его нетоксичной фармацевтически приемлемой соли, физиологически гидролизуемого эфира или сольвата, где X обозначает -O-CO-, -NH-CO-, -CS-NH-, -CO-O-, -CO-NH-, -COS-, -SCH2-, -CH2-CH2-,  -CH2-NH-, -COCH2-, -NHCS-, -CH2S-, -CH2O-, -OCH2-, -NHCH2- или -CR5 = CR6-; Rm и Rk независимо друг от друга - водород, галоген; n = 0 или 1; R4 - -(CH2)t-Y, C1-6 алкил; R1 - -CO2Z; R2 и R3 независимо друг от друга - водород или C1-6 алкил; Ra и Rb независимо друг от друга - водород или C1-6 алкил и, когда n = 1, Ra и Rb могут вместе образовывать радикал формулы
-CH2-NH-, -COCH2-, -NHCS-, -CH2S-, -CH2O-, -OCH2-, -NHCH2- или -CR5 = CR6-; Rm и Rk независимо друг от друга - водород, галоген; n = 0 или 1; R4 - -(CH2)t-Y, C1-6 алкил; R1 - -CO2Z; R2 и R3 независимо друг от друга - водород или C1-6 алкил; Ra и Rb независимо друг от друга - водород или C1-6 алкил и, когда n = 1, Ra и Rb могут вместе образовывать радикал формулы
Y - фенил, необязательно замещенный C1-6 алкилом или галогеном; Z - водород или C1-6 алкил; R5 и R6 независимо друг от друга - водород или C1-6 алкил и t = 0. Изобретение относится также к способам профилактики и/или лечения опухолей, артрита и расстройств кожи, не имеющих злокачественного характера, включающим введение соединения формулы I млекопитающим, а также к фармацевтической композиции, содержащей соединение формулы I в смеси с фармацевтически приемлемым(и) носителем(лями). 3 с. и 45 з.п.ф-лы, 1 табл., 4 ил.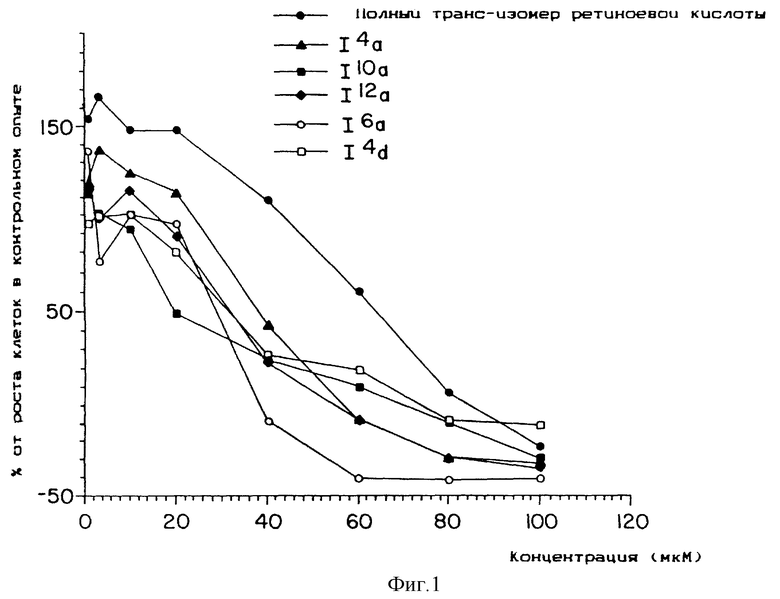
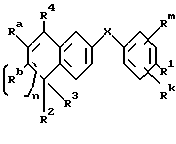
или его нетоксичная фармацевтически приемлемая соль, физиологически гидролизуемый эфир или сольват,
где X обозначает -O-CO-, -NH-CO-, -CS-NH-, -CO-O-, -CO-NH-, COS-, -SCO-, -SCH2-, -CH2-CH2-, 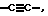 -CH2-NH-, -COCH2-, NHCS-, -CH2S-, -CH2O-, -OCH2-, -NHCH2- или -CR5=CR6-;
-CH2-NH-, -COCH2-, NHCS-, -CH2S-, -CH2O-, -OCH2-, -NHCH2- или -CR5=CR6-;
Rm и Rk независимо друг от друга - водород или гидроксил;
n = 0 или 1;
R4 представляет - (CH2)t-Y или C1-C6 алкил;
R1 - -CO2Z;
R2 и R3 независимо друг от друга - водород или C1-C6 алкил;
Ra и Rb независимо друг от друга - водород или C1-C6 алкил и, когда n = 1, Ra и Rb могут вместе образовывать радикал формулы
Y - фенил, необязательно замещенный C1-C6 алкилом или галогеном;
Z - водород или C1-C6 алкил;
R5 и R6 независимо друг от друга - водород или C1-C6 алкил;
t = 0.
40. Соединение по п.39, которое является 4-[[(5,8,10,10а-тетрагидро-10,10-диметил-9-фенил-2-антраценил)карбонил]амино]-бензойной кислотой.
| US 4876381, 1989 | |||
| ТРИНУС Ф.П | |||
| Фармако-терапевтический справочник | |||
| - Киев: Здоровья, 1989, с.520-522 | |||
| HONG W.K | |||
| Engl | |||
| J.Med | |||
| Способ приготовления консистентных мазей | 1919 |
|
SU1990A1 |
| COFFEY J.W | |||
| Chemistry and Biology of Synthetic Retinoids | |||
| CRC press | |||
| Jnc | |||
| Способ приготовления консистентных мазей | 1919 |
|
SU1990A1 |
Авторы
Даты
2001-02-27—Публикация
1996-06-04—Подача