Изобретение относится к гетероциклическим углеродсодержащим соединениям, обладающим лекарственными и биовоздействующими свойствами, а также к их получению и использованию. В частности, изобретение связывается с производными оксазола, которые являются ингибиторами агрегации кровяных пластинок.
Известна химия стирилоксазолов формулы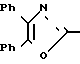 CH
CH CH
CH
в которой R является водородом, пара-метокси-, орто-гидрокси- и 3,4-метилендиокси-группой.
Известен класс аксазол-2-полиуглеродных алифатических монокарбоновых кислот, арилированных в положении 4 и/или 5 оксазольного кольца формулы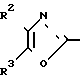 R1
R1
в которой каждый из заместителей R2 и R3 является членом группы, состоящей из незамещенных фенильных, нафтильных, тиенильных и фурильных радикалов, замещенных заместителями, выбираемыми из группы, состоящей из галогеновых, низших алкильных, низших алкокси-, нитро- и трифторметильных радикалов, и в которой R1 выбирается из группы, состоящей из карбоксиалкильных и карбоксилалкенильных радикалов, каждый из которых содержит от 2 до 5 атомов углерода, и амидов, производных гидроксамовой кислоты, низших алкиловых сложных эфиров и низших алканоилокси-низших алкиловых сложных эфиров из них. Соединения известного патента включают эффективное в клинике противовоспалительное средство, известное обычно как оксапрозин (R2=R3=фенил, R1=(CH2)2COOH).
Известны серии производных 2,3-дигидро-2-оксо-1Н-имидазо [4,5-в]-хинолинильного простого эфира формулы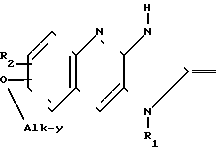 O в которой между прочим R1 и R2 являются водородом, а "alk-Y" является остатком алкановой кислоты и сложного эфира.
O в которой между прочим R1 и R2 являются водородом, а "alk-Y" является остатком алкановой кислоты и сложного эфира.
Известны соединения имеющие циклическую аденозинмонофосфат (АМФ) фосфодиэстеразную ингибирующую активность и являющиеся полезными в качестве ингибиторов агрегации кровяных пластинок и/или в качестве карбиотонических средств.
Известен ряд трифенилимидазол-2-илоксиалкановых кислот формулы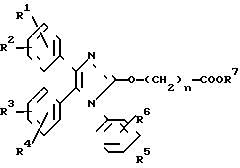
в которой R1, R2, R3, R4, R5 и R6 каждый является Н, галогеном, алкилом, алкокси-группой и трифторметилом; n является целым числом от 1 до 10, а R7 является Н, ионами щелочного металла, алкильной или бензильной группой. Эти соединения являются полезными при лечении тромбоэмболической, воспалительной и/или атеросклеротической болезни у человека. Особенно предпочтительный член серий, в котором от R1 до R6является водородом, n является 7, а R7 является натрием (идентифицируемый в области техники как октимибат натрия), описан как обладающий противоагрегаторной активностью и разрабатывается в клинике в качестве антигиперлипидемического средства.
По своей полнейшей особенности изобретение относится к производным оксазола формулы 1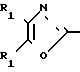 X
X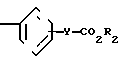
в которых R1, R2, X, Y определяются ниже и которые являются ингибиторами аденозиндифосфата и индуцированной коллагеном агрегации человеческой плазмы, обогащенной тромбоцитами, и особенно полезными в качестве ингибиторов агрегации кровяных пластинок млекопитающих
Другой пример осуществления изобретения относится к солям щелочных металлов карбоновых кислот указанных производных оксазола, где R2 является водородом.
Изобретение относится к ингибиторам агрегации кровяных пластинок у млекопитающих, имеющих формулу 1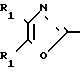 X
X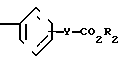
в которой R1 фенилом или тиенилом;
R2 водородом, низшим алкилом или вместе с СО2 тетразол-1-илом;
Х двухвалентно-связывающей группой, выбираемой из группы, состоящей из CH2CH2, CH=CH и CH2O;
Y двухвалентно-связывающей группой, присоединенной в 3- или 4-положение фенила, выбираемой из группы, состоящей из OCH2- CH2CH2 и CH=CH;
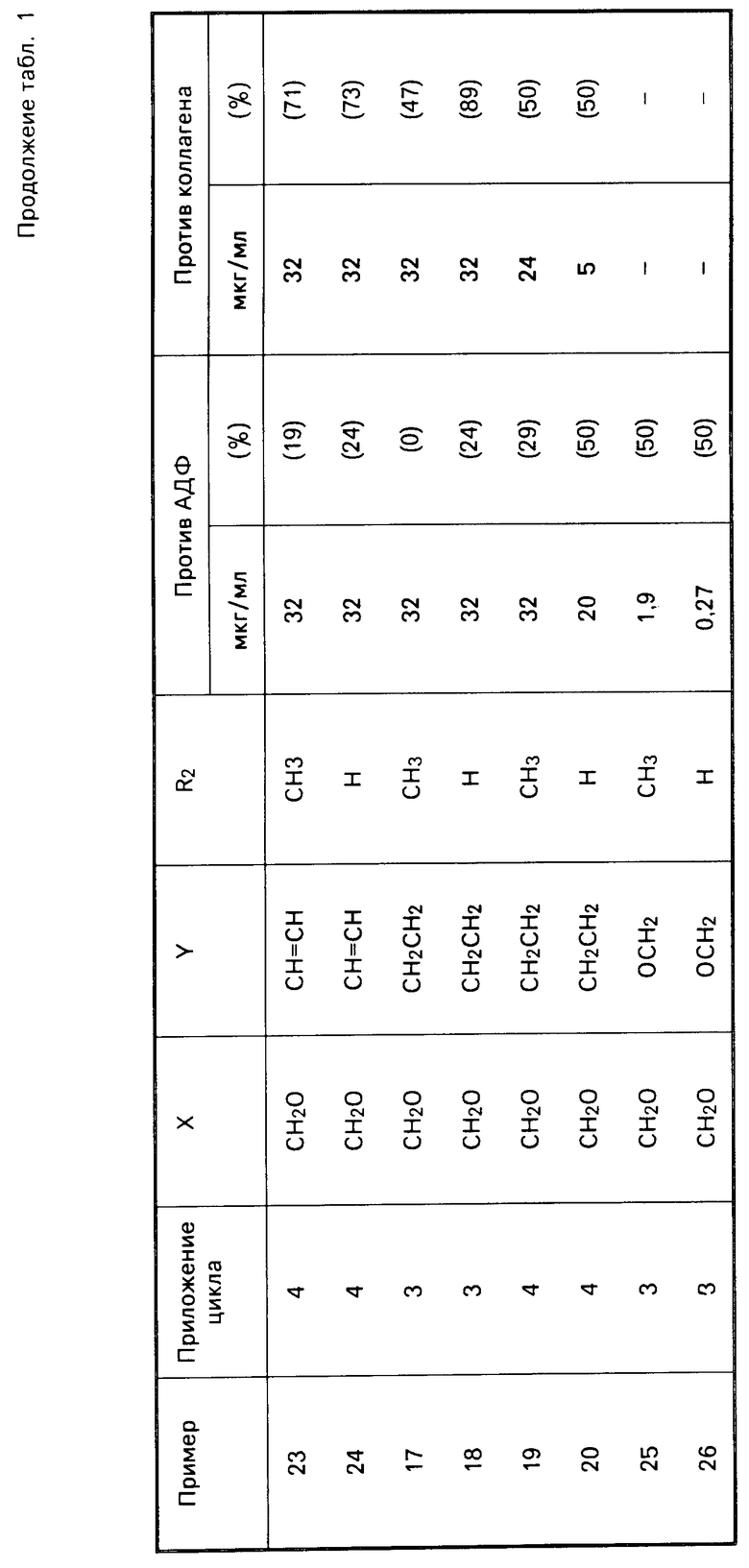
или когда R2 водородом, солью щелочного металла его.
Термин "низший алкил" относится к разветвленной или неразветвленной насыщенной углеводородной цепи, содержащей 1-4 атома углерода; в частности метил, этил, н-пропил, изопропил, н-бутил, вторичный бутил и третичный бутил. Термин "низший алканол" обозначает спирт, имеющий 1-4 атома углерода и определенный термином "низший алкил". Термин "соли щелочного металла" охватывает щелочные металлы и наиболее предпочтительно натрий и калий. Когда "двухвалентно-связывающей группой Х является CH2O", углерод ковалентно связывается с оксазолом, а кислород ковалентно связывается с замещенной фенильной группировкой.
Когда "двухвалентно-связывающей группой Y является СH2O", кислород ковалентно связывается с фенилом, а углерод ковалентно связывается с карбоксильной функцией.
Согласно изобретения, соединения, характеризуемые формулой 1 X
X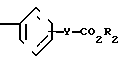
(а) гидролиз соединения формулы Ia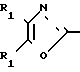 X
X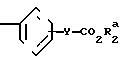
в которой R2a является низший алкил; а R1, X и Y такими, как это определено выше, до соответствующей кислоты; или (б) этерификацию соединения формулы Iв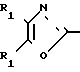 X
X
в которой R1, X и Y являются такими, как определено выше, низшим алканолом; или
(в) восстановление соединения формулы (II)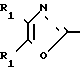 CH
CH CH
CH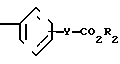
в которой R1, R2 и Y являются такими, как определено выше, чтобы получить соединение формулы (III)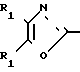 CH2CH
CH2CH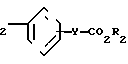
в которой R1, R2 и Y являются такими, как определено выше;
(г) алкилирование соединения формулы (IV) X
X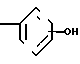
в которой R1 и Х являются такими, как определено выше, а ОН присоединяется в положение 3- или 4-фенила с помощью ВrСН2СООR2a в котором R2a является низшим алкилом, чтобы получить соединение формулы (V)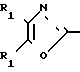 X
X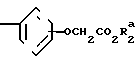
в которой R2a является низшим алкилом; R1 является таким, как определено выше, а Х СН2СН2, СН=СН; или
(д) алкилирование 3- или 4-замещенного фенила формулы (VI)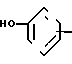 YaCO2R
YaCO2R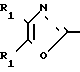 CH2Br
CH2Br
в которой R1 является фенилом или тиенилом, чтобы получить соединение формулы (VIII) Y
Y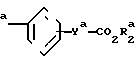
в которой R1 и R2 являются такими, как определено выше, а Ya является СН2О или СН2СН2;
(е) реакцию взаимодействия трифторметансульфонатного сложного эфира соединения формулы (IX)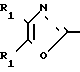 CH2CH
CH2CH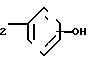
в которой R1 является фенилом или тиенилом, а ОН присоединенным в 3- или 4-положение фенила с H2C=CHCOOR2a, в котором R2a является низшим алкилом, чтобы получить соединение формулы (Х) CH2O
CH2O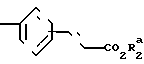
в которой R1 является фенилом или тиенилом, а R2a низшим алкилом;
(ж) реакцию взаимодействия соединения формулы (ХI)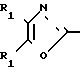 CH2O
CH2O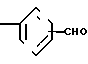
в которой R1 является фенилом, а формильная группировка присоединяется в положение 3- или 4-фенила с триметилфосфонатным производным CH2COOR2a, в котором R2a является низшим алкилом, чтобы получить соединение формулы (XII)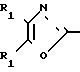 CH2O
CH2O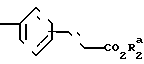 в которой R1 и R2а являются такими, как определено выше;
в которой R1 и R2а являются такими, как определено выше;
(з) реакцию взаимодействия соединения формулы (XIII)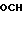
 OCH2CO2R
OCH2CO2R
в которой R2a является низшим алкилом, а боковая цепь присоединяется в положение 3- или 4-фенила с фосфонатоксазолом формулы (XIV)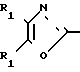 CH2PO(OCH3)2
CH2PO(OCH3)2
в которой R1 является фенилом или тиенилом, чтобы получить соединение формулы (XV)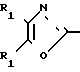 CH
CH CH
CH
в которой R1 является фенилом или тиенилом, а R2a низшим алкилом;
(и) обработку соединения формулы (XVI)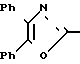 X
X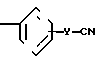
в которой Х и Y являются такими, как определено выше;
(к) азидом три-н-бутилолова, чтобы получить тетразол формулы (XVII)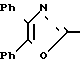 X
X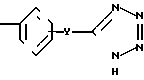
в которой Х и Y являются такими, как определено выше.
Следующие схемы получения показательных соединений формулы I поясняют следующим способом.
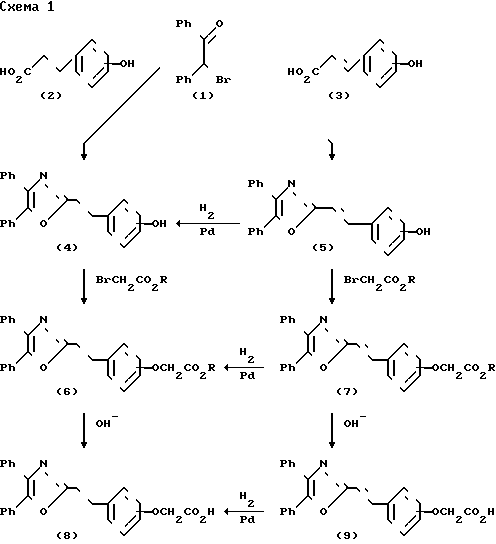
Схема I изображает получение соединений формулы I, получаемых из фенилпропионовой и окричной кислот. Алкилиpование натриевой соли гидроксифенилпропионовой кислоты (2) или гидроксикоричной кислоты (3) дезилбромидом (1), за которым следует образование оксазола, обеспечивающее фенолы (4) и (5), которые были алкилированы с помощью сложного эфира 2-бромалкановой кислоты, чтобы получить сложные эфиры (6) и (7) соответственно.
Последующий гидролиз с помощью водной щелочи дает соответствующие кислоты (8) и (9). Насыщенные соединения (6) и (8) были синтезированы из ненасыщенных предшественников (7) и (9) путем гидрогенизации, предпочтительно каталитической, которую можно проводить также в фенольной стадии, как это показано в схеме.
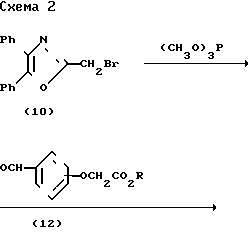

Схема 2 представляет альтернативный метод получения сложных эфиров (7), включающий реакцию сочетания диметилфосфоната (11), полученного из бромида (10) через реакцию Арбузова, описанную Шредером и др. (D.C.Schroeder. et al J. Org. Chem. 27, 1098-1101 (1962), с функционализированным альдегидом (12). Протонные ЯМР данные показывают, что ненасыщенные соединения были преимущественно, если не исключительно, в транс-конфигурации.
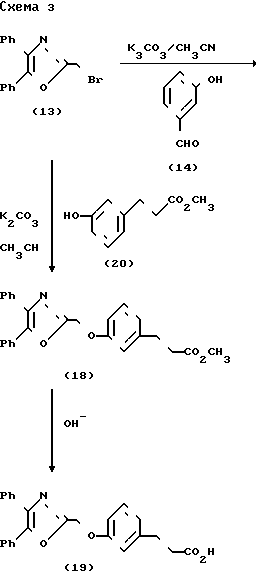
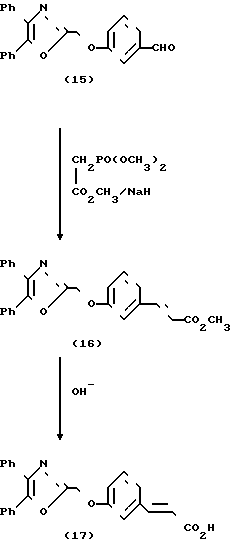
Схема 3 представляет получение соединений формулы I, включающих атом кислорода в связь между арильным и оксазольным циклами. Бромирование 4,5-дифенил-2-метилоксазола согласно модификации методики Элдоус и др. (D.L. Aldous et. al. J. Org.Chem. 25, 1151-1154 (1060), используя II-бромсукцинимид в четыреххлористом углероде при нагревании с обратным холодильником в присутствии 2,2l-азобис-(2-метилпропионитрила), дает бромид (13). Алкилирование гидроксибензальдегида (14) с помощью бромида (13) в присутствии карбоната калия при кипячении с обратным холодильником дает альдегид (15), который был превращен в сложный эфир (16) путем модификации Уадсворта-Эммонса реакции Виттига, согласно Уадсворта (W.S.Wadsworth, Org.Raections, 25, 73-252 (1978). Обычный щелочной гидролиз сложного эфира (16) дает карбоновую кислоту (17). Насыщенный сложный эфир (18) и кислота (19) были синтезированы путем алкилирования сложного эфира 3-гидроксифенилпропионовой кислоты (20) в присутствии карбоната калия и последующего гидролиза.
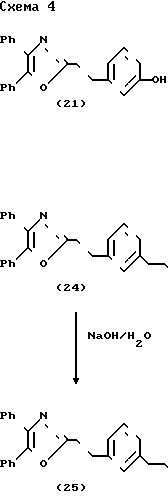

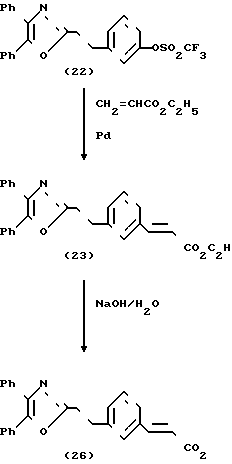
Схема 4 представляет получение соединений формулы I, в которой связывающий радикал Y является "CH2CH2", а Х является CH2CH2 или CH=CH. Трифлат (трифторметансульфонат) (22) был синтезирован из оксазол-фенола (21) путем обработки ангидридом трифторметансульфоновой кислоты в пиридине. Реакция сложного трифторметансульфонатного эфира (22) с этиловым эфиром акриловой кислоты в присутствии Рd-катализатора приводит к образованию сложного эфира коричной кислоты (23). Индуцированный основанием гидролиз соединения (23) дает кислоту (26). Каталитическое гидрирование сложного эфира коричной кислоты (14) дает насыщенный сложный эфир (24), который был превращен в кислоту (25) при водных щелочных условиях.

Схема 5 показывает получение соединений формулы I, когда "Х связывающая группа" является CH2O, а "Y-боковую цепь связывающая группа" OCH2. Моноацетат резорцина (27) был алкилирован метиловым эфиром бромуксусной кислоты, чтобы получить (28), который был растворен в метанольном растворе хлористого водорода, чтобы получить фенол (29). Алкилирование фенола (29) с помощью бромида (10) дает сложный эфир оксазола (30), который был гидролизован до карбоновой кислоты (31): используя водный раствор гидроокиси.
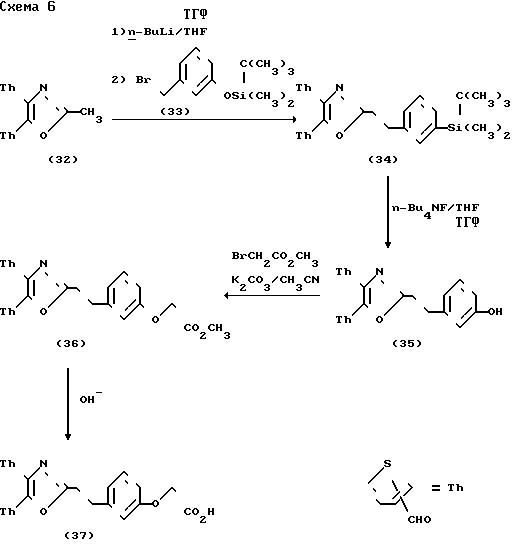
Схема 6 показывает получение соединений формулы I, в которой два фенильных цикла заменяются тиофеновыми циклами в двух возможных региоизомерных формах. Производные 2-метил-4,5-(2- или 3-тиенил)-оксазола (32) были получены по методу Дэвидсона (D.Davidson et al. J.Org.Chem. 2, 329-334 (1037) из 2- или 3-тиофен-карбоксальдегида. Металлация соединения (32), используя н-бутиллитий, за который следует добавление бромистого бензила (33), дает оксазолы (34). Фенольная защитная группа диметил-(1,1-диметилэтил)-силана была удалена путем использования фтористого н-бутиламмония, чтобы получить фенолы (35). Обычное алкилирование с помощью метилового эфира бромуксусной кислоты дает сложные эфиры (36), которые были гидролизованы до карбоновых кислот (37) с помощью водного раствора гидроокиси.
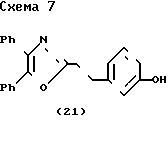
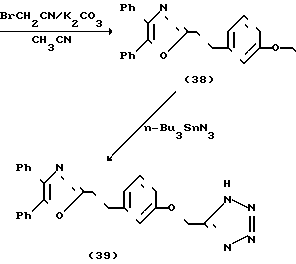

Схема 7 показывает получение соединений формулы I, в которой остаток карбоновой кислоты заменяется тетразольным гетероциклом. Обработка фенола (21) бромацетонитрилом и карбонатом калия дает нитрил (38), который был превращен в тетразол (39) с помощью азида три-н-бутилолова.
Соли щелочных металлов карбоновых кислот формулы I обычно получаются растворением кислоты в подходящем растворителе, таком как метанол, добавлением молярного эквивалента щелочного основания, такого как метоксид натрия, и осаждением осадка соли или выпариванием растворителя.
Как установлено выше, соединения формулы I имеют фармакологические свойства, которые делают их особенно полезными в качестве ингибиторов агрегации кровяных пластинок (тромбоцитов).
Агрегация тромбоцитов считается частью сложного физиологического механизма образования тромба в сосудистой системе. Тромбоэмболическое явление, т. е. образование тромбов, связывается с гемостазом и рядом болезненных состояний у млекопитающих, включая тромбофлебит, флеботромбоз, церебральный тромбоз, коронарный тромбоз и ретинальный сосудистый тромбоз. Повышение в склонности к агрегации тромбоцитов, иногда называемое адгезивностью ("прилипаемостью") тромбоцитов, наблюдается после родов, хирургических операций, таких как хирургия шунтирования коронарной артерии, трансплантация органа, пластическая операция на сосудах, имплантации искусственных клапанов сердца, не говоря о других, и при ишемической болезни сердца, атеросклерозе, множественном склерозе, внутричерепных опухолях, тромбоэмболизе и гиперлипемии; ссылка на Поплавски и др. (A.Poplauski et. al. J.Artjerosclerosis Research, 8, 721 (1968). Таким образом, соединения изобретения, которые имеют антитромбогенные свойства (ингибируют агрегацию кровяных пластинок), являются полезными при предупреждении или лечении состояний, включающих агрегацию тромбоцитов и тромбоз, такой как указывалось выше. Также считается, что рассматриваемые соединения имеют антиметастатический потенциал ввиду их свойств ингбирования тромбоцитов.
Фармакологические свойства рассматриваемых соединений могут быть продемонстрированы обычными ин витро и ин виво биологическими испытаниями, такими как следующие.
ИНГИБИРОВАНИЕ АГРЕГАЦИИ ТРОМБОЦИТОВ ЧЕЛОВЕКА IN VITRO.
Агрегометр (прибор для измерения агрегации) был использован по методу Борна (C. V.R.Born J.Physiol (London), 1962, 162, 67-68), который модифицирован Мустардом и др. (Mustard J.F. et. al. J.Lab.Ghem.Med. 1964, 64, 548-599), чтобы оценить ин витро активность различных соединений относительно ингибирования аденозин-дифосфатом (АДФ) и коллагеном индуцированной агрегации тромбоцитов. Рука добровольца-донора очищается с помощью 70%-ного этилового спирта. Стерилизованные шприц объемом 20 мл и игла были использованы, чтобы отобрать 20 мл крови. Кровь немедленно добавляется в трубку для испытания, содержащую 3,8% -ный цитрат натрия, чтобы предупредить свертывание крови (1 ч. цитрата на 9 ч. крови).
Обогащенная тромбоцитами плазма (ОТП) была выделена центрифугированием в течение 10 мин со скоростью 10000 об/мин (140 хо) из цитратной (3,8%) крови человека. Все стеклянные изделия, используемые для получения ОТП, обрабатываются силиконом. АДФ в конечной концентрации 0,5 мкг/мл или 0,05 мл коллагеновой суспензии, полученной по методу, описанному Эвансом и др. (Evanas G. et. al. J.Exp.Med. 1968, 128, 877-894), был использован, чтобы индуцировать агрегацию. Различные испытуемые соединения были растворены в диметилсульфоксиде (ДМСО) с тем, чтобы 5 мкл, добавленного к обогащенной тромбоцитами плазме, дали бы требуемую концентрацию для испытания. Контрольные испытания с наполнителем были осуществлены и сравнены с агрегацией, индуцированной в обогащенной тромбоцитами плазме, содержащей различные концентрации испытуемых соединений. Кривые ответной реакции на дозу были получены и величины Ингибирующей Концентрации (IC50) были вычислены или процент ингибирования при 32 мкг/мл был отмечен. В этом испытании величины IC50для дипиридамола в клинике антитромбогенного средства, являются 512 мкг/мл против АДФ и 245 мкг/мл против коллагена.
Результаты представляются в табл.1 и 2 ниже для различных соединений и родственных прототипных соединений.
ИНГИБИРОВАНИЕ ТРОМБОЗА, ИНДУЦИРОВАННОГО ЛАЗЕРОМ, IN VIVO.
Метод тромбоза, индуцированного лазером, является модификацией методики, разработанной Сандерсом и др. (Sanders, A.G. в Brit. of Exp.Pathol, 1954, 35, 331) и Грантом и др. (Grant, L. et. al. в Proc.Soc.Exp.Biol.Med. 1965, 119, 1123). Подробное описание этого метода описано Флемингом и др. (Fleming J. S. et. al.) в книге Тромбоциты и Тромбоз, издатели Серябин и Шерри, Балтимор, Универсал Парк Пресс, с,247-262, 1974 (в Plateles and Thrambosis A. Scriabane and S. Sherry. ads. Baltimore, Univ Park Press) и таким образом включается ссылкой.
Слуховые камеры Луцита хронически были имплантированы взрослым английским вислоухим кроликам. Животные были приведены в спокойное лежачее состояние в положении супинации. Локалированное микрососудистое повреждение было вызвано путем фокусирования отдельного луча рубинового лазера через микроскоп в полость (просвет) сосуда с диаметром 10-60 мкм. Это вызывает образование маленького тромба, состоящего из тромбоцитов, собранных вокруг сердцевины одного или двух поврежденных эритроцитов. Зона тромбов была определена в результате двух перпендикулярных измерений, сделанных путем использования окуляра микрометра. Среднюю зону тромбов (мкм2), полученную для 10 испытаний каждого кролика, используют в качестве контрольной величины. Испытуемое соединение было введено перорально и последозовые испытания были осуществлены при выбранных периодах времени. Фармакологическая активность была оценена путем сравнения до и последозовых соседних зон, тромбов.
В приведенной выше биолазерной модели тромбоза соединение примера 6 проявляет 53%-ное ингибирование тромбоза при пероральной дозе 10 мг/кг, 38% -ное ингибирование при дозе 3 мг/кг и 23%-ное ингибирование при дозе 1 мг/кг живого веса.
Дозировка, применяемая в терапевтических способах изобретения, варьирует с изменением формы введения, конкретно выбранного соединения, испытуемого субъекта и требуемого эффекта. Подходящие эффективные дозы для животных варьируют в пределах 0,1-50 мг/кг живого веса перорально и 0,05-10 мг/кг живого веса парентерально (большей частью характеризуются как подкожная, внутримышечная и внутривенная инъекции). Предполагается, что эффективная унифицированная доза для человека варьирует в пределах 1-100 мг и предпочтительно 0,5-20 мг, вводимой от одного до трех раз в день. В соответствии с общепринятой клинической практикой эффективная доза может быть определена путем введения соединения формулы I при дозировке, значительно меньшей чем доза соединения, которая должна быть эффективной, и затем увеличением дозировки с незначительными возрастаниями до тех пор, пока не достигается требуемый эффект.
При проведении рассматриваемых здесь терапевтических способов действующий ингредиент формулы I или соли щелочных металлов карбоновых кислот формулы I предпочтительно вводятся вместе с фармацевтически приемлемым носителем. Подходящими лекарственными формами для перорального использования являются таблетки, диспергируемые порошки, гранулы, капсулы, сиропы и эликсиры. Примерами парентеральных лекарственных форм являются растворы, суспензии, дисперсии, эмульсии и тому подобные. Композиции для перорального использования могут содержать один или более обычных адъювантов, таких как подслащиващие вещества, вещества, придающие вкус и аромат, красящие вещества и консервирующие средства, для того, чтобы обеспечить композицию подходящей фармацевтической элегантности (изящества). Таблетки могут содержать действующий ингредиент в смеси с обычными фармацевтически приемлемыми наполнителями, включая инертные разбавители, такие как карбонат кальция, карбонат натрия, лактоза и тальк; гранулирующие и дезинтегрирующие средства, такие как крахмал и альгиновую кислоту; связующие средства, такие как крахмал, желатина и акация, и смазывающие вещества, такие как стеарат магния, стеариновая кислота и тальк. Таблетки могут быть непокрытыми или покрытыми по известным методам, чтобы задерживать дезинтеграцию и поглощение в желудочно-кишечном тракте и тем самым обеспечивать длительное действие в течение продолжительного периода времени. Подобным образом суспензия, сиропы и эликсиры могут содержать действующий ингредиент в смеси с любыми обычными наполнителями, применяемыми для получения таких композиций, такими как суспендирующие средства (например метилцеллюлоза, трагакант и альгинат натрия), смачивающие вещества (например лецитин, полиоксиэтиленстеарат) и консервирующие средства, такие как этиловый эфир пара-гидроксибензойной кислоты. Капсулы могут содержать действующий ингредиент самостоятельно или смешанного вместе с инертным твердым разбавителем, таким как карбонат кальция, фосфат кальция и каолин. Инъецируемые композиции составляют, как это известно в данной области техники, и могут содержать соответствующие диспергирующие или смачивающие вещества и суспензирующие средства, идентичные или подобные с таковыми, упомянутыми выше.
Следующие примеры представляются с целью показа, а не должны быть истолкованы как ограничивающие изобретение каким-либо образом, ввиду того, что многие вариации изобретения являются возможными в пределах сущности изобретения.
В следующих примерах, все температуры представляются в градусах стоградусной шкалы. Температуры плавления были зарегистрированы на приборе Томаса-Гувера для капиллярного определения точки плавления и являются неисправленными. Спектры протонного магнитного резонанса (1Н-ЯМР) были записаны на спектрометре Брукер АМ 300, Брукер WМ 360 или Вариан Джемини. Все спектры были определены в CDCl3 или ДМСО-d6, если не указано особо, и химические сдвиги сообщаются в единицах дельта, сдвигаемых в слабое поле от внутреннего стандарта тетраметилсилана (ТМС), а константы взаимодействия между протонами сообщаются в герцах. Виды расщепления обозначаются следующим образом: с, синглет; д, дублет; т. триплет; кв. квартет; м, мультиплет; уш, уширенный пик и дд, дублет дублетов.
П р и м е р 1. Метиловый эфир 2-[3-[2-(4,5-дифенил-2-оксазолил)-этил]-фенокси]-уксусной кислоты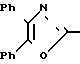 CH2CH
CH2CH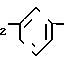 OCH2CO2CH3
OCH2CO2CH3
Cмесь 3-[2-(4,5-дифенил-2-оксазолил)-этил] -фенола (3,41 г, 10 ммолей), карбоната калия (1,52 г, 11 ммолей), йодистого калия (каталитическое количество), метилового эфира бромуксусной кислоты (1,68 г, 11 ммолей) и ацетонитрила (32 мл) перемешивают при кипячении с обратным холодильником в атмосфере азота. После 90 мин смесь охлаждают, фильтруют и концентрируют, чтобы получить в остатке масло, которое подвергают хроматографии на колонке с силикагелем. Элюирование с помощью смеси гексанов, этилацетата и триэтиламина (75: 25: 1) дает метиловый эфир 2-[3-[2-(4,5-дифенил-2-оксазолил)-этил]-фенокси] -уксусной кислоты (3,59 г, 86%) в виде вязкого масла.
Анализ: для C26H23NO4:
Вычислено: C 75,54; H 5,61; N 3,39.
Найдено: C 75,57; H 5,67; N 3,41%
IH-ЯМР (CDCl3) δ: 3,14 (4H, c); 3,76 (3H, c.); 4,60 (2H, c.); 6,75 (1H, дд. J=8 Гц, Jl=2,5 Гц); 6,90 (1Н, д. J=8 Гц); от 7,15 до 7,40 (7Н, м.) и от 7,50 до 7,75 (4Н, м.).
П р и м е р 2. 2-[3-[2-(4,5-Дифенил-2-оксазолил)-этил]-фенокси]-уксусная кислота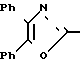 CH2CH
CH2CH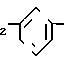 OCH2CO2H
OCH2CO2H
Смесь метилового эфира 2-[3-[2-(4,5-дифенил-2-оксазолил)-этил]-фенокси] -уксус-ной кислоты (2,25 г, 5,5 ммолей), 3N раствора гидроокиси натрия (5,5 мл) и метанола (50 мл) нагревают до кипения с обратным холодильником на паровой бане. После 5 мин смесь охлаждают, метанол выпаривают и остаток разбавляют водой. Подогревание дает раствор, который разбавляют 1 N раствором соляной кислоты до pH 3, чтобы получить маслянистый осадок. Смесь экстрагируют с помощью CH2Cl2 и органические экстракты промывают дважды водой и один раз насыщенным раствором хлористого натрия. Концентрирование после высушивания над сульфатом натрия дает в остатке бледно-желтое твердое вещество, которое перекристаллизовывают дважды из смеси гексанов и CH2Cl2 (2:1), чтобы получить 2-[3-[2-(4,5-дифенил-2-оксазолил)-этил] -фенокси]-уксусную кислоту (1,74 г, 80%), т.пл. 153,3-154,5оС.
Анализ: для C25H21NO4:
Вычислено: C 75,18; H 5,30; N 3,51.
Найдено: C 75,15; H 5,35; N 3,30%
IH-ЯМР (ДМСО-d6) δ: 3,12 (4Н, м.); 4,64 (2Н, с.); 6,73 (1Н, дд. J=8Гц, Jl= 2 Гц); 6,88 (2Н, м.); 7,20 (1Н, т. J=8 Гц); 7,30-7,50 (6Н, м.) и 12,98 (1Н, уш.с.).
Металлический натрий (0,58 г, 25 мг/атом) растворяют в метаноле (10 мл) и 1 мл этого раствора разбавляют метанолом (20 мл). Добавляют 2-[3-[2-(4,5-дифенил-2-оксазолил)-этил]-фенокси]-уксусную кислоту (100 г, 2,5 ммоля) и смесь перемешивают при комнатной температуре в течение 18 ч. Выпаривание растворителя дает в остатке твердое вещество бежевого цвта, натриевую соль 2-[3-[2-(4,5-дифенил-2-оксазолил)-этил] -фенокси] -уксусной кислоты (1,06 г, 100), т.пл. 278-280оС.
Анализ: для C25H20N4Na˙0,2H2O:
Вычислено: C 70,65; H 4,84; N 3,30; H2O 0,85.
Найдено: C 70,46; H 4,75; N 3,32; H2O 0,60% I
IH=ЯМР (Д2О) δ: 2,55 (4Н, уш.с.); 4,19 (2Н, с.); 6,20 (1Н, д. J=7,5 Гц); 6,45-6,70 (5Н, м.); 6,79 (1Н, т. J=7,5 Гц) 6,90-7,30 (7Н, м.).
П р и м е р 3. Метиловый эфир 2-[4-[2-(4,5-дифенил-2-оксазолил)-этил]-фенокси] уксусной кислоты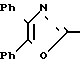 CH2CH
CH2CH OCH2CO2CH3
OCH2CO2CH3
Смесь 4-[2-(4,5-дифенил-2-оксазолил)-этил] -фенола (6,00 г, 17 ммолей), метилового эфира бромуксусной кислоты (2,96 г, 1,83 мл, 19 ммолей), карбоната калия (2,91 г, 21 ммолей), йодистого калия (каталитическое количество) и ацетонитрила (80 мл) перемешивают при кипячении с обратным холодильником. После 1 ч смесь охлаждают, фильтруют и растворитель удаляют, чтобы в остатке получить кристаллическое твердое вещество, которое растирают в порошок с помощью гексанов и фильтруют, чтобы получить метиловый эфир 2-[4-[2-(4,5-дифенил-2-оксазолил)-этил] -фенокси] -уксусной кислоты (7,27 г, 100%). Аналитический образец получают перекристаллизацией навески в 2,25 г из метанола, чтобы получить 1,70 г чистого вещества, которое имеет т.пл. 122-125оС.
Анализ: для C26H23NO4:
Вычислено: C 75,53; H 5,61; N 3,39.
Найдено: C 75,30; H 5,86; N 3,39%
IH-ЯМР (CДСl3) δ: 3,11 (4Н, с.); 3,77 (3Н, с.); 4,60 (2Н, с.); 6,84 (2Н, д. J=8 Гц); 7,18 (2Н, д. J=8,5 Гц); 7,20-7,50 (6Н, м.); и 7,60-7,80 (4Н, м. ).
П р и м е р 4. 2-[4-[2-(4,5-Дифенил-2-оксазолил)-этил]-фенокси]-уксусная кислота.
 CH2CH
CH2CH OCH2CO2H
OCH2CO2H
Смесь метилового эфира 2-[4-[2-(4,5-дифенил-2-оксазолил)-этил]-фенокси] -уксус-ной кислоты (5 г, 12 ммолей), 5 N раствора гидроокиси натрия (7,26 мл) и метанола (100 мл) нагревают на паровой бане в течение 45 мин. Раствор концентрируют под вакуумом, разбавляют водой и 2 N раствором HCl и белое твердое вещество отфильтровывают. Перекристаллизация из метанола дает 2-[4-[2-(4,5-дифенил-2-оксазолил)-этил]-фенокси]-уксусную кислоту (2,88 г, 59% ), т.пл. 147-149оС.
Анализ: для C25H21NO4:
Вычислено: C 75,17; H 5,30; N 3,51.
Найдено: C 75,03; H 5,50; N 3,44%
IH-ЯМР (ДМСО-d6) δ: 3,11 (4Н, уш.с.); 4,68 (2Н, с.); 6,90 (2Н, уш.с.); 7,24 (2Н, д. J=6 Гц); от 7,30 до 7,90 (10 Н, м.); и 13,10 (1Н, уш.с.).
П р и м е р 5. Этиловый эфир 3-[3-[2-(4,5-дифенил-2-оксазолил)-этил]-фенил]-2-пропеновой кислоты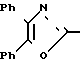 CH2CH
CH2CH
Смесь 3-[2-(4,5-дифенил-2-оксазолил)-этил] -фенилтрифторметансульфоната (11,8 г, 25 ммолей), этилового эфира акриловой кислоты (5,01 г, 50 ммолей), триэтиламина (10,12 г, 100 ммолей), ацетата палладия 11 (0,28 г, 1,25 ммоля), 1,3-бис-(дифенилфосфин)-пропана (0,52 г, 1,25 ммоля) и ДМФА (100 мл) перемешивают при 90оС в атмосфере азота. После 2 и 6 часов добавляют дополнительно ацетата палладия 11 (0,28 г, 1,25 ммоля) и 1,3-бис-(дифенилфосфин)-пропана (0,52 г, 1,25 ммоля). После 22 ч смесь разбавляют водой и экстрагируют этилацетатом. Объединенные экстракты промывают трижды водой и один раз насыщенным раствором хлористого натрия, высушивают над сульфатом натрия и концентрируют. Остаточное масло хроматографируют на колонке с силикагелем, используя смесь гексанов и этилацетата (3:1) в качестве элюента, чтобы получить этиловый эфир 3-[3-[2-(4,5-дифенил-2-оксазолил)-этил]-фенил]-2-пропеновой кислоты (9,37 г, 88%) в виде масла.
Анализ: для C28H25NO3:
Вычислено: C 79,41; H 5,96; N 3,31.
Найдено: C 79,20; H 6,21; N 3,45%
IH-ЯМР (СДСl3) δ: 1,31 (3Н, т. J=7 Гц); 3,17 (4Н, м.); 4,24 (2Н, кв. J=7 Гц); 6,41 (1Н, д. J=16 Гц); 7,20-7,50 (1Н, м.); 7,50-7,80 (5Н, м.).
П р и м е р 6. Гексановый сольват гидрата 3-[3-[2-(4,5-дифенил-2-оксазолил)-этил]-фенил]-2-пропеновой кислоты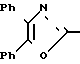 CH2CH
CH2CH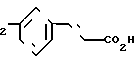
Смесь этилового эфира 3-[3-[2-(405-дифенил-2-оксазолил(-этил]-фенил]-2-пропе-новой кислоты (1,50 г, 3,5 ммоля), 3 N раствора гидроокиси натрия (3,5 мл) и метанола (100 мл) нагревают на паровой бане. После 25 мин смесь охлаждают, концентрируют, разбавляют водой и с помощью разбавленного раствора соляной кислоты делают pH 1. Смесь экстрагируют трижды с помощью CH2Cl2. Объединенные экстракты промывают насыщенным раствором NaCl, высушивают на сульфатом натрия и растворитель выпаривают. Остаточное масло хроматографируют на колонке с силикагелем, используя смесь хлороформа и метанола (9: 1) в качестве элюента, чтобы получить 3-[3-[2-(4,5-дифенил-2-оксазолил)-этил] -фенил] -2- пропеновую кислоту (1,400 г, 100%) в виде гидратированного гексанового сольвата после перекристаллизации из смеси гексанов и CН2Cl2 (3:1), т.пл. 114-115оС.
Анализ: для C26H21NO3˙0,6C6H14 x x0,2H2O:
Вычислено: С 78,88; H 6,67; N 3,11; H2O 0,70.
Найдено: C 78,54; H 6,86; N 3,04; H2O 0,21%
IH-ЯМР (СДСl3) δ, 0,86 (3Н, т. J=7 Гц); 1,25 (4Н, м.); 3,19 (4Н, с.); 6,44 (1Н, д. J=16 Гц); от 7,25 до 7,70 (14 Н, м.) и 7,75 (1Н, д. J=16 Гц).
П р и м е р 7. Этиловый эфир 3-[2-(4,5-дифенил-2-оксазоли)-этил]-бензолпропановой кислоты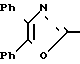 CH2CH
CH2CH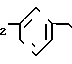
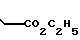
Раствор этилового эфира 3-[2-(4,5-дифенил-2-оксазолил)-этил]-фенил-2-пропено- вой кислоты (1,02 г, 2,4 ммоля) в этилацетате (50 мл) гидрируют над 10% палладия на древесном угле (0,06 г) при давлении 35 фунтов/дюйм2 (2,4584 атм. ). После 27 ч смесь фильтруют, концентрируют и остаток подвергают хроматографии на колонке с силикагелем, используя смесь этилацетата и гексанов (9: 1) в качестве элюента. Элюирование дает этиловый эфир 3-[2-(4,5-дифенил-2-оксазолил)-этил]-бензолпропановой кислоты (0,92 г, 90%) в виде масла.
Анализ: C28H27NO3:
Вычислено: C 79,04; H 6,40; N 3,30.
Найдено: C 79,12; H 6,72; N 3,30%
IH-ЯМР (СДСl3) δ: 1,22 (3Н, триплет, J=7 Гц); 2,59 (2Н, т. J=8 Гц); 2,93 (2Н, т. J=8 Гц); 3,14 (4Н, с.); 4,11 (2Н, кв. J=7 Гц); 7,00-7,50 (10 Н, м.); и 7,50-7,70 (4Н, м.).
П р и м е р 8. 3-[2-(4,5-Дифенил-2-оксазолил)-этил]-бензолпропановая кислота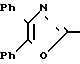 CH2CH
CH2CH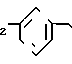

Смесь этилового эфира 3-[2-(4,5-дифенил-2-оксазолил)-этил]-бензолпропановой кислоты (1,85 г, 4,3 ммоля), 3N раствора гидроокиси натрия (4,4 мл) и метанола (100 мл) нагревают на паровой бане. После 20 мин смесь концентрируют, разбавляют водой и 1 N раствором соляной кислоты до pH 1 и экстрагируют с помощью CH2Cl2. Объединенные экстракты высушивают над сульфатом натрия и растворитель выпаривают, чтобы в остатке получить белое твердое вещество. Перекристаллизация из смеси гексана и CH2Cl2 дает 3-[2-(4,5-дифенил- 2-оксазолил)-этил]-бензолпропановую кислоту (1,58 г, 91%), т.пл. 119-120оС.
Анализ: для C26H23NO3:
Вычислено: C 78,57; H 5,84; N 3,53.
Найдено: С 78,61; H 5,96; N 3,31%
IН-ЯМР (СДСl3) δ: 2,64 (2Н, т. J=8 Гц); 2,93 (2Н, т. J=7 Гц); 3,14 (4Н, с.); 7,05-7,50 (10Н, м.); 7,50-7,75 (4Н, м.).
П р и м е р 9. Метиловый эфир [3-[2-(4,5-дифенил-2-оксазолил)-этил]-фенокси]-ук- сусной кислоты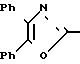 CH
CH CH
CH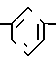 OCH2CO2CH3
OCH2CO2CH3
Металлический натрий (260 мг, 11 мг/атома) растворяют в метаноле (50 мл) и добавляют диметиловый эфир [(4,5-дифенил-2-оксазолил)-метил]-фосфиновой кислоты (3,89 г, 11 ммолей), за которым следует метиловый эфир (3-формилфенокси)-уксусной кислоты (2 г, 10 ммолей). Смесь перемешивают при комнатной температуре в течение 20 мин до того, как ее концентрируют и разбавляют 2 N раствором HCl. Смесь экстрагируют с помощью CH2Cl2, органическую фазу высушивают над сульфатом натрия и растворитель выпаривают, чтобы получить в остатке желтое масло. Это масло объединяют с сырым веществом из реакции, осуществленной из 2 г фосфоната и 985 мг альдегида, и хроматографируют на конке с силикагелем. Элюирование с помощью смеси гексанов и диэтилового эфира (3: 2) дает метиловый эфир [3-[2-(4,5-дифенил-2-оксазолил)-этенил]-фенокси] -уксусной кислоты в виде сольвата диэтилового эфира (2,92 г, 46%) после перекристаллизации из диэтилового эфира, т.пл. 79-82оС.
Анализ: для С26Н21NO4˙0,4C4H10O:
Вычислено: С 75,34; H 5,58; N 3,23.
Найдено: C 75,35; H 5,47; N 3,17%
IH-ЯМР (СДСl3) δ: 1,26 (1,25 Н, т. J=7 Гц); 3,53 (0,75 Н, кв. J=7 Гц); 3,88 (3Н, с.); 4,73 (2Н, с.); 6,94 (1Н, дд. J=7,5 Гц, Jl=2 Гц); 7,06 (1Н, д. J= 16 Гц); 7,14 (1Н, т. J=2 Гц); 7,20-7,55 (8Н, м.); 7,60 (1Н, д. J=16 Гц) и 7,70-7,90 (5Н, м.).
П р и м е р 10. [3-[2-(4,5-Дифенил-2-оксазолил)-этенил]-фенокси]-уксусная кислота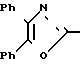 CH
CH CH
CH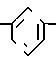 OCH2CO2H
OCH2CO2H
Смесь метилового эфира [3-[2-(4,5-дифенил-2-оксазолил)-этенил]-фенокси] -уксус- ной кислоты (1,00 г, 2,5 ммоля), 5N раствора гидроокиси натрия (2 мл) и метанола (15 мл) нагревают на паровой бане в течение 10 мин до того, как ее концентрируют. Разбавление водой и 2N раствором HCl дает желтое твердое вещество, которое объединяют с сырым продуктом реакции, осуществленной из 1,46 г сложного эфира, используя 3 мл 5 N NaOH в 40 мл метанола. Перекристаллизация из этанола дает [3-[2-(4,5-дифенил-2-оксазолил)-этенил]-фенокси] -уксусную кислоту (1,70 г, 70%), т.пл. 213-215оС.
Анализ: для C25H19NO4.
Вычислено: C 75,56; H 4,82; N 3,53.
Найдено: С 75,37; Н 4,87; N 3,43
IH-ЯМР (ДМСО-d6) δ: 4,75 (2Н, с.); 6,90 (1Н, м.); 7,20-7,70 (13Н, м.); и 13,02 (1Н, уш.с.).
П р и м е р 11. Метиловый эфир [4-[2-(4,5-дифенил-2-оксазолил)-этенил] -фенокси]-уксусной кислоты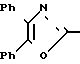 CH
CH CH
CH OCH2CO2CH3
OCH2CO2CH3
Металлический натрий (570 мг, 25 мг/атома) растворяют в метаноле (50 мл) и добавляют диметиловый эфир [(4,5-дифенил-2-оксазолил)-метил]-фосфиновой кислоты (7,80 г, 22 ммолей). Смесь перемешивают в течение 10 мин до того, как добавляют метиловый эфир (4-формил-фенокси)-уксусной кислоты (4,00 г, 20 ммолей). После перемешивания при комнатной температуре в течение 1 ч смесь разбавляют водой и желтое твердое вещество отфильтровывают и высушивают на воздухе, чтобы получить сырой продукт реакции (3,80 г, 44%). Этот продукт реакции объединяют вместе с 3,50 г ранее проведенного опыта и перекристаллизовывают дважды из метанола, чтобы получить аналитически чистый метиловый эфир [4-[2-(4,5-дифенил-2-оксазолил)-этенил] -фенокси]-уксусной кислоты, т. пл. 122-123оС.
Анализ: для C26H21NO4:
Вычислено: C 75,90; H 5,15; N 3,41.
Найдено: C 76,00; H 5,16; N 3,44%
IH-ЯМР (ДМСО-d6) δ: 3,70 (3Н, с.); 4,85 (2Н, с.); 6,97 (2Н, д. J=10 Гц); 7,08 (1Н, д. J=13 Гц); 7,30-7,55 (6Н, м.); 7,55-7,80 (7Н, м.).
П р и м е р 12. [4-[2-(4,5-Дифенил-2-оксазолил)-этенил]-фенокси]-уксусная кислота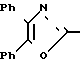 CH
CH CH
CH OCH2CO2H
OCH2CO2H
Смесь метилового эфира [4-[2-(4,5-дифенил-2-оксазолил)-этенил]-фенокси] -уксус- ной кислоты (2,00 г, 5 ммолей), 5 N раствора гидроокиси натрия (2,90 мл), воды (40 мл) и метанола (10 мл) нагревают на паровой бане, чтобы получить раствор. Смесь охлаждают, разбавляют 2 N раствором соляной кислоты до pH 1 и фильтруют. Перекристаллизация из этанола дает [4-[2-(4,5-дифенил-2-оксазолил)-этенил]-фенокси]-уксусную кислоту (1,34 г, 69%), т.пл. 223-225оС.
Анализ: для С25Н19NO4:
Вычислено: C 75,56; H 4,82; N 3,53.
Найдено: C 75,47; H 4,79; N 3,55%
IH-ЯМР (ДМСО-d6) δ: 4,74 (2Н, с.); 6,95 (2Н, д. J=8,5 Гц); 7,08 (1Н, д. J= 16 Гц); 7,20-7,50 (6Н, м.); 7,50-7,70 (5Н, м.); 7,69 (2Н, д. J=8,5 Гц) и 13,08 (1Н, уш. с.).
П р и м е р 13. Метиловый эфир [3-[3-(4,5-дифенил-2-оксазолил)-метокси] -фенил]-пропановой кислоты CH2O
CH2O
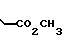
Смесь 2-бромметил-4,5-дифенилоксазола (10,0 г, 3 ммоля), метилового эфира 3-(3-гидроксифенил)-пропановой кислоты (5,73 г, 3 ммоля), карбоната калия (4,83 г, 3,5 ммоля), йодистого калия (каталитическое количество) и ацетонитрила (150 мл) перемешивают при температуре кипения с обратным холодильником. После 30 мин смесь фильтруют, концентрируют под вакуумом и остаточное масло хроматографируют на колонке с силикагелем. Элюирование с помощью смеси гексанов и диэтилового эфира (3:1) дает метиловый эфир [3-[3-(4,5-дифенил-2-оксазолил)-метокси] -фенил]-пропановой кислоты (10,34 г, 78%) в виде масла. Аналитический образец получают, подвергая 4 г образца хроматографии при условиях, описанных выше, чтобы получить чистое вещество в виде масла.
Анализ: для C26H23NO4:
Вычислено: C 75,53; H 5,61; N 3,39.
Найдено: C 75,11; H 5,60; N 3,33%
IH-ЯМР (СДСl3) δ: 2,62 (2Н, т. J=8 Гц); 2,95 (2Н, т. J=8 Гц); 3,65 (3Н, с.); 5,19 (2Н, с.); 6,80-7,05 (3Н, м.); 7,20-7,55 (7Н, м.); и 7,60-7,80 (4Н, м.).
П р и м е р 14. 3-[3-[(4,5-Дифенил-2-оксазолил)-метокси]-фенил]-пропановая кислота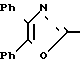 CH2O
CH2O
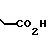
Смесь метилового эфира 3-[3-[(4,5-дифенил-2-оксазолил)-метокси]-фенил] -пропа- новой кислоты (6 г, 14,5 ммолей), 5 N раствора гидроокиси натрия (8,7 мл) в метаноле (150 мл) нагревают до кипения с обратным холодильником на паровой бане. После 20 мин смесь концентрируют, разбавляют водой (200 мл) и 2 N раствором соляной кислоты до pH 1. После фильтрации и высушивания на воздухе в течение ночи твердое вещество перекристаллизовывают из смеси гексанов и CH2Cl2, чтобы получить 3-[3-[(4,5-дифенил-2-оксазолил)-метокси]-фенил]-пропановую кислоту (4,15 г, 71%), т.пл. 118-120оС.
Анализ: для C25H21NO4˙0,11 H2O:
Вычислено: C 74,84; H 5,33; N 3,50; H2O 0,45.
Найдено: C 74,49; H 5,31; N 3,31; H2O 0,05%
IH-ЯМР (СДСl2) δ: 2,67 (2Н, т. J=8 Гц); 2,95 (2Н, т. J=8 Гц); 5,22 (2Н, с. ); 6,80-7,00 (3Н, м.) 7,15-7,50 (7Н, м.); 7,55-7,80 (4Н, м.) и 10,71 (1Н, уш.с.).
П р и м е р 15. Метиловый эфир 3-[4-[(4,5-дифенил-2-оксазолил)-метокси] -фенил] пропановой кислоты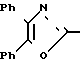 CH2O
CH2O

Реакция 2-бромметил-4,5-дифенилоксазола и метилового эфира 3-(4-гидроксифенил)-пропановой кислоты по методике примера 17 дает названное выше соединение, т.пл. 92-95оС.
Анализ: для C26H23NO4˙0,3H2O:
Вычислено: C 74,56; H 5,68; N 3,35; H2O 1,29.
Найдено: C 74,37; H 5,81; N 5,81; HO2 0,13.
П р и м е р 16. 3-[4-[(4,5-ДифениЛ-2-оксазолил)-метокси]-фенил]-пропановая кислота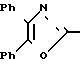 CH2O
CH2O
Метиловый эфир 3-[4-[(4,5-дифенил-2-оксазолил)-метокси]-фенил]-пропановой кислоты гидролизуют водным раствором гидроокиси натрия по методике примера 18, чтобы получить названное выше соединение, т.пл. 124-127оС.
Анализ: для C25H21NO4:
Вычислено: C 75,18; H 5,30; N 3,51.
Найдено: С 74,73; Н 5,38; N 3,49%
П р и м е р 17. Метиловый эфир 3-[3-[(4,5-дифенил-2-оксазолил)-метокси] -фенил]-2- пропеновой кислоты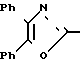 CH2O
CH2O
Гидрид натрия (2,57 г, 60%-ной дисперсии, 64 ммолей) промывают гексанами, покрывают диметиловым эфиром (250 мл) и по частям добавляют триметил-фосфоноацетат (триметиловый эфир форсфиноуксусной кислоты) (10,71 г, 9,52 мл, 50 ммолей). Смесь перемешивают в течение 15 мин и раствор 3-[(4,5-дифенил-2-оксазолил)-метокси] -бен- зальдегида (19,00 г, 53 ммолей) в диметилформамиде (50 мл) добавляют в один прием. Смесь перемешивают в течение 30 мин, чтобы получить раствор янтарного цвета до того, как ее разбавляют водой и экстрагируют с помощью CH2Cl2. Объединенные экстракты высушивают над сульфатом натрия и растворитель выпаривают, чтобы в остатке получить масло, которое кристаллизуется при растирании в порошок с помощью смеси гексанов и диэтилового эфира, чтобы получить метиловый эфир 3-[3-[(4,5-дифенил-2-оксазолил)-метокси] фенил]-2-пропеновой кислоты (27,20 г, 78 ). Аналитический образец получают перекристаллизацией 1,40 г вещества из изопропилового спирта, чтобы получить 0,85 г чистого вещества с т.пл. 88-90оС.
Анализ: для С26H21NO4:
Вычислено: C 75,90; Н 5,15; N 3,41.
Найдено: С 75,80; Н 5,18; N 3,43%
IH-ЯМР (СДСl3) δ: 3,85 (3Н, с.); 5,27 (2Н, с.); 6,49 (1Н, д. J=16 Гц); 7,10-7,55 (10Н, м.); 7,60-7,80 (5Н, м.).
П р и м е р 18. 3-[3-[(4,5-Дифенил-2-оксазолил)-метокси]-фенил]-2-пропеновая кислота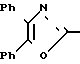 CH2O
CH2O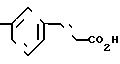
Смесь метилового эфира 3-[3-[(4,5-дифенил-2-оксазолил)-метокси]-фенил] -2-пропеновой кислоты (3 г, 7,2 ммолей), 5 N раствора гидроокиси натрия (4,40 мл) и метанола (60 мл) нагревают при кипячении с обратным холодильником. После 30 минут смесь охлаждают, концентрируют, разбавляют водой и подкисляют до pH 1 с помощью 2 N раствора соляной кислоты. Желтое твердое вещество отфильтровывают и перекристаллизовывают из смеси гексанов и CH2Cl2, чтобы получить 3-[3-[(4,5-дифенил-2-оксазолил)-метокси]-фенил]-2-пропеновую кислоту (2,25 н, 77%), т.пл. 145-147оС.
Анализ: для C25H19NO4˙0,1H2O:
Вычислено: С 75,22; H 4,85; N 3,51; H2O 0,45.
Найдено: C 74,94; H 4,86; N 3,42; H2O 0,11%
IH-ЯМР (СДСl3/ДМСО-d6) δ: 5,24 (2Н, с.); 6,64 (1Н, д. J=16 Гц); 7,09 (1Н, дд. J= 8 Гц, Jl=2 Гц); 7,18 (1Н, д. J=8 Гц); 7,25 (1Н, д. J=2 Гц); 7,30-7,50 (7Н, м.); и 7,60-7,80 (5Н, м.)
П р и м е р 19. Метиловый эфир 3-[4-[(4,5-дифенил-2-оксазолил)-метокси] -фенил]-2-пропеновой кислоты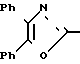 CH2O
CH2O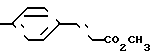
Реакция триметил-фосфоноацетата и 4-[(4,5-дифенил-2-оксазолил)-метокси] -бензальдегида по методике примера 21 дает названное выше соединение, т.пл. 159-161оС
Анализ: для C26H21NO4˙0,3H2O:
Вычислено: C 74,92; H 5,23; N 3,37; H2O 1,30.
Найдено: С 74,96; H 5,04; N 3,35; H2O 0,03%
П р и м е р 20. 3-[4-(4,5-дифенил-2-оксазолил)-метокси]-фенил-2-пропеновая кислота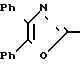 CH2O
CH2O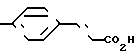
Метиловый эфир 3-[4-(4,5-дифенил-2-оксазолил)-метокси]-фенил-2-пропеновой кислоты гидролизуют водной гидроокисью натрия по методике примера 22, чтобы получить названное выше соединение, т.пл. 205-207оС.
Анализ: для C25H19NO4˙0,1H2O:
Вычислено: C 75,22; H 4,85; N 3,51; H2O 0,45.
Найдено: C 75,14; H 4,86; N 3,47; H2O 0,20%
П р и м е р 21. Метиловый эфир [3-[(4,5-дифенил-2-оксазолил)-метокси]-фенокси] уксусной кислоты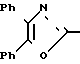 CH2O
CH2O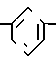 OCH2CO2CH3
OCH2CO2CH3
Смесь 2-бромметил-4,5-дифенил-оксазола (6,68 г, 21 ммолей) метилового эфира (3-ацетоксифенокси)-уксусной кислоты (3,87 г, 21 ммолей), карбоната калия (3,52 г, 25 ммолей), йодистого калия (каталитическое количество) и ацетонитрила (125 мл) перемешивают при кипячении с обратным холодильником. После 40 мин смесь охлаждают, фильтруют и растворитель выпаривают, чтобы в остатке получить масло. Хроматография на колонке с силикагелем, используя смесь гексанов и диэтилового эфира (3:1) в качестве элюента, дает гидратированный метиловый эфир [3-[(4,5-дифенил-2-оксазолил)-метокси]-фенокси]-уксусной кислоты (6,45 г, 72%) в виде масла.
Анализ: для C25H21NO5˙0,2H2O:
Вычислено: С 71,66; H 5,15l N 3,35; H2O 0,86.
Найдено: C 71,56; H 5,49; N 3,44; H2O 0,60%
IH=ЯМР (СДСl3) δ: 3,77 (3Н, с.); 4,61 (2Н, с.); 5,17 (2Н, с.); 6,55 (1Н, дд. J= 8 Гц, Jl=2 Гц); 6,65 (1Н, м.); 6,72 (1Н, дд. J=8 Гц, Jl=2 Гц); 7,20 (1Н, т. J=8Гц); 7,30-7,50 (6Н, м.); и 7,50-7,70 (4Н, м).
П р и м е р 22. [3-[(4,5-Дифенил-2-оксазолил)-метокси]-фенокси]-уксусная кислота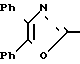 CH2O
CH2O OCH2CO2H
OCH2CO2H
Смесь метилового эфира [3-[(4,5-дифенил-2-оксазолил)-метокси]-фенокси] -уксус- ной кислоты (5,85 г, 14 ммолей), 5 N раствора гидроокиси натрия (8,45 мл) и метанола (100 мл) нагревают при кипячении с обратным холодильником. После 10 мин смесь охлаждают, растворитель выпаривают и остаток разбавляют водой и 2 N раствором HCl до pH 1. Желтое твердое вещество отфильтровывают и перекристаллизовывают из смеси хлороформа, диэтилового эфира, метанола и гексанов, чтобы получить гидратированную [3-[(4,5-дифенил-2-оксазолил)-метокси]-фенокси]-уксусную кислоту (2,70 г, 47), т.пл. 133-135оС.
Анализ: для C24H19NO5˙0,6H2O:
Вычислено: C 69,93; H 4,84; N 3,40; H2O 2,62.
Найдено: С 69,61l H 4,79; N 3,35; H2O 0,21%
IH-ЯМР (ДМСО-d6) δ: 4,47 (2Н, с.); 5,29 (2Н, с.); 6,54 (1Н, д. J=8 Гц); 6,68 (2Н, м.); 7,20 (1Н, т. J=8 Гц); 7,30-7,80 (14Н, м.).
П р и м е р 23. Этиловый эфир 3-[3-[2-(4,5-дифенил-2-оксазолил)-этенил] -фенил]-2- пропеновой кислоты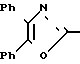 CH
CH CH
CH
Реакция 3-[2-(4,5-дифенил-2-оксазолил)-этенил] -фенилтрифторметансульфоната, полученного по реакции ангидрида трифторметансульфоновой кислоты с 3-[2-(4,5-дифенил-2-оксазолил)-этенил]-фенолом по методике примера 37 и этиловым эфиром акриловой кислоты, подобно методике примера 9, дает названное выше соединение.
П р и м е р 24. 3-[3-[2-(4,5-Дифенил-2-оксазолил)-этенил]-фенил]-2-пропеновая кислота CH
CH CH
CH
Гидролиз этилового эфира 3-[3-[2-(4,5-дифенил-2-оксазолил)-этенил]-фенил] -2- пропеновой кислоты с помощью гидроокиси натрия, аналогично методике примера 10, дает названное выше соединение.
П р и м е р 25. Метиловый эфир [3-[2-[4,5-ди-(3-тиенил)-2-оксазолил]-этил]-фенокси]-уксусной кислоты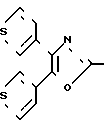 CH2CH
CH2CH OCH2CO2CH3
OCH2CO2CH3
Смесь 3-[2-[4,5-ди-(3-тиенил)-2-оксазолил] -этил] -фенола (2,00 г, 5,6 ммолей), метилового эфира бромуксусной кислоты (1,04 г, 6,8 ммолей), карбоната калия (0,94 г, 6,8 ммолей), йодистого калия (каталитическое количество) и ацетонитрила (100 мл) перемешивают при кипячении с обратным холодильником в атмосфере азота. После 15 ч смесь охлаждают, фильтруют и концентрируют и остаток подвергают хроматографии на колонке с силикагелем. Элюирование с помощью смеси гексанов и этилацетата (7:2) дает метиловый эфир [3-[2-[4,5-ди-(3-тиенил)-2-оксазолил] -этил] -фено- кси] -уксусной кислоты (1,95 г, 80%) в виде масла.
Анализ: для C22H19NO4S2:
Вычислено: C 62,10; H 4,51; N 3,30.
Найдено: C 62,39; H 4,64; N 3,37%
IH-ЯМР (СДСl3) δ: 3,10 (4Н, с.); 3,78 (3Н, с.); 4,60 (2Н, с.); 6,74 (1Н, дд. J=8 Гц, Jl=2,5 Гц); 6,81 (1Н, уш.с.); 6,89 (1Н, д. Jl=8 Гц); 7,10-7,40 (5Н, м.); и 7,50-7,70 (2Н, м.).
П р и м е р 26. [3-[2-[4,5-Ди-(3-тиенл)-2-оксазолил]-этил]-фенокси]-уксусная кислота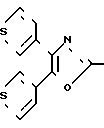 CH2CH
CH2CH OCH2CO2H
OCH2CO2H
Смесь метилового эфира [3-[2-[4,5-ди-(3-тиенил)-2-оксазолил]-этил]-фенокси] -уксусной кислоты (1,40 г, 3,3 ммоля), 3 N раствора гидроокиси натрия (3,3 мл) и метанола (50 мл) нагревают на паровой бане в течение 20 мин. Растворитель выпаривают, остаток разбавляют водой и 1 N раствором HCl до pH=1 и экстрагируют с помощью CH2Cl2. Объединенные экстракты высушивают над сульфатом натрия и концентрируют, чтобы получить твердое вещество бежевого цвета. Перекристаллизация из смеси гексанов и CH2Cl2 (5:3) дает гидратированную [3-[2-[4,5-ди-(3-тиенил)-2-оксазолил]-этил]-фенокси]-уксусную кислоты (1,16 г, 85%), т.пл. 154-156оС.
Анализ: для C21H17NO4S2˙0,4 H2O:
Вычислено: C 60,25; H 4,29; N 3,35; H2O 1,72.
Найдено: C 60,11; H 4,20; N 3,25; H2O 1,06%
IH-ЯМР (ДМСО-d6) δ: 3,06 (4Н, м.); 4,61 (2Н, с.); 6,72 (Н, дд. J=8 Гц, Jl= 2,5 Гц); 6,87 (2Н, м.); 7,17 (1Н, т. J=8 Гц); 7,25 (2Н, м.); 7,60-7,90 (4Н, м.); и 13,03 (1Н, уш.с.).
П р и м е р 27. Метиловый эфир [3-[2-[4,5-ди-(2-тиенил)2-оксазолил]-этил]-фенокси] уксусной кислоты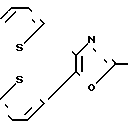 CH2CH
CH2CH OCH2CO2CH3
OCH2CO2CH3
Реакция 3-[2-[4,5-ди-(2-тиенил)2-оксазолил] -этил] -фенола с метиловым эфиром бромуксусной кислоты по методике примера 29 дает названное выше соединение.
П р и м е р 28. [3-[2-[4,5-Ди-(2-тиенил)-2-оксазолил]-этил]-феноксиуксусная кислота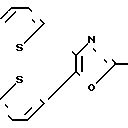 CH2CH
CH2CH OCH2CO2H
OCH2CO2H
Гидролиз метилового эфира [3-[2-[4,5-ди-(2-тиенил)-2-оксазолил]-этил]-фенокси] -уксусной кислоты с помощью водной гидроокиси натрия дает названное выше гидратированное соединение, т.пл. 105,5-107оС.
Анализ: для C21H17NO4S2˙0,3H2O:
Вычислено: С 60,51; H 4,26; N 3,36; H2O 1,29.
Найдено: C 60,40; H 4,29; N 2,95; H2O 1,26%
П р и м е р 29. Получение интермедиатов схемы (29-1)
HO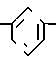 (CH2)2CO2H
(CH2)2CO2H
Раствор 3-гидроксикоричной кислоты (20,00 г, 122 ммолей) в метаноле (200 мл) гидрируют над 100 палладием на древесном угле (1,25 г) при давлении 45-50 фунтов на кв. дюйм (3,16-3,51 атм.), используя аппарат Парра для гидрирования. После 4 ч смесь фильтруют через Целит и растворитель выпаривают, чтобы получить в остатке рыжевато-коричневое твердое вещество, которое используют без дополнительной очистки.
IH-ЯМР (СД3ОД) δ: 2,32 (2Н, т. J=7,5 Гц); 2,68 (2Н, т. J=7,5 Гц); от 6,30 до 6,50 (3Н, м.); и 6,82 (1H, т. J=8,5 Гц).
П р и м е р 29. 3-[2-(4,5-Дифенил-2-оксазолил)-этил]-фенол (29-2)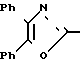 CH2CH
CH2CH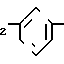 OH
OH
Металлический натрий (2,69 г, 9,12 г/атома) растворяют в абсолютном этаноле (250 мл) и раствор 3-(3-гидроксифенил)-пропионовой кислоты (19,38 н, 120 ммолей) в абсолютном этаноле (125 мл) добавляют. Смесь нагревают недолго при кипячении с обратным холодильником, охлаждают и добавляют концентрированную серную кислоту (5 капель) в абсолютном этаноле (5 мл), за которым следует добавление 2-бром-2-фефнилацетофенона (32,11 г, 120 ммолей). Смесь перемешивают при кипячении с обратным холодильником в течение 5,57 ч, охлаждают и концентрируют под вакуумом. К остатку добавляют ледяную уксусную кислоту (600 мл) и ацетат аммония. (45,09 г, 0,58 ммоля) и смесь нагревают при кипячении с обратным холодильником в течение 10,5 ч. Охлажденную реакционную смесь разделяют на части между водой и CH2Cl2 органическую фазу отделяют, промывают водой (трижды) и насыщенным раствором NaCl. После высушивания над сульфатом натрия, выпаривание растворителя дает в остатке окрашенное в золотистый цвет твердое вещество. Перекристаллизация из смеси гексанов и CH2Cl2 (2:1) дает 3-[2-(4,5-дифенил)-2-оксазолил)-этил]-фенол (29,35 г, 73%), т.пл. 146-147,5оС.
Анализ: для C23H19NO2˙0,05H2O:
Вычислено: C 80,70; H 5,63; N 4,10; H2O 0,26.
Найдено: С 80,45; H 5,69; N 3,92; H2O 0,11%
IH-ЯМР (СДСl3) δ: 3,05 (4Н, м.); 6,60 (2Н, м.); 6,68 (1Н, д. J=7,5 Гц); 7,05 (1Н, т. J=7,5 Гц); 7,20-7,45 (6Н, м.); и 7,5-7,80 (5Н, м.).
П р и м е р 29. 4-[2-(4,5-Дифенил-2-оксазолил)-этил]-фенол (29-3)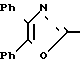 CH2CH
CH2CH OH
OH
Металлический натрий (1,00 г, 43 мг/атома) растворяют в этаноле (125 мл) и добавляют 3-(4-гидроксифенил)-пропионовую кислоту (6,04 г, 36 ммолей) чтобы получить белый выпавший осадок. Смесь подогревают ненадолго с перемешиванием и добавляют концентрированную H2SO4 (3 капли), за которым следует добавление 2-бром-2-фенилацетофенона (1,00 г, 36 ммолей). Смесь нагревают при кипячении с обратным холодильником в течение 2 ч, охлаждают, концентрируют и разбавляют водой. Смесь экстрагируют с помощью CH2Cl2, объединенные экстракты высушивают над сульфатом натрия и концентрируют, чтобы получить масло, которое растворяют в уксусной кислоте (250 мл). Добавляют ацетат аммония (14,00 г, 180 ммолей) и смесь нагревают при кипячении с обратным холодильником. После 100 мин раствор охлаждают, разбавляют водой и экстрагируют с помощью CH2Cl2. Объединенные экстракты высушивают над сульфатом натрия и растворитель выпаривают, чтобы получить в остатке твердое вещество, которое растирают в порошок с помощью смеси гексанов и диэтилового эфира и фильтруют, чтобы получить 4-[2-(4,5-дифенил-2-оксазолил)-этил]-фенол (8,00 г, 64% ). Аналитический образец получают перекристаллизацией 1,5 г вещества из смеси гексанов и CH2Cl2, чтобы получить 1,20 г чистого вещества, т.пл. 142-144оС.
Анализ: для C23H19NO4˙0,1H2O:
Вычислено: C 80,50; H 5,64; N 4,04; H2O 0,53.
Найдено: C 80,16; H 5,80; N 4,16; H2O 0,06%
IH-ЯМР (СДСl3) δ: 3,30 (4Н, м.); 6,80 (2Н, д. J=8,5 Гц); 7,15 (2Н, д. J= 8,5 Гц); 7,35-7,70 (6Н, м.); 7,20-7,90 (4Н, м.); и 7,95 (1Н, уш.с.).
П р и м е р 29. 3-[2-(4,5-Дифенил-2-оксазолил)-этенил]-фенол (29-4)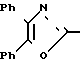 CH
CH CH
CH OH
OH
Металлический натрий (1,68 г, 73 мг/атома) растворяют в этаноле (160 мл) и добавляют 3-гидроксикоричную кислоту (10 г, 6 ммолей). После перемешивания в течение 5 мин добавляют 2-бром-2-феноксиацетофенон (16,76 г, 6 ммолей) и смесь нагревают при кипячении с обратным холодильником. После 135 мин смесь охлаждают, разбавляют водой и экстрагируют с помощью CH2Cl2. Объединенные экстракты высушивают над сульфатом натрия и концентрируют, чтобы получить в остатке масло, которое растворяют в уксусной кислоте (110 мл). Добавляют ацетат аммония (23,47 г, 300 ммолей) и смесь нагревают при кипячении с обратным холодильником. После 75 мин раствор охлаждают, разбавляют водой и экстрагируют с помощью CH2Cl2. Органические экстракты высушивают над сульфатом натрия и растворитель выпаривают, чтобы в остатке получить твердое вещество цвета хаки, которое растирают в порошок с помощью диэтилового эфира, чтобы получить (10,80 г, 52%). Перекристаллизация образца в 1,5 г из этанола дает 0,7 г аналитически чистого 3-[2-(4,5-дифенил-2-оксазолил)-этенил]-фенол, т. пл. 201-203оС.
Анализ: для C23H17NO2.
Вычислено: C 81,40; H 5,05; N 4,13.
Найдено: C 81,02; H 4,94; N 3,93%
IH-ЯМР (ДМСО-d6) δ: 6,77 (1Н, д. J=7,5 Гц); 7,00-7,35 (4Н, м.); 7,35-7,50 (6Н, м.); 7,53 (1Н, д. J=16 Гц); 7,60-7,70 (4Н, м.); и 9,58 (1Н, с.).
П р и м е р 30. Диметиловый эфир [(4,5-дифенил-2-оксазолил)-метил]-фосфиновой кислоты
Получение интермедиата схемы 2 CH
CH (OCH3)2
(OCH3)2
Смесь 2-бромметил-4,5-дифенилоксазола (26,72 г, 85 ммолей), полученного по Элдоусу и др. (D.L.Aldous et.al. J.Org.Chem. 25, 1151 (1960) и триметилфосфита (80 г, 84 мл, 645 ммолей) нагревают с перемешиванием при 120оС в атмосфере азота. После 90 мин избыток триметилфосфита удаляют под вакуумом и остаток хроматографируют на колонке с силикагелем. Элюирование с помощью смеси диэтилового эфира и метанола (49:1) дает 6,13 г желтого твердого вещества и 18,90 г масла, с идентичными характеристиками ТСХ. Перекристаллизация 1,3 г твердого вещества из гексана дает аналитически чистый диметиловый эфир [(4,5-диметил-2-оксазолил)метил]-фосфиновой кислоты 1,15 г, т.пл. 54-57оС.
Анализ: для C18H18NO4P:
Вычислено: C 62,98; H 5,29; N 4,09.
Найдено: C 62,88; H 5,26; N 4,00%
IH-ЯМР (СДСl3) δ: 3,48 (2Н, д. J=21 Гц); 3,81 (6Н, д. J= 11 Гц); 7,20-7,35 (6Н, м.); и 7,50-7,70 (4Н, м.).
П р и м е р 31. Получение интермедиата схемы 3.
3-[(4,5-Дифенил-2-оксазолил)-метокси]-бензальдегид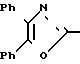 CH2O
CH2O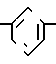 CHO
CHO
Смесь 2-бромметил-4,5-дифенилоксазола (26,72 г, 85 ммолей), полученного по Элдоусу и др. (D.L.Aldous et. al. J.Org.Chem. 2, 228-334 (1937)), 3-гидроксибензальдегида (9,34 г, 76 ммолей), карбоната калия (12,92 г, 93 ммолей), йодистого калия (0,5 г) и диметилформамида (250 мл) перемешивают при 110оС. После 45 мин смесь охлаждают, разбавляют водой и экстрагируют диэтиловым эфиром (трижды). Объединенные экстракты промывают водой (трижды), высушивают над сульфатом натрия и концентрируют под вакуумом, чтобы получить масло, которое хроматографируют на колонке с силикагелем. Элюирование с помощью смеси гексанов и диэтилового эфира (2:1) дает 3-(4,5-дифенил-2-оксазолил)-метокси-бензальдегид (21,16 г, 70%). Аналитический образец перекристаллизовывают из смеси CH2Cl2 и и гексанов и имеет т.пл. 72-75оС.
Анализ: для C23H17NO3:
Вычислено: С 77,74; Н 4,83; N 3,95.
Найдено: C 77,49; H 4,90; N 3,87%
IH-ЯМР (СДСl3) δ: 5,28 (2Н, с); 7,30-7,80 (14Н, м.); и 9,99 (1Н, с.).
П р и м е р 32. Получение интермедиата схемы 4. 3-[2-(4,5-Дифенил-2-оксазолил)-этил]-фенилтрифторметансульфонат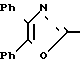 CH2CH
CH2CH OSO2CF3
OSO2CF3
Ангидрид трифторметансульфоновой кислоты (16,55 г, 58 ммолей) добавляют к перемешиваемому раствору 3-[2-(4,5-дифенил-2-оксазолил)-этил] -фенола (10,00 г, 29 ммолей) в пиридине (60 мл), поддерживаемому при 0оС. Смеси позволяют стоять в холодильнике в течение ночи до того, как ее выливают на ледяную воду и экстрагируют с помощью диэтилового эфира (трижды). Объединенные экстракты промывают четырежды водой, высушивают над безводным сульфатом магния и концентрируют, чтобы получить в остатке масло. Хроматография на колонке с силикагелем, используя смесь гексанов и этилацетата (17:3), дает 3-[2-(4,5-дифенил-2-оксазолил)-этил] -фенилтрифторметансульфонат (12,54 г, 90%) в виде масла.
Анализ: для C24H18NO4:
Вычислено: C 60,89; H 3,84; N 2,96.
Найдено: С 60,97; H 3,93; N 3,21%
IH-ЯМР (СДСl3) δ: 3,18 (4Н, м.); 7,10-7,50 (10Н, м.); и 7,50-7,70 (4Н, м.).
П р и м е р 33. Получение интермедиата схемы 5.
Метиловый эфир (3-гидроксифенокси)-уксусной кислоты
HO OCH2CO2CH3
OCH2CO2CH3
Смесь моноацетата резорцина (20,00 г, 0,13 ммоля), метилового эфиpа бромуксусной кислоты (21,14 г, 13,05 мл, 0,14 ммоля), карбоната калия (21,80 г, 0,16 ммоля) и ацетонитрила (350 мл) перемешивают при кипячении с обратным холодильником. После 30 мин смесь фильтруют и растворитель удаляют под вакуумом, чтобы получить в остатке масло, которое растворяют в метаноле (350 мл). Добавляют концентрированную соляную кислоту (2 мл) и смесь перемешивают при кипячении с обратным холодильником. После 20 мин раствор концентрируют, разбавляют водой и экстрагируют с помощью CH2Cl2, чтобы получить масло, которое перегоняют при пониженном давлении, чтобы получить метиловый эфир (3-гидроксифенокси)-уксусной кислоты с т.пл. 154-180оС/1,5 мм (15,98 г, 66% ).
П р и м е р 34. Получение интермедиатов схемы 6 (34-1)
2-[2-[3-[(Диметил-(1,1-дифенилэтил)-силокси] -фенил] -этил] 4,5-ди-(3-тиенил)-оксазол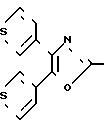 CH2CH
CH2CH
н-Бутиллитий (0,518 г, 8 ммолей) в гексанах (3,24 мл) добавляют к раствору диизопропиламина (0,82 г, 8 ммолей) в сухом тетрагидрофуране (20 мл), поддерживаемому при 0оС, в атмосфере азота. После 20 мин смесь охлаждают до -78оС и раствор 2-метил-4,5-ди-(3-тиенил)-оксазола (1,60 г, 6,5 ммолей), полученного аналогично Дэвидсону и др. (D.Davidson et. el. J.Org.Chem. 2, 328-334 (1937)) в тетрагидрофуране (10 мл) добавляют по каплям, чтобы получить раствор красно-оранжевого цвета. Смесь перемешивают при -78оС в течение 2 ч до того, как добавляют раствор 3-(бромметил)-фенокси-диметил-(1,1-диметилэтил)-силана (2,44 г, 8 ммолей) в тетрагидрофуране (5 мл). После перемешивания при -78оС в течение 4 ч смесь выливают на насыщенный раствор хлористого аммония и экстрагируют диэтиловым эфиром. Объединенные экстракты дважды промывают насыщенным раствором хлористого аммония, один раз насыщенным раствором NaCl и высушивают над сульфатом магния. Растворитель выпаривают и остаток хроматографируют на колонке с силикагелем, используя смесь гексанов и этилацетата (19:1) в качестве элюента, что бы получить 2-[2-[3-диметил-(1,1-диметилэтил)-силокси] -фенил] -этил-4,5 -ди-(3-тиенил)-оксазол (1,33 г. 43%) в виде масла.
IH-ЯМР (СДСl3) δ: 0,14 (6Н, с.); 0,94 (9Н, с.); 3,09 (4Н, с.); 6,70 (2Н, м. ); 6,83 (1Н, д. J=8 Гц); 7,13 (1Н, т. J=8 Гц); 7,20-7,40 (4Н, м.); и 7,50-7,75 (2Н, м.).
П р и м е р 34-2. 3-[2-[4,5-Ди-(3-тиенил)-2-оксазолил]-этил]-фенол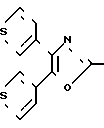 CH2CH
CH2CH OH
OH
К раствору 2-[2-[3-[диметил-(1,1-диметилэтил)-силокси]-фенил]-этил]-4,5- ди-(3-тиенил)-оксазола (4,26 г, 9 ммолей) в тетрагидрофуране (185 мл) добавляют раствор тетра-н-бутиламмония фтористого (2,98 г, 11 ммолей) в тетрагидрофуране (11,40 мл). Смесь перемешивают при комнатной температуре в атмосфере азота. После 30 мин смесь разбавляют диэтиловым эфиром и насыщенным раствором хлористого аммония. Органическую фазу отделяют, промывают дважды насыщенным раствором хлористого аммония и один раз насыщенным раствором NaCl до того, как ее высушивают над сульфатом натрия и концентрируют под вакуумом. Хроматографию остатка на колонке с силикагелем, используя смесь гексанов и этилацетата (3:1), в количестве элюента, дает 3-[2-[4,5-ди-(3-тиенил)-2-оксазолил] -этил]-фенол (2,45 г, 76%). Аналитический образец получают перекристаллизацией 0,45 г вещества из смеси гексанов и CH2Cl2 (2: 1) и имеет т.пл. 143,5-145оС.
Анализ: для C19H15NO2S2:
Вычислено: С 64,57; Н 4,28; N 3,97.
Найдено: C 64,65; H 4,41; N 3,89%
IH-ЯМР (ДМСО-d6) δ: 3,00 (4Н, м.); 6,58 (1Н, дд. J=8 Гц, Jl=2 Гц); 6,67 (2Н, м. ); 7,07 (1Н, т. J=8 Гц); 7,25 (2Н, м.); 7,60-7,90 (4Н, м.); и 9,30 (1Н, с.).
П р и м е р 35. 5-[[3-[2(4,5-Дифенил-2-оксазолил)-этил]-фенокси]-метил] -1Н-тетра- зол CH2CH
CH2CH OCH
OCH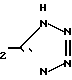
Смесь 2-[3-[2-(4,5-дифенил-2-оксазолил)-этил] -фенокси] -ацетонитрила (1,60 г, 4,2 ммоля) и азида три-н-бутилолова (1,45 г, 4,4 ммоля) перемешивают при 140оС в атмосфере азота. После 20 ч смесь охлаждают, разбавляют этилацетатом (300 мл) и 1 N раствором HCl (200 мл) и смесь перемешивают в течение 2 ч. Водную фазу удаляют, а органическую фазу добавляют к 0,1 М раствору фтористого калия. После перемешивания в течение ночи органический слой отделяют, промывают водой и насыщенным раствором хлористого натрия, высушивают над сульфатом натрия и концентрируют под вакуумом. Остаток хроматографируют на колонке с силикагелем, используя смесь хлороформа и метанола (10:1) в качестве элюента, чтобы получить 5-[3-[2-(4,5-дифенил-2-оксазолил)-этил]-фенокси]-метил-1Н-тетразол (1,18 г, 66) после перекристаллизации из смеси гексанов и CH2Cl2, т.пл. 138,5-140оС.
Анализ: для C25H21NO5O2:
Вычислено: C 70,91; H 5,00; N 16,54.
Найдено: C 70,83; H 5,05; N 16,49%
IH-ЯМР (СДСl3+ДМСО-d6) δ: 2,91 (4Н, с.); 5,13 (2Н, с.); 6,55-6,70 (3Н, м.); 6,90-7,20 (7Н, м.); и 7,30-7,50 (4Н, м.).
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРОИЗВОДНЫЕ ОКСАЗОЛА | 1992 |
|
RU2030408C1 |
| СОЕДИНЕНИЯ ОКСАЗОЛА И СПОСОБ ИХ ПОЛУЧЕНИЯ | 1991 |
|
RU2042669C1 |
| СПОСОБ ПОЛУЧЕНИЯ АМИДОВ ИМИДАЗО(4,5-B)ХИНОЛИНИЛОКСИАЛКАНОВЫХ КИСЛОТ ИЛИ ИХ ФАРМАЦЕВТИЧЕСКИ ПРИМЕНЯЕМЫХ СОЛЕЙ | 1990 |
|
RU2041210C1 |
| РЕТИНОИДОПОДОБНЫЕ СОЕДИНЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СПОСОБ ЛЕЧЕНИЯ | 1996 |
|
RU2163590C2 |
| ПРОИЗВОДНЫЕ ЦЕФЕМА ИЛИ КАРБА(ДЕТИА)ЦЕФЕМА | 1990 |
|
RU2044738C1 |
| БИФЕНИЛИЗОКСАЗОЛСУЛЬФОНАМИДЫ | 1995 |
|
RU2174979C2 |
| ТАКСАНЫ С БОКОВОЙ ЦЕПЬЮ, ПРОМЕЖУТОЧНЫЕ СОЕДИНЕНИЯ, СПОСОБЫ ПОЛУЧЕНИЯ | 1993 |
|
RU2125042C1 |
| Способ получения четвертичных аминоалкилтиолов | 1985 |
|
SU1442072A3 |
| 3-ЗАМЕЩЕННЫЕ ОКСИНДОЛЬНЫЕ ПРОИЗВОДНЫЕ В КАЧЕСТВЕ МОДУЛЯТОРОВ КАЛИЙНЫХ КАНАЛОВ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СПОСОБ ЛЕЧЕНИЯ | 1996 |
|
RU2165925C2 |
| Способ получения карбапенемов | 1984 |
|
SU1395142A3 |
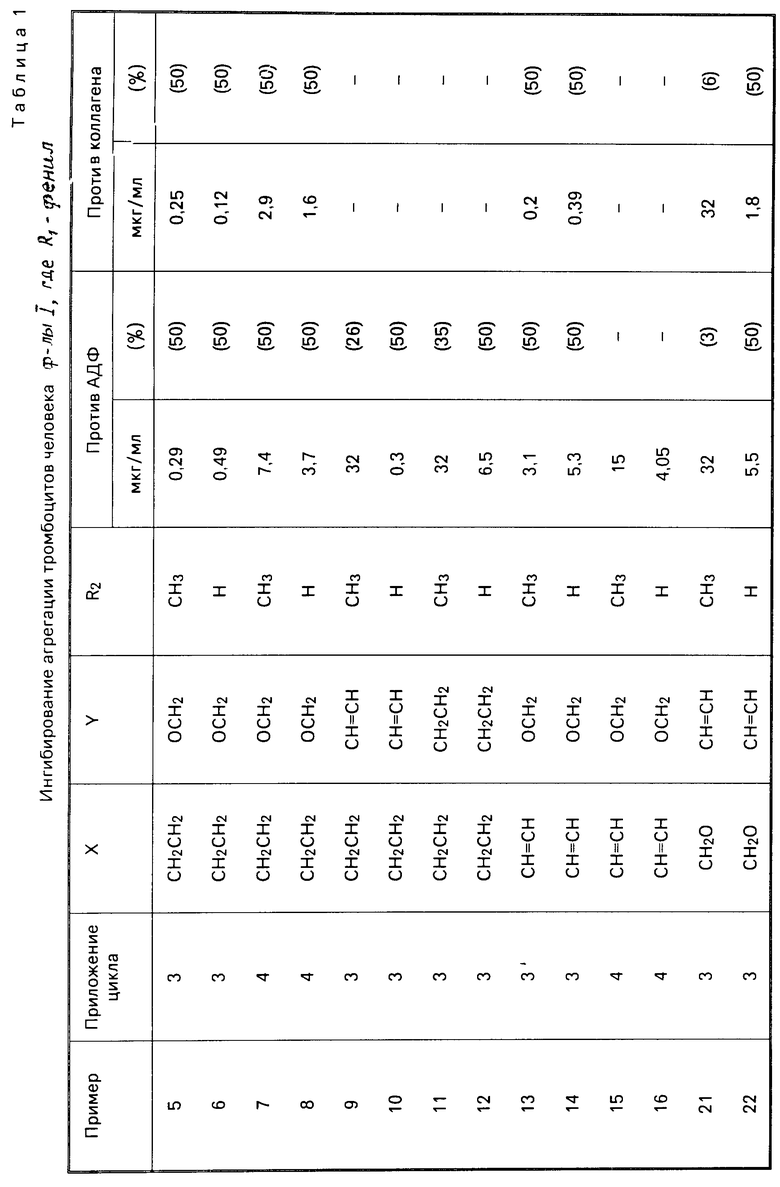

Использование: в медицине, в частности в качестве веществ, ингибирующих агрегацию кровяных пластинок. Сущность изобретения: производные оксазола ф-лы 1, 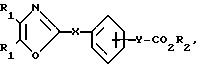 где R1 фенил или тиенил; R2 - водород или низший алкил или вместе с "=С(О)=О-" - тетразол - 1 - ил; X - двухвалентный связывающий радикал, выбираемый из группы: CH=CH, CH2CH2, CH2O; Y - двухвалентный связывающий радикал, присоединенный в 3 или 4 положении фенильного кольца и выбираемый из группы: OCH2, CH2-CH2, CH-CH, 2 табл.
где R1 фенил или тиенил; R2 - водород или низший алкил или вместе с "=С(О)=О-" - тетразол - 1 - ил; X - двухвалентный связывающий радикал, выбираемый из группы: CH=CH, CH2CH2, CH2O; Y - двухвалентный связывающий радикал, присоединенный в 3 или 4 положении фенильного кольца и выбираемый из группы: OCH2, CH2-CH2, CH-CH, 2 табл.
ПРОИЗВОДНЫЕ ОКСАЗОЛА общей формулы
где R1 фенил или тиенил;
R2 водород, низший алкил или вместе с CO2 тетразол-1-ил;
X двухвалентная связывающая группа, выбираемая из CH2CH2, CH CH или CH2O;
Y двухвалентная связывающая группа, присоединенная в положении 3 или 4 фенильного кольца и выбираемая из группы, состоящей из OCH2, CH2CH2 или CH CH.
| Патент GB N 1542315, кл | |||
| Способ восстановления хромовой кислоты, в частности для получения хромовых квасцов | 1921 |
|
SU7A1 |
Авторы
Даты
1995-04-10—Публикация
1992-05-05—Подача