Настоящее изобретение относится к методам, биореакторам и композициям для культивирования и трансформации клеток млекопитающих в культуральной среде, в частности для выращивания и трансформации культур гемопоэтических клеток.
Все форменные элементы крови у здорового взрослого человека, в том числе эритроциты, лейкоциты, тромбоциты и лимфоциты, вырабатываются в костном мозге как клетки-предшественники при дифференцировке. Эти клетки в свою очередь продуцируются из очень зрелых клеток, называемых недифференцированными клетками-предшественниками, которые, как показывает анализ, продуцируют колонии зрелых гемоцитов в 1-3-недельных культурах в полутвердой среде, например метилцеллюлозе или агаре. Указанные клетки-предшественники по существу происходят из класса клеток-предшественников, называемых стволовыми клетками. Стволовые клетки обладают способностью при делении как к самоподдержанию, так и самодифференцировке в недифференцированных клетках-предшественниках. Таким образом, стволовые клетки при делении продуцируют как клетки эмбриобласта, так и несколько более дифференцированные клетки-предшественники. Кроме продуцирования гемоцитов стволовые клетки могут также повышать выход остеобластов и остеокластов и, возможно, клеток других тканей. В данном описании раскрываются методы и композиции, которые впервые позволяют осуществлять успешное культивирование in vitro гемоцитобластов, приводя к их пролиферации и дифференцировке в клетках-предшественниках и более зрелых гемоцитах.
В конце 1970-x годов были получены суспензионные культуры клеток для выращивания in vitro гемопоэтических клеток костного мозга. Эти культуры обладают большой эффективностью как при исследованиях процесса кроветворения здоровых и лейкозных клеток, так и в экспериментах по пересадке костного мозга, например для ретровирусного переноса генов. Указанные культуры позволили детально изучить гемопоэз у мышей и полностью понять их систему кроветворения. Более того, проведенные исследования позволили осуществить ретровирусный перенос генов в культивируемые клетки костного мозга мышей. В результате этого стало возможным получение меченых мышиных гемопоэтических клеток, поддерживающих существование многоядерной стволовой клетки, и изучение различных генов в процессе лейкемогенеза.
И хотя стало возможным осуществлять перенос ретровирусных генов в культивируемые мышиные остеоциты, однако такой перенос был еще возможен в клетки костного мозга человека, поскольку до настоящего времени культуры декстеровского типа (долгоживущие культуры клеток костного мозга) ограничены как продолжительностью их жизни, так и их способностью обеспечивать выживаемость стволовых клеток и продуцировать клетки-предшественники в течение всего срока жизни.
Суспензионные культуры клеток костного мозга человека, как установлено на первоначальном этапе, имеют ограниченный потенциал кроветворения, в результате чего снижается выход клеток-предшественников и зрелых гемоцитов, причем синтез клеток прекращается к 6-8-й неделе. Последующие модификации первоначально полученной суспензионной культуры привели лишь к улучшению методов культивирования. Решение указанной проблемы имеет такое огромное значение, которое невозможно оценить, поскольку это позволило бы, например, реплицировать стволовые клетки человека и клетки-предшественники для трансплантации костного мозга и защиты от воздействия химиопрепаратов, выбирать и проводить различные манипуляции с такими клетками, то есть использовать для генного переноса и синтезировать зрелые гемоциты человека для трансфузионной терапии.
В результате исследований гемопоэза и культивирования клеток костного мозга установлено, что внутри адгезивных слоев в качестве центральных элементов клеточной стромы выступают фибробласты и эндоциты. Указанные клетки как создают активные центры связывания для роста гемопоэтических клеток, так и их можно индуцировать для секреции гемопоэтических факторов роста, стимулирующих пролиферацию и дифференцировку клеток-предшественников. К указанным гемопоэтическим факторам роста относятся гранулоцит-колониестимулирующий фактор (G-CSF), гранулоцит-макрофар-колониестимулирующий фактор (GM-CSF) и интерлейкин-6 (IL-6).
Культивирование человеческих остеоцитов на таких адгезивных слоях in vitro, однако, не дало обнадеживающих результатов. В отличие от аналогичных культур родственных видов, например как землеройки и тупайи, суспензионные культуры остеоцитов человека не способны обеспечить продуцирование значительного количества как не связанных с субстратом гемопоэтических клеток-предшественников, так и клоногенных клеток-предшественников в течение 6-8 недель. И хотя из литературы известно о непрерывно продуцирующих культурах в течение 3-5 месяцев, нигде не сообщается о культуральных средах, которые обеспечивают стабильный непрерывный синтез клеток-предшественников из стволовых клеток в течение более 4-6 недель.
Более того, внеклеточный синтез и продуцирование клеток-предшественников в течение даже такой непродолжительной жизни указанных культур обычно снижались настолько, чтобы понять, что эти культуры вообще не обеспечивают выживаемость или пролиферацию стволовых клеток. К тому же неактивированные клетки стромы костного мозга, исследуемые в изолированном состоянии, секретируют незначительное количество, если его вообще можно определить, гемопоэтических факторов роста (HGF).
Отсутствие стабильного синтеза клеток-предшественников и зрелых клеток крови в указанных культурах дало убедительное основание считать, что они не способны обеспечить поддержку для непрерывной регенерации и увеличения продукции стволовых клеток. Исходя из этого было выдвинуто предположение о том, что указанные культуры либо не содержат критического стимулятора (стимуляторов) стволовых клеток и/или содержат новый их ингибитор (ингибиторы). Но одновременно с объяснением неудачи в выявлении культур гемопоэтических факторов роста и неиндуцируемых стромальных клеток была выдвинута нулевая гипотеза, объединившая неудачу по выявлению HGF и относительные недостатки суспензионных культур человеческих остеоцитов, о том, что такие системы непрерывного культивирования, используемые in vitro, не обеспечивают полного восстановления гемопоэза исходных клеток стромы костного мозга in vivo.
Увеличение объема стволовых клеток и клеток-предшественников для трансплантации костного мозга является потенциальной областью использования долгоживущих культур человеческих остеоцитов. В настоящее время используют аутологичную и аллогенную трансплантацию костного мозга человека в качестве методов лечения таких болезней, как лейкемия, лимфома, и других угрожающих жизни системных заболеваний. Однако для проведения такой терапии необходимо наличие большого количества донорского костного мозга, которое обеспечивало бы требуемое количество клеток для успешного их приживления.
Культура, обеспечивающая увеличениe объема продукции стволовых клеток и клеток-прогениторов, снижает потребность взятия большого количества донорского костного мозга и позволяет брать небольшое количество клеток костного мозга, а затем увеличивать количество стволовых клеток и клеток-прогениторов in vitro перед введением их реципиенту. Известно также, что небольшое количество стволовых клеток и клеток-предшественников циркулирует в системе кровообращения. Если такие клетки можно было бы собрать электрофоретическими методами и увеличить их объем, тогда стало бы возможным получение необходимого количества стволовых клеток и клеток-предшественников для трансплантации из периферической крови, и отпала бы необходимость взятия донорского костного мозга.
При трансплантации костного мозга необходимо введение примерно 1х10 - 2х10 мононуклеарных клеток костного мозга на 1 кг веса больного для их приживления. Для получения такого количества клеток необходимо взять донорского костного мозга в количестве примерно 70 мл мозга на 70 кг веса донора. И хотя 70 мл составляет небольшую долю костного мозга у доноров, процедура ее взятия требует значительных затрат времени и восполнения большой кровопотери в процессе ее проведения. Если продукцию стволовых клеток и клеток-предшественников можно было бы увеличить в 10 раз, то эта процедура значительно сократилась бы и, возможно, была бы сведена только к забору таких клеток из периферической крови с последующим размножением их in vitro.
Увеличение продукции клеток-предшественников также пригодно в качестве заместительной поддерживающей терапии к химиотерапии и представляет собой другой аспект применения долгоживущих клеточных культур костного мозга человека. Дилемма, с которой сталкиваются врачи-онкологи, заключается в том, что большинство химиотерапевтических препаратов, применяемых для разрушения раковых клеток, оказываeт губительное воздействие на все клетки, проходящие через цикл клеточного деления. Костный мозг является одной из самых производительных тканей в организме и, следовательно, часто относится к органу, который в первую очередь подвергается разрушению при воздействии химиотерапевтических препаратов. Это приводит к быстрому нарушению процесса кроветворения при лечении химиотерапевтическими препаратами, и поэтому необходимо прервать курс для восстановления гeмопоэза, прежде чем продолжить такое лечение. Может потребоваться месяц и даже более, чтобы покоящиеся стволовые клетки смогли поднять до требуемого уровня количество лейкоцитов, чтобы возобновить курс химиотерапии, в течение которого неоднократно происходит снижение количества эритроцитов. К несчастью, хотя лейкоциты восстанавливаются только в промежутках между курсами химиотерапии, у раковых клеток имеется время для их роста, и возможно повысить их резистентность к химиопрепаратам вследствие их природной избирательной способности.
Для сокращения промежутков между проводимыми курсами химиотерапии большое количество клеток-предшественников и незрелых клеток крови могло бы нормализовать состояние больного. Это оказало бы влияние на значительное уменьшение промежутков времени, когда у больного отмечается низкий показатель форменных элементов крови, что позволило бы быстрее возобновить курс химиотерапии. Чем продолжительнее курс химиотерапии и короче промежутки между приемами химиотерапевтических препаратов, тем больше вероятность успешного излечения ракового заболевания. Гемопоэтические клетки, необходимые для увеличения продукции клеток-предшественников можно получить либо путем взятия донорского костного мозга, либо сбором клеток из периферической крови. Харвестеры костных клеток обеспечивают сбор примерно 4x10 гранулоцитарно-макрофагальных колониеобразующих единиц (CFU-GM) клеток-предшественников. При электрофорезе 5 л периферической крови обычно собирают примерно 10 CFG-GM, хотя это количество можно повысить до 10 предварительным введением донору GM-CSF-фактора. Для быстрой нормализации состояния больного необходимо вливание примерно 1x10 - 5x10 CFU-GM, что примерно в 100-1000 раз больше количества, которое получают рутинной процедурой взятия костного мозга у донора или сбором клеток из периферической крови. Таким образом, увеличение продукции клеток из донорского костного мозга или их сбора из периферической крови для повышения количества CFU-GM на 2-3 порядка оказывает значительное влияние на использование и лечение раковых болезней химиопрепаратами.
Генная терапия относится к самой быстро развивающейся области медицины, и лечебный потенциал которой также трудно оценить. Генные методы терапии имеют множество потенциальныx применений при лечении заболеваний (см., например, Boggs, Int. J. All Cloning (1990), 8:80-96, Kohn и др., Cancer Invest. (1989), 7 (2):179-192, Lehn. Bone Marrow Transp. (1990), 5:287-293 и Verma, Scientific Amer., (1990), стр. 68-34. Генетически трансформированные стволовые клетки человека обладают широким диапазоном потенциальных применений в клинической медицине в качестве лекарственных средств генной терапии.
Однако имеется несколько проблем, которые необходимо преодолеть для успешного проведения генной терапии. Первая проблема заключается в обеспечении возможности введения требуемого лечебного гена в заданные клетки. Во-вторых, указанный ген должен быть соответствующим образом экспрессирован в клетке-мишени, в результате чего обеспечиваeтся требуемая концентрация генного продукта. И, наконец, продуцируемые РНК или белок должны быть надлежащим образом процессированы клеткой-мишенью, чтобы обеспечить их функциональную активность, то есть чтобы генная терапия оказывала влияние на клиническую картину лечения заболевания. В таблице 1 приведенo несколько методов инсерции гена в человеческие клетки in vitro.
Также во многих лабораториях находятся в стадии разработки другие такие методы, например как гомологичная рекомбинация. Исследования в области генной терапии проводились в течение нескольких лет на нескольких видах клеток in vitro, затем продолжены на животных, и, наконец, недавно вступили в первую стадию клинической проверки на человеке.
Система кроветворения является идеальным материалом в качестве системы доставки генного продукта в генной терапии. Гемопоэтические клетки легко доступны посредством вытяжки костного мозга или с помощью сбора мононуклеарных клеток из периферической крови. Сразу же после осуществления генетической инсерции in vitro обработанные клетки можно повторно ввести внутривенным вливанием, после чего генетически трансформированные клетки возвращаются на свое место и продолжают расти в костном мозге. Поскольку зрелые клетки крови циркулируют по всему организму, генетические модифицированные клетки могут доставлять специфический генный продукт к любой ткани-мишени.
Наиболее важное значение имеет то, что ткань органов кроветворения содержит стволовые клетки, которые обладают огромным потенциалом (возможно неограниченным) к самовосстановлению. Под этим имеется в виду то, что если обеспечена стабильная трансдукция генетического материала в такие стволовые клетки, то при реинфузии гемопоэтической ткани эти модифицированные стволовые клетки способны к разрастанию и репопуляции в мозговой ткани вместе с клетками, обеспечивающими экспрессию нового гена. Это приводит к долговременной, возможно в течение всего цикла их жизни, доставке требуемого генного продукта. Аналогично этому успешный стабильный генный перенос в стволовые клетки, расположенные в других органах, или эмбриональные стволовые клетки также приводит к непрерывной долговременной доставке генного продукта.
Генная терапия при использовании гемопоэтических стволовых клеток имеет широкий диапазон применений как для лечения заболеваний, специфических к системе кроветворения, так и системных болезней других органов. B рамках гемопоэтической системы генную терапию стволовыми клетками можно применять для лечения как наследственных, так и приобретенных заболеваний. Так, например, состояния, связанные с дефицитом гемоглобина, в частности альфа- и бета-талассемия, можно лечить путем интродукции гена, кодирующего глобин альфа- или бета-цепи в комбинации с регуляторными последовательностями, которые передают эритроцитам высокое тканеспецифичное сродство (см. Grosvell и др. , Cell, (1987), 51:975-986). Аналогичным образом можно корректировать серповидно-клеточную анемию путем генетической инсерции гена фетального глобина в гемопоэтические стволовые клетки, так как регулируемая экспрессия высоких концентраций эмбрионального гемоглобина достаточна для предупреждения выработки серповидно-клеточных эритроцитов несмотря на копрезентацию гемоглобина серповидных клеток (см. Sunshine и др., J. Molec. Biol. (1979), 133:435).
Генетическое нарушение нейрофилов, обусловленное недостаточной функциональной активностью белков, например как недостаточность лимфоцитективирующей детерминанты (LAD) или хронический гранулематоз (CGD), можно успешно лечить путем генетической инсерции гена, кодирующего дефектный или потерянный ген, в комбинации с регуляторными ДНК-последовательностями, передающими высокую степень тканеспецифической экспрессии в гемопоэтические стволовые клетки (см. Wilson и др., Science (1990), 248:1413-1416). Наследственные болезни, в том числе тромбопатию, например как ангиогемофилия, можно лечить инсерцией гена, кодирующего например, фактор Биллебранда в комбинации с последовательностями, регулирующими его экспрессию и секрецию.
Особенно очевидна пригодность генной терапии на основе гемопоэтических стволовых клеток для замены врожденно дефектных генов при лечении лимфоцит-опосредованных иммунодефицитных комплексов, например как ярко выраженных иммунодефицитных состояний, обусловленных недостатком аденозиндезаминазы. Ретровирусная генная терапия циркулирующих T-клеток в комбинации с геном, кодирующим аденозиндезаминазу, как установлено, эффективнa для уменьшения клинической картины у пациентов с иммунной недостаточностью, однако эти эффекты носят только временный характер, поскольку трансфектированные T-лимфоциты имеют ограниченный период жизни in vivo (см. Kasid и др., Proc. Nat. Acad. Sci. (USA) (1990), 37:473-477, или Culver и др., Proc. Nat. Acad. Sci. (USA) (1991), 38:3155-3159). Если указанный ген можно было бы успешно переносить в такие гемопоэтические стволовые клетки, то любая T-клетка, продуцированная из этих стволовых клеток, содержала бы и экспрессировала ген аденозиндезаминазы. Таким образом, ввиду того, что трансфектированные стволовые клетки обладают способностью к выживанию и быстрому размножению в течение всей жизни больного, T-клеточно-опосредованную недостаточность ADA обычно лечат методом поддерживающей терапии путем переноса гена в стволовую клетку (см. Wilson и др., Proc. Natl. Acad. Sci., (USA) (1990), 87:439-443).
Кроме врожденных нарушений ферментативных процессов системы кроветворения, метод генной терапии на основе стволовых клеток можно было бы использовать для защиты эмбриональных клеток и их клеток-предшественников от токсичного воздействия экзогенных факторов, например вирусов и химиотерапии. Так, например, установлено, что перенос гена ДНК-последовательности, кодирующей сайт связывания антигенреактивных T-лимфоцитов (TAR) трансактивирующего фактора TAT ВИЧ, обеспечивает защиту T-клеток от распространяющейся ВИЧ-инфекции (см. Sullenger и др., Cell, (1990), 63:601-608). Стабильная трансдукция указанных последовательностей в гемопоэтические стволовые клетки ведет к агрегации T-клеток, продуцированных из этих стволовых клеток, которые относительно или абсолютно резистенты к распространению ВИЧ-инфекции.
Аналогичным образом успешная трансфекция генов, кодирующих ген устойчивости к комбинированным препаратам (MDR), в гемопоэтические стволовые клетки костного мозга, которые относительно резистентны к эффектам противоракового химиотерапевтического лечения. После проведения аутологичной трансплантации костного мозга на основе таких генетически трансформированных клеток больные смогут легче переносить терапию химиопрепаратами, от воздействия которых защищали стволовые клетки вследствие глубокого угнетения функции костного мозга, которую вызывают эти противораковые препараты. В результате этого больные смогут принимать более эффективные дозировки противораковых химиопрепаратов с меньшей их токсичностью.
Каждый может легко понять, что генная терапия на основе кроветворных стволовых клеток также пригодна для лечения приобретенных болезней системы кроветворения, например, лейкемии, лимфомы и апластической анемии. Сразу же после установления генетической природы указанных болезней введение генного продукта, который либо устраняет причину патологии гена в клетке, либо непосредственно сам ген (возможно сплайсингом или заменой самого гена), обеспечивает коррекцию отклонения от нормы.
На более широком уровне, однако, генную терапию на основе гемопоэтических стволовых клеток можно также использовать для лечения болезней, не относящихся к системе кроветворения. Генный перенос ДНК-последовательностей, несущих лекарственные растворимые белки, может привести к получению зрелых клеток крови, которые непрерывно секретируют требуемое количество лечебных молекул. Так, например, этот метод можно также использовать для лечения, например, сахарного диабета путем введения ДНК-последовательностей инсулина в комбинации с регуляторными ДНК-последовательностями, обеспечивающими надлежащую экспрессию трансфектированного гена инсулина, возможно в ответ на повышение содержания сахара в плазме крови. Системную гипертензию можно лечить путем генетической инсерции стволовых клеток с ДНК-последовательностями, кодирующими секреторные пептиды, которые действуют в качестве конкурентного ингибитора относительно ангиотензин-конвертазы, кальциевых канальцев сосудистой сети ровной мышцы или адренорецепторов. Болезнь Альцгеймера, по всей вероятности, можно лечить путем генетической инсерции в стволовые клетки ДНК-последовательностей, кодирующих ферменты, разрушающие амилоидные бляшки в центральной нервной системе.
Таким образом, известно множество применений генной терапии, в частности введение генного продукта в стволовые клетки (см. выше Boggs и др., Kohn и др. , и/или Verma и др.). И, конечно, имеется множество случаев некоторого прогресса в обеспечении переноса лечебного гена в дифференцированные стволовые клетки человека, как описано, например, в случае T-лимфоцитов (см., Kalsd и др., Proc. Nat. Acad. Sci. (USA) (1990), 37:473-477, и Culver и др., Proc. Nar. Acad. Sci. (USA) (1991), 88:3155-3159).
К несчастью, до создания настоящего изобретения обеспечение стабильного переноса генов в человеческие стволовые клетки было неуспешным. Хотя несколько групп исследователей продемонстрировали возможность реализации ретровирус-опосредованного переноса генов в человеческие гемопоэтические клетки, была неудачной попытка трансфекции примитивных элементов кроветворных стволовых клеток человека. Результаты таких исследований резко отличаются от экспериментов, проводимых на мышах, которые показали возможность осуществления ретровирус-опосредованного переноса генов в гемопоэтические стволовые клетки человека (см. Wilson и др., Pro. Nat. Acad. Sci. (USA) (1990), 87:439-443).
Основная трудность для успешного проведения генной терапии на основе гемопоэтических стволовых клеток человека заключалась в невозможности обеспечить вставку генов в человеческие гемоциты в условиях деления и пролиферации стволовых клеток. Для успешной устойчивой инсерции гена в клетку-мишень необходимо, чтобы такая клетка-мишень прошла по крайней мере один цикл клеточного деления. Таким образом, если стволовые клетки не делятся в присутствии целевого генетического продукта, то этот продукт вводится нестабильно в такие стволовые клетки. Перед созданием настоящего изобретения отсутствовала какая-либо система, которая поддерживала бы ex vivo деление и пролиферацию человеческой стволовой клетки и позволила бы осуществить успешную генетическую трансформацию таких стволовых клеток.
В объем литературы, релевантной настоящему описанию изобретения, входит также патент США N 4721096, в котором раскрыта 3-мерная система, включающая стромальные клетки для роста гемоцитов. См. также противопоставленные в данном описании источники Glanville и др., Nature (1981), 292: 267-269 - описывает генный продукт мышиного металлотионеина; Wong и др., Science (1985), 228: 810-815 описывает человеческий фактор GM-CSF; Lemischka и др., Cell (1986), 45:817-927 описывает ретровирус-опосредованный перенос гена в качестве маркера гемопоэтических стволовых клеток и методику слежения развития указанных клеток после их трансплантации; Yang и др., Cell (1986), 47: 3-10 описывает получение человеческого интерлейкина-3; Chen и др., Mol. Cell. Biol. (1987). 7: 2745-2752 описывает трансформацию клеток млекопитающих плазмидной ДНК; Greaves и др., Cell (1989), 58: 979-986 описывает человеческий ген CD2; Civin и др., J. Immunol. (1984), 133:1576 раскрывает антиген CD34; Martin и др., Cell (1990), 63: 20-211 описывает человеческий S-CSF; Forrester и др., J. Cell Science (1984), 70: 93-110 описывает проточную камеру для параллельного иммунноэлектрофореза; Coulembel и др., J. Clin. Invest., (1986), 75: 961 описывает дефицит CML клеток в статических культурах.
С учетом вышеизложенного имеется большая потребность разработки методов и композиций для ex vivo репликации и стабильной генетической трансформации человеческих стволовых клеток и оптимизации культур человеческих гемопоэтических клеток-предшественников, особенно в свете огромных потенциальных возможностей увеличения выхода стволовых клеток и клеток-предшественников, а также расширения возможностей генной терапии, которую обеспечивают указанные системы. К несчастью, до настоящего времени попытки решения указанных проблем не оправдали надежд.
Раскрытие сущности изобретения
В соответствии с вышеизложенным целью настоящего изобретения является создание новых методов, в том числе культуральных условий и реакторов, для ex vivo репликации и стабильной генетической трансформации человеческих стволовых клеток.
Другой целью настоящего изобретения является создание новых методов, в том числе культуральных условий и реакторов, для оптимизации (I) культур человеческих гемопоэтических клеток-предшественников и (II) стабильно генетически трансформированных человеческих гемопоэтических клеток-предшественников.
Настоящее изобретение основано на результатах проведенных автором исследований, в ходе которых разработаны новые методы, в том числе культуральные условия и реакторы, для ex vivo репликации и стабильной генетической трансформации человеческих стволовых клеток и/или для оптимизации культур человеческих гемопоэтических клеток-предшественников. В основе указанных методов лежит культивирование человеческих стволовых клеток и/или человеческие гемопоэтические клетки-предшественники в жидкой культуральной среде, которую заменяют, предпочтительно перфузированную, либо непрерывно, либо периодически при расходе 1 мл среды на 1 мл культуры через примерно от 24 до 48 ч с последующим удалением метаболитов и восполнением дефицита питательных веществ, одновременно поддерживая физиологически приемлемое состояние указанной культуры. В особенно предпочтительном варианте осуществления настоящего изобретения одновременно с заменой вышеуказанной среды прибавляют к указанной культуральной среде гемопоэтические факторы роста.
В ходе создания настоящего изобретения авторы неожиданно установили, что возрастание интенсивности обмена в указанной среде, которую используют в соответствии с настоящим изобретением, с факультативным добавлением гемопоэтических факторов роста в быстро изменяющейся культуральной среде (1) обеспечивает жизнеспособность культур, в которых происходит разрастание человеческих стволовых клеток в течение продолжительного промежутка времени - порядка 5 месяцев, (2) обеспечивает поддержку культурам, в которых происходит генерация человеческих гемопоэтических клеток-предшественников путем деления и дифференцировки человеческих стволовых клеток в течение продолжительного промежутка времени порядка - 5 месяцев и (3) стимулирует повышенный обмен веществ человеческих стромальных клеток и высвобождение из них GM-CSF фактора, в том числе из клеток стромы человеческого костного мозга. Настоящее изобретение позволяет впервые обеспечить выживаемость человеческих стволовых клеток и их пролиферацию в культуре.
Настоящее изобретение также предлагает систему ex vivo, которая обеспечивает непрерывную пролиферацию человеческих стволовых клеток, что позволяет успешно ввести генетический продукт в человеческие стволовые клетки, приводя тем самым к получению стабильно генетически трансформированных человеческих стволовых клеток. Этот вариант осуществления предлагаемого изобретения можно использовать для переноса любого генетического материала, который можно ввести как методом генетической инженерии в рекомбинантный ретровирус, так и любым вектором генного переноса, для которого необходимо клеточное деление. Генетически трансформированные стволовые клетки человека, полученные в соответствии с предлагаемым методом можно использовать для лечения широкого спектра вышеназванных болезней.
Настоящее изобретение предлагает также способы для повышения эффективности переноса генетического материала в человеческие гемопоэтические клетки-предшественники в сочетании с методами, обеспечивающими стабильную генетическую трансформацию человеческих стволовых клеток и/или человеческих гемопоэтических клеток-предшественников.
Настоящее изобретение также предлагает биореакторы и составы, которые обеспечивают эффективную пролиферацию человеческих клеток в культуре, особенно клеток на ранних стадиях их созревания, включая стволовые клетки. В указанных методах используют клетки стромы, трансформированных стандартными методиками, которые обеспечивают постоянное или индуцируемое продуцирование факторов роста, причем указанные клетки изолированы для возможности более легкого выделения гемопоэтических клеток. Обеспечивая непрерывную перфузию и рециклинг соответствующих клеток, можно значительно повысить плотность распределения жизнеспособных гемопоэтических клеток и их выход. В биореакторе в качестве исходного материала используют белковый носитель для стромальных клеток. Эта белковая мембрана или другие подложки обеспечивают отделение стромальных и гемопоэтических клеток.
Краткое описание чертежей.
На фиг. 1 показан схематический вид перфузионной камеры.
На фиг. 2 показаны схематический вид и технологическая схема прохождения перфузата.
На фиг. 3А показан схематический вид проточной камеры для измерения напряжения сдвига при разделении клеток.
На фиг. 3В показана боковая проекция проточной камеры по фиг. 3А.
На фиг. 3С показан графический профиль сдвигового напряжения гемопоэтических клеток.
На фиг. 4А и 4В показаны горизонтальная и боковая проекции проточной камеры для выращивания и отделения гемопоэтических клеток.
На фиг. 5А и 5В показан перспективный вид проточной камеры, где последовательно удаляют подложки для возможности непрерывного выращивания стромальных клеток.
Предпочтительный пример осуществления изобретения.
Преимущества настоящего изобретения можно наблюдать при его использовании применительно к любой стандартной системе жидких культур человеческих стволовых и/или клеток-предшественников, например как установленовленная в гемопоэтической клеточной культуре (культурах). При использовании методики с быстрой заменой культуральной среды, которую применяют согласно изобретению в комбинации с необязательным прибавлением к ней факторов роста гемопоэтических клеток, авторы неожиданно обнаружили, что это позволяет создавать стандартные системы суспензионных культур человеческих гемопоэтических клеток, которые включают культуры, действующие в присутствии или отсутствии сыворотки или плазмы крови животного, включая лошадиную, бычью, фетальную телячью или человеческую сыворотки.
Суспензионные культуры человеческих гемопоэтических клеток, которые пригодны для использования согласно настоящему изобретению, можно приготовить при плотности распределения клеток от 104 до 109 клеток на 1 мл культуры при использовании стандартных общеизвестных компонентов для получения питательных сред, например как среда Дульбекко, модифицированная по методу Исков (IMDM), модифицированная Дульбекко среда Игла (DMEM), минимальная незаменимая среда (MEM), среда RPMI 1640, среда Альфа или МcCoy's среда, которые можно использовать в комбинации с сывороточным альбумином, холестеролом и/или лецитином, селеном и неорганическими солями. Как указывалось ранее, к указанным культурам можно прибавлять кортикостероиды, например гидрокортизон при концентрации 10-4 - 10-7 М, или другие кортикостероиды в такой же дозировке, например кортизон, дексаметазон или солюмедрол. Культивирование обычно проводят при pH, приближающейся к pH организма, то есть в интервале от 6,9 до 7,4. Культуральную среду обычно выдерживают в кислородсодержащей атмосфере, включающей от 4 до 20 об.%, предпочтительно от 6 до 8 об.% кислорода.
При использовании таких стандартных методов выращивания используемую клеточную массу можно восполнить до требуемого размера, например до 103-кратного количества или даже более либо за счет содержания стволовых клеток, либо за счет гемопоэтических клеток-предшественников. Для обеспечения такого обогащения можно использовать общеизвестные методы в соответствии либо с методами избирательной отрицательной реакции, либо избирательной положительной реакции. Так, например, для избирательной отрицательной реакции зрелые клетки удаляют при использовании методов иммуноанализа, например, введением меток в не содержащие стволовых клеток или клеток-предшественников пулы при использовании микропланшета с мышиными античеловеческими моноклональными антителами с последующим удалением покрытых мышиными антителами клеток при адгезии их на пластиковых чашках, покрытых кроличьим-антимышиным Ig (см. , например, Amerson и др., J. Clin. Invest. (1985), 76: 1286-1230).
В основе предлагаемого изобретения лежит фундаментальное изменение условий культивирования суспендированных человеческих клеток костного мозга при использовании любого из вышеуказанных условий поддержания культуры, быстрое восполнение питательной среды. В соответствии со стандартной методикой культивирования предлагаемого изобретения необходимо осуществлять замену питательной среды и сыворотки каждую неделю, то есть либо проводить полную их замену еженедельно, либо половину среды и половину сыворотки два раза в неделю. В соответствии с предлагаемым изобретением питательную среду указанной культуры заменяют предпочтительно в виде перфузата, либо непрерывно либо периодически, при расходе примерно 1 мл среды на 1 мл культуры в течение примерно от 24 до 48 ч, причем плотность культивируемых клеток составляет от 2x10 до 1x10 клеток на 1 мл среды. Для обеспечения плотности распределения клеток от примерно 1x10 до 2x10 клеток на 1 мл при восполнении можно использовать такое же самое количество питательной среды. Для увеличения плотности клеток более 10 клеток на мл необходимо увеличить расход заменяемой среды пропорционально, чтобы обеспечить расход среды и сыворотки на постоянном уровне в расчете 1 кл. в единицу времени.
Восполнение питательной среды в соответствии с предлагаемым изобретением можно осуществлять любым методом, который обеспечивает ее восстановление, например путем взятия аликвоты отработанной культуральной среды и заменой ее свежей аликвотой. Указанную аликвоту можно прибавлять самотеком либо с помощью насоса или других подходящих для этого средств. Поток среды может поступать в любом направлении или можно использовать множество потоков, подаваемых из различных направлений в зависимости от конфигурации и носителя культуры. Предпочтительно, чтобы свежая питательная среда поступала так, чтобы обеспечивался ее контакт со всей клеточной массой. В наиболее предпочтительном варианте питательную среду прибавляют к культуре подобно процессу кровообращения, происходящему in vivo, то есть обеспечивают ее перфузию по крайней мере через часть клеточной массы, а предпочтительнее, чтобы она проходила через всю биомассу.
Другой необязательный, но важный аспект реализации настоящего изобретения заключается в том, что к культурам с быстрым обменным процессом прибавляют гемопоэтические факторы роста, в том числе синтетические факторы роста. В особенно предпочтительном варианте осуществления настоящего изобретения, к такой культуре прибавляют цитокины IL-3 и GM-CSF вместе с питательной средой при расходе от 0.1 до 100 нг/мл/сутки, предпочтительно от 0.5 до 10 нг/мл/сутки, и наиболее предпочтительно от 1 до 2 нг/мл/сутки. Эритропойэтин (Epo) можно прибавлять к питательной среде в количестве от 0.001 до 10 ед/мл/сутки, предпочтительно от 0.5 до 0.15 ед/мл/сутки. Факторы роста тучных клеток (MCF, лиганд c-комплемента, фактор Стилла) можно прибавлять к питательной среде в количестве от 1 до 100 нг/мл/сутки, предпочтительно от 10 до 50 нг/мл/сутки. IL-1 (a- или b-) можно также прибавлять к питательной среде в количестве 100 ед/мл в течение 3-5 дней. Кроме того, можно прибавлять к питательной среде IL-6, GM-CSF, факторы роста фибробластов, IL-7, IL-8, IL-9, IL-10, IL-11, PDGF или EGF в количестве от 1 до 100 нг/мл/сутки.
В ходе создания настоящего изобретения установлено, что когда IL-3, GM-CSF и Epo используют в соответствии с условиями, описанными выше, можно обеспечить специфичный к дифференцировке рост эритроцитов. В альтернативном варианте, если используют IL-3 и GM-CSF в присутствии или отсутствии IL-6 или G-CSF указанная культура продуцирует преимущественно гранулоциты. Установлен также тот факт, что культуры предлагаемого изобретения на протяжении всего времени утрачивали T- и B-лимфоциты.
Уровень продуктов обмена в указанной среде обычно удерживается в пределах заданного диапазона. Содержание глюкозы обычно удерживается в интервале от примерно 5 до 20 мМ. Концентрация лактата обычно удерживается на уровне менее 35 мМ. Уровень глутамина обычно поддерживается в интервале примерно 1-3 мМ. Концентрация аммония обычно удерживается на уровне менее 35 мМ. Эти концентрации можно регулировать путем проведения либо периодических замеров, либо непрерывными замерами содержания в реальном масштабе времени при использовании традиционных методов (cм. , например, Caldwell и др., J. Cell, Physiol. (1991), 147: 344-353).
В качестве клеток, которые можно выращивать согласно настоящему изобретению, можно использовать любые человеческие стволовые клетки, или клеточную массу, содержащую такие стволовые клетки, и в том числе человеческие мононуклеарные клетки периферической крови, человеческие остеоциты, эмбриональные клетки печени человека, эмбриональные стволовые клетки и/или человеческие серповидные клетки. Каждая из указанных клеточных композиций содержит стволовые клетки и/или человеческие гемопоэтические клетки-предшественники. В других клеточных композициях, содержащих человеческие стволовые клетки, можно также использовать в соответствии с предлагаемым изобретением любую человеческую стволовую клетку костного мозга человека.
В предпочтительном варианте осуществления предлагаемого изобретения указанную клеточную культуру можно обогатить за счет дополнительной продукции стволовых клеток в указанной клеточной композиции. Такое обогащение культуры можно обеспечить в соответствии с вышеописанными методами, и такая обогащенная культура, если используется в соответствии с настоящим изобретением, в первую очередь пригодна в качестве средства для генной терапии путем переноса генного материала в человеческие стволовые клетки, в том числе стволовые клетки, содержащиеся в костном мозге человека и в человеческие стволовые клетки костного мозга. В качестве стволовых клеток человеческого костного мозга можно использовать клетки, которые можно выделить из ткани человеческого костного мозга, из периферической крови, эмбриональных гепатоцитов, или кровяного сердцевидного тельца.
Вообще говоря, в данном аспекте осуществления настоящего изобретения для обеспечения устойчивой генетической трансформации человеческих стволовых клеток к таким клеткам, культивируемым в соответствии с предлагаемыми методами, прибавляют линию клеток с дефектом упаковки, инфицированную ретровирусом, или супернатант, полученный при культивировании такой линии клеток с дефектом упаковки, или любой другой вектор переноса генного материала. Настоящее изобретение позволяет повысить содержание стволовых клеток и репликацию человеческих гемопоэтических клеток-предшественников, однако в противоположность этому известные культуры обеспечивали репликацию человеческих гемопоэтических клеток-предшественников при снижении ее интенсивности (то есть "затухающие культуры"). Предлагаемая методика культивирования клеток позволяет обеспечить впервые увеличение клеточной массы в культуре, требующей инфицирования клеток ретровирусом. Известные до настоящего времени системы, где проводили инфицирование ретровирусом на затухающих культурах, не обеспечивали инфицирования клеток на ранних стадиях их роста. Настоящее изобретение, особенно если его реализуют в комбинации с обогащением пула стволовых клеток и даже, более того, когда добавляют гемопоэтические факторы роста, в том числе синтезированные факторы роста, то это позволяет получить очень эффективное средство для инфицирования стволовых клеток in vitro.
В ходе создания настоящего изобретения установлено, что прибавление супернатантов, содержащих рекомбинантные ретровирусы, к указанным культурам приводят интродукции вирусов и генов, которые они несут, в человеческие (гемопоэтически) стволовые клетки. Клетки-предшественники, образующиеся при делении и дифференцировке из указанных стволовых клеток, и зрелые клетки крови, образующиеся из последующего деления и дифференцировки указанных клеток-предшественников, содержат трансфектированные ДНК-последовательности на всем протяжении культивирования гемопоэтических клеток in vitro. Установлено также, что когда ретровирус вводят только на первоначальном этапе культивирования, то получают трансфектированные клетки-предшественники и зрелые форменные элементы крови, которые могут выходить из стволовых клеток, пролиферация и стабильная генетическая трансформация которых была обеспечена только в начале биосинтеза, поскольку никакая инфицированная ретровирусным путем клетка не может инфицировать соседнюю клетку. Таким образом, клетки-предшественники и более зрелые клетки, несущие целевой генетический материал, приняли ген от более примитивных стволовых клеток, которые были генетически трансформированы на начальном этапе ретровирусного заражения.
В предпочтительном аспекте реализации предлагаемого изобретения человеческие гемопоэтические клетки либо изолированные из ткани костного мозга, периферической крови, эмбриональных клеток печени или крови, взятой из пуповины, вначале обогащают относительно увеличения содержания стволовых клеток путем удаления более зрелых гемоцитов. Такое обогащение осуществляют путем инкубирования гемопоэтических клеток с мышиными моноклональными антителами, распознающими эпитопы на зрелых немоцитах и клетках-предшественников костного мозга, а не стволовых клеток. После этого удаляют меченые клетки методом иммуноадгезии с покрытой кроличьим антимышиным Ig поверхностью иммуноадсорбента. Полученные клетки с негативной реакцией к дифференцировке (Lin-) затем инкубируют в присутствии ретровирусного или другого вектора генного переноса в соответствии с предлагаемым изобретением. В предпочтительном варианте культивирование выполняют в присутствии фактора GM-CSF предпочтительно в количестве 1 мг/мл/сутки) и IL-3 (предпочтительно в количестве 1 мг/мл/сутки) в присутствии или без IL-1 (предпочтительно в дозе 50 ед/мл в течение 4-дневного периода), а также в присутствии или без c-комплемент-связывающего лиганда (фактора роста тучных клеток) (предпочтительно в дозе 10 ед/мл/сутки).
Ретровирусное инфицирование можно осуществлять либо введением в указанную культуральную среду супернатантов (например, от 5 до 20%, об/об.), полученных из линии клеток с дефектом упаковки, инфицированной рекомбинантным ретровирусом в течение 2-21, предпочтительно 10-14 дней от начала культивирования либо выращиванием Lin-клеток непосредственно на самой этой ранее указанной линии клеток или при использовании обоих.
Предпочтительно использование ретровирусных супернатантов и чтобы инкубационный период в присутствии вируса составлял от 12 до 16 дней. Инкубирование клеточных линий с дефектом упаковки предпочтительно проводить в условиях, близких к состоянию конфлюэнтности, с заменой питательной среды, после чего инкубирование проводят еще в течение 12-15 ч. После этого культуральную среду собирают и используют при трансфекции человеческих стволовых клеток. В соответствии с предлагаемым изобретением можно использовать любые (общеизвестные ретровирусные клеточные линии с дефектом упаковки, а их культивирование проводить любой известной методикой (см., например, Wilson и др. , Science (1990), 248: 1413-1416 и/или Sullenger и др., Cell (1990), 63: 601-608). В качестве примера таких клеточных линий с дефектом упаковки можно указать клетки линии NIH 3T3 и клеточную линию 5337 карциномы почки.
Любой ген, который интродуцируют в рекомбинантный ретровирус вместе с соответствующими промотoрами и энхансерами, обеспечивающими его экспрессию, можно вводить в человеческие стволовые клетки и гемопоэтические клетки-предшественники. Настоящее изобретение впервые предлагает условия, которые обеспечивают жизнеспособность стволовых клеток и их пролиферацию
в указанных культурах, что делает возможным получать стабильно трансфектированные и генетически модифицированные стволовые клетки в таких культурах. Термины "стабильно трансфектированные" и "стабильно трансформированные" в данном контексте используют для того, чтобы подчеркнуть, что введение экзогенной ДНК в хромосомы человеческих стволовых клеток стало возможно благодаря настоящему изобретению вследствие того, что оно позволяет осуществлять воздействие на эту ДНК делящимися человеческими стволовыми клетками ex vivo.
В соответствии с предлагаемым изобретением можно получить культуры, в которых происходит продуцирование человеческих гемопоэтических клеток-предшественников путем их деления и дифференцировки из стволовых клеток в течение всего культивируемого периода времени, и по крайней мере в течение 5 месяцев.
Полученные данные свидетельствуют о том, что скорость перфузии среды очень существенно варьирует при определении поведения внеклеточных культур человеческого костного мозга. Эти данные показали, что когда возрастала интенсивность обновления указанной среды от традиционного одного раза в неделю декстеровского типа до частоты замены среды ежедневно порядка 7 объемов в неделю, то получают значительный положительный эффект процесса кроветворения ex vivo. В экспериментах, проводимых в ходе создания изобретения, все культуры продемонстрировали значительную потерю клеток в течение первых 3-4 недель. После такого спада культуры стабилизировались, и эффект интенсивности перфузии в среде стал более выраженным. Частота обновления питательной среды 3.5 объема в неделю привела к наибольшей пролиферации клеточных культур, и, кроме того, к самому продолжительному непрерывному периоду культивирования с точки зрения продукции клеток-предшественников. Следует особо отметить, что в течение интервала времени от 4 до 10 недель количество неадгезивных клеток, продуцируемых два раза в неделю, было фактически стабильным или имело тенденцию к повышению.
В течение всего периода культивирования суммарное количество продуцированных клеток через 3.5 недели выросло почти в три раза по сравнению с традиционной методикой культивирования декстеровского типа. Более того, стабильный выход клеток-предшественников сохраняется до 18 недель.
Человеческие стромальные клетки, например которые идентифицированы в ткани человеческого костного мозга, можно или не обязательно включать в культуры предлагаемого изобретения. В стандартных культурах такие клетки содержатся в количестве примерно от 104 до 109 (стромальные клетки от общего содержания клеток).
В другом аспекте настоящего изобретения предлагаемые культуры клеток, как неожиданно установлено, приводят к увеличению интенсивности метаболического процесса и секреции из стромальных клеток человеческого костного мозга GM-CSF и IL-6. В то время как не обнаружено присутствия GM-CSF-фактора в супернатанте стромальных клеток человеческого костного мозга, быстрое обновление питательной среды в соответствии с предлагаемым изобретением приводит к стимуляции клеток стромы человеческого мозга с высвобождением от 300 нг/мл/сутки до 200 нг/мл/сутки фактора GM-CSF. Секреция IL-6 стромальными клетками человеческого костного мозга также повышается при быстром обновлении питательной среды в соответствии с предлагаемым изобретением с 1-2 нг/мл/сутки до 2-4 нг/мл/сутки. Такое увеличение отмечено как в случае, когда только проводят быстрое обновление питательной среды, так и в случае, когда быстро обновляют питательную среду с одновременным введением в нее гемопоэтических факторов роста. На основе полученных авторами данного изобретения данных влияние быстрой замены питательной среды на продукцию цитокинов из человеческих стромальных клеток можно наблюдать при использовании таких стромальных клеток в любой комплексной системе тканевых культур.
В качестве примера используемая в предлагаемом изобретении питательная среда может содержать три основных компонента. Первый компонент включает среду Дульбекко, модифицированную по методу Исков (IMDM), модифицированную Дульбекко среду Игла (DMEM), минимальную незаменимую среду (MEM), среду RPMI 1640, среду Альфа или McCoy's среду, или эквивалентный компонент для приготовления известных культуральных сред. Ко второму компоненту относится сывороточный компонент, в состав которого входит по крайней мере лошадиная или человеческая сывороткa крови, и при желании он также может включать фетальную телячью сыворотку, сыворотку новорожденного теленка и/или бычью сыворотку. В качестве третьего компонента можно использовать кортикостероиды, например гидрокортизон, кортизон, дексаметазон или солюмедрол, или их комбинации, но предпочтительно использование гидрокортизона.
Композиционный состав для приготовления различных питательных сред, которые можно использовать, приведен в таблице A.
Сывороточный компонент может присутствовать в культуре в количестве по крайней мере от 1 до 50% (об/об.). Концентрация сыворотки в культуре может составлять в предпочтительном варианте примерно от 15 до 30% (об/об.). При повышении концентрации сывороточного компонента в пропорциональной зависимости возрастает скорость обмена веществ. Третий компонент культуры может присутствовать в количестве от 10 до 10- М, и предпочтительно от 5x10- до 4x10- М. Этот компонент культуральной среды используют до баланса, в результате чего в сумме все три указанных компонента составляют 100%. В альтернативном варианте сывороточный компонент можно заменить на любой из нескольких стандартных сывороточных заменяющих смесей, в состав которых обычно входят инсулин, альбумин и лецитин либо холестерол (см., например, Migliaceio и др. , Exp. Hematol. (1990), 18: 1043-1045, Iscove и др., Exp. Cell Res. (1980), 126: 121-126 и Dainiak и др., J. Clin. Invest. (1985) 76: 1237-1242).
В качестве иллюстрации концентрации человеческих гемопоэтических стволовых клеток можно увеличить следующим образом. Эритроциты выделяют из пунктата костного мозга методом центрифугирования в градиенте плотности фикол-гипака, после чего мононуклеарные клетки инкубируют вместе с "коктейлем" из антител, распознающих зрелые гемоциты, включая эритроциты, гранулоциты, макрофаги и зрелые лимфоциты (как B-, так и T-клетки). Кроме того, в объем настоящего изобретения включены антитела, которые распознают конмитированные клетки-предшественники (в том числе анти-CD33). Затем зрелые клетки удаляют любым из множества общеизвестных методов, в том числе пэннингом, иммуносвязыванием на магнитных бусах или клеточной сортировкой на лазерном сортировщике клеток по интенсивности флюоресценции (FACS). При удалении зрелых элементов крови значительно повышается возможность инфицирования рекомбинантным вирусом, и, следовательно, перенос требуемого гена (генов).
В другом варианте осуществления настоящего изобретения предлагаются методы выращивания гемопоэтических клеток в культуре с использованием фибробластоцитов, обычно модифицированных, которые обеспечивают возможность введения факторов роста вместе с белковыми компонентами в указанные смеси из фибробластных и гемопоэтических клеток и практически непрерывной перфузии, с проведением рециклинга при желании, и тем самым обеспечивают стабильное эффективное состояние ростовой среды.
Описание предлагаемого метода настоящего изобретения можно разделить на несколько частей, которые относятся к условиям проведения перфузии, биореактору и его конструкции трансформации фибробластов.
Заявляемый биореактор включает реакционный сосуд, который может иметь любую конструкцию, позволяющую обеспечивать необходимое распределение клеток, введение питательных веществ и кислорода, удаление отработанных продуктов обмена веществ, факультативный рециклинг гемопоэтических клеток, замену стромальных клеток и сбор гемопоэтических клеток. Такой реактор должен обеспечить условия, практически приближенные к костной перфузии. In vivo расходуется примерно 0.08 мл сыворотки крови на 1 мл костного мозга в минуту, или, если сказать иначе, 0.3 мл сыворотки на 10 клеток ежедневно. Такая среда, таким образом, должна заменяться в среднем по крайней мере на 50%, предпочтительно на 100% через каждые 24 ч для стабилизации нормального уровня продуктов обмена веществ, которые не должны ограничиваться в росте. Расход при замене обычно варьирует от 0.5 до 1.0 перфузата на 10 клеток ежедневно, что аналогично эмпирическим расчетам перфузии in vivo.
Интенсивность перфузии в биореакторе варьирует в зависимости от плотности клеток в реакторе. Для клеток, выращиваемых при их расходе 2-10·10 клеток/мл, этот показатель составляет 1 мл/мл объема реактора (24-48 ч, в том случае если используемая среда содержит 20% сыворотки, либо 10% фетальной телячьей сыворотки и 10% лошадиной сыворотки, либо 20% только фетальной сыворотки теленка). При повышении плотности клеток пропорционально растет и скорость перфузии, что обеспечивает на постоянном уровне расход сыворотки на клетку в единицу времени. Так, если клетки культивируют при их плотности 5·10 клеток/мл среды, скорость перфузии составляет 0.1 мл/мл объема реактора в минуту. Указанные показатели расхода важны для стимуляции эндогенной продукции гемопоэтических факторов роста из здоровых клеток стромы человеческого костного мозга в культуре. В качестве гемопоэтических факторов роста, индуцируемых при таких показателях расхода сыворотки и среды, можно использовать GM-CSF, а также S-CSF, g-38-IL-6, G-CSF и другие гемопоэтические факторы роста. Такие нормы обычно устанавливают в биореакторах так, чтобы сдвиговое напряжение из продольно поступаемого потока, которое испытывают стволовые клетки и клетки-предшественники в их сайтах прикрепления к стромальной клетке, составляло в интервале 1.0-5.0 дин/см2.
Множество различных сред можно использовать для выращивания гемопоэтических и стромальных клеток. В качестве примера можно указать MEM, IMDM и RPMI, которые могут быть дополнены комбинациями из 5-20% фетальной телячьей сыворотки, 5-20% телячьей сыворотки и 0-15% лошадиной, и/или не содержащей сыворотки среды, дополненной PDGF, EGF, HGF, PGF и другими факторами роста для стимуляции стромальных и стволовых клеток. В дополнение к факторам роста, которые обеспечивают трансформированные фибробласты, можно в перфузионной среде использовать дополнительные факторы роста, особенно в тех случаях когда "обученные клетки" требуют сайт-специфичной дифференцировки. В объем факторов роста, которые могут быть включены в такую перфузионную среду либо при их секреции стволовыми клетками, либо путем прибавления к ней, входят GM-CSF, G-CSF или M-CSF, интерлейкины 1-7, особенно 1, 3, 6 и 7, TGF-a или b, эритропойэтин и тому подобные, предпочтительно человеческие факторы роста. Особый интерес представляет комбинация, содержащая примерно 0.5-2, предпочтительно 1 нг/мл GM-CSF и 0.5-2, предпочтительно 1 нг/мл, и также 0.1-2 ед/мл/сутки конечного разведения эритропойэтина, от примерно 100-300 ед/мл/сутки G-CSF и примерно 1-10 ед/мл/сутки (фактор известен как фактор роста тучных клеток или kit-ligand). Ясно, что один и несколько, предпочтительно по крайней мере два фактора роста, будут поддерживаться при секретировании из трансформированных клеток, которые содержатся в количестве, достаточном для поддержания требуемого уровня указанных факторов роста в этой перфузионной среде.
Для удобства в биореакторе поддерживают физиологическую температуру, то есть 37oC, хотя также можно использовать более низкие температуры, в том числе 33oC, но, как правило, не ниже 25oC. Влажность обычно составляет 100%, а в воздухе содержится примерно 5% двуокиси углерода. Перфузионную среду можно насыщать кислородом внутри или вне реактора, причем предлагаются различные способы внутренней оксигенации. Так, например, оксигенацию внутри биореактора можно обеспечить полыми волокнами, пористыми спеченными дисками, через силиконовые трубки или другие мембраны с соответствующей проницаемостью и гидрофобностью. Уровень питательных веществ и метаболистов обычно поддерживается в относительно широком диапазоне. Содержание глюкозы обычно варьирует в диапазоне примерно от 5 до 20 мМ, обычно от 10 до 20 мМ, концентрация лактата обычно удерживается на уровне ниже 35 мМ, но его содержание может достигать примерно 20%. Концентрация глутамина поддерживается обычно в диапазоне от 1 до 3 мМ, как правило от 1,5 до 2,5 мМ, в то время как аммония - примерно ниже 2,5 мМ, предпочтительно ниже 2,0 мМ. Поток среды может поступать самотеком, с помощью насоса или другими способами, причем он может продвигаться в любом направлении или в виде множества разных потоков, поступаемых из различных направлений в зависимости от упаковки реактора. Предпочтительно использование ламинарного потока, где струя проходит горизонтально по реактору или вертикально снизу вверх реактора или наоборот.
В случае, когда имеется подозрение, что человеческие гемопоэтические клетки содержат неопластические клетки, лейколимфомы или карциномы, перфузионный поток можно подбирать так, чтобы изолировать нормальные клетки-предшественники от неопластических гемопоэтических клеток. Здоровые гемопоэтические клетки-предшественники, как установлено, прикрепляются к строме и к матриксу белков с аффинностью, способной выдерживать напряжение на сдвиг, создаваемое горизонтальным потоком, примерно 1,5-2,0 дин/см2 В противоположность этому неопластические клетки и их предшественники имеют значительно низкое сродство к строме в интервале примерно 0,05-1,2 дин/см2. Удерживая скорость подачи перфузата, которая предусматривает показатель сдвигового напряжения промежуточный между переносимой нормальными и неопластическими клетками-предшественниками, обычно более 1 дин/см2, можно обеспечить отделение неопластических клеток-предшественников от здоровых клеток-предшественников, проводя перфузию примерно хотя бы в течение двух дней, предпочтительно по крайней мере в течение четырех дней и более предпочтительно в течение семи дней и более. Таким способом можно увеличить объем здоровых гемопоэтических клеток у больного одновременно при использовании подходящей скорости подачи потока отделять неопластические клетки.
В качестве иллюстрации использования сдвигового напряжения для отделения гемопоэтических опухолевых клеток от здоровых гемопоэтических клеток можно привести случай хронической миелоидной лейкемии (CML). Переносимость напряжения на сдвиг для клеток CML варьирует в интервале от 0.05-1.2 дин/см2. Эта разность позволяет эффективно удалять CML клетки вместе с индивидуальной пробой костного мозга. При использовании показателя сдвига порядка 1.2-1.5, предпочтительно 1.3 дин/см2, можно успешно отделять клетку CML.
Устойчивость к сдвиговому напряжению в клетках костного мозга индуцидуального больного можно определить с помощью радиальной конусообразной поточной камеры. В этой камере сдвиговое напряжение, которое испытывают клетки, снижается с расстояния d от начала камеры как функция 1/d. Полоски затем можно проанализировать на размер клеточной популяции, и показатель сдвигового напряжения определяет, на каком уровне должна быть заданная популяция клеток.
Для отделения лейкемических стволовых клеток клетки-предшественники и стволовые клетки из пунктата костного мозга больных с лейкемией помещают в радиальную проточную камеру. Эта камера состоит из двух параллельных пластин, изготовленных из поликарбонатной смолы или стекла.
На основе результатов этих измерений устанавливают каскад параллельных прямоугольных ячеек, где скорость потока перфузата (см. фиг. 4А и 4В) на более нижнем уровне создает напряжение сдвига, которое устанавливается в конусообразной камере с удалением лейкемических клеток из стромы, но не затрагивая любую из здоровых клеток. В случае костного мозга больного с хронической миелоидной лейкемией это сдвиговое напряжение обычно составляет 1.01-0.05 дин/см2. Фактическая скорость потока перфузата зависит от размера и геометрии указанных ячеек. Клетки костного мозга этого больного выращивали в этих прямоугольных ячейках при концентрации 5x10 - 50x10/мл в среде Дульбекко, модифицированной по методу Исков с 5-20% (обычно 10%) лошадиной сыворотки при добавлении или без гидрокортизона 10 М. Указанные клетки костного мозга инкубировали в течение 12-24 ч без подачи перфузата, а после этого начали вводить перфузат. Клетки культивировали в течение 3-7 дней, удаляя все неадгезивные клетки. Адгезивные клетки извлекали из этих прямоугольных планшетов аспирацией или механическим встряхиванием, после чего их собирали. Эти клетки затем можно непосредственно инъецировать больному или хранить их в жидком азоте по стандартным методикам перед непосредственным их использованием.
Кроме клеток системы кроветворения можно также разделять клетки других органов при использовании разницы в толерантности на сдвиговое давление. Таким образом, где имеются отчетливые субпопуляции клеток внутри данного комплекса клеток, вышеописанные методы можно использовать для разделения типов исследуемых клеток суспензионной культуры, полученной, например, из кожной ткани, печени, мышцы, нервной ткани или эпителия. Особенный интерес представляет разделение клеток внутри популяции здоровых клеток. Разделяемую популяцию клеток приводят в контакт со стромальной подложкой, как будет описано далее в описании, например как очищенный белок или клеточный компонент, с которым связываются исследуемые клетки. Устойчивость на сдвиговое напряжение каждой из адгезивных субпопуляций определяют по вышеописанной методике. Подаваемый поток перфузата затем можно регулировать так, чтобы сохранить требуемую субпопуляцию клеток на строме. Целевые клетки затем собирают по вышеописанной методике.
Различные упаковки можно использовать в предлагаемом реакторе для обеспечения адгезивного роста клеток, одновременно обеспечивая некоторое физическое разделение между стромальными и гемoпоэтическими клетками, а также для возможности некоторого или тесного взаимодействия между стромальными и гемопоэтическими клетками. В таком случае факторы, высвобождаемые из стромальных клеток, могут быть легко поглощаемы гемопоэтическими клетками для облегчения их пролиферации и надлежащей дифференцировки и созревания.
Белковый матрикс, используемый в качестве подложки для клеток, может принимать форму коллагеновых частиц, например губок, и пористых коллагеновых бусин, причем указанные губки или микросферы состоят из внеклеточного белкового матрикса костного мозга или протеин-покрытых мембран, где в качестве белка может быть коллаген, фибронектин, гемонектин, пептид, смесь белка с костномозговым матриксом и тому подобное. Размеры пор мембраны обычно варьируют от 1 до 5 мс для того, чтобы можно было обеспечить взаимодействие между различными типами клеток, хотя все еще сохраняется физическое разделение.
Можно использовать протеин-покрытые мембраны. Для получения мембран можно использовать множество материалов например как полипропилен, полиэтилен, поликарбонатная и полисульфонатная смолы. Мембраны должны иметь достаточно небольшие поры, через которые не должны проходить модифицированные клетки, однако они могут расти и образовывать конфлюентный слой на боковой поверхности такой мембраны. Обычно поры таких мембран варьируют в диапазоне примерно от 1 до 5 мс. В этом случае гемопоэтические стволовые клетки могут расти на противоположной стороне мембраны и взаимодействовать с модифицированными клетками, в результате чего факторы роста могут переноситься непосредственно из трансформированных клеток к гемопоэтическим клеткам-предшественникам. Клетки-предшественники, стволовые клетки, обладают способностью прикрепляться к боковым цитоплазматическим проекциям, которые выходят в указанные поры. Гемопоэтическая дифференцировка из стволовых клеток происходит на одной стороне мембраны, и дифференцированные клетки-предшественники не способны пройти назад через мембраны, которые уже большей частью покрыты слоем стромальных клеток, когда почти или уже достигнуто состояние сплошности. Например, можно установить множество ячеек, в которых могут расти стромальные клетки, а гемопоэтические клетки могут перемещаться в соответствии с ячейкой, которую имеют стромальные клетки на субконфлюентном уровне. Таким образом, при наличии подвижной мембраны между указанными ячейками, когда стромальные клетки приближаются к конфлюентному состоянию, обычно через примерно 8-12 недель, можно открыть или удалить такой барьер между ячейками и обеспечить возможность перемещения стромальной клетки к новой ячейке, а гемопоэтическим клеткам прийти во взаимодействие с субконфлюeнтными стромальными клетками, хотя эти субконфлюeнтные стромальные клетки перемещают факторы роста к камере, содержащей гемопоэтические клетки (фиг. 5А и 5В). Перенос гемопоэтических клеток можно обеспечить путем регулирования скорости подачи потока перфузата или другими общеизвестными методами. Это позволяет получить множество различных лунок в указанной камере, которые разделены соответствующими перегородками, и после обсеменения одной лунки, когда клетки достигают конфлюентного состояния, то они будут перемещаться к следующей лунке, и затем после ее засевания аналогичным образом будут перемещаться к следующей лунке. Другая модификация системы состоит в том, что через 8-12 недель в культуре гемопоэтические клетки воздействуют на новые пролиферирующие стромальные клетки. Это обеспечивается одним из нескольких способов. Согласно первому методу клеточную культуру обрабатывают в течение 3-5 мин ЭДТУК (EDTA), которая удаляет из стромальных клеток гемопоэтические стволовые клетки. Изолированные клетки затем переносят в сосуд со свежей средой, которая может сама содержать стромальные клетки костного мозга, засеянные за 3-7 дней до этого. Этот процесс повторяют через каждые 8-12 недель. И, наконец, небольшие органические молекулы или белки, особенно гормоны, например фактор роста, полученный из тромбоцитов (при концентрации 100-500 нг/мл), интерлейкин-1-альфа, альфа-фактор некроза опухоли или фактор роста основных фибробластов, либо другие молекулы, митогенные относительно фибробластов, можно прибавлять к указанным культурам через 3-7 дней. Такое воздействие на стромальные митоген-стимулирующие факторы усиливает непрерывную пролиферацию стромальных клеток костного мозга и их непрерывный синтез гемопоэтических факторов роста. Таким образом, можно обеспечить непрерывную стадию субконфлюентного развития стромальных клеток.
Непрерывную подачу перфузата можно также использовать для отделения здоровых от раковых клеток внутри популяции клеток костного мозга. В указанном методе вначале используют радиальную проточную кювету для определения специфической адгезионной способности здоровых клеток относительно раковых, после чего используют прямоугольную проточную кювету при заданных скоростях подачи потоков, которые позволяют обеспечить сдвиговое напряжение, достаточное для отделения раковых клеток.
Заявляемый метод и аппарат также обеспечивают возможность для рециклинга стволовых клеток, утраченных в потоке перфузата. Маркер поверхностной мембраны CD34 обеспечивает разделение незрелых гемопоэтических клеток от зрелых. Таким образом, при захвате и рециклинге клеток, которые относятся к CD34+, можно избежать потери в среду стволовых клеток.
Для захвата и возврата незрелой фракции клеток в реактор можно использовать различные методы. Так, например, можно вводить метку антитела, специфичного к CD34 в указанные клетки, а затем использовать антитела против антитела для сбора клеток CD34+ и их рециклинга в реактор. В альтернативном варианте можно выбирать клетки с отрицательной реакцией, в результате чего можно обеспечить удаление зрелых клеток, использующих антитела против различных маркеров, связанных со зрелыми клетками, например как антитела к гликофорину, CD33, MO1, OKT3, CKT4, OKT8, OKT11, OKT16, OKM1, OKM5, Leu 7, Leu 9, Leu M1, Leu M3 и тому подобное. Имеется множество различных антител для маркеров, специфичных к зрелым клеткам различных гемoпоэтических дифференцировок, лимфоидных, миелоидных и эритроидных, и эти антитела можно использовать для удаления зрелых клеток из эфлюентных потоков из реактора с последующим сбором оставшихся клеток и возвращением их в реактор.
Разделение при использовании антительных маркеров можно обеспечить различными путями, используя стандартные методы индивидуально или в комбинации, например как пэннинг, сортировка клеток с усилением по флюоресценции, связывание антител с различными носителями, например с поверхностью полистироловых микросфер, металломикросфер и магнитными носителями и т.д. Антитела связываются с поверхностями, которые позволяют обеспечить разделение адгезивных от неадгезивных клеток или в антитела вводят метки непосредственно или косвенно, в результате чего обеспечивается выбор между мечеными и немечеными клетками.
Следуя предлагаемым методикам, можно значительно увеличить время жизнедеятельности in vitro гемопоэтических клеток, обычно обеспечивается гемопоэз человеческих клеток ex vivo в течение примерно шести месяцев в культуре, причем выращивание гранулоцитов продолжается в течение четырех месяцев, а эритроцитов по крайней мере трех месяцев. Кроме того, гемопоэтические клетки-предшественники непрерывно образуются в течение всего периода выращивания, приводя к 10-кратному увеличению объема чистой продукции клеток-предшественников от первоначального объема.
В дополнение к сказанному, придерживаясь предлагаемых в настоящем изобретении методов, можно существенно повысить интенсивность деления стволовых клеток, что делает возможным эффективное введение ретровирусно-трансфектированного генетического материала. Гены, введенные соответствующим ретровирусным вектором в течение первых двух недель с момента заражения, можно экспрессировать до 10-30% во всех клетках-предшественниках и клетках-предшественниках, продуцируемых в течение дальнейшего культивирования в течение четырех месяцев в культуре. Предлагаемые методы, таким образом, обеспечивают успешную доставку генного продукта в высокопролиферативную человеческую гемопоэтическую стволовую клетку.
На фиг. 1 показан схематический вид перфузионной камеры. Реактор 10 с пластиной 12, расположенной сверху реактора, и пластиной 14, расположенной в основании реактора, соединяют болтами 16 с фиксированием их положения крыльчатой гайкой 18. Используют три болта для предотвращения перекоса. Камера 20 имеет три отсека, средний отсек 22 содержит поддерживающий матрикс для стромальных клеток посадки стромальных клеток и клеток костного мозга. Центральная часть отсека 22 отделена от верхней секции 24 и нижней секции 23 мембранами или ситами 28 и 30 соответственно. Для удобства можно использовать полисульфонатную мембрану или сито из нержавеющей стали, при этом размер отверстий сита достаточен, чтобы клетки могли попадать в центральную часть камеры. Разделительную межфазную перегородку можно установить в камере при использовании внутреннего цилиндра 27, который разделен на секции для обеспечения механической опоры для разделительной мембраны. Верхняя секция 24 и нижняя секция 26 могут иметь разные профили и содержать в поперечном сечении трубопровод или мембраны, где происходит замена питательной среды и газов. Газы проходят по гидрофобной, например, силиконовой трубке, размер которой (и, следовательно, площадь контакта газ-жидкость) может меняться для обеспечения необходимого количества поступаемых потоков, чтобы обеспечить потребности клеточной популяции, метаболизм которой происходит в центральной части. Питательную среду можно нагнетать насосом или она может поступать самотеком сверху и снизу камеры через отверстие 24, либо поступать по трубопроводу 34.
При необходимости верхнюю и нижнюю секции можно исключить путем замены их на внешний оксигенатор. В этом случае разделительная мембрана фиксируется с помощью стеклянного цилиндра 36, который установлен в цилиндрические канавки пластин 12 и 14, причем внешняя поверхность цилиндрической канавки идентична ее внутренней, что обеспечивает превосходное распределение поступаемого потока среды по всей мембране. Такая геометрия позволяет обеспечивать смешивание потока из конечного пункта входных отверстий для стабилизации радиального давления. Такая организация пригодна для камер, которые имеют относительно немного клеток, в результате процесс окисления не становится ограничивающим.
На фиг. 2 показан схематический вид контура, который соединяет перфузионную камеру с резервуаром с питательной средой, оксигенатором, измерительной (сенсорной) ячейкой и отверстиями для подачи пробы и закачки среды.
Внешний источник свежей среды 50 закачивают насосом 52 в резервуар для среды через трубопровод 56, а отработанную среду удаляют по трубопроводу 58 из резервуара 54 посредством насоса 52 в резервуар для отработанного продукта для последующей его обработки. Второй насос 52 закачивает среду из резервуара 54 по трубопроводу 64 через полое волокно оксигенатора 66. Среду направляют по трубопроводу 68 в первую камеру биореактора 70. Для удобства установлено средство для нагнетания компонента среды 82, который по трубопроводу 68 транспортирует среду в первую камеру биореактора 70. В качестве этого компонента могут быть исследуемые материалы, дополнительные факторы роста и тому подобное. Питательную среду из биореактора 70 направляют через центральную часть камеры 72 во вторую камеру 74 биореактора. Отсюда среда поступает по трубопроводу 76 в датчики, работающие в реальном масштабе времени для определения изменения состава среды.
Так, например, желательно, чтобы соотношение глутамина к глюкозе составляло в интервале 1:5-8 в зависимости от используемых клеточных линий, например предпочтительно соотношение 1:8 для трансфектированных клеток линии 3T3. Более того, концентрация аммония предпочтительно составляет менее 2.0 мМ, а концентрации лактата предпочтительно менее чем примерно 40 мМ. При регулировании потоков, поступаемых из биореактора, можно обеспечить модификацию вводимой в биореактор среды, изменить величину парциального давления кислорода и изменить скорость подачи кислорода, добавление различных компонентов или снижение или увеличение скорости.
Из сенсорных элементов среду направляют по трубопроводу 80 с помощью насоса 62 в резервуар 54.
При использовании вышеописанной схемы подачи потоков среда в боковом резервуаре медленно обменивается. Такая организация позволяет осуществлять автономное регулирование частоты замены среды (внешний насос) и скорости прохождения потоков через оксигенатор и перфузионную камеру. Первый используют для долгосрочного регулирования переменных в составе среды и условий перфузии, в то время как последний можно использовать для регулирования давления растворенного кислорода и режимов течения потоков в камеру. Использование небольшой биосовместимой сетчатой мембраны позволяет обеспечить перемещение поршня в камеру, а это в свою очередь - осуществлять четкий контроль подачи факторов роста и других специальных соединений, которые желательно добавлять к гемопоэтическим и стромальным клеткам в строго установленных количествах.
После обработки в автоклаве камеры элементов подающего контура указанный биореактор собирают в стерильных условиях. Среда может циркулировать по боковому контуру и камере в течение нескольких дней, одновременно регулируя степень загрязнения. Если обеспечена стерильная сборка, то проводят инокуляцию центральной секции камеры либо при использовании в чистом виде внеклеточного матрикса, либо предварительно инокулированной подложки для внеклеточного матрикса, который содержит стромальные клетки. После этого стромальные клетки либо (1) выдерживают в камере в течение нескольких дней, одновременно регулируя параметры их метаболизма и/или чувствительность фактора роста, и если результаты удовлетворительны, осуществляют инокуляцию костного мозга, либо (2) сразу же инокулируют костный мозг. В любом случае суспендированные клетки выдерживают в нижней части центрального отсека камеры. Затем клетки накладывают на дополнительный внеклеточный матрикс и иммобилизуют указанный слой клеток на разделительной перегородке. В это время камера может опрокидываться, и слой клеток переместится на верх указанной центральной секции. При такой конфигурации созревающие клетки оседают в нижнюю часть центральной камеры, поскольку они утратили адгезивную способность относительно стромальных клеток. Этот признак имеет важное значение для предотвращения повреждения стромального слоя и/или менее зрелых гемопоэтических клеток при воздействии зрелых клеток. Этот признак также обеспечивает непрерывное более легкое отделение зрелых клеток.
Стромальные клетки в основном представляют собой фибробласты, модифицированные одним или несколькими генами. Те же самые или другие клетки можно трансфектировать с генами в зависимости от конкретного выбора клеток-хозяев, причем те же самые или другие клетки можно использовать для множества различных генов.
Можно использовать широкое разнообразие здоровых клеток или устойчивых клеточных линий. Однако не все клеточные штаммы, как установлено, можно использовать, поскольку трансформация некоторых клеточных линий может привести к чрезмерному росту клеток. Желательно, чтобы используемые клетки не были неопластичными клетками, и для скорее необходимо иммобилизация на подложке. Для клеток млекопитающих не обязательно, чтобы они относились к человеческим или были примированы. Множество нетрансформированных клеток можно использовать в слоях адгезивных клеток, в том числе здоровые адгезивные клетки человеческой селезенки и интактные эпителиальные клетки тимуса человека.
Хорошо известны методы трансформации клеток млекопитающих, и имеется много литературы по этому вопросу, хотя в данном описании приведено только несколько источников. Указанные конструкции можно использовать в природно-встречающейся регуляторной области инициации транскрипции, содержащей промотор и соответствующий энхансер либо можно включить другую область инициации транскрипции, которая может быть индуцируемой или нерегулируемой.
Имеется множество сайтов инициации транскрипции, нашедших применение, и к ним относятся хромосомальные промотoры, например как промоторы мышиного или человеческого металлотионеина-I и II, промотор актина и т.д. или вирусные промоторы, например как промотор раннего гена SU 40, промотор SMU, аденовирусные промоторы, промоторы, связанные с LTRS ретровирусов и т.д. Указанные промоторы легко доступны, их можно легко вставить в соответствующие векторы, которые содержат
полинкеры для инсерции сайта инициации транскрипции, а также исследуемого гена. В других примерах используют векторы экспрессии, которые содержат полилинкер между областью инициации транскрипции и областью терминации транскрипции, обеспечивающий передачу различных сигналов, связанных с процессингом мессерджера трансляции, то есть сигнал сайта кэпирования и полиаденилирования. При конструировании полигенного экспрессирующего кластера, содержащего регуляторные области и структурный ген, можно использовать один или несколько рестрикционных ферментов, адаптеров, полилинкеров, in vitro мутагенез, праймерную репарацию, реселекцию и т.д.
Полигенный экспрессирующий кластер обычно является частью вектора, содержащего маркер и одну или несколько систем для репликации. Маркер обеспечивает детекцию и/или селекцию клеток, в которые интродуцируют полигенный экспрессирующий кластер и маркер. Можно использовать различные маркеры, особенно маркеры, обеспечивающие резистентность к токсину, особенно антибиотику. Предпочтительно использовать резистентность гентамицина, который обеспечивает резистентность к G418 млеклетки-хозяина млекопитающего. В качестве системы репликации можно использовать системы репликации прокариот, которые позволяют осуществлять клонирование на разных стадиях, собирая индивидуальные компоненты (полигенный экспрессирующий) кластера.
При интродукции полигенного экспрессирующего кластера в клетку-хозяин можно использовать любой из общеизвестных методов, включая трансформацию, прицепитированную кальцием ДНК, трансфекцию, инфекцию, электропорацию, баллистические частицы и тому подобное. Сразу же после модификации клеток-хозяев можно провести их амплификацию в соответствующей питательной среде, содержащей селективный агент для выбора тех клеток, которые содержат маркер. Выжившие клетки затем можно амплифицировать и использовать в дальнейшем.
В качестве клеток-хозяев можно использовать клеточную линию aфриканской зеленой мартышки CV-1, мышиные клетки NIH-3T3, здоровые человеческие фибробласты костного мозга, человеческие фибробласты селезенки, здоровые мышиные фибробласты костного мозга и здоровые фибробласты селезенки. Следует подчеркнуть, что в некоторых случаях в зависимости от выбранного вектора и клеточной линии клетки переходят в неопластическое состояние. Важное значение имеет тот факт, что полученные трансформированные клетки обладают способностью к адгезии, посредством которой они обеспечивают иммобилизацию на подложке, например как белковая губка, протеин-покрытие мембраны и тому подобное.
Сразу же после построения вектора для экспрессии требуемого фактора роста его можно использовать для трансформации клеток любым общеизвестным методом. Полученные трансформированные клетки можно использовать для инокуляции подложек, о которых говорилось ранее. Указанные подложки можно вводить в реактор или же они могут присутствовать в реакторе в течение инокуляции.
Реакционную массу затем можно инокулировать надлежащим образом вместе с гемопоэтическими клетками. Гемопоэтические клетки могут содержать практически чистые стволовые клетки, смесь гемопоэтических клеток, практически не содержащую зрелых гемопоэтических клеток одной или нескольких дифференцировок, или смесь, включающую любую из (или практически все) дифференцировки гемопоэтической системы на разных стадиях их созревания.
Клетки подращивают при практически непрерывном прохождении перфузата через реактор и регулировании уровней питательных веществ и факторов роста, включенных в среду. В большей своей части первичные факторы роста поддерживаются стромальными клетками, в результате чего обычно восстанавливается нормальный уровень факторов роста. Поскольку кондиционированные супернатанты, как установлено, обладают эффективностью при выращивании гемопоэтических факторов роста, можно обеспечить соотношение стромальных к гемопоэтическим клеткам, которое поддерживает фактор роста на должном уровне концентраций в указанном реакторе.
Трансфектированная строма позволяет обеспечить интродукцию генов в человеческие стволовые клетки. У мышей ретровирус-опосредованный перенос гена в стволовые клетки можно осуществить предварительно обработкой мышей 5-FV с последующим выращиванием созревающих клеток костного мозга в кондиционированной среде WEHI, содержащей IL-3 и GM-CSF (Lemischka) Cell (1986), 45: 917). Синтезированная строма, выращиваемая с клеточной линией с дефектом упаковки, секретирующая исследуемый ретровирусный вектор, может использоваться для обеспечения эффективной интродукции генов в человеческие стволовые клетки. Так, например, человеческие T-клетки можно сделать резистентными к ВИЧ-инфекции путем инфицирования стволовых клеток ретровирусным вектором, содержащим антисмысловую ВИЧ-последовательность под контролем регуляторной последовательности CDC2 (Greaves, Cell (1989), 56:979-986), которая приводит к тканеспецифичной экспрессии генов в T-клетках. Такой эффект должен оказать фактор, обеспечивающий клеточную линию ретровирусной упаковкой: этот фактор отсутствует в гемопоэтических клетках-мишенях. Как только этот вирус перенесен в гемопоэтические клетки-мишени, то они сразу же теряют способность к репликации.
На фиг. 3А и В изображена радиальная проточная камера 100, имеющая входное отверстие 102 и выходное отверстие 104, и камера 106, где стрелками 108 показано направление потока. Гемопоэтические клетки 110 засевают в стромальный слой 112 в камере и культивируют. Скорость потока будет определяться клетками, которые способны к адгезии, а неадгезивные клетки 114 выходят через выпускное отверстие 104.
На фиг. 4А и 4В камера для культивирования 120 снабжена впускным отверстием 122 и выпускным отверстием 124. На Фиг. 4В впускное отверстие 122 содержит клапанную систему 128, которая снабжает отдельные камеры 126, содержащие клетки 110 и строму 112 и предназначенные для культивирования и разделения.
На рис. 5А и 5В показаны камеры для культивирования, в которых перегородки 134, 136, 138 удаляют в процессе культивирования по следующей схеме: барьеры 134 удаляют приблизительно на 8-10-й неделе, барьер 135 удаляют приблизительно на 18-20-й неделе, а барьер 138 удаляют приблизительно на 28-32-й неделе.
Для более ясного понимания настоящего изобретения, которое в общих чертах описано выше, представлены конкретные примеры, иллюстрирующие, но не ограничивающие рассматриваемое изобретение, если только это не оговорено особо.
Иллюстративное разделение клеток и процедуры окрашивания
Разделение клеток костного мозга на Ficoll
1. Разводят образец костного мозга в отношении 1:4 в I-MDM среде, выдерживаемой при комнатной температуре (среда Дульбекко, модифицированная по способу Исков, GIBCO, кат. N 430-2200).
2. Осторожно слой 5 мл разведенного образца переносят в 15 мл Ficoll-Paque при комнатной температуре (удельный вес 1,077 г/см3, Pharmacia; кат. N 17-0840-02) в 50-мл центрифужной пробирке.
3. Центрифугируют при 700·g (1800 об/мин на Beckmah) в течение 30 мин при комнатной температуре (20oC).
4. После центрифугирования удаляют большую часть верхнего слоя (удаляя приблизительно 5 мл поверх интерфазы), собирают межфазный слой (клетки костного мозга) и три раза промывают в охлажденной льдом среде I-MDM следующим образом:
первая промывка: 1400 об/мин, 15 мин, 4oC;
вторая промывка: 1200 об/мин, 10 мин, 4oC;
третья промывка: 1200 об/мин, 10 мин, 4oC.
5. После третьей промывки клетки суспендируют либо в среде, либо в сбалансированном солевом растворе... (в зависимости от их дальнейшего использования), и подсчитывают клетки после 1:10-разведения клеток в уксусной кислоте (10 мкл клеточной суспензии = 90 мкл 2%-ной уксусной кислоты в PBS, что позволяет подсчитывать только лейкоциты, поскольку эритроциты подвергаются лизису в уксусной кислоте).
6. Затем клетки суспендируют до нужной конечной концентрации в соответствующей среде (для различных применений).
Флуоресцентное окрашивание МY-10 положительных клеток костного мозга
Реагенты
Стандартный буфер:
порошок сухого Бакто-буфера DIFCO (Baxter, кат. N 2314-15GB) - 200 г,
10% NaN3 (азид натрия) - 20 г,
термоинактивированная околоплодная сыворотка теленка (56oC, 30 мин) - 200 мл.
Объем доводят до 20 л в dd - H2O, pH 7,15-7,25, хранят при 4oC. Годен для использования в течение 1 месяца
2%-ный Параформальдегидный раствор:
параформальдегид - 10 г,
dd - H2O - 500 мл,
10 н. NaOH (под вытяжным боксом) - 8-20 капель,
порошковый сухой Бакто-буфер DIFCO - 5 г.
Выливают dd - H2O в 500-мл колбу и размешивают в горячей чашке, нагреваемой до 60oC, в вытяжном шкафу.
Добавляют 10 г параформальдегида.
По капле добавляют NaOH до тех пор, пока раствор не станет прозрачным.
Добавляют 5 г DIFCO.
Раствор охлаждают, а pH доводят до 7,35-7,45 с помощью 2 н. HCl.
1. После подсчета клеток их один раз промывают в стандартном буфере (100 об/мин, 5 мин, 4oC).
2. Затем клетки суспендируют в стандартном буфере при концентрации 2·105 кл/мл.
3. Две 50-мкл аликвоты клеток помещают в 215-мл центрифужные пробирки.
4. В одну пробирку добавляют 50 мкл 1:5-разведения анти-HPCA-1 (антиген против человеческих клеток-предшественников, Becton Dickinson, кат. N 7660, разведенный 1:5 в стандартном буфере). В другую пробирку добавляют 50 мкл 1: 5-разведения MIg (мышиный IgG1-контроль, Becton Dickinson, кат. N 9040, разведенный 1:5 в стандартном буфере).
5. Затем обе пробирки инкубируют на льду в течение получаса.
6. После инкубации клетки два раза промывают в 5-мл стандартном буфере (1000 об/мин, 5 мин, 4oC).
7. После второй промывки клеточный дебрис ресуспендируют в 50 мкл 1: 40-разведении GAM-FITC (аффинно выделенные козьи F(ab'), 2 антимышиные IgG и IgM, адсорбированные человеческие Ig, флюоресцин-конъюгированны, TAGO, кат. N 4353, разведенные 1:40 в стандартном буфере).
8. Клетки инкубируют в течение 1/2 и 1 ч в темноте на льду.
9. После инкубации клетки два раза промывают в 5 мл стандартного буфера (100 об/мин, 5 мин, 4oC), и каждый дебрис ресуспендируют в 100 мкл стандартного буфера + 100 мкл 2% параформальдегидного раствора.
10. Затем клетки анализируют на флуоресценцию с использованием проточного цитометра. Процент положительной флуоресценции равен % флуоресценции в образце анти-HPCA-1 минус % флуоресценции в образце MIg.
Флуоресцентное окрашивание клеток костного мозга для отбора зрелых клеток-предшественников
Цели
Целью такого окрашивания является обогащение гемопоэтическими стволовыми клетками (наиболее примитивными стволовыми клетками) путем удаления зрелыx клеточных популяций, используя проточный цитометр или магнитные микросферы. Почти всегда следует оставлять некоторые клетки в виде полных клеток костного мозга (после разделения на Ficoll) для окрашивания на MY-10-положительные клетки в целях сравнения эффективности сортинга и определения степени обогащения.
1. Клетки разделяют на Ficoll-Paque, как описано выше. (Выделяют 0,5·106 клеток и разделяют на две части для окрашивания анти-HPCA-1/GAM-FITG и MIg/CAM-FITC).
2. После третьей промывки клеточный дебрис суспендируют в коктейле, содержащем моноклональное антитело (см. описание изготовления этого коктейля), используя 1 мл коктейля на 107 клеток, и клетки инкубируют на льду в течение 1 ч.
3. Затем клетки промывают три раза в избытке охлажденной льдом I-MDM-среде (1000 об/мин, 5 мин, 4oC).
4. После третьей промывки клетки суспендируют в 1:40-разведении GAM-FITC (разведенном в I-MDM, нестандартный буфер) при расходе 50 мкл на 0,25·106 клеток и инкубируют на льду в темноте в течение 1/2 ч.
5. После инкубации клетки промывают три раза в охлажденной льдом I-MDM-среде, а после последней промывки клетки суспендируют в 2-4 мл охлажденной льдом I-MDM и выдерживают на льду до проведения сортинга.
6. Затем клетки сортируют на флуоресцентном проточном цитометре для исключения верхних 85%-ной флуоресцентной гистограммы. Для лучшего обогащения сортинг можно повторить дважды.
7. После сортировки клетки подсчитывают, промывают и аликвоту окрашивают на MY-10-положительные клетки (как описано выше) в целях определения степени обогащения по сравнению с окрашенными аликвотами полных клеток костного мозга.
Отбор на незрелые клетки с использованием магнитных антител
1. После осуществления стадий 1-3 в процедуре флуоресцентного окрашивания клеток костного мозга отсортировывают зрелые клетки.
Внимание! азид натрия не входит в состав какого-либо из буферов.
2. При этом соответствующее количество магнитного козьего антимышиного Ig (Biomag: Collaborative Research; кат. N 74340-50, 1 мг/мл, 5·108 частиц/мл) промывают три раза в охлажденной льдом I-MDM-среде при 1500 об/мин, 5 мин, 4oC (для отмывки азида натрия, который использовали в качестве консерванта).
3. Ресуспендируют клеточный дебрис, полученный после третьей промывки в "стадии 1" в Biomag при уровне 50 частиц Biomag/кл. (например, для 1·106 клеток используют 5·107 частиц, и, следовательно, 0,1 мл Biomag).
4. Клетки осаждают в колбе для тканевых культур T-25 или T-75 (в зависимости от числа клеток) и инкубируют полчаса на льду, периодически встряхивая.
5. После инкубации колбу помещают на плоский магнит (поставляемый Biomag) и закрепляют с помощью резиновой или липкой ленты, и инкубируют 10-15 мин при 4oC.
6. Магнит и колбу ставят в вертикальном положении и собирают супернатант.
7. Стадии 4-6 повторяют еще два раза.
8. Подсчитывают клетки, промывают один раз в охлажденной льдом I-MDM, выделяют аликвоту для окрашивания на MY-10-положительные клетки и ресуспендируют в соответствующих средах для дальнейшего использования.
I. Замена среды
Материалы и методы
Клетки: клетки костного мозга человека получали из гепаринизированного аспирационного биоптата, взятого из подвздошного гребня волонтеров, давших на это информированное согласие. Костный мозг выделяли путем центрифугирования в градиенте плотности Ficoll-Paque (Pharmacia, N 17-0840-02), и клетки с низкой плотностью (<1,077 г/см3) собирали и три раза промывали средой Дульбекко, модифицированной по способу Исков (IMDM). Между второй и третьей промывками, клетки подсчитывали. Затем клетки высевали на 24-луночные планшеты для тканевых культур (Costar N 3524) с двойным или тройным дублированием при 1, 2 и 5·106 кл/мл при 322 мкл на лунку.
Условия для долгоживущих культур: клетки с низкой плотностью инкубировали в IMDM, дополненной 10% околоплодной сывороткой теленка Laboratories Hyclone, 10% лошадиной сывороткой (Hyclone Laboratories), 1% пенициллин/стрептомицин (Sigma, 10000 ед/мл пенициллина G и 10 мг/мл стрептомицина, кат. N P3539) и 10-5 М гидрокортизона (17-гидроксикортикостерона, Sigma, кат. N H0888) в увлажненной атмосфере, содержащей 5% CO2 и 95% воздуха. Культуры обрабатывали одной из трех сред для обмена: 100%-ная среда для ежедневной замены (7/нед.), 50%-ная среда для ежедневной замены (5,5/нед.) или 50%-ная среда для замены два раза в неделю (1/нед.). Два раза в неделю во время замены среды из каждой лунки с культурой удаляли 50% неадгезивных клеток и подсчитывали с помощью гемоцитометра.
Когда клетки удаляли для подсчета (2/нед.), все среды, удаляемые в процессе подачи 3,5/нед.- и 1/нед.-культур, сохраняли для подсчета клеток, а в лунки подавали свежую среду. Из 7/нед.-культур половину сохраняли для подсчета клеток, а неадгезивные клетки центрифугировали и возвращали в оставшуюся половину удаляемой среды. Затем к каждой лунке добавляли свежую среду для замены среды, удаляемой для счета клеток. Если клетки не удаляли для подсчета, то от каждой лунки с 7/нед. и 3,5/нед.-культурами удаляли 100% или 50% среды соответственно, клетки центрифугировали и возвращали в исходные лунки вместе с добавляемой свежей средой.
Метилцеллюлоза и морфологические анализы: oдин раз в две недели неадгезивные клетки, удаленные для подсчета, высевали в метилцеллюлозу в присутствии эритропоэтина, GM-CSF и IL-3 и подсчитывали гранулоцитарно-макрофагальные колониеобразующие единицы макрофагов (CFV-GM). Аликвоты удаленных клеток цитоцентрифугировали, окрашивали по Райту-Гимзе и осуществляли подсчет дифференцированных клеток.
Статистические анализы: pезультаты продуцирования клеток за две недели выражали как среднее значение ± ср. кв. ош. от дубликатных культур. Вероятность значительных расхождений между группами культур определяли путем сравнения нормализованных величин кумулятивной продукции клеток, полученных от быстро заменяемых культур (7/нед. и 3,5/нед.) по отношению к контрольным культурам (1/нед.) с использованием двустороннего T-критерия. Статистическую значимость считали при 5%-ном уровне.
Результаты
Кинетика продуцирования неадгезивных клеток: продуцирование неадгезивных клеток оценивали как функцию плотности клеточного инокулята (в пределах 1-5·106 кл/мл) и скорости обмена среды. Скорость обмена среды варьировала от обмена одного объема среды в неделю (традиционная культура декстеровского типа) до обмена всего объема среды 7 раз в неделю. Число клеток, собранных два раза в неделю, нормализовали путем деления на число клеток, инокулированных в культуру.
При каждой скорости обмена среды кривые нормализованных значений числа собранных клеток не показывают значительного изменения в зависимости от плотности инокулята. Продуцирование клеток для культур, поддерживаемых при трех режимах обмена: 7/нед., 3,5/нед. и 1/нед., было одинаковым после их нормализации к числу инокулированных клеток на культуру. Сравнение конечной кумулятивной продукции клеток при различных плотностях инокулята не показало значительных расхождений при любом режиме обмена (p > 0,2 при двустороннем T-критерии для всех пар образцов).
В противоположность этому скорость обмена среды имеет очень большое значение для скорости и продолжительности продуцирования клеток в этих культурах. Продуцирование клеток в культурах, заменяемых при режимах 1/нед. (контроль), 3,5 нед. и 7/нед. снижалось в первые несколько недель. Однако это различие в продуктивности культур становилось заметным через 3 недели. Через 3-10 недель продуцирование клеток оставалось постоянным в 7/нед.-культурах, постоянным на более низком уровне в 1/нед.-культурах, но экспоненциально возрастало в 3,5/нед.-культурах. Через 10-12 недель продуцирование клеток снижалось во всех культурах до полного его завершения.
Результаты, полученные для 1/нед. -обмениваемых культур, эквивалентны тем, которые обычно наблюдаются в традиционных культурах декстеровского типа в ряде систем, тогда как быстрообмениваемые культуры 3,5 и 7/нед. обнаруживают повышенную клеточную продуктивность по сравнению с ранее используемыми методами оптимального культивирования. Культуры, у которых половина среды ежедневно обменивалась (3,5/нед.), сохраняли повышенную клеточную продуктивность в течение более длительного времени, чем контрольные (1/нед.) или полностью ежедневно заменяемые культуры (7/нед.). Через 3-9 недель число неадгезивных клеток, собранных от 3,5/нед.-обмениваемых культур, экспоненциально возрастало вдвое каждые 2,1 недели.
Продуцирование клеток при режимах 3,5/нед. и 1/нед. может быть непосредственно оценено путем построения кривой зависимости продуцирования клеток при скорости обмена 3,5/нед. как процент продуцирования культур по отношению к культурам с режимом обмена 1/нед. Эти сравнения показали, что продолжительность первоначальной фазы снижения продуцирования клеток для двух режимов одинакова. Однако через 3,5-18 недель клеточная продуктивность культур с режимом обмена 3,5/нед. остается на постоянно более высоком уровне.
Пролиферативный потенциал культур может быть поэтому определен по их способности продуцировать клетки после первоначальной фазы спада. Нормализованное число кумулятивной продукции клеток, полученной через 3 недели (Σ
Таким образом, увеличение скорости обмена среды от 1/нед. до 7/нед. способствовало увеличению продуцирования клеток примерно на 60% по сравнению с продуктивностью традиционных культур декстеровского типа. В результате скорость обмена среды 3,5 нед. дает почти 3-кратное увеличение продуцирование клеток по сравнению с продуктивностью культур с декстеровским режимом обмена (1/нед.). Статистический анализ этих данных с использованием двустороннего T-критерия показал значительное расхождение между культурами с 7/нед. и 1/нед. -режимами, а также между культурами с 3,5/нед.- и 1/нед.-режимами при уровне значимости 5%. Таким образом, режим обмена среды 3,5/нед. способствует повышению продуцирования клеток по сравнению с традиционным декстеровским режимом 1/нед.
Продуцирование клеток-предшественников гранулоцитов и макрофагов
Анализ на продуцирование клеток-предшественников осуществляли путем воспроизведения экспериментов с данным режимом перфузии среды и данной плотностью инокулята (таблица 2). Скорость перфузии среды оказывала заметное влияние на число продуцируемых клеток-предшественников гранулоцитов и макрофагов. Наибольшую продолжительность продуцирования клеток-предшественников обнаруживали культуры с режимом обмена 3,5/нед. Эти культуры продуцировали предшественников при стабильном уровне через 4-18 недель от начала культивирования.
Оптимальные условия в отношении продуцирования клеток-предшественников давали культуры с режимом обмена среды 3,5/нед. и плотностью инокуляции 5·106 кл. /мл. Эти культуры продуцировали значительное число клеток-предшественников вплоть до 20-й недели после начала культивирования. Статистический анализ с использованием двустороннего Т-критерия показал, что культуры с указанным оптимальным режимом обмена (т.е. 3,5/нед.) продуцируют значительно большее количество клеток-предшественников гранулоцитов и макрофагов после 8-й недели, чем 7/нед.- и 1/нед.-культуры при всех трех плотностях инокуляции при уровне значимости 1%. Число продуцированных клеток-предшественников является важным фактором, поскольку оно является косвенным показателем восстановления стволовых клеток. Клетки-предшественники могут присутствовать в культуре только спустя несколько недель при дифференцировке от более ранних клеток предпочтительно, стволовых клеток, которые все еще находятся в культуре. Таким образом, полученные данные позволяют предположить, что более физиологический режим быстрой смены среды/сыворотки и более высокой плотности клеток может обеспечить условия, при которых будет поддерживаться определенный уровень регенерации стволовых клеток в течение пяти месяцев.
Морфология неадгезивных клеток: для определения имеются ли качественные отличия пролонгированнорго гемопоэза, поддерживаемого в 3,5/нед.-культурах, от гемопоэза в других культурах, неадгезивные клетки собирали на 10-19-й неделе, окрашивали и морфологически типировали. При режимах обмена 1/нед. и 7/нед. продуцируемые клетки были в основном макрофагами к 15-й неделе и позже (таблица 3), что полностью совпадало с результатами, полученными в экспериментах, проведенных в других лабораториях. В противоположность этому культуры с режимом обмена 3,5 объемов среды в неделю при плотности инокулята 5·106 кл/мл продуцировали гранулоциты, а также макрофаги через 19 недель. Таким образом, очевидно, что указанные режим обмена и плотность инокулята являются более эффективными для восстановления гранулопоэза in vitro.
II. Замена среды в сочетании с дополнением среды гемопоэтическими факторами роста
Материалы и методы
Клетки: клетки костного мозга человека получали из гепаризированных аспирационных биоптатов, взятых из костного мозга подвздошного гребня волонтеров, давших на это информированное согласие, в соответствии с процедурой, апробированной Университетом мичиганского комитета исследования человека. Костный мозг выделяли путем центрифугирования в градиенте плотности Ficoll-Paque (Pharmacia), и клетки с низкой плотностью (<1,077 г/см3) собирали и промывали 3 раза IMDM. Между второй и третьей промывками клетки подсчитывали. Затем клетки высевали в 6-луночные планшеты для тканевых культур (Costar N 3406) или в 6-луночные планшеты, покрытые коллагеном (коллаген крысиного хвоста типа I, Biocoat. Collaborative Research Inc., кат. N 40400) в дубликате 5·106 кл/мл при 1,5 мл на лунку.
Культуральная среда: использовали среду IMDM (Gibo Laboratories, кат. N 430-2200), содержащую 10% околоплодной сыворотки теленка (Hyclone Laboratories), 10% лошадиной сыворотки (Hyclone Laboratories), 1% пенициллин/стрептомицин (Sigma, 10000 ед/мл пенициллина G и 10 мг/мл стрептомицина, кат. N P3539) и 10-5 гидрокортизона (17-гидроксикортикостерон, Sigma, кат. N H0888).
Полученный результат подтверждает гипотезу относительно того, что условия, используемые для долгоживущих культур декстеровского типа, являются субоптимальными, и что может быть получена in vitro культура, которая имеет лучшее приближение к условиям гемопоэза in vivo и является более эффективной для регенерации костного мозга ex vivo.
Физические характеристики: скорость обмена среды значительно влияет на внешний вид культур. На 10-ю неделю в 7/нед.-культурах наблюдается большое число липоцитов в строме, тогда как 3,5/нед.-культуры имеют очень мало жировых клеток, а 1/нед.-культуры вообще не имеют жировых клеток. При истощении культуры на 26-й неделе строма 7/нед.-культур состоит приблизительно из 20-30% жирных клеток, тогда как 3,5/нед. культуры имеют к этому времени лишь несколько жирных клеток. Распределение адгезивных колоний также варьирует в зависимости от скорости перфузии среды. Адгезивные колонии в 3,5/нед.-культурах являются более персистентными, чем колонии в 7/нед.- и 1/нед.-культурах.
Гемопоэтические факторы роста (HGH): было обнаружено, что благодаря частому восполнению культуры посредством быстрой смены среды добавляемые к среде гемопоэтические факторы роста приблизительно в концентрации 1/20 способствуют максимальному образованию колоний в клональных анализах 4. При этом использовали следующие концентрации: 1 нг/мл 1-3, 1 нг/мл GM-CSF (Amgen Biological, кат. N 13050), 0,1 ед/мл Epo (Terry Fox Labs. Ванкувер, Канада).
Анализ на продуцирование гемопоэтических клеток-предшественников: неадгезивные гемопоэтические клетки, выделенные из культуры, подсчитывали и высевали в метилцеллюлозу при концентрации клеток 1·105 кл/мл или меньше. Затем в метилцеллюлозу добавляли GM-CSF и Epo при 20 нг/мл и 2 ед/мл соответственно. Эти клетки высевали в 24-луночные планшеты при 0,25 мл/лунка и инкубировали 14 дней при 37oC. После этого подсчитывали колонии с помощью инвертированного микроскопа, и колонии с более чем 50 клетками считали как колониеобразующие единицы гранулоцитов и макрофагов (CFU-GM), эритроцитную бурстобразующую единицу (BFU-E), или колониеобразующую единицу гранулоцитов-эритроцитов-макрофагов-мегакариоцитов (CFU-GEMM).
TBMC-условия: культуры инкубировали при 37oC в увлажненной атмосфере, содержащей 5% CO2 и 95% воздуха, и перфузировали при режиме ежедневной смены 50% среды. В течение первой недели культивирования 50% всех неадгезивных клеток удаляли из культур два раза в неделю во время обмена среды, мононуклеарные клетки подсчитывали, а в лунки возвращали свежую среду. В остальные пять дней в неделю, когда клетки не подсчитывали, из каждой лунки с культурой удаляли 50% среды и заменяли свежей средой, а удаленную среду центрифугировали, среду декантировали с клеточного осадка, а клетки возвращали в их первоначальные лунки.
Статистические анализы: вероятность значимого расхождения между группами культур определяли путем сравнения нормализованных значений кумулятивной продукции клеток от быстро перфузированных культур, дополненных гемопоэтическими факторами роста, с необработанными контрольными культурами, используя двусторонний T-критерий. Статистическую значимость считали при уровне 5%. При этом не наблюдалось статистических различий между быстро перфузированными LTBMC, культивированными на пластике и на коллагене типа I крысиного хвоста, при уровне значимости 5%. Поэтому данные для пластикового и коллагенового матрикса объединяли для представления на графиках, и для проведения статистических анализов.
Результаты
Кинетика продуцирования клеток в быстро заменяемых и дополненных фактором роста LTBMAc-культурах
Поскольку первый тест проводили для проверки гипотезы относительно того, что продолжительность и продуктивность долгоживущих культур костного мозга (LTBMC) ограничиваются недостаточным продуцированием НСГ, то были использованы быстро заменяемые ex vivo культуры костного мозга, в которые были добавлены IL-3 или Epo. В этих культурах 50% среды удаляли ежедневно в заменяли равным объемом свежей среды, дополненной IL-3 или Epo. Затем удаленные клетки центрифугировали, среду декантировали и отбрасывали, клетки ресуспендировали и возвращали в исходные культуры. IL-3 и Epo отдельно усиливали клеточную продуктивность быстро заменяемых LTBMC. Культуры, содержащие только один Epo, вначале имели высокую степень продуцирования клеток благодаря значительной конечной эритроидной дифференцировке. Однако на четвертой неделе эритропоэз прекращался, и скорость продуцирования клеток снижалась до уровня контрольных культур. IL-3 и Epo индуцировали в среднем повышенное продуцирование неадгезивных клеток по сравнению с контролем в течение 18 недель культивирования на 175 и 173% соответственно.
Объединение факторов роста дало большую эффективность в повышении скорости продуцирования неадгезивных клеток. Наибольшая степень клеточной продуктивности наблюдалась при комбинации IL-3+GM-CSF+Epo. Эти культуры продуцировали приблизительно 25% числа клеток, инокулированных два раза в неделю в течение первых шести недель, и имели в среднем 4,8-кратное увеличение продуцирования неадгезивных клеток по сравнению с контролем в течение 2-8 недель. Комбинация IL-3+GM-CSF давала в среднем 3,5-кратное увеличение в продуцировании неадгезивных клеток по сравнению с контролем в течение восьми недель. В отдельных экспериментах добавление либо IL-6, либо G-CSF к комбинации IL-3+GM-CSF+Epo вместо ожидаемого повышения степени продуцирования неадгезивных клеток не давало заметного отличия от культур, содержащих IL-3+GM-CSF. Во всех случаях стимулирующее действие на клеточную продуктивность, индуцированное добавлением HGF, было максимальным в течение 0-8 недель, хотя продуцирование клеток было более высоким по сравнению с контролем в течение всего времени культивирования.
Комбинации HGF дают высокие абсолютные значения неадгезивных клеток, продуцированных в быстро заменяемых LTBMC-культурах. Продуктивность культур может быть продемонстрирована путем сравнения кумулятивного числа клеток, продуцированных в течение периода времени (Σ
Комбинация IL-3+GM-CSF+Epo способствует индуцированию кумулятивной продукции клеток, которая в три раза превышает число инокулированных клеток. Степень продуцирования клеток была наиболее высокой в течение первых шести недель культивирования, в течение которых культура продуцировала примерно столько клеток, сколько было инокулировано каждые две недели. Эта максимальная степень продуцирования клеток составляла 15% от оцененной in vivo степени продуцирования клеток костного мозга, где ежедневно генерировалось 50% миелоидной клеточной массы. Комбинация IL-3+GM-CSF давала более чем 2-кратную экспансию числа клеток, и при скоростях, сравнимых с теми, что давала комбинация IL-3+GM-CSF+Epo в течение 3-7 недель. Необработанные быстро заменяемые (ежедневный обмен 50% среды) и медленно заменяемые (обмен 50% среды два раза в неделю) контрольные культуры, которые не дополнялись HGF, продуцировали клетки, число которых составляло примерно 1- и 0,37-кратное значение по отношению к числу инокулированных клеток через 18 недель соответственно. Важно отметить, что более половины всех клеток, удаленных из этих недополненных культур, приходят от первых двух выборок, что указывает на то, что многие из этих клеток происходят от исходного инокулята и добавление культур с HGF необходимо для индуцирования заметного чередования предшественников и стволовых клеток.
Морфологический анализ неадгезивных клеток: добавление кратных количеств HGF также приводит к повышению разнообразия миелоидных клеток, продуцируемых в культурах. Контрольные культуры продуцировали неадгезивные клетки, которые через три недели оказались преимущественно макрофагами. Продуцирование эритроидных клеток быстро снижалось, и очень немного эритроидных клеток было обнаружено через 5 недель культивирования. Культуры, содержащие Epo (только Epo, IL-3+Epo и IL-3+GM-CSF+Epo), продуцировали неустойчивое возрастание продуцирования эритроидных клеток, причем высокий процент (55-75%) неадгезивных клеток приходился на эритроиды на третью неделю культивирования. Если присутствовала комбинация IL-3+Epo+GM-CSF, то культуры продолжали продуцировать эритроидные клетки в течение 16 недель, причем около 5-15% неадгезивных клеток были типированы как эритроидные. Таким образом, присутствие IL-3+Epo способствовало активному эритропоэзу.
IL-3±Epo давала популяцию неадгезивных клеток, которую на пятой неделе преимущественно составляли (60-70%) зрелые гранулоциты (LG). Процентное содержание LG постепенно уменьшалось до тех пор, пока на 18-й неделе не достигло около 20%. Продуцирование макрофагов соответственно возрастало. Когда к IL-3±Epo добавляли GM-CSF, то высокий процент LG сохранялся в течение 18 недель. Таким образом, комбинация IL-3+GM-CSF способствовала активному гранулопоэзу в течение 18 ч в культуре, а добавление Epo также поддерживало эритропоэз. Фотомикрограммы контрольных и IL-3+GM-CSF+Epo-дополненных культур на 5,5-й неделе показали резкое увеличение плотности культур и разнообразие продуцированных клеток.
Кинетика продуцирования неадгезивных клеток-предшественников
Продуцирование клеток-предшественников возрастало при добавлении кратных количеств HGF. Продуцирование колониестимулирующих единиц гранулоцитов-макрофагов CFU-GM в необработанных контрольных культурах было длительным и постоянным на протяжении 18 недель, что согласуется с более ранними результатами, полученными с использованием быстро перфузированной LTBMC без добавления HGF. CFU-GM, продуцированные в IL-3+GM-CSF- и IL-3+Epo±GM-CSF-культурах приблизительно в 10 раз выше, чем в контрольных средах в течение 3-5 недель.
Ранее сообщалось, что продуцирование эритроидных бурстобразующих единиц в LTBMC быстро снижается и прекращается (Coutinho и др., Blood (1990) 75 11: 2118-2129). Быстрообменные необработанные контрольные культуры показали быстрое снижение продуцирования BFU-E, хотя низкие уровни BFU-E продуцировались в течение 17 недель в культуре. Добавление одного Epo не оказало значительного влияния на число продуцируемых BFU-E. IL-3 один стимулирует легко кратковременное повышение продуцирования BFU-E в 3-5 недель. С другой стороны, IL-3+ либо Epo, либо GM-CSF индуцируют 10-20-кратное повышение уровней неадгезивных BFU-E по сравнению с контрольными уровнями в течение 3-5 недель культивирования.
III. Трансформация человеческих стволовых клеток
Материалы и методы
Клетки: клетки костного мозга человека получали из гепаризированных аспирационных биоптатов, взятых из костного мозга подвздошного гребня волонтеров, давших на это информированное согласие в соответствии с процедурой, апробированной Университетом мичиганского комитета исследования человека. Костный мозг выделяли путем центрифугирования в градиенте плотности Ficolla-Paque (Pharmacia), и клетки с низкой плотностью собирали (<1,077 г/см3) и три раза промывали IMDM. Между второй и третьей промывками клетки подсчитывали. Для экспериментов с переносом гена костный мозг получали от пациентов с дефицитом CD18 и их информированного согласия.
Отбор клеток костного мозга с негативной реакцией к дифференцировке (Lin-)
Зрелые мононуклеарные клетки выделяли из вышеуказанных клеточных препаратов путем инкубирования этих клеток со смесью моноклональных антител (MAb) после третьей промывки IMDM. 107 клеток инкубировали в 1 мл MAb-коктейля на льду в течение 1 ч, слегка помешивая каждые 10-15 мин. Используемый MAb-коктейль показан в таблице 4.
Клетки промывали 3 раза с избыточным количеством охлажденного льдом IMDM и центрифугировали при 4oC. Соответствующее количество магнитного козьего антимышиного Ig (Biomag; Collaborative Research Corp., кат. N 74340-50, 1 мг/мл, 5·108 частиц/мл) промывали 3 раза в охлажденной льдом IMDM и центрифугировали. Клетки ресупендировали в Biomag при 50 част./кл. и помещали в колбу с тканевой культурой T-25 или T-75, после чего инкубировали на льду в течение получаса, периодически встряхивая. После инкубирования колбу помещали на плоский магнит, прикрепляли к магниту и инкубировали 10-15 мин при 4oC. Магнит и колбу ставили прямо вертикально и супернатант собирали. Описанное инкубирование со встряхиванием, помещением на магнит, установлением вертикально и сбором супернатанта повторяли еще 2 раза. После этого клетки подсчитывали и высевали на 6-луночные планшеты для культивирования тканей (Costar N 3406).
Культуральная среда. В экспериментах использовали среду IMDM (Gibco Laboratories, кат. N 430-2200), содержащую 10% околоплодной сыворотки теленка (Hyclone Laboratories), 10% лошадиной сыворотки (Hyclone Laboratories), 1% пенициллина/стрептомицина (Sigma, 10000 ед/мл пенициллина G и 10 мг/мл стрептомицина, кат. N P3539) и 10-5 М гидрокортизона (17-гидроксикортикостерон, Sigma кат. N H0888).
Гемопоэтические факторы роста. Используемые гемопоэтические факторы роста были описаны выше. Используемые концентрации составляли 1 нг/мл или 0,4 ед/мл IL-3 (полученный из Института генетики, Кембридж, MA), 1 нг/мл GM-CSF (полученный из Института генетики, Кембридж, MA), 50 ед/мл IL-1a (Genzyme Corp.), 0,1 ед/мл Epo (Terry Fox Labs, Ванкувер, Канада), 10 нг/мл MGF (фактор роста тучных клеток, c-Kit-лиганд, Immunex Corp., Сиэтл, WA), и 2,0 нг/мл Гибрикина ([P1XY321] Immunex Corp., Сиэтл, WA).
Анализ на гемопоэтические клетки-предшественники
Неадгезивные гемопоэтические клетки, выделенные из культур во время еженедельного взятия проб, подсчитывали и высевали в метилцеллюлозу при концентрации 1-105 кл/мл или меньше. Затем к метилцеллюлозе добавляли MGF, GM-CSF и Epo при 50 нг/мл, 20 нг/мл и 2 ед/мл соответственно. После этого колонии подсчитывали с помощью инвертированного микроскопа, и колонии более чем 50 клеток квалифицировали как GM-колониеобразующие единицы (CFU-GM), эритроидная бурстобразующая единица (BFU-E) или колониеобразующая единица гранулоцитов-эритроцитов-макрофагов-мегакариоцитов (CFU-GEMM).
Клеточные линии ретровирусных продуцентов.
Линии клеток-продуцентов ретровирусов были получены из лаборатории Dr. Eli Gilboa в Memorial Cloan Kettering Cancer Center, Нью-Йорк, NY. Эта клеточная линия продуцирует амфотропные вирусные частицы, которые содержат NEO-ген, продуцирующий неомицинфосфотрансферазу, обеспечивающую резистентность к аналогу неомицина G418 млекопитающих. Обе клеточные линии также продуцируют ретровирусные частицы, которые не содержат генов, необходимых для ретровируса, поэтому клетки, инфицированные этим ретровирусом не могут сами продуцировать инфекционный вирус.
SAX-содержащая клеточная линия с дефектом упаковки представляет собой клеточную линию на основе 3T3, которая содержит модифицированный вирус мышиного лейкоза Молони (MoMuLV). SAX-провирусы содержат NEO-ген, SV40-активированный ген аденозин-деаминазы, в сайте рестрикции XhoI. SAX-провирусы также содержат Ψ-область, которая не содержит гены gag (капсидные белки), pol (обратная транскриптаза) и env (оболочные белки). Эта вторая ретровирусная частица содержит двойную копию чужеродной ДНК, и эти ретровирусные частицы были обозначены DC-29 (двухкопийный 29-й клон). Провирусы DC-29 содержат 2 копии NEO-гена и другую ретровирусную и чужеродную ДНК в клеточной линии 3T3.
Для CD18-экспериментов, использовали амфотропные с дефектом упаковки клетки Psi-Crip, инфицированные ретровирусным вектором, содержащим человеческую полную (CD19-кДНК, Wilson и др., Science (1990) 248 1413-1416). В этом ретровирусе полную кДНК CD18 человека клонировали в BamHI-сайт вектора, который экспрессирует рекомбинантный ген из гетерологических последовательностей, расположенных в 5'-области гена β-актина курицы, обозначаемого BA-CD18. Последовательности от 5' до предраннего гена (IE) цитомегаловируса человека субклонировали с PUC19, а область, содержащую последовательности энхансера IE удаляли, начиная с XhoI (от полилинкера и по NcoI (-220 гена IH-фрагмент). Синтетические линкеры использовали для превращения NcoI-сайта в XhoI-сайт, а модифицированный фрагмент клонировали в уникальный XhoI-сайт BA-CD18, расположенного в области от 5' до промотора β-актина. Этот новый вектор обозначали CMV-BA-CD18.
Продуцирование ретровирусных частиц
SAX-ретровирусные частицы были получены из лаборатории Dr. Clay Smith Eli Gilboa Laboratory в виде замороженных и хранимых при -80oC растворов вирусного супернатанта. Ретровирусные частицы DC-29 и CD18 продуцировали путем выращивания линий с дефектной DC-29 и CD18-вирусной упаковкой до состояния, близкого к сплошности в колбе T-75, с заменой всей среды, инкубированием клеток в течение 12-15 ч, и с последующим сбором среды, содержащей вирусные частицы. Вирус-содержащий супернатант затем центрифугировали для удаления клеток с жизнеспособной упаковкой, после чего среду удаляли и замораживали в аликвотах при -80oC.
LTBMC с супернатантом, содержащим SAX-ретровирусы, DC-29-ретровирусы или CD18-ретровирусы
Культуры инкубировали при 37oC в увлажненной атмосфере, содержащей 5% CO2/95%. В течение первых двух недель культивирования из каждой лунки с культурой ежедневно удаляли две трети среды (1 мл), и среду заменяли эквивалентным объемом среды, содержащей HGF (0,85 мл) и супернатантом, содержащим клетку-продуцента вируса (0,15 мл). Среду, содержащую ретровирусный супернатант, оттаивали непосредственно до использования, а если среду необходимо использовать срочно, то ее помещали на лед в рефрижератор. Среду, удаленную из культур, центрифугировали, среду декантировали, а клетки возвращали в исходные лунки.
LTBMC, совместно культивированная с клеточной линией, упакованной SAX-ретровирусом
Клеточную линию с SAX-ретровирусной упаковкой культивировали до приблизительно 10%-ной сплошности в колбах T-25 (Costar, N 3056), а затем подвергали облучению в 2000 рад. К облученным клеткам-продуцентам вируса добавляли гемопоэтические клетки, полученные, как описано выше, и культивировали с ежедневной сменой 50% среды в течение 2,5 недели, причем все клетки возвращали в лунки после смены среды. После 2,5-недельного культивирования в колбы добавляли 0,5 мМ раствора ЭДТК в целях удаления гемопоэтических клеток, покинувших строму. Эти удаленные гемопоэтические клетки добавляли в 3 лунки 6-луночной планшеты со свежетрипсинизированными клетками (1000 на лунку) фибробластов костного мозга.
Взятие проб инфицированных LTBMC:
Начиная со второй недели культивирования, после добавления ретровирусов и прекращения совместного культивирования, в культурах заменяли 50% среды ежедневно, причем неадгезивные клетки в заменяемой среде удаляли один раз для анализов. Неадгезивные клетки удаляли из культур во время ежедневного обмена среды, мононуклеарные клетки подсчитывали, а в лунки добавляли свежую среду. В остальные шесть дней недели, когда клетки не подсчитывались, 50% среды из каждой лунки с культурой заменяли свежей средой, удаленную среду центрифугировали, после чего среду декантировали с клеточного осадка, а клетки возвращали в их исходные лунки.
Анализ на ретровирусную инфекцию
Исходный инокулят костного мозга высевали в 0, 0,4, 0,8, 1,2, 1,6 и 2,0 мг/мл G418 для построения кривой ингибирования в целях определения концентрации G418, при которой культивируются постинфицированные клетки. Клетки, выделенные из культур, высевали в метилцеллюлозу с G418 при концентрациях 0,0, 0,8 и 1,6 мг/мл. Через две недели число колоний клеток-предшественников в метилцеллюлозе подсчитывали. Затем отдельные колонии собирали с метилцеллюлозы и анализировали на наличие ретровирусной ДНК с помощью полимеразно-цепной реакции (PCR).
Статистические анализы: вероятность значимого расхождения между группами культур определяли путем сравнения кумулятивных количеств продуцированных клеток от экспериментальных образцов с соответствующими контрольными культурами, используя двусторонний T-критерий. Статистическую значимость считали при уровне 5%.
Результаты
Ретровирусное инфицирование с использованием SAX-ретровирусов
Кинетика продуцирования клеток в LTBMC, инфицированной SAX-ретровирусом.
Продуцирование клеток в культурах, зараженных ретровирусом является показателем вероятности заражения ретровирусной инфекцией, а поэтому может быть использовано в качестве параметра для измерения уровня заражения. Интеграция ретровируса в геном целевой клетки, по всей вероятности, происходит во время деления клетки. По этой причине повышенная продуктивность культуры увеличивает вероятность митоза стволовых клеток, а следовательно, и увеличивает вероятность ретровирусной инфекции. Наиболее высокий уровень продуктивности имеет место в культурах, содержащих супернатант с вирусом, и дополненных IL-3+GM-CSF и IL-3+GM-CSF+IL-1α, которые продуцируют возрастающее число клеток в течение 4 недель культивирования. LTBMC, культивированные совместно с клетками, упакованными SAX-вирусом, продуцировали большее число клеток, чем культуры с добавлением супернатанта за 2 недели, хотя через две недели продуцирование клеток уменьшалось.
Анализ на ретровирусную инфекцию в LTBMC с добавлением супернатанта, содержащего SAX-вирус
Процентное содержание выживших клеток-предшественников при высоких [G418] варьировало от 2 до 50% в культурах, дополненных IL-31GM-CSF или IL-3+GM-CSF+IL-1α в течение первых 4-6 недель культивирования. Через 10 недель культивирования (через 8 недель после окончания добавления вируса) 43% от числа клеток-предшественников, которые были способны к клонированию в гемопоэтические колонии, выживали при воздействии на них G418. Это свидетельствует о том, что эти клетки-предшественники имели приобретенную резистентность к G418 благодаря содержанию гена устойчивости к G418, перенесенного ретровирусом в стволовые клетки, присутствующие в культуре во время первоначального 14-дневного периода инфицирования. Быстрозаменяемые культуры, в которые не были добавлены HGF, имели в среднем 12% выживших клеток-предшественников при высоких [G418] в период от 8 до 11 недели культивирования. После завершения культивирования через 11 недель стромальный слой культур с добавленными IL-3+GM-CSF трипсинизировали, и 17% клеток-предшественников были связаны с выжившей стромой при высоких [G418]. Это позволяет предположить, что значимый процент адгезивных клеток-предшественников был также инфицирован SAX-вирусом.
Анализ ретровирусной инфекции в LTBMC, культивированных совместно с облученными клетками с SAX-вирусной упаковкой
Процент клеток-предшественников, выживших в G418 при совместном культивировании с облученными SAX-клетками, варьировал между 0 и 36%. Культуры, в которые не добавляли HGF, продуцировали CFU-GM, которые выживали при высоких [G418] лишь в течение недель 4-7. После 7-й недели в этих культурах не продуцировались CFU-GM, которые выживали при высоких [G418], что позволяет предположить, что стволовые клетки были очень незначительно инфицированными или вовсе не были инфицированными. LTBMC, дополненные IL-3+GM-CSF и культивированные совместно с облученными SAX-клетками в течение 2,5 недели, продуцировали высокий процент CFU-GM, которые выживали при 0,8 мг/мл G418 на 4-й, 5-й и 8-й неделе. Однако на 10-й неделе, продуцирование CFU-GM в этих культурах резко падало, что объясняется резистентностью CFU-GM к G418. Это позволяет предположить, что в этих культурах стволовые клетки являются мало инфицированными или вообще не являются инфицированными, или что стволовые клетки могут дифференцироваться или погибнуть.
Ретровирусное инфицирование с использованием ретровируса DC-29
Кинетика продуцирования клеток в LTBMC, инфицированных ретровирусом DC-29
Число клеток, продуцированных в культурах, инфицированных супернатантом, содержащим ретровирус DC-29, является HGF-зависимым. Культуры, дополненные IL-3+GM-CSF+Epo, продуцировали 1,5-4·106 клеток, исходя из еженедельной оценки в течение 10 недель культивирования. Культуры, дополненные IL-3+GM-CSF+Epo+MGF, были более продуктивными, а культуры, дополненные Гибрикин+Epo, давали наиболее высокий уровень клеточного продуцирования. Интересно отметить, что контрольные культуры, дополненные IL-3+GM-CSF+Epo, но в которые не был добавлен DC-29-ретровирусный супернатант, были менее производительными, чем аналогичные культуры с добавлением DC-29-ретровирусным супернатантом. Продуцирование клеток в IL-3+GM-CSF+Epo-, IL-3+GM-CSF+Epo+MGF-, и гибрикин+Epo-культурах (с добавлением вируса) было значительно выше, чем в контрольной культуре (IL-3+GM-CSF+Epo, без добавления вируса), при уровнях значимости 5, 1 и 1 соответственно. Некоторая доля повышенного продуцирования клеток в культурах с добавлением ретровирусного супернатанта может быть обусловлена присутствием факторов роста, таких, как MGF (c-Kit-лиганд), который, как известно, продуцируется клеточной линией с дефектной упаковкой на основе 3T3.
Анализ ретровирусной инфекции в LTBMC с добавлением DC-29-ретровирусного супернатанта
Эффективность ретровирусной инфекции оценивали с помощью уровня выживания CFU-GM при 1,6 мг/мл G418, концентрации, которая убивала все клетки костного мозга до инфицирования ретровирусом. Во всех инфицированных культурах (см. таблицу 5), средний процент выживших на 8-й неделе (6 недель после инфицирования) CFU-GM был высоким.
Как оказалось, добавление MGF к комбинации IL-3+GM-CSF+Epo способствовало увеличению эффективности инфицирования на 8-10 неделю культивирования, причем одна из культур содержала 7,7% G418-резистентных колоний. Данные, полученные на 8-й неделе, позволяют предположить, что культуры, в которые были добавлены Гибрикин+Epo,, обладают высокой эффективностью инфицирования, хотя данные, полученные за 10-ю неделю, указывают на отсутствие инфекции. Что касается данных, полученных за 10-ю неделю, то следует отметить, что снижение числа CFU-GM, выделенных из нескольких культур, до очень малого количества или до полного отсутствия CFU-GM должно ожидаться при уровне инфицирования приблизительно 10%. Кроме того, концентрация 1,5 мг/мл G418 представляет собой исключительно высокую дозу антибиотика, очевидно, вполне достаточную для подавления эффективности трансфецированного гена устойчивости к G418 при даже очень небольших субоптимальных уровнях. Таким образом, эффективность гена переноса в гемопоэтические стволовые клетки в этих культурах в некоторых образцах составляла по крайней мере 7,7%, а возможно, 45% или выше.
Кинетика продуцирования неадгезивных клеток-предшественников
Поскольку анализ ретровирусного инфицирования в этих экспериментах зависит от оценки клеток-предшественников для того, чтобы сделать вывод о присутствии стволовых клеток, о инфицировании и изменении клеток, то очень важно оценить влияние HGF на продуцирование клеток в культуре. Кроме того, в этом эксперименте с ретровирусом, MGF и Гибрикин использовали в сочетании с другими HGF. Оба MGF и Гибрикин не использовались в быстро перфузированных HGF-дополненных LTBMC, а поэтому было необходимо оценить их влияние на гемопоэз.
Продуцирование клеток-предшественников очень сильно зависело от добавления HGF. Число CFU-GM, выделенных из культур, показано в таблице 6.
Каждую вторую неделю образцы, взятые из культур, оценивали на CFU-GM, а неоцененные величины определяли путем линейной интерполяции между двумя точками данных. Известные и интерполированные величины суммировали для получения приблизительного значения полного числа CFU-GM, выделенных из культуры.
Добавление ретровирусного супернатанта способствовало увеличению клеток-предшественников в 2,2 раза по сравнению с теми случаями, когда этого добавления не делали. Число выделенных из культур, в которые добавляли ретровирусный супернатант и IL-3+GM-CSF+Epo+MGF или Гибрикин+Epo, в 4,2 и 3,8 раза превышало число CFU-GM от неинфицированных контрольных культур, соответственно. Число удаленных CFU-GM было статистически больше при 1%-ном уровне значимости во всех культурах с добавлением вируса, чем число инокулированных CFU-GM.
Продуцирование клеток-предшественников в культуре
Соотношение популяций в отношении распределения CFU-GM показывает, что добавление MGF или Гибрикина к культурам, дополненным IL-3+GM-CSF+Epo дает значимый положительный эффект в отношении CFU-GM-пула. Добавление MGF к комбинации IL-3+GM-CSF+Epo способствует увеличению выделенных CFU-GM в 1,9 раза, а дифференцировка составляет 0,5-кратное значение по сравнению с аналогичными культурами, в которые не было добавлено MGF (см. таблицу 7).
Каждую вторую неделю образцы, взятые из культур, оценивали на CFU-GM, а неоцененные величины определяли путем линейной интерполяции между двумя точками данных. Известные и интерполированные величины суммировали для получения приблизительного значения полного числа CFU-GM, выделенных из культуры.
Комбинация Гибрикин+Epo оказывала весьма значительное влияние на продуцирование и дифференцировку CFU-GM. Гибрикин+Epo давала 1,8-кратное превышение числа удаленных CFU-GM и более чем 3-кратное превышение дифференцировки CFU-GM по сравнению с ранее оптимальными культурами, дополненными IL-3+GM-CSF+Epo. Кроме того, Гибрикин+Epo способствовала продуцированию почти вдвое большего числа гранулоцитов и макрофагов, чем это имело место в случае комбинации IL-3+GM-CSF+Epo+MGF. Это свидетельствует о том, что Гибрикин является сильным индуктором линии дифференцировки гранулоцитов и макрофагов.
Анализ нейтрофилов, продуцированных из стволовых клеток, инфицированных CD18 кодирующим ретровирусом.
Костный мозг с CD18-недостаточностью обогащали ранними гемопоэтическими клетками, как было описано ранее, а затем культивировали в течение 14 дней с ежедневной заменой 50% среды супернатантом, дополненным 1,0 нг/мл/день GM-CSF и 1,0 нг/мл/день IL-3 и 40 ед/мл/день IL-1α и линией CD18-ретровирусного продуцента. Начиная с 15-го дня клетки культивировали при тех же самых условиях, но без добавления ретровирусного супернатанта. Неадгезивные клетки удаляли из культур еженедельно и анализировали на присутствие CD18 клеточной поверхности путем проточной цитометрии с использованием биотинилированного анти-CD18 моноклонального антитела с помощью стандартных методов (Updyke и др. , Meth. Enzymol. (1986) 12: 717-725). Клетки костного мозга с дефицитом CD18 были не способны экспрессировать белок CD18 клеточной поверхности в данном анализе, тогда, как нейтрофилы и моноциты, число которых возросло в культурах с ретровирусной инфекцией, экспрессировали CD18 клеточной поверхности. В культурах с тройным дублированием, экспрессия CD18 клеточной поверхности 3,5%/5%/2% на 6-й неделе и 11%/28%/3% на 11-й неделе. Поскольку нейтрофилы и моноциты, присутствующие в культурах через 11 недель, способствуют образованию клеток-предшественников CFU-GM только на 10-14 дней раньше, то это свидетельствует о том, что гемопоэтические стволовые клетки являются достаточно и стабильно трансфецированным рекомбинантным ретровирусом в течение первых двух недель культивирования.
Для интерпретации полученных результатов важно понять, что хотя некоторые группы обнаруживают перенос гена ретровируса в гемопоэтические клетки-предшественники человека, однако перенос гена в гемопоэтические стволовые клетки человека не был продемонстрирован. Быстрое снижение продуцирования клеток в традиционных медленно перфузируемых человеческих LTBMC не позволяет определить степень инфицирования вследствие отсутствия клеток-предшественников, необходимых для проведения анализа.
Ретровирусное инфицирование в настоящих исследованиях было сначала оценено путем культивирования клеток, удаленных из LTBMC в метилцеллюлозе в присутствии антибиотика G418 клеток млекопитающих. Клетки-предшественники, инфицированные SAX- или DC-29-ретровирусом, и экспрессирующие NEO-продукт, должны обладать способностью к выживанию и образованию колоний при высоких концентрациях G418, тогда как неинфицированные клетки должны погибать при высоких концентрациях G418. Кроме того, для продуцирования клеток-предшественников, которые выживают при высоких концентрациях G418 через 6 или более недель после окончания добавления вируса, необходимо, чтобы эти клетки были только что дифференцированы из более примитивных клеток (стволовых клеток), а поэтому можно предположить, что стволовые клетки были инфицированы. Аналогично для CD18-экспрессии на поверхности нейтрофилов и моноцитов, продуцированных в течение 11-й недели культивирования, необходимо чтобы примитированная гемопоэтическая стволовая клетка была инфицирована в течение первых двух недель культивирования, поскольку все зрелые клетки, предшественники, и клоногенные предшественники, присутствующие в течение периода инфицирования, погибали через 4-5 недель культивирования.
Анализ на ретровирусную инфекцию, используемый в настоящем исследовании, может дать заниженную оценку процента клеток, инфицированных ретровирусом, вследствие недостаточной экспрессии NEO-генного продукта. Было показано, что недостаточная экспрессия продукта перенесенного гена создает определенные неудобства при использовании моделей человека и приматов. Поэтому, в настоящем исследовании, оценка процента клеток-предшественников, инфицированных как описано выше, является, вероятно, заниженной.
Процент клеток-предшественников, которые выживали при высоких [G418], составлял приблизительно 40% на 10-й неделе в культурах, инфицированных SAX-ретровирусным супернатантом и дополненных IL-3+GM-CSF±IL-1α. Эти предварительные результаты показали, что высокий процент стволовых клеток инфицирован в культурах, дополненных ретровирусным супернатантом, в течение первых двух недель культивирования.
Процент клеток-предшественников, инфицированных DC-29-ретровирусом, был высоким (0-21%) в IL-3+GM-CSF+Epo+MGF и Гибрикин+Epo-культурах в течение первых четырех недель после окончания добавления вируса. Этот высокий уровень инфицирования клеток-предшественников, вероятно, обусловлен прямой инфекцией предшественника и примитивных клеток ретровирусами. Процент клеток-предшественников, выживших в высоких концентрациях G418, снижался через 4 недели после завершения добавления вируса, но 2 недели спустя восстанавливался до 0-22% выживших клеток.
Эксперимент с использованием DC-29 при продуцировании клеток-предшественников, резистентных к G418, вероятно дает заниженную оценку процента клеток-предшественников, инфицированных DC-29-ретровирусом. Высокая концентрация G418, используемая для отбора инфицированных колоний (1,6 мг/мл G418), вдвое превышает концентрацию, используемую в эксперименте с SAX-инфицированием, и для выживания требуются высокие уровни экспрессии NRO-генного продукта, неомицин-фосфотрансферазы.
Интересно отметить, что в LTBMC, в которые добавляли супернатант, содержащий SAX- или DC-29-ретровирус, HGF, IL-3+GM-CSF±Epo, IL-1α, или MGF, или комбинацию гибрикин+Epo, процент клеток-предшественников, выживших в присутствии G418, возрастал через 6-8 недель после завершения добавления вируса. Хотя механизм возрастания процента клеток-предшественников, выживших в присутствии G418, в более поздних стадиях культивирования не известен, однако можно предположить, что стволовые клетки, которые были инфицированы в течение первых двух недель культивирования, становятся более активными в процессе культивирования. Этот факт способствует эффективному возрастанию процента клеток, выживших в присутствии G418. В качестве другого объяснения указанного явления можно предположить, что экспрессия NEO-генного продукта возрастает в клетках-предшественниках, поздно продуцированных в культуре вследствие их дифференцировки из стволовых клеток, которые имеют другую и более экспрессируемую область интегрирования, чем клетки-предшественники, трансфецированные непосредственно в течение начального периода инфицирования культуры. Поэтому высокий уровень выживания клеток-предшественников в поздний период культивирования, хотя и может иметь несколько причин, однако, скорее всего он обусловлен тем, что стволовые клетки были инфицированы в этих LTBMC.
Резюмируя вышесказанное, можно утверждать, что полученные данные свидетельствуют о том, что в условиях культивирования, раскрытых в данной заявке, гемопоэтические стволовые клетки пролиферируют в данных культурах, что позволяет вводить в эти клетки генетический материал, переносимый посредством ретровируса. Клетки-предшественники постоянно и активно продуцировались из этих стволовых клеток, и многие из этих предшественников содержали и экспрессировали трансфецированные гены. Полученные данные показали, что генетически модифицированные гемопоэтические стволовые клетки человека присутствовали и пролиферировали в указанных культурах.
IV. Эксперименты
I. Конструирование трансформантов
Человеческий фактор роста GM-CSF (Wong. Science (1984) 228: 810-815) вводили эукариотический вектор экспрессии. hGM-CSF-кДНК (EcoRI-AhaIII-фрагмент, приблизительно 700 п.о.) клонировали в EcoRI-PstI-фрагмент pSP65 (Melton, Nucl. Acids. Res. (1984) 2: 7035-7056). Полученную плазмиду обозначали P65GM-CSF. Промотор мышиного металлотионеина (Glanville, Nature (1981), 292: 267-269) переваривали EcoRI и BgIII, и фрагмент приблизительно 2 kb, содержащий этот промотор, инсертировали в EcoRI-BamHI-фрагмент pSP65 для получения p65T. Затем конструировали плазмиду pMT GM-CSF путем переваривания pSP65GM-CSF с помощью EcoRI, заполняя "липкие" концы с помощью фрагмента Кленова ДНК-полимеразы 1 с последующим перевариванием полученной линеаризованной ДНК с помощью HindIII для выделения 700 п.о.-фрагмента, содержащего кодирующую область GM-CSF. Этот фрагмент субклонировали в SalI - заполненный HindIII-сайт p65MT. Затем 2,7 kb-фрагмент, содержащий промотор металлотионеина и GM-CSF кодирующую область, выделяли и вводили в pSV2neo (Southen и Berg. J. Mol. Appl. Genet (1982) 1:327), из которой удаляли промотор SV-40. Это приводило к тому, что SV-40-поли A-сигнал находился ниже (5'--->3') от GM-CSF-кодирующей последовательности.
Неомицин-резистентный ген, который сообщал резистентность к антибиотику гентамицину (G418) брали от pSV2neo путем выделения PvuII-EcoRI-фрагмента приблизительно в 3 kb и вводили EcoRI-линкеры в PvuII-сайт. Ген neo-резистентности с EcoRI-концами субклонировали в EcoRI-сайт GM-CSF-экспрессирующей плазмиды для конструирования плазмиды MTGM-CSFneo.
Плазмиду MTGM-CSFneo отдельно и в качестве котрансфектанта с плазмидой (Yang, Cell (1986) 47: 3-10), кодирующей ген IL-3 гиббона (обезьяны) под контролем SV-40-промотора и поли-A-сайта, трансфецировали путем электропорации линеаризованной ДНК в клеточную линию CVI африканской зеленой мартышки и клетки мышиной клеточной линии NIH 3T3. Трансформанты отбирали путем селекции в среде, содержащей 500 мг/мл G418, выделяли и скринировали на продуцирование GM-CSF или IL-3 с помощью биоанализа супернатантов с использованием клеток AML-193 (Adams и др., Leukemia (1989) 3:314). Некоторые позитивные линии затем использовали в качестве стромы для клеток костного мозга в декстеровской культуре.
Кроме того, нормальные клетки мышиного костного мозга трансфецировали с вышеуказанными плазмидами, используя кальций/фосфатный метод Okayama (Chen. Mol. Cell. Biol. (1987) 7: 2745-2752), и как было установлено, они эффективно экспрессировали введенные гены.
Было исследовано секретирование GM-CSF и IL-3 трансфецированными фибробластами. Супернатанты 72-часовой культуры, не содержащей сыворотку, получали от клеток NIH-3T3 и анализировали на секрецию hGF путем 3H-поглощения на целевых клетках, ингибируемого посредством нейтрализации кроличьих анти-GM-CSF или анти-IL-3 антител. Пролиферацию, индуцированную 20 мг/мл GM-CSF, устанавливали как 100 ед. GM-CSF, а пролиферацию, индуцированную 10 нг/мл IL-3, устанавливали как 100 ед. IL-3. Эти совместно трансфецированные клетки продуцировали около 35 ед./мл GM-CSF и около 57 ед./мл IL-3.
II. Перфузионная камера
Перфузионная камера представляла собой стеклянный цилиндр с крышками Derlin, которые позволяют осуществлять автоклавирование без деформации и биосовместимости. Эти крышки имеют цилиндрические бороздки, в которые вставляется стеклянный цилиндр. На дно бороздки помещают уплотнительное кольцо для герметизации просвета в камере. Указанные крышки имеют несколько отверстий, в которые вставляются фитинги Leuer (Leuer Lok), а в них вставляются линии подачи среды и газа, а также удлинительный трубопровод, ведущий в центральную секцию камеры для взятия проб адгезивных и/или неадгезивных клеток. Эти крышки прикрепляются тремя длинными болтами, разнесенными на 120o и расположенными вне стеклянного цилиндра, при этом для плотной сборки использовали кольцевые прокладки и гайки.
Эта камера присоединена к боковому резервуару. Эта петля содержит насос, камеру датчиков, работающих в реальном режиме времени, оксигенатор и в дополнение к боковому резервуару отверстия для взятия проб и инъекций. Среда в боковом резервуаре затем медленно обменивают с использованием отдельного насоса. Такая конфигурация позволяет отдельно контролировать скорость обмена среды и скорость потока через оксигенатор и перфузионную камеру. Оксигенатор используется для контроля длительного обмена состава среды и перфузии, а перфузионная камера может быть использована для контроля давления растворенного кислорода и структуры потока в камере. Использование полисульфонатной мембраны с мелкими отверстиями позволяет осуществлять поршневый режим потока и точный контроль подачи факторов роста и других специфических соединений, которые необходимо вводить биореактор в очень точных количествах.
Трансфецированные стромальные клетки высевают либо поверх слоя измельченной коллагеновой губки, либо их высевают на одну сторону 5-мкм пористого поликарбонатного фильтра, предварительно покрытого коллагеном, что позволяет стромальным клеткам связываться с фильтром в течение нескольких часов. Клетки культивируют в соответствующей питательной среде до тех пор, пока клетки не достигнут состояния сплошности на одной стороне, а цитоплазматические выбросы осуществляли через поры. Затем клетки костного мозга высевали на другой стороне мембраны, и стволовые клетки связываются с внедренными цитоплазматическими выбросами, проходящими через поры.
После автоклавирования камеры и компонентов петли реактор монтировали в стерильных условиях. Затем среду пропускали через боковую петлю и камеру путем ее циркулирования в течение нескольких дней, и контролировали на признаки загрязнения. Центральную часть биореактора затем инокулировали либо одним внеклеточным матриксом, либо заранее инокулированной подложкой для внеклеточного матрикса, который содержал стромальные клетки. Стромальные клетки могут затем содержаться в камере в течение нескольких дней, и контролировали их метаболическую продуктивность и/или реактивность фактора роста, и если результаты были удовлетворительными, то костный мозг инокулировали или сразу засевали камеру костным мозгом. В любом случае, клеточный слой выдерживали на дне центральной секции перфузионной камеры.
Клетки засевали на внеклеточный матрикс и клеточный слой приклеивался с подложкой. При использовании мембраны камера может быть перевернута и клеточный слой будет располагаться на потоке центральной секции. При этой конфигурации созревающие клетки оседают на дно центрально камеры, поскольку они теряют свою адгезивность по отношению к стромальному слою. Неадгезивные клетки затем собирают посредством постоянного клеточного потока, вызываемого давления перфузии среды, и направляемого в выпускную трубу.
В обычном цикле камеру инокулируют клетками NIH-3T3 в первый день эксперимента, высевая на подложку из измельченной коллагеновой губки. В течение первых 40 дней корректируют скорости перфузии и другие параметры операции. На 40-й день достигаются стационарные условия, которые поддерживаются в течение около 20 дней. На 64-й день камеру засевают 33·106 клетками костного мозга. В течение первых 10 дней число собранных клеток уменьшается до тех пор, пока оно не установится на устойчивом уровне около 7-8·105 клеток каждые три дня. Проточный цитометрический анализ показал, что постоянная фракция, около 20% собранных клеток была HLA-DP-положительна. На 90-й день насос отключали и pH падало ниже 6,9 в течение ночи. При восстановлении скорости перфузии продуцирование неадгезивных клеток восстанавливалось и приближалось к предыдущему устойчивому уровню продуцирования, если имела место бактериальная контаминация. На этой стадии исследование завершали.
Полученные результаты показали, что перфузионная камера позволяет осуществлять гемопоэз ex vivo, гемопоэз может быть восстановлен ex vivo после падения pH, а данные о концентрации глюкозы указывают на то, что гемопоэтические клетки сначала развиваются аэробно на глюкозе, поскольку концентрация глюкозы падает после инокуляции, а концентрация лактата при этом не возрастает, что свидетельствует о том, что оксигенация является ограниченной. Очевидно, что глюкоза/лактатный (анаэробный) метаболизм прежде всего обусловлен стромальным слоем IH-3T3. Аналогично, концентрации глутамина и аммиака достигают уровней до инокуляции после того, как число гемопоэтических клеток снижается, что указывает на то, что поглощение глутамина клетками костного мозга гораздо меньше, чем поглощение стромального слоя.
III. Контролирование продуктов метаболизма
Скорость поглощения и образование глюкозы и лактата, а также глутамина и аммиака определяли для трансфецированных клеток NIH-3T3. (Использованная среда: IMDM + 20% околоплодной сыворотки теленка). Возрастание поглощения глюкозы наблюдалось лишь для ежедневно питаемых T-колб, тогда как подпитываемые культуры показывали одинаковое медленное снижение уровня поглощения глюкозы. Культуры, в которых режим обмена с 50%-ного ежедневного меняли на 100%-ный ежедневный на 18-й день культивирования, показывали непосредственное повышение поглощения глюкозы с той же тенденцией, которая наблюдалась для культур со 100%-ным ежедневным обменом с первого дня культивирования. Скорость продуцирования лактата имела аналогичный характер, поскольку их соотношение было в основном постоянным (лактат/глюкоза = 0,9, что указывает на преимущественно анаэробный стромальный метаболизм).
Концентрации глутамина и аммиака были такими же по своему характеру, как в случае глюкозо-лактатного метаболизма. С использованием величин, скорректированных на химическое разложение глутамина при 37oC, было показано, что соотношение уровней поглощения глутамина и глюкозы остается постоянным, около 1:8 = глутамин:глюкоза. Это предсказанное оптимальное отношение варьирует в зависимости от скорости поглощения кислорода (это отношение снижается с увеличением его оптимального уровня поглощения).
Аналогичные выводы были сделаны относительно данных для метаболизма глюкозы/лактата, полученных от нормальных фибробластов стромального костного мозга. В условиях частой смены среды, культуры сначала являются анаэробными с постоянными высокими и быстро достигаемыми уровнями лактата. При более частой смене среды, клеточный метаболизм становится более быстрым, с возрастанием поглощения глюкозы и продуцирования лактата. После коррекции данных за спонтанное химическое разложение, какого-либо значительного поглощения глутамина не наблюдалось. Исследования с клетками 3T3 и нормальными клетками костного мозга показали, что клетки продолжали делиться и быстро расти при скорости обмена сыворотки/среды, которая превышала, очевидно, критический режим смены среды.
Для оценки относительной важности скорости перфузии сыворотки по отношению к скорости перфузии питательной среды были проведены следующие эксперименты: 1) одна серия - с использованием T-колб с ежедневным обменом среды, содержащей 20% сыворотки, 2) две серии с T-колбами, где в одной серии использовали 20% сыворотки, а среду меняли через день, а в другой серии использовали 10% сыворотки с ежедневным обменом среды, 3) две серии с T-колбами, где в одной содержалось 10% сыворотки и среда менялась через день, а в другой содержалось 5% сыворотки с ежедневным обменом среды, 4) две серии с T-колбами, где одна содержала 5% сыворотки с обменом среды через день, а другая содержала 2,5% сыворотки с ежедневным обменом среды. Скорость обмена сыворотки в каждой группе была одинаковой, тогда как скорость обмена питательной среды варьировала. Результаты указанных серий экспериментов показали, что скорость обмена сыворотки является критическим параметром. Хотя для эксперимента (1) поглощение глюкозы возрастало, и на 4-й день выравнивалось до уровня приблизительно 9,5 мМ в день, однако во всех других случаях, поглощение глюкозы было ниже исходного поглощения глюкозы группы (1) и падало примерно линейно независимо от того, использовалось ли двойное количество сыворотки, и от того ежедневно ли или через день меняли среду. Полученный результат подтверждает вывод относительно того, что скорость перфузии сыворотки или одного или более из ее компонентов является критическим параметром, который оказывает влияние на характер метаболического роста стромальных клеток.
Из вышеуказанных результатов очевидно, что гемопоэтические клетки могут быть с успехом культивированы в биореакторе. Стромальные клетки могут быть получены из гомологичных или гетерологичных источников, причем эти стромальные клетки могут быть трансфецированы генами для обеспечения важными факторами роста. Таким образом, для поддержания роста клеток не обязательно добавлять к среде сыворотку. Получение стромальных клеток, которые прикрепляются к подложке так, что гемопоэтические клетки можно отделять от стромальных клеток, позволяет постоянно собирать гемопоэтические клетки для использования. Путем соответствующего подбора комбинаций факторов могут быть культивированы гемопоэтические клетки с конкретным направлением дифференцировки. Кроме того, если необходимо, стромальные клетки могут пополнить запасы трансфецирующих вирусов для введения генов в гемопоэтические клетки.
Все цитируемые в настоящей заявке публикации и патентные заявки вводятся в ее описание посредством ссылки, если только это не оговорено особо.
Очевидно, что в настоящее изобретение могут быть внесены различные изменения и модификации, не выходящие, однако, за рамки существа и объема изобретения, сформулированные в формуле изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| СТВОЛОВЫЕ КЛЕТКИ И РЕШЕТКИ, ПОЛУЧЕННЫЕ ИЗ ЖИРОВОЙ ТКАНИ | 2000 |
|
RU2306335C2 |
| МАТЕРИАЛЫ И СПОСОБЫ ЛЕЧЕНИЯ ХРОНИЧЕСКИХ ФИБРОЗНЫХ ЗАБОЛЕВАНИЙ | 2006 |
|
RU2446825C2 |
| СПОСОБЫ СТАБИЛЬНОЙ ТРАНСДУКЦИИ КЛЕТОК ВИРУСНЫМИ ВЕКТОРАМИ | 2001 |
|
RU2280074C2 |
| СПОСОБЫ И КОМПОЗИЦИИ ДЛЯ ДИАГНОСТИКИ И ЛЕЧЕНИЯ РАКА | 1996 |
|
RU2174409C2 |
| СПОСОБЫ РЕЦЕЛЛЮЛЯРИЗАЦИИ ТКАНИ ИЛИ ОРГАНА ДЛЯ УЛУЧШЕНИЯ ПРИЖИВЛЕНИЯ ТРАНСПЛАНТАТА | 2011 |
|
RU2611361C2 |
| ЭРИТРОФЕРРОН И ERFE-ПОЛИПЕПТИДЫ И СПОСОБЫ РЕГУЛЯЦИИ МЕТАБОЛИЗМА ЖЕЛЕЗА | 2013 |
|
RU2684216C2 |
| ПРИМЕНЕНИЕ АНАЛОГОВ АЦИЛФУЛЬВЕНА И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ | 1994 |
|
RU2145849C1 |
| УДАЛЕНИЕ И ВОССТАНОВЛЕНИЕ СОДЕРЖАНИЯ КЛЕТОК В ОРГАНАХ И ТКАНЯХ | 2006 |
|
RU2463081C2 |
| СПОСОБЫ И АППАРАТЫ ДЛЯ ПОДГОТОВКИ КЛЕТОЧНЫХ ПОПУЛЯЦИЙ ДЛЯ КЛЕТОЧНОЙ ТЕРАПИИ | 2016 |
|
RU2761634C2 |
| УНИВЕРСАЛЬНЫЕ АНТИГЕНПРЕЗЕНТИРУЮЩИЕ КЛЕТКИ И ИХ ПРИМЕНЕНИЯ | 2019 |
|
RU2809113C2 |
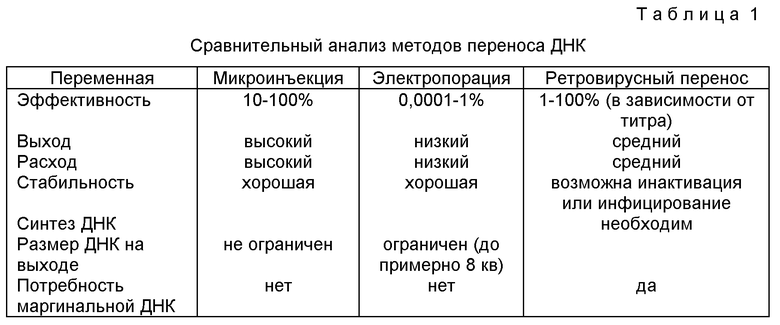
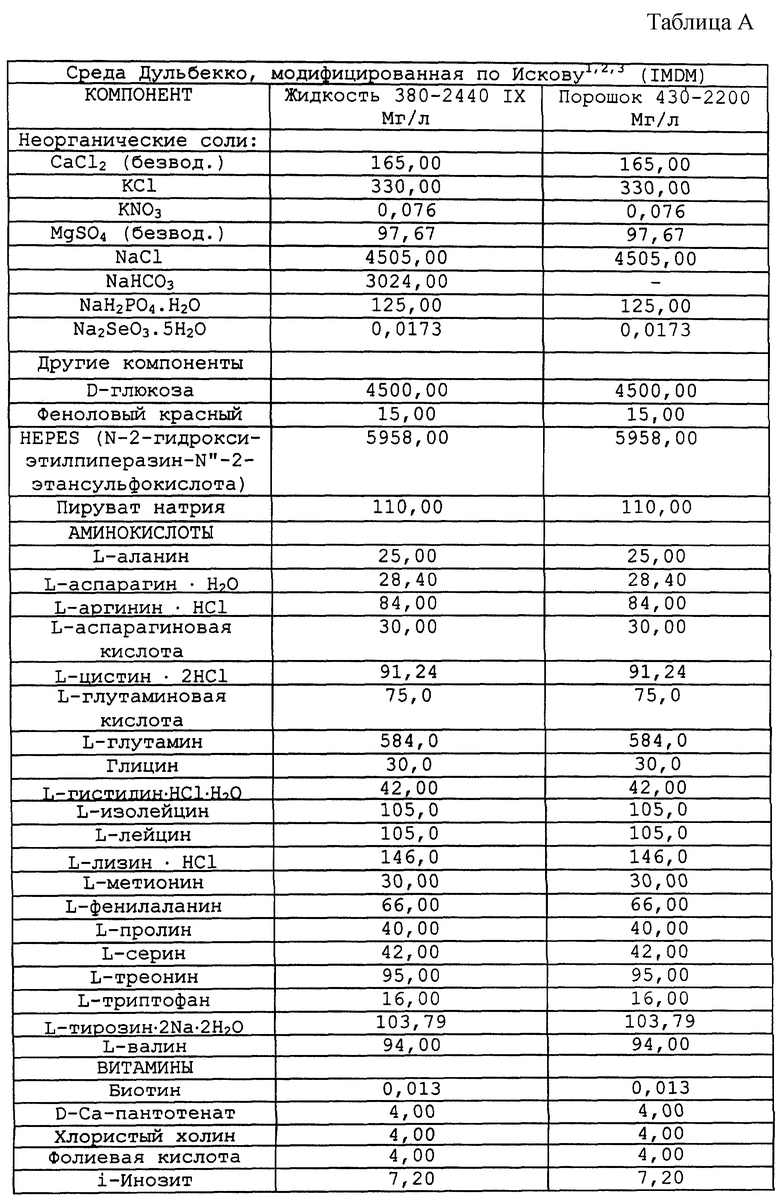
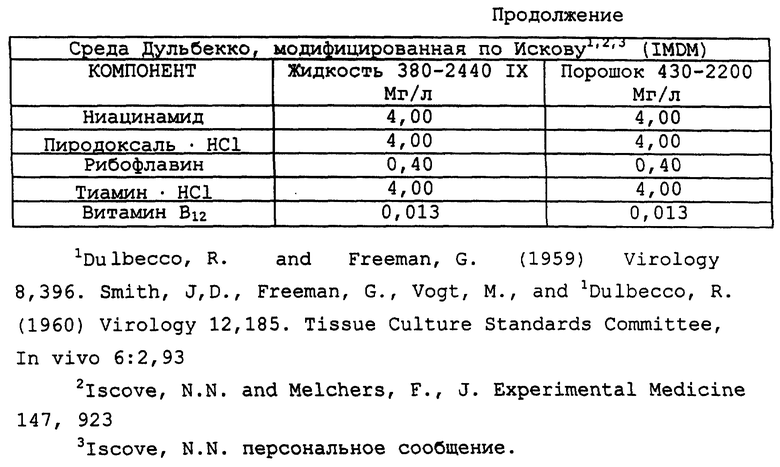
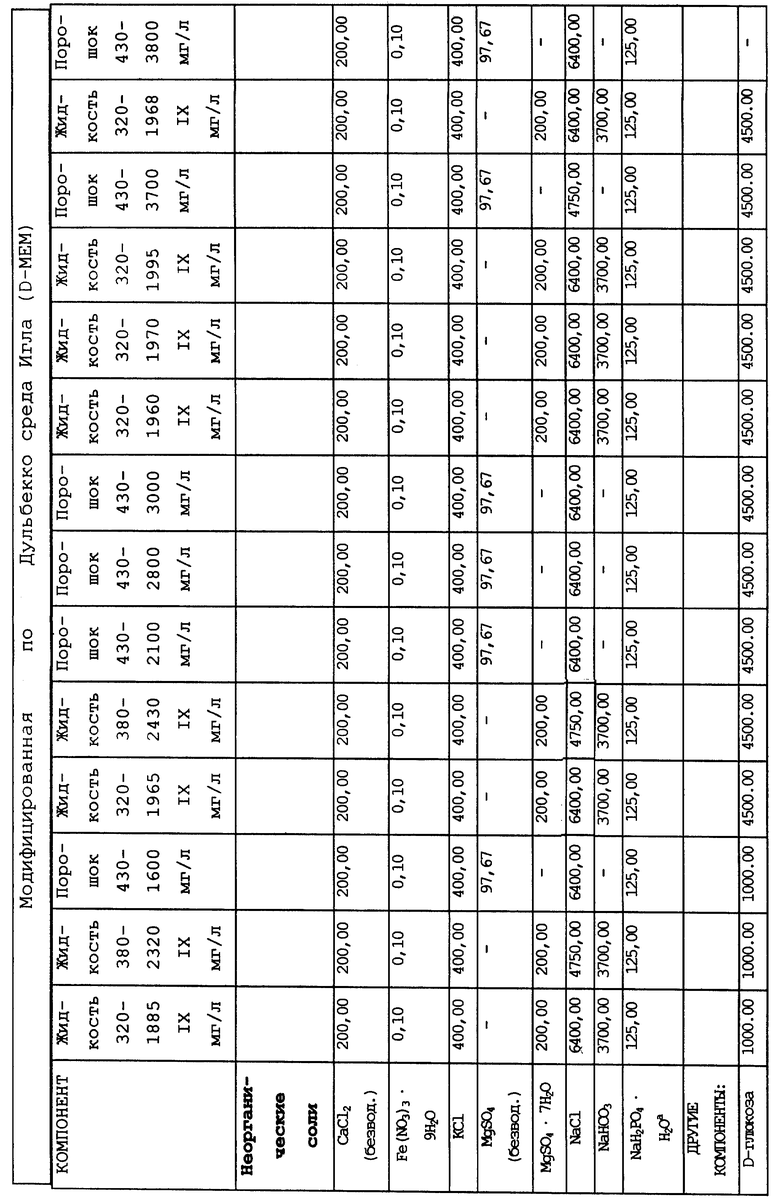
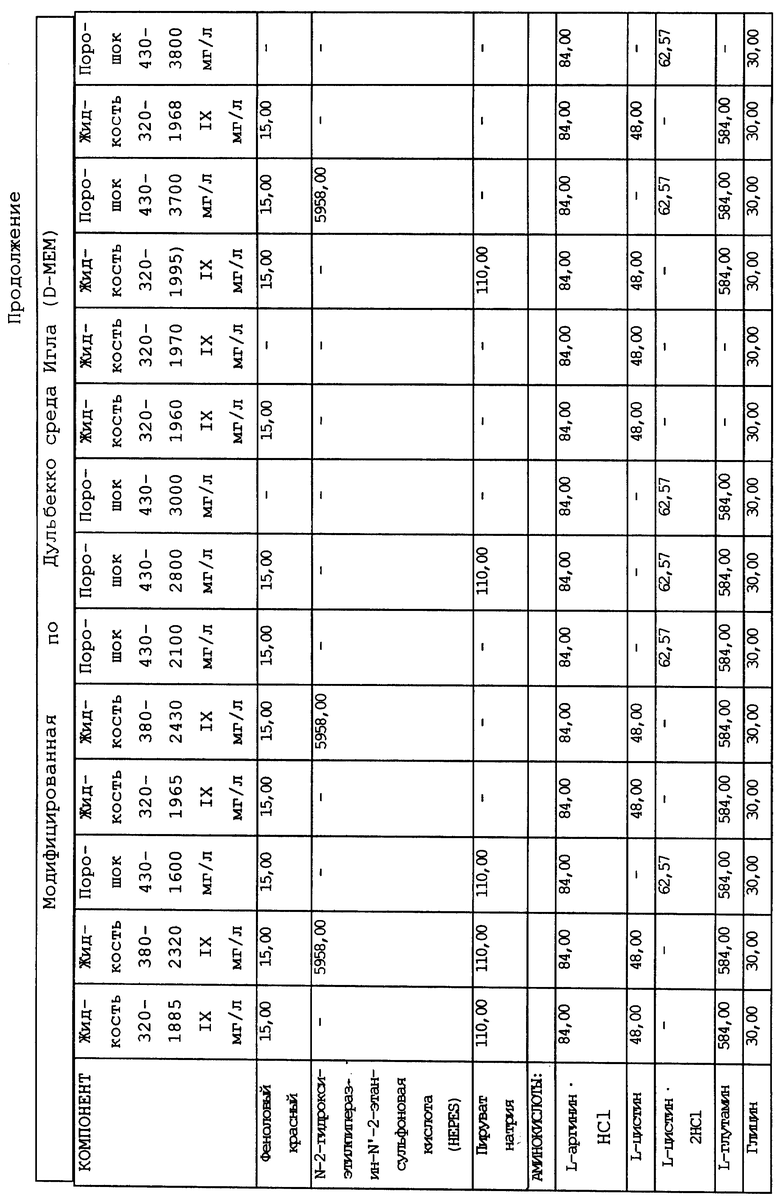
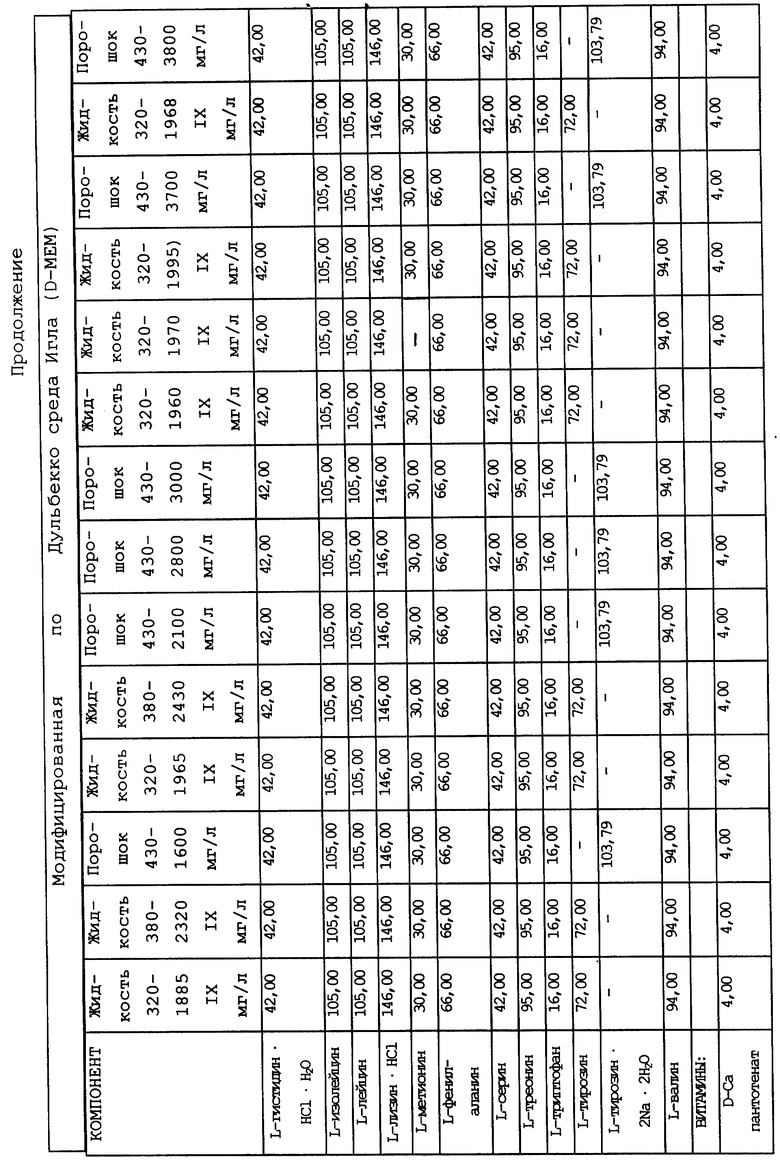
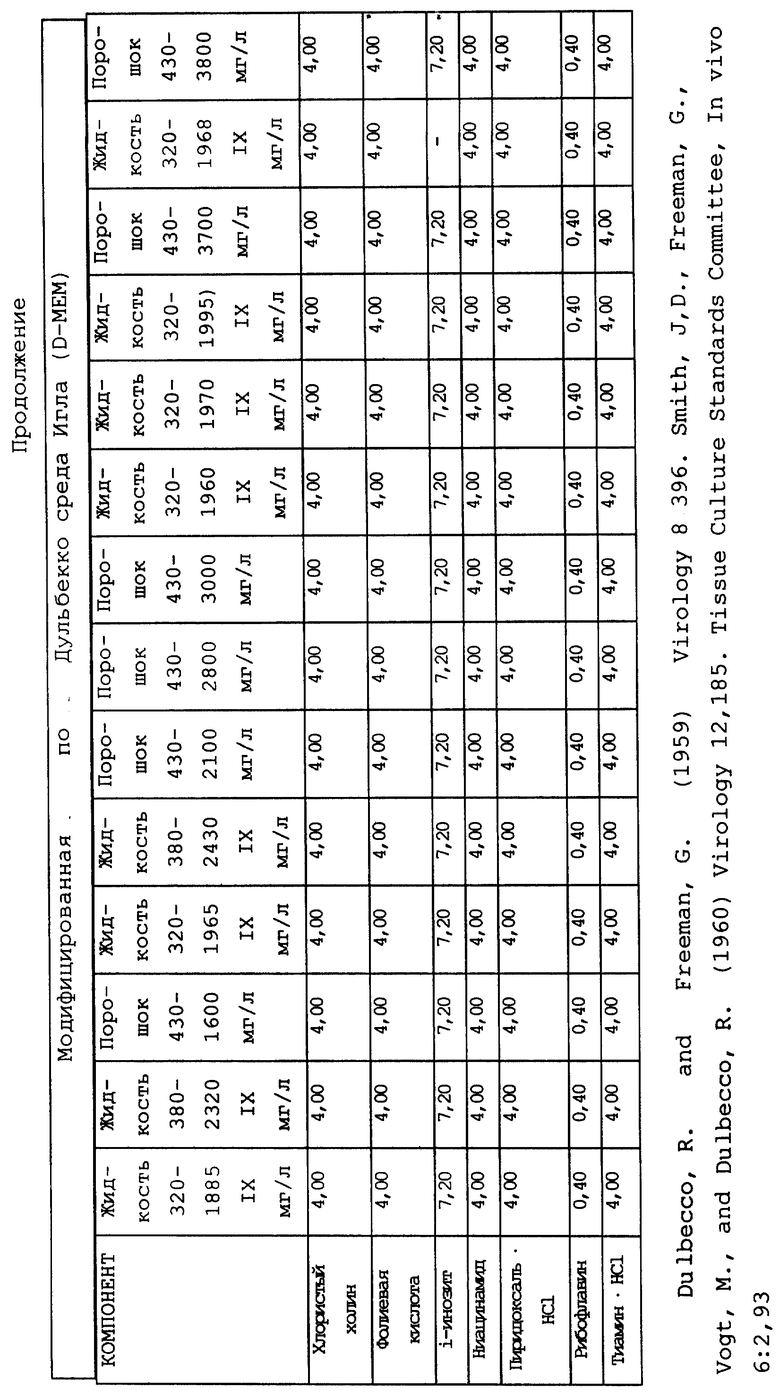
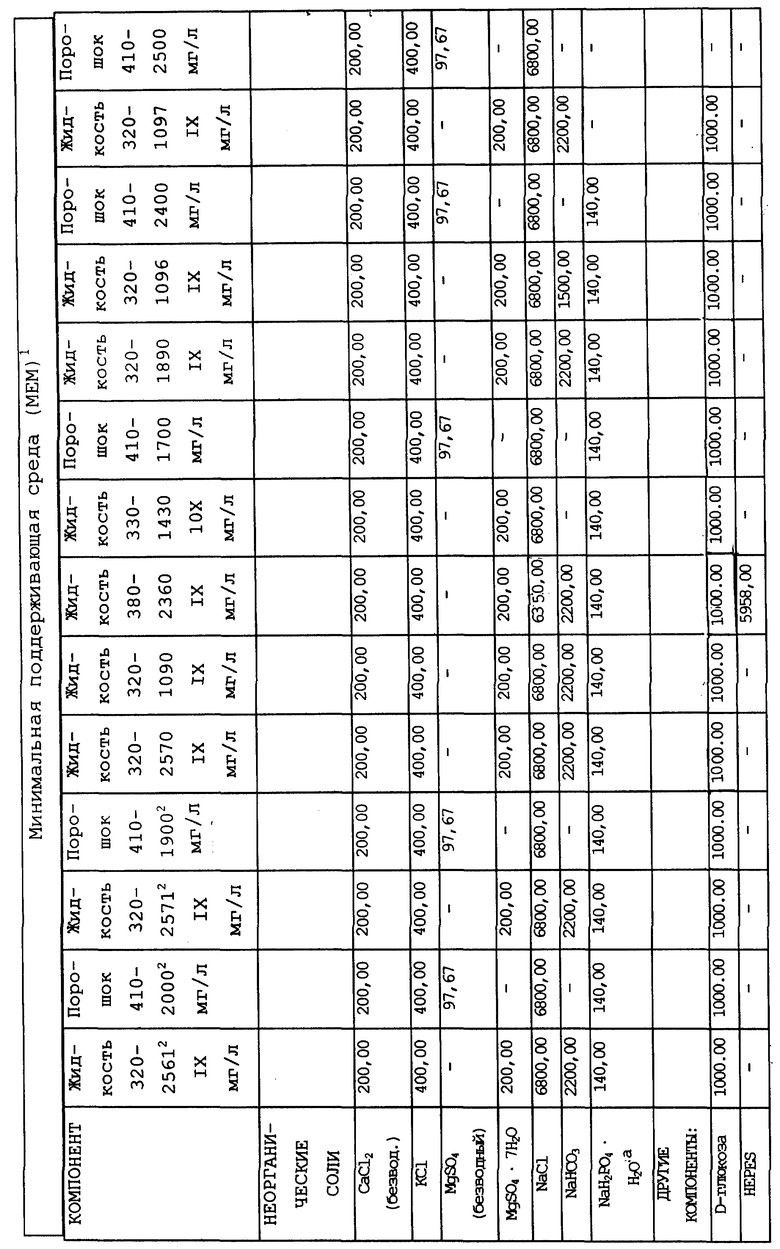
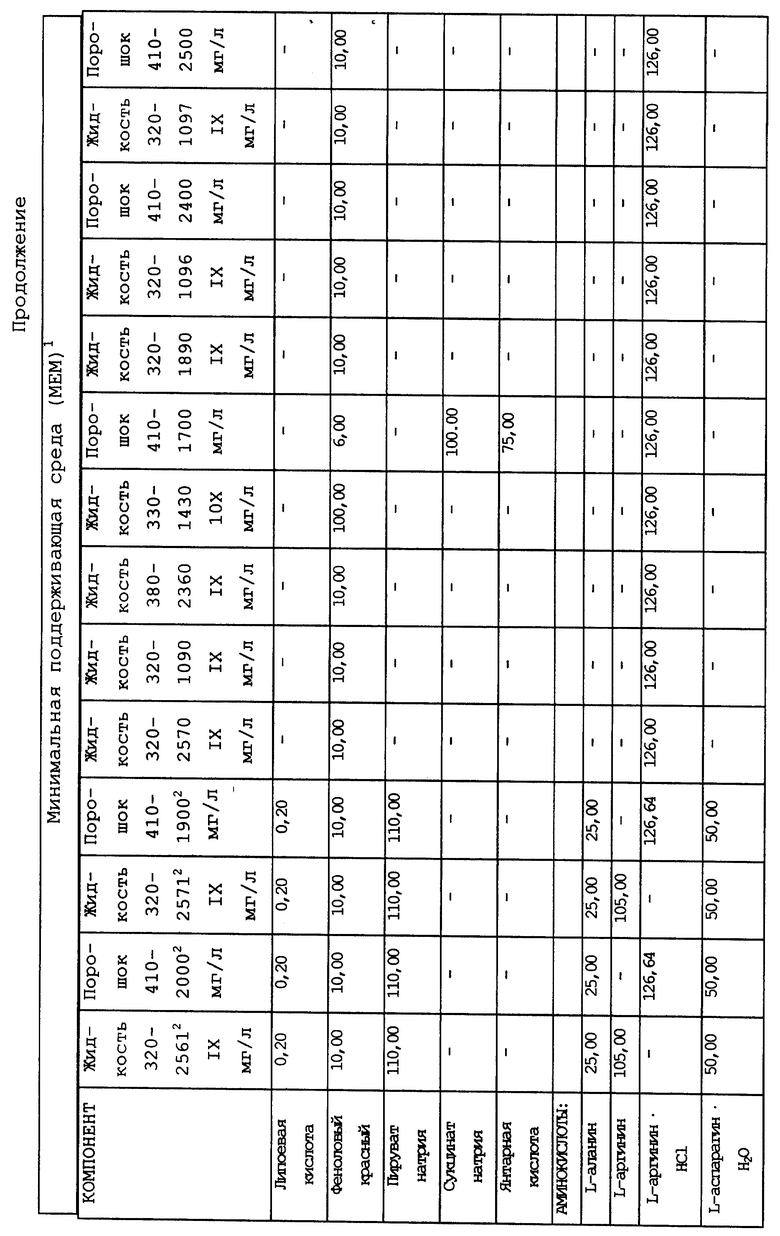
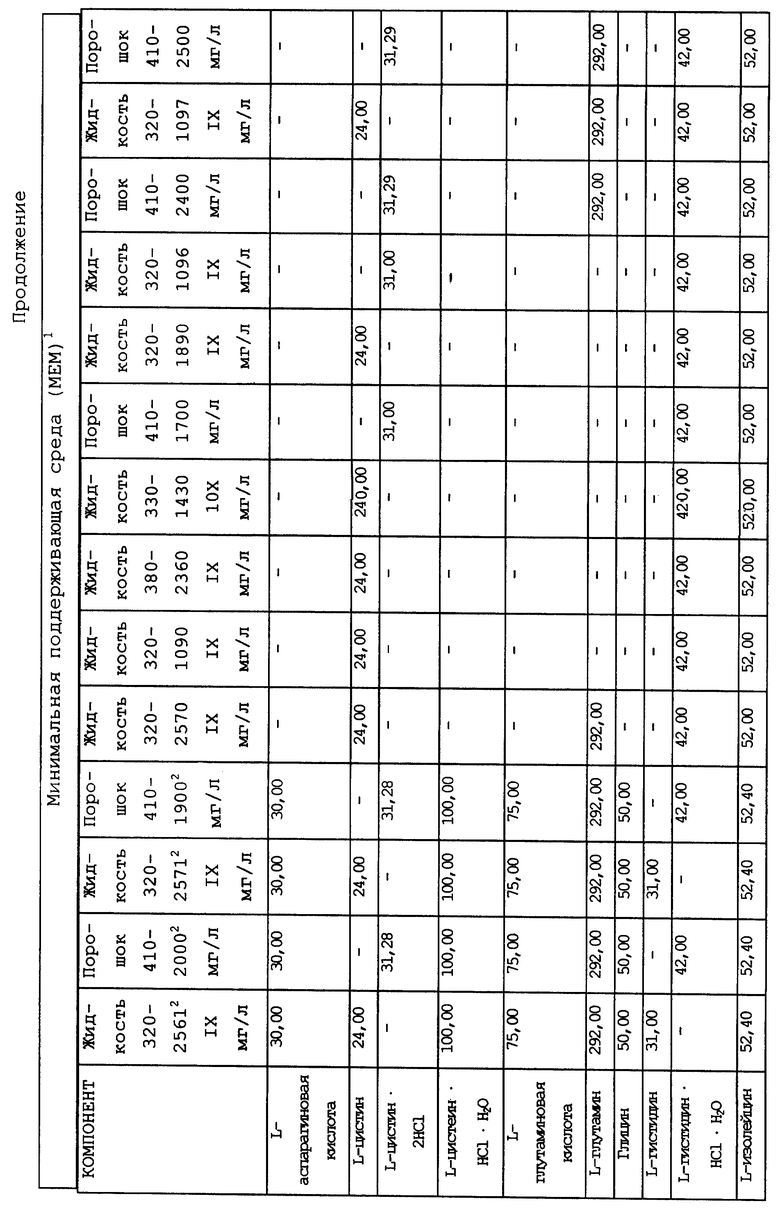
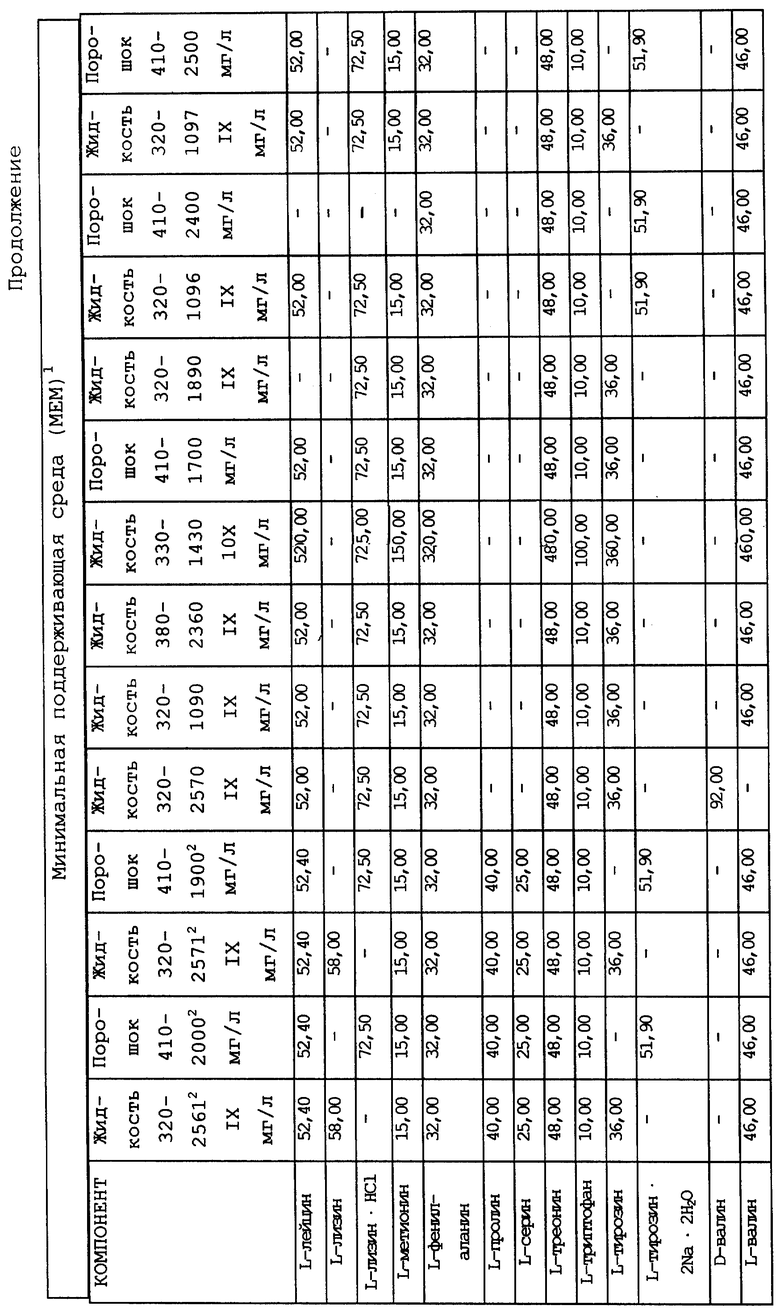
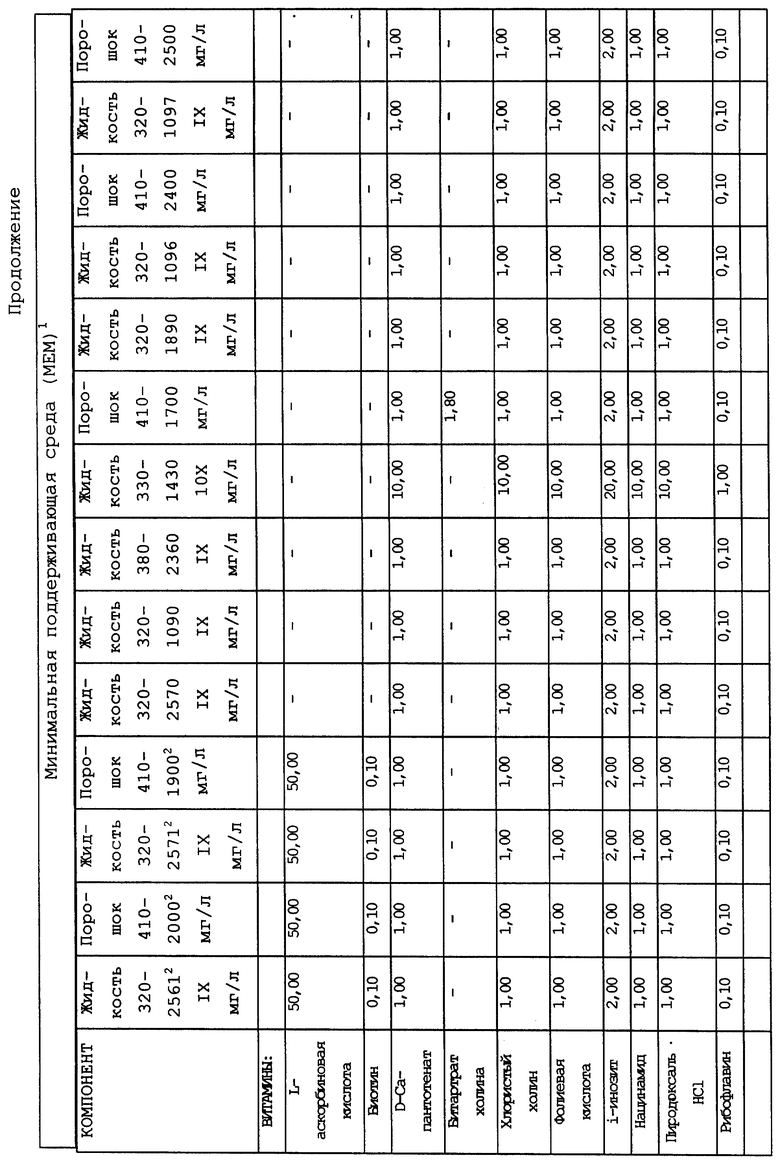
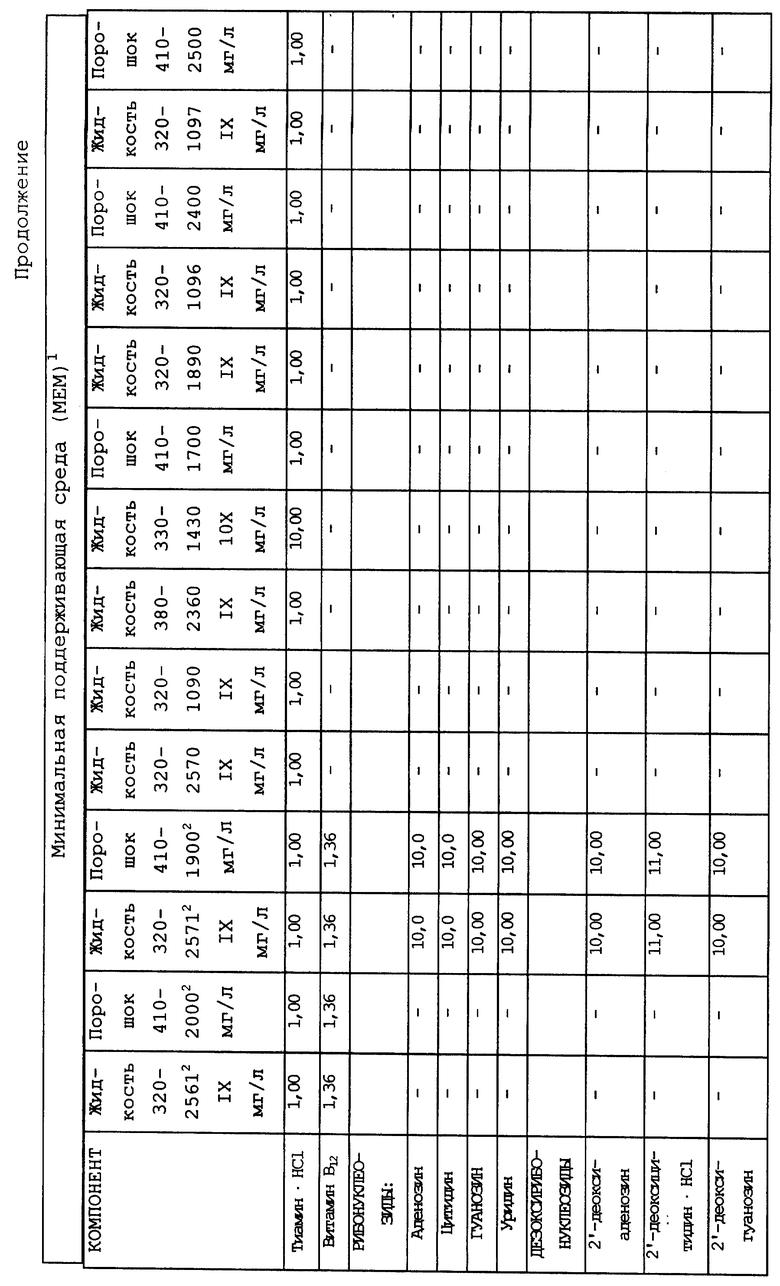
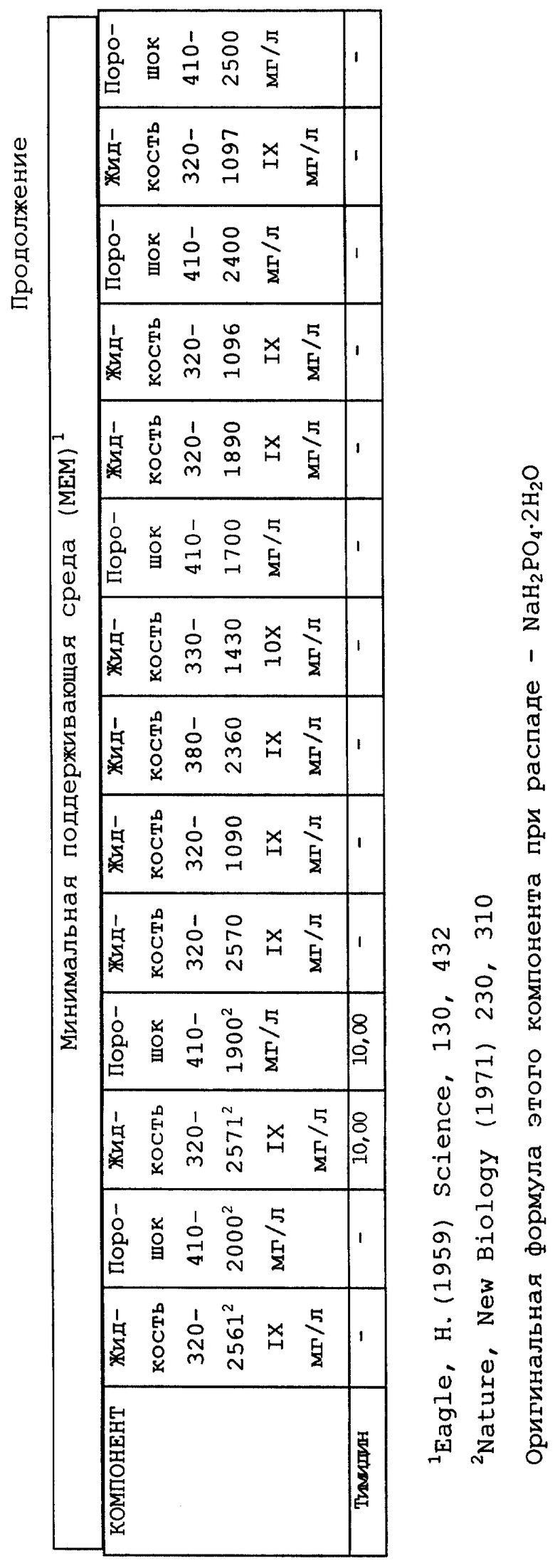
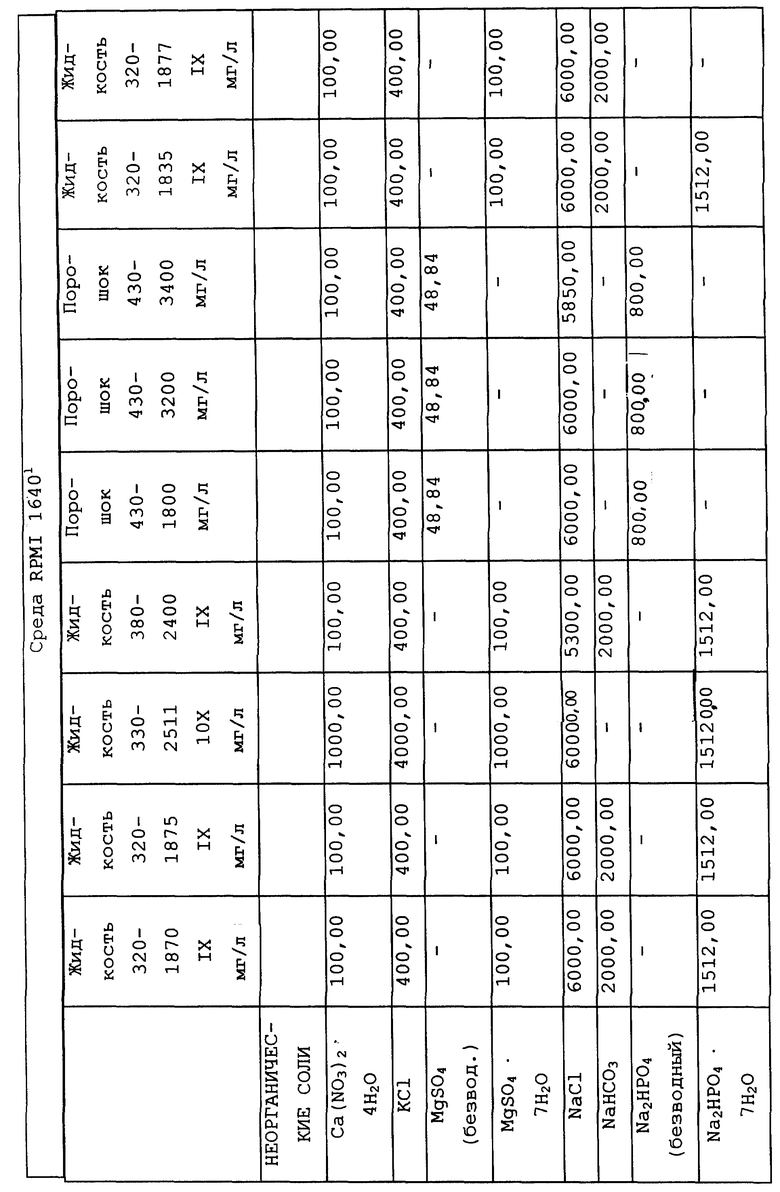

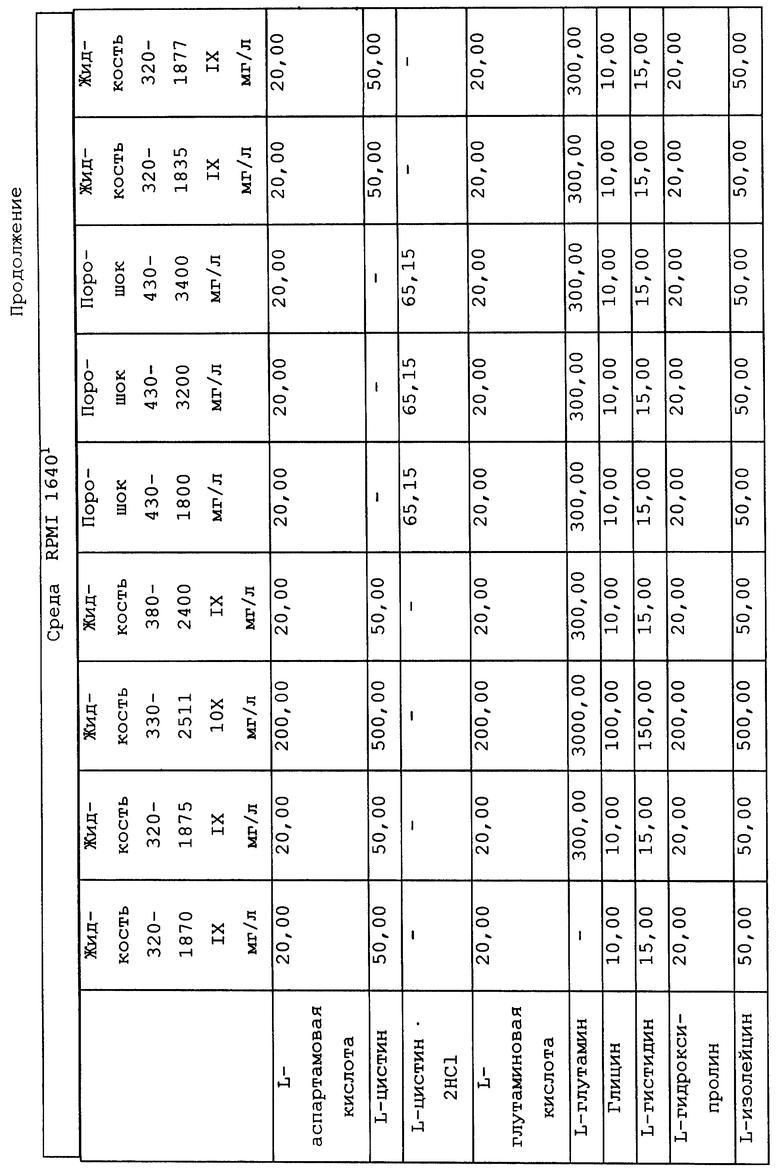
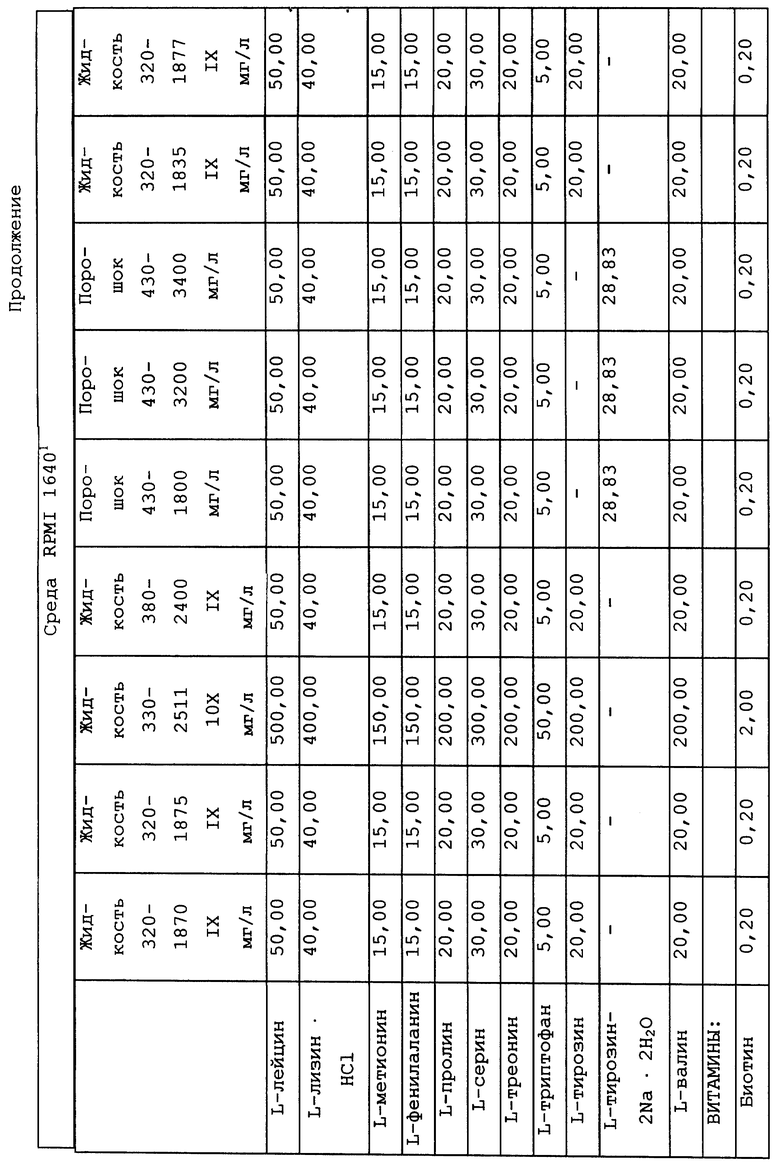
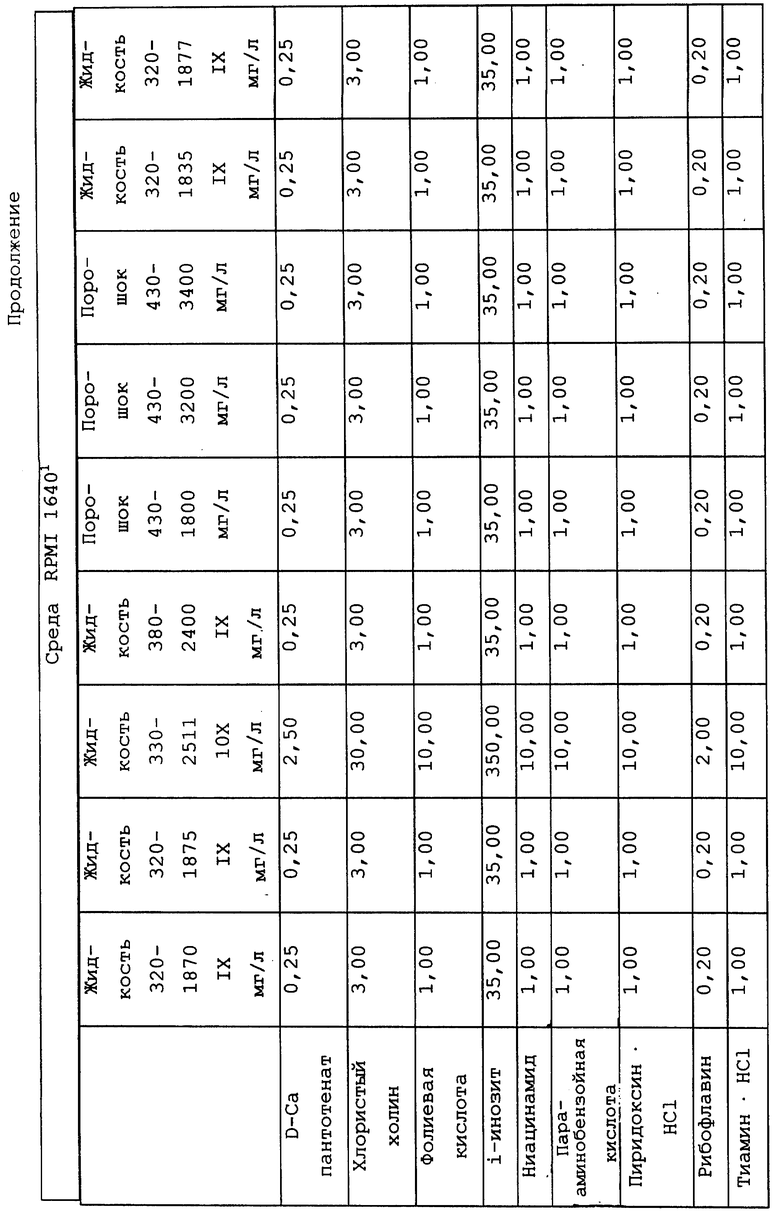
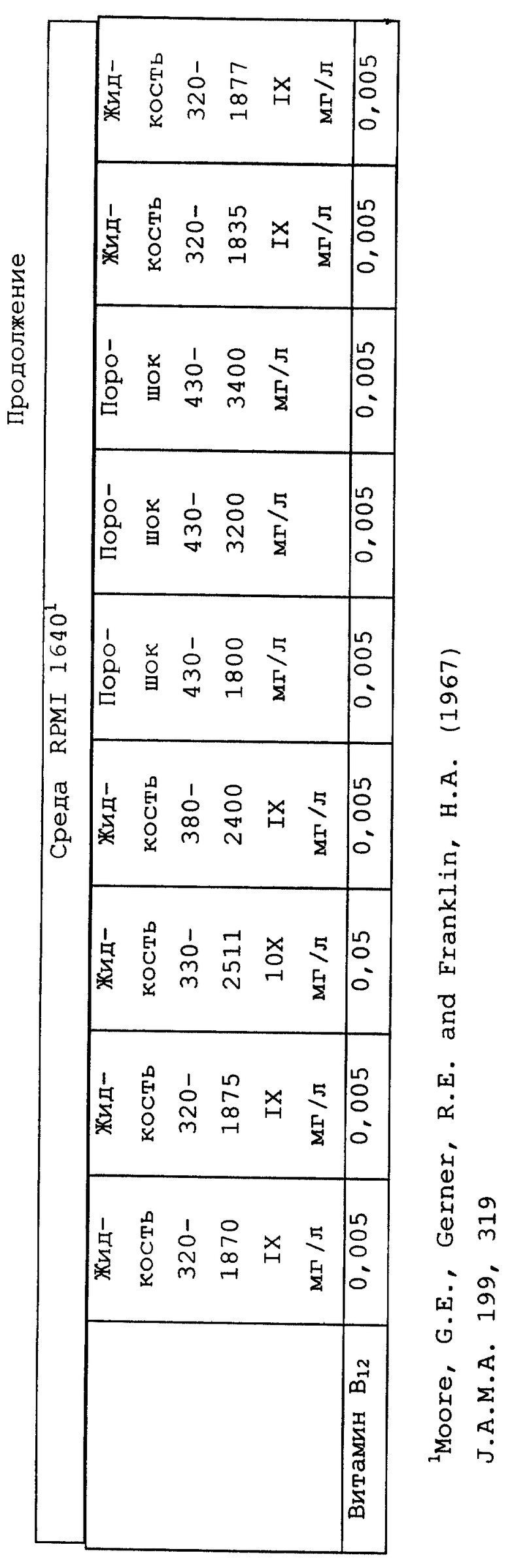
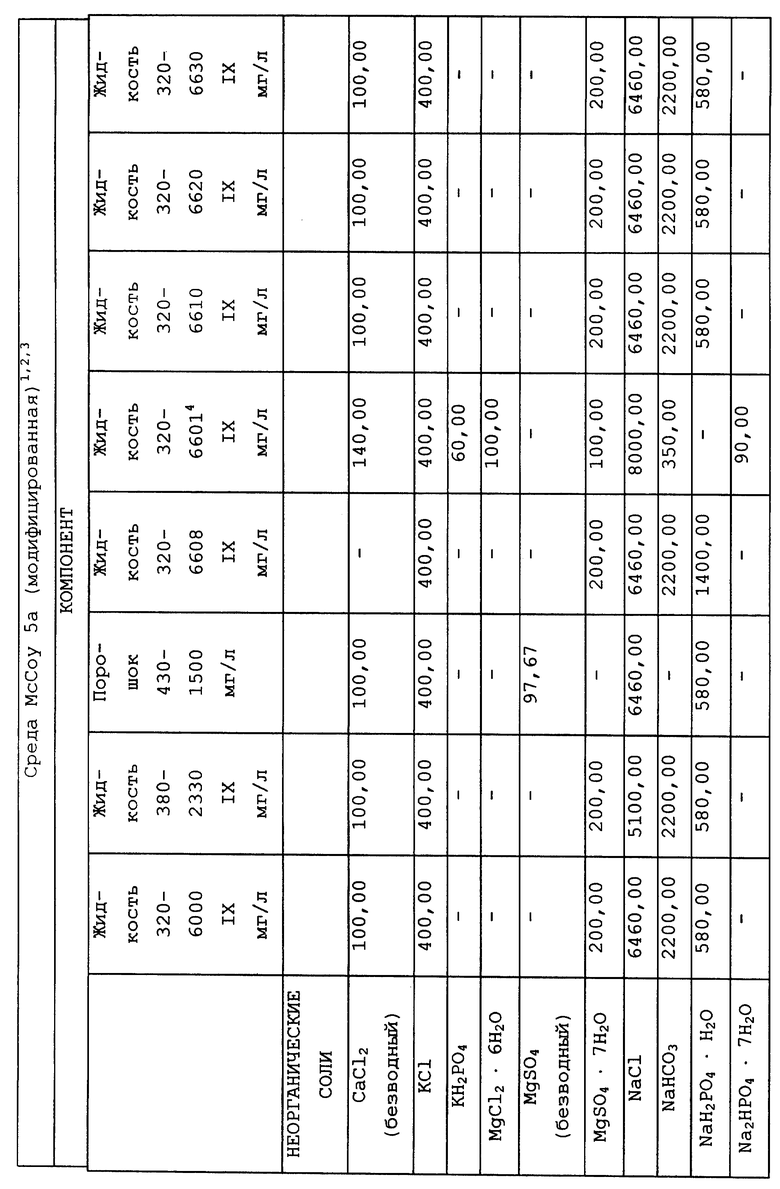
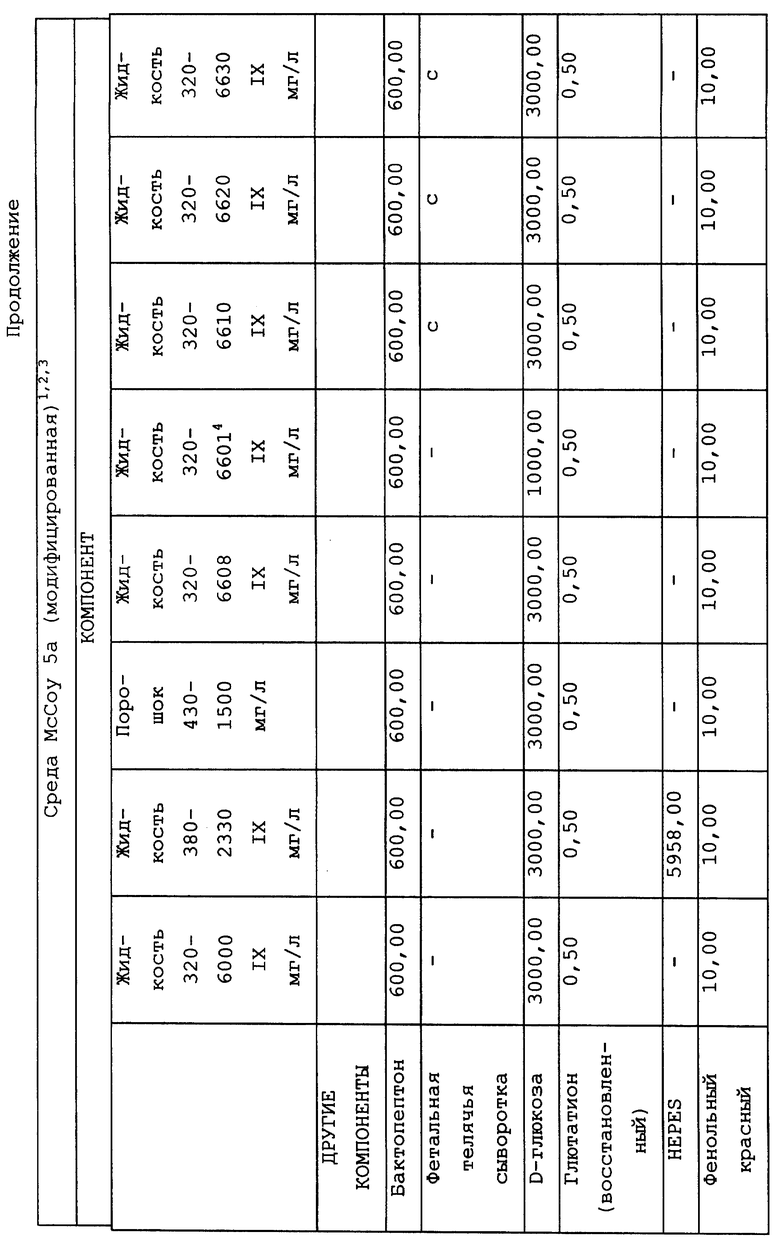
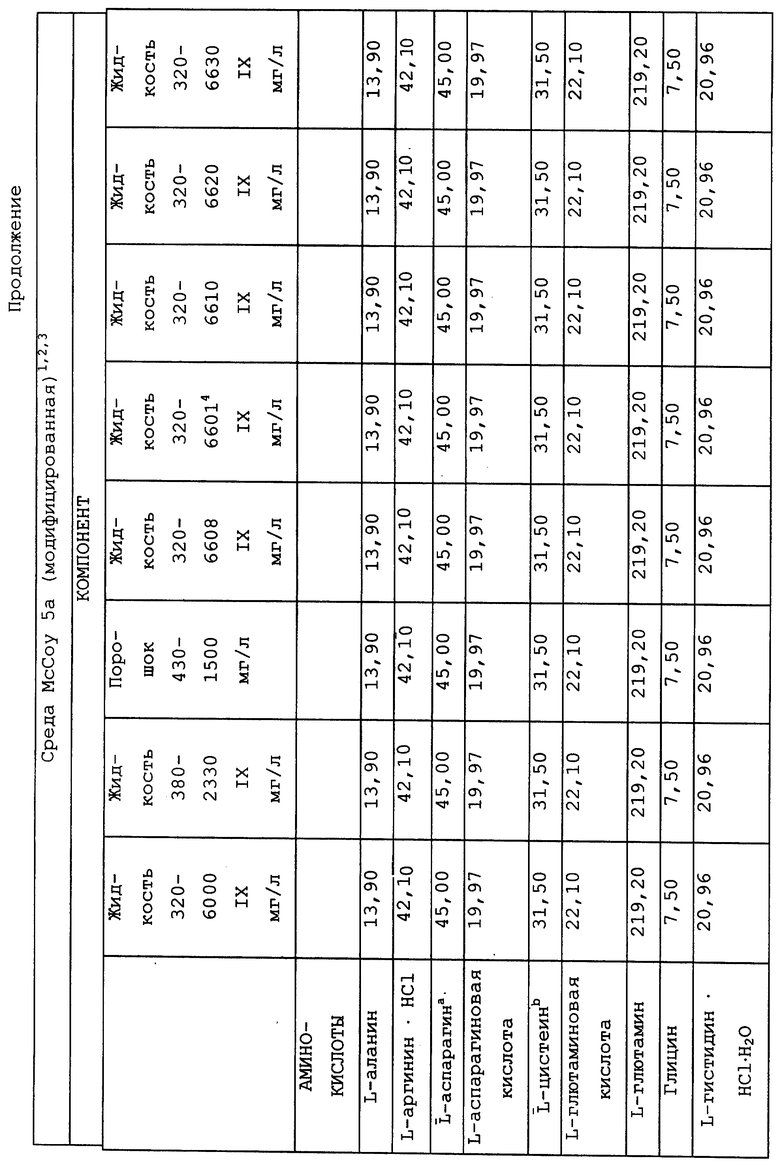
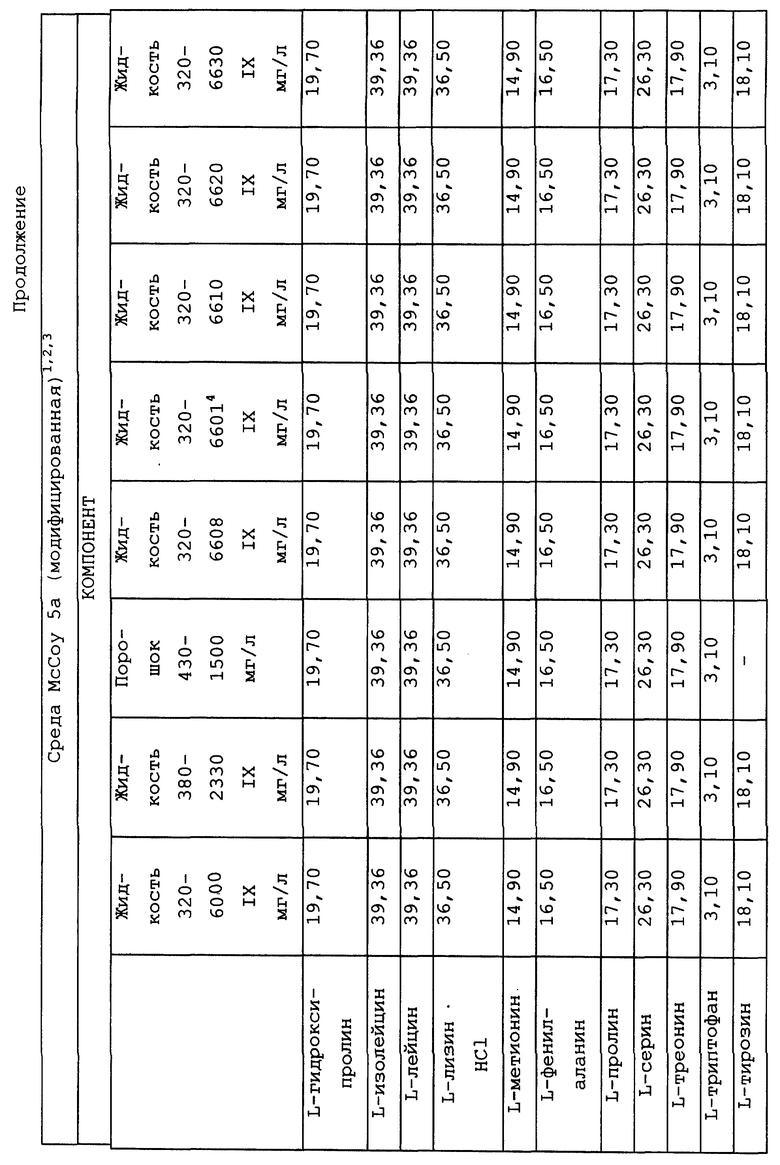
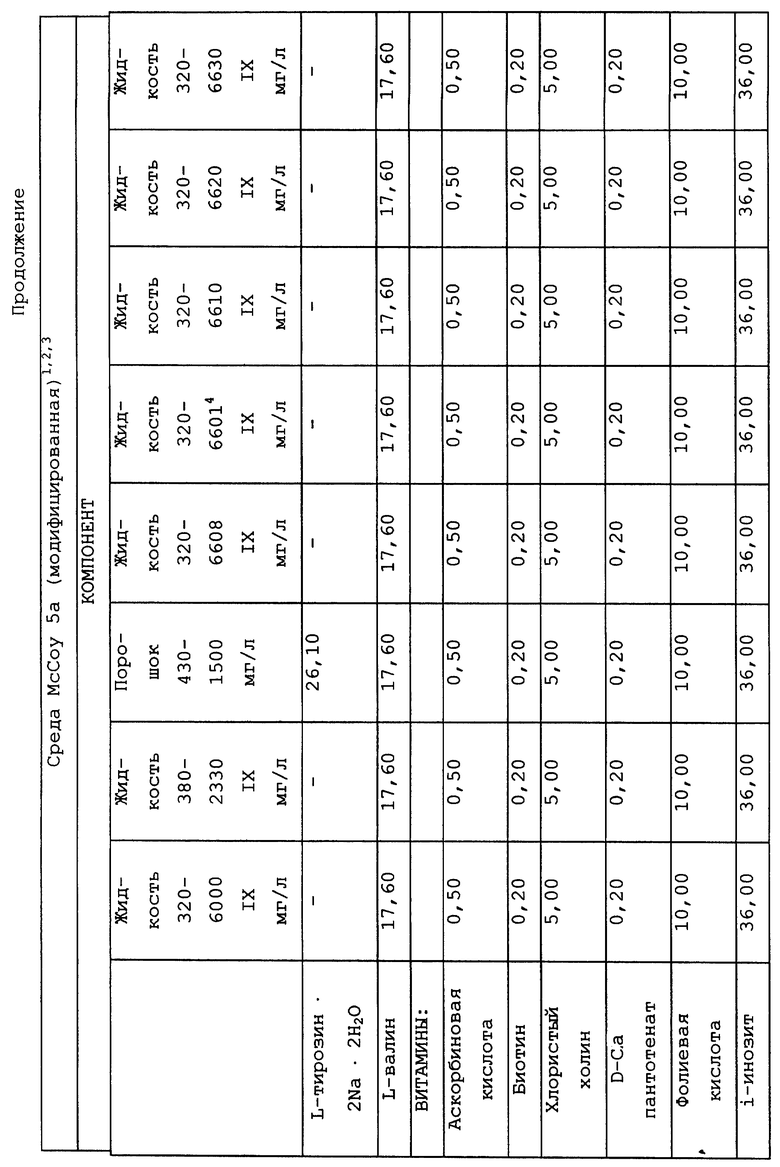
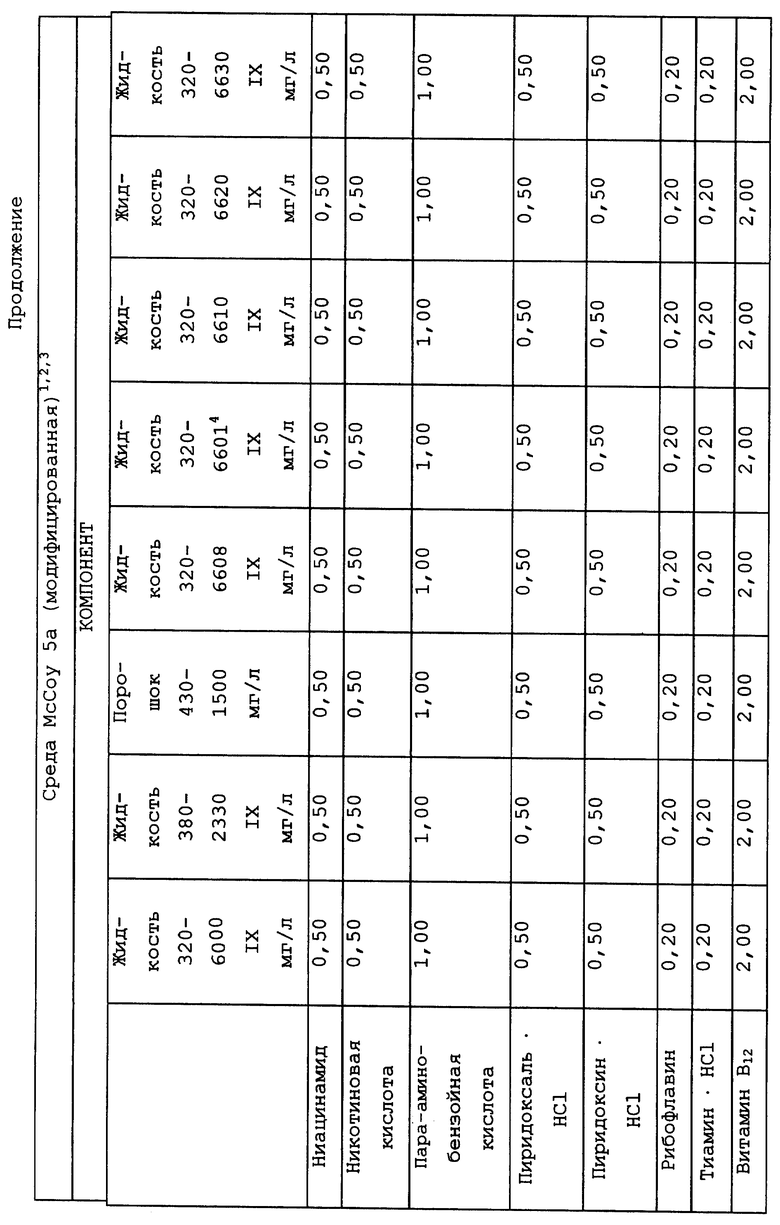

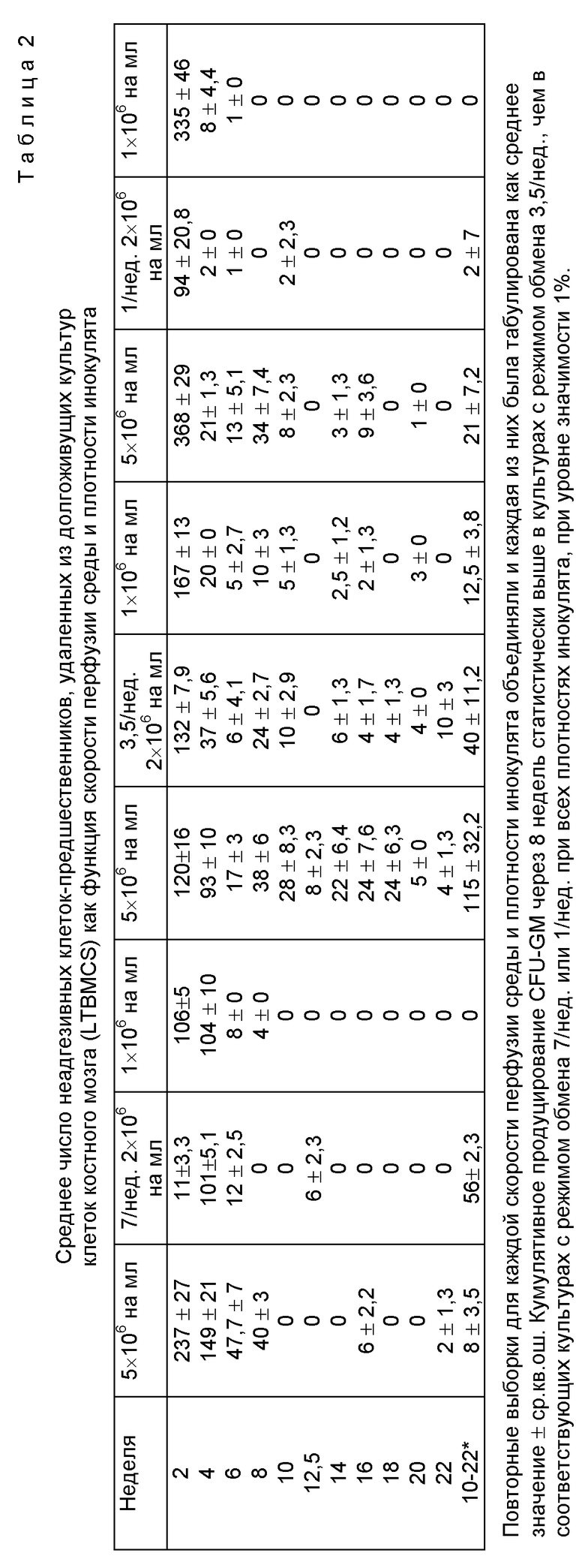
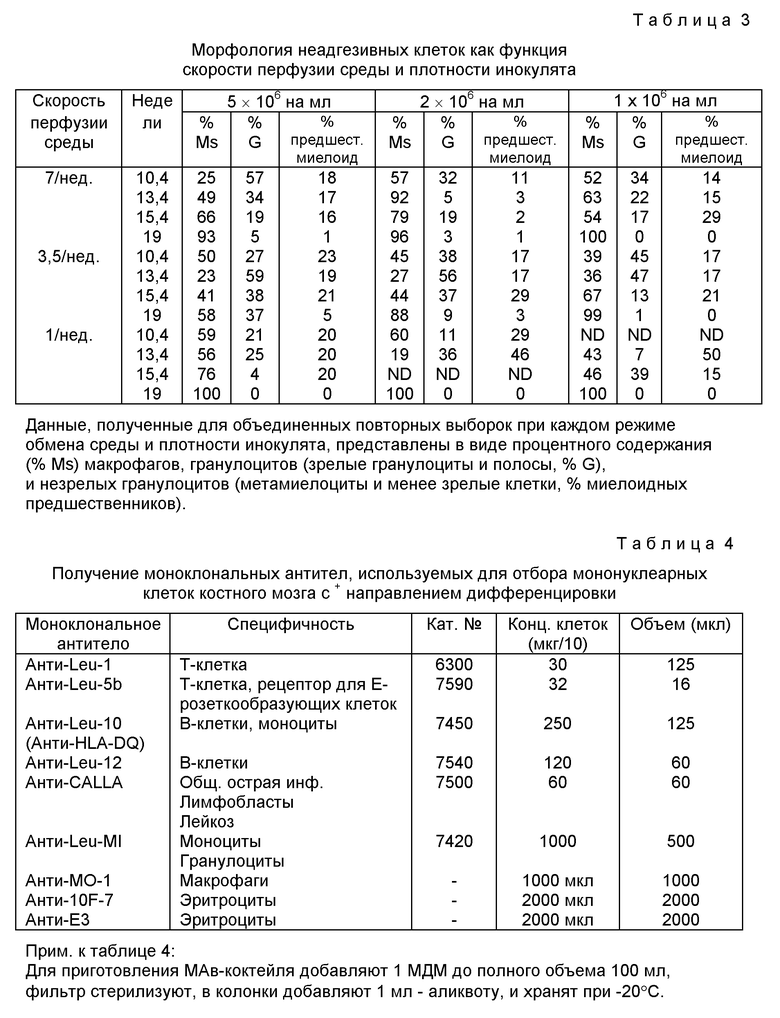
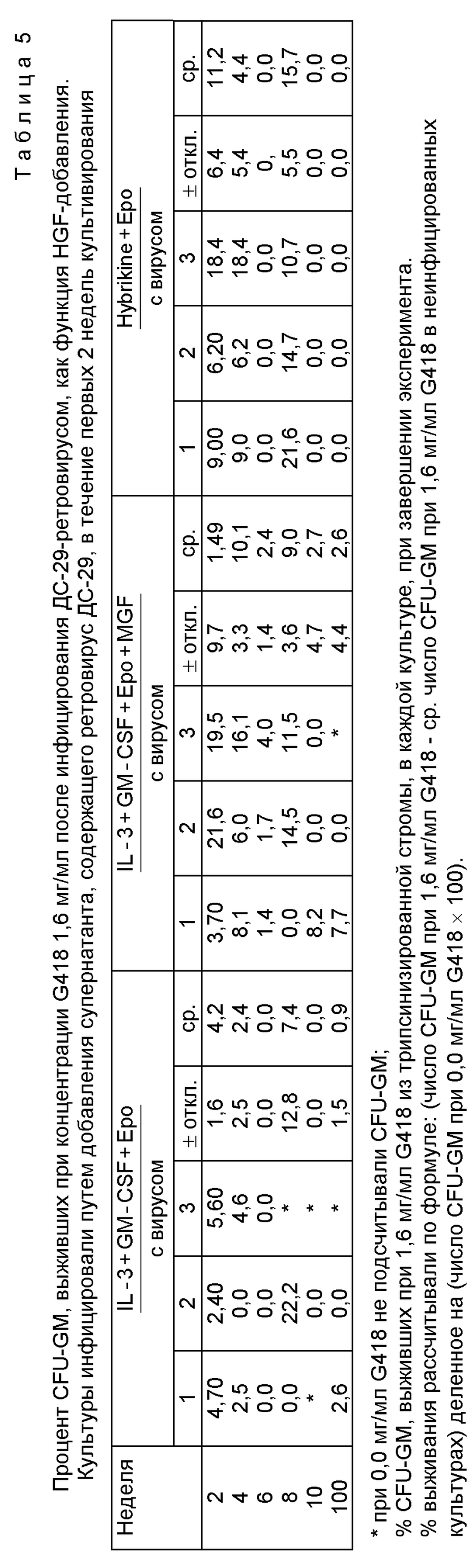
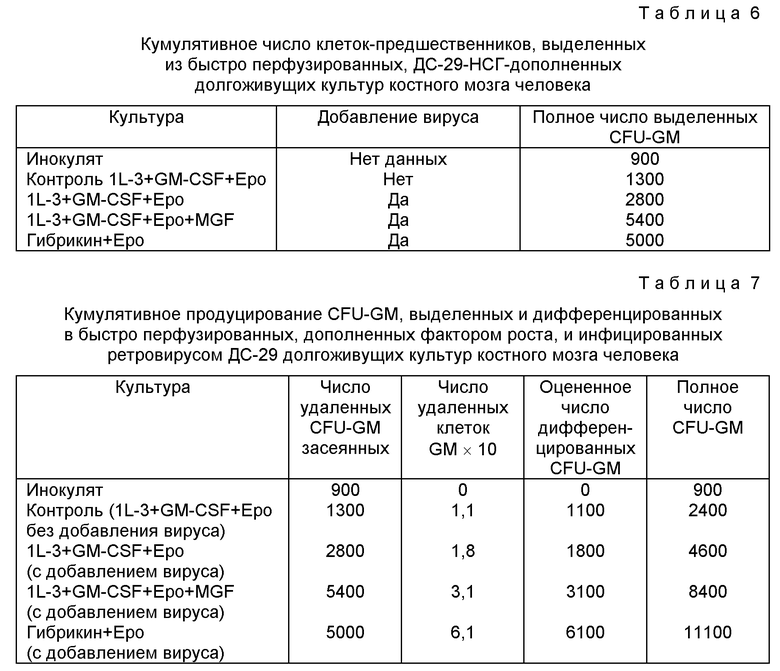
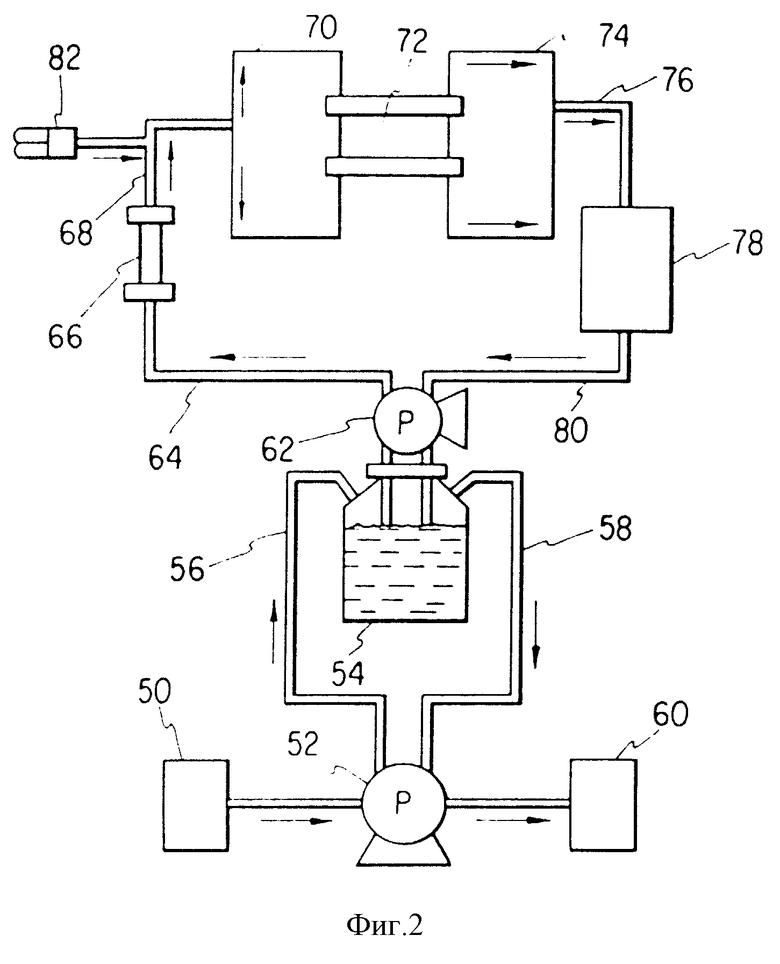
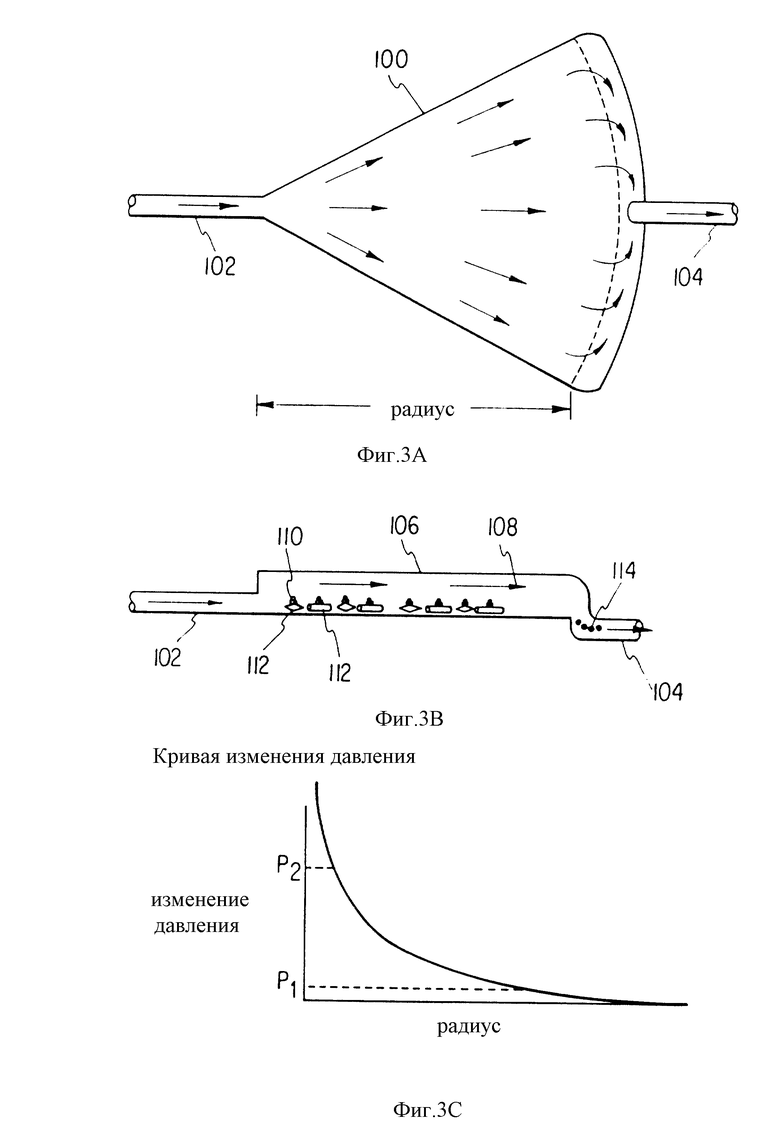
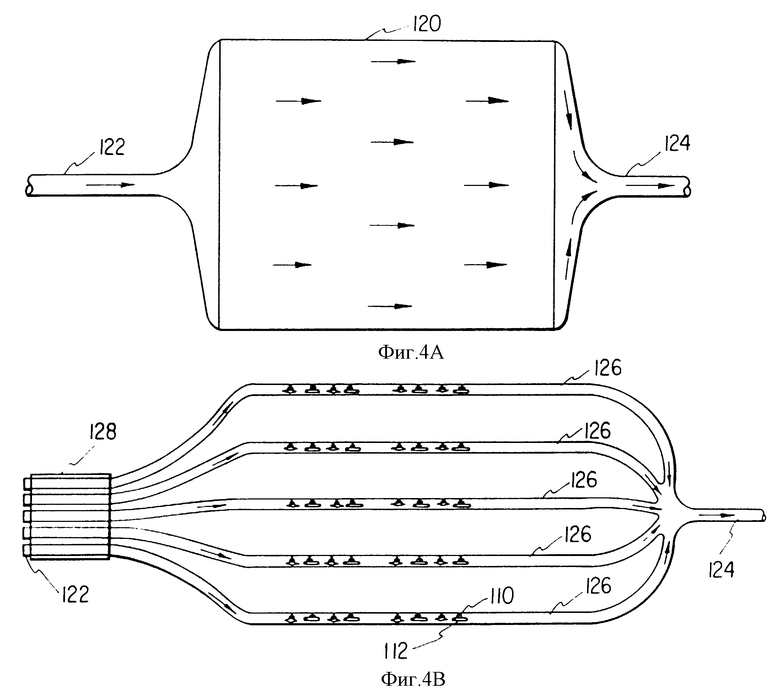
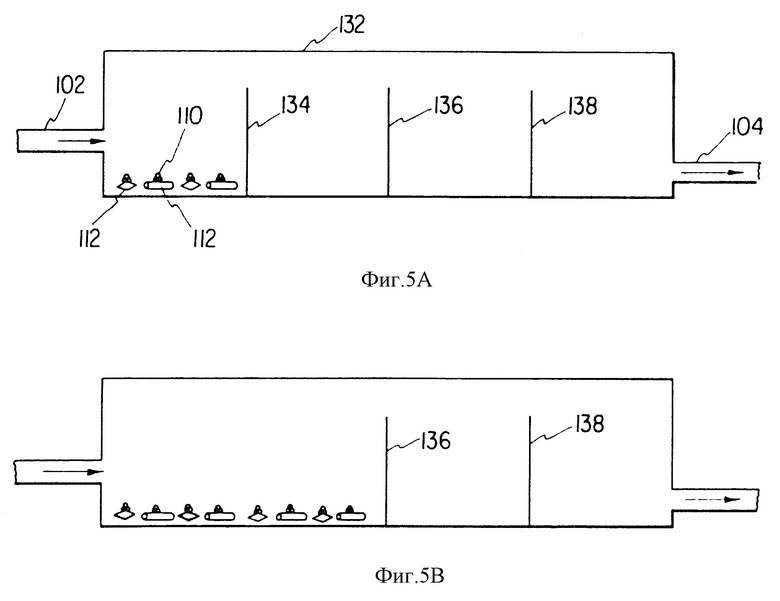
Изобретение относится к биотехнологии и может быть использовано для выращивания культур гемопоэтических клеток. Культивирование стволовых клеток человека осуществляют ex vivo в жидкой культуральной среде с заменой среды со скоростью 50-100% ежедневного замещения при плотности клеток 1·104-1·107 на 1 мл среды. Культивирование проводят в присутствии факторов роста и/или трансформированных стромальных клеток, секретирующих фактор роста. Дополнительно в среду культивирования добавляют вектор переноса гена, обеспечивающий получение стабильной генетической трансформации. Для отделения неопластических клеток от нормальных на гемопоэтические клетки, объединенные со стромальными клетками, воздействуют потоком жидкости, создающим сдвиговое напряжение, равное или более 1,0 дин/см2. Изобретение позволяет оптимизировать выращивание стволовых клеток и клеток-предшественников. 3 с. и 18 з.п. ф-лы, 8 табл., 5 ил.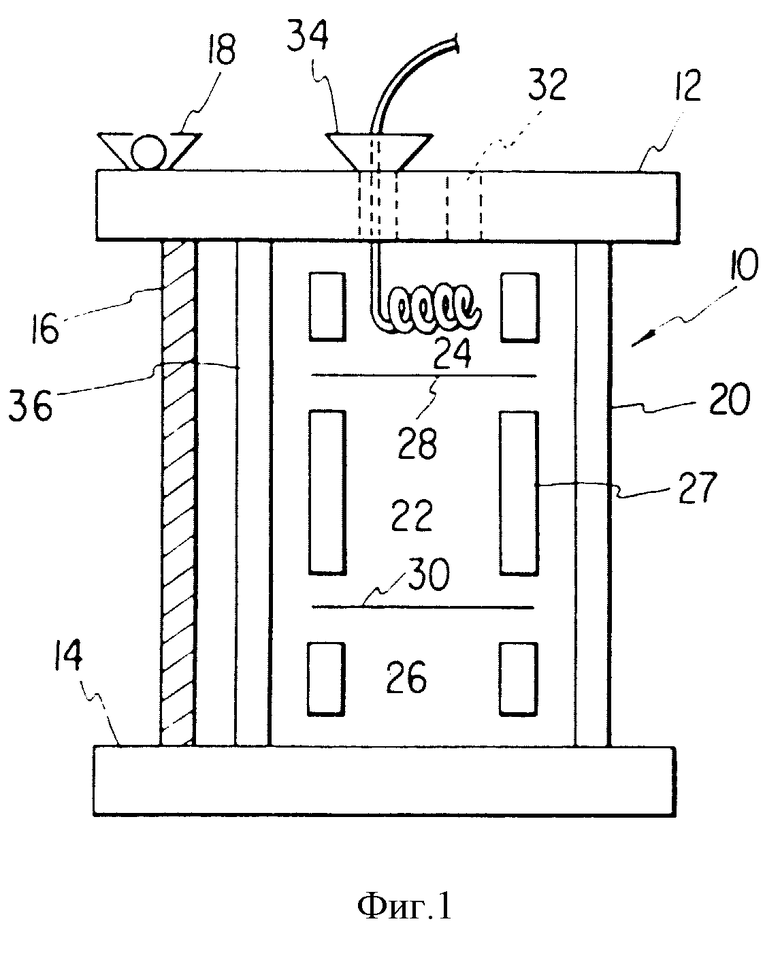
| Пожарный двухцилиндровый насос | 0 |
|
SU90A1 |
| Пожарный двухцилиндровый насос | 0 |
|
SU90A1 |
| Coutinho et al., Blood, v.75, p.2118 - 2129, 1990 | |||
| Культура животных клеток/Под ред.Р.Фрешни | |||
| - М.: Мир, 1989. | |||
Авторы
Даты
2001-03-20—Публикация
1991-12-17—Подача