[01] ССЫЛКА НА СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ, ПРЕДСТАВЛЕННЫХ ЧЕРЕЗ EFS-WEB
[03] Содержание текстового файла ASCII списка последовательностей под названием "20131031_034044_119WO1_seq_ST25", размер которого составляет 14,3 кбайт, созданного 28 октября 2013 г. и представленного в электронном виде через EFS-Web вместе с настоящей заявкой, полностью включено в настоящее описание посредством ссылки.
[03] ПОДТВЕРЖДЕНИЕ ПРАВИТЕЛЬСТВЕННОЙ ПОДДЕРЖКИ
[04] Данное изобретение было создано при поддержке Правительства в виде грантов №№ R01 DK 082717 и R01 DK 065029, выданных Национальным институтом диабета и заболеваний пищеварения и почек (NIDDK) Национального института здоровья. Правительство имеет определенные права на это изобретение.
[05] ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
[06] 1. ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
[07] Настоящее изобретение относится к полипептидам, которые регулируют метаболизм железа, и способам их получения и применения.
[08] 2. ОПИСАНИЕ ПРЕДШЕСТВУЮЩЕГО УРОВНЯ ТЕХНИКИ
[09] Выработка эритроцитов безусловно является основным потребителем железа в организме. Существование гормонов, которые регулируют железо в ответ на потребности выработки эритроцитов, предполагалось более 50 лет тому назад Finch et al., среди прочих. См. Finch 1994. К сожалению, Finch и другие никогда не обнаруживали каких-либо таких гормонов.
[10] Другие исследователи изучили причины увеличенного всасывания железа при талассемии и предположили, что два вещества, GDF15 и TWSG1, могут вызывать подавление гепсидина и перегрузку железом при этом заболевании, но сделали вывод, что это не является физиологическим сигналом для всасывания железа. См. Tanno 2010b и Casanovas 2013. Роль GDF15 или TWSG1 в перегрузке железом при талассемии никогда конкретно не была показана.
[11] КРАТКОЕ СОДЕРЖАНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
[12] В некоторых вариантах осуществления настоящее изобретение направлено на изолированный, очищенный, синтетический и/или рекомбинантный полипептид, который содержит С-концевую последовательность, имеющую приблизительно 95-100%, по меньшей мере приблизительно 96%, по меньшей мере приблизительно 97%, по меньшей мере приблизительно 98% или по меньшей мере приблизительно 99% идентичности последовательности с SEQ ID NO:16. В некоторых вариантах осуществления полипептид содержит N-концевую последовательность, имеющую приблизительно 70-100%, по меньшей мере приблизительно 80%, по меньшей мере приблизительно 90% или по меньшей мере приблизительно 95% идентичности последовательности с SEQ ID NO:17. В некоторых вариантах осуществления настоящее изобретение направлено на изолированный, очищенный, синтетический и/или рекомбинантный полипептид, который состоит по существу из или состоит из С-концевой последовательности, имеющей приблизительно 95-100%, по меньшей мере приблизительно 96%, по меньшей мере приблизительно 97%, по меньшей мере приблизительно 98% или по меньшей мере приблизительно 99% идентичности последовательности с SEQ ID NO:16 и N-концевой последовательности, имеющей приблизительно 70-100%, по меньшей мере приблизительно 80%, по меньшей мере приблизительно 90% или по меньшей мере приблизительно 95% идентичности последовательности с SEQ ID NO:17. В некоторых вариантах осуществления настоящее изобретение направлено на изолированный, очищенный, синтетический и/или рекомбинантный полипептид, который имеет приблизительно от 70 до 100%, по меньшей мере приблизительно 80%, по меньшей мере приблизительно 90%, или по меньшей мере приблизительно 95% идентичности последовательности с SEQ ID NO:1 или SEQ ID NO:2. В некоторых вариантах осуществления настоящее изобретение направлено на изолированный, очищенный, синтетический и/или рекомбинантный полипептид, который содержит, состоит по существу из или состоит из по меньшей мере одной из следующих последовательностей: SEQ ID NO:3, SEQ ID NO:4, SEQ ID NO:5, SEQ ID NO:6, SEQ ID NO:7, SEQ ID NO:8, SEQ ID NO:9, SEQ ID NO:10, SEQ ID NO:11, SEQ ID NO:12, SEQ ID NO:13, SEQ ID NO:14 и SEQ ID NO:15, где X представляет собой любую аминокислоту. В некоторых вариантах осуществления настоящее изобретение направлено на изолированный, очищенный, синтетический и/или рекомбинантный полипептид, который содержит, состоит по существу из или состоит из всех из следующих последовательностей: SEQ ID NO:3, SEQ ID NO:4, SEQ ID NO:5, SEQ ID NO:6, SEQ ID NO:7, SEQ ID NO:8, SEQ ID NO:9, SEQ ID NO:10, SEQ ID NO:11, SEQ ID NO:12, SEQ ID NO:13, SEQ ID NO:14 и SEQ ID NO:15, где X представляет собой любую аминокислоту. В некоторых вариантах осуществления полипептиды настоящего изобретения снижают уровни печеночной гепсидиновой мРНК и/или сывороточного гепсидина у людей-субъектов, когда данные полипептиды вводят этим субъектам. В некоторых вариантах осуществления полипептиды настоящего изобретения проявляют эритроферроновую активность, которая является такой же или по существу аналогичной активности SEQ ID NO:1 или SEQ ID NO:2. В некоторых вариантах осуществления полипептиды настоящего изобретения проявляют эритроферроновую активность, которая составляет приблизительно 60-100%, приблизительно 70-100%, приблизительно 80-100%, приблизительно 90-100% или приблизительно 95-100% от активности, предоставляемой SEQ ID NO:1 или SEQ ID NO:2.
[13] В некоторых вариантах осуществления настоящее изобретение направлено на изолированный, очищенный, синтетический и/или рекомбинантный полипептид, который содержит, состоит по существу из или состоит из по меньшей мере приблизительно 10, по меньшей мере приблизительно 11, по меньшей мере приблизительно 12, по меньшей мере приблизительно 13, по меньшей мере приблизительно 14, по меньшей мере приблизительно 15, по меньшей мере приблизительно 16, по меньшей мере приблизительно 17, по меньшей мере приблизительно 18, по меньшей мере приблизительно 19, по меньшей мере приблизительно 20, по меньшей мере приблизительно 21, по меньшей мере приблизительно 22, по меньшей мере приблизительно 23, по меньшей мере приблизительно 24 или по меньшей мере приблизительно 25 последовательных аминокислотных остатков из SEQ ID NO:1, SEQ ID NO:2 или SEQ ID NO:16.
[14] В некоторых вариантах осуществления полипептиды настоящего изобретения получают, используя синтетические или рекомбинантные методы.
[15] В некоторых вариантах осуществления настоящее изобретение направлено на изолированную, очищенную, синтетическую и/или рекомбинантную молекулу нуклеиновой кислоты, которая содержит, состоит по существу из или состоит из последовательности, которая кодирует полипептид в соответствии с настоящим изобретением.
[16] В некоторых вариантах осуществления настоящее изобретение направлено на рекомбинантную клетку, которая способна экспрессировать полипептид в соответствии с настоящим изобретением, и/или содержит молекулу нуклеиновой кислоты, которая кодирует полипептид в соответствии с настоящим изобретением.
[17] В некоторых вариантах осуществления настоящее изобретение направлено на антитело, которое вырабатывается против полипептида в соответствии с настоящим изобретением. Антитело может представлять собой моноклональное антитело. В некоторых вариантах осуществления антитело представляет собой гуманизированное антитело, химерное антитело или человеческое антитело.
[18] В некоторых вариантах осуществления настоящее изобретение направлено на композицию, которая содержит, состоит по существу из или состоит из полипептида в соответствии с настоящим изобретением и/или молекулы нуклеиновой кислоты, которая кодирует полипептид в соответствии с настоящим изобретением, и/или антитела, которое вырабатывается против полипептида в соответствии с настоящим изобретением. В некоторых вариантах осуществления композиция содержит полипептид в соответствии с настоящим изобретением и/или молекулу нуклеиновой кислоты, которая кодирует полипептид в соответствии с настоящим изобретением, и/или антитело, которое вырабатывается против полипептида в соответствии с настоящим изобретением, при концентрации, которая является более высокой, чем концентрация, обнаруженная у нормальных субъектов.
[19] В некоторых вариантах осуществления настоящее изобретение направлено на способ лечения заболевания, связанного с метаболизмом железа у субъекта, который включает, состоит по существу из или состоит из введения по меньшей мере одного полипептида в соответствии с настоящим изобретением, одной молекулы нуклеиновой кислоты, кодирующей полипептид в соответствии с настоящим изобретением, одного антитела, вырабатываемого против полипептида в соответствии с настоящим изобретением, или композиции, которая содержит полипептид в соответствии с настоящим изобретением. В некоторых вариантах осуществления субъектом является человек. В некоторых вариантах осуществления субъект нуждается в таком введении. Как используют в настоящем описании, "субъект, который нуждается" представляет собой субъекта, который диагностирован как имеющий или страдает от заболевания, связанного с метаболизмом железа. В некоторых вариантах осуществления заболевание, связанное с метаболизмом железа, является заболеванием перегрузки железом или заболеванием и/или расстройством, ассоциированным с аномально низкими уровнями гепсидина. В некоторых вариантах осуществления заболевание, связанное с метаболизмом железа, представляет собой заболевание или расстройство, ассоциированное с аномально низкими уровнями железа и/или аномально высокими уровнями гепсидина. В некоторых вариантах осуществления полипептид, вводимый субъекту, представляет собой -ERFE-полипептид. В некоторых вариантах осуществления полипептид, вводимый субъекту, представляет собой +ERFE-полипептид. В некоторых вариантах осуществления один или несколько полипептидов вводят в эффективном количестве, предпочтительно терапевтически эффективном количестве. В некоторых вариантах осуществления способ включает, состоит по существу из или состоит из регуляции количества гепсидина у субъекта посредством введения субъекту ERFE-полипептида в эффективном количестве, предпочтительно терапевтически эффективном количестве. В некоторых вариантах осуществления способы включают измерение количества одного или нескольких ERFE-полипептидов и/или гепсидина у субъекта до, во время или после введения. В некоторых вариантах осуществления количество ERFE-полипептидов измеряют с использованием аналитического теста, используя одну или несколько молекул нуклеиновой кислоты, которые кодируют полипептид в соответствии с настоящим изобретением и/или одно или несколько антител, вырабатываемых против полипептида в соответствии с настоящим изобретением. В некоторых вариантах осуществления способы включают введение субъекту одного или нескольких +ERFE-полипептидов, где значение измерения гепсидина выше нормального или одного или нескольких -ERFE-полипептидов, где значение измерения гепсидина ниже нормального.
[20] В некоторых вариантах осуществления настоящее изобретение направлено на аналитический тест для обнаружения присутствия и/или измерения количества ERFE-полипептида в образце, который содержит контактирующий образец с антителом, вырабатываемым против полипептида в соответствии с настоящим изобретением, и затем обнаружения присутствия и/или измерения количества связанных антител.
[21] В некоторых вариантах осуществления настоящее изобретение направлено на набор, содержащий по меньшей мере один полипептид в соответствии с настоящим изобретением, молекулу нуклеиновой кислоты, которая кодирует полипептид в соответствии с настоящим изобретением, рекомбинантную клетку, как раскрыто в настоящем описании, антитело, вырабатываемое против полипептида в соответствии с настоящим изобретением, или композицию, как раскрыто в настоящем описании, упакованную вместе с реагентом, устройством, инструкцией или их комбинацией.
[22] В некоторых вариантах осуществления настоящее изобретение направлено на клеточную линию гибридомы, которая обладает способностью к экспрессии антитела, которое специфически распознает полипептид в соответствии с настоящим изобретением или вырабатывается против полипептида в соответствии с настоящим изобретением.
[23] В некоторых вариантах осуществления настоящее изобретение направлено на комплекс, содержащий по меньшей мере один полипептид в соответствии с настоящим изобретением, связанный с антителом, где по меньшей мере один полипептид и/или одно антитело получают посредством рекомбинантных методов.
[24] В некоторых вариантах осуществления настоящее изобретение направлено на применение одного или нескольких полипептидов в соответствии с настоящим изобретением, молекулы нуклеиновой кислоты, которая кодирует полипептид в соответствии с настоящим изобретением, антитела, вырабатываемого против полипептида в соответствии с настоящим изобретением, или композиции, содержащей один или несколько полипептидов, молекул нуклеиновой кислоты, и антитела для производства лекарственного средства для лечения заболевания, связанного с метаболизмом железа.
[25] В некоторых вариантах осуществления настоящее изобретение направлено на один или несколько полипептидов в соответствии с настоящим изобретением, молекулу нуклеиновой кислоты, которая кодирует полипептид в соответствии с настоящим изобретением, антитела, вырабатываемого против полипептида в соответствии с настоящим изобретением, или композицию, содержащую один (одну, одно) или несколько из полипептидов, молекул нуклеиновой кислоты и антител, для применения при лечении заболевания, связанного с метаболизмом железа.
[26] ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[27] Как приведенное выше общее описание, так и последующее подробное описание являются только иллюстративными и пояснительными и предназначены, чтобы предоствить дополнительное объяснение изобретения в том виде, как оно заявлено. Сопроводительные чертежи включены, чтобы предоставить дополнительное понимание изобретения, и введены в данное описание и составляют часть данного описания, иллюстрируют некоторые варианты осуществления изобретения, и вместе с описанием служат для объяснения принципов изобретения.
[28] ОПИСАНИЕ ЧЕРТЕЖЕЙ
[29] Данное изобретение дополнительно следует понимать со ссылкой на чертежи, где:
[30] Фиг. 1: Печеночная мРНК Hamp подавляется после эритропоэтической стимуляции (флеботомии (сплошная линия) или инъекции ЭПО (пунктирная линия)) относительно необработанных животных. Использовали самцов мышей 6-недельного возраста, n=4/группу. *p<0,05, **p<,01, ***p<,001, по t-критерию Стьюдента, по сравнению с необработанными животными.
[31] Фиг. 2: Ответы здоровых добровольцев-людей на ЭПО 5000 Ед, вводимый в 9 часов утра в день 2 (Ashby 2010).
[32] Фиг. 3A-3B: ERFE является членом суперсемейства TNF-α. Фиг. 3A: Выравнивание мышиного (SEQ ID NO:2) и человеческого белка ERFE (SEQ ID NO:1). Выделенная последовательность представляет собой SEQ ID NO:16. Проводили окрашенные CLUSTAL выравнивания C-концевого сегмента человеческого ERFE с другими представителями семейства TNF у человека и человеческими вариантами ERFE. Было обнаружено, что человеческие варианты ERFE отличаются по сигнальной последовательности. Таким образом, ERFE-полипептиды в соответствии с настоящим изобретением содержат 90-100%, предпочтительно 95-100%, более предпочтительно 98-100% и наиболее предпочтительно 99-100% идентичности последовательности с N-концевым сегментом, как приведено в SEQ ID NO:16. Фиг. 3B: структурная модель ERFE, основанная на сходстве с другими членами суперсемейства TNFα.
[33] Фиг. 4: Кратность увеличения в костном мозге Erfe мРНК после флеботомии (сплошная линия) или инъекции ЭПО (пунктирная линия) по сравнению с необработанными мышами. Использовали самцов шестинедельного возраста, n=4/группу. *p<,001, **p<,01 по t-критерию по сравнению с необработанными животными. Фиг. 5: Человеческий ERFE представляет собой эритроидный транскрипт, максимально экспрессируемый в промежуточных эритробластах. Фиг. 5A показывает относительную экспрессию человеческого ERFE мРНК в различных тканях в порядке интенсивности. Печень зародыша и костный мозг, органы, которые экспрессируют человеческий ERFE мРНК на высоком уровне, содержат эритробласты. Фиг. 5B основана на Базе данных созревания человеческих эритробластов (Merryweather-Clarke 2011). Показана относительная экспрессия человеческого ERFE мРНК при созревании человеческих эритробластов, в интервале от эритроидных колониеобразующих единиц (КОЕ-Э), очень ранней стадии развития эритроидов, через проэритробласты (Pro-E), промежуточные эритробласты (Int-E) к поздним эритробластам (LateE).
[34] Фиг. 6: Экспрессия Erfe мРНК в эритробластах мышиного костного мозга, отсортированных на проэритробласты (ProE) и эритробласты стадий EryA, B, C по методу Socolovsky (Liu 2006). Белые столбцы представляют костный мозг от мышей C57BL/6 через 15 часов после флеботомии 0,5 мл; а черные столбцы представляют костный мозг от контрольных мышей, с которыми не производили никаких действий. Самцы мышей, шестинедельного возраста, n=3/группу, *p<0,01 по t-критерию.
[35] Фиг. 7A-7C: Изменение Hamp мРНК в печени флеботомизированных мышей Erfe+/+, Erfe+/- и Erfe-/- (помеченных как WT (дикий тип, Фиг. 7A), HT (гетерозиготы, Фиг. 7B), и KO (С выключенным геном, Фиг. 7C)). n=3-6 мышей на группу. *p<,001, **p<,01 по t-критерию по сравнению с нефлеботомизированными контролями.
[36] Фиг. 8: Erfe-дефицитные мыши показывают замедленное восстановление от анемии. (A и B) Флеботомизированные Erfe-дефицитные мыши (сплошная линия) по сравнению с мышами дикого типа (пунктирная линия) показали замедленное восстановление гемоглобина и более низкий средний корпускулярный гемоглобин (MCH). Гематологические параметры (A, B) сравнивали для каждого измерения между WT (n=17) и KO (n=15) по t-критерию Стьюдента. При отсутствии гендерных различий, гендерные характеристики комбинировали для каждого параметра. ***p<0,001, **p<0,01, *p<0,05.
[37] Фиг. 9A-9C: Фиг. 9A: Клетки HEK293T, трансфицированные 0,5 или 1 мкг плазмидной ДНК, кодирующей мышиную Erfe кДНК, гибридизированную с C-концевой 6His-меткой. Вестерн-блоттинг с анти-6His антителом обнаруживает Erfe в основном в супернатанте, указывая на то, что Erfe массированно секретируется. Фиг. 9B: секретируемый Erfe является N- и O-гликозилированным. Фиг. 9C: кроличьи анти-мышиные анти-Erfe антитела 2, вырабатываемые против последовательности внутреннего пептида PSRVPAAQEL (SEQ ID NO:18), обнаруживают рекомбинантный белок при Вестерн-блоттинге, где +/- указывает на наличие трансфекции Erfe плазмидой или ее отсутствие.
[38] Фиг. 10: Erfe действует непосредственно на печень, чтобы подавить гепсидин. (A, B, C) Шесть самцов мышей C57BL/6 обрабатывали внутрибрюшинно либо мышиным рекомбинантным Erfe (2 мкг/г) или физраствором и анализировали через 15 часов. Уровни печеночной мРНК гепсидина (A) и сывороточного гепсидина (B) были значительно подавлены при обработке Erfe, несмотря на воспалительный ответ, на который указывало увеличение в печени экспрессии Saa1 мРНК (C). (D, E, F) Восемь самцов 7 недельного возраста C57BL/6 трансдуцировали с помощью лентивируса, кодирующего GFP или последовательность мышиной Erfe кДНК. (D) Экспрессия Erfe мРНК несколько увеличивалась в печени мышей, трансдуцированных Erfe лентивирусом (только в 2 раза выше, чем исходный уровень в костном мозге по сравнению с 32-кратной регуляцией с увеличением в костном мозге мышей с эритропоэтической стимуляцией), но это увеличение было достаточным, чтобы снизить уровни печеночной мРНК гепсидина (E) и сывороточного гепсидина (F). (G) Рекомбинантный мышиный Erfe секретируется клетками HEK293T, инфицированными Erfe лентивирусом, как обнаружено посредством Вестерн-блоттинга с анти-FLAG антителами. (H) Обработка мышиных первичных гепатоцитов супернатантами (50% об/об) от контрольных клеток или клеток HEK293T, сверхэкспрессирующих Erfe, показала, что Erfe действует непосредственно на печень, чтобы подавить экспрессию мРНК гепсидина. Показаны средние значения ± SEM от 3 независимых экспериментов с 15-часовыми обработками при тройном повторе. Уровни гепсидина (Hamp), сывороточного амилоида 1 (Saa1) и Erfe мРНК (Erfe) измеряли посредством кРВ-ПЦР. Показаны средние значения ± SEM для -ΔCt (т.е., Ct Hprt - Ct Hamp, Saa1 или Erfe). Сывороточные уровни гепсидина (B, F) измеряли посредством фермент-связанного иммуносорбентного исследования. Средние значения у обработанных мышей и контрольных мышей или Erfe-обработанных образцов и контрольных образцов сравнивали посредством t-критерия Стьюдента. ***p<0,001, **p<0,01, *p<0,05.
[39] Фиг. 11: Увеличенная мРНК Erfe в костном мозге и селезенке th3/+-мышей с искусственно вызванной β-талассемией (тал) (n=4) по сравнению с мышами дикого типа (WT) (n=5). Использовали самцов мышей 6-месячного возраста. *p=0,016, **p<0,001. Hprt применяли в качестве референтного гена.
[40] Фиг. 12: Предсказанные структурные домены Erfe. SP = сигнальный пептид, NTD = N-концевые домены 1 и 2.
[41] ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[42] Настоящее изобретение основано на открытии белка, который в настоящем описании называют "Эритроферрон". Эритроферрон представляет собой первый идентифицированный "гормон", который является посредником между выработкой эритроцитов и всасыванием и распределением железа у субъектов. Эритроферрон продуцируется в костном мозге субъекта, и его выработка в значительной степени увеличивается, когда выработка эритроцитов стимулируется, например, после кровотечения или во время нормализации от анемии. Эритроферрон регулирует поступление железа, чтобы удовлетворять потребностям выработки эритроцитов в костном мозге. Конкретно, было обнаружено, что эритроферрон действует на печень, чтобы подавить выработку основного железорегуляторного белка, гепсидина. Таким образом, сверхвыработка эритроферрона может вызывать перегрузку железом при заболеваниях, таких как β-талассемия, и антагонистический эритроферрон мог бы, таким образом, применяться для лечения β-талассемии.
[43] Эритроферрон был открыт в поисках фактора, который подавляет экспрессию гепсидина. Гепсидин, пептидный гормон из 25 кислот, синтезируемый печенью, является центральным регулятором гомеостаза железа. См. Ganz 2011. Гепсидин действует посредством связывания с исключительным экспортером железа ферропортином, приводящего к его убиквитинированию, интернализации и разрушению в лизосомах. Когда ферропортин исчезает из клеточных мембран, всасывание из пищи ингибируется, и рециклированное железо блокируется в макрофагах, уменьшая доступность железа для эритропоэза. Напротив, низкий гепсидин позволяет ферропортину оставаться активным на клетках, которые экспортируют железо в плазму, делая больше железа доступным для синтеза гемоглобина. Железо, воспаление или ER-стресс стимулируют выработку гепсидина, в то время как гипоксия, дефицит железа и увеличенная эритропоэтическая активность сдерживают ее.
[44] Гепсидин подавляется после кровоизлияния или введения эритропоэтина (ЭПО). Гепсидин снижается при анемии, вызываемой кровотечением, гемолизом или дефицитом железа, или при наследственных анемиях с неэффективным эритропоэзом. Подавляющий эффект эритропоэза на гепсидин является особенно заметным при заболеваниях с неэффективным эритропоэзом, где предшественники эритроцитов обширно распространяются, но, главным образом, подвергаются апоптозу на стадии эритробластов, скорее, чем созревают в эритроциты. Таким образом, у мышей C57BL/6, исследовали зависимость от времени мРНК гепсидина в ответ на кровоизлияние (500 мкл) или инъекцию ЭПО (200 Ед), и наблюдали значительное подавление мРНК печеночного гепсидина между 9 и 15 часами. Через 12-15 часов после эритропоэтической стимуляции, ингибирование было максимальным при приблизительно 90% (Фиг. 1). Зависимость ответа от времени является аналогичной зависимости у людей-добровольцев, где уменьшение происходит между 9-24 часами (Фиг. 2).
[45] Эти данные in vivo по зависимости ответа на кровоизлияние от времени у мышей показывают, что ни мРНК белка α (C/EBPα), связывающего центральный элемент фактора транскрипции, ни уровни белка в печени не изменяются, даже несмотря на то, что происходит наблюдаемое сильное подавление гепсидина. Также не происходит подавления гепсидина после введения ЭПО, вследствие увеличенной утилизации железа, поскольку сильное уменьшение гепсидина предшествует любым изменениям при насыщении трансферрина или других известных относящимся к железу параметрах (Фиг. 2). Таким образом, очевидно, что в ответ на анемию или другие гипоксические стимулы, высокие уровни ЭПО вызывают подавление гепсидина косвенно, посредством индуцирования секреции одного или нескольких эритроидных факторов из костного мозга, которые, в свою очередь, действуют на печень, чтобы подавить экспрессию гепсидина и увеличить доставку железа от всасывания из пищи и запасов. Раннее подавление гепсидина после инъекции ЭПО может делать больше железа доступным для быстрого захвата предшественниками эритроцитов и ускорять эритропоэз.
[46] Таким образом, исследовали профили генной экспрессии в костном мозге в ответ на кровотечение (0-48 часов), используя доступное для приобретения профилирование генной экспрессии на основе чипа (AffymetrixMouse Gene 1.0 ST Array). Профилирование экспрессии может также осуществляться альтернативными методами, включающими секвенирование следующего поколения кДНК, в данной области называемое "RNA Seq." Среди эритроид-специфичных транскриптов, чья экспрессия индуцировалась перед подавлением гепсидиновой мРНК и поддерживалась на высоких уровнях перед возвращением уровня гепсидина к нормальному исходному уровню, находился неохарактеризованный одиночный транскрипт, приводимый в различных базах данных общего пользования как Fam132b, который кодирует секретируемый белок. Было обнаружено, что мРНК Fam132b сильно индуцируется в интервале 4 часов после кровотечения, перед подавлением гепсидина. Эритроферрон представляет собой белок, кодируемый мРНК Fam132b.
[47] За исключением тех случаев, когда это относится к "ERFE-полипептидам" (+ERFE и -ERFE-полипептидам) и "ERFE-полинуклеотидам", как используют в настоящем описании, "ERFE" (все буквы являются заглавными и приводятся курсивом) относится к человеческому гену, кодирующему эритроферрон, "Erfe" (первая буква является заглавной и приводится курсивом) относится к мышиному гену, кодирующему эритроферрон, "ERFE" (все буквы являются заглавными и не приводятся курсивом) относится к человеческому белку эритроферрону, и "Erfe" (первая буква является заглавной и не приводится курсивом) относится к мышиному белку эритроферрону.
[48] Эритроферрон представляет собой член суперсемейства TNFα - аминокислотная последовательность гомологов эритроферрона является довольно консервативной на протяжении эволюции позвоночных, так что мышиные и человеческие белки являются приблизительно на 71% идентичными (Фиг. 3A), а C-концевая половина является приблизительно на 44% идентичной гомологу полосатой гиреллы. Анализ доменов показал, что Erfe представляет собой член суперсемейства TNFα только с умеренным сходством с известными цитокинами. TNFα и лиганд RANK (RANKL) являются самыми близкими родственниками. Поиск по геномным базам данных и базам данных мРНК позволил идентифицировать два варианта человеческого ERFE, которые отличаются только по сигнальной последовательности. Остается определить, экспресируются ли они оба в костном мозге, и обусловливают ли варианты белки с различными уровнями экспрессии или различной биологической активностью. Посредством обратной транскрипции мРНК из имеющих печеночное происхождение человеческих зародышевых эритробластов и секвенирования кДНК, C-концевые 220 аминокислот (выделенные на Фигуре 3A) были подтверждены.
[49] Структурное моделирование целого белка с использованием HHPredictB (Фиг. 3B) показывает, что N-концевая часть белка (слева) состоит из сигнальной последовательности с последующей открытой областью с коллаген-подобным сегментом, а C-концевая часть является гомологичной с TNFα/RANKL (справа). Сходные черты с TNFα являются примечательными, так как TNFα подавляет мРНК гепсидина в культурах первичных гепатоцитов. Сходство с TNFα позволяет предсказать тенденцию к образованию мультимеров.
[50] Экспрессия эритроферрона в костном мозге реагирует на ЭПО - С использованием кПЦР, была подтверждена индукция экспрессии мРНК Erfe после флеботомии в костном мозге (Фиг. 4), а также в селезенке (данные не показаны), таким образом поддерживая его включение в эритропоэз. Инъекция ЭПО у мышей приводит к сравнимому подавлению гепсидина, как и у флеботомизированных мышей, как по амплитуде, так и по характеру изменения во времени (Фиг. 1). Аналогично, реакция мРНК Erfe на ЭПО в костном мозге и селезенке является сходной с реакцией, вызываемой флеботомией, но стимуляция Erfe происходит раньше у ЭПО-инъицированных мышей (Фиг. 4). Данный факт согласуется с тем, что Erfe действует вниз по потоку от ЭПО на модели с флеботомией.
[51] Эритроферрон, вероятно, является эритрокином, продуцируемым эритробластами - Поиск в базах данных генной эксрессии показал, что человеческий ERFE в высокой степени экспрессируется в человеческих костном мозге и печени зародыша (например, Фиг. 5A), и в "in vitro" дифференцированных клетках CD34+ человека достигает максимальной экспрессии в промежуточных эритробластах, приблизительно с 8-кратным увеличением по сравнению с КОЕ-E (Фиг. 5B). Это позволяет предположить, что эритробласты являются основным источником эритроферрона. Данное было непосредственно верифицировано с мышиным костным мозгом ex vivo, полученным через 15 часов после флеботомии 0,5 мл, который показал обширное увеличение экспрессии Erfe в эритробластах по сравнению с контрольными мышами, преимущественно на стадиях EryA и B (ранние и промежуточные эритробласты) (Фиг. 6, кРВ-ПЦР, обозначение Hprt). Вследствие относительной распространенности стадии EryB, эти клетки, вероятно, составляют основной источник Erfe в костном мозге.
[52] Гепсидиновая реакция на кровоизлияние у мышей с выключенным Erfe и гаплонедостаточных мышей - Мыши Erfe+/- на смешанном фоновом генотипе Sv129/C57BL/6 (Fam132btm1Lex, Lexicon Pharmaceuticals) а также мыши, обратно скрещенные на фоновый генотип C57BL/6 с использованием ускоренного с применением маркера обратным скрещиванием, могут применяться, чтобы дополнительно анализировать ERFE-полипептиды в соответствии с настоящим изобретением. В некоторых экспериментах, мышей с фоновым генотипом Erfe-/- и Erfe+/- сравнивали с их однопометными животными дикого типа (WT). Мыши с выключенным Erfe (KO) являются жизнеспособными, выглядят фенотипически нормальными, имеют полностью нормальные и очень экстенсивные стандартизованные обследования, проведенные для мышиной базы данных Lexicon, и являются способными к размножению. Полный подсчет форменных элементов крови, проведенный с использованием автоматического гематологического анализатора (Hemavet 850; Drew Scientific, Oxford, CT) в возрасте 6 недель (но не 3 недели, 12 недель или 6 месяцев), показал сниженные уровни гемоглобина на исходном уровне у Erfe-дефицитных животных по сравнению с животными дикого типа и гетерозиготов. Возраст 6 недель является временем быстрого распространения эритроидов и роста с высокой потребностью в железе, аналогично стрессовому эритропоэзу после кровотечения. Чтобы тестировать, является ли Erfe решающим медиатором репрессии гепсидина при кровотечении, однопометных животных Erfe-/-, Erfe+/- и Erfe+/+ подвергали флеботомии (500 мкл) и анализировали через 12, 15, 24 и 48 часов после флеботомии (Фиг. 7A-7C). Erfe-/- мыши не снижали экспрессию мРНК печеночного гепсидина, указывая на то, что Erfe является незаменимым для быстрого подавления гепсидина после кровоизлияния (Фиг. 7A-7C). Гаплонедостаточные мыши показали только частичную реакцию при 12-15 часах, что предполагает дозозависимый ответ гепсидина на Erfe.
[53] Erfe-дефицитные мыши показывают замедленное восстановление от анемии, индуцируемой кровотечением - 12-недельных мышей Erfe +/+ и Erfe-/- подвергали флеботомии, и их восстановление непрерывно регистрировали в течение 9 дней. Erfe-дефицитные мыши проявляли более низкий гемоглобин и средний корпускулярный гемоглобин по сравнению с контролями дикого типа (Фиг. 8), и восстановление Erfe-дефицитных мышей от анемии, индуцированной кровоизлиянием, было замедлено на несколько дней.
[54] Продуцирование и анализ рекомбинантного белка - Было сконструировано множество плазмид экспрессии, кодирующих кДНК мышиного и человеческого ERFE с C-концевой Myc/Flag, V5 эпитоп/His, Myc/His и Flag/His. Вестерн-блоттинг трансфицированных HEK293T подтвердил, что белок секретируется (Фиг. 9A). Вещество было очищено посредством хроматографии с аффинной меткой, проанализировано на SDS-PAGE, и основные идентифицированные полосы соответствовали полосам, обнаруженным посредством Вестерн-блоттинга. Идентичность полос как Fam132b/Erfe была подтверждена протеомным анализом трипсинизированных фрагментов посредством ВЭЖХ-МС. Интересно, что секретируемая форма Erfe имеет немного более высокую молекулярную массу, чем клеточная форма, и оба белка имели двухкратный предсказанный размер, что указывает на возможную димеризацию. Дегликозилирование очищенного секретируемого продукта указывало на то, что Erfe является N- и O-гликозилированным (Фиг. 9B). Рекомбинантные формы Erfe и ERFE-полипептидов могут применяться для анализа их активностей in vitro и in vivo. Генерировались антитела, вырабатываемые против Erfe, и они могут применяться для обнаружения эндогенного белка (Фиг. 9C) и для определения сывороточных концентраций одного или нескольких ERFE-полипептидов у субъектов, например, мышиных моделей и пациентов с расстройствами обмена железа. В предварительных экспериментах было обнаружено, что один вариант клеточной линии HEK293 экспрессирует Erfe на высоких уровнях, но не может секретировать его, таким образом, указывая на то, что событие секреции может являться специфичным для клеточного типа или зависимым от специализированных характеристик клетки.
[55] Чтобы тестировать, является ли секретируемый эритроферроновый белок супрессором гепсидина, самцам мышей C57BL/6 инъекционно вводили мышиный рекомбинантный Erfe (2 мкг/г). Было обнаружено, что мРНК гепсидина и уровни сывороточного белка значительно снижались через 15 часов после обработки Erfe по сравнению с мышами, которым инъекционно вводили физраствор (Фиг. 10A, 10B), несмотря на существенный воспалительный ответ, запускаемый рекомбинантным белком, как показано посредством увеличенной экспрессии мРНК Saa1 (Фиг. 10C). Воспаление могло бы увеличить экспрессию гепсидина.
[56] Чтобы избежать острого воспалительного эффекта препарата рекомбинантного Erfe, самцов мышей C57BL/6 трансдуцировали вектором на основе лентивируса, кодирующим Erfe. Три недели спустя, умеренное увеличение мРНК Erfe наблюдали в печени (но не костном мозге) мышей, обработанных Erfe-лентивирусом, по сравнению с мышами, обработанными контрольным лентивирусом (Фиг. 10D). Тем не менее, мРНК гепсидина и сывороточные уровни значительно снижались в 30 раз и 10 раз, соответственно (Фиг. 10E, 10F), позволяя предположить, что даже малое количество Erfe в печени было достаточным, чтобы проявить его ингибиторный эффект на транскрипцию гепсидина. Следовательно, тестировали, может ли Erfe действовать непосредственно на печень, чтобы регулировать гепсидин. Мышиные первичные гепатоциты обрабатывали в течение 15 часов 50% (об/об) супернатантами от контрольных HEK293T или HEK293T, сверхэкспрессирующих Erfe (Фиг. 10G), что в результате приводило к 4-кратному уменьшению уровней мРНК гепсидина в Erfe-обработанных клетках (Фиг. 10H). Рассматриваемые вместе, эти результаты показывают, что эритроферрон представляет собой сильный супрессор гепсидина, который может действовать непосредственно на печень, чтобы подавлять экспрессию мРНК гепсидина.
[57] Получение антител - Чтобы облегчить обнаружение и характеризацию эритроферрона, может генерироваться и применяться ряд антител, направленный против пептидных антигенов, как в мышиных, так и человеческих формах эритроферрона и ERFE-полипептидах. В дополнение, антитела против внутренних и N-концевых эпитопов эритроферрона и/или ERFE-полипептидов могут использоваться в различных аналитических тестах и способах обработки в соответствии с настоящим изобретением.
[58] Обширное увеличение Erfe у талассемических мышей - Сверхвыработка эритроферрона может способствовать перегрузке железом при нетрансфузируемой β-талассемии. Применяя мышиную модель Hbbth3/+ β-талассемии (Gardenghi 2007), было показано, что мРНК Erfe является в значительной степени увеличенной в костном мозге и селезенке мышей Hbbth3/+ по сравнению с контролями дикого типа (Фиг. 11). Суммарная экспрессия Erfe является даже более высокой у мышей Hbbth3/+, если учитывать, что они имеют расширенный костный мозг и в 3 раза более крупные селезенки, чем мыши дикого типа.
[59] Полипептиды и композиции
[60] В некоторых вариантах осуществления настоящее изобретение направлено на эритроферрон и его аналоги и фрагменты. Как используют в настоящем описании, эритроферрон (включая ERFE и Erfe) и его аналоги и фрагменты обобщенно именуются в настоящем описании как "ERFE-полипептиды". ERFE-полипептиды могут проявлять или не проявлять эритроферроновую активность. Как используют в настоящем описании, "эритроферроновая активность" относится к способности вещества снижать уровни печеночной мРНК гепсидина или сывороточного гепсидина по сравнению с контролем.
[61] Как используют в настоящем описании, термины "белок", "полипептид" и "пептид" используют взаимозаменяемо для обозначения двух или нескольких аминокислот, связанных вместе. Группы или цепочки сокращенных наименований аминокислот применяют для представления пептидов. За исключением конкретно указанных случаев, пептиды указаны от N-конца в левую сторону, и последовательность пишется от N-конца к C-концу.
[62] ERFE-полипептиды настоящего изобретения могут быть получены с использованием способов, известных в данной области, включающих химический синтез, биосинтез или синтез in vitro, с использованием методов рекомбинантных ДНК и твердофазного синтеза. См. например, Kelly & Winkler (1990) Genetic Engineering Principles and Methods, vol. 12, J. K. Setlow ed., Plenum Press, NY, pp. 1-19; Merrifield (1964) J Amer Chem Soc 85:2149; Houghten (1985) PNAS USA 82:5131-5135; и Stewart & Young (1984) Solid Phase Peptide Synthesis, 2ed. Pierce, Rockford, IL, которые включены в настоящее описание посредством ссылки. ERFE-полипептиды настоящего изобретения могут быть очищены с использованием методов очистки белков, известных в данной области, таких как обращенно-фазовая высокоэффективная жидкостная хроматография (ВЭЖХ), ионообменная или иммуноаффинная хроматография, фильтрация или эксклюзия по размерам или электрофорез. См. Olsnes and Pihl (1973) Biochem. 12(16):3121-3126; и Scopes (1982) Protein Purification, Springer-Verlag, NY, которые включены в настоящее описание посредством ссылки. Альтернативно, ERFE-полипептиды настоящего изобретения могут быть получены посредством методов рекомбинантных ДНК, известных в данной области. Таким образом, полинуклеотиды, которые кодируют ERFE-полипептиды настоящего изобретения, рассматриваются в настоящем описании и именуются в настоящем описании как "ERFE-полинуклеотиды". В некоторых вариантах осуществления ERFE-полинуклеотиды изолируют. Как используют в настоящем описании, "изолированные" полинуклеотиды относятся к полинуклеотидам, которые находятся в окружении, отличном от окружения, в котором полинуклеотид находится естественным образом. Например, изолированный полинуклеотид представляет собой полинуклеотид, который не имеет оснований, обычно фланкирующих 5'- и/или 3'-концы полинуклеотида, как обнаруживают в природных условиях.
[63] В некоторых вариантах осуществления ERFE-полипептиды настоящего изобретения являются очищенными по существу. Как используют в настоящем описании, "очищенное по существу" соединение относится к веществу, которое удаляют из его природного окружения и/или которое не содержит по меньшей мере приблизительно 60%, предпочтительно приблизительно 75%, и более предпочтительно приблизительно 90%, и наиболее предпочтительно приблизительно 95-100% других макромолекулярных компонентов или соединений, с которыми соединение является ассоциированым в природе или в результате его синтеза.
[64] Как используют в настоящем описании, "изолированное" соединение относится к соединению, которое выделяют из его нативного окружения. Например, изолированный полипептид представляет собой полипептид, который не имеет нативных аминокислот, которые соответствуют непроцессированному полипептиду, фланкирующих N-конец, C-конец или и тот и другой. Например, изолированный фрагмент эритроферрона или ERFE-полипептида относится к изолированному полипептиду, который содержит некоторые, но не все, из аминокислотных остатков эритроферрона или ERFE-полипептида, но может иметь ненативные аминокислоты по его N-концу, C-концу или обоим, т.е., различные аминокислоты, которые не имеют идентичности с аминокислотами по соответствующему положению эритроферрона или ERFE-полипептида. В некоторых вариантах осуществления ERFE-полипептиды настоящего изобретения получают, используя синтетические и/или рекомбинантные методы.
[65] В некоторых вариантах осуществления один или несколько ERFE-полипептидов, описанных в настоящем описании, предоставлены в форме композиции, которая содержит носитель, подходящий для заданной цели. Композиции могут также включать один или несколько дополнительных ингредиентов, подходящих для заданной цели. Например, для аналитических тестов, композиции могут содержать липосомы, никлозамид, SL220 средство для солюбилизации (NOF, Japan), Кремофор EL (Sigma), этанол и ДМСО. Для лечения расстройства обмена железа композиции могут содержать различные усилители всасывания и ингибиторы протеаз, твердые микрочастицы или наночастицы для инкапсулирования пептидов (такие как хитозан и гидрогели), макромолекулярной конъюгации, липидизации и другой химической модификации. В некоторых вариантах осуществления композиции настоящего изобретения содержат один или несколько ERFE-полипептидов при концентрации, которая является более высокой, чем концентрация, при которой они обнаруживаются у субъектов с нормой.
[66] Один или несколько ERFE-полипептидов в соответствии с настоящим изобретением или их композиции могут применяться для лечения заболеваний, связанных с метаболизмом железа. Как используют в настоящем описании, термин "заболевание, связанное с метаболизмом железа" включает заболевания, при которых аберрантный метаболизм железа непосредственно вызывает заболевание, или при которых уровни железа в крови являются дисрегулированными, вызывая заболевание, или при которых дисрегуляция железа является последствием еще одного другого заболевания, или при которых заболевания могут подвергаться лечению посредством модулирования уровней железа и т.п. Более конкретно, заболевание, связанное с метаболизмом железа в соответствии с данным раскрытием, включает заболевания перегрузки железом, расстройства, связанные с дефицитом железа, расстройства биораспределения железа, другие расстройства метаболизма железа и другие расстройства, потенциально относящиеся к метаболизму железа, и т.д. Заболевания, связанные с метаболизмом железа, включают гемохроматоз, гемохроматоз с мутацией HFE, гемохроматоз с мутацией ферропортина, гемохроматоз с мутацией трансферринового рецептора 2, гемохроматоз с мутацией гемоювелина, гемохроматоз с мутацией гепсидина, ювенильный гемохроматоз, неонатальный гемохроматоз, недостаточность гепсидина, трансфузионную перегрузку железом, талассемию, промежуточную талассемию, альфа-талассемию, сидеробластную анемию, порфирию, позднюю кожную порфирию, африканскую перегрузку железом, гиперферритинемию, недостаточность церулоплазмина, атрансферринемию, врожденную дисэритропоэтическую анемию, анемию хронического заболевания, анемию воспаления, анемию инфекции, микроцитарную гипохромную анемию, железодефицитную анемию, железо-рефрактерную железодефицитную анемию, анемию хронического заболевания почки, резистентность к эритропоэтину, недостаточность железа при ожирении, другие анемии, доброкачественные или злокачественные опухоли, которые сверхпродуцируют гепсидин или индуцируют его сверхпродуцирование, состояния с избытком гепсидина, атаксию Фридрейха, GRACILE-синдром, болезнь Галлервордена-Шпатца, болезнь Вильсона, гемосидероз лёгких, гепатоцеллюлярную карциному, злокачественное новообразование, гепатит, цирроз печени, пикацизм, хроническую почечную недостаточность, резистентность к инсулину, диабет, атеросклероз, нейродегенеративные расстройства, рассеянный склероз, болезнь Паркинсона, болезнь Хантингтона и болезнь Альцгеймера. В некоторых вариантах осуществления заболевание перегрузки железом представляет собой миелодиспластический синдром. В некоторых случаях заболевания и расстройства, включенные в определение "заболевание, связанное с метаболизмом железа", не идентифицируют обычно как относящиеся к железу. Например, гепсидин в высокой степени экспрессируется в поджелудочной железе мыши, что позволяет предположить, что состояния при диабете (Типа I или Типа II), резистентности к инсулину, нарушения толерантности к глюкозе и другие расстройства могут быть улучшены посредством лечения лежащих в основе расстройств метаболизма железа. См. Ilyin, G. et al. (2003) FEBS Lett. 542 22-26, которая включена в настоящее описание посредством ссылки. Как таковые, эти заболевания охватываются широким определением. Специалисты в данной области будут способны легко определить, является ли данное заболевание "заболеванием, связанным с метаболизмом железа" в соответствии с настоящим изобретением, с использованием способов, известных в данной области, включающих аналитические тесты из WO 2004092405, которая включена в настоящее описание посредством ссылки, и аналитические тесты, которые регистрируют гепсидин, гемоювелин или уровни железа и экспрессию, которые известны в данной области, такие как аналитические тесты, описанные в патенте США № 7,534,764, который включен в настоящее описание посредством ссылки. В некоторых вариантах осуществления настоящего изобретения, заболевания, связанные с метаболизмом железа, представляют собой заболевания перегрузки железом, которые включают наследственный гемохроматоз, железонагрузочные анемии, алкогольные заболевания печени и хронический гепатит C.
[67] Как используют в настоящем описании, заболевания и расстройства, относящиеся к избытку гепсидина, включают анемию хронического заболевания (также называемую анемией воспаления), анемии, ассоциированые с острыми или хроническими инфекциями, анемию хронического заболевания почки, анемии вследствие опухолей, которые секретируют гепсидин, и железорефрактерную железодефицитную анемию (IRIDA).
[68] Как используют в настоящем описании, заболевания и расстройства, относящиеся к недостатку гепсидина, включают взрослые и ювенильные формы наследственного гемохроматоза, α-талассемию, β-талассемию и врожденные дисэритропоэтические анемии и хронические заболевания печени, включающие алкогольное заболевание печени и хронический гепатит B и C.
[69] Как используют в настоящем описании, "+ERFE-полипептид" относится к ERFE-полипептиду, который проявляет эритроферроновую активность, которая является идентичной или аналогичной активности мышиного и/или человеческого эритроферрона. Эритроферрон представляет собой +ERFE-полипептид. Как используют в настоящем описании, "-ERFE-полипептид" относится к ERFE-полипептиду, который не проявляет эритроферроновую активность и в некоторых вариантах осуществления препятствует активности +ERFE-полипептидов. Эритроферрон не является -ERFE-полипептидом. Таким образом, термин "ERFE-полипептиды" используют для обозначения как +ERFE-полипептидов, так и -ERFE-полипептидов. Другими словами, ERFE-полипептид может представлять собой +ERFE-полипептид или -ERFE-полипептид.
[70] +ERFE-полипептиды и способы терапии
[71] В некоторых вариантах осуществления настоящее изобретение направлено на способы использования одного или нескольких +ERFE-полипептидов по отдельности или в комбинации с одним или несколькими агонистами эритроферрона для лечения заболеваний и расстройств, относящихся к избытку гепсидина и/или недостаткам железа, например, анемии воспаления и железорефрактерной железодефицитной анемии (IRIDA). В некоторых вариантах осуществления +ERFE-полипептиды настоящего изобретения имитируют действие эритроферрона, т.е., проявляют такую же или по существу сходную активность с активностью эритроферрона. В некоторых вариантах осуществления настоящее изобретение направлено на способы использования одного или нескольких +ERFE-полипептидов, чтобы ингибировать, подавлять или снижать экспрессию гепсидина или предотвращать дополнительную экспрессию гепсидина.
[72] -ERFE-полипептиды и способы терапии
[73] В некоторых вариантах осуществления настоящее изобретение направлено на способы использования одного или нескольких -ERFE-полипептидов по отдельности или в комбинации с одним или несколькими антагонистами эритроферрона для лечения заболеваний и расстройств, относящихся к недостаткам гепсидина и/или перегрузке железом. В некоторых вариантах осуществления настоящее изобретение направлено на использование одного или нескольких -ERFE-полипептидов для увеличения экспрессии гепсидина и/или его количеств. В некоторых вариантах осуществления -ERFE-полипептиды включают -ERFE-полипептиды, которые конкурентным образом соперничают с эритроферроном за рецептор для эритроферрона и увеличивают экспрессию гепсидина и/или количества гепсидина. Таким образом, в некоторых вариантах осуществления настоящее изобретение направлено на способы использования одного или нескольких -ERFE-полипептидов по отдельности или в комбинации с одним или несколькими антагонистами эритроферрона для лечения заболеваний и расстройств, вызываемых недостатками гепсидина, например, β-талассемии или врожденной дисэритропоэтической анемии, и токсичностью железа.
[74] Таким образом, один или несколько ERFE-полипептидов настоящего изобретения могут вводиться субъекту, предпочтительно млекопитающему, такому как человек. В некоторых вариантах осуществления ERFE-полипептиды вводят в форме фармацевтической композиции. В некоторых вариантах осуществления ERFE-полипептиды вводят в терапевтически эффективном количестве. Как используют в настоящем описании, "терапевтически эффективное количество" является количеством, которое смягчает симптомы и/или патологию данного заболевания, связанного с метаболизмом железа, по сравнению с контролем, таким как плацебо.
[75] Терапевтически эффективное количество может быть легко определено стандартными методами, известными в данной области. Дозировки для введения могут быть определены рядовым специалистом в области в зависимости от клинической тяжести заболевания, возраста и массы тела субъекта или воздействия железа на субъекта. Предпочтительные эффективные количества соединений изобретения находятся в интервале от приблизительно 0,01 до приблизительно 10 мг/кг массы тела, предпочтительно от приблизительно 0,1 до приблизительно 3 мг/кг массы тела, и более предпочтительно от приблизительно 0,5 до приблизительно 2 мг/кг массы тела для парентеральных готовых лекарственных форм. Предпочтительные эффективные количества для перорального введения будут достигать значений выше указанных приблизительно в 10 раз. Более того, лечение субъекта с использованием ERFE-полипептида или композиции настоящего изобретения может включать однократную терапию или предпочтительно может включать ряд терапий. Следует учитывать, что действительные дозировки будут варьировать в соответствии с конкретными ERFE-полипептидом или композицией, конкретной лекарственной формой, способом введения и конкретным участком, реципиентом и заболеванием, подвергающимся лечению. Также следует учитывать, что эффективная дозировка, применяемая для лечения, может увеличиваться или уменьшаться на протяжении курса конкретного лечения. Оптимальные дозировки для данного набора условий могут быть установлены специалистами в данной области с использованием общепринятых тестов для определения дозировки с учетом экспериментальных данных для данных ERFE-полипептида или композиции. Изменения в дозировке могут приводить и становиться очевидными посредством стандартных диагностических аналитических тестов, известных в данной области. При некоторых состояниях может требоваться постоянное введение.
[76] Фармацевтические композиции изобретения могут быть получены в форме единичной лекарственной формы, подходящей для желательного способа введения. Композиции настоящего изобретения могут вводиться для терапии посредством любого подходящего пути, включающего пероральный, ректальный, назальный, местный (включая буккальный и подъязычный), вагинальный и парентеральный (включая подкожный, внутримышечный, внутривенный и внутрикожный). Следует учитывать то, что предпочтительный путь будет варьировать вместе с состоянием и возрастом реципиента, природой состояния, подлежащего лечению, и выбранных ERFE-полипептида и композиции.
[77] Фармацевтические композиции настоящего изобретения содержат терапевтически эффективное количество по меньшей мере одного ERFE-полипептида, как раскрыто в настоящем описании, и инертный, фармацевтически приемлемый носитель или разбавитель. Как используют в настоящем описании словосочетание "фармацевтически приемлемый носитель" предназначено, чтобы включать любые и все растворители, дисперсионные среды, покрытия, антибактериальные и противогрибковые средства, изотонические и замедляющие всасывание средства и т.п., совместимые с фармацевтическим введением и известные в данной области. За исключением случаев, когда какие-либо общепринятые среда или средство являются несовместимыми с активным соединением, предусмотрено их применение в композициях.
[78] Дополнительные активные соединения могут также быть включены в композиции. Дополнительные активные соединения включают никлозамид, липосомы, солюбилизатор SL220 (NOF, Japan), Кремофор EL (Sigma), этанол и ДМСО.
[79] Токсичность и терапевтическая эффективность действия ERFE-полипептидов и композиций настоящего изобретения могут быть определены посредством стандартных фармацевтических методик в клеточных культурах или на экспериментальных животных, например, для определения LD50 (дозы, летальной для 50% популяции) и ED50 (дозы, терапевтически эффективной у 50% популяции). Дозовое отношение между токсическими и терапевтическими эффектами представляет собой терапевтический индекс, и он может выражаться в виде отношения LD50/ED50. ERFE-полипептиды, которые проявляют высокие терапевтические индексы, являются предпочтительными. В то время как могут применяться ERFE-полипептиды, которые проявляют токсические побочные эффекты, должны быть приняты меры для конструирования системы доставки, которая нацеливает такие ERFE-полипептиды к участку пораженной ткани, чтобы минимизировать потенциальное повреждение для неинфицированных клеток и, таким образом, снизить побочные эффекты.
[80] Данные, полученные в результате аналитических тестов на клеточных культурах и исследований на животных, могут применяться при составлении интервала дозировки для применения у людей. Дозировка ERFE-полипептидов настоящего изобретения находится предпочтительно в пределах интервала циркулирующих концентраций, который включает ED50 с небольшой токсичностью или без токсичности. Дозировка может варьировать в пределах этого интервала в зависимости от использованной дозированной формы и применяемого пути введения. Для любого ERFE-полипептида, применяемого в способе изобретения, терапевтически эффективную дозу можно оценить первоначально по результатам аналитических тестов на клеточных культурах. Доза может быть составлена на животных моделях для достижения интервала циркулирующих плазменных концентраций, который включает IC50 (т.е., концентрацию тестируемого соединения, которая достигает половины максимального ингибирования симптомов), как определяют в клеточной культуре. Такую информацию можно использовать, чтобы более точно определить применимые дозы у людей. Уровни в плазме могут быть измерены, например, посредством высокоэффективной жидкостной хроматографии.
[81] Настоящее изобретение также предоставляет наборы, содержащие один или более ERFE-полипептидов и/или одну или более композиций настоящего изобретения, упакованные вместе с реагентами, устройствами, инструкцией или их комбинациями. Например, наборы могут включать реагенты, применяемые для проведения аналитических тестов, лекарственные средства и композиции для диагностики, лечения или регистрации расстройств метаболизма железа, устройства для получения образцов, подлежащих тестированию, устройства для смешивания реагентов и проведения аналитических тестов и т.п.
[82] Следующие примеры предназначены для иллюстрации, но не для ограничения изобретения.
[83] ЭКСПЕРИМЕНТЫ
[84] 1. Роль эритроферрона в эритрон-зависимой регуляции метаболизма железа
[85] Продуцирование эритроферрона - Предварительные данные указывают на то, что мРНК Erfe в значительной степени увеличивается в костном мозге и селезенке после кровоизлияния и инъекции ЭПО. Клеточные типы костного мозга и селезенки, экспрессирующие транскрипт Erfe при нормальных условиях и во время стрессового эритропоэза, идентифицировали следующим образом: вкратце, общие клетки селезенки и костного мозга выделяют из контрольных мышей и флеботомизированных мышей (15 часов) и сортируют посредством проточной цитометрии на основании уровней экспрессии Ter119, CD71 и дальнейшего рассеивания. См. например, Socolovsky 2007; Chen 2009. Экспрессию мРНК Erfe количественно оценивали посредством кПЦР в каждой клеточной популяции относительно двух конститутивных генов. Экспрессия Erfe сильно увеличивалась на всех эритробластных стадиях после флеботомии по сравнению с контрольными мышами (Фиг. 6) (ProE, EryA, B и C). Вследствие относительной распространенности стадии EryB, эти клетки, вероятно, составляют основной источник эритроферрона в костном мозге. Чтобы подтвердить, является ли Erfe несомненным эритроид-специфичным продуктом, может проводиться анализ кПЦР представительных мышиных тканей на исходном уровне и после флеботомии.
[86] Гематопоэтические клетки - Чтобы исследовать вклад гематопоэтических клеток в продуцирование биоактивного эритроферрона, может проводиться возвратная трансплантация костного мозга между мышами Erfe-/- и Erfe+/+ после миелоаблативного облучения, с использованием аутотрансплантатов в качестве контролей. Такие эксперименты могут осуществляться в соответствии с недавними руководствами по ветеринарии. См. Duran-Struuck 2009. После предоставления 3 недель для эритропоэтического восстановления и прекращения воспалительной реакции на излучение и трансплантат, подавление гепсидина через 15 часов после флеботомии 500 мкл может применяться в качестве фенотипического считывания. Приживление и доминирование донорных клеток могут быть подтверждены посредством кПЦР ДНК костного мозга для интактных Erfe аллелей по сравнению с разрушенными Erfe аллелями, и продуцирование Erfe может быть оценено посредством кРВ-ПЦР (или ELISA, и т.п.). Ожидают, что фенотип будет переноситься с костным мозгом. При маловероятном альтернативном исходе, другие клеточные типы могут быть проанализированы в качестве источника эритроферрона.
[87] Регуляция посредством ЭПО - ЭПО может иметь двойные эффекты на экспрессию эритроферрона: 1) он увеличивает число клеток (промежуточных эритробластов), которые экспрессируют эритроферрон посредством инициации выживания предшественников через проэритробласт-базофильные эритробластные стадии, или 2) он может непосредственно или косвенно регулировать концентрации мРНК эритроферрона. Поскольку Erfe почти максимально, 30-кратно, увеличивается уже через 4 часа после инъекции ЭПО у мышей (Фиг. 4), причем в это время число эритроидных предшественников из селезенки или костного мозга лишь слегка увеличивается, преобладает второй механизм, и ответ на ЭПО является, вероятно, эритробласт-автономным. Тем не менее, регуляция посредством ЭПО может быть определена следующим образом: вкратце, свежесобранные клетки мышиного костного мозга инкубируют в течение 4 часов, дополняя среду концентрацией ЭПО, равной 0-2,5 мкг/мл, и затем сортируют эритроидные клетки, используя методы, известные в данной области. Каждая стадия созревания эритроидов будет проанализирована посредством кРВ-ПЦР на предмет экспрессии Erfe как функции дозы ЭПО.
[88] Поскольку эритроферрон не требуется для базального эритропоэза, ожидают, что эритроферрон будет регулироваться посредством стрессового пути рецептора ЭПО (EPOR). Stat5 является основным фактором транскрипции пути ЭПО-EPOR/Jak2 для генов, активируемых стрессовым эритропоэзом (Teglund 1998; Menon 2006), и анализ 3 тысяч гетероциклических оснований нуклеиновой кислоты промотора мышиного и человеческого эритроферрона с использованием программного обеспечения Genomatix показал множество потенциальных элементов, связывающих Stat5 (или другие Stat), и GATA-связывающих мотивов. Следовательно, можно проверить, регулируется ли транскрипция Erfe посредством пути Stat, в соответствии со следующим: эритроидные предшественники из печени мышиного зародыша и мышиного костного мозга культивируют (England 2011), обрабатывают ступенчато изменяющимися концентрациями ЭПО в течение 4 часов с ингибиторами Stat5 или без них (пимозидом или N′-((4-оксо-4H-хромен-3-ил)метилен)никотиногидразидом), и эффект на уровни мРНК Erfe оценивают посредством кПЦР. Если эритробласты плохо переносят короткое воздействие ингибиторов Stat5, можно применять клеточную линию UT7, которая проходит через дифференциацию эритроидов при обработке ЭПО, или непрерывную клеточную линию CD36E, клеточную линию предшественников эритроидов, обладающих способностью продуцировать гемоглобин (Wong 2010) или линию клеток J2E (Greene 2002). Используя эти клеточные линии и конструкцию промотора Erfe с люциферазой проводят сайт-направленный мутагенез предполагаемых сайтов связывания Stat5, чтобы тестировать механизм, посредством которого ЭПО регулирует промотор Erfe. Наконец, если эти подходы окажутся безуспешными при определении того, регулирует ли путь STAT5 экспрессию Erfe, можно получить мышей EPOR-HM, мышей с недостаточным ступенчатым ответом на STAT5, и определить, регулируют ли эти мыши Erfe в ответ на EPO. См. Porpiglia 2012. Хотя и менее вероятно, один или несколько альтернативных путей передачи сигналов от рецептора ЭПО могут быть более важными, чем STAT5 при регуляции Erfe. В целом, эти пути являются менее понятными, но включают пути PI3-киназы и MAP-киназы, и преимущественно включены в регуляцию выживания и пролиферации эритробластов. См. Richmond 2005; Bouscary 2003.
[89] Зависимость от дозы ЭПО - Терапевтические дозы ЭПО снижают концентрацию гепсидина даже в условиях нормального или увеличенного продуцирования эндогенного ЭПО, и даже в случае воспаления и перегрузки железом. См. Huang 2009. Этот важный эффект ЭПО является непонятным и важен, поскольку он может способствовать его терапевтической эффективности при анемии воспаления и анемии злокачественного новообразования, где гепсидин повышается, а железо секвестрируется в макрофагах. Дозовая зависимость ответа печеночной мРНК гепсидина и сывороточного гепсидина на ступенчатые дозы ЭПО (однократная инъекция, 0,2-200 Ед) может быть определена у Erfe KO и гетерозиготных животных по сравнению с WT-контролями. Как показано предварительными данными у WT-мышей, инъекция ЭПО имела эффект, идентичный эффекту однократной флеботомии на зависимость от времени гепсидина или экспрессии мРНК Erfe, таким образом, ожидают, что ЭПО-инъицированные Erfe-/- мыши не смогут подавлять гепсидин аналогично флеботомизированным Erfe-/-. Возможно, что альтернативный путь, подавляющий гепсидин, станет проявляться у Erfe-/- KO-мышей при более высоких концентрациях EPO. Несмотря на то, что сообщалось о прямом эффекте ЭПО на экспрессию гепсидина (Pinto 2008), такое подавление не наблюдали в экспериментах, проводимых авторами настоящего изобретения. Если высокая доза ЭПО подавляет гепсидин у Erfe-/- мышей, можно повторно исследовать, могут ли высокие концентрации ЭПО подавлять мРНК гепсидина в печени косвенно, возможно, посредством действия на популяции негепатоцитных клеток, которые также могут составлять примеси у некоторых первичных гепатоцитных культур.
[90] Анемия в результате гемолиза - Модель фенилгидразин-индуцированного гемолиза традиционно применяется для исследований стрессового эритропоэза у мышей, и анемия является ассоциированной с подавлением гепсидина (Nicolas 2002). Модель отличается от геморрагической анемии тем, что восстановление зависит от рециркуляции гема и железа. Можно подвергнуть анализу эффект абляции Erfe на восстановление от острой гемолитической анемии после однократной дозы фенилгидразина, равной 100 мг/кг (Lim 1998). Мыши будут проанализированы в дни 2, 4 и 6 для полного подсчета форменных элементов крови, определения созревания эритроидов посредством проточной цитометрии, на предмет экспрессии гепсидина, и параметров железа. Ожидают, что гепсидин не будет подавляться у Erfe-/--мышей, и они будут иметь замедленное восстановление эритроидов.
[91] Компенсаторное всасывание железа из пищи и высвобождение железа из запасов - У людей всасывание железа из пищи составляет менее чем 10% от общих суточных потребностей в железе, и большую часть железа получают из макрофагов, рециркулирующих стареющие эритроциты. У мышей, питающихся нормальным кормом, однако, всасывание из пищи обеспечивает почти 50% от общей суточной потребности в железе. См. Ramos 2011. Таким образом, чтобы провести разграничение, имеет ли абляция Erfe отличимые эффекты на утилизацию пищевого железа по сравнению с рециклизованным железом во время восстановления от кровоизлияния, можно управлять запасами железа мыши и содержанием железа в пище. Для оценки эффекта недостаточности Erfe на всасывание железа из пищи, нужно сначала истощить запасы железа, кормя животных 4 ч/млн диеты в течение двух недель. Как только запасы железа становятся низкими, что подтверждается анализом исходного уровня железа в печени и селезенке у подгруппы мышей, еще одну другую группу животных флеботомизируют 500 мкл и помещают в условия диеты, богатой железом (300 ч/млн). Чтобы оценить эффект Erfe на рециклизацию железа и его мобилизацию из запасов, мышей предварительно обрабатывают декстраном железа, чтобы обеспечить их достаточными запасами железа, для компенсации 500 мкл кровопотери (300 мкг железа), и неделей позже флеботомизируют и помещают в условия 4 ч/млн железодефицитной диеты. Ожидают, что недостаток подавления гепсидина у Erfe KO-мышей будет снижать компенсаторное увеличение как при высвобождении запасного железа, так и при всасывании железа из пищи. Другие исходы будут создавать возможность разграниченной регуляции транспорта железа в кишечнике по сравнению с транспортом железа макрофагами, как сообщалось другими авторами (Chaston 2008), или резервных путей для их регуляции.
[92] Другая возможная активность: Возможно, что Erfe оказывает некоторое влияние на окружение костного мозга. Для обнаружения основных эффектов можно сравнить морфологию срезов бедра у Erfe-сверхэкспрессирующих, Erfe-/- и WT-мышей. Для сравнения эритроидной клеточной линии у этих мышей можно проанализировать общие клетки селезенки и костного мозга посредством проточной цитометрии, основанной на уровнях экспрессии c-kit, Ter119, CD71 и/или CD44. См. Socolovsky 2007; Chen 2009.
[93] 2. Характеризация эритроферрона, его активность и механизм действия
[94] Могут быть охарактеризованы масса и состав эритроферрона, включая его внутриклеточные и внеклеточные изоформы, и проведен анализ делеции домена, чтобы установить его функциональные компоненты. Также можно определить, секретируется ли эритроферрон в кровоток, и проявляет ли он свой эффект непосредственно на печень. Рекомбинантные и/или синтетические формы эритроферрона могут применяться для исследования его воздействия на экспрессию гепсидина in vivo и in vitro. Могут быть исследованы воздействие, которое эритроферрон оказывает на эритроидные предшественники и их дифференциацию, а также рецептор эритроферрона.
[95] Физико-химические и составные характеристики - Можно провести временную трансфекцию среднего масштаба клеток HEK293T (Freestyle 293 Экспресси System, Invitrogen) с использованием плазмиды, содержащей последовательность кДНК мышиного и человеческого эритроферрона, гибридизированную с C-концевой FLAG и 6-гистидиновой меткой. Экспрессия в клетках млекопитающих увеличивает вероятность того, что рекомбинантный белок будет настолько близок к нативной форме, насколько практически достижимо. Внутриклеточная форма из клеточных лизатов и секретируемая форма из среды могут быть очищены и проанализированы. На основании предыдущего опыта, 2-стадийная очистка является предпочтительной для получения удовлетворительно чистого белка, который может применяться для обработок in vivo и in vitro. Следовательно, первоначальная очистка рекомбинантного эритроферрона может быть проведена прежде всего с использованием аффинных шариков, специфичных для одной из C-концевых меток, а окончательная очистка может быть проведена посредством ВЭЖХ. Для предотвращения потенциального ингибирования активности во время очистки или посредством меток можно также тестировать активность частично очищенных фракций и белка, обработанного для удаления меток. Очищенный белок может быть охарактеризован по размеру с использованием гель-проникающей хроматографии и SDS-PAGE, и затем последовательность может быть определена посредством N-концевой деградации Эдмана и посредством расщепления эндопротеазами и фрагментационной масс-спектрометрии. Используя Вестерн-блоттинг с антителами против эритроферрона, можно сравнить размер рекомбинантного белка с Erfe, секретируемым ЭПО-стимулированными мышиными эритробластами в культуре.
[96] ERFE-полипептиды и активность - Можно провести анализ функциональных форм и доменов ERFE-полипептидов посредством двух комплементарных подходов. Во-первых, растворимый и полученный из клеток ERFE, частично или полностью очищенные, тестируют на предмет биоактивности при инъекции мышам. При втором подходе, лентивирусные методы доставки применяют для исследования вариантов Erfe, в которых белок модифицируют для удаления частично или полностью его индивидуальных структурных доменов. Первоначально, можно заместить родовую сигнальную последовательность и подвергнуть белок N-концевому отсекающему анализу, чтобы удалить N-концевой домен (NTD1) и/или коллагеновый домен (Фиг. 12) для определения того, являются ли они решающими для активности Erfe in vivo. N-концевой домен 2 (NTD2) может быть более трудным для удаления полностью, поскольку его Cys142 вероятно участвует в образовании дисульфидной пары, но по меньшей мере его N-концевая половина будет удалена. На основании его гомологии с другими цитокинами, ожидают, что TNF-подобный C-конец является активным фрагментом, и что другие домены способствуют синтезу, секреции или возможной альтернативной функции, такой как передача сигнала клетка-к-клетке мембранно-ассоциированой формы Erfe. При обоих подходах, считывание через 4-15 часов будет включать сывороточный гепсидин посредством иммуноанализа и измерения кПЦР экспрессии мРНК гепсидина в печени. Чтобы предотвратить вмешательство от сильного сигнала железа, который стимулирует гепсидин, когда мыши находятся на "стандартной" диете (обычно 270-300 ч/млн), которое вызывает мягкую перегрузку железом, мыши могут быть помещены в условия диеты с низким (4 ч/млн Fe) или достаточным (50 ч/млн Fe) содержанием железа в течение 2 недель перед инъекцией. Это предварительное кондиционирование будет гарантировать восприимчивость гепсидина как к положительным, так и отрицательным стимулам.
[97] Созревание эритроидов - Эритроферрон может также оказывать воздействия на распространение и созревание эритроидов, либо непосредственно, либо через его воздействия на доставку железа. Было показано, что насыщенность железом после железодефицитной анемии увеличивает ядросодержащие эритроидные клетки в 2,5 раза, а эритробласты до 3,9 раз, указывая на то, что доступность железа ограничивает распространение эритробластов. В предварительных исследованиях проточную цитометрию (маркеры Ter119, CD71, CD44) (Socolovsky 2007; Chen 2009) применяли для анализа созревания эритробластов в костном мозге и селезенке флеботомизированных мышей дикого типа, гетерозиготов и KO-мышей по сравнению с необработанными однопометными контролями. Через 72 часа после флеботомии эритроидные клетки у Erfe-/--мышей, по-видимому, являются менее зрелыми, чем у WT и гетерозиготов, но больше мертвых клеток не наблюдали, таким образом, предполагая, что Erfe не играет роли при защите эритробластов против апоптоза. Поскольку KO-мыши, по-видимому, имеют относительно меньше незрелых предшественников (ранних эритробластов), и апоптоз, по-видимому, не изменяется у Erfe KO-мышей, возможно, что Erfe может иметь значение при регуляции ранней пролиферации и дифференциации предшественников.
[98] Можно исследовать роль эритроферрона в эритропоэзе посредством проточной цитометрии предшественников из селезенки и костного мозга, собранных при различных интервалах после эритропоэтической стимуляции, а также культивируемых предшественников из печени зародышей, посредством сравнения Erfe KO-мышей с WT-мышами. Можно также исследовать эффекты инъекционно введенного эритроферрона на эритропоэз, используя аналогичные методы как у Erfe KO-, так и WT-мышей. Дифференциация эритробластов может быть охарактеризована посредством экспрессии Ter119, CD71 и/или CD44. Передачу сигналов при апоптозе и смерть клеток можно оценить посредством окрашивания аннексином V и 7-аминоактиномицином D (7-AAD), соответственно.
[99] Обработки Erfe in vivo с последующим анализом методом проточной цитометрии количеств эритроидных предшественников и распределения между стадиями созревания продемонстрируют какие-либо значимые эффекты Erfe на пролиферацию или созревание эритроидных предшественников. Однако они не установят, опосредуются ли эффекты железом и гепсидином или имеет место прямое воздействие Erfe на эритроидные предшественники. Для ответа на этот вопрос можно исследовать эффект Erfe, добавленного к культурам эритроидов из печени зародышей, где железо (голотрансферрин) присутствует в среде, и концентрации гепсидина являются очень низкими. Культивирование in vitro 14,5-15,5-дневных эритроидных предшественников печени зародышей из WT- и Erfe-/--мышей может осуществляться в присутствии или в отсутствие добавленного рекомбинантного Erfe. Созревание эритроидных предшественников может быть проанализировано посредством проточной цитометрии, как прежде. Во всех этих исследованиях можно сравнивать популяции предшественников или индексы смерть клеток/апоптоз между Erfe KO- и WT-мышами и между Erfe- и условиями ложной обработки.
[100] Рецепторы ERFE - Исходя из сходства эритроферрона с TNFα, рецептор эритроферрона может принадлежать к семейству рецепторов TNF (TNFR). Несколько рецепторов в этом семействе являются "сиротами", т.е., у них отсутствуют какие-либо известные лиганды. См. Bossen 2006. Таким образом, можно провести скрининг библиотеки экспрессии известного мышиного и человеческого семейства TNFR посредством проточной цитометрии. Конструкции рецептора могут преходящим образом экспрессироваться в клетках HEK293 (Bossen 2006), и они могут быть окрашены FLAG-меченной формой мышиного или человеческого эритроферрона (Фиг. 10G) с последующей обработкой биотинилированным анти-FLAG M2 антителом и PE-связанным стрептавидином. Если ни один из известного семейства TNFR не связывет эритроферрон, можно осуществить роботизированный высокопроизводительный скрининг всех рецептор-подобных молекул из библиотеки экспрессии мышиной и человеческой кДНК, используя прилипающие клетки в 384-луночных планшетах и высокопроизводительную флуоресцентную микроскопию. Попадания могут быть подвергнуты подтверждению методом проточной цитометрии. Профиль экспрессии генов всех идентифицированных рецепторов может быть скринирован при исследовании баз данных тканевой экспрессии (например, Nextbio Body Atlas), для подтверждения того, что рецептор экспрессируется в целевой ткани эритроферрона (гепатоцитах, если медиатор действует напрямую), и для идентификации потенциальных тканевых и органных мишеней для эритроферрона. Можно также предпринять биохимический подход, чтобы идентифицировать белки, взаимодействующие с эритроферроном. Эритроферрон и/или ERFE-полипептиды могут быть иммобилизованы на магнитных шариках и применяться для экстракции любых связывающих белков из мембранных или клеточных лизатов мышиных первичных гепатоцитов (или других клеточных типов, идентифицированных как мишени для ERFE в предшествующих исследованиях). Комплекс может быть идентифицирован с использованием ВЭЖХ-масс-спектрометрии. Как только рецептор эритроферрона идентифицируют, можно использовать его сходство с другими рецепторами (если они есть), чтобы точно указать его потенциальные механизмы передачи сигналов.
[101] 3. Возрастает ли эритроферрон при расстройствах, связанных с перегрузкой железом, ассоциированных с подавлением гепсидина
[102] Концентрации эритроферрона в образцах сыворотки от здоровых добровольцев и пациентов, а также у мышиных моделей могут быть проанализированы, чтобы подтвердить, что эритроферрон действует в качестве патологического супрессора гепсидина при анемиях с неэффективным эритропоэзом.
[103] Нормальные и патологические концентрации эритроферрона - Антитела против эритроферрона, направленные против эритроферрона и/или ERFE-полипептидов, могут применяться для определения нормальных и аномальных концентраций эритроферрона у субъектов. Было обнаружено, что антитела против мышиного Erfe против двух различных эпитопов белка Erfe сильно взаимодействуют с рекомбинантным белком при Вестерн-блоттингах (Фиг. 9C). Анализы методом ELISA могут применяться для измерения циркулирующих уровней ERFE у субъектов, включающих нормальных субъектов и субъектов после флеботомии, гемолитической анемии или во время восстановления от анемии, и субъектов, имеющих расстройства, связанные с обменом железа, включающие железодефицитную анемию и различные формы талассемии, включая промежуточную талассемию.
[104] Абляция эритроферрона - Гепсидин является недостаточным у пациентов с промежуточной талассемией (Papanikolaou 2005; Origa 2007), и данный факт объясняет, почему эти пациенты имеют сверхвсасывание пищевого железа, и у них развивается перегрузка железом даже без эритроцитарных трансфузий или любого другого источника непищевого железа. Чтобы исследовать роль эритроферрона в качестве патогенного супрессора гепсидина при β-талассемии, можно проанализировать эффекты абляции Erfe на экспрессию гепсидина и печеночную перегрузку железом у мышиной модели для промежуточной талассемии, такой как Hbbth3/+. Мышь Hbbth3/+ является более строгой из двух доступных моделей промежуточной β-талассемии, с уровнями Hb, равными 7-9 г/дл, от 5 до 10 раз увеличенными циркулирующими концентрациями ЭПО и неэффективным эритропоэзом, включающим экстрамедуллярные участки. Она проявляет низкий гепсидин, но он постепенно возрастает до "нормальных" уровней по мере того, как печеночная перегрузка железом увеличивается в 3-5 раз по сравнению со значениями для контролей из той же линии с возрастом 6 месяцев. См. Gardenghi 2007; Nai 2012.
[105] Например, уровни Erfe измеряли у 6-месячных Hbbth3/+-мышей и их WT-контролей из той же линии, чтобы определить могут ли высокие уровни Erfe быть ответственными за неуместно низкие уровни гепсидина. Было показано, что мРНК Erfe в значительной степени увеличивалась в костном мозге и селезенке Hbbth3/+-мышей по сравнению с WT-мышами (Фиг. 11). Чтобы протестировать, является ли увеличенный Erfe ответственным за перегрузку железом, наблюдаемую у этой модели, можно подтвердить эффект абляции экспрессии Erfe. Ген Erfe находится на мышиной хромосоме 1, а ген бетаглобина находится на мышиной хромосоме 7, и можно, следовательно, генерировать Hbbth3/+Erfe-/--мышей посредством скрещивания, как было сделано для других генов мышей с промежуточной талассемией. См. Nai 2012; Gardenghi 2010. Hbbth3/+-мыши на основе C57B/6J могут быть получены от Jackson Labs (B6.129P2-Hbb-b1tm1Unc Hbb-b2tm1Unc/J, инвентарный номер, 002683).
[106] Следующие ссылки включены в настоящее описание посредством ссылки во всей полноте:






[176] В степени, необходимой для понимания или дополнения раскрытия настоящего изобретения, все публикации, патенты и патентные заявки, упомянутые в настоящем описании, полностью включены в него посредством ссылки, в той же степени, как если бы каждая из них была включена так индивидуально.
[177] Имея, таким образом, описанные иллюстративные варианты осуществления настоящего изобретения, специалистам в данной области следует отметить, что в своих пределах раскрытия являются только иллюстративными, и что в пределах объема притязаний настоящего изобретения могут быть сделаны различные альтернативы, адаптации и модификации. Соответственно, настоящее изобретение не ограничено конкретными вариантами осуществления, как иллюстрируется в настоящем описании, но ограничено только следующей формулой изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| АНТИТЕЛА К ГЕПСИДИНУ И ИХ ПРИМЕНЕНИЯ | 2014 |
|
RU2668391C2 |
| ЛЕЧЕНИЕ РАКА С ИСПОЛЬЗОВАНИЕМ ХИМЕРНОГО АНТИГЕНСПЕЦИФИЧЕСКОГО РЕЦЕПТОРА НА ОСНОВЕ ГУМАНИЗИРОВАННОГО АНТИТЕЛА ПРОТИВ EGFRvIII | 2014 |
|
RU2708032C2 |
| ЛЕЧЕНИЕ РАКА С ПОМОЩЬЮ ГУМАНИЗИРОВАННОГО АНТИ-CD19 ХИМЕРНОГО АНТИГЕННОГО РЕЦЕПТОРА | 2014 |
|
RU2711975C2 |
| Белки, связывающиеся с гепсидином | 2011 |
|
RU2625011C2 |
| ЛИГАНД GITR И СВЯЗАННЫЕ С ЛИГАНДОМ GITR МОЛЕКУЛЫ И АНТИТЕЛА И ВАРИАНТЫ ИХ ПРИМЕНЕНИЯ | 2004 |
|
RU2369636C2 |
| СПОСОБ ДИАГНОСТИКИ ЗАБОЛЕВАНИЙ ПУТЕМ СКРИНИНГА ТКАНЕЙ, КРОВИ ИЛИ ЖИДКОСТЕЙ ОРГАНИЗМА ЖИВОТНЫХ ИЛИ ЧЕЛОВЕКА НА ПРЕДМЕТ ОБНАРУЖЕНИЯ НЕФИЗИОЛОГИЧЕСКИХ УРОВНЕЙ ГЕПСИДИНА И ЕГО ТЕРАПЕВТИЧЕСКОЕ ПРИМЕНЕНИЕ | 2003 |
|
RU2359268C2 |
| ПЕПТИДЫ НАПРАВЛЕННОГО ДЕЙСТВИЯ НА VEGFR-1/NRP-1 | 2008 |
|
RU2488592C2 |
| ФАКТОРЫ, ДЕЙСТВУЮЩИЕ НА АКТИВНОСТЬ ФЕРМЕНТА, ВЫСВОБОЖДАЮЩЕГО РЕЦЕПТОР ФАКТОРА НЕКРОЗА ОПУХОЛЕЙ | 1999 |
|
RU2279478C2 |
| СПЕЦИФИЧЕСКИЕ К ОПУХОЛИ АНТИТЕЛА И ИХ ПРИМЕНЕНИЕ | 2011 |
|
RU2595403C2 |
| ЛЕЧЕНИЕ РАКА С ПОМОЩЬЮ ХИМЕРНОГО АНТИГЕННОГО РЕЦЕПТОРА К CD33 | 2015 |
|
RU2747384C2 |










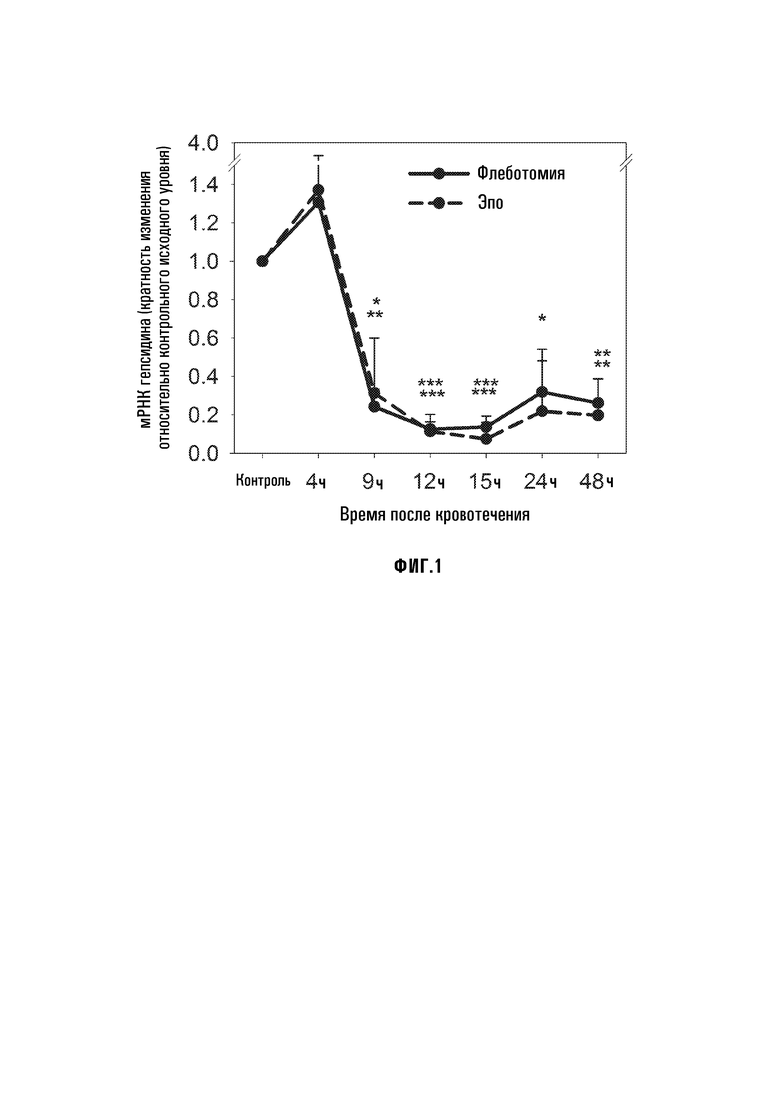
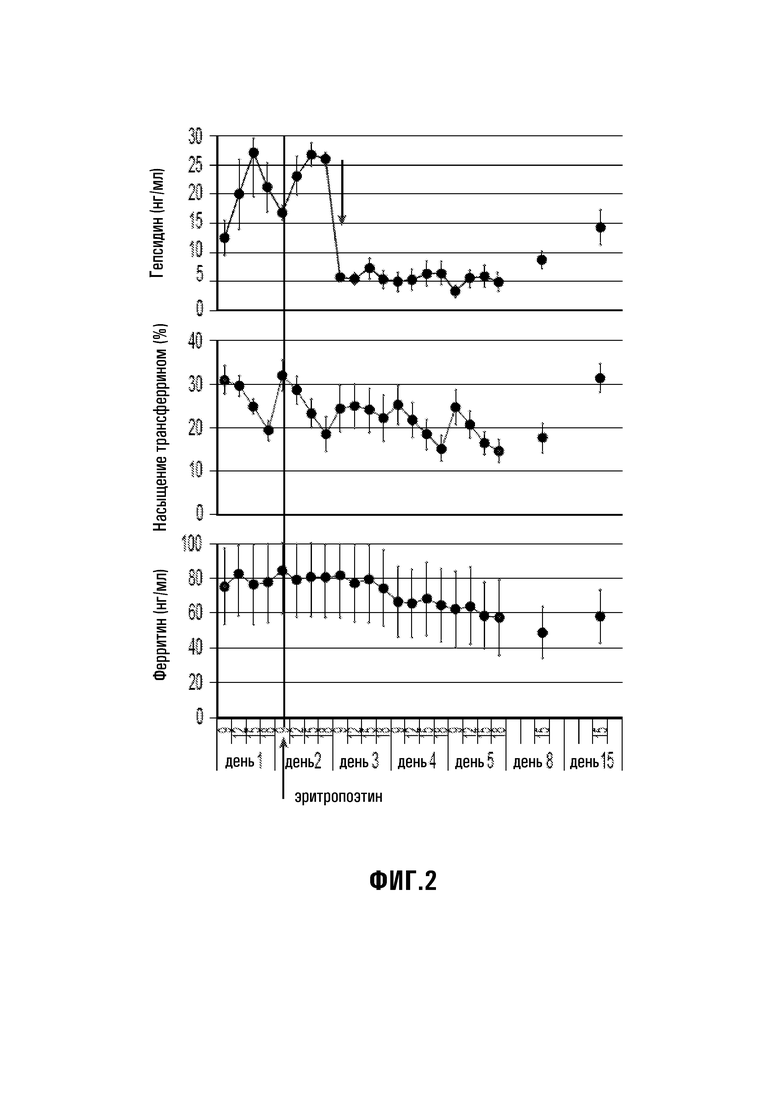
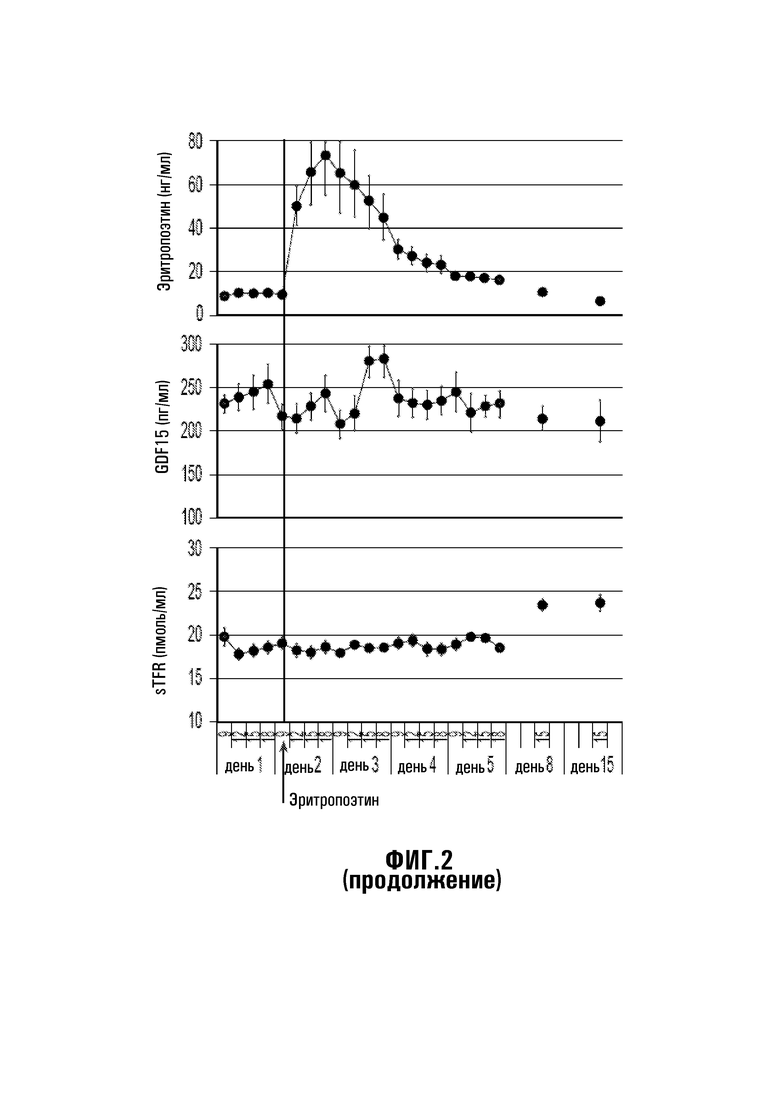


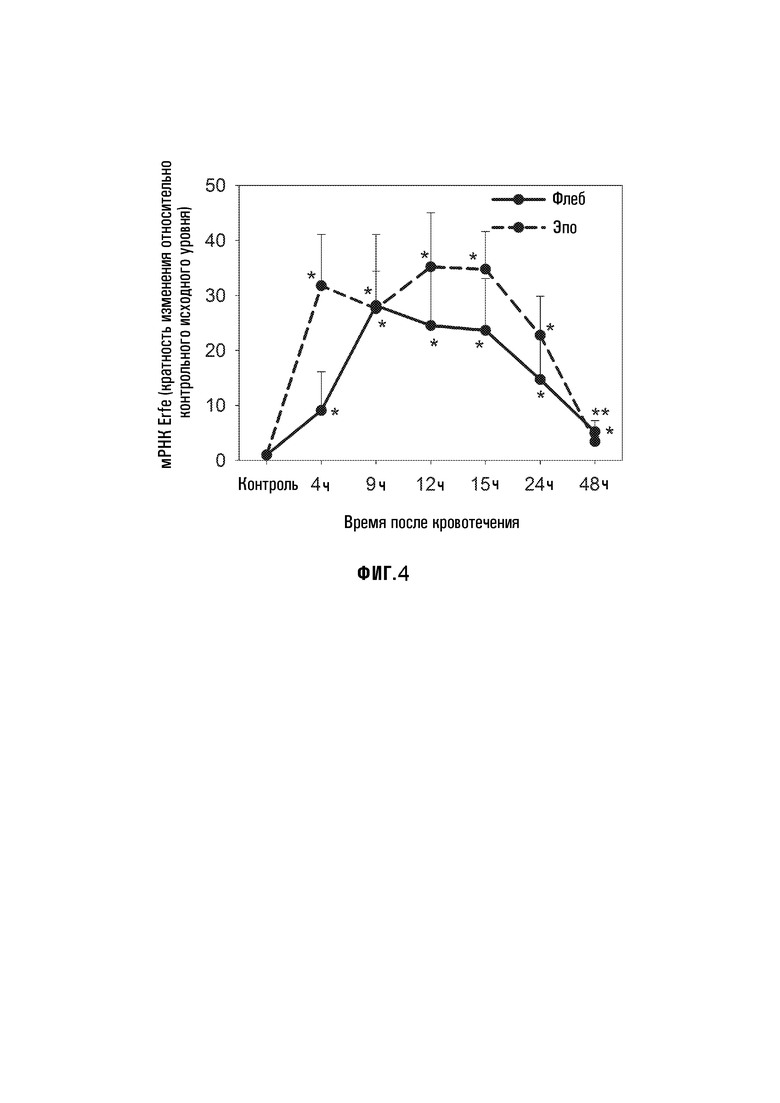
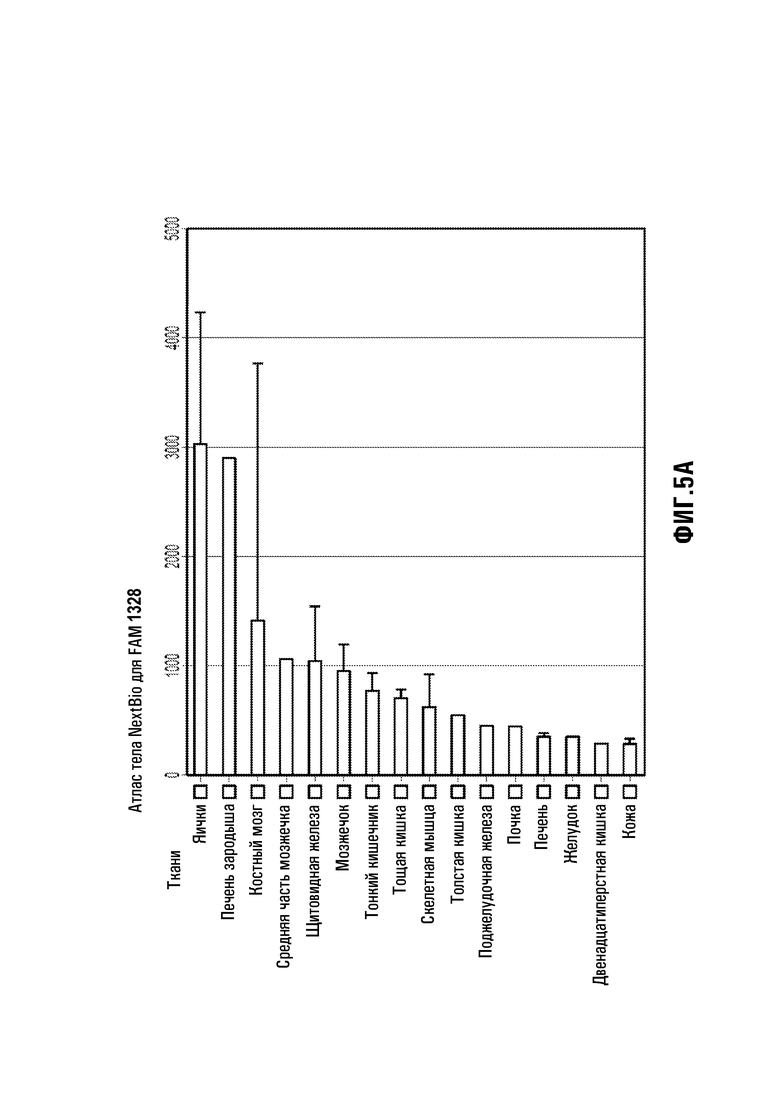
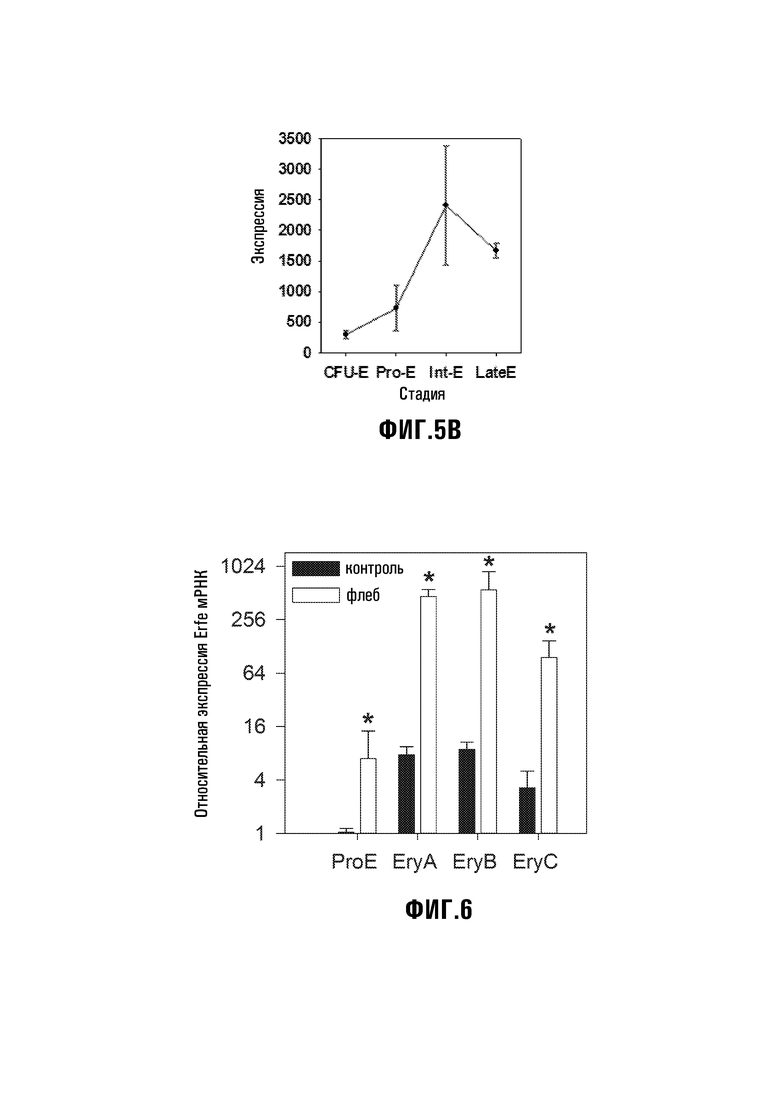
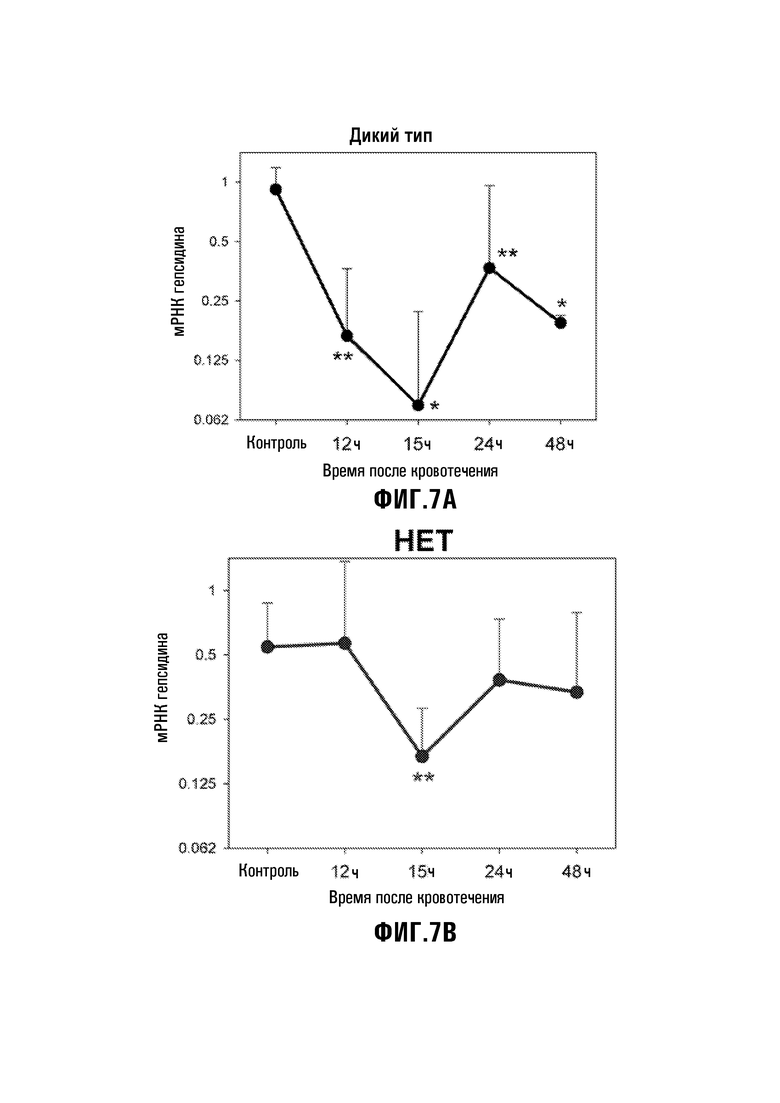
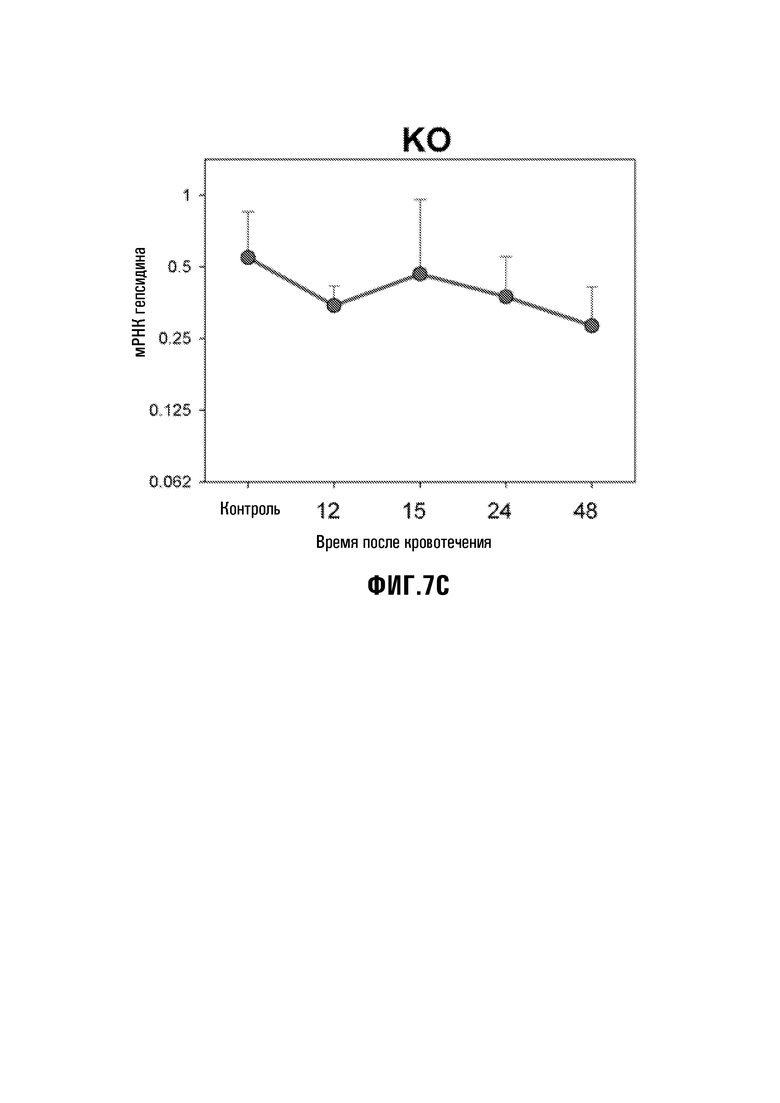
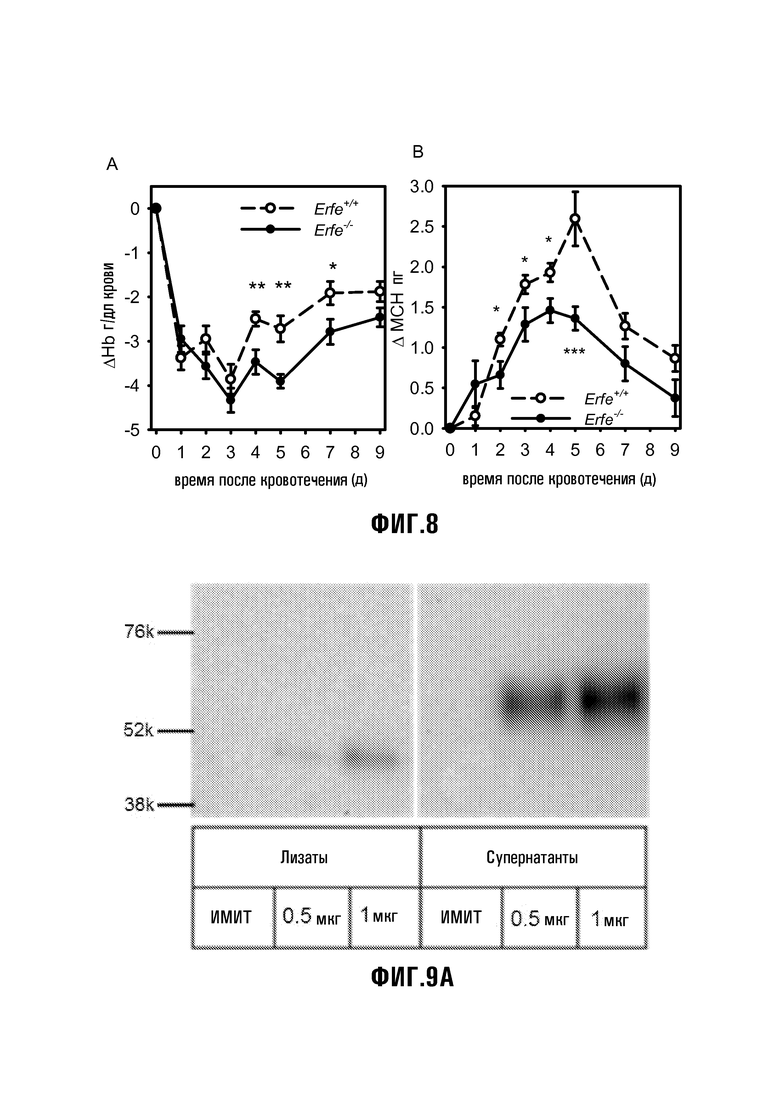
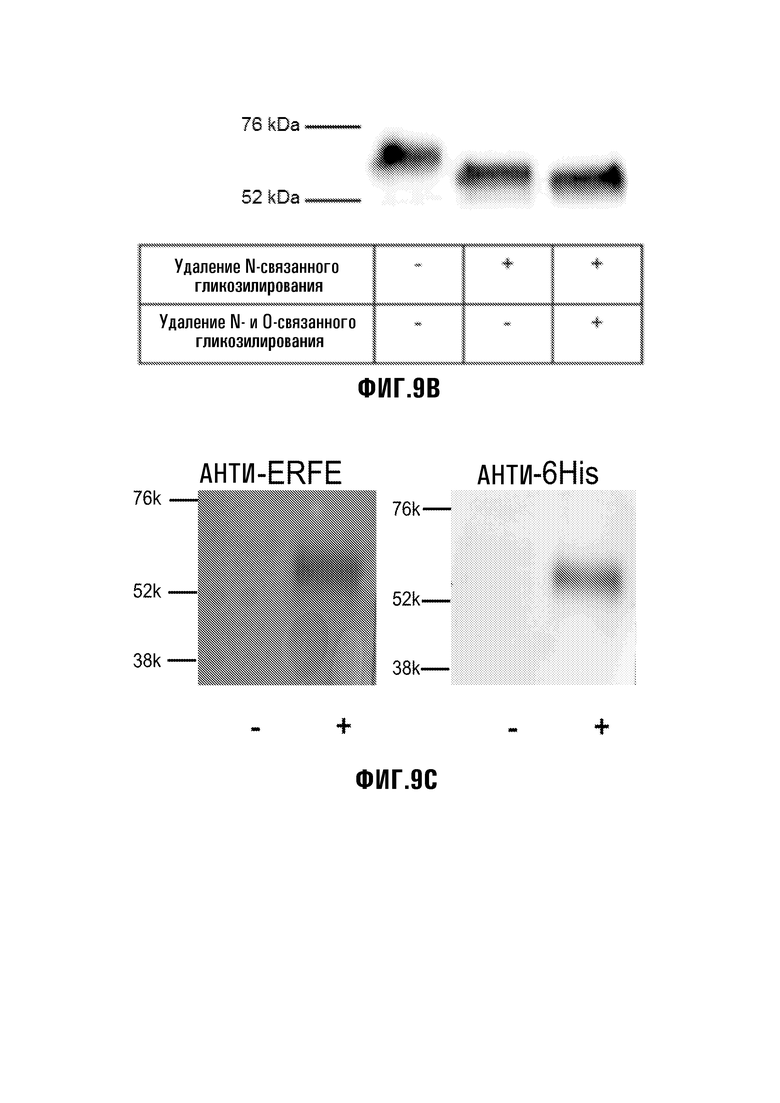
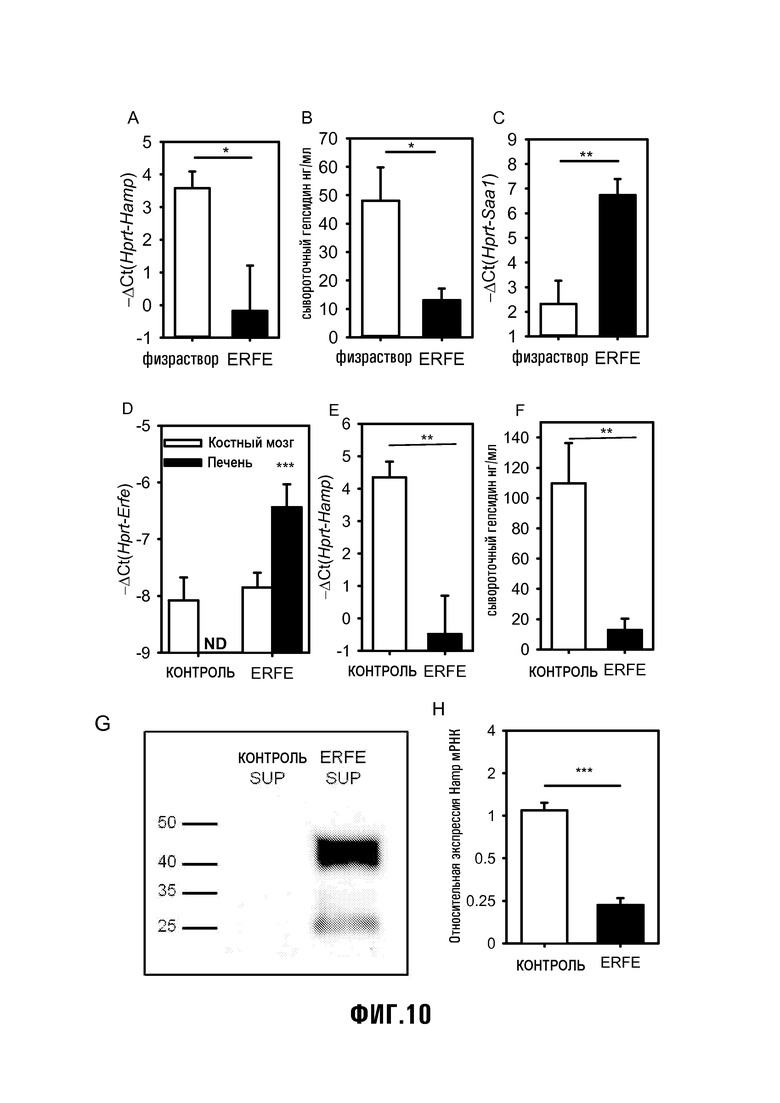
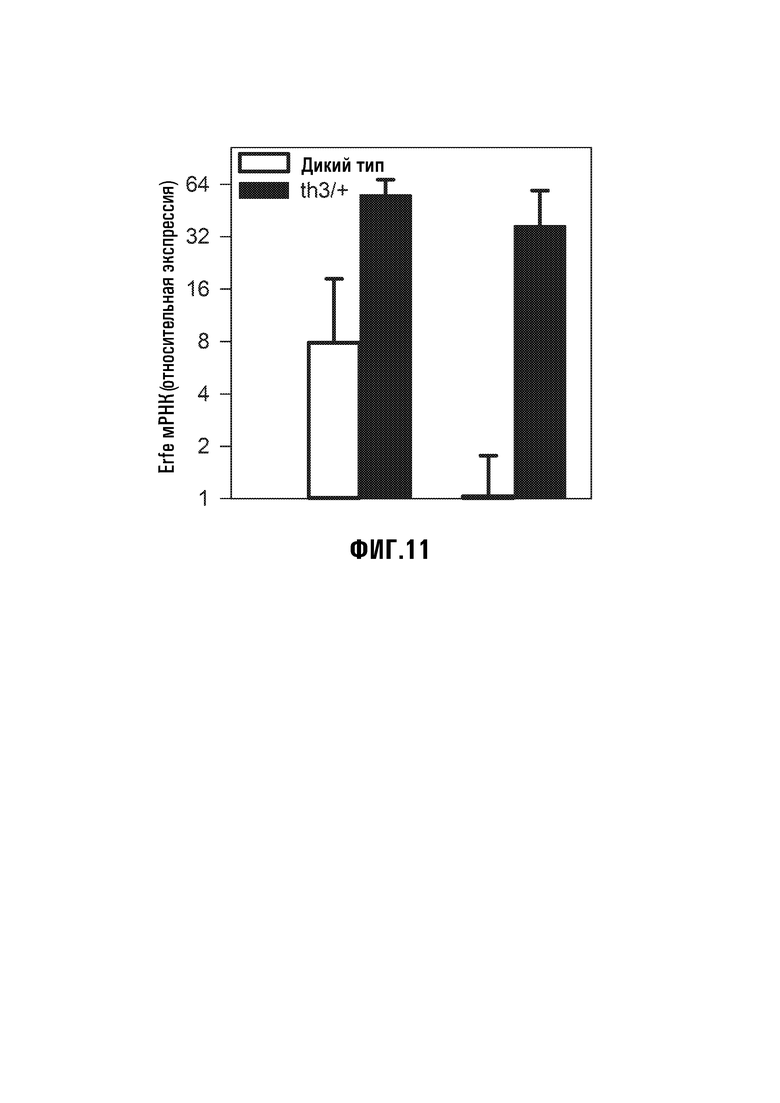
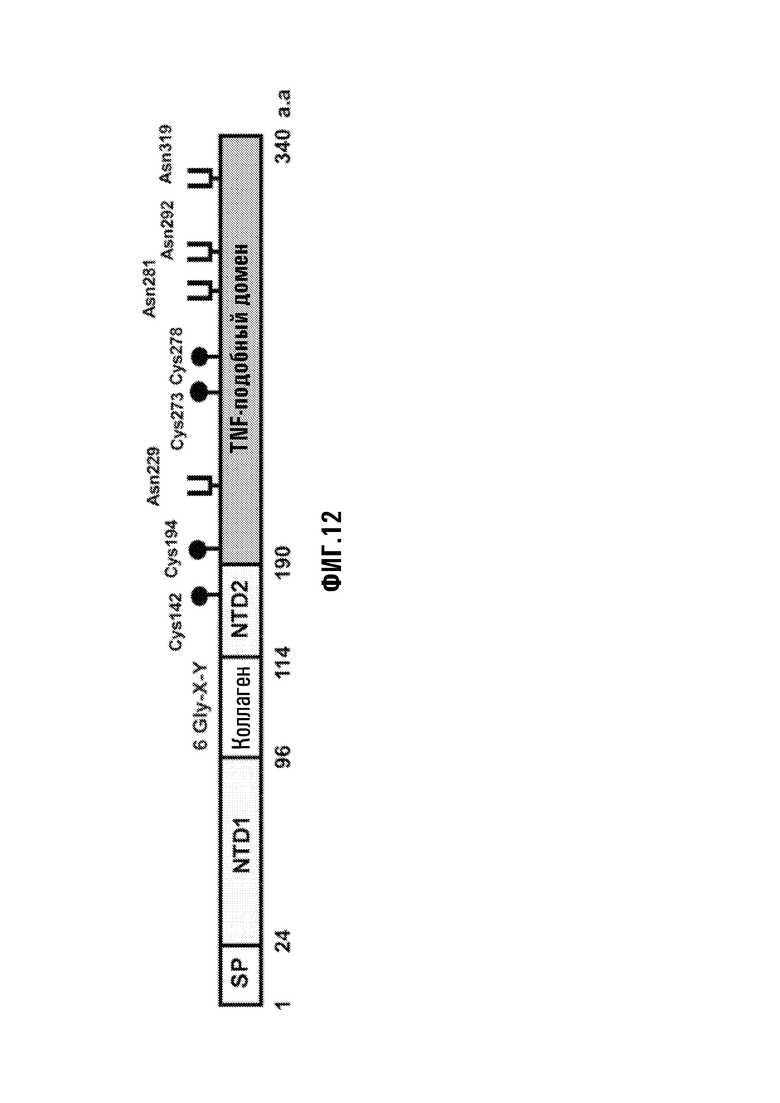
Изобретение относится к области биотехнологии, конкретно к модуляции количества гепсидина, и может быть применено в медицине для лечения заболеваний, связанных с метаболизмом железа у субъекта. Способ лечения предусматривает введение субъекту композиции, содержащей (i) антитело, которое специфически распознает полипептид эритроферона или его фрагмент, и (ii) фармацевтически приемлемый носитель или разбавитель. Изобретение эффективно при гемахроматозах или расстройствах, ассоциированных с аномально низкими уровнями гепсидина. 3 з.п. ф-лы, 12 ил.
1. Способ лечения заболевания, связанного с метаболизмом железа у субъекта, который включает или состоит из введения композиции, содержащей (i) антитело, которое специфически распознает полипептид, содержащий одну из SEQ ID NO: 1-15, и (ii) фармацевтически приемлемый носитель или разбавитель, субъекту, где заболевание, связанное с метаболизмом железа, является заболеванием перегрузки железом или заболеванием и/или расстройством, ассоциированным с аномально низкими уровнями гепсидина.
2. Способ по п.1, где заболевание, связанное с метаболизмом железа, включает гемохроматоз, гемохроматоз с мутацией HFE, гемохроматоз с мутацией ферропортина, гемохроматоз с мутацией трансферринового рецептора 2, гемохроматоз с мутацией гемоювелина, гемохроматоз с мутацией гепсидина, ювенильный гемохроматоз, неонатальный гемохроматоз, недостаточность гепсидина, трансфузионную перегрузку железом, талассемию, промежуточную талассемию, альфа-талассемию, сидеробластную анемию, порфирию, позднюю кожную порфирию, африканскую перегрузку железом, гиперферритинемию, недостаточность церулоплазмина, атрансферринемию или врожденную дисэритропоэтическую анемию.
3. Способ по п.1 или 2, где антитело является человеческим или гуманизированным.
4. Способ по любому из пп.1-3, дополнительно включающий получение измерения количества одного или более ERFE-полипептидов и/или гепсидина у субъекта до, во время или после введения.
| WO 2006046073, 04.05.2006 | |||
| SELDIN M.M | |||
| ET AL | |||
| Прибор для нагревания перетягиваемых бандажей подвижного состава | 1917 |
|
SU15A1 |
| СПОСОБ ИЗГОТОВЛЕНИЯ ЧЕРТЕЖЕЙ ДЛЯ ОДНООБРАЗНОЙ РАСКРОЙКИ ПРЕДМЕТОВ ОДЕЖДЫ | 1919 |
|
SU287A1 |
| Прибор для нагревания перетягиваемых бандажей подвижного состава | 1917 |
|
SU15A1 |
| СПОСОБ ДИАГНОСТИКИ ЗАБОЛЕВАНИЙ ПУТЕМ СКРИНИНГА ТКАНЕЙ, КРОВИ ИЛИ ЖИДКОСТЕЙ ОРГАНИЗМА ЖИВОТНЫХ ИЛИ ЧЕЛОВЕКА НА ПРЕДМЕТ ОБНАРУЖЕНИЯ НЕФИЗИОЛОГИЧЕСКИХ УРОВНЕЙ ГЕПСИДИНА И ЕГО ТЕРАПЕВТИЧЕСКОЕ ПРИМЕНЕНИЕ | 2003 |
|
RU2359268C2 |
Авторы
Даты
2019-04-04—Публикация
2013-10-31—Подача