Изобретение касается ксенотрансплантации, в частности, - эндотелиальных клеток, которые изменяют таким образом, что содержащая их ткань становится менее вероятно отторгаемой реципиентом при ксенотрансплантации. Более конкретно, настоящее изобретение касается фактора, подавляющего активность транспкрипционного фактора NFχB, и его использования для подавления активации эндотелиальных клеток, а также подавления воспалительного процесса.
Главной проблемой успешной трансплантации органов между дискордантными видами является сверхострое отторжение соответствующего органа. Двумя основными компонентами, вовлеченными в явление сверхострого отторжения, являются наличие антител, специфичных к ксеногенным клеткам, а также последовательное фиксирование и активация системы комплемента в реципиенте. Известно [1] решение указанной проблемы, при котором трансгенные животные экспрессируют факторы, подавляющие комплемент у реципиента. Таким образом, в том случае, если реципиенту пересаживают орган от трансгенного животного, активация пути комплемента оказывается заблокированной указанным ингибирующим фактором.
Однако клетки донорного органа тоже вызывают отторжение, стимулируя свертывания крови в реципиенте, а также вызывая изменения в эндотелии указанного донорного органа. В течение воспалительного процесса в эндотелиальных клетках повышается экспрессия определенного числа различных генов, включая гены, кодирующие интерлейкины, транскрипционные факторы, молекулы адгезии, а также компоненты системы свертывания крови. В транскрипции многих из указанных генов принимает участие транскрипционный фактор NFχB.
Транскрипционный фактор NFχB конститутивно экспрессируется в клеточной цитоплазме. Было высказано предположение, что индукция транскрипции гена с помощью белков, сходных с NFχB, является результатом пост-транскрипционных модификаций, включающих в себя перемещение предсуществующего транскрипционного фактора из цитоплазмы в ядро. Указанное перемещение контролируется с помощью модификации ингибирующего белка, названного IχB, который связывается и образует комплекс с NFχB, тем самым удерживая его в цитоплазме. Стимуляция указанных клеток определенными сигналами приводит к модификации IχB, что в свою очередь вызывает диссоциацию его комплекса с NFχB.
Считают, что связывание белка IχB с NFχB маскирует сигналы ядерной локализации (СЯЛ) NFχB. В ходе стимулирования клеток специфическими агентами, которые зависят от типа клеток и стадии клеточного развития, IχB оказывается модифицированным таким образом, что указанная модификация нарушает его связывание с NFχB, в результате чего NFχB отсоединяется от IχB. Считают, что сигналы, приводящие к указанной модификации, участвуют в генерировании радикалов кислорода и приводят к фосфорилированию NFχB по специфическим сайтам. В результате этого СЯЛ оказываются открытыми, а NFχB перемещается в ядро, где связывается с сайтами присоединения NFχB. Это немедленно приводит к транскрипции генов, задействованных в воспалительном процессе.
Транскрипционный фактор NFχB был исходно выделен из зрелых B-клеток, в которых он связывается с мотивом, представляющим собой декамерную последовательность в энхансере легких цепей χ. Хотя NFχB изначально считали специфичным для указанного типа клеток и указанной стадии клеточного развития, сходные с NFχB белки были впоследствии обнаружены в большом количестве типов клеток, и, как отмечено выше, было продемонстрировано, что NFχB более широко вовлечен в индукцию транскрипции генов. В дальнейшем этот факт был подтвержден обнаружением функционально активных сайтов связывания NFχB в различных индуцибельных генах [2].
NFχB представляет собой гетеродимерный белок, состоящий из субъединицы с молекулярной массой 50 кД (p50) и субъединицы с молекулярной массой 65 кД (p65). Были клонированы кДНК, соответствующие p50 и p65, показано, что они имеют гомологию на протяжении участка в 300 аминокислот. Субъединица p50 обладает существенной гомологией с продуктами протоонкогена c-rel, выделенными у млекопитающих и птиц, а также с продуктом гена dorsal у дрозофилы. Недавно еще один член семейства NFχB, ген relB, был клонирован из фибробластов, стимулированных сывороткой, как ген сверхраннего ответа.
Как p50, так и p65 способны к образованию гомодимеров, которые, тем не менее, отличаются своими свойствами: в то время как гомодимеры p50 обладают высоким сродством к связыванию с ДНК, но не способны к трансактивации транскрипции, гомодимеры p65 могут лишь слабо связываться с ДНК, однако способны к трансактивации. p50 синтезируется в виде амино-терминальной части предшественника с молекулярным весом 110 кД (p110), который не обладает ДНК-связывающей или способствующей димеризации активностью. Карбокси-терминальная часть указанного предшественника содержит восемь анкириновых повторов, представляющих собой мотив, обнаруженный в некоторых белках, участвующих в контроле клеточного цикла и дифференцировки. Клонирование короткой (2,6 т. п.н.) РНК, появляющейся одновременно с РНК предшественника p50, которая имеет длину 4 т.п.н., показало, что C-терминальная часть белка с молекулярным весом 110 кД также может самостоятельно экспрессироваться либо за счет альтернативного сплайсинга, либо в результате использования дифференциальных промоторов.
Клонировано три белка, сходных с IχBα: pp40, идентифицированный в трансформированных лимфоидных клетках цыпленка в качестве связанного с rel фосфопротеина [3]; RL/IF-1, представляющий собой фактор 1 подавления регенерации печени [4]; а также MAD-3, являющийся продуктом гена, индуцируемого в макрофагах человека в ходе прикрепления к пластиковым поверхностям [5].
Все три указанных белка, сходных с IχBα, содержат пять анкириновых повторов. RL/IF был клонирован, показана его экспрессия в регенерирующей печи в течение 30 мин после гепатэктомии. Исследования с помощью делеционного мутагенеза продемонстрировали обязательность наличия четырех из пяти анкириновых повторов в pp40 для подавления ДНК-связывающей активности и для ассоциации с c-rel, а также необходимость его C-терминального района для осуществления указанных эффектов. Исследования с использованием моноспецифических антител, присоединенных к предшественнику p50 с молекулярным весом 110 кД, показали, что указанная C-терминальная часть (часть, обладающая активностью IχB) маскирует сигнал ядерной локализации (СЯЛ), расположенный в амино-терминальном районе p50.
Неожиданно мы обнаружили, что экспрессия IχB индуцируется в эндотелиальных клетках (ЭК) с помощью тех же самых стимулов, которые активируют ЭК, хотя и с отстающей кинетикой по сравнению с быстрой пост-транскрипционной активацией NFχB. Таким образом, оказывается, что экспрессия IχB представляет собой естественный механизм обратной связи, подавляющий активацию ЭК. Мы использовали указанный факт для разработки дальнейшей стратегии, призванной препятствовать отторжению трансплантата.
В соответствии с этим, первый аспект настоящего изобретения предусматривает эндотелиальную клетку, которая экспрессирует белок, обладающий активностью IχB, в результате чего активация указанной клетки с помощью NFχB оказывается совершенно подавленной.
В настоящем описании понятие "белок, обладающий активностью IχB ", означает белок, который способен связываться с NFχB и препятствовать его миграции в ядро и/или связыванию NFχB с сайтами его узнавания в генетическом материале клетки, тем самым предотвращая NFχB-зависимую индукцию транскрипции гена. Указанный белок может представлять собой естественный белок, сходный с IχB, его часть, либо аналог или вариант указанных белков, имеющих вышеупомянутую NFχB-связывающую активность, а также активность, подавляющую индукцию транскрипции генов. В случае предпочтительного воплощения настоящего изобретения указанный белок может представлять собой вариант, включающий в себя одну или более сигнальную последовательность, предназначенную для направления указанного белка в специфический клеточный компартмент, такой как клеточное ядро.
В предпочтительном случае эндотелиальные клетки, предусмотренные настоящим изобретением, экспрессируют белок, обладающий активностью IχB, причем указанная экспрессия осуществляется конститутивно (т.е. постоянно, а также в отсутствие запаздывающей кинетики по сравнению с экспрессией NFχB), непосредственно после действия стимулов, активирующих эндотелиальные клетки, или же при необходимости, в ответ на предопределенный внешний стимул.
Обычно предусмотренные настоящим изобретением эндотелиальные клетки получают в результате модификации генетического материала указанных клеток. Эта модификация включает в себя введение гетерологичной ДНК, которая кодирует экспрессию белка, обладающего активностью IχB, а также изменение или замену сигналов, контролирующих указанных экспрессию и расположенных в составе нативных последовательностей, кодирующих IχB.
Таким образом, одно из воплощений эндотелиальных клеток, соответствующих настоящему изобретению, предусматривает гетерологичную последовательность ДНК, которая конститутивно экспрессируется указанной клеткой и кодирует экспрессию белка, обладающего активностью IχB.
Указанную последовательность, кодирующую белок, обладающий активностью IχB, оперативным образом присоединяют к промоторной последовательности, которая обычно также является гетерологичной по отношению к вышеописанным клеткам, в результате чего указанный белок экспрессируется конститутивно.
В альтернативном воплощении эндотелиальные клетки, соответствующие настоящему изобретению, содержат гетерологичную индуцибельную промоторную последовательность ДНК, присоединенную к последовательности ДНК, кодирующей экспрессию белка, обладающего активностью IχB, в результате чего указанный белок экспрессируется непосредственно после действия стимулов, активирующих эндотелиальные клетки, или же при необходимости, в ответ на предопределенный внешний стимул.
Указанная кодирующая белок последовательность, оперативным образом присоединенная к гетерологичной последовательности индуцибельного промотора, может представлять собой нативную или гетерологичную последовательность, кодирующего IχB, а также может включать в себя последовательность, кодирующую соответствующую сигнальную последовательность, например специфичную сигнальную последовательность ядерной локализации. Вышеупомянутые стимулы, активирующие эндотелиальные клетки, могут представлять собой любые стимулы, приводящие к изменениям в эндотелии донорных тканей или органов, а также стимулирующие свертывание крови в реципиенте, что ведет к отторжению. Указанным предопределенным стимулом может служить наличие лекарства, цитокина или другого индуцирующего агента, стимулирующего экспрессию с указанного индуцибельного промотора. В частности, перенесший трансплантацию пациент может быть после трансплантации подвергнут обработке индуцирующим агентом, таким как лекарство, для того, чтобы индуцировать экспрессию IχB и, таким образом, предотвратить активацию эндотелиальных клеток в донорном органе, а также последующее отторжение указанного органа.
Может быть использован любой приемлемый индуцибельный промотор, например, такой, который описан в [6].
Еще одним аспектом настоящего изобретения является способ получения эндотелиальных клеток, соответствующих настоящему изобретению, предусматривающий трансфекцию эндотелиальных клеток гетерологичной последовательностью ДНК, которая конститутивно экспрессируется указанными клетками и кодирует экспрессию белка, обладающего активностью IχB.
Кроме того, еще одним аспектом настоящего изобретения является способ получения эндотелиальных клеток, соответствующих настоящему изобретению, предусматривающий оперативное присоединение гетерологичной последовательности ДНК, которая представляет собой индуцибельный промотор, к нативной последовательности ДНК, кодирующей экспрессию белка, обладающего активностью  , в результате чего указанный белок экспрессируется непосредственно после действия стимулов, активирующих эндотелиальные клетки, или же при необходимости, в ответ на предопределенный внешний стимул.
, в результате чего указанный белок экспрессируется непосредственно после действия стимулов, активирующих эндотелиальные клетки, или же при необходимости, в ответ на предопределенный внешний стимул.
В предпочтительном случае указанные гетерологичные последовательности ДНК включают в геном эндотелиальной клетки. В альтернативном случае указанные гетерологичные последовательности можно поддерживать в эндотелиальной клетке экстрахромосомно либо стабильно, либо в течение ограниченного периода.
В соответствии с настоящим изобретением в эндотелиальных клетках аорты свиньи (ЭКАС), стимулированных воспалительными агентами, такими как TNFα и IL-1α, был идентифицирован ранее неизвестный белок, сходный с IχB и обозначаемый в дальнейшем ECI-6. Указанный белок и его части, обладающие активностью IχB, а также их аналоги подпадают под область рассмотрения настоящего изобретения. Аминокислотная последовательность ECI-6 и кодирующая ее природная последовательность ДНК представлена в виде Последовательности N 1 (перечень последовательностей приведен в конце описания). Указанный белок, обладающий активностью IχB, может включать в себя ECI-6 или его активные части, либо их активные аналоги или варианты.
Таким образом, в случае своего предпочтительного воплощения, гетерологичная последовательность, кодирующая белок, обладающий активностью IχB, кодирует белок, который включает в себя последовательность, характеризующуюся по меньшей мере 70%-ной, в предпочтительном случае - по меньшей мере 80%-ной, в более предпочтительном случае - по меньшей мере 90%-ной гомологией с белковой последовательностью, представленной в виде Последовательностей N 1 или N 2, начиная от положения 1 до положения 280, либо включает в себя часть указанного белка, проявляющую активность IχB.
В особо предпочтительном варианте своего воплощения указанная гетерологичная последовательность кодирует последовательность белка, измененную с целью повреждения одного или более сайтов фосфорилирования (аминокислоты 30-36, аминокислоты 39-47, а также аминокислоты 260-264 в Последовательности N 1). Эти изменения могут включать в себя замены центрального остатка Ser, находящегося в первой или третьей вышеупомянутых последовательностях, на Gly, а также замены Tyr, расположенного во второй вышеупомянутой последовательности, на Phe.
Указанный белок, обладающий сходной с IχB активностью, препятствует миграции NFχB в ядро и/или подавляет присоединение NFχB к сайтам связывания NFχB, находящимся в генетическом материале клетки. Подавление связывания NFχB можно выявлять с помощью стандартных биотестерных методов. Так, для того, чтобы зарегистрировать подавление связывания NFχB в эндотелиальных клетках, можно использовать тест на изменение электрофоретической мобильности. Конкретным примером такого теста является следующее.
Эндотелиальные клетки аорты свиньи выращивают в культуральной среде, представляющей собой модифицированную по Дульбекко среду Игла, содержащую 10%-ную фетальную сыворотку теленка. Для стимуляции указанных клеток в течение 2 ч используют 100 нг бактериального липополисахарида, после чего экстрагируют ядерные белки в соответствии с [7]. Затем in vitro транскрибируют РНК с плазмиды (Bluescript II, получена от Strategene), содержащей фрагмент BamHI-XhoI (основания 126-1605) кДНК, представленной на фиг. 1. Реакцию транскрипции осуществляют в соответствии с протоколом производителя, за исключением того, что добавляют 0,25 нМ m7G(5')ppp(5')G (Boehriger).
Полученную РНК в дальнейшем используют для трансляции in vitro в экстракте зародышей пшеницы или в лизате ретикулоцитов кролика (оба из них получают от Promega Corporation, Madison, WI, USA) в соответствии с протоколом производителя. Затем осуществляют EMSA, приготовляя меченный 16-мерный BS-2 олигонуклеотид (представленный в виде Последовательности N 3), который является сайтом связывания NFχB. Реакцию связывания проводят при температуре 20oC и pH 7,9 в течение 15 мин в суммарном объеме 15 мкл, содержащем 12%-ный глицерин, 12 мМ HEPES, 4 мМ Трис, 60 мМ KCl, 1 мМ Эдта, 1 мМ ДТТ, 200 мкг/мл поли(dl-dC), 300 мкг/мл бычьего сывороточного альбумина, 0,2 нг меченого BS-2 (100.000 вспышек/мин), 5 мкг ядерных белков и различные количества указанного транслированного белка. Подавление связывания NFχB с олигонуклеотидом BS-2 можно выявлять, используя для сравнения контрольные экстракты зародышей пшеницы или лизаты ретикулоцитов кролика.
Еще один аспект настоящего изобретения предусматривает донорную ткань или донорный орган, содержащие указанные эндотелиальные клетки. Этот донорный материал может быть ксеногенным по отношению к реципиенту или же может быть взят от особей тех же видов. В предпочтительном случае указанный донорный материал получают от свиней.
Указанный донорный материал может быть получен от трансгенного животного. В альтернативном случае в эндотелиальные клетки донорного органа может быть введена гетерологичная ДНК с использованием традиционных методов генной терапии. Приемлемые для этого методы описаны в [8].
Еще один аспект настоящего изобретения предусматривает трансгенных млекопитающих, отличных от человека и имеющих вышеописанные эндотелиальные клетки.
Гетерологичную ДНК можно вводить в указанное животное или в предка указанного животного, находящегося на одноклеточной стадии или на стадии ранней морулы. Предпочтительной стадией является одноклеточная стадия, хотя процесс введения ДНК можно осуществлять между двухклеточной и восьмиклеточной стадиями. Последовательность ДНК можно микроинъецировать в клетки в соответствии с традиционными методами, либо можно использовать ретровирусную или сходную с ней систему [9].
В предпочтительном случае указанным млекопитающим является свинья.
Настоящее изобретение предусматривает также донорный орган, полученный от указанного трансгенного млекопитающего.
Наряду с созданием донорного органа и ткани, настоящее изобретение также может быть использовано для создания генетически измененных эндотелиальных клеток, экспрессирующих IχB в соответствии с вышеприведенным и нижеследующим описанием, в частности, в связи с такими заболеваниями эндотелиальных клеток, которые могут быть облегчены за счет блокирования опосредованной NFχB индукции экспрессии.
Еще один аспект настоящего изобретения предусматривает нуклеотидную последовательность, которая кодирует белок, обладающий активностью IχB, и включает в себя аминокислотную последовательность, представленную в виде Последовательности N 1, начиная с аминокислотного положения 1 и заканчивая аминокислотным положением 280; либо содержит аминокислотные последовательности, которые существенно, т.е. по меньшей мере на 95%, гомологичны указанной выше; и предназначена для использования в трансформированных эндотелиальных клетках. Соответствующие трансформированные эндотелиальные клетки могут быть использованы при трансплантации или для контроля экспрессии в клетках гладких мышц.
Указанные нуклеотидные последовательности также могут включать в себя кодоны, кодирующие аминокислоты с 281 по 314 из последовательности, приведенной в Последовательности N 1. В предварительном случае, указанные нуклеотидные последовательности кодируют белок, в котором эта последовательность изменена с целью нарушения одного или более сайтов фосфорилирования (аминокислоты 30-36, аминокислоты 39-47, а также аминокислоты 260-264).
Указанные изменения предпочтительно приводят к замене центрального Ser, находящегося в первой или третьей вышеупомянутой последовательности, на Gly, а также к замене Tyr, расположенного во второй вышеупомянутой последовательности, на Phe.
Еще один аспект настоящего изобретения предусматривает последовательность ДНК, которая кодирует белок, обладающий активностью IχB, и включает в себя гетерологичную сигнальную последовательность.
Обычно указанная сигнальная последовательность представляет собой сигнальную последовательность, предназначенную для направления белка в специфический клеточный компартмент, в предпочтительном случае - сигнальную последовательность, специфичную для ядерной локализации.
Еще один аспект настоящего изобретения предусматривает также рекомбинантную конструкцию ДНК, включающую в себя последовательность ДНК, которая кодирует белок, обладающий активностью IχB, и присоединена оперативным образом к
1) индуцибельному промотору или
2) специфическому промотору эндотелиальных клеток,
причем указанный промотор отличается от естественного промотора вышеупомянутой последовательности ДНК, которая кодирует белок, обладающий активностью IχB.
В предпочтительном случае указанный промотор является как индуцибельным, так и специфичным для эндотелиальных клеток.
Обычно вышеупомянутая последовательность ДНК, которая кодирует белок, обладающий активностью IχB, является гетерологичной последовательностью, а также может представлять собой вышеописанную последовательность, включающую в себя сигнальную последовательность или соответствующую Последовательности N 1.
Настоящее изобретение предусматривает также вектор экспрессии, содержащий описанную выше нуклеотидную последовательность или рекомбинантную конструкцию ДНК.
В предпочтительном случае указанный вектор представляет собой ретровирусный вектор, аденовирусный вектор, комплекс нуклеотидной последовательности и трансферрин-поликатионного конъюгата, а также плазмиду, заключенную в липосому.
Приемлемые ретровирусные вектора описаны в [10]. Приемлемые аденовирусные вектора описаны в [11]. Приемлемые трансферрин-поликатионные комплексы описаны в [12]. Липосомные комплексы описаны в [13].
Еще один аспект настоящего изобретения предусматривает белок, обладающий IχB-подобной активностью и включающий в себя аминокислотную последовательность, представленную в Последовательности N 1, начиная с аминокислотного положения 1 и заканчивая аминокислотным положением 280.
Указанный белок также может включать в себя аминокислоты 281-314 из Последовательности N 1. Эти аминокислоты содержат последовательности PEST, для которых показано, что в других белках они отвечают за нестабильность белка [14]. В предпочтительном случае эти аминокислоты не присутствуют в указанном белке, что можно осуществить, вводя стоп-кодон после кодона, соответствующего аминокислоте 280. Указанный результат может быть достигнут путем мутирования кодона, соответствующего пролину, находящемуся в аминокислотном положении 281, с помощью полимеразной цепной реакции.
В предпочтительном случае аминокислотного последовательность указанного белка изменяют с целью нарушения одного или нескольких сайтов фосфорилирования (аминокислоты 30-36, аминокислоты 39-47, а также аминокислоты 260-264).
Эти изменения могут включать в себя замену центрального Ser, находящегося в первой или третьей вышеупомянутой последовательности, на Gly, а также к замене Tyr, расположенного по второй вышеупомянутой последовательности, на Phe.
Еще один аспект настоящего изобретения предусматривает белок, обладающий активностью IχB и включающий в себя гетерологичную сигнальную последовательность, например сигнальную последовательность, специфичную для ядерной локализации.
Следует отметить, что вышеописанные эндотелиальные клетки и донорные органы выполняют вспомогательную функцию в предотвращении отторжения трансплантата при ксенотрансплантации, поскольку указанное первичное отторжение представляет собой сверхострое отторжение. В связи с этим, обычно генетический материал клеток донорного органа также изменяют, в результате чего активация пути комплемента в реципиенте оказывается подавленной. В соответствии с [1] этого можно достичь с помощью трансгенных животных, экспрессирующих специфичные для вида реципиента факторы, подавляющие комплемент. Эндотелиальные клетки донорных органов, полученные у такого животного, могут быть модифицированы с использованием методов генной терапии для создания вышеописанных эндотелиальных клеток. В альтернативном случае, в указанное трансгенное животное, находящееся на одноклеточной стадии или стадии ранней морулы, может быть введен вышеописанный вектор. Полученное таким образом трансгенное животное должно экспрессировать указанные факторы, подавляющие комплемент, а также должно иметь вышеописанные эндотелиальные клетки.
Таким образом, еще один аспект настоящего изобретения предусматривает соответствующие приведенному выше описанию отличные от человеческих эндотелиальные клетки, ткани, донорные органы и трансгенных животных, экспрессирующие один или более факторов, подавляющих комплемент человека.
РНК, кодирующую белок ECI-6, была выделена из эндотелиальных клеток аорты свиньи (ЭКАС), стимулированных воспалительными агентами TNFα и IL-1α. Была выявлена индукция РНК ECI-6, осуществляющаяся в течение 2 ч после стимуляции указанными воспалительными агентами и ослабляющаяся через 4 ч. Кроме того, небольшое количество ее было обнаружено в "нестимулированных" клетках. Добавление циклогексимида вместе с ЛПС в течение 6 ч приводило к усилению указанного сигнала, свидетельствуя о том, что для индукции не требуется предварительного синтеза белка. Указанную РНК выявляли с помощью метода дифференциального скрининга, использующего активированные эндотелиальные клетки против неактивированных.
IχB-активность белка ECI-6 тестировали с помощью метода связывания ДНК in vitro; было показано, что она специфично, а также в зависимости от дозы подавляет активность, связывающую NFχB и присутствующую в ядерных фракциях ЭКАС, стимулированных липополисахаридом (ЛАС). Сходным образом, эндогенный NFχB, присутствующий в лизатах ретикулоцитов кролика, подавлялся при добавлении к указанным лизатам РНК ECI-6, но не контрольных лизатов. Связывание NFχB было специфичным, поскольку оно могло вступать в конкурентные взаимоотношения с немеченными олигонуклеотидами, представляющими собой сайты связывания NFχB, но не с мутированными сайтами связывания NFχB или неродственными олигонуклеотидами.
Белок ECI-6 проявляет очень высокую гомологию (более 90%) с белком IχB-белком MAD3, а также высокую гомологию с белками pp40 и RL/IF-1.
Далее воплощения настоящего изобретения описаны лишь с помощью примеров со ссылкой на представленные чертежи, на которых:
фиг. 1 демонстрирует полиакриламидный гель, иллюстрирующий подавление связывания ядерных белков с сайтами связывания NFχB в присутствии ECI-6, транслированного in vitro в экстракте зародышей пшеницы,
фиг. 2 демонстрирует полиакраламидный гель, иллюстрирующий подавление связывания эндогенного NFχB с сайтом связывания IχB в лизатах ретикулоцитов кролика.
Примеры
Пример 1: Клонирование индуцированных генов
А. Получение библиотеки кДНК стимулированных эндотелиальных клеток аорты свиньи (ЭКАС)
Пост-конфлюэнтные ЭКАС обрабатывают комбинацией рекомбинантных TNFα и IL-1α человека (получены от Genzyme), при концентрации каждого 100 ед/мл в течение 4 и 9 ч. Клетки собирают в оба момента времени с помощью метода, описанного в [15] , экстрагируют и выделяют тотальную клеточную РНК для каждого момента времени. После этого объединяют полученные РНК для каждого времени. В соответствии с протоколом производителя готовят 5 мкг поли A+ РНК с олиго-dT-целлюлозой (Boehringer Mannheim).
С помощью набора для синтеза кДНК (Stratagene, La Jolla, California), в соответствии с протоколом производителя получают библиотеку кДНК в бактериофаге λ Zap II. Затем осуществляют упаковку полученных векторов с использованием системы Gigipack Gold (Stratagene, La Jolla, California). Получают приблизительно 2,2 миллиона первичных клонов. Скринируют приблизительно 5000 бляшек.
Б. Получение зондов и скринирование
Готовят два зонда: один - из РНК, которая получена из неиндуцированных ЭКАС, и еще один - из ЭКАС, индуцированных как описано в пункте А. Указанный неиндуцированный зонд получают посредством обратной транскрипции 1 мкг РНК с помощью обратной транскриптазы (Gibco-BRL) в соответствии с протоколом производителя. В этой реакции используют 50 мкКи 32P-CTP. Индуцированный зонд получают таким же образом, однако в дальнейшем его дважды подвергают очистке с помощью 10 мкг биотинилированной неиндуцированной РНК. Указанное биотинилирование и очистку осуществляют с использованием Subtractor I (InVitrogen, San Diego, California) в соответствии с протоколом производителя.
Скринируют две реплики из библиотеки ЭКАС, одну - неиндуцированным зондом, а другую - индуцированным зондом в стандартных условиях гибридизации при 65oC [15]. Фаги, давшие более сильный сигнал при использовании индуцированного зонда по сравнению с неиндуцированным, были субклонированы путем вырезания in vivo с использованием протокола Stratagene.
В каждом случае осуществляют анализ по Ноузерну стандартным способом [15] . В качестве зонда используют фрагмент EcoRI-Xho1 длиной 1,5 тпн из индуцированного клона, меченный с помощью набора для получения случайных олигонуклеотидных праймеров (Stratagene) в соответствии с протоколом производителя.
Затем определяют нуклеотидную последовательность полученных клонов кДНК, применяя метод терминации цепи с помощью дидеоксила с использованием набора Sequenase (US Biochemicals, Cleceland, Ohio) в соответствии с протоколом производителя. Полученная нуклеотидная последовательность и предсказанная на ее основании аминокислотная последовательности представлены в виде Последовательности N 1. Вышеупомянутые пять анкириновых повторов находятся в аминокислотных положениях 73-99, 110-136, 143-169, 182-208 и 216-242, а три потенциальных сайта фосфорилирования CK-II TYR и PKC находятся в аминокислотных положениях 30-36, 39-47 и 260-264, соответственно. 5'-конец указанной последовательности (положения 1-270) получен из геномного клона и присоединен к вышеупомянутой кДНК по сайту Xhol (положение 285) с получением функционального клона для трансляции in vitro.
В дальнейшем, сравнивая указанную белковую последовательность с последовательностями MAD-3, RL/IF-1 и pp40 с использованием программы PILEUP из программного обеспечения UWGCG, обнаруживают ее высокую гомологию с перечисленными белками. Этот белок обозначают как ECI-6.
Пример 2: Трансляция in vitro
Линеаризованный вектор (10 мкг; Bluescript), несущий вставку, которая содержит нуклеотидную последовательность, соответствующую положениям 126-1605 Последовательности N 1, транскрибируют в РНК с помощью полимеразы T7 (Stratagene) в суммарном объеме 100 мкл, следуя рекомендациям производителя, но с включением также 0,25 мМ m7G(5')ppp(5')G. В дальнейшем полученную кэпированную мРНК экстрагируют фенолом и хлороформом, а также осаждают в этаноле. 1/50 полученного продукта используют для трансляции in vitro в экстракте зародышей пшеницы или в лизате ретикулоцитов кролика, следуя рекомендациям производителя (Promega). Для анализа изменения электрофоретической подвижности (АИЭН) использовали различные концентрации, соответствующие 5, 1, 0,2 и 0,04 мкл системы трансляции in vitro.
Пример 3: АИЭН
Использованный протокол АИЭН описан в [16]. Эндотелиальные клетки (ЭК) культивируют в среде Игла, модифицированной по Дульбекко и содержащей 10% фетальной сыворотки теленка. Указанные эндотелиальные клетки стимулируют 100 нг/мл бактериального липополисахарида (ДПС) в течение 2 ч, после чего экстрагируют ядерные белки в соответствии с [7]. 0,2 нг двухцепочечного 26-мерного олигонуклеотида BS-2 (последовательность которого представлена ниже в виде Последовательности N 4; 100,000 всп/мин) метят путем заполнения свободных концов с помощью кленовского фрагмента ДНК-полимеразы I в присутствии радиоактивных нуклеозид трифосфатов. В дальнейшем полученный олигонуклеотид инкубируют в 15 мкл буфера для связывания, содержащего 12% глицерина, 12 мМ HEPES, , 4 мМ Трис, 60 мМ KCl, 1 мМ ЭДТА, 1 мМ DTT, 200 мкг/мл поли(dl-DC) и 300 мкг/мл бычьего сывороточного альбумина. Затем добавляют 15 мкг ядерных белков, а также 5, 1, 0,2 или 0,04 мкл транслированного белка ECI-6. Реакцию связывания осуществляют при температуре 30oC и pH 7,9 в течение 15 мин. Подавление связывания NFχB с олигонуклеотидом BS-2 может быть выявлено с помощью сравнения полученных результатов с контрольными экстрактами зародышей пшеницы или лизатами ретикулоцитов кролика.
Указанную процедуру повторяют с лизатами ретикулоцитов кролика, содержащими или несодержащими РНК ECI-6, но без использования упомянутого ядерного экстракта.
Создают конкурентные условия связывания либо с холодным BS-2, либо с BS-1 (последовательность которого представлена ниже в виде Последовательности N 5), либо с ELχB (сайтом связывания из промотора ELAM-1 свиньи, последовательность которого представлена ниже в виде Последовательности N 6), либо с IgχB (сайтом связывания NFχB из энхансера легкой каппа-цепи иммуноглобулина человека, последовательность которого представлена ниже в виде Последовательности N 7), но не с мутированным сайтом NFχB, последовательность которого представлена ниже в виде Последовательности N 8. В тестах на конкурентное связывание используют 500-кратный молярный избыток немеченных олигонуклеотидов. Образующиеся в результате этого комплексы разделяют на 5%-ном полиакриламидном геле, описанном в [7]. Белок ECI-6 подавляет связывание NFχB с сайтом связывания IχB-2.
Пример 4: Эксперименты по транзиентной экспрессии
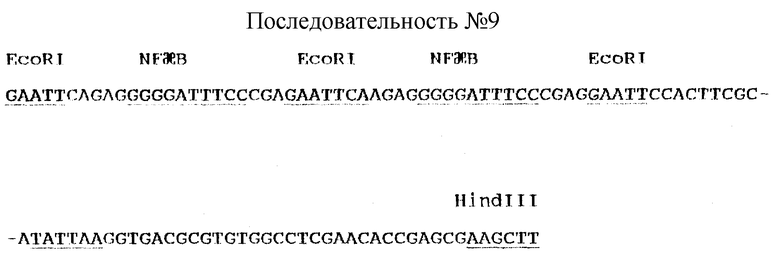
Минимальный NFχB-зависимый промотор конструируют в векторе UBT.Luc [17], содержащем репортерный ген люциферазы, с использованием стандартных методов молекулярной биологии. Коротко, двухцепочечный олигонуклеотид, представляющий собой фрагмент промотора тимидин киназы длиной 37 п.о. и несущий на своих 5' и 3' концах дополнительные участки, характерные для рестриктаз EcoRI и HindIII, соответственно, клонируют в плазмиду pKSM13 (Stragene) с получением вектора pKSM13-TK. Две копии двухцепочечного олигонуклеотида, который несет дополнительные участки, характерные для рестриктазы EcoRI, и представляет собой сайт связывания NFχB, клонируют в плазмиду pKSM13-TK с получением вектора pKSM13-2xIgkB-TK. Правильность указанной конструкции подтверждают с помощью секвенирования ДНК. Полученный фрагмент 2xIgkB-TK вырезают посредством расщепления ДНК рестриктазами NotI и HindIII (сайт узнавания NotI локализован выше по течению (5') по отношению к EcoRI-сайту). Образующийся при этом фрагмент лигируют в вектор UBT.Luc, предварительно расщепленный соответствующими ферментами рестрикции, с получением вектора 2xIgkBTK. Luc. Последовательность фрагмента 2xIgkB-TK представлена ниже, а также в виде Последовательности N 9:
Указанный вектор с помощью трансфекции вводят в клетки NIH3T3 с использованием Lipofectin (BRL, см. прилагаемый протокол). Тест на активность люциферазы осуществляют в соответствии с [18] . Не выявляют превышения экспрессии люциферазы по сравнению с фоном. В том случае, если осуществляют ко-трансфекцию вектора 2xIgkBTK. Luc вместе с вектором, определяющим экспрессию субъединицы p65 белка NFχB (CMV.p65), выявляют высокий уровень активности люциферазы. В том случае, если вместе с векторами 2xIgkBTK.Luc и CMV. p65 осуществляют трансфекцию вектора, определяющего экспрессию ECI-6/IkBa, уровни активности люциферазы уменьшаются до уровня фона. В качестве внутреннего контроля в ходе всех трансфекций используют вектор экспрессии ESV. β-галактозидазы.
Вышеупомянутый мутант, несущий делецию района PEST, получают с использованием ПЦР, вводя стоп-кодон после аминокислоты Лейцин-280.
Пример 5: Конструирование рекомбинантных ретровирусов для стабильной трансдукции первичных ЭКАС кДНК ECI-6/IχB
5 ретровирусных векторов оценивают в плане получения рекомбинантных ретровирусов, способных к высокоэффективной трансдукции ЭКАС (эндотелиальных клеток аорты свиньи) с помощью молекул тромбомодулина человека. Обнаружено, что вектор pNTK-2 приводит к наивысшему титру рекомбинантных вирусов, а также к столь же высокой экспрессии в пуле инфецированных ЭКАС, как и в случае использования векторов, в которых указанный ген переносится за счет 5'-вирусного LTR. На основании этого исследования, для конструирования рекомбинантного ретровируса, предназначенного для экспрессии кДНК ECI-6/IχB в ЭКАС, выбирают вектор pNTK-2. Соответствующий рекомбинантный провирус конструируют, вставляя часть фрагмента Xho1-Sal1 длиной приблизительно 1 т.п.о., включающую в себя кДНК ECI-6, в уникальный сайт Xho1, расположенный в провирусе pNTK-2 ниже по течению по отношению к tk-промотору. Очищенные рекомбинантные продукты, которые содержат указанную кДНК как в смысловой, так и в антисмысловой ориентации по отношению к tk-промотору и могут быть различены при помощи расщепления рестриктазой BamHI, выявляют в штамме E. coli XL-1 blue. Полученную антисмысловую конструкцию используют в качестве контроля. Для достижения максимальной эффективности трансфекции упаковочной клеточной линии PA317 высокоочищенную плазмиду выделяют из бактериальных культур с использованием Qiagen. Для сведения к минимуму вероятности интеграции, несовместимой с продукцией вируса, смысловую и антисмысловую конструкции (10 мкг) линеаризуют с помощью рестрикционной эндонуклеазы HindIII, производящей расщепление вне провируса. Расщепленную ДНК очищают, проводя последовательную экстракцию фенол-хлороформом и хлороформом, а также осаждение этанолом и растворение в 100 мкл буфера для электропорации (PBSA + 20 мМ буфера HEPES, pH 7,0) в течение ночи при температуре 4oC. Повторное растворение подтверждают с помощью предшествующего трансфекции электрофореза в агарозном геле. Упаковочные клетки PA317 трансфецируют или псевдо-трансфецируют (в отсутствие ДНК) с использованием набора для электропорации Biorad при 0,25 кВ и 500 микрофарадах, что определяет продолжительность воздействия, равную 13,7 мс. Выжившие клетки ресуспендируют в 20 мл свежей культуральной среды и инкубируют в течение ночи перед добавлением селективного агента (0,8 мг/мл G418). После 7 дней селекции получают устойчивые к антибиотику колонии клеток, образовавшиеся в результате трансфекции как смысловой, так и антисмысловой конструкцией, в то время как контрольные клетки (трансфецированные в отсутствие ДНК) полностью погибают.
Полученные колонии объединяют и высевают в колбы T-75 в среду, содержащую G41B. Находящиеся в log-фазе и начинающие слипаться клетки из каждой колбы замораживают в виде аликвот в LN2 (хозяйские сток-клетки). Клетки, предназначенные для наработки вируса, выращивают до состояния слипания и через 24 ч собирают вирус в 20 мл полной среды. Затем содержащую вирус среду быстро замораживают в LN2 для убивания находящихся в суспензии продуцентных клеток, а также для хранения при температуре -80oC. Затем проводят два дополнительных сбора вируса. Исследуют клетки на экспрессию IχB, а также тестируют их на подавление связанной с NFχB индукции экспрессии.
Литература
1. WO 91/05855.
2. Baeuerle P. (1991), BBA 1072, 63-80.
3. Davies et al. (1991), Science 253, 1268-1271.
4. Tewarl et al. (1992), Mol. Cell. Biol. 12(6), 2898-2908.
5. Haskill et al. (1991), Cell 65, 1281-1289.
6. Gosen and Bujard (1992), PNAS 89, 5547-5551.
7. Dignam et al. (1983), Nucl. Acids Res. 11, 1475-1489.
8. Miller A.D. (1992), Nature 357, 455-460.
8. Miller A.D. and Rosman G.T. (1989), Biotechniques 7(9), 980-990.
10. WO 92/07573.
11. Rosenfeld M.A. (1991), Science 252, 432.
12. Wagner et al. (1991), PNAS 88, 4255-4259.
13. Stewart et al. (1992), Human Gene Therapy 3, 267-275.
14. Rogers et al. (1986), Science 234, 364-368.
15. Maniatis et al. (1989), Molecular Cloning, Cold Spring Harbor, 7-10.
16. Ausubel I. and Frederick M. / Eds. (1987), "Current Protocols in Molecular Biology", J. Willey & Sons, section 12-2.
17. de Martin et al. (1993), Gene 124, 137-138.
18. de Wet et al. (1987), Mol. Cell. Biol. 7, 725-737.












Изобретение относится к медицине. Описаны эндотелиальные клетки, которые экспрессируют белок, обладающий активностью IχB в результате чего NFχB - зависимая активация этих клеток оказывается полностью подавленной. Клетки могут быть получены за счет изменения генетического материала указанных клеток, например, с помощью введения в них гетерологичных последовательностей, кодирующих активность IχB или промотора, при котором активность IχB экспрессируется конструктивно, непосредственно после действия стимулов, активирующих эндотелиальные клетки, либо при необходимости, в ответ на предопределенный внешний стимул. Технический результат - создание пересадочного материала, удобного для использования при трансплантации, например ксенотрансплантации, поскольку они характеризуются благоприятной, меньшей вероятностью отторжения. 7 с. и 9 з.п. ф-лы, 2 ил.
| Автоматический огнетушитель | 0 |
|
SU92A1 |
| C.Creminon et al | |||
| "Differ meas | |||
| Of constitutive.. | |||
| endotnelial cells"..., BBA, V.1254, №3, 333/341, 1990. | |||
Авторы
Даты
2001-03-27—Публикация
1993-10-29—Подача