Уровень техники, к которой относится изобретение
Это изобретение относится в целом к фаговому дисплею и, в частности, к отбору бактериофагов, экспрессирующих пептиды и белки, которые связываются с рецепторами клеточной поверхности и интернализуются.
Известный уровень техники
Бактериофаг, экспрессирующий на своей поверхности пептид, применяли для идентификации связывающих доменов белка, включая антигенные детерминанты, антител со специфической реактивностью, мутантов с высокоаффинным связыванием, для идентификации новых лигандов и сайтов субстратов для ферментов. В самом общем виде пептид экспрессируется в виде белка, слитого с капсидным белком нитчатого фага. Это приводит к экспозиции чужеродного белка на поверхности фаговой частицы. Созданы библиотеки фагов, которые экспрессируют множество чужеродных белков. Эти библиотеки связываются с субстратом или клеткой, которые представляют собой интересующий компонент связывания. Этот процесс скринига, по существу, представляет собой аффинную очистку. Связанные фаги выделяют, разводят, благодаря чему можно выделить и охарактеризовать ген, кодирующий чужеродный белок. Эту технологию обычно обозначают как "фаговый дисплей".
С помощью процесса, именуемого "биопанорамированием", можно идентифицировать и выделить специфический фаг, несущий пептид или белок, реагирующий с белком или другой составляющей на твердой фазе. Однако, в некоторых вариантах применения связывание или сродство связывания является не единственным существенным параметром. Например, в генной терапии последовательность гена необходимо ввести в клетку. В предпочтительных способах последовательность гена направленно доставляется к конкретным клеткам за счет взаимодействия лиганда с рецептором клеточной поверхности. Таким образом, лиганд должен не только взаимодействовать с клетками, но должен также интернализироваться. Природный интернализующийся лиганд при применении в системе для генной терапии может интернализироваться неэффективно. Например, FGF2 (фактор роста фибробластов 2) и EGF (эпидермальный ростовой фактор) являются интернализующими лигандами; однако, среди этих двух лигандов FGF (или полипептиды, взаимодействующие с рецептором FGF) в настоящее время предпочтительны в качестве лиганда для направленной доставки генов.
Можно провести скрининг библиотек фагов в отношении интернализующих лигандов с помощью биопанорамирования на живых клетках и высвобождения интернализованного фага из клеток после удаления фагов, связанных с внешней поверхностью клеток (например, с помощью элюции кислотой). Этот способ может приводить к выявлению нежелательных фагов, очень прочно связываемых (с поверхностью) или только частично интернализируемых. Более того, те фаги, которые интернализуются и подвергаются действию протеаз, теряют инфекционность и не могут быть выделены. Следовательно, имеющиеся в настоящее время методологии неадекватны для определения применимости лигандов для генной терапии.
Таким образом, имеющиеся в настоящее время методы скрининга неадекватны для отбора пептидных или белковых лигандов, которые взаимодействуют с рецептором клеточной поверхности и интернализуются. Настоящее изобретение раскрывает способ фагового дисплея, с помощью которого отбирают пептидные или белковые лиганды, способные к интернализации, и предлагает другие дополнительные, относящиеся к этому преимущества.
Краткое изложение существа изобретения
В одном варианте настоящего изобретения представлен способ идентификации в библиотеке бактериофагов, экспрессирующих гетерологичные пептиды или белки, бактериофага, который связывается с рецептором клеточной поверхности и интернализуется, включающий: (а) контактирование библиотеки бактериофагов, экспрессирующих множество пептидов, с клеткой, где геном бактериофага несет ген, кодирующий определяемый продукт; и (b) определение продукта, в результате чего идентифицируется бактериофаг, экспрессирующий гетерологичный пептид, который связывается с рецептором клеточной поверхности и интернализуется.
В другом варианте в изобретении предлагается способ выделения клеток, которые интернализуют бактериофаг, представленный в библиотеке бактериофагов, экспрессирующих гетерологичные пептиды или белки, включающий: (а) контактирование библиотеки бактериофагов, экспрессирующих множество пептидов, с клеткой, где геном бактериофага несет ген, кодирующий определяемый продукт; (b) определение продукта; и (с) выделение клеток, которые экспрессируют продукт.
В еще одном варианте в изобретении предлагается способ отбора бактериофага, экспрессирующего гетерологичный пептид, который связывается с рецептором клеточной поверхности и интернализуется, включающий: (а) контактирование библиотеки бактериофагов, экспрессирующих множество пептидов, с клеткой, где геном бактериофага несет ген, кодирующий определяемый продукт; (b) определение продукта; и (с) выделение гена бактериофага, кодирующего пептид из клеток, экспрессирующих продукт; в результате чего отбирают бактериофаг, экспрессирующий гетерологичный пептид, который связывается с рецептором клеточной поверхности и интернализуется.
В еще одном варианте предлагается способ отбора бактериофага, экспрессирующего гетерологичный пептид, который связывается с рецептором клеточной поверхности и интернализуется, включающий: (а) контактирование библиотеки бактериофагов, экспрессирующих множество пептидов, с клетками, где геном бактериофага несет ген, кодирующий селектируемый продукт; (b) инкубацию клеток в селективных условиях; и (с) выделение гена бактериофага, кодирующего пептид, из отобранных клеток; в результате чего отбирают бактериофаг, экспрессирующий гетерологичный пептид, который связывается с рецептором клеточной поверхности и интернализуется.
В другом варианте в изобретении предлагается способ идентификации бактериофага, экспрессирующего гетерологичный пептид, который связывается с рецептором клеточной поверхности и интернализуется, включающий: (а) контактирование библиотеки бактериофагов, экспрессирующих множество пептидов, с рядом клеток, где геном бактериофага несет ген, кодирующий определяемый продукт; и (b) определение продукта в этом ряду, в результате чего идентифицируют подгруппу бактериофагов, экспрессирующих гетерологичный пептид, который связывается с рецептором клеточной поверхности и интернализуется. В одном осуществлении ряд содержит множество клеточных типов. В другом варианте осуществления способ дополнительно включает стадию (с), в которой библиотеку бактериофагов повторно делят на подгруппы пулов и проводят скрининг, применяя стадии (а) и (b) до тех пор, пока не идентифицируют конкретный бактериофаг, экспрессирующий гетерологичный пептид, который связывается с рецептором клеточной поверхности и интернализуется.
В предпочтительных вариантах осуществления библиотека представляет собой библиотеку кДНК, библиотеку генов антител или библиотеку генов случайных пептидов. В других предпочтительных вариантах осуществления определяемый продукт выбирают из группы, состоящей из белка зеленой флуоресценции, β-галактозидазы, связанного с мембраной белка, секретируемой щелочной фосфатазы, хлорамфениколацетилтрансферазы, люциферазы, гормона роста человека и неомицинфосфотрансферазы.
В других вариантах осуществления рецептор клеточной поверхности представляет собой FGF-R или еrbВ2. В еще одних вариантах клетки представляют собой опухолевые клетки или эндотелиальные клетки. Клетки могут быть выделены, например, проточной цитометрией.
В предпочтительных вариантах осуществления бактериофаг представляет собой нитчатый фаг или лямбдовидный фаг.
В еще одном варианте в настоящем изобретении представлены лиганды, идентифицированные с помощью указанных выше методов скрининга. В одном варианте осуществления эти лиганды имеют аминокислотную последовательность, выбираемую из группы, состоящей из FVPDPYRKSR (SEQ ID NO: 1), CGGGPVAQRC (SEQ ID NO: 2) и CLAHPHGQRC (SEQ ID NO: 3). В другом варианте осуществления лиганд имеет аминокислотную последовательность FVPDPYRKSR (SEQ ID NO: 1).
Эти и другие аспекты настоящего изобретения будут очевидными при ссылке на последующее подробное описание и прилагаемые фигуры. Кроме того, ниже представлены различные ссылки, в которых более подробно описаны определенные процедуры или композиции (например, плазмиды и т.д.), и, следовательно, они включены здесь в виде ссылок в полном объеме.
Краткое описание чертежей
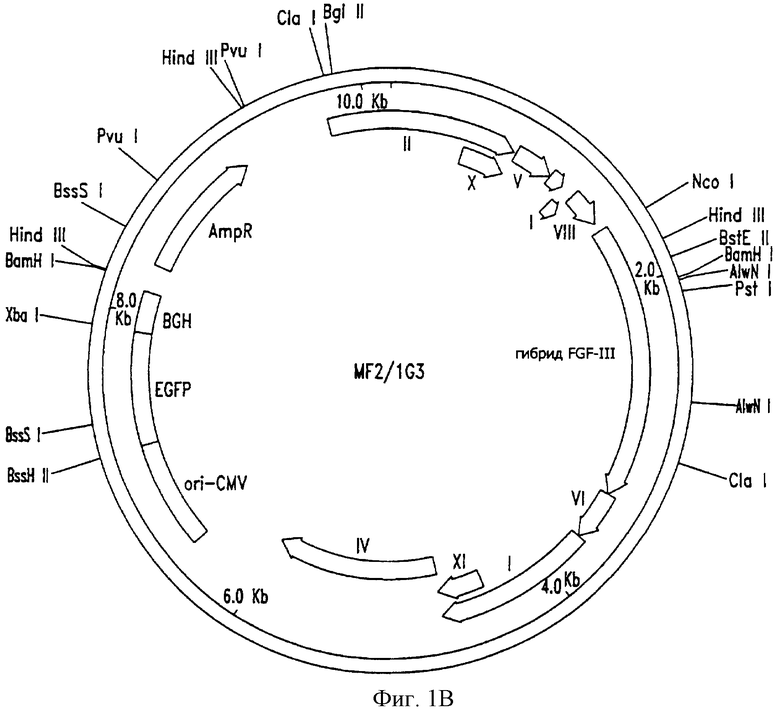
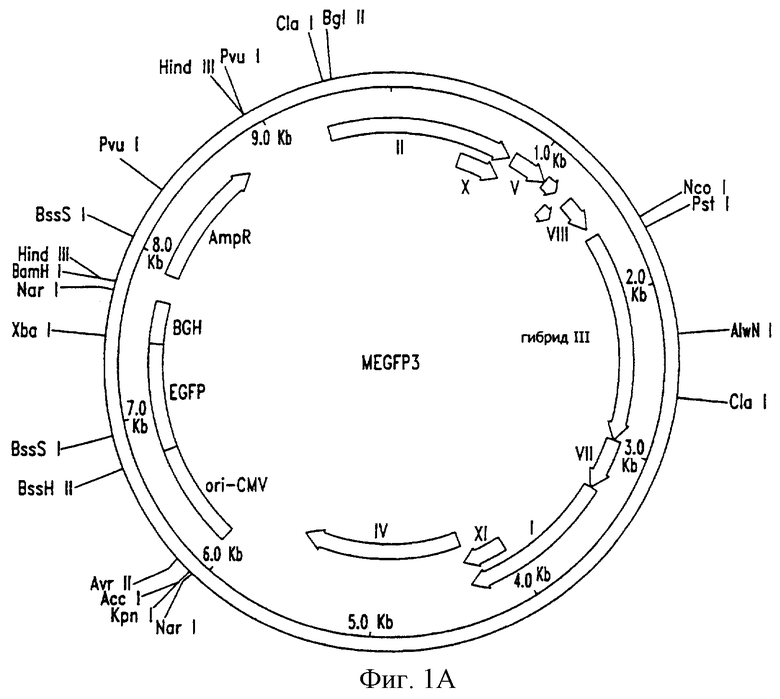
На фиг. 1А и 1В представлены схематические изображения фаговых векторов для трансдукции в клетки млекопитающих. На фиг. 1А изображен родительский фаговый вектор с диким типом белка pIII оболочки. Основной вектор является геномом М13 с геном устойчивости к ампициллину (АmрR) и экспрессионной кассетой GFP, введенной в межгенный район между pIV и pII (MEGFP3). Вектор MEGFP3 содержит следующие элементы: ori-CMV, точку начала репликации SV40 и промотор CMV; EGFP, усиленный ген белка зеленой флуоресценции; BGH и последовательность полиаденилирования гормона роста быка. На фиг. 1В представлен слитый фаговый дисплей FGF-pIII (MF2/1G3).
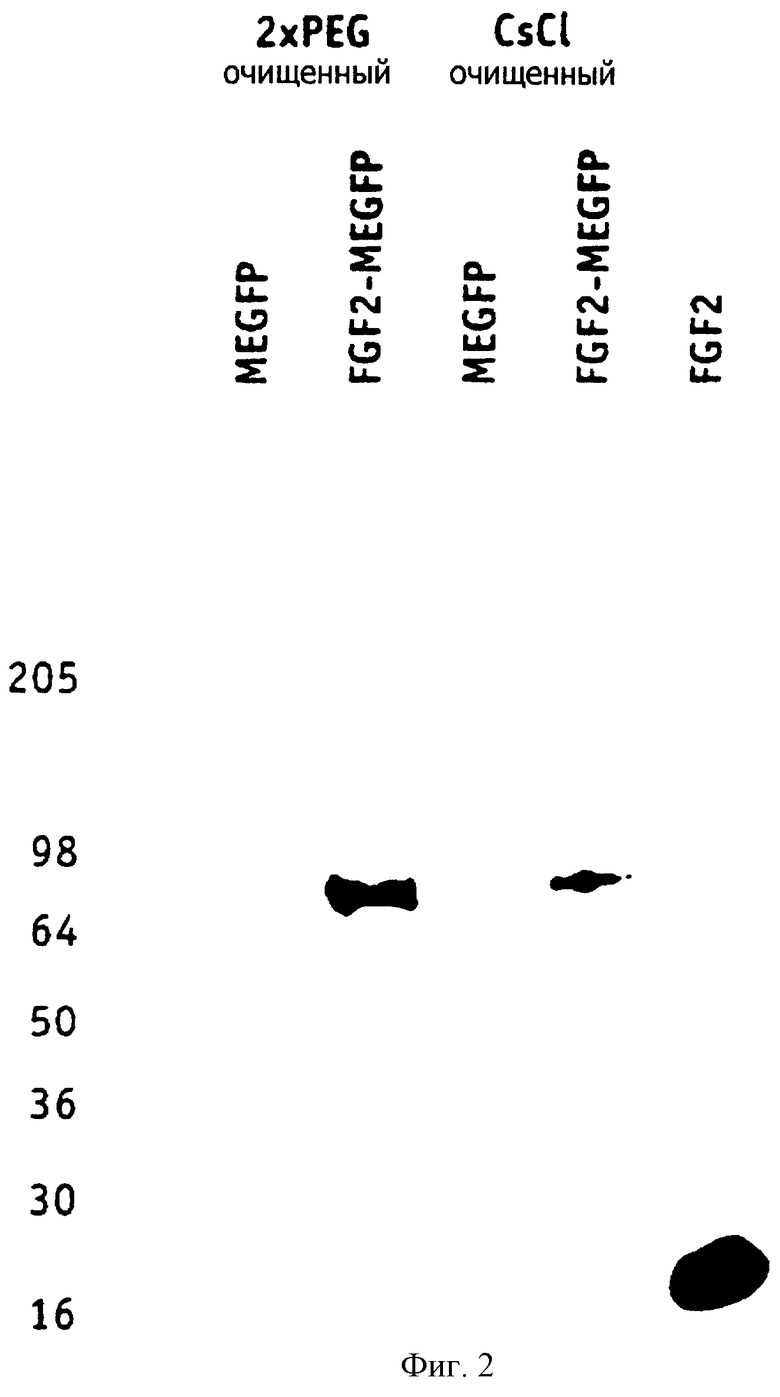
На фиг. 2 представлено сканированное изображение иммуноблоттинга, показывающего выявление слитого белка FGF2-pIII в белковых экстрактах из очищенного FGF2-фага (FGF2-MEGFP).
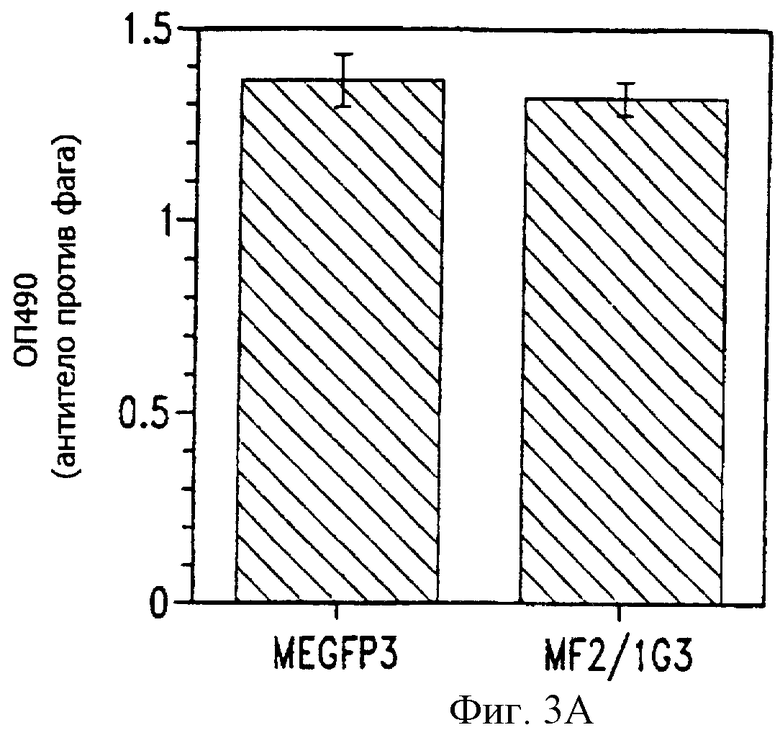
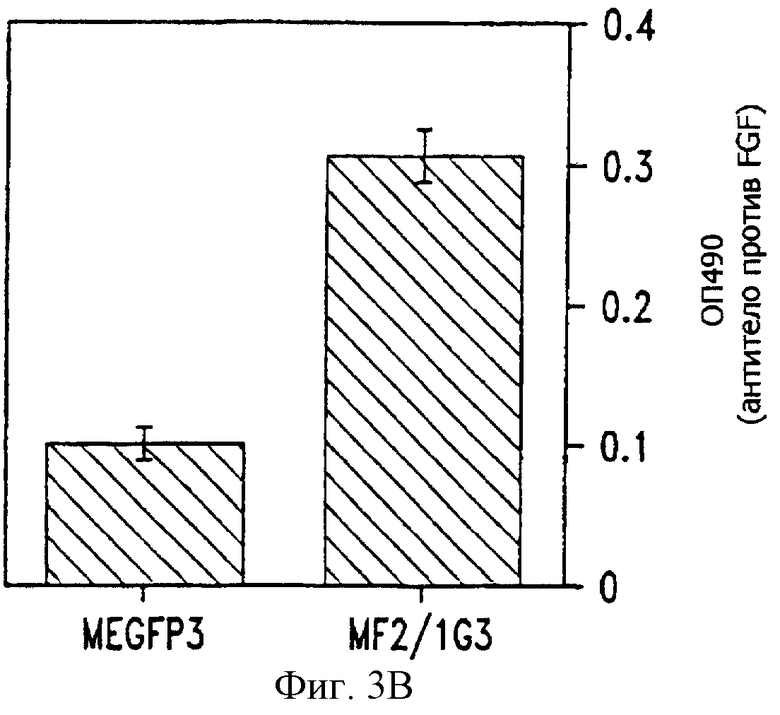
Фиг. 3А и 3В представляют собой гистограммы определения FGF2 на FGF2-фаге с помощью ELISA (ТИФА). На фиг. 3А изображено количество белка фага, определяемое с применением как пустого вектора MEGFP3, так и FGF2 слитой конструкции (FGF2-MEGFP). На фиг. 3В изображено количество FGF2, определенное на фаге, имеющем слитую конструкцию.
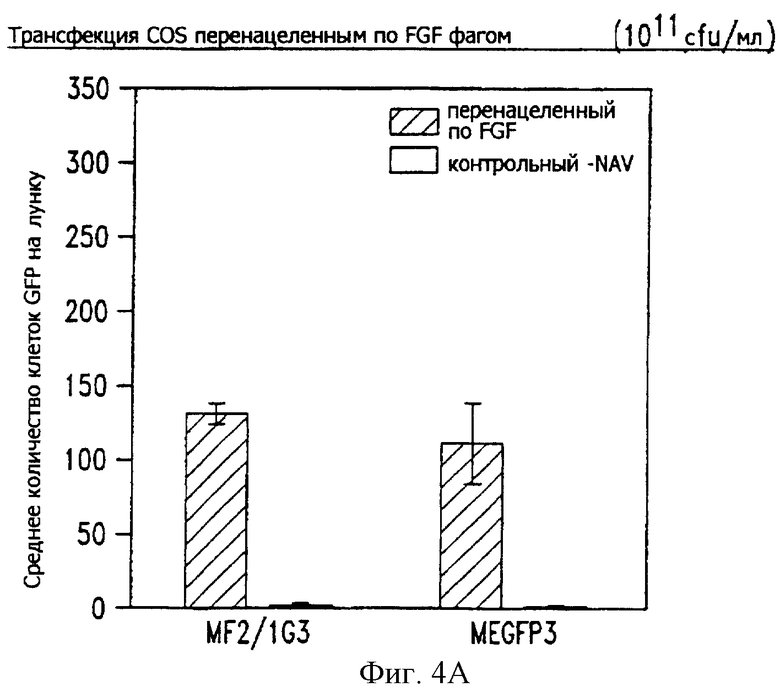
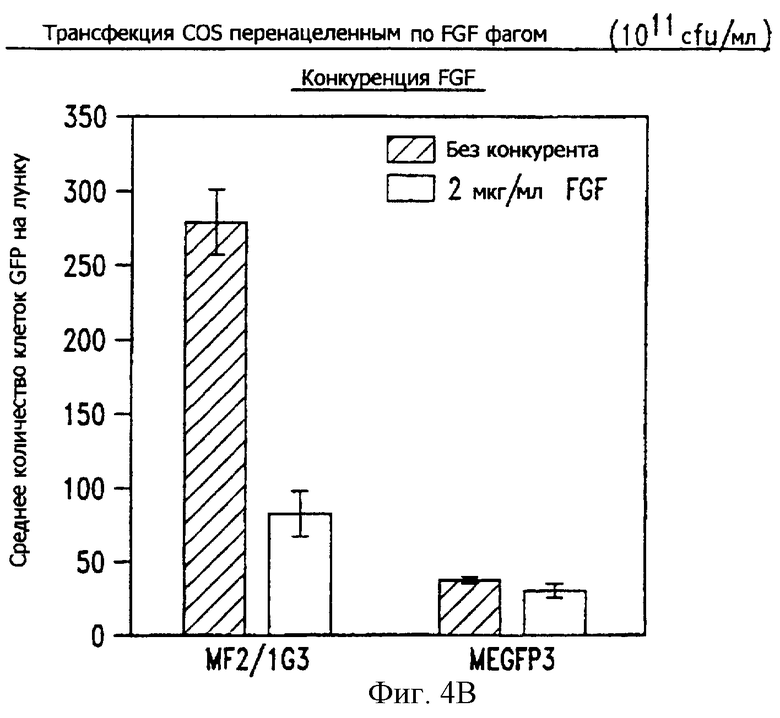
Фиг. 4А и 4В представляют собой гистограммы, показывающие трансдукцию FGF2-фагом в клетках COS.
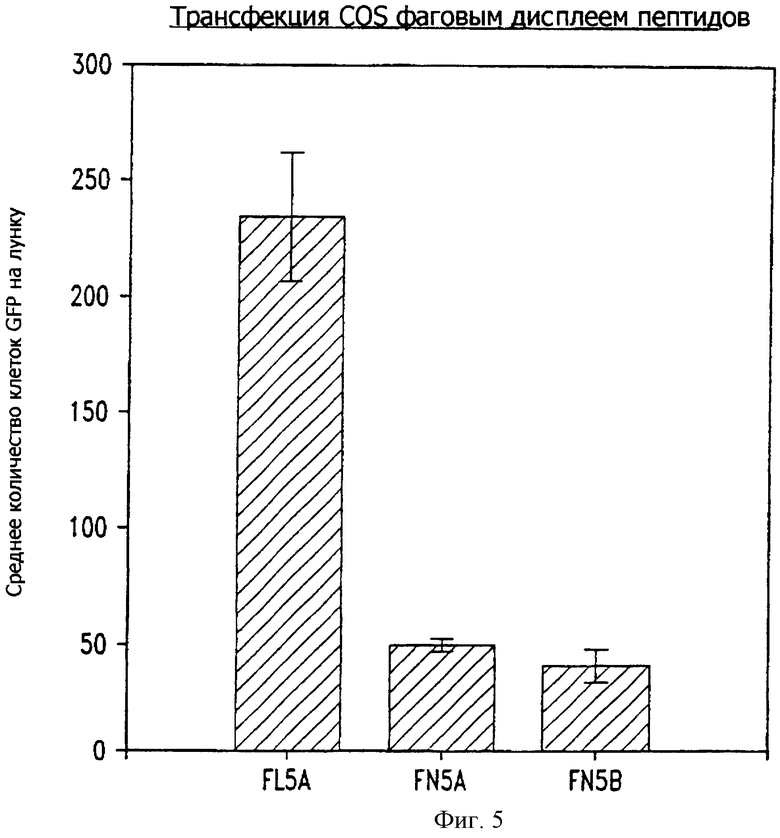
Фиг. 5 представляет собой гистограмму, показывающую трансдукцию фаговым дисплеем пептида в клетки COS.
Подробное описание изобретения
Как отмечалось выше, в настоящем изобретении предлагается способ фагового дисплея на основе экспрессии трансгена, переносимого фаговым геномом, с помощью которого идентифицируют и/или отбирают пептидные и белковые лиганды, которые связываются и интернализуются.
В кратком виде в настоящем изобретении библиотеку антител, кДНК или генов, кодирующих случайные пептиды, клонируют в белке оболочки бактериофага (например, гене белка III нитчатого фага). Геном фага также содержит "экспрессионную кассету", кодирующую трансген, расположенный ниже клеточного промотора, который активен в инфицируемых клетках (фиг. 1А). Трансгеном обычно является отбираемый генный продукт и/или определяемый маркер. Фаг контактирует с тестируемыми клетками и экспрессию трансгена отслеживают или отбирают. Интернализуемый фаг будет обеспечивать фенотип трансгена, такой как устойчивость к лекарству или экспрессия флуоресцирующего белка. На основе экспрессии трансгена могут быть выделены клетки. Например, когда трансген является геном устойчивости к лекарству, клетки выращивают в присутствии лекарства, в результате чего размножаются только клетки, получившие и экспрессирующие трансген. Слитые с белком оболочки ген(ы), которые стимулируют связывание с клеткой и интернализацию, выявляют в отобранных клетках с помощью подходящего способа.
I. Векторы фагового дисплея и способы
В контексте настоящего изобретения могут быть применены различные бактериофаги. Такие фаги включают нитчатые фаги, лямбда, Т4, MS2 и тому подобное. Предпочтительным фагом является нитчатый фаг, такой как М13 или f1.
Фаги, которые представляют чужеродный белок или пептид в виде гибрида с белком оболочки фага, конструируют так, чтобы он содержал соответствующие кодирующие участки. Могут быть применены различные бактериофаги и белки оболочки. Примеры включают, не ограничиваясь этим, ген III, ген VIII М13; минорный белок оболочки pIII fd (Saggio et al., Gene 152:35, 1995); белок D лямбда (Sternberg and Hoess, Proc. Natl. Acad. Sci. USA 92:1609, 1995; Mikawa et al., J. Mol. Biol. 262:21, 1996); белок pV хвоста лямбда фага (Maruyama et al., Proc. Natl. Acad. Sci. USA 91:8273, 1994; патент США №5627024); белок оболочки fr (WO 96/11947; DD 292928; DD 286817; DD 300652); белок gp9 хвоста φ29 (Lee, Virol. 69:5018, 1995); белок оболочки MS2; малый внешний капсидный белок Т4 (Ren et al., Protein Sci. 5:1833, 1996), неосновной капсидный каркасный белок IPIII T4 (Hong and Black, Virology 194:481, 1993), или ген удлиненного фибритинового белка T4 (Efimov, Virus Genes 10:173, 1995); ген III PRD-1; капсидный белок Qβ3 (до тех пор, пока на него не повлияет димеризация); и белок острия хвоста Р22 (Carbonell and Villaverde, Сеnе 176:225, 1996). Техника вставки чужеродной кодирующей последовательности в ген фага хорошо известна (смотри, например, Sambrook et al., Molecular Cloning: A Laboratory Approach, Cold Spring Harbor Press, NY, 1989; Ausubel et al., Current Protocols in Molecular Biology, Greene Publishing Co., NY, 1995).
В предпочтительной системе нитчатого фага доступен широкий спектр векторов (смотри Кау et al., Phage Display of Peptides and Proteins: A Laboratory Manual, Academic Press, San Diego, 1996). Наиболее обычные векторы допускают вставки в ген III или ген VIII. Более того, чужеродный ген можно вставлять прямо в геном фага или в фагемидный вектор. Методы размножения нитчатых фагов и фагемид хорошо известны.
Векторы нитчатых фагов обычно разделяют на две категории: геномы фагов и фагемиды. В контексте настоящего изобретения может быть применен любой тип вектора. Много таких векторов имеется в продаже. Например, могут быть использованы векторы серии pEGFP (Clontech; Palo Alto, CA), векторы M13mp (Pharmacia Biotech, Sweden), pCANTAB 5E (Pharmacia Biotech), серии pBluescript (Stratagene Cloning Systems, La Jolla, CA) и другие. Одним из особенно пригодных коммерческих фагемидных векторов является pEGFP-Nl, который содержит ген белка зеленой флуоресценции (GFP) под контролем сверхраннего промотора CMV. Эта плазмида включает также точку начала репликации SV40 для усиления экспрессии гена за счет обеспечения репликации фагемид в большом количестве копий в клетках, синтезирующих Т антиген SV40.
В научном сообществе доступны другие векторы (смотри, например, Smith, in Vectors: A Survey of Molecular Cloning Vectors and their Uses, Rodriquez and Denhardt, eds., Butterworth, Boston, pp. 61-84, 1988), или они могут быть сконструированы с применением стандартных методов (Sambrook et al., Molecular Biology: A Laboratory Approach, Cold Spring Harbor, NY, 1989; Ausubel et al., Current Protocols in Molecular Biology, Greene Publishing, NY, 1995), руководствуясь принципами, обсуждаемыми ниже.
Источник лиганда (например, ген, фрагмент гена или последовательность, кодирующая пептид) может происходить, например, из библиотеки кДНК, библиотеки антител или библиотеки случайных пептидов. В противоположном варианте лиганд может быть из библиотеки случайных мутаций известного лиганда. Еще одной альтернативой является происхождение лиганда из библиотеки известных связывающихся с рецептором агентов. Например, библиотека может содержать подгруппу пептидов, для которых известно, что они связываются с рецептором FGF или EGF, но для которых неизвестна доставка генов и экспрессионные характеристики (т.е. способность к трансдукции).
Когда применяют библиотеку кДНК, исходную кДНК синтезируют из мРНК, выделенной из тканевого источника или клеточной линии, из которой происходит желаемый лиганд. кДНК затем амплифицируют, применяя праймеры, содержащие последовательности подходящих сайтов для ферментов рестрикции, для вставки в желаемый вектор. В противоположном варианте для вставки в вектор можно амплифицировать имеющиеся в продаже библиотеки кДНК (например, Clotech; Palo Alto, CA).
Сходным образом библиотеки фрагментов антител могут быть получены из мРНК, выделенной из клеток селезенки иммунизированных животных (иммунизированных, например, целыми клетками-мишенями или мембранами), или субклонированы из существующих библиотек антител от иммунизированных или интактных животных. Случайные пептиды субклонируют из библиотек, имеющихся в продаже (New England Biolabs; MA), или их можно синтезировать и клонировать, применяя методы, описанные ранее (смотри Кау et al., выше).
Библиотеки фагового дисплея случайных мутаций известных лигандов для улучшения доставки генов получают тем же способом, что и описанный для скрининга библиотек случайных пептидов. Случайные мутации гена нативного лиганда могут быть вызваны с помощью перетасовки ДНК по Stemmer (Stemmer P., Nature 370:389-391, 1994). Вкратце, в этом методе лиганд амплифицируют и гидролизуют случайным образом ДНКазой I. Фрагменты из 50-300 пар оснований заново объединяют при амплификации, проводимой без праймеров, с применением Taq ДНК-полимеразы или сходного фермента. Высокая частота ошибок при работе этой полимеразы вводит случайные мутации в фрагменты, которые заново объединяются случайным образом, вводя таким образом комбинаторные вариации различных мутаций, распределенные по всей длине гена. В противоположном варианте для введения случайных мутаций может быть применена амплификация, подверженная ошибкам (Bartell and Szostak, Science, 261:1411, 1993). Мутацию лиганда можно создать с помощью кассетного мутагенеза (Hutchison et al., in Methods in Enzymology 202:356-390, 1991), при котором случайные мутации вводят, применяя синтетические олигонуклеотиды, и клонируют в лиганд для создания библиотеки лигандов с измененной специфичностью связывания. Могут быть применены дополнительные методы мутагенеза. Некоторые из дополнительных методов описаны в Кау et al., смотри выше.
Если библиотеки кДНК не могут быть созданы, потому что, например, источник желаемого лиганда недоступен или неизвестен, в качестве исходной точки для скрининга могут быть применены библиотеки случайных пептидов или библиотека кДНК из плаценты. Способы конструирования библиотек случайных пептидов могут быть найдены, например, в Кау et al., смотри выше. Вкратце, случайные пептиды кодируются ДНК, собранной из вырожденных олигонуклеотидов, и вставленной в один из описанных здесь бактериофаговых векторов. Для создания случайных пептидов может быть применено несколько различных стратегий. Например, триплеты NNN, где каждый N представляет собой эквимолярное представление всех четырех нуклеотидов, будут генерировать все 20 аминокислот (а также 3 стоп-кодона).
Альтернативные стратегии используют NN(G/T) и NN(G/C), что ведет к образованию 32 кодонов, которые кодируют все 20 аминокислот и только один стоп-кодон. В других стратегиях применяют синтез смесей трехнуклеотидных кодонов, представляющих все 20 аминокислот и никаких стоп-кодонов. Как только нуклеотиды синтезируются, их объединяют в виде двойных цепей различными способами, один из которых включает синтез комплементарной цепи (смотри выше Кау et al.).
В дополнение к гибриду лиганда и белка оболочки вектор содержит ген, чей продукт может быть определен или использован для селекции. Как обозначается здесь, "репортерным" геном является тот ген, чей продукт может быть определен за счет флуоресценции, ферментативной активности на хромогенном или флуоресцирующем субстрате и тому подобное, или может быть отобран по условиям роста. Такие репортерные гены включают, не ограничиваясь этим, белок зеленой флуоресценции (GFP), β-галактозидазу, хлорамфениколацетилтрансферазу (CAT), люциферазу, неомицинфосфотрансферазу, секретируемую щелочную фосфатазу (SEAP) и гормон роста человека (HGH). Селектируемые маркеры включают устойчивость к лекарствам, таким как неомицин (G418), гидромицин и тому подобное.
Маркерный ген функционально связан с промотором. Может быть использован любой промотор, который активен в клетках, подвергаемых трансфекции. Вектор должен также иметь точку начала репликации вируса и сигнал упаковки для сборки векторной ДНК с капсидными белками.
Большая часть применения настоящего изобретения должна включать трансфекцию клеток млекопитающих, включая клетки человека, собаки, кошки, лошади и тому подобное. Выбор промотора частично должен зависеть от типа клетки-мишени. Промоторы, которые подходят в контексте настоящего изобретения, включают, не ограничиваясь этим, конститутивные, индуцибельные, тканеспецифические, специфичные для определенного типа клеток, временно специфичные или специфичные в определенных обстоятельствах, хотя предпочтительны конститутивные промоторы.
Примеры конститутивных или неспецифических промоторов включают ранний промотор SV40 (патент США №5118627), поздний промотор SV40 (патент США №5118627), промотор раннего гена CMV (патент США №5168062), промотор вируса папилломы быка и аденовирусный промотор. В дополнение к вирусным промоторам в контексте настоящего изобретения также подходят клеточные промоторы. В частности, применимы клеточные промоторы для так называемых генов домашнего хозяйства (например, β-актина). Вирусные промоторы обычно являются более сильными промоторами, чем клеточные промоторы.
В предпочтительных осуществлениях фаг имеет точку начала репликации, подходящую для трансфецируемых клеток. Могут быть использованы вирусные системы репликации, такие как EBV ori и EBNA ген, SV 40 ori и Т антиген или BPV ori. Можно провести замену на другие системы репликации млекопитающих. Гены репликации могут создать большое число копий. Экспрессия терапевтических генов из генома фага может быть усилена путем увеличения числа копий фагового генома. В одном методе для создания нескольких сотен тысяч копий применяют точку начала репликации SV40 в присутствии Т антигена SV40. Ген Т антигена может уже присутствовать в клетках, вводиться отдельно или включаться в геном фага под транскрипционным контролем подходящего клеточного промотора. Для увеличения числа копий можно также использовать другие вирусные системы репликации, такие как точку начала EBV и EBNA.
В других вариантах осуществления включают и экспрессируют на поверхности бактериофага пептиды или другие составляющие, которые позволяют или стимулируют исключение векторов (и любой молекулы, прикрепленной к ним или включенной в них) из эндосомы. Такие "другие составляющие" включают молекулы, которые сами не являются пептидами, но которые обладают способностью разрушать мембрану эндосом, облегчая тем самым исключение вектора, и молекулы, которые иным способом имитируют способность описанных здесь пептидных последовательностей вызывать исключение из эндосом (смотри, например, заявку РСТ №WO 96/10038, включенную здесь в качестве ссылки).
Особенно предпочтительны пептидные последовательности, которые обладают способностью вызывать исключение из эндосом. Такие последовательности хорошо известны и могут быть легко слиты, ковалентно или генетически, с белком оболочки, таковы ген III или ген VIII нитчатого фага. Хотя слияние одной или более пептидных последовательностей с белком оболочки описано здесь в качестве предпочтительного варианта осуществления, должно быть понятно, что, как раскрыто здесь, применимы и другие способы присоединения и другие составляющие, кроме пептидов.
Так, примером двойного дисплея нитчатого фага является лиганд (например, FGF) в виде гибрида с геном III и пептид эндосомального исключения, слитого с геном VIII. Локализация лигандной и исключающей последовательностей взаимозаменяема. Подходящие исключающие последовательности включают, не ограничиваясь этим, следующие примеры последовательностей: пептид экзотоксина Pseudomonas (Donnelly, J.J., et al., PNAS 90:3530-3534, 1993); пептиды вируса гриппа, такие как НА пептид и происходящие из него пептиды, например, пептид FP13; пептид слияния вируса Сендай; последовательность генетического слияния из белка gpl HIV; пептид генетического слияния Paradaxin; и пептид генетического слияния Melittin (смотри WO 96/41606).
Другой последовательностью, которая может быть включена в вектор, является последовательность, которая облегчает перемещение белков в ядро. Эти так называемые последовательности ядерной транслокации или ядерной локализации (NLS) обычно богаты положительно заряженными аминокислотами. Поскольку карбоксильный конец белкового продукта гена VIII нитчатого фага уже несет положительный заряд, увеличение заряда и облегчение ядерного транспорта может быть стимулировано путем слияния известных последовательностей NLS клеток млекопитающих с геном белка VIII. Слияния NLS можно заменить на другие белки оболочки нитчатого фага.
Примеры последовательностей NLS включают те из них, которые сходны с короткой основной NLS Т антигена SV40; двухкомпонентную NLS нуклеоплазмина; последовательность А1 рибонуклеопротеина; последовательность U1A малого ядерного рибонуклеопротеина и вирус-1 Tax белок Т-лимфоцитов человека. Другие пригодные последовательности NLS включают NLS белка HIV матрикса; и компоненты ядерной транслокации importain/hSRP1 и Ran/TC4; консенсусную последовательность KXX (K/R), фланкирующую Pro или Аlа; последовательность ядерной транслокации нуклеоплазмина; или NLS из антеннапедии (смотри WO 96/41606).
Как здесь описано, библиотеку затем размножают в фаговом дисплее путем трансфекции подходящего бактериального хозяина (например, DH5αF’ для нитчатых фагов) и выращивают в культуре с добавлением, если необходимо, компетентного для репликации вируса-хелпера в течение ночи при 37°С. Фаговые частицы выделяют из культуральной среды с использованием стандартных протоколов.
Инфицирование клеток млекопитающих фагом выполняют в условиях, которые блокируют вход фагов дикого типа в клетки Barry et al., Nature Med. 2:299-305, 1996). Фаги добавляют прямо к клеткам, обычно с титром ≤1012 CFU/мл в буфере, таком как ЗФР, с 0,1% БСА или другими подходящими блокирующими агентами и инкубируют с клетками при 37°С или на льду. Количество фага, добавляемого к клеткам, должно частично зависеть от сложности библиотеки. Например, библиотека фагового дисплея, содержащая 105 членов, содержит 106 копий каждого члена в 1 мл при типичном титре фагов 1011 колониеобразующих единиц/мл.
II. Определение/отбор трансгенной экспрессии
В конечном итоге проводят скрининг библиотеки фагового дисплея по отношению к ткани-мишени или клеточной линии. Скрининг может быть выполнен in vitro или in vivo. Критерием позитивного "попадания" является то, что фаг должен обладать способностью связываться, интернализовываться и экспрессировать геномную ДНК, содержащую репортерный ген, в клетке-мишени. В этом случае считается, что фаг должен связываться, интернализовываться, транслоцироваться в ядро, покидать оболочку и реплицироваться для того, чтобы экспрессировать ген. Таким образом, отбирают только те фаги, которые экспрессируют репортерный ген.
Тестируемыми клетками могут быть любые клетки, которые экспрессируют выбранный рецептор или являются тем клеточным типом или источником, для которого предназначена генная терапия. Таким образом, в некоторых случаях рецептор может быть неизвестен. В таких случаях может быть применен способ селекции для выделения лиганда для рецептора, лиганд которого неизвестен (сиротского рецептора), такого как еrbВ3.
Вкратце, сиротский рецептор клонируют в экспрессионный вектор млекопитающих, который содержит также селектируемый ген устойчивости к лекарству, и трансфецируют в клетки млекопитающих, такие как клетки COS. С помощью культивирования с соответствующим лекарством отбирают стабильные трансфектанты, которые характеризуются гиперпродукцией сиротского рецептора. Такую трансформированную рецептором клеточную линию COS затем используют как клеточную линию для отбора экспонирующего лиганд фага.
Тканеспецифические или специфичные для опухоли лиганды могут быть отобраны путем предварительной абсорбции библиотеки фага с использованием нормальных тканей или тканей-немишеней клеточных культур. Процесс селекции может быть также применен in vivo с помощью введения библиотеки мышам-носителям опухоли. Опухоль забирают из мыши через 48-72 ч после введения. Готовят клеточную суспензию и клетки, несущие геном фага, отбирают с помощью одного из методов, описанных выше. Затем из устойчивых к лекарству клеточных колоний выделяют ген, чей продукт позволяет геному фага входить и экспрессироваться.
Скрининг можно проводить прямо в отношении клеток-мишеней без предварительного скрининга или предварительного обогащения. Предварительный скрининг и предварительное обогащение могут быть использованы и могут быть особенно полезными в том случае, когда наблюдается либо слишком мало, либо слишком много попаданий. Обогащение клеточного связывания может улучшить определяемость, если при первоначальном скрининге не найдено никаких попаданий. Предварительный скрининг для удаления фагов, которые связываются с неспецифическими белками клеточной поверхности, может снижать неспецифические попадания, если проявляется слишком много первоначальных попаданий. Например, инфицирование 107 клеток-мишеней проводят приблизительно 1011 фагами, однако применимы различная плотность клеток и диапазон титров фагов. Клетки инкубируют в течение, по меньшей мере, 2 ч в ЗФР/БСА и интенсивно отмывают (Barry et al., Nature Med. 2:299-305, 1996). Клетки инкубируют в среде при 37°С в течение 48-96 ч и затем определяют или отбирают на основе экспрессии репортерного гена.
Определение продуктов каждого из этих репортерных генов хорошо известно. Например, GFP определяют с помощью флуоресцентной микроскопии или поточной цитометрии, SEAP определяют в среде с применением флуоресцирующего субстрата (Clontech; Palo Alto, CA), гормон роста человека может быть определен в среде с помощью простого и чувствительного радиоиммунного метода (Nichols Institute; CA). Для иммунологического определения и измерения присутствия продукта репортерного гена можно также применять иммуноблоттинг и ТИФА (ELISA). В противоположном варианте сигнал для репортерного гена определяют, применяя метод защиты зонда от РНКазы или гибридизацию флуоресцентного зонда. Для выделения ДНК фагового вектора и вставки может быть применена любая техника, которая позволяет идентифицировать и выделять клетки, экспрессирующие определяемый маркерный продукт. В частности, для определения флуоресценции в или на клетке и выделения такой клетки хорошо подходит проточная цитометрия.
Когда репортерным геном является селективный маркер, клетки выращивают в селективных условиях. В зависимости от маркера условиями может быть конкретная температура роста, добавление лекарства или тому подобное. В представленных здесь примерах селективным маркером является неомицинтрансфераза, которая сообщает клеткам млекопитающих устойчивость к G418. Вкратце, клетки растут в присутствии G418 в течение 7-14 дней или до тех пор, пока устойчивые колонии не будут видимыми под микроскопом. Колонии собирают и ДНК фагового вектора, пригодную для амплификации вставки, выделяют.
В противоположном варианте применяют множественные циклы инфицирования и селекции для снижения сложности организации инфицирующих фагов. Например, объединяют устойчивые к лекарству колонии и отобранные вставки амплифицируют и вновь клонируют в векторе фагового дисплея для нового цикла инфицирования. Когда репортер является флуоресцентным, для отбора наиболее сильно флуоресцирующих клеток, чтобы выбрать наиболее высокоэффективные лиганды для доставки гена, может быть применена проточная цитометрия. Более строгие условия скрининга также включают более высокие концентрации селективного лекарства. При завершении процесса селекции образцы клонов фагов могут быть подвергнуты анализу с помощью секвенирования ДНК для дальнейшей характеристики лигандов для доставки генов.
В еще одном варианте для идентификации лигандов могут быть применены высокопроизводительные методологии скрининга, такие как библиотеки для скрининга путем субселекции пулов. Вкратце, может быть использован массив фагов, содержащий множество членов, в сочетании с набором для идентификации интернализующих лигандов. Например, массив бактериофагов, содержащий члены библиотеки, может быть подразделен на подгруппы массивов таким образом, чтобы каждый массив содержал от приблизительно 102 до приблизительно 103 членов. Затем проводят скрининг каждого исходного раствора с применением набора (например, многолуночных планшетов, содержащих клетки-мишени). После определения репортерного гена массив фагов можно разбить на подгруппы еще раз и повторно провести скрининг до тех пор, пока не идентифицируют фаг, который содержит интернализующий лиганд. В противоположном варианте специалисты в данной области должны принимать во внимание, что набор может содержать множество клеточных типов, которые можно подвергнуть скринингу с одной или более фаговыми библиотеками, каждая из которых может также включать множество репортерных генов (если это желательно). В соответствии с этим может быть проведена быстрая идентификация тех клеток, которые интернализуют бактериофаг и/или библиотеки, которые содержат интернализующие лиганды для специфического типа клетки. Применение как множества библиотек фагов, так и множества клеточных типов должно позволить применить высокоэффективный метод для одновременного определения подгрупп библиотек, которые содержат лиганды для конкретных клеточных типов. Наборы для связывающих биомолекул известны науке и, следовательно, могут быть адаптированы для применения в методологии скрининга фагов настоящего изобретения, смотри, например, РСТ WO 95/11755, заявка РСТ №WO 95/35505, патент США №4591570. Кроме того, для иммобилизации фага или клеток для высокоэффективного скрининга могут быть применены биосенсоры, функционирующие на основе сродства, такие как Biacore instrument, продаваемый Biacore AB, Uppsula, Швеция.
Скрининг in vivo может быть выполнен сходно со способами для органов-мишеней или ксенотрансплантатов опухолей с применением пептидов, экспонируемых фагом (Pasqualini et al., Nature Biotech. 25:542-546, 1997; Pasqualini et al., Nature 380:364-366, 1996), за исключением того, что органы или опухоли проверяют на экспрессию репортерного гена, вместо того, чтобы проверять на присутствие фага. Вкратце, библиотеку фагового дисплея вводят животным, обычно мышам, внутривенно и образцы органов или опухолей тестируют через 48-96 ч после введения на наличие функции репортерного гена. Опухолевые клетки можно культивировать в селективных условиях или отсортировывать с помощью проточной цитометрии или другого метода для обогащения клетками, которые экспресcируют трансдуцированный ген фага. Последовательности, кодирующие лиганд, могут быть амплифицированы из отобранных клеток, как описывалось выше. Как и в скрининге in vitro, для получения наиболее эффективных лигандов для доставки генов могут быть использованы повторные циклы инфицирования и повторный скрининг как таковой или в сочетании с увеличенной жесткостью скрининга.
Специфичность может быть также проверена in vitro с применением панелей линий клеток-немишеней и клеток-мишеней и определения экспрессии трансдуцируемого гена фага. Исследование конкуренции со свободным лигандом или нейтрализующим антителом к лиганду или к рецептору применяют для подтверждения специфичного входа фага посредством лиганд-рецепторного комплекса. В противоположном варианте можно создать гиперэкспрессию клонированного рецептора для лиганда в клеточной линии, которая не экспрессирует этот рецептор в обычных условиях. Интернализация фага и экспрессия в стабильных трансфектантах, экспрессирующих рецептор, но не в родительской клеточной линии указывает на специфичность лиганда для его рецептора на клетках, несущих рецептор.
Лиганды, которые идентифицируют как лиганды для направленной доставки генов, применяя описанную здесь стратегию селекции, могут быть дополнительно протестированы на специфичность по экспрессии репортерного гена в клетках и тканях-мишенях или немишенях. Лиганд может быть также протестирован множеством методов для доставки генов, таких как лиганд/полилизин/ДНК комплексы (Sosnowski et al., J. Biol. Chem. 272:33647-33653, 1996) или перенастроенной доставки гена аденовируса (Goldman et al., Cancer Research 57:1447-1451, 1997).
Специфичность лиганда для направленной доставки в противоположном варианте может быть определена in vivo путем анализа биологического распределения с применением одного из описанных здесь репортерных генов, такого как люцифераза. Через различные промежутки времени мышей, с введенным лигандом, экспонирующих фаг, забивают и ткани тестируют на присутствие фага в тканях-немишенях с помощью иммуногистохимии, ферментного анализа, с помощью которого определяют активность репортерного продукта, и тому подобное.
III. Применения
Описываемые здесь методы разработаны для отбора кДНК, Fab-фрагментов, SFV, случайных пептидов и тому подобное для выявления новых лигандов. Они могут быть также использованы для селекции мутантных версий и версий с перетасованными генами известных лигандов на предмет способности к направленной доставке.
Эти лиганды могут обладать повышенной эффективностью трансдукции (измеряемой по увеличению процента инфицированных клеток, экспрессирующих репортерный ген); повышенной экспрессией репортерного гена (измеряемой по интенсивности экспрессии репортерного гена) в трансдуцированных фагом клетках; повышенной специфичностью трансдукции для клеток-мишеней (измеряемой по специфичности лиганда); повышенной стабильностью лиганда (измеряемой по способности направлять лиганд in vivo к опухолевым клеткам); повышенным сродством к рецептору (например, путем снятия необходимости димеризации для димеризующихся лигандов); могут снимать необходимость в кофакторах (например, разработка варианта FGF, который связывается с высоким сродством с рецептором FGF, но не с гепарином); измененной специфичностью в отношении к подтипам рецепторов (например, вариант FGF, реагирующий только с одним из четырех рецепторов FGF).
Лиганды, идентифицированные описываемыми здесь методами, могут быть применены в качестве агентов направленной доставки терапевтических агентов к клеткам или тканям. Например, терапевтический ген может быть включен в геном фага и доставлен к клеткам посредством фага, несущего на своей белковой оболочке лиганд для доставки генов.
Термин "трансдуцируемый ген", как это применяется здесь, относится к гену, кодирующему выявляемый продукт в клетке-мишени. Предпочтительно, трансдуцируемый ген является терапевтическим геном. Термины "терапевтическая нуклеиновая кислота" и "терапевтический ген" описывают любую молекулу нуклеиновой кислоты, используемую в контексте изобретения, которая производит лечебное действие, обычно путем модификации транскрипции или трансляции. Это включает, но не ограничивается этим, следующие типы нуклеиновых кислот: нуклеиновые кислоты, кодирующие белок, рибозим, антисмысловую нуклеиновую кислоту, ДНК, предназначенную для образования триплексных молекул, нуклеиновые кислоты, связывающие белок и малые нуклеотидные молекулы. По существу, продуктом терапевтического гена может быть ДНК или РНК. Эти генные последовательности могут быть последовательностями естественного или рекомбинантного происхождения. Терапевтическая нуклеиновая кислота может быть применена для осуществления генной терапии в виде замены дефектного гена, за счет кодирования терапевтического продукта, такого как TNF, или за счет кодирования цитотоксической молекулы, в особенности фермента, такого как сапорин. Терапевтическая нуклеиновая кислота может кодировать весь ген или его часть и может действовать путем рекомбинации с уже имеющейся в клетке ДНК, замещая тем самым дефектную часть гена. Она может также кодировать часть белка и осуществлять свое действие путем ко-супрессии продукта гена.
Как обсуждалось выше, терапевтический ген функционально связан с избранным промотором и необязательно функционально связан с другими элементами, участвующими в транскрипции, трансляции, локализации, стабильности и тому подобное.
Терапевтическая нуклеотидная композиция настоящего изобретения составляет от приблизительно 20 пар оснований до приблизительно 100000 пар оснований в длину. Предпочтительно молекула нуклеиновой кислоты составляет от приблизительно 50 пар оснований до приблизительно 50000 пар оснований в длину. Более предпочтительно молекула нуклеиновой кислоты составляет от приблизительно 50 пар оснований до приблизительно 10000 пар оснований в длину. Еще более предпочтительна молекула нуклеиновой кислоты от приблизительно 50 пар оснований до приблизительно 4000 пар оснований в длину.
Предлагаемые здесь бактериофаги могут применяться для лечения и предотвращения различных заболеваний, синдромов и гиперпролиферативных расстройств, таких как рестеноз, другие заболевания гладкомышечных клеток, опухоли, такие как меланомы, варианты рака яичников, нейробластомы, птеригии, вторичное помутнение хрусталика и тому подобное. Применяемый здесь термин "лечение" обозначает любой способ, при котором симптомы состояния, расстройства или заболевания улучшаются или изменяются каким-либо другим благоприятным образом. Лечение также охватывает фармацевтическое применение композиций настоящего изобретения. Применяемый здесь термин "улучшение" симптомов конкретного расстройства относится к любому их ослаблению, постоянному или временному, продолжительному или преходящему, которое может быть отнесено к или ассоциированно с введением композиции.
В некоторых осуществлениях композиции настоящего изобретения могут быть применены для лечения зависимых от ангиогенеза заболеваний. При этих заболеваниях рост сосудов является избыточным или способствующим нежелательному росту других тканей за счет обеспечения снабжением кровью. Эти заболевания включают ангиофиброму, артериовенозные мальформации, артрит, атеросклеротические бляшки, неоваскуляризацию трансплантированной роговицы, позднее заживление ран, диабетическую ретинопатию, грануляцию, обусловленную ожогами, гемангиомы, гемофилические узлы, гипертрофические рубцы, неоваскуляризированную глаукому, несрастающиеся переломы, синдром Osler-Weber, псориаз, пиогенную гранулему, ретролентальную фиброплазию, склеродерму, плотные опухоли, трахому и сращение сосудов.
За счет торможения образования сосудов (ангиогенеза) нежелательный рост может быть заторможен или остановлен, обеспечивая тем самым облегчение заболевания. В нормальном сосуде его просвет выстилает единственный слой эндотелиальных клеток, и для роста сосуда требуется пролиферация эндотелиальных и гладкомышечных клеток.
Фаги настоящего изобретения могут быть также применены для лечения опухолей. При этих заболеваниях клеточный рост избыточен или не контролируем. Опухоли, подходящие для лечения в контексте настоящего изобретения, включают, но не ограничиваются этим, опухоли молочной железы, глиомы, меланомы, рак предстательной железы, гепатомы, саркомы, лимфомы, лейкемии, опухоли яичников, тимомы, нефромы, рак поджелудочной железы, рак прямой кишки, рак головы и шеи, рак желудка, рак легкого, мезотелиомы, миелому, нейробластому, ретинобластому, рак шейки матки, рак матки и сквамозно-клеточную карциному кожи. Для такого лечения выбирают лиганды для связывания с рецепторами клеточной поверхности, которые обычно предпочтительно экспрессируются в опухолях.
За счет доставки композиций настоящего изобретения нежелательный рост клеток может быть заторможен или остановлен, что обеспечивает тем самым облегчение заболевания. Применяемые здесь методы специфически направляют, убивают или останавливают пролиферацию опухолевых клеток, содержащих рецепторы для лиганда на своих поверхностях.
Фаги могут быть также применены для лечения или предотвращения атеросклероза и стеноза, процесса и состояния, сопровождающие ангиопластику, при вторичной закупорке артерий. В целом, лечение атеросклероза включает расширение стенозированного просвета сосуда, обеспечивающего больший ток крови и оксигенацию дистально расположенной ткани. К сожалению, эти процедуры продуцируют нормальное заживление ран сосудистой сети, приводя к рестенозу. Из трех компонентов нормального ответа сосуда на повреждение, тромбоз, эластичной тяги и пролиферации гладкомышечных клеток, антитромботические агенты/ингибиторы тромбоцитов и стенты (устройства для реконструкции просвета сосудов) сосудов эффективно борются, соответственно, с острым/подострым тромбозом и эластичной тягой. Однако, ни один из существующих вариантов терапии не способен оказывать влияние на ремоделирование сосудов, обусловленное пролиферацией гладкомышечных клеток при повреждении, выделением ими внеклеточного матрикса и последующим образованием неоинтимы. Соответственно, для доставки терапевтических нуклеиновых кислот или белков, которые тормозили бы рестеноз, мог бы быть использован фаг.
Ответ на повреждение возникает также и при других вмешательствах, таких как баллонная ангиопластика коронарных и периферических сосудов с или без вставления стента; каротидные эндартеректомии; трансплантаты вен; и синтетические трансплантаты периферических артерий и артериовенозные шунты. Хотя временная динамика ответа на повреждение определена недостаточно хорошо, если ответ можно подавить за короткое время (приблизительно 2 недели), достигается улучшение в течение длительного времени.
Последующие примеры предлагаются как иллюстрирующие изобретение, но не ограничивающие его.
Примеры
Пример 1
Модифицированные фаговые векторы для трансдукции в клетки млекопитающего
Производят вставку кассеты для экспрессии у млекопитающего в фаговый или фагемидный вектор и применяют ее для определения опосредуемого лигандом входа фага с помощью экспрессии репортерного гена в клетках млекопитающего. Для трансдукции в клетки млекопитающего модифицируют нитчатый фаговый вектор типа 3 с помощью вставки экспрессирующей GEP кассеты, состоящей из промотора транскрипции CMV млекопитающего, гена белка зеленой флуоресценции из pEGFP-N1 (Clontech; Palo Alto, CA), терминатора транскрипции гормона роста быка и сигнала полиаденилирования, для создания вектора MEGFP3 (см. фиг. 1А). Кассета для экспрессии у млекопитающего включает также точку начала репликации SV40 вслед за промотором CMV. Сходные конструкции для отслеживания входа и последующей экспрессии геномов фагов в клетках млекопитающего конструируют из других известных фаговых или фагемидных векторов, включая pCANTAB 5 Е (Pharmacia Biotech; Piscataway, NJ) или М13, типа 3 или 33, для слияния гена III (смотри Кау et al., Phage Display of Peptides and Proteins: A Laboratory Manual, Academic Press, 1996; McConnell et al., Mol. Divers. 1: 165-176, 1996) и вектор М13, типа 8 или 88, для слияния гена белка VIII (Roberts et al., Methods Enzymol. 257:68-82, 1996; Markland et al., Gene 109:13-19, 1991).
Пример 2
Конструирование содержащих FGF2
фаговых векторов дисплея
В следующих примерах фаг, содержащий на своей поверхности FGF2, используют для связывания с рецептором FGF2 на клетках млекопитающего для интернализации. Ген FGF2 субклонируют в модифицированный вектор типа 3 фага М13, MEGFP3, для создания фагового дисплея лиганда MF2/1G3 (см. фиг. 1В). Вектор MEGFP3 был предварительно модифицирован кассетой экспрессии у млекопитающего, созданной для экспрессии репортерного гена GFP, предназначенного для отслеживания трансдукции в клетки млекопитающего под действием фага. Другие векторы включают pCANTAB 5 E (Pharmacia Biotech; Piscataway, NJ) или М13, типа 3 или 33, для слияний гена III (см. Кау et al., Phage Display of Peptides and Proteins: A Laboratory Manual, Academic Press, 1996; McConnell et al., Mol. Divers. 2:165-176, 1996). Сходным образом, FGF2 клонируют в вектор М13, типа 8 или 88, для слияния с геном белка VIII (Roberts et al., Methods Enzyme 1. 267:68-82, 1996; Markland et al., Gene 209:13-19, 1991).
Для облегчения клонирования ген FGF2 амплифицируют с помощью ПЦР с применением олигонуклеотидных праймеров, содержащих подходящие сайты рестрикции эндонуклеазами в фаговом векторе гена III или генов VIII. Как показано с помощью иммуноблоттинга с использованием антител против FGF2 (фиг. 2) и ELISA (твердофазным иммуноферментным анализом, ТИФА) (фиг. 3), полученные фаги экспрессируют FGF2 на своей поверхностной оболочке.
Для определения слитого FGF2-pIII с помощью иммуноблоттинга используют экстракты с эквивалентными фаговыми титрами очищенного фага FGF2 и контрольного фага (MEGFP3), выделенных электрофорезом в полиакриламидном геле и перенесенных на нитроцеллюлозу. FGF2 и слитый FGF2 фаг определяют с помощью моноклонального антитела против FGF2 (Transduction Labs; Lexington, KY) и конъюгированного с HRP (пероксидазой хрена) второго антимышиного антитела (American Qualex; San Clemente, CA) с хемолюминесцентной окраской. В экстракте очищенного в хлористом цезии фага FGF2 выявляется одна белковая полоса с подвижностью, соответствующей приблизительно 80 кДа. Это приблизительно соответствует ожидаемому размеру слитого белка FGF2-pIII (FGF2 (18 кДа), слитый с pIII (движущимся ≈ как 60 кДа)). Очистку в CsCl проводят для отделения от фаговых частиц любого связанного нековалентно слитого белка FGF2.
Связывание фага, содержащего слитый FGF2, с рецептором FGF2 оценивают с помощью ТИФА, в котором рекомбинантный рецептор FGF2 присоединен к твердой фазе, а в качестве первичного антитела обнаружения используют антитело против фага. Вкратце, фаги захватываются поликлональной антисывороткой кролика против FGF2, связанной с лункой планшета. Для выявления связанных фагов использовали конъюгированное с HRP антитело против М13 (Pharmacia Biotech; Piscataway, NJ). Если при использовании для захвата фагов антитела против фага наблюдается одинаковая ОП в случае контроля (MEGFP3) и FGF2-фага (MF2/1G3), то это свидетельствует о внесении в планшет эквивалентного количества фаговых частиц (фиг. 3А). На фиг. 3В повышенная ОП указывает на присутствие FGF2 на MF2/1G3 FGF2-фаге.
Пример 3
Конструирование линии клеток-мишеней
Для повышения чувствительности способа оценки трансдукции с помощью содержащего лиганд фагового дисплея линию клеток-мишеней трансфецировали плазмидой, сконструированной для экспрессии большого Т-антигена вируса SV40 (т.е. pSV3neo). Эта плазмида содержит также ген лекарственного отбора, такой как ген неомицинфосфотрансферазы (nео), который обеспечивает устойчивость к антибиотику G418 стабильно трансфецированных клеток млекопитающего. После трансфекции линии клеток-мишеней плазмидной ДНК с помощью стандартных методов (т.е. копреципитации СаРO4) клетки высевают и культивируют в среде, содержащей G418 до появления колоний, устойчивых к лекарству. Колонии размножают для определения синтеза Т-антигена SV40 с помощью иммуноблоттинга или иммунопреципитации с использованием подходящего антитела. Примерами экспрессирующих Т-антиген линий клеток-мишеней служат: ВОS (ВНК с SV40 Т-АГ) для скрининга вариантов FGF; HOS-116 (HCT116 с SV40 Т-АГ) для скрининга пептидов направленной доставки в карциному прямой кишки человека; AOS-431 (A431 с SV40 Т-АГ) для скрининга вариантов FGF (все родительские клеточные линии могут быть получены из АТСС, Manassas, VA).
Пример 4
Связывание и интернализация экспрессирующих FGF2 фагов
Экспрессирующие FGF2 фаги определяют также по высокоаффинному связыванию с рецептором и интернализации клетками, содержащими рецептор, анализируемых с помощью иммунолокализации и флуоресцентной микроскопии (Hart, J. Biol. Chem. 269:12468-12474, 1994; Barry et al., Nature Med. 2:299-305, 1996; Li, Nature Biotech. 25:559-563, 1997).
Клетки млекопитающего инфицируют экспрессирующим FGF2 фагом в условиях, которые блокируют вхождение в клетки фага М13 дикого типа, за исключением того, что хлорихин не применяется (Barry et al., см. выше). Фаг добавляют непосредственно к клеткам при титрах ≤1010 CFU/мл (колониеобразующих единиц) в ЗФР с 0,1% БСА или другими подходящими блокирующими агентами и инкубируют при 37°С или на льду в течение по меньшей мере 1 ч. Клетки затем интенсивно отмывают PBS, фиксируют 2% параформальдегидом и повышают проницаемость их мембран с помощью обработки 100% метанолом при комнатной температуре в течение 10 мин. Клетки инкубируют с кроличьим антителом против М13 (Sigma; St. Louis, МО) в ЗФР/БСА в течение 1 ч. Первичное антитело выявляют с помощью антикроличьего антитела, меченного фикоэритрином (Life Technologies (Gibco BRL); Rockville, MD). Связанные с поверхностью клетки (инкубация на льду) или интернализованные (инкубация при 37°С) фаги определяют флуоресцентной микроскопией.
Пример 5
Трансдукция в клетки млекопитающего фагового дисплея лиганда FGF2
Фаговый дисплей FGF2 (MF2/1G3) и идентичный фаг, не содержащий ген FGF2 (MEGFP3), сравнивают по способности к опосредуемой рецептором интернализации и экспрессии репортерного гена в клетках COS. Фаги инкубируют с клетками в течение 4 ч при 37°С в DME (модифицированной по Дульбекко среде Игла, Life Technologies (Gibco BRL); Rockville, MD), содержащей 2% БСА (бычий сывороточный альбумин) в качестве блокирующего агента. После промывки для удаления несвязанных фагов клетки возвращают в инкубатор еще на 72 ч. Трансдукцию измеряют подсчетом позитивных по GFP аутофлуоресцирующих клеток. Как показано на фиг. 4В, фаговый дисплей FGF2 обеспечивает приблизительно в 10 раз более высокую эффективность трансдукции по сравнению с контрольным фагом, что указывает на то, что экспонированный на поверхности фаговых частиц лиганд FGF2 приводит к опосредуемым рецептором связыванию и интернализации фага с последующей экспрессией фагового репортерного гена. О специфичности опосредуемой FGF2-фагом трансдукции свидетельствует эффективное ингибирование трансдукции избытком свободного FGF2 (2 мкг/мл) (фиг. 4В). Низкий уровень неспецифического захвата и трансдукции контрольным фагом (MEGFP3) не меняется в присутствии избытка FGF2.
Важно показать, что контрольный фаг MEGFP3 обладает равной с фаговым дисплеем способностью к трансдукции в клетки млекопитающего при наличии подходящей мишени. Для сравнения способности к трансдукции FGF2-фага и контрольного фага для трансфекции клеток COS с помощью авидин-биотин-FGF2 метода направленной доставки использовали эквивалентные титры каждого из фагов. В этом методе биотинилированный FGF2 контактирует с клетками и используется для захвата фаговых частиц путем добавления авидина и биотинилированного антитела против фага. Связывание фаг/FGF2/клетка проводят на льду, несвязанный фаг удаляют промывкой, клетки возвращают в инкубатор при 37°С и трансдукцию оценивают через 72 ч. Как видно на фиг. 4А, нет существенной разницы в трансдукции между FGF2-фагом и контрольным фагом в случае, когда FGF2 присоединен к фагу через авидинбиотиновый мостик. В этом случае биотинилированный FGF2 находится в избытке по отношению к FGF2, экспонированному на фаговой поверхности, в результате чего можно ожидать, что интернализация происходит в основном благодаря биотинилированному FGF2. Эти данные демонстрируют опосредуемую специфическим рецептором трансдукцию в клетки млекопитающего нитчатым фагом, генетически экспонирующим лиганд для направленной доставки (FGF2).
Пример 6
Конструирование репортерного гена и гена устойчивости к лекарству в векторах фагового дисплея
В фагемидном векторе гена III, таком как pCANTAB 5E, с помощью стандартных методов (Sambrook et al., Molecular Cloning: A Laboratory Manual, Cold Spring Harbor Press, 1989) клонируют экспрессионную кассету GFP, состоящую из гена GFP (Cormack et al., Gene 175:33-37, 1996) под контролем промотора CMV (цитомегаловируса), гена неомицинфосфотрансферазы под контролем промотора раннего гена SV40 и точки начала репликации SV40. Полученный фаг обозначен как рmаМ13.
Такой же фагемидный геном, содержащий также FGF2-3, слитый с геном III, обозначен как pFGF-maM13. Сходные конструкции получают также с фагом М13, типа 3 и 33, и фагемидными и фаговыми векторами гена VIII. Рекомбинантный фаг, экспонирующие FGF2 на оболочке и несущие кассеты экспрессии у млекопитающего, включая точку начала репликации SV40, получают высвобождением фагемида с помощью М13К07 (или подходящего вспомогательного фага) при добавлении к клеткам COS, как описано выше. Экспрессию GFP определяют с помощью флуоресцентной микроскопии, флуориметрии или цитометрии через 48-96 ч после добавления фагов. Устойчивые к лекарству клетки отбирают с помощью G418.
Пример 7
Селекция экспрессирующих FGF2 фагов из смешанной популяции
Библиотеку случайных или неизвестных последовательностей в фаговом дисплее М13 соединяют с фагом pFGF-maM13. Смесь используют для инфицирования клеток COS, как описано выше. Клетки интенсивно промывают для удаления неспецифически связанных фагов. Клетки рассевают через 48-96 ч в разведении от 1 до 10 и выращивают в присутствии G418 для селекции только тех клеток, которые получили трансдуцированный фагом ген. В другом варианте клетки, экспрессирующие GFP, выделяют проточной цитометрией при длине волны возбуждения 488 и длине волны испускания 510.
Экстрагируют ДНК из резистентных к G418 клеток и амплифицируют последовательность FGF2. Праймеры амплификации содержат последовательности, комплиментарные последовательностям фага, расположенным с обеих сторон от последовательности FGF2 в кодирующей ген III последовательности. Определение последовательностей FGF2 в отобранных клетках COS, инфицированных смесью фагов, когда фаг pFGF-maM13 разведен по меньшей мере как 1:10000 фаговой библиотекой случайных последовательностей, показывает работоспособность метода.
Пример 8
Идентификация вариантов FGF2 для усовершенствованной доставки гена
С помощью метода перетасовки генов, описанного Stemmer (см. выше), создают библиотеку перетасованных мутантов FGF2. Ген FGF2 амплифицируют с помощью ПЦР и фрагментируют обработкой ДНКазой 1. Фрагменты вновь объединяют с помощью ПЦР в отсутствие праймеров. Вновь собранный ген разрезают подходящими ферментами рестрикции и клонируют в фаговый вектор М13 таким образом, чтобы мутанты FGF сшивались с геном белка оболочки pIII с сохранением рамки. Фаговый вектор содержит репортерный ген GFP, управляемый промотором CMV, и точку начала репликации SV40. Несколько индивидуальных фаговых клонов секвенируют для подтверждения того, что в среднем во время процесса повторной сборки образовалось по 3 мутации на фаг. Полученную фаговую библиотеку мутаций GF2 амплифицируют стандартными способами. Линию клеток-мишеней BOS (BHK с Т-АГ) инкубируют с библиотекой таким образом, чтобы каждый из членов библиотеки находился при по меньшей мере 10 m.o.i. В соответствии с этим 1011 фагов, представляющих 106 копий 105 индивидуальных фаговых типов, вносят к 105 клеток. Фаги инкубируют с клетками в ЗФР с 2% сывороткой плодов телят в течение 1-3 ч, после чего несвязанные фаги удаляют интенсивной промывкой ЗФР. Добавляют среду и клетки возвращают в инкубатор при 37°С для обеспечения интернализации фагов.
Пример 9
Скрининговые библиотеки для лигандов доставки генов
Если источник желаемого лиганда неизвестен, в качестве отправной точки для скрининга библиотеки кДНК используют библиотеки случайных пептидов или библиотеку кДНК из плаценты. Библиотеку амплифицируют в фаге mаМ13-33 путем инфицирования DH5αF’ (или другого подходящего хозяина) бактерий, выращивания в культуре в течение ночи при 37°С и выделения фага из культуральной среды с помощью стандартных методов. Библиотека кДНК, содержащая 105 членов, включает каждый из членов в 106 копиях при типичном фаговом титре 1011 колониеобразующих единиц на мл. Количество используемых для инфицирования фагов зависит от сплошности библиотеки.
Проводят скрининг завершенной фаговой библиотеки mаМ13 с помощью ткани-мишени или линии клеток. Скрининг может быть проведен in vitro или in vivo. Критериями положительного “попадания” служат такие условия, как необходимые для фага способность связываться, интернализовываться, транслоцироваться в ядро, сбрасывать оболочку, реплицироваться и экспрессировать геномную ДНК, содержащую репортерный ген, в клетке-мишени. Таким образом отбирают только трансдуцированные клетки-мишени либо по экспрессии GFP и сортировке клеток, либо по резистентности к лекарству. Скрининг проводят непосредственно с клетками-мишенями без предварительного скрининга или обогащения. Обогащение по связыванию с клеткой проводят в случае, если не обнаружены попадания при исходном скрининге. Предварительный скрининг для отбраковки фагов, которые связывают неспецифические белки клеточной поверхности, проводят для снижения неспецифических попаданий или тогда, когда имеется слишком много исходных попаданий. Проводят инфицирование, по меньшей мере, 107 клеток, по меньшей мере, 1011 фагами. Клетки инкубируют, по меньшей мере, в течение 2 ч в ЗФР и интенсивно промывают, как описано Barry (Barry et al., Nature Med., 2:299-305, 1996). Клетки инкубируют в среде при 37°С в течение 48-96 ч и отбирают в присутствии соответствующего лекарства (например, G418) в течение 7-14 дней или до тех пор, пока резистентные колонии не становятся видны под микроскопом. Резистентные к лекарству колонии объединяют и отобранные кДНК амплифицируют и вновь субклонируют в фаговом векторе mаМ13-33 с помощью ПЦР и стандартных методов молекулярной биологии. В другом варианте скринингу подвергают индивидуальные колонии. Репрезентативные клоны фага секвенируют для идентификации потенциальных лигандов доставки генов. Для снижения сложности отобранных клонов проводят повторные циклы инфицирования и селекции. В последних случаях скрининга для отбора наиболее высокоэффективных лигандов для доставки генов, из обнаруженных при начальном скрининге, используют более жесткие условия скрининга, такие как повышенные концентрации лекарства селекции, сортировки FACS или отбора наиболее сильно флуоресцирующих клеток.
Скрининг in vivo проводят с помощью методов, описанных ранее Pasqualini для направленной доставки к органам или ксенотрансплантатным опухолям с помощью экспонируемых фагом пептидов (Pasqualini, R. et al., Nature Biotechnology, 15, 542-546 (1997); Pasqualini, R. et al., Nature, 380, 364-366 (1996)), исключая органы и опухоли, анализируемые на экспрессию репортерного гена вместо наличия фага. Фаговую библиотеку вводят мышам внутривенно и через 48-96 ч определяют функцию репортерного гена в образцах органов или опухоли. Опухолевые клетки культивируют в присутствии G418 или подвергают сортировке FACS (по экспрессии GFP) для обогащения клеток, экспрессирующих трансдуцированный фагом ген. Последовательности, кодирующие лиганд, амплифицируют из отобранных клеток с помощью ПЦР, как описано для скрининга in vitro. Как и при скрининге in vitro, для получения наиболее эффективных лигандов доставки генов проводят повторные циклы при повышенной жесткости условий скрининга.
Пример 10
Идентификация лигандов направленной доставки к карциноме прямой кишки
В этом примере библиотеку олигонуклеотидов, кодирующих случайные пептиды, вводят в геном нитчатого фага таким образом, что пептиды оказываются слитыми с С-концами интактных белков pIII оболочки. Применяют фаговый вектор типа 3, содержащий лишь одну копию гена pIII, в результате чего весь образующийся белок pIII должен быть слит с пептидом. Таким образом, на каждом фаге экспонируется 3-5 копий пептида. Для упрощения скрининга сложность библиотеки сначала снижают за счет скрининга на интернализируемые пептиды. Пептиды, облегчающие интернализацию фага в клетки линии карциномы прямой кишки, выделяют с помощью нескольких циклов селекции. Фаговую библиотеку инкубируют с клетками в течение 3 ч при комнатной температуре. Клетки интенсивно промывают ЗФР. Для инактивации фагов, адгезированных на клеточной поверхности, применяют краткую обработку протеиназой К. Клетки затем лизируют и клеточные лизаты инкубируют с бактериальным хозяином. Интернализованный фаг амплифицируют в бактерии и подвергают 4 или более повторным циклам экспозиции с клетками и выделения интернализованного фага. Из полученной подбиблиотеки интернализируемого фага получают репликативную форму ДНК. Случайные последовательности подбиблиотеки субклонируют в фаговый вектор MEGFP2, содержащий копию репортерного гена (GFP) под управлением CMV и точки начала репликации SV40. MEGFP2 отличается от MEGFP3 (фиг. 1А) тем, что экспрессионная кассета ori-CMV/EGFP организована в обратном порядке, за EGFP следует сайт полиаденилирования SV40 вместо поли-А гормона роста быка, и вектор содержит три дополнительных сайта Ncol в экспрессионной кассете ori-CMV/EGFP.
Полученную модифицированную CMV-GFP подбиблиотеку инкубируют с линией реципиентных клеток HOS-116 с тем, чтобы каждый член библиотеки был представлен, по меньшей мере, 106 раз. Так, например, библиотеку с 105 членами добавляют к ≈ 105 клеток с титрами ≈ 1×1011, что обеспечивает для каждого члена m.o.i., по меньшей мере, 10. Фаги инкубируют с клетками в ЗФР с 2% плодной телячьей сывороткой в течение 1-3 ч, после чего несвязанные фаги удаляют интенсивной промывкой ЗФР. Добавляют среду и возвращают клетки в инкубатор при 37°С для обеспечения интернализации фагов.
Пример 11
Выделение последовательностей, кодирующих лиганд, в репликативном фаге
Через 72 ч после добавления фаговой библиотеки клетки-мишени извлекают из планшета и подвергают сортировке по экспрессии GFP с помощью FACS. Выделенные позитивные клетки лизируют и обрабатывают протеиназой К. Белки экстрагируют фенолом/хлороформом (раствор 24:1), а нуклеиновые кислоты осаждают этанолом. Полученную ДНК ресуспендируют в буфере для нуклеазы S1 и обрабатывают нуклеазой S1 для удаления нерепликативной одноцепочечной фаговой ДНК. ДНК вновь экстрагируют фенолом/хлороформом, осаждают и ресуспендируют в буфере для полимеразной цепной реакции. В другом варианте из позитивных клеток получают ядра, обрабатывают протеиназой К и лизируют прямо в смесь для ПЦР. В обоих случаях параллельно обрабатывают равное количество негативно отсортированных клеток и используют для реакции ПЦР для контроля обогащения репликативной фаговой ДНК (двухцепочечной) по сравнению с нерепликативной фаговой ДНК (одноцепочечной) с тем, чтобы в образцах негативных по GFP клеток не происходила амплификация фаговой ДНК. Если амплифицируется фаговая ДНК из негативно отобранных клеток, то условия для удаления одноцепочечной фаговой ДНК должны быть ужесточены, например, за счет усиления обработки нуклеазой S1 или дополнительной очистки ядер при очистке с помощью ступенчатого градиента очистки сахарозы или других известных способов очистки ядер (для удаления нерепликативных фагов). Может возникнуть необходимость в эмпирическом выявлении этих условий для каждой используемой линии клеток и библиотеки.
Фаговую последовательность (последовательности), кодирующую пептидный лиганд, амплифицируют с помощью подходящего набора олигонуклеотидных праймеров, примыкающих к вставкам последовательности ДНК, кодирующей лиганд, слитой с геном pIII. Эти амплифицированные вставки вновь клонируют в родительском фаговом векторе для создания подбиблиотеки фага, обогащенной теперь лигандами доставки генов к линии карциномных клеток-мишеней прямой кишки. Для определения сложности производят секвенирование репрезентативных клонов. Процесс скрининга повторяют до снижения степени сложности, достаточной для идентификации одного или более лигандов доставки.
Пример 12
Второе поколение скрининга пептидов
Отбирают пептиды, идентифицированные ранее на основе случайной библиотеки с помощью процедур панорамирования или скрикинга с помощью обычных векторов и методов панорамирования (смотри Кау et al., Phage Display of Peptides and Proteins: A Laboratory Manual, Academic Press, 1996). ДНК, кодирующую отобранные пептиды, вставляют в виде слитой с белком оболочки pIII части в вектор MEGFP2, содержащий кассету репортерного гена GFP.
Проводят скрининг библиотеки случайных пептидов в фаге М13 на пептиды, которые связываются и интернализуются в гиперпродуцирующей рецептор FGF линии клеток Flg37 (стабильном трансфектанте FGFR1 клеток L6 (имеющихся в АТСС; Manassas, VA, полученной от Dr. Murray Korc, UCI; Irvine, CA). Кроме того, такая клеточная линия может быть легко создана специалистами. После 5 циклов панорамирования и повторного скрининга сложность библиотеки снижается таким образом, что 80% фагов оказываются представленными единственным гибридом пептида-pIII. Полученный пептид FL5 имеет последовательность FVPDPYRKSR (SEQ ID NO: 1). Ту же самую библиотеку подвергают скринингу с клетками Flg37 путем селекции инфекционных фаговых частиц, которые интернализуются и связываются с ядрами и белками цитоскелета. С помощью этого скрининга после 5 циклов панорамирования идентифицированы 2 преобладающие пептидные последовательности, FN5A, CGGGPVAQRC (43%) (SEQ ID NO:2) и FN5B, CLAHPHGQRC (34%) (SEQ ID NO: 3).
Олигонуклеотиды, кодирующие 3 пептида, вставляют в вектор MEGFP в виде слитых с белком оболочки pIII частей. Полученные фаги используют для трансфекции клеток COS. Фаги добавляют к клеткам и инкубируют в течение ночи при 37°С в среде с 10% плодной телячьей сывороткой. Клетки промывают для удаления несвязанных фагов и возвращают в инкубатор. Трансдукцию оценивают подсчетом экспрессирующих GFP аутофлуоресцирующих клеток через 72 ч после добавления фагов. В результате получено (фиг. 5), что с FL5 эффективность трансдукции была выше, чем с FN5A или FN5B, что свидетельствует о большей эффективности FL5 в качестве лиганда транспорта генов в этой системе. Метод скрининга трансдукции в качестве скрининга второго поколения способен обеспечивать дифференцировку пептидов, отобранных на основе различных вариантов первичного скрининга клеток.
Из представленного выше должно быть понятно, что хотя конкретные варианты осуществления изобретения были здесь описаны для иллюстративных целей, различные модификации могут быть произведены без отклонения от духа и объема изобретения. Таким образом, изобретение не ограничено ничем, кроме прилагаемой формулы изобретения.
Изобретение относится к генной инженерии, конкретно к технологии фагового дисплея, и может быть использовано для отбора бактериофагов, экспрессирующих пептиды и белки, которые связываются с рецепторами клеточной поверхности и интернализуются. Бактериофаг или подгруппу бактериофагов идентифицируют путем контактирования библиотеки бактериофагов, экспрессирующих множество пептидов, с клеткой или рядом клеток млекопитающего, где геном бактериофага несет, по меньшей мере, один ген, кодирующий определяемый продукт. Способ выделения клеток млекопитающего, которые интернализовали бактериофаг, присутствующий в библиотеке бактериофагов, включает контактирование библиотеки бактериофагов, экспрессирующих множество пептидов, с клеткой млекопитающего, где бактериофаг несет ген, кодирующий определяемый продукт, определение продукта и выделение клеток млекопитающего, которые экспрессируют продукт. Способ селекции бактериофага, экспрессирующего гетерологичный пептид, который связывается с рецептором клеточной поверхности млекопитающего и интернализуется, проводят путем контактирования библиотеки бактериофагов, экспрессирующих множество пептидов, с клеткой млекопитающего, где бактериофаг несет ген, кодирующий определяемый продукт. Определяют продукт и выделяют ген бактериофага, кодирующий пептид, из клеток млекопитающего, экспрессирующих продукт. Изобретение позволяет идентифицировать in vitro или in vivo пептидные или белковые лиганды, способные к интернализации, 12 н. и 52 з.п. ф-лы, 8 ил.
| WO 9220791, 26.11.1992 | |||
| WO 9534648, 21.12.1995 | |||
| BARRY M.A | |||
| et al | |||
| Toward cell-targeting gene therapy vectors: selection of cell-binding peptides from random peptide-presenting phage libraries | |||
| Nature medicine, vol.2 | |||
| no | |||
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| АВТОМАТ ДЛЯ ПУСКА В ХОД ПОРШНЕВОЙ МАШИНЫ | 1920 |
|
SU299A1 |
| МАРРИ Р | |||
| и др | |||
| Биохимия человека | |||
| - М.: МИР, 1993, т | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
Авторы
Даты
2004-08-20—Публикация
1998-08-28—Подача