Изобретение относится к области молекулярной биологии, молекулярной генетике и биотехнологии и может быть использовано для целей генотерапии в медицине, а также в сельском хозяйстве и в промышленной биотехнологии для ген-специфического сайленсинга тех генов, экспрессия которых способствует развитию тех или иных заболеваний или нарушает процесс наработки необходимого продукта.
Известны разные способы изменения генетических свойств организма. Одни из них предполагают повреждение самого гена. К их числу относится так называемый "нокаут" генов. Эти подходы предполагают внесение повреждений (мутаций) в выбранном гене в клетках зародышевого пути или в стволовых клетках и поэтому далеко не всегда могут использоваться для изменения свойств развившегося организма [L. V. Varga, S. Toth, I. Novak, A. Falus, Immunol. Lett. , 1999, vol. 69, p. 217; J. Osada, N. Maeda, Methods Mol. Biol., 1998, vol. 110, p. 79].
В последние годы вызывает повышенный интерес другой подход к изменению генетических свойств организма - использование РНК-интерференции, приводящей к ген-специфическому сайленсингу, при котором ген не повреждается, а изменяется его регуляция [M.K. Montgomery, A. Fire, Trends in Genetics, 1998, vol. 14, p. 255; P. Sharp, Genes & Development, 1999, vol. 13, p. 139]. РНК-интерференция может использоваться для ген-специфического сайленсинга на любых стадиях развития, в том числе и для изменений свойств взрослого организма. Повышенное внимание к исследованиям РНК-интерференции связано с тем, что они позволили случайно обнаружить ранее неизвестные древние механизмы генной регуляции. Физиологическая роль этих механизмов может заключаться в изменении в локальных структурах хромосом, во влиянии на активность транскрипции, на процессинг мРНК, ее транспорт в цитоплазму и на ее стабильность.
К настоящему времени РНК-интерференция, приводящая к ген-специфическому сайленсингу, описана на различных организмах - нематоде, дрозофиле, грибах, растениях.
Известен способ изменения генетических свойств организма, основанный на РНК-интерференции с использованием для этой цели антисмысловой РНК (асРНК), которая комплементарна в антипараллельном направлении мРНК выбранного гена, синтезируется in vitro и вводится в организм [A. Fire, S-Q. Xu, M.K. Montgomery, S.V. Kostas, S.E. Driver, C.C. Mello, Nature, 1998, vol. 391, p. 806].
Описанный способ осуществляют следующим образом:
1. Выбирают ген, активность которого нежелательна;
2. Готовят генетическую конструкцию, в которой данный ген или соответствующая ему кДНК (последовательность, соответствующая мРНК), т.е. природная ДНК, ориентирована в противоположном направлении и находится под контролем нужного промотора. Этим обеспечивается транскрипция незначащей цепи гена. Для получения конструкций используют разнообразные векторы, которые могут содержать последовательности ДНК, важные для селекции трансформанта, для эффективной экспрессии перевернутого гена и для "правильного вписывания" конструкции в хромосомные домены;
3. На полученной конструкции in vitro синтезируют и вводят в организм асРНК с помощью разных методов (электропорация, инъекции, per os).
Существенным недостатком этого способа изменения генетических свойств организма с помощью РНК-интерференции является то, что при использовании конструкций, предназначенных для синтеза асРНК в результате перестроек, может произойти реверсия, т. е. прекратится экспрессия асРНК и начнется синтез последовательности соответствующей цепи мРНК. Т.е. вместо подавления активности выбранного гена можно получить его активирование. Синтез цепи мРНК может также начаться из-за того, что в месте инсерции конструкции могут оказаться последовательности хозяина, имеющие промоторную активность в цепи, соответствующей цепи мРНК. Вероятность таких событий высока.
Наиболее демонстративно высокая вероятность реверсий подтверждена работами с трансгенными организмами. Конструкции при этом вводились с противоположной целью - добиться большей активности какого-либо гена. Однако, реверсии в результате спонтанного активирования транскрипции с противоположной цепи приводили не к увеличению активности гена, а к полному ее подавлению, т.е. к ген-специфическому сайленсингу в результате РНК-интерференции [M. K. Montgomery, A. Fire, Trends in Genetics, 1998, vol. 14, p. 255; P. Sharp, Genes & Development, 1999, vol. 13, p. 139].
В основу предлагаемого изобретения положена задача повышения надежности РНК-интерференции, при которой были бы невозможны реверсии, приводящие к синтезу цепи мРНК на конструкциях, исходно предназначенных для ген-специфичекого сайленсинга.
Предложен способ изменения генетических свойств организма путем РНК- интерференции, приводящей к ген-специфическому сайленсингу выбранного гена с помощью молекул РНК, синтезированных in vitro, при этом используют молекулы РНК, комплементарные в параллельном направлении (пкРНК) мРНК выбранного гена, которые синтезируют in vivo или in vitro на искусственной последовательности ДНК, имеющей зеркально-симметричную последовательность нуклеотидов по отношению к последовательности нуклеотидов гена.
Предлагаемый способ приводит к эффективной РНК-интерференции и ген-специфическому сайленсингу и исключает синтез мРНК, т.к. в конструкциях используется негомологичная искусственная последовательность ДНК.
Предложенный способ осуществляют следующим образом:
1. Выбирают ген, активность которого нежелательна (т.е. она приводит к заболеванию или нарушает биотехнологический процесс);
2. Химически синтезируют искусственную последовательность ДНК, имеющую зеркальное чередование нуклеотидов по отношению к выбранному гену или его части;
3. Готовят генетическую конструкцию, в которой используют разнообразные векторы, содержащие синтезированную ДНК под нужным промотором и другими последовательностями, важными для эффективной экспрессии и для "правильного вписывания" конструкции в хромосомные домены;
4. Конструкцию тем или иным путем вводят в организм для синтеза пкРНК in vivo (трансформация), либо пкРНК синтезируют in vitro на конструкции и вводят в организм с помощью инъекций.
Изобретение поясняется конкретными примерами осуществления способа изменения генетических свойств организма, в которых эти изменения проявляются как изменения фенотипа, и иллюстрируется фигурами, где
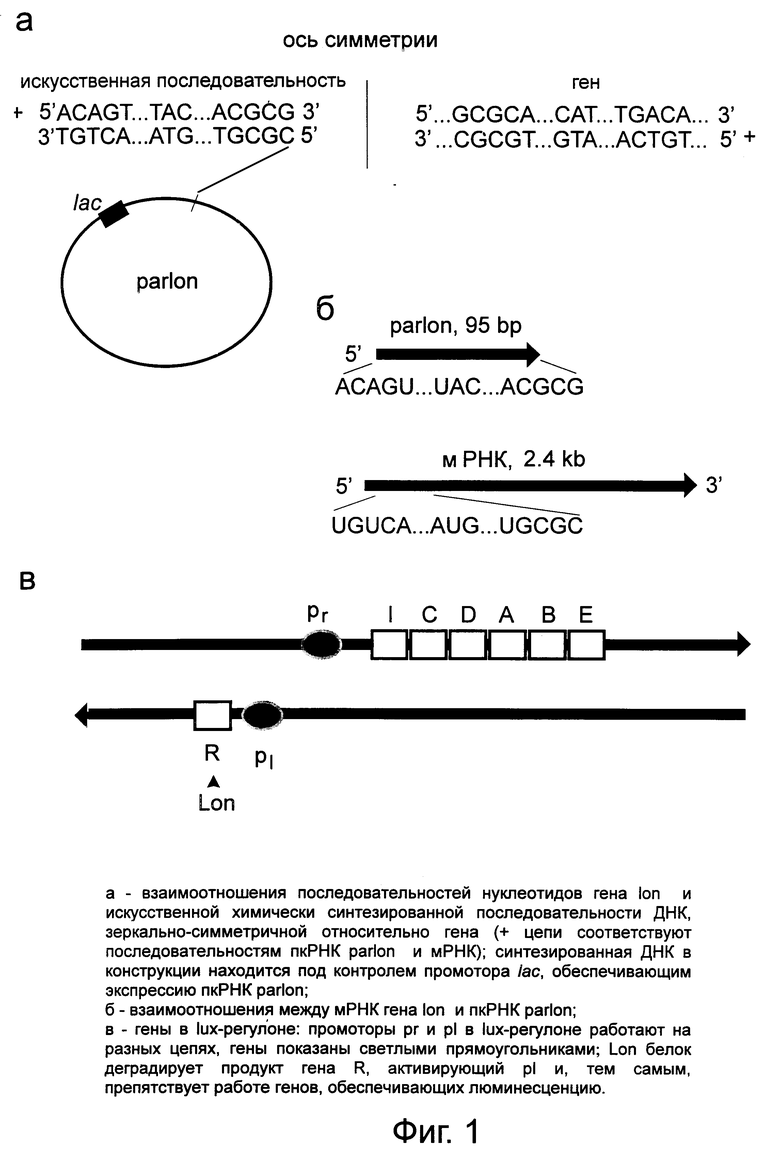
фиг. 1 приводит данные о структуре ДНК-конструкции, содержащей зеркальную последовательность нуклеотидов относительно гена lon E. coli и предназначенной для экспрессии пкРНК;
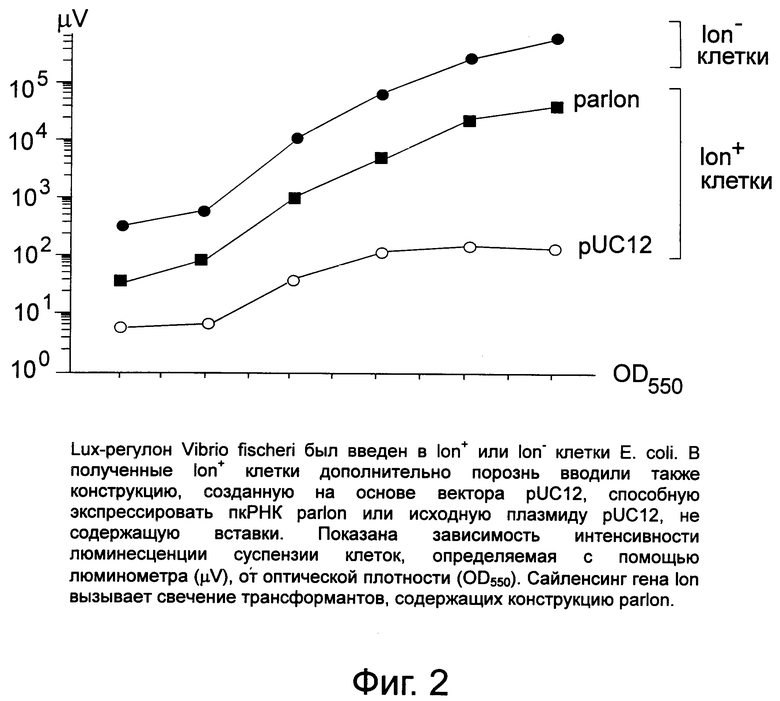
фиг. 2 показывает результаты люминесценции клеток E. coli, которая наблюдается при сайленсинге гена lon в результате экспрессии пкРНК (parlon);
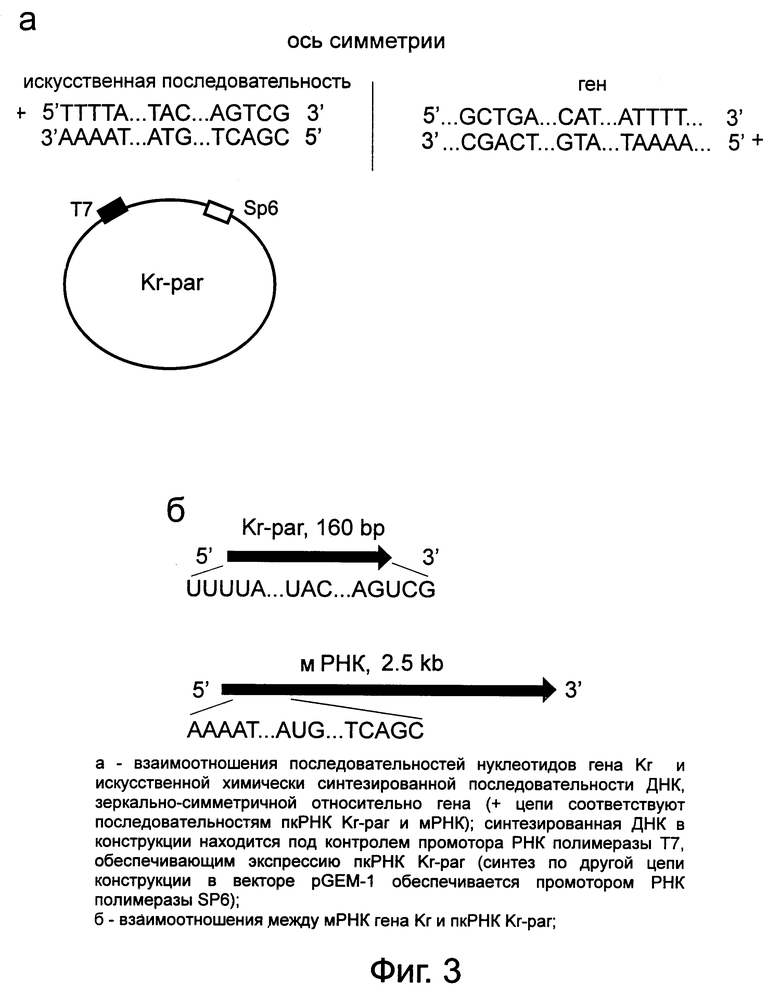
фиг. 3 представляет данные о структуре ДНК-конструкции, содержащей зеркальную последовательность нуклеотидов относительно гена Kruppel дрозофилы и предназначенной для экспрессии пкРНК (Kr-par);
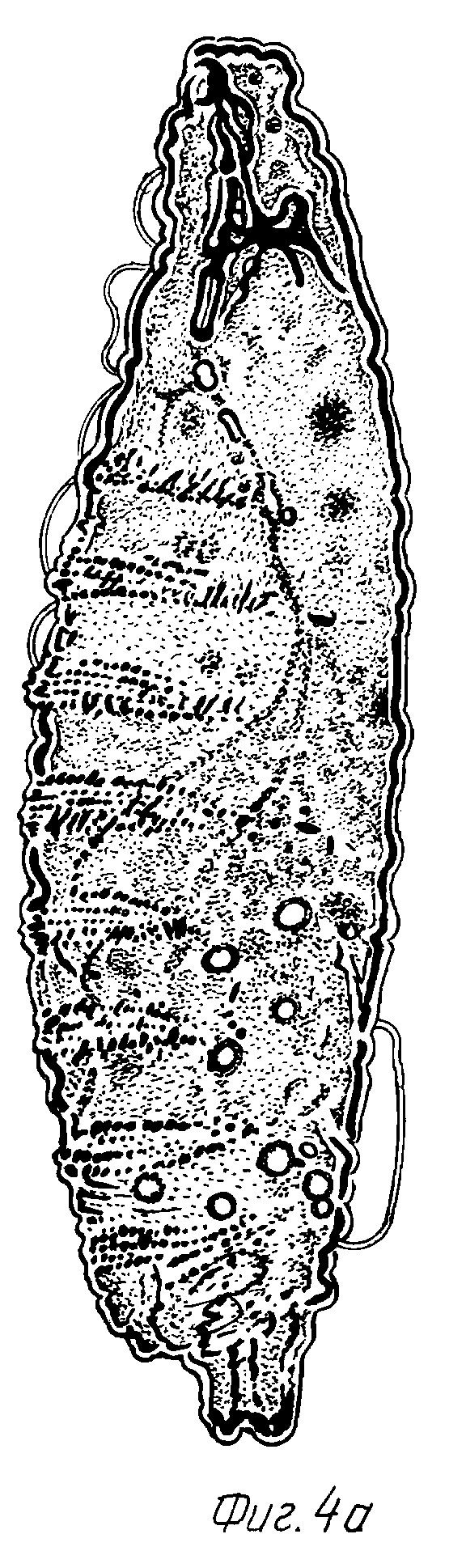
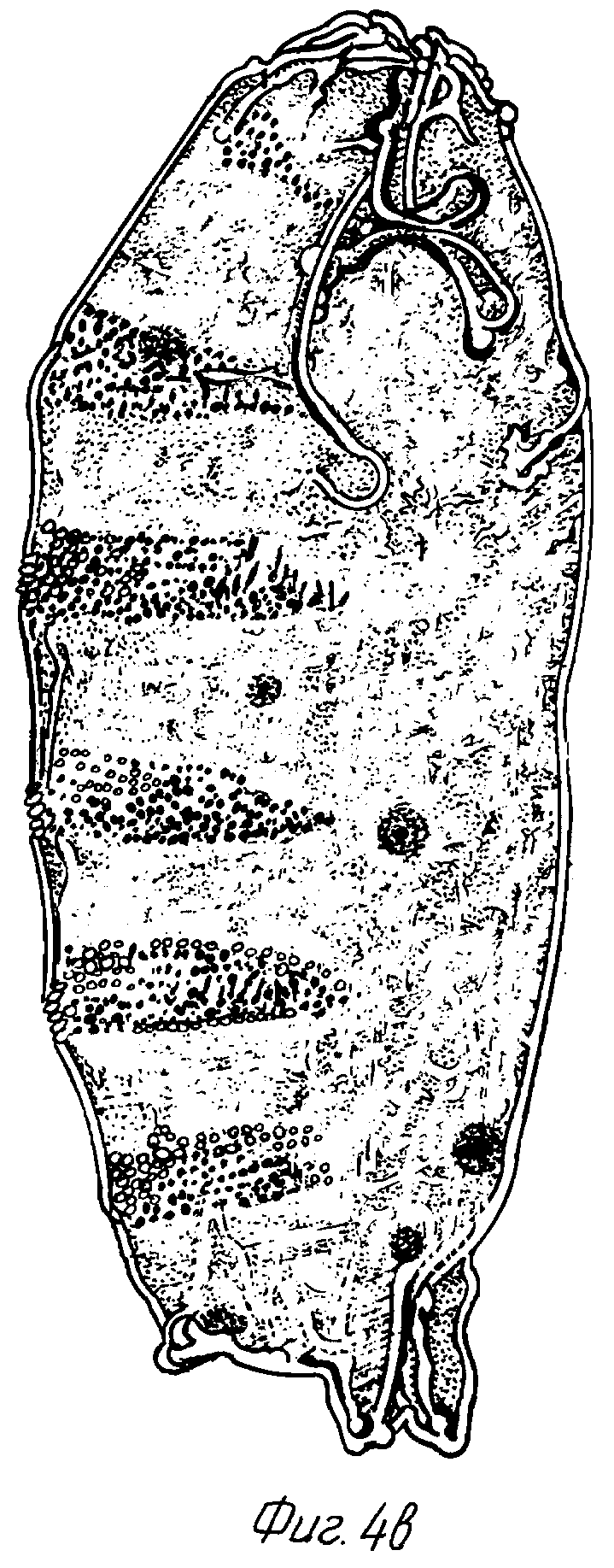
фиг. 4 (а, б, в) показывает фенотипы нормальной личинки дрозофилы и фенокопий Kr, полученных после инъекций пкРНК Kr-par.
Пример 1. РНК-интерференция в клетках Escherichia coli с помощью молекул РНК, комплементарных в параллельном направлении мРНК гена lon, синтезированных in vivo.
Ген lon выбран в качестве модели, поскольку он является одним из ключевых в регуляции многих процессов в клетках E. coli.
Химически синтезирована искусственная последовательность ДНК длиной 95 bp (bp - пара оснований в ДНК или РНК), имеющая зеркально-симметричную последовательность нуклеотидов по отношению к соответствующей области гена lon.
Эта ДНК использована для создания конструкции на основе вектора pUC12, в которой под контролем lac-промотора находится цепь, экспрессирующая пкРНК parlon (фиг. 1 а, б).
Полученная конструкция с помощью трансформации введена в клетки E. coli.
За влиянием пкРНК parlon на активность эндогенного гена lon следят по эффекту последнего на работу lux-регулона, внесенного в клетки E. coli из клеток Vibrio fischeri. Lon-протеаза является негативным регулятором lux-регулона, т. к. она специфически деградирует белок LuxR. Последний в комплексе с автоиндуктором запускает синтез белков, обеспечивающих люминесценцию. Промоторы pr и pl в lux-регулоне работают на разных цепях, гены показаны светлыми прямоугольниками (фиг. 1 в). Активно работающий ген lon вызывает репрессию транскрипции lux-регулона, что фенотипически проявляется в подавлении люминесценции. Напротив, сайленсинг гена lon приводит к увеличению концентрации LuxR и, следовательно, к активации транскрипции lux-регулона, что приводит к заметному усилению свечения клеток. Lux-регулон в составе 16 kb BamHI фрагмента ДНК Vibrio fischeri, был введен в lon+ клетки E. coli K12 AB1157, а также в lon- клетки E. coli K12 AB1899 (lon1).
В полученные lon+ клетки дополнительно порознь вводят также конструкцию, созданную на основе вектора pUC12, способную экспрессировать пкРНК parlon или исходную плазмиду pUC12, не содержащую вставки. Сайленсинг гена lon определяют по возрастанию свечения клеток. Интенсивность люминесценции клеток, экспрессирующих пкРНК parlon, возрастает на несколько порядков по сравнению с контролем, содержащим исходную плазмиду pUC12 (фиг. 2).
При выращивании трансформантов parlon на твердых средах наблюдали развитие "слизистых" колоний, что характерно для lon- фенотипа или сайленсинга гена lon.
Пример 2.
Получение фенокопий Kruppel (Kr) при инъекциях в эмбрионы дрозофилы РНК, комплементарной мРНК в параллельном направлении, синтезированной in vitro.
Kr - гомеотический ген, активный уже в зиготе и контролирующий образование сегментов на ранней эмбриональной стадии развития дрозофилы, выбран в качестве модели, позволяющей наблюдать раннее развитие в многоклеточном организме. Мутанты Kr имеют делеции прилежащих торакальных и передних абдоминальных сегментов. Фенотипически это заметно сразу после развития кутикулы и вылупливания личинок. Мутанты Kr имеют делеции торакальных сегментов и от одного до нескольких абдоминальных сегментов, а иногда также атопически развившиеся дыхальца в передней части тела личинки [E. Weischaus, C. Nusslein-Volhard, H. Kluding, Development, 1984, vol. 104, p. 172]. Таким образом, мутанты Kruppel имеют уникальный фенотип, проявляющийся уже через сутки развития эмбрионов дрозофилы, что удобно для изучения влияния РНК на фенотип. Дополнительным аргументом в пользу выбора данной модели было то обстоятельство, что влияние инъекций антисмысловой РНК Kr было проведено ранее [U. B. Rosenberg, A. Preiss, E. Seifert, H. Jackle, D.C. Knippe, Nature, 1985, vol. 313, p. 703].
Химически синтезируют искусственную последовательность ДНК длиной 160 bp, имеющую симметричную последовательность нуклеотидов по области гена Kr (фиг. 3 а, б). Следует подчеркнуть, что антисмысловые РНК синтезируют на незначащей цепи того же самого гена, тогда как пкРНК может быть синтезирована только на гетерологичной последовательности ДНК, имеющей зеркально-симметричное чередование.
Синтезированную ДНК используют для получения конструкции в векторе pGEM-1, позволяющем с промотора РНК полимеразы T7 вести синтез пкРНК. пкРНК была названа Kr-par, т.к. она комплементарна мРНК гена Kr в параллельном направлении.
Эмбрионы линии Oregon RC инъецируют препаратами пкРНК в область плазмы заднего полюса на стадии синцития и инкубируют под водой при 25oC в течение 18-24 ч. Затем готовят препараты кутикулы и наблюдают развитие сегментов личинок под фазово-контрастным микроскопом.
Обнаружено развитие личинок, имеющих характерный Kr-фенотип. В контрольных экспериментах, после инъекций РНК, синтезированной на противоположной цепи той же конструкции с помощью SP6 РНК полимеразы, наблюдают только развитие нормальных личинок.
Фиг. 4 представляет нормальную личинку (а), а также две личинки, полученные после инъекций препарата Kr-par (б, в). Последние имеют делеции торакальных сегментов и одного или трех брюшных сегментов и эктопически развитое дыхальце в передней части тела личинки, что характерно для фенотипа Kr. Частота появления фенокопий Kr после инъекций РНК Kr-par примерно соответствует таковой после инъекций соответствующей асРНК [U.B. Rosenberg, A. Preiss, E. Seifert, H. Jackle, D.C. Knippe, Nature, 1985, vol. 313, p. 703]. Показано, что в многоклеточном организме, воздействуя пкРНК на экспрессию ключевого гена дифференцировки, получают направленное изменение генетических свойств организма.
Таким образом, обнаружено влияние зеркальных инверсий нуклеотидных последовательностей, тем или иным путем введенных в организм, на его фенотип. Основное преимущество предлагаемого способа состоит в том, что зеркальные последовательности способны обеспечить синтез пкРНК и РНК-интерференцию, но, будучи гетерологичными последовательностями, не могут синтезировать соответствующую мРНК. Поэтому при использовании этого подхода ("палиндромный подход"), в отличие от традиционного способа, использующего асРНК ("антисмысловой подход"), не может произойти реверсия и начаться синтез цепи мРНК.
Изобретением предложен общий подход к изменению генетических свойств организма, основанный на биологических свойствах зеркальных инверсий нуклеотидных последовательностей и реализующийся в РНК-интерференции, приводящей к ген-специфическому сайленсингу. Предлагаемый способ, основанный на обнаруженной высокой и избирательной биологической активности транскриптов с зеркальных инверсий нуклеотидных последовательностей, приводит к изменению фенотипа и может быть использован для целей генотерапии в медицине, а также в сельском хозяйстве и в промышленной биотехнологии для ген-специфического сайленсинга тех генов, экспрессия которых способствует развитию тех или иных заболеваний или нарушает процесс наработки необходимого продукта.

Предложен способ изменения генетических свойств организмов путем РНК-интерференции, приводящей к ген-специфическому сайленсингу выбранного гена с помощью молекул РНК, синтезированных in vitro, при этом используют молекулы РНК, комплементарные в параллельном направлении (пкРНК) мРНК выбранного гена, которые синтезируют in vivo или in vitro на искусственной последовательности ДНК, имеющей зеркально-симметричную последовательность нуклеотидов по отношению к последовательности нуклеотидов гена. Изобретением предложен общий подход к изменению генетических свойств организма, основанный на биологических свойствах зеркальных инверсий нуклеотидных последовательностей и реализующийся в РНК-интерференции, приводящей к ген-специфическому сайленсингу. Изобретение может быть использовано для целей генотерапии в медицине, а также в сельском хозяйстве и в промышленной биотехнологии для ген-специфического сайленсинга тех генов, экспрессия которых способствует развитию тех или иных заболеваний или нарушает процесс наработки необходимого продукта. 1 з.п. ф-лы, 4 ил.
| СПОСОБ ВВЕДЕНИЯ ЧУЖЕРОДНЫХ ГЕНОВ В ГЕНОМЫ ГРАМОТРИЦАТЕЛЬНЫХ МИКРООРГАНИЗМОВ, ПЛАЗМИДНЫЙ ВЕКТОР РКС47М ДЛЯ ВВЕДЕНИЯ ЧУЖЕРОДНЫХ ГЕНОВ В ГЕНОМЫ ГРАМОТРИЦАТЕЛЬНЫХ МИКРООРГАНИЗМОВ, СПОСОБ КОНСТРУИРОВАНИЯ ПЛАЗМИДНОГО ВЕКТОРА РКС47М | 1995 |
|
RU2092556C1 |
| US 5565358 A, 15.10.1996 | |||
| WO 9429461 A1, 22.12.1994. | |||
Авторы
Даты
2001-04-10—Публикация
1999-12-09—Подача