Изобретение относится к молекулярной биологии и медицине и рассматривает способ частичного секвенирования для определения мутаций в последовательностях ДНК. Обнаружение мутаций путем частичного секвенирования происходит с использованием олигонуклеотидного микрочипа, в ячейках которого иммобилизованы специально выбранные последовательности синтетических олигонуклеотидов определенной длины.
Изобретение включает оригинальную методику выбора и модификации олигонуклеотидов, иммобилизованных в ячейках микрочипа, и стыковых олигонуклеотидов, а также методику регистрации, анализа и интерпретации полученных результатов.
Предшествующий уровень техники
Известен гибридизационный подход для секвенирования ДНК с использованием микрочипа, содержащего полный набор олигонуклеотидов определенной длины [Докл. АН СССР, 303 (1988) 1508-1511; Патент СССР 1794088; Патент СССР 2041261].
Сущность метода заключается в том, что фрагмент ДНК прочно связывается в тех ячейках микрочипа, в которых иммобилизованы олигонуклеотиды, полностью комплементарные участку фрагмента ДНК. Зная последовательность этих нуклеотидов, возможно восстановить последовательность исходного фрагмента или определить положение и тип мутации. Этот подход получил название "секвенирование путем гибридизации на олигонуклеотидном микрочипе".
Известно, что секвенирование ДНК путем гибридизации возможно лишь для фрагментов ДНК ограниченной длины. Например, в случае гибридизации с октануклеотидным микрочипом длина анализируемого фрагмента ДНК не превышает приблизительно 200 нуклеотидов [J. Biomol. Struct. Dyn., 9 (1991) 399-410].
Наиболее очевидный путь развития указанного подхода - увеличение длины олигонуклеотидов в гибридизационной матрице - приводит к тому, что на микрочипе в поле анализа должно поместиться К ячеек (К=4N где N - длина олигонуклеотида), что сделает микрочип очень громоздким.
Известен подход к увеличению эффективности секвенирования с помощью "непрерывной гибридизации встык". Его сущность состоит в том, что олигонуклеотиды длины N иммобилизуют на микрочипе, гибридизуют ДНК с матрицей иммобилизованных олигонуклеотидов, затем вводят короткие флуоресцентно меченные олигонуклеотиды длиной n и проводят гибридизацию, которая в случае образования совершенного дуплекса с ДНК и гибридизации встык к иммобилизованному олигонуклеотиду увеличивает эффективную длину олигонуклеотида на микрочипе до величины N+n [Молекуляр. биология, 27 (1993) 1126-1138].
Повышенная стабильность дуплекса n-олигонуклеотида (т. наз. стыкового олигонуклеотида) с ДНК в случае гибридизации встык обусловлена коаксиальным стэкинг-взаимодействием между N- и n-олигонуклеотидами [Nucleic Acids Res., 17 (1989) 4551-4565; Biochemistry, 29 (1990) 6017-6025; Nucleic Acids Res., 29 (2001) 2303-2313].
При иммобилизации октануклеотидов (N-олигонуклеотидов) на матрицу и гибридизации встык с различными наборами пентануклеотидов (n-олигонуклеотидов) длина секвенируемого с помощью октануклеотидной матрицы фрагмента ДНК увеличивается с 200 до нескольких тысяч нуклеотидов [J. Biomol. Struct. Dyn., 11 (1994) 797-812].
Однако способ реконструкции последовательности ДНК с использованием "непрерывной гибридизации встык" имеет ряд недостатков.
Недостатки
1. Стерические затруднения в геле приводят к тому, что на микрочипе остается множество свободных мест. Стыковые олигонуклеотиды могут гибридизоваться на иммобилизованных N-олигонуклеотидах микрочипа (т. наз. паразитная перекрестная гибридизация), внося ложные сигналы, ухудшая технологические свойства микрочипа (уменьшая рабочий диапазон концентраций неизвестной пробы и надежность восстановления последовательности и снижая точность определения соотношения между нативной и мутантной формами в анализируемом образце).
2. а) Стыковые олигонуклеотиды могут образовывать тандемные структуры (паразитная тандемная гибридизация) на продолжении анализируемой одноцепочечной ДНК и давать ложный сигнал; что также приведет к ошибке в реконструкции ДНК;
б) стыковые олигонуклеотиды могут пристыковываться с другого конца N-олигонуклеотида и также давать ложный сигнал.
3. Разная энергетика AT- и GС-богатых олигонуклеотидов (разные температуры диссоциации) не позволяет осуществлять мониторинг при одной температуре (т.е. проводить одновременное определение всех мутаций) и требует проведения нескольких раундов гибридизации и построения кривых плавления, что усложняет анализ и увеличивает его продолжительность, существенно усложняя аппаратный комплекс для мониторинга.
4. Флуоресцентный метод не позволяет однозначно идентифицировать каждый из 45 пентануклеотидов, используемых для гибридизации встык из-за отсутствия соответствующего числа различающихся по своим параметрам флуоресцентных меток.
В основу изобретения положена задача создания способа частичного секвенирования ДНК для определения мутаций в коротких фрагментах одноцепочечной ДНК с использованием микрочипа, позволяющего:
1) повысить надежность интерпретации результатов для восстановления исходной последовательности ДНК с целью локализации мутации;
2) повысить рабочий диапазон концентраций исследуемой пробы и увеличить соотношение сигнал/шум при анализе;
3) упростить анализ и сократить его продолжительность.
Поставленная задача решается предлагаемым изобретением.
Сущность изобретения
Предлагается способ частичного секвенирования ДНК для определения мутаций в коротких фрагментах одноцепочечной ДНК с использованием микрочипа, включающий:
I. Выбор олигонуклеотидов длины N (N-олигонуклеотидов) для иммобилизации на микроматрицу и олигонуклеотидов длины n (n-олигонуклеотидов) для гибридизации встык к иммобилизованным N-олигонуклеотидам, образующих совершенные дуплексы с анализируемой ДНК, причем
выбор N-олигонуклеотидов для иммобилизации и n-олигонуклеотидов для гибридизации встык осуществляют в соответствии с нижеперечисленными критериями:
а) иммобилизованные последовательности на микрочипе (N-олигонуклеотиды) должны иметь самозакрывающуюся шпилечную структуру для предотвращения паразитной перекрестной гибридизации,
б) n-олигонуклеотиды должны быть несамокомплементарными и для предотвращения возможной паразитной тандемной гибридизации содержать терминатор стэкинга на нестыковом конце,
в) температуры плавления трех вариантов дуплексов, а именно, (1) ДНК - иммобилизованный N-олигонуклеотид, (2) самозакрывающаяся шпилька и (3) n-олигонуклеотиды - иммобилизованный N-олигонуклеотид, должны отвечать неравенству
Тпл(1)>>Тпл(2)>>Тпл(3) [1],
а логика выбора N- и n-олигонуклеотидов следует определенному алгоритму, который использует эмпирическую модель расчета термодинамических параметров ДНК-дуплексов [Biochemistry, 35 (1996) 3555-3562].
Подбор N-олигонуклеотидов для изготовления микрочипа, предназначенного для определения мутаций (аналитического микрочипа), и n-олигонуклеотидов для гибридизации встык с ними осуществляют с использованием микрочипа с теоретически выбранными иммобилизованными N-олигонуклеотидами (тестового микрочипа) путем проведения их гибридизации со смесью флуоресцентно меченных модельной ДНК и каждого из n-олигонуклеотидов в отдельности в условиях выравнивания энергетики AT- и GC-богатых олигонуклеотидов и регистрации результатов гибридизации путем построения кривых плавления, отвечающих термодинамическим переходам образующихся дуплексов, с использованием метода флуоресцентного анализа;
II. Иммобилизацию на микрочип N-олигонуклеотидов, причем
иммобилизацию N-олигонуклеотидов, отобранных в соответствии с п.1, проводят в буферном растворе при значениях рН, ионной силы и температуры, обеспечивающих закрытое состояние шпильки.
III. Гибридизацию анализируемой ДНК и n-олигонуклеотидов с микрочипом, причем
для гибридизации с аналитическим микрочипом используют смесь анализируемой одноцепочечной ДНК и несамокомплементарных стыковых n-олигонуклеотидов, служащих масс-меткой при масс-спектрометрическом анализе или модифицированных введением масс-метки в случае вырожденности их масс, а гибридизацию проводят в условиях выравнивания энергетики AT- и GC-богатых олигонуклеотидов;
IV. Регистрацию результатов гибридизации, позволяющую осуществить интерпретацию полученных результатов в расшифровку мутации, причем
идентификацию n-олигонуклеотидов, образовавших совершенный дуплекс с анализируемой ДНК и пригибридизовавшихся встык к N-олигонуклеотидам, иммобилизованным на аналитическом микрочипе, проводят методом масс-спектрометрии;
V. Интерпретацию результатов гибридизации, причем
реконструкцию последовательности анализируемой ДНК проводят поэтапно, исходя из структур иммобилизованного N-олигонуклеотида, в состав которого входит фрагмент длиной L, образующий совершенный дуплекс с анализируемой ДНК, и n-олигонуклеотида, пригибридизовавшегося к нему встык, образующего совершенный дуплекс с ДНК при гибридизации и выявляемого на основании данных масс-спектрометрии. Положение ячейки аналитического микрочипа определяет структуру N-олигонуклеотида, содержащего L-фрагмент, комплементарный определенному участку анализируемой ДНК, а величина массы информативного пика в масс-спектре, зарегистрированном из этой ячейки, позволяет однозначно идентифицировать n-олигонуклеотид, причем для однозначной идентификации n-олигонуклеотидов в случае вырожденности их структуры используют различные линкеры в качестве масс-меток.
Таким образом определяется последовательность "L+n" в ячейке. Анализ последовательностей иммобилизованных в ячейках микрочипа N-олигонуклеотидов с частичным перекрыванием (метод черепицы) в сочетании с идентификацией пристыковавшихся к ним n-олигонуклеотидов позволяет реконструировать последовательность анализируемой ДНК. Сравнение реконструированных последовательностей ДНК дикого и мутантных типов позволяет однозначно расшифровать мутации.
В качестве флуоресцентной метки n-олигонуклеотидов при построении кривых плавления на тестовом микрочипе используют краситель Техасский красный (Texas Red).
Для введения флуоресцентной метки в модельную ДНК при построении кривых плавления на тестовом микрочипе используют флуоресцеинизотиоцианат (FITC).
В качестве масс-меток для анализа методом масс-спектрометрии используют комбинации стандартных аминолинкеров разной длины, связанных с n-олигонуклеотидами при их синтезе стандартным автоматизированным фосфорамидитным методом.
В качестве терминаторов стэкинга используют FITC, Texas Red или их аналоги или уреидное производное 2'-дезоксирибозы.
Способ предусматривает использование микрочипа, представляющего собой микроматрицу с иммобилизованными N-олигонуклеотидами, имеющими шпилечную структуру, фрагмент каждого из которых комплементарен константному участку анализируемого гена в области мутаций.
Микрочип с иммобилизованными N-олигонуклеотидами, на котором проводят подбор N-олигонуклеотидов, n-олигонуклеотидов и условий гибридизации с модельной ДНК путем определения температур плавления дуплексов с использованием флуоресцентного анализа и термодинамических параметров с тем, чтобы температуры плавления дуплексов отвечали неравенству [1], является тестовым.
Микрочип с иммобилизованными N-олигонуклеотидами, подобранными на тестовом микрочипе, является аналитическим. Анализ результатов гибридизации на аналитическом микрочипе проводят с использованием метода масс-спектрометрии.
Способ предусматривает использование микрочипа, специально приготовленного для решения конкретных задач, содержащего небольшое количество ячеек с иммобилизованными последовательностями, подобранными для каждого конкретного случая, с целью максимизировать чувствительность и рабочий диапазон метода.
Раскрытие сущности изобретения
Предлагаемый способ определения мутаций в гене предполагает вначале изучение того участка гена, в котором будут определяться мутации, используя литературные данные. При этом выделяют участки, содержащие мутации.
Для определения мутаций используют микрочипы двух типов - тестовый и аналитический.
Микрочип представляет собой микроматрипу полиакриламидного геля, содержащую ячейки с иммобилизованными олигонуклеотидами.
Используя эмпирическую модель расчета термодинамических параметров ДНК-дуплексов [Biochemistry, 35 (1996) 3555-3562], выбирают возможные N-олигонуклеотиды и n-олигонуклеотиды, которые должны участвовать в образовании совершенных дуплексов с константными участками анализируемой ДНК и соответственно с ее вариабельными участками, в которых локализованы все возможные мутации ("горячие точки" гена), причем от количества мутаций зависит количество необходимых стыковых олигонуклеотидов. В случае, когда мутации стоят близко, и расстояние между ними меньше, чем длина комплементарной к ДНК последовательности N-олигонуклеотида (без учета длины шпилечной части), другая (соседняя) мутация (недетектируемая в данной ячейке), попадала бы в зону гибридизации N-олигонуклеотида и вносила бы дополнительную нестабильность, так как возможно образовывался бы мисматч, дестабилизирующий дуплекс N-олигонуклеотида с ДНК. Решение проблемы состоит во введении в N-олигонуклеотид одного или нескольких универсальных оснований (преимущественно нитроиндола) напротив мутации в ДНК и в перерасчете всей термодинамической схемы олигонуклеотидов согласно NN1 модели с учетом термодинамических коэффициентов для универсальных оснований [см. Biochemistry, 35 (1996) 3555-3562].
Синтезируют выбранные N-олигонуклеотиды, которые предназначены для иммобилизации на тестовом микрочипе. Синтезируют модельные флуоресцентно меченные ДНК-мишени и флуоресцентно меченные n-олигонуклеотиды, флуоресцентные метки в которых различны.
N-Олигонуклеотиды имеют самозакрывающуюся шпилечную структуру, их иммобилизуют на матрицу в условиях, обеспечивающих закрытое состояние шпильки. Преимущество использования иммобилизованного N-олигонуклеотида в виде самозакрывающейся шпильки состоит в том, что такая структура позволяет подавить паразитную перекрестную гибридизацию.
Стыковые n-олигонуклеотиды несамокомплементарны и для предотвращения возможной паразитной тандемной гибридизации содержат терминатор стэкинга на нестыковом конце.
Температуры плавления (Тпл) трех вариантов дуплексов, а именно (1) ДНК - иммобилизованный N-олигонуклеотид, (2) самозакрывающаяся шпилька и (3) n-олигонуклеотиды - иммобилизованный N-олигонуклеотид, должны отвечать условию Тпл(1)>>Тпл(2)>>Тпл(3) [1], т.е. термодинамика шпильки должна быть подобрана так, чтобы она была полностью открыта при гибридизации с ДНК, полностью закрыта в ее отсутствии и не гибридизовалась с n-олигонуклеотидами в закрытом состоянии. При образовании совершенного дуплекса с ДНК шпилька должна оставаться открытой, и стыковой n-олигонуклеотид должен гибридизоваться встык к концу шпилечного N-олигонуклеотида. Именно в этом случае стэкинг-эффект проявляется с наибольшей силой, и в методе достигается максимальная дискриминация.
Иммобилизованные на тестовом микрочипе N-олигонуклеотиды гибридизуют с флуоресцентно меченными ДНК и n-олигонуклеотидами в условиях выравнивания энергетики AT- и GС-богатых олигонуклеотидов, что обеспечивается использованием уравнивающих буферных растворов.
Варьируя длину N-олигонуклеотидов и конструкцию шпилек, иммобилизованных на тестовом микрочипе, подбирают температуры плавления всех трех типов дуплексов в заведомо нужном узком диапазоне, чтобы соблюдалось приведенное выше неравенство [1] сразу для всех ячеек микрочипа и всех n-олигонуклеотидов смеси.
Плавление олигонуклеотидных дуплексов, иммобилизованых на тестовом микрочипе, проводят с помощью управляемого термостолика, а регистрацию плавления проводят с помощью автоматизированного флуоресцентного микроскопа, оборудованного высокочувствительной ПЗС-камерой, подключенной к компьютеру. Массив экспериментальных данных, полученных в ходе плавления, обрабатывают с помощью компьютерной программы, которая вычисляет температуры плавления и термодинамические параметры дуплексов.
Подобранные таким путем N-олигонуклеотиды, обеспечивающие выполнение указанного выше неравенства, используют для приготовления аналитического микрочипа.
Затем проводят определение мутации в анализируемой ДНК. Для этого аналитический микрочип гибридизуют со смесью подготовленной пробы и n-олигонуклеотидов, которые также выбраны с использованием тестового микрочипа и предназначены для анализа методом масс-спектрометрии. Олигонуклеотиды, различающиеся по молекулярным массам, используют без дополнительной модификации, тогда как в случае вырожденности масс их модифицируют введением стандартных аминолинкеров.
По окончании гибридизации микрочип отмывают от неспецифически связавшихся олигонуклеотидов и нагревают в присутствии масс-спектральной матрицы для разрушения дуплексов n-олигонуклеотидов, пригибридизовавшихся встык к N-олигонуклеотидам, с анализируемой ДНК. Высвободившиеся стыковые n-олигонуклеотиды регистрируют с помощью масс-спектрометрии. Положение ячейки аналитического микрочипа определяет структуру N-олигонуклеотида, содержащего фрагмент, комплементарный определенному участку анализируемой ДНК, а величина массы информативного пика в масс-спектре, зарегистрированном из этой ячейки, позволяет однозначно идентифицировать n-олигонуклеотид.
При гибридизации смеси мишени и стыковых олигонуклеотидов только один из них гибридизуется встык к иммобилизованному олигонуклеотиду с образованием совершенного дуплекса. Возможно также образование мисматчевого дуплекса стыкового олигонуклеотида с раскрытой частью шпильки, что, однако, не мешает детекции.
Определение мутаций проводят, сравнивая последовательности n-олигонуклеотидов, комплементарных вариабельным участкам ДНК дикого типа и исследуемой пробы.
Предлагаемое изобретение иллюстрируется следующими примерами и фигурами, на которых
фиг.1 изображает принципиальную схему гибридизации ДНК и стыковых олигонуклеотидов с иммобилизованными олигонуклеотидами, как обладающими, так и не обладающими шпилечной структурой;
фиг. 2 представляет масс-спектры пентануклеотидов: пригибридизовавшегося встык к иммобилизованному олигонуклеотиду и "паразитного";
фиг.3 представляет принцип функционирования аналитического микрочипа;
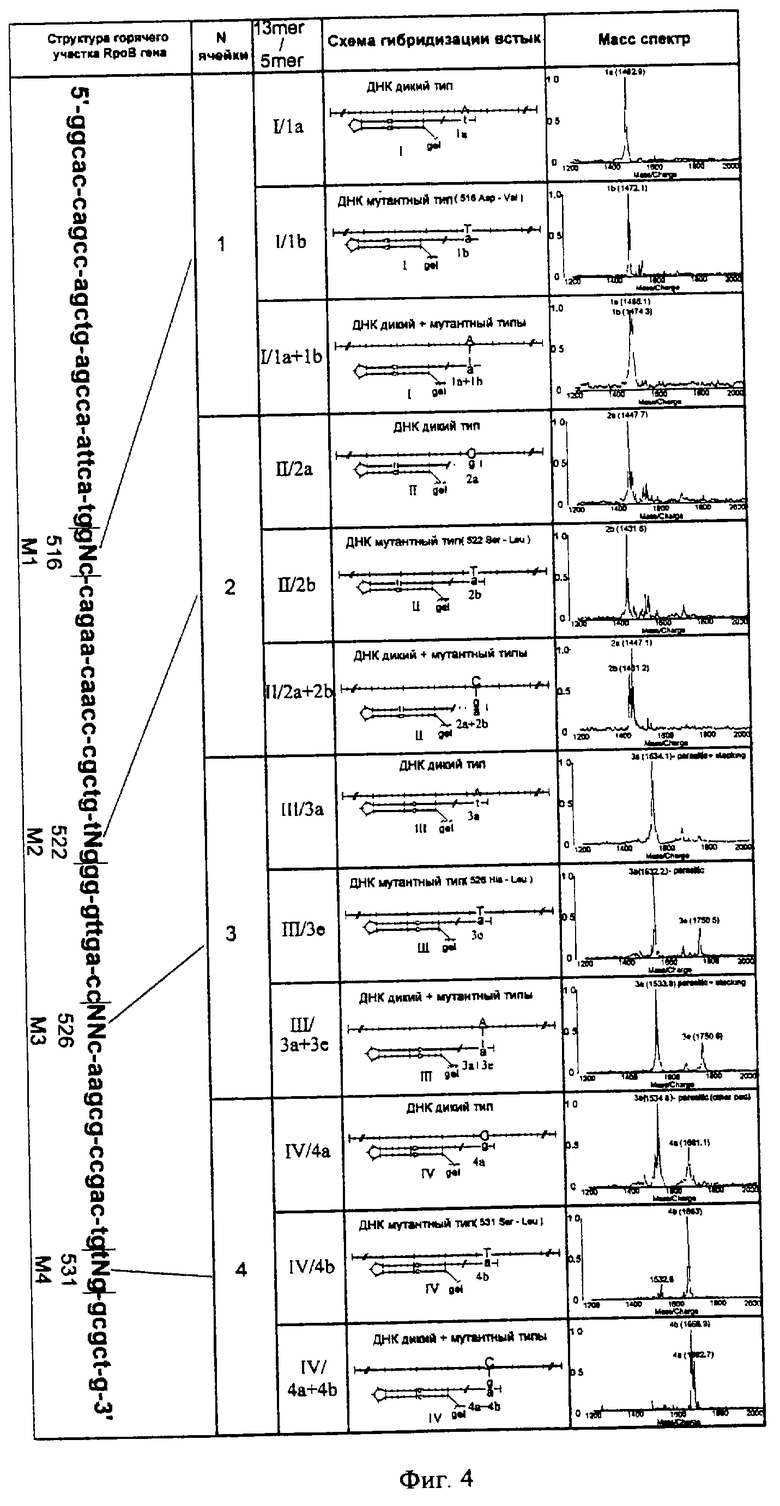
фиг. 4 представляет результаты определения точечных мутаций в rроВ гене микобактерии Mycobacterium tuberculosis.
Пример 1. Использование самозакрывающихся шпилечных структур для повышения надежности определения мутации в анализируемой ДНК.
Теоретически выбранные 5-, 10- и 21-членные олигонуклеотиды и нуклеотиды-мишени синтезируют на ABI-394 ДНК-РНК синтезаторе (Applied Biosystems, Foster City, CA, USA). 3'-Аминогруппу вводят в 10- и 21-членные олигонуклеотиды с помощью 3' -аминомодификатора С7 CPG (Glen Research Corp., Sterling, VA, USA) в процессе синтеза. Олигонуклеотиды очищают с помощью обращенно-фазовой высокоэффективной жидкостной хроматографии на С-18 Nucleosil (Sigma, St Louis, МО, USA) или с помощью электрофореза в денатурирующем полиакриламидном геле.
Масс-спектры регистрируют на масс-спектрометре Kompact MALDI 4 (Kratos Analytical, Chestnut Ridge, NY, USA).
Микрочипы, содержащие 10- и 21-членные олигонуклеотиды, иммобилизованные в полиакриламидном геле, изготавливают по стандартной технологии [Proc. Natl Acad. Sci. USA, 93 (1996) 4913-4118].
Микрочипы для масс-спектрального мониторинга изготавливают на электропроводящей кремниевой подложке размером 50•10•0,3 мм, они состоят из 2 гелевых ячеек размером 1•1•0,02 мм, которые отстоят друг от друга на 1,5 мм. Каждая гелевая ячейка фрагментирована и состоит из массива микроячеек размером 0,1•0,1•0,02 мм.
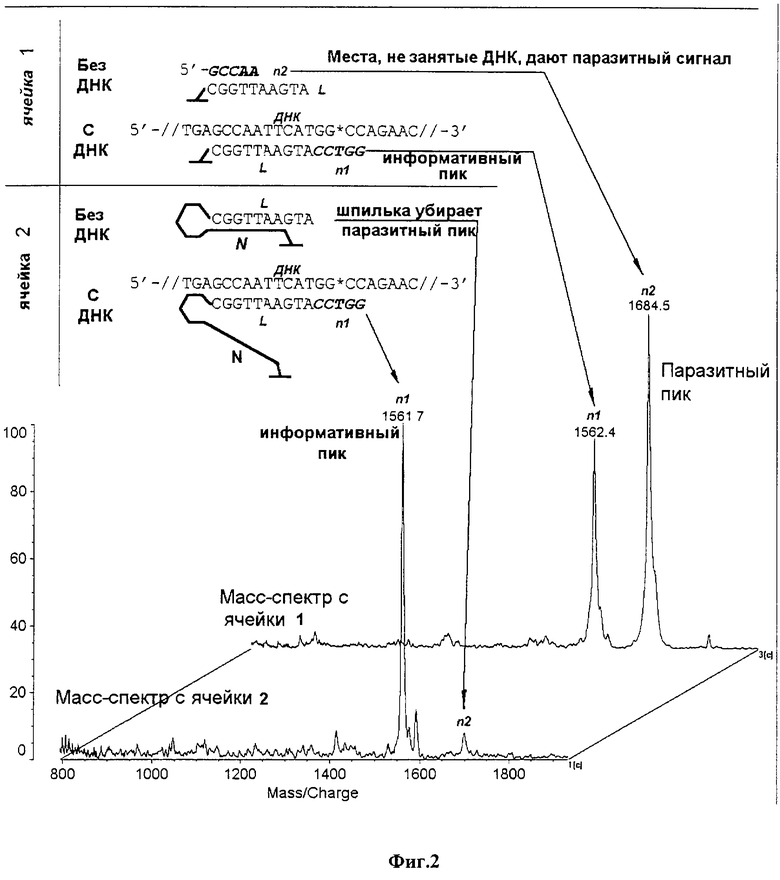
Модельный микрочип содержит 2 ячейки (фиг.1). В одной из них иммобилизован обычный (линейный) 10-членный олигонуклеотид (L), а во второй - самозакрывающаяся шпилька (21-членный олигонуклеотид, N), оба олигонуклеотида способны образовывать дуплексы одинаковой протяженности (10 п.о.) с анализируемой ДНК. Обе ячейки гибридизуют с ДНК, содержащей мутацию в зоне стэкинга 5-членного n-пентануклеотида с иммобилизованным L- или N-олигонукдеотидом в 1 М ТЕАА буфере при рН 7,0 и 15oС в течение суток. Перед гибридизацией микрочип с гибридизационным раствором прогревают при 60oС в течение 5 минут, после чего температуру резко понижают до 15oС.
После гибридизации микрочип отмывают от неспецифически связавшихся олигонуклеотидов при 5oС в течение 10 минут. Далее на каждую ячейку микрочипа наносят 0.7 мкл раствора масс-спектральной матрицы (0,3% цитрат аммония и насыщенный раствор 2-амино-5-нитропиридина (2A5NP, Sigma)) и микрочип инкубируют в герметичных условиях при точке росы и 55oС в течение 20 мин. Затем микрочип быстро высушивают, помещают в масс-спектрометр и с каждой ячейки регистрируют масс-спектры (фиг. 2). С целью проверки надежности и точности предлагаемого способа прямого масс-спектрального анализа микрочипа олигонуклеотиды из ячеек элюируют на стандартный слайд для анализа фирмы KRATOS. Масс-спектры получают в линейном режиме с импульсной экстракцией и регистрацией отрицательных ионов.
Вследствие стерических затруднений в геле в гибридизации с ДНК участвует 5% иммобилизованных олигонуклеотидов (фиг.1, цифры условные), причем в соответствии с разной устойчивостью дуплексов (см. выше, неравенство [1]) гибридизация со шпилькой сопровождается ее раскрытием. Затем микрочип гибридизуют со смесью стыковых n-олигонуклеотидов, один из которых (информативный, n1) комплементарен ДНК в зоне мутации и стыкуется с иммобилизованной последовательностью; его содержание соответствует содержанию пригибридизовавшейся ДНК (не более 5%) в обеих ячейках.
Другой n-олигонуклеотид смеси (n2) способен гибридизоваться с иммобилизованным L-олигонуклеотидом, не участвовавшим в гибридизации с ДНК (до 95%, ячейка 1), или со свободной половиной иммобилизованной шпильки (N-олигонуклеотидом), раскрывшейся в результате гибридизации с ДНК (не более 5%, ячейка 2). Такая паразитная перекрестная гибридизация приводит к появлению "паразитного" пика в масс-спектре. Как видно из приведенной схемы (фиг.1) и экспериментально полученных масс-спектров (фиг.2), паразитный пик превышает по интенсивности информативный пик в случае иммобилизации обычного олигонуклеотида (ячейка 1) и практически отсутствует в ячейке 2, содержащей иммобилизованную шпилечную структуру. Тем самым существенно повышается надежность определения мутации в анализируемой ДНК.
Результаты масс-спектрального анализа микрочипа и слайда совпадают.
Предлагаемый данным изобретением способ был применен к реальной модели - детекции мутаций, приводящих к устойчивости к рифампицину у Mycobacterium tuberculosis.
Основной проблемой, возникающей при лечении туберкулеза, является устойчивость штаммов микобактерий к антибиотикам. Рифампицин является наиболее распространенным препаратом для лечения туберкулеза, поэтому быстрое определение устойчивости к нему имеет большое медицинское и экономическое значение.
Пример 2. Определение мутаций в rроВ гене микобактерий Mycobacterium tuberculosis.
Подавляющее большинство мутаций, вызывающих у микобактерий устойчивость к рифампицину, являются точечными и сосредоточены в достаточно небольшой (~ 80 п. о.) вариабельной области rроВ гена, кодирующего β-субъединицу РНК-полимеразы.
Последовательность этой области гена представлена на фиг.3 и 4, причем мутации M1-М4 локализованы только лишь в четырех "горячих точках", разделенных между собой константными участками.
Определение мутаций предполагает использование двух типов микрочипов - тестового и аналитического.
Первый из них служит для подбора n- и N-олигонуклеотидов, чтобы температуры плавления соответствующих дуплексов отвечали неравенству [I]. Подбор производят с помощью построения кривых плавления на микрочипе с использованием флуоресцентного микроскопа [J. Opt. Technol., 65 (1998) 938-941]. Подобранные таким путем N-олигонуклеотиды используют для приготовления аналитического микрочипа.
Для подбора N- и n-олигонуклеотидов были синтезированы пять 81-членных нуклеотидов-мишеней, содержащие вариабельную часть rроВ гена и соответствующие одному дикому типу микобактерий и четырем мутантным, мутации в которых ответственны за следующие замены аминокислот: 1) 516 Asp-Val, 2) 522 Ser-Leu, 3) 526 His-Leu и 4) 531 Ser-Leu. Для подбора термодинамических параметров методом флуоресцентного анализа и последующего изготовления аналитического микрочипа во все мишени были введены флуоресцентные метки.
Теоретически выбранные 5-членные и 27-членные олигонуклеотиды (n- и N-олигонуклеотиды) и 81-членные нуклеотиды-мишени синтезируют на ABI-394 ДНК-РНК синтезаторе (Applied Biosystems, Foster City, CA, USA). 3'-Аминогруппу вводят в N-олигонуклеотиды с помощью 3'-амино-модификатора С7 CPG (Glen Research Corp., Sterling, VA, USA) в процессе синтеза. Введение FITC-метки в и 81-членные нуклеотиды-мишени и TR-метки в n-олигонуклеотиды осуществляют с помощью стандартного протокола [Haugland,R.P., (1996) Hadnbook of Fluorescent Probes and Research Chemicals, 6th Edn., Molecular Probes Inc., Eugene, OR, USA]. Немеченные и флуоресцентно меченные олигонуклеотиды очищают с помощью обращенно-фазовой высокоэффективной жидкостной хроматографии на С-18 Nucleosil (Sigma, St Louis, МО, USA) или с помощью электрофореза в денатурирующем полиакриламидном геле.
Масс-спектры регистрируют на масс-спектрометре Kompact MALDI 4 (Kratos Analytical, Chestnut Ridge, NY, USA).
Микрочипы для масс-спектрального мониторинга изготавливают на электропроводящей кремниевой подложке размером 50•10•0,3 мм, они имеют линейную упорядоченность, состоят из 4-х гелевых ячеек размером 1•1•0,02 мм, которые отстоят друг от друга на 1,5 мм. Каждая гелевая ячейка была фрагментирована и состояла из массива микроячеек размером 0,1•0,1•0,02 мм.
Стандартный микрочип для флуоресцентного мониторинга состоит из ячеек, закрепленных на стеклянной подложке, размером 0,1•0,1•0,02 мм, расположенных в двумерном массиве и отстоящих друг от друга на 0,2 мм.
Микрочип, содержащий 27-членные олигонуклеотиды, комплементарные константным участкам гена вблизи мутаций, иммобилизованные в полиакриламидном геле, изготавливают по стандартной технологии [Proc. Natl Acad. Sci. USA, 93 (1996) 4913-4118].
Синтетический олигонуклеотид N1 предназначенный для определения мутации Ml (см. фиг.3 и 4), выбирают следующим образом:
1) он имеет структуру 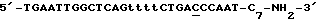 (27 нуклеотидов), в которой фрагмент 5'-TGAATTGGCTCAG-3' (13 нуклеотидов) комплементарен последовательности 3'-ACTTAACCGAGTC-5' (13 нуклеотидов) мишени;
(27 нуклеотидов), в которой фрагмент 5'-TGAATTGGCTCAG-3' (13 нуклеотидов) комплементарен последовательности 3'-ACTTAACCGAGTC-5' (13 нуклеотидов) мишени;
2) фрагмент олигонуклеотида длиной в 13 нуклеотидов выбирают для того, чтобы он а) был уникальным в гене и не повторялся; б) температура плавления его дуплекса с мишенью была выше, чем температура плавления шпилечных структур, образующихся в самой мишени (63oС); в) температура плавления его дуплекса с мишенью была гораздо выше температуры плавления дуплексов со стыковыми n-олигонуклеотидами (15-20oС) и выше температуры плавления его шпилечной самозакрывающейся структуры (30oС). Дальнейшее наращивание длины указанного фрагмента приводит к повышению температуры плавления до 80oС и выше, что затрудняет отмывку микрочипа для повторных экспериментов и уменьшает специфичность гибридизации;
3) фрагменты 5'-TGAATTGGCTCAG-3' и 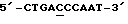 в составе 27-членного олигонуклеотида способны образовать самозакрывающуюся шпильку, а последовательность tttt вводят для образования головки шпильки, поскольку известно, что остатки t представляют собой самые гибкие основания [Biochemistry, 33 (1994) 12715-12719);
в составе 27-членного олигонуклеотида способны образовать самозакрывающуюся шпильку, а последовательность tttt вводят для образования головки шпильки, поскольку известно, что остатки t представляют собой самые гибкие основания [Biochemistry, 33 (1994) 12715-12719);
4) в участок  вводят мисматч
вводят мисматч 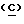 для того, чтобы температура плавления шпильки отвечала неравенству [1] и была в соответствии с теоретическими расчетами [Biochemistry, 35 (1996) 3555-3562]. Тем самым ее понижают с 55oС (без мисматчей) до 30oС.
для того, чтобы температура плавления шпильки отвечала неравенству [1] и была в соответствии с теоретическими расчетами [Biochemistry, 35 (1996) 3555-3562]. Тем самым ее понижают с 55oС (без мисматчей) до 30oС.
5) Аминолинк-C7-NH2 на 3'-конце вводят для иммобилизации в гель [Anal. Biochemistry, 250 (1997) 203-211; Nucleic Acids Res., 24 (1996) 3142-3148)].
Выбор иммобилизованных и стыковых олигонуклеотидов проводят с помощью расчета и последующей проверки путем снятия кривых плавления на тестовом микрочипе с использованием метода флуоресцентного анализа и в растворе (для шпилечных структур, методом УФ-спектроскопии).
Гибридизацию анализируемой пробы и одного из стыковых пентануклеотидов проводят за один цикл. В гибридизационную камеру помещают 100 мкл смеси 1 мкМ раствора FITC-меченного 81-членного олигонуклеотида и 5 мкМ раствора TR-меченного 5-членного n-олигонуклеотида в 1 М триэтиламмоний-ацетатном буфере (ТЕАА, Fluka).
Цикл гибридизации состоит из двух стадий. Первоначально гибридизационную камеру помещают на термостолик, имеющий температуру 20oС, на 20 часов. Затем камеру выдерживают 2 часа при -5oС. При помощи флуоресцентного микроскопа, оборудованного ПЗС-камерой, регистрируют флуоресценцию FITC и TR, т.е. детектируют гибридизацию на микрочипе.
Флуоресцентные измерения термодинамических параметров дуплексов на микрочипе проводят в автоматическом режиме и реальном времени. Установка состоит из двухволнового флуоресцентного микроскопа, ПЗС-камеры (Princeton Instruments, Trenton, NJ, USA), термостолика Пельтье, термоконтроллера и компьютера с платой сбора данных и программным обеспечением. Флуоресцентный микроскоп обладает сменными фильтрами испускания и поглощения для FITC и TR.
Пригибридизованную ДНК отмывают при 90oС в течение 5 мин и повторяют цикл гибридизация встык - плавление с другим 5-членным n-олигонуклеотидом.
Проводят уравнивание всех температур плавления стыковых n-олигонуклеотидов, так чтобы все они лежали в полуширине температурной зоны оптимальной дискриминации мисматчей, что достигается использованием уравнивающего буфера (1М ТЕАА), и выбирают те стыки (комбинации двух оснований в зоне стыка), которые дают максимальный энергетический эффект.
Выбранные синтетические стыковые олигонуклеотиды представлены смесью 13 пентануклеотидов, комплементарных к "горячим" участкам гена (фиг.3). Каждый пентануклеотид комплементарен константному участку мишени, соседнему с константным участком, образующим дуплекс со шпилечной структурой N-нуклеотида, и "покрывает" собой "горячую точку" в мишени, причем каждый олигонуклеотид смеси комплементарен своему "горячему участку" в ДНК мишени, содержащей определенный тип замены, а вся смесь охватывает все возможные комбинации замен, т. е. мутации, а также дикий тип.
Приведенную выше методологию применяют к подбору иммобилизованных и стыковых олигонуклеотидов, предназначенных для определения мутаций М2, М3 и М4.
В иммобилизованные олигонуклеотиды N3 и N4 вводят одно или два универсальных основания (нитроиндол) напротив мутации в ДНК во избежание образования мисматча, дестабилизирующего дуплекс N-олигонуклеотида с ДНК, так как мутации М3 и М4 расположены близко, расстояние между ними меньше, чем длина комплементарной к ДНК последовательности N-олигонуклеотида (без учета длины шпилечной части), и соседняя мутация (недетектируемая в данной ячейке) может оказаться в зоне гибридизации N-олигонуклеотида. Соответственно проводят перерасчет всей термодинамической схемы олигонуклеотидов согласно NN1 модели с учетом термодинамических коэффициентов для универсальных оснований [Biochemistry, 35 (1996) 3555-3562].
Аналитический микрочип состоит из четырех ячеек, в которых иммобилизованы N-олигонуклеотиды, комплементарные к четырем разным константным частям rроВ гена вблизи мест мутации, отобранные с использованием тестового микрочипа (фиг.4).
Для каждой из четырех зон мутации проводят три независимых эксперимента, в каждом из которых микрочип гибридизуют 1) с ДНК дикого типа, 2) с ДНК мутантного типа (с охарактеризованным местом и типом нуклеотидной замены) 3) с эквимольной смесью дикой и мутантной ДНК (для дифференциальной диагностики) и одновременно с одной и той же смесью выбранных с использованием тестового микрочипа 13 стыковых олигонуклеотидов, комплементарных к "горячим" участкам гена, причем каждый n-олигонуклеотид смеси был выбран комплементарным к определенному типу замены в определенной ячейке чипа, а вся смесь охватывает дикий тип, а также все возможные комбинации замен, то есть мутации.
После гибридизации микрочип подготавливают к масс-спектрометрическому исследованию, как описано в примере 1, и с каждой ячейки регистрируют масс-спектры (фиг.4).
Возможно также образование мисматчевого дуплекса стыкового олигонуклеотида с раскрытой частью шпильки, что видно на спектрах с 3-й и 4-й ячеек, когда образуется паразитный пик. Этот пик не мешает детекции.
По пику в масс-спектре определяют, какой пентануклеотид пригибридизовался встык к иммобилизованному олигонуклеотиду. В случае "горячей точки" M1 при гибридизации ДНК дикого типа таким пентануклеотидом оказался 1а (m/z= 1463), при гибридизации ДНК мутантного типа таким пентануклеотидом оказался 1b (m/z=1472). Сравнение пентануклеотидов, пригибридизовавшихся встык к иммобилизованному олигонуклеотиду, показывает характер мутации, а именно: в ДНК мутантного типа в точке M1 произошла замена А на Т. Наличие ДНК мутантного типа обнаруживается и в том случае, когда она присутствует совместно с ДНК дикого типа: в масс-спектре регистрируются пики с m/z=1465 и 1474.
В каждом из 12 случаев, изображенных на фиг.4, четко определяют тот тип ДНК, который был использован, то есть констатируют отсутствие мутаций (дикий тип ДНК), или определяют однонуклеотидную мутацию, а именно для M1 - Т вместо А, для М2 - Т вместо С, для М3 - Т вместо А, для М4 - Т вместо С, или обнаруживают смесь мутантного и дикого типов ДНК.
Последнее обстоятельство используют для определения устойчивости образцов микобактерий к рифампицину при проведении клинических анализов.

Изобретение относится к молекулярной биологии и медицине. Обнаружение мутаций путем частичного секвенирования происходит с использованием олигонуклеотидного микрочипа, в ячейках которого иммобилизованы выбранные последовательности синтетических олигонуклеотидов определенной длины, имеющих шпилечную структуру. Подбирают (теоретически) олигонуклеотиды длиной N (N-олигонуклеотиды), имеющие самозакрывающуюся шпилечную структуру (N-олигонуклеотиды иммобилизуют на микроматрицу), несамокомплементарные олигонуклеотиды длиной n (n-олигонуклеотиды) для гибридизации встык. Температура плавления (Тпл) трех вариантов дуплексов, а именно: (1) ДНК-иммобилизованный N-олигонуклеотид, (2) самозакрывающаяся шпилька, (3) n-олигонуклеотид - иммобилизованный N-олигонуклеотид, отвечает неравенству Тпл(1)>>Тпл(2)>>Тпл(3). Изготавливают тестовый микрочип с теоретически выбранными иммобилизованными N-олигонуклеотидами. Проводят их гибридизацию со смесью флуоресцентно меченных модельной ДНК и каждым из теоретически выбранных n-олигонуклеотидов, подбирая условия выравнивания энергетики АТ- и GC-богатых олигонуклеотидов. Регистрируют результаты гибридизации путем построения кривых плавления с использованием метода флуоресцентного анализа. На основе полученных данных выбирают N-олигонуклеотиды для изготовления аналитического микрочипа, n-олигонуклеотиды для гибридизации встык и условия гибридизации. изобретение позволяет упростить анализ и сократить его продолжительность. 2 с. и 12 з.п. ф-лы, 4 ил.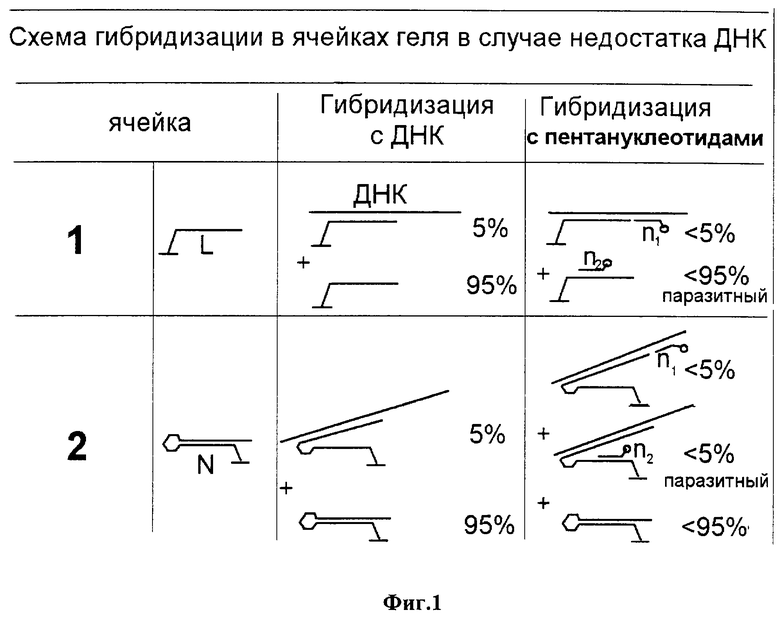
| US 5741644 А, 21.04.1998 | |||
| US 6284463 А, 04.09.2001 | |||
| СПОСОБ ИЗГОТОВЛЕНИЯ МАТРИЦЫ ДЛЯ ДЕТЕКТИРОВАНИЯ МИСМАТЧЕЙ | 1993 |
|
RU2041261C1 |
| СПОСОБ ОБНАРУЖЕНИЯ ИДЕНТИФИКАЦИИ И/ИЛИ КОЛИЧЕСТВЕННОЙ ОЦЕНКИ МАТЕРИАЛА, НАБОР ДЛЯ АНАЛИЗА, ОПТИЧЕСКИЙ ВОЛНОВОД, БИОСЕНСОР | 1992 |
|
RU2116349C1 |
| GINGERAS T.R | |||
| et al | |||
| Simultaneous Genotyping and Species Identification Using Hybridization Pattern Recognition Analysis of Generic Mycobacterium DNA Arrays, Genome Res | |||
| Способ и аппарат для получения гидразобензола или его гомологов | 1922 |
|
SU1998A1 |
| СПОСОБ ИЗГОТОВЛЕНИЯ МИКРОЧИПОВ НА ОСНОВЕ ОЛИГОНУКЛЕОТИДОВ | 1999 |
|
RU2157385C1 |
Авторы
Даты
2003-06-20—Публикация
2001-10-22—Подача