Изобретение относится к производным изоксазола и их фармацевтически приемлемым солям, которые обладают превосходными ингибирующими активностями в отношении моноаминоксидазы типа A;
композициям, содержащим соединения для лечения или профилактики нервных заболеваний (в частности, депрессии), включая депрессию, болезнь Паркинсона, деменцию Альцгеймера (нарушение познавательной способности, свойственное болезни Альцгеймера) или цереброваскулярную деменцию (нарушение познавательной способности, свойственное цереброваскулярной деменции);
применению соединений для получения фармацевтических препаратов для лечения или профилактики вышеуказанных заболеваний и
способу лечения или профилактики указанных заболеваний путем введения фармацевтически эффективного количества соединений теплокровным животным.
Депрессия является заболеванием, которое демонстрирует обычное состояние подавленного настроения из числа расстройств настроения, и одной из ее причин считаются функциональные нарушения в центральных серотонергической и норадренергической нервных системах. Серотонин и норадреналин разлагаются и подвергаются метаболизму моноаминоксидазами (главным образом, моноаминоксидазой типа A) до потери их биологических активностей. Предполагается, что ингибиторы моноаминоксидазы типа A могут использоваться в качестве антидепрессантов, и такие ингибиторы интенсивно исследовались и разрабатывались. В последнее время в клиники поставляется Моклобемид в качестве селективного ингибитора моноаминоксидазы типа A.
Авторы настоящего изобретения проводили в течение нескольких лет интенсивные исследования синтеза производных изоксазола и их фармакологической активности с целью разработки превосходного терапевтического средства против депрессии и обнаружили, что производные изоксазола, имеющие определенную структуру, обнаруживают сильную ингибирующую моноаминоксидазу типа A активность и имеют терапевтические или профилактические действия (в частности, терапевтическое действие) по отношению к нервным заболеваниям (в частности, на депрессию), включая депрессию, болезнь Паркинсона, деменцию Альцгеймера (нарушение познавательной способности, присущее болезни Альцгеймера) или цереброваскулярную деменцию (нарушение познавательной способности, присущее цереброваскулярной деменции).
Данное изобретение относится к
производным изоксазола и их фармацевтически приемлемым солям, которые обладают превосходной ингибирующей активностью по отношению к моноаминоксидазе типа A;
композициям, содержащим соединения для лечения или профилактики нервных заболеваний (в частности, депрессии), включая депрессию, болезнь Паркинсона, деменцию Альцгеймера (нарушение познавательной способности, присущее болезни Альцгеймера) или цереброваскулярную деменцию (нарушение познавательной способности, присущее цереброваскулярной деменции);
применению соединений для получения фармацевтических препаратов для лечения или профилактики вышеуказанных заболеваний и
способу лечения или профилактики указанных болезней путем введения фармацевтически эффективного количества соединений теплокровным животным.
Производные изоксазола по настоящему изобретению имеют общую формулу (I):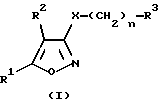
где R1 обозначает C6-C14 арилгруппу, необязательно имеющую от 1 до 3 заместителей, которые могут быть одинаковыми или отличными друг от друга и выбраны из следующей группы заместителей, или 5- или 6-членную ароматическую гетероциклическую группу, необязательно имеющую от 1 до 3 заместителей и имеющую один гетероатом, выбранный из группы, состоящей из атомов азота, кислорода и серы [группой заместителей является галоген; C1-C6 алкил; C1-C6 алкил, замещенный галогеном; C1-C6 алкокси; фенил; фенокси; бензилокси; бензиламино; нитро; гидроксил; C1-C7 алканоил; аминогруппа;
R2 обозначает атом водорода; атом галогена; C1-C6 алкил; C1-C6 алкил, замещенный галогеном; C2-C6 алкенил; C2-C6 алкинил; C3-C10 циклоалкил; C3-C10 циклоалкенил; циано; карбоксил; C1-C7 алканоил; C2-C7 алкоксикарбонил; карбамоил; монo(C1-C6 алкил)карбамоил;
R3 обозначает амино, моно C1-C6 алкил амино, ди(C1-C6 алкил)амино, моно C1-C7 алканоиламино, моно C2-C7 алкоксикарбониламино, моно C7-C15арилкарбониламино,
или 5- или 6-членную насыщенную гетероциклическую группу (присоединенную через атом азота кольца), которая содержит один атом азота и необязательно может содержать еще один атом азота или атом кислорода.
X обозначает атом кислорода или серы и
n обозначает целое число от 2.
Кроме того, активным ингредиентом ингибитора моноаминоксидазы данного изобретения является производное изоксазола формулы (I).
В формуле (I) "атом галогена" в определении R2 и в определении заместителя, включенного в R1, может быть, например, атомом фтора, хлора, брома или иода, предпочтительно атомом фтора или хлора, более предпочтительно атомом хлора.
В формуле (I) "C1-C6 алкилгруппой" в определении R2 и в определении заместителя, включенного в R1, может быть, например, линейная или разветвленная алкилгруппа, имеющая от 1 до 6 атомов углерода, такая как метил, этил, пропил, изопропил, бутил, изобутил, втор-бутил, трет-бутил, пентил, изопентил, 2-метилбутил, неопентил, 1-этилпропил, гексил, 4-метилпентил, 3-метилпентил, 2-метилпентил, 1-метилпентил, 3,3-диметилбутил, 2,2-диметилбутил, 1,1-диметилбутил, 1,2-диметилбутил, 1,3-диметилбутил, 2,3-диметилбутил или 2-этилбутилгруппа. Заместителем, включенным в R1, является предпочтительно C1-C4 алкилгруппа, более предпочтительно метил или этилгруппа и, наиболее предпочтительно, метилгруппа. Кроме того, R2 предпочтительно обозначает C1-C4 алкилгруппу, более предпочтительно этил, пропил, изопропил, изобутил или третбутилгруппу, наиболее предпочтительно изопропилгруппу.
В формуле (I) "C2-C6 алкенил-группой" в определении R2 может быть, например, линейная или разветвленная алкенил-группа, имеющая от 2 до 6 атомов углерода с одной или двумя двойными связями, такая как винил, 1-пропенил, аллил, 1- метил-1-пропенил, 1-метил-2-пропенил, 2-метил-1-пропенил, изопропенил, алленил, 1-бутенил, 2-бутенил, 3-бутенил, 2- пентенил, изопренил, 5-гексенил или 1,4-гексадиенилгруппа, предпочтительно винил, 1-пропенил, аллил, 1-метил-1-пропенил, изопропенил, 2-бутенил или 3-бутенилгруппа, более предпочтительно аллил, изопропенил или 2-бутенилгруппы, наиболее предпочтительно аллилгруппа.
В формуле (I) "C2-C6 алкинилгруппой" в определении R2 может быть, например, линейная или разветвленная алкинил-группа, имеющая от 2 до 6 атомов углерода, такая как этинил, 1-пропинил, пропаргил, 1-метил-2-пропинил, 2-метил-2-пропинил, 2-этил-2-пропинил, 2-бутинил, 1-метил-2-бутинил, 2- метил-2-бутинил, 3-бутинил, 2-пентинил, 5-гексинил или 2-метил-4- пентинилгруппа, предпочтительно этинил, пропаргил, 2-бутинил или 3-бутинил-группа, более предпочтительно пропаргилгруппа.
В формуле (I) "C3-C10 циклоалкилгруппой" в определении R2 может быть, например, 3- до 10-членная насыщенная циклическая углеводородная группа, которая может образовывать конденсированное кольцо, такая как циклопропил, циклобутил, циклопентил, циклогексил, циклогептил, норборнил или адамантилгруппа, предпочтительно циклопропил, циклопентил или циклогексилгруппа, более предпочтительно циклопропилгруппа.
В формуле (I) "C3-C10 циклоалкенилгруппой" в определении R2 может быть, например, 3- до 10-членная ненасыщенная циклическая углеводородная группа, которая может образовывать конденсированное кольцо, имеющая одну двойную связь, такая как 2-циклопропенил, 2-циклобутенил, 1-циклопентенил, 2- циклопентенил, 3-циклопентенил, 1-циклогексенил, 2-циклогексенил, 3-циклогексенил, 2-циклогептенил, 3-норборненил или 3-адамантенилгруппа, предпочтительно 2-циклопентенил, 3-циклопентенил, 2-циклогексенил или 3-циклогексенилгруппа, более предпочтительно 2-циклопентенилгруппа.
В формуле (I) "C1-C6 алкилгруппа, замещенная галогеном в определении R2 и в определении заместителя, включенного в R1, обозначает группу, в которой от 1 до 5 "атомов галогена", указанных выше, связаны с вышеуказанной "C1-C6 алкилгруппой".
Группой, в которой галоген связан с C1-C6 алкилгруппой, может быть, например, фторметил, дифторметил, трифторметил, 2-фторэтил, 2-хлорэтил, 2,2,2-трифторэтил, 3- фторпропил, 3-хлорпропил, 3-бромпропил, 4-фторбутил или 6- иодгексилгруппа.
Заместителем, включенным в R1, является предпочтительно C1-C6 алкилгруппа, замещенная 1-3 атомами галогена или C1-C4 алкокси, более предпочтительно фторметил, дифторметил, трифторметил, 2-фторэтил, 2-хлорэтил, 2,2,2-трифторэтил, метоксиметил или метоксиэтилгруппы, еще более предпочтительно трифторметил, 2,2,2-трифторэтил или метоксиметилгруппа, наиболее предпочтительной является трифторметилгруппа. Кроме того, R2 предпочтительно обозначает фторметил, дифторметил, трифторметил, 2-фторэтил, 1-хлорэтил, 2-хлорэтил, 2,2,2-трифторэтил, метоксиметил или метоксиэтилгруппу, более предпочтительно трифторметил, 2-фторэтил, 1-хлорэтил или 2-хлорэтилгруппу, наиболее предпочтительно 1-хлорэтилгруппу.
В формуле (I) "C1-C6 алкоксигруппа" в определении заместителя, включенного в R1, и в определении R2 обозначает группу, в которой вышеуказанная "C1-C6 алкилгруппа" связана с атомом кислорода, и такой группой может быть, например, метокси, этокси, пропокси, изопропокси, бутокси, изобутокси, втор-бутокси, трет-бутокси, пентилокси, изопентилокси, 2-метилбутокси, неопентилокси, 1-этилпропокси, гексилокси, 4-метилпентилокси, 3-метилпентилокси, 2-метилпентилокси, 3-метилпентилокси, 1-метилпентилокси, 3,3-диметилбутокси, 2,2-диметилбутокси, 1,1-диметилбутокси, 1,2-диметилбутокси, 1,3-диметилбутокси, 2,3-диметилбутокси или 2-этилбутоксигруппа, предпочтительно C1-C4 алкоксигруппа, более предпочтительно метокси или этоксигруппа, наиболее предпочтительно метоксигруппа.
В формуле (I) "C6-C14 арилгруппа, необязательно имеющая от 1 до 3 заместителей, которые могут быть одинаковыми или отличными друг от друга и выбраны из следующей группы (группой заместителей является галоген, C1-C6 алкил или C1-C6 алкокси)" в определении заместителя, включенного в R1, обозначает ароматическую углеводородную группу, имеющую от 6 до 14 атомов углерода, необязательно имеющую от 1 до 3 заместителей, которые могут быть одинаковыми или отличными друг от друга и выбраны из группы заместителей, и такой группой может быть, например, фенил, фторфенил, хлорфенил, дихлорфенил, метилфенил, триметилфенил, метоксифенил, инденил, метилинденил, нафтил, дихлорнафтил, фенантренил, гексилфенантренил, антраценил, диметилантраценил или гексилоксиантраценилгруппа, предпочтительно фенилгруппа, необязательно имеющая один или два заместителя, которые могут быть одинаковыми или отличными друг от друга и выбраны из группы, состоящей из фтора, хлора, метила и метокси, более предпочтительно фенил, 4-фторфенил, 4-хлорфенил, 2,4-дихлорфенил, 4-метилфенил или 4-метоксифенилгруппа, наиболее предпочтительно фенилгруппа.
В формуле (I) "C1-C7 алканоилгруппа" в определении заместителя, включенного в R1, и в определении R2 обозначает группу, в которой атом водорода или вышеуказанный "C1-C6 алкил" связан с карбонилгруппой, и такой группой может быть, например, формил, ацетил, пропионил, бутирил, изобутирил, валерил, изовалерил, пивалоил, гексаноил или гептаноилгруппа, предпочтительно формил или ацетилгруппа, наиболее предпочтительно ацетилгруппа.
В формуле (I) "моно-C1-C6 алкиламиногруппа" в определении R3 обозначает группу, в которой вышеуказанная "C1-C6 алкилгруппа" связана с аминогруппой, и такой группой может быть, например, метиламино, этиламино, пропиламино, изопропиламино, бутиламино, изобутиламино, втор-бутиламино, трет-бутиламино, пентиламино или гексиламиногруппа, предпочтительно C1-C4 алкиламиногруппа, более предпочтительно метиламино или этиламиногруппы, наиболее предпочтительно метиламиногруппа.
В формуле (I) "ди(C1-C6 алкил)амино" в определении R3 может быть, например, N, N-диметиламино, N-этил-N-метиламино, N-метил-N-пропиламино, N-изопропил-N-метиламино, N-бутил-N-метиламино, N-изобутил-N-метиламино, N-втор-бутил- N-метиламино, N-трет-бутил-N-метиламино, N,N-диэтиламино, N-этил-N-пропиламино, N-этил-N-изобутиламино, N,N-дипропиламино, N,N-дибутиламино, N, N-дипентиламино или N,M-дигексиламиногруппа, предпочтительно ди(C1-C4 алкил) аминогруппа, более предпочтительно N,N-диметиламино или N,N-диэтиламиногруппа, наиболее предпочтительно N,N-диметиламиногруппа.
В формуле (I) "C1-C7 алканоиламиногруппа" в определении R3 обозначает группу, в которой вышеупомянутая "C1-C7 алканоилгруппа" связана с аминогруппой.
В формуле (I) "C2-C7 алкоксикарбониламиногруппа" в определении R3 обозначает группу, в которой вышеуказанная "C2-C7 алкоксикарбонилгруппа" связана с аминогруппой, и такой группой может быть, например, метоксикарбониламино, этоксикарбониламино, пропоксикарбониламино, изопропоксикарбониламино, бутоксикарбониламино, изобутоксикарбониламино, втор-бутоксикарбониламино, трет-бутоксикарбониламино, пентилоксикарбониламино, изопентилоксикарбониламино, 2-метил-бутоксикарбониламино, неопентилоксикарбониламино, 1-этил-пропоксикарбониламино, гексилоксикарбониламино, 4-метил-пентилоксикарбониламино, 3-метилпентилоксикарбониламино, 2-метилпентилоксикарбониламино, 1-метилпентилоксикарбониламино, 3,3-диметилбутоксикарбониламино, 2,2-диметилбутоксикарбониламино, 1,1-диметилбутоксикарбониламино, 1,2-диметилбутоксикарбониламино, 1,3-диметилбутоксикарбониламино, 2,3-диметилбутоксикарбониламино или 2-этилбутоксикарбониламиногруппа, предпочтительно C2-C5 алкоксикарбониламиногруппа, более предпочтительно метоксикарбониламино или этоксикарбониламиногруппа, наиболее предпочтительно метоксикарбониламиногруппа.
В формуле (I) "моно C7-C15 арилкарбониламиногруппа, необязательно имеющая от 1 до 3 заместителей, которые могут быть одинаковыми или отличными друг от друга и выбраны из следующей группы (группой заместителей является галоген, C1-C6 алкил или C1-C6 алкокси)" в определении заместителя, включенного в R1, и в определении R3 обозначает группу, в которой вышеуказанная "C6-C14 арилгруппа, необязательно имеющая от 1 до 3 заместителей, которые могут быть одинаковыми или отличными друг от друга и выбраны из следующей группы (группой заместителей является галоген, C1-C6 алкил или C1-C6 алкокси)", связана с карбониламиногруппой, и такой группой может быть, например, бензоиламино, фторбензоиламино, хлорбензоиламино, дихлорбензоиламино, толуоиламино, триметилбензоиламино, анизоиламино, инденоиламино, метилинденоиламино, нафтоиламино, дихлорнафтоиламино, фенантреноиламино, гексилфенантреноиламино, антраценоиламино, диметилантраценоиламино или гексилоксиантраценоиламиногруппа, предпочтительно бензоиламиногруппа, необязательно имеющая один или два заместителя, которые могут быть одинаковыми или отличными друг от друга и выбраны из группы, состоящей из фтора, хлора, метила и метокси, более предпочтительно бензоиламино, 4-фторбензоил, 4- хлорбензоиламино, 2,4-дихлорбензоиламино, 4-толуиламино или 4- анизоиламиногруппа, наиболее предпочтительно бензоиламиногруппа.
В формуле (I) "5- или 6-членной насыщенной гетероциклической группой (при условии, что группа присоединена через атом азота кольца), содержащей один атом азота и необязательно содержащей один атом азота или атом кислорода", в определении R3 может быть, например, пирролидинил, имидазолидинил, пиразолидинил, пиперидил, пиперазинил или морфолинилгруппа, предпочтительно пиперидил или морфолинилгруппа.
В формуле (I) "5- или 6-членной ароматической гетероциклической группой, имеющей один или два гетероатома, которые могут быть одинаковыми или отличными друг от друга и выбраны из группы, состоящей из атомов азота, кислорода и серы" в определении R1 может быть, например, пирролил, имидазолил, пиразолил, фурил, тиенил, оксазолил, изоксазолил, тиазолил, изотиазолил, пиридил, пиразинил, пиримидинил или пиридазинилгруппа,
Кроме того, что касается связи ароматической гетероциклической группы и кольца изоксазола, то связь предпочтительно образуется на атоме углерода на ароматическом гетероцикле.
В формуле (I) X предпочтительно обозначает атом кислорода.
В формуле (I) n предпочтительно обозначает целое число от 2 до 4, более предпочтительно 2.
Соединение (I) по данному изобретению может быть превращено в аддитивную соль с кислотой обычным способом. Например, соль может быть получена путем обработки соединения (I) соответствующей кислотой в растворителе (например, простые эфиры, сложные эфиры или спирты, особенно простые эфиры) при комнатной температуре в течение 5-30 минут и собирания осажденных кристаллов путем фильтрования или удаления растворителя испарением. Такая соль включает соль неорганической кислоты, такую как гидрофторид, гидрохлорид, гидробромид, гидроиодид, нитрат, перхлорат, сульфат и фосфат; соль сульфоновой кислоты, такую как метансульфонат, трифторметансульфонат, этансульфонат, бензолсульфонат и п-толуолсульфонат; соль карбоновой кислоты, такую как фумарат, сукцинат, цитрат, тартрат, оксалат и малеат, и соль аминокислоты, такую как глутамат и аспартат, предпочтительно соль неорганической кислоты (более предпочтительно гидрохлорид).
Соединение (I) по данному изобретению иногда имеет асимметричный атом углерода в молекуле, и иногда присутствуют стереоизомеры R-конфигурации и S-конфигурации. Каждый из стереоизомеров или смесь, содержащая изомеры в необязательной пропорции, все это включено в данное изобретение.
Соединение (I) и его соль время от времени абсорбируют влагу, когда их оставляют в атмосфере, и они иногда образуют гидраты, когда их подвергают перекристаллизации. Такие продукты, содержащие воду, также включены в данное изобретение.
Примеры предпочтительных соединений формулы (I) включают:
(1) соединения, в которых R1 обозначает C6-C14 арил-группу, необязательно имеющую от 1 до 3 заместителей, которые могут быть одинаковыми или отличными друг от друга и выбраны из следующей группы заместителей, или 5- или 6-членную ароматическую гетероциклическую группу, имеющую один гетероатом, выбранный из группы, состоящей из атомов азота, кислорода и серы [группой заместителей является галоген; C1-C6 алкил; C1-C6 алкил, замещенный галогеном; C1-C6 алкокси; фенил, фенокси, бензилокси; нитро; гидроксильная группа; ацетокси; бензоиламино,
(2) соединения, в которых R1 обозначает C6-C14 арил-группу, необязательно имеющую от 1 до 3 заместителей, которые могут быть одинаковыми или отличными друг от друга и выбраны из следующей группы заместителей, или 5- или 6-членную ароматическую гетероциклическую группу, имеющую один или два гетероатома, которые могут быть одинаковыми или отличными друг от друга и выбраны из группы, состоящей из атомов азота, кислорода и серы [группой заместителей является галоген; C1-C6 алкил; C1-C6 алкил, замещенный галогеном; C1-C6 алкокси; фенил],
(3) соединения, в которых R1 обозначает C6-C14 арил-группу, необязательно имеющую от 1 до 3 заместителей, которые могут быть одинаковыми или отличными друг от друга и выбраны из следующей группы заместителей, или 5- или 6-членную ароматическую гетероциклическую группу, имеющую один гетероатом, выбранный из группы, состоящей из атомов азота, кислорода и серы [группой заместителей является галоген, C1-C4 алкил, фторметил, дифторметил, трифторметил, 2-фторэтил, 2,2,2-трифторэтил, C1-C4 алкокси, фенил],
(4) соединения, в которых R1 обозначает фенилгруппу, необязательно имеющего от 1 до 3 заместителей, которые могут быть одинаковыми или отличными друг от друга и выбраны из следующих заместителей, или фурил, тиенил или пиридилгруппу [группой заместителей является галоген, метил, этил, трифторметил, метокси, фенил, метоксикарбонил],
(5) соединения, в которых R1 обозначает фенилгруппу, необязательно имеющую один или два заместителя, которые могут быть одинаковыми или отличными друг от друга и выбраны из следующей группы заместителей, или фурил, тиенил или пиридилгруппу [группой заместителей является фтор, хлор, метил, этил, трифторметил и метоксигруппа],
(6) соединения, в которых R1 обозначает фенил, фторфенил, хлорфенил, дифторфенил, дихлорфенил, метилфенил, 2-фурил, 3-фурил, 2-тиенил или 3-тиенилгруппу,
(7) соединения, в которых R1 обозначает фенил, 2- хлорфенил, 4-хлорфенил, 2,4-дифторфенил, 2,4-дихлорфенил, 2-фурил или 2-тиенилгруппу,
(8) соединения, в которых R2 обозначает водород, галоген, C1-C6 алкил, фторметил, дифторметил, трифторметил, 2-фторэтил, 1-хлорэтил, 2-хлорэтил, 2,2,2-трифторэтил, метоксиметил, метоксиэтил, C2-C6 алкенил, C2-C6 алкинил, циклопропил, циклопентил, циклогексил, 2-циклопентенил, 3-циклопентенил, 2-циклогексенил, 3-циклогексенил, метокси, этокси, циано, карбоксил, формил, ацетил, метоксикарбонил, этоксикарбонил, карбамоил, метилкарбамоил, этилкарбамоил или N,N-диметилкарбамоилгруппу.
(9) соединения, в которых R2 обозначает водород, галоген, C1-C6 алкил, C2-C6 алкенил или C2-C6 алкинилгруппу,
(10) соединения, в которых R2 обозначает водород, галоген, C1-C4 алкил, аллил, изопропенил, 2-бутенил или пропаргилгруппу,
(11) соединения, в которых R2 обозначает водород, хлор, этил, пропил, изопропил, изобутил или трет-бутилгруппу,
(12) соединения, в которых R2 обозначает водород или изопропилгруппу,
(13) соединения, в которых R3 обозначает амино, моно C1-C6 алкиламино, ди(C1-C6 алкил) амино или 5- или 6-членную насыщенную гетероциклическую группу (при условии, что группа присоединена через атом азота кольца), имеющую один атом азота и еще необязательно имеющую один атом азота или атом кислорода,
(14) соединения, в которых R3 обозначает амино, метиламино, этиламино, N,N-диметиламино, пиперидил или морфолинилгруппу,
(15) соединения, в которых R3 обозначает аминогруппу,
(16) соединения, в которых X обозначает атом кислорода, и
(17) соединения, в которых n равно 2.
Степень предпочтения R1 повышается в возрастающем порядке от (1) к (7), R2 повышается в возрастающем порядке от (8) к (12) и R3 повышается в возрастающем порядке от (13) к (15).
Кроме того, соединения формулы (I) включают комбинации из от двух до пяти, выбранных из группы, состоящей из (1)-(7), (8)-(12), (13)-(15), (16) и (17), и предпочтительные примеры таких комбинаций показаны ниже.
(18) соединения, в которых R1 обозначает C6-C14арилгруппу, необязательно имеющую от 1 до 3 заместителей, которые могут быть одинаковыми или отличными друг от друга и выбраны из следующей группы заместителей, или 5- или 6- членную ароматическую гетероциклическую группу, необязательно имеющую от 1 до 3 заместителей и имеющую один или два гетероатома, которые могут быть одинаковыми или отличными друг от друга и выбраны из группы, состоящей из атомов азота, кислорода и серы [группой заместителей является галоген, C1-C6 алкил; C1-C6 алкил, замещенный галогеном или C1-C6 алкокси; C1-C6 алкокси; C6-C14 арил, необязательно имеющий от 1 до 3 заместителей, которые могут быть одинаковыми или отличными друг от друга и выбраны из следующей группы (группой заместителей является галоген, C1-C6 алкил или C1-C6 алкокси; циано; C2-C7 алкоксикарбонил; карбамоил; моно (C1-C6 алкил) карбамоил и ди(C1-C6 алкил) карбамоилгруппа],
R2 обозначает водород, галоген, C1-C6 алкил, C2-C6 алкенил или C2-C6 алкинилгруппу, и
R3 обозначает амино, моно C1-C6 алкиламино, ди(C1-C6 алкил) аминогруппу или 5- или 6-членную насыщенную гетероциклическую группу (при условии, что группа присоединена через атом азота кольца), содержащую один атом азота и еще один атом азота или кислорода.
(19) соединения, в которых R1 обозначает C6-C14арилгруппу, необязательно имеющую от 1 до 3 заместителей, которые могут быть одинаковыми или отличными друг от друга и выбраны из следующей группы заместителей, или 5- или 6- членную ароматическую гетероциклическую группу, необязательно имеющую от 1 до 3 заместителей и имеющую один или два гетероатома, которые могут быть одинаковыми или отличными друг от друга и выбраны из группы, состоящей из атомов азота, кислорода и серы [группой заместителей является галоген, C1-C6 алкил; C1-C6 алкил, замещенный галогеном или C1-C6 алкокси; C1-C6 алкокси; C6-C14 арил, необязательно имеющий от 1 до 3 заместителей, которые могут быть одинаковыми или отличными друг от друга и выбраны из следующей группы [группой заместителей является галоген, C1-C6 алкил или C1-C6 алкокси; циано; C2-C7 алкоксикарбонил; карбамоил; моно(C1-C6 алкил)карбамоил и ди(C1-C6 алкил)карбамоилгруппа],
R3 обозначает водород, галоген, C1-C6 алкил, C2-C6 алкенил или C2-C6 алкинилгруппу,
R3 обозначает аминогруппу,
X обозначает атом кислорода и
n равно 2,
(20) соединения, в которых R1 обозначает C6-C14 арил-группу, необязательно имеющую от 1 до 3 заместителей, которые могут быть одинаковыми или отличными друг от друга и выбраны из следующей группы заместителей, или 5- или 6-членную ароматическую гетероциклическую группу, необязательно имеющую один или два заместителя и имеющую один или два гетероатома, которые могут быть одинаковыми или отличными друг от друга и выбраны из группы, состоящей из атомов азота, кислорода и серы [группой заместителей является галоген, C1-C4 алкил, фторметил, дифторметил, трифторметил, 2-фторэтил, 2,2,2-трифторэтил, метоксиметил, метоксиэтил, C1-C4 алкокси, фенил, 4-фторфенил, 4-хлорфенил, 2,4-дихлорфенил, 4-метилфенил, 4-метоксифенил, циано, метоксикарбонил, этоксикарбонил, карбамоил, метилкарбамоил, этилкарбамоил, N,N-диметилкарбамоил и N,N-диэтилкарбамоилгруппа],
R2 обозначает водород, галоген, C1-C4 алкил, аллил, изопропенил, 2-бутенил или пропаргилгруппу,
R3 обозначает аминогруппу,
X обозначает атом кислорода и
n равно 2,
(21) соединения, в которых R1 обозначает фенилгруппу, необязательно имеющую от 1 до 3 заместителей, которые могут быть одинаковыми или отличными друг от друга и выбраны из следующей группы заместителей, или фурил, тиенил или пиридилгруппу, необязательно имеющую один или два заместителя [группой заместителей является галоген, метил, этил, трифторметил, метокси, фенил, циано, метоксикарбонил, карбамоил, метилкарбамоил, этилкарбамоил и N,N- диметилкарбамоилгруппа],
R2 обозначает водород, галоген, C1-C4 алкил, аллил, изопропенил, 2-бутенил или пропаргилгруппу,
R3 обозначает аминогруппу,
X обозначает атом кислорода и
n равно 2,
(22) соединения, в которых R1 обозначает фенилгруппу, необязательно имеющую один или два заместителя, которые могут быть одинаковыми или отличными друг от друга и выбраны из следующей группы заместителей, или фурил, тиенил или пиридилгруппу, необязательно имеющую один заместитель [группой заместителей является фтор, хлор, метил, этил, трифторметил и метоксигруппа] ,
R2 обозначает водород, хлор, этил, пропил, изопропил, изобутил или трет-бутилгруппу,
R3 обозначает аминогруппу,
X обозначает атом кислорода и
n равно 2,
(23) соединения, в которых R1 обозначает фторфенил, хлорфенил, дифторфенил, дихлорфенил, метилфенил, 2-фурил, 3-фурил, 2-тиенил или 3-тиенилгруппу,
R2 обозначает водород, хлор, этил, пропил, изопропил, изобутил или трет-бутилгруппу,
R3 обозначает аминогруппу,
X обозначает атом кислорода и
n равно 2,
(24) соединения, в которых R1 обозначает фенил, 2-хлорфенил, 4-хлорфенил, 2,4-дифторфенил, 2,4-дихлорфенил, 2-фурил или 2-тиенилгруппу,
R2 обозначает атом водорода или изопропилгруппу,
R3 обозначает аминогруппу,
X обозначает атом кислорода и
n равно 2.
Что касается соединений, описанных выше, степень предпочтения соединений возрастает в возрастающем порядке от (18) к (24).
Представительные соединения по данному изобретению иллюстрируются в табл. 1, но данное изобретение не ограничивается только ими.
В табл. 1 использованы следующие аббревиатуры:
Ac: Ацетил
All: Аллил
Bn: Бензил
Bu: Бутил
Bui: Изобутил
Bus: втор-Бутил
But: трет-Бутил
Bun (2): 2-Бутенил
Bz: Бензоил
Et: Этил
Fur (2): 2-фурил
Hex: Гексил
Imid (2): 2-Имидазолил
Inde (1): 1-Инденил
Isothiz (3): 3-Изотиазолил
Isox (3): 3-Изоксазолил
Me: Метил
Moc: Метоксикарбонил
Mor (4): 4-Морфолинил
Np (1): 1-Нафтил
Np (2): 2-Нафтил
Oxa (2): 2-Оксазолил
Penc (2): 2-Циклопентенил
Ph: Фенил
Pip (1): 1-Пиперидил
Piz (1): 1-Пиперазинил
Pn: Пентил
Phc: Циклопентил
Pni: Изопентил
Pr: Пропил
Rrc: Циклопропил
Pri: Изопропил
Prei: Изопропенил
Prg: Пропаргил
Pym (2): 2-Пиримидинил
Pyr (2): 2-Пиридил
Pyr (3): 3-Пиридил
Pyr (4): 4-Пиридил
Pyrd (1): 1-Пирролидинил
Pyrr (3): 3-Пирролил
Pyz (2): 2-Пиразинил
Pyza (1): 1-Пиразолил
Pyzn (3): 3-Пиридазинил
Thi (2): 2-Тиенил
Thi (3): 3-Тиенил
Thiz (2): 2-Тиазолил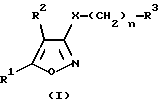
Из производных изоксазола, представленных в табл. 1 изобретения, предпочтительными соединениями являются
1, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 25, 27, 28, 29, 30, 32, 36, 48, 50, 54, 66, 70, 74, 93, 95, 99, 111, 112, 113, 114, 115, 116, 117, 125, 127, 131, 143, 146, 147, 148, 149, 150, 151, 152, 153, 154, 155, 170, 171, 172, 173, 174, 175, 176, 177, 178, 179, 180, 188, 190, 194, 206, 208, 212, 224, 226, 230, 242, 244, 248, 260, 262, 263, 264, 266, 278, 296, 298, 314, 316, 332, 334, 350, 357, 363, 368, 379, 386, 397, 408, 469, 475, 481, 505, 510, 511, 517, 523, 535, 538, 539, 540, 541, 542, 543, 544, 545, 546, 562, 568, 574, 580, 586, 592, 598, 604, 610, 616, 622, 628, 724, 728, 729, 730, 731, 732, 733, 752, 764, 776, 788, 794, 800, 806, 812, 818, 824, 1056, 1061, 1347, 1348, 1349, 1350, 1351, 1357, 1359, 1386, 1388, 1390, 1392, 1394, 1396, 1398, 1400, 1402, 1404, 1406, 1408, 1410, 1412, 1414, 1416, 1459, 1495, 1499, 1500, 1526, 1545, 1549, 1550, 1576, 1590, 1604, 1618, 1632, 1646, 1660, 1674, 1688, 1702, 1716, 1809 или 1811,
более предпочтительными соединениями являются
1, 4, 5, 6, 7, 8, 9, 11, 13, 14, 15, 30, 32, 36, 48, 50, 54, 66, 70, 74, 93, 95, 99, 111, 113, 117, 125, 127, 131, 143, 147, 149, 150, 151, 170, 172, 176, 188, 190, 194, 206, 208, 212, 224, 226, 230, 242, 244, 248, 260, 262, 263, 264, 266, 278, 296, 298, 314, 316, 332, 334, 350, 357, 363, 368, 379, 386, 397, 408, 469, 475, 481, 505, 510, 511, 517, 523, 535, 538, 539, 540, 541, 542, 543, 544, 545, 546, 562, 568, 574, 580, 586, 592, 598, 604, 610, 616, 622, 628, 724, 728, 729, 730, 731, 732, 733, 752, 764, 776, 788, 794, 800, 806, 812, 818, 824, 1056, 1061, 1392, 1394, 1398, 1809 или 1811,
еще более предпочтительными соединениями являются 1, 4, 5, 6, 7, 8, 9, 11, 13, 14, 15, 30, 48, 66, 74, 93, 111, 117, 125, 143, 149, 150, 151, 170, 176, 188, 206, 224, 242, 260, 296, 314, 332, 350, 368, 386, 408, 469, 475, 481, 505, 510, 511, 517, 523, 535, 538, 539, 543, 568, 586, 598, 604, 622, 724, 733, 1392, 1394 или 1398, и в частности, предпочтительными соединениями являются 1, 4, 5, 6, 7, 8, 9, 11, 13, 66, 93, 111, 117, 125, 143, 149, 150, 151, 170, 176, 224, 260, 332, 386, 510, 535, 539, 543, 604, 1392, 1394 или 1398.
Наиболее предпочтительными соединениями являются:
Соединение N 1: 3-(2-аминоэтокси)-5-фенилизоксазол.
Соединение N 5: 3-(2-аминоэтокси)- 4-хлор-5-фенилизоксазол.
Соединение N 7: 3-(2-аминоэтокси)-4-этил-5-фенилизоксазол.
Соединение N 8: 3-(2-аминоэтокси)-5-фенил-4-пропилизоксазол.
Соединение N 9: 3-(2-аминоэтокси)-4-изопропил-5-фенилизоксазол.
Соединение N 11: 3-(2-аминоэтокси)-4-изобутил-5-фенилизоксазол.
Соединение N 117: 3-(2-аминоэтокси)-5-(2-хлорфенил)-4- изопропилизоксазол.
Соединение N 143: 3-(2-аминоэтокси)-5-(4-хлорфенил)-изоксазол.
Соединение N 151: 3-(2-аминоэтокси)-5-(4-хлорфенил)-4-изопропилизоксазол.
Соединение N 176: 3-(2-аминоэтокси)-5-(2,4-дихлорфенил)- 4-изопропилизоксазол.
Соединение N 510: 3-(2-аминоэтокси)-5-(2-фурил)-4-изопропилизоксазол.
Соединение N 535: 3-(2-аминоэтокси)-5-(2-тиенил)изоксазол.
Соединение N 539: 3-(2-аминоэтокси)-4-хлор-5-(2-тиенил)изоксазол.
Соединение N 543: 3-(2-аминоэтокси)-4-изопропил-5-(2-тиенил)изоксазол или
Соединение N 1392: 4-аллил-3-(2-аминоэтокси)-5-фенил-изоксазол.
Способы получения соединений данного изобретения иллюстрируются ниже.
Способ А (см. в конце описания).
Защитная группа аминогруппы или моно C1-C6 алкиламиногруппы Ra3 может быть использована без особого ограничения, пока эта группа используется в качестве защитной группы для аминогруппы, и может быть, например, C1-C6 алканоилгруппой, такой как формил, ацетил, пропионил, бутирил, изобутирил, пентаноил, пивалоил, валерил, изовалерил или гексаноил группы; C1-C4 алканоилгруппой, замещенной галогеном или C1-C4 алкокси, такой как хлорацетил, дихлорацетил, трихлорацетил, трифторацетил, 3-фторпропионил, 4,4-дихлорбутирил, метоксиацетил, бутоксиацетил, этоксипропионил или пропоксибутирил группы, ненасыщенной C1-C4 алканоилгруппой, такой как акрилоил, пропиолоил, метакрилоил, кротоноил или изокротоноил группы; C6-C10арилкарбонилгруппой, необязательно замещенной галогеном, C1-C4 алкилом, C1-C4 алкокси, C1-C4 алкоксикарбонилом, C6-C10арилом или нитро, такой как бензоил, α- -нафтоил, β- нафтоил, 2-фторбензоил, 2-бромбензоил, 2,4-дихлорбензоил, 6-хлор-α-нафтоил, 4-толуоил, 4-пропилбензоил, 4-трет-бутилбензоил, 2,4,6-триметилбензоил, 6-этил-α-нафтоил, 4-анизоил, 4-пропоксибензоил, 4-трет-бутоксибензоил, 6-этокси-α-нафтоил, 2-этоксикарбонилбензоил, 4-трет-бутоксикарбонилбензоил, 6-метоксикарбонил-α-нафтоил, 4-фенилбензоил, 4-фенил-α-нафтоил, 6-α-нафтилбензоил, 4-нитробензоил, 2-нитробензоилгруппа или 6-нитро-α-нафтоилгруппы; C1-C4 алкоксикарбонилгруппой, необязательно замещенной галогеном или три C1-C4 алкилсилилом, такой как метоксикарбонил, этоксикарбонил, пропоксикарбонил, изопропоксикарбонил, бутоксикарбонил, изобутоксикарбонил, втор-бутоксикарбонил, трет-бутоксикарбонил, хлорметоксикарбонил, 2,2,2-трихлорэтоксикарбонил, 2-фторпропоксикарбонил, 2-бром-трет-бутоксикарбонил, 2,2-дибром-трет- бутоксикарбонил, триэтилсилилметоксикарбонил, 2-триметилсилилэтоксикарбонил, 4-трипропилсилилбутоксикарбонил или трет-бутилдиметилсилилпропоксикарбонилгруппы; C2-C5 алкенилоксикарбонилгруппой, такой как винилоксикарбонил, аллилоксикарбонил, 1,3-бутадиенилоксикарбонил или 2-пентенилоксикарбонилгруппы; арилдикарбонилгруппой, такой как фталоилгруппа; аралкилгруппой, такой как бензил, фенетил, 3-фенилпропил, 4-фенилбутил, α-нафтилметил, β-нафтилметил, дифенилметил, трифенилметил или α-нафтилдифенилметилгруппа или 9-антрилметилгруппы; или C7-C15аралкилоксикарбонилгруппой, необязательно замещенной метокси или нитро, такой как бензилоксикарбонил, (1-фенил)бензилоксикарбонил, α-нафтилметоксикарбонил, β-нафтилметоксикарбонил, 9-антрилметоксикарбонил, п-метоксибензилоксикарбонил или п-нитробензилоксикарбонилгруппы, предпочтительны C1-C4 алканоил; трифторацетил; метоксиацетил; бензoилгpуппa; α-нaфтoил; β-нaфтoил; анизоил; нитробензоил; C1-C4 алкоксикарбонил; метоксикарбонил; этоксикарбонил; трет-бутоксикарбонил; 2,2,2-трихлорэтоксикарбонил, триэтилсилилметоксикарбонил; 2-триметилсилилэтоксикарбонил; винилоксикарбонилгруппа; аллилоксикарбонил; фталоил; бензил; бензилоксикарбонил или нитробензилоксикарбонилгруппы, более предпочтительны формил, ацетил, бензоил, 4-анизоил, 4-нитробензоил, метоксикарбонил, этоксикарбонил, бутоксикарбонил, трет-бутоксикарбонил, фталоил, бензил, бензилоксикарбонил или п-нитробензилоксикарбонилгруппы, наиболее предпочтительна трет-бутоксикарбонилгруппа.
Уходящая группа Y ничем особенно не лимитируется, пока это обычная уходящая группа, как нуклеофильная остаточная группа, и может быть, например, атомом галогена, таким как атомы хлора, брома и иода; C1-C4 алкансульфонилоксигруппой, такой как метансульфонилокси, этансульфонилокси, пропансульфонилокси или бутансульфонилоксигруппы; галоген-C1-C4 алкансульфонилоксигруппой, такой как трифторметансульфонилокси, 2,2,2-трихлорэтансульфонилокси, 3,3,3-трибромпропансульфонилокси или 4,4,4-трифторбутансульфонилоксигруппы; или C6-C10 арилсульфонилоксигруппой, необязательно имеющей от одного до трех C1-C4 алкилов, такой как бензолсульфонилокси, α-нафтилсульфонилокси, β-нафтилсульфонилокси, п-толуолсульфонилокси, 4-трет-бутилбензолсульфонилокси, мезитиленсульфонилокси или 6-этил-α-нафтилсульфонилоксигруппы, и предпочтительны атомы хлора, брома или иода, метансульфонилокси, этансульфонилокси, трифторметансульфонилокси, 2,2,2-трихлорэтансульфонилокси, бензолсульфонилокси, толуолсульфонилокси или мезитиленсульфонилоксигруппы, более предпочтительны атомы хлора, брома или иода, метансульфонилокси, трифторметансульфонилокси, бензолсульфонилокси, п-толуолсульфонилокси или мезитиленсульфонилоксигруппы.
Атомом галогена Z могут быть, например, атомы фтора, хлора, брома или иода и предпочтительно атом хлора.
Способ A является способом синтеза соединения общей формулы (I).
На стадии A1 соединение формулы (III) получают путем реакции соединения (II) с агентом галогенирования в инертном растворителе или без растворителя (предпочтительно в инертном растворителе) в присутствии основания или без него (предпочтительно в присутствии основания).
Используемый растворитель специально не ограничивается, если он не мешает реакции и может растворять определенное количество исходного материала. Примерами подходящих растворителей могут быть алифатические углеводороды, такие как гексан, гептан, лигроин или петролейный эфир; ароматические углеводороды, такие как бензол, толуол или ксилол; галогенированные углеводороды, такие как метиленхлорид, хлороформ, четыреххлористый углерод, дихлорэтан, хлорбензол или дихлорбензол; или простые эфиры, такие как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран, диоксан, диметоксиэтан или диметиловый эфир диэтиленгликоля, предпочтительно галогенированные углеводороды (в частности, метиленхлорид) или простые эфиры (в частности, тетрагидрофуран или диоксан).
Используемым основанием могут быть, например, карбонаты щелочных металлов, такие как карбонат натрия, карбонат калия или карбонат лития; кислые карбонаты (гидрокарбонаты) щелочных металлов, такие как гидрокарбонат натрия, гидрокарбонат калия или гидрокарбонат лития; или органические амины, такие как триэтиламин, трибутиламин, диизопропилэтиламин, N-метилморфолин, пиридин, 4-(N, N-диметиламино)пиридин, N,N-диметиланилин, N,N-диэтиланилин, 1,5-диазабицикло[4.3.0]нон-5-ен (DBN), 1,4-диазабицикло-[2.2.2]октан (DABCO) или 1,8-диазабицикло[5.4.0] ундец-7-ен (DBU), предпочтительно карбонаты щелочных металлов или органические амины, более предпочтительно органические амины (в частности, триэтиламин или пиридин).
Агентом галогенирования для использования здесь может быть, например, оксихлорид фосфора, оксибромид фосфора, оксииодид фосфора или пентахлорид фосфора или их смесь, предпочтительно оксихлорид фосфора, пентахлорид фосфора или их смесь.
Температура реакции может варьироваться в зависимости от природы исходного материала и реагента и обычно составляет от 0oC до 150oC, предпочтительно от 10 до 100oC.
Время реакции может изменяться в зависимости от природы исходного материала, реагента и температуры реакции и обычно равно от 30 мин до 10 ч, предпочтительно от 1 до 5 ч.
После завершения реакции целевое соединение этой стадии выделяют из реакционной смеси обычным методом. Например, целевое соединение получают путем удаления растворителя испарением, добавления воды к реакционной смеси, добавления гидрофобного растворителя (например, бензола, простого эфира, этилацетата и т.п.) к полученной смеси для экстрагирования целевого соединения, промывания экстрагированного органического слоя водой, сушки его над безводным сульфатом магния и удаления растворителя испарением. Полученное таким образом целевое соединение может быть подвергнуто дальнейшей очистке, если необходимо, обычным методом, например путем перекристаллизации, повторного осаждения или хроматографии.
На стадии A2 соединение формулы (V) получают путем взаимодействия соединения (III) с соединением общей формулы (IV) в инертном растворителе в присутствии основания.
Используемый растворитель специально не ограничивается, если он не мешает реакции и может растворять определенное количество исходного материала. Примерами подходящих растворителей могут быть алифатические углеводороды, такие как гексан, гептан, лигроин или петролейный эфир; ароматические углеводороды, такие как бензол, толуол или ксилол; галогенированные углеводороды, такие как метиленхлорид, хлороформ, четыреххлористый углерод, дихлорэтан, хлорбензол или дихлорбензол; простые эфиры, такие как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран, диоксан, диметоксиэтан или диметиловый эфир диэтиленгликоля; амиды, такие как формамид, диметилформамид, диметилацетамид или гексаметилфосфорный триамид; или сульфоксиды, такие как диметилсульфоксид или сульфолан, предпочтительно простые эфиры (в частности, диэтиловый эфир, тетрагидрофуран или диоксан) или амиды (в частности, диметилформамид).
Используемым основанием могут быть, например, карбонаты щелочных металлов, такие как карбонат натрия, карбонат калия или карбонат лития; кислые карбонаты (гидрокарбонаты) щелочных металлов, такие как гидрокарбонат натрия, гидрокарбонат калия или гидрокарбонат лития; гидриды щелочных металлов, такие как гидрид лития, гидрид натрия или гидрид калия; гидроксиды щелочных металлов, такие как гидроксид натрия, гидроксид калия или гидроксид лития; органические амины, такие как триэтиламин, трибутиламин, диизопропилэтиламин, N-метилморфолин, пиридин, 4-(N,N-диметиламино) пиридин, N,N-диметиланилин, N, N-диэтиланилин, 1,5-диазабицикло[4.3.0]нон-5-ен (DBN), 1,4-диазабицикло-[2.2.2] октан (DABCO) или 1,8-диазабицикло[5.4.0] ундец-7-ен (DBU); алкиллитий, такой как метиллитий, этиллитий или бутиллитий; или алкиламиды лития, такие как диизопропиламид лития, или дициклогексиламид лития, предпочтительно карбонаты щелочных металлов, гидриды щелочных металлов или органические амины, более предпочтительно карбонаты щелочных металлов (в частности, карбонат натрия или карбонат калия) или гидриды щелочных металлов (в частности, гидрид натрия).
В данном случае, для более эффективного проведения реакции к реакционной смеси могут быть также добавлены простые краун-эфиры, такие как дибензо-18-краун-6.
Температура реакции может варьироваться в зависимости от природы исходного материала и реагента и обычно составляет от -10oC до 150oC, предпочтительно от 0oC до 80oC.
Время реакции может изменяться в зависимости от природы исходного материала, реагента и температуры реакции и обычно равно от 30 мин до 30 ч, предпочтительно от 1 до 10 ч.
После завершения реакции целевое соединение этой стадии выделяют из реакционной смеси обычным методом. Например, целевое соединение получают путем соответствующей нейтрализации реакционной смеси, удаления нерастворимых веществ фильтрованием, если необходимо, в случае, когда присутствуют нерастворимые вещества, удалением растворителя испарением, добавления воды к реакционной смеси, добавления гидрофобного растворителя (например, бензола, простого эфира, этилацетата и т.п.) к полученной смеси для экстрагирования целевого соединения, промывания экстрагированного органического слоя водой, сушки органического слоя, содержащего желательный продукт, над безводным сульфатом магния и удаления растворителя испарением. Полученное таким образом целевое соединение может быть подвергнуто дальнейшей очистке, если необходимо, обычным методом, например путем перекристаллизации, повторного осаждения или хроматографии.
На стадии A3 соединение общей формулы (I) получают путем удаления защитной группы аминогруппы или алкиламиногруппы, если необходимо.
Удаление защитной группы аминогруппы варьируется в зависимости от вида ее, и его осуществляют обычно следующим образом, обычным методом в органической химии.
В случае, когда защитной группой аминогруппы является C1-C6 алканоилгруппа (предпочтительно формил или ацетилгруппы); C6-C10 арилкарбонилгруппа (предпочтительно бензоилгруппа); C1-C4 алкоксикарбонилгруппа, необязательно замещенная галогеном или три- C1-C4 алкилсилилгруппой (предпочтительно метоксикарбонил, этоксикарбонил, трет-бутоксикарбонил, 2-триметилсилилэтоксикарбонил, 2-бром-трет-бутоксикарбонил или 2,2-дибром-трет-бутоксикарбонилгруппы); C2-C5 алкенилоксикарбонилгруппа (предпочтительно винилоксикарбонилгруппа); или C7-C15 аралкилоксикарбонилгруппа, необязательно замещенная метокси или нитро (предпочтительно бензилоксикарбонил, (1-фенил)бензилоксикарбонил, 9-антрил-метоксикарбонил, п-метоксибензилоксикарбонил или п-нитробензилоксикарбонилгруппы), она может быть удалена путем обработки ее кислотой в инертном растворителе или водном растворителе. Кроме того, в этом случае целевое соединение может быть также получено как соль. Кислотой для использования здесь может быть, например, такая кислота, как хлороводородная кислота, серная кислота, фосфорная кислота, бромоводородная кислота или трифторуксусная кислота, предпочтительно хлороводородная кислота, серная кислота, бромоводородная кислота или трифторуксусная кислота.
Используемый растворитель специально не ограничивается, если он не мешает реакции и может растворять определенное количество исходного материала. Примерами подходящих растворителей могут быть алифатические углеводороды, такие как гексан, гептан, лигроин или петролейный эфир; ароматические углеводороды, такие как бензол, толуол или ксилол; галогенированные углеводороды, такие как метиленхлорид, хлороформ, четыреххлористый углерод, дихлорэтан, хлорбензол или дихлорбензол; простые эфиры, такие как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран, диоксан, диметоксиэтан или диметиловый эфир диэтиленгликоля; сложные эфиры, такие как метилацетат или этилацетат; спирты, такие как метанол, этанол, пропанол, изопропанол или бутанол; амиды, такие как формамид, диметилформамид, диметилацетамид или гексаметилфосфорный триамид; сульфоксиды, такие как диметилсульфоксид или сульфолан; алифатические кислоты, такие как муравьиная кислота или уксусная кислота; вода; или водная смесь вышеуказанного растворителя, предпочтительно галогенированные углеводороды, простые эфиры, спирты, алифатические кислоты или водная смесь вышеуказанного растворителя, более предпочтительно галогенированные углеводороды (в частности, метиленхлорид), простые эфиры (в частности, тетрагидрофуран или диоксан), алифатические кислоты (в частности, уксусная кислота), вода или водная смесь вышеуказанного растворителя.
Температура реакции может варьироваться в зависимости от природы исходного материала, используемого растворителя или кислоты и обычно составляет от -10oC до 150oC, предпочтительно от 0oC до 60oC.
Время реакции может изменяться в зависимости от природы исходного материала, используемого растворителя или кислоты и обычно равно от 5 мин до 20 ч, предпочтительно от 10 мин до 5 ч.
После завершения реакции целевое соединение этой стадии выделяют из реакционной смеси обычным методом. Например, целевое соединение получают собиранием осажденного целевого соединения в реакционной смеси путем фильтрования или соответствующей нейтрализации реакционной смеси, удаления растворителя испарением, добавления воды к реакционной смеси, добавления гидрофобного растворителя (например, бензола, простого эфира, этилацетата и т.п.) к полученной смеси для экстрагирования целевого соединения, промывания экстрагированного органического слоя водой, сушки органического слоя, содержащего целевое соединение, над безводным сульфатом магния и удаления растворителя испарением. Полученное таким образом целевое соединение может быть подвергнуто дальнейшей очистке, если необходимо, путем обычной методики, например путем перекристаллизации, повторного осаждения или хроматографии.
В случае, когда защитной группой аминогруппы является алканоил, арилкарбонил, алкенилоксикарбонил, арилдикарбонил, аралкил или аралкилоксикарбонил, она может быть удалена путем обработки основанием в инертном растворителе или водном растворителе.
Используемым основанием могут быть, например, карбонат щелочного металла, такой как карбонат натрия, карбонат калия или карбонат лития; кислый карбонат (гидрокарбонат) щелочного металла, такой как гидрокарбонат натрия, гидрокарбонат калия или гидрокарбонат лития; гидрид щелочного металла, такой как гидрид лития, гидрид натрия или гидрид калия; гидроксид щелочного металла, такой как гидроксид натрия, гидроксид калия или гидроксид лития; алкоксид щелочного металла, такой как метоксид натрия, этоксид натрия, трет-бутоксид калия или метоксид лития; меркаптид щелочного металла, такой как метилмеркаптид натрия или этилмеркаптид натрия, предпочтительно карбонаты щелочных металлов (в частности, карбонат натрия или карбонат калия) или гидроксиды щелочных металлов (в частности, гидроксид натрия или гидроксид калия), алкоксиды щелочных металлов (в частности, метоксид натрия, этоксид натрия или трет-бутоксид калия) или органические амины (в частности, гидразин или метиламин).
Используемый растворитель специально не ограничивается, если он не мешает реакции и может растворять определенное количество исходного материала. Примерами подходящих растворителей могут быть алифатические углеводороды, такие как гексан, гептан, лигроин или петролейный эфир; ароматические углеводороды, такие как бензол, толуол или ксилол; простые эфиры, такие как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран, диоксан, диметоксиэтан или диметиловый эфир диэтиленгликоля; спирты, такие как метанол, этанол, пропанол, изопропанол или бутанол; амиды, такие как диметилацетамид или гексаметилфосфорный триамид; сульфоксиды, такие как диметилсульфоксид или сульфолан, или водная смесь вышеуказанного растворителя, предпочтительно галогенированные углеводороды, простые эфиры, спирты или водная смесь вышеуказанного растворителя, более предпочтительно простые эфиры (в частности, тетрагидрофуран или диоксан), спирты (в частности, метанол или этанол) или водная смесь вышеуказанного растворителя.
Температура реакции может варьироваться в зависимости от природы исходного материала, используемого растворителя или основания и обычно составляет от -10oC до 150oC, предпочтительно от 0oC до 50oC.
Время реакции может изменяться в зависимости от природы исходного материала, используемого растворителя или основания и обычно равно от 30 мин до 20 ч, предпочтительно от 1 до 5 ч.
После завершения реакции целевое соединение этой стадии выделяют из реакционной смеси обычным методом. Например, целевое соединение получают отделением осажденного целевого соединения от реакционной смеси путем фильтрования или удаления растворителя испарением, добавления воды к реакционной смеси, отделения осадка от смеси фильтрованием или добавления гидрофобного растворителя (например, бензола, простого эфира, этилацетата и т.п.) к полученной смеси для экстрагирования целевого соединения, промывания экстрагированного органического слоя, содержащего целевое соединение, водой, сушки его над безводным сульфатом магния и удаления растворителя испарением. Полученное таким образом целевое соединение может быть подвергнуто дальнейшей очистке, если необходимо, путем обычной методики, например путем перекристаллизации, повторного осаждения или хроматографии.
Далее, в случае, когда защитной группой аминогруппы является трет-бутоксикарбонилгруппа, она может быть удалена путем обработки силил-соединением или кислотой особенно в инертном растворителе.
Силил-соединением для использования здесь может быть, например, триметилсилилхлорид, триметилсилилиодид или триметилсилил-трифторметансульфонат.
Используемой здесь кислотой может быть, например, хлорид алюминия, хлороводородная кислота или трифторуксусная кислота.
Используемый растворитель специально не ограничивается, если он не мешает реакции и может растворять определенное количество исходного материала. Примерами подходящих растворителей могут быть галогенированные углеводороды, такие как метиленхлорид, хлороформ или четыреххлористый углерод; простые эфиры, такие как диэтиловый эфир, тетрагидрофуран или диоксан, и нитрилы, такие как ацетонитрил, предпочтительно галогенированные углеводороды (в частности, метиленхлорид или хлороформ) или нитрилы (в частности, ацетонитрил).
Температура реакции может варьироваться в зависимости от природы исходного материала, реагента или растворителя и обычно составляет от -20oC до 100oC, предпочтительно от 0oC до 50oC.
Время реакции может изменяться в зависимости от природы исходного материала, реагента, растворителя или температуры реакции и обычно равно от 10 мин до 10 ч, предпочтительно от 30 мин до 3 ч.
После завершения реакции целевое соединение этой стадии выделяют из реакционной смеси обычным методом. Например, целевое соединение получают отделением осажденного желаемого соединения от реакционной смеси путем фильтрования или добавления воды к реакционной смеси, подщелачивания водного слоя для отделения осажденного соединения от смеси путем фильтрования или добавления гидрофобного растворителя (например, бензола, простого эфира, этилацетата и т.п.) к полученной смеси для экстрагирования желаемого соединения, промывания органического слоя, содержащего желаемое соединение, водой, сушки его над безводным сульфатом магния и удаления растворителя испарением. Полученное таким образом целевое соединение может быть подвергнуто дальнейшей очистке, если необходимо, обычным способом, например путем перекристаллизации, повторного осаждения или хроматографии.
Далее, в случае, когда защитной группой аминогруппы является аллилоксикарбонилгруппа, она может быть удалена с использованием палладия и трифенилфосфина или тетракарбонилникеля в условиях реакции, таких как растворитель, температура реакции, время реакции и тому подобное, подобных условиям реакции удаления аралкилгруппы и т.п. каталитическим восстановительным реагентом.
В случае, когда защитной группой аминогруппы является аралкилгруппа или C7-C11 аралкилкарбонилгруппа, защитная группа легко может быть удалена путем контактирования ее с восстановителем (предпочтительно каталитической реакцией гидрирования в присутствии катализатора) в инертном растворителе или путем взаимодействия удаления с использованием окислителя.
В случае реакции удаления защитной группы путем каталитической реакции гидрирования при каталитическом восстановлении, используемый растворитель специально не ограничивается, если он не мешает данной реакции. Примерами подходящих растворителей могут быть алифатические углеводороды, такие как гексан или циклогексан; ароматические углеводороды, такие как толуол, бензол или ксилол; простые эфиры, такие как диэтиловый эфир, тетрагидрофуран или диоксан; сложные эфиры, такие как этилацетат или пропилацетат; спирты, такие как метанол, этанол или изопропанол; алифатические кислоты, такие как муравьиная кислота или уксусная кислота, или водная смесь вышеуказанного растворителя, предпочтительно алифатические углеводороды, простые эфиры, сложные эфиры, спирты, алифатические кислоты или водная смесь вышеуказанного растворителя, более предпочтительно спирты (в частности, метанол или этанол), алифатические кислоты (в частности, муравьиная кислота или уксусная кислота) или водная смесь вышеуказанного растворителя.
Используемый катализатор специально не ограничивается, если он не мешает реакции каталитического восстановления. Примерами подходящих катализаторов могут быть палладиевая чернь, палладий- углерод, никель Ренея, родий-оксид алюминия или палладий-сульфат бария, предпочтительно палладий-углерод или никель Ренея.
Давление водорода конкретно не ограничивается, и обычно оно между 1 и 10 атмосферным давлением, предпочтительно 1-атмосферное давление.
Температура реакции может варьироваться в зависимости от природы исходного материала, используемого растворителя или восстановителя и обычно составляет от 0oC до 100oC, предпочтительно от 0oC до 50oC.
Время реакции может изменяться в зависимости от природы исходного материала, растворителя, восстановителя или температуры реакции и обычно равно от 15 мин до 10 ч, предпочтительно от 30 мин до 3 ч.
После завершения реакции целевое соединение этой стадии выделяют из реакционной смеси обычным методом. Например, целевое соединение получают путем удаления катализатора фильтрованием, удаления растворителя испарением, добавления воды к реакционной смеси, подщелачивания водного слоя для отделения осадка от смеси путем фильтрования или добавления гидрофобного растворителя (например, бензола, простого эфира, этилацетата и т.п.) к полученной смеси для экстрагирования желаемого соединения, промывания органического слоя, содержащего желаемое соединение, водой, сушки его над безводным сульфатом магния и удаления растворителя испарением. Полученное таким образом целевое соединение может быть подвергнуто дальнейшей очистке, если необходимо, обычным способом, например путем перекристаллизации, повторного осаждения или хроматографии.
При реакции удаления защитной группы путем окисления используемый растворитель специально не ограничивается, если он не мешает реакции. Примерами подходящих растворителей могут быть кетоны, такие как ацетон; галогенированные углеводороды, такие как метиленхлорид, хлороформ или четыреххлористый углерод; нитрилы, такие как ацетонитрил; простые эфиры, такие как диэтиловый эфир, тетрагидрофуран или диоксан; амиды, такие как диметилформамид, диметилацетамид или гексаметилфосфорный триатмид; сульфоксиды, такие как диметилсульфоксид, или водная смесь вышеуказанного растворителя, предпочтительно кетоны, галогенированные углеводороды, нитрилы, простые эфиры, амиды, сульфоксиды или водная смесь вышеуказанного растворителя, более предпочтительно кетоны (в частности, ацетон), галогенированные углеводороды (в частности, метиленхлорид), нитрилы (в частности, ацетонитрил), амиды (в частности, гексаметилфосфорный триамид), сульфоксиды (в частности, диметилсульфоксид) или водная смесь вышеуказанного растворителя.
Окислителем для использования здесь может быть, например, персульфат калия, персульфат натрия, нитрат церия-аммония (CAN) или 2,3-дихлор-5,6-дициано-п-бензохинон (DDQ), предпочтительно нитрат церия-аммония (CAN) или 2,3-дихлор-5,6-дициано-п-бензохинон (DDQ).
Температура реакции может варьироваться в зависимости от природы исходного материала, используемого растворителя или окислителя и обычно составляет от 0oC до 150oC, предпочтительно от 10 до 50oC.
Время реакции может изменяться в зависимости от природы исходного материала, растворителя и окислителя и обычно равно от 15 мин до 24 ч, предпочтительно от 30 мин до 5 ч.
После завершения реакции целевое соединение этой стадии выделяют из реакционной смеси обычным методом. Например, целевое соединение получают путем удаления окислителя фильтрованием, удаления растворителя испарением, добавления воды к реакционной смеси, подщелачивания водного слоя для отделения осадка путем фильтрования или добавления гидрофобного растворителя (например, бензола, простого эфира, этилацетата и т.п.) к полученной смеси для экстрагирования желаемого соединения, промывания органического слоя, содержащего желаемое соединение, водой, сушки его над безводным сульфатом магния и удаления растворителя испарением. Полученное таким образом целевое соединение может быть подвергнуто дальнейшей очистке, если необходимо, обычным способом, например путем перекристаллизации, повторного осаждения или хроматографии.
Кроме того, в случае, когда защитную группу аминогруппы удаляют с помощью кислоты, желаемое соединение обычно получают в форме соли, но аминогруппа желаемого соединения может быть переведена в форму свободного основания путем удаления использованной кислоты, обычным методом в органической химии.
Способ B является альтернативным способом синтеза соединения (Va), где X обозначает атом кислорода в промежуточном соединении (V) Процесса A.
На стадии B1 соединение формулы (Va) получают путем взаимодействия соединения формулы (II) с соединением формулы (IVa).
В случае, когда Y обозначает гидроксильную группу, реакцию проводят путем дегидратации-конденсации между соединением (II) и соответствующим соединением (IVA) в инертном растворителе в присутствии фосфин-соединения и азосоединения, как проводят на основе реакции Mitsunobu, описанной в Bull. Chem. Soc. Jap., 40, 2380 (1967).
Используемый растворитель специально не ограничивается, если он не мешает реакции и может растворять определенное количество исходного материала. Примерами подходящих растворителей могут быть алифатические углеводороды, такие как гексан, гептан, лигроин или петролейный эфир; ароматические углеводороды, такие как бензол, толуол или ксилол; галогенированные углеводороды, такие как метиленхлорид, хлороформ, четыреххлористый углерод, дихлорэтан, хлорбензол или дихлорбензол; или простые эфиры, такие как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран, диоксан, диметоксиэтан или диметиловый эфир диэтиленгликоля, предпочтительно алифатические углеводороды, ароматические углеводороды или простые эфиры, более предпочтительно простые эфиры (в частности, диэтиловый эфир или тетрагидрофуран).
Фосфин-соединением для использования здесь может быть, например, три-C1-C6 алкилфосфин, такой как триметилфосфин, триэтилфосфин, трипропилфосфин, трибутилфосфин, трипентилфосфин или тригексилфосфин; три-C6-C10 арилфосфин, такой как трифенилфосфин, триинденилфосфин или тринафтилфосфин; или три-C6-C10 арилфосфин, необязательно имеющий C1-C4 алкил в качестве заместителя, такой как толилдифенилфосфин, тритолилфосфин, тримезитилфосфин, трибутилфенилфосфин или три-6-этил-2-нафтилфосфин, предпочтительно тpи-C1-C6 алкилфосфины (в частности, триметилфосфин, триэтилфосфин, трипропилфосфин или трибутилфосфин) или три-C6-C10 арилфосфин (в частности, трифенилфосфин, триинденилфосфин или тринафтилфосфин, более предпочтительно три-C6-C10 арилфосфины (в частности, трифенилфосфин).
Азосоединение для использования здесь конкретно не ограничивается, пока оно является известным производным азодикарбоновой кислоты, и может быть, например, ди-C1-C4 алкил-азодикарбоксилатом, таким как диметил-азодикарбоксилат, диэтил-азодикарбоксилат, дипропил-азодикарбоксилат или дибутил-азодикарбоксилат, предпочтительно диметил-азодикарбоксилат или диэтил-азодикарбоксилат.
Температура реакции может варьироваться в зависимости от природы исходного материала и реагента и обычно составляет от -10oC до 100oC, предпочтительно от 0oC до 50oC.
Время реакции может изменяться в зависимости от природы исходного материала, реагента и температуры реакции и обычно равно от 15 мин до 48 ч, предпочтительно от 30 мин до 24 ч.
После завершения реакции целевое соединение этой стадии выделяют из реакционной смеси обычным методом. Например, целевое соединение получают путем удаления фильтрованием нерастворимых веществ, когда они присутствуют, или добавления воды к остатку, полученному путем удаления растворителя испарением, добавления гидрофобного растворителя (например, бензола, простого эфира, этилацетата и т.п.) к полученной смеси для осуществления экстракции, промывания экстракта водой, сушки над безводным сульфатом магния и удаления растворителя испарением. Полученное таким образом целевое соединение может быть подвергнуто дальнейшей очистке, если необходимо, обычным способом, например путем перекристаллизации, повторного осаждения или хроматографии.
В случае, когда Y обозначает уходящую группу, соединение (Va) может быть получено путем взаимодействия соединения (II) с соответствующим соединением (IVa) в присутствии основания в инертном растворителе.
Используемый растворитель специально не ограничивается, если он не мешает реакции и может растворять определенное количество исходного материала. Примерами подходящих растворителей могут быть алифатические углеводороды, такие как гексан, гептан, лигроин или петролейный эфир; ароматические углеводороды, такие как бензол, толуол или ксилол; галогенированные углеводороды, такие как метиленхлорид, хлороформ, четыреххлористый углерод, дихлорэтан, хлорбензол или дихлорбензол; простые эфиры, такие как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран, диоксан, диметоксиэтан или диметиловый эфир диэтиленгликоля; амиды, такие как формамид, диметилформамид, диметилацетамид или гексаметилфосфорный триамид; или сульфоксиды, такие как диметилсульфоксид или сульфолан, предпочтительно амиды и сульфоксиды, более предпочтительно амиды (в частности, диметилформамид, диметилацетамид или гексаметилфосфорный триамид).
Используемым основанием может быть, например, карбонат щелочного металла, такой как карбонат натрия, карбонат калия или карбонат лития; кислый карбонат щелочного металла, такой как гидрокарбонат натрия, гидрокарбонат калия или гидрокарбонат лития; гидрид щелочного металла, такой как гидрид лития, гидрид натрия или гидрид калия; гидроксид щелочного металла, такой как гидроксид натрия, гидроксид калия или гидроксид лития; алкоксид щелочного металла, такой как метоксид натрия, этоксид натрия, трет-бутоксид калия или метоксид лития; меркаптид щелочного металла, такой как метилмеркаптид натрия или этилмеркаптид натрия; органический амин, такой как триэтиламин, трибутиламин, диизопропилэтиламин, N-метилморфолин, пиридин, 4-(N,N-диметиламино)пиридин, N, N-диметиланилин, N, N-диэтиланилин, 1,5-диазабицикло [4.3.0] нон-5-ен (DBN), 1,4-диазабицикло[2.2.2]октан (DABCO) или 1,8-диазабицикло [5.4.0]ундец-7-ен (DBU); алкиллитий, такой как метиллитий, этиллитий или бутиллитий; или алкиламиды лития, такие как диизопропиламид лития или дициклогексиламид лития, предпочтительно карбонаты щелочных металлов, гидриды щелочных металлов или гидроксиды щелочных металлов, более предпочтительно гидриды щелочных металлов (в частности, гидрид натрия).
Для улучшения реакции может быть добавлен простой краун-эфир, такой как дибензо-18-краун-6.
Температура реакции может варьироваться в зависимости от природы исходного материала, реагента и т.п. и обычно составляет от -10oC до 100oC, предпочтительно от 0oC до 50oC.
Время реакции может изменяться в зависимости от природы исходного материала, реагента и температуры реакции и обычно равно от 30 мин до 20 ч, предпочтительно от 1 до 5 ч.
После завершения реакции целевое соединение этой стадии выделяют из реакционной смеси обычным методом. Например, целевое соединение получают путем соответствующей нейтрализации реакционной смеси, удаления нерастворимых веществ фильтрованием в случае, когда они присутствуют, удаления растворителя испарением, добавления воды к реакционной смеси, добавления гидрофобного растворителя (например, бензола, простого эфира, этилацетата и т. п. ) к полученной смеси для осуществления экстракции, промывания органического слоя, содержащего целевое соединение, водой, сушки его над безводным сульфатом магния и удаления растворителя испарением. Полученное таким образом целевое соединение может быть подвергнуто дальнейшей очистке, если необходимо, обычным методом, например путем перекристаллизации, повторного осаждения или хроматографии.
Способ C является альтернативным способом синтеза соединения (1) способа A.
Стадию C1 проводят, если необходимо, и она включает
реакцию (a): реакция, по которой алкилгруппу, алкоксигруппу или карбоксилгруппу вводят в кольцо изоксазола или ароматическое кольцо, включенное в R1,
реакцию (b): реакция, по которой гидроксиалкилгруппу вводят в кольцо изоксазола или ароматическое кольцо, включенное в R1,
реакцию (c): реакция, по которой гидроксильную группу, заключенную в гидроксиалкилгруппе, полученной путем взаимодействия (b), превращают в атом галогена,
реакцию (d): реакция, по которой гидроксильную группу, заключенную в гидроксиалкилгруппе, полученной путем взаимодействия (b), подвергают реакции 1,2-элиминирования (β-элиминирование),
реакцию (e): реакция, по которой гидроксиалкилгруппу, полученную путем реакции (b), превращают в карбонилгруппу,
реакцию (f): реакция, по которой карбоксильную группу этерифицируют,
реакцию (g): реакция, по которой алкоксикарбонильную группу превращают в карбамоилгруппу,
реакцию (h): реакция, по которой карбоксильную группу превращают в карбамоилгруппу,
реакцию (i): реакция, по которой карбамоилгруппу превращают в цианогруппу,
реакцию (j): реакция, по которой алкоксигруппу на ароматическом кольце превращают в гидроксильную группу,
реакцию (k): реакция, по которой гидроксильную группу или аминогруппу подвергают взаимодействию ацилирования,
реакцию (l): реакция, по которой гидроксильную группу или аминогруппу подвергают взаимодействию аралкилирования,
реакцию (m): реакция, по которой нитрогруппу превращают в аминогруппу, и
реакцию (n): реакция, по которой удаляют защитную группу аминогруппы, включенной в Ra3.
Эти реакции проводят подходящим образом в любом порядке.
Реакция (а):
Реакцию, по которой алкилгруппу, алкоксигруппу или карбоксилгруппу вводят в кольцо изоксазола или ароматическое кольцо в R1, осуществляют обычным методом органической химии. Например, реакцию осуществляют путем взаимодействия галоген-C1-C6 алкана, ди-C1-C6 алкилкарбоната или диоксида углерода (предпочтительно галоген-C1-C6 алкана или диоксида углерода) в присутствии основания в инертном растворителе.
Галоген-C1-C6 алканом для использования здесь может быть, например, метилхлорид, метилбромид, метилиодид, этилхлорид, этилиодид, пропилбромид, бутилиодид, пентилиодид или гексилиодид, предпочтительно метилбромид или метилиодид, более предпочтительно метилиодид.
Ди-C1-C6 алкилкарбонатом может быть, например, диметилкарбонат, диэтилкарбонат, дипропилкарбонат, диизопропилкарбонат, дибутилкарбонат, ди-втор-бутилкарбонат, ди-трет-бутилкарбонат, дипентилкарбонат или дигексилкарбонат, предпочтительно диметилкарбонат или диэтилкарбонат.
Используемый растворитель специально не ограничивается, если он не мешает реакции и может растворять определенное количество исходного материала. Примерами подходящих растворителей могут быть алифатические углеводороды, такие как гексан, гептан, лигроин или петролейный эфир; ароматические углеводороды, такие как бензол, толуол или ксилол; галогенированные углеводороды, такие как метиленхлорид, хлороформ, четыреххлористый углерод, дихлорэтан, хлорбензол или дихлорбензол; простые эфиры, такие как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран, диоксан, диметоксиэтан или диметиловый эфир диэтиленгликоля, диамины, такие как N,N,N',N'- тетраметилэтилендиамин; амиды, такие как формамид, диметилформамид, диметилацетамид или гексаметилфосфорный триамид; или сульфоксиды, такие как диметилсульфоксид или сульфолан, предпочтительно простые эфиры, амиды или сульфоксиды, более предпочтительно простые эфиры (в частности, тетрагидрофуран).
Используемым основанием может быть, например, гидрид щелочного металла, такой как гидрид лития, гидрид натрия или гидрид калия; алкиллитий, такой как метиллитий, этиллитий, бутиллитий или втор- бутиллитий; или алкиламид лития, такой как диизопропиламид лития, дициклогексиламид лития, бис(триметилсилил)амид лития, бис(триметилсилил)амид калия или бис(триметилсилил)амид натрия, предпочтительно алкиллитий (в частности, бутиллитий) или алкиламиды лития (в частности, диизопропиламид лития).
Температура реакции может варьироваться в зависимости от природы исходного материала, реагента и т. п. и обычно составляет от -100oC до 30oC, предпочтительно от -70oC до 0oC.
Время реакции может изменяться в зависимости от природы исходного материала, реагента и температуры реакции и обычно равно от 5 мин до 10 ч, предпочтительно от 10 мин до 5 ч.
После завершения реакции целевое соединение этой стадии выделяют из реакционной смеси обычным методом. Например, целевое соединение получают путем удаления растворителя испарением или добавления воды к остатку, полученному путем удаления растворителя испарением, подкисления водного слоя, если желательно, добавления гидрофобного растворителя (например, бензола, простого эфира, этилацетата и т.п.) к полученной смеси для экстрагирования желаемого соединения, промывания экстрагированного органического слоя водой, сушки его над безводным сульфатом магния и удаления растворителя испарением. Полученное таким образом целевое соединение может быть подвергнуто дальнейшей очистке, если необходимо, обычным способом, например путем перекристаллизации, повторного осаждения или хроматографии.
Реакция (b):
Реакцию, по которой гидроксиалкилгруппу вводят в кольцо изоксазола или ароматическое кольцо в R1, осуществляют обычным методом в органической химии. Например, реакцию осуществляют путем взаимодействия соединений с альдегидами или кетонами в присутствии основания в инертном растворителе.
Альдегидами могут быть, например, линейные или разветвленные алканали, имеющие от 2 до 6 атомов углерода, такие как ацетальдегид, пропиональдегид, бутилальдегид, изобутилальдегид, валеральдегид, изовалеральдегид или гексальдегид, предпочтительно C2-C4 алканаль, более предпочтительно ацетальдегид.
Кетонами могут быть, например, линейные или разветвленные алканоны, имеющие от 3 до 6 атомов углерода, такие как ацетон, 2-бутанон, 2-пентанон, 3-пентанон, 3-метил-2-бутанон, 2-гексанон, 3-гексанон, 3-метил-2-пентанон, 4-метил-2-пентанон или 3,3-диметил-2-бутанон, предпочтительно ацетон, 2-бутанон или 3-бутанон, более предпочтительно ацетон.
Используемый растворитель специально не ограничивается, если он не мешает реакции и может растворять определенное количество исходного материала. Примерами подходящих растворителей могут быть алифатические углеводороды, такие как гексан, гептан, лигроин или петролейный эфир; ароматические углеводороды, такие как бензол, толуол или ксилол; галогенированные углеводороды, такие как метиленхлорид, хлороформ, четыреххлористый углерод, дихлорэтан, хлорбензол или дихлорбензол; простые эфиры, такие как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран, диоксан, диметоксиэтан или диметиловый эфир диэтиленгликоля, диамины, такие как N,N,N',N'- тетраметилэтилендиамин; амиды, такие как формамид, диметилформамид, диметилацетамид, гексаметилфосфорный триамид или гексаметилфосфористый триамид; или сульфоксиды, такие как диметилсульфоксид или сульфолан, предпочтительно простые эфиры, амиды или сульфоксиды, более предпочтительно простые эфиры (в частности, тетрагидрофуран).
Используемым основанием может быть, например, гидрид щелочного металла, такой как гидрид лития, гидрид натрия или гидрид калия; алкиллитий, такой как метиллитий, этиллитий, бутиллитий или втор- бутиллитий; или алкиламид лития, такой как диизопропиламид лития, дициклогексиламид лития, бис(триметилсилил)амид лития, бис- (триметилсилил)амид калия или бис(триметилсилил)амид натрия, предпочтительно алкиллитий (в частности, бутиллитий) или алкиламиды лития (в частности, диизопропиламид лития).
Температура реакции может варьироваться в зависимости от природы исходного материала, реагента и т. п. и обычно составляет от -100oC до 30oC, предпочтительно от -70oC до 0oC.
Время реакции может изменяться в зависимости от природы исходного материала, реагента и температуры реакции и обычно равно от 5 мин до 10 ч, предпочтительно от 10 мин до 5 ч.
После завершения реакции целевое соединение этой стадии выделяют из реакционной смеси обычным методом. Например, целевое соединение получают путем удаления растворителя испарением или добавления воды к остатку, полученному путем удаления растворителя испарением, добавления гидрофобного растворителя (например, бензола, простого эфира, этилацетата и т.п.) к полученной смеси для экстрагирования желаемого соединения, промывания экстрагированного органического слоя водой, сушки его над безводным сульфатом магния и удаления растворителя испарением. Полученное таким образом целевое соединение может быть подвергнуто дальнейшей очистке, если необходимо, обычным способом, например путем перекристаллизации, повторного осаждения или хроматографии.
Реакция (с):
Реакцию, по которой гидроксильную группу в гидроксиалкилгруппе, полученной путем взаимодействия (b), превращают в атом галогена, проводят обычным методом органической химии. Например, реакцию осуществляют путем взаимодействия гидроксильной группы с галогенводородной кислотой в инертном растворителе.
Галогенводородной кислотой для использования здесь может быть, например, фтороводородная кислота, хлороводородная кислота, бромоводородная кислота или иодоводородная кислота, предпочтительно хлороводородная кислота.
Используемый растворитель специально не ограничивается, если он не мешает реакции и может растворять определенное количество исходного материала. Примерами подходящих растворителей могут быть алифатические углеводороды, такие как гексан, гептан, лигроин или петролейный эфир; ароматические углеводороды, такие как бензол, толуол или ксилол; галогенированные углеводороды, такие как метиленхлорид, хлороформ, четыреххлористый углерод, дихлорэтан, хлорбензол или дихлорбензол; простые эфиры, такие как диэтиловый эфир,
диизопропиловый эфир, тетрагидрофуран, диоксан, диметоксиэтан или диметиловый эфир диэтиленгликоля, сложные эфиры, такие как метилацетат или этилацетат; вода или водная смесь вышеуказанного растворителя, предпочтительно простые эфиры, амиды или сульфоксиды, более предпочтительно простые эфиры (в частности, диоксан) или смесь простых эфиров и воды.
Температура реакции может варьироваться в зависимости от природы исходного материала и реагента и обычно составляет от -50oC до 80oC, предпочтительно от 0oC до 50oC.
Время реакции может изменяться в зависимости от природы исходного материала, реагента и температуры реакции и обычно равно от 5 мин до 10 ч, предпочтительно от 10 мин до 5 ч.
После завершения реакции целевое соединение этой стадии выделяют из реакционной смеси обычным методом. Например, после реакции целевое соединение получают путем удаления растворителя испарением или добавления воды к остатку, полученному путем удаления растворителя испарением, добавления гидрофобного растворителя (например, бензола, простого эфира, этилацетата и т. п. ) к полученной смеси для экстрагирования желаемого соединения, промывания экстрагированного органического слоя водой, сушки его над безводным сульфатом магния и удаления растворителя испарением. Полученное таким образом целевое соединение может быть подвергнуто дальнейшей очистке, если необходимо, обычным способом, например путем перекристаллизации, повторного осаждения или хроматографии.
Реакция (d):
Реакцию, по которой гидроксильную группу в гидроксиалкил-группе, полученной путем взаимодействия (b), подвергают реакции 1,2-элиминирования (β-элиминирование), проводят обычным методом органической химии. Например, реакцию проводят путем взаимодействия гидроксильной группы с кислотой в инертном растворителе.
Кислотой для использования здесь может быть, например, неорганическая кислота, такая как фтороводородная кислота, хлороводородная кислота, бромоводородная кислота, иодоводородная кислота, азотная кислота, перхлорная кислота, серная кислота или фосфорная кислота; сульфоновая кислота, такая как метансульфоновая кислота, трифторметансульфоновая кислота, этансульфоновая кислота, бензолсульфоновая кислота или п-толуолсульфоновая кислота, или карбоновая кислота, такая как трифторуксусная кислота, фумаровая кислота, янтарная кислота, лимонная кислота, винная кислота, щавелевая кислота или малеиновая кислота, предпочтительно неорганические кислоты (в частности, хлороводородная кислота).
Используемый растворитель специально не ограничивается, если он не мешает реакции и может растворять определенное количество исходного материала. Примерами подходящих растворителей могут быть алифатические углеводороды, такие как гексан, гептан, лигроин или петролейный эфир; ароматические углеводороды, такие как бензол, толуол или ксилол; галогенированные углеводороды, такие как метиленхлорид, хлороформ, четыреххлористый углерод, дихлорэтан, хлорбензол или дихлорбензол; простые эфиры, такие как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран, диоксан, диметоксиэтан или диметиловый эфир диэтиленгликоля, или сложные эфиры, такие как метилацетат или этилацетат; предпочтительно простые эфиры, амиды или сульфоксиды, более предпочтительно простые эфиры или сложные эфиры, более предпочтительно простые эфиры (в частности, диоксан).
Температура реакции может варьироваться в зависимости от природы исходного материала и реагента и обычно составляет от 0oC до 150oC, предпочтительно от 50 до 130oC.
Время реакции может изменяться в зависимости от природы исходного материала, реагента и температуры реакции и обычно равно от 5 мин до 10 ч, предпочтительно от 10 мин до 5 ч.
После завершения реакции целевое соединение этой стадии выделяют из реакционной смеси обычным методом. Например, после реакции целевое соединение получают путем удаления растворителя испарением или добавления воды к остатку, полученному путем удаления растворителя испарением, добавления гидрофобного растворителя (например, бензола, простого эфира, этилацетата и т.п.) к полученной смеси для экстрагирования желаемого соединения, промывания экстрагированного органического слоя водой, сушки его над безводным сульфатом магния и удаления растворителя испарением. Полученное таким образом целевое соединение может быть подвергнуто дальнейшей очистке, если необходимо, обычным способом, например путем перекристаллизации, повторного осаждения или хроматографии.
Реакция (e):
Реакцию, по которой гидроксиалкилгруппу, полученную путем взаимодействия (b), превращают в карбонилгруппу, проводят обычным методом органической химии. Например, реакцию проводят путем взаимодействия гидроксиалкилгруппы с окислителем в инертном растворителе.
Используемый окислитель специально не ограничивается, если его используют для реакции окисления, и им может быть, например, неорганический металлический окислитель, такой как оксиды марганца, например перманганат калия или диоксид марганца; оксид рутения, например тетраоксид рутения; соединение серебра, такое как оксид серебра; соединение хромовой кислоты, например хромат калия, комплекс хромовой кислоты и серной кислоты или комплекс хромовой кислоты и пиридина, или соединение церия, такое как нитрат церия-аммония (CAN); реагент, используемый для окисления DMSO (комплекс диметилсульфоксида и дициклогексилкарбодиимида, оксалилхлорида, уксусного ангидрида или пентоксида фосфора или комплекс пиридина и серного ангидрида); сукцинимид, такой как N-бромсукцинимид; или соединение хинона, такое как 2,3-дихлор-5,6-дициано-п-бензохинон (DDQ), предпочтительно неорганические металлические окислители или реагенты, используемые для окисления DMSO, более предпочтительно неорганические металлические окислители (в частности, комплекс хромовой кислоты и пиридина).
Используемый растворитель специально не ограничивается, если он не мешает реакции и может растворять определенное количество исходного материала. Примерами подходящих растворителей могут быть алифатические углеводороды, такие как гексан, гептан, лигроин или петролейный эфир; ароматические углеводороды, такие как бензол, толуол или ксилол; галогенированные углеводороды, такие как метиленхлорид, хлороформ, четыреххлористый углерод, дихлорэтан, хлорбензол или дихлорбензол; простые эфиры, такие как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран, диоксан, диметоксиэтан или диметиловый эфир диэтиленгликоля; кетоны, такие как ацетон; сложные эфиры, такие как метилацетат или этилацетат; нитрилы, такие как ацетонитрил; амиды, такие как диметилформамид, диметилацетамид или гексаметилфосфорный триамид; сульфоксиды, такие как диметилсульфоксид; или водная смесь вышеуказанного растворителя, предпочтительно галогенированные углеводороды, простые эфиры, кетоны, нитрилы, амиды или сульфоксиды, более предпочтительно галогенированные углеводороды (в частности, метиленхлорид).
Температура реакции может варьироваться в зависимости от природы исходного материала и реагента и обычно составляет от 0oC до 100oC, предпочтительно от 20 до 50oC.
Время реакции может изменяться в зависимости от природы исходного материала, реагента и температуры реакции и обычно равно от 30 мин до 48 ч, предпочтительно от 1 до 30 ч.
После завершения реакции целевое соединение этой стадии выделяют из реакционной смеси обычным методом. Например, целевое соединение получают путем отфильтровывания окислителя, удаления растворителя испарением или добавления воды к остатку, полученному путем удаления растворителя испарением, добавления гидрофобного растворителя (например, бензола, простого эфира, этилацетата и т.п.) к полученной смеси для экстрагирования желаемого соединения, промывания экстрагированного органического слоя водой, сушки его над безводным сульфатом магния и удаления растворителя испарением. Полученное таким образом целевое соединение может быть подвергнуто дальнейшей очистке, если необходимо, обычным способом, например путем перекристаллизации, повторного осаждения или хроматографии.
Реакция (f):
Реакцию, по которой карбоксильную группу этерифицируют, проводят обычным методом органической химии. Например, реакцию проводят путем
(1) реакции с этерифицирующим агентом в инертном растворителе,
(2) реакции с активным этерифицирующим агентом в инертном растворителе, чтобы получить активный сложный эфир, и затем путем взаимодействия активного сложного эфира со спиртом в инертном растворителе или
(3) реакции с галогенирующим агентом в инертном растворителе, чтобы получить галогенангидрид кислоты, и затем путем взаимодействия галогенангидрида кислоты со спиртом.
Этерифицирующий агент в реакции (f1) конкретно не лимитируется, пока он используется, как обычно, в органической химии, и им может быть, например, диазоалкан или триалкилсилилдиазоалкан, предпочтительно C1-C6 диазоалкан, такой как диазометан, диазоэтан, диазопропан, диазобутан, диазопентан или диазогексан, более предпочтительно C1-C4 диазоалкан или триметилсилилдиазоалкан, в частности, предпочтительно диазометан.
Используемый растворитель, в реакции с диазо C1-C6 алканом, специально не ограничивается, если он не мешает реакции и может растворять определенное количество исходного материала. Примерами подходящих растворителей могут быть алифатические углеводороды, такие как гексан, гептан, лигроин или петролейный эфир; ароматические углеводороды, такие как бензол, толуол или ксилол; галогенированные углеводороды, такие как метиленхлорид, хлороформ, четыреххлористый углерод, дихлорэтан, хлорбензол или дихлорбензол; простые эфиры, такие как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран, диоксан, диметоксиэтан или диметиловый эфир диэтиленгликоля, сложные эфиры, такие как метилацетат или этилацетат; или смесь вышеуказанных растворителей, предпочтительно галогенированные углеводороды, простые эфиры, сложные эфиры или смесь вышеуказанных растворителей, более предпочтительно простые эфиры (в частности, диэтиловый эфир), сложные эфиры (в частности, этилацетат) или смесь вышеуказанных растворителей.
Используемый растворитель, в реакции с триметилсилилдиазометаном, специально не ограничивается, если он не мешает реакции и может растворять определенное количество исходного материала. Примерами подходящих растворителей могут быть спирты, такие как метанол, этанол, пропанол, изопропанол, бутанол, изобутанол, трет-бутанол, пентанол или гексанол; или смесь растворителя, выбранного из группы, состоящей из алифатических углеводородов, таких как гексан, гептан, лигроин или петролейный эфир; ароматических углеводородов, таких как бензол, толуол или ксилол; галогенированных углеводородов, таких как метиленхлорид, хлороформ, четыреххлористый углерод, дихлорэтан, хлорбензол или дихлорбензол; простых эфиров, таких как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран, диоксан, диметоксиэтан или диметиловый эфир диэтиленгликоля, и сложных эфиров, таких как метилацетат или этилацетат, и вышеуказанных спиртов, предпочтительно спирты (в частности, метанол) и смесь ароматических углеводородов (в частности, бензола) и спиртов (в частности, метанола).
Температура реакции может варьироваться в зависимости от природы исходного материала и реагента и обычно составляет от -10oC до 100oC, предпочтительно от 10 до 50oC.
Время реакции может изменяться в зависимости от природы исходного материала и реагента и температуры реакции и обычно равно от 10 мин до 10 ч, предпочтительно от 15 мин до 2 ч.
После завершения реакции целевое соединение этой стадии выделяют из реакционной смеси обычным методом. Например, после реакции целевое соединение получают путем удаления растворителя испарением. Полученное таким образом целевое соединение может быть подвергнуто дальнейшей очистке, если необходимо, путем обычной методики, например путем перекристаллизации, повторного осаждения или хроматографии.
Активный этерифицирующий агент, используемый в реакции (f2), специально не ограничивается, если он используется, как обычно, в методах органической химии, и им может быть, например, активный эфир, такой как этилхлорформиат; N-гидроксисоединение, такое как N-гидроксисукцинимид, 1-гидроксибензотриазол или N-гидрокси-5-норборнен-2,3-дикарбоксимид, или дисульфидное соединение, такое как дипиридилдисульфид.
Реакцию этерификации предпочтительно проводят в присутствии агента конденсации, такого как дициклогексилкарбодиимид, карбонилдиимидазол или трифенилфосфин.
Используемый растворитель, в обеих реакциях, специально не ограничивается, если он не мешает реакции и может растворять определенное количество исходного материала. Примерами подходящих растворителей могут быть галогенированные углеводороды, такие как метиленхлорид, хлороформ, четыреххлористый углерод, дихлорэтан, хлорбензол или дихлорбензол; простые эфиры, такие как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран, диоксан, диметоксиэтан или диметиловый эфир диэтиленгликоля, амиды, такие как формамид, диметилформамид, диметилацетамид или гексаметилфосфорный триамид; или нитрилы, такие как ацетонитрил; предпочтительно простые эфиры (в частности, тетрагидрофуран) или амиды (в частности, диметилформамид).
Температура реакции может варьироваться в зависимости от природы исходных материалов и реагентов и обычно составляет от -70oC до 15,0oC (предпочтительно от -10oC до 100oC) в реакции активной этерификации и от -20oC до 100oC (предпочтительно от 0oC до 50oC) в реакции активного соединения сложного эфира со спиртами.
Время реакции может изменяться в зависимости от природы исходных материалов, реагентов и температур реакции и обычно составляет от 30 мин до 80 ч (предпочтительно от 1 до 48 ч) в обеих реакциях.
После завершения реакции целевое соединение этой стадии выделяют из реакционной смеси обычным методом. Например, после реакции целевое соединение получают путем удаления растворителя испарением или добавления воды к остатку, полученному путем удаления растворителя испарением, добавления гидрофобного растворителя (например, бензола, простого эфира, этилацетата и т. п.) к полученной смеси, чтобы экстрагировать желаемое соединение, промывания экстрагированного органического слоя водой, сушки его над безводным сульфатом магния и удаления растворителя испарением. Полученное таким образом целевое соединение может быть подвергнуто дальнейшей очистке, если необходимо, обычным способом, например путем перекристаллизации, повторного осаждения или хроматографии.
Галогенирующий агент, используемый в реакции (f3), специально не ограничивается, если он используется, как обычно, в методах органической химии, и им может быть, например, оксалилхлорид, тионилхлорид, оксихлорид фосфора или пентахлорид фосфора, предпочтительно тионилхлорид.
Используемый растворитель, в обеих реакциях, специально не ограничивается, если он не мешает реакции и может растворять определенное количество исходного материала. Примерами подходящих растворителей могут быть ароматические углеводороды, такие как бензол, толуол или ксилол; галогенированные углеводороды, такие как метиленхлорид, хлороформ, четыреххлористый углерод, дихлорэтан, хлорбензол или дихлорбензол, и простые эфиры, такие как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран, диоксан, диметоксиэтан или диметиловый эфир диэтиленгликоля, предпочтительно простые эфиры (в частности, тетрагидрофуран).
Температура реакции может варьироваться в зависимости от исходных материалов и реагентов и обычно составляет от -70oC до 150oC (предпочтительно от -10oC до 100oC) в реакции галогенирования и от -20oC до 100oC (предпочтительно от 0oC до 50oC) в реакции галогенангидрида кислоты со спиртом.
Время реакции в обеих реакциях может изменяться в зависимости от природы исходных материалов и реагентов и температур реакции и обычно равно от 30 мин до 80 ч (предпочтительно от 1 до 48 ч).
После завершения реакции целевое соединение этой реакции выделяют из реакционной смеси обычным методом. Например, после реакции целевое соединение получают путем удаления растворителя испарением или добавления воды к остатку, полученному путем удаления растворителя испарением, добавления гидрофобного растворителя (например, бензола, простого эфира, этилацетата и т. п.) к полученной смеси, чтобы экстрагировать желаемое соединение, промывания экстрагированного органического слоя водой, сушки его над безводным сульфатом магния и удаления растворителя испарением. Полученное таким образом целевое соединение может быть подвергнуто дальнейшей очистке, если необходимо, обычным способом, например путем перекристаллизации, повторного осаждения или хроматографии.
Реакция (g):
Реакцию, по которой алкоксикарбонилгруппу превращают в карбамоилгруппу в реакции (g), проводят обычным методом в органической химии. Например, реакцию проводят путем взаимодействия алкоксикарбонилгруппы с газообразным аммиаком или конц. аммиаком в воде в инертном растворителе.
Используемый растворитель специально не ограничивается, если он не мешает реакции и может растворять определенное количество исходного материала. Примерами подходящих растворителей могут быть алифатические углеводороды, такие как гексан, гептан, лигроин или петролейный эфир; ароматические углеводороды, такие как бензол, толуол или ксилол; галогенированные углеводороды, такие как метиленхлорид, хлороформ, четыреххлористый углерод, дихлорэтан, хлорбензол или дихлорбензол; простые эфиры, такие как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран, диоксан, диметоксиэтан или диметиловый эфир диэтиленгликоля; спирты, такие как метанол, этанол, пропанол, изопропанол, бутанол или изобутанол; диамины, такие как N,N,N',N'-тетраметилэтилендиамин; амиды, такие как формамид, диметилформамид, диметилацетамид, гексаметилфосфорный триамид или гексаметилфосфористый триамид или сульфоксиды, такие как диметилсульфоксид или сульфолан, предпочтительно простые эфиры или спирты, более предпочтительно простые эфиры (в частности, тетрагидрофуран).
Температура реакции может варьироваться в зависимости от природы исходного материала и реагента и обычно составляет от -10oC до 100oC, предпочтительно от 0oC до 50oC.
Время реакции может изменяться в зависимости от природы исходного материала, реагента и температуры реакции и обычно равно от 10 мин до 10 ч, предпочтительно от 30 мин до 3 ч.
После завершения реакции целевое соединение этой реакции выделяют из реакционной смеси обычным методом. Например, после реакции целевое соединение получают путем удаления растворителя испарением или добавления воды к остатку, полученному путем удаления растворителя испарением, добавления гидрофобного растворителя (например, бензола, простого эфира, этилацетата и т. п.) к полученной смеси, чтобы экстрагировать желаемое соединение, промывания экстрагированного органического слоя водой, сушки его над безводным сульфатом магния и удаления растворителя испарением. Полученное таким образом целевое соединение может быть подвергнуто дальнейшей очистке, если необходимо, обычным способом, например путем перекристаллизации, повторного осаждения или хроматографии.
Реакция (h):
Реакцию, по которой карбоксилгруппу превращают в карбамоилгруппу, проводят обычным методом в органической химии. Например, реакцию проводят путем конденсации карбоксильной группы с аммиаком в инертном растворителе обычным методом синтеза пептида, например азидным методом, методом активного сложного эфира, методом смешанного ангидрида кислоты или методом конденсации (предпочтительно методом смешанного ангидрида кислоты).
В вышеуказанном методе азидный метод осуществляют путем взаимодействия аминокислотного гидразида, полученного реакцией гидразина в инертном растворителе (например, в амиде, таком как формамид, диметилформамид, диметилацетамид или гексаметилфосфорный триамид, предпочтительно в диметилформамиде) при от -10oC до 100oC (предпочтительно от 0oC до 50oC) с нитритным соединением, чтобы получить азид-соединение, и затем обработкой его аммиаком.
Используемым нитритным соединением может быть, например, нитрит щелочного металла, такой как нитрит натрия, или алкилнитрит, такой как изоамилнитрит.
Реакцию предпочтительно проводят в инертном растворителе, и растворителем для использования здесь может быть, например, амид, такой как формамид, диметилформамид, диметилацетамид или гексаметилфосфорный триамид; сульфоксид, такой как диметилсульфоксид или сульфолан, или пирролидон, такой как N-метилпирролидон, предпочтительно амиды (в частности, диметилформамид).
Кроме того, две стадии данной реакции (азидирование и реакцию с аммиаком) обычно проводят в одном реакционном растворе.
Температура реакции может варьироваться в зависимости от природы исходных материалов и реагентов и обычно составляет от -70oC до 50oC (предпочтительно от -50oC до 0oC) на стадии азидирования и обычно от -70oC до 50oC (предпочтительно от -10oC до 10oC) в реакции с аммиаком.
Время, необходимое для реакции, может изменяться в зависимости от природы исходного материала, реагента и температуры реакции. Обычно оно составляет от 5 мин до 3 ч (предпочтительно от 10 мин до 1 ч) на стадии азидирования. В реакции с аммиаком оно равно от 5 ч до 7 сут (предпочтительно от 10 ч до 5 сут).
После завершения реакции целевое соединение этой реакции выделяют из реакционной смеси обычным методом. Например, после реакции целевое соединение получают путем удаления растворителя испарением или добавления воды к остатку, полученному путем удаления растворителя испарением, добавления гидрофобного растворителя (например, бензола, простого эфира, этилацетата и т. п.) к полученной смеси, чтобы экстрагировать желаемое соединение, промывания экстрагированного органического слоя водой, сушки его над безводным сульфатом магния и удаления растворителя испарением. Полученное таким образом целевое соединение может быть подвергнуто дальнейшей очистке, если необходимо, обычным способом, например путем перекристаллизации, повторного осаждения или хроматографии.
Метод с участием активного сложного эфира осуществляют путем взаимодействия с реагентом для получения активного сложного эфира в инертном растворителе и затем путем взаимодействия активного сложного эфира с аммиаком в инертном растворителе.
Используемый растворитель, в обеих реакциях, специально не ограничивается, если он не мешает реакции и может растворять определенное количество исходного материала, и им может быть, например, галогенированный углеводород, такой как метиленхлорид, хлороформ, четыреххлористый углерод, дихлорэтан, хлорбензол или дихлорбензол; простой эфир, такой как диэтиэтовый эфир, диизопропиловый эфир, тетрагидрофуран, диоксан, диметоксиэтан или диметиловый эфир диэтиленгликоля; амид, такой как формамид, диметилформамид, диметилацетамид или гексаметилфосфорный триамид; или нитрил, такой как ацетонитрил, предпочтительно простые эфиры (в частности, тетрагидрофуран) или амиды (в частности, диметилформамид).
Реагентом для получения активного сложного эфира может быть, например, N-гидроксисоединение, такое как N-гидроксисукцинимид, 1-гидроксибензотриазол или N-гидрокси-5-норборнен-2,3-дикарбоксимид, или дисульфидное соединение, такое как дипиридилдисульфид. Реакцию активной этерификации предпочтительно проводят в присутствии агента конденсации, такого как дициклогексилкарбодиимид, карбонилдиимидазол или трифенилфосфин.
Температуры реакции могут варьироваться в зависимости от природы исходных материалов и реагента и обычно составляют от -70oC до 150oC (предпочтительно от -10oC до 100oC) в реакции активной этерификации и от -20oC до 100oC (предпочтительно от 0oC до 50oC) в реакции активного соединения сложного эфира с аммиаком.
Периоды времени, необходимые для обеих реакций, могут изменяться в зависимости от природы исходных материалов, реагентов и температур реакции и обычно это от 30 мин до 80 ч (предпочтительно от 1 до 48 ч).
После завершения реакции целевое соединение этой реакции выделяют из реакционной смеси обычным методом. Например, после реакции целевое соединение получают путем удаления растворителя испарением или добавления воды к остатку, полученному путем удаления растворителя испарением, добавления гидрофобного растворителя (например, бензола, простого эфира, этилацетата и т.п.) к полученной смеси, чтобы экстрагировать желаемое соединение, промывания экстрагированного органического слоя водой, сушки его над безводным сульфатом магния и удаления растворителя испарением. Полученное таким образом целевое соединение может быть подвергнуто дальнейшей очистке, если необходимо, обычным способом, например путем перекристаллизации, повторного осаждения или хроматографии.
Метод с участием смешанного ангидрида кислоты осуществляют путем взаимодействия с реагентом для получения смешанного ангидрида кислоты в присутствии основания в инертном растворителе и затем путем взаимодействия смешанного ангидрида кислоты с аммиаком в инертном растворителе.
Используемый растворитель, в реакции для получения смешанного ангидрида кислоты, специально не ограничивается, если он не мешает реакции и может растворять определенное количество исходного материала, и им может быть, например, галогенированный углеводород, такой как метиленхлорид, хлороформ, четыреххлористый углерод, дихлорэтан, хлорбензол или дихлорбензол; простой эфир, такой как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран, диоксан, диметоксиэтан или диметиловый эфир диэтиленгликоля; или амид, такой как формамид, диметилформамид, диметилацетамид или гексаметилфосфорный триамид; предпочтительно простые эфиры (в частности, тетрагидрофуран).
Примерами реагентов для получения смешанных ангидридов кислот могут быть, например, C1-C4 алкилгалогенформиаты, такие как этилхлорформиат или изобутилхлорформиат; C1-C5 алканоилгалогенид, такой как пивалоилхлорид; или C1-C4 алкил или ди-C6-C14 арилцианофосфорная кислота, такая как диэтилцианофосфорная кислота или дифенилцианофосфорная кислота, предпочтительно C1-C4 алкилгалогенформиат (в частности, изобутилхлорформиат).
Используемым здесь основанием может быть, например, карбонат щелочного металла, такой как карбонат натрия, карбонат калия или карбонат лития; или органический амин, такой как триэтиламин, трибутиламин, диизопропилэтиламин, N-метилморфолин, пиридин, 4-(N,N-диметиламино)пиридин, N,N-диметиланилин, N, N-диэтиланилин, 1,5-диазабицикло[4.3.0]нон-5-ен, 1,4-диазабицикло[2.2.2]октан (DABCO) или 1,8-диазабицикло[5.4.0]ундец-7-ен (DBU), предпочтительно органические амины (в частности, триэтиламин).
Температура реакции в реакции получения смешанного ангидрида кислот может варьироваться в зависимости от природы исходного материала и реагента и обычно составляет от -50oC до 100oC (предпочтительно от -10oC до 50oC).
Время реакции в реакции получения смешанного ангидрида кислот может изменяться в зависимости от природы исходного материала, реагента и температуры реакции, и обычно оно составляет от 5 мин до 20 ч (предпочтительно от 10 мин до 10 ч).
Используемый растворитель, в реакции смешанного ангидрида кислоты с аммиаком, специально не ограничивается, если он не мешает реакции и может растворять определенное количество исходного материала, и им может быть, например, простой эфир, такой как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран, диоксан, диметоксиэтан или диметиловый эфир диэтиленгликоля; или амид, такой как формамид, диметилформамид, диметилацетамид или гексаметилфосфорный триамид; предпочтительно простые эфиры (в частности, тетрагидрофуран).
Температура реакции в реакции смешанного ангидрида кислот с аммиаком может варьироваться в зависимости от природы исходного материала и реагента и обычно составляет от -30oC до 100oC (предпочтительно от 0oC до 80oC).
Время реакции в реакции смешанного ангидрида кислот с аммиаком может изменяться в зависимости от природы исходного материала, реагента и температуры реакции, и обычно оно составляет от 5 мин до 24 ч (предпочтительно от 10 мин до 5 ч).
После завершения реакции целевое соединение этой реакции выделяют из реакционной смеси обычным методом. Например, после реакции целевое соединение получают путем удаления растворителя испарением или добавления воды к остатку, полученному путем удаления растворителя испарением, добавления гидрофобного растворителя (например, бензола, простого эфира, этилацетата и т. п.) к полученной смеси, чтобы экстрагировать желаемое соединение, промывания экстрагированного органического слоя водой, сушки его над безводным сульфатом магния и удаления растворителя испарением. Полученное таким образом целевое соединение может быть подвергнуто дальнейшей очистке, если необходимо, обычным способом, например путем перекристаллизации, повторного осаждения или хроматографии.
Метод конденсации осуществляют путем непосредственной реакции карбоксильной группы с аммиаком в присутствии агента конденсации в инертном растворителе.
Используемым здесь агентом конденсации может быть, например дициклогексилкарбодиимид, карбонилдиимидазол или 1-метил-2-хлор-пиридинийиодтриэтиламин, предпочтительно дициклогексилкарбодиимид.
Данная реакция может быть проведена в условиях, подобных тем, которые описаны для получения активного сложного эфира.
После завершения реакции целевое соединение этой реакции выделяют из реакционной смеси обычным методом. Например, после реакции целевое соединение получают путем удаления растворителя испарением или добавления воды к остатку, полученному путем удаления растворителя испарением, добавления гидрофобного растворителя (например, бензола, простого эфира, этилацетата и т.п.) к полученной смеси, чтобы экстрагировать желаемое соединение, промывания экстрагированного органического слоя водой, сушки его над безводным сульфатом магния и удаления растворителя испарением. Полученное таким образом целевое соединение может быть подвергнуто дальнейшей очистке, если необходимо, обычным способом, например путем перекристаллизации, повторного осаждения или хроматографии.
Реакция (i):
Реакцию, в которой карбамоилгруппу превращают в циано-группу, проводят обычным методом в органической химии. Например, реакцию проводят путем взаимодействия карбамоил-группы с дегидратирующим агентом в инертном растворителе.
Используемый растворитель специально не ограничивается, если он не мешает реакции и может растворять определенное количество исходного материала, и им может быть, например, алифатический углеводород, такой как гексан, гептан, лигроин или петролейный эфир; ароматический углеводород, такой как бензол, толуол или ксилол; галогенированный углеводород, такой как метиленхлорид, хлороформ, четыреххлористый углерод, дихлорэтан, хлорбензол или дихлорбензол; простой эфир, такой как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран, диоксан, диметоксиэтан или диметиловый эфир диэтиленгликоля; сложный эфир, такой как метилацетат или этилацетат; кетон, такой как ацетон; амид, такой как формамид, диметилформамид, диметилацетамид, гексаметилфосфорный триамид или гексаметилфосфористый триамид; или сульфоксид, такой как диметилсульфоксид или сульфолан, предпочтительно простые эфиры, амиды или сульфоксиды, более предпочтительно амиды (в частности, диметилформамид).
Используемым здесь дегидратирующим агентом может быть, например, оксихлорид фосфора, трифторуксусный ангидрид, метансульфонил-хлорид, пара-толуолсульфонил-хлорид или пентоксид фосфора, предпочтительно оксихлорид фосфора.
Температура реакции может варьироваться в зависимости от природы исходного материала и реагента и обычно составляет от -30oC до 100oC, предпочтительно от 0oC до 50oC.
Время реакции может изменяться в зависимости от природы исходного материала, реагента и температуры реакции и обычно равно от 5 мин до 10 ч, предпочтительно от 10 мин до 3 ч.
После завершения реакции целевое соединение этой реакции выделяют из реакционной смеси обычным методом. Например, целевое соединение получают путем удаления растворителя испарением или добавления воды к реакционной смеси, добавления гидрофобного растворителя (например, бензола, простого эфира, этилацетата и т. п.) к полученной смеси для экстрагирования желаемого соединения, промывания органического слоя водой, сушки его над безводным сульфатом магния и удаления растворителя испарением. Полученное таким образом целевое соединение может быть подвергнуто дальнейшей очистке, если необходимо, обычным способом, например путем перекристаллизации, повторного осаждения или хроматографии.
Реакция (j):
Реакцию, в ходе которой алкоксигруппу на ароматическом кольце превращают в гидроксильную группу, проводят обычным методом в органической химии. Например, реакцию проводят путем взаимодействия алкоксигруппы с хлоридом алюминия в инертном растворителе.
Используемый растворитель специально не ограничивается, если он не мешает реакции и может растворять определенное количество исходного материала, и им может быть, например, алифатический углеводород, такой как гексан, гептан, лигроин или петролейный эфир; ароматический углеводород, такой как бензол, толуол или ксилол; галогенированный углеводород, такой как метиленхлорид, хлороформ, четыреххлористый углерод, дихлорэтан, хлорбензол или дихлорбензол; простой эфир, такой как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран, диоксан, диметоксиэтан или диметиловый эфир диэтиленгликоля; или сложный эфир, такой как метилацетат или этилацетат; предпочтительно галогенированные углеводороды (в частности, метиленхлорид).
Температура реакции может варьироваться в зависимости от природы исходного материала и реагента и обычно составляет от -10oC до 100oC, предпочтительно от 10 до 50oC.
Время реакции может изменяться в зависимости от природы исходного материала, реагента и температуры реакции и обычно равно от 1 до 72 ч, предпочтительно от 2 до 30 ч.
После завершения реакции целевое соединение этой реакции выделяют из реакционной смеси обычным методом. Например, целевое соединение получают путем удаления растворителя испарением или добавления воды к реакционной смеси, добавления гидрофобного растворителя (например, бензола, простого эфира, этилацетата и т. п.) к полученной смеси для экстрагирования желаемого соединения, промывания органического слоя водой, сушки его над безводным сульфатом магния и удаления растворителя испарением. Полученное таким образом целевое соединение может быть подвергнуто дальнейшей очистке, если необходимо, обычным способом, например путем перекристаллизации, повторного осаждения или хроматографии.
Реакция (k):
Реакцию, по которой гидроксильную группу или аминогруппу ацилируют, проводят обычным методом в органической химии. Например, реакцию проводят путем взаимодействия гидроксильной группы или аминогруппы с агентом ацилирования (предпочтительно с алканоилгалогенидом, смешанным ангидридом муравьиной и уксусной кислоты, ангидридом алканкарбоновой кислоты, арилкарбонилгалогенидом или ангидридом арилкарбоновой кислоты) в присутствии основания или без него (предпочтительно в присутствии основания) в инертном растворителе.
Используемым здесь алканоилгалогенидом может быть, например, линейный или разветвленный алканоилгалогенид, имеющий от 2 до 6 атомов углерода, такой как ацетилхлорид, пропионилхлорид, бутирилхлорид, бутирилбромид, изобутирилхлорид, валерилхлорид, пивалоилхлорид или гексаноилхлорид, предпочтительно C2-C4 алканоилхлорид, более предпочтительно ацетилхлорид.
Используемым здесь ангидридом алканкарбоновой кислоты может быть, например, линейный или разветвленный ангидрид алканкарбоновой кислоты, имеющий от 4 до 12 атомов углерода, такой как уксусный ангидрид, пропионовый ангидрид, бутановый ангидрид, валериановый ангидрид, пивалоиловый ангидрид, пентановый ангидрид или гексановый ангидрид, предпочтительно C4-C8 ангидрид алканкарбоновой кислоты, более предпочтительно уксусный ангидрид.
Используемым здесь арилкарбонилгалогенидом может быть, например, C6-C10 галогенид арилкарбоновой кислоты, такой как бензоилхлорид, бензоилбромид, фторбензоилхлорид, хлорбензоилхлорид, дихлорбензоилхлорид, толуоилхлорид, анизоилхлорид, инденоилхлорид, инденоилбромид, нафтоилхлорид, нафтоилбромид, фенантреноилхлорид или антраценоилхлорид, предпочтительно бензоилхлорид.
Используемым здесь ангидридом арилкарбоновой кислоты может быть, например, C6-C10 ангидрид арилкарбоновой кислоты, такой как бензойный ангидрид, фторбензойный ангидрид, хлорбензойный ангидрид, метилбензойный ангидрид, метоксибензойный ангидрид, ангидрид инденилкарбоновой кислоты или ангидрид нафтилкарбоновой кислоты, предпочтительно бензойный ангидрид.
Используемым здесь основанием может быть, например, карбонат щелочного металла, такой как карбонат натрия, карбонат калия или карбонат лития; или органический амин, такой как триэтиламин, трибутиламин, диизопропилэтиламин, N-метилморфолин, пиридин, 4-(N,N-диметиламино)пиридин, N,N-диметиланилин, N, N-диэтиланилин, 1,5-диазабицикло[4.3.0] -нон-5-ен, 1,4-диазабицикло[2.2.2] октан (DABCO) или 1,8-диазабицикло[5.4.0]ундец-7-ен (DBU), предпочтительно органические амины (в частности, триэтиламин, диизопропилэтиламин, пиридин или 4-(N,N-диметиламино)пиридин.
Используемый растворитель специально не ограничивается, если он не мешает реакции и может растворять определенное количество исходного материала, и им может быть, например, алифатический углеводород, такой как гексан, гептан, лигроин или петролейный эфир; ароматический углеводород, такой как бензол, толуол или ксилол; галогенированный углеводород, такой как метиленхлорид, хлороформ, четыреххлористый углерод, дихлорэтан, хлорбензол или дихлорбензол; простой эфир, такой как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран, диоксан, диметоксиэтан или диметиловый эфир диэтиленгликоля; кетон, такой как ацетон и метилэтилкетон; или амид, такой как формамид, диметилформамид, диметилацетамид или гексаметилфосфорный триамид; предпочтительно простые эфиры (в частности, тетрагидрофуран).
Температура реакции может варьироваться в зависимости от природы исходного материала и реагента и обычно составляет от -50oC до 100oC, предпочтительно от 0oC до 50oC.
Время реакции может изменяться в зависимости от природы исходного материала, реагента и температуры реакции и обычно равно от 5 мин до 20 ч (предпочтительно от 10 мин до 10 ч).
После завершения реакции целевое соединение этой реакции выделяют из реакционной смеси обычным методом. Например, после реакции целевое соединение получают путем удаления растворителя испарением или добавления воды к остатку, полученному путем удаления растворителя испарением, добавления гидрофобного растворителя (например, бензола, простого эфира, этилацетата и т. п. ) к полученной смеси для экстрагирования желаемого соединения, промывания органического слоя водой, сушки его над безводным сульфатом магния и удаления растворителя испарением. Полученное таким образом целевое соединение может быть подвергнуто дальнейшей очистке, если необходимо, обычным способом, например путем перекристаллизации, повторного осаждения или хроматографии.
Реакция (l):
Реакцию, по которой гидроксильную группу или аминогруппу аралкилируют, проводят обычным методом в органической химии. Например, реакцию проводят путем взаимодействия гидроксильной группы или аминогруппы с аралкилгалогенидом в присутствии основания или без него (предпочтительно в присутствии основания) в инертном растворителе.
Используемым здесь C6-C48 аралкилгалогенидом может быть, например, C6-C48 аралкилгалогенид, который имеет от 1 до 3 заместителей, которые могут быть одинаковыми или отличными друг от друга и выбраны из группы, состоящей из галогена, C1-C6 алкила и C1-C6 алкокси, такой как бензилхлорид, бензилбромид, 4-хлорбензилхлорид, 4-хлорбензилбромид, 4-бромбензилхлорид, 4-бромбензилбромид, 2,4-дифторбензилхлорид, 2,4-дихлорбензилхлорид, 2,4-дихлорбензилбромид, 4-метоксибензилхлорид, 4-метоксибензилбромид, тритилхлорид, тритилбромид, диметокситритилхлорид или α-нафтилдифенилметилхлорид, предпочтительно бензилхлорид или бензилбромид, которые могут иметь от 1 до 3 заместителей, которые могут быть одинаковыми или отличными друг от друга и выбраны из группы, состоящей из галогена, C1-C4 алкила и C1-C4 алкокси, более предпочтительно бензилхлорид или бензилбромид.
Используемым основанием может быть, например, карбонат щелочного металла, такой как карбонат натрия, карбонат калия или карбонат лития; кислый карбонат щелочного металла, такой как гидрокарбонат натрия, гидрокарбонат калия или гидрокарбонат лития; гидрид щелочного металла, такой как гидрид лития, гидрид натрия или гидрид калия; гидроксид щелочного металла, такой как гидроксид натрия, гидроксид калия или гидроксид лития; органический амин, такой как триэтиламин, трибутиламин, диизопропилэтиламин, N-метилморфолин, пиридин, 4-(N, N-диметиламино)пиридин, N,N-диметиланилин, N,N-диэтиланилин, 1,5-диазабицикло[4.3.0]нон-5-ен (DBN), 1,4-диазабицикло[2.2.2]октан (DABCO) или 1,8-диазабицикло[5.4.0]ундец-7-ен (DBU); алкиллитий, такой как метиллитий, этиллитий или бутиллитий; или алкиламиды лития, такие как диизопропиламид лития или дициклогексиламид лития, предпочтительно карбонаты щелочных металлов, гидриды щелочных металлов или органические амины, более предпочтительно карбонаты щелочных металлов (в частности, карбонат натрия или карбонат калия) или гидриды щелочных металлов (в частности, гидрид натрия).
Используемый растворитель специально не ограничивается, если он не мешает реакции и может растворять определенное количество исходного материала, и им может быть, например, алифатический углеводород, такой как гексан, гептан, лигроин или петролейный эфир; ароматический углеводород, такой как бензол, толуол или ксилол; галогенированный углеводород, такой как метиленхлорид, хлороформ, четыреххлористый углерод, дихлорэтан, хлорбензол или дихлорбензол; простой эфир, такой как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран, диоксан, диметоксиэтан или диметиловый эфир диэтиленгликоля; кетон, такой как ацетон или метилэтилкетон; или амид, такой как формамид, диметилформамид, диметилацетамид, гексаметилфосфорный триамид; предпочтительно амиды (в частности, диметилформамид).
Температура реакции может варьироваться в зависимости от природы исходного материала и реагента и обычно составляет от -50oC до 100oC, предпочтительно от 0oC до 50oC.
Время реакции может изменяться в зависимости от природы исходного материала, реагента и температуры реакции и обычно равно от 5 мин до 24 ч (предпочтительно от 10 мин до 5 ч).
После завершения реакции целевое соединение этой реакции выделяют из реакционной смеси обычным методом. Например, после реакции целевое соединение получают путем удаления растворителя испарением или добавления воды к остатку, полученному путем удаления растворителя испарением, нейтрализации его, если желательно, добавления гидрофобного растворителя (например, бензола, простого эфира, этилацетата и т.п.) к полученной смеси для экстрагирования желаемого соединения, промывания органического слоя водой, сушки его над безводным сульфатом магния и удаления растворителя испарением. Полученное таким образом целевое соединение может быть подвергнуто дальнейшей очистке, если необходимо, обычным способом, например путем перекристаллизации, повторного осаждения или хроматографии.
Реакция (m):
Реакцию, по которой нитрогруппу превращают в аминогруппу, проводят обычным методом в органической химии. Например, реакцию проводят путем взаимодействия нитрогруппы с цинком в присутствии уксусной кислоты в инертном растворителе.
Используемый растворитель специально не ограничивается, если он не мешает реакции и может растворять определенное количество исходного материала, и им может быть, например, алифатический углеводород, такой как гексан, гептан, лигроин или петролейный эфир; ароматический углеводород, такой как бензол, толуол или ксилол; галогенированный углеводород, такой как метиленхлорид, хлороформ, четыреххлористый углерод, дихлорэтан, хлорбензол или дихлорбензол; простой эфир, такой как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран, диоксан, диметоксиэтан или диметиловый эфир диэтиленгликоля; спирт, такой как метанол, этанол, пропанол, изопропанол, бутанол или изобутанол; диамин, такой как N,N,N',N'-тетраметилэтилендиамин; амид, такой как формамид, диметилформамид, диметилацетамид, гексаметилфосфорный триамид или гексаметилфосфористый триамид; сульфоксид, такой как диметилсульфоксид или сульфолан; вода или водная смесь вышеуказанного растворителя, предпочтительно вода.
Температура реакции может варьироваться в зависимости от природы исходного материала и реагента и обычно составляет от -10oC до 100oC, предпочтительно от 0oC до 50oC.
Время реакции может изменяться в зависимости от природы исходного материала, реагента и температуры реакции и
обычно равно от 10 мин до 10 ч, предпочтительно от 30 мин до 3 ч.
После завершения реакции целевое соединение этой реакции выделяют из реакционной смеси обычным методом. Например, после реакции целевое соединение получают путем удаления растворителя испарением или добавления воды к остатку, полученному путем удаления растворителя испарением, нейтрализации его, добавления гидрофобного растворителя (например, бензола, простого эфира, этилацетата и т.п.) к полученной смеси для экстрагирования желаемого соединения, промывания органического слоя водой, сушки его над безводным сульфатом магния и удаления растворителя испарением. Полученное таким образом целевое соединение может быть подвергнуто дальнейшей очистке, если необходимо, обычным способом, например путем перекристаллизации, повторного осаждения или хроматографии.
Реакция (n):
Реакцию для удаления защитной группы аминогруппы, включенной в Ra3, и т. д. проводят в условиях, подобных условиям, описанным в Стадии A3.
Соединение формулы (II), которое является исходным материалом данного изобретения, является известным соединением или может быть получено согласно известному способу [например, Chem. Abstr., 74, 125521 (1970), Annual report of Sankyo Research Laboratories, 22, 215 (1970), Agric. Biol. Chem., EN, 50, 1831 (1986), Can. J. Chem., 48, 1371 (1970), Патентная заявка Японии (Kokai) N Sho 59-216881, Патентная публикация Японии (Kokoku) N Sho 43-14704, и т.д. ].
А также, соединение формулы (IV) или (IVa) является известным соединением или может быть получено известным способом [например, Syntesis, 366 (1990), J. Med. Chem., 14, 1258 (1991), и т.д.].
Кроме того, соединение формулы (II), которое является исходным материалом данного изобретения, является известным соединением или может быть получено известным способом. Соединение общей формулы (VI), (X) или (XIII) может быть получено путем взаимодействия согласно способам D, E, F (см. в конце описания).
Способ D является процессом получения соединения (II), которое является исходным материалом в Процессе A или Процессе B.
На стадии D1 соединение формулы (VIII) получают:
(a) путем взаимодействия соединения общей формулы (VI) в инертном растворителе с реагентом для получения активного сложного эфира с последующим взаимодействием активного сложного эфира с соединением формулы (VII) в инертном растворителе,
(b) путем взаимодействия соединения общей формулы (VI) с галогенирующим агентом в инертном растворителе с последующим взаимодействием галогенированного соединения с соединением (VII) или
(c) путем взаимодействия соединения формулы (VI) с соединением формулы (VII) в присутствии кислоты в инертном растворителе.
Стадию D1(a) и Стадию D1(b) проводят в условиях, подобных тем, которые описаны в реакции (f2) и реакции (f3) на Стадии C1, соответственно.
Кислота, используемая на Стадии D1(c), конкретно не лимитируется, пока она обычно используется в методах органической химии, и это может быть неорганическая кислота, такая как фтороводородная кислота, хлороводородная кислота, бромоводородная кислота, иодоводородная кислота, азотная кислота, перхлорная кислота, серная кислота или фосфорная кислота; сульфоновая кислота, такая как метансульфоновая кислота, трифторметансульфоновая кислота, этансульфоновая кислота, бензолсульфоновая кислота или п-толуолсульфоновая кислота; или карбоновая кислота, такая как фумаровая кислота, янтарная кислота, лимонная кислота, винная кислота, щавелевая кислота или малеиновая кислота, предпочтительно неорганические кислоты (в частности, серная кислота).
Используемый растворитель специально не ограничивается, если он не мешает реакции и может растворять определенное количество исходного материала, и им может быть, например, алифатический углеводород, такой как гексан, гептан, лигроин или петролейный эфир; ароматический углеводород, такой как бензол, толуол или ксилол; галогенированный углеводород, такой как метиленхлорид, хлороформ, четыреххлористый углерод, дихлорэтан, хлорбензол или дихлорбензол; простой эфир, такой как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран, диоксан, диметоксиэтан или диметиловый эфир диэтиленгликоля; кетон, такой как ацетон и метилэтилкетон; спирт, такой как метанол, этанол, пропанол, изопропанол, бутанол или изобутанол; или амид, такой как формамид, диметилформамид, диметилацетамид или гексаметилфосфорный триамид; предпочтительно спирты (в частности, метанол или этанол).
Температура реакции может варьироваться в зависимости от природы исходного материала и реагента и обычно составляет от -50oC до 150oC (предпочтительно от 20 до 100oC).
Время реакции может изменяться в зависимости от природы исходного материала, реагента и температуры реакции и обычно равно от 5 мин до 24 ч (предпочтительно от 10 мин до 5 ч).
После завершения реакции целевое соединение этой реакции выделяют из реакционной смеси обычным методом. Например, после реакции целевое соединение получают путем удаления растворителя испарением или добавления воды к остатку, полученному путем удаления растворителя испарением, добавления гидрофобного растворителя (например, бензола, простого эфира, этилацетата и т. п. ) к полученной смеси для экстрагирования желаемого соединения, промывания органического слоя водой, сушки его над безводным сульфатом магния и удаления растворителя испарением. Полученное таким образом целевое соединение может быть подвергнуто дальнейшей очистке, если необходимо, обычным способом, например путем перекристаллизации, повторного осаждения или хроматографии.
На стадии D2 соединение формулы (IX) получают путем взаимодействия соединения (VIII) с молекулой галогена в инертном растворителе.
Используемой здесь молекулой галогена может быть, например, молекула хлора или молекула брома, предпочтительно молекула брома.
Используемый растворитель специально не ограничивается, если он не мешает реакции и может растворять определенное количество исходного материала, и им может быть, например, алифатический углеводород, такой как гексан, гептан, лигроин или петролейный эфир; ароматический углеводород, такой как бензол, толуол или ксилол; галогенированный углеводород, такой как метиленхлорид, хлороформ, четыреххлористый углерод, дихлорэтан, хлорбензол или дихлорбензол; простой эфир, такой как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран, диоксан, диметоксиэтан или диметиловый эфир диэтиленгликоля; кетон, такой как ацетон и метилэтилкетон; спирт, такой как метанол, этанол, пропанол, изопропанол, бутанол или изобутанол; или амид, такой как формамид, диметилформамид, диметилацетамид или гексаметилфосфорный триамид; предпочтительно галогенированные углеводороды (в частности, хлороформ или четыреххлористый углерод).
Температура реакции может варьироваться в зависимости от природы исходного материала и реагента и обычно составляет от -50oC до 100oC (предпочтительно от 0oC до 50oC).
Время реакции может изменяться в зависимости от природы исходного материала, реагента и температуры реакции и обычно равно от 5 мин до 12 ч (предпочтительно от 10 мин до 5 ч).
После завершения реакции целевое соединение этой реакции выделяют из реакционной смеси обычным методом. Например, после реакции целевое соединение получают путем удаления растворителя испарением или добавления воды к остатку, полученному путем удаления растворителя испарением, добавления гидрофобного растворителя (например, бензола, простого эфира, этилацетата и т.п.) к полученной смеси для экстрагирования желаемого соединения, промывания органического слоя водой, сушки его над безводным сульфатом магния и удаления растворителя испарением. Полученное таким образом целевое соединение может быть подвергнуто дальнейшей очистке, если необходимо, обычным способом, например путем перекристаллизации, повторного осаждения или хроматографии.
На стадии D3 соединение формулы (II) получают путем взаимодействия соединения (IX) с гидроксиламином или солью неорганической кислоты и гидроксиламина (предпочтительно с солью неорганической кислоты и гидроксиламина) в присутствии основания или без него (предпочтительно в присутствии основания) в инертном растворителе.
Солью неорганической кислоты и гидроксиламина, используемой здесь, может быть, например, гидрофторид гидроксиламина, гидрохлорид гидроксиламина, гидробромид гидроксиламина, гидроиодид гидроксиламина, соль азотной кислоты гидроксиламина, соль перхлорной кислоты гидроксиламина, соль серной кислоты гидроксиламина или соль фосфорной кислоты гидроксиламина, предпочтительно гидрохлорид гидроксиламина.
Способ E является альтернативным способом получения соединения (II), которое является исходным материалом в Процессе A или Процессе B.
На стадии E1 соединение формулы (XII) получают путем взаимодействия соединения формулы (X) с соединением формулы (XI) в присутствии основания в инертном растворителе.
Используемый растворитель специально не ограничивается, если он не мешает реакции и может растворять определенное количество исходного материала, и им может быть, например, алифатический углеводород, такой как гексан, гептан, лигроин или петролейный эфир; ароматический углеводород, такой как бензол, толуол или ксилол; галогенированный углеводород, такой как метиленхлорид, хлороформ, четыреххлористый углерод, дихлорэтан, хлорбензол или дихлорбензол; простой эфир, такой как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран, диоксан, диметоксиэтан или диметиловый эфир диэтиленгликоля; или сульфоксид, такой как диметилсульфоксид или сульфолан; предпочтительно ароматические углеводороды, галогенированные углеводороды или простые эфиры, более предпочтительно ароматические углеводороды (в частности, бензол) или простые эфиры (в частности, тетрагидрофуран и диоксан).
Используемым здесь основанием может быть, например, карбонат щелочного металла, такой как карбонат натрия, карбонат калия или карбонат лития; кислый карбонат щелочного металла, такой как гидрокарбонат натрия, гидрокарбонат калия или гидрокарбонат лития; гидрид щелочного металла, такой как гидрид лития, гидрид натрия или гидрид калия; гидроксид щелочного металла, такой как гидроксид натрия, гидроксид калия или гидроксид лития; алкоксид щелочного металла, такой как метоксид натрия, этоксид натрия, трет-бутоксид калия или метоксид лития; меркаптид щелочного металла, такой как метилмеркаптид натрия или этилмеркаптид натрия, органический амин, такой как триэтиламин, трибутиламин, диизопропилэтиламин, N-метилморфолин, пиридин, 4-(N,N-диметиламино)пиридин, N,N-диметиланилин, N,N-диэтиланилин, 1,5-диазабицикло[4.3.0] нон-5-ен (DBN), 1,4-диазабицикло[2.2.2] октан (DABCO) или 1,8-диазабицикло[5.4.0] ундец-7-ен (DBU); алкиллитий, такой как метиллитий, этиллитий или бутиллитий; или алкиламид лития, такой как диизопропиламид лития или дициклогексиламид лития, предпочтительны алкиламиды лития (в частности, диизопропиламид лития) или органические амины (в частности, или 1,8-диазабицикло[5.4.0]ундец-7-ен) (DBU).
Температура реакции может варьироваться в зависимости от природы исходного материала и реагента и обычно составляет от -100oC до 100oC, предпочтительно от -70oC до 50oC.
Время реакции может изменяться в зависимости от природы исходного материала, реагента и температуры реакции и обычно равно от 5 мин до 48 ч, предпочтительно от 10 мин до 24 ч.
После завершения реакции целевое соединение этой стадии выделяют из реакционной смеси обычным методом. Например, целевое соединение получают путем удаления растворителя испарением, добавления воды к реакционной смеси, доведения реакционной смеси до слабо кислого значения pH, добавления гидрофобного растворителя (например, бензола, простого эфира, этилацетата и т.п.) к полученной смеси для экстрагирования желаемого соединения, промывания органического слоя водой, сушки его над безводным сульфатом магния и удаления растворителя испарением. Полученное таким образом целевое соединение может быть подвергнуто дальнейшей очистке, если необходимо, обычным способом, например путем перекристаллизации, повторного осаждения или хроматографии.
На стадии E2 соединение формулы (II) получают путем взаимодействия соединения формулы (XII) с гидроксиламином или солью неорганической кислоты и гидроксиламина (предпочтительно с солью неорганической кислоты и гидроксиламина) в присутствии основания или без него (предпочтительно в присутствии основания) в инертном растворителе и проводят ее в условиях, подобных тем, которые описаны для Стадии D3.
Способ F является процессом получения соединения (Xlla), R2 означает атом галогена, C1-C6 алкил, C1-C6 алкил, замещенный галогеном или C1-C6 алкокси, C2-C6 алкенил, C2-C6 алкинил, C3-C10 циклоалкил, C3-C10 циклоалкенил, C2-C6 алканоил или C1-C6 алкоксикарбонил в промежуточном соединении (XII) Способа E.
На стадии F1 соединение формулы (XIIa) получают путем взаимодействия соединения формулы (XIII) с соединением формулы (XIV) в присутствии основания в инертном растворителе и проводят ее в условиях, подобных тем, которые описаны для Стадии E1.
Производное изоксазола (I) данного изобретения имеет превосходные свойства ингибирования моноаминоксидазы типа A и является слаботоксичным. Поэтому оно полезно в качестве средства для лечения или профилактики (в частности, как средство для лечения) нервных заболеваний, включая депрессию, болезнь Паркинсона, деменцию Альцгеймера (нарушение познавательной способности, свойственное болезни Альцгеймера) или цереброваскулярную деменцию (нарушение познавательной способности, свойственное цереброваскулярной деменции), (в частности, депрессии).
[Наилучший метод осуществления изобретения]
Далее данное изобретение описано более подробно с помощью Примеров, Сравнительных примеров. Опытного примера и Примеров приготовления, но данное изобретение не ограничивается только ими.
Пример 1
Гидрохлорид 3-(2-аминоэтокси)-5-фенилизоксазола (Соединение N 1)
(a) 3-(2-(N-трет-Бутоксикарбониламино)этокси-5-фенилизоксазол
Трифенилфосфин (0,87 г) растворяют в тетрагидрофуране (10 мл) и к раствору добавляют по каплям диэтилазодикарбоксилат (0,57 г) при охлаждении льдом с перемешиванием и смесь перемешивают при той же температуре в течение 10 мин. 3-Гидрокси-5-фенилизоксазол (0,48 г) и 2-(N-трет-бутоксикарбониламино)этанол (0,48 г) добавляют к реакционной смеси и полученную смесь перемешивают при охлаждении льдом 10 мин и при комнатной температуре в течение 24 ч. Растворитель испаряют при пониженном давлении и остаток очищают колоночной хроматографией на силикагеле (элюент: циклогексан/этилацетат = 4/1) и кристаллизуют из простого изопропилового эфира, чтобы получить указанное в заголовке соединение (0,63 г, 69%) в виде бесцветных кристаллов.
Т.пл.: 125-126oC.
ИК спектр (KBr) νmax см-1: 3322, 1721, 1710, 1619;
ЯМР спектр (CDCl3) δ м.д.: 1,46 (9H, с), 3,56 (2H, кв, J = 5,1 Гц), 4,35 (2H, т, J = 5,1 Гц), 4,94 (1H, ушир.с), 6,14 (1H, с), 7,43-7,51 (3H, м), 7,71-7,74 (2H, м).
(b) Гидрохлорид 3-(2-аминоэтокси)-5-фенилизоксазола
Раствор 4 н. хлороводородной кислоты/1,4-диоксана (4,0 мл) добавляют к 3-(2-(N-трет-бутоксикарбониламино)этокси-5-фенилизоксазолу (0,50 г) и смесь перемешивают при комнатной температуре в течение 15 мин. Осадок отделяют от смеси фильтрованием и промывают этилацетатом, чтобы получить указанное в заголовке соединение (0,39 г, 99%) в виде бесцветных кристаллов.
Т.пл.: 215-218oC (разлагается)
ИК спектр (KBr) νmax см-1: 3132, 2963, 2810, 2756, 1620, 1597, 1579;
ЯМР спектр (ДМСО-d6) δ м.д.: 3,26 (2H, т, J = 5,1 Гц), 4,45 (2H, т, J = 5,1 Гц), 6,85 (1H, с), 7,51-7,57 (3H, м), 7,84-7,87 (2H, м), 8,25 (3H, ушир. с).
Пример 2
Гидрохлорид 3-(2-аминоэтокси)-4-хлор-5-фенилизоксазола (Соединение N 5)
(a) 3-(2-(N-трет-Бутоксикарбониламино)этокси-4-хлор-5-фенилизоксазол
4-Хлор-3-гидрокси-5-фенилизоксазол (0,58 г) и 2-(N-трет-бутоксикарбониламино)этанол (0,48 г) подвергают взаимодействию и последующей обработке подобно тому, как описано в Примере 1(a), чтобы получить указанное в заголовке соединение (0,73 г, 72%) в виде бесцветных кристаллов.
Т.пл.: 115-116oC;
ИК спектр (KBR) νmax см-1: 3346, 1720, 1709, 1616;
ЯМР спектр (CDCl3) δ м.д.: 1,46 (9H, с), 3,61 (2H, кв, J = 5,1 Гц), 4,42 (2H, т, J = 5,1 Гц), 4,97 (1H, ушир.с), 7,46-7,53 (3H, м), 7,94-8,00 (2H, м).
(b) Гидрохлорид 3-(2-аминоэтокси)-4-хлор-5-фенилизоксазола
3-(2-(N-трет-Бутоксикарбониламино)этокси-4-хлор-5-фенилизоксазол (0,54 г) подвергают взаимодействию и последующей обработке подобно тому, как описано в Примере (1b), чтобы получить указанное в заголовке соединение (0,41 г, 93%) в виде бесцветных кристаллов.
Т.пл.: 204-207oC (разлагается).
ИК спектр (KBR) νmax см-1: 2971, 2905, 2848, 2775, 1606, 1575, 1534;
ЯМР спектр (ДМСО-d6) δ м.д: 3,31 (2H, т, J = 5,1 Гц), 4,56 (2H, т, J = 5,1 Гц), 7,59-7,67 (3H, м), 7,92-7,97 (2H, м), 8,27 (3H, ущир.с).
Пример 3
Гидрохлорид 3-(2-аминоэтокси)-5-(4-хлорфенил)изоксазола (Соединение N 143)
(a) 3-(2-(N-трет-Бутоксикарбониламино)этокси)-5-(4-хлорфенил)изоксазол
5-(4-Хлорфенил)-3-гидроксиаминоизоксазол (0,58 г) и 2-(N-трет-бутоксикарбониламино)этанол (0,48 г) подвергают взаимодействию и последующей обработке подобно тому, как описано в Примере (1a), чтобы получить указанное в заголовке соединение (0,69 г, 68%) в виде бесцветных кристаллов.
Т.пл.: 128-129oC;
ИК спектр (KBr) νmax см-1: 3378, 1683, 1622;
ЯМР спектр (CDCl3) δ м.д: 1,46 (9H, с), 3,56 (2H, кв, J = 5,1 Гц), 4,35 (2H, т, J = 5,1 Гц), 4,93 (1H, ушир.с), 6,14 (1H, с), 7,43 (2H, д, J = 8,7 Гц), 7,66 (2H, д, J = 8,7 Гц).
(b) Гидрохлорид 3-(2-аминоэтокси)-5-(4-хлорфенил)изоксазола
3-(2-(N-трет-Бутоксикарбониламино)этокси)-5-(4-хлорфенил)изоксазол (0,54 г) подвергают взаимодействию и последующей обработке подобно тому, как описано в Примере (1b), чтобы получить указанное в заголовке соединение (0,43 г, 98%) в виде бесцветных кристаллов.
Т.пл.: 218-223oC (разл.);
ИК спектр (KBr) νmax см-1: 3135, 2998, 2809, 1618, 1603, 1594, 1575, 1567;
ЯМР спектр (ДМСО-d6) δ м.д.: 3,26 (2H, т, J = 5,1 Гц), 4,45 (2H, т, J = 5,1 Гц), 6,91 (1H, с), 7,63 (2H, д, J = 8,7 Гц), 7,89 (2H, д, J = 8,7 Гц), 8,25 (3Н, ушир.с).
Пример 4
Гидрохлорид 3-(2-аминоэтокси)-4-изопропил-5-фенилизоксазола (Соединение N 9)
(a) 3-(2-(N-трет-Бутоксикарбониламино)этокси)-4-изопропил-5-фенилизоксазол
3-Гидрокси-4-изопропил-5-фенилизоксазол (0,50 г) и 2-(H-трет-бутоксикарбониламино)этанол (0,40 г) подвергают взаимодействию и последующей обработке подобно тому, как описано в Примере 1(a), чтобы получить указанное в заголовке соединение (0,60 г, 69%) в виде бесцветных кристаллов.
Т.пл.: 98-99oC;
ИК спектр (KBr) νmax см-1: 3386, 1686, 1642;
ЯМР спектр (CDCl3) δ м.д: 1,29 (6H, д, J = 6,8 Гц), 1,46 (9H, с), 3,06 (1H, кв, J = 6,8 Гц), 3,60 (2H, кв, J = 5,1 Гц), 4,38 (2H, т, J = 5,1 Гц), 4,85 (1H, ушир.с), 7,42-7,50 (3H, м), 7,55-7,60 (2H, м).
(b) Гидрохлорид 3-(2-аминоэтокси)-4-изопропил-5-фенилизоксазола
3-(2-(N-трет-Бутоксикарбониламино)этокси)-4-изопропил-5-фенилизоксазол (0,50 г) подвергают взаимодействию и последующей обработке подобно тому, как описано в Примере 1(b), чтобы получить указанное в заголовке соединение (0,39 г, 95%) в виде бесцветных кристаллов. Т.пл.: 202-210oC (разлагается);
ИК спектр (KBr) νmax см-1 : 2975, 2939, 1642, 1599, 1575;
ЯМР спектр (ДМСО-d6) δ м.д.: 1,26 (6H, д, J = 6,8 Гц), 3,04 (1H, кв, J = 6,8 Гц), 3,28 (2H, т, J = 5,1 Гц), 4,46 (2H, т, J = 5,1 Гц), 7,50-7,64 (5H, м), 8,26 (3H, ушир.с).
Пример 5
Гидрохлорид 3-(2-аминоэтокси)-5-(2-тиенил)изоксазола (Соединение N 535)
(a) 3-(2-(N-трет-Бутоксикарбониламино)этокси)-5-(2-тиенил)изоксазол
3-Гидрокси-5-(2-тиенил)изоксазол (0,42 г) и 2-(N-трет-бутоксикарбониламино)этанол (0,40 г) подвергают взаимодействию и последующей обработке подобно тому, как описано в Примере 1(a), чтобы получить указанное в заголовке соединение (0,63 г, 82%) в виде бесцветных кристаллов.
Т.пл.: 129-130oC (разлагается);
ИК спектр (KBr) νmax см-1: 3323, 1708, 1694, 1618;
ЯМР спектр (CDCl3) δ м.д.: 1,46 (9H, с), 3,56 (2H, кв, J = 5,1 Гц), 4,34 (2H, т, J = 5,1 Гц), 4,93 (1H, ушир.с), 6,05 (1H, с), 7,11 (1H, дд, J = 5,1 Гц, J = 3,7 Гц), 7,43-7,48 (2H, м).
(b) Гидрохлорид 3-(2-аминоэтокси)-5-(2-тиенил)изоксазола
3-(2-(N-трет-Бутоксикарбониламино)этокси)-5-(2-тиенил)изоксазол (0,05 г) подвергают взаимодействию и последующей обработке подобно тому, как описано в Примере 1(b), чтобы получить указанное в заголовке соединение (0,37 г, 95%) в виде бесцветных кристаллов.
Т.пл.: 278-283oC (разлагается);
ИК спектр (KBr) νmax см-1: 3108, 3086, 2993, 2978, 2913, 1613, 1596;
ЯМР спектр (ДМСО-d6) δ м.д.: 3,25 (2H, т, J = 5,1 Гц), 4,44 (2H, т, J = 5,1 Гц), 6,69 (1H, с), 7,25 (1H, дд, J = 5,5 Гц, J = 3,7 Гц), 7,71 (1H, д, J = 3,7 Гц), 7,84 (1H, д, J = 5,5 Гц), 8,25 (3H, ушир.с).
Пример 6
Гидрохлорид 3-(2-аминоэтокси)-4-хлор-5-(2-тиенил)изоксазола (Соединение N 539)
(a) 3-(2-(N-трет-Бутоксикарбониламино)этокси)-4-хлор-5-(2- тиенил)изоксазол
4-Хлор-3-гидрокси-5-(2-тиенил)изоксазол (0,50 г) и 2-(N-трет-бутоксикарбониламино)этанол (0,40 г) подвергают взаимодействию и последующей обработке подобно тому, как описано в Примере 1(a), чтобы получить указанное в заголовке соединение (0,57 г, 66%) в виде бесцветных кристаллов.
Т.пл.: 94-95oC;
ИК спектр (KBr) νmax см-1: 3342, 1718, 1708, 1622;
ЯМР спектр, (CDCl3) δ м.д.: 1,46 (9H, с), 3,60 (2H, кв, J = 5,1 Гц), 4,40 (2H, т, J = 5,1 Гц), 4,96 (1H, ушир.с), 7,19 (1H, дд, J = 5,2 Гц, J = 3,6 Гц), 7,56 (1H, д, J = 5,2 Гц), 7,74 (1H, д, J = 3,6 Гц).
(b) Гидрохлорид 3-(2-аминоэтокси)-4-хлор-5-(2-тиенил)изоксазола
3-(2-(N-трет-Бутоксикарбониламино)этокси)-4-хлор-5-(2-тиенил)изоксазол (0,40 г) подвергают взаимодействию и последующей обработке подобно тому, как описано в Примере 1(b), чтобы получить указанное в заголовке соединение (0,31 г, 95%) в виде бесцветных кристаллов.
Т.пл.: 278-283oC (разлагается);
ИК спектр (KBr) νmax см-1: 3109, 2960, 2897, 1626, 1596, 1579;
ЯМР спектр (ДМСО-d6) δ м.д.: 3,30 (2H, т, J = 5,1 Гц), 4,54 (2H, т, J = 5,1 Гц), 7,34 (1H, дд, J = 5,1 Гц, J = 3,6 Гц), 7,83 (1H, д, J = 3,6 Гц), 8,01 (1H, д, J = 5,1 Гц), 8,26 (3H, ушир.с).
Пример 7
Дигидрохлорид 3-(2-аминоэтокси)-5-(3-пиридил)изоксазола (Соединение N 1056)
(a) 3-(2-(N-трет-Бутоксикарбониламино)этокси)-5-(3-пиридил)изоксазол
3-Гидрокси-5-(3-пиридил)изоксазол (0,41 г) и 2-(N-трет-бутоксикарбониламино)этанол (0,40 г) подвергают взаимодействию и последующей обработке подобно тому, как описано в Примере 1(a), чтобы получить указанное в заголовке соединение (0,50 г, 65%) в виде бесцветных кристаллов.
Т.пл.: 97-98oC;
ИК спектр (KBr) νmax см-1: 3249, 3145, 1712, 1626;
ЯМР спектр (CDCl3) δ м.д.: 1,46 (9H, с), 3,57 (2H, кв, J = 5,1 Гц), 4,37 (2H, т, J = 5,1 Гц), 4,94 (1H, ушир.с), 6,25 (1H, с), 7,42 (1H, дд, J = 8,0 Гц, J = 4,9 Гц), 8,04 (1H, д, J = 8,0 Гц), 8,64 (1H, д, J = 4,9 Гц), 8,97 (1H, с).
(b) Дигидрохлорид 3-(2-аминоэтокси)-5-(3-пиридил)изоксазола
3-(2-(N-трет-Бутоксикарбониламино)этокси)-5-(3-пиридил)изоксазол (0,48 г) подвергают взаимодействию и последующей обработке подобно тому, как описано в Примере 1(b), чтобы получить указанное в заголовке соединение (0,41 г, 92%) в виде бесцветных кристаллов.
Т.пл.: 222-227oC;
ИК спектр (KBr) νmax см-1: 3096, 3068, 3043, 2967, 2886, 2813, 1641, 1597, 1539;
ЯМР спектр (ДМСО-d6) δ м.д.: 3,26 (2H, кв, J = 5,1 Гц), 4,48 (2H, т, J = 5,1 Гц), 7,11 (1H, с), 7,77 (1H, дд, J = 8,0 Гц, J = 5,1 Гц), 8,38 (3H, ушир.с), 8,46 (1H, д, J = 8,0 Гц), 8,79 (1H, д, J = 5,1 Гц), 9,21 (1H, с).
Пример 8
Дигидрохлорид 3-(2-аминоэтокси)-4-хлор-5-(3-пиридил)изоксазола (Соединение N 1061)
(a) 3-(2-(N-трет-Бутоксикарбониламино)этокси)-4-хлор-5-(3- пиридил)изоксазол
4-Хлор-3-гидрокси-5-(3-пиридил)изоксазол (0,49 г) и 2-(N-трет-бутоксикарбониламино)этанол (0,40 г) подвергают взаимодействию и последующей обработке подобно тому, как описано в Примере 1(a), чтобы получить указанное в заголовке соединение (0,54 г, 63%) в виде бесцветных кристаллов.
Т.пл.: 76-77oC;
ИК спектр (KBr) νmax см-1: 3353, 3248, 1754, 1721, 1709, 1616;
ЯМР спектр (CDCl3) δ м.д.: 1,47 (9H, с), 3,62 (2H, кв, J = 5,1 Гц), 4,43 (2H, т, J = 5,1 Гц), 4,97 (1H, ушир.с), 7,45 (1H, дд, J = 8,0 Гц, J = 5,1 Гц), 8,24 (1H, ддд, J = 8,0 Гц, J = 2,0 Гц, J = l,5 Гц), 8,72 (1H, дд, J = 5,1 Гц, J = l,5 Гц), 9,24 (1H, д, J = 2,0 Гц).
(b) Дигидрохлорид 3-(2-аминоэтокси)-4-хлор-5-(3-пиридил)изоксазола
3-(2-(N-трет-Бутоксикарбониламино)этокси)-4-хлор-5-(3-пиридил)изоксазол (0,40 г) подвергают взаимодействию и последующей обработке подобно тому, как описано в Примере 1(b), чтобы получить указанное в заголовке соединение (0,35 г, 96%) в виде бесцветных кристаллов.
Т.пл.: 205-210oC (разлагается);
ИК спектр (KBr) νmax см-1: 3103, 3053, 2937, 2899, 2875, 2823, 2800, 1634, 1607, 1590, 1541;
ЯМР спектр (ДМСО-d6) δ м.д.: 3,31 (2H, кв, J = 5,1 Гц), 4,59 (2H, т, J = 5,1 Гц), 7,74 (1H, дд, J = 8,0 Гц, J = 5,1 Гц), 8,40 (1H, ддд, J = 8,0 Гц, J = 2,0 Гц, J = 1,5 Гц), 8,40 (3H, ушир.с), 8,82 (1H, дд, J = 5,1 Гц, J = l,5 Гц), 9,15 (1H, д, J = 2,0 Гц).
Пример 9
Гидрохлорид 3-(2-аминоэтокси)-5-(2-метоксифенил)изоксазола (Соединение N 357)
(a) 3-(2-(N-трет-Бутоксикарбониламино)этокси)-5-(2- метоксифенил)изоксазол
Трифенилфосфин (0,45 г) растворяют в тетрагидрофуране (5 мл) и к раствору добавляют по каплям диэтилазодикарбоксилат (0,27 мл) при охлаждении льдом с перемешиванием и полученную смесь перемешивают при той же температуре в течение 30 мин. Затем 2-(N-трет-бутоксикарбониламино)этанол (0,20 г) и 3-гидрокси-5-(2-метоксифенил)изоксазол (0,22 г) добавляют к реакционной смеси с последующим перемешиванием полученной смеси при охлаждении льдом в течение 10 мин и при комнатной температуре в течение 24 ч. Растворитель испаряют при пониженном давлении и остаток очищают колоночной хроматографией на силикагеле (элюент: гексан/этилацетат = 4/1), чтобы получить указанное в заголовке соединение (0,33 г, 86%) в виде бесцветных кристаллов.
Т.пл.: 131-133oC;
ИК спектр (KBr) νmax см-1: 3309, 1712, 1620;
ЯМР спектр (CDCl3) δ м.д.: 1,46 (9H, с), 3,57 (2H, кв, J = 5,2 Гц), 3,95 (3H, с), 4,36 (2H, т, J = 5,2 Гц), 4,96 (1H, ушир.с), 6,43 (1H, с), 7,00 (1H, д, J = 7,8 Гц), 7,06 (1H, т, J = 7,8 Гц), 7,41 (1H, ддд, J = 7,8 Гц, J = 7,8 Гц, J = 1,7 Гц), 7,91 (1H, дд, J = 7,8 Гц, J = 1,7 Гц).
(b) Гидрохлорид 3-(2-аминоэтокси)-5-(2-метоксифенил)изоксазола
3-(2-(N-трет-бутоксикарбониламино)этокси)-5-(2-метоксифенил)изоксазол (0,31 г) растворяют в растворе 4 н. хлороводородная кислота/1,4-диоксан (2,3 мл) и раствор перемешивают при комнатной температуре в течение 30 мин. Растворитель испаряют при пониженном давлении и остаток перекристаллизуют из смеси этанола и изопропанола, чтобы получить указанное в заголовке соединение (0,21 г, 84%) в виде бесцветных кристаллов.
Т.пл.: 160-162oC (разлагается);
ИК спектр (KBr) νmax см-1: 3000, 2959, 2837, 1621, 1614;
ЯМР спектр (ДМСО-d6) δ м.д.: 3,25 (2H, т, J = 5,1 Гц), 3,94 (3H, с), 4,45 (2H, т, J = 5,1 Гц), 6,56 (1H, с), 7,11 (1H, т, J = 7,8 Гц), 7,23 (1H, д, J = 7,8 Гц), 7,52 (1H, ддд, J = 7,8 Гц, J = 7,8 Гц, J = 1,7 Гц), 7,81 (1H, дд, J = 7,8 Гц, J = 1,7 Гц), 8,25 (3H, ушир.с).
Пример 10
Гидрохлорид 3-(2-аминоэтокси)-5-(3-метоксифенил)изоксазола (Соединение N 363)
(a) 3-(2-(N-трет-Бутоксикарбониламино)этокси)-5-(3- метоксифенил)изоксазол
3-Гидрокси-5-(3-метоксифенил)изоксазол (0,22 г) и 2-(N-трет-бутоксикарбониламино)этанол (0,20 г) подвергают взаимодействию и последующей обработке подобно тому, как описано в Примере 9(a), чтобы получить указанное в заголовке соединение (0,31 г, 82%) в виде бесцветного порошка.
Т.пл.: 89-90oC;
ИК спектр (KBr) νmax см-1: 3312, 1710;
ЯМР спектр (CDCl3) δ м.д.: 1,46 (9H, с), 3,56 (2H, кв, J = 5,2 Гц), 3,86 (3H, с), 4,35 (2H, т, J = 5,2 Гц), 4,93 (1H, ушир.с), 6,13 (1H, с), 6,96-7,00 (1H, м), 7,26-7,42 (3H, м).
(b) Гидрохлорид 3-(2-аминоэтокси)-5-(3-метоксифенил)изоксазола
3-(2-(N-трет-Бутоксикарбониламино)этокси)-5-(3-метоксифенил)изоксазол (0,29 г) подвергают взаимодействию подобно тому, как описано в Примере 9(b), и продукт реакции повторно кристаллизуют из смеси этанола и изопропанола, чтобы получить указанное в заголовке соединение (0,19 г, 83%) в виде бесцветных кристаллов.
Т.пл.: 180-182oC (разлагается);
ИК спектр (KBr) νmax см-1: 2995, 2976, 2914, 1591;
ЯМР спектр (ДМСО-d6) δ м.д.: 3,26 (2H, т, J = 5,1 Гц), 3,84 (3H, с), 4,45 (2H, т, J = 5,1 Гц), 6,88 (1H, с), 7,09-7,11 (1H, м), 7,38-7,48 (3H, м), 8,28 (3H, ушир.с).
Пример 11
Гидрохлорид 3-(2-аминоэтокси)-5-(4-метоксифенил)изоксазола (Соединение N 350)
(a) 3-(2-(N-трет-Бутоксикарбониламино)этокси)-5-(4- метоксифенил)изоксазол
3-Гидрокси-5-(4-метоксифенил)изоксазол (0,22 г) и 2-(N-трет-бутоксикарбониламино)этанол (0,20 г) подвергают взаимодействию и последующей обработке подобно тому, как описано в Примере 9(a), чтобы получить указанное в заголовке соединение (0,32 г, 84%) в виде бесцветного порошка.
Т.пл.: 117-118oC;
ИК спектр (KBr) νmax см-1: 3344, 1719, 1623;
ЯМР спектр (CDCl3) δ м.д.: 1,46 (9H, с), 3,56 (2H, кв, J = 5,2 Гц), 3,86 (3H, с), 4,34 (2H, т, J = 5,2 Гц), 4,95 (1H, ушир.с), 6,02 (1H, с), 6,96 (2H, д, J = 8,9 Гц), 7,66 (2H, д, J = 8,9 Гц).
(b) Гидрохлорид 3-(2-аминоэтокси)-5-(4-метоксифенил)изоксазола
3-(2- (N-трет-Бутоксикарбониламино)этокси)-5-(4-метоксифенил)изоксазол (0,30 г) подвергают взаимодействию подобно тому, как описано в Примере 9(b), и продукт реакции повторно кристаллизуют из смеси этанола и изопропанола, чтобы получить указанное в заголовке соединение (0,17 г, 71%) в виде бесцветных кристаллов.
Т.пл.: 190-193oC (разлагается);
ИК спектр (KBr) νmax см-1: 2990, 2969, 2950, 2900, 1617;
ЯМР спектр (ДМСО-d6) δ м.д.: 3,25 (2H, т, J = 5,1 Гц), 3,83 (3H, с), 4,43 (2H, т, J = 5,1 Гц), 6,69 (1H, с), 7,09 (2H, д, J = 8,9 Гц), 7,79 (2H, д, J = 8,9 Гц), 8,25 (3H, ушир.с).
Пример 12
Гидрохлорид 3-(2-аминоэтокси)-5-(2-хлорфенил)изоксазола (Соединение N 111)
(a) 3-(2-(N-трет-Бутоксикарбониламино)этокси)-5-(2-хлорфенил)изоксазол
5-(2-Хлорфенил)-3-гидрокси-изоксазол (0,23 г) и 2-(N-трет-бутоксикарбониламино)этанол (0,20 г) подвергают взаимодействию и последующей обработке подобно тому, как описано в Примере 9(a), чтобы получить указанное в заголовке соединение (0,35 г, 88%) в виде бесцветного порошка.
Т.пл.: 125-127oC;
ИК спектр (KBr) νmax см-1: 3333, 1710, 1697, 1618;
ЯМР спектр (CDCl3) δ м.д.: 1,46 (9H, с), 3,57 (2H, кв, J = 5,2 Гц), 4,37 (2H, т, J = 5,2 Гц), 4,96 (1H, ушир.с), 6,59 (1H, с), 7,33-7,43 (2H, м), 7,46-7,54 (1H, м), 7,87-7,94 (1H, м).
(b) Гидрохлорид 3-(2-аминоэтокси)-5-(2-хлорфенил)изоксазола
3-(2-(N-трет-Бутоксикарбониламино)этокси)-5-(2-хлорфенил)изоксазол (0,33 г) подвергают взаимодействию подобно тому, как описано в Примере 9(b), и продукт взаимодействия повторно кристаллизуют из изопропанола, чтобы получить указанное в заголовке соединение (0,20 г, 74%) в виде бесцветных кристаллов.
Т.пл.: 141-144oC (разлагается);
ИК спектр (KBr) νmax см-1: 3003, 2965, 1610;
ЯМР спектр (ДМСО-d6) δ м.д.: 3,278 (2H, т, J = 5,1 Гц), 4,48 (2H, т, J = 5,1 Гц), 6,80 (1H, с), 7,52-7,60 (2H, м), 7,68 (1H, дд, J = 7,5 Гц, J = 1,9 Гц), 7,87 (1H, дд, J = 7,5 Гц, J = 1,9 Гц), 8,27 (3H, ушир.с).
Пример 13
Гидрохлорид 3-(2-аминоэтокси)-5-(3-хлорфенил)изоксазола (Соединение N 125)
(a) 3-(2-(N-трет-Бутоксикарбониламино)этокси)-5-(3-хлорфенил)изоксазол
5-(3-Хлорфенил)-3-гидроксиизоксазол (0,23 г) и 2-(N-трет-бутоксикарбониламино)этанол (0,20 г) подвергают взаимодействию и последующей обработке подобно тому, как описано в Примере 9(a), чтобы получить указанное в заголовке соединение (0,34 г, 85%) в виде бесцветного порошка.
Т.пл.: 117-119oC;
ИК спектр (KBr) νmax см-1: 3385, 1685;
ЯМР спектр (CDCl3) δ м.д.: 1,46 (9H, с), 3,57 (2H, кв, J = 5,2 Гц), 4,36 (2H, т, J = 5,2 Гц), 4,93 (1H, ушир.с), 6,16 (1H, с), 7,36-7,44 (2H, м), 7,57-7,67 (1H, м), 7,70 (1H, с).
(b) Гидрохлорид 3-(2-аминоэтокси)-5-(3-хлорфенил)изоксазола
3-(2-(N-трет-Бутоксикарбониламино)этокси)-5-(3-хлорфенил)изоксазол (0,33 г) подвергают взаимодействию подобно тому, как описано в Примере 9(b), и продукт взаимодействия повторно кристаллизуют из смеси этанола и изопропанола, чтобы получить указанное в заголовке соединение (0,21 г, 78%) в виде бесцветных кристаллов.
Т.пл.: 204-208oC (разлагается);
ИК спектр (KBr) νmax см-1: 2996, 2980, 2920, 1619;
ЯМР спектр (ДМСО-d6) δ м.д.: 3,26 (2H, т, J = 5,1 Гц), 4,45 (2H, т, J = 5,1 Гц), 6,98 (1H, с), 7,56-7,63 (2H, м), 7,80-7,84 (1H, м), 7,96 (1H, с), 8,22 (3H, ушир.с).
Пример 14
Гидрохлорид 3-(2-аминоэтокси)-4-метил-5-фенилизоксазола (Соединение N 6)
(a) 3-(2-(N-трет-Бутоксикарбониламино)этокси)-4-метил-5-фенилизоксазол
3-(2-(N-трет-Бутоксикарбониламино)этокси)-5-фенилизоксазол (0,30 г) растворяют в тетрагидрофуране (10 мл) и добавляют по каплям раствор н-бутиллитий/н-гексан (1,56 М, 1,4 мл) при -70oC под атмосферой азота с последующим перемешиванием полученной смеси в течение 10 мин. Затем к реакционной смеси добавляют по каплям метилиодид (0,09 мл) и полученную смесь перемешивают в течение 10 мин. Затем температуру реакционной смеси повышают до 0oC, реакционную смесь выливают в ледяную воду и водный раствор дигидрофосфата калия добавляют к смеси, чтобы довести pH до величины 6. Затем смесь экстрагируют этилацетатом и органический слой промывают насыщенным водным раствором NaCl с последующей сушкой над безводным сульфатом магния. После фильтрования растворитель испаряют при пониженном давлении. Остаток очищают колоночной хроматографией на силикагеле (элюент: гексан/этилацетат = 4/1), чтобы получить указанное в заголовке соединение (0,29 г, 94%) в виде бесцветного порошка.
Т.пл.: 118-120oC;
ИК спектр (KBr) νmax см-1: 3334, 2974, 1719, 1708;
ЯМР спектр (CDCl3) δ м.д.: 1,46 (9H, с), 2,12 (3H, с), 3,59 (2H, кв, J = 5,1 Гц), 4,38 (2H, т, J = 5,1 Гц), 4,94 (1H, ушир.с), 7,40-7,53 (3H, м), 7,69 (2H, д, J = 7,9 Гц).
(b) Гидрохлорид 3-(2-аминоэтокси)-4-метил-5-фенилизоксазола
3-(2-(N-трет-Бутоксикарбониламино)этокси)-4-метил-5-фенилизоксазол (0,29 г) подвергают взаимодействию подобно тому, как описано в Примере 9(b), и продукт реакции повторно кристаллизуют из смеси метанола и этанола, чтобы получить указанное в заголовке соединение (0,18 г, 78%) в виде бесцветных кристаллов.
Т.пл.: 245-250oC (разлагается);
ИК спектр (KBr) νmax см-1: 3003, 2892, 1516;
ЯМР спектр (ДМСО-d6) δ м.д.: 2,13 (3H, с), 3,28 (2H, т, J = 5,1 Гц), 4,46 (2H, т, J = 5,1 Гц), 7,50-7,59 (3H, м), 7,73 (2H, д, J = 7,2 Гц), 8,21 (3H, ушир.с).
Пример 15
Гидрохлорид 3-(2-аминоэтокси)-4-этил-5-фенилизоксазола (Соединение N 7)
(a) 3-(2-(N-трет-Бутоксикарбониламино)этокси)-4-этил-5-фенилизоксазол
3-(2-(N-трет-Бутоксикарбониламино)этокси)-5-фенилизоксазол (0,3 г) и этилиодид (0,12 мл) подвергают взаимодействию и последующей обработке подобно тому, как описано в Примере 14(a), чтобы получить указанное в заголовке соединение (0,24 г, 73%) в виде бесцветного масла.
ИК спектр (CHCl3) νmax см-1: 3460, 2980, 1713;
ЯМР спектр (CDCl3) δ м.д.: 1,21 (3H, т, J = 7,5 Гц), 1,46 (9H, с), 2,56 (2H, кв, J = 7,5 Гц), 3,59 (2H, кв, J = 5,2 Гц), 4,38 (2H, т, J = 5,2 Гц), 4,90 (1H, ушир.с), 7,37-7,51 (3H, м), 7,64-7,68 (2H, м).
(b) Гидрохлорид 3-(2-аминоэтокси)-4-этил-5-фенилизоксазола
3-(2-(N-трет-Бутоксикарбониламино)этокси)-4-этил-5-фенилизоксазол (0,21 г) подвергают взаимодействию и последующей обработке подобно тому, как описано в Примере 9(b), чтобы получить указанное в заголовке соединение (0,12 г, 71%) в виде бесцветных кристаллов.
Т.пл.: 210-215oC (разлагается);
ИК спектр (KBr) νmax см-1: 2968, 2886, 1518;
ЯМР спектр (ДМСО-d6) δ м.д.: 1,15 (3H, т, J = 7,5 Гц), 2,58 (2H, кв, J = 7,5 Гц), 3,29 (2H, т, J = 5,1 Гц), 4,46 (2H, т, J = 5,1 Гц), 7,51-7,59 (3H, м), 7,67-7,70 (2H, м), 8,25 (3H, ушир.с).
Пример 16
Гидрохлорид 3-(2-аминоэтокси)-5-фенил-4-пропилизоксазола (Соединение N 8)
(a) 3-(2-(N-трет-Бутоксикарбониламино)этокси)-5-фенил-4-пропилизоксазол
3-(2-(N-трет-Бутоксикарбониламино)этокси)-5-фенилизоксазол (0,3 г) и пропилиодид (0,29 мл) подвергают взаимодействию и последующей обработке подобно тому, как описано в Примере 14(a), чтобы получить указанное в заголовке соединение (0,22 г, 65%) в виде бесцветного масла.
ИК спектр (CHCl3) νmax см-1: 3460, 2966, 1713;
ЯМР спектр (CDCl3) δ м. д. : 0,97 (3H, т, J = 7,4 Гц), 1,46 (9H, с), 1,56-1,69 (2H, м), 2,51 (2H, т, J = 7,6 Гц), 3,58 (2H, кв, J = 5,2 Гц), 4,37 (2H, т, J = 5,2 Гц), 4,90 (1H, ушир.с), 7,43-7,53 (3H, м), 7,65-7,68 (2H, м).
(b) Гидрохлорид 3-(2-аминоэтокси)-5-фенил-4-пропилизоксазола
3-(2-(N-трет-Бутоксикарбониламино)этокси)-5-фенил-4-пропилизоксазол (0,18 г) подвергают взаимодействию и последующей обработке подобно тому, как описано в Примере 9(b), чтобы получить указанное в заголовке соединение (0,10 г, 71%) в виде бесцветных кристаллов.
Т.пл.: 119-121oC (разл.);
ИК спектр (KBr) νmax см-1: 2960, 2933, 2872, 1518;
ЯМР спектр (ДМСО-d6) δ м.д.: 0,91 (3H, т, J = 7,3 Гц), 1,51-1,61 (2H, м), 2,54 (2H, т, J = 7,7 Гц), 3,28 (2H, т, J = 5,1 Гц), 4,45 (2H, т, J = 5,1 Гц), 7,50-7,59 (3H, м), 7,68-7,70 (2H, м), 8,20 (3H, ушир.с).
Пример 17
Гидрохлорид 3-(2-аминоэтокси)-4-бутил-5-фенилизоксазола (Соединение N 10)
(a) 3-(2-(N-трет-Бутоксикарбониламино)этокси)-4-бутил-5-фенилизоксазол
3-(2-(N-трет-Бутоксикарбониламино)этокси)-5-фенилизоксазол (0,3 г) и бутилиодид (0,17 мл) подвергают взаимодействию и последующей обработке подобно тому, как описано в Примере 14(a), чтобы получить указанное в заголовке соединение (0,23 г, 66%) в виде бесцветного масла.
ИК спектр (CHCl3) νmax см-1: 3460, 2962, 1713;
ЯМР спектр (CDCl3) δ м.д.: 0,93 (3H, т, J = 7,3 Гц), 1,31-1,63 (4H, м), 1,46 (9H, с), 2,53 (2H, т, J = 7,6 Гц), 3,58 (2H, кв, J = 5,3 Гц), 4,38 (2H, т, J = 5,3 Гц), 4,90 (1H, ушир.с), 7,42-7,51 (3H, м), 7,65-7,68 (2H, м).
(b) Гидрохлорид 3-(2-аминоэтокси)-4-бутил-5-фенилизоксазола
3-(2-(N-трет-Бутоксикарбониламино)этокси)-4-бутил-5-фенилизоксазол (0,20 г) подвергают взаимодействию и последующей обработке подобно тому, как описано в Примере 9(b), чтобы получить указанное в заголовке соединение (0,12 г, 75%) в виде бесцветных кристаллов.
Т.пл.: 104-106oC;
ИК спектр (KBr) νmax см-1: 3006, 2963, 2951, 2931, 2869, 1516;
ЯМР спектр (ДМСО-d6) δ м.д.: 0,87 (3H, т, J = 7,3 Гц), 1,27-1,37 (2H, м), 1,47-1,55 (2H, м), 2,57 (2H, т, J = 7,7 Гц), 3,28 (2H, т, J = 5,1 Гц), 4,46 (2H, т, J = 5,1 Гц), 7,51-7,59 (3H, м), 7,68-7,70 (2H, м), 8,23 (3H, ушир.с).
Пример 18
Гидрохлорид 3-(2-аминоэтокси)-4-гексил-5-фенилизоксазола (Соединение N 1388)
(a) 3-(2-(N-трет-Бутоксикарбониламино)этокси)-4-гексил-5-фенилизоксазол
3-(2-(N-трет-Бутоксикарбониламино)этокси)-5-фенилизоксазол (0,4 г) и гексилиодид (0,23 мл) подвергают взаимодействию и последующей обработке подобно тому, как описано в Примере 14(a), чтобы получить указанное в заголовке соединение (0,31 г, 61%) в виде бесцветного порошка.
ИК спектр (KBr) νmax см-1: 3387, 2936, 1715;
ЯМР спектр (CDCl3) δ м.д.: 0,88 (3H, т, J = 6,6 Гц), 1,23-1,42 (6H, м), 1,46 (9H, с), 1,53-1,70 (2H, м), 2,52 (2H, т, J = 7,7 Гц), 3,58 (2H, кв, J = 5,1 Гц), 4,37 (2H, т, J = 5,1 Гц), 4,90 (1H, ушир.с), 7,40-7,51 (3H, м), 7,65-7,68 (2H, м).
(b) Гидрохлорид 3-(2-аминоэтокси)-4-гексил-5-фенилизоксазола
3-(2-(N-трет-Бутоксикарбониламино)этокси)-4-гексил-5-фенилизоксазол (0,2 г) подвергают взаимодействию и последующей обработке подобно тому, как описано в Примере 9(b), чтобы получить указанное в заголовке соединение (0,13 г, 81%) в виде бесцветных кристаллов.
Т.пл.: 99-101oC;
ИК спектр (KBr) νmax см-1: 2954, 2930, 1515;
ЯМР спектр (ДМСО-d6) δ м.д.: 0,83 (3H, т, J = 6,9 Гц), 1,18-1,32 (6H, м), 1,48-1,55 (2H, м), 2,56 (2H, т, J = 7,7 Гц), 3,28 (2H, т, J = 5,1 Гц), 4,45 (2H, т, J = 5,1 Гц), 7,50-7,59 (3H, м), 7,67-7,69 (2H, м), 8,16 (3H, ушир.с).
Пример 19
Гидрохлорид 3-(2-аминоэтокси)-4-карбокси-5-фенилизоксазола (Соединение N 1408)
(a) 3-(2-(N-трет-Бутоксикарбониламино)этокси)-4-карбокси-5- фенилизоксазол
3-(2-(N-трет-Бутоксикарбониламино)этокси)-5-фенилизоксазол (2,00 г) растворяют в тетрагидрофуране (20 мл) и добавляют по каплям бутиллитий (1,56 М раствор в гексане, 9,3 мл) при -70oC под атмосферой азота и полученную смесь перемешивают в течение 10 мин. Затем реакционную смесь барботируют диоксидом углерода в течение 10 мин и температуру реакционной смеси повышают до 0oC. Реакционную смесь выливают в ледяную воду и доводят pH смеси до 6 водным раствором дигидрофосфата калия с последующим экстрагированием этилацетатом. Органический слой промывают насыщенным водным раствором NaCl и сушат над безводным сульфатом магния. После фильтрования растворитель испаряют при пониженном давлении. Остаток промывают простым эфиром, чтобы получить указанное в заголовке соединение (2,18 г, 95%) в виде бесцветного порошка.
ИК спектр (KBr) νmax см-1: 2982, 1706;
ЯМР спектр (ДМСО-d6) δ м.д.: 1,38 (9H, с), 3,38 (2H, кв, J = 5,7 Гц), 4,29 (2H, т, J = 5,7 Гц), 7,01 (1H, ушир.с), 7,51-7,62 (3H, м), 7,84-7,91 (2H, м).
(b) Гидрохлорид 3-(2-аминоэтокси)-4-карбокси-5-фенилизоксазола
3-(2-(N-трет-Бутоксикарбониламино)этокси)-4-карбокси-5-фенилизоксазол (0,12 г) подвергают взаимодействию и последующей обработке подобно тому, как описано в Примере 9(b), чтобы получить указанное в заголовке соединение (0,06 г, 60%) в виде бесцветных кристаллов.
Т.пл.: 180-183oC (разлагается);
ИК спектр (KBr) νmax см-1: 3149, 2873, 2820, 1755, 1709;
ЯМР спектр (ДМСО-d6) δ м.д.: 3,30 (2H, т, J = 5,3 Гц), 4,54 (2H, т, J = 5,3 Гц), 7,54-7,65 (3H, м), 7,85-7,87 (2H, м), 8,22 (3H, ушир.с).
Пример 20
Гидрохлорид 3-(2-аминоэтокси)-4-карбамоил-5-фенилизоксазола (Соединение N 1414)
(a) 3-(2-(N-трет-Бутоксикарбониламино)этокси)-4-карбамоил-5- фенилизоксазол
3-(2-(N-трет-Бутоксикарбониламино)этокси)-4-карбокси-5-фенилизоксазол (0,6 г) растворяют в тетрагидрофуране (6 мл) и добавляют карбонилдиимидазол (0,31 г) при охлаждении льдом с перемешиванием с последующим перемешиванием смеси при комнатной температуре в течение 30 мин. Затем к реакционной смеси добавляют по каплям водный аммиак (1 мл) и смесь перемешивают при комнатной температуре в течение одного часа. Реакционную смесь выливают в ледяную воду и экстрагируют этилацетатом. Органический слой промывают насыщенным водным раствором NaCl и сушат над безводным сульфатом магния. После фильтрования растворитель испаряют при пониженном давлении, чтобы получить указанное в заголовке соединение (0,60 г, количественный) в виде бесцветного порошка.
ИК спектр (KBr) νmax см-1: 3439, 3371, 3149, 1694, 1680;
ЯМР спектр (ДМСО-d6) δ м.д.: 1,39 (9H, с), 3,39 (2H, кв, J = 5,0 Гц), 4,30 (2H, т, J = 5,0 Гц), 7,38 (1H, ушир.с), 7,51-7,57 (3H, м), 7,71 (1H, ушир.с), 7,91-7,94 (2H, м).
(b) Гидрохлорид 3-(2-аминоэтокси)-4-карбамоил-5-фенилизоксазола
3-(2-(N-трет-Бутоксикарбониламино)этокси)-4-карбамоил-5-фенилизоксазол (0,22 г) подвергают взаимодействию и последующей обработке подобно тому, как описано в Примере 9(b), чтобы получить указанное в заголовке соединение (0,13 г, 72%) в виде бесцветных кристаллов.
Т.пл.: 225-230oC (разлагается),
ИК спектр (KBr) νmax см-1: 3407, 3213, 2963, 2878, 1662;
ЯМР спектр (ДМСО-d6) δ м.д.: 3,32 (2H, т, J = 4,9 Гц), 4,54 (2H, т, J = 4,9 Гц), 7,52-7,60 (4H, м), 7,77 (1H, ушир.с), 7,92-7,94 (2H, м), 8,29 (3H, ушир.с).
Пример 21
Гидрохлорид 3-(2-аминоэтокси)-4-циано-5-фенилизоксазола (Соединение N 1406)
(a) 3-(2-(N-трет-Бутоксикарбониламино)этокси)-4-циано-5-фенилизоксазол
3-(2-(N-трет-Бутоксикарбониламино)этокси)-4-карбамоил-5-фенилизоксазол (0,38 г) растворяют в диметилформамиде (4 мл) и добавляют по каплям оксихлорид фосфора (0,11 мл) при 5oC под атмосферой азота с последующим перемешиванием смеси при комнатной температуре в течение 30 мин. Реакционную смесь выливают в ледяную воду и экстрагируют этилацетатом. Органический слой промывают насыщенным водным раствором NaCl и сушат над безводным сульфатом магния. После фильтрования растворитель испаряют при пониженном давлении. Остаток очищают колоночной хроматографией на силикагеле (элюент: гексан/этилацетат = 3/1), чтобы получить указанное в заголовке соединение (0,28 г, 78%) в виде бесцветного твердого вещества.
ИК спектр (KBr) νmax см-1: 3384, 2237, 1690, 1680;
ЯМР спектр (CHCl3) δ м.д.: 1,47 (9H, с), 3,61 (2H, кв, J = 5,2 Гц), 4,43 (2H, т, J = 5,2 Гц), 4,97 (1H, ушир.с), 7,52-7,64 (3H, м), 8,01-8,05 (2H, м).
(b) Гидрохлорид 3-(2-аминоэтокси)-4-циано-5-фенилизоксазола
3-(2-(N-трет-Бутоксикарбониламино)этокси)-4-циано-5-фенилизоксазол (0,25 г) подвергают взаимодействию и последующей обработке подобно тому, как описано в Примере 9(b), чтобы получить указанное в заголовке соединение (0,13 г, 65%) в виде бесцветных кристаллов.
Т.пл.: 200-205oC (разлагается);
ИК спектр (KBr) νmax см-1: 2967, 2236, 1611;
ЯМР спектр (ДМСО-d6) δ м.д.: 3,32 (2H, т, J = 5,1 Гц), 4,60 (2H, т, J = 5,1 Гц), 7,68-7,76 (3H, м), 7,98-8,01 (2H, м), 8,29 (3H, ушир.с).
Пример 22
Гидрохлорид 3-(2-аминоэтокси)-4-метоксикарбонил-5-фенилизоксазола (Соединение N 1412)
(a) 3-(2-(N-трет-Бутоксикарбониламино)этокси)-4-метоксикарбонил-5- фенилизоксазол
3-(2-(N-трет-Бутоксикарбониламино)этокси)-4-карбокси-5-фенилизоксазол (0,2 г) растворяют в смеси метанола и бензола (1:5, 10 мл) и добавляют по каплям триметилсилилдиазометан (0,6 мл, 2,0 М раствор в гексане) при охлаждении льдом с последующим перемешиванием смеси при комнатной температуре в течение 30 мин. Реакционную смесь выливают в ледяную воду и экстрагируют этилацетатом. Органический слой промывают насыщенным водным раствором NaCl и сушат над безводным сульфатом магния. После фильтрования растворитель испаряют при пониженном давлении. Остаток очищают колоночной хроматографией на силикагеле (элюент: гексан/этилацетат = 3/1), чтобы получить указанное в заголовке соединение (0,17 г, 81%) в виде бесцветного твердого вещества.
ИК спектр (KBr) νmax см-1: 3355, 1725, 1691;
ЯМР спектр (CDCl3) δ м.д.: 1,46 (9H, с), 3,62 (2H, кв, J = 5,1 Гц), 3,85 (3H, с), 4,43 (3H, т, J = 5,1 Гц), 5,03 (1H, ушир.с), 7,46-7,54 (3H, м), 7,87-7,91 (2H, м).
(b) Гидрохлорид 3-(2-аминоэтокси)-4-метоксикарбонил-5-фенилизоксазола
3-(2-(N-трет-Бутоксикарбониламино)этокси)-4-метоксикарбонил-5- фенилизоксазол (0,16 г) подвергают взаимодействию и последующей обработке подобно тому, как описано в Примере 9(b), чтобы получить указанное в заголовке соединение (0,08 г, 62%) в виде бесцветных кристаллов.
Т.пл.: 195-198oC (разлагается);
ИК спектр (KBr) νmax см-1: 3148, 2870, 2848, 2821, 1708;
ЯМР спектр (ДМСО-d6) δ м.д.: 3,30 (2H, т, J = 5,2 Гц), 3,77 (3H, с), 4,54 (2H, т, J = 5,2 Гц), 7,56-7,66 (3H, м), 7,85-7,87 (2H, м), 8,24 (3H, ушир.с).
Пример 23
Гидрохлорид 3-(2-аминоэтокси)-4-метиламинокарбонил-5-фенилизоксазола (Соединение N 1416)
(a) 3-(2-(N-трет-Бутоксикарбониламино)этокси)-4-метиламинокарбонил-5- фенилизоксазол
3-(2-(N-трет-Бутоксикарбониламино)этокси)-4-карбокси-5-фенилизоксазол (0,2 г) и метиламин (30%-ный раствор в метаноле, 0,12 мл) подвергают взаимодействию и последующей обработке подобно тому, как описано в Примере 20(a), чтобы получить указанное в заголовке соединение (0,18 г, 87%) в виде бесцветного порошка.
ИК спектр (KBr) νmax см-1: 3405, 3369, 1677;
ЯМР спектр (CDCl3) δ м.д.: 1,45 (9H, с), 2,97 (3H, д, J = 5,0 Гц), 3,64 (2H, кв, J = 5,1 Гц), 4,44 (2H, т, J = 5,1 Гц), 4,90 (1H, ушир.с), 7,30 (1H, ушир.с), 7,46-7,50 (3H, м), 8,05-8,09 (2H, м).
(b) Гидрохлорид 3-(2-аминоэтокси)-4-метиламинокарбонил-5- фенилизоксазола
3-(2-(N-трет-Бутоксикарбониламино)этокси)-4-метиламинокарбонил-5- фенилизоксазол (0,17 г) подвергают взаимодействию и последующей обработке подобно тому, как описано в Примере 14(a), чтобы получить указанное в заголовке соединение (0,08 г, 57%) в виде бесцветных кристаллов.
Т.пл.: 223-226oC (разлагается);
ИК спектр (KBr) νmax см-1: 3102, 2935, 2879, 1646;
ЯМР спектр (ДМСО-d6) δ м.д.: 2,78 (3H, д, J = 4,4 Гц), 3,32 (2H, т, J = 4,8 Гц), 4,53 (2H, т, J = 4,8 Гц), 7,51-7,60 (3H, м), 7,89-7,92 (2H, м), 8,18 (1H, д, J = 4,4 Гц), 8,31 (3H, ушир.с).
Пример 24
Гидрохлорид 3-(2-аминоэтокси)-5-(4-хлорфенил)-4-метилизоксазола (Соединение N 148)
(a) 3-(2-(N-трет-Бутоксикарбониламино)этокси)-5-(4-хлорфенил)-4- метилизоксазол
3-(2-(N-трет-Бутоксикарбониламино)этокси)-5-(4-хлорфенил)изоксазол (0,25 г) и метилиодид (0,06 мл) подвергают взаимодействию и последующей обработке подобно тому, как описано в Примере 14(a), чтобы получить указанное в заголовке соединение (0,23 г, 89%) в виде бесцветного порошка.
ИК спектр (KBr) νmax см-1: 3344, 2980, 1682;
ЯМР спектр (CDCl3) δ м.д.: 1,46 (9H, с), 2,10 (3H, с), 3,58 (2H, кв, J = 5,2 Гц), 4,37 (2H, т, J = 5,2 Гц), 4,90 (1H, ушир.с), 7,45 (2H, д, J = 8,6 Гц), 7,63 (2H, д, J = 8,6 Гц).
(b) Гидрохлорид 3-(2-аминоэтокси)-5-(4-хлорфенил)-4-метилизоксазола
3-(2-(N-трет-Бутоксикарбониламино)этокси)-5-(4-хлорфенил)-4- метилизоксазол (0,22 г) подвергают взаимодействию и последующей обработке подобно тому, как описано в Примере 9(b), чтобы получить указанное в заголовке соединение (0,09 г, 50%) в виде бесцветных кристаллов.
Т.пл.: 248-253oC (разлагается);
ИК спектр (KBr) νmax см-1: 3020, 2991, 2884, 1513;
ЯМР спектр (ДМСО-d6) δ м.д.: 2,12 (3H, с), 3,27 (2H, т, J = 5,1 Гц), 4,45 (2H, т, J = 5,1 Гц), 7,63 (2H, д, J = 8,6 Гц), 7,75 (2H, д, J = 8,6 Гц), 8,23 (3H, ушир.с).
Пример 25
Гидрохлорид 3-(2-аминоэтокси)-5-(4-хлорфенил)-4-этилизоксазол (Соединение N 149)
(a) 3-(2-(N-трет-Бутоксикарбониламино)этокси)-5-(4-хлорфенил)-4- этилизоксазол
3-(2-(N-трет-Бутоксикарбониламино)этокси)-5-(4-хлорфенил)изоксазол (0,4 г) и этилиодид (0,11 мл) подвергают взаимодействию и последующей обработке подобно тому, как описано в Примере 14(a), чтобы получить указанное в заголовке соединение (0,26 г, 61%) в виде бесцветного масла.
ИК спектр (KBr) νmax см-1: 3460, 2980, 1713;
ЯМР спектр (CDCl3) δ м.д.: 1,20 (3H, т, J = 7,4 Гц), 1,46 (9H, с), 2,54 (2H, кв, J = 7,4 Гц), 3,59 (2H, кв, J = 5,2 Гц), 4,37 (2H, т, J = 5,2 Гц), 4,90 (1H, ушир.с), 7,45 (2H, д, J = 8,5 Гц), 7,59 (2H, д, J = 8,5 Гц).
(b) Гидрохлорид 3-(2-аминоэтокси)-5-(4-хлорфенил)-4-этилизоксазола
3-(2-(N-трет-Бутоксикарбониламино)этокси)-5-(4-хлорфенил)-4- этилизоксазол (0,22 г) подвергают реакции и последующей обработке подобно тому, как описано в Примере 9(b), чтобы получить указанное в заголовке соединение (0,13 г, 72%) в виде бесцветных кристаллов.
Т.пл.: 217-220oC (разлагается);
ИК спектр (KBr) νmax см-1: 2972, 2892, 1515;
ЯМР спектр (ДМСО-d6) δ м.д.: 1,14 (3H, т, J = 7,5 Гц), 2,58 (2H, кв, J = 7,5 Гц), 3,28 (2H, т, J = 5,2 Гц), 4,46 (2H, т, J = 5,2 Гц), 7,64 (2H, д, J = 8,6 Гц), 7,71 (2H, д, J = 8,6 Гц), 8,20 (3H, ушир.с).
Пример 26
Гидрохлорид 3-(2-аминоэтокси)-5-(4-хлорфенил)-4-пропилизоксазола (Соединение N 150)
(a) 3-(2-(N-трет-Бутоксикарбониламино)этокси)-5-(4-хлорфенил)-4- пропилизоксазол
3-(2-(N-трет-Бутоксикарбониламино)этокси)-5-(4-хлорфенил)изоксазол (0,4 г) и пропилиодид (0,14 мл) подвергают взаимодействию и последующей обработке подобно тому, как описано в Примере 14(a), чтобы получить указанное в заголовке соединение (0,21 г, 47%) в виде бесцветного порошка.
ИК спектр (KBr) νmax см-1: 3392, 2963, 1685;
ЯМР спектр (CDCl3) δ м. д. : 0,96 (3H, т, J = 7,4 Гц), 1,46 (9H, с), 1,57-1,69 (2H, м), 2,49 (2H, т, J = 7,6 Гц), 3,58 (2H, кв, J = 5,2 Гц), 4,37 (2H, т, J = 5,2 Гц), 4,87 (1H, ушир.с), 7,45 (2H, д, J = 8,6 Гц), 7,60 (2H, д, J = 8,6 Гц).
(b) Гидрохлорид 3-(2-аминоэтокси)-5-(4-хлорфенил)-4-пропилизоксазола
3-(2-(N-трет-Бутоксикарбониламино)этокси)-5-(4-хлорфенил)-4- пропилизоксазол (0,19 г) подвергают взаимодействию и последующей обработке подобно тому, как описано в Примере 9(b), чтобы получить указанное в заголовке соединение (0,13 г, 81%) в виде бесцветных кристаллов.
Т.пл.: 146-149oC (разлагается);
ИК спектр (KBr) νmax см-1: 2958, 2871, 2829, 1516;
ЯМР спектр (ДМСО-d6) δ м.д.: 0,90 (3H, т, J = 7,3 Гц), 1,50-1,59 (2H, м), 2,54 (2H, т, J = 7,3 Гц), 3,28 (2H, т, J = 5,2 Гц), 4,45 (2H, т, J = 5,2 Гц), 7,63 (2H, д, J = 8,7 Гц), 7,72 (2H, д, J = 8,7 Гц), 8,21 (3H, ушир.с).
Пример 27
Гидрохлорид 3-(2-аминоэтокси)-5-(4-метилфенил)изоксазола (Соединение N 260)
(a) 3-(2-(N-трет-Бутоксикарбониламино)этокси)-5-(4-метилфенил)изоксазол
3-Гидрокси-5-(4-метилфенил)изоксазол (1,5 г) и 2-(N-трет-бутоксикарбониламино)этанол (1,5 г) подвергают взаимодействию и последующей обработке подобно тому, как описано в Примере 9(a), чтобы получить указанное в заголовке соединение (2,2 г, 82%) в виде бесцветного порошка.
ИК спектр (KBr) νmax см-1: 3375, 3356, 3332, 1719, 1684;
ЯМР спектр (CDCl3) δ м.д.: 1,46 (9H, с), 2,40 (3H, с), 3,56 (2H, кв, J = 5,1 Гц), 4,35 (2H, т, J = 5,1 Гц), 4,94 (1H, ушир.с), 6,09 (1H, с), 7,26, (2H, д, J = 8,1 Гц), 7,61 (2H, д, J = 8,1 Гц).
(b) Гидрохлорид 3-(2-аминоэтокси)-5-(4-метилфенил)изоксазола
3-(2-(N-трет-Бутоксикарбониламино)этокси)-5-(4-метилфенил)изоксазол (0,3 г) подвергают взаимодействию и последующей обработке подобно тому, как описано в Примере 9(b), чтобы получить указанное в заголовке соединение (0,16 г, 67%) в виде бесцветных кристаллов.
Т.пл.: 215-220oC (разлагается);
ИК спектр (KBr) νmax см-1: 2993, 2979, 1622;
ЯМР спектр (ДМСО-d6) δ м.д.: 2,37 (3H, с), 3,25 (2H, т, J = 5,0 Гц), 4,44 (2H, т, J = 5,0 Гц), 6,76 (1H, с), 7,35 (2H, д, J = 8,1 Гц), 7,74 (2H, д, J = 8,1 Гц), 8,26 (3H, ушир.с).
Пример 28
Гидрохлорид 3-(2-аминоэтокси)-5-(4-трифторметилфенил)изоксазола (Соединение N 332)
(a) 3-(2-(N-трет-Бутоксикарбониламино)этокси-5-(4- трифторметилфенил)изоксазол
3-Гидрокси-5-(4-трифторметилфенил)изоксазол (0,2 г) и 2-(N-трет-бутоксикарбониламино)этанол (0,15 г) подвергают взаимодействию и последующей обработке подобно тому, как описано в Примере 9(a), чтобы получить указанное в заголовке соединение (0,26 г, 81%) в виде бесцветного порошка.
ИК спектр (KBr) νmax см-1: 3376, 1679, 1608;
ЯМР спектр (CDCl3) δ м.д.: 1,46 (9H, с), 3,58 (2H, кв, J = 5,1 Гц), 4,37 (2H, т, J = 5,1 Гц), 4,92 (1H, ушир.с), 6,25 (1H, с), 7,72 (2H, д, J = 8,2 Гц), 7,84 (2H, д, J = 8,2 Гц).
(b) Гидрохлорид 3-(2-аминоэтокси)-5-(4-трифторметилфенил)изоксазола
3-(2-(N-трет-Бутоксикарбониламино)этокси)-5-(4- трифторметилфенил)изоксазол (0,24 г) подвергают взаимодействию и последующей обработке подобно тому, как описано в Примере 9(b), чтобы получить указанное в заголовке соединение (0,14 г, 70%) в виде бесцветных кристаллов.
Т.пл.: 226-232oC (разлагается);
ИК спектр (KBr) νmax см-1: 2993, 2965, 2914, 1608;
ЯМР спектр (ДМСО-d6) δ м.д.: 3,27 (2H, т, J = 5,1 Гц), 4,47 (2H, т, J = 5,1 Гц), 7,07 (1H, с), 7,93 (2H, д, J = 8,3 Гц), 8,09 (2H, д, J = 8,3 Гц), 8,26 (3H, ушир.с).
Пример 29
Гидрохлорид 3-(2-аминоэтокси)-5-(4-фторфенил)изоксазола (Соединение N 66)
(a) 3-(2-(N-трет-Бутоксикарбониламино)этокси)-5-(4-фторфенил)изоксазол
5-(4-Фторфенил)-3-гидроксиизоксазол (0,06 г) и 2-(N-трет-бутоксикарбониламино)этанол (0,06 г) подвергают взаимодействию и последующей обработке подобно тому, как описано в Примере 9(a), чтобы получить указанное в заголовке соединение (0,08 г, 74%) в виде бесцветного порошка.
ИК спектр (KBr) νmax см-1: 3375, 1682;
ЯМР спектр (CDCl3) δ м.д.: 1,46 (9H, с), 3,56 (2H, кв, J = 5,1 Гц), 4,35 (2H, т, J = 5,1 Гц), 4,93 (1H, ушир.с), 6,09 (1H, с), 7,15 (2H, т, J = 8,6 Гц), 7,71 (2H, дд, J = 8,6 Гц, J = 5,3 Гц).
(b) Гидрохлорид 3-(2-аминоэтокси)-5-(4-фторфенил)изоксазола
3-(2-(N-трет-Бутоксикарбониламино)этокси)-5-(4-фторфенил)изоксазол (0,05 г) подвергают взаимодействию и последующей обработке подобно тому, как описано в Примере 9(b), чтобы получить указанное в заголовке соединение (0,02 г, 56%) в виде бесцветных кристаллов.
Т.пл.: 232-238oC (разлагается);
ИК спектр (KBr) νmax см-1: 2993, 2978, 2911, 1621;
ЯМР спектр (ДМСО-d6) δ м.д.: 3,26 (2H, т, J = 5,0 Гц), 4,44 (2H, т, J = 5,0 Гц), 6,84 (1H, с), 7,40 (2H, т, J = 8,8 Гц), 7,93 (2H, дд, J = 8,8 Гц, J = 5,3 Гц), 8,25 (3H, ушир.с).
Пример 30
Гидрохлорид 3-(2-аминоэтокси)-5-(1-нафтил)изоксазола (Соединение N 475)
(a) 3-(2-(N-трет-Бутоксикарбониламино)этокси)-5-(1-нафтил)изоксазол
3-Гидрокси-5-(1-нафтил)изоксазол (0,20 г) и 2-(N-трет-бутоксикарбониламино)этанол (0,17 г) подвергают взаимодействию и последующей обработке подобно тому, как описано в Примере 9(a), чтобы получить указанное в заголовке соединение (0,30 г, 89%) в виде бесцветного порошка.
ИК спектр (KBr) νmax см-1: 3318, 1712;
ЯМР спектр (CDCl3) δ м.д.: 1,47 (9H, с), 3,61 (2H, кв, J = 5,3 Гц), 4,42 (2H, т, J = 5,3 Гц), 4,97 (1H, ушир.с), 6,25 (1H, с), 7,52-7,61 (3H, м), 7,77-7,79 (1H, м), 7,90-7,99 (2H, м), 8,27-8,31 (1H, м).
(b) Гидрохлорид 3-(2-аминоэтокси)-5-(1-нафтил)изоксазола
3-(2-(N-трет-Бутоксикарбониламино)этокси)-5-(1-нафтил)изоксазол (0,28 г) подвергают взаимодействию и последующей обработке подобно тому, как описано в Примере 9(b), чтобы получить указанное в заголовке соединение (0,18 г, 78%) в виде бесцветных кристаллов.
Т.пл.: 201-205oC (разлагается);
ИК спектр (KBr) νmax см-1: 3002, 2968, 2913, 1602;
ЯМР спектр (ДМСО-d6) δ м.д.: 3,31 (2H, т, J = 5,1 Гц), 4,52 (2H, т, J = 5,1 Гц), 6,83 (1H,с), 7,63-7,70 (3H, м), 7,87-7,89 (1H, м), 8,07-8,25 (3H, м), 8,30 (3H.ушир.с).
Пример 31
Гидрохлорид 3-(2-аминоэтокси)-4-бром-5-фенилизоксазола (Соединение N 1357)
(a) 4-Бром-3-(2-(N-трет-бутоксикарбониламино)этокси)-5-фенилизоксазол
4-Бром-3-гидрокси-5-фенилизоксазол (0,2 г) и 2-(N-трет-бутоксикарбониламино)этанол (0,15 г) подвергают взаимодействию и последующей обработке подобно тому, как описано в Примере 9(a), чтобы получить указанное в заголовке соединение (0,26 г, 81%) в виде бесцветного порошка.
ИК спектр (KBr) νmax см-1: 3352, 2976, 1719, 1709;
ЯМР спектр (CDCl3) δ м.д.: 1,47 (9H, с), 3,61 (2H, кв, J = 5,1 Гц), 4,41 (2H, т, J = 5,1 Гц), 4,97 (1H, ушир.с), 7,47-7,55 (3H, м), 7,98-8,04 (2H, м).
(b) Гидрохлорид 3-(2-аминоэтокси)-4-бром-5-фенилизоксазола
4-Бром-3-(2-(N-трет-бутоксикарбониламино)этокси)-5-фенилизоксазол (0,24 г) подвергают взаимодействию и последующей обработке подобно тому, как описано в Примере 9(b), чтобы получить указанное в заголовке соединение (0,13 г, 65%) в виде бесцветных кристаллов.
Т.пл.: 192-198oC (разлагается);
ИК спектр (KBr) νmax см-1: 2991, 2921, 2894, 1614, 1594, 1574;
ЯМР спектр (ДМСО-d6) δ м.д.: 3,32 (2H, т, J = 5,1 Гц), 4,54 (2H, т, J = 5,1 Гц), 7,60-7,66 (3H, м), 7,95-7,98 (2H, м), 8,19 (3H, ушир.с).
Пример 32
Гидрохлорид 3-(2-аминоэтокси)-4-иод-5-фенилизоксазола (Соединение N 1359)
(a) 3-(2-(N-трет-бутоксикарбониламино)этокси)-4-иод-5-фенилизоксазол
3-Гидрокси-4-иод-5-фенилизоксазол (0,2 г) и 2-(N-трет-бутоксикарбониламино)этанол (0,12 г) подвергают взаимодействию и последующей обработке подобно тому, как описано в Примере 9(a), чтобы получить указанное в заголовке соединение (0,22 г, 73%) в виде бесцветного порошка.
ИК спектр (KBr) νmax см-1: 3328, 2977, 1696;
ЯМР спектр (CDCl3) δ м.д.: 1,47 (9H, с), 3,61 (2H, кв, J = 5,2 Гц), 4,41 (2H, т, J = 5,2 Гц), 4,97 (1H, ушир.с), 7,47-7,55 (3H, м), 7,99-8,06 (2H, м).
(b) Гидрохлорид 3-(2-аминоэтокси)-4-иод-5-фенилизоксазола
3-(2-(N-трет-бутоксикарбониламино)этокси)-4-иод-5-фенилизоксазол (0,20 г) подвергают взаимодействию и последующей обработке подобно тому, как описано в Примере 9(b), чтобы получить указанное в заголовке соединение (0,12 г, 71%) в виде бесцветных кристаллов.
Т.пл.: 201-206oC (разлагается);
ИК спектр (KBr) νmax см-1: 2961, 2912, 1591;
ЯМР спектр (ДМСО-d6) δ м.д.: 3,30 (2H, т, J = 5,3 Гц), 4,51 (2H, т, J = 5,3 Гц), 7,58-7,64 (3H, м), 7,96-8,01 (2H, м), 8,22 (3H, ушир.с).
Пример 33
Гидрохлорид 3-(2-аминоэтокси)-5-(4-изопропилфенил)изоксазола (Соединение N 1618)
(a) 3-(2-(N-трет-бутоксикарбониламино)этокси)-5-(4- изопропилфенил)изоксазол
3-Гидрокси-5-(4-изопропилфенил)изоксазол (0,2 г) и 2-(N-трет-бутоксикарбониламино)этанол (0,17 г) подвергают взаимодействию и последующей обработке подобно тому, как описано в Примере 9(a), чтобы получить указанное в заголовке соединение (0,26 г, 77%) в виде бесцветного порошка.
ИК спектр (KBr) νmax см-1: 3326, 2973, 1713, 1697, 1623;
ЯМР спектр (CDCl3) δ м.д.: 1,27 (6H, д, J = 6,9 Гц), 1,46 (9H, с), 2,95 (1H, кв.кв, J = 6,9 Гц, J = 6,9 Гц), 3,56 (2H, кв, J = 5,1 Гц), 4,35 (2H, т, J = 5,1 Гц), 4,94 (1H, ушир.с), 6,09 (1H, с), 7,31 (2H, д, J = 8,3 Гц], 7,65 (2H, д, J = 8,3 Гц).
(b) Гидрохлорид 3-(2-аминоэтокси)-5-(4-изопропилфенил)изоксазола
3-(2-(N-трет-бутоксикарбониламино)этокси)-5-(4-изопропилфенил)изоксазол (0,25 г) подвергают взаимодействию и последующей обработке подобно тому, как описано в Примере 9(b), чтобы получить указанное в заголовке соединение (0,11 г, 55%) в виде бесцветных кристаллов.
Т.пл.: 162-166oC (разлагается);
ИК спектр (KBr) νmax см-1: 3000, 2959, 2924, 1623, 1604;
ЯМР спектр (ДМСО-d6) δ м.д.: 1,23 (6H, д, J = 6,9 Гц), 2,96 (1H, кв.кв, J = 6,9 Гц, J = 6,9 Гц), 3,26 (2H, т, J = 5,1 Гц), 4,44 (2H, т, J = 5,1 Гц), 6,77 (1H, с), 7,41 (2H, д, J = 8,2 Гц), 7,77 (2H, д, J = 8,2 Гц), 8,20 (3H, ушир.с).
Пример 34
Гидрохлорид 3-(2-аминоэтокси)-5-(2-метилфенил)изоксазола (Соединение N 224)
(a) 3-(2-(N-трет-бутоксикарбониламино)этокси)-5-(2-метилфенил)изоксазол
3-Гидрокси-5-(2-метилфенил)изоксазол (0,2 г) и 2-(N-трет-бутоксикарбониламино)этанол (0,2 г) подвергают взаимодействию и последующей обработке подобно тому, как описано в Примере 9(a), чтобы получить указанное в заголовке соединение (0,31 г, 86%) в виде бесцветного порошка.
ИК спектр (KBr) νmax см-1: 3315, 1710, 1619;
ЯМР спектр (CDCl3) δ м.д.: 1,46 (9H, с), 2,49 (3H, с), 3,57 (2H, кв, J = 5,2 Гц), 4,37 (2H, т, J = 5,2 Гц), 4,95 (1H, ушир.с), 6,06 (1H, с), 7,19-7,39 (3H, м), 7,65-7,69 (1H, м).
(b) Гидрохлорид 3-(2-аминоэтокси)-5-(2-метилфенил)изоксазола
3-(2-(N-трет-бутоксикарбониламино)этокси)-5-(2-метилфенил)изоксазол (0,30 г) подвергают взаимодействию и последующей обработке подобно тому, как описано в Примере 9(b), чтобы получить указанное в заголовке соединение (0,18 г, 75%) в виде бесцветных кристаллов.
Т.пл.: 165-167oC;
ИК спектр (KBr) νmax см-1: 2996, 2976, 2911, 1613;
ЯМР спектр (ДМСО-d6) δ м.д.: 2,46 (3H, с), 3,26 (2H, т, J = 5,2 Гц), 4,46 (2H, т, J = 5,2 Гц), 6,59 (1H, с), 7,34-7,46 (3H, м), 7,67-7,69 (1H, м), 8,21 (3H, ушир.с).
Пример 35
Гидрохлорид 3-(2-аминоэтокси)-5-(4-фенилфенил)изоксазола (Соединение N 368)
(a) 3-(2-(N-трет-Бутоксикарбониламино)этокси)-5-(4-фенилфенил)изоксазол
3-Гидрокси-5-(4-фенилфенил)изоксазол (0,2 г) и 2-(N-трет-Бутоксикарбониламино)этанол (0,15 г) подвергают взаимодействию и последующей обработке подобно тому, как описано в Примере 9(a), чтобы получить указанное в заголовке соединение (0,22 г, 69%) в виде бесцветного порошка.
ИК спектр (KBr) νmax см-1: 3345, 1694;
ЯМР спектр (CDCl3) δ м.д.: 1,46 (9H, с), 3,58 (2H, кв, J = 5,1 Гц), 4,37 (2H, т, J = 5,1 Гц), 4,95 (1H, ушир.с), 6,18 (1H, с), 7,37-7,51 (3H, м), 7,61-7,70 (4H, м), 7,79-7,82 (2H, м).
(b) Гидрохлорид 3-(2-аминоэтокси)-5-(4-фенилфенил)изоксазола
3-(2-(N-трет-Бутоксикарбониламино)этокси)-5-(4-фенилфенил)изоксазол (0,2 г) подвергают взаимодействию и последующей обработке подобно тому, как описано в Примере 9(b), чтобы получить указанное в заголовке соединение (0,1 г, 63%) в виде бесцветных кристаллов.
Т.пл.: 212-218oC (разлагается);
ИК спектр (KBr) νmax см-1: 2996, 2966, 2909, 1619, 1602;
ЯМР спектр (ДМСО-d6) δ м.д.: 3,27 (2H, т, J = 5,1 Гц), 4,46 (2H, т, J = 5,1 Гц), 6,90 (1H, с), 7,41-7,55 (3H, м), 7,74-7,76 (2H, м), 7,84-7,87 (2H, м), 7,94-7,96 (2H, м), 8,18 (3H, ушир.с).
Пример 36
Гидрохлорид 3-(2-аминоэтокси)-5-(4-феноксифенил)изоксазола (Соединение N 1632)
(a) 3-(2-(N-трет-Бутоксикарбониламино)этокси)-5-(4- феноксифенил)изоксазол
3-Гидрокси-5-(4-феноксифенил)изоксазол (0,2 г) и 2-(N-трет-бутоксикарбониламино)этанол (0,14 г) подвергают взаимодействию и последующей обработке подобно тому, как описано в Примере 9(a), чтобы получить указанное в заголовке соединение (0,23 г, 74%) в виде бесцветного порошка.
ИК спектр (KBr) νmax см-1: 3331, 1720;
ЯМР спектр (CDCl3) δ м.д.: 1,46 (9H, с), 3,56 (2H, кв, J = 5,2 Гц), 4,34 (2H, т, J = 5,2 Гц), 4,95 (1H, ушир.с), 6,06 (1H, с), 7,02-7,08 (4H, м), 7,15-7,20 (1H, м), 7,35-7,42 (2H, м), 7,65-7,70 (2H, м).
(b) Гидрохлорид 3-(2-аминоэтокси)-5-(4-феноксифенил)изоксазола
3-(2-(N-трет-Бутоксикарбониламино)этокси)-5-(4-феноксифенил)изоксазол (0,18 г) подвергают взаимодействию и последующей обработке подобно тому, как описано в Примере 9(b), чтобы получить указанное в заголовке соединение (0,1 г, 67%) в виде бесцветных кристаллов.
Т.пл.: 207-213oC (разлагается);
ИК спектр (KBr) νmax см-1: 3000, 2959, 2909, 1625;
ЯМР спектр (ДМСО-d6) δ м.д.: 3,26 (2H, т, J = 5,1 Гц), 4,43 (2H, т, J = 5,1 Гц), 6,76 (1H, с), 7,10-7,14 (4H, м), 7,21-7,25 (1H, м), 7,44-7,48 (2H, м), 7,85-7,88 (2H, м), 8,18 (3H, ушир.с).
Пример 37
Гидрохлорид 3-(2-аминоэтокси)-5-(2-трифторметилфенил)изоксазола (Соединение N 296)
(a) 3-(2-(N-трет-Бутоксикарбониламино)этокси)-5-(2- трифторметилфенил)изоксазол
3-Гидрокси-5-(2-трифторметилфенил)изоксазол (0,3 г) и 2-(N-трет-Бутоксикарбониламино)этанол (0,23 г) подвергают взаимодействию и последующей обработке подобно тому, как описано в Примере 9(a), чтобы получить указанное в заголовке соединение (0,36 г, 74%) в виде бесцветного масла.
ИК спектр (CHCl3) νmax см-1: 3457, 2983, 1712;
ЯМР спектр (CDCl3) δ м.д.: 1,46 (9H, с), 3,58 (2H, кв, J = 5,2 Гц), 4,37 (2H, т, J = 5,2 Гц), 4,96 (1H, ушир.с), 6,21 (1H, с), 7,56-7,69 (2H, м), 7,75-7,82 (2H, м).
(b) Гидрохлорид 3-(2-аминоэтокси)-5-(2-трифторметилфенил)изоксазола
3-(2-(N-трет-Бутоксикарбониламино)этокси)-5-(2- трифторметилфенил)изоксазол (0,35 г) подвергают взаимодействию и последующей обработке подобно тому, как описано в Примере 9(b), чтобы получить указанное в заголовке соединение (0,22 г, 76%) в виде бесцветных кристаллов.
Т.пл.: 118-122oC (разлагается);
ИК спектр (KBr) νmax см-1: 2996, 2917, 1622;
ЯМР спектр (ДМСО-d6) δ м.д.: 3,28 (2H, т, J = 5,1 Гц), 4,46 (2H, т, J = 5,1 Гц), 6,63 (1H, с), 7,79-7,89 (3H, м), 7,96-7,98 (1H, м), 8,22 (3H, ушир. с).
Пример 38
Гидрохлорид 3-(2-аминоэтокси)-5-(4-гидроксифенил)изоксазола (Соединение N 1674)
(a) 3-(2-(N-трет-Бутоксикарбониламино)этокси)-5-(4- гидроксифенил)изоксазол
3-Гидрокси-5-(4-гидроксифенил)изоксазол (0,1 г) и 2-(N-трет-бутоксикарбониламино)этанол (0,1 г) подвергают взаимодействию и последующей обработке подобно тому, как описано в Примере 9(a), чтобы получить указанное в заголовке соединение (0,12 г, 67%) в виде бесцветного порошка.
ИК спектр (KBr) νmax см-1: 3331, 3247, 1698, 1666, 1645, 1619;
ЯМР спектр (ДМСО-d6) δ м.д.: 1,38 (9H, с), 3,32 (2H, кв, J = 5,6 Гц), 4,17 (2H, т, J = 5,6 Гц), 6,53 (1H, с), 6,87 (2H, д, J = 8,8 Гц), 7,05 (1H, ушир.с), 7,63 (2H, д, J = 8,8 Гц), 8,98 (1H, ушир.с).
(b) Гидрохлорид 3-(2-аминоэтокси)-5-(4-гидроксифенил)изоксазола
3-(2-(N-трет-Бутоксикарбониламино)этокси)-5-(4-гидроксифенил)изоксазол (0,12 г) подвергают взаимодействию и последующей обработке подобно тому, как описано в Примере 9(b), чтобы получить указанное в заголовке соединение (0,05 г, 56%) в виде бесцветных кристаллов.
Т.пл.: 240-245oC (разлагается);
ИК спектр (KBr) νmax см-1: 3145, 3056, 1620;
ЯМР спектр (ДМСО-d6) δ м.д.: 3,24 (2H, т, J = 5,1 Гц), 4,41 (2H, т, J = 5,1 Гц), 6,58 (1H, с), 6,90 (2H, д, J = 8,7 Гц), 7,67 (2H, д, J = 8,7 Гц), 8,13 (3H, ушир.с).
Пример 39
Гидрохлорид 3-(2-аминоэтокси)-5-(2,4-дихлорфенил)изоксазола (Соединение N 170)
(a) 3-(2-(N-трет-Бутоксикарбониламино)этокси)-5-(2,4- дихлорфенил)изоксазол
5-(2,4-Дихлорфенил)-3-гидроксиизоксазол (0,2 г) и 2-(N-трет-бутоксикарбониламино)этанол (0,17 г) подвергают взаимодействию и последующей обработке подобно тому, как описано в Примере 9(a), чтобы получить указанное в заголовке соединение (0,26 г, 81%) в виде бесцветного порошка.
ИК спектр (KBr) νmax см-1: 3386, 1681, 1606;
ЯМР спектр (CDCl3) δ м.д.: 1,46 (9H, с), 3,57 (2H, кв, J = 5,2 Гц), 4,37 (2H, т, J = 5,2 Гц), 4,94 (1H, ушир.с), 6,58 (1H, с), 7,38 (1H, дд, J = 8,5 Гц, J = 2,1 Гц), 7,53 (1H, д, J = 2,1 Гц), 7,85 (1H, д, J = 8,5 Гц).
(b) Гидрохлорид 3-(2-аминоэтокси)-5-(2,4-дихлорфенил)изоксазола
3-(2-(N-трет-Бутоксикарбониламино)этокси)-5-(2,4-дихлорфенил)изоксазол (0,24 г) подвергают взаимодействию и последующей обработке подобно тому, как описано в Примере 9(b), чтобы получить указанное в заголовке соединение (0,12 г, 60%) в виде бесцветных кристаллов.
Т.пл.: 192-195oC (разлагается);
ИК спектр (KBr) νmax см-1: 3069, 3005, 2967, 1611;
ЯМР спектр (ДМСО-d6) δ м.д.: 3,27 (2H, т, J = 5,1 Гц), 4,47 (2H, т, J = 5,1 Гц), 6,84 (1H, с), 7,64 (1H, дд, J = 8,7 Гц, J = 2,1 Гц), 7,89 (1H, д, J = 2,1 Гц), 7,90 (1H, д, J = 8,7 Гц), 8,20 (3H, ушир.с).
Пример 40
Гидрохлорид 3-(2-аминоэтокси)-5-(3,4-дихлорфенил)изоксазола (Соединение N 1604)
(a) 3-(2-(N-трет-Бутоксикарбониламино)этокси)-5-(3,4- дихлорфенил)изоксазол
5-(3,4-Дихлорфенил)-3-гидроксиизоксазол (0,3 г) и 2-(N-трет-бутоксикарбониламино)этанол (0,23 г) подвергают взаимодействию и последующей обработке подобно тому, как описано в Примере 9(a), чтобы получить указанное в заголовке соединение (0,41 г, 85%) в виде бесцветного порошка.
ИК спектр (KBr) νmax см-1: 3369, 1687;
ЯМР спектр (CDCl3) δ м.д.: 1,46 (9H, с), 3,56 (2H, кв, J = 5,1 Гц), 4,35 (2H, т, J = 5,1 Гц), 4,91 (1H, ушир.с), 6,16 (1H, с), 7,54 (2H, с), 7,80 (1H, с).
(b) Гидрохлорид 3-(2-аминоэтокси)-5-(3,4-дихлорфенил)изоксазола
3-(2-(N-трет-Бутоксикарбониламино)этокси)-5-(3,4-дихлорфенил)изоксазол (0,4 г) подвергают взаимодействию и последующей обработке подобно тому, как описано в Примере 9(b), чтобы получить указанное в заголовке соединение (0,22 г, 67%) в виде бесцветных кристаллов.
Т.пл.: 202-210oC (разлагается);
ИК спектр (KBr) νmax см-1: 2993, 2977, 2915, 1617;
ЯМР спектр (ДМСО-d6) δ м.д.: 3,26 (2H, т, J = 5,1 Гц), 4,45 (2H, т, J = 5,1 Гц), 7,02 (1H, с), 7,84 (1H, д, J = 8,9 Гц), 7,85 (1H, д, J = 8,9 Гц), 8,17 (4H, ушир.с).
Пример 41
Гидрохлорид 3-(2-аминоэтокси)-5-(2,3-дихлорфенил)изоксазола (Соединение N 1526)
(a) 3-(2-(N-трет-Бутоксикарбониламино)этокси)-5-(2,3- дихлорфенил)изоксазол
5-(2,3-Дихлорфенил)-3-гидроксиизоксазол (0,3 г) и 2-(N-трет-бутоксикарбониламино)этанол (0,23 г) подвергают взаимодействию и последующей обработке подобно тому, как описано в Примере 9(a), чтобы получить указанное в заголовке соединение (0,37 г, 77%) в виде бесцветного порошка.
ИК спектр (KBr) νmax см-1: 3381, 1688, 1607;
ЯМР спектр (CDCl3) δ м.д.: 1,46 (9H, с), 3,58 (2H, кв, J = 5,1 Гц), 4,37 (2H, т, J = 5,1 Гц), 4,95 (1H, ушир.с), 6,60 (1H, с), 7,34 (1H, т, J = 7,9 Гц), 7,58 (1H, дд, J = 7,9 Гц, J = 1,4 Гц), 7,81 (1H, дд, J = 7,9 Гц, J = 1,4 Гц).
(b) Гидрохлорид 3-(2-аминоэтокси)-5-(2,3-дихлорфенил)изоксазола
3-(2-(N-трет-Бутоксикарбониламино)этокси)-5-(2,3-дихлорфенил)изоксазол (0,36 г) подвергают взаимодействию и последующей обработке подобно тому, как описано в Примере 9(b), чтобы получить указанное в заголовке соединение (0,20 г, 67%) в виде бесцветных кристаллов.
Т.пл.: 183-186oC (разлагается);
ИК спектр (KBr) νmax см-1: 3010, 2979, 2908, 1604;
ЯМР спектр (ДМСО-d6) δ м.д.: 3,27 (2H, т, J = 5,1 Гц), 4,48 (2H, т, J = 5,1 Гц), 6,87 (1H, с), 7,57 (1H, т, J = 7,8 Гц), 7,82-7,87 (2H, м), 8,19 (3H, ушир.с).
Пример 42
Гидрохлорид 3-(2-аминоэтокси)-5-(2,6-дихлорфенил)изоксазола (Соединение N 188)
(a) 3-(2-(N-трет-Бутоксикарбониламино)этокси)-5-(2,6- дихлорфенил)изоксазол
5-(2,6-Дихлорфенил)-3-гидроксиизоксазол (0,3 г) и 2-(N-трет-бутоксикарбониламино)этанол (0,23 г) подвергают взаимодействию и последующей обработке подобно тому, как описано в Примере 9(a), чтобы получить указанное в заголовке соединение (0,31 г, 65%) в виде бесцветного порошка.
ИК спектр (KBr) νmax см-1: 3358, 1703, 1626;
ЯМР спектр (CDCl3) δ м.д.: 1,46 (9H, с), 3,58 (2H, кв, J = 5,1 Гц), 4,39 (2H, т, J = 5,1 Гц), 4,96 (1H, ушир.с), 6,11 (1H, с), 7,32-7,44 (3H, м).
(b) Гидрохлорид 3-(2-аминоэтокси)-5-(2,6-дихлорфенил)изоксазола
3-(2-(N-трет-Бутоксикарбониламино)этокси)-5-(2,6-дихлорфенил)изоксазол (0,16 г) подвергают взаимодействию и последующей обработке подобно тому, как описано в Примере 9(b), чтобы получить указанное в заголовке соединение (0,07 г, 54%) в виде бесцветных кристаллов.
Т.пл.: 148-151oC (разлагается);
ИК спектр (KBr) νmax см-1: 3005, 2966, 2935, 1631;
ЯМР спектр (ДМСО-d6) δ м.д.: 3,27 (2H, т, J = 5,0 Гц), 4,47 (2H, т, J = 5,0 Гц), 6,69 (1H, с), 7,61-7,71 (3H, м), 8,15 (3H, ушир.с).
Пример 43
Гидрохлорид 3-(2-аминоэтокси)-5-(2,4-дифторфенил)изоксазола (Соединение N 93)
(a) 3-(2-(N-трет-Бутоксикарбониламино)этокси)-5-(2,4- дифторфенил)изоксазол
5-(2,4-Дифторфенил)-3-гидроксиизоксазол (0,3 г) и 2-(N-трет-бутоксикарбониламино)этанол (0,27 г) подвергают взаимодействию и последующей обработке подобно тому, как описано в Примере 9(a), чтобы получить указанное в заголовке соединение (0,44 г, 85%) в виде бесцветного порошка.
ИК спектр (KBr) νmax см-1: 3382, 1694;
ЯМР спектр (CDCl3) δ м.д.: 1,46 (9H, с), 3,57 (2H, кв, J = 5,1 Гц), 4,36 (2H, т, J = 5,1 Гц), 4,93 (1H, ушир.с), 6,30 (1H, с), 6,90-7,05 (2H, м), 7,85-7,94 (1H, м).
(b) Гидрохлорид 3-(2-аминоэтокси)-5-(2,4-дифторфенил)изоксазола
3-(2-(N-трет-Бутоксикарбониламино)этокси)-5-(2,4-дифторфенил)изоксазол (0,42 г) подвергают взаимодействию и последующей обработке подобно тому, как описано в Примере 9(b), чтобы получить указанное в заголовке соединение (0,32 г, 94%) в виде бесцветных кристаллов.
Т.пл.: 226-232oC (разлагается);
ИК спектр (KBr) νmax см-1: 2997, 2980, 2922, 1626;
ЯМР спектр (ДМСО-d6) δ м.д.: 3,26 (2H, т, J = 5,1 Гц), 4,47 (2H, т, J = 5,1 Гц), 6,63 (1H, с), 7,29-7,34 (1H, м), 7,53-7,59 (1H, м), 7,94-8,00 (1H, м), 8,21 (3H, ушир.с).
Пример 44
Гидрохлорид 3-(2-аминоэтокси)-4-(1-хлорэтил)-5-фенилизоксазола (Соединение N 1390)
(a) 3-(2-(N-трет-Бутоксикарбониламино)этокси)-4-(1- гидроксиэтил)-5-фенилизоксазол
3-(2-(N-трет-Бутоксикарбониламино)этокси)-5-фенилизоксазол (0,8 г) растворяют в тетрагидрофуране (16 мл) и добавляют по каплям бутиллитий (1,6 М раствор в гексане, 3,7 мл) при -70oC под атмосферой азота и смесь перемешивают в течение 10 мин. Затем к реакционной смеси добавляют по каплям ацетальдегид (0,22 мл) и полученную смесь перемешивают в течение 10 мин и температуру смеси повышают до 0oC. Затем смесь выливают в ледяную воду и pH смеси доводят до величины 6 водным раствором дигидрофосфата калия. Затем реакционную смесь экстрагируют этилацетатом и органический слой промывают насыщенным водным раствором NaCl, растворитель испаряют при пониженном давлении. Остаток очищают колоночной хроматографией на силикагеле (элюент: гексан/этилацетат = 2/1), чтобы получить указанное в заголовке соединение (0,90 г, 98%) в виде бесцветного масла.
ИК спектр (CHCl3) νmax см-1: 3602, 3459, 2982, 2936, 1712;
ЯМР спектр (CDCl3) δ м.д.: 1,45 (9H, с), 1,60 (3H, д, J = 6,7 Гц), 2,64 (1H, ушир.с), 3,58 (2H, кв, J = 5,0 Гц), 4,39 (2H, т, J = 5,0 Гц), 4,90-5,10 (2H, м), 7,45-7,50 (3H, м), 7,64-7,69 (2H, м).
(b) Гидрохлорид 3-(2-аминоэтокси)-4-(1-хлорэтил)-5-фенилизоксазола
3-(2-(N-трет-Бутоксикарбониламино)этокси)-4-(1-гидроксиэтил)-5- фенилизоксазол (0,2 г) подвергают взаимодействию и последующей обработке подобно тому, как описано в Примере 1(b), чтобы получить указанное в заголовке соединение (0,13 г, 75%) в виде бесцветных кристаллов.
Т.пл.: 200-204oC (разлагается);
ИК спектр (KBr) νmax см-1: 2975, 1640;
ЯМР спектр (ДМСО-d6) δ м.д.: 1,86 (3H, д, J = 7,0 Гц), 3,27 (2H, т, J = 5,2 Гц), 4,52 (2H, т, J = 5,2 Гц), 5,46 (1H, кв, J = 7,0 Гц), 7,60-7,68 (3H, м), 7,71-7,77 (2H, м), 8,20 (3H, ушир.с).
Пример 45
Гидрохлорид 4-ацетил-3-(2-аминоэтокси)-5-фенилизоксазола (Соединение N 1410)
(a) 4-Ацетил-3-(2-(N-трет-бутоксикарбониламино)этокси)-5-фенилизоксазол
3-(2-(N-трет-бутоксикарбониламино)этокси)-4-(1-гидроксиэтил)-5- фенилизоксазол (0,3 г) растворяют в метиленхлориде (3 мл) и добавляют бихромат пиридиния (0,49 г) при комнатной температуре с последующим перемешиванием полученной смеси при той же температуре в течение 24 ч. После реакции нерастворимые вещества отфильтровывают и растворитель из фильтрата испаряют при пониженном давлении. Остаток очищают колоночной хроматографией на силикагеле (элюент: гексан/этилацетат = 2/1), чтобы получить указанное в заголовке соединение (0,26 г, 87%) в виде бесцветного порошка.
ИК спектр (KBr) νmax см-1: 3359, 1685;
ЯМР спектр (CDCl3) δ м.д.: 1,47 (9H, с), 2,51 (3H, с), 3,65 (2H, кв, J = 5,2 Гц), 4,48 (2H, т, J = 5,2 Гц), 4,87 (1H, ушир.с), 7,40-7,63 (3H, м), 7,93-7,96 (2H, м).
(b) Гидрохлорид 4-ацетил-3-(2-аминоэтокси)-5-фенилизоксазола
4-Ацетил-3-(2-(N-трет-бутоксикарбониламино)этокси)-5-фенилизоксазол (0,2 г) подвергают взаимодействию и последующей обработке подобно тому, как описано в Примере 9(b), чтобы получить указанное в заголовке соединение (0,12 г, 75%) в виде бесцветных кристаллов.
Т.пл.: 150-152oC (разлагается);
ИК спектр (KBr) νmax см-1: 3006, 2909, 1682;
ЯМР спектр (ДМСО-d6) δ м.д.: 2,52 (3H, с), 3,35 (2H, т, J = 5,0 Гц), 4,59 (2H, т, J = 5,0 Гц), 7,54-7,64 (3H, м), 7,85-7,88 (2H, м), 8,30 (3H, ушир.с).
Пример 46
Гидрохлорид 3-(2-аминоэтокси)-4-изопропенил-5-фенилизоксазола (Соединение N 1394)
(a) 3-(2-(N-трет-Бутоксикарбониламино)этокси)-4-(1- гидроксиизопропил)-5-фенилизоксазол
3-(2-(N-трет-Бутоксикарбониламино)этокси)-5-фенилизоксазол (0,8 г) растворяют в тетрагидрофуране (16 мл), добавляют по каплям бутиллитий (1,6 М раствор в гексане, 3,7 мл) при -70oC под атмосферой азота и полученную смесь перемешивают при той же температуре в течение 10 мин. Затем к реакционной смеси добавляют по каплям ацетон (0,3 мл) и смесь перемешивают в течение 10 мин, температуру смеси повышают до 0oC. Реакционную смесь выливают в ледяную воду и pH смеси доводят до величины 6 водным раствором дигидрофосфата калия. Смесь экстрагируют этилацетатом и органический слой промывают насыщенным водным раствором NaCl с последующим испарением растворителя при пониженном давлении. Остаток очищают колоночной хроматографией на силикагеле (элюент: гексан/этилацетат = 3/1), чтобы получить указанное в заголовке соединение (0,42 г, 44%) в виде бесцветного масла.
ИК спектр (CHCl3) νmax см-1: 3460, 2982, 2936, 1713;
ЯМР спектр (CDCl3) δ м.д.: 1,46 (9H, с), 1,50 (6H, с), 2,52 (1H, ушир. с), 3,60 (2H, кв, J = 5,3 Гц), 4,41 (2H, т, J = 5,3 Гц), 4,87 (1H, ушир.с), 7,41-7,49 (3H, м), 7,52-7,56 (2H, м).
(b) Гидрохлорид 3-(2-аминоэтокси)-4-изопропенил-5-фенилизоксазола
3-(2-(N-трет-Бутоксикарбониламино)этокси)-4-(1-гидроксиизопропил)-5- фенилизоксазол (0,13 г) растворяют в растворе 4 н. хлороводородная кислота/1,4-диоксан и раствор перемешивают при 100oC в течение одного часа. После реакции реакционную смесь оставляют остывать с последующим испарением растворителя при пониженном давлении. Остаток промывают этилацетатом, чтобы получить указанное в заголовке соединение (0,10 г, 83%) в виде бесцветных кристаллов.
Т.пл.: 130-133oC (разлагается);
ИК спектр (KBr) νmax см-1: 2974, 1591, 1572;
ЯМР спектр (ДМСО-d6) δ м.д.: 1,95 (3H, с), 3,28 (2H, т, J = 5,2 Гц), 4,48 (2H, т, J = 5,2 Гц), 5,23 (1H, с), 5,33 (1H, с), 7,53-7,58 (3H, м), 7,62-7,71 (2H, м), 8,20 (3H, ушир. с).
Пример 47
Гидрохлорид 3-(2-аминоэтокси)-5-(4-нитрофенил)изоксазола (Соединение N 1660)
(a) 3-(2-(N-трет-Бутоксикарбониламино)этокси)-5-(4-нитрофенил)изоксазол
3-Гидрокси-5-(4-нитрофенил)изоксазол (0,64 г) и 2-(N-трет-бутоксикарбониламино)этанол (0,55 г) подвергают взаимодействию и последующей обработке подобно тому, как описано в Примере 9(a), чтобы получить указанное в заголовке соединение (0,86 г, 80%) в виде бесцветного порошка.
ИК спектр (KBr) νmax см-1: 3385, 1681;
ЯМР спектр (CDCl3) δ м.д.: 1,46 (9H, с), 3,57 (2H, кв, J = 5,2 Гц), 4,38 (2H, т, J = 5,2 Гц), 4,90 (1H, ушир.с), 6,33 (1H, с), 7,90 (2H, д, J = 8,6 Гц), 8,33 (2H, д, J = 8,6 Гц).
(b) Гидрохлорид 3-(2-аминоэтокси)-5-(4-нитрофенил)изоксазола
3-(2-(N-трет-Бутоксикарбониламино)этокси)-5-(4-нитрофенил)изоксазол (0,28 г) подвергают взаимодействию и последующей обработке подобно тому, как описано в Примере 9(b), чтобы гголучить указанное в заголовке соединение (0,12 г, 52%) в виде бесцветных кристаллов.
Т.пл.: 216-220oC (разлагается);
ИК спектр (KBr) νmax см-1: 2994, 2977, 2913, 1620, 1608;
ЯМР спектр (ДМСО-d6) δ м.д.: 3,28 (2H, т, J = 5,1 Гц), 4,47 (2H, т, J = 5,1 Гц), 7,16 (1H, с), 8,15 (2H, д, J = 8,9 Гц), 8,22 (3H, ушир.с), 8,39 (2H, д, J = 8,9 Гц).
Пример 48
Дигидрохлорид 3-(2-аминоэтокси)-5-(4-аминофенил)изоксазола (Соединение N 1702)
(a) 5-(4-Аминофенил-3-(2-(N-трет-бутоксикарбониламино)этокси)изоксазол
3-(2-(N-трет-Бутоксикарбониламино)этокси)-5-(4-нитрофенил)изоксазол (0,55 г) растворяют в смеси уксусной кислоты и воды (9:1, 5,5 мл) и добавляют цинковый порошок (0,55 г) при комнатной температуре с последующим перемешиванием полученной смеси при той же температуре в течение 2 ч. После реакции порошок цинка отфильтровывают и фильтрат экстрагируют этилацетатом. Органический слой промывают насыщенным водным раствором NaCl и сушат над безводным сульфатом магния. После фильтрования растворитель испаряют при пониженном давлении. Остаток очищают колоночной хроматографией на силикагеле (элюент: гексан/этилацетат = 2/1), чтобы получить указанное в заголовке соединение (0,45 г, 90%) в виде бесцветного порошка.
ИК спектр (KBr) νmax см-1: 3391, 3378, 3300, 1712, 1615;
ЯМР спектр (CDCl3) δ м.д.: 1,46 (9H, с), 3,55 (2H, кв, J = 5,1 Гц), 4,00 (2H, ушир. с), 4,33 (2H, т, J = 5,1 Гц), 4,96 (1H, ушир.с), 5,94 (1H, с), 6,70 (2H, д, J = 8,7 Гц), 7,52 (2H, д, J = 8,7 Гц).
(b) Дигидрохлорид 3-(2-аминоэтокси)-5-(4-аминофенил)изоксазола
5-(4-Аминофенил-3-(2-(N-трет-бутоксикарбониламино)этокси)изоксазол (0,25 г) подвергают взаимодействию и последующей обработке подобно тому, как описано в Примере 9(b), чтобы получить указанное в заголовке соединение (0,15 г, 65%) в виде бесцветных кристаллов.
Т.пл.: 242-248oC (разлагается);
ИК спектр (KBr) νmax см-1: 3039, 2939, 2584, 1625, 1597;
ЯМР спектр (ДМСО-d6) δ м.д.: 3,25 (2H, т, J = 5,0 Гц), 4,21 (2H, ушир. с), 4,42 (2H, т, J = 5,0 Гц), 6,56 (1H, с), 6,94 (2H, д, J = 8,3 Гц), 7,65 (2H, д, J = 8,3 Гц), 8,25 (3H, ушир.с).
Пример 49
Гидрохлорид 3-(2-аминоэтокси)-5-(4-бензоиламинофенил)изоксазола (Соединение N 1716)
(a) 5-(4-Бензоиламинофенил)-3-(2-(N-трет- бутоксикарбониламино)этокси)изоксазол
5-(4-Аминофенил)-3-(2-(N-трет-бутоксикарбониламино)этокси)изоксазол (0,1 г) растворяют в тетрагидрофуране (1 мл) и последовательно добавляют по каплям при 5oC под атмосферой азота триэтиламин (0,05 мл) и бензоилхлорид (0,04 мл) с последующим перемешиванием полученной смеси при комнатной температуре в течение 30 мин. Реакционную смесь выливают в ледяную воду и экстрагируют этилацетатом. Органический слой промывают насыщенным водным раствором NaCl и сушат над безводным сульфатом магния. После фильтрования растворитель испаряют при пониженном давлении. Остаток очищают колоночной хроматографией на силикагеле (элюент: гексан/этилацетат = 3/1), чтобы получить указанное в заголовке соединение (0,08 г, 62%) в виде бесцветного порошка.
ИК спектр (KBr) νmax см-1: 3375, 1712;
ЯМР спектр (CDCl3) δ м.д.: 1,46 (9H, с), 3,57 (2H, кв, J = 5,1 Гц), 4,35 (2H, т, J = 5,1 Гц), 4,96 (1H, ушир.с), 6,12 (1H, с), 7,52-7,61 (3H, м), 7,72-7,80 (4H, м), 7,87-7,95 (3H, м).
(b) Гидрохлорид 3-(2-аминоэтокси)-5-(4-бензоиламинофенил)изоксазола
5-(4-Бензоиламинофенил)-3-(2-(N-трет- бутоксикарбониламино)этокси)изоксазол (0,07 г) подвергают взаимодействию и последующей обработке подобно тому, как описано в Примере 9(b), чтобы получить указанное в заголовке соединение (0,04 г, 68%) в виде бесцветных кристаллов.
Т.пл.: 242-248oC (разлагается);
ИК спектр (KBr) νmax см-1: 3322, 2959, 2910, 1645, 1621;
ЯМР спектр (ДМСО-d6) δ м.д.: 3,26 (2H, т, J = 5,1 Гц), 4,44 (2H, т, J = 5,1 Гц), 6,75 (1H, с), 7,53-7,65 (3H, м), 7,83-8,00 (6H, м), 8,20 (3H, ушир. с), 10,55 (1H, с).
Пример 50
Гидрохлорид 3-(2-аминоэтокси)-5-(2,4-дихлор-3-метилфенил)изоксазола (Соединение N 1576)
(a) 3-(2-(N-трет-Бутоксикарбониламино)этокси)-5-(2,4-дихлор-3- метилфенил)изоксазол
3-(2-(N-трет-Бутоксикарбониламино)этокси)-5-(2,4-дихлорфенил)изоксазол (0,3 г) и метилиодид (0,08 мл) подвергают взаимодействию и последующей обработке подобно тому, как описано в Примере 14(a), чтобы получить указанное в заголовке соединение (0,14 г, 45%) в виде бесцветного порошка.
ИК спектр (KBr) νmax см-1: 3342, 1710;
ЯМР спектр (CDCl3) δ м.д.: 1,46 (9H, с), 2,56 (3H, с), 3,58 (2H, кв, J = 5,1 Гц), 4,38 (2H, т, J = 5,1 Гц), 4,95 (1H, ушир.с), 6,54 (1H, с), 7,39 (1H, д, J = 8,5 Гц), 7,76 (1H, д, J = 8,5 Гц).
(b) Гидрохлорид 3-(2-аминоэтокси)-5-(2,4-дихлор-3-метилфенил)изоксазола
3-(2-(N-трет-Бутоксикарбониламино)этокси)-5-(2,4-дихлор-3- метилфенил)изоксазол (0,13 г) подвергают взаимодействию и последующей обработке подобно тому, как описано в Примере 9(b), чтобы получить указанное в заголовке соединение (0,06 г, 55%) в виде бесцветных кристаллов.
Т.пл.: 197-200oC (разлагается);
ИК спектр (KBr) νmax см-1: 3130, 2969, 2897, 1607;
ЯМР спектр (ДМСО-d6) δ м.д.: 2,52 (3H, с), 3,27 (2H, т, J = 5,1 Гц), 4,47 (2H, т, J = 5,1 Гц), 6,82 (1H, с), 7,65 (1H, д, J = 8,5 Гц), 7,71 (1H, д, J = 8,5 Гц), 8,17 (3H, ушир.с).
Пример 51
Гидрохлорид 3-(2-аминоэтокси)-5-(2,4-дихлор-3-этилфенил)изоксазола (Соединение N 1590)
(a) 3-(2-(N-трет-Бутоксикарбониламино)этокси)-5-(2,4-дихлор-3- этилфенил)изоксазол
3-(2-(N-трет-Бутоксикарбониламино)этокси)-5-(2,4-дихлорфенил)изоксазол (0,3 г) и этилиодид (0,1 мл) подвергают взаимодействию и последующей обработке подобно тому, как описано в Примере 14(a), чтобы получить указанное в заголовке соединение (0,25 г, 78%) в виде бесцветного порошка.
ИК спектр (KBr) νmax см-1: 3342, 1702;
ЯМР спектр (CDCl3) δ м.д.: 1,21 (3H, т, J = 7,5 Гц), 1,46 (9H, с), 3,05 (2H, кв, J = 7,5 Гц), 3,57 (2H, кв, J = 5,1 Гц), 4,36 (2H, т, J = 5,1 Гц), 4,94 (1H, ушир.с), 6,54 (1H, с), 7,40 (1H, д, J = 8,5 Гц), 7,65 (1H, д, J = 8,5 Гц).
(b) Гидрохлорид 3-(2-аминоэтокси)-5-(2,4-дихлор-3-этилфенил)изоксазола
3-(2-(N-трет-Бутоксикарбониламино)этокси)-5-(2,4-дихлор-3- этилфенил)изоксазол (0,23 г) подвергают взаимодействию и последующей обработке подобно тому, как описано в Примере 9(b), чтобы получить указанное в заголовке соединение (0,14 г, 74%) в виде бесцветных кристаллов.
Т.пл.: 173-176oC (разлагается);
ИК спектр (KBr) νmax см-1: 2970, 2935, 2876, 1608;
ЯМР спектр (ДМСО-d6) δ м.д.: 1,16 (3H, т, J = 7,4 Гц), 3,00 (2H, кв, J = 7,4 Гц), 3,27 (2H, т, J = 5,1 Гц), 4,47 (2H, т, J = 5,1 Гц), 6,82 (1H, с), 7,65 (1H, д, J = 8,4 Гц), 7,70 (1H, д, J = 8,4 Гц), 8,21 (3H, ушир.с).
Пример 52
Гидрохлорид 5-(4-ацетоксифенил)-3-(2-аминоэтокси)изоксазола (Соединение N 1688)
(a) 5-(4-Ацетоксифенил)-3-(2-(N-трет-бутоксикарбониламино) этокси)изоксазол
3-(2-(N-трет-Бутоксикарбониламино)этокси)-5-(4-гидроксифенил)изоксазол (0,15 г) растворяют в тетрагидрофуране (1,5 мл) и добавляют по каплям триэтиламин (0,07 мл) и ацетилхлорид (0,04 мл) при 5oC под атмосферой азота с последующим перемешиванием полученной смеси при комнатной температуре в течение 30 мин. Реакционную смесь выливают в ледяную воду и экстрагируют этилацетатом. Органический слой промывают насыщенным водным раствором NaCl и сушат над безводным сульфатом магния. После фильтрования растворитель испаряют при пониженном давлении. Остаток очищают колоночной хроматографией на силикагеле (элюент: гексан/этилацетат = 2/1), чтобы получить указанное в заголовке соединение (0,12 г, 71%) в виде бесцветного порошка.
ИК спектр (KBr) νmax см-1: 3345, 1696;
ЯМР спектр (CDCl3) δ м.д.: 1,46 (9H, с), 2,33 (3H, с), 3,56 (2H, кв, J = 5,2 Гц), 4,35 (2H, т, J = 5,2 Гц), 4,94 (1H, ушир.с), 6,12 (1H, с), 7,20 (2H, д, J = 8,8 Гц), 7,74 (2H, д, J = 8,8 Гц).
(b) Гидрохлорид 5-(4-ацетоксифенил)-3-(2-аминоэтокси)изоксазола
5-(4-Ацетоксифенил)-3-(2-(N-трет-бутоксикарбониламино)этокси)изоксазол (0,1 г) подвергают взаимодействию и последующей обработке подобно тому, как описано в Примере 9(b), чтобы получить указанное в заголовке соединение (0,05 г, 63%) в виде бесцветных кристаллов.
Т.пл.: 202-212oC (разлагается);
ИК спектр (KBr) νmax см-1: 2996, 2977, 2912, 1755, 1621;
ЯМР спектр (ДМСО-d6) δ м.д.: 2,30 (3H, с), 3,26 (2H, т, J = 5,1 Гц), 4,45 (2H, т, J = 5,1 Гц), 6,84 (1H, с), 7,32 (2H, д, J = 8,6 Гц), 7,91 (2H, д, J = 8,6 Гц), 8,22 (3H, ушир.с).
ПРИМЕР 53
Гидрохлорид 3-(2-аминоэтокси)-5-(4-бензилоксифенил)изоксазола (Соединение N 1646)
(a) 5-(4-Бензилоксифенил)-3-(2-(N-трет-бутоксикарбониламино) этокси)изоксазол
3-(2-(N-трет-Бутоксикарбониламино)этокси)-5-(4-гидроксифенил)изоксазол (0,2 г) растворяют в диметилформамиде (2 мл) и добавляют 55%-ный гидрид натрия (масло, 0,03 г) при 5oC под атмосферой азота с последующим перемешиванием полученной смеси при той же температуре в течение 10 мин. Затем к ней добавляют по каплям бензилбромид (0,08 мл) и смесь перемешивают при комнатной температуре в течение 30 мин. Реакционную смесь выливают в ледяную воду и экстрагируют этилацетатом. Органический слой промывают насыщенным водным раствором NaCl и сушат над безводным сульфатом магния. После фильтрования растворитель испаряют при пониженном давлении. Остаток очищают колоночной хроматографией на силикагеле (элюент: гексан/этилацетат = 3/1), чтобы получить указанное в заголовке соединение (0,14 г, 54%) в виде бесцветного порошка.
ИК спектр (KBr) νmax см-1: 3338, 1698;
ЯМР спектр (CDCl3) δ м.д.: 1,46 (9H, с), 3,56 (2H, кв, J = 5,0 Гц), 4,34 (2H, т, J = 5,0 Гц), 4,94 (1H, ушир.с), 5,12 (2H, с), 6,02 (1H, с), 7,04 (2H, д, J = 8,7 Гц), 7,28-7,47 (5H, м), 7,66 (2H, д, J = 8,7 Гц).
(b) Гидрохлорид 3-(2-аминоэтокси)-5-(4-бензилоксифенил)изоксазола
5-(4-Бензилоксифенил)-3-(2-(N-трет-бутоксикарбониламино) этокси)изоксазол (0,13 г) подвергают взаимодействию и последующей обработке подобно тому, как описано в Примере 9(b), чтобы получить указанное в заголовке соединение (0,07 г, 64%) в виде бесцветных кристаллов.
Т.пл.: 205-210oC (разлагается);
ИК спектр (KBr) νmax см-1: 2997, 2966, 2912, 1621, 1604;
ЯМР спектр (ДМСО-d6), δ м.д.: 3,25 (2H, т, J = 5,1 Гц), 4,43 (2H, т, J = 5,1 Гц), 5,19 (2H, с), 6,69 (1H, с), 7,17 (2H, д, J = 9,0 Гц), 7,33-7,48 (5H, м), 7,79 (2H, д, J = 9,0 Гц), 8,21 (3H, ушир.с).
Пример 54
Гидрохлорид 3-(2-аминоэтокси)-5-(2-фурил)-4-изопропилизоксазола (Соединение N 510)
(a) 3-(2-(N-трет-Бутоксикарбониламино)этокси)-5-(2-фурил)-4- изопропилизоксазол
5-(2-фурил)-3-гидрокси-4-изопропилизоксазол (0,2 г) и 2-(N-трет-бутоксикарбониламино)этанол (0,18 г) подвергают взаимодействию и последующей обработке подобно тому, как описано в Примере 9(a), чтобы получить указанное в заголовке соединение (0,29 г, 83%) в виде бесцветного порошка.
ИК спектр (KBr) νmax см-1: 3317, 2985, 1690;
ЯМР спектр (CDCl3) δ м.д.: 1,28 (6H, д, J = 7,2 Гц), 1,46 (9H, с), 3,33 (1H, кв.кв, J = 7,2 Гц, J = 7,2 Гц), 3,58 (2H, кв, J = 5,1 Гц), 4,35 (2H, т, J = 5,1 Гц), 4,84 (1H, ушир.с), 6,52 (1H, дд, J = 3,4 Гц, J = 1,8 Гц), 6,80 (1H, д, J = 3,4 Гц), 7,55 (1H, д, J = 1,8 Гц).
(b) Гидрохлорид 3-(2-аминоэтокси)-5-(2-фурил)-4-изопропилизоксазола
3-(2-(N-трет-Бутоксикарбониламино)этокси)-5-(2-фурил)-4- изопропилизоксазол (0,27 г) подвергают взаимодействию и последующей обработке подобно тому, как описано в Примере 1(b), чтобы получить указанное в заголовке соединение (0,17 г, 77%) в виде бесцветных кристаллов.
Т.пл.: 137-139oC;
ИК спектр (KBr) νmax см-1: 2972, 2898, 1560, 1513;
ЯМР спектр (ДМСО-d6) δ м.д.: 1,26 (6H, д, J = 7,0 Гц), 3,24 (1H, кв.кв, J = 7,0 Гц, J = 7,0 Гц), 3,28 (2H, т, J = 5,2 Гц), 4,44 (2H, т, J = 5,2 Гц), 6,73 (1H, дд, J = 3,4 Гц, J = 1,8 Гц), 7,01 (1H, д, J = 3,4 Гц), 7,97 (1H, д, J = 1,8 Гц), 8,21 (3H, ушир.с).
Пример 55
Гидрохлорид 3-(2-аминоэтокси)-4-(трет-бутил)-5-фенилизоксазола (Соединение N 13)
(a) 3-(2-(N-трет-Бутоксикарбониламино)этокси)-4-(трет-бутил)-5- фенилизоксазол
4-(трет-Бутил)-3-гидрокси-5-фенилизоксазол (0,15 г) и 2-(N-трет-бутоксикарбониламино)этанол (0,12 г) подвергают взаимодействию и последующей обработке подобно тому, как описано в Примере 9(a), чтобы получить указанное в заголовке соединение (0,16 г, 64%) в виде бесцветного порошка.
ИК спектр (KBr) νmax см-1: 3374, 2974, 1683;
ЯМР спектр (CDCl3) δ м.д.: 1,18 (9H, с), 1,46 (9H, с), 3,60 (2H, кв, J = 5,2 Гц), 4,38 (2H, т, J = 5,2 Гц), 4,85 (1H, ушир.с), 7,36-7,55 (5H, м).
(b) Гидрохлорид 3-(2-аминоэтокси)-4-(трет-бутил)-5-фенилизоксазола
3-(2-(N-трет-Бутоксикарбониламино)этокси)-4-(трет-бутил)-5- фенилизоксазол (0,14 г) подвергают взаимодействию и последующей обработке подобно тому, как описано в Примере 1(b), чтобы получить указанное в заголовке соединение (0,09 г, 82%) в виде бесцветных кристаллов.
Т.пл.: 230-234oC (разлагается);
ИК спектр (KBr) νmax см-1: 2961, 2910, 2890, 1516;
ЯМР спектр (ДМСО-d6) δ м.д.: 1,16 (9H, с), 3,30 (2H, т, J = 5,3 Гц), 4,46 (2H, т, J = 5,3 Гц), 7,44-7,57 (5H, м), 8,20 (3H, ушир.с).
Пример 56
Гидрохлорид 3-(2-аминоэтокси)-4-циклопропил-5-фенилизоксазола (Соединение N 1400)
(a) 3-(2-(N-трет-Бутоксикарбониламино)этокси)-4-циклопропил-5- фенилизоксазол
4-Циклопропил-3-гидрокси-5-фенилизоксазол (0,2 г) и 2-(N-трет-бутоксикарбониламино)этанол (0,18 г) подвергают взаимодействию и последующей обработке подобно тому, как описано в Примере 9(a), чтобы получить указанное в заголовке соединение (0,25 г, 74%) в виде бесцветного порошка.
ИК спектр (KBr) νmax см-1: 3369, 1692, 1536, 1520;
ЯМР спектр (CDCl3) δ м.д.: 0,66-0,75 (2H, м), 0,88-0,95 (2H, м), 1,46 (9H, с), 1,67-1,73 (1H, м), 3,58 (2H, кв, J = 5,1 Гц), 4,35 (2H, т, J = 5,1 Гц), 4,90 (1H, ушир.с), 7,40-7,51 (3H, м), 7,84-7,87 (2H, м).
(b) Гидрохлорид 3-(2-аминоэтокси)-4-циклопропил-5-фенилизоксазола
3-(2-(N-трет-Бутоксикарбониламино)этокси)-4-циклопропил-5- фенилизоксазол (0,15 г) подвергают взаимодействию и последующей обработке подобно тому, как описано в Примере 1(b), чтобы получить указанное в заголовке соединение (0,06 г, 49%) в виде бесцветных кристаллов.
Т.пл.: 180-182oC;
ИК спектр (KBr) νmax см-1: 2919, 2851, 1713, 1519;
ЯМР спектр (ДМСО-d6) δ м. д. : 0,68-0,76 (2H, м), 0,83-0,92 (2H, м), 1,71-1,78 (1H, м), 3,27 (2H, т, J = 5,2 Гц), 4,44 (2H, т, J = 5,2 Гц), 7,51-7,60 (3H, м), 7,83-7,86 (2H, м), 8,20 (3H, ушир.с).
Пример 57
Гидрохлорид 3-(2-аминоэтокси)-5-(2,4-дихлорфенил)-4-изопропилизоксазола (Соединение N 176)
(a) 3-(2-(N-трет-Бутоксикарбониламино)этокси)-5-(2,4- дихлорфенил)-4-изопропилизоксазол
5-(2,4-Дихлорфенил)-3-гидрокси-4-изопропилизоксазол (0,06 г) и 2-(N-трет-бутоксикарбониламино)этанол (0,04 г) подвергают взаимодействию и последующей обработке подобно тому, как описано в Примере 9(a), чтобы получить указанное в заголовке соединение (0,078 г, 86%) в виде бесцветного масла.
ИК спектр (CHCl3) νmax см-1: 3460, 2975, 2936, 1713;
ЯМР спектр (CDCl3) δ м.д: 1,18 (6H, д, J = 7,0 Гц), 1,46 (9H, с), 2,69 (1H, кв.кв, J = 7,0 Гц, J = 7,0 Гц), 3,59 (2H, кв, J = 5,2 Гц), 4,38 (2H, т, J = 5,2 Гц), 4,85 (1H, ушир.с), 7,30 (1H, д, J = 8,3 Гц), 7,35 (1H, дд, J = 8,3 Гц, J = 1,9 Гц), 7,52 (1H, д, J = 1,9 Гц).
(b) Гидрохлорид 3-(2-аминоэтокси)-5-(2,4-дихлорфенил)-4- изопропилизоксазола
3-(2-(N-трет-Бутоксикарбониламино)этокси)-5-(2,4-дихлорфенил)-4- изопропилизоксазол (0,07 г) подвергают взаимодействию и последующей обработке подобно тому, как описано в Примере 1(b), чтобы получить указанное в заголовке соединение (0,04 г, 68%) в виде бесцветных кристаллов.
Т.пл.: 171-173oC;
ИК спектр (KBr) νmax см-1: 2968, 2875, 1514;
ЯМР спектр (ДМСО-d6) δ м.д.: 1,13 (6H, д, J = 7,0 Гц), 2,69 (1H, кв.кв, J = 7,0 Гц, J = 7,0 Гц), 3,29 (2H, т, J = 5,3 Гц), 4,46 (2H, т, J = 5,3 Гц), 7,56 (1H, д, J = 8,5 Гц), 7,62 (1H, дд, J = 8,5 Гц, J = 2,0 Гц), 7,89 (1H, д, J = 2,0 Гц), 8,18 (3H, ушир.с).
Пример 58
Гидрохлорид 3-(2-аминоэтокси)-5-(2-хлорфенил)-4-изопропилизоксазола (Соединение N 117)
(a) 3-(2-(N-трет-Бутоксикарбониламино)этокси)-5-(2-хлорфенил)-4- изопропилизоксазол
5-(2-Хлорфенил)-3-гидрокси-4-изопропилизоксазол (0,13 г) и 2-(N-трет-бутоксикарбониламино)этанол (0,1 г) подвергают взаимодействию и последующей обработке подобно тому, как описано в Примере 9(a), чтобы получить указанное в заголовке соединение (0,15 г, 72%) в виде бесцветного порошка.
ИК спектр (KBr) νmax см-1: 3382, 2974, 1691;
ЯМР спектр (CDCl3); δ м.д.: 1,18 (6H, д, J = 6,9 Гц), 1,46 (9H, с), 2,71 (1H, кв. кв., J = 6,9 Гц, J = 6,9 Гц), 3,60 (2H, кв, J = 5,2 Гц), 4,39 (2H, т, J = 5,2 Гц), 4,87 (1H, ушир.с), 7,34-7,51 (4H, м).
(b) Гидрохлорид 3-(2-аминоэтокси)-5-(2-хлорфенил)-4-изопропилизоксазола
3-(2-(N-трет-Бутоксикарбониламино)этокси)-5-(2-хлорфенил)-4- изопропилизоксазол (0,13 г) подвергают взаимодействию и последующей обработке подобно тому, как описано в Примере 1(b), чтобы получить указанное в заголовке соединение (0,08 г, 73%) в виде бесцветных кристаллов.
Т.пл.: 143-145oC;
ИК спектр (KBr) νmax см-1: 2970, 2937, 2896, 2879, 1513;
ЯМР спектр (ДМСО-d6) δ м.д.: 1,13 (6H, д, J = 7,0 Гц), 2,69 (1H, кв.кв, J = 7,0 Гц, J = 7,0 Гц), 3,29 (2H, т, J = 5,2 Гц), 4,47 (2H, т, J = 5,2 Гц), 7,50-7,68 (4H, м), 8,24 (3H, ушир.с).
Пример 59
Гидрохлорид 3-(2-аминоэтокси)-5-(4-хлорфенил)-4-изопропилизоксазола (Соединение N 151)
(a) 3-(2-(N-трет-Бутоксикарбониламино)этокси)-5-(4-хлорфенил)-4- изопропилизоксазол
5-(4-Хлорфенил)-3-гидрокси-4-изопропилизоксазол (0,15 г) и 2-(N-трет-бутоксикаррониламино)этанол (0,11 г) подвергают взаимодействию и последующей обработке подобно тому, как описано в Примере 9(a), чтобы получить указанное в заголовке соединение (0,19 г, 79%) в виде бесцветного порошка.
ИК спектр (KBr) νmax см-1: 3382, 2966, 1685;
ЯМР спектр (CDCl3) δ м.д.: 1,29 (6H, д, J = 7,0 Гц), 1,46 (9H, с), 3,03 (1H, кв.кв, J = 7,0 Гц, J = 7,0 Гц), 3,59 (2H, кв, J = 5,1 Гц), 4,36 (2H, т, J = 5,1 Гц), 7,44 (2H, д, J = 8,7 Гц), 7,52 (2H, д, J = 8,7 Гц).
(b) Гидрохлорид 3-(2-аминоэтокси)-5-(4-хлорфенил)-4-изопропилизоксазола
3-(2-(N-трет-Бутоксикарбониламино)этокси)-5-(4-хлорфенил)-4- изопропилизоксазол (0,18 г) подвергают взаимодействию и последующей обработке подобно тому, как описано в Примере 1(b), чтобы получить указанное в заголовке соединение (0,12 г, 80%) в виде бесцветных кристаллов.
Т.пл.: 224-227oC;
ИК спектр (KBr) νmax см-1: 2971, 2919, 2851, 1639;
ЯМР спектр (ДМСО-d6) δ м.д.: 1,26 (6H, д, J = 7,0 Гц), 3,02 (1H, кв.кв, J = 7,0 Гц, J = 7,0 Гц), 3,28 (2H, т, J = 5,3 Гц), 4,45 (2H, т, J = 5,3 Гц), 7,62 (2H, д, J = 9,0 Гц), 7,63 (2H, д, J = 9,0 Гц), 8,18 (3H, ушир.с).
Пример 60
Гидрохлорид 4-аллил-3-(2-аминоэтокси)-5-фенилизоксазола (Соединение N 1392)
(a) 4-Аллил-3-(2-(N-трет-Бутоксикарбониламино)этокси)-5-фенилизоксазол
4-Аллил-3-гидрокси-5-фенилизоксазол (1,00 г) и 2-(N-трет-бутоксикарбониламино)этанол (0,96 г) подвергают взаимодействию и последующей обработке подобно тому, как описано в Примере 1(a), чтобы получить указанное в заголовке соединение (1,57 г, 91%) в виде бесцветных кристаллов.
Т.пл.: 78-79oC;
ИК спектр (KBr) νmax см-1: 3327, 1708, 1644, 1526, 1518;
ЯМР спектр (CDCl3) δ м.д.: 1,46 (9H, с), 3,27-3,29 (2H, м), 3,57 (2H, кв, J = 5,1 Гц), 4,38 (2H, т, J = 5,1 Гц), 4,90 (1H, ушир.с), 5,05-5,15 (2H, м), 5,91-6,01 (1H, м), 7,41-7,49 (3H, м), 7,63-7,68 (2H, м).
(b) Гидрохлорид 4-аллил-3-(2-аминоэтокси)-5-фенилизоксазола
4-Аллил-3-(2-(N-трет-бутоксикарбониламино)этокси)-5-фенилизоксазол (200 мг) подвергают взаимодействию и последующей обработке подобно тому, как описано в Примере 1(b), чтобы получить указанное в заголовке соединение (160 мг, 98%) в виде бесцветных кристаллов.
Т.пл.: 95-96oC;
ИК спектр (KBr) νmax см-1: 2967, 2912, 2885, 2817, 2694, 1643, 1601, 1577, 1514, 1495;
ЯМР спектр (ДМСО-d6) δ м.д.: 3,25-3,30 (2H, м), 3,35 (2H, т, J = 5,1 Гц), 4,46 (2H, т, J = 5,1 Гц), 5,03-5,09 (2H, м), 5,91-6,00 (1H, м), 7,52-7,58 (3H, м), 7,67-7,70 (2H, м), 8,20 (3H, ушир.с).
Пример 61
Гидрохлорид 3-(2-аминоэтокси)-5-фенил-4-пропаргилизоксазола (Соединение N 1398)
(a) 3-(2-(N-трет-Бутоксикарбониламино)этокси)-5-фенил-4- пропаргилизоксазол
3-Гидрокси-5-фенил-4-пропаргилизоксазол (1,00 г) и 2-(N-трет-бутоксикарбониламино)этанол (0,96 г) подвергают взаимодействию и последующей обработке подобно тому, как описано в Примере 1(a), чтобы получить указанное в заголовке соединение (1,44 г, 84%) в виде бесцветного масла.
ИК спектр (KBr) νmax см-1: 3352, 3302, 1711, 1643, 1600, 1577, 1520, 1499;
ЯМР спектр (CDCl3) δ м.д.: 1,46 (9H, с), 2,09 (1H, т, J = 2,8 Гц), 3,43 (2H, д, J = 2,8 Гц), 3,60 (2H, кв, J = 5,1 Гц), 4,41 (2H, т, J = 5,1 Гц), 5,02 (1H, ушир.с), 7,45-7,55 (3H, м), 7,74-7,76 (2H, м).
(b) Гидрохлорид 3-(2-аминоэтокси)-5-фенил-4-пропаргилизоксазола
3-(2-(N-трет-Бутоксикарбониламино)этокси)-5-фенил-4-пропаргилизоксазол (200 мг) подвергают взаимодействию и последующей обработке подобно тому, как описано в Примере 1(b), чтобы получить указанное в заголовке соединение (152 мг, 94%) в виде бесцветных кристаллов.
Т.пл.: 210-212oC (разлагается);
ИК спектр (KBr) νmax см-1: 3258, 2959, 2899, 2830, 1632, 1601, 1577, 1523;
ЯМР спектр (ДМСО-d6) δ м.д.: 2,97 (1H, т, J = 2,8 Гц), 3,30 (1H, т, J = 5,1 Гц), 3,59 (2H, д, J = 2,8 Гц), 4,47 (2H, т, J = 5,1 Гц), 7,56-7,62 (3H, м), 7,79-7,82 (2H, м), 8,13 (3H, ушир.с).
Пример 62
Гидрохлорид 3-(2-аминоэтокси)-4-изобутил-5-фенилизоксазола (Соединение N 11)
(a) 3-(2-(N-трет-Бутоксикарбониламино)этокси)-4-изобутил-5- фенилизоксазол
3-Гидрокси-4-изобутил-5-фенилизоксазол (217 мг) и 2-(N-трет-бутоксикарбониламино)этанол (193 мг) подвергают взаимодействию и последующей обработке подобно тому, как описано в Примере 1(a), чтобы получить указанное в заголовке соединение (303 мг, 84%) в виде бесцветных кристаллов.
Т.пл.: 80-81oC;
ИК спектр (KBr) νmax см-1: 3377, 1683, 1637, 1516, 1498;
ЯМР спектр (CDCl3) δ м. д. : 0,93 (6H, д, J = 6,8 Гц), 1,46 (9H, с), 1,89-1,96 (1H, м), 2,42 (2H, д, J = 7,3 Гц), 3,58 (2H, кв, J = 5,1 Гц), 4,37 (2H, т, J = 5,1 Гц), 4,88 (1H, ушир.с), 7,40-7,49 (3H, м), 7,66-7,70 (2H, м).
(b) Гидрохлорид 3-(2-аминоэтокси)-4-изобутил-5-фенилизоксазола
3-(2-(N-трет-Бутоксикарбониламино)этокси)-4-изобутил-5-фенилизоксазол (200 мг) подвергают взаимодействию и последующей обработке подобно тому, как описано в Примере 1(b), чтобы получить указанное в заголовке соединение (160 мг, 98%) в виде бесцветных кристаллов.
Т.пл.: 202-210oC (разлагается);
ИК спектр (KBr) νmax см-1: 3005, 2957, 2869, 1629, 1601, 1576, 1514, 1495;
ЯМР спектр (ДМСО-d6) δ м.д.: 0,86 (6H, д, J = 6,8 Гц), 2,47 (2H, д, J = 7,3 Гц), 3,27 (2H, т, J = 5,1 Гц), 4,45 (2H, т, J = 5,1 Гц), 7,49-7,58 (3H, м), 7,70-7,74 (2H, м), 8,19 (3H, ушир.с).
Пример 63
Гидрохлорид 3-(2-аминоэтокси)-4-циклопентил-5-фенилизоксазола (Соединение N 1402)
(a) 3-(2-(N-трет-Бутоксикарбониламино)этокси)-4-циклопентил-5- фенилизоксазол
3-Гидрокси-4-циклопентил-5-фенилизоксазол (229 мг) и 2-(N-трет-бутоксикарбониламино)этанол (193 мг) подвергают взаимодействию и последующей обработке подобно тому, как описано в Примере 1(a), чтобы получить указанное в заголовке соединение (308 мг, 83%) в виде бесцветных кристаллов.
Т.пл.: 112-113oC;
ИК спектр (KBr) νmax см-1: 3391, 1691, 1655, 1643, 1531, 1515;
ЯМР спектр (CDCl3) δ м.д.: 1,46 (9H, с), 1,56-1,67 (2H, м), 1,71-1,92 (6H, м), 3,03-3,12 (1H, м), 3,58 (2H, кв, J = 5,1 Гц), 4,38 (2H, т, J = 5,1 Гц), 4,82 (1H, ушир.с), 7,41-7,49 (3H, м), 7,55-7,61 (2H, м).
(b) Гидрохлорид 3-(2-аминоэтокси)-4-циклопентил-5-фенилизоксазола
3-(2-(N-трет-Бутоксикарбониламино)этокси)-4-циклопентил-5- фенилизоксазол (200 мг) подвергают взаимодействию и последующей обработке подобно тому, как описано в Примере 1(b), чтобы получить указанное в заголовке соединение (161 мг, 97%) в виде бесцветных кристаллов.
Т.пл.: 197-199oC;
ИК спектр (KBr) νmax см-1: 2954, 2869, 1637, 1599, 1576, 1511, 1490;
ЯМР спектр (ДМСО-d6) δ м. д. : 1,57-1,63 (2H, м), 1,72-1,91 (6H, м), 2,98-3,07 (1H, м), 3,27 (2H, т, J = 5,1 Гц), 4,45 (2H, т, J = 5,1 Гц), 7,51-7,61 (5H, м), 8,07 (3H, ушир.с).
Пример 64
Гидрохлорид 3-(2-аминоэтокси)-4-(2-циклопентил)-5-фенилизоксазола (Соединение N 1404)
(a) 3-(2-(N-трет-Бутоксикарбониламино)этокси)-4-(2- циклопентил)-5-фенилизоксазол
3-Гидрокси-4-(2-циклопентил)-5-фенилизоксазол (227 мг) и 2-(N-трет-бутоксикарбониламино)этанол (193 мг) подвергают взаимодействию и последующей обработке подобно тому, как описано в Примере 1(a), чтобы получить указанное в заголовке соединение (295 мг, 80%) в виде бесцветных кристаллов.
Т.пл.: 81-82oC;
ИК спектр (KBr) νmax см-1: 3394, 1690, 1636, 1515, 1495;
ЯМР спектр (CDCl3) δ м.д.: 1,46 (9H, с), 1,88-1,98 (1H, м), 2,24-2,34 (1H, м), 2,39-2,49 (1H, м), 2,52-2,61 (1H, м), 3,47-3,59 (2H, м), 4,01-4,06 (1H, м), 4,30-4,36 (2H, м), 4,86 (1H, ушир.с), 5,63-5,67 (1H, м), 5,89-5,92 (1H, м), 7,42-7,49 (3H, м), 7,60-7,63 (2H, м).
(b) Гидрохлорид 3-(2-аминоэтокси)-4-(2-циклопентил)-5-фенилизоксазола
3-(2-(N-трет-Бутоксикарбониламино)этокси)-4-(2-циклопентил)-5- фенилизоксазол (200 мг) подвергают взаимодействию и последующей обработке подобно тому, как описано в Примере 1(b), чтобы получить указанное в заголовке соединение (156 мг, 94%) в виде бесцветные кристаллов.
Т.пл.: 157-160oC (разлагается);
ИК спектр (KBr) νmax см-1: 3051, 2954, 2901, 2852, 1635, 1599, 1575, 1516, 1492;
ЯМР спектр (ДМСО-d6) δ м. д. : 1,79-1,99 (1H, м), 2,21-2,41 (2H, м), 2,44-2,53 (1H, м), 3,25 (2H, ушир.с), 3,95-4,02 (1H, м), 4,38-4,48 (2H, м), 5,56-5,71 (1H, м), 5,85-5,89 (1H, м), 7,51-7,57 (3H, м), 7,59-7,63 (2H, м), 8,12 (3H, ушир.с).
Пример 65
Гидрохлорид 3-(2-аминоэтокси)-4-пентил-5-фенилизоксазола (Соединение N 1386)
(a) 3-(2-(N-трет-Бутоксикарбониламино)этокси)-4-пентил-5-фенилизоксазол
3-Гидрокси-4-пентил-5-фенилизоксазол (231 мг) и 2-(N-трет-бутоксикарбониламино)этанол (193 мг) подвергают взаимодействию и последующей обработке подобно тому, как описано в Примере 1(a), чтобы получить указанное в заголовке соединение (305 мг, 82%) в виде бесцветного масла.
ИК спектр (KBr) νmax см-1: 3461, 1713, 1640, 1510, 1496;
ЯМР спектр (CDCl3) δ м.д.: 0,89 (3H, т, J = 7,0 Гц), 1,26-1,38 (2H, м), 1,46 (9H, с), 1,49-1,61 (2H, м), 2,52 (2H, т, J = 7,7 Гц), 3,59 (2H, кв, J = 5,1 Гц), 4,37 (2H, т, J = 5,1 Гц), 4,89 (1H, ушир.с), 7,40-7,49 (3H, м), 7,64-7,69 (2H, м).
(b) Гидрохлорид 3-(2-аминоэтокси)-4-пентил-5-фенилизоксазола
3-(2-(N-трет-Бутоксикарбониламино)этокси)-4-пентил-5-фенилизоксазол (100 мг) подвергают взаимодействию и последующей обработке подобно тому, как описано в Примере 1(b), чтобы получить указанное в заголовке соединение (80 мг, 95%) в виде бесцветных кристаллов.
Т.пл.: 107-109oC;
ИК спектр (KBr) νmax см-1: 3008, 2955, 2930, 2869, 1641, 1601, 1576, 1566, 1516, 1496;
ЯМР спектр (ДМСО-d6) δ м.д.: 0,83 (3H, т, J = 7,0 Гц), 1,25-1,30 (4H, м), 1,48-1,56 (2H, м), 2,55 (2H, т, J = 7,7 Гц), 3,28 (2H, т, J = 5,1 Гц), 4,45 (2H, т, J = 5,1 Гц), 7,51-7,59 (3H, м), 7,66-7,69 (2H, м), 8,10 (3H, ушир.с).
Пример 66
Гидрохлорид 3-(2-аминоэтокси)-4-(2-бутенил)-5-фенилизоксазола (Соединение N 1396)
(a) 3-(2-(N-трет-Бутоксикарбониламино)этокси)-4-(2-бутенил)-5- фенилизоксазол
3-Гидрокси-4-(2-бутенил)-5-фенилизоксазол (215 мг) и 2-(N-трет-бутоксикарбониламино)этанол (193 мг) подвергают взаимодействию и последующей обработке подобно тому, как описано в Примере 1(a), чтобы получить указанное в заголовке соединение (292 мг, 82%) в виде бесцветных кристаллов.
Т.пл.: 62-63oC;
ИК спектр (KBr) νmax см-1: 3378, 1682, 1634, 1514, 1497;
ЯМР спектр (CDCl3) δ м.д.: 1,46 (9H, с), 1,68-1,74 (3H, м), 3,19-3,21 (2H, м), 3,57 (2H, кв, J = 5,1 Гц), 4,37 (2H, т, J = 5,1 Гц), 4,89 (1H, ушир.с), 5,46-5,60 (2H, м), 7,40-7,52 (3H, м), 7,64-7,68 (2H, м).
(b) Гидрохлорид 3-(2-аминоэтокси)-4-(2-бутенил)-5-фенилизоксазола
3-(2-(N-трет-Бутоксикарбониламино)этокси)-4-(2-бутенил)-5- фенилизоксазол (200 мг) подвергают взаимодействию и последующей обработке подобно тому, как описано в Примере 1(b), чтобы получить указанное в заголовке соединение (162 мг, 98%) в виде бесцветных кристаллов.
Т.пл.: 123-125oC;
ИК спектр (KBr) νmax см-1: 3028, 2961, 2934, 2916, 2855, 1641, 1601, 1577, 1570, 1515, 1494;
ЯМР спектр (ДМСО-d6) δ м.д.: 1,60-1,70 (3H, м), 3,26-3,28 (2H, м), 3,33 (2H, т, J = 5,1 Гц), 4,45 (2H, т, J = 5,1 Гц), 5,43-5,59 (2H, м), 7,50-7,58 (3H, м), 7,65-7,70 (2H, м), 8,10 (3H, ушир.с).
Пример 67
Гидрохлорид 3-(2-аминоэтокси)-4-изопропил-5-(2-тиенил)изоксазола (Соединение N 543)
(a) 3-(2-(N-трет-Бутоксикарбониламино)этокси)-4-изопропил-5-(2- тиенил)изоксазол
3-Гидрокси-4-изопропил-5-(2-тиенил)изоксазол (209 мг) и 2-(N-трет-бутоксикарбониламино)этанол (193 мг) подвергают взаимодействию и последующей обработке подобно тому, как описано в Примере 1(a), чтобы получить указанное в заголовке соединение (301 мг, 86%) в виде бесцветных кристаллов.
Т.пл.: 94-95oC;
ИК спектр (KBr) νmax см-1: 3325, 1711, 1693, 1635, 1542, 1528, 1508;
ЯМР спектр (CDCl3) δ м.д.: 1,29 (6H, д, J = 7,1 Гц), 1,46 (9H, с), 3,19 (1H, м), 3,58 (2H, кв, J = 5,1 Гц), 4,36 (2H, т, J = 5,1 Гц), 4,83 (1H, ушир. с), 7,14 (1H, дд, J = 5,3 Гц, J = 3,7 Гц), 7,42 (1H, дд, J = 3,4 Гц, J = 1,4 Гц), 7,46 (1H, д, J = 5,3 Гц).
(b) Гидрохлорид 3-(2-аминоэтокси)-4-изопропил-5-(2-тиенил)изоксазола
3-(2-(N-трет-Бутоксикарбониламино)этокси)-4-изопропил-5-(2- тиенил)изоксазол (200 мг) подвергают взаимодействию и последующей обработке подобно тому, как описано в Примере 1(b), чтобы получить указанное в заголовке соединение (150 мг, 93%) в виде бесцветных кристаллов.
Т.пл.: 192-194oC (разлагается);
ИК спектр (KBr) νmax см-1: 3105, 3087, 2973, 1644, 1579, 1527, 1498;
ЯМР спектр (ДМСО-d6) δ м.д.: 1,27 (6H, д, J = 7,2 Гц), 3,16 (1H, м), 3,28 (2H, т, J = 5,1 Гц), 4,44 (2H, т, J = 5,1 Гц), 7,26 (1H, дд, J = 5,2 Гц, J = 1,4 Гц), 7,54 (1H, дд, J = 4,7 Гц, J = 1,0 Гц), 7,87 (1H, д, J = 5,2 Гц), 8,13 (3H, ушир.с).
Пример 68
Гидрохлорид 3-(2-аминоэтокси)-4-фтор-5-фенилизоксазола (Соединение N 4)
(a) 4-Метоксиметокси-5-фенилизоксазол
3-Гидрокси-5-фенилизоксазол (8,05 г) растворяют в диметилформамиде (80 мл) и добавляют к нему по каплям метоксид натрия (28%-ный раствор, 3,24 г) с последующим перемешиванием полученной смеси при комнатной температуре в течение одного часа. Пока реакционную смесь охлаждают до 5oC, добавляют к ней простой хлорметилметиловый эфир (4,83 г) с последующим перемешиванием полученной смеси при той же температуре в течение одного часа. Реакционную смесь выливают в ледяную воду (200 мл) и экстрагируют простым эфиром (200 мл х 2) и органический слой сушат над безводным сульфатом магния. После фильтрования растворитель испаряют при пониженном давлении. Остаток очищают колоночной хроматографией на силикагеле (элюент: гексан/этилацетат = 4/1), чтобы получить указанное в заголовке соединение (6,30 г, 61%) в виде бесцветного масла.
ИК спектр (KBr) νmax см-1: 1621, 1596, 1577, 1512;
ЯМР спектр (CDCl3) δ м.д.: 3,58 (3H, с), 5,37 (2H, с), 7,40-7,48 (3H, м), 7,71-7,95 (2H, м).
(b) 4-Фтор-3-метоксиметокси-5-фенилизоксазол
3-Метоксиметокси-5-фенилизоксазол (2,05 г) растворяют в безводном тетрагидрофуране (30 мл) и раствор охлаждают до -78oC. Добавляют к нему по каплям бутиллитий (1,68 М раствор в гексане, 7,1 мл), и полученную смесь перемешивают при той же температуре в течение 15 мин. Затем к реакционной смеси добавляют N-фторбензолсульфонимид (3,15 г) с последующим перемешиванием полученной смеси при той же температуре в течение 15 мин. Охлаждающую баню удаляют и температуру полученной смеси повышают до комнатной температуры. Реакционную смесь выливают в ледяную воду (200 мл) и экстрагируют простым эфиром (200 мл х 2). Органический слой сушат над безводным сульфатом магния. После фильтрования растворитель испаряют при пониженном давлении. Остаток очищают колоночной хроматографией на силикагеле (элюент: гексан/этилацетат = 4/1), чтобы получить указанное в заголовке соединение (1,78 г, 80%) в виде бесцветного масла.
ИК спектр (KBr) νmax см-1: 1672, 1545;
ЯМР спектр (CDCl3) δ м.д.: 3,62 (3H, с), 5,45 (2H, с), 7,43-7,52 (3H, м), 7,70-7,80 (2H, м).
(c) 4-Фтор-3-гидрокси-5-фенилизоксазол
4-Фтор-3-метоксиметокси-5-фенилизоксазол (0,44 г) растворяют в растворе 4 н. хлороводородная кислота/диоксан (5,0 мл) и раствор перемешивают при комнатной температуре в течение одного часа. После реакции растворитель испаряют при пониженном давлении и полученное таким образом кристаллическое вещество промывают дихлорметаном (10 мл), чтобы получить указанное в заголовке соединение (0,30 г, 83%) в виде бесцветных кристаллов.
ИК спектр (KBr) νmax см-1: 3059, 3014, 2995, 2919, 2851, 2822, 2747, 2645, 2565, 1674, 1582, 1527;
ЯМР спектр (ДМСО-d6) δ м.д.: 7,51-7,61 (3H, м), 7,73-7,74 (2H, м), 12,6 (1H, ушир.с).
(d) 3-(2-(N-трет-Бутоксикарбониламино)этокси)-4-фтор-5-фенилизоксазол
4-Фтор-3-гидрокси-5-фенилизоксазол (100 мг) и 2-(N-трет-бутоксикарбониламино)этанол (108 мг) подвергают взаимодействию и последующей обработке подобно тому, как описано в Примере 1(a), чтобы получить указанное в заголовке соединение (132 мг, 73%) в виде бесцветных кристаллов.
Т.пл.: 103-104oC;
ИК спектр (KBr) νmax см-1: 3325, 1718, 1667, 1549, 1532;
ЯМР спектр (CDCl3) δ м.д.: 1,46 (9H, с), 3,60 (2H, кв, J = 5,1 Гц), 4,41 (2H, т, J = 5,1 Гц), 4,97 (1H, ушир.с), 7,41-7,52 (3H, м), 7,76-7,79 (2H, м).
(e) Гидрохлорид 3-(2-аминоэтокси)-4-фтор-5-фенилизоксазола
3-(2-(N-трет-Бутоксикарбониламино)этокси)-4-фтор-5-фенилизоксазол (110 мг) подвергают взаимодействию и последующей обработке подобно тому, как описано в Примере 1(b), чтобы получить указанное в заголовке соединение (82 мг, 93%) в виде бесцветных кристаллов.
Т.пл.: 207-211oC (разлагается);
ИК спектр (KBr) νmax см-1: 2999, 2965, 2909, 2845, 1665, 1602, 1581, 1555, 1532;
ЯМР спектр (ДМСО-d6) δ м.д.: 3,32 (2H, т, J = 5,1 Гц), 4,55 (2H, т, J = 5,1 Гц), 7,55-7,64 (3H, м), 7,75-7,78 (2H, м), 8,17 (3H, ушир.с).
Пример 69
Гидрохлорид 3-(2-диметиламиноэтокси)-5-фенилизоксазола (Соединение N 27)
(a) 3-(2-Бромэтокси)-5-фенилизоксазол
Трифенилфосфин (15,7 г) растворяют в толуоле (200 мл) и раствор охлаждают до 5oC. К раствору добавляют диэтилдиазодикарбоксилат (10,4 г) и полученную смесь перемешивают при той же температуре в течение 10 мин. Затем 3-гидрокси-5-фенилизоксазол (8,0 г) и 2-бромэтанол (7,5 г) добавляют в этом порядке к реакционной смеси с последующим перемешиванием полученной смеси при той же температуре в течение 10 мин и далее при комнатной температуре в течение 2 ч. Нерастворимые вещества отфильтровывают от смеси и растворитель испаряют при пониженном давлении. Остаток очищают колоночной хроматографией на силикагеле (элюент: гексан/этилацетат = 4/1), чтобы получить указанное в заголовке соединение (12,1 г, 90%) в виде бесцветных кристаллов.
ИК спектр (KBr) νmax см-1: 3148, 1623, 1597, 1576, 1510;
ЯМР спектр (CDCl3) δ м.д.: 3,71 (2H, т, J = 5,9 Гц), 4,62 (2H, т, J = 5,9 Гц), 6,19 (1H, с), 7,42-7,49 (3H, м), 7,70-7,77 (2H, м).
(b) 3-(2-Диметиламиноэтокси)-5-фенилизоксазол
После растворяют гидрохлорид диметиламина (815 мг) в метаноле (50 мл) и добавляют к нему 3-(2-бромэтокси)-5-фенилизоксазол (268 мг) и триэтиламин (2,8 мл) с последующим кипячением с обратным холодильником полученной смеси в течение 8 ч. После реакции растворитель испаряют при пониженном давлении, остаток растворяют в простом эфире (20 мл) и раствор промывают насыщенным водным раствором NaCl (20 мл) с последующей сушкой органического слоя над безводным сульфатом магния. После фильтрования растворитель испаряют при пониженном давлении. Остаток очищают колоночной хроматографией на силикагеле (элюент: этилацетат), чтобы получить указанное в заголовке соединение (146 мг, 63%) в виде бесцветных кристаллов.
Т.пл.: 28-29oC;
ИК спектр (KBr) νmax см-1: 2980, 2951, 1625, 1597, 1577, 1514;
ЯМР спектр (CDCl3) δ м.д.: 2,34 (6H, с), 2,75 (2H, т, J = 5,4 Гц), 4,40 (2H, т, J = 5,4 Гц), 6,18 (1H, с), 7,40-7,48 (3H, м), 7,69-7,73 (2H, м).
(c) Гидрохлорид 3-(2-диметиламиноэтокси)-5-фенилизоксазола
3-(2-Диметиламиноэтокси)-5-фенилизоксазол (130 мг) растворяют в диоксане (1,0 мл) и добавляют к нему раствор 4 н. хлороводородная кислота/диоксан (0,2 мл) и полученную смесь оставляют при комнатной температуре на 15 мин. Растворитель испаряют при пониженном давлении и остаток промывают этилацетатом, чтобы получить указанное в заголовке соединение (148 мг, 98%) в виде бесцветных кристаллов.
Т.пл.: 163-164oC (разлагается);
ИК спектр (KBr) νmax см-1: 3133, 1624, 1597, 1577, 1513;
ЯМР спектр (ДМСО-d6) δ м.д.: 2,84 (6H, с), 3,55 (2H, т, J = 5,0 Гц), 4,61 (2H, т, J = 5,0 Гц), 7,50-7,58 (3H, м), 7,81-7,87 (2H, м), 10,31 (1H, ушир.с).
Пример 70
Гидрохлорид 5-фенил-3-(2-(1-пиперидил)этокси)изоксазола (Соединение N 28)
(a) 5-Фенил-3-(2-(1-пиперидил)этокси)изоксазол
3-(2-бромэтокси)-5-фенилизоксазол (268 мг) растворяют в метаноле (1,0 мл) и добавляют к нему пиперидин (426 мг) с последующим кипячением полученной смеси с обратным холодильником в течение 3 ч. Затем реакционную смесь добавляют к ледяной воде (20 мл) и экстрагируют простым эфиром (20 мл х 2), органический слой сушат над безводным сульфатом магния. После фильтрования растворитель испаряют при пониженном давлении. Остаток очищают колоночной хроматографией на силикагеле (элюент: этилацетат), чтобы получить указанное в заголовке соединение (251 мг, 92%) в виде бесцветных кристаллов.
Т.пл.: 75-76oC;
ИК спектр (KBr) νmax см-1: 3149, 1625, 1598, 1577, 1513;
ЯМР спектр (CDCl3) δ м.д.: 1,42-1,48 (2H, м), 1,54-1,67 (4H, м), 2,50 (4H, ушир.с), 2,79 (2H, т, J = 5,8 Гц), 4,42 (2H, т, J = 5,8 Гц), 6,16 (1H, с), 7,41-7,48 (3H, м), 7,69-7,75 (2H, м).
(b) Гидрохлорид 5-фенил-3-(2-(1-пиперидил)этокси)изоксазола
5-фенил-3-(2-(1-пиперидил)этокси)изоксазол (200 мг) подвергают взаимодействию и последующей обработке подобно тому, как описано в Примере 1(b), чтобы получить указанное в заголовке соединение (181 мг, 80%) в виде бесцветных кристаллов.
Т.пл.: 190-192oC (разлагается);
ИК спектр (KBr) νmax см-1: 2950, 2938, 1620, 1595, 1576, 1511;
ЯМР спектр (ДМСО-d6) δ м. д. : 1,32-1,44 (2H, м), 1,68-1,86 (4H, м), 2,95-3,04 (2H, м), 3,45-3,58 (4H, м), 4,64 (2H, т, J = 4,7 Гц), 6,87 (1H, с), 7,50-7,58 (3H, м), 7,81-7,85 (2H, м), 9,94-10,05 (1H, ушир.с).
Пример 71
Гидрохлорид 5-фенил-3-(2-(1-пирролидинил)этокси)изоксазола (Соединение N 1350)
(a) 5-фенил-3-(2-(1-пирролидинил)этокси)изоксазол
Пирролидин (710 мг) добавляют к 3-(2-бромэтокси)-5-фенилизоксазолу (268 мг) и смесь перемешивают при 100oC в течение одного часа. Затем ледяную воду (20 мл) добавляют к реакционной смеси и смесь экстрагируют простым эфиром (20 мл х 2), органический слой сушат над безводным сульфатом магния. После фильтрования растворитель испаряют при пониженном давлении. Остаток очищают колоночной хроматографией на силикагеле (элюент: этилацетат), чтобы получить указанное в заголовке соединение (211 мг, 82%) в виде бесцветных кристаллов.
Т.пл.: 61-62oC;
ИК спектр (KBr) νmax см-1: 1623, 1596, 1575, 1509;
ЯМР спектр (CDCl3) δ м.д.: 1,77-1,87 (4H, м), 2,57-2,65 (4H, м), 2,92 (2H, т, J = 5,5 Гц), 4,43 (2H, т, J = 5,5 Гц), 6,18 (1H, с), 7,40-7,48 (3H, м), 7,69-7,75 (2H, м).
(b) Гидрохлорид 5-фенил-3-(2-(1-пирролидинил)этокси)изоксазола
5-Фенил-3-(2-(1-пирролидинил)этокси)изоксазол (200 мг) подвергают взаимодействию и последующей обработке подобно тому, как описано в Примере 1(b), чтобы получить указанное в заголовке соединение (211 мг, 93%) в виде бесцветных кристаллов.
Т.пл.: 182-184oC (разлагается);
ИК спектр (KBr) νmax см-1: 2982, 2950, 2884, 2848, 2671, 2653, 2607, 2560, 2480, 1619, 1595, 1576, 1511;
ЯМР спектр (ДМСО-d6) δ м. д. : 1,83-2,08 (4H, м), 3,01-3,21 (2H, м), 3,50-3,68 (4H, м), 4,60 (2H, т, J = 5,1 Гц), 6,87 (1H, с), 7,50-7,58 (3H, м), 7,81-7,87 (2H, м), 10,63 (1H, ушир.с).
Пример 72
Гидрохлорид 3-(2-(4-морфолинил)этокси)-5-фенилизоксазола (Соединение N 29)
(a) 3-(2-(4-Морфолинил)этокси-5-фенилизоксазол
Морфолин (871 мг) добавляют к 3-(2-бромэтокси)-5-фенилизоксазолу (268 мг) и смесь перемешивают при 100oC в течение одного часа. Затем ледяную воду (20 мл) добавляют к реакционной смеси и полученную смесь экстрагируют простым эфиром (20 мл х 2), органический слой сушат над безводным сульфатом магния. После фильтрования растворитель испаряют при пониженном давлении. Остаток очищают колоночной хроматографией на силикагеле (элюент: этилацетат), чтобы получить указанное в заголовке соединение (250 мг, 91%) в виде бесцветных кристаллов.
Т.пл.: 66-67oC;
ИК спектр (KBr) νmax см-1: 3152, 1623, 1596, 1575, 1512;
ЯМР спектр (CDCl3) δ м.д.: 2,57 (2H, т, J = 5,4 Гц), 2,82 (2H, т, J = 5,4 Гц), 3,75 (2H, т, J = 5,5 Гц), 4,44 (2H, т, J = 5,5 Гц), 6,17 (1H, с), 7,41-7,50 (3H, м), 7,69-7,76 (2H, м).
(b) Гидрохлорид 3-(2-(4-морфолинил)этокси)-5-фенилизоксазола
3-(2-(4-Морфолинил)этокси-5-фенилизоксазол (200 мг) подвергают взаимодействию и последующей обработке подобно тому, как описано в Примере 1(b), чтобы получить указанное в заголовке соединение (202 мг, 89%) в виде бесцветных кристаллов.
Т.пл.: 180-182oC (разлагается);
ИК спектр (KBr) νmax см-1: 2981, 2925, 2897, 2878, 2683, 2646, 2584, 2512, 2469, 1620, 1595, 1576, 1512;
ЯМР спектр (ДМСО-d6) δ м. д. : 3,10-3,25 (2H, м), 3,40-3,55 (2H, м), 3,55-3,65 (2H, м), 3,70-3,85 (2H, м), 3,90-4,05 (2H, м), 4,67 (2H, ушир.с), 6,86 (1H, с), 7,50-7,58 (3H, м), 7,81-7,87 (2H, м), 10,96 (1H, ушир.с).
Пример 73
Дигидрохлорид 5-фенил-3-(2-(1-пиперазинил)этокси)изоксазола (Соединение N 1351)
(a) 3-(2-(4-N-трет-Бутоксикарбонил-1-пиперазинил)этокси)-5- фенилизоксазол
3-(2-бромэтокси)-5-Фенилизоксазол (268 мг) растворяют в метаноле (1,0 мл) и добавляют к нему пиперазин (861 мг) с последующим кипячением полученной смеси с обратным холодильником в течение 3 ч. Затем реакционную смесь добавляют к разбавленному водному раствору NaCl (40 мл) и экстрагируют дихлорметаном (40 мл х 2), органический слой сушат над безводным сульфатом магния. После фильтрования растворитель испаряют при пониженном давлении. Остаток растворяют в дихлорметане (5 мл) и к смеси добавляют ди-трет-бутилдикарбонат (1,09 г) с последующим перемешиванием полученной смеси при комнатной температуре в течение 30 мин. После реакции растворитель испаряют при пониженном давлении и остаток очищают колоночной хроматографией на силикагеле (элюент: гексан/этилацетат = 2/1), чтобы получить указанное в заголовке соединение (310 мг, 83%) в виде бесцветных кристаллов.
Т.пл.: 110-111oC;
ИК спектр (KBr) νmax см-1: 3146, 1696, 1626, 1598, 1577, 1514;
ЯМР спектр (CDCl3) δ м.д.: 1,46 (9H, с), 2,51 (2H, т, J = 5,0 Гц), 2,83 (2H, т, J = 5,5 Гц), 3,47 (2H, т, J = 5,0 Гц), 4,43 (2H, т, J = 5,5 Гц), 6,16 (1H, с), 7,41-7,49 (3H, м), 7,69-7,75 (2H, м).
(b) Дигидрохлорид 5-фенил-3-(2-(1-пиперазинил)этокси)изоксазола
3-(2-(4-трет-Бутоксикарбонил-1-пиперазинил)этокси)-5-фенилизоксазол (250 мг) подвергают взаимодействию и последующей обработке подобно тому, как описано в Примере 1(b), чтобы получить указанное в заголовке соединение (222 мг, 95%) в виде бесцветных кристаллов.
Т.пл.: 216-222oC (разлагается);
ИК спектр (KBr) νmax см-1: 3443, 3189, 3123, 3001, 2972, 2950, 2915, 2771, 2715, 2623, 2527, 2422, 1704, 1648, 1621, 1596, 1578, 1565, 1514;
ЯМР спектр (ДМСО-d6) δ м.д.: 3,00-3,85 (10H, ушир.с), 4,64 (2H, ушир.с), 6,86 (1H, с), 7,50-7,57 (3H, м), 7,82-7,85 (2H, м), 9,10-9,80 (1H, ушир.с).
Пример 74
Гидрохлорид 3-(2-N-метиламиноэтокси)-5-фенилизоксазола (Соединение N 25)
(a) 3-(2-(4-N-трет-Бутоксикарбонил-N-метиламино)этокси)-5- фенилизоксазол
3-(2-(N-трет-Бутоксикарбониламино)этокси)-5-фенилизоксазол (304 мг) растворяют в диметилформамиде (3 мл) и добавляют к нему гидрид натрия [>55% (маслянистый), 52 мг] с последующим перемешиванием полученной смеси при комнатной температуре в течение одного часа. Реакционную смесь охлаждают до 5oC и добавляют к ней метилиодид (220 мг) с последующим перемешиванием полученной смеси при той же температуре в течение 15 мин и далее при комнатной температуре в течение 1 ч. В конце этого периода времени реакционную смесь добавляют к ледяной воде (20 мл) и экстрагируют простым эфиром (20 мл х 2), органический слой сушат над безводным сульфатом магния. После фильтрования растворитель испаряют при пониженном давлении. Остаток очищают колоночной хроматографией на силикагеле (элюент: гексан/этилацетат = 4/1), чтобы получить указанное в заголовке соединение (296 мг, 93%) в виде бесцветных кристаллов.
Т.пл.: 72-73oC;
ИК спектр (KBr) νmax см-1: 3125, 1680, 1626, 1596, 1578, 1514;
ЯМР спектр (CDCl3) δ м.д.: 1,49 (9H, с), 2,97 (3H, с), 3,64 (2H, ушир. с), 4,41 (2H, ушир.с), 6,14 (1H, с), 7,41-7,52 (3H, м), 7,69-7,75 (2H, м).
(b) Гидрохлорид 3-(2-N-метиламиноэтокси)-5-фенилизоксазола
3-(2-(N-трет-Бутоксикарбонил-N-метиламино)этокси)-5-фенилизоксазол (250 мг) подвергают взаимодействию и последующей обработке подобно тому, как описано в Примере 1(b), чтобы получить указанное в заголовке соединение (197 мг, 99%) в виде бесцветных кристаллов.
Т.пл.: 219-221oC (разлагается);
ИК спектр (KBr) νmax см-1: 3134, 3022, 2981, 2954, 2883, 2869, 2843, 2803, 2785, 2734, 1621, 1597, 1578, 1516;
ЯМР спектр (ДМСО-d6) δ м.д.: 2,62 (3H, с), 3,37 (2H, т, J = 5,1 Гц), 4,50 (1H, т, J = 5,1 Гц), 6,85 (1H, с), 7,50-7,58 (3H, м), 7,82-7,88 (2H, м), 8,79 (2H, ушир.с).
Пример 75
3-(2-Ацетиламиноэтокси)-5-фенилизоксазол (Соединение N 1347)
3-(2-Аминоэтокси)-5-фенилизоксазол гидрохлорид (240 мг) суспендируют в безводном тетрагидрофуране (5 мл) и суспензию охлаждают до 5oC. Добавляют к ней ацетилхлорид (94 мг) и триэтиламин (243 мг) и полученную смесь перемешивают при той же температуре в течение 30 мин. В конце этого периода времени реакционную смесь добавляют к ледяной воде (40 мл) и экстрагируют этилацетатом (40 мл х 2). Затем органический слой сушат над безводным сульфатом магния. После фильтрования растворитель испаряют при пониженном давлении. Полученные таким образом кристаллы перекристаллизуют из этилацетата, чтобы получить указанное в заголовке соединение (225 мг, 91%) в виде бесцветных кристаллов.
Т.пл.: 144-145oC;
ИК спектр (KBr) νmax см-1: 3316, 1641, 1624, 1597, 1578, 1547, 1509;
ЯМР спектр (CDCl3) δ м.д.: 2,03 (3H, с), 3,70 (2H, кв, J = 5,1 Гц), 4,39 (2H, кв, J = 5,1 Гц), 6,16 (1H, ушир.с), 6,26 (1H, с), 7,41-7,49 (3H, м), 7,70-7,75 (2H, м).
Пример 76
3-(2-Бензоиламиноэтокси)-5-фенилизоксазол (Соединение N 1349)
3-(2-Аминоэтокси)-5-фенилизоксазол гидрохлорид (240 мг) суспендируют в безводном тетрагидрофуране (5 мл) и суспензию охлаждают до 5oC. Добавляют к ней бонзоилхлорид (168 мг) и триэтиламин (243 мг) с последующим перемешиванием полученной смеси при той же температуре в течение 30 мин. В конце этого периода времени реакционную смесь добавляют к ледяной воде (40 мл) и экстрагируют этилацетатом (40 мл х 2). Затем органический слой сушат над безводным сульфатом магния. После фильтрования растворитель испаряют при пониженном давлении. Остаток перекристаллизуют из этилацетата, чтобы получить указанное в заголовке соединение (276 мг, 90%) в виде бесцветных кристаллов.
Т.пл.: 129-130oC;
ИК спектр (KBr) νmax см-1: 3359, 1641, 1626, 1597, 1578, 1534, 1518;
ЯМР спектр (CDCl3) δ м.д.: 3,92 (2H, кв, J = 5,1 Гц), 4,52 (2H, кв, J = 5,1 Гц), 6,17 (1H, с), 6,74 (1H, ушир.с), 7,42-7,53 (6H, м), 7,71-7,74 (2H, м), 7,79-7,88 (2H, м).
Пример 77
3-(2-Метоксикарбониламиноэтокси)-5-фенилизоксазол (Соединение N 1348)
3-(2-Аминоэтокси)-5-фенилизоксазол гидрохлорид (240 мг) суспендируют в безводном тетрагидрофуране (5 мл) и суспензию охлаждают до 5oC. Добавляют к ней метилхлорформиат (113 мг) и триэтиламин (243 мг) и полученную смесь перемешивают при той же температуре в течение 30 мин. В конце этого периода времени реакционную смесь добавляют к ледяной воде (40 мл) и экстрагируют этилацетатом (40 мл х 2). Затем органический слой сушат над безводным сульфатом магния. После фильтрования растворитель испаряют при пониженном давлении. Полученные таким образом кристаллы перекристаллизуют из смеси этилацетата и простого эфира, чтобы получить указанное в заголовке соединение (233 мг, 89%) в виде бесцветных кристаллов.
Т.пл.: 95-96oC;
ИК спектр (KBr) νmax см-1: 3293, 1729, 1624, 1596, 1577, 1552, 1516;
ЯМР спектр (CDCl3) δ м.д.: 3,63 (2H, кв, J = 5,1 Гц), 3,70 (3H, с), 4,37 (2H, кв, J = 5,1 Гц), 5,11 (1H, ушир.с), 6,14 (1H, с), 7,40-7,49 (3H, м), 7,69-7,75 (2H, м).
Пример 78
Гидрохлорид 3-(2-аминоэтилтио)-5-фенилизоксазола (Соединение N 15)
(a) 3-(2-(N-трет-Бутоксикарбониламино)этилтио)-5-фенилизоксазол
2-(N-трет-Бутоксикарбониламино)этантиол (300 мг) растворяют в диметилформамиде (3,0 мл) и смесь охлаждают до 5oC с последующим добавлением гидрида натрия [>55% (масло), 73 мг]. Полученную смесь перемешивают при той же температуре в течение 30 мин. Затем к реакционной смеси добавляют 3-хлор-5-фенилизоксазол (300 мг) с последующим перемешиванием смеси при той же температуре в течение 30 мин и далее при комнатной температуре в течение 3 сут. В конце этого периода времени реакционную смесь добавляют к ледяной воде (40 мл) и экстрагируют этилацетатом (40 мл х 2). Затем органический слой сушат над безводным сульфатом магния. После фильтрования растворитель испаряют при пониженном давлении. Остаток очищают колоночной хроматографией на силикагеле (элюент: гексан/этилацетат = 4/1), чтобы получить указанное в заголовке соединение (130 мг, 24%) в виде бесцветных кристаллов.
Т.пл.: 87-88oC;
ИК спектр (KBr) νmax см-1: 3376, 1682, 1613, 1572, 1521, 1494;
ЯМР спектр (CDCl3) δ м.д.: 1,44 (9H, с), 3,27 (2H, т, J = 6,3 Гц), 3,53 (2H, кв, J = 6,3 Гц), 5,01 (1H, ушир.с), 6,44 (1H, с), 7,42-7,50 (3H, м), 7,71-7,76 (2H, м).
(b) Гидрохлорид 3-(2-аминоэтилтио)-5-фенилизоксазола
3-(2-(N-трет-Бутоксикарбониламино)этилтио)-5-фенилизоксазол (64 мг) подвергают взаимодействию и последующей обработке подобно тому, как описано в Примере 1(b), чтобы получить указанное в заголовке соединение (40 мг, 78%) в виде бесцветных кристаллов.
Т.пл.: 196-198oC (разлагается);
ИК спектр (KBr) νmax см-1: 3141, 2988, 2951, 2923, 1609, 1590, 1569, 1492;
ЯМР спектр (ДМСО-d6) δ м.д.: 3,18 (2H, т, J = 7,2 Гц), 3,36 (2H, т, J = 7,2 Гц), 7,23 (1H, с), 7,53-7,59 (3H, м), 7,83-7,97 (2H, м), 7,97 (3H, ушир. с).
Пример 79
Дигидрохлорид 3-(2-аминоэтокси)-4-изопропил-5-(3-пиридил)изоксазола (Соединение N 1065)
(a) 3-(2-(N-трет-Бутоксикарбониламино)этокси)-4-изопропил-5-(3- пиридил)изоксазол
3-Гидрокси-4-изопропил-5-(3-пиридил)изоксазол (0,12 г) и 2-(N-трет-бутоксикарбониламино)этанол (0,09 г) подвергают взаимодействию и последующей обработке подобно тому, как описано в Примере 9(a), чтобы получить указанное в заголовке соединение (0,14 г, 74%) в виде бесцветного порошка.
ИК спектр (KBr) νmax см-1: 3323, 3247, 2979, 1753, 1690;
ЯМР спектр (CDCl3) δ м.д.: 1,31 (6H, д, J = 6,8 Гц), 1,46 (9H, с), 3,06 (1H, кв.кв, J = 6,8 Гц, J = 6,8 Гц), 3,60 (2H, кв, J = 5,2 Гц), 4,39 (2H, т, J = 5,2 Гц), 4,84 (1H, ушир.с), 7,43 (1H, дд, J = 8,0 Гц, J = 4,7 Гц), 7,90 (1H, ддд, J = 8,0 Гц, J = 2,0 Гц, J = 1,4 Гц), 8,69 (1H, дд, J = 4,7 Гц, J = 1,4 Гц), 8,83 (1H, д, J = 2,0 Гц).
(b) Дигидрохлорид 3-(2-аминоэтокси)-4-изопропил-5-(3-пиридил)изоксазола
3-(2-(N-трет-Бутоксикарбониламино)этокси)-4-изопропил-5-(3- пиридил)изоксазол (0,13 г) подвергают взаимодействию и последующей обработке подобно тому, как описано в Примере 9(b), чтобы получить указанное в заголовке соединение (0,07 г, 64%) в виде бесцветных кристаллов.
Т.пл.: 193-197oC (разлагается);
ИК спектр (KBr) νmax см-1: 3049, 2963, 2874, 1549;
ЯМР спектр (ДМСО-d6) δ м.д.: 1,27 (6H, д, J = 7,0 Гц), 3,03 (1H, кв.кв, J = 7,0 Гц, J = 7,0 Гц), 3,29 (2H, т, J = 5,4 Гц), 4,48 (2H, т, J = 5,4 Гц), 7,68 (1H, дд, J = 8,0 Гц, J = 5,0 Гц), 8,12 (1H, ддд, J = 8,0 Гц, J = 2,0 Гц, J = 1,4 Гц), 8,28 (3H, ушир.с), 8,78 (1H, дд, J = 5,0 Гц, J = 1,4 Гц), 8,85 (1H, д, J = 2,0 Гц).
Пример 80
Гидрохлорид 3-(2-аминоэтокси)-4-(1-хлорпропил)-5-фенилизоксазола (Соединение N 1802)
(a) 3-(2-(N-трет-Бутоксикарбониламино)этокси)-4-(1- гидроксипропил)-5-фенилизоксазол
3-(2-(N-трет-Бутоксикарбониламино)этокси)-5-фенилизоксазол (0,2 г), бутиллитий (1,6 М раствор в гексане, 0,9 мл) и пропиональдегид (0,06 мл) подвергают взаимодействию и последующей обработке подобно тому, как описано в Примере 44(a), чтобы получить указанное в заголовке соединение (0,14 г, 58%) в виде бесцветного масла.
ИК спектр (CHCl3) νmax см-1: 3602, 3459, 2980, 2937, 1712;
ЯМР спектр (CDCl3) δ м. д. : 0,95 (3H, т, J = 7,4 Гц), 1,45 (9H, с), 1,83-2,08 (2H, м), 2,51 (1H, ушир.с), 3,57 (2H, кв, J = 5,2 Гц), 4,39 (2H, т, J = 5,2 Гц), 4,68 (1H, т, J = 7,2 Гц), 4,94 (1H, ушир.с), 7,43-7,52 (3H, м), 7,64-7,75 (2H, м).
(b) Гидрохлорид 3-(2-аминоэтокси)-4-(1-хлорпропил)-5-фенилизоксазола
3-(2-(N-трет-Бутоксикарбониламино)этокси)-4-(1-гидроксипропил)-5- фенилизоксазол (0,13 г) подвергают взаимодействию и последующей обработке подобно тому, как описано в Примере 1(b), чтобы получить указанное в заголовке соединение (0,10 г, 91%) в виде бесцветных кристаллов.
Т.пл.: 122-124oC;
ИК спектр (KBr) νmax см-1: 2974, 2936, 2878, 1631, 1600, 1577;
ЯМР спектр (ДМСО-d6) δ м.д.: 0,94 (3H, т, J = 7,3 Гц), 2,11-2,28 (2H, м), 3,31 (2H, т, J = 5,1 Гц), 4,50 (2H, т, J = 5,1 Гц), 5,14 (1H, т, J = 6,5 Гц), 7,61-7,65 (3H, м), 7,72-7,75 (2H, м).
Пример 81
Гидрохлорид 3-(2-аминоэтокси)-4-(1-хлоризобутил)-5-фенилзоксазола (Соединение N 1804)
(a) 3-(2-(N-трет-Бутоксикарбониламино)этокси)-4-(1- гидроксиизобутил)-5-фенилизоксазол
3-(2-(N-трет-Бутоксикарбониламино)этокси)-5-фенилизоксазол (0,2 г), бутиллитий (1,6 М раствор в гексане, 0,9 мл) и изобутилальдегид (0,07 мл) подвергают взаимодействию и последующей обработке подобно тому, как описано в Примере 44(a), чтобы получить указанное в заголовке соединение (0,21 г, 84%) в виде бесцветного масла.
ИК спектр (CHCl3) νmax см-1: 3606, 3459, 2981, 2937, 1712, 1637;
ЯМР спектр (CDCl3) δ м.д.: 0,79 (3H, д, J = 6,6 Гц), 1,11 (3H, д, J = 6,6 Гц), 1,45 (9H, с), 2,16-2,29 (1H, м), 2,56 (1H, ушир.с), 3,58 (2H, кв, J = 5,1 Гц), 4,30-4,48 (3H, м), 4,94 (1H, ушир.с), 7,46-7,51 (3H, м), 7,70-7,74 (2H, м).
(b) Гидрохлорид 3-(2-аминоэтокси)-4-(1-хлоризобутил)-5-фенилизоксазола
3-(2-(N-трет-Бутоксикарбониламино)этокси)-4-(1- гидроксиизобутил)-5-фенилизоксазол (0,20 г) подвергают взаимодействию и последующей обработке подобно тому, как описано в Примере 1(b), чтобы получить указанное в заголовке соединение (0,11 г, 65%) в виде бесцветных кристаллов.
Т.пл.: 165-167oC;
ИК спектр (KBr) νmax см-1: 2967, 2902, 2870, 1636, 1600;
ЯМР спектр (ДМСО-d6) δ м.д.: 0,78 (3H, д, J = 6,6 Гц), 1,15 (3H, д, J = 6,6 Гц), 2,53-2,63 (1H, м), 3,30 (2H, т, J = 5,2 Гц), 4,50 (2H, т, J = 5,2 Гц), 4,85 (1H, д, J = 10,7 Гц), 7,60-7,65 (3H, м), 7,71-7,75 (2H, м), 8,25 (3H, ушир.с).
Пример 82
Гидрохлорид 3-(2-аминоэтокси)-4-(1-хлоризопентил)-5-фенилизоксазола (Соединение N 1806)
(a) 3-(2-(N-трет-Бутоксикарбониламино)этокси)-4-(1- гидроксиизопентил)-5-фенилизоксазол
3-(2-(N-трет-Бутоксикарбониламино)этокси)-5-фенилизоксазол (0,2 г), бутиллитий (1,6 М раствор в гексане, 0,9 мл) и изовалеральдегид (0,09 мл) подвергают взаимодействию и последующей обработке подобно тому, как описано в Примере 44(a), чтобы получить указанное в заголовке соединение (0,2 г, 77%) в виде бесцветного масла.
ИК спектр (CHCl3) νmax см-1: 3601, 3459, 2981, 2961, 2936, 1712, 1639;
ЯМР спектр (CDCl3) δ м.д.: 0,87 (3H, д, J = 6,3 Гц), 0,92 (3H, д, J = 6,3 Гц), 1,45 (9H, с), 1,63-1,78 (2H, м), 1,83-1,98 (1H, м), 3,58 (2H, кв, J = 5,2 Гц), 4,40 (2H, т, J = 5,2 Гц), 4,75-5,00 (2H, м), 7,44-7,50 (3H, м), 7,66-7,71 (2H, м).
(b) Гидрохлорид 3-(2-аминоэтокси)-4-(1-хлоризопентил)-5-фенилизоксазола
3-(2-(N-трет-Бутоксикарбониламино)этокси)-4-(1-гидроксиизопентил)-5- фенилизоксазол (0,19 г) подвергают взаимодействию и последующей обработке подобно тому, как описано в Примере 1(b), чтобы получить указанное в заголовке соединение (0,11 г, 69%) в виде бесцветных кристаллов.
Т.пл.: 134-136oC;
ИК спектр (KBr) νmax см-1: 2961, 2905, 2873, 1630;
ЯМР спектр (ДМСО-d6) δ м.д.: 0,79 (3H, д, J = 6,6 Гц), 0,82 (3H, д, J = 6,6 Гц), 1,57 (1H, кв.кв, J = 6,6 Гц, J = 6,6 Гц), 2,00-2,12 (2H, м), 3,31 (2H, т, J = 5,4 Гц), 4,51 (2H, т, J = 5,4 Гц), 5,21 (1H, т, J = 8,0 Гц), 7,62-7,65 (3H, м), 7,69-7,72 (2H, м), 8,22 (3H, ушир.с).
Пример 83
Гидрохлорид 3-(2-аминоэтокси)-5-(2,4-дифторфенил)-4-изопропилизоксазола (Соединение N 99)
(a) 3-(2-(N-трет-Бутоксикарбониламино)этокси)-5-(2,4- дифторфенил)-4-изопропилизоксазол
5-(2,4-Дифторфенил)-3-гидрокси-4-изопропилизоксазол (0,2 г) и 2-(N-трет-бутоксикарбониламино)этанол (0,16 г) подвергают взаимодействию и последующей обработке подобно тому, как описано в Примере 1(a), чтобы получить указанное в заголовке соединение (0,25 г, 78%) в виде бесцветного порошка.
ИК спектр (KBr) νmax см-1: 3400, 2980, 2936, 1683;
ЯМР спектр (CDCl3) δ м.д.: 1,22 (6H, д, J = 6,9 Гц), 1,46 (9H, с), 2,78 (1H, кв.кв, J = 6,9 Гц, J = 6,9 Гц), 3,59 (2H, кв, J = 5,2 Гц), 4,38 (2H, т, J = 5,2 Гц), 4,86 (1H, ушир.с), 6,90-7,03 (2H, м), 7,42-7,50 (1H, м).
(b) гидрохлорид 3-(2-аминоэтокси)-5-(2,4-дифторфенил)-4- изопропилизоксазола
3-(2-(N-трет-Бутоксикарбониламино)этокси)-5-(2,4-дифторфенил)-4- изопропилизоксазол (0,24 г) подвергают взаимодействию и последующей обработке подобно тому, как описано в Примере 1(b), чтобы получить указанное в заголовке соединение (0,17 г, 85%) в виде бесцветных кристаллов.
Т.пл.: 177-179oC;
ИК спектр (KBr) νmax см-1: 2973, 2936, 1642, 1614, 1590;
ЯМР спектр (ДМСО-d6) δ м.д.: 1,18 (6H, д, J = 6,9 Гц), 2,76 (1H, кв.кв, J = 6,9 Гц, J = 6,9 Гц), 3,29 (2H, т, J = 5,3 Гц), 4,46 (2H, т, J = 5,3 Гц), 7,28-7,33 (1H, м), 7,50-7,56 (1H, м), 7,60-7,66 (1H, м), 8,12 (3H, ушир.с).
Пример 84
Гидрохлорид 3-(2-аминоэтокси)-4-изопропил-5-(4-метилфенил)изоксазола (Соединение N 266)
(a) 3-(2-(N-трет-Бутоксикарбониламино)этокси)-4-изопропил-5-(4- метилфенил)изоксазол
3-Гидрокси-4-изопропил-5-(4-метилфенил)изоксазол (0,2 г) и 2-(N-трет-бутоксикарбониламино)этанол (0,16 г) подвергают взаимодействию и последующей обработке подобно тому, как описано в Примере 1(a), чтобы получить указанное в заголовке соединение (0,27 г, 82%) в виде бесцветного порошка.
ИК спектр (KBr) νmax см-1: 3383, 2965, 1686;
ЯМР спектр (CDCl3) δ м.д.: 1,28 (6H, д, J = 7,0 Гц), 1,46 (9H, с), 2,41 (3H, с), 3,06 (1H, кв.кв, J = 7,0 Гц, J = 7,0 Гц), 3,59 (2H, кв, J = 5,2 Гц), 4,37 (2H, т, J = 5,2 Гц), 4,84 (1H, ушир.с), 7,27 (2H, д, J = 8,1 Гц), 7,46 (2H, д, J = 8,1 Гц).
(b) Гидрохлорид 3-(2-аминоэтокси)-4-изопропил-5-(4- метилфенил)изоксазола
3-(2-(N-трет-Бутоксикарбониламино)этокси)-4-изопропил-5-(4- метилфенил)изоксазол (0,25 г) подвергают взаимодействию и последующей обработке подобно тому, как описано в Примере 1(b), чтобы получить указанное в заголовке соединение (0,13 г, 65%) в виде бесцветных кристаллов.
Т.пл.: 208-210oC;
ИК спектр (KBr) νmax см-1: 2971, 2877, 1641, 1522;
ЯМР спектр (ДМСО-d6) δ м.д.: 1,25 (6H, д, J = 7,0 Гц), 2,38 (3H, с), 3,02 (1H, кв. кв, J = 7,0 Гц, J = 7,0 Гц), 3,28 (2H, т, J = 5,2 Гц), 4,44 (2H, т, J = 5,2 Гц), 7,37 (2H, д, J = 8,1 Гц), 7,47 (2H, д, J = 8,1 Гц), 8,20 (3H, ушир.с).
Сравнительный пример 1
4-Хлор-5-(4-хлорфенил)-3-гидроксиизоксазол
(a) Этиловый эфир 4-хлоркоричной кислоты
4-Хлоркоричную кислоту (300 г) суспендируют в бензоле (1200 мл) и добавляют к ней этанол (340 г) и конц. серную кислоту (14 мл) с последующим кипячением с обратным холодильником полученной смеси в течение 15 ч. После реакции смесь промывают последовательно разбавленным водным раствором NaCl (500 мл), насыщенным водным раствором гидрокарбоната натрия (500 мл) и разбавленным водным раствором NaCl (500 мл), органический слой сушат над безводным сульфатом магния. После фильтрования растворитель испаряют при пониженном давлении. Остаток испаряют при пониженном давлении, чтобы получить указанное в заголовке соединение (334 г, 97%) в виде бесцветной жидкости.
Т.пл.: 147-148oC (4 мм рт.ст.);
ЯМР спектр (CDCl3) δ м.д.: 1,33 (3H, т, J = 7,0 Гц), 4,30 (2H, кв, J = 7,0 Гц), 6,47 (1H, д, J = 16,0 Гц), 7,63 (1H, д, J = 16,0 Гц), 7,63 (4H, почти с).
(b) Этиловый эфир α,β- дибром-4-хлоркоричной кислоты
Этиловый эфир 4-хлоркоричной кислоты (330 г) растворяют в четыреххлористом углероде (1200 мл) и добавляют по каплям бром (251 г) при перемешивании при комнатной температуре. Полученную смесь перемешивают при комнатной температуре в течение 4 ч и оставляют на ночь. Растворитель испаряют при пониженном давлении, чтобы получить указанное в заголовке соединение (572 г, 99%) в виде бесцветных кристаллов.
Т.пл.: 67-68oC;
ЯМР спектр (CDCl3) δ м.д.: 1,34 (3H, т, J = 7,0 Гц), 4,37 (2H, кв, J = 7,0 Гц), 4,80 (1H, д, J = 12,0 Гц), 5,32 (1H, д, J = 12,0 Гц), 7,37 (4H, почти с).
(c) 5-(4-Хлорфенил-3-гидроксиизоксазол
Гидроксид натрия (151 г) растворяют в метаноле (600 мл), добавляют по каплям водный раствор (50 мл) гидрохлорида гидроксиламина (45 г) при перемешивании при 0oC и затем к смеси добавляют по каплям раствор этилового эфира α,β- дибром-4-хлоркоричной кислоты (200 г) в диоксане (200 мл). Полученную смесь перемешивают при комнатной температуре 4 ч и далее кипятят с обратным холодильником в течение 5 ч. Реакционную смесь охлаждают до 5oC и pH смеси доводят до величины 2 конц. хлороводородной кислотой. Затем реакционную смесь добавляют к воде (5 л). Осадок отделяют от смеси фильтрованием и промывают водой (2 л) и затем этанолом (1 л), чтобы получить 90 г указанного в заголовке соединения (85%) в виде бледно-желтого порошка.
Т.пл.: 215-220oC (разлагается),
ЯМР спектр (ДМФ-d7) δ м.д.: 6,66 (1H, с), 7,52-8,20 (4H, м), 11,5-12,0 (1H, ушир.с).
(d) 4-Хлор-5-(4-хлорфенил)-3-гидроксиизоксазол
К раствору 5-(4-хлорфенил)-3-гидроксиизоксазола (50,0 г) в сухом тетрагидрофуране (300 мл) добавляют по каплям раствор сульфурилхлорида (34,5 г) в сухом бензоле (50 мл) при перемешивании при 5oC. Полученную смесь перемешивают при той же температуре 30 мин и затем при комнатной температуре один час и далее кипятят с обратным холодильником в течение 3 ч. Растворитель из реакционной смеси испаряют при пониженном давлении и полученное таким образом твердое вещество перекристаллизуют из этанола, чтобы получить указанное в заголовке соединение (44,2 г, 76,8%) в виде бесцветных игольчатых кристаллов.
Т.пл. 235-238oC (разлагается),
ЯМР спектр (ДМФ-d7) δ м.д.: 7,60-8,20 (4H, м), 12,6-13,6 (1H, ушир.с).
Сравнительный пример 2
3-Гидрокси-5-(2-тиенил)изоксазол
2-Тиофенакриловую кислоту подвергают взаимодействию и последующей обработке подобно тому, как описано в Сравнительном примере 1(a), Сравнительном примере 1(b) и Сравнительном примере 1(c), чтобы получить указанное в заголовке соединение.
Т.пл.: 163-165oC;
ЯМР-спектр (ДМСО-d6) δ м.д.: 6,38 (1H, с), 7,20-7,25 (1H, м), 7,60-7,80 (2H, м), 11,2-11,6 (1H, ушир.с).
Сравнительный пример 3
4-Хлор-3-гидрокси-5-(2-тиенил)изоксазол
3-Гидрокси-5-(2-тиенил)изоксазол подвергают взаимодействию и последующей обработке подобно тому, как описано в Сравнительном примере 1(d), чтобы получить указанное в заголовке соединение.
Т.пл.: 191-194oC;
ЯМР спектр (ДМФ-d7) δ м. д. : 7,21-7,45 (1H, м), 7,70-8,20 (2H, м), 10,0-13,0 (1H, ушир.с).
Сравнительный пример 4
3-Гидрокси-5-(3-пиридил)изоксазол
3-Пиридинакриловую кислоту подвергают взаимодействию и последующей обработке подобно тому, как описано в Сравнительном примере 1(a), Сравнительном примере 1(b) и Сравнительном примере 1(c), чтобы получить указанное в заголовке соединение.
Т.пл.: 212-214oC (разлагается),
ЯМР спектр (ДМФ-d7) δ м.д.: 6,76 (1H, с), 7,40-7,80 (1H, м), 8,10-8,50 (1H, м), 8,66-9,00 (1H, м), 9,05-9,33 (1H, м).
Сравнительный пример 5
4-Хлор-3-гидрокси-5-(2-пиридил)изоксазол
3-Гидрокси-5-(2-пиридил)изоксазол подвергают взаимодействию и последующей обработке подобно тому, как описано в Сравнительном примере 1(d), чтобы получить указанное в заголовке соединение.
Сравнительный пример 6
3-Гидрокси-4-изопропил-5-фенилизоксазол
Этил-бензоилацетат подвергают взаимодействию и последующей обработке подобно тому, как описано в Agric. Biol. Chem., EN. 50, 1831 (1986), чтобы получить указанное в заголовке соединение.
Т.пл.: 203-205oC;
ЯМР-спектр (ДМСО-d6) δ м.д.: 1,24 (6H, д, J = 7,1 Гц), 3,01 (1H, кв, J = 7,1 Гц), 7,47-7,61 (5H, м), 11,2-11,6 (1H, ушир.с).
Сравнительный пример 7
2-(N-трет-Бутоксикарбониламино)этанол
2-Аминоэтанол (6,1 г) растворяют в смеси тетрагидрофурана и воды (1:1, 100 мл) и добавляют по каплям ди-трет-бутил-дикарбонат (21,8 г) при охлаждении льдом с перемешиванием с последующим перемешиванием полученной смеси при той же температуре в течение одного часа и далее при комнатной температуре в течение 5 ч. Затем к реакционной смеси добавляют этилацетат (200 мл) и смесь промывают водой, органический слой сушат над безводным сульфатом магния. После фильтрования растворитель испаряют при пониженном давлении, чтобы получить указанное в заголовке соединение (15,3 г, 95%) в виде бесцветного масла.
Величина Rf: 0,35 (Проявляющий раствор: циклогексан/этилацетат = 1/1).
ЯМР спектр (CDCl3) δ м.д.: 1,45 (9H, с), 2,35-2,50 (1H, ушир.с), 3,29 (2H, кв, J = 5,3 Гц), 3,71 (2H, кв, J = 5,3 Гц), 4,85-5,05 (1H, ушир.с).
Сравнительный пример 8
4-(трет-Бутил)-3-гидрокси-5-фенилизоксазол
(a) Этиловый эфир 2-бензоил-3,3-диметилмасляной кислоты
Диизопропиламин (5,6 мл) растворяют в тетрагидрофуране (56 мл), добавляют по каплям бутиллитий (1,6 М раствор в гексане, 25 мл) при 5oC с перемешиванием под атмосферой азота и полученную смесь перемешивают в течение 15 мин. Реакционную смесь охлаждают до -70oC и добавляют к ней по каплям этиловый эфир 3,3-диметилмасляной кислоты (6,7 мл) с последующим перемешиванием полученной смеси в течение 10 мин. Затем к реакционной смеси по каплям добавляют бензоилхлорид (2,3 мл) и полученную смесь перемешивают при той же температуре в течение 10 мин. После реакции к реакционной смеси добавляют насыщенный водный раствор хлорида аммония и смесь экстрагируют этилацетатом. Органический слой промывают насыщенным водным раствором NaCl и сушат над безводным сульфатом магния. После фильтрования растворитель испаряют при пониженном давлении. Остаток очищают колоночной хроматографией на силикагеле (элюент: гексан/этилацетат = 20/1), чтобы получить указанное в заголовке соединение (4,5 г, 91%) в виде бесцветного масла.
(b) 4-(трет-Бутил)-3-гидрокси-5-фенилизоксазол
Этиловый эфир 2-бензоил-3,3-диметилмасляной кислоты (2,0 г) растворяют в метаноле (20 мл) и добавляют по каплям метоксид натрия (28%-ный раствор в метаноле, 1,6 мл) при 5oC под атмосферой азота с последующим перемешиванием полученной смеси в течение 10 мин. Реакционную смесь охлаждают до -30oC и к реакционной смеси добавляют по каплям суспензию гидрохлорида гидроксиламина (1,1 г) и метоксид натрия (28%-ный раствор в метаноле, 6,2 мл) в метаноле (10 мм). Полученную смесь перемешивают при той же температуре в течение 30 мин и добавляют к реакционной смеси 6 н. хлороводородную кислоту (14 мл) с последующим перемешиванием полученной смеси при 80oC в течение одного часа. После реакции растворитель испаряют при пониженном давлении. Затем остаток выливают в ледяную воду и экстрагируют этилацетатом, органический слой промывают насыщенным водным раствором NaCl и сушат над безводным сульфатом магния. После фильтрования растворитель испаряют при пониженном давлении. Остаток кристаллизуют из простого изопропилового эфира, чтобы получить указанное в заголовке соединение (0,35 г, 20%) в виде бесцветных кристаллов.
ИК спектр (KBr) νmax см-1: 3027, 2993, 2960, 2936, 2869, 2790, 2697, 2623, 2574, 1644, 1600;
ЯМР спектр (CDCl3) δ м.д.: 1,22 (9H, с), 7,39-7,50 (5H, м).
Сравнительный пример 9
5-(4-Хлорфенил)-3-гидрокси-4-изопропилизоксазол
(a) Этиловый эфир 2-(4-хлорбензоил)изовалериановой кислоты
4-Хлорбензоилхлорид (2,5 мл) и этиловый эфир изовалериановой кислоты (1,5 мл) подвергают взаимодействию и последующей обработке подобно тому, как описано в Сравнительном примере 8(a), чтобы получить указанное в заголовке соединение (2,2 г, 82%) в виде бесцветного масла.
(b) 5-(4-Хлорфенил)-3-гидрокси-4-изопропилизоксазол
Этиловый эфир 2-(4-хлорбензоил)изовалериановой кислоты (2,1 г), гидрохлорид гидроксиламина (1,1 г) и метоксид натрия (28%-ный раствор в метаноле, 7,5 мл) подвергают взаимодействию и последующей обработке подобно тому, как описано в Сравнительном примере 8(b), чтобы получить указанное в заголовке соединение (1,3 г, 71%) в виде бесцветных кристаллов.
ИК-спектр (KBr) νmax см-1: 3065, 3018, 2970, 2935, 2875, 2820, 2768, 2695, 2609, 1646;
ЯМР спектр (CDCl3) δ м.д.: 1,35 (6H, д, J = 7,0 Гц), 3,06 (1H, кв.кв, J = 7,0 Гц, J = 7,0 Гц), 7,46 (2H, д, J = 8,6 Гц), 7,54 (2H, д, J = 8,6 Гц).
Сравнительный пример 10
5-(2,4-Дифторфенил)-3-гидроксиизоксазол
(a) Этиловый эфир 2,4-дифторкоричной кислоты
2,4-Дифторкоричную кислоту (10,1 г) растворяют в этаноле (100 мл) и добавляют к ней конц. серную кислоту (1 мл) и полученную смесь кипятят с обратным холодильником в течение 3 ч. Растворитель испаряют при пониженном давлении и остаток выливают в ледяную воду и экстрагируют этилацетатом. Экстракт промывают последовательно 5%-ным водным раствором гидрокарбоната натрия и насыщенным водным раствором NaCl и органический слой сушат над безводным сульфатом магния. После фильтрования растворитель испаряют при пониженном давлении, чтобы получить указанное в заголовке соединение (11,2 г, 97%) в виде бесцветного масла.
(b) Этиловый эфир α,β- дибром-2,4-дифторкоричной кислоты
Этиловый эфир 2,4-дифторкоричной кислоты (11,2 г) растворяют в четыреххлористом углероде (110 мл) и добавляют по каплям бром (2,7 мл) при комнатной температуре с перемешиванием с последующим перемешиванием смеси при комнатной температуре в течение 3 ч. После реакции растворитель испаряют при пониженном давлении, чтобы получить указанное в заголовке соединение (19,6 г, количественный) в виде бесцветного порошка.
(c) 5-(2,4-Дифторфенил)-3-гидроксиизоксазол
Гидроксид натрия (10,9 г) растворяют в метаноле (110 мл) и добавляют по каплям раствор гидрохлорида гидроксиламина (4,2 г) в воде (10 мл) при 5oC с перемешиванием. К смеси добавляют по каплям раствор этилового эфира α,β- дибром-2,4-дифторкоричной кислоты (19,6 г) в тетрагидрофуране (20 мл) и полученную смесь перемешивают при комнатной температуре 2 ч с последующим кипячением с обратным холодильником в течение 5 ч. Растворитель испаряют при пониженном давлении и остаток выливают в ледяную воду. Величину pH смеси доводят до 2 конц. хлороводородной кислотой и реакционную смесь экстрагируют этилацетатом. Экстракт промывают насыщенным водным раствором NaCl и органический слой сушат над безводным сульфатом магния. После фильтрования растворитель испаряют при пониженном давлении. Остаток очищают колоночной хроматографией на силикагеле (элюент: циклогексан/этилацетат = 1/1), чтобы получить указанное в заголовке соединение (8,2 г, 79%) в виде бесцветных кристаллов.
ИК спектр (KBr) νmax см-1: 3170, 3090, 3028, 2848, 2806, 2689, 2655, 2603, 1630;
ЯМР-спектр (ДМСО-d6) δ м.д.: 6,38 (1H, с), 7,25-7,32 (1H, м), 7,47-7,56 (1H, м), 7,89-7,99 (1H, м), 11,62 (1H, ушир.с).
Сравнительный пример 11
3-Гидрокси-5-(2-трифторметилфенил)изоксазол
(a) Этиловый эфир 2-трифторметилкоричной кислоты
2-Трифторметилкоричную кислоту (10,1 г), конц. серную кислоту (1 мл) и этанол (100 мл) подвергают взаимодействию и последующей обработке подобно тому, как описано в Сравнительном примере 10(a), чтобы получить указанное в заголовке соединение (10,8 г, 95%) в виде бесцветного масла.
(b) Этиловый эфир α,β- дибром-2-трифторметилкоричной кислоты
Этиловый эфир 2-трифторметилкоричной кислоты (10,8 г) и бром (2,3 мл) подвергают взаимодействию и последующей обработке подобно тому, как описано в Сравнительном примере 10(b), чтобы получить указанное в заголовке соединение (17,9 г, количественный) в виде бесцветного порошка.
(c) 3-Гидрокси-5-(2-трифторметилфенил)изоксазол
Этиловый эфир α,β- дибром-2-трифторметилкоричной кислоты (17,9 г), гидрохлорид гидроксиламина (3,8 г) и гидроксид натрия (9,1 г) подвергают взаимодействию и последующей обработке подобно тому, как описано в Сравнительном примере 10(c), чтобы получить указанное в заголовке соединение (7,6 г, 76%) в виде бесцветных кристаллов.
ИК спектр (KBr) νmax см-1: 3176, 3096, 3022, 2950, 2836, 2796, 2669, 1620, 1600;
ЯМР-спектр (ДМСО-d6) δ м.д.: 6,34 (1H, с), 7,73-7,87 (3H, м), 7,92-7,95 (1H, м), 11,58 (1H, ушир.с).
Сравнительный пример 12
3-Гидрокси-5-(4-трифторметилфенил)изоксазол
(a) Этил-4-трифторметилциннамат
4-Трифторметилкоричную кислоту (10,2 г), конц. серную кислоту (1 мл) и этанол (100 мл) подвергают взаимодействию и последующей обработке подобно тому, как описано в Сравнительном примере 10(a), чтобы получить указанное в заголовке соединение (10,9 г, 95%) в виде бесцветного масла.
(b) Этиловый эфир α,β- дибром-4-трифторметилкоричной кислоты
Этиловый эфир 4-трифторметилкоричной кислоты (10,8 г) и бром (2,4 мл) подвергают взаимодействию и последующей обработке подобно тому, как описано в Сравнительном примере 10(b), чтобы получить указанное в заголовке соединение (17,9 г, количественный) в виде бесцветного порошка.
(c) 3-Гидрокси-5-(4-трифторметилфенил)изоксазол
Этиловый эфир α,β- дибром-4-трифторметилкоричной кислоты (17,9 г), гидрохлорид гидроксиламина (3,8 г) и гидроксид натрия (9,1 г) подвигают взаимодействию и последующей обработке подобно тому, как описано в Сравнительном примере 10(c), чтобы получить указанное в заголовке соединение (8,3 г, 83%) в виде бесцветных кристаллов.
ИК спектр (KBr) νmax см-1: 3154, 3018, 2987, 2838, 2788, 2673, 2637, 2607, 2547, 1631, 1614;
ЯМР-спектр (ДМСО-d6) δ м. д.: 6,77 (1H, с), 7,88 (2H, д, J = 8,4 Гц), 8,03 (2H, д, J = 8,4 Гц), 11,60 (1H, ушир.с).
Сравнительный пример 13
3-Гидрокси-5-(4-изопропилфенил)изоксазол
(a) Этиловый эфир 4-изопропилкоричной кислоты
4-Изопропилкоричную кислоту (5,0 г), конц. серную кислоту (0,5 мл) и этанол (50 мл) подвергают взаимодействию и последующей обработке подобно тому, как описано в Сравнительном примере 10(a), чтобы получить указанное в заголовке соединение (5,5 г 97%) в виде бесцветного масла.
(b) Этиловый эфир α,β- дибром-4-изопропилкоричной кислоты
Этиловый эфир 4-изопропилкоричной кислоты (5,5 г) и бром (1,3 мл) подвергают взаимодействию и последующей обработке подобно тому, как описано в Сравнительном примере 10(b), чтобы получить указанное в заголовке соединение (9,5 г, количественный) в виде бесцветного порошка.
(c) 3-Гидрокси-5-(4-изопропилфенил)изоксазол
Этиловый эфир α,β- дибром-4-изопропилкоричной кислоты (9,5 г), гидрохлорид гидроксиламина (2,2 г) и гидроксид натрия (5,2 г) подвергают взаимодействию и последующей обработке подобно тому, как описано в Сравнительном примере 10(c), чтобы получить указанное в заголовке соединение (3,6 г, 71%) в виде бесцветных кристаллов.
ИК спектр (KBr) νmax см-1: 3013, 2964, 2934, 2893, 2872, 2793, 2665, 2631, 2542, 1624;
ЯМР-спектр (ДМСО-d6) δ м.д.: 1,22 (6H, д, J = 6,9 Гц), 2,94 (1H, кв.кв, J = 6,9 Гц, J = 6,9 Гц), 6,48 (1H, с), 7,39 (2H, д, J = 8,3 Гц), 7,72 (2H, д, J = 8,3 Гц).
Сравнительный пример 14
3-Гидрокси-5-(4-феноксифенил)изоксазол
(a) 4-Феноксикоричная кислота
4-Феноксибензальдегид (10,0 г) и ацетат калия (9,8 г) суспендируют в уксусном ангидриде (9,5 мл) с последующим кипячением с обратным холодильником при 180oC в течение 5 ч. После реакции pH смеси доводят до величины 2 хлороводородной кислотой и полученную смесь экстрагируют этилацетатом. Экстракт промывают насыщенным водным раствором NaCl и органический слой сушат над безводным сульфатом магния. После фильтрования растворитель испаряют при пониженном давлении. Остаток очищают колоночной хроматографией на силикагеле (элюент: гексан/этилацетат = 2/1), чтобы получить указанное в заголовке соединение (6,5 г, 54%) в виде бесцветных кристаллов.
(b) Этиловый эфир 4-феноксикоричной кислоты
4-Феноксикоричную кислоту (4,0 г), конц. серную кислоту (0,4 мл) и этанол (40 мл) подвергают взаимодействию и последующей обработке подобно тому, как описано в Сравнительном примере 10(b), чтобы получить указанное в заголовке соединение (4,4 г, 98%) в виде бесцветного масла.
(c) Этиловый эфир α,β- дибром-4-феноксикоричной кислоты
Этиловый эфир 4-феноксикоричной кислоты (4,4 г) и бром (0,84 мл) подвергают взаимодействию и последующей обработке подобно тому, как описано в Сравнительном примере 10(b), чтобы получить указанное в заголовке соединение (7,0 г, количественный) в виде бесцветного порошка.
(d) 3-Гидрокси-5-(4-феноксифенил)изоксазол
Этиловый эфир α,β- дибром-4-феноксикоричной кислоты (7,0 г), гидрохлорид гидроксиламина (1,4 г) и гидроксид натрия (3,3 г) подвергают взаимодействию и последующей обработке подобно тому, как описано в Сравнительном примере 10(c), чтобы получить указанное в заголовке соединение (3,4 г, 83%) в виде бесцветных кристаллов.
ИК спектр (KBr) νmax см-1: 3147, 3013, 2951, 2852, 2785, 2614, 2557, 1627;
ЯМР-спектр (ДМСО-d6) δ м.д.: 6,47 (1H, с), 7,07-7,25 (5H, м), 7,42-7,48 (2H, м), 7,79-7,83 (2H, м), 11,36 (1H, ушир.с).
Сравнительный пример 15
3-Гидрокси-5-(1-нафтил)изоксазол
(a) 1-Нафтилакриловая кислота
1-Нафтилальдегид (30,5 г), ацетата калия (38,3 г) и уксусный ангидрид (36,9 мл) подвергают взаимодействию и последующей обработке подобно тому, как описано в Сравнительном примере 14(a), чтобы получить указанное в заголовке соединение (22,4 г, 58%) в виде бесцветного порошка.
(b) Этиловый эфир 1-нафтилакриловой кислоты
1-Нафтилакриловую кислоту (9,5 г), конц. серную кислоту (1 мл) и этанол (100 мл) подвергают взаимодействию и последующей обработке подобно тому, как описано в Сравнительном примере 10(a), чтобы получить указанное в заголовке соединение (10,2 г, 94%) в виде бесцветного масла.
(c) Этиловый эфир α,β- дибром-1-нафтилакриловой кислоты
Этиловый эфир 1-нафтилакриловой кислоты (10,1 г) и бром (2,5 мл) подвергают взаимодействию и последующей обработке подобно тому, как описано в Сравнительном примере 10(b), чтобы получить указанное в заголовке соединение (17,2 г, количественный) в виде бесцветного порошка.
(d) 3-Гидрокси-5-(1-нафтил)изоксазол
Этиловый эфир α,β- дибром-1-нафтилакриловой кислоты (6,0 г), гидрохлорид гидроксиламина (1,3 г) и гидроксид натрия (7,2 г) подвергают взаимодействию и последующей обработке подобно тому, как описано в Сравнительном примере 10(c), чтобы получить указанное в заголовке соединение (2,6 г, 78%) в виде бесцветных кристаллов.
ИК спектр (KBr) νmax см-1: 3136, 3045, 3017, 2790, 2710, 2640, 2569, 1628;
ЯМР-спектр (ДМСО-d6) δ м.д.: 6,53 (1H, с), 7,61-7,70 (3H, м), 7,84-7,87 (1H, м), 8,03-8,13 (2H, м), 8,22-8,28 (1H, м).
Сравнительный пример 16
3-Гидрокси-5-(4-гидроксифенил)изоксазол
3-Гидрокси-5-(4-метоксифенил)изоксазол (5,0 г) суспендируют в дихлорметане (50 мл) и добавляют хлорид алюминия (7,0 г) с последующим кипячением с обратным холодильником полученной смеси в течение 66 ч. В конце этого периода времени реакционную смесь выливают в ледяную воду и добавляют 6 н. хлороводородную кислоту с последующим экстрагированием этилацетатом. Затем экстракт промывают насыщенным водным раствором NaCl, органический слой сушат над безводным сульфатом магния. После фильтрования растворитель испаряют при пониженном давлении. Остаток очищают колоночной хроматографией на силикагеле (элюент: циклогексан/этилацетат = 2/1), чтобы получить указанное в заголовке соединение (3,8 г, 83%) в виде бесцветных кристаллов.
ИК спектр (KBr) νmax см-1: 3140, 3074, 1624, 1588;
ЯМР-спектр (ДМСО-d6) δ м. д.: 6,24 (1H, с), 6,86 (2H, д, J = 8,2 Гц), 7,62 (2H, д, J = 8,2 Гц), 10,03 (1H, с), 11,24 (1H, ушир.с).
Сравнительный пример 17
5-(2,4-Дифторфенил)-3-гидрокси-4-изопропилизоксазол
(a) Этиловый эфир 2-(2,4-дифторбензоил)изовалериановой кислоты
2,4-Дифторбензоилхлорид (4,9 мл) и этиловый эфир изовалериановой кислоты (3,0 мл) подвергают взаимодействию и последующей обработке подобно тому, как описано в Сравнительном примере 8(a), чтобы получить указанное в заголовке соединение (3,65 г, 68%) в виде бесцветной жидкости.
(b) 5-(2,4-Дифторфенил)-3-гидрокси-4-изопропилизоксазол
Этиловый эфир 2-(2,4-дифторбензоил)изовалериановой кислоты (1,7 г), гидрохлорид гидроксиламина (0,9 г) и метоксид натрия (28%-ный раствор в метаноле, 7,5 мл) подвергают взаимодействию и последующей обработке подобно тому, как описано в Сравнительном примере 8(b), чтобы получить указанное в заголовке соединение (0,59 г, 39%) в виде бесцветных кристаллов.
ИК спектр (KBr) νmax см-1: 3082, 3033, 2980, 2968, 2935, 2913, 2877, 2836, 2795, 2699, 2636, 2604, 1660, 1610;
ЯМР-спектр (ДМСО-d6) δ м.д.: 1,28 (6H, д, J = 7,0 Гц), 2,81 (1H, кв.кв, J = 7,0 Гц, J = 7,0 Гц), 6,91-7,05 (2H, м), 7,43-7,52 (1H, м).
Сравнительный пример 18
4-Циклопропил-3-гидрокси-5-фенилизоксазол
(a) Метиловый эфир 2-бензоил-2-циклопропилуксусной кислоты
Бензоилхлорид (1,0 мл) и метиловый эфир 2-циклопропилуксусной кислоты подвергают взаимодействию и последующей обработке подобно тому, как описано в Сравнительном примере 8(a), чтобы получить указанное в заголовке соединение (1,05 г, 28%) в виде бесцветной жидкости.
(b) 4-Циклопропил-3-гидрокси-5-фенилизоксазол
Метиловый эфир 2-бензоил-2-циклопропилуксусной кислоты (0,9 г), гидрохлорид гидроксиламина (0,6 г) и метоксид натрия (28%-ный раствор в метаноле, 4,0 мл) подвергают взаимодействию и последующей обработке подобно тому, как описано в Сравнительном примере 8(b), чтобы получить указанное в заголовке соединение (0,32 г, 39%) в виде бесцветных кристаллов.
ИК спектр (KBr) νmax см-1: 3085, 3066, 3012, 2972, 2909, 2851, 2778, 2716, 2652, 2601, 1646;
ЯМР спектр (CDCl3) δ м.д.: 0,79-0,85 (2H, м), 0,91-0,98 (2H, м), 1,67-1,77 (1H, м), 7,43-7,53 (3H, м), 7,86-7,90 (2H, м).
Сравнительный пример 19
3-Гидрокси-4-изопропил-5-(3-пиридил)изоксазол
(a) Этиловый эфир 2-никотиноилизовалериановой кислоты
Гидрохлорид хлорангидрида никотиновой кислоты (0,9 г), этиловый эфир изовалериановой кислоты (2,3 мл), диизопропиламин (2,1 мл) и бутиллитий (1,6 М раствор в гексане, 9,4 мл) подвергают взаимодействию и последующей обработке подобно тому, как описано в Сравнительном примере 8(a), чтобы получить указанное в заголовке соединение (0,78 г, 44%) в виде бесцветной жидкости.
(b) 3-Гидрокси-4-изопропил-5-(3-пиридил)изоксазол
Этиловый эфир 2-никотиноилизовалериановой кислоты (0,76 г), гидрохлорид гидроксиламина (0,46 г) и метоксид натрия (28%-ный раствор в метаноле, 3,1 мл) подвергают взаимодействию и последующей обработке подобно тому, как описано в Сравнительном примере 8(b), чтобы получить указанное в заголовке соединение (0,15 г, 23%) в виде бесцветных кристаллов.
ИК спектр (KBr) νmax см-1: 3069, 3035, 2970, 2934, 2876, 2809, 2770, 2709, 2665, 2605, 2576, 2519, 1511;
ЯМР спектр (CDCl3) δ м.д.: 1,38 (6H, д, J = 7,0 Гц), 3,10 (1H, кв.кв, J = 7,0 Гц, J = 7,0 Гц), 7,45 (1H, дд, J = 7,9 Гц, J = 4,4 Гц), 7,94 (1H, д, J = 7,9 Гц), 8,72 (1H, д, J = 4,4 Гц), 8,88 (1H, с).
Сравнительный пример 20
4-Хлор-3-гидрокси-5-(3-пиридил)изоксазол
3-гидрокси-5-(3-пиридил)изоксазол подвергают взаимодействию и последующей обработке подобно тому, как описано в Сравнительном примере 1(d), чтобы получить указанное в заголовке соединение.
Т.пл. 220-224oC (разлагается),
ЯМР спектр (ДМФ-d7) δ м.д.: 7,60-8,20 (4H, м), 12,6-13,6 (1H, ушир. с).
Пример испытания 1
Способность ингибировать моноаминоксидазу типа A
Способность ингибировать моноаминоксидазу типа A определяют по методу, описанному в Biochem. Pharmacol., 12, 1439 (1963) и J. Neurochem., 35, 109 (1980). К 30 мкл образца сырой митохондрии мозга мыши (30 мкг белка) добавляют 210 мкл фосфатного буфера (pH 7,4) и испытуемое соединение (растворенное в смеси 10% ДМСО и воды) и полученную смесь предварительно инкубируют при 38oC в течение 20 мин. Вслед за этим, к предварительно инкубированной смеси добавляют 14C-5-гидрокситриптамин (5-HT, конечная концентрация: 100 мкМ), чтобы осуществить реакцию при 38oC в течение 20 мин. После этого реакцию гасят путем добавления 2 н. хлороводородной кислоты (200 мкл), 14C-меченный метаболит, полученный путем ферментативной реакции, экстрагируют растворителем (этилацетат : толуол = 1:1) и 14C-радиоактивность определяют с помощью жидкостного сцинтилляционного счетчика, чтобы получить концентрацию соединения, которая снижает 14C-радиоактивность контроля на 50%.
Результаты испытаний показывают, что соединения 1, 2, 3, 4, 5, 6, 54, 57, 58, 59, 60, 62 и 67 имеют особенно превосходные активности IC50 ≤ 28 нМ.
Пример приготовления 1
Приготовление жесткой капсулы
Смешивают 50 мг порошкообразного соединения из Примера 4, 128,7 мг лактозы, 70 мг целлюлозы и 1,3 мг стеарата магния и пропускают через сито 60 меш и полученным порошком наполняют желатиновые капсулы N 3 по 250 мг, чтобы получить препарат в виде капсул.
Пример приготовления 2
Приготовление таблетки
Смешивают 50 мг порошкообразного соединения из Примера 4, 124 мг лактозы, 25 мг целлюлозы и 1 мг стеарата магния и формуют в таблетки на таблетировочной машине, чтобы получить таблетки 200 мг. Эти таблетки могут быть покрыты сахарной глазурью, если необходимо.
[Промышленное применение]
Производные изоксазола, имеющие общую формулу (I) данного изобретения, имеют превосходную способность ингибировать моноаминоксидазу типа A и относительно свободны от нежелательных побочных эффектов. Поэтому они полезны в качестве средств для лечения или профилактики (в частности, средств для лечения) нервных заболеваний, включая депрессию, болезнь Паркинсона, деменцию Альцгеймера (нарушение познавательной способности, присущее болезни Альцгеймера) или цереброваскулярную деменцию (нарушение познавательной способности, присущее цереброваскулярной деменции), (в частности, депрессии).
В случае, когда соединения (I) или их фармацевтически приемлемые соли по данному изобретению используются в качестве терапевтического или профилактического средства при нервных заболеваниях, соединения (I) или их соли, как таковые, или их смесь, полученная соответствующим смешиванием соединения (I) с фармацевтически приемлемыми наполнителями, разбавителями и т.п., может вводиться путем перорального приема таблеток, капсул, гранул, порошков или сиропов или путем парентерального введения инъекцией или с помощью суппозитория и т.д.
Такие фармацевтические препараты готовят обычным способом, используя добавки, такие как наполнители (например, производные сахара, такие как лактоза, сахароза, глюкоза, маннит и сорбит; производные крахмала, такие как кукурузный крахмал, картофельный крахмал, α- крахмал, декстрин и карбоксиметил-крахмал; производные целлюлозы, такие как кристаллическая целлюлоза, гидроксипропилцеллюлоза с низкой степенью замещения, гидроксипропилметилцеллюлоза, кармеллоза, кальциевая соль кармеллозы и натриевая соль внутримолекулярно сшитой кармеллозы (кроскармеллоза); камедь; декстран; пуллулан; силикатные производные, такие как легкая безводная кремниевая кислота, синтетический силикат алюминия или алюмометасиликат магния; соли фосфорной кислоты, такие как фосфат кальция; соли угольной кислоты, такие как карбонат кальция, и соли серной кислоты, такие как сульфат кальция), связующие (например, вышеуказанные наполнители; желатин; поливинилпирролидон; макрогол и тому подобное), вещества, способствующие распаду лекарственной формы (например, вышеуказанные наполнители; натриевая соль кроскармеллозы; натриевая соль карбоксиметилкрахмала, крахмал, который химически модифицирован подобно кросповидону, производные целлюлозы и тому подобное), смазки (например, тальк; стеариновая кислота; стеараты металлов, такие как стеарат кальция и стеарат магния; коллоидный диоксид кремния; пчелиная камедь; воски, такие как спермацет; борная кислота; гликоль; карбоновые кислоты, такие как фумаровая кислота и адипиновая кислота; карбоксилаты натрия, такие как бензоат натрия; сульфаты, такие как сульфат натрия; лейцин; лаурил-сульфаты, такие как лаурилсульфат натрия и лаурил-сульфат магния; кремниевые кислоты, такие как ангидрид кремниевой кислоты и гидрат кремниевой кислоты, и производные крахмала в вышеуказанных наполнителях), фунгициды (например, п-гидроксибензоаты, такие как метилпарабен и пропилпарабен; спирты, такие как хлорбутанол, бензиловый спирт и фенилэтиловый спирт; хлорид бензалкония; фенолы, такие как фенол и крезол; тримеросал; ангидрид уксусной кислоты и сорбиновая кислота), вещества, маскирующие вкус или запах (например, обычно используемые подслащиватели, подкислители и ароматизаторы и тому подобное), разбавители и растворители для инъекций (например, вода, этанол, глицерин и тому подобное).
Используемые дозы различаются в зависимости от состояния и возраста пациента. Например, в случае перорального введения, желательно вводить 1 мг (предпочтительно, 10 мг) в качестве нижнего предела и 2000 мг (предпочтительно, 400 мг) в качестве верхнего предела, и в случае внутривенного введения, желательно вводить 0,1 мг (предпочтительно, 1 мг) в качестве нижнего предела и 500 мг (предпочтительно, 300 мг) в качестве верхнего предела взрослому от одного до 6 раз в день в зависимости от симптомов.
Данные IC50 приведены в таблице 2.
Заявленные соединения обладают низким уровнем токсичности.
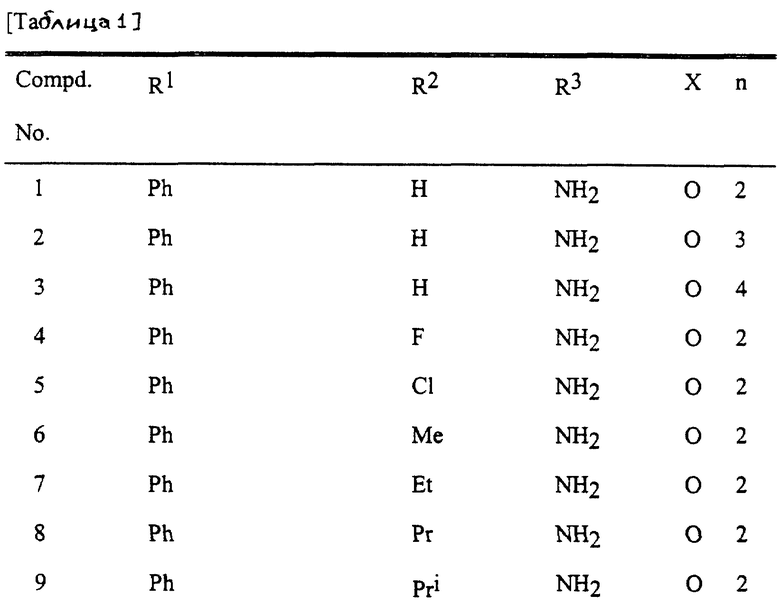
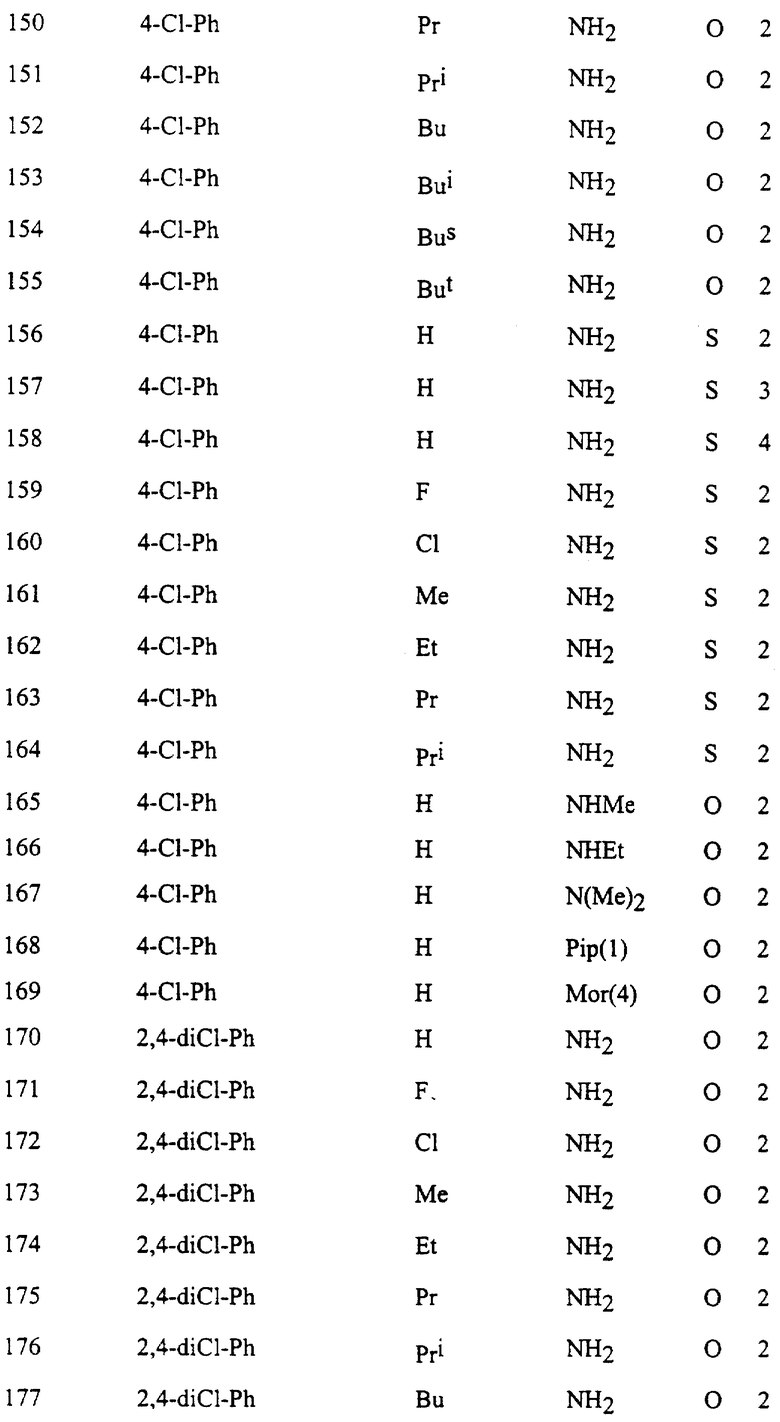
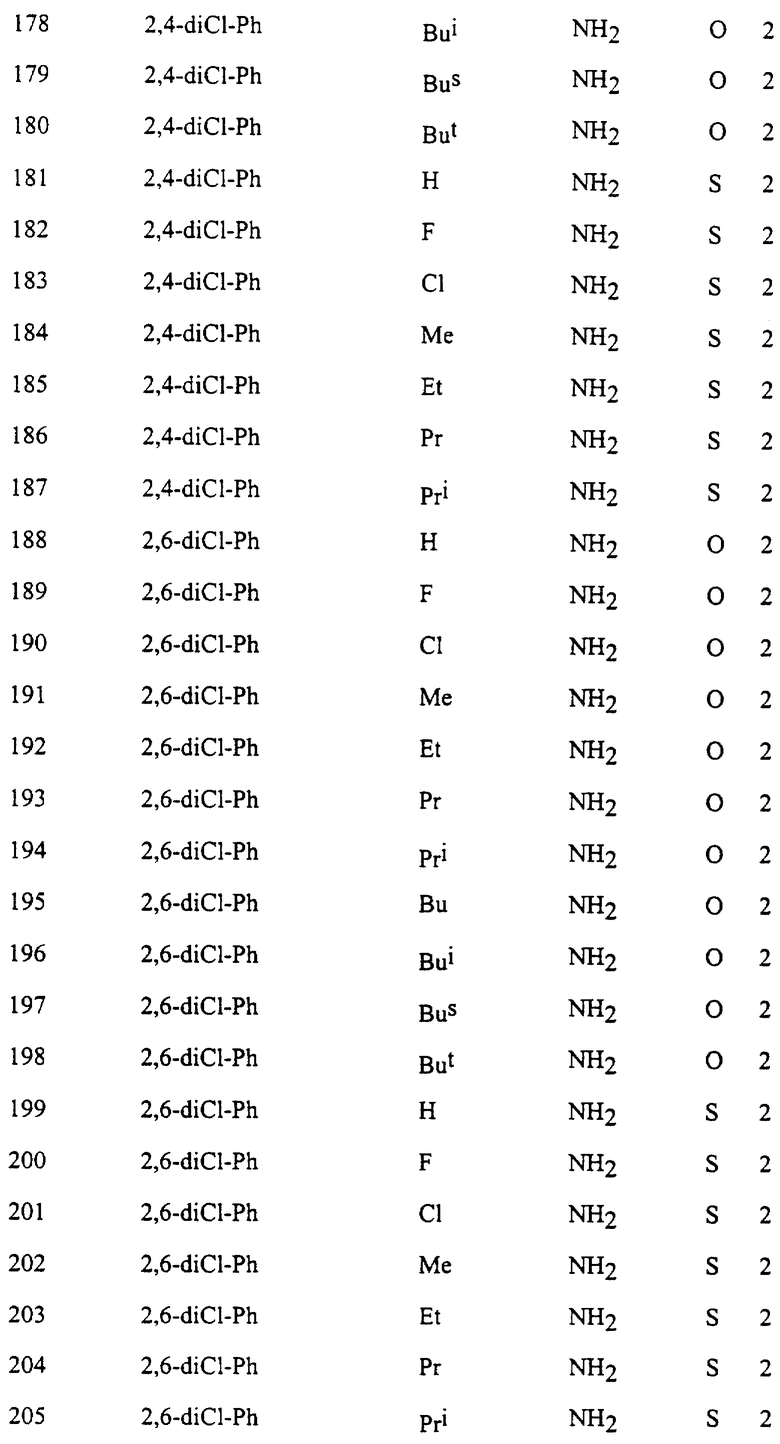
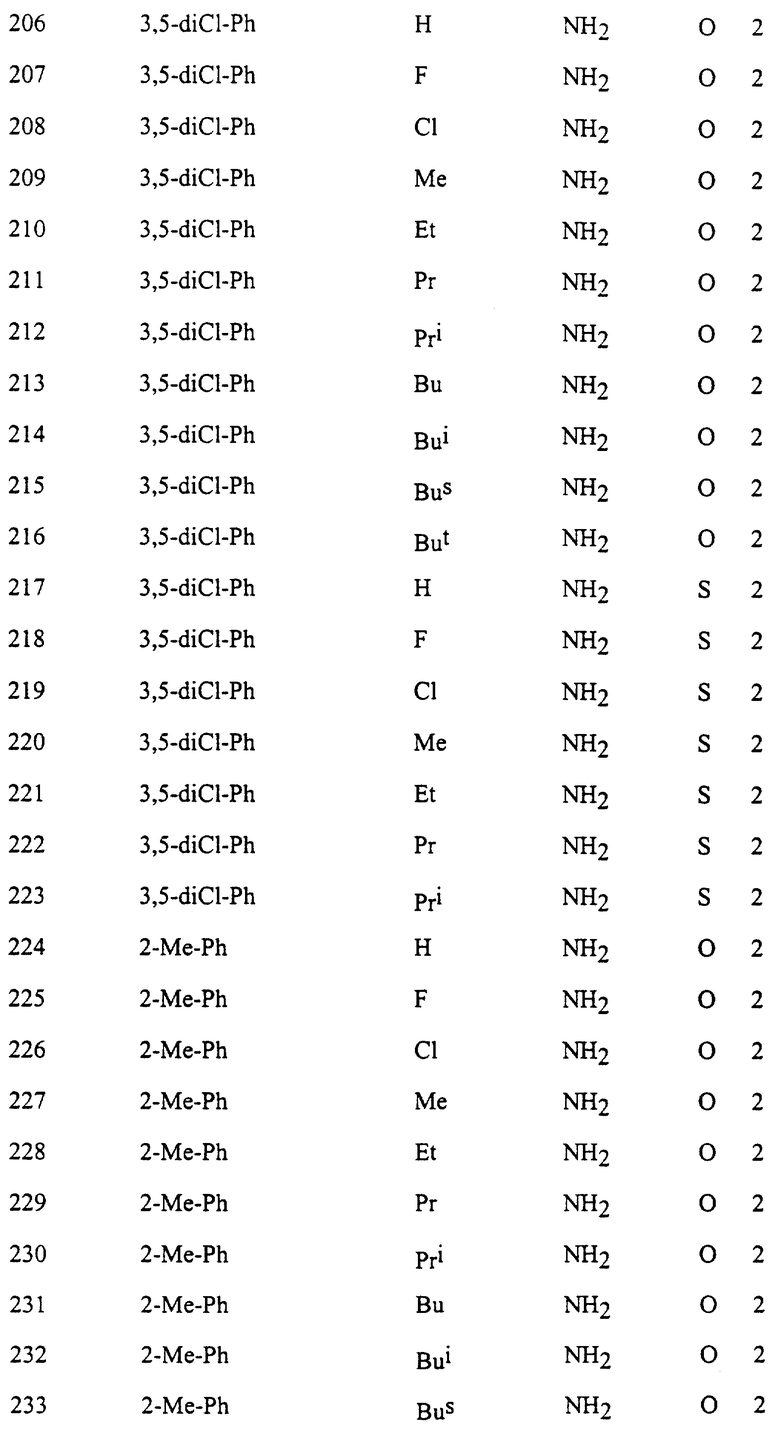
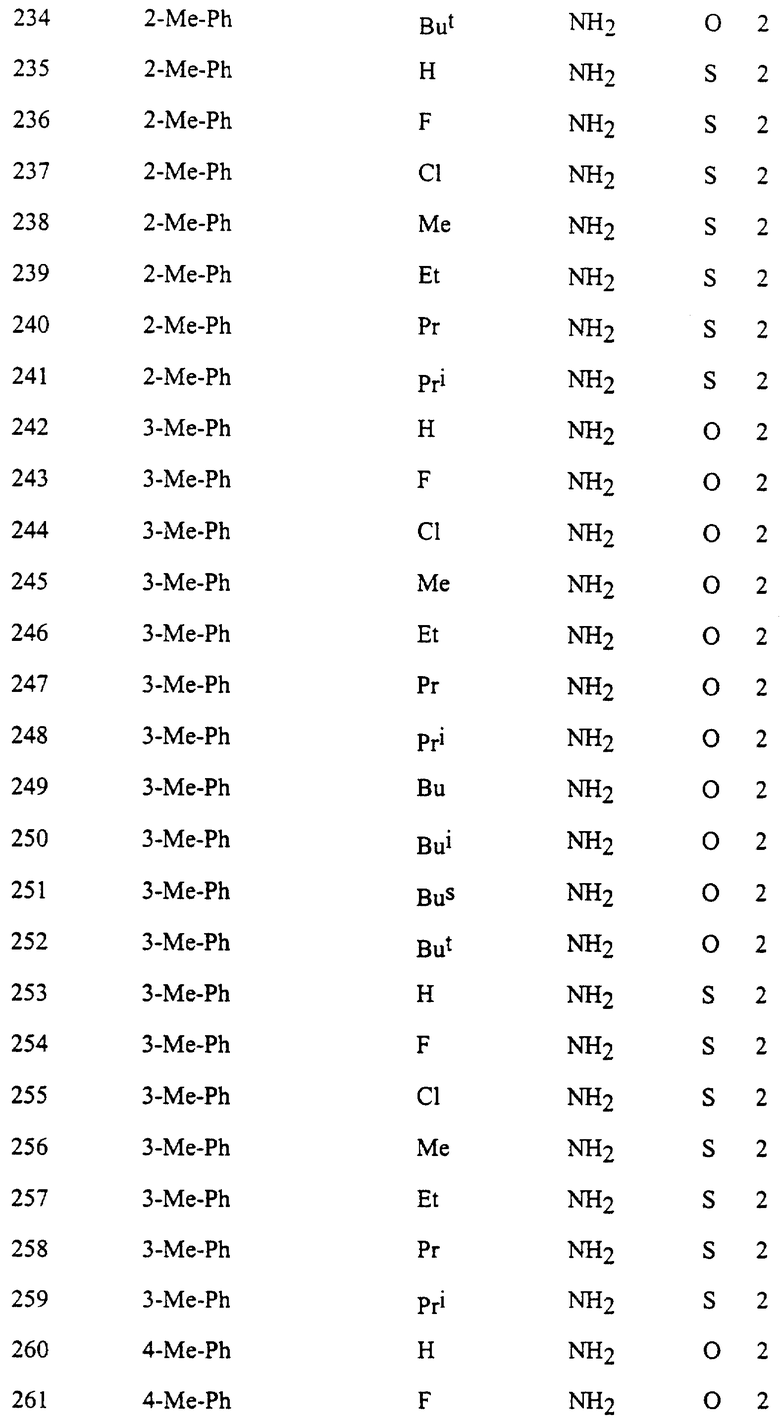
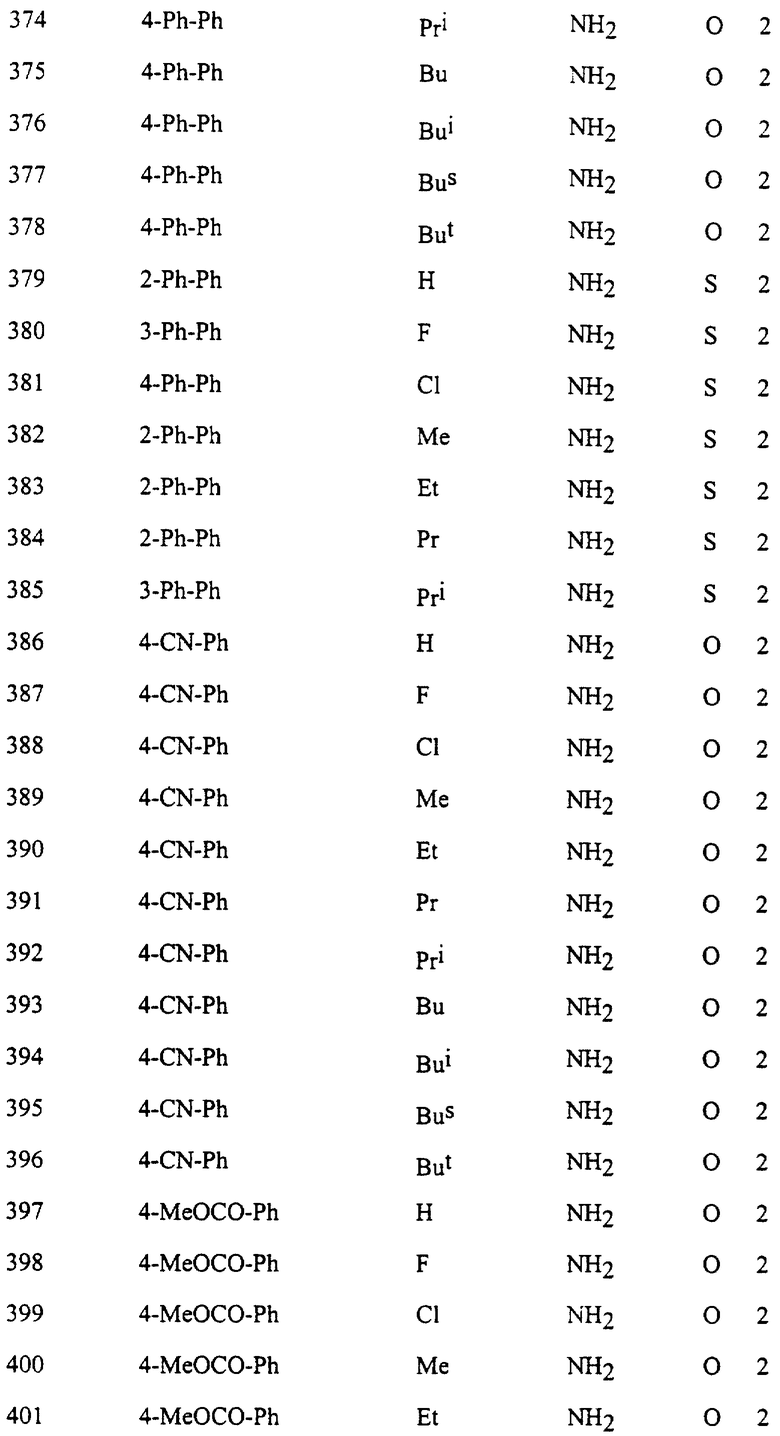
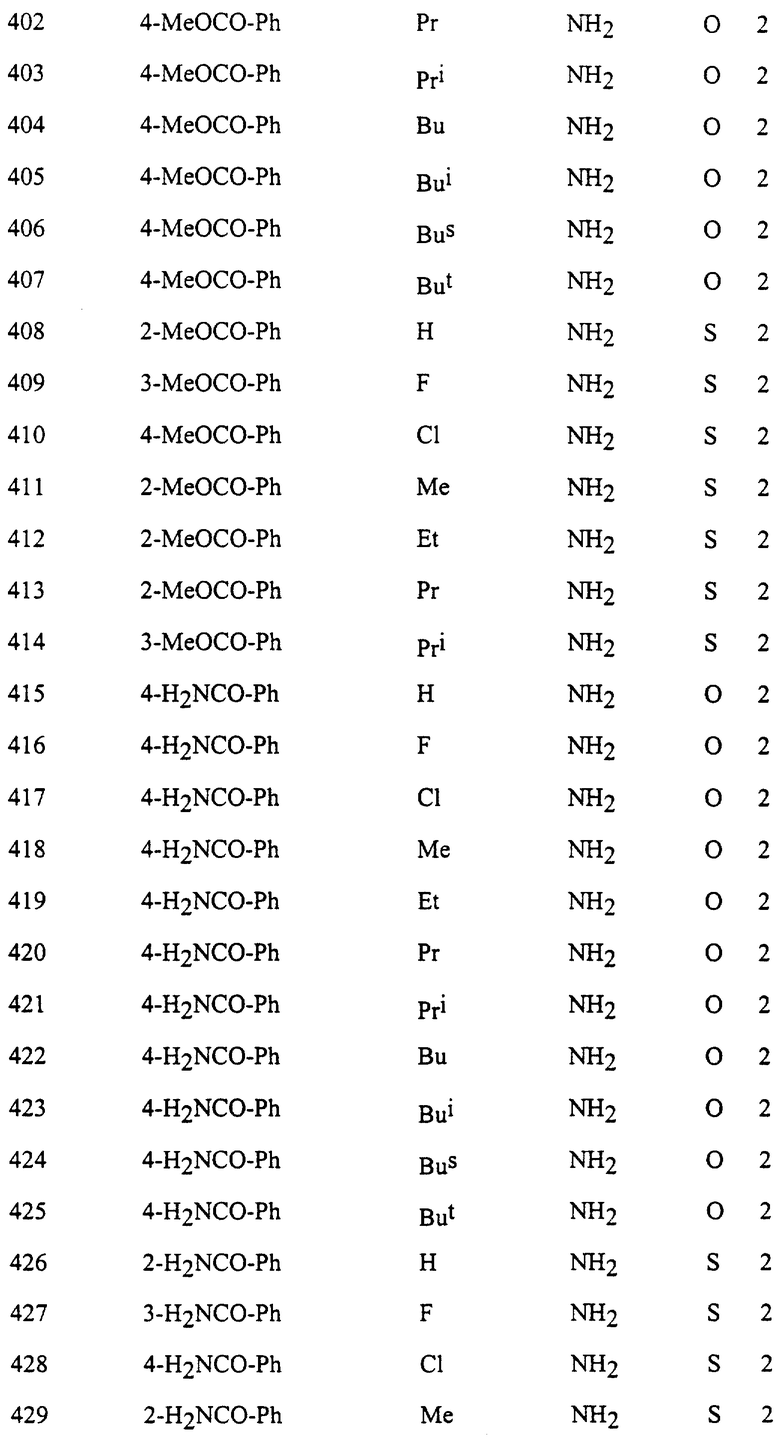
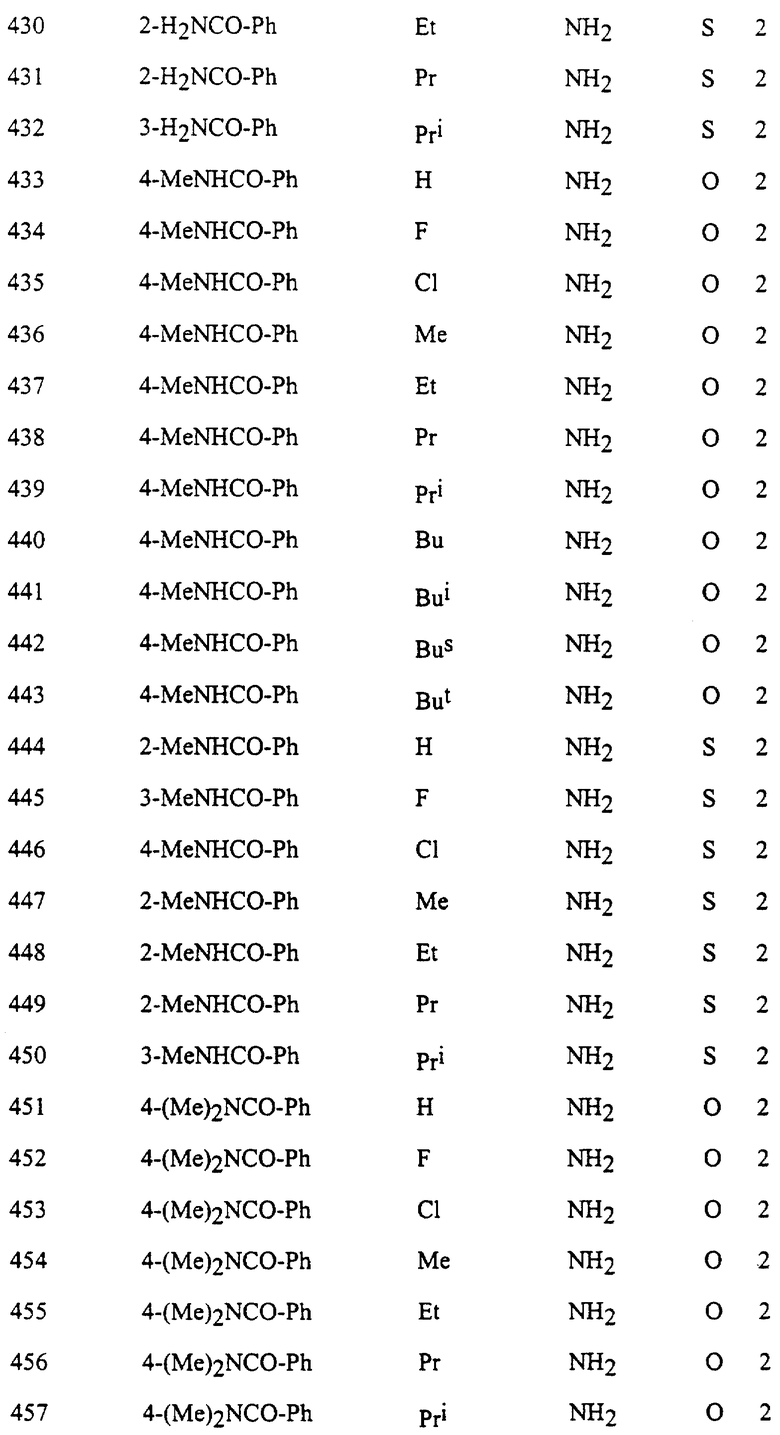
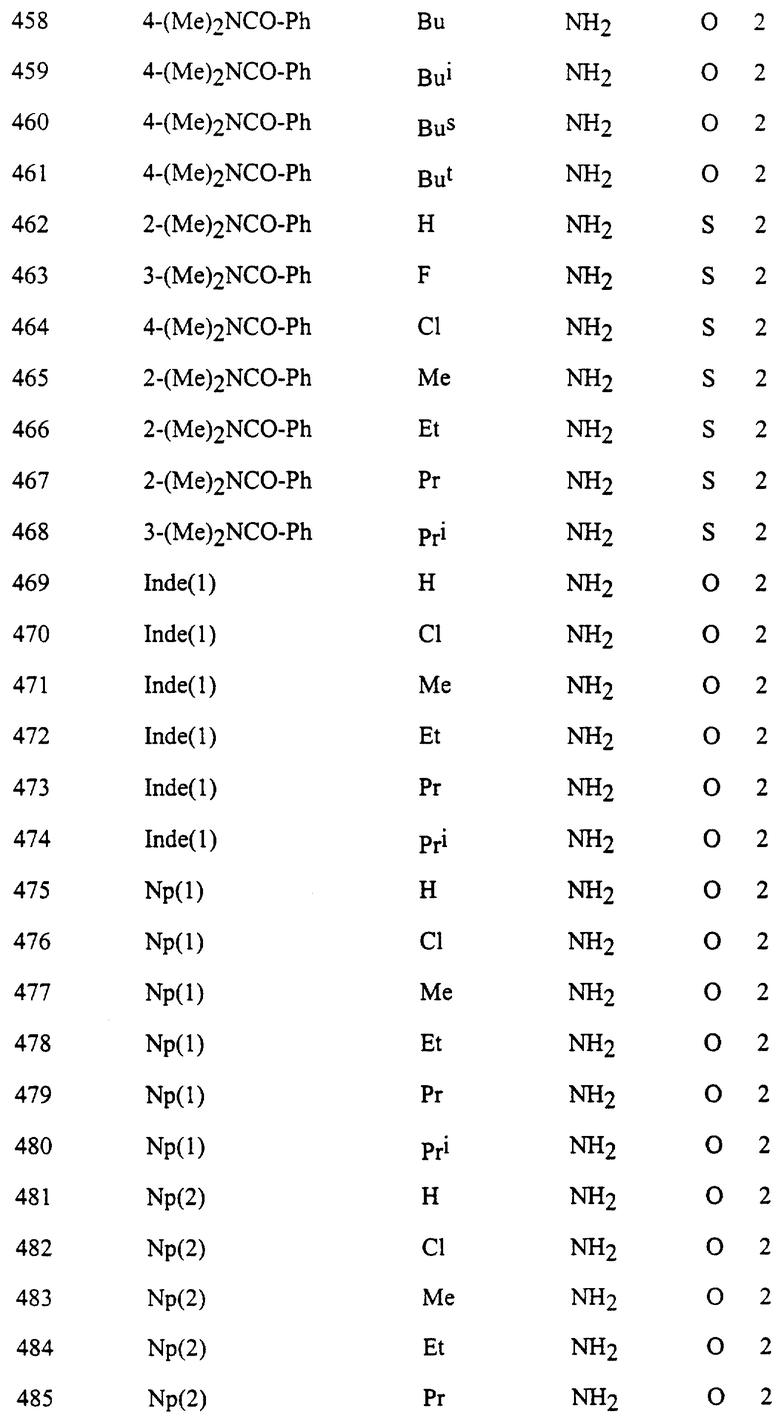
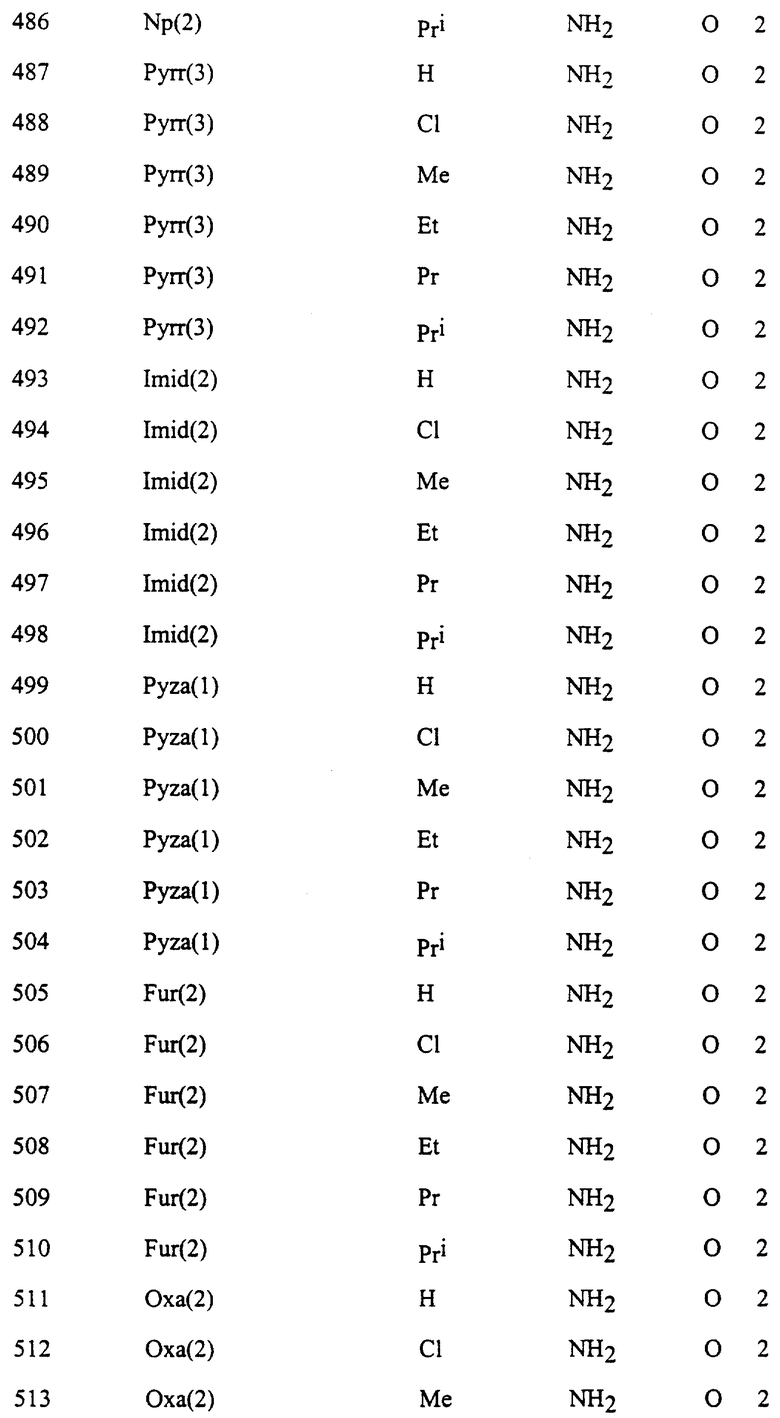
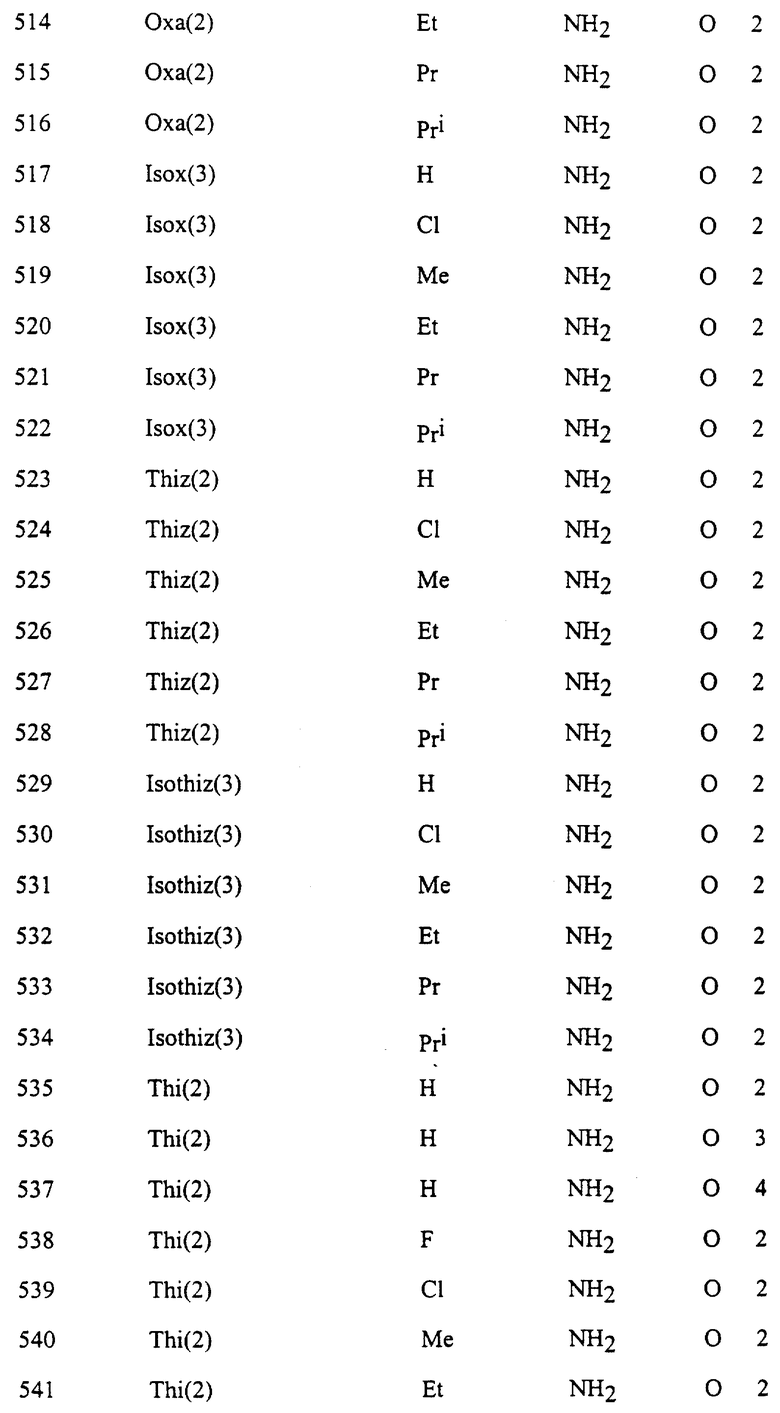
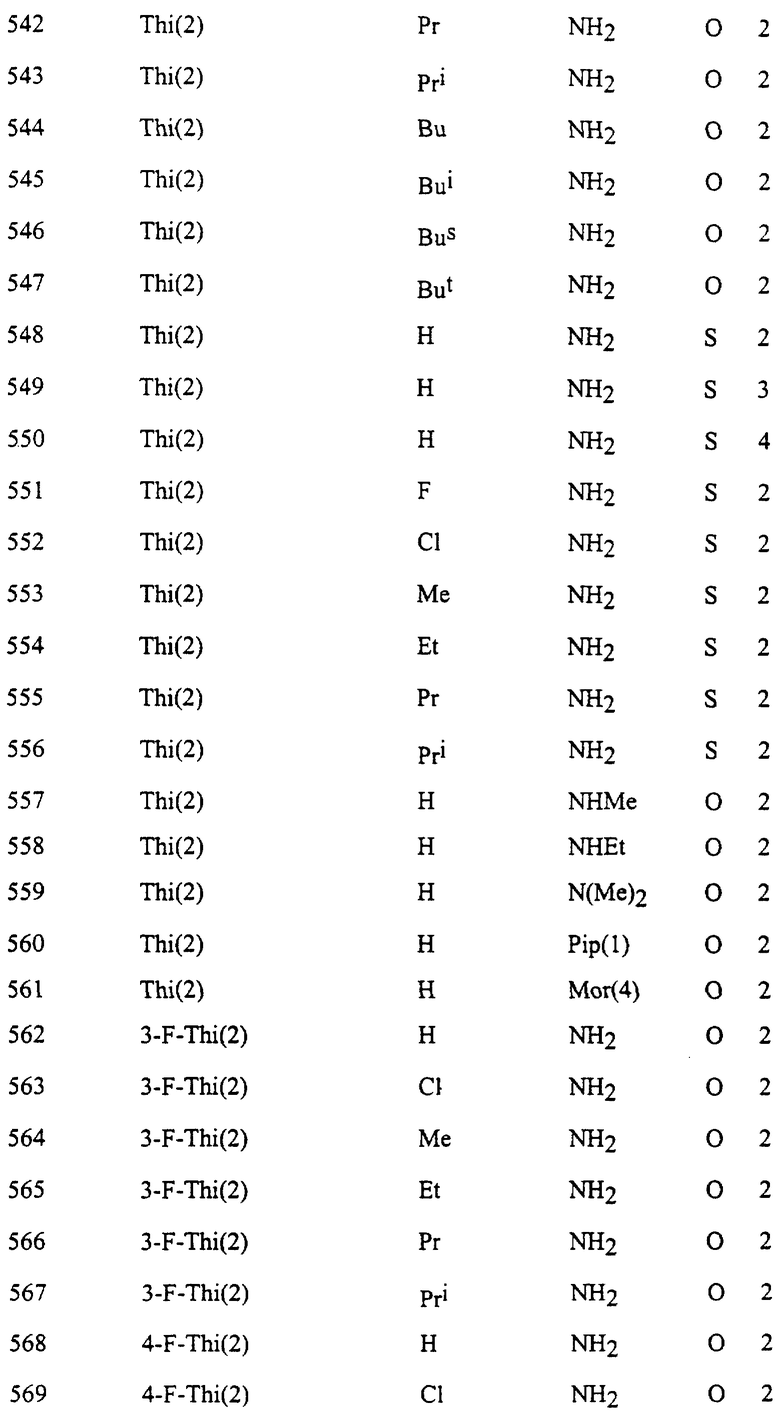
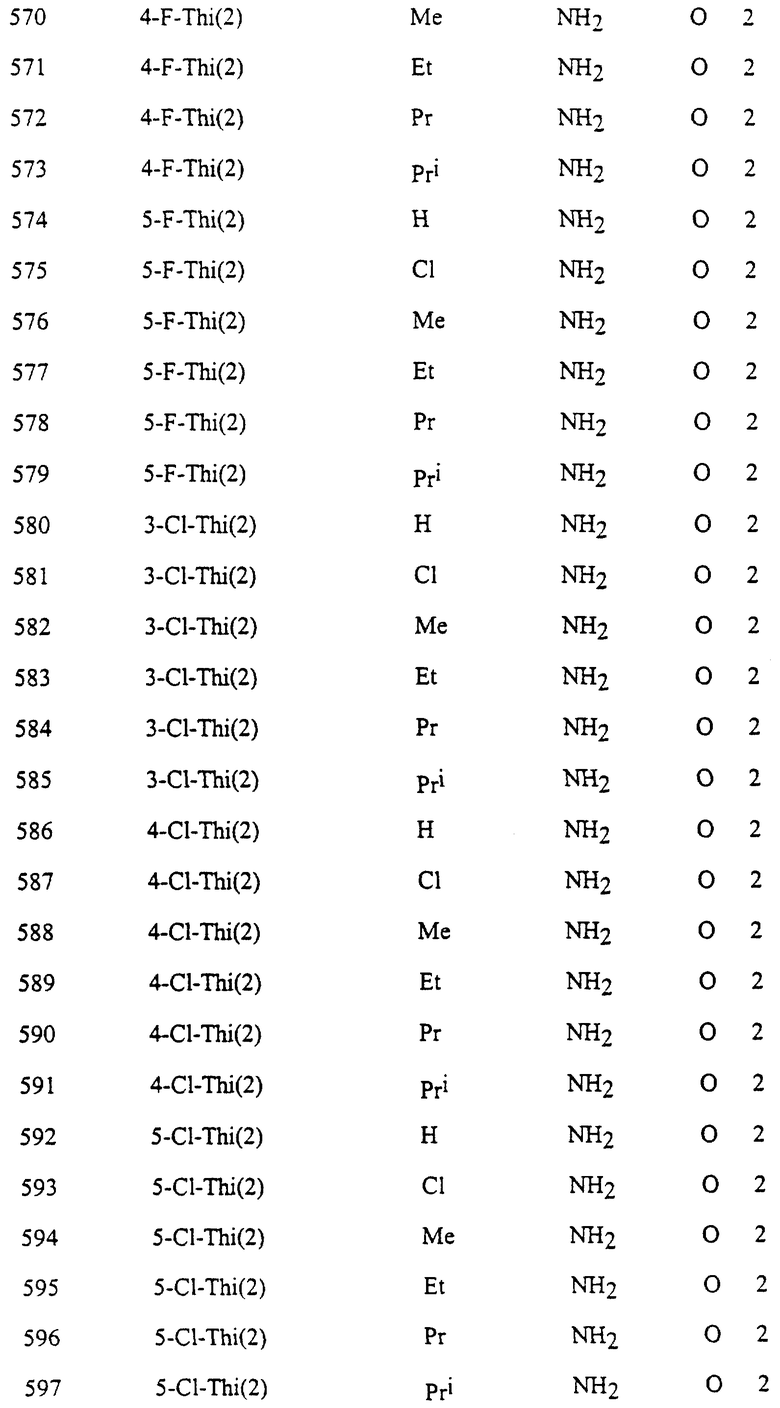
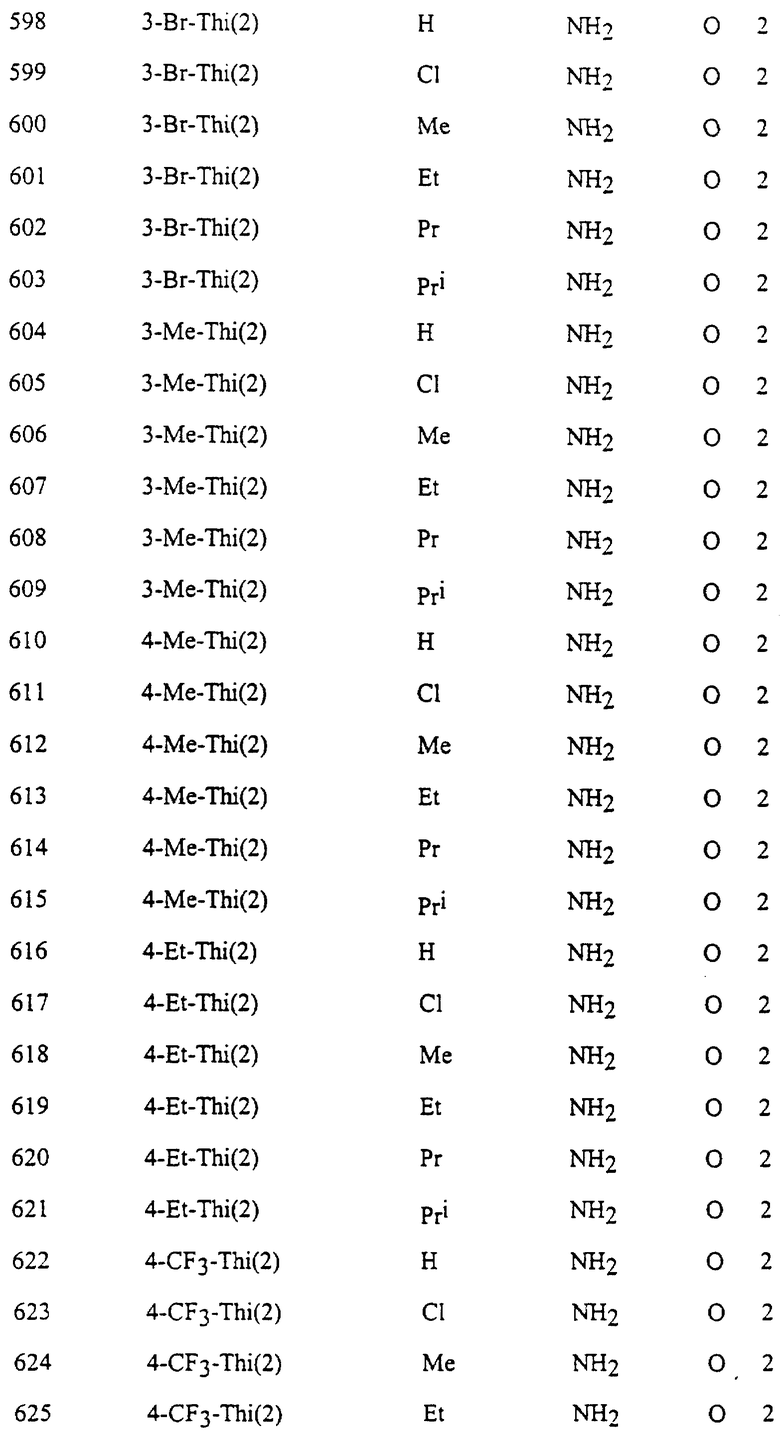
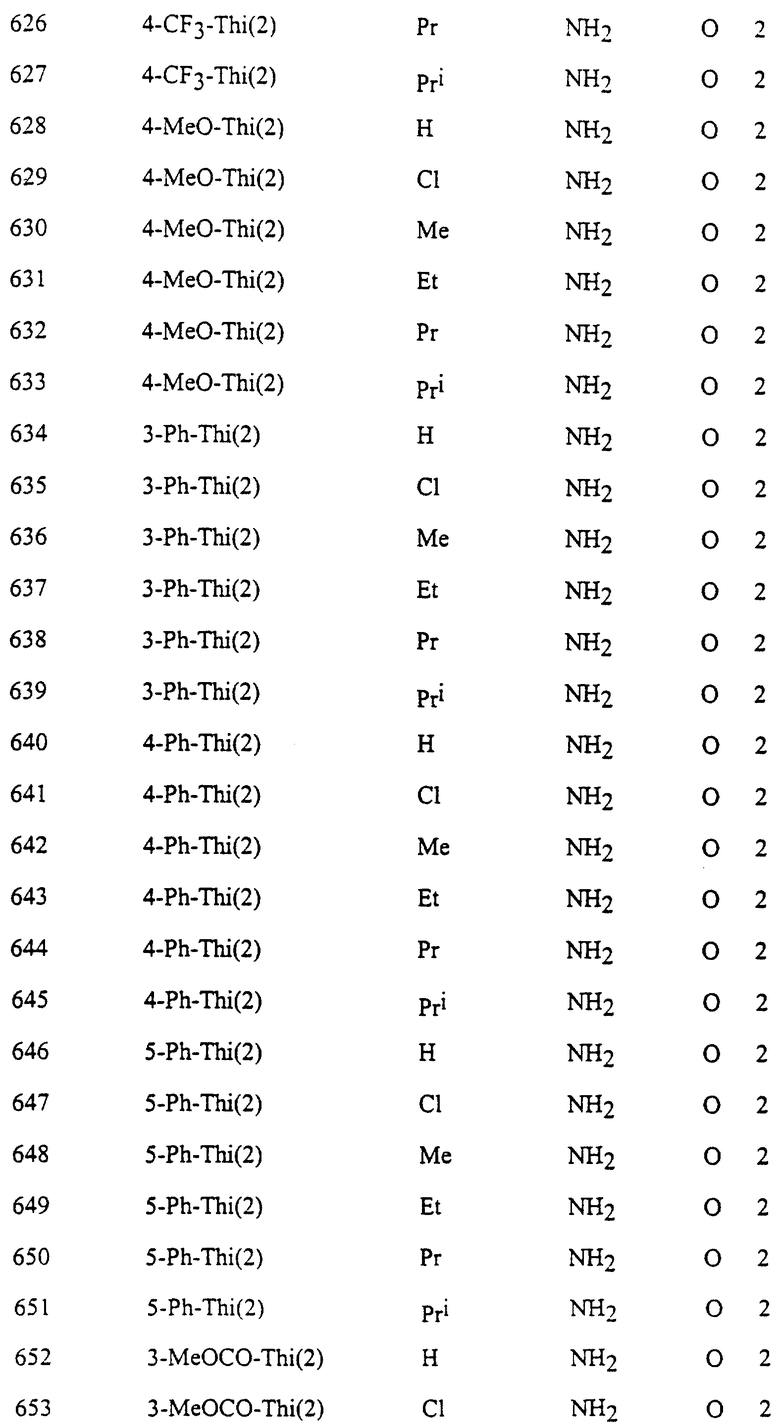
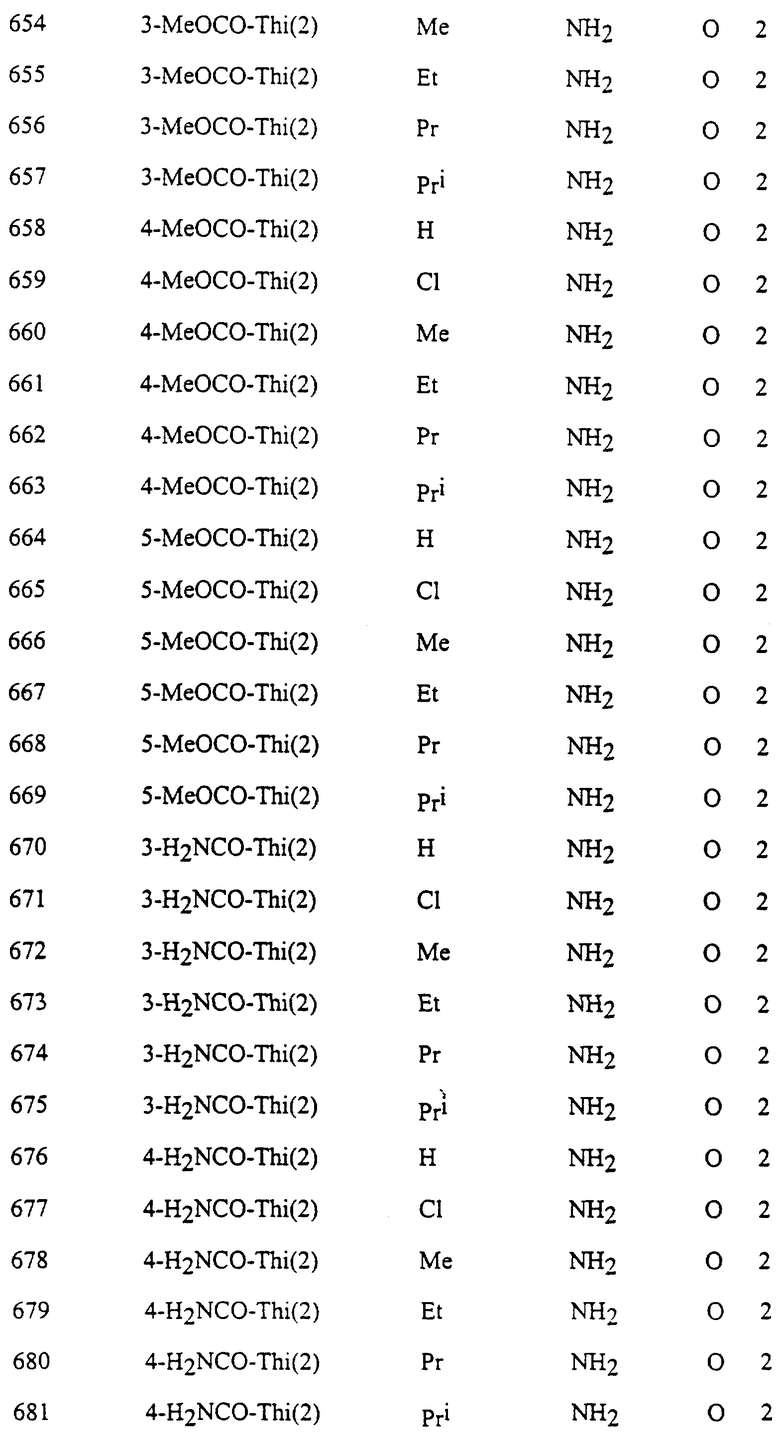

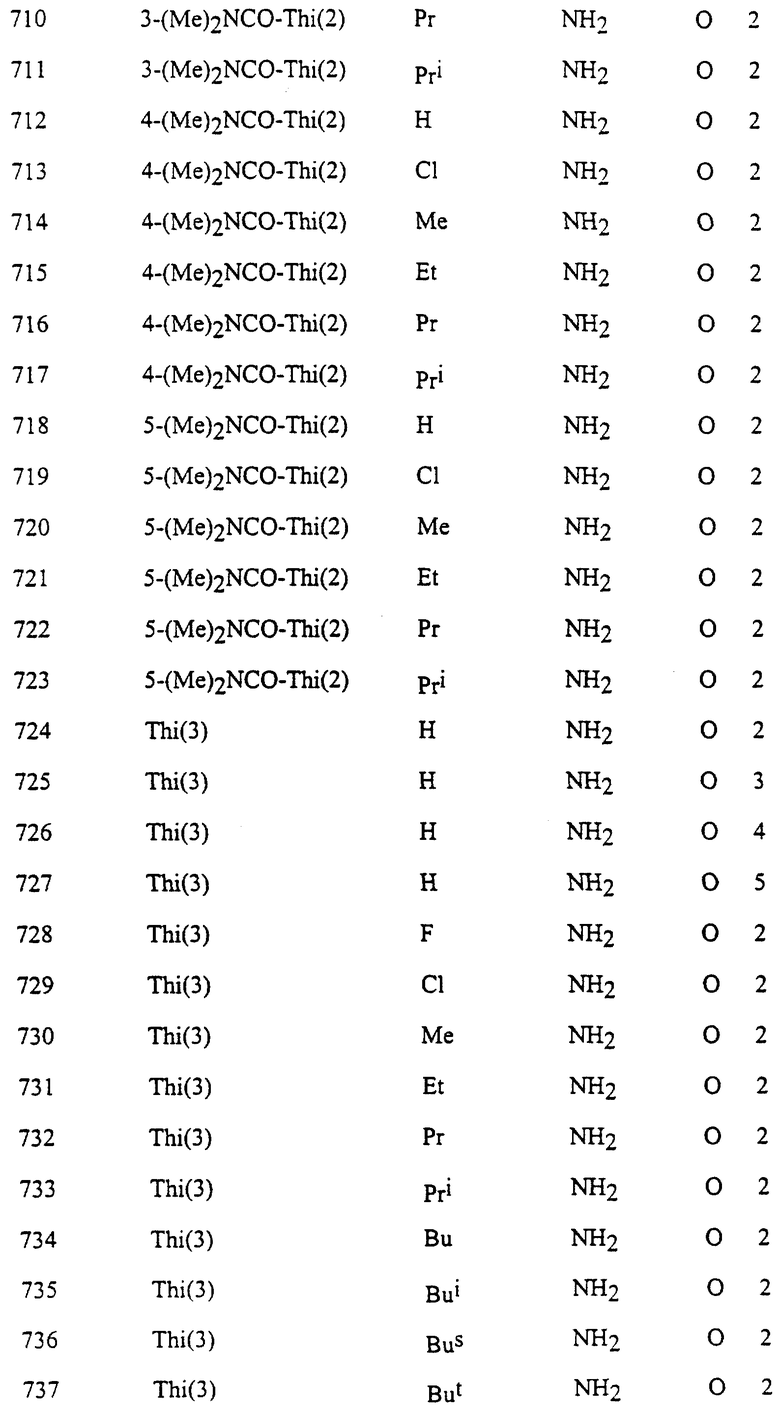









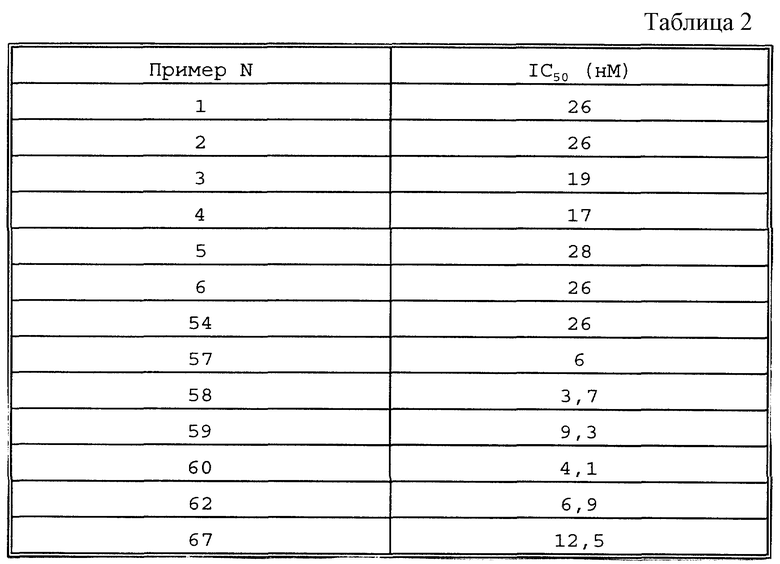
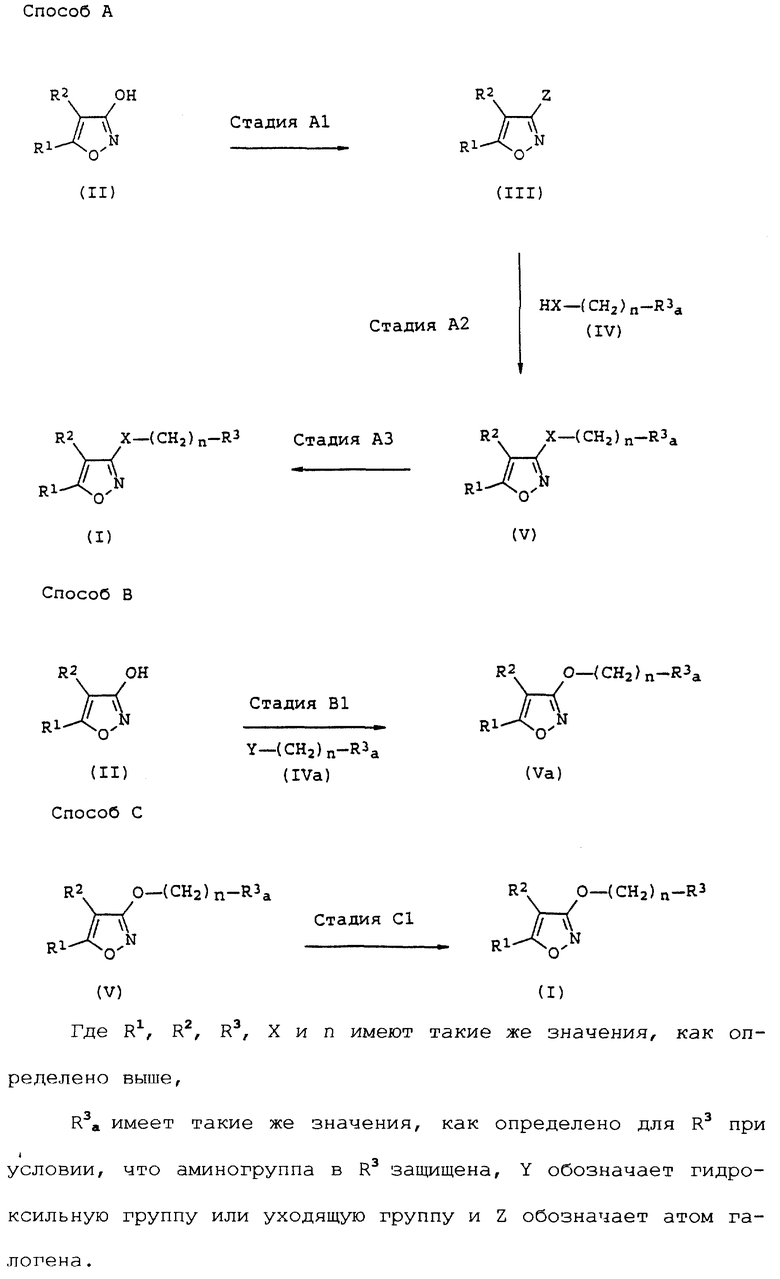
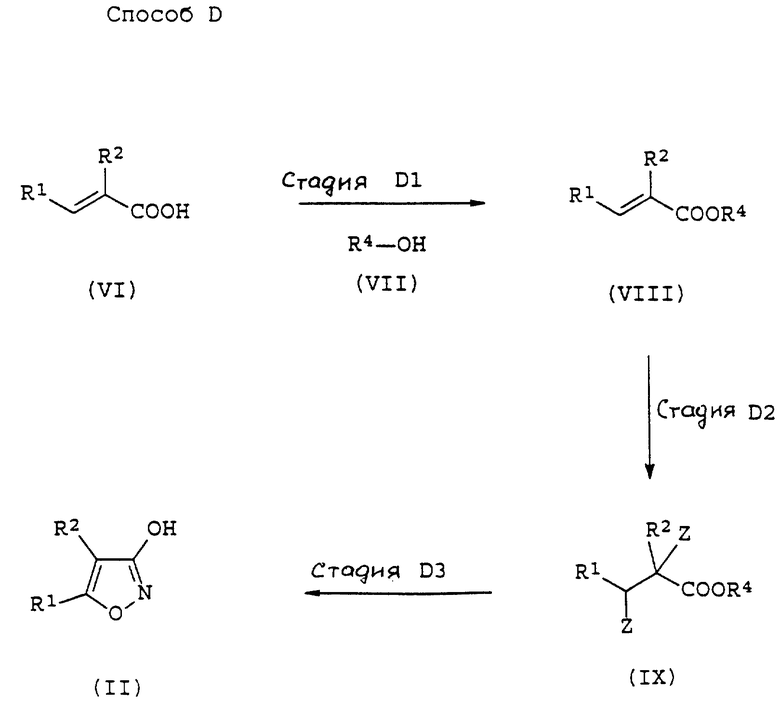

Изобретение относится к новым производным изоксазола общей формулы I, где R1 обозначает необязательно замещенную С6-С14арилгруппу или 5-6-членную гетероциклическую группу, имеющую один гетероатом, выбранный из азота, кислорода, серы; R2 обозначает атом водорода, атом галогена, необязательно замещенную С1-С6алкильную группу, С2-С6алкенильную группу, С2-С6алкинильную группу, С3-С10циклоалкильную группу, С3-С10циклоалкенильную группу, цианогруппу, карбоксилгруппу, С1-С7алканоилгруппу, С2-С7алкоксикарбонильную группу или необязательно замещенную карбамоилгруппу; R3 обозначает необязательно замещенную аминогруппу или насыщенную 5-6-членную гетероциклическую группу, содержащую атом азота; Х обозначает атом кислорода или атом серы; n обозначает целое число от 2 до 6, и их фармацевтически приемлемые соли. Фармацевтическая композиция, обладающая ингибирующей активностью по отношению к моноаминоксидазе типа А, содержащая соединение формулы I или его фармацевтически приемлемую соль и фармацевтически приемлемый носитель. Технический результат - новые производные изоксазола. 2 с. и 26 з.п. ф-лы, 2 табл. 
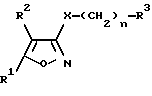
где R1 обозначает C6-C14 арильную группу, необязательно имеющую от 1 до 3 заместителей, которые могут быть одинаковыми или отличными друг от друга, и выбраны из следующей группы заместителей, или 5- или 6-членную ароматическую гетероциклическую группу, имеющую один гетероатом, выбранный из группы, включающей атомы азота, кислорода и серы (заместителем является галоген; C1-C6 алкил; C1-C6 алкил, замещенный галогеном; C1-C6 алкокси; фенил; фенокси; бензилокси; бензоиламино; нитро; гидроксил; C1-C7 алканоилокси, и (аминогруппа);
R2 обозначает водород; галоген; C1-C6 алкил; C1-C6 алкил, замещенный галогеном; C2-C6 алкенил; C2-C6 алкинил; C3-C10 циклоалкил; C3-C10 циклоалкенил; циано; карбоксил; C1-C7 алканоил; C2-C7 алкоксикарбонил; карбамоил; или моно(C1-C6 алкил)карбамоил;
R3 обозначает амино, моно(C1-C6 алкил)амино, ди(C1-C6 алкил)амино, моно-C1-C7 алканоиламино, моно-C2-C7 алкоксикарбониламино, моно-C7-C15 арилкарбониламино, или 5- или 6-членную насыщенную гетероциклическую группу (присоединенную через атом азота кольца), которая содержит один атом азота и необязательно содержит еще один атом азота или атом кислорода;
Х обозначает атом кислорода или атом серы;
n обозначает целое число от 2 до 6,
или его фармацевтически приемлемые соли.
3-(2-аминоэтокси)-5-фенилизоксазол,
3-(2-аминоэтокси)-4-хлор-5-фенилизоксазол,
3-(2-аминоэтокси)-4-этил-5-фенилизоксазол,
3-(2-аминоэтокси)-5-фенил-4-пропилизоксазол,
3-(2-аминоэтокси)-4-изопропил-5-фенилизоксазол,
3-(2-аминоэтокси)-4-изобутил-5-фенилизоксазол,
3-(2-аминоэтокси)-5-(2-хлорфенил)-4-изопропилизоксазол,
3-(2-аминоэтокси)-5-(4-хлорфенил)изоксазол,
3-(2-аминоэтокси)-5-(4-хлорфенил)-4-изопропилизоксазол,
3-(2-аминоэтокси)-5-(2,4-дихлорфенил)-4-изопропилизоксазол,
3-(2-аминоэтокси)-5-(2-фурил)-4-изопропилизоксазол,
3-(2-аминоэтокси)-5-(2-тиенил)изоксазол,
3-(2-аминоэтокси)-4-хлор-5-(2-тиенил)изоксазол,
3-(2-аминоэтокси)-4-изопропил-5-(2-тиенил)изоксазол и
4-аллил-3-(2-аминоэтокси)-5-фенилизоксазол
и их фармацевтически приемлемых солей.
| US 5321037 А, 14.06.1994 | |||
| US 5116839 А, 26.05.1992 | |||
| Способ получения производных изоксазола | 1981 |
|
SU1053750A3 |
Авторы
Даты
2001-04-20—Публикация
1997-02-27—Подача