Изобретение относится к гетероциклическому соединению, которое обладает превосходной иммуносупрессивной активностью, к его фармакологически приемлемой соли или к его фармакологически приемлемому пролекарству.
Уровень техники
В симптоматической терапии аутоиммунных и других заболеваний обычно применяли противовоспалительные лекарственные препараты, такие как стероиды, однако для лечения этих заболеваний необходима более эффективная радикальная терапия. Кроме того, были отмечены случаи патологических изменений в иммунной системе при сахарном диабете и нефрите (например, смотри непатентную литературу 1 и непатентную литературу 2). Тем не менее, до настоящего времени не было разработано лекарственного препарата, который бы препятствовал развитию патологических изменений в иммунной системе.
С другой стороны, существует потребность в разработке способа ослабления иммунных ответов не только для профилактики симптомов отторжения трансплантатов органов и клеточных трансплантатов, но также для профилактики и лечения различных аутоиммунных заболеваний. Тем не менее, до сих пор для уменьшения таких побочных эффектов широко применяют ранее известные иммунносупрессанты, такие как циклоспорин A (CsA), такролимус (TRL) и тому подобные известные ингибиторы печеночной и почечной токсичности, сопутствующее применение стероидов или тому подобное. В то же время, до сих пор отсутствует эффективное иммуносупрессивное действие, не вызывающее побочные эффекты.
На основании уровня техники были сделаны многочисленные попытки получения средства, которое обладает эффективной иммуносупрессивной активностью с низкой токсичностью. Далее приведены документы, в которых раскрыт уровень техники настоящего изобретения.
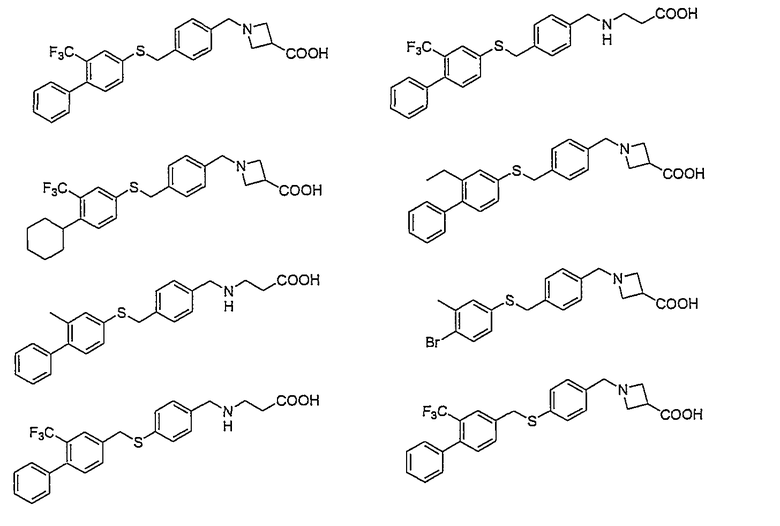
Например, следующие соединения, представленные ниже, описаны в патентной литературе 1.
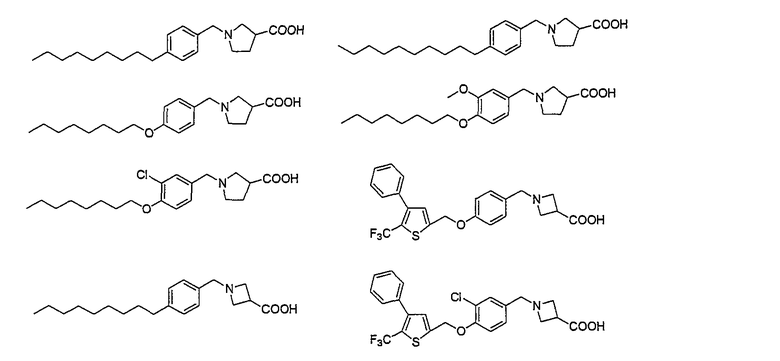
Например, следующие соединения, представленные ниже, описаны в патентной литературе 2.
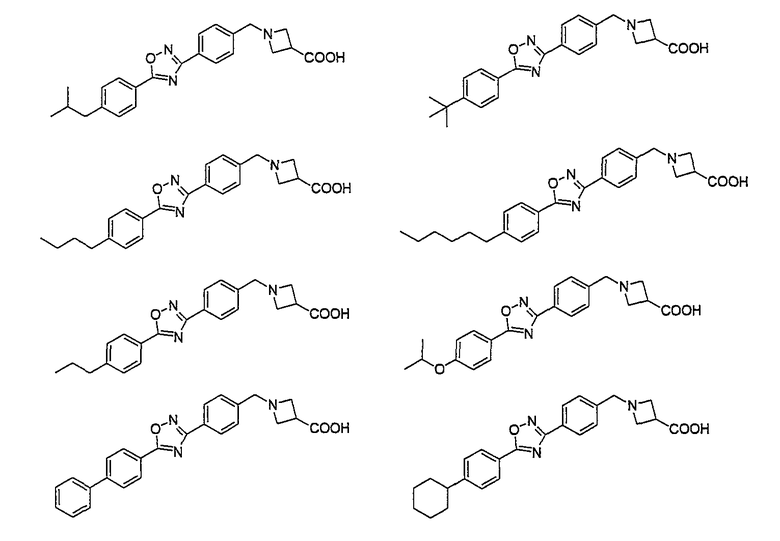

Например, следующие соединения, представленные ниже, описаны в патентной литературе 3.
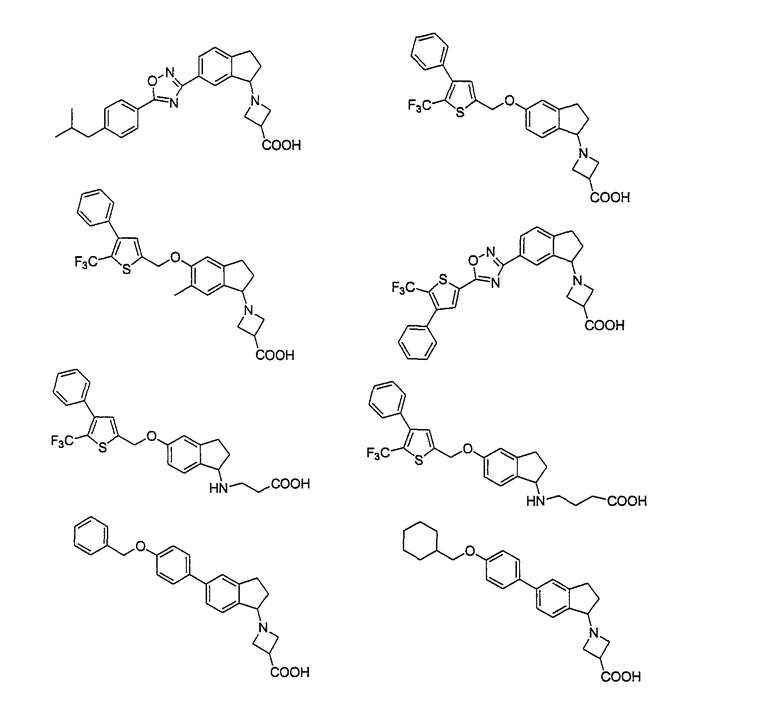
Например, следующие соединения, представленные ниже, описаны в патентной литературе 4.
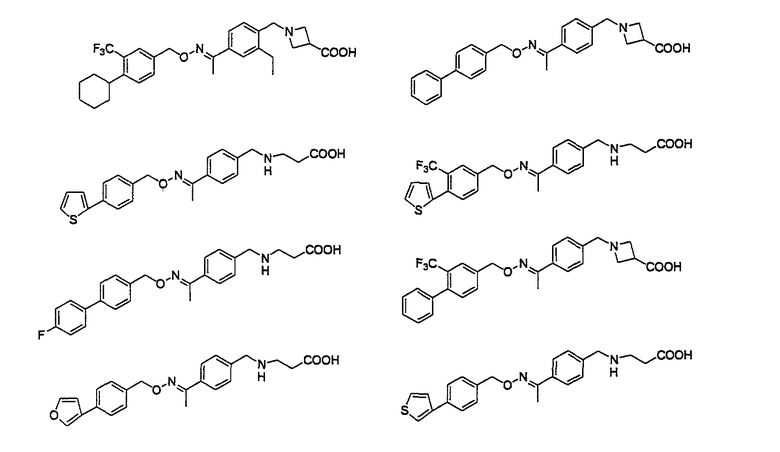
Например, следующие соединения, представленные ниже, описаны в патентной литературе 5.
Например, следующие соединения, представленные ниже, описаны в патентной литературе 6.
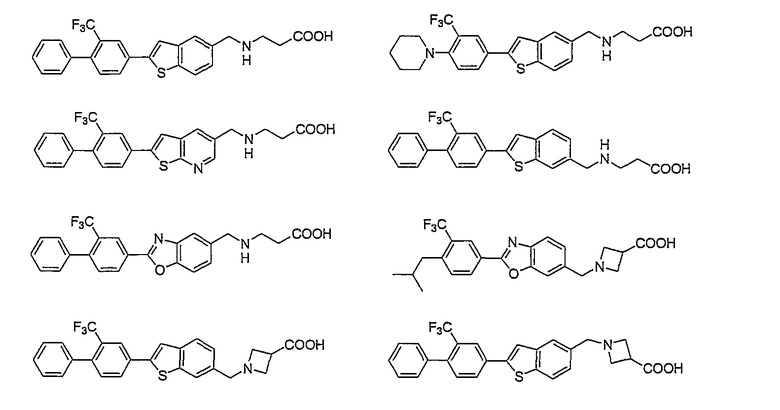
Тем не менее, химические структуры соединений, описанных в Патентной литературе 1 - 6, описанные выше, отличаются от структур соединений по настоящему изобретению.
[Патентная литература 1] номер международной публикации WO 03/062252 памфлет
[Патентная литература 2] номер международной публикации WO 03/105771 памфлет
[Патентная литература 3] номер международной публикации WO 2004/058149 памфлет
[Патентная литература 4] номер международной публикации WO 2004/103306 памфлет
[Патентная литература 5] номер международной публикации WO 2004/103309 памфлет
[Патентная литература 6] номер международной публикации WO 2005/000833 памфлет
[Непатентная литература 1] Kidney International, Vol. 51, 94 (1997)
[Непатентная литература 2] Journal of Immunology, Vol. 157, 4691 (1996)
Описание изобретения
Цель изобретения
В течение длительного времени, прилагая большие усилия, авторы настоящего изобретения исследовали различные новые соединения, которые могут обладать превосходной иммуносупрессивной активностью с низкой токсичностью. В результате, авторы настоящего изобретения обнаружили новые соединения, которые могут использоваться для лечения симптомов отторжения при трансплантации различных органов или при пересадке кожной ткани, и для лечения аутоиммунных заболеваний, таких как системная красная волчанка, хронический ревматоидный артрит, полимиозит, фиброз, миозит скелетных мышц, артрит, остеоартрит, дерматомиозит, склеродермия, болезнь Бехчета, болезнь Крона, язвенный колит, аутоиммунный гепатит, апластическая анемия, идиопатическая тромбоцитопеническая пурпура, аутоиммунная гемолитическая анемия, рассеянный склероз, аутоиммунный буллезный дерматоз, псориаз, васкулитный синдром, гранулематоз Вегенера, увеит, синдром Шегрена, идиопатическая интерстициальная пневмония, синдром Гудпасчера, саркоидоз, аллергический гранулематозный ангиит, бронхиальная астма, миокардит, кардиомиопатия, аортит синдром, постмиокардиальный инфаркт синдром, первичная легочная гипертензия, минимальных изменений при нефротическом синдроме, мембранозная нефропатия, мембранозно-пролиферативный гломерулонефрит, очаговый гломерулярный склероз, серповидный гломерулонефрит, миастения gravis, воспалительная нейропатия, атопический дерматит, хронический актинический дерматит, светочувствительность, пролежневая язва, хорея Сиденгама, склероз, наступление осложнений, вызванных диабетом у взрослых, осложнения, вызванные инсулинзависимым сахарным диабетом, осложнения, вызванные ювенильным сахарным диабетом, атеросклероз, гломерулярный нефрит, нефропатия IgA, тубулоинтерстициальный нефрит, первичный билиарный цирроз печени, первичный склерозный холангит, скоротечный гепатит, вирусный гепатит, GVHD, контактный дерматит, сепсис и тому подобное, или другие связанные с иммуннитетом заболевания, и, кроме того, инфекционных заболеваний, вызванных грибками, микоплазмой, вирусом и простейшими, для лечения сердечно-сосудистых заболеваний, таких как сердечная недостаточность, гипертрофия сердца, аритмия, грудная жаба, ишемическая болезнь сердца, артериальная эмболия, аневризма, варикоз и нарушение кровообращения, для лечения заболеваний центральной нервной системы, таких как болезнь Альцгеймера, деменция, болезнь, удар, инфаркт головного мозга, депрессия, депрессия и мания, хорея Хантингтона, эпилепсия, судороги, нарушение дефицита внимания и гиперактивность (ADHD), энцефалит, менингит, анорексия и булемия, и для лечения различных других заболеваний, таких как лимфоматоз, лейкемия, полиурия, частое мочеиспускание, диабетическая ретинопатия и тому подобное (особенно полезны при симптомах отторжения при трансплантации различных органов или при пересадке кожной ткани, и для лечения аутоиммунных заболеваний, таких как системная красная волчанка, хронический ревматоидный артрит, рассеянный склероз, атопический дерматит, и тому подобное), и таким образом авторами настоящего изобретения и было разработано настоящее изобретение.
Таким образом, объектом настоящего изобретения являются новые соединения, обладающие превосходной иммуносупрессивной активностью с низкой токсичностью, их фармакологически приемлемые соли и фармакологически приемлемые пролекарства.
Способ достижения цели
Авторы настоящего изобретения провели интенсивное исследование соединений, обладающих иммуносупрессивной активностью, и обнаружили, что соединения по настоящему изобретению, представленные общей формулой (I), их фармакологически приемлемые соли или фармакологически приемлемые пролекарства (далее в настоящем документе называемые “соединение по настоящему изобретению” в некоторых случаях) обладают превосходной иммуносупрессивной активностью с низкой токсичностью и могут быть использованы для профилактики или лечения заболеваний, описанных выше, и таким образом авторы настоящего изобретения создали настоящее изобретение.
Таким образом, настоящее изобретение подробно описано далее в настоящем документе.
Настоящее изобретение относится к
(1) соединению, представленному общей формулой (I), показанной ниже,
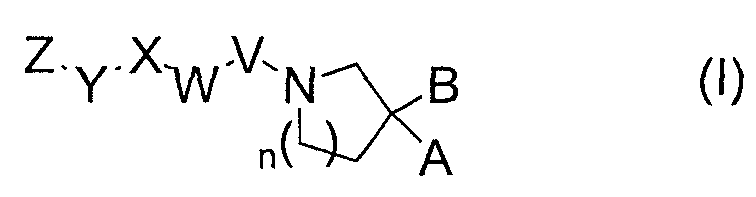
[где
A представляет собой карбоксильную группу, фосфогруппу, сульфогруппу или 1H-тетразол-5-ильную группу,
B представляет собой атом водорода или группу, выбранную из группы заместителей А,
n представляет собой целое число от 0 до 2,
V представляет собой метиленовую группу, которая необязательно может быть замещена заместителем(ями), выбранными из группы заместителей А или одинарной связи,
W представляет собой 5-7-членную гетероциклическую группу, которая необязательно может быть замещена от 1 до 3 заместителями, выбранными из группы заместителей А, в том случае, когда V представляет собой метиленовую группу, которая необязательно может быть замещена заместителем(ями), выбранными из группы заместителей А, при этом, в том случае, когда V представляет собой одинарную связь, W представляет собой конденсированную кольцевую гетероциклическую группу, которая необязательно может быть замещена от 1 до 3 заместителями, выбранными из группы заместителей А,
X представляет собой C1-C8 алкиленовую группу, которая необязательно может быть замещена от 1 до 5 заместителями, выбранными из группы заместителей А, C1-C8 алкиленовую группу, содержащую атом кислорода или атом серы в углеродной цепи, которая необязательно может быть замещена от 1 до 5 заместителями, выбранными из группы заместителей А, C6-C10 ариленовую группу, которая необязательно может быть замещена от 1 до 3 заместителями, выбранными из группы заместителей А, 5-7-членную гетероциклическую группу, которая необязательно может быть замещена от 1 до 3 заместителями, выбранными из группы заместителей А, или конденсированную кольцевую гетероциклическую группу, которая необязательно может быть замещена от 1 до 3 заместителями, выбранными из группы заместителей А,
Y представляет собой C6-C10 ариленовую группу, которая необязательно может быть замещена от 1 до 3 заместителями, выбранными из группы заместителей А, 5-7-членную гетероциклическую группу, которая необязательно может быть замещена от 1 до 3 заместителями, выбранными из группы заместителей А, или конденсированную кольцевую гетероциклическую группу, которая необязательно может быть замещена от 1 до 3 заместителями, выбранными из группы заместителей А,
Z представляет собой группу, выбранную из группы заместителей А, C1-C8 алкильную группу, которая необязательно может быть замещена от 1 до 5 заместителями, выбранными из группы заместителей А, C1-C8 алкильную группу, содержащую атом кислорода или атом серы в углеродной цепи, которая необязательно может быть замещена от 1 до 5 заместителями, выбранными из группы заместителей А, C3-C7 циклоалкильную группу, которая необязательно может быть замещена от 1 до 5 заместителями, выбранными из группы заместителей А, C6-C10 арильную группу, которая необязательно может быть замещена от 1 до 5 заместителями, выбранными из группы заместителей А, C6-C10 арилокси группу, которая необязательно может быть замещена от 1 до 5 заместителями, выбранными из группы заместителей А, C6-C10 арилтио группу, которая необязательно может быть замещена от 1 до 5 заместителями, выбранными из группы заместителей А, C6-C12 аралкильную группу, которая необязательно может быть замещена от 1 до 5 заместителями, выбранными из группы заместителей А, или C6-C10 арилкарбонильную группу, которая необязательно может быть замещена от 1 до 5 заместителями, выбранными из группы заместителей А,
группа заместителей A представляет собой группу, состоящую из атома галогена, C1-C6 алкильную группу, C3-C7 циклоалкильную группу, C6-C10 арильную группу, C6-C10 арилокси группу, C6-C12 аралкильную группу, галоген C1-C6 алкильную группу, C1-C6 алкокси группу, галоген C1-C6 алкокси группу, C1-C6 алкилтио группу, карбоксильную группу, C1-C6 алкилкарбокси группу, гидроксильную группу, C1-C6 алифатическую ацильную группу, амино группу, моно-C1-C6 алкиламино группу, ди-C1-C6 алкиламино группу, C1-C6 алифатическую ациламино группу, циано группу и нитро группу],
его фармакологически приемлемой соли или его фармакологически приемлемому пролекарству, и предпочтительно,
(2) соединению, описанному в (1), где B представляет собой атом водорода, или его фармакологически приемлемой соли,
(3) соединению, описанному в (1) или (2), где A представляет собой карбоксильную группу, или его фармакологически приемлемой соли,
(4) соединению, описанному в любом пункте, выбранному из (1)-(3), где n представляет собой целое число, равное 0, или его фармакологически приемлемой соли,
(5) соединению, описанному в любом пункте, выбранному из (1)-(4), где V представляет собой метиленовую группу и W представляет собой 5-7-членную гетероциклическую группу, которая необязательно может быть замещена от 1 до 3 заместителями, выбранными из группы заместителей А, или его фармакологически приемлемой соли,
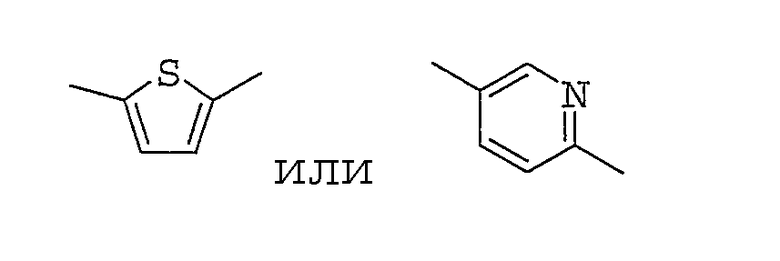
(6) соединению, описанному в (5), где 5-7-членная гетероциклическая группу представляет собой тиениленовую, фуриленовую, пирроленовую или пиридиленовую группу, или его фармакологически приемлемой соли,
(7) соединению, описанному в (5), где W представляет собой тиениленовую или пиридиленовую группу, которая необязательно может быть замещена 1-2 заместителями, выбранными из группы заместителей А, или его фармакологически приемлемой соли,
(8) соединению, описанному в (6), где тиениленовую или пиридиленовую группу, представляющую собой группу, показанную далее, соответственно, или его фармакологически приемлемой соли,
(9) соединению, описанному в любом пункте, выбранном из (1)-(4), где V представляет собой одинарную связь и W представляет собой конденсированную кольцевую гетероциклическую группу, которая необязательно может быть замещена от 1 до 3 заместителями, выбранными из группы заместителей А, или его фармакологически приемлемой соли,
(10) соединению, описанному в (9), где W представляет собой конденсированную кольцевую гетероциклическую группу или его фармакологически приемлемой соли,
(11) соединению, описанному в (10), где конденсированная кольцевая гетероциклическая группа представляет собой тетрагидробензофураниленовую, тетрагидробензотиениленовую или N-метилтетрагидроиндолиленовую группу, или его фармакологически приемлемой соли,
(12) соединению, описанному в (11), где в конденсированной кольцевой гетероциклической группе есть два положения, позволяющих осуществить присоединение по 2- и 4-положениям, или его фармакологически приемлемой соли,
(13) соединению, описанному в (12), где заместитель во 2-положении представляет собой группу формулы Z-Y-X-, или его фармакологически приемлемой соли,
(14) соединению, описанному в любом пункте, выбранном из (1)-(13), где X представляет собой C1-C8 алкиленовую группу, C1-C8 алкиленовую группу, содержащую атом кислорода или атом серы в углеродной цепи, C6-C10 ариленовую группу, 5-7-членную гетероциклическую группу или конденсированную кольцевую гетероциклическую группу, или его фармакологически приемлемой соли,
(15) соединению, описанному в любом пункте, выбранном из (1)-(13), где X представляет собой 5-7-членную гетероциклическую группу, или его фармакологически приемлемой соли,
(16) соединению, описанному в любом пункте, выбранном из (1)-(15), где Y представляет собой любую группу, выбранную из группы, состоящей из фениленовой группы, 5-7-членной гетероциклической группы, которая необязательно может быть замещена от 1 до 3 заместителями, выбранными из группы заместителей А, и конденсированную кольцевую гетероциклическую группу, которая необязательно может быть замещена от 1 до 3 заместителями, выбранными из группы заместителей А, или его фармакологически приемлемой соли,
(17) соединению, описанному в любом пункте, выбранном из (1)-(15), где Y представляет собой фениленовую группу, или тиениленовую, пиридиленовую или индолиленовую группу, которая необязательно может быть замещена от 1 до 3 заместителями, выбранными из группы заместителей А, или его фармакологически приемлемой соли,
(18) соединению, описанному в любом пункте, выбранном из (1)-(15), где Y представляет собой фенилен или пиридиленовую группу, или его фармакологически приемлемой соли,
(19) соединению, описанному в любом пункте, выбранном из (1)-(18), где Z представляет собой C6-C10 арилокси группу, которая необязательно может быть замещена от 1 до 5 заместителями, выбранными из группы заместителей А, или его фармакологически приемлемой соли, и
(20) соединению, описанному в любом пункте, выбранном из (1)-(18), где Z представляет собой фенокси группу, или его фармакологически приемлемой соли,
(21) соединению, описанному в (1), где общая формула (I) представлена общей формулой (I'), показанной ниже:
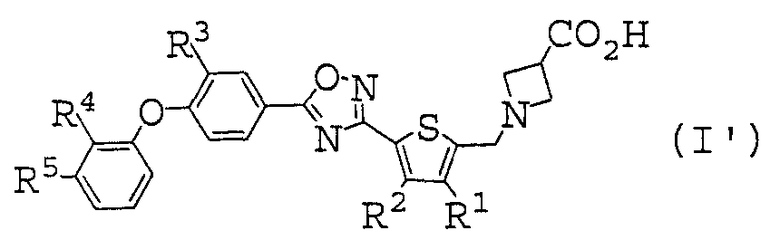
[где
R1 представляет собой атом водорода или C1-C6 алкильную группу,
R2 представляет собой атом водорода или C1-C6 алкильную группу,
R3 представляет собой атом водорода, атом галогена или C1-C6 алкильную группу,
R4 представляет собой атом водорода, атома галогена, циано группу, C1-C6 алкильную группу или C1-C6 алкокси группу, и
R5 представляет собой атом водорода или атом галогена], или его фармакологически приемлемая соль,
(22) соединение, описанное в (21), где R1 представляет собой атом водорода, или его фармакологически приемлемая соль,
(23) соединение, описанное в (21) или (22), где R2 представляет собой атом водорода, метильную группу, или этильную группу, или его фармакологически приемлемая соль,
(24) соединение, описанное в любом пункте, выбранном из (21) или (23), где R3 представляет собой атом водорода, атом фтора, атом хлора или метильную группу, или его фармакологически приемлемая соль,
(25) соединение, описанное в любом пункте, выбранном из (21) или (24), где R4 представляет собой атом водорода, атом фтора, атом хлора, циано группу, метильную группу или метокси группу, или его фармакологически приемлемая соль,
(26) соединение, описанное в любом пункте, выбранном из (21) или (25), где R5 представляет собой атом водорода или атом фтора, или его фармакологически приемлемая соль,
(27) соединение, описанное в (1), где общая формула (I) представлена общей формулой (I''), показанной далее:
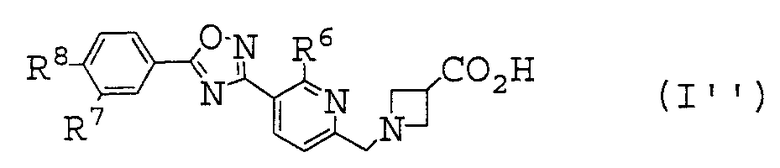
[где
R6 представляет собой атом водорода или C1-C6 алкильную группу,
R7 представляет собой атом водорода, атом галогена или C1-C6 алкильную группу, и
R8 представляет собой C1-C6 алкильную группу или C1-C6 алкокси группу], или его фармакологически приемлемая соль,
(28) соединение, описанное в (27), где R6 представляет собой атом водорода, метильную группу или этильную группу, или его фармакологически приемлемая соль,
(29) соединение, описанное в любом пункте, выбранном из (27) или (28), где R7 представляет собой атом водорода, атом фтора, атом хлора или метильную группу, или его фармакологически приемлемая соль,
(30) соединение, описанное в любом пункте, выбранном из (27)-(29), где R8 представляет собой н-пропильную группу, н-бутильную группу или изобутильную группу, или его фармакологически приемлемая соль.
(31) соединение, описанное в (1), где указанное соединение выбрано из следующих соединений, или его фармакологически приемлемая соль:
1-[(4-{5-[4-фенил-5-(трифторметил)-2-тиенил]-1,2,4-оксадиазол-3-ил}-2-фурил)метил]азетидин-3-карбоновая кислота,
1-({5-[5-(4-изобутилфенил)-1,2,4-оксадиазол-3-ил]-2-фурил}метил)азетидин-3-карбоновая кислота,
1-({5-[5-(4-циклогексилфенил)-1,2,4-оксадиазол-3-ил]-2-фурил}метил)азетидин-3-карбоновая кислота,
1-(2-{5-[4-фенил-5-(трифторметил)-2-тиенил]-1,2,4-оксадиазол-3-ил}-4,5,6,7-тетрагидро-1-бензофуран-4-ил)азетидин-3-карбоновая кислота,
1-({5-[5-(4-феноксифенил)-1,2,4-оксадиазол-3-ил]-2-тиенил}метил)азетидин-3-карбоновая кислота,
1-({4-[5-(4-бензоилфенил)-1,2,4-оксадиазол-3-ил]-2-тиенил}метил)азетидин-3-карбоновая кислота,
1-({4-[5-(4-бензилфенил)-1,2,4-оксадиазол-3-ил]-2-тиенил}метил)азетидин-3-карбоновая кислота,
1-({4-[5-(1-изобутил-1H-индол-5-ил)-1,2,4-оксадиазол-3-ил]-2-тиенил}метил)азетидин-3-карбоновая кислота,
1-({6-[5-(4-изобутилфенил)-1,2,4-оксадиазол-3-ил]пиридин-3-ил}метил)азетидин-3-карбоновая кислота и 1-({5-[5-(4-изобутилфенил)-1,2,4-оксадиазол-3-ил]пиридин-2-ил}метил)азетидин-3-карбоновая кислота,
(32) соединение, описанное в (1), где указанное соединение выбрано из следующих соединений, или его фармакологически приемлемая соль:
1-({5-[5-(4-феноксифенил)-1,2,4-оксадиазол-3-ил]-2-тиенил}метил)азетидин-3-карбоновая кислота,
1-({4-метил-5-[5-(4-феноксифенил)-1,2,4-оксадиазол-3-ил]-2-тиенил}метил)азетидин-3-карбоновая кислота,
1-({5-[5-(3-фтор-4-феноксифенил)-1,2,4-оксадиазол-3-ил]-4-метил-2-тиенил}метил)азетидин-3-карбоновая кислота,
1-({4-этил-5-[5-(4-феноксифенил)-1,2,4-оксадиазол-3-ил]-2-тиенил}метил)азетидин-3-карбоновая кислота,
1-[(4-этил-5-{5-[4-(3-фторфенокси)фенил]-1,2,4-оксадиазол-3-ил}-2-тиенил)метил]азетидин-3-карбоновая кислота,
1-({4-этил-5-[5-(3-фтор-4-феноксифенил)-1,2,4-оксадиазол-3-ил]-2-тиенил}метил)азетидин-3-карбоновая кислота,
1-[(4-этил-5-{5-[3-фтор-4-(3-фторфенокси)фенил]-1,2,4-оксадиазол-3-ил}-2-тиенил)метил]азетидин-3-карбоновая кислота,
1-[(4-этил-5-{5-[4-(2-метоксифенокси)фенил]-1,2,4-оксадиазол-3-ил}-2-тиенил)метил]азетидин-3-карбоновая кислота,
1-[(5-{5-[3-хлор-4-(3-фторфенокси)фенил]-1,2,4-оксадиазол-3-ил}-4-этил-2-тиенил)метил]азетидин-3-карбоновая кислота,
1-[(4-этил-5-{5-[4-(2-метоксифенокси)фенил]-1,2,4-оксадиазол-3-ил}-2-тиенил)метил]азетидин-3-карбоновая кислота,
1-[(4-этил-5-{5-[4-(2-фторфенокси)фенил]-1,2,4-оксадиазол-3-ил}-2-тиенил)метил]азетидин-3-карбоновая кислота,
1-[(5-{5-[4-(2,3-дифторфенокси)фенил]-1,2,4-оксадиазол-3-ил}-4-этил-2-тиенил)метил]азетидин-3-карбоновая кислота,
1-[(4-этил-5-{5-[3-фтор-4-(2-фторфенокси)фенил]-1,2,4-оксадиазол-3-ил}-2-тиенил)метил]азетидин-3-карбоновая кислота,
1-[(5-{5-[4-(2,3-дифторфенокси)-3-фторфенил]-1,2,4-оксадиазол-3-ил}-4-этил-2-тиенил)метил]азетидин-3-карбоновая кислота,
1-[(5-{5-[3-хлор-4-(2-фторфенокси)фенил]-1,2,4-оксадиазол-3-ил}-4-этил-2-тиенил)метил]азетидин-3-карбоновая кислота,
1-[(5-{5-[3-хлор-4-(2,3-дифторфенокси)фенил]-1,2,4-оксадиазол-3-ил}-4-этил-2-тиенил)метил]азетидин-3-карбоновая кислота,
1-[(5-{5-[4-(2-хлорфенокси)фенил]-1,2,4-оксадиазол-3-ил}-4-этил-2-тиенил)метил]азетидин-3-карбоновая кислота,
1-[(5-{5-[4-(2-хлорфенокси)-3-фторфенил]-1,2,4-оксадиазол-3-ил}-4-этил-2-тиенил)метил]азетидин-3-карбоновая кислота,
1-({3-метил-5-[5-(4-феноксифенил)-1,2,4-оксадиазол-3-ил]-2-тиенил}метил)азетидин-3-карбоновая кислота и
1-({3-этил-5-[5-(4-феноксифенил)-1,2,4-оксадиазол-3-ил]-2-тиенил}метил)азетидин-3-карбоновая кислота, и
(33) соединение, описанное в (1), где указанное соединение выбрано из следующих соединений, или его фармакологически приемлемая соль:
1-({5-[5-(4-изобутил-3-метилфенил)-1,2,4-оксадиазол-3-ил]пиридин-2-ил}метил)азетидин-3-карбоновая кислота,
1-({5-[5-(3-фтор-4-изобутилфенил)-1,2,4-оксадиазол-3-ил]пиридин-2-ил}метил)азетидин-3-карбоновая кислота,
1-({5-[5-(3-хлор-4-изобутилфенил)-1,2,4-оксадиазол-3-ил]пиридин-2-ил}метил)азетидин-3-карбоновая кислота,
1-({5-[5-(4-изобутил-3-метилфенил)-1,2,4-оксадиазол-3-ил]-6-метилпиридин-2-ил}метил)азетидин-3-карбоновая кислота,
1-({5-[5-(3-фтор-4-пропилфенил)-1,2,4-оксадиазол-3-ил]-6-метилпиридин-2-ил}метил)азетидин-3-карбоновая кислота,
1-({5-[5-(4-бутил-3-фторфенил)-1,2,4-оксадиазол-3-ил]-6-метилпиридин-2-ил}метил)азетидин-3-карбоновая кислота,
1-({5-[5-(3-фтор-4-изобутилфенил)-1,2,4-оксадиазол-3-ил]-6-метилпиридин-2-ил}метил)азетидин-3-карбоновая кислота,
1-({5-[5-(3-хлор-4-изобутилфенил)-1,2,4-оксадиазол-3-ил]-6-метилпиридин-2-ил}метил)азетидин-3-карбоновая кислота,
1-({6-этил-5-[5-(4-изобутил-3-метилфенил)-1,2,4-оксадиазол-3-ил]пиридин-2-ил}метил)азетидин-3-карбоновая кислота,
1-({6-этил-5-[5-(3-фтор-4-пропилфенил)-1,2,4-оксадиазол-3-ил]пиридин-2-ил}метил)азетидин-3-карбоновая кислота,
1-({5-[5-(4-бутил-3-фторфенил)-1,2,4-оксадиазол-3-ил]-6-этилпиридин-2-ил}метил)азетидин-3-карбоновая кислота,
1-({6-этил-5-[5-(3-фтор-4-изобутилфенил)-1,2,4-оксадиазол-3-ил]пиридин-2-ил}метил)азетидин-3-карбоновая кислота и
1-({5-[5-(3-хлор-4-изобутилфенил)-1,2,4-оксадиазол-3-ил]-6-этилпиридин-2-ил}метил)азетидин-3-карбоновая кислота.
Далее, настоящее изобретение касается
(34) лекарственной композиции, содержащей одно или два или более соединений, описанных в любом пункте, выбранном из (1) или (33), в качестве активного ингредиента, или его фармакологически приемлемая соль,
(35) лекарственной композиции, указанной в п.(34), которая может быть использована для подавления симптомов иммунологического ответа, сопровождающих пересадку кожной ткани или трансплантацию различных органов,
(36) лекарственной композиции, указанной в п.(34), которая может быть использована в способе профилактики или терапии аутоиммунных заболеваний,
(37) лекарственной композиции, указанной в п.(36), где указанное аутоиммунное заболевание представляет собой одно или два или более состояний, выбранных из группы, содержащей ревматоидный артрит, псориаз, атопический дерматит, рассеянный склероз, язвенный колит и болезнь Крона,
(38) способ подавления симптомов иммунологического ответа, сопровождающих пересадку кожной ткани или трансплантацию различных органов, который характеризуется введением эффективной дозы фармацевтической композиции, указанной в п.(34), млекопитающему,
(39) способ профилактики или терапии аутоиммунных заболеваний, который характеризуется введением эффективной дозы фармацевтической композиции, указанной в п.(34), млекопитающему, и
(40) способ профилактики или терапии, как указано в п.(39), где указанное аутоиммунное заболевание представляет собой одно или два или более состояний, выбранных из группы, содержащей ревматоидный артрит, псориаз, атопический дерматит, рассеянный склероз, язвенный колит и болезнь Крона.
Группа заместителей A, описанных выше, предпочтительно, представляет собой группу, содержащую атом галогена, C1-C6 алкильную группу, C3-C7 циклоалкильную группу, C6-C10 арильную группу, C6-C10 арилокси группу, C6-C12 аралкильную группу, галоген C1-C6 алкильную группу, C1-C6 алкокси группу, галоген C1-C6 алкокси группу и C1-C6 алкилтио группа.
“5-7-членная гетероциклическая группа” в определениях W, X, и Y в формуле выше представляет собой, например, 5- или 7-членную ароматическую гетероциклическую группу, содержащую один или несколько (например, от 1 до 3) гетероатомов, выбранных из атома азота, атома серы и атома кислорода, в дополнение к атомам углерода, которая имеет два положения, доступные для присоединения, и может представлять собой, в частности, тиениленовую, фуриленовую, пирролиленовую, имидазолиленовую, пиразолиленовую, тиазолиленовую, изотиазолиленовую, оксазолиленовую, изоксазолиленовую, пиридиленовую, пиразиниленовую, пиримидиниленовую, пиридазиниленовую, оксадиазолиленовую, тиадиазолиленовую или фуразаниленовую группу,
W, предпочтительно, представляет собой фуриленовую, тиениленовую, пирролиленовую или пиридиленовую группу,
X, предпочтительно, представляет собой изоксазолиленовую или оксадиазолиленовую группу, и
Y, предпочтительно, представляет собой фениленовую, пиридиленовую или тиениленовую группу.
“Конденсированная кольцевая гетероциклическая группа” в определениях W, X и Y в вышеприведенной формуле представляет собой заместитель, в котором “5-7-членная гетероциклическая группа”, описанная выше, представляет собой конденсированную с другой(ими) циклической(ими) группой(ами), и, в частности, 9-14-членную (предпочтительно, 9- или 10-членную) конденсированную многокольцевую ароматическую гетероциклическую группу, содержащую один или несколько гетероатомов (например, от 1 до 3 гетероатомов), выбранных из атома азота, атома серы и атома кислорода, в дополнение к атомам углерода, которая имеет два положения, доступных для присоединения, и, предпочтительно, представляет собой бициклическую, трициклическую или тетрациклическую группу, и, более предпочтительно, бициклическую группу, и может представлять собой, например, бензотиениленовую, бензофураниленовую, бензимидазолиленовую, бензоксазолиленовую, бензотиазолиленовую, бензизотиазолиленовую, нафто[2,3-b]тиофениленовую, изохинолиленовую, хинолиленовую, индолиленовую, хиноксалиниленовую, фенантридиниленовую, фенотиазиниленовую, феноксазиниленовую, фталазиниленовую, нафтиридиниленовую, хиназолиниленовую, циннолиниленовую, карбазолиленовую, β-карболиниленовую, акридиниленовую, феназиниленовую, фталимидоиленовую, (тиоксантенил)тетрагидрохинолиленовую, тетрагидроизохинолиленовую, тетрагидроиндолиленовую, тетрагидробензофураниленовую, тетрагидробензотиениленовую, 5,6-дигидро-4H-циклопента[b]фураниленовую, 5,6-дигидро-4H-циклопента[b]тиениленовую или 1,4,5,6-тетрагидроциклопента[b]пирролиленовую группу,
W, предпочтительно, представляет собой тетрагидробензофураниленовую, тетрагидробензотиениленовую, тетрагидроиндолиленовую, 5,6-дигидро-4H-циклопента[b]фураниленовую, 5,6-дигидро-4H-циклопента[b]тиениленовую или 1,4,5,6-тетрагидроциклопента[b]пирролиленовую группу, или тому подобное и
Y, предпочтительно, представляет собой индолиленовую группу.
“C1-C8 алкиленовая группа” в определении X в вышеприведенной формуле представляет собой прямую или разветвленную C1-C8 алкиленовую группу и может представлять собой, например, метиленовую, этиленовую, пропиленовую, бутиленовую, пентиленовую, гексиленовую, гептиленовую, октиленовую, изопропиленовую, втор-бутиленовую, трет-бутиленовую, 3,3-диметилпропиленовую или 4,4-диметилбутиленовую группу, или тому подобное, и, предпочтительно, представляет собой метиленовую, этиленовую, или пропиленовую группу.
“C1-C8 алкиленовая группа, содержащая атом кислорода или атом серы в углеродной цепи” в определении X в вышеприведенной формуле представляет собой, например, -(CH2)m1O(CH2)m2-, -(CH2)m1S(CH2)m2-, -(CH2)m1CO(CH2)m2-, -(CH2)m1SO(CH2)m2-, -(CH2)m1SO2(CH2)m2- или тому подобное (где m1 и m2 являются одинаковыми или различными, и, каждый, представляют собой целое число от 0 до 7, но сумма m1 и m2 представляет собой целое число от 0 до 7), и, предпочтительно, представляет собой -CH2OCH2-, -CH2SCH2-, -OCH2-, -SCH2-, -CH2O- или -CH2S- группу.
“C1-C8 алкильная группа” в определении Z в вышеприведенной формуле представляет собой прямую или разветвленную C1-C8 алкильную группу и может представлять собой, например, метильную, этильную, пропильную, бутильную, пентильную, гексильную, гептильную, октильную, изопропильную, втор-бутильную, трет-бутильную, 3,3-диметилпропильную или 4,4-диметилбутильную группу, или тому подобное, и, предпочтительно, представляет собой метиленовую, этиленовую или пропиленовую группу.
“C1-C8 алкильная группа, содержащая атом кислорода или атом серы в углеродной цепи” в определении Z в вышеприведенной формуле представляет собой, например, H(CH2)m1O(CH2)m2-, H(CH2)m1S(CH2)m2-, H(CH2)m1CO(CH2)m2-, H(CH2)m1SO(CH2)m2- или H(CH2)m1SO2(CH2)m2- (где m1 и m2 являются одинаковыми или различными, и, каждый, представляют собой целое число от 0 до 7, но сумма m1 и m2 представляет собой целое число от 0 до 7), и, предпочтительно, представляет собой метоксиметильную, метилтиометильную, метокси или метилтио группу.
“C3-C7 циклоалкильная группа” в определениях Z и группе заместителей A в вышеприведенной формуле представляет собой циклопропильную группу, циклобутильную группу, циклопентильную группу, циклогексильную группу или циклогептильную группа.
“C6-C10 ариленовая группа” в определениях X и Y в вышеприведенной формуле может представлять собой, например, фениленовую группу, индениленовую группу или нафтиленовую группу, и, предпочтительно, представляет собой фениленовую группа.
“C6-C10 арильная группа” в определениях Z и группе заместителей A в вышеприведенной формуле может представлять собой, например, фенильную группу, инденильную группу или нафтильную группу, и, предпочтительно, представляет собой фенильную группу.
“C6-C10 арилокси группа” в определениях Z и группе заместителей A в вышеприведенной формуле может представлять собой, например, фенилокси группу, инденилокси группу или нафтилокси группу, и, предпочтительно, представляет собой фенилокси группу.
“C6-C10 арилтио группа” в определении Z в вышеприведенной формуле может представлять собой, например, фенилтио группу, инденилтио группу или нафтилтио группу, и, предпочтительно, представляет собой фенилтио группу.
“C6-C10 аралкильная группа” в определении Z в вышеприведенной формуле может представлять собой, например, бензильную группу, инденилметильную группу или нафтилметильную группу, и, предпочтительно, представляет собой бензильную группу.
“C6-C10 арилкарбонильная группа” в определении Z в вышеприведенной формуле может представлять собой, например, бензоильную группу, инденилкарбонильную группу или нафтилкарбонильную группу, и, предпочтительно, представляет собой бензоильную группу.
“Атом галогена” в определении группы заместителей A в вышеприведенной формуле представляет собой атом фтора, атом хлора, атом брома или атом йода.
“C1-C6 алкильная группа” в определении группы заместителей A в вышеприведенной формуле может представлять собой, например, метильную группу, этильную группу, пропильную группу, изопропильную группу, бутильную группу, изобутильную группу, втор-бутильную группу, трет-бутильную группу, пентильную группу, изопентильную группу или гексильную группу, и, предпочтительно, представляет собой метильную группу, этильную группу, пропильную группу, изопропильную группу или изобутильную группу.
“Галоген C1-C6 алкильная группа” в определении группы заместителей A в вышеприведенной формуле представляет собой группу, где C1-C6 алкильная группа, описанная выше, замещена настолько, насколько возможно атомом галогена, и может представлять собой, например, фторметильную группу, дифторметильную группу, трифторметильную группу, фторэтильную группу, дифторэтильную группу, трифторэтильную группу, фторпропильную группу, дифторпропильную группу, трифторпропильную группу, фторбутильную группу, дифторбутильную группу, трифторбутильную группу, фторпентильную группу, дифторпентильную группу, трифторпентильную группу, фторгексильную группу, дифторгексильную группу, трифторгексильную группу, пентафторэтильную группу, гексафторпропильную группу, нонафторбутильную группу, хлорметильную группу, дихлорметильную группу, трихлорметильную группу, хлорэтильную группу, дихлорэтильную группу, трихлорэтильную группу, хлорпропильную группу, дихлорпропильную группу, трихлорпропильную группу, хлорбутильную группу, дихлорбутильную группу, трихлорбутильную группу, хлорпентильную группу, дихлорпентильную группу, трихлорпентильную группу, хлоргексильную группу, дихлоргексильную группу, трихлоргексильную группу, пентахлорэтильную группу, гексахлорпропильную группу, или нонахлорбутильную группу, и, предпочтительно, представляет собой фторметильную группу, дифторметильную группу, трифторметильную группу, фторэтильную группу, дифторэтильную группу, трифторэтильную группу, фторпропильную группу, дифторпропильную группу или трифторпропильную группу, и, более предпочтительно, фторметильную группу, дифторметильную группу, трифторметильную группу, фторэтильную группу, дифторэтильную группу или трифторэтильную группу.
“C1-C6 алкокси группа” в определении группы заместителей A в вышеприведенной формуле представляет собой группу, где атом кислорода присоединен к C1-C6 алкильной группе, описанной выше, и, предпочтительно, представляет собой метокси группу, этокси группу, пропокси группу, изопропокси группу или бутокси группу, и, более предпочтительно, метокси группу или этокси группу.
“C1-C6 алкилтио группа” в определении группы заместителей A в вышеприведенной формуле представляет собой группу, где атом серы присоединен к C1-C6 алкильной группе, описанной выше, и, предпочтительно, представляет собой метилтио группу, этилтио группу, пропилтио группу, изопропилтио группу или бутилтио группу, и, более предпочтительно, метилтио группу или этилтио группу.
“C1-C6 алкилкарбокси группа” в определении группы заместителей A в вышеприведенной формуле представляет собой группу, где карбоксильная группа присоединена к C1-C6 алкильной группе, описанной выше, и, предпочтительно, представляет собой метилкарбоксильную группу, этилкарбоксильную группу, пропилкарбоксильную группу, изопропилкарбоксильную группу или бутилкарбоксильную группу, и, более предпочтительно, метилкарбоксильную группу или этилкарбоксильную группу.
“C1-C6 алифатическая ацильная группа” в определении группы заместителей A в вышеприведенной формуле представляет собой группу, где карбонильная группа присоединена к C1-C6 алкильной группе, описанной выше, и может представлять собой, например, ацетильную группу, этилкарбонильную группу, пропилкарбонильную группу, бутилкарбонильную группу, пентилкарбонильную группу или гексилкарбонильную группу, и, предпочтительно, представляет собой ацетильную группу, этилкарбонильную группу или пропилкарбонильную группу.
“Моно-C1-C6 алкиламино группа” в определении группы заместителей A в вышеприведенной формуле представляет собой группу, где амино группа присоединена к C1-C6 алкильной группе, описанной выше, и, предпочтительно, представляет собой метиламино группу, этиламино группу, пропиламино группу, изопропиламино группу или бутиламино группу и, более предпочтительно, метиламино группу или этиламино группу.
“Ди-C1-C6 алкиламино группа” в определении группы заместителей A в вышеприведенной формуле представляет собой группу, где две C1-C6 алкильные группы, описанные выше, присоединены к одной амино группе и представляют собой, например, предпочтительно, диметиламино группу, диэтиламино группу, дипропиламино группу, диизопропиламино группу или дибутиламино группу, и, более предпочтительно, диметиламино группу или диэтиламино группу.
“C1-C6 алифатическая ациламино группа” в определении группы заместителей A в вышеприведенной формуле представляет собой группу, где карбонильная группа присоединена к C1-C6 алкильной группе, и, кроме того, к такой карбонильной группе присоединена амино группа, и может представлять собой, например, ацетиламино группу, этилкарбониламино группу, пропилкарбониламино группу, бутилкарбониламино группу, пентилкарбониламино группу или гексилкарбониламино группу, и, предпочтительно, представляет собой ацетиламино группу, этилкарбониламино группу или пропилкарбониламино группу.
Соединение, представленное общей формулой (I), по настоящему изобретению, предпочтительно, представляет собой соединение, представленное общей формулой (I'), или соединение, представленное общей формулой (I'').
В соединении, представленном общей формулой (I), по настоящему изобретению, A, предпочтительно, представляет собой карбоксильную группу.
B, предпочтительно, представляет собой атом водорода.
n, предпочтительно равен 0.
V, предпочтительно, представляет собой метиленовую группу.
W, предпочтительно, представляет собой 5-7-членную гетероциклическую группу, которая необязательно может быть замещена от 1 до 3 заместителями, выбранными из группы заместителей А, более предпочтительно, тиениленовую, фуриленовую, пирроленовую или пиридиленовую группу, которая необязательно может быть замещена от 1 до 3 заместителями, выбранными из группы заместителей А, и, даже более предпочтительно, тиениленовую или пиридиленовую группу, которая необязательно может быть замещена одним или двумя заместителями, выбранными из группы заместителей А.
X, предпочтительно, представляет собой C1-C8 алкиленовую группу, C1-C8 алкиленовую группу, содержащую атом кислорода или атом серы в углеродной цепи, C6-C10 ариленовую группу, 5-7-членную гетероциклическую группу или конденсированную кольцевую гетероциклическую группу, и, более предпочтительно, 5-7-членную гетероциклическую группу.
Y, предпочтительно, представляет собой любую группу, выбранную из группы, состоящей из фениленовой группы, 5-7-членной гетероциклической группы, которая необязательно может быть замещена от 1 до 3 заместителями, выбранными из группы заместителей А, и конденсированную кольцевую гетероциклическую группу, которая необязательно может быть замещена от 1 до 3 заместителями, выбранными из группы заместителей А, более предпочтительно, фениленовую группу, или тиениленовую, пиридиленовую или индолиленовую группу, которая необязательно может быть замещена от 1 до 3 заместителями, выбранными из группы заместителей А, и, даже более предпочтительно, фениленовую или пиридиленовую группу.
Z, предпочтительно, представляет собой C6-C10 арилокси группу, которая необязательно может быть замещена от 1 до 5 заместителями, выбранными из группы заместителей А, и, даже более предпочтительно, фенокси группу.
В соединении, представленном общей формулой (I'), по настоящему изобретению,
R1, предпочтительно, представляет собой атом водорода.
R2, предпочтительно, представляет собой атом водорода, метильную группу или этильную группа.
R3, предпочтительно, представляет собой атом водорода, атом фтора, атом хлора или метильную группу.
R4, предпочтительно, представляет собой атом водорода, атом фтора, атом хлора, циано группу, метильную группу или метокси группу.
R5, предпочтительно, представляет собой атом водорода или атом фтора.
В соединении, представленном общей формулой (I''), по настоящему изобретению,
R6, предпочтительно, представляет собой атом водорода, метильную группу или этильную группу.
R7, предпочтительно, представляет собой атом водорода, атом фтора, атом хлора или метильную группу.
R8, предпочтительно, представляет собой н-пропильную группу, н-бутильную группу или изобутильную группу.
“Его фармакологически приемлемая соль”, описанная здесь выше, означает соль, которая может быть получена путем взаимодействия соединения, представленного общей формулой (I), по настоящему изобретению имеющего кислотную группу или основную группу, и может быть получено в виде соли основания или соли кислоты путем взаимодействия с основанием или кислотой, соответственно. Такая соль описана далее в настоящем документе.
Фармакологически приемлемая “соль основания” соединения, представленного общей формулой (I), по настоящему изобретению, предпочтительно, представляет собой соль щелочного металла, такую как соль натрия, соль калия или соль лития; соль щелочноземельного металла, такую как соль магния или соль кальция; соль органического основания, такую как соль N-метилморфолина, соль триэтиламина, соль трибутиламина, соль диизопропилэтиламина, соль дициклогексиламина, соль N-метилпиперидина, соль пиридина, соль 4-пирролидинопиридина или соль пиколина, или соль аминокислоты, такую как соль глицина, соль лизина, соль аргинина, соль орнитина, соль глютаминовой кислоты, или соль аспарагиновой кислоты. Соль, предпочтительно, представляет собой соль щелочного металла.
Фармакологически приемлемая “соль кислоты” соединения, представленного общей формулой (I), по настоящему изобретению, предпочтительно, представляет собой соль неорганической кислоты, например, гидрогалогенид, такой как гидрофторид, гидрохлорид, гидробромид, или гидройодид, нитрат, перхлорат, сульфат, фосфат или тому подобное; соль органической кислоты, например, низший алкансульфонат, такой как метансульфонат, трифторметансульфонат или этансульфонат, арилсульфонат, такой как бензолсульфонат или п-толуолсульфонат, ацетат, малат, фумарат, сукцинат, цитрат, аскорбат, тартрат, оксалат, малеат или тому подобное; или соль аминокислоты, такую как соль глицина, соль лизина, соль аргинина, соль орнитина, соль глютаминовой кислоты, или соль аспарагиновой кислоты, и, наиболее предпочтительно, гидрогалогенид.
“Его фармакологически приемлемое пролекарство”, описанное выше, представляет собой соединение, которое преобразуется в соединение (I) посредством воздействия ферментов, желудочной кислоты или тому подобное в физиологических условиях in vivo, то есть, соединение, которое преобразуется в соединение (I) путем ферментативного окисления, восстановления, гидролиза или тому подобное, или соединение, которое преобразуется в соединение (I) путем гидролиза, индуцированного желудочной кислотой.
Пролекарство, описанное выше, представляет собой соединение, которое, когда соединения (I) имеет карбоксильную группу, может быть получено путем этерификации или амидирования такой карбоксильной группы (например, соединения, полученные этильной этерификацией, фенильной этерификацией, карбоксиметильной этерификацией, диметиламинометильной этерификацией, пивалоилоксиметильной этерификацией, этоксикарбонилоксиэтильной этерификацией, фталидильной этерификацией, (5-метил-2-оксо-1,3-диоксолен-4-ил)метильной этерификацией, циклогексилоксикарбонилэтильной этерификацией или метиламидированием карбоксильной группы соединения (I)) или тому подобное.
Эти соединения могут быть получены из соединения (I) известными способами.
Далее, в качестве пролекарства соединения (I) по настоящему изобретению включены различные производные, которые описаны в литературе (“Development of medicine” Vol. 7, Molecular design, pp 163-198, published in 1990 by Hirokawa Shoten), и расщепляются в соединения (I) в физиологических условиях.
Когда соединения по настоящему изобретению оставляют в контакте с атмосферой или перекристаллизовывают, они могут поглощать воду, или вода может воздействовать на них с образованием гидрата. Настоящее изобретение охватывает такие гидраты.
Соединения по настоящему изобретению включают также соответствующие соединения, которые мечены изотопами (например, 3H, 14C, 35S и т.д.).
Когда соединения по настоящему изобретению имеют асимметрические(ий) атом(ы) углерода в своих структурах, благодаря такому(им) атому(ам) эти соединения могут существовать в виде оптических изомеров. В настоящем изобретении индивидуальный оптический изомер и смеси оптических изомеров представлены в виде одной химической формулы. Настоящее изобретение охватывает как отдельные оптические изомеры и их смеси в любом соотношении.
Предпочтительные примеры соединений, представленные общей формулой (I), по настоящему изобретению представляют собой, например, соединения, представленные общей формулой (I-1), (I-2), (I'-1) или (I''-1), представленные в следующих таблицах 1, 2, 3 и 4, но объем настоящего изобретения не должно быть ограничен этими соединениями.
Значения аббревиатур в следующих таблицах даны далее. Пунктирная линия (---) представляет собой одинарную связь или двойную связь, и эта связь определяется в зависимости от природы замещенных атомов.
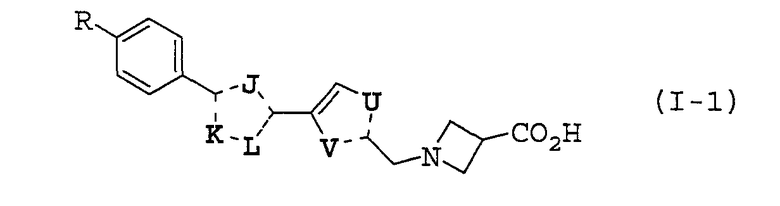
В таблице 1 описанные выше предпочтительные соединения (I-1) по настоящему изобретению включают следующие:
Иллюстративное соединение номер 1-3: 1-({4-[3-(4-Циклогексилфенил)-1,2,4-оксадиазол-5-ил]-2-тиенил}метил)азетидин-3-карбоновая кислота,
Иллюстративное соединение номер 1-8:
1-({4-[3-(4-Циклогексилфенил)-1,2,4-оксадиазол-5-ил]-2-фурил}метил)азетидин-3-карбоновая кислота,
Иллюстративное соединение номер 1-17:
1-({5-[3-(4-Изобутилфенил)-1,2,4-оксадиазол-5-ил]пиридин-2-ил}метил)азетидин-3-карбоновая кислота,
Иллюстративное соединение номер 1-22:
1-({6-[3-(4-Изобутилфенил)-1,2,4-оксадиазол-5-ил]пиридин-3-ил}метил)азетидин-3-карбоновая кислота,
Иллюстративное соединение номер 1-28:
1-({5-[3-(4-Циклогексилфенил)-1,2,4-оксадиазол-5-ил]-2-тиенил}метил)азетидин-3-карбоновая кислота,
Иллюстративное соединение номер 1-33:
1-({5-[3-(4-Циклогексилфенил)-1,2,4-оксадиазол-5-ил]-2-фурил}метил)азетидин-3-карбоновая кислота,
Иллюстративное соединение номер 1-43:
1-({4-[3-(4-Циклогексилфенил)изооксазол-5-ил]-2-тиенил}метил)азетидин-3-карбоновая кислота,
Иллюстративное соединение номер 1-48:
1-({4-[3-(4-Циклогексилфенил)изооксазол-5-ил]-2-фурил}метил)азетидин-3-карбоновая кислота,
Иллюстративное соединение номер 1-57:
1-({5-[3-(4-Изобутилфенил)изооксазол-5-ил]пиридин-2-ил}метил)азетидин-3-карбоновая кислота,
Иллюстративное соединение номер 1-62:
1-({6-[3-(4-Изобутилфенил)изооксазол-5-ил]пиридин-2-ил}метил)азетидин-3-карбоновая кислота,
Иллюстративное соединение номер 1-68:
1-({5-[3-(4-Циклогексилфенил)изооксазол-5-ил]-2-тиенил}метил)азетидин-3-карбоновая кислота,
Иллюстративное соединение номер 1-73:
1-({5-[3-(4-Циклогексилфенил)изооксазол-5-ил]-2-фурил}метил)азетидин-3-карбоновая кислота,
Иллюстративное соединение номер 1-82:
1-({4-[5-(4-Изобутилфенил)-1,2,4-оксадиазол-3-ил]-2-тиенил}метил)азетидин-3-карбоновая кислота,
Иллюстративное соединение номер 1-83:
1-({4-[5-(4-Циклогексилфенил)-1,2,4-оксадиазол-3-ил]-2-тиенил}метил)азетидин-3-карбоновая кислота,
Иллюстративное соединение номер 1-84:
1-({4-[5-(4-Циклогексилфенил)-1,2,4-оксадиазол-3-ил]-2-тиенил}метил)азетидин-3-карбоновая кислота,
Иллюстративное соединение номер 1-88:
1-({4-[5-(4-Циклогексилфенил)-1,2,4-оксадиазол-3-ил]-2-фурил}метил)азетидин-3-карбоновая кислота,
Иллюстративное соединение номер 1-97:
1-({5-[5-(4-Изобутилфенил)-1,2,4-оксадиазол-3-ил]пиридин-2-ил}метил)азетидин-3-карбоновая кислота,
Иллюстративное соединение номер 1-102:
1-({6-[5-(4-Изобутилфенил)-1,2,4-оксадиазол-3-ил]пиридин-2-ил}метил)азетидин-3-карбоновая кислота,
Иллюстративное соединение номер 1-107:
1-({5-[5-(4-Изобутилфенил)-1,2,4-оксадиазол-3-ил]-2-тиенил}метил)азетидин-3-карбоновая кислота,
Иллюстративное соединение номер 1-108:
1-({5-[5-(4-Циклогексилфенил)-1,2,4-оксадиазол-3-ил]-2-тиенил}метил)азетидин-3-карбоновая кислота,
Иллюстративное соединение номер 1-109:
1-({5-[5-(4-Феноксифенил)-1,2,4-оксадиазол-3-ил]-2-тиенил}метил)азетидин-3-карбоновая кислота,
Иллюстративное соединение номер 1-113:
1-({5-[5-(4-Циклогексилфенил)-1,2,4-оксадиазол-3-ил]-2-фурил}метил)азетидин-3-карбоновая кислота,
Иллюстративное соединение номер 1-122:
1-({4-[5-(4-Изобутилфенил)изоксазол-3-ил]-2-тиенил}метил)азетидин-3-карбоновая кислота,
Иллюстративное соединение номер 1-123:
1-({4-[5-(4-Циклогексилфенил)изоксазол-3-ил]-2-тиенил}метил)азетидин-3-карбоновая кислота,
Иллюстративное соединение номер 1-124:
1-({4-[5-(4-Феноксифенил)изоксазол-3-ил]-2-тиенил}метил)азетидин-3-карбоновая кислота,
Иллюстративное соединение номер 1-128:
1-({4-[5-(4-Циклогексилфенил)изоксазол-3-ил]-2-фурил}метил)азетидин-3-карбоновая кислота,
Иллюстративное соединение номер 1-137:
1-({5-[5-(4-Изобутилфенил)изоксазол-3-ил]пиридин-2-ил}метил)азетидин-3-карбоновая кислота,
Иллюстративное соединение номер 1-142:
1-({6-[5-(4-Изобутилфенил)изоксазол-3-ил]пиридин-3-ил}метил)азетидин-3-карбоновая кислота,
Иллюстративное соединение номер 1-147:
1-({5-[5-(4-Изобутилфенил)изоксазол-3-ил]-2-тиенил}метил)азетидин-3-карбоновая кислота,
Иллюстративное соединение номер 1-148:
1-({5-[5-(4-Циклогексилфенил)изоксазол-3-ил]-2-тиенил}метил)азетидин-3-карбоновая кислота,
Иллюстративное соединение номер 1-149:
1-({5-[5-(4-Феноксифенил)изоксазол-3-ил]-2-тиенил}метил)азетидин-3-карбоновая кислота,
Иллюстративное соединение номер 1-153:
1-({5-[5-(4-Циклогексилфенил)изоксазол-3-ил]-2-фурил}метил)азетидин-3-карбоновая кислота,
более предпочтительные соединения представляют собой иллюстративные соединения №№ 1-83, 1-84, 1-88, 1-97, 1-102, 1-108, 1-109, 1-113, 1-123, 1-124, 1-137, 1-142, и 1-148.
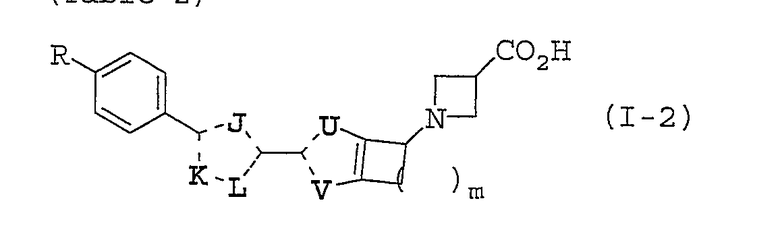
В таблице 2, описанной выше, предпочтительные соединения (I-2) по настоящему изобретению включают следующие:
Иллюстративное соединение номер 2-33: 1-{2-[3-(4-Циклогексилфенил)-1,2,4-оксадиазол-5-ил]-5,6-дигидро-4H-циклопента[b]тиен-4-ил}азетидин-3-карбоновая кислота,
Иллюстративное соединение номер 2-38: 1-{2-[3-(4-Циклогексилфенил)-1,2,4-оксадиазол-5-ил]-4,5,6,7-тетрагидро-1-бензотиен-4-ил}азетидин-3-карбоновая кислота,
Иллюстративное соединение номер 2-43: 1-{2-[3-(4-Циклогексилфенил)-1,2,4-оксадиазол-5-ил]-5,6-дигидро-4H-циклопента[b]фуран-4-ил}азетидин-3-карбоновая кислота,
Иллюстративное соединение номер 2-48: 1-{2-[3-(4-Циклогексилфенил)-1,2,4-оксадиазол-5-ил]-4,5,6,7-тетрагидро-1-бензофуран-4-ил}азетидин-3-карбоновая кислота,
Иллюстративное соединение номер 2-93: 1-{2-[3-(4-Циклогексилфенил)изоксазол-5-ил]-5,6-дигидро-4H-циклопента[b]тиен-4-ил}азетидин-3-карбоновая кислота,
Иллюстративное соединение номер 2-98: 1-{2-[3-(4-Циклогексилфенил)изоксазол-5-ил]-4,5,6,7-тетрагидро-1-бензотиен-4-ил}азетидин-3-карбоновая кислота,
Иллюстративное соединение номер 2-103: 1-{2-[3-(4-Циклогексилфенил)изоксазол-5-ил]-5,6-дигидро-4H-циклопента[b]тиен-4-ил}азетидин-3-карбоновая кислота,
Иллюстративное соединение номер 2-108: 1-{2-[3-(4-Циклогексилфенил)изоксазол-5-ил]-4,5,6,7-тетрагидро-1-бензофуран-4-ил}азетидин-3-карбоновая кислота,
Иллюстративное соединение номер 2-153: 1-{2-[5-(4-Циклогексилфенил)1,2,4-оксадиазол-3-ил]-5,6-дигидро-4H-циклопента[b]тиен-4-ил}азетидин-3-карбоновая кислота,
Иллюстративное соединение номер 2-158: 1-{2-[5-(4-Циклогексилфенил)1,2,4-оксадиазол-3-ил]-4,5,6,7-тетрагидро-1-бензотиен-4-ил}азетидин-3-карбоновая кислота,
Иллюстративное соединение номер 2-163: 1-{2-[5-(4-Циклогексилфенил)1,2,4-оксадиазол-3-ил]-5,6-дигидро-4H-циклопента[b]фуран-4-ил}азетидин-3-карбоновая кислота,
Иллюстративное соединение номер 2-168: 1-{2-[5-(4-Циклогексилфенил)1,2,4-оксадиазол-3-ил]-4,5,6,7-тетрагидро-1-бензофуран-4-ил}азетидин-3-карбоновая кислота,
Иллюстративное соединение номер 2-213: 1-{2-[5-(4-Циклогексилфенил)изоксазол-3-ил]-5,6-дигидро-4H-циклопента[b]тиен-4-ил}азетидин-3-карбоновая кислота,
Иллюстративное соединение номер 2-218: 1-{2-[5-(4-Циклогексилфенил)изоксазол-3-ил]-4,5,6,7-тетрагидро-1-бензотиен-4-ил}азетидин-3-карбоновая кислота,
Иллюстративное соединение номер 2-223: 1-{2-[5-(4-Циклогексилфенил)изоксазол-3-ил]-5,6-дигидро-4H-циклопента[b]фуран-4-ил}азетидин-3-карбоновая кислота,
Иллюстративное соединение номер 2-228: 1-{2-[5-(4-Циклогексилфенил)изоксазол-3-ил]-4,5,6,7-тетрагидро-1-бензофуран-4-ил}азетидин-3-карбоновая кислота,
более предпочтительные соединения представляют собой иллюстративные соединения №№ 2-43, 2-48, 2-103, 2-108, 2-163, 2-168, 2-223 и 2-228.
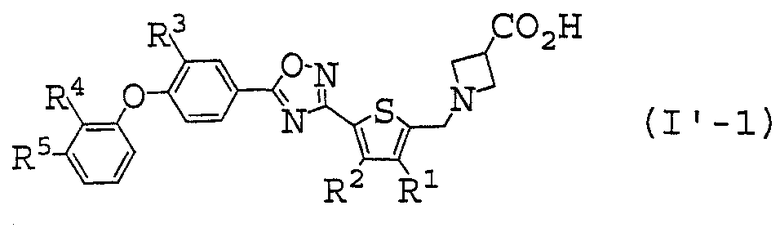
В таблице 3 описанные выше предпочтительные соединения (I'-1) по настоящему изобретению включают следующие:
Иллюстративное соединение номер 3-1: 1-({5-[5-(4-Феноксифенил)-1,2,4-оксадиазол-3-ил]-2-тиенил}метил)азетидин-3-карбоновая кислота (Пример 5),
Иллюстративное соединение номер 3-25: 1-({4-Метил-5-[5-(4-феноксифенил)-1,2,4-оксадиазол-3-ил]-2-тиенил}метил)азетидин-3-карбоновая кислота (Пример 12),
Иллюстративное соединение номер 3-27: 1-({5-[5-(3-Фтор-4-феноксифенил)-1,2,4-оксадиазол-3-ил]-4-метил-2-тиенил}метил)азетидин-3-карбоновая кислота (Пример 11),
Иллюстративное соединение номер 3-49: 1-({4-Этил-5-[5-(4-феноксифенил)-1,2,4-оксадиазол-3-ил]-2-тиенил}метил)азетидин-3-карбоновая кислота (Пример 13),
Иллюстративное соединение номер 3-50:
1-[(4-Этил-5-{5-[4-(3-фторфенокси)фенил]-1,2,4-оксадиазол-3-ил}-2-тиенил)метил]азетидин-3-карбоновая кислота (Пример 17),
Иллюстративное соединение номер 3-51: 1-({4-Этил-5-[5-(3-фтор-4-феноксифенил)-1,2,4-оксадиазол-3-ил]-2-тиенил}метил)азетидин-3-карбоновая кислота (Пример 14),
Иллюстративное соединение номер 3-52: 1-[(4-Этил-5-{5-[3-фтор-4-(3-фторфенокси)фенил]-1,2,4-оксадиазол-3-ил}-2-тиенил)метил]азетидин-3-карбоновая кислота (Пример 20),
Иллюстративное соединение номер 3-53: 1-[(4-Этил-5-{5-[4-(2-метоксифенокси)фенил]-1,2,4-оксадиазол-3-ил}-2-тиенил)метил]азетидин-3-карбоновая кислота (Пример 15),
Иллюстративное соединение номер 3-54:
1-[(5-{5-[3-Хлор-4-(3-фторфенокси)фенил]-1,2,4-оксадиазол-3-ил}-4-этил-2-тиенил)метил]азетидин-3-карбоновая кислота (Пример 16),
Иллюстративное соединение номер 3-55: 1-[(4-Этил-5-{5-[4-(2-метоксифенокси)фенил]-1,2,4-оксадиазол-3-ил}-2-тиенил)метил]азетидин-3-карбоновая кислота (Пример 21),
Иллюстративное соединение номер 3-61: 1-[(4-Этил-5-{5-[4-(2-фторфенокси)фенил]-1,2,4-оксадиазол-3-ил}-2-тиенил)метил]азетидин-3-карбоновая кислота (Пример 10),
Иллюстративное соединение номер 3-62: 1-[(5-{5-[4-(2,3-Дифторфенокси)фенил]-1,2,4-оксадиазол-3-ил}-4-этил-2-тиенил)метил]азетидин-3-карбоновая кислота (Пример 18),
Иллюстративное соединение номер 3-63: 1-[(4-Этил-5-{5-[3-фтор-4-(2-дифторфенокси)фенил]-1,2,4-оксадиазол-3-ил}-2-тиенил)метил]азетидин-3-карбоновая кислота,
Иллюстративное соединение номер 3-64: 1-[(5-{5-[4-(2,3-Дифторфенокси)-3-фторфенил]-1,2,4-оксадиазол-3-ил}-4-этил-2-тиенил)метил]азетидин-3-карбоновая кислота,
Иллюстративное соединение номер 3-65:
1-[(5-{5-[3-Хлор-4-(2-фторфенокси)фенил]-1,2,4-оксадиазол-3-ил}-4-этил-2-тиенил)метил]азетидин-3-карбоновая кислота,
Иллюстративное соединение номер 3-66: 1-[(5-{5-[3-Хлор-4-(2,3-дифторфенокси)фенил]-1,2,4-оксадиазол-3-ил}-4-этил-2-тиенил)метил]азетидин-3-карбоновая кислота,
Иллюстративное соединение номер 3-67: 1-[(5-{5-[4-(2-Хлорфенокси)фенил]-1,2,4-оксадиазол-3-ил}-4-этил-2-тиенил)метил]азетидин-3-карбоновая кислота (Пример 19),
Иллюстративное соединение номер 3-69:
1-[(5-{5-[4-(2-Хлорфенокси)-3-фторфенил]-1,2,4-оксадиазол-3-ил}-4-этил-2-тиенил)метил]азетидин-3-карбоновая кислота,
Иллюстративное соединение номер 3-73: 1-({3-Метил-5-[5-(4-феноксифенил)-1,2,4-оксадиазол-3-ил]-2-тиенил}метил)азетидин-3-карбоновая кислота,
Иллюстративное соединение номер 3-97: 1-({3-Этил-5-[5-(4-феноксифенил)-1,2,4-оксадиазол-3-ил]-2-тиенил}метил)азетидин-3-карбоновая кислота (Пример 22),
более предпочтительные соединения представляют собой иллюстративные соединения №№ 3-25, 3-27, 3-49, 3-50, 3-51, 3-52, 3-53, 3-54, 3-55, 3-61 и 3-67.
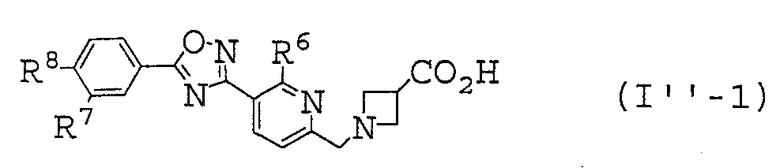
В таблице 4 описанные выше предпочтительные соединения (I''-1) по настоящему изобретению включают
Иллюстративное соединение номер 4-6: 1-({5-[5-(4-Изобутил-3-метилфенил)-1,2,4-оксадиазол-3-ил]пиридин-2-ил}метил)азетидин-3-карбоновая кислота (Пример 28),
Иллюстративное соединение номер 4-9: 1-({5-[5-(3-Фтор-4-изобутилфенил)-1,2,4-оксадиазол-3-ил]пиридин-2-ил}метил)азетидин-3-карбоновая кислота (Пример 23),
Иллюстративное соединение номер 4-12: 1-({5-[5-(3-Хлор-4-изобутилфенил)-1,2,4-оксадиазол-3-ил]пиридин-2-ил}метил)азетидин-3-карбоновая кислота (Пример 26),
Иллюстративное соединение номер 4-21: 1-({5-[5-(4-Изобутил-3-метилфенил)-1,2,4-оксадиазол-3-ил]-6-метилпиридин-2-ил}метил)азетидин-3-карбоновая кислота (Пример 27),
Иллюстративное соединение номер 4-22: 1-({5-[5-(3-Фтор-4-пропилфенил)-1,2,4-оксадиазол-3-ил]-6-метилпиридин-2-ил}метил)азетидин-3-карбоновая кислота,
Иллюстративное соединение номер 4-23: 1-({5-[5-(4-Бутил-3-фторфенил)-1,2,4-оксадиазол-3-ил]-6-метилпиридин-2-ил}метил)азетидин-3-карбоновая кислота,
Иллюстративное соединение номер 4-24: 1-({5-[5-(3-Фтор-4-изобутилфенил)-1,2,4-оксадиазол-3-ил]-6-метилпиридин-2-ил}метил)азетидин-3-карбоновая кислота,
Иллюстративное соединение номер 4-27: 1-({5-[5-(3-Хлор-4-изобутилфенил)-1,2,4-оксадиазол-3-ил]-6-метилпиридин-2-ил}метил)азетидин-3-карбоновая кислота (Пример 24),
Иллюстративное соединение номер 4-36:
1-({6-Этил-5-[5-(4-изобутил-3-метилфенил)-1,2,4-оксадиазол-3-ил]пиридин-2-ил}метил)азетидин-3-карбоновая кислота (Пример 29),
Иллюстративное соединение номер 4-37: 1-({6-Этил-5-[5-(3-фтор-4-пропилфенил)-1,2,4-оксадиазол-3-ил]пиридин-2-ил}метил)азетидин-3-карбоновая кислота,
Иллюстративное соединение номер 4-38: 1-({5-[5-(4-Бутил-3-фторфенил)-1,2,4-оксадиазол-3-ил]-6-этилпиридин-2-ил}метил)азетидин-3-карбоновая кислота,
Иллюстративное соединение номер 4-39:
1-({6-Этил-5-[5-(3-фтор-4-изобутилфенил)-1,2,4-оксадиазол-3-ил]пиридин-2-ил}метил)азетидин-3-карбоновая кислота (Пример 30), и
Иллюстративное соединение номер 4-42: 1-({5-[5-(3-Хлор-4-изобутилфенил)-1,2,4-оксадиазол-3-ил]-6-этилпиридин-2-ил}метил)азетидин-3-карбоновая кислота (Пример 25),
более предпочтительные соединения представляют собой иллюстративные соединения №№. 4-6, 4-9, 4-12, 4-21, 4-27, 4-36 и 4-42.
Преимущества изобретения
Поскольку соединения по настоящему изобретению обладают превосходной иммуносупрессивной активностью с низкой токсичностью, соединения по настоящему изобретению могут быть использованы в качестве профилактического агента или терапевтического агента (особенно терапевтического агента) при заболевниях, связанных с подавлением иммунной системы у млекопитающих (особенно у человека).
Наилучший способ осуществления изобретения
Соединение, представленное общей формулой (I), по настоящему изобретению может быть получено в соответствии со способами, описанными далее в настоящем документе.
Способы получения, описанные далее, обычно устанавливают в соответствии с известными способами. В качестве известных способов можно указать способы, описанные, например, в “Organic Functional Group Preparation”, Second Edition, Academic Press, Inc., 1989, и “Comprehensive Organic Transformations”, VCH Publishers Inc., 1989, и тому подобное.
Способ A является способом получения соединений, представленных общей формулой (I).
Способ A
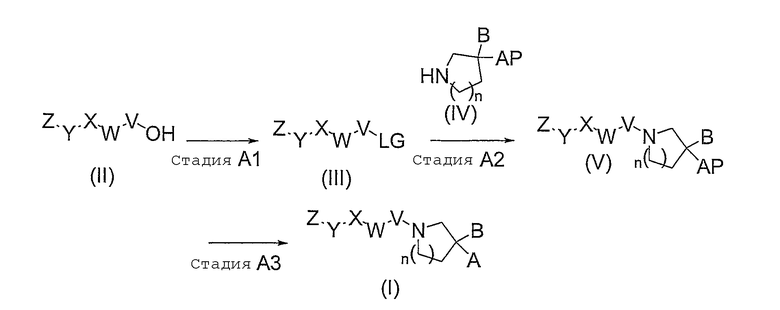
На вышеуказанной реакционной схеме A, B, V, W, X, Y, Z и n имеют те же значения, что указаны здесь выше.
LG представляет собой группу, которая известна в области химии органического синтеза как удаляемая группа и может представлять собой, например, атом галогена или группу формулы -O-S(O)2Rc (где Rc представляет собой метокси группу, C1-C6 алкильную группу, которая необязательно может быть замещена от 1 до 3 атомами галогена, или фенильную группу, которая необязательно может быть замещена от 1 до 3 заместителями, выбранными из группы, содержащей атом галогена и метильную группу), и, предпочтительно, представляет собой атом хлора, атом брома, атом йода, метансульфонилокси группу или п-толуолсульфонилокси группу.
AP представляет собой группу, в которой функциональная группа, указанная в определении A, защищена защитной группой в такой форме, которая считается в химии органического синтеза в качестве подходящей, и такая защитная группа P может быть, например, защитной группой, приведенной в “Protective Groups in Organic Synthesis, third edition” (ed. by Green, T. W. and Wuts, P. G. M., John Wiley and Sons, Inc., 1999).
В том случае, когда A представляет собой карбоксильную группу, такая защитная группа P, предпочтительно, представляет собой низшую алкильную группу, такую как метильная группа, этильная группа, пропильная группа, или тому подобное, и, особенно предпочтительно, этильная группа.
В том случае, когда A представляет собой фосфо группу, такая защитная группа P, предпочтительно, представляет собой низшую алкильную группу, такую как метильная группа или этильная группа; аллильная группа или 2,2,2-трихлорэтильная группа, и, особенно предпочтительно, аллильная группа.
В том случае, когда A представляет собой сульфо группу, такая защитная группа P, предпочтительно, представляет собой фенильную группу, п-метоксифенильную группу или п-нитрофенильную группу, и, особенно предпочтительно, фенильную группу.
В том случае, когда A представляет собой 1H-тетразол-5-ильную группу, такая защитная группа P, предпочтительно, представляет собой трифенилметильную группу, п-метоксифенилдифенилметильную группу или ди(p-метоксифенил)фенилметильную группу, и, особенно предпочтительно, трифенилметильную группу.
Стадия A1
Стадия A1 представляет собой способ получения соединения, представленного общей формулой (III), путем преобразования гидроксильной группы соединения, представленного общей формулой (II), в удаляемую группу.
Этот способ осуществляют путем взаимодействия соединения, представленного общей формулой (II), с галогенирующим агентом или сульфонилирующим агентом, и, предпочтительно, проводят путем взаимодействия с галогенирующим агентом в растворителе.
Галогенирующим агентом, описанным выше, может быть, например, тригалогенид фосфора, такой как трихлорид фосфора или трибромид фосфора; или сочетание фосфина, который состоит из триарилфосфина, включая трифенилфосфин и три-низший алкилфосфин, такой как трибутилфосфин, и либо молекулярного простого галогена, такого как бром или йод, либо эквивалента галогена, такого как тетрахлорид углерода, тетрабромид углерода или гексахлорацетон, и, предпочтительно, представляет собой сочетание триарилфосфина и эквивалента галогена, и, особенно предпочтительно, сочетание трифенилфосфина и тетрабромида углерода.
Растворитель, используемый в реакции, указанной выше, особенно никак не ограничивают, при условии, что он не оказывает отрицательного воздействия на реакцию, и может быть, например, галогенированным углеводородом, таким как дихлорметан, хлороформ, 1,2-дихлорэтан, или тому подобное; или эфир, такой как тетрагидрофуран, 1,2-диметоксиэтан, или тому подобное, и, предпочтительно, представляет собой галогенированный углеводород, и, особенно предпочтительно, дихлорметан.
Температура, при которой осуществляют реакцию, указанную выше, обычно находится в интервале между -23°C и 60°C, и, предпочтительно, между 0°C и 30°C.
Время, в течение которого осуществляют реакцию, указанную выше, является различным, в зависимости от температуры реакции, исходного продукта, используемого реагента или вида используемого растворителя, но обычно составляет от 15 минут до 3 часов, и, предпочтительно, от 30 минут до 1 часа.
После того как реакция завершена, целевой продукт этой реакции может быть выделен из реакционной смеси обычными методами. Желаемое соединение может быть получено, например, путем нейтрализации реакционной смеси, если необходимо, или фильтрацией реакционной смеси, когда в реакционной смеси присутствуют нерастворимые продукты, экстракцией нейтрализованного раствора или фильтрата органическим смешивающимся с водой растворителем, таким как толуол, промывкой полученного органического слоя водой, отделением органического слоя, содержащего желаемое соединение, и последующим упариванием органического растворителя при пониженном давлении.
Желаемый продукт, полученный таким образом, если необходимо, может быть затем выделен и очищен обычными методами, например, с помощью перекристаллизации, переосаждения или другими известными методами, обычно используемыми при выделении и очистке органического соединения (например, абсорбционная колоночная хроматография, используя носитель, такой как силикагель, оксид алюминия или Florisil, содержащий магний и силикагель; разделительная колоночная хроматография, используя Sephadex LH-20 (продукт фирмы PharmaciCo., Ltd.), Amberlite XAD-11 (продукт фирмы Rohm & Hass Co., Ltd.) или Diaion HP-20 (продукт фирмы Mitsubishi Chemicals Co., Ltd.); ионобменная хроматография; или колоночная хроматография с нормальной фазой или обращенной фазой, используя силикагель или алкилированный силикагель, и, предпочтительно, с помощью колоночной хроматографии, используя силикагель).
Стадия A2
Стадия A2 представляет собой способ получения соединения, представленного общей формулой (V), путем замещения удаляемой группы LG соединения, представленного общей формулой (III), соединением, представленным общей формулой (IV).
Этот способ проводят в присутствии основания в растворителе.
Основание, используемое в реакции, указанной выше, может представлять собой, например, триалкиламин, такой как триэтиламин, N,N-диизопропилэтиламин, трибутиламин или тому подобное; или пиридин, такой как пиридин, лутидин, коллидин или тому подобное; карбонат щелочного металла, такой как гидрокарбонат натрия, калия гидрокарбонат, карбонат натрия или карбонат калия, или тому подобное, и, предпочтительно, представляет собой триалкиламин, и, особенно предпочтительно, N,N-диизопропилэтиламин.
Для растворителя, используемого в реакции, указанной выше, нет никаких конкретных ограничений, при условии, что он не оказывает вредного влияния на реакцию, и он может представлять собой, например, галогенированный углеводород, такой как дихлорметан, хлороформ, 1,2-дихлорэтан, или тому подобное; или простой эфир, такой как диэтиловый эфир, тетрагидрофуран, 1,2-диметоксиэтан, диоксан или тому подобное, и, предпочтительно, представляет собой галогенированный углеводород, и, особенно предпочтительно, дихлорметан.
Температура, при которой осуществляют реакцию, указанную выше, обычно находится в интервале между 0°C и 100°C, и, предпочтительно, между 0°C и 30°C.
Время, в течение которого осуществляют реакцию, указанную выше, является различным, в зависимости от температуры реакции, исходного продукта, используемого реагента или используемого растворителя, но обычно составляет от 15 минут до 3 часов, и, предпочтительно, от 30 минут до 2 часов.
После того как реакция завершена, целевой продукт этой реакции, если необходимо, может быть выделен из реакционной смеси и очищен таким же образом, как описано в стадии A1.
Стадия A3
Стадия A3 представляет собой способ получения соединения, представленного общей формулой (I), путем проведения реакции удаления защитной группы заместителя AP в соединении, представленном общей формулой (V).
Условия проведения реакции удаления защитной группы в этом способе являются различными в зависимости от защитной группы, используемой при получении заместителя AP, где заместитель A был в защищенном виде. Далее в настоящем документе описаны общие способы защиты, например, для случая, когда A представляет собой карбоксильную группу и заместитель AP представляет собой низшую алкильную сложноэфирную группу.
Этот способ проводят в присутствии основания в растворителе, содержащем воду.
Основание, используемое в реакции, указанной выше, может представлять собой, например, гидроксид щелочного металла, такой как гидроксид лития, гидроксид натрия, гидроксид калия или тому подобное; карбонат щелочного металла, такой как карбонат лития, карбонат натрия, карбонат калия или тому подобное; или алкоксид металла, такой как метоксид лития, метоксид натрия или этоксид натрия, и, предпочтительно, представляет собой гидроксид щелочного металла, и, особенно предпочтительно, гидроксид лития.
Для растворителя, используемого в реакции, указанной выше, нет никаких конкретных ограничений, при условии, что он не оказывает отрицательного воздействия на реакцию, и может представлять собой, например, простой эфир, такой как диэтиловый эфир, тетрагидрофуран, 1,2-диметоксиэтан или диоксан; спирт, такой как метанол, этанол, изопропанол, трет-бутанол, или тому подобное; вода; или смесь воды и растворителя(ей), описанные выше, и, предпочтительно, представляет собой смесь простого эфира, спирта и воды, и, особенно предпочтительно, смесь тетрагидрофурана, метанола и воды.
Температура, при которой осуществляют реакцию, указанную выше, обычно находится в интервале между 0°C и 100°C, и, предпочтительно, между 0°C и 40°C.
Время, в течение которого осуществляют реакцию, указанную выше, является различным, в зависимости от температуры реакции, исходного продукта, используемого реагента или используемого растворителя, но обычно составляет от 15 минут до 3 часов, и, предпочтительно, от 30 минут до 2 часов.
Затем, даже в том случае, когда заместитель является иным, чем конкретно указанный в этом способе, этот способ может быть проведен в соответствии со способами, например, описанными в “Protective Groups in Organic Synthesis, third edition” (ed. by Green, T. W. and Wuts, P. G. M., John Wiley and Sons, Inc., 1999), и тому подобное.
После того как реакция была завершена, целевой продукт этой реакции, если необходимо, может быть выделен из реакционной смеси и очищен таким же образом, как описано в стадии A1.
Способ получения соединений, представленных общей формулой (II), используемый в способе A, может быть разным, в зависимости от природы заместителя X. Далее в настоящем документе описан общий способ получения, например, для случая, когда X представляет собой оксадиазольное кольцо или изоксазольное кольцо.
Способ B представляет собой способ получения соединения, представленного общей формулой (II-1), которое включено в соединение, представленное общей формулой (II), где заместитель X представляет собой оксадиазольное кольцо.
Способ B
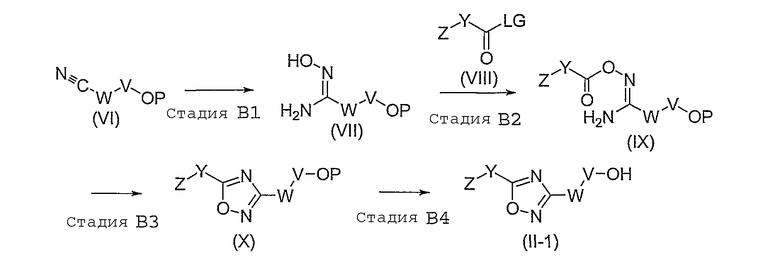
На вышеуказанной реакционной схеме V, W, Y и Z имеют те же значения, что указаны здесь выше.
LG имеет то же значение, что указано здесь выше, или представляет собой гидроксильной группу,
P представляет собой защитную группу для гидроксильной группы. Такая защитная группа для гидроксильной группы представляет собой, например, защитную группу для гидроксильной группы, описанную в “Protective Groups in Organic Synthesis, third edition” (ed. by Green, T. W. and Wuts, P. G. M., John Wiley and Sons, Inc., 1999), и тому подобное, и может представлять собой, предпочтительно, триалкилсилильную группу, такую как триэтилсилильную группу, трет-бутилдиметилсилильную группу или трет-бутилдифенилсилильную группу; замещенную метильную эфирную группу, такую как метоксиметильную группу, тетрагидропиранильную группу или 2-(триметилсилил)этоксиметильную группу; или ацильную группу, такую как ацетильную группу, бензоильную группу или пивалоильную группу. Такая защитная группа, предпочтительно, представляет собой триалкилсилильную группу, и, особенно предпочтительно, трет-бутилдиметилсилильную группу.
Стадия B1
Стадия B1 представляет собой способ получения соединения, представленного общей формулой (VII), путем проведения реакции добавления гидроксиламина к соединению, представленному общей формулой (VI).
Этот способ может быть осуществлен путем взаимодействия соединения, представленного общей формулой (VI), с гидроксиламином или гидроксиламиновым эквивалентом в растворителе.
Гидроксиламиновый эквивалент может представлять собой раствор гидроксиламина, такой как водный раствор гидроксиламина, смешанный раствор гидроксиламина и метанола, смешанный раствор гидроксиламина и этанола, или тому подобное; или сочетание соли гидроксиламина, такой как гидрохлорид гидроксиламина, фосфат гидроксиламина, сульфат гидроксиламина или тому подобное, и три-низшего алкиламина, такого как триэтиламин, N,N-диизопропилэтиламин или трибутиламин, или карбоната щелочного металла, такого как гидрокарбонат натрия, гидрокарбонат калия, карбонат натрия, карбонат калия или тому подобное, и, предпочтительно, представляет собой раствор гидроксиламина и, особенно предпочтительно, водный раствор гидроксиламина.
Для растворителя, используемого в реакции, указанной выше, нет никаких конкретных ограничений, при условии, что он не оказывает вредного влияния на реакцию, и он может представлять собой, например, галогенированный углеводород, такой как дихлорметан, хлороформ, 1,2-дихлорэтан или тому подобное; или простой эфир, такой как тетрагидрофуран, 1,2-диметоксиэтан, или тому подобное, или спирт, такой как метанол, этанол, изопропанол, трет-бутанол или тому подобное, и, предпочтительно, представляет собой спирт, и, особенно предпочтительно, этанол.
Температура, при которой осуществляют реакцию, указанную выше, обычно находится в интервале между 0°C и 80°C, и, предпочтительно, между 30°C и 60°C.
Время, в течение которого осуществляют реакцию, указанную выше, является различным, в зависимости от температуры реакции, исходного продукта, используемого реагента или используемого растворителя, но обычно составляет от 15 минут до 5 часов, и, предпочтительно, от 30 минут до 2 часов.
После того как реакция завершена, целевой продукт этой реакции, если необходимо, может быть выделен из реакционной смеси и очищен таким же образом, как описано в стадии A1.
Стадия B2
Стадия B2 представляет собой способ получения соединения, представленного общей формулой (IX), путем взаимодействия соединения, представленного общей формулой (VII), с соединением, представленным общей формулой (VIII).
Далее в настоящем документе описаны способы получения для тех случаев, когда (1) заместитель LG в соединении, представленном общей формулой (VIII), представляет собой гидроксильную группу, и (2) заместитель LG в соединении, представленном общей формулой (VIII), представляет собой группу, отличающуюся от гидроксильной группы.
(1) Случай, когда заместитель LG в соединении, представленном общей формулой (VIII), представляет собой гидроксильную группу.
Этот способ осуществляют путем взаимодействия соединения, представленного общей формулой (VII), с соединением, представленным общей формулой (VIII), в присутствии конденсирующего агента в растворителе.
Конденсирующим агентом, используемым в реакции, указанной выше, может быть, например, карбодиимид, такой как N,N'-дициклогексилкарбодиимид, N,N'-диизопропилкарбодиимид, 1-этил-3-(3'-диметиламинопропил)карбодиимид (WSCI), или тому подобное; или O-бензотриазол, такой как BOP [бензотриазол-1-илокситрис(диметиламино)фосфоний гексафторфосфат], HATU [O-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилуроний гексафторфосфат], HBTU [O-бензотриазол-1-ил-N,N,N',N'-тетраметилуроний гексафторфосфат] и тому подобное, и, предпочтительно, представляет собой карбодиимид, и, особенно предпочтительно, N,N'-дициклогексилкарбодиимид.
Для растворителя, используемого в реакции, указанной выше, нет никаких конкретных ограничений, при условии, что он не оказывает вредного влияния на реакцию, и он может представлять собой, например, галогенированный углеводород, такой как дихлорметан, хлороформ, 1,2-дихлорэтан или тому подобное; простой эфир, такой как тетрагидрофуран, 1,2-диметоксиэтан; или бензол, такой как бензол, толуол или ксилол, и, предпочтительно, представляет собой галогенированный углеводород, и, особенно предпочтительно, дихлорметан.
Температура, при которой осуществляют реакцию, указанную выше, обычно находится в интервале между -20°C и 40°C, и, предпочтительно, между 0°C и 30°C.
Время, в течение которого осуществляют реакцию, указанную выше, является различным, в зависимости от температуры реакции, исходного продукта, используемого реагента или используемого растворителя, но обычно составляет от 15 минут до 5 часов, и, предпочтительно, от 30 минут до 2 часов.
После того как реакция завершена, целевой продукт этой реакции, если необходимо, может быть выделен из реакционной смеси и очищен таким же образом, как описано в стадии A1.
(2) Случай, когда заместитель LG в соединении, представленном общей формулой (VIII), представляет собой группу, отличающуюся от гидроксильной группы.
Этот способ осуществляют путем взаимодействия соединения, представленного общей формулой (VII), с соединением, представленным общей формулой (XIII), в присутствии основания в инертном расторителе.
Заместитель LG, предпочтительно, представляет собой атом хлора.
Основание, используемое в реакции, указанной выше, может представлять собой, например, триалкиламин, такой как триэтиламин, N,N-диизопропилэтиламин, трибутиламин или тому подобное; или пиридин, такой как пиридин, лутидин, коллидин или тому подобное, и, предпочтительно, представляет собой триалкиламин, и, особенно предпочтительно, N,N-диизопропилэтиламин.
Для растворителя, используемого в реакции, указанной выше, нет никаких конкретных ограничений, при условии, что он не оказывает вредного влияния на реакцию, и он может представлять собой, например, галогенированный углеводород, такой как дихлорметан, хлороформ, 1,2-дихлорэтан или тому подобное; простой эфир, такой как диэтиловый эфир, тетрагидрофуран, 1,2-диметоксиэтан или тому подобное; или бензол, такой как бензол, толуол, ксилол или тому подобное, и, предпочтительно, представляет собой галогенированный углеводород, и, особенно предпочтительно, дихлорметан.
Температура, при которой осуществляют реакцию, указанную выше, обычно находится в интервале между -20°C и 40°C, и, предпочтительно, между 0°C и 30°C.
Время, в течение которого осуществляют реакцию, указанную выше, является различным, в зависимости от температуры реакции, исходного продукта, используемого реагента или используемого растворителя, но обычно составляет от 15 минут до 5 часов, и, предпочтительно, от 30 минут до 2 часов.
После того как реакция завершена, целевой продукт этой реакции, если необходимо, может быть выделен из реакционной смеси и очищен таким же образом, как описано в стадии A1.
Стадия B3
Стадия B3 представляет собой способ получения соединения, представленного общей формулой (X), из соединения, представленного общей формулой (IX).
Этот способ может быть осуществлен путем взаимодействия соединения, представленного общей формулой (IX), с основанием в растворителе.
Основание, используемое в реакции, указанной выше, может представлять собой тетра-низший алкиламмоний фторид, такой как фторид тетрабутиламмония, фторид бензилтриметиламмония, фторид бензилтриэтиламмония или тому подобное; три-низший алкиламин, такой как триэтиламин, N,N-диизопропилэтиламин или трибутиламин; пиридин, такой как пиридин, лутидин, коллидин или тому подобное; или гидрид щелочного металла, такой как гидрид лития, гидрид натрия, гидрид калия или тому подобное, и, предпочтительно, представляет собой фторид тетра-низшего алкиламмония, и, особенно предпочтительно, фторид тетрабутиламмония.
Для растворителя, используемого в реакции, указанной выше, нет никаких конкретных ограничений, при условии, что он не оказывает вредного влияния на реакцию, и он может представлять собой, например, простой эфир, такой как диэтиловый эфир, тетрагидрофуран, 1,2-диметоксиэтан или тому подобное; галогенированный углеводород, такой как дихлорметан, хлороформ, 1,2-дихлорэтан или тому подобное; или амид, такой как диметилформамид, диметилацетамид или тому подобное, и, предпочтительно, представляет собой эфир, и, особенно предпочтительно, тетрагидрофуран.
Температура, при которой осуществляют реакцию, указанную выше, обычно находится в интервале между 0°C и 80°C, и, предпочтительно, между 30°C и 60°C.
Время, в течение которого осуществляют реакцию, указанную выше, является различным, в зависимости от температуры реакции, исходного продукта, используемого реагента или используемого растворителя, но обычно составляет от 15 минут до 5 часов, и, предпочтительно, от 30 минут до 2 часов.
После того как реакция завершена, целевой продукт этой реакции, если необходимо, может быть выделен из реакционной смеси и очищен таким же образом, как описано в стадии A1.
Стадия B4
Стадия B4 представляет собой способ получения соединения, представленного общей формулой (II-1), путем удаления защитной группы P из гидроксильной группы соединения, представленного общей формулой (X).
Способ удаления защитной группы P является различным, в зависимости от природы используемой защитной группы, но обычно проводят в соответствии со способом удаления защитной группы у гидроксильной группы, описанным в “Protective Groups in Organic Synthesis, third edition” (ed. by Green, T. W. and Wuts, P. G. M., John Wiley and Sons, Inc., 1999), и тому подобное.
Далее в настоящем документе описан общий способ получения для случая, когда защитная группа представляет собой триалкилсилильную группу. Этот способ осуществляют путем взаимодействия соединения, представленного общей формулой (X), с эквивалентом аниона фтора в растворителе.
Эквивалент аниона фтора, используемый в реакции, указанной выше, может представлять собой, например, фторид тетралкиламмония, такой как фторид тетрабутиламмония или фторид бензилтриметиламмония; комплекс гидрофторид-амин, такой как комплекс гидрофторид-триэтиламин или комплекс гидрофторид-пиридин, и, предпочтительно, представляет собой фторид тетралкиламмония, и, особенно предпочтительно, фторид тетрабутиламмония.
Для растворителя, используемого в реакции, указанной выше, нет никаких конкретных ограничений, при условии, что он не оказывает вредного влияния на реакцию, и он может представлять собой, например, простой эфир, такой как диэтиловый эфир, тетрагидрофуран, 1,2-диметоксиэтан или тому подобное; галогенированный углеводород, такой как дихлорметан, хлороформ, 1,2-дихлорэтан или тому подобное; или амид, такой как N,N-диметилформамид, N,N-диметилацетамид или тому подобное, и, предпочтительно, представляет собой эфир, и, особенно предпочтительно, тетрагидрофуран.
Температура, при которой осуществляют реакцию, указанную выше, обычно находится в интервале между 0°C и 80°C, и, предпочтительно, между 30°C и 60°C.
Время, в течение которого осуществляют реакцию, указанную выше, является различным, в зависимости от температуры реакции, исходного продукта, используемого реагента или используемого растворителя, но обычно составляет от 15 минут до 5 часов, и, предпочтительно, от 30 минут до 2 часов.
После того как реакция завершена, целевой продукт этой реакции, если необходимо, может быть выделен из реакционной смеси и очищен таким же образом, как описано в стадии A1.
Способ C представляет собой способ получения соединений, представленных общей формулой (II-2), которое включено в соединение, представленное общей формулой (II), где заместитель X представляет собой изоксазольное кольцо.
Способ C
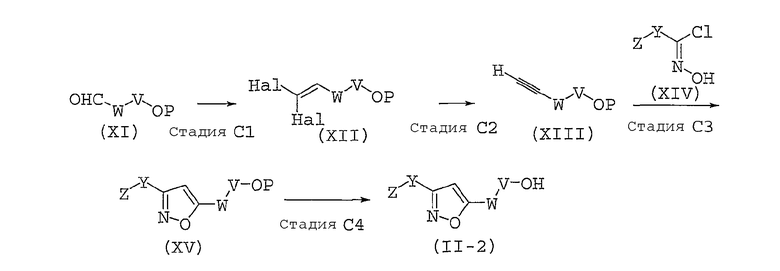
На вышеуказанной реакционной схеме V, P, W, Y и Z имеют те же значения, что указаны здесь выше.
Hal представляет собой атома галогена.
Стадия C1
Стадия C1 представляет собой способ получения соединения, представленного общей формулой (XII), путем преобразования формильной группы соединения, представленного общей формулой (XI), в дигалогенвинильную группу.
Этот способ осуществляют путем взаимодействия соединения, представленного общей формулой (XI), с гем-дигалогенметиленирующим агентом в растворителе.
Гем-дигалогенметиленирующий агент, используемый в этом способе, может представлять собой сочетание фосфина, состоящего из триарилфосфина, включая трифенилфосфин и три-низший алкилфосфин, такой как трибутилфосфин, и тетрагалогенид углерода, такой как тетрахлорид углерода, тетрабромид углерода или тетрайодид углерода; или сочетание ди-низшего алкил (тригалогенированный метил)фосфоната, такого как диэтил (трихлорметил)фосфонат, диэтил (трибромметил)фосфонат, диметил (трихлорметил)фосфонат или диметил (трибромметил)фосфонат, и алкиллитий, такой как метиллитий, н-бутиллитий, втор-бутиллитий или трет-бутиллитий, и, предпочтительно, представляет собой сочетание триарилфосфина и тетрагалогенида углерода, и, особенно предпочтительно, сочетание трифенилфосфина и тетрабромида углерода.
Для растворителя, используемого в реакции, указанной выше, нет никаких конкретных ограничений, при условии, что он не оказывает вредного влияния на реакцию, и он может представлять собой, например, галогенированный углеводород, такой как дихлорметан, хлороформ, 1,2-дихлорэтан или тому подобное; или простой эфир, такой как диэтиловый эфир, тетрагидрофуран, 1,2-диметоксиэтан, диоксан или тому подобное, и, предпочтительно, представляет собой эфир, и, особенно предпочтительно, тетрагидрофуран.
Температура, при которой осуществляют реакцию, указанную выше, обычно находится в интервале между -23°C и 60°C, и, предпочтительно, между 0°C и 30°C.
Время, в течение которого осуществляют реакцию, указанную выше, является различным, в зависимости от температуры реакции, исходного продукта, используемого реагента или используемого растворителя, но обычно составляет от 15 минут до 5 часов, и, предпочтительно, от 30 минут до 3 часов.
После того как реакция завершена, целевой продукт этой реакции, если необходимо, может быть выделен из реакционной смеси и очищен таким же образом, как описано в стадии A1.
Стадия C2
Стадия C2 представляет собой способ получения соединения, представленного общей формулой (XIII), путем преобразования дигалогенвинильной группы соединений, представленных общей формулой (XII), в этинильную группу.
Этот способ осуществляют путем взаимодействия соединения (XII) с алкилметаллом в растворителе.
Алкилметалл, используемый в реакции, указанной выше, может представлять собой, например, алкиллитий, такой как метиллитий, н-бутиллитий, втор-бутиллитий или трет-бутиллитий; или алкилнатрий, такой как метилнатрий, бутилнатрий, втор-бутилнатрий или тому подобное, и, предпочтительно, представляет собой алкиллитий, и, особенно предпочтительно, н-бутиллитий.
Для растворителя, используемого в реакции, указанной выше, нет никаких конкретных ограничений, при условии, что он не оказывает вредного влияния на реакцию, и он может представлять собой, например, простой эфир, такой как диэтиловый эфир, тетрагидрофуран, 1,2-диметоксиэтан, диоксан, или тому подобное; или бензол, такой как бензол, толуол, ксилол, или тому подобное, и, предпочтительно, представляет собой эфир, и, особенно предпочтительно, тетрагидрофуран.
Температура, при которой осуществляют реакцию, указанную выше, обычно находится в интервале между -100°C и 0°C, и, предпочтительно, между -78°C и -45°C.
Время, в течение которого осуществляют реакцию, указанную выше, является различным, в зависимости от температуры реакции, исходного продукта, используемого реагента или используемого растворителя, но обычно составляет от 15 минут до 2 часов, и, предпочтительно, от 30 минут до 1 часа.
После того как реакция завершена, целевой продукт этой реакции, если необходимо, может быть выделен из реакционной смеси и очищен таким же образом, как описано в стадии A1.
Стадия C3
Стадия C3 представляет собой способ получения соединения, представленного общей формулой (XV), путем взаимодействия соединения, представленного общей формулой (XIII), с соединением, представленным общей формулой (XIV).
Этот способ может быть осуществлен путем взаимодействия обоих соединений с основанием в растворителе. Общий способ получения соединений, представленных общей формулой (XIV), описан в литературе, J. Org. Chem., 45, 3916 (1980) and Acta. Chemica, Scandinavica, 426 (1987), и эти соединения легко могут быть синтезированы из хорошо известных соединений.
Основание, используемое в реакции, указанной выше, может представлять собой, например, триалкиламин, такой как триэтиламин, N,N-диизопропилэтиламин, трибутиламин, или тому подобное; или пиридин, такой как пиридин, лутидин, коллидин, или тому подобное, и, предпочтительно, представляет собой триалкиламин, и, особенно предпочтительно, триэтиламин.
Для растворителя, используемого в реакции, указанной выше, нет никаких конкретных ограничений, при условии, что он не оказывает вредного влияния на реакцию, и он может представлять собой, например, простой эфир, такой как диэтиловый эфир, тетрагидрофуран, 1,2-диметоксиэтан, диоксан, или тому подобное; сложный эфир, такой как этилацетат, пропилацетат, бутилацетат или тому подобное; или галогенированный углеводород, такой как дихлорметан, хлороформ, 1,2-дихлорэтан или тому подобное; и, предпочтительно, представляет собой сложный эфир, и, особенно предпочтительно, этилацетат.
Температура, при которой осуществляют реакцию, указанную выше, обычно находится в интервале между -20°C и 80°C, и, предпочтительно, между 0°C и 40°C.
Время, в течение которого осуществляют реакцию, указанную выше, является различным, в зависимости от температуры реакции, исходного продукта, используемого реагента или используемого растворителя, но обычно составляет от 5 часов до 72 часов, и, предпочтительно, от 24 часов до 48 часов.
После того как реакция завершена, целевой продукт этой реакции, если необходимо, может быть выделен из реакционной смеси и очищен таким же образом, как описано в стадии A1.
Стадия C4
Стадия C4 представляет собой способ получения соединения, представленного общей формулой (II-2), путем удаления защитной группы P в гидроксильной группе соединения, представленного общей формулой (XV).
Этот способ может быть проведен таким же образом, как описано на стадии B4 способа B.
Способ получения соединения, представленного общей формулой (VI), используемого в способе B, является различным, в зависимости от природы заместителя W. Далее в настоящем документе описаны общие способы получения, например, способ D для случая, когда W представляет собой тиофеновое кольцо или фурановое кольцо, и способ E для случая, когда W представляет собой группу, имеющую конденсированную структуру, такую как 4,5,6,7-тетрагидробензотиофеновое кольцо или 4,5,6,7-тетрагидробензофурановое кольцо, соответственно.
Способ D
Способ D представляет собой способ получения соединения, представленного общей формулой (VI-1), которое включено в соединение, представленное общей формулой (VI), где заместитель W представляет собой тиофеновое кольцо или фурановое кольцо.
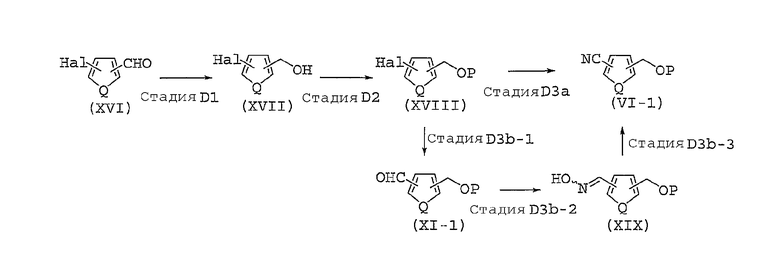
На вышеуказанной реакционной схеме Hal представляет собой атом галогена, как описано выше, и, предпочтительно, представляет собой атом брома или атом йода, Q представляет собой атом кислорода или атом серы, и P представляет собой защитную группу для гидроксильной группы, как описано выше.
Стадия D1
Стадия D1 представляет собой способ получения соединения, представленного общей формулой (XVII), путем преобразования формильной группы соединения, представленного общей формулой (XVI), в гидроксиметильную группу.
Этот способ осуществляют путем взаимодействия соединения (XVI) с восстанавливающим агентом в растворителе. Кроме того, многие соединения, представленные общей формулой (XVI), используемые в качестве исходных соединений, являются коммерчески доступными и могут быть легко синтезированы в соответствии с широко известными способами получения.
Восстанавливающий агент, используемый в реакции, указанной выше, может представлять собой, например, гидрид алюминия, такой как литий алюминий гидрид, натрий алюминий гидрид или диизобутилалюминий гидрид; боргидрид, такой как литий боргидрид, боргидрид натрия или боран, и, предпочтительно, представляет собой боргидрид, и, особенно предпочтительно, боргидрид натрия.
Для растворителя, используемого в реакции, указанной выше, нет никаких конкретных ограничений, при условии, что он не оказывает вредного влияния на реакцию, и он может представлять собой, например, простой эфир, такой как диэтиловый эфир, тетрагидрофуран, 1,2-диметоксиэтан, диоксан, или тому подобное; или спирт, такой как метанол, этанол, изопропанол, или тому подобное, и, предпочтительно, представляет собой спирт, и, особенно предпочтительно, метанол.
Температура, при которой осуществляют реакцию, указанную выше, обычно находится в интервале между -23°C и 50°C, и, предпочтительно, между 0°C и 30°C.
Время, в течение которого осуществляют реакцию, указанную выше, является различным, в зависимости от температуры реакции, исходного продукта, используемого реагента или используемого растворителя, но обычно составляет от 15 минут до 2 часов, и, предпочтительно, от 30 минут до 1 часа.
После того как реакция завершена, целевой продукт этой реакции, если необходимо, может быть выделен из реакционной смеси и очищен таким же образом, как описано в стадии A1.
Стадия D2
Стадия D2 представляет собой способ получения соединения, представленного общей формулой (XVIII), путем защиты гидроксильной группы в соединении, представленном общей формулой (XVII), путем введения подходящей защитной группы для гидроксильной группы. Защитная группа, используемая в этой реакции, особенно никак не ограничивается, при условии, что она не оказывает отрицательного воздействия на реакцию в последующих способах и, кроме того, легко может быть удалена, и, предпочтительно, представляет собой триалкилсилан. Общий способ получения для того случая, когда в качестве защитной группы используется триалкилсилан, описан далее в настоящем документе.
Этот способ может быть проведен путем взаимодействия соединения, представленного общей формулой (XVII), с силилирующим агентом в присутствии подходящего основания в растворителе.
Силилирующий агент, используемый в реакции, указанной выше, может представлять собой, например, триалкилсилил хлорид, такой как триэтилсилил хлорид, трет-бутилдиметилсилил хлорид, триизопропилсилил хлорид или трет-бутилдифенилсилил хлорид; или триалкилсилил трифторметансульфонат, такой как триэтилсилил трифторметансульфонат, трет-бутилдиметилсилил трифторметансульфонат, триизопропилсилил трифторметансульфонат или трет-бутилдифенилсилил трифторметансульфонат, и, предпочтительно, представляет собой триалкилсилил хлорид, и, особенно предпочтительно, трет-бутилметилсилил хлорид.
Основание, используемое в реакции, указанной выше, может представлять собой, например, триалкиламин, такой как триэтиламин, N,N-диизопропилэтиламин или тому подобное; имидазол, такой как имидазол, 2-метилимидазол или тому подобное; или пиридин, такой как пиридин, лутидин, коллидин или тому подобное, и, предпочтительно, представляет собой имидазол, и, особенно предпочтительно, имидазол.
Для растворителя, используемого в реакции, указанной выше, нет никаких конкретных ограничений, при условии, что он не оказывает вредного влияния на реакцию, и он может представлять собой, например, простой эфир, такой как диэтиловый эфир, тетрагидрофуран, 1,2-диметоксиэтан, диоксан или тому подобное; галогенированный углеводород, такой как дихлорметан, 1,2-дихлорэтан, хлороформ или тому подобное; или амид, такой как N,N-диметилформамид, N,N-диметилацетамид или тому подобное, и, предпочтительно, представляет собой амид, и, особенно предпочтительно, N,N-диметилформамид.
Температура, при которой осуществляют реакцию, указанную выше, обычно находится в интервале между -23°C и 50°C, и, предпочтительно, между 0°C и 30°C.
Время, в течение которого осуществляют реакцию, указанную выше, является различным, в зависимости от температуры реакции, исходного продукта, используемого реагента или используемого растворителя, но обычно составляет от 30 минут до 4 часов, и, предпочтительно, от 1 часа до 3 часов.
После того как реакция завершена, целевой продукт этой реакции, если необходимо, может быть выделен из реакционной смеси и очищен таким же образом, как описано в стадии A1.
Стадия D3
Стадия D3 представляет собой способ получения соединения, представленного общей формулой (VI-1), путем преобразования атома галогена соединения, представленного общей формулой (XVIII), в нитрильную группу.
Этот способ может быть проведен в соответствии с двумя способами, один из которых представляет собой способ прямого преобразования атома галогена соединения, имеющего общую формулу (XVIII), в нитрильную группу (стадия D3a), а другой представляет собой способ преобразования соединения (XVIII) в соединение, содержащее формильную группу (XI-1), с последующим преобразованием формильной группы в нитрильную группу посредством реакции оксимирования и реакции дегидратации (стадия D3b). Далее в настоящем документе эти способы описаны отдельно.
Стадия D3a
Стадия D3a представляет собой способ получения соединения, представленного общей формулой (VI-1), путем преобразования атома галогена соединения, представленного общей формулой (XVIII), в нитрильную группу.
Этот способ может быть осуществлен путем взаимодействия соединения, представленного общей формулой (XVIII), с подходящим агентом цианирования в растворителе.
Агент цианирования, используемый в этой реакции, может представлять собой, например, соединение меди, такое как цианид меди; или сочетание палладиевого катализатора, такого как тетракис(трифенилфосфина)палладий, дихлорбис(трифенилфосфина)палладий, или тому подобное, и цианида металла, такого как цианид цинка, триметилсилил цианид или цианид трибутилолова, и, предпочтительно, представляет собой цианид меди или сочетание тетракис(трифенилфосфина)палладия и цианида цинка, и, особенно предпочтительно, цианид меди.
Для растворителя, используемого в реакции, указанной выше, нет никаких конкретных ограничений, при условии, что он не оказывает вредного влияния на реакцию, и он может представлять собой, например, простой эфир, такой как диэтиловый эфир, тетрагидрофуран, 1,2-диметоксиэтан, диоксан или тому подобное; или амид, такой как N,N-диметилформамид, N,N-диметилацетамид или тому подобное, и, предпочтительно, представляет собой амид, и, особенно предпочтительно, N,N-диметилформамид.
Температура, при которой осуществляют реакцию, указанную выше, обычно находится в интервале между 20°C и 180°C, и, предпочтительно, между 100°C и 140°C.
Время, в течение которого осуществляют реакцию, указанную выше, является различным, в зависимости от температуры реакции, исходного продукта, используемого реагента или используемого растворителя, но обычно составляет от 2 часов до 12 часов, и, предпочтительно, от 3 часов до 10 часов.
После того как реакция завершена, целевой продукт этой реакции, если необходимо, может быть выделен из реакционной смеси и очищен таким же образом, как описано в стадии A1.
Стадия D3b
Стадия D3b-1
Стадия D3b-1 представляет собой способ получения соединения, представленного общей формулой (XI-1), путем преобразования атома галогена соединения, представленного общей формулой (XVIII), в формильную группу.
Этот способ также может быть использован в качестве общего способа получения соединения, представленного общей формулой (XI), которое используется в качестве исходного продукта в способе C, описанного здесь выше.
Этот способ осуществляют проведением обмена галоген-металл в соединении, представленном общей формулой (XVIII), с последующим взаимодействием полученного продукта с подходящим формилирующим агентом в растворителе.
Агент металлирования, используемый в реакции, указанной выше, может представлять собой, например, металл, такой как металлический литий, металлический магний, металлический цинк или тому подобное; или алкиллитий, такой как н-бутиллитий, втор-бутиллитий, трет-бутиллитий или тому подобное; и, предпочтительно, представляет собой алкиллитий, и, особенно предпочтительно, н-бутиллитий.
Формилирующий агент, используемый в этой реакции, может представлять собой формамид, такой как N,N-диметилформамид, N-метилформанилид, N-формилпиперидин или тому подобное; формиат, такой как метилформиат, этилформиат, пропилформиат или тому подобное, и, предпочтительно, представляет собой формамид, и, особенно предпочтительно, N,N-диметилформамид.
Для растворителя, используемого в реакции, указанной выше, нет никаких конкретных ограничений, при условии, что он не оказывает вредного влияния на реакцию, и он может представлять собой, например, простой эфир, такой как диэтиловый эфир, тетрагидрофуран, 1,2-диметоксиэтан, диоксан, или тому подобное; или ароматический углеводород, такой как толуол, ксилол или тому подобное, и, предпочтительно, представляет собой эфир, и, особенно предпочтительно, тетрагидрофуран.
Температура, при которой осуществляют реакцию, указанную выше, обычно находится в интервале между -100°C и 0°C, и, предпочтительно, между -78°C и -45°C.
Время, в течение которого осуществляют реакцию, указанную выше, является различным, в зависимости от температуры реакции, исходного продукта, используемого реагента или используемого растворителя, но обычно составляет от 15 минут до 2 часов, и, предпочтительно, от 30 минут до 1 часа.
После того как реакция завершена, целевой продукт этой реакции, если необходимо, может быть выделен из реакционной смеси и очищен таким же образом, как описано в стадии A1.
Стадия D3b-2
Стадия D3b-2 представляет собой способ получения соединения, представленного общей формулой (XIX), путем преобразования формильной группы соединения, представленного общей формулой (XI-1), в оксимную группу.
Этот способ может быть осуществлен путем взаимодействия соединения, представленного общей формулой (XI-1), с гидроксиламином или гидроксиламиновым эквивалентом в растворителе.
Гидроксиламиновый эквивалент может представлять собой раствор гидроксиламина, такой как водный раствор гидроксиламина, смешанный раствор гидроксиламина и метанола, смешанный раствор гидроксиламина и этанола или тому подобное; или сочетание соли гидроксиламина, такой как гидрохлорид гидроксиламина, фосфат гидроксиламина, сульфат гидроксиламина или тому подобное, и три-низшего алкиламина, такого как триэтиламин, N,N-диизопропилэтиламин или трибутиламин, или карбоната щелочного металла, такого как гидрокарбонат натрия, гидрокарбонат калия, карбонат натрия, карбонат калия, или тому подобное, и, предпочтительно, представляет собой сочетание соли гидроксиламина и три-низшего алкиламина, и, особенно предпочтительно, сочетание гидрохлорида гидроксиламина и триэтиламина.
Для растворителя, используемого в реакции, указанной выше, нет никаких конкретных ограничений, при условии, что он не оказывает вредного влияния на реакцию, и он может представлять собой, например, галогенированный углеводород, такой как дихлорметан, хлороформ, 1,2-дихлорэтан или тому подобное; или эфир, такой как тетрагидрофуран, 1,2-диметоксиэтан или тому подобное, и, предпочтительно, представляет собой галогенированный углеводород, и, особенно предпочтительно, дихлорметан.
Температура, при которой осуществляют реакцию, указанную выше, обычно находится в интервале между 0°C и 80°C, и, предпочтительно, между 20°C и 60°C.
Время, в течение которого осуществляют реакцию, указанную выше, является различным, в зависимости от температуры реакции, исходного продукта, используемого реагента или используемого растворителя, но обычно составляет от 30 минут до 5 часов, и, предпочтительно, от 1 часа до 3 часов.
После того как реакция завершена, целевой продукт этой реакции, если необходимо, может быть выделен из реакционной смеси и очищен таким же образом, как описано в стадии A1.
Стадия D3b-3
Стадия D3b-3 представляет собой способ получения соединения, представленного общей формулой (VI-1), путем преобразования оксимной группы соединения, представленного общей формулой (XIX), в нитрильную группу.
Этот способ может быть осуществлен путем взаимодействия соединения, представленного общей формулой (XIX), с подходящим дегидратирующим агентом в растворителе.
Дегидратирующий агент, используемый в реакции, указанной выше, может представлять собой карбодиимид, такой как N,N'-дициклогексилкарбодиимид, N,N'-диизопропилкарбодиимид, 1-этил-3-(3'-диметиламинопропил)карбодиимид (WSCI) или тому подобное; соединение фосфора, такое как пентаоксид дифосфора или оксихлорид фосфора; или тионилхлорид, или тому подобное, и, предпочтительно, представляет собой карбодиимид, и, особенно предпочтительно, N,N'-дициклогексилкарбодиимид.
Для растворителя, используемого в реакции, указанной выше, нет никаких конкретных ограничений, при условии, что он не оказывает вредного влияния на реакцию, и он может представлять собой, например, галогенированный углеводород, такой как дихлорметан, хлороформ, 1,2-дихлорэтан или тому подобное; или эфир, такой как тетрагидрофуран, 1,2-диметоксиэтан, диоксан или тому подобное; или ароматический углеводород, такой как бензол, толуол, ксилол или тому подобное, и, предпочтительно, представляет собой ароматический углеводород, и, особенно предпочтительно, толуол.
Температура, при которой осуществляют реакцию, указанную выше, обычно находится в интервале между 20°C и 150°C, и, предпочтительно, между 60°C и 110°C.
Время, в течение которого осуществляют реакцию, указанную выше, является различным, в зависимости от температуры реакции, исходного продукта, используемого реагента или используемого растворителя, но обычно составляет от 2 часов до 24 часов, и, предпочтительно, от 6 часов до 12 часов.
После того как реакция завершена, целевой продукт этой реакции, если необходимо, может быть выделен из реакционной смеси и очищен таким же образом, как описано в стадии A1.
Способ E
Способ E представляет собой способ получения соединения, представленного общей формулой (VI-2), которое включено в соединение, представленное общей формулой (VI), где заместитель W представляет собой группу, имеющую конденсированную структуру, такую как 4,5,6,7-тетрагидробензотиофеновое кольцо или 4,5,6,7-тетрагидробензофурановое кольцо.
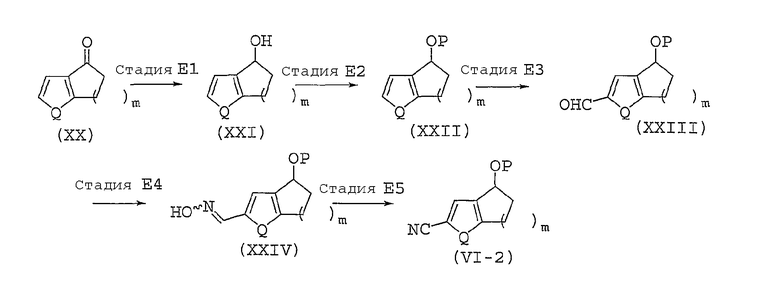
На вышеуказанной реакционной схеме P и Q имеют те же значения, что указаны здесь выше, и m представляет собой целое число, равное 1 или 2.
Стадия E1
Стадия E1 представляет собой способ получения соединения, представленного общей формулой (XXI), путем преобразования карбонильной группы соединения, представленного общей формулой (XX), в гидроксильную группу.
Этот способ может быть осуществлен путем взаимодействия соединения, представленного общей формулой (XX), с подходящим восстанавливающим агентом в растворителе. Кроме того, соединения, представленные общей формулой (XX), используемые в качестве исходных соединений, соединения, где m равно 2, являются коммерчески доступными и могут быть легко получены. Кроме того, соединения, где m равно 1, могут быть легко синтезированы в соответствии со способом(ами) получения, описанным в литературе, J. Am. Chem. Soc., 127 (10), 3248-3249 (2005).
Восстанавливающий агент, используемый в реакции, указанной выше, может представлять собой, например, алюминий гидрид, такой как литий алюминий гидрид, натрий алюминий гидрид или диизобутилалюминий гидрид; боргидрид, такой как литий боргидрид, боргидрид натрия, или боран, и, предпочтительно, представляет собой боргидрид, и, особенно предпочтительно, боргидрид натрия.
Для растворителя, используемого в реакции, указанной выше, нет никаких конкретных ограничений, при условии, что он не оказывает вредного влияния на реакцию, и он может представлять собой, например, простой эфир, такой как диэтиловый эфир, тетрагидрофуран, 1,2-диметоксиэтан, диоксан или тому подобное; или спирт, такой как метанол, этанол, изопропанол или тому подобное, и, предпочтительно, представляет собой спирт, и, особенно предпочтительно, метанол.
Температура, при которой осуществляют реакцию, указанную выше, обычно находится в интервале между -23°C и 50°C, и, предпочтительно, между 0°C и 30°C.
Время, в течение которого осуществляют реакцию, указанную выше, является различным, в зависимости от температуры реакции, исходного продукта, используемого реагента или используемого растворителя, но обычно составляет от 15 минут до 2 часов, и, предпочтительно, от 30 минут до 1 часа.
После того как реакция завершена, целевой продукт этой реакции, если необходимо, может быть выделен из реакционной смеси и очищен таким же образом, как описано в стадии A1.
Стадия E2
Стадия E2 представляет собой способ получения соединения, представленного общей формулой (XXII), путем защиты гидроксильной группы в соединении, представленном общей формулой (XXI), путем введения подходящей защитной группы для гидроксильной группы. Защитная группа, используемая в этой реакции, особенно никак не ограничивается, при условии, что она не оказывает отрицательного воздействия на реакцию в последующих способах и, кроме того, легко может быть удалена, и, предпочтительно, представляет собой триалкилсилан. Общий способ получения для того случая, когда в качестве защитной группы используется триалкилсилан, описан далее в настоящем документе.
Этот способ может быть проведен путем взаимодействия соединения, представленного общей формулой (XXI), с силилирующим агентом в присутствии подходящего основания в растворителе.
Силилирующий агент, используемый в реакции, указанной выше, может представлять собой, например, триалкилсилил хлорид, такой как триэтилсилил хлорид, трет-бутилдиметилсилил хлорид, триизопропилсилил хлорид или трет-бутилдифенилсилил хлорид; или триалкилсилил трифторметансульфонат, такой как триэтилсилил трифторметансульфонат, трет-бутилдиметилсилил трифторметансульфонат, триизопропилсилил трифторметансульфонат или трет-бутилдифенилсилил трифторметансульфонат, и, предпочтительно, представляет собой триалкилсилил хлорид, и, особенно предпочтительно, трет-бутилдифенилсилил хлорид.
Основание, используемое в реакции, указанной выше, может представлять собой, например, триалкиламин, такой как триэтиламин, N,N-диизопропилэтиламин или тому подобное; имидазол, такой как имидазол, 2-метилимидазол или тому подобное; или пиридин, такой как пиридин, лутидин, коллидин или тому подобное и, предпочтительно, представляет собой имидазол, и, особенно предпочтительно, имидазол.
Для растворителя, используемого в реакции, указанной выше, нет никаких конкретных ограничений, при условии, что он не оказывает вредного влияния на реакцию, и он может представлять собой, например, простой эфир, такой как диэтиловый эфир, тетрагидрофуран, 1,2-диметоксиэтан, диоксан или тому подобное; галогенированный углеводород, такой как дихлорметан, 1,2-дихлорэтан или хлороформ; или амид, такой как N,N-диметилформамид, N,N-диметилацетамид или тому подобное; и, предпочтительно, представляет собой амид, и, особенно предпочтительно, N,N-диметилформамид.
Температура, при которой осуществляют реакцию, указанную выше, обычно находится в интервале между -23°C и 100°C, и, предпочтительно, между 0°C и 60°C.
Время, в течение которого осуществляют реакцию, указанную выше, является различным, в зависимости от температуры реакции, исходного продукта, используемого реагента или используемого растворителя, но обычно составляет от 30 минут до 4 часов, и, предпочтительно, от 1 часа до 3 часов.
После того как реакция завершена, целевой продукт этой реакции, если необходимо, может быть выделен из реакционной смеси и очищен таким же образом, как описано в стадии A1.
Стадия E3
Стадия E3 представляет собой способ получения соединения, представленного общей формулой (XXIII), путем введения формильной группы в соединение, представленное общей формулой (XXII).
Этот способ может быть осуществлен путем взаимодействия соединения, представленного общей формулой (XXII), с сильным основанием, с последующим взаимодействием полученного продукта с подходящим формилирующим агентом в растворителе.
Сильное основание, используемое в реакции, указанной выше, может представлять собой, например, алкиллитий, такой как н-бутиллитий, втор-бутиллитий или трет-бутиллитий; или амид щелочного металла, такой как диизопропиламид лития, гексаметилдисилазид лития, гексаметилдисилазид натрия, гексаметилдисилазид калия или тому подобное, и, предпочтительно, представляет собой алкиллитий, и, особенно предпочтительно, н-бутиллитий.
Формилирующий агент, используемый в этой реакции, может представлять собой формамид, такой как N,N-диметилформамид, N-метилформанилид, N-формилпиперидин или тому подобное; формиат, такой как метилформиат, этилформиат, пропилформиат или тому подобное, и, предпочтительно, представляет собой формамид, и, особенно предпочтительно, N,N-диметилформамид.
Для растворителя, используемого в реакции, указанной выше, нет никаких конкретных ограничений, при условии, что он не оказывает вредного влияния на реакцию, и он может представлять собой, например, простой эфир, такой как диэтиловый эфир, тетрагидрофуран, 1,2-диметоксиэтан, диоксан или тому подобное; или ароматический углеводород, таким как толуол, ксилол или тому подобное, и, предпочтительно, представляет собой эфир, и, особенно предпочтительно, тетрагидрофуран.
Температура, при которой осуществляют реакцию, указанную выше, обычно находится в интервале между -100°C и 0°C, и, предпочтительно, между -78°C и 0°C.
Время, в течение которого осуществляют реакцию, указанную выше, является различным, в зависимости от температуры реакции, исходного продукта, используемого реагента или используемого растворителя, но обычно составляет от 15 минут до 4 часов, и, предпочтительно, от 1 часа до 3 часов.
После того как реакция завершена, целевой продукт этой реакции, если необходимо, может быть выделен из реакционной смеси и очищен таким же образом, как описано в стадии A1.
Стадия E4
Стадия E4 представляет собой способ получения соединения, представленного общей формулой (XXIV), путем преобразования формильной группы соединения, представленного общей формулой (XXIII), в оксимную группу.
Этот способ может быть осуществлен путем взаимодействия соединения, представленного общей формулой (XXIII), с гидроксиламином или гидроксиламиновым эквивалентом в растворителе, и может быть проведен таким же образом, как описано в стадии D3b-2.
Стадия E5
Стадия E5 представляет собой способ получения соединения, представленного общей формулой (VI-2), путем преобразования оксимной группы соединения, представленного общей формулой (XXIV), в нитрильную группу.
Этот способ может быть осуществлен путем взаимодействия соединения, представленного общей формулой (XXIV), с подходящим дегидратирующим агентом в растворителе, и может быть проведен таким же образом, как описано в стадии D3b-2.
Способ F
Способ F представляет собой способ получения соединения, представленного общей формулой (VI-3), которое включено в соединение, представленное общей формулой (VI), где заместитель W представляет собой тиофеновое кольцо или фурановое кольцо, и, кроме того, эти кольца замещены алкильной группой в качестве заместителя R.
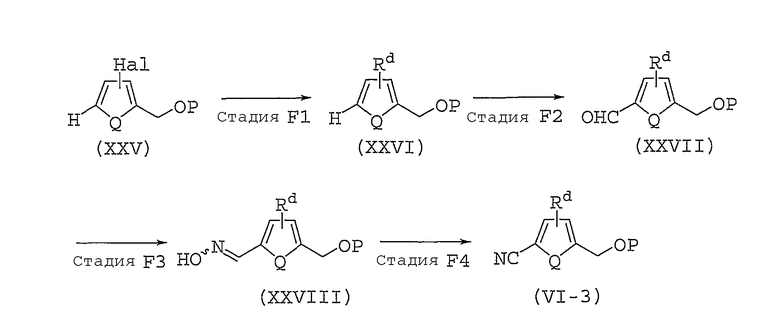
На вышеуказанной реакционной схеме Hal представляет собой атом галогена, как описано выше, и, предпочтительно, представляет собой атом брома или атом йода, Q представляет собой атом кислорода или атом серы, P представляет собой защитную группу для гидроксильной группы, как описано выше, и Rd представляет собой C1-C6 алкильную группу.
Стадия F1
Стадия F1 представляет собой способ получения соединения, представленного общей формулой (XXVI), путем преобразования атома галогена соединения, представленного общей формулой (XXV), в алкильную группу.
Этот способ может быть осуществлен путем взаимодействия соединения, представленного общей формулой (XXV), с алкилирующим агентом в растворителе. Кроме того, многие соединения, представленные общей формулой (XXV), используемые в качестве исходных соединений, могут быть синтезированы в соответствии со способом D, описанным здесь выше.
Алкилирующий агент, используемый в реакции, указанной выше, может представлять собой, например, сочетание никелевого катализатора, такого как [1,3-бис(дифенилфосфино)пропан]дихлорникель, бис(трифенилфосфина)дихлорникель или [1,1'-бис(дифенилфосфино)ферроцена]дихлорникель, и реагента Гриньяра, такого как алкилмагний хлорид, алкилмагний бромид или алкилмагний йодид; или сочетание палладиевого катализатора, такого как тетракис(трифенилфосфина)палладий или дихлорбис(трифенилфосфина)палладий, и алкилборной кислоты, такой как моно-алкилборная кислота, сложный эфир моно-алкилборной кислоты, диалкилборной кислоты или сложный эфир диалкилборной кислоты, и, предпочтительно, представляет собой сочетание никелевого катализатора и реагента Гриньяра, и, особенно предпочтительно, сочетание [1,3-бис(дифенилфосфино)пропан]дихлорникеля и алкилмагний бромида.
Для растворителя, используемого в реакции, указанной выше, нет никаких конкретных ограничений, при условии, что он не оказывает вредного влияния на реакцию, и он может представлять собой, например, простой эфир, такой как диэтиловый эфир, тетрагидрофуран, 1,2-диметоксиэтан, диоксан или тому подобное; или ароматический углеводород, таким как бензол, толуол или ксилол, и, предпочтительно, представляет собой простой эфир, и, особенно предпочтительно, тетрагидрофуран.
Температура, при которой осуществляют реакцию, указанную выше, обычно находится в интервале между -23°C и 60°C, и, предпочтительно, между -10°C и 40°C.
Время, в течение которого осуществляют реакцию, указанную выше, является различным, в зависимости от температуры реакции, исходного продукта, используемого реагента или используемого растворителя, но обычно составляет от 15 минут до 4 часов, и, предпочтительно, от 1 часа до 2 часов.
После того как реакция завершена, целевой продукт этой реакции, если необходимо, может быть выделен из реакционной смеси и очищен таким же образом, как описано в стадии A1.
Стадия F2
Стадия F2 представляет собой способ получения соединения, представленного общей формулой (XXVII), путем преобразования атома водорода соединения, представленного общей формулой (XXVI), в формильную группу.
Этот способ может быть осуществлен путем взаимодействия соединения, представленного общей формулой (XXVI), с подходящим основанием, с последующим взаимодействием полученного продукта с формилирующим агентом в растворителе.
Основание, используемое в реакции, указанной выше, может представлять собой, например, алкиллитий, такой как н-бутиллитий, втор-бутиллитий или трет-бутиллитий; или амид металла, такой как литий диизопропиламид лития, гексаметилдисилазид лития или гексаметилдисилазид калия, и, предпочтительно, представляет собой алкиллитий, и, особенно предпочтительно, н-бутиллитий.
Формилирующий агент, используемый в этой реакции, может представлять собой формамид, такой как N,N-диметилформамид, 1-формилпирролидин или 1-формилпиперидин; или изоцианид, такой как трет-бутил изоцианид, 1,1,3,3-тетраметилбутил изоцианид или тому подобное, и, предпочтительно, представляет собой формамид, и, особенно предпочтительно, N,N-диметилформамид.
Для растворителя, используемого в реакции, указанной выше, нет никаких конкретных ограничений, при условии, что он не оказывает вредного влияния на реакцию, и он может представлять собой, например, простой эфир, такой как диэтиловый эфир, тетрагидрофуран, 1,2-диметоксиэтан, диоксан или тому подобное; или ароматический углеводород, таким как бензол, толуол или ксилол, и, предпочтительно, представляет собой простой эфир, и, особенно предпочтительно, тетрагидрофуран.
Температура, при которой осуществляют реакцию, указанную выше, обычно находится в интервале между -78°C и комнатной температурой, и, предпочтительно, между -78°C и 0°C.
Время, в течение которого осуществляют реакцию, указанную выше, является различным, в зависимости от температуры реакции, исходного продукта, используемого реагента или используемого растворителя, но обычно составляет от 30 минут до 4 часов, и, предпочтительно, от 1 часа до 3 часов.
После того как реакция завершена, целевой продукт этой реакции, если необходимо, может быть выделен из реакционной смеси и очищен таким же образом, как описано в стадии A1.
Стадия F3
Стадия F3 представляет собой способ получения соединения, представленного общей формулой (XXVIII), путем преобразования формильной группы соединения, представленного общей формулой (XXVII), в оксимную группу.
Этот способ может быть осуществлен путем взаимодействия соединения, представленного общей формулой (XXVII), с гидроксиламином или гидроксиламиновым эквивалентом в растворителе.
Гидроксиламиновый эквивалент может представлять собой раствор гидроксиламина, такой как водный раствор гидроксиламина, смешанный раствор гидроксиламина и метанола, смешанный раствор гидроксиламина и этанола, или тому подобное; или сочетание соли гидроксиламина, такой как гидрохлорид гидроксиламина, фосфат гидроксиламина, сульфат гидроксиламина или тому подобное, и три-низшего алкиламина, такого как триэтиламин, N,N-диизопропилэтиламин или трибутиламин, или карбоната щелочного металла, такого как гидрокарбонат натрия, гидрокарбонат калия, карбонат натрия, карбонат калия или тому подобное, и, предпочтительно, представляет собой сочетание соли гидроксиламина и три-низшего алкиламина, и, особенно предпочтительно, сочетание гидрохлорида гидроксиламина и триэтиламина.
Для растворителя, используемого в реакции, указанной выше, нет никаких конкретных ограничений, при условии, что он не оказывает вредного влияния на реакцию, и он может представлять собой, например, галогенированный углеводород, такой как дихлорметан, хлороформ, 1,2-дихлорэтан или тому подобное; или простой эфир, такой как тетрагидрофуран, 1,2-диметоксиэтан или тому подобное; или спирт, такой как метанол, этанол или изопропанол, и, предпочтительно, представляет собой галогенированный углеводород, и, особенно предпочтительно, дихлорметан.
Температура, при которой осуществляют реакцию, указанную выше, обычно находится в интервале между 0°C и 80°C, и, предпочтительно, между 20°C и 60°C.
Время, в течение которого осуществляют реакцию, указанную выше, является различным, в зависимости от температуры реакции, исходного продукта, используемого реагента или используемого растворителя, но обычно составляет от 30 минут до 5 часов, и, предпочтительно, от 1 часа до 3 часов.
После того как реакция завершена, целевой продукт этой реакции, если необходимо, может быть выделен из реакционной смеси и очищен таким же образом, как описано в стадии A1.
Стадия F4
Стадия F4 представляет собой способ получения соединения, представленного общей формулой (VI-3), путем преобразования оксимной группы соединения, представленного общей формулой (XXVIII), в нитрильную группу.
Этот способ может быть осуществлен путем взаимодействия соединения, представленного общей формулой (XXVIII), с подходящим дегидратирующим агентом в растворителе.
Дегидратирующий агент, используемый в реакции, указанной выше, может представлять собой карбодиимид, такой как N,N'-дициклогексилкарбодиимид, N,N'-диизопропилкарбодиимид, 1-этил-3-(3'-диметиламинопропил)карбодиимид (WSCI) или тому подобное; соединение фосфора, такое как пентаоксид дифосфора или оксихлорид фосфора; или тионилхлорид или тому подобное, и, предпочтительно, представляет собой карбодиимид, и, особенно предпочтительно, N,N'-дициклогексилкарбодиимид.
Для растворителя, используемого в реакции, указанной выше, нет никаких конкретных ограничений, при условии, что он не оказывает вредного влияния на реакцию, и он может представлять собой, например, галогенированный углеводород, такой как дихлорметан, хлороформ, 1,2-дихлорэтан или тому подобное; или простой эфир, такой как тетрагидрофуран, 1,2-диметоксиэтан, диоксан, или тому подобное; или ароматический углеводород, такой как бензол, толуол, ксилол или тому подобное, и, предпочтительно, представляет собой ароматический углеводород, и, особенно предпочтительно, толуол.
Температура, при которой осуществляют реакцию, указанную выше, обычно находится в интервале между 20°C и 150°C, и, предпочтительно, между 60°C и 110°C.
Время, в течение которого осуществляют реакцию, указанную выше, является различным, в зависимости от температуры реакции, исходного продукта, используемого реагента или используемого растворителя, но обычно составляет от 2 часов до 24 часов, и, предпочтительно, от 6 часов до 12 часов.
После того как реакция завершена, целевой продукт этой реакции, если необходимо, может быть выделен из реакционной смеси и очищен таким же образом, как описано в стадии A1.
Способ G
Способ G представляет собой способ получения соединения, представленного общей формулой (VI-4), которое включено в соединение, представленное общей формулой (VI), где заместитель W представляет собой пиридиновое кольцо.
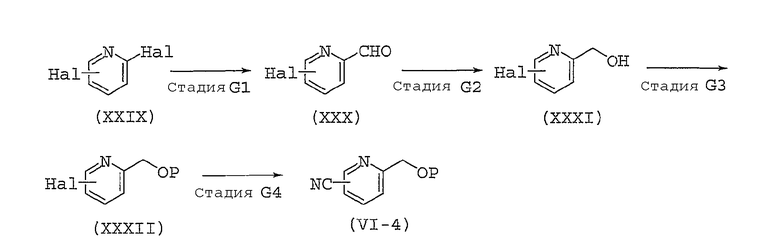
На вышеуказанной реакционной схеме Hal представляет собой атом галогена, как описано выше, и, предпочтительно, представляет собой атом брома или атом йода, и P представляет собой защитную группу для гидроксильной группы, как описано выше.
Стадия G1
Стадия G1 представляет собой способ получения соединения, представленного общей формулой (XXX), путем преобразования атома галогена во 2-м положении соединения, представленного общей формулой (XXIX), в формильную группу.
Этот способ осуществляют проведением обмена галоген-металл в соединении, представленном общей формулой (XXIX), с последующим взаимодействием полученного продукта с подходящим агентом в растворителе.
Агент металлирования, используемый в реакции, указанной выше, может представлять собой, например, металл, такой как металлический литий, металлический магний, металлический цинк или тому подобное; или алкиллитий, такой как н-бутиллитий, втор-бутиллитий, трет-бутиллитий или тому подобное; и, предпочтительно, представляет собой алкиллитий, и, особенно предпочтительно, н-бутиллитий.
Формилирующий агент, используемый в этой реакции, может представлять собой формамид, такой как N,N-диметилформамид, N-метилформанилид, N-формилпиперидин или тому подобное; или формиат, такой как метилформиат, этилформиат, пропилформиат или тому подобное, и, предпочтительно, представляет собой формамид, и, особенно предпочтительно, N,N-диметилформамид.
Для растворителя, используемого в реакции, указанной выше, нет никаких конкретных ограничений, при условии, что он не оказывает вредного влияния на реакцию, и он может представлять собой, например, простой эфир, такой как диэтиловый эфир, тетрагидрофуран, 1,2-диметоксиэтан, диоксан или тому подобное; или ароматический углеводород, такой как толуол, ксилол или тому подобное, и, предпочтительно, представляет собой ароматический углеводород, и, особенно предпочтительно, толуол.
Температура, при которой осуществляют реакцию, указанную выше, обычно находится в интервале между -100°C и 0°C, и, предпочтительно, между -78°C и -45°C.
Время, в течение которого осуществляют реакцию, указанную выше, является различным, в зависимости от температуры реакции, исходного продукта, используемого реагента или используемого растворителя, но обычно составляет от 15 минут до 5 часов, и, предпочтительно, от 30 минут до 3 часов.
После того как реакция завершена, целевой продукт этой реакции, если необходимо, может быть выделен из реакционной смеси и очищен таким же образом, как описано в стадии A1.
Стадия G2
Стадия G2 представляет собой способ получения соединения, представленного общей формулой (XXXI), путем преобразования формильной группы соединения, представленного общей формулой (XXX), в гидроксиметильную группу.
Этот способ может быть осуществлен путем взаимодействия соединения, представленного общей формулой (XXX), с восстанавливающим агентом в растворителе.
Восстанавливающий агент, используемый в реакции, указанной выше, может быть, например, гидрид алюминия, такой как литий алюминий гидрид, натрий алюминий гидрид или диизобутилалюминий гидрид; боргидрид, такой как литий боргидрид, боргидрид натрия или боран, и, предпочтительно, представляет собой боргидрид, и, особенно предпочтительно, боргидрид натрия.
Для растворителя, используемого в реакции, указанной выше, нет никаких конкретных ограничений, при условии, что он не оказывает вредного влияния на реакцию, и он может представлять собой, например, простой эфир, такой как диэтиловый эфир, тетрагидрофуран, 1,2-диметоксиэтан, диоксан, или тому подобное; или спирт, такой как метанол, этанол, изопропанол, или тому подобное, и, предпочтительно, представляет собой спирт, и, особенно предпочтительно, метанол.
Температура, при которой осуществляют реакцию, указанную выше, обычно находится в интервале между -23°C и 50°C, и, предпочтительно, между 0°C и 30°C.
Время, в течение которого осуществляют реакцию, указанную выше, является различным, в зависимости от температуры реакции, исходного продукта, используемого реагента или используемого растворителя, но обычно составляет от 15 минут до 2 часов, и, предпочтительно, от 30 минут до 1 часа.
После того как реакция завершена, целевой продукт этой реакции, если необходимо, может быть выделен из реакционной смеси и очищен таким же образом, как описано в стадии A1.
Стадия G3
Стадия G3 представляет собой способ получения соединений, представленных общей формулой (XXXII), путем защиты гидроксильной группы в соединении, представленном общей формулой (XXXI), путем введения подходящей защитной группы для гидроксильной группы. Защитная группа, используемая в этой реакции, особенно никак не ограничивается, при условии, что она не оказывает отрицательного воздействия на реакцию в последующих способах и, кроме того, легко может быть удалена, и, предпочтительно, представляет собой триалкилсилан. Общий способ получения для того случая, когда в качестве защитной группы используется триалкилсилан, описан далее в настоящем документе.
Этот способ может быть проведен путем взаимодействия соединения, представленного общей формулой (XXXI), с силилирующим агентом в присутствии подходящего основания в растворителе.
Силилирующий агент, используемый в реакции, указанной выше, может представлять собой, например, триалкилсилил хлорид, такой как триэтилсилил хлорид, трет-бутилдиметилсилил хлорид, триизопропилсилил хлорид или трет-бутилдифенилсилил хлорид; или триалкилсилил трифторметансульфонат, такой как триэтилсилил трифторметансульфонат, трет-бутилдиметилсилил трифторметансульфонат, триизопропилсилил трифторметансульфонат или трет-бутилдифенилсилил трифторметансульфонат, и, предпочтительно, представляет собой триалкилсилил хлорид, и, особенно предпочтительно, трет-бутилдиметилсилил хлорид.
Основание, используемое в реакции, указанной выше, может представлять собой, например, триалкиламин, такой как триэтиламин, N,N-диизопропилэтиламин или тому подобное; имидазол, такой как имидазол или 2-метилимидазол; или пиридин, такой как пиридин, лутидин, коллидин, или тому подобное, и, предпочтительно, представляет собой имидазол, и, особенно предпочтительно, имидазол.
Для растворителя, используемого в реакции, указанной выше, нет никаких конкретных ограничений, при условии, что он не оказывает вредного влияния на реакцию, и он может представлять собой, например, простой эфир, такой как диэтиловый эфир, тетрагидрофуран, 1,2-диметоксиэтан, диоксан или тому подобное; галогенированный углеводород, такой как дихлорметан, 1,2-дихлорэтан или хлороформ; или амид, такой как N,N-диметилформамид, N,N-диметилацетамид или тому подобное; и, предпочтительно, представляет собой амид, и, особенно предпочтительно, N,N-диметилформамид.
Температура, при которой осуществляют реакцию, указанную выше, обычно находится в интервале между -23°C и 50°C, и, предпочтительно, между 0°C и 30°C.
Время, в течение которого осуществляют реакцию, указанную выше, является различным, в зависимости от температуры реакции, исходного продукта, используемого реагента или используемого растворителя, но обычно составляет от 30 минут до 4 часов, и, предпочтительно, от 1 часа до 3 часов.
После того как реакция завершена, целевой продукт этой реакции, если необходимо, может быть выделен из реакционной смеси и очищен таким же образом, как описано в стадии A1.
Стадия G4
Стадия G4 представляет собой способ получения соединения, представленного общей формулой (VI-4), путем преобразования атома галогена соединения, представленного общей формулой (XXXII), в нитрильную группу.
Этот способ осуществляют путем взаимодействия соединения, представленного общей формулой (XXXII), с подходящим агентом цианирования в растворителе.
Агент цианирования, используемый в этой реакции, может представлять собой, например, соединение меди, такое как цианид меди; или сочетание палладиевого катализатора, такого как тетракис(трифенилфосфина)палладий, дихлорбис(трифенилфосфина)палладий, [1,1'-бис(дифенилфосфино)ферроцена]дихлорпалладий или тому подобное, и цианида металла, такого как цианид цинка, триметилсилил цианид или цианид трибутилолова, и, предпочтительно, представляет собой сочетание палладиевого катализатора и цианида цинка, и, особенно предпочтительно, сочетание [1,1'-бис(дифенилфосфино)ферроцен]дихлорпалладия и цианида цинка.
Для растворителя, используемого в реакции, указанной выше, нет никаких конкретных ограничений, при условии, что он не оказывает вредного влияния на реакцию, и он может представлять собой, например, простой эфир, такой как диэтиловый эфир, тетрагидрофуран, 1,2-диметоксиэтан, диоксан, или тому подобное; или амид, такой как N,N-диметилформамид, N,N-диметилацетамид, N-метил-2-пирролидинон, или тому подобное; и, предпочтительно, представляет собой амид, и, особенно предпочтительно, N-метил-2-пирролидинон.
Температура, при которой осуществляют реакцию, указанную выше, обычно находится в интервале между 20°C и 180°C, и, предпочтительно, между 80°C и 120°C.
Время, в течение которого осуществляют реакцию, указанную выше, является различным, в зависимости от температуры реакции, исходного продукта, используемого реагента или используемого растворителя, но обычно составляет от 30 минут до 4 часов, и, предпочтительно, от 1 часа до 3 часов.
После того как реакция завершена, целевой продукт этой реакции, если необходимо, может быть выделен из реакционной смеси и очищен таким же образом, как описано в стадии A1.
Способ H
Способ H представляет собой способ получения соединения, представленного общей формулой (VI-5), которое включено в соединение, представленное общей формулой (VI), где заместитель W представляет собой пиридиновое кольцо, и, кроме того, кольцо замещено алкильной группой в качестве заместителя.
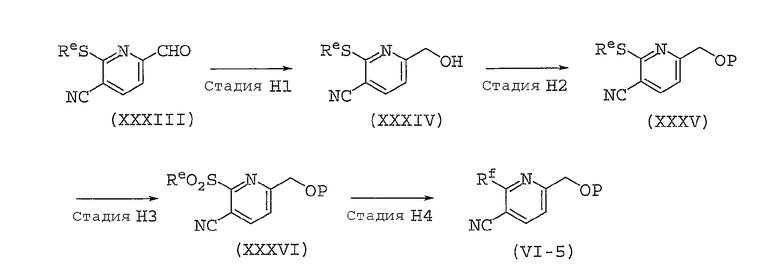
На вышеуказанной реакционной схеме Re и Rf являются одинаковыми или различными и, каждый, представляют собой C1-C6 алкильную группу, и, предпочтительно, представляют собой метильную группу или этильную группу, и P представляет собой защитную группу для гидроксильной группы, как описано выше.
Стадия H1
Стадия H1 представляет собой способ получения соединения, представленного общей формулой (XXXIV), путем преобразования формильной группы соединения, представленного общей формулой (XXXIII), в гидроксиметильную группу. Кроме того, в качестве соединения, представленного общей формулой (XXXIII), применяемого как исходное соединение, может быть использован коммерчески доступный 6-формил-2-(метилсульфанил)никотинонитрил и тому подобное (Maybridge Chemicals Ltd.).
Этот способ может быть осуществлен путем взаимодействия соединения, представленного общей формулой (XXXIII), с восстанавливающим агентом в растворителе.
Восстанавливающий агент, используемый в реакции, указанной выше, может представлять собой, например, гидрид алюминия, такой как литий алюминий гидрид, натрий алюминий гидрид, или диизобутилалюминий гидрид; боргидрид, такой как литий боргидрид, боргидрид натрия или боран, и, предпочтительно, представляет собой боргидрид, и, особенно предпочтительно, боргидрид натрия.
Для растворителя, используемого в реакции, указанной выше, нет никаких конкретных ограничений, при условии, что он не оказывает вредного влияния на реакцию, и он может представлять собой, например, простой эфир, такой как диэтиловый эфир, тетрагидрофуран, 1,2-диметоксиэтан, диоксан, или тому подобное; или спирт, такой как метанол, этанол, изопропанол, или тому подобное, и, предпочтительно, представляет собой спирт, и, особенно предпочтительно, метанол.
Температура, при которой осуществляют реакцию, указанную выше, обычно находится в интервале между -23°C и 50°C, и, предпочтительно, между 0°C и 30°C.
Время, в течение которого осуществляют реакцию, указанную выше, является различным, в зависимости от температуры реакции, исходного продукта, используемого реагента или используемого растворителя, но обычно составляет от 15 минут до 2 часов, и, предпочтительно, от 30 минут до 1 часа.
После того как реакция завершена, целевой продукт этой реакции, если необходимо, может быть выделен из реакционной смеси и очищен таким же образом, как описано в стадии A1.
Стадия H2
Стадия H2 представляет собой способ получения соединения, представленного общей формулой (XXXV), путем защиты гидроксильной группы в соединении, представленном общей формулой (XXXIV), путем введения подходящей защитной группы для гидроксильной группы. Защитная группа, используемая в этой реакции, особенно никак не ограничивается, при условии, что она не оказывает отрицательного воздействия на реакцию в последующих способах и, кроме того, легко может быть удалена, и, предпочтительно, представляет собой триалкилсилан. Общий способ получения для того случая, когда в качестве защитной группы используется триалкилсилан, описан далее в настоящем документе.
Этот способ может быть проведен путем взаимодействия соединения, представленного общей формулой (XXXIV), с силилирующим агентом в присутствии подходящего основания в растворителе.
Силилирующий агент, используемый в реакции, указанной выше, может представлять собой, например, триалкилсилил хлорид, такой как триэтилсилил хлорид, трет-бутилдиметилсилил хлорид, триизопропилсилил хлорид или трет-бутилдифенилсилил хлорид; или триалкилсилил трифторметансульфонат, такой как триэтилсилил трифторметансульфонат, трет-бутилдиметилсилил трифторметансульфонат, триизопропилсилил трифторметансульфонат или трет-бутилдифенилсилил трифторметансульфонат, и, предпочтительно, представляет собой триалкилсилил хлорид, и, особенно предпочтительно, триизопропилсилил хлорид.
Основание, используемое в реакции, указанной выше, может представлять собой, например, триалкиламин, такой как триэтиламин, N,N-диизопропилэтиламин, или тому подобное; имидазол, такой как имидазол, 2-метилимидазол, или тому подобное; или пиридин, такой как пиридин, лутидин, коллидин, или тому подобное, и, предпочтительно, представляет собой имидазол, и, особенно предпочтительно, имидазол.
Для растворителя, используемого в реакции, указанной выше, нет никаких конкретных ограничений, при условии, что он не оказывает вредного влияния на реакцию, и он может представлять собой, например, простой эфир, такой как диэтиловый эфир, тетрагидрофуран, 1,2-диметоксиэтан, диоксан, или тому подобное; галогенированный углеводород, такой как дихлорметан, 1,2-дихлорэтан или хлороформ; или амид, такой как N,N-диметилформамид, N,N-диметилацетамид, или тому подобное; и, предпочтительно, представляет собой амид, и, особенно предпочтительно, N,N-диметилформамид.
Температура, при которой осуществляют реакцию, указанную выше, обычно находится в интервале между -23°C и 50°C, и, предпочтительно, между 0°C и 30°C.
Время, в течение которого осуществляют реакцию, указанную выше, является различным, в зависимости от температуры реакции, исходного продукта, используемого реагента или используемого растворителя, но обычно составляет от 30 минут до 4 часов, и, предпочтительно, от 1 часа до 3 часов.
После того как реакция завершена, целевой продукт этой реакции, если необходимо, может быть выделен из реакционной смеси и очищен таким же образом, как описано в стадии A1.
Стадия H3
Стадия H3 представляет собой способ получения соединения, представленного общей формулой (XXXVI), путем окисления алкилтио группы соединения, представленного общей формулой (XXXV).
Этот способ осуществляют путем взаимодействия соединения, представленного общей формулой (XXXV), с подходящим окислительным агентом в растворителе.
Окислительный агент, используемый в реакции, указанной выше, может представлять собой, например, перкислоту, такую как перуксусная кислота, пербензойная кислота, или м-хлорпербензойная кислота; перманганат, такой как перманганат натрия или перманганат калия, и, предпочтительно, представляет собой перкислоту, и, особенно предпочтительно, м-хлорпербензойную кислоту.
Для растворителя, используемого в реакции, указанной выше, нет никаких конкретных ограничений, при условии, что он не оказывает вредного влияния на реакцию, и он может представлять собой, например, спирт, такой как метанол, этанол, изопропанол или тому подобное; или галогенированный углеводород, такой как дихлорметан, 1,2-дихлорэтан, хлороформ или тому подобное, и, предпочтительно, представляет собой спирт, и, особенно предпочтительно, этанол.
Температура, при которой осуществляют реакцию, указанную выше, обычно находится в интервале между -23°C и 50°C, и, предпочтительно, между 0°C и 30°C.
Время, в течение которого осуществляют реакцию, указанную выше, является различным, в зависимости от температуры реакции, исходного продукта, используемого реагента или используемого растворителя, но обычно составляет от 30 минут до 4 часов, и, предпочтительно, от 1 часа до 3 часов.
После того как реакция завершена, целевой продукт этой реакции, если необходимо, может быть выделен из реакционной смеси и очищен таким же образом, как описано в стадии A1.
Стадия H4
Стадия H4 представляет собой способ получения соединения, представленного общей формулой (VI-5), путем преобразования алкилсульфоновой группы соединения, представленного общей формулой (XXXVI), в алкильную группу.
Этот способ проводят путем взаимодействия соединения, представленного общей формулой (XXXVI), с алкилирующим агентом в растворителе.
Алкилирующий агент, используемый в реакции, указанной выше, может представлять собой, например, реагент Гриньяра, такой как алкилмагний хлорид, алкилмагний бромид или алкилмагний йодид; или алкиллитий, такой как метиллитий, этиллитий или изопропиллитий, и, предпочтительно, представляет собой реагент Гриньяра.
Для растворителя, используемого в реакции, указанной выше, нет никаких конкретных ограничений, при условии, что он не оказывает вредного влияния на реакцию, и он может представлять собой, например, простой эфир, такой как диэтиловый эфир, тетрагидрофуран, 1,2-диметоксиэтан, диоксан или тому подобное; или ароматический углеводород, такой как бензол, толуол или ксилол, и, предпочтительно, представляет собой простой эфир, и, особенно предпочтительно, диэтиловый эфир.
Температура, при которой осуществляют реакцию, указанную выше, обычно находится в интервале между -100°C и 0°C, и, предпочтительно, между -78°C и -23°C.
Время, в течение которого осуществляют реакцию, указанную выше, является различным, в зависимости от температуры реакции, исходного продукта, используемого реагента или используемого растворителя, но обычно составляет от 15 минут до 4 часов, и, предпочтительно, от 1 часа до 2 часов.
После того как реакция завершена, целевой продукт этой реакции, если необходимо, может быть выделен из реакционной смеси и очищен таким же образом, как описано в стадии A1.
Способ I
Способ I представляет собой способ получения соединения, представленного общей формулой (VIII-1), которое включено в соединение, представленное общей формулой (VIII), где заместитель Z может представлять собой фенокси группу, которая необязательно может быть замещена заместителем(ями), и, кроме того, заместитель Y может представлять собой бензольное кольцо, которое необязательно может быть замещено заместителем(ями), и LG представляет собой гидроксильную группу.
На вышеуказанной реакционной схеме Rg и Rh являются одинаковыми или различными и, каждый, представляют собой группу, выбранную из группы заместителей А, описанных выше.
Стадия I1
Стадия I1 представляет собой способ получения соединения, представленного общей формулой (XXXVIII), путем замещения атома фтора в соединении, представленном общей формулой (XXXVII), фенокси группой, которая необязательно может быть замещена заместителем(ями).
Этот способ проводят путем взаимодействия соединения, представленного общей формулой (XXXVII), с различными фенолами в присутствии подходящего основания в растворителе.
Основание, используемое в реакции, указанной выше, может представлять собой, например, карбонат щелочного металла, такой как карбонат лития, карбонат натрия или карбонат калия; или гидрид щелочного металла, такой как гидрид лития, гидрид натрия или гидрид калия, и, предпочтительно, представляет собой карбонат щелочного металла, и, особенно предпочтительно, карбонат калия.
Для растворителя, используемого в реакции, указанной выше, нет никаких конкретных ограничений, при условии, что он не оказывает вредного влияния на реакцию, и он может представлять собой, например, амид, такой как N,N-диметилформамид, N,N-диметилацетамид, N-метил-2-пирролидинон или тому подобное; или простой эфир, такой как диэтиловый эфир, тетрагидрофуран, 1,2-диметоксиэтан, диоксан или тому подобное, и, предпочтительно, представляет собой амид, и, особенно предпочтительно, N,N-диметилформамид.
Температура, при которой осуществляют реакцию, указанную выше, обычно находится в интервале между 0°C и 140°C, и, предпочтительно, между 60°C и 100°C.
Время, в течение которого осуществляют реакцию, указанную выше, является различным, в зависимости от температуры реакции, исходного продукта, используемого реагента или используемого растворителя, но обычно составляет от 1 часа до 24 часов, и, предпочтительно, от 3 часов до 12 часов.
После того как реакция завершена, целевой продукт этой реакции, если необходимо, может быть выделен из реакционной смеси и очищен таким же образом, как описано в стадии A1.
Стадия I2
Стадия I2 представляет собой способ получения соединения, представленного общей формулой (VIII-1), путем окисления формильной группы соединения, представленного общей формулой (XXXVIII).
Этот способ осуществляют путем взаимодействия соединения, представленного общей формулой (XXXVIII), с подходящим окислительным агентом в растворителе.
Окислительный агент, используемый в реакции, указанной выше, может представлять собой, например, гипохлорит, такой как гипохлорит натрия или гипохлорит калия; хлорит, такой как хлорит натрия или хлорит калия; или перманганат, такой как перманганат натрия или перманганат калия, и, предпочтительно, представляет собой хлорит, и, особенно предпочтительно, хлорит натрия.
Для растворителя, используемого в реакции, указанной выше, нет никаких конкретных ограничений, при условии, что он не оказывает вредного влияния на реакцию, и он может представлять собой, например, сочетание воды и третичного спирта, такого как трет-бутанол или трет-амиловый спирт; или сочетание воды и галогенированного углеводорода, такого как дихлорметан, 1,2-дихлорэтан, хлороформ или тому подобное, и, предпочтительно, представляет собой сочетание воды и третичного спирта, и, особенно предпочтительно, сочетание воды и трет-бутанола.
Температура, при которой осуществляют реакцию, указанную выше, обычно находится в интервале между 0°C и 60°C, и, предпочтительно, между 0°C и 40°C.
Время, в течение которого осуществляют реакцию, указанную выше, является различным, в зависимости от температуры реакции, исходного продукта, используемого реагента или используемого растворителя, но обычно составляет от 30 минут до 24 часов, и, предпочтительно, от 1 часа до 4 часов.
После того как реакция завершена, целевой продукт этой реакции, если необходимо, может быть выделен из реакционной смеси и очищен таким же образом, как описано в стадии A1.
Способ J
Способ J представляет собой способ получения соединения, представленного общей формулой (VIII-2), которое включено в соединение, представленное общей формулой (VIII), где заместитель Z может представлять собой алкильную группу, которая необязательно может быть разветвленной, и, кроме того, заместитель Y может представлять собой бензольное кольцо, которое необязательно может быть замещено заместителем(ями), и LG может представлять собой гидроксильную группу.
На вышеуказанной реакционной схеме Ri представляет собой группу, выбранную из группы заместителей А, описанных выше, Hal представляет собой атом галогена, как описано выше, и, предпочтительно, представляет собой атом брома или атом йода, и Rj и Rk являются одинаковыми или различными и, каждый, представляют собой C1-C6 алкильную группу, которая необязательно может быть замещена группой(ами), выбранными из группы заместителей А, описанных выше.
Стадия J1
Стадия J1 представляет собой способ получения соединения, представленного общей формулой (XL), путем преобразования формильной группы соединения, представленного общей формулой (XXXIX), в алкенильную группу.
Этот способ проводят путем взаимодействия соединения, представленного общей формулой (XXXIX), с различными алкилтрифенилфосфониевыми солями в присутствии подходящего основания в растворителе.
Основание, используемое в реакции, указанной выше, может представлять собой, например, алкоксид, такой как метоксид натрия, этоксид натрия или трет-бутоксид калия; гидрид щелочного металла, такой как гидрид лития, гидрид натрия или гидрид калия; или алкиллитий, такой как н-бутиллитий, втор-бутиллитий или трет-бутиллитий, и, предпочтительно, представляет собой алкоксид, и, особенно предпочтительно, трет-бутоксид калия.
Для растворителя, используемого в реакции, указанной выше, нет никаких конкретных ограничений, при условии, что он не оказывает вредного влияния на реакцию, и он может представлять собой, например, амид, такой как N,N-диметилформамид, N,N-диметилацетамид, N-метил-2-пирролидинон, или тому подобное; или простой эфир, такой как диэтиловый эфир, тетрагидрофуран, 1,2-диметоксиэтан, диоксан, или тому подобное, и, предпочтительно, представляет собой амид, и, особенно предпочтительно, N,N-диметилформамид.
Температура, при которой осуществляют реакцию, указанную выше, обычно находится в интервале между -45°C и 100°C, и, предпочтительно, между 0°C и 40°C.
Время, в течение которого осуществляют реакцию, указанную выше, является различным, в зависимости от температуры реакции, исходного продукта, используемого реагента или используемого растворителя, но обычно составляет от 15 минут до 4 часов, и, предпочтительно, от 30 минут до 2 часов.
После того как реакция завершена, целевой продукт этой реакции, если необходимо, может быть выделен из реакционной смеси и очищен таким же образом, как описано в стадии A1.
Стадия J2
Стадия J2 представляет собой способ получения соединения, представленного общей формулой (XLI), путем преобразования атома галогена в соединении, представленном общей формулой (XL), в карбоксильную группу.
Этот способ осуществляют проведением обмена галоген-металл в соединении, представленном общей формулой (XL), с последующим взаимодействием полученного продукта с диоксидом углерода в растворителе.
Агент металлирования, используемый в реакции, указанной выше, может представлять собой, например, металл, такой как металлический литий, металлический магний, металлический цинк или тому подобное; или алкиллитий, такой как н-бутиллитий, втор-бутиллитий, трет-бутиллитий или тому подобное; и, предпочтительно, представляет собой алкиллитий, и, особенно предпочтительно, н-бутиллитий.
Для растворителя, используемого в реакции, указанной выше, нет никаких конкретных ограничений, при условии, что он не оказывает вредного влияния на реакцию, и он может представлять собой, например, простой эфир, такой как диэтиловый эфир, тетрагидрофуран, 1,2-диметоксиэтан, диоксан или тому подобное; или ароматический углеводород, такой как бензол, толуол, ксилол или тому подобное, и, предпочтительно, представляет собой простой эфир, и, особенно предпочтительно, тетрагидрофуран.
Температура, при которой осуществляют реакцию, указанную выше, обычно находится в интервале между -100°C и 0°C, и, предпочтительно, между -78°C и -23°C.
Время, в течение которого осуществляют реакцию, указанную выше, является различным, в зависимости от температуры реакции, исходного продукта, используемого реагента или используемого растворителя, но обычно составляет от 15 минут до 4 часов, и, предпочтительно, от 30 минут до 2 часов.
После того как реакция завершена, целевой продукт этой реакции, если необходимо, может быть выделен из реакционной смеси и очищен таким же образом, как описано в стадии A1.
Стадия J3
Стадия J3 представляет собой способ получения соединения, представленного общей формулой (VIII-2), путем восстановления двойной связи в соединении, представленном общей формулой (XLI).
Этот способ проводят путем взаимодействия соединения, представленного общей формулой (XLI), с водородом в присутствии подходящего катализатора на основе переходного металла в растворителе.
Катализатор на основе переходного металла, используемый в реакции, указанной выше, может представлять собой, например, гетерогенный катализатор, такой как палладий на углероде, оксид платины или никель Ренея; гомогенный катализатор, такой как хлортрис(трифенилфосфина)родий или тетракис(трифенилфосфина)палладий, и, предпочтительно, представляет собой гетерогенный катализатор, и, особенно предпочтительно, палладий на углероде.
Для растворителя, используемого в реакции, указанной выше, нет никаких конкретных ограничений, при условии, что он не оказывает вредного влияния на реакцию, и он может представлять собой, например, спирт, такой как метанол, этанол или изопропанол; простой эфир, такой как диэтиловый эфир, тетрагидрофуран, 1,2-диметоксиэтан, диоксан или тому подобное; или ароматический углеводород, такой как бензол, толуол или ксилол, и, предпочтительно, представляет собой спирт, и, особенно предпочтительно, этанол.
Температура, при которой осуществляют реакцию, указанную выше, обычно находится в интервале между 0°C и 80°C, и, предпочтительно, между 20°C и 40°C.
Время, в течение которого осуществляют реакцию, указанную выше, является различным, в зависимости от температуры реакции, исходного продукта, используемого реагента или используемого растворителя, но обычно составляет от 15 минут до 4 часов, и, предпочтительно, от 30 минут до 2 часов.
После того как реакция завершена, целевой продукт этой реакции, если необходимо, может быть выделен из реакционной смеси и очищен таким же образом, как описано в стадии A1.
Примеры
(Пример 1)
1-[(4-{5-[4-Фенил-5-(трифторметил)-2-тиенил]-1,2,4-оксадиазол-3-ил}-2-фурил)метил]азетидин-3-карбоновая кислота
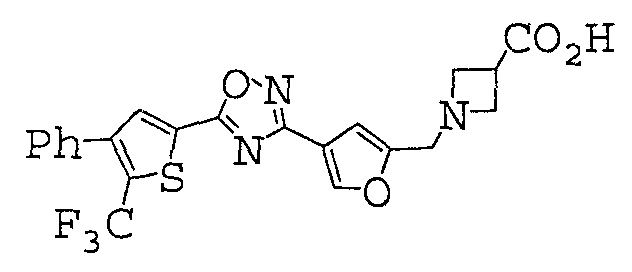
(1a) [(4-Бром-2-фурил)метокси](трет-бутил)диметилсилан
К раствору 4-бром-2-фуральдегида (5,0 г, 29 ммоль) в метаноле (40 мл) добавляли боргидрид натрия (1,1 г, 29 ммоль) при 0°C при перемешивании, и полученную смесь перемешивали в течение 1 часа. После упаривания реакционной смеси в вакууме, полученный остаток разбавляли эфиром, выливали в воду и экстрагировали эфиром. Экстракт промывали насыщенным водным раствором хлорида натрия и сушили над сульфатом магния. После фильтрации фильтрат упаривали в вакууме. Затем, к раствору полученного остатка в N,N-диметилформамиде (30 мл) добавляли последовательно имидазол (3,9 г, 57 ммоль) и трет-бутилдиметилхлорсилан (4,7 г, 31 ммоль) при перемешивании, и полученную смесь перемешивали в течение 4 часов. После перемешивания, реакционную смесь выливали в воду (50 мл) для гашения реакции и экстрагировали эфиром. Экстракт промывали насыщенным водным раствором хлорида натрия и сушили над сульфатом магния. После фильтрации фильтрат упаривали в вакууме, и полученный таким образом сырой продукт указанного в заголовке соединения очищали хроматографией на колонке с силикагелем, используя смешанный растворитель, состоящий из этилацетата и гексана (3:97) в качестве элюента, что давало указанное в заголовке соединение (7,4 г) с выходом 89% в виде бесцветного маслянистого продукта.
1H ЯМР (400 МГц, CDCl3) δ м.д.: 0,09 (с, 6H), 0,90 (с, 9H), 4,60 (с, 2H), 6,29 (с, 1H), 7,36 (с, 1H).
ИК-спектр (жидкая пленка): 1230, 1257, 1464, 1473 см-1.
Масс-спектр (EI+) m/z: 290 (M+).
(1b) 5-({[трет-Бутил(диметил)силил]окси}метил)-3-фуральдегид
К раствору [(4-бром-2-фурил)метокси](трет-бутил)диметилсилана (7,3 г, 25 ммоль), который был получен в примере 1 (1a), в тетрагидрофуране (50 мл) медленно по каплям добавляли н-бутиллитий (1,6 M раствор в гексане, 17 мл, 28 ммоль) при -78°C при перемешивании, и полученную смесь перемешивали в течение 5 минут. Далее, к реакционной смеси затем добавляли N,N-диметилформамид (3,8 мл, 50 ммоль) при той же температуре при перемешивании, и полученную смесь перемешивали в течение 45 минут. После перемешивания, к реакционной смеси добавляли насыщенный водный раствор хлорида аммония (10 мл) для гашения реакции, и полученную смесь выливали в воду (100 мл) и экстрагировали эфиром. Экстракт промывали насыщенным водным раствором хлорида натрия и сушили над сульфатом магния. После фильтрации фильтрат упаривали в вакууме, и полученный таким образом сырой продукт указанного в заголовке соединения очищали хроматографией на колонке с силикагелем, используя смешанный растворитель, состоящий из этилацетата и гексана (от 1:49 до 1:19) в качестве элюента, что давало указанное в заголовке соединение (3,3 г) с выходом 55% в виде бесцветного маслянистого продукта.
1H ЯМР спектр (500 МГц, CDCl3) δ м.д.: 0,10 (с, 6H), 0,91 (с, 9H), 4,65 (с, 2H), 6,62 (с, 1H), 8,00 (с, 1H), 9,90 (с, 1H).
ИК-спектр (жидкая пленка): 1083, 1139, 1258, 1473, 1544, 1693 см-1.
Масс-спектр (FAB+) m/z: 241 ((M+H)+).
(1c) 5-({[трет-Бутил(диметил)силил]окси}метил)-3-фуронитрил
К раствору 5-({[трет-бутил(диметил)силил]окси}метил)-3-фуральдегида (3,2 г, 13 ммоль), который был получен в примере 1 (1b), в дихлорметане (40 мл) добавляли последовательно гидрохлорид гидроксиламина (1,0 г, 15 ммоль) и триэтиламин (3,7 мл, 27 ммоль) при перемешивании, и полученную смесь перемешивали при комнатной температуре в течение 2 часов. После перемешивания, реакционную смесь упаривали в вакууме. Далее, к раствору полученного остатка в толуоле (40 мл) добавляли N,N'-дициклогексилкарбодиимид (3,1 г, 15 ммоль) при перемешивании, и полученную смесь перемешивали при 90°C в течение 16 часов. После охлаждения до комнатной температуры к реакционной смеси добавляли гексан (40 мл), и нерастворенные продукты удаляли фильтрацией через целит. Фильтрат упаривали в вакууме, и полученный таким образом сырой продукт указанного в заголовке соединения очищали хроматографией на колонке с силикагелем, используя смешанный растворитель, состоящий из этилацетата и гексана (3:97) в качестве элюента, что давало указанное в заголовке соединение (1,8 г) с выходом 57% в виде бесцветного маслянистого продукта.
1H ЯМР спектр (400 МГц, CDCl3) δ м.д.: 0,10 (с, 6H), 0,91 (с, 9H), 4,64 (с, 2H), 6,45 (с, 1H), 7,88 (с, 1H).
ИК-спектр (жидкая пленка): 1087, 1142, 1258, 1464, 1473, 1540, 2238 см-1.
Масс-спектр (FAB+) m/z: 238((M+H)+).
(1d) 5-({[трет-Бутил(диметил)силил]окси}метил)-N'-гидроксифуран-3-карбоксимидамид
К раствору 5-({[трет-бутил(диметил)силил]окси}метил)-3-фуронитрила (1,8 г, 7,6 ммоль), который был получен в примере 1 (1c), в этаноле (10 мл) добавляли 40% водный раствор гидроксиламина (1,0 мл) при перемешивании, и полученную смесь перемешивали при 60°C в течение 1 часа. После упаривания реакционной смеси в вакууме, полученный остаток разбавляли эфиром, выливали в воду (40 мл) и экстрагировали эфиром. Экстракт промывали насыщенным водным раствором хлорида натрия и сушили над сульфатом магния. После фильтрации фильтрат упаривали в вакууме, и полученный таким образом сырой продукт указанного в заголовке соединения очищали хроматографией на колонке с силикагелем, используя смешанный растворитель, состоящий из этилацетата и гексана (1:1) в качестве элюента, что давало указанное в заголовке соединение (2,0 г) с выходом 97% в виде белого кристаллического твердого продукта.
1H ЯМР спектр (400 МГц, CDCl3) δ м.д.: 0,09 (с, 6H), 0,90 (с, 9H), 4,62 (с, 2H), 4,69 (ушир.с, 2H), 6,44 (с, 1H), 7,30 (ушир., 1H), 7,64 (с, 1H).
ИК-спектр (KBr): 1059, 1594, 1613, 1671, 3203, 3376, 3498 см-1.
Масс-спектр (FAB+) m/z: 271 ((M+H)+), 309 ((M+K)+).
(1e) (4-{5-[4-Фенил-5-(трифторметил)-2-тиенил]-1,2,4-оксадиазол-3-ил}-2-фурил)метанол
К раствору 5-({[трет-бутил(диметил)силил]окси}метил)-N'-гидроксифуран-3-карбоксимидамид (0,14 г, 0,50 ммоль), который был получен в примере 1 (1d), и 4-фенил-5-(трифторметил)тиофен-2-карбонилхлорида (0,17 г, 0,60 ммоль) в дихлорметане (10 мл) добавляли N,N-диизопропилэтиламин (0,17 мл, 1,0 ммоль) при 0°C при перемешивании, и полученную смесь перемешивали в течение 1 часа. После перемешивания к реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия (1,0 мл) для гашения реакции, и полученную смесь выливали в воду (20 мл) и экстрагировали эфиром. Экстракт промывали насыщенным водным раствором хлорида натрия и сушили над сульфатом магния. После фильтрации фильтрат упаривали в вакууме. Далее, к раствору полученного остатка в тетрагидрофуране (1,0 мл) добавляли фторид тетрабутиламмония (1,0 М раствор в тетрагидрофуране, 0,75 мл, 0,75 ммоль) при перемешивании, и полученную смесь перемешивали при 60°C в течение 3 часов. После перемешивания реакционную смесь выливали в воду (20 мл) для гашения реакции и экстрагировали эфиром. Экстракт промывали насыщенным водным раствором хлорида натрия и сушили над сульфатом магния. После фильтрации фильтрат упаривали в вакууме, и полученный таким образом сырой продукт указанного в заголовке соединения очищали хроматографией на колонке с силикагелем, используя смешанный растворитель, состоящий из этилацетата и гексана (1:1), в качестве элюента, что давало указанное в заголовке соединение (0,20 г) с выходом 10% в виде белого кристаллического твердого продукта.
1H ЯМР спектр (500 МГц, CDCl3) δ м.д.: 4,69 (с, 2H), 6,83 (с, 1H), 7,47 (с, 5H), 7,88 (с, 1H), 8,12 (с, 1H).
ИК-спектр (KBr): 1143, 1179, 1416, 1581, 1605, 1629, 3326 см-1.
Масс-спектр (FAB+) m/z: 393 ((M+H)+).
(1f) Этил 1-[(4-{5-[4-фенил-5-(трифторметил)-2-тиенил]-1,2,4-оксадиазол-3-ил}-2-фурил)метил]азетидин-3-карбоксилат
Раствор (4-{5-[4-фенил-5-(трифторметил)-2-тиенил]-1,2,4-оксадиазол-3-ил}-2-фурил)метанола (0,20 г, 0,50 ммоль), который был получен в примере 1 (1e), тетрабромида углерода (0,20 г, 0,60 ммоль) и трифенилфосфина (0,16 г, 0,60 ммоль) в дихлорметане (1,0 мл) перемешивали при 0°C в течение 1 часа. Далее, к реакционной смеси добавляли последовательно этил 3-азетидинкарбоксилат гидрохлорид (0,12 г, 0,75 ммоль) и N,N-диизопропилэтиламин (0,26 мл, 1,5 ммоль) при той же температуре при перемешивании, и полученную смесь перемешивали при комнатной температуре в течение 2 часов. После перемешивания, к реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия (1,0 мл) для гашения реакции, и полученную смесь выливали в воду (20 мл) и экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и сушили над сульфатом магния. После фильтрации фильтрат упаривали в вакууме, и полученный таким образом сырой продукт указанного в заголовке соединения очищали хроматографией на колонке с силикагелем, используя смешанный растворитель, состоящий из этилацетата и гексана (от 1:1 до 2:1) в качестве элюента, что давало указанное в заголовке соединение (0,21 г) с выходом 84% в виде белого кристаллического твердого продукта.
1H ЯМР спектр (500 МГц, CDCl3) δ м.д.: 1,27 (т, 3H, J=7,3 Гц), 3,35 (квинтет, 1H, J=7,3 Гц), 3,41 (т, 2H, J=7,3 Гц), 3,62 (т, 2H, J=7,3 Гц), 3,66 (с, 2H) 4,16 (кв, 2H, J=7,3 Гц), 6,72 (с, 1H), 7,46 (с, 5H), 7,87 (с, 1H), 8,09 (с, 1H).
ИК-спектр (KBr): 1125, 1178, 1203, 1216, 1581, 1606, 1624, 1727 см-1.
Масс-спектр (FAB+) m/z: 504 ((M+H)+).
(1g) 1-[(4-{5-[4-Фенил-5-(трифторметил)-2-тиенил]-1,2,4-оксадиазол-3-ил}-2-фурил)метил]азетидин-3-карбоновая кислота
К раствору этил 1-[(4-{5-[4-фенил-5-(трифторметил)-2-тиенил]-1,2,4-оксадиазол-3-ил}-2-фурил)метил]азетидин-3-карбоксилата (0,20 г, 0,40 ммоль), который был получен в примере 1 (1f), в смешанном растворителе, состоящем из тетрагидрофурана (0,50 мл), метанола (0,50 мл) и воды (0,50 мл), добавляли моногидрат гидроксида лития (37 мг, 0,88 ммоль) при перемешивании, и полученную смесь перемешивали при комнатной температуре в течение 1 часа. После перемешивания к реакционной смеси добавляли уксусную кислоту (48 мкл, 0,88 ммоль) для гашения реакции. Далее, к полученной смеси добавляли раствор щавелевой кислоты (18 мг, 0,20 ммоль) в метаноле (0,5 мл) при перемешивании, и полученную смесь перемешивали в течение 30 минут. Выпавший в осадок белый твердый продукт собирали фильтрацией, используя воронку Kiriyama, промывали смешанным растворителем, состоящим из воды и метанола (3:7), и сушили в вакууме, что давало указанное в заголовке соединение (82 мг) с выходом 39% в виде белого кристаллического твердого продукта.
1H ЯМР спектр (500 МГц, CD3OD) δ м.д.: 3,35 (квинтет, 1H, J=7,8 Гц), 3,93 (т, 2H, J=8,3 Гц), 4,01 (т, 2H, J=9,3 Гц), 4,19 (с, 2H), 7,04 (с, 1H), 7,47-7,52 (м, 5H), 8,03 (с, 1H), 8,34 (с, 1H).
ИК-спектр (KBr): 1135, 1177, 1379, 1410, 1594, 1626, 3421 см-1.
Масс-спектр (FAB+) m/z: 476 ((M+H)+).
(Пример 2)
1-({5-[5-(4-Циклогексилфенил)-1,2,4-оксадиазол-3-ил]-2-фурил}метил)азетидин-3-карбоновая кислота
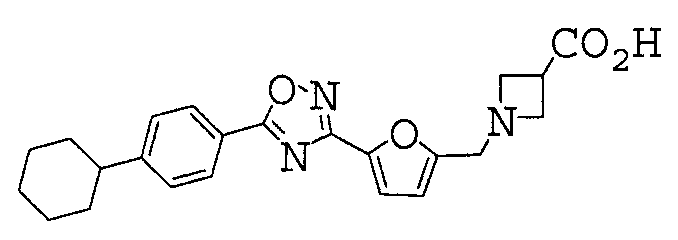
(2a) 5-({[трет-Бутил(диметил)силил]окси}метил)-2-фуронитрил
Полученный таким образом сырой продукт указанного в заголовке соединения синтезировали с помощью реакции, подобной той, что указана в примере 1 (1c), используя 5-({[трет-бутил(диметил)силил]окси}метил)-2-фуральдегид (9,1 г, 38 ммоль) [ссылочная литература: Tetrahedron, vol. 50 (23), 6767 (1994)], гидрохлорид гидроксиламина (2,9 г, 42 ммоль), триэтиламин (11 мл, 76 ммоль) и N,N'-дициклогексилкарбодиимид (8,6 г, 42 ммоль). Далее, полученный таким образом сырой продукт указанного в заголовке соединения очищали хроматографией на колонке с силикагелем, используя смешанный растворитель, состоящий из этилацетата и гексана (1:9), в качестве элюента, что давало указанное в заголовке соединение (7,5 г) с выходом 84% в виде бесцветного маслянистого продукта.
1H ЯМР спектр (400 МГц, CDCl3) δ м.д.: 0,11 (с, 6H), 0,82 (с, 9H), 4,67 (с, 2H), 6,36 (д, 1H, J=3,4 Гц), 7,04 (д, 1H, J=3,4 Гц).
ИК-спектр (жидкая пленка): 1093, 1122, 1258, 1464, 1473, 1524, 2120, 2233 см-1.
Масс-спектр (EI+) m/z: 238 (M+).
(2b) 5-({[трет-Бутил(диметил)силил]окси}метил)-N'-гидроксифуран-2-карбоксимидамид
Сырой продукт указанного в заголовке соединения синтезировали с помощью реакции, подобной той, что указана в примере 1 (1d), используя 5-({[трет-бутил(диметил)силил]окси}метил)-2-фуронитрил (7,5 г, 32 ммоль), который был получен в примере 2 (2a), и 40% водный раствор гидроксиламина (4,0 мл). Далее, полученный таким образом сырой продукт указанного в заголовке соединения очищали хроматографией на колонке с силикагелем, используя смешанный растворитель, состоящий из этилацетата и гексана (1:1), в качестве элюента, что давало указанное в заголовке соединение (8,1 г) с выходом 95% в виде белого кристаллического твердого продукта.
1H ЯМР спектр (400 МГц, CDCl3) δ м.д.: 0,09 (с, 6H), 0,91 (с, 9H), 4,66 (с, 2H), 4,99 (ушир.с, 2H), 6,28 (д, 1H, J=3,4 Гц), 6,70 (д, 1H, J=3,4 Гц), 8,76 (ушир., 1H).
ИК-спектр (KBr): 1255, 1613, 1669, 3243, 3367, 3474 см-1
Масс-спектр (EI+) m/z: 270 (M+).
(2c) {5-[5-(4-Циклогексилфенил)-1,2,4-оксадиазол-3-ил]-2-фурил}метанол
Раствор 5-({[трет-бутил(диметил)силил]окси}метил)-N'-гидроксифуран-2-карбоксимидамида (0,19 г, 0,70 ммоль), который был получен в примере 2 (2b), 4-циклогексилбензойной кислоты (0,16 г, 0,77 ммоль), и N,N'-дициклогексилкарбодиимида (0,17 г, 0,84 ммоль) в дихлорметане (1,5 мл) перемешивали в течение 1 часа. После перемешивания, реакционную смесь разбавляли эфиром, и нерастворенные продукты удаляли фильтрацией через целит, и затем фильтрат упаривали в вакууме. Далее, к раствору полученного остатка в тетрагидрофуране (1,0 мл) добавляли фторид тетрабутиламмония (1,0 М раствор в тетрагидрофуране, 1,1 мл, 1,1 ммоль) при перемешивании, и полученную смесь перемешивали при 60°C в течение 1 часа. После перемешивания реакционную смесь выливали в воду (20 мл) для гашения реакции и экстрагировали эфиром. Экстракт промывали насыщенным водным раствором хлорида натрия и сушили над сульфатом магния. После фильтрации фильтрат упаривали в вакууме, и полученный таким образом сырой продукт указанного в заголовке соединения очищали хроматографией на колонке с силикагелем, используя смешанный растворитель, состоящий из этилацетата и гексана (1:1), в качестве элюента, что давало указанное в заголовке соединение (0,18 г) с выходом 81% в виде белого кристаллического твердого продукта.
1H ЯМР спектр (500 МГц, CDCl3) δ м.д.: 1,24-1,51 (м, 5H), 1,75-1,81 (м, 1H), 1,84-1,96 (м, 4H), 2,56-2,64 (м, 1H), 4,74 (д, 2H, J=8,3 Гц), 6,50 (д, 1H, J=3,4 Гц), 7,16 (д, 1H, J=3,4 Гц), 7,38 (д, 2H, J=7,8 Гц), 8,11 (д, 2H, J=7,8 Гц).
ИК-спектр (KBr): 1157, 1216, 1344, 1406, 1561, 1584, 1613, 3369 см-1.
Масс-спектр (FAB+) m/z: 325 ((M+H)+).
(2d) Этил 1-({5-[5-(4-циклогексилфенил)-1,2,4-оксадиазол-3-ил]-2-фурил}метил)азетидин-3-карбоксилат
Сырой продукт указанного в заголовке соединения синтезировали с помощью реакции, подобной той, что указана в примере 1 (1f), используя {5-[5-(4-циклогексилфенил)-1,2,4-оксадиазол-3-ил]-2-фурил}метанол (0,18 г, 0,55 ммоль), который был получен в примере 2 (2c), тетрабромид углерода (0,22 г, 0,67 ммоль), трифенилфосфин (0,18 г, 0,67 ммоль), этил 3-азетидинкарбоксилат гидрохлорид (0,14 г, 0,83 ммоль) и N,N-диизопропилэтиламин (0,30 мл, 1,7 ммоль). Далее, полученный таким образом сырой продукт указанного в заголовке соединения очищали хроматографией на колонке с силикагелем, используя смешанный растворитель, состоящий из этилацетата и гексана (от 1:1 до 2:1), в качестве элюента, что давало указанное в заголовке соединение (0,23 г) с выходом 96% в виде белого кристаллического твердого продукта.
1H ЯМР спектр (500 МГц, CDCl3) δ м.д.: 1,24-1,32 (м, 4H), 1,37-1,51 (м, 4H), 1,78 (д, 1H, J=12,7 Гц), 1,84-1,94 (м, 4H), 2,56-2,63 (м, 1H), 3,34 (квинтет, 1H, J=7,8 Гц), 3,44 (т, 2H, J=7,8 Гц), 3,64 (т, 2H, J=7,8 Гц), 3,73 (с, 2H), 4,16 (кв, 2H, J=7,3 Гц), 6,37 (д, 1H, J=3,4 Гц), 7,13 (д, 1H, J=3,4 Гц), 7,37 (д, 2H, J=8,3 Гц), 8,10 (д, 2H, J=8,3 Гц).
ИК-спектр (KBr): 1374, 1561, 1614, 1736 см-1.
Масс-спектр (FAB+) m/z: 436 ((M+H)+).
(2e) 1-({5-[5-(4-Циклогексилфенил)-1,2,4-оксадиазол-3-ил]-2-фурил}метил)азетидин-3-карбоновая кислота
К раствору этил 1-({5-[5-(4-циклогексилфенил)-1,2,4-оксадиазол-3-ил]-2-фурил}метил)азетидин-3-карбоксилата (0,23 г, 0,53 ммоль), который был получен в примере 2 (2d), в смешанном растворителе, состоящем из тетрагидрофурана (0,50 мл), метанола (0,50 мл) и воды (0,50 мл), добавляли моногидрат гидроксида лития (50 мг, 1,2 ммоль) при перемешивании, и полученную смесь перемешивали при комнатной температуре в течение 1 часа. После перемешивания к реакционной смеси добавляли уксусную кислоту (65 мкл, 1,2 ммоль) для гашения реакции. Выпавший в осадок белый твердый продукт собирали фильтрацией, используя воронку Кирияма (Kiriyama), промывали смешанным растворителем, состоящим из воды и метанола (3:7), и сушили в вакууме, что давало указанное в заголовке соединение (122 мг) с выходом 56% в виде белого кристаллического твердого продукта.
1H ЯМР спектр (500 МГц, CD3OD) δ м.д.: 1,30-1,40 (м, 1H), 1,43-1,57 (м, 4H), 1,79 (д, 1H, J=11,7 Гц), 1,87-1,94 (м, 4H), 2,63-2,69 (м, 1H), 3,36 (квинтет, 1H, J=8,3 Гц), 3,97 (т, 2H, J=8,3 Гц), 4,05 (т, 2H, J=8,3 Гц), 4,27 (с, 2H), 6,77 (д, 1H, J=3,4 Гц), 7,26 (д, 1H, J=3,4 Гц), 7,48 (д, 2H, J=8,3 Гц), 8,11 (д, 2H, J=8,3 Гц).
ИК-спектр (KBr): 1346, 1410, 1442, 1503, 1561, 1588, 1618, 3105, 3430 см-1.
Масс-спектр (FAB+) m/z: 408 ((M+H)+).
(Пример 3)
1-[(4-{5-[4-Фенил-5-(трифторметил)-2-тиенил]-1,2,4-оксадиазол-3-ил}-2-тиенил)метил]азетидин-3-карбоновая кислота
(3a) 5-({[трет-Бутил(диметил)силил]окси}метил)тиофен-3-карбонитрил
К раствору [(4-бром-2-тиенил)метокси]трет-бутилдиметилсилана (9,0 г, 29 ммоль) [ссылочная литература: J. Med Chem., vol. 45, 5005 (2002)] в N,N-диметилформамиде (20 мл) добавляли цианид меди (4,7 г, 53 ммоль) при перемешивании, и полученную смесь кипятили с обратным холодильником в течение 2 часов. После охлаждения до комнатной температуры реакционную смесь разбавляли эфиром (80 мл), и, после добавления 28% водного раствора аммиака (50 мл), полученную смесь перемешивали при комнатной температуре в течение 1 часа. После перемешивания реакционную смесь экстрагировали эфиром, и экстракт промывали последовательно водой и насыщенным водным раствором хлорида натрия и сушили над сульфатом натрия. После фильтрации фильтрат упаривали в вакууме, и полученный таким образом сырой продукт указанного в заголовке соединения очищали хроматографией на колонке с силикагелем, используя смешанный растворитель, состоящий из этилацетата и гексана (от 1:50 до 1:4), в качестве элюента, что давало указанное в заголовке соединение (4,3 г) с выходом 58% в виде бесцветного маслянистого продукта.
1H ЯМР спектр (400 МГц, CDCl3) δ м.д.: 0,11 (с, 6H), 0,93 (с, 9H), 4,85 (с, 2H), 7,06 (с, 1H), 7,82 (с, 1H).
ИК-спектр (тонкая пленка): 1086, 1128, 1258, 2229 см-1.
Масс-спектр (EI+) m/z: 253 (M+).
(3b)
5-({[трет-Бутил(диметил)силил]окси}метил)-N'-гидрокситиофен-3-карбоксимидамид
Сырой продукт указанного в заголовке соединения синтезировали с помощью реакции, подобной той, что указана в примере 1 (1d), используя 5-({[трет-бутил(диметил)силил]окси}метил)тиофен-3-карбонитрил (4,3 г, 17 ммоль), который был получен в примере 3 (3a), и 40% водный раствор гидроксиламина (2, 2 мл). Далее, полученный таким образом сырой продукт указанного в заголовке соединения очищали хроматографией на колонке с силикагелем, используя смешанный растворитель, состоящий из этилацетата и гексана (от 1:10 до 2:5), в качестве элюента, что давало указанное в заголовке соединение (4,7 г) с выходом 97% в виде белого кристаллического твердого продукта.
1H ЯМР спектр (400 МГц, CDCl3) δ м.д.: 0,10 (с, 6H), 0,93 (с, 9H), 1,69 (ушир.с, 1H), 4,79 (ушир.с, 2H), 4,84 (с, 2H), 7,02 (д, 1H, J=1,4 Гц), 7,31 (д, 1H, J=1,4 Гц).
ИК-спектр (KBr): 1101, 1256, 1371, 1655, 3208, 3389, 3495 см-1
Масс-спектр (FAB+) m/z: 287 ((M+H)+).
(3c) (4-{5-[4-Фенил-5-(трифторметил)-2-тиенил]-1,2,4-оксадиазол-3-ил}-2-тиенил)метанол
Сырой продукт указанного в заголовке соединения синтезировали с помощью реакции, подобной той, что указана в примере 1 (1e), используя 5-({[трет-бутил(диметил)силил]окси}метил)-N'-гидрокситиофен-3-карбоксимидамид (0,43 г, 1,5 ммоль), который был получен в примере 3 (3b), 4-фенил-5-(трифторметил)тиофен-2-карбонил хлорид (0,52 г, 1,8 ммоль), N,N-диизопропилэтиламин (0,52 мл, 3,0 ммоль), и 1,0 М раствор фторида тетрабутиламмония (3,0 мл, 3,0 ммоль). Далее, полученный таким образом сырой продукт указанного в заголовке соединения очищали хроматографией на колонке с силикагелем, используя смешанный растворитель, состоящий из этилацетата и гексана (от 1:2 до 1:1), в качестве элюента, что давало указанное в заголовке соединение (0,60 г) в виде белого кристаллического твердого продукта.
1H ЯМР спектр (400 Мгц, CDCl3) δ м.д.: 1,95 (ушир.с, 1H), 4,89 (с, 2H), 7,45 (с, 5H), 7,56 (с, 1H), 7,87 (д, 1H, J=1,2 Гц), 8,07 (д, 1H, J=1,2 Гц).
ИК-спектр (KBr): 1126, 1183, 1268, 1313, 1417, 1578, 1606, 3324 см-1.
Масс-спектр (FAB+) m/z: 409 ((M+H)+).
(3d) Этил 1-[(4-{5-[4-фенил-5-(трифторметил)-2-тиенил]-1,2,4-оксадиазол-3-ил}-2-тиенил)метил]азетидин-3-карбоксилат
Сырой продукт указанного в заголовке соединения синтезировали с помощью реакции, подобной той, что указана в примере 1 (1f), используя (4-{5-[4-фенил-5-(трифторметил)-2-тиенил]-1,2,4-оксадиазол-3-ил}-2-тиенил)метанол (0,10 г, 0,25 ммоль), который был получен в примере 3 (3c), тетрабромид углерода (0,17 г, 0,50 ммоль), трифенилфосфин (0,13 г, 0,50 ммоль), этил 3-азетидинкарбоксилат гидрохлорид (62 мг, 0,38 ммоль) и N,N-диизопропилэтиламин (0,11 мл, 0,63 ммоль). Далее, полученный таким образом сырой продукт указанного в заголовке соединения очищали с помощью тонкослойной хроматографии на пластинке с силикагелем, используя смешанный растворитель, состоящий из этилацетата и гексана (2:3), в качестве подвижной фазы, что давало указанное в заголовке соединение (73 мг) с выходом 56% в виде белого кристаллического твердого продукта.
1H ЯМР спектр (400 МГц, CDCl3) δ м.д.: 1,27 (т, 3H, J=7,0 Гц), 3,31-3,41 (м, 3H), 3,55-3,68 (м, 2H), 3,83 (с, 2H), 4,17 (кв, 2H, J=7,0 Гц), 7,47 (с, 6H), 7,89 (д, 1H, J=1,2 Гц), 8,04 (д, 1H, J=1,2 Гц).
ИК-спектр (KBr): 1132, 1180, 1197, 1272, 1316, 1577, 1608, 1720 см-1.
Масс-спектр (FAB+) m/z: 520 ((M+H)+).
(3e) 1-[(4-{5-[4-Фенил-5-(трифторметил)-2-тиенил]-1,2,4-оксадиазол-3-ил}-2-тиенил)метил]азетидин-3-карбоновая кислота
К раствору этил 1-[(4-{5-[4-фенил-5-(трифторметил)-2-тиенил]-1,2,4-оксадиазол-3-ил}-2-тиенил)метил]азетидин-3-карбоксилата (70 мг, 0,13 ммоль), который был получен в примере 3 (3d), в диоксане (2 мл) добавляли 1н. водный раствор гидроксида натрия (0,39 мл, 0,39 ммоль) при перемешивании, и полученную смесь перемешивали при комнатной температуре в течение 2 часов. После перемешивания к реакционной смеси добавляли уксусную кислоту (22 мкл, 0,39 ммоль) для гашения реакции, и полученную смесь упаривали в вакууме. К остатку, полученному таким образом, добавляли последовательно метанол (1 мл) и воду (1 мл) при перемешивании, и выпавший в осадок белый твердый продукт собирали фильтрацией, используя воронку Кирияма (Kiriyama), промывали смешанным растворителем, состоящим из воды и метанола (3:7), и сушили в вакууме, что давало указанное в заголовке соединение (34 мг) с выходом 53% в виде белого кристаллического твердого продукта.
1H ЯМР спектр (400 МГц, CD3CO2D) δ м.д.: 3,75-3,88 (м, 1H), 4,35-4,46 (м, 2H), 4,46-4,58 (м, 2H), 4,76 (с, 2H), 7,45-7,60 (м, 5H), 7,93 (с, 1H), 8,03 (с, 1H), 8,37 (с, 1H).
ИК-спектр (KBr): 1133, 1178, 1270, 1579, 1605, 3429 см-1
Масс-спектр (FAB+) m/z: 492 ((M+H)+).
(Пример 4)
1-[(5-{5-[4-Фенил-5-(трифторметил)-2-тиенил]-1,2,4-оксадиазол-3-ил}-2-тиенил)метил]азетидин-3-карбоновая кислота
(4a) 5-({[трет-Бутил(диметил)силил]окси}метил)тиофен-2-карбонитрил
Сырой продукт указанного в заголовке соединения синтезировали с помощью реакции, подобной той, что указана в примере 3 (3a), используя [(5-бром-2-тиенил)метокси]трет-бутилдиметилсилан (2,4 г, 7,8 ммоль) [ссылочная литература: Tetrahedron, vol. 39, 2531 (1983)] и цианид меди (1,3 г, 14 ммоль). Далее, полученный таким образом сырой продукт указанного в заголовке соединения очищали хроматографией на колонке с силикагелем, используя смешанный растворитель, состоящий из этилацетата и гексана (от 1:50 до 1:7), в качестве элюента, что давало указанное в заголовке соединение (1,1 г) с выходом 56% в виде белого кристаллического твердого продукта.
1H ЯМР спектр (400 МГц, CDCl3) δ м.д.: 0,12 (с, 6H), 0,93 (с, 9H), 4,88 (д, 2H, J=1,2 Гц), 6,70 (дт, 1H, J=3,9 Гц, 1,2 Гц), 7,46 (д, 1H, J=3,9 Гц).
ИК-спектр (тонкая пленка)]: 1096, 1258, 1377, 1464, 1472, 2219 см-1.
Масс-спектр (EI+) m/z: 253 (M+).
(4b) 5-({[трет-Бутил(диметил)силил]окси}метил)-N'-гидрокситиофен-2-карбоксимидамид
Сырой продукт указанного в заголовке соединения синтезировали с помощью реакции, подобной той, что указана в примере 1 (1d), используя 5-({[трет-бутил(диметил)силил]окси}метил)тиофен-2-карбонитрил (1,3 г, 5,0 ммоль), который был получен в примере 4 (4a), и 40% водный раствор гидроксиламина (0,7 мл). Далее, полученный таким образом сырой продукт указанного в заголовке соединения очищали путем перекристаллизации из смешанного растворителя, состоящего из этилацетата и гексана, что давало указанное в заголовке соединение (1,2 г) с выходом 81% в виде белого кристаллического твердого продукта.
1H ЯМР спектр (400 МГц, CDCl3) δ м.д.: 0,10 (с, 6H), 0,93 (с, 9H), 4,82 (ушир.с, 2H), 4,84 (с, 2H), 6,81 (ушир.с, 1H), 6,84 (д, 1H, J=3,7 Гц), 7,11 (д, 1H, J=3,7 Гц).
ИК-спектр (KBr): 1067, 1250, 1256, 1368, 1387, 1588, 1658, 3206, 3384, 3498 см-1.
Масс-спектр (EI+) m/z: 286 (M+).
(4c) (5-{5-[4-Фенил-5-(трифторметил)-2-тиенил]-1,2,4-оксадиазол-3-ил}-2-тиенил)метанол
Сырой продукт указанного в заголовке соединения синтезировали с помощью реакции, подобной той, что указана в примере 1 (1e), используя 5-({[трет-бутил(диметил)силил]окси}метил)-N'-гидрокситиофен-2-карбоксимидамид (0,43 г, 1,5 ммоль), который был получен в примере 4 (4b), 4-фенил-5-(трифторметил)тиофен-2-карбонил хлорид (0,52 г, 1,8 ммоль), N,N-диизопропилэтиламин (0,52 мл, 3,0 ммоль), и 1,0 М раствор фторида тетрабутиламмония (3,0 мл, 3,0 ммоль). Далее, полученный таким образом сырой продукт указанного в заголовке соединения очищали хроматографией на колонке с силикагелем, используя смешанный растворитель, состоящий из этилацетата и гексана (1:2), в качестве элюента, что давало указанное в заголовке соединение (0,60 г) с выходом 99% в виде белого кристаллического твердого продукта.
1H ЯМР спектр (400 МГц, CDCl3) δ м.д.: 1,97 (ушир.с, 1H), 4,89 (с, 2H), 7,06 (д, 1H, J=3,7 Гц), 7,45 (с, 5H), 7,72 (д, 1H, J=3,7 Гц), 7,88 (кв, 1H, J=1,6 Гц).
ИК-спектр (KBr): 1108, 1126, 1176, 1269, 1373, 1572, 3322 см-1.
Масс-спектр (FAB+) m/z: 409 ((M+H)+).
(4d) Этил 1-[(5-{5-[4-фенил-5-(трифторметил)-2-тиенил]-1,2,4-оксадиазол-3-ил}-2-тиенил)метил]азетидин-3-карбоксилат
Сырой продукт указанного в заголовке соединения синтезировали с помощью реакции, подобной той, что указана в примере 1 (1f), используя (5-{5-[4-фенил-5-(трифторметил)-2-тиенил]-1,2,4-оксадиазол-3-ил}-2-тиенил)метанол (0,12 г, 0,29 ммоль), который был получен в примере 4 (4c), тетрабромид углерода (0,19 г, 0,58 ммоль), трифенилфосфин (0,15 г, 0,58 ммоль), этил 3-азетидинкарбоксилат гидрохлорид (62 мг, 0,38 ммоль) и N,N-диизопропилэтиламин (0,13 мл, 0,73 ммоль). Далее, полученный таким образом сырой продукт указанного в заголовке соединения очищали с помощью тонкослойной хроматографии на пластинке с силикагелем, используя смешанный растворитель, состоящий из этилацетата и гексана (4:5) в качестве подвижной фазы, что давало указанное в заголовке соединение (0,12 г) с выходом 80% в виде бесцветного маслянистого продукта.
1H ЯМР спектр (400 МГц, CDCl3) δ м.д.: 1,28 (т, 3H, J=7,0 Гц), 3,30-3,42 (м, 3H), 3,59-3,69 (м, 2H), 3,84 (с, 2H), 4,17 (кв, 2H, J=7,0 Гц), 6,96 (д, 1H, J=3,7 Гц), 7,45 (с, 5H), 7,69 (д, 1H, J=3,7 Гц), 7,87 (с, 1H).
ИК-спектр (жидкая пленка): 1133, 1182, 1214, 1269, 1284, 1373, 1571, 1734 см-1.
Масс-спектр (FAB+) m/z: 520 ((M+H)+).
(4e) 1-[(5-{5-[4-Фенил-5-(трифторметил)-2-тиенил]-1,2,4-оксадиазол-3-ил}-2-тиенил)метил]азетидин-3-карбоновая кислота
Указанное в заголовке соединение (60 мг) синтезировали с выходом 53% в виде белого кристаллического твердого продукта с помощью реакции, подобной той, что указана в примере 3 (3e), используя этил 1-[(5-{5-[4-фенил-5-(трифторметил)-2-тиенил]-1,2,4-оксадиазол-3-ил}-2-тиенил)метил]азетидин-3-карбоксилат (0,12 г, 0,23 ммоль), который был получен в примере 4 (4d), и 1н. водный раствор гидроксида натрия (0,69 мл, 0,69 ммоль).
1H ЯМР спектр (400 МГц, CD3CO2D) δ м.д.: 3,80-3,92 (м, 1H), 4,33-4,48 (м, 2H), 4,52-4,65 (м, 2H), 4,80 (с, 2H), 7,45-7,57 (м, 6H), 7,87 (с, 1H), 8,02 (с, 1H).
ИК-спектр (KBr): 1134, 1179, 1214, 1267, 1366, 1379, 1570, 1605, 3429 см-1.
Масс-спектр (FAB+) m/z: 492 ((M+H)+).
(Пример 5)
1-({5-[5-(4-Феноксифенил)-1,2,4-оксадиазол-3-ил]-2-тиенил}метил)азетидин-3-карбоновая кислота
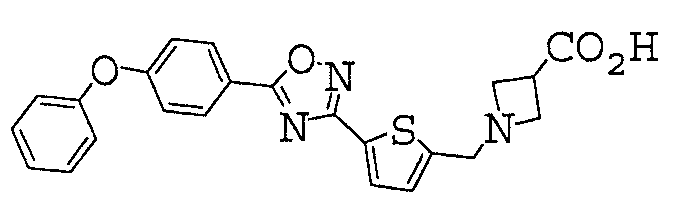
(5a) {5-[5-(4-Феноксифенил)-1,2,4-оксадиазол-3-ил]-2-тиенил}метанол
К раствору 4-феноксибензойной кислоты (0,12 г, 0,55 ммоль) в ацетонитриле (5 мл) добавляли последовательно 1-гидроксибензотриазол (88 мг, 0,65 ммоль), 1-этил-3-(3-диметиламинопропил)карбодиимид гидрохлорид (0,12 г, 0,60 ммоль), 5-({[трет-бутил(диметил)силил]окси}метил)-N'-гидрокситиофен-2-карбоксидиамид (0,14 г, 0,5 ммоль), который был получен в примере 4 (4b), при перемешивании, и полученную смесь перемешивали при комнатной температуре в течение 30 минут. После перемешивания к реакционной смеси добавляли воду (5 мл) для гашения реакции, и полученную смесь экстрагировали этилацетатом. Экстракт промывали последовательно 0,1н. соляной кислотой, насыщенным водным раствором гидрокарбоната натрия и насыщенным водным раствором хлорида натрия и сушили над сульфатом натрия. После фильтрации фильтрат упаривали в вакууме. Далее, к раствору полученного остатка в тетрагидрофуране (4,0 мл) добавляли фторид тетрабутиламмония (1,0 М раствор в тетрагидрофуране, 1,0 мл, 1,0 ммоль) при перемешивании, и полученную смесь перемешивали при 60°C в течение 3 часов. После перемешивания реакционную смесь выливали в воду (20 мл) для гашения реакции и экстрагировали эфиром. Экстракт промывали насыщенным водным раствором хлорида натрия и сушили над сульфатом натрия. После фильтрации фильтрат упаривали в вакууме, и полученный таким образом сырой продукт указанного в заголовке соединения очищали хроматографией на колонке с силикагелем, используя смешанный растворитель, состоящий из этилацетата и гексана (1:1), в качестве элюента, что давало указанное в заголовке соединение (97 мг) с выходом 55% в виде белого кристаллического твердого продукта.
1H ЯМР спектр (400 МГц, CDCl3) δ м.д.: 1,89 (т, 1H, J=5,9 Гц), 4,89 (д, 2H, J=5,9 Гц), 7,03-7,10 (м, 4H), 7,19-7,28 (м, 2H), 7,35-7,44 (м,2H), 7,71 (д, 1H, J=3,5 Гц), 8,61 (д, 2H, J=8,6 Гц).
ИК-спектр (KBr): 1241, 1366, 1487, 1575, 1590, 1613, 3331 см-1.
Масс-спектр (FAB+) m/z: 351 ((M+H)+).
(5b) Этил 1-({5-[5-(4-феноксифенил)-1,2,4-оксадиазол-3-ил]-2-тиенил}метил)азетидин-3-карбоксилат
Сырой продукт указанного в заголовке соединения синтезировали с помощью реакции, подобной той, что указана в примере 1 (1f), используя {5-[5-(4-феноксифенил)-1,2,4-оксадиазол-3-ил]-2-тиенил}метанол (97 мг, 0,28 ммоль), который был получен в примере 5 (5a), тетрабромид углерода (0,19 г, 0,56 ммоль), трифенилфосфин (0,15 г, 0,56 ммоль), этил 3-азетидинкарбоксилат гидрохлорид (70 мг, 0,42 ммоль), и N,N-диизопропилэтиламин (0,18 мл, 1,1 ммоль). Далее, полученный таким образом сырой продукт указанного в заголовке соединения очищали с помощью тонкослойной хроматографии на пластинке с силикагелем, используя смешанный растворитель, состоящий из этилацетата и гексана (4:3) в качестве подвижной фазы, что давало указанное в заголовке соединение (93 мг) с выходом 72% в виде бесцветного маслянистого продукта.
1H ЯМР спектр (400 МГц, CDCl3) δ м.д.: 1,27 (т, 3H, J=7,0 Гц), 3,29-3,41 (м, 3H), 3,59-3,68 (м, 2H), 3,84 (с, 2H), 4,17 (кв, 2H, J=7,0 Гц), 6,96 (д, 1H, J=3,3 Гц), 7,06-7,15 (м, 4H), 7,23 (т, 1H, J=7,4 Гц), 7,42 (т, 2H, J=7,8 Гц), 7,70 (д, 1H, J=3,3 Гц), 8,14 (д, 2H, J=9,0 Гц).
ИК-спектр (жидкая пленка): 1168, 1196, 1246, 1367, 1489, 1732 см-1.
Масс-спектр (FAB+) m/z: 462 ((M+H)+).
(5c) 1-({5-[5-(4-Феноксифенил)-1,2,4-оксадиазол-3-ил]-2-тиенил}метил)азетидин-3-карбоновая кислота
Указанное в заголовке соединение (69 мг) синтезировали с выходом 80% в виде белого кристаллического твердого продукта с помощью реакции, подобной той, что указана в примере 3 (3e), используя этил 1-({5-[5-(4-феноксифенил)-1,2,4-оксадиазол-3-ил]-2-тиенил}метил)азетидин-3-карбоксилат (90 мг, 0,20 ммоль), который был получен в примере 5 (5b) и 1н. водный раствор гидроксида натрия (0,60 мл, 0,60 ммоль).
1H ЯМР спектр (400 МГц, CD3CO2D) δ м.д.: 3,76-3,87 (м, 1H), 4,35-4,44 (м, 2H), 4,49-4,57 (м, 2H), 4,74 (с, 2H), 7,15 (д, 4H, J=8,6 Гц), 7,25 (т, 1H, J=7,8 Гц), 7,40-7,48 (м, 3H), 7,84 (д, 1H, J=3,9 Гц), 8,18 (д, 2H, J=8,6 Гц).
ИК-спектр (KBr): 1243, 1366, 1488, 1569, 1591, 1613, 3469 см-1.
Масс-спектр (FAB+) m/z: 434 ((M+H)+).
(Пример 6)
1-({4-[5-(4-Бензилфенил)-1,2,4-оксадиазол-3-ил]-2-тиенил}метил)азетидин-3-карбоновая кислота
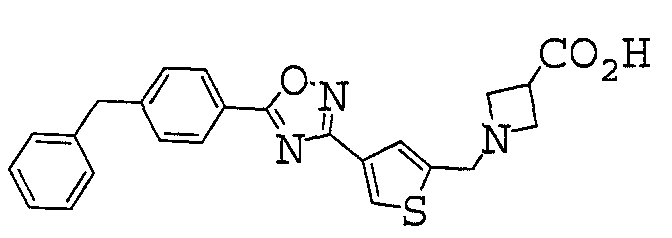
(6a) {4-[5-(4-Бензилфенил)-1,2,4-оксадиазол-3-ил]-2-тиенил}метанол
Сырой продукт указанного в заголовке соединения синтезировали с помощью реакции, подобной той, что указана в примере 5 (5a), используя 4-бензилбензойную кислоту (0,12 г, 0,55 ммоль), 1-гидроксибензотриазол (88 мг, 0,65 ммоль), 1-этил-3-(3-диметиламинопропил)карбодиимид (0,12 г, 0,60 ммоль), 5-({[трет-бутил(диметил)силил]окси}метил)-N'-гидрокситиофен-3-карбоксидиамид (0,14 г, 0,5 ммоль), который был получен в примере 3 (3b), и фторид тетрабутиламмония (1,0 М раствор в тетрагидрофуране, 1,0 мл, 1,0 ммоль). Далее, полученный таким образом сырой продукт указанного в заголовке соединения очищали путем перекристаллизации из смешанного растворителя, состоящего из этилацетата и гексана, что давало указанное в заголовке соединение (99 мг) с выходом 57% в виде белого кристаллического твердого продукта.
1H ЯМР спектр (400 МГц, CDCl3) δ м.д.: 1,68 (ушир.с, 1H), 4,08 (с, 2H), 4,90 (с, 2H), 7,18-7,43 (м, 7H), 7,59 (с, 1H), 8,07-8,15 (м, 3H).
ИК-спектр (KBr): 1019, 1418, 1495, 1563, 1585, 16161, 3334 см-1.
Масс-спектр (FAB+) m/z: 349 ((M+H)+).
(6b) Этил 1-({4-[5-(4-бензилфенил)-1,2,4-оксадиазол-3-ил]-2-тиенил}метил)азетидин-3-карбоксилат
Сырой продукт указанного в заголовке соединения синтезировали с помощью реакции, подобной той, что указана в примере 1 (1f), используя {4-[5-(4-бензилфенил)-1,2,4-оксадиазол-3-ил]-2-тиенил}метанол (95 мг, 0,27 ммоль), который был получен в примере 6 (6a), тетрабромид углерода (0,18 г, 0,54 ммоль), трифенилфосфин (0,14 г, 0,54 ммоль), этил 3-азетидинкарбоксилат гидрохлорид (67 мг, 0,41 ммоль) и N,N-диизопропилэтиламин (0,12 мл, 0,68 ммоль). Далее, полученный таким образом сырой продукт указанного в заголовке соединения очищали с помощью тонкослойной хроматографии на пластинке с силикагелем, используя смешанный растворитель, состоящий из этилацетата и гексана (6:4) в качестве подвижной фазы, что давало указанное в заголовке соединение (84 мг) с выходом 68% в виде белого кристаллического твердого продукта.
1H ЯМР спектр (400 МГц, CDCl3) δ м.д.: 1,27 (т, 3H, J=7,0 Гц), 3,30-3,39 (м, 3H), 3,56-3,66 (м, 2H), 3,82 (с, 2H), 4,06 (с, 2H), 4,15 (кв, 2H, J=7,0 Гц), 7,16-7,38 (м, 7H), 7,47 (с, 1H), 8,01 (с, 1H), 8,08 (д, 2H, J=8,2 Гц).
ИК-спектр (KBr): 1184, 1296, 1356, 1423, 1585, 1735 см-1.
Масс-спектр (FAB+) m/z: 460 ((M+H)+).
(6c) 1-({4-[5-(4-Бензилфенил)-1,2,4-оксадиазол-3-ил]-2-тиенил}метил)азетидин-3-карбоновая кислота
Указанное в заголовке соединение (67 мг) синтезировали с выходом 86% в виде белого кристаллического твердого продукта с помощью реакции, подобной той, которая указана в примере 3 (3e), используя этил 1-({4-[5-(4-бензилфенил)-1,2,4-оксадиазол-3-ил]-2-тиенил}метил)азетидин-3-карбоксилат (82 мг, 0,18 ммоль), который был получен в примере 6 (6b), и 1н. водный раствор гидроксида натрия (0,54 мл, 0,54 ммоль).
1H ЯМР спектр (400 МГц, CD3CO2D) δ м.д.: 3,74-3,86 (м, 1H), 4,07 (с, 2H), 4,34-4,43 (м, 2H), 4,45-4,55 (м, 2H), 4,72 (с, 2H), 7,16-7,31 (м, 5H), 7,42 (д, 2H, J=8,2 Гц), 7,89 (с, 1H), 8,11 (д, 2H, J=7,8 Гц), 8,31 (с, 1H).
ИК-спектр (KBr): 1323, 1387, 1428, 1562, 1587, 1604, 1616, 3427 см-1.
Масс-спектр (FAB+) m/z: 432 ((M+H)+).
(Пример 7)
1-{2-[5-(4-Изобутилфенил)-1,2,4-оксадиазол-3-ил]-4,5,6,7-тетрагидро-1-бензофуран-4-ил}азетидин-3-карбоновая кислота 1/2 оксалат
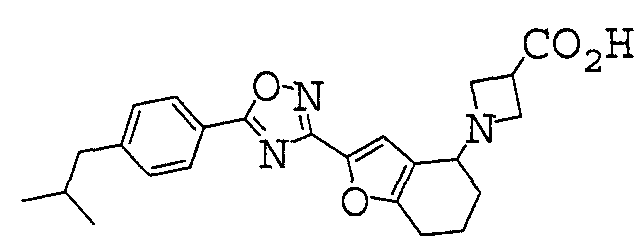
(7a) трет-Бутил(диметил)(4,5,6,7-тетрагидро-1-бензофуран-4-илокси)силан
К раствору 6,7-дигидро-4-(5H)-бензофуранона(5,0 г, 37 ммоль) в метаноле (50 мл) добавляли боргидрид натрия (1,4 г, 37 ммоль) при 0°C при перемешивании, и полученную смесь перемешивали в течение 1 часа. После упаривания реакционной смеси в вакууме полученный остаток разбавляли эфиром, выливали в воду (40 мл) и экстрагировали эфиром. Экстракт промывали насыщенным водным раствором хлорида натрия и сушили над сульфатом магния. После фильтрации фильтрат упаривали в вакууме. Далее, к раствору остатка, полученного таким образом, в диметилформамиде (30 мл) добавляли последовательно имидазол (4,0 г, 59 ммоль) и трет-бутилдиметилхлорсилан (4,9 г, 32 ммоль) при перемешивании, и полученную смесь перемешивали в течение 2 часов. После перемешивания реакционную смесь выливали в воду (50 мл) для гашения реакции и экстрагировали эфиром. Экстракт промывали насыщенным водным раствором хлорида натрия и сушили над сульфатом магния. После фильтрации фильтрат упаривали в вакууме, и полученный таким образом сырой продукт указанного в заголовке соединения очищали хроматографией на колонке с силикагелем, используя смешанный растворитель, состоящий из этилацетата и гексана (от 1:49 до 3:97) в качестве элюента, что давало указанное в заголовке соединение (7,2 г) с выходом 77% в виде бесцветного маслянистого продукта.
1H ЯМР спектр (400 МГц, CDCl3) δ м.д.: 0,12 (с, 3H), 0,13 (с, 3H), 0,92 (с, 9H), 1,63-1,79 (м, 2H), 1,89-1,94 (м, 1H), 1,98-2,08 (м, 1H), 2,51 (дт, 1H, J=16,4 Гц, 6,3 Гц), 2,62 (дт, 1H, J=16,4 Гц, 6,3 Гц), 4,74 (т, 1H, J=6,3 Гц), 6,30 (д, 1H, J=1,6 Гц), 7,24 (д, 1H, J=1,6 Гц).
ИК-спектр (жидкая пленка): 1074, 1255, 2858, 2932 см-1.
Масс-спектр (EI+) m/z: 252 (M+).
(7b) 4-{[трет-Бутил(диметил)силил]окси}-4,5,6,7-тетрагидро-1-бензофуран-2-карбоксальдегид
К раствору трет-бутил(диметил)(4,5,6,7-тетрагидро-1-бензофуран-4-илокси)силана (4,1 г, 16 ммоль), который был получен в примере 7 (7a), в тетрагидрофуране (30 мл) медленно по каплям добавляли н-бутиллитий (1,6 M раствор в гексане, 31 мл, 49 ммоль) при -78°C при перемешивании, и после повышения температуры реакции до 0°C, полученную смесь перемешивали в течение 30 минут. Затем реакционную смесь вновь охлаждали до -78°C при перемешивании, к реакционной смеси добавляли N,N-диметилформамид (13 мл, 162 ммоль) при перемешивании, и полученную смесь перемешивали в течение 30 минут. После перемешивания, к реакционной смеси добавляли насыщенный водный раствор хлорида аммония (10 мл) для гашения реакции, и полученную смесь выливали в воду (50 мл) и экстрагировали эфиром. Экстракт промывали насыщенным водным раствором хлорида натрия и сушили над сульфатом магния. После фильтрации фильтрат упаривали в вакууме, и полученный таким образом сырой продукт указанного в заголовке соединения очищали хроматографией на колонке с силикагелем, используя смешанный растворитель, состоящий из этилацетата и гексана (1:9), в качестве элюента, что давало указанное в заголовке соединение (4,3 г) с выходом 94% в виде белого кристаллического твердого продукта.
1H ЯМР спектр (500 МГц, CDCl3) δ м.д.: 0,14 (с, 3H), 0,16 (с, 3H), 0,92 (с, 9H), 1,66-1,86 (м, 2H), 1,90-1,99 (м, 1H), 2,04-2,14 (м, 1H), 2,61 (дт, 1H, J=17,6 Гц, 6,3 Гц), 2,73 (дт, 1H, J=17,6 Гц, 6,3 Гц), 4,75 (т, 1H, J=5,9 Гц), 7,15 (с, 1H), 9,53 (с, 1H).
ИК-спектр (KBr): 1074, 1085, 1525, 1678 см-1.
Масс-спектр (FAB+) m/z: 280 ((M+H)+).
(7c) 4-{[трет-Бутил(диметил)силил]окси}-4,5,6,7-тетрагидро-1-бензофуран-2-карбонитрил
Сырой продукт указанного в заголовке соединения синтезировали с помощью реакции, подобной той, что указана в примере 1 (1c), используя 4-{[трет-бутил(диметил)силил]окси}-4,5,6,7-тетрагидро-1-бензофуран-2-карбоксальдегид (4,3 г, 15,3 ммоль), который был получен в примере 7 (7b), гидрохлорид гидроксиламина (1,2 г, 17 ммоль), триэтиламин (4,3 мл, 31 ммоль) и N,N'-дициклогексилкарбодиимид (3,5 г, 17 ммоль). Далее, полученный таким образом сырой продукт указанного в заголовке соединения очищали хроматографией на колонке с силикагелем, используя смешанный растворитель, состоящий из этилацетата и гексана (1:9), в качестве элюента, что давало указанное в заголовке соединение (3,0 г) с выходом 71% в виде бесцветного маслянистого продукта.
1H ЯМР спектр (400 МГц, CDCl3) δ м.д.: 0,12 (с, 3H), 0,14 (с, 3H), 0,91 (с, 9H), 1,16-1,38 (м, 1H), 1,65-1,82 (м, 1H), 1,86-1,96 (м, 1H), 2,02-2,12 (м,1H), 2,55 (дт, 1H, J=17,2 Гц, 5,9 Гц), 2,66 (дт, 1H, J=17,2 Гц, 5,9 Гц), 4,70 (т, 1H, J=5,9 Гц), 6,99 (с, 1H).
ИК-спектр (жидкая пленка): 1087, 1255, 1526, 1616, 2120, 2227 см-1.
Масс-спектр (FAB+) m/z: 278 ((M+H)+), 300 ((M+Na)+).
(7d) 4-{[трет-Бутил(диметил)силил]окси}-N'-гидрокси-4,5,6,7-тетрагидро-1-бензофуран-2-карбоксидиамид
Сырой продукт указанного в заголовке соединения синтезировали с помощью реакции, подобной той, что указана в примере 1 (1d), используя 4-{[трет-бутил(диметил)силил]окси}-4,5,6,7-тетрагидро-1-бензофуран-2-карбонитрил (3,0 г, 11 ммоль), который был получен в примере 7 (7c), и 40% водный раствор гидроксиламина (3,0 мл). Далее, полученный таким образом сырой продукт указанного в заголовке соединения очищали хроматографией на колонке с силикагелем, используя смешанный растворитель, состоящий из этилацетата и гексана (3:7) в качестве элюента, что давало указанное в заголовке соединение (2,7 г) с выходом 82% в виде белого кристаллического твердого продукта.
1H ЯМР спектр (500 МГц, CDCl3) δ м.д.: 0,12 (с, 3H), 0,13 (с, 3H), 0,91 (с, 9H), 1,64-1,81 (м, 2H), 1,85-1,93 (м, 1H), 2,00-2,10 (м,1H), 2,54 (дт, 1H, J=17,4 Гц, 5,1 Гц), 2,65 (дт, 1H, J=17,2 Гц, 5,1 Гц), 4,72 (т, 1H, J=5,1 Гц), 4,85 (ушир.с, 2H), 6,57 (ушир.с, 1H), 6,62 (с, 1H).
ИК-спектр (KBr): 1252, 1362, 1377, 1569, 1544, 1645, 1670, 3171, 3371, 3484 см-1.
Масс-спектр (FAB+) m/z: 311 ((M+H)+).
(7e) 2-[5-(4-Изобутилфенил)-1,2,4-оксадиазол-3-ил]-4,5,6,7-тетрагидро-1-бензофуран-4-ол
Сырой продукт указанного в заголовке соединения синтезировали с помощью реакции, подобной той, что указана в примере 5 (5a), используя 4-изобутилбензойную кислоту (0,12 г, 0,66 ммоль), 1-гидроксибензотриазол (0,11 г, 0,78 ммоль), 1-этил-3-(3-диметиламинопропил)карбодиимид гидрохлорид (0,14 г, 0,72 ммоль), 4-{[трет-бутил(диметил)силил]окси}-N'-гидрокси-4,5,6,7-тетрагидро-1-бензофуран-2-карбоксимидамид (0,19 г, 0,6 ммоль), который был получен в примере 7 (7d), и фторид тетрабутиламмония (1,0 М раствор в тетрагидрофуране, 1,2 мл, 1,2 ммоль). Далее, полученный таким образом сырой продукт указанного в заголовке соединения очищали хроматографией на колонке с силикагелем, используя смешанный растворитель, состоящий из этилацетата и гексана (1:2-1:1), в качестве элюента, что давало указанное в заголовке соединение (0,15 г) с выходом 75% виде бледно желтоватого маслянистого продукта.
1H ЯМР спектр (400 МГц, CDCl3) δ м.д.: 0,93 (д, 6H, J=6,7 Гц), 1,80-2,12 (м, 5H), 2,56 (д, 2H, J=7,4 Гц), 2,64-2,72 (м, 1H), 2,76-2,86 (м, 1H), 4,80 (ушир.с, 1H), 7,21 (с, 1H), 7,29 (д, 2H, J=8,2 Гц), 8,08 (д, 2H, J=8,2 Гц).
ИК-спектр (тонкая пленка): 1204, 1343, 1386, 1420, 1505, 1560, 1590, 1616, 3389 см-1.
Масс-спектр (FAB+) m/z: 339 ((M+H)+).
(7f) Этил 1-{2-[5-(4-изобутилфенил)-1,2,4-оксадиазол-3-ил]-4,5,6,7-тетрагидро-1-бензофуран-4-ил}азетидин-3-карбоксилат
Сырой продукт указанного в заголовке соединения синтезировали с помощью реакции, подобной той, что указана в примере 1 (1f), используя 2-[5-(4-изобутилфенил)-1,2,4-оксадиазол-3-ил]-4,5,6,7-тетрагидро-1-бензофуран-4-ол (0,15 г, 0,45 ммоль), который был получен в примере 7 (7e), тетрабромид углерода (0,30 г, 0,90 ммоль), трифенилфосфин (0,24 г, 0,90 ммоль), этил 3-азетидинкарбоксилат гидрохлорид (0,11 г, 0,68 ммоль) и N,N-диизопропилэтиламин (0,20 мл, 1,1 ммоль). Далее, полученный таким образом сырой продукт указанного в заголовке соединения очищали с помощью тонкослойной хроматографии на пластинке с силикагелем, используя смешанный растворитель, состоящий из этилацетата и гексана (4:3) в качестве подвижной фазы, что давало указанное в заголовке соединение (27 мг) с выходом 13% в виде белого кристаллического твердого продукта.
1H ЯМР спектр (400 МГц, CDCl3) δ м.д.: 0,93 (д, 6H, J=6,6 Гц), 1,29 (т, 3H, J=7,4 Гц), 1,60-1,87 (м, 3H), 1,87-2,00 (м, 1H), 2,00-2,14 (м, 1H), 2,56 (д, 2H, J=7,4 Гц), 2,60-2,83 (м, 2H), 3,27-3,44 (м, 3H), 3,51 (т, 1H, J=6,8 Гц), 3,58-3,70 (м, 2H), 4,18 (кв, 2H, J=7,4 Гц), 7,12 (с, 1H), 7,31 (д, 2H, J=8,0 Гц), 8,10 (д, 2H, J=8,0 Гц).
ИК-спектр (жидкая пленка): 1186, 1208, 1342, 1387, 1560, 1590, 1616, 1733 см-1.
Масс-спектр (FAB+) m/z: 450((M+H)+).
(7g) 1-{2-[5-(4-Изобутилфенил)-1,2,4-оксадиазол-3-ил]-4,5,6,7-тетрагидро-1-бензофуран-4-ил}азетидин-3-карбоновая кислота 1/2 оксалат
Указанное в заголовке соединение (13 мг) синтезировали с выходом 50% в виде белого кристаллического твердого продукта с помощью реакции, подобной той, что указана в примере 3 (3e), используя этил 1-{2-[5-(4-изобутилфенил)-1,2,4-оксадиазол-3-ил]-4,5,6,7-тетрагидро-1-бензофуран-4-ил}азетидин-3-карбоксилат (25 мг, 0,056 ммоль), который был получен в примере 7 (7f), 1н. водный раствор гидроксида натрия (0,17 мл, 0,17 ммоль) и щавелевую кислоту (3 мг, 0,028 ммоль).
1H ЯМР спектр (400 МГц, CD3CO2D) δ м.д.: 0,94 (д, 6H, J=6,3 Гц), 1,90-2,23 (м, 5H), 2,60 (д, 2H, J=7,0 Гц), 2,69-2,79 (м, 1H), 2,79-2,90 (м, 1H), 3,79-3,92 (м, 1H), 4,38-4,73 (м, 5H), 7,40 (д, 2H, J=7,4 Гц), 7,43 (с, 1H), 8,13 (д, 2H, J=7,4 Гц).
ИК-спектр (KBr): 1387, 1409, 1559, 1592, 1613, 3431 см-1.
Масс-спектр (FAB+) m/z: 422 ((M+H)+).
(Пример 8)
1-{2-[5-(4-Изобутилфенил)-1,2,4-оксадиазол-3-ил]-4,5,6,7-тетрагидро-1-бензотиен-4-ил}азетидин-3-карбоновая кислота
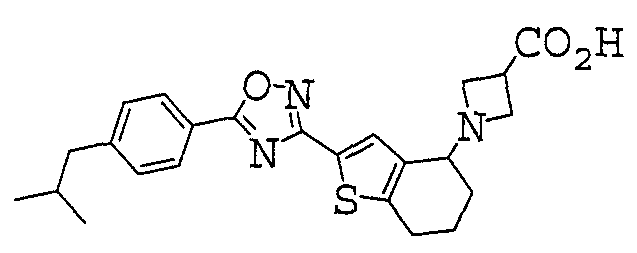
(8a) 2-Бром-4,5,6,7-тетрагидро-1-бензотиофен-4-ол
К раствору 4,5,6,7-тетрагидро-1-бензотиен-4-ил ацетата (5,1 г, 26 ммоль) в хлороформе (30 мл) добавляли N-бромсукцинимид (5 г, 28 ммоль) при 0°C при перемешивании, и полученную смесь перемешивали при комнатной температуре в течение 3 часов. После перемешивания реакционную смесь выливали в воду (40 мл) и экстрагировали эфиром. Экстракт промывали насыщенным водным раствором хлорида натрия и сушили над сульфатом магния. После фильтрации фильтрат упаривали в вакууме. Далее, к раствору остатка, полученного таким образом, в смешанном растворителе, состоящем из тетрагидрофурана (20 мл) и воды (20 мл), добавляли гидроксид натрия (2,3 г, 57 ммоль) при перемешивании, и полученную смесь перемешивали в течение 2 часов. После перемешивания реакционную смесь выливали в воду (50 мл) для гашения реакции и экстрагировали эфиром. Экстракт промывали насыщенным водным раствором хлорида натрия и сушили над сульфатом магния. После фильтрации фильтрат упаривали в вакууме, и полученный таким образом сырой продукт указанного в заголовке соединения очищали хроматографией на колонке с силикагелем, используя смешанный растворитель, состоящий из этилацетата и гексана (3:7) в качестве элюента, что давало указанное в заголовке соединение (5,0 г) с выходом 82% в виде бесцветного маслянистого продукта.
1H ЯМР спектр (400 МГц, CDCl3) δ м.д.: 1,67 (д, 1H, J=6,6 Гц), 1,75-1,89 (м, 2H), 1,90-2,04 (м, 2H), 2,57-2,67 (м, 1H), 2,69-2,77 (м, 1H), 4,66-4,72 (м, 1H), 6,97 (с, 1H).
ИК-спектр (жидкая пленка): 1182, 1435, 1453, 3330 см-1.
Масс-спектр (EI+) m/z: 232 (M+).
(8b) [(2-Бром-4,5,6,7-тетрагидро-1-бензотиофен-4-ил)окси](трет-бутил)диметилсилан
К раствору 2-бром-4,5,6,7-тетрагидро-1-бензотиофен-4-ола (5,0 г, 21 ммоль), который был получен в примере 8 (8a), в N,N-диметилформамиде (30 мл) добавляли последовательно имидазол (2,9 г, 43 ммоль) и трет-бутилдиметилхлорсилан (3,5 г, 24 ммоль) при перемешивании, и полученную смесь перемешивали в течение 2 часов. После перемешивания реакционную смесь выливали в воду (50 мл) для гашения реакции и экстрагировали эфиром. Экстракт промывали насыщенным водным раствором хлорида натрия и сушили над сульфатом магния. После фильтрации фильтрат упаривали в вакууме, и полученный таким образом сырой продукт указанного в заголовке соединения очищали хроматографией на колонке с силикагелем, используя смешанный растворитель, состоящий из этилацетата и гексана (1:9), в качестве элюента, что давало указанное в заголовке соединение (6,8 г) с выходом 91% в виде бесцветного маслянистого продукта.
1H ЯМР спектр (400 МГц, CDCl3) δ м.д.: 0,12 (с, 3H), 0,14 (с, 3H), 0,92 (с, 9H), 1,66-1,81 (м, 2H), 1,88-2,06 (м, 2H), 2,59 (дт, 1H, J=5,5 Гц, 16,4 Гц), 2,68 (дт, 1H, J=5,5 Гц, 16,4 Гц), 4,68 (т, 1H, J=5,5 Гц), 6,84 (с, 1H).
ИК-спектр (жидкая пленка): 1101, 1255, 2858, 2930 см-1.
Масс-спектр (EI+) m/z: 346 (M+).
(8c) 4-{[трет-Бутил(диметил)силил]окси}-4,5,6,7-тетрагидро-1-бензотиофен-2-карбоксальдегид
К раствору [(2-бром-4,5,6,7-тетрагидро-1-бензотиофен-4-ил)окси](трет-бутил)диметилсилана (5,6 г, 16 ммоль), который был получен в примере 8 (8b), в тетрагидрофуране (30 мл) медленно по каплям добавляли н-бутиллитий (1,6 M раствор в гексане, 11 мл, 18 ммоль) при -78°C при перемешивании, и полученную смесь перемешивали в течение 5 минут. Далее, к полученной смеси добавляли N,N-диметилформамид (2,5 мл, 32 ммоль) при той же температуре при перемешивании, и полученную смесь перемешивали в течение 30 минут. После перемешивания к реакционной смеси добавляли насыщенный водный раствор хлорида аммония (10 мл) для гашения реакции, и полученную смесь выливали в воду (50 мл) и экстрагировали эфиром. Экстракт промывали насыщенным водным раствором хлорида натрия и сушили над сульфатом магния. После фильтрации фильтрат упаривали в вакууме, и полученный таким образом сырой продукт указанного в заголовке соединения очищали хроматографией на колонке с силикагелем, используя смешанный растворитель, состоящий из этилацетата и гексана (1:9) в качестве элюента, что давало указанное в заголовке соединение (4,4 г) с выходом 92% в виде бесцветного маслянистого продукта.
1H ЯМР спектр (500 МГц, CDCl3) δ м.д.: 0,16 (с, 3H), 0,18 (с, 3H), 0,94 (с, 9H), 1,72-1,86 (м, 2H), 1,97-2,11 (м, 2H), 2,78 (дт, 1H, J=5,4 Гц, 16,5 Гц), 2,87 (дт, 1H, J=5,4 Гц, 16,5 Гц), 4,77 (т, 1H, J=5,4 Гц), 7,58 (с, 1H), 9,82 (с, 1H).
ИК-спектр (жидкая пленка): 1240, 1255, 1462, 1673 см-1.
Масс-спектр (EI+) m/z: 296 (M+).
(8d) 4-{[трет-Бутил(диметил)силил]окси}-4,5,6,7-тетрагидро-1-бензотиофен-2-карбонитрил
Сырой продукт указанного в заголовке соединения синтезировали с помощью реакции, подобной той, что указана в примере 1 (1c), используя 4-{[трет-бутил(диметил)силил]окси}-4,5,6,7-тетрагидро-1-бензотиофен-2-карбоксальдегид (4,4 г, 15,3 ммоль), который был получен в примере 8 (8c), гидрохлорид гидроксиламина (1,1 г, 16 ммоль), триэтиламин (4,1 мл, 30 ммоль) и N,N'-дициклогексилкарбодиимид (3,4 г, 16 ммоль). Далее, полученный таким образом сырой продукт указанного в заголовке соединения очищали хроматографией на колонке с силикагелем, используя смешанный растворитель, состоящий из этилацетата и гексана (1:9), в качестве элюента, что давало указанное в заголовке соединение (4,1 г) с выходом 94% в виде бесцветного маслянистого продукта.
1H ЯМР спектр (400 МГц, CDCl3) δ м.д.: 0,14 (с, 3H), 0,16 (с, 3H), 0,92 (с, 9H), 1,70-1,85 (м, 2H), 1,96-2,10 (м, 2H), 2,70-2,85 (м, 2H), 4,72 (т, 1H, J=5,5 Гц), 7,43 (с, 1H).
ИК-спектр (жидкая пленка): 1103, 1256, 1460, 2215 см-1.
Масс-спектр (FAB+) m/z: 294 ((M+H)+), 332((M+K)+).
(8e) 4-{[трет-Бутил(диметил)силил]окси}-N'-гидрокси-4,5,6,7-тетрагидро-1-бензотиофен-2-карбоксимидамид
Сырой продукт указанного в заголовке соединения синтезировали с помощью реакции, подобной той, что указана в примере 1 (1d), используя 4-{[трет-бутил(диметил)силил]окси}-4,5,6,7-тетрагидро-1-бензотиофен-2-карбонитрил (4,1 г, 13,9 ммоль), который был получен в примере 8 (8d), и 40% водный раствор гидроксиламина (2,0 мл). Далее, полученный таким образом сырой продукт указанного в заголовке соединения очищали хроматографией на колонке с силикагелем, используя смешанный растворитель, состоящий из этилацетата и гексана (3:7), в качестве элюента, что давало указанное в заголовке соединение (3,9 г) с выходом 96% в виде белого кристаллического твердого продукта.
1H ЯМР спектр (500 МГц, CDCl3) δ м.д.: 0,14 (с, 3H), 0,16 (с, 3H), 0,93 (с, 9H), 1,70-1,82 (м, 2H), 1,94-2,07 (м, 2H), 2,69 (дт, 1H, J=16,5 Гц, 5,5 Гц), 2,76 (дт, 1H, J=16,5 Гц, 5,5 Гц), 4,73 (т, 1H, J=5,5 Гц), 4,78 (ушир.с, 2H), 7,06 (с, 1H), 7,31 (ушир.с, 1H).
ИК-спектр (KBr): 1255, 1361, 1584, 1648, 3295, 3370, 3462 см-1.
Масс-спектр (FAB+) m/z: 327 ((M+H)+).
(8f) 2-[5-(4-Изобутилфенил)-1,2,4-оксадиазол-3-ил]-4,5,6,7-тетрагидро-1-бензотиофен-4-ол
Сырой продукт указанного в заголовке соединения синтезировали с помощью реакции, подобной той, что указана в примере 2 (2c), используя 4-{[трет-бутил(диметил)силил]окси}-N'-гидрокси-4,5,6,7-тетрагидро-1-бензотиофен-2-карбоксимидамид (0,15 г, 0,50 ммоль), который был получен в примере 8 (8e), 4-изобутилбензойную кислоту (89 мг, 0,50 ммоль), N,N'-дициклогексилкарбодиимид (0,11 г, 0,55 ммоль) и 1,0 М раствор фторида тетрабутиламмония (0,75 мл, 0,75 ммоль). Далее, полученный таким образом сырой продукт указанного в заголовке соединения очищали хроматографией на колонке с силикагелем, используя смешанный растворитель, состоящий из этилацетата и гексана (1:1), в качестве элюента, что давало указанное в заголовке соединение (92 мг) с выходом 52% в виде бесцветного маслянистого продукта.
1H ЯМР спектр (400 МГц, CDCl3) δ м.д.: 0,93 (д, 6H, J=6,6 Гц), 1,84-1,97 (м, 2H), 1,97-2,11 (м, 2H), 2,56 (д, 2H, J=7,4 Гц), 2,78 (дт, 1H, J=16,0 Гц, 4,7 Гц), 2,90 (дт, 1H, J=16,0 Гц, 4,7 Гц), 4,80-4,85 (д, 2H, J=7,8 Гц), 7,31 (д, 2H, J=7,8 Гц), 7,81 (с, 1H), 8,08 (д, 2H, J=7,8 Гц).
ИК-спектр (жидкая пленка): 1363, 1519, 1559, 1584, 1614, 3385 см-1.
Масс-спектр (FAB+) m/z: 355 ((M+H)+).
(8g) Этил 1-{2-[5-(4-изобутилфенил)-1,2,4-оксадиазол-3-ил]-4,5,6,7-тетрагидро-1-бензотиен-4-ил}-азетидин-3-карбоксилат
Сырой продукт указанного в заголовке соединения синтезировали с помощью реакции, подобной той, что указана в примере 1 (1f), используя 2-[5-(4-изобутилфенил)-1,2,4-оксадиазол-3-ил]-4,5,6,7-тетрагидро-1-бензотиофен-4-ол (92 мг, 0,26 ммоль), который был получен в примере 8 (8f), тетрабромид углерода (0,10 г, 0,31 ммоль), трифенилфосфина (81 мг, 0,31 ммоль), этил 3-азетидинкарбоксилат гидрохлорид (65 мг, 0,39 ммоль) и N,N-диизопропилэтиламин (0,14 мл, 0,78 ммоль). Далее, полученный таким образом сырой продукт указанного в заголовке соединения очищали хроматографией на колонке с силикагелем, используя смешанный растворитель, состоящий из этилацетата и гексана (от 1:1 до 2:1), в качестве элюента, что давало указанное в заголовке соединение (44 мг) с выходом 36% в виде бесцветного маслянистого продукта.
1H ЯМР спектр (500 МГц, CDCl3) δ м.д.: 0,93 (д, 6H, J=6,8 Гц), 1,29 (т, 3H, J=7,3 Гц), 1,70 (дт, 1H, J=11,2 Гц, 4,4 Гц), 1,75-1,83 (м, 3H), 1,93 (септет, 1H, J=6,8 Гц), 2,04-2,13 (м, 1H), 2,56 (д, 2H, J=7,3 Гц), 2,75-2,82 (м, 1H), 2,91 (дт, 1H, J=12,7 Гц,4,5 Гц), 3,30 (квинтет, 1H, J=7,8 Гц), 3,37 (т, 1H, J=6,8 Гц), 3,41 (т, 1H, J=3,9 Гц), 3,56 (т, 1H, J=7,3 Гц), 3,59-3,65 (м, 2H), 4,18 (кв, 2H, J=6,8 Гц), 7,31 (д, 2H, J=8,3 Гц), 7,65 (с, 1H), 8,09 (д, 2H, J=8,3 Гц).
ИК-спектр (тонкая пленка): 1186, 1332, 1363, 1450, 1517, 1560 см-1.
Масс-спектр (FAB+) m/z: 466 ((M+H)+).
(8h) 1-{2-[5-(4-Изобутилфенил)-1,2,4-оксадиазол-3-ил]-4,5,6,7-тетрагидро-1-бензотиен-4-ил}азетидин-3-карбоновая кислота
Указанное в заголовке соединение (26 мг) синтезировали с выходом 64% в виде белого кристаллического твердого продукта с помощью реакции, подобной той, которая указана в примере 2 (2e), используя этил 1-{2-[5-(4-изобутилфенил)-1,2,4-оксадиазол-3-ил]-4,5,6,7-тетрагидро-1-бензотиен-4-ил}-азетидин-3-карбоксилат (44 мг, 0,094 ммоль), который был получен в примере 8 (8g), моногидрат гидроксида лития (8,7 мг, 0,20 ммоль), и уксусную кислоту (11 мкл, 0,20 ммоль).
1H ЯМР спектр (500 МГц, CD3OD) δ м.д.: 0,94 (д, 6H, J=6,8 Гц), 1,90-2,01 (м, 3H), 2,02-2,08 (м,2H), 2,60 (д, 2H, J=7,3 Гц), 2,91 (дт, 1H, J=17,5 Гц, 7,3 Гц), 3,01 (дт, 1H, J=17,5 Гц, 5,4 Гц), 3,37 (квинтет, 1H, J=7,8 Гц), 4,16-4,24 (м, 2H), 4,31 (т, 1H, J=9,3 Гц), 4,35-4,45 (м, 2H), 7,41 (д, 2H, J=8,3 Гц), 7,86 (с, 1H), 8,09 (д, 2H, J=8,3 Гц).
ИК-спектр (тонкая пленка): 1517, 1559, 1613, 1714, 3428 см-1.
Масс-спектр (FAB+) m/z: 438 ((M+H)+).
(Пример 9)
1-({4-[3-(4-Изобутилфенил)изоксазол-5-ил]-2-тиенил}метил)азетидин-3-карбоновая кислота
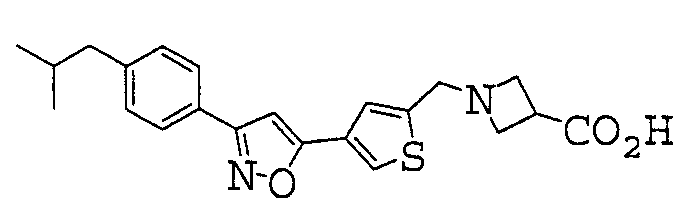
(9a) 4-[(Триметилсилил)этинил]тиофен-2-карбоксальдегид
К раствору 4-бром-2-тиофенкарбоксальдегида (3,0 г, 16 ммоль) в N,N-диметилформамиде (30 мл) добавляли последовательно (триметилсилил)ацетилен (11 мл, 79 ммоль), триэтиламин (13 мл, 94 ммоль) и дихлорбис(трифенилфосфина)палладий (1,1 г, 1,6 ммоль) в атмосфере азота при перемешивании, и полученную смесь перемешивали при 80°C в течение 2 часов в атмосфере азота. После перемешивания, реакционную смесь разбавляли этилацетатом, выливали в насыщенный водный раствор хлорида аммония (250 мл) и экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и сушили над сульфатом магния. После фильтрации фильтрат упаривали в вакууме, и полученный таким образом сырой продукт указанного в заголовке соединения очищали хроматографией на колонке с силикагелем, используя смешанный растворитель, состоящий из этилацетата и гексана (от 0:1 до 1:19) в качестве элюента, что давало указанное в заголовке соединение (3,3 г) с выходом 100% в виде коричневого маслянистого продукта.
1H ЯМР спектр (500 МГц, CDCl3) δ м.д.: 0,25 (с, 9H), 7,77 (с, 1H), 7,81 (с, 1H), 9,88 (с, 1H).
ИК-спектр (жидкая пленка): 665, 761, 847, 966, 1182, 1230, 1250, 1434, 1684, 2163, 2823, 2899, 2960, 3097 см-1.
Масс-спектр (EI+) m/z: 208(M+).
(9b) 4-Этинилтиофен-2-карбоксальдегид
К раствору 4-[(триметилсилил)этинил]тиофен-2-карбоксальдегида (3,3 г, 16 ммоль), который был получен в примере 9 (9a), в метаноле (160 мл) добавляли карбонат калия (4,3 г, 31 ммоль) при перемешивании, и полученную смесь перемешивали при комнатной температуре в течение 1 часа. После перемешивания нерастворенные продукты удаляли фильтрацией, и фильтрат упаривали в вакууме. Полученный таким образом остаток разбавляли этилацетатом, выливали в воду (100 мл) и экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и сушили над сульфатом магния. После фильтрации фильтрат упаривали в вакууме, и полученный таким образом сырой продукт указанного в заголовке соединения очищали хроматографией на колонке с силикагелем, используя смешанный растворитель, состоящий из этилацетата и гексана (от 0:1 до 1:19), в качестве элюента, что давало указанное в заголовке соединение (1,5 г) с выходом 69% в виде коричневого твердого продукта.
1H ЯМР спектр (400 МГц, CDCl3) δ м.д.: 3,10 (с, 1H), 7,79 (с, 1H), 7,86 (с, 1H), 9,90 (с, 1H).
ИК-спектр (KBr): 616, 661, 726, 800, 858, 1124, 1190, 1231, 1364, 1432, 1673, 3098, 3426 см-1.
Масс-спектр (EI+) m/z: 136 (M+).
(9c) (4-Этинил-2-тиенил)метанол
К раствору 4-этинилтиофен-2-карбоксальдегида (1,5 г, 11 ммоль), который был получен в примере 9 (9b), в метаноле (30 мл) добавляли боргидрид натрия (0,49 г, 13 ммоль) при 0°C при перемешивании, и затем полученную смесь перемешивали при комнатной температуре в течение 15 минут. После охлаждения реакционной смеси до 0°C к реакционной смеси добавляли воду (100 мл), и полученную смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и сушили над сульфатом магния. После фильтрации фильтрат упаривали в вакууме, и полученный таким образом сырой продукт указанного в заголовке соединения очищали хроматографией на колонке с силикагелем, используя смешанный растворитель, состоящий из этилацетата и гексана (от 1:9 до 3:7), в качестве элюента, что давало указанное в заголовке соединение (0,88 г) с выходом 60% в виде коричневого маслянистого продукта.
1H ЯМР спектр (400 МГц, CDCl3) δ м.д.: 1,82 (т, 1H, J=6,1 Гц), 3,01 (с, 1H), 4,75 (д, 1H, J=6,1 Гц), 4,79 (д, 1H, J=6,1 Гц), 7,04 (д, 1H, J=1,0 Гц), 7,46 (д, 1H, J=1,0 Гц).
ИК-спектр (жидкая пленка): 609, 660, 761, 846, 1012, 1116, 1165, 1185, 1356, 1370, 2111, 2875, 2932, 3107, 3289 см-1.
Масс-спектр (EI+) m/z: 138 (M+).
(9d) трет-бутил[(4-этинил-2-тиенил)метокси]диметилсилан
К раствору (4-этинил-2-тиенил)метанола (0,88 г, 6,4 ммоль), который был получен в примере 9 (9c), в дихлорметане (20 мл) добавляли последовательно триэтиламин (1,3 мл, 9,6 ммоль), трет-бутилдиметилхлорсилан (1,2 г, 7,6 ммоль) и 4-диметиламинопиридин (78 мг, 0,64 ммоль) при перемешивании, и полученную смесь перемешивали при комнатной температуре в течение 1 часа. После перемешивания к реакционной смеси добавляли воду (50 мл), и полученную смесь экстрагировали дихлорметаном. Экстракт промывали насыщенным водным раствором хлорида натрия и сушили над сульфатом магния. После фильтрации фильтрат упаривали в вакууме, и полученный таким образом сырой продукт указанного в заголовке соединения очищали хроматографией на колонке с силикагелем, используя смешанный растворитель, состоящий из этилацетата и гексана (от 0:1 до 1:9), в качестве элюента, что давало указанное в заголовке соединение (1,5 г) с выходом 94% в виде коричневого маслянистого продукта.
1H ЯМР спектр (400 МГц, CDCl3) δ м.д.: 0,10 (с, 6H), 0,92 (с, 9H), 2,98 (с, 1H), 4,80 (с, 2H), 6,91 (д, 1H, J=1,2 Гц), 7,38 (д, 1H, J=1,2 Гц).
ИК-спектр (жидкая пленка): 778, 838, 1080, 1122, 1171, 1257, 1374, 1464, 1472, 2858, 2930, 2956, 3313 см-1.
Масс-спектр (EI+) m/z: 252 (M+).
(9e) Оксим 4-изобутилбензальдегида
К раствору 4-изобутилбензальдегида (5,0 г, 31 ммоль) в смешанном растворителе, состоящем из этанола (25 мл) и пиридина (25 мл), добавляли гидрохлорид гидроксиламина (2,4 г, 34 ммоль) при перемешивании, и полученную смесь перемешивали при комнатной температуре в течение 18 часов. После упаривания реакционной смеси в вакууме полученный таким образом остаток разбавляли эфиром, выливали в воду (150 мл) и экстрагировали эфиром. Экстракт промывали последовательно 1н. соляной кислотой и насыщенным водным раствором хлорида натрия и сушили над сульфатом магния. После фильтрации фильтрат упаривали в вакууме, и полученный таким образом сырой продукт указанного в заголовке соединения очищали хроматографией на колонке с силикагелем, используя смешанный растворитель, состоящий из этилацетата и гексана (от 1:19 до 1:9), в качестве элюента, что давало указанное в заголовке соединение (4,6 г) с выходом 84% в виде бесцветного маслянистого продукта.
1H ЯМР спектр (500 МГц, CDCl3) δ м.д.: 0,90 (д, 6H, J=6,8 Гц), 1,87 (м, 1H), 2,49 (д, 2H, J=7,3 Гц), 7,16 (д, 2H, J=8,3 Гц), 7,48 (д, 2H, J=8,3 Гц), 7,63 (ушир.с, 1H), 8,12 (с, 1H).
ИК-спектр (жидкая пленка): 534, 790, 845, 962, 1296, 1466, 1517, 1611, 2869, 2925, 2957, 3308 см-1.
Масс-спектр (EI+) m/z: 177 (M+).
(9f) N-Гидрокси-4-изобутилбензолкарбоксиимидоил хлорид
К раствору оксима 4-изобутилбензальдегида (1,0 г, 5,6 ммоль), который был получен в примере 9 (9e), в N,N-диметилформамиде (10 мл) добавляли N-хлорсукцинимид (0,15 г, 1,1 ммоль) при перемешивании, и затем в полученную смесь при перемешивании барботировали небольшое количество газообразной хлористоводородной кислоты, и затем полученную смесь перемешивали при комнатной температуре в течение 10 минут. После повторения серий тех же процедур, что описаны выше, пять раз в целом, реакционную смесь выливали в ледяную воду (100 мл) и экстрагировали эфиром. Экстракт промывали последовательно водой и насыщенным водным раствором хлорида натрия и сушили над сульфатом магния. После фильтрации фильтрат упаривали в вакууме, что давало указанное в заголовке соединение (1,2 г) с выходом 100% в виде желтого маслянистого продукта.
1H ЯМР спектр (500M Гц, CDCl3) δ м.д.: 0,91 (д, 6H, J=6,8 Гц), 1,88 (м, 1H), 2,51 (д, 2H, J=7,3 Гц), 7,18 (д, 2H, J=8,3 Гц), 7,75 (д, 2H, J=8,3 Гц), 7,82 (с, 1H).
ИК-спектр (жидкая пленка): 795, 850, 937, 994, 1185, 1249, 1413, 1466, 1609, 2957, 3380 см-1.
Масс-спектр (EI+) m/z: 211 (M+).
(9g) {4-[3-(4-Изобутилфенил)изоксазол-5-ил]-2-тиенил}метанол
К раствору N-гидрокси-4-изобутилбензолкарбоксиимидоил хлорида (0,50 г, 2,4 ммоль), который был получен в примере 9 (9f), и трет-бутил[(4-этинил-2-тиенил)метокси]диметилсилана (0,72 г, 2,8 ммоль), который был получен в примере 9 (9d), в этилацетате (10 мл) добавляли триэтиламин (0,40 мл, 2,8 ммоль) при 0°C при перемешивании, и полученную смесь перемешивали при комнатной температуре в течение 18 часов. После перемешивания реакционную смесь выливали в воду (50 мл) и экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и сушили над сульфатом магния. После фильтрации фильтрат упаривали в вакууме. Далее, к раствору остатка, полученного таким образом, в тетрагидрофуране (15 мл) добавляли фторид тетрабутиламмония (1,0 М раствор в тетрагидрофуране, 2,8 мл, 2,8 ммоль) при 0°C при перемешивании, и полученную смесь перемешивали при комнатной температуре в течение 1 часа. После перемешивания реакционную смесь выливали в воду (50 мл) и экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и сушили над сульфатом магния. После фильтрации фильтрат упаривали в вакууме. Далее, к полученному остатку добавляли смешанный растворитель, состоящий из этилацетата и гексана (1:3) при перемешивании, и выпавший в осадок твердый продукт собирали фильтрацией, используя воронку Кирияма (Kiriyama), и промывали тем же растворителем, что давало указанное в заголовке соединение (0,44 г) с выходом 59% в виде белого кристаллического твердого продукта.
1H ЯМР спектр (500 МГц, CDCl3) δ м.д.: 0,93 (д, 6H, J=6,3 Гц), 1,91 (м, 1H), 1,98 (ушир.с, 1H), 2,53 (д, 2H, J=6,8 Гц), 4,89 (с, 2H), 6,64 (с, 1H), 7,25 (д, 2H, J=8,3 Гц), 7,35 (с, 1H), 7,73-7,77 (м, 3H).
ИК-спектр (KBr): 774, 794, 847, 1018, 1380, 1440, 1467, 1615, 2869, 2926, 2953, 3344 см-1.
Масс-спектр (EI+) m/z: 313 (M+).
(9h) Этил 1-({4-[3-(4-изобутилфенил)изоксазол-5-ил]-2-тиенил}метил)азетидин-3-карбоксилат
Раствор {4-[3-(4-изобутилфенил)изоксазол-5-ил]-2-тиенил}метанола (0,43 г, 1,4 ммоль), который был получен в примере 9 (9g), тетрабромида углерода (0,68 г, 2,1 ммоль) и трифенилфосфина (0,54 г, 2,1 ммоль) в дихлорметане (15 мл) перемешивали при 0°C в течение 5 минут. Далее, к реакционной смеси добавляли последовательно этил 3-азетидинкарбоксилат гидрохлорид (0,34 мг, 2,1 ммоль) и N,N-диизопропилэтиламин (0,60 мл, 3,4 ммоль) при перемешивании, и полученную смесь перемешивали при комнатной температуре в течение 18 часов. После перемешивания к реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия (5 мл) для гашения реакции, и полученную смесь выливали в воду (50 мл) и экстрагировали дихлорметаном. Экстракт промывали насыщенным водным раствором хлорида натрия и сушили над сульфатом магния. После фильтрации фильтрат упаривали в вакууме, и полученный таким образом сырой продукт указанного в заголовке соединения очищали хроматографией на колонке с силикагелем, используя смешанный растворитель, состоящий из этилацетата и гексана (от 1:4 до 3:2), в качестве элюента, что давало указанное в заголовке соединение (0,48 г) с выходом 82% в виде белого кристаллического твердого продукта.
1H ЯМР спектр (500 МГц, CDCl3) δ м.д.: 0,93 (д, 6H, J=6,7 Гц), 1,27 (т, 3H, J=7,0 Гц), 1,90 (м, 1H), 2,52 (д, 2H, J=7,0 Гц), 3,32-3,38 (м, 3H), 3,56-3,64 (м, 2H), 3,81 (с, 2H), 4,16 (кв, 2H, J=7,0 Гц), 6,60 (с, 1H), 7,21-7,26 (м, 3H), 7,68 (с, 1H), 7,72 (д, 2H, J=8,2 Гц).
ИК-спектр (KBr): 797, 1193, 1369, 1436, 1607, 1731, 2955, 3115 см-1.
Масс-спектр (FAB+) m/z: 425 ((M+H)+).
(9i)
1-({4-[3-(4-Изобутилфенил)изоксазол-5-ил]-2-тиенил}метил)азетидин-3-карбоновая кислота
К раствору этил 1-({4-[3-(4-изобутилфенил)изоксазол-5-ил]-2-тиенил}метил)азетидин-3-карбоксилата (0,47 г, 1,1 ммоль), который был получен в примере 9 (9h), в 1,4-диоксане (15 мл) добавляли 1н. водный раствор гидроксида натрия (3,3 мл, 3,3 ммоль) при 0°C при перемешивании, и затем полученную смесь перемешивали при комнатной температуре в течение 30 минут. После добавления к реакционной смеси метанола (15 мл) и воды (5 мл) полученную смесь нагревали при перемешивании до растворения выпавшего в осадок белого твердого продукта, и затем добавляли уксусную кислоту (0,19 мл, 3,3 ммоль). Выпавший в осадок белый твердый продукт собирали фильтрацией, используя воронку Кирияма (Kiriyama), промывали метанолом и сушили в вакууме, что давало указанное в заголовке соединение (0,35 г) с выходом 78% в виде белого кристаллического твердого продукта.
1H ЯМР спектр (500 МГц, CD3CO2D) δ м.д.: 0,93 (д, 6H, J=6,6 Гц), 1,92 (м, 1H), 2,54 (д, 2H, J=7,3 Гц), 3,77-3,87 (м, 1H), 4,35-4,60 (м, 4H), 4,73 (с, 2H), 6,98 (с, 1H), 7,30 (д, 2H, J=8,2 Гц), 7,77 (д, 1H, J=1,4 Гц), 7,82 (д, 2H, J=8,2 Гц), 8,06 (д, 1H, J=1,4 Гц).
ИК-спектр (KBr): 792, 826, 951, 1386, 1440, 1614, 2924, 2954, 3103, 3423 см-1.
Масс-спектр (FAB+) m/z: 397 ((M+H)+).
(Пример 10)
1-[(4-Этил-5-{5-[4-(2-фторфенокси)фенил]-1,2,4-оксадиазол-3-ил}-2-тиенил)метил]азетидин-3-карбоновая кислота 1/2 оксалат
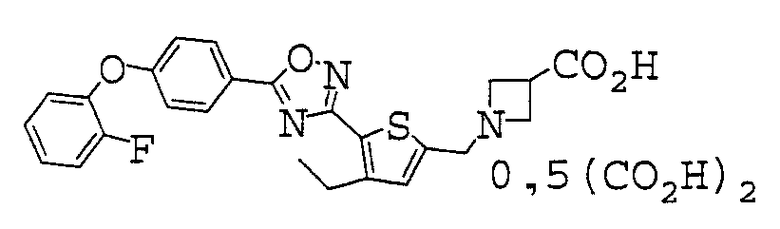
(10a) трет-бутил[(4-этил-2-тиенил)метокси]диметилсилан
К раствору [(4-бром-2-тиенил)метокси](трет-бутил)диметилсилана (0,61 г, 2,0 ммоль) и [1,3-бис(дифенилфосфино)пропан]дихлорникеля (54 мг, 0,1 ммоль) в эфире (5 мл) медленно добавляли 1,0 М раствор этилмагний бромида в тетрагидрофуране (3,0 мл, 3,0 ммоль) при 0°C при перемешивании, и после повышения температуры реакции до комнатной температуры полученную смесь перемешивали в течение 1 часа. После перемешивания к реакционной смеси добавляли насыщенный водный раствор хлорида аммония (5 мл) для гашения реакции, и полученную смесь выливали в воду (20 мл) и экстрагировали эфиром. Экстракт промывали насыщенным водным раствором хлорида натрия и сушили над сульфатом магния. После фильтрации фильтрат упаривали в вакууме, и полученный таким образом сырой продукт указанного в заголовке соединения очищали хроматографией на колонке с силикагелем, используя смешанный растворитель, состоящий из этилацетата и гексана (от 0:10 до 5:95), в качестве элюента, что давало указанное в заголовке соединение (0,44 г) с выходом 95% в виде бледно-желтого маслянистого продукта.
1H ЯМР спектр (400 МГц, CDCl3) δ м.д.: 0,10 (с, 6H), 0,93 (с, 9H), 1,21 (т, 3H, J=7,4 Гц), 2,58 (кв, 2H, J=7,4 Гц), 4,82 (с, 2H), 6,77 (с, 1H), 6,81 (с, 1H).
ИК-спектр (жидкая пленка): 1077, 1131, 1174, 1255, 1463, 1471 см-1.
Масс-спектр (FAB+) m/z: 255 ((M-H)+).
(10b) 5-({[трет-Бутил(диметил)силил]окси}метил)-3-этилтиофен-2-карбоксальдегид
К раствору трет-бутил[(4-этил-2-тиенил)метокси]диметилсилана (1,3 г, 5,6 ммоль), который был получен в примере 10 (10a), в тетрагидрофуране (10 мл) медленно добавляли 1,6 M раствор н-бутиллития в гексане (4,2 мл, 6,7 ммоль) при -78°C при перемешивании, и после повышения температуры реакции до 0°C полученную смесь перемешивали в течение 30 минут. Далее температуру реакции опять понижали до -78°C при перемешивании, и к реакционной смеси добавляли N,N-диметилформамид (0,86 мл, 11 ммоль) при перемешивании, и полученную смесь перемешивали в течение 30 минут. После перемешивания к реакционной смеси добавляли насыщенный водный раствор хлорида аммония (5 мл) для гашения реакции, и полученную смесь выливали в воду (20 мл) и экстрагировали эфиром. Экстракт промывали насыщенным водным раствором хлорида натрия и сушили над сульфатом магния. После фильтрации фильтрат упаривали в вакууме, и полученный таким образом сырой продукт указанного в заголовке соединения очищали хроматографией на колонке с силикагелем, используя смешанный растворитель, состоящий из этилацетата и гексана (от 0:10 до 5:95), в качестве элюента, что давало указанное в заголовке соединение (1,3 г) с выходом 86% в виде бледно-желтого маслянистого продукта.
1H ЯМР спектр (400 МГц, CDCl3) δ м.д.: 0,12 (с, 6H), 0,94 (с, 9H), 1,29 (т, 3H, J=7,4 Гц), 2,94 (кв, 2H, J=7,4 Гц), 4,86 (с, 2H), 6,84 (с, 1H), 9,99 (с, 1H).
ИК-спектр (жидкая пленка): 1092, 1156, 1225, 1256, 1461, 1659 см-1.
Масс-спектр (EI+) m/z: 285 (M+).
(10c) 5-({[трет-Бутил(диметил)силил]окси}метил)-3-этилтиофен-2-карбонитрил
К суспензии 5-({[трет-бутил(диметил)силил]окси}метил)-3-этилтиофен-2-карбоксальдегида (1,3 г, 4,8 ммоль), который был получен в примере 10 (10b), и гидрохлорида гидроксиламина (0,37 г, 5,3 ммоль) в дихлорметане (20 мл) добавляли последовательно метанол (2 мл) и триэтиламин (1,3 мл, 9,6 ммоль) при перемешивании, и полученную смесь перемешивали при комнатной температуре в течение 2 часов. После удаления растворителя в вакууме к остатку добавляли толуол (10 мл) и полученную смесь азеотропно упаривали в вакууме. Далее, полученный остаток и N,N- N,N'-дициклогексилкарбодиимид (1,1 г, 5,3 ммоль) суспендировали в толуоле (20 мл) и перемешивали при 90°C в течение 15 часов. После охлаждения до комнатной температуры к реакционной смеси добавляли гексан (20 мл), и полученную смесь фильтровали через целит. Фильтрат упаривали в вакууме, и полученный таким образом сырой продукт указанного в заголовке соединения очищали хроматографией на колонке с силикагелем, используя смешанный растворитель, состоящий из этилацетата и гексана (от 0:10 до 5:95), в качестве элюента, что давало указанное в заголовке соединение (0,94 г) с выходом 69% в виде бледно-желтого маслянистого продукта.
1H ЯМР спектр (400 МГц, CDCl3) δ м.д.: 0,11 (с, 6H), 0,93 (с, 9H), 1,25 (т, 3H, J=7,8 Гц), 2,75 (кв, 2H, J=7,8 Гц), 4,83 (с, 2H), 6,74 (с, 1H).
ИК-спектр (жидкая пленка): 1093, 1149, 1256, 2212 см-1.
Масс-спектр (EI+) m/z: 282 (M+).
(10d) 5-({[трет-Бутил(диметил)силил]окси}метил)-3-этил-N'-гидрокситиофен-2-карбоксимидамид
Сырой продукт указанного в заголовке соединения синтезировали с помощью реакции, подобной той, которая указана в примере 1 (1d), используя 5-({[трет-бутил(диметил)силил]окси}метил)-3-этилтиофен-2-карбонитрил (0,93 г, 3,3 ммоль), который был получен в примере 10 (10c), и 40% водный раствор гидроксиламина (0,5 мл)). Далее, полученный таким образом сырой продукт указанного в заголовке соединения очищали путем перекристаллизации из гексана (6:4), что давало указанное в заголовке соединение (0,60 г) с выходом 60% в виде белого кристаллического твердого продукта.
1H ЯМР спектр (400 МГц, CDCl3) δ м.д.: 0,11 (с, 6H), 0,93 (с, 9H), 1,20 (т, 3H, J=7,8 Гц), 2,76 (кв, 2H, J=7,8 Гц), 4,80 (с, 4H), 6,76 (с, 1H), 7,10 (ушир., 1H).
ИК-спектр (KBr): 1059, 1590, 1643, 3284, 3357, 3491 см-1.
Масс-спектр (EI+) m/z: 315 (M+).
(10e) 4-(2-Фторфенокси)бензойная кислота
К раствору 4-фторбензальдегида (1,2 г, 10 ммоль) и 2-фторфенола (1,3 г, 12 ммоль) в N,N-диметилформамиде (10 мл) добавляли карбонат калия (2,8 г, 20 ммоль) при перемешивании, и полученную смесь перемешивали при 100°C в течение 16 часов. После охлаждения до комнатной температуры реакционную смесь выливали в воду (20 мл) и экстрагировали эфиром. Экстракт промывали насыщенным водным раствором хлорида натрия и сушили над сульфатом магния. После фильтрации фильтрат упаривали в вакууме. Далее, к раствору полученного остатка в смеси тетрагидрофурана (5 мл), трет-бутанола (10 мл) и воды (5 мл) добавляли последовательно 2-метил-2-бутен (5,3 мл, 50 ммоль), дигидрофосфат калия (3,4 г, 25 ммоль), и гипохлорит натрия (2,7 г, 30 ммоль) при перемешивании, и полученную смесь перемешивали при комнатной температуре в течение 2 часов. После перемешивания реакционную смесь выливали в воду (20 мл) и экстрагировали эфиром. Далее, к водному слою добавляли 1M водный раствор гидроксида натрия (20 мл), и полученный водный слой подкисляли 10M водным раствором соляной кислоты (2 мл) и вновь экстрагировали эфиром. Экстракт промывали насыщенным водным раствором хлорида натрия и сушили над сульфатом магния. После фильтрации фильтрат упаривали в вакууме, что давало указанное в заголовке соединение (2,0 г) с выходом 87% в виде белого кристаллического твердого продукта.
1H ЯМР спектр (400 МГц, CDCl3) δ м.д.: 6,98 (д, 2H, J=8,6 Гц), 7,15-7,24 (м, 4H), 8,07 (д, 2H, J=8,6 Гц).
ИК-спектр (KBr): 1266, 1290, 1428, 1498, 1594, 1682, 2544, 2672, 2884, 2990 см-1.
Масс-спектр (EI+) m/z: 232 (M+).
(10f) (4-Этил-5-{5-[4-(2-фторфенокси)фенил]-1,2,4-оксадиазол-3-ил}-2-тиенил)метанол
К раствору 5-({[трет-бутил(диметил)силил]окси}метил)-3-этил-N'-гидрокситиофен-2-карбоксидиамида (0,16 г, 0,50 ммоль), который был получен в примере 10 (10d), и 4-(2-фторфенокси)бензойной кислоты (0,13 г, 0,55 ммоль), которая была получена в примере 10 (10e), в дихлорметане (1,5 мл) добавляли N,N'-дициклогексилкарбодиимид (0,11 г, 0,55 ммоль) при перемешивании, и полученную смесь перемешивали при комнатной температуре в течение 30 минут. После перемешивания к реакционной смеси добавляли гексан (2 мл), и нерастворенные продукты удаляли фильтрацией, и полученный фильтрат упаривали в вакууме. Далее, к раствору полученного остатка в тетрагидрофуране (1 мл) добавляли 1,0 М раствор фторида тетрабутиламмония в тетрагидрофуране (0,75 мл, 0,75 ммоль) при перемешивании, и полученную смесь перемешивали при 60°C в течение 1 часа. После охлаждения до комнатной температуры реакционную смесь выливали в воду (10 мл) и экстрагировали эфиром. Экстракт промывали насыщенным водным раствором хлорида натрия и сушили над сульфатом магния. После фильтрации фильтрат упаривали в вакууме, и полученный таким образом сырой продукт указанного в заголовке соединения очищали хроматографией на колонке с силикагелем, используя смешанный растворитель, состоящий из этилацетата и гексана (от 3:7 до 5:5), в качестве элюента, что давало указанное в заголовке соединение (0,18 г) с выходом 89% в виде белого кристаллического твердого продукта.
1H ЯМР спектр (400 МГц, CDCl3) δ м.д.: 1,29 (т, 3H, J=7,8 Гц), 3,05 (кв, 2H, J=7,8 Гц), 4,83 (с, 2H), 6,98 (с, 1H), 7,07 (д, 2H, J=8,6 Гц), 7,17-7,25 (м, 4H), 8,15 (д, 2H, J=8,6 Гц).
ИК-спектр (KBr): 1270, 1353, 1497, 1602, 3340 см-1.
Масс-спектр (FAB+) m/z: 397 ((M+H)+).
(10g) Метил 1-[(4-этил-5-{5-[4-(2-фторфенокси)фенил]-1,2,4-оксадиазол-3-ил}-2-тиенил)метил]азетидин-3-карбоксилат
Сырой продукт указанного в заголовке соединения синтезировали с помощью реакции, подобной той, которая указана в примере 1 (1f), используя (4-этил-5-{5-[4-(2-фторфенокси)фенил]-1,2,4-оксадиазол-3-ил}-2-тиенил)метанол (0,17 г, 0,43 ммоль), который был получен в примере 10 (10f), тетрабромид углерода (0,17 г, 0,51 ммоль), трифенилфосфин (0,13 г, 0,51 ммоль), метил 3-азетидинкарбоксилат гидрохлорид (0,10 г, 0,65 ммоль), N,N-диизопропилэтиламин (0,23 мл, 1,3 ммоль). Далее, полученный таким образом сырой продукт указанного в заголовке соединения очищали хроматографией, используя смешанный растворитель, состоящий из этилацетата и гексана (5:5), что давало указанное в заголовке соединение (0,19 г) с выходом 90% в виде белого кристаллического твердого продукта.
1H ЯМР спектр (500 МГц, CDCl3) δ м.д.: 1,28 (т, 3H, J=7,8 Гц), 3,03 (кв, 2H, J=7,8 Гц), 3,32-3,40 (м, 4H), 3,60-3,66 (м, 1H), 3,72 (с, 3H), 3,79 (с, 2H), 6,86 (с, 1H), 7,07 (д, 2H, J=8,8 Гц), 7,17-7,25 (м, 4H), 8,13 (д, 2H, J=8,8 Гц).
ИК-спектр (жидкая пленка): 1497, 1514, 1557, 1604, 1737 см-1.
Масс-спектр (FAB+) m/z: 494 ((M+H)+).
(10h) 1-[(4-Этил-5-{5-[4-(2-фторфенокси)фенил]-1,2,4-оксадиазол-3-ил}-2-тиенил)метил]азетидин-3-карбоновая кислота 1/2 оксалат
Указанное в заголовке соединение (77 мг) синтезировали с выходом 39% в виде белого кристаллического твердого продукта с помощью реакции, подобной той, которая указана в примере 1 (1g), используя метил 1-[(4-этил-5-{5-[4-(2-фторфенокси)фенил]-1,2,4-оксадиазол-3-ил}-2-тиенил)метил]азетидин-3-карбоксилат (0,19 г, 0,38 ммоль), который был получен в примере 10 (10g), моногидрат гидроксида лития (36 мг, 0,85 ммоль), уксусную кислоту (46 мкл, 0,85 ммоль) и щавелевую кислоту (17 мг, 0,19 ммоль).
1H ЯМР спектр (400 МГц, CD3OD) δ м.д.: 1,26 (т, 3H, J=7,4 Гц), 3,03(кв, 2H, J=7,4 Гц), 3,22 (квинтет, 1H, J=8,6 Гц), 3,37 (т, 2H, J=8,2 Гц), 3,62 (т, 2H, J=7,0 Гц), 3,82 (с, 2H), 6,98 (с, 1H), 7,12 (д, 2H, J=9,0 Гц), 7,25-7,33 (м, 4H), 8,16 (д, 2H, J=9,0 Гц).
ИК-спектр (KBr): 1420, 1497, 1601, 1659, 3413 см-1.
Масс-спектр (FAB+) m/z: 480 ((M+H)+).
(Пример 11)
1-({5-[5-(3-Фтор-4-феноксифенил)-1,2,4-оксадиазол-3-ил]-4-метил-2-тиенил}метил)азетидин-3-карбоновая кислота
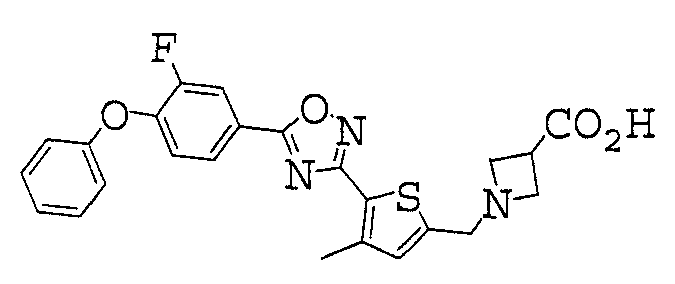
(11a) трет-Бутил(диметил)[(4-метил-2-тиенил)метокси]силан
К раствору 2-гидроксиметил-4-метилтиофен (1,8 г, 14 ммоль) (ссылочная литература: J. Heterocycl. Chem., vol. 19, 1125 (1982)) и имидазол (1,9 г, 28 ммоль) в N,N-диметилформамид (20 мл) добавляли трет-бутилдиметилсилил хлорид (2,3 г, 15 ммоль) при перемешивании, и полученную смесь перемешивали при комнатной температуре в течение 2 часов. После перемешивания реакционную смесь выливали в воду (20 мл) и экстрагировали эфиром. Экстракт промывали насыщенным водным раствором хлорида натрия и сушили над сульфатом магния. После фильтрации фильтрат упаривали в вакууме, и полученный таким образом сырой продукт указанного в заголовке соединения очищали хроматографией на колонке с силикагелем, используя смешанный растворитель, состоящий из этилацетата и гексана (от 0:10 до 1:19) в качестве элюента, что давало указанное в заголовке соединение (2,5 г) с выходом 74% в виде бесцветного маслянистого продукта.
1H ЯМР спектр (400 МГц, CDCl3) δ м.д.: 0,10 (с, 6H), 0,93 (с, 9H), 2,22 (с, 3H), 4,81 (с, 2H), 6,72 (с, 1H), 6,78 (с, 1H).
ИК-спектр (жидкая пленка): 1077, 1130, 1256, 1464 см-1.
Масс-спектр (EI+) m/z: 242 ((M+H)+).
(11b) 5-({[трет-Бутил(диметил)силил]окси}метил)-3-метилтиофен-2-карбоксальдегид
Сырой продукт указанного в заголовке соединения синтезировали с помощью реакции, подобной той, которая указана в примере 10 (10b), используя трет-бутил(диметил)[(4-метил-2-тиенил)метокси]силан (2,5 г, 10 ммоль), который был получен в примере 11 (11a), 1,6 M раствор н-бутиллития в гексане (7,8 мл, 12 ммоль), и N,N-диметилформамид (1,6 мл, 21 ммоль). Далее, полученный таким образом сырой продукт указанного в заголовке соединения очищали хроматографией на колонке с силикагелем, используя смешанный растворитель, состоящий из этилацетата и гексана (от 0:10 до 5:95), в качестве элюента, что давало указанное в заголовке соединение (2,5 г) с выходом 89% в виде бледно желтоватого маслянистого продукта.
1H ЯМР спектр (400 МГц, CDCl3) δ м.д.: 0,12 (с, 6H), 0,94 (с, 9H), 2,52 (с, 3H), 4,85 (с, 2H), 6,78 (с, 1H), 9,98 (с, 1H).
ИК-спектр (жидкая пленка): 1092, 1363, 1393, 1472, 1661 см-1.
Масс-спектр (FAB+) m/z: 271 ((M+H)+).
(11c) 5-({[трет-Бутил(диметил)силил]окси}метил)-3-метилтиофен-2-карбонитрил
Сырой продукт указанного в заголовке соединения синтезировали с помощью реакции, подобной той, которая указана в примере 10 (10c), используя 5-({[трет-бутил(диметил)силил]окси}метил)-3-метилтиофен-2-карбоксальдегид (2,5 г, 9,2 ммоль), который был получен в примере 11 (11b), гидрохлорид гидроксиламина (0,71 г, 10 ммоль), триэтиламин (2,6 мл, 18 ммоль) и N,N'-дициклогексилкарбодиимид (2,1 г, 10 ммоль). Далее, полученный таким образом сырой продукт указанного в заголовке соединения очищали хроматографией на колонке с силикагелем, используя смешанный растворитель, состоящий из этилацетата и гексана (от 0:10 до 5:95), в качестве элюента, что давало указанное в заголовке соединение (2,5 г) с выходом 100% в виде бледно желтоватого маслянистого продукта.
1H ЯМР спектр (400 МГц, CDCl3) δ м.д.: 0,11 (с, 6H), 0,93 (с, 9H), 2,39 (с, 3H), 4,83 (с, 2H), 6,71 (с, 1H).
ИК-спектр (жидкая пленка): 1093, 1150, 1258, 2120, 2214 см-1.
Масс-спектр (FAB+) m/z: 268 ((M+H)+).
(11d) 5-({[трет-Бутил(диметил)силил]окси}метил)-N'-гидрокси-3-метилтиофен-2-карбоксидиамид
Сырой продукт указанного в заголовке соединения синтезировали с помощью реакции, подобной той, которая указана в примере 1 (1d), используя 5-({[трет-бутил(диметил)силил]окси}метил)-3-метилтиофен-2-карбонитрил (2,5 г, 9,2 ммоль), который был получен в примере 11 (11c), и 40% водный раствор гидроксиламина (20 мл). Далее, полученный таким образом сырой продукт указанного в заголовке соединения очищали хроматографией на колонке с силикагелем, используя смешанный растворитель, состоящий из этилацетата и гексана (от 0:10 до 5:95), в качестве элюента, что давало указанное в заголовке соединение (1,4 г) с выходом 52% в виде белого кристаллического твердого продукта.
1H ЯМР спектр (400 МГц, CDCl3) δ м.д.: 0,10 (с, 6H), 0,93 (с, 9H), 2,35 (с, 3H), 4,79 (с, 4H), 6,68 (с, 1H), 7,16 (ушир., 1H).
ИК-спектр (KBr): 1255, 1651, 3277, 3353, 3455 см-1.
Масс-спектр (FAB) m/z: 301 ((M+H)+).
(11e) 3-Фтор-4-феноксибензойная кислота
Указанное в заголовке соединение (1,1 г) синтезировали с выходом 93% в виде белого кристаллического твердого продукта с помощью реакции, подобной той, которая указана в примере 10 (10e), используя 3,4-дифторбензальдегид (0,71 г, 5,0 ммоль), фенол (0,56 г, 6,0 ммоль), карбонат калия (1,4 г, 10 ммоль), 2-метил-2-бутен (2,5 мл, 23 ммоль), дигидрофосфат калия (1,6 г, 12 ммоль) и гипохлорит натрия (1,3 г, 14 ммоль).
1H ЯМР спектр (400 МГц, CDCl3) δ м.д.: 6,96 (т, 1H, J=8,2 Гц)), 7,04-7,07 (м, 2H), 7,19 (т, 1H, J=7,4 Гц), 7,37 (д, 1H, J=7,4 Гц), 7,39 (д, 1H, J=7,4 Гц), 7,80-7,83 (м, 1H), 7,89 (дд, 1H, J=11,0 Гц, 2,0 Гц).
ИК-спектр (KBr): 1025, 1275, 1444, 1492, 1692, 2596, 2673, 2983, 3065 см-1.
Масс-спектр (EI+) m/z: 232 (M+).
(11f) {5-[5-(3-Фтор-4-феноксифенил]-1,2,4-оксадиазол-3-ил)-4-метил-2-тиенил}метанол
Сырой продукт указанного в заголовке соединения синтезировали с помощью реакции, подобной той, которая указана в примере 10 (10f), используя 5-({[трет-бутил(диметил)силил]окси}метил)-N'-гидрокси-3-метилтиофен-2-карбоксимидамид (0,18 г, 0,60 ммоль), который был получен в примере 11 (11d), 3-фтор-4-феноксибензойную кислоту (0,15 г, 0,66 ммоль), которая была получена в примере 11 (11e), N,N'-дициклогексилкарбодиимид (0,14 г, 0,66 ммоль), и 1,0 M раствор фторида тетрабутиламмония в тетрагидрофуране (0,90 мл, 0,90 ммоль). Далее, полученный таким образом сырой продукт указанного в заголовке соединения очищали хроматографией на колонке с силикагелем, используя смешанный растворитель, состоящий из этилацетата и гексана (1:1) в качестве элюента, что давало указанное в заголовке соединение (0,21 г) с выходом 93% в виде белого кристаллического твердого продукта.
1H ЯМР спектр (400 МГц, CDCl3) δ м.д.: 2,60 (с, 3H), 4,84 (д, 2H, J=5,9 Гц), 6,92 (с, 1H), 7,06-7,11 (м, 3H), 7,22 (т, 1H, J=7,4 Гц), 7,42 (т, 2H, J=6,6 Гц), 7,91 (дд, 1H, J=1,2 Гц, 8,6 Гц), 8,01 (дд, 1H, J=2,3 Гц, 10,9 Гц).
ИК-спектр (KBr): 1444, 1488, 1577, 1590, 1626, 3264, 3327 см-1.
Масс-спектр (FAB+) m/z: 383 ((M+H)+).
(11g) Метил 1-({5-[5-(3-фтор-4-феноксифенил)-1,2,4-оксадиазол-3-ил]-4-метил-2-тиенил}метил)азетидин-3-карбоксилат
Сырой продукт указанного в заголовке соединения синтезировали с помощью реакции, подобной той, которая указана в примере 1 (1f), используя {5-[5-(3-фтор-4-феноксифенил]-1,2,4-оксадиазол-3-ил)-4-метил-2-тиенил}метанол (0,21 г, 0,55 ммоль), который был получен в примере 11 (11f), тетрабромид углерода (0,22 г, 0,66 ммоль), трифенилфосфин (0,17 г, 0,66 ммоль), метил 3-азетидинкарбоксилат гидрохлорид (0,13 г, 0,83 ммоль) и N,N-диизопропилэтиламин (0,30 мл, 1,7 ммоль). Далее, полученный таким образом сырой продукт указанного в заголовке соединения очищали хроматографией, используя смешанный растворитель, состоящий из этилацетата и гексана (5:5), что давало указанное в заголовке соединение (0,23 г) с выходом 86% в виде бесцветного маслянистого продукта.
1H ЯМР спектр (500 МГц, CDCl3) δ м.д.: 2,56 (с, 3H), 3,30-3,39 (м, 4H), 3,58-3,64 (м, 1H), 3,71 (с, 3H), 3,76 (с, 2H), 7,02-7,08 (м, 3H), 7,19 (т, 1H, J=7,4 Гц), 7,38 (т, 2H, J=7,4 Гц), 7,85-7,89 (м, 1H), 7,97 (дд, 1H, J=2,0 Гц, 10,5 Гц).
ИК-спектр (жидкая пленка): 1489, 1514, 1562, 1590, 1621, 1737 см-1.
Масс-спектр (FAB+) m/z: 480 ((M+H)+).
(11h) 1-({5-[5-(3-Фтор-4-феноксифенил)-1,2,4-оксадиазол-3-ил]-4-метил-2-тиенил}метил)азетидин-3-карбоновая кислота
Указанное в заголовке соединение (0,17 г) синтезировали с выходом 74% в виде белого кристаллического твердого продукта с помощью реакции, подобной той, которая указана в примере 2 (2e), используя метил 1-({5-[5-(3-фтор-4-феноксифенил)-1,2,4-оксадиазол-3-ил]-4-метил-2-тиенил}метил)азетидин-3-карбоксилат (0,23 г, 0,48 ммоль), который был получен в примере 11 (11g), моногидрат гидроксида лития (46 мг, 1,1 ммоль) и уксусную кислоту (60 мкл, 1,1 ммоль).
1H ЯМР спектр (400 МГц, CD3OD) δ м.д.: 2,61 (с, 3H), 3,50-3,62 (м, 1H), 4,22-4,33 (м, 4H), 4,58 (с, 2H), 7,09 (д, 2H, J=7,8 Гц), 7,15 (т, 1H, J=8,6 Гц), 7,19-7,24 (м, 2H), 7,42 (т, 2H, J=7,8 Гц), 7,94 (д, 1H, J=8,2 Гц), 8,02 (д, 1H, J=11,0 Гц).
ИК-спектр (KBr): 1272, 1340, 1507, 1515, 1561, 1591, 1619, 3404 см-1.
Масс-спектр (FAB+) m/z: 466 ((M+H)+).
(Пример 12)
1-({4-Метил-5-[5-(4-феноксифенил)-1,2,4-оксадиазол-3-ил]-2-тиенил}метил)азетидин-3-карбоновая кислота
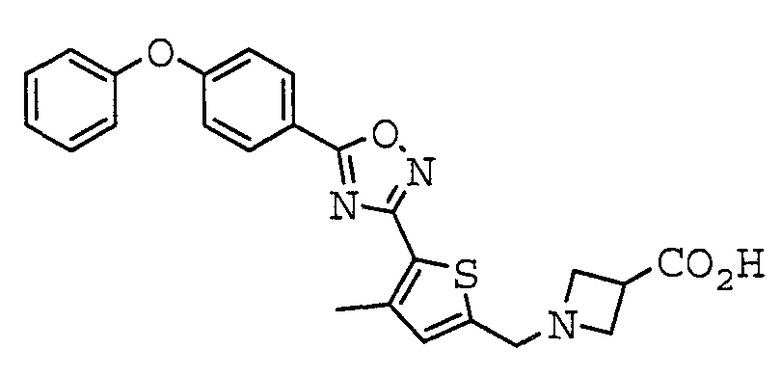
(12a) {4-Метил-5-[5-(4-феноксифенил)-1,2,4-оксадиазол-3-ил]-2-тиенил}метанол
К раствору 4-феноксибензойной кислоты (0,14 г, 0,63 ммоль) в смеси ацетонитрила (4 мл) и тетрагидрофурана (2 мл) добавляли последовательно 1-гидроксибензотриазол (89 мг, 0,66 ммоль), 1-этил-3-(3-диметиламинопропил)карбодиимид гидрохлорид (0,13 г, 0,66 ммоль) и 5-({[трет-бутил(диметил)силил]окси}метил)-N'-гидрокси-3-метилтиофен-2-карбоксимидамид (0,18 г, 0,60 ммоль), который был получен в примере 11 (11d), при перемешивании, и полученную смесь перемешивали при 50°C в течение 30 минут. После перемешивания к реакционной смеси добавляли воду (5 мл) для гашения реакции, и полученную смесь экстрагировали этилацетатом. Экстракт промывали последовательно 0,1н. соляной кислотой, насыщенным водным раствором гидрокарбоната натрия и насыщенным водным раствором хлорида натрия и сушили над сульфатом натрия. После фильтрации фильтрат упаривали в вакууме. Далее, к раствору полученного остатка в тетрагидрофуране (5 мл) добавляли 1,0 М раствор фторида тетрабутиламмония в тетрагидрофуране (1,2 мл, 1,2 ммоль) при перемешивании, и полученную смесь перемешивали при 50°C в течение 2 часов. После перемешивания реакционную смесь выливали в воду (20 мл) для гашения реакции и экстрагировали эфиром. Экстракт промывали насыщенным водным раствором хлорида натрия и сушили над сульфатом натрия. После фильтрации фильтрат упаривали в вакууме, и полученный таким образом сырой продукт указанного в заголовке соединения очищали хроматографией на колонке с силикагелем, используя смешанный растворитель, состоящий из этилацетата и гексана (от 1:3 до 1:2), в качестве элюента, что давало указанное в заголовке соединение (0,19 г) с выходом 86% в виде белого кристаллического твердого продукта.
1H ЯМР спектр (400 МГц, CDCl3) δ м.д.: 1,87 (ушир.с, 1H), 2,59 (с, 3H), 4,83 (с, 2H), 6,91 (с, 1H), 7,09 (д, 2H, J=8,8 Гц), 7,10 (д, 2H, J=8,3 Гц), 7,22 (т, 1H, J=7,1 Гц), 7,42 (т, 2H, J=7,8 Гц), 8,14 (д, 2H, J=8,3 Гц).
ИК-спектр (KBr): 1249, 1341, 1489, 1514, 1588, 1612, 3279, 3393 см-1.
Масс-спектр (FAB+) m/z: 365 ((M+H)+).
(12b) Метил 1-({4-метил-5-[5-(4-феноксифенил)-1,2,4-оксадиазол-3-ил]-2-тиенил}метил)азетидин-3-карбоксилат
Сырой продукт указанного в заголовке соединения синтезировали с помощью реакции, подобной той, которая указана в примере 1 (1f), используя {4-метил-5-[5-(4-феноксифенил)-1,2,4-оксадиазол-3-ил]-2-тиенил}метанол (0,19 г, 0,51 ммоль), который был получен в примере 12 (12a), тетрабромид углерода (0,22 г, 0,66 ммоль), трифенилфосфин (0,17 г, 0,66 ммоль), гидрохлорид метил 3-азетидинкарбоксилата (0,12 г, 0,77 ммоль) и N,N-диизопропилэтиламин (0,27 мл, 1,5 ммоль). Далее, полученный таким образом сырой продукт указанного в заголовке соединения очищали хроматографией на колонке с силикагелем, используя смешанный растворитель, состоящий из этилацетата и гексана (2:3), в качестве элюента, что давало указанное в заголовке соединение (0,20 г) с выходом 85% в виде бледно желтоватого маслянистого продукта.
1H ЯМР спектр (400 МГц, CDCl3) δ м.д.: 2,57 (с, 3H), 3,31-3,40 (м, 3H), 3,59-3,61 (м, 2H), 3,72 (с, 3H), 3,77 (с, 2H), 6,80 (с, 1H), 7,07-7,13 (м, 4H), 7,22 (т, 1H, J=7,1 Гц), 7,42 (т, 2H, J=7,8 Гц), 8,14 (д, 2H, J=8,3 Гц).
ИК-спектр (KBr): 1166, 1201, 1242, 1341, 1488, 1516, 1592, 1613, 1732 см-1.
Масс-спектр (FAB+) m/z: 462 ((M+H)+).
(12c) 1-({4-Метил-5-[5-(4-феноксифенил)-1,2,4-оксадиазол-3-ил]-2-тиенил}метил)азетидин-3-карбоновая кислота
Указанное в заголовке соединение (0,16 г) синтезировали с выходом 85% в виде белого кристаллического твердого продукта с помощью реакции, подобной той, которая указана в примере 3 (3e), используя метил 1-({4-метил-5-[5-(4-феноксифенил)-1,2,4-оксадиазол-3-ил]-2-тиенил}метил)азетидин-3-карбоксилат (0,20 г, 0,42 ммоль), который был получен в примере 12 (12b), и 1н. водный раствор гидроксида натрия (1,3 мл, 1,3 ммоль).
1H ЯМР спектр (400 МГц, CD3CO2D) δ м.д.: 2,61 (с, 3H), 3,77-3,86 (м, 1H), 4,34-4,44 (м, 2H), 4,50-4,58 (м, 2H), 4,67 (с, 2H), 7,15 (д, 4H, J=8,6 Гц), 7,21-7,26 (м, 1H), 7,26 (с, 1H), 7,45 (т, 2H, J=7,8 Гц), 8,18 (д, 2H, J=9,0 Гц).
ИК-спектр (KBr): 1244, 1336, 1488, 1593, 1612, 3429 см-1.
Масс-спектр (FAB+) m/z: 448 ((M+H)+).
(Пример 13)
1-({4-Этил-5-[5-(4-феноксифенил)-1,2,4-оксадиазол-3-ил]-2-тиенил}метил)азетидин-3-карбоновая кислота
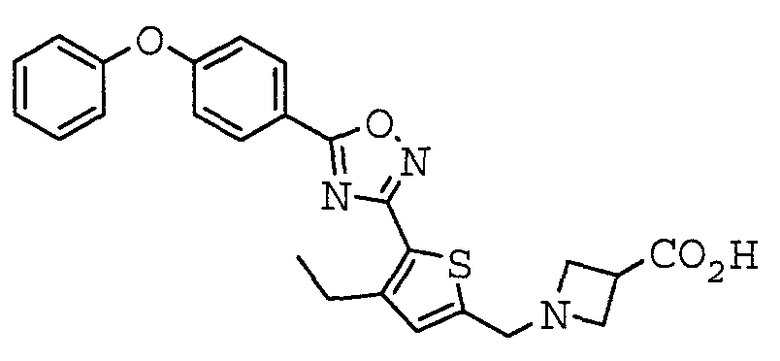
(13a) {4-Этил-5-[5-(4-феноксифенил)-1,2,4-оксадиазол-3-ил]-2-тиенил}метанол
Сырой продукт указанного в заголовке соединения синтезировали с помощью реакции, подобной той, которая указана в примере 12 (12a), используя 4-феноксибензойную кислоту (0,12 г, 0,53 ммоль), 1-гидроксибензотриазол (74 мг, 0,55 ммоль), 1-этил-3-(3-диметиламинопропил)карбодиимид гидрохлорид (0,11 г, 0,55 ммоль), 5-({[трет-бутил(диметил)силил]окси}метил)-3-этил-N'-гидрокситиофен-2-карбоксидиамид (0,16 г, 0,50 ммоль), который был получен в примере 10 (10d), и 1,0 M раствор тетрабутиламмонийфторида в тетрагидрофуране (1,0 мл, 1,0 ммоль). Далее, полученный таким образом сырой продукт указанного в заголовке соединения очищали хроматографией на колонке с силикагелем, используя смешанный растворитель, состоящий из этилацетата и гексана (1:3), в качестве элюента, что давало указанное в заголовке соединение (0,17 г) с выходом 89% в виде бледно желтоватого твердого кристаллического продукта.
1H ЯМР спектр (400 МГц, CDCl3) δ м.д.: 1,29 (т, 3H, J=7,4 Гц), 1,88 (т, 1H, J=5,9 Гц), 3,05 (кв, 2H, J=7,4 Гц), 4,83 (д, 2H, J=5,9 Гц), 6,96 (с, 1H), 7,04-7,10 (м, 4H), 7,20 (т, 1H, J=7,4 Гц), 7,39 (т, 2H, J=7,4 Гц), 8,12 (д, 2H, J=9,0 Гц).
ИК-спектр (KBr): 1248, 1353, 1490, 1496, 1515, 1588, 1612, 3356 см-1.
Масс-спектр (FAB+) m/z: 379 ((M+H)+).
(13b) Метил 1-({4-этил-5-[5-(4-феноксифенил)-1,2,4-оксадиазол-3-ил]-2-тиенил}метил)азетидин-3-карбоксилат
Сырой продукт указанного в заголовке соединения синтезировали с помощью реакции, подобной той, которая указана в примере 1 (1f), используя {4-этил-5-[5-(4-феноксифенил)-1,2,4-оксадиазол-3-ил]-2-тиенил}метанол (0,17 г, 0,44 ммоль), который был получен в примере 13 (13a), тетрабромид углерода (0,19 г, 0,57 ммоль), трифенилфосфин (0,15 г, 0,57 ммоль), гидрохлорид метил 3-азетидинкарбоксилата (0,10 г, 0,66 ммоль) и N,N-диизопропилэтиламин (0,23 мл, 1,3 ммоль). Далее, полученный таким образом сырой продукт указанного в заголовке соединения очищали хроматографией на колонке с силикагелем, используя смешанный растворитель, состоящий из этилацетата и гексана (от 1:3 до 1:2), в качестве элюента, что давало указанное в заголовке соединение (0,19 г) с выходом 89% в виде бледно-желтого маслянистого продукта.
1H ЯМР спектр (400 МГц, CDCl3) δ м.д.: 1,27 (т, 3H, J=7,4 Гц), 3,03 (кв, 2H, J=7,4 Гц), 3,30-3,40 (м, 3H), 3,59-3,67 (м, 2H), 3,71 (с, 3H), 3,78 (с, 2H), 6,84 (с, 1H), 7,04-7,10 (м, 4H), 7,20 (т, 1H, J=7,4 Гц), 7,39 (т, 2H, J=7,4 Гц), 8,11 (д, 2H, J=9,0 Гц).
ИК-спектр (жидкая пленка): 1168, 1200, 1245, 1346, 1489, 1514, 1589, 1613, 1737 см-1.
Масс-спектр (FAB+) m/z: 476 ((M+H)+).
(13c) 1-({4-Этил-5-[5-(4-феноксифенил)-1,2,4-оксадиазол-3-ил]-2-тиенил}метил)азетидин-3-карбоновая кислота
Указанное в заголовке соединение (0,15 г) синтезировали с выходом 86% в виде белого кристаллического твердого продукта, используя с помощью реакции, подобной той, что указана в примере 3 (3e), используя метил 1-({4-этил-5-[5-(4-феноксифенил)-1,2,4-оксадиазол-3-ил]-2-тиенил}метил)азетидин-3-карбоксилат (0,180 г, 0,39 ммоль), который был получен в примере 13 (13b), и 1н. водный раствор гидроксида натрия (1,2 мл, 1,2 ммоль).
1H ЯМР спектр (400 МГц, CD3CO2D) δ м.д.: 1,30 (т, 3H, J=7,4 Гц), 3,09 (кв, 2H, J=7,4 Гц), 3,76-3,87 (м, 1H), 4,33-4,45 (м, 2H), 4,45-4,57 (м, 2H), 4,68 (с, 2H), 7,15 (д, 4H, J=9,0 Гц), 7,24 (т, 1H, J=7,4 Гц), 7,32 (с, 1H), 7,45 (т, 2H, J=7,4 Гц), 8,17 (д, 2H, J=9,0 Гц).
ИК-спектр (KBr): 1167, 1249, 1347, 1489, 1517, 1557, 1592, 1613, 3422 см-1.
Масс-спектр (FAB+) m/z: 462 ((M+H)+).
(Пример 14)
1-({4-Этил-5-[5-(3-фтор-4-феноксифенил)-1,2,4-оксадиазол-3-ил]-2-тиенил}метил)азетидин-3-карбоновая кислота
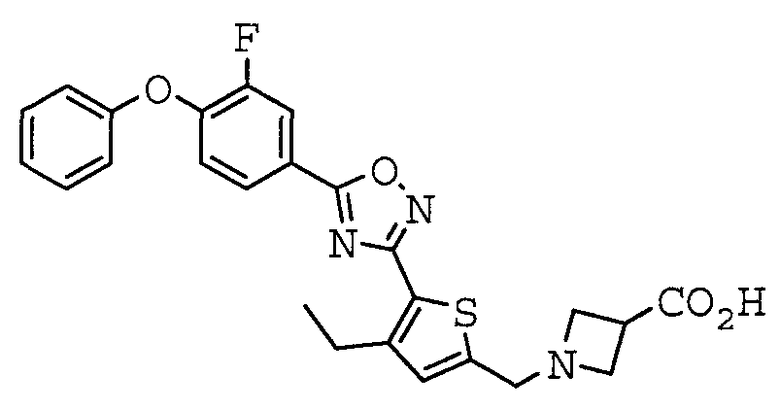
(14a) {4-Этил-5-[5-(3-фтор-4-феноксифенил)-1,2,4-оксадиазол-3-ил]-2-тиенил}метанол
Сырое указанное в заголовке соединение синтезировали с помощью реакции, подобной той, что указана в примере 12 (12a), используя 3-фтор-4-феноксибензойную кислоту (0,12 г, 0,50 ммоль), которая была получена в примере 11 (11e), 1-гидроксибензотриазол (72 мг, 0,53 ммоль), 1-этил-3-(3-диметиламинопропил)карбодиимид гидрохлорид (0,10 г, 0,53 ммоль), 5-({[трет-бутил(диметил)силил]окси}метил)-3-этил-N'-гидрокситиофен-2-карбоксимидамид (0,15 г, 0,48 ммоль), который был получен в примере 10 (10d), и 1,0 М раствор фторида тетрабутиламмония в тетрагидрофуране (0,96 мл, 0,96 ммоль). Далее, полученный таким образом сырой продукт указанного в заголовке соединения очищали хроматографией на колонке с силикагелем, используя смешанный растворитель, состоящий из этилацетата и гексана (1:3), в качестве элюента, что давало указанное в заголовке соединение (0,16 г) с выходом 85% в виде бледно желтоватого твердого кристаллического продукта.
1H ЯМР спектр (400 МГц, CDCl3) δ м.д.: 1,29 (т, 3H, J=7,4 Гц), 1,91 (т, 1H, J=5,9 Гц), 3,05 (кв, 2H, J=7,4 Гц), 4,84 (д, 2H, J=5,9 Гц), 6,96 (с, 1H), 7,02-7,09 (м, 3H), 7,19 (т, 1H, J=7,4 Гц), 7,39 (т, 2H, J=7,4 Гц), 7,88 (дд, 1H, J=8,4 Гц, 1,4 Гц), 7,99 (дд, 1H, J=10,6 Гц, 2,0 Гц).
ИК-спектр (KBr): 1207, 1270, 1283, 1342, 1436, 1456, 1492, 1513, 1576, 1595, 3433 см-1.
Масс-спектр (FAB+) m/z: 397((M+H)+).
(14b) Метил 1-({4-этил-5-[5-(3-фтор-4-феноксифенил)-1,2,4-оксадиазол-3-ил]-2-тиенил}метил)азетидин-3-карбоксилат
Сырой продукт указанного в заголовке соединения синтезировали с помощью реакции, подобной той, которая указана в примере 1 (1f), используя {4-этил-5-[5-(3-фтор-4-феноксифенил)-1,2,4-оксадиазол-3-ил]-2-тиенил}метанол (0,16 г, 0,40 ммоль), который был получен в примере 14 (14a), тетрабромид углерода (0,17 г, 0,52 ммоль), трифенилфосфин (0,14 г, 0,52 ммоль), гидрохлорид метил 3-азетидинкарбоксилата (91 мг, 0,60 ммоль) и N,N-диизопропилэтиламин (0,21 мл, 1,2 ммоль). Далее, полученный таким образом сырой продукт указанного в заголовке соединения очищали хроматографией на колонке с силикагелем, используя смешанный растворитель, состоящий из этилацетата и гексана (от 1:3 до 1:2), в качестве элюента, что давало указанное в заголовке соединение (0,15 г) с выходом 77% в виде бледно-желтого маслянистого продукта.
1H ЯМР спектр (400 МГц, CDCl3) δ м.д.: 1,28 (т, 3H, J=7,4 Гц), 3,02 (кв, 2H, J=7,4 Гц), 3,31-3,40 (м, 3H), 3,58-3,67 (м, 2H), 3,71 (с, 3H), 3,78 (с, 2H), 6,85 (с, 1H), 7,02-7,09 (м, 3H), 7,19 (т, 1H, J=7,4 Гц), 7,38 (т, 2H, J=7,4 Гц), 7,87 (дт, 1H, J=9,0 Гц, 1,7 Гц), 7,98 (дд, 1H, J=10,8 Гц, 2,2 Гц).
ИК-спектр (жидкая пленка): 1204, 1272, 1348, 1454, 1489, 1523, 1559, 1590, 1737 см-1.
Масс-спектр (FAB+) m/z: 494 ((M+H)+).
(14c) 1-({4-Этил-5-[5-(3-фтор-4-феноксифенил)-1,2,4-оксадиазол-3-ил]-2-тиенил}метил)азетидин-3-карбоновая кислота
Указанное в заголовке соединение (0,11 г) синтезировали с выходом 77% в виде белого кристаллического твердого продукта с помощью реакции, подобной той, которая указана в примере 3 (3e), используя метил 1-({4-этил-5-[5-(3-фтор-4-феноксифенил)-1,2,4-оксадиазол-3-ил]-2-тиенил}метил)азетидин-3-карбоксилат (0,15 г, 0,30 ммоль), который был получен в примере 14 (14b), и 1н. водный раствор гидроксида натрия (0,9 мл, 0,9 ммоль).
1H ЯМР спектр (400 МГц, CD3CO2D) δ м.д.: 1,31 (т, 3H, J=7,4 Гц), 3,09 (кв, 2H, J=7,4 Гц), 3,75-3,87 (м, 1H), 4,33-4,44 (м, 2H), 4,44-4,58 (м, 2H), 4,68 (с, 2H), 7,09-7,20 (м, 3H), 7,23 (т, 1H, J=7,6 Гц), 7,33 (с, 1H), 7,44 (т, 2H, J=7,6 Гц), 7,97 (д, 1H, J=9,0 Гц), 8,04 (д, 1H, J=10,6 Гц).
ИК-спектр (KBr): 1201, 1275, 1349, 1491, 1515, 1556, 1591, 3427 см-1.
Масс-спектр (FAB+) m/z: 480 ((M+H)+).
(Пример 15)
1-({5-[5-(3-Хлор-4-феноксифенил)-1,2,4-оксадиазол-3-ил]-4-этил-2-тиенил}метил)азетидин-3-карбоновая кислота
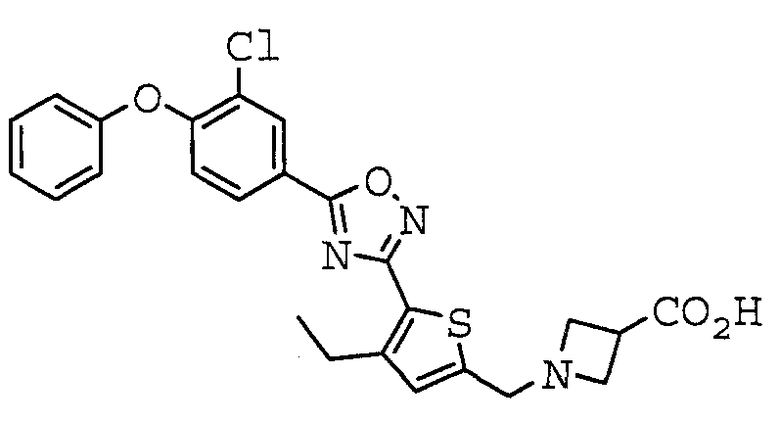
(15a) 3-Хлор-4-феноксибензойная кислота
Указанное в заголовке соединение (0,95 г) синтезировали с выходом 77% в виде белого кристаллического твердого продукта с помощью реакции, подобной той, что указана в примере 10 (10e), используя 3-хлор-4-фторбензальдегид (0,80 г, 5,0 ммоль), фенол (0,66 г, 7,0 ммоль), карбонат калия (1,7 г, 13 ммоль), 2-метил-2-бутен (2,7 мл, 25 ммоль), дигидрофосфат калия (1,7 г, 13 ммоль) и гипохлорит натрия (1,4 г, 15 ммоль).
1H ЯМР спектр (400 МГц, CDCl3) δ м.д.: 6,87 (д, 1H, J=8,6 Гц), 7,05 (дд, 2H, J=7,4 Гц, 1,2 Гц), 7,21 (т, 1H, J=7,4 Гц), 7,39 (т, 2H, J=7,4 Гц), 7,88 (дд, 1H, J=8,6 Гц, 2,0 Гц), 8,19 (д, 1H, J=2,0 Гц).
(15b) {5-[5-(3-Хлор-4-феноксифенил)-1,2,4-оксадиазол-3-ил]-4-этил-2-тиенил}метанол
Сырой продукт указанного в заголовке соединения синтезировали с помощью реакции, подобной той, которая указана в примере 12 (12a), используя 3-хлор-4-феноксибензойную кислоту (0,12 г, 0,50 ммоль), которая была получена в примере 15 (15a), 1-гидроксибензотриазол (72 мг, 0,53 ммоль), 1-этил-3-(3-диметиламинопропил)карбодиимид гидрохлорид (0,10 г, 0,53 ммоль), 5-({[трет-бутил(диметил)силил]окси}метил)-3-этил-N'-гидрокситиофен-2-карбоксидиамид (0,15 г, 0,48 ммоль), который был получен в примере 10 (10d), и 1,0 M раствор тетрабутиламмонийфторида в тетрагидрофуране (0,96 мл, 0,96 ммоль). Далее, полученный таким образом сырой продукт указанного в заголовке соединения очищали хроматографией на колонке с силикагелем, используя смешанный растворитель, состоящий из этилацетата и гексана (1:3), в качестве элюента, что давало указанное в заголовке соединение (0,17 г) с выходом 87% в виде бледно-желтого твердого кристаллического продукта.
1H ЯМР спектр (400 МГц, CDCl3) δ м.д.: 1,30 (т, 3H, J=7,4 Гц), 1,90 (т, 1H, J=5,8 Гц), 3,06 (кв, 2H, J=7,4 Гц), 4,85 (д, 2H, J=5,8 Гц), 6,98 (д, 1H, J=8,6 Гц), 6,99 (с, 1H), 7,09 (д, 2H, J=8,6 Гц), 7,23 (т, 1H, J=7,4 Гц), 7,43 (т, 2H, J=7,4 Гц), 7,99 (дд, 1H, J=8,6 Гц, 2,1 Гц), 8,31 (д, 1H, J=2,1 Гц).
ИК-спектр (KBr): 1242, 1265, 1393, 1480, 1591, 3250, 3335 см-1.
Масс-спектр (FAB+) m/z: 413 ((M+H)+).
(15c) Метил 1-({5-[5-(3-хлор-4-феноксифенил)-1,2,4-оксадиазол-3-ил]-4-этил-2-тиенил}метил)азетидин-3-карбоксилат
Сырой продукт указанного в заголовке соединения синтезировали с помощью реакции, подобной той, которая указана в примере 1 (1f), используя {5-[5-(3-хлор-4-феноксифенил)-1,2,4-оксадиазол-3-ил]-4-этил-2-тиенил}метанол (0,17 г, 0,41 ммоль), который был получен в примере 15 (15b), тетрабромид углерода (0,18 г, 0,53 ммоль), трифенилфосфин (0,14 г, 0,53 ммоль), гидрохлорид метил 3-азетидинкарбоксилата (93 мг, 0,62 ммоль) и N,N-диизопропилэтиламин (0,21 мл, 1,2 ммоль). Далее, полученный таким образом сырой продукт указанного в заголовке соединения очищали хроматографией на колонке с силикагелем, используя смешанный растворитель, состоящий из этилацетата и гексана (1:3), в качестве элюента, что давало указанное в заголовке соединение (0,15 г) с выходом 73% в виде бледно желтоватого маслянистого продукта.
1H ЯМР спектр (400 МГц, CDCl3) δ м.д.: 1,28 (т, 3H, J=7,8 Гц), 3,03 (кв, 2H, J=7,8 Гц), 3,32-3,43 (м, 3H), 3,59-3,69 (м, 2H), 3,79 (с, 3H), 3,84 (с, 2H), 6,87 (с, 1H), 6,98 (д, 1H, J=8,6 Гц), 7,09 (д, 2H, J=7,4 Гц), 7,24 (т, 1H, J=7,4 Гц), 7,43 (т, 2H, J=7,4 Гц), 7,98 (дд, 1H, J=8,6 Гц, 2,2 Гц), 8,30 (д, 1H, J=2,2 Гц).
ИК-спектр (тонкая пленка): 1198, 1245, 1266, 1343, 1483, 1513, 1737 см-1.
Масс-спектр (FAB+) m/z: 510 ((M+H)+).
(15d) 1-({5-[5-(3-Хлор-4-феноксифенил)-1,2,4-оксадиазол-3-ил]-4-этил-2-тиенил}метил)азетидин-3-карбоновая кислота
Указанное в заголовке соединение (0,13 г) синтезировали с выходом 88% в виде белого кристаллического твердого продукта с помощью реакции, подобной той, которая указана в примере 3 (3e), используя метил 1-({5-[5-(3-хлор-4-феноксифенил)-1,2,4-оксадиазол-3-ил]-4-этил-2-тиенил}метил)азетидин-3-карбоксилат (0,15 г, 0,29 ммоль), который был получен в примере 15 (15c), и 1н. водный раствор гидроксида натрия (0,87 мл, 0,87 ммоль).
1H ЯМР спектр (400 МГц, CD3CO2D) δ м.д.: 1,31 (т, 3H, J=7,6 Гц), 3,09 (кв, 2H, J=7,6 Гц), 3,75-3,87 (м, 1H), 4,33-4,44 (м, 2H), 4,48-4,59 (м, 2H), 4,68 (с, 2H), 7,07 (д, 1H, J=8,6 Гц), 7,13 (д, 2H, J=7,8 Гц), 7,25 (т, 1H, J=7,8 Гц), 7,33 (с, 1H), 7,45 (т, 2H, J=7,8 Гц), 8,06 (дд, 1H, J=8,6 Гц, 2,2 Гц), 8,31 (с, 1H).
ИК-спектр (KBr): 1265, 1344, 1392, 1484, 1514, 1591, 1609, 3414 см-1.
Масс-спектр (FAB+) m/z: 496 ((M+H)+).
(Пример 16)
1-[(5-{5-[3-Хлор-4-(3-фторфенокси)фенил]-1,2,4-оксадиазол-3-ил}-4-этил-2-тиенил)метил]азетидин-3-карбоновая кислота
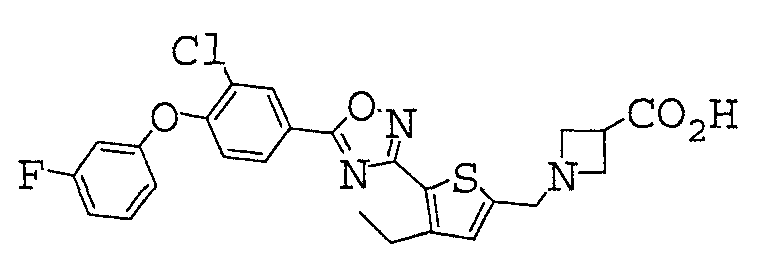
(16a) 3-Хлор-4-(3-фторфенокси)бензойная кислота
Указанное в заголовке соединение (1,3 г) синтезировали с выходом 79% в виде бледного желтого твердого кристаллического продукта с помощью реакции, подобной той, что указана в примере 10 (10e), используя 3-хлор-4-фторбензальдегид (1,0 г, 6,3 ммоль), 2-фторфенол (1,1 г, 9,5 ммоль), карбонат калия (2,2 г, 16 ммоль), 2-метил-2-бутен (3,0 мл, 28 ммоль), дигидрофосфат калия (1,9 г, 14 ммоль) и гипохлорит натрия (1,5 г, 17 ммоль).
1H ЯМР спектр (400 МГц, CDCl3) δ м.д.: 6,75-6,95 (м, 3H), 7,04 (д, 1H, J=8,6 Гц), 7,33-7,38 (м, 1H), 7,96 (дд, 1H, J=8,6 Гц, 2,2 Гц), 8,23 (д, 1H, J=2,2 Гц).
ИК-спектр (KBr): 1123, 1269, 1423, 1486, 1592, 1705, 2663, 2982, 3078 см-1.
Масс-спектр (EI+) m/z: 266 (M+).
(16b) (5-{5-[3-Хлор-4-(3-фторфенокси)фенил]-1,2,4-оксадиазол-3-ил}-4-этил-2-тиенил)метанол
Сырой продукт указанного в заголовке соединения синтезировали с помощью реакции, подобной той, которая указана в примере 5 (5a), используя 3-хлор-4-(3-фторфенокси)бензойную кислоту (0,14 г, 0,53 ммоль), которая была получена в примере 16 (16a), 1-гидроксибензотриазол (0,086 г, 0,56 ммоль), 1-этил-3-(3-диметиламинопропил)карбодиимид гидрохлорид (0,11 г, 0,56 ммоль), 5-({[трет-бутил(диметил)силил]окси}метил)-3-этил-N'-гидрокситиофен-2-карбоксимидамид (0,16 г, 0,51 ммоль), который был получен в примере 10 (10d), и 1,0M раствор тетрабутиламмонийфторида в тетрагидрофуране (1,0 мл, 1,0 ммоль). Далее, полученный таким образом сырой продукт указанного в заголовке соединения очищали хроматографией на колонке с силикагелем, используя смешанный растворитель, состоящий из этилацетата и гексана (от 2:8 до 5:5), в качестве элюента, что давало указанное в заголовке соединение (0,17 г) с выходом 89% в виде бледно желтоватого твердого кристаллического продукта.
1H ЯМР спектр (400 МГц, CDCl3) δ м.д.: 1,30 (т, 3H, J=7,6 Гц), 1,89 (т, 1H, J=5,9 Гц), 3,06 (кв, 2H, J=7,6 Гц), 4,86 (д, 2H, J=5,9 Гц), 6,75-6,97 (м, 3H), 6,99 (с, 1H), 7,09 (д, 1H, J=8,6 Гц), 7,33-7,40 (м, 1H), 8,04 (дд, 1H, J=8,6 Гц, 2,0 Гц), 8,32 (д, 1H, J=2,0 Гц).
ИК-спектр (KBr): 759, 958, 1120, 1269, 1393, 1480, 1603, 2928, 2973, 3334 см-1.
Масс-спектр (FAB+) m/z: 431 ((M+H)+).
(16c) Метил 1-[(5-{5-[3-хлор-4-(3-фторфенокси)фенил]-1,2,4-оксадиазол-3-ил}-4-этил-2-тиенил)метил]азетидин-3-карбоксилат
Сырой продукт указанного в заголовке соединения синтезировали с помощью реакции, подобной той, которая указана в примере 1 (1f), используя (5-{5-[3-хлор-4-(3-фторфенокси)фенил]-1,2,4-оксадиазол-3-ил}-4-этил-2-тиенил)метанол (0,15 г, 0,34 ммоль), который был получен в примере 16 (16b), тетрабромид углерода (0,16 г, 0,51 ммоль), трифенилфосфин (0,13 г, 0,51 ммоль), гидрохлорид метил 3-азетидинкарбоксилата (0,073 г, 0,51 ммоль) и N,N-диизопропилэтиламин (0,14 мл, 0,84 ммоль). Далее, полученный таким образом сырой продукт указанного в заголовке соединения очищали хроматографией на колонке с силикагелем, используя смешанный растворитель, состоящий из этилацетата и гексана (от 2:8 до 5:15) в качестве элюента, что давало указанное в заголовке соединение (0,16 г) с выходом 88% в виде бесцветного маслянистого продукта.
1H ЯМР спектр (400 МГц, CDCl3) δ м.д.: 1,28 (т, 3H, J=7,4 Гц), 3,02 (кв, 2H, J=7,4 Гц), 3,32-3,42 (м, 3H), 3,60-3,67 (м, 2H), 3,71 (с, 3H), 3,78 (с, 2H), 6,75-6,93 (м, 4H), 7,06 (д, 1H, J=8,2 Гц), 7,30-7,37 (м, 1H), 7,99-8,03 (м, 1H), 8,29 (д, 1H, J=2,0 Гц).
ИК-спектр (жидкая пленка): 959, 1120, 1270, 1343, 1483, 1513, 1604, 1738, 2846, 2966 см-1.
Масс-спектр (FAB+) m/z: 528 ((M+H)+).
(16d) 1-[(5-{5-[3-Хлор-4-(3-фторфенокси)фенил]-1,2,4-оксадиазол-3-ил}-4-этил-2-тиенил)метил]азетидин-3-карбоновая кислота
Указанное в заголовке соединение (0,14 г) синтезировали с выходом 92% в виде белого кристаллического твердого продукта с помощью реакции, подобной той, которая указана в примере 3 (3e), используя метил 1-[(5-{5-[3-хлор-4-(3-фторфенокси)фенил]-1,2,4-оксадиазол-3-ил}-4-этил-2-тиенил)метил]азетидин-3-карбоксилат (0,16 г, 0,30 ммоль), который был получен в примере 16 (16c), 1н. водный раствор гидроксида натрия (0,89 мл, 0,89 ммоль), и уксусную кислоту (51 мкл, 0,89 ммоль).
1H ЯМР спектр (400 МГц, CD3CO2D) δ м.д.: 1,31 (т, 3H, J=7,5 Гц), 3,10 (кв, 2H, J=7,5 Гц), 3,78-3,89 (м, 1H), 4,30-4,65 (м, 4H), 4,71 (с, 2H), 6,87-7,01 (м, 3H), 7,20 (д, 1H, J=8,6 Гц), 7,38 (с, 1H), 7,39-7,46 (м, 1H), 8,12 (дд, 1H, J=8,6 Гц, 2,1 Гц), 8,33 (д, 1H, J=2,1 Гц).
ИК-спектр (KBr): 769, 847, 959, 1118, 1231, 1272, 1344, 1393, 1447, 1486, 1514, 1552, 1603, 2969, 3429 см-1.
Масс-спектр (FAB+) m/z: 514 ((M+H)+).
(Пример 17)
1-[(4-Этил-5-{5-[4-(3-фторфенокси)фенил]-1,2,4-оксадиазол-3-ил}-2-тиенил)метил]азетидин-3-карбоновая кислота
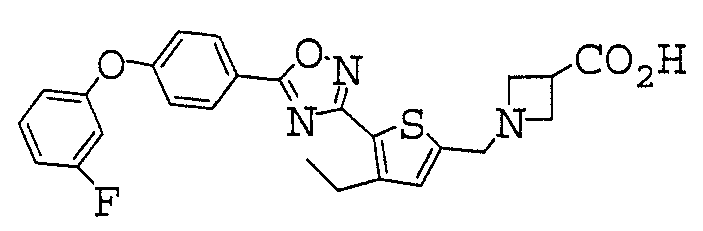
(17a) 4-(3-Фторфенокси)бензойная кислота
Указанное в заголовке соединение (2,0 г) синтезировали с выходом 96% в виде белого кристаллического твердого продукта с помощью реакции, подобной той, что указана в примере 10 (10e), используя 4-фторбензальдегид (1,5 г, 12 ммоль), 3-фторфенол (1,2 мл, 13 ммоль), карбонат калия (3,3 г, 24 ммоль), 2-метил-2-бутен (4,8 мл, 45 ммоль), дигидрофосфат калия (3,1 г, 23 ммоль) и гипохлорит натрия (2,5 г, 27 ммоль).
1H ЯМР спектр (400 МГц, CDCl3) δ м.д.: 6,75-6,92 (м, 3H), 7,03 (д, 2H, J=8,6 Гц), 7,27-7,37 (м, 1H), 8,08 (д, 2H, J=8,6 Гц).
ИК-спектр (KBr): 1117, 1226, 1271, 1293, 1314, 1484, 1597, 1689, 2553, 2671, 2842, 2984 см-1.
Масс-спектр (EI+) m/z: 232 (M+).
(17b) (4-Этил-5-{5-[4-(3-фторфенокси)фенил]-1,2,4-оксадиазол-3-ил}-2-тиенил)метанол
Сырой продукт указанного в заголовке соединения синтезировали с помощью реакции, подобной той, которая указана в примере 10 (10f), используя 5-({[трет-бутил(диметил)силил]окси}метил)-3-этил-N'-гидрокситиофен-2-карбоксимидамид (0,16 г, 0,50 ммоль), который был получен в примере 10 (10d), 4-(3-фторфенокси)бензойную кислоту (0,13 г, 0,55 ммоль), которая была получена в примере 17(17a), дициклогексилкарбодиимид (0,11 г, 0,55 ммоль) и 1,0 M раствор фторида тетрабутиламмония в тетрагидрофуране (0,75 мл, 0,75 ммоль). Далее, полученный таким образом сырой продукт указанного в заголовке соединения очищали хроматографией на колонке с силикагелем, используя смешанный растворитель, состоящий из этилацетата и гексана (от 3:7 до 5:5) в качестве элюента, что давало указанное в заголовке соединение (0,15 г) с выходом 73% в виде белого кристаллического твердого продукта.
1H ЯМР спектр (400 МГц, CDCl3) δ м.д.: 1,30 (т, 3H, J=7,4 Гц), 1,87 (ушир., 1H), 3,07 (кв, 2H, J=7,8 Гц), 4,85 (д, 2H, J=4,7 Гц), 6,82 (дт, 1H, J=7,4 Гц, 2,3 Гц), 6,85-6,95 (м, 3H), 6,99 (с, 1H), 7,14 (д, 2H, J=9,0 Гц), 7,35-7,40 (м, 1H), 8,18 (д, 2H, J=9,0 Гц).
ИК-спектр (KBr): 1341, 1486, 1515, 1557, 1603, 3373 см-1.
Масс-спектр (FAB+) m/z: 397 ((M+H)+).
(17c) Метил 1-[(4-этил-5-{5-[4-(3-фторфенокси)фенил]-1,2,4-оксадиазол-3-ил}-2-тиенил)метил]азетидин-3-карбоксилат
Сырой продукт указанного в заголовке соединения синтезировали с помощью реакции, подобной той, которая указана в примере 1 (1f), используя (4-этил-5-{5-[4-(3-фторфенокси)фенил]-1,2,4-оксадиазол-3-ил}-2-тиенил)метанол (0,15 г, 0,38 ммоль), который был получен в примере 17 (17b), тетрабромид углерода (0,15 г, 0,45 ммоль), трифенилфосфин (0,12 г, 0,45 ммоль), гидрохлорид метил 3-азетидинкарбоксилата (86 мг, 0,57 ммоль) и N,N-диизопропилэтиламин (0,19 мл, 1,1 ммоль). Далее, полученный таким образом сырой продукт указанного в заголовке соединения очищали хроматографией, используя смешанный растворитель, состоящий из этилацетата и гексана (5:5), что давало указанное в заголовке соединение (0,16 г) с выходом 85% в виде бледно-желтого маслянистого продукта.
1H ЯМР спектр (500 МГц, CDCl3) δ м.д.: 1,28 (т, 3H, J=7,8 Гц), 3,03 (кв, 2H, J=7,8 Гц), 3,33-3,40 (м, 4H), 3,60-3,66 (м, 1H), 3,72 (с, 3H), 3,79 (с, 2H), 6,80 (дт, 1H, J=7,4 Гц, 2,4 Гц), 6,86-6,94 (м, 3H), 7,13 (д, 2H, J=8,8 Гц), 7,35 (кв, 1H, J=8,3 Гц), 8,17 (д, 2H, J=8,8 Гц).
ИК-спектр (жидкая пленка): 1346, 1485, 1498, 1514, 1603, 1737 см-1.
Масс-спектр (FAB+) m/z: 494 ((M+H)+).
(17d) 1-[(4-Этил-5-{5-[4-(3-фторфенокси)фенил]-1,2,4-оксадиазол-3-ил}-2-тиенил)метил]азетидин-3-карбоновая кислота
Указанное в заголовке соединение (83 мг) синтезировали с выходом 54% в виде белого кристаллического твердого продукта с помощью реакции, подобной той, которая указана в примере 2 (2e), используя метил 1-[(4-этил-5-{5-[4-(3-фторфенокси)фенил]-1,2,4-оксадиазол-3-ил}-2-тиенил)метил]азетидин-3-карбоксилат (0,16 мг, 0,32 ммоль), который был получен в примере 17 (17c), моногидрат гидроксида лития (30 мг, 0,71 ммоль) и уксусную кислоту (39 мкл, 0,71 ммоль).
1H ЯМР спектр (500 МГц, CD3OD) δ м.д.: 1,29 (т, 3H, J=7,3 Гц), 3,07 (кв, 2H, J=7,3 Гц), 3,34 (квинтет, 1H, J=8,8 Гц), 3,84-3,90 (м, 2H), 3,94-4,01 (м, 2H), 4,27 (с, 2H), 6,88-7,01 (м, 3H), 7,17 (с, 1H), 7,20 (д, 2H, J=8,8 Гц), 7,44 (кв, 1H, J=7,8 Гц), 8,20 (д, 2H, J=8,8 Гц).
ИК-спектр (KBr): 1224, 1273, 1342, 1498, 1514, 3428 см-1.
Масс-спектр (FAB+) m/z: 480 ((M+H)+).
(Пример 18)
1-[(5-{5-[4-(2,3-Дифторфенокси)фенил]-1,2,4-оксадиазол-3-ил}-4-этил-2-тиенил)метил]азетидин-3-карбоновая кислота
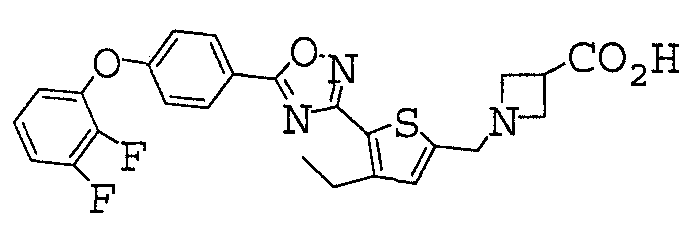
(18a) 4-(2,3-Дифторфенокси)бензойная кислота
Указанное в заголовке соединение (2,2 г) синтезировали с выходом 94% в виде белого кристаллического твердого продукта с помощью реакции, подобной той, что указана в примере 10 (10e), используя 4-фторбензальдегид (1,3 г, 10 ммоль), 2,3-дифторфенол (2,0 г, 15 ммоль), карбонат калия (2,8 г, 20 ммоль), 2-метил-2-бутен (4,9 мл, 46 ммоль), дигидрофосфат калия (3,1 г, 23 ммоль) и гипохлорит натрия (2,5 г, 27 ммоль).
1H ЯМР спектр (400 МГц, CDCl3) δ м.д.: 6,88-6,95 (м, 1H), 6,98-7,12 (м, 4H), 8,08 (д, 2H, J=9,0 Гц).
ИК-спектр (KBr): 1170, 1249, 1297, 1498, 1603, 1678, 1703, 2565, 2683, 2839, 2991 см-1.
Масс-спектр (EI+) m/z: 250 (M+).
(18b) (5-{5-[4-(2,3-Дифторфенокси)фенил]-1,2,4-оксадиазол-3-ил}-4-этил-2-тиенил)метанол
Сырой продукт указанного в заголовке соединения синтезировали с помощью реакции, подобной той, которая указана в примере 10 (10f), используя 5-({[трет-бутил(диметил)силил]окси}метил)-3-этил-N'-гидрокситиофен-2-карбоксимидамид (0,16 г, 0,50 ммоль), который был получен в примере 10 (10d), 4-(2,3-дифторфенокси)бензойную кислоту (0,14 г, 0,55 ммоль), которая была получена в примере 18 (18a), N,N'-дициклогексилкарбодиимид (0,11 г, 0,55 ммоль), и 1,0 M раствор фторида тетрабутиламмония в тетрагидрофуране (0,75 мл, 0,75 ммоль). Далее, полученный таким образом сырой продукт указанного в заголовке соединения очищали хроматографией на колонке с силикагелем, используя смешанный растворитель, состоящий из этилацетата и гексана (от 2:8 до 3:7) в качестве элюента, что давало указанное в заголовке соединение (0,18 г) с выходом 88% в виде белого кристаллического твердого продукта.
1H ЯМР спектр (400 МГц, CDCl3) δ м.д.: 1,29 (т, 3H, J=7,4 Гц), 3,04 (кв, 2H, J=7,4 Гц), 4,84 (с, 2H), 6,90-7,13 (м, 5H), 8,14 (д, 2H, J=9,0 Гц).
ИК-спектр (KBr): 1248, 1352, 1474, 1512, 1607, 1628, 3305 см-1.
Масс-спектр (FAB+) m/z: 415 ((M+H)+).
(18c) Метил 1-[(5-{5-[4-(2,3-дифторфенокси)фенил]-1,2,4-оксадиазол-3-ил}-4-этил-2-тиенил)метил]азетидин-3-карбоксилат
Сырой продукт указанного в заголовке соединения синтезировали с помощью реакции, подобной той, которая указана в примере 1 (1f), используя (5-{5-[4-(2,3-дифторфенокси)фенил]-1,2,4-оксадиазол-3-ил}-4-этил-2-тиенил)метанол (0,18 г, 0,43 ммоль), который был получен в примере 18 (18b), тетрабромид углерода (0,17 г, 0,52 ммоль), трифенилфосфин (0,14 г, 0,52 ммоль), гидрохлорид метил 3-азетидинкарбоксилата (0,10 г, 0,86 ммоль) и N,N-диизопропилэтиламин (0,15 мл, 1,1 ммоль). Далее, полученный таким образом сырой продукт указанного в заголовке соединения очищали хроматографией, используя смешанный растворитель, состоящий из этилацетата и гексана (5:5), что давало указанное в заголовке соединение (0,20 г) с выходом 91% в виде бледно-желтого маслянистого продукта.
1H ЯМР спектр (500 МГц, CDCl3) δ м.д.: 1,28 (т, 3H, J=7,4 Гц), 3,03 (кв, 2H, J=7,4 Гц), 3,32-3,40 (м, 4H), 3,58-3,68 (м, 1H), 3,72 (с, 3H), 3,79 (с, 2H), 6,92-6,97 (м, 1H), 7,03-7,16 (м, 4H), 8,16 (д, 2H, J=9,0 Гц).
ИК-спектр (жидкая пленка): 1250, 1346, 1476, 1498, 1512, 1557, 1608, 1737 см-1.
Масс-спектр (FAB+) m/z: 512 ((M+H)+).
(18d) 1-[(5-{5-[4-(2,3-Дифторфенокси)фенил]-1,2,4-оксадиазол-3-ил}-4-этил-2-тиенил)метил]азетидин-3-карбоновая кислота
Указанное в заголовке соединение (77 мг) синтезировали с выходом 38% в виде белого кристаллического твердого продукта с помощью реакции, подобной той, которая указана в примере 2 (2e), используя метил 1-[(5-{5-[4-(2,3-дифторфенокси)фенил]-1,2,4-оксадиазол-3-ил}-4-этил-2-тиенил)метил]азетидин-3-карбоксилат (0,20 г, 0,39 ммоль), который был получен в примере 18 (18c), моногидрат гидроксида лития (36 мг, 0,86 ммоль) и уксусную кислоту (47 мкл, 0,86 ммоль).
1H ЯМР спектр (500 МГц, CD3OD) δ м.д.: 1,29 (т, 3H, J=7,4 Гц), 3,07 (кв, 2H, J=7,4 Гц), 3,40 (квинтет, 1H, J=6,1 Гц), 4,07 (т, 2H, J=10,2 Гц), 4,13 (т, 2H, J=9,8 Гц), 4,44 (с, 2H), 7,04-7,10 (м, 1H), 7,16-7,28 (м, 4H), 8,19 (д, 2H, J=8,6 Гц).
ИК-спектр (KBr): 1498, 1511, 1607, 3320, 3444 см-1.
Масс-спектр (FAB+) m/z: 498 ((M+H)+).
(Пример 19)
1-[(5-{5-[4-(2-Хлорфенокси)фенил]-1,2,4-оксадиазол-3-ил}-4-этил-2-тиенил)метил]азетидин-3-карбоновая кислота, 1/2 оксалат
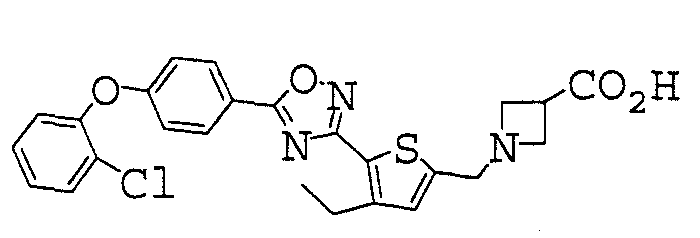
(19a) 4-(2-Хлорфенокси)бензойная кислота
Указанное в заголовке соединение (1,0 г) синтезировали с выходом 84% в виде желтовато-белого твердого кристаллического продукта с помощью реакции, подобной той, что указана в примере 10 (10e), используя 4-фторбензальдегид (0,60 г, 5,0 ммоль), 2-хлорфенол (0,90 г, 7,0 ммоль), карбонат калия (1,7 г, 13 ммоль), 2-метил-2-бутен (2,7 мл, 25 ммоль), дигидрофосфат калия (1,7 г, 13 ммоль) и гипохлорит натрия (1,4 г, 15 ммоль).
1H ЯМР спектр (400 МГц, CDCl3) δ м.д.: 6,95 (д, 2H, J=8,9 Гц), 7,13 (дд, 1H, J=7,8 Гц, 1,5 Гц), 7,20 (тд, 1H, J=7,8 Гц, 1,5 Гц), 7,31 (тд, 1H, J=7,8 Гц, 1,5 Гц), 7,50 (дд, 1H, J=7,8 Гц, 1,5 Гц), 8,08 (д, 2H, J=8,9 Гц).
(19b) (5-{5-[4-(2-Хлорфенокси)фенил]-1,2,4-оксадиазол-3-ил}-4-этил-2-тиенил)метанол
Сырой продукт указанного в заголовке соединения синтезировали с помощью реакции, подобной той, которая указана в примере 10 (10f), используя 5-({[трет-бутил(диметил)силил]окси}метил)-3-этил-N'-гидрокситиофен-2-карбоксимидамид (0,16 г, 0,50 ммоль), который был получен в примере 10 (10d), 4-(2-хлорфенокси)бензойную кислоту (0,14 г, 0,55 ммоль), которая была получена в примере 19 (19a), дициклогексилкарбодиимид (0,11 г, 0,55 ммоль) и 1,0 M раствор фторида тетрабутиламмония в тетрагидрофуране (0,75 мл, 0,75 ммоль). Далее, полученный таким образом сырой продукт указанного в заголовке соединения очищали хроматографией на колонке с силикагелем, используя смешанный растворитель, состоящий из этилацетата и гексана (от 3:7 до 5:5), в качестве элюента, что давало указанное в заголовке соединение (0,19 г) с выходом 92% в виде белого кристаллического твердого продукта.
1H ЯМР спектр (400 МГц, CDCl3) δ м.д.: 1,29 (т, 3H, J=7,4 Гц), 3,04 (кв, 2H, J=7,4 Гц), 4,83 (с, 2H), 6,96 (с, 1H), 7,01 (д, 2H, J=8,6 Гц), 7,13 (дд, 1H, J=1,2 Гц, 7,8 Гц), 7,19 (дт, 1H, J=1,2 Гц, 7,4 Гц), 7,30 (дт, 1H, J=1,2 Гц, 7,4 Гц), 7,49 (дд, 1H, J=1,2 Гц, 7,8 Гц), 8,12 (д, 2H, J=9,0 Гц).
ИК-спектр (KBr): 1245, 1259, 1353, 1473, 1498, 1517, 1556, 1612, 3329 см-1.
Масс-спектр (FAB+) m/z: 413 ((M+H)+).
(19c) Метил 1-[(5-{5-[4-(2-хлорфенокси)фенил]-1,2,4-оксадиазол-3-ил}-4-этил-2-тиенил)метил]азетидин-3-карбоксилат
Сырой продукт указанного в заголовке соединения синтезировали с помощью реакции, подобной той, которая указана в примере 1 (1f), используя (5-{5-[4-(2-хлорфенокси)фенил]-1,2,4-оксадиазол-3-ил}-4-этил-2-тиенил)метанол (0,19 г, 0,46 ммоль), который был получен в примере 19 (19b), тетрабромид углерода (0,18 г, 0,55 ммоль), трифенилфосфин (0,14 г, 0,55 ммоль), гидрохлорид метил 3-азетидинкарбоксилата (0,10 г, 0,69 ммоль) и N,N-диизопропилэтиламин (0,16 мл, 0,92 ммоль). Далее, полученный таким образом сырой продукт указанного в заголовке соединения очищали хроматографией, используя смешанный растворитель, состоящий из этилацетата и гексана (5:5), что давало указанное в заголовке соединение (0,21 г) с выходом 91% в виде бледно-желтого маслянистого продукта.
1H ЯМР спектр (400 МГц, CDCl3) δ м.д.: 1,28 (т, 3H, J=7,4 Гц), 3,03 (кв, 2H, J=7,4 Гц), 3,32-3,40 (м, 4H), 3,58-3,66 (м, 1H), 3,72 (с, 3H), 3,78 (с, 2H), 6,86 (с, 1H), 7,03 (д, 2H, J=7,9 Гц), 7,15 (дд, 1H, J=1,6 Гц, 7,8 Гц), 7,21 (дт, 1H, J=1,6 Гц, 7,4 Гц), 7,32 (дт, 1H, J=1,6 Гц,7,4 Гц), 7,51 (дд, 1H, J=1,6 Гц, 7,8 Гц), 8,14 (д, 2H, J=9,0 Гц).
ИК-спектр (жидкая пленка): 1475, 1514, 1557, 1581, 1613, 1737 см-1.
Масс-спектр (FAB+) m/z: 510 ((M+H)+).
(19d) 1-[(5-{5-[4-(2-Хлорфенокси)фенил]-1,2,4-оксадиазол-3-ил}-4-этил-2-тиенил)метил]азетидин-3-карбоновая кислота, 1/2 оксалат
Указанное в заголовке соединение (140 мг) синтезировали с выходом 67% в виде белого кристаллического твердого продукта с помощью реакции, подобной той, которая указана в примере 1 (1g), используя метил 1-[(5-{5-[4-(2-хлорфенокси)фенил]-1,2,4-оксадиазол-3-ил}-4-этил-2-тиенил)метил]азетидин-3-карбоксилат (0,21 г, 0,41 ммоль), который был получен в примере 19 (19c), моногидрат гидроксида лития (38 мг, 0,90 ммоль), уксусную кислоту (49 мкл, 0,90 ммоль) и щавелевую кислоту (18 мг, 0,20 ммоль).
1H ЯМР спектр (400 МГц, CD3OD+CD3CO2D(5:1)) δ м.д.: 1,29 (т, 3H, J=7,4 Гц), 3,08 (кв, 2H, J=7,4 Гц), 3,56 (квинтет, 1H, J=7,4 Гц), 4,25 (т, 2H, J=10,2 Гц), 4,29 (т, 2H, J=10,2 Гц), 4,58 (с, 2H), 7,08 (д, 2H, J=9,0 Гц), 7,24 (дд, 1H, J=1,6 Гц, 7,8 Гц), 7,30 (дт, 1H, J=1,6 Гц, 8,2 Гц), 7,42 (дт, 1H, J=1,6 Гц, 8,2 Гц), 7,57 (дд, 1H, J=1,6 Гц, 7,8 Гц), 8,17 (д, 2H, J=9,0 Гц).
ИК-спектр (KBr): 1475, 1497, 1515, 1613, 1665, 3418 см-1.
Масс-спектр (FAB+) m/z: 496 ((M+H)+).
(Пример 20)
1-[(4-Этил-5-{5-[3-фтор-4-(3-фторфенокси)фенил]-1,2,4-оксадиазол-3-ил}-2-тиенил)метил]азетидин-3-карбоновая кислота
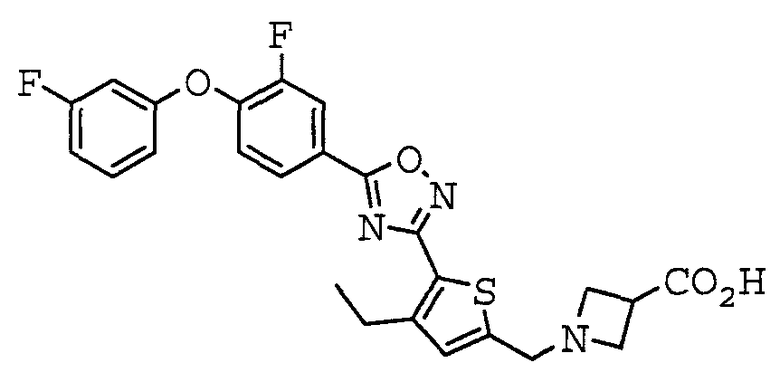
(20a) 3-Фтор-4-(3-фторфенокси)бензойная кислота
Указанное в заголовке соединение (2,0 г) синтезировали с выходом 84% в виде желтовато-белого твердого кристаллического продукта с помощью реакции, подобной той, что указана в примере 10 (10e), используя 3,4-дифторбензальдегид (1,4 г, 10 ммоль), 3-фторфенол (1,6 г, 14 ммоль), карбонат калия (3,5 г, 25 ммоль), 2-метил-2-бутен (5,1 мл, 48 ммоль), дигидрофосфат калия (3,3 г, 24 ммоль) и гипохлорит натрия (2,6 г, 29 ммоль).
1H ЯМР спектр (400 МГц, CDCl3) δ м.д.: 6,76 (дт, 1H, J=9,8 Гц, 2,3 Гц), 6,82 (дд, 1H, J=8,2 Гц, 2,3 Гц), 6,88 (тдд, 1H, J=8,2 Гц, 2,3 Гц, 0,8 Гц), 7,06 (т, 1H, J=8,2 Гц), 7,31 (тд, 1H, J=8,2 Гц, 6,7 Гц), 7,86 (ддд, 1H, J=8,6 Гц, 2,0 Гц, 1,2 Гц), 7,91 (дд, 1H, J=11,0 Гц, 2,0 Гц).
(20b) (4-Этил-5-{5-[3-фтор-4-(3-фторфенокси)фенил]-1,2,4-оксадиазол-3-ил}-2-тиенил)метанол
Сырой продукт указанного в заголовке соединения синтезировали с помощью реакции, подобной той, которая указана в примере 12 (12a), используя 3-фтор-4-(3-фторфенокси)бензойную кислоту (0,13 г, 0,53 ммоль), которая была получена в примере 20 (20a), 1-гидроксибензотриазол (74 мг, 0,55 ммоль), 1-этил-3-(3-диметиламинопропил)карбодиимид гидрохлорид (0,11 г, 0,55 ммоль), 5-({[трет-бутил(диметил)силил]окси}метил)-3-этил-N'-гидрокситиофен-2-карбоксимидамид (0,16 г, 0,50 ммоль), который был получен в примере 10 (10d), и 1,0 M раствор тетрабутиламмонийфторида в тетрагидрофуране (1,0 мл, 1,0 ммоль). Далее, полученный таким образом сырой продукт указанного в заголовке соединения очищали хроматографией на колонке с силикагелем, используя смешанный растворитель, состоящий из этилацетата и гексана (1:3), в качестве элюента, что давало указанное в заголовке соединение (0,18 г) с выходом 87% в виде бледно-желтого твердого кристаллического продукта.
1H ЯМР спектр (400 МГц, CDCl3) δ м.д.: 1,30 (т, 3H, J=7,4 Гц), 1,89 (т, 1H, J=6,3 Гц), 3,06 (кв, 2H, J=7,4 Гц), 4,86 (д, 2H, J=6,3 Гц), 6,79 (дт, 1H, J=9,8 Гц, 2,3 Гц), 6,84 (дд, 1H, J=8,2 Гц, 2,3 Гц), 6,90 (тд, 1H, J=8,2 Гц, 2,3 Гц), 6,99 (с, 1H), 7,17 (т, 1H, J=8,2 Гц), 7,34 (тд, 1H, J=8,2 Гц, 6,6 Гц), 7,96 (дт, 1H, J=9,0 Гц, 2,0 Гц), 8,03 (дд, 1H, J=10,6 Гц, 2,0 Гц).
ИК-спектр (KBr): 1127, 1277, 1354, 1488, 1516, 1558, 1607, 3318 см-1.
Масс-спектр (FAB+) m/z: 415 ((M+H)+).
(20c) Метил 1-[(4-этил-5-{5-[3-фтор-4-(3-фторфенокси)фенил]-1,2,4-оксадиазол-3-ил}-2-тиенил)метил]азетидин-3-карбоксилат
Сырой продукт указанного в заголовке соединения синтезировали с помощью реакции, подобной той, которая указана в примере 1 (1f), используя (4-этил-5-{5-[3-фтор-4-(3-фторфенокси)фенил]-1,2,4-оксадиазол-3-ил}-2-тиенил)метанол (0,18 г, 0,43 ммоль), который был получен в примере 20 (20b), тетрабромид углерода (0,22 г, 0,65 ммоль), трифенилфосфин (0,17 г, 0,65 ммоль), гидрохлорид метил 3-азетидинкарбоксилата (99 мг, 0,65 ммоль), N,N-диизопропилэтиламин (0,22 мл, 1,3 ммоль). Далее, полученный таким образом сырой продукт указанного в заголовке соединения очищали хроматографией на колонке с силикагелем, используя смешанный растворитель, состоящий из этилацетата и гексана (от 1:3 до 1:2), в качестве элюента, что давало указанное в заголовке соединение (0,14 г) с выходом 64% в виде бледно-желтого маслянистого продукта.
1H ЯМР спектр (400 МГц, CDCl3) δ м.д.: 1,28 (т, 3H, J=7,4 Гц), 3,03 (кв, 2H, J=7,4 Гц), 3,32-3,43 (м, 3H), 3,60-3,68 (м, 2H), 3,72 (с, 3H), 3,79 (с, 2H), 6,79 (дт, 1H, J=9,8 Гц, 2,3 Гц), 6,85 (дд, 1H, J=8,2 Гц, 2,3 Гц), 6,87 (с, 1H), 6,90 (тд, 1H, J=8,6 Гц, 0,8 Гц), 7,17 (т, 1H, J=8,2 Гц), 7,34 (тд, 1H, J=8,2 Гц, 6,6 Гц), 7,95 (дт, 1H, J=8,6 Гц, 2,0 Гц), 8,02 (дд, 1H, J=10,6 Гц, 2,0 Гц).
ИК-спектр (жидкая пленка): 1128, 1200, 1275, 1348, 1451, 1486, 1513, 1605, 1737 см-1.
Масс-спектр (FAB+) m/z: 512 ((M+H)+).
(20d) 1-[(4-Этил-5-{5-[3-фтор-4-(3-фторфенокси)фенил]-1,2,4-оксадиазол-3-ил}-2-тиенил)метил]азетидин-3-карбоновая кислота
Указанное в заголовке соединение (0,11 г) синтезировали с выходом 83% в виде белого кристаллического твердого продукта с помощью реакции, подобной той, которая указана в примере 3 (3e), используя метил 1-[(4-этил-5-{5-[3-фтор-4-(3-фторфенокси)фенил]-1,2,4-оксадиазол-3-ил}-2-тиенил)метил]азетидин-3-карбоксилат (0,14 г, 0,27 ммоль), который был получен в примере 20 (20c), и 1н. водный раствор гидроксида натрия (0,81 мл, 0,81 ммоль).
1H ЯМР спектр (400 МГц, CD3CO2D) δ м.д.: 1,31 (т, 3H, J=7,4 Гц), 3,10 (кв, 2H, J=7,4 Гц), 3,75-3,87 (м,1H), 4,34-4,45 (м, 2H), 4,50-4,59 (м, 2H), 4,69 (с, 2H), 6,88-7,00 (м, 3H), 7,28 (т, 1H, J=8,6 Гц), 7,34 (с, 1H), 7,37-7,47 (м, 1H), 8,02 (д, 1H, J=8,6 Гц), 8,06 (д, 1H, J=11,0 Гц).
ИК-спектр (KBr): 1130, 1278, 1488, 1515, 1607, 3434 см-1.
Масс-спектр (FAB+) m/z: 498 ((M+H)+).
(Пример 21)
1-[(4-Этил-5-{5-[4-(2-метоксифенокси)фенил]-1,2,4-оксадиазол-3-ил}-2-тиенил)метил]азетидин-3-карбоновая кислота, 1/2 оксалат
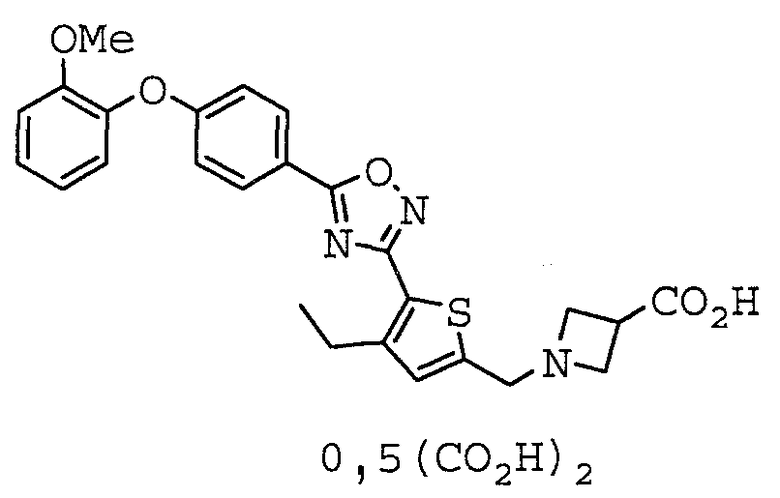
(21a) 4-(2-Метоксифенокси)бензойная кислота
Указанное в заголовке соединение (1,6 г) синтезировали с выходом 89% в виде желтовато-белого твердого кристаллического продукта с помощью реакции, подобной той, что указана в примере 10 (10e), используя 4-фторбензальдегид (1,2 г, 10 ммоль), 2-метоксифенол (1,7 г, 14 ммоль), карбонат калия (3,5 г, 25 ммоль), 2-метил-2-бутен (3,9 мл, 37 ммоль), дигидрофосфат калия (2,5 г, 19 ммоль) и гипохлорит натрия (2,0 г, 22 ммоль).
1H ЯМР спектр (400 МГц, CDCl3) δ м.д.: 3,80 (с, 3H), 6,93 (дд, 2H, J=8,6 Гц, 2,0 Гц), 6,99 (тд, 1H, J=7,4 Гц, 1,6 Гц), 7,04 (дд, 1H, J=8,2 Гц, 1,6 Гц), 7,09 (дд, 1H, J=8,2 Гц, 1,6 Гц), 7,23 (тд, 1H, J=7,4 Гц, 1,6 Гц), 8,04 (дд, 1H, J=8,6 Гц, 2,0 Гц).
(21b) (4-Этил-5-{5-[4-(2-метоксифенокси)фенил]-1,2,4-оксадиазол-3-ил}-2-тиенил)метанол
Сырой продукт указанного в заголовке соединения синтезировали с помощью реакции, подобной той, которая указана в примере 12 (12a), используя 4-(2-метоксифенокси)бензойную кислоту (0,13 г, 0,53 ммоль), которая была получена в примере 21 (21a), 1-гидроксибензотриазол (74 мг, 0,55 ммоль), 1-этил-3-(3-диметиламинопропил)карбодиимид гидрохлорид (0,11 г, 0,55 ммоль), 5-({[трет-бутил(диметил)силил]окси}метил)-3-этил-N'-гидрокситиофен-2-карбоксимидамид (0,16 г, 0,50 ммоль), который был получен в примере 10 (10d), и 1,0 M раствор тетрабутиламмонийфторида в тетрагидрофуране (1,0 мл, 1,0 ммоль). Далее, полученный таким образом сырой продукт указанного в заголовке соединения очищали хроматографией на колонке с силикагелем, используя смешанный растворитель, состоящий из этилацетата и гексана (2:5) в качестве элюента, что давало указанное в заголовке соединение (0,15 г) с выходом 72% в виде желтовато-белого твердого кристаллического продукта.
1H ЯМР спектр (400 МГц, CDCl3) δ м.д.: 1,29 (т, 3H, J=7,4 Гц), 1,85 (т, 1H, J=6,3 Гц), 3,06 (кв, 2H, J=7,4 Гц), 3,81 (с, 3H), 4,85 (д, 2H, J=6,3 Гц), 6,98 (с, 1H), 6,99-7,07 (м, 4H), 7,11 (дд, 1H, J=7,8 Гц, 1,6 Гц), 7,24 (дт, 1H, J=7,8 Гц, 1,6 Гц), 8,11 (дд, 2H, J=9,0 Гц, 2,0 Гц).
ИК-спектр (KBr): 1228, 1262, 1354, 1497, 1513, 1612, 3316, 3379 см-1.
Масс-спектр (FAB+) m/z: 409 ((M+H)+).
(21c) Метил 1-[(4-этил-5-{5-[4-(2-метоксифенокси)фенил]-1,2,4-оксадиазол-3-ил}-2-тиенил)метил]азетидин-3-карбоксилат
Сырой продукт указанного в заголовке соединения синтезировали с помощью реакции, подобной той, которая указана в примере 1 (1f), используя (4-этил-5-{5-[4-(2-метоксифенокси)фенил]-1,2,4-оксадиазол-3-ил}-2-тиенил)метанол (0,14 г, 0,35 ммоль), который был получен в примере 21 (21b), тетрабромид углерода (0,17 г, 0,53 ммоль), трифенилфосфин (0,14 г, 0,53 ммоль), гидрохлорид метил 3-азетидинкарбоксилата (80 мг, 0,53 ммоль) и N,N-диизопропилэтиламин (0,18 мл, 1,1 ммоль). Далее, полученный таким образом сырой продукт указанного в заголовке соединения очищали хроматографией на колонке с силикагелем, используя смешанный растворитель, состоящий из этилацетата и гексана (от 2:5 до 1:2), в качестве элюента, что давало указанное в заголовке соединение (89 мг) с выходом 50% в виде бесцветного маслянистого продукта.
1H ЯМР спектр (400 МГц, CDCl3) δ м.д.: 1,27 (т, 3H, J=7,4 Гц), 3,03 (кв, 2H, J=7,4 Гц), 3,31-3,41 (м, 3H), 3,59-3,68 (м, 2H), 3,72 (с, 3H), 3,78 (с, 2H), 3,81 (с, 3H), 6,86 (с, 1H), 6,97-7,07 (м,4H), 7,11 (дд, 1H, J=8,2 Гц, 1,6 Гц), 7,24 (тд, 1H, J=7,4 Гц, 1,6 Гц), 8,10 (дд, 2H, J=9,0 Гц, 2,2 Гц).
ИК-спектр (тонкая пленка): 1168, 1176, 1201, 1265, 1346, 1455, 1496, 1513, 1613, 1737 см-1.
Масс-спектр (FAB+) m/z: 506 ((M+H)+).
(21d) 1-[(4-Этил-5-{5-[4-(2-метоксифенокси)фенил]-1,2,4-оксадиазол-3-ил}-2-тиенил)метил]азетидин-3-карбоновая кислота, 1/2 оксалат
К раствору метил 1-[(4-этил-5-{5-[4-(2-метоксифенокси)фенил]-1,2,4-оксадиазол-3-ил}-2-тиенил)метил]азетидин-3-карбоксилата (86 мг, 0,17 ммоль), который был получен в примере 21 (21c), в диоксане (3 мл) добавляли 1н. водный раствор гидроксида натрия (0,51 мл, 0,51 ммоль) при перемешивании, и полученную смесь перемешивали при комнатной температуре в течение 2 часов. После перемешивания к реакционной смеси добавляли уксусную кислоту (29 мкл, 0,51 ммоль) для гашения реакции, и полученную смесь упаривали в вакууме. Далее, к полученному остатку добавляли последовательно метанол (2 мл) и воду (1 мл) при перемешивании, и затем добавляли раствор щавелевой кислоты (8 мг, 0,09 ммоль) в метаноле (0,5 мл), и далее полученную смесь перемешивали в течение 30 минут. Выпавший в осадок белый твердый продукт собирали фильтрацией, используя воронку Кирияма (Kiriyama), промывали смешанным растворителем, состоящим из воды и метанола (3:7), и сушили в вакууме, что давало указанное в заголовке соединение (63 мг) с выходом 69% в виде белого кристаллического твердого продукта.
1H ЯМР спектр (400 МГц, CD3CO2D) δ м.д.: 1,30 (т, 3H, J=6,8 Гц), 3,09 (кв, 2H, J=6,8 Гц), 3,78 (с, 3H), 3,76-3,89 (м, 1H), 4,33-4,43 (м, 2H), 4,50-4,61 (м, 2H), 4,68 (с, 2H), 6,98-7,07 (м, 3H), 7,10-7,18 (м, 2H), 7,27 (т, 1H, J=6,6 Гц), 7,34 (с, 1H), 8,12 (д, 2H, J=8,6 Гц).
ИК-спектр (KBr): 1233, 1265, 1346, 1497, 1515, 1614, 3422 см-1.
Масс-спектр (FAB+) m/z: 492 ((M+H)+).
(Пример 22)
1-({3-Этил-5-[5-(4-феноксифенил)-1,2,4-оксадиазол-3-ил]-2-тиенил}метил)азетидин-3-карбоновая кислота
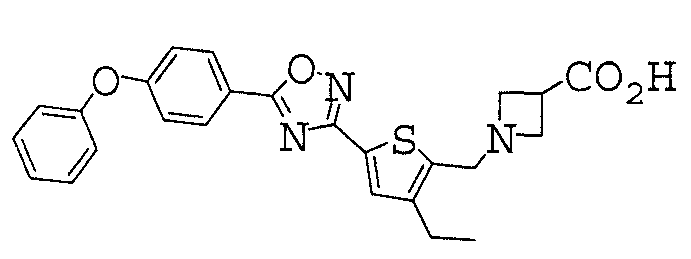
(22a) [5-({[трет-Бутил(диметил)силил]окси}метил)-3-этил-2-тиенил]метанол
К раствору 5-({[трет-бутил(диметил)силил]окси}метил)-3-этилтиофен-2-карбоксальдегида, который был получен в примере 10 (10b), (1,5 г, 5,8 ммоль) в метаноле (10 мл) медленно добавляли боргидрид натрия (0,22 г, 5,8 ммоль) при 0°C при перемешивании, и полученную смесь перемешивали в течение 30 минут. После перемешивания, растворитель упаривали в вакууме. Далее, к раствору полученного остатка в эфире наливали воду (20 мл) и экстрагировали эфиром. Экстракт промывали насыщенным водным раствором хлорида натрия и сушили над сульфатом магния. После фильтрации фильтрат упаривали в вакууме, и полученный таким образом сырой продукт указанного в заголовке соединения очищали хроматографией на колонке с силикагелем, используя смешанный растворитель, состоящий из этилацетата и гексана (от 1:4 до 3:7), в качестве элюента, что давало чистое указанное в заголовке соединение (1,4 г) с выходом 94% в виде бесцветного маслянистого продукта.
1H ЯМР спектр (400 МГц, CDCl3) δ м.д.: 0,11 (с, 6H), 0,93 (с, 9H), 1,18 (т, 3H, J=7,4 Гц), 2,57 (кв, 2H, J=7,4 Гц), 4,71 (д, 2H, J=5,9 Гц), 4,80 (с, 2H), 6,72 (с, 1H).
ИК-спектр (жидкая пленка): 1075, 1149, 1255, 1362, 1390, 1463, 3352 см-1.
Масс-спектр (FAB+) m/z: 285 ((M-H)+).
(22b) 4-Этил-5-[(тетрагидро-2H-пиран-2-илокси)метил]тиофен-2-карбоксальдегид
К раствору [5-({[трет-бутил(диметил)силил]окси}метил)-3-этил-2-тиенил]метанола (1,4 г, 5,3 ммоль), который был получен в примере 22 (22a), в дихлорметане (10 мл) добавляли последовательно 3,4-дигидро-2H-пиран (0,58 мл, 6,4 ммоль) и п-толуолсульфоновую кислоту (10 мг, 0,04 ммоль) при 0°C при перемешивании, и полученную смесь перемешивали при комнатной температуре в течение 30 минут. После перемешивания к реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия (5 мл) для гашения реакции, и полученную смесь выливали в воду (20 мл) и экстрагировали эфиром. Экстракт промывали насыщенным водным раствором хлорида натрия и сушили над сульфатом магния. После фильтрации фильтрат упаривали в вакууме. Далее, к раствору полученного остатка в тетрагидрофуране (5 мл) добавляли 1,0 М раствор фторида тетрабутиламмония в тетрагидрофуране (6,4 мл, 6,4 ммоль) при перемешивании, и полученную смесь перемешивали при комнатной температуре в течение 30 минут. После перемешивания реакционную смесь выливали в воду (20 мл) и экстрагировали эфиром. Экстракт промывали насыщенным водным раствором хлорида натрия и сушили над сульфатом магния. После фильтрации фильтрат упаривали в вакууме. Далее, к раствору полученного остатка в дихлорметане (30 мл) добавляли молекулярные сита 4Å (10 г), и после охлаждения до 0°C к полученной смеси затем добавляли дихромат пиридиния (3,3 г, 8,7 ммоль) при перемешивании, и полученную смесь перемешивали при комнатной температуре в течение 2 часов. После перемешивания к реакционной смеси добавляли эфир (150 мл) при перемешивании, и нерастворенные продукты удаляли фильтрацией через силикагель. Фильтрат упаривали в вакууме, и полученный таким образом сырой продукт указанного в заголовке соединения очищали хроматографией на колонке с силикагелем, используя смешанный растворитель, состоящий из этилацетата и гексана (от 0:10 до 2:8), в качестве элюента, что давало указанное в заголовке соединение (0,97 г) с выходом 78% в виде бесцветного маслянистого продукта.
1H ЯМР спектр (400 МГц, CDCl3) δ м.д.: 1,23 (т, 3H, J=7,6 Гц), 1,50-1,92 (м, 6H), 2,61 (кв, 2H, J=7,6 Гц), 3,53-3,59 (м, 1H), 3,84-3,92 (м, 1H), 4,65 (д, 1H, J=13,5 Гц), 4,74 (т, 1H, J=3,5 Гц), 4,87 (д, 1H, J=13,5 Гц), 7,55 (с, 1H), 9,80 (с, 1H).
ИК-спектр (жидкая пленка): 1023, 1036, 1121, 1158, 1454, 1670, 2873, 2942, 3440 см-1.
Масс-спектр (EI+) m/z: 254(M+).
(22c) 4-Этил-5-[(тетрагидро-2H-пиран-2-илокси)метил]тиофен-2-карбонитрил
Сырой продукт указанного в заголовке соединения синтезировали с помощью реакции, подобной той, которая указана в примере 1 (1c), используя 4-этил-5-[(тетрагидро-2H-пиран-2-илокси)метил]тиофен-2-карбонитрил (0,97 г, 3,6 ммоль), который был получен в примере 22 (22b), гидрохлорид гидроксиламина (0,29 г, 3,9 ммоль), триэтиламин (1,1 мл, 7,2 ммоль) и N,N'-дициклогексилкарбодиимид (0,87 г, 3,9 ммоль). Далее, полученный таким образом сырой продукт указанного в заголовке соединения очищали хроматографией на колонке с силикагелем, используя смешанный растворитель, состоящий из этилацетата и гексана (от 0:10 до 10:90), в качестве элюента, что давало указанное в заголовке соединение (0,86 г) с выходом 95% в виде бесцветного маслянистого продукта.
1H ЯМР спектр (400 МГц, CDCl3) δ м.д.: 1,19 (т, 3H, J=7,6 Гц), 1,52-1,90 (м, 6H), 2,58 (кв, 2H, J=7,6 Гц), 3,52-3,59 (м, 1H), 3,82-3,90 (м, 1H), 4,62 (д, 1H, J=13,3 Гц), 4,71 (т, 1H, J=3,3 Гц), 4,84 (д, 1H, J=13,3 Гц), 7,38 (с, 1H).
ИК-спектр (жидкая пленка): 903, 1024, 1036, 1066, 1077, 1123, 1174, 1201, 1342, 1454, 2216, 2873, 2942 см-1.
Масс-спектр (EI+) m/z: 251 (M+).
(22d) 4-Этил-N'-гидрокси-5-[(тетрагидро-2H-пиран-2-илокси)метил]тиофен-2-карбоксимидамид
Сырой продукт указанного в заголовке соединения синтезировали с помощью реакции, подобной той, которая указана в примере 1 (1d), используя 4-этил-5-[(тетрагидро-2H-пиран-2-илокси)метил]тиофен-2-карбонитрил (0,86 г, 3,4 ммоль), который был получен в примере 22 (22c), и 50% водный раствор гидроксиламина (0,5 мл). Далее, полученный таким образом сырой продукт указанного в заголовке соединения очищали хроматографией на колонке с силикагелем, используя смешанный растворитель, состоящий из этилацетата и гексана (от 1:3 до 5:5), в качестве элюента, что давало указанное в заголовке соединение (0,96 г) с выходом 98% в виде бесцветного маслянистого продукта.
1H ЯМР спектр (400 МГц, CDCl3) δ м.д.: 1,20 (т, 3H, J=7,6 Гц), 1,47-1,89 (м, 6H), 2,59 (кв, 2H, J=7,6 Гц), 3,52-3,59 (м, 1H), 3,87-3,94 (м, 1H), 4,61 (д, 1H, J=12,9 Гц), 4,71 (т, 1H, J=3,3 Гц), 4,80 (д, 1H, J=12,9 Гц), 4,82 (ушир., 2H), 7,07 (с, 1H), 7,23 (ушир., 1H).
ИК-спектр (жидкая пленка): 1022, 1117, 1344, 1390, 1588, 1635, 2872, 2942, 3353 см-1.
Масс-спектр (FAB+) m/z: 285 ((M+H)+).
(22e) 3-{4-Этил-5-[(тетрагидро-2H-пиран-2-илокси)метил]-2-тиенил}-5-(4-феноксифенил)-1,2,4-оксадиазол
Сырое указанное в заголовке соединение синтезировали с помощью реакции, подобной той, что указана в примере 5 (5a), используя 4-феноксибензойную кислоту (0,16 г, 0,73 ммоль), 1-гидроксибензотриазол (0,12 г, 0,76 ммоль), 1-этил-3-(3-диметиламинопропил)карбодиимид гидрохлорид (0,15 г, 0,76 ммоль), 4-этил-N'-гидрокси-5-[(тетрагидро-2H-пиран-2-илокси)метил]тиофен-2-карбоксимидамид (0,17 г, 0,69 ммоль), который был получен в примере 22 (22d), и фторид тетрабутиламмония (1,0 М раствор в тетрагидрофуране, 14 мл, 1,4 ммоль). Далее, полученный таким образом сырой продукт указанного в заголовке соединения очищали хроматографией на колонке с силикагелем, используя смешанный растворитель, состоящий из этилацетата и гексана (от 0:10 до 2:8), в качестве элюента, что давало указанное в заголовке соединение (0,25 г) с выходом 78% в виде бесцветного маслянистого продукта.
1H ЯМР спектр (400M Гц, CDCl3) δ м.д.: 1,26 (т, 3H, J=7,6 Гц), 1,50-1,93 (м, 6H), 2,65 (кв, 2H, J=7,6 Гц), 3,55-3,61 (м, 1H), 3,89-3,96 (м, 1H), 4,69 (д, 1H, J=12,9 Гц), 4,77 (т, 1H, J=3,5 Гц), 4,88 (д, 1H, J=12,9 Гц), 7,07-7,12 (м, 4H), 7,20-7,25 (м, 1H), 7,41 (д, 1H, J=7,4 Гц), 7,43 (д, 1H, J=7,4 Гц), 7,66 (с, 1H), 8,15 (д, 2H, J=9,0 Гц).
ИК-спектр (жидкая пленка): 761, 1022, 1167, 1245, 1488, 1589, 1613, 2872, 2940 см-1.
Масс-спектр (FAB+) m/z: 463 ((M+H)+).
(22f) {3-Этил-5-[5-(4-феноксифенил)-1,2,4-оксадиазол-3-ил]-2-тиенил}метанол
К раствору 3-{4-этил-5-[(тетрагидро-2H-пиран-2-илокси)метил]-2-тиенил}-5-(4-феноксифенил)-1,2,4-оксадиазола (0,25 г, 0,54 ммоль), который был получен в примере 22 (22e), в этаноле (5 мл) добавляли п-толуолсульфонат пиридиния (0,014 г, 0,54 ммоль) при перемешивании, и полученную смесь перемешивали при 60°C в течение 4 часов. После перемешивания реакционную смесь выливали в воду (20 мл) для гашения реакции и экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и сушили над сульфатом магния. После фильтрации фильтрат упаривали в вакууме, что давало указанное в заголовке соединение (0,19 г) с выходом 92% в виде белого твердого кристаллического продукта.
1H ЯМР спектр (400 МГц, CDCl3) δ м.д.: 1,27 (т, 3H, J=7,6 Гц), 1,79 (т, 1H, J=5,9 Гц), 2,67 (кв, 2H, J=7,6 Гц), 4,83 (д, 2H, J=5,9 Гц), 7,07-7,12 (м, 4H), 7,20-7,25 (м, 1H), 7,41 (д, 1H, J=7,4 Гц), 7,43 (д, 1H, J=7,4 Гц), 7,67 (с, 1H), 8,15 (д, 2H, J=8,6 Гц).
ИК-спектр (KBr): 760, 998, 1232, 1422, 1487, 1579, 1591, 1615, 2964, 3452 см-1.
Масс-спектр (FAB+) m/z: 379 ((M+H)+).
(22g) Метил 1-({3-этил-5-[5-(4-феноксифенил)-1,2,4-оксадиазол-3-ил]-2-тиенил}метил)азетидин-3-карбоксилат
Сырой продукт указанного в заголовке соединения синтезировали с помощью реакции, подобной той, которая указана в примере 1 (1f), используя {3-этил-5-[5-(4-феноксифенил)-1,2,4-оксадиазол-3-ил]-2-тиенил}метанол (0,19 г, 0,50 ммоль), который был получен в примере 22 (22f), тетрабромид углерода (0,33 г, 0,99 ммоль), трифенилфосфин (0,26 г, 0,99 ммоль), гидрохлорид метил 3-азетидинкарбоксилата (0,11 г, 0,75 ммоль), N,N-диизопропилэтиламин (0,22 мл, 1,2 ммоль). Далее, полученный таким образом сырой продукт указанного в заголовке соединения очищали хроматографией на колонке с силикагелем, используя смешанный растворитель, состоящий из этилацетата и гексана (от 2:8 до 4:6), в качестве элюента, что давало указанное в заголовке соединение (0,17 г) с выходом 72% в виде бледно-желтого твердого кристаллического продукта.
1H ЯМР спектр (500 МГц, CDCl3) δ м.д.: 1,23 (т, 3H, J=7,6 Гц), 2,61 (кв, 2H, J=7,6 Гц), 3,33-3,41 (м, 3H), 3,62-3,70 (м, 2H), 3,72 (с, 3H), 3,77 (с, 2H), 7,06-7,12 (м, 4H), 7,20-7,24 (м, 1H), 7,38-7,43 (м, 2H), 7,62 (с, 1H), 8,14 (д, 2H, J=8,8 Гц).
ИК-спектр (KBr): 1167, 1249, 1367, 1490, 1589, 1736, 2963 см-1.
Масс-спектр (FAB+) m/z: 476 ((M+H)+).
(22h) 1-({3-Этил-5-[5-(4-феноксифенил)-1,2,4-оксадиазол-3-ил]-2-тиенил}метил)азетидин-3-карбоновая кислота
Указанное в заголовке соединение (0,16 г) синтезировали с выходом 95% в виде белого кристаллического твердого продукта с помощью реакции, подобной той, которая указана в примере 3 (3e), используя метил 1-({3-этил-5-[5-(4-феноксифенил)-1,2,4-оксадиазол-3-ил]-2-тиенил}метил)азетидин-3-карбоксилат (0,17 г, 0,36 ммоль), который был получен в примере 22 (22g), 1н. водный раствор гидроксида натрия (1,1 мл, 1,1 ммоль) и уксусную кислоту (62 мкл, 1,1 ммоль).
1H ЯМР спектр (400 МГц, CD3CO2D) δ м.д.: 1,29 (т, 3H, J=7,5 Гц), 2,78 (кв, 2H, J=7,5 Гц), 3,75-3,86 (м, 1H), 4,30-4,60 (м, 2H), 4,71 (с, 2H), 7,11-7,17 (м, 4H), 7,22-7,27 (м, 1H), 7,41-7,48 (м, 2H), 7,80 (с, 1H), 8,15-8,21 (м, 2H).
ИК-спектр (KBr): 761, 1170, 1241, 1368, 1487, 1591, 1614, 2969, 3536 см-1.
Масс-спектр (FAB+) m/z: 462 ((M+H)+).
(Пример 23)
1-({5-[5-(3-Фтор-4-изобутилфенил)-1,2,4-оксадиазол-3-ил]пиридин-2-ил}метил)азетидин-3-карбоновая кислота
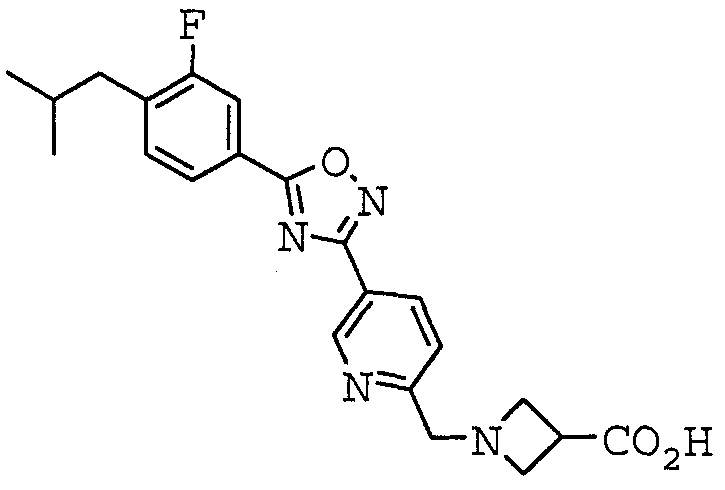
(23a) 5-Бром-2-({[трет-Бутил(диметил)силил]окси}метил)пиридин
К раствору 5-бром-2-формилпиридина (4,6 г, 25 ммоль) в метаноле (30 мл) добавляли боргидрид натрия (0,93 г, 25 ммоль) при 0°C при перемешивании, и полученную смесь перемешивали в течение 1 часа. После упаривания растворителя в вакууме полученный остаток разбавляли эфиром, выливали в воду (20 мл) и экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и сушили над сульфатом магния. После фильтрации фильтрат упаривали в вакууме. Далее, к раствору полученного остатка и имидазола (3,4 г, 49 ммоль) в N,N-диметилформамиде (30 мл) добавляли трет-бутилдиметилсилил хлорид (4,1 г, 27 ммоль) при перемешивании, и полученную смесь перемешивали при комнатной температуре в течение 1 часа. После перемешивания реакционную смесь выливали в воду (50 мл) и экстрагировали эфиром. Экстракт промывали насыщенным водным раствором хлорида натрия и сушили над сульфатом магния. После фильтрации фильтрат упаривали в вакууме, и полученный таким образом сырой продукт указанного в заголовке соединения очищали хроматографией на колонке с силикагелем, используя смешанный растворитель, состоящий из этилацетата и гексана (от 1:49 до 1:9), в качестве элюента, что давало указанное в заголовке соединение (6,8 г) с выходом 90% в виде белого кристаллического твердого продукта.
1H ЯМР спектр (400 МГц, CDCl3) δ м.д.: 0,12 (с, 6H), 0,95 (с, 9H), 4,78 (с, 2H), 7,42 (д, 1H, J=8,6 Гц), 7,82 (дд, 1H, J=2,3 Гц, 8,6 Гц), 8,56 (д, 1H, J=2,3 Гц).
ИК-спектр (KBr): 1008, 1104, 1258, 1377, 1471, 1578 см-1.
Масс-спектр (FAB+) m/z: 302 ((M+H)+).
(23b) 6-({[трет-Бутил(диметил)силил]окси}метил)никотинонитрил
Раствор 5-бром-2-({[трет-бутил(диметил)силил]окси}метил)пиридина (0,30 г, 1,0 ммоль), который был получен в примере 23 (23a), цианида цинка (0,18 г, 1,5 ммоль), бис(дибензилиденацетон)палладия (18 мг, 0,02 ммоль) и 1,1'-бис(дифенилфосфино)ферроцена (44 мг, 0,08 ммоль) в N-метил-2-пирролидиноне (4 мл) перемешивали при 100°C в течение 1 часа. После охлаждения до комнатной температуры реакционную смесь выливали в воду и экстрагировали эфиром. Экстракт промывали насыщенным водным раствором хлорида натрия и сушили над сульфатом магния. После фильтрации фильтрат упаривали в вакууме, и полученный таким образом сырой продукт указанного в заголовке соединения очищали хроматографией на колонке с силикагелем, используя смешанный растворитель, состоящий из этилацетата и гексана (1:9), в качестве элюента, что давало указанное в заголовке соединение (0,23 г) с выходом 93% в виде белого кристаллического твердого продукта.
1H ЯМР спектр (400 МГц, CDCl3) δ м.д.: 0,14 (с, 6H), 0,96 (с, 9H), 4,87 (с, 2H), 7,67 (д, 1H, J=8,2 Гц), 7,98 (дд, 1H, J=2,0 Гц, 8,2 Гц), 8,78 (д, 1H, J=2,0 Гц).
ИК-спектр (KBr): 1110, 1254, 1470, 1594, 2230 см-1.
Масс-спектр (FAB+) m/z: 249 ((M+H)+).
(23c) 6-({[трет-Бутил(диметил)силил]окси}метил)-N'-гидроксипиридин-3-карбоксимидамид
Сырое указанное в заголовке соединение синтезировали с помощью реакции, подобной той, что указана в примере 1 (1d), используя 6-({[трет-бутил(диметил)силил]окси}метил)никотинонитрил (2,0 г, 8,1 ммоль), который был получен в примере 23 (23b), и 40% водный раствор гидроксиламина (1 мл). Далее, полученный таким образом сырой продукт указанного в заголовке соединения очищали путем перекристаллизации из смешанного растворителя, состоящего из этилацетата и гексана (1:9), что давало указанное в заголовке соединение (2,1 г) с выходом 94% в виде белого кристаллического твердого продукта.
1H ЯМР спектр (500 МГц, CDCl3) δ м.д.: 0,13 (с, 6H), 0,96 (с, 9H), 4,86 (с, 2H), 4,89 (ушир., 2H), 7,56 (д, 1H, J=8,3 Гц), 7,95 (дд, 1H, J=2,4 Гц, 8,3 Гц), 8,77 (д, 1H, J=2,4 Гц).
ИК-спектр (KBr): 1258, 1380, 1397, 1645, 3166, 3299, 3467 см-1.
Масс-спектр (FAB+) m/z: 282 ((M+H)+).
(23d) 4-Бром-2-фтор-1-(2-метилпроп-1-ен-1-ил)бензол
К раствору изопропилтрифенилфосфоний йодида (0,65 г, 1,5 ммоль) в N,N-диметилформамиде (6 мл) медленно добавляли раствор трет-бутоксида калия (0,18 г, 1,6 ммоль) в N,N-диметилформамиде (2 мл) при 0°C при перемешивании, и полученную смесь перемешивали в течение 30 минут. Затем, к реакционной смеси добавляли раствор 4-бром-2-фторбензальдегида (0,20 г, 1,0 ммоль) в N,N-диметилформамиде (2 мл) при той же температуре при перемешивании, и после повышения температуры реакции до комнатной температуры, полученную смесь затем перемешивали в течение 1 часа. После перемешивания к реакционной смеси добавляли насыщенный водный раствор хлорида аммония (5 мл) для гашения реакции, и полученную смесь выливали в воду (20 мл) и экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и сушили над сульфатом натрия. После фильтрации фильтрат упаривали в вакууме, и сырое указанное в заголовке соединение, полученное таким образом, очищали хроматографией на колонке с силикагелем, используя смешанный растворитель, состоящий из этилацетата и гексана (от 0:10 до 5:95), в качестве элюента, что давало указанное в заголовке соединение (0,19 г) с выходом 82% в виде бесцветного маслянистого продукта.
1H ЯМР спектр (400 МГц, CDCl3) δ м.д.: 1,76 (с, 3H), 1,92 (с, 3H), 6,13 (с, 1H), 7,09 (т, 1H, J=8,2 Гц), 7,19-7,24 (м, 2H).
ИК-спектр (жидкая пленка): 1403, 1483, 1562, 1599 см-1.
Масс-спектр (EI+)m/z: 228 (M+).
(23e) 3-Фтор-4-изобутилбензойная кислота
К раствору 4-бром-2-фтор-1-(2-метилпроп-1-ен-1-ил)бензола (0,19 г, 0,81 ммоль), который был получен в примере 23 (23d), в тетрагидрофуране (4 мл) добавляли по каплям 1,6 M раствор н-бутиллития в гексане (0,62 мл, 0,97 ммоль) при -78°C при перемешивании, и полученную смесь перемешивали при той же температуре в течение 1 часа, барботируя при этом в раствор диоксид углерода. После перемешивания к реакционной смеси добавляли 1н. водный раствор гидроксида натрия (2 мл) для гашения реакции, и полученный водный слой промывали эфиром, подкисляли 10M водным раствором соляной кислоты и опять экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и сушили над сульфатом натрия. После фильтрации фильтрат упаривали в вакууме. Далее, к раствору полученного остатка в этаноле (3 мл) добавляли 10% палладий на углероде (30 мг), и полученную смесь перемешивали при комнатной температуре в течение 1 часа в атмосфере водорода. После перемешивания реакционную смесь фильтровали через целит, и фильтрат упаривали в вакууме, что давало указанное в заголовке соединение (0,12 г) с выходом 77% в виде белого кристаллического твердого продукта.
1H ЯМР спектр (400 МГц, CDCl3) δ м.д.: 0,93 (т, 6H, J=6,6 Гц), 1,88-2,00 (м, 1H), 2,58 (д, 2H, J=7,4 Гц), 7,25 (т, 1H, J=7,8 Гц), 7,73 (дд, 1H, J=7,8 Гц, 1,6 Гц), 7,81 (дд, 1H, J=10,2 Гц, 1,6 Гц).
(23f) {5-[5-(3-Фтор-4-изобутилфенил)-1,2,4-оксадиазол-3-ил]пиридин-2-ил}метанол
Сырой продукт указанного в заголовке соединения синтезировали с помощью реакции, подобной той, которая указана в примере 12 (12a), используя 3-фтор-4-изобутилбензойную кислоту (0,12 г, 0,63 ммоль), которая была получена в примере 23 (23e), 1-гидроксибензотриазол (89 мг, 0,66 ммоль), 1-этил-3-(3-диметиламинопропил)карбодиимид гидрохлорид (0,13 г, 0,66 ммоль), 6-({[трет-бутил(диметил)силил]окси}метил)-N'-гидроксипиридин-3-карбоксимидамид (0,17 г, 0,60 ммоль), который был получен в примере 23 (23c), и 1,0 M раствор тетрабутиламмонийфторида в тетрагидрофуране (1,2 мл, 1,2 ммоль). Далее, полученный таким образом сырой продукт указанного в заголовке соединения очищали хроматографией на колонке с силикагелем, используя смешанный растворитель, состоящий из этилацетата и гексана (от 2:3 до 1:1), в качестве элюента, что давало указанное в заголовке соединение (0,16 г) с выходом 80% в виде белого кристаллического твердого продукта.
1H ЯМР спектр (400 МГц, CDCl3) δ м.д.: 0,96 (д, 6H, J=6,6 Гц), 1,62 (ушир.с, 1H), 1,91-2,04 (м, 1H), 2,62 (д, 2H, J=8,2 Гц), 4,87 (с, 2H), 7,36 (т, 1H, J=7,8 Гц), 7,43 (д, 1H, J=8,2 Гц), 7,87 (дд, 1H, J=10,2 Гц, 1,6 Гц), 7,93 (дд, 1H, J=7,8 Гц, 1,6 Гц), 8,44 (дд, 1H, J=8,2 Гц, 2,0 Гц), 9,34 (д, 1H, J=1,6 Гц).
ИК-спектр (KBr): 1030, 1128, 1394, 1500, 1560, 1594, 1612, 3170 см-1.
Масс-спектр (FAB+) m/z: 328 ((M+H)+).
(23g) Метил 1-({5-[5-(3-фтор-4-изобутилфенил)-1,2,4-оксадиазол-3-ил]пиридин-2-ил}метил)азетидин-3-карбоксилат
{5-[5-(3-Фтор-4-изобутилфенил)-1,2,4-оксадиазол-3-ил]пиридин-2-ил}метанол (0,16 г, 0,47 ммоль), который был получен в примере 23 (23f), тетрабромид углерода (0,23 г, 0,71 ммоль), и трифенилфосфин (0,19 г, 0,71 ммоль) растворяли в дихлорметане (6 мл) при 0°C и перемешивали при той же температуре в течение 10 минут. После перемешивания реакционную смесь упаривали в вакууме, и полученный остаток очищали хроматографией на колонке с силикагелем, используя смешанный растворитель, состоящий из этилацетата и гексана (1:6), что давало промежуточный продукт реакции. Далее, к полученному раствору промежуточного продукта реакции в дихлорметане (7 мл) добавляли последовательно гидрохлорид метил 3-азетидинкарбоксилата (0,11 г, 0,71 ммоль) и N,N-диизопропилэтиламин (0,25 мл, 1,4 ммоль) при перемешивании, и полученную смесь перемешивали при комнатной температуре в течение 13 часов. После перемешивания к реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия (2 мл) для гашения реакции, и полученную смесь выливали в воду (20 мл) и экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и сушили над сульфатом натрия. После фильтрации фильтрат упаривали в вакууме, и полученный таким образом сырой продукт указанного в заголовке соединения очищали хроматографией на колонке с силикагелем, используя смешанный растворитель, состоящий из этилацетата и гексана (1:12), в качестве элюента, что давало указанное в заголовке соединение (0,12 г) с выходом 59% в виде белого кристаллического твердого продукта.
1H ЯМР спектр (400 МГц, CDCl3) δ м.д.: 0,96 (д, 6H, J=6,6 Гц), 1,90-2,04 (м, 1H), 2,62 (д, 2H, J=7,0 Гц), 3,35-3,46 (м, 1H), 3,48 (т, 2H, J=7,2 Гц), 3,66 (т, 2H, J=7,4 Гц), 3,73 (с, 3H), 3,87 (с, 2H), 7,35 (т, 1H, J=8,2 Гц), 7,48 (д, 1H, J=7,4 Гц), 7,86 (дд, 1H, J=10,0 Гц, 1,6 Гц), 7,93 (дд, 1H, J=7,8 Гц, 1,6 Гц), 8,39 (дд, 1H, J=8,2 Гц, 2,1 Гц), 9,30 (д, 1H, J=1,2 Гц).
ИК-спектр (KBr): 1218, 1340, 1373, 1398, 1500, 1559, 1729 см-1.
Масс-спектр (FAB+) m/z: 425 ((M+H)+).
(23h) 1-({5-[5-(3-Фтор-4-изобутилфенил)-1,2,4-оксадиазол-3-ил]пиридин-2-ил}метил)азетидин-3-карбоновая кислота
Указанное в заголовке соединение (90 мг) синтезировали с выходом 81% в виде белого кристаллического твердого продукта, используя метил 1-({5-[5-(3-фтор-4-изобутилфенил)-1,2,4-оксадиазол-3-ил]пиридин-2-ил}метил)азетидин-3-карбоксилат (0,12 г, 0,27 ммоль), который был получен в примере 23 (23g), и 1н. водный раствор гидроксида натрия (0,81 мл, 0,81 ммоль), с помощью реакции, подобной той, которая указана в примере 3 (3e).
1H ЯМР спектр (400 МГц, CD3CO2D) δ м.д.: 0,97 (д, 6H, J=6,6 Гц), 1,93-2,05 (м, 1H), 2,65 (д, 2H, J=7,0 Гц), 3,83-3,94 (м, 1H), 4,48-4,57 (м, 2H), 4,60-4,71 (м, 2H), 4,82 (с, 2H), 7,47 (т, 1H, J=7,8 Гц), 7,77 (д, 1H, J=8,2 Гц), 7,92 (д, 1H, J=9,8 Гц), 7,99 (д, 1H, J=7,8 Гц), 8,60 (д, 1H, J=8,2 Гц), 9,34 (с, 1H).
ИК-спектр (KBr): 1129, 1344, 1367, 1399, 1500, 1602, 1627, 2128, 2958 см-1.
Масс-спектр (FAB+) m/z: 411 ((M+H)+).
(Пример 24)
1-({5-[5-(3-Хлор-4-изобутилфенил)-1,2,4-оксадиазол-3-ил]-6-метилпиридин-2-ил}метил)азетидин-3-карбоновая кислота
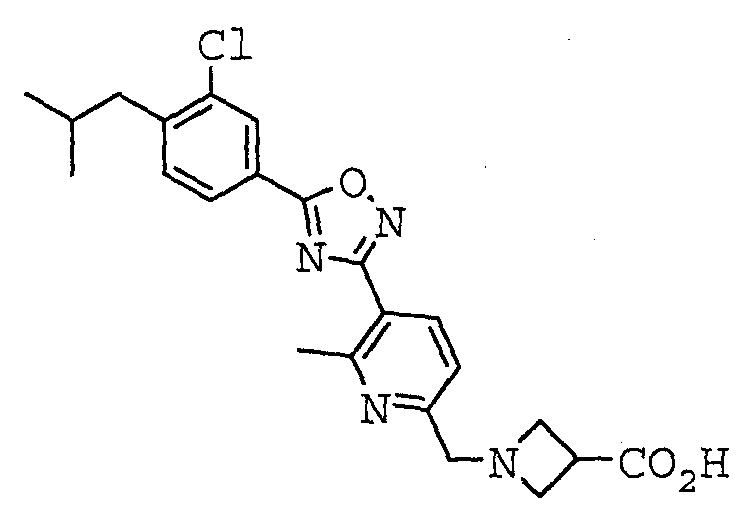
(24a) 2-(Метилтио)-6-{[(триизопропилсилил)окси]метил}никотинонитрил
К раствору 6-формил-2-(метилтио)никотинонитрила (1,0 г, 5,6 ммоль) в метаноле (10 мл) медленно добавляли боргидрид натрия при 0°C при перемешивании, и полученную смесь перемешивали при той же температуре в течение 10 минут. После упаривания растворителя в вакууме, полученный остаток разбавляли этилацетатом, выливали в воду (20 мл) и экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и сушили над сульфатом магния. После фильтрации фильтрат упаривали в вакууме. Далее, к раствору полученного остатка и имидазола (0,76 г, 11 ммоль) в N,N-диметилформамиде (6 мл) добавляли триизопропилсилилхлорид (1,3 мл, 6,2 ммоль) при перемешивании, и полученную смесь перемешивали при комнатной температуре в течение 2 часов. После перемешивания реакционную смесь выливали в воду (20 мл) и экстрагировали эфиром. Экстракт промывали насыщенным водным раствором хлорида натрия и сушили над сульфатом магния. После фильтрации фильтрат упаривали в вакууме, и полученный таким образом сырой продукт указанного в заголовке соединения очищали хроматографией на колонке с силикагелем, используя смешанный растворитель, состоящий из этилацетата и гексана (от 0:10 до 3:97), в качестве элюента, что давало указанное в заголовке соединение (1,7 г) с выходом 91% в виде бесцветного маслянистого продукта.
1H ЯМР спектр (400 МГц, CDCl3) δ м.д.: 1,10 (д, 18H, J=6,6 Гц), 1,18-1,25 (м, 3H), 2,60 (с, 3H), 4,89 (с, 2H), 7,34 (д, 1H, J=7,8 Гц), 7,80 (д, 1H, J=7,8 Гц).
ИК-спектр (KBr): 1372, 1423, 1552, 1573, 2220 см-1.
Масс-спектр (FAB+) m/z: 337 ((M+H)+).
(24b) 2-(Метилсульфонил)-6-{[(триизопропилсилил)окси]метил}никотинонитрил
К раствору 2-(метилтио)-6-{[(триизопропилсилил)окси]метил}никотинонитрила (1,5 г, 4,5 ммоль), который был получен в примере 24 (24a), в этаноле (10 мл) добавляли м-хлорбензойную кислоту (2,3 г, 14 ммоль) при 0°C при перемешивании, и после повышения температуры реакции до комнатной температуры полученную смесь перемешивали в течение 3 часов и затем упаривали в вакууме. Далее, к раствору полученного остатка в эфире (20 мл) добавляли насыщенный водный раствор карбоната калия (10 мл) при перемешивании, и полученную смесь перемешивали в течение 1 часа. После перемешивания реакционную смесь выливали в воду (20 мл) и экстрагировали эфиром. Экстракт промывали насыщенным водным раствором хлорида натрия и сушили над сульфатом магния. После фильтрации фильтрат упаривали в вакууме, и полученный таким образом сырой продукт указанного в заголовке соединения очищали хроматографией на колонке с силикагелем, используя смешанный растворитель, состоящий из этилацетата и гексана (от 2:8 до 3:7), в качестве элюента, что давало указанное в заголовке соединение (1,7 г) с выходом 100% в виде белого кристаллического твердого продукта.
1H ЯМР спектр (400 МГц, CDCl3) δ м.д.: 1,12 (д, 18H, J=6,8 Гц), 1,19-1,28 (м, 3H), 3,36 (с, 3H), 5,02 (с, 2H), 7,99 (д, 1H, J=7,8 Гц), 8,26 (д, 1H, J=7,8 Гц).
ИК-спектр (KBr): 1317, 1384, 1463, 1585, 2237 см-1.
Масс-спектр (FAB+) m/z: 369 ((M+H)+).
(24c) 2-Метил-6-{[(триизопропилсилил)окси]метил}никотинонитрил
К раствору 2-(метилсульфонил)-6-{[(триизопропилсилил)окси]метил}никотинонитрила (0,80 г, 2,2 ммоль), который был получен в примере 24 (24b), в эфире (10 мл) добавляли 3,0 M раствор метилмагний бромида в эфире (1,5 мл, 4,4 ммоль) при -78°C при перемешивании, и полученную смесь перемешивали при той же температуре в течение 1 часа. После перемешивания к реакционной смеси добавляли насыщенный водный раствор хлорида аммония (1 мл) для гашения реакции, и полученную смесь выливали в воду (20 мл) и экстрагировали эфиром. Экстракт промывали насыщенным водным раствором хлорида натрия и сушили над сульфатом магния. После фильтрации фильтрат упаривали в вакууме, и полученный таким образом сырой продукт указанного в заголовке соединения очищали хроматографией на колонке с силикагелем, используя смешанный растворитель, состоящий из этилацетата и гексана (от 0:10 до 1:9), в качестве элюента, что давало указанное в заголовке соединение (0,64 г) с выходом 95% в виде белого кристаллического твердого продукта.
1H ЯМР спектр (400 МГц, CDCl3) δ м.д.: 1,09 (д, 18H, J=6,6 Гц), 1,18-1,26 (м, 3H), 2,74 (с, 3H), 4,92 (с, 2H), 7,55 (д, 1H, J=7,8 Гц), 7,92 (д, 1H, J=7,8 Гц).
ИК-спектр (KBr): 1128, 1410, 1463, 1567, 1590, 2227 см-1.
Масс-спектр (FAB+) m/z: 305 ((M+H)+).
(24d) N'-Гидрокси-2-метил-6-{[(триизопропилсилил)окси]метил}пиридин-3-карбоксидиамид
Сырой продукт указанного в заголовке соединения синтезировали с помощью реакции, подобной той, которая указана в примере 1 (1d), используя 2-метил-6-{[(триизопропилсилил)окси]метил}никотинонитрил (0,63 г, 2,1 ммоль), который был получен в примере 24 (24c), и 40% водный раствор гидроксиламина (0,5 мл). Далее, полученный таким образом сырой продукт указанного в заголовке соединения очищали путем перекристаллизации из смешанного растворителя, состоящего из этилацетата и гексана (1:9), что давало указанное в заголовке соединение (0,61 г) с выходом 86% в виде белого кристаллического твердого продукта.
1H ЯМР спектр (400 МГц, CDCl3) δ м.д.: 1,09 (д, 18H, J=6,8 Гц), 1,15-1,26 (м, 3H), 2,63 (с, 3H), 4,79 (ушир.с, 2H), 4,92 (с, 2H), 7,18 (ушир., 1H), 7,46 (д, 1H, J=7,8 Гц), 7,72 (д, 1H, J=7,8 Гц).
ИК-спектр (KBr): 1124, 1462, 1579, 1597, 1644, 3050, 3337, 3449 см-1.
Масс-спектр (FAB+) m/z: 338 ((M+H)+).
(24e) (4-Бром-2-хлорфенил)метанол
К раствору 4-бром-2-хлорбензойной кислоты (3,1 г, 13,2 ммоль) в тетрагидрофуране (30 мл) добавляли 1,0 М раствор комплекса боран-тетрагидрофуран в тетрагидрофуране (13,8 мл, 13,8 ммоль) при 0°C при перемешивании, и полученную смесь перемешивали при той же температуре в течение 20 минут, и после повышения температуры реакции до комнатной температуры реакционную смесь затем перемешивали в течение 4 часов. После перемешивания к реакционной смеси добавляли воду (10 мл) для гашения реакции, и полученную смесь выливали в насыщенный водный раствор гидрокарбоната натрия (50 мл) и экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и сушили над сульфатом натрия. После фильтрации фильтрат упаривали в вакууме, и полученный таким образом сырой продукт указанного в заголовке соединения очищали хроматографией на колонке с силикагелем, используя смешанный растворитель, состоящий из этилацетата и гексана (от 1:9 до 7:3), в качестве элюента, что давало указанное в заголовке соединение (2,8 г) с выходом 97% в виде белого кристаллического твердого продукта.
1H ЯМР спектр (400 МГц, CDCl3) δ м.д.: 7,51 (д, 1H, J=2,0 Гц), 7,40 (дд, 1H, J=8,2 Гц, 2,0 Гц), 7,36 (д, 1H, J=8,2 Гц), 4,73 (д, 2H, J=6,3 Гц), 1,90 (т, 1H, J=6,3 Гц).
ИК-спектр (KBr): 1036, 1063, 1385, 1469, 1561, 1586, 3239 см-1.
Масс-спектр (EI+) m/z: 220 (M+).
(24f) 4-Бром-2-хлорбензальдегид
К раствору (4-бром-2-хлорфенил)метанола (2,8 г, 12,8 ммоль), который был получен в примере 24 (24e), в дихлорметане (50 мл) добавляли дихромат пиридиния (7,2 г, 19,2 ммоль) при перемешивании, и полученную смесь перемешивали при комнатной температуре в течение 1 часа. После перемешивания к реакционной смеси добавляли эфир (250 мл) при перемешивании, и полученную смесь фильтровали через целит. Фильтрат упаривали в вакууме, и полученный таким образом сырой продукт указанного в заголовке соединения очищали хроматографией на колонке с силикагелем, используя смешанный растворитель, состоящий из этилацетата и гексана (1:20), в качестве элюента, что давало указанное в заголовке соединение (2,0 г, выход: 70%) в виде белого кристаллического твердого продукта.
1H ЯМР спектр (400 МГц, CDCl3) δ м.д.: 7,55 (дд, 1H, J=8,2 Гц, 1,6 Гц), 7,66 (д, 1H, J=1,6 Гц), 7,79 (д, 1H, J=8,2 Гц), 10,42 (с, 1H).
ИК-спектр (KBr): 1201, 1374, 1577, 1693 см-1.
Масс-спектр (EI+) m/z: 218 (M+).
(24g) 4-Бром-2-хлор-1-(2-метилпроп-1-ен-1-ил)бензол
Сырой продукт указанного в заголовке соединения синтезировали с помощью реакции, подобной той, что указана в примере 23 (23d), используя йодид изопропилтрифенилфосфония (5,4 г, 12,6 ммоль), трет-бутоксид калия (1,5 г, 13,5 ммоль) и 4-бром-2-хлорбензальдегид (2,0 г, 9,0 ммоль), который был получен в примере 24 (24f). Далее, полученный таким образом сырой продукт указанного в заголовке соединения очищали хроматографией на колонке с силикагелем, используя смешанный растворитель, состоящий из этилацетата и гексана (от 0:10 до 6:94), в качестве элюента, что давало указанное в заголовке соединение (2,1 г) с выходом 94% в виде бесцветного маслянистого продукта.
1H ЯМР спектр (400 МГц, CDCl3) δ м.д.: 1,74 (с, 3H), 1,93 (с, 3H), 6,20 (с, 1H), 7,10 (д, 2H, J=8,2 Гц), 7,33 (дд, 1H, J=8,2 Гц, 2,0 Гц), 7,53 (д, 1H, J=2,0 Гц).
ИК-спектр (тонкая пленка): 1045, 1083, 1373, 1468, 1579 см-1.
Масс-спектр (EI+) m/z: 244 (M+).
(24h) 3-Хлор-4-изобутилбензойную кислоту
Указанное в заголовке соединение (1,5 г) синтезировали с выходом 99% в виде белого кристаллического твердого продукта с помощью реакции, подобной той, которая указана в примере 23 (23e), используя 4-бром-2-хлор-1-(2-метилпроп-1-ен-1-ил)бензол (2,1 г, 8,5 ммоль), который был получен в примере 24 (24g), 1,6 M раствор н-бутиллития в гексане (5,6 мл), и 5% платину на углероде (200 мг).
1H ЯМР спектр (400 МГц, CDCl3) δ м.д.: 0,95 (д, 6H, J=6,6 Гц), 1,96-2,08 (м, 1H), 2,68 (д, 2H, J=7,4 Гц), 7,28 (д, 1H, J=7,8 Гц), 7,90 (д, 1H, J=7,0 Гц), 8,08 (с, 1H).
Масс-спектр (FAB+) m/z: 212(M+).
(24i) {5-[5-(3-Хлор-4-изобутилфенил)-1,2,4-оксадиазол-3-ил]-6-метилпиридин-2-ил}метанол
Сырой продукт указанного в заголовке соединения синтезировали с помощью реакции, подобной той, что указана в примере 12 (12a), используя 3-хлор-4-изобутилбензойную кислоту (0,11 г, 0,50 ммоль), которая была получена в примере 24 (24h), 1-гидроксибензотриазол (72 мг, 0,53 ммоль), 1-этил-3-(3-диметиламинопропил)карбодиимид гидрохлорид (0,10 г, 0,53 ммоль), N'-гидрокси-2-метил-6-{[(триизопропилсилил)окси]метил}пиридин-3-карбоксимидамид (0,16 г, 0,48 ммоль), который был получен в примере 24 (24d), и 1,0 М раствор фторида тетрабутиламмония в тетрагидрофуране (0,96 мл, 0,96 ммоль). Далее, полученный таким образом сырой продукт указанного в заголовке соединения очищали хроматографией на колонке с силикагелем, используя смешанный растворитель, состоящий из этилацетата и гексана (1:1), в качестве элюента, что давало указанное в заголовке соединение (0,15 г) с выходом 89% в виде белого твердого кристаллического продукта.
1H ЯМР спектр (400 МГц, CDCl3) δ м.д.: 0,97 (д, 6H, J=6,8 Гц), 2,00-2,09 (м, 1H), 2,71 (д, 2H, J=7,3 Гц), 2,95 (с, 3H), 3,87 (т, 1H, J=4,9 Гц), 4,81 (д, 2H, J=4,9 Гц), 7,24 (д, 1H, J=7,8 Гц), 7,38 (д, 1H, J=7,8 Гц), 8,01 (дд, 1H, J=7,8 Гц, 1,5 Гц), 8,21 (д, 1H, J=1,5 Гц), 8,39 (д, 1H, J=7,8 Гц).
ИК-спектр (KBr): 1332, 1407, 1454, 1591, 3238 см-1.
Масс-спектр (FAB+) m/z: 358 ((M+H)+).
(24j) Метил 1-({5-[5-(3-хлор-4-изобутилфенил)-1,2,4-оксадиазол-3-ил]-6-метилпиридин-2-ил}метил)азетидин-3-карбоксилат
Сырой продукт указанного в заголовке соединения синтезировали с помощью реакции, подобной той, что указана в примере 23 (23g), используя {5-[5-(3-хлор-4-изобутилфенил)-1,2,4-оксадиазол-3-ил]-6-метилпиридин-2-ил}метанол (0,15 г, 0,42 ммоль), который был получен в примере 24 (24i), тетрабромид углерода (0,22 г, 0,67 ммоль), трифенилфосфин (0,18 г, 0,67 ммоль), гидрохлорид метил 3-азетидинкарбоксилата (96 мг, 0,63 ммоль), и N,N-диизопропилэтиламин (0,22 мл, 1,3 ммоль). Далее, полученный таким образом сырой продукт указанного в заголовке соединения очищали хроматографией на колонке с силикагелем, используя смешанный растворитель, состоящий из этилацетата и гексана (от 1:1 до 2:1 или 3:1), в качестве элюента, что давало указанное в заголовке соединение (0,11 г) с выходом 58% в виде бледно желтоватого маслянистого продукта.
1H ЯМР спектр (400 МГц, CDCl3) δ м.д.: 0,97 (д, 6H, J=6,6 Гц), 1,98-2,10 (м, 1H), 2,70 (д, 2H, J=7,4 Гц), 2,91 (с, 3H), 3,34-3,45 (м, 1H),3,47 (т,2H, J=7,2 Гц), 3,66 (т, 2H, J=7,6 Гц), 3,73 (с, 3H), 3,83 (с, 2H), 7,32 (д, 1H, J=7,8 Гц), 7,37 (д, 1H, J=7,8 Гц), 8,01 (дд, 1H, J=7,8 Гц, 1,9 Гц), 8,21 (д, 1H, J=1,6 Гц), 8,34 (д, 1H, J=7,8 Гц).
ИК-спектр (KBr): 1203, 1332, 1405, 1438, 1450, 1589, 1735, 2957 см-1.
Масс-спектр (FAB+) m/z: 455 ((M+H)+).
(24k) 1-({5-[5-(3-Хлор-4-изобутилфенил)-1,2,4-оксадиазол-3-ил]-6-метилпиридин-2-ил}метил)азетидин-3-карбоновая кислота
Указанное в заголовке соединение (76 мг) синтезировали с выходом 72% в виде белого кристаллического твердого продукта с помощью реакции, подобной той, которая указана в примере 3 (3e), используя метил 1-({5-[5-(3-хлор-4-изобутилфенил)-1,2,4-оксадиазол-3-ил]-6-метилпиридин-2-ил}метил)азетидин-3-карбоксилат (0,11 г, 0,24 ммоль), который был получен в примере 24 (24j), и 1н. водный раствор гидроксида натрия (0,72 мл, 0,72 ммоль).
1H ЯМР спектр (400 МГц, CD3CO2D) δ м.д.: 0,98 (д, 6H, J=6,6 Гц), 2,00-2,09 (м, 1H), 2,75 (д, 2H, J=7,0 Гц), 2,93 (с, 3H), 3,83-3,94 (м,1H), 4,46-4,58 (м, 2H), 4,61-4,71 (м, 2H), 4,77 (с, 2H), 7,49 (д, 1H, J=7,8 Гц), 7,55 (д, 1H, J=7,8 Гц), 8,08 (д, 1H, J=6,6 Гц), 8,23 (с, 1H), 8,53 (д, 1H, J=7,8 Гц).
ИК-спектр (KBr): 1335, 1385, 1568, 1589, 1611, 3412, 3480 см-1.
Масс-спектр (FAB+) m/z: 441 ((M+H)+).
(Пример 25)
1-({5-[5-(3-Хлор-4-изобутилфенил)-1,2,4-оксадиазол-3-ил]-6-этилпиридин-2-ил}метил)азетидин-3-карбоновая кислота
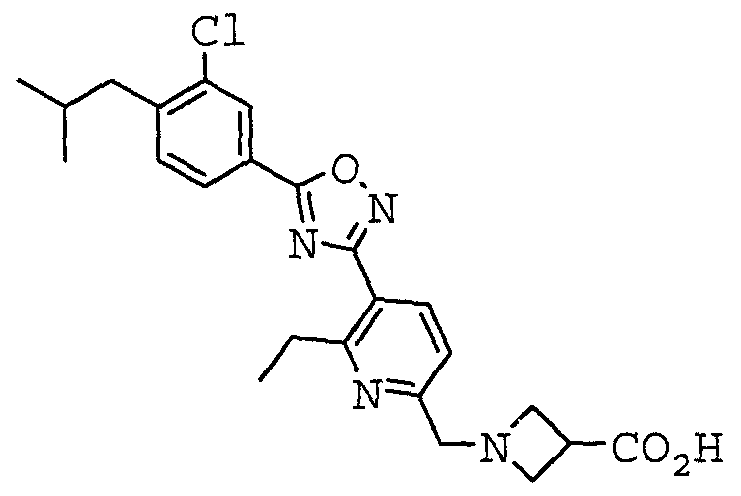
(25a) 2-Этил-6-{[(триизопропилсилил)окси]метил}никотинонитрил
Сырой продукт указанного в заголовке соединения синтезировали с помощью реакции, подобной той, что указана в примере 24 (24c), используя 2-(метилсульфонил)-6-{[(триизопропилсилил)окси]метил}никотинонитрил (0,78 г, 2,1 ммоль), который был получен в примере 24 (24b), и 3,0 M раствор этилмагний бромида в эфире (1,4 мл, 4,2 ммоль). Далее, полученный таким образом сырой продукт указанного в заголовке соединения очищали хроматографией на колонке с силикагелем, используя смешанный растворитель, состоящий из этилацетата и гексана (от 0:10 до 1:9), в качестве элюента, что давало указанное в заголовке соединение (0,65 г) с выходом 97% в виде белого кристаллического твердого продукта.
1H ЯМР спектр (400 МГц, CDCl3) δ м.д.: 1,09 (д, 18H, J=6,8 Гц), 1,16-1,25 (м, 3H), 1,34 (т, 3H, J=7,4 Гц), 3,02 (кв, 2H, J=7,4 Гц), 4,94 (с, 2H), 7,55 (д, 1H, J=7,8 Гц), 7,92 (д, 1H, J=7,8 Гц).
ИК-спектр (KBr): 1125, 1409, 1464, 1564, 1587, 2227 см-1.
Масс-спектр (FAB+) m/z: 319 ((M+H)+).
(25b) 2-Этил-N'-гидрокси-6-{[(триизопропилсилил)окси]метил}пиридин-3-карбоксимидамид
Сырой продукт указанного в заголовке соединения синтезировали с помощью реакции, подобной той, которая указана в примере 1 (1d), используя 2-этил-6-{[(триизопропилсилил)окси]метил}никотинонитрил (0,75 г, 2,4 ммоль), который был получен в примере 25 (25a), и 40% водный раствор гидроксиламина (0,5 мл). Далее, полученный таким образом сырой продукт указанного в заголовке соединения очищали хроматографией на колонке с силикагелем, используя смешанный растворитель, состоящий из этилацетата и гексана (от 3:7 до 1:1), в качестве элюента, что давало указанное в заголовке соединение (0,80 г) с выходом 95% в виде белого кристаллического твердого продукта.
1H ЯМР спектр (400 МГц, CDCl3) δ м.д.: 1,10 (д, 18H, J=6,8 Гц), 1,16-1,24 (м, 3H), 1,28 (т, 3H, J=7,4 Гц), 2,93 (кв, 2H, J=7,4 Гц), 4,80 (ушир.с, 2H), 4,93 (с, 2H), 7,45 (д, 1H, J=7,8 Гц), 7,69 (д, 1H, J=7,8 Гц), 8,08 (ушир., 1H).
ИК-спектр (KBr): 1120, 1385, 1404, 1462, 1573, 1596, 1637, 3161, 3282, 3362 см-1.
Масс-спектр (FAB+) m/z: 352 ((M+H)+).
(25c) {5-[5-(3-Хлор-4-изобутилфенил)-1,2,4-оксадиазол-3-ил]-6-этилпиридин-2-ил}метанол
Сырой продукт указанного в заголовке соединения синтезировали с помощью реакции, подобной той, что указана в примере 12 (12a), используя 3-хлор-4-изобутилбензойную кислоту (0,10 г, 0,48 ммоль), который был получен в примере 24 (24h), 1-гидроксибензотриазол (69 мг, 0,51 ммоль), 1-этил-3-(3-диметиламинопропил)карбодиимид гидрохлорид (97 мг, 0,51 ммоль), 2-этил-N'-гидрокси-6-{[(триизопропилсилил)окси]метил}пиридин-3-карбоксимидамид (0,16 г, 0,46 ммоль), который был получен в примере 25 (25b), и 1,0 М раствор фторида тетрабутиламмония в тетрагидрофуране (0,92 мл, 0,92 ммоль). Далее, полученный таким образом сырой продукт указанного в заголовке соединения очищали хроматографией на колонке с силикагелем, используя смешанный растворитель, состоящий из этилацетата и гексана (1:2), в качестве элюента, что давало указанное в заголовке соединение (0,15 г) с выходом 89% в виде белого кристаллического твердого продукта.
1H ЯМР спектр (400 МГц, CDCl3) δ м.д.: 0,97 (д, 6H, J=6,8 Гц), 1,38 (т, 3H, J=7,3 Гц), 2,00-2,10 (м, 1H), 2,71 (д, 2H, J=7,3 Гц), 3,29 (кв, 2H, J=7,3 Гц), 4,09 (т, 1H, J=4,7 Гц), 4,82 (д, 2H, J=4,7 Гц), 7,21 (д, 1H, J=8,3 Гц), 7,38 (д, 1H, J=7,8 Гц), 8,01 (дд, 1H, J=7,8 Гц, 1,5 Гц), 8,21 (д, 1H, J=1,5 Гц), 8,34 (д, 1H, J=8,3 Гц).
ИК-спектр (KBr): 1324, 1442, 1451, 1567, 1587, 3286, 3366 см-1.
Масс-спектр (FAB+) m/z: 372 ((M+H)+).
(25d) Метил 1-({5-[5-(3-хлор-4-изобутилфенил)-1,2,4-оксадиазол-3-ил]-6-этилпиридин-2-ил}метил)азетидин-3-карбоксилат
Сырой продукт указанного в заголовке соединения синтезировали с помощью реакции, подобной той, что указана в примере 23 (23g), используя {5-[5-(3-хлор-4-изобутилфенил)-1,2,4-оксадиазол-3-ил]-6-этилпиридин-2-ил}метанол (0,15 г, 0,40 ммоль), который был получен в примере 25 (25c), тетрабромид углерода (0,27 г, 0,80 ммоль), трифенилфосфин (0,21 г, 0,80 ммоль), гидрохлорид метил 3-азетидинкарбоксилата (91 мг, 0,60 ммоль) и N,N-диизопропилэтиламин (0,21 мл, 1,2 ммоль). Далее, полученный таким образом сырой продукт указанного в заголовке соединения очищали хроматографией на колонке с силикагелем, используя смешанный растворитель, состоящий из этилацетата и гексана (от 1:1 до 2:1 или 3:1), в качестве элюента, что давало указанное в заголовке соединение (0,16 г) с выходом 83% в виде бледно желтоватого маслянистого продукта.
1H ЯМР спектр (400 МГц, CDCl3) δ м.д. 0,97 (д, 6H, J=6,6 Гц), 1,26 (т, 3H, J=7,4 Гц), 1,99-2,10 (м, 1H), 2,71 (д, 2H, J=7,0 Гц), 3,24 (кв, 2H, J=7,4 Гц), 3,35-3,46 (м, 1H), 3,49 (т, 2H, J=7,2 Гц), 3,67 (т, 2H, J=7,8 Гц), 3,73 (с, 3H), 3,84 (с, 2H), 7,30 (д, 1H, J=7,8 Гц), 7,37 (д, 1H, J=8,2 Гц), 8,00 (дд, 1H, J=8,2 Гц, 1,6 Гц), 8,20 (д, 1H, J=1,6 Гц), 8,28 (д, 1H, J=7,8 Гц).
ИК-спектр (KBr): 1179, 1203, 1405, 1449, 1589, 1740 см-1.
Масс-спектр (FAB+) m/z: 469 ((M+H)+).
(25e) 1-({5-[5-(3-Хлор-4-изобутилфенил)-1,2,4-оксадиазол-3-ил]-6-этилпиридин-2-ил}метил)азетидин-3-карбоновая кислота
Указанное в заголовке соединение (0,10 г) синтезировали с выходом 71% в виде белого кристаллического твердого продукта с помощью реакции, подобной той, которая указана в примере 3 (3e), используя метил 1-({5-[5-(3-хлор-4-изобутилфенил)-1,2,4-оксадиазол-3-ил]-6-этилпиридин-2-ил}метил)азетидин-3-карбоксилат (0,15 г, 0,32 ммоль), который был получен в примере 25 (25d), и 1н. водный раствор гидроксида натрия (0,96 мл, 0,96 ммоль).
1H ЯМР спектр (400 МГц, CD3CO2D) δ м.д. 0,98 (д, 6H, J=6,3 Гц), 1,37 (т, 3H, J=7,2 Гц), 1,95-2,09 (м, 1H), 2,74 (д, 2H, J=7,0 Гц), 3,29 (кв, 2H, J=7,2 Гц), 3,87-3,97 (м, 1H), 4,47-4,60 (м, 2H), 4,67-4,78 (м, 2H), 4,79 (с, 2H), 7,49 (д, 1H, J=7,8 Гц), 7,51 (д, 1H, J=7,4), 8,08 (д, 1H, J=7,4 Гц), 8,23 (с, 1H), 8,47 (д, 1H, J=7,8 Гц).
ИК-спектр (KBr): 1337, 1389, 1397, 1589, 1611, 3432 см-1.
Масс-спектр (FAB+) m/z: 455 ((M+H)+).
(Пример 26)
1-({5-[5-(3-Хлор-4-изобутилфенил)-1,2,4-оксадиазол-3-ил]пиридин-2-ил}метил)азетидин-3-карбоновая кислота
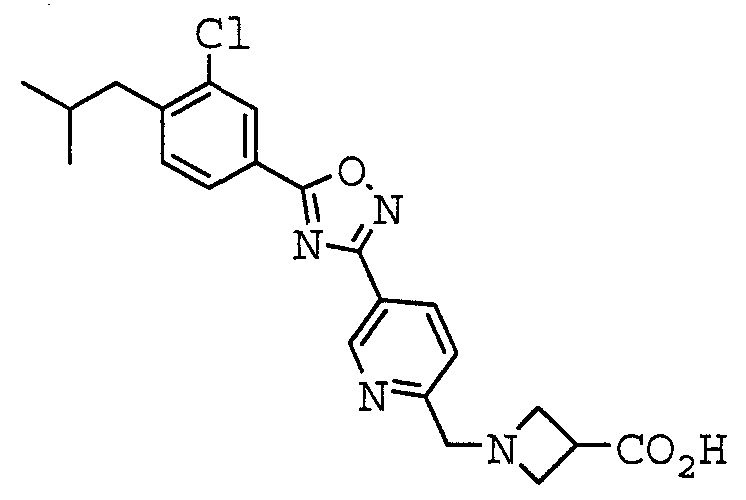
(26a) {5-[5-(3-Хлор-4-изобутилфенил)-1,2,4-оксадиазол-3-ил]пиридин-2-ил}метанол
Сырой продукт указанного в заголовке соединения синтезировали с помощью реакции, подобной той, что указана в примере 12 (12a), используя 3-хлор-4-изобутилбензойную кислоту (0,13 г, 0,61 ммоль), которая была получена в примере 24 (24h), 1-гидроксибензотриазол (86 мг, 0,64 ммоль), 1-этил-3-(3-диметиламинопропил)карбодиимид гидрохлорид (0,12 г, 0,64 ммоль), 6-({[трет-бутил(диметил)силил]окси}метил)-N'-гидроксипиридин-3-карбоксимидамид (0,16 г, 0,58 ммоль), который был получен в примере 23 (23c), и 1,0 М раствор фторида тетрабутиламмония в тетрагидрофуране (1,2 мл, 1,2 ммоль). Далее, полученный таким образом сырой продукт указанного в заголовке соединения очищали хроматографией на колонке с силикагелем, используя смешанный растворитель, состоящий из этилацетата и гексана (от 2:3 до 1:1), в качестве элюента, что давало указанное в заголовке соединение (0,19 г) с выходом 94% в виде белого кристаллического твердого продукта.
1H ЯМР спектр (400 МГц, CDCl3) δ м.д.: 0,98 (д, 6H, J=6,6 Гц), 1,99-2,10 (м, 1H), 2,71 (д, 2H, J=7,4 Гц), 3,62 (ушир.с, 1H), 4,87 (с, 2H), 7,39 (д, 1H, J=7,8 Гц), 7,44 (д, 1H, J=8,2 Гц), 8,03 (дд, 1H, J=7,8 Гц, 1,6 Гц), 8,23 (д, 1H, J=1,6 Гц), 8,44 (дд, 1H, J=8,2 Гц, 2,2 Гц), 9,34 (д, 1H, J=1,2 Гц).
ИК-спектр (KBr): 1336, 1393, 1411, 1488, 1607, 3213, 3353, 3436 см-1.
Масс-спектр (FAB+) m/z: 344 ((M+H)+).
(26b) Метил 1-({5-[5-(3-хлор-4-изобутилфенил)-1,2,4-оксадиазол-3-ил]пиридин-2-ил}метил)азетидин-3-карбоксилат
Сырой продукт указанного в заголовке соединения синтезировали с помощью реакции, подобной той, которая указана в примере 23 (23g), используя {5-[5-(3-хлор-4-изобутилфенил)-1,2,4-оксадиазол-3-ил]пиридин-2-ил}метанол (0,18 г, 0,54 ммоль), который был получен в примере 26 (26a), тетрабромид углерода (0,36 г, 1,1 ммоль), трифенилфосфин (0,28 г, 1,1 ммоль), гидрохлорид метил 3-азетидинкарбоксилата (0,12 г, 0,81 ммоль) и N,N-диизопропилэтиламин (0,28 мл, 1,6 ммоль). Далее, полученный таким образом сырой продукт указанного в заголовке соединения очищали хроматографией на колонке с силикагелем, используя смешанный растворитель, состоящий из этилацетата и гексана (от 2:1 до 3:1), в качестве элюента, что давало указанное в заголовке соединение (0,15 г) с выходом 61% в виде белого кристаллического твердого продукта.
1H ЯМР спектр (400 МГц, CDCl3) δ м.д.: 0,97 (д, 6H, J=6,7 Гц), 1,98-2,08 (м, 1H), 2,70 (д, 2H, J=7,0 Гц), 3,33-3,46 (м, 1H), 3,47 (т, 2H, J=7,0 Гц), 3,65 (т, 2H, J=7,6), 3,72 (с, 3H), 3,86 (с, 2H), 7,35 (д, 1H, J=7,8 Гц), 7,46 (д, 1H, J=8,2 Гц), 7,99 (дд, 1H, J=7,8 Гц, 1,6 Гц), 8,19 (д, 1H, J=1,6 Гц), 8,36 (дд, 1H, J=8,2 Гц, 2,0 Гц), 9,28 (д, 1H, J=2,0 Гц).
ИК-спектр (KBr): 1207, 1339, 1352, 1389, 1486, 1605, 1738 см-1.
Масс-спектр (FAB+) m/z: 441 ((M+H)+).
(26c) 1-({5-[5-(3-Хлор-4-изобутилфенил)-1,2,4-оксадиазол-3-ил]пиридин-2-ил}метил)азетидин-3-карбоновая кислота
Указанное в заголовке соединение (0,12 г) синтезировали с выходом 90% в виде белого кристаллического твердого продукта с помощью реакции, подобной той, которая указана в примере 3 (3e), используя метил 1-({5-[5-(3-хлор-4-изобутилфенил)-1,2,4-оксадиазол-3-ил]пиридин-2-ил}метил)азетидин-3-карбоксилат (0,14 г, 0,32 ммоль), который был получен в примере 26 (26b), и 1н. водный раствор гидроксида натрия (0,96 мл, 0,96 ммоль).
1H ЯМР спектр (400 МГц, CD3CO2D) δ м.д.: 0,98 (д, 6H, J=6,6 Гц), 1,94-2,07 (м, 1H), 2,75 (д, 2H, J=7,0 Гц), 3,83-3,94 (м, 1H), 4,49-4,60 (м, 2H), 4,60-4,70 (м, 2H), 4,83 (с, 2H), 7,50 (д, 1H, J=7,8 Гц), 7,78 (д, 1H, J=7,4 Гц), 8,09 (д, 1H, J=7,8 Гц), 8,25 (с, 1H), 8,60 (д, 1H, J=7,4 Гц), 9,35 (с, 1H).
ИК-спектр (KBr): 1368, 1403, 1569, 1587, 1605, 3431 см-1.
Масс-спектр (FAB+) m/z: 427 ((M+H)+).
(Пример 27)
1-({5-[5-(4-Изобутил-3-метилфенил)-1,2,4-оксадиазол-3-ил]-6-метилпиридин-2-ил}метил)азетидин-3-карбоновая кислота, 1/2 оксалат
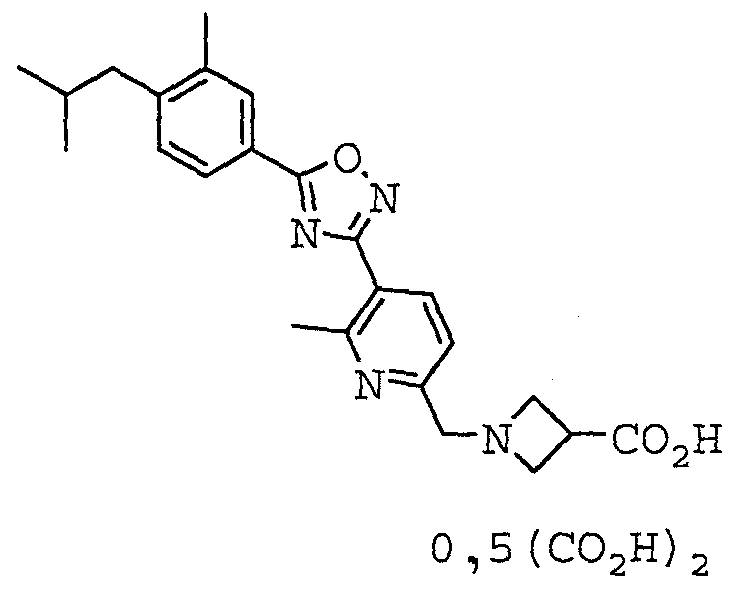
(27a) (4-Бром-2-метилфенил)метанол
Сырой продукт указанного в заголовке соединения синтезировали с помощью реакции, подобной той, что указана в примере 24 (24e), используя 4-бром-2-метилбензойную кислоту (4,0 г, 19 ммоль) и 1,0 М раствор комплекса боран-тетрагидрофуран в тетрагидрофуране (20 мл, 20 ммоль). Далее, полученный таким образом сырой продукт указанного в заголовке соединения очищали хроматографией на колонке с силикагелем, используя смешанный растворитель, состоящий из этилацетата и гексана (от 1:19 до 3:2), в качестве элюента, что давало указанное в заголовке соединение (3,7 г) с выходом 99% в виде бесцветного маслянистого продукта.
1H ЯМР спектр (400 МГц, CDCl3) δ м.д.: 1,60 (т, 1H, J=5,5 Гц), 2,32 (с, 3H), 4,65 (д, 2H, J=5,5 Гц), 7,23 (д, 1H, J=8,6 Гц), 7,32-7,36 (м, 2H).
ИК-спектр (тонкая пленка): 1006, 1040, 1396, 1454, 1483, 1594, 3328 см-1.
Масс-спектр (EI+) m/z: 200 (M+).
(27b) 4-Бром-2-метилбензальдегид
Сырой продукт указанного в заголовке соединения синтезировали с помощью реакции, подобной той, которая указана в примере 24 (24f), используя (4-бром-2-метилфенил)метанол (3,7 г, 19 ммоль), который был получен в примере 27 (27a), и дихромат пиридиния (11 г, 28 ммоль). Далее, полученный таким образом сырой продукт указанного в заголовке соединения очищали хроматографией на колонке с силикагелем, используя смешанный растворитель, состоящий из этилацетата и гексана (от 1:19 до 1:4), в качестве элюента, что давало указанное в заголовке соединение (2,4 г) с выходом 64% в виде бесцветного маслянистого продукта.
1H ЯМР спектр (400 МГц, CDCl3) δ м.д.: 2,65 (с, 3H), 7,45 (с, 1H), 7,51 (дд, 1H, J=8,2 Гц, 1,6 Гц), 7,66 (д, 1H, J=8,2 Гц), 10,25 (с, 1H).
ИК-спектр (KBr): 1288, 1301, 1588, 1686 см-1.
Масс-спектр (EI+) m/z: 198 (M+).
(27c) 4-Бром-2-метил-1-(2-метилпроп-1-ен-1-ил)бензол
Сырой продукт указанного в заголовке соединения синтезировали с помощью реакции, подобной той, что указана в примере 23 (23d), используя йодид изопропилтрифенилфосфония (7,2 г, 17 ммоль), трет-бутоксид калия (2,0 г, 18 ммоль) и 4-бром-2-метилбензальдегид (2,4 г, 12 ммоль), который был получен в примере 27 (27b). Далее, полученный таким образом сырой продукт указанного в заголовке соединения очищали хроматографией на колонке с силикагелем, используя смешанный растворитель, состоящий из этилацетата и гексана (от 0:10 до 6:94), в качестве элюента, что давало указанное в заголовке соединение (2,2 г) с выходом 84% в виде бесцветного маслянистого продукта.
1H ЯМР спектр (400 МГц, CDCl3) δ м.д.: 1,67 (д, 3H, J=1,2 Гц), 1,89 (д, 3H, J=1,6 Гц), 2,19 (с, 3H), 6,09 (с, 1H), 6,95 (д, 1H, J=8,2 Гц), 7,23 (дд, 1H, J=8,2 Гц, 2,0 Гц), 7,28 (д, 1H, J=2,0 Гц).
ИК-спектр (тонкая пленка): 1444, 1478, 1587 см-1.
Масс-спектр (EI+) m/z: 224 (M+).
(27d) 4-Изобутил-3-метилбензойная кислота
Указанное в заголовке соединение (1,4 г) синтезировали с выходом 95% в виде белого кристаллического твердого продукта с помощью реакции, подобной той, которая указана в примере 23 (23e), используя 4-бром-2-метил-1-(2-метилпроп-1-ен-1-ил)бензол (2,2 г, 9,8 ммоль), который был получен в примере 27 (27c), 1,6 M раствор н-бутиллития в гексане (6,5 мл, 10 ммоль) и 10% палладий на углероде (200 мг).
1H ЯМР спектр (400 МГц, CDCl3) δ м.д.: 0,94 (д, 6H, J=6,3 Гц), 1,84-1,96 (м, 1H), 2,36 (с, 3H), 2,54 (д, 2H, J=7,0 Гц), 7,19 (д, 1H, J=7,8 Гц), 7,84 (д, 1H, J=7,8 Гц), 7,88 (с, 1H).
(27e) {5-[5-(4-Изобутил-3-метилфенил)-1,2,4-оксадиазол-3-ил]-6-метилпиридин-2-ил}метанол
Сырой продукт указанного в заголовке соединения синтезировали с помощью реакции, подобной той, что указана в примере 12 (12a), используя 4-изобутил-3-метилбензойную кислоту (96 мг, 0,50 ммоль), которая была получена в примере 27 (27d), 1-гидроксибензотриазол (72 мг, 0,53 ммоль), 1-этил-3-(3-диметиламинопропил)карбодиимид гидрохлорид (0,10 г, 0,53 ммоль), N'-гидрокси-2-метил-6-{[(триизопропилсилил)окси]метил}пиридин-3-карбоксимидамид (0,16 г, 0,48 ммоль), который был получен в примере 24 (24d), и 1,0 М раствор фторида тетрабутиламмония в тетрагидрофуране (0,96 мл, 0,96 ммоль). Далее, полученный таким образом сырой продукт указанного в заголовке соединения очищали хроматографией на колонке с силикагелем, используя смешанный растворитель, состоящий из этилацетата и гексана (1:2), в качестве элюента, что давало указанное в заголовке соединение (0,15 г) с выходом 91% в виде белого кристаллического твердого продукта.
1H ЯМР спектр (400 МГц, CDCl3) δ м.д.: 0,96 (д, 6H, J=6,6 Гц), 1,87-1,98 (м, 1H), 2,42 (с, 3H), 2,57 (д, 2H, J=7,0 Гц), 2,95 (с, 3H), 3,92 (ушир.с, 1H), 4,81 (с, 2H), 7,24 (д, 1H, J=8,2 Гц), 7,28 (д, 1H, J=8,2 Гц), 7,95 (дд, 1H, J=7,8 Гц, 1,6 Гц), 7,99 (с, 1H), 8,39 (д, 1H, J=8,2 Гц).
ИК-спектр (KBr): 1334, 1445, 1460, 1557, 3204, 3445 см-1.
Масс-спектр (FAB+) m/z: 338 ((M+H)+).
(27f) Метил 1-({5-[5-(4-изобутил-3-метилфенил)-1,2,4-оксадиазол-3-ил]-6-метилпиридин-2-ил}метил)азетидин-3-карбоксилат
Сырой продукт указанного в заголовке соединения синтезировали с помощью реакции, подобной той, что указана в примере 23 (23g), используя {5-[5-(4-изобутил-3-метилфенил)-1,2,4-оксадиазол-3-ил]-6-метилпиридин-2-ил}метанол (0,14 г, 0,43 ммоль), который был получен в примере 27 (27e), тетрабромид углерода (0,29 г, 0,86 ммоль), трифенилфосфин (0,23 г, 0,86 ммоль), гидрохлорид метил 3-азетидинкарбоксилата (98 мг, 0,65 ммоль) и N,N-диизопропилэтиламин (0,22 мл, 1,3 ммоль). Далее, полученный таким образом сырой продукт указанного в заголовке соединения очищали хроматографией на колонке с силикагелем, используя смешанный растворитель, состоящий из этилацетата и гексана (от 2:1 до 3:1), в качестве элюента, что давало указанное в заголовке соединение (0,12 г) с выходом 66% в виде бесцветного маслянистого продукта.
1H ЯМР спектр (400 МГц, CDCl3) δ м.д.: 0,96 (д, 6H, J=6,6 Гц), 1,88-1,97 (м, 1H), 2,41 (с, 3H), 2,57 (д, 2H, J=7,4 Гц), 2,91 (с, 3H), 3,36-3,44 (м, 1H), 3,47 (т, 2H, J=7,4 Гц), 3,65 (т, 2H, J=7,2 Гц), 3,73 (с, 3H), 3,83 (с, 2H), 7,27 (д, 1H, J=7,8 Гц), 7,31 (д, 1H, J=7,8 Гц), 7,95 (дд, 1H, J=7,8 Гц, 1,8 Гц), 7,99 (с, 1H), 8,33 (д, 1H, J=8,2 Гц).
ИК-спектр (жидкая пленка): 1176, 1202, 1336, 1561, 1592, 1739 см-1.
Масс-спектр (FAB+) m/z: 435 ((M+H)+).
(27g) 1-({5-[5-(4-Изобутил-3-метилфенил)-1,2,4-оксадиазол-3-ил]-6-метилпиридин-2-ил}метил)азетидин-3-карбоновая кислота, 1/2 оксалат
Указанное в заголовке соединение (0,10 г) синтезировали с выходом 78% в виде белого кристаллического твердого продукта с помощью реакции, подобной той, что указана в примере 21 (21d), используя метил 1-({5-[5-(4-изобутил-3-метилфенил)-1,2,4-оксадиазол-3-ил]-6-метилпиридин-2-ил}метил)азетидин-3-карбоксилат (0,12 г, 0,28 ммоль), который был получен в примере 27 (27f), 1н. водный раствор гидроксида натрия (0,84 мл, 0,84 ммоль), уксусную кислоту (48 мкл, 0,84 ммоль) и щавелевую кислоту (13 мг, 0,14 ммоль).
1H ЯМР спектр (400 МГц, CD3CO2D) δ м.д.: 0,97 (д, 6H, J=6,6 Гц), 1,88-1,99 (м, 1H), 2,43 (с, 3H), 2,61 (д, 2H, J=7,4 Гц), 2,93 (с, 3H), 3,84-3,96 (м, 1H), 4,46-4,56 (м, 2H), 4,62-4,74 (м, 2H), 4,77 (с, 2H), 7,35 (д, 1H, J=8,2 Гц), 7,55 (д, 1H, J=8,2 Гц), 7,99 (д, 1H, J=7,4 Гц), 8,03 (с, 1H), 8,53 (д, 1H, J=8,2 Гц).
ИК-спектр (KBr): 1337, 1382, 1565, 1588, 1618, 3410 см-1.
Масс-спектр (FAB+) m/z: 421 ((M+H)+).
(Пример 28)
1-({5-[5-(4-Изобутил-3-метилфенил)-1,2,4-оксадиазол-3-ил]пиридин-2-ил}метил)азетидин-3-карбоновая кислота, 1/2 оксалат
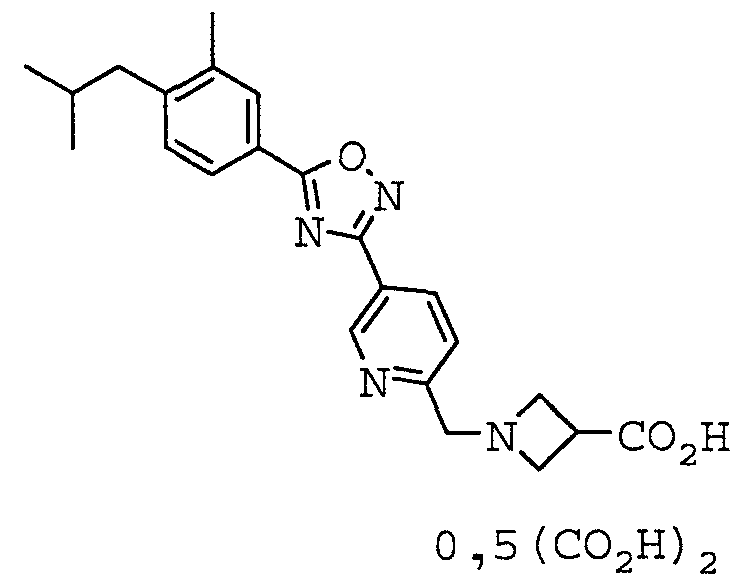
(28a) {5-[5-(4-Изобутил-3-метилфенил)-1,2,4-оксадиазол-3-ил]пиридин-2-ил}метанол
Сырой продукт указанного в заголовке соединения синтезировали с помощью реакции, подобной той, что указана в примере 12 (12a), используя 4-изобутил-3-метилбензойную кислоту (0,12 г, 0,61 ммоль), которая была получена в примере 27 (27d), 1-гидроксибензотриазол (86 мг, 0,64 ммоль), 1-этил-3-(3-диметиламинопропил)карбодиимид гидрохлорид (0,12 г, 0,64 ммоль), 6-({[трет-бутил(диметил)силил]окси}метил)-N'-гидроксипиридин-3-карбоксимидамид (0,16 г, 0,58 ммоль), который был получен в примере 23 (23c), и фторид тетрабутиламмония (1,0 М раствор в тетрагидрофуране, 1,2 мл, 1,2 ммоль). Далее, полученный таким образом сырой продукт указанного в заголовке соединения очищали хроматографией на колонке с силикагелем, используя смешанный растворитель, состоящий из этилацетата и гексана (от 2:3 до 1:1), в качестве элюента, что давало указанное в заголовке соединение (0,19 г) с выходом 99% в виде белого кристаллического твердого продукта.
1H ЯМР спектр (400 МГц, CDCl3) δ м.д.: 0,97 (д, 6H, J=6,6 Гц), 1,65 (ушир.с, 1H), 1,84-1,97 (м, 1H), 2,42 (с, 3H), 2,58 (д, 2H, J=7,0 Гц), 4,87 (с, 2H), 7,28 (д, 1H, J=8,2 Гц), 7,42 (д, 1H, J=8,2 Гц), 7,96 (дд, 1H, J=7,8 Гц, 1,6 Гц), 8,00 (с, 1H), 8,44 (дд, 1H, J=8,2 Гц, 2,4 Гц), 9,35 (д, 1H, J=2,4 Гц).
ИК-спектр (KBr): 1066, 1394, 1559, 1612, 3203 см-1.
Масс-спектр (FAB+) m/z: 324 ((M+H)+).
(28b) Метил 1-({5-[5-(4-изобутил-3-метилфенил)-1,2,4-оксадиазол-3-ил]пиридин-2-ил}метил)азетидин-3-карбоксилат
Сырой продукт указанного в заголовке соединения синтезировали с помощью реакции, подобной той, что указана в примере 23 (23g), используя {5-[5-(4-изобутил-3-метилфенил)-1,2,4-оксадиазол-3-ил]пиридин-2-ил}метанол (0,19 г, 0,58 ммоль), который был получен в примере 28 (28a), тетрабромид углерода (0,39 г, 1,2 ммоль), трифенилфосфин (0,30 г, 1,2 ммоль), гидрохлорид метил 3-азетидинкарбоксилата (0,13 мг, 0,87 ммоль) и N,N-диизопропилэтиламин (0,30 мл, 1,7 ммоль). Далее, полученный таким образом сырой продукт указанного в заголовке соединения очищали хроматографией на колонке с силикагелем, используя смешанный растворитель, состоящий из этилацетата и гексана (от 1:1 до 2:1 или 3:1) в качестве элюента, что давало указанное в заголовке соединение (0,15 г) с выходом 60% в виде белого кристаллического твердого продукта.
1H ЯМР спектр (400 МГц, CDCl3) δ м.д.: 0,96 (д, 6H, J=6,7 Гц), 1,86-1,97 (м, 1H), 2,41 (с, 3H), 2,57 (д, 2H, J=7,4 Гц), 3,34-3,44 (м, 1H), 3,47 (т, 2H, J=7,2 Гц), 3,64 (т, 2H, J=7,6), 3,72 (с, 3H), 3,85 (с, 2H), 7,25 (д, 1H, J=7,8 Гц), 7,45 (д, 1H, J=8,2 Гц), 7,93 (д, 1H, J=7,8 Гц), 7,97 (с, 1H), 8,37 (дд, 1H, J=8,2 Гц, 2,0 Гц), 9,28 (д, 1H, J=2,0 Гц).
ИК-спектр (KBr): 1191, 1208, 1224, 1388, 1732 см-1.
Масс-спектр (FAB+) m/z: 421 ((M+H)+).
(28c) 1-({5-[5-(4-Изобутил-3-метилфенил)-1,2,4-оксадиазол-3-ил]пиридин-2-ил}метил)азетидин-3-карбоновая кислота, 1/2 оксалат
Указанное в заголовке соединение (0,13 г) синтезировали с выходом 83% в виде белого кристаллического твердого продукта с помощью реакции, подобной той, которая указана в примере 21 (21d), используя метил 1-({5-[5-(4-изобутил-3-метилфенил)-1,2,4-оксадиазол-3-ил]пиридин-2-ил}метил)азетидин-3-карбоксилат (0,14 г, 0,34 ммоль), который был получен в примере 28 (28b), 1н. водный раствор гидроксида натрия (1,0 мл, 1,0 ммоль), уксусную кислоту (58 мкл, 1,0 ммоль) и щавелевую кислоту (15 мг, 0,17 ммоль).
1H ЯМР спектр (400 МГц, CD3CO2D) δ м.д.: 0,98 (д, 6H, J=6,6 Гц), 1,88-2,01 (м, 1H), 2,44 (с, 3H), 2,61 (д, 2H, J=7,4 Гц), 3,84-3,95 (м, 1H), 4,28-4,60 (м, 2H), 4,60-4,72 (м, 2H), 4,82 (с, 2H), 7,35 (д, 1H, J=7,8 Гц), 7,78 (д, 1H, J=7,8 Гц), 8,00 (д, 1H, J=7,8 Гц), 8,04 (с, 1H), 8,60 (д, 1H, J=7,8 Гц), 9,34 (с, 1H).
ИК-спектр (KBr): 1343, 1366, 1398, 1591, 1606, 3431 см-1.
Масс-спектр (FAB+) m/z: 407 ((M+H)+).
(Пример 29)
1-({6-Этил-5-[5-(4-изобутил-3-метилфенил)-1,2,4-оксадиазол-3-ил]пиридин-2-ил}метил)азетидин-3-карбоновая кислота
(29a) {6-Этил-5-[5-(4-изобутил-3-метилфенил)-1,2,4-оксадиазол-3-ил]пиридин-2-ил}метанол
Сырой продукт указанного в заголовке соединения синтезировали с помощью реакции, подобной той, что указана в примере 12 (12a), используя 4-изобутил-3-метилбензойную кислоту (92 мг, 0,48 ммоль), которая была получена в примере 27 (27d), 1-гидроксибензотриазол (69 мг, 0,51 ммоль), 1-этил-3-(3-диметиламинопропил)карбодиимид гидрохлорид (97 мг, 0,51 ммоль), 2-этил-N'-гидрокси-6-{[(триизопропилсилил)окси]метил}пиридин-3-карбоксимидамид (0,16 г, 0,46 ммоль), который был получен в примере 25 (25b), и 1,0 М раствор фторида тетрабутиламмония в тетрагидрофуране (0,92 мл, 0,92 ммоль). Далее, полученный таким образом сырой продукт указанного в заголовке соединения очищали хроматографией на колонке с силикагелем, используя смешанный растворитель, состоящий из этилацетата и гексана (1:3) в качестве элюента, что давало указанное в заголовке соединение (0,15 г) с выходом 93% в виде белого кристаллического твердого продукта.
1H ЯМР спектр (400 МГц, CDCl3) δ м.д.: 0,96 (д, 6H, J=6,3 Гц), 1,37 (т, 3H, J=7,4 Гц), 1,85-1,98 (м, 1H), 2,41 (с, 3H), 2,57 (д, 2H, J=7,0 Гц), 3,29 (кв, 2H, J=7,4 Гц), 4,14 (ушир.с, 1H), 4,82 (с, 2H), 7,21 (д, 1H, J=8,2 Гц), 7,28 (д, 1H, J=7,8 Гц), 7,95 (дд, 1H, J=7,8 Гц, 1,6 Гц), 7,99 (с, 1H), 8,34 (д, 1H, J=8,2 Гц).
ИК-спектр (KBr): 1071, 1322, 1342, 1454, 1556, 1591, 3266, 3342 см-1.
Масс-спектр (FAB+) m/z: 352 ((M+H)+).
(29b) Метил 1-({6-этил-5-[5-(4-изобутил-3-метилфенил)-1,2,4-оксадиазол-3-ил]пиридин-2-ил}метил)азетидин-3-карбоксилат
Сырой продукт указанного в заголовке соединения синтезировали с помощью реакции, подобной той, что указана в примере 23 (23g), используя {6-этил-5-[5-(4-изобутил-3-метилфенил)-1,2,4-оксадиазол-3-ил]пиридин-2-ил}метанол (0,15 г, 0,42 ммоль), который был получен в примере 29 (29a), тетрабромид углерода (0,28 г, 0,84 ммоль), трифенилфосфина (0,22 г, 0,84 ммоль), гидрохлорид метил 3-азетидинкарбоксилата (96 мг, 0,63 ммоль) и N,N-диизопропилэтиламин (0,22 мл, 1,3 ммоль). Далее, полученный таким образом сырой продукт указанного в заголовке соединения очищали хроматографией на колонке с силикагелем, используя смешанный растворитель, состоящий из этилацетата и гексана (от 1:1 до 2:1), в качестве элюента, что давало указанное в заголовке соединение (0,13 г) с выходом 71% в виде бесцветного маслянистого продукта.
1H ЯМР спектр (400 МГц, CDCl3) δ м.д.: 0,96 (д, 6H, J=6,3 Гц), 1,33 (т, 3H, J=7,4 Гц), 1,87-1,97 (м, 1H), 2,41 (с, 3H), 2,57 (д, 2H, J=7,0 Гц), 3,24 (кв, 2H, J=7,4 Гц), 3,33-3,44 (м, 1H), 3,49 (т, 2H, J=7,2 Гц), 3,67 (т, 2H, J=7,6), 3,73 (с, 3H), 3,84 (с, 2H), 7,27 (д, 1H, J=8,2 Гц), 7,29 (д, 1H, J=7,8 Гц), 7,95 (д, 1H, J=7,8 Гц), 7,99 (с, 1H), 8,27 (д, 1H, J=8,2 Гц).
ИК-спектр (жидкая пленка): 1176, 1202, 1340, 1560, 1591, 1739 см-1.
Масс-спектр (FAB+) m/z: 449 ((M+H)+).
(29c) 1-({6-Этил-5-[5-(4-изобутил-3-метилфенил)-1,2,4-оксадиазол-3-ил]пиридин-2-ил}метил)азетидин-3-карбоновая кислота
Указанное в заголовке соединение (0,10 г) синтезировали с выходом 82% в виде белого кристаллического твердого продукта с помощью реакции, подобной той, которая указана в примере 3 (3e), используя метил 1-({6-этил-5-[5-(4-изобутил-3-метилфенил)-1,2,4-оксадиазол-3-ил]пиридин-2-ил}метил)азетидин-3-карбоксилат (0,13 г, 0,29 ммоль), который был получен в примере 29 (29b), и 1н. водный раствор гидроксида натрия (0,87 мл, 0,87 ммоль).
1H ЯМР спектр (400 МГц, CD3CO2D) δ м.д.: 0,97 (д, 6H, J=6,6 Гц), 1,36 (т, 3H, J=7,4 Гц), 1,89-2,00 (м, 1H), 2,43 (с, 3H), 2,61 (д, 2H, J=7,4 Гц), 3,29 (кв, 2H, J=7,4 Гц), 3,84-3,95 (м, 1H), 4,47-4,61 (м, 2H), 4,61-4,73 (м, 2H), 4,78 (с, 2H), 7,35 (д, 1H, J=7,8 Гц), 7,49 (д, 1H, J=7,8 Гц), 7,98 (д, 1H, J=7,8 Гц), 8,02 (с, 1H), 8,47 (д, 1H, J=8,2 Гц).
ИК-спектр (KBr): 1327, 1338, 1400, 1563, 1590, 1617, 3451 см-1.
Масс-спектр (FAB+) m/z: 435 ((M+H)+).
(Пример 30)
1-({6-Этил-5-[5-(3-фтор-4-изобутилфенил)-1,2,4-оксадиазол-3-ил]пиридин-2-ил}метил)азетидин-3-карбоновая кислота
(30a) {6-Этил-5-[5-(3-фтор-4-изобутилфенил)-1,2,4-оксадиазол-3-ил]пиридин-2-ил}метанол
Сырой продукт указанного в заголовке соединения синтезировали с помощью реакции, подобной той, что указана в примере 12 (12a), используя 3-фтор-4-изобутилбензойную кислоту (0,11 г, 0,54 ммоль), которая была получена в примере 23 (23e), 1-гидроксибензотриазол (86 мг, 0,56 ммоль), 1-этил-3-(3-диметиламинопропил)карбодиимид гидрохлорид (0,11 г, 0,56 ммоль), 2-этил-N'-гидрокси-6-{[(триизопропилсилил)окси]метил}пиридин-3-карбоксимидамид (0,18 г, 0,51 ммоль), который был получен в примере 25 (25b) и 1,0 М раствор фторида тетрабутиламмония в тетрагидрофуране (1,0 мл, 1,0 ммоль). Далее, полученный таким образом сырой продукт указанного в заголовке соединения очищали хроматографией на колонке с силикагелем, используя смешанный растворитель, состоящий из этилацетата и гексана (от 2:8 до 4:6), в качестве элюента, что давало указанное в заголовке соединение (0,13 г) с выходом 74% в виде белого кристаллического твердого продукта.
1H ЯМР спектр (400 МГц, CDCl3) δ м.д.: 0,96 (д, 6H, J=6,7 Гц), 1,37 (т, 3H, J=7,4 Гц), 1,91-2,03 (м, 1H), 2,61 (д, 2H, J=7,0 Гц), 3,28 (кв, 2H, J=7,4 Гц), 4,09 (ушир., 1H), 4,80 (с, 2H), 7,19 (д, 1H, J=7,8 Гц), 7,31-7,36 (м, 1H), 7,81-7,91 (м, 2H), 8,32 (д, 1H, J=7,8 Гц).
ИК-спектр (KBr): 762, 899, 1078, 1427, 1453, 1509, 1568, 1593, 2957, 3294 см-1.
Масс-спектр (FAB+) m/z: 356 ((M+H)+).
(30b) Метил 1-({6-этил-5-[5-(3-фтор-4-изобутилфенил)-1,2,4-оксадиазол-3-ил]пиридин-2-ил}метил)азетидин-3-карбоксилат
Сырой продукт указанного в заголовке соединения синтезировали с помощью реакции, подобной той, что указана в примере 23 (23g), используя {6-этил-5-[5-(3-фтор-4-изобутилфенил)-1,2,4-оксадиазол-3-ил]пиридин-2-ил}метанол (0,13 г, 0,38 ммоль), который был получен в примере 30 (30a), тетрабромид углерода (0,25 г, 0,75 ммоль), трифенилфосфин (0,20 г, 0,75 ммоль), гидрохлорид метил 3-азетидинкарбоксилата (78 мг, 0,51 ммоль) и N,N-диизопропилэтиламин (0,15 мл, 0,86 ммоль). Далее, полученный таким образом сырой продукт указанного в заголовке соединения очищали хроматографией на колонке с силикагелем, используя смешанный растворитель, состоящий из этилацетата и гексана (от 3:7 до 7:3), в качестве элюента, что давало указанное в заголовке соединение (0,11 г) с выходом 69% в виде бледно-желтого маслянистого продукта.
1H ЯМР спектр (400 МГц, CDCl3) δ м.д.: 0,96 (д, 6H, J=6,6 Гц), 1,33 (т, 3H, J=7,4 Гц), 1,92-2,03 (м, 1H), 2,61 (д, 2H, J=7,0 Гц), 3,24 (кв, 2H, J=7,4 Гц), 3,35-3,45 (м, 1H), 3,49 (т, 2H, J=7,8 Гц), 3,67 (т, 2H, J=7,8 Гц), 3,73 (с, 3H), 3,84 (с, 2H), 7,28-7,37 (м, 2H), 7,83-7,93 (м, 2H), 8,27 (д, 1H, J=8,2 Гц).
ИК-спектр (жидкая пленка): 1203, 1342, 1562, 1590, 1739, 2958 см-1.
Масс-спектр (FAB+) m/z: 453 ((M+H)+).
(30c) 1-({6-Этил-5-[5-(3-фтор-4-изобутилфенил)-1,2,4-оксадиазол-3-ил]пиридин-2-ил}метил)азетидин-3-карбоновая кислота
Указанное в заголовке соединение (90 мг) синтезировали с выходом 87% в виде белого кристаллического твердого продукта с помощью реакции, подобной той, которая указана в примере 3 (3e), используя метил 1-({6-этил-5-[5-(3-фтор-4-изобутилфенил)-1,2,4-оксадиазол-3-ил]пиридин-2-ил}метил)азетидин-3-карбоксилат (0,11 г, 0,24 ммоль), который был получен в примере 30 (30b), и 1н. водный раствор гидроксида натрия (0,71 мл, 0,71 ммоль).
1H ЯМР спектр (400 МГц, CD3CO2D) δ м.д.: 0,97 (д, 6H, J=6,6 Гц), 1,37 (т, 3H, J=7,5 Гц), 1,92-2,04 (м, 1H), 2,65 (д, 2H, J=7,3 Гц), 3,29 (кв, 2H, J=7,5 Гц), 3,86-3,97 (м, 1H), 4,45-4,77 (м, 4H), 4,79 (с, 2H), 7,43-7,53 (м, 2H), 7,87-8,00 (м, 2H), 8,47 (д, 1H, J=8,1 Гц).
ИК-спектр (KBr): 760, 900, 1103, 1342, 1402, 1508, 1561, 1592, 2873, 2963, 3438 см-1.
Масс-спектр (FAB+) m/z: 439 ((M+H)+).
Настоящее изобретение описано далее в настоящем документе более подробно с помощью примеров исследования и примеров препарата далее, но объем настоящего изобретения не должен быть ограничен этими примерами.
(Пример исследования 1)
Оценка противоартрической активности соединения
Исследовали ингибирующую активность лекарственной композиции, содержащей соединение по настоящему изобретению, используя крыс с индуцированным адъювантом артритом, которые проявляли симптомы, аналогичные симптомам артрита человека, используя в качестве индикатора уровень ингибирования опухания правой задней конечности (сторона инъецированная адъювантом).
Для исследования использовали крыс Льюиса в возрасте 8 недель.
(1) Получение адъюванта
Высушенные, убитые нагреванием Mycobacterium butyricum измельчали агатовой ступкой и затем суспенидровали в безводном стерильном жидком парафине с получением 2 мг/мл суспензии. Полученный суспендированный раствор затем подвергали воздействию ультразвука и использовали в качестве адъюванта.
(2) Приготовление исследуемого соединения
Исследуемые соединения растворяли или суспендировали в 0,5% растворе трагаканта.
(3) Индукция артрита адъювантом
Артрит индуцировали путем чрезкожной инъекции адъюванта (0,05 мл), полученного в описанной выше стадии (1), в подушечку стопы правой задней лапы крыс в группе, получающей препарат, и контрольной группы. Крыс, не обработанных адъювантом, использовали в качестве положительной контрольной группы.
(4) Введение соединения
Исследуемое соединение, полученное в описанной выше стадии (2), перорально вводили крысам в группе, получающей препарат, в количестве 5 мл/кг один раз в день на следующий день после инъекции адъюванта (день 0) в течение 18 последующих дней. Крысам в контрольных группах аналогичным образом вводили только 0,5%-ный раствор трагаканта.
(5) Расчет уровня ингибирования опухания стопы под воздействием исследуемого соединения
На 11-й и 18-й дни после начала введения препарата измеряли размер правой стопы каждой крысы с помощью самодельного аппарата для измерения размера. Таким образом был рассчитан средний размер отека в каждой группе.
Процент ингибирования отека стопы исследуемых животных, в которую вводили инъекцию, по сравнению с контрольными животными рассчитывали по следующей формуле:
Уровень ингибирования опухшей стопы (%)={1-[(размер отекшей стопы у животных, получающих соединение)-(размер стопы у животных положительного контроля)]/[(размер стопы у контрольных животных)-(размер стопы у животных положительного контроля)]}×100
(Пример исследования 2)
Определение ингибиторной активности соединения в отношении реакции «трансплантат против хозяина» (HvGR) у крыс
(1) Использовали две линии крыс [крысы Льюиса (самец, возраст 6 недель, Charles River Japan Inc.) и крысы WKAH/Hkm (самец, возраст 7 недель, Japan SLC Inc.)]. В каждой группе было пять крыс (хозяев).
(2) Индукция HvGR
Клетки селезенки выделяли из селезенки крыс WKAH/Hkm или крыс Льюиса и помещали в среду RPMI1640 (Life Technologies Inc.) с концентрацией 1×108 клеток/мл. Затем в билатеральные подушечки стопы обеих задних лап крыс Льюиса чрезкожно инъецировали 0,1 мл аликвоту среды, содержащей взвешенные клетки селезенки (1×107 клеток) крыс WKAH/Hkm или крыс Льюиса.
(3) Введение исследуемого соединения
Исследуемые соединения суспендировали в 0,5% растворе трагаканта. Суспендированный раствор соединения по настоящему изобретению (5 мл/кг массы тела крысы) перорально вводили крысам в группе, получающей препарат (крысы Льюиса, которым инъецировали клетки селезенки крыс WKAH/Hkm и вводили исследуемое соединение) один раз в течение 4 последующих дней, начиная со дня введения клеток селезенки. Также крысам той же линии (крысы Льюиса, которым вводили клетки селезенки крыс Льюиса) и контрольной группы (крысы Льюиса, которым инъецировали клетки селезенки крыс WKAH/Hkm и которым не вводили исследуемое соединение) перорально вводили раствор трагаканта (0,5%) вместо исследуемого вещества.
(4) Определение ингибиторной активности против HvGR
Средний вес подколенных лимфатических узлов одной линии крыс вычитали из веса подколенных лимфатических узлов каждой крысы (“вес подколенных лимфатических узлов после индукции HvGR”). Ингибиторную активность соединения рассчитывали по “весу подколенных лимфатических узлов после индукции HvGR” каждой крысы в группе, которой вводили препарат, по сравнению со средним “весом подколенных лимфатических узлов после индукции HvGR” в контрольной группе. Результаты суммированы в таблице 5 далее.
(Таблица 5)
(введение % 0,1 мг/кг)
Из представленных данных видно, что соединения по настоящему изобретению проявляют превосходную ингибирующую активность в отношении HvGR.
Ссылочное соединение 1 и Ссылочное соединение 2 являются соединениями, описанными в качестве примера 19 и примера 21 в патентной литературе 1 (Номер международной публикации WO 03/105771, брошюра), и их химические структуры являются следующими:
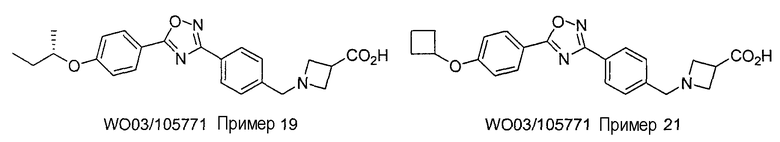
(Пример исследования 3)
Исследование ингибиторной активности соединения на периферических лимфоцитах крыс
Использовали крыс Льюиса (самец, возраст 5 недель, Charles River Japan Inc.). Использовали пять крыс/группа.
(1) Введение соединения
Исследуемое соединение суспендировали в 1% растворе трагаканта (носитель). Суспендированный раствор исследуемого соединения перорально вводили крысам в объеме 5 мл/кг.
Контрольным крысам перорально вводили носитель вместо суспендированного раствора исследуемого соединения.
(2) Подсчет периферических лимфоцитов
Через три часа после введения либо носителя, либо суспендированного раствора исследуемого соединения, кровь собирали из посткавальной вены крыс под эфирным наркозом. Затем собранную кровь помещали в пробирку, содержащую EDTA. Подсчитывали абсолютное число лимфоцитов в собранной крови, используя счетчик-анализатор для цельной крови. Ингибиторную активность (%) исследуемого соединения определяли подсчетом относительного числа периферических лимфоцитов, принимая за 100% число лимфоцитов в собранной крови здоровых крыс.
(Пример препарата 1)
Таблетка
Таблетки (200 мг в таблетке) получают путем смешивания порошков по вышеуказанной рецептуре в блендере, и таблетируя смесь, используя таблетируемые машину.
Преимущества изобретения
Поскольку соединения по настоящему изобретению обладают превосходной иммуносупрессирующей активностью с низкой токсичностью, соединения по настоящему изобретению могут быть использованы в качестве профилактических и терапевтических агентов при лечении заболеваний, связанных с подавлением иммунной системы у млекопитающих (в частности, у людей).
Дополнительные данные
Представленные данные получены в результате оценки противоартрической активности заявленных соединений, проводимой в Примере 1 исследования.
Данные Примера исследования 1: оценка противоартрической активности
| название | год | авторы | номер документа |
|---|---|---|---|
| ЗАМЕЩЕННЫЕ ГЕТЕРОАРИЛОМ ПИРИДИНЫ И СПОСОБЫ ПРИМЕНЕНИЯ | 2017 |
|
RU2756743C2 |
| ПИРИДИН-2-ИЛЬНЫЕ ПРОИЗВОДНЫЕ В КАЧЕСТВЕ ИММУНОМОДУЛИРУЮЩИХ АГЕНТОВ | 2009 |
|
RU2494099C2 |
| ИНГИБИТОРЫ ГИСТОНДЕАЦЕТИЛАЗЫ | 2014 |
|
RU2673819C2 |
| 6, 6-БИЦИКЛИЧЕСКИЕ КОЛЬЦЕВЫЕ ЗАМЕЩЕННЫЕ ГЕТЕРОБИЦИКЛИЧЕСКИЕ ИНГИБИТОРЫ ПРОТЕИНКИНАЗ | 2005 |
|
RU2379308C2 |
| ПРОИЗВОДНЫЕ ПИРИДИН-3-ИЛА В КАЧЕСТВЕ ИММУНОМОДУЛИРУЮЩИХ АГЕНТОВ | 2007 |
|
RU2454413C2 |
| СОЕДИНЕНИЯ ГЕТЕРОАРИЛА В КАЧЕСТВЕ ИНГИБИТОРОВ ТКБ И ИХ ПРИМЕНЕНИЕ | 2015 |
|
RU2742122C2 |
| ПРОИЗВОДНОЕ ТИОФЕНА И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ЕГО ОСНОВЕ | 1997 |
|
RU2172737C2 |
| МАКРОЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ В КАЧЕСТВЕ IRAK1/4 ИНГИБИТОРОВ И ИХ ПРИМЕНЕНИЕ | 2016 |
|
RU2730016C2 |
| ФЕНИЛОКСАЗОЛИДИНОНЫ, ИМЕЮЩИЕ С-С-СВЯЗЬ С 4-8-ЧЛЕННЫМИ ГЕТЕРОЦИКЛИЧЕСКИМИ КОЛЬЦАМИ | 1996 |
|
RU2175324C2 |
| ГЕТЕРОАРОМАТИЧЕСКИЕ МОДУЛЯТОРЫ РЕТИНОЛ-СВЯЗАННОГО ОРФАННОГО РЕЦЕПТОРА ГАММА | 2017 |
|
RU2771280C2 |
Изобретение относится к группе новых химических соединений или его фармакологически приемлемым солям общей формулы I
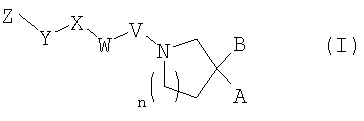
где А означает СООН; В означает Н; n равно 0; V означает -СН2-, одинарную связь; W означает 5-7-членную гетероароматическую группу с одним гетероатомом, выбранным из N, О, S, которая необязательно может быть замещена 1-3 заместителями, выбранными из группы заместителей А, в том случае, когда V представляет собой -CH2-группу, при этом в том случае, когда V означает одинарную связь, W означает бициклическую конденсированную кольцевую 9-членную гетероциклическую группу с одним гетероатомом, выбранным из О, S, которая необязательно может быть замещена 1-3 заместителями, выбранными из группы заместителей А; Х означает 5-7-членную гетероароматическую группу с одним атомом О и одним или двумя атомами N, которая необязательно может быть замещена 1-3 заместителями, выбранными из группы заместителей A; Y означает С6-С10 арил, который необязательно может быть замещен 1-3 заместителями, выбранными из группы заместителей А, 5-7-членную гетероароматическую группу с одним атомом S, которая необязательно может быть замещена 1-3 заместителями, выбранными из группы заместителей A; Z означает C1-C8 алкил, С3-С7 циклоалкил, которая необязательно может быть замещена 1-5 заместителями, выбранными из группы заместителей А; С6-С10 арил, который необязательно может быть замещен 1-5 заместителями, выбранными из группы заместителей А; С6-С10 арилокси, который необязательно может быть замещен 1-5 заместителями, выбранными из группы заместителей А, или С6-C12 аралкил, который необязательно может быть замещен 1-5 заместителями, выбранными из группы заместителей А; группа заместителей А означает галоген, С1-С6 алкил, галоген С1-С6 алкил, C1-С6 алкокси. Соединения проявляют ингибирующую активность в отношении HvGR, что позволяет использовать их для получения фармацевтической композиции, используемой для терапии аутоиммунных заболеваний. 4 н. и 29 з.п. ф-лы, 6 табл.
1. Соединение, представленное общей формулой (I), показанной далее,

где А представляет собой карбоксильную группу,
В представляет собой атом водорода,
n представляет собой целое число 0,
V представляет собой метиленовую группу или одинарную связи,
W представляет собой 5-7-членную гетероароматическую группу с одним гетероатомом, выбранным из азота, кислорода или серы, которая необязательно может быть замещена от 1 до 3 заместителями, выбранными из группы заместителей А, в том случае, когда V представляет собой метиленовую группу, при этом в том случае, когда V представляет собой одинарную связь, W представляет собой бициклическую конденсированную кольцевую 9-членную гетероциклическую группу с одним гетероатомом, выбранным из кислорода или серы, которая необязательно может быть замещена от 1 до 3 заместителями, выбранными из группы заместителей А,
Х представляет собой 5-7-членную гетероароматическую группу с одним атомом кислорода и одним или двумя атомами азота, которая необязательно может быть замещена от 1 до 3 заместителями, выбранными из группы заместителей А,
Y представляет собой С6-С10 ариленовую группу, которая необязательно может быть замещена от 1 до 3 заместителями, выбранными из группы заместителей А, 5-7-членную гетероароматическую группу с одним атомом серы в качестве гетероатома, которая необязательно может быть замещена от 1 до 3 заместителями, выбранными из группы заместителей А,
Z представляет собой C1-C8 алкильную группу, С3-С7 циклоалкильную группу, которая необязательно может быть замещена от 1 до 5 заместителями, выбранными из группы заместителей А, С6-С10 арильную группу, которая необязательно может быть замещена от 1 до 5 заместителями, выбранными из группы заместителей А, С6-С10 арилокси группу, которая необязательно может быть замещена от 1 до 5 заместителями, выбранными из группы заместителей А, или С6-С12 аралкильную группу, которая необязательно может быть замещена от 1 до 5 заместителями, выбранными из группы заместителей А,
группа заместителей А представляет собой группу, состоящую из атома галогена, С1-С6 алкильной группы, галоген C1-С6 алкильной группы и С1-С6 алкокси группы, или его фармакологически приемлемая соль.
2. Соединение по п.1, где V представляет собой метиленовую группу, и W представляет собой 5-7-членную гетероароматическую группу с одним гетероатомом, выбранным из атома азота, кислорода или серы, которая необязательно может быть замещена от 1 до 3 заместителями, выбранными из группы заместителей А, или его фармакологически приемлемая соль.
3. Соединение по п.2, где 5-7-членная гетероароматическая группа представляет собой тиениленовую, фуриленовую, пирролиленовую или пиридиленовую группу, или его фармакологически приемлемая соль.
4. Соединение по п.2, где W представляет собой тиениленовую или пиридиленовую группу, которая необязательно может быть замещена от 1 до 2 заместителями, выбранными из группы заместителей А, или его фармакологически приемлемая соль.
5. Соединение по п.3, где тиениленовая или пиридиленовая группа представляет собой группу, показанную ниже, соответственно, или его фармакологически приемлемая соль
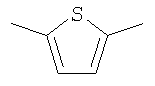 или
или 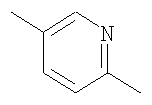 .
.
6. Соединение по п.1, где V представляет собой одинарную связь и W представляет собой бициклическую конденсированную кольцевую 9-членную гетероциклическую группу с одним гетероатомом, выбранным из кислорода или серы, которая необязательно может быть замещена от 1 до 3 заместителями, выбранными из группы заместителей А, или его фармакологически приемлемая соль.
7. Соединение по п.6, где W представляет собой бициклическую конденсированную кольцевую 9-членную гетероциклическую группу с одним гетероатомом, выбранным из кислорода или серы, или его фармакологически приемлемая соль.
8. Соединение по п.7, где бициклическая конденсированная кольцевая 9-членная гетероциклическая группа представляет собой тетрагидробензофураниленовую, тетрагидробензотиениленовую группу, или его фармакологически приемлемая соль.
9. Соединение по п.8, где бициклическая конденсированная кольцевая 9-членная гетероциклическая группа имеет два положения, позволяющие осуществить присоединение по 2- и 4-положениям, или его фармакологически приемлемая соль.
10. Соединение по п.9, где заместитель во 2-ом положении представляет собой группу формулы Z-Y-X-, или его фармакологически приемлемая соль.
11. Соединение по п.1, где Y представляет собой любую группу, выбранную из группы, состоящей из фениленовой группы, и 5-7-членной гетероароматической группы с одним атомом серы в качестве гетероатома, которая необязательно может быть замещена от 1 до 3 заместителями, выбранными из группы заместителей А, или его фармакологически приемлемая соль.
12. Соединение по п.11, где Y представляет собой фениленовую группу, или тиениленовую группу, которая необязательно может быть замещена от 1 до 3 заместителями, выбранными из группы заместителей А, или его фармакологически приемлемая соль.
13. Соединение по п.12, где Y представляет собой фениленовую группу, или его фармакологически приемлемая соль.
14. Соединение по п.1, где Z представляет собой С6-С10 арилокси группу, которая необязательно может быть замещена от 1 до 5 заместителями, выбранными из группы заместителей А, или его фармакологически приемлемая соль.
15. Соединение по п.14, где Z представляет собой фенокси группу, или его фармакологически приемлемая соль.
16. Соединение по п.1, где общая формула (I) представляет собой общую формулу (I'), показанную ниже,
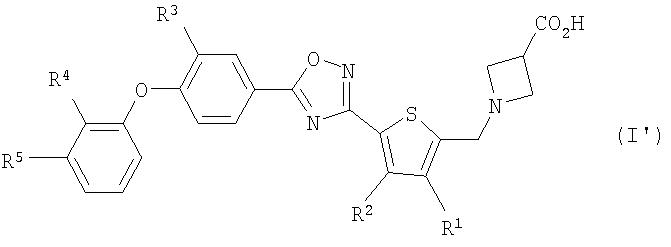
где R1 представляет собой атом водорода или С1-С6 алкильную группу,
R2 представляет собой атом водорода или С1-С6 алкильную группу,
R3 представляет собой атом водорода, атом галогена или С1-С6 алкильную группу,
R4 представляет собой атом водорода, атом галогена или C1-С6 алкокси группу, и
R5 представляет собой атом водорода или атом галогена, или его фармакологически приемлемая соль.
17. Соединение по п.16, где R1 представляет собой атом водорода, или его фармакологически приемлемая соль.
18. Соединение по п.16, где R2 представляет собой атом водорода, метальную группу, или этильную группу, или его фармакологически приемлемая соль.
19. Соединение по п.16, где R3 представляет собой атом водорода, атом фтора, атом хлора, или метальную группу, или его фармакологически приемлемая соль.
20. Соединение по п.16, где R4 представляет собой атом водорода, атом фтора, атом хлора или метокси группу, или его фармакологически приемлемая соль.
21. Соединение по п.16, где R5 представляет собой атом водорода или атом фтора, или его фармакологически приемлемая соль.
22. Соединение по п.1, где общая формула (I) представляет собой общую формулу (I”), показанную ниже
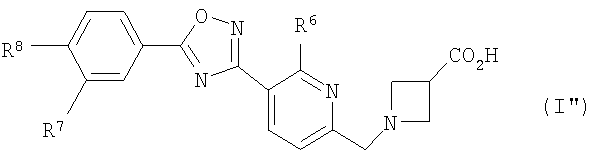
где R6 представляет собой атом водорода или С1-С6 алкильную группу,
R7 представляет собой атом галогена, или С1-С6 алкильную группу, и
R8 представляет собой С1-С6 алкильную группу, или его фармакологически приемлемая соль.
23. Соединение по п.22, где R6 представляет собой атом водорода, метильную группу или этильную группу, или его фармакологически приемлемая соль.
24. Соединение по п.22, где R7 представляет собой атом фтора, атом хлора или метильную группу, или его фармакологически приемлемая соль.
25. Соединение по п.22, где R8 представляет собой н-пропильную группу, н-бутильную группу или изобутильную группу, или его фармакологически приемлемая соль.
26. Соединение по п.1, где указанное соединение является любым, выбранным из следующих соединений, или его фармакологически приемлемая соль:
1-[(4-{5-[4-фенил-5-(трифторметил)-2-тиенил]-1,2,4-оксадиазол-3-ил}-2-фурил)метил]азетидин-3-карбоновая кислота,
1-({5-[5-(4-циклогексилфенил)-1,2,4-оксадиазол-3-ил]-2-фурил}метил)азетидин-3-карбоновая кислота,
1-({5-[5-(4-феноксифенил)-1,2,4-оксадиазол-3-ил]-2-тиенил}метил)азетидин-3-карбоновая кислота, и
1-({4-[5-(4-бензилфенил)-1,2,4-оксадиазол-3-ил]-2-тиенил}метил)азетидин-3-карбоновая кислота.
27. Соединение по п,1, где указанное соединение является любым, выбранным из следующих соединений, или его фармакологически приемлемая соль:
1-({4-метил-5-[5-(4-феноксифенил)-1,2,4-оксадиазол-3-ил]-2-тиенил}метил)азетидин-3-карбоновая кислота,
1-({4-этил-5-[5-(4-феноксифенил)-1,2,4-оксадиазол-3-ил]-2-тиенил}метил)азетидин-3-карбоновая кислота,
1-[(4-этил-5-{5-[4-(3-фторфенокси)фенил]-1,2,4-оксадиазол-3-ил}-2-тиенил)метил]азетидин-3-карбоновая кислота,
1-[(4-этил-5-{5-[4-(2-метоксифенокси)фенил]-1,2,4-оксадиазол-3-ил}-2-тиенил)метил]азетидин-3-карбоновая кислота,
1-[(5-{5-[3-хлор-4-(3-фторфенокси)фенил]-1,2,4-оксадиазол-3-ил}-4-этил-2-тиенил)метил]азетидин-3-карбоновая кислота,
1-[(5-{5-[4-(2,3-дифторфенокси)фенил]-1,2,4-оксадиазол-3-ил}-4-этил-2-тиенил)метил]азетидин-3-карбоновая кислота, и
1-[(5-{5-[4-(2-хлорфенокси)фенил]-1,2,4-оксадиазол-3-ил}-4-этил-2-тиенил)метил]азетидин-3-карбоновая кислота.
28. Соединение по п.1, указанное соединение является любым, выбранным из следующих соединений, или его фармакологически приемлемая соль:
1-({5-[5-(4-изобутил-3-метилфенил)-1,2,4-оксадиазол-3-ил]пиридин-2-ил}метил)азетидин-3-карбоновая кислота,
1-({5-[5-(3-фтор-4-изобутилфенил)-1,2,4-оксадиазол-3-ил]пиридин-2-ил}метил)азетидин-3-карбоновая кислота,
1-({5-[5-(3-хлор-4-изобутилфенил)-1,2,4-оксадиазол-3-ил]пиридин-2-ил}метил)азетидин-3-карбоновая кислота,
1-({5-[5-(4-изобутил-3-метилфенил)-1,2,4-оксадиазол-3-ил]-6-метилпиридин-2-ил}метил)азетидин-3-карбоновая кислота,
1-({5-[5-(3-хлор-4-изобутилфенил)-1,2,4-оксадиазол-3-ил]-6-метилпиридин-2-ил}метил)азетидин-3-карбоновая кислота,
1-({6-этил-5-[5-(4-изобутил-3-метилфенил)-1,2,4-оксадиазол-3-ил]пиридин-2-ил}метил)азетидин-3-карбоновая кислота, и
1-({6-этил-5-[5-(3-фтор-4-изобутилфенил)-1,2,4-оксадиазол-3-ил]пиридин-2-ил}метил)азетидин-3-карбоновая кислота.
29. Фармацевтическая композиция, обладающая ингибирующей активностью в отношении HvGR, содержащая одно, или два, или более соединений по любому из пп.1-28 в качестве активного ингредиента или его фармакологически приемлемую соль.
30. Фармацевтическая композиция по п.29, которая может быть использована для подавления симптомов иммунологического ответа, сопровождающих пересадку кожной ткани или трансплантацию различных органов.
31. Фармацевтическая композиция по п.29, которая может быть использована для профилактики или терапии аутоиммунных заболеваний, где указанное аутоиммунное заболевание представляет собой одно, или два, или более состояний, выбранных из группы, включающей ревматоидный артрит, псориаз, атопический дерматит, рассеянный склероз, язвенный колит и болезнь Крона.
32. Способ подавления симптомов иммунологического ответа, сопровождающих пересадку кожной ткани или трансплантацию различных органов, включающий введение млекопитающему эффективной дозы фармацевтической композиции по п.29.
33. Способ профилактики или терапии аутоиммунных заболеваний, где указанное аутоиммунное заболевание представляет собой одно, или два, или более состояний, выбранных из группы, содержащей ревматоидный артрит, псориаз, атопический дерматит, рассеянный склероз, язвенный колит и болезнь Крона, включающий введение млекопитающему эффективной дозы фармацевтической композиции по п.29.
| WO 00/56727 A1, 23.09.2000 | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| WO 00/56728 A1, 28.09.2000 | |||
| Топчак-трактор для канатной вспашки | 1923 |
|
SU2002A1 |
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| ЛАБОРАТОРНЫЙ АППАРАТ ДЛЯ ВЫДЕЛЕНИЯ ОПУХОЛЕВЫХ КЛЕТОК | 0 |
|
SU207464A1 |
Авторы
Даты
2010-02-27—Публикация
2006-04-21—Подача