Это изобретение относится к конъюгатам олигонуклеотидов, которые содержат комплексообразующий агент или комплекс. Эти конъюгаты используют в областях диагностики и лечения.
Визуальная диагностика достигла большого прогресса за последние десятилетия и продолжает непрерывно развиваться. Сегодня возможно сделать видимой сосудистую систему, большинство органов и многие ткани в живом организме без особого вмешательства. Во многих случаях диагностику заболевания проводят по изменениям формы, размера и положения анатомических структур в теле. Такие анатомические данные о состоянии внутренних органов тела можно получить с помощью рентгеновской техники, ультразвуковой диагностики и магнитной резонансной томографии. Эффективность каждой из упомянутых техник может быть повышена путем использования фармацевтических средств для повышения естественного контраста тканей и жидкостей тела на получающейся картине. Фармацевтические средства, о которых идет речь, вводят в полости тела или инъецируют в кровеносные сосуды с целью контрастного изменения полостей или сосудов. Кроме того, они распространяются с помощью кровотока в организме и могут изменять видимость органов и тканей. В исключительных случаях, такие вещества связываются с определенными структурами в теле, и/или активно транспортируются, и/или экскретируются (выделяются) последними. Таким путем, в индивидуальных случаях функции могут быть также сделаны видимыми и могут быть использованы для диагностики заболеваний.
В противоположность этому, ядерная диагностика основана на веществах, которые могут сами по себе делаться видимыми. В этом случае радиоактивные изотопы, которые излучают радиацию в большом диапазоне, вводят в организм. Распространение этих веществ в организме можно проследить с помощью подходящих детекторов. Преимущество ядерного медицинского способа заключается в высокой эффективности при низкой дозе посылающих сигнал радиоактивных веществ, обозначаемых как радиофармацевтические средства.
Если используют изотопы, которые выделяют α- или β-излучение или другие токсичные продукты разложения, эффективные в ткани, то радиофармацевтические средства могут быть также использованы для терапевтических целей, например для деструкции опухолей. Такого же эффекта можно достигнуть тем, что неопасные изотопы или вещества вводят в организм и превращают только там путем, например, облучения нейтронами или рентгеновскими лучами, ультразвуком или радиоволнами в терапевтически эффективную форму.
Общая проблема заключается в диагностике и локализации патологических изменений за имеющееся в распоряжении время, при котором нет ясных изменений формы, строения и кровообращения в органах и тканях, о которых идет речь. Такая диагностика и постоянное наблюдение имеет важное значение, например, в случае опухолевых заболеваний, включая поиск метастаз, оценку дефицита снабжения тканей кислородом и в случае некоторых инфекций и также метаболических заболеваний.
В настоящее время имеющиеся терапевтические и визуализирующие диагностические методы значительно зависят от доступности фармацевтических препаратов, которые аккумулируются в местах патологических нарушений, которые невозможно определить другим путем.
Контрастными средами, коммерчески доступными в данное время, преимущественно являются так называемые неспецифические препараты. Они пассивно распространяются в пространствах, в которые их вводят, например, путем инъекции.
В прошлом были идентифицированы многие вещества и классы веществ, которые могут проявлять специфичность или, как можно предположить, имеют специфичность в отношении их распространения в живом организме. Таким примерами, помимо антител, пектинов, являются все типы рецепторсвязанных веществ, клетки, мембраны и компоненты мембран, нуклеиновые кислоты, природные метаболиты и их производные, а также большое количество фармацевтических веществ. Пептиды изучались и также подлежат исследованию с особым вниманием.
В патенте США N 4707352 рассматривается специальный способ маркировки комплексообразующих молекул радиоактивными изотопами, но не описаны приемлемые комплексообразующие агенты для связывания ионов металла.
В ЕР-A-0 285057 раскрываются конъюгаты - нуклеотидкомплексообразующий агент, которые не пригодны из-за in vivo нестабильности используемых нуклеотидов в качестве in vivo диагностических или терапевтических средств и которые, кроме того, с трудом удовлетворяют другим требованиям совместимости и фармакокинетики.
Во многих патентах США, таких как, например, патент США 4707440, речь идет о модифицированных полимерах, которые имеют определенную химическую группу. Полимеры могут представлять собой полинуклеотиды и олигонуклеотиды, но они ни стабилизированы против деградации встречающимися в природе нуклеазами, ни отобраны специальным способом, для этого их специфически связывают с высоким связующим сродством со структурами-мишенями. Конкретные варианты воплощения этих детектируемых молекул упоминаются в патентах США N 4843122 и 4943523. Индивидуальный нуклеотид, модифицированный таким путем, заявлен в патенте США N 4952685. Использование этих средств в способах визуализации раскрывается в патенте США 4849208.
Целью данного изобретения является получение специфически связывающихся диагностических средств для обнаружения структур-мишеней, с помощью которых, например, становится возможным визуализация органов, тканей и их патологических изменений in vitro и in vivo.
Найдено, что эта цель может быть достигнута при помощи конъюгатов нуклеотидов, которые помимо олигонуклеотидного радикала имеют комплексообразующий агент, связанный непосредственно или с помощью связующего компонента и чей олигонуклеотидный радикал модифицирован так, чтобы предотвратить или, по крайней мере, значительно ингибировать деградацию встречающимися в природе нуклеазами.
Целью изобретения являются:
1. Конъюгаты олигонуклеотидов, состоящие из олигонуклеотидного радикала N и n заместителей (B-K), в которых В обозначает непосредственную связь или соединяющий компонент с олигонуклеотидным радикалом, и К означает комплексообразующий агент, или комплекс радиоактивных изотопов металла, или стабильных изотопов, которые
- превращаются в радиоактивные изотопы при помощи внешнего облучения,
- превращают внешнее облучение в облучение различного качества, различного энергетического содержания и/или различной длины волны, элементов под атомными номерами 5, 21-29, 31, 39, 42-44, 49, 57-83 или 85, при этом олигонуклеотидный радикал N представляет модификацию, которая предотвращает или, по крайней мере, значительно ингибирует деградацию имеющимися в природе нуклеазами.
2. В предпочтительном варианте воплощения конъюгаты олигонуклеотидов данного изобретения имеют общую формулу (I)
H-(B-K)n (I)
в которой N представляет олигонуклеотид с высоким связующим сродством, который специфически связывается со структурами- мишенями и имеет модификации, которые значительно понижают деградацию встречающимися в природе нуклеазами,
B есть химическая связь или соединяющий компонент, который обеспечивает связь между N и К,
K есть комплексообразующий лиганд, который может содержать посылающий сигнал или терапевтически активный элемент,
n - целое число от 1 до 10.
3. Соединение по п.п. 1 или 2, в котором N представляет олигонуклеотид с от 5 до 200 нуклеотидами, в котором
а) 2'-положение сахаридного звена, независимо одно от другого, занято следующими группами:
группа OR, в которой
R означает алкильный радикал с 1 до 20 углеродными атомами, который произвольно содержит вплоть до 2 гидроксильных групп и который произвольно прерывается 1-5 кислородными атомами,
атом водорода,
гидроксильная группа,
атом фтора,
аминовый радикал,
аминовая группа,
и гидроксильные группы, присутствующие в концевых положениях 3' и 5', независимо одна от другой, произвольно этерифицированы радикалом R и/или
b) фосфодиэфиры, которые необязательно используются в качестве межнуклеотидной связи, независимо друг от друга, замещены фосфортиоатами, фосфордитиоатами и/или алкилфосфонатами, предпочтительно метил фосфонатом, и/или
с) концевые радикалы в 3'- и 5'-положениях связаны внутримолекулярно один с другим при помощи межнуклеотидной связи, как описано в b) и/или
d) он содержит межнуклеотидную связь, как описано в b), которая связывает 3'-3'- или 5'-5'-положение и/или
е) он содержит фосфодиэфирную связь, описанную в b), которая соединяет, подобно сложноэфирной, два тимидина при помощи C2-C20 гидроксиалкильного радикала соответственно в 3-положении или соединяет аналогично замещенный тимидиновый радикал, подобно сложноэфирной, с гидроксильной группой другого сахара в 2'-, или 3'-, или 5'-положении и/или
f) концевые радикалы в 3'- и 5'-положениях содержат межнуклеотидные связи, произвольно модифицированные, как описано в b).
4. Соединение по п. 3, в котором олигонуклеотид N включает от 15 до 100 нуклеотидов.
5. Соединение по п.п. 1-4, в котором N является олигонуклеотидом с высоким связующим сродством, который специфически связывается со структурами-мишенями с высоким связующим сродством и который может быть получен тем, что смесь олигонуклеотидов, содержащую статистические последовательности, вводят вместе со структурой-мишенью, и некоторые олигонуклеотиды проявляют повышенное сродство к структуре-мишени относительно смеси олигонуклеотидов, последний отделяют от остатка олигонуклеотидной смеси, затем олигонуклеотиды с повышенным сродством к структуре-мишени амплифицируют, чтобы получить смесь олигонуклеотидов, которая имеет большое количество олигонуклеотидов, которые связываются на структурах-мишенях.
6. Соединения, описанные в п.п. 1-5, в которых N есть олигонуклеотид с высоким связующим сродством, который специфически связывается со структурами-мишенями, и которые могут быть получены тем, что
а) сначала путем химического синтеза получают ДНК цепь, так что на 3'-конце эта ДНК цепь содержит определенную последовательность, которая комплементарна промотору для РНК-полимеразы и в то же самое время комплементарна праймеру полимеразно-цепьевой реакции (PCR), и так, что эта ДНК цепь содержит определенную последовательность на 5'-конце, которая комплементарна праймерной последовательности для полимеразно-цепьевой реакции, и последовательность между данными определенными последовательностями содержит статистическую последовательность,
b) ДНК цепь транскрибируют в комплементарную РНК цепь с помощью РНК-полимеразы, и нуклеотиды предлагаются полимеразе, которые модифицированы в 2-положении рибозного звена,
с) РНК олигонуклеотиды, полученные таким путем, вводят вместе со структурой-мишенью, с которой олигонуклеотид должен быть специфически связан, и тем, что
d) те олигонуклеотиды, которые связаны со структурой-мишенью, отделяют сначала вместе со структурой-мишенью от несвязывающихся нуклеотидов, и затем связанные нуклеотиды снова отделяют от структуры-мишени, и тем, что
е) эти структура-мишень-специфические РНК олигонуклеотиды подвергают транскрибированию с помощью обратной транскриптазы в комплементарную ДНК цепь, и тем, что
f) эти ДНК цепи амплифицируют полимеразно-цепной реакцией с использованием определенных праймерных последовательностей, и тем, что
g) ДНК олигонуклеотиды, амплифированные таким путем, затем подвергают транскрибированию снова с помощью РНК-полимеразы и модифицированных нуклеотидов в РНК-олигонуклеогиды, и тем, что
h) вышеупомянутые стадии отбора c) -g) произвольно повторяют до тех пор, пока олигонуклеотиды, которые отличаются высоким связывающим сродством к структуре-мишени, не будут достаточно отобраны, и тогда последовательности полученного таким путем олигонуклеотила произвольно могут быть способными к определению.
7. Соединение по п. 6, в котором структуру-мишень выбирают среди макромолекул, тканевых структур высших организмов, таких как животные или люди, органы или части органов животного или человека, клетки, опухолевые клетки или опухоли.
8. Соединение по п.п. 1-7, в котором соединяющий компонент(ы) В связан (связаны)
а) с 4'-концом олигонуклеотидного радикала N, уменьшенном в 4'-положении на CH2-ОН группу и/или
b) с 3'-концом олигонуклеотидного радикала N, уменьшенном в 3'-положении на атом водорода и/или
c) с фосфодиэфирным мостиком(ами), уменьшенным на ОН группу(ы), каждый между двумя нуклеотидами и/или
d) с 1 до 10 нуклеоснованием(ями), которое(ые) уменьшено на атом водорода, соответственно, в 5-, 8-положении(ях) и/или на аминогруппу(ы) в 2-, 4- и 6-положении(ях).
9. Соединение по п.п. 8a) или 8b), в котором B имеет общую формулу X-Y-Z1, который по X стороне связан с комплексообразующим агентом или комплексом и по Z стороне связан с олигонуклеотидом, в котором
X обозначает, непосредственную связь, -NH или -S группу,
Y обозначает неразветвленную-цепную, разветвленную-цепную, насыщенную или ненасыщенную C1-C20 алкиленовую цепь, которая произвольно содержит 1-2 циклогексилен, 1-5 имино, 1-3 фенилен, 1-3 фениленимино, 1-3 фениленокси, 1-3 гидроксифенилен, 1-5 амидо, 1-2 гидразидо, 1-5 карбонил, 1-5 этиленокси, уреидо, тиоуреидо, 1-2 карбоксиалкилимино, 1-2 сложно-эфирные группы,
1-3 группы Ar, в которых Ar обозначает насыщенное или ненасыщенное 5- или 6-членное кольцо, которое произвольно содержит 1-2 гетероатома, выбранные из азота, кислорода и серы и/или 1-2 карбонильные группы; 1-10 атомов кислорода, 1-5 атомов азота и/или 1-5 атомов серы, и/или произвольно замещена 1-5 гидрокси, 1-2 меркапто, 1-5 оксо, 1-5 тиоксо, 1-3 карбокси, 1-5 карбокси-C1-C4 алкильными, 1-5 сложноэфирными, 1-3 амино, 1-3 гиlрокси-C1-C4 алкильными, 1-3 C1- C7 алкоксигруппами, и
Z1 обозначает -CONH-CH2-4', -NH-CO-4', -O-P(O)R'-NH-CH2-4', -O-P(O)R'-O-CH2-4', -O-P(S)R'-O-3', или -O-P(O)R'-O-3', где 4' или 3' указывают на связь с концевым сахаридным звеном(ями) и R' обозначает О-, S-, C1-C6 алкильную или NR2R3 группу, причем R2 и R3 обозначают водород и C1-C4 алкильные радикалы.
В качестве циклических структур (Ar) особенно пригодными являются циклические насыщенные или ненасыщенные алкилены с 3 до 6, особенно 5 или 6 C атомами, которые произвольно содержат гетероатомы, такие как N, S или O. В качестве примеров могут быть упомянуты: циклопентилен-, пирролилен-, фуранилен-, тиофенилен-, имидазолилен-, тиазолилен-, пиразолилен-, пирролидилен-, пиридилен-, пиримидилен-, малеинимидилен- и фталимидиленовые группы.
10. Соединение по п. 8c), в котором B имеет общую формулу X-Y-Z2, который связан по X стороне с комплексообразующим агентом или комплексом и по Z стороне с олигонуклеотидом, в котором
Z2, в мостике, связывающем два соседних сахаридных звена,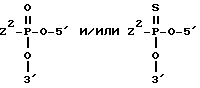
обозначает группу - NH2-, -O- или -S-, и X, Y и R2 имеют значения, указанные в пункте 9.
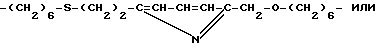
В качестве радикала Y, соединяющего компоненты Z1-Y-X (согласно п. 9) или Z2-Y-X (согласно п. 10), можно упомянуть в качестве примеров радикалы
- (CH2)6-NH-CS-NH-C6H4-CH(CH2CO2H)- CH2-CO-NH-CH2-CH(OH)-CH2-, - (CH2)6-NH-CS-NH-C6H4-CH2-, -(CH2)6-NH-CO-CH2-,
-(CH2)6-NH-CO-CH2-CH2-, -(CH2)2-, -(CH2)6-, -(CH2)6-S-(CH2)2-, -(CH2)6-S-(CH2)6-, -(CH2)2-NH-CO-, -(CH2)6-NH-CO-,
-(CH2)6-S-(CH2)-NH-CO, -(CH2)6-S-(CH2)6-NH-CO-,



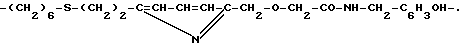
11. Соединение по п. 8d), в котором B имеет общую формулу X-Y-Z3, в которой Z3 обозначает -NH группу или непосредственную связь с нуклеоснованием и X и Y имеют значение, указанное в п. 9.
В качестве примеров можно упомянуть радикалы -CH2-CO-NH-CH2-CH(OH)-CH2-, -NH-CO-CH2-CO-NH-CH2-CH(OH)-CH2-, -CO-NH-CH2-CH2-NH-, -CH2-S-CH2-CH2-NH-,
-CH2-S-CH2-CH2-, -(CH2)4-S-CH2-CH2-NH-, -CO-CH2-S-CH2-CH2-NH-,
-CO-CH2-S-(CH2)6-NH-, -CH= CH-CO-NH-CH2-CH2-NH-, -CH= CH-CH2-NH-, -C≡C-CH2-NH- or -CO-CH2-CH2-NH-CH2-CH2-NH-.
В качестве связывающих мест в случае пуриновых оснований особенно пригодно 8-положение, а в случае пиримидиновых оснований особенно пригодно 5-положение. В этом случае, чисто формально, атом водорода соответствующего основания замещен радикалом B-K. Но связь может осуществляться, кроме того, с помощью аминогрупп, необязательно содержащихся в 2-, 4- или 6- положении, так, например, при помощи 2-аминогруппы в гуанине, с помощью, 6-аминогруппы в аденине или с помощью 4-аминогруппы в цитозине. В этом случае, атом водорода соответствующей аминогруппы, соответственно, замещен радикалом B-K.
12. Соединения по одному из предшествующих п.п., в которых комплекс металла в качестве визуализирующего элемента содержит радиоактивный изотоп, выбранный из элементов меди, висмута, технеция, рения или индия.
13. Изобретение, кроме того, включает способ обнаружения структуры-мишени, в котором одно или более из соединений по одному из предшествующих п. п. вносят вместе in vivo или in vitro с образцом, подлежащим исследованию, и который основан на сигнале, с помощью которого определяют, присутствует ли в образце структура-мишень, на которой олигонуклеотид связан специфически и с высоким связывающим родством, а также
14. Способ неинвазивной диагностики заболеваний, в котором одно или более из соединений по одному из п.п. 1-12 вносят вместе со структурой-мишенью, подлежащей исследованию in vivo, и основанном на сигнале, с помощью которого определяют, присутствует ли в организме, подлежащем изучению, структура-мишень, с которой олигонуклеотид специфически связан.
15. Целью изобретения также является использование соединения по п.п. 1-12 в радиодиагностике и/или в радиотерапии, а также
16. Диагностический набор для in vivo или in vitro определения структур-мишеней, и этот диагностический набор содержит, по крайней мере, одно соединение по одному из п.п. 1-12.
17. Соединение по одному из п.п. 1-4, в котором N представляет собой не встречающийся в природе олигонуклеотидный лиганд, имеющий специфическое связывающее сродство к молекуле-мишени, причем такая молекула-мишень имеет трехмерную химическую структуру, другую, чем полинуклеотид, которая связывается с указанным олигонуклеотидным лигандом посредством механизма, который преимущественно зависит от спаривания оснований Уотсона-Крика (Watson/Crick) или от тройного спирального связывания, где указанный олигонуклеотидный лиганд не является нуклеиновой кислотой, имеющей известную физиологическую функцию, будучи связанным с молекулой-мишенью.
Если предлагаемые конъюгаты должны быть использованы в качестве диагностического агента, то комплексообразующий агент (ы) содержит (содержат) визуализирующий радиоактивный изотоп элементов с атомными номерами 21, 26-27, 29, 31, 43 или 49, предпочтительно 43 или 49. Если предлагаемые конъюгаты должны быть использованы в качестве терапевтического агента, то помимо вышеупомянутых элементов, также подходят изотопы элементов с атомными номерами 5, 22-25, 28, 42, 44, 57-83 и 85. Вне радиоактивных вышеупомянутых элементов особенно пригодными в области лечения являются стабильные изотопы, которые
a) превращаются с помощью внешнего облучения в радиоактивные изотопы,
b) превращают внешнее облучение в облучение различного качества, различного энергетического содержания и/или различной длины волны.
Число визуализирующих или терапевтически эффективных заместителей B-K, связанных с олигонуклеотидным радикалом, с одной стороны, ограничивается величиной олигонуклеотида, но оно не бывает выше 10. Согласно изобретению предпочтителен один или два заместителя B-K.
В принципе величина олигонуклеотидного радикала N не ограничена. Для данного изобретения олигонуклеотиды с 5 до 600 нуклеотидов являются пригодными к употреблению, особенно предпочтительны олигонуклеотиды с 15 до 100 нуклеотидами.
Олигонуклеотиды, годные к употреблению, согласно изобретению являются стабилизированными против деградации нуклеазами, встречающимися in vivo.
Немодифицированные олигонуклеотиды или полинуклеотиды расщепляются in vivo эндонуклеазами и эксонуклеазами. Реакция деградации в РНК ряде начинается с активации 2-гидроксигруппы. Другими катаболитическими ферментами являются, например, рибозимы, которые расщепляют фосфодиэфирную связь RNS (смотри Science 261, 709 (1993)). In vivo стабильность RNS производных можно увеличить частичным или полным замещением 2-гидроксильной группы другими заместителями. Такими заместителями являются, например, алкоксигруппы, особенно метоксигруппа (смотри, например, Chem. Pharm. Bull. 13, 1273 (1965), Biochemistry 10, 2581 (1971), атом водорода, атом фтора (смотри, например, Can. J. Chem. 46, 1131 (1986) или аминогруппа (смотри, например, J. Org. Chem. 42, 714 (1977). Некоторые из этих заместителей, а также другие могут быть введены в 2'-положение, используя способы, раскрываемые в заявке на патент США Сер. N 08/264029, поданной 22 июня 1994. Другие возможности для стабилизации межнуклеотидной связи заключаются в замещении одного или двух атомов кислорода в фосфодиэфирном мостике при образовании фосфотиоатов (Trends Biochem. Sci. 14, 97 (1989)) или фофсфородитиоатов (J. Chem. Soc., Chem. Commun. 591 (1993) и Nucleic Acids Res. 12, 9095 (1984)) и в использовании алкилфосфонатов вместо фосфодиэфиров (Ann. Rep. N.Y. Acad. Sci. 507, 220 (1988)).
Стабилизация может быть достигнута, когда гидроксильные группы в 2'-положении рибозных звеньев, независимо друг от друга, модифицированы. Такую модификацию можно обеспечить замещением этой гидроксильной группы OR группой, атомом галоида, особенно атомом фтора, атомом водорода или аминовым радикалом, особенно аминогруппой. Радикал R алкоксигруппы обозначает в этом случае неразветвленный-цепной или разветвленный-цепной алкильный радикал с 1-20oC атомами, такой как метил, этил, пропил, изопропил, бутил, трет-бутил, пентил или гексил или циклический незамещенный или замещенный алкильный радикал с 4-20oC атомами, такой как циклопентил или циклогексил, которые произвольно содержат 1-2 гидроксигруппы, и произвольно прерываются 1-5 атомами кислорода. Стабилизация также повышается, так как присутствующие гидроксильные группы в 3'- и 5'-положениях произвольно этерифицированы.
Другая (возможность стабилизации) стабилизация полинуклеотида достигается тем, что фосфодиэфиры, подлежащие использованию в качестве межнуклеотидной связи, замещают частично или полностью, и независимо друг от друга, фосфоротиоатами, фосфородитиоатами или алкилфосфонатами, особенно предпочтительно низшими алкилфосфонатами, такими как, например, метилфосфонат. Эти межнуклеотидные связи могут быть также связаны с концевыми радикалами в 3'- и 5'-положениях или же также могут соединять 3'-3'- или 5'-5'-положения. Фосфодиэфирная связь делает возможным дополнительное связывание гидроксиалкильными радикалами, которые присутствуют при азотных или углеродных атомах нуклеоснований, так, например, два тимидина могут быть связаны гидроксиалкильными цепями, присутствующими в 3 положении, или два пуриновых основания радикалами, присутствующими в 8-положениях. Связывание может также происходить с гидроксильными группами в 2'-, или 3'-, или 5'-положении.
Модифицированные межнуклеотидные связи могут необязательно иметь место предпочтительно на концах полинуклеотида, и они особенно предпочтительно связывают с тимидином.
Согласно данному изобретению используемые олигонуклеотидные радикалы N не ограничиваются специфическими олигонуклеотидными последовательностями. Но предпочтительными являются те олигонуклеотиды, которые специфически связываются с высоким связывающим сродством со структурами-мишенями, за исключением нуклеиновой кислоты.
Способ идентификации подходящих олигонуклеотидов, которые требуются в качестве исходных веществ для конъюгатов предлагаемого изобретения, описан в патенте США 5270163. Этот способ, названный SELEX, может быть использован для того, чтобы получить лиганд нуклеиновой кислоты для любой требуемой молекулы-мишени.
SELEX способ включает отбор из смеси кандидатов-олигонуклеотидов и ступенчатые итерации связывания, разделения и амплификации, используя одну и ту же общую схему отбора для того, чтобы достичь фактически требуемого критерия связывающего сродства и селективности. Исходя из смеси нуклеиновых кислот, предпочтительно включающей сегмент статистической последовательности, SELEX способ включает стадии контактирования смеси с мишенью в условиях, благоприятных для связывания, разделения несвязанных нуклеиновых кислот от тех нуклеиновых кислот, которые специфически связались с молекулами-мишенями, диссоциации комплексов нуклеиновая кислота-мишень, амплификации нуклеиновых кислот, диссоциированных из комплексов нуклеиновая кислота-мишень, с получением лигандобогащенной смеси нуклеиновых кислот, затем повторная итерация стадий связывания, разделения, диссоциации и амплификации с таким количеством циклов, сколько требуется для того, чтобы получить высоко специфические лиганды с высоким сродством нуклеиновой кислоты к молекуле-мишени.
Основной SELEX способ был модифицирован, чтобы достичь ряда конкретных целей. Например, заявка на патент США сер. N 07/960093, поданная 14 октября 1992, раскрывает использование SELEX в конъюгации при электрофорезе в геле для отбора молекул нуклеиновой кислоты со специфическими структурными характеристиками, такую как изогнутая ДНК. Заявка на патент США Сер. N 08/123935, поданная 17 сентября 1993, раскрывает способ на основе SELEX для селекции лиганлов нуклеиновой кислоты, содержащих фотореакционно-способные группы, способные к связыванию и/или фотосшиванию с молекулой-мишенью и/или способных фотоинактивироваться молекулой-мишенью. Заявка на патент США Сер. N 08/134028, поданная 7 октября 1993, раскрывает способ идентификации высокоспецифических лигандов нуклеиновой кислоты, способных различать близко-родственные молекулы, получивший название Couter-SELEX. Заявка на патент США Сер. N 08/143564, поданная 25 октября 1993, раскрывает способ на основе SELEX, который обеспечивает достаточно высокое разделение между олигонуклеотидами, имеющими высокое и низкое сродство к молекулам-мишеням. Заявка на патент США Сер. N 07/964624, поданная 21 октября 1992, раскрывает способы получения улучшенных лигандов нуклеиновой кислоты после проведения SELEX. Заявка на патент США Сер. N 08/400440, поданная 8 марта 1995, раскрывает способы ковалентного связывания лиганда с его мишенью.
SELEX способ охватывает идентификацию лигандов нуклеиновой кислоты с высоким сродством, содержащих модифицированные нуклеотиды, придающие улучшенные характеристики лиганду, такие как повышенная in vivo стабильность или улучшенные характеристики доставки. К примерам таких модификаций относятся химические замещения на рибозном заместителе, и/или фосфатном, и/или основном заместителях. SELEX- идентифицированные лиганды нуклеиновой кислоты, содержащие модифицированные нуклеотиды, раскрываются в заявке на патент США Сер. N 08/117991, поданной 8 сентября 1993, которая описывает олигонуклеотиды, содержащие производные нуклеотида, химически модифицированные в 5- и 2'-положениях пиримидинов. В заявке на патент США Сер. N 08/134028, указано выше, раскрываются высокоспецифичные лиганды нуклеиновой кислоты, содержащие один или более нуклеотидов, модифицированных 2'-амино (2-NH2), 2-фторо (2'-F), и/или 2'-O-метилом (2'-OMe). В заявке на патент США Сер. N 08/264029, поданной 22 июня 1994, раскрываются олигонуклеотиды, содержащие различные 2-модифицированные пиримидины.
SELEX способ включает в себя объединение отобранных олигонуклеотидов с другими отобранными олигонуклеотидами и неолигонуклеотидными функциональными единицами, описанными в заявках на патент США Сер. N 08/284063, поданной 2 августа 1994, и Сер. N 08/234997, поданной 28 апреля 1994 соответственно. Эти заявки допускают комбинацию широкого ряда форм и других свойств, и эффективных свойств амплификации и репликации, олигонуклеотидов с желательными свойствами других молекул.
В своей наиболее главной форме SELEX способ может быть охарактеризован следующими стадиями:
1) Получают смесь нуклеиновых кислот различной последовательности. Смесь обычно включает области фиксированных последовательностей (т.е. каждый из представителей смеси содержит одни и те же последовательности в одном и том же месте расположения) и области статистических последовательностей. Области фиксированных последовательностей выбирают либо: (a) чтобы помогать в стадиях амплификации, описанных ниже, (b) чтобы имитировать известную последовательность, которая связывается с мишенью, либо увеличить концентрацию данного структурного расположения (порядка чередования) нуклеиновых кислот в смеси. Статистические последовательности могут быть статистическими полностью (то есть вероятность нахождения основания в любой позиции составляет одну четвертую) или только частично статистическими (например, вероятность нахождения основания в любой позиции может быть выбрана на любом уровне между 0 и 100 процентами).
2) Смесь контактирует с выбранной мишенью при условиях, благоприятных для связывания между мишенью и представителями смеси. В этих обстоятельствах взаимодействие между мишенью и нуклеиновыми кислотами смеси-кандидата можно рассматривать как образование пар нуклеиновая кислота-мишень между мишенью и теми нуклеиновыми кислотами, которые имеют самое сильное сродство к мишени.
3) Нуклеиновые кислоты с самым сильным сродством к мишени отделяют от нуклеиновых кислот с меньшим сродством к мишени. Из-за того что в смеси-кандидате существует лишь чрезвычайно малое число последовательностей (и возможно только одна молекула нуклеиновой кислоты), соответствующих нуклеиновым кислотам с самым высоким сродством, обычно желательно установить критерии разделения такие, что существенное количество нуклеиновых кислот в смеси-кандидате (приблизительно 5-50%) сохраняется во время разделения.
4) Эти нуклеиновые кислоты, отобранные во время разделения, как имеющие относительно более высокое сродство к мишени, затем амплифицируют, создавая новую смесь, которая обогащена нуклеиновыми кислотами, имеющими относительно более высокое сродство к мишени.
5) Повторяя стадии разделения и амплификации, указанные выше, заново образованная смесь содержит меньше и меньше последовательностей, и средняя степень сродства нуклеиновых кислот к мишени обычно увеличивается. Наконец, SELEX способом получают смесь, содержащую одну или небольшое число нуклеиновых кислот, представляющих те нуклеиновые кислоты из исходной смеси, которые имеют наивысшее сродство к молекуле-мишени.
SELEX патенты и заявки на патент описывают и тщательно разрабатывают этот способ в деталях. Здесь же изложены мишени, которые могут быть использованы; способы разделения нуклеиновых кислот в смеси-кандидате и способы увеличения разделенных нуклеиновых кислот, чтобы генерировать обогащенную смесь-кандидат. SELEX патенты и заявки на патент, кроме того, описывают лиганды, получаемые с рядом видов мишеней, включая как белковые мишени, где белок является белком, связывающим нуклеиновую кислоту, так и белковые мишени, где белок не является белком, связывающим нуклеиновую кислоту. Поэтому SELEX способ может быть использован для того, чтобы обеспечить высокоаффинные лиганды молекулы-мишени.
Молекулы-мишени являются предпочтительно белками, но могут также включать, среди других, карбогидраты, пептидогликаны и ряд небольших молекул. Как и в случае белковых антител, антитела нуклеиновых кислот (олигонуклеотидные лиганды) могут быть применены для торпедирования биологических структур, таких как поверхности клеток или вирусы, посредством специфического взаимодействия с молекулой, которая является неотъемлемой частью той биологической структуры. Олигонуклеотидные лиганды выгодны тем, что они не ограничены собственной толерантностью, как обычные антитела. Кроме того, антитела нуклеиновых кислот не требуют животных и клеточных культур для синтеза или получения, поскольку SELEX есть полностью in vitro способ. Известно, нуклеиновые кислоты могут связываться с комплементарными последовательностями нуклеиновых кислот. Это свойство нуклеиновых кислот широко используют для определения, подсчета и выделения молекул нуклеиновых кислот. Таким образом, способы данного изобретения, как полагают, не включают эти хорошо известные способности к связыванию между нуклеиновыми кислотами. В частности, способы данного изобретения, относящиеся к использованию антител нуклеиновых кислот, не включают известные связывающие сродства между молекулами нуклеиновых кислот. Известно, что ряд белков функционирует путем связывания с нуклеиновыми последовательностями, такие как регуляторные белки, которые связываются с нуклеиновыми последовательностями оператора. Такая способность некоторых нуклеиновых кислот, связывающих белки, связываться с их природными сайтами, например, применена для определения, подсчета, изоляции и очистки таких белков. Способы данного изобретения, относящиеся к использованию олигонуклеотидных лигандов, как полагают, не включают известное связывающее сродство между белками, связывающими нуклеиновую кислоту, и последовательностями нуклеиновых кислот, с которыми они, как известно, связываются. Однако, используя SELEX, могут быть разработаны новые, не встречающиеся в природе последовательности, которые связываются с теми же белками, связывающими нуклеиновые кислоты. В частности, олигонуклеотидные лиганды данного изобретения связываются с такими молекулами-мишенями, которые включают (содержат) трехмерную химическую структуру, другую чем полинуклеотид, которая связывается с указанным олигонуклеотидным лигандом через механизм, который преимущественно зависит от спаривания оснований Уотсон-Крика или образования тройной спирали, где указанный олигонуклеотидный лиганд не является нуклеиновой кислотой, имеющей известную физиологическую функцию будучи связанной молекулой-мишенью.
Следует иметь в виду, что SELEX позволяет очень быстро определять последовательности нуклеиновых кислот, которые могут связываться с белком и, таким образом, может быть легко использован для определения структуры неизвестного оператора и последовательностей связующего сайта, и эти последовательности затем могут быть применены для описываемых здесь применений. SELEX, таким образом, представляет собой общий способ использования молекул нуклеиновой кислоты для определения, подсчета, изоляции и очистки белков, которые, как известно, не связывают нуклеиновые кислоты. Кроме того, некоторые антитела нуклеиновых кислот, выделяемые с помощью SELEX, могут также применяться для воздействия на функцию, например ингибировать, усиливать или активировать функцию конкретных молекул-мишеней или структур. В частности, антитела нуклеиновых кислот могут применяться для ингибирования, усиления или активации функции белков.
Олигонуклеотиды, используемые в конъюгатах согласно изобретению, получают в предпочтительном варианте воплощения согласно описанному ниже способу.
Так, подходящие олигонуклеотиды могут быть получены тем, что смесь олигонуклеотидов, содержащую статистические последовательности, вносят вместе со структурой-мишенью, и некоторые олигонуклеотиды демонстрируют повышенное сродство к структуре-мишени относительно смеси олигонуклеотидов, последние отделяют от остатка олигонуклеотидной смеси, затем олигонуклеотиды с повышенным сродством к структуре-мишени амплифицируют с получением смеси олигонуклеотидов, которая демонстрирует повышенное содержание олигонуклеотидов, которые связаны со структурами-мишенями.
В способе сначала получают ДНК цепь подходящим путем с помощью химического синтеза. На 3'-конце эта ДНК цепь имеет известную последовательность, которую используют как промотор для РНК-полимеразы, и в то же время эта последовательность комплементарна праймерной последовательности для полимеразно-цепьевой реакции (PCR, ПЦР). В особенно предпочтительном варианте воплощения, в этом случае, включен промотор для Т7 РНК-полимеразы. Затем на промоторе синтезируют статистическую последовательность. Статистическая последовательность может быть получена тем, что подходящие четыре основания вводят в машину синтеза в том же самом отношении. Таким образом, получают полностью статистические ДНК последовательности. В предпочтительном варианте воплощения длина статистической последовательности составляет от около 15 до 100 нуклеотидов. Другую ДНК последовательность, которая может быть использована для полимеразно-цепьевой реакции (PCR), синтезируют на этом ДНК участке со статистической последовательностью.
После синтеза этой ДНК цепи последнюю транскрибируют в комплементарную РНК цепь с помощью РНК полимеразы. В предпочтительном варианте воплощения, в этом случае, используют Т7 РНК полимеразу. При транскрипции нуклеотиды, которые модифицированы, представляют РНК полимеразе. В особенно предпочтительном варианте воплощения рибозу модифицируют в 2-положении. В этом случае может быть включено замещение атома водорода или гидроксильной группы алкоксигруппой, предпочтительно метокси, амино или фтором. РНК олигонуклеотиды, полученные этим способом, затем используют в селекции.
В селекционном способе РНК олигонуклеотиды смешивают (вносят) вместе со структурой-мишенью. Как полагают, структура-мишень означает структуру, с которой олигонуклеотид должен связываться специфически и с высоким сродством.
Такими структурами являются, например, макромолекулы, тканевые структуры высших организмов, таких как животные или люди, органы или части органов, клетки, в частности опухолевые клетки или опухоли.
В этой связи, структура-мишень не должна быть в абсолютно чистой форме, она может также присутствовать на встречающемся в природе органе или на поверхности клетки. Преимущественно в способе селекции возможно добавление полиамино (тРНК, гепарин), плазмы или цельной крови в SELEX реакцию.
Если здесь включают изолированный белок, то последний может быть связан с твердой фазой, например, фильтром. При селекции используют избыток структуры-мишени относительно РНК смеси. При инкубации молекулы конкретных олигонуклеотидов связываются на структурах-мишенях, в то время как несвязанные олигонуклеотиды отделяют от смеси, например, путем промывки.
Затем олигонуклеотидные молекулы отделяют от молекул-мишеней или удаляют промыванием соответствующими буферами или растворителями.
С помощью обратной транскриптазы найденный РНК олигонуклеотид подвергают транскрипции в комплементарную ДНК цепь.
Поскольку полученная ДНК цепь содержит праймерные последовательности (или промоторные последовательности) на обоих концах, амплификацию найденных ДНК последовательностей можно осуществить просто с помощью полимеразно-цепьевой реакции.
ДНК олигонуклеотиды, амплифицированные таким путем, затем снова транскрибируют с помощью ДНК полимеразы в РНК олигонуклеотиды, и таким образом полученные РНК олигонуклеотиды могут быть использованы в последующей стадии селекции (как описано выше).
После отделения связавшихся РНК олигонуклеотидов, полученных во второй стадии селекции, от молекул-мишеней последние снова транскрибируют в ДНК с помощью обратной транскриптазы, и таким образом полученные комплементарные ДНК олигонуклеотиды амплифицируют с помощью полимеразно-цепьевой реакции и затем снова транскрибируют с помощью РНК полимеразы в РНК олигонуклеотиды, которые пригодны для последующей стадии селекции.
Оказалось, что требуемые высокие специфичности и высокие связывающие сродства можно получить, если стадии селекции повторять несколько раз. Изредка, требуемую олигонуклеотидную последовательность можно получить уже после одной или двух стадий селекции. Как только требуемая специфичность и связывающее сродство между структурой-мишенью и олигонуклеотидом получена, олигонуклеотид(ы) может быть секвенирован и, как результат, последовательность специфически связывающих олигонуклеотидов может быть определена.
Особое преимущество в этом способе заключается в том, что этот способ может быть использован не только с соответствующими белками, но также и in vivo. Однако вышеупомянутый способ селекции может быть также осуществлен на очищенных структурах-мишенях. Но существенно, особенно для in vivo диагностики, что специфичность олигонуклеотидов обеспечивается структурой-мишенью в живой окружающей среде. Поэтому селекционные способы можно также проводить на клетках или клеточных культурах, на тканях или тканевых сечениях, на кровоснабжаемых органах и даже на живых организмах.
В этом случае преимущество состоит в том, что модифицированные олигонуклеотиды могут противостоять деградации почти вездесущими РНК-ами. Как результат, требуемые олигонуклеотидные последовательности сами аккумулируются в способах селекции на живых организмах, поскольку соответствующие встречающиеся в природе олигонуклеотиды должны деградироваться РНК-ами.
Олигонуклеотидный радикал N может (содержать) один или более соединяющих компонентов B или заместителей B-K, которые могут быть выбраны независимо один от другого. Здесь же заявлены олигонуклеотидные конъюгаты, которые содержат от 1 до 10 идентичных или от 2 10 различных соединяющих компонентов В. Особенно предпочтительны олигонуклеотидные конъюгаты с одним или двумя соединяющими компонентами В. Соединяющий компонент В соединяет олигонуклеотидный радикал N с комплексообразующим агентом или комплексом К. Преимущественно, в качестве донорных атомов могут быть использованы полидентат, комплексообразующие лиганды с открытой цепью или циклические комплексообразующие лиганды с О, S и N. В качестве примеров для комплексообразующего агента К радикалов могут быть упомянуты полиаминополикарбоновые кислоты, уменьшенные на атом водорода, гидроксильную группу и/или уксуснокислую группу, этилендиаминтетрауксусная кислота, диэтилентриаминпентауксусная кислота, транс-1,2-циклогександиаминтетрауксусная кислота, 1,4,7,10-тетраазациклододекантетрауксусная кислота, 1,4,7-триазациклононантриуксусная кислота, 1,4,8,11-тетраазатетрадекантетрауксусная кислота, 1,5,9-триазациклододекантриуксусная кислота, 1,4,7,10-тетраазациклододекантриуксусная кислота и 3,6,9,15-тетраазабицикло-[9,3,1] -пентадека-1(15), 11,13-триентриуксусная кислота.
Соответствующие комплексообразующие агенты описаны, например, в ЕР 0485045, ЕР 0071564 и EP 0588229, в DE 4310999 и DE 4311023, а также US 4965392.
Для иллюстрации варьируемых возможностей комплексообразующих агентов K согласно данному изобретению делается ссылка на фиг. 1-3, в которых несколько преимущественных структур компилированы. Эти иллюстрации подразумевают пример селекции и не ограничивают данное изобретение каким-либо способом в отношении представляемых комплексообразующих агентов.
Комплексообразующий агент K может содержать все радиоактивные изотопы, обычно используемые в ядерной медицине для диагностических и терапевтических целей в виде их ионов металлов. Могут быть также использованы стабильные изотопы, которые возбуждаются внешним облучением, чтобы испускать диагностическое или терапевтическое излучение, или изотопы, которые превращаются излучением извне в радиоактивные изотопы.
Изотопы, пригодные для данного изобретения, выбирают из элементов с атомными номерами 5, 21-29, 31, 39, 42-44, 49, 57-83 или 85.
Для использования соединения согласно изобретению в качестве радиофармацевтического средства комплексообрзующий агент содержит радиоактивный элемент. Для этой цели пригодны все радиоактивные элементы, которые способны оказывать терапевтическое или диагностическое действие in vivo или in vitro. Предпочтительными являются радиоактивные изотопы элементов меди, висмута, технеция, рения или индия. Особенно предпочтительны 99mТс-комплексы.
Если соединения общей формулы I согласно изобретению содержат позитрониспускающие изотопы, такие как, например, Sc-43, Sc-44, Fe-52, Co-55, Ga-68 или Cu-61, последние могут быть использованы в позитронэмиссионной томографии (ПЭТ, PET).
Если соединения общей формулы I согласно изобретению содержат гамма-излучениеиспускающие изотопы, такие как, например, Tc-99m или In-111, то их можно использовать в синглетной протонной эмиссионной томографии (СПЭТ, SPECT).
Соединения согласно изобретению могут быть использованы также в радиотерапии в виде их комплексов с радиоизотопами, такими как, например, Ir-192.
Соединения согласно данному изобретению могут быть также использованы в радиоиммунотерапии или радиационной терапии. Последние отличаются от соответствующей диагностики только количеством и типом используемого изотопа. В этом случае цель состоит в разрушении клеток опухоли высокоэнергетическим коротковолновым излучением в самой маленькой, насколько это возможно, области. Подходящими β-излучающими ионами являются, например, Sc-46, Sc-47, Sc-48, Ga-72, Ga-73, Y-90, Re-186 или Re-188. Подходящими α-излучающими ионами, имеющими небольшие периоды полураспада, являются, например, At-209, At-211, Bi-211, Bi-212, Bi-213 и Bi-214, и предпочтительным является Bi-212. Подходящим протон- и электронизлучающим ионом является 158Gd, который может быть получен из 157Gd путем нейтронного захвата.
Если агент согласно данному изобретению предназначен для использования в данном варианте радиационной терапии, предложенной R.L. Mills et al. (Nature 336, 787 (1988)), то центральный ион должен быть получен из Mossbauer изотопа, такого как, например, 57Fe или 151Eu.
Те группы карбоксильных кислот, которые не требуют для комплексообразования ионов металлов с атомными номерами с 21 по 29, 31, 39, 42 по 44, 49, 57 по 83 или 85, могут произвольно присутствовать в виде солей неорганических или органических
оснований, таких как гидроксиды и карбонаты щелочного металла или щелочноземельного металла, особенно гидроксид натрия и калия, или аммиак и алкиламины, или аминокислота, или в виде сложного эфира или амида.
Кроме того, могут быть использованы соединения, которые возбуждаются нейтронами с испусканием частиц и/или излучения. Особенно эффективен в этом случае гадолиний. Преимущественно, кроме того, могут быть использованы те соединения, которые содержат изотоп бор-10. В таких случаях K может иметь структуру
в которой X обозначает целое число от 1 до 10.
Кроме того, изобретение относится к способам получения конъюгатов согласно изобретению.
Так, конъюгаты, в которых соединяющий компонент B связан на 5'-конце олигонуклеотида, можно получить путем взаимодействия олигонуклеотида с фосфорамидитным производным (Tetrahedron 49, 1925-1963 (1993)). По этому концу 5'-гидроксигруппа олигонуклеотида подвергается взаимодействию с фосфорамидитом общей формулы PR'(NR''2)OR'''. В этом случае R' обозначает алкильную, алкокси или арилалкоксигруппу, произвольно содержащую N, NO2, Si или SO2, с 1 до 20 C атомов, такую как метил, этил, пропил, бутил, пентил, гексил, метокси, этокси, пропилокси, бутилокси, бензилокси или фенилэтокси, которая произвольно может быть замещена. В качестве заместителей особенно используют циано и нитрогруппы. Преимущественно, могут быть, например, использованы метокси, β- цианэтокси или нитрофенилэтоксигруппы. Особенно предпочтительны β-цианэтокси группы. R'' является C1-C4 алкильным радикалом, и особенно предпочтительными являются этильный и пропильный радикалы. R''' представляет алкильную или арилалкильную группу, произвольно содержащую S, O, N, CN, NO2 или галоид, с 1 до 20 C атомов. Предпочтительно используют защищенные амино и тиоалкильные радикалы, а также защищенные амино и тиоксаалкильные радикалы. Особенно предпочтительными являются 6-амино-гексил, 6-тиогексил, 3,6,9-триокса-11-амино-ундецил и 3,6-диокса-8-амино-октанильные группы. В качестве защитных групп обычно можно использовать обыкновенную N- или S-защитную группу. Например, подходящими являются трифторацетил, фталимидо и монометокситритильные группы.
В особенно предпочтительном варианте воплощения данного изобретения β-циaнoэтил-N,N-диизoпpoпилaминo-6- (трифторацетамидо)-1-гексил-фосфорамидит используют в качестве фосфорамидитного производного.
В другом предпочтительном варианте воплощения данного изобретения β-цианоэтил-N, N-диизопропиламино-(3,6,9-триокса-11-фталимидо-1- ундецил)-фосфорамидит используют в качестве фосфорамидитного производного.
В другом варианте воплощения данного изобретения соединяющий компонент B связан на 3'-конце олигонуклеотида N путем, аналогичным пути, описанном выше, при помощи фосфорсодержащей группы.
Вышеописанную реакцию между олигонуклеотидом и фосфорамидитом проводят по схеме твердофазного синтеза, и олигонуклеотид находится на колонке автоматического синтезатора. После получения олигонуклеотида требуемой последовательности 5'-гидроксигруппу олигонуклеотида обрабатывают, например, трихлоруксусной кислотой и подвергают взаимодействию с фосфорамидитом, продукт реакции окисляют и выделяют. Затем, таким образом полученное олигонуклеотидное производное связывают по концевой амино или тиольной группе с комплексообразующим агентом или комплексом К произвольно при помощи другой линкерной группы. Радикал, связанный на первой стадии при помощи фосфорсодержащей группы на олигонуклеотиде, затем образует, вместе с произвольно присутствующей дополнительной линкерной группой, соединяющий компонент В.
Сцепление между олигонуклеотидом и комплексообразующим агентом может также происходить таким образом, что свободная 5'-гидроксильная группа олигонуклеотида взаимодействует с комплексообразующим агентом или комплексом, который терминально несет способный образовывать связь фосфорсодержащий радикал. Такой радикал может быть описан формулой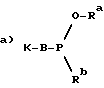
где Ra обозначает C1-C6 алкильный радикал, который произвольно несет цианогруппу в β-положении,
Rb обозначает вторичную аминогруппу и
K и B имеют указанное значение,
или формулой
где Rc обозначает катион триалкиламмоний и К и В имеют упомянутое значение,
или формулой
β
где R4 обозначает арильный радикал, произвольно замещенный одним или более атомами галоида и/или одной или более нитрогруппами, или C1-C6 алкильный радикал, который произвольно замещен в  -положении циано группой, и K, B и Rс имеют упомянутое значение, и при использовании радикала формулы а) стадия окисления в фосфат имеет место после завершения реакции связывания. В обоих случаях радикал -ORa или -ORo произвольно может быть отщеплен при гидролизе.
-положении циано группой, и K, B и Rс имеют упомянутое значение, и при использовании радикала формулы а) стадия окисления в фосфат имеет место после завершения реакции связывания. В обоих случаях радикал -ORa или -ORo произвольно может быть отщеплен при гидролизе.
Связывание олигонуклеотидного производного с помощью линкера с комплексообразующим агентом или комплексом может также происходить на твердой фазе на колонке автоматического синтезатора. Соединение согласно изобретению может быть затем отделено от твердого носителя путем разделения.
Сцепление олигонуклеотидного производного с линкером может иметь место не только при помощи 5'-ОН группы сахара концевого нуклеотида, но также при помощи других функциональных групп, которые могут быть генерированы из 5'-ОН группы, таких как, например, амино или карбоксигруппа. Такие нуклеотиды, несущие амино или карбоксигруппы, известны и могут быть легко получены. Синтез 5'-дезокси- 5'-аминоуридина описан в J. Med. Chem. 22, 1273 (1979), а также в Chem. Lett. 6, 601 (1976). 4'-Карбокси-5'-дезоксиуридин доступен, как описано в J. Med. Chem. 21, 1141, (1978) или Nucleic Acids Symp. Ser. 9, 95, (1981).
Связывание с комплексообразующим агентом в таком случае происходит при помощи линкера, несущего карбоновую кислоту или аминогруппу, способом, известным специалистам в данной области. Затем линкер образует соединяющий компонент В вместе с -NH-CH2-4' или -CO-4' группой.
Следует отметить, что распределение конъюгатов согласно изобретению в нуклеотидном радикале, соединяющем компоненте и комплексообразующем агенте или комплексе происходит исключительно формально и поэтому независимо от действительной синтетической структуры. Так, например, в вышеупомянутом случае группа -NH-CH2-4' или -CO-4' рассматривается как принадлежащая соединяющему компоненту B, в то время как олигонуклеотид, уменьшенный в 4-положении на CH2-OH группу, обозначают как олигонуклеотидный радикал N.
Способ получения конъюгатов, в которых соединяющий компонент с фосфордиэфирным или фосфоротиоатным мостиками, уменьшенными на ОН группы, имеет место, состоит в том, что сначала две сахаридные единицы связывают с динуклеотидом (смотри, например, Chem. Lett. 1305 (1933)). В этом случае сначала получается триэфир формулы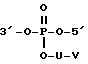
в которой U обозначает соответствующий алкиленовый радикал и V обозначает защищенную амино или серную группу. После отщепления, например, аминозащитной группы комплексообразующий агент может быть произвольно связан способом, известным специалистам в данной области, при помощи линкера с аминогруппой - например, в форме амидной связи. Линкер затем образует соединяющий компонент B вместе с группой O-U-V' (в которой V' обозначает группу -NH).
Альтернативный способ состоит в том, что фосфотриэфир, проходя через промежуточное положение (например, путем реакции с 1,5-диаминопентаном), подвергают аминолизу (смотри Biochemistry 27, 7237 (1988) или J. Am. Chem. Soc. 110, 4470 (1988)).
Полученные таким образом соединения формулы
могут быть связаны, как описано выше, с комплексообразующим агентом произвольно при помощи линкера.
Для целей связывания пригодны также динуклеозид-фосфат-монотиотриэфиры (смотри J. Am. Chem. Soc. 111, 9117 (1983) и Nucl. Acids Res. 20, 5205 (1992)).
Нуклеоснования представляют особенно большое разнообразие для связывания комплексообразующих агентов с нуклеотидами. Связывание с помощью аминогрупп в 2-положении в пуринах и в 4-положении в пиримидинах может происходить непосредственно. Но часто более выгодно сначала модифицировать пурины или пиримидины и связать эти модифицированные основания с комплексообразующими агентами (произвольно с помощью дополнительных линкеров). Подходящие модифицированные нуклеоснования описаны, например, в Biochemie [Biochemistry] 71, 319 (1989), Nucl. Acids Res. 16, 4937 (1988) или Nucleosides Nucleotides 10, 633 (1991).
Альтернативный способ связывания с помощью нуклеоснований заключается в палладийкатализируемом связывании бром или иод нуклеоснований с функциональными радикалами (Biogenic and Medical Chemistry Letter V, 361 (1994)). При помощи этих функциональных радикалов комплексообразующий агент может быть затем произвольно связан с нуклеоснованием посредством другого линкера согласно известным способам. В качестве функциональных радикалов в 5-положении пиримидина и в 8-положении пурина могут быть упомянуты в качестве примеров акриловый сложный эфир или аллиламин (смотри Nucl. Acids Res. 14, 6115 (1986) и Nucl. Acids Res. 16, 4077 (1988)). Другой альтернативный способ получения в 5-положении модифицированных пиримидинов, особенно для введения функциональных групп, таких как карбонильная, алкенильная или арильная группы в 5-положении, и улучшенный палладиевый катализатор, способный связывать модифицированные группы в 5-положении пиримидинов, описан в заявке на патент США Сер. N 08/076735, поданной 14 июня 1993. Галоидные производные, используемые в качестве предшественника, могут быть получены, как описано в Biophys. J. 41, 201 (1983), J. Am. Chem. Soc. 86, 1242 (1964) или Chem. Commun. 17 (1967).
Получение металлических комплексов согласно изобретению из свободных от металла олигонуклеотидных конъюгатов проводят, как раскрыто в DE 3401052, с помощью оксида металла или соли металла (например, нитрат, ацетат, карбонат, хлорид или сульфат) требуемого изотопа металла, который растворяют или суспендируют в воде и/или низшем спирте (таком как метанол, этанол или изопропанол) и который затем подвергают взаимодействию с раствором или суспензией эквивалентного количества олигонуклеотидного конъюгата, содержащего комплексообразующий агент, и затем, при необходимости, присутствующие кислые атомы водорода замещают катионами неорганических и/или органических оснований, или аминокислоты или свободные группы карбоновых кислот превращают в амиды аминокислот.
Нейтрализацию возможно все же присутствующих свободных кислых групп проводят с помощью неорганических оснований (например, гидроксиды, карбонаты или бикарбонаты) например, натрия, калия, лития, магния или кальция и/или органических оснований, таких как, среди других, первичные, вторичные и третичные амины, такие как, например, этаноламин, морфолин, глюкамин, N-метил- и N,N-диметил-глюкамин, а также основные аминокислоты, такие как, например, лизин, аргинин и орнитин, или с помощью амидов первоначально нейтральных или кислых аминокислот.
Получение фармацевтических агентов согласно данному изобретению происходит также путем, известным в данной области, при помощи олигонуклеотидных конъюгатов согласно изобретению - произвольно при помощи добавления добавок, обычных для галеновых препаратов - которые суспендируют или растворяют в водной среде, и затем суспензию или раствор произвольно стерилизуют или стерилизуют фильтрацией. Подходящими добавками являются, например, физиологически безвредные буферы (такие как, например, трометамин), добавки комплексообразующих агентов (такие как, например, диэтилентриаминпентауксусная кислота) или - при необходимости - электролиты, такие как, например, хлорид натрия или - при необходимости - антиоксиданты, такие как, например, аскорбиновая кислота, или, особенно для пероральных форм введения, маннит или другие осмотически активные вещества.
Если суспензии или растворы предлагаемых фармацевтических агентов в воде или физиологическом растворе требуются для энтерального применения или других целей, то их можно смешать с одним или более адъювантов, обычных для галеновых препаратов (например, метилцеллюлоза, лактоза, маннит), и/или с одним или более поверхностно-активных веществ (например, лектины, Твин (TweenTR, MyrjTR)).
Фармацевтические агенты согласно изобретению предпочтительно содержат от 0,1 мкмоль/л до 3 ммоль/л олигонуклеотидных конъюгатов согласно изобретению и обычно дозируются в количествах от 0,01 нмоль/кг - 60 мкмоль/кг. Они предназначены для энтерального и парентерального применения.
При in vivo использовании в медицине меченые соединения обычно дозируют в количествах меньших чем 10-10 моль/кг веса тела, и точную дозу можно широко варьировать как функцию области тела, подлежащей исследованию, но особенно также как функцию соответственно выбранного способа исследования. Исходя из среднего веса тела 70 кг, количество радиоактивности для диагностических применений находится между 40 и 1100 МБк, предпочтительно 200-800 МВк, для терапевтических применений - 1-500 МБк, предпочтительно 10-100 МБк на применение. Введение обычно проводят внутривенно, внутриартериально, внутритканево, перитонеально или внутрь опухоли, и внутривенное введение является предпочтительным. В общем, вводят на исследование от 0,01 до 20 мл агента, о котором идет речь.
Данное изобретение относится также к способу обнаружения структур-мишеней. В этом случае, одно или более из вышеописанных соединений контактирует с образцом, подлежащим изучению in vivo или in vitro. В этом случае, олигонуклеотидный радикал N связывается специфически и с высоким связывающим сродством со структурой-мишенью, подлежащей обнаружению.
Если структура-мишень присутствует в образце, то она может быть определена там на основе сигнала. Способ особенно пригоден для неинвазивной диагностики заболеваний. В этом случае, одно или более из вышеописанных соединений вводят in vivo и можно определить с помощью сигнала, присутствует ли структура-мишень, с которой олигонуклеотидный радикал N связывается специфически и с высоким сродством, в организме, подлежащем исследованию.
Но помимо просто обнаружения структур-мишеней в образцах, подлежащих исследованию, последнюю можно также специфически разрушить. В этом аспекте, соединения данного изобретения особенно пригодны в радиотерапии, например, при лечении рака.
Другой вариант воплощения данного изобретения включает диагностический набор для in vivo определения структур-мишеней, который содержит один или более из вышеупомянутых соединений.
Конъюгаты и агенты согласно изобретению отвечают многим требованиям, которые должны предъявляться к фармацевтическому агенту для радиотерапии и диагностики. Они особенно отличаются высокой специфичностью или сродством по отношению к рассматриваемой структуре-мишени. Что касается известных олигонуклеотидных конъюгатов, конъюгаты предлагаемого изобретения демонстрируют особенно высокую in vivo стабильность. Это достигается путем замещения 2-гидроксильной группы и включением модифицированных тимидиновых последовательностей по концевым гидроксильным группам нуклеотидов. Неожиданно, что специфичность олигонуклеотида существенно не ухудшается ни путем этой модификации, ни путем связывания с комплексообразующим агентом. Другими преимуществами являются контролируемая фармакокинетика, а также требуемая совместимость.
Краткое описание фигур.
Различные другие цели, признаки и сопутствующие преимущества настоящего изобретения будут более полно оценены, как они же становятся более понятными при рассмотрении в сочетании с прилагаемыми фигурами, в которых:
фиг. 1 показывает отбор циклических комплексообразующих агентов K, которые могут быть преимущественно использованы для данного изобретения, "b" обозначает место связывания на соединяющем компоненте B;
фиг. 2 и 3 показывают отбор комплексообразующих агентов K с открытой цепью, которые могут быть преимущественно использованы для данного изобретения.
Следующие примеры приведены для более подробной иллюстрации изобретения.
Полинуклеотиды, описанные в примерах, содержат модифицированные соединения.
Они означают:
A, U, C, G нуклеотиды содержат 2'-OCH3 группу
*: нуклеотидная связь - метил фосфонат
**: нуклеотидная связь - тиофосфонат
***: нуклеотидная связь - дитиофосфонат
Без дальнейших уточнений, полагают, что любой специалист в данной области может, используя предшествующее описание, использовать данное изобретение в его наиболее полном объеме. Нижеследующие предпочтительные конкретные варианты воплощения изобретения следует поэтому рассматривать как просто иллюстративные и не ограничивающие объем данного изобретения.
В нижеследующих примерах все температуры приводятся (некорректированными) в градусах Цельсия; и, за исключением особо оговоренных случаев, все части и процентные содержания являются весовыми.
Полное раскрытие всех заявок, патентов и публикаций, цитируемых выше и ниже, включая DE 4424922.5, поданной 14 июля 1994, включены здесь в качестве уровня техники.
Пример 1
a) 5'(6-Амино-гексил-фосфорная кислота сложный эфир-)35-мерного олигонуклеотида
5'-CUCAUGGAGCGCAAGACGAAUAGCUACAUAT*T*T*T*T*-3'
30-мерный олигонуклеотид
5'-CUCAUGGAGCGCAAGACGAAUAGCUACAUA-3', идентифицированный по SELEX способу, с модификацией последовательности T*T*T*T*T-3', расположенной против хода транскрипции, получают обычным путем в автоматическом синтезаторе Pharmacia company (смотри Oligonucleotides and Analogues, A Practical Approach, Ed. F. Eckstein, Oxford University Press. Oxford, New York, Tokyo, 1991), и олигонуклеотид также присутствует на колонке твердого носителя. Путем реакции с раствором трихлоруксусной кислоты в дихлорметане открывают 5'-гидроксигруппу. Нагрузка колонки составляет около 10 мг 35- мерного олигонуклеотида. Чтобы соединить линкер, колонку подвергают взаимодействию с ацетонитрильным раствором 50 мкмоль β-циано-этил-N,N-диизопропиламино-6-(трифтороацетамидо)1-гексил- фосфорамидита (полученного согласно Nucl. Acids Res. 16, 2659-2669 (1988)) в присутствии тетразола. Окисление образовавшегося фосфита в полностью защищенный фосфотриэфир проводят с помощью иода в тетрагидрофуране. Затем колонку промывают последовательно метанолом и водой. Чтобы удалить модифицированный олигонуклеотид от твердого носителя, содержимое колонки транспортируют в мультиампулу, смешивают с 5 мл 30% раствора аммиака, сосуд герметизируют и встряхивают на протяжении ночи при 55oC. Затем охлаждают до 0oC, центрифугируют, носитель промывают 5 мл воды, и объединенные водные фазы подвергают лиофильной сушке.
Для очистки твердое вещество помещают в 2 мл воды, смешивают с 2 мл 0,5 М раствора ацетата аммония и смешивают с 10 мл этанола, оставляют стоять на протяжении ночи при -20oC, центрифугируют и остаток промывают 1 мл этанола (-20oC) и, наконец, сушат в вакууме при комнатной температуре. 8 мг названного соединения получают в виде бесцветного порошка.
b) 10-[5-(2-карбоксифенил)-2-гидрокси-5-оксо-4-аза-пентил] -1,4,7-трис- (карбоксиметил)-1,4,7,10-тетраазациклододекан
50 г (144,3 ммоль) 1,4,7-трис-(карбоксиметил)-1,4,7,10- тетраазациклододекана (D03A) растворяют в 250 мл воды и pH доводят до 13 при помощи 5 N раствора гидроксида натрия. Затем раствор 38,12 г (187,6 ммоль) N-(2,3-эпоксипропил)-фталимида в 100 мл диоксана прикапывают по капле в пределах одного часа, перемешивают в течение 24 часов при 50oC и pH поддерживают при 13 путем добавления 5 N раствора гидроксида натрия. Раствор доводят до pH 2 с помощью 10% хлористоводородной кислоты и выпаривают досуха в вакууме. Остаток растворяют в небольшом количестве воды и очищают на ионообменной колонке (Reillex(R) = поли-(4-винил)-пиридин, колонку элюируют водой). Основные фракции концентрируют путем испарения в вакууме, и остаток подвергают окончательной очистке при помощи хроматографии на RP-18 (LiChroPrep(R)/подвижный растворитель: градиент тетрагидрофуран/метанол/вода). После концентрирования испарением основных фракций получают 63,57 г (71% от теор.) аморфного твердого вещества.
Содержание воды: 8,5%
Элементный анализ (относительно безводного вещества):
Рассч. C 52,90; H 6,57; N 12,34.
Найд. C 52,65; H 6,68; N 12,15.
c) 10-(3-Амино-2-гидрокси-пропил)-1,4,7-трис(карбоксиметил)- 1,4,7,10-тетраазациклододекан
50 г (88,1 ммоль) названного соединения примера 1b кипятят с обратным холодильником в 300 мл концентрированной хлористоводородной кислоты в течение 24 часов. Содержимое испаряют досуха, остаток растворяют в небольшом количестве воды и очищают на ионообменной колонке (Reillex(R) = поли-(4-винил)-пиридин, колонку элюируют водой). Основные фракции выпаривают досуха.
Выход: 39 г (95% от теор.) стекловидного твердого вещества
Содержание воды: 10,3%
Элементный анализ (относительно безводного вещества):
Рассч. C 48,68; H 7,93; N 16,70.
Найд. C 48,47; H 8,09; N 16,55.
d) 10-[7-(4-Нитрофенил)-2-гидрокси-5-оксо-7-(карбоксиметил) -4-аза-гептил]-1,4,7-трис(карбоксиметил)-1,4,7,10-тетраазациклододекан
9,84 г (41,8 ммоль) 3-(4-нитрофенил)-глутарового ангидрида (J. Org. Chem. 26, 3856 (1961)) добавляют к 14,62 г (34,86 ммоль) названного соединения примера 1c) в 200 мл диметилформамида/20 мл триэтиламина и перемешивают на протяжении ночи при комнатной температуре. Выпаривают досуха в вакууме. Остаток перекристаллизовывают из смеси изопропанол/уксусная кислота 95:5.
Выход: 21,68 г (95% от теор.) желтоватого твердого вещества
Содержание воды: 0,9%
Элементный анализ (относительно безводного вещества):
Рассч. C 51,37; H 6,47; N 12,84.
Найд. C 51,18; H 6,58; N 12,67.
e) 10-[7-(4-Аминофенил)-2-гидрокси-5-оксо-7-(карбоксиметил)-4-aзa- гeптил]-1,4,7-трис(карбоксиметил)- 1,4,7,10-тетраазациклододекан
21,0 г (32,07 ммоль) названного соединения примера 1d) растворяют в 250 мл этанола и добавляют 5 г палладиевого катализатора (10% Pd на C). Содержимое гидрируют в течение ночи при комнатной температуре. Катализатор отфильтровывают, и фильтрат выпаривают досуха в вакууме.
Выход: 19, 63 г (98% от теор.) твердого вещества кремового цвета
Содержание воды: 0,8%
Элементный анализ (относительно безводного вещества):
Рассч. C 53,84; H 6,35; N 12,60.
Найд. C 53,73; H 6,45; N 12,51.
f) 10-[7- (4-Изотиоцианатофенил) -2-гидрокси-5-оксо-7-(карбоксиметил)- 4-аза-гептил]-1,4,7-трис(карбоксиметил)-1,4,7,10-тетраазациклододекан
12,4 г (19,27 ммоль) названного соединения примера 1e) растворяют в 200 мл воды и добавляют 6,64 г (57,8 ммоль) тиофосгена в 50 мл хлороформа. Содержимое перемешивают в течение 1 часа при 50oC. Охлаждают до комнатной температуры, органическую фазу отделяют, и водную фазу встряхивают дважды со 100 мл хлороформа. Водную фазу выпаривают досуха, и остаток абсорбционно осаждают в 100 мл изопропанола при комнатной температуре. Твердое вещество отфильтровывают и промывают эфиром. После сушки на протяжении ночи в вакууме (40oC) получают 12,74 г (97% от теор.) твердого вещества кремового цвета.
Содержание воды: 3,1%
Элементный анализ (относительно безводного вещества):
Рассч. C 52,24; H 6,35; N 12,60; S 4,81
Найд. C 52,37; H 6,44; N 12,48; S 4,83.
g) Конъюгат 5-(6-амино-1-гексил-фосфорная кислота сложный эфир) 35-мерного олигонуклеотида
5'- CUCAUGGAGCGCAAGACGAAUAGCUACAUAT*T*T*T*T-3' и 10-[7-(4-Изотиоцианатофенил)-2-гидрокси-5-оксо-7-(карбоксиметил)-4-аза-гептил] - 1,4,7-трис(карбоксиметил)-1,4,7,10-тетраазациклододекана
8 мг олигонуклеотида, полученного в примере 1a), растворяют в 2,5 мл NaHCO3/Na2CO3 буфера (pH 8,0) и смешивают с 1 мг 10-[7-(4-изотиоцианатофенил)-2-гидрокси-5-оксо-7- (карбоксиметил)-4-аза-гептил]-1,4,7-трис(карбоксиметил)-1,4,7,10- тетраазациклододекана (названное соединение примера 1f). Перемешивают в течение 5 часов при комнатной температуре, pH доводят до 7,2 путем добавления 0,01 М хлористоводородной кислоты, и этот раствор подвергают ультрафильтрации через мембрану с пределом эксклюзии 3000 (Amicon YM3) и затем лиофильно сушат. Получают 7 мг требуемого конъюгата.
h) 111Индий комплекс тиомочевинового конъюгата 5'-(6-амино-гексил-фосфорная кислота сложный эфир) 35-мерного олигонуклеотида 5'-CUCAUGGAGCGCAAGACGAAUAGCUACAUAT*T*T*T*T-3' и 10-[7-(4-изотиоцианатофенил)-2-гидрокси-5-оксо-7-(карбоксиметил)-4-аза-гептил] - 1,4,7-трис(карбоксиметил)-1,4,7,10-тетраазациклододекана
15 мкл 111Индий (III) ацетатного раствора (350 мкКи), (полученного из 111Индий (III) хлорида в 2 М растворе ацетата натрия и доведенного до pH 4,0 с помощью 0,1 М хлористоводородной кислоты) добавляют к 135 мкл раствора 1 мг названного соединения примера 1g) в MES буфере, pH 6,2 (MES = 2-(N- морфолино)-этилсульфоновая кислота). pH доводят до 4,2 добавлением 0,01 М хлористоводородной кислоты. Перемешивают в течение 1 часа при 37oC при pH 4,2. Доводят до pH 6 при помощи 2 М раствора ацетата натрия и добавляют 10 мкл 0,1 М Na2EDTA = динатриевая соль этилендиаминтетрауксусной кислоты, чтобы комплексовать избыток 111Индий. Конечную очистку полученного таким образом меченого конъюгата (1h) проводят с помощью HPLC (ЖХВР) (вытеснительная хроматография: TSK-400/MES-буфер). Фракции, содержащие меченый конъюгат, разбавляют обычным физиологическим раствором, доведенным до pH 7,2 с помощью 0,01 М раствора гидроксида натрия, и фильтруют. Полученный таким образом раствор представляет препарат, пригодный для радиодиагностики.
Пример 2.
а) Конъюгат 5'-(6-амино-1-гексил-фосфорная кислота сложный эфир) 35-мерного олигонуклеотида 5'- CUCAUGGAGCGCAAGACGAAUAGCUACAUAT*T*T*T*T-3' и N-[2-aмино-3-(4-изотиоцианатофенил)пропил]-транс-циклогексан-1,2-диамин- N,N', N',N'',N''-пентауксусной кислоты
8 мг олигонуклеотида, полученного в примере 1a), растворяют в 2,5 мл NaHCO3/Na2CO3 буфера (pH 8,0) и добавляют 1 мг N-[2-амино-3-(п-изотиоцианатофенил)пропил] -транс-циклогексан-1,2-диамин- N, N', N',N'',N''-пентауксусной кислоты (полученной согласно Bioconjugate Chem. 1, 59 (1990)), перемешивают в течение 5 часов при комнатной температуре, затем доводят pH до 7,2 с помощью 0,2 М хлористоводородной кислоты, и раствор подвергают ультрафильтрации через мембрану с пределом эксклюзии 3000 (Amicon YM3). После лиофильной сушки получают 6 мг тиомочевинового конъюгата 2a).
b) Висмут-212 комплекс конъюгата 5'-(6-амино-1-гексилфосфорная кислота сложный эфир) 35-мерного олигонуклеотида 5'-CUCAUGGAGCGCAAGACGAAUAGCUACAUAT*T*T*T*T-3' и N-[2-амино-3-(4-изотиоцианатофенил)пропил]-транс-циклогексан-1,2-диамин-N,N'-N',N'',N''-пeнтaукcуcнoй кислоты
Раствор 212Висмут-тетраиодида в 0,1 М иодистоводородной кислоте доводят до pH 4 с помощью 2 М уксусной кислоты. Аликвоту этого раствора активностью около 3 мКи (mCi) добавляют к 1 мг названного соединения примера 2a), растворенного в 0,5 мл 0,02 М MES-буфера и добавляют 0,5 мл 0,15 М раствора хлорида натрия. Перемешивают в течение 20 минут при комнатной температуре. Доводят до pH 6 с помощью 2 М раствора ацетата натрия и добавляют 20 мкл 0,01 М Na2EDTA раствора. Перемешивают в течение 20 минут. Очистку комплекса проводят с помощью HPLC (ЖХВР) (вытеснительная хроматография: TSK-400/MES-буфер). Фракции радиоактивного конъюгата объединяют, разбавляют обычным физиологическим раствором и доводят до pH 7,2 с помощью 0,1 М раствора гидроксида натрия. После фильтрации получают препарат, пригодный для радиотерапии.
Пример 3.
a) Индий-III комплекс конъюгата 5'-(6-амино-1-гексилфосфорная кислота сложный эфир) 35-мерного олигонуклеотида 5'-CUCAUGGAGCGCAAGACGAAUAGCUACAUAT*T*T*T*T-3' и N-[2-амино-3-(4-изотиоцианатофенил)пропил]-транс-циклогексан-1,2-диамин-N,N',N',N",N''-пентауксусной кислоты
15 мл 15 мкл 111Индий (III) ацетатного раствора (350 мкКи) (полученного из 111Индий (III) хлорида в 2 М растворе ацетата натрия и доведенного до pH 4,0 с помощью 0,1 М хлористоводородной кислоты) добавляют к 0,5 мл раствора 1 мг названного соединения примера 2a) в MES буфере, pH 6,2 (MES = 2-(N-морфолино)-этилсульфоновая кислота). pH доводят до pH 5,0 добавлением 0,01 М хлористоводородной кислоты. Перемешивают в течение 1 часа при 37oC при pH 5,0. Доводят до pH 6 при помощи 2 М раствора ацетата натрия и добавляют 10 мкл 0,1 М Na2EDTA = динатриевая соль этилендиаминтетрауксусной кислоты, чтобы комплексовать избыток 111Индий. Конечную очистку полученного таким образом меченого конъюгата (1h) проводят с помощью ЖХВР (вытеснительная хроматография: TSK-400/MES-буфер). Фракции, содержащие меченый конъюгат, разбавляют обычным физиологическим раствором, доведенным до pH 7,2 с помощью 0,01 М раствора гидроксида натрия, и фильтруют. Полученный таким образом раствор представляет препарат, пригодный для радиодиагностики.
Пример 4.
a) Конъюгат 5'-(6-амино-1-гексил-фосфорная кислота сложный эфир) 35-мерного олигонуклеотида 5'- CUCAUGGAGCGCAAGACGAAUAGCUACAUAT*T*T*T*T-3' и 2-(4-изотиоцианато-бензил)-диэтилентриамин-N,N,N',N'',N''-пентауксусной кислоты
8 мг олигонуклеотида, полученного в примере 1a), растворяют в 2,5 мл NaHCO3/Na2CO3 буфера (pH 8,0) и добавляют 1 мг 2-(4-изотиоцианато-бензил)-диэтилентриамин-N, N',N',N'',N''- пентауксусной кислоты (полученной согласно Bioconjugate Chem. 2, 187 (1991)). Перемешивают в течение 5 часов при комнатной температуре, затем pH доводят до 7,2 с помощью 0,01 М хлористоводородной кислоты, и этот раствор подвергают ультрафильтрации через мембрану с пределом эксклюзии 3000 (Amicon YM3). После лиофильной сушки получают 6 мг конъюгата тиомочевины.
b) Иттрий-90 комплекс конъюгата 5'-(6-амино-1-гексил-фосфорная кислота сложный эфир) 35-мерного олигонуклеотида 5'-CUCAUGGAGCGCAAGACGAAUAGCUACAUAT*T*T*T*T-3' и 2-(4-изотиоцианато-бензил)-диэтилентриамин-N, N,N',N'', N''- пентауксусной кислоты
К раствору 90Иттрия, растворенного в 0,05 М растворе ацетата аммония (прибл. 380 мКи), добавляют 1 мг производного тиомочевины примера 4a) в 0,5 мл 0,05 М раствора ацетата аммония с pH 6, доводят до pH 5,2 с помощью 3 М уксусной кислоты и перемешивают в течение 1 часа при комнатной температуре. Доводят до pH 7,0 с помощью 0,01 М раствора гидроксида натрия, и конъюгат очищают с помощью ЖХВР (TSK-400/MES-буфер). Основные фракции объединяют, разбавляют обычным физиологическим раствором и доводят до pH 7,2 с помощью 0,01 М раствора гидроксида натрия. После фильтрации получают препарат, пригодный для радиотерапии.
Пример 5.
a) 5'-(6-Меркапто-1-гексил-фосфорная кислота сложный эфир) 35-мерного олигонуклеотида 5'-T*T*T*T*TAGGAGGAGGAGGGAGAGCGCAAAUGAGAUU-3' (модифицированный лиганд для сериновой протеазы) 30-мерный олигонуклеотид
5'-AGGAGGAGGAGGGAGAGCGCAAAUGAGAUU-3' (посл. N 13 патент США N 5 270163), идентифицированный по SELEX способу, модифицированный в сахаридных звеньях и при помощи 5'-связанной последовательности 5 тимидинов, получают обычным путем в автоматическом синтезаторе Pharmacia company (смотри Oligonucleotides and Analogues, A Practical Approach, Ed. F. Eckstein, Oxford University Press, Oxford, New York, Tokyo, 1991), и олигонуклеотид также присутствует на колонке твердого носителя. Путем реакции с раствором трихлоруксусной кислоты в дихлорметане открывают 5'-гидроксигруппу. Нагрузка колонки составляет около 10 мг 35-мерного олигонуклеотида. Чтобы соединить линкер, колонку подвергают взаимодействию с раствором 50 мкмоль β-цианоэтил-N,N-диизопропил-амино-S-тритил-6-(меркапто)-фосфорамидита в ацетонитриле в присутствии тетразола. Окисление образовавшегося фосфита в полностью защищенный фосфотриэфир проводят с помощью иода в тетрагидрофуране. Затем колонку промывают последовательно метанолом и водой. Чтобы удалить модифицированный олигонуклеотид от твердого носителя, содержимое колонки транспортируют в мультиампулу, смешивают с 5 мл 30% раствора аммиака, сосуд герметизируют и подвергают вибрации на протяжении ночи при 55oC. Затем охлаждают до 0oC, центрифугируют, носитель промывают 5 мл воды, и объединенные водные фазы подвергают лиофильной сушке.
Для очистки твердое вещество помещают в 2 мл воды, смешивают с 2 мл 0,5 М раствора ацетата аммония и смешивают с 10 мл этанола, оставляют на всю ночь при -20oC, центрифугируют, и остаток промывают 1 мл этанола (-20oC) и, наконец, сушат в вакууме при комнатной температуре.
Получают 9 мг S-тритилированного названного соединения.
Чтобы отщепить защитную тритиловую группу, продукт растворяют в 0,5 мл воды, смешанной с 0,2 мл 1 М раствора нитрата серебра и перемешивают в течение 1 часа при комнатной температуре. Затем содержимое смешивают с 0,1 мл 1 М дитиотреитольного раствора. Через 15 минут центрифугируют, и супернатантный раствор экстрагируют несколько раз этилацетатом. После лиофилизации из водного раствора получают 8 мг требуемого названного соединения.
b) 4-Бензилокси-N-метансульфонил-фенилаланин-метиловый эфир
19,58 г хлорида метансульфоновой кислоты вливают по капле в 50 г 4-бензилокси-фенилаланин-метиловый эфир-гидрохлорида в 300 мл пиридина при 0oC и перемешивают в течение 3 часов при 0oC. Выпаривают досуха в вакууме, и этот остаток растворяют в 500 мл дихлорметана. Дважды встряхивают, каждый раз с 300 мл 5 N хлористоводородной кислоты, сушат сульфатом магния и концентрируют выпариванием в вакууме. Остаток перекристаллизовывают из 150 мл метанола.
Выход: 53,64 г бесцветного кристаллического порошка.
с) 2-(4-Бензилоксибензил)-1-метансульфонил-1,4,7-триазагептан-3-он
37,2 г 4-бензилокси-N-метансульфонил-фенилаланин-метилового эфира и 1,2 л 1,2-диаминоэтана перемешивают в течение 3 часов при 80oC. Остаток выпаривают досуха и абсорбционно осаждают 200 мл воды, осадок отсасывают, промывают до нейтральной реакции водой и сушат в течение ночи при 60oC.
Выход: 37,68 г кремового аморфного порошка.
d) 2-(4-Бензилоксибензил)-1-метансульфонил-7- (трет-бутил- оксикарбонил)-1,4,7-триазагептан-3-он
Раствор 16,23 г 2-(4-бензилоксибензил)-1-метансульфонил-1,4,7-тpиaзaгeптaн-3-oнa и 4,76 г триэтиламина в 200 мл хлороформа смешивают при 0oC с раствором 10,27 г ди-трет-бутил-дикарбоната в 50 мл хлороформа. Перемешивают в течение 5 часов при комнатной температуре, встряхивают с 5% раствором карбоната натрия и водой, сушат над сульфатом магния и концентрируют выпариванием в вакууме. Остаток рекристаллизуют из 100 мл метанола.
Выход: 20,19 г вспененного твердого вещества.
e) 2-(4-Гидроксибензил)-1-метансульфонил-7-(трет-бутил-оксикарбонил) -1,4,7-триазагептан-3-он
20 г 2-(4-бензилоксибензил)-1-метансульфонил-7-(трет-бутилоксикарбонил)- 1,4,7-триазагептан-3-она, растворенного в 300 мл дихлорметана, перемешивают с 4 г палладий-углерода (10%) в течение ночи в атмосфере водорода. Фильтруют, и раствор концентрируют выпариванием в вакууме.
Выход: 16,17 г стекловидной пены, которая затвердевает через несколько минут.
f) 2-[4-(3-Оксапропионовая кислота-бензиловый эфир)-бензил]-1- метансульфонил-7-(трет-бутилоксикарбонил)-1,4,7-триазагептан-3-он
15 г 2-(4-гидроксибензил)-1-метансульфонил-7- (трет-бутилоксикарбонил)- 1,4,7-триазагептан-3-она, 8,56 г бромуксусная кислота-бензилового эфира и 13,18 г карбоната калия нагревают с обратным холодильником в 300 мл ацетонитрила в течение 24 часов. Фильтруют и выпаривают досуха в вакууме. Остаток растворяют в 200 мл дихлорметана, дважды встряхивают, каждый раз с 50 мл воды. Органическую фазу сушат над сульфатом магния и концентрируют выпариванием в вакууме. Остаток хроматографируют смесью дихлорметан-гексан-ацетон (20/10/1) в качестве элюента.
Выход: 10,06 г вспененного твердого вещества
g) 2-[4-(3-Оксапропионовая кислота-бензиловый эфир)-бензил]-1- метансульфонил-1,4,7-триазагептан-3-он
10 г 2-[4-(3-Оксапропионовая кислота-бензиловый эфир)-бензил]-1- метансульфонил-7-(трет-бутилоксикарбонил)-1,4,7-триазагептан-3-она перемешивают в течение 1 часа при комнатной температуре со 100 мл трифторуксусной кислоты. Выпаривают досуха в вакууме.
Выход: 9,2 г стекловидной пены, которая отверждается при стоянии.
h) 9-Хлоро-1-метансульфонил-2-[4-(3-оксапропионовая кислота-бензиловый эфир)-бензил]-1,4,7-триаза-3,8-дион
9 г 2-[4-(3-Оксапропионовая кислота-бензиловый эфир)-бензил]-1- метансульфонил-1,4,7-триазагептан-3-она и 1,78 г триэтиламина растворяют в 200 мл хлороформа. При 0oC 1,98 г хлорацетил хлорида, растворенного в 20 мл хлороформа, вливают по капле в течение 30 минут и затем перемешивают в течение 2 часов при 0oC. Промывают 100 мл 5% хлористоводородной кислоты, дважды водой по 50 мл каждый раз, сушат над сульфатом магния и выпаривают досуха в вакууме. Остаток хроматографируют на силикагеле смесью дихлорметан-этилацетат (20/1) в качестве элюента.
Выход; 6,97 г воскообразного твердого вещества.
i) 9-Хлоро-1-метансульфонил-2-[4-(3-оксапропионовая кислота-бензиловый эфир)-бензил] -1,4,7-триаза-3,8-дион
6,5 г 9-Хлоро-1-метансульфонил-2-[4-(3-оксапропионовая кислота-бензиловый эфир)-бензил] -1,4,7-триаза-3,8-диона, растворенного в 150 мл дихлорметана, перемешивают с 2 г палладий-углерода (10%) в течение ночи в атмосфере водорода. Фильтруют, и раствор концентрируют выпариванием в вакууме.
Выход: 5,33 стекловидного твердого вещества.
j) 10-Ацетил-2-[4-(3-оксапропионовая кислота)-бензил]-1- (метансульфонил)-10-тиа-1,4,7-триазадекан-3,8-дион
5 г 9-хлоро-1-метансульфонил-2-[4-(3-оксапропионовая кислота- бензиловый эфир)-бензил]-1,4,7-триаза-3,8-диона, растворенного в 80 мл хлороформа, кипятят с обратным холодильником с 1,98 г триэтиламина и 0,74 г тиоуксусной кислоты в течение 10 минут. Раствор выливают в 200 мл охлаждаемой льдом 5% хлористоводородной кислоты, органическую фазу отделяют, сушат над сульфатом магния и концентрируют выпариванием в вакууме. После хроматографирования на силикагеле смесью гексан-этилацетат (3/1) получают 4,64 г требуемого соединения в виде стекловидного твердого вещества.
k) 10-Ацетил-2-[4-(3-оксапропионовая кислота)-(2,5-диоксо-пирролидин- 1-ил)-эфир)-бензил]-1-(метансульфонил)-10-тиа-1,4,7-триазадекан-3,8-дион
4 г 10- ацетил-2-[4-(3-оксапропионовая кислота)-бензил]-1- (метансульфонил)-10-тиа-1,4,7-триазадекан-3,8-диона, 1,91 г дициклогексилкарбодиимида, 4 г N-гидроксисукцинимида и 30 мг 4- диметиламинопиридина перемешивают в течение 24 часов в 20 мл хлороформа при комнатной температуре. Затем перемешивают с 20 мл диэтилового эфира, фильтруют, и остаток концентрируют выпариванием в вакууме. Остаток хроматографируют на силикагеле смесью дихлорметан-диоксан (10/1) в качестве элюента.
Выход: 3,47 г кремового твердого вещества
Элементный анализ:
Рассч. C 46,15; H 4,93; N 9,78; S 11,20,
Найд. C 46,03; H 4,83; N 9,64; S 11,05.
1) 10-Ацеатил-2-{[4-(3-оксапропионовая кислота-(6-малеимидо-гексаноил)- гидразид]-бензил}-1-метансульфонил-10-тиа-1,4,7-триазадекан-3,8-дион
3 г 10-ацетил-2-[4-(3-оксапропионовая кислота)-(2,5-диоксо- пирролидин-1-ил)-эфир)-бензил] -1-(метансульфонил)-10-тиа-1,4,7-триазадекан- 3,8-диона и 1,17 г гидразида 6-малеимидокапроновая кислота (Science 261, 212 (1993)) перемешивают в 40 мл диметилформамида в течение 5 часов при 60oC. При интенсивном перемешивании вливают по капле 100 мл воды и отфильтровывают от осаждаемого осадка. Сушат в вакууме, и остаток очищают с помощью Флеш (FLASH) хроматографии на силикагелевой колонке смесью дихлорметан/диоксан (10/1) в качестве элюента. Получают 2,8 г названного соединения в виде белого твердого вещества.
Элементный анализ (относительно безводного вещества):
Рассч. C 49,25; H 5,61; N 12,30; S 9,39.
Найд. C 49,33; H 5,95; N 12,43; S 9,11.
m) Конъюгат 5'-(6-Меркапто-1-гексил-фосфорная кислота сложный эфир) 35-мерного олигонуклеотида
5'- T*T*T*T*TAGGAGGAGGAGGGAGAGCGCAAAUGAGAUU-3' и 10-Ацетил-2-{4-[3-оксапропионовая кислота)-(6-малеимидо-гексаноил)-гидразид] - бензил}-1-метансульфонил-10-тиа-1,4,7-триазадекан-3,8-дион
5 мг тиолсодержащего олигонуклеотида, полученного согласно примеру 5a), смешивают в 2 мл фосфатного буфера (pH 7,4) с 1 мг производного малеимида, полученного согласно примеру 51), растворенного в 0,2 мл диметилформамида. Оставляют стоять в течение 2 часов при комнатной температуре, и раствор подвергают ультрафильтрации через мембрану с пределом эксклюзии 3 000 (Amicon YM3) и затем лиофильно сушат. Получают 5 мг требуемого конъюгата.
n) Технеций-99m комплекс конъюгата 5'-(6-Меркапто-1- гексил-фосфорная кислота сложный эфир) 35-мерного олигонуклеотида 5'-T*T*T*T*TAGGAGGAGGAGGGAGAGCGCAAAUGAGAUU-3' и 10-ацетил-2-{4-[3-оксапропионовая кислота)-(6-малеимидо-гексаноил) -гидразид] -бензил} -1-метансульфонил-10-тиа-1,4,7-триазадекан-3,8-дион
1 мл раствора калий-D-глюкарата (12 мг/мл) и хлорида олова (II) (100 мкг/мл) в 0,2 М NaHCO3 сушат вымораживанием в ампуле и затем смешивают с раствором [Tc-99m] -натрий пертехнетата (1 мл, 1 мКи [mCi]) из Мо-99/Tc-99m генератора. После стояния при комнатной температуре в течение 15 минут аликвоту удаляют и смешивают с таким же объемом конъюгата примера 5m) (1 мг/мл), растворенного в 0,2 М растворе NaHCO3. Через 15 минут как тонкослойная хроматография, так и HPLC (ЖХВР) показывают, что > 98% радиоактивности взято конъюгатом.
Пример 6.
а) Конъюгат 5'-(6-амино-1-гексил-фосфорная кислота сложный эфир) 35-мерного олигонуклеотида
5'-CUCAUGGAGCGCAAGACGAAUAGCUACAUAT*T*T*T*T-3' и S-бензоил-MAG3-2,3,5,6-тетрафторфенилового эфира
3 г S-бензоил-MAG3-2,3,5,6-тетрафторфенилового эфира (полученного согласно патенту США 4965392), растворенного в 0,2 мл диметилформамида, добавляют к 8 мг названного соединения примера 1a), растворенного в 0,5 мл 0,1 М фосфатного буфера (pH 7), и перемешивают в течение 3 часов при комнатной температуре. Разбавляют водой, и раствор подвергают ультрафильтрации (Amicon YM3, предел эксклюзии 3000). После лиофильной сушки получают 5 мг конъюгата 6a).
b) 99mТехнеций комплекс конъюгата 5'-(6-амино- 1-гексил-фосфорная кислота сложный эфир) 35-мерного олигонуклеотида 5'-CUCAUGGAGCGCAAGACGAAUAGCUACAUAT*T*T*T*T-3' и S-бензоил-MAG3-2,3,5,6-тетрафторфенилового эфира
1 мг названного соединения примера 6a) растворяют в 200 мкл воды и смешивают с 1 мл 0,1 М фосфатного буфера, pH 8,5. К этой смеси добавляют 200 мкл раствора 99mТехнеций-(Y)-глюконат (прибл. 15 мКи) и оставляют стоять в течение 15 минут при комнатной температуре. Выход по изотопу (определено с помощью ЖХВР) составляет около 95%.
Пример 7.
a) Конъюгат 5'-(6-амино-1-гексил-фосфорная кислота сложный эфир) 35-мерного олигонуклеотида 5'-CUCAUGGAGCGCAAGACGAAUAGCUACAUAT*T*T*T*T-3' и 99mТехнеций комплекса 2,3,5,6-тетрафторфенил-4,5-бис(меркаптоацетамидо)-пентановая кислота сложного эфира
3 мг названного соединения примера 1a), растворенного в 0,6 мл фосфатного буфера, добавляют к 99mТехнеций комплексу 2,3,5,6-тетрафторфенил-4,5-бис(меркаптоацетамидо)-пентановая кислота сложного эфира (полученного согласно: J. Nucl. Med. 32, 1445 (1991)) прибл. 100 мКи, растворенного в 2 мл фосфатного буфера, pH 7,2. Раствор доводят до pH 10 с помощью 1,0 М калий карбонатного буфера и перемешивают в течение 20 минут при комнатной температуре. Для финальной очистки раствор вводят в Сефадекс (Sephadex) колонку (Pharmacia) и элюируют раствором с 75 ммоль хлорида натрия. Основные фракции объединяют, разбавляют обычным физиологическим раствором и фильтруют. Таким образом, полученный раствор может быть использован для радиодиагностических исследований.
Пример 8.
a) Конъюгат 5'-(6-Меркапто-1-гексил-фосфорная кислота сложный эфир) 35-мерного олигонуклеотида 5'-T*T*T*T* TAGGAGGAGGAGGGAGAGCGCAAAUGAGAUU-3' и 5'-(N-малеимидо)-3- оксапентил-{ 2-[3-карбоксибензоил)-тио]-ацетил}-глицилглицилглицината
5 мг тиосодержащего олигонуклеотида, полученного согласно примеру 5a), смешивают в атмосфере N2 в 2 мл фосфатного буфера (pH 7,4) с 1 мг 5-(N-малеимидо)-3-оксапентил-{ 2-[3-карбокси-бензоил) -тио]-ацетил}-глицилглицилглицината (полученного согласно Bioconj. Chem. 1, 431 (1990)), растворенного в 0,2 мл диметилформамида. Оставляют перемешиваться в течение 2 часов при комнатной температуре, и раствор подвергают ультрафильтрации через мембрану (Amicon YM3) и затем сушат вымораживанием. Получают 5,5 мг требуемого конъюгата.
b) Технеций-99m комплекс конъюгата 5'-(6-Меркапто-1-гексил-фосфорная кислота сложный эфир) 35-мерного олигонуклеотида 5'-T*T*T*T*TAGGAGGAGGAGGGAGAGCGCAAAUGAGAUU-3' и 5'-(N-малеимидо)-3-оксапентил-{ 2-[3-карбоксибензоил)-тио]-
ацетил}-глицилглицилглицината
1 мл раствора калий-D-глюкарата (12 мг/мл) и хлорида олова (II) (100 мкг/мл) в 0,2 М NaHCO3 сушат вымораживанием в ампуле и затем смешивают с раствором [Tc-99m] -натрий пертехнетата (1 мл, 1 мКи [mCi]) из Мо-99/Tc-99m генератора. После стояния при комнатной температуре в течение 15 минут аликвоту удаляют и смешивают с таким же объемом конъюгата примера 8a) (1 мг/мл), растворенного в 0,2 М растворе NaHCO3. Вещество можно выделить с помощью сушки вымораживанием. Выход по изотопу, определенный с помощью ЖХВР, составлял > 96%.
Пример 9.
a) Конъюгат 5'-(6-Меркапто-1-гексил-фосфоновая кислота сложный эфир) 35-мерного олигонуклеотида 5'- T*T*T*T*TAGGAGGAGGAGGGAGAGCGCAAAUGAGAUU-3' и 1-[6-(2-винил-6-гексилоксиметил)-пиридин] -1,4,8,11-тетраазациклотетрадекана
Раствор 4 мг тиосодержащего олигонуклеотида, полученного согласно примеру 5a), в 2 мл фосфатного буфера (pH 7,4) смешивают в атмосфере N2 с 1 мг 1-[6-(2-винил-6-гексил-оксиметил) -пиридин] -1,4,8,11-тетраазациклотетрадекана (полученного согласно ЕР 0588229), растворенного в 0,5 мл диметилформамида. Оставляют перемешиваться в течение 4 часов при 35oC, смешивают с 10 мл этанола, и продукт выделяют с помощью центрифугирования. Очистку проводят при помощи хроматографии с обращенной фазой на 1 х 25 см колонке с градиентом 50 ммоль триэтиламмоний ацетат (pH 7)/ацетонитрил. Объединенные фракции сушат вымораживанием, растворяют в 1 мл воды и обессоливают на Сефадекс G-10 колонке. Названное соединение (около 4 мг) выделяют с помощью сушки вымораживанием.
b) Tc-99m комплекс конъюгата 5'-(6-Mepкaпто-1-гекcил-фосфоновая кислота сложный эфир) 35-мерного олигонуклеотида 5-T*T*T*T*TAGGAGGAGGAGGGAGAGCGCAAAUGAGAUU-3' и 1-[6-(2-винил-6-гексилоксиметил)-пиридин]-1,4,8,11-тетраазациклотетрадекана
Процедуру осуществляют, как описано в примере 8b). Выход по изотопу, определенный с помощью ЖХВР, составлял 92%.
Пример 10.
a) Конъюгат 5'-(6-меркапто-1-гексил-фосфоновая кислота сложный эфир) 35-мерного олигонуклеотида 5'- T*T*T*T*TAGGAGGAGGAGGGAGAGCGCAAAUGAGAUU-3' и N-[4-гидрокси-3-(1,4,8,11-тетрааза-циклотетрадек-5-ил)-бензил] -2-(6-винил-пиридин-2-илметокси)-ацетамида
Раствор 6,5 мг тиолсодержащего олигонуклеотида, полученного согласно примеру 5a), в 2 мл фосфатного буфера (pH 8,0), смешивают с 1,2 мг N-[4-гидрокси-3-(1,4,8,11-тетрааза-циклотетрадек-5-ил) -бензил] -2-(6-винил-пиридин-2-илметокси)-ацетамида (полученного согласно J. Chem. Soc., Chem. Commun. 156 (1988)), растворенного в 0,1 мл диметилформамида. Перемешивают в течение 4 часов в атмосфере N2 при 35oC, смешивают с 10 мл этанола, и продукт выделяют с помощью центрифугирования. Очистку проводят при помощи хроматографии с обращенной фазой на 1 х 25 см колонке с градиентом 50 ммоль триэтиламмоний ацетат (pH 7)/ацетонитрил. Объединенные фракции обессоливают на Сефадекс G-10 колонке. Путем сушки вымораживанием получают 5 мг названного соединения в виде белого порошка.
b) Медь-64 комплекс 5'-(6-меркапто-1-гексил-фосфоновая кислота сложный эфир) 35-мерного олигонуклеотида 5'-T*T*T*T*TAGGAGGAGGAGGGAGAGCGCAAAUGAGAUU-3' и N-[4-гидрокси-3-(1,4,8,11-тетраазациклотетрадек-5-ил)-бензил] -2- (6-винил-пиридин-2-илметокси)-ацетамида
1 мг конъюгата, полученного согласно 10a), инкубируют в 1 мл фосфатного буфера (pH 8) с 64CuCl2 (0,2 мКи). Выход по изотопу, определенный через 1 час с помощью ЖХВР, составлял > 98%. Продукт выделяют путем сушки вымораживанием.
Пример 11.
A) Конъюгат 5'-(6-меркапто-1-гексил-фосфорная кислота сложный эфир) 35-мерного олигонуклеотида 5'-T*T*T*T*TAGGAGGAGGAGGGAGAGCGCAAAUGAGAUU-3' и 1,4,7,10-тетраазациклододекан-2-[(5-аза-8-малеимидо-6-оксо)-октан] - 1,4,7,10-тетрауксусной кислоты
1 мг 1,4,7,10-тетраазациклододекан-2-[(5-аза-8-малеимидо-6-оксо)-октан]- 1,4, 7,10-тетрауксусной кислоты (полученного согласно J. Chem. Soc., Chem. Commun. 796 (1989)), добавляют к раствору 5 мг тиолсодержащего олигонуклеотида, полученного согласно примеру 5a), в 2 мл фосфатного буфера (pH 8) в атмосфере N2. Перемешивают в течение 3 часов при 35oC, смешивают с 10 мл изопропилового спирта, и продукт выделяют с помощью центрифугирования. Очистку проводят при помощи хроматографии с обращенной фазой на 1 х 25 см колонке с градиентом 25 ммоль триэтиламмоний ацетат (pH 7)/ацетонитрил. Объединенные фракции осторожно концентрируют путем испарения в вакууме, растворяют в небольшом количестве волы и обессоливают с помощью Сефадекс G-10 колонки. Путем сушки вымораживанием получают 4 мг названного соединения в виде белого порошка.
b) Иттрий-90 комплекс конъюгата 5'-(6-меркапто-1-гексил-фосфоновая кислота сложный эфир) 35-мерного олигонуклеотида 5'-T*T*T*T*TAGGAGGAGGAGGGAGAGCGCAAAUGAGAUU-3' и 1,4,7,10-тетраазациклододекан-2-[(5-аза-8-малеимидо-6-оксо)-октан] -1,4,7,10-тетрауксусной кислоты
90Y-ацетат (1 мКи), растворенный в 1 мл 0,05 М раствора ацетата аммония, смешивают с 1 мг конъюгата, полученного согласно примеру 11a), и нагревают в течение 1 часа при 85oC. Выход по изотопу, определенный с помощью ЖХВР, составлял > 95%. Продукт выделяют с помощью сушки вымораживанием.
Пример 12.
a) Конъюгат 5'-(6-меркапто-1-гексил-фосфоновая кислота сложный эфир) 35-мерного олигонуклеотида 5'-T*T*T*T*TAGGAGGAGGAGGGAGAGCGCAAAUGAGAUU-3' и 1,4,7-триазациклононан-2-[(5-аза-8-малеимидо-6-оксо)-октан] -1,4,7- триуксусной кислоты
1 мг 1,4,7, -триазациклононан-2-[(5-аза-8-малеимидо-6-оксо)-октан] - 1,4,7, -триуксусной кислоты (полученного согласно J. Chem. Soc., Chem. Commun. 794 (1989)), добавляют к раствору 5 мг тиолсодержащего олигонуклеотида, полученного согласно примеру 5a), в 2 мл фосфатного буфера (pH 8) в атмосфере N2. Перемешивают в течение 6 часов при 35oC, смешивают с 10 мл изопропанола, и продукт выделяют с помощью центрифугирования. Очистку проводят при помощи хроматографии с обращенной фазой на 1 х 25 см колонке с градиентом 25 ммоль триэтиламмоний ацетат (pH 7)/ацетонитрил. Объединенные фракции осторожно концентрируют путем испарения в вакууме, растворяют в небольшом количестве воды и обессоливают с помощью Сефадекс G-10 колонки. Путем сушки вымораживанием получают 3 мг названного соединения в виде белого порошка.
b) Галлий-67 комплекс конъюгата 5'-(6-меркапто-1-гексил-фосфоновая кислота сложный эфир) 35-мерного олигонуклеотида 5'-T*T*T*T*TAGGAGGAGGAGGGAGAGCGCAAAUGAGAUU-3' и 1,4,7-триазациклононан-2-[(5-аза-8-малеимидо-6-оксо)-октан]-1,4,7- триуксусной кислоты
20 мг конъюгата, полученного согласно примеру 12a), растворяют в 0,5 мл 0,1 М нитратного буфера, pH 4,5, и смешивают с 0,1 мл галлий-67-цитратного раствора (0,2 мКи). Выдерживают в течение 2 часов при комнатной температуре, и продукт обессоливают на Сефадекс-G-10 колонке. После лиофильной сушки получают 17 мг названного соединения в виде белого порошка.
Пример 13.
Фосфитилирование 5'-O-(4,4'-диметокситритил)-5-(проп-2-ен-1-он)- 2-дезоксиуридина
50 мг 4-диметиламинопиридина, 3 мл диизопропилэтиламина и 962 мкл (4,31 ммоль) 2-цианоэтил-N,N-диизопропилхлорофосфорамидита добавляют один за другим к перемешиваемому раствору 5'-O-(4,4'- диметокситритил)-5-(проп-2-ен-1-он)-2'-дезоксиуридина (полученного согласно Nuclesides & Nucletides 13, 939-944)) в 50 мл тетрагидрофурана. После приблизительно 30 мин образуется белый осадок. Его отфильтровывают, раствор концентрируют выпариванием в вакууме, и остаток распределяют между дихлорметаном и 5% раствором бикарбоната натрия. Дихлорметановую фазу сушат над сульфатом магния и концентрируют выпариванием в вакууме. Остаток очищают быстрой хроматографией на силикагеле и элюируют смесью дихлорметан/гексан/диизопропилэтиламин (80:18:2). 1,8 г требуемого соединения получают в виде белой пены.
Элементный анализ:
Рассч. C 64,28; H 6,29; N 7,14; P 3,95.
Найд. C 64,02; H 6,60; N 7,21; P 4,09.
b) Конъюгат 36-мерного олигонуклеотида
U*T*T*T*T*TCUCAUGGAGCCAAGACGAAUAGCUACAUA-3' и 10-(4-аза-2-гидрокси-5-имино-8-меркапто-октан-1,4,7-трис-(карбоксиметил)- 1,4,7,10-тетраазациклододекана
U*: 5-(проп-2-ен-1-он)-2'-дезоксиуридин
30-мерный олигонуклеотид, идентифицированный согласно SELEX способу, получают с модификацией 5'-связанной последовательности 5'-T*T*T*T*T обычным способом в автоматическом синтезаторе Pharmacia Company (смотри Oligonucleotides and Analogues, A Practical Approach, Ed. F. Eckstein, Oxford University Press, Oxford, New York, Tokyo, 1991), и олигонуклеотид также присутствует на колонке твердого носителя. Путем реакции с раствором трихлоруксусной кислоты в дихлорметане открывают 5'-гидроксигруппу. Нагрузка на колонку составляет около 10 мг 35- мерного олигонуклеотида. 5'-гидроксигруппа взаимодействует в присутствии тетразола с фосфорамидитом, полученным согласно примеру 13a). Затем фосфит превращают в фосфотриэфир путем обработки раствором иода, и концевой DMT радикал отщепляют путем взаимодействия с раствором трихлоруксусной кислоты в дихлорметане. Для введения тиольной группы в α,β-ненасыщенную карбонильную систему, присутствующую на концевом 2'-дезоксиуридине, проводят взаимодействие с раствором 10-(4-аза-2-гидрокси-5-имино-8-меркапто-октан-1,4,7-трис- (карбоксиметил)-1,4,7,10-тетраазациклододекана, получение см. ниже) в тетрагидрофуране и промывают последовательно метанолом и водой. Чтобы удалить модифицированный олигонуклеотид от твердого носителя, содержимое колонки транспортируют в мультиампулу, смешивают с 5 мл 30% раствора аммиака, сосуд герметизируют и встряхивают на протяжении ночи при 55oC. Затем охлаждают до 0oC, центрифугируют, носитель промывают 5 мл воды, и объединенные водные фазы подвергают лиофильной сушке.
Для очистки твердое вещество помещают в 2 мл воды, смешивают с 2 мл 0,5 М раствора ацетата аммония и смешивают с 10 мл этанола, дают возможность отстояться на протяжении ночи при -20oC, центрифугируют, и остаток промывают 1 мл этанола (-20oC) и, наконец, сушат в вакууме при комнатной температуре.
6 мг названного соединения получают в виде бесцветного порошка.
15,7 мл 1 N раствора гидроксида натрия и 480 мг (3,49 ммоль) 2-иминотетрагидротиофенгидрохлорида добавляют к раствору 1,46 г (3,49 ммоль) 10-(3-амино-2-гидрокси-пропил)-1,4,7-трис-(карбоксиметил) -1,4,7,10-тетраазациклододекана (смотри пример 1c) в смеси 50 мл воды и 50 мл метанола и перемешивают в течение 3 часов при комнатной температуре, концентрируют выпариванием в вакууме до приблизительно 1/4 начального объема и смешивают при перемешивании с анионообменной смолой (IRA 410) до тех пор, пока не достигнут pH 11. Раствор фильтруют и смешивают при перемешивании с малыми порциями катионообменной смолы IRC 50 до тех пор, пока не достигнут pH 3,5. После фильтрации раствор лиофильно сушат. 1,39 г требуемого вещества получают в виде белого порошка с содержанием воды 4,9%.
Элементный анализ (относительно безводного вещества):
Рассч. C 48,45; H 7,74; N 16,14; S 6,16
Найд. C 48,30; H 7,98; N 16,05; S 6,44.
c) Иттрий-90 комплекс конъюгата 36-мерного олигонуклеотида U*T*T*T*T*TCUCAUGGAGCCAAGACGAAUAGCUACAUA-3' и 10-(4-аза-2-гидрокси-5-имино-8-меркапто-октан-1,4,7-трис-(карбоксиметил)- 1,4,7,10-тетраазациклододекана
U*: 5-(проп-2-ен-1-он)-2'-дезоксиуридин
К раствору 90Иттрия, растворенного в 0,05 М растворе ацетата аммония (прибл. 380 мКи), добавляют 1 мг тиопроизводного примера 13b) в 0,5 мл 0,05 М раствора ацетата аммония с pH 6, доводят до pH 5,2 с помощью 3 М уксусной кислоты и перемешивают в течение 1 часа при комнатной температуре. Доводят до pH 7,0 0,01 М раствором гидроксида натрия, и конъюгат очищают с помощью ЖХВР (TSK-400/MES-буфер). Основные фракции объединяют, разбавляют обычным физиологическим раствором и доводят до pH 7,2 с помощью 0,01 М раствора гидроксида натрия. После фильтрации получают препарат, пригодный для радиотерапии.
Пример 14.
a) S-(Трифенилметил-меркаптоацетил)-глицилглицин метиловый эфир
3,34 г (10 ммоль) 3-трифенилметил меркаптоуксусной кислоты и 1,83 г (10 ммоль) глицилглицин метиловый эфир гидрохлорида суспендируют в 250 мл абсолютного дихлорметана. После добавления 1,01 г (10 ммоль) триэтиламина вливают по каплям при охлаждении льдом 2,06 г (10 ммоль) дициклогексилкарбодиимида, растворенного в 50 мл абсолютного дихлорметана. Перемешивают в течение 1 часа при 0oC и в течение 18 часов при комнатной температуре. Фильтруют, концентрируют путем выпаривания и хроматографируют на силикагеле (элюент: CH2Cl2/MeOH: 10%-30%).
Выход: 3,56 г (77,0% от теор.), белый порошок.
Элементный анализ:
Рассч. C 67,51; H 5,67, N 6,06; O 13,84; S 11,20.
Найд. C 67,37; H 6,02; N 5,91; S 6,73.
b) [S-(Трифенилметил-меркаптоацетил) глицил-глицинамидил]- 6-гексанол
4,63 г (10 ммоль) 5-(трифенилметил-меркаптоацетил)глицил-глицин метилового эфира, полученного в примере 14a), нагревают до 100oC в 11,72 г (100 ммоль) 6-амино-гексанол/50 мл 1,4-диоксана в атмосфере аргона в течение 2 часов. Затем реакционную загрузку выливают на смесь 100 мл дихлорметана и 100 мл воды. При перемешивании и охлаждении льдом до pH 6 доводят с помощью 10 М хлористоводородной кислоты, органическую фазу отделяют и сушат над сульфатом натрия. После испарения растворителя сырой продукт очищают на силикагеле (элюент: CH2Cl2/MeOH: 10%-50%).
Выход: 2,97 г (54,2% от теор.), белый порошок.
Элементный анализ:
Рассч. C 67,98; H 6,81; N 7,67; О 11,68, S 5,85.
Найд. C 67,72; H 6,93; N 7,93; S 5,64.
c) О-{[S-(Трифенилметил-меркаптоацетил)глицил-глицинамидил]-6-гекс-1-ил} - диизопропиламил-O'-метил-фосфористая кислота диэфир
5,48 (10 ммоль) [S-(трифенилметил-меркаптоацетил)глицил-глицинамилил]- 6-гексанола, полученного согласно примеру 14b), растворяют в 100 мл абсолютного дихлорметана, 5,17 г (40 ммоль) диизопропилэтиламина добавляют в атмосфере аргона и вливают по каплям при 0oC 3,95 г (20 ммоль) фосфористая кислота монометиловый эфир диизопропиламид хлорида, растворенного в 50 мл абсолютного дихлорметана. Перемешивают в течение 0,5 часа при 0oC и затем в течение 2 часов при комнатной температуре. Для завершения обработки смешивают при охлаждении льдом с 320 мг (10 ммоль) абсолютного метанола и после концентрирования хроматографируют на силикагеле (элюент: CH2Cl2/MeOH: 95%: 5/5% триэтиламин).
Выход: 1,98 г (27,9% от теор.), бесцветное масло.
d) 5'-[(Меркаптоацетил-глицил-глицил-амидил)-6-гекс-1-ил] -фосфорная кислота эфир 35-мерного олигонуклеотида 5'-T*T*T*T*TCUCAUGGAGCGCAAGACGAAUAGCUACAUA-3'
30-мерный олигонуклеотид, идентифицированный согласно SELEX способу, получают модификацией 5'-связанной последовательности 5'-T*T*T*T*T с помощью автоматического синтезатора Pharmacia Company (смотри Oligonucleotides and Analogues, A Practical Approach, Ed. F. Eckstein, Oxford University Press, Oxford, New York, Tokyo, 1991), и олигонуклеотид в защищенной фирме также присутствует на колонке твердого носителя. Нагрузка на колонку составляет около 15 мг 35-мерного олигонуклеотида. После отщепления 5'-DMT-защитной группы (трихлоруксусная кислота/дихлорметан), его соединяют согласно стандартным методам с фосфорамидитом, описанным в примере 14c). После окисления иодом в тетрагидрофуране конъюгат отщепляется от носителя. В этом случае вещество смешивают с 10 мл 30% раствора аммиака, сосуд герметизируют и встряхивают на протяжении ночи при 55oC. Содержимое охлаждают до 0oC, центрифугируют, носитель промывают 10 мл воды и соединенные водные фазы подвергают сушке замораживанием.
Для очистки твердое вещество помещают в 5 мл воды, смешивают с 4 мл 0,5 М раствора ацетата аммония и смешивают с 20 мл этанола. Для завершения осаждения смесь охлаждают на протяжении ночи (-20oC), центрифугируют, и остаток промывают 1 мл этанола (-20oC) и сушат в вакууме. Получают 9 мг белого порошка.
Для отщепления S-тритил защитной группы вещество помещают в 5 мл раствора (pH 7,0) с 50 ммоль триэтиламмоний ацетата и инкубируют с 500 мкл 0,1 М раствора нитрата серебра в течение 30 минут. Затем добавляют 500 мкл 0,14 М дитиотреитольного раствора и инкубируют последующие 30 минут. После центрифугирования прозрачный супернатант обессоливают на Сефадексе G 10. Фракции, содержащие продукт, лиофилизируют. Получают 4 мг конъюгата в виде белого порошка.
e) Технеций-99m комплекс конъюгата 5'[(меркаптоацетил-глицил-глицил-амидил)-6-гекс-1-ил] -фосфорная кислота эфир 35- мерного олигонуклеотида 5'-T*T*T*T*TCUCAUGGAGCGCAAGACGAAUAGCUACAUA-3'
1 мг конъюгата 14d) растворяют в 1 мл 0,1 М динатриевого кислого фосфатного буфера (pH 9,5). После добавления 10 мг динатрий тартрата смешивают с раствором пертехнетата (1 мКи) и затем с 10 мл раствора хлорида олова (II) (5 мг SnCl2/1 мл 0,01 М HCl). Выход по изотопу (прибл. 93%) определяют с помощью ЖХВР.
Пример 15.
a) О-{[S-(Трифенилметил-меркаптоацетил)глицил-глицинамидил]-6-гекс-1-ил} - толуолсульфоновая кислота сложный эфир
5,48 г (10 ммоль) [S-(трифенилметил-меркаптоацетил)-глицил-глицинамидил] - 6-гексанола, полученного в примере 14b), растворяют в 100 мл абсолютного дихлорметана. Добавляют 1,01 г (10 ммоль) триэтиламина и 1,91 г (10 ммоль) хлорангидрида п-толуолсульфоновой кислоты и перемешивают в течение 24 часов при комнатной температуре. Затем концентрируют и хроматографируют на силикагеле (элюент: CH2Cl2/MeOH: 95:5).
Выход: 4,32 г (61,5% от теор.), бесцветное масло
Элементный анализ:
Рассч. C 65,03; H 6,18; N 5,99; O 1,68; S 9,14.
Найд. C 64,93; H 6,32; N 5,78; S 8,87.
b) 5'[(Меркаптоацетил-глицил-глицинамидил)-6-гекс-1-ил] - фосфорная кислота сложный эфир 35-мерного олигонуклеотида 5'- T*T*T*T*TCUCAUGGAGCGCAAGACGAAUAGCUACAUA-3'
30-мерный олигонуклеотид, идентифицированный согласно SELEX способу, получают модификацией 5'-связанной последовательности 5'-T*T*T*T*T с помощью автоматического синтезатора Pharmacia Company (смотри Oligonucleotides and Analogues, A Practical Approach, Ed. F. Eckstein, Oxford University Press, Oxford, New York, Tokyo, 1991), и олигонуклеотид в защищенной форме также присутствует на колонке твердого носителя. Нагрузка на колонку составляет около 15 мг 35-мерного олигонуклеотида. После отщепления 5'-DMT-защитной группы (трихлоруксусная кислота/дихлорметан) его соединяют согласно стандартным способам с S-тритил-6-меркапто-гексил-фосфорамидитом. После окисления иодом в тетрагидрофуране тритилзащищенное соединение отщепляют от носителя, изолируют и очищают (смотри пример 14d).
Отщепление S-тритил защитной группы, изоляцию SH-группу-несущего олигонуклеотида и очистку проводят, как описано в примере 14d) (6 мг).
Для связывания SH-группу-несущий 35-мерный олигонуклеотид (6 мг) в 500 мкл 0,1 М раствора карбоната натрия смешивают в атмосфере аргона со 100 мг сложного эфира толуолсульфокислоты 15a), растворенной в 500 мкл диметилформамида. Через 30 минут нейтрализуют и разбавляют водой до объема 5 мл. После центрифугирования прозрачный супернатант лиофильно сушат.
Для отщепления S-тритил защитных групп процедуру проводят, как описано в 14d). После очистки получают 4 мг конъюгата.
с) Технеций-99m комплекс конъюгата 5' [(меркаптоацетил-глицил-глицинамидил)-6-гекс-1-ил]-фосфорная кислота сложный эфир 35-мерного олигонуклеотида 5'-T*T*T*T*TCUCAUGGAGCGCAAGACGAAUAGCUACAUA-3'
1 мг конъюгата, описанного в примере 15b), растворяют в 1 мл 0,1 М динатриевого кислого фосфатного буфера (pH 9,5). После добавления 10 мг динатрий тартрата смешивают с раствором пертехнетата (1 мКи) и затем с 10 мкл раствора хлорида олова (II) (5 мг SnCl2/1 мл 0,01 М HCl). Выход по изотопу (прибл. 95%) определяют с помощью ЖХВР.
Пример 16.
a) N-[3-Тиа-5-(трифенилметилмеркапто)-1-оксо-пент-1-ил]-S-трифенилметил- цистеин метиловый эфир
2,69 г (10 ммоль) N-[3-тиа-5-(трифенилметилмеркапто)-1-оксо-пент-1-ил]- S-трифенилметил-цистеин метилового эфира (получение согласно DE 4310999) растворяют вместе с 5,58 г (20 ммоль) трифенилметил хлорида в 100 мл абсолютного дихлорметана. После добавления 2,02 г (20 ммоль) триэтиламина смесь выдерживают при перемешивании на протяжении ночи в атмосфере аргона при комнатной температуре. Для завершения обработки органическую фазу промывают три раза, в каждом случае 1% раствором лимонной кислоты, насыщенным раствором бикарбоната натрия и водой. После высушивания над сульфатом натрия концентрируют путем выпаривания и очищают на силикагеле (элюент: CH2Cl2/MeOH: 95:5).
Выход: 4,53 г (60,1% от теор.), бесцветное масло
Элементный анализ:
Рассч. C 73,27; H 5,75; N 1,86; O 6,37; S 12,76.
Найд. C 73,31; H 5,48; N 1,63; S 12,49.
b) N-[3-Тиа-5-(трифенилметилмеркапто)-1-оксо-пент-1-ил] - S-трифенилметил-N'-(6-гидрокси-гекс-1-ил)цистеинамид.
7,54 г (10 ммоль) N-[3-тиа-5-(трифенилметилмеркапто)-1- оксо-пент-1-ил] -S-цистеин метилового эфира, описанного в примере 16a), нагревают до 100oC в 11,72 г (100 ммоль) 6-аминогексанол/50 мл 1,4-диоксана в атмосфере аргона в течение 2 часов. Затем реакционную смесь выливают на смесь 100 мл дихлорметана и 100 мл воды. При перемешивании и охлаждении льдом доводят pH до 6 с помощью 10 М хлористоводородной кислоты, органическую фазу отделяют и сушат над сульфатом натрия. После выпаривания растворителя сырой продукт очищают на силикагеле (элюент: CH2Cl2/MeOH: 5%-50%).
Элементный анализ:
Рассч. C 72,99; H 6,49; N 3,34; О 5,72, S 11,46.
Найд. C 72,73; H 6,62; N 3,11; S 11,17.
c) O-{{[N-[3-Тиа-5-(трифенилметилмеркапто)-1-оксо-пент-1-ил]-S- трифенилметил-цистеинил} -2-амино-эт-1-ил}-диизопропиламид-О'-метилфосфористая кислота сложный эфир
8,39 г (10 ммоль) N-[3-тиа-5-(трифенилметилмеркапто)-1-оксо-пент-1-ил]- 3-трифенилметил-N'-(6-гидрокси-гекс-1-ил)цистеинамида, полученного в примере 16b), растворяют в 200 мл абсолютного дихлорметана. В атмосфере аргона добавляют 5,17 г (40 ммоль) диизопропилэтиламина и по каплям при 0oC вливают 3,95 г (20 ммоль) фосфористая кислота монометилэфир-диизопропиламид-хлорида, растворенного в 50 мл абсолютного дихлорметана. Перемешивают в течение 0,5 часа при 0oC и затем перемешивают в течение 1,5 часов при комнатной температуре. Для завершения обработки смешивают при охлаждении льдом с 320 мг (10 ммоль) абсолютного метанола и после концентрирования хроматографируют на силикагеле (элюент: CH2Cl2/MeOH: 95:5/5% (триэтиламин)).
Выход: 5,37 г (53,7% от теор.) желтоватого масла.
d) 5'-[N-(3-Тиа-5-меркапто-1-оксо-пент-1-ил] -цистеин-N' -(6-гидрокси-гекс-1-ил)-амид] -фосфорная кислота эфир 35-мерного олигонуклеотида 5'-CUCAUGGAGCGCAAGACGAAUAGCUACAUAT*T*T*T*T-3'
30-мерный олигонуклеотид, идентифицированный согласно SELEX способу, получают модификацией последовательности T*T*T*T*T-3', расположенной против хода транскрипции, с помощью автоматического синтезатора Pharmacia Company (смотри Oligonucleotides and Analogues, A Practical Approach, Ed. F. Eckstein, Oxford University Press, Oxford, New York, Tokyo, 1991), и олигонуклеотид в защищенной форме также присутствует на колонке твердого носителя. Нагрузка на колонку составляет около 15 мг 35-мерного олигонуклеотида. После отщепления 5'-DMT-защитной группы (трихлоруксусная кислота/дихлорметан), его соединяют согласно стандартным способам с фосфорамидитом (16c) и затем окисляют.
Отщепление от носителя основных защитных групп и очистку бис-S-тритилзащищенного конъюгата проводят, как описано в 14d) (около 12 мг).
Для отщепления S-тритил защитных групп вещество помещают в 5 мл 50 ммоль раствора (pH 7,0) триэтиламмоний ацетата и инкубируют с 500 мкл 0,1 М раствора нитрата серебра в течение 30 минут. Затем добавляют 500 мкл 0,14 М дитиотреитольного раствора и инкубируют в течение последующих 30 минут. После центрифугирования прозрачный супернатант обессоливают на Сефадексе G 10. Фракции, содержащие продукт, лиофилизируют. Получают 5 мг конъюгата в виде белого порошка.
e) Технеций-99m комплекс конъюгата 5'-[N-(3-тиa-5-мepкапто-1-оксо-пент-1-ил] -цистеин-N'- (6-гидрокси-гекс-1-ил)-амид]-фосфорная кислота эфир 35-мерного олигонуклеотида 5'-CUCAUGGAGCGCAAGACGAAUAGCUACAUAT*T*T*T*T-3'
1 мг конъюгата, описанного в примере 16d), растворяют в 1 мл 0,1 М динатриевого кислого фосфатного буфера (pH 9,5). После добавления 10 мг динатрий тартрата смешивают с раствором пертехнетата натрия (1 мКи) и затем с 10 мл раствора хлорида олова (II) (5 мг SnCl2/1 мл 0,01 М HCl). Выход по изотопу (прибл. 96%) определяют с помощью ЖХВР.
Пример 17.
a) O-{N-[3-Тиа-5-(трифенилметилмеркапто)-1-оксо-пент-1-ил]-S- трифенилметил-N'-{ 6-гидрокси-гекс-1-ил)цистеинимидил} -п-толуолсульфокислота сложный эфир
8,39 г (10 ммоль) N-[3-тиа-5-(трифенилметилмеркапто)-1-оксо-пент-1-ил]- S-трифенилметил-N'-(6-гидрокси-гекс-1-ил)цистеинамида, полученного согласно примеру 16b, растворяют в 200 мл абсолютного дихлорметана. Добавляют 1,01 г (10 ммоль) триэтиламина, 1,91 г (10 ммоль) хлорангидрида п-толуолсульфокислоты и перемешивают в течение 20 часов при комнатной температуре. Затем концентрируют и хроматографируют на силикагеле (элюент: CH2Cl2/MeOH: 97:3).
Выход: 6,44 г (67,0% от теор.) желтоватого масла.
Элементный анализ:
Рассч. C 72,47; H 6,29; N 2,91; O 8,32; S 10,01,
Найд. C 72,19; H 6,47; N 2,68; S 9,83
b) 5'-[(Меркаптоацетил-глицил-гдицинамидил)-13-тpидeк-7-тио-1-ил] -фосфорная кислота сложный эфир 35-мерного олигонуклеотида 5'-CUCAUGGAGCGCAAGACGAAUAGCUACAUAT*T*T*T*T-3'
30-мерный олигонуклеотид, идентифицированный согласно SELEX способу, получают модификацией последовательности T*T*T*T*T-3', расположенной против хода транскрипции, с помощью автоматического синтезатора Pharmacia Company (смотри Oligonucleotides and Analogues, A Practical Approach, Ed. F. Eckstein, Oxford University Press, Oxford, New York, Tokyo, 1991), и олигонуклеотид в защищенной форме также присутствует на колонке твердого носителя. Нагрузка на колонку составляет около 15 мг 35-мерного олигонуклеотида. После отщепления 5'-DMT-защитной группы (трихлоруксусная кислота/дихлорметан), его соединяют согласно стандартным способам с S-тритил-6-меркаптогексил-фосфорамидитом.
После окисления иодом в тетрагидрофуране тритилзащищенное соединение отщепляют от носителя, изолируют и очищают (смотри пример 14d).
Отщепление S-тритилзащищенной группы, изоляцию SH-группунесущего олигонуклеотида и очистку проводят, как описано в 14d) (7,5 мг).
Для связывания, SH-группу-несущий 30-мерный олигонуклеотид (7 мг) в 550 мкл 0,1 М раствора карбоната натрия смешивают в атмосфере аргона со 180 мг сложного эфира толуолсульфокислоты 17a), растворенного в 500 мкл диметилформамида. Через 30 минут нейтрализуют и разбавляют водой до объема 5 мл. После центрифугирования прозрачный супернатант лиофильно сушат. Для отщепления S-тритилгрупп процедуру проводят, как описано в 14d). После очистки получают 4,3 мг конъюгата.
c) Технеций-99m комплекс конъюгата 5'-[(меркаптоацетил- глицил-гдицинамидил)-13-тридека-7-тио-1-ил]-фосфорная кислота сложный эфир 35-мерного олигонуклеотида 5'-CUCAUGGAGCGCAAGACGAAUAGCUACAUAT*T*T*T*T-3'
1 мг конъюгата, описанного в примере 17b), растворяют в 1 мл 0,1 М динатриевого кислого фосфатного буфера (pH 9,5). После добавления 10 мг динатрий тартрата смешивают с раствором пертехнетата натрия (1 мКи) и затем с 10 мкл раствора хлорида олова (II) (5 мг SnCl2/1 мл 0,01 М HCl). Выход по изотопу (прибл. 93%) определяют с помощью ЖХВР.
Пример 18.
a) Конъюгат 5'-(6-Амино-1-гексил-фосфорная кислота сложный эфир) 35-мерного олигонуклеотида 5'-CUCAUGGAGCGCAAGACGAAUAGCUACAUAT*T*T*T*T-3' и моноамида N-(тетрагидро-2-оксо-тиофен-3-ил)-тиодигликолевой кислоты
30-мерный олигонуклеотид, идентифицированный согласно SELEX способу, получают модификацией последовательности T*T*T*T*T-3', расположенной против хода транскрипции, с помощью автоматического синтезатора Pharmacia Company (смотри Oligonucleotides and Analogues, A Practical Approach, Ed. F. Eckstein, Oxford University Press, Oxford, New York, Tokyo, 1991), и олигонуклеотид в защищенной форме также присутствует на колонке твердого носителя. Нагрузка на колонку составляет около 15 мг 35-мерного олигонуклеотида. После отщепления 5'-DMT-защитной группы (трихлоруксусная кислота/дихлорметан) его соединяют согласно стандартным способам с N-трифтороацетиламиногексилфосфорамидитом.
После окисления иодом в тетрагидрофуране аминогруппунесущий олигонуклеотид отщепляют от носителя, изолируют и очищают, как описано в 1b) (9,3 мг).
Для связывания с моноамидом N-(тетрагидро-2-оксо-тиофен- 3-ил)-тиодигликолевой кислоты (DE 4311023) 5 мг аминогруппунесущего олигонуклеотида растворяют в 1 мл 0,2 М раствора карбоната натрия. После добавления 100 мг производного тиолактона содержимое инкубируют в течение 4 часов при комнатной температуре. Затем нейтрализуют и обессоливание производят с помощью ультрафильтрации через мембрану с пределом эксклюзии 3000 (Amicon YM3). После лиофилизации его подвергают сушке вымораживанием. Получают 6,3 мг требуемого конъюгата.
b) Технеций-99m комплекс конъюгата 5'(6-Амино-1-гексил- фосфорная кислота сложный эфир) 35-мерного олигонуклеотида 5'-CUCAUGGAGCGCAAGACGAAUAGCUACAUAT*T*T*T*T-3' и моноамида N- (тетрагидро-2-оксо-тиофен-3-ил)-тиодигликолевой кислоты
1 мг SH-группунесущего конъюгата, описанного в примере 18a), растворяют в 1 мл 0,1 М динатриевого кислого фосфатного буфера (pH 9,5). После добавления 10 мг динатрий тартрата смешивают с раствором пертехнетата натрия (1 мКи) и затем с 10 мкл раствора хлорида олова (II) (5 мг SnCl2/1 мл 0,01 М HCl). Выход по изотопу (94%) определяют с помощью ЖХВР.
Пример 19.
a) 5'(6-Амино-1-гексил-фосфорная кислота сложный эфир 32-мерного олигонуклеотида 5'-CUCAUGGAGCGCAAGACGAAUAGCUACAUAT-3'-3'-T-5'
30-мерный олигонуклеотид 5'-CUCAUGGAGCGCAAGACGAAUAGCUACAUA-3', идентифицированный по SELEX способу, с модификацией тимидиновой последовательности T-3'-3'-T-5', расположенной против хода транскрипции, которая связана 5'-положением на носителе, получают обычным путем в автоматическом синтезаторе Pharmacia Company (смотри Oligonucleotides and Analogues, A Practical Approach, Ed. F. Eckstein, Oxford University Press, Oxford, New York, Tokyo, 1991), и олигонуклеотид также присутствует на колонке твердого носителя. Путем реакции с раствором трихлоруксусной кислоты в дихлорметане открывают 5'-гидроксигруппу. Нагрузка на колонку составляет около 10 мг 32-мерного олигонуклеотида. Чтобы соединить линкер, колонку подвергают взаимодействию с ацетонитрильным раствором 50 мкмоль β- цианоэтил-N,N-диизопропиламино-6-(трифторацетамидо) -1-гексил-фосфорамидита (полученного согласно Nuсl. Acids. Res. 16, 2659-2669 (1988)) в присутствии тетразола. Окисление образовавшегося фосфита в полностью защищенный фосфотриэфир проводят с помощью иода в тетрагидрофуране. Затем колонку промывают последовательно метанолом и водой. Чтобы удалить модифицированный олигонуклеотид от твердого носителя, содержимое колонки транспортируют в мультиампулу, смешивают с 5 мл 30% раствора аммиака, сосуд герметизируют и подвергают встряхиванию на протяжении ночи при 55oC. Затем охлаждают до 0oC, центрифугируют, носитель промывают 5 мл воды, и объединенные водные фазы подвергают лиофильной сушке.
Для очистки твердое вещество помещают в 2 мл воды, смешивают с 2 мл 0,5 М раствора ацетата аммония и смешивают с 10 мл этанола и оставляют стоять на протяжении ночи при -20oC, центрифугируют, и остаток промывают 1 мл этанола (-20oC и, наконец, сушат в вакууме при комнатной температуре.
8 мг названного соединения получают в виде бесцветного порошка.
b) Конъюгат 5'(6-амино-1-гексил)-фосфорная кислота сложный эфир 32-мерного олигонуклеотида 5'-CUCAUGGAGCGCAAGACGAAUAGCUACAUAT-3'-3'-T-5' и 10-[7-(4-изо-тиоцианатофенил)-2-гидрокси-5-оксо-7-(карбоксиметил) -4-аза-гептил]-1,4,7-трис-(карбоксиметил)-1,4,7,10-тетраазациклододекана
8 мг олигонуклеотида, полученного в примере 19a), растворяют в 2,5 мл NaHCO3/Na2CO3 буфера (pH 8,0) и смешивают с 1 мг 10-[7-(4-изотиоцианатофенил)-2-гидрокси-5-оксо-7-(карбоксиметил-4- азагептил]-1,4,7-трис-(карбоксиметил)-1,4,7,10-тетраазациклододекана (названное соединение примера 1f). Перемешивают в течение 5 часов при комнатной температуре, затем доводят pH до 7,2 с помощью 0,1 М хлористоводородной кислоты, и раствор подвергают ультрафильтрации через мембрану с пределом эксклюзии 3000 (Amicon YM3) и затем лиофильно сушат. Получают 7 мг требуемого конъюгата.
c) 111Индий комплекс конъюгата 5'(6-амино-1-гексил- фосфорная кислота сложный эфир) 32-мерного олигонуклеотида 5'-CUCAUGGAGCGCAAGACGAAUAGCUACAUAT-3'-3'-T-5' и 10-[7-(4- изотиоцианатофенил)-2-гидрокси-5-оксо-7-(карбоксиметил)-4-аза- гептил] -1,4,7-трис-(карбоксиметил)-1,4,7,10-тетраазациклододекана
15 мкл 111Индий (III) ацетатного раствора (350 мКи) (полученного из 111Индий (III) хлорида в 2 М растворе ацетата натрия и доведенного до pH 4,0 с помощью 0,1 М хлористоводородной кислоты) добавляют к 135 мкл раствора 1 мг названного соединения примера 19b) в MES буфере, pH 6,2 (MES = 2-(N- морфолино)-этилсульфоновая кислота). pH доводят до 4,2 добавлением 0,01 М хлористоводородной кислоты. Перемешивают в течение 1 часа при 37oC при pH 4,2. Доводят до pH 6 при помощи 2 М раствора ацетата натрия и добавляют 10 мкл 0,1 М раствора Na2EDTA (Na2EDTA = динатриевая соль этилендиаминтетрауксусной кислоты), чтобы комплексовать избыток 111Индий. Конечную очистку полученного таким образом меченого конъюгата (1h) проводят с помощью ЖХВР (вытеснительная хроматография: TSK-400/MES-буфер). Фракции, содержащие меченый конъюгат, разбавляют обычным физиологическим раствором, доводят до pH 7,2 с помощью 0,01 М раствора гидроксида натрия и фильтруют. Полученный таким образом раствор представляет препарат, пригодный для радиодиагностики.
Пример 20.
a) 5'(6-Амино-1-гексил-фосфорная кислота сложный эфир 35-мерного олигонуклеотида 5'-T***T***T***T*** TAGGAGGAGGAGGGAGAGCGCAAAUGAGAUU-3'
30-мерный олигонуклеотид 5'-TAGGAGGAGGAGGGAGAGCGCAAAUGAGAUU-3' (послед. N 13 патент США N 5270163), идентифицированный по SELEX способу, получают обычным путем в автоматическом синтезаторе Pharmacia Company (смотри Oligonucleotides and Analogues, A Practical Approach, Ed. F. Eckstein, Oxford University Press, Oxford, New York, Tokyo, 1991), и олигонуклеотид также присутствует на колонке твердого носителя. Четыре конечных тимидина связывают фосфородитиоатами с тимидином, присутствующим на 5'-конце согласно технике, описанной G. Blaton et al. in "Oligonucleotides and Analogues", pp. 109-135. Для этой цели сначала 5'-гидроксигруппу открывают путем обработки с трихлоруксусной кислотой. Затем 3'-гидроксигруппу 5'-DMTO-тиридина превращают с помощью трис-пирролидинофосфина и тетразола в диамидит, который превращают в фосфоротиоамидит путем добавления 2,4-дихлорбензил меркаптана. Это соединение активируют тетразолом и подвергают взаимодействию с 5'-гидроксигруппой олигонуклеотида в тиофосфаттриэфир. Окисление в фосфородитиоат происходит с помощью элементарной серы в растворе дисульфида углерода, пиридина, триэтиламина 95: 95: 10. Бензильные группы еще не удалены. Аналогичным путем также связывают 3 дополнительных тимидина. Нагрузка на колонку составляет около 10 мг 35-мерного олигонуклеотида. Затем 5'-гидроксигруппу снова открывают.
Чтобы соединить линкер, колонку подвергают взаимодействию с ацетонитрильным раствором 50 мкмоль 2-цианоэтил-N,N'-диизопропил-амино-6-(трифтороацетамидо)-1-гексил фосфорамидита (лит. в примере) в присутствии тетразола. Окисление образовавшегося фосфита в фосфотриэфир проводят с помощью иода в тетрагидрофуране. Затем колонку промывают последовательно метанолом и водой. Затем защитные группы дитионатных связей удаляют раствором тиофенол/триэтиламин/диоксан 1:2:2, что происходит в течение 2 часов. После чего колонку промывают, в каждом случае тройным объемом колонки, метанолом, затем эфиром и сушат. Чтобы удалить модифицированный олигонуклеотид от твердого носителя, содержимое колонки транспортируют в мультиампулу, смешивают с 5 мл 30% раствора аммиака, сосуд герметизируют и подвергают встряхиванию на протяжении ночи при 55oC. Затем охлаждают до 0oC, центрифугируют, носитель промывают 5 мл воды, и объединенные водные фазы подвергают лиофильной сушке.
Для очистки твердое вещество помещают в 2 мл воды, смешивают с 2 мл 0,5 М раствора ацетата аммония и смешивают с 10 мл этанола, и оставляют на протяжении ночи при -20oC, центрифугируют, и остаток промывают 1 мл этанола (-20oC) и, наконец, сушат в вакууме при комнатной температуре.
8 мг названного соединения получают в виде бесцветного порошка.
b) Конъюгат 5'(6-Амино-1-гексил-фосфорная кислота сложный эфир) 35-мерного олигонуклеотида 5'-T***T***T***T*** TAGGAGGAGGAGGGAGAGCGCAAAUGAGAUU-3' и 10-[7-(4-изотиоцианатофенил) -2-гидрокси-5-оксо-7-(карбоксиметил)-4-азагептил] -1,4,7-трис- (карбоксиметил)-1,4,7,10-тетраазациклододекана
8 мг олигонуклеотида, полученного в примере 20a), растворяют в 2,5 мл NaHCO3/Na2CO3 буфера (pH 8,0) и смешивают с 1 мг 10-[7-(4-изотиоцианатофенил)-2-гидрокси-5-оксо-7- (карбоксиметил-4-азагептил]-1,4,7-трис-(карбоксиметил)-1,4,7,10- тетраазациклододекана (названное соединение примера 1f). Перемешивают в течение 5 часов при комнатной температуре, затем доводят pH до 7,2 с помощью 0,1 М хлористоводородной кислоты, и раствор подвергают ультрафильтрации через мембрану с пределом эксклюзии 3000 (Amicon YM3) и затем лиофильно сушат. Получают 7 мг требуемого конъюгата.
c) 111Индий комплекс конъюгата 5'(6-амино-1-гексил-фосфорная кислота сложный эфир) 35-мерного олигонуклеотида 5'-T***T***T***T*** TAGGAGGAGGAGGGAGAGCGCAAAUGAGAUU-3' и 10-[7-(4-изотиоцианатофенил)- 2-гилрокси-5-оксо-7-(карбоксиметил)- 4-азагептил] -1,4,7-трис-(карбоксиметил)-1,4,7,10-тетраазациклододекана
15 мкл 111Индий (III) ацетатного раствора (350 мкКИ) (полученного из 111Индий (III) хлорида в 2 М растворе ацетата натрия и доведенного до pH 4,0 с помощью 0,1 М хлористоводородной кислоты) добавляют к 135 мкл раствора 1 мг названного соединения примера 20b) в MES буфере, pH 6,2 (MES = 2-(N-морфолино)-этилсульфоновая кислота). pH доводят до 4,2 добавлением 0,01 М хлористоводородной кислоты. Перемешивают в течение 1 часа при 37oC при pH 4,2. Доводят до pH 6 при помощи 2 М раствора ацетата натрия и добавляют 10 мкл 0,1 М раствора Na2EDTA = динатриевая соль этилендиаминтетрауксусной кислоты, чтобы комплексовать избыток 111Индия. Конечную очистку полученного таким образом конъюгата (1h) проводят с помощью ЖХВР (вытеснительная хроматография: TSK-400/MES-буфер). Фракции, содержащие меченый конъюгат, разбавляют обычным физиологическим раствором, доводят до pH 7,2 с помощью 0,01 М раствора гидроксида натрия и фильтруют. Полученный таким образом раствор представляет препарат, пригодный для радиодиагностики.
Пример 21.
a) 5'-(6-Амино-1-гексил-фосфорная кислота сложный эфир) 35-мерного олигонуклеотида 5'-CUCAUGGAGCGCAAGACGAAUAGCUACAUAT**T**T**T**T-3'
Получают 30-мерный олигонуклеотид 5'-CUCAUGGAGCGCAAGACGAAUAGCUACAUAT**T**T**T**T-3', идентифицированный по SELEX способу, с модификацией последовательности T**T**T**T**T-3', расположенной против хода транскрипции, причем сначала получают последовательность из 5 тимидинов, соединенных цианоэтилфосфатными группами на носителе при 3'. Посредством реакции этого соединения с 0,5 М раствором тетраэтилтиурам дисульфида в ацетонитриле, сульфирование в фосфонотиоат происходит в течение 15 минут, что и является затем со свободной 5'-гидроксильной группой исходным веществом для 35- мерного олигонуклеотида. Полный синтез происходит обычным путем в автоматическом синтезаторе Pharmacia Company (смотри Oligonucleotides and Analogues, A Practical Approach, Ed. F. Eckstein, Oxford University Press, Oxford, New York, Tokyo, 1991), и олигонуклеотид все еще присутствует на колонке твердого носителя. Посредством взаимодействия с раствором трихлоруксусной кислоты в дихлорметане 5'-гидрокси открывают. Нагрузка на колонку составляет около 10 мг 35-мерного олигонуклеотида. Чтобы соединить линкер, колонку подвергают взаимодействию с ацетонитрильным раствором 50 мкмоль β--цианоэтил-N, N- диизопропиламино-6-(трифтороацетамидо)-1-гексил-фосфорамидита (полученного согласно Nucl. Acids. Res. 16, 2659-2669 (1988)) в присутствии тетразола. Окисление полученного таким путем фосфита в полностью защищенный фосфотриэфир проводят с помощью иода в тетрагидрофуране. Затем колонку промывают последовательно метанолом и водой. Чтобы удалить модифицированный олигонуклеотид от твердого носителя и отщепить цианоэтильные группы, содержимое колонки транспортируют в мультиампулу, смешивают с 5 мл 30% раствора аммиака, сосуд герметизируют и подвергают встряхиванию на протяжении ночи при 55oC. Затем охлаждают до 0oC, центрифугируют, носитель промывают 5 мл воды, и объединенные водные фазы подвергают лиофильной сушке.
Для очистки твердое вещество помещают в 2 мл воды, смешивают с 2 мл 0,5 М раствора ацетата аммония и смешивают с 10 мл этанола, и оставляют стоять на протяжении ночи при -20oC, центрифугируют, и остаток промывают 1 мл этанола (-20oC) и, наконец, сушат в вакууме при комнатной температуре.
8 мг названного соединения получают в виде бесцветного порошка.
b) Конъюгат 5'-(6-Амино-1-гексил-фосфорная кислота сложный эфир) 35-мерного олигонуклеотида 5'-CUCAUGGAGCGCAAGACGAAUAGCUACAUAT**T**T**T**T-3' и 10-[7-(4-изотиоцианатофенил)-2-гидрокси-5-оксо-7-(карбоксиметил)-4-азагептил] -1,4,7-трис- (карбоксиметил) - 1,4,7,10-тетраазациклододекана
8 мг олигонуклеотида, полученного в примере 20a), растворяют в 2,5 мл NaHCO3/Na2CO3 буфера (pH 8,0) и смешивают с 1 мг 10-[7-(4-изотиоцианатофенил)-2-гидрокси-5-оксо-7- (карбоксиметил-4-азагептил]-1,4,7-трис-(карбоксиметил)-1,4,7,10- тетраазациклододекана (названное соединение примера 1f). Перемешивают в течение 5 часов при комнатной температуре, затем доводят pH до 7,2 с помощью 0,1 М хлористоводородной кислоты, и раствор подвергают ультрафильтрации через мембрану с пределом эксклюзии 3000 (Amicon YM3) и затем лиофильно сушат. Получают 7 мг требуемого конъюгата.
c) 111Индий комплекс конъюгата 5'(6-амино-1-гексил-фосфорная кислота сложный эфир) 35-мерного олигонуклеотида 5''-CUCAUGGAGCGCAAGACGAAUAGCUACAUAT**T**T** T**T-3' и 10-[7-(4-изотиоцианатофенил)-2-гидрокси-5-оксо- 7-(карбоксиметил)-4- азагептил] -1,4,7-трис-(карбоксиметил)-1,4,7,10-тетраазациклододекана
15 мкл 111Индий (III) ацетатного раствора (350 мкКИ), (полученного из 111Индий (III) хлорида в 2 М растворе ацетата натрия и доведенного до pH 4,0 с помощью 0,1 М хлористоводородной кислоты) добавляют к 135 мкл раствора 1 мг названного соединения примера 21b) в MES буфере, pH 6,2 (MES = 2- (N-морфолино)-этилсульфоновая кислота). pH доводят до 4,2 добавлением 0,01 М хлористоводородной кислоты. Перемешивают в течение 1 часа при 37oC при pH 4,2. Доводят до pH 6 при помощи 2 М раствора ацетата натрия и добавляют 10 мкл 0,1 М раствора Na2EDTA = динатриевая соль этилендиаминтетрауксусной кислоты, чтобы комплексовать избыток 111Индия. Конечную очистку полученного таким образом конъюгата (1h) проводят с помощью ЖХВР (вытеснительная хроматография: TSK-400/MES-буфер). Фракции, содержащие меченый конъюгат, разбавляют обычным физиологическим раствором, доводят до pH 7,2 с помощью 0,01 М раствора гидроксида натрия и фильтруют. Полученный таким образом раствор представляет препарат, пригодный для радиодиагностики.
Пример 22.
a) N-(5-Меркапто-3-тиа-1-оксо-пент-1-ил)-глицин метиловый эфир
12,56 г (0,1 моль) гидрохлорида метилового эфира глицина, 13,42 г (0,1 моль) 2,5-дитиа-циклогексанона и 10,12 г (0,1 моль) триэтиламина растворяют в атмосфере аргона в 500 мл абсолютного дихлорметана. Перемешивают в течение 24 часов при комнатной температуре, и затем загрузку выливают на 250 мл 5% водной лимонной кислоты. Хорошо перемешивают, органическую фазу отделяют и сушат над сульфатом натрия. После выпаривания растворителя в вакууме маслянистый остаток хроматографируют на силикагеле (подвижный растворитель: дихлорметан/метанол, метанол 0-10%).
Выход: 18,9 г (84,6%), бесцветное масло
Элементный анализ:
Рассч. C 37,65; H 5,87; N 6,27; O 21,49; S 28,71.
Найд. C 37,43; H 6,02; N 6,12; S 28,48.
b) N-[5-(Трифенилметилмеркапто)-3-тиа-1-оксо-пент-1-ил] - глицин метиловый эфир
11,17 г (50 ммоль) N-(5-Меркапто-3-тиа-1-оксо-пент-1-ил)-глицин метилового эфира (пример 22а)), 13,94 г (50 ммоль) трифенилметил хлорида и 5,06 г (50 ммоль) триэтиленамина растворяют в атмосфере аргона в 500 мл абсолютного дихлорметана. Перемешивают в течение 16 часов при комнатной температуре, и загрузку затем выливают в 150 мл 5% водной уксусной кислоты. Хорошо перемешивают, органическую фазу отделяют и сушат над сульфатом натрия. После выпаривания растворителя в вакууме маслянистый остаток хроматографируют на силикагеле (подвижный растворитель: дихлорметан/метанол, 95:5).
Выход: 15,7 г (67,4%), бесцветное масло
Элементный анализ:
Рассч. C 67,07; H 5,85; N 3,01; O 10,31; S 13,77.
Найд. C 67,01; H 6,11; N 2,93; S 13,49.
c) N-[5-(Трифенилметилмеркапто)-3-тиа-1-оксо-пент-1-ил]-глицин-N'- (6-гидроксигексил)-амид
11,64 г (25 ммоль) N-[5-(трифенилметилмеркапто)-3-тиa-1-оксо-пент-1-ил]- глицин метилового эфира (пример 22b) и 29,3 г (250 ммоль) 6-аминогексанола сплавляют вместе в атмосфере аргона в течение 16 часов при 100oC. После охлаждения реакционной смеси ее помещают в 500 мл дихлорметана и затем в 250 мл 5% водной лимонной кислоты. При охлаждении и перемешивании pH доводят до 6,5 концентрированной хлористоводородной кислотой. Органическую фазу отделяют и сушат над сульфатом натрия. После выпаривания растворителя в вакууме маслянистый остаток хроматографируют на силикагеле (подвижный растворитель: дихлорметан/метанол, 0-10% метанол).
Выход: 7,7 г (56,0%), бесцветное масло
Элементный анализ:
Рассч. C 67,60; H 6,96; N 5,09; O 8,72; S 11,64
Найд. C 67,48; H 7,03; N 4,92; S 11,43.
d) N-Диизопропил-O-цианоэтил-O'-[7,9-диаза-8,11-диоксо-13- тиа-15-(трифенилмеркапто)-пентадек-1-ил]-фосфористая кислота амид
5,51 (10 ммоль) N-[5-(Трифенилметилмеркапто)-3-тиа-1-оксо- пент-1-ил]-глицин-N'-(6-гидроксигексил)-амида (пример 22c) растворяют в 50 мл абсолютного дихлорметана и 50 мл абсолютного пиридина. 4,73 г (20 ммоль) хлорангидрида диизопропиламино-O-цианоэтил-фосфористой кислоты, растворенного в 50 мл абсолютного дихлорметана, вливают по каплям в загрузку при комнатной температуре. Через 4 часа содержимое выливают на 250 мл насыщенного водного раствора бикарбоната натрия, перемешивают, и органическую фазу сушат над сульфатом магния. После испарения растворителя маслянистый остаток хроматографируют на силикагеле (дихлорметан/метанол/триэтиламин 98:1:1).
Выход: 4,32 г (57,5%), бесцветное вспененное масло
Элементный анализ:
Рассч. C 63,97; H 7,38; N 7,46; O 8,52; P 4,12; S 8,54.
Найд. C 63,81; H 7,41; N 7,22; P 3,97; S 8,31.
e) 5'-[N-(3'-Аза-8'-меркапто-1', 4'-диоксо-6'-тиа-окт-1'-ил) -6-аминогексил-фосфорная кислота сложный эфир] 5'-CUCAUGGAGCGCAAGACGAAUAGCUACAUAT*T*T*T*T-3'
30-мерный олигонуклеотид 5'-CUCAUGGAGCGCAAGACGAAUAGCUACAUAT*T*T*T*T-3', идентифицированный по SELEX способу, с модификацией последовательности T*T*T*T*T-3', расположенной против хода транскрипции, получают с помощью автоматического синтезатора Pharmacia Company (смотри Oligonucleotides and Analogues, A Practical Approach, Ed. F. Eckstein, Oxford University Press, Oxford, New York, Tokyo, 1991), и олигонуклеотид в защищенной форме все еще присутствует на колонке твердого носителя. Нагрузка на колонку составляет около 15 мг 35-мерного олигонуклеотида. После отщепления 5'-DМT-защитной группы его связывают согласно стандартным методам с фосфорамидитом, описанным в примере 22d). После окисления иодом в тетрагидрофуране конъюгат отщепляют от носителя. Для этой цели вещество смешивают с 10 мл 30% раствора аммиака и подвергают встряхиванию на протяжении ночи при 55oC. Затем охлаждают до 0oC, центрифугируют, носитель промывают 10 мл воды, и объединенные водные фазы лиофилизуют. Для очистки вещество помещают в 5 мл воды, добавляют 4 мл 0,5 моль ацетата аммония и смешивают с 20 мл этанола. Для полного осаждения охлаждают в течение ночи (-20oC), центрифугируют, и остаток промывают 1 мл этанола (-20oC), и сушат в вакууме. Получают 9,5 мг белого порошка. Для отщепления S-тритилзащитной группы вещество помещают в 5 мл 50 ммоль раствора ацетата триэтиламмония (pH 7) и инкубируют с 500 мкл 0,1 М раствора нитрата серебра в течение 30 минут. Затем добавляют 500 мкл 0,14 М раствора дитиотреитола и инкубируют в течение еще 30 минут. После центрифугирования прозрачный супернатант обессоливают на Сефадексе G 10. Фракции, содержащие продукт, сушат вымораживанием Получают 3,5 мг белого порошка.
f) Tc-99m Комплекс 5'-[N-(3'-Аза-8'-меркапто-1',4'-ди-оксо-6'-тиа-окт-1'-ил)- 6-аминогексил-фосфорная кислота сложный эфир] 5'-CUCAUGGAGCGCAAGACGAAUAGCUACAUAT*T*T*T*T-3'
1 мг конъюгата, описанного в примере 22e), растворяют в 1 мл 0,1 М динатрий кислого фосфатного буфера (pH 8,5). После добавления 10 мг динатрий тартрата раствор смешивают с раствором пертехнетата натрия (1 мКи) и затем с 10 мкл раствора хлорида олова (II) (5 мг/1 мл 0,01 М HCl). Выход по изотопу (прибл. 95%) определяют с помощью ЖХВР.
Пример 23.
a) 5'-[N-(6'-Аза-7'-гидроксикарбокси-9'-меркапто-1',5'-диоксо-3' -тиа-нон-1'-ил)-6-аминогексил-фосфорная кислота сложный эфир] 5'-CUCAUGGAGCGCAAGACGAAUAGCUACAUAT*T*T*T*T-3'
Сначала получают раствор N-гидросукцинимид сложный эфир моноамида N-(2-оксо-тетрагидротиофен-3-ил)тиодигликолевой кислогы (DE 4311023) в 500 мкл абсолютного ДМФ (DMF). Для этой цели 24,9 мг (0,1 ммоль) моноамида N-(2-оксо-тетрагидротиофен-3-ил)- тиодигликолевой кислоты и 11,5 мг (0,1 ммоль) N-гидросукцинимида растворяют в 500 мкл абсолютного ДМФ. При 0oC к загрузке добавляют 19,2 мг (0,1 ммоль) EDC. Перемешивают в течение 30 минут при 0oC.
10 мг 5'-(6-амино гексил-фосфорная кислота сложный эфир) 5'-CUCAUGGAGCGCAAGACGAAUAGCUACAUAT*T*T*T*T-3', полученного в примере 1, растворяют в 1 мл бикарбонат натрия/карбонат натрия буфера (pH 8,0). Добавляют ДМФ раствор NHS сложного эфира, полученного заранее, и инкубируют в течение 16 часов при комнатной температуре в атмосфере аргона. Затем центрифугируют, концентрируют до объема 500 мкл и хроматографируют на Сефадексе G-25. После сушки вымораживанием получают 2 мг конъюгата в виде белого порошка.
Tс-99m Комплекс
5'-[N-(6'-Аза-7'-гидроксикарбокси-9'-меркапто-1', 5' -диоксо-3'-тиа-нон-1'-ил)-6-аминогексил-фосфорная кислота сложный эфир] 5'-CUCAUGGAGCGCAAGACGAAUAGCUACAUAT*T*T*T*T-3'
1 мг конъюгата, описанного в примере 23a), растворяют в 1 мл 0,1 М динатрий кислого фосфатного буфера. После добавления 10 мг динатрий тартрата его смешивают с раствором пертехнетата натрия (1 мКи) и затем с 10 мкл раствора хлорида олова (II) (5 мг/1 мл 0,01 М HCl). Выход по изотопу (прибл. 92%) определяют с помощью ЖХВР.
Пример 24.
а) 5'-[N-(Меркаптоацетил)-6-аминогексилфосфорная кислота сложный эфир] 5'-CUCAUGGAGCGCAAGACGAAUAGCUACAUAT*T*T*T*T-3'
10 мг 5'-(6-амино-гексил-фосфорная кислота сложный эфир) 5'- CUCAUGGAGCGCAAGACGAAUAGCUACAUAT*T*T*T*T-3', полученного в примере 1, растворяют в 1 мл бикарбонат натрия/карбонат натрия буфера (pH 8,0). Затем 23,1 мг (0,1 ммоль) сложного эфира S-ацетилмеркаптоуксусной кислоты -NHS, растворенного в 500 мкл абсолютного ДМФ, добавляют к загрузке и инкубируют в течение 17 часов при комнатной температуре в атмосфере аргона. Затем центрифугируют, концентрируют до объема 500 мкл и хроматографируют на Сефадексе G-25. После сушки вымораживанием получают 3 мг конъюгата в виде белого порошка.
b) Tc-99m Комплекс 5'-[N-(меркаптоацетил)-6-аминогексил-фосфорная кислота сложный эфир] 5'-CUCAUGGAGCGCAAGACGAAUAGCUACAUAT*T*T*T*T-3'
1 мг конъюгата, описанного в примере 24 a), растворяют в 1 мл 0,1 М динатрий кислого фосфатного буфера (pH 8,5). После добавления 10 мг динатрий тартрата его смешивают с раствором пертехнетата натрия (1 мКи) и затем с 10 мкл раствора хлорида олова (II) (5 мг/1 мл 0,01 М HCl). Выход по изотопу (прибл. 97%) определяют с помощью ЖХВР.
Пример 25.
a) N-[2-(Трифенилметилмеркапто)-эт-1-ил]-тиодигликолевая кислота моноамид
31,9 г (0,1 моль) 2-(Трифенилметилмеркапто)-этиламина и 10,1 г (0,1 моль) триэтиламина вводят в 500 мл абсолютного дихлорметана. При 0oC вливают по каплям раствор 13,2 г (0,1 моль) ангидрида тиодигликолевой кислоты, перемешивают в течение 1 часа при 0oC и в течение 16 часов при комнатной температуре. Затем выливают на 250 мл 5% водной лимонной кислоты, хорошо перемешивают, органическую фазу отделяют и сушат над сульфатом натрия. После выпаривания растворителя в вакууме остаток хроматографируют на силикагеле (подвижный растворитель: дихлорметан/метанол, 0-20% метанола).
Выход: 20,32 г (45,0%), бесцветное масло
Элементный анализ:
Рассч. C 66,49; H 5,58; N 3,10; O 10,63; S 14,20;
Найд. C 66,21; H 5,73; N 2,98; S 14,02.
b) 5'-[N-(1', 5'-Диоксо-6-аза-3'-тиа-8'-меркапто-окт-1-ил)- аминогексилфосфорная кислота сложный эфир] 5'-CUCAUGGAGCGCAAGACGAAUAGCUACAUAT*T*T*T*T-3'
Сначала получают NHS-эфир моноамида N-[2-(трифенилметил-меркапто)-эт-1-ил] -тиодигликолевой кислоты (пример 25a). Для этой цели 45,2 мг (0,1 ммоль) ранее упомянутой кислоты растворяют в 500 мкл абсолютного ДМФ (0,1 ммоль) и смешивают с 11,5 мг (0,1 ммоль) NHS. После охлаждения до 0oC добавляют 19,2 мг (0,1 ммоль) EDC и инкубируют в течение 30 минут при 0oC.
Раствор 10 мг 5-(6-аминогексил-фосфорная кислота сложный эфир) 5'-CUCAUGGAGCGCAAGACGAAUAGCUACAUAT*T*T*T*T-3' в 1 мл бикарбонат натрия/карбонат натрия буфера (pH 8,0), описанного в примере 1, смешивают с 500 мкл раствора NHS-эфира, полученного заранее. Инкубируют в течение 16 часов при комнатной температуре. Затем концентрируют путем выпаривания до объема 500 мкл и хроматографируют на Сефадексе G-25. Получают 6 мг S-тритилзащищенного соединения. Отщепление S-тритилзащитной группы, изоляцию олигонуклеотида, несущего SH группы, и очистку проводят, как описано в примере 22e. Получают 4 мг белого лиофилизата.
b) Tc-99m Комплекс 5'-[N-(1',5'-Диоксо-6'-аза-3'-тиа-8'-меркапто-окт-1-ил) -аминогексилфосфорная кислота сложный эфир] 5'-CUCAUGGAGCGCAAGACGAAUAGCUACAUAT*T*T*T*T-3'
1 мг конъюгата, описанного в примере 25b), растворяют в 1 мл 0,1 М динатрий кислого фосфатного буфера (pH 8,5). После добавления 10 мг динатрий тартрата его смешивают с раствором пертехнетата натрия (1 мКи) и затем с 10 мкл раствора хлорида олова (II) (5 мг/1 мл 0,01 М HCl). Выход по изотопу (91%) определяют с помощью ЖХВР.
Пример 26.
N,N'-Бис-[2-(трифенилметилмеркапто)-1-оксо-эт-1-ил]-3,4-диаминобензойная кислота метиловый эфир
3,32 г (20 ммоль) метилового эфира 3,4-диаминобензойной кислоты и 13,38 г (40 ммоль) S-трифенилметил-меркаптоуксуной кислоты растворяют в 200 мл абсолютного дихлорметана. При 0oC 8,25 г (40 ммоль) дициклогексилкарбодиимида, растворенного в 100 мл абсолютного дихлорметана, вливают по капле в загрузку. Перемешивают в течение более 1 часа при 0oC и, наконец, в течение более 16 часов при комнатной температуре. Фильтруют, встряхивают с 1% водной лимонной кислотой, и органическую фазу сушат над сульфатом натрия, и растворитель испаряют в вакууме. Остаток хроматографируют на силикагеле (подвижный растворитель: дихлорметан/метанол, 0-10% метанола).
Выход: 10,2 г (63,8%), бесцветное масло
Элементный анализ:
Рассч. C 75,16; H 5,30; N 3,51; O 8,01; S 8,02,
Найд. C 75,01; H 5,58; N 3,30; S 7,89.
b) N,N'-Бис-[2-(трифенилметилмеркапто)-1-оксо-эт-1-ил] - 3,4-диаминобензойная кислота
7,99 (10 ммоль) метилового эфира N,N'-Бис- [2-(трифенилметилмеркапто)-1-оксо-эт-1-ил]-3,4-диаминобензойной кислоты (пример 26a) смешивают в 200 мл диоксана, 20 мл воды и 20 мл метанола с 4 г (100 ммоль) гидроксида натрия. Перемешивают в течение 5 часов при комнатной температуре, и загрузку выливают в 300 мл 5% водной лимонной кислоты. Полностью экстрагируют дихлорметаном, органическую фазу сушат над сульфатом натрия. После испарения растворителя остаток хроматографируют на силикагеле (подвижный растворитель: дихлорметан/метанол, 0-40% метанола).
Выход: 3,56 г (45,4%), бесцветное масло
Элементный анализ:
Рассч. C 74,97; H 5,14; N 3,57; O 8,15; S 8,17,
Найд. C 74,71; H 5,32; N 3,31; S 7,88.
с) 5'-{ N-[3',4'-Бис-(2''-меркаптоацетиламино)-бензоил]-6- аминогексилфосфорная кислота сложный эфир} 5'-CUCAUGGAGCGCAAGACGAAUAGCUACAUAT*T*T*T*T-3'
Сначала получают NHS-эфир N,N'-Бис-[2-(трифенилметилмеркапто)-1-оксо-эт-1-ил] -3,4- диаминобензойной кислоты (пример 26b). Для этой цели 78,5 мг (0,1 ммоль) кислоты растворяют в 500 мкл абсолютного ДМФ и смешивают с 11,5 мг (0,1 ммоль) NHS. После охлаждения до 0oC добавляют 19,2 мг (0,1 ммоль) EDC и инкубируют в течение 30 минут при 0oC.
Раствор 10 мг 5'-(6-аминогексил-фосфорная кислота сложный эфир) 5'-CUCAUGGAGCGCAAGACGAAUAGCUACAUAT*T*T*T*T-3' в 1 мл бикарбонат натрия/карбонат натрия буфера (pH 8,0), описанном в примере 1, смешивают с 500 мкл раствора NHS-эфира, полученного заранее. Инкубируют в течение 17 часов при комнатной температуре. Затем концентрируют упариванием до 500 мкл и хроматографируют на Сефадексе G-25. Получают 7 мг S-тритилзащищенного соединения.
Отщепление S-тритилзащитной группы, изоляцию олигонуклеотида, несущего SH-группы, и очистку проводят, как описано в примере 22e. Получают 3 мг белого лиофилизата.
d) Tc-99m Комплекс 5'-{N-[3',4'-Бис-(2'-меркаптоацетиламино) -бензоил] -6-аминогексилфосфорная кислота сложный эфир} 5'-CUCAUGGAGCGCAAGACGAAUAGCUACAUAT*T*T*T*T-3'
1 мг конъюгата, описанного в примере 26c), растворяют в 1 мл 0,1 М динатрий кислого фосфатного буфера (pH 9,5). После добавления 10 мг динатрий тартрата его смешивают с раствором пертехнетата натрия (1 мКи) и затем с 10 мкл раствора хлорида олова (II) (5 мг/1 мл 0,01 М HCl). Выход по изотопу (прибл. 91%) определяют с помощью ЖХВР.
Пример 27.
a) N-[O-Ацетил-гидроксиацетил]-глицил-глицил-глицин-трет-бутиловый эфир
24,5 г (0,1 моль) глицил-глицил-глицин-трет-бутилового эфира и 11,8 г (0,1 моль) O-ацетил-гликолевой кислоты вместе добавляют при 0oC в 500 мл абсолютного диметилформамида. Раствор 20,6 г (0,1 моль) дициклогексилкарбодиимида в 500 мл абсолютного диметилформамида добавляют по каплям к загрузке, перемешивают в течение 1 часа при 0oC и, наконец, в течение ночи при комнатной температуре. Фильтруют, и фильтрат концентрируют выпариванием на масляном насосе (форвакуумный насос).
Кристаллизуют неоднократно из смеси этилацетат/н-пентан.
Выход: 12,5 г (36,2%), белый порошок.
Элементный анализ:
Рассч. C 48,69; H 6,71; N 12,17; O 32,43.
Найд. C 48,43; H 7,01; N 11,93.
b) N-[О-Ацетил-гидроксиацетил]-глицил-глицил-глицин
3,45 г (10 ммоль) N-[0-Ацетил-гидроксиацетил]-глицил-глицил-глицин-трет-бутилового эфира перемешивают в 50 мл трифторуксусной кислоты в течение 15 минут. Затем выливают в 500 мл абсолютного диэтилового сложного эфира, и продукт отфильтровывают. Неоднократно перекристаллизовывают из смеси этилацетат/н-пентан.
Выход: 1,23 г (42,5%), белый порошок.
Элементный анализ:
Рассч. C 41,53; H 5,23; N 14,53; O 38,72.
Найд. C 41,31; H 5,51; N 14,32.
c) 5-{ N-[N'-Гидроксиацетил) глицил-глицил-глицил]-6- амино-гексилфосфорная кислота сложный эфир) 5'-CUCAUGGAGCGCAAGACGAAUAGCUACAUAT*T*T*T*T-3'
Сначала получают NHS-эфир N-[O-ацетил-гидроксиацетил]-глицил-глицил-глицин (пример 27b). Для этой цели 28,9 мг (0,1 ммоль) кислоты растворяют в 500 мкл абсолютного ДМФ и смешивают с 11,5 мг (0,1 ммоль) NHS. После охлаждения до 0oC добавляют 19,2 мг (0,1 ммоль) EDC и инкубируют в течение 30 минут при 0oC. Раствор 10 мг (6-аминогексил-фосфорная кислота сложный эфир) 5'-CUCAUGGAGCGCAAGACGAAUAGCUACAUAT*T*T*T*T-3' в 1 мл раствора бикарбоната натрия, описанного в примере 1, смешивают с 500 мкл раствора NHS-эфира, полученного заранее. Инкубируют в течение 18 часов при комнатной температуре. Затем концентрируют упариванием до 500 мкл и хроматографируют на Сефадексе G-25. После лиофилизации получают 3 мг названного соединения.
d) Tc-99m Комплекс 5-{N-[N'-Гидроксиацетил)глицил-глицил-глицил]-6- аминогексил-фосфорная кислота сложный эфир) 5'-CUCAUGGAGCGCAAGACGAAUAGCUACAUAT*T*T*T*T-3'
1 мг конъюгата, описанного в примере 27c), растворяют в 1 мл 0,1 М динатрий кислого фосфатного буфера (pH 10,5). После добавления 10 мг динатрия тартрата его смешивают с раствором пертехнетата натрия (1 мКи) и затем с 10 мкл раствора хлорида олова (II) (5 мг/1 мл 0,01 М HCl). Выход по изотопу (95%) определяют с помощью ЖХВР.
Предшествующие примеры можно повторить с тем же самым успехом путем замены используемых в предшествующих примерах взаимодействующих веществ и/или рабочих условий на описанные в общем или конкретно взаимодействующие вещества и/или рабочие условия данного изобретения.
Из вышеприведенного описания специалист в данной области техники может легко установить существенные характеристики данного изобретения, и не выходя за рамки сущности и объема его, может провести различные изменения и модификации изобретения, чтобы адаптировать его к различным использованиям и условиям.
| название | год | авторы | номер документа |
|---|---|---|---|
| СОЕДИНЕНИЕ, СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2002 |
|
RU2305096C2 |
| КОМПЛЕКСЫ НУКЛЕИНОВЫХ КИСЛОТ - ЛИГАНДОВ СОСУДИСТОГО ЭНДОТЕЛИАЛЬНОГО ФАКТОРА РОСТА (VEGF) | 1997 |
|
RU2177950C2 |
| КАСКАДНЫЕ ПОЛИМЕРНЫЕ КОМПЛЕКСЫ, ИСХОДНЫЕ СОЕДИНЕНИЯ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1996 |
|
RU2166501C2 |
| НУКЛЕИНОВЫЕ КИСЛОТЫ, МОДИФИЦИРОВАННЫЕ АМИНОКИСЛОТАМИ | 1995 |
|
RU2154638C2 |
| СПОСОБ ПОЛУЧЕНИЯ ПОЛИМЕРНЫХ КОНЪЮГАТОВ | 2006 |
|
RU2401283C2 |
| ПОЛИМЕРНЫЕ ОЛИГОНУКЛЕОТИДНЫЕ ПРОЛЕКАРСТВА | 2004 |
|
RU2394041C2 |
| ПЕРФТОРАЛКИЛСОДЕРЖАЩИЕ СОЕДИНЕНИЯ, СПОСОБ ИХ ПОЛУЧЕНИЯ (ВАРИАНТЫ) И ФАРМАЦЕВТИЧЕСКОЕ СРЕДСТВО, СОДЕРЖАЩЕЕ УКАЗАННЫЕ СОЕДИНЕНИЯ | 1997 |
|
RU2242477C2 |
| ГЕТЕРОБИФУНКЦИОНАЛЬНЫЕ ПОЛИМЕРНЫЕ СОЕДИНЕНИЯ, СПОСОБ ПОЛУЧЕНИЯ ПОЛИМЕРНЫХ КОНЪЮГАТОВ И СПОСОБ ЛЕЧЕНИЯ МЛЕКОПИТАЮЩИХ С ИХ ИСПОЛЬЗОВАНИЕМ | 2004 |
|
RU2361596C2 |
| НИЗКОМОЛЕКУЛЯРНЫЕ КОНЪЮГАТЫ ДЛЯ ВНУТРИКЛЕТОЧНОЙ ДОСТАВКИ НУКЛЕИНОВЫХ КИСЛОТ | 2011 |
|
RU2582235C2 |
| НИЗКОМОЛЕКУЛЯРНЫЕ КОНЪЮГАТЫ ДЛЯ ВНУТРИКЛЕТОЧНОЙ ДОСТАВКИ БИОЛОГИЧЕСКИ АКТИВНЫХ СОЕДИНЕНИЙ | 2011 |
|
RU2629957C2 |



Изобретение относится к биохимии, в частности к химически модифицированным олигонуклеотидным конъгатам, которые содержат комплексообразующий агент или комплекс, который связан соединяющим компонентом с олигонуклеотидами. Олигонуклеотиды модифицированы, что препятствует или, по крайней мере, существенно ингибирует деградацию встречающимися в природе нуклеазами. Олигонуклеотидный радикал может связываться специфически с высоким связывающим сродством со структурами-мишенями и тем самым может производить специфическое терапевтическое и диагностическое действие посредством связанного комплексообразующего агента или комплекса. Техническим результатом изобретения является расширение арсенала средств для диагностики патологичеких состояний, например опухолевых заболеваний. 4 с. и 13 з.п. ф-лы, 3 ил.
N-(B-K)n (I)
в которой N представляет собой олигонуклеотид, который связывается специфически с высоким связывающим сродством с другими структурами-мишенями, и имеет модификации, которые существенно понижают деградацию встречающимися в природе нуклеазами;
B представляет собой химическую связь или связующий компонент, который образует связь между N и K;
K представляет собой комплексообразующий лиганд, который может проявлять себя, как сигнал-передающий или терапевтический активный элемент;
n является числом от 1 до 10.
-O-P-(S)R1-O-3' или -O-P(O)R1-O-3', в котором 4' или 3' указывает связь с концевым сахаридным звеном(ями) и R1 представляет собой O-, S-, C1-C4 алкильную или NR2R3 группу, причем R2 и R3 означают водород или C1-C4 алкильные радикалы.
представляют собой группу -NR2, -O- или -S-, X представляет собой непосредственную связь, -NH или -S группу, Y представляет собой неразветвленную цепь, разветвленную цепь, насыщенную или ненасыщенную C1-C20 алкиленовую цепь, которая произвольно содержит 1-2 циклогексилена, 1-5 имино, 1-3 фенилена, 1-3 фениленимино, 1-3 фениленокси, 1-3 гидроксифенилена, 1-5 амидо, 1-2 гидразидо, 1-5 карбонила, 1-5 этиленокси, уреидо, тиоуреидо, 1-2 карбоксиалкилимино, 1-2 сложноэфирных групп, 1-3 групп Ar, где Ar обозначает насыщенное или ненасыщенное 5- или 6-членное кольцо, которое произвольно содержит 1-2 гетероатомов, выбранных из азота, кислорода и сера и/или 1-2 карбонильных групп, 1-10 кислородов, 1-5 азотов и/или 1-5 атомов серы, и/или произвольно замещена 1-5 гидрокси, 1-2 меркапто, 1-5 оксо, 1-5 тиоксо, 1-3 карбокси, 1-5 карбокси-C1-C4-алкильной, 1-5 сложноэфирной, 1-3 амино, 1-3 гидрокси-C1-C4алкильной, 1-3 C1-C7-алкокси группами и R2 представляет собой водород или C1-C4 алкильные радикалы.
| US A 4416988, 22.11.83 | |||
| Устройство для рыхления мерзлых грунтов и нарезки траншей | 1975 |
|
SU588299A1 |
| Способ размножения копий рисунков, текста и т.п. | 1921 |
|
SU89A1 |
Авторы
Даты
2001-04-27—Публикация
1995-06-30—Подача