Изобретение относится к замещенным производным 19-норпрегнена, способам получения этих соединений и фармацевтическим композициям, содержащим их.
Соединения согласно данному изобретению имеют специфические и сильные прогестациональные (способствующие наступлению или сохранению беременности) свойства и не обладают остаточной андрогенной активностью.
Производные 19-норпрегнена, замещенные в положении 1,2-, описаны в литературе. Например, FR-A-1 525 916 относится к способу получения соединений формулы: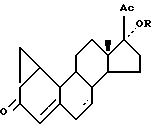
в которой R является водородом или ацильным остатком, таким как ацетил или гексаноил.
Кроме того, производные 19-норпрегнена, замещенные в положении 6-, описаны в следующих документах:
FR-A-1 524 013, который относится к производным 3-енольного эфира прегнана, полученным из 4-прегнен-3,20-дионов формулы: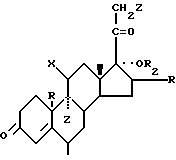
средикоторыхможетбытьуказан6α-метил-17α-гидрокси-4-прегнен-3,20-дион;
DE-A-2148261,которыйописываетспособполучения6α-метил-19-норпрегненов формулы: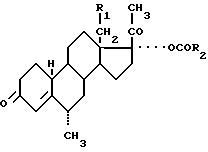
в которой R1 является водородом или метильной группой и
R2 является (C1-C9) алкильной группой; или
BE 757 285, который относится к фармацевтическим средствам, содержащим 3,20-диоксо-6α-метил-17α-ацетокси-19-нор-Δ4-прегнен.
Производные 19-норпрегнена, такие как производные, описанные выше, однако, оказывают обычно андрогенные побочные действия.
С другой стороны, превращение 17α-20,изопропилидендиокси-4,5-секо-3-прегнин-5-она в 6,6-диметил-17α-гидроксипрогестерон описано в патенте США 3 891 677.
Заявитель обнаружил, что производные 19-норпрегнена, которые обладают, по крайней мере двумя заместителями в положении 1-, 2-, 1,2- и/или 6-, проявляют сильную прогестациональную активность, не проявляя при этом остаточной андрогенной активности.
Первый аспект этого изобретения, следовательно, охватывает соединения, имеющие структуру, представленную следующей общей формулой (I);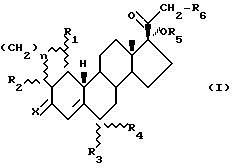
в которой R1, R2, R3, R4 и R6 каждый независимо представляют водород или (C1-C6)алкильную группу,
R5 является водородом, (C1-C6)алкильной или -COR7 группой, в которой R7 является (C1-C6)алкильной группой,
n представляет ноль или единицу, и
x является кислородом или гидроксиимино группой, при условии, что, когда n= 0, по крайней мере два из R1, R2, R3 и R4 отличаются от водорода и, когда n=1, R3 и R4 не являются одновременно водородом.
Используемый здесь термин "алкил" означает разветвленный или линейный, насыщенный углеводородный радикал, такой как, например, метил, этил, пропил, изопропил, бутил, изо-бутил, трет-бутил, пентил и гексил.
Используемая здесь группа -COR7, в которой R7 является (C1-C6)алкилом, включает, например, ацетил, пропионил, бутирил, изобутирил, трет-бутирил, валерил и гексаноил, причем ацетил предпочтителен.
Предпочтительными соединениями формулы (I) являются соединения, в которых R1, R2 и R6 являются водородом, R3 и R4 являются (C1-C6)алкилом, R5 является группой -COR7 и n представляет ноль, причем те соединения, в которых X является кислородом, особенно предпочтительны. Также предпочтительными являются соединения формулы (I), в которой R1, R2, R4 и R6 являются водородом, R3 является (C1-C6)алкилом, R5 является группой -COR7 и n равен единице. Кроме того, предпочтительными являются соединения формулы (I), в которой R4 и R6 являются водородом, R3 является (C1-C6)алкилом, R5 является группой -COR7 и n равен нулю. Среди последних также предпочтительными являются соединения, в которых R1 является водородом и R2 - (C1-C6)алкилом, и соединения, в которых R1 является (C1-C6)алкилом и R2 является водородом, причем особенно предпочтительны соединения, в которых X является кислородом.
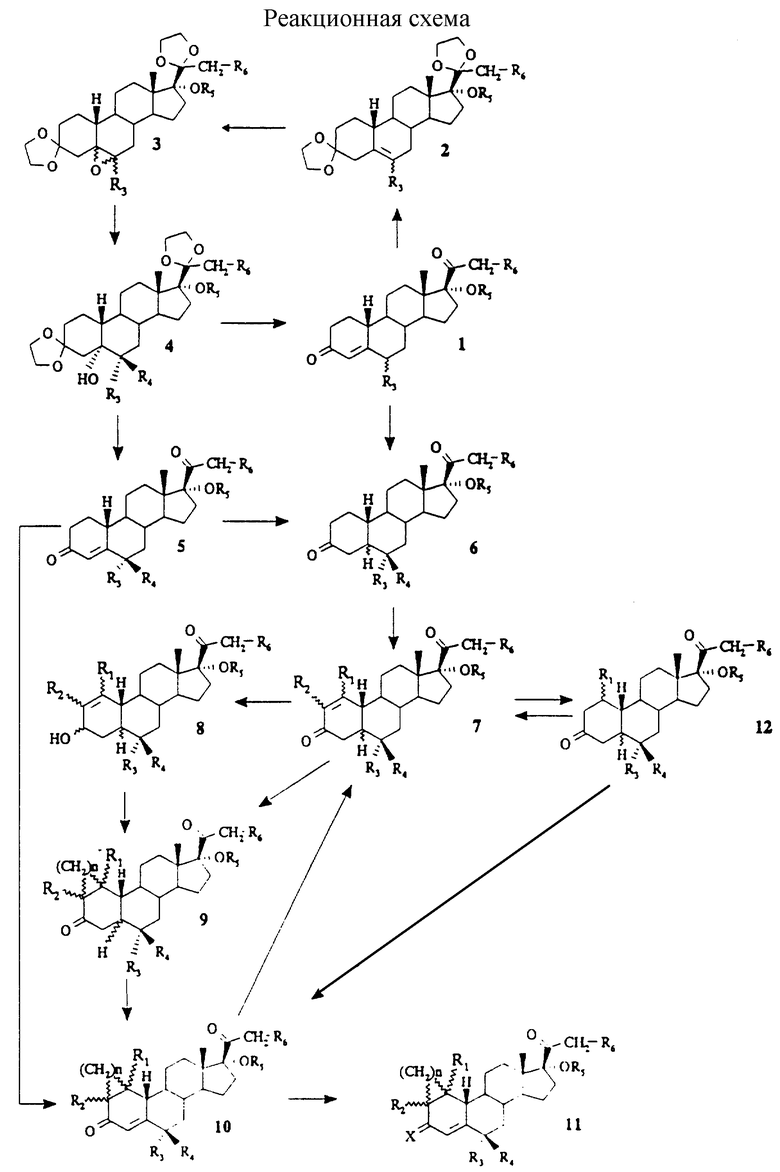
Согласно еще одному аспекту изобретение относится к способу получения соединений формулы (I): они могут быть получены, следуя реакционной схеме (см. в конце описания): в которой R1, R2, R3, R4, R5, R6, n и X имеют те же самые значения, как представлено выше.
Соединения 5, в которых R3 и R4 являются (C1-C6)алкилами, могут быть получены следующим образом.
Соединения 1 получают, используя процесс, подобный процессу, описанному в DE-A-2 148 261. В случае, когда R5=COR7, они омыляются гидроксидом натрия в смеси этанола и тетрагидрофурана. Продукты 1 (R5=H) выделяют путем осаждения в воде с последующей кристаллизацией в спирте, предпочтительно в метаноле или этаноле. Затем их растворяют в толуоле, к которому добавляют от 1 до 10 молярных эквивалентов этиленгликоля, предпочтительно 5 молярных эквивалентов, три-этилортоформиат и каталитическое количество пара-толуолсульфоновой кислоты. Реакционную смесь перемешивают при температуре от приблизительно 20oC до 80oC, предпочтительно при 40oC, в течение приблизительно от 2 до 8 часов. Реакционную смесь охлаждают и вливают в ледяную воду и экстрагируют подходящим органическим растворителем. Осадок, полученный после выпаривания растворителя, может быть очищен кристаллизацией или флэш-хроматографией с тем, чтобы получить соединения 2.
Обработка соединений 2 3-хлорпероксибензойной кислотой (MCPBA) в метиленхлориде дает смесь 5,6-оксиранов 3, которые выделяют путем кристаллизации или путем флэш-хроматографии. Добавление избытка R4-магнийгалогенида к соединениям 3 в тетрагидрофуране при температуре от приблизительно 20oC до 60oC в течение приблизительно 8 часов и обработка реакционной смеси раствором хлорида аммония, экстракция толуолом и выпаривание растворителя дают в результате соединения 4.
Снятие защиты с последующей дегидратацией третичной гидроксигруппы дает соединения 5, которые могут быть необязательно этерифицированы известными способами, используемыми в химии стероидов, или алкилированы алкилгалогенидами в соответствии с традиционными способами синтеза простых эфиров по Вильямсону, такими как способы, описанные B.G.Zupan-cic и M.Sopcic, Synthesis, 1979, 123 или D.R.Benedict et al. Synthesis, 1979, 428-429.
Соединения 6, где R3 является (C1-C6)алкилом и R4 является водородом, могут быть получены следующим образом.
Соединения 6 с 5β-H конфигурацией получают путем гидрирования соединений 1 или 5 в тетрагидрофуране, уксусной кислоте или в спирте, таком как метанол, этанол или пропанол, палладием или производным палладия или платины.
Соединения 6 с 5α-H конфигурацией могут быть получены путем химического восстановления соединений 1 или 5 дитионитом натрия, используя методику проведения, описанную F. Camps et al. Tetrahedron Lett., 1986, 42, N 16, 4603-4609 или R.S.Dhilion et al., Tetrahedron Lett., 1995, 36, N 7, 1107-1108.
Соединения формулы (I) могут быть получены следующим образом.
Бромирование с последующим дегидробромированием соединений 6 в соответствии с хорошо известными методиками проведения (Y.J.Abul-Hajj, J.Org.Chem., 1986, 51, 3059-3061; C. Djerassi и C.R. Scholz, J.Am. Chem. Soc., 1948, 417; R. Joly et al., Bull. Soc. Chim. Fr., 1957, 366) дает соединения 7 (R1= R2= H).
Соединения 5 (R5=H) могут быть превращены в их 20,20-этандиокси производные, затем превращены в их 2-гидроксиметилен натриевую соль и алкилированы, используя алкилиодид, такой как метилиодид, этилиодид или пропилиодид, следуя способу, описанному N.W.Atwater et al., in J. Org. Chem., 1961, 23, 3077-3083, с тем, чтобы получить соединения 10 (R1=H, R2=алкил, n=0).
Необязательно химическое восстановление путем гидрирования 4,5-двойной связи соединений 10 (R1= H, R2= алкил, n= 0) с последующим бромированием/дегидробромированием дает соединения 7 (R1=H, R2=алкил).
Добавление диалкилкупрата лития LiCu(R1)2 или соответствующего галогенида алкилмагния в условиях медного катализа (например, CuI, CuCl или CuCN) к соединениям 7 (R1= R2=H) дает соединения 12 (R1=алкил), которые могут быть превращены в соединения 10 (R1=алкил, R2=H, n=0), используя хорошо известные в химии стероидов методики проведения реакций для введения 4,5-двойной связи, или превращены в соединения 7 (R1=алкил, R2=H) путем дегидрирования или путем бромирования/дегидробромирования.
Соединения 12 также могут быть алкилированы в положении 2 путем проведения подобного процесса с тем, чтобы получить соединения 10 (R2=алкил, n= 0), которые затем превращают в соединения 7 (R1=R2=алкил), как описано выше.
Соединения 9 (R1=H или алкил, R2=H или алкил, n=1) получают путем проведения реакции между соединениями 7 (R1=H или алкил, R2=H или алкил) и метилидом диметилсульфоксония, полученного реакцией иодида триметилсульфоксония (предпочтительно с основанием) с гидриром натрия в тетрагидрофуране, диметилформамиде или диметилсульфоксиде. Также они могут быть получены реакцией соединений 7 с диазометаном, катализированной палладиевыми или медными производными. Альтернативно, соединения 7 (R1=H или алкил, R2=H или алкил) могут быть восстановлены боргидридом натрия в присутствии хлорида церия в соединения 8 (R1=H или алкил, R2=H или алкил), которые подвергают реакции Симмонса-Смита согласно различным известным описанным методикам проведения реакции (H.E.Simmons and R.D.Smith, J.Am.Chem.Soc., 1958, 80, 5323; H.E.Sim-mons and R.D.Smith, J.Am.Chem.Soc., 1959, 81, 4256; Org.Synthesis, 1961, 41, 72; J. Furukawa et al. Tetrahedron Lett., 1966, 3353; J.Furukawa et ai. Tetrahedron, 1968, 24, 53; S. E. Denmark and Edwards, J.Org.Chem., 1991, 56, 6974-6981).
Окисление 3-гидроксигруппы соединений 8 различными окислителями, такими как CrO3/пиридин, дает соединения 9.
Соединения 9 (R1=H или алкил, R2=H или алкил, n=0 или 1) превращают в их силил-енольный простой эфир и дегидрируют ацетатом палладия в кипящем (с обратным холодильником) ацетонитриле с тем, чтобы получить соединения 10. Альтернативно, 4,5-двойная связь может быть введена бромированием с последующим дегидробромированием, используя процесс, подобный процессу, описанному выше для соединений 7. Конденсация соединений 10 гидрохлоридом гидроксиламина в смеси диоксана и пиридина дает соединения 11.
Соединения согласно этому изобретению обладают специфическими и сильными прогестациональными свойствами. Следовательно, они пригодны для лечения ряда эндокрин-гинекологических расстройств, связанных либо с нарушением баланса эстроген/прогестерон, включая менструальные расстройства (спаноменорея, олигоменорея, вторичная аменорея, предменструальное напряжение, головная боль, удержание воды, изменение (перемена) настроения), заболевания молочной железы (циклическая масталгия, доброкачественная болезнь молочной железы, опухоли молочной железы); либо с состояниями, требующими ингибирование гонадотропных/гонадных выделений: эндометриоз, поликистозный синдром яичника у женщин, заболевания предстательной железы у мужчин.
С другой стороны, соединения согласно этому изобретению могут быть использованы в качестве контрацептивных агентов, либо одни, либо в сочетании с эффективным количеством полового стероида, такого как эстрадиол, этинилэстрадиол или тестостерон, и, кроме того, одни или в сочетании с эстрогеном для проведения гормонально-заменяющей терапии в постклимактерический период у женщин.
Прогестациональная активность соединений согласно настоящему изобретению главным образом может быть оценена в двух специфических экспериментальных моделях: по сродству с рецептором прогестерона (PR) in vitro и по эндометриальным изменениям матки кролика in vivo. Человеческие рецепторы прогестерона легко доступны в больших количествах из T47-D выращенных клеток (M.B. Mockus et al. Endocrinology, 1982, 110, 1564-1571). Относительные связывающие свойства (сродство) (RBA) для человеческого T47-D клеточного рецептора прогестерона определяют, как прежде описано (J. Botella et al., J.Steroid Biochem. Molec. Biol. , 1994, 50, 41-47), используя 3[H]-ORG 2058 в качестве меченого специфического лиганда (G. Fieischmann and M.Beato, Biochim.Biophys. Acta, 1978, 540, 500-517) и ацетат номегестрола в качестве нерадиоактивного эталона прогестина. Сравнительные инкубации (выращивания) были выполнены относительно 2 нМ 3[H]-ORG 2058 в течение 3 часов при 4oC с шестью различными концентрациями немеченого стероида, выбранными между 4 и 256 нМ, следуя схеме разбавления 1/2n. Смещенные кривые точно соответствовали каждому эксперименту, и для каждой кривой была рассчитана концентрация, при которой ингибируется 50% специфического связывания 3[H]-ORG 2058 (IC50)(Таблица 1).
Один специфический фармакологический тест был стандартизован in vivo для обнаружения и количественного определения псевдогестагенной активности со времени середины 30-х годов: он основан на свойстве матки эстроген-введенных молодых самок кроликов реагировать на очень небольшие количества прогестина путем типичного эндометриального превращения в уплотненную и сплетенную эпителиальную сеть, называемую "дентель" (dentelle). Первоначальный тестовый режим, который включает 6 дней введения эстрогена (общая подкожная доза бензоата эстрадиола - 30 микрограмм/кролик) с последующим прогестациональным лечением в течение 5 дней, был разработан еще в 1930 г. C.Clauberg, Zentr. Gynakol. , 1930, 54, 2757-2770. Полуколичественный анализ, используемый для выделения (оценки) интенсивности микроскопического возникновения дентеля, был установлен M. K. McPhail, J.Physiol. (London), 1934, 83, 145-156. Эта общая методика проведения исследований по Clauberg-McPhail была широко использована для произведения отбора стероидов с предполагаемой прогестациональной активностью in vivo и по-прежнему является частью исследований основного гормонального профиля любого нового прогестина, такого как норгестимат (A.Phillips et al., Cotraception, 1987, 36, 181-192), или дезогестрел (J.Van der Vies and J.De Visser, Arzneim.Forsch./Drug.Res., 1983, 33, 231-236).
Прогестациональная сила обратно пропорционально связана с дозой, необходимой для того, чтобы индуцировать полумаксимальное возбуждение дентеля, т. е. записать среднюю степень по шкале McPhail, равную 2. Это значение ED50 получают из кривой, зависимой от дозы, и выражают в общей дозе/кролик/ 5 дней. Все соединения были протестированы, только следуя пероральному введению путем принудительного кормления, в суспензии в карбоксиметилцеллюлозном растворе. Максимальная вводимая доза составила 1 мг, грубо соответствует 5-кратному значению ED50 ацетата номегестрола, сильнодействующего орально активного прогестина, полученного из 19-норпрогестерона (J.Paris et al., Arzneim. Forsch./Drug Res., 1983, 33, 710-715)(Таблица).
Остаточный андрогенный потенциал является важной характеристикой, которую следует оценивать для любого нового прогестина из-за высокой предсказуемости возникновения андрогенных побочных эффектов у женщин. Одна фармакологическая модель андрогенной активности в молодых кастрированных мужских особях крыс была стандартизована для подбора стероидов или родственных соединений, используя гипертрофию брюшной предстательной железы и семенного пузырька в качестве конечной точки (стадии), следуя 10-дневным приемам (R.I. Dorfman, в Методах Исследования Гормонов, том 2, Лондон, Academic Press, 1962, 275-313; A.G.Hilgar and D.J. Hummel, Данные Андрогенного и Миогенного Эндокринного Биоанализа, Департамент США по Здоровью, Образованию и Благосостоянию, Washington D. C. , 1964). Ацетат медроксипрогестерона является 6α-метил-прегнен-производным, которое, кроме его основной прогестациональной активности, хорошо известно по своим слабым андрогенным свойствам (M.Tausk and J. de Visser, в Международной Энциклопедии по Фармакологии и Терапии, Секция 48: Прогестерон, Прогестациональные Лекарства и Противозачаточные Средства, том II, Оксфорд, Pergamon Press, 1972, 35-216); его, следовательно, выбрали в качестве эталонного соединения при тестировании некоторых соединений на остаточную андрогенную активность согласно этому изобретению.
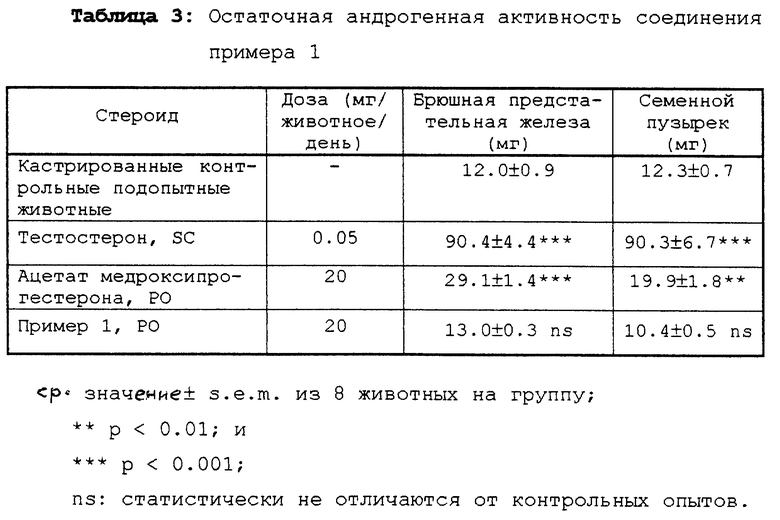
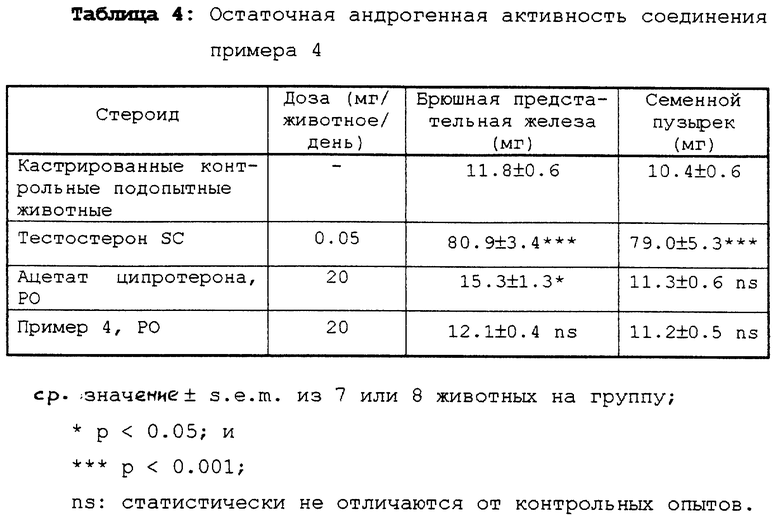
Соединения примеров 1 и 4 были протестированы на остаточную андрогенную активность в модели молодой кастрированной мужской особи крысы путем принудительного кормления (PO) в сравнении соответственно с ацетатом медроксипрогестерона и ацетатом ципротерона (1,2α-циклометилен-прегнен производное с сильной прогестациональной активностью); тестостерон был использован в качестве стандартного андрогенного агента путем подкожной инъекции (SC).
Соединения примеров 1 и 4 были абсолютно неактивны по отношению к росту мужских второстепенных половых органов (Таблица 3 и 4). Возбуждающий (стимулирующий) эффект ацетата ципротерона был очень слабым и ограничивался брюшной предстательной железой, на границе статистической ошибки (Таблица 4), в то время как ацетат медроксипрогестерона вызвал более или менее двойное увеличение в весе обоих органов (Таблица 3).
Таким образом, соединения согласно настоящему изобретению являются сильнодействующими прогестогенами, не обладающими никакой остаточной андрогенной активностью.
Таким образом, согласно другому аспекту изобретение относится к фармацевтическим композициям, содержащим эффективное количество соединения формулы (I), смешанного с подходящими фармацевтически приемлемыми наполнителями (средой для лекарства). Указанные композиции, кроме того, могут включать эффективное количество эстрогена.
Другой аспект этого изобретения включает способ лечения или предотвращения эндокрин-гинекологических расстройств (заболеваний) и способ ингибирования гонадотропных/гонадных выделений. Соединения согласно настоящему изобретению могут быть назначены при терапевтически эффективной дозировке для каждого состояния, указанного выше. Прием активных соединений, описанных здесь, может быть осуществлен в любой из приемлемых форм приема агентов, используемых при сходных показаниях.
Обычная необходимая ежедневная доза соединения согласно изобретению будет находиться в диапазоне от 0,001 до 1 мг/кг веса тела в день активного соединения формулы (I). Большая часть состояний реагирует на лечение, включая уровень дозировки порядка от 0,002 до 0,2 мг/кг веса тела в день. Таким образом, при назначении лечения человеку весом 50 кг диапазон дозировки будет составлять приблизительно 1 мг в день, предпочтительно между приблизительно 0,1 и 10 мг в день.
В зависимости от специфического клинического статуса болезни прием может быть осуществлен по любой приемлемой систематической системе введения, например орально или парентерально, как внутривенное, внутримышечное, подкожное, или введение путем впрыскивания или через вагинальный, глазной или носовой путь, в твердых, полутвердых или жидких дозированных формах, таких как, например, таблетки, суппозитории, пилюли, капсулы, порошки, растворы, суспензии, крем, гель, капиллярная трубочка, пластырь, пессарий, аэрозоли, свеча, эмульсии или тому подобное, предпочтительно в целых единицах дозированных форм, пригодных для легкого приема установленных (назначенных) дозировок. Фармацевтические композиции будут включать традиционный носитель или связующее вещество и соединение формулы (I) и в дополнение могут включать другие медицинские агенты, фармацевтические агенты, носители, полезные добавки, т.д.
По желанию (при необходимости), фармацевтическая композиция, которую следует назначать для лечения, также может содержать меньшие количества нетоксичных дополнительных веществ, таких как смачивающие (увлажняющие) агенты или эмульгаторы, pH буферные агенты и тому подобное, как, например, ацетат натрия, монолаурат сорбитана, олеат триэтаноламина, т.д.
Соединения этого изобретения обычно назначают в виде фармацевтической композиции, которая включает фармацевтическое связующее вещество в сочетании с соединением формулы (I). Количество лекарства в составе готовой формы может варьироваться в пределах всего диапазона, применяемого специалистами в данной области, например от приблизительно 0,01 весового процента (вес.%) до приблизительно 99,99 вес. % лекарства, основанных на общем составе, и от приблизительно 0,01 вес.% до 99,99 вес.% среды для лекарства.
Предпочтительным способом приема лекарства для состояний, указанных выше, является пероральный прием при использовании традиционного ежедневного дозировочного режима, который можно регулировать в соответствии со стадией (степенью) болезни. Для упомянутого перорального приема фармацевтически приемлемую нетоксичную композицию готовят путем внедрения выбранного соединения формулы (I) в любую из используемых в текущий момент сред для лекарств, такую как, например, фармацевтические сорта маннита, лактоза, крахмал, стеарат магния, сахарин натрия, тальк, целлюлоза, глюкоза, желатин, сахароза, карбонат магния и тому подобное. Такие смеси имеют форму растворов, суспензий, таблеток, пилюль, капсул, порошков, готовых форм с пролонгированным высвобождением активного вещества, и тому подобное. Такие смеси могут содержать от 0,01 вес.% до 99,99 вес.% активного соединения согласно этому изобретению. Предпочтительно, чтобы смеси имели форму (представляли собой) сахаром покрытой пилюли или таблетки и, следовательно, чтобы они содержали вместе с активным компонентом разбавитель, такой как лактоза, сахароза, фосфат дикальция и тому подобное; разрыхлитель, такой как крахмал или его производные; смазывающее вещество, такое как стеарат магния и тому подобное; и связующее вещество, такое как крахмал, поливинилпирролидон, смолистое выделение акации, желатин, целлюлоза и ее производные, и тому подобное. Изобретение проиллюстрировано примерами, представленными ниже. В этих примерах используется следующая аббревиатура:
s: синглет
d: дублет
t: триплет
q: квадруплет
m: мультиплет
dd: сдвоенный дублет
bs: широкий синглет
ПРИМЕР 1: 17α-Ацетокси-6,6-диметил-3,20-диокси-19- норпрегна-4-ен (5)
A) 17α-Гидрокси-6α-метил-3,20-диоксо-19- норпрегна-4-ен (1)
К раствору 17α-ацетокси-6α-метил-3,20-диоксо-19- норпрегна-4-ена (100 г, 268 ммол) в абсолютном этаноле и тетрагидрофуране (200 мл) добавляли в течение 45 мин при нормальной температуре 1N раствор гидроксида натрия (300 мл, 300 ммол). Раствор перемешивали (8 часов) и вливали в ледяную воду (4000 мл). Осадок отфильтровывали и сушили при 50oC под вакуумом (выход: 70 г, 78,9%), mp (точка плавления): 172oC.
1H-ЯМР (CDCl3, δ): 0.79 (s, 3H), 1.25 (d, 3H), 2.29 (s, 3H), 2.68 (m, 1H), 5.87 (s, 1H).
В) Бис-[3,3-20, 20-этандиокси] -1α-гидpoкcи-6-метил- 19-нopпрегна-5-ен (2)
К суспензии соединения 1 (70 г, 211 ммол) в безводном этиленгликоле (1000 мл), ацетонитриле (700 мл) и триэтилортоформиате (105 мл, 633 ммол) добавляли моногидрат паратолуолсульфоновой кислоты (5,25 г, 27,6 ммол). Смесь перемешивали (2 часа) и затем нейтрализовали триэтиламином (8 мл, 57,4 ммол). После концентрирования до 1000 мл суспензию влили в воду (4000 мл). Осадок фильтровали и сушили при 60oC под вакуумом (выход: 81 г, 92,1%), точка плавления: 214oC.
1H-ЯМР (CDCl3, δ): 0.85 (s, 3H), 1.40 (s, 3H), 1.65 (s, 3H), 2.80 (m, 1H), 4.00 (m, 8H).
C) 5α, 6α-Эпокси-бис[3,3-20,20-этандиокси] -17α-гидрокси-6β-метил-19-норпрегнан (3)
К раствору соединения 2 (70 г, 167 ммол) в метиленхлориде (800 мл) добавляли раствор MCPBA (43,29 г, 200,17 ммол, 80% чистоты) в метиленхлориде (250 мл). Реакционную смесь перемешивали в течение 1 часа. Осадок был отфильтрован и органическая фаза была промыта NaHSO3 и раствором гидрокарбоната натрия. Органическую фазу сушили (N2SO4), концентрировали и осадок был подвергнут флэш-хроматографии на силикагеле при использовании толуола/этилацетата в качестве элюента с получением 20,3 г целевого соединения (выход: 27,63%), точка плавления: 220oC.
1H-ЯМР (CDCl3, δ): 0.80 (s, 3H), 1.25 (s, 3H), 1.35 (s, 3H), 4.00 (m, 8H).
D) Бис-[3,3-20,20-этандиокси] -5α, 17α-дигидрокси-6,6- диметил-19-норпрегнан (4)
К раствору соединения 3 (30 г, 69 ммол) в тетрагидрофуране (1200 мл) добавили 1.4 М метилмагнийбромид в смеси тетрагидрофурана и толуола (250 мл, 345 ммол). Раствор перемешивали при кипячении с обратным холодильником в течение ночи. Смесь влили в смесь льда и насыщенного хлорида аммония (1000 мл). Реакционную смесь экстрагировали толуолом, промывали водой и сушили (Na2SO4). Выпаривание растворителя дало осадок, который был подвергнут хроматографии при использовании толуола/этилацетата в качестве элюента (выход: 15,4 г, 49,55%), точка плавления: 212oC.
1H-ЯМР (CDCl3, δ): 0.85 (s, 3H), 0.95 (s, 6H), 1.35 (s, 3H), 4,00 (m, 8H).
E) 17α-Ацетокси-6,6-диметил-3,20-диоксо-19-норпрегна-4-ен
К вышеуказанному соединению (30,8 г, 68,33 ммол) в ацетоне (300 мл) и воде (30 мл) добавляли моногидрат пара-толуолсульфоновой кислоты (1,33 г, 7 ммол). Реакционную смесь перемешивали при комнатной температуре в течение 5 часов. После нейтрализации с помощью NaHCO3 смесь выливали в ледяную воду (100 мл) и экстрагировали дважды метиленхлоридом. Органический слой был промыт водой, осушен (Na2SO4) и концентрирован с тем, чтобы получить 24,3 г 5α,17α-дигидрокси-6,6-диметил-3,20-диоксо-19-норпрегнана (выход: 98,2%), точка плавления: 224o C.
1H-ЯМР (CDCl3, δ): 0.75 (s, 3H), 0.91 (s, 3H), 1.08 (s, 3H), 2.29 (s, 3H).
К раствору этого соединения (15 г, 41,20 ммол) в уксусной кислоте (120 мл) добавляли несколько капель H2SO4 (98%). Смесь нагревали при 60oC в течение 5 часов. Затем ее вливали в раствор, насыщенный NaHCO3, и экстрагировали метиленхлоридом. Органическую фазу осушивали (Na2SO4) и выпаривали с тем, чтобы получить 12,3 г 17α-гидрокси-6,6-диметил-3,20-диоксо-19-норпрегна-4-ена (выход: 96,3%), точка плавления: 172oC.
1H-ЯМР (CDCl3, δ): 0.79 (s, 3H), 1.15 (s, 6H), 2.09 (s, 3H), 5.97 (s, 1H).
К раствору этого соединения (12,3 г, 35,7 ммол) в уксусной кислоте (120 мл) и уксусном ангидриде (70 мл) добавляли пара-толуолсульфоновую кислоту (2,5 г, 13,2 ммол). Смесь перемешивали в течение 12 часов при комнатной температуре. После завершения реакции избыток ангидрида был разложен водой. Смесь экстрагировали метиленхлоридом и промывали 1N водным раствором гидроксида натрия. Органическую фазу сушили (Na2SO4) и концентрировали. Осадок был подвергнут флэш-хроматографии c использованием толуол/этилацетата в качестве элюента и перекристаллизован в диизопропиловом эфире (выход: 7 г, 50,81%), точка плавления: 200oC.
1H-ЯМР (CDCl3, δ): 0.71 (s, 3H), 1.18 (s, 6H), 2.05 (s, 3H), 2.11 (s, 3H), 5.99 (3, 1H).
ПРИМЕРЫ 2 и 3: 17α-Ацетокси-6β-этил-6α-метил-3,20-диоксо-19-норпрегна-4-ен (5a) и 17α-ацетокси-6β-пропил-6α-метил-3,20-диоксо-19-норпрегна-4-ен (5b)
Начиная с соединения 3 (выбирая соединение 3 в качестве исходного), используя процесс, описанный для соединения 5, но заменяя метилмагнийбромид этил- или пропилмагнийбромидом, получили следующие соединения:
17α-Ацетокси-6β-этил-6α-метил-3,20-диоксо-19 -норпрегна-4-ен, точка плавления: 160oC (пример 2),
1H-ЯМР (CDCl3, δ): 0.7 (s, 3H), 0.72 (t, 3H), 1.08 (s, 3H), 2.05 (s, 3H), 2.11 (s, 3H), 5.95 (s, 1H); и
17α-ацетокси-6β-пропил-6α-метил-3,20-диоксо-19-норпрегна-4-ен (пример 3).
ПРИМЕР 4: 17α-Ацетокси-1α, 2α-метилен-6α-метил-3,20-ди- оксо-19-норпрегна-4-ен (10)
A1) 17α-Ацетокси-6α-метил-3,20-диоксо-19-норпрегнан (6)
К раствору 17α-ацетокси-6α-метил-3,20-диоксо-19-норпрегна-4-ена (10 г, 26,84 ммол) в диоксане (100 мл) и воде (100 мл), содержащей NaHCO3 (14,65 г, 174,46 ммол), добавляли дитионит натрия (7,9 г, 38,5 ммол) и реакционную смесь перемешивали при 50oC в течение 1 часа, в течение которого добавляли дополнительный дитионит натрия тремя порциями по 7,9 г каждая. Реакционную смесь охлаждали до комнатной температуры и добавляли холодную воду до тех пор, пока раствор не стал прозрачным. После этого раствор экстрагировали диэтиловым эфиром, сушили (Na2SO4), концентрировали под вакуумом и подвергали флэш-хроматографии (толуол/этилацетат) с тем, чтобы получить 2 г соединения 6 (выход: 20%), точка плавления: 202oC.
1H-ЯМР (CDCl3, δ): 0.65 (s, 3H), 0.86 (d, 3H), 2.03 (s, 3H), 2.09 (s, 3H), 2.31 (m, 3H), 2.62 (m, 1H), 2.90 (m, 1H).
B1) 17α-Ацетокси-6α-метил-3,20-диоксо-19-норпрегна-1-ен (7)
Смесь соединения 6 (20 г, 53,40 ммол) и Pd(OAc)2 (14,38 г, 64,05 ммол) в ацетонитриле (300 мл) кипятили с обратным холодильником в течение 8 часов. После охлаждения палладий был отфильтрован, и растворитель упаривали. Осадок был подвергнут флэш-хроматографии на силикагеле, используя толуол/этилацетат (8/2) в качестве элюента с получением 7 г соединения 7 (выход: 35%), точка плавления: 186-188oC.
1H-ЯМР (CDCl3, δ): 0.69 (s, 3H), 0.93 (d, 3H), 2.07 (s, 3H), 2.12 (s, 3H), 2.76 (d, 1H), 2.94 (m, 1H), 6.02 (dd, 1H), 7.11 (dd, 1H).
C1) 17α-Ацетокси-1α,2α-метилен-6 α -метил-3,20-диоксо-19-норпрегнан (9)
К перемешиваемой суспензии иодида триметилсульфоксония (7,68 г, 34,91 ммол) в диметилсульфоксиде (50 мл) добавляли гидрид натрия в масле (60%) (1,53 г, 38,2 ммол). Смесь перемешивали при 25oC в течение 1 часа и затем добавили соединение 7 (2,97 г, 7,98 ммол). После 3 часов реакционную смесь влили в воду. Сбор получающегося в результате твердого
вещества путем фильтрации и флэш-хроматографии на силикагеле, используя толуол/этилацетат в качестве элюента, дало 1 г соединения 9 (выход; 33%), точка плавления: 204oC.
1H-ЯМР (CDCl3, δ): 0.68(s, 3Н), 0.84(d, 3H), 2.02 (s, 3H), 2.12 (s, 3H), 2.52 (dd, 1H), 2.92 (m, 1h).
Di) 17α-Ацетокси-1α,2α-метилен-6α-метил-3,20-диоксо-19-норпрегна-4-ен
К раствору соединения 9 (4 г, 10,35 ммол) в тетрагидрофуране (80 мл) добавляли порционно пиридинтрибромид (3,83 г, 11,38 ммол). После 30 минут смесь профильтровали, упарили и осадок, экстрагированный метиленхлоридом, промыли водой и сушили (Na2SO4). Выпаривание растворителя дало 5 г коричневого масла, к которому добавили диметилформамид (80 мл), Li2CO3 (1,53 г, 20,70 ммол) и LiBr (0,90 г, 10,35 ммол). Смесь нагревали при 140oC в течение 1 часа. После охлаждения соли были удалены путем фильтрации, и растворитель концентрировали при пониженном давлении. Осадок экстрагировали метиленхлоридом, промывали водой и сушили над Na2SO4. Флэш-хроматография на силикагеле при использовании толуола/этилацетата в качестве элюента дала 2 г основного соединения (выход: 50%), точка плавления: 210oC.
1H-ЯМР (CDCl3, δ): 0.71 (s, 3H), 1.09 (d, 3H), 2.04 (s, 3H), 2.12 (s, 3H), 2.42 (m, 1H), 2.84 (m, 1H), 5.65 (s, 1H).
A2) Альтернативно, соединение 10 также может быть получено из 17α-ацетокси-6α-метил-3,20-диоксо-19-нор-5β-прегнана, полученного путем гидрирования 17α-ацетокси-6α-метил-3,20-диоксо-19-норпрегна-4-ена в уксусной кислоте при использовании Pd(OH)2 в качестве катализатора.
B2) Затем к охлажденному раствору конечного соединения (20 г, 53 ммол) в THF (200 мл) добавили 17,1 г (53 ммол) пиридинтрибромида. После 2 часов смесь отфильтровали, влили в ледяную воду и экстрагировали метиленхлоридом. Выпаривание растворителя дало 23,8 г (выход: 93,8%) сырого (неочищенного) 17α-ацетокси-2α-бром-6α-метил-3,20-диоксо-19-нор-5β-прегнана, который был дегидробромирован, следуя условиям, описанным выше для стадии D1, чтобы получить15,9г(выход:80%)17α-ацетокси-6α-метил-3,20-диоксо-19-нор-5β-прегна-1-ена (7a), точка плавления: 184oC.
1H-ЯМР (CDCl3, δ): 0.69 (s, 3H), 0.9 (d, 3H), 2.02 (s, 3H), 2.1 (s, 3H), 2.9 (m, 1H), 6.02 (d, 1H).
C2) 17α-Ацетoкcи-3α-гидpoкcи-6α-мeтил-20-oкco-19-нop-5β-H-прегна-1-ен (8a)
К 10 г (27 ммол) соединения, полученного на стадии B2, и 12 г гептагидрата хлорида церия в метаноле (200 мл), охлажденном до 0oC, добавляли порционно 2,5 г (54 ммол) боргидрида натрия. Затем смесь перемешивали в течение 1 часа при комнатной температуре, вливали в ледяную воду и осадок, собранный путем фильтрации, осушивали и перекристаллизовывали из диизопропилового эфира с тем, чтобы получить 3,6 г соединения 8a (выход: 35,6%), точка плавления: 211oC.
1H-ЯМР (CDCl3, δ): 0.65 (s, 3H), 0.92 (d, 3H), 2.0 (s, 3H), 2.1 (s, 3H), 2.9 (m, 1H), 4.32 (m, 1H), 5.64 (d, 1H), 5.96 (dd, 1H).
D2) 17α-Ацетoкcи-1α, 2α-метилен-6α-метил-3,20-диоксо-19-нор-5β-прегнан (9a)
К 3 г (80 ммол) соединения 8а в дихлорэтане (200 мл) при -25oC добавляли по каплям 40 мл 1N раствора диэтилцинка в гексане с последующим добавлением 6,45 мл дииодметана. После выдерживания в течение 1 ночи при комнатной температуре смесь белого цвета вливали в раствор хлорида аммония и экстрагировали метиленхлоридом. Выпаривание растворителя дало осадок, который был подвергнут флэш-хроматографии на силикагеле при использовании толуола/этилацетата в качестве элюента, чтобы получить 1,43 г 3α-гидрокси-1α, 2α-метилен-производное.
1H-ЯМР (CDCl3, δ): 0.4 (m, 2H), 0.68 (s, 3H), 0.85 (d, 3H), 2.05 (s, 3H), 2.16 (s, 3H), 2.9 (m, 1H), 4.13 (m, 1H).
Окисление 3α-гидрокси-1α, 2α-метилен-производного в ацетоне реагентом Джонса дало 1 г соединения 9a (70% выхода), которое было превращено в соединение 10 таким же способом, как способ, описанный для стадии D1.
ПРИМЕР 5: 17α-Ацетокси-1β, 2β-метилен-6α-метил-3,20-диоксо-19-норпрегна-4-ен (10a)
A) 17α-Ацетокси-6α-метил-3,20-диоксо-19-нор-5β-прегнан (6a)
Соединение 1 (20 г, 53,69 ммол) в метаноле (200 мл), содержащем уксусную кислоту (5 мл) и 20% Pd(OH)2 (200 мг) на древесном угле, гидрируют под давлением 1 атм водорода. Фильтрация катализатора и удаление растворителя с последующей кристаллизацией в этилацетате дали 12,06 г соединения 6a (выход: 60%), точка плавления: 204oC.
1H-ЯМР (CDCl3, δ): 0.63 (s, 3H), 0.80 (d, 3H), 2.01 (s, 3H), 2.10 (s, 3H), 2.91 (m, 1H).
B) 17α-Ацетокси-6α-метил-3,20-диоксо-19-нор-5β-прегна-1-ен
Соединение 7a было получено с 30% выходом, следуя методике проведения, описанной в примере 4 для стадии В2, точка плавления: 184oC.
1H-ЯМР (CDCl3, δ): 0.68 (s, 3H), 0.92 (d, 3H), 2.03 (s, 3H), 2.09 (s, 3H), 2.92 (m, 1H), 6.03 (d, 1H), 7.16 (dd, 1H).
C) 17α-Ацетокси-1β, 2β-метилен-6α-метил-3,20-диоксо-19-нор-5β-прегнан (9b)
Соединение 9b было получено с 30% выходом, следуя методике проведения, описанной в примере 4 для стадий C1 и D1, точка плавления: 174-176oC.
1H-ЯМР (CDCl3, δ): 0.61(s, 3H), 0.79 (d, 3H), 2.01 (s, 3H), 2.11 (s, 3H), 2.88 (m, 1H).
D) 17α-Ацетокси-1β,2β-метилен-6α-метил-3,20-диоксо-19-норпрегна-4-ен
Это соединение получают с 19% выходом, следуя методике проведения, описанной в примере 4 для стадии D1, точка плавления: 247oC.
ИК-спектроскопия (KBr, см-1): 1730 ν C=O; 1720 ν C=O; 1644 ν C=O; 1458 ν C=C
1H-ЯМР (CDCl3, δ): 0.59 (s, 3H), 0.94 (d, 3H), 1.95 (s, 3H), 2.00 (s, 3H), 2.37 (d, 1H), 2.82 (m, 1H), 5.52 (s, 1H).
ПРИМЕРЫ 6 и 7: 17α-Ацетокси-1β, 2β-метилен-3E-гидрокси-имино-6α-метил-20-оксо-19-норпрегна-4-ен (11) и 17α-ацетокси-1β,2β-метилен-3Z-гидроксиимино-6α-метил-20-оксо-19-норпрегна-4-ен (11a)
К раствору соединения 10a (1,24 г, 3,25 ммол) в диоксане (50 мл) последовательно были добавлены гидрохлорид гидроксиламина (0,45 г, 6,46 ммол) и пиридин (3,1 мл). Смесь нагревали в течение 1,5 часов с обратным холодильником. Затем реакционную смесь влили в ледяную воду и подкислили 1N раствором соляной кислоты. Экстракция метиленхлоридом и выпаривание растворителя дали 1,29 г неочищенного продукта, который был подвергнут флэш-хроматографии при использовании толуола/этилацетата в качестве элюента.
Первый элюированный продукт был E изомер и кристаллизовался из этанола (0,3 г, выход: 28,8%), точка плавления: 172oC (пример 6).
1H-ЯМР (CDCl3, δ): 0.5 (q, 1H), 0.65 (s, 3H), 1.02-1.04 (d, 3H), 2.05 (s, 3H), 2.12 (s, 3H), 2.95 (m, 2H), 5.62 (s, 1H).
Второй элюированный продукт представлял собой Z изомер и он был кристаллизован из смеси чистого этанола и диизопропилового эфира (0.080 г, выход: 7,7%), точка плавления: 168oC (пример 7).
1H-ЯМР (CDCl3, δ): 0.681 (s, 3H), 1.08-1.1 (d, 3H), 2.05 (s, 3H), 2.12 (s, 3H), 2.95 (m, 1H), 6.32 (3, 1H).
ПРИМЕР 8: 17α-Ацетокси-2α,6α-метил-3,20-диоксо-19-норпрегна-4-ен (10b)
Раствор 20,20-этандиокси-17α-гидрокси-6α-метил-19-норпрегна-4-ена (полученный из соединения 5, R3=CH3, R5=H, R6=H, R4=H) (10 г, 26,7 ммол), метоксид натрия (8,25 г, 152,2 ммол) и этилформиат (12,71 г, 171,6 ммол) перемешивали при комнатной температуре в течение 4 часов. Затем осадок был отфильтрован, промыт диэтиловым эфиром с тем, чтобы получить на выходе 11 г неочищенного производного 2-гидроксиметилена (натриевую соль 2-гидроксиметилена), который был использован без дополнительной очистки.
К этому соединению (11 г) в ацетоне (180 мл) добавили карбонат калия (13,5 г, 98 ммол) и метилиодид (46,4 г, 326,8 ммол), и смесь перемешивали при комнатной температуре в течение 12 часов. После фильтрации органический раствор вливали в 1N раствор гидроксида натрия, экстрагировали метиленхлоридом, сушили (Na2SO4) и концентрировали под вакуумом, чтобы получить неочищенный продукт (12,70 г), к которому добавили метанол (70 мл) и раствор 6,66 г (166,5 ммол) гидроксида натрия в воде (6,6 мл) и этот раствор кипятили с обратным холодильником в течение 5 часов. После охлаждения смесь подкисляли до pH 1 1N раствором соляной кислоты и затем влили в воду. Осадок был собран, промыт водой и осушен. Флэш-хроматография на силикагеле (толуол/этилацетат) дала 4,10 г 17α-гидрокси-производного названного (данного в заглавии) соединения (выход: 40%).
1H-ЯМР (CDCl3, δ): 0.78 (s, 3H), 1.10 (d, 6H), 2.27 (s, 3H), 2.68 (t, 1H), 2.83 (s, 1H), 5.87 (s, 1H).
Оно было превращено в его ацетильное производное, следуя методике проведения, описанной для соединения 6a, с 30% выходом, точка плавления: 144oC.
1H-ЯМР (CDCl3, δ): 0.7 (s, 3H), 1.13 (d, 6H), 2.06 (s, 3H), 2.12 (s, 3H), 2.95 (t, 1H), 5.88 (bs, 1H).
ПРИМЕР 9: 17α-Ацетокси-1α,6α-диметил-3,20-диоксо-19- норпрегн-4-ен (10c)
A) 17α-Ацетокси-1α,6α-диметил-3,20-диоксо-19- норпрегнан (12)
К суспензии хлорида меди (1,59 г, 16,11 ммол) в тетрагидрофуране (400 мл) при 0oC под азотом медленно добавляли метиллитий (1,6N) в диэтилоксиде (28,76 мл, 32,21 ммол). После 1 часа к смеси при 0oC добавили раствор соединения 7 (5 г, 13,42 ммол) в тетрагидрофуране (40 мл). После 6 часов насыщенный раствор хлорида аммония добавляли осторожно, по каплям в течение 10 минут. Эту смесь перемешивали в течение 15 минут, затем экстрагировали дихлорметаном. Органический слой был осушен (MqSO4) и концентрирован. Получающийся в результате неочищенный продукт был подвергнут флэш-хроматографии (толуол/этилацетат), после чего получили 3 г соединения 12 (выход: 57%), точка плавления: 183oC.
1H-ЯМР (CDCl3, δ): 0.66 (s, 3H), 0.81 (d, 3H), 0.86 (d, 3H), 2.01 (s, 3H), 2.10 (s, 3H), 2.90 (t, 1H).
В) Используя ту же методику, которая описана для получения соединения 10 из соединения 9, получили соединение 10c с выходом 35%, точка плавления: 209oC.
1H-ЯМР (CDCl3, δ): 0.81 (s, 3H), 0.90 (d, 3H), 1.15 (d, 3H), 2.06 (s, 3H), 2.12 (s, 3H), 2.95 (t, 1H), 5.95 (s, 1H).
ПРИМЕР 10: 17α-Ацетокси-1β, 6α-диметил-3,20-диоксо-19-норпрегна-4-ен (10d)
A) 17α-Ацетокси-1β,6α-диметил-3,20-диоксо-19-нор-5β-прегнан (12a)
Соединение 12a получили с 60% выходом, следуя методике проведения, описанной для соединения 12, точка плавления: 142oC.
1H-ЯМР (CDCl3, δ): 0.66 (3, 3H), 0.83 (d, 3H), 0.98 (d, 3H), 2.06 (s, 3H), 2.14 (s, 3H), 2.92 (t, 1H).
В) Используя ту же самую методику, как методика, описанная для получения соединения 10 из соединения 9, получили соединение 10d с 40% выходом, точка плавления: 187oC.
1H-ЯМР (CDCl3, δ): 0.69 (s, 3H), 1.06 (d, 3H), 1.09 (d, 3H), 2.06 (s, 3H), 2.12 (s, 3H), 2.97 (m, 1H), 5.77 (s, 1H).
ПРИМЕР 11: 17α-Ацетокси-1,2α-метилен-6,6-диметил-3,20- диоксо-19-норпрегна-4-ен (10e)
Это соединение было получено, следуя методике проведения синтеза, описанной в примере 4 для соединения 10; точка плавления: 251,5oC.
1H-ЯМР (CDCl3, δ): 0.75 (s, 3H), 1.12 (d, 6H), 2.03 (s, 3H), 2.11 (s, 3H), 2.65 (m, 1H), 2.95 (m, 1H), 5.25 (s, 1H).
Следующие примеры иллюстрируют приготовление типичных готовых фармацевтических форм, содержащих соединение формулы (I):
Для перорального примерения
ПРИМЕР 12: Таблетки, обладающие замедленным действием.
Единичный состав для различных дозировок:
Соединение формулы (I) - 0,50-10,00 мг
Аэросил® 200 - 0,37-0,50 мг
Precirol® ATO 5 - 1,85-2,25 мг
Methocel® E4 - 55,00-70,00 мг
Avicel PH® 101 - 10,00-20,00 мг
Лактоза: количества для 1 таблетки - 185,00-200,00 мг
ПРИМЕР 13: Таблетки быстрого воздействия.
Единичный состав для различных дозировок:
Соединение формулы (I) - 0.50-10,00 мг
Аэросил® 200 - 0.37-0,50 мг
Precirol® ATO 5 - 1,85-2,50 мг
Avicel PH® 102 - 50,00-70,00 мг
Expotab® или polyplasdone® XL - 5,00-25,00 мг
Лактоза: количества для 1 таблетки - 185,00-200,00 мг
ПРИМЕР 14:
Таблетки
Единичный состав для различных дозировок:
Соединение формулы (I) - 0,50-10,00 мг
Аэросил® 200 - 30-0,50 мг
Compritol® - 1,50-3,00 мг
Avicel PH® 101 - 55,00-70,00 мг
Лактоза: количества для 1 таблетки - 185,00-200,00 мг
Капсулы
Единичный состав для различных дозировок:
Соединение формулы (I) - 0,50-10,00 мг
Олеиновая кислота: количества для 1 капсулы - 250,00-260,00 мг
Покрытие (оболочка): желатин, консервант, глицерин.
Для вагинального применения
ПРИМЕР 15: Вагинальная гинекологическая капсула,
Единичный состав для капсулы:
Соединение формулы (I) - 0,50-15,00 мг
Вазелин - 150,00-200,00 мг
Сесквиолеат сорбитола - 150,00-200,00 мг
Синтетический пергидросквален кол-ва для капсулы весом 1,85 г
Оболочка: желатин, глицерин, предохранительные оболочки для жидкой (мягкой) капсулы, имеющей вес 2,55 г.
ПРИМЕР 16: Вагинальный суппозиторий (свеча)
Единичный состав для суппозитория:
Соединение формулы (I) - 0,50-15,00 мг
Witepsol® H35 или H37: количества для суппозитория весом 3,00 г
ПРИМЕР 17: Вагинальный суппозиторий медленного действия
Единичный состав для суппозитория весом 3,00 г:
Соединение формулы (I) - 0,50-30,00 мг
Witepsol® H19 или H35 - 1,00-1,30 г
Suppocire® BM или NA150 - 1,00-1,50 г
Precirol® - 0,00-0,20 г
Для кожного или гинекологического применения
ПРИМЕР 18: Биосвязывающий гель для кожного или гинекологического применения
Рецепт для 100 г:
Соединение формулы (I) - 0,10-1,00 г
Полиэтиленгликоль - 0,00-6,00 г
Transcutol® - 0,00-6,00 г
Карбоксиполивиниловый полимер - 0,50-1,00 г
Предохранительные средства - 0,30 г
Триэтаноламин: кол-ва для pH 6,5
Очищенная вода: кол-ва для 100 г
ПРИМЕР 19: Гель для кожного применения
Рецепт для 100 г:
Соединение формулы (I) - 0,10-2,00 г
Полиэтиленгликоль или Transcutol® - 1,00-4,00 г
Этиловый спирт - 20,00-40,00 г
Карбоксиполивиниловый полимер - 0,50-2,00 г
Триэтаноламин: кол-ва для pH 6.5
Очищенная вода: кол-ва для 100 г
ПРИМЕР 20: Пластырь (бинты)
Содержание в "резервуаре" или матрице.
Получение 100 г:
Соединение формулы (I) - 0,25-20,00 мг
Вещество*, усиливающее действие соединения формулы (I) - 0,20-0,50 г
Суспендирующий агент (HPMC** или Аэросил® - 0,10-1,00 г
Этиловый спирт или силиконовое масло: кол-ва для 100 г
*вещество, усиливающее действие формулы (I): изопропилпальмитат, пропиленгликоль, ментол, азон, N, N- диметилацетамид, моно- или дизамещенные производные пирролидона;
**HPMC: гидроксипропилметилцеллюлоза
Для применения через кожу
ПРИМЕР 21:
Имплантаты (капиллярные трубочки, вводимые в живую ткань)
Состав для 100 г материала, который следует вытеснять (выдавливать):
Соединение формулы (I) - 1,00 - 5,00 г
Полимеры (EVA, полиортокарбонаты, полимеры, основанные на силиконе): количества для 100 г
Температура смеси не должна превышать 150oC для того, чтобы не ухудшить качество активного компонента.
Имплантаты с резервуаром
Имплантат представляет собой запечатанную силиконовую трубочку длиной от 2,5 до 3,5 см, толщиной от 0,4 до 0,8 мм и диаметром от 1,40 до 2,00 мм. Рецепт составлен для суспензии следующим образом:
Для 100 г:
Соединение формулы (I) - 30,00-50,00 г
Суспендирующий агент: количества для 100 г количества
50 мг суспензии для одного имплантата.
ПРИМЕР 22: Депонируемый состав для инъекций
Единичный состав для колбы объемом 5 мл:
Соединение формулы (I) - 10,00-50,000 мг
Полиэтиленгликоль 4000 - 100,00-200,000 мг
Консерванты - 0,006 мг
Хлорид натрия или соль лимонной кислоты - 0,150 мг
Дистиллированная вода для инъекции кол-ва для 5,00 мл
ПРИМЕР 23: Суспензия для инъекций
Единичный состав для ампулы объемом на 2 мл
Соединение формулы (I) - 5,00-10,00 мг
Суспензионный раствор:
Polysorbate® 80 - 0,015 г
Карбоксиметилцеллюлоза натрия - 0,010 г
Хлорид натрия - 0,010 г
Очищенная вода для инъекции: кол-во для 2,00 мл
ПРИМЕР 24: Внутриматочное устройство (средство) с резервуаром
Устройство с силиконовым резервуаром длиной от 2,5 до 3,5 см и толщиной от 0,4 до 0,8 мм. Рецепт составлен для приготовления суспензии следующим образом:
Для 100 г суспензии:
Соединение формулы (I), суспендируемое в: - 0,60-1,00 г
Суспендирующий агент (Аэросил® или HPMC) - 0,50 г
Синтетический пергидроженален: количество для 100 г
ПРИМЕР 25: Биосвязывающая гинекологическая пена
Рецепт для распределителя на 50 г и пульверизатора (2 мл:
Соединение формулы (I) - 0,10-0,25 г
Карбоксиполивиниловый полимер - 0,50-1,00 г
Изобутан - 5,00-10,00 г
Наполнитель F25/1: количество для 50,00 г
Перед использованием суспензию встряхивать.
Распределяемая дозировка от 2,00 до 10,00 мг.
Для носового применения
ПРИМЕР 26: Суспензия для носа
Состав для 100 г суспензии:
Соединение формулы (I) - 5,00-50,00 мг
Аэросил® РН 101 - 10,00-20,00 мг
Карбоксиметилцеллюлоза натрия - 5,00-50,00 мг
Фенилэтиловый спирт - 2,00-10,00 мг
Polysorbate® 80 - 10,00-20,00 мг
Очищенная вода: кол-во для 100 г
Перед применением суспензию встряхивать.
Распределяемая доза от 0,5 до 2,5 мг.
Для глазного применения
ПРИМЕР 27: Глазной раствор (суппозиторий, свеча)
Состав для 100 г раствора. Контейнер на 5 мл со стеклянными дозаторами для получения капель:
Соединение формулы (I) - 0,50-1,00 г
Глицерол - 5,00 г
Поливидон или хлорид натрия - 0,50-0,90 г
Сорбитол - 4,00 г
Консерванты (хлорид бензалкония или Cetrimide®) - 0,01 г
EDTA - 0,01 г
Дистиллированная вода: количество для 100 г
Раствор представляет собой стерильный водный раствор; он может содержать стабилизаторы и антимикробные агенты.
Рекомендованная доза - одна капля четыре раза в день.
ПРИМЕР 28: Глазной гель
Состав для 100 г геля. Контейнер: складной тюбик.
Соединение формулы (I) - 0,50-2,00 г
Cetrimide® - 0,01 г
Сорбитол - 4,00 г
EDTA - 0,01 г
Карбоксиполивиниловый полимер: (Carbopol® 971) - 0,14-0,20 г
Гидроксид натрия 10%: количество для pH 6.5
Дистиллированная вода: количество для 100 г
Стерильный водный гель наполняют в складные тюбики. Рекомендованная доза - одна капля один или два раза в день.
Типичные примеры соединений формулы (I), обеспеченные этим изобретением, включают:
17α-ацетокси-6,6-диметил-3,20-диоксо-19-норпрегна-4-ен
17α-ацетокси-6β-этил-6α-метил-3,20-диоксо-19-норпрегна-4-ен
17α-ацетокси-6β-пропил-6α-метил-3,20-диоксо-19- норпрегна-4-ен
17α-ацетокси-1α,2α-метилен-6α-метил-3,20-диоксо-19-норпрегна-4-ен
17α-ацетокси-1β,2β-метилен-6α-метил-3,20-диоксо-19-норпрегна-4-ен
17α-ацетокси-1β,2β-метилен-3E-гидроксиимино-6α-метил-20-оксо-19-норпрегна-4-ен
17α-ацетокси-1β,2β-метилен-3Z-гидроксиимино-6α-метил-20-оксо-19-норпрегна-4-ен
17α-ацетокси-2α,6α-диметил-3,20-диоксо-19-норпрегна-4-ен
17α-ацетокси-1α,6α-диметил-3,20-диоксо-19-норпрегна-4-ен
17α-ацетокси-1β,6α-диметил-3,20-диoкco-19-нopпрегна-4-ен
17α-ацетокси-1,2α-метилен-6,6-диметил-3,20-диоксо-19-норпрегна-4-енМ


Описываются новые производные 19-норпрегнена общей формулы I, в которой R1, R2, R3 и R4 каждый независимо представляет собой водород или (С1-С6)алкил, R5 -COR7 группа, в которой R7 является (С1-С6)алкилом, R6 является водородом, n = 0 или 1 и Х является кислородом или гидроксииминогруппой, при условии, что, когда n = 0, по крайней мере два из R1, R2, R3 и R4 отличаются от водорода и что, когда n = 1, R1 и R4 не являются одновременно водородом. Эти соединения являются отличными прогестогенами, которые не обладают остаточной андрогенной активностью. Описывается также фармацевтическая композиция, содержащая соединения формулы I. 4 с. и 14 з.п.ф-лы, 4 табл.
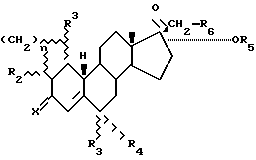 (I)
(I)
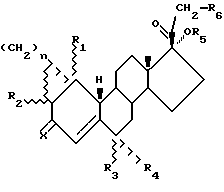
где R1, R2, R3, R4 и R6 каждый независимо представляют собой водород или (C1 - C6)алкил;
R5 является -COR7 группой, в которой R7 является (C1 - C6)алкилом, R6 является водородом;
n = 0 или 1;
Х является кислородом или гидроксиимино группой,
при условии, что, когда n = 0, по крайней мере два из R1, R2, R3 и R4 отличаются от водорода, и, что, когда n = 1, R3 и R4 не являются одновременно водородом.
| US 5395831 A, 1995 | |||
| ФИЗЕР Л., ФИЗЕР М | |||
| Стероиды | |||
| - М.: Мир, 1964, с.475 | |||
| AYANOGIN et al | |||
| TETRAHEDRON, v.35, N13, 1591-1594 | |||
| MAGERLEIN B.J | |||
| HOGG J.A | |||
| J | |||
| Amer.Chem.Soc | |||
| Способ приготовления серо-угольноселитряного пороха | 1924 |
|
SU2220A1 |
Авторы
Даты
2001-05-10—Публикация
1997-01-17—Подача