Данное изобретение относится к предшественникам, которые можно эффективно использовать для синтеза аналогов 19-нор-витамина D, а также к способу и промежуточным продуктам для их получения. Более конкретно, изобретение относится к предшественникам А-кольца указанных аналогов витамина D, где А-кольцо представлено указанной ниже структурой
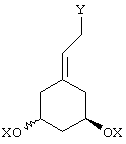
(см., например, Mazur et al.. Tetrahedron Letters 1995, 2987).
Синтез производных бицикло[3.1.0]гексана, как предшественников 19-нор-А-кольца, был разработан из (-)-хинной кислоты или циклогексантриола М. Vandewalle et al. (Tetrahedron Letters, 1995, 36 (45), 8299-8302) и основан на хорошо известной сигматропной перегруппировке циклопропилового спирта в гомоаллиловый спирт. Возможность данной перегруппировки в природный витамин D была впервые продемонстрирована Masur et al. (цитированная статья). Описан также альтернативный синтез из 2,4-пентандиона (S.Z. Zhou, S. Anne, M. Vanderwalle, Tetrahedron Letters, 1996, 37 (42), 7637-7640). 3-Циклопентенол можно также использовать в качестве исходного продукта для указанного получения (W. Yong, M. Vanderwalle; Synlett, 1996, 9, 911-912).
Указанные способы, однако, имеют следующие недостатки:
- Получение из (-)-хинной кислоты включает радикальное дезоксигенирование, которое трудно регулировать при проведении дезоксигенирования в больших количествах, и использование токсичного трибутилоловогидрида.
- Способ из циклогексантриола является многостадийным (12) и требует проведения двух ферментативных реакций.
- Исходный материал, 3-циклопентенол, не является коммерчески доступным. Его получают из циклопентадиена посредством стадии гидроборирования с низким выходом (30%). Кроме того, циклопропанирование и введение формильной группы являются затруднительными.
- Синтез, использующий в качестве исходного продукта 2,4-пентандион (10 стадий) отличается низкими выходами на первой стадии для получения промежуточного бисэпоксида. Кроме того, вследствие их низкой молекулярной массы некоторые промежуточные продукты являются весьма летучими и трудно подвергаются очистке при проведении способа в больших масштабах.
Теперь обнаружено, что широкий диапазон предшественников 19-нор-А-кольца можно получить, исходя из производных 3,5-дигидроксибензойной кислоты или их 4-алкилзамещенных гомологов. Указанные предшественники можно получить в больших масштабах способом, который является более эффективным, чем ранее описанные способы.
Таким образом, изобретение относится к способу получения соединения формулы (I):
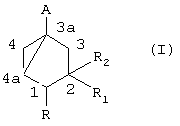
в которой:
- А представляет группу –CH2OH, -CH2-OCOR’, -COR’’, -CSR’’ или этинил;
- R представляет водород или (C1-С6) алкил;
- R1 представляет водород, (C1-C6) алкил или группу -(СН2)n-ОР;
- R2 представляет водород или группу -ОР;
- R’ представляет (C1-C6) алкил или фенил;
- R” представляет водород, гидроксил, (C1-C6) алкил, (С1-С6)алкокси, (С1-С6)алкилтио или ди (C1-С3) алкиламино;
- Р представляет водород; (С1-С6)алканоил; бензоил, в котором фенил, необязательно, замещен (C1-C4)алкилом, галогеном или нитро; (C1-C6)алкоксикарбонил; группу -Si(R3)3, в которой каждый R3, независимо, представляет (C1-C6)алкил или фенил; моно- или ди (C1-C6) алкокси (C1-C6) алкил; тетрагидрофуранил или тетрагидропиранил;
- n равно 0, 1, 2, 3 или 4, предпочтительно 0 или 1, включающему следующие стадии:
(i) взаимодействие соединения формулы 1
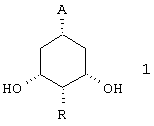
в которой А представляет (C1-C6) алкоксикарбонил, предпочтительно метоксикарбонил или ди(С1-С3)-алкиламинокарбонил, и R имеет указанные выше значения, с липазой в винилалканоате или ангидриде кислоты и
(ii) превращение образовавшегося соединения формулы 2 или 2’

в которой Z представляет алкил, такой как (C1-C6)алкил, предпочтительно (C1-С3)алкил, в соответствующее соединение формулы (I).
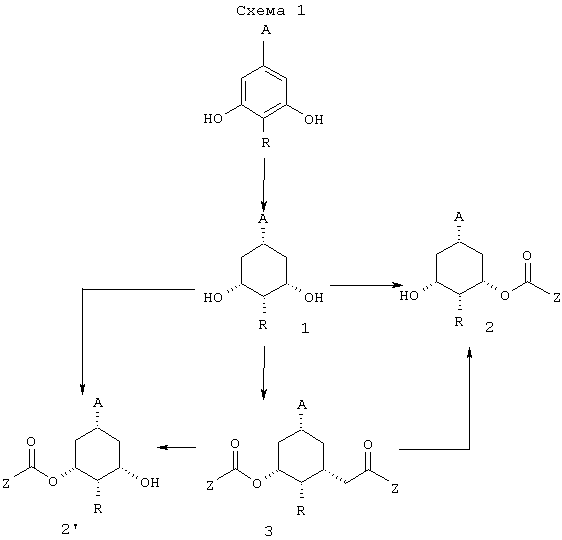
Как показано в общей схеме 1, исходный материал для получения предшественников А-кольца получают гидрированием метил-3,5-дигидроксибензойной кислоты или ее эфира, или их 4-алкилзамещенных гомологов согласно модифицированной методике, описанной Р. Wang and J. Adams in J. Am. Chem. Soc. 1994, 116, 3296-3305.
Первая стадия включает катализируемую ферментом асимметризацию 1-алкокси или (диалкиламино)карбонил-3,5-дигидроксициклогексана, или его 4-алкилзамещенных гомологов в растворителе, таком как винилалканоат, например винилацетат, винилпропионат или винилбутират, или ангидрид кислоты, например уксусный ангидрид, пропионовый ангидрид или масляный ангидрид, и с использованием липазы, такой как SAM II (липаза из Pseudomonas fluorescens), CCL (липаза из Candida cylindrcea), PPL (липаза из свиной поджелудочной железы), PSL (липаза из Pseudomonas cepacia), GCL (липаза из Cotrichum candidum), при температуре между 10°С и 40°С, предпочтительно 20°С, в течение от 6 до 72 часов, что дает соответствующий алкил- (или диалкил)-(1S,3S,5R)-3-алкилкарбонилокси-5-гидрокси- или (1S,3S,4R,5R)-4-алкил-3-алкилкарбонилокси-5-гидроксициклогексанкарбоксилат (или карбоксамид) 2 или соответствующий алкил- (или диалкил)-(1S,3S,5R)-5-алкилкарбонилокси-3-гидрокси- или (1S,3S,4R,5R)-4-алкил-5-алкилкарбонилокси-3-гидроксициклогексанкарбоксилат (или карбоксамид) 2’.
Кроме того, асимметризацию через энантиотопоселективный, катализируемый ферментом гидролиз сложных диэфиров 3 подходящим ферментом можно проводить для получения того же семейства соединений.
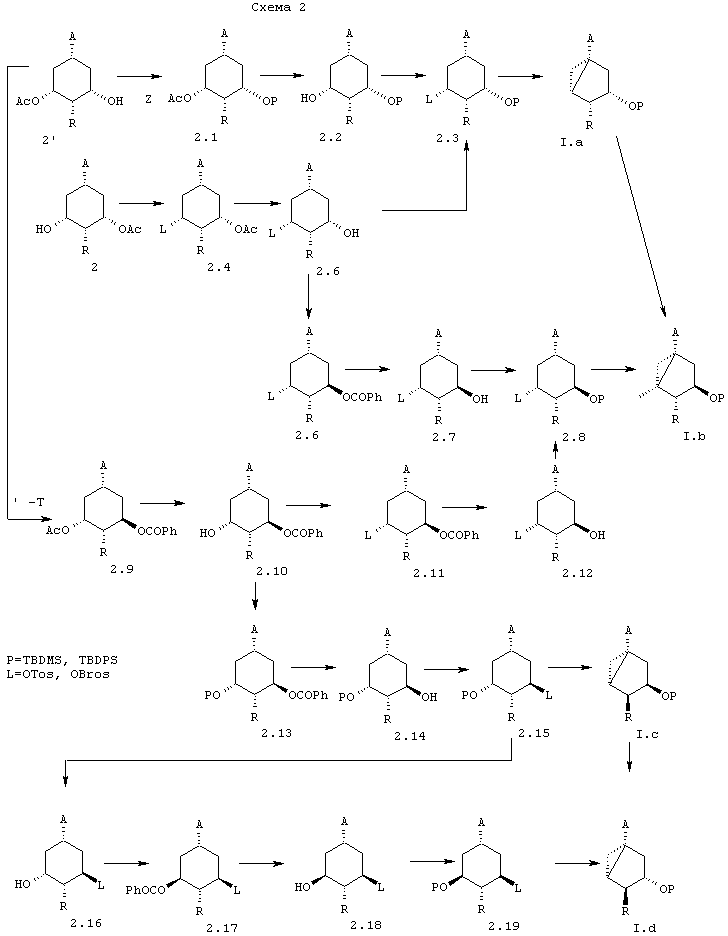
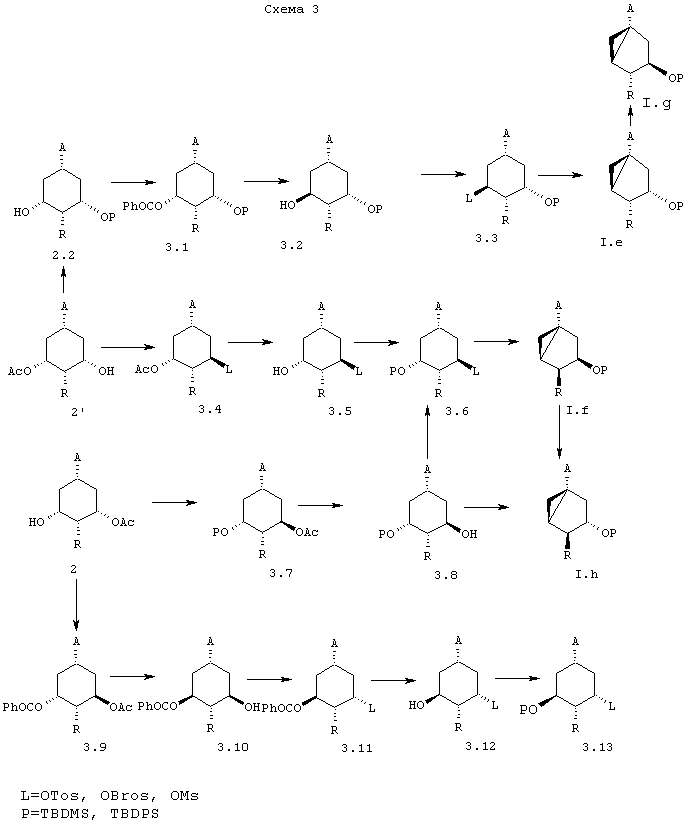
В схемах 2 и 3 описывается синтез всех диастереомеров общей формулы (I) с R1=Н и R2=ОР, из соединений 2 и 2’, описанных в схеме 1.
Как показано на указанных схемах, превращение соединения 2 или 2’ в соединение (I) проводят посредством одной или нескольких следующих стадий, порядок которых можно частично или полностью менять в зависимости от конечного диастереоизомера: (1) защита гидроксигрупп (Р=,например, TBDMS, TBDPS), (2) омыление сложного эфира, (3) инверсия 3- или 5-гидроксигруппы, (4) образование уходящей группы (L=,например, OTos, OBros, OMs), 5) включающая обработку основанием циклизация в требуемый бицикло[3.1.0]гексан, (6) превращение функциональной группы карбоалкокси или карбамоил (А) в требуемый заместитель А.
Стадии (2) и (4) представляют собой общепринятые реакции, хорошо известные специалистам в данной области. Стадию (1) можно проводить в соответствии с J. Am. Chem. Soc. 1972, 94, 6190 или Protective groups in Organic Synthesis, T.W. Greene, John Wiley Sons, New York. Стадию (3) можно проводить в соответствии с Synthesis, 1981, 1, или двухстадийным способом (элиминирование, гидроборирование). Стадию (5) можно проводить в соответствии с Tetrahedron Letters, 1995, 36 (45), 8299-8302. Стадию (6) можно проводить в соответствии с J. Gen. Chem. USSR 1964, 34, 1021.
В схеме 2, в частности, раскрыт синтез всех диастереомеров с конфигурацией 3aS (α-ориентированное циклопропильное кольцо).
В схеме 3, в частности, раскрыт синтез всех диастереомеров с конфигурацией 3aR (β-ориентированное циклопропильное кольцо).
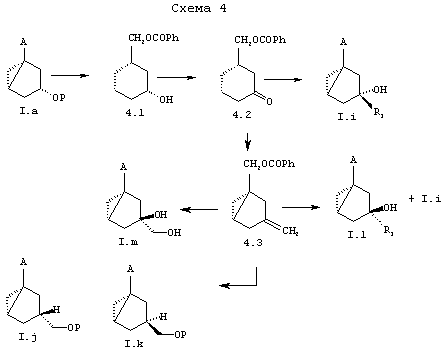
Как показано на общей схеме 4, 3а-гидроксиметилзамещенные соединения бицикло[3.1.0]гексана (I) с R=Н и А=СН2OН можно также использовать для синтеза предшественников А-кольца аналогов витамина D, модифицированных у С-1. Данная возможность получения иллюстрируется, исходя из I.a (R=H, P=TBDPS, А=СН2ОН) через кетон 4.2 в качестве ключевого промежуточного продукта. Реакция Гриньяра (например, R1=Me или Et) приводит диастереоселективно к третичным спиртам I.i с последующим удалением защитной эфирной функциональной группы. С другой стороны, метиленирование 4.2 дает 4.3. Самый лучший результат (выход 68%) был получен с процедурой Ломбарде (Lombardo) (Tetrahedron Lett. 1982, 23, 4293). В альтернативном случае реакция Виттига или Теббе (J. Org. Chem., 1985, 50, 1212) дает соответствующие выходы 39% и 54%.
Дигидроксилирование 4.3 дает ожидаемый диол I.m. в качестве основного продукта наряду с эпимером 4.4 (отношение 85:15, не показано). С другой стороны, гидроборирование 4.3 дает 2R- и 2S-гидроксиметилсоединения в отношении 75:25 (73%). Указанные эпимерные спирты разделяли с получением I.j и I.k после образования простого эфира TBDPS (81%) и последующего гидролиза сложного эфира (81%). Опосредованное ацетатом ртути присоединение воды к 4.3 дает третичный спирт I.1 наряду с I.i в отношении 75:25.
Указанный новый способ получения предшественников 19-нор-А-кольца, исходя из производных 3,5-дигидроксибензойной кислоты, является более коротким, чем ранее описанный способ. Практической важностью вышеуказанного пути является в основном тот факт, что большинство промежуточных продуктов являются кристаллическими и их можно очистить кристаллизацией, которая является более легкой операцией при проведения ее в больших масштабах, чем традиционная очистка хроматографией на силикагеле, и гарантирует высокую степень энантиомерной чистоты.
Все соединения (I), полученные таким образом, являются новыми, за исключением соединений с конфигурацией 2S, 3аS, 4aS, где А представляет формил, гидроксиметил, этинил или метоксикарбонил, R и R2, оба, представляют водород и R1 представляет группу -OSi(R3)3.
Изобретение относится к указанным новым соединениям.
Предпочтительные соединения (I) включают соединения, у которых
- А представляет группу –СН2ОН, -СНОСОR’, -COR’’ или этинил;
- R1 представляет (С1-С6)алкил или группу -(СН2)n-ОР;
- R’ представляет фенил;
- R’’ представляет водород;
- Р представляет водород или группу -Si(R3)3;
- n равно 0 или 1.
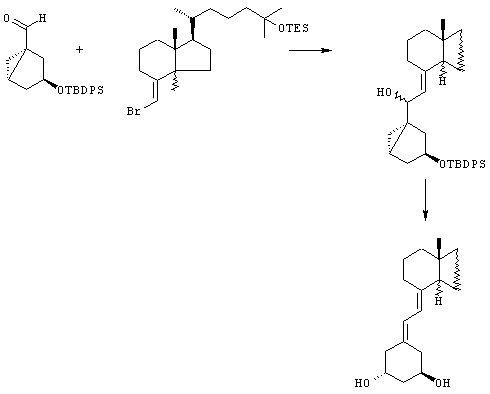
Соединения (I) можно использовать для синтеза витамина D (19-нор, 1α, 25-(ОН)2-D3) в соответствии с примером следующей схемы, как описано в Tetrahedron Letters, 1996; 37(42): 7634-7640:
Изобретение далее относится к промежуточным продуктам для получения соединения (I). В частности, изобретение относится к диастереоизомерному соединению формулы (II):
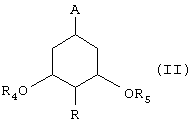
в которой:
- А и R имеют указанные выше значения,
- R4 и R5, каждый независимо, представляют группу Р, как указано выше, или мезильную, тозильную, брозильную или трифтормезильную группу,
при условии, что, когда А представляет метоксикарбонил и R представляет водород, соединение (II) не имеет конфигурацию 1R, 3R, 5R.
В объем изобретения включены также соединения формулы 2 или 2'
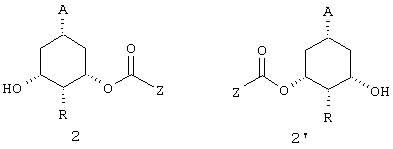
в которой
- А и R имеют указанные выше значения;
- Z представляет алкил,
а также соединения формулы 1
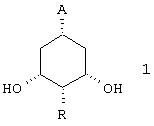
в которой А имеет указанные выше значения и R представляет (C1-С6) алкил.
Предполагается, что в настоящем описании и прилагаемой формуле изобретения термин “(C1-С3) алкил”, “(C1-C4) алкил” или “(C1-C6)алкил” означают неразветвленную или разветвленную углеводородную цепь, имеющую от 1 до 3 (соответственно, 4 или 6) атомов углерода, такую как, например, метильный, этильный, пропильный, изопропильный, бутильный, изобутильный, трет-бутильный, пентильный, изопентильный или гексильный радикал.
Предполагается, что термин “(C1-C6) алкокси” или “(C1-C6) алкилтио” означает группу OR или, соответственно, SR, в которой R представляет (C1-C6)алкил, как указано выше.
Изобретение теперь будет иллюстрировано следующими получениями и примерами.
ПОЛУЧЕНИЕ ПРОМЕЖУТОЧНЫХ ПРОДУКТОВ ФОРМУЛЫ 1
а) цис,цис-3,5-Дигидрокси-1-(метоксикарбонил)-циклогексан: 1.А (R=Н, А=СООСН3).
Метил 3,5-дигидроксибензоат гидрируют в МеОН в условиях, аналогичных описанным Peng Wang and Julian Adams в J. Am. Chem. Soc. 1994, 116, 3296-5505 для гидрирования 3,5-дигидроксибензойной кислоты.
Метил 3,5-дигидроксибензоат (57,6 г, 0,629 моль, 97%), 5% Rh/Al2О3 (5,76 г) в МеОН (400 мл), содержащем 0,1% АсОН, добавляют в автоклав (1 л). В автоклав два раза вводят струю водорода (от 130 атм до 40 атм). Давление водорода достигает 130 атм, и температуру повышают до 80-85°С. В процессе повышения температуры давление водорода снижается. Когда давление снижается до 90 атм, давление водорода снова устанавливают 130 атм. Гидрирование проводят в течение 12 час при 80-85°С и 130 атм, затем температуру повышают до 150°С и соответственно давление достигает приблизительно 155 атм. Реакцию продолжают в течение 36 час. Катализатор отфильтровывают. Фильтрат концентрируют и остаток кристаллизуют из смеси EtOAc/изооктан, получая при этом 1.А (31,1 г, выход 50%). Т. пл.: 135,9°С.
УФ (EtOH): 211,4 нм (ε=90,9);
ИК (КВr): 3284, 1734, 1259, 1015 см-1
1H-ЯМР (DMSO-d6): δ 1,13 (3Н, м); 2,06 (3Н, м); 2,30 (1Н, м); 3,47 (2Н, м); 3,61 (3Н, с); 4,70 (2Н, д) м.д.
Аналогичным образом, как описано выше, но с заменой 3,5-дигидроксибензоата метил-3,5-дигидрокси-4-метилбензоатом или метил-3,5-дигидрокси-4-этилбензоатом получают следующие соединения:
- Метил все-цис-3,5-дигидрокси-4-метилциклогексанкарбоксилат: 1.B (R=Me, А=СООСН3), т. пл.: 123°С;
1H-ЯМР (500 МГц, CD3OD): δ 3,698 (2Н, дт, J=4,0, 12,0 Гц); 3,666 (3Н, с); 2,40 (2Н, тт, J=4,0, 13,0 Гц); 2,23 (1H, м); (2Н, дт, J=4,0, 13,0 Гц); 1,54 (2Н, кв, J=13,0 Гц); 0,88 (3Н, д, J=7,08 Гц) м.д.
- Метил все-цис-4-этил-3,5-дигидроксициклогексанкарбоксилат: 1.C (R=Et, A=СООСН3), т. пл.: 94-96°С;
1H-ЯМР (500 МГц, MeOD): δ 3,72 (2Н, дт, J=10,9, 4,1 Гц), 3,66 (3Н, с), 2,42 (1H, м), 1,86 (1H, уш.с), 1,79 (2Н, дт, J=12,8, 4,1 Гц), 1,59 (2Н, д, J=9,0 Гц), 1,46 (2Н, м), 1,02 (3Н, т, J=7,5 Гц) м.д.
ПОЛУЧЕНИЕ ПРОМЕЖУТОЧНЫХ ПРОДУКТОВ ФОРМУЛ 2 И 2’ (схема 1)
I) Ферментативная этерификация диолов общей формулы (I)
1а) Метил (1S,3S,5R)-3-ацетокси-5-гидроксициклогексанкарбоксилат: 2.А (R=Н, Z=Me, А=СООСН3)
Метил-цис,цис-3,5-дигидроксициклогексанкарбоксилат 1.А (R=Н, А=СООСН3) (15,2 г, 87 ммоль) и липазу из свиной поджелудочной железы (PPL - 16,8 Е/мг, 9,12 г) помещают в круглодонную колбу с последующим добавлением винилацетата (450 мл) при комнатной температуре. Колбу продувают азотом. Суспензию перемешивают в темноте в течение 22 час, затем фильтруют через подушку целита для удаления липазы. Фильтрат концентрируют упариванием. Остаток разделяют фильтрованием через подушку силикагеля (70-200 меш, 45 г). Элюирование толуолом (210 мл) с последующим элюированием смесью 75/25 (об./об, 210 мл), затем 50/50 (об./об., 210 мл) толуол/этилацетат и, наконец, этилацетатом (240 мл) дает после концентрирования 2.A (R=Н, Z=Me, A=СООСН3) (22,3 г, количественный выход) в виде желтого масла.
ИК (пленка): 3447, 1734, 1243 см-1;
1H-ЯМР (СDСl3): δ 1,4 (3Н, м), 2,1 (3Н, с), 2,3 (5Н, м), 3,7 (3Н, с), 3,75 (1Н, м), 4,7 (1Н, м) м.д.:
[α]
Ib) Метил (1R,3S,4S,5R)-5-ацетокси-3-гидрокси-4-метилциклогексанкарбоксилат: 2’.В (R=Me, Z=Me, A=СООСН3) и метил (1R,3S,4S,5R)-5-ацетокси-3-гидрокси-4-этилциклогексанкарбоксилат: 2’.С (R=Et, Z=Me, A=СООСН3)
Способом, аналогичным способу, описанному для I.a, но с заменой PPL на SAM II, PSL или CCL, соответственно, из
- метил все-цис-3,5-дигидрокси-4-метилциклогексанкарбоксилата: 1.В (R=Me, A=СООСН3)
- метил все-цис-3,5-дигидрокси-4-этилциклогексанкарбоксилата: 1.C (R=Et, A=СООСН3) были получены следующие соединения:
- метил (1R,3S,4S,5R)-5-ацетокси-3-гидрокси-4-метилциклогексанкарбоксилат: 2’.В (R=Me, Z=Me, A=СООСН3)
ИК (пленка): 3434, 1731, 1439, 1243, 1027 см-1;
1H ЯМР (500 МГц, СDСl3): δ 4,84 (1Н, дт, J=4,3, 4,3 Гц); 3,82 (1Н, м); 3,69 (3Н, с); 2,45 (1Н, м); 2,32 (1H, д, J=6,4 Гц); 2,05 (3Н, с); 1,92 (2Н, дт, J=4,0, 4,0 Гц); 1,77 (3Н, м); 0,96 (3Н, д, J=7,0 Гц) м.д.;
MS (м/z): 231 (М+,1); 213; 199; 186; 170; 152; 127; 111; 83; 87; 67; 43 (основной пик);
[α]
- метил (1R,3S,4S,5R)-5-ацетокси-4-этил-3-гидроксициклогексанкарбоксилат: 2’.С (R=Et, Z=Me, A=СООСН3)
ИК (пленка): 3421, 2958, 2360, 1733, 1437, 1239, 1027, 739 см-1
1H-ЯМР (500 МГц, СDСl3): δ 4,98 (1Н, т, J=4,1 Гц), 3,87 (1Н, м), 3,69 (3Н, с), 2,60 (1Н, уш.с), 2,16 (2Н, м), 2,02 (3Н, с), 1,84 (2Н, м), 1,72 (1Н, уш.с), 1,59 (2Н, м), 1,47 (1Н, м), 0,97 (3Н, т, J=7,5 Гц) м.д.;
MS (м/z): 245 (M++1), 233, 206, 184, 166, 141, 125, 111, 95, 87, 57, 43 (основной пик),
[α]
II) ФЕРМЕНТАТИВНОЕ ОМЫЛЕНИЕ СЛОЖНЫХ ДИЭФИРОВ ФОРМУЛЫ 3
IIа) Метил (1S,3S,5R)-3-ацетокси-5-гидроксициклогексанкарбоксилат: 2.А (R=Н, Z=Me, А=СООСН3)
К раствору мезо-диацетата 3.А (R=H, Z=Me, A=СООСН3) (92,1 мг, 0,36 ммоль) в 3,0 мл СН3СN добавляют 27,0 мл буфера с рН 7,0 с последующим добавлением SAM II (13,8 мг, 46,8 Е/мг). Образовавшуюся смесь перемешивают при комнатной температуре и поддерживают рН 7,0 добавлением 1,0 М раствора NaOH. Мониторинг реакции проводят анализом ТСХ. Реакцию заканчивают добавлением NaCl до насыщения реакционного раствора. Реакционную смесь экстрагируют AcOEt (3×50 мл). Объединенные органические экстракты промывают насыщенным раствором соли (3×10 мл), сушат над МgSO4 и концентрируют. Остаток очищают ВЭЖХ с элюированием смесью изооктан/EtOAc (6:4), получая при этом моноацетат 2.A (R=Н, Z=Me, А=СООСН3) (30,1 мг, 38,9%) в виде бесцветного масла.
IIb) Метил (1S,3R,4R,5S)-3-бутаноилокси-5-гидрокси-4-метилциклогексанкарбоксилат: 2.В (R=Me, Z=н-С3Н7, А=СООСН3)
К раствору 1.В (R=Me, A=СООСН3) (0,2 г, 1,10 ммоль) в 2 мл CH2Cl2 добавляют масляный ангидрид (538 мкл, 3,29 ммоль) при комнатной температуре и затем раствор TMSOTf (триметилсилилтрифторметансульфонат) (25 мкл, 1 М). Смесь перемешивают при комнатной температуре в течение 30 мин и затем добавляют 2,5 мл МеОН и смесь перемешивают в течение еще 2 час и гасят 5% NаНСО3. Реакционный раствор промывают насыщенным раствором соли (3×20 мл), сушат над MgSO4 и концентрируют, получая при этом остаток. Остаток очищают хроматографией на силикагеле с элюированием смесью изооктан:AcOEt (9:1), получая при этом дибутират 3.В (R=Me, Z=н-С3Н7, А=СООСН3) (3,9 г, 98,8%) в виде бесцветного масла. К раствору данного сложного мезо-диэфира (110 мг, 0,34 ммоль) в 2,0 мл СН3СN добавляют 22,0 мл буфера (рН 7,0) с последующим добавлением SАМ II (37 мг, 46,8 Е/мг). Образовавшуюся смесь перемешивают при комнатной температуре и рН устанавливают при 7,0 добавлением 1,0 М раствора NaOH. Мониторинг реакции проводят анализом ТСХ. Реакцию завершают добавлением NaCl к реакционному раствору. Реакционную смесь экстрагируют EtOAc (3×50 мл), сушат над МgSO4 и концентрируют, получая при этом остаток. Остаток очищают ВЭЖХ с элюированием смесью изооктан/EtOAc (7:3), получая при этом монобутират 2.В (R=Me, Z=н-С3Н7, А=СООСН3) (78 мг, 90%) в виде бесцветного масла.
ИК (пленка): 3495, 2964, 2878, 1731, 1438, 1281, 1183, 990 см-1,
1H-ЯМР (СDСl3): 4,83 (1Н, дт), 3,83 (1H, м), 3,68 (3Н, с), 2,45 (1H, м), 2,32 (1H, м), 2,28 (2Н, т, J=7,9 Гц), 1,91 (2Н, м), 1,82-1,62 (5Н, м), 0,95 (6Н, м).
[α]
MS: 259 (M++1), 227, 214, 187, 170, 152, 127, 111, 93, 71, 43
IIс) Метил (1S,3R,4R,5S)-3-ацетокси-5-гидрокси-4-метилциклогексанкарбоксилат: 2.С (R=Me, Z=Me, A=СООСН3)
Из мезо-диацетата 3.С (R=Me, Z=Me, A=СООСН3), как описано для IIа). [α]
IId) Метил (1R,3S,4S,5R)-5-ацетокси-3-гидрокси-4-метилциклогексанкарбоксилат: 2’.В (R=Me, Z=Me, A=СООСН3)
Из мезо-диацетата 3.С (R=Me, Z=Me, A=СООСН3), как описано для IIа), но с PPL в качестве липазы.
[α]
ПРИМЕР 1: (2S,3aS,4aS)-2-трет-бутилдиметилсилилокси-3а-карбометоксибицикло[3.1.0]гексан: I.b.1 (A=СООСН3, R=Н, Р=TBDMS)
a) Метил (1R,3S,5R)-3-ацетокси-5-тозилоксициклогексанкарбоксилат: 2.4.a (R=Н, L=OTos, A=СООСН3)
п-Толуолсульфонилхлорид (13,3 г, 70 ммоль) добавляют к раствору метил (1S,3S,5R)-3-ацетокси-5-гидроксициклогексанкарбоксилата 2.A (R=Н, Z=Me, А=СООСН3) (10,1 г, 43,7 ммоль) и диметиламинопиридина (0,1 г) в смеси триэтиламина (50 мл) и метиленхлорида (10 мл) при 0°С. Раствор перемешивают в течение 1 час при 0°С, затем 22 час при комнатной температуре. Реакцию гасят водой (300 мл) и экстрагируют метиленхлоридом. Органический слой промывают водой, сушат над MgSO4, фильтруют и концентрируют. Сырой продукт кристаллизуют из EtOH, получая при этом 2.4.а (R=Н, L=OTos, А=СООСН3) (13,2 г, 81,6%). Т. пл. 83,1°С.
ИК (КВr): 1734, 1175 см-1;
1H-ЯМР (СDСl3): δ 1,5 (3Н, м), 2,0 (3Н, с), 2,28 (4Н, м), 2,47 (3Н, с), 3,68 (3Н, с), 4,4 (1Н, м), 4,68 (1Н, м), 7,35 (1Н, д, J=8,5 Гц), 7,8 (2Н, д, J=8,5 Гц) м.д.
b) Метил (1R,3S,5R)-3-гидрокси-5-тозилоксициклогексанкарбоксилат: 2.5.а (R=Н, L=OTos, А=СООСН3)
К суспензии 2.4.а (R=Н, L=OTos, А=СООСН3) (23,35 г, 63 ммоль) в МеОН добавляют карбонат калия (4,36 г, 31 ммоль).
Суспензию перемешивают в течение 30 мин и выливают в воду (1,5 л). Осадок отфильтровывают и сушат, получая при этом 2.5.a (R=Н, L=OTos, A=СООСН3) (18,5 г, 89%).
Т. пл. 98,4°С.
УФ (EtOH): 225 нм (е=11935);
ИК (КВr): 3447, 1719, 1176 см-1;
1H-ЯМР (CDCl3): δ 1,52 (4Н, м), 2,25 (4Н, м), 2,45 (3Н, с), 3,6 (1Н, м), 3,68 (3Н, с), 4,42 (1Н, м), 7,35 (2Н, д, J=8,5 Гц), 7,8 (2Н, д, J=8,5 Гц) м.д.;
[α]
с) Метил (1R,3R,5R)-3-бензоилокси-5-тозилоксициклогексанкарбоксилат: 2.6.а (R=Н, L=OTos, А=СООСН3)
К раствору 2.5.а (R=Н, L=OTos, А=СООСН3) (18,35 г, 56 ммоль), трифенилфосфина (18,4 г, 70 ммоль) и бензойной кислоты (8,53 г, 70 ммоль) в толуоле (180 мл) и ТГФ (70 мл) при 0°С добавляют диэтилазодикарбоксилат (11 мл, 70 ммоль). Смесь перемешивают при комнатной температуре в течение 30 мин, после добавления гептана (735 мл) ее фильтруют и фильтрат концентрируют. К сырому продукту добавляют толуол и раствор фильтруют через подушку силикагеля (30-70 меш). Элюирование толуолом, затем смесью толуол/метиленхлорид дает после концентрирования остаток, который кристаллизуют из EtOH, получая при этом 2.6.а (R=Н, L=OTos, A=СООСН3) (19,77 г, 82%). Т. пл. 76,2°С.
УФ (ЕtОН): 227 нм (е=20840);
ИК (KBr): 1709, 1177 см-1;
1H-ЯМР (СDСl3): δ 1,7 (3Н, м), 2,14 (2Н, м), 2,35 (3Н, с), 2,48 (1Н, м), 2,83 (1Н, м), 3,18 (3Н, с), 4,75 (1Н, м), 5,43 (1Н, м), 7,2 (2Н, д, J=11,4 Гц), 7,5 (2Н, д, J=8,5 Гц), 7,6 (1Н, м), 7,75 (2Н, д, J=11,4 Гц), 7,94 (2Н, д, J=8,5 Гц) м.д.;
[α]
d) Метил (1R,3R,5R)-3-гидрокси-5-тозилоксициклогексанкарбоксилат: 2.7.a (R=Н, L=OTos, A=СООСН3)
К суспензии 2.6.а (R=Н, L=OTos, А=СООСН3) (19,77 г, 46 ммоль) в МеОН (260 мл) добавляют карбонат калия (3,16 г, 22,9 ммоль). Смесь перемешивают в течение 6 час при комнатной температуре и выливают в воду (1 л). Водный слой экстрагируют диизопропилоксидом, сушат над МgSO4, фильтруют и концентрируют, получая при этом 2.7. а (R=Н, L=OTos, А=СООСН3) (17,45 г, количеств.) в виде масла.
УФ (EtOH): 224 нм (ε=12262);
ИК (KBr): 3525, 1731, 1174 см-1;
1H-ЯМР (СDСl3): δ 1,67 (3Н, м), 2,1 (3Н, м), 2,45 (3Н, с), 2,85 (1Н, м), 3,7 (3Н, с), 4,3 (1Н, с), 4,82 (1Н, м), 7,35 (2Н, д, J=8,5 Гц), 7,8 (2Н, д, J=8,5 Гц) м.д.;
[α]
е) Метил (1R,3R,5R)-3-трет-бутилдиметилсилилокси-5-тозилоксициклогексанкарбоксилат: 2.8.а (R=Н, L=OTos, Р=TBDMS, А=СООСН3)
К раствору 2.7. a (R=Н, L=OTos, A=СООСН3) (17,45 г, 46 ммоль) и имидазола (3,9 г, 57 ммоль) в сухом диметилформамиде (80 мл) добавляют трет-бутилдиметилсилилхлорид (8,6 г, 57 ммоль). Смесь перемешивают при комнатной температуре в течение 1,5 час, затем выливают на воду и экстрагируют толуолом. Органический слой промывают водой, затем концентрируют. Сырой продукт кристаллизуют из гептана, получая при этом 2.8. a (R=Н, L=OTos, P=TBDMS, А=СООСН3) (13,94 г, 69%). Т. пл. 68,2°С.
УФ (EtOH): 225 нм (ε=12390);
ИК (КВr): 2853, 1726, 1436, 1359, 1173, 831 см-1;
1H-ЯМР (СDСl3): δ 0,002 (3Н, с), 0,05 (3Н, с), 0,82 (9Н, с), 1,55 (4Н, м), 1,85 (2Н, м), 2,45 (3Н, с), 2,8 (1Н, м), 3,67 (3Н, с), 4,2 (1Н, уш.с), 4,7 (1Н, м), 7,33 (2Н, д, J=8,5 Гц), 7,8 (2Н, д, J=8,5 Гц) м.д.:
[α]
f) (2S,3aS,4aS)-2-трет-Бутилдиметилсилилокси-3а-карбометоксибицикло[3.1.0]гексан: I.b.1 (R=Н, P=TBDMS, A=СООСН3)
К перемешиваемому раствору 2.8.а (R=Н, L=OTos, Р=TBDMS, А=СООСН3) (378,5 г, 856 ммоль) в трет-бутаноле при 64°С медленно добавляют в течение 1 час 1 М раствор трет-бутилата калия в трет-бутаноле (1,02 л). Спустя 5 минут после окончания добавления суспензию охлаждают до 30°С и добавляют насыщенный раствор хлорида аммония (3 л). Спустя 10 мин водную фазу экстрагируют диизопропилоксидом. Органический слой промывают водой, сушат над MgSO4, фильтруют и концентрируют. Осадок флэш-хроматографируют на силикагеле с применением смеси гептан/этилацетат в качестве элюирующего растворителя, получая при этом I.b.1 (R=Н, Р=TBDMS, А=СООСН3) (211,3 г, 91,3%) в виде желтого масла.
Eb760: 135°С;
УФ (EtOH): 201 нм (ε=742);
ИК (пленка) 1726 см-1, 1458 см-1, 1437 см-1, 1254 см-1, 837 см-1;
1H-ЯМР (СDСl3): δ 0,01 (6Н, с), 0,83 (9Н, с), 1,28 (2Н, м), 1,8 (2Н, м), 2,11 (3Н, м), 3,65 (3Н, с), 3,9 (1Н, м) м.д.;
[α]
ПРИМЕР 2: (2S,3aS,4aS)-2-трет-бутилдиметилсилилокси-3а-(гидроксиметил)бицикло[3.1.0]гексан: I.b.2 (R=Н, Р=TBDMS, A=CH2OH)
К раствору (2S,3aS,4aS)-2-трет-бутилдиметилсилилокси-3а-карбометоксибицикло[3.1.0]гексана I.b.1 (R=Н, Р=TBDMS, А=СООСН3) (207,5 г, 768 ммоль) в толуоле (2,1 л) при -70°С добавляют 1,5 М раствор диизобутилалюминийгидрида в толуоле (1,25 л) в течение 1,5 час. После завершения добавления медленно добавляют насыщенный раствор тартрата калия и натрия и температуру повышают до 0°С. После перемешивания в течение 2 час реакционную смесь экстрагируют толуолом, органический слой сушат над MgSO4 и концентрируют, получая при этом 142,9 г (88%) указанного в заголовке соединения I.b.2 в виде желтого масла.
ИК (КВr): 3355, 1471, 1255, 835, 774 см-1;
1H-ЯМР (СDСl3): δ 0 (6Н, с), 0,32 (1Н, м), 0,5 (1Н, м), 0,83 (9Н, с), 1,16 (1Н, м), 1,87 (5Н, м), 3,54 (2Н, м), 4,0 (1Н, м) м.д.
ПРИМЕР 3: (2S,3aS,4aS)-2-трет-бутилдиметилсилилокси-3а-формилбицикло[3.1.0]гексан: I.b.3 (R=Н, Р=TBDMS, А=СНО)
К I.b.2 (R=Н, Р=TBDMS, А=СН2ОН) (69,6 г, 287 ммоль) в метиленхлориде (700 мл) при комнатной температуре добавляют хлорхромат пиридиния (68 г, 315 ммоль). Смесь энергично перемешивают в течение 1 час. Температуру затем повышают до 35°С, затем снижают до 25°С. Суспензию фильтруют через подушку целита и промывают метиленхлоридом и диизопропилоксидом. Органический слой промывают последовательно водой, насыщенным раствором гидрокарбоната натрия и водой до рН 6-7. Объединенные органические слои сушат над MgSO4, фильтруют и концентрируют. Остаток (66,8 г) очищают флэш-хроматографией на флорисиле с применением в качестве элюента смеси 95/5 (об./об.) гептан/этилацетат, получая при этом I.b.3 (R=Н, Р=TBDMS, А=СНО) в виде желтого масла (50,33 г, 73%).
УФ (EtOH): 204 нм (ε=6292);
ИК (КВr): 1726, 1253, 1119, 838 см-1;
1H-ЯМР (CDCl3); δ 0 (6Н, с), 0,87 (9Н, с), 1,3 (2Н, м), 1,85 (2Н, м), 2,1 (3Н, м), 4 (1Н, м), 8,9 (1Н, с) м.д.;
[α]
ПРИМЕР 4: (2R,3aR,4aR)-2-трет-бутилдиметилсилилокси-3а-карбометоксибицикло[3.1.0]гексан: I.h.1 (R=H, A=СООСН3, P=TBDMS)
а) Метил (1R,3S,5S)-3-ацетокси-5-бензоилоксициклогексанкарбоксилат: 3.9.а (R=Н, А=СООСН3)
Как описано для 2.6.а (R=Н, L=OTos, A=СООСН3), метил (1S,3S,5R)-3-ацетокси-5-гидроксициклогексанкарбоксилат 2.А (R=Н, Z=Me, A=СООСН3) (25 г, 111,3 ммоль) превращают в метил (1R,3S,5S)-3-ацетокси-5-бензоилоксициклогексанкарбоксилат 3.9.а (R=Н, А=СООСН3) (32,4 г, 91%)
1H-ЯМР (CDCl3): δ 1,68 (3Н, м), 2,05 (3Н, с), 2,34 (3Н, м), 2,92 (1Н, м), 3,70 (3Н, с), 5,18 (1Н, м), 5,55 (1Н, м), 7,50 (3Н, м), 8,05 (2Н, м) м.д.;
[α]
b) Метил (1R,3S,5S)-5-бензоилокси-3-гидроксициклогексанкарбоксилат: 3.10.а (R=Н, А=СООСН3)
Метил (1R,3S,5S)-3-ацетокси-5-бензоилоксициклогексанкарбоксилат: 3.9.a (R=Н, A=СООСН3) (32,4 г, 151,9 ммоль) омыляют, как описано для 2.5.а (R=Н, L=OTos, А=СООСН3). Сырой продукт очищают флэш-хроматографией на силикагеле (гептан/этилацетат 5/5), получая при этом 3.10.а (R=Н, А=СООСН3) (22,38 г, 79,5%).
1H-ЯМР (СDСl3): δ 1,63 (4Н, м), 1,92 (1Н, с), 2,3 (2Н, м), 2,86 (1Н, м), 3,7 (3Н, с), 4,1 (1Н, м), 5,53 (1Н, м), 7,5 (3Н, м), 8,0 (2Н, м) м.д.;
[α]
с) Метил (1S,3S,5S)-5-бензоилокси-3-тозилоксициклогексанкарбоксилат: 3.11.a (R=Н, L=OTos, А=СООСН3)
Спирт 3.10.а (R=Н, А=СООСН3) (25,2 г, 90,88 ммоль) тозилируют, как описано для 2.4.а (R=Н, L=OTos, А=СООСН3). После очистки флэш-хроматографией (гептан/этилацетат 7/3) и кристаллизации из смеси гептан/EtOH с количественным выходом получают указанное в заголовке соединения 3.11.а (R=Н, L=OTos, A=СООСН3) (39,75 г).
Т. пл. 128,4°С.
ИК (КВr): 2950, 1715, 1175, 939 см-1;
1H-ЯМР (СDСl3): δ 1,7 (3Н, м), 2,18 (2Н, м), 2,38 (3Н, с), 2,5 (1Н, м), 2,85 (1Н, м), 3,68 (3Н, с), 4,76 (1Н, м), 5,43 (1Н, м), 7,19 (2Н, д), 7,5 (2Н, д), 7,58 (1Н, м), 7,77 (2Н, д), 7,96 (2Н, д) м.д.;
[α]
d) Метил (1S,3S,5S)-5-гидрокси-3-тозилоксициклогексанкарбоксилат: 3.12.а (R=Н, L=OTos, А=СООСН3)
Из 3.11.а (R=Н, L=OTos, А=СООСН3) (38,25 г, 88,4 ммоль), как описано для 2.7. а (R=Н, L=OTos, А=СООСН3), получают метил (1S,3S,5S)-5-гидрокси-3-тозилоксициклогексанкарбоксилат 3.12.а (R=Н, L=OTos, А=СООСН3) (29,25 г) в виде желтого масла с количественным выходом.
1H-ЯМР (CDCl3): δ 1,6 (4Н, м), 2,08 (3Н, м), 2,47 (3Н, с), 2,83 (1Н, м), 3,68 (3Н, с), 4,3 (1Н, м), 4,82 (1Н, м), 7,36 (2Н, д), 7,8 (2Н, д) м.д.
е) Метил (1S,3S,5S)-5-трет-бутилдиметилсилилокси-3-тозилоксициклогексанкарбоксилат: 3.13.a (R=Н, L=OTos, Р=TBDMS, А=СООСН3)
Из 3.12.а (R=Н, L=OTos, А=СООСН3) (29,2 г, 89,07 ммоль), как описано для 2.8.а (R=Н, L=OTos, Р=TBDMS, А=СООСН3). Очистка флэш-хроматографией на силикагеле (гептан/этилацетат 8/2) дает 3.13.а (R=Н, L=OTos, Р=TBDMS, А=СООСН3) (34,8 г, 88%) в виде желтого масла.
ИК (пленка): 2953, 2855, 1725, 1278, 1177, 949 см-1:
1H-ЯМР (СDСl3): δ 0 (6Н, д), 0,85 (9Н, с), 1,55 (3Н, м), 1,88 (2Н, м), 2,38 (1Н, с), 2,48 (3Н, с), 2,82 (1Н, м), 3,7 (3Н, с), 4,2 (1Н, м), 4,7 (1Н, м), 7,8 (2Н, д), 8,09 (2Н, д) м.д.;
[α]
f) (2R,3aR,4aR)-2-трет-Бутилдиметилсилилокси-3а-карбометоксибицикло[3.1.0]гексан: I.h.1 (R=Н, Р=TBDMS, А=СООСН3)
Из 3.13. а (R=Н, L=OTos, Р=TBDMS, А=СООСН3) (33,2 г, 75 ммоль), как описано для I.b.1 (из 2.8.1). Очистка флэш-хроматографией на силикагеле (гептан/этилацетат 95/5) дает (2R,3aR,4aR)-2-трет-бутилдиметилсилилокси-3а-карбометоксибицикло[3.1.0]гексан: I.h.1 (R=Н, Р=TBDMS, А=СООСН3) (15,5 г, 78%) в виде желтого масла.
ИК (пленка): 2952, 2856, 1724, 1113, 837 см-1;
1H-ЯМР (СDСl3): δ 0 (6Н, с), 0,85 (9Н, с), 1,11 (1Н, д), 1,27 (2Н, м), 1,6 (3Н, с), 1,8 (1Н, м), 2,11 (3Н, м), 3,65 (3Н, с), 3,9 (1Н, м) м.д.;
[α]
ПРИМЕР 5: (2R,3aR,4aR)-2-трет-бутилдиметилсилилокси-3а-(гидроксиметил)бицикло[3.1.0]гексан: I.h.2 (R=H, P=TBDMS, A=CH2OH)
(2R,3aR,4aR)-2-трет-Бутилдиметилсилилокси-3а-карбометоксибицикло[3.1.0]гексан: I.h.1 (R=H, P=TBDMS, A=СООСН3) (15,15 г, 56 ммоль) превращают в I.h.2 (R=H, Р=TBDMS, А=CH2OH) (11,85 г, 87%) с использованием условий, описанных для I.b.2 (R=H, P=TBDMS, А=CH2OH).
ИК (пленка): 3354, 2928, 2856, 1255, 835 см-1;
1H-ЯМР (CDCl3) δ 0,1 (6Н, с), 0,35 (1Н, т), 0,5 (1Н, т), 0,86 (9Н, с), 1,17 (1Н, с), 1,85 (5Н, м), 3,52 (2Н, м), 4,0 (1Н, м) м.д.;
[α]
ПРИМЕР 6: (2R,3aR,4aR)-2-трет-бутилдиметилсилилокси-3а-формилбицикло[3.1.0]гексан: I.h.3 (R=H, P=TBDMS, A=CHO)
Из I.h.2 (R=H, P=TBDMS, A=CH2OH) (11,3 г, 46,6 ммоль) по процедуре I.b.3 (R=H, P=TBDMS, А=CHO) I.h.3 (R=H, Р=TBDMS, А=CHO) получают (6,2 г, 55%) в виде желтого масла.
УФ (EtOH): 204,5 мм (ε=6600);
ИК (пленка): 2930, 2880, 2856, 1705, 1119, 1097, 836 см-1;
1H-ЯМР (СDСl3): δ 0 (6Н, с), 0,83 (9Н, с), 0,95 (1Н, т), 1,22 (2Н, м), 1,85 (2Н, м), 2,1 (3Н, м), 4,0 (1Н, кв), 8,87 (1Н, с) м.д.;
[α]
ПРИМЕР 7: (2R,3aS,4aS)-2-трет-бутилдиметилсилилокси-3а-карбометоксибицикло[3.1.0]гексан: I.a.1 (R=Н, Р=TBDMS, А=СООСН3)
а) Метил (1R,3S,5R)-3-трет-бутилдиметилсилилокси-5-тозилоксициклогексанкарбоксилат: 2.3.а (R=Н, L=OTos, Р=TBDMS, A=СООСН3)
Функциональную гидроксигруппу метил (1R,3S,5R)-3-гидрокси-5-тозилоксициклогексанкарбоксилата 2.5.а (R=Н, L=OTos, А=СООСН3) (29,3 г, 89,2 ммоль) защищают, как описано для 2.8.а (R=Н, L=OTos, Р=TBDMS, А=СООСН3), получая при этом 2.3. а. (R=Н, L=OTos, Р=TBDMS, А=СООСН3) (36,75 г, 93%). Т. пл. 70,9°С.
ИК (КВr): 2957, 2855, 1734, 1174, 923 см-1;
1H-ЯМР (CDCl3): δ 0 (6Н, с), 0,82 (9Н, с), 1,41 (3Н, м), 2,16 (4Н, м), 2,46 (3Н, с), 3,54 (1Н, м), 3,69 (3Н, с), 4,41 (1Н, м), 7,34 (2Н, д), 7,8 (2Н, д) м.д.;
[α]
b) (2R,3aS,4aS)-2-трет-Бутилдиметилсилилокси-3а-карбометоксибицикло[3.1.0]гексан: I.a.1 (R=Н, Р=TBDMS, А=СООСН3)
Из 2.3. a (R=Н, L=OTos, P=TBDMS, A=СООСН3) (34,81 г, 78,6 ммоль), как описано для I.b.l (R=Н, Р=TBDMS, А=СООСН3). Очистка флэш-хроматографией на силикагеле (гептан/этилацетат 5/5) дает I.a.1 (R=Н, Р=TBDMS, А=СООСН3) (16,6 г, 78%) в виде желтого масла.
ИК (пленка): 2953, 2855, 1726, 1148, 836 см-1;
1H-ЯМР (СDСl3): δ 0 (6Н, с), 0,86 (9Н, с), 1,5 (5Н, м), 2,1 (1Н, м), 2,48 (1Н, м), 3,68 (3Н, с), 4,33 (1Н, т) м.д.;
[α]
ПРИМЕР 8: (2R,3aS,4aS)-2-трет-Бутилдиметилсилилокси-3а-(гидроксиметил)бицикло [3.1.0]гексан: I.а.2 (R=H, P=TBDMS, A=СН2OН)
Из I.a.1 (R=Н, Р=TBDMS, А=СН2OН) (15,6 г, 57,7 ммоль), как описано для I.b.2 (R=Н, Р=TBDMS, А=СН2OН). I.a.2 (R=Н, Р=TBDMS, А=СН2OН) получают в виде желтого масла (11,7 г, 83,7%).
ИК (пленка): 3331, 2927, 2855, 1254, 1094, 1006, 835 см-1;
1H-ЯМР (CDCl3): δ 0 (6Н, с), 0,5 (1Н, м), 0,88 (9Н, с), 1,19 (3Н, м), 1,72 (2Н, м), 2,1 (2Н, м), 3,6 (2Н, с), 4,34 (1Н, т) м.д.;
[α]
ПРИМЕР 9: (2R,3aS,4aS)-2-трет-бутилдиметилсилилокси-3а-формилбицикло[3.1.0]гексан: I.a.3 (R=Н, Р=TBDMS, А=СНО)
Из I.a.2 (R=Н, Р=TBDMS, А=СН2OН) (11,1 г, 45,5 ммоль), как описано для I.b.3 (R=Н, Р=TBDMS, А=СНО). I.a.3 (R=Н, Р=TBDMS, А=СНО) (8,8 г, 80%) получают в виде желтого масла.
УФ (EtOH): 204,7 нм (ε=6991);
ИК (пленка): 2928, 2855, 1702, 1255, 1072, 837 см-1;
1H-ЯМР (CDCl3): δ 0 (6Н, с), 0,85 (9Н, с), 1,45 (1Н, м), 1,78 (3Н, м), 2,02 (2Н, м), 2,5 (1Н, м), 4,35 (1Н, м), 8,81 (1Н, с) м.д.;
[α]
ПРИМЕР 10: (2S,3aR,4aR)-2-трет-бутилдиметилсилилокси-3а-карбометоксибицикло[3.1.0]гексан: I.f.1 (R=Н, Р=TBDMS, А=СООСН3)
а) Метил-(1R,3S,5R)-3-ацетокси-5-трет-бутилдиметилсилилоксициклогексанкарбоксилат: 3.7.а (R=Н, Р=TBDMS, A=СООСН3)
Функциональную гидроксигруппу метил (1S,3S,5R)-3-ацетокси-5-гидроксициклогексанкарбоксилата 2.А (R=Н, А=СООСН3) (45,5 г, 0,210 ммоль) силилируют, как описано для 2.8.а (R=Н, L=OTos, Р=TBDMS, А=СООСН3). Очистка флэш-хроматографией на силикагеле с применением смеси гептан/этилацетат в качестве элюирующего растворителя (9/1) дает 3,7.a (R=H, P=TBDMS, A=СООСН3) в виде желтого масла (69,97 г, 92%).
ИК (пленка): 2953, 2856, 1736, 1240 см-1;
1H-ЯМР (CDCl3): δ 0 (6Н, с), 0,8 (9Н, с), 1,33 (4Н, м), 2 (3Н, с), 2,1 (2Н, м), 2,32 (1Н, м), 3,55 (1Н, м), 3,62 (3Н, с), 4,66 (1Н, м) м.д.
b) Метил (1R,3S,5R)-5-трет-бутилдиметилсилилокси-3-гидроксициклогексанкарбоксилат: 3.8.a (R=H, P=TBDMS, A=СООСН3)
Из 3.7.a (R=Н, Р=TBDMS, А=СООСН3) (63,67 г, 0,1926 ммоль), как описано для 2.5.а (R=Н, L=OTos, А=СООСН3). Очистка флэш-хроматографией на силикагеле с использованием смеси гептан/этилацетат (7/3) в качестве элюента дает 3.8. а (R=Н, Р=TBDMS, А=СООСН3) (46,24 г, 83%) в виде желтого масла.
ИК (пленка): 3404, 2952, 2856, 1736, 837 см-1;
1H-ЯМР (СDСl3): δ 0 (6Н, с), 0,81 (9Н, с), 1,3 (3Н, м), 1,67 (1Н, м), 2,13 (4Н, м), 3,56 (2Н, м), 3,63 (3Н, с) м.д.;
[α]
с) Метил (1S,3S,5R)-5-трет-бутилдиметилсилилокси-3-тозилоксициклогексанкарбоксилат: 3.6.а (R=Н, L=OTos, Р=TBDMS, А=СООСН3)
Из 3.8.а (R=Н, Р=TBDMS, А=СООСН3) (45,99 г, 0,159 ммоль), как описано для 2.4. а (R=Н, L=OTos, А=СООСН3). Очистка флэш-хроматографией на силикагеле с использованием смеси гептан/этилацетат, 8/2, в качестве элюента с последующей кристаллизацией из EtOH дает 3.6. а (R=Н, L=OTos, Р=TBDMS, А=СООСН3) (53,7 г, 76%).
Т. пл.: 71°С.
ИК (КВr): 2957, 2855, 1734, 1174, 923 см-1;
1H-ЯМР (CDCl3): δ 0 (6Н, с), 0,82 (9Н, с), 1,41 (3Н, м), 2,16 (4Н, м), 2,46 (3Н, с), 3,54 (1Н, м), 3,69 (3Н, с), 4,41 (1H, м), 7,34 (2Н, д), 7,8 (2Н, д) м.д.;
[α]
d) (2S,3aR,4aR)-2-трет-Бутилдиметилсилилокси-3а-карбометоксибицикло[3.1.0]гексан: I.f.1 (R=H, P=TBDMS, A=СООСН3)
Из 3.6. a (R=H, L=OTos, P=TBDMS, A=СООСН3) (53,7 г, 0,121 ммоль), как описано для I.b.1 (R=H, Р=TBDMS, А=СООСН3). I.f.1 (R=H, P=TBDMS, А=СООСН3) получают (24,48 г, 74,6%) в виде бледно-желтого масла.
ИК (пленка): 2953, 2856, 1726, 1148, 836 см-1;
1H-ЯМР (CDCl3): δ 0 (6Н, с), 0,86 (9Н, с), 1,5 (5Н, м), 2,1 (1Н, м), 2,48 (1Н, м), 3,68 (3Н, с), 4,33 (1Н, т) м.д.;
[α]
ПРИМЕР 11: (2S,3aR,4aR)-2-трет-бутилдиметилсилилокси-3а-(гидроксиметил)бицикло[3.1.0]гексан: I.f.2 (R=H, Р=TBDMS, А=СН2ОН)
Из I.f.1 (R=H, Р=TBDMS, А=СООСН3) (10 г, 0,037 ммоль), как описано для I.b.2 (R=H, P=TBDMS, А=СН2OH). I.f.2 (R=H, Р=TBDMS, А=СН2ОН) получают с количественным выходом (10 г) в виде масла.
ИК (пленка): 3331, 2927, 2855, 1254, 1094, 1006, 835 см-1;
1H-ЯМР (CDCl3); δ 0 (6Н, с), 0,5 (1Н, м), 0,88 (9Н, с), 1,19 (3Н, м), 1,72 (2Н, м), 2,1 (2Н, м), 3,6 (2Н, с), 4,34 (1Н, т) м.д.;
[α]
ПРИМЕР 12: (2S,3aR,4aR)-2-трет-бутилдиметилсилилокси-3а-формилбицикло[3.1.0]гексан: I.f.3 (R=H, P=TBDMS, A=CHO)
Как для I.b.3 (R=H, P=TBDMS, A=CHO), I.f.2 (R=H, P=TBDMS, A=CH2OH) (10 г, 0,037 ммоль) превращают в I.f.3 (R=H, P=TBDMS, А=CHO), полученный в виде бледно-желтого масла (5,3 г, 59,7%).
ИК (пленка): 2928, 2855, 1702, 1255, 1072, 837 см-1;
1H-ЯМР (СDСl3): δ 0 (6Н, с), 0,85 (9Н, с), 1,45 (1Н, м), 1,78 (3Н, м), 2,02 (2Н, м), 2,5 (1Н, м), 4,35 (1Н, м), 8,81 (1Н, с) м.д.;
УФ (EtOH): 205 нм;
[α]
ПРИМЕР 13: (2S,3aS,4aS)-2-трет-бутилдифенилсилилокси-3а-карбометоксибицикло[3.1.0]гексан: I.b.4 (R=Н, P=TBDMS, А=СООСН3)
а) Метил (1R,3S,5R)-3-ацетокси-5-(4-бромбензолсульфонилокси)циклогексанкарбоксилат: 2.4.Ь (R=Н. L=OBros, A=СООСН3)
Из 2.А (R=Н) (1,4 г, 6,47 ммоль) и 4-бромбензолсульфонилхлорида (4,22 г, 16,19 ммоль), как описано для 2.4.a (R=H. L=OTos). 2.4.b (R=H. L=OBros, A=СООСН3) (2,6 г, 96%) получают в виде белых кристаллов.
Т. пл.: 110-111°С.
ИК (пленка): 2956, 1734, 1363, 1246, 1188, 822, 742 см-1;
1H-ЯМР (500 МГц, СDСl3); δ 7,76 (2Н, д, J=8,6 Гц), 7,70 (2Н, д, J=8,6 Гц), 4,68 (1Н, дддд, J=11,6, 11,6, 4,37, 4,37 Гц), 4,46 (1Н, дддд, 11,6, 11,6, 4,6, 4,6 Гц), 3,69 (3Н, с), 2,37 (1Н, м), 2,28 (2Н, м), 2,02 (3Н, с), 1,58 (2Н, м), 1,39 (1Н, дд, J=24,0, 12,4 Гц) м.д.;
MS (м/z): 419 (М+, 1), 405 (1), 363 (3), 221 (10), 157 (34), 138 (70), 107 (15), 79 (68);
[α]
b) Метил (1R,3S,5R)-5-(4-бромбензолсульфонилокси)-3-гидроксициклогексанкарбоксилат: 2.5.b (R=H, L=OBros, A=СООСН3)
Из 2.4.b (R=H, L=OBros, A=СООСН3) (2,55 г, 6,08 ммоль), как описано для 2.5. а (R=H, L=OTos). 2.5.b (R=H, L=OBros, A=СООСН3) получают (2,25 г, 98%) в виде белых кристаллов. Т. пл. 95-98°С.
ИК (пленка): 3397, 2954, 1734, 1396, 1186, 815, 740 см-1;
1H-ЯМР (500 МГц, СDСl3): δ 7,76 (2Н, д, J=8,6 Гц), 7,70 (2Н, д, J=8,6 Гц), 4,46 (1Н, дддд, J=11,5, 11,5, 4,5, 4,5 Гц), 3,68 (3Н, с), 3,64 (1Н, м), 2,25 (4Н, м), 1,60 (1Н, дд, J=24,2, 12,5 Гц), 1,48 (1Н, дд, J=23,0, 11,5 Гц), 1,35 (1Н, дд, J=23,8, 12,5 Гц) м.д.;
MS (м/z): 377 (М+,1), 328 (3), 235 (10), 221 (13), 156 (85), 113 (100), 97 (52), 79 (53);
[α]
c) Метил (1R,3R,5R)-3-бензоилокси-5-(4-бромбензолсульфонилокси)циклогексанкарбоксилат: 2.6.b (R=H, L=OBros, A=СООСН3)
Из 2.5.b (R=H, L=OBros, A=СООСН3) (1,15 г, 3,05 ммоль), как описано для 2.6. a (R=H, L=OTos, А=СООСН3). Выход составляет 1,13 г (73%).
Т. пл.: 131-133°С.
ИК (пленка): 3420, 2948, 1717, 1362, 1186, 817, 707 см-1;
1H-ЯМР (500 МГц, СDСl3): δ 7,95 (2Н, д, J=7,4 Гц), 7,72 (2Н, д, J=8,5 Гц), 7,60 (1H, т, J=7,4 Гц), 7,58 (2Н, д, J=8,5 Гц), 7,49 (2Н, т, 7,7 Гц), 5,46 (1H, м), 4,81 (1H, дддд, J=11,3, 11,3, 4,4, 4,4 Гц), 2,85 (1H, дддд, J=12,5, 12,5, 3,7, 3,7 Гц), 2,47 (1H, м), 2,20 (2Н, м), 1,73 (3Н, м) м.д.;
MS (м/z): 497 (M+,1), 391 (4), 377 (10), 260 (100), 237 (8), 221 (25);
[α]
d) Метил (1R,3R,5R)-5-(4-бромбензолсульфонилокси)-3-гидроксициклогексанкарбоксилат: 2.7.b (R=H, L=OBros, A=СООСН3)
Из 2.6.b (R=H, L=OBros, A=СООСН3) (240 мг, 0,483 ммоль), как описано для 2.7.а (R=H, L=OTos, А=СООСН3). Выход составляет 167 мг (88%).
Т. пл.: 107-108°С.
ИК (пленка): 3527, 2954, 1732, 1577, 1365, 1187, 940, 818 см-1;
1H-ЯМР (500 МГц, СDСl3): δ 7,78 (2Н, д, J=8,6 Гц), 7,70 (2Н, д, J=8,6 Гц), 4,87 (1H, дддд, J=10,9, 10,9, 4,5, 4,5 Гц), 4,31 (1H, м), 3,69 (3Н, с), 2,86 (1H, дддд, J=12,1, 12,1, 3,7, 3,7 Гц), 2,24 (1H, д, J=12,7 Гц), 2,04 (1H, д, J=11,7 Гц), 1,94 (1H, д, J=14,0 Гц), 1,65 (3Н, м) м.д.;
MS (м/z): 394 (M++1,1), 295 (2), 221 (4), 157 (11), 97 (10);
[α]
е) Метил (1R,3S,5R)-5-(4-бромбензолсульфонилокси)-3-трет-бутилдифенилсилилоксициклогексанкарбоксилат: 2.8.b (R=H, L=OBros, P=TBDPS, A=СООСН3)
Из 2.7.b (R=H. L=OBros, A=СООСН3) (299 мг, 0,760 ммоль), как описано для 2.8. а (R=H, L=OTos, P=TBDPS, A=СООСН3). 2.8.b (R=H. L=OBros, P=TBDPS, A=СООСН3) (198 мг, 93%) получают в виде вязкого масла.
ИК (пленка): 2955, 1738, 1577, 1472, 1370, 1180, 947, 821, 703 см-1;
1H-ЯМР (500 МГц, CDCl3): δ 7,71 (2Н, д, J=8,8 Гц), 7,34-7,60 (12Н, м), 4,87 (1H, м), 4,17 (1H, уш.с), 3,78 (3Н, м), 2,98 (1H, дддд, J=9,1, 9,1, 3,5, 3,5 Гц), 2,39 (1H, д, J=11,9 Гц), 1,89 (1H, Д, J=13,9 Гц), 1,79 (1H, д, J=12,3 Гц), 1,63 (1H, м), 1,34 (2Н, м), 1,02 (9Н, с), 0,91 (3Н, с) м.д.;
MS (м/z): 599 (M+,1), 419 (28), 337 (34), 293 (8), 199 (46), 139 (100), 107 (50), 79 (72);
[α]
f) (2S,3aS,4aS)-2-трет-бутилдифенилсилилокси-3а-карбометоксибицикло[3.1.0]гексан: I.b.4 (R=H, P=TBDPS, A=СООСН3)
Как описано для I.b.1 (R=Н, Р=TBDPS, А=СООСН3), соединение 2.8.b (R=Н, L=OBros, Р=TBDPS, А=СООСН3) (206 мг, 0,344 ммоль) превращают в I.b.4 (R=Н, Р=TBDMS, А=СООСН3) (79 мг, 76%), полученный в виде бесцветного масла.
ИК (пленка): 2952, 1725, 1428, 1113, 703 см-1;
1H-ЯМР (500 МГц, СDСl3): δ 7,64 (4Н, дд, J=6,20, 6,20 Гц), 7,35-7,45 (6Н, м), 3,89 (1Н, дддд, J=7,7, 7,7, 7,7, 7,7 Гц), 3,65 (3Н, с), 2,28 (1Н, дд, J=12,9, 8,2 Гц), 2,12 (1Н, дд, J=12,9, 7,1 Гц), 1,91 (2Н, м), 1,77 (1Н, ддд, J=8,6, 5,0, 5,0 Гц), 1,19 (1Н, дд, J=8,6, 4,8 Гц), 1,02 (9Н, с), 0,44 (1Н, дд, J=5,1, 5,1 Гц) м.д.;
MS (м/z): 394 (M+,1), 363 (4), 337 (65), 259 (3), 213 (100), 199 (20), 135 (18), 77 (21);
[α]
ПРИМЕР 14: (2S,3aS,4aS)-2-трет-бутилдифенилсилилокси-3а-(гидроксиметил)бицикло[3.1.0]гексан: I.b.5 (R=H, P=TBDPS, А=СН3ОН)
Из I.b.4 (R=Н, Р.=TBDMS, А=СООСН3) (188 мг, 1,253 ммоль), как описано для I.b.2 (R=Н, Р=TBDMS, А=СН2OH). Очистка флэш-хроматографией на силикагеле (изооктан/этилацетат 83:17) дает I.b.5 (R=Н, Р=TBDPS, А=СН2ОН) (240 мг, 96%) в виде вязкого масла.
ИК (пленка): 3322, 2932, 1428, 1113, 702 см-1;
1H-ЯМР (500 МГц, CDCl3): δ 7,75 (4Н, м), 7,58 (6Н, м), 3,97 (1Н, дддд, J=7,1, 7,1, 7,1, 7,1 Гц), 3,56 (2Н, уш.с), 1,84-2,05 (3Н, м), 1,12 (1Н, м), 1,03 (9Н, с), 0,34 (1Н, дд, J=7,8, 5,4 Гц), 0,13 (1Н, дд, J=4,6, 4,6 Гц) м.д.;
MS (м/z): 365 (M+-1, 1), 291 (3), 231 (10), 199 (100), 181 (12), 139 (27), 93 (77), 79 (24);
[α]
ПРИМЕР 15: (2S,3aS,4aS)-2-трет-бутилдифенилсилилокси-3а-формилбицикло[3.1.0]гексан: I.b.6 (R=Н, Р=TBDPS, А=СНО)
Из I.b.5 (R=Н, Р=TBDPS, A=CH2OH) (230 мг, 0,627 ммоль), как описано для I.b.3 (R=Н, Р=TBDMS, А=СНО). Выход I.b.6 (R=Н, Р=TBDPS, А=СНО) 210 мг (92%).
ИК(пленка): 3439, 3061, 2954, 2858, 1704, 1589, 1471, 1111, 1036, 823, 703 см-1;
1H-ЯМР (500 МГц, CDCl3): δ 8,85 (1Н, с), 7,68-7,60 (4Н, м), 3,99 (1Н, кв, J=7,4 Гц), 2,30 (1Н, дд, J=13,1, 8,0 Гц), 2,03-1,98 (2Н, м), 1,93-1,87 (2Н, м), 1,22 (1Н, дд, J=8,4, 6,0 Гц), 1,02 (9Н, с), 0,74 (1Н, дд, J=5,3, 5,3 Гц) м.д.;
[α]
ПРИМЕР 16: (2S,3aS,4aS)-2-трет-бутилдифенилсилилокси-3а-этинилбицикло[3.1.0]гексан: I.b.7 (R=Н, Р=TBDPS, А=С≡СН)
К раствору (MeO)2P(O)CHN2 (188 мг, 1,253 ммоль) в ТГФ (3 мл), охлажденному до -78°С, добавляют по каплям трет-ВuОК (1,26 мл, 1,26 ммоль, 1,0 М раствор в ТГФ). Смесь перемешивают при -78°С в течение 20 мин до сохранения желтого цвета раствора. Медленно добавляют I.b.6 (R=Н, Р=TBDPS, А=СНО) (380 мг, 1,043 ммоль) в ТГФ (3 мл) и перемешивание продолжают в течение ночи, температуру повышают естественным образом от -78°С до комнатной температуры. Реакцию гасят добавлением воды (10 мл) и Et2O (20 мл) и органическую фазу отделяют, водный слой экстрагируют Et2O (3×50 мл) и сушат над MgSO4. Остаток разделяют ВЭЖХ (гексан/EtOAc 96:4), получая при этом I.b.7 (R=Н, Р=TBDPS, А=С≡СН) (338 мг, 90%) в виде бесцветного масла.
ИК (пленка): 3291, 3072, 2932, 2143, 1590, 1473, 1428, 1114, 1091, 824, 741 см-1;
1H-ЯМР (500 МГц, СDСl3): δ 7,61-7,63 (4Н, м), 7,34-7,43 (6Н, м), 3,81 (1Н, кв, J=7,6 Гц), 2,16 (1Н, дд, J=12,5, 7,13 Гц), 2,02 (1Н, ддд, J=12,5, 8,1, 0,9 Гц), 1,95 (1Н, м), 1,93 (1Н, с), 1,56 (1Н, м), 1,02 (9Н, с), 0,70 (1Н, дд, J=8,3, 5,1 Гц), 0,31 (1Н, т, J=5,0 Гц) м.д.;
[α]
ПРИМЕР 17: (2S,3aR,4aR)-2-трет-бутилдифенилсилилокси-3а-карбометоксибицикло[3.1.0]гексан: I.f.4 (R=H, P=TBDPS, A=СООСН3)
а) Метил (1R, 3R,5S)-3-трет-бутилдифенилсилилокси-5-гидроксициклогексанкарбоксилат: 3.8.b (R=H, P=TBDPS, A=СООСН3)
Из 2.A (R=H, A=СООСН3) и TBDPSC1 через образование 3.7.b (R=H, P=TBDPS, A=СООСН3), как описано для 3.8. а (R=H, P=TBDMS, A=СООСН3) в примере 4. Указанное в заголовке соединение получают в виде вязкого масла; выход для двух стадий составляет 92%.
ИК (пленка): 3404, 2952, 1738, 1428, 1112, 1049, 807, 710 см-1;
1H-ЯМР (500 МГц, СDСl3): δ 7,66 (4Н, м), 7,40 (6Н, м), 3,65 (3Н; с), 3,60 (1Н, дддд, J=10,9, 10,9, 4,3, 4,3 Гц), 3,41 (1Н, м), 2,11 (4Н, м), 1,50 (1Н, дд, J=12,6, 12,6 Гц), 1,41 (1Н, Д, J=5,2 Гц), 1,34 (3Н, м) м.д.;
MS (м/z): 412 (М+, 1), 355 (5), 323 (67), 199 (100), 153 (37), 105 (21), 79 (85);
[α]
b) Метил (1S,3R,5S)-3-трет-бутилдифенилсилилокси-5-тозилоксициклогексанкарбоксилат: 3.6.b (R=Н, L=OTos, Р=TBDPS, А=СООСН3)
Из 3.8.b (R=Н, Р=TBDPS, A=СООСН3), как описано для 2.4.а (R=Н, L=OTos, А=СООСН3). 3.6.b получают в виде вязкого масла, выход 94%.
ИК (пленка): 2955, 1738, 1363, 1178, 1111, 824, 704 см-1;
1H-ЯМР (500 МГц, СDСl3): δ 7,69 (2Н, д, J=8,3 Гц), 7,58 (4Н, м), 7,28 (2Н, д, J=8,1 Гц), 4,18 (1Н, дддд, J=11,6, 11,6, 4,6, 4,6 Гц) 3,62 (3Н; с), 3,48 (1Н, дддд, J=11,1, 11,1; 4,1, 4,1 Гц), 2,47 (3Н, с), 2,15-1,99 (4Н, м), 1,52 (1Н, ддд, J=5,6, 5,57, 5,6 Гц), 1,42 (1Н, ддд, J=12,0, 12,0, 12,0 Гц), 0,98 (9Н, с) м.д.;
MS (м/z): 567 (М+, 1), 509 (9), 451 (1), 353 (49), 337 (67), 293 (38), 213 (47), 139 (32), 91(100), 79 (77);
[α]
с) (2S,3aR,4aR)-2-трет-Бутилдифенилсилилокси-3а-карбометоксибицикло[3.1.0]гексан: I.f.4 (R=H, P=TBDPS, A=СООСН3)
Из 3.6.b (R=H, L=OBros, P=TBDPS, A=СООСН3), как описано для I.b.1 (R=H, P=TBDMS, A=СООСН3). Выход составляет 81%.
ИК(пленка): 3287, 2934, 1732, 1457, 1281, 1017 см-1;
1H-ЯМР (500 МГц, СDСl3): δ 3,73 (2Н, м), 3,72 (3Н; с), 2,53 (1Н, дддд, J=12,2, 12,2, 3,4, 3,4 Гц), 2,26 (1Н, д, J=11,3 Гц), 2,17 (2Н, д, J=11,7 Гц), 1,30 (2Н, ддд, J=12,0, 12,0, 12,0 Гц), 1,23 (1Н, ддд, J=11,4, 11,4, 11,4 Гц) м.д.;
MS (м/z): 394 (М+, 1), 337 (31), 259 (5), 199 (55), 153 (48), 107 (100), 79 (52);
[α]
ПРИМЕР 18: (2S,3aR,4aR)-2-трет-бутилдифенилсилилокси-3а-(гидроксиметил)бицикло[3.1.0]гексан: I.f.5 (R=H, P=TBDPS, A=CH2OH)
Из I.f.4 (R=H, P=TBDPS, A=СООСН3), как описано для I.b.2 (R=H, P=TBDMS, A=CH2OH). (2S, 3aR, 4aR) -2-трет-бутилдифенилсилилокси-3а-(гидроксиметил)бицикло[3.1.0]гексан I.f.5 (R=H, P=TBDPS, A=CH2OH) получают с выходом 98%.
ИК (пленка): 3332, 2931, 1428, 1111, 1008, 822, 702 см-1;
1H-ЯМР (500 МГц, CDCl3): δ 7,62 (4Н, дд, J=7,9, 1,5 Гц), 7,39 (6Н, м), 4,37 (1Н, т, J=6,27 Гц), 3,57 (2Н, с), 1,90-2,02 (3Н, м), 1,80 (1Н, д, J=13,8 Гц), 1,21 (1Н, т, J=4,1 Гц), 1,15 (1Н, м), 1,03 (9Н, с), 0,60 (1Н, м) м.д.;
MS (м/z): 35 (M+-1, 1), 291 (6), 231 (17), 199 (100), 181 (17), 139 (28), 93 (79), 79 (16);
[α]
ПРИМЕР 19: (2S,3aR,4aR)-2-трет-бутилдифенилсилилокси-3а-формилбицикло[3.1.0]гексан: I.f.6 (R=Н, Р=TBDPS, А=СНО)
Из I.f.5 (R=Н, Р=TBDPS, А=CH2OH), как описано для I.b.3 (R=Н, Р=TBDMS, А=СНО). Выход 96%.
ИК(пленка): 2956, 1704, 1590, 1472, 1428, 1112, 1072, 822, 702 см-1;
1H-ЯМР (500 МГц, CDCl3); δ 8,85 (1Н, с), 7,61 (4Н, м), 7,43 (2Н, дт, J=7,0, 1,0 Гц), 7,37 (4Н, дт, J=7,0, 1,0 Гц), 4,40 (1Н, т, J=6,0 Гц), 2,39 (1Н, дд, J=14, 6,0 Гц), 1,89 (1Н, д, J=13,0 Гц), 1,86 (1Н, д, J=14,0 Гц), 1,53 (1Н, м), 1,04 (9Н, с) м.д.;
[α]
ПРИМЕР 20: (2S,3aR,4aR)-2-трет-бутилдифенилсилилокси-3а-этинилбицикло[3.1.0]гексан: I.f.7 (R=H, P=TBDPS, А=С≡СН)
Из I.f.6 (R=Н, Р=TBDPS, А=СНО), как описано для I.b.7 (R=Н, Р=TBDMS, А=С≡СН). Выход составляет 88%.
ИК (пленка): 3310 (с), 3071, 2931, 2857, 2113, 1590, 1472, 1428, 1378, 1362, 1299, 1262, 1234, 1198, 1113, 1026, 933, 913, 865, 822, 701 см-1;
1H-ЯМР (500 МГц, CDCl3): δ 7,60 (4Н, м), 7,42 (2Н, тд, J=2, 8 Гц), 7,37 (4Н, тд, J=1, 8 Гц), 4,32 (1Н, м), 2,06 (2Н, м), 2,04 (1Н, дт, J=6, 14 Гц), 1,90 (1Н, с), 1,80 (1Н, д, J=14 Гц), 1,65 (1Н, дт, J=5, 10 Гц), 1,49 (1Н, т, J=5 Гц), 1,03 (9Н, с), 1,03 (1Н, м);
[α]
ПРИМЕР 21: (2R,3аS,4аS)-2-трет-бутилдифенилсилилокси-3а-карбометоксибицикло[3.1.0]гексан: I.а.4 (R=H, Р=TBDPS, А=СООСН3)
а) Метил (1R,3S,5R)-3-трет-бутилдифенилсилилокси-5-тозилоксициклогексанкарбоксилат: 2.3.b (R=H, L=OTos, Р=TBDPS, A=СООСН3)
Из 2.5.а (R=H, L=OTos, A=СООСН3), как описано для 2.8. а (R=H, L=OTos, Р=TBDMS, А=СООСН3). Выход составляет 91%.
ИК (пленка): 2932, 2857, 1736, 1428, 1364, 1177, 1107, 929, 822, 703, 665 см-1;
1H-ЯМР (500 МГц, СDСl3): δ 7,69 (2Н, д, J=8,3 Гц), 7,57 (4Н, дм, J=7 Гц), 7,44 (2Н, кв, J=7 Гц), 7,36 (4Н, т, J=8 Гц), 7,28 (2Н, д, J=8,4 Гц), 4,16 (1Н, тт, J=4, 12 Гц), 3,63 (3Н, с), 3,46 (1Н, тт, J=4, 11 Гц), 2,43 (3Н, с), 2,13 (1Н, дм, J=12 Гц), 1,00 (9Н, с) м.д.;
[α]
b) (2R,3aS,4aS)-2-трет-Бутилдифенилсилилокси-3а-карбометоксибицикло[3.1.0]гексан: I.a.4 (R=H, P=TBDPS, А=СООСН3)
Из 2.3.b (R=H, L=OTos, Р=TBDPS, А=СООСН3), как описано для I.b.1 (R=Н, Р=TBDMS, А=СООСН3). Выход 75%.
ИК (пленка): 2932, 2857, 1723, 1589, 1472, 1428, 1297, 1148, 1112, 1088, 702 см-1;
1H-ЯМР (500 МГц, СDСl3): δ 7,61 (4Н, дд, J=1, 7 Гц), 7,42 (2Н, т, J=7 Гц), 7,37 (4Н, т, J=7 Гц), 4,36 (1Н, т, 6,1 Гц), 3,63 (3Н, с), 2,37 (1Н, ддд, J=1, 6,4, 14 Гц), 1,99 (1Н, д, J=14 Гц), 1,96 (1Н, дд, J=6, 14 Гц), 1,87 (1Н, дт, J=5, 9 Гц), 1,82 (1Н, д, J=14 Гц), 1,63 (1Н, дд, J=4, 5 Гц), 1,50 (1Н, дм, J=9 Гц), 1,03 (9Н, с) м.д.;
[α]
ПРИМЕР 22: (2R,3аS,4aS)-2-трет-бутилдифенилсилилокси-3а-(гидроксиметил) бицикло[3.1.0]гексан: I.a.5 (R=H, Р=TBDPS, А=СН2OH)
Из I.a.4 (R=Н, Р=TBDPS, A=СООСН3), как описано для I.b.2 (R=Н, Р=TBDMS, А=СН2OH), получают с количественным выходом.
ИК (пленка): 3346, 2930, 1589, 1472, 1428, 1111, 1092, 1076, 1031, 822, 701 см-1;
1H-ЯМР (500 МГц, СDСl3): δ 7,26 (4Н, дд, J=1, 7 Гц), 7,41 (2Н, т, J=7 Гц), 7,36 (4Н, т, J=7 Гц), 4,38 (1Н, т, J=6,3 Гц), 3,57 (2Н, с), 2,00 (1H, дд, J=6, 13 Гц), 1,95 (1Н, дд, J=7, 14 Гц), 1,92 (1H, д, J=14 Гц), 1,80 (1H, дд, J=14 Гц), 1,22 (2Н, м), 1,15 (1H, м), 1,04 (9Н, с), 0,60 (1H, м) м.д.;
[α]
ПРИМЕР 23: (2R,3аS,4aS)-2-трет-бутилдифенилсилилокси-3а-формилбицикло[3.1.0]гексан: I.а.6 (R=Н, P=TBDPS, A=СНО)
Из I.a.5 (R=Н, Р=TBDPS, А=CH2OH), как описано для I.b.3 (R=Н, Р=TBDMS, А=СНО). Выход 93%.
ИК (пленка): 2931, 1701, 1589, 1472, 1196, 1008, 822, 702 см-1;
1H-ЯМР (500 МГц, СDСl3): δ 8,85 (1Н, с), 7,61 (4Н, м), 7,43 (2Н, т, J=7 Гц), 7,37 (4Н, т, J=7 Гц), 4,41 (1Н, т, J=6 Гц), 2,39 (1Н, дд, J=6, 14 Гц), 1,04 (9Н, с) м.д.;
[α]
ПРИМЕР 24: (2R,3aR,4aR)-2-трет-бутилдифенилсилилокси-3а-карбометоксибицикло[3.1.0]гексан: I.h.4 (R=Н, Р=TBDPS, А=СООСН3)
а) Метил (1S,3S,5S)-3-трет-бутилдифенилсилилокси-5-тозилоксициклогексанкарбоксилат: 3.13.b (R=Н, L=OTos, Р=TBDPS, A=СООСН3)
Из 3.12 (R=Н, L=OTos, А=СООСН3) (4,8 г, 14,63 ммоль), как описано для 2.8. а (R=Н, L=OTos, Р=TBDPS, А=СООСН3). Выход составляет 90%.
ИК (пленка): 2954, 1731, 1272, 1176, 1107, 945, 813, 713, 664 см-1;
1H-ЯМР (500 МГц, СDСl3): δ 7,53-7,25 (14Н, м), 4,84 (1Н, м), 3,68 (3Н, с), 2,95 (1H, дт, J=3,3, 12,7 Гц), 2,45 (3Н, с), 2,37 (1H, д, J=12,4 Гц), 1,84 (1H, д, J=12,7 Гц), 1,60 (1H, м), 1,29 (3Н, м) м.д.;
MS (м/z): 566 (М+), 477, 431, 399, 353, 283, 225, 198, 139, 91 (основной пик);
[α]
b) (2R,3aR,4aR)-2-трет-Бутилдифенилсилилокси-3а-карбометоксибицикло[3.1.0]гексан: I.h.4 (R=Н, Р=TBDPS, А=СООСН3)
Из 3.13.b (R=Н, Р=TBDPS, А=СООСН3) (7,3 г, 12,89 ммоль), как описано для I.b.1 (R=Н, Р=TBDMS, А=СООСН3). Выход составляет 79%.
ИК (пленка): 2952, 2858, 1723, 1428, 1370, 1219, 1112, 823, 741, 702 см-1;
1H-ЯМР (500 МГц, СDСl3): δ 7,66-7,38 (10H, м), 3,89 (1Н, м), 3,65 (3Н, с), 2,12 (1Н, м), 1,92 (2Н, м), 1,77 (1Н, м), 1,14 (2Н, м), 1,02 (9Н, с), 0,45 (1Н, м) м.д.;
MS (м/z): 394 (М+), 393 (M+-1), 363, 351, 337, 296, 259, 213 (основной пик), 183, 135, 105, 77.
[α]
ПРИМЕР 25: (2R,3aR,4aR)-2-трет-бутилдифенилсилилокси-3а-(гидроксиметил)бицикло [3.1.0]гексан: I.h.5 (R=H, P=TBDPS, А=СН2OH)
Из I.h.4 (R=Н, Р=TBDPS, А=СООСН3), как описано для I.b.2 (R=Н, Р=TBDMS, А=СН2OH). Выход 98%.
ИК (пленка): 3327, 2929, 2856, 1470, 1426, 1279, 1112, 1087, 1030, 822, 739, 700 см-1;
1H-ЯМР (500 МГц, CDCl3): δ 7,65-7,35 (10H, м), 3,97 (1Н, ддд, J=7,0, 7,2, 7,0 Гц), 3,55 (2Н, уш.с), 2,04 (1Н, м), 1,93 (1Н, м), 1,87 (2Н, м), 1,39 (1Н, м), 1,02 (9Н, с), 0,45 (1Н, м), 0,13 (1Н, м) м.д.;
MS (м/z): 365 (M+-1), 322, 281, 237, 189 (основной пик), 181, 139, 99, 77;
[α]
ПРИМЕР 26: (2R,3aR,4aR)-2-трет-бутилдифенилсилилокси-3а-формилбицикло[3.1.0]гексан: I.h.6 (R=Н, Р=TBDPS, А=СНО)
Из I.h.5 (R=Н, Р=TBDPS, A=CH2OH), как описано для I.b.3 (R=Н, Р=TBDMS, А=СНО).
ИК (пленка): 2931, 2857, 1708, 1472, 1388, 1362, 1200, 1113, 1093, 1036, 901, 823, 742, 612 см-1;
1H-ЯМР (500 МГц, CDCl3): δ 8,87 (1H, с), 7,5-7,35 (10Н, м), 3,98 (1H, м), 2,29 (1H, дд, J=12,9, 8,1 Гц), 2,01 (2Н, м), 1,89 (2Н, м), 1,22 (1H, м), 1,02 (9Н, с), 0,74 (1H, т, J=5,4 Гц) м.д.;
MS (м/z): 363 (М+1), 332, 307 (основной пик), 289, 277, 263, 229, 211, 199, 181, 151, 139, 121, 91, 77, 57, 41;
[α]
ПРИМЕР 27: (1R,2S,3aS,4aS)-3а-карбометокси-2-трет-бутилдифенилсилилокси-1-метилбицикло[3.1.0]гексан: I.а.7 (R=Me, Р=TBDPS, А=СООСН3)
а) Метил-(1S,3S,4R,5R)-3-трет-бутилдифенилсилилокси-4-метил-5-ацетоксициклогексан: 2.1.с (R=Me, Р=TBDPS, А=СООСН3)
К перемешиваемому раствору 2’В (R=Me, A=СООСН3) (0,81 г, 3,52 ммоль), имидазола (0,72 г, 10,57 ммоль, 99%) и DMAP (4-диметиламинопиридин; 22 мг) в сухом ДМФ (15 мл) добавляют по каплям TBDPSC1 (1,8 мл, 7,04 ммоль, 98%). Смесь перемешивают в течение 20 час при комнатной температуре. После завершения добавления реакционный раствор выливают в смесь вода-EtOAc (80 мл). Органический слой отделяют и затем водный слой экстрагируют EtOAc (50 мл×3). Объединенные экстракты промывают насыщенным раствором соли (3×10 мл), сушат над МgSO4 и концентрируют, получая при этом остаток. Остаток очищают ВЭЖХ (изооктан/EtOAc 9:1), получая при этом 2.1.с (R=Me, Р=TBDPS, А=СООСН3) (1,34 г, 84%).
[α]D=+9,9 (СНСl3, с=0,65)
1H-ЯМР (500 МГц, CDCl3, м.д.): 7,65-7,35 (10H, м), 4,59 (1Н, дт, J=12,4, 4,5 Гц), 3,72 (1Н, м), 3,62 (3Н, с), 2,26 (1Н, м), 2,09 (1H, м), 2,02 (3Н, с), 1,81 (1H, дт, J=12,6, 4,1 Гц), 1,61 (1H, м), 1,08 (10H, с), 1,05 (3Н, д, J=6,4 Гц).
ИК (пленка): 2954, 1737, 1428, 1364, 1239, 1111, 1037, 822, 740, 702 см-1
MS (м/z): 411 (M+-57), 369, 351, 317, 291, 259, 258, 241, 199, 181, 135, 121, 93, 43 (основной пик).
b) Метил (1S,3S,4R,5R)-3-трет-бутилдифенилсилилокси-4-метил-5-гидроксициклогексанкарбоксилат: 2.2.с (R=Me, Р=TBDPS, A=СООСН3)
К перемешиваемой суспензии 2.1.с (R=Me, P=TBDPS, А=СООСН3) (392 мг, 0,992 ммоль) в 10 мл сухого МеОН при комнатной температуре добавляют сухой К2СО3 (30 мл). Спустя 10 мин добавляют вторую порцию К2СО3 (19 мг) (всего: 49 мг, 0,496 ммоль). Смесь перемешивают в течение 6 час, затем выливают в воду и Et2O (70 мл:50 мл). Органический слой отделяют и водный слой экстрагируют Et2O (50 мл×3) и сушат над MgSO4. Разделение флэш-хроматографией на силикагеле (изооктан/EtOAc 9:1) дает гидроксисоединение 2.2.с (R=Me, Р=TBDPS, А=СООСН3) (344 мг, 98%) в виде бесцветного масла.
ИК (пленка): 3448, 2954, 2858, 1737, 1654, 1472, 1362, 1279, 1240, 1173, 1008, 852, 822, 795, 741, 702, 611 см-1;
1H-ЯМР (500 МГц, СDСl3, м.д.): 7,65 (4Н, м), 7,44 (2Н, м), 7,37 (4Н, м), 3,69 (1Н, м), 3,64 (3Н, с), 3,51 (1Н, м), 2,16 (1Н, м), 2,08 (1Н, м), 1,77 (1Н, дт, J=12,6, 4,1 Гц), 1,69 (2Н, т, J=8,9 Гц), 1,56 (1Н, кв, J=12,4 Гц), 1,37 (1Н, д, J=5,3 Гц), 1,06 (9Н, с), 1,02 (3Н, д, J=7,0 Гц),
MS (м/z): 337 (7), 309 (5), 291 (35), 199 (100), 156 (85), 181 (17), 153 (34), 121 (23), 93 (68), 57 (47).
[α]
с) Метил-(1S,3S,4R,5R)-3-трет-бутилдифенилсилилокси-4-метил-5-тозилоксициклогексанкарбоксилат: 2.3.с (R=Me, Р=TBDPS, L=OTos, A=СООСН3)
К смеси 2.2.с (R=Me, P=TBDMS, A=СООСН3) (279 мг, 0,828 ммоль), п-толуолсульфонилхлорида (323 мг, 1,69 ммоль, 98%), DMAP (5,1 мг, 0,042 ммоль) в 10 мл сухого CH2Cl2 при 0°С (ледяная баня) добавляют Et3N (308 мкл, 2,54 ммоль). Смесь кипятят с обратным холодильником в течение трех дней; затем добавляют п-толуолсульфонилхлорид (320 мг, 1,69 ммоль, 98%), DMAP (5,1 мг, 0,042 ммоль) и Et3N (500 мкл). Образовавшийся раствор кипятят с обратным холодильником в течение двух дней, снова добавляют п-толуолсульфонилхлорид (320 мг, 1,69 ммоль, 98%), DMAP (5,1 мг, 0,042 ммоль) и Et3N (500 мкл) и кипячение с обратным холодильником продолжают в течение еще одного дня. Образовавшуюся смесь разбавляют 20 мл CH2Cl2, промывают насыщенным раствором соли и водную фазу экстрагируют EtOAc (4×50 мл). Объединенные органические фазы сушат над МgSO4. Фильтрование растворителя, концентрирование и флэш-хроматография на силикагеле (изооктан/EtOAc 9:1) дают 2.3.с (R=Me, Р=TBDPS, L=OTos, A=СООСН3) (316 мг, 83,5%) в виде светло-желтого масла.
ИК (пленка): 2954, 2858, 1737, 1365, 1246, 1177, 1106, 955, 704, 667 см-1
1H-ЯМР (500 МГц, CDCl3, м.д.): 7,71 (2Н, д, J=8,3 Гц), 7,58 (4Н, м), 7,43 (2Н, м), 7,37 (4Н, м), 7,31 (2Н, д, J=8,1 Гц), 4,27 (1Н, дт, J=12,0, 4,7 Гц), 3,61 (3Н, с), 3,57 (1Н, ддд, J=10,6, 5,1, 4,6 Гц), 2,45 (3Н, с), 2,17 (1Н, м), 2,01 (1H, м), 1,81 (1Н, дт, J=12,8, 4,2 Гц), 1,74 (1Н, дд, J=12,6 Гц), 1,64 (2Н, м), 1,02 (9Н, с), 0,99 (3Н, д, J=6,6 Гц).
MS (м/z): 523 (25), 507 (1), 463 (1), 409 (3), 353 (94), 307 (20), 293 (18), 213 (30), 199 (32), 135 (35), 91 (100), 77 (30).
[α]
d) (1R,2S,3aS,4aS)-3а-Карбометокси-2-трет-бутилдифенилсилилокси-1-метилбицикло[3.1.0]гексан: I.а.7 (R=Me, P=TBDPS, A=СООСН3)
К раствору тозилата 2.3. с (R=Me, Р=TBDPS, L=OTos, А=СООСН3) (240 мг, 0,415 ммоль) в смеси трет-ВuОН (5 мл) и ТГФ (2,8 мл) при 45°С добавляют по каплям трет-ВuОК (540 мкл, 0,54 ммоль, 1 М раствор в трет-ВuОН). Смесь перемешивают в течение 1,5 час при 45°С, затем выливают в воду и EtOAc (100 мл:50 мл). Органическую фазу отделяют, водный слой экстрагируют EtOAc (3×50 мл) и сушат над MgSO4. Остаток разделяют флэш-хроматографией (изооктан/EtOAc 100:2), получая при этом I.a.7 (R=Me, P=TBDPS, A=СООСН3) (122 мг, 72,0%) в виде бесцветного масла.
ИК (пленка): 2931, 1724, 1428, 1288, 1224, 1147, 1111, 1073, 1015, 933, 822, 740, 702, 609 см-1;
1H-ЯМР (500 МГц, CDCl3, м.д.): 7,61 (14Н, м), 7,42 (2Н, м), 7,36 (4Н, т, J=7,2 Гц), 4,19 (1H, т, J=6,0 Гц), 3,62 (3Н, с), 2,30 (2Н, м), 1,97 (1H, д, J=14,2 Гц), 1,85 (1H, м), 1,64 (1H, т, J=4,6 Гц), 1,35 (1H, дд, J=8,7, 3,9 Гц), 1,09 (9Н, с), 0,99 (3Н, д, J=6,9 Гц),
[α]
ПРИМЕР 28: (1R,2S,3aS,4aS)-3а-гидроксиметил-2-трет-бутилдифенилсилилокси-1-метилбицикло[3.1.0]гексан: 1.а.8 (R=Me, P=TBDPS, A=СН2ОН)
К раствору I.a.7 (R=Me, Р=TBDPS, А=СООСН3) (136 мг, 0,33 ммоль) в ТГФ (15 мл) при 0°С добавляют по каплям LiAlH4 (0,85 мл, 0,85 ммоль, 1 М раствор в ТГФ). Образовавшуюся смесь перемешивают при данной температуре в течение 1,5 час, затем добавляют воду (0,1 мл). Реакционную смесь фильтруют через целит и концентрируют. Остаток очищают флэш-хроматографией (силикагель, изооктан/EtOAc 7:3), получая при этом I.a.8 (R=Me, P=TBDPS, А=СН2OH) (124 мг, 97,8%) в виде бесцветного масла.
ИК (пленка): 3420, 2930, 1427, 1111, 1078, 1014, 701, 611, 504 см-1;
1H-ЯМР (500 МГц, CDCl3, м.д.): 7,63 (4Н, м), 7,42 (2Н, м), 7,36 (4Н, м), 4,21 (1Н, т, J=6,0 Гц), 3,54 (1Н, дд, J=11,4, 5,6 Гц), 3,50 (1Н, дд, J=11,4, 5,6 Гц), 2,29 (1Н, м), 1,95 (1H, ддд, J=13,7, 6,0, 1,4 Гц), 1,23 (1Н, т, J=4,12 Гц), 1,14 (1H, м), 1,08 (9Н, с), 0,99 (3Н, д, J=7,0 Гц), 0,41 (1H, дд, J=8,4, 4,3 Гц), 0,80 (1H, м).
MS (м/z): 381 (M+-1, 1), 363 (22), 337 (1), 323 (22), 305 (5), 285 (9), 267 (24), 245 (63), 225 (19), 199 (83), 179 (19), 153 (29), 139 (51), 107 (100), 91 (58), 79 (72), 57 (86), 41 (78).
[α]
ПРИМЕР 29: (1R,2S,3аS,4аS)-3а-Формил-2-трет-бутилдифенилсилилокси-1-метилбицикло[3.1.0]гексан I.а.9 (R=Me, P=TBDPS, A=СНО)
К раствору (СОСl)2 (18 мкл, 0,21 ммоль) в СН2Сl2 (1,5 мл) при -78°С добавляют по каплям ДМСО (32 мкл, 0,42 ммоль) в СН2Сl2 (100 мкл). Смесь перемешивают при -78°С в течение 20 мин с последующим добавление спирта I.a.8 (R=Me, Р=TBDPS, А=СН2OH) (40 мг, 0,105 ммоль) в СН2Сl2 (1,5 мл).
Образовавшуюся белую суспензию перемешивают при -78°С в течение 20 мин. Затем смеси дают возможность нагреться до комнатной температуры на протяжении 1 час. Реакцию гасят добавлением холодной воды и органическую фазу отделяют, водный слой экстрагируют Et2O (3×50 мл) и сушат над MgSO4. Остаток разделяют ВЭЖХ (изооктан/EtOAc 95:5), получая при этом соединение I.a.9 (R=Me, P=TBDPS, А=СНО) (30 мг, 75%) в виде бесцветного масла.
ИК (пленка): 3420, 2930, 1427, 1111, 1078, 1014, 701, 611, 504 см-1;
1H-ЯМР (500 МГц, CDCl3, м.д.): 8,80 (1Н, с), 7,62 (4Н, м), 7,42 (6Н, м), 4,24 (1Н, т, J=5,8 Гц), 2,32 (1Н, дд, J=14,4, 6,1 Гц), 1,96 (2Н, м), 1,84 (1Н, д, J=14,4 Гц), 1,36 (1Н, м), 1,08 (9Н, с), 1,00 (3Н, д, J=7,0 Гц), 0,91 (1Н, д, J=6,8 Гц).
MS (м/z): 378 (М+,-1), 361 (4), 321 (100), 303 (10), 285 (10), 267 (24), 263 (16), 243 (74), 225 (39), 199 (100), 183 (76), 165 (39), 139 (72), 135 (48), 105 (59), 91 (34), 77 (60), 57 (95), 41 (80).
[α]
ПРИМЕР 30: (1S,2R,3aR,4aR)-3а-карбометокси-2-трет-бутилдифенилсилилокси-1-метилбицикло[3.1.0]гексан I.f.8 (R=Me, P=TBDPS, A=СООСН3)
а) Метил-(1S,3S,4R,5R)-3-тозилокси-4-метил-5-ацетоксициклогексанкарбоксилат 3.4.с (R=Me, L=OTos, A=СООСН3)
Из 2’В (R=Me, Z=Me, A=СООСН3) (1,05 г, 4,57 ммоль), как описано для 2.3. с (R=Me, Р=TBDPS, L=OTos, А=СООСН3). Выход составляет 1,51 г, 89%.
ИК (пленка): 2954, 1736, 1557, 1363, 1242, 1189, 1025, 956, 919, 667 см-1;
1H-ЯМР (500 МГц, CDCl3, м.д.): 7,69 (2Н, д, J=7,2 Гц), 7,38 (2Н, д, J=7,2 Гц), 4,74 (1H, дт, J=12,2, 4,5 Гц), 4,49 (1H, дт, J=12,1, 4,7 Гц), 3,69 (3Н, с), 2,46 (3Н, с), 2,02 (3Н, с), 1,98 (1H, дт, J=12,1, 4,7 Гц), 1,93 (1H, дт, J=12,6, 4,6 Гц), 1,81 (2Н, дд, J=12,8 Гц), 1,63 (2Н, дд, J=12,6 Гц), 0,97 (3Н, д, J=6,9 Гц).
MS (м/z): 384 (М+), 343, 326, 311, 300, 269, 258, 213, 170, 152, 111, 93, 43 (основной пик),
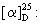 +51,1 (с=0,59, СНСl3).
+51,1 (с=0,59, СНСl3).
b) Метил (1S,3S,4R,5R)-3-тозилокси-4-метил-5-гидроксициклогексанкарбоксилат 3.5.с (R=Me, L=OTos, A=СООСН3)
Из 3.4.с (R=Me, L=OTos, A=СООСН3), как описано для 2.2.с (R=Me, P=TBDPS, A=СООСН3). Выход 90%.
ИК (пленка): 3439, 2988, 1732, 1439, 1353, 1176, 1097, 1021, 945, 667 см-1;
1H-ЯМР (500 МГц, СDСl3, м.д.): 7,78 (2Н, д, J=7,2 Гц), 7,32 (2Н, д, J=7,2 Гц), 4,52 (1H, дт, J=10,8, 4,7 Гц), 3,69 (1H, м), 3,68 (3Н, с), 2,45 (3Н, с), 2,34 (1H, м), 2,25 (1H, м), 1,94 (2Н, м), 1,87 (1H, дт, J=13,2, 4,5 Гц), 1,75 (1H, уш.с), 1,66 (1H, дд, J=11,9 Гц), 0,91 (3Н, д, J=7,0 Гц).
MS (м/z): 340 (М*-2), 295, 278, 247, 220, 194, 170, 155, 127 (основной пик), 91, 87, 57,
[α]
с) Метил (1S,3S,4R,5R)-3-тозилокси-4-метил-5-трет-бутилдифенилсилилоксициклогексанкарбоксилат 3.6.с (R=Me, L=OTos, P=TBDPS, A=СООСН3)
Из 3.5.с (R=Me, L=OTos, A=СООСН3), как описано для 2.1.с (R=Me, P=TBDPS, A=СООСН3). Выход 86%.
ИК (пленка): 2955, 1736, 1598, 1427, 1363, 1177, 1031, 955, 914, 863, 820, 741, 703, 667см-1;
1H-ЯМР (500 МГц, СDСl3, м.д.): 7,69-7,38 (14Н, м), 4,27 (1Н, дт, J=12,1, 4,8 Гц), 3,61 (3Н, с), 3,56 (1H, м), 2,44 (3Н, с), 2,17 (1H, м), 2,02 (1H, м), 1,83 (1H, дт, J=12,5, 4,3 Гц), 1,73 (1H, дд, J=12,7 Гц), 1,63 (2Н, м), 1,01 (9Н, с), 0,99 (3Н, д, J=7,2 Гц),
MS (м/z): 523 (M+-57), 463, 403, 353, 351, 293, 227, 213, 135, 91 (основной пик), 77.
[α]
d) (1S,2R,3aR,4aR)-3a-карбометокси-2-тpeт-бутилдифенилсилилокси-1-метилбицикло[3.1.0]гексан: I.f.8 (R=Me, P=TBDPS, A=СООСН3)
Из 3.6.с (R=Me, L=OTos, P=TBDPS, A=СООСН3), как описано для I.а.7 (R=Me, P=TBDPS, A=СООСН3). Указанное в заголовке соединение получают с выходом 68% в виде бесцветного масла.
ИК (пленка): 2931, 2857, 1724, 1428, 1367, 1288, 1223, 1147, 1111, 1073, 1015, 934, 822, 740, 702, 609 см-1;
1H-ЯМР (500 МГц, СDСl3, м.д.): 7,62-7,31 (10Н, м), 4,19 (1H, т, J=5,9 Гц), 3,59 (3Н, с), 2,31 (2Н, дд, J=13,7, 6,3 Гц), 1,96 (1H, д, J=14,5 Гц), 1,84 (1H, м), 1,64 (1H, т, J=4,6 Гц), 1,35 (1H, дд, J=12,8, 5,0 Гц), 1,25 (1H, уш.с), 1,07 (9Н, с), 0,99 (3Н, д, J=6,9 Гц), 0,91 (1H, м).
MS (м/z): 408 (М+), 351, 323, 273, 213, 199, 153, 121 (основной пик), 77.
[α]
ПРИМЕР 31: (1S,2R,3aR,4aR)-3а-Гидроксиметил-2-трет-бутилдифенилсилилокси-1-метилбицикло[3.1.0]гексан: I.f.9 (R=Me, P=TBDPS, A=CH2OH)
Из I.f.8 (R=Me, P=TBDPS, A=СООСН3), как описано для I.a.8 (R=Me, P=TBDPS, A=CH2OH). Выход 98%.
ИК (пленка): 3324, 2929, 2857, 1654, 1471, 1427, 1363, 1194, 1107, 1078, 1011, 822, 740, 701, 610 см-1;
1H-ЯМР (500 МГц, CDCl3, м.д.): 7,68-7,37 (10Н, м), 4,21 (1H, т, J=6,0 Гц), 3,54 (1H, дд, J=11,4, 6,0 Гц), 3,52 (1H, дд, J=11,4, 6,0 Гц), 2,29 (1H, дд, J=11,3, 8,1 Гц), 1,94 (1H, дд, J=14,6, 5,9 Гц), 1,86 (1H, д, J=13,2 Гц), 1,23 (1H, т, J=4,1 Гц), 1,14 (1H, м), 1,07 (9Н, с), 0,99 (3Н, д, J=6,9 Гц), 0,89 (1H, м), 0,41 (дд, J=8,1, 4,3 Гц).
MS (м/z): 323 (M+-57), 305, 267, 245, 199, 181, 139, 107.
[α]
ПРИМЕР 32: (1S,2R,3aR,4aR)-3a-формил-2-тpeт-бутилдифенилсилилокси-1-метилбицикло[3.1.0]гексан: I.f.10 (R=Me, P=TBDPS, A=CHO)
Из I.f.9 (R=Me, P=TBDPS, A=CH2OH), как описано для I.a.9 (R=Me, P=TBDPS, A=CHO). Выход 28%.
[α]
1H-ЯМР (500 МГц, CDCl3, м.д.): 8,80 (1Н, с), 7,61-7,35 (10Н, м), 4,24 (1Н, т, J=5,8 Гц), 2,31 (2Н, м), 1,96 (1H, м, дд, J=8,1, 5,9 Гц), 1,84 (1H, д, J=14,3 Гц), 1,37 (1H, дд, J=11,0, 7,1 Гц), 1,26 (1H, дд, J=9,7, 4,6 Гц), 1,07 (9Н, с), 1,04 (3Н, т, J=6,9 Гц).
ИК (пленка): 2959, 2857, 1703, 1471, 1391, 1383, 1274, 1215, 1191, 1111, 1109, 1009, 963, 823, 701 см-1;
MS (м/z): 377 (М+-1, 5), 337 (75), 321 (M+-57, 8), 319 (10), 309 (10), 293 (6), 259 (12), 231 (20), 215 (16), 199 (100), 181 (30), 153 (20), 139 (60), 121 (95).
ПРИМЕР 33: (1R,2S,3aS,4aS)-3а-Карбометокси-2-трет-бутилдифенилсилилокси-1-этилбицикло[3.1.0]гексан I.а.10 (R=Et, P=TBDPS, A=СООСН3)
а) Метил (1S,3S,4R,5R)-3-трет-бутилдифенилсилилокси-4-этил-5-ацетоксициклогексан 2.1.d (R=Et, P=TBDPS, A=СООСН3)
Из 2'С (R=Et, Z=Me, A=СООСН3), как описано для 3.4.с. Выход составляет 92%.
[α]
1H-ЯМР (500 МГц, CDCl3, м.д.): 7,45-7,36 (10Н, м), 4,62 (1H, дт, J=12,2, 4,4 Гц), 3,69 (1Н, дт, J=11,5, 4,3 Гц), 3,61 (3Н, с), 2,08 (2Н, тт, J=8,8, 3,9 Гц), 2,01 (3Н, с), 1,85 (2Н, м), 1,60 (3Н, м), 1,51 (1Н, м), 1,06 (9Н, с), 1,02 (3Н, т, J=7,5 Гц).
ИК (пленка): 2954, 2848, 1739, 1462, 1428, 1364, 1238, 1194, 1178, 1110, 1034, 986, 812, 740, 702 см-1.
MS (м/z): 482 (М+, 2), 468 (5), 451 (7), 425 (М+ -57), 391 (1), 365 (80), 351 (25), 305 (15), 273 (20), 241 (100), 213 (88), 199 (92), 153 (56), 135 (75), 107 (85).
b) Метил (1S,3S,4R,5R)-3-трет-бутилдифенилсилилокси-4-этил-5-гидроксициклогексанкарбоксилат 2.2.d (R=Me, P=TBDPS, A=СООСН3)
Из 2.1.d (R=Et, P=TBDPS, A=СООСН3), как описано для 2.2. с (R=Me, P=TBDPS, A=СООСН3). Выход 98%.
[α]
1H-ЯМР (500 МГц, CDCl3, м.д.): 7,68 (10Н, м), 3,68 (1Н, дт, J=8,2, 4,2 Гц), 3,62 (3Н, с), 3,57 (1Н, дт, J=11,1, 4,6 Гц), 2,07 (1Н, м), 1,85 (1H, т, J=4,1 Гц), 1,77 (1H, дт, J=8,6, 4,0 Гц), 1,71 (1H, тт, J=11,0, 4,0 Гц), 1,64 (2Н, т, J=9,0), 1,59 (1H, overlap), 1,52 (1H, уш.с), 1,45 (1H, м), 1,06 (9Н, с), 1,05 (3Н, т, J=7,5 Гц).
ИК (пленка): 3435, 2995, 2858, 1736, 1589, 1460, 1427, 1363, 1271, 1236, 1172, 1111, 1050, 915, 875, 823, 740, 702, 647 см-1.
MS (м/z): 383 (M+-57, 14), 351 (16), 323 (18), 305 (90), 273 (18), 253 (10), 227 (50), 199 (100), 183 (70), 153 (80), 107 (98).
с) Метил (1S,3S,4R,5R)-3-трет-бутилдифенилсилилокси-4-этил-5-тозилоксициклогексанкарбоксилат: 2.3.d (R=Et, P=TBDPS, L=OTos, A=СООСН3)
Из 2.2.d (R=Et, P=TBDPS, A=СООСН3), как описано для 2.3.с (R=Me, P=TBDPS, L=OTos, A=СООСН3). Выход составляет 82%.
[α]
1H-ЯМР (500 МГц, CDCl3, м.д.): 7,72-7,30 (14Н, м), 4,28 (1Н, дт, J=12,5, 4,5 Гц), 3,59 (3Н, с), 3,55 (1Н, дт, J=11,4, 4,3 Гц), 2,45 (3Н, с), 1,96 (1H, тт, J=8,5, 4,1 Гц), 1,91 (1H, т, J=4,2 Гц), 1,84 (1H, дт, J=8,5, 4,1 Гц), 1,77 (1H, м), 1,73 (1H, м), 1,53 (2Н, м), 1,47 (1H, м), 1,02 (9Н, с), 0,97 (3Н, т, J=7,5 Гц).
ИК (пленка): 2957, 2858, 1738, 1598, 1487, 1462, 1428, 1360, 1277, 1189, 1111, 1030, 953, 885, 822, 741, 704 см-1.
MS (м/z): 357 (M+- 57, 45), 353 (100), 293 (22), 227 (5), 199 (48), 135 (70).
d) (1R,2S,3aS,4aS)-3a-карбометокси-2-трет-бутилдифенилсилилокси-1-этилбицикло[3.1.0]гексан: I.а.10 (R=Et, P=TBDPS, A=СООСН3)
Из 2.3.d (R=Et, P=TBDPS, L=OTos, A=СООСН3), как описано для I.а.7 (R=Me, P=TBDPS, A=СООСН3). Выход 71%.
[α]
1H-ЯМР (500 МГц, CDCl3, м.д.): 7,63-7,35 (10Н, м), 4,18 (1H, т, J=5,9 Гц), 3,61 (3Н, с), 2,26 (1H, м), 2,06 (1H, м), 1,98 (1H, д, J=14,3 Гц), 1,92 (1H, м), 1,67 (1Н, т, J=4,3 Гц), 1,48 (2Н, м), 1,36 (1H, дд, J=8,7, 3,9 Гц), 1,05 (9Н, с), 0,89 (3Н, J=7,4 Гц).
ИК (пленка): 2958, 1723, 1427, 1366, 1298, 1224, 1148, 1111, 1064, 1028, 926, 821, 740, 610, 507 см-1.
MS (м/z): 422 (М+, 2), 391 (4), 365 (М+-57, 40), 337 (8), 287 (12), 259 (10), 225 (8), 199 (65), 135 (100), 105 (38).
ПРИМЕР 34: (1S,2R,3aR,4aR)-3а-Карбометокси-2-трет-бутилдифенилсилилокси-1-этилбицикло[3.1.0]гексан: I.f.11 (R=Et, P=TBDPS, A=СООСН3)
а) Метил (1S,3S,4R,5R)-3-мезилокси-4-этил-5-ацетоксициклогексанкарбоксилат 3.4.d (R=Et, L=OMs, A=СООСН3)
К раствору моноацетата 2’С (А=СООСН3, R=Et, Z=Me) (0,1 г, 0,41 ммоль), Et3N (0,30 мл, 2,10 ммоль) в 5 мл СН2Сl2 добавляют по каплям MsCl (96 мкл, 1,23 ммоль) при комнатной температуре. Образовавшуюся смесь перемешивают при комнатной температуре в течение 10 час. Реакционный раствор выливают в смесь лед-вода, экстрагируют AcOEt (3×50 мл). Объединенные экстракты промывают насыщенным раствором соли (3×5 мл), сушат над MgSO4 и концентрируют с получением остатка. Остаток очищают ВЭЖХ с элюированием смесью изооктан/EtOAc (90:10), получая при этом мезилат 3.4.d (А=СООСН3, R=Et, L=OMs) (0,11 г, 85%).
ИК (пленка): 2954, 1737, 1641, 1357, 1241, 1175, 952 см-1
1H-ЯМР (500 МГц, СDСl3, м.д.): 4,87 (1Н, дт, J=10,9, 4,2 Гц), 4,75 (1Н, дт, J=4,5, 10,9 Гц), 3,69 (3Н, с), 3,00 (3Н, с), 2,48 (1Н, м), 2,23 (1Н, уш.с), 2,13 (1Н, дт, J=4,2, 11,8 Гц), 2,05 (3Н, с), 2,01 (1Н, д, J=8,8 Гц), 1,96 (1Н, дт, J=13,3, 4,5 Гц), 1,83 (1Н, м), 1,58 (2Н, м), 1,01 (3Н, с).
MS (м/z): 322 (М+), 309, 291, 248, 227, 199, 166, 135, 107, 78, 43 (основной пик)
[α]
b) Метил (1S,3S,4R,5R)-3-мезилокси-4-этил-5-гидроксициклогексанкарбоксилат 3.5.d (A=СООСН3, R=Et, L=OMs)
Из 3.4.d (R=Et, L=OMs, A=СООСН3), как описано для 2.5.a (R=H, L=OTos, A=СООСН3). Выход 90%.
ИК (пленка): 3439, 2957, 1729, 1438, 1351, 1277, 1174, 944, 877, 838, 757, 530 см-1
1H-ЯМР (500 МГц, СDСl3, м.д.): 4,87 (1Н, т, J=3,1 Гц), 3,91 (1Н, т, J=2,9 Гц), 3,74 (3Н, с), 3,00 (3Н, с), 2,69 (1Н, уш.с), 2,44 (1H, уш.с), 2,17 (1Н, уш.с), 2,00 (2Н, м), 1,84 (2Н, дт, J=14,3, 4,7 Гц), 1,71 (2Н, м), 1,03 (3Н, т, J=7,4 Гц).
MS (м/z): 281 (M++1), 263, 249, 236, 200, 184, 166, 141, 125, 111, 87, 78, 55 (основной пик),
[α]
с) Метил (1S,3S,4R,5R)-3-мезилокси-4-этил-5-трет-бутилдифенилсилилоксициклогексанкарбоксилат: 3.6.d (R=Et, L=OMs, P=TBDPS, A=СООСН3)
Из 3.5.d (R=Et, L=OMs, A=СООСН3), как описано для 2.8. a (R=H, L=OTos, P=TBDPS, A=СООСН3). Выход составляет 86%.
ИК (пленка): 2957, 2857, 1738, 1588, 1462, 1427, 1358, 1276, 1177, 1111, 1030, 949, 885, 823, 741, 703, 614 см-1
1H-ЯМР (500 МГц, СDСl3, м.д.): 7,65-7,35 (10Н, м), 4,44 (1H, дт, J=12,2, 4,6 Гц), 3,67 (1Н, дт, J=11,6, 4,2 Гц), 3,63 (3Н, с), 2,79 (3Н, с), 2,09 (1H, дт, J=12,9, 3,9 Гц), 2,06 (1H, м), 2,02 (2Н, м), 1,85 (1H, м), 1,79 (1H, дд, J=12,8 Гц), 1,65 (1H, дт, J=13,1, 4,0 Гц), 1,49 (1H, м), 1,06 (9Н, с), 1,04 (3Н, т, J=7,5 Гц).
MS (м/z): 461 (М+ -57), 401, 365, 351, 305, 277, 231, 199, 167, 135, 107 (основной пик).
[α]
d) (1S,2R,3aR,4aR)-3а-Карбометокси-2-трет-бутилдифенилсилилокси-1-этилбицикло[3.1.0]гексан I.f.11 (R=Et, P=TBDPS, A=СООСН3)
Из 3.6.d (R=Et, L=OMs, P=TBDPS, A=СООСН3), как описано для I.а.7 (R=Me, P=TBDPS, A=СООСН3). Выход 71%.
ИК (пленка): 2958, 1723, 1427, 1366, 1298, 1224, 1148, 1111, 1064, 1028, 926, 821, 740, 610, 507см-1.
1H-ЯМР (500 МГц, CDCl3, м.д.): 7,63-7,35 (10Н, м), 4,18 (1H, т, J=5,9 Гц), 3,61 (3Н, с), 2,26 (1H, м), 2,06 (1H, м), 1,98 (1H, д, J=14,3 Гц), 1,92 (1H, м), 1,67 (1H, т, J=4,3 Гц), 1,48 (2Н, м), 1,36 (1H, дд, J=8,7, 3,9 Гц), 1,05 (9Н, с), 0,89 (3Н, J=7,4 Гц).
MS (м/z): 422 (М+, 2), 391 (4), 365 (М+ -57, 40), 337 (8), 287 (12), 259 (10), 225 (8), 199 (65), 135 (100), 105 (38).
[α]
ПРИМЕР 35: (1R,2S,3aR,4aR)-3а-Карбометокси-2-трет-бутилдифенилсилилокси-1-метилбицикло[3.1.0]гексан I.e.1 (R=Me, P=TBDPS, А=СООСН3)
а) Метил (1S,3S,4R,5S)-3-трет-бутилдифенилсилилокси-4-метил-5-гидроксициклогексанкарбоксилат: 3.2.с (R=Me, Р=TBDPS, А=СООСН3)
К раствору 2.2.с (R=Me, P=TBDPS, А=СООСН3) (167 мг, 0,392 ммоль), пиколиновой кислоты (257 мг, 2,092 ммоль) и трифенилфосфина (548 мг, 2,092 ммоль) в ТГФ при -38°С добавляют по каплям DIAD (диизопропилазодикарбоксилат; 412 мкл, 2,092 ммоль) в течение 4 мин. Реакционный раствор перемешивают в течение 4,5 час и нагревают до комнатной температуры в течение ночи. Смесь выливают в воду и EtOAc 50 мл:50 мл. Органическую фазу отделяют и водный слой экстрагируют EtOAc (3×50 мл) и сушат над МgSO4. Остаток разделяют ВЭЖХ (изооктан/EtOAc 98:2), получая при этом (4S,6S)-4-карбометокси-6-трет-бутилдифенилсилилокси-1-метилциклогексен (142 мг, 88,8%) в виде бесцветного масла.
ИК (пленка): 2953, 2856, 1738, 1428, 1247, 1168, 1111, 1068, 999, 893, 820, 741, 702, 614 см-1
1H-ЯМР (500 МГц, СDСl3, м.д.): 7,71 (4Н, м), 7,43 (2Н, м), 7,38 (4Н, м), 5,39 (1H, м), 4,25 (1H, уш.с), 3,60 (3Н, с), 2,39 (1H, м), 2,19 (1H, м), 2,13 (1H, м), 2,04 (1H, м), 1,75 (1H, дд, J=22,3, 12,5 Гц), 1,66 (3Н, уш.с), 1,08 (9Н, с).
MS (м/z): 387 (1), 361 (1), 351 (75), 319 (5), 273 (5), 273 (5), 213 (100), 183 (70), 137 (65), 105 (30), 77 (85).
[α]
К перемешиваемому раствору указанного циклогексена (110 мг, 0,27 ммоль) в 2 мл диглима (диметиловый эфир диэтиленгликоля) при 0°С добавляют по каплям раствор комплекса боран-ТГФ (1,0 М, 325 мкл, 0,325 ммоль, 1,5 экв.). Образовавшийся раствор перемешивают в течение 4 час при 0°С. ТГФ удаляют и добавляют ТАО (N-оксид триметиламина, 90 мг, 0,81 ммоль). Смесь нагревают и кипятят с обратным холодильником на протяжении 2 час. Образовавшуюся смесь охлаждают до комнатной температуры, экстрагируют EtOAc (4×40 мл) и сушат над MgSO4. Остаток разделяют флэш-хроматографией на диоксиде кремния, затем очищают ВЭЖХ (циклогексан/EtOAc 9:1), получая при этом соединение 3.2.с (R=Me, Р=TBDPS, А=СООСН3) (46 г, 40,5%) в виде бесцветного масла.
ИК (пленка, см-1): 3453, 2954, 2858, 1737, 1462, 1428, 1379, 1272, 1195, 1111, 1032, 934, 823, 702.
1H-ЯМР (500 МГц, CDCl3, м.д.): 7,66 (4Н, м), 7,42 (2Н, м), 7,38 (4Н, м), 4,17 (1H, дт, J=10,7, 4,7 Гц), 3,88 (1H, уш.с), 3,62 (3Н, с), 2,61 (1H, м), 1,85-1,65 (5Н, м), 1,06 (9Н, с), 0,96 (3Н, д, J=7,2 Гц).
[α]
b) Метил (1S,3S,4R,5S)-3-трет-бутилдифенилсилилокси-5-мезилокси-4-метилциклогексанкарбоксилат 3.3.с (R=Me, L=OMs, P=TBDPS, А=СООСН3)
Из 3.2.с (R=Me, P=TBDPS, A=СООСН3), как описано для 3.4.d (R=Et, L=OMs, A=СООСН3). Выход 84,5%.
ИК (пленка): 2952, 1732, 1470, 1427, 1357, 1275, 1177, 1112, 1029, 929, 904 см-1.
1H-ЯМР (500 МГц, СDСl3, м.д.): 7,65 (4Н, т, J=8,0 Гц), 7,40 (6Н, м), 4,80 (1Н, уш.с), 4,06 (1H, м), 3,65 (3Н, с), 2,70 (3Н, с), 2,58 (1H, м), 2,04 (1H, уш.с), 1,98-1,76 (4Н, м), 1,06 (9Н, с), 1,03 (3Н, д, J=7,2 Гц).
[α]
с) (1R,2S,3aR,4aR)-3а-Карбометокси-2-трет-бутилдифенилсилилокси-1-метилбицикло[3.1.0]гексан I.е.1 (R=Me, P=TBDPS, A=СООСН3)
Из 3.3. с (R=Me, L=OMs, P=TBDPS, А=СООСН3), как описано для I.a.7 (R=Me, P=TBDPS, A=СООСН3). Выход 68,8%.
ИК (пленка): 2951, 1725, 1428, 1259, 1238, 1111, 880, 814, 742, 702 см-1.
1H-ЯМР (500 МГц, CDCl3, м.д.): 7,63 (4Н, м), 7,45-7,35 (6Н, м), 3,84 (1H, м), 3,64 (3Н, с), 2,23 (1H, м), 2,02 (1H, м), 1,93 (1H, м), 1,60 (1H, м), 1,17 (1H, м), 1,04 (12Н, уш.с), 0,56 (1H, м).
ПРИМЕР 36: (2R,3aS,4aS)-2-метил-2-гидрокси-3а-гидроксиметилбицикло[3.1.0]гексан: I.i.1 (A – CH2OH, R1=Me: схема 4)
а) (2R,3аS,4аS)-2-гидрокси-3а-[(бензоилокси)метил]бицикло[3.1.0]гексан: 4.1
К раствору I.a.5 (R=Н, Р=TBDPS, А=СН2OH) (4,451 г, 12,15 ммоль), DMAP (250 мг, 2,27 ммоль) и Et3N (16,5 мл, 121,1 ммоль) в CH2Cl2 (50 мл) при 0°С добавляют по каплям бензоилхлорид. Смесь перемешивают в течение 22 час при комнатной температуре, раствор разбавляют 70 мл CH2Cl2. Органическую фазу отделяют, промывают насыщенным раствором соли (3×100 мл) и сушат над MgSO4. Остаток очищают флэш-хроматографией (силикагель, изооктан/EtOAc 100:2,5), получая при этом соответствующий бензоат (5,51 г, 96,5%) в виде бесцветного масла. К раствору указанного бензоата (2,22 г, 4,72 ммоль) в ТГФ (40 мл) добавляют TBAF (14 мл, 14 ммоль, 1 М в ТГФ) и образовавшийся раствор перемешивают при комнатной температуре в течение 14 час.Растворитель выпаривают в вакууме. Остаток пропускают через короткую колонку с силикагелем (изооктан/EtOAc 7:3). Сырой продукт очищают ВЭЖХ (изооктан/EtOAc 7:3), получая при этом соединение 4.1 (1,03 г, 94,0%) в виде бесцветного масла.
ИК (пленка): 3413,8, 2928,3, 1714,1, 1602,1, 1452,1, 1277,5, 1115,1, 1070,0, 958,3, 808,3, 711,5 см-1
1H-ЯМР (500 МГц, CDCl3, м.д.): 8,06 (2Н, д, J=7,8 Гц), 7,56 (1Н, т, J=7,3 Гц), 7,45 (1H, т, J=7,7 Гц), 4,48 (1H, м), 4,34 (2Н, дд, J=19,4, 11,5 Гц), 2,23 (2Н, м), 1,94 (1Н, д, J=14,0 Гц), 1,78 (1Н, д, J=14,2 Гц), 1,38 (1H, ддд, J=8,3, 4,3, 4,3 Гц), 1,30 (1H, уш.с), 1,06 (1H, т, J=4,4 Гц), 0,75 (1H, м).
MS (м/z): 232 (M+, 1), 214 (1), 199 (1), 189 (1), 161 (1), 149 (1), 127 (1), 110 (13), 105 (100), 77 (43), 67 (14).
[α]
b) (3aS,4aS)-3а-[(Бензоилокси)метил]бицикло -[3.1.0]гексан-2-он: 4.2
К раствору спирта 4.1 (209 мг, 0,904 ммоль) в СН2Сl2 (30 мл) добавляют дихромат пиридиния (РDС, 1,072 г, 4,97 ммоль) и смесь перемешивают при комнатной температуре в течение 16 час. Образовавшийся раствор непосредственно очищают флэш-хроматографией (колонка с силикагелем 3×5 см) (изооктан/EtOAc от 9:1 до 8:2), получая при этом 4.2 (197 мг, 95%) в виде бесцветного масла.
ИК (пленка): 1745,0, 1715,9, 1451,2, 1355,4, 1272,1, 1155,7, 1111,3, 1069,9, 711,0 см-1.
1H-ЯМР (500 МГц, СDСl3, м.д.): 8,05 (2Н, д, J=8,9 Гц), 7,58 (1H, т, J=7,4 Гц), 7,46 (2Н, т, J=7,6 Гц), 4,41 (2Н, дд, J=29,6, 12,7 Гц), 2,75 (2Н, м), 2,41 (1H, д, J=9,0 Гц), 2,28 (1H, д, J=9,3 Гц), 1,68 (1H, м), 1,10 (1H, т, J=7,0 Гц), 0,37 (1H, т, J=5,1 Гц).
MS (м/z): 230 (М+, 1), 212 (1), 202 (6,9), 183 (1), 161 (1), 149 (1), 125 (1), 106 (13), 105 (100), 77 (46), 51 (20).
[α]
с) (2R,3aS,4aS)-2-Метил-2-гидрокси-3а-гидроксиметилбицикло[3.1.0]гексан I.i.1 (R1=Me, A=CH2OH)
К раствору кетона 4.2 (120 мг, 0,52 ммоль) в ТГФ (4 мл) добавляют по каплям раствор МеMgBr в Et2O (1,5 мл, 3,0 М) в течение 5 мин при -78°С. Образовавшуюся смесь перемешивают в течение 6 час при данной температуре, затем дают ей возможность нагреться до комнатной температуры в течение ночи. Для гашения реакции добавляют насыщенный водный ледяной раствор NH4Cl (0,2 мл). Смесь пропускают через короткую колонку с силикагелем, включающим МgSO4. Остаток разделяют ВЭЖХ (изооктан/EtOAc 5:5), получая при этом соединение I.i.1 (R1=Me, A=CH2OH) (55 мг, 74%) в виде белого твердого вещества.
ИК (пленка): 3288,4, 2931,3, 2858,5, 1459,1, 1370,2, 1260,7, 1183,9, 1135,7, 1111,5, 1064,0, 1016,0, 922,6 см-1.
1H-ЯМР (500 МГц, СDСl3, м.д.): 3,58 (2Н, с), 2,08 (1H, д, J=13,7 Гц), 2,03 (1H, дд, J=13,8, 5,0 Гц), 1,88 (1H, д, J=13,7 Гц), 1,76 (1H, д, J=13,8 Гц), 1,34 (3Н, с), 1,29 (1H, уш.с), 1,21 (1H, м), 1,14 (1H, т, J=4,3 Гц), 1,11 (1H, с), 0,57 (1H, дд, J=8,4, 4,5 Гц).
MS (м/z): 124 (2), 109 (6), 93 (12), 81 (12), 71 (10), 67 (10), 55 (11), 43 (100),
[α]
ПРИМЕР 37: (2R,3aS,4aS)-2-метил-2-гидрокси-3а-формилбицикло [3.1.0] гексан I.i.2 (R1=Me, A=СНО)
К раствору комплекса SO3-пиридин (2,5 экв., 140 мг) в смеси ДМСО:СН2Сl2 (500 мкл:250 мкл) и Et3N (2,5 экв., 120 мкл) добавляют при -15°С раствор I.i.1 (R1=Me, A=СН2ОН) (1 экв., 50 мг, 35 мкмоль) в ДМСО:СН2Сl2 (500 мкл:250 мкл) и Et3N (2,5 экв., 120 мкл). После перемешивания в течение 1 час при температуре от -10°С до -5°С смесь выливают в смесь Et2O: насыщенный раствор соли. Органический слой сушат (MgSO4). После выпаривания растворителя остаток очищают колоночной хроматографией (от Et2O/изоктан 1:1 до Et2O:изооктан:метанол:CH2Cl2 100:100:1:20), получая при этом l.i.2 (R1=Me, A=СНО) в виде бесцветного масла (37 мг, 75%).
ИК (пленка): 3441, 2929, 1694, 1435, 1258, 1105, 1049, 963, 893 см-1
1H-ЯМР (500 МГц, СDСl3, м.д.): 8,81 (1Н, с), 2,47 (1H, д, J=14 Гц), 2,03 (2Н, м), 1,91 (1H, т, J=5 Гц), 1,88 (1H, д, J=13 Гц), 1,81 (1H, д, J=14 Гц), 1,49 (1H, ддт, J=9,5, 1 Гц), 1,36 (3Н, с).
[α]
ПРИМЕР 38: (2R, 3aS,4aS)-2-этил-2-гидрокси-3а-гидроксиметилбицикло[3.1.0]гексан: I.i.3 (A=СН2OH, R1=Et) (схема 4)
Из 4.2, как описано для I.i.1 (R1=Me, A=CH2OH). Выход 66,6%.
ИК (пленка): 3275,4, 2921,3, 2858,5, 1431,8, 1284,3, 1237,3, 1122,3, 1068,0, 1027,8, 930,7 см-1
1H-ЯМР (500 МГц, СDСl3, м.д.): 3,59 (2Н, д, J=5,6 Гц), 2,03 (1Н, д, J=13,6 Гц), 1,99 (1Н, дд, J=13,9, 4,9 Гц), 1,83 (1Н, д, J=13,7 Гц), 1,72 (1Н, д, J=13,8 Гц), 1,55 (2Н, кв, J=6,4), 1,23 (2Н, м), 1,16 (1Н, т, J=4,2 Гц), 1,04 (1Н, с), 0,92 (3Н, т, 7,4 Гц), 0,54 (1Н, дд, J=8,4, 4,3 Гц),
MS (м/z): 138 (2), 123 (4), 109 (12,9), 97 (2), 91 (6), 79 (20), 72 (6), 67 (12,9), 57 (100), 43 (8).
[α]
ПРИМЕР 39: (2R,3аS,4аS)-2-Этил-2-гидрокси-3а-формилбицикло[3.1.0]гексан: I.i.4 (A=СНО, R1=Et)
Из I.i.3 (R1=Et, A=CH2OH), как описано для I.i.2 (R1=Me, A=СНО). Выход 50%.
ИК (пленка): 3418, 2966, 1689, 1114, 1057, 982, 632 см-1;
1H-ЯМР (500 МГц, CDCl3, м.д.): 8,80 (1Н, с), 2,09 (2Н, м), 1,92 (1Н, т, J=5,0 Гц), 1,83 (1Н, д, J=13,3 Гц), 1,69 (1Н, д, J=10,0 Гц), 1,57 (2Н, м), 1,49 (1H, м), 1,15 (1Н, с), 0,93 (3Н, т, J=7,4 Гц).
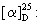 -68,1 (с=0,30, СНСl3).
-68,1 (с=0,30, СНСl3).
ПРИМЕР 40: (2R,3aS,4aS)-2-[(трет-бутилдифенилсилилокси)метил]-3а-гидроксиметилбицикло-[3.1.0]гексан I.j.1 (A=CH2OH, Р=TBDPS) (схема 4)
а) (3аS,4аS)-2-Метилен-3а-[(бензоилокси)метил]бицикло-[3.1.0]гексан: 4.3
К перемешиваемой суспензии цинковой пыли (5,75 г) в CH2Br2 (2,02 мл) и ТГФ (40 мл) при -78°С по каплям добавляют TiCl4 в течение 10 мин. Смеси дают возможность нагреться до 8°С и перемешивают при данной температуре в течение 72 час, получая при этом густую серую суспензию активного соединения (реагент Ломбардо).
К раствору кетона 4.2 (98 мг, 0,426 ммоль) с CH2Cl2 (8 мл) добавляют по частям реагент Ломбардо при комнатной температуре до исчезновения кетона (ТСХ). Реакционную смесь разбавляют Et2O (40 мл), добавляют насыщенный NаНСО3 и перемешивание продолжают в течение 30 мин, получая при этом две прозрачные фазы. Водную фазу экстрагируют Et2O (3×25 мл) и СН2Сl2 (2×25 мл). Объединенные органические фазы сушат MgSO4. Остаток очищают флэш-хроматографией (силикагель, пентан/простой эфир 100:1), получая при этом соединение 4.3 (66 мг, 67,9%) в виде бесцветного масла.
ИК (пленка): 2925,8, 1715,6, 1451,5, 1269,7, 1111,0, 1069,0, 1026,1, 741,9, 710,7 см-1.
1H-ЯМР (500 МГц, СDСl3, м.д.): 8,07 (2Н, д, J=7,3 Гц), 7,56 (1Н, т, J=7,4 Гц), 7,45 (2Н, т, J=7,7 Гц), 4,81 (2Н, д, J=12,4 Гц), 4,38 (2Н, с), 2,68 (2Н, м), 2,43 (1Н, д, J=15,4 Гц), 2,28 (1Н, д, J=15,6 Гц), 1,36 (1Н, м), 0,68 (1Н, т, J=6,5 Гц), 0,39 (1Н, т, J=4,5 Гц).
MS (м/z): 228 (М+, 1), 213 (1), 199 (1), 181 (2), 169 (1), 141 (1), 123 (5), 105 (100), 91 (88), 77 (57), 65 (7), 51 (20).
[α]
b) (2R,3aS,4aS)-2-[(трет-Бутилдифенилсилилокси)метил]-3а-гидроксиметилбицикло[3.1.0]гексан I.j.1 (A=СН2OH, Р=TBDPS) и (2S,3aS,4aS)-2-[(трет-бутилдифенилсилилокси)-метил]-3а-гидроксиметилбицикло[3.1.0]гексан: I.k.1 (A=СН2OH, Р=TBDPS)
К раствору алкена 4.3 (49 мг, 0,21 ммоль) в ТГФ (6 мл) при -5°С добавляют ВН3. ТГФ и реакционную смесь перемешивают при данной температуре в течение 3,5 час.Реакцию гасят насыщенным водным NаНСО3 (3,9 мл) и H2O2 (30%) (3,9 мл). Реакционному раствору дают возможность нагреться до комнатной температуры и перемешивают в течение 1,5 час. Затем раствор экстрагируют Et2O (2×20 мл) и EtOAc (2×20 мл). Объединенные органические слои сушат над MgSO4 и концентрируют. Остаток пропускают через короткую колонку с силикагелем, сырой продукт очищают ВЭЖХ (изооктан/EtOAc 7:3), получая при этом смесь эпимерных гидроксилированных продуктов (отношение 2R:2S как 75:25, 39 мг, 73,7%) в виде бесцветного масла. К раствору указанной смеси (35 мг, 0,142 ммоль) имидазола (49 мг, 0,720 ммоль, 5 экв.) и DMAP (7,8 мг, 0,064 ммоль, 0,45 экв.) в ДМФ (3 мл) добавляют по каплям TBDPSC1 при 0°C; образовавшуюся смесь перемешивают при комнатной температуре в течение 19 час. Реакционный раствор выливают в смесь Et2O/вода (50 мл/40 мл) и водную фазу экстрагируют Et2O (3×20 мл) и EtOAc (2×20 мл). Объединенные органические слои сушат над MgSO4 и концентрируют. Остаток очищают флэш-хроматографией (силикагель, изооктан/EtOAc 100:2), получая при этом соответствующие силиловые простые эфиры (56 мг, 81,3%) в виде бесцветного масла.
К перемешиваемому раствору указанной смеси (50 мг, 0,106 ммоль) в МеОН (6 мл, включая 0,2 мл Н2O) при комнатной температуре добавляют К2СО3 (50 мг, 0,505 ммоль). Смесь перемешивают в течение 20 час при комнатной температуре, твердое вещество отфильтровывают, фильтрат разбавляют Et2O (50 мл), промывают насыщенным раствором соли (2×20 мл) и сушат над МgSO4 и растворитель выпаривают. Остаток пропускают через короткую колонку с силикагелем и очистка ВЭЖХ (изооктан/EtOAc 75:25) дает соединения I.j.1 (A=CH2OH, Р=TBDPS) (24 мг, 61,8%) и I.k.1 (А=CH2OH, Р=TBDPS) (8 мг, 20,4%) в виде бесцветных масел.
MS (м/z): 379 (M+-1, 1), 305 (1), 275 (2), 229 (2), 199 (47), 181 (7), 107 (100), 79 (53).
Соединение I.j.1 (A=CH2OH, Р=TBDPS)
ИК(пленка): 3342,5, 2930,3, 2858,0, 1471,8, 1427,7, 1389,8, 1111,9, 1008,2, 823,7, 739,7, 701,6 см-1
1H-ЯМР (500 МГц, СDСl3, м.д.): 7,64 (4Н, д, J=7,8 Гц), 7,45-7,35 (6Н, м), 3,54 (2Н, дд, J=14,4, 11,2 Гц), 3,41 (2Н, д, J=7,4 Гц), 2,61 (1Н, м), 2,19-2,09 (2Н, м), 1,64 (1Н, дд, J=13,5, 4,8 Гц), 1,47 (1Н, дд, J=13,6, 4,6 Гц), 1,26 (1Н, уш.с), 1,18 (1Н, дт, J=8,6, 4,3, 4,3 Гц), 1,02 (9Н, с), 0,62 (1Н, дд, J=8,4, 4,7 Гц), 0,35 (1Н, т, J=4,4 Гц).
[α]
Соединение I.k.l (A=CH2OH, Р=TBDPS)
ИК (пленка): 3342,5, 2929,9, 2856,7, 1471,6, 1427,7, 1388,8, 1111,9, 1086,1, 1031,5, 1008,5, 823,7, 739,3, 701,5 см-1.
1H-ЯМР (500 МГц, CDCl3, м.д.): 7,64 (4Н, д, J=6,7 Гц), 7,39 (6Н, м), 3,64 (1H, д, J=11,2 Гц), 3,57 (3Н, д, J=7,8 Гц), 1,97-1,87 (2Н, м), 1,80 (1H, дд, J=12,3, 7,0 Гц), 1,56 (2Н, м), 1,22 (1H, м), 1,15 (1H, ддд, J=8,3, 4,1, 4,1 Гц), 1,02 (9Н, с), 0,52 (1H, т, J=4,3 Гц), 0,41 (1H, дд, J=8,0, 5,0 Гц).
[α]
ПРИМЕР 41: (2R,3aS,4aS)-2-[(трет-бутилдифенилсилилокси)метил]-3а-формилбицикло[3.1.0]гексан I.j.2 (А=СНО, Р=TBDPS) (схема 4)
К раствору (СОСl)2 (30 мкл, 0,344 ммоль) в СН2Сl2 (1 мл) при -78°С добавляют по каплям ДМСО (36,6 мкл, 0,515 ммоль) в CH2Cl2 (100 мкл). Смесь перемешивают при -78°С в течение 20 мин с последующим добавлением I.j.1 (A=CH2OH, Р=TBDPS) (14 мг, 0,37 ммоль) в СН2Сl2 (0,5 мл). Образовавшуюся белую суспензию перемешивают при -78°С в течение 20 мин, по каплям добавляют Et3N (0,2 мл, 1,435 ммоль) и перемешивание продолжают в течение 20 мин. Затем смеси дают возможность нагреться до комнатной температуры на протяжении 1 час. Реакцию гасят добавлением холодной воды и органическую фазу отделяют, водный слой экстрагируют Et2O (3×50 мл) и сушат над MgSO4. Остаток разделяют ВЭЖХ (гексан/EtOAc 95:5), получая при этом соединение I.j.2 (А=СНО, Р=TBDPS) (4 мг, 28,7%) в виде бесцветного масла.
ИК (пленка): 2931, 2858, 1699, 1428, 1112, 824, 740, 613 см-1
1H-ЯМР (500 МГц, CDCl3, м.д.): 8,83 (1Н, с), 7,63 (4Н, д, J=7,4 Гц), 7,68-7,35 (6Н, м), 3,43 (2Н, д, J=5,5 Гц), 2,68 (2Н, м), 2,18 (1Н, м), 2,02 (1H, м), 1,59 (1Н, м), 1,51 (1H, д, J=8,0 Гц), 1,25 (1H, уш.с), 1,02 (9Н, с), 0,90 (1H, м).
MS (м/z): 337 (4), 307 (2), 293 (4), 259 (2), 217 (9), 199 (54), 183 (20), 135 (24), 105 (30), 93 (100).
[α]
ПРИМЕР 42: (2S,3aS,4aS)-2-[(трет-бутилдифенилсилилокси) метил]-3а-формилбицикло[3.1.0]гексан I.k.2 (A=СНО, Р=TBDPS) (схема 4)
Из I.k.l (А=СН2OH, Р=TBDPS), как описано для I.j.2 (А=CH2OH, Р=TBDPS). Выход 92,8%.
ИК (пленка): 2932, 2858, 1703, 1471, 1427, 1112, 824, 741, 702 см-1
1H-ЯМР (500 МГц, СDСl3, м.д.): 8,96 (1H, с), 7,63 (4Н, м), 7,48-7,35 (6Н, м), 3,58 (2Н, м), 2,05-1,88 (5Н, м), 1,62 (1H, м), 1,34 (1H, дд, J=8,5, 5,5 Гц), 1,20 (1H, т, J=5,4 Гц), 1,02 (9Н, с).
MS (м/z): 337 (15), 259 (14), 231 (30), 199 (100), 137 (20), 93 (60), 77 (70).
ПРИМЕР 43: (2S,3aS,4aS)-2-метил-2-гидрокси-3а-гидроксиметилбицикло[3.1.0]гексан I.I.1 (A=СН2OH, R1=СН3) (схема 4)
К раствору Нg(ОАс)2 (350 мг, 1,10 ммоль) в воде (1,5 мл) добавляют по каплям раствор олефина 4.3 (164 мг, 0,719 ммоль) в ТГФ (1,5 мл). После перемешивания смеси в течение 30 мин при комнатной температуре добавляют водный раствор NaOH (1,5 мл, 3 н.), затем 0,5 М NaBH4 в 3 н. растворе NaOH (1,5 мл). Образовавшуюся смесь перемешивают в течение 2 час при комнатной температуре до тех пор, пока большая часть ртути не будет коагулирована. Твердое вещество отфильтровывают. Фильтрат экстрагируют Et2O (2×30 мл) и EtOAc (2×30 мл). К остатку добавляют К2СО3 (500 мг, 5,05 ммоль) и МеОН (2 мл). Смесь перемешивают в течение 20 час при комнатной температуре. Реакционную смесь пропускают через короткую колонку с силикагелем. Сырой продукт очищают ВЭЖХ (циклогексан/EtOAc 62:45), получая при этом соединения I.l.1 (А=CH2OH, R1=Me) и I.i.1 (A=CH2OH, R1=Me) (отношение 3:1, 68 мг, 66,6%) в виде бесцветного масла.
ИК (пленка): 3288,4, 2931,3, 2858,5, 1459,1, 1370,2, 1260,7, 1183,9, 1135,7, 1111,5, 1064,0, 1016,0, 922,6 см-1
1H-ЯМР (500 МГц, CDCl3, м.д.): 4,02 (1Н, д, J=10,7 Гц), 3,07 (1Н, д, J=10,7 Гц), 2,05 (2Н, м), 1,65 (1Н, уш.с), 1,52 (1H, д, J=12,8 Гц), 1,37 (3Н, м), 1,25 (3Н, с), 1,05 (1Н, дд, J=8,0, 4,8 Гц), 0,49 (1H, т, J=4,3 Гц).
ПРИМЕР 44: (2S,3aS,4aS)-2-метил-2-гидрокси-3а-формилбицикло[3.1.0]гексан I.l.2 (А=CHO, R1=Me) (схема 4)
Из I.l.1 (A=CH2OH, R1=Me), как описано для I.j.2 (А=CHO, Р=TBDPS). Выход составляет 48,2%.
ИК (пленка): 3429, 2967, 2929, 1691, 1377, 1249, 1102, 1036, 668 см-1
1H-ЯМР (500 МГц, CDCl3, м.д.): 8,90 (1Н, с), 2,66 (1H, дд, J=14,3, 2,4 Гц), 1,98 (2Н, м), 1,88 (1H, дд, J=8,5, 5,2 Гц), 1,65 (1H, уш.с), 1,51 (2Н, т, J=14,2 Гц), 1,31 (3Н, с), 1,14 (1H, т, J=5,2 Гц).
MS (м/z): 140 (М+, 2), 123 (10), 111 (10), 97 (15), 85 (25), 71 (25), 67 (30), 48 (100).
[α]
ПРИМЕР 45: (2S,3aS,4aS)-2-гидрокси-2-гидроксиметил-3а-[(бензоилокси)метил]бицикло[3.1.0]гексан I.m (A=CH2OCOPh) (схема 4)
К раствору 4.3 (65 мг, 0,285 ммоль) и NMO (48 мг, 0,344 ммоль, 1,21 экв.) в смеси ацетон/вода (5 мл:2,5 мл) при 0°С добавляют водный раствор OsO4 (121 мкл, 0,02 ммоль, 4 масс.%, 0,07 экв.). Образовавшийся раствор перемешивают в течение 39 час при комнатной температуре, затем добавляют дитионит натрия (70 мг) и флорисил (150 мг). Черный осадок удаляют фильтрованием и промывают Et2O (200 мл). Растворитель выпаривают в вакууме. Остаток растворяют в Et2O, содержащем небольшое количество ацетона (100:5), и фильтруют через флорисил. Сырую смесь разделяют ВЭЖХ (циклогексан/EtOAc 7:3), получая при этом соединение I.m наряду с С-2-эпимером в качестве незначительного продукта (отношение 85,15) с общим выходом 64% в виде бесцветных масел.
ИК (пленка): 3385,5, 2927,8, 1713,7, 1451,6, 1315,2, 1274,6, 1114,7, 1070,3, 1026,2, 934,5, 711,5 см-1
1H-ЯМР (500 МГц, СDСl3, м.д.): 8,06 (2Н, д, J=7,3 Гц), 7,57 (1Н, т, J=7,4 Гц), 7,46 (2Н, т, J=7,6 Гц), 4,48 (1Н, д, J=11,5 Гц), 4,21 (1H, д, J=11,5 Гц), 3,49 (2Н, м), 2,58 (1H, с), 2,36 (1H, с), 2,16 (1H, д, J=14,6 Гц), 2,12 (1H, дд, J=14,2, 6,3 Гц), 1,94 (1H, т, J=14,1 Гц), 1,89 (1H, т, J=14,1 Гц), 1,65 (1H, д, J=14,2 Гц), 1,07 (1H, дд, J=8,4, 5,3 Гц), 0,47 (1H, т, J=4,6 Гц).
MS (м/z): 262 (M+, 1), 244 (1), 232 (3), 213 (4), 203 {3), 176 (1), 163 (4), 145 (4), 123 (16), 105 (100), 77 (52), 67 (13).
[α]
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРОИЗВОДНЫЕ ТРИАЗОЛА АМИДНОГО ТИПА, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ И СПОСОБ ПРОФИЛАКТИКИ ИЛИ ЛЕЧЕНИЯ | 2001 |
|
RU2232761C2 |
| 17-ДЕЗОКСИ-1,3,5(10)-ЭСТРАТРИЕН, СПОСОБЫ ЛЕЧЕНИЯ, СПОСОБ СИНТЕЗА 7АЛЬФА-МЕТИЛЭСТРОНА, СОЕДИНЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1998 |
|
RU2233288C2 |
| СОЕДИНЕНИЯ N, N-ЗАМЕЩЕННОГО ЦИКЛИЧЕСКОГО АМИНА | 1999 |
|
RU2232156C2 |
| НОВЫЕ ПРОИЗВОДНЫЕ 2,4-ДИОКСОПИРРОЛИДИНА И 2,4-ДИОКСОТЕТРАГИДРОФУРАНА И ЛЕКАРСТВЕННЫЕ СРЕДСТВА, СОДЕРЖАЩИЕ ИХ В КАЧЕСТВЕ АКТИВНОГО ИНГРЕДИЕНТА | 1997 |
|
RU2179976C2 |
| СИНТЕЗ ГАЛИХОНДРИНОВ | 2018 |
|
RU2794176C2 |
| N-(2-АРИЛПРОПИОНИЛ)СУЛЬФОНАМИДЫ И СОДЕРЖАЩИЕ ИХ ФАРМАЦЕВТИЧЕСКИЕ ПРЕПАРАТЫ | 1999 |
|
RU2255084C2 |
| СОЕДИНЕНИЯ С ГИДРОКСИКАРБОНИЛЬНЫМИ-ГАЛОГЕНАЛКИЛЬНЫМИ БОКОВЫМИ ЦЕПЯМИ | 2000 |
|
RU2247106C2 |
| МЕТАЛЛОЦЕНОВОЕ СОЕДИНЕНИЕ, ЛИГАНД, СПОСОБЫ ПОЛУЧЕНИЯ ЛИГАНДА, КАТАЛИЗАТОР, СПОСОБ ПОЛУЧЕНИЯ ПОЛИМЕРА АЛЬФА-ОЛЕФИНОВ, ГОМОПОЛИМЕР ПРОПИЛЕНА, СОПОЛИМЕР ПРОПИЛЕНА | 2000 |
|
RU2243229C2 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ N-АКРИЛОИЛПИПЕРАЗИНА | 1990 |
|
RU2024513C1 |
| СПОСОБ ПОЛУЧЕНИЯ ЭНАНТИОМЕРНЫХ ПРОИЗВОДНЫХ ЛАКТОНА КОРИ | 2011 |
|
RU2501793C2 |
Изобретение относится к предшественникам А-кольца витамина D формулы (I) 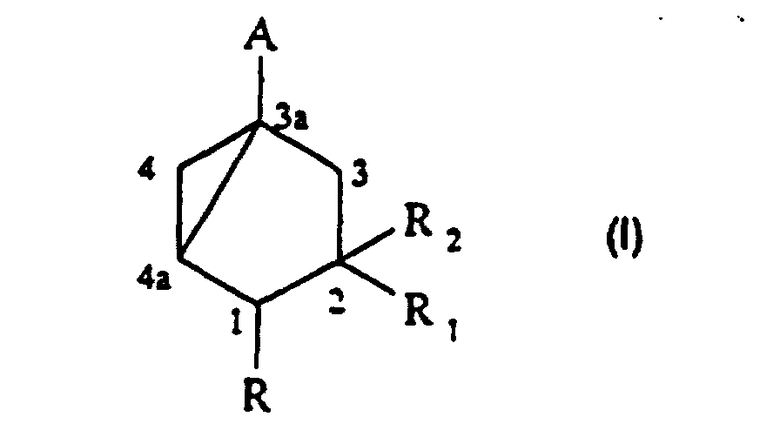
в которой: А представляет группу –CH2OH, -CH2-OCOR’, -COR’’ или этинил; R представляет водород или (С1-С6)алкил; R1 представляет водород, (С1-С6)алкил или группу (СН2)nОР; R2 представляет водород или группу -ОР; R’ представляет фенил; R’’ представляет водород, гидроксил, (С1-С6)алкокси; Р представляет водород или группу -Si(R3)3, в которой каждый R3, независимо, представляет (С1-С6)алкил или фенил; n равно 0 или 1, при условии, что, когда конфигурацией соединения (I) является 2S, 3aS, 4aS, А представляет формил, гидроксиметил, этинил или метоксикарбонил и R и R2, оба, представляют водород, тогда R1 не является группой -OSi(R3)3. Изобретение относится также к способу получения соединений формулы (I), включающему следующие стадии: (i) взаимодействие соединения формулы 1
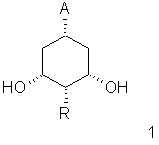
в которой А представляет (C1-C6) алкоксикарбонил или ди (С1-С3)алкиламинокарбонил, с липазой в винилалканоате или ангидриде кислоты и (ii) превращение образовавшегося соединения формулы 2 или 2'
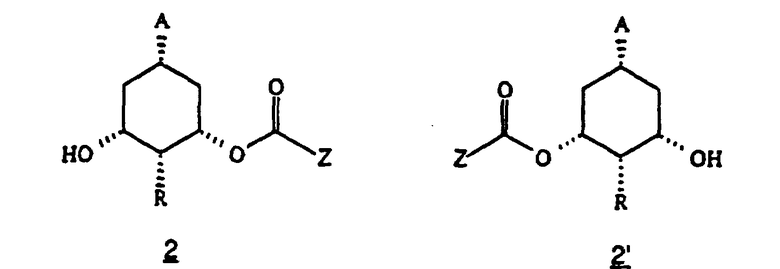
в которой Z представляет алкил, предпочтительно (C1-С3)алкил, в соответствующее соединение формулы (I) посредством образования уходящей группы и циклизации путем обработки основанием с образованием требуемого бицикло[3.1.0]гексана, причем превращение далее включает одну или несколько следующих стадий: защита гидроксигрупп, омыление сложного эфира, инверсия 3- или 5-гидроксигруппы, превращение карбоалкокси или карбамоильной функциональной группы в требуемый заместитель А. Указанные предшественники получают в больших масштабах способом, являющимся более эффективным, чем ранее описанные способы. 2 с. и 6 з.п. ф-лы.
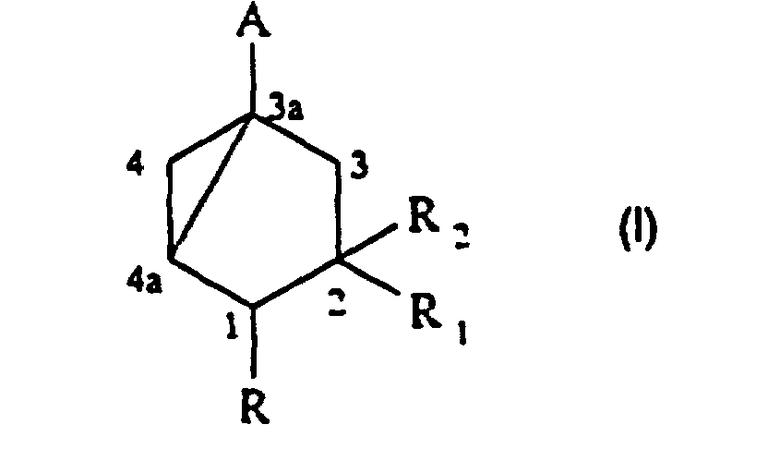
в которой А представляет группу -СН2OН, -CH2-OCOR’, -COR’’ или этинил;
R представляет водород или (С1-С6)алкил;
R1 представляет водород, (С1-С6)алкил или группу
(СН2)n-ОР;
R2 представляет водород или группу -ОР;
R’ представляет фенил;
R’’ представляет водород или (С1-С6)алкокси;
Р представляет водород или группу -Si(R3)3, в которой каждый R3 независимо представляет (С1-С6)алкил или фенил;
n равно 0 или 1,
включающий следующие стадии:
(i) взаимодействие соединения формулы 1
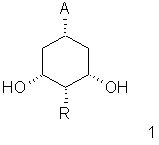
в которой А представляет (C1-C6) алкоксикарбонил или ди (С1-С3)алкиламинокарбонил и R имеет указанные выше значения,
с липазой в винилалканоате или ангидриде кислоты и
(ii) превращение образовавшегося соединения формулы 2 или 2'
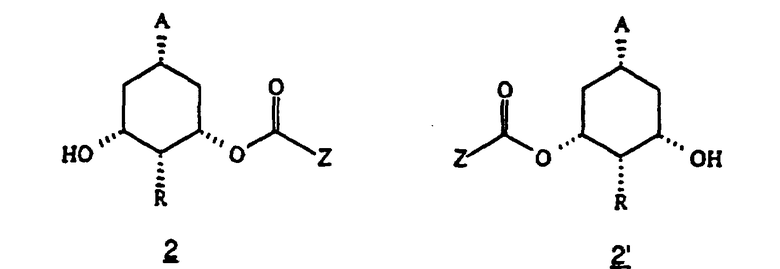
в которой Z представляет алкил, предпочтительно (C1-С3)алкил,
в соответствующее соединение формулы (I) посредством образования уходящей группы и циклизации путем обработки основанием с образованием требуемого бицикло[3.1.0]гексана, причем превращение далее включает одну или несколько следующих стадий: защита гидроксигрупп, омыление сложного эфира, инверсия 3- или 5-гидроксигруппы, превращение карбоалкокси или карбамоильной функциональной группы в требуемый заместитель А.
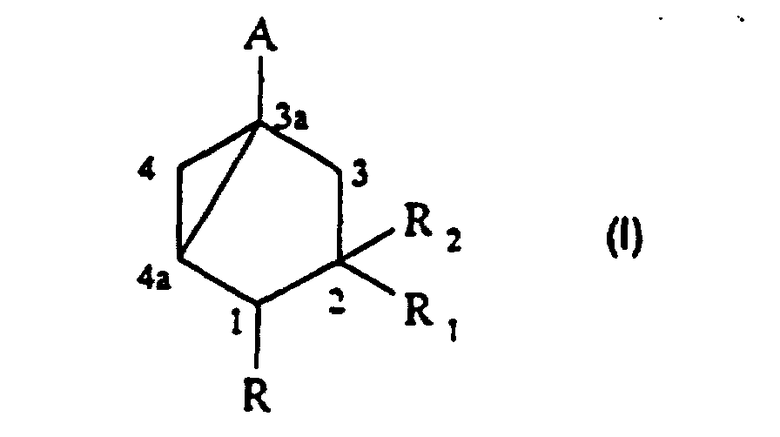
в которой А представляет группу –CH2OH, -CH2-OCOR’, -COR’’ или этинил;
R представляет водород или (С1-С6)алкил;
R1 представляет водород, (С1-С6)алкил или группу (СН2)nОР;
R2 представляет водород или группу -ОР;
R’ представляет фенил;
R’’ представляет водород, гидроксил, (С1-С6)алкокси;
Р представляет водород или группу -Si(R3)3, в которой каждый R3 независимо представляет (С1-С6)алкил или фенил;
n равно 0 или 1,
при условии, что, когда конфигурацией соединения (I) является 2S,3aS,4aS, А представляет формил, гидроксиметил, этинил или метоксикарбонил и R и R2 оба представляют водород, тогда R1 не является группой -OSi(R3)3.
| WANG PENG et al | |||
| “Model Studies of the Stereoelectronic Effect in Rh(II) Mediated Carbenoid C-H Insertion Reactions”, J.Am.Chem.Soc., 1994, vol | |||
| Способ получения бензидиновых оснований | 1921 |
|
SU116A1 |
| Электрическая лампа накаливания с двойной колбой | 1925 |
|
SU3296A1 |
| ZNOU SHENG-ZE et al | |||
| Способ изготовления электрических сопротивлений посредством осаждения слоя проводника на поверхности изолятора | 1921 |
|
SU19A1 |
| Пишущая машина | 1922 |
|
SU37A1 |
| Устройство для усиления микрофонного тока с применением самоиндукции | 1920 |
|
SU42A1 |
| Приспособление в прессах для выделки искусственных камней, предназначенное для перемещения наполнительного ящика | 1927 |
|
SU7637A1 |
| JONG WU et al | |||
| Способ изготовления электрических сопротивлений посредством осаждения слоя проводника на поверхности изолятора | 1921 |
|
SU19A1 |
| Откидной кривошип | 1923 |
|
SU911A1 |
| WO 9501960 A, 19.01.1995 | |||
| RU 96104272 A, 10.05.1998. | |||
Авторы
Даты
2005-03-10—Публикация
2000-12-04—Подача