Область изобретения
Данное изобретение относится к фармацевтическим композициям против заболеваний печени, включающим тритерпеновые производные или их соли в качестве активного ингредиента. Данное изобретение также относится к новым тритерпеновым производным.
Предпосылки создания изобретения
Печень является важным органом, который имеет различные функции, необходимые для поддержания жизни в живом организме, такие как детоксикация, различные метаболизмы и накопление веществ. Она, однако, часто подвергается острому или хроническому поражению вирусами, лекарствами, алкоголем и другими факторами. Это вызывает вирусный гепатит, лекарственную гепатопатию, алкогольную гепатопатию, жировое перерождение печени и, кроме того, такие заболевания как цирроз и рак печени. Для лечения таких заболеваний печени до сих пор использовали диетотерапию, лечение покоем и другие виды терапии с использованием препаратов глицирризина, адренокортикостероидов, интерферона и тому подобные. Однако нельзя сказать, что эта терапия достаточно эффективна для лечения заболеваний печени. Глицирризин и интерферон вводят внутривенно, и следовательно, они не подходят для продолжительного введения. Кроме того, интерферон и стероиды имеют проблемы, связанные с их побочным действием.
Некоторые тритерпеновые производные обладают антикомплеменной активностью и активностью по подавлению агрегации тромбоцитов. Таким образом, они сами и фармацевтические композиции, содержащие их, известны в качестве профилактических и лекарственных средств против иммунологических заболеваний и тромбоза (Japanese Patent Laid-Open N 85344/1986). Однако не существует сообщений, в которых описывается, что тритерпеновые производные являются эффективными в виде фармацевтической композиции для лечения заболеваний печени.
КРАТКОЕ ИЗЛОЖЕНИЕ ИЗОБРЕТЕНИЯ
Обнаружено, что некоторые тритерпеновые производные эффективны при лечении заболеваний печени. Кроме того, удалось синтезировать новые тритерпеновые производные. Данное изобретение основано на этих новых данных.
Первым аспектом данного изобретения является фармацевтическая композиция для лечения заболевания печени, включающая в качестве активного ингредиента тритерпеновое производное, представленное следующей формулой (I) или его соль: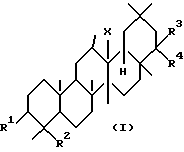
где R1 представляет гидроксильную группу, арилметилокси низший алкокси или низший алканоилокси;
R2 представляет низший алкил, низший алкенил,
-CH2OR5, где R5 представляет атом водорода, арилметил, низший алкил или низший алканоил,
формил,
-COOR6, где R6 представляет атом водорода или низший алкил, или
-CH2N(R7)R8, где R7 и R8, которые могут быть одинаковыми или различными, представляют собой атом водорода, низший алкил, арил или низший алканоил;
или R1 и R2 могут соединяться друг с другом с образованием -O-C(R9)R10-O-CH2-, где R9 и R10, которые могут быть одинаковыми или разными, представляют атом водорода, низший алкил или арил;
R3 и R4, которые могут быть одинаковыми или разными, представляют атом водорода, гидроксильную группу, низший алкил, низший алкенил, арил, гидроксиметил,
-N(R11)R12, где R11 и R12, которые могут быть одинаковыми или разными, представляют атом водорода, низший алкил или низший алканоил,
формил,
-COOR6, где R6 определено выше,
-OR13, где R13 представляет низший алкил, низший циклоалкил, аралкил, низший алканоил, арилкарбонил, аралкилкарбонил, низший алкенил, низший алкенилкарбонил или арил-низший алкенилкарбонил;
или R3 и R4 могут соединяться друг с другом с образованием оксо, гидроксиимино или алкилидена; и
X представляет собой O, CH2 или NH.
Вторым аспектом данного изобретения является фармацевтическая композиция для лечения заболевания печени, включающая в качестве активного ингредиента тритерпеновое производное, представленное следующей формулой (II), или его соль: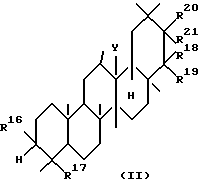
где R16 представляет гидроксильную группу, арилметилокси, низший алкокси или низший алканоилокси;
R17 представляет низший алкил, низший алкенил,
-CH2OR5, где R5 определен выше,
формил,
-COOR6, где R6 определен выше,
-CH2OCON(R9)R10, где R9 и R10 определены выше,
-CON(R29)R30, где R29 и R30, которые могут быть одинаковыми или разными, представляют атом водорода, низший алкил, низший алканоил, арил, или аралкил;
-CH2N(R7)R8, где R7 и R8 определены выше;
-C(R6)2OH, где R6 определен выше;
-COR6, где R6 определен выше;
-CH=CHR6, где R6 определен выше;
или R16 и R17 могут объединяться друг с другом с образованием -O-C-(R9)R10-O-CH2-, где R9 и R10 определены выше;
R18 и R19, которые могут быть одинаковыми или разными, представляют атом водорода, гидроксильную группу, арилметилокси, низший алкил,
-N(R11)R12, где R11 и R12 определены выше,
-COOR6, где R6 определен выше,
-OR13, где R13 определен выше,
-O-(CH2)m-R22, где R22 представляет амино,
-NH-COOR23, где R23 представляет арилметил или низший алкил, гидроксильную группу, арилметилокси или
-COOR24, где R24 представляет атом водорода, низший алкил или арилметил и
m является целым числом от 1 до 4,
-OCOCH(R25) (CH2)n-R22, где R22 определен выше, R25 представляет атом водорода, низший алкил, аралкил или арил, а n является целым числом от 0 до 3,
-OCOCH=CH-COOR6, где R6 определен выше, или
-OCON(R29)R30, где R29 и R30 определены выше;
или R18 и R19 могут соединяться друг с другом с образованием оксо,
R20 и R21, соответственно, имеют те же значения, что и R18 и R19, при условии, что R20 и R21 не представлены атомом водорода;
или R18 и R20 могут соединяться друг с другом с образованием -O-[C(R9)R10]p-O-, где R9 и R10 определены выше, а p является целым числом от 1 до 3, или -OCO-[C(R9)R10]q-OCO-, где R9 и R10 определены выше, a q является целым числом от 0 до 2; и
Y представляет O, CH, NH или одинарную связь для образования двойной связи в кольце, к которому Y присоединен.
Третьим аспектом данного изобретения является фармацевтическая композиция для лечения заболевания печени, включающая в качестве активного ингредиента тритерпеновое производное, имеющее формулу (III) или его соль: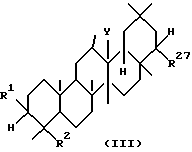
где R1, R2 и Y имеют те же значения, что и выше, а R27 представляет
-O-(CH2)m-R22, где R22 и m имеют те же значения, что и выше,
-OCOCH(R25)(CH2)n-R22, где R22, R25 и n имеют те же значения, что и выше,
-OCON(R29)R30, где R29 и R30 имеют те же значения, что и выше,
-OCO-(CH2)n-R16, где R16 определен выше, или
-OCOCH=CH-COOR6, где R6 определен выше.
Четвертым аспектом данного изобретения является фармацевтическая композиция для лечения заболевания печени, включающая в качестве активного ингредиента тритерпеновое производное, представленное следующей формулой (IV), или его соль: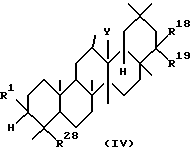
где R1, R18, R19 и Y определены выше; а R28 представляет
-CON(R29)R30, где R29 и R30 определены выше,
-C(R6)2OH, где R6 определен выше,
-COR6a, где R6a представляет низший алкил, или
-CR=CHR6, где R6 определен выше.
Первая группа новых соединений по данному изобретению является тритерпеновыми производными, представленными следующей формулой (Ia), или их солями: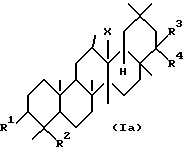
где R1 представляет гидроксильную группу, низший алкокси или низший алканоилокси;
R2 представляет гидроксиметил, низший алкоксиметил, низший алканоилоксиметил или карбоксил;
или R1 и R2 могут объединяться друг с другом с образованием -O-C(R14)R15-O-CH2-, где R14 и R15, которые могут быть одинаковыми или разными, представляют атом водорода или низший алкил;
R3 и R4, которые могут быть одинаковыми или разными, представляют атом водорода, гидроксильную группу, низший алкил, низший алкенил, арил, гидроксиметил,
-N(R11)R12, где R11 и R12, которые могут быть одинаковыми или разными, представляют атом водорода, низший алкил или низший алканоил,
формил, -COOR6, где R6 определен выше,
-OR13, где R13 представляет низший алкил, низший циклоалкил, аралкил, низший алканоил, арилкарбонил, аралкилкарбонил, низший алкенил, низший алкенилкарбонил или арил-низший алкенилкарбонил;
или R3 и R4 могут соединяться друг с другом с образованием оксо, гидроксиимино или алкилиден; и
X представляет O, CH2 или NH,
при условии что, соединения, где R1 представляет гидроксильную группу, R2 представляет гидроксиметил, R3 представляет атом водорода, R4 представляет гидроксильную группу и X представляет O, исключены.
Второй группой новых соединений по данному изобретению являются тритерпеновые производные, представленные следующей формулой (IIa), или их соли: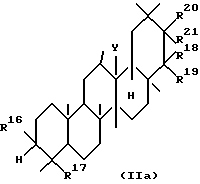
где R16 представляет гидроксильную группу, арилметилокси, низший алкокси, исключая метокси, или низший алканоилокси, исключая ацетокси;
R17 представляет низший алкил, низший алкенил,
-CH2OR5 где R5 определен выше, формил,
-COOR6, где R6 определен выше,
-CH2OCON(R9)R10, где R9 и R10 определены выше,
-CON(R7)R8, где R7 и R8 определены выше,
-CH2N(R7)R8, где R7 и R8 определены выше,
-C(R6)2OH, где R6 определен выше,
-COR6a, где R6a представляет низший алкил, или
-CH=CHR6, где R6 определен выше,
или R16 и R17 могут соединяться друг с другом с образованием -O-C(R9)R10-О-CH2-, где R9 и R10 определены выше,
R18 и R19, которые могут быть одинаковыми или разными, представляют атом водорода, гидроксильную группу, арилметилокси, низший алкил,
-N(R11)R12, где R11 и R12 определены выше,
-COOR6, где R6 определен выше,
-OR13, где R13 определен выше,
-O-(CH2)m-R22,
где R22 представляет амино,
-NH-COOR23, где R23 представляет арилметил или низший алкил,
гидроксильную группу, арилметилокси или
-COOR24, где R24 представляет атом водорода, низший алкил или арилметил и
m является целым числом от 1 до 4,
-OCOCH(R25)(CH2)n-R22, где R22 определен выше,
R25 представляет атом водорода, низший алкил, аралкил или арил и n является целым числом от 0 до 3,
-OCOCH=CH-COOR6, где R6 определен выше, или
-OCON(R29)R30, где R29 и R30 определены выше;
или R18 и R19 могут объединяться друг с другом с образованием оксо,
R20 и R21, соответственно, имеют те же самые значения, что и R18 и R19, при условии, что R20 и R21 не являются атомом водорода;
или R18 и R20 могут соединяться друг с другом с образованием -O-[C(R9)R10] p-O-, где R9 и R10 имеют те же значения, что и выше, а p является целым числом от 1 до 3, или -OCO-[C-(R9)R10]q-OCO-, где R9 и R10 определены выше, и q является целым числом от 0 до 2; и
Y представляет O, CH2, NH или одинарную связь с образованием двойной связи в кольце, к которому Y присоединен; при условии, что соединения, где R16 представляет гидроксильную группу, R17 представляет -CH2OCH3, R20 представляет гидроксильную группу или метокси, оба, R18 и R21, представляют атомы водорода, R19 представляет гидроксильную группу или метокси, а Y представляет одинарную связь, а соединения, в которых R16 представляет гидроксильную группу, R17 представляет CH2OH, R20 представляет гидроксильную группу, R18, R19 и R21, R20 представляет гидроксильную группу, R18, R19 и R21 представляют атом водорода, а Y представляет одинарную связь, исключены.
Третьей группой новых соединений по данному изобретению являются соединения, представленные формулой (III).
Четвертой группой новых соединений по данному изобретению являются соединения, представленные формулой (IV).
На чертеже дана диаграмма, показывающая эффект фармацевтической композиции для лечения заболеваний печени по данному изобретению, при гепатите, вызываемом конканавалином А у мышей. А именно, активность аланинаминотрансферазы (АЛТ) в плазме, которая является показателем гепатопатологии, составляет 2068±518(ед/л) для контрольной группы, тогда как для группы мышей, которых лечили фармацевтической композицией для лечения заболевания печени по данному изобретению, она понижается до 55±16 (ед/л), уровня, который был таким же, что и в группе, не подвергавшейся воздействию (то есть, нормального значения).
ДЕТАЛЬНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Определения
Термин "низший алкил", используемый здесь, как группа или часть группы, обозначает низшие алкилы с прямой или разветвленной цепью, которые предпочтительно имеют от 1 до 6 атомов углерода, более предпочтительно, от 1 до 4 атомов углерода. Термины "низший алкенил" и "низший алкинил", как группа или часть группы, обозначают низшие алкенилы или низшие алкинилы с прямой или разветвленной цепью, которые, предпочтительно, имеют от 2 до 6 атомов углерода, более предпочтительно, от 2 до 4 атомов углерода.
Термин "атом галогена" означает атом фтора, хлора, брома или йода. Термин "арил" предпочтительно означает фенил, нафтил, толил, метоксифенил или тому подобное. Термин "аралкил" как группа или часть группы, предпочтительно означает фенил-Cl4-алкил, более предпочтительно, бензил, фенетил или тому подобное.
В соединениях данного изобретения примеры арилметилокси включают фенилметилокси и нафтилметилокси.
Примеры низших алкокси включают алкокси с прямой или разветвленной цепью, имеющие от 1 до 6 атомов углерода, такие как метокси, этокси, пропокси, изопропокси, бутокси, третбутокси, пентилокси и гексилокси.
Примеры низших алканоилокси включают алканоилокси с прямой цепью, имеющих от 2 до 6 атомов углерода, такие как ацетокси, пропионилокси, бутирилокси, пентаноилокси и гексаноилокси.
Примеры низшего алканоила включают алканоилы с прямой или разветвленной цепью, имеющих от 1 до 6 атомов углерода, такие как формил, ацетил, пропионил, бутирил, изобутил, пентаноил, трет-бутилкарбонил и гексаноил.
Примеры низшего алкила включают алкилы с прямой или разветвленной цепью, имеющие от 1 до 6 атомов углерода, такие как метил, этил, пропил, изопропил, бутил, трет-бутил, пентил и гексил.
Примеры низшего алкенила включают алкенилы с прямой или разветвленной цепью, имеющие от 2 до 6 атомов углерода, такие как винил, аллил, 2-бутенил, 3-бутенил, 1-метилаллил, 2-пентенил и 2-гексенил.
Примеры арила включают фенил, нафтил и бифенил.
Примеры низшего циклоалкила включают циклопропил, циклопентил и циклогексил. Примеры аралкила включают бензил, фенетил и фенилпропил.
Примеры арилкарбонила включают бензоил и нафтилкарбонил.
Примеры низшего алкенилкарбонила включают алкенилкарбонилы, имеющие от 3 до 6 атомов углерода, такие как акрилоил, аллилкарбонил и 2-бутенилкарбонил.
Примеры аралкилкарбонила включают фенилацетил, фенилпропионил и нафтилацетил. Примеры аралкенилкарбонила включают циннамоил и фенилбутеноил.
Примеры алкилидена включают этилиден, пропилилен и бутилиден.
Что касается арилметилокси, арила, аралкила, арилкарбонила, аралкилкарбонила и аралкенилкарбонила, по меньшей мере один атом водорода в них может быть замещен рядом заместителей, предпочтительно 1 - 2, и примеры заместителей включают метил, этил, метокси, этокси, атом галогена, амино, диметиламино, гидроксильную группу, ацетокси и метилендиокси.
Фармацевтическая композиция для лечения заболеваний печени/соединения формулы (I), (II), (III) и (IV)
Соединения, представленные общей формулой (I), (II), (III) или (IV), и их соли эффективны при лечении заболеваний печени.
Заболевания печени, при которых могут применяться соединения, представленные общей формулой (I), (II), (III) или (IV) и их соли, включают острый и хронический вирусные гепатиты, аутоиммунный гепатит, вызванный лекарствами, токсический, алкогольный, внутрипеченочный холестаз и гепатопатию в результате врожденного нарушения метаболизма. Термин "гепатопатия", использованный здесь, относится к воспалительным заболеваниям печени и в зависимости от развития симптомов используется как понятие, охватывающее также жировую инфильтрацию печени, цирроз и гепатому.
Конкретно, тритерпеновые производные, представленные формулой (I), (II), (III) или (IV), и их соли при инкубировании вместе с клетками человеческой гепатомы (Hep G2) в присутствии афлатоксина В1 (вещество, вызывающее гепатопатию), обладают подавляющей активностью в отношении некроза таких клеток и подавляющей активностью в отношении заболеваний печени при вирусном гепатите у мышей, вызванном конканавалином A.
Соединения, представляемые формулой (I), (II), (III) или (IV), имеют различные изомеры, и данное изобретение включает такие изомеры и их смеси. Кроме того, также рассматривается наличие изомеров, связанных с другими группами, в формуле (I), (II), (III) или (IV), и эти изомеры и их смеси также включены в данное изобретение.
В соответствии с предпочтительным воплощением данного изобретения предпочтительные соединения, представленные формулой (I), (II), (III) или (IV), имеют конфигурацию, представляемую следующей формулой (I-1), (II-1), (III-1) или (IV-1):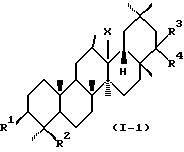
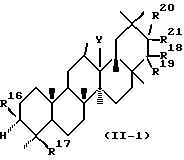
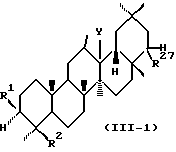
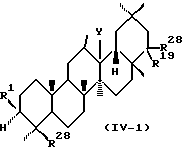
Среди соединений, представленных формулой (I), (II), (III) или (IV) по данному изобретению, предпочтительны следующие группы соединений.
Что касается соединений, представляемых формулой (I), предпочтительными являются:
группа соединений, в которых R1 представляет гидроксильную группу, R3 представляет атом водорода и X представляет O; и группа соединений, где R1 представляет гидроксильную группу, R2 представляет гидроксиметил, R3 представляет атом водорода, R4 представляет гидроксильную группу или -OR13, a X представляет O.
Что касается соединений, представляемых формулой (II), предпочтительными являются:
группа соединений, где R16 представляет, гидроксильную группу, R17 представляет -CH2OH, оба, R18 и R20, представляют атом водорода, оба, R19 и R21, представляют гидроксильную группу, а Y представляет одинарную связь с образованием двойной связи в кольце, к которому Y присоединен;
группа соединений, где R16 представляет гидроксильную группу, низший алкокси или низший алканоилокси, R17 представляет - CH2OR5, R18 представляет атом водорода, R19 представляет -OR13, R20 представляет атом водорода, R21 представляет -OR13 и Y представляет одинарную связь с образованием двойной связи в кольце, к которому Y присоединен;
группа соединений, где R16 представляет гидроксильную группу, низший алкокси или низший алканоилокси, R17 представляет - CH2OR5, R18 и R19 соединяются друг с другом с образованием оксо, R20 и R21 соединяются друг с другом с образованием оксо и Y представляет одинарную связь с образованием двойной связи в кольце, к которому Y присоединен;
группа соединений, где R16 представляет гидроксильную группу, низший алкокси или низший алканоилокси, R17 представляет - CH2OR5, R18 и R19 соединяются друг с другом с образованием оксо, R20 представляет атом водорода, R21 представляет гидроксильную группу, а Y представляет одинарную связь с образованием двойной связи в кольце, к которому Y присоединен;
группа соединений, где R16 представляет гидроксильную группу, низший алкокси или низший алканоилокси, R17 представляет - CH2OR5, R18 и R19 представляет атом водорода, R20 и R21 соединяются друг с другом с образованием оксо и Y представляет одинарную связь с образованием двойной связи в кольце, к которому Y присоединен;
группа соединений, где R16 представляет гидроксильную группу, низший алкокси, исключая метокси, или низший алканоилокси, исключая ацетокси, R17 представляет -CH7OR5, R18 и R19 представляют атом водорода, R20 представляет атом водорода, R21 представляет гидроксильную группу, а Y представляет одинарную связь с образованием двойной связи в кольце, к которому Y присоединен;
группа соединений, где R16 представляет гидроксильную группу, R17 представляет -CH2OR5, R18 представляет атом водорода, R19 представляет гидроксильную группу или -OR13, R20 представляет атом водорода, R21 представляет гидроксильную группу или -OR13, а Y представляет одинарную связь и, таким образом, представляет O;
группа соединений, где R16 представляет гидроксильную группу, низший алкокси или низший алканоилокси, R17 представляет -C(R6)2OH, R18 представляет атом водорода, R19 представляет гидроксильную группу или -OR13, R20 представляет атом водорода, R21 представляет гидроксильную группу или -OR13 и Y представляет одинарную связь для образования двойной связи в кольце, к которому Y присоединен;
группа соединений, где R16 представляет гидроксильную группу, низший алкокси или низший алканоилокси, R17 представляет -COR6a, R18 представляет атом водорода, R19 представляет гидроксильную группу или OR13, R20 представляет атом водорода R21 представляет гидроксильную группу или -OR13 a Y представляет одинарную связь для образования двойной связи в кольце, к которому Y присоединен;
группа соединений, где R16 представляет гидроксильную группу, низший алкокси или низший алканоилокси, R17 представляет -CH=CHR6, R18 представляет атом водорода, R19 представляет гидроксильную группу или -OR13, R20 представляет атом водорода, R21 представляет гидроксильную группу или -OR13, a Y представляет одинарную связь для образования двойной связи в кольце, к которому Y присоединен.
Для соединений, представляемых формулой (III), предпочтительными являются:
группа соединений, где R1 представляет гидроксильную группу, низший алкокси или низший алканоилокси, R2 представляет - CH2OR5, R27 представляет -OCO-(CH2)n-R16 и Y представляет одинарную связь для образования двойной связи в кольце, к которому Y присоединен;
группа соединений, где R1 представляет гидроксильную группу, низший алкокси или низший алканоилокси, R2 представляет -CH2OR5, R27 представляет -O-(CH2)m-R22 и Y представляет одинарную связь для образования двойной связи в кольце, к которому Y присоединен;
группа соединений, где R1 представляет гидроксильную группу, низший алкокси или низший алканоилокси, R2 представляет -CH2OR5, R27 представляет -OCOCH(R25)(CH2)n-R22 или -OCOCH= CH-COOR6, a Y представляет одинарную связь для образования двойной связи в кольце, к которому Y присоединен;
группа соединений, где R1 представляет гидроксильную группу, низший алкокси или низший алканоилокси, R2 представляет - CH2OR5, R27 представляет -OCON(R29)R30 и Y представляет одинарную связь для образования двойной связи в кольце, к которому Y присоединен.
Для соединений, представленных формулой (IV), предпочтительными являются:
группа соединений, где R18 и R19 представляют атом водорода, гидроксильную группу или -OR13, R28 представляет CON(R29)R30, где R29 и R30 дано определение выше, -C(R6)2OH, где R6 дано определение выше, -COR6a, где R6a дано определение выше, или -CH=CHR6, где R6 дано определение выше.
Соединения, представленные формулой (I), (II), (III) или (IV) по данному изобретению, могут присутствовать в форме соли. Соль может быть получена простой реакцией вышеприведенных соединений с фармацевтически приемлемым основанием обычным способом. В этом случае могут использоваться в качестве основания неорганические основания, такие как гидроксид натрия, гидроксид калия, гидроксид алюминия, карбонат натрия, карбонат калия и гидрокарбонат натрия, и органические основания, такие как пиперазин, морфолин, пиперидин, этиламин и триметиламин.
Хотя соединение по данному изобретению можно вводить в виде чистого вещества, предпочтительно его можно вводить в виде фармацевтической композиции. Фармацевтические композиции, в виде фармацевтических композиций для лечения заболеваний печени, включающие в качестве активного ингредиента соединение или его соли по данному изобретению, можно вводить или перорально или парентерально (например, путем внутривенной инъекции, внутримышечной инъекции, подкожного введения, ректального введения или чрезкожного введения) людям или другим животным.
Поэтому фармацевтические композиции для лечения заболеваний печени по данному изобретению могут быть изготовлены в виде препарата, подходящего для определенного пути введения. А именно, они могут быть изготовлены в виде любого из следующих препаратов: инъекционного, такого как инъекционный препарат для внутривенных или внутримышечных инъекций; перорального препарата, такого как капсулы, таблетки, гранулы, порошки, пилюли, тонкие пластинки или пастилки; препарат для ректального введения; суппозитории на жировой основе; и суппозитории на водной основе. Вышеописанные разнообразные препараты могут быть изготовлены обычным способом с использованием основы, наполнителя, связывающего вещества, увлажняющего вещества, разрыхляющего вещества, поверхностно-активного вещества, вещества, увеличивающего скольжение, диспергирующего вещества, буфера, консерванта, повышающего растворимость вещества, антисептика, улучшающего вкус вещества, умягчающего вещества, стабилизатора и тому подобного. Примеры вышеприведенных добавок, которые нетоксичны и приемлемы для препаратов, включают молочный сахар, фруктовый сахар, виноградный сахар, крахмал, желатин, карбонат магния, синтетический силикат магния, тальк, стеарат магния, метил-целлюлозу, карбоксиметилцеллюлозу или ее соль, аравийскую камедь, полиэтиленгликоль, сироп, вазелин, глицерин, этанол, пропиленгликоль, лимонную кислоту, хлорид натрия, силикат натрия и фосфат натрия.
Доза соединения, представленного формулой (I), может меняться в зависимости от возраста, веса, состояния больного или тяжести заболевания. В основном, однако, она находится в интервале примерно от 0,1 до 1000 мг, предпочтительно, от 1 до 100 мг в сутки для взрослого человека, с приемом 1 или дважды в день. Введение может быть или пероральным или парентеральным.
Группа новых соединений/соединения формулы (Ia), (IIa), (III) и (IV)
Другим аспектом данного изобретения являются новые тритерпеновые производные, представляемые формулой (Ia), (IIa), (III) или (IV).
Предпочтительные примеры каждой группы в этих формулах могут быть теми же самыми, что и описанные выше для формул (I), (II), (III) и (IV).
В вышеприведенном определении формулы (IIa) в отношении R16 метокси исключен из низших алкокси, а ацетокси исключен из низших алканоилокси. В отношении следующих групп, однако, метокси включается в низшие алкилы, представленные R16, а ацетокси включается в низшие алканоилокси, представленные R16. А именно, такими группами соединений являются:
группа соединений, где R16 представляет гидроксильную группу, низший алкокси или низший алканоилокси, R17 представляет - CH2OR5, R18 представляет атом водорода, R19 представляет -OR13, R20 представляет атом водорода, R21 представляет -OR13, a Y представляет одинарную связь для образования двойной связи в кольце, к которому Y присоединен;
группа соединений, где R16 представляет гидроксильную группу, низший алкокси или низший алканоилокси, R17 представляет - CH2OR5, R18 и R19 соединяются друг с другом с образованием оксо, R20 и R21 соединяются друг с другом с образованием оксо, а Y представляет одинарную связь для образования двойной связи в кольце, к которому Y присоединен;
группа соединений, где R16 представляет гидроксильную группу, низший алкокси или низший алканоилокси, R17 представляет - CH2OR5, R18 и R19 соединяются друг с другом с образованием оксо, R20 представляет атом водорода, R21 представляет гидроксильную группу, а Y представляет одинарную связь для образования двойной связи в кольце, к которому Y присоединен; и
группа соединений, где R16 представляет гидроксильную группу, низший алкокси или низший алканоилокси, R17 представляет -CH2OR5, R18 и R19 представляют собой атом водорода, R20 и R21 соединяются друг с другом с образованием оксо, а Y представляет одинарную связь для образования двойной связи в кольце, к которому Y присоединен.
Для этих новых соединений, предпочтительные группы соединений, представленных формулами (I), (II), (III) и (IV) и предпочтительная их конфигурация может быть такой же, которая описана выше для вышеприведенных формул (I), (II), (III) и (IV).
Соединения, представленные формулами (Ia), (IIa), (III) или (IV), также имеют различные изомеры, изданное изобретение включает все такие изомеры и их смеси. Кроме того, также рассматривается наличие изомеров, связанных с другими группами в формулах (Ia), (IIa), (III) и (IV), и эти изомеры и их смеси также включена в данное изобретение. Эти соединения, представляемые формулами (Ia), (IIa), (III) и (IV), также можно легко превратить в соответствующие соли, позволяя фармацевтически приемлемому основанию взаимодействовать с этими соединениями. Предпочтительные основания могут быть теми же самыми, что и описанные выше для формул (I), (II), (III) и (IV).
Получение соединений
Способ (А)
Среди соединений, представленных формулой (I), соединение, представленное формулой (VI), где R1, R2, R3 и R4 определены выше, может быть получено реакцией соединения, представленного следующей формулой (V), где R1, R2, R3, R4 определены выше, с соответствующим окисляющим агентом.
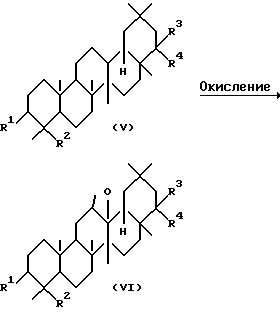
Растворители, используемые в этой реакции, включают, например, дихлорметан, хлороформ, бензол и толуол. Окисляющие агенты, приемлемые здесь, включают, например, пербензойную кислоту, м-хлорпербензойную кислоту и перуксусную кислоту, В основном, окисляющий агент используется количестве, равном 1-3 эквивалентам в расчете на количество соединения, представленного формулой (V). Реакция может обычно проводиться при температуре 0-60oC.
Способ (Б)
Среди тритерпеновых производных, представленных формулой (I), соединение, представляемое следующей формулой (VII), где R1, R2, R3 и R4 определены выше, может быть получено реакцией соединения, представляемого следующей формулой (V), с циклопропанирующим агентом.
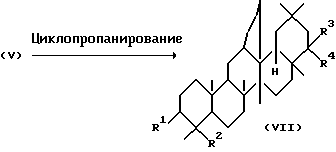
Растворители, применяемые здесь, включают бензол, толуол, гексан, диэтиловый эфир, тетрагидрофуран и 1,2-дихлорэтан. Циклопропанирующие агенты, используемые здесь, включают Z(Cu)-CH2I2 и Et2Zn-CH2I2. В основном циклопропанирующий агент используется в количестве от 1 до 10 эквивалентов в расчете на количество вещества, представленного формулой (V). Реакция может обычно проводиться при температуре от 40 до 60oC. Добавление к этой системе кислоты Льюиса, такой как тетрахлорид титана, часто ускоряет реакцию.
Способ (В)
Среди соединений, представленных формулой (I), соединение, представленное формулой (VIII), где R1, R2, R3 и R4 определены выше, можно получить реакцией соединения, представленного формулой (V), с IN3 и затем с соответствующим восстанавливающим агентом.
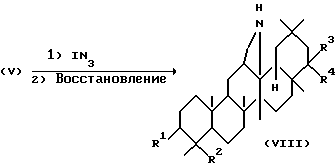
В основном IN3 используется в количестве от 1 до 3 эквивалентов в расчете на количество вещества, представленного формулой (V). Растворители, используемые при этой реакции, включают ДМФ и ацетонитрил. Реакцию можно проводить при температуре от 0 до 40oC, В качестве восстанавливающего агента можно использовать литий алюмогидрид в количестве от 1 до 5 эквивалентов, а растворители, используемые в этой реакции с восстанавливающими агентами включают диэтиловый: эфир и тетрагидрофуран, Реакция с восстанавливающим агентом может проводиться при температуре от 0 до 60oC.
Способ (Г)
Среди соединений, представленных формулой (II), соединение, представленное формулой (X), где R18, R19, R20 и R21 определено выше, могут быть получены реакцией соединения, представленного следующей формулой (IX), где R18, R19, R20 и R21 определены выше, с соответствующим окисляющим веществом.
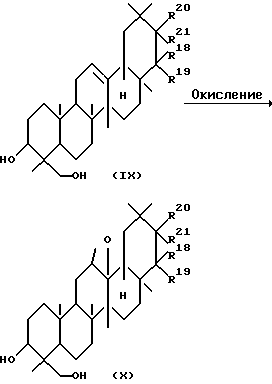
Растворители, применяемые в этой реакции, включают, например, дихлорметан, хлороформ, бензол и толуол. Окисляющие агенты, используемые в этой реакции, включают, например, пербензойную кислоту, м-хлорпербензойную кислоту и перуксусную кислоту. В основном, окисляющий агент используется в количестве от 1 до 3 эквивалентов в расчете на количество соединений, представленное формулой (V). Реакция может обычно проводиться при температуре от 0 до 60oC.
Способ (Д)
Среди соединений, представленных формулой (III), соединение, представленное формулой (XIV), где R27* представляет -O- (CH2)m-R22, -OCOCH (R25) (CH2)n-R22, -OCON(R29)R30, -OCO-(CH2)n-R16 или OCOCH=CH-COOR6 и R16, R22, R25, R29, R30, n и m дано определение выше, может быть получено с помощью следующей реакции.
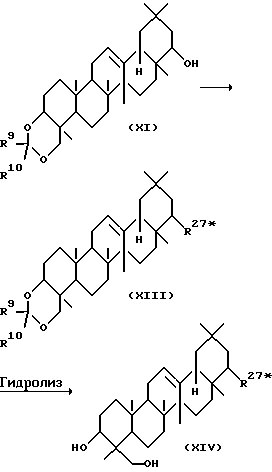
Сначала соединение, представленное формулой (XI), где R9 и R10 определены выше, реагирует с соединением, представленным формулой -Z-(CH2)m-R22, где Z представляет атом галогена, Cl-CO-(CH2)n-R6, или Cl-COCH=CH-COOR6 в присутствии или в отсутствие основания с получением соединения, представляемого формулой (XIII), где R9, R10, R27* и m определены выше. Растворители, используемые при этом, включают диэтиловый эфир, тетрагидрофуран, бензол, толуол, дихлорметан, хлороформ, диметилформамид. Основания, используемые при этом, включают, например, триэтиламин, пиридин, 4-диметиламинопиридин, натрия гидрид, калия гидрид, н-бутиллитий, NaCH2SOCH3 и трет-ВиОК. Соединение, представленное формулой -Z-(CH2)m-R22, где Z представляет атом галогена, ClCOCH(R25)(CH2) n-R22; R29-NCO, Cl-CO-(CH2)n-R16 или Cl-COCH== CH-COOR6, может использоваться в количестве от 1 до 3 эквивалентов в расчете на количество соединения, представленного формулой (IX).
Основание может обычно использоваться в количестве от 1 до 10 эквивалентов в расчете на количество соединения, представленного формулой (XI) и, в некоторых случаях, может использоваться в качестве растворителя. Реакция может проводиться при температуре от -60o до 60oC. Основание может обычно использоваться в количестве от 1 до 10 эквивалентов в расчете на количество соединения, представленного формулой (XI), и в некоторых случаях, может использоваться в качестве растворителя. Реакцию можно проводить при температуре в интервале от -20 до 60oC.
Соединение, представленное формулой (XIII), можно подвергать гидролизу в присутствии кислоты для получения соединения, представленного формулой (XIV). Растворители, используемые при этом, включают метанол, этанол, пропанол, воду, дихлорметан и хлороформ. Кислоты, используемые при этом, включают минеральные кислоты, такие как соляная кислота и серная кислота и кислоты Льюиса, такие как BF3•Et2O. В основном, реакцию можно проводить при температуре от 0 до 120oC.
Способ (Е)
Среди соединений, представленных формулой (IV), соединение, представленное формулой (XVIII), может быть получено с помощью следующей методики.
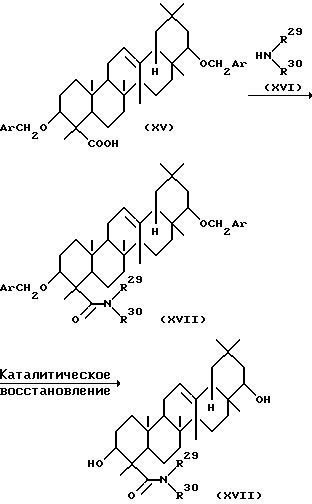
Сначала соединение, представленное формулой (XV), где Ar представляет арил, реагирует с соединением, представленным формулой (XVI), где R29 и R30 определены выше, в присутствии соответствующего конденсирующего агента с получением соединения, представленного формулой (XVII), где Ar, R29 и R30 определены выше. Растворители, используемые при этом, включают, например, дихлорметан, хлороформ, бензол, толуол, тетрагидрофуран и диметилформамид. Конденсирующие агенты, используемые при этом, включают, дициклогексилкарбодиимид (ДЦК), ДЦК-гидроксибензотриазол, бензотриазол-1-илокситрис (диметиламино)-фосфония гексафторфосфат (реагент БОФ) и дифенилфосфорилазид. Конденсирующий агент может использоваться в количестве от 1 до 3 эквивалентов в расчете на количество соединения, представленное формулой (XV). Обычно реакция может проводиться при температуре от -20 до 60oC.
Соединение, представленное формулой (XVII), может быть каталитически восстановлено в присутствии катализатора с получением соединения, представленного формулой (XVIII). Растворители, используемые при этом, включают, например, воду, метанол, этанол, тетрагидрофуран, диоксан, дихлорметан и хлороформ. Катализаторы, используемые при этом, включают, например, Pd-C, Pd(OH)2-C. Катализатор может использоваться в количестве от 0,1 до 0,6 эквивалента в расчете на количество вещества, представленного формулой (XVII).
Обычно реакция может проводиться при комнатной температуре в атмосфере водорода при давлении от 1 до 4 атм.
Гидроксильная группа соединения, представленного формулой (XVII), может быть далее модифицирована с получением соединения, представленного формулой (IV).
Соединение, представленное формулой (XV), может быть получено с помощью следующей методики.
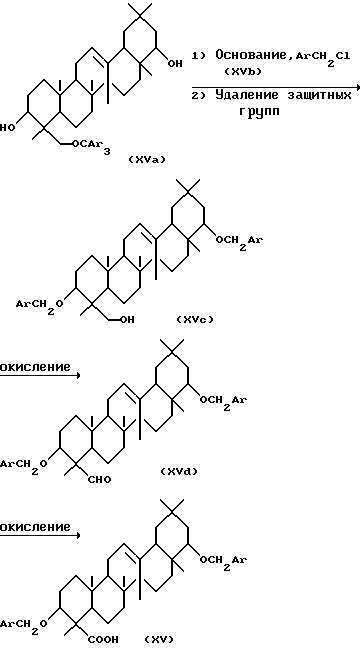
Соединение, представленное формулой (XVa), может реагировать с соединением, представленным формулой (XVb), в присутствии основания с последующим удалением защиты триарильной группы с получением соединения, представленного формулой (XVc), где Ar представляет арильную группу. Растворители, используемые при этом, включают диэтиловый эфир, ТГФ, ДМФ, диметилсульфоксид (ДМСО), бензол и толуол. Основания, используемые при этом, включают, например, гидрид натрия, гидрид калия, н-бутиллитий, NaCH2SOCH3 и трет-ВиОК. Предпочтительно, основание и соединение, представленное формулой (XVb), используются в количестве от 1 до 10 эквивалентов в расчете на количество соединения, представленного формулой (XVa). Предпочтительно, реакция проводится при температуре от -78 до 60oC. Удаление защиты может производиться в присутствии минеральной кислоты, такой как соляная кислота или серная кислота, в растворителе, таком как метанол, этанол, изопропиловый спирт (ИПС) или вода, при температуре от 0 до 80oC.
Соединение, представленное формулой (XVc), можно затем окислить с помощью соответствующего окисляющего вещества с получением соединения, представленного формулой (XVd). Окисляющие агенты, используемые при этом, включают, например, пиридиния хромат, пиридиния дихромат, диоксид марганца и ДМСО окисляющие реагенты, такие как ДМСО-оксалилхлорид. Растворители, используемые в этой реакции, включают дихлорметан, хлороформ, диэтиловый эфир и ТГФ. Предпочтительно, окисляющий агент используется в количестве от 1 до 5 эквивалентов в расчете на количество соединения, представленного формулой (XVc), Реакция может обычно проводиться при температуре от -78 до 40oC.
Соединение, представленное формулой (XVd), можно далее окислить с помощью соответствующего окисляющего агента с получением соединения, представленного формулой (XV), Растворители, используемые при этом, включают, например, ДМФ, трет-бутанол, ацетон и воду. Окисляющие агенты, используемые при этом, включают пиридиния дихромат, реактив Джонса, перманганат калия и хлорит натрия. Окисляющий агент может быть использован в количестве от 1 до 30 эквивалентов в расчете на количество соединения, представленного формулой (XVd). Реакция может проводиться при температуре от 0 до 60oC.
Способ (Ж)
Соединение, представленное формулой (I), где R1 представляет низший алкокси или низший алканоилокси, а R2 представляет - CH2OR5 (где R5 представляет низший алкил или низший алканоил), соединение, представленное формулой II, где R16 представляет арилметилокси, низший алкокси или низший алканоилокси, а R17 представляет -CH2OR5 (где R5 представляет низший алкил или низший алканоил), а соединение, представленное формулой (III), где R1 представляет низший алкокси или низший алканоилокси, a R2 представляет - CH2OR5 (где R5 представляет низший алкил или низший алканоил), может быть получен реакцией, соответственно, соединения, представленного формулой (I), где R1 представляет гидроксильную группу, а R2 представляет -CH2OH, соединения, представленного формулой (II), где R16 представляет гидроксильную группу, а R17 представляет -CH2OH, и соединения, представленного формулой (III), где R1 представляет гидроксильную группу, a R2 представляет -CH2OH, с соединением, представленным формулой R5Z или (R5a)2O, где R5a представляет низший алкил или низший алканоил, в присутствии основания. Растворители, используемые в этой реакции, включают диэтиловый эфир, тетрагидрофуран, бензол, толуол, дихлорметан, хлороформ и диметилформамид. Основания, используемые при этом, включают, например, триэтиламин, пиридин и 4-диметиламинопиридин. Предпочтительно, соединение, представленное формулой R5Z или (R5a)2O, используется в количестве от 1 до 3 эквивалентов в расчете на количество соединений, представленных формулами (I), (II) и (III). Основание используется в количестве, предпочтительно, от 1 до 10 эквивалентов в расчете на количество соединений, представленных формулами (I), (II) и (III), и в некоторых случаях, может быть использовано в качестве растворителя. Реакция может проводиться при температуре от -20oC до 60oC.
Способ (3)
Среди соединений, представленных формулой (II), соединение, представленное формулой (XIX), где R* представляет -OR13, -O-(CH2)m-R22, -OCOCH(R25)(CH2)n-R22, -OCOCH=CH-COOR6 или -OCON(R29)R30, может быть получено с помощью следующей реакции.
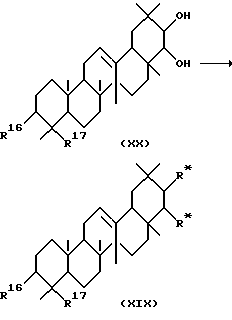
Сначала соединение, представленное формулой (XX), может реагировать с соединением, представленным формулой R13Z, где Z представляет атом галогена, (R13)2O, Cl-COCH (R25)(CH2)n-R22, ClCOCH=CH-COOR6 или R29-NCO в присутствии основания с получением соединения, представленного формулой (XIX). Растворители, используемые в этой реакции, включают, например, диэтиловый эфир, тетрагидрофуран, бензол, толуол, дихлорметан, хлороформ и диметилформамид. Основания, используемые при этом, включают, например, триэтиламин, пиридин и 4-диметиламинопиридин. Соединение, представленное формулой R13Z, где Z представляет атом галогена, (R13)2O, Cl-COCH(R25)(CH2)n-R22, R29-NCO, Cl-CO-(CH2)n-R16 или ClCOCH= CH-COOR6, используется в количестве от 1 до 3 эквивалентов, в расчете на количество соединения, представленного формулой (XX). Обычно основание используется в количестве от 1 до 10 эквивалентов в расчете на количество соединения, представленного формулой (XX), и в некоторых случаях, в качестве растворителя. Реакцию можно проводить при температуре от -60 до 60oC.
Среди соединений, представленных формулой (II), соединение, представленное формулой (XIX), где R* представляет -OR13 или -O-(CH2)m-R22, может быть получено реакцией соединения, представленного формулой (II), где R18 представляет атом водорода, R19 представляет гидроксильную группу, R20 представляет атом водорода и R21 представляет гидроксильную группу, с соединением, представленным формулой R13Z или Z-(CH2)m-R22, где Z представляет атом галогена, в присутствии основания. Растворители, используемые при этом включают, например, диэтиловый эфир, ТГФ, бензол, толуол, ДМФ и ДМСО. Основания, используемые при этом, включают, например, гидрид натрия, гидрид калия, н-бутиллитий, NaCH2SOCH3 и трет-ВиОК. Предпочтительно, основание и соединение, представленное R13Z или Z-(CH2)m-R22, используются в количестве от 1 до 10 эквивалентов, в расчете на количество соединения, представленного формулой (II). Предпочтительно, реакция проводится при температуре от -78 до 60oC.
Способ (И)
Соединение, представляемое формулой (I), где R3 и R4 соединяются друг с другом с образованием оксо, соединение, представленное формулой (II), где R18 и R19 соединяются друг с другом с образованием оксо и/или R20 и R21 соединяются друг с другом с образованием оксо, и соединение, представляемое формулой (IV), где R18 и R19 соединяются друг с другом с образованием оксо, могут быть получены, соответственно, окислением соединения, представленного формулой (I), где R3 представляет атом водорода и R4 представляет гидроксильную группу, соединения, представляемого формулой (II), где R18 и R20 представляют атом водорода, и оба, R19 и R21 представляют гидроксильную группу, или же, любой один из R19 и R21 представляет гидроксильную группу, а другой заместитель представляет атом водорода, и соединения, представленного формулой (IV), где R18 представляет атом водорода, а R19 представляет гидроксильную группу, с помощью окисляющего агента. Окисляющие агенты, используемые при этом, включают, например, хромат пиридиния, дихромат пиридиния, диоксид марганца и ДМСО окисляющие агенты, такие как ДМСО-оксалилхлорид. Растворители, используемые в этой реакции, включают дихлорметан, хлороформ, диэтиловыи эфир и ТГФ. Предпочтительно, окисляющий агент используется в количестве от 1 до 5 эквивалентов. Реакция может обычно проводиться при температуре от -78 до 40o.
Способ (К)
Соединение, представляемое формулой (I), где R3 представляет атом водорода, а R4 представляет гидроксильную группу, соединение, представленное формулой (II), где R18 и R20 представляют атом водорода и как R19, так и R21 представляет гидроксильную группу, или же любой из R19 и R21 представляет гидроксильную группу, а другой заместитель представляет атом водорода, и соединение, представленное формулой (IV), где R18 представляет атом водорода и R19 представляет гидроксильную группу, могут быть получены, соответственно, восстановлением соединения, представленного формулой (I), где R3 и R4 соединяются друг с другом с образованием оксо, соединения, представленного формулой (II), где R18 и R19 соединяются друг с другом с образованием оксо, и соединения, представленного формулой (IV), где R18 и R19 соединяются друг с другом с образованием оксо, с помощью восстанавливающего агента. Восстанавливающие агенты, используемые при этом, включают, например, литий-алюмогидрид и натрий-борогидрид. Обычно восстанавливающий агент может использоваться в количестве от 1 до 5 эквивалентов. Растворители, используемые при этом, включают, например, диэтиловый эфир, ТГФ, бензол, толуол и дихлорметан. Реакцию можно проводить при температуре от -78 до 60o.
Способ (Л)
Среди соединений, представленных формулой (II), соединение, представленное формулой (XXI), может быть получено с помощью следующей методики.
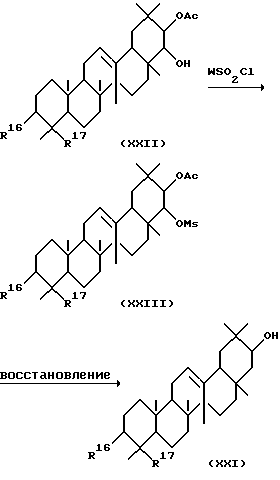
Сначала соединение, представленное формулой (XXII), может реагировать с соединением, представляемым формулой WSO2Cl, где W представляет алкил или арил, в присутствии основания с получением соединения, представленного формулой (XXIII). Растворители, используемые при этом, включают бензол, толуол, дихлорметан, хлороформ, диэтиловый эфир, ТГФ и ДМФ, Конкретные примеры соединений, представленные формулой WSO2Cl, включают, например, метансульфонилхлорид, бензолсульфонилхлорид и п-толуолсульфонилхлорид. Основания, используемые при этом, включают, например, триэтиламин, пиридин и 4-диметиламинопиридин. Обычно соединение, представленное формулой WSO2Cl, и основание используются в количестве от 1 до 3 эквивалентов в расчете на количество соединения, представленного формулой (XXII). Реакцию можно обычно проводить при температуре от 0 до 60o.
Соединение, представленное формулой (XXIII), может реагировать с восстанавливающим агентом с получением соединения, представленного формулой (XXI). Растворители, используемые в этой реакции, включают, например, диэтиловый эфир, ТГФ, бензол, толуол и дихлорметан. Восстанавливающие агенты, используемые при этом, включают, например, триэтилбора-лития гидрид, и могут обычно использоваться в количестве от 1 до 5 эквивалентов. Реакцию можно проводить при температуре от -78 до 60o.
Способ (М)
Соединение, представленное формулой (IV), где R28 представляет -C(R6)2OH, может быть получено реакцией соединения, представленного формулой (IV), где R28 представляет -CHO, с соединением, представленным формулой (R6)iMZj, где R6 определен выше, M представляет литий, магний, цинк или алюминий, Z представляет атом галогена, i является целым числом от 1 до 3, а j является 0 или 1. Растворители, используемые в этой реакции, включают диэтиловый эфир, ТГФ, бензол, толуол, гексан, диметилформамид (ДМФ), гексаметилфосфотриамид и дихлорметан. Предпочтительно, соединение, представленное формулой (R6)iMZj, используется в количестве от 1 до 3 эквивалентов в расчете на количество соединения, представленного формулой (IV). Обычно реакцию можно проводить при температуре от -78 до 20o.
Способ (Н)
Соединение, представленное формулой (IV), где R28 представляет -CH=CHR6, может быть получено реакцией соединения, представленного формулой (IV), где R28 представляет -CHO, с олефинирующим реагентом. Растворители, используемые при этом, включают дихлорметан, хлороформ, диэтиловый эфир, ТГФ, ДМФ и ДМСО. Олефинирующе реагенты, используемые при этом, включают, например, Ph3P=CHK6, реактив Тебба и реактив Нистеда. Предпочтительно, олефинирующий реагент используется в количестве от 1 до -10 эквивалентов в расчете на количество соединения, представленного формулой (IV). Обычно реакцию можно проводить при температуре от -78 до 40o. Добавление кислоты Льюиса, такой как тетрахлорид титана, к реакционной системе часто ускоряет реакцию и, следовательно, предпочтительно.
Способ (О)
Соединение, представленное формулой (IV), где R28 представляет -COR6 или -C(R6)OH, может быть получено реакцией, соединения, представленного формулой (II), где R28 представляет -COOR6 с соединением, представленным формулой (R6)iMZj, где R6 определен выше, M представляет литий, магний, цинк или алюминий, Z представляет атом галогена, i является целым числом лом от 1 до 3, а j является 0 или 1. Растворители, используемые в этой реакции, включают диэтиловый эфир, ТГФ, бензол, толуол, гексан, диметилформамид (ДМФ), гексаметилфосфотриамид и дихлорметан. Предпочтительно, соединение, представленное формулой (R6)iMZj, используется в количестве от 1 до 3 эквивалентов в расчете на соединение, представленное формулой (IV). Обычно реакция может проводиться при температуре от -78 до 20oC.
Специалисту должно быть ясно, что различные соединения, представленные формулами (I), (II), (III) и (IV), могут быть получены с помощью сочетания вышеприведенных способов от (A) до (M). Кроме того, в вышеприведенных способах очевидна возможность предварительного введения защитных групп, которые не участвуют в реакции или инертны в отношении вовлечения в реакцию. В связи с этим использование обычно применяемых защитных групп также очевидно для специалиста.
ПРИМЕРЫ
Данное изобретение будет описано более подробно со ссылками на следующие примеры, хотя оно не ограничивается только этими примерами.
Структуры соединений с 1 по 74 сведены в таблицу. В таблице формула (A) является структурной формулой, образованной путем совместного обобщения структур, соответственно представленных формулами (I), (II), (III) и (VI).
Соединения 3, 11, 18 и 21 были получены в соответствии со способом, описанным в Chem. Pharm. Bull. , 36, 153 (1988), а соединения 1 и 7 были получены в соответствии со способом, описанными в Ber., 70, 2083, 2093 (1937), Ber. , 71, 790, 1604 (1938), Chem. Pharm. Bull., 31, 664 (1983) и Chem, Pharm. Bull., 31, 674 (1983).
Пример 1
12 α, 13 α- Эпоксиолеанан-3 β, 22 β, 24 (4β)- триол (соединение 2)
Соединение 1 (230 мг, 0,5 ммоль) растворяли в 10 мл дихлорметана и 3 мл хлороформа, к раствору добавляли 216 мг 50-60% м-хлорпероксибензойной кислот, и смесь перемешивали при комнатной температуре в течение ночи. Реакционный раствор разбавляли дихлорметаном, промывали насыщенным водным раствором бикарбоната натрия, а затем насыщенным раствором соли и сушили над сульфатом магния. Неорганическую соль удаляли фильтрованием и фильтрат концентрировали при пониженном давлении с получением масла, которое затем очищали с помощью колоночной хроматографии на силикагеле (проявляющая система, н-гексан: этилацетат = 1:1) с получением 193 мг (выход 81%) соединения 2 в виде бесцветного твердого вещества.
1H-ЯМР (CDCl3) δ м.д.
0.88 (3H, s), 0.90 (3H, s), 0.97 (3H, s), 0.98 (3H, s), 0.99 (3H, s), 1.04 (3H, s), 1.22 (3H, s), 0.74-1.87 (22H, m), 2.36 (1H, d, J = 4.16 Hz), 2.76 (1H, dd, J = 2.50 Hz, 9.16 Hz), 3.05 (1H, s), 3.29 (1H, t, J = 10.5 Hz), 3.40-3.45 (1H, m), 3.55-3.60 (1H, m), 4.17 (1H, d, J = 10.5 Hz)
[s = с; d = д; t = т; т = м; Hz = Гц]
МС ЭИ (м/з): 474 (М+)
Пример 2
3 β, 24 (4β)- Изопропилидендиокси-22 β- метоксиолеан-12-ен
(соединение 4)
Соединение 3 (300 мг) растворяли в 5 мл ТТФ, к раствору добавляли 130 мг 55% гидрида натрия и смесь перемешивали при комнатной температуре в течение 1 часа. Затем добавляли 2 мл метилиодида и смесь перемешивали в течение ночи. Реакционный раствор разбавляли этилацетатом, промывали водой и сушили над сульфатом магния. Неорганическую соль удаляли фильтрованием и фильтрат концентрировали при пониженном давлении с получением концентрата, который затем очищали с помощью колоночной хроматографии на силикагеле (проявляющая система, н-гексан: этилацетат = 10:1) с получением 285 мг (выход: 93%) соединения 4 в виде бесцветной пены.
1H-ЯМР (CDCl3) δ м.д.
0.86 (3H, s), 0.90 (3H, s), 0.99 (3H, s), 1.00 (3H, s), 1.11 (3H, s), 1.15 (3H, s), 1-22 (3H, s), 1.37 (3H, s), 1.44 (3H, s), 0.83-2.10 (21H, m), 2.80-2.83 (1H, m), 3.23 (1H, d, J = 11-8 Hz), 3.28 (3H, s), 3.44-3.47 (1H, m), 4.06 (1H, d, J = 11.8 Hz), 5.23 (1H, t-like)
t-like = т-подобный
MC FD (м/з): 512 (M+)
Пример 3
22 β- Метоксиолеан-12-ен-3 β, 24 (4β)- диол (соединение 5)
Соединение 4 (280 мг) растворяли в ТГФ, к раствору добавляли 0,66 мл бортрифторидного этилового эфира и смесь перемешивали при комнатной температуре в течение 1 часа. Реакционный раствор нейтрализовали насыщенным водным раствором гидрокарбоната натрия и экстрагировали этилацетатом. Экстракт сушили над сульфатом магния. Неорганическую соль удаляли фильтрованием и фильтрат концентрировали при пониженном давлении с получением концентрата, который затем очищали с помощью колоночной хроматографии на силикагеле (проявляющая система, н-гексан: этилацетат = 2: 1) с получением 203 мг (выход: 79%) соединения 5 в виде бесцветного твердого вещества.
1H-ЯМР (CDCl3) δ м.д.
0.85 (3H, s), 0.89 (3H, s), 0.90 (3H, s), 0.94 (3H, s), 1.00 (3H, s), 1.11 (3H, s), 1,25 (3H, s), 0.80-2.10 (21H, m), 2.80-2.82 (1H, m), 3.28 (3H, s), 3.33 (1H, d, J = 11.1 Hz), 3.42-3.45 (1H, m), 5.22 (1H, t-like)
MC ЭИ (м/з): 472 (M+)
Пример 4
22 β- Метокси-12,13-эпоксиоленан-3 β, 24 (4β)- диол (соединение 6)
Соединение 5 (50 мг, 0,1 ммоль) растворяли в 1 мл дихлорметана, к раствору добавляли 31 мг 70% м-хлорпероксибензойной кислоты и смесь перемешивали при комнатной температуре в течение ночи. Реакционный раствор разбавляли дихлорметаном, промывали насыщенным водным раствором бикарбоната натрия и затем насыщенным раствором соли и сушили над сульфатом магния. Неорганическую соль удаляли фильтрованием и фильтрат концентрировали при пониженном давлении с получением твердого вещества, которое очищали с помощью колоночной хроматографии на силикагеле (проявляющая система, н-гексан: этилацетат = 1:1) с получением 14,5 мг (выход:28%) соединения 6 в виде бесцветного твердого вещества.
1H-ЯМР (CDCl3) δ м.д.
0.87 (3H, s), 0.89 (3H, s), 0,96 (3H, s), 0.97 (3H, s), 0.99 (3H, s), 1.04 (3H, s), 1.22 (3H, s), 0.74-1.88 (21H, m), 2.42 (1H, br. s), 2.80 (1H, br. s), 2.94 (1H, dd, J = 3.33 Hz, 9.71 Hz), 3.04 (1H, s), 3.26- 3.30 (1H, m), 3.29 (3H, s), 3.40-3.44 (1H, m), 4.17 (1H, d, J = 9.71 Hz)
MC ЭИ (м/з): 488 (M+)
Пример 5
12,13-Эпоксиоленан-3 β, 21 β, 22 β, 24 (4β)- тетраол (соединение 8)
Соединение 7 (50 мг, 0,1 ммоль) растворяли в 1 мл дихлорметана и 1 мл хлороформа, к раствору добавляли 32 мг 70% м-хлорпероксибензойной кислоты и смесь перемешивали при температуре 37oC в течение ночи. Реакционный раствор разбавляли дихлорметаном, промывали насыщенным водным раствором бикарбоната натрия и затем насыщенным раствором соли и сушили над сульфатом магния. Неорганическую соль удаляли фильтрованием и фильтрат концентрировали при пониженном давлении с получением твердого вещества, которое очищали с помощью колоночной хроматографии на силикагеле (проявляющая система, н-гексан: этилацетат =1:1) с получением 18 мг (выход: 35%) соединения 8 в виде бесцветного твердого вещества.
1H-ЯМР (CDCl3) δ м.д.
0.89 (3H, s), 0,91 (3H, s), 1.00 (3H, s), 1.05 (3H, 5), 1.13 (3H, s), 1.14 (3H, s), 1.23 (3H, s), 0.75-2.08 (23H, m), 3.03 (1H, s), 3.28 (1H, d, J = 11.28 Hz), 3.40-3.51 (3H, m), 4.17 (1H, d, J = 11.28 Hz)
MC FAB (м/з): 491 (M++1)
Пример 6
22 β- Бензилоксиацетилокси-3 β, 24 (4β)- изопропилидендиоксиолеан-12-ен (соединение 9)
Соединение 3 (38 мг) растворяли в 5 мл дихлорметана, к раствору добавляли 15 мг 4-диметиламинопиридина и 18 мкл бензилоксиацетилхлорида и смесь перемешивали при комнатной температуре в течение 1,5 часов. Реакционный раствор разбавляли дихлорметаном, промывали водой и сушили над сульфатом магния. Неорганическую соль удаляли фильтрованием и фильтрат концентрировали при пониженном давлении с получением концентрата, который затем очищали с помощью колоночной хроматографии на силикагеле (проявляющая система, н-гексан: этилацетат = 3:1) с получением 36 мг (выход: 76%) соединения 9 в виде бесцветной пены.
1H-ЯМР (CDCl3) δ м.д.
0.81 (3H, s), 0,90 (3H, s), 0.96 (3H, s), 0.98 (3H, s), 1.14 (3H, s), 1.15 (3H, s), 1.22 (3H, s), 1,38 (3H, s), 1.44 (3H, s), 0.87-2.20 (21H, m), 3.23 (1H, d, J = 11.65 Hz), 3.46 (1H, dd, J = 4.44 Hz, 11.44 Hz), 4.03-4.10 (3H, m), 4.64 (2H, d, J = 1.94 Hz), 4.78 (1H, t-like), 5.25 (1H, t-like), 7.30-7.39 (5H, m)
MC FAB (м/з): 647 (M++1)
Пример 7
22 β- -Бензилоксиацетилоксиолеан-12-ен-3 β, 24 (4β)- диол (соединение 10)
Соединение 9 (36 мг) растворяли в 1 мл дихлорметана и 2 мл метанола, к раствору добавляли 1 мл соляной кислоты и смесь перемешивали при комнатной температуре в течение 1 часа. Реакционный раствор разбавляли дихлорметаном, промывали водой и сушили над сульфатом магния. Неорганическую соль удаляли фильтрованием и фильтрат концентрировали при пониженном давлении с получением 30 мг (выход: 88%) соединения 10 в виде бесцветного твердого вещества.
1H-ЯМР (CDCl3) δ м.д.
0.80 (3H, s), 0.89 (3H, s), 0.90 (3H, s), 0.94 (3H, s), 0,96 (3H, s), 1.14 (3H, s), 1.25 (3H, s), 0.84-2.20 (21H, m), 3.35 (1H, d, J = 11.1 Hz), 3.42-3.47 (1H, m), 4.10 (2H, dd, J = 16.37 Hz, 26.91 Hz), 4.20 (1H, d, J = 11.1 Hz), 4,64 (2H, d, J = 1.67 Hz), 4.78 (1H, t-like), 5.24 (1H, t-like), 7.28-7.38 (5H, m)
MC ЭИ (м/з): 606 (M+)
Пример 8
3 β, 22 β- Дибензилокси-24 (4β)- трифенилметилоксиолеан-12-ен (соединение 12)
Соединение 11 (95 мг) растворяли в 5 мл безводного ДМФ, к раствору добавляли 83 мг 60% гидрида натрия и смесь перемешивали при комнатной температуре в течение 1,5 час. Затем к реакционной смеси добавляли 75 мкл бензилбромида и смесь перемешивали при 40oC в течение 5 час. Реакционную смесь разбавляли этилацетатом, промывали трижды водой и сушили над сульфатом магния. Неорганическую соль удаляли фильтрованием и фильтрат концентрировали при пониженном давлении с получением масла, которое затем очищали с помощью колоночной хроматографии на силикагеле (проявляющая система, н-гексан: этилацетат = 10:1) с получением 118 мг (выход:65%) соединения 12 в виде бесцветного твердого вещества.
1H-ЯМР (CDCl3) δ м.д.
0.33 (3H, s), 0.82 (3H, s), 0.88 (3H, s), 0.92 (3H, s), 1.03 (3H, s), 1.08 (3H, s), 1.34 (3H, s), 0.70-2.15 (21H, m), 2.93-2.97 (1H, m), 3.06-3.07 (1H, m), 3.17 (1H, d, J = 11.9 Hz), 3.53 (1H, d, J = 9.2 Hz), 4.32 (1H, d, J = 11.9 Hz), 4.38 (1H, d, J = 11.9 Hz), 4.61 (1H, d, J = 11.9 Hz), 4.63 (1H, d, J = 11.9 Hz), 5.17 (1H, t-like), 7.19-7.50 (25H, m)
MC FD (м/з): 881 (M++1)
Пример 9
3 β, 22 β- Дибензилоксиолеан-12-ен-24 (4β)- ол (соединение 13)
Соединение 12 (440 мг) растворяли в 10 мл метанола и 2 мл ацетона. К раствору добавляли концентрированную соляную кислоту (0,4 мл) и смесь кипятили с обратным холодильником в течение 30 мин. К реакционному раствору добавляли воду и затем смесь нейтрализовали 1 N гидроксидом натрия и экстрагировали трижды метиленхлоридом. Органический слой сушили над сульфатом магния, неорганическую соль удаляли фильтрованием и фильтрат концентрировали при пониженном давлении до получения масла, которое затем очищали путем колоночной хроматографии на силикагеле (проявляющая система, н-гексан: этилацетат = 10:1) с получением 231 мг (выход: 72%) соединения 13 в виде масла.
1H-ЯМР (CDCl3) δ м.д.
0.88 (3H, s), 0.89 (3H, s), 0.93 (3H, s), 0.94 (3H, s), 1.05 (3H, s), 1.11 (3H, s), 1.21 (3H, s), 0.85-2.18 (22H, m), 3.07-3.08 (1H, m), 3.18-3.24 (2H, m), 4.16 (1H, d, J = 10,5 Hz), 4,32 (1H, d, J = 11.7 Hz), 4.39 (1H, d, J = 11.7 Hz), 4.62 (1H, d, J = 11.7 Hz), 4.67 (1H, d, J = 11.7 Hz), 5.22 (1H, t-like), 7.26-7.34 (10H, m)
MC SIMS [МСВИ] (м/з): 639 (M++1)
Пример 10
3 β, 22 β-Дибензилокси-24(4 β )-оксолеан-12-ен (соединение 14)
Оксалилхлорид (0,15 мл) растворяли в 4 мл метиленхлорида и раствор охлаждали до -7oC. К охлажденному раствору добавляли раствор 0,23 мл ДМСО в метиленхлориде и смесь перемешивали в течение 10 мин. К полученному таким образом реакционному раствору добавляли раствор 128 мг соединения 13 в 2 мл метиленхлорида и смесь перемешивали при -78oC в течение 15 мин. К реакционному раствору добавляли 0,7 мл триэтиламина и смесь перемешивали при -78oC в течение 5 мин. Температура реакционного раствора постепенно повышалась до 0oC. Реакционный раствор разбавляли водой, экстрагировали метиленхлоридом, промывали насыщенным гидрокарбонатом натрия и сушили над безводным сульфатом магния. Неорганическую соль удаляли фильтрованием, фильтрат концентрировали при пониженном давлении и полученное в результате масло очищали путем колоночной хроматографии на силикагеле (проявляющая система, н-гексан: этилацетат = 10: 1) с получением 104 мг (выход: 82%) соединения 14 в виде бесцветного пенообразного вещества.
1H-ЯМР (CDCl3) δ м.д.
0.83 (3H, s), 0.89 (3H, s), 0.93 (3H, s), 0.94 (3H, s), 1.04 (3H, s), 1.10 (3H, s), 1.21 (3H, s), 0.85-2.18 (21H, m), 3.07 (1H, dd, J = 3.1 Hz, 3.1 Hz), 3.18 (1H, dd, J = 5.1 Hz, 5.1 Hz), 4,20, 4.61 (1H, each, both d, J = 11.7 Hz), 5.23 (1H, t-like), 7.22-7.35 (10H, m), 10.07 (1H, s)
MC SIMS [МСВИ] (м/з): 637 (M++1)
Пример 11
3 β, 22 β-Дибенэилоксиолеан-12-ен-24 (4β)- овая кислота (соединение 15)
Соединение 14 (20 мг) растворяли в 6 мл трет-бутанола и к этому раствору добавляли 1,5 мл 2-метил-2-бутена. К реакционному раствору добавляли раствор 250 мг хлорита натрия и 250 мг мононатрий фосфата в 2,5 мл воды и смесь затем перемешивали при комнатной температуре в течение ночи. Реакционный раствор концентрировали при пониженном давлении и экстрагировали этилацетатом, а экстракт сушили над сульфатом магния. Неорганическую соль удаляли путем фильтрования и фильтрат концентрировали при пониженном давлении до получения масла, которое затем очищали путем колоночной хроматографии на силикагеле {проявляющая система, н-гексан: этилацетат =5:1) с получением 6,8 мг {выход: 34%) соединения 15 в виде бесцветного твердого вещества.
1H-ЯМР (CDCl3) δ м.д.
0.89 (3H, s), 0.94 (3H, s), 0.95 (3H, s), 1.02 (3H, s), 1.04 (3H, s), 1.10 (3H, s), 1.40 (3H, s), 0.85-2.19 (21H, m), 3.05-3.09 (1H, m), 3.15-3.19 (1H, m), 4.32 (1H, d, J = 11-83 Hz), 4.56 (1H, d, J - 11.83 Hz), 4.61 (1H, d, J = 11-83 Hz), 4.85 (1H, d, J = 11.83 Hz), 5.23 (1H, t-like), 7.23-7.52 (10H, m).
MC ЭИ (м/э): 652 (M+)
Пример 12
Амид N-н-бутил-3 β, 22 β- дибензилоксиолеан-12-ен-24 (4β)- овой кислоты (соединение 16)
Соединение 15 (20 мг) растворяли в 1 мл безводного ДМФ. К раствору добавляли реагент БОФ (16 мг) и смесь перемешивали при комнатной температуре в течение 2 часов. К реакционному раствору добавляли н-бутиламин (0,1 мл) и смесь перемешивали при комнатной температуре в течение 1 часа. Реакционный раствор разбавляли этилацетатом, промывали дважды водой и сушили над сульфатом магния. Неорганическую соль удаляли фильтрованием и фильтрат концентрировали при пониженном давлении с получением концентрата, который затем очищали путем колоночной хроматографии на силикагеле (проявляющая система, н-гексан: этилацетат =5:1) с получением 16 мг (выход: 73%) соединения 16 в виде бесцветной пены.
1H-ЯМР (CDCl3) δ м.д.
0.89 (3H, s), 0.92 (3H, s), 0.93 (3H, s), 1.01 (3H, s), 1.04 (3H, s), 1.10 (3H, s), 1.34 (3H, s), 0.82-2.25 (28H, m), 3.08- 3.18 (4H, m), 4.32 (1H, d, J = 11.65 Hz), 4.46 (1H, d, J = 11.65 Hz), 4.61 (1H, d, J = 11.65 Hz), 4.75 (1H, d, J = 11.65 Hz), 5.23 (1H, t-like), 7.28- 7.37 (10H, m), 7.50 (1H, t-like)
MC FAB (м/з): 708 (M++1)
Пример 13
Амид N-н-бутил-3 β, 22 β- дигидроксиолеан-12-ен-24 (4β)- овой кислоты (соединение 17)
Соединение 16 (13 мг) растворяли в 1 мл метанола и 1 мл дихлорметана и к этому раствору добавляли 13 мг 10% Pd-C. Смесь каталитически восстанавливали при комнатной температуре при атмосферном давлении в течение 2 часов. Реакционный раствор фильтровали через броунмиллерит и фильтрат концентрировали при пониженном давлении с получением 10 мг (выход: 100%) соединения 17 в виде бесцветного твердого вещества.
1H-ЯМР (CDCl3) δ м.д.
0.87 (3H, s), 0.90 (3H, s), 0,92 (3H, s), 1.02 (3H, s), 1.04 (3H, s), 1.12 (3H, s), 1.38 (3H, s), 0.91-2.22 (29H, m), 3.10-3.25 (3H, m),3.40- 3.45 (1H, m), 3.77 (1H, d, J = 8.75 Hz), 5.27 (1H, t-like), 5.97 (1H, t-like)
MC ЭИ (м/э): 527 (M+)
Пример 14
3 β, 24 (4β)- Диацетокси-21 β, 22 β- изопропилидендиоксиолеан-12-ен (соединение 19)
21 β, 22 β- Изопропилидендиоксиолеан-12-ен-3 β, 24 (4β)- диол (соединение 18) (20 мг) растворяли в 0,5 мл безводного пиридина, к раствору добавляли 0,5 мл безводной уксусной кислоты и смесь перемешивали при комнатной температуре в течение ночи. К реакционному раствору добавляли ледяную воду, экстрагировали этилацетатом и сушили над сульфатом магния. Неорганическую соль удаляли фильтрованием и фильтрат концентрировали при пониженном давлении до получения концентрата, который затем очищали путем колоночной хроматографии на силикагеле (проявляющая система, н-гексан: этилацетат =3:1) с получением 19 мг (выход: 80%) соединения 19 в виде бесцветного твердого вещества.
1H-ЯМР (CDCl3)δ м.д.
0.92 (3H, s), 0.98 (9H, s), 1.00 (3H, s), 1.03 (3H, S) 1.11 (3H, s), 1.34 (3H, s), 1.49 (3H, s), 2.04 (3H, s), 2 07 (3H, s), 1.00-2.28 (19H, m), 3.73 (2H, s), 4,14 (1H, d, J= 11.5 Hz), 4.37 (1H, d, J = 11.5 Hz), 4.57-4.61 (1H, m), 5.27 (1H, t-like)
MC ЭИ (м/з): 598 (M+)
Пример 15
3 β, 24 (4β)- Диацетоксиолеан 12-ен-21 β, 22 β- диол (соединение 20)
Соединение 19 (18 мг) растворяли в 0,5 мл дихлорметана и 1 мл метанола, к раствору добавляли 0,2 мл 1 N соляной кислоты и смесь перемешивали при комнатной температуре в течение 2 часов. Реакционный раствор разбавляли дихлорметаном, промывали водой и сушили над сульфатом магния. Неорганическую соль удаляли фильтрованием и фильтрат концентрировали при пониженном давлении до получения концентрата, который затем очищали путем колоночной хроматографии на силикагеле (проявляющая система, дихлорметан: этилацетат =3:1) с получением 14 мг (выход: 79%) соединения 20 в виде бесцветного твердого вещества.
1H-ЯМР (CDCl3) δ м.д.
0.96 (3H, s), 0.97 (3H, s), 0.98 (6H, s), 1.02 (3H, s), 1.03 (3H, s), 1.15 (3H, s), 2.02 (3H, s), 2.04 (3H, s), 0.99-2.27 (21H, m), 3.41 (1H, t, J = 3.6 Hz), 3.51 (1H,
dd, J = 3.6 Hz, 7.5 Hz), 4.14 (1H, d, J = 11.7 Hz), 4.37 (1H, d, J = 11.7 Hz), 4.56-4.61 (1H, m), 5.26 (1H, t-like)
MC FAB (м/з): 581 (M+)
Пример 16
3 β, 24 (4β)- Диметоксиолеан-12-ен-21 β, 22 β- диол (соединение 22)
21 β, 22 β- Изопропилидендиокси-3 β, 24 (4β)- диметоксиолеан-12-ен (соединение 21) (15 мг) растворяли в 1 мл дихлорметана и 1 мл метанола, к раствору добавляли 0,2 мл 1 N соляной кислоты и смесь перемешивали при комнатной температуре в течение 1,5 часов. Реакционный раствор разбавляли дихлорметаном, промывали водой и сушили над сульфатом магния. Неорганическую соль удаляли фильтрованием и фильтрат концентрировали при пониженном давлении с получением 12 мг (выход: 87%) соединения 22 в виде бесцветного твердого вещества.
1H-ЯМР (CDCl3) δ м.д.
0.97 (6H, s), 0.99 (3H, s), 1.00 (3H, s), 1.02 (3H, s), 1.12 (3H, s), 1.14 (3H, s), 0.73-2.26 (21H, m), 2.72 (1H, dd, J = 4.2 Hz, 11.9 Hz), 3.27 (3H, s), 3.31 (1H, d, J = 9.7 Hz), 3.35 (3H, s), 3.41 (1H, t, J = 3.6 Hz), 3.51 (1H, dd, J = 3.6 Hz, 7.5 Hz), 3.54 (1H, d, J = 9.7 Hz), 5.27 (1H, t-like)
MC ЭИ (м/з): 502 (M+)
Пример 17
3 β, 24 (4β)- Бензилидендиоксиолеан-12-ен-21 β, 22 β- диол (соединение 23)
Сойазапогенол A (соединение 7) (1,0 г) растворяли в 10 мл безводного ДМФ и к раствору добавляли 0,38 мл диметилацеталя бензальдегида и 10 мг камфорсульфоновой, и смесь перемешивали при комнатной температуре в течение ночи. Реакционный раствор разбавляли этилацетатом, промывали насыщенным раствором гидрокарбоната натрия и сушили над сульфатом магния. Неорганическую соль удаляли фильтрованием и фильтрат концентрировали и фильтрат концентрировали при пониженном давлении до получения концентрата, который затем очищали путем колоночной хроматографии на силикагеле (проявляющая система, н-гексан: этилацетат. - 2:1) с получением 728 мг (выход: 61%) соединения 23 в виде бесцветного твердого вещества.
1H-ЯМР (CDCl3) δ м.д.
0.96 (6H, s), 0.97 (3H, s), 1.00 (3H, s), 1.02 (3H, s), 1.08 (3H, s), 1.17 (3H, s), 1.48 (3H, s), 0.90-2.47 (21H, m), 3.42 (1H, br s) 3.51 (1H, br s), 3.62 (1H, d, J = 11.0 Hz), 3.64 (1H, dd, J = 5.4 Hz, 12.1 Hz), 4.31 (1H, d, J = 11.0 Hz), 5.27 (1H, t-like), 5.78 (1H, s), 7.32-7.39 (3H, m), 7.49-7.52 (2H, m)
MC FAB (м/з): 585 (M+Na+)
Пример 18
21 β, 22 β- Диацетокси-3 β, 24 (4β)- бензилидендиоксиолеан-12-ен (соединение 24) и
21 β- ацетокси-3 β, 24 (4β)- бензилидендиоксиолеан-12-ен-22 β- ол (соединение 24)
Соединение 23 (100 мг) растворяли в 2,5 мл безводного пиридина, к раствору добавляли 1 мл безводной уксусной кислоты и смесь перемешивали при комнатной температуре в течение 3 часов. К реакционному раствору добавляли ледяную воду, экстрагировали этилацетатом и сушили над сульфатом магния. Неорганическую соль удаляли путем фильтрования и фильтрат концентрировали при пониженном давлении до получения концентрата, который затем очищали путем колоночной хроматографии на силикагеле (проявляющая система, н-гексан: этилацетат = 3: 1) с получением 23 мг (выход: 20%) соединения 24 и 69 мг (выход 65%) соединения 25 в виде бесцветных твердых веществ.
1H-ЯМР (CDCl3) δ м.д. (соединение 24)
0.80 (3H, s), 0.88 (3H, s), 0.97 (3H, s), 1.07 (3H, s), 1.08 (3H, s), 1.18 (3H, s), 1.48 (3H, s), 2.00 (3H, s), 2 07 (3H, s) 0.89-2.47 (19H, m), 3.62 (1H, d, J = 11.0 Hz), 3.64 (1H, dd, J = 5.1 Hz, 12.1 Hz), 4.30 (1H, d, J = 11.0 Hz), 4.90 (2H, s), 5.29 (1H, t-like), 5.78 (1H, s), 7.30-7.39 (3H, m), 7.49-7.52 (2H, m)
MC ЭИ (м/з): 647 (M+H)+
1H-ЯМР (CDCl3) δ м.д. (соединение 25)
0.87 (3H, s), 0.97 (3H, s), 1.00 (3H, s), 1.08 (3H, s), 1.13 (3H, s), 1,18 (3H, s), 1.49 (3H, s), 2.14 (3H, s), 0.90-2.48 (20H, m), 3.46 (1H, d, J = 3.1 Hz), 3.62 (1H, d, J = 11.3 Hz), 3.65 (1H, dd, J = 5.9 Hz, 12.8 Hz), 4.31 (1H, d, J = 11.3 Hz), 4.94 (1H, d, J = 3,1 Hz), 5.28 (1H, t-like), 5.79 (1H, s), 7.28-7.39 (3H, m), 7.49-7,52 (2H, m)
MC ЭИ (м/з): 604 (M+)
Пример 19
21 β, 22 β- Диацетоксиолеан-12ен-3 β, 24 (4β)- диол (соединение 26)
Соединение 24 (23 мг) растворяли в 1 мл метанола и 1 мл дихлорметана и к раствору добавляли 5 мг 10% Pd-C. Смесь каталитически восстанавливали при комнатной температуре при атмосферном давлении в течение 4 часов. Реакционный раствор фильтровали через броунмиллерит и фильтрат концентрировали при пониженном давлении с получением 16 мг (выход: 82%) соединения 26 в виде бесцветного твердого вещества.
1H-ЯМР (CDCl3) δ м.д.
0.79 (3H, s), 0.87 (3H, s), 0,89 (3H, s), 0.94 (3H, s), 1.07 (3H, s), 1.16 (3H, s), 1.25 (3H, s), 0.83-1.98 (18H, m), 2.00 (3H, s), 2.06 (3H, s), 2.23-2.28 (1H, m), 2,48 (1H, br s), 2.72 (1H, br s), 3.32-3.38 (1H, m), 3.45 (1H, dd, J = 5.4 Hz, 12.1 Hz), 4.20 (1H, d, J = 11.1 Hz), 4.89 (2H, s), 5.27 (1H, t-like),
MC ЭИ (м/з): 558 (M+)
Пример 20
21 β- Ацетоксиолеан-12-3 β, 22 β, 24 (4β)- триол (соединение 27)
Соединение 25 (20 мг) растворяли в 1 мл метанола и 1 мл дихлорметана и к раствору добавляли 5 мг 10% Pd-C. Смесь каталитически восстанавливали при комнатной температуре при атмосферном давлении в течение 1 часа. Реакционный раствор фильтровали через броунмиллерит и фильтрат концентрировали при пониженном давлении с получением 13 мг (выход: 79oC) соединения 27 в виде бесцветного твердого вещества.
1H-ЯМР (CDCl3) δ м.д.
0.85 (3H, s), 0.89 (3H, s), 0.96 (6H, s), 1.12 (3H, s), 1.15 (3H, s), 1.25 (3H, s), 0,84-1.98 (19H, m), 2.13 (3H, s), 2.28-2.34 (1H, m), 2.43 (1H, br s), 2.71 (1H, br s), 3.32-3.50 (3H, m), 4.21 (1H, d, J = 11.1 Hz), 4.93 (1H, d, J = 3.3 Hz), 5.26 (1H, t-like)
MC FAB (м/з): 539 (M+Na+)
Пример 21
3 β, 24 (4β)- Бензилидендиокси-21 β, 22 β- диметоксиолеан-12-ен (соединение 28),
3 β, 24 (4β)- бензилидендиокси-22 β- метоксиолеан-12-ен-21 β- ол (соединение 29) и
3 β, 24 (4β)- бензилидендиокси-21 β- метоксиолеан-12-ен-22 β- ол (соединение 30)
Соединение 23 (20 мг) растворяли в безводном ТГФ, к раствору добавляли 14 мг 60% гидрида натрия и смесь перемешивали при комнатной температуре в течение 1 часа. Затем к реакционной, смеси добавляли 32 мкл метилиодида и смесь перемешивали в течение 6 часов. К реакционному раствору добавляли воду и смесь экстрагировали этилацетатом. Экстракт сушили над сульфатом магния. Неорганическую соль удаляли фильтрованием и фильтрат концентрировали при пониженном давлении до получения концентрата, который затем очищали путем колоночной хроматографии на силикагеле (проявляющая система, н-гексан: этилацетат = 3:1) с получением 6 мг (выход: 28%) соединения 28,5 мг (выход: 26%) соединения 29 и 3 мг (выход; 14%) соединения 30 в виде твердого бесцветного вещества.
1H-ЯМР (CDCl3) δ м.д. (соединение 28)
0.94 (6H, s), 0.99 (3H, s), 1.03 (3H, s), 1.07 (3H, s), 1.15 (3H, s), 1.48 (3H, s), 0.88-2.47 (19H, m), 3.02 (2H, br s), 3.43 (3H, s), 3.46 (3H, s), 3.62 (1H, d, J = 11.5 Hz), 3.64 (1H, dd, J = 5.7 Hz, 12.1 Hz), 4.31 (1H, d, J = 11.5 Hz), 5.24 (1H, t-like), 5.78 (1H, s), 7.32- 7.39 (3H, m), 7.49-7.52 (2H, m)
MC ЭИ (м/з): 590 (M+)
1H-ЯМР (CDCl3) δ м.д. (соединение 29)
0.95 (3H, s), 1.00 (3H, s), 1.01 (3H, s), 1.03 (3H, s), 1.08 (3H, s), 1.16 (3H, s), 1.48 (3H, s), 0.90-2.48 (20H, m), 2.99 (1H, d, J = 3.3 Hz), 3.40 (3H, s), 3.57 (1H, d, J = 3.3 Hz), 3.62 (1H, d, J = 11.1 Hz), 3.64 (1H, dd, J = 5.6 Hz, 12.1 Hz), 4.30 (1H, d, J = 11.1 Hz), 5.27 (1H, t-like), 5.79 (1H, s), 7.31-7.38 (3H, m), 7.49-7.52 (2H, m)
MC ЭИ (м/з): 576 (M+)
1H-ЯМР (CDCl3) δ м.д. (соединение 30)
0.92 (3H, s), 0.95 (3H, s), 0.96 (3H, s), 0.99 (3H, s), 1.08 (3H, s), 1.15 (3H, s), 1.43 (3H, s), 0.90-2.46 (20H, m), 2.91 (1H, d, J = 3.9 Hz), 3.44 (1H, d, J = 3.9 Hz), 3.47 (3H, s), 3.62 (1H, J = 10.8 Hz), 3.64 (1H, dd, J = 5.4 Hz, 12.1 Hz), 4.30 (1H, d, J = 10.3 Hz), 5.24 (1H, t-like), 5.78 (1H, s), 7.31-7.38 (3H, m), 7.49-7.52 (2H, m)
MC ЭИ (м/з): 576 (M+)
Пример 22
21 β, 22 β- Диметоксиолеан-12-ен-3 β, 24 (4β)- диол (соединение 31)
Соединение 28 (20 мг) растворяли в 1 мл метанола и 1 мл дихлорметана и к раствору добавляли 5 мг 10% Pd-C. Смесь каталитически восстанавливали при комнатной температуре при атмосферном давлении в течение 1 часа. Реакционный раствор фильтровали через броунмиллерит и фильтрат концентрировали при пониженном давлении с получением 15 мг (выход: 89%) соединения 31 в виде бесцветного твердого вещества.
1H-ЯМР (CDCl3) δ м.д.
0.89 (3H, s), 0.93 (6H, s), 0.95 (3H, s), 1.02 (3H, s), 1.13 (3H, s), 1.25 (3H, s), 0.83-1.88 (18H, m), 2.18-2.21 (1H, m), 2.41 (1H, br s), 2.74 (1H, br s), 3.01 (2H, s), 3.32-3.50 (2H, m), 3.42 (3H, s), 3.45 (3H, s), 4.21 (1H, d, J = 11.3 Hz), 5.22 (1H, t-like),
MC ЭИ (м/з): 502 (M+)
Пример 23
22 β- Метоксиолеан-12-ен-3 β, 21 β, 24 04β)- триол (соединение 32)
Соединение 29 (13 мг) растворяли в 1 мл метанола и 1 мл дихлорметана и к раствору добавляли 5 мг 10% Pd-C. Смесь каталитически восстанавливали при комнатной температуре при атмосферном давлении в течение 2,5 часов. Реакционный раствор фильтровали через броунмиллерит и фильтрат концентрировали при пониженном давлении с получением 1 мг (выход; 68%) соединения 32 в виде бесцветного твердого вещества,
1H-ЯМР (CDCl3) δ м.д.
0.89 (3H, s), 0.94 (3H, s), 0.96 (3H, s), 0.99 (3H, s), 1.02 (3H, s), 1.14 (3H, s), 1.25 (3H, s), 0.82-1.89 (19H, m), 2.25-2.31 (2H, m), 2.41 (lH, br s), 2.73 (1H, br s), 2.98 (1H, d, J = 3.3 Hz), 3.32-3.37 (1H, m), 3.40 (3H, s), 3.42-3.48 (1H, m), 3.56 (1H, d, J = 3.3 Hz), 4.21 (1H, d, J = 11.1 Hz), 5.24 (1H, t-like)
MC ЭИ (м/з): 488 (M+)
Пример 24
21-Метоксиолеан-12-ен-3,22,24(4 )-триол (соединение 31)
Соединение 30 (8 мг) растворяли в 1 мл метанола и 1 мл дихлорметана и к раствору добавляли 5 мг 10% Pd-C. Смесь каталитически восстанавливали при комнатной температуре при атмосферном давлении в течение 1 часа. Реакционный раствор фильтровали через броунмиллерит и фильтрат концентрировали при пониженном давлении с получением 6 мг (выход: 80%) соединения 33 в виде бесцветного твердого вещества.
1H-ЯМР (CDCl3) δ м.д.
0.89 (3H, s), 0.91 (3H, s), 0.94 (3H, s), 0.95 (3H, s), 0.95 (3H, s), 1.13 (3H, s), 1.25 (3H, s), 0.82-2.18 (20H, m), 2.41 (1H, br s), 2.73 (1H, br s), 2.90 (1H, d, J = 4.0 Hz), 3.32-3.46 (3H, m), 3.46 (3H, s), 4.21 (1H, d, J = 11.1 Hz), 5.22 (1H, t-like)
MC ЭИ (м/з): 488 (М+)
Пример 25
3 β, 24 (4β)- Бензилидендиокси-21,22-диоксоолеан-12-ен (соединение 34) и
3 β- 24 β, Бензилидендиокси-22-диоксоолеан-12-ен-21 β ол (соединение 35)
Оксалилхлорид (0,15 мл) растворяли в 4 мл дихлорметана и раствор охлаждали до -78oC. Раствор 0,25 мл ДМСО в 1 мл дихлорметана добавляли к охлажденному раствору и смесь перемешивали в течение 10 мин. К реакционному раствору по каплям добавляли раствор 200 мг соединения 23 в 4 мл дихлорметана и смесь перемешивали при -78oC в течение 15 мин. К реакционному раствору добавляли 0,74 мл триэтиламина и смесь перемешивали при -78oC в течение 5 мин. Температура реакционного раствора постепенно повышалась до 0oC. К нему добавляли воду и смесь экстрагировали дихлорметаном, и экстракт промывали насыщенным водным раствором соли и сушили над сульфатом магния. Неорганическую соль удаляли фильтрованием, фильтрат концентрировали при пониженном давлении до получения концентрата, который затем очищали путем колоночной хроматографии на силикагеле (проявляющая система, дихлорметан) с получением 76 мг (выход: 37%) соединения 34 и 30 мг (выход: 15%) соединения 35 в виде желтого твердого вещества.
1H-ЯМР (CDCl3) δ м.д. (соединение 34)
0.98 (3H, s), 1.09 (3H, s), 1.14 (3H, s), 1.15 (3H, s), 1.16 (3H, s), 1.20 (3H, s), 1.49 (3H, s), 0.90-2.63 (19H, m), 3.62 (1H, d, J = 11.1 Hz), 3.64 (1H, dd,J = 5.3 Hz, 11.4 Hz), 4.29 (1H, d, J = 11.1 Hz), 5.41 (1H, t-like), 5.78 (1H, s), 7.31-7.39 (3H, m), 7.49-7.52 (2H, m)
MC ЭИ (м/з): 558 (М+)
1H-ЯМР (CDCl3) δ м.д. (соединение 35)
0.70 (3H, s), 0.97 (3H, s), 1.06 (3H, s), 1.09 (3H, s), 1.12 (3H, s), 1.27 (3H, s), 1.49 (3H, s), 0.91-2.49 (19H, m), 3.60-3.68 (3H, m), 4.19 (1H, d, J = 4.2 Hz), 4,30 (1H, d, J = 11.1 Hz), 5.32 (1H, t- like), 5.79 (1H, s), 7.30-7.40 (3H, m), 7.48-7.52 (2H, m)
MC ЭИ (м/з): 560 (M+)
Пример 26
21,22-Диоксоолеан-12-ен-3 β, 24 (4β)- диол (соединение 36)
Соединение 34 (25 мг) растворяли в 1 мл дихлорметана и 2 мл метанола, к раствору добавляли 0,5 мл 1 N соляной кислоты и смесь перемешивали при комнатной температуре в течение 4 часов. Реакционный раствор разбавляли дихлорметаном, промывали водой и сушили над сульфатом магния. Неорганическую соль удаляли фильтрованием и фильтрат концентрировали при пониженном давлении до получения концентрата, который затем очищали путем колоночной хроматографии на силикагеле (проявляющая система, н-гексан: этилацетат =1:1) с получением 12 мг (выход: 59%) соединения 36 в виде бесцветного твердого вещества.
1H-ЯМР (CDCl3) δ м.д. (соединение 34)
0.91 (3H, s), 0.94 (3H, s), 1.13 (3H, s), 1.14 (3H, s), 1.15 (3H, s), 1.18 (3H, s), 1.25 (3H, s), 0.80-2.75 (21H, m), 3.32-3.39 (1H, m), 3.41-3.49 (1H, m), 4.21 (1H, d, J = 11.0 Hz), 5.40 (1H, t-like)
MC FAB (м/з): 471 (M+H)+
Пример 21
22-Оксоолеан-12-ен-3 β, 21 β, 24 (4β)- триол (соединение 37)
Соединение 35 (25 мг) растворяли в 1 мл дихлорметана и 2 мл метанола, к раствору добавляли 0,5 мл 1 N соляной кислоты и смесь перемешивали при комнатной температуре в течение 4 часов. Реакционный раствор разбавляли дихлорметаном, промывали водой и сушили над сульфатом магния. Неорганическую соль удаляли фильтрованием и фильтрат концентрировали при пониженном давлении до получения концентрата, который затем очищали путем колоночной хроматографии на силикагеле (проявляющая система, н-гексан: этилацетат =1:1) с получением 13 мг (выход:61%) соединения 37 в виде бесцветного твердого вещества.
1H-ЯМР (CDCl3) δ м.д.
0.69 (3H, s), 0.90 (3H, s), 0.94 (3H, s), 1.05 (3H, s), 1.11 (3H, s), 1.25 (3H, s), 1.26 (3H, s), 0.80-2.73 (21H, m), 3.32-3.38 (1H, m), 3.42-3.49 (1H, m), 3.65 (1H, d, J = 4.1 Hz), 4.18 (lH, d, J = 4.1 Hz), 4.21 (1H, d, J = 11.2 Hz), 5.30 (1H, t-like)
MC FAB (M/3): 473 (M+)
Пример 28
3 β, 24 (4β)- Бензилидендиоксиолеан-12-ен-21 β, 22 β- диол (соединение 23)
3 β, 24 (4β)- бензилидендиоксиолеан-12-ен-21 α, 22 α- диол (соединение 38)
3 β, 24 (4β)- бензилидендиоксиолеан-12-ен-21 α, 22 β- диол (соединение 39)
3 β, 24 (4β)- Бензилидендиоксиолеан-12-ен-21 β, 22 α- диол (соединение 40)
Литий алюмогидрид (30 мг) суспендировали в 3 мл безводного ТГФ. К раствору при охлаждении льдом по каплям добавляли раствор соединения 34 (193 мг) в 2 мл безводного ТГФ и смесь перемешивали в течение 2 часов. К реакционному раствору добавляли насыщенный раствор сульфата натрия и перемешивали в течение некоторого времени при комнатной температуре. Нерастворимые вещества удаляли фильтрованием, фильтрат концентрировали при пониженном давлении до получения концентрата, который очищали с помощью колоночной хроматографии на силикагеле (проявляющая система, н-гексан: ТГФ = 3:1) с получением 89 мг (выход: 461) смеси соединения 23, соединения 38, 11 мг (выход: 5%) соединения 39 и 8 мг (выход: 4%) соединения 40.
1H-ЯМР (CDCl3) δ м.д. (соединение 39)
0.85 (3H, s), 0.89 (3H, s), 0.95 (3H, s), 1.08 (6H, s), 1.10 (3H, s), 1.48 (3H, s), 0.85-2.48 (21H, m), 3.21-3.44 (2H, m), 3.60-3,68 (2H, m), 4.30 (1H, d, J = 11.3 Hz), 5.30 (1H, t-like), 5.78 (1H, s), 7.31- 7.40 (3H, m), 7.48-7.53 (2H, m)
MC FAB (м/з): 585 (M+Na+)
1H-ЯМР (CDCl3)δ м.д. (соединение 40)
0.91 (3H, s), 0.97 (3H, s), 1.00 (3H, s), 1.01 (3H, s), 1.07 (3H, s), 1.16 (3H, s), 1.48 (3H, s), 0.85-2,48 (21H, m), 3.27-3.35 (2H, m), 3.60-3.68 (2H, m), 4.30 (1H, d, j = 11.3 Hz), 5.25 (1H, t-like), 5.78 (1H, s), 7.30-7.39 (3H, m), 7.48-7.52 (2H, m)
MC FAB (м/з): 585 (M+Na+)
Пример 29
Олеан-12-ен-3 β, 21 α, 22 β, 24 (4β)- тетраол (соединение 41)
Соединение 39 (11 мг) растворяли в 0,5 мл дихлорметана и 1 мл метанола, к раствору добавляли 0,1 мл 1 N соляной кислоты и смесь перемешивали при комнатной температуре в течение 4 часов. Реакционный раствор разбавляли дихлорметаном, промывали водой и сушили над сульфатом магния. Неорганическую соль удаляли фильтрованием и фильтрат концентрировали при пониженном давлении до получения концентрата, который затем очищали путем колоночной хроматографии на силикагеле (проявляющая система, н-гексан: этилацетат =1:1) с получением 3 мг (выход: 34%) соединения 41 в виде бесцветного твердого вещества.
1H-ЯМР (CDCl3) δ м.д.
0.83 (3H, s), 0.87 (3H, s), 0.90 (3H, s), 0.91 (3H, s), 1.05 (3H, s), 1.08 (3H, s), 1,23 (3H, s), 0.85-2.27 (23H, m), 3.20-3.35 (3H, m), 3.40-3.46 (1H, m), 4.19 (1H, d, J = 11.3 Hz), 5.26 (1H, t-like)
MC ЭИ (м/з): 474 (M+)
Пример 30
Олеан-12-ен-3 β, 21 β, 22 α, 24 (4β)- тетраол (соединение 42)
Соединение 40 (9 мг) растворяли в 0.5 мл дихлорметана и 1 мл метанола, к раствору добавляли 0,1 мл 1 N соляной кислоты и смесь перемешивали при комнатной температуре в течение 4 часов. Реакционный раствор разбавляли дихлорметаном, промывали водой и сушили над сульфатом магния. Неорганическую соль удаляли фильтрованием и фильтрат концентрировали при пониженном давлении до получения концентрата, который затем очищали путем колоночной хроматографии на силикагеле (проявляющая система, н-гексан: этилацетат - 1:1) с получением 4 мг (выход: 58%) соединения 42 в виде бесцветного твердого вещества.
1H-ЯМР (CDCl3) δ м.д.
0.89 (3H, s), 0.90 (3H, s), 0.93 (3H, s), 0.99 (6H, s), 1.14 (3H, s), 1.25 (3H, s), 0.82-2.44 (21H, m), 3.00-3.05 (1H, m), 3.10-3.14 (1H, m), 3.22-3.47 (3H, m), 3.42 (1H, dd, J = 6.6 Hz, 11.0 Hz), 4.20 (1H, d, J = 11.0 Hz), 5.23 (1H, t-like)
MC ЭИ (м/з): 474 (M+)
Пример 31
21 β- Ацетокси-3 β, 24 (4β)- бензилидендиокси-22-оксоолеан-12-ен (соединение 43)
Соединение 43 (49 мг, выход: 54%) получали из 91 мг соединения 25 тем же самым способом, что и в примере 18.
1H-ЯМР (CDCl3) δ м.д.
0.86 (3H, s), 0.97 (3H, s), 1.03 (3H, s), 1.04 (3H, s), 1.08 (3H, s), 1.27 (3H, s), 1.49 (3H, s), 2.18 (3H, s), 0.90-2.49 (19H, m), 3.60- 3.68 (2H, m), 4.30 (1H, d, J = 11.3 Hz), 5.32 (2H, t-like), 5.78 (1H, s), 7.31-7.40 (3H, m), 7.48-7.52 (2H, m)
MC ЭИ (м/з): 602 (M+)
Пример 32
21 β- Ацетокси-3 β, 24 (4β)- бензилидендиокси-22 β- мезилоксиолеан-12-ен (соединение 44)
Соединение 25 (316 мг) растворяли в 8 мл безводного пиридина, к раствору добавляли 162 мкл метансульфонилхлорида и каталитическое количество 4-ДМАФ и смесь перемешивали при комнатной температуре в течение ночи. К реакционному раствору добавляли ледяную воду, смесь экстрагировали этилацетатом и экстракт сушили над сульфатом магния. Неорганическую соль удаляли фильтрованием и фильтрат концентрировали при пониженном давлении до получения твердого вещества, которое затем промывали смешанным раствором н-гексана и этилацетата с получением 331 мг (выход: 93%) соединения 44.
1H-ЯМР (CDCl3) δ м.д.
0.91 (3H, s), 0.98 (3H, s), 1.00 (3H, s), 1.08 (3H, s), 1.10 (3H, s), 1.19 (3H, s), 1.49 (3H, s), 2.14 (3H, s), 0.93-2.48 (18H, m), 3.08 (3H, s), 3.60-3.68 (2H, m), 3.72-3.78 (1H, m), 4.30 (1H, d, J = 11.5 Hz), 4.59 (1H, d, J = 3.1 Hz), 4.97 (1H, d, J = 3.1 Hz), 5.30 (1H, t-like), 5.78 (1H, s), 7.30-7.39 (3H, m), 7.49-7.52 (2H, m)
MC ТНФ (м/з): 700 (M+NH4+)
Пример 33
3 β, 24 (4β)- Бензилидендиоксиолеан-12-ен-21 β- ол (соединение 45)
Триэтилборлития гидрид (1,0 М ТГФ раствор, 4,6 мл) добавляли к 315 мг соединения 44 при охлаждении на льду и смесь перемешивали при комнатной температуре в течение 15 мин. К реакционному раствору добавляли воду и смесь экстрагировали этилацетатом, и экстракт сушили над сульфатом магния. Неорганическую соль удаляли фильтрованием и фильтрат концентрировали при пониженном давлении до получения концентрата, который затем очищали путем колоночной хроматографии на силикагеле (проявляющая система, н-гексан: этилацетат = 5: 1) с получением 221 мг (выход: 88%) соединения 45 в виде пенистого вещества.
1H-ЯМР (CDCl3) δ м.д.
0.85 (3H, s), 0.94 (6H, s), 0.96 (3H, s), 1.08 (3H, s), 1.18 (3H, s), 1.48 (3H, s), 0.90-2.48 (22H, m), 3.47 (1H, br s), 3.62 (1H, d, J = 11.3 Hz), 3.64 (1H, dd, J = 5.1 Hz, 12.1 Hz), 4.30 (1H, d, J = 11.3 Hz), 5.24 (1H, t-like), 5.78 (1H, s), 7.30-7.39 (3H, m), 7.49-7.52 (2H, m)
MC ТНФ (м/з): 564 (M+NH4+)
Пример 34
Олеан-12-ен-3 β, 21 β, 24 (4β)- триол (соединение 46)
Соединение 46 (18 мг, выход:46%) в виде бесцветного твердого вещества получали из 46 мг соединения 45 таким же образом, как и в примере 12.
1H-ЯМР (CDCl3) δ м.д.
0.84 (3H, s), 0.89 (3H, s), 0.92 (3H, s), 0.93 (6H, s), 1.16 (3H, s), 1.24 (3H, s), 0.86-2.48 (24H, m), 3.33 (1H, d, J= 11.3 Hz), 3.39-3.48 (2H, m), 4.20 (1H, d, J = 11.3 Hz), 5.22 (1H, t-like)
MC ТНФ (м/з): 476 (M+NH4+)
Пример 35
3 β, 24 (4β)- Бензилиденокси-21-оксоолеан-12-ен (соединение 47)
Соединение 47 (56 мг, выход: 51%) а виде бесцветного твердого вещества получали из 110 мг соединения 45 таким же образом, как и в примере 25.
1H-ЯМР (CDCl3) δ м.д. (соединение 34)
0.96 (3H, s), 0.98 (3H, s), 1.02 (3H, s), 1.08 (3H, s), 1.13 (3H, s), 1.21 (3H, s), 1.48 (3H, s), 0.90-2.50 (21H, m), 3.62 (1H, d, J = 11.3 Hz), 3.64 (1H, dd, J = 4.9 Hz, 12.6 Hz), 4.30 (1H, d, J = 11.3 Hz), 5.34 (1H, t-like), 5.79 (1H, s), 7.30-7.39 (3H, m), 7.49-7.53 (2H, m)
MC FAB (м/з): 567 (M+Na+)
Пример 36
3 β, 24 (4β)- Бензилидендиоксиолеан-12-ен-21 α- ол (соединение 48)
Соединение 48 (11 мг, выход: 20%) в виде бесцветного твердого вещества получали из 55 мг соединения 47 таким же образом, как и в примере 28.
1H-ЯМР (CDCl3)δ м.д. (соединение 34)
0.86 (3H, s), 0.87 (3H, s), 0.96 (3H, s), 0.97 (3H, s), 1.08 (3H, s), 1.14 (3H, s), 1.48 (3H, s), 0.90-2.48 (22H, m), 3.52 (1H, dd, J = 4.6 Hz, 12.1 Hz), 3.62 (1H, d, J = 11.0 Hz), 3.64 (1H, dd, J = 5.1 Hz, 11.8 Hz) 4.30 (1H, d, J = 11.0 Hz), 5.23 (1H, t-like), 5.78 (1H, s), 7.30-7.39 (3H, m), 7.49-7.53 (2H, m)
MC FAB (м/з): 569 (M+Na+)
Пример 37
Олеан-12-ен-3 β, 21 α, 24 (4β)- триол (соединение 49)
Соединение 49 (7 мг, выход: 82%) в виде бесцветного твердого вещества получали из 11 мг соединения 48 таким же образом, как и в примере 19.
1H-ЯМР (CDCl3) δ м.д.
0.85 (3H, s), 0.86 (3H, s), 0.89 (3H, s), 0.92 (6H, s), 0.96 (3H, s), 1.12 (3H, s), 1.23 (3H, s), 0.83-2.21 (21H, m), 3.32 (1H, d, J = 11.0 Hz), 3.39-3.45 (1H, m), 3.50 (1H, dd, J = 5.6 Hz, 11.8 Hz), 4.19 (1H, d, J = 11.0 Hz), 5.21 (1H, t-like)
MC ТНФ (м/з): 459 (M+H)+
Пример 38
3 β, 24 (4β)- Изопропилидендиокси-22 β- тозилоксиолеан-12-ен (соединение 50)
Соединение 1 (500 мг) растворяли в пиридине, к раствору добавляли 287 мг п-толуолсульфонилхлорида и каталитическое количество 4-диметиламинопиридина и смесь перемешивали при комнатной температуре в течение ночи. К реакционному раствору добавляли воду, смесь экстрагировали этилацетатом и экстракт сушили над сульфатом магния. Неорганическую соль удаляли фильтрованием и фильтрат концентрировали при пониженном давлении с получением 654 мг (выход 100%) соединения 50 в виде бесцветного твердого вещества.
1H-ЯМР (CDCl3) δ м.д.
0.76 (3H, s), 0.84 (9H, s), 0.94 (3H, s), 0.96 (3H, s), 1.10 (3H, s), 1.14 (3H, s), 1.21 (3H, s), 1.37 (3H, s), 1.44 (3H, s), 0.78-2.10 (21H, m), 2.45 (3H, s), 3.22 (1H, d, J = 11.65 Hz), 3.43-3.46 (1H, m), 4.03 (1H, d, J = 11.65 Hz), 4.34-4.37 (1H, m), 5.22 (1H, t-like)
MC FD (м/з): 652 (M+)
Пример 39
3 β, 24 (4β)- Изопропилидендиоксиолеан-12,21-диен (соединение 51)
Триэтилборогидридлития (1,0 M ТГФ раствор, 2 мл) добавляли к 65 мг соединения 50 при охлаждении на льду и смесь перемешивали при 65oC в течение 1 часа. Температура реакционного раствора возвращалась к комнатной температуре. К реакционному раствору добавляли воду, смесь экстрагировали этилацетатом, и экстракт сушили над сульфатом магния. Неорганическую соль удаляли фильтрованием и фильтрат концентрировали при пониженном давлении с получением твердого вещества, которое затем очищали путем колоночном хроматографии на силикагеле (проявляющая система, н-гексан: этилацетат = 10:1) с получением 38 мг (выход: 79%) соединения 51 в виде бесцветного твердого вещества.
1H-ЯМР (CDCl3) δ м.д.
0.88 (3H, s), 0.96 (9H, s), 0.98 (3H, s), 0.99 (3H, s), 1.12 (3H, s), 1.17 (3H, s), 1.22 (3H, s), 1.38 (3H, s), 1.44 (3H, s), 0.90-2.13 (19H, m), 3.23 (1H, d, J = 11.54 Hz), 3.45-3.48 (1H, m), 4.05 (1H, d, J = 11.54 Hz), 5.20-5.32 (3H, m)
MC ЭИ (м/з): 480 (М+)
Пример 40
Олеан-12,21-диен-3 β, 24 (4β)- диол (соединение 52)
Соединение 51 (48 мг) растворяли в 1 мл метанола и 1 мл дихлорметана, к раствору добавляли 0,5 мл 1 N соляной кислоты и смесь перемешивали в течение 1 часа. Реакционный раствор разбавляли дихлорметаном, промывали водой и сушили над сульфатом магния. Неорганическую соль удалили фильтрованием и фильтрат концентрировали при пониженном давлении с получением 36 мг (выход: 82%) соединения 52 в виде бесцветного твердого вещества.
1H-ЯМР (CDCl3) δ м.д.
0.87 (3H, s), 0.90 (3H, s), 0.94 (3H, s), 0.95 (3H, s), 0.98 (3H, s), 1.11 (3H, s), 1.25 (3H, s), 0.84-2.13 (19H, m), 2.36 (1H, d, J = 4.10 Hz), 2.68 (1H, d, J = 6.67 Hz), 3.32-3.37 (1H, m), 3.43-3.48 (1H, m), 4.21 (1H, d, J = 11.28 Hz), 5.20-5.30 (3H, m)
MC ЭИ (м/з): 440 (M+)
Пример 41
Олеан-12-ен-3 β 24 (4β) диол (соединение 53)
Соединение 51 (30 мг) растворяли в 2 мл метанола и 1 мл дихлорметана и к раствору добавляли 5 мг 20% Pd(OH)2-C. Смесь каталитически восстанавливали при атмосферном давлении в течение ночи. Реакционный раствор фильтровали и фильтрат концентрировали при пониженном давлении с получением 26 мг (выход: 93%) соединения 53 в виде бесцветного твердого вещества.
1H-ЯМР (CDCl3) δ- м.д.
0.82 (3H, s), 0.87 (6H, s), 0.89 (3H, s), 0.93 (3H, s), 1.13 (3H, s), 1.25 (3H, s), 1.25 (3H, s), 0.78-2.03 (23H, m), 2.37 (1H, d, J = 4.16 Hz), 2.71 (1H, dd, J = 2.50 Hz, 8.88 Hz), 3.32-3.37 (1H, m), 3.42-3.48 (1H, m), 4.21 (1H, d, J = 10.88 Hz), 5.18 (1H, t-like)
MC ЭИ (м/з): 442 (M+)
Пример 42
3 β,-Бензоилоксиолеан-12-ен-24 (4β)- ол (соединение 56)
Соединение 53 (1,00 г, 2,26 ммоль) растворяли в 10 мл пиридина. К раствору добавляли тритилхлорид (881 мг, 3,16 ммоль) и смесь кипятили с обратным холодильником в течение 5 часов. Растворитель удаляли с помощью дистилляции, к остатку добавляли воду и смесь экстрагировали этилацетатом, экстракт сушили над сульфатом натрия. Неорганическую соль удаляли фильтрованием и фильтрат концентрировали при пониженном давлении с получением 1,5 г соединения 54 (неочищенный продукт). Соединение 54 (неочищенный продукт, 1,5 г) растворяли в 20 мл дихлорметана, к раствору добавляли 690 мг 4-ДМАФ и 476,5 мг бензоилхлорида и смесь перемешивали в течение 2 часов. Реакционный раствор разбавляли дихлорметаном, промывали водой и сушили над сульфатом натрия. Неорганическую соль удаляли фильтрованием и фильтрат концентрировали при пониженном давлении с получением 1,7 г соединения 55 (неочищенный продукт). Соединение 55 (неочищенный продукт, 1,7 г) растворяли в 20 мл метанола и 50 мл ацетона. К раствору добавляли концентрированную соляную кислоту (0.5 мл) и смесь перемешивали при 70oC в течение 2 часов. Реакционный раствор затем нейтрализовали 1 N гидроксидом натрия и растворитель удаляли с помощью дистилляции. К остатку затем добавляли воду и смесь экстрагировали этилацетатом, а экстракт сушили над сульфатом натрия. Неорганическую соль удаляли фильтрованием и фильтрат концентрировали при пониженном давлении с получением неочищенного продукта, который затем очищали путем колоночной хроматографии на силикагеле (проявляющая система, н-гексан: этилацетат = 10:1) с получением 818 мг (выход; 66%) соединения 56 в виде бесцветного твердого вещества.
1H-ЯМР (CDCl3) δ м.д.
0.84 (3H, s), 0.87 (3H, s), 0.88 (3H, s), 0.98 (3H, s), 1.14 (3H, s), 1.15 (3H, s), 1.60 (3H, s), 0.80-2.10 (24H, m), 3.59 (1H, t, J = 10.7 Hz), 4.26 (1H, dd, J = 11.7 Hz, 2.6 Hz), 4.92 (1H, dd, J = 8.6 Hz, 7.6 Hz), 5.19 (1H, t, J = 3.6 Hz), 7.43-7.60 (3H, m), 7.96-8.00 (2H, m).
FABMS (м/з): 569 (M++Na)
Пример 43
3 β- Бензоилокси-24 (4β)- оксоолеан-12-ен (соединение 57)
Соединение 56 (1,50 мг) растворяли в 5 мл дихлорметана, к раствору добавляли 71,1 мг хлорхроматапиридиния и смесь перемешивали в течение 1 часа. Через один час после начала перемешивания к реакционному раствору добавляли 71,1 мг хлорхроматапиридиния и смесь дополнительно перемешивали в течение 1 часа. К реакционному раствору добавляли силикагель с последующим фильтрованием. Фильтрат концентрировали при пониженном давлении с получением неочищенного продукта, который затем очищали путем колоночной хроматографии на силикагеле (проявляющая система, н-гексан: этилацетат =20:1) с получением 142 мг (выход: 95%) соединения 57 в виде бесцветного твердого вещества.
1H-ЯМР (CDCl3) δ м.д.
0.83 (3H, s), 0.88 (3H, s), 0.91 (3H, s), 0.96 (3H, s), 1,16 (3H, s), 1.17 (3H, s), 1.58 (3H, s), 0.80-2.20 (23H, m), 4.93 (1H, dd, J = 11.4 Hz, 5.9 Hz), 5.20 (1H, t, J = 3.5 Hz), 7.41-7.59 (3H, m), 7.97-8.00 (2H, m), 10.23 (1H, s).
FABMS (м/з): 545 (M++1)
Пример 44
24 (4β)- Оксоолеан-12-ен-3 β- ол (соединение 58)
Соединение 57 (121 мг, 0,222 ммоль) растворяли в 3 мл метанола и 4 мл ТГФ, к раствору добавляли 0,5 мл 1 N гидроксида натрия и смесь перемешивали в течение 3 час. Реакционный раствор нейтрализовали 1 N соляной кислотой и растворитель удаляли с помощью дистилляции. К остатку добавляли воду, смесь экстрагировали этилацетатом и экстракт сушили над сульфатом натрия. Неорганическую соль удаляли фильтрованием и фильтрат концентрировали при пониженном давлении с получением неочищенного продукта, который затем очищали с помощью колоночной хроматографии на силикагеле (проявляющая система, н-гексан: этилацетат = 12:1) с получением 75,4 мг (выход: 77%) соединения 58 в виде бесцветного твердого вещества.
1H-ЯМР (CDCl3) δ м.д.
0.83 (3H, s), 0.87 (9H, s), 0.99 (3H, s), 1.14 (3H, s), 1.29 (3H, s), 0.80-2.10 (23H, m), 3.10-3.25 (2H, m), 5.19 (1H, t, J = 3.6 Hz), 9.77 (1H, d, J = 2.3 Hz).
FABMS (м/з): 441 (M++1)
Пример 45
24 (4β)- Метилолеан-12-ен-3 β, 24 (4β)- диол (соединение 59)
Соединение 58 (50,0 мг, 0,114 ммоль) растворяли в 2 мл ТГФ и раствор охлаждали до -78oC. К раствору при той же температуре добавляли эфирный раствор MeLi (0,42 мл, 1,08 ммоль/мл). Температуру смеси постепенно повышали до 0oC в течение срока в 30 мин с последующим перемешиванием при 0oC в течение дополнительно в течение 10 мин. К реакционному раствору добавляли воду и смесь экстрагировали этилацетатом, и экстракт сушили над сульфатом натрия. Неорганическую соль удаляли фильтрованием и фильтрат концентрировали при пониженном давлении с получением неочищенного продукта, который затем очищали путем препаративной ТСХ (проявляющая система, н-гексан: ТГФ = 2,2:1) с получением 39,0 мг (выход: 75%) соединения 59 в виде бесцветного твердого вещества.
1H-ЯМР (CDCl3) δ м.д.
0.83 (3H, s), 0.87 (6H, s), 0.96 (3H, s), 0.97 (3H, s), 1.12 (3H, s), 1.17 (3H, s), 1.23 (3H, d, J = 6.3 Hz), 0.80-2.10 (25H, m), 3.42 (1H, dd, J = 12.1 Hz, 3.8 Hz), 4.57 (1H, q, J = 6.3 Hz), 5.19 (1H, t, J = 3.6 Hz).
FABMS (м/з): 479 (M++Na)
Пример 46
3 β- Бензилоксиолеан-12-ен-24 (4β)- овая кислота (соединение 60)
Соединение 57 (300 мг) растворяли в 15 мл трет-бутанола и к этому раствору добавляли 2,93 мл 2-метил-2-бутена. К смеси добавляли раствор 250 мг хлорита натрия и 430 мг мононатрий фосфата в 2 мл воды, и смесь затем перемешивали при комнатной температуре в течение ночи. Реакционный раствор концентрировали при пониженном давлении, концентрат экстрагировали этилацетатом и экстракт сушили над сульфатом натрия. Неорганическую соль удаляли фильтрованием и фильтрат концентрировали под пониженным давление до получения масла, которое очищали путем колоночной хроматографии на силикагеле (проявляющая система, н-гексан: этилацетат =4:1) с получением 261 мг (выход: 85%) соединения 60 в виде бесцветного твердого вещества.
1H-ЯМР (CDCl3) δ м.д.
0.84 (3H, s), 0.87 (3H, s), 0.88 (3H, s), 1.00 (3H, s), 1.01 (3H, s), 1.16 (3H, s), 1.37 (3H, s), 0.80-2.60 (23H, m), 4.81 (1H, dd, J = 12.3 Hz, 4.3 Hz), 5.21 (1H, t, J = 3.4 Hz), 7.40-7.58 (3H, m), 8.05-8.08 (2H, m)
FABMS (м/з): 583 (M++Na)
Пример 47
Метил{олеан-12-ен-3 β- ол-24 (4β) ат} (соединение 62)
Соединение 60 (251 мг) растворяли в 1 мл метанола и 6 мл ТГФ, к раствору добавляли 1 мл 4 N гидроксида натрия и смесь перемешивали при комнатной температуре в течение ночи. Затем доводили значение pH до 3 путем добавления 1 N соляной кислоты и растворитель удаляли с помощью дистилляции. К остатку добавляли воду, смесь экстрагировали этилацетатом и экстракт сушили над сульфатом натрия. Неорганическую соль удаляли фильтрованием и фильтрат концентрировали при пониженном давлении с получением концентрата, который растворяли в 6 мл метанола и 6 мл ТГФ. К этому раствору добавляли избыточное количество раствора триметилсилилдиазометана и смесь перемешивали при комнатной температуре в течение 1 мин. Реакционный раствор концентрировали при пониженном давлении с получением неочищенного продукта, который затем очищали путем колоночной хроматографии на силикагеле (проявляющая система, н-гексан: этилацетат = 15:1) с получением 136 мг (выход: 65%) соединения 62 в виде бесцветного твердого вещества.
1H-ЯМР (CDCl3) δ м.д.
0.79 (3H, s), 0.83 (3H, s), 0.87 (3H, s), 0.98 (3H, s), 1.13 (3H, s), 1.41 (3H, s), 1.58 (3H, s), 0.80-2.10 (23H, m), 3.09 (1H, td, J = 12.0 Hz, 4.5 Hz), 3.34-3.38 (1H, m), 3.68 (3H, s), 5.19 (1H, t, J = 3.5 Hz).
FABMS (м/з): 583 (M++Na)
Пример 48
24 (4β)- Метил-24 (4β) оксоолеан-12-ен-3 β- ол (соединение 63) и 24 (4β), 24 (4β) -Диметилолеан-12-ен-3 β, 24 (4β)- диол (соединение 63)
Соединение 62 (30,0 мг) растворяли в 2 мл ТГФ и раствор охлаждали до - 78oC. К раствору при той же самой температуре добавляли эфирный раствор MeLi (0,71 мл, 1,08 ммоль/мл). Температуру смеси постепенно повышали до комнатной температуры в течение срока в 30 мин и смесь перемешивали при комнатной температуре в течение 4 часов. К реакционному раствору добавляли воду, смесь экстрагировали этилацетатом и экстракт сушили над сульфатом натрия. Неорганическую соль удаляли фильтрованием и фильтрат концентрировали при пониженном давлении с получением неочищенного продукта, который затем очищали с помощью препаративной ТСХ (проявляющая система, н-гексан: ТГФ = 6:1) с получением 16,7 мг (выход: 58%) соединения 63 и 3,4 мг (выход: 11%) соединения 64 в виде бесцветного твердого вещества.
1H-ЯМР (CDCl3) δ м.д. (соединение 63)
0.81 (3H, s), 0.83 (3H, s), 0.87 (3H, s), 1.01 (3H, s), 1.14 (3H, s), 1.39 (3H, s), 1.59 (3H, s), 2.18 (3H, s), 0.80-2.20 (23H, m), 3.05 (1H, td, J = 11.9 Hz, 4.1 Hz), 3.18-3.22 (1H, m), 5.20 (1H, t, J = 3.6 Hz).
FABMS (м/з): 454 (M++Na)
1H-ЯМР (CDCl3) δ м.д.
0.83 (3H, s), 0.87 (6H, s), 1.02 (3H, s), 1.12 (3H, s), 1.19 (3H, s), 1.22 (3H, s), 1.41 (3H, s), 1.42 (3H, s), 0.80-2.40 (25H, m), 3.37- 3.43 (1H, m), 5.21 (1H, t, J = 3.6 Hz).
FABMS (м/з): 493 (M++Na)
Пример 49
22-Метиленолеан-12-ен-3-ол (соединение 65)
Соединение 58 (25 мг) растворяли в 1 мл ТГФ, к этому раствору при 0oC добавляли 0,57 мл раствора реактива Теббе 0,5 ммоль/мл и смесь перемешивали при 0oC в течение 30 мин, а затем при комнатной температуре в течение ночи. К реакционному раствору добавляли диэтиловый эфир и 1 N NaOH с последующим фильтрованием. Фильтрат концентрировали при пониженном давлении. К концентрату добавляли воду, смесь экстрагировали этилацетатом и затем сушили над сульфатом натрия. Неорганическую соль удаляли фильтрованием и фильтрат концентрировали при пониженном давлении с получением неочищенного продукта, который затем очищали с помощью препаративной ТСХ (проявляющая система, н-гексан: ТГФ = 5:1) с получением 17,9 мг (выход: 72%) соединения 65 в виде бесцветного твердого вещества.
1H-ЯМР (CDCl3) δ м.д.
0.83 (3H, s), 0.87 (6H, s), 0.93 (3H, s), 0.94 (3H, s), 1.14 (3H, s), 1.18 (3H, s), 0.80-2.10 (24H, m), 3.20-3.35 (1H, m), 5.09 (1H, dd, J = 17.6 Hz, 1.7 Hz), 5.17-5.24 (2H, m), 6.06 (1H, dd, J = 17.6 Hz, 11.2 Hz).
FABMS (м/з): (M++Na)
Пример 50
21-Оксоолеан-12-ен-3 β, 24 (4β)- диол (соединение 66)
Соединение 66 (6 мг, выход: 100%) получали из 7 мг соединения 47 таким же образом, как и в примере 19.
1H-ЯМР (CDCl3) δ м.д.
0.89 (3H, s), 0.93 (3H, s), 0.94 (3H, s), 1.00 (6H, s), 1.11 (3H, s), 1.20 (3H, s), 1.25 (3H, s), 0.83-2.50 (23H, m), 3.34 (1H, d, J = 11.0 Hz), 3.45 (1H, dd, J = 3.8 Hz, 11.0 Hz), 4.21 (1H, d, J = 11.0 Hz), 5.32 (1H, t-like)
MC ТСФ (м/з): 474 (M++NH4+)
Пример 51
22 β- Этилмалонилокси-3 β, 24 (4β)- изопропилидендиоксиолеан-12-ен (соединение 67)
Соединение 3 (100 мг) растворяли в 3 мл дихлорметана, к раствору добавляли 37 мг 4-диметиламинопиридина и 38 мкл этилмалонилхлорида и смесь перемешивали при комнатной температуре в течение 30 мин. К реакционному раствору добавляли насыщенный раствор гидрокарбоната натрия и реакционный раствор дважды экстрагировали дихлорметаном. Органический слой промывали насыщенным раствором соли и сушили над сульфатом магния. Неорганическую соль удаляли фильтрованием и фильтрат концентрировали при пониженном давлении до получения концентрата, который затем очищали с помощью колоночной хроматографии на силикагеле (проявляющая система, н-гексан: этилацетат =5:1) с получением 85 мг (выход: 67%) соединения 67 в виде бесцветного твердого вещества.
1H-ЯМР (CDCl3) δ м.д.
0.83 (3H, s), 0.90 (3H, s), 0.98 (3H, s), 0.99 (3H s), 1.15 (3H, s), 1.16 (3H, s), 1.22 (3H, s), 1.28 (3H t, J = 7.2 Hz), 1.38 (3H, s), 1.44 (3H, s), 0.86-2.21 (21H, m), 3.23 (1H, d, J = 11.5 Hz), 3.35 (2H, s), 3.46 (1H, dd, J = 4.6 Hz, 9.5 Hz), 4.05 (1H, d, J = 11.5 Hz), 4.19 (2H, q, J = 7.2 Hz), 4.73 (1H, t-like), 5.32 (1H, t-like)
МС ТСФ (м/з): 635 (M++Na+)
Пример 52
22 β- Малонилоксиолеан-12-ен-3 β, 24 (4β)- диол (соединение 68)
Соединение 67 (73 мг) растворяли в 5 мл этанола и 1 мл дихлорметана, к раствору добавляли 0,8 мл 1 N гидроксида натрия и смесь перемешивали при комнатной температуре в течение 1 часа. Реакционный раствор подкисляли 1 N соляной кислотой и экстрагировали дихлорметаном. Экстракт концентрировали при пониженном давлении. Концентрат растворяли в 2 мл метанола и 1 мл дихлорметана, к смеси добавляли 0,5 мл 1 N соляной кислоты и смесь перемешивали при комнатной температуре в течение 30 мин. К реакционному раствору добавляли воду и смесь экстрагировали дихлорметаном, экстракт затем сушили над сульфатом магния. Неорганическую соль удаляли фильтрованием и фильтрат концентрировали при пониженном давлении с получением 54 мг (выход: 83%) соединения 68 в виде бесцветного твердого вещества.
1H-ЯМР (CDCl3) δ м.д.
0.81 (3H, s), 0.87 (3H, s), 0.88 (3H, s), 0.91 (3H, s), 0.96 (3H, s), 1.12 (3H, s), 1-22 (3H, s), 0.84-2.20 (21H, m), 3.28-3.44 (2H, m), 3.33 (2H, s), 4.18 (lH, d, J = 11.3 Hz), 4.71 (1H, t-like), 5.22 (1H, t-like)
MC FAB (м/з): 567 (M++Na+)
Пример 53
3 β, 24 (4β)- Изопропилидендиокси-22 β-0 метоксикарбонил пропокси-олеан-12-ен (соединение 69)
Соединение 3 (50 мг) растворяли в 1 мл безводного ДМФ, к раствору добавляли 20 мг 60% гидрида натрия и смесь перемешивали при комнатной температуре в течение 2,5 часов. Затем к реакционному раствору добавляли 87 мкл триметил-4-бромортобутирата и смесь перемешивали при 50oC в течение ночи. К реакционному раствору добавляли этилацетат и смесь дважды промывали водой и сушили над сульфатом магния. Неорганическую соль удаляли фильтрованием и фильтрат концентрировали при пониженном давлении до получения концентрата, который затем очищали с помощью колоночной хроматографии на силикагеле (проявляющая система, н-гексан: этилацетат = 5:1) с получением 15 мг (выход: 24%) соединения 69 в виде бесцветного твердого вещества.
1H-ЯМР (CDCl3) δ м.д.
0.86 (3H, s), 0.88 (3H, s), 0.99 (3H, s), 1.00 (3H, s), 1.12 (3H, s), 1.16 (3H, s), 1.22 (3H, s), 1.38 (3H, s), 1.44 (3H, s), 0.82-2.13 (23H, m), 2.43 (2H, t, J = 7.2 Hz), 2.86-2.89 (1H, m), 3.16-3.22 (lH, m), 3.23 (1H, d, J = 11.5 Hz), 3.46 (1H, dd, J = 4.6 Hz, 9.5 Hz), 3.52-3.58 (1H, m), 3.67 (3H, s), 4.05 (1H, d, J = 11.5 Hz), 5.23 (1H, t-like)
MC ТСФ (м/з): 599 (M+H)+
Пример 54
22 β- Метоксикарбонилпропоксиолеан-12-ен-3 β, 24 (4β)- диол (соединение 70)
Соединение 69 (15 мг) растворяли в 1 мл метанола и 0,5 мл дихлорметана, к раствору добавляли 0,2 мл 1 N соляной кислоты и смесь перемешивали при комнатной температуре в течение 15 мин. Реакционный раствор экстрагировали дихлорметаном и экстракт сушили над сульфатом магния. Неорганическую соль удаляли фильтрованием и фильтрат концентрировали при пониженном давлении с получением 13 мг (выход: 94%) соединения 70 в виде бесцветного твердого вещества.
1H-ЯМР (CDCl3)δ м.д.
0.86 (3H, s), 0.87 (3H, s), 0.89 (3H, s), 0.94 (3H, s), 1.00 (3H, s), 1.11 (3H, s), 1.25 (3H, s), 0.83-2.13 (25H, m), 2.42 (2H, t, J = 7.2 Hz), 2.86-2.88 (1H, m), 3.16-3.22 (1H, m), 3.32-3.38 (1H, m), 3.42- 3.48 (1H, m), 3.52-3.58 (1H, m), 3.67 (3H, s), 4.21 (1H, d, J = 11.0 Hz), 5.21 (1H, t-like)
MC ТСФ (м/з): 576 (M++NH+)
Пример 55
Олеан-12-ен-3 β, 24 (4β)- диол-22 β- о-пропанкарбоновая кислота
Соединение 70 (13 мг) растворяли в 2 мл метанола и 1 мл дихлорметана, к раствору добавляли 0,8 мл 1 N гидроксида натрия и смесь перемешивали при комнатной температуре в течение 10 часов. Реакционный раствор подкисляли 1 N соляной кислотой и экстрагировали дихлорметаном, и экстракт сушили над сульфатом магния. Неорганическую соль удаляли фильтрованием и фильтрат концентрировали при пониженном давлении с получением 10 мг (выход: 83%) соединения 71 в виде бесцветного твердого вещества.
1H-ЯМР (CDCl3) δ м.д.
0.86 (3H, s), 0.88 (3H, s), 0.89 (3H, s), 0.94 (3H, s), 1-00 (3H, s), 1.11 (3H, s), 1.24 (3H, s), 0.82-2.12 (23H, m), 2.43 (2H, t, J = 7.2 Hz), 2.88-2.91 (1H, m), 3.20-3.26 (lH, m), 3.33 (lH, d, J = 11-0 Hz), 3.39-3.44 (1H, m), 3.53-3.60 (lH, m), 4.20 (lH, m), 5.22 (1H, t-like)
MC ТСФ (м/з): 543 (M-H)-
Пример 56
3 β, 24 (4β)- Изопропилидендиокси-22 β- анилинкарбонилоксиолеан-12-ен (соединение 72)
Соединение 3 (30,0 мг) растворяли в 2 мл пиридина, к раствору добавляли 14 мг фенилизоцианата и смесь кипятили с обратным холодильником в течение 1 часа. К реакционному раствору добавляли воду, смесь экстрагировали этилацетатом и экстракт сушили над сульфатом натрия. Неорганическую соль удаляли фильтрованием и фильтрат концентрировали при пониженном давлении с получением твердого вещества, которое затем очищали с помощью препаративной ТСХ (проявляющая система, н-гексан: ТГФ = 7:1) с получением 23,0 мг (выход: 62%) соединения 72 в виде бесцветного твердого вещества.
1H-ЯМР (CDCl3) δ м.д.
0.89 (3H, s), 0.92 (3H, s), 1.00 (3H, s), 1.02 (3H, s), 1.16 (6H, s), 1.23 (3H, s), 1.38 (3H, s), 1.44 (3H, s), 0.80-2.30 (21H, m), 3.23 (1H, d, J = 11.6 Hz), 3.46 (1H, dd, J = 9.3, 4.1 Hz), 4.05 (1H, d, J = 11.6 Hz), 4.65 (1H, t, J = 3.8 Hz), 5.27 (1H, t-like), 6.50 (1H, s), 7.05 (1H, t, J = 7.2 Hz), 7.28-7.42 (4H, m).
FABMS (м/з): 640 (M+Na)+
Пример 57
22 β- Анилинокарбонилоксиолеан-12-ен-3 β, 24 (4β)- диол (соединение 73)
Соединение 72 (20,0 мг) растворяли в 1 мл метанола, к раствору добавляли 0,1 мл 1 N HCl и смесь перемешивали при комнатной температуре в течение 5 мин. Растворитель удаляли дистилляцией, к остатку добавляли насыщенный раствор NaHCO3 и смесь экстрагировали этилацетатом. Экстракт сушили над сульфатом натрия. Неорганическую соль удаляли фильтрованием и фильтрат концентрировали при пониженном давлении с получением твердого вещества, которое затем очищали путем препаративной ТСХ (проявляющая система, н-гексан: ТГФ = 2,5: 1) с получением 16,2 мг (выход: 87%) соединения 73 в виде бесцветного твердого вещества.
1H-ЯМР (CDCl3) δ м.д.
0.88 (3H, s), 0.90 (3H, s), 0.92 (3H, s), 0.95 (3H, s), 1.02 (3H, s), 1.15 (3H, s), 1.25 (3H, s), 0.80-2.70 (23H, m), 3.31-3.49 (2H, m), 4.21 (1H, dd, J = 11.4, 2.0 Hz), 4.65 (1H, t, J = 4.1 Hz), 5.26 (1H, t, J = 3.2 Hz) 6.49 (1H, s), 7.05 (1H, t, J = 7.4 Hz), 7.27-7.43 (4H, m)
FABMS (м/3): 600 (M+Na)+
Пример 58
22 β- Аминокарбонилоксиолеан-12-ен-3 β, 24 (4β)- диол (соединение 74)
Соединение 3 (5,6 мг) растворяли в 0,2 мл пиридина, к раствору добавляли 4,2 мг дихлорацетилизоцианата и смесь перемешивали при комнатной температуре в течение 1 часа. Реакционный раствор концентрировали при пониженном давлении с получением твердого вещества. К твердому веществу добавляли метанол (0,558 мл) и смесь перемешивали при комнатной температуре в течение 10 мин. Растворитель удаляли дистилляцией, к остатку добавляли воду и смесь экстрагировали этилацетатом. Экстракт сушили над сульфатом натрия. Неорганическую соль удаляли фильтрованием и фильтрат концентрировали при пониженном давлении с получением твердого вещества, которое затем очищали с помощью препаративной ТСХ (проявляющая система, н-гексан: AcOEl = 1:1,5) с получением 2,5 мг (выход: 44%) соединения 74 в виде бесцветного твердого вещества.
1H-ЯМР (CDCl3) δ м.д.
0.84 (3H, s), 0.89 (3H, s), 0.90 (3H, s), 0.95 (3H, s), 1.00 (3H, s), 1.14 (3H, s), 1.25 (3H, s), 0.80-2.80 (23H, m), 3.32-3.48 (2H, m), 4.21 (1H, d, J = 11.0 Hz), 4.48-4.56 (3H, m), 5.24 (1H, t, J = 3.5 Hz)
FABMS (м/з): 524 (M+Na)+
Пример препаративной формы 1 Таблетки
Соединение данного изобретения гранулируют с помощью процесса влажной грануляции, к грануляту добавляют стеарат магния и смесь прессуют для получения таблеток. Каждая таблетка имеет следующий состав.
Соединение 2 - 200 мг
Лактоза - 50 мг
Натрийкарбоксиметилкрахмал - 20 мг
Гидроксипропилметилцеллюлоза - 5 мг
Стеарат магния - 3 мг
Всего - 278 мг
Пример препаративной формы 2 Суппозитории
Вейлапзоль H-15 нагревали до 60oC, добавляли соединение 2 и диспергировали его в полученном расплаве и дисперсией заполняли формы для суппозиториев. Формы для суппозиториев, заполненные дисперсией, охлаждали до комнатной температуры для получения суппозиториев. Каждый суппозиторий имел следующий состав.
Соединение 2 - 200 мг
Вейлапзоль H-15 - 1000 мг
Всего - 1200 мг
Испытания Пример 1
Эффект на модели подавления гепатоцитотоксичности (in vitro)
Тестируемое соединение добавляли до концентрации 0,1 10 мкг/мл к клеткам Hep G2 в присутствии афлатоксина Bi(10-5 M) и клетки затем инкубировали в термостате с повышенным содержанием CO2 при 37oC в течение 48 часов. После завершения инкубации клетки окрашивали трипановым синим и оценивали их способность поглощать краску с помощью Monocellater (производимого Olympus Optical Co., Ltd.). Активность по подавлению гепатоцитотоксичности (%) рассчитывали по представленному ниже уравнению. В уравнении значение для контрольной группы является поглощением (%) в присутствии одного афлатоксина B1, а значение для обработанной группы, является поглощением (%) при одновременном присутствии афлатоксина B1 и испытуемого соединения.
В результате активность по подавлению гепатоцитотоксичности соединений 2, 6, 10, 17, 20, 22, 26, 27, 32, 33, 36, 37, 46, 49, 66 и 73 составила не менее 5%.

Испытания Пример 2
Эффект на модели гепатита, вызванного конканавалином A (Кон A)
Кон A, растворенный в физиологическом растворе соли, вводили мышам самцам BALB/c (8-недельного возраста), весящим от 21 до 25 г, в дозе 20 мг/кг, чтобы вызвать гепатит. Испытуемое соединение (соединение 7) суспендировали в смешанном растворе (контрольный носитель), состоящем из 25% диметилсульфоксида, 25% полиэтиленгликоля 400 и 0,25% карбоксиметилцеллюлозы, и эту суспензию вводили подкожно за 2 и 14 часов до введения Кон A в трех дозах, т. е. 0,2 мг/мышь, 1,0 мг/мышь и 2,0 мг/мышь. Группе контрольных мышей вводили один контрольный носитель. Через двадцать четыре часа после введения Кон A мышей умерщвляли эфирной анестезией для исследования на активность аланинаминотрансферазы (АЛТ) в плазме в качестве показателя заболевания печени.
Результаты представлены на чертеже. Конкретно, активность АЛТ составляла 2068±518 (ед/л) для группы мышей, которые не получали испытуемого соединения (контрольная группа), тогда как активность АЛТ была снижена до того же самого уровня, что и в группе мышей, которые не получали Кон A (то есть до нормального значения), которое составляет 55±16 (ед/л) для группы мышей, которые получали соединение 7 в дозе 1,0 мг/мышь, и для группы мышей, которые получали соединение 7 в дозе 2,0 мг/мышь.
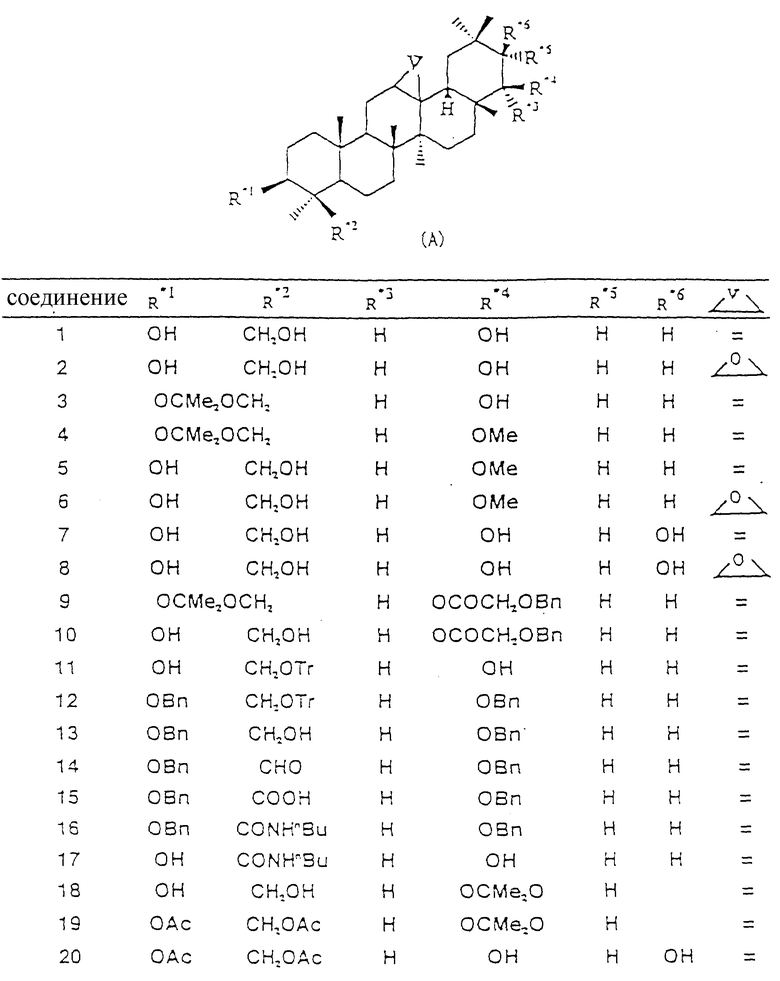
Описываются новые фармацевтические композиции для лечения гепатита, включающие в качестве активного ингредиента тритерпеновое производное общей формулы I или его соль, где R1 представляет гидроксильную группу, арилметилокси, низший алкокси или низший алканоилокси; R2 представляет низший алкенил, -CH2OR5, где R5 представляет атом водорода, арилметил, низший алкил или низший алканоил, формил, -COOR6, где R6 представляет атом водорода или низший алкил, или -CH2N(R7)R8, где R7 и R8, которые могут быть одинаковыми или различными, представляют собой атом водорода, низший алкил, арил или низший алканоил; или R1 и R2 могут соединяться друг с другом с образованием - O-C(R9)R10-O-CH2-, где R9 и R10, которые могут быть одинаковыми или разными, представляют низший алкил или арил; R3 и R4, которые могут быть одинаковыми или разными, представляют атом водорода, гидроксильную группу, гидроксиметил, -N(R11)R12, где R11 и R12 представляют низший алканоил, -OR13, где R13 представляет низший алкил, аралкил, низший алканоил, арилкарбонил, аралкилкарбонил, или арил(низший алкенил)карбонил; Х представляет собой О, СН2. Вписываются также новые тритерпеновые производные. 8 с. и 26 з.п.ф-лы, 1 табл., 1ил.
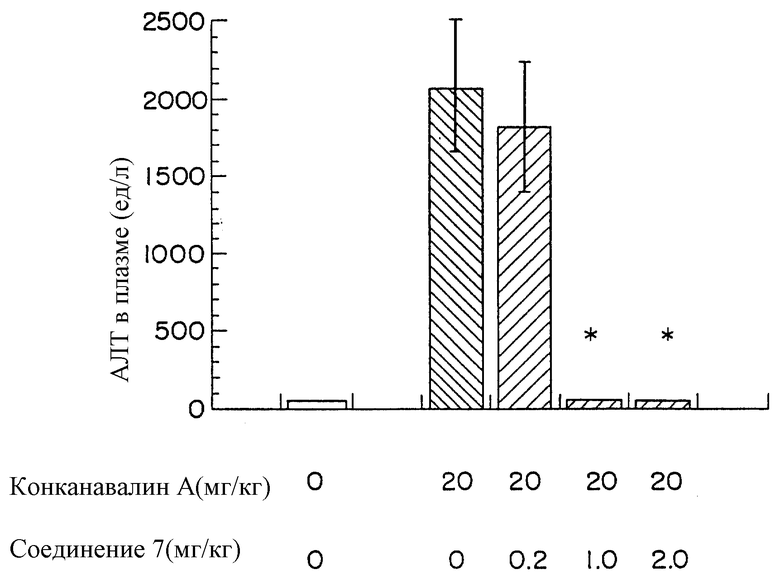
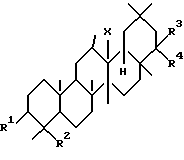
где R1 представляет гидроксильную группу, арилметилокси, низший алкокси или низший алканоилокси;
R2 представляет низший алкенил, CH2OR5, где R5 представляет атом водорода, арилметил, низший алкенил или низший алканоил, формил: -COOR6, где R6 представляет атом водорода или низший алкил, или -CH2N(R7)R8, где R7 и R8, которые могут быть одинаковыми или различными, представляют собой атом водорода, низший алкил, арил или низший алканоил,
или R1 и R2 могут соединяться друг с другом образованием - O-C(R9)R10-O-CH2-, где R9 и R10, которые могут быть одинаковыми или разными, представляют низший алкил или арил;
R3 и R4, которые могут быть одинаковыми или разными, представляют атом водорода, гидроксильную группу, гидроксиметил, -N(R11)R12, где R11 и R12 представляют низший алканоил, -OR13, где R13 представляет низший алкил, аралкил, низший алканоил, арилкарбонил, аралкилкарбонил или арил(низший алкенил)карбонил;
X представляет O, CH2.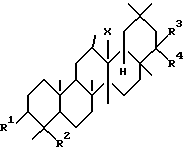
где R1 представляет гидроксильную группу, низший алкокси или низший алканоилокси;
R2 представляет гидроксиметил, низший алкоксиметил,
или R1 и R2 могут соединяться друг с другом с образованием -O-C(R14)R15-O-CH2-, где R14 и R15 представляют низший алкил;
R3 и R4, которые могут быть одинаковыми или разными, представляют атом водорода, гидроксильную группу, гидроксиметил, -N(R11)R12, где R11 и R12 представляют низший алканоил, -OR13, где R13 представляет низший алкил, аралкил, низший алканоил, арилкарбонил, аралкилкарбонил или арил(низший алкенил)карбонил;
X представляет O, CH2,
при условии, что соединения, где R1 представляет гидроксильную группу, R2 представляет гидроксиметил, R3 представляет атом водорода, R4 представляет гидроксильную группу и X представляет O, исключены.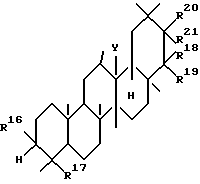
где R16 представляет гидроксильную группу, арилметилокси, низший алкокси или низший алканоилокси;
R17 представляет низший алкенил, -CH2OR5, где R5 представляет атом водорода, арилметил, низший алкил, формил; -COOR6, где R6 представляет атом водорода; -CON(R29)R30, где R29 и R30, которые могут быть одинаковыми или разными, представляют атом водорода, низший алкил, низший алканоил, арил или аралкил; -CH2N(R7)R8, где R7 и R8, которые могут быть одинаковыми или различными, представляют водород или низший алкил; -C(R6)2OH, где R6 представляет водород или низший алкил, -COR6а, где R6а представляет низший алкил, -CH2=CH2-,
или R16 и R17 могут соединяться друг с другом с образованием -O-C(R9)R10-O-CH2-, где R9 и R10, которые могут быть одинаковыми или разными, представляют низший алкил или арил;
R18 и R19, которые могут быть одинаковыми или разными, представляют атом водорода, гидроксильную группу, арилметилокси; -OR13, где R13 представляет низший алкил, аралкил; -OCON(R29)R30, где R29 и R30, которые могут быть одинаковыми или разными и представляют атом водорода или арил;
или R18 и R19 могут соединяться друг с другом с образованием оксо;
R20 и R21 соответственно имеют те же значения, что и R18 и R19, при условии, что R20 и R21 одновременно не являются атомом водорода;
или R18 и R20 могут соединяться друг с другом с образованием -O[C(R9)R10]p -O-, где R9 и R10 определены выше, а p является целым числом от 1 до 3;
Y представляет O, CH2 или одинаковую связь для образования двойной связи в кольце, к которому Y присоединен.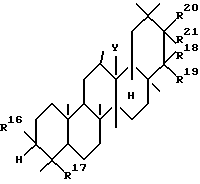
где R16 представляет гидроксильную группу, арилметилокси, низший алкокси, исключая метокси или низший алканоилокси, исключая ацетокси;
R17 представляет низший алкенил, -CH2OR5, где R5 представляет атом водорода, арилметил, низший алкил, формил, -COOR6, где R6 представляет атом водорода; -CON(R7)R8, где R7 и R8, которые могут быть одинаковыми или разными, представляют атом водорода, низший алкил; -CH2N(R7)R8, где R7 и R8, которые могут быть одинаковыми или различными, представляют водород или низший алкил; -C(R6)2OH, где R6 представляет водород или низший алкил; -COR6а, где R6а представляет низший алкил; -CH2=CH2-,
или R16 и R17 могут соединяться друг с другом с образованием -O-C(R9)R10-O-CH2-, где R9 и R10, которые могут быть одинаковыми или разными, представляют низший алкил или арил;
R18 и R19, которые могут быть одинаковыми или разными, представляют атом водорода, гидроксильную группу, арилметилокси, -OR13, где R13 представляет низший алкил, аралкил,
или R18 и R19 могут соединяться друг с другом с образованием оксо;
R20 и R21 соответственно имеют те же значения, что и R18 и R19, при условии, что R20 и R21 одновременно не являются атомом водорода; -OCON(R29)R30, где R29 и R30, которые могут быть одинаковыми или разными и представляют атом водорода или арил;
или R18 и R20 могут соединяться друг с другом с образованием -O[(R9)R10] p-O-, где R9 и R10 определены выше, а p является целым числом от 1 до 3;
Y представляет O, CH2 или одинарную связь для образования двойной связи в кольце, к которому Y присоединен, при условии, что соединения, где R16 представляет гидроксильную группу, R17 представляет -CH2OCH3; R20 представляет гидроксильную группу или метокси; R18 и R21 оба представляют атомы водорода; R19 представляет гидроксильную или метоксигруппу, а Y представляет одинарную связь, и соединения, в которых R16 представляет гидроксильную группу, R17 представляет -CH2OH, R20 представляет гидроксильную группу, R18, R19 и R21 представляют атом водорода, а Y представляет одинарную связь, исключены.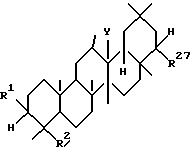
где R1, R2 и Y имеют значения, определенные выше;
R27 представляет -OCON(R29)R30, где R29 и R30 имеют определенные выше значения; -OCO-(CH2)n-R16, где R16 определен выше.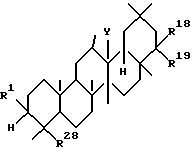
где R1, R18, R19 и Y имеют значения, определенные выше;
R28 представляет -CON(R29)R30, где R29 и R30 имеют определенные выше значения; -C(R6)OH, где R6 определен выше; -COR6а, где R6а представляет низший алкил, или -CH=CH2.
| RU 94013464, 1995 | |||
| ВЕЩЕСТВО, ОБЛАДАЮЩЕЕ ЖЕЛЧЕГОННОЙ И ГЕПАТОПРОТЕКТОРНОЙ АКТИВНОСТЯМИ | 1991 |
|
RU2029554C1 |
| US 4891221, 1990 | |||
| US 4987151, 1991 | |||
| Устройство для сортировки каменного угля | 1921 |
|
SU61A1 |
| ТРИНУС Ф.П | |||
| Фармако-терапевтический справочник | |||
| - Киев: Здоровья, 1989, с.238-244. | |||
Авторы
Даты
2001-06-10—Публикация
1997-02-26—Подача