Изобретение относится к химии стероидных соединений эстранового ряда и касается усовершенствованного способа получения D-эстра-1,3,5(10)-триен-3- ол-17-она (эстрона)формулы 1
Эстрон (D-эстра-1,3,5(10)-триен-3-ол-17-он) является не только женским половым гормоном, но и ценным стероидным продуктом и полупродуктом фармацевтической промышленности, производимым в мире сотнями килограммов в год. Эстрон (и его эфиры) используется и как активное действующее начало, и как ключевое промежуточное вещество в производстве множества стероидных лекарственных средств, основанных на эстрогенном, гестагенном, антигестагенном, анаболическом и контрацептивном действии различных стероидов.
Масляный раствор эстрона является препаратом, используемым в гинекологии под названием фолликулин.
В настоящее время эстратриеновые стероиды производятся в основном химическим синтезом из D-андроста-1,4-диен-3,17-диона (АДД), производимого, в свою очередь, микробиологической трансформацией стеринов- β-ситостерина или холестерина. Используются 2 основных способа получения (и производства) эстратриенов из АДД, в обоих из которых получают эстрон.
В первом из способов используется высокотемпературный (500-700oC) пиролиз раствора АДД в растворителях - донорах водорода (ксилол, керосин) [Патент США (Mitsubishi Chemical Industry Ltd.) 3,994,938, класс C 07 J 1/00, опубл. 30.11.1976; патент ФРГ (Shering AG) 3,931,820, класс C 07 J 1/00, опубл. 28.03.1991]. Хотя способ позволяет получить высокий выход эстрона, он требует сложной установки, точного регулирования и поддержания экстремального режима пиролиза (время контакта - до 1 с, быстрое охлаждение) и периодической очистки установки от продуктов обугливания.
Во втором способе для удаления из АДД ангулярной 19-метильной группы (т. е. проведения так называемой ароматизации стероида) используется реакция Драйдена (H. L.Dryden, G.M.Webber, J.J.Wieczorek, J.Am.Chem.Soc., 1964, 86, 742; H.L.Dryden, G.M.Webber, патент США 3,274,182, класс НКИ 540- 17, опубл. 24.12.1964; Меньшова Н. И., Шувалова С.Д., патент РФ 2056430, класс C 07 J 1/00, опубл. 20.03.96 Бюл. N 8). Способ состоит во взаимодействии 17-этиленкеталь андроста-1,4-диен-3,17- диона (17-этиленкеталя АДД) с продуктами взаимодействия полициклических ароматических углеводородов с, по крайней мере, одним щелочным металлом в среде растворителя. При этом в результате переноса электронов образуется радикал-анион (или дианион) по диеноновой группировке АДД, стабилизирующийся выбросом 19-метильной группы с образованием аниона 17-этиленкеталя эстрона, который затем гидролизуют в эстрон. Этот способ позволяет получить высокий общий выход эстрона (приблизительно 60%) и не требует специальной аппаратуры.
Наиболее близким аналогом настоящего изобретения является способ, в котором металлический натрий подвергают взаимодействию с полициклическим ароматическим углеводородом в среде растворителя формулы 2:
CH3(OCH2CH3)nOCH3, где n≥2 (2)
в температурном интервале 98-105oC до 70oC (Меньшова Н.И., Шувалова С.Д. , патент РФ 2056430, класс C 07 J 1/00, опубл. 20.03.96 Бюл. N 8). К реакционной массе, содержащей полициклический ароматический углеводород, добавляют 17-этиленкеталь андроста-1,4-диен-3,17-диона в виде порошка в противотоке инертного газа. Восстановительную ароматизацию проводят в температурном интервале 105-70oC. Выделение целевого продукта осуществляют следующим образом: к реакционной массе прибавляют последовательно низший спирт, воду, после охлаждения до 30-32oC полученную смесь обрабатывают концентрированной соляной кислотой и выдерживают при 62±2oC в течение 1 ч. Смесь охлаждают до комнатной температуры, затем прибавляют воду, ароматический углеводород (например, толуол) и выдерживают при 83±2oC в течение 1 ч при перемешивании, а затем оставляют, не перемешивая, на кристаллизацию при комнатной температуре на 8-12 ч. Выпавшие кристаллы продукта отфильтровывают. Выход технического эстрона составляет 86-88%.
Необходимым и достаточным условием способа является использование только одного растворителя, в среде которого оказалось возможным как получение анион-радикалов полициклического ароматического углеводорода, так и проведение восстановительной ароматизации.
Однако предложенный способ имеет ряд недостатков. Так как 17- этиленкеталь АДД вводится в реакционную смесь в виде порошка, введение происходит неравномерно, кроме того, часть порошка осаждается на установке, что приводит к потере реагента и создает трудности при производстве эстрона в промышленном масштабе. Кроме того, в маточном растворе после выделения основной порции эстрона кристаллизацией остается значительное количество эстрона. В предложенном способе выделения оставшегося количества эстрона не производилось.
В патенте США N 3, 274, 182 (класс НКИ 540-17, опубл. 24.12.1964) оставшийся в маточном растворе эстрон выделяют экстракцией разбавленным раствором гидроксида калия. Однако этот процесс требует большого количества водной щелочи.
Вследствие указанных недостатков способ по прототипу оказался трудно воспроизводимым. Авторы настоящего изобретения после неоднократных повторов сумели получить выход эстрона пониженной чистоты (с т.пл. 251- 252oC) с повторяющимся выходом в 69-71% (с выделением дополнительного количества эстрона из маточного раствора). В связи с этим возникла необходимость в разработке усовершенствованного способа получения эстрона.
Задачей настоящего изобретения является создание способа получения эстрона, при котором стероидный субстрат вводят в виде раствора, что обеспечивает равномерное протекание реакции, полноту выделения целевого продукта и одновременную частичную регенерацию вводимых в реакцию реагентов.
Данная задача решается настоящим изобретением.
В способе получения D-эстра-1,3,5(10)-триен-3-ол-17-она (эстрона), включающем восстановительную ароматизацию 17-этиленкеталя андроста-1,4- диен-3,17-диона путем его введения в реакционную смесь, содержащую металлический натрий и дифенил в диглиме при повышенной температуре, и последующий кислотный гидролиз, согласно изобретению 17-этиленкеталь андроста-1,4-диен-3,17-диона вводят в реакционную смесь в виде раствора в расплаве дифенила в токе инертного газа.
При этом реакционная смесь предпочтительно содержит количество дифенила меньше стехиометрического, а оставшееся количество дифенила, необходимое для проведения реакции, добавляют введением 17-этиленкеталя андроста-1,4-диен-3,17-диона.
Оставшееся количество дифенила используют для приготовления раствора 17-этиленкеталя андроста- 1,4-диен-3,17-диона в расплаве дифенила смешением равных весовых количеств 17-этиленкеталя андроста-1,4-диен-3,17-диона и дифенила при температуре выше 75oC.
Дополнительное количество эстрона, остающееся в маточном растворе после выделения основного количества, может быть выделено экстракцией водным раствором гидроксида натрия.
При этом для экстракции используют 20-40%-ный вводный раствор гидроксида натрия.
Альтернативно, дополнительное количество эстрона, остающееся в маточном растворе после выделения основного количества, выделяют при регенерации диглима и дифенила.
Таким образом, дифенил используют одновременно как реагент и как растворитель для 17-этиленкеталя АДД, который вводят в реакционную смесь в виде раствора в расплаве дифенила, что обеспечивает медленное и равномерное поступление субстрата.
Практически полное выделение оставшегося в маточном растворе эстрона производят экстракцией водным раствором гидроксида натрия или, альтернативно, освобождением органического маточного раствора от дифенила и диглима в процессе их регенерации, что приводит к достаточно полной кристаллизации стероида.
Сведения, подтверждающие возможность осуществления изобретения.
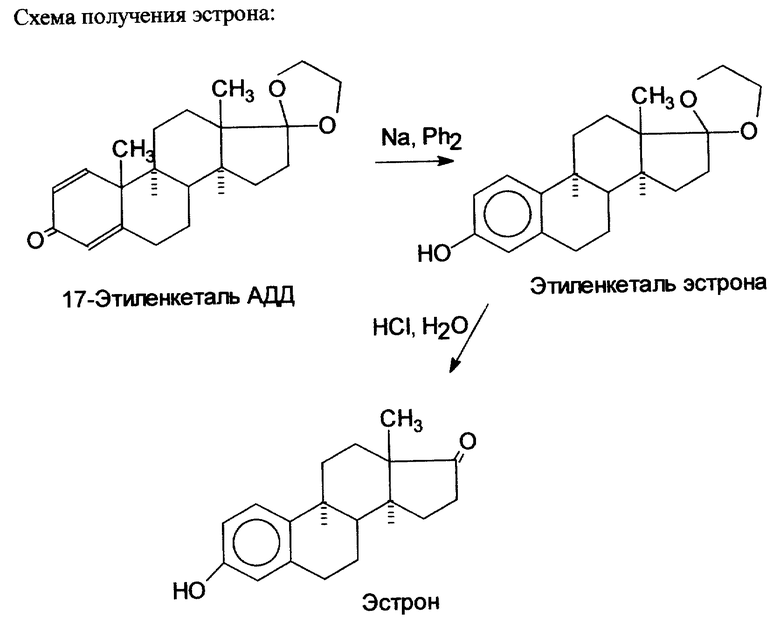
Предложенный способ получения эстрона представляет собой один из вариантов реакции Драйдена. Схему получения эстрона см. в конец описания.
17-Этиленкеталь АДД, требуемый в первой стадии способа, получали кетализацией D-андроста-1,4-диен-3,17-диона (АДД), нагревая в вакууме раствор АДД в этиленгликоле в присутствии катализатора тозилата пиридиния (Py.TsOH).
Схема реакции:
В грушевидную колбу объемом 50 мл с магнитной мешалкой, снабженную насадкой Вюрца с термометром и присоединенным к боковому отводу источником вакуума, поместили 6.5 мл этиленгликоля и 0.2 г (2 вес.% от загружаемого АДД) тозилата пиридиния (Py.TsOH) (в реакции может использоваться от 0.1 до 0.3 г тозилата пиридиния (1-3% от загружаемого АДД) без существенного изменения выхода и состава продуктов реакции). Массу перемешивали при комнатной температуре в течение 5 мин до полного растворения Py.TsOH и добавили 10 г АДД. Полученную суспензию нагревали до 110-115oC при перемешивании до полного растворения АДД (5-10 мин) (обеспечение полного растворения АДД до вакуумирования реакционного сосуда и интенсивного перемешивания необходимо для того, чтобы избежать возможных "всплесков" суспензии АДД в этиленгликоле при вакуумировании) и затем вакуумировали при 25-35 мм рт.ст. и 125-130oC и интенсивном перемешивании. Выпадение осадка 17-этиленкеталя АДД наблюдали через 5-8 мин после достижения вышеуказанных температур и вакуума. В ряде случаев дальнейшее перемешивание после этого становится невозможным (зависит от мощности мешалки). Образовавшуюся суспензию выдерживали далее при 130-135oC, если возможно - при перемешивании, в течение времени, троекратно превышающего время выдержки до выпадения осадка (т.е. 15-24 мин). Попытки существенно увеличить время выдержки реакционной массы после выпадения осадка (до 1 ч) приводят к накапливанию продуктов ароматизации в смеси и не дают достоверного увеличения выхода целевого продукта. Прекращение проведения процесса непосредственно после выпадения осадка 17-этиленкеталя АДД дает более низкий выход целевого продукта (9.2 г, 79.6%). Однако при разбавлении маточника водой непрореагировавший АДД выпадает в осадок в виде кристаллов, которые после отделения, промывания водой и осушки (получено 1.9 г, 19%) можно подвергнуть повторной кетализации, получив еще 1.7 г 17-этиленкеталя АДД (77.5% на введенное в повторную кетализацию количество), что повышает общий выход 17-этиленкеталя АДД в расчете на АДД до 94.3%.
Реакционный сосуд далее девакуумировали при 100-110oC и при 90-100oC добавили 0.3 мл триэтиламина и одной порцией 27 мл 45%-ного (по объемам) раствора H2O в MeOH, предварительно нагретого до 50- 60oC. Если ранее перемешивание остановилось, оно восстанавливается через некоторое время вследствие разжижения смеси. Этому же способствует недолгое ручное перемешивание смеси. Полученную суспензию перемешивали 2 ч при понижении температуры от 90oC до 20oC, белый кристаллический осадок отфильтровывали на пористом стеклянном фильтре и промыли 5 раз водой порциями по 30 мл, каждый раз с перемешиванием и отжимом кристаллов на фильтре. Полученный белый порошок 17-этиленкеталя АДД сушили до постоянного веса в вакуум-эксикаторе (20oC, 2 мм рт. ст. , 12 ч). Выход 10.2 г (88% от теоретического), чистота полученного продукта составила более 99%, основной примесью (до 1%) является исходный АДД (по ТСХ анализу). Белый кристаллический порошок, т.пл. 168-170oC, Rf 0.40 (ТСХ- пластинки Silufol UV 254, гексан-ацетон-бензол, 45:20:5, два проявления).
Тозилат пиридиния, используемый в реакции кетализации в качестве катализатора, может быть приготовлен заранее и может храниться в закрытой емкости не менее 2 лет. Тозилат пиридиния получают следующим образом.
К раствору 20 г моногидрата п-толуолсульфокислоты в 20 мл этанола добавляют за 5 мин при 10oC 10.9 г пиридина. Прозрачный раствор перемешивают в течение 1 ч при комнатной температуре, этанол упаривают в вакууме досуха, к оставшейся кристаллической массе добавляют 30 мл толуола и снова упаривают досуха для освобождения от избытка пиридина. Эту процедуру повторяют еще один раз. Полученные кристаллы сушат при 2 мм рт.ст. и 50oC в течение 1 ч и оставляют в вакуум-эксикаторе над безводным CaCl2 (2 мм рт.ст., 12 ч). Выход тозилата пиридиния в виде белого или очень светло-кремового кристаллического порошка составляет 25.3 г (97.3%), т. пл. 118oC.
Полученный таким образом 17-этиленкеталь АДД подвергают ароматизации в этиленкеталь эстрона по реакции Драйдена.
Анион-радикалы образуются в результате взаимодействия металлического натрия и дифенила в диглиме. Требовалось обеспечить медленное и равномерное прибавление 17-этиленкеталя АДД в реакционную смесь, при котором нельзя использовать значительные количества диглима или подобного растворителя, а растворимость 17-этиленкеталя АДД в этих растворителях низка (50%-ный (w/v) раствор 17-этиленкеталя АДД в диглиме образуется только при 120oC). Было найдено оригинальное решение - прибавление по каплям 50%-ного (w/w) раствора 17-этиленкеталя АДД в расплавленном дифениле. Этот раствор образуется при смешении равных весовых количеств 17-этиленкеталя АДД и дифенила при 90-95oC и остается раствором до 75oC и легко и надежно может быть прибавлен по каплям в этом интервале температур. При этом количество используемого в реакции дифенила не увеличивается - для растворения 17- этиленкеталя АДД используется 2/5 части от общего количества дифенила, которое используется в реакции, но эта часть поступает в реакционную смесь постепенно, по ходу реакции.
Выделение целевого продукта производят следующим образом. К реакционной смеси прибавляют последовательно низший спирт, регулируя скорость прибавления так, чтобы вспенивание не было чрезмерным, затем добавляют воду, после чего при интенсивном перемешивании прибавляют концентрированную соляную кислоту и выдерживают при 60-70oC в течение 1 ч, прекращают перемешивание и оставляют медленно остывать. Количество добавляемых в реакционную смесь соляной кислоты и воды минимизировано так, что водный слой минимален по объему и практически насыщен образовавшимся при нейтрализации щелочи хлористым натрием. Это обеспечивает расслоение диглима (смешивающегося с чистой водой во всех отношениях) и водного слоя, что используется для частичной регенерации диглима. С другой стороны, большая взаимная смешиваемость 2 слоев ускоряет реакцию гидролиза нерастворимого в водных средах 17-этиленкеталя АДД.
К остывшей смеси прибавляют небольшое (для облегчения регенерации диглима) количество толуола для селективного растворения выпадающего вместе с эстроном дифенила и лучшего расслоения, перемешивают смесь при 40-45oC и из теплого раствора отфильтровывают эстрон. Поддержание суспензии теплой способствует более полному отделению дифенила при отфильтровывании эстрона.
Было найдено, что количество эстрона, остающееся в маточном растворе после выделения основной порции эстрона кристаллизацией из диглимо-толуольной смеси значительно превышает растворимость эстрона в толуоле (15 мг/100 мл) и в диглиме. Причиной этого, по-видимому, является присутствие в маточном растворе большого количества дифенила, значительно повышающего растворимость эстрона (дифенил- хороший растворитель для 17- этиленкеталя АДД). С другой стороны, выделение этого растворенного эстрона экстракцией водным раствором едкого кали требует большого количества водной щелочи. Было предложено два способа выделения остаточного количества эстрона.
1. Экстракция эстрона из органического слоя 2-4 мл (на 1 г извлекаемого эстрона) 20-40%- ного водного раствора едкого натра. В отличие от калиевой натриевая соль эстрона плохо растворима в воде. При указанных соотношениях и объемах происходит достаточно полное выпадение натриевой соли эстрона в виде темного вязкого масла, прилипающего к стенкам сосуда, и органический слой (теперь лишенный эстрона) легко отделяется декантацией. Из липкого остатка в колбе при перемешивании с кислым водным маточным раствором, полученным при выделении основной порции эстрона (взамен свежей кислоты), выделяется дополнительная порция эстрона.
2. Освобождение органического маточного раствора от дифенила (и диглима). Это происходит в процессе предлагаемой регенерации диглима и дифенила, состоящей в разделении перегонкой на 4 фракции диглимо-толуольного слоя маточного раствора после выделения основной порции эстрона фильтрованием. Все эти 4 фракции резко различаются по температуре кипения и легко отделяются при перегонке без дефлегматора:
1) толуол (отгонка при атмосферном давлении);
2) диглим (в слабом вакууме);
3) дифенил (в более глубоком вакууме);
4) стероиды (нелетучий остаток).
Кроме решения проблемы выделения дополнительного количества эстрона, этот процесс позволяет регенерировать примерно 1/3 использованного в реакции диглима. Остальное количество диглима находится в водном слое маточного раствора. Из него также оказалось возможным регенерировать дополнительное количество диглима отгонкой азеотропа диглима с водой, содержащего 20-40% диглима (в литературе нет сведений об этом азеотропе), и отслоением последнего сильным подщелачиванием дистиллята (до 40%-ной концентрации щелочи). Регенерация диглима позволяет значительно снизить стоимость получения эстрона.
Изобретение иллюстрируется следующими примерами.
Пример 1. В реакционную колбу загрузили (в этой последовательности) 21 г дифенила, 32 мл диглима и 5.6 мл металлического натрия. В капельную воронку засыпали растертую смесь 16 г 17-этиленкеталя АДД и 16.7 г дифенила. Весь прибор продули в течение 5 мин осушенным аргоном и оставили на протяжении всей реакции под слабым (1-2 мм водяного столба) давлением аргона. Одновременно начали разогрев масляной бани и парогенератора. По достижении 95oC в капельной воронке образуется подвижный прозрачный расплав, и эту температуру поддерживают в воронке подачей пара до ее опорожнения. По достижении в масляной бане 85oC начинают перемешивание темно-синей реакционной смеси, доводя температуру в бане до 100-105oC. После перемешивания при этой температуре в течение 10 мин при поддержании той же температуры начали прибавление из воронки по каплям раствора 17- этиленкеталя АДД в расплаве дифенила с такой скоростью, чтобы постоянно сохранялась темно-синяя окраска реакционной смеси, что заняло 35 мин. Емкость воронки обмыли 5 мл диглима, которые также прикапали в колбу.
Отключив нагрев, дождались охлаждения бани до 80oC (30 мин) и из воронки прибавили по каплям 8.9 мл метанола, регулируя скорость прибавления так, чтобы вспенивание не было чрезмерным. При интенсивном перемешивании загустевшей реакционной смеси дождались исчезновения синего окрашивания и блестящих кусочков металлического натрия (5-10 мин) и образования красно-коричневой негомогенной смеси. В этот момент температура в бане была 75oC. Из воронки быстро добавили по каплям 42 мл воды, после чего образовался раствор кирпичного цвета, температура в бане 65oC.
При интенсивном перемешивании прибавили из воронки 42 мл концентрированной соляной кислоты с такой скоростью, чтобы не происходило вскипания смеси. Образовалась светло-кирпичная двухслойная смесь, на границе слоев начал выпадать желтый осадок (образовавшийся эстрон), на дне небольшое количество тяжелого белого осадка (NaCl). Поддерживая в бане температуру 60-70oC, перемешивали смесь 1 ч, после чего перемешивание прекратили и весь прибор оставили на ночь медленно остывать.
Остывшая смесь состоит из желтой полутвердой массы вверху (кристаллические эстрон и дифенил в диглиме), бесцветного кислотного водного слоя в середине и небольшого количества тяжелого белого осадка на дне (NaCl). К смеси прибавили 30 мл толуола для растворения дифенила и лучшего расслоения, смесь перемешали при 40-45oC и из теплого раствора на пористом стеклянном фильтре отфильтровали с отсасыванием эстрон. Кристаллы на фильтре промыли 10 мл нагретого до 40-45oC толуола и 20 мл воды и высушили 2 ч при 90-95oC в вакууме 3 мм, до прекращения осаждения на холодных частях прибора белых кристаллов дифенила. В кристаллах эстрона не остается дифенила (ТСХ контроль). Получили 9.234 г (70.1% от теории) эстрона в виде белого кристаллического порошка, т. пл. 261-262oC, чистого по ТСХ (Rf 0.33 (ТСХ-пластинки Silufol UV 254, циклогексан-этилацетат, 67:33).
Маточный раствор состоит из органического и водного слоев. Слои разделили и обработали отдельно.
Органический слой - красно-коричневая жидкость с белыми кристаллами в ней (дифенил) фракционировали перегонкой. При температуре бани до 130-140oC при атмосферном давлении и затем вакууме 50 мм отогнали толуол (собрано 38 мл, 95%), в более глубоком вакууме отогнан диглим при т.кип. 86-105oC/27 мм (собрано 12 мл, 32%), в предельном вакууме отогнали дифенил при т.кип. 91- 96oC/3 мм (собрано 34.6 г, 92%). Темный смолистый остаток в перегонной колбе использован для выделения дополнительной порции эстрона. Водный слой с сильнокислой реакцией (100 мл) перегоняли при атмосферном давлении, собирая при т. кип. 96-104oC слабокислый азеотроп воды с диглимом и прекращая перегонку при начале отгонки азеотропа соляной кислоты. В дистилляте (50 мл) растворили 20 г едкого натра; при этом образовался слой диглима (18 мл, 49%), который отделили.
Остаток от перегонки растворили в 10 мл толуола, прибавили затравку (1 мг тонкорастертого эстрона) и темный раствор оставили на 2 суток. Выпавший кристаллический осадок отфильтровали, промыли 2 мл толуола и высушили, как описано для основной порции эстрона. Получили 0.926 г (7%) эстрона, желтоватый кристаллический порошок, т.пл. 256-257oC.
Пример 2. Реакцию Драйдена, гидролиз этиленкеталя эстрона, выделение основной порции эстрона производят, как описано выше. Для выделения дополнительной порции эстрона к смеси стероидов (3.3 г), полученной в аналогичном опыте (на 8 г 17-этиленкеталя АДД) после выделения основной порции эстрона, в растворе в 130 мл толуола (содержащего также 18 г дифенила), прибавили 4 мл 20%-ного водного раствора NaOH (впоследствии найдено, что лучше использовать 40%-ный раствор) и двухслойную смесь интенсивно перемешивали 5 мин. Нижний водный слой превратился в слой вязкой темной смолы, а органический слой посветлел. Органический слой отделили декантацией, к оставшейся в колбе смоле прибавили 20 мл толуола и половину кислотного водного слоя из маточного раствора, оставшегося после выделения основного количества эстрона (100 мл), и смесь энергично перемешивали до исчезновения смолы и образования двухслойной смеси с кристаллами эстрона на границе фаз. Эстрон отфильтровали, промыли 10 мл толуола и 20 мл воды и высушили, как описано выше. Получили 1.19 г эстрона в виде коричневого порошка, который подлежит дополнительной очистке.
В капельную воронку с байпасом помещают на дно плотный слой ваты (а при особо грязном эстроне еще слой активированного угля или силикагеля и еще слой ваты) и на него насыпают порошок неочищенного эстрона. К низу воронки присоединяют колбу с толуолом, а в верхний шлиф вставляют обратный холодильник. Толуол в колбе интенсивно кипятят при полностью открытом кране воронки. Пары толуола проходят по байпасу в верхнюю часть воронки и затем в холодильник, конденсируются, горячий толуол стекает на эстрон, проходит через него, растворяя эстрон до насыщения, раствор фильтруется через вату (и очищается на угле или силикагеле, если положены) и через кран стекает обратно в колбу, где постепенно концентрируется. После растворения всего эстрона в воронке кипячение прекращают, колбу охлаждают и отфильтровывают выкристаллизовавшийся эстрон, промывая небольшим количеством чистого толуола.
Благодаря очень большой разнице в растворимостях эстрона в кипящем и холодном толуоле экстракция проходит быстро, а выход определяется в основном чистотой исходного эстрона.
Таким образом, предложенный способ позволяет проводить процесс в среде одного растворителя, медленно и равномерно вводить реагенты в реакционную смесь, что обеспечивает ровное и контролируемое протекание реакции, позволяет достаточно полно выделить целевой продукт при использовании небольших количеств реагентов и получить воспроизводимый выход в 77% и, кроме того, позволяет при выделении дополнительной порции целевого продукта регенерировать дорогостоящие реагенты, что существенно снижает стоимость получения целевого продукта.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ 17,17-ЭТИЛЕНДИОКСИАНДРОСТА-1,4-ДИЕН-3-ОНА | 2017 |
|
RU2639147C1 |
| МИКРОБИОЛОГИЧЕСКИЙ СПОСОБ ПОЛУЧЕНИЯ 1,2-ДЕГИДРИРОВАННЫХ ПРОИЗВОДНЫХ Δ-3-КЕТОСТЕРОИДОВ РЯДА АНДРОСТАНА В ВОДНО-ОРГАНИЧЕСКИХ СРЕДАХ | 2010 |
|
RU2447154C1 |
| СПОСОБ ПОЛУЧЕНИЯ 6-МЕТИЛЕНАНДРОСТ-4-ЕН-3,17-ДИОНА ИЗ АНДРОСТ-4-ЕН-3,17-ДИОНА, СПОСОБ ПОЛУЧЕНИЯ 6-МЕТИЛЕНАНДРОСТА-1,4-ДИЕН-3,17-ДИОНА (ЭКСЕМЕСТАНА) С ИСПОЛЬЗОВАНИЕМ ПОЛУЧЕННОГО 6-МЕТИЛЕНАНДРОСТ-4-ЕН-3,17-ДИОНА | 2010 |
|
RU2425052C1 |
| Способ получения стероидов или их фармацевтически приемлемых солей | 1986 |
|
SU1540656A3 |
| СПОСОБ ПОЛУЧЕНИЯ 11БЕТА, 17АЛЬФА, 21-ТРИГИДРОКСИ-16АЛЬФА-МЕТИЛ-9АЛЬФА-ФТОРПРЕГНА-1,4-ДИЕН-3,20-ДИОНА (ДЕКСАМЕТАЗОНА) ИЗ ФИТОСТЕРИНА | 2013 |
|
RU2532902C1 |
| СПОСОБ ПОЛУЧЕНИЯ КЕТАЛЯ СТЕРОИДНОГО ПРОИЗВОДНОГО, СПОСОБЫ ПОЛУЧЕНИЯ СОЕДИНЕНИЙ | 1996 |
|
RU2165430C2 |
| Способ получения замещенных андроста-1,4-диен-3,17-дионов | 1986 |
|
SU1442077A3 |
| СПОСОБ ПОЛУЧЕНИЯ АНДРОСТА-1,4-ДИЕН-3,17-ДИОНА | 1993 |
|
RU2039824C1 |
| N-ЗАМЕЩЕННЫЕ ПРОИЗВОДНЫЕ 6α-ПИПЕРАЗИНОМЕТИЛАНДРОСТ-4-ЕН-3,17-ДИОНА, ОБЛАДАЮЩИЕ АНТИМИКРОБНОЙ АКТИВНОСТЬЮ, И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2023 |
|
RU2807924C1 |
| ПРОИЗВОДНЫЕ 17-ГАЛОГЕН-4-АЗААНДРОСТЕНА | 1993 |
|
RU2103275C1 |
Изобретение относится к способу получения D-эстра-1,3,5(10)-триен-3-ол-17-она (эстрона). Способ включает в себя восстановительную ароматизацию 17-этиленкеталя андроста-1,4-диен-3,17-диона путем его введения в реакционную смесь, содержащую металлический натрий и дифенил в диглиме при повышенной температуре, и последующий кислотный гидролиз, причем 17-этиленкеталь андроста-1,4-диен-3,17-диона вводят в реакционную смесь в виде раствора в расплаве дифенила в токе инертного газа. Реакционная смесь содержит количество дифенила меньше стехиометрического, а оставшееся количество дифенила, необходимое для проведения реакции, добавляют введением 17-этиленкеталя андроста-1,4-диен-3,17-диона в расплавленном дифениле. Раствор 17-этиленкеталя андроста-1,4-диен-3,17-диона в расплаве дифенила выполняют смешением равных весовых количеств 17-этиленкеталя андроста-1,4-диен-3,17-диона и дифенила при температуре выше 75oC. Дополнительное количество эстрона, остающееся в маточном растворе после выделения основного количества, выделяют экстракцией водным раствором гидроксида натрия, причем для экстракции используют 20 - 40%-ный водный раствор гидроксида натрия. Альтернативно дополнительное количество эстрона, остающееся в маточном растворе после выделения основного количества, выделяют при регенерации диглима и дифенила. Способ обеспечивает равномерное протекание реакции, полноту выделения эстрона и одновременную частичную регенерацию используемых реагентов. 5 з.п. ф-лы.
| RU 2056430, 1996 | |||
| US 3994938, 1976 | |||
| US 3274182, 1964 | |||
| US 4622181, 1986. |
Авторы
Даты
2001-07-20—Публикация
2000-02-22—Подача