Данное изобретение относится к способу снижения уровней TNFα у млекопитающего и соединениям и композициям, используемым в этом способе.
TNFα, или фактор α-некроза опухоли является цитокином, который выделяется главным образом одноядерными фагоцитами в ответ на разные иммуностимуляторы. При введении животным или людям он вызывает воспаление, лихорадочное состояние, сердечно-сосудистые эффекты, кровотечение, коагуляцию и ответные реакции в острой фазе, подобные реакциям, наблюдаемым во время острых инфекционных болезней и шоковых состояний.
Избыточное или нерегулируемое продуцирование TNFα считали причастным к ряду болезненных состояний. Они включают синдром наличия в крови эндотоксинов и/или токсического шока [Tracey et al. Nature 330, 662-664 (1987) и Hinshaw et al. Circ. Shock 30, 279-292 (1990)]; кахексию [Dezube et al., Lancet, 335 (8690), 662 (1990)] и респираторный дистресс-синдром (ARDS) взрослых, причем в тканях легких ARDS-пациентов обнаруживали концентрацию TNFα в избыточном количестве - 12000 пг/мм [Millar et al., Lancet 2 (8665), 712-714 (1989)] . Системная инфузия рекомбинантного TNFα также приводила к изменениям, обычно наблюдаемым в случае ARDS [Ferria-Baliviera et al. Arch Surg. 124 (12), 1400-1405 (1989)].
По-видимому, TNFα принимает участие в болезнях, заключающихся в резорбции костей, включая артрит, в случае этих болезней было установлено, что после активации лейкоциты развивают резорбцирующую кости активность, данные допускают, что TNFα содействуют этой активности. (Bertolini et al. Nature 319, 516-518 (1986) и Johnson et al. Endocrinology 124 (3), 1424-1427 (1989)]. Было установлено, что TNFα стимулирует резорбцию костей и ингибирует костеобразование in vitro и in vivo посредством стимуляции образования и активации остеокластов, комбинированной с ингибированием функции остеобластов. Несмотря на то, что TNFα может быть вовлечен во многие болезни, заключающиеся в резорбции костей, включая артрит, наиболее непреодолимой связью с болезнью является связь между продуцированием TNFα опухолевыми тканями или тканями организма-хозяина и ассоциированной со злокачественностью гиперкальциемией [Calci Tissue. Int. (US) 46 (Suppl.) S3-10 (1990)].
В гомологичной болезни повышенные уровни TNFα в сыворотке были связаны с основным осложнением после экстренных трансплантаций аллогенного костного мозга [Holler et al., Blood, 75 (4), 1011-1016 (1990)].
Церебральная малярия является летальным гиперострым нейрональным синдромом, связанным с высокими уровнями TNFα в крови, и наиболее тяжелым осложнением, встречающимся у малярийных пациентов. Уровни TNFα в сыворотке крови коррелировали непосредственно с тяжестью болезни и прогнозом у пациентов с острыми приступами малярии [Grau et al., N. Engl. J. Med. 320 (24), 1586-1591 (1989)].
TNFα играет роль также в области хронических легочных воспалительных болезней. Отложение частиц диоксида кремния ведет к силикозу, болезни прогрессивной дыхательной недостаточности, вызванной фиброзной реакцией. Антитела против TNFα полностью блокировали вызванный диоксидом кремния легочный фиброз у мышей [Pignet et al., Nature, 344: 245-247 (1990)]. Высокие уровни продуцирования TNFα (в сыворотке крови и выделенных макрофагах) демонстрировали на животных моделях фиброза, вызванного диоксидом кремния и асбестом (Bissonnette et al., Inflammation 13 (3), 329-339 (1989)]. Было также найдено, что альвеолярные макрофаги от пациентов с легочным саркоидозом спонтанно выделяют массированные количества TNFα по сравнению с макрофагами от нормальных доноров [Baughman et al., J. Lab. Clin. Med. 115 (1), 36-42 (1990)].
TNFα вовлекается также в воспалительную реакцию, названную реперфузионным повреждением, которая следует за реперфузией и является основной причиной повреждения ткани после прекращения кровотока (Vedder et al., PNAS 87, 2643-2646 (1990)]. TNFα изменяет также свойства эндотелиальных клеток и обладает различными прокоагулирующими активностями, например, вызывает повышение прокоагулирующей активности тканевого фактора и подавление пути антикоагулирующего белка C, а также отрицательную регуляцию экспрессии тромбомодулина [Sherry et al. , J. ell Biol. 107, 1269 - 1277 (1988)]. TNFα обладает противовоспалительной активностью, которая вместе с его ранним образованием (во время начальной стадии воспаления) делает его возможным медиатором повреждения ткани в нескольких важных болезнях, включающих, но не ограничивающихся ими, инфаркт миокарда, удар и циркуляторный шок. Конкретно важной может быть TNFα, индуцированная экспрессия молекул адгезии, например, межклеточной молекулы адгезии (ICAM) или эндотелиальной лейкоцитной молекулы адгезии (ELAM) на эндотелиальных клетках [Munro et al. Am. J. Path. 135 (1), 121-132 (1989)].
Кроме того, сейчас известно, что TNFα является сильнодействующим активатором ретровирусной репликации, включая активацию ВИЧ-1. [Duch et al., Proc. Nat. Acad. Sci., 86, 5974-5978 (1989); Poll et al., Proc. Nat.Acad. Sci. 87, 782-785 (1990); Monto et al. Blood 79, 2670 (1990); Clouse et al., J. Immunol. 142, 431-438 (1989); Poll et al. AIDS Res. Hum. Retrovirus, 191-197 (1992)] . СПИД является результатом инфицирования Т-лимфоцитов вирусом иммунодефицита человека (БИЧ). Идентифицировано по меньшей мере три типа или штамма ВИЧ, т.е. ВИЧ-1, ВИЧ-2 и ВИЧ-3. В результате ВИЧ-инфицирования ослабляется медиированный Т-клетками иммунитет, и у инфицированных индивидуумов обнаруживаются тяжелые инфекционные болезни, вызываемые условно-патогенными микроорганизмами, и/или редкие опухоли. Проникновение ВИЧ в Т-лимфоциты требует активации Т-лимфоцитов. Другие вирусы, например ВИЧ-1, ВИЧ-2, инфицируют Т-лимфоциты после активации Т-клеток и экспрессия и/или репоикация таких вирусных белков медиируется или поддерживается такой активацией Т-клеток. После того, как активированный Т-лимфоцит инфицируется ВИЧ, Т-лимфоцит должен продолжать поддерживаться в активированном состоянии, чтобы сделать возможной экспрессию гена ВИЧ и/или репликацию ВИЧ. Цитокины, конкретно TNFα вовлекаются в медиированную активированными Т-клетками экспрессию ВИЧ-белка и/или вирусную репликацию, принимая участие в поддержании активации Т-лимфоцитов. Следовательно, препятствие активности цитокинов, например, предотвращением или ингибированием продуцирования цитокина, a именно TNFα , в ВИЧ-инфицированных индивидуумах способствует ограничению поддержания активности Т-лимфоцитов, вызываемой ВИЧ-инфекцией.
Моноциты, макрофаги и родственные клетки, например звездчатые эндотелиоциты и глиальные клетки, также считали причастными к поддержанию ВИЧ-инфекции. Эти клетки, подобно Т-клеткам, являются мишенями для вирусной репликации и уровень вирусной репликации зависит от состояния активации клеток [Rosenberg et al. The Immunopathogenesis of HIV Infection, Advanced in Immunology, 57 (1989)]. Было показано, что цитокины, например TNFα, активируют репликацию БИЧ в моноцитах и/или макрофагах [Poli et al. Proc. Natl. Acad. Sci. , 87. 782-784 (1990)], следовательно, предотвращение или ингибирование продуцирования цитокинов или их активности помогает в ограничении развития ВИЧ, как сообщалось выше для Т-клеток. Дополнительные исследования идентифицировали TNFα в качестве общего фактора в активации ВИЧ in vitro и предложили ясный механизм действия через нуклеарный регуляторный белок, найденный в цитоплазме клеток (Osborn et al., PNAS, 86, 2336-2340). Это доказательство предполагает, что уменьшение синтеза TNFα может иметь антивирусное действие в ВИЧ-инфекциях путем снижения транскрипции и, таким образом, продуцирования вируса.
Присущая СПИДу вирусная репликация латентного ВИЧ в линиях Т-клеток и макрофагов может быть индуцирована TNFα [Folrs et al., PNAS 86, 2365-2368 (1989)].
Молекулярный механизм для индуцирующей вирус активности предполагается на основании способности TNFα активировать регуляторный белок гена (NFkB), найденный в цитоплазме клеток, который промотирует репликацию ВИЧ через связывание с регуляторной генной последовательностью (LTR) [Osborn et. al., PNAS 86, 2336-2340 (1989)]. Участие TNFα в СПИДе и связанной с раком кахексии предполагается на основе повышенного уровня TNFα в сыворотке и высоких уровней спонтанного продуцирования TNFα в моноцитах периферической крови пациентов [Wright et al., J. Immunol. 141 (1) 99-104 (1988)]. Eur. J. Gastroen Hepat 6 (9), 821-829, 1994.
TNFα считали причастным к выполнению разных функций в случае других вирусных инфекций, например вируса цитомегалии (CMV), вируса гриппа, аденовируса и вирусов семейства герпес, по причинам, аналогичным указанным.
Поэтому предсказывают, что предотвращение или ингибирование продуцирования или действия TNFα представляет убедительную терапевтическую стратегию для многих воспалительных, инфекционных, иммунологических или злокачественных болезней. Они включают, но не ограничиваются ими, септический шок, сепсис, эндотоксический шок, гемодинамический шок и синдром сепсиса, повреждение после ишемической реперфузии, малярию, микобактериальную инфекцию, менингит, псориаз, застойную сердечную недостаточность, фиброзную болезнь, кахексию, отторжение трансплантата, рак, аутоиммунную болезнь, инфекции при СПИДе, вызываемые условно-патогенными микроорганизмами, ревматический артрит, ревматический спондилит, остеоартрит, другие артритные состояния, болезнь Крона, неспецифический язвенный колит, рассеянный склероз, системную красную волчанку, ENL при проказе, радиационное повреждение и альвеолярное повреждение из-за гипероксии. Усилия, направленные на подавление действия TNFα, варьируют от использования стероидов, например дексаметазона и преднизалона, до использования как поликлональных, так и моноклональных антител [Beutler et al. Science 234, 470-474 (1985); WO 92/11383]. (Clinical and Experimental Rheumatology 1993, 11 (Suppl. 8), 5173-5175). (PNAS 1992, 89, 9784-88). (Annals of the Rheumatic Diseases 1990, 49, 480-486).
Нуклеарный фактор kB (NFkB) является плейотропным транскрипционным активатором (Lenardo, et al. Cell 1989, 58, 227-29). NFkB считали причастным в качестве транскрипционного активатора к ряду заболеваний и воспалительных состояний и полагают, что он регулирует уровни цитокинов, включая, но не ограничиваясь TNFα и является также активатором ВИЧ-транскрипции (Dbaibo, et al. J. Biol. Chem. 1993, 17762-66; Duh et al. Proc. Nail. Acad. Sci., 1989, 86, 5974-78; Bachelerie etal. Nature 1991, 350, 709-12; Boswas et al., J. Acquired Immune Deficiency Syndrome 1993, 6, 778-786; Suzuki et al. Biochem. and Biophys. Res. Comm. 1993, 193, 277-83; Suzuki et al. Biochem. and Biophys. Res. Comm. 1992, 189, 1709-15; Suzuki et al. Biochem. and Biophys Mol. Bio. Int. 1993, 31 (4), 693-700; Shaknov et al. 1990, 171, 35-47; and Staal et al. Proc. Natl. Acad. Sci. USA 1990, 87, 9943-47). Таким образом, ингибирование связывания NFkB может регулировать транскрипцию гена(ов) цитокинов, и полагают, что эта модуляция и другие механизмы полезны при ингибировании большого числа болезненных состояний. Соединения, заявленные в этом патенте, могут ингибировать действие NFkB в ядре клетки и, таким образом, полезны при лечении ряда болезней, включая, но не ограничиваясь ими, ревматический артрит, ревматический спондилез, остеоартрит, другие артритные состояния, септический шок, сепсис, эндотоксический шок, гомологичная болезнь, истощение, болезнь Крона, неспецифический язвенный колит, рассеянный склероз, системную красную волчанку, ENL при проказе, СПИД и инфекции при СПИДе, вызываемые условно-патогенными микроорганизмами.
На уровни TNFα и NFkB влияет реципрокная петля по типу обратной связи. Как указано выше, соединения данного изобретения влияют на уровни как TNFα так и NFkB. В настоящее время, однако, не известно, как соединения данного изобретения регулируют уровни TNFα , NFkB или обоих.
Подробное описание
Данное изобретение основывается на открытии, что класс неполипептидных имидов, более полно описанный здесь, по-видимому, ингибирует действие TNFα
Данное изобретение относится к соединениям формулы;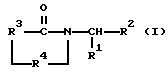
где R1 представляет (i) нормальный, разветвленный или циклический алкил, имеющий от 1 до 12 атомов углерода, (ii) фенил или фенил, замещенный одним или несколькими заместителями, каждый из которых независимо от других выбран из нитро, циано, трифторметила, карбэтокси, карбометокси, карбопропокси, ацетила, карбамоила, ацетокси, карбокси, гидрокси, амино, нормального или разветвленного алкила, имеющего от 1 до 10 атомов углерода, алкокси, имеющей от 1 до 10 атомов углерода или галогена, (iii) бензил или бензил, замещенный одним или несколькими заместителями, каждый из которых независимо от других выбран из нитро, циано, трифторметила, карбэтокси, карбометокси, карбопропокси, ацетила, карбамоила, ацетокси, карбокси, гидрокси, амино, алкила, имеющего от 1 до 10 атомов углерода, алкокси, имеющей от 1 до 10 атомов углерода, или галогена, или (iv) -Y-Ph, где Y представляет нормальный, разветвленный или циклический алкил, имеющий от 1 до 12 атомов углерода, и Ph представляет фенил или фенил, замещенный одним или несколькими заместителями, каждый из которых независимо от других выбран из нитро, циано, трифторметила, карбэтокси, карбометокси, карбопропокси, ацетила, карбамоила, ацетокси, карбокси, гидрокси, амино, алкила, имеющего от 1 до 10 атомов углерода, алкокси, имеющей от 1 до 10 атомов углерода, или галогена;
R2 представляет -H, нормальный или разветвленный алкил, имеющий от 1 до 10 атомов углерода, фенил, пиридил, гетероцикл, -CH2-арил или -CH2-гетероцикл;
R3 представляет i) этилен, ii) винилен, iii) разветвленный алкилен, имеющий от 3 до 10 атомов углерода, iv) разветвленный алкенилен, имеющий от 3 до 10 атомов углерода, v) циклоалкилен, имеющий от 4 до 9 атомов углерода и незамещенный или замещенный 1 или 2 заместителями, каждый из которых независимо выбран из нитро, циано, трифторметила, карбэтокси, карбометокси, карбопропокси, ацетила, карбамоила, ацетокси, карбокси, гидрокси, амино, замещенной амино, алкила, имеющего от 1 до 4 атомов углерода, алкокси, имеющей от 1 до 4 атомов углерода или галогена, (vi) циклоалкенилен, имеющий от 4 до 9 атомов углерода и незамещенный или замещенный 1 или 2 заместителями, каждый из которых независимо выбран из нитро, циано, трифторметила, карбэтокси, карбометокси, карбопропокси, ацетила, карбамоила, ацетокси, карбокси, гидрокси, амино, замещенной амино, алкила, имеющего от 1 до 4 атомов углерода, алкокси, имеющей от 1 до 4 атомов углерода, или галогена, или vii) O-фенилен, незамещенный или замещенный 1 или 2 заместителями, каждый из которых независимо выбран из нитро, циано, трифторметила, карбэтокси, карбометокси, карбопропокси, ацетила, карбамоила, ацетокси, карбокси, гидрокси, амино, замещенной амино, алкила, имеющего от 1 до 4 атомов углерода, алкокси, имеющей от 1 до 4 атомов углерода, или галогена; и
R4 представляет -CX- или -CH2-,
X представляет O или S.
Термин "алкил", как используется здесь, обозначает одновалентную насыщенную разветвленную или нормальную углеводородную цепь. Если не оговорено особо, такие цепи могут содержать от 1 до 18 атомов углерода. Представителями таких алкильных групп являются метил, этил, пропил, изопропил, бутил, изобутил, втор-бутил, трет-бутил, пентил, изопентил, нео-пентил, трет-пентил, гексил, изогексил, гептил, октил, нонил, децил, ундецил, додецил, тридецил, тетрадецил, пентадецил, гексадецил, гептадецил, октадецил и подобные. При определении "низший" алкильная группа будет содержать от 1 до 6 атомов углерода. Такое же число атомов углерода относится к родительскому термину "алкан" и терминам производных, например "алкокси".
Соединения можно получить с использованием способов, которые известны в общем для получения имидов. Общие схемы реакций включают реакцию замещенного амина либо с фталевым ангидридом, N-карбэтоксифталимидом, 1,2-бензолдикарбальдегидом либо с различными замещенными ангидридами, иллюстрируемыми формулами: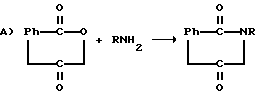

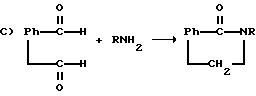
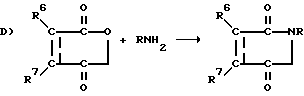
R представляет 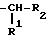
R6 и R7 представляют водород, нитро, циано, трифторметил, карбэтокси, карбометокси, карбопропокси, ацетил, карбамоил, ацетокси, карбокси, гидрокси, амино, замещенную амино, алкил, имеющий от 1 до 4 атомов углерода, алкокси, имеющая от 1 до 4 атомов углерода, галоген, или R6 и R7 вместе с атомами углерода, к которым они присоединены, представляют циклоалкиленовое кольцо, имеющее от 4 до 9 атомов углерода и незамещенное или замещенное одним или несколькими заместителями, каждый из которых независимо выбран из нитро, циано, трифторметила, карбэтокси, карбометокси, карбопропокси, ацетила, карбамоила, ацетокси, карбокси, гидрокси, амино, замещенной амино, алкила, имеющего от 1 до 4 атомов углерода, алкокси, имеющей от 1 до 4 атомов углерода, или галогена.
Первый предпочтительный подкласс соединений формулы I относится к соединениям, у которых:
R1 представляет 3,4-диэтоксифенил или 3,4-диметоксифенил,
R3 представляет о-фенилен, замещенный амино, и
R4 представляет -CO- или -CH2-.
Соединения можно использовать под наблюдением квалифицированных профессионалов для ингибирования нежелательных действий TNFα . Соединения можно вводить млекопитающему, нуждающемуся в лечении, перорально, ректально или парентерально, отдельно или в комбинации с другими терапевтическими средствами, включая антибиотики, стероиды и т.д. Пероральные лекарственные формы включают таблетки, капсулы, драже и подобные формованные, прессованные фармацевтические формы. Изотонические солевые растворы, содержащие 20-100 мг/ мл, можно использовать для парентерального введения, которое включает внутримышечные, внутриоболочечные, внутривенные и внутриартериальные способы введения. Ректальное введение можно осуществить путем использования суппозиториев, изготовленных из обычных носителей, например, какао-масла.
Схемы приема лекарственного средства должны определяться конкретным показанием, возрастом, массой и общим физическим состоянием пациента и желаемой восприимчивостью, но обычно дозы будут от около 1 до около 500 мг/день, как необходимо, при однократном или многократном суточном введении. Вообще режим начального лечения можно копировать с режима, который, как известно, эффективен в препятствии активности TNFα соединениями данного изобретения в других TNFα -медиированных болезненных состояниях. Принимающих лечение индивидуумов можно регулярно проверять на число Т-клеток и отношений Т4/Т8 и/или показатели вирусемии, например уровни обратной транскриптазы или вирусных белков, и/или на прогрессирование проблем, связанных с медиированной цитокином болезнью, например кахексией или мышечной дегенерацией. Если после обычной схемы лечения никакое действие не обнаруживают, то количество вводимого средства, препятствующего активности цитокина, повышают, например, на пятьдесят процентов в неделю.
Соединения данного изобретения можно использовать местно для лечения или профилактики местных болезненных состояний, медиированных или обостренных избыточным продуцированием TNFα соответственно, таких, как вирусные инфекции, например инфекции, вызванной вирусами герпеса или вирусного конъюктивита и т.д.
Соединения можно также использовать при ветеринарном лечении млекопитающих, исключая людей, нуждающихся в предотвращении или ингибировании продуцирования TNFα. TNFα -медиированные болезни для лечения животных терапевтически или профилактически включают болезненные состояния, например болезни, указанные выше, но в особенности вирусные инфекции. Примеры включают вирус кошачьего иммунодефицита, вирус лошадиной инфекционной анемии, вирус козлиного артрита, вирус visna и вирус maedi, а также другие лентивирусы.
Некоторые из этих соединений обладают центрами хиральности и могут существовать в виде оптических изомеров. Оба рацемата этих изомеров и сами индивидуальные изомеры, а также диастереомеры, когда имеются два хиральных центра, находятся в пределах объема данного изобретения. Рацематы можно использовать как таковые или их можно разделить на их индивидуальные изомеры механически, как, например, хроматографией, используя хиральный абсорбент. Альтернативно индивидуальные изомеры можно получить в хиральной форме или разделить химически из смеси путем образования солей с хиральной кислотой, например индивидуальными энантимерами 10-камфорасульфокислотой, камфорной кислотой, альфа-бромкамфорной кислотой, метоксиуксусной кислотой, винной кислотой, диацетилвинной кислотой, яблочной кислотой, пирролидон-5-карбоновой кислотой и подобными, и затем освобождением одного или обоих разделенных оснований, необязательно повторяя процесс, чтобы получить один из двух или оба изомера, по существу свободные от другого изомера, т.е. в форме, имеющей оптическую чистоту > 95%.
Предотвращение или ингибирование продуцирования TNFα этими соединениями можно стандартно испытать, используя антитела против TNFα. Например, планшеты (иммунопланшеты Nunc, Roskilde, DK) обрабатывают 5 мкг/мл очищенных кроличьих антител против TNFα при 4oC в течение от 12 до 14 ч. Планшеты затем блокируют в течение 2 ч при 25oC PBS (забуференный фосфатом физиологический раствор)/ 0,05% твин, содержащий 5 мг/мл BSA (альбумин бычьей сыворотки). После промывания добавляют 100 мкл испытуемых соединений, а также контрольные образцы и планшеты инкубируют при 4oC в течение от 12 до 14 ч. Планшеты промывают и анализируют конъюгатом пероксидазы (хрена обыкновенного) и мышиных моноклональных антител против TNFα , и цвет проявляют о-фенилендиамином в фосфатцитратном буфере, содержащем 0,012% пероксида водорода, и читают у 492 нм.
Типичные соединения этого изобретения включают:
1-фталимидо-1-(3',4'-диэтоксифенил)этан,
1-(1'-оксоизоиндолинил)-1-(3',4'-диэтоксифенил)этан,
1-фталимидо-1-(3',4'-диэтоксифенил)пропан,
1-(1'-оксоизоиндолинил)-1-(3',4'-диэтоксифенил)пропан,
1-фталимидо-1-(3',4'-диэтоксифенил)бутан,
1-(1'-оксоизоиндолинил)-1-(3',4'-диэтоксифенил)бутан,
1-фталимидо-1-(3',4'-диэтоксифенил)-2-фенилэтан,
1-(1'-оксоизоиндолинил)-1-(3',4'-диэтоксифенил)-2-фенилэтан,
1-фталимидо-1-(3',4'-диэтоксифенил)-3-пиридилпропан,
1-(1'-оксоизоиндолинил)-1-(3',4'-диэтоксифенил)-3-пиридилпропан,
1-фталимидо-1-(3',4'-диэтоксифенил)-3-фенилпропан,
1-(1'-оксоизоиндолинил)-1-(3',4'-диэтоксифенил)-3-фенилпропан,
1-фталимидо-1-(3',4'-диэтоксифенил)-2-пиридилэтан,
1-(1'-оксоизоиндолинил)-1-(3',4'-диэтоксифенил)-2-пиридилэтан,
1-фталимидо-1-(3',4'-диэтоксифенил)бутан,
1-(1'-оксоизоиндолинил)-1-(3',4'-диэтоксифенил)бутан,
1-фталимидо-1-(3',4'-диэтоксифенил)-2-имидазолилэтан,
1-(1'-оксоизоиндолинил)-1-(3',4'-диэтоксифенил)-2-имидазолилэтан,
1-фталимидо-1-(3',4'-диэтоксифенил)-3-метилбутан,
1-(1'-оксоизоиндолинил)-1-(3',4'-диэтоксифенил)-3-метилбутан.
Следующие примеры будут служить для дальнейшего типирования сущности этого изобретения, но не должны истолковываться как ограничение в его объеме, которое определяется исключительно прилагаемой формулой изобретения.
Пример 1
2-Фталимидо-3-(3,4-диметоксифенил)пропан
В перемешиваемый раствор 3-(3,4-диметоксифенил)-2-аминопропана (1,95 г, 10,0 ммоль) и карбоната натрия (1,06 г, 10,0 ммоль) в 50 мл воды добавляли N-карбэтоксифталимид (2,19 г, 10,0 ммоль). Через 10 мин реакционную смесь разбавляли 40 мл ацетонитрила и смесь перемешивали в течение 40 мин. Реакционный раствор частично концентрировали в вакууме для удаления ацетонитрила. Получаемую смесь масла и водного слоя экстрагировали метиленхлоридом (25 мл). Органический слой сушили над сульфатом натрия и концентрировали в вакууме, получая неочищенный продукт, который очищали флэш-хроматографией, что давало 1,73 г (53%) продукта в виде густого масла, которое медленно отверждалось в белый воск; 1H ЯМР (DMSO-d6, 250 МГц) δ 7,7 (м, 4H, Ar), 6,7 (м, 3Н, Ar), 4,63 (м, 1H, CH), 3,79 (с, 3Н, OMe), 3,73 (с, 3Н, OMe), 3,28 (дд, 1Н, J = 13,8, 9,8 Гц), 3,03 (дд, J= 13,8, 6,5 Гц, 1H), 1,54 (д, J= 6,9 Гц, 3Н);
1C ЯМР (DMSO-d6) δ 168,4, 148,6, 147,4, 133,7, 131,8, 130,9, 122,9, 120,9, 111,1, 55,7, 55,6, 48,6, 39,3, 18,3. Анал. Рассчитано для C19H19NO2: C 70,14; H 5,89; N 4,30. Найдено: C 70,08; H 5,83; N 4,30.
Пример 2
1-Фталимидо-1-(3',4'-диметоксифенил)этан
а) Оксим 3',4'-диметоксиацетофенона
Раствор гидрохлорида гидроксиламина (3,33 г, 48 ммоль) и ацетата натрия (4,92 г, 6 ммоль) в 20 мл воды добавляли в перемешиваемый раствор 3',4'-диметоксиацетофенона (5,41 г, 30,0 ммоль) в смеси воды (30 мл) и этанола (30 мл) и раствор перемешивали в течение ночи. Получаемую смесь фильтровали и твердую часть сушили в вакууме (60oC < 1 мм), что давало 4,68 г (80%) продукта в виде желтого твердого вещества: т.пл. 137-138oC; 1H ЯМР (CDCl3) δ 7,34-7,08 (м, 2Н), 6,94-6,80 (м, 1Н), 3,92 (c,3H), 3,90 (с, 3Н), 2,28 (с, 3Н); 13C ЯМР (CDCl3) δ 155,6, 150,1, 148,8, 129,2, 119,2 110,6, 108,6, 55,8.
b) 1-(3',4'-Диметоксифенил)этиламин
Оксим 3', 4'-диметоксиацетофенона (1 г, 5,1 ммоль) растворяли в 10 мл ледяной уксусной кислоты, раствор продували N2 и добавляли палладий на угле (0,2 г, 5%). Смесь обрабатывали H2 при 4,219 атм в вибраторе типа Парра в течение 24 ч. Катализатор отделяли фильтрованием и фильтрат концентрировали, что давало желтое масло, которое растворяли в воде, подщелачивали до pH 12 насыщенным раствором карбоната натрия и экстрагировали метиленхлоридом. Объединенные экстракты сушили над сульфатом магния и концентрировали, что давало 1,97 г (82%) продукта в виде желтого масла: 1H ЯМР (CDCl3) δ 7,02-6,75 (м, 3Н), 4,08 (к, J1=6,6 Гц, J2 = 13,1 Гц, 1Н), 3,89 (с, 3Н), 3,87 (с, 3Н), 1,37 (д, J = 6,6 Гц, 3Н).
c)1-Фталимидо-1-(3', 4'-диметоксифенил)этан. В перемешиваемый раствор 1-(3', 4'-диметоксифенил)этиламина (1,81 г, 10,0 ммоль) и карбоната натрия (1,14 г, 10,8 ммоль) в смеси воды (80 мл) и ацетонитрила (50 мл) добавляли N-карбэтоксифталимид (2,19 г, 10 ммоль). Получаемую суспензию перемешивали в течение 3,5 ч при комнатной температуре и затем фильтровали, что давало 1,24 г (40%) неочищенного продукта в виде белого порошка. Неочищенный продукт перекристаллизовывали из смеси гексан/этилацетат и сушили в вакууме (60oC, < 1 мм), что давало 0,85 г (27%) продукта в виде кристаллов: т.пл. 124-125oC; 1H ЯМР (DMSO-d6) δ 7,96-7,78 (м, 4Н), 7,09-6,81 (м, 3Н), 5,40 (кв, J = 7,2 Гц, 1Н), 3,73 (с, 3Н), 3,72 (с, 3Н), 1,81 (д, J= 7,2 Гц, 3Н); 13C ЯМР (DMSO-d6) δ 167,6, 148,4, 148,0, 134,4, 132,9, 131,3, 122,9, 118,8, 111,5, 110,8, 55,4, 48,6, 17,7. Анал. Рассчитано для C18H17NO4: C 69,44; H 5,50; N 4,50. Найдено: C 69,63; H 5,45; N 4,42. ВЭЖХ (чистота) 100%.
Пример 3
1-Фталимидо-1-(4'-метоксифенил)пропан
а) оксим 4'-метоксипропиофенона
Раствор гидрохлорида гидроксиламина (3,33 г, 48 ммоль) и ацетат натрия (4,92 г, 60 ммоль) в 20 мл воды добавляли в перемешиваемый раствор 4-метоксипропиофенона (5,26 г, 30,0 ммоль) в смеси воды (30 мл) и этанола (30 мл), далее добавляли 20 мл этанола для получения гомогенного раствора, который перемешивали в течение ночи. Получаемую суспензию фильтровали, фильтрат частично концентрировали для удаления этанола и осаждения белого твердого продукта. Суспензию фильтровали и твердую часть, промывали водой и сушили в вакууме (25oC, < 1 мм), что давало 5,26 г (98%) продукта в виде белого твердого вещества: 1H ЯМР (CDCl3) δ 7,64-7,42 (м, 2Н), 7,04-6,81 (м, 2Н), 3,82 (с, 3Н), 2,81 (кв, J = 7,6 Гц, 2Н), 1,17 (т, J = 7,6 Гц, 3Н).
b) 1-(4'-Метоксифенил)пропиламин. В продутый N2 раствор оксима 4'-метоксипропиофенона (4 г, 22,3 ммоль) в ледяной уксусной кислоте (40 мл) добавляли 0,8 г 5% Pd/C. Смесь обрабатывали H2 при 4,219 атм в течение 23 ч. Катализатор отделяли фильтрованием через целит и фильтрат концентрировали, что давало желтое масло. Масло растворяли в воде, устанавливали pH 12, используя насыщенный раствор карбоната натрия, и экстрагировали метиленхлоридом. Органический экстракт сушили над сульфатом магния и концентрировали, что давало 3,04 г (83%) продукта в виде желтого масла: 1H ЯМР (CDCl3) δ 7,32 - 7,20 (м, 2Н), 6,94-6,82 (м, 2Н), 3,79 (с, 3Н), 1,88-1,54 (м, 4Н), 0,87 (т, J = 7,4 Гц, 3Н).
c) 1-Фталимидо-1-(4'-метоксифенил)пропан. В перемешиваемый раствор 1-(4'-метоксифенил)пропиламина (2,5 г, 15,2 ммоль) и карбоната натрия (1,74 г, 16,4 ммоль) в смеси воды (50 мл) и ацетонитрила (50 мл) добавляли N-карбэтоксифталимид (3,34 г, 15,2 ммоль). Получаемую суспензию перемешивали в течение 4,5 ч при комнатной температуре, ацетонитрил удаляли в вакууме, в результате чего происходило образование твердого продукта. Суспензию фильтровали и твердую часть промывали водой и сушили, что давало 1,73 г (39%) неочищенного продукта в виде белого порошка. Неочищенный продукт перекристаллизовали из смеси гексан/этилацетат и сушили в вакууме (60oC < 1 мм), что давало 1,71 г (38%) продукта в виде белых кристаллов: т.пл. 85-86oC; 1H ЯМР (DMCO-d6) δ 7,92-7,79 (м, 4Н), 7,46-7,28 (м, 2Н), 6,97-6,83 (м, 2Н), 5,19-5,06 (м, 1Н), 3,72 (с, 3Н), 2,56-2,13 (м, 2Н), 0,87 (т, J = 7,3 Гц, 3H)13ЯМР(DMSO -d6) δ 167,8, 1, 5, 134,6, 131,7, 131,0, 128,6, 123,1, 113,7, 55,2, 54,9, 23,8, 11,3. Анал. Рассчитано для C18H17NO3: C 73,20; H 5,80; N 4,74. Найдено: C 73,24; H 5,74; N 4,86. ВЭЖХ 100%.
Пример 4
1-Фталимидо-1-(3'4'-диметоксифенил)метан
В перемешиваемый раствор 3,4-диметоксибензиламина (0,836 г, 5,00 ммоль) и N-карбэтоксифталимида (1,10 г, 5,00 ммоль) в 20 мл тетрагидрофурана добавляли 1 каплю триэтиламина и смесь перемешивали в течение ночи. После выдерживания смеси 24 ч при комнатной температуре смесь кипятили с обратным холодильником в течение 16 ч, затем оставляли для охлаждения до комнатной температуры без перемешивания. При охлаждении образовались кристаллы. Смесь фильтровали и твердую часть сушили в вакууме, что давало 0,89 г (60%) 1-фталимидо-1-(3', 4'- диметоксифенил)метана в виде мелких белых игл: т.пл. 160-161oC; 1H ЯМР (CDCl3/ТМС) δ 7,8 (м, 2Н), 7,7 (м, 2Н), 7,03 (м, 2Н), 6,8 (М, 1Н), 4,78 (с, 2Н), 3,88 (с, 3Н, OCH3), 3,84 (с, 3Н, OCH3); 13C ЯМР (CDCl3/ТМС) δ 168,0, 148,9, 148,7, 133,9, 132,1, 129,0,
123,3, 121,3, 112,1, 111,1, 55,9, 41,4. Анал. Рассчитано для C17H15NO4: с 68,68; H 5,09; N 4,71. Найдено: C 68,49; H 4,99; N 4,67.
Пример 5
1-Фталимидо-(3,4-диметоксифенил)толуол
а) 1-Фенил-1-(3,4-диметоксифенил)метиламин
В перемешиваемый раствор 3,4-диметоксибензонитрила (1,63 г, 10,0 ммоль) в тетрагидрофуране (25 мл) добавляли фенилмагнийбромид (3,7 мл, 3 М, 11,0 ммоль) и получаемый раствор кипятили с обратным холодильником в течение 40 мин. Развитие реакции контролировали ТСХ (30% этилацетат/метиленхлорид, УФ), через 40 мин реакция завершалась. Реакционную смесь оставляли для охлаждения и медленно добавляли метанол (25 мл). После прекращения бурного выделения газа медленно добавляли борогидрид натрия (0,40 г, 10,5 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение ночи. Получаемую темно-красную смесь экстрагировали простым эфиром (3 раза по 50 мл) и объединенные эфирные экстракты обратно экстрагировали в водную 3 н. соляную кислоту (150 мл). pH водного слоя затем устанавливали до 14, используя едкий натр (5 молярный), и смесь экстрагировали метиленхлоридом (2 раза по 50 мл). Объединенные органические слои сушили над сульфатом магния и концентрировали в вакууме, что давало 1,76 г (72%) продукта в виде оранжевого масла, 1H ЯМР (CDCl3) δ 7,43-7,16 (м, 5Н), 6,95-6,74 (м, 3Н), 5,17 (с, 1H), 3,85 (с, 3Н), 3,84 (с, 3Н), 1,78 (с, 2Н).
b) Смесь 1-фенил-1-(3,4-диметоксифенил)метиламина
(0,73 г, 3 ммоль) и фталевого ангидрида (0,44 г, 3 ммоль) плавили вместе и перемешивали в течение 5 мин. После охлаждения образовался неочищенный продукт в количестве 1 г в виде желто-оранжевого стекловидного твердого вещества. Этот неочищенный продукт перекристаллизовывали из толуола и сушили в вакууме (60oC, < 1 мм), что давало 0,36 г (33%) продукта в виде белого твердого вещества; 1H ЯМР (DMSO-d6) δ 12,96 (с, 1H), 9,31-9,17 (м, 1H), 7,85- 6,73 (м, 12Н), 6,42-6,22 (м, 1H), 3,72 (с, 6Н); 1C ЯМР 9 (DMCO-d6) δ 167,7, 167,6, 148,5, 147,6, 142,7, 138,5, 134,8, 131,2, 130,5, 129,1, 128,9, 128,1, 127,8, 127,3, 126,6, 119,6, 111,5, 111,4, 55,7, 55,4, 55,4.
с) 1-Фталимидо-(3,4-диметоксифенил)толуол
Раствор продукта приведенной выше стадии b) (0,25 г, 0,68 ммоль) и ацетата натрия (0,03 г, 0,34 ммоль) в уксусном ангидриде (6 мл) кипятили с обратным холодильником в течение 30 мин. Развитие реакции контролировали ТСХ (2% этилацетат/метиленхлорид, УФ), реакция завершалась через 30 мин. Реакционную смесь охлаждали до комнатной температуры, выливали в ледяную воду (20 мл) и перемешивали в течение 15 мин. Смесь экстрагировали в метиленхлориде (25 мл) и промывали последовательно насыщенным водным раствором бикарбоната натрия (15 мл) рассолом (10 мл), бикарбонатом натрия (15 мл) и рассолом (10 мл). Органический слой сушили над сульфатом магния и концентрировали в вакууме, что давало 0,19 г неочищенного продукта в виде оранжевого масла. Неочищенный продукт очищали флэш-хроматографией (силикагель, 10% этилацетат/метиленхлорид) и сушили в вакууме (25oC, < 1 мм), что давало 0,15 г (63%) продукта в виде окрашенного в бледно-зеленый цвет твердого вещества: 1H ЯМР (CDCl3) δ 7,90-7,64 (м, 4Н), 7,39-7,22 (м, 5Н), 7,07-6,91 (м, 2Н), 6,88-6,76 (м, 1Н), 6,66 (с, 1Н), 3,87 (с, 3Н), 3,80 (с, 3Н); 13H ЯМР (CDCl3) δ 167,9, 148,8, 148,6, 138,3, 134,1, 131,9, 130,8, 128,3 128,1, 127,5, 123,4, 121,6, 112,5, 110,7, 57,6, 55,9, 55,8.
Пример 6
1-Фталимидо-1-(3',4'-диметоксифенил)пентан
а) 3',4'-Диметиоксивалерофенон
3', 4'-Диметоксиацетофенон (9,91 г, 55 ммоль) добавляли в течение 20 мин в охлажденный (0oC) перемешиваемый раствор диизопропиламида лития (28,9 мл, 2М, 57,8 ммоль). Через дополнительные 5 мин раствор охлаждали до -78oC и быстро добавляли 1-иодпропан (10,73 мл, 110 ммоль). Раствор оставляли для медленного нагревания до комнатной температуры и перемешивание продолжали в течение 3 дней. Развитие реакции контролировали ТСХ (30% этилацетат/гексан, УФ), равновесие между исходным материалом (Rf = 0,15), моноалкилированным продуктом (Rf = 0,32) и диалкилированным продуктом (Rf = 0,42) достигали через три дня. Реакционную смесь обрабатывали водой (60 мл), этилацетатом (100 мл) и насыщенным раствором бикарбоната натрия (100 мл). Органический слой отделяли и промывали последовательно 5% соляной кислотой (100 мл) и насыщенным водным бикарбонатом натрия (100 мл). Органический слой сушили над сульфатом магния и концентрировали, что давало 15,17 г неочищенного продукта в виде оранжевой масляной жидкости. Неочищенный продукт очищали флэш-хроматографией (силикагель, 20% этилацетат/гексан), что давало 3,68 (25%) диалкилированного продукта (3',4'-диметокси-2-пропилвалерофенон) в виде желтого твердого вещества и 1,01 г (8%) моноалкилированного продукта (3',4'-диметоксивалерофенон) в виде желтой масляной жидкости: 1H ЯМР (CDCl3) δ 7,65-7,50 (м, 2Н), 6,95-6,85 (м, 1Н), 3,95 (с, 3Н), 3,94 (с, 3Н), 2,99-2,88 (м, 2Н), 1,81-1,64 (м, 2Н), 1,52-1,34 (м, 2Н), 1,04-0,91 (м, 3Н). 13C ЯМР (CDCl3) δ 199,1, 152,9, 148,8, 130,2, 122,5, 110,0, 109,8, 55,9, 55,8, 37,7, 26,7, 22,4, 13,8.
b) Оксим 3',4'-диметоксивалерофенона. В перемешиваемый раствор 3',4'-диметоксивалерофенона (0,08 г, 3,60 ммоль) в смеси этанола (25 мл) и воды (5 мл) добавляли гидрохлорид гидроксиламина (0,40 г, 5,76 ммоль) и ацетат натрия (0,59 г, 7,20 ммоль) в воде (5 мл). Раствор кипятили с обратным холодильником в течение двух дней. Развитие реакции контролировали ТСХ (20%, этилацетат/гексан, УФ), она завершалась через два дня. Реакционную смесь оставляли для охлаждения до комнатной температуры и этанол удаляли в вакууме, что давало смесь масло-водный компонент. Смесь экстрагировали метиленхлоридом. Высушенные экстракты концентрировали в вакууме, что давало 0,93 г неочищенного продукта в виде желтого масла. Неочищенный продукт очищали флэш-хроматографией (силикагель, 20% этилацетата/гексан), что давало 0,56 г продукта в виде желтого масла: 1H ЯМР (CDCl3) δ 8,23-8,01 (шир. с. 1Н), 7,30-7,05 (м, 2Н), 6,93-6,81 (м, 1Н), 3,91 (с, 3Н), 3,90 (с, 3Н), 2,84-2,70 (м, 2Н), 1,74-1,31 (м, 4Н), 0,93 (т, J= 7,2 Гц, 3Н); 1C ЯМР (CDCl3) δ 159,6, 150,1, 148,9, 128,5, 119,3, 110,6, 108,9, 55,9, 28,7, 25,6, 22,9, 13,8.
с)1-(3',4'-Диметоксифенил)пентиламин
В продутый N2 раствор оксима 3', 4'-метоксивалерофенона (0,5 г, 2,1 ммоль) в ледяной уксусной кислоте (10 мл) добавляли 0,1 г 5% Pd/C. Смесь обрабатывали H2 при 4,219 атм в вибраторе типа Парра в течение 24 ч. Катализатор удаляли фильтрованием через целит и фильтрат концентрировали, что давало желтое масло. Масло растворяли в воде. pH устанавливали 12, используя насыщенный раствор карбоната натрия, и экстрагировали метиленхлоридом. Органический экстракт сушили над сульфатом магния и концентрировали, что давало 0,41 г (87%) продукта в виде желтого масла: 1H ЯМР (CDCl3) δ 6,91-6,76 (м, 3Н), 3,98-3,78 (м, 1Н), 3,89 (с, 3Н), 3,87 (с, 3Н), 1,94-0,78 (м, 11Н).
d) 1-Фталимидо-1-(3',4'-диметоксифенил) пентан
В перемешиваемый раствор 1-(3',4'-диметоксифенил) пентиламина (0,3 г, 1,34 ммоль) и карбоната натрия (0,15 г, 1,45 ммоль) в смеси воды (10 мл) и ацетонитрила (10 мл) добавляли N-карбэтоксифталимид (0,29 г, 1,34 ммоль). Получаемый раствор перемешивали в течение 3 ч при комнатной температуре, ацетонитрил выпаривали и получали двухфазную смесь. Органическую фазу экстрагировали в метиленхлорид, сушили над сульфатом магния и концентрировали, что давало 0,41 г неочищенного продукта в виде масла. Неочищенный продукт очищали флэш-хроматографией (силикагель, 30% этилацетат/гексан), что давало 0,18 г (38%) продукта в виде масла: 1H ЯМР (CDCl3) δ 7,88-7,63 (м, 4Н), 7,20-7,07 (м, 2Н), 6,82-6,76 (м, 1Н), 5,34-5,18 (м, 1Н), 3,89 (с, 3Н), 3,85 (с, 3Н), 2,66-2,43 (м, 1Н), 2,40-2,17 (м, 1Н), 1,50-1,20 (м, 2Н), 0,96-0,81 (м, 3Н). 13C ЯМР (CDCl3) δ 168,5, 148,8, 148,5, 133,8, 132,5, 131,9, 123,1, 120,6, 111,6, 110,8, 55,9, 55,8, 55,0, 30,9, 29,2, 22,3, 13,9.
Пример 7
1-фталимидо-1-(3',4'-диметоксифенил)-2-пропилпентан
a) 3'4' -Диметокси-2-пропилвалерофенон, 3'4'-диметокси-ацетофенон (9,91 г, 55 ммоль) добавляли в течение 20 мин в охлажденный (0oC) перемешиваемый раствор диизопропиламида лития (28,9 мл, М, 57,8 ммоль). Через дополнительные 5 мин раствор охлаждали до -78oC и быстро добавляли 1-иодпропан (10,73 мл, 110 ммоль). Раствор оставляли для медленного нагревания до комнатной температуры и перемешивание продолжали в течение 3 дней. Развитие реакции контролировали ТСХ (30%, этилацетат/гексан, УФ), через три дня достигалось равновесие между исходным материалом (Rf = 0,15), моноалкилированным продуктом (Rf= 0,32) и диалкилированным продуктом (Rf= 0,42). Реакционную смесь обрабатывали водой (60 мл), этилацетатом (100 мл) и насыщенным раствором бикарбоната натрия (100 мл). Органический слой отделяли и промывали последовательно 5% HCl (100 мл) и насыщенным водным бикарбонатом натрия (100 мл). Органический слой сушили над сульфатом магния и концентрировали, что давало 15,17 г неочищенного продукта в виде оранжевой масляной жидкости. Неочищенный продукт очищали флэш-хроматографией (силикагель, 20% этилацетат/гексан), что давало 3,68 г (25%) диалкилированного продукта (3',4'-диметокси-2-пропилвалерофенон) в виде желтого твердого вещества и 1,01 г (8%) моноалкилированного продукта (3',4'-диметоксивалерофенон) в виде желтой маслянистой жидкости: т. пл. 55,5-56,5oC.1H ЯМР (CDCl3) δ 7,67-7,54 (м, 2Н), 6,96-6,86 (м, 1Н), 3,95 (с, 3Н), 3,93 (с, 3Н), 3,52-3,36 (м, 1Н), 1,86-1,17 (м, 8Н), 0,96-0,80 (м, 6Н). 13C ЯМР (CDCl3) δ 203,4, 143,1, 149,1, 131,0, 122,6, 110,3, 109,9, 56,0, 55,9, 45,1, 35,1, 20,9, 14,3.
b) Оксим 3',4'-диметокси-2-пропилвалерофенона
В перемешиваемый раствор 3',4'-диметокси-2-пропилвалерофенона (2,64 г, 10 ммоль) в смеси этанола (45 мл) и воды (10 мл) добавляли гидрохлорид гидроксиламина (1,11 г, 16 ммоль) и ацетат натрия (1,64 г, 20 ммоль) в воде (10 мл). Раствор кипятили с обратным холодильником в течение 1 недели. Развитие реакции контролировали ТСХ (30% этилацетат/гексан, УФ), равновесие достигалось через 1 неделю. Реакционную смесь оставляли для охлаждения до комнатной температуры и этанол удаляли в вакууме, что давало смесь масло/водный компонент, которую экстрагировали метиленхлоридом, сушили над сульфатом магния и концентрировали в вакууме, что давало 2,93 г неочищенного продукта в виде желтого масла. Неочищенный продукт очищали флэш-хроматогрфией-(силикагель, 30% этилацетат/гексан), что давало 1,28 г (46%) продукта в виде желтого масла. 1H ЯМР (CDCl3) δ 7,10-6,75 (м, 3Н), 3,78-3,96 (м, 6Н), 3,49-3,31 (м, 0,5Н), 2,65-2,50 (м, 0,5Н), 1,91-1,19 (м, 8Н), 1,01-0,81 (м, 6Н). 1C ЯМР (CDCl3) δ 162,5, 161,5, 149,5, 149,0, 148,6, 129,4, 125,9, 120,2, 111,2, 110,6, 110,5, 55,9, 55,8, 45,1, 38,9, 34,8, 21,3, 20,5, 14,02.
c) 1-(3',4'-Диметоксифенил)-2-пропилпентиламин
В продутый N2 раствор 3',4'-метокси-2-пропилвалерофенона (1,0 г, 3,6 ммоль) в ледяной уксусной кислоте (20 мл) добавляли 0,2 г 5% Pd/C. Смесь обрабатывали H2 при 4,219 атм в вибраторе типа Парра в течение 24 ч. Развитие реакции контролировали ТСХ (30% этилацетат/гексан, УФ), после 24 ч оставалось некоторое количество исходного материала. Добавляли дополнительные 0,4 г 10% Pd/C и смесь обрабатывали H2 при 4,219 атм в вибраторе Парра в течение 24 ч. Катализатор удаляли фильтрованием через целит и фильтрат концентрировали, что давало желтое масло. Масло растворяли в воде, pH устанавливали 12, используя насыщенный раствор карбоната натрия, и экстрагировали метиленхлоридом. Органический экстракт сушили над сульфатом магния и концентрировали в вакууме, что давало 0,51 г (57%) продукта в виде желтого масла: 1H ЯМР (CDCl3) δ 6,91-6,74 (м, 3Н), 3,95-3,78 (м, 1Н), 3,89 (с, 3Н), 3,87 (с, 3Н), 1,67-0,75 (м, 17Н).
d)1-Фталимидо-1-(3',4'-диметоксифенил)-2-пропилпентан
В перемешиваемый раствор 1-(3',4'-диметоксифенил)-2-пропилпентиламина (0,40 г, 1,60 ммоль) и карбоната натрия (0,18 г, 1,72 ммоль) в смеси воды (5 мл) и ацетонитрила (10 ммоль) добавляли N-карбэтоксифталимид (0,35 г, 1,60 ммоль). Получаемый раствор перемешивали в течение 2,5 ч при комнатной температуре, ацетонитрил выпаривали и получали двухфазную смесь. Органическую фазу экстрагировали в метиленхлорид, сушили над сульфатом магния и концентрировали в вакууме, что давало 0,6 г неочищенного продукта в виде масла. Неочищенный продукт очищали флэш-хроматографией (силикагель, 25% этилацетат/гексан), что давало 0,25 г продукта в виде масла, которое через несколько дней отверждалось. Белый твердый продукт сушили в вакууме (60oC <1 мм), что давало 0,24 г чистого продукта в виде твердого белого вещества: т.пл. 100-101oC; 1H ЯМР (CDCl3) δ 7,84-7,59 (м, 4H), 7,27-7,02 (м, 2H), 6,81-6,68 (м, 1H), 5,01 (д, J = 12 Гц, 1H), 3,89 (с, 3Н), 3,84 (с, 3Н), 3,17-2,98 (м, 1H), 1,49-0,66 (м, 14H). 13C ЯМР (CDCl3) δ 168,5, 148,7; 148,4; 133,8, 131,9, 131,8, 123,1, 121,6, 112,0, 110,7, 58,9; 55,9; 55,7; 36,2, 31,9, 31,8, 18,7, 18,1, 14,6, 14,3. Анал. Рассчитано для C24H29NO4: C 72,87, H 7,40; N 3,54. Найдено: C 72,70; H 7,40; N 3,51.
Пример 8
Таблетки, каждая из которых содержит 50 мг активного ингредиента, можно получить следующим образом:
Составные части (ингредиенты)
(на 1000 таблеток)
активный ингредиент - 50,0 г
лактоза - 50,7 г
пшеничный крахмал - 7,5 г
полиэтиленгликоль 6000 - 5,0 г
тальк - 5,0 г
стеарат магния - 1,8 г
деминерализованная вода - (до баланса)
Твердые ингредиенты сначала пропускают через сито с шириной отверстий 0,6 мм. Затем смешивают активный ингредиент, лактозу, тальк, стеарат магния и половину крахмала. Другую половину крахмала суспендируют в 40 мл воды и эту суспензию добавляют в кипящий раствор полиэтиленгликоля в 100 мл воды. Получаемую пасту добавляют в порошкообразные вещества и смесь гранулируют, если необходимо, с добавлением воды. Гранулят сушат в течение ночи при 35oC, пропускают через сито с шириной отверстия 1,2 мм и прессуют для образования таблеток диаметром приблизительно 6 мм, которые вогнуты с обеих сторон.
Пример 9
Таблетки, каждая из которых содержит 100 мг активного ингредиента, можно получить следующим образом:
Составные части (ингредиенты)
(на 1000 таблеток)
активный ингредиент - 100,0 г
лактоза - 100,0 г
пшеничный крахмал - 47,0 г
стеарат магния - 3,0 г
Все твердые ингредиенты сначала пропускают через сито с шириной отверстия 0,6 мм. Затем смешивают активный ингредиент, лактозу, стеарат магния и половину крахмала. Другую половину крахмала суспендируют в 40 мл воды и эту суспензию добавляют в 100 мл кипящей воды. Получаемую пасту добавляют в порошкообразные вещества и смесь гранулируют, если необходимо, с добавлением воды. Гранулят сушат в течение ночи при 35oC, пропускают через сито с шириной отверстия 1,2 мм и прессуют для образования таблеток диаметром приблизительно 6 мм, которые вогнутые с обеих сторон
Пример 10
Таблетки для жевания, каждая из которых содержит 75 мг активного ингредиента, можно получить следующим образом:
Составные части (ингредиенты)
(на 1000 таблеток)
активный ингредиент - 75,0 г
маннит - 230,0 г
лактоза - 150,0 г
тальк - 21,0 г
глицин - 12,5 г
стеариновая кислота - 10,0 г
сахарин - 1,5 г
50 раствор желатина - (до баланса)
Все твердые ингредиенты сначала пропускают через сито с шириной отверстия 0,25 мм. Маннит и лактозу смешивают, гранулируют с добавлением раствора желатина, пропускают через сито с шириной отверстия 2 мм, сушат при 50oC и снова пропускают через сито с шириной отверстия 1,7 мм. Активный ингредиент, глицин и сахарин тщательно смешивают, добавляют гранулят маннита и лактозы, стеариновую кислоту и тальк и всю массу тщательно перемешивают и прессуют для образования таблеток с диаметром приблизительно 10 мм, которые вогнутые с обеих сторон и на верхней стороне имеют выемку для дробления.
Пример 11
Таблетки, каждая из которых содержит 10 мг активного ингредиента, можно получить следующим образом:
Составные части (ингредиенты) (на 1000 таблеток)
активный ингредиент - 10,0 г
лактоза - 328,5 г
кукурузный крахмал - 17,5 г
полиэтиленгликоль 6000 - 5,0 г
тальк - 25,0 г
стеарат магния - 4,0 г
деминерализованная вода - (до баланса)
Твердые ингредиенты сначала пропускают через сито с шириной отверстия 0,6 мм. Затем тесно смешивают активный ингредиент, лактозу, тальк, стеарат магния и половину крахмала. Другую половину крахмала суспендируют в 65 мл воды и эту суспензию добавляют в кипящий раствор полиэтиленгликоля в 260 мл воды. Получаемую пасту добавляют в порошкообразные вещества и всю массу смешивают и гранулируют, если необходимо, с добавлением воды. Гранулят сушат в течение ночи при 35oC, пропускают через сито с шириной отверстия 1,2 мм и прессуют для образования таблеток диаметром приблизительно 10 мм, которые вогнутые с обеих сторон и имеют на верхней стороне выемку для дробления.
Пример 12
Желатиновые капсулы сухого наполнения, каждая из которых содержит 100 мг активного ингредиента, можно получить следующим образом.
Составные части (ингредиенты)
(на 1000 капсул)
активный ингредиент - 100,0 г
микрокристаллическая целлюлоза - 30,0 г
лаурилсульфат натрия - 2,0 г
стеарат магния - 8,0 г
Лаурилсульфат натрия просеивают в активный ингредиент через сито с шириной отверстия 0,2 мм и два компонента тесно перемешивают в течение 10 мин. Затем через сито с шириной отверстия 0,9 мм добавляют микрокристаллическую целлюлозу и всю массу снова тесно перемешивают в течение 10 мин. Наконец, через сито с шириной отверстия 0,8 мм добавляют стеарат магния и после перемешивания в течение дополнительных 3 мин смесь вводят порциями по 140 мг в желатиновые капсулы размера 0 (удлиненные) сухого наполнения.
Пример 13
0,2%-ный Раствор для инъекции или инфузии можно получить, например, следующим образом:
активный компонент - 5,0 г
хлорид натрия - 22,5 г
фосфатный буфер с pH 7,4 - 300,0 г
деминерализованная вода - до 2500,0 мл
Активный ингредиент растворяют в 1000 мл воды и фильтруют через микрофильтр. Добавляют буферный раствор и объем доводят до 2500 мл добавлением воды. Для получения унифицированных лекарственных форм порции по 1,0 или 2,5 мг вводят в стеклянные ампулы (каждая содержит 2,0 или 5,0 мг активного ингредиента).
Соединения по изобретению подвергали испытаниям согласно следующей методике:
РВМ-клетки человека от нормальных доноров были получены Ficoll-Hypaque (Pharmacia Fine Chemical, Piscataway, NJ) центрифугированием в градиенте плотности. Клетки (106 клеток/мл) выращивают в среде RPMI (Gibco Laboratories, Grand Island, NY), дополненной сывороточным альбумином 10 AB+ (Biocell, Rancho Dominguez, CA), 2 мМ L-глутамина, 100 E/мл пенициллина и 100 мкг/мл стрептомицина (Gibco).
Испытываемые соединения растворяют в ДМСО (Sigma Chemical, St. Louis, МО) до концентрации 20 мг/мл; дальнейшие разведения осуществляют культуральной средой. Конечная концентрация ДМСО во всех опытных образцах, включая контроли, составляет 0,25%. Испытываемые соединения добавляют к клеткам за час до добавления ЛПС (липополисахарида). РВМ-клетки (106 клеток/мл) стимулируют 1 мкг/мл ЛПС из Salmonella minnesota R595 (List Biological Labs., Campbell, CA). Клетки трижды инкубируют с ЛПС в течение 18-20 ч при 37oC в 5% CO2. Надосадочные жидкости затем собирают и исследуют на уровень цитокина. (Надосадочные жидкости можно хранить замороженными при -70oC перед использованием).
Жизнеспособность клеток оценивали методом Trypan'a исключения голубого красителя. Концентрации TNFα в надосадочных жидкостях культуры определяли методом ELISA (ENDOGEN, Boston, МА) согласно указаниям производителя. Все соединения испытаны как минимум в трех отдельных экспериментах. Процент ингибирования определяют как: 100 х [1-(цитокин (экспериментальный)/цитокин (контрольный)].
Установлено, что при концентрации 5, 10, 20 и 50 мкМ соединение Примера 2 ингибирует производство TNFα на 81,5%, 97,9% и 100%, соответственно. Соединение Примера 3 при концентрации 10, 20 и 50 мкМ ингибирует производство TNFα на 9,5%, 7,7% и 62,9% соответственно.
Описываются замещенные имиды формулы I, где R1 - замещенный фенил, R2 - алкил, фенил, пиридил, гетероциклил и др., R3 - этилен, винилен, разветвленный алкилен и др., R4-CH2-, -СХ, X-O или S. Соединения формулы I обладают свойством снижать TNFα и ингибировать TNFα - активированную репликацию ретровирусов, поэтому их можно использовать для борьбы с кахексией, эндотоксическим шоком и репликацией ретровирусов. Соединения формулы I получают взаимодействием замещенного амина с соответствующим ангидридом, фталимидом или альдегидом. 4 с. и 17 з.п.ф-лы.
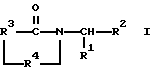
где R1 представляет фенил, замещенный одним или несколькими заместителями, каждый из которых независимо выбран из группы, состоящей из нитро, циано, трифторметила, карбэтокси, карбометокси, карбопропкси, ацетила, карбамоила, ацетокси, карбокси, гидрокси, амино, алкила, имеющего от 1 до 10 атомов углерода, алкокси, имеющего от 1 до 10 атомов углерода, или галогена;
R2 представляет алкил, имеющий от 1 до 10 атомов углерода, фенил, пиридил, гетероциклил, -СН2-арил или -СН2-гетероцикл;
R3 представляет: (i) этилен, (ii) винилен, (iii) разветвленный алкилен, имеющий от 3 до 10 атомов углерода, (iv) разветвленный алкенилен, имеющий от 3 до 10 атомов углерода, (v) циклоалкилен, имеющий от 4 до 9 атомов углерода, незамещенный или замещенный 1 или 2 заместителями, каждый из которых независимо выбран из нитро, циано, трифторметила, карбэтокси, карбометокси, карбипропокси, ацетила, карбамоила, ацетокси, карбокси, гидрокси, амино, замещенного амино, алкила, имеющего от 1 до 4 атомов углерода, алкокси, имеющего от 1 до 4 атомов углерода, или галогена, (vi) циклоалкенилен, имеющий от 4 до 9 атомов углерода, незамещенный или замещенный 1 или 2 заместителями, каждый из которых независимо выбран из нитро, циано, трифторметила, карбэтокси, карбометокси, карбопропокси, ацетила, карбоамоила, ацетокси, карбокси, гидрокси, амино, замещенного амино, алкила, имеющего от 1 до 4 атомов углерода, алкокси, имеющего от 1 до 4 атомов углерода, или галогена, или (vii) о-фенилен, незамещенный или замещенный 1 или 2 заместителями, каждый из которых независимо выбран из нитро, циано, трифторметила, карбэтокси, карбометокси, карбопропокси, ацетила, карбамоила, ацетокси, карбокси, гидрокси, амино, замещенного амино, алкила, имеющего от 1 до 4 атомов углерода, алкокси, имеющего от 1 до 4 атомов углерода, или галогена;
R4 представляет -СН2- или -СХ, где Х представляет 0 или S.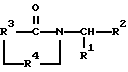
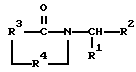
где R1 представляет фенил, замещенный одним или несколькими заместителями, каждый из которых независимо выбран из группы, состоящей из нитро, циано, трифторметила, карбэтокси, карбометокси, карбопропокси, ацетила, карбамила, ацетокси, карбокси, гидрокси, амино, алкила, имеющего от 1 до 10 атомов углерода, алкокси, имеющего от 1 до 10 атомов углерода, или галогена;
R2 представляет алкил, имеющий от 1 до 10 атомов углерода, фенил, пиридил, гетероциклил, -СН2-арил или -СН2-гетероцикл; R3 представляет; (i) этилен, (ii) винилен, (iii) разветвленый алкилен, имеющий от 3 до 10 атомов углерода, (iv) разветвленный алкенилен, имеющий от 3 до 10 атомов углерода, (v) циклоалкилен, имеющий от 4 до 9 атомов углерода, незамещенный или замещенный 1 или 2 заместителями, каждый из которых независимо выбран из нитро, циано, трифторметила, карбэтокси, карбометокси, карбопропокси, ацетила, карбамоила, ацетокси, карбокси, гидрокси, амино, замещенного амино, алкила, имеющего от 1 до 4 атомов углерода, алкокси, имеющего от 1 до 4 атомов углерода, или галогена, (vi) циклоалкенилен, имеющий от 4 до 9 атомов углерода, незамещенный или замещенный 1 или 2 заместителями, каждый из которых независимо выбран из нитро, циано, трифторметила, карбэтокси, карбометокси, карбопропокси, ацетила, карбамоила, ацетокси, карбокси, гидрокси, амино, замещенного амино, алкила, имеющего от 1 до 4 атомов углерода, алкокси, имеющего от 1 до 4 атомов углерода, или галогена, или (vii) о-фенилен, незамещенный или замещенный 1 или 2 заместителями, каждый из которых независимо выбран из нитро, циано, трифторметила, карбэтокси, карбометокси, карбопропокси, ацетила, карбамоила, ацеокси, карбокси, гидрокси, амино, замещенного амино, алкила, имеющего от 1 до 4 атомов углерода, алкокси, имеющего от 1 до 4 атомов углерода, или галогена;
R4 представляет -СН2- или -СО.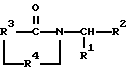
где R1 представляет фенил, замещенный двумя заместителями, каждый из которых независимо выбран из группы, состоящей из нитро, циано, трифторметила, карбэтокси, карбометокси, карбопропокси, ацетила, карбамоила, ацетокси, карбокси, гидрокси, амино, алкила, имеющего от 1 до 10 атомов углерода, алкокси, имеющего от 1 до 10 атомов углерода, или галогена;
R2 представляет алкил, имеющий от 1 до 10 атомов углерода, фенил или бензил;
R3 представляет 0-фенилен, незамещенный или замещенный 1 или 2 заместителями, каждый из которых независимо выбран из нитро, циано, трифторметила, карбэтокси, карбометокси, карбопропокси, ацетила, карбамоила, ацетокси, карбокси, гидрокси, амино, замещенного амино, алкила, имеющего от 1 до 4 атомов углерода, алкокси, имеющего от 1 до 4 атомов углерода, или галогена;
R4 представляет -СН2- или -СО.
| СПОСОБ ПОЛУЧЕНИЯ N-АЛКИЛИРОВАННЫХ ИМИДОВ ДИКАРБОНОВЫХ КИСЛОТ | 0 |
|
SU368250A1 |
| Способ получения 3,5-диалкил-(арил)-4-окси- @ -бензиламидов или соответствующих имидов | 1972 |
|
SU438258A1 |
| Способ получения 6,7-диметокси-N-алкилфталимидинов | 1987 |
|
SU1502568A1 |
| Способ получения замещенных фтал- или нитрофталимидов | 1990 |
|
SU1781213A1 |
| Tetrahedron Lett., 1988, v.29, N 22, p.2639-2642. | |||
Авторы
Даты
2001-01-20—Публикация
1995-11-20—Подача