Изобретение относится к полисахаридам с привитыми антиоксидантами и предпочтительно к гиалуроновой кислоте или сшитой гиалуроновой кислоте с привитыми затрудненными фенолами.
Синовиальная жидкость, обнаруженная в суставах млекопитающих, выполняет функцию смазки и поглотителя ударов. Самым важным компонентом синовиальной жидкости является гиалуронат натрия, который вносит самый большой вклад в механические свойства жидкости. Гиалуроновая кислота представляет собой природный высокомолекулярный гликозаминогликан, содержащий повторяющееся дисахаридное звено, представляющее собой 2-амино-2-деокси-3-О-( β -D-глюкопиранозилуроновая кислота)-D-глюкозу. Дисахариды соединяются посредством глюкозидных связей β 1->4 с образованием неразветвленной несшитой полисахаридной цепи. Помимо наличия в синовиальных жидкостях гиалуроновая кислота встречается в оболочках клеток, перицеллюлярных гелях, внеклеточном матричном веществе соединительных тканей позвоночника, в стекловидном теле глаза, пупочном канатике людей, петушиных гребешках и в некоторых бактериях.
При воспалениях сустава, вызванных, например, остео- или ревматоидным артритом, молекулярный вес гиалуроновой кислоты, равно как и ее концентрация снижаются. Это уменьшение молекулярного веса снижает способность синовиальной жидкости действовать в качестве поглотителя ударов, и, таким образом, жидкость не обеспечивает требуемой защиты суставного хряща. Более того, уменьшение молекулярного веса также снижает вязкость и тем самым ускоряет истечение из сустава. В случае прогрессирующего артрита хрящ разрушается, что причиняет боль, когда сустав находится в движении (см., например, "The Merck Manual of Diagnosis and Therapy", 16-е изд., стр. 1338-42).
Одной из причин снижения молекулярного веса и высокой скорости потери гиалуроната натрия из синовиальной полости является деструкция молекулы гидроксильными радикалами. Гидроксильные радикалы появляются из двух источников. Основным источником являются белые кровяные клетки, которые попадают в суставы, где они воспаляются и выделяют ксантинпероксидазу и другие ферменты с образованием аниона надокиси, перекиси водорода и гипохлорита, которые при распаде образуют гидроксильный радикал. Другим источником гидроксильных радикалов является восстановление кислорода восстановителями в присутствии железа. Типичным восстановителем в теле является аскорбиновая кислота. Кислород восстанавливается железом (II) с образованием аниона надокиси, который затем реагирует с железом (III) с образованием перекиси водорода. Перекись водорода восстанавливается до гидроксильного радикала.
Применение гиалуроната натрия сравнительно умеренного молекулярного веса в качестве дополнительной синовиальной жидкости в суставах ног скаковых лошадей известно (Balazs et al., Y. Equine Vet. Sci., стр. 217-228, 1985). Однако синовиальная жидкость в суставах людей содержит значительно более высокомолекулярный гиалуронат натрия, чем у лошадей.
Растворы гиалуроната натрия также испытывали в качестве дополнительной синовиальной жидкости для суставов, пораженных остеоартритом, у людей, вводимой путем инъекции в суставы.
Лечение артрита инъекциями гиалуроната натрия описано Weiss et al., Semin. Arthritis Rheum., 11, стр. 143 (1981); Nakimi et al., J. Clin. Pharmcol. Therapy Toxicology, 20, стр. 501 (1982); Grecomoro et al., Pharmatherapeutica, 5, стр. 137 (1987) и Briganiti et al., Clinical Trials Journal, 24, стр. 333 (1987). Однако в литературе сообщалось, что внутрисуставные инъекции растворов гиалуроната натрия незначительно отличаются от плацебо (Dahiberg et al. в "Arthritis and Rheumatism", 37, стр. 521, 1994). В работе Brown et al. в Exp.Physiol. 76, стр. 125 (1991) говорится, что период полувыведения гиалуроновой кислоты, впрыснутой в сустав, равен только примерно 13 час. У Dahiberg (см. выше) указано, что период полувыведения, равный 13 час, недостаточен для терапевтических целей. Полагают, что короткий период полувыведения гиалуроновой кислоты после инъекций обусловлен частично разложением под действием гидроксильных радикалов (J.M.McCord, Science, 185, стр. 529, 1974).
Настоящее изобретение относится к новым способам повышения стойкости полисахаридов, в частности гиалуроновой кислоты и гиалуроната натрия, к гидроксильным радикалам путем прививки на них антиоксидантов.
В настоящем изобретении предложены композиции привитых полисахаридов, содержащие полисахариды с антиоксидантом, привитым по меньшей мере на одну гидроксильную группу полисахарида.
Согласно предпочтительному варианту полисахарид представляет собой полисахарид, содержащий кислотные группы. Согласно наиболее предпочтительному варианту полисахарид представляет собой гиалуроновую кислоту или соль гиалуроновой кислоты; антиоксидант представляет собой затрудненный фенол; и привитое соединение обладает значительно более высокой стойкостью к гидроксильным радикалам, чем непривитые гиалуроновая кислота или ее натриевая соль.
Еще одним предметом изобретения является способ получения привитого полисахарида, включающий взаимодействие полисахарида с реакционноспособным по отношению к гидроксилу производным антиоксиданта.
Еще одним предметом изобретения также являются фармацевтические композиции для лечения воспаления суставов у млекопитающих, например артрита, для предотвращения послеоперационного образования спаек и ускорения заживления хронических ран, содержащие в качестве активного компонента полисахарид с привитым антиоксидантом по настоящему изобретению.
Еще одним предметом изобретения являются системы для доставки лекарства, содержащие полисахарид с привитым антиоксидантом, который был сшит.
Изобретение относится также к косметическим композициям, содержащим привитой полисахарид по изобретению.
Еще одним предметом изобретения являются способы лечения воспаления суставов у млекопитающих, например артрита, уменьшения возможности образования послеоперационных спаек и ускорения заживления хронических ран и язв, включающие инъекцию или нанесение эффективного количества фармацевтической композиции, содержащей в качестве активного компонента полисахарид с привитым антиоксидантом по настоящему изобретению.
Композиции привитых полисахаридов по изобретению включают полисахарид с антиоксидантом, привитым по меньшей мере на одну гидроксильную группу полисахарида.
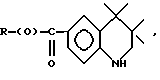
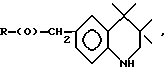
Композиции по изобретению включают соединение, имеющее формулу, выбранную из группы, состоящей из: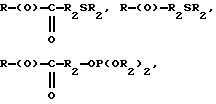
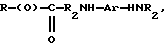
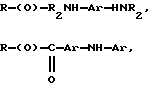
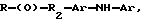
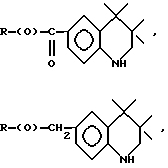
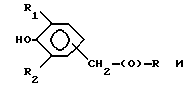
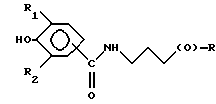
где R представляет собой основную цепь полисахарида или сшитого полисахарида, содержащего кислотные группы или их соли,
-(О) - означает остаток гидроксильной группы полисахарида,
R1 означает водород, C1-C20алкил, фенил или замещенный фенил,
R2 означает C1-C20алкил, фенил или замещенный фенил и
Ar означает арил или замещенный арил.
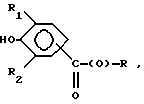
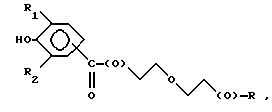
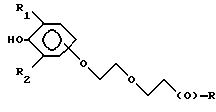
Предпочтительно соединения по изобретению представляют собой вещество, имеющее формулу, выбранную из группы, состоящей из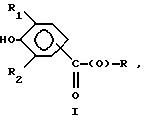
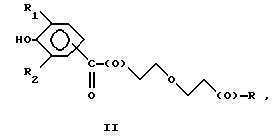
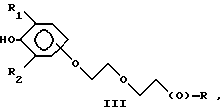
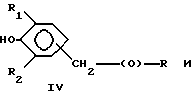
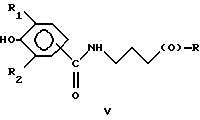
где R представляет собой основную цепь полисахарида или сшитого полисахарида, содержащего кислотные группы или соли,
-(О) - означает остаток гидроксильной группы полисахарида,
R1 означает водород, C1-C20алкил, фенил или замещенный фенил и
R2 означает C1-C20алкил, фенил или замещенный фенил.
В формулах I-V R1 предпочтительно выбран из группы, состоящей из водорода, метила, этила, изопропила и трет-бутила, и R2 выбран из группы, состоящей из метила, этила, изопропила и трет-бутила.
Более предпочтительно, чтобы соединения представляли собой вещества формулы I, II и IV, где R1 и R2 означают трет-бутил и где полисахарид является гиалуроновой кислотой.
Полисахариды, используемые по настоящему изобретению, могут включать, например, полимеры, выбранные из группы, состоящей из гуммиарабика, смолы карайи, трагакантовой камеди, смолы стручковой акации, гуарана, псиллановой смолы, крахмала, пектина, агара, альгиновой кислоты, фурцелларана, декстрана, ксантана, карбоксиметилцеллюлозы, метилцеллюлозы, гидроксиэтилкарбоксиметилцеллюлозы, карбоксиметилированного крахмала, катионного крахмала, гиалуроновой кислоты, хондроитинсульфата, кератансульфата, дерматансульфата, гепарансульфата, гепарина, полигалактуроновой кислоты, полиманнуроновой кислоты, полиглюкуроновой кислоты и каррагенана.
Предпочтительно полисахариды по настоящему изобретению включают полисахариды, содержащие кислотные группы или соли кислотных групп.
Предпочтительно кислотные группы представляют собой по меньшей мере одну группу, выбранную из карбоксильных, сульфатных, сульфитных и фосфатных групп. Наиболее предпочтительной кислотной группой является карбоксильная группа.
Полисахариды, содержащие кислотную группу, могут включать, например, соединения, выбранные из группы, состоящей из гиалуроновой кислоты, хондроитинсульфата, кератансульфата, дерматансульфата, гепарансульфата, гепарина, карбоксиметилцеллюлозы, гидроксиэтилкарбоксиметилцеллюлозы, карбоксиметилированного крахмала, пектина, ксантана, альгиновой кислоты, полигалактуроновой кислоты, полиманнуроновой кислоты, полиглюкуроновой кислоты и каррагенана. Наиболее предпочтительна гиалуроновая кислота.
Предпочтительные соли согласно настоящему изобретению включают соли щелочных или щелочно-земельных металлов, алюминия или аммония. Наиболее предпочтительной солью является натриевая соль.
Привитые полисахариды по настоящему изобретению могут также быть сшиты. Сшитые полисахариды могут быть получены любым известным методом. В патенте США 4716224 на имя Sakurai et al. описаны сшитые гиалуроновая кислота или ее соли, полученные сшивкой гиалуроновой кислоты или ее солей полифункциональным эпоксидом. В патенте США 4863907 на имя Sakurai et al. описаны сшитые гликозаминогликан или его соли, полученные сшивкой гликозаминогликана или его соли полифункциональным эпоксисоединением. В Европейской заявке 0507604-A2 на имя Huang et al. описаны сшитые ионным методом карбоксилсодержащие полисахариды, где сшивающим агентом является соединение с трехвалентным катионом. В патенте США 4716154 на имя Malson et al. описана сшивка гиалуроновой кислоты би- или полифункциональными эпоксидами или их соответствующими галоидгидринами, эпигалоидтидринами или галогенидами и дивинилсульфоном. В патенте США 4772419 на имя Malson et al. также представлена сшивка гиалуроновой кислоты полифункциональными эпоксидами. В патенте США 4957744 на имя della Valle et al. описаны сшитые эфиры гиалуроновой кислоты, полученные этерификацией карбоксильных групп гиалуроновой кислоты многоатомными спиртами. В патентах США 4582865, 4605691 и 4636524 на имя Balazs et al. описана сшивка гиалуроновой кислоты и ее солей и других полисахаридов реакцией с дивинилсульфоном. В патентах США 5128326 и 4582865 на имя Balazs et al. описана сшивка гиалуроновой кислоты формальдегидом, эпоксидами, полиазиридильными соединениями и дивинилсульфоном. В патенте США 4713448 на имя Balazs et al. представлена химическая модификация гиалуроновой кислоты реакцией с альдегидами, например формальдегидом, глутаровым альдегидом и глиоксалем и описана возможность осуществления такой сшивки. В патенте США 5356883 на имя Kuo et al. описана сшивка гиалуроновой кислоты реакцией с бискарбодиимидами.
Предпочтительным методом сшивки полисахаридов является их взаимодействие с ди- или полиангидридами карбоновой кислоты. Предпочтительное сшитое соединение представляет собой соединение вышеуказанной формулы I, где R1 и R2 означают трет- бутил, а полисахарид является гиалуроновой кислотой или ее натриевой солью, сшитыми реакцией с пиромеллитовым диангидридом.
В привитых соединениях степень прививки легче всего выражать числом фактических эквивалентов антиоксиданта на эквивалент повторяющегося звена полисахарида. Для целей настоящего изобретения минимальная степень прививки может быть составлять примерно 1 эквивалент антиоксиданта на 1000 эквивалентов повторяющихся звеньев полисахарида. Предпочтительная минимальная степень прививки составляет примерно 1 эквивалент на 700 и наиболее предпочтительная минимальная степень прививки составляет примерно 1 эквивалент на 600 повторяющихся звеньев полисахарида.
Максимальная степень прививки может составлять примерно 1 эквивалент на 10 эквивалентов повторяющихся звеньев полисахарида. Предпочтительная максимальная степень прививки составляет примерно 1 эквивалент на 10 и наиболее предпочтительная максимальная степень прививки составляет примерно 1 эквивалент на 400 повторяющихся звеньев полисахарида.
Было установлено, что когда соединение с привитым антиоксидантом в соответствии с настоящим изобретением получают на основе гиалуроновой кислоты или ее солей, оно обладает гораздо большей стойкостью к деструкции в присутствии гидроксильных радикалов, чем непривитая гиалуроновая кислота или ее соли.
В опытах по проведению деструкции под действием гидроксильного радикала гидроксильные радикалы получали взаимодействием хлорида железа (III) с аскорбиновой кислотой, как описано Wong et al. в Inorganic Biochemistry, 14, стр. 127 (1981). В типичном опыте полупериод снижения вязкости составляет 0,9 ч в случае гиалуроновой кислоты. Когда этот опыт проводят в тех же условиях с привитыми соединениями, как сшитыми, так и несшитыми, по настоящему изобретению, имеющими формулу I, где R, т.е. полисахарид, является гиалуроновой кислотой и R1 и R2 означают трет-бутил, то полупериод снижения вязкости составляет от 3 до 48 ч, что свидетельствует о значительно большей стойкости привитых соединений к деструкции под действием гидроксильных радикалов.
Соединения с привитыми антиоксидантами получают взаимодействием полисахаридов с производными антиоксидантов, реакционноспособными по отношению к гидроксильным группам. Понятие "производные антиоксиданта, реакционноспособные по отношению к гидроксильным группам", означает антиоксидант, содержащий функциональную группу, способную вступать во взаимодействие с гидроксильными группами полисахарида.
Предпочтительными антиоксидантами, реакционноспособными по отношению к гидроксильным группам, для получения соединений по настоящему изобретению являются соединения, выбранные из группы, состоящей из: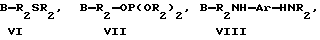
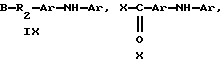
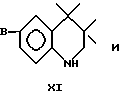
где R1 означает водород, C1-C20алкил, фенил или замещенный фенил;
R2 означает C1-C20алкил, фенил или замещенный фенил;
A означает -C(O)X, -C(O)OCH2CH2OCH2CH2Y, -C(O)NHCH2CH2CH2Y,
-OCH2CH2OCH2CH2Y или -CH2Y;
B означает -C(О)X, -CH2Y или X;
X означает галоген, 1-имидазол, фенокси, нитрофенокси, п-толуолсульфонат, метансульфонат или алкил - либо арилкарбоксилат;
Y означает галоген, п-толуолсульфонат и метансульфонат.
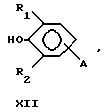
Предпочтительные антиоксиданты, реакционноспособные по отношению к гидроксильным группам, включают затрудненные фенолы с реакционноспособными по отношению к гидроксилам группами формулы XII, где R1 означает водород, метил, этил, изопропил или трет-бутил и R2 означает метил, этил, изопропил или трет-бутил. Термин "затрудненный фенол" относится к фенолам, у которых по меньшей мере одно орто-положение по отношению к гидроксильной группе занято фенилом, замещенным фенилом или C1-C20алкилом.
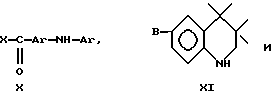
Предпочтительные затрудненные фенолы, реакционноспособные по отношению к гидроксильным группам, формулы XII включают таковые, где R1 и R2 представляют собой трет-бутил, A означает -C(O)X, - CH2Y или -C(O)OCH2CH2OCH2CH2Y, где X означает хлор или 1-имидазол и Y означает бром. Конкретными предпочтительными затрудненными фенолами, реакционноспособными по отношению к гидроксильным группам, являются 3,5-ди-трет-бутил-4- гидроксибензоилхлорид, 2,6-ди-трет-бутил-4-бром-метилфенол, 3,5- ди-трет-бутил-4-гидрокси-бензоил-2-[2-(хлорэтокси)этокси] этиловый эфир и 3,5-ди-трет-бутил-4-гидроксибензоил-1-имидазол.
Вследствие того, что производные антиоксидантов, реакционноспособные по отношению к гидроксильным группам, легко вступают во взаимодействие с водой, предпочтительно, чтобы их взаимодействие с полисахаридом осуществлялось в безводном полярном апротонном растворителе. Предпочтительными растворителями являются N-метилпирролидинон, N-этилпирролидинон, N- циклогексилпирролидинон, N-оксид 4-метилморфолина, диметилформамид, сульфолан и диметилсульфоксид.
Соли кислых полисахаридов могут не растворяться в предпочтительных растворителях. В частности, натриевая соль гиалуроновой кислоты не растворяется в предпочтительных растворителях, и поэтому обычно целесообразно для этого превращать натриевую соль в тетраалкиламмониевую соль для увеличения растворимости. После реакции прививки производного антиоксиданта, реакционноспособного по отношению к гидроксильным группам, на тетраалкиламмониевую соль продукт можно снова превратить в натриевую форму ионным обменом.
Если требуется получить сшитое соединение с привитым антиоксидантом, то реакцию сшивки можно осуществлять до либо после реакции прививки. Ее можно также проводить одновременно с прививкой в тех случаях, когда растворители, используемые для сшивки, являются теми же, которые используют для реакции прививки.
В процессе прививки отношение производного антиоксиданта, реакционноспособного по отношению к гидроксильным группам, к полисахариду лучше всего выражать в молях производного оксиданта на эквивалент повторяющегося звена в полисахариде. Для целей настоящего изобретения минимальное количество производного антиоксиданта может составлять примерно 1 эквивалент на 1000 эквивалентов повторяющихся звеньев полисахарида. Предпочтительное минимальное количество составляет примерно 1 эквивалент на 700 и наиболее предпочтительное минимальное количество составляет 1 эквивалент на 600 повторяющихся звеньев полисахарида.
Максимальное количество реакционноспособного по отношению к гидроксильным группам производного антиоксиданта может составлять примерно 1 эквивалент на 10 эквивалентов повторяющихся звеньев полисахарида. Предпочтительное максимальное количество составляет примерно 1 эквивалент на 100 и наиболее предпочтительное максимальное количество составляет примерно 1 эквивалент на 400 повторяющихся звеньев полисахарида.
Как отмечено выше, одним из предметов изобретения являются композиции для лечения воспалившихся суставов у млекопитающих, например, артрита, для предотращения образования спаек после операций и для ускорения заживления хронических ран и язв. Активным компонентом этих композиций являются полисахариды с привитыми антиоксидантами по настоящему изобретению. Предпочтительными полисахаридами с привитыми антиоксидантами являются гиалуроновая кислота с привитым затрудненным фенолом или сшитая гиалуроновая кислота с привитым затрудненным фенолом или их фармацевтически приемлемые соли.
Фармацевтически приемлемые соли включают соли щелочных или щелочно-земельных металлов, алюминия или аммония. Предпочтительной фармацевтически приемлемой солью является натриевая соль.
Полисахариды с привитыми антиоксидантами согласно настоящему изобретению можно использовать для предотвращения послеоперационных спаек у любого животного, которое подвержено образованию спаек после хирургического вмешательства. Соединения используют для предотвращения образования спаек у млекопитающих, предпочтительно у людей. Они приемлемы при всех типах операций, когда необходимо предотвратить образование послеоперационных спаек, например, при операциях в брюшной полости, гинекологических операциях, в торакальной хирургии, ортопедических операциях, нейрохирургии и офтальмологических операциях. Предпочтительными для этой цели соединениями являются гиалуроновая кислота с привитым затрудненным фенолом или сшитая гиалуроновая кислота с привитым затрудненным фенолом или их фармацевтически приемлемые соли.
Агенты, предотвращающие образование спаек, можно вводить в область хирургической травмы любым приемлемым методом, таким, как, например, промывкой, непосредственным нанесением на эту область геля, крема, пленки или пены или любым другим пригодным способом. Введение агентов, предотвращающих образование спаек, можно осуществлять в любое время до того, как произойдет заметное заживление раны. Предпочтительно вводить их в конце операции перед самым закрытием раны. Однако в некоторых случаях может быть необходимо вводить агент непрерывно в течение некоторого времени. Эффективное количество агента, предотвращающего спайки, представляет собой количество, необходимое для воздействия на уменьшение возможности образования послеоперационных спаек. Предпочтительно это количество должно быть достаточным для покрытия всей поверхности, на которой произошла хирургическая травма, и при необходимости дополнительное количество для покрытия тканей, примыкающих к области травмы.
Полисахариды с привитыми антиоксидантами по настоящему изобретению могут быть также использованы для ускорения заживления хронических ран, например ожогов, и язв, например диабетических язв на ногах у млекопитающих, в частности у людей. Предпочтительными соединениями для этой цели является гиалуроновая кислота с привитыми затрудненными фенолами или сшитая гиалуроновая кислота с привитыми затрудненными фенолами или их фармацевтически приемлемые соли. Гиалуроновая кислота удерживает влагу, а также обладает ангиогенезисными свойствами, что делает ее приемлемой для этой цели. При использовании для заживления ран соединения можно применять индивидуально в водном растворе, предпочтительно физиологическом растворе, или же растворы можно смешивать с лекарствами для заживления ран и другими водорастворимыми полимерами. Их можно вводить в область раны или язвы любым приемлемым методом, таким, как, например, промывкой, непосредственным нанесением на эту область геля, крема, пленки или пены, пропиткой бинтов или повязки, накладываемой на рану или язву, или любым другим пригодным способом. Эффективное количество для ускорения заживления достаточно для покрытия всей поверхности раны или язвы, а при необходимости дополнительное количество наносят на ткань, примыкающую к ране или язве. Типичный полисахарид с привитым антиоксидантом может содержать в качестве дополнительных ингредиентов водорастворимые полимеры, антибиотики, иммунодепрессанты и вещества, уменьшающие боль.
В случае применения привитой гиалуроновой кислоты или сшитой гиалуроновой кислоты согласно настоящему изобретению для лечения воспаления суставов, например, артрита, у млекопитающих, в частности у людей, производное гиалуроновой кислоты обычно растворяют в физиологическом растворе до получения вязкости, достаточной для пропускания через иглу для инъекций. Максимальная вязкость составляет около 50000 сПз, предпочтительно 30000 сПз. Минимальная вязкость составляет примерно 5000 сПз. Затем производят инъекцию раствора в больной сустав.
Типичная процедура инъекции для введения в синовиальную жидкость коленного сустава аналогична описанной Miller et al. в J. Bone and Joint Surgery, 40, стр. 636 (1985). Согласно этой методике 2,5 мл стерильного раствора натриевой соли гиалуроновой кислоты с привитым антиоксидантом (концентрация привитой гиалуроновой кислоты составляет 10 мг/мл) в буферном солевом растворе (8,5 мг/мл хлористого натрия, 0,537 мг/мл двухосновного фосфата натрия, 0,016 мг/мл мононатрийфосфата) медленно набирают в шприц, чтобы обеспечить отсутствие пузырьков воздуха. Затем подготавливают колено для инъекции, промывая его мылом, смывая цетилтриметиламмонийбромидом и смазывая йодной настойкой. Раствор вводят в синовиальную полость через обозначенную трехугольную дугу на боковой поверхности сустава, образованной верхней суставной поверхностью большеберцовой кости, краем надколенных связок и изгибом бокового бедренного мыщелка. До инъекции можно применять местную анестезию. В некоторых случаях может потребоваться аспирация из коленного сустава при помощи буферного солевого раствора перед инъекцией для дополнения синовиальной жидкости. Эта процедура описана Dahlberg et al. в Arthritis and Rheumatism, 37, 1994, стр. 521.
Впрыскиваемый раствор может содержать другие вещества дополнительно к привитому соединению. Они включают водорастворимые полимеры, например, хондроитинсульфат, дерматансульфат и/или фосфолипид для улучшения смазывающей способности раствора. Можно также добавлять анестетики, противовоспалительные агенты, антибиотики, антибактериальные агенты, цитотоксины и сахара.
Полисахариды с привитыми антиоксидантами по настоящему изобретению, прежде всего в сшитом виде, можно использовать в качестве системы для доставки лекарств. Предпочтительными соединениями для этой цели являются гиалуроновая кислота с привитым затрудненным фенолом или сшитая гиалуроновая кислота с привитым затрудненным фенолом или их фармацевтически приемлемые соли. Сшитая гиалуроновая кислота образует молекулярную клетку, в которой могут быть диспергированы молекулы с фармакологической активностью. Вещества, содержащиеся в клетке, выделяются в окружающую среду путем диффузии. Молекула лекарства или смесь молекул может быть связана с гиалуроновой кислотой ковалентными или нековалентными связями. Ковалентная связь может осуществляться через присоединение к карбоксильным или гидроксильным группам остатков гиалуроновой кислоты. Гели, пленки, нити, частицы или губки из состава на основе гиалуроновой кислоты могут быть помещены, нанесены разбрызгиванием, приняты внутрь, введены путем инъекций или имплантированы в область, в которую необходимо ввести, соотв. на которую необходимо нанести фармакологическое вещество. Эти вещества могут быть терапевтическими средствами (например, анестетиками, анальгетиками, противовоспалительными средствами, диуретиками, антагонистами, антибиотиками, гормонами, противоревматическими средствами, адренергическими агонистами, цитостатиками, гипотензивными средствами или иммунодепрессантами), факторами роста, ферментами или цитологическими антиадгезионными соединениями.
Полисахариды с привитым антиоксидантом по изобретению могут также действовать как компоненты косметики для локального применения. Для этой цели предпочтительны гиалуроновая кислота с привитым затрудненным фенолом или сшитая гиалуроновая кислота с привитым затрудненным фенолом или их фармацевтически приемлемые соли. Поскольку гиалуроновая кислота удерживает влагу при сравнительно низкой относительной влажности и дает приятное и разглаживающее ощущение при высокой относительной влажности, ее используют как увлажнитель в косметических составах. Соединения по изобретению обладают таким же действием. Можно также использовать смеси привитой гиалуроновой кислоты с другими недорогими водорастворимыми полимерами, например, карбоксиметилцеллюлозой, пектином, альгинатом, соевым протеином, казеином и желатином.
В косметический состав, содержащий привитую гиалуроновую кислоту, можно добавлять натуральные экстракты растительного происхождения, такие как из кактуса алоэ вера, мескитового дерева, ромашки, моркови, жожоба, розы и др. Для улучшения эластичности кожи в состав можно вводить альфа-оксикислоты, например молочную и оксиэтановую.
Типичная косметическая композиция, замедляющая старение, имеет следующий состав: 7% 2-оксиэтановой кислоты, 15% пропиленгликоля, 1% раствора гиалуроновой кислоты с привитым затрудненным фенолом (1 г/100 мл), 60% воды и 17% этилового спирта (все проценты указаны по весу).
Состав мягкого геля для лица состоит из: 25% водной суспензии карбоксиметилцеллюлозы (3 г/100 мл), 11% водного раствора триэтаноламина (10 г/100 мл), 5% Methyl Gluceth-10, 1% водного раствора гиалуроновой кислоты с привитым затрудненным фенолом (1 г/100 мл), 1% отдушки и консервантов, 57% воды (все проценты указаны по весу).
Типичный эссенциальный состав увлажнителя для кожи состоит из: 0,5% гидроксиэтилцеллюлозы, 2% Methyl Gluceth-10, 2% глицерина, 1% водного раствора гиалуроновой кислоты с привитым затрудненным фенолом (1 г/100 мл), 94% воды, 0,5% консервантов и отдушки (все проценты указаны по весу). Нижеследующие примеры иллюстрируют изобретение и не ограничивают его объем. Все части и проценты в примерах указаны по весу, если не указано иное.
Пример 1
Синтез 3,5-ди-трет-бутил-4-гидроксибензоилхлорида
Смесь 3,5-ди-трет-бутил-4-гидроксибензойной кислоты (4 г), 20 мл гексана и 20 мл тионилхлорида кипятят в течение 4,5 ч. Растворитель и избыток тионилхлорида удаляют отгонкой с получением твердой массы, которую используют без дальнейшей очистки. Для подтверждения идентичности галоидангидрида небольшое количество продукта обрабатывают избытком безводного этанола и триэтиламина. Обработанный образец экстрагируют водой и метиленхлоридом. После выпаривания растворителя получают масло. 1H-ЯМР-спектр (CDCl3, част./млн из TMC) подтверждает, что маслянистый продукт представляет собой соответствующий сложный эфир: 7,9 част./млн (s, Ar, 2), 5,25 част./млн (s, OH, 1), 4,3 част. /млн (q, CH3, 18) и 1,44 част./млн (t, CH3, 3). Этот результат подтверждает, что получен 3,5-ди-трет-бутил-4-гидроксибензоилхлорид.
Пример 2
Синтез 2,6-ди-трет-бутил-4-бромметилфенола
Смесь 1 г 2,6-ди-трет-бутил-4-метилфенола, 0,9 г N-бромсукцинимида и 40 мл четыреххлористого углерода кипятят в течение 1,5 ч. Сукцинимид удаляют фильтрованием и полученный органический раствор упаривают с получением вязкой жидкости, характеризующейся следующим 1H-ЯМР-спектром (CDCl3, част./млн из TMC): 7,05 част./млн (s, ArH, 2), 5,15 част./млн (s, OH, 1), 4,35 част. /млн (s, CH2Br, 2) и 1,3 част./млн (s, CH3, 18).
Пример 3
Синтез 3,5-ди-трет-бутил-4-гидроксибензоил-2- [2-(2-хлорэтокси)этокси] этилового эфира
В колбе объемом 250 мл, снабженной ловушкой Дина-Старка, нагревают при кипячении в течение 4 дней смесь 5 г 3,5-ди-трет-бутил-4-гидроксибензойной кислоты, 3,7 г 2-[2-(2- хлорэтокси)этокси]этанола, 0,1 г п-толуолсульфо-кислоты и 60 мл толуола. Полученную смесь экстрагируют водой и метиленхлоридом и затем раствор в метиленхлориде сушат над MgSO4. Путем выпаривания растворителя получают 6,97г эфира, характеризующегося следующим 1H-ЯМР-спектром (CDCl3, част. /млн из TMC): 7,9 част./млн (s, ArH, 2), 5,72 част. /млн (s, OH, 1), 5,45 част./млн (m, CH2, 2), 3,86 част./млн (m, CH2, 2), 3,7 част. /млн (m, CH2, 6), 3,6 част./млн (m, CH2, 2) и 2,45 част./млн (s, CH3, 18).
Пример 4
Синтез 3,5-ди-трет-бутил-4-гидроксибензоил-1-имидазола
Смесь 1 г 3,5-ди-трет-бутил-4-гидроксибензойной кислоты, 0,7 г 1,1'-дикарбонилдиимидазола и 50 мл метиленхлорида перемешивают при комнатной температуре в течение 17 ч. После удаления растворителя продукт подвергают перекристаллизации в смеси толуола и гексана с получением гигроскопичного твердого вещества. Небольшое количество твердого продукта смешивают с 0,2 г этанола и 2 мл метиленхлорида и оставляют стоять на 10 ч. После удаления растворителя 1H-ЯМР-спектр позволяют установить наличие только соответствующего этилового эфира, как в примере 1. Этот результат свидетельствует об образовании 3,5-ди-трет-бутил-4-гидроксибензоил-1-имидазола.
Пример 5
Получение метилтрикаприламмониевой соли гиалуроновой кислоты
К раствору 10 г гиалуроната натрия (продукт ферментации, фирма Chisso Corporation, Чиба, Япония) в 1000 мл воды добавляют раствор 50 г метилтрикаприламмонийхлорида (Aliquat 336, фирма Aldrich Chemical, Милуоки, штат Висконсин) в 50 мл ацетона. Смесь перемешивают в течение ночи и затем отфильтровывают каучукоподобный осадок, промывают его водой и ацетоном и затем высушивают в вакууме в течение ночи. Продукт погружают на 7 ч в 500 мл ацетона и сушат в вакууме в течение ночи, получая 46,9 г каучукоподобного продукта.
Пример 6
Прививка 3,5-ди-трет-бутил-4-гидроксибензоилхлорида на гиалуроновую кислоту
К раствору 10 г метилтрикаприламмониевой соли гиалуроновой кислоты (полученной по примеру 5) в 1000 мл безводного N-метилпирролидинона (ММП) добавляют 0,4 г 3,5-ди-трет-бутил-4-гидроксибензоилхлорида (пример 1). Смесь взбалтывают в течение 3 ч и затем выдерживают при 10oC в течение 16 ч. Для проведения ионообмена для получения натриевой соли к реакционной смеси затем добавляют водный раствор NaCl (15 г в 250 мл воды). После перемешивания полученного раствора в течение 1 ч для осаждения продукта добавляют 3 г бикарбоната натрия и 200 мл ацетона. Полимер отфильтровывают и пять раз промывают смесью ацетон/вода (соотношение 4/1, 200 мл) и затем 100 мл ацетона. Далее продукт очищают повторным растворением в 1 л воды и последующим осаждением большим количеством метанола. Получают 4 г продукта.
Пример 7
Прививка 3,5-ди-трет-бутил-4-гидроксибензоил-1- имидазола на гиалуроновую кислоту
К раствору 2 г метилтрикаприламмониевой соли гиалуроновой кислоты (полученной по примеру 5) в 280 мл NMH добавляют 0,25 г 3,5-ди-трет-бутил-4-гидроксибензоил-1-имидазола (пример 4). Смесь выдерживают при 45oC в течение 20 ч и затем проводят ионный обмен для получения натриевой соли, как описано в примере 6. Вес полученного продукта составляет 0,92 г.
Пример 8
Прививка 3,5-ди-трет-бутил-4-гидроксибензоилхлорида на гиалуроновую кислоту, сшитую диглицидиловым эфиром бисфенола A
Вначале осуществляют реакцию сшивки путем смешения 2 г метилтрикаприламмониевой соли гиалуроновой кислоты (полученной по примеру 5), 0,2 г диглицидилового эфира бисфенола A и 280 мл NМП и выдержки смеси при 45oC в течение 24 ч. К этой смеси затем добавляют 0,2 г 3,5-ди-трет-бутил-4-гидроксибензоилхлорида и затем эту реакционную смесь выдерживают при комнатной температуре в течение 17 ч. Продукт превращают в натриевую соль и обрабатывают, как описано в примере 6.
Пример 9
Прививка 3,5-ди-трет-бутил-4-гидроксибензоилхлорида на гиалуроновую кислоту, сшитую диангидридом 1,2,4,5-бензолтетракарбоновой кислоты
К раствору 5 г метилтрикаприламмониевой соли гиалуроновой кислоты (полученной по примеру 5) в 700 мл NMH добавляют 0,5 г диангидрида 1,2,4,5-бензолтетракарбоновой кислоты. Смесь выдерживают при 10oC в течение 7 дней. Затем к реакционной смеси добавляют триэтиламин (1 мл) и 3,5-ди-трет-бутил-4-гидроксибензоилхлорид (0,5 г). Через 16 ч осуществляют ионный обмен в полученном продукте при помощи раствора NaCl (0,5 г) и NaHCO3 (0,5 г) в 50 мл воды и затем продукт осаждают добавлением 400 мл ацетона. Полученный продукт фильтруют и промывают смесью ацетон/вода 4/1 и затем чистым ацетоном. После сушки получают 2,9 г полимера.
Пример 10
Прививка 3,5-ди-трет-бутил-4-гидроксибензоил-2- [2-(2-хлорэтокси)этокси] -этилового эфира на гиалуроновую кислоту
Смесь 2 г метилтрикаприламмониевой соли гиалуроновой кислоты (полученной по примеру 5) и 0,25 г 3,5-ди-трет-бутил-4-гидроксибензоил-2-[2-(2-хлорэтокси)этокси] этилового эфира в 280 мл NМП выдерживают при 45oC в течение 20 ч. Смесь обрабатывают раствором 0,1 г NaCl и 0,1 г NaHCO3 в 20 мл воды и далее работают аналогично примеру 9. После сушки получают 1,0 г полимера.
Пример 11
Стойкость привитой гиалуроновой кислоты к деструкции под действием гидроксильных радикалов
Гидроксильные радикалы получают по реакции иона трехвалентного железа с аскорбиновой кислотой, как описано Wong et al. в Inorganic Biochemistry, 14, стр. 127 (1981).
К 100 мл водного раствора гиалуроната натрия с привитым затрудненным фенолом с концентрацией 0,3-0,6% в отношении веса к объему (вес/объем) (как указано в публикации, забуференным до pH 7,4) добавляют 0,25 мл раствора хлорида железа (III) (1,1 г в 20 мл воды) и 0,25 мл раствора аскорбиновой кислоты (0,64 г в 20 мл воды). Смесь встряхивают в течение примерно 10 с и затем измеряют первое значение вязкости (по Брукфилду) через 10 мин. Вязкость в этот момент принимают за 100%. Стойкость к деструкции образца оценивают путем измерения времени, необходимого для уменьшения вязкости до 50% от значения, измеренного через 10 мин (полупериод снижения вязкости). Контрольным образцом служит гиалуронат натрия. Результаты приведены в таблице.
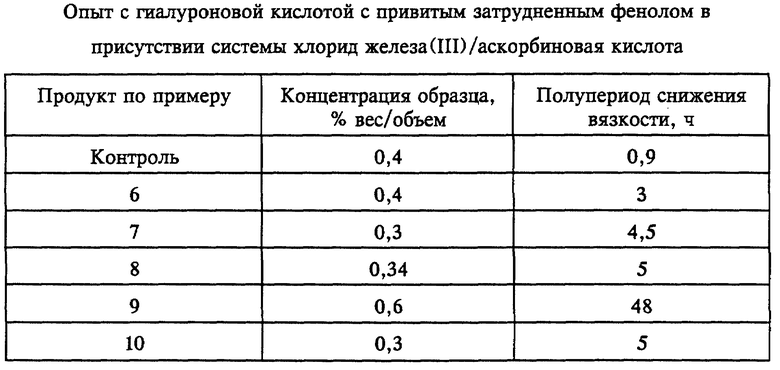
Описывается полисахарид с антиоксидантом, привитым по меньшей мере на одну гидроксильную группу полисахарида, а также способ получения полисахарида с антиоксидантом, привитым по меньшей мере на одну гидроксильную группу полисахарида, включающий взаимодействие полисахарида по меньшей мере с одним производным антиоксиданта, реакционноспособным по отношению к гидроксильным группам. Изобретение позволяет повысить стойкость привитых полисахаридов к деструкции под действием гидроксильных радикалов. 2 с. и 18 з.п.ф-лы, 1 табл.
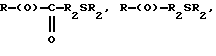
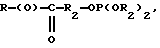
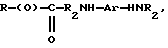
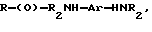
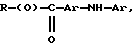
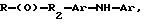
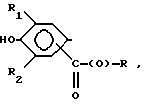
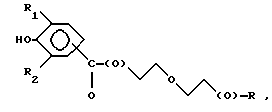
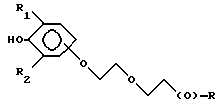
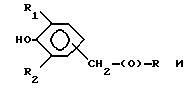
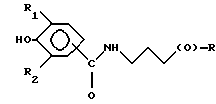
где R представляет собой основную цепь полисахарида или сшитого полисахарида, содержащего кислотные группы или их соли;
- (О) - означает остаток гидроксильной группы полисахарида;
R1 означает водород, С1-С20 алкил, фенил или замещенный фенил;
R2 означает С1-С20 алкил, фенил или замещенный фенил и
Аr означает арил или замещенный арил.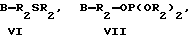
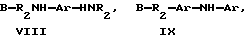
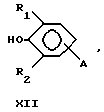
где R1 означает водород, С1С20 алкил, фенил или замещенный фенил;
R2 означает С1-С20 алкил, фенил или замещенный фенил;
А означает -С(O)Х, -С(О)ОСН2CН2ОСН2СH2Y, -C(O)NHCH2CH2CH2Y, -OCH2CH2OCH2CH2Y или -CH2Y;
В означает -C(O)X, -CH2Y или X;
X означает галоген, 1-имидазол, фенокси, нитрофенокси, п-толуолсульфонат, метансульфонат, алкилкарбоксилат либо арилкарбоксилат;
Y означает галоген, п-толуолсульфонат или метансульфонат.
| Сшитые сополимеры хитозана | 1977 |
|
SU729197A1 |
| Способ стабилизации гиалуроновой кислоты | 1989 |
|
SU1623991A1 |
| US 4957744 A, 18.09.1990 | |||
| US 5128362 A, 23.07.1992. | |||
Авторы
Даты
2001-10-20—Публикация
1996-06-21—Подача