Предпосылки создания изобретения
Нативный соматостатин включает в свой состав как изоформу из 14-аминокислот (соматостатин-28), так и изоформу из 18 аминокислот (соматостатин-18) (Heiman. et al., Neuroendocrinology, 45: 429-436 (1987)). В связи с коротким периодом полувыведения нативного соматостатина были разработаны различные его аналоги, например, для лечения акромегалии (Raynor, et al., Molecular Pharmacol. 43: 838 (1993)). Были идентифицированы и описаны пять различных рецепторов соматостатина. (Hoyer, et al., Naunyn-Schmiedeberg's Arch. Pharmacol., 350:441 (1994)). Соматостатин вызывает многочисленные реакции, включая модулирование высвобождения гормона, например гормона роста, глюкагона, инсулина, амилина, и высвобождение нейротрансмиттера. Некоторые из таких воздействий соматостатина сопровождаются его связыванием со специфическим рецептором соматостатина. Так, например, ингибирование ростового гормона относят к рецептору соматостатина типа-2 ("SSTR-2") (Raynor, et al., Molecular Pharmacol. 43: 838 (1993); Lloyd, et al., Am. J. Physiol. 262:0102 (1995)), тогда как в ингибировании инсулина отводят соответствующую роль рецептору соматостатина типа 5 ("SSTR-5") (Coy, et al., 197:366-371 (1993)). Предпочтительно иметь аналог, обладающий селективностью действия относительно данного подтипа специфического рецептора соматостатина, ответственного за нужный биологический ответ, что позволит, таким образом, снизить взаимодействие с другими подтипами рецепторов, которое могло бы привести к развитию побочных действий.
Краткое описание сущности изобретения
Изобретение относится к пептиду, описываемому следующей общей формулой: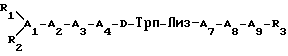
где A1 обозначает D- или L-изомер Цис или Мпк;
A2 обозначает Асн, Глн или алифатическую аминокислоту, ароматическую аминокислоту или отсутствует;
A3 обозначает ароматическую аминокислоту;
A4 обозначает Гис или ароматическую аминокислоту;
A7 обозначает Тре, Сер или алифатическую аминокислоту;
A8 обозначает ароматическую аминокислоту;
A9 обозначает D- или L-изомер Цис;
каждый из R1 и R2 представляет собой, независимо друг от друга, H C1-12 алкил, C7-20 фенилалкил, C11-20 нафтилалкил, C1-12 гидроксиалкил, C7-20 гидроксифенилалкил, C11-20 гидроксинафтилалкил или COE1, где E1 обозначает C1-12 алкил, C7-20 фенилалкил, C11-20 нафтилалкил, C1-12 гидроксиалкил, C7-20 гидроксифенилалкил или C11-20 гидроксинафтилалкил; и
R3 обозначает NH2 или NHYCH2Z, где Y обозначает C1-12 углеводородную группировку (двухвалентную, например, линейную или разветвленную алкильную группу) и Z обозначает H, OH, CO2H или CONH2; и
дисульфидная связь соединяет боковые цепи остатков A1 и A9; или их фармацевтически приемлемую соль.
В одном из вариантов реализации настоящего изобретения каждая группировка из A3 и A8 представляет собой, независимо друг от друга, Фен, п-X-Фен (где X представляет собой галоген, OH, OCH3, CH3 или NO2), о-X-Фен (где X представляет собой галоген, OH, OCH3, CH3 или NO2), пиридил-Ала, Трп, β-Нал, 2,4-дихлор-Фен, Тир (I) или F5-Фен, A4 представляет собой Гис, Фен, п-X-Фен (где X представляет собой галоген, OH, OCH3, CH3 или NO2), о-X-Фен (где X представляет собой галоген, OH, OCH3, CH3 или NO2), пиридил-Ала, Трп, β-Нал, 2,4-дихлор-Фен, Тир (I) или F5-Фен, A2 - обозначает Асн, Глн, Ала, Аим, Вал, Лей, Иле, Нле, Нва, Амк, Фен, п-X-Фен (где X представляет собой галоген, OH, OCH3, CH3 или NO2), о-X-Фен (где X представляет собой галоген, OH, OCH3, CH3 или NO2), пиридил-Ала, Трп, β-Нал, 2,4-дихлор-Фен, Тир (I) F5-Фен или отсутствует и A7 обозначает Тре, Сер, Ала, Аим, Вал, Лей, Иле, Нле, Нва или Амк.
В другом варианте реализации изобретения Ар обозначает Цис, каждый из A3 и A8, независимо друг от друга, представляет собой Фен, п-X-Фен (где X обозначает галоген, OH или CH3), Тир (I) или Трп; A4 обозначает Гис, Фен, п-X-Фен (где X представляет собой галоген, OH или CH3), Тир (I) или Трп, A2 обозначает Асн, Глн или отсутствует и A7 обозначает Тре или Сер.
В еще одном варианте реализации настоящего изобретения A2 обозначает Асн или отсутствует, A3 обозначает Фен, A4 обозначает Фен, Гис, п-X-Фен (где X представляет собой галоген, OH или CH3), Тир (I) или Трп, A8 обозначает Фен или п-X-Фен (где X представляет собой галоген, OH или CH3) и каждая из группировок R1 и R2, независимо друт от друга, представляет собой H и R3 обозначает NH2.
Ниже приведены примеры пептидов по настоящему изобретению, которые соответствуют приведенной выше формуле:
H2-c[D-Цис-Фен-Фен-D-Трп-Лиз-Тре-Фен-Цис]-NH2 (Аналог II)
H2-c[Цис-Фен-Трп-D-Трп-Лиз-Тре-Фен-Цис)-NH2,
H2-c[D-Цис-Фен-Трп-D-Трп-Лиз-Тре-Фен-Цис]-NH2,
H2-c[Цис-Фен-Гис-D-Трп-Лиз-Тре-Фен-Цис]-NH2,
H2-c[D-Цис-Фен-Гис-D-Трп-Лиз-Тре-Фен-Цис]-NH2,
H2-c[Цис-Фен-Фен-D-Трп-Лиз-Сер-Фен-Цис]-NH2 (Аналог IV),
H2-c[D-Цис-Фен-Фен-D-Трп-Лиз-Сер-Фен-Цис]-NH2,
H2-с[Цис-Фен-Трп-D-Трп-Лиз-Сер-Фен-Цис]-NH2 (Аналог III),
H2-с(D-Цис-Фен-Трп-D-Трп-Лиз-Сер-Фен-Цис]-NH2,
H2-c[Цис-Фен-Гис-D-Трп-Лиз-Сер-Фен-Цис]-NH2,
H2-c[D-Цис-Фен-Гис-D-Трп-Лиз-Сер-Фен-Цис]-NH2,
H2-c[Цис-Фен-Тир(I)-D-Трп-Лиз-Тре-Фен-Цис]-NH2 (Аналог VIII),
H2-c[D-Цис-Фен-Тир(I)-D-Трп-Лиз-Тре-Фен-Цис]-NH2,
H2-c[Цис-Фен-Тир(I)-D-Трп-Лиз-Сер-Фен-Цис]-NH2,
H2-c[D-Цис-Фен-Тир(I)-D-Трп-Лиз-Сер-Фен-Цис]-NH2,
H2-c[Цис-Асн-Фен-Фен-D-Трп-Лиз-Тре-Фен-Цис]-NH2 (Аналог V),
H2-c[D-Цис-Асн-Фен-Фен-D-Трп-Лиз-Тре-Фен-Цис]-NH2,
H2-c[Цис-Асн-Фен-Трп-D-Трп-Лиз-Тре-Фен-Цис]-NH2,
H2-c[D-Цис-Асн-Фен-Трп-D-Трп-Лиз-Тре-Фен-Цис]-NH2,
H2-с(Цис-Асн-Фен-Гис-D-Трп-Лиз-Тре-Фен-Цис]-NH2,
H2-c[D-Цис-Асн-Фен-Гис-D-Трп-Лиз-Тре-Фен-Цис]-NH2,
H2-c[Цис-Асн-Фен-Фен-D-Трп-Лиз-Сер-Фен-Цис]-NH2,
H2-c[D-Цис-Асн-Фен-Фен-D-Трп-Лиз-Сер-Фен-Цис]-NH2,
H2-c[Цис-Асн-Фен-Трп-D-Трп-Лиз-Сер-Фен-Цис]-NH2,
H2-c[D-Цис-Асн-Фен-Трп-D-Трп-Лиз-Сер-Фен-Цис]-НH2,
H2-c[Цис-Асн-Фен-Гис-D-Трп-Лиз-Сер-Фен-Цис]-NH2,
H2-c[D-Цис-Асн-Фен-Гис-D-Трп-Лиз-Сер-Фен-Цис]-NH2,
H2-c[Цис-Асн-Фен-Тир(I)-D-Трп-Лиз-Тре-Фен-Цис]-NH2,
H2-c[D-Цис-Асн-Фен-Тир(I)-D-Трп-Лиз-Тре-Фен-Цис]-NH2,
H2-c[Цис-Асн-Фен-Тир(I)-D-Трп-Лиз-Сер-Фен-Цис]-NH2,
H2-c[D-Цис-Асн-Фен-Тир(I)-D-Трп-Лиз-Сер-Фен-Цис]-NH2,
H2-c[Цис-Фен-Тир-D-Трп-Лиз-Тре-Фен-Цис]-NH2 (Аналог VI),
H2-с[Цис-Фен-β-Нал-D-Трп-Лиз-Тре-Фен-Цис]-NH2 (Аналог VII),
H2-c[Цис-Фен-Хфа-D-Трп-Лиз-Тре-Фен-Цис]-NH2 (Аналог IX),
H2-c[Мра-Фен-Фен-D-Трп-Лиз-Тре-Фен-Цис]-NH2 (Аналог X),
H2-c[Цис-Фен-Тир-D-Трп-Лиз-Тре-Фен-D-Цис]-NH2 (Аналог XI),
H2-c[Цис-Фен-Фен-D-Трп-Лиз-Тре-Тир-Цис]-NH2 (Аналог XII),
H2-c[Цис-Фен-Гис-D-Трп-Лиз-Тре-Фен-Цис]-NH2 (Аналог XIII).
За исключением N-концевой аминокислоты все сокращения (например, Ала или A2) аминокислот в настоящем описании соответствуют структуре -NH-CH(R)-CO-, где R является боковой цепью аминокислоты (например, представляет собой CH3 в Ала). В случае N-концевой аминокислоты сокращение соответствует структуре = N-CH(CH2SH)-CO-, если это D- или L-изомер Цис, или C=(-CH2SH)-CO, если это D- или L-изомер Мпк, при этом R представляет собой боковую цепь аминокислоты. Нле, Нва, пиридил-Ала, F5-Фен, 2,4-дихлор-Фен, β-Нал, Амк, Мпк, Хфа и Аим представляют собой сокращенные обозначения соответственно: норлейцина, норвалина, β-пиридил-аланина, пентафтор-фенилаланина, 2,4-дихлорфенилаланина, β-нафтилаланина, α-аминомасляной кислоты, меркаптопропионовой кислоты, п-хлорфенилаланина и α-аминоизомасляной кислоты. Обозначение Тир (I) относится к йодсодержащему остатку тирозина (например, к 3-I-Тир, 5-I-Тир, 3,5-I-Тир), в котором йод может представлять собой радиоактивный изотоп, например, I125, I127 или I131. Алифатическая кислота представляет собой α-аминокислоту, включающую одну или две боковых цепи, которые, независимо друг от друга, являются углеводородами, например представляют собой линейную или разветвленную цепочку, содержащую от 1 до 6 атомов углерода. Примеры алифатических аминокислот включают Ала, Аим, Вал, Лей, Иле, Нле, Нва или Амк. Ароматическая аминокислота представляет собой α-аминокислоту, боковая цепочка которой несет нейтральный (т.е. не кислый или не щелочной) ароматический заместитель, например, замещенный или не замещенный фенил, нафтил или ароматическую гетероциклическую группу (например, пиридил или индолил). Примеры ароматических аминокислот включают Фен, п-X-Фен (где X обозначает галоген (например, F, Cl или I), OH, OCH3, CH3 или NO2), о-X-Фен (где X обозначает галоген, OH, OCH3, CH3 или NO2), пиридил-Ала, Трп, β-Нал, 2,4-дихлор-Фен, Тир (I), F5-Фен. Если аминокислотный остаток представлен оптически активным изомером, это L-изомер, если особо не оговорено иное. Кроме того, в вышеуказанной общей формуле гидроксиалкил, гидроксифенилалкил и гидроксинафтилалкил могут содержать от 1 до 4 гидроксильных заместителей и COE1-C= OE1. Примеры -C=OE1 включают, не ограничиваясь ими, п-гидроксифенилпропионил (т. е. -C=OCH2-CH2-C6H4-OH) и фенилпропионил. В приведенной выше формуле не показана дисульфидная связь, соединяющая тиоловую группу на боковой цепи остатка A1 (например, Мпк, D-Мпк, Цис или D-Цис) и тиоловую группу на боковой цепи остатка A9 (например, Мпк, D-Мпк, Цис или D-Цис). Пептид по настоящему изобретению обозначается также в другой форме, например в виде H2-c[Цис-Фен-Фен-D-Трп-Лиз-Тре-Фен-Цис] -NH2, в этом случае два связанных дисульфидной связью остатка (т.е. Цис) помещены в скобках после "c".
Пептиды по настоящему изобретению могут применяться для ингибирования высвобождения инсулина у субъекта (у млекопитающего, такого как больной человек). Так, пептиды могут использоваться при лечении физиологических состояний, при которых желательно достичь ингибирования высвобождения инсулина, например, при диабете типа II. Кроме того, пептиды по настоящему изобретению, несущие остаток Тир (I), могут использоваться для сканирования клеток, содержащих рецепторы соматостатина (например, SSTR-5). Такие пептиды по настоящему изобретению могут использоваться либо in vivo для обнаружения клеток, несущих рецепторы соматостатина (например, раковых клеток), или in vitro как радиоактивный лиганд в тесте на связывание с рецептором соматостатина.
Пептиды по настоящему изобретению могут быть представлены фармацевтически приемлемыми солями. Примеры таких солей включают, не ограничиваясь ими, соли, образованные на основе органических кислот (например, уксусной, молочной, малеиновой, лимонной, яблочной, аскорбиновой, янтарной, бензойной, метансульфоновой, толуолсульфоновой или памовой кислот), неорганических кислот (т.е. соляной кислоты, серной кислоты или фосфорной кислоты), полимерных кислот (например, дубильной кислоты, карбоксиметилцеллюлозы, полимера молочной кислоты, полигликолевой или сополимеров полимолочной кислоты - гликолевой кислоты).
Терапевтически эффективное количество пептида по настоящему изобретению и фармацевтически приемлемое вещество носителя (например, карбоната магния, лактозы или фосфолипида, с которыми лекарственное соединение образует мицеллу) вместе образуют лекарственную композицию (например, в виде пилюлей, таблеток, капсул или жидкости) для введения (например, перорального, внутривенного, чрескожного, внутрилегочного, вагинального, подкожного, назального, методом ионофореза, внутритрахеального) субъекту, нуждающемуся в пептиде. Пилюля, таблетка или капсула могут быть покрыты веществом, способным защищать композицию от действия желудочного сока или пищеварительных ферментов в желудке субъекта в течение периода времени, достаточного для того, чтобы композиция прошла нерасщепленной в тонкий кишечник субъекта. Лекарственная композиция может также иметь вид формы пролонгированного действия, которая может как подлежать биологическому разложению, так и не подвергаться деградации под действием биологических факторов и которая используется для подкожного или внутримышечного введения. См., в частности, патенты США 3773919 и 4767628 и заявки PCT N WO 94/00148.
Возможно также осуществлять непрерывное введение с помощью имплантируемого или наружного насоса (например, насоса INFUSAIDTM), пригодного для введения лекарственной композиции. Пептид может быть введен пациенту перед сном.
Доза пептида по настоящему изобретению, применяемая при лечении вышеуказанных заболеваний, варьирует в зависимости от способа введения препарата, возраста и веса тела субъекта, состояния здоровья субъекта, подлежащего лечению, и, наконец, будет определяться в каждом конкретном случае лечащим врачом или ветеринаром. Такое количество пептида, определяемое лечащим врачом или ветеринаром, в настоящем описании будет соответствовать термину "терапевтически эффективное количество".
В рамках настоящего изобретения рассматривается также пептид, охватываемый приведенной выше общей формулой, который используется как для лечения заболеваний или расстройств, связанных с потребностью ингибировать высвобождение инсулина, например, при диабете типа II, так и для применения с целью обнаружения рецепторов соматостатина, например, при сканировании с использованием радиоактивных изотопов.
Другие характеристики и преимущества настоящего изобретения будут очевидны из приведенного ниже подробного описания, а также из формулы изобретения.
Подробное описание изобретения
Синтез и использование аналогов соматостатина по настоящему изобретению не вызовут затруднений у специалистов со средним уровнем знаний в данной области. Если особо не оговорено иное, все технические и научные термины, применяемые в контексте настоящего описания, соответствуют тем их значениям, которые специалисты традиционно им присваивают. Кроме того, все публикации, патентные заявки, патенты и другие упомянутые в описании ссылки приведены в нем в качестве вспомогательных материалов.
Мы считаем, что каждый специалист со средним уровнем знаний в данной области на основании приведенного в заявке описания может в полной мере использовать настоящее изобретение. Приведенные ниже конкретные варианты реализации настоящего изобретения следует, в этой связи, понимать просто как иллюстративные, никоим образом не ограничивающие изобретение.
Синтез аналогов соматостатина
Синтез коротких пептидов хорошо изучен в области химии пептидов. (См., в частности, Stewart et al., Solid Phase Peptide Synthesis (Pierce Chemical Co., 2d ed., 1984)). Ниже описан способ синтеза Аналога I. Другие пептиды по настоящему изобретению могут быть получены аналогичным способом любым специалистом со средним уровнем знаний в данной области.
Бензилгидриламин-полистироловую смолу (Advanced ChemTech, Inc., Louisville, KY) (1,1 г, 0,5 ммоль) в форме, содержащей хлоридный ион, помещают в реакционный сосуд в системе программируемого синтеза пептидов (Advanced ChemTech ACT 200) для внесения следующих реагентов/растворителей: (а) метиленхлорида; (б) 33% трифторуксусной кислоты в метиленхлориде (2 раза по 1 и 25 минут каждого); (в) метиленхлорида; (г) этанола: (д) метиленхлорида; и (е) 10% триэтиламина в хлороформе.
Нейтрализованную смолу перемешивают с Бок-S-4-метилбензил-Цис и диизопропилкарбодиимидом (каждого по 1.5 ммоль) в метиленхлориде в течение 1 часа и полученную аминокислотную смолу подвергают циклической обработке, включающей стадии от (а) до (е) вышеописанной программы. Затем с применением той же самой процедуры проводят последовательное связывание следующих аминокислот (1,5 ммоль): Бок-Фен, Бок-O-бензил-Тре, Бок-N-бензилоксикарбонил-Лиз; Бок-D-Трп, Бок-Фен, Бок-Фен и Бок-S-метилбензил-Цис. После промывания и высушивания вес готовой смолы составляет 1,6 г.
Затем смолу (1,6 г, 0,5 ммоль) смешивают с анизолом (5 мл), дитиотрейтолом (100 мг) и безводным фтороводородом (35 мл) при 0oC и перемешивают в течение 45 минут. Избыток фтороводорода быстро выпаривают в потоке сухого азота и осажденный при этом свободный пептид промывают диэтиловым эфиром. После этого неочищенный пептид растворяют в 500 мл 90% уксусной кислоты, к которой добавляют концентрированный раствор I2/MeOH до получения стойкого коричневого цвета. Удаляют избыток I2 добавлением аскорбиновой кислоты и выпаривают раствор до небольшого объема и наносят на колонку (2,5 х 90 см) с Сефадексом G-25, которую промывают 50% AcOH. Затем объединяют фракции, содержащие основной компонент, на основании данных об ультрафиолетовом (УФ) поглощении и результатов тонкослойной хроматографии, выпаривают до небольшого объема и наносят на колонку (1,5 х 70 см) с октадецилсилан-силикагелем VYDACTM (10-15 мкм). Проводят элюцию с колонки с применением линейного градиента от 80 процентов А и 20 процентов Б до 40 процентов А и 60 процентов Б, где А является 0,1% трифторуксусной кислотой (ТФУ) в воде и Б представляет собой 79,9% ацетонитрила, 20% воды и 0,1% ТФУ. Фракции исследуют с помощью тонкослойной хроматографии (ТСХ) и аналитической высокоэффективной жидкостной хроматографии (ВЭЖХ) и после этого объединяют так, чтобы добиться максимальной чистоты. Применяя повторную лиофилизацию раствора из воды, получают 95 мг продукта в виде белого пушистого порошка.
Анализы методом ТСХ и ВЭЖХ указывают на гомогенность продукта. Аминокислотный анализ кислотного гидролизата и масс-спектрометрия методом лазерной десорбции матрицы (MALDI MS) подтверждают состав циклического октапептида (расчетный MB - 1077, получен MB - 1080).
Ниже приведен метод синтеза Аналога V. Бензилгидриламинполистироловую смолу (Advanced ChemTech, Inc., Louisville, KY) (0,7 r, 0,25 ммоль) в форме, содержащей хлоридный ион, помещают в реакционный сосуд в системе программируемого синтеза пептидов (Advanced ChemTech ACT 200) для внесения следующих реагентов/растворителей: (а) метиленхлорида; (б) 33% трифторуксусной кислоты в метиленхлориде (2 раза по 1 и 25 минут каждого); (в) метиленхлорида; (г) этанола; (д) метиленхлорида; и (е) 10% триэтиламина в хлороформе.
Нейтрализованную смолу перемешивают с Бок-S-4-метилбензил-Цис и диизопропилкарбодиимидом (каждого по 1,5 ммоль) в метиленхлориде в течение 1 часа и полученную аминокислотную смолу подвергают циклической обработке, включающей стадии от (а) до (е) вышеописанной программы. Затем с применением той же самой процедуры проводят последовательное связывание следующих аминокислот (1,5 ммоль): Бок-Фен, Бок-O-бензил-Тре, Бок-N-бензилокосикарбонил-Лиз, Бок-D-Трп, Бок-Фен, Бок-Фен. Бок-Асн и Бок-S-метилбензил-Цис. После промывания и высушивания вес готовой смолы составляет 1,2 г. Далее пептидную смолу подвергают циклической обработке, включающей расщепление фтороводородом и обработку I2, как описано выше. Очистка с использованием колоночной хроматографии, как описано выше, приводит к получению 21 мг циклического нанопептида, который, как показывают анализы с применением ВЭЖХ и ТСХ, является гомогенным. Аминокислотный анализ кислотного гидролизата и анализ методом MALDI MS подтверждают состав циклического нанопептида (расчетное значение MB - 1192; полученное значение MB - 1192).
Синтез йодсодержащих аналогов соматостатина на основе тирозинового остатка (например, с помощью хлорамин-T метода) хорошо описан в литературе и доступен для реализации каждому специалисту со средним уровнем знаний в данной области. (См. , например, Czemick, et al., J. Biol Chem. 258:5525 (1993) и Европейский патент N 389180 B1).
Тест на связывание с рецептором соматостатина
(1) Тест на связывание с человеческим SSTR-2
Клетки CHO-K1 (клетки яичника китайского хомячка), полученные из Американской Коллекции культур (ATCC, Rockville, MD) (ATCC N CCL61), подвергают трансфекции кДНК из человеческого SSTR-2, которая описана в работе Ямада с соавт. (Yamada, et al. , Proc. Natl. Acad. Sci. USA. 89:251-255 (1992)) и доступна из ATCC (ATCC N 79046) с использованием стандартной методики, известной в молекулярной биологии. (См., в частности, Patel, et al., Biochem. Biophys. Res. Commun. 198:605 (1994)). Неочищенные мембраны получают гомогенизацией CHO-K1 клеток после трансфекции человеческим SSTR-2 в 20 мл охлажденного на льду 50 мМ Трис-HCl (буфер А) с помощью гомогенизатора POLYTRONTM (Brinkmann Instruments, Westbury, NY) при установке в положении 6, в течение 15 секунд. Добавляют еще некоторое количество буфера А до получения конечного объема 40 мл и центрифугируют гомогенат с использованием ротора SS-34 (DuPont, Newton, CT) в SORVALTM при 39000 g в течение 10 минут при температуре 0-4oC. Полученный после центрифугирования супернатант декантриуют и отбрасывают. Осадок гомогенизируют в охлажденном на льду буфере А, разбавляют и центрифугируют, как и раньше. Полученный в конце процедур осадок ресуспендируют в 10 мМ Трис HCl и выдерживают на льду для проведения теста на связывание с рецептором.
Аликвоты мембранного препарата инкубируют в течение 90 минут при 25oC с 0,05 нМ [125I-Тир]МК-678 (2000 Кюри/ммоль; c[N-метил-Ала-Тир(I125)-D-Трп-Лиз-Вал-Фен] ) в 50 мМ HEPES (pH 7,4), содержащем исследуемый пептид в различных концентрациях (т.е. от 10-11 до 10-6 М), 10 мг/мл бычьего сывороточного альбумина фракция V (Sigma Chemical Co., St. Louis, MO), MgCl2 (5 мМ), тразилол (200 КИЕ/мл), бацитрацин (0,02 мг/мл) и фенилметил-сульфонилфторид (0,02 мг/мл). Конечный объем составляет 0,3 мл. Инкубации заканчивают проведением быстрой фильтрации через фильтры GF/C (предварительно вымоченные в 0,3% полиэтиленимине в течение 30 минут) с использованием фильтровального коллектора (Brandel, Gaithersburg, MD). Каждую трубку и каждый фильтр затем промывают по три раза аликвотами охлажденного на льду буфера А по 5 мл. Специфическое связывание определяют по уровню общей радиоактивности [125I-Тир] МК-678 минус значение радиоактивности, связанной в присутствии 200 нМ соматостатина-14.
С применением указанного теста исследуют следующие пептиды: соматостатин-14, соматостатин-28, Аналог I, Аналог II, Аналог III, Аналог IV и Аналог V. Выше приведена структура Аналогов I-V. Значения величины Ki вычисляют с помощью следующей формулы:
Ki = IC50/[1+(LC/LEC)],
где IC50 (ИК50) обозначает концентрацию исследуемого пептида, которая приводит к ингибированию на 50 процентов специфического связывания радиоактивного лиганда [125I-Тир]МК-678, LC обозначает концентрацию радиоактивного лиганда (0,05 нМ) и LEC представляет собой значение константы равновесия диссоциации радиоактивного лиганда (0,155 нМ). Значения Ki, вычисленные для исследуемых пептидов, приведены в таблице в колонке, обозначенной "SSTR-2".
(2) Тест на связывание с человеческим SSTR-5
Клетки CHO-K1 подвергают трансфекции кДНК из человеческого SSTR-5 по методу, описанному в работе Ямада с соавт. (Yamada, et al., Biochem. Biophys. Res. Commun. , 195-844 (1993)) с использованием стандартной методики, известной в молекулярной биологии. (См., в частности, Patel et al., Biochem. Biophys. Res. Comm. 198:605 (1994)). Неочищенные мембраны получают гомогенизацией CHO-K1 клеток после трансфекции человеческим SSTR-5 в 20 мл охлажденного на льду 50 мМ Трис-HCI в гомогенизаторе POLYTRONTM (установка в положении 6, 15 с). Добавляют еще некоторое количество буфера до конечного объема 40 мл и центрифугируют гомогенат с использованием ротора SS-34 в SORVALTM при 39000 g в течение 10 минут при температуре 0-4oC. Полученный после центрифугирования супернатант декантируют и отбрасывают. Осадок гомогенизируют в охлажденном на льду буфере, разбавляют и центрифугируют, как и раньше. Полученный в конце осадок ресуспендируют в 10 мМ Трис HCl и выдерживают на льду для проведения теста на связывание с рецептором.
Аликвоты мембранного препарата инкубируют в течение 30 минут при 30oC с 0,05 нМ [125I-Тир11]соматостатина-14 [2000 Кюри/ммоль (Amersham Corp., Arlington Heights, IL) в 50 мМ HEPES (pH 7,4), содержащем исследуемый пептид в различных концентрациях (например, от 10-11 до 10-6 М), 10 мг/мл бычьего сывороточного альбумина (фракция V), MgCl2 (5 мМ), тразилол (200 КИЕ/мл), бацитрацин (0,02 мг/мл) и фенилметил-сульфонилфторид (0,02 мг/мл). Конечный объем составляет 0,3 мл. Инкубации заканчивают проведением быстрой фильтрации через фильтры GF/C (предварительно вымоченные в 0,3% полиэтиленимине в течение 30 минут) с использованием фильтровального коллектора фирмы Брандель. Каждую трубку и каждый фильтр затем промывают по три раза аликвотами охлажденного на льду буфера по 5 мл. Специфическое связывание определяют по уровню общей радиоактивности [125I-Тир11]соматостатина-14 минус значение радиоактивности, связанной в присутствии 1000 нМ лиганда BIM-23052 рецептора соматостатина типа 5. (H2-D-Фен-Фен-Фен-D-Трп-Лиз-Тре-Фен-Трп-NH2). Значения величины Ki вычисляют с помощью следующей формулы: IC50/[1+(LC/LEC)], где IC50 (ИК50) обозначает концентрацию исследуемого пептида, которая приводит к ингибированию на 50 процентов специфического связывания радиоактивного лиганда [125I-Тир11] соматостатина-14, LC обозначает концентрацию радиоактивного лиганда (0,05 нМ) и LEC представляет собой значение константы равновесия диссоциации радиоактивного лиганда (0,16 нМ). Значения Ki, вычисленные для исследуемых пептидов, приведены в таблице в колонке, обозначенной "SSTR-5".
В таблице приведены также соответствующие значения коэффициентов Ki для человеческого SSTR-2 и Ki для человеческого SSTR-5. Пептиды по настоящему изобретению (т. е. Аналоги I-V) имеют гораздо более высокие значения указанных коэффициентов и характеризуются большей селективностью для SSTR-5, чем для SSTR-2.
Другие варианты реализации изобретения
Следует иметь в виду, что приведенное выше описание изобретения имеет своей целью иллюстрацию изобретения, но не ограничение его никоим образом, которое полностью определяется прилагаемой формулой изобретения. Все другие аспекты, преимущества и модификации также охватываются формулой изобретения.
В настоящем изобретении описывается пептид формулы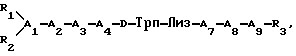
где заместители охарактеризованы в описании, являющийся циклическим аналогом соматостатина, в котором дисульфидная связь соединяет N-концевой остаток с C-концевым остатком. 20 з.п. ф-лы, 1 табл.
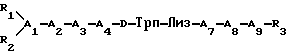
где А1 - обозначает D- или L-изомер Цис или Мпк;
А2 обозначает Асн, Глн или алифатическую аминокислоту, ароматическую аминокислоту или отсутствует;
А3 обозначает ароматическую аминокислоту;
А4 обозначает Гис или ароматическую аминокислоту;
А7 обозначает Тре, Сер или алифатическую аминокислоту;
А8 обозначает ароматическую аминокислоту;
А9 обозначает D- или L-изомер Цис;
каждый из R1 и R2 представляет собой, независимо друг от друга, Н, С1-12 алкил, С7-20 фенилалкил, С11-20 нафтилалкил, С1-12 гидроксиалкил, С7-20 гидроксифенилалкил, С11-20 гидроксинафтилалкил или СОЕ1, где Е1 обозначает С1-12 алкил, С7-20 фенилалкил, С11-20нафтилалкил, С1-12 гидроксиалкил, С7-20 гидроксифенилалкил или С11-20 гидроксинафтилалкил;
R3 обозначает NH2 или NH•Y•СН2•Z, где Y обозначает С1-12 углеводородную группировку и Z обозначает Н, ОН, СО2Н или СОNH2;
дисульфидная связь соединяет боковые цепи остатков А1 и А9;
или их фармацевтически приемлемую соль.
9. Пептид по п.8, отличающийся тем, что каждый из R1 и R2 обозначает, независимо друг от друга, Н и R3 представляет собой NH2.
Н2-с[Цис-Фен-Фен-D-Трп-Лиз-Тре-Фен-Цис]-NH2,
Н2-с[D-Цис-Фен-Фен-D-Трп-Лиз-Тре-Фен-Цис]-NH2,
Н2-с[Цис-Фен-Трп-D-Трп-Лиз-Сер-Фен-Цис]-NH2,
Н2-с[Цис-Фен-Фен-D-Трп-Лиз-Сер-Фен-Цис]-NH2 или
Н2-с[Цис-Фен-Тир(I)-D-Трп-Лиз-Тре-Фен-Цис]-NH2,
11. Пептид по п.7 формулы:
Н2-с[Цис-Фен-Трп-D-Трп-Лиз-Тре-Фен-Цис]-NH2,
Н2-с[D-Цис-Фен-Трп-D-Трп-Лиз-Тре-Фен-Цис]-NH2,
Н2-с[Цис-Фен-Гис-D-Трп-Лиз-Тре-Фен-Цис]-NH2,
Н2-с[D-Цис-Фен-Гис-D-Трп-Лиз-Тре-Фен-Цис]-NH2,
Н2-с[D-Цис-Фен-Фен-D-Трп-Лиз-Тре-Фен-Цис]-NH2,
Н2-с[D-Цис-Фен-Трп-D-Трп-Лиз-Тре-Фен-Цис]-NH2,
Н2-с[Цис-Фен-Гис-D-Трп-Лиз-Тре-Фен-Цис]-NH2,
Н2-с[D-Цис-Фен-Гис-D-Трп-Лиз-Тре-Фен-Цис]-NH2,
Н2-с[D-Цис-Фен-Тир(I)-D-Трп-Лиз-Тре-Фен-Цис]-NH2,
Н2-с[Цис-Фен-Тир(I)-D-Трп-Лиз-Сер-Фен-Цис]-NH2 или
Н2-с[D-Цис-Фен-Тир(I)-D-Трп-Лиз-Сер-Фен-Цис]-NH2.
Н2-с[D-Цис-Асн-Фен-Фен-D-Трп-Лиз-Тре-Фен-Цис]-NH2,
20. Пептид по п.16 формулы:
Н2-с[D-Цис-Асн-Фен-Фен-D-Трп-Лиз-Тре-Фен-Цис]-NH2,
Н2-с[Цис-Асн-Фен-Трп-D-Трп-Лиз-Тре-Фен-Цис]-NH2,
Н2-с[D-Цис-Асн-Фен-Трп-D-Трп-Лиз-Тре-Фен-Цис]-NH2,
Н2-с[Цис-Асн-Фен-Гис-D-Трп-Лиз-Тре-Фен-Цис]-NH2,
Н2-с[D-Цис-Асн-Фен-Гис-D-Трп-Лиз-Тре-Фен-Цис]-NH2,
Н2-с[Цис-Асн-Фен-Фен-D-Трп-Лиз-Сер-Фен-Цис]-NH2,
Н2-с[D-Цис-Асн-Фен-Фен-D-Трп-Лиз-Сер-Фен-Цис]-NH2,
Н2-с[Цис-Асн-Фен-Трп-D-Трп-Лиз-Сер-Фен-Цис]-NH2,
Н2-с[D-Цис-Асн-Фен-Трп-D-Трп-Лиз-Сер-Фен-Цис]-NH2,
Н2-с[Цис-Асн-Фен-Гис-D-Трп-Лиз-Сер-Фен-Цис]-NH2,
Н2-с[D-Цис-Асн-Фен-Гис-D-Трп-Лиз-Сер-Фен-Цис]-NH2,
Н2-с[Цис-Асн-Фен-Тир(I)-D-Трп-Лиз-Тре-Фен-Цис]-NH2,
Н2-с[D-Цис-Асн-Фен-Тир(I)-D-Трп-Лиз-Тре-Фен-Цис]-NH2,
Н2-с[Цис-Асн-Фен-Тир(I)-D-Трп-Лиз-Сер-Фен-Цис]-NH2 или
Н2-с[D-Цис-Асн-Фен-Тир(I)-D-Трп-Лиз-Сер-Фен-Цис]-NH2.
Н2-с[Цис-Фен-Фен-D-Трп-Лиз-Тре-Фен-Цис]-NH2.
| ЕР 0214872 А2, 18.03.1987 | |||
| Циклический октапептид,обладающий гипотензивной активностью и устройство к действию карбоксипептидаз | 1983 |
|
SU1114020A1 |
| US 4837303 А, 06.06.1989 | |||
| US 4191754 А, 26.02.1980 | |||
| US 4238481 А, 09.12.1980. | |||
Авторы
Даты
2001-12-20—Публикация
1996-09-04—Подача