Изобретение относится к производным OB-протеина с продолжительным временем полужизни. В частности, изобретение относится к OB-протеин-иммуноглобулиновым химерам и другим производным OB-протеина с продолжительным временем полужизни, к содержащим их композициям и к способам их введения. Кроме того, изобретение относится к способу лечения ожирения путем введения варианта OB-протеина с продолжительным временем полужизни, например OB-ротеин-иммуноглобулиновой химеры.
Ожирение является наиболее общим нарушением питания, которым согласно последним эпидемиологическим исследованиям страдают около 1/3 всех американцев в возрасте 20 лет и старше (Kuczmarski et al. , J. Am. Med. Assoc. 272, 205-11 (1994)). Ожирение ответственно за целый ряд серьезных проблем, связанных со здоровьем, включая сердечно-сосудистые нарушения, диабет II типа, инсулинорезистентность, гипертензию, гипертриглицеридемию, диспипопротеинемию, и некоторые формы злокачественных образований (Pi-Sunyer, F. X. , Anns. Int. Med. 119, 655-60 (1993); Colfitz, G. A. , Am. J. Clin. Nutr. 55, 503S- 507S (1992)). Показано, что мутация однокопийного гена (ожирение или "ob мутация" приводит к ожирению и диабету II типа у мышей (Friedman, Genomics 11, 1054-1062 (1991)). В работе Zhang et al. , Nature 372, 425-431 (1994) недавно сообщалось о клонировании и секвенировании ob-гена мыши и его гомолога, относящегося к человеку, и высказывалось предположение, что продукт ob-гена может функционировать как часть сигнального пути от жировой ткани, которая влияет на регулирование величины запаса жира в теле. Исследования парабиоза, проведенные более 20 лет назад, предсказали, что мышь, генетически страдающая ожирением, содержащая две мутантные копии ob-гена (ob/ob мыши), не продуцирует фактора сытости, который регулирует потребление пищи, в то время как мышь, страдающая диабетом (db/db), продуцирует фактор сытости, но не реагирует на него (Coleman, Hummal; Am. J. Physiol. 217, 1298-1304 (1969); Coleman, Diabetol 9, 294-98 (1973)). Недавние сообщения трех независимых исследовательских коллективов продемонстрировали, что ежедневные инъекции химерного (рекомбинантного) OB протеина ингибируют потребление пищи и уменьшают вес тела и отложение жира в ob/ob мышах, страдающих чрезмерным ожирением, а не в db/db мышах (Pelleymounter et al. , Science 269, 540-43 (1995); Halaas et al. , Science 269, 543-46 (1995); Campfield et al. , Science 269, 546-49 (1995)), предполагая, что ob-протеин является таким фактором сытости (насыщения), как это ранее предполагалось в исследованиях по перекрестному кровообращению. Результаты этих первых исследований оставили много нерешенных вопросов и показали ряд еще нерешенных противоречий. Например, хотя об умеренных влияниях ежедневных инъекций ob-протеина на потребление пищи и на вес тела сообщалось для худых мышей, наблюдалось значительное уменьшение запаса жира в теле, что объяснялось строением тела (комплекцией) в одном (Halaas et al. , supra), но не в другом (Pelleymounter et al. , supra) из этих сообщений, несмотря на эквивалентные уменьшения веса тела. Кроме того, Pelleymounter et al. , supra заметили, что по неизвестным причинам при лечении ob/ob мышей дозой в 0,1 мг/кг/день OB-протеина действительно увеличивался их вес тела на 17,13%, в то время как уменьшение веса мышей, страдающих ожирением, которые получали дозу ob в 1 мг/кг/день было довольно небольшим. Рецептор или рецепторы ob-протеина до сих пор не идентифицированы. Хотя существование периферийных рецепторов нельзя в настоящее время исключить, последнее сообщение о том, что увеличенная экспрессия ob-гена в жировой ткани мышей с гипоталамусным повреждением не приводит к худому фенотипу, наводит на мысль, что OB-протеин не действует непосредственно на жировые клетки (Maffei et al. , Proc Natl. Acad. Sd. 92, 6957-60 (1995)). Ученые предполагают, что по крайней мере один OB рецептор расположен в мозгу. Об идентификации и экспрессии клонирования лептинового рецептора (OB-R) сообщалось в работе Tartaglia et al. , Cell 83, 1263-71 (1995). Различные изоформы лептинового рецептора описаны Ciofi et al. , Nature Medicine 2, 585-89 (1996). Гематопоэтиновый рецептор человека, который может быть рецептором OB-протеина, описан в заявке PCT (Publication No. WO 96/08510, published 21 March 1996). Рецептор OB-протеина обнаружен Tartaglia et al. , Cell 83, 1263-71 (1995).
Настоящее изобретение основано на наблюдении, что OB-протеин значительно более эффективен для уменьшения веса тела и веса жировой ткани, если его вводить непрерывным подкожным вливанием, чем если та же доза вводится ежедневной подкожной инъекцией. Кроме того, изобретение основано на неожиданно полученных данных, что химерный белок, в котором OB полипептид слит с константной областью иммуноглобулина, является значительно более эффективным для уменьшения веса тела и жировых отложений, чем нативный OB человека, если оба протеина вводятся подкожной инъекцией один раз в день. Последнее наблюдение особенно неожиданно, так как считают, что ОВ-протеин-иммуноглобулиновая химера вследствие ее большого молекулярного веса не в состоянии преодолевать гематоэнцефалический барьер и достигать ОВ-рецептора, который, полагают, расположен в мозге.
В одном варианте изобретение относится к производным ОВ-протеина с продолжительным временем полужизни, способным уменьшить вес тела и/или потребление пищи у лечащихся людей. Кроме того, изобретение относится к композициям, содержащим такие производные, и введению их для уменьшения веса тела и/или потребления пищи.
В другом варианте изобретение относится к химерным полипептидам, содержащим аминокислотную последовательность ОВ-протеина, способную к связыванию с нативным OB-рецептором, присоединенным к последовательности иммуноглобулина (для краткости называемой OB-иммуноглобулиновыми химерами или иммуноадгезинами). В особом (конкретном) варианте, химерные полипептиды включают слияние OB-аминокислотной последовательности, способной к связыванию нативного ОВ-рецептора, с последовательностью константной области иммуноглобулина. Предпочтительно, чтобы OB-область химер, описанных в настоящем изобретении, имела бы достаточное количество аминокислотных последовательностей из нативного ОВ-протеина для сохранения способности его к связыванию с нативным OB-рецептором и для передачи сигнала посредством нативного ОВ-рецептора. Наиболее предпочтительно, чтобы OB-протеин сохранял бы способность к уменьшению веса тела при введении его страдающим ожирением людям или субъектам, не относящимся к человеческому роду. OB-полипептид предпочтительно относится к человеку, и слияние происходит предпочтительно с последовательностью константной области тяжелой цепи иммуноглобулина. В отдельном (частном) варианте, ассоциация двух слияний тяжелой цепи OB-полипептид - иммуноглобулина (например, путем ковалентного связывания с помощью дисульфидной(ых) связи(ей)) приводит к гомодимерной иммуноглобулин-подобной структуре. Легкая цепь иммуноглобулина, кроме того, может связываться с одной или обеими OB-иммуноглобулиновыми химерами в димер, соединенный дисульфидными связями, с образованием гомотримерной или гомотетрамерной структуры.
Кроме того, изобретение относится к нуклеиновой кислоте, кодирующей цепи химерного (гибридного) полипептида, описанного в данном изобретении, к экспрессирующим векторам, содержащим ДНК, кодирующую такие молекулы, к трансформированным клеткам хозяина и к способам продуцирования молекул путем культивирования трансформантов клеток хозяина.
Несмотря на то что производные с продолжительным временем полужизни, описанные в данном изобретении, особенно пригодны для уменьшения веса тела и/или потребления пищи, они также могут применяться для лечения состояний, связанных с патологической (аномальной) экспрессией или функцией OB-гена и/или для установления (вызывания) биологической ответной реакции, вызванной OB-рецептором. Таким образом, OB-производные, описанные в данном изобретении, могут использоваться для лечения булемии, для уменьшения уровня инсулина, например, у пациентов с I и II типами сахарного диабета и в качестве митогенов различных типов клеток, экспрессирующих OB-рецептор. Все эти и другие применения находятся в пределах объема данного изобретения.
В другом варианте данное изобретение относится к очистке OB-рецептора с применением OB-протеин-иммуноглобулиновой химеры.
Фиг. 1. Верхний рисунок (фиг. 1A). Худых самок мышей лечили относящимся к мышам или крысам OB-протеином при помощи непрерывной подкожной инфузии или ежедневных подкожных инъекций. Представленные данные являются средним значением веса тела каждой группы в граммах, n= 4 мыши/для точки.
Фиг. 1. Нижний рисунок (фиг. 1Б). Показан средний вес ретроперитонеального скопления жировой ткани. Непрерывные подкожные инфузии (вливания) OB-протеина также более эффективны, чем ежедневные подкожные инъекции для уменьшения веса жировой ткани.
Фиг. 2. Верхний рисунок (фиг. 2А). Страдающих ожирением ob/ob мышей лечили OB-протеином человека (hOB), или OB-IgG-1-гибридным протеином, относящимся к человеку (hOB IgG-1). Представленные данные являются средней величиной изменения веса тела для каждой лечащейся группы с первого до последнего дня эксперимента, в граммах, n= 3 мыши/на столбец диаграммы, за исключением инъекции hOB 0,19 мг/кг/день, где n= 4 и при инъекции PBS (забуференного фосфатом физиологического раствора), где n= 1.
Фиг. 2. Нижний рисунок, (фиг. 2Б). Представленные данные являлись средней величиной потребления пищи для каждой лечащейся группы для шести 24-часовых периодов эксперимента, в г/мышь/день, n= 1/на столбец диаграммы.
Фиг. 3. Верхний и нижний рисунки (фиг. 3А и фиг. 3Б). Страдающих ожирением самок ob/ob мышей лечили или OB-протеином человека (hOB) или hOB-IgG-1-гибридным протеином, относящимся к человеку, при помощи ежедневных подкожных инъекций в течение 7 дней. Данные, изображенные как и на фиг. 2, с n= 4 для всех лечащихся групп.
Фиг. 4. Верхний рисунок (фиг. 4А). Страдающих ожирением самок ob/ob мышей лечили OB-протеином человека (hOB) или PEG-hOB. Представленные данные являются средним значением изменения веса тела для каждой лечащейся группы с первого до последнего дня эксперимента, в граммах, n= 3-4 мыши/на столбец диаграммы, за исключением инъекции забуференным фосфатом физиологического раствора, где n= 1. Вещества вводили ежедневно подкожно. "PEG IX" и "PEG 2X" относятся к отношению PEG реагента (полиэтиленгликоля) к протеину при получении молекулы.
Фиг. 4. Нижний рисунок (фиг. 4Б). Приведенные данные представляли среднее потребление пищи для каждой лечащейся группы для шести 24 часовых периодов эксперимента, в граммах/мышь/день, n= 3-4 мыши/на столбец диаграммы.
Фиг. 5. Страдающих ожирением (ob/ob) самок мышей лечили или hOB-IgG лечили гибридным протеином, нативным OB-протеином человека (hOB), или hCD4-IgG при помощи ежедневных подкожных инъекций в течение 7 дней, n= 6 для всех лечащихся групп, за исключением hOB при 3,8 мг/кг/день, где n= 2. Снова наблюдали, что гибридный протеин был более эффективен для уменьшения веса тела (верхний и средний рисунки - фиг. 5А и фиг. 5Б) и потребления пищи (нижний рисунок - фиг. 5В), чем нативный hOB протеин.
Фиг. 6. Нуклеотидная последовательность (SEQ. ID. No: 1) и аминокислотная последовательность (SEQ. ID. No: 2) OB-IgG-1 химеры примера 1, относящейся к человеку.
А. Определения
Термин "ожирение" используется для обозначения состояния, связанного с избыточным весом, чрезмерной телесной упитанностью. Подходящий вес для определенного индивидуума зависит от ряда факторов, включающих пол, рост, возраст, общее телосложение и т. д. Теми же факторами будет определяться, страдает ли индивидуум ожирением. Определение оптимального веса тела данного индивидуума как раз находится в компетенции обычного врача.
Фраза "продолжительное время полужизни" и ее грамматические варианты, которые используются в связи с OB-производными, относятся к OB-производным, имеющим более продолжительное время полужизни плазмы и/или более медленный клиренс, чем у соответствующего нативного OB-протеина. Предпочтительно, чтобы производные с продолжительным временем полужизни имели бы время полужизни по крайней мере примерно в 1,5 раза более продолжительное, чем у нативного OB-протеина; более предпочтительно по крайней мере примерно в 2 раза более продолжительное, чем у нативного OB-протеина; и наиболеее предпочтительно по крайней мере примерно в 3 раза более продолжительное, чем у нативного OB-протеина. Нативный OB-протеин предпочтительно является протеином индивидуума, которого лечат.
Термин "OB", "ОВ-полипептид", "ОВ-протеин и их грамматические варианты используются взаимозаменяемо и относятся к "нативным" OB-протеинам или к "нативным последовательностям" OB-протеинов (известных также как "лептины") и их функциональным производным. OB-полипептиды обладают типичными структурными свойствами цитокинов, т. е. полипептидов, высвобождающихся одной популяцией клеток, которые действуют на другие клетки как межклеточные медиаторы, такие как, например, гормоны роста, инсулиноподобные факторы роста, интерлейкины, инсулин, гликопротеиновые гормоны, например, фолликулостимулирующий гормон (follicle stimulating hormone. FSH), тиреотропный [тиреостимулирующий] гормон (thyroid stimulating hormone, TSH), α- и β-фактор опухолевого некроза (tumor necrosis factor-α и -β (TNF-α и -β); нервные факторы роста, такие как NGF-β, PDGF; трансформирующие факторы роста (transforming growth factors, TGFs), например, TGF-α и TGF-β, инсулиноподобный ростовый фактор-1 и -2 (insulinlike growth factor-1 и -2, IGF-1 и IGF-2), эритропоэтин, остеоиндуктивные факторы, интерфероны (interferons, IFNs), например, IFN-α, IFN-β, и IFN-γ; колониестимулирующие факторы (colony stimulating factors, CSFs), например, M-CSF, GM-CSF и G-CSF; интерлейкины (interleukins, ILs), например, IL-1, IL-2, IL-3, IL-4, IL-5, IL-6, IL-7, IL-8 и другие полипептидные факторы.
Термины "нативный" OB-полипептид или "нативная последовательность" OB-полипептида используются для обозначения OB-полипептида из любого вида животного (например, относящегося к человеку, мышам или крысам, кролику, кошке, корове, овце, цыпленку, свинье, лошади и т. д. ), как встречающегося в природе, включая встречающиеся в природе варианты аллелей, делеции, замещения и/или инсерции, которые известны в настоящее время или которые могут быть идентифицированы в будущем, при условии, что они сохранят способность к связыванию с OB-рецептором и предпочтительно дадут сигнал посредством OB-рецептора. Таким образом, нативный OB-полипептид человека включает аминокислотную последовательность между N-концевой последовательностью и цистеином (Cys) в положении 167 аминокислотной последовательности, представленной на фиг. 6 (см. также SEQ. ID. No: 2 и фиг. 6 работы Zhang et al. , supra) и встречающиеся в природе варианты этого протеина, которые в настоящее время известны или могут быть идентифицированы в будущем. Аналогично, "нативный" OB-полипептид или "нативная последовательность" OB-полипептида, относящегося к мышам или крысам, имеет аминокислотную последовательность, представленную на фиг. 6 из работы Zhang et al. , supra и встречающиеся в природе варианты этого полипептида, которые известны в настоящее время или которые могут быть идентифицированы в будущем. Определение, в частности, включает варианты с глутамином в положении 49 или без него, используя нумерацию аминокислот из Zhang et al. , supra. Термины "нативный" OB-полипептид и "нативная последовательность" OB-полипептида включают нативные протеины с инициирующим N-концевым метионином (Met) или без него и с нативной сигнальной последовательностью или без нее, или в мономерной, или в димерной форме. Известные нативные OB-полипептиды, относящиеся к человеку и мышам или крысам, имеют 167 аминокислот, содержат два сохраненных остатка цистеина и обладают свойствами (особенностями) секретируемого (выделяемого) протеина. Полипептиды в значительной степени гидрофильны и предсказанный сайт расщепления сигнальной последовательности находится в положении 21, используя нумерацию аминокислот Zhang et al. , supra. Полная гомологичность последовательности последовательностям, относящимся к человеку и мышам или крысам, составляет около 84%. Два протеина показывают более широкую идентичность в N-концевой области созревшего протеина только с четырьмя консервативными и тремя неконсервативными заменами среди остатков между сайтом расщепления сигнальной последовательности и сохраненным Cys в положении 117. Молекулярный вес OB-протеинов в мономерной форме составляет около 16 kD.
"Функциональным производным" нативного полипептида является соединение, обладающее качественным биологическим свойством (способностью), общим с нативным полипептидом. Функциональным производным OB-полипептида является соединение, обладающее качественным биологическим свойством, общим с нативным OB-полипептидом (относящимся и не относящимся к человеческому роду). "Функциональные производные" включают, но не ограничиваются только фрагментами нативных полипептидов из любых видов животных (включая людей) и производными нативных полипептидов и их фрагментов (относящихся и не относящихся к человеческому роду) при условии, что они обладают биологической активностью, общей с соответствующим нативным полипептидом.
"Фрагменты" включают области в пределах последовательности созревшего нативного OB-полипептида. Предпочтительные фрагменты OB-полипептидов включают C-концевую последовательность созревшего протеина и могут содержать относительно короткую(ие) делецию(ии) на N-концевой последовательности и в других частях молекулы, неиспользуемых для связывания рецептора и/или структурной целостности.
Термин "производное" используется для определения вариантов аминокислотной последовательности и ковалентных модификаций нативного полипептида, тогда как термин "вариант" относится к вариантам аминокислотной последовательности в пределах данного определения.
"Биологическое свойство" в контексте определения "функциональных производных" определяется или как 1) иммунологическая перекрестная реактивность по крайней мере с одним эпитопом (антигенной детерминантой) нативного полипептида (например, нативного OB-полипептида любого вида), или 2) обладание по крайней мере одной адгезивной, регуляторной или эффекторной функцией, качественно общей с нативным полипептидом.
Предпочтительно, чтобы функциональные производные являлись полипептидами, которые имели по крайней мере 65% идентичности аминокислотной последовательности, более предпочтительно приблизительно 75% идентичности аминокислотной последовательности и даже более предпочтительно по крайней мере около 85% идентичности аминокислотной последовательности и наиболее предпочтительно по крайней мере около 95% идентичности аминокислотной последовательности нативному полипептиду. В контексте данного изобретения функциональные производные нативной последовательности OB-полипептидов, относящихся к человеческому роду, предпочтительно показывают по крайней мере 95% идентичности аминокислотной последовательности нативным OB-протеинам и не являются иммуногенными у людей.
Идентичность или гомологичность аминокислотной последовательности в данном изобретении определяется как процентное содержание остатков аминокислот в последовательности кандидата, которые идентичны остаткам соответствующей последовательности нативного полипептида после выравнивания последовательностей и введения "брешей", если необходимо, для достижения максимального процента гомологии и без учета любых консервативных замен как части идентичности последовательности. Ни N- или C-концевые удлиняющие сегменты, ни инсерционные сегменты не должны рассматриваться как уменьшающие идентичность или гомологичность.
Иммунологично перекрестно реакционноспособный, как это используется в данном изобретении, означает, что (поли)пептид кандидата способен к конкурентному ингибированию качественной биологической активности соответствующего нативного полипептида, обладающего данной активностью, поликлональными антителами или иммунной сывороткой, направленной против известной активной молекулы. Такие антитела и иммунную сыворотку (антисыворотку) получают по принятой форме путем введения, например, козе или кролику подкожно с известным нативным OB-протеином полного адъюванта Фрейнда, за которым следовала бустер-инъекция - внутрибрюшинная или подкожная инъекция неполного адъюванта Фрейнда.
Термин "выделенный" (изолированный) OB-полипептид" и его грамматические варианты относятся к OB-полипептидам (как определено выше), отделенным от контаминантных полипептидов, присутствующих в человеке, других видах животных или в другом источнике, из которого полипептид выделен.
Обычно термин "вариант аминокислотной последовательности" относится к молекулам с некоторыми различиями в их аминокислотных последовательностях по сравнению с исходным (например, нативной последовательностью) полипептидом. Изменения аминокислот можно осуществлять замещениями, инсерциями, делециями или любыми необходимыми комбинациями таких изменений в нативной аминокислотной последовательности.
Варианты замещения (замены) являются такими, которые имеют по крайней мере один удаляемый аминокислотный остаток в нативной последовательности и введение вместо него другой аминокислоты в то же положение. Замещение может быть единственным, если замещается только одна аминокислота в молекуле, или эти замещения могут быть многочисленными, если две или более аминокислот замещаются в одной и той же молекуле.
Инсерционные варианты являются вариантами с одной или более аминокислот, вводимых непосредственно по соседству с аминокислотой в определенном положении в нативной аминокислотной последовательности. Непосредственно по-соседству к аминокислоте означает связывание или с α-карбокси- или α-амино-функциональной группой аминокислоты.
Варианты делеции являются вариантами с одной или более удаляемых аминокислот в нативной аминокислотной последовательности. Обычно варианты делеции должны иметь одну или две аминокислоты, подвергаемых делеции, в определенной области молекулы.
"Ковалентные производные" включают модификации нативного полипептида или его фрагмента органическим белковым или небелковым дериватизирующим агентом, и посттрансляционные модификации. Ковалентные модификации по традиции вводят путем взаимодействия определенных аминокислотных остатков с органическим дериватизирующим агентом, который способен реагировать с выбранными сайтами или концевыми остатками или с помощью механизмов "впрягания" посттрансляционных модификаций, которые функционируют в выбранных рекомбинантных клетках-хозяина. Некоторые посттрансляционные модификации являются результатом воздействия рекомбинантных клеток хозяина на экспрессируемый полипептид. Глутаминил- и аспарагинилостатки часто деамидируются посттрансляционно до соответствующих глутамил- и аспартилостатков. Или же эти остатки деамидируются в умеренно кислых условиях. Каждая форма этих остатков может присутствовать в OB-иммуноглобулиновых химерах, описанных в данном изобретении. Другие посттрансляционные модификации включают гидроксилирование пролина и лизина, фосфорилирование гидроксильных групп серильных, тирозинных или треонильных остатков, метилирование α-аминогрупп боковых цепей лизина, аргинина и гистидина (Т. Е. Creighton, Proteins: Structure and Molecular Properties, W. H. Freeman & Co. , San Francisco, pp. 79-86 (1983)).
Термины "ДНК-последовательность кодирующая", "ДНК-кодирующая" и "нуклеиновая кислота кодирующая" относятся к упорядоченности или последовательности деоксирибонуклеотидов вдоль цепи деоксирибонуклеиновой кислоты. Последовательность этих деоксирибонуклеотидов определяет порядок аминокислот вдоль полипептидной цепи. Таким образом, ДНК-последовательность кодирует аминокислотную последовательность.
Термин "способный реплицироваться экспрессирующий вектор" и "экспрессирующий вектор" относятся к фрагменту ДНК, обычно двухцепочечному, который может вводиться во фрагмент другой (чужой) ДНК. Чужую ДНК определяют как гетерологичную ДНК, которая является ДНК, не встречающейся в клетке-хозяине. Вектор используют для переноса чужой или гетерологичной ДНК в подходящую клетку-хозяин. Если в клетке-хозяине вектор может реплицироваться независимо от хромосомной ДНК хозяина, то может генерироваться несколько копий вектора и вставленной в него чужой ДНК (с чужой ДНК-вставкой). Кроме того, вектор содержит необходимые элементы, которые позволяют трансформировать чужую ДНК в полипептид. Таким образом, могут быстро синтезироваться много молекул полипептида, кодируемого чужой ДНК.
Термин "контрольные последовательности" относится к ДНК-последовательностям, необходимым для экспрессии непосредственно (операбельно) связанной кодирующей последовательности в определенном организме хозяина. Контрольные последовательности, которые пригодны для прокариотов, например, включают промотор, возможно операторный участок (последовательность), рибосомосвязывающий сайт и возможно другие еще плохо понимаемые последовательности. Известно, что эукариотные клетки используют промоторы, полиаденилированные сигналы и энхансер.
Нуклеиновая кислота является "непосредственно (операбельно) соединенной", если она помещена в функциональную зависимость от другой последовательности нуклеиновой кислоты. Например, ДНК- предпоследовательности или секреторной лидерной последовательности операбельно соединена с ДНК полипептида, если он экспрессирует как предшественник протеина, который участвует в секреции полипептида; промотор или энхансер непосредственно (операбельно) соединен с кодирующей последовательностью, если он затрагивает транскрипцию последовательности; или рибосомосвязывающий сайт непосредственно соединен с кодирующей последовательностью, если он расположен так, что облегчает трансляцию. Обычно "непосредственно (операбельно) соединенный" означает, что ДНК- последовательности, будучи соединенными, являются близкими, и в случае секреторной лидерной последовательности являются близкими и в фазе считывания. Однако энхансеры не должны быть близкими. Соединение достигается лигацией в удобных сайтах рестрикции. Если такие сайты не существуют, тогда в соответствии с принятой практикой используют синтетические олигонуклеотидные адаптеры или линкеры.
В контексте данного изобретения выражения "клетка", "линия клеток" и "культура клеток" используются взаимозаменяемо и все такие обозначения включают потомство. Таким образом, слова "трансформанты" и "трансформируемые клетки (хозяина)" включают первичные подверженные клетки и культуры, полученные из них, не учитывая количество переносов. Также следует понять, что все потомство не должно быть полностью идентичным по содержанию ДНК вследствие преднамеренных или нечаянных мутаций. Включено мутантное потомство, которое имеет ту же функцию или биологическую активность, по которой проводился скрининг в первоначально трансформируемых клетках. Где предполагаются отличные обозначения, будет ясно из контекста.
Нативные иммуноглобулины обычно являются гетеротетрамерными гликопротеинами с молекулярным весом около 150000 дальтон, состоящие из двух идентичных легких (light, L) цепей и двух идентичных тяжелых (heavy, Н) цепей. Каждая легкая цепь соединена с тяжелой цепью с помощью ковалентной дисульфидной связи, тогда как количество дисульфидных связей изменяется между тяжелыми цепями различных изотипов иммуноглобулина. Каждая тяжелая и легкая цепь также имеет закономерно расположенные внутри цепи дисульфидные мостики. Каждая тяжелая цепь имеет на одном конце вариабельную область (VH), за которой следует ряд константных областей. Каждая легкая цепь имеет вариабельную область (VL) на одном и константную область на другом конце; константная область легкой цепи находится на одной линии с первой константной областью тяжелой цепи, и вариабельная область легкой цепи находится на одной линии с вариабельной областью тяжелой цепи. Считают, что определенные остатки аминокислот образуют поверхность раздела между вариабельными областями легкой и тяжелой цепи (Clothia et al. , J. Mol. Biol. 186. 651-663 (1985); Novotny, Haber, Proc. Natl. Acad. Sci. USA 82, 4592-4596 (1985)).
Иммуноглобулины в зависимости от аминокислотной последовательности константной области их тяжелых цепей относят к различным классам. Существует пять основных классов иммуноглобулинов: IgA, IgD, IgE, IgG и IgM и некоторые из них далее могут подразделяться на подклассы (изотипы), например: IgG-1, IgG-2, IgG-3 и IgG-4; IgA-1 и IgA-2. Константные области тяжелых цепей, которые соответствуют различным классам иммуноглобулинов, называются α, Δ, ε, γ, μ, соответственно. Хорошо известны структуры субъединиц и трехмерные конфигурации различных классов иммуноглобулинов. IgA-1 и IgA-2 являются мономерными подклассами IgA, который обычно находится в виде димеров или полимеров с большим количеством мономеров. Иммуноциты в кишке продуцируют главным образом полимерный IgA (также относится к поли-IgA, включая димеры и полимеры с большим количеством мономеров). Такой поли-IgA содержит связанный дисульфидным мостиком полипептид, называемый "соединительным" пептидом или "J-пептидом, и может переноситься посредством гландулярного эпителия вместе с J-содержащим полимерным IgM (поли-IgМ), включающим пять субъединиц.
Гибридизацию предпочтительно проводят при "точных условиях", которые означают (1) использование растворов с низким значением ионной силы и высокой температурой для промывки, например 0,015 М хлорид натрия/0,0015 М цитрат натрия/0,1% додецилсульфат натрия при 50oC, или (2) применение при гибридизации денатурирующего агента, такого как формамид, например 50% (об. /об. ) формамид с 0,1% бычьим сывороточным альбумином/0,1% Ficoll/ 0,1% поливинилпирролидон/50 нМ натрийфосфатного буфера с pH 6,5 с 750 мМ хлорида натрия, 75 мМ цитрата натрия при 42oC. В другом примере используют 50% формамид, 5xSSC (0,75 М NaCl, 0,075 М цитрат натрия), 50 мМ фосфат натрия (pH 6/8), 0,1% пирофосфат натрия, 5 х раствор Денхардта (Denhardt's solution), гомогенат, полученный из клеток ДНК спермы лосося при воздействии ультразвука (50 мкг/мл), 0,1% SDS (додецилсульфат натрия) и 10% сульфата декстрана при 42oC, с промывками при 42oC в 0,2xSSC и 0,1% SDS.
В. OB-протеин-иммуноглобулиновые химеры (иммуноадгезины)
Иммуноадгезины представляют собой молекулы, подобные химерному антителу, которые объединяют функциональную(ые) область(и) связывающего протеина (обычно рецептора, молекулы или лиганда клеточной адгезии) с последовательностью иммуноглобулина. Наиболее общий пример этого типа гибридного протеина объединяет шарнирную и Fc области иммуноглобулина (Ig) с доменами (областями) клеточно-поверхностного рецептора, который распознает специфический лиганд. Данный тип молекулы называют "иммуноадгезином", поскольку он объединяет "иммунные" и "адгезионные" функции; другим часто используемым названием является "Ig-химера", "Ig-" или "Fc-гибридный протеин" или "рецептор-глобулин".
В настоящее время известно более пятидесяти иммуноадгезинов. Иммуноадгезины, о которых сообщалось в литературе, включают, например, слияния Т-клеточного рецептора (Gascoigne et al. , Proc. Natl. Acad. Sci. USA 84, 2936-2940 (1987)); CD4 (Capon et al. , Nature 337, 525-531 (1989); Traunecker et al. , Nature 339, 68-70 (1989); Zettmeissi et al. , DNA Cell Biol. USA 9, 347-353 (1990); Bym et al. , Nature 344, 667-670 (1990)); L-селектина ("хоминг"-рецептора) (Watson et al. , J. Cell. Biol. 110, 2221-2229 (1990); Watson et al. , Nature 349, 164-167 (1991)); E-селектина (Mulligan et al. , J. Immunol. 151, 6410-17 (1993); Jacob et al. , Biochemistry 34, 1210-1217 (1995)); P-селектина (Mulligan et al. , supra; Hollenbaugh et al. , Biochemistry 34, 5678-84 (1995)); ICAM-1 (Stauton et al. , J. Exp. Med. 176, 1471-1476 (1992); Martin et al. , J. Virol. 67, 3561-68 (1993); Roep et al. , Lancet 343, 1590-93 (1994)); ICAM-2 (Damle et al. , J. Immunol. 148, 665-71 (1992)); ICAM-3 (Holness et al. , J. Biol. Chem. 270, 877-84 (1995)); LFA-3 (Kanner et al. J. Immunol. 148, 2-23-29 (1992)); L1 гликопротеина (Doherty et al. , Neuron 14, 57-66 (1995)); TNF-R1 (Ashkenazi et al. , Proc. Natl. Acad. Sci. USA 88, 10535-539 (1991); Lesslauer et al. , Eur. J. Immunol. 21, 2883-86 (1991); Peppel et al. , J. Exp. Med. 174, 1483-1489 (1991)); TNF-R2 (Zack et al. , Proc. Natl. Acad. Sci. USA 90, 2335-39 (1993); Wooley et al. , J. Immunol. 151, 6602-07 (1993)); CD44 (Aruffo et al. , Cell 61, 1303-1313 (1990)); CD28 и B7 (Linsley et al. , J. Exp. Med. 173, 721-730 (1991)); CTLA-4 (Lisley et al. , J. Exp. Med. 174, 561-569 (1991)); CD22 (Stamenkovic et al. , Cell 66, 1133-1144 (1991)); NP рецепторов (Bennett et al. , J Biol. Chem. 266, 23060-23067 (1991)); IgE α-рецептора (Ridgway и Gorman, J, Cell. Biol. 115, abstr. 1448 (1991)); HGF рецептора (Mark, M. R. etal. , 1992, J. Biol. Chem. submitted)); IFN-γR α- и β-цепи (Marsters et al. , Proc. Nail. Acad. Sci. USA 92, 5401-05 (1995)); trk-A, -В b -С (Shelton etal. , J. Neuriosci. 15, 477-91 (1995)); IL-2 (Landolfi, J. Immunol. 146. 915-19 (1991)); IL-10 (Zheng etal. , J. Immunol. 154, 5590-5600 (1995)).
Самая простая и самая прямая конструкция иммуноадгезина объединяет связывающую(ие) область(и) "адгезин" протеина с шарнирной и Fc областями тяжелой цепи иммуноглобулина. Обычно, когда получают OB-иммуноглобулиновые химеры, описанные в данном изобретении, нуклеиновая кислота, кодирующая нужный OB-полипептид, должна сливаться по C-концу с нуклеиновой кислотой, кодирующей N-концевую последовательность константной области иммуноглобулина, однако N-концевое слияние также возможно. Обычно, при таких слияниях кодируемый химерный полипептид будет сохранять, по крайней мере функционально, активные шарнирный, CH2 и CH3 домены константной области тяжелой цепи иммуноглобулина. Слияния также проводятся с C-концом Fc участка константной области или непосредственно N-конца с CH1 тяжелой цепи или соответствующей области легкой цепи. Точный участок, на котором происходит слияние, не является решающим; определенные сайты хорошо известны и могут выбираться для того, чтобы оптимизировать биологическую активность, секрецию или связывающие характеристики OB-иммуноглобулиновых химер.
В предпочтительном варианте последовательность нативного созревшего OB-полипептида сливается с N-концом C-концевого участка антитела (в частности Fc-областью), содержащего эффекторные функции иммуноглобулина, например IgG-1. Возможно слить всю константную область тяжелой цепи с OB-последовательностью. Однако более предпочтительно, когда в слиянии используется начало последовательности в шарнирной области, как раз в обратном направлении (в 3'-5' направлении) от сайта расщепления папаина (который определяет IgG Fc химически; остаток 216, приняв первый остаток константной области тяжелой цепи - 114 (Kobet et al. , supra) или аналогичные сайты других иммуноглобулинов). В особенно предпочтительном варианте последовательность OB-полипептида сливается с шарнирной областью и CH2 и CH3 или CH1, шарнирной, CH2 и CH3 областями тяжелой цепи IgG-1, IgG-2 или IgG-3. Точный сайт, на котором происходит слияние, не является решающим и оптимальный сайт может определяться рутинным экспериментированием.
В некоторых вариантах OB иммуноглобулиновые химеры собираются в мультимеры и, в частности, в гомодимеры или -тетрамеры (WO 9108298). Обычно эти собранные иммуноглобулины состоят из известных единичных структур. Основной четырехцепочной структурной единицей является форма, в которой существуют IgG, IgD и IgE. Четырехцепочная единица повторяется в иммуноглобулинах большего молекулярного веса; IgM обычно существует в виде пентамера основных четырехцепочных единиц, соединенных между собой дисульфидными связями. IgA глобулин и иногда IgG глобулин могут также существовать в мультимерной форме в сыворотке. В случае мультимера каждая четырехцепочная единица может быть одинаковой или различной.
Различные типичные собранные OB-иммуноглобулиновые химеры в пределах объема изобретения представлены схематически ниже:
(a) ACL-ACL;
(б) АСH-[АСH, АСL-АСH, АСL-VHСH, или VLСL-ACH] ;
(в) АСL-АСH-[ACL-АСH, АСL-VHСH, VLCL-АСH или VLCL-VHCH] ;
(г) АСL-VHCH-[АСH, или АСL-VHCH, или VLCL-ACH] ;
(д) VLСL-АСH-[АСL-VH-СH или VLCL-АСH] , и
(е) [A-Y] n-[VL-CL-VHСH] 2,
где А - каждый представляет собой одинаковую или разную аминокислотную последовательность OB полипептида;
VL - вариабельная область легкой цепи иммуноглобулина;
VH - вариабельная область тяжелой цепи иммуноглобулина:
СL - константная область легкой цепи иммуноглобулина;
СH - константная область тяжелой цепи иммуноглобулина;
n - целое число, большее 1;
Y - обозначает остаток перекрестносшивающего (ковалентного) агента.
В интересах краткости вышеприведенные структуры показывают только основные свойства; они не указывают соединительные (J) или другие области иммуноглобулинов, не показаны дисульфидные связи. Однако там, где такие области требуются для связывающей активности, они должны быть созданы, причем должны присутствовать в обычных определенных местах, которые они занимают в молекулах иммуноглобулинов.
Наоборот, OB-аминокислотные последовательности могут вставляться (помещаться) между последовательностями тяжелой цепи и легкой цепи иммуноглобулина, так что получают иммуноглобулин, включающий химерную тяжелую цепь. В данном варианте OB-полипептидные последовательности сливаются с 3'-концом тяжелой цепи иммуноглобулина с каждым плечом иммуноглобулина или между шарнирной и CH2 областями, или между CH2 и CH3 областями. О подобных конструкциях сообщалось Hoogenboom, H. R. et al. , Mol. Immunol. 28, 1027-1037 (1991).
Хотя присутствие легкой цепи иммуноглобулина не требуется в иммуноадгезинах, описанных в данном изобретении, легкая цепь иммуноглобулина может присутствовать или ковалентносвязанной с OB-протеин-иммуноглобулиновой тяжелой цепью гибридного полипептида, или непосредственно сливаться с OB-полипептидом. В первом случае ДНК, кодирующая легкую цепь иммуноглобулина, обычно коэкспрессирует с ДНК, кодирующей OB-иммуноглобулиновую тяжелую цепь гибридного протеина. При секреции тяжелая цепь и легкая цепь гибрида будут ковалентно связываться, давая иммуноглобулиноподобную структуру, содержащую две пары тяжелой - легкой цепи иммуноглобулина, связанных дисульфидным мостиком. Способ, пригодный для получения таких структур, например, был предложен в патенте США (U. S. Patent No. 4816567, issued 28 March 1989).
В предпочтительном варианте последовательности иммуноглобулина, используемые в создании иммуноадгезинов, описанных в настоящем изобретении, представляют собой константную область тяжелой цепи IgG иммуноглобулина. Для иммуноадгезинов человека предпочтительно использовать последовательности IgG-1 и IgG-3 иммуноглобулинов, относящихся к человеку. Основное преимущество при использовании IgG-1 заключается в том, что IgG-1 иммуноадгезины можно легко очистить на иммобилизованном протеине А. Наоборот, очистка IgG-3 требует протеина G - значительно менее подвижной среды. Однако, следует учитывать другие структурные и функциональные свойства иммуноглобулинов, когда выбирают lg гибридного партнера для создания данного иммуноадгезина. Например, IgG-3 шарнирная область более длинная и более гибкая, поэтому она может приспосабливать большие "адгезиновые" области, которые не могут сгибаться или функционировать надлежащим образом при слиянии с IgG-l. Возможные структуры иммуноадгезина на основе IgG показаны на фиг. 3 А-В. Поскольку IgG иммуноадгезины являются, как правило, моно- или двухвалентными, другие Ig подтипы, подобные IgA и IgM, могут приводить к димерным или пентамерным структурам, соответственно, основных Ig гомодимерных единиц. Типичный мультимерный иммуноадгезин на основе IgM представлен на фиг. 3 Г. Мультимерные иммуноадгезины выгодны тем, что они могут связывать их соответственные мишени с большей авидностью, чем их аналоги на основе IgG. Приведенными примерами таких структур являются CD4-IgМ (Traunecker et аl. , supra); ICAM-IgM (Martin et al. , J. Virol. 61, 3561-68 (1993)); и CD2-IgM (Arulanandam et al. , J. Exp. Med. 177, 1439-50 (1993)).
Для OB-Ig-иммуноадгезинов, которые предназначены для применения in vivo, также важны фармакокинетические свойства и эффекторные функции, определяемые Fc областью. Хотя IgG-1, IgG-2 и IgG-4 - все имеют время полужизни 21 день, их относительные эффективности при активации комплементной системы различны. IgG-4 не активирует комплемента и IgG-2 значительно слабее при активации комплемента, чем IgG-1. Кроме того, в отличие от IgG-1, IgG-2 не связывается с Fc рецепторами на мононуклеарных клетках или нейтрофилах. Тогда как IgG-3 является оптимальным для активации комплемента, его время полужизни in vivo составляет примерно одну третью часть от других изотипов IgG. Другим важным соображением относительно иммуноадгезинов, предназначенных для использования в качестве терапевтических средств для человека, является количество аллотипических вариантов данного изотипа. Обычно предпочтительны IgG изотипы с меньшими типированными антисывороткой аллотипами. Например, IgG-1 имеет только четыре типированных антисывороткой аллотипических сайта, два из которых (G1m и 2) расположены в Fc области; и один их этих сайтов G1m1 не является иммуногенным. Наоборот, имеются 12 типированных антисывороткой аллотипов в IgG-3, все они находятся в Fc-области; только три из этих сайтов (G3m5, 11 и 21) имеют один аллотип, который является неиммуногенным. Таким образом, потенциальная иммуногенность γ3 иммуноадгезина больше, чем потенциальная иммуногенность γ1 иммуноадгезина.
В связанных OB-Ig иммуноадгезинах, описанных в данном изобретении, области, которые не требуются для связывания рецептора, структурной целостности (например, соответствующей складчатости (укладки)) и/или биологической активности молекулы, могут быть стерты. В таких структурах важно поместить стык слияния на остатках, которые расположены между областями (доменами), чтобы избежать ошибочной складчатости. Что касается родительского иммуноглобулина, нужная точка стыка находится в обратном направлении (в 3'-5' направлении) от цистеинов шарнирной области, которые образуют дисульфидные связи между двумя тяжелыми цепями. В часто применяемой конструкции кодон C-концевого остатка "адгезиновой" (OB) части молекулы помещается прямо в обратном направлении (в 3'-5' направлении) от кодонов DKTHTCPPCP последовательности IgG-1 шарнирной области.
OB-Ig-иммуноадгезины создаются наиболее удобно путем слияния кДНК-последовательности, кодирующей OB-участок внутри рамки считывания, с Ig кДНК последовательностью. Однако может также использоваться слияние с геномными Ig фрагментами (см. например, Gascoigne et al. , Proc. Natl. Acad. Sci. USA 84, 2936-2940 (1987): Aruffo et al. , Cell 61, 1303-1313 (1990); Stamenkovic et al. , Cell 66, 1133-1144 (1991)). Последний вид слияния требует присутствия Ig регуляторных последовательностей для экспрессии. кДНК-ты, кодирующие константные области IgG тяжелой цепи, могут изолироваться, основываясь на опубликованной последовательности из кДНК библиотек, полученных из селезенки и лимфоцитов периферической крови с помощью гибридизационного способа или метода полимеразной реакции синтеза цепи (polymerase chain reaction, PCR). OB кДНК, относящуюся к мышам или крысам, можно, например, получить с помощью полимеразной реакции синтеза цепи из кДНК библиотеки жировой ткани мыши (Clontech), используя праймеры, созданные на основе последовательности Zhang et al. Аналогичным способом можно получить OB кДНК, относящуюся к человеческому роду. Или же можно использовать OB ген мыши в качестве зонда для изолирования кДНК клонов жировой ткани человека (Clontech), например из λ gtll библиотеки, как описано Zhang et al. кДНК-ты, кодирующие "адгезиновые" и Ig участки иммуноадгезина, помещаются в тандеме, в плазмидный вектор, который направляет эффективную экспрессию в выбранные клетки хозяина. Для экспрессии в клетках млекопитающих предпочтительны вектора, основанные на pRK5 (Schall et al. , Cell 61, 361-370 (1990)), pRK7-вектора и вектора, основанные на CDM8 (Seed, Nature 329, 840 (1989)). (pRK7 идентичны pRK5, за исключением того, что упорядоченность (последовательность) сайтов рестрикции эндонуклеазы в полилинкерной области между ClaI и HindIII противоположна (см. U. S. Patent No. 5108901? issued 28 April 1992). Точная область соединения может создаваться удалением дополнительной последовательности между созданными кодонами соединения, используя сайт-направленный мутагенез с использованием олигонуклеотида (Zoller, Smith, Nucleic Acids Res. 10, 6487 (1982); Capon et al. , Nature 337, 525-531 (1989)). Могут использоваться синтетические олигонуклеотиды, в которых каждая половина комплементарна последовательности на каждой стороне нужной области соединения: идеально они составляют от 36- до 48-mers. Или же метод полимеразной реакции синтеза цепи может использоваться для соединения двух частей молекулы внутри рамки считывания с соответствующим вектором.
Иммуноадгезины могут эффективно экспрессировать в различных клетках хозяина, включая миеломные клеточные линии, клетки яичника китайского хомячка (Chinese Hamster ovary, CHO), COS клетки обезьяны, 293 эмбриональные клетки почки человека и клетки насекомых, инфицированных бакуловирусом. В этих системах иммуноадгезиновые полипептиды собираются и секретируют (выделяются) в клеточную культуральную среду. В качестве хозяев могут также использоваться дрожжи, например Saccharomyces cerevisiae, Pichia pastoris и т. д. и бактериальные клетки, предпочтительно Е. coli. OB-иммуноглобулиновые химеры могут экспрессировать в дрожжи, например, аналогично процессу, описанному для экспрессии OB-протеинов в работах Leiber et al. Crit. Res. Food Sci. Nutr. 33, 351 (1993); Friedman, Leibel, Cell 69, 217 (1992); и Beavis, Chait, Proc. Natl. Acad. Sci. USA 87, 6873 (1990). Таким образом, кодирующие последовательности могут субклонироваться в дрожжевую плазмиду, как например плазмиду pPIC g(Invitrogen) экспрессии дрожжей. Данный вектор направляет секрецию гетерологических протеинов из дрожжей в среду для культивирования. Согласно Halaas et al. , supra экспрессия OB-генов мыши и человека в Saccharomyces cerevisiae, трансформируемых данным вектором, приводит к получению секретируемого 16-kD протеина, который является непроцессированным OB-протеином с отсутствующей сигнальной последовательностью. Экспрессия OB-иммуноглобулиновых химер мыши и человека в Е. coli может, например, осуществляться по аналогии с методикой, описанной Halaas et al. , supra. Кодирующие последовательности OB-иммуноглобулиновых химер мыши и человека могут субклонироваться в РЕТ15b экспрессирующий вектор (Novagen) и экспрессироваться в Е. coli (BL21 (DE3)plYsS) при использовании T7 Е. coli PHK полимеразной системы. Наоборот, гибридный протеин может экспрессировать в Е. coli путем вставки кодирующей последовательности внутрь рамки считывания с последовательностью секреции термостабильного энтеротоксина II Е. coli, в прямом направлении (5'-3' направлении) промотора Е. coli щелочной фосфатазы (Chang et al. Gene 55, 189-96 (1987)).
Выбор линии клеток хозяина для экспрессии OB-Ig-иммуноадгезинов зависит, главным образом, от экспрессирующего вектора. Другим соображением является количество требуемого протеина. Миллиграммовые количества часто можно получить при помощи временной трансфекции. Например, аденовирусные EIA-трансформируемые 293 эмбриональные клетки почки человека могут временно трансфектироваться с pRK-5 и pRK7-векторами путем модификации кальцийфосфатного метода для достижения эффективной экспрессии иммуноадгезина. Данный метод иллюстрируется на примерах. Векторы на основе CDM8 могут использоваться для трансфекции COS клеток DEAE-декстрановым методом (Aruffo et al. , Cell 61, 1303-1313 (1990); Zettmeissl et al. , DNA Cell Biol. (US) 9, 347-353 (1990)). Если требуются большие количества протеина, иммуноадгезин может экспрессироваться после стабильной трансфекции клеточной линии хозяина. Например, вектор, основанный на pRK5 или pRK7, может вводиться в клетки яичника китайского хомячка (CHO) в присутствии дополнительной плазмиды, кодирующей дигидрофолатредуктазу (dihydrofolate reductase, DHFR) и придающей устойчивость к G418. Клоны, резистентные (устойчивые) к G418, могут отбираться в культуре; данные клоны культивируют в присутствии увеличивающихся уровней метотрексата - ингибитора дигидрофолатредуктазы; клоны селектируют, в которых количество копий генов, кодирующих последовательности DHFR и иммуноадгезина, совместно амплифицируются. Если иммуноадгезин содержит гидрофобную лидерную последовательность на его N-конце, тогда вероятнее всего он будет процессировать и секретировать трансфектными клетками.
Экспрессия иммуноадгезинов более сложных структур может требовать уникально соответствующих клеток хозяина, например, компоненты легкой цепи или "J" пептида могут обеспечиваться некоторыми миеломными или гибридомными клетками хозяев (Gascoigne et al. , 1987, supra; Martin et al. J. Virol. 67, 3561-3568 (1993)). Экспрессия иммуноадгезинов с более сложными олигомерными структурами может требовать уникально соответствующих клеток-хозяев, например компоненты легкой цепи или "J"-пептида могут обеспечиваться некоторыми миеломными или гибридомными клетками хозяев (Gascoigne et al. ,
supra, Martin et al. , J. Immunol. 61, 3561-68 (1993)).
Иммуноадгезины могут легко очищаться с помощью аффинной хроматографии. Пригодность протеина А в качестве аффинного лиганда зависит от вида и изотипа Fc области иммуноглобулина, который используется в химере. Протеин А можно использовать для очистки иммуноадгезинов, которые основаны на γ1, γ2 или γ4 тяжелых цепей, принадлежащих человеческому роду (Lindmark et al. , J. Immunol. Meth. 62, 1- 13 (1983)). Протеин G рекомендуется для всех изотипов, относящихся к мыши, и γ3, принадлежащих человеческому роду (Guss et al. , EMBO J. 5, 1567-1575 (1986)). Матрица, к которой присоединяется аффинный лиганд, наиболее часто является агарозой, но пригодны также и другие матрицы. Механически прочные матрицы, как например стекло с определенным размером пор или поли(стиролдивинил)бензол, позволяют увеличить скорости потока и уменьшить времена процессирования, чем те, которые достигаются с агарозой. Условия связывания иммуноадгезина с протеином А или G аффинной колонки полностью диктуются характеристиками Fc-области; т. е. видом и изотипом. Обычно, когда выбирается соответствующий лиганд, происходит эффективное связывание непосредственно из абсолютной культуральной жидкости. Одним из отличительных свойств иммуноадгезинов является то, что для γ1 молекул, относящихся к человеческому роду, связывающая способность протеина А несколько уменьшается по сравнению с антителом того же Fc типа. Связанный иммуноадгезин может эффективно элюироваться или при кислых pH (при pH 3,0 или выше), или в буфере с нейтральным pH, содержащим умеренно chaotropic salt. Данная стадия аффинной хроматографии может приводить к получению иммуноадгезина с чистотой более 95%.
Для очистки иммуноадгезинов другие известные способы можно использовать вместо или в дополнение к аффинной хроматографии на протеине А или П. Иммуноадгезины ведут себя аналогично антителам в тиофильной гель-хроматографии (Hutchens, Porath. , Anal. Biochem. 1596217-226 (1986)) и иммобилизированной металлокомплексной хроматографии (Al-Mashikhi, Makai, J. Dairy Sci. 71, 1756-1763 (1988)). В противоположность антителам, их поведение на ионообменных колонках диктуется, однако, не только их изоэлектрическими точками, но также и зарядом диполя, который может существовать в молекулах вследствие их химерной природы. Микрогетерогенность заряда может также являться фактором для иммуноадгезинов, в которых адгезиновая часть молекулы гликозилируется и содержит сиаловую кислоту. Процедура специфической очистки описана в примерах.
Результаты с многочисленными иммуноадгезинами, полученными до сих пор, показывают, что слияние адгезинового участка с Fc областью обычно не нарушает складчатость индивидуальных областей. Как адгезиновая, так и иммуноглобулиновая области по-видимому складываются правильно и Fc область сохраняет многие из эффекторных функций, которые являются характеристиками антител, как например связывание с Fc рецепторами.
Способы, обычно применяемые для создания, экспрессии и очистки иммуноадгезинов, описаны, например, в патентах США (U. S. Pat. Nos. 5225538 (issued 6 July 1993) и 5455165 (issued 30 October 1995)), обнаружение которых таким образом, специально приведено в виде ссылок. Создание иммуноадгезина, экспрессия, очистка и различные структуры иммуноадгезинов также описаны в обзорных статьях (Ashkenazi, Chamnov, Methods in Enzymology 8, 104-115 (1995) и Peach, Linsley, Methods in Enzymology 8, 116-123 (1995)), обнаружение которых наряду с процитированными ссылками, также специально приведено в качестве ссылки.
С. Другие OB-производные с продолжительным временем полужизни.
Другие производные OB-протеинов, которые обладают более продолжительным временем полужизни, чем нативные молекулы, содержат OB-протеин или OB-иммуноглобулиновую химеру ковалентно-связанные с небелковым полимером. Небелковый полимер обычно представляет собой гидрофильный синтетический полимер, т. е. полимер, не встречающийся в природе. Однако пригодны и полимеры, которые существуют в природе и продуцируются рекомбинантными методами или методами in vitro, как и полимеры, которые выделяются из природных источников. Гидрофильные поливиниловые полимеры, например поливиниловый спирт, и поливинилпирролидон входят в объем данного изобретения. Особенно пригодны полиалкиленовые эфиры, как например полиэтиленгликоль (PEG); полиелкилены, как например полиоксиэтилен, полиоксипропилен и блок-сополимеры полиоксиэтилена и полиоксипропилена (плуроники, Pluronics); полиметакрилаты; карбомеры; разветвленные и неразветвленные полисахариды, которые содержат углеводные мономеры D-маннозы, D- и L-галактоны, фукозы. фруктозы, D-ксилозы, L-арабинозы, D-глюкуроновой кислоты, сиаловой кислоты, D-галактуроновой кислоты, D-маннуроновой кислоты (например, полиманнуроновой кислоты или альгиновой кислоты), D-глюкозамина, D-галактозамина, D-глюкозы и нейраминовой кислоты, включая гомополисахариды и гетерополисахариды, как например лактозу, амилопектин, крахмал, гидроксиэтилкрахмал, амилозу, сульфат декстрана, декстран, декстрины, гликоген или полисахаридные субъединицы кислых мукополисахаридов, как например гуалуроновой кислоты; полимер углеводсодержащих спиртов, как например полисорбит и полиманнит; гепарин или гепарон. Полимер до введения перекрестных сшивок не обязательно, но предпочтительно должен быть водорастворимым, но конечный конъюгат должен быть водорастворимым. Кроме того, полимер не должен быть высокоиммуногенным в конъюгатной форме, не должен быть вязким, что является несовместимым с внутривенным вливанием или инъекцией, если предназначается для такого способа введения.
Предпочтительно, когда полимер содержит только одну реакционноспособную группу. Это позволяет предотвратить перекрестное сшивание молекул протеина. Однако в пределах объема изобретения находится оптимизация условий проведения реакции, чтобы уменьшить перекрестное сшивание или очистить продукты реакции посредством гель-фильтрации или молекулярных сит для регенерирования практически гомогенных производных.
Молекулярный вес полимера может находиться в пределах от ~ 100 до 500000 и предпочтительно составлять от 1000 до 20000. Выбор молекулярного веса будет зависеть от природы полимера и степени замещения. Обычно чем выше гидрофильность полимера и выше степень замещения, тем скорее можно использовать полимер с более низким молекулярным весом. Оптимальные молекулярные веса определятся рутинным экспериментированием.
Полимер обычно ковалентно связан с OB-протеином или с OB-иммуноглобупиновыми химерами с помощью многофункционального перекрестносшивающего агента, который реагирует с полимером и одним или несколькими аминокислотными или углеводными остатками OB-протеина или OB-иммуноглобулиновой химеры для связывания. Однако в пределах объема изобретения также непосредственное перекрестное сшивание полимера при взаимодействии дериватизированного полимера с гибридом или наоборот.
Участок ковалентного перекрестного сшивания на OB-протеине или OB-Ig содержит N-концевую аминогруппу и ε-аминогруппы, имеющиеся в остатках лизина, а также другие амино-, имино-, карбоксильные, сульфгидрильные, гидроксильные или другие гидрофильные группы. Полимер может ковалентно связываться непосредственно с гибридом без применения многофункционального (обычно бифункционального) перекрестносшивающего агента. Ковалентное связывание аминогруппы достигается известными в химии методами на основе использования реакционноспособных групп хлорангидрида циануровой кислоты, карбонильного производного диимидазола, альдегида (PEG алкоксид + диэтилацеталь бромацетальдегида; PEG + диметилсульфоксид + уксусный ангидрид, или PEG хлорид + феноксид 4-гидроксибензальдегида, активные эфиры сукцинимида, активированный дитиокарбонатом PEG, 2,4,5-трихлорфенилхлорформиатом или n -нитрофенилхлорформиатом активированный PEG). Карбоксильные группы дериватизируются при связывании с PEG-амином, используя карбодиимид.
Полимеры соединяются с группами олигосахарида при окислении с использованием химических веществ, например метапериодата, или ферментов, например глюкозо- или галактозооксидазы (каждая из которых приводит к получению альдегидных производных углеводов), за которым следует реакция с гидразидными или аминодериватизированными полимерами, таким же образом, как описано в работах Heitzmann et al. , P. N. A. S. 71, 3537-41 (1974) или Bayer et al. , Methods in Enzymology 62, 310 (1979) для получения меченных биотином или авидином олигосахаридов. Кроме того, особенно полезны химические и ферментативные способы, которые прежде были использованы для связывания олигосахаридов, поскольку обычно имеется меньшее количество замещений, чем аминокислотных участков для дериватизации и, таким образом, олигосахаридные продукты будут более гомогенными. Заместители олигосахаридов также возможно модифицируют ферментативным расщеплением, чтобы удалить сахара, например, при расщеплении нейраминидазой до дериватизации полимера.
Полимер должен содержать группу, которая непосредственно реагирует с аминокислотой боковой цепи или N-, или C-концом связанного полипептида, или которая реагирует с многофункциональным поперечносшивающим агентом. Обычно полимеры, содержащие такие реакционноспособные группы, известны для получения иммобилизованных протеинов. Для того чтобы использовать такие способы в данном изобретении, необходимо применять водорастворимый полимер, дериватизированный таким же образом, как прежде применялось для нерастворимых полимеров, используемых для иммобилизации протеина. Особенно пригоден метод активации бромистым цианом для применения в перекрестном сшивании полисахаридов.
"Водорастворимый", что касается исходного полимера, означает, что полимер или его реакционноспособное промежуточное соединение, используемое для связывания, является достаточно растворимым в воде, чтобы участвовать в реакции дериватизации.
"Водорастворимый", что касается полимерного конъюгата, означает, что конъюгат растворим в физиологических растворах (жидкостях), как например в крови.
Степень замещения таким полимером будет изменяться в зависимости от количества реакционноспособных участков на протеине, используется ли весь протеин или его фрагмент, слит ли протеин с гетерологическим протеином (например, OB-иммуноглобулиновой химерой), от молекулярного веса, гидрофильности и других характеристик полимера и от выбранных участков дериватизации данного протеина. Обычно конъюгат содержит приблизительно от 1 до 10 полимерных молекул, хотя любая гетерологическая последовательность может замещаться практически неограниченным количеством полимерных молекул, пока на требуемую активность в значительной степени не будет оказано вредного влияния. Оптимальная степень перекрестного сшивания легко определяется экспериментальной матрицей, в которой изменяются время, температура и другие условия реакции для изменения степени замещения, после чего определяется способность конъюгатов функционировать нужным образом.
Полимер, например PEG, перекрестносшивается с использованием целого ряда методов, по-существу, известных для ковалентной модификации протеинов небелковыми полимерами, как например PEG. Некоторые из этих методов, однако, предпочтительно не использовать для целей, обозначенных данным изобретением. Применение хлорангидрида циануровой кислоты приводит к большому количеству побочных реакций, включая перекрестное связывание протеина. Кроме того, это может в частности, привести к возможной инактивации протеинов, содержащих сульфгидрильные группы. Использование карбонилдиимидазола (Beauchamp et al. , Anal. Biochem. 131, 25- 33 (1983)) требует высоких pH (>8,5), при которых могут инактивироваться протеины. Кроме того, поскольку промежуточный "активированный PEG" может реагировать с водой, требуется очень большой мольный избыток "активированного PEG" по сравнению с протеином. Высокие концентрации PEG, необходимые при использовании карбонилдиимидазола, также создают проблемы при очистке, поскольку это оказывает вредное воздействие и на гель-фильтрацию (гель-хроматографию) и хроматографию гидрофильного взаимодействия. Кроме того, высокие концентрации "активированного PEG" могут осаждать протеин, проблема в том же, о чем, по-существу, отмечалось выше (Davis, U. S. Patent No. 4179337). С другой стороны, применение альдегида (Royer, U. S. Patent No. 4002531) более эффективно, так как оно требует только 40-кратного мольного избытка PEG и 1-2 часа инкубирования. Однако двуокись марганца, предложенная Ройером (Royer) для получения PEG альдегида, проблематична "из-за явно выраженной тенденции PEG образовывать комплексы с окисляющим агентом на основе металла" (Harris et al. , J. Polym. Sci. Polym. Chem. Ed. 22, 341-52 (1984)). Использование окисления Моффатта (Moffatt), применяющего диметилсульфоксид (DMSO) и уксусный ангидрид, устраняет эту проблему. Кроме того, боргидрид натрия, предложенный Ройером (Royer), должен использоваться при высоких pH и обладает значительной склонностью к восстановлению дисульфидных связей. Наоборот, предпочтителен цианоборгидрид натрия, который эффективен при нейтральных pH, и обладает очень малой склонностью к восстановлению дисульфидных связей.
PEG полимеры с функциональными группами для модификации OB-протеина или OB-Ig-химер, описанных в данном изобретении, доступны от Shearwater Polymers, Inc. (Huntsville, AL). Такие коммерчески доступные PEG-производные включают, но не ограничиваются ими, амино-PEG, эфиры аминокислот-PEG, PEG- гидразид, PEG-тиол, PEG-сукцинат, карбоксиметилированный PEG, PEG-пропионовая кислота, PEG-аминокислоты, PEG сукцинимидилсукцинат, PEG-сукцинимидилпропионат, сукцинимидиловый эфир карбоксиметилированного PEG, сукцинимидилкарбонат PEG; сукцинимидиловые эфиры аминокислот PEG-ов, PEG-оксикарбонилимидазол, PEG-нитрофенилкарбонат, PEG-трезилат, PEG-глицидиловый эфир, PEG-альдегид, PEG винилсульфон, PEG-имидмалеиновой кислоты, PEG-о-пиридилдисульфид, гетерофункциональные PEG-и, PEG-виниловые производные, PEG-силаны и PEG-фосфолиды. Условия реакции связывания этих PEG-производных будут изменяться в зависимости от протеина, требуемой степени PEG-илирования, и от использованного PEG-производного. Некоторые факторы, учитываемые при выборе PEG-производных включают: необходимый сайт связывания (лизин или цистеин), гидролитическую стабильность и реакционную способность производных, стабильность, токсичность и антигенность сцепления, пригодность для анализа и т. д. Специфические инструкции по использованию любых данных производных доступны от производителя.
Конъюгаты с продолжительным временем жизни, описанные в данном изобретении, отделяются от непрореагировавших исходных веществ с помощью гель-фильтрации. Гетерологические виды конъюгатов очищают один от другого таким же образом. Полимер также может быть водорастворимым, как гидрофильный гель.
Конъюгаты также можно очищать с помощью ионообменной хроматографии. Химия многих электрофильно активированных PEG-ов приводит к уменьшению заряда аминогруппы PEG-илированного продукта. Таким образом, ионоообменная хроматография высокого разрешения может использоваться для отделения свободных и конъюгированных протеинов и для разделения частиц с различными уровнями PEG-илирования. В действительности, разделение различных частиц (например, содержащих один или два PEG остатков) также возможно вследствие различия в ионных свойствах непрореагировавших аминокислот.
Г. Применение OB-иммуноглобулиновых химер и других производных с продолжительным временем полужизни
OB-иммуноглобулиновые химеры и другие OB-производные с продолжительным временем полужизни, описанные в данном изобретении, пригодны для уменьшения веса и, конкретно, для лечения ожирения и других расстройств, связанных с аномальной экспрессией или функцией OB-гена. Наши исследования показывают, что OB-иммуноглобулиновые химеры и другие OB-производные с продолжительным временем полужизни, например PEG-илированные OB, уменьшают потребление пищи и увеличивают потребление энергии подвергаемых лечению животных, и поэтому являются очень эффективными для уменьшения веса как тучных, так и нормальных субъектов. Для целей проверки молекулы можно растворить в забуференном фосфатом физиологическом растворе (phosphate-buffered saline. PBS) (pH 7,4) и вводить внутривенными или подкожными инъекциями или вливаниями.
OB-производные с продолжительным действием, описанные в настоящем изобретении, могут использоваться, кроме того, для лечения других метаболических расстройств, как например диабета и булимии. Было показано, что OB-протеин уменьшает уровень инсулина у животных и может быть пригоден для уменьшения излишнего уровня инсулина у людей. Уменьшение уровня инсулина у тучных и нетучных пациентов (например, больных диабетом I или II типа) может восстанавливать или улучшать чувствительность к инсулину таких пациентов.
Кроме того, OB-производные с продолжительным временем полужизни могут использоваться для лечения заболеваний почек, гипертензии и дисфункции легких, как например эмфиземы. OB-протеин также может вызывать митогенную реакцию в рецепторсодержащих тканях, действуя в качестве фактора роста для данных клеток.
Терапевтические композиции, описанные в настоящем изобретении, получают при смешивании активного ингредиента, имеющего необходимую степень чистоты, с физиологически приемлемыми носителями, наполнителями или стабилизаторами (Remington's Pharmaceutical Sciences 16th edition, Osol A. Ed. (1980)) в виде лиофилизированных композиций или водных растворов. Приемлемые носители, наполнители или стабилизаторы являются нетоксичными к реципиенту при применяемых дозах и концентрациях и включают буферы, как например фосфатный, цитратный и буферы других органических кислот; антиоксиданты, включая аскорбиновую кислоту; низкомолекулярные (менее, чем ≈ 10 остатков) полипептиды; протеины, как например, сывороточный альбумин, желатин или иммуноглобулины; гидрофильные полимеры, как например, поливинилпирролидон; аминокислоты, как например глицин, глутамин, аспарагин, аргинин или лизин; моносахариды, дисахариды и другие углеводы, включая глюкозу, маннозу или декстрины; хелатирующие агенты, как например EDTA; сахарные спирты, как например маннит или сорбит; сольобразующие противоионы, как например натрий; и/или неионные поверхностно-активные вещества, как например твин, плуроники или PEG.
Активные ингредиенты могут также заключаться в приготовленные микрокапсулы, например, с помощью техники коацервации или полимеризации на границе раздела фаз, например гидроксиметилцеллюлозные или желатиновые микрокапсулы и поли-(метилметакрилатные) микрокапсулы, соответственно, в коллоидных системах доставки лекарственного вещества к участку действия (например, липосомы, альбуминовые микросферы, микроэмульсии, наночастицы и нанокапсулы), или в макроэмульсиях. Такие методы представлены в Remington's Pharmaceutical Sciences, supra.
Композиции, которые предназначаются для использования in vivo должны быть стерильны. Это легко достигается путем фильтрации через стерильные фильтрационные мембраны до или после лиофилизации и создания действующей композиции.
Терапевтические композиции, описанные в данном изобретении, обычно помещают во флакон, имеющий стерильное входное отверстие, например баллон для внутривенного раствора или пузырек, имеющий пробку, способную протыкаться иглой для подкожных инъекций.
Способ введения находится в соответствии с известными методами, например внутривенная, внутрибрюшинная инъекция или вливание и другие способы. Также предлагается использовать композиции непрерывного выделения. Соответствующие примеры композиций непрерывного выделения включают полупроницаемые полимерные матрицы в виде определенной формы, например пленок или микрокапсул. Матрицы непрерывного выделения включают полиэфиры, гидрогели, полилактиды (U. S. Patent 3773919, ЕР 58481), сополимеры L-глутаминовой кислоты и γ-этил-L-глутамата (U. Sidman et al. , Biopolymers 22(1), 547-556 (1983)), поли(2- гидроксиэтилметакрилат) (R. Langer et al. , J. Biomed. Mater. Res. 15, 167-277 (1981) и R. Langer Chem. Tech. 12, 98-105 (1982)), этиленвинилацетат (R. Langer et al. , id. ), или поли-D-(-)-3- гидроксимасляную кислоту (ЕР 133988А). Композиции непрерывного выделения также включают липосомы. Липосомы, содержащие молекулы в пределах объема настоящего изобретения, получают по методу, известному из работ, заявок и патентов: DE 3218121А; Epstein et al. , Proc. Nail. Acad. Sci. USA 82, 3688-3692 (1985); Hwang et al. , Proc. Nail. Acad Sci. USA 71, 4030-4034 (1980), ЕР 52322А; ЕР 36676А; ЕР 88046А; ЕР 143949А; ЕР 142641А; Japanese patent application 83-118008; U. S. Patents 4485045 и 4544545; и ЕР 102324А. Обычно липосомы представляют собой маленькие (около 200-800 ангстрем) однопластинчатые виды, в которых содержание липида составляет более 30 мол. % холестерина, причем выбранное количество регулируется оптимальной терапией.
Эффективное количество молекулы, применяемой терапевтически, зависит, например, от терапевтических целей, способа введения и состояния пациента. Таким образом, для терапевта необходимо определить дозу и модифицировать способ введения, чтобы получить оптимальный терапевтический эффект. Типичная дневная доза может варьироваться от примерно 1 мкг/кг вплоть до 100 мг/кг или более в зависимости от вышеупомянутых факторов. Обычно клиницист должен вводить молекулу, описанную в данном изобретении, до тех пор, пока не достигнет дозы, которая обеспечит требуемый биологический эффект. Достижения данной терапии легко контролировать обычными методами анализа. Если целью лечения является уменьшение веса, то обычно терапия продолжается до тех пор, пока не достигается нужный вес тела.
Не относящиеся к терапии применения гибридных OB-протеин-иммуноглобулинов, описанных в данном изобретении, включают использование их для идентификации и очистки OB-рецепторов. Идентификация и экспрессия клонирования OB-рецептора, использующего OB-протеин-иммуноадгезин, описана в приведенных ниже примерах.
Изобретение далее будет проиллюстрировано следующими, не ограничиващими его, примерами.
Пример 1. Экспрессия OB-иммуноадгезинов
Применяя методы генной инженерии, OB-протеин человека экпресссировал как слитый с шарнирной, CH2 и CH3 областями IgG-1. ДНК конструкции, кодирующие химеру OB-протеина человека и IgG-1 Fc-области, создавали с клонами Fc-области IgG-1 человека. OB кДНК человека получали с помощью полимеразной реакции синтеза цепи (PCR) из жировых клеток дцсДНК человека (продукт Clontech Buick - Clone cDNA). Источником IgG-1 кДНК являлась плазмида pBSSK-CH2CH3. Химера, содержащая кодирующую последовательность первичного (полной длины) OB-протеина (аминокислоты 1-167, фиг. 5) и последовательности IgG-1 человека, начинающиеся от аспарагиновой кислоты 216, считая аминокислоту в положении 114 в качестве первого остатка константной области тяжелой цепи (Kabat et al. , Sequences of Proteins of Immunoloqical Interest 4th ed. (1987)), которая является первым остатком шарнирной области IgG-1 после того, как остаток цистеина включается в связывание тяжелой - легкой цепи и заканчивается остатком в положении 441, чтобы включить CH2 и CH3 Fc области IgG-1. Имела место вставка кодонов трех аминокислот (GlyValThr) между OB-и IgG-1-кодирующими последовательностями. Если необходимо, эту короткую линкерную последовательность можно легко стереть (удалить), например, с помощью сайтнаправленного мутагенеза делеции, для создания точного связывания (стыка) между кодирующими последовательностями OB-протеина и шарнирной областью IgG-1. Кодирующую последовательность OB-IgG-1-иммуноадгезина субклонировали в вектор pRK5tk-neo на основе pRK5, который содержал неомицин-селектируемый маркер, для временной экспрессии в 293 клетках, используя кальцийфосфатный метод (Suva et al. , Science 237, 893-896 (1987)). 293 клетки культивировали в HAM's: низкой концентрации глюкозы DMEM (модифицированная по способу Дульбекко среда Игла) среде (50: 50), содержащей 10% FBS и 2 мМ L-Gln. Для очистки OB-IgG-1-химер клетки на следующий день после трансфекции переносили в бессывороточную продуцирующую среду PS24 и среды собирали после трех дней. Культуральные среды фильтровали.
Отфильтрованный супернатант 293 клеток (400 мл), содержащий рекомбинантный OB IgG-1 человека, готовили 1 мМ в фенилметил-сульфонилфториде и содержащем 2 мг/мл апротинина. Данное вещество помещали при 4oC в 1 х 4,5 см колонку с протеином А, иммобилизованном на агарозе (Pierce catalog N 20365); уравновешенную 100 мМ HEPES pH8.
Скорость потока составляла 75 мл/ч. Как только помещали образец, колонку промывали уравновешивающим буфером до тех пор, пока А280 не достигала базисной линии. OB-IgG-1-протеин элюировали раствором 3,5 М MgCl2 + 2% глицерина (незабуференным) со скоростью потока 15 мл/ч. Элюат собирали с периодическим перемешиванием в 10 мл 100 мМ HEPES pH8, чтобы уменьшить концентрацию MgCl2 примерно в 2 раза и увеличить pH. Элюированный протеин затем подвергали диализу против забуференного фосфатом физиологического раствора, концентрировали, стерилизовали и хранили или при 4oC или замораживали при -70oC. OB-IgG-1-иммуноадгезин, полученный данным способом, определяли по SDS-PAGE и чистота его была выше 90%.
Пример 2. Исследования животных
А. Вещества и способы
Продуцирование OB-протеина - OB кДНК, относящийся к мышам или крысам, получали с помощью полимеразной реакции синтеза цепи (PCR) из адипоцитной кДНК библиотеки, используя праймеры, основанные на последовательности Zhang et al. , supra. Созревший OB-протеин (аминокислоты 22-167) экспрессировал в E. coli путем вставки OB-кодирующей последовательности внутрь рамки считывания с секреторной последовательностью E. coli термостабильного энтеротоксина II, в 5'-3' направлении промотора E. coli щелочной фосфатазы (Chang et al. , Gene 55, 189-96 (1987)). После лизиса клеток нерастворимую фракцию растворяли в 8 М буфере с мочевиной с pH 8,35, в присутствии 25 мМ DTT (дитиотреитола).
Восстановленный OB-протеин очищали с помощью гель-фильтрации и жидкостной хроматографии высокого разрешения (HPLC) с обращенной фазой, далее заново складывали в присутствии глутатиона. Заново сложенный OB-протеин очищали HPLC с обращенной фазой и анализировали с помощью SDS-PAGE и аминокислотным и масс-спектрометрическими анализам.
Получение PEG-hOB - PEG-производные OB-протеина человека получали по реакции hOB, очищенного с помощью хроматографии с обращенной фазой, с сукцинимидильным производным PEG пропионовой кислоты (SPA-PEG), имеющим номинальный молекулярный вес 10 kD, который был получен из Shearwater Polymers, Inc. (HuntsVille, AL). После очистки hOB-протеина с помощью хроматографии с обращенной фазой, приблизительно 1-2 мг/мл раствора протеина в 0,1% трифторуксусной кислоты и примерно 40% ацетонитриле разбавляли от 1/3 до 1/2 объемом 0,2 М боратного буфера и pH доводили до 8,5 с помощью NaOH. SPA-PEG прибавляли к реакционной смеси, доводя молярные соотношения протеина к SPA-PEG до 1: 1 и 1: 2 и смесь инкубировали при комнатной температуре в течение одного часа. После реакции и очистки гель-электрофорезом или ионообменной хроматографией образцы экстенсивно подвергали диализу против забуференного фосфатом физиологического раствора и стерилизовали фильтрацией через 0,22 микронный фильтр. Образцы хранили при 4oC. При этих условиях PEG-hOB, полученный по реакции при молярном соотношении протеина к SPA-PEG, равного 1: 1, состоял, главным образом, из молекул с одним присоединенным 10 кD PEG с незначительным количеством 2 PEG - содержащей разновидности. PEG-hOB при молярном соотношении 1: 2 состоял примерно из равных количеств 2 и 3 PEG-ов, присоединенных к hOB, как это показано SDS гель-электрофорезом. В обоих реакциях также обнаружено небольшое количество непрореагировавшего протеина. Данный непрореагировавший протеин при необходимости можно легко удалить с помощью гель-фильтрации или ионным обменом. PEG производные OB-протеина человека можно также получить, по существу, после применения альдегида, способа, описанного в европейском патенте (ЕР 372752, published June 13, 1990).
Исследования животных. Все манипуляции, связанные с животными, проверяли и утверждали Genentech's Institutional Animal Care and Use Committee. Семи-восьминедельного возраста C57BI/6J-ob/ob (ob/ob) самок мышей, генетически страдающих ожирением, закупали в Jackson Labs (Bar Harbor, ME). Худых самок мышей того же самого генетического фона (C57ВI/6) закупали в Harlan Sprague Dawley (Hollister, CA). Мышей поселяли в группы по 3-6 с ad libitum доступом к воде и стандартной еде для мышей (Purina 5010: Purina Mills, Richmond, IN) в семейный бокс с контролируемыми температурой, влажностью и освещением (освещение с 06: 00 часов до 18: 00 часов).
Миниосмотические насосы (Alzet model 2002: Alza Corp. , Palo Alto, CA) заполняли очищенным рекомбинантным (химерным) OB-протеином (100 мкг/кг/день) в стерильном забуференном фосфатом физиологическом растворе (PBS) или только PBS при стерильных условиях после предписания производителя и инкубировали (выдерживали) в течение ночи в стерильном физиологическом растворе при комнатной температуре до имплантации мышам. Мышей анестезировали кетамин/ксилазином, и миниосмотические насосы вводили препарат подкожно в середину лопаточной области. Ежедневные подкожные инъекции очищенного рекомбинантного (химерного) OB-протеина, hOB-IgG-1 гибридного протеина или PBS вводили в середину лопаточной области здоровых мышей. Инъекции проводили в течение одного часа без освещения. Регистрировали вес тела каждой мыши (с точностью до 0,1 г) и вес пищи, содержащейся в кормушке в каждой клетке (с точностью до 0,1 г), в течение одного часа без освещения каждые один-два дня. Данные представляли как средние ±SEM. Количество животных - как описано ниже и в надписях на фигурах.
Б. Результаты при непрерывном подкожном вливании OB-протеина
Худых самок мышей лечили OB-протеином, относящимся к мышам или крысам, или в виде непрерывного подкожного вливания, или ежедневных подкожных инъекций. Результаты приведены на фиг. 1. Верхняя часть фиг. 1 (фиг. 1А) показывает, что OB-протеин значительно более эффективен для снижения веса тела, когда осуществляется введение в виде непрерывного вливания, чем когда та же доза вводится в виде ежедневных подкожных инъекций. Нижняя часть фиг. 1 (фиг. 1Б) показывает то же самое различие в способности OB-протеина уменьшать вес жировой ткани.
В. Результаты с OB IgG-1-химерой
Страдающих ожирением самок ob/ob мышей лечили OB-протеином человека или OB-IgG-1 химерой, относящейся к человеческому роду. Данные приведены на фиг. 2. Данные, представленные на верхней части фиг. 2 (фиг. 2А), показали, что hOB-IgG-1-гибридный протеин более эффективен, чем нативный hOB-протеин, для снижения веса тела, когда оба протеина вводятся одинаково с помощью ежедневных подкожных вливаний. Следует заметить, что увеличение эффективности будет даже более выраженным, если данные представить в виде молярных количеств, поскольку только около 1/3 от OB IgG-1 химеры получается из OB-протеина. Данные, кроме того, подтверждают предыдущее наблюдение, что непрерывное подкожное вливание (насосом) hOB-протеина более эффективно, чем ежедневные подкожные инъекции (inj) для снижения веса тела.
Данные, приведенные на нижней части фиг. 2 (фиг. 2Б), показывают, что hOB-IgG-1-гибридный протеин существенно уменьшает потребление пищи. Данный результат был неожиданным, поскольку предполагали, что гибридный протеин будет слишком велик, чтобы преодолеть гематоэнцефалический барьер и оказать воздействие.
Страдающих ожирением (ob/ob) самок мышей лечили hOB- или hOB-IgG-1-химерой ежедневными подкожными инъекциями в течение 7 дней. Данные, приведенные на фиг. 3, снова демонстрируют, что химера более эффективна, чем нативный hOB-протеин для снижения веса тела (верхняя часть фиг. 3, фиг. 3А) и потребления пищи (нижняя часть фиг. 3, фиг. 3Б).
В дополнительном эксперименте страдающих ожирением (ob/ob) самок мышей лечили или hOB-IgG-1 гибридным протеином, нативным hOB или hCD4-IgG-1 (контроль) при помощи ежедневных подкожных инъекций в течение семи дней. Результаты, показанные на фиг. 5, подтверждают, что hOB-IgG-1-гибридный протеин более эффективен, чем нативный hOB-протеин для снижения веса тела (верхняя и средняя часть фиг. 5, фиг. 5А и фиг. 5Б) и потребления пищи (нижняя часть фиг. 5, фиг. 5В).
Г. Результаты с PEG-hOB
Страдающих ожирением (ob/ob) самок мышей лечили OB-протеином человека или PEG производными OB, относящегося к человеческому роду. Данные представлены на фиг. 4. Данные, приведенные на верхней диаграмме, фиг. 4А, показывают, что PEG-hOB более эффективен, чем нативный hOB протеин для уменьшения веса тела, когда оба протеина вводят аналогично при помощи ежедневных подкожных вливаний.
Данные, приведенные на нижней диаграмме, фиг. 4Б, показывают, что PEG-hOB протеины значительно более эффективны для уменьшения потребления пищи, чем немодифицированный нативный hOB.
Контрольный пример. Идентификация и клонирование OB-рецептора
OB-протеин-иммуноадгезин примера 1 использовали для обнаружения и экспрессии клона OB рецептора. Вначале, чтобы определить источник рецептора, проводили скрининг клеточных линий с 1 мг/мл OB IgG-1-гибридного протеина при помощи проточной цитометрии. Система идентифицирования, которая состоит из биотинилированного вторичного антитела, за которым следует стрептавидинфикоэринтрин, обеспечивает эффективную амплификацию сигнала и предусматривает детекцию клеток, экспрессирующих малое количество рецепторов. Найдено, что две линии клеток: 293 эмбриональные клетки почки человека и A549 клетки легкого человека связываются с OB IgG-1, а не с Flt-4 контрольным иммуноадгезином. Специфическое связывание OB IgG-1 с клетками также продемонстрировано при добавлении избытка бактериального экспрессирующего OB-протеина человека. Прибавление 10 мкг/мл OB человека полностью блокирует связывание OB IgG-1 с 293 клетками.
Для изолирования кДНК, кодирующей OB-рецептор, COSN клетки временно трансфектировали с пулами приблизительно 105 клонов олиго dT примированных 293 клеток кДНК библиотеки в pRK5B. Трансфектированные клетки обогащали с помощью пэннинга на пластинках, покрытых Fc антителом против человека, после инкубации с OB IgG-1. После трех циклов обогащения один из тридцати пулов вызывал OB IgG-1-опосредованную адгезию COSN клеток со связывающими пластинками, которые могут конкурировать за лептин человека. кДНК клоны, выбранные случайно из третьего цикла, трансфектировали в пулы из 10-20. Индивидуальные клоны окончательно идентифицировали после разрушения одного пула из 10, что точно подсчитывалось с помощью пэннинга.
Анализ последовательности обнаруживал клон примерно с 5300 bp с открытой рамкой считывания, кодирующей протеин из 896 аминокислот. Последовательность соответствовала трансмембранному протеину I типа с сигнальным пептидом длиной в 22 аминокислоты, внеклеточной области из 819 аминокислот, трансмембранной области с 21 аминокислотой и короткой внутриклеточной областью из 34 аминокислот. Найдено, что последовательность практически соответствует OB-рецептору человека, идентифицированного и выделенного Tartaglia et al. , supra и данная последовательность идентична последовательности рецептора человека, представленной в родственной заявке (Serial No. 08/585005 filed January 11, 1996).
Несмотря на то что изобретение проиллюстрировано с помощью примеров, объем изобретения ими не ограничивается. Ясно, что возможны другие модификации и варианты в пределах сущности изобретения. Предполагается, что все такие модификации находятся в пределах объема данного изобретения.
Все приведенные ссылки, включая примеры, таким образом, специально включены в описание данного изобретения.
Перечень последовательностей приведен в конце описания.


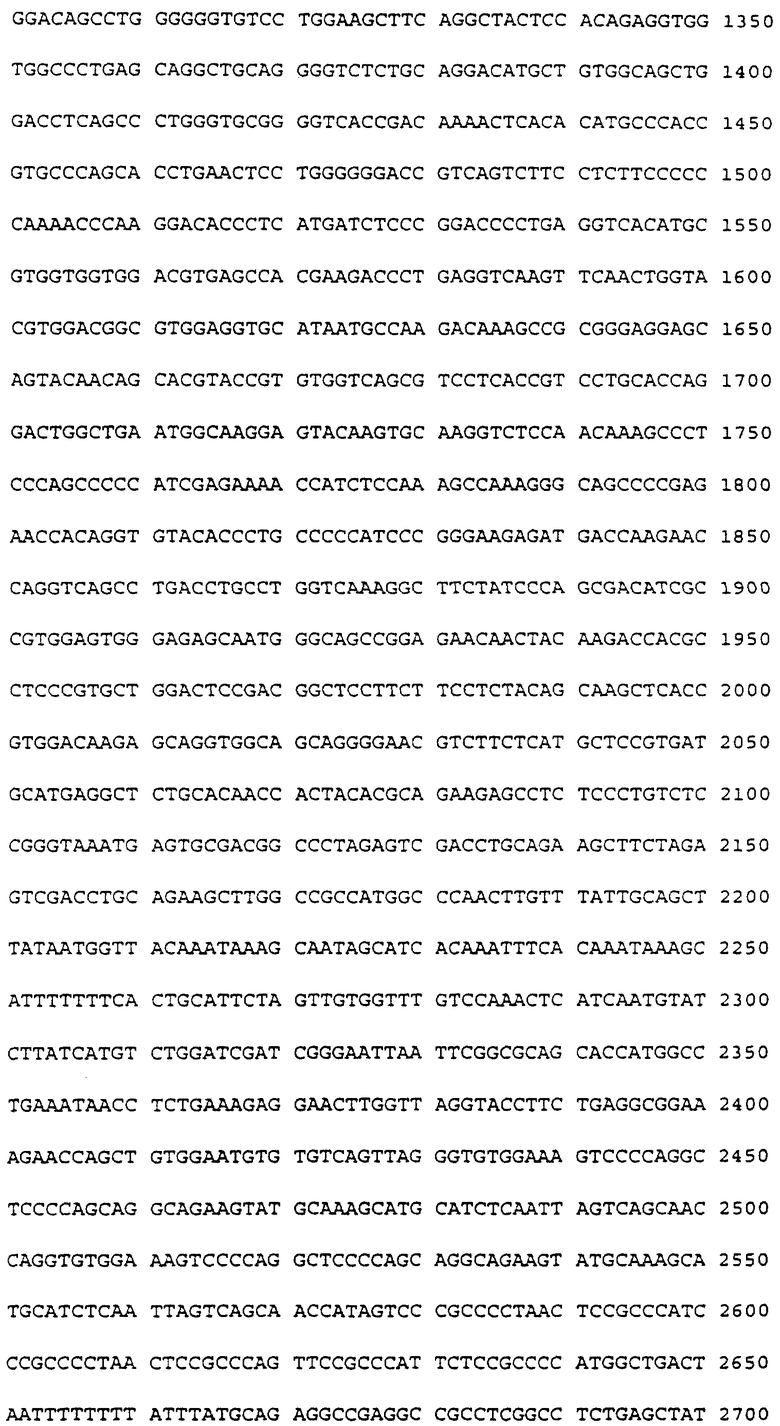





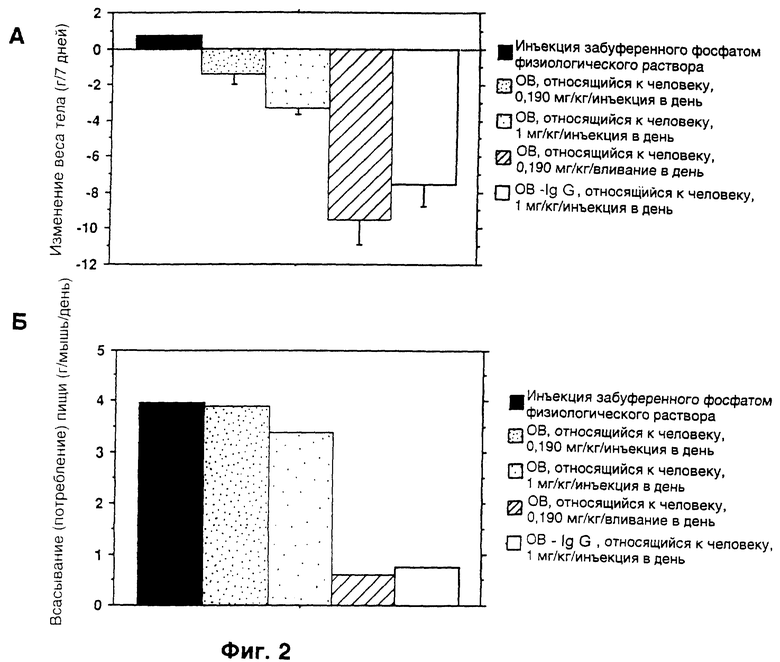
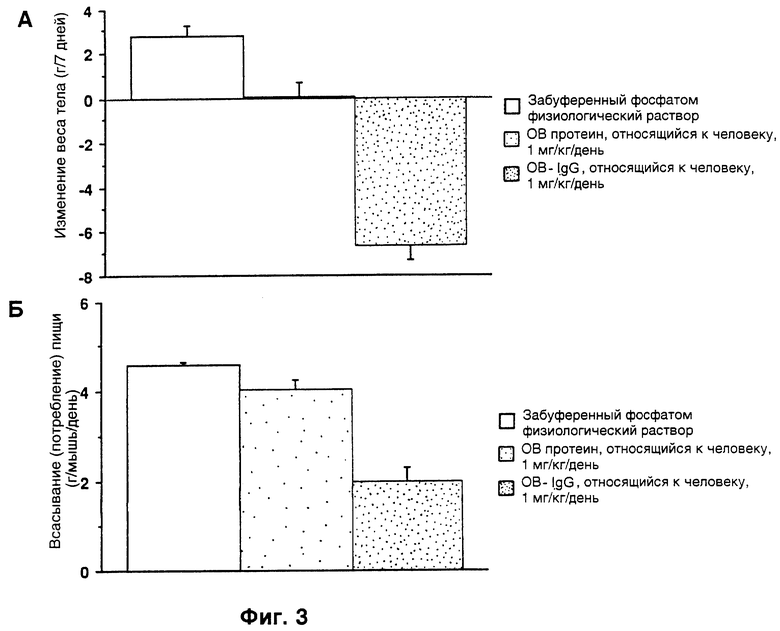
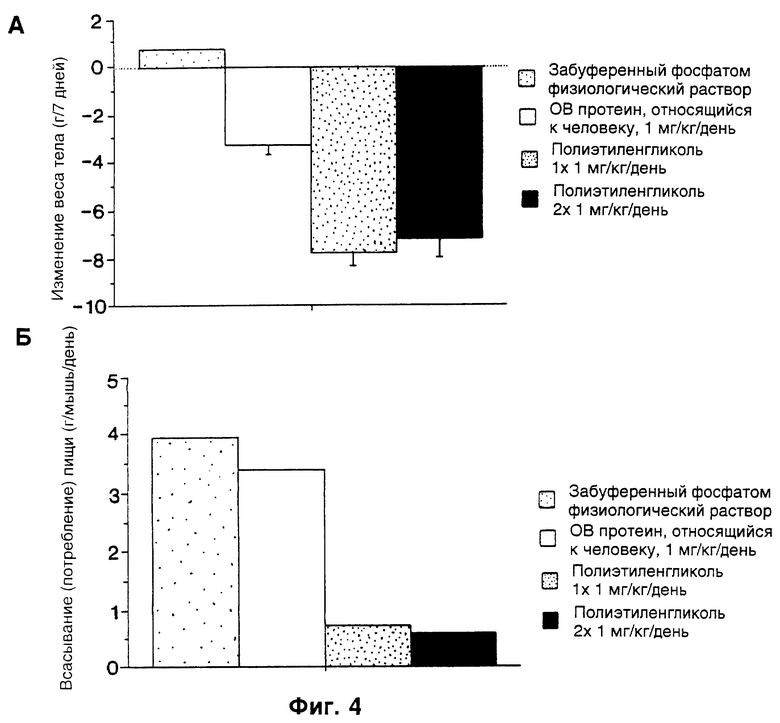
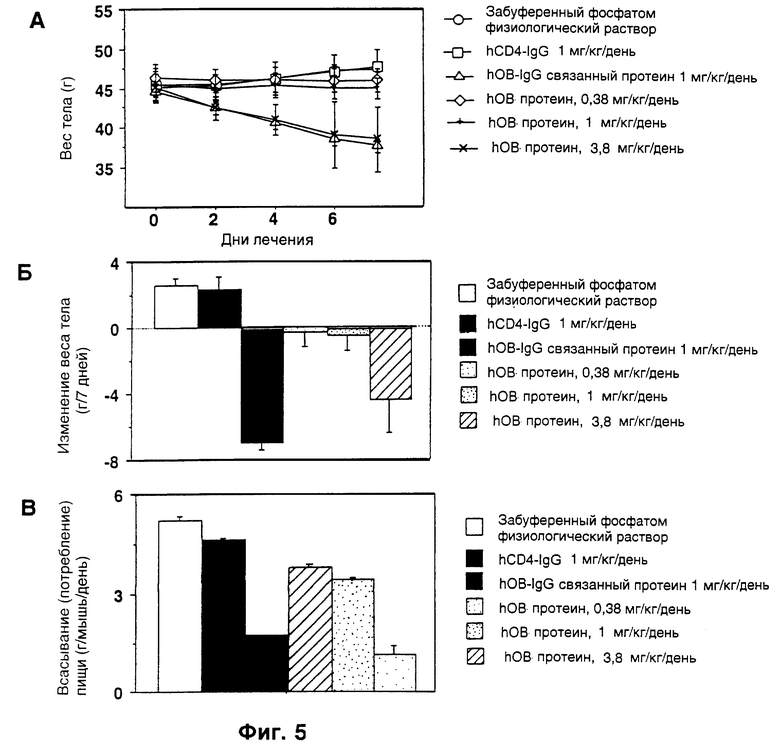










Изобретение относится к области медицины, а именно производному протеина ожирения ОВ с продолжительным временем полужизни. Изобретение, в частности, относится к ОВ-протеин-иммуноглобулиновым химерам и полиэтиленгликоль (PEG)-ОВ-производным, которые имеют продолжительное время полужизни по сравнению с соответствующими нативными ОВ-протеинами. Кроме того, изобретение относится к способам уменьшения аппетита и/или веса и лечения других физиологических состояний, используя ОВ-производные с продолжительным временем полужизни. Технический результат изобретения - расширение арсенала средств для борьбы с ожирением. 12 с. и 14 з. п. ф-лы, 33 ил.
Приоритет по пунктам:
27.12.1995 по пп. 1-8, 10,12-24 и 26;
20.06.1996 по пп. 9,11 и 25.
| Автоматический огнетушитель | 0 |
|
SU92A1 |
| Zhang V | |||
| et al | |||
| Positional Cloning of the Mouse Obese Gene and its Homan Gomologue | |||
| Электромагнитный счетчик электрических замыканий | 1921 |
|
SU372A1 |
Авторы
Даты
2002-01-20—Публикация
1996-12-19—Подача