Область техники, к которой относится изобретение
Изобретение относится к химическим препаратам, в частности к производным 7-[3-[4-(6-фторбензо[d] изоксазол-3-ил) пиперидин-1-ил]пропокси] -хромен-4-она и их солям, которые могут быть использованы в фармацевтической промышленности при изготовлении средства для лечения психоза и шизофрении.
Уровень техники
В патентных заявках Испании 9500737 и 9600323 описаны производные хромена, обладающие нейролептическим и анксиолитическим действием. Известные соединения воздействуют на D2- и 5-НТ2А-рецепторы, что характерно для психотропных средств. Однако, до настоящего времени нет публикаций об Н1-антигистаминном действии соединений, известных из предшествующих патентов.
Сущность изобретения
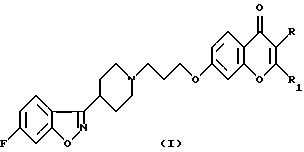
Настоящее изобретение относится к производным 7-[3-[4-(6-фторбензо[d]изоксазол-3-ил)пиперидин-1-ил]пропокси]-хромен-4-она общей формулы (I)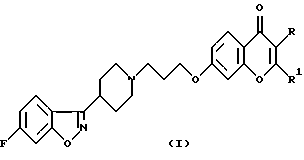
где R означает водород, СНO, CH2OR2 или СООН; R1 означает водород или СН2ОН и R2 означает алкил, содержащий от 1 до 4 атомов углерода при условии, что один из заместителей R и R1 является водородом, а также к их фармацевтически приемлемым аддитивным солям.
Соединения согласно настоящему изобретению являются новыми и их получают путем взаимодействия 2- (или 3)-замещенного 7-(3-галоидпропокси)-4Н-1-бензопиран-4-она общей формулы (II), где R и R1 определены для формулы (I), a X является галогеном, предпочтительно хлором или бромом, с 6-фтор-3-(4-пиперидинил)-бензо[d] изоксазолом (III) в соответствии со схемой 1 в присутствии основания, которое выбирают из карбонатов или бикарбонатов щелочных или щелочноземельных металлов и каталитического количества иодида калия. Реакция обычно протекает при нагревании и в неполярной среде, например, содержащей растворитель, который выбирают из N,N-диметилформамида, ацетонитрила или т. п.
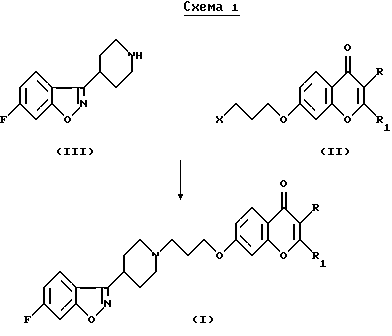
Согласно другому способу соединения (I, R=CHO, R1=H) и (I, R=CH2OR2, R1= H) можно получить, соответственно, путем окисления или алкилирования 7-[3-[4-(6-фторбензо[d] изоксазол-3-ил)пиперидин-1-ил] пропокси]-3-гидроксиметил) -хромен-4-она (см. заявку на выдачу патента Испании 9600323). Окисление обычно проводят в присутствии оксалилхлорида и диметилсульфоксида в галогенированном растворителе, предпочтительно дихлорметане. Алкилирование обычно проводят с использованием соответствующего спирта R2-OH (IV), где R2 определен ранее для формулы (I), в кислой среде при температуре кипения реакционной смеси. Из новых соединений формулы (I) можно получить их соли путем добавления соответствующих кислот с использованием известных методов органической химии.
Свойства соединений согласно настоящему изобретению отличаются от соединений, описанных в упомянутых выше патентах. Действительно, заявителями было найдено, что соединения общей формулы (I) обладают, кроме сильного действия на D2- и 5-НТ2А-рецепторы, что характерно для психотропных средств, сильным действием на Н1-рецепторы гистамина. В противоположность этому, до настоящего времени ни в одной из публикаций не описано Н1-антигистаминное действие соединений, известных из предшествующих патентов.
Сведения, подтверждающие возможность использования изобретения
Специфическое связывание с рецепторами D2, 5-НТ2А и Н1 исследовали, как описано ниже.
D2-рецепторы: мембранную фракцию, соответствующую 20 мг полосатого тела (striatum) крысы, инкубируют в 2 нМ растворе радиоактивного спиперона ([3Н] спиперона), который используют в качестве специфического лиганда, в Трис-НСl буферном растворе при 35oС и рН 7,4 в течение 20 мин. Затем определяют неспецифическое связывание путем добавления немеченного спиперона в микромолярной концентрации. Величину IС50 (концентрацию, при которой наблюдается 50% ингибирование) рассчитывают по степени ингибирования специфического связывания, определенного при добавлении 11 различных концентраций тестируемых соединений. После завершения инкубирования образец фильтруют через стекловолоконный фильтр и промывают три раза буферным раствором Трис-HCl. Связанная с рецептором радиоактивность удерживается на мембране и определяется с помощью жидкостного сцинтилляционного счетчика.
5-НТ2А-рецепторы: мембранную фракцию, соответствующую 1 мг коры головного мозга крысы, инкубируют в 0,5 нМ растворе радиоактивного кетансерина ([3Н] кетансерин), который используют в качестве специфического лиганда, в Трис-НСl буферном растворе при 35oС и рН 7,4 в течение 30 мин. Затем определяют неспецифическое связывание путем добавления немеченного миансерина при концентрации 5 мкМ. Величину IС50 (концентрацию, при которой наблюдается 50% ингибирование) рассчитывают по степени ингибирования специфического связывания, определенного при добавлении 11 различных концентраций тестируемых соединений. После завершения инкубирования образец фильтруют через стекловолоконный фильтр и промывают три раза буферным раствором Трис-HCl. Связанная с рецептором радиоактивность удерживается на мембране и определяется с помощью жидкостного сцинтилляционного счетчика.
Н1-рецепторы: определение активности проводят путем инкубирования мембран мозжечка морской спинки в присутствии или отсутствии тестируемых соединений в 1 нМ растворе [3Н]-пириламина, используемого в качестве специфического маркера, при 25oС в течение 60 мин. Связанную радиоактивность отделяют фильтрованием (Whatman GF/B) на коллекторе клеток Brandel Harvester. Количество связанной с рецептором радиоактивности, удержанной на фильтре, определяют с использованием счетчика Packard 1800TR. Специфическое связывание оценивают с использованием трипролидина в концентрации 1 мкМ.
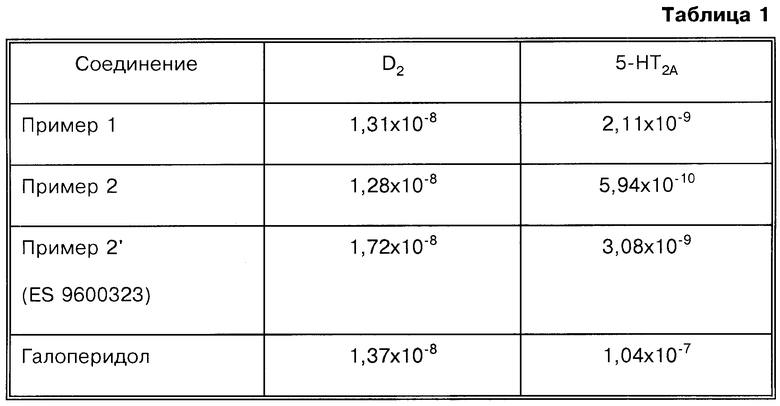
Результаты биохимического исследования, представленные в виде величины IC50 (молярная концентрация) для D2- и 5-НТ2А-рецепторов по сравнению с соединением согласно примеру 2', описанным в испанской заявке 9600323, и со стандартным галоперидолoм сведены в таблицу 1, а результаты для Н1-рецептора по сравнению с соединением согласно примеру 2', описанным в патенте Испании 9600323, и со стандартным прометазином сведены в таблицу 2.
На основании данных таблицы 1 можно заключить, что соединения согласно настоящему изобретению, полученные, как указано в примерах 1 и 2, проявляют в качестве лигандов D2- и 5-НТ2A-рецепторов более сильное действие, чем соединение согласно примеру 2' испанской заявки 9600323. Соотношение D2/5-HT2A свидетельствует о том, что все соединения по активности превосходят стандартный галоперидол, что в результате свидетельствует о снижении риска экстрапирамидальных эффектов.
Аналогичным образом, на основании данных таблицы 2 можно заключить, что соединения согласно настоящему изобретению, полученные, как указано в примерах 3 и 6, проявляют в качестве лигандов Н1-рецептора более сильное действие, чем соединение согласно примеру 2' испанской заявки 9600323, и активность, равную действию прометазина. Кроме того, активность соединения согласно примеру 3 выше, чем активность стандартного прометазина.
Соединения согласно настоящему изобретению сравнивали с соединением согласно примеру 2' испанской заявки 9600323 посредством испытания, используемого в области фармакологии животных, а именно, по ингибирующему действию на инициированное апоморфином поведение "подъем на сетку" (P. Protais et al: "Psychopharmacology", 50, 1-6, 1976). Для выполнения этого эксперимента были использованы самцы швейцарских мышей весом 22-24 г. За одну неделю до эксперимента животных выдерживают в помещении при 20-22oС, цикличности темнота-свет 12/12 ч и со свободным доступом к пище и воде. За 2 ч до эксперимента животных помещают в индивидуальные клетки без доступа к пище. Затем в момент времени эксперимента 0 животным вводят тестируемое лекарство или 0,25% агар. Через 60 мин животным вводят подкожно апоморфин в дозе 1 мг/кг и еще через 70 мин оценивают поведение животных. Две дополнительные оценки проводят с интервалом 10 мин.
С целью оценки поведения каждое животное помещают на дно небольшой прямоугольной коробки (11•7,5•4,5 см). Стенки коробки изготовлены из полупрозрачного метакрилата кроме одной боковой поверхности (шириной 7,5 см), которая представляет собой 3 мм проволочную сетку. Позицию животного в течение 2 мин оценивают следующими баллами: 0 = четыре лапы на полу, 1 = три лапы на полу, 2 = две лапы на полу, 4 = четыре лапы на сетке. Если животное принимает несколько позиций в течение 2 мин наблюдения, записывают время нахождения животного в каждой позиции в секундах. Наконец, рассчитывают среднюю величину. Одновременно оценивают каталептическую активность соединений, введенных крысам оральным путем, и выражают ее в виде эффективной дозы 50% (ED50).
Полученные результаты, представленные в виде ингибирующей дозы 50% (ID50, мг/кг) по тесту "подъем на сетку" и в виде ED50 (мг/кг) по каталептическому тесту, сведены в таблицу 3. В этой таблице приведен также терапевтический индекс (TI), который является мерой безопасности использования исследованных соединений.
На основании данных таблицы 3 можно заключить, что соединения согласно настоящему изобретению, полученные, как указано в примерах 3 и 6, обладают более высоким терапевтическим индексом, чем соединение согласно примеру 2' испанской заявки 9600323 и чем стандартный галоперидол, что подтверждает преимущество по снижению риска экстрапирамидальных эффектов при терапевтических дозах.
Соединения согласно настоящему изобретению могут быть использованы в качестве психотропных средств для лечения психоза и шизофрении путем орального введения, инъекции или введения ректальным путем, причем дневная доза составляет от 1 до 500 мг, предпочтительно от 2 до 50 мг включительно. Обычными формами для орального введения соединений в качестве психотропных средств являются растворы, таблетки, таблетки в оболочке, капсулы, гранулы, сиропы и т. п. Соединения согласно настоящего изобретения можно также использовать в качестве антигистаминных средств для лечения аллергии путем орального введения, инъекции или введения ректальным путем, причем дневная доза составляет от 1 до 500 мг, предпочтительно от 2 до 150 мг включительно. Обычными формами для орального введения этих соединений для лечения аллергии являются растворы, таблетки, таблетки в оболочке, капсулы, гранулы, сиропы и т.п. Соединения, используемые в качестве антиаллергенных агентов, можно также вводить в форме композиции для наружного применения, таких как мазь, лосьон, порошок и т.п. при концентрациях от 0,5 до 5%, предпочтительно от 1 до 2% включительно.
Изобретение иллюстрируется ниже следующими примерами.
Пример 1: 7-[3-[4-(6-фторбензо[d]изоксазол-3-ил)пиперидин-1-ил]пропокси] -3-формилхромен-4-он
Раствор 3 мл (42 ммоль) диметилсульфоксида в 10 мл дихлорметана по каплям добавляют к раствору 2 мл (23 ммоль) оксалилхлорида в 35 мл сухого дихлорметана, охлажденного до -70oС, и смесь перемешивают в течение 5 мин. Затем несколькими порциями в течение 15 мин добавляют 5 г (11 ммоль) 7-[3-[4-(6-фторбензо[d]изоксазол-3-ил)пиперидин-1-ил]пропокси]-3-(гидроксиметил)хромен-4-она (испанская заявка на патент ES 9600323) и перемешивают в течение еще 30 мин при -70oС. Затем по каплям добавляют 15 мл (107 моль) триэтиламина, перемешивают в течение ночи, оставляя реакционную смесь постепенно нагреваться до комнатной температуры. При охлаждении до -20oС к реакционной смеси добавляют 50 мл воды, смеси дают нагреться до комнатной температуры, органическую фазу декантируют, сушат над сульфатом натрия и упаривают. Полученный остаток очищают хроматографией на колонке с силикагелем. При элюции колонки смесью СНСl3:СН3ОН (98:2, об.:об.) получают 2,12 г 7-[3-[4-(6-фторбензо[d] изоксазол-3-ил)пиперидин-1-ил] пропокси] -3-формилхромен-4-он с выходом 43%, т. пл. 163-165oС.
ИК-спектр (KBr): 1691, 1652, 1619, 1441 см-1.
ЯМР-спектр (CDCl3): 2,10 (m, 6 Н), 2,20 (m, 2 H), 2,60 (t, 2 H), 3,10 (m, 3 H), 4,19 (t, 2 H), 6,96 (d, 1 Н), 7,05 (m, 2 H), 7,24 (dd, 1 H), 7,69 (dd, 1 H), 8,19 (d, 1 H), 8,47 (s, 1 H), 10,37 (s, 1 H).
Пример 2: гидрохлорид 7-[3-[4-(6-фторбензол[d] изоксазол-3-ил) пиперидин-1-ил] пропокси] -4-оксохромен-3-карбоновой кислоты.
Смесь 0,87 г (3 ммоль) 7 (3-хлорпропокси)-4-оксохромен-3-карбоновой кислоты, 0,7 г (3 ммоль) гидрохлорида 6-фтор-3-(4-пиперидинил)бензо[d]изоксазола, 0,85 г (6 ммоль) безводного карбоната калия и каталитического количества иодида калия в 25 мл N,N-диметилформамида нагревают при 89-90oС в течение 24 ч. После охлаждения раствор выливают в 125 мг воды и затем нейтрализуют HCl до рН 7. Полученный осадок отфильтровывают, промывают водой и сушат в вакууме. Остаток растворяют в 60 мл 0,1 М NaOH, разбавляют водой до 300 мл и раствор промывают этилацетатом. Водный раствор подкисляют HCl до рН 1-2, полученный осадок отфильтровывают и сушат в вакууме, при этом получают 0,62 г гидрохлорида 7-[3-[4-(6-фторбензо[d] изоксазол-3-ил) пиперидин-1-ил] пропокси]-оксохромен-3-карбоновой кислоты с выходом 40%.
ИК-спектр: 3100-3700, 1698, 1616, 1447, 1384, 1165, 1121 см-1.
ЯМР-спектр (ДМСО): 2,13 (m 6Н), 2,30 (m, 2H), пиперидин-2Нa и -6Ha, 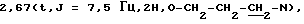 3,16 (d+m, 3H, пиперидин-2Нe, -4Н, -6Нe), 4,10 (t, J=6 Гц, 2H, О-СН2), 6,67 (s, 1H, 8-Н), 6,79 (d, J=8,7 Гц, 1 H, 6-Н), 7,10 (td, J=8,4 и 2,1 Гц, 1 Н, бензизоксазол-5Н), 7,27 (dd, J=8,4 и 2,1 Гц, 1Н, бензизоксазол-7Н), 7,79 (dd, J=8,4 и 5,4 Гц, 1Н, бензизоксазол-4Н), 7,97 (d, J=8,7 Гц, 1Н, -5Н), 9,86 (s, 1H, 2-H).
3,16 (d+m, 3H, пиперидин-2Нe, -4Н, -6Нe), 4,10 (t, J=6 Гц, 2H, О-СН2), 6,67 (s, 1H, 8-Н), 6,79 (d, J=8,7 Гц, 1 H, 6-Н), 7,10 (td, J=8,4 и 2,1 Гц, 1 Н, бензизоксазол-5Н), 7,27 (dd, J=8,4 и 2,1 Гц, 1Н, бензизоксазол-7Н), 7,79 (dd, J=8,4 и 5,4 Гц, 1Н, бензизоксазол-4Н), 7,97 (d, J=8,7 Гц, 1Н, -5Н), 9,86 (s, 1H, 2-H).
Пpимeр 3: гидpoxлopид 7-[3-[4-(6-фтopбoнзo[d] изокcaзoл-3-ил) пипepидин-1-ил] пропокси]-3-метоксиметил -хромен-4-она.
Раствор 2 г (4,4 ммоль) 7-[3-[4-(6-фторобензо[d]изоксазол-3-ил)пиперидин-1-ил]пропокси]-3-(гидроксиметил)-хромен-4-она в 20 мл 2 М HCl в метаноле нагревают с обратным холодильником в течение 2 ч. Растворитель упаривают, остаток растворяют в дихлорметане и промывают насыщенным раствором CO3HNa. Органическую фазу упаривают, остаток растворяют в ацетонитриле и осаждают с помощью добавления раствора HCl в эфире. Полученный осадок перекристаллизовывают из метанола, при этом получают 0,75 г гидрохлорида 7-[3-[4-(6-фторбензо[d] изоксазол-3-ил)пиперидин-1-ил] пропокси]-3-метоксиметил-хромен-4-она, выход 34%, т. пл. 219-221oС.
ИК-спектр (KBr): 1659, 1615, 1443, 1273, 1244 см-1.
ЯМР-спектр (СDСl3-СD3ОD): 2,25 (m, 2H), 2,50 (m, 2H), 2,90 (m, 2H), 3,05 (m, 2H), 3,35 (m, 2H), 3,48 (s, 3H) 3,60 (m, 1H), 3,80 (d, 2H), 4,20 (m, 2H), 4,39 (s, 2Н), 6,90 (d, 1H), 6,97 (d, 1H), 7,16 (td, 1H), 7,66 (dd, 1H), 7,95 (s, 1H), 8,10 (d, 1H), 8,20 (dd, 1H).
Пример 4: 7-гидрокси-2-(гидроксиметил)-хромен-4-он
3 г боргидрида натрия добавляют несколькими порциями к суспензии 5 г (21 ммоль) этил 7-гидрокси-4-оксо-хромен-2-карбоксилата и 5 г (45 ммоль) безводного хлорида кальция в 100 мл абсолютного этанола, охлажденного до 0oС, и смесь перемешивают при комнатной температуре в течение 16 ч. Затем добавляют еще 1 г боргидрида натрия и перемешивают еще 2 ч. Реакционную смесь суспендируют в 200 мл воды и медленно подкисляют HCl. Осадок отфильтровывают, промывают водой и сушат в вакууме, при этом получают 2,7 г 7-гидрокси-2-(гидроксиметил)-хромен-4-она в виде твердого вещества, выход 66%, т. пл. 250-252oС.
ИК-спектр (KBr): 2700-3500, 1650, 1634, 1570, 1458, 1326, 1250, 1101 см-1.
ЯМР-спектр (d6-ДМСО): 3,50 (s, ушир., 2Н, ОН) 4,40 (s, 2Н, СН2ОН), 6,20 (s, 1H, 3-Н), 6,82 (d, J=2,4 Гц, 1H, 8-Н), 6,92 (dd, J=8,7 и 2,4 Гц, 1H, 6-Н), 7,86 (d J=8,7, 1H, 5-H).
Пример 5: 7-(3-хлорпропокси)-2-(гидроксиметил)-хромен-4-он
Смесь 6 г (31 ммоль) соединения, полученного согласно примеру 4, 6 мл (61 ммоль) 1-бром-3-хлорпропана, 4,3 г (31 ммоль) безводного карбоната калия в 100 мл ацетона и 25 мл N,N-диметилформамида нагревают с обратным холодильником в течение 16 ч. Реакционную смесь выливают в 100 мл воды и экстрагируют 100 мл этилацетата. Органические экстракты промывают двумя порциями по 100 мл воды, сушат над сульфатом натрия и упаривают в вакууме. Полученный остаток суспендируют в 25 мл этилового эфира, фильтруют и сушат в вакууме, при этом получают 4,2 г 7-(3-хлорпропокси) -2- (гидроксиметил) -хромен-4-она, выход 50%, т. пл. 110-112oС.
ИК-спектр (KBr): 2600-3500, 1651, 1628, 1592, 1448, 1246, 1099 см-1.
ЯМР-спектр (CDCl3): 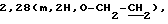 3,76 (t, J=6 Гц, 2Н, CH2C1), 4,16 (t, J=6 Гц, 2 H, O-СН2),
3,76 (t, J=6 Гц, 2Н, CH2C1), 4,16 (t, J=6 Гц, 2 H, O-СН2), 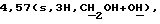 6,44 (s, 1Н, 3-Н), 6,78 (d J= 2,1 Гц, 1Н, 8-Н), 6,90 (dd, J=8,7 и 2,1 Гц, 1Н, 6-Н), 7,99 (d, J=8,7 Гц, 1Н, 5-Н).
6,44 (s, 1Н, 3-Н), 6,78 (d J= 2,1 Гц, 1Н, 8-Н), 6,90 (dd, J=8,7 и 2,1 Гц, 1Н, 6-Н), 7,99 (d, J=8,7 Гц, 1Н, 5-Н).
Пример 6: гидрохлорид 7-[3-[4-(6-фторбензо[d] изоксазол-3-ил) пиперидин-1-ил] пропокси]-2-(гидроксиметил) хромен-4-она.
Смесь 3 г (11 ммоль) соединения, полученного согласно примеру 5, 2,88 г (11 ммоль) гидрохлорида 6-фтор-3-(4-пиперидинил)-бензо[d]изоксазола, 2,16 г (26 ммоль) бикарбоната натрия и каталитического количества иодида калия в 80 мл ацетонитрила нагревают с обратным холодильником в течение 48 ч. Смесь охлаждают, выливают в 100 мл воды и экстрагируют 100 мл хлороформа. Слой хлороформа промывают водой, сушат над сульфатом натрия и упаривают. Остаток суспендируют в этиловом эфире, фильтруют и сушат в вакууме, при этом получают 2 г 7-[3-[4-(6-фторбензо[d] изоксазол-3-ил) пиперидин-1-ил] пропокси]-2-(гидроксиметил) -хромен-4-она, выход 40%.
ЯМР-спектр (СDСl3): 2,0-2,2 (m, 8H), 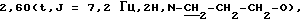 3,10 (d+m, 3Н, пиперидин-2Нe, -4Н и -6He), 4,13 (t,J = 6,6 Гц,2H,O-CH2-CH2-CH2),
3,10 (d+m, 3Н, пиперидин-2Нe, -4Н и -6He), 4,13 (t,J = 6,6 Гц,2H,O-CH2-CH2-CH2), 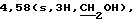 6,41 (s, 1Н, 3-Н), 6,89 (d, J=2,1 Гц, 1Н, 8-Н), 6,94 (dd, J=8,7 и 2,1 Гц, 1Н, 6-Н), 7,07 (td, J= 8,7 и 2,4 Гц, 1Н, бензизоксазол-5Н), 7,25 (dd, J=8,7 и 2,4 Гц, 1 Н, бензизоксазол-7Н), 7,71 (dd, J=8,7 и 5,1 Гц, 1Н, бeнзизоксазол-4Н), 8,04 (d, J=8,7 Гц, 1Н, 5-Н).
6,41 (s, 1Н, 3-Н), 6,89 (d, J=2,1 Гц, 1Н, 8-Н), 6,94 (dd, J=8,7 и 2,1 Гц, 1Н, 6-Н), 7,07 (td, J= 8,7 и 2,4 Гц, 1Н, бензизоксазол-5Н), 7,25 (dd, J=8,7 и 2,4 Гц, 1 Н, бензизоксазол-7Н), 7,71 (dd, J=8,7 и 5,1 Гц, 1Н, бeнзизоксазол-4Н), 8,04 (d, J=8,7 Гц, 1Н, 5-Н).
Гидрохлорид: Полученный продукт растворяют в смеси хлороформ:метанол (3: 1) и осаждают при добавлении раствора НC1 в метаноле, при этом получают 1,4 г гидрохлорида 7-[3-[4-(6-фтopбeнзo [d]изoкcaзoл-3-ил) пиперидин-1-ил] пропокси] -2-(гидроксиметил) -хромен-4-она в виде твердого вещества, т. пл. 248-251oC.
ИК-спектр (KBr): 3300, 2500, 1648, 1603, 1439, 1329, 1122, 1094 см-1.
Пример 7: 0,025% состав для инъекций
Состав композиции на 1 ампулу
Соединение согласно примеру 3 - 0,5 мг
Метил п-гидроксибензоат - 1,0 мг
Пропил п-гидроксибензоат - 0,1 мг
Бидистиллированная вода - Довести до 2,0 мл
Пример 8: состав 0,1% раствора для орального введения
Состав композиции на 100 мл
Соединение согласно примеру 3 - 100 мг
Метил п-гидроксибензоат - 135 мг
Пропил п-гидроксибензоат - 15 мг
Сорбитол 70% - 20 мг
Сахарин натрия - 50 мг
Апельсиновая эссенция - 0,25 мл
Дистиллированная вода - Довести до 100 мл
Пример 9: состав таблетки, содержащей 1 мг активного соединения
Состав композиции на 1 таблетку
Соединение согласно примеру 3 - 1,0 мг
Кукурузный крахмал - 32,4 мг
Тальк - 4,5 мг
Гидрогенизированное касторовое масло - 1,5 мг
Лактоза - До 150,0 мг
Пример 10: состав таблетки, содержащей 5 мг активного соединения
Состав композиции на 1 таблетку
Соединение согласно примеру 3 - 5,0 мг
Кукурузный крахмал - 43,2 мг
Тальк - 6,0 мг
Гидрогенизированное касторовое масло - 2,0 мг
Лактоза - До 200,0 мг
Пример 11: состав таблетки, содержащей 10 мг активного соединения
Состав композици на 1 таблетку
Соединение согласно примеру 3 - 10,0 мг
Кукурузный крахмал - 40,0 мг
Лаурилсульфат натрия - 0,50 мг
Кукурузный крахмал (предварительно желатинизированный) - 8,00 мг
Стеарат магния - 1,20 мг
Лактоза - До 240,00 мг
Пример 12: состав 1% крема для наружного применения
Состав композиции весом 100 г
Соединение согласно примеру 3 - 1,0 г
Изопропил миристат - 9,00 г
Цетостеариловый спирт - 6,00 г
Пропиленгликоль - 3,00 г
Полигликолевый эфир жирных кислот - 5,00 г
Дециловый эфир олеиновой кислоты - 6,00 г
Ароматизатор - 0,30 г
Метил п-гидроксибензоат - 0,15 г
Пропил п-гидроксибензоат - 0,02 г
Этил п-гидроксибензоат - 0,03 г
Деминерализованная вода - Довести до 100,00 г
Специалисту должно быть понятно, что приведенные примеры использованы в качестве иллюстрации и не должны ограничивать объем изобретения, предполагающий различные варианты и модификации и представленный в нижеследующей формуле изобретения.

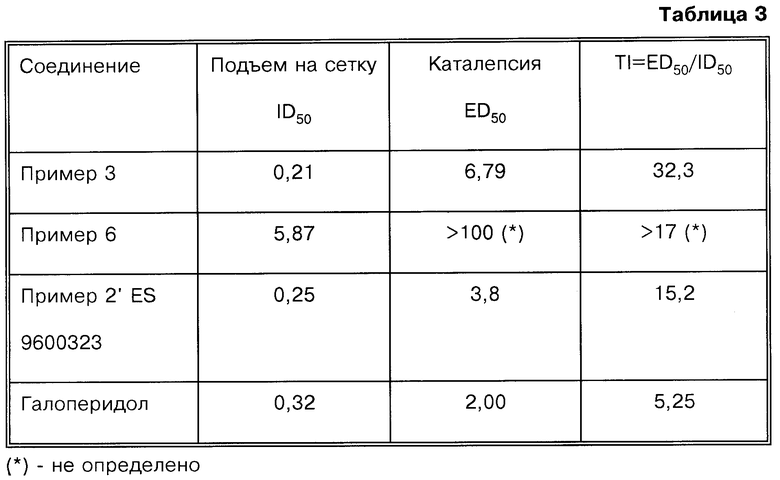
Изобретение относится к новым производным 7-[3-[4-(6-фторбензо[d] изоксазол-3-ил)пиперидин-1-ил] пропокси] -хромен-4-она формулы I, где R означает водород, СНО, CH2OR2 или СООН; R1 означает алкил, содержащий от 1 до 4 атомов углерода, при условии, что один из заместителей R и R1 является водородом, и их фармацевтически приемлемым солям, предназначенным для использования при лечении психоза и шизофрении, а также к способу получения этих соединений, фармацевтической композиции на их основе и способу ингибирования D2-, 5-HT2a- и Н1-рецепторов при лечении психоза и шизофрении. Технический результат - получение новых соединений, используемых в медицине в качестве лекарственных средств. 4 с. и 3 з.п. ф-лы, 3 табл.
где R означает водород, СНO, CH2OR2 или СОOН;
R1 означает водород или СН2ОН;
R2 означает алкил, содержащий от 1 до 4 атомов углерода при условии, что один из заместителей R и R1 является водородом,
а также их фармацевтически приемлемые соли.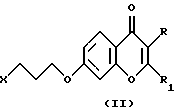
где R и R1 определены для формулы I;
Х является галогеном, предпочтительно хлором или бромом,
с промежуточными соединениями формулы III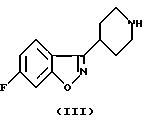
для получения соединений формулы I с последующей необязательной обработкой соответствующей кислотой для получения их фармацевтически приемлемых солей.
| WO 9632389 A, 17.10.1996 | |||
| ТЕПЛОЗВУКОИЗОЛЯЦИОННЫЙ МАТЕРИАЛI? | 0 |
|
SU190015A1 |
| КОМПЛЕКСНОЕ ТЕЛЕМЕХАНИЧЕСКОЕ УСТРОЙСТВО ДЛЯ РАССРЕДОТОЧЕННЫХ ОБЪЕКТОВ | 1972 |
|
SU428437A1 |
| RU 94039284 A1, 10.08.1996 | |||
| Каплан Г.И | |||
| и др | |||
| Клиническая психиатрия | |||
| - М.: Медицина, 1994, с | |||
| Железнодорожный снегоочиститель | 1920 |
|
SU264A1 |
Авторы
Даты
2002-02-20—Публикация
1998-12-29—Подача