Данное изобретение относится к морфогенетическим материалам для восстановления хряща и кости для лечения костных переломов и костных дефектов. Более конкретно, данное изобретение касается морфогенетических материалов для восстановления хряща и кости, которые содержат полиоксиэтилен-полиоксипропиленгликоль и костный морфогенетический протеин.
Уровень техники
Для восстановления хрящей и костей в дополнение к аутопластике используется методика, в которой протезные материалы для поврежденных участков хряща и кости, состоящие из комбинации костного морфогенетического протеина и подходящего носителя, укрепляют в поврежденном участке. В данной методике дефектное место может быть подвергнуто хирургическому вмешательству для введения хрящевого и костного восстанавливающего материала, содержащего костный морфогенетический протеин непосредственно в поврежденный участок, и поэтому находят широкое применение материалы в твердой форме, такие как блоки, тампоны, пластины и подобные, которые просты в применении. Также используют такие полутвердые формы, как гели или пасты. В качестве носителей, которые делают такие твердые или полутвердые формы применимыми, используют, например, металлы, такие как нержавеющие или титановые сплавы или коллаген и гидроксиапатит (ГАП) или их смеси.
С другой стороны, предпринимались попытки вводить костный морфогенетический протеин для лечения костных переломов или остеоартритов, не прибегая к каким-либо хирургическим операциям. Такой способ введения крайне желателен с той точки зрения, что бескровное введение, а именно инъекции, сможет облегчить боли пациентов. Тем не менее инъекции простых водных жидких препаратов костного морфогенетического протеина приводят к диффузии и исчезновению препарата после введения, и, таким образом, для того чтобы достигнуть эффективного введения, костный морфогенетический протеин должен удерживаться в месте инъекции некоторый период времени. Ввиду вышесказанного необходим носитель, который обладает способностью в жидком состоянии проходить через иглу при введении, а затем трансформироваться в гелеобразное состояние после введения для удерживания костного морфогенетического протеина в месте инъекции. Предпочтительно носитель должен быть нетоксичным, иметь хорошие биосовместимость и высокую биоабсорбцию в живом организме.
Коллаген является известным носителем для костного морфогенетического протеина и обладает желаемой биосовместимостью и биоабсорбцией (Japanese Patent Publication 75425/1993). Также сообщалось о коллагене с характеристиками для инъекций, который может обеспечить инъецируемый морфогенетический материал для восстановления хряща и кости (Japanese Patent Publication 23322/1995 и 53140/1993). Однако доступный в настоящее время коллаген для использования в медицине получают из натуральных источников, таких как рогатый скот или свиньи, таким образом, его свойства, такие как молекулярный вес, состав аминокислот и свойство сохранять влагу, не всегда постоянны. Кроме того, существуют некоторые побочные эффекты, такие как антигенность, т.к. для человека он является ксеногенным протеином. В частности антигенность не может быть полностью ликвидирована даже у ателоколлагена, т.е. коллагена, из которого удалены теропептидные участки, как отмечено у (J. American Academy of Dermatology 10, 638-646 и 647-651, 1984 и ibid. 21, 1203-1208, 1989).
С другой стороны, указывалось, что биологически разлагаемые полимеры, такие как полимолочная кислота или сополимеры полимолочной кислоты-гликолевой кислоты, могут быть использованы в качестве фармацевтических носителей (US, Patent 5385887 и Japanese Patent Publication 22570/1994). Однако биологически разлагаемые полимеры существуют в твердом или полутвердом состоянии, которые могут сохранять данную форму, и с этой точки зрения они классифицируются как группы материалов, применимых для хирургических операций. Даже если инъецируемый комплекс может быть приготовлен с использованием таких биологически разлагаемых полимеров, в процессе приготовления должен применяться органический растворитель, с которым можно легко предвидеть возникновение проблемы инактивации активного ингредиента, костного морфогенетического протеина.
Подробное описание изобретения
Объектом данного изобретения является получение такого морфогенетического материала для восстановления хряща и кости, который позволит избежать неблагоприятных показателей и недостатков известных средств, которые обсуждались выше, который имеет высокую биоабсорбцию и хорошее сродство с активным ингредиентом или костным морфогенетическим протеином, которое демонстрирует постоянное расположение костного морфогенетического протеина, вызываемое зависимым от температуры обратимым превращением золь-гель, при отсутствии побочных эффектов, таких как антигенность и подобные.
Были проведены ранние исследования соотношения между активным ингредиентом, костным морфогенетическим протеином, и носителем в случае методики восстановления кости без хирургического вмешательства и обнаружено, что некоторые классы полиоксиэтилен-полиоксипропиленгликолей могут демонстрировать высокую биоабсорбцию, хорошее сродство с костным морфогенетическим протеином и зависимое от температуры обратимое превращение золь-гель.
Получен костный морфогенетический материал смешиванием водного раствора полиоксиэтилен-полиоксипропиленгликоля и костного морфогенетического протеина, который представлял собой инъекционную жидкость при температуре от 1 до 30oС на момент введения и мог желатинизироваться при температуре около 37oС в течение 3 минут после введения. Обнаружено, что эктопический хрящевой и костный морфогенез имел место при введении указанного материала мыши внутримышечно в бедренную мышцу и последующем удерживании костного морфогенетического протеина при введении in vivo, на основе чего данное исследование было завершено.
Данное изобретение относится к морфогенетическому материалу для хрящевого и костного восстановления, который содержит полиоксиэтилен-полиоксипропиленгликоль и костный морфогенетический протеин.
Используемый здесь термин "полиоксиэтилен-полиоксипропиленгликоль(и)" является общим названием неионных поверхностно-активных агентов полимерного типа, имеющих меньше гидрофильных полипропиленгликолей в качестве гидрофобной группы и этиленоксид в качестве гидрофильной группы. Легко получить поверхностно-активные агенты, имеющие различные свойства, изменяя молекулярный вес полипропиленгликоля и его соотношение с этиленоксидом. Синтезируемые полиоксиэтилен-полиоксипропиленгликоли имеют молекулярный вес полипропиленгликоля в пределах от 900 до 4000 и массовый процент этиленоксида в целой молекуле 5-90%. Например, блок-полимеры полиоксиэтилен-полиоксипропиленгликоля (ADEKA®), производимые Asahi Denka Kogyo К.К, имеют систематическое название согласно молекулярному весу полипропиленгликоля и массовому проценту этиленоксида, классификационный перечень которых представлен на фиг.1.
Промышленное применение полиоксиэтилен-полиоксипропиленгликолей включает легкие слабительные средства, основы для мазей, искусственную кровь, оболочки для таблеток, наполнители, солюбилизаторы или агенты, увеличивающие растворимость вещества для инъекций, и другие области фармации, кроме того, они используются в качестве основных очищающих агентов или пенопонижающих агентов. В частности, Pluronic F-68 (молекулярный вес полипропиленгликоля 1,750 и содержание этиленоксида 80%) имеет замечательное антигемолитическое действие и продается под названием EXOCOPOL® от Green Cross Corporation в качестве добавки для экстракорпорального кровообращения. Из результатов тестов на токсичность с использованием различных животных очевидно, что полиоксиэтилен-полиоксипропиленгликоли имеют крайне низкую токсичность и раздражающее действие при отсутствии данных о возможных побочных эффектах, таких как антигенность и подобные (Fragrance Journal, 7, 82-87, 1974). Результаты тестов на токсичность показаны в таблице 1.
Полиоксиэтилен-полиоксипропиленгликоли являются лучшими в отношении легкости их использования по сравнению с коллагеном, демонстрирующим необратимое переходное фазовое превращение при изменении температуры с той точки зрения, что они демонстрируют обратимое фазовое превращение золь-гель. Это свойство может контролироваться выбором оптимальной температуры для достижения фазового превращения полиоксиэтилен-полиоксипропиленгликоля и изменением концентрации водного раствора указанного полиоксиэтилен-полиоксипропиленгликоля (Int. J. Pharm. 22, 207-218, 1984 и ЕР 0551626 А1).
Исходя из вышеизложенного очевидно, что полиоксиэтилен-полиоксипропиленгликоли имеют превосходные характеристики в качестве носителей для лекарств. Уже предпринимались попытки объединять их с препаратами, имеющими низкий молекулярный вес, такими как местные анестезирующие средства, противоопухолевые агенты и так далее (Int. J. Pharm. 8, 89-99, 1981 и Chem. Pharm. Bull. 32, 4205-4208, 1984) и смешивать их с физиологически активным протеином с высоким молекулярным весом, таким как интерлейкины и подобные (Pharm. Res. 9, 425-434, 1992).
Данное изобретение относится к морфогенетическому материалу для восстановления хряща и кости, который содержит полиоксиэтилен-полиоксипропиленгликоль и костный морфологический протеин, где полипропиленгликоль в качестве составляющего указанного полиоксиэтилен-полиоксипропиленгликоля имеет молекулярный вес около 1500-4000 и содержание этиленоксида составляет около 40-80% на молекулу. В указанных пределах обеспечивается способность Pluronics совершать зависимое от температуры обратимое превращение золь-гель, которое характеризует данный Pluronics.
Далее, данное изобретение относится к морфогенетическому материалу для восстановления хряща и кости, в котором концентрация полиоксиэтилен-полиоксипропиленгликолей, как описано выше, в водном растворе составляет 10-50%. Известно, что температура обратимого фазового превращения полиоксиэтилен-полиоксипропиленгликолей обычно варьируется в зависимости от концентрации их приготовленных водных растворов, и полиоксиэтилен-полиоксипропиленгликоли в указанных выше пределах могут превращаться в гель при температуре тела, т.е. около 37oС при концентрации около 10-90% в водных растворах. В качестве предпочтительного примера получают водный раствор блок-полимера полиоксиэтилен-полиоксипропиленгликоля с концентрацией 15-30%, имеющий молекулярный вес полипропиленгликоля 3850 и содержание этиленоксида 70% (Pluronic F-127).
Используемый здесь костный морфогенетический протеин (КМП) является протеином, обладающим способностью индуцировать недифференцированные клетки среднего мозга до клеток хряща, обеспечивая таким образом костный морфогенез.
Костные морфогенетические протеины, используемые в данном изобретении, включают, но не ограничиваются, ряд протеинов, относящихся к суперсемейству генов TGF-β, таких как от ВМР-2 до BMP-9 и так далее, протеин, названный МР52, протеин, названный ПВА-5 и подобные. Особо предпочтительный ВМР-2 является протеином, полученным с использованием клеток яичника китайского хомяка (ЯКХ) по технологии генной инженерии, описанной Wang, et al. (Proc. Natl. Acad. Sci. USA, 87, 2220-2224, 1990 и US, Patent 4877864), и особенно предпочтительный протеин МР52 является новым протеином, полученным по технологии генной инженерии, предлагаемой в данном изобретении (Japanese Patent Application 93664/1995). Этот новый протеин может быть получен конструированием плазмиды, содержащей последовательность ДНК, кодирующую последовательность аминокислот, как показано в SEQ ID NO.: 1 Sequence Listing производную от MP52 и имеющую дополнительный кодон кодирующего метионина на М-терминале указанной последовательности ДНК; превращением плазмида в Е. coli; инкубированием Е. coli с получением телец включений и солюбилизацией и очисткой телец включений с получением мономерного протеина, который затем димеризируют и очищают.
Водный раствор 15-30% блок-полимера полиоксиэтилен-полиоксипропиленгликоля, содержащий в качестве активного ингредиента ВМР-2 или MP52, внутримышечно вводят мыши в бедренную мышцу. MP52 удерживается в месте введения, и затем наблюдают in vivo эктопическую способность хрящевого и костного морфогенеза.
До сих пор не публиковались данные об инъекционном морфогенетическом материале для восстановления хряща и кости, включающем полиоксиэтилен-полиоксипропиленгликоль в сочетании с костным морфогенетическим протеином, который мог бы использоваться для восстановления костей и хрящей, особенно в качестве агента для лечения переломов костей.
Данное изобретение далее относится к агенту для восстановления хряща и кости, содержащему полиоксиэтилен-полиоксипропиленгликоль и костный морфогенетический протеин.
Более того, данное изобретение относится к методу лечения для восстановления хряща и кости, в котором хрящевой и костный морфогенетический агент, состоящий из полиоксиэтилен-полиоксипропиленгликоля в сочетании с костным морфогенетическим протеином, вводят локально в место перелома или повреждения кости человека или животного.
На фиг. 1 представлена классификация ADEKA® Pluronics, где содержание этиленоксида в мас. % по отношению к весу полной молекулы полиоксиэтилен-полиоксипропиленгликоля указано по оси абсцисс, а молекулярный вес компонента полипропиленгликоля в полиоксиэтилен-полиоксипропиленгликоле указан по оси ординат.
Фиг. 2 представляет мягкие рентгеновские снимки кальцинированной ткани бедренной кости/хряща правой задней лапы мыши, полученные в примере 4. Снимки (а) и (b) были сделаны через 2 недели после введения чистого ADEKA® Pluronics F-127, и ADEKA® Pluronics F-127, содержащего МР52 соответственно. Явно затемненные части мускула указывают на эктопически образовавшуюся кость.
Фиг. 3 представляет микрофотографии окрашенных тканей недекальцинированного участка бедренной кости правой задней лапы мыши, полученные в примере 4. Образование костной основы и костной основы с остеобластами и костного мозга может быть подтверждено окрашиванием von-Kossa (а) и окрашиванием Hematoxylin-Eosin (b) соответственно.
Фиг.4 представляет карту плазмидов вектора экспрессии протеина МР52, как получено в ссылочном примере 1 (2).
Описание предпочтительных воплощений изобретения.
Эффект данного изобретения иллюстративно объясняется с помощью следующих примеров и ссылочных примеров. Тем не менее данное изобретение не должно быть ограничено данными примерами.
Пример 1. Получение морфогенетического материала для восстановления кости и хряща, содержащего ВМР-2.
ADEKA® Pluronics F-127 (Asahi Denka Kogyo К.К.) известен как один из наименее токсичных полиоксиэтилен-полиоксипропиленгликолей ("SEIYAKU KOJO" 6, 875-880, 1986). В 7,0 г дистиллированной воды для инъекций растворяют при охлаждении льдом 3,0 г ADEKA® Pluronics F-127 с получением 30% водного раствора ADEKA® Pluronics F-127. Водный раствор ADEKA® Pluronics F-127 порциями вливают при охлаждении льдом в 96-ячеичный титровочный планшет по 360 мкл/ячейку, в каждую ячейку добавляют 40 мкл 0,01н. НСl, содержащей 80 мкг ВМР-2, и смешивают. Смесь стерилизуют, пропуская через 0,22 мкм фильтр при 4oС, с получением инъекционного раствора ВМР-2 общим объемом около 400 мкл (конечная концентрация ADEKA® Pluronics F-127 составляет 27%). Таким же образом готовят инъекционные растворы ВМР-2, имеющие конечную концентрацию ADEKA® Pluronics F-127 10, 15, 18 и 22,5%.
Обнаружено, что инъекционный раствор может существовать при 5oС или ниже, если конечная концентрация ADEKA® Pluronics F-127 составляет 27%, при 10oС и ниже, если конечная концентрация ADEKA® Pluronics F-127 составляет 22,5%, или при 25oС или ниже, если конечная концентрация ADEKA® Pluronics F-127 составляет 10-18%, в то время как инъекционным раствором ADEKA® Pluronics F-127, переходящим в гелевое состояние при 37oС, является препарат, имеющий конечную концентрацию 15% и выше. Поэтому наиболее предпочтительным является препарат ADEKA® Pluronics F-127 с конечной концентрацией 18%, который при комнатной температуре имеет жидкое состояние и превращается в гель при 37oС.
Пример 2. Получение морфогенетического материала для восстановления кости и хряща, содержащего МР52.
Инъекционный раствор МР52, имеющий конечную концентрацию ADEKA® Pluronics F-127 10, 15, 18, 22,5 и 27% получают согласно методике, описанной в примере 1. Для МР52 получают те же инъекционные препараты, что и для ВМР-2; то есть инъекционный раствор, может существовать при 5oС или ниже, если конечная концентрация ADEKA® Pluronics F-127 составляет 27%, при 10oС и ниже, если конечная концентрация ADEKA® Pluronics F-127 составляет 22,5%, или при 25oС или ниже, если конечная концентрация ADEKA® Pluronics F-127 составляет 10-18%.
Пример 3. Остаточные количества МР52 in vivo после введения морфогенетического материала для восстановления хряща и кости.
125I-меченный инъекционный раствор МР52, имеющий конечную концентрацию ADEKA® Pluronics F-127 18, 22,5 и 27%, который получают, используя ту же методику и состав лекарственного средства, что и в примере 2, за исключением того, что дополнительно добавляют 125I-меченый МР52, внутримышечно вводят самцу мыши (ICR штамм, возраст 8 недель) при анестезии в бедренную мышцу правой задней лапы в количестве 100 мкл, используя иглу 23G (около 37 КБк 125I-MP52/участок), и затем фиксируют радиоактивность правой задней лапы через 0,5, 2 и 8 часов после введения. В качестве контроля используют инъекционный водный раствор 125I-WP52. Результаты показаны в таблице 2.
Из таблицы 2 видно, что МР52 при использовании полиоксиэтилен-полиоксипропиленгликоля в качестве фармацевтического носителя удерживается гораздо лучше, чем при введении простого водного раствора МР52. Также сходные результаты наблюдались и при использовании инъекционного препарата из примера 1.
Пример 4. Фармакологическое действие на эктопический хрящевой и костный морфогенез.
Инъекционный препарат МР52 с конечной концентрацией ADEKA® Pluronics F-127 18%, такой как получен в примере 2, внутримышечно вводят самцу мыши (штамм ICR, возраст 8 недель) при анестезии в бедренную мышцу правой задней лапы в количестве 100 мкл, используя иглу 23G (20 мкг МР52/место). В качестве контроля используют инъекционный препарат ADEKA® Pluronics F-127, не содержащий МР52. Образование хряща и кости определяют через 2 недели после введения. Мышь умерщвляли смещением шейных позвонков и правую заднюю лапу с местом инъекции отрезали и исследовали образование кости в месте введения, используя мягкий рентгеновский облучатель. Результаты показаны на фиг.2 (n= 5). Из рентгеновских снимков видно, что при использовании чистого ADEKA® Pluronics F-127 в месте введения не наблюдается никаких затемнений (фиг.2а), в то время как у 80% и более животных, получивших ADEKA® Pluronics F-127, содержащий МР52, наблюдаются явные затемнения (фиг.2b).
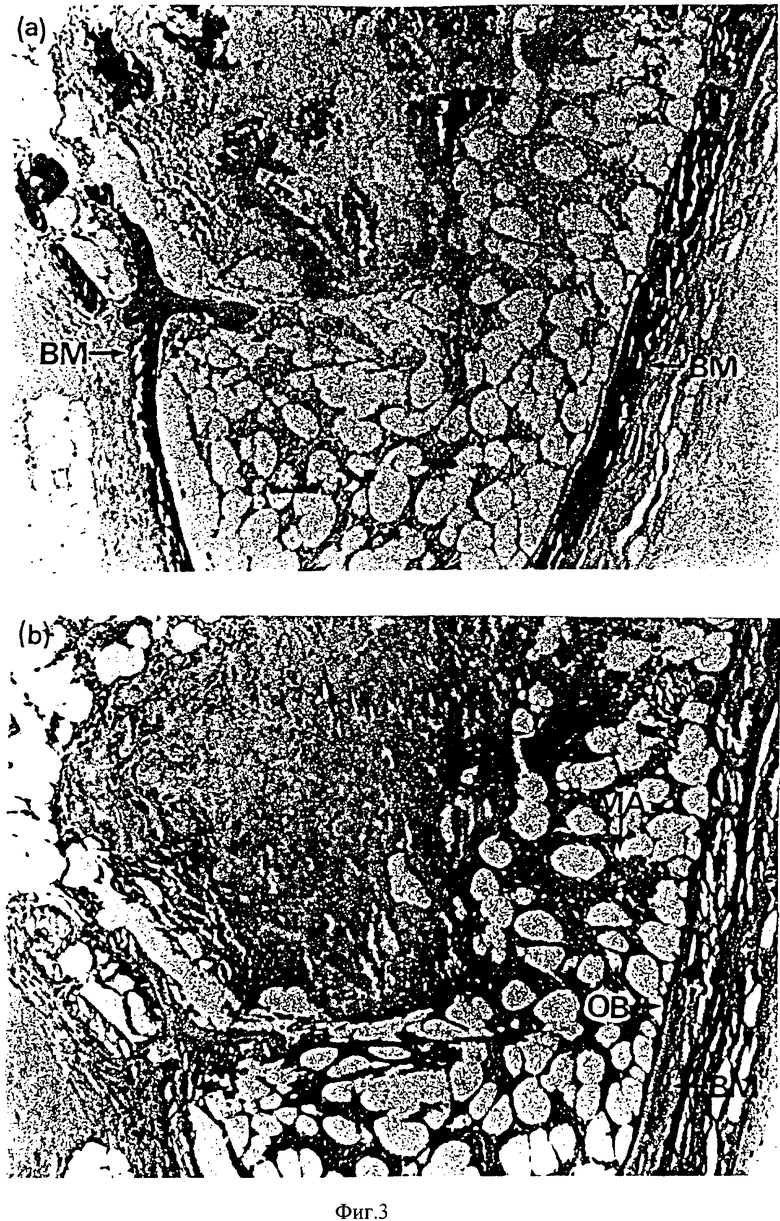
Затем, после получения снимков с помощью мягкого рентгеновского облучения, образцы помещали в 10% формалин и проводили гистологические исследования. Микроскопические фотографии окрашенных тканей мыши, которые можно видеть на фиг. 2b справа, показаны на фиг.3. На фиг.3 наблюдают отложение кальция на затемненном участке при окрашивании von-Kossa (фиг.3-а) и остеобласты, костные матрицы и костный мозг подтверждались окрашиванием Hematoxylin-Eosin (фиг.3b), тем самым подтверждая образование кости. Никаких воспалительных реакций не наблюдалось. На данных фигурах костная матрица, остеобласт и костный мозг обозначены как ВМ, ОВ и МА соответственно.
Проводили подобные тесты с использованием инъекционного раствора ВМР-2, имеющего конечную концентрацию ADEKA® Pluronics F-127 18%, которые дали сходные результаты.
Приведенными выше результатами подтверждается безопасность и полезность полиоксиэтилен-полиоксипропиленгликоля при использовании его в качестве носителя для фактора формирования кости.
Ссылочный пример. Получение нового протеина МР52
1. Конструирование вектора
(1) Выделение зрелой части варианта МР52.
Человеческий МР52кДНК амплифицируют цепной реакцией полимеризации (ЦРП) только зрелой части, используя плазмидный вектор, содержащий кДНК, описанный в WO 93/16099 (pSK52s) в качестве матричной ДНК.
Часть ДНК зрелого гена типа МР52 замещают согласно методике увеличения продуктивности желаемого протеина, увеличивая содержание AT вокруг инициаторного кодона АТГ (описано у М. Nobuhara et al., Agric. Biol. Chem., 52(6), 1331-1338, 1988).
Замещение проводят согласно методике ЦРП, используя ортодромный ЦРП-праймер SEQ ID NO.:2. Последовательность ДНК ЦРП-праймера использует ДНК, описанную в SEQ ID No.:2 в качестве ортодромного праймера, и описанную в SEQ ID No.:3 в качестве антидромного праймера.
ЦРП проводят добавлением в ту же пробирку для исследования матрицы ДНК (10 нг), 50 пикомоль каждого ортодромного и антидромного ЦРП-праймера, дезоксинуклеозидтрифосфата (0,2 ммоль) и MgCl2 (1,5 ммоль), одновременно с Так ДНК полимеразой (5 ЕД).
Предпочтительна ЦРП, состоящая из 30 циклов, каждый цикл включает денатурацию (94oС, одна минута), гибридизацию праймера (55oС, одна минута) и удлинение праймера (72oС, 2 минуты) (Все дальнейшие ЦРП проведены при указанных выше условиях).
Продукт, полученный по методике ЦРП, отделяют электрофорезом в 1,5% агарозе с низкой температурой плавления (доступной ФМК) с удалением ДНК, составленной из около 360 пар нуклеотидов соответствующей последовательности аминокислоты SEQ ID NO: 1, которая определена как фрагмент 1.
(2) Конструирование вектора экспрессии Е. coli для данного протеина.
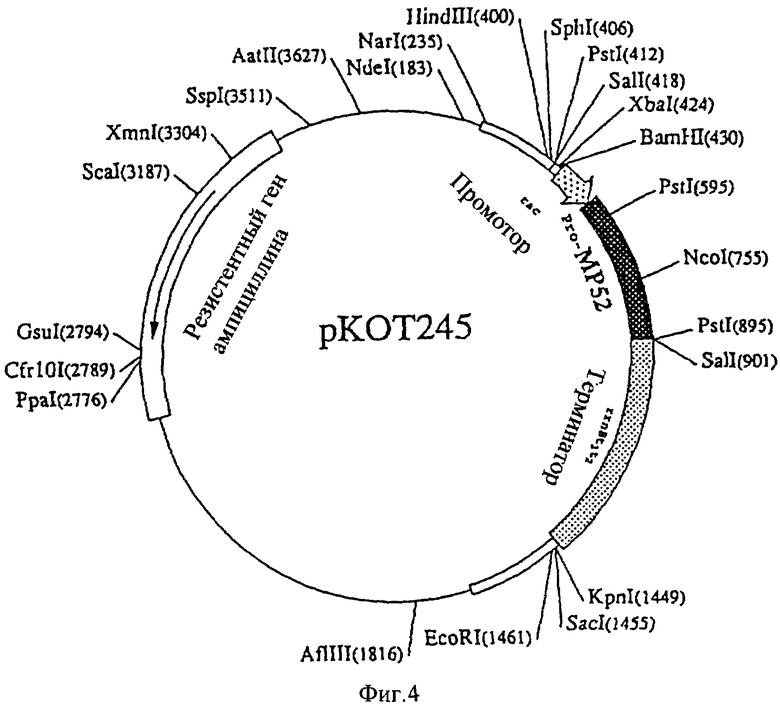
С целью повышения числа репликаций плазмида первоначальную репликацию изменяли от клеточной линии pBR до клеточной линии pUC. Tac промоторную область вектора экспрессии рКК223-3 имеющейся в продаже Е. Coli (производимой Pharmacia Biotech AB) расщепляют рестрикцией энзимов Sspl и EcoRI, обрабатывают нуклеазой Mung Bean (Takara Shuzo K.K., Catalogue 2420A), лигируют для инициирования кодона сайта фрагмента 1 с помощью лигазы Т4ДНК (Takara Shuzo K. K. , Catalogue 2011А) и rrnBTiTs терминаторный участок рКК223-3, сжигают рестрикцией энзимов SalI и SspI, лигируют участок для терминации кодона сайта фрагмента 1, сжигаемого SalI, интегрируют в SmaI сайт pUCl8 с конструированием вектора экспрессии для получения данного протеина [рКОТ245 (фиг. 4)], который депонирован (Accession Number Bikokenki FERM-P P-14895) в National Institute of Bioscience and Human-Technology (NIBH), Agency of Industrial Science and Technology, расположенный в 1-3, Higashi 1-chome, Tsukuba-shi, Ibaraki-ken, Japan 14 апреля 1995, и переведен в депозит (Accession BIKOKEN-KI ВР-5499) 10 апреля 1996 согласно Budapest Treaty on the International Recognition of the Deposit of Microorganisms. ДНК рКОТ245 имеет длину 3,7 т. п. н. Экспрессия вектора данного протеина такая, как сконструирована, определена для его основной последовательности с помощью определителя последовательностей Pharmacia ALF ДНК.
(3) Трансформация
Трансформацию осуществляют по методу Kushner et al. с использованием хлорида рубидия (Genetic Engineering, p. 17, Elsevier (1978)). Отмечено, что рКОТ245 мигрируют в хозяина Е. coli W3110M согласно описанной выше методике получения Е. coli, способной производить данный протеин.
2. Культивирование
(1) Культивирование
Данный протеин, производящий Е. coli, предварительно культивируют в модифицированной среде SOC (бактотриптон 20 г/л, бактодрожжевой экстракт 5 г/л, NaCl 0,5 г/л, МgСl2•6Н2О 2,03 г/л, глюкоза 3,6 г/л) и добавляют 100 моль/л суспензии мицелия к 5 л производительной среды (бактотриптон 5 г/л, лимонная кислота 4,3 г/л, К2НРО4 4,675 г/л, КН2РO4 1,275 г/л, NaCl 0,865 г/л, FeSO4•7H2O 100 мг/л, CuSO4•5H2O 1 г/л, MnSO4•nH2O 0,5 мг/л, СаСl2•2Н2О 2 мг/л, Na2B4O7•10H2O 0,225 мг/л, (NH4)6Мo7O24•4Н2O 0,1 мг/л, ZnSO4•7H2O 2,25 мг/л, CoCl2•6H2O 6 мг/л, MgSO4•7H2O 2,2 мг/л, Тиамин НСl 5,0 мг/л, глюкоза 3 г/л) и затем культивируют при перемешивании и продувании воздухом в 10 л культивационном резервуаре и добавляют изопропил--β-D-тиогалактопиранозид в концентрации 1 мМ на стадии фазы логаритмического роста (OD550= 5/0) и затем культивацию продолжают до тех пор, пока OD550 не достигнет 150. Во время культивации температуру поддерживают на уровне 32oС и уровень рН доводят до 7,15 добавлением аммиака, в то время как концентрацию кислорода поддерживают на уровне 50% насыщенности воздуха увеличением скорости перемешивания для предотвращения какого-либо снижения концентрации растворенного кислорода. Альтернативно, культивацию проводят добавлением 50% раствора глюкозы при концентрации 0,2%, используя в качестве стандарта быстрое увеличение концентрации растворенного кислорода для сохранения высокой концентрации мицелия.
(2) Получение тельца включения Е. Coli
Культуральный бульон, полученный как описано выше, центрифугируют для отделения мицелия, который затем суспендируют 25 мМ трис-HCl буфера, содержащего 10 мМ этилендиаминтетрауксусной кислоты (рН 7,3) и затем расщепляют бактерии с помощью аппарата для расщепления мицелия (производится Gohlin Co. , Inc.) и снова центрифугируют для отделения осадка, содержащего тельца включения.
3. Очистка
(1) Солюбилизация телец включения E. coli.
Тельца включения Е. coil трижды промывают 1% Triton Х-100 и затем центрифугируют при 3000 g при 4oС в течение 30 минут. Полученный таким образом осадок солюбилизируют при обработке ультразвуком с 20 мМ трис-HCl буфером, рН 8,3, 8М мочевина, 10 мМ дитиотреитола и 1 мМ ЭДТК.
(2) Очистка мономера.
Полученную таким образом солюбилизированную жидкость центрифугируют при 20000 g при 4oС в течение 30 минут для отделения надсадочной жидкости. Полученную надсадочную жидкость пропускают через SP-Sepharose FF (Pharmacia), которую уравновешивают 20 мМ трис-HCl буфером (рН 8,3), 6 М мочевины и 1 мМ ЭДТК, промывают указанным раствором и затем элюируют указанным раствором, содержащим 0,5 М хлорида натрия. К элюату добавляют Na2SO4 и Na2S4O6 при соответствующих конечных концентрациях 111 мМ и 13 мМ и проводят сульфирование при 4oС в течение 15 часов. Сульфированный раствор - гель фильтруют с Sephacryl S-200 (Pharmacia), который уравновешивают 20 мМ трис-HCl буфером (рН 8,3), 6 М мочевины, 0,2 М хлорида натрия и 1 М ЭДТК с получением единственного сульфированного мономера протеина данного изобретения.
(3) Преобразование складок.
К раствору сульфированного мономера протеина данного изобретения добавляют 9-кратный объем 50 мМ Na-глицинового буфера (рН 9,8), 0,2 М хлорида натрия, 16 мМ CHAPS, 5 мМ ЭДТК и 2 мМ GSH (глютатиона восстановленного типа) и 1 мМ GSSG (глютатиона окисленного типа) и затем смесь перемешивают при 4oС в течение 1 дня для осуществления преобразования складок.
(4) Очистка димера.
Образец растворяют в двукратном объеме очищенной воды и затем добавляют 6н. NaCl, доводя рН приблизительно до 7,4, и помещают для изоэлектрического осаждения. Осадок, собранный центрифугированием при 3000 g в течение 20 минут, солюбилизируют в растворе с 30% ацетонитрилом, содержащим 0,1% TFA. Раствор разбавляют двумерным объемом очищенной воды и загружают в колонку RESOURCE RPC (Pharmacia) обращенно-фазовой ЖХВР, которую уравновешивают 25% ацетонитрилом, содержащим 0,05% TFA, и затем элюируют линейным градиентом 25-45% ацетонитрила, содержащего 0,05% TFA. Элюат регистрируют при 280 нм поглощения. Очищенные фракции гомодимера протеина собирают и лиофилизируют с помощью Speedback Concentrator (Servant Co.).
(5) Определение физико-химических свойств данного очищенного протеина.
(а) Анализ N-окончаний последовательности аминокислот.
Данный очищенный протеин, полученный, как описано выше, анализируют на предмет N-окончаний последовательности аминокислот с помощью определителя аминокислотных последовательностей, модель 476А (Applied Biosystems) для подтверждения последовательности аминокислот от N-окончания до 30 аминокислоты, как показано в SEQ ID NO.:l перечня последовательностей.
(b) Анализ состава аминокислот
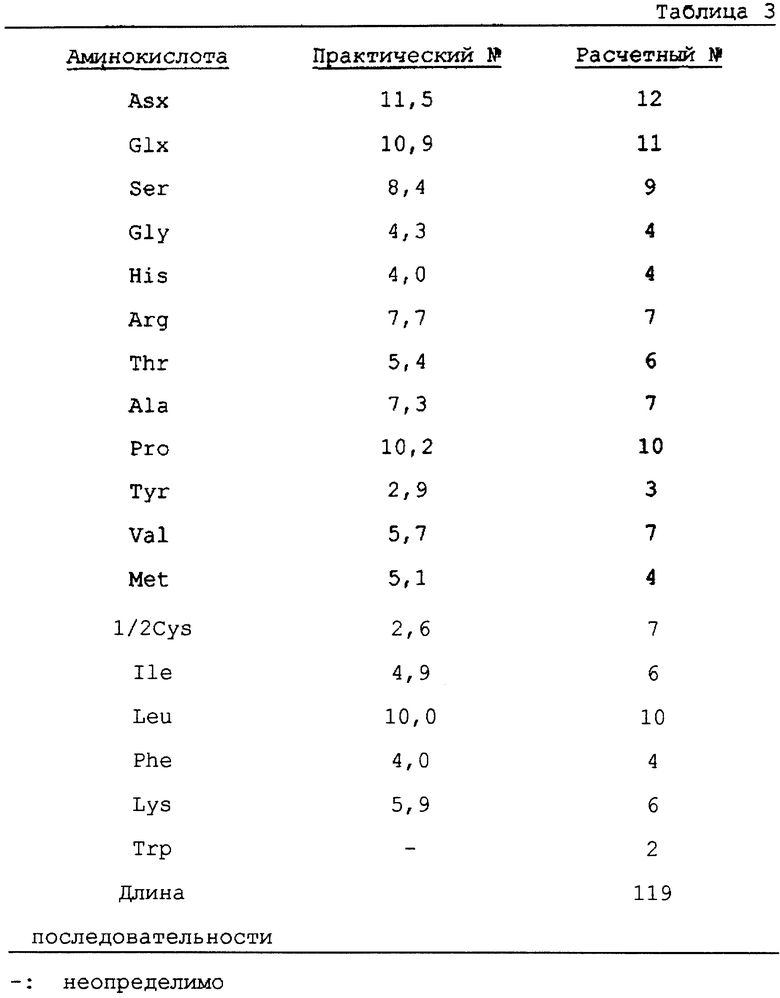
Данный очищенный протеин, полученный, как описано выше, исследуют с помощью аминокислотного анализатора [PICO TAG System (Waters Co., Ltd.)]. Результаты показаны в таблице 3, где цифровые индексы означают номер аминокислотного остатка в мономере.
(с) Анализ электрофорезом
Молекулярный вес данного очищенного протеина, полученного, как описано выше, подтверждают с помощью SDS-PAGE при восстанавливающих условиях, показавшего молекулярный вес около 28 кДа.
Представленные в пунктах (а), (b), и (с) результаты подтверждают, что данный протеин является протеином, состоящим из 119 аминокислотных остатков, начинающихся от N-окончания Pro.
Промышленная применимость.
Морфогенетический материал для восстановления хряща и кости, согласно данному изобретению, может применяться на поврежденных участках при терапии переломов кости, не требуя хирургического вмешательства, являясь простым и безболезненным способом благодаря высокой биоабсорбции, хорошему сродству с активным ингредиентом, т.е. костным морфогенетическим протеином, и зависимому от температуры обратимому превращению золь-гель. Таким образом, действие костного морфогенетического протеина может быть продлено и дополнительный морфогенетический материал для восстановления хряща и кости без побочного действия может быть получен.





Изобретение относится к медицине, к материалам для восстановления костно-хрящевой ткани. Сущностью изобретения является морфогенетический материал для восстановления хряща и кости, который содержит костный морфогенетический протеин и полиоксиэтилен-полиоксипропиленгликоль. В частности предпочтительно, чтобы молекулярный вес полипропиленгликоля, т.е. компонента указанного полиоксиэтилен-полиоксипропиленгликоля, находился в пределах от 1500 до 4000, уровень содержания этиленоксида находился в пределах от 40 до 80%/ молекулу, и концентрация указанного полиоксиэтилен-полиоксипропиленгликоля в водном растворе составляла около 10-50%. Он может применяться в хрящевом и костном морфогенетическом методе, не требующем никакого хирургического вмешательства, который включает костный морфогенетический протеин и носитель, имеющий высокую биоабсорбцию, хорошее сродство с костным морфогенетическим протеином и способность к зависимому от температуры обратимому превращению гель-золь. Он удобен для использования локально, в месте перелома кости или повреждения кости и обладает действенным лечебным эффектом. Технический результат - расширение арсенала средств для восстановления костей при переломах. 3 с. и 4 з. п.ф-лы, 3 табл., 4 ил.
7. Способ лечения для восстановления хряща и кости, в котором хрящевой и костный морфогенетический агент, содержащий полиоксиэтилен-полиоксипропиленгликоль в сочетании с костным морфогенетическим протеином, обладающий активностью индуцировать дифференцировку недифференцированных мезенхимальных клеток в клетки хряща и/или принадлежащий к надсемейству TGF-β, вводят местно в место перелома кости или повреждения кости человека или животного.
| US 4857456 А, 15.08.1989 | |||
| US 5067963 А, 26.11.1991 | |||
| US 5059588 А, 22.10.1991 | |||
| US 5211664 А, 18.05.1993. |
Авторы
Даты
2002-03-10—Публикация
1996-11-14—Подача