Изобретение касается последовательностей ДНК, кодирующих новые факторы роста/дифференциации семейства TGF-β, в частности новых последовательностей ДНК, кодирующих TGF-β подобные белки, выделения этих последовательностей ДНК, содержащих эти ДНК экспрессирующих плазмид, способа получения TGF-β-подобного белка путем культивирования трансформанта и фармацевтических композиций, содержащих этот белок. Семейство TGF-β факторов роста, содержащее BMP, TGF и родственные ингибину белки (Roberts и Sporn, Handbook of Experimental Pharmacology, 95 (1990), 419-472) имеет особенное значение в широком диапазоне способов консервативного лечения и использования в медицине. Эти факторы применимы в способах, касающихся заживления ран и репарации тканей. Некоторые члены TGF-семейства являются индукторами тканеобразования, в частности индукторами костеобразования, и играют решающую роль в индуцировании роста хрящевой и костной тканей.
Wozey (Progress in Growth Factor Research I (1989), 267-280) и Vale с сотр. (Handbook of Experimental Pharmacology, 95 (1990), 211-248) описывают различные факторы роста, например, относящиеся к группе BMP (костных морфогенетических белков) и группе ингибина. Члены этих групп обладают значительным структурным сходством. Предшественник такого белка состоит из аминоконцевой сигнальной последовательности, пропептида и карбоксиконцевой последовательности приблизительно из 110 аминокислот, которая впоследствии отщепляется от предшественника и представляет собой зрелый белок. Wozey упоминал также, что случае N-концевого фрагмента расщепление происходит по схеме RXXR, зрелый белок расщепляется по сайту REKR. Из публикации Roberts и Sporn (Handbook of Experimental Pharmacology 95 (1990)) известно, что белки TGF-B1, TGF-B2, TGF-B3, TGF-B4 и TGF-B5 расщепляются по сайтам RHRR, RKKR, RKKR, RRRR, RKKR соответственно. Таким образом, отщепление зрелой формы происходит всегда по типичной схеме по расположению сайтов RXXR. Кроме того, члены этих групп имеют определенную гомологию аминокислотной последовательности. Зрелый белок содержит наиболее консервативные последовательности, в частности семь остатков цистеина, которые сохраняются среди членов TGF-β-семейства. TGF-β-подобные белки представляют собой многофункциональные гормонально активные факторы роста. Все они обладают также родственными биологическими активностями, такими как хемотактическое аттрагирование клеток, ускорение клеточной дифференциации и способность индуцирования тканеобразования, например индуцирования образования хрящевой и костной тканей. Патент США 5013649 описывает последовательности ДНК, кодирующие белки, индуцирующие костеобразование, названные белками ВМР-2 (костными морфогенетическими белками), а заявки США с номерами сер. 179101 и 179197 описывают белки BMP-1 и BMP-3, Более того, многие типы клеток способны синтезировать TGF-β-подобные белки и, в сущности, все клетки имеют TGF-β рецепторы.
При общем рассмотрении эти белки обнаруживают различия в их структуре, приводящие к значительному варьированию в их отдельных биологических функциях. Кроме того, они были обнаружены в широком разнообразии различных тканей и стадий развития. Следовательно, они могут иметь различия, касающиеся их отдельных функций, например, таких как требуемая клеточная физиологическая среда, продолжительность жизни, их мишени, потребность в дополнительных факторах и их устойчивость к деградации. Таким образом, хотя описаны многочисленные белки, проявляющие тканеиндуктивный, в частности остеоиндуктивный потенциал, их природная роль в организме и, что более важно, возможность их применения в медицине требуют еще подробного объяснения. Существуют сильные основания, чтобы предполагать наличие неизвестных пока членов семейства ТGF-β, имеющих значение для костеобразования или дифференциации/индукции других тканей. Однако главной проблемой при выделении этих новых ТGF-β-подобных белков является то, что их функции до настоящего времени не могут быть описаны достаточно точно для создания дискриминирующего биотеста. С другой стороны, ожидаемая гомология нуклеотидной последовательности для известных членов семейства могла бы быть слишком низкой для возможности скрининга при помощи классических способов гибридизации нуклеиновых кислот. Тем не менее, дальнейшее выделение и характеристика новых ТGF-β-подобных белков является настоятельной необходимостью для того, чтобы держать в руках все множество белков индукции и дифференциации, удовлетворяющих все желательные требования медицины. Эти факторы могут найти полезное применение в медицине в заживлении дефектов и лечении дегенеративных нарушений костных и (или) других тканей, например тканей почек и печени.
Таким образом, технической проблемой, лежащей в основе данного изобретения, является в основном обеспечение последовательностей ДНК, кодирующих новые члены семейства белков ТGF-β, имеющих митогенный и (или) индуцирующий дифференциацию, например индуцирующий костеобразование, потенциал.
Решение этой технической проблемы достигнуто обеспечением вариантов (воплощений изобретения), охарактеризованных в пунктах формулы изобретения 1-17. Другие особенности и преимущества данного изобретения будут видны из описания предпочтительных вариантов и чертежей. Далее будут даны краткие описания последовательностей и чертежей.
SЕQ ID 1 (последовательность с идентификационным номером 1) изображает нуклеотидную последовательность МР-52, т.е. полученную из эмбриона последовательность, соответствующую зрелому пептиду, и большую часть последовательности, кодирующей пропептид МР-52.
Часть последовательности пропептида у 5I-конца MР-52 пока еще не охарактеризована.
SEQ ID 2 изображает охарактеризованную до сих пор нуклеотидную последовательность полученной из печени последовательности MP-121.
SEQ ID 3 изображает аминокислотную последовательность МР-52, выведенную из SEQ ID 1.
Фиг. 1 изображает сопоставление (сравнительный анализ) аминокислотных последовательностей MР-52 и MР-121 с некоторыми родственными белками.
1а показывает сопоставление MР-52 с некоторыми членами семейства белков BMP, начиная с первого из семи остатков цистеина;
1b показывает сопоставление MР-121 с некоторыми членами семейства белков Ингибина.
* указывает, что данная аминокислота является одинаковой во всех сравниваемых белках;
+ указывает, что данная аминокислота одна и та же по меньшей мере в одном из белков, сравниваемых с МР-52 (фиг.1а) или с MP-121 (фиг.1b).
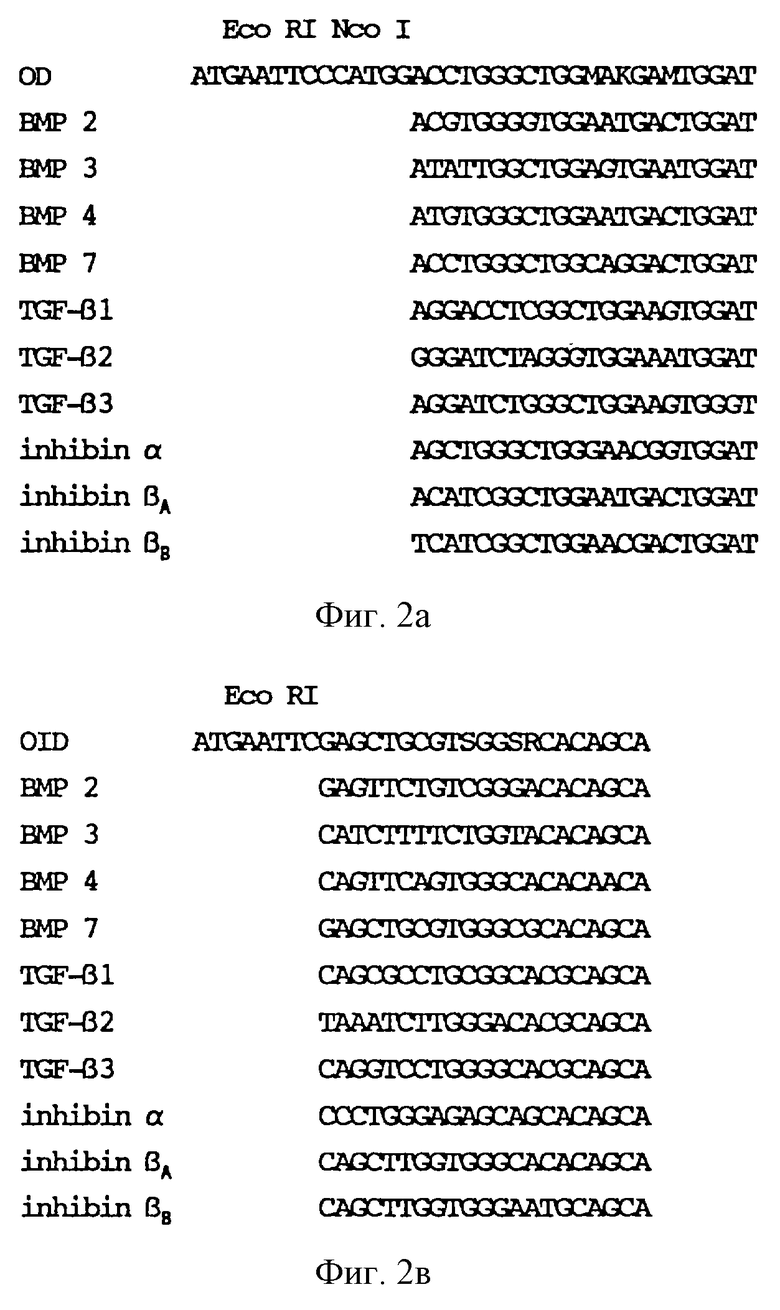
Фиг. 2 изображает нуклеотидные последовательности олигонуклеотидного праймера (затравки), применяемого в данном изобретении, и сопоставление этих последовательностей с известными членами семейства TGF-β.
М обозначает А или Ц;
S обозначает Ц или Г;
R обозначает A или Г.
К обозначает Г или Т.
2а изображает последовательность праймера OD;
2b изображает последовательность праймера OID.
Фиг.3-9 - экспрессия и биологическая активность МР-52.
Данное изобретение касается новых TGF-β-подобных белков и обеспечивает последовательности ДНК, содержащиеся в соответствующих генах. В таких последовательностях находятся нуклеотидные последовательности, содержащие последовательность
AТGAACTCCATGGACCCCGAGTCCACA и
CTTCTCAAGGCCAACACAGCTGCAGGCACC
и, в частности, последовательности, представленные в SEQ ID 1 и 2, аллельные производные этих последовательностей и последовательности, вырожденные как результат вырожденности генетического кода для этих последовательностей. В таких последовательностях могут также находиться последовательности ДНК, гибридизующиеся в строгих условиях гибридизации с описанными выше последовательностями ДНК и соответствующие следующим аминокислотным последовательностям:
Met-Asn-Ser-Met-Asp-Prp-Glu-Ser-Тhr или
Leu-Leu-Lys-Ala-Asn-Thr-Ala-Ala-Gly-Thr.
Хотя эти аллельные, вырожденные и гибридизующиеся последовательности могут иметь структурные отклонения, обусловленные природными мутациями, такие как небольшие делеции или замены, обычно они проявляют, в основном, те же самые полезные свойства, что позволяет применять их, в основном, в тех же самых способах применения в медицине.
Согласно данному изобретению, термин "гибридизация" обозначает обычные условия гибридизации, предпочтительно условия с концентрацией солей 6хSSC при 62-66oC с последующим промыванием в течение одного часа при помощи 0,6хSSC, 0,1% SDS при 62-66oС (SSC - раствор хлорида и цитрата натрия, SDS - додецилсульфат натрия). Термин "гибридизация" предпочтительно относится к строгим условиям гибридизации с концентрацией солей 4хSSC при 62-66oC с последующим промыванием в течение одного часа при помощи 0,1хSSС, 0,1% SDS при 62-66oС.
Важными биологическими активностями кодируемых белков являются митогенный потенциал и остеоиндуктивный потенциал, которые могут быть определены в тестах согласно Roberts et al., РNAS 78 (1981). 5339-5343, Sеуеdin et al., PNAS 82 (1985), 2267-2271 или Sampath and Reddi, PNAS 78 (1981), 7599-7603.
Предпочтительными воплощениями (вариантами) данного изобретения являются последовательности ДНК, описанные выше и полученные из позвоночных, предпочтительно из млекопитающих, таких как свиньи или коровы, и из грызунов, таких как крысы или мыши, и, в частности, из приматов, таких как человек.
Особенно предпочтительными вариантами данного изобретения являются последовательности ДНК, обозначаемые МР-52 и MP-121, которые представлены в SEQ ID 1 и 2. Соответствующие транскрипты МР-52 были получены из эмбриогенной ткани и кодировали белок, обнаруживающий значительную аминокислотную гомологию со зрелой частью BMP-подобных белков (см. фиг.1а). Последовательности белков ВМР-2 (=ВМР2А) и ВМР-4 (=ВМР2В) описаны в Wozney et аl., Science Vol. 242, 1528-1534 (1988). Соответственные последовательности ВМР5, ВМР6 и BMP7 описаны в Celeste et al. , Рroс. Nat1. Acad. Sсi. USA Vol. 87, 9843-9847 (1990). Некоторые типичные гомологии последовательности, которые специфичны только для известных последовательностей BMP, также были обнаружены в пропептидной части MP-52 тогда, как другие части участка предшественника MP-52 обнаруживают заметные различия при сравнении с предшественниками BMP. В ткани печени была обнаружена мРНК MP-121 и соответствующая ей аминокислотная последовательность обнаруживает гомологию с аминокислотными последовательностями белковых цепей Ингибина (см. фиг.1b). Последовательности кДНК, кодирующие TGF-β-подобные белки, пока не были выделены из ткани печени, возможно вследствие низкого количества специфических для TGF-β транскриптов в этой ткани. Однако в эмбриогенной ткани последовательности, кодирующие известные TGF-β-подобные белки, могут быть обнаружены в относительном изобилии. Заявители недавно также обнаружили присутствие в печени скопления TGF-β-подобных белков. Высокий фоновый уровень клонов, относящихся к известным факторам этой группы, представляет собой главную трудность в установлении новых родственных TGF-β последовательностей в этих и, возможно, других тканях. В данном изобретении клонирование проводили по способу, описанному ниже. Как только последовательность ДНК была клонирована, получение клеток хозяина, способных продуцировать TGF-β-подобные белки, и получение этих белков можно было легко завершить при помощи известных способов рекомбинантных ДНК, предусматривающих конструирование экспрессирующих плазмид, кодирующих такой белок, и трансформацию клетки хозяина этой экспрессирующей плазмидой, культивирование трансформанта в подходящей кулътуральной среде и извлечение продукта с TGF-β-подобной активностью.
Таким образом, данное изобретение касается также рекомбинантных молекул, содержащих описанные выше последовательности ДНК, иногда соединенные с последовательностью регуляции транскрипции. Такие векторы можно применять в получении TGF-β-подобных белков в стабильно или временно трансформированных клетках. Некоторые животные, растительные, грибковые и бактериальные системы можно применять для трансформации и последующего культивирования. Предпочтительно, чтобы экспрессирующие векторы, которые можно использовать в данном изобретении, содержали последовательности, необходимые для репликации в клетке хозяина, и были автономно реллицируемыми. Также предпочтительно применение векторов, содержащих селектируемые маркерные гены, которые могут быть легко отобраны для трансформированных клеток. Необходимая для этого операция хорошо известна работающим в этой области.
Другим объектом данного изобретения является обеспечение клетки хозяина, трансформированной экспрессирующей плазмидой данного изобретения и способной продуцировать белок семейства TGF-β Примерами подходящих клеток хозяина являются различные эукариотические и прокариотические клетки, такие как Е. coli, клетки насекомых, клетки растений, клетки млекопитающих и грибы, например дрожжи.
Следующим объектом данного изобретения является обеспечение белка семейства TGF-β, кодируемого описанными выше последовательностями ДНК и обнаруживающего такие биологические особенности, как способность индуцирования тканеобразования, в частности костеобразования и (или) митогенная способность, возможно, имеющие значение для терапевтических способов. Эти особенности белков могут варьировать в зависимости от образования гомодимеров или гетеродимеров. Такие структуры могут оказаться полезными также в клинических применениях. Аминокислотная последовательность особенно предпочтительного белка семейства TGF-β (MP-52) показана в SEQ ID 3.
Следующим аспектом изобретения является обеспечение способа получения TGF-β-подобных белков. Такой способ предусматривает культивирование клетки хозяина, трансформируемой последовательностью ДНК данного изобретения, в подходящей культуральной среде и очистку полученного TGF-β-подобного белка. Таким образом, этот способ позволяет получить достаточное количество целевого белка для применения в консервативном лечении или в способах с использованием культур клеток, требующих факторов роста для их продуктивности. Клетку хозяина получают из бактерий, таких как Bacillus или Escherichia coli, из грибов, таких как дрожжи, из растений таких, как табак, картофель или Arabidopsis, и из животных, в частности, линии клеток позвоночных, такие как линии клеток Мо-, СОS- или СНО.
Еще одним аспектом данного изобретения является обеспечение особенно чувствительного способа выделения последовательностей ДНК, соответствующих низкому количеству мРНК в целевых тканях. Способ данного изобретения предусматривает сочетание четырех различных стадий. Сначала должна быть выделена мРНК и использована в реакции амплификации с применением олигонуклеотидных праймеров. Последовательность олигонуклеотидных праймеров содержит вырожденные последовательности ДНК, произведенные в соответствии с аминокислотной последовательностью белков, относящихся к целевому гену. Эта стадия может приводить к амплификации уже известных членов целевого семейства генов, и эти нежелательные последовательности должны быть, следовательно, исключены. Это достигается при помощи рестрикционных эндонуклеаз (рестриктаз), которые, как это известно, способны переваривать уже подвергнутые анализу члены этого семейства генов. После обработки популяции амплифицированной ДНК этими рестриктазами оставшиеся целевые ДНК выделяют при помощи гель-электрофореза и повторно амплифицируют в третьей стадии при помощи реакции амплификации. В четвертой стадии их клонируют в подходящие векторы для секвенирования. Для повышения чувствительности и эффективности вторую и третью стадии повторяют по меньшей мере два раза в одном из вариантов данного способа.
В одном из предпочтительных вариантов описанный выше способ выделения применяют для выделения последовательностей ДНК из ткани печени. В наиболее предпочтительном варианте этого способа один из праймеров, применяемый для эксперимента с ПЦР (полимеразной цепной реакцией), гомологичен poly(A)-фрагменту мРНК, тогда как второй праймер содержит генспецифическую последовательность. Способы, применяемые в проведении различных стадий данного способа (такие, как реакции амплификации или способы секвенирования) известны специалистам, работающим в этой области, и описаны, например, в Sambrook et al. , 1989, "Molecular Cloning: А laboratory manual", Cold Spring Harbor Laboratory Press.
Другим объектом данного изобретения является обеспечение фармацевтических композиций, содержащих терапевтически эффективное количество белка семейства TGF-β данного изобретения. Иногда такая композиция содержит фармацевтически приемлемый носитель. Подобная композиция может применяться в заживлении ран и репарации тканей так же, как в заживлении кости, хрящей или дефектов зубов, либо отдельно, либо в соединении с подходящими носителями и, возможно, с другими родственными белками или факторами роста. Так терапевтическая композиция данного изобретения может содержать (но не ограничивается этим) кодируемый МР-52 белок в сочетании с кодируемым MP-121 белком и иногда с другими известными биологически активными веществами, такими как EGF (эпидермальный фактор роста) или PDGF (тромбоцитарный фактор роста). Другим возможным клиническим приложением TGF-β-подобного белка является его применение в качестве супрессора иммунного ответа, который может предотвращать отторжение трансплантируемых органов. Фармацевтическая композиция, содержащая белки данного изобретения, может также применяться профилактически и в косметической пластической хирургии. Кроме того, применение такой композиции не лимитировано человеком, а распространяется на животных, в частности на домашних животных.
Наконец, еще одним объектом данного изобретения является антитело или фрагмент антитела, которые способны специфически связываться с белками данного изобретения. Способы получения такого специфического антитела хорошо известны. Предпочтительно антитело, являющееся моноклональным. Такие антитела или фрагменты антител могут быть применены для диагностических способов.
Следующие примеры детально иллюстрируют описанное изобретение, но не ограничивают его.
Пример 1
Выделение MP-121
1.1 Тотальную РНК выделяли из ткани печени человека (40-летнего мужчины) по способу Chergwin et al., Biochemistry 18 (1979), 5294-5299. Poly(A)+-РНК выделяли из тотальной РНК при помощи олиго(dТ)-хроматографии в соответствии с инструкциями изготовителя (Stratagene Poli (A) Quick columns).
1.2 Для реакции обратной транскрипции poli (A)+-РНК (1-2.5 мкг), полученную из ткани печени, нагревали 5 мин до 65oС и быстро охлаждали на льду. Реагенты для обратной транскрипции, содержащие 27 Е защитного реагента для РНК (Pharmacia), 2.5 мкг олиго d(T)12-18 (Pharmacia), 5 х буфер (250 мМ Трис-HCl рН 8.5; 50 мМ МgСl2; 50 мМ ДТТ; 5 мМ каждого из дНТФ; 600 мМ КСl) и 20 единиц обратной транскриптазы вируса птичьего миелобластоза (AMV, Boehringer Mannheim) добавляли на мкг poli (A)+-РНК.
1.3 Дезоксинуклеотидные праймеры OD и ОID (фиг.2), предназначенные для затравки реакции амплификации, генерировали на автоматизированном синтезаторе ДНК (Biosearch). Очистку проводили при помощи денатурирующего гель-электрофореза и выделения основной полосы из геля при помощи изотахофореза. Олигонуклеотиды были сконструированы путем сравнительного анализа первичной структуры последовательностей некоторых известных членов семейства TGF-β и отбора наиболее консервативных районов. Сравнительный анализ такого района показан на фиг.2. Для облегчения клонкрования оба олигонуклеотида содержали сайты рестрикции ЕcoR I, a OD дополнительно содержал сайт рестрикции Nсо I у его 5I-конца.
1.4 В полимеразной цепной реакции в качестве матрицы применяли полученный из печени пул кДНК в реакционной смеси объемом 50 мкл. Амплификацию проводили в 1 x PCR-буфере (16.6 мМ (NН4)2SO4; 67 мМ Трис-НСl рН 8.8; 2 мМ MgCl2; 6.7 мкМ ЭДТА; 10 мМ β-меркаптоэтанол; 170 мкг/мл БСА (Gibco)), 200 мкМ каждого из олигонуклеотидов (OD и OID) и 1.5 единиц Taq-полимеразы (AmpliTaq, Perkin Elmer Cetus). PCR-peакцию проводили в присутствии кДНК, соответствующей 30 нг poli (A)+-РНК в качестве исходного материала. На эту реакционную смесь наслаивали парафин и проводили 40 циклов полимеразной цепной реакции (PCR) (цикл 1: 80 с 93oС/40 с 52oC/40 с 72oС; циклы 2-9: 60 с 93oС/40 с 52oС/60 с 72oС; циклы 10-29: 60 с 93oС/40 с 52oС/60 с 72oС; циклы 30-31: 60 с 93oС/40 с 52oС/90 с 72oС; цикл 40: 60 с 93oС/40 с 52oС/420 с 72oС). Шесть реакционных смесей PCR-реакции объединяли вместе, очищали последовательными экстракциями, равными объемами фенола, смеси фенол/хлороформ (1: 1 об./об.) и смеси хлороформ/изоамиловый спирт (24:1 об./об.)и концентрировали осаждением этанолом.
1.5 Половина полученного пула PCR была достаточной для переваривания рестрикционными ферментами Sph I (Pharmcia) и AlwN I (Biolabs). Другую половину переваривали в серии реакций рестрикционными ферментами Аvа I (BRL), AlwN I (Biolabs) и Tfi I (Biolabs). Переваривание рестрикционными ферментами проводили в объеме 100 мкл при 37oС (за исключением Tfi I - при 65oС) с использованием 8 единиц каждого фермента в течение 2-12 ч в буфере, рекомендованном изготовителем.
1.6 Каждую пробу ДНК фракционировали при помощи электрофореза с применением 4%-ного агарозного геля (3% FMC Nusieve agarose, Biozym и 1% agarose, BRL) в Трис-боратном буфере (89 мМ Trisbase, 89 мM борная кислота, 2 мМ ЭДТА, рН 8). После окрашивания этидиумбромидом нерасщепленные продукты амплификации (приблизительно 200 пар оснований; маркер размера шел в параллельной пробе) вырезали из геля и выделяли фенольной экстракцией: равный объем фенола добавляли к вырезанной агарозе, которую измельчали до маленьких кусочков, замораживали в течение 10 мин, интенсивно перемешивали и центрифугировали. Водную фазу собирали, интерфазу повторно экстрагировали ТЕ-буфером такого же объема, центрифугировали и обе водные фазы объединяли. Далее ДНК очищали дважды экстракцией смесью фенола с хлороформом и один раз смесью хлороформ/изоамиловый спирт.
1.7 После осаждения этанолом одну четвертую или одну пятую часть выделенной ДНК повторно амплифицировали при тех же условиях, которые применяли при первичной амплификации, за исключением того, что количество циклов уменьшали до 13 (цикл 1: 80 с 93oС/40 с 52oС/40 с 72oС; циклы 2-12: 60 с 93oС/ 40 с 52oС/60 с 72oС; цикл 13: 60 с 93oС/40 с 52oС/420 с 72oС). Продукты повторной амплификации очищали, подвергали действию тех же рестрикционных ферментов, которые описаны выше, и нерасщепленные продукты выделяли из агарозных гелей, как описано выше для продуктов амплификации. Повторную реамплификацию сопровождали рестрикцией, выделение из геля повторяли один раз.
1.8 После последнего выделения из геля продукты амплификации переваривали 4 единицами EcoR I (Pharmacia) в течение 2 ч при 37oС с применением буфера, рекомендованного изготовителем. Одну четвертую часть рестрикциошюй смеси лигировали в вектор pBluescript II SK+ (Stratagene), который был также переварен при помощи EcoR I. После лигирования 24 клона из каждого сочетания ферментов анализировали далее при помощи секвенирования. Проба, рестриктированная ферментами AlwN I и Sph I, не содержала новых последовательностей, только последовательности ВМР6 и Ингибина βA. 19 идентичных новых последовательностей, которые были названы MP-121, были обнаружены при обработке проб рестриктазами Аva I, AlwN I и Tfi I. Одна последовательность отличалась от основной обнаруженной последовательности двумя нуклеотидными заменами. Реакцию лигирования и трансформации Е. coli HBIOI проводили, как описано в Sambrook et al., Molecular cloning: A laboratory manual (1989). Трансформанты отбирали по устойчивости к ампициллину и плазмидные ДНК выделяли в соответствии со стандартными протоколами (Sambrook et a1., (1989)). Двухцепочечные плазмиды секвенировали при помощи "дидезоксисеквенирования с терминацией цепи" с набором (китом) "Sеquenаsе Version 2.0" (United States Biochemical Corporation).
Клон был дополнен до 3I-конца кДНК по способу, детально описанному Frohman (Amplifications, published by Perkin-Elmer Corporation, issue 5 (1990), pp. 11-15). Ту же самую мРНК печени, которую применяли для выделения первого фрагмента MP-121, обратно транскрибировали при помощи праймера, состоящего из олиго (dT) (16 остатков), соединенного с адапторным праймером
AGAATTCGCATGCCATGGTCGACGAAGC(T)16
Амплификацию проводили с применением адапторного праймера
AGAATTCGCATGCCATGGTCGACG
и внутреннего праймера
GGCTACGCCATGAACTTCTGCATA
последовательности MP-121. Продукты амплификации повторно амплифицировали с примением вставленного внутреннего праймера
ACATAGCAGGCATGCCTGGTATTG
последовательности MP-121 и адапторного праймера. Продукты повторной амплификации клонировали после рестрикции при помощи Sph I в таким же образом рестриктированном векторе рТ7/Т3 U19 (Pharmacia) и секвенировали при помощи набора (кита) "Sеquenаsе Version 2.0" (United States Biochemical Corporation). Клоны отличались тем, что их последовательность перекрывалась с 3I-концом известной последовательности MP-121.
Пример 2
Выделение МР-52
Следующая последовательность кДНК, MP-52, была выделена согласно описанному выше способу (пример 1) с применением РНК из ткани эмбриона человека (8-9 недель). В полимеразной цепной реакции использовали кДНК, соответствующую 20 нг поли(A)+-РНК, в качестве исходного материала. Стадию повторной амплификации повторяли дважды для обеих комбинаций ферментов. После лигирования 24 клона из каждой ферментной комбинации анализировали далее при помощи секвенирования. Проба, рестриктированная ферментами AlwN I и Sph I, давала новую последовательность, которая была названа МР-52. Другие клоны содержали, в основном, последовательвость ВМР6 и одну последовательность ВМР7. Проба, рестриктированная ферментами Ava I, AlwN I и Tfi I, не содержала новых последовательностей, а состояла, в основном, из последовательностей BMP7 и небольшого числа последовательностей Ингибина A.
Клон дополняли до 3I-конца согласно описанному выше способу (пример 1). Ту же самую мРНК эмбриона человека, которую применяли для выделения первого фрагмента MР-52, подвергали действию обратной транскриптазы, как в примере 1. Амплификацию проводили с применением адапторного праймера
AGAATTCGCATGCCATGGTCGACG
и внутреннего праймера
CTTGAGTACGAGGCXXXCCACTG
последовательности МР-52. Продукты амплификации повторно амплифицировали с применением вставленного адапторного праймера
ATTCGCATGCCATGGTCGACGAAG
и вставленного внутреннего праймера
GGAGCCCACGAATCATGCAGTCA
последовательности МР-52. Продукты повторной амплификации клонировали после рестрикции при помощи Nco I в таким же образом рестриктированном векторе (рSU 19 (Pharmacia #27-4951-01) с измененным сайтом множественного клонирования, содержащим уникальный сайт рестрикции Nсo I) и секвенировали. Клоны отличались тем, что их последовательность перекрывалась с 3I-концом известной последовательности МР-52. Некоторые из этих клонов содержат последние 143 пары оснований 3I-конца последовательности, представленной в SEQ ID 1, и 0.56 кб 3I-нетранслируемого района (последовательность не представлена). Один из клонов применяли в качестве зонда для скрининга геномной библиотеки человека (Stratagene #946203) по общепринятому способу, детально описанному Ausubel et al. (Current Protocolс in Molecular Biology, published by Greene publishing Associates and Wiley - Interscience (1989)). Из 8х105 λ-фагов выделили и депонировали в DSM (#7387) один фаг (λ 2.7.4), который, как было показано, содержал инсерцию размером приблизительно 20 кб. Этот клон содержит, кроме последовательности, выделенной из мРНК при помощи описанных способов амплификации, информацию далее до 5I-конца. Для секвенирования фрагмент Hind III размером приблизительно 7.5 кб субклонировали в таким же образом рестриктированном векторе (Bluescript SK, Stratagene # 212206). Эту плазмиду, названную SKL 52 (НЗ) MP12, также депонировали в DSM (# 7353). Информация в виде последовательностей, полученная из этого клона, показана в SEQ ID 1. По месту нуклеотида 1050 определенная кДНК и соответствующая геномная последовательность различаются одним основанием (кДНК: Г; геномная ДНК: А). Мы полагаем, что геномная последовательность является верной, т. к. это было подтверждено также секвенированием амплифицированной геномной ДНК из эмбриональной ткани, которую применяли для получения мРНК. Эта геномная ДНК содержит интрон размером приблизительно 2 кб между парами оснований 332 и 333 SEQ ID 1. Последовательность интрона не представлена. Правильное место соединения экзон/экзон было подтверждено секвенированием продукта амплификации, полученного из кДНК, которая содержит этот район. Эта информация была получена при помощи слегка модифицированного способа, детально описанного Frohman (Amfications, published by Perkin-Elmer Corporation, issue 5 (I990), pp. 11-15). Ту же эмбриональную РНК, которую применяли для выделения 3I-конца МР-52, обратно транскрибировали с применением внутреннего праймера последовательности MР-52, ориентированной в 5I-направлении
AGAGCAGGTGGGTGGTGTGGACT
Поли(А)-конец добавляли к 5I-концу первой цепи кДНК при помощи терминальной трансферазы. Двухступенчатую амплификацию проводили сначала с применением праймера, состоящего из олиго-dТ и адапторного праймера
AGAATTCGCATGCCATGGTCGACGAAGC (T16)
и затем с применением адапторного праймера
AGAATTCGCATGCCATGGTCGACG
и внутреннего праймера
CCAGCAGCCCATCCTTCTCC
последовательности МР-52. Продукты амплификации повторно амплифицировали с применением того же адапторного праймера и вставленного внутреннего праймера
TCCAGGGCACTAATGTCAAACACG
последовательности МР-52. Затем продукты повторной амплификации еще раз амплифицировали с применением вставленного адапторного праймера
ATTCGCATGCCATGGTCGACGAAG
и вставленного внутреннего праймера
ACTAATGTCAAACACGTACCTCTG
последовательности MР-52. Конечные продукты реамплификации затупляли и клонировали в векторе (Bluescript SK, Stratagene #212206), обработанном Ecor V. Клоны отличались тем, что их последовательность перекрывалась с ДНК фага λ 2.7.4.
Плазмида SKL 52 (КЗ) была депонирована под 7353 в DSM (Deutshe Sammlung von Mikroorganismen und Zellkulturen (Немецкая коллекция микроорганизмов и клеточных культур)), Mascheroder Weg lb, 3300 Вraunschweig, 10.12.1992.
Фаг λ 2.7.4 был депонирован под 7387 в DSM 13.01.1993.
Пример 3
Экспрессия TGF-β белка МР52 в прокариотной системе (E.coli)
Часть МР52, содержащая дополнительные остатки гистидина на N-концах, экспрессировалась в E.coli. Метка His упрощает очистку за счет образования хелатного комплекса с металлом.
Часть МР52 с С-концами (119 аминокислот), содержащая аминокислоты 283-401 в SEQ ID 3 и дополнительно 10 аминокислот на N-концах (MHHHHHHKLI) экспрессировалась с использованием прокариотного вектора рВР2. Вектор рВР2 является производным плазмиды рВР322, содержащей устойчивый к ампицилину ген. За промотером Т7 следует связывающий сайт рибосомы, стартовый кодон, 6 гистидиновых кодона, множественный сайт клонирования для вставки целевого гена, стоп-кодон в каждой рамке считывания и терминатор. Экспрессия MP52His индуцировалась источником полимеразы Т7 РНК. Хозяин экспрессии BL21(DE3)pLysS (Новаген) содержит хромосомную копию гена полимеразы Т7 РНК под контролем lacUV5, экспрессия MP52His индуцировалась с помощью IPTG согласно инструкции изготовителя. Мономерный MP52His экспрессировался в телах включения с возможностью выделения стандартными способами. Очистка MP52His производилась с использованием хелатного комплекса никеля, как описано Hochuli и др. (BIO/Technology 6, 1988, 1321-1325). Дальнейшая очистка производилась реверсированной фазовой колонкой (нуклеосил 300-7С4, Machery-Nagel, 715023) с 0-90% градиентом ацетонитрила, содержащего 0,1% TFA, в течение 100 мин (скорость течения 2 мл/мин). Главная фракция MP52His была собрана, лиофилизована и хранилась при - 70oС. MP52His солюбилизирован в денатурирующем буфере (6 М гуанидин хлорида, 150 мМ Nad, 3 мМ DTT, 10 мМ Tris pH 8; 2,6 мг/мл) и развернут в активный двумерный MP52His при конечной концентрации 160 мкг/мл в обычной буферной системе Tris (pH 9,5), содержащей EDTA (2-10 мМ), CHAPS (15-50 мМ), NaCI (1-2 М) и редокс-систему (1 мМ GSSG, 2 мМ GSH) в течение 48 ч при 23oС. Остаточный мономерный MP52His отделялся от двумерного посредством ВЭЖХ. Для этого MP52His загружался в колонку (аквапор октил, 20 мкм, Applied Biosystems) с 35% буфером В (буфер А: 0,1% TFA в воде, буфер В: 90% ацетонитрил, 0,1% TFA). При градиенте буфера В 35-60% в течение 50 мин (скорость потока 3 мл/мин) двумерный MP52His начинает элюироваться при примерно 40% буфера В, затем следует мономерная форма, начиная примерно с 43% буфера В.
Очищенный двумерный MP52His был лиофилизован, хранился при 70oС и использовался в описанных далее экспериментах по изучению биологической активности.
Аналогично была экспрессирована С-концевая часть МР52 (120 аминокислот), содержащая аминокислоты 282-401 в SEQ ID 3 и дополнительный остаток метионина на N-концах, с использованием прокариотного вектора рВР2. При использовании бактериального штамма BL21(DE3)pLysS (Новаген), индуцируя ген полимеразы Т7 в соответствии с инструкциями производителя, был также экспрессирован МР52m в телах включения с возможностью выделения с помощью стандартных способов. Дальнейшая очистка производилась реверсивной фазовой колонкой (нуклеосил 300-7С4, Machery-Nagel, 715023) с 0-50% градиентом буфера В (буфер А: 0,1% TFA в воде, буфер В: 90% ацетонитрил, 0,1% TFA) в течение 50 мин (скорость течения 2 мл/мин). Главные фракции МР52m были собраны, лиофилизованы и хранились при - 70oС. Солюбилизация, развертывание и сепарация остаточного мономерного МР52m производилась, как описано для MP52His. Фракции, содержащие очищенный двумерный МР52m, были собраны, лиофилизованы, хранились при - 70oС и использовались в описанных опытах по изучению биологической активности.
Нагруженные на полиамидные гели SDS (15%) MP52m и MP52His показали кажущийся молекулярный вес примерно 14 kD (теоретический молекулярный вес 13,7 kD) и 15 kD (теоретический молекулярный вес 14,8 kD) соответственно, как показано на фиг.3 после окрашивания серебром.
Тест на наличие МР52 производился с использованием Вестерн блотинга в соответствии со стандартными методами со специфическими для МР52 антителами.
Пример 4
Биологическая активность МР52
Опыт с пристенной костью in vivo
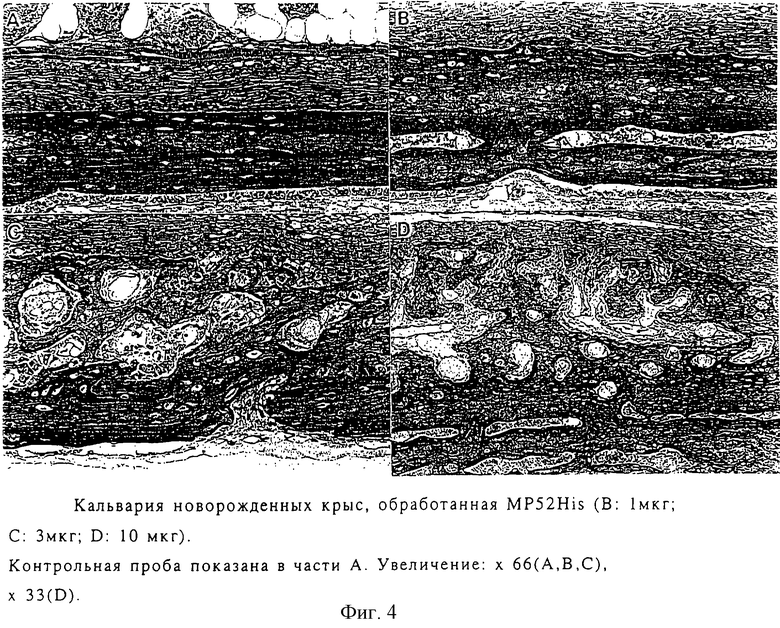
MP52His (1, 3 и 10 мкг/20 мкл/сайт) был растворен в физиологическом растворе с фосфатным буфером (PBS; рН 3,4), содержащим 0,01% человеческого серумальбумина, и повторно инъекцировался в пристенную кость новорожденной мыши один раз в день. Инъекция МР52 была начата спустя один день после рождения и закончена после 12 дней для гистопатологического исследования (штамм гематоксилин-эозина).
Как показано на фиг.4 MP52His стимулирует в зависимости от дозы увеличение толщины новообразованной кости.
Модель сегментального дефекта кости in vivo
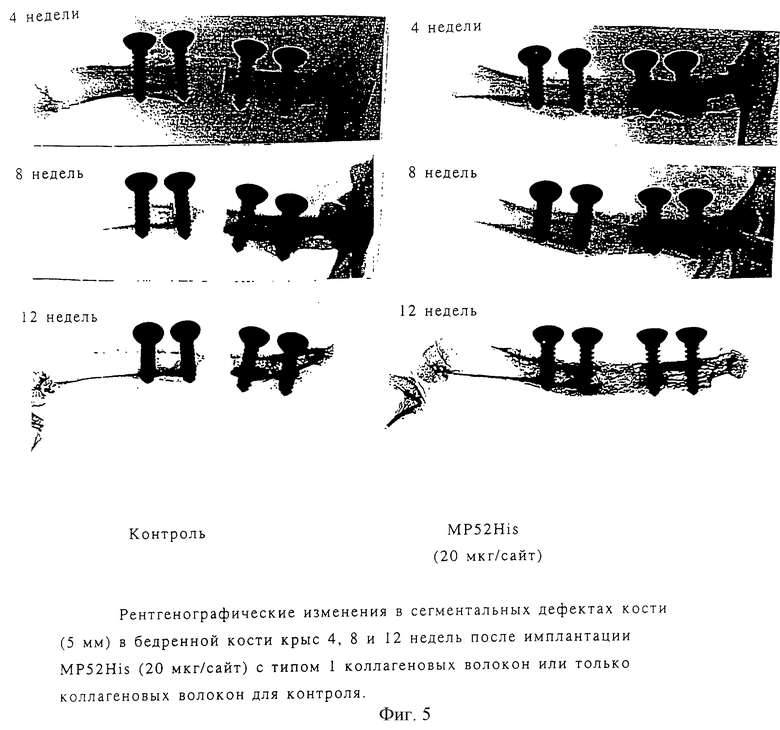
Пятимиллиметровый сегментальный дефект кости был создан в средней области бедренной кости 13-недельного самца крысы Sprague-Dawley с использованием мелкозубчатой пилы. Был закапан физиологический раствор для предотвращения повреждения ткани. Полиэтиленовая пластина была закреплена вдоль латерального кортекса с помощью нержавеющих винтов диаметром 2 мм. Раствор, содержащий 0,5% свиного коллагена типа 1 (200 мкл), был смешан с MP52His (20 мкл), лиофилизован и имплантирован в дефекты. Раствор свиного коллагена типа 1 был так же обработан и использован для контроля. Через 12 недель после имплантации крысы были умерщвлены и бедренные кости извлечены.
Заживление сегментальных дефектов кости в течение времени оценивалось с помощью рентгенографии мягкими рентгеновскими лучами после 4, 8 и 12 недель после имплантации. Как показано на фиг.5, дефектная кость, обработанная МР52, заполнялась минерализованной тканью после 8 и 12 недель, в то время как в контроле не было обнаружено изменений при радиографии в дефектной кости даже спустя 12 недель.
Содержание костных минералов в дефектах бедренной кости было измерено после 12-недельной обработки с помощью измерения поглощения рентгеновских лучей двойной энергии. Как показано на фиг.6, группа MP52His имеет значительно повышенный уровень по сравнению с контрольной группой.
По одной крысе из обеих групп были подвергнуты гистологическому анализу через 12 недель. Окрашивание (гематоксилин и эозин, синий альциан) декальцинированных участков дефектов бедренной кости, обработанных MP52His, выявило законченное костное соединение поперек дефекта, содержащее клетки костного мозга (данные не показаны). У контрольной крысы мышечные, жировые и волокнистые ткани показали только задержанный или несросшийся дефект.
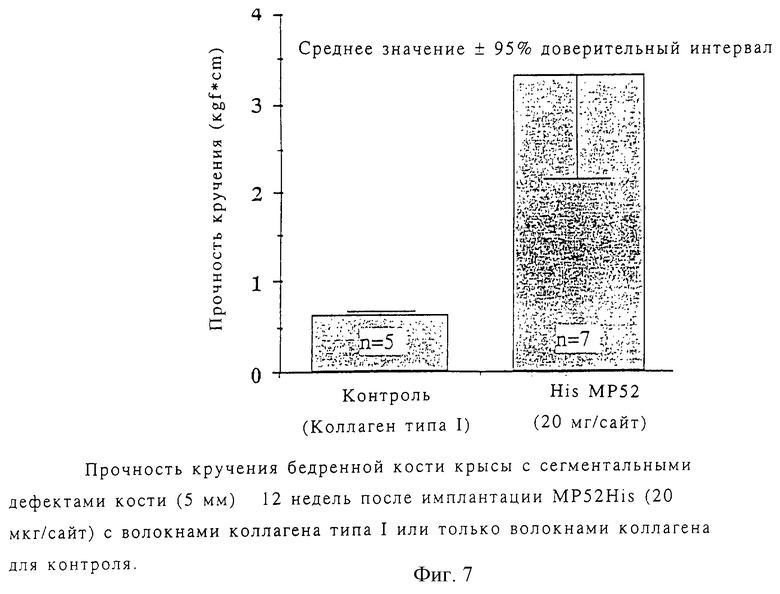
Для измерения прочности на скручивание были удалены полиэтиленовые пластины и нержавеющие винты и диафизы бедренной кости оставшихся крыс были зафиксированы закрытием обоих концов смолой и закреплением их в системе нагрузки кости (MZ-500D, Maruto Testing Machine Co.). Смола на нижнем конце поворачивалась со скоростью 180 град/мин. Прочность на скручивание определяли измерением максимальной силы, необходимой для перелома кости. Как показано на фиг.7, прочность на скручивание бедренной кости, обработанной MP52His, значительно выше контрольной величины.
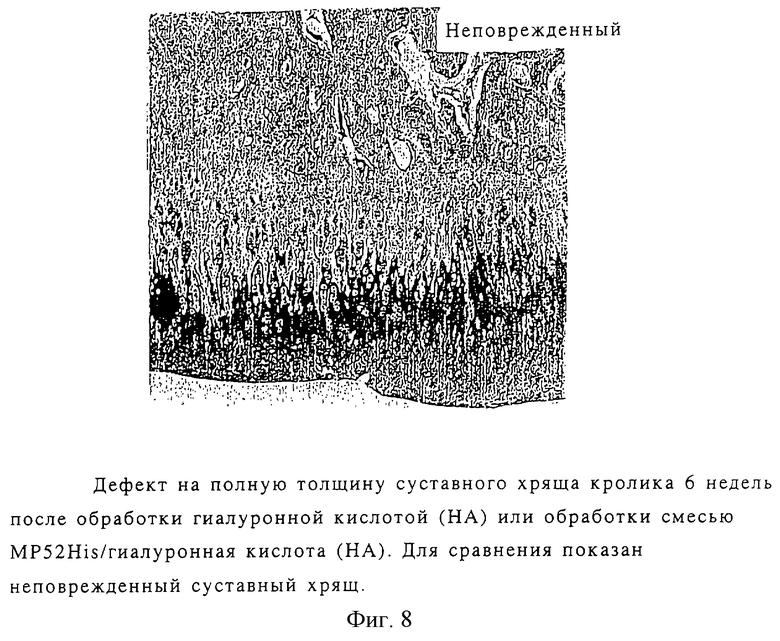
Модель дефекта на полную толщину суставного хряща кролика
Дефект диаметром 2 мм был создан в средней части бедренной кости через подхрящевую пластину у кроликов (около 2 кг) с помощью ортопедического ручного сверла. После этого просверленное отверстие было расширено игольной биопсией. Гиалуроновый кислый гель (10 мкл, 1%), смешанный с MP52His и без него, был введен в дефект хряща. Шесть недель после операции декальцинированные трансекции суставного хряща были окрашены гематоксилин-эозином и голубым альцианом.
На фиг.8 показано, что после обработки смесью гиалуроновой кислоты (НА) с MP52His появилась зона, по структуре схожая со здоровым хрящом.
Обработанные гиалуроновой кислотой контрольные дефекты показывают генерацию хондроцитов, однако отсутствует зональная структура суставного хряща.
Биологическая активность МР52
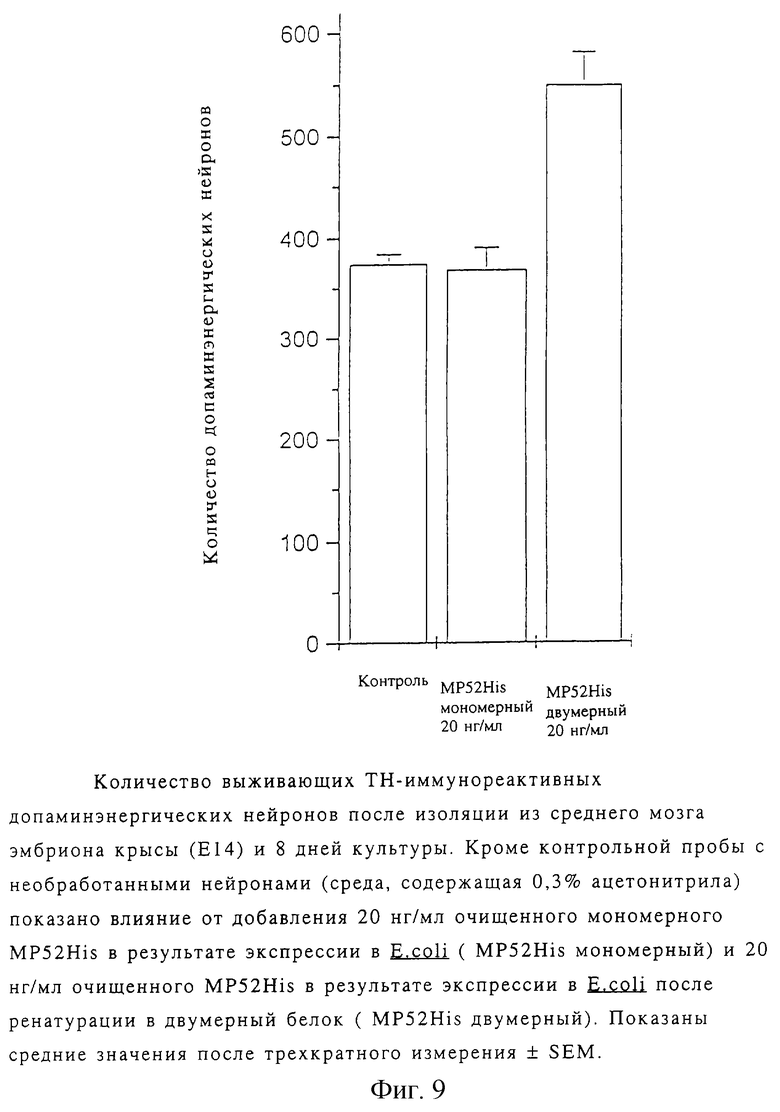
Влияние МР52 на допаминэргические нейроны
Для изучения влияния МР52 на допаминэргические нейроны, были изолированы нейроны со дна среднего мозга 14-дневного эмбриона крысы (Е14) согласно метода, описанного Shimoda и др. (Brain. Res. 586, 319-331 (1992)). Клетки были отделены и культивированы по методу, описанному Krieglstein и др. (Neuroscience 63, 1189-1196 (1994)). Плотность клеток на покрытых полиорнитином/ламинином покровных стеклах составляла 200000 клеток/см2. После культивирования в течение 24 ч последовательно каждые три дня изымались две трети среды (500 мкл) и заменялись свежей средой, содержащей соответствующие добавки. MP52His, очищенный сефарозой и реверсивной фазой ВЭЖХ, был растворен в 50% ацетонитриле и добавлен к среде.
Конечная концентрация MP52His в среде составляла 20 нг/мл (конечная концентрация ацетонитрила составляла 0,3%). Сравнимое количество очищенного мономерного MP52His, растворенного в 50% ацетонитриле, было использовано для контроля. Через 8 дней культуры были зафиксированы в течение 10 мин при комнатной температуре в 4% формальдегиде; клетки были переведены в проницаемое состояние ацетоном (10 мин, -20oС) и промыты PBS (физиологический раствор с фосфатным буфером). После обработки 1% HiOi в PBS, промывания и блокирования лошадиной сывороткой они были окрашены иммуноцитохимическим путем. Тирозин гидроксилаза (ТН) является лимитирующим энцимом в биосинтезе допамина и других катехоламинов, так что ТН может быть использован в качестве маркера для допаминэргических нейронов в данных культурах (клетки, содержащие норадреналин, не были изолированы).
ТН детектировался посредством одночасовой инкубации при 37oС с использованием мышиного моноклонального антитела против крысиного ТН (разведение 1: 200, Boehringen Mannheim) и последовательного детектирования с помощью набора Vektastain ABC (Vekto Labs). ТН-позитивные клетки были сосчитаны на площади 0,12 см2. На фиг.9 можно видеть, что двумерный МР52 оказывают положительный эффект на выживаемость допаминэргических нейронов. Белок может действовать как нейротропный фактор. Мономерный МР52 не оказывал воздействия по сравнению с контрольной средой как ожидалось от TGF-β белков.
Влияние МР52 на нейроны сетчатки
С целью исследования влияния МР52 в различных системах были выделены культуры ткани сетчатки эмбрионов цыплят. Метод выделения дискообразных проб ткани из сетчатки примерно равного размера детально описан Carri & Ebendal (Dev. Brain Res. , том 8 (1983) 219-229), Carri & Ebendal (Anat. Rec., том 214 (1986) 226-229) и Carri и др. (J. Neurosci. Res., том 19 (1988) 428-439).
В этих экспериментах стимулирование роста нервных волокон из эмбрионального эксплантата сетчатки измерялось in vitro на коллагеновой матрице. Брали части ткани сетчатки эмбрионов цыплят (белый леггорн, 6-й день эмбрионального развития) с использованием стеклянных капилляров и были удалены мезенхимальные клетки повторным промыванием пигментного эпителия сетчатки. Обработанные таким образом частицы ткани были перенесены на планшет для культивирования, покрытый коллагеном, и инкубировались всю ночь (37,5oС, 5% СО2). Последовательно добавлялись соответствующие факторы или контрольные составы и культуры инкубировались далее. Двумерный МР52 использовался в различных концентрациях (см. табл. 1). Мономерный МР52, который не проявлял активности ни в одном эксперименте, использовался в качестве негативного контроля.
Таблица 1: длина невритов сетчатки после 4 дней культивирования под влиянием различных концентраций МР52m. Длина невритов контрольных проб, содержащих только культуральную среду, составила 5,5/8/10/11/4,8/7 условных единиц, что соответствует среднему значению 7,7 (SEM 1,0). Длина невритов контрольных проб, содержащих мономерный МР52m (в равных концентрациях с двумерным МР52m), показала тот же рост, что и контрольные пробы, содержащие только культуральную среду. Одна условная единица соответствует 0,03 мм в реальном масштабе. В качестве независимого контроля эксплантаты находились в культуральной среде, содержащей небольшое количество бычьего сывороточного альбумина. Белки были растворены в водном буфере или 50% ацетонитриле и далее в культуральной среде до конечных концентраций 1,25, 12,5, 25, 100 и 200 нг/мл.
После 4 дней пребывания в культуре была измерена максимальная длина волокна ведущих нервных волокон в темном поле под микроскопом. МР52 в зависимости от дозы стимулировал рост невритов как показано в таблице 1, проявлял максимальную активность в диапазоне 25-100 нг/мл, что соответствует реальной длине волокна 1,3-1,7 мм по сравнению с 0,2 мм для негативного контроля. Мономерный МР52 и некультивированный контроль не показали стимуляции, превышающей негативный контроль.
Описанные выше эксперименты отчетливо показывают, что МР52 является очень полезным для лечения или профилактики повреждений хряща и кости, а также расстройств и болезней, которые могут быть уменьшены или излечены посредством нарастания кости и/или хряща или косметической хирургией. Это может быть, например, лечение переломов кости и несрастаний, реконструкция и трансплантация кости, спинные слияния и зубоврачебное применение, а также заболевания, вызванные анормальным метаболизмом кости или хряща, как, например, остеопороз. При применении белков согласно изобретению с целью образования нового хряща и/или кости рекомендуется локальное применение, предпочтительно на матрице. При этом могут быть использованы обычно применяемые матрицы, широко известные для белков, стимулирующих рост хрящей и костей.
При устранении дефектов костей могут применяться матрицы, например материалы на коллагеновой основе, куски хряща из других участков тела или полимеры, соответственно сополимеры, такие как полигликолевая или полимолочная кислота.
При необходимости могут применяться целлюлозные материалы, смеси описанных матричных материалов с гиалуроновой кислотой. Введение белков на матрице производится с помощью обычно применяемых методов. За процессом заживления хряща необходимо наблюдение вплоть до полного излечения с помощью рентгеновского анализа, белки в растворе, при необходимости при добавлении гиалуроновой кислоты или производных целлюлозы и/или и инъецируемого коллагена, могут впрыскиваться неоднократно в пораженное место.
Для индукции новой кости используются при локальном применении матрицы естественного происхождения (также и модифицированные) или полученные синтетически. Матрицы могут быть биологически неразлагаемыми, как, например, керамика, алюминаты или биостекло. Но особенно предпочтительны биосовместимые пористые матрицы, которые на месте повреждения создают структуру и заполняют пораженный участок, однако затем с ростом или после роста нового хряща и/или кости in vivo разрушаются. К таким матрицам относятся, например, производные коллагена, трикальцийфосфаты, гидроксилапатит, производные полигликолевой или полимолочной кислоты или их смеси.
При трансплантациях белки могут наноситься локально непосредственно на участок хряща, кости или искусственных протезов, которым предварительно сообщена шероховатость. В отдельных случаях может быть эффективна локальная инъекция белков без матрицы. При локальном применении белков дозировка составляет от 5 мкг до 50 мг на 1 г матрицы, соответственно на одно место имплантации. Дозировка зависит от отдельных факторов, таких как, например, вид и локализация повреждения хряща или кости, величина подлежащего регенерации хряща или кости, характер матрицы, однократность применения или повторные последующие инъекции, возраст и общая конституция пациента, начало и вид лечения, а также других клинических факторов, решение по которым в каждом отдельном случае принимает лечащий врач.





Изобретение относится к генной инженерии и может быть использовано в медицине. Определены ДНК-последовательности, кодирующие новые белки TGF-бета семейства, МР-52 и МР-121. В результате трансформации клеток организма-хозяина вектором экспрессии, содержащим фрагмент ДНК с последовательностью, кодирующей МР-52, получен активный полипептидный продукт, обладающий способностью индуцировать рост костной и хрящевой тканей. Изобретение обеспечивает использование нового TGF-бета подобного белка (МР-52) в качестве активного начала в фармкомпозициях, предназначенных для лечения или профилактики повреждения костной и хрящевой тканей. 5 с. и 2 з.п. ф-лы, 9 ил.
б) нуклеотидную последовательность, соотносящуюся с последовательностью (а) в рамках вырожденности генетического кода,
в) нуклеотидную последовательность, включающую фрагмент последовательности (а) или (б), соответствующий части, кодирующей зрелую форму белка.
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| WO А 9105802, 02.05.1991 | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| СПОСОБ TIСОЙ ОБРАБОТКИ ЛИСТОВ МАПШТШРОВОДОВ | 1971 |
|
SU433225A1 |
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| WO А 9014360, 29.11.1990 | |||
| Очаг для массовой варки пищи, выпечки хлеба и кипячения воды | 1921 |
|
SU4A1 |
| СПОСОБ ПРИГОТОВЛЕНИЯ ФУРФУРОЛ-АЦЕТОНОВОГО | 0 |
|
SU290012A1 |
Авторы
Даты
2003-07-20—Публикация
1993-02-12—Подача