Перекрестная ссылка на родственные заявки
В заявке испрашивается приоритет заявки на патент США №62/536034, поданной 24 июля 2017 года, и заявки на патент США №62/595207, поданной 6 декабря 2017 года, полное раскрытие которых включено в настоящий документе путем ссылки.
Область техники, к которой относится изобретение
Настоящее изобретение относится к фармацевтической композиции с высокой эффективностью инкапсулирования или загрузкой лекарственного средства, способам изготовления и применению фармацевтической композиции, раскрытой в настоящем документе.
Предпосылки создания изобретения
Липосомы представляют собой везикулы, образованные липидными бислоями, содержащими внутреннюю водную среду. Липосомы использовали в качестве носителей для разнообразных терапевтических агентов для обеспечения улучшенных свойств доставки, таких как увеличенное время циркуляции в крови, пониженная цитотоксичность, замедленное высвобождение лекарственного средства и специфическая доставка лекарственного средства в выбранные ткани. При использовании липосом для терапевтической доставки лекарственного средства желательна более высокая эффективность инкапсулирования лекарственного средства.
В настоящее время существует ряд способов загрузки лекарственных средств для включения лекарственных средств в липосомы. Что касается слабокислотных лекарственных средств, липосомы, имеющие градиент более высокого внутреннего/более низкого внешнего рН, описаны для загрузки лекарственного средства, например, в патенте США №5939096. Градиент рН устанавливается солью слабой кислоты, включая карбоновую кислоту, такую как муравьиная кислота, уксусная кислота, пропановая кислота, бутановая кислота, пентановая кислота и их замещенные производные. В WO 96/25147 раскрыто применение бикарбонатной соли для загрузки лекарственного средства. Однако более поздние исследования дают основание предполагать, что использование бикарбонатной соли в изготовлении липосом вызывает накопление газа, которое будет разрушать и дестабилизировать липосомы, и инициировать преждевременное высвобождение лекарственного средства (Nature et al. pH-triggered echogenicity and contents release from liposomes, Mol Pharm. 2014 Nov 3; 11(11):4059-68; и Chen et al. A thermoresponsive bubble-generating liposomal system for triggering Localized Extracellular Drug Delivery, ACS Nano. 2013 Jan 22; 7(1):438-46), что указывает на то, что следует избегать использования бикарбонатной соли в качестве агента для загрузки из-за ее разрушающего и дестабилизирующего действия на липосомы.
Многие проблемы все еще остаются нерешенными в отношении слабокислотных лекарственных средств, использующих обычные липосомы, включая слабую загрузку лекарственного средства и неудовлетворительную скорость контролируемого высвобождения. До сих пор существует неудовлетворенная потребность в липосомальных суспензиях, обладающих высокой эффективностью загрузки лекарственного средства, для повышения терапевтической эффективности. Настоящее изобретение направлено на удовлетворение этой и других потребностей.
Краткое описание изобретения
В одном варианте осуществления настоящее изобретение раскрывает фармацевтическую композицию, содержащую одну или несколько липосом, содержащих (а) липидный бислой, содержащий по меньшей мере один везикулообразующий липид; и (b) внутреннюю водную среду внутри липидного бислоя, содержащую бикарбонатную соль и слабокислотное лекарственное средство, при этом липосомы суспендированы во внешней среде, и молярное соотношение лекарственного средства к бикарбонатной соли составляет от около 0,1:1 до 1:1.
В другом варианте осуществления настоящего изобретения предлагается фармацевтическая композиция, содержащая одну или несколько липосом, содержащих (а) липидный бислой, содержащий по меньшей мере один везикулообразующий липид; и (b) внутреннюю водную среду внутри липидного бислоя, содержащую бикарбонатную соль и слабокислотное лекарственное средство, при этом липосомы суспендированы во внешней среде и концентрация бикарбонатной соли составляет от около 50 мМ до менее чем около 1000 мМ.
В третьем варианте осуществления настоящего изобретения предлагается фармацевтическая композиция, содержащая одну или несколько липосом, содержащих (а) липидный бислой, содержащий по меньшей мере один везикулообразующий липид; и (b) внутреннюю водную среду внутри липидного бислоя, содержащую бикарбонатную соль и слабокислотное лекарственное средство, при этом липосомы суспендированы во внешней среде, и рН внешней среды выше pKa слабокислотного лекарственного средства.
В четвертом варианте осуществления настоящего изобретения предлагается фармацевтическая композиция, содержащая одну или несколько липосом, содержащих (а) липидный бислой, содержащий по меньшей мере один везикулообразующий липид; и (b) внутреннюю водную среду внутри липидного бислоя, содержащую бикарбонатную соль и простациклин, при этом липосомы суспендированы во внешней среде, и молярное соотношение простациклина и бикарбонатной соли составляет от около 0,1:1 до около 1:1.
В пятом варианте осуществления настоящего изобретения предлагается фармацевтическая композиция, содержащая одну или несколько липосом, содержащих (а) липидный бислой, содержащий по меньшей мере один везикулообразующий липид; и (b) внутреннюю водную среду внутри липидного бислоя, содержащую бикарбонатную соль и простациклин, при этом липосомы суспендированы во внешней среде, и концентрация бикарбонатной соли составляет от около 50 мМ до менее чем около 1000 мМ.
В еще одном варианте осуществления предлагается фармацевтическая композиция, содержащая одну или несколько липосом, при этом указанная липосома содержит (а) липидный бислой, содержащий по меньшей мере один везикулообразующий липид; и (b) внутреннюю водную среду внутри липидного бислоя, содержащую бикарбонатную соль и простациклин, при этом рН внешней среды выше pKa простациклина.
Настоящее изобретение, кроме того, обеспечивает способ получения фармацевтической композиции, раскрытой в настоящем документе, включающий следующие стадии:
(i) получение липидного раствора с использованием по меньшей мере одного везикулообразующего липида;
(ii) смешивание липидного раствора, полученного на стадии (i), с бикарбонатной солью с образованием по меньшей мере одной липосомы, содержащей липидный бислой и внутреннюю водную среду, при этом липосома суспендирована во внешней среде;
(iii) регулирование концентрации бикарбонатной соли во внешней среде для достижения более низкого значения рН во внешней среде липосомы и более высокого значения рН во внутренней водной среде липосомы, при этом рН внешней среды выше pKa слабокислотного лекарственного средства; и
(iv) добавление слабокислотного лекарственного средства к внешней среде.
Также, предлагаются способы лечения респираторного заболевания, включающие стадии введения фармацевтической композиции, раскрытой в настоящем документе, субъекту, нуждающемуся в этом.
Изобретение также обеспечивает фармацевтическую композицию, раскрытую в настоящем документе, для ее применения в лечении и/или профилактическом лечении респираторного заболевания.
Изобретение также включает применение фармацевтической композиции, раскрытой в настоящем документе, для изготовления лекарственного средства для терапевтического и/или профилактического лечения респираторного заболевания.
Подробное описание одного или нескольких вариантов осуществления изобретения представлено в приведенном ниже описании. Другие признаки или преимущества настоящего изобретения будут очевидны из следующего подробного описания нескольких вариантов осуществления, а также из прилагаемой формулы изобретения. Следует понимать, что утверждения, содержащие эти термины, не ограничивают объект, описанный в настоящем документе, или не ограничивают значение или объем формулы изобретения, представленной ниже. Это краткое изложение представляет собой общий обзор различных аспектов изобретения и вводит некоторые понятия, которые дополнительно описаны ниже в разделе «Подробное описание изобретения». Это краткое изложение не предназначено для идентификации ключевых или существенных признаков заявленного объекта изобретения и не предназначено для отдельного использования в качестве помощи при определении объема заявленного объекта изобретения. Объект изобретения станет понятным при обращении к соответствующим разделам полного описания, любому или всем чертежам и каждому пункту формулы изобретения.
Подробное описание изобретения
Если не указано иное, все технические и научные термины, использованные в настоящем документе, имеют то же самое значение, в котором они обычно понимаются специалистом в области техники, к которой относится данное изобретение.
Используемые в настоящем документе существительные в единственном числе могут относиться к одному или более чем одному (то есть, по меньшей мере, одному) грамматическому объекту. Например, элемент означает один элемент или более чем один элемент.
Термин «содержит» или «содержащий» обычно используется в смысле включает/включая, что означает, что допускается присутствие одного или нескольких признаков, ингредиентов или компонентов. Термин «содержит» или «содержащий» охватывает термин «состоит» или «состоящий из».
Все числа модифицированы термином «около». Используемый в настоящем документе термин «около» относится к диапазону ±10% от указанного значения.
Термин «субъект» может относиться к позвоночному, имеющему респираторное заболевание, или к позвоночному, которое признается нуждающимся в лечении респираторного заболевания. Субъекты включают теплокровных животных, таких как млекопитающие, такие как примат, и более предпочтительно человека. Не относящиеся к человеку приматы также являются субъектами. Термин «субъект» включает домашних животных, таких как кошки, собаки и т.д., домашний скот (например, крупный рогатый скот, лошади, свиньи, овцы, козы и т.д.) и лабораторных животных (например, мышь, кролик, крыса, песчанка, морская свинка и т.д.). Таким образом, в настоящем документе рассматривается применение в ветеринарии и медицинские рецептуры.
Используемый в настоящем документе термин «по существу свободный» означает, что фармацевтическая композиция содержит менее 5%, 4%, 3%, 2% или 1% конкретного вещества. В некоторых вариантах осуществления фармацевтическая композиция не содержит конкретного вещества.
Используемый в настоящем документе термин «липосома» относится к микроскопическим везикулам или частицам, состоящим из одного или нескольких липидных бислоев, заключающих внутреннюю водную среду. Для образования липосом необходимо присутствие по меньшей мере одного «везикулообразующего липида», который представляет собой амфипатический липид, способный образовывать или внедряться в липидный бислой. Любой подходящий везикулообразующий липид может быть использован для образования липидного бислоя, составляющего липосомы. Везикулообразующий липид включает, но без ограничения, фосфолипиды, такие как фосфатидилхолин (PC), фосфатидилглицерин (PG), фосфатидилинозитол (PI), фосфатидная кислота (РА), фосфатидилэтаноламин (РЕ) или фосфатидилсерин (PS), и заряженные липиды, такие как положительно заряженный липид или отрицательно заряженный липид.
Липидный бислой липосомы включает по меньшей мере один везикулообразующий липид и стерин, который выбран из группы, состоящей из холестерина, гексасукцината холестерина, эргостерина, ланостерина и любой их комбинации, но не ограничивается ими. В иллюстративном варианте осуществления стерин представляет собой холестерин.
В некоторых вариантах осуществления везикулообразующий липид представляет собой смесь первого фосфолипида и второго фосфолипида. В некоторых вариантах осуществления первый фосфолипид представляет собой фосфатидилхолин (PC), который выбран из группы, состоящей из гидрогенизированного фосфатидилхолина яйца (НЕРС), гидрогенизированного фосфатидилхолина сои (HSPC), дипальмитоилфосфатидилхолина (DPPC), дистеароилфосфатидилхолина (DSPC), диарахидоилфосфатидилхолина, димиристоилфосфатидилхолина (DMPC), фосфатидилхолина яйца (ЕРС), фосфатидилхолина сои (SPC), олеоилпальмитоилфосфатидилхолина, диолеоилфосфатидилхолина (DOPC), дипетроселиноилфосфатидилхолина, пальмитоилэлаидоилфосфатидилхолина, пальмитоилолеоилфосфатидилхолина, дилауроилфосфатидилхолина (DLPC), диундеканоилфосфатидилхолина, дидеканоилфосфатидилхолина, динонаноилфосфатидилхолина и любой их комбинации. В других вариантах осуществления второй фосфолипид представляет собой модифицированный полиэтиленгликолем фосфолипид, содержащий полиэтиленгликоль, имеющий молекулярную массу от около 500 до около 10000 дальтон, такой как 1,2-дистеароил-sn-глицеро-3-фосфоэтаноламин-N- [метокси(полиэтиленгликоль)-2000] (DSPE-PEG2000), отрицательно заряженный фосфолипид, такой как дистеарилоилфосфатидилглицерин (DSPG), дипальмитоилфосфатидилглицерин (DPPG) или димиристоилфосфатидилглицерин (DMPG) или (DOPG). В иллюстративном варианте осуществления молярное процентное соотношение первый фосфолипид : холестерин : второй фосфолипид составляет 50-70:20-45:0,1-10, 50-70:20-45:0,5-8 или 55-65:25-40:1-6.
В других вариантах осуществления везикулообразующие липиды представляют собой смесь первого фосфолипида и заряженного липида. В одном иллюстративном варианте осуществления везикулообразующие липиды представляют собой смесь первого фосфолипида, второго фосфолипида и заряженного липида. Заряженный липид включает стеариламин, 1,2-диолеоил-3-триметиламмоний-пропан (DOTAP), 3β-[N-(N',N'-диметиламиноэтан)карбамоил]холестерин (DC-холестерин), N4-холестерин-спермин (GL67), диметилдиоктадециламмоний (DDAB), 1,2-ди-О-октадеценил-3-триметиламмонийпропан (DOTMA), этилфосфохолин (этил PC) или их комбинацию. В другом иллюстративном варианте осуществления молярное процентное соотношение первый фосфолипид : холестерин : заряженный липид составляет 50-70:20-45:0,1-10, 50-70:20-45:0,5-8 или 55-65:25-40:1-6.
В одном варианте осуществления молярное % соотношение HSPC, холестерина и DSPG в липидном бислое составляет 50-70:20-45:0,1-10, 50-70:20-45:0,1-5 или 55-65:25-40:0,5-8. В другом варианте осуществления молярное % соотношение HSPC, холестерина и DSPE-PEG2000 в липидном бислое составляет 50-70:20-45:0,1-10, 50-70:20-45:0,1-5 или 55-65:25-40:0,5-8. В другом варианте осуществления молярное % соотношение DPPC : холестерин:DSPE-PEG2000 в липидном бислое составляет 50-70:20-45:0,5-8, 50-70:20-45:0,1-5 или 55-65:25-40:1-6.
В одном варианте осуществления липидный бислой липосом может также включать по меньшей мере один везикулообразующий липид и поверхностно-активное вещество, которое может представлять собой неионогенное поверхностно-активное вещество, катионное поверхностно-активное вещество или цвиттерионное поверхностно-активное вещество. Неионогенное поверхностно-активное вещество не имеет формально заряженных групп в своей голове. Катионное поверхностно-активное вещество несет чистый положительный заряд в своей голове. Цвиттерионное поверхностно-активное вещество является электрически нейтральным, но несет формальные положительные и отрицательные заряды на разных атомах.
Неограничивающие примеры неионогенных поверхностно-активных веществ включают неионогенные водорастворимые моно-, ди- и триглицериды; неионогенные водорастворимые сложные моно- и диэфиры жирных кислот и полиэтиленгликоля; неионогенные водорастворимые сложные эфиры сорбита и жирных кислот (например, моноолеаты сорбита, такие как TWEEN 20 (полиоксиэтилен 20 сорбита моноолеат), SPAN 80); неионогенные водорастворимые триблок-сополимеры (например, триблок-сополимеры поли(этиленоксид)/поли(пропиленоксид)/поли(этиленоксид), такие как POLOXAMER 406 (PLURONIC F-127)) или их производные.
Неограничивающие примеры катионного поверхностно-активного вещества включают диметилдиалкиламмоний бромид или додецилтриметиламмоний бромид.
Неограничивающие примеры цвиттерионного поверхностно-активного вещества включают 3-(N,N-диметилпальмитиламмонио)пропансульфонат.
В некоторых вариантах осуществления липосомы по существу не содержат ионофор, который представляет собой соединение, способное облегчать транспорт Н+ или ОН- через мембрану липосом.
Растворителем для растворения везикулообразующего липида для получения липосом может быть, например, метанол, этанол, эфир и их комбинации. Необязательно растворитель может быть удален позже сверхкритической жидкостью, и предпочтительно используется в минимальном количестве, чтобы уменьшить время выполнения стадии удаления органического растворителя.
Согласно настоящему изобретению липосомы получают в среде, содержащей бикарбонатную соль. В частности, когда везикулообразующий липид находится в контакте со средой, содержащей бикарбонатную соль, образуется суспензия липосом.
Используемая в настоящем документе «бикарбонатная соль» предпочтительно представляет собой фармацевтически приемлемое соединение в виде соли, включающее бикарбонатный анион и катионный компонент. В одном варианте осуществления катионный компонент соединения в виде соли представляет собой металл. Неограничивающие примеры металла включают металл Группы IA или ПА, такой как калий (К), натрий (Na), кальций (Са), магний (Mg), цезий (Cs) и литий (Li) или металл, отличный от металла Группы IA или IIA, такой как двухвалентное железо (Fe) и никель (Ni). Примеры бикарбонатной соли включают, но без ограничения, бикарбонат калия, бикарбонат натрия, бикарбонат кальция, бикарбонат магния, бикарбонат цезия, бикарбонат лития, бикарбонат никеля, бикарбонат двухвалентного железа или любую их комбинацию.
Липосомы в суспензии подвергают уменьшению размера. Размер липосомы обычно относится к ее диаметру. Уменьшение размера липосом может быть достигнуто рядом способов, таких как экструзия, обработка ультразвуком, методы гомогенизации или методы измельчения, которые хорошо известны и могут быть выполнены специалистами в данной области. Экструзия включает пропускание липосом под давлением один или несколько раз через фильтры, имеющие определенные размеры пор. Фильтры обычно изготавливают из поликарбоната, но фильтры также могут быть изготовлены из любого стойкого материала, который не взаимодействует с липосомами и который является достаточно прочным, чтобы осуществлять экструзию под достаточным давлением. Размер липосом может быть уменьшен с использованием ультразвуковой обработки, при которой ультразвуковая энергия используется для разрушения или расщепления липосом, которые затем спонтанно формируют липосомы меньших размеров. Например, обработку ультразвуком осуществляют погружением стеклянной пробирки, содержащей суспензию липосом, в эпицентр ультразвука ультразвукового аппарата типа бани, или можно использовать ультразвуковой аппарат зондового типа, в котором ультразвуковая энергия генерируется вибрацией титанового зонда в прямом контакте с суспензией липосом. В настоящем изобретении липосомы обычно имеют диаметр от около 50 нм до 500 нм, такой как около 500 нм или менее, около 400 нм или менее, около 300 нм или менее, около 200 нм или менее или около 100 нм или менее.
После установления размера концентрацию бикарбонатной соли во внешней среде регулируют для обеспечения градиента рН между внутренней водной средой и внешней средой, что может быть выполнено несколькими способами, например, путем замены внешней среды подходящим буфером, в котором отсутствуют бикарбонатные соли, таким как цитратный буфер (Н3С6Н5О) и фосфатный буфер (Н3РО4), такими способами, как диафильтрация, диализ, ультрафильтрация или фильтрация в тангенциальном потоке.
В одном варианте осуществления бикарбонатная соль обеспечивает градиент более низкого внешнего и более высокого внутреннего рН между внешней средой и внутренней водной средой липосом. В другом варианте осуществления рН внутренней водной среды по меньшей мере на одну единицу выше, чем рН внешней среды. В еще одном варианте осуществления рН внутренней водной среды составляет около 7, 8, 9 или 10, а рН внешней среды составляет менее 7, менее 6, менее 5, менее 4, менее 3, около 3-7, около 3,5-6,5 или около 4-6. В еще одном иллюстративном варианте осуществления рН внешней среды выше pKa слабокислотного лекарственного средства.
Полученную липосому можно хранить в течение длительного времени перед загрузкой лекарственного средства и введением субъекту. Например, липосомы можно хранить при температуре охлаждения в течение длительного времени перед загрузкой лекарственного средства. Альтернативно, липосомы можно дегидрировать, хранить, а затем регидрировать и загружать одним или несколькими активными агентами, если необходимо, перед введением. Липосомы могут быть также дегидрированы после загрузки одним или несколькими слабокислотными лекарственными средствами. Дегидрирование может быть выполнено рядом способов, доступных и известных в данной области. В некоторых вариантах осуществления липосомы дегидрируют с использованием стандартного аппарата для сушки замораживанием, то есть дегидрирования в условиях низкого давления. Кроме того, липосомы могут быть заморожены, например, с использованием жидкого азота. Сахариды могут быть добавлены в липосомальное окружение, например, в буфер, содержащий липосомы, перед дегидрированием, чтобы обеспечить стабильность и целостность липосомы во время дегидрирования. Примеры сахаридов включают, но без ограничения, мальтозу, лактозу, сахарозу, трегалозу, декстрозу, сорбит, маннит, ксилит или их комбинацию.
Липосомальная суспензия, имеющая градиент более низкого внешнего/более высокого внутреннего рН, как описано выше, готова для загрузки лекарственным средством. Обычно слабокислотное лекарственное средство, подлежащее загрузке, добавляют во внешнюю среду липосомы, и полученную суспензию инкубируют в условиях, обеспечивающих загрузку лекарственного средства во внутреннюю водную среду липосомы, обеспечивая диффузию слабокислотного лекарственного средства во внутреннюю водную среду липосомы и до достижения желаемой концентрации загрузки и эффективности инкапсуляирования (процентное содержание внутреннего/инкапсулированного количества лекарственного средства по отношению к общему количеству лекарственного средства в композиции).
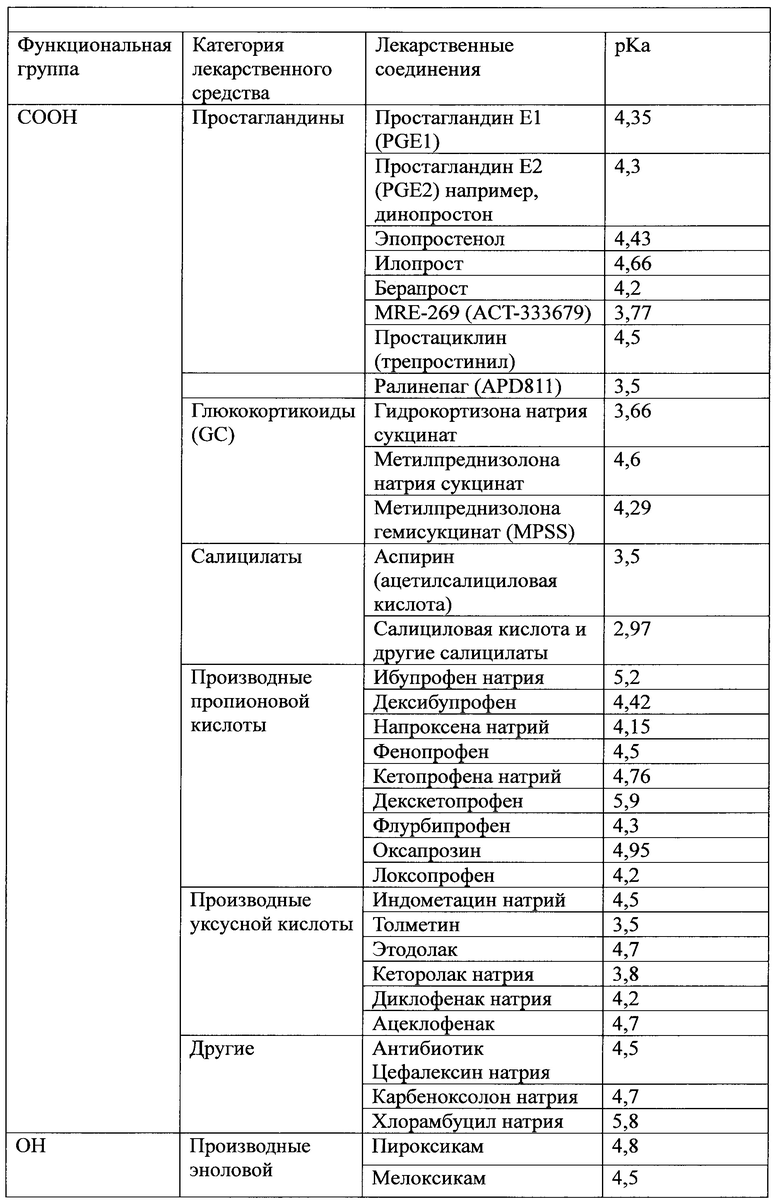
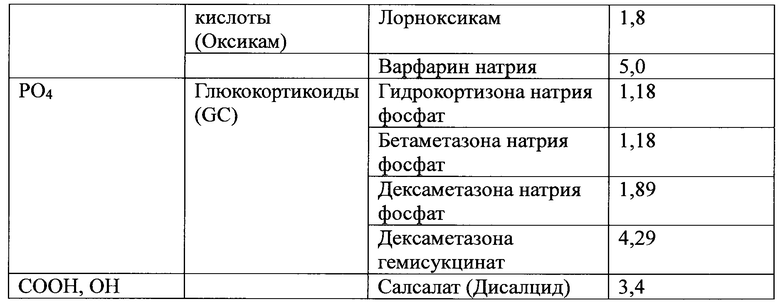
Слабокислотное лекарственное средство, используемое в настоящем документе, если не указано иное или иное не очевидно из контекста, также включает его фармацевтически приемлемую соль и его протонированную форму. В одном варианте осуществления слабокислотное лекарственное средство содержит по меньшей мере одну функциональную группу, выбранную из группы, состоящей из карбоксильной группы (-СООН), гидроксильной группы (-ОН), фосфатной группы (-РО4) и любой их комбинации. В другом варианте осуществления слабокислотное лекарственное средство имеет значение pKa менее чем около 7, менее чем около 6, от 1 до менее чем около 7, от 2 до менее чем около 6, от 2 до 6,9 или от 2,5 до 6. Слабокислотное лекарственное средство может также содержать одну или несколько функциональных групп дополнительно к вышеупомянутой карбоксильной группе (-СООН), гидроксильной группе (-ОН) и фосфатной группе (-РО4); такая дополнительная функциональная группа(ы) не должна значительно изменять кислотность лекарственного средства по сравнению с его нефункционализированными вариантами. В таблице 1 приведены неограничивающие примеры слабокислотного лекарственного средства по настоящему изобретению.

Настоящее изобретение, кроме того, обеспечивает способ изготовления фармацевтической композиции, раскрытой в настоящем документе, включающий следующие стадии:
(i) получение липидного раствора с использованием по меньшей мере одного везикулообразующего липида;
(ii) смешивание липидного раствора, полученного на стадии (i), с бикарбонатной солью с образованием по меньшей мере одной липосомы, содержащей липидный бислой и внутреннюю водную среду, при этом липосома суспендирована во внешней среде;
(iii) регулирование концентрации бикарбонатной соли во внешней среде для получения более низкого значения рН во внешней среде липосомы и более высокого значения рН во внутренней водной среде липосомы, при этом рН внешней среды выше pKa слабокислотного лекарственного средства; и
(iv) добавление слабокислотного лекарственного средства к внешней среде.
В некоторых вариантах осуществления стадия (i) способа включает растворение по меньшей мере одного везикулообразующего липида в органическом растворителе с образованием липидного раствора. Везикулообразующий липид может представлять собой смесь первого фосфолипида и второго фосфолипида или смесь первого фосфолипида и заряженного липида. На стадии (ii) липидный раствор затем смешивают с водным буферным раствором бикарбонатной соли металла с образованием суспензии, которая содержит внешнюю среду и по меньшей мере одну липосому, причем липосома суспендирована во внешней среде. На стадии (iii) концентрация бикарбонатной соли во внешней среде регулируется путем замены внешней среды другим буферным раствором, не содержащим бикарбонатных солей, для получения градиента более низкого внешнего/более высокого внутреннего рН между внешней средой и внутренней фазой липосом. На стадии (iv) слабокислотное лекарственное средство добавляют к внешней среде суспензии, и полученную суспензию инкубируют в предварительно заданных условиях для достижения загрузки лекарственного средства во внутреннюю фазу липосом.
В некоторых вариантах осуществления концентрация бикарбонатной соли во внутренней водной среде составляет от около 50 мМ до менее чем около 1000 мМ на стадии (iii) способа.
В некоторых вариантах осуществления рН внешней среды выше pKa простациклина на стадии (iii) способа. В других вариантах осуществления рН внешней среды по меньшей мере на одну единицу ниже, чем рН внутренней водной среды.
В некоторых вариантах осуществления молярное отношение лекарственного средства к бикарбонатной соли во внутренней водной среде составляет от около 0,1:1 до 1:1 на стадии (iv) способа.
Кроме того, настоящее изобретение обеспечивает способ использования лиофилизированных или замороженных липосом, раскрытых в настоящем документе, для загрузки слабокислотного лекарственного средства во внутреннюю фазу липосом.
В некоторых вариантах осуществления концентрация бикарбонатной соли во внутренней водной среде липосомы составляет 50 мМ или выше, 100 мМ или выше, 150 мМ или выше, 200 мМ или выше, 250 мМ или выше, 300 мМ или выше, 350 мМ или выше, 400 мМ или выше, 450 мМ или выше, 500 мМ или выше, 600 мМ или выше, 700 М или выше, 800 мМ или выше и самое большее менее 1000 мМ. В некоторых вариантах осуществления концентрация бикарбонатной соли в водном буферном растворе составляет от 50 мМ до менее 1000 мМ, от 50 мМ до 800 мМ, от 200 мМ до менее 1000 мМ, от 200 мМ до 800 мМ или от 200 мМ до 600 мМ, от 250 мМ до менее 1000 мМ, от 250 мМ до 800 мМ или от 250 мМ до 600 мМ, от 300 мМ до 600 мМ. В иллюстративном варианте осуществления концентрация бикарбонатной соли во внутренней водной среде липосомы может быть измерена любым способом, который известен или будет известен в данной области техники, или с помощью следующих стадий: (а) отделение бикарбонатной соли во внешней среде от бикарбонатной соли внутренней водной среды с помощью диализа или эксклюзионной хроматографии; (b) липосомную суспензию без бикарбонатной соли во внешней среде растворяют метанолом и определяют концентрацию бикарбонатной соли во внутренней водной среде с помощью ионной хроматографии. В некоторых вариантах осуществления внешняя среда по существу не содержит бикарбонатной соли.
В одном варианте осуществления фармацевтические композиции по настоящему изобретению имеют эффективность инкапсулирования лекарственного средства по меньшей мере 50%, по меньшей мере 55%, по меньшей мере 60%, по меньшей мере 65%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85% или по меньшей мере 90%.
В другом варианте осуществления молярное соотношение лекарственного средства к бикарбонатной соли во внутренней водной среде липосомы (далее в настоящем документе молярное соотношение лекарственное средство/соль) составляет от около 0,1:1 до около 1:1. В иллюстративных вариантах осуществления соотношение лекарственное средство/соль составляет от около 0,1:1 до 0,9:1, от около 0,1:1 до 0,8:1, от около 0,1:1 до 0,7:1, от около 0,1:1 до 0,6:1 или от около 0,1:1 до 0,5:1.
В еще одном варианте осуществления слабокислотное лекарственное средство, инкапсулированное во внутренней фазе липосом, находится при концентрации от 1 мМ до 800 мМ или выше. В некоторых вариантах осуществления лекарственное средство, инкапсулированное во внутренней фазе липосом, находится при концентрации 5 мМ или выше, 10 мМ или выше, 20 мМ или выше, 40 мМ или выше, 50 мМ или выше, 80 мМ или выше, или 100 мМ или выше и не более 800 мМ.
В соответствии с настоящим изобретением фармацевтическая композиция, описанная в настоящем документе, обладает более высокой эффективностью инкапсулирования лекарственного средства, увеличенным молярным отношением слабокислотного лекарственного средства к бикарбонатной соли, составляющим от около 0,1 до около 1, и высокой концентрацией инкапсулированного лекарственного средства. Не будучи связанными какой-либо конкретной теорией, полагают, что более высоко инкапсулированное лекарственное средство или более высокая нагрузка лекарственного средства в фармацевтической композиции, описанной в настоящем документе, обеспечивает доставку большего количества лекарственных средств к участку действия, продлевает эффект инкапсулированного лекарственного средства и обладает более высокой эффективностью в отношении уменьшения симптомов или признаков заболевания.
Фармацевтическую композицию по настоящему изобретению с высокой эффективностью инкапсулирования лекарственного средства или высокой загрузкой лекарственного средства, как описано в настоящем документе, можно вводить в терапевтически эффективном количестве для лечения респираторного заболевания субъекту, нуждающемуся в этом. Примеры респираторного заболевания включают, но без ограничения, легочную гипертензию, хроническую обструктивную болезнь легких (COPD), астму, муковисцидоз, инфекцию нижних дыхательных путей, бронхоэктазию, бронхит, бронхиолит или круп. В иллюстративном варианте осуществления респираторное заболевание представляет собой легочную гипертензию, а слабокислотным лекарственным средством является простациклин или простагландин. В другом иллюстративном варианте осуществления респираторное заболевание представляет собой COPD, а слабокислотным лекарственным средством является стероид или простагландин. В еще одном иллюстративном варианте осуществления респираторное заболевание представляет собой астму, а слабокислотное лекарственное средство представляет собой стероид. В еще одном иллюстративном варианте осуществления респираторное заболевание представляет собой инфекцию нижних дыхательных путей, а слабокислотное лекарственное средство представляет собой антибиотик.
В целом, термин «лечение», используемый в настоящем документе, относится к нанесению или введению фармацевтической композиции, описанной в настоящем документе, включающей по меньшей мере одно слабокислотное лекарственное средство, субъекту, страдающему респираторным заболеванием, симптомом или состояниями респираторных заболеваний, или прогрессированием респираторного заболевания, с целью излечения, заживления, облегчения, снятия боли, изменения, устранения, улучшения, регрессии или воздействия на заболевание, симптомы или состояния заболевания, потерю трудоспособности, вызванную заболеванием, или прогрессирование заболевания. Используемый в настоящем документе термин «терапевтически эффективное количество» относится к количеству слабокислотного лекарственного средства, которое оказывает терапевтический эффект на субъекта. Терапевтически эффективное количество может изменяться в зависимости от различных факторов, таких как способ и частота введения, масса тела и возраст. Специалисты в данной области могут определить дозировку в каждом случае на основании раскрытия в настоящем документе, установленных способов и своего собственного опыта.
В частности, липосомальную композицию, содержащую слабокислотное лекарственное средство, как описано в настоящем документе, вводят путем ингаляции, парентеральной инъекции, то есть внутриартериально, внутривенно, интраперитонеально, подкожно, интравитреально, интратекально, внутрисуставно, внутримышечно, в другие полости человеческого тела или диспергирования посредством аэрозоля. Способы введения посредством аэрозоля включают интраназальное и легочное введение. В некоторых вариантах осуществления липосомальную композицию по изобретению вводят внутривенно или интраперитонеально путем болюсной инъекции или инфузии.
Настоящее изобретение далее проиллюстрировано следующими примерами, которые представлены с целью демонстрации, а не ограничения. Специалистам в данной области техники в свете настоящего раскрытия должно быть понятно, что можно сделать много изменений в раскрытых конкретных вариантах осуществления и все же получить такой же или подобный результат, не отступая от сущности и объема изобретения.
Пример 1. Эффект различных солей на загрузку лекарственного средства.
1. Материалы и способы
1.1. Получение липосомы PGE 1 с использованием ацетата натрия (NaC2H3O2)
Липосомальные коллоидные суспензии получали методом инжекции этанола. Вкратце, 496,8 мг гидрогенизированного соевого фосфатидилхолина (HSPC), 154,65 мг холестерина и 42,15 мг 1,2-дистеарол-sn-глицеро-3-фосфоэтаноламин-N-[метокси(полиэтиленгликоля)-2000] (DSPE-PEG2000) растворяли в 2,86 мл этанола. Раствор липидов в этаноле инжектировали в 17,4 мл ацетата натрия (200 мМ или 400 мМ) при интенсивном перемешивании при 60°С. Образование липосом происходило сразу же после приведения в контакт липидного раствора с ацетатом натрия. После этого липосомальную суспензию экструдировали через поликарбонатную мембрану с размером пор 200 нм и 100 нм (шесть раз, соответственно). Липосому диаметром около 100 нм получали и подвергали диафильтрации против цитратного буфера (рН 5,5) с образованием градиента более высокого внутреннего/более низкого внешнего рН между внешней средой и внутренней водной средой липосом. Пустую липосомальную суспензию затем хранили при 4°С до процесса загрузки лекарственного средства.
PGE1 (алпростадил) добавляли к липосомальной суспензии, полученной в предыдущем параграфе, при различных молярных соотношениях лекарственное средство/липид при комнатной температуре (25°С) в течение 20 мин. Суспензию липосом, загруженную PGE1, хранили при 4°С.
1.2. Получение липосом PGE 1 с использованием бикарбоната натрия (NaHCO3)
Липосомальную суспензию получали в соответствии со способом, описанным в разделе 1.1, за исключением того, что ацетат натрия (200 мМ или 400 мМ) заменяли на бикарбонат натрия (например, 200 мМ, 400 мМ или другие концентрации).
1.3 Количественное определение лекарственных средств
Количество лекарственного средства, инкапсулированного в липосому, определяли с использованием системы Waters Alliance® HPLC с детектором с фотодиодной матрицей (PDA). Вкратце, аликвоту 100 мкл раствора каждого образца непосредственно инжектировали в систему HPLC со смесью метанола и фосфатного буфера (6,7 мМ конц., рН 3,0) в объемном соотношении 80:20 в качестве подвижной фазы при скорости потока 1,0 мл/мин. Разделение проводили в колонке С18 (Phenomenex Prodigy 5U ODS-3 150×4,6 мм), а затем последующую реакцию осуществляли, смешивая с 1N КОН при 65°С. Пик лекарственного средства, например, PGE1 детектировали при 280 нм. Время удерживания составило около 4,6 минут.
1.4 Эффективность инкапсулирования
Эффективность инкапсулирования (ЕЕ), т.е. процентное содержание лекарственного средства, инкапсулированного (или загруженного) во внутренней водной среде липосом, от общего количества лекарственного средства, присутствующего в липосомальной суспензии (т.е. лекарственное средство во внешней среде и лекарственное средство, загруженное во внутреннюю водную среду липосом) количественно определяли следующим образом. Вкратце, липосомальную суспензию подвергали колоночной хроматографии. Свободное или не связанное лекарственное средство (то есть лекарственное средство во внешней среде) и липосомы, содержащие инкапсулированные лекарственные средства во внутренней водной среде, отделяли друг от друга, элюируя липосомальную суспензию через колонку G-25. Количество свободного лекарственного средства определяли с использованием Waters HPLC с детектированием PDA, а количество инкапсулированного лекарственного средства во внутренней водной среде липосомы после разрушения липосом метанолом (90% метанола и 10% липосомальной суспензии) также определяли с использованием этого же способа. Эффективность инкапсулирования рассчитывали по следующей формуле:
ЕЕ (%)=(L / (L+F)) × 100,
где L - количество инкапсулированного лекарственного средства во внутренней водной среде липосом, a F - количество свободного лекарственного средства во внешней среде.
Кроме того, внутреннюю концентрацию лекарственного средства (мМ) рассчитывали следующим образом.
Внутренняя концентрация лекарственного средства (мМ) = [Лекарственное средство [мкг/мл] × ЕЕ% / молекулярная масса] / [захваченный объем*]
(*В определенных условиях захваченный объем составляет 0,0314 мл на мл липосомальной суспензии, тогда как размер липосомальных частиц составляет около 110 нм, а концентрация фосфолипида составляет 10 мМ. Захваченный объем можно рассчитать способом, известным в данной области (Xu et al., International Journal of Pharmaceutics (2012) 423(2), pp. 410-418.)
1.5 Средний размер частиц и индекс полидисперсности (PdI)
Средний размер частиц липосом оценивали с помощью динамического рассеяния света. Индекс полидисперсности (PdI), значение, указывающее распределение липосом по размерам, определяли с использованием такой же методики оценки, что и для средней частицы, с помощью анализатора размера частиц (анализатор частиц (Beckman Coulter Delsa™ Nano С).
2. Результаты
2.1. Бикарбонат натрия обеспечивает более высокую эффективность инкапсулирования лекарственного средства
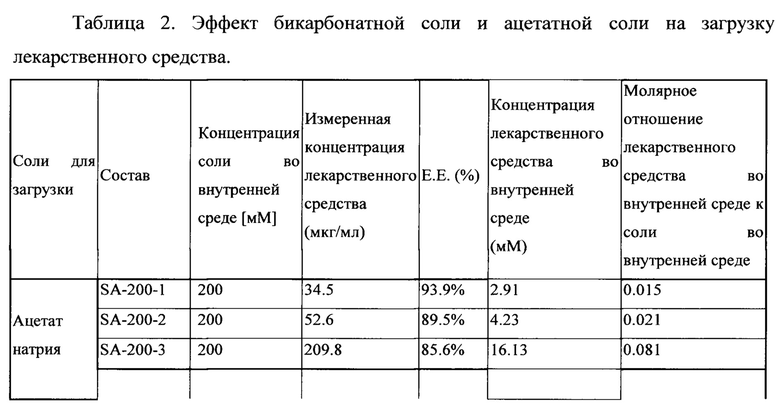
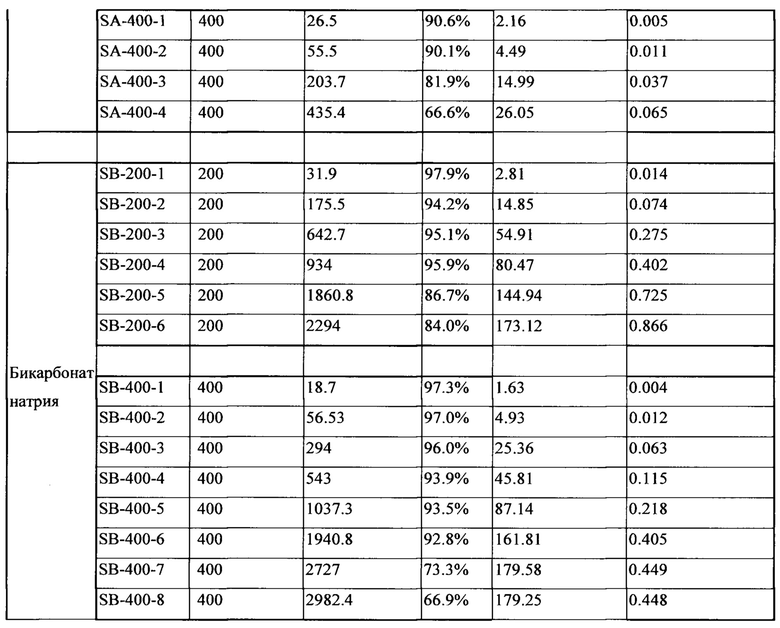
В таблице 2 показана эффективность инкапсулирования лекарственного средства (Е.Е.) и молярное отношение лекарственного средства к соли липосомальных суспензий с использованием бикарбоната натрия и ацетата натрия в качестве солей для загрузки.
a. Липосомальная композиция включает 10 мМ фосфолипида (HSPC:Choi:mPEG-DSPE=3: 1,91: 0,072)
b. Концентрация лекарственного средства во внутренней среде (мМ) = [Лекарственное средство [мкг/мл] × ЕЕ% / молекулярная масса] / [захваченный объем (мл) *]
*В этом примере захваченный объем составляет 0,0314 мл на мл липосомальной суспензии, тогда как размер частиц липосом составляет около 110 нм, и концентрация фосфолипида составляет 10 мМ
Результаты, представленные в таблице 2, указывают на то, что бикарбонат натрия повышает эффективность инкапсулирования лекарственного средства, которое представляет собой слабокислотное лекарственное средство, и значительно увеличивает концентрацию лекарственного средства во внутренней водной среде липосом по сравнению с ацетатом натрия. В частности, молярное соотношение лекарственного средства к бикарбонатной соли составляет менее чем 0,1:1 при использовании ацетата натрия в качестве агента для загрузки, и молярное соотношение не увеличивается в дальнейшем при увеличении вдвое концентрации ацетата натрия, тогда как молярное соотношение лекарственного средства к соли составляет выше 0,1:1 при использовании бикарбоната натрия в качестве агента для загрузки.
Пример 2. Эффект физиологического состояния человека на фармацевтические композиции с использованием бикарбонатной соли для загрузки лекарственного средства.
Липосомальные суспензии с использованием различных концентраций бикарбоната натрия для загрузки PGE1 получали в соответствии с разделом 1.1 примера 1. Липосомальные суспензии инкубировали при 25°С и 37°С в течение 20 минут во внешнем буфере с осмолярностью в диапазоне 280-300 мОсм/кг для имитации физиологического состояния человека.
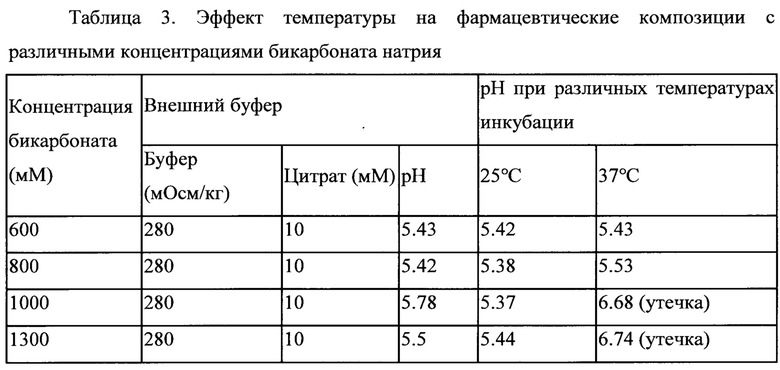
Инкубирование составов с концентрацией бикарбоната выше, чем около 1000 мМ в физиологических условиях человека (37°С и 280-300 мОсм/кг) привело к образованию большего количества СО2 и привело к утечке липосом. Имеющие утечку липосомы высвобождали бикарбонатную соль и лекарственное средство из внутренней водной среды во внешнюю среду и повышали рН внешней среды до значения выше 6,5.
Пример 3. Эффект различных концентраций бикарбонатной соли на загрузку лекарственного средства
Липосомальную суспензию получали в соответствии со способом, описанным в разделе 1.1 примера 1, и PGE1 загружали с различными концентрациями бикарбоната натрия (50 мМ, 150 мМ, 200 мМ, 250 мМ, 300 мМ, 400 мМ, 500 мМ, 600 мМ и 800 мМ).
В таблице 4 показан эффект концентраций бикарбонатной соли на загрузку лекарственного средства.
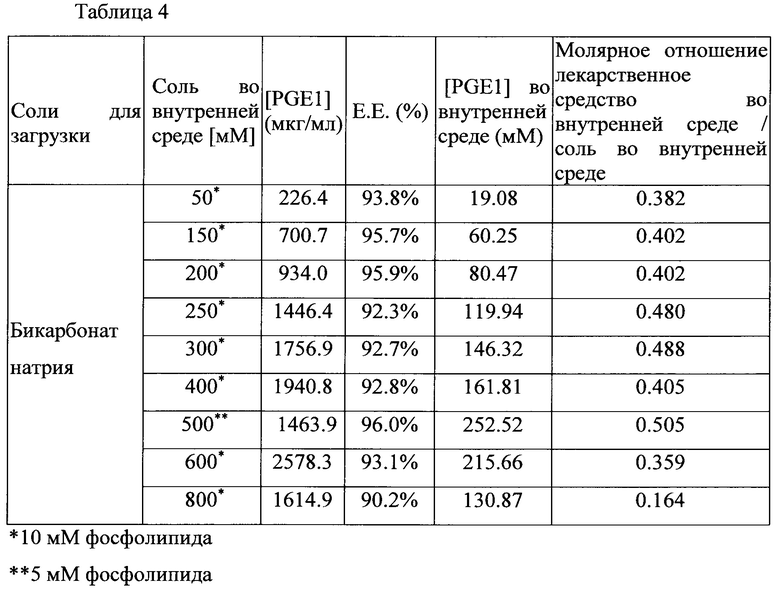
На основании полученных результатов можно предположить, что для фиксированного количества фосфолипида эффективность инкапсулирования лекарственного средства составляет более 90%, и молярное соотношение лекарственного средства к соли составляет выше 0,1:1 при концентрации бикарбонатной соли от 50 мМ до 800 мМ. Концентрация бикарбонатной соли 500 мМ обеспечивает самую высокую эффективность инкапсулирования лекарственного средства и молярное отношение лекарственного средства к соли.
Пример 4: Загрузка различных слабокислотных лекарственных средств с использованием бикарбонатной соли
Первую (4-1) липосомальную суспензию, содержащую HSPC, холестерин и DSPE-mPEG2000 в молярном соотношении 3:2:0,075, получали в соответствии со способом, описанным в Примере 1.
Вторую (4-2) липосомальную суспензию, содержащую HSPC, холестерин и DSPG в молярном соотношении 3:2:0,075, получали в соответствии со способом, описанным в примере 1.
Третью (4-3) липосомальную суспензию, содержащую DPPC, холестерин и DSPE-mPEG2000 в молярном соотношении 3:2:0,075, получали в соответствии со способом, описанным в примере 1.
Четвертую (4-4) липосомальную суспензию, содержащую DSPC, DPPC, холестерин и mPEG2000-DSPE в молярном соотношении 2,7:0,3:2:0,075, получали в соответствии со способом, описанным в примере 1.
Пятую (4-5) липосомальную суспензию, содержащую HSPC, холестерин, mPEG2000-DSPE и стеариламин в молярном соотношении 3:2:0,075:0,025, получали в соответствии со способом, описанным в примере 1.
Шестую (4-6) липосомальную суспензию, содержащую HSPC, DMPC, холестерин и mPEG2000-DSPE в молярном соотношении 2,7:0,3:2:0,075, получали в соответствии со способом, описанным в примере 1.
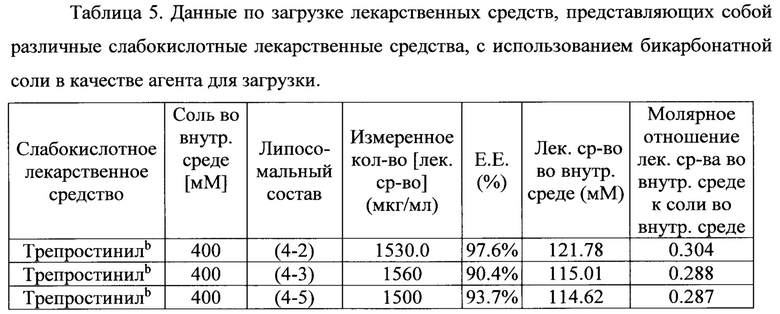
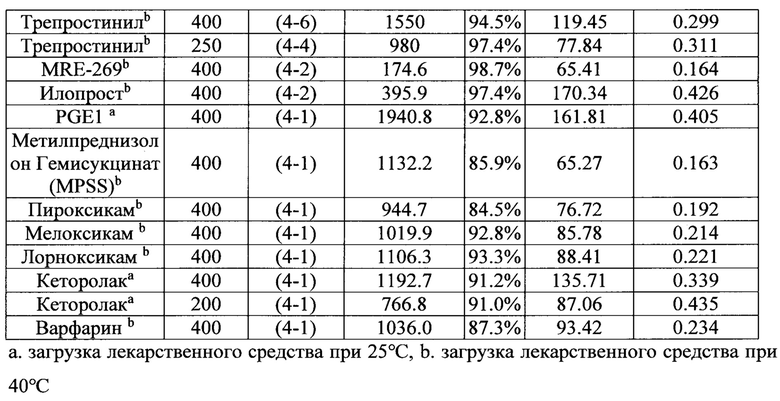
200-400 мМ бикарбонатной соли использовали для загрузки различных слабокислотных лекарственных средств в первую, вторую и третью липосомальные суспензии при 25°С или 40°С в течение 20 минут. Липосомальные суспензии с загруженными лекарственными средствами хранили при 4°С.
В таблице 5 показано, что бикарбонатная соль является эффективным агентом для загрузки различных слабокислотных лекарственных средств, инкапсулированных в различные липосомальные составы, с высокой эффективностью инкапсулирования лекарственных средств (выше 80%) и молярным соотношением лекарственного средства к соли больше, чем 0,1:1.
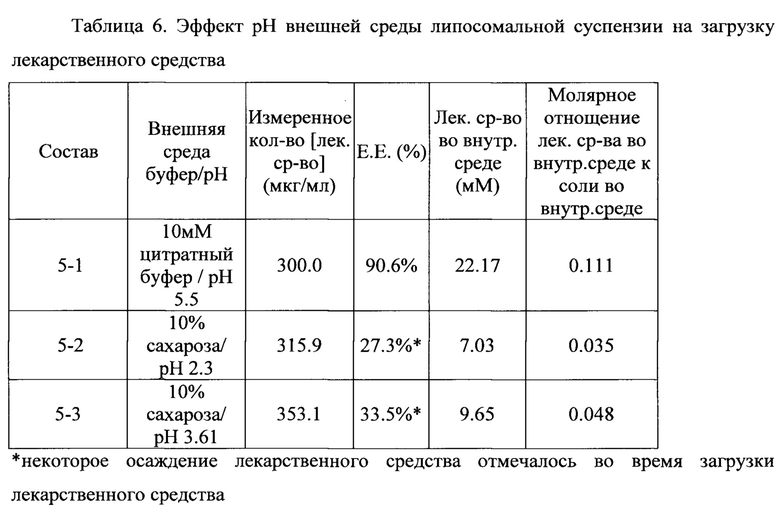
Пример 5. Эффект рН внешней среды липосомальной суспензии на загрузку лекарственного средства
Получали первую (5-1) липосомальную суспензию, содержащую HSPC, холестерин и mPEG2000-DSPE в молярном соотношении 3:2:0,075, а также вторую (5-2) и третью (5-3) липосомальные суспензии, содержащие HSPC, холестерин и mPEG2000-DSPE в молярном соотношении 3:2:0,28. Трепростинил загружали в липосомальные суспензии с 200 мМ бикарбоната.
Значение рН внешней среды первой (5-1) липосомальной суспензии выше рKа лекарственного средства (pKa трепростинила составляет 4,5), и значения рН внешней среды второй липосомальной суспензии (5-2) и третьей липосомальной суспензии (5-3) ниже рKа лекарственного средства.
В таблице 6 показано, что значение рН внешней среды липосомальной суспензии играет важную роль в загрузке лекарственного средства. В частности, эффективность инкапсулирования лекарственного средства является значительно более высокой, если значение рН внешней среды липосомальной суспензии выше pKa лекарственного средства по сравнению со значением рН липосомальной суспензии, которое ниже pKa лекарственного средства (90,6% против 27,3% и 33,5%). Аналогично, молярное соотношение лекарственного средства во внутренней среде к соли выше, чем 0,1:1, если значение рН внешней среды липосомальной суспензии выше pKa лекарственного средства по сравнению со значением рН липосомальной суспензии, которое ниже pKa лекарственного средства, которое составляет менее 0,1:1.
Пример 6: Терапевтическая эффективность фармацевтических композиций с высокой загрузкой лекарственного средства
Оценку in vivo терапевтической эффективности фармацевтической композиции по примеру 4 (липосомальная суспензия 4-2, инкапсулированная около 1,5 мг трепростинила с использованием 400 мМ бикарбонатной соли) на легочную гипертензию выполняли с использованием 18 самцов крыс Sprague Dawley, каждая из которых весила примерно 300-350 г.
Для того, чтобы вызвать легочную гипертензию, в легочную артерию каждой крысы вводили катетер для измерения давления. Один конец катетера был обнажен на затылке и соединен с датчиком давления. Через 24 часа после введения катетера крыс переносили в гипоксическую камеру, где уровень кислорода (О2) снижали до 10% (FiO2=0,1) за счет увеличения уровня азота (N2). После установления стабильной легочной гипертензии каждой крысе вводили однократную дозу трех тестируемых препаратов: солевой раствор (N=6), свободный трепростинил в дозе 6 мкг/кг (N=6) или фармацевтическую композицию по примеру 4 с трепростинилом в дозе 6 мкг/кг (липосомальный трепростинил, N=6). Тестируемый препарат вводили с помощью микрораспылителя в зоне бифуркации трахеи крысы. После введения тестируемого препарата измеряли среднее значение давления в легочной артерии (РАР) в запланированные моменты времени.
Результаты показывают, что липосомальный трепростинил является более эффективным в отношении достижения максимального снижения среднего значения РАР после инъекции по сравнению со свободным трепростинилом (40% среднее снижение РАР в группе, получавшей липосомальный трепростинил, против 20% среднего снижения РАР в группе, получавшей свободный трепростинил).
| название | год | авторы | номер документа |
|---|---|---|---|
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ СЛАБОКИСЛОТНОГО ЛЕКАРСТВЕННОГО СРЕДСТВА И СПОСОБЫ ПРИМЕНЕНИЯ | 2020 |
|
RU2832678C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ УПРАВЛЯЕМОГО ВЫСВОБОЖДЕНИЯ СЛАБОКИСЛОТНЫХ ЛЕКАРСТВЕННЫХ СРЕДСТВ И ЕЕ ПРИМЕНЕНИЯ | 2019 |
|
RU2810790C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ КОНТРОЛИРОВАННОГО ВЫСВОБОЖДЕНИЯ ТРЕПРОСТИНИЛА | 2019 |
|
RU2796305C2 |
| ЛИПОСОМНЫЕ КОМПОЗИЦИИ, ИСПОЛЬЗУЕМЫЕ ДЛЯ ДОСТАВКИ ЛЕКАРСТВЕННЫХ СРЕДСТВ | 2015 |
|
RU2757110C2 |
| СТАБИЛЬНЫЕ ЛИПОСОМАЛЬНЫЕ КОМПОЗИЦИИ | 2004 |
|
RU2369384C2 |
| СТАБИЛИЗИРУЮЩИЕ ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ КАМПТОТЕЦИНА | 2016 |
|
RU2833053C2 |
| УСОВЕРШЕНСТВОВАННЫЕ ЛИПОСОМЫ И ИХ ПРИМЕНЕНИЕ | 2008 |
|
RU2482837C2 |
| СТАБИЛИЗИРОВАННЫЕ ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ КАМПТОТЕЦИНА | 2016 |
|
RU2732567C2 |
| ЛИПОСОМАЛЬНАЯ КОМПОЗИЦИЯ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 2018 |
|
RU2734900C1 |
| СРЕДСТВО ДЛЯ ЛЕЧЕНИЯ ОПУХОЛИ И НАБОР, СОДЕРЖАЩИЙ ЛИПОСОМАЛЬНУЮ КОМПОЗИЦИЮ ГЕМЦИТАБИНА | 2016 |
|
RU2761620C2 |
Группа изобретений относится к области медицины, а именно к фармацевтической композиции для лечения и/или профилактического лечения легочной гипертензии, хронической обструктивной болезни легких (СОРD), астмы, муковисцидоза, инфекции нижних дыхательных путей, бронхоэктазии, бронхита, бронхиолита или крупа, содержащей одну или несколько липосом, при этом указанная липосома содержит: (а) липидный бислой, содержащий по меньшей мере один везикулообразующий липид; и (b) внутреннюю водную среду внутри липидного бислоя, содержащую бикарбонатную соль при концентрации от 50 мМ±10% до 800 мМ±10% и слабокислотное лекарственное средство с рКа от 1±10% до 6±10%, при этом липосомы суспендированы во внешней водной среде, при этом рН внешней водной среды выше значения рКа слабокислотного лекарственного средства, составляющего до 7±10%, и рН внутренней водной среды по меньшей мере на одну единицу выше, чем рН внешней водной среды, также относится к способу лечения респираторного заболевания, включающему стадии введения фармацевтической композиции, содержащей одну или несколько липосом, при этом указанная липосома содержит: (a) липидный бислой, содержащий по меньшей мере один везикулообразующий липид; и (b) внутреннюю водную среду внутри липидного бислоя, содержащую бикарбонатную соль при концентрации от 50 мМ±10% до 800 мМ±10% и слабокислотное лекарственное средство, где слабокислотное лекарственное средство представляет собой простагландин, стероид, антибиотик, варфарин, нестероидное противовоспалительное лекарственное средство (NSAID) или любую их комбинацию, при этом липосомы суспендированы во внешней водной среде, при этом рН внешней водной среды выше значения рКа слабокислотного лекарственного средства, составляющего до 7±10%, при этом рН внутренней водной среды по меньшей мере на одну единицу выше, чем рН внешней водной среды, и респираторное заболевание представляет собой легочную гипертензию, хроническую обструктивную болезнь легких (COPD), астму, муковисцидоз, инфекцию нижних дыхательных путей, бронхоэктазию, бронхит, бронхиолит или круп, и также относится к фармацевтической композиции для лечения и/или профилактического лечения легочной гипертензии, содержащей одну или более липосом, при этом указанная липосома содержит: (а) липидный бислой, содержащий по меньшей мере один везикулообразующий липид; и (b) внутреннюю водную среду внутри липидного бислоя, содержащую бикарбонатную соль при концентрации от 50 мМ±10% до 800 мМ±10% и простациклин, при этом липосомы суспендированы во внешней водной среде, при этом рН внешней водной среды выше значения pКа простациклина, составляющего до 7±10%, и pН внешней водной среды по меньшей мере на одну единицу выше, чем pН внешней среды. Группа изобретений обеспечивает создание липосомальных композиций, обладающих высокой эффективностью загрузки лекарственного средства, для повышения терапевтической эффективности. 3 н. и 19 з.п. ф-лы, 6 табл., 6 пр.
1. Фармацевтическая композиция для лечения и/или профилактического лечения легочной гипертензии, хронической обструктивной болезни легких (СОРD), астмы, муковисцидоза, инфекции нижних дыхательных путей, бронхоэктазии, бронхита, бронхиолита или крупа, содержащая одну или несколько липосом, при этом указанная липосома содержит:
(a) липидный бислой, содержащий по меньшей мере один везикулообразующий липид; и
(b) внутреннюю водную среду внутри липидного бислоя, содержащую бикарбонатную соль при концентрации от 50 мМ±10% до 800 мМ±10% и слабокислотное лекарственное средство с рКа от 1±10% до 6±10%,
при этом липосомы суспендированы во внешней водной среде, при этом рН внешней водной среды выше значения рКа слабокислотного лекарственного средства, составляющего до 7±10%, и рН внутренней водной среды по меньшей мере на одну единицу выше, чем рН внешней водной среды.
2. Фармацевтическая композиция по п. 1, отличающаяся тем, что молярное соотношение слабокислотного лекарственного средства и бикарбонатной соли составляет от 0,1:1 до 1:1.
3. Фармацевтическая композиция по п. 1 или 2, отличающаяся тем, что концентрация бикарбонатной соли составляет от 250 мМ±10% до 800 мМ±10%.
4. Фармацевтическая композиция по любому из пп. 1-3, отличающаяся тем, что везикулообразующий липид представляет собой смесь первого фосфолипида и второго фосфолипида или смесь первого фосфолипида и заряженного липида.
5. Фармацевтическая композиция по п. 4, отличающаяся тем, что первый фосфолипид представляет собой фосфатидилхолин (PС), фосфатидилглицерин (PG), фосфатидилинозитол (PI), фосфатидную кислоту (PА), фосфатидилэтаноламин (PЕ), фосфатидилсерин (PS) или любую их комбинацию, второй фосфолипид представляет собой РЕG-модифицированный фосфолипид, положительно заряженный или отрицательно заряженный фосфолипид, и заряженный липид представляет собой положительно заряженный или отрицательно заряженный липид.
6. Фармацевтическая композиция по п. 5, отличающаяся тем, что первый фосфолипид представляет собой НSPС, DSPС, DPPС, DМPС или любую их комбинацию и второй фосфолипид представляет собой DSРG, DPPG, DМРG, РЕG-DSРЕ или любую их комбинацию.
7. Фармацевтическая композиция по п. 6, отличающаяся тем, что первый фосфолипид представляет собой НSРС, DSРС, DРРС, DМРС или любую их комбинацию и заряженный липид представляет собой стеариламин, 1,2-диолеоил-3-триметиламмоний-пропан (DОТАР), 3β-[N-(N',N'-диметиламиноэтан)карбамоил]холестерин (DC-холестерин), N4-холестерин-спермин (GL67), диметилдиоктадециламмоний (DDАВ), 1,2-ди-О-октадеценил-3-триметиламмоний-пропан (DОТМА), этилфосфохолин (этил РС) или любую их комбинацию.
8. Фармацевтическая композиция по любому из пп. 1-7, отличающаяся тем, что липидный бислой дополнительно содержит стерин.
9. Фармацевтическая композиция по п. 8, отличающаяся тем, что стерин представляет собой холестерин, гексасукцинат холестерина, эргостерин, ланостерин или любую их комбинацию.
10. Фармацевтическая композиция по п. 9, отличающаяся тем, что молярное процентное соотношение первый фосфолипид:холестерин:второй фосфолипид или заряженный липид составляет 50-70:20-45:0.1-10.
11. Фармацевтическая композиция по любому из пп. 1-10, отличающаяся тем, что бикарбонатная соль представляет собой бикарбонат калия, бикарбонат натрия, бикарбонат кальция, бикарбонат магния, бикарбонат цезия, бикарбонат лития, бикарбонат никеля, бикарбонат двухвалентного железа или любую их комбинацию.
12. Фармацевтическая композиция по любому из пп. 1-11, отличающаяся тем, что слабокислотное лекарственное средство представляет собой простагландин, стероид, нестероидное противовоспалительное лекарственное средство (NSAID), антибиотик или антикоагулянт.
13. Способ лечения респираторного заболевания, включающий стадии введения фармацевтической композиции, содержащей одну или несколько липосом, при этом указанная липосома содержит:
(a) липидный бислой, содержащий по меньшей мере один везикулообразующий липид; и
(b) внутреннюю водную среду внутри липидного бислоя, содержащую бикарбонатную соль при концентрации от 50 мМ±10% до 800 мМ±10% и слабокислотное лекарственное средство, где слабокислотное лекарственное средство представляет собой простагландин, стероид, антибиотик, варфарин, нестероидное противовоспалительное лекарственное средство (NSAID) или любую их комбинацию,
при этом липосомы суспендированы во внешней водной среде, при этом рН внешней водной среды выше значения рКа слабокислотного лекарственного средства, составляющего до 7±10%, при этом рН внутренней водной среды по меньшей мере на одну единицу выше, чем рН внешней водной среды, и респираторное заболевание представляет собой легочную гипертензию, хроническую обструктивную болезнь легких (COPD), астму, муковисцидоз, инфекцию нижних дыхательных путей, бронхоэктазию, бронхит, бронхиолит или круп.
14. Способ по п. 13, отличающийся тем, что бикарбонатная соль представляет собой бикарбонат калия, бикарбонат натрия, бикарбонат кальция, бикарбонат магния, бикарбонат цезия, бикарбонат лития, бикарбонат никеля, бикарбонат двухвалентного железа или любую их комбинацию.
15. Способ по п. 13 или 14, отличающийся тем, что везикулообразующий липид представляет собой смесь первого фосфолипида и второго фосфолипида или смесь первого фосфолипида и заряженного липида.
16. Способ по любому из пп. 13-15, где липидный бислой дополнительно содержит стерин.
17. Способ по п. 16, где стерин представляет собой холестерин, гексасукцинат холестерина, эргостерин, ланостерин или любую их комбинацию.
18. Фармацевтическая композиция для лечения и/или профилактического лечения легочной гипертензии, содержащая одну или более липосом, при этом указанная липосома содержит:
(a) липидный бислой, содержащий по меньшей мере один везикулообразующий липид; и
(b) внутреннюю водную среду внутри липидного бислоя, содержащую бикарбонатную соль при концентрации от 50 мМ±10% до 800 мМ±10% и простациклин,
при этом липосомы суспендированы во внешней водной среде, при этом рН внешней водной среды выше значения pКа простациклина, составляющего до 7±10%, и pН внешней водной среды по меньшей мере на одну единицу выше, чем pН внешней среды.
19. Фармацевтическая композиция по п. 18, отличающаяся тем, что бикарбонатная соль представляет собой бикарбонат калия, бикарбонат натрия, бикарбонат кальция, бикарбонат магния, бикарбонат цезия, бикарбонат лития, бикарбонат никеля, бикарбонат двухвалентного железа или любую их комбинацию.
20. Фармацевтическая композиция по п. 18 или 19, отличающаяся тем, что везикулообразующий липид представляет собой смесь первого фосфолипида и второго фосфолипида или смесь первого фосфолипида и заряженного липида.
21. Фармацевтическая композиция по любому из пп. 18-20, отличающаяся тем, что липидный бислой дополнительно содержит стерин.
22. Фармацевтическая композиция по п. 21, отличающаяся тем, что стерин представляет собой холестерин, гексасукцинат холестерина, эргостерин, ланостерин или любую их комбинацию.
| WO 9625147 A1, 22.08.1996 | |||
| US 2015328232 A1, 19.11.2015 | |||
| US 5262168 A, 16.11.1993 | |||
| US 5811118 A, 22.09.1998. |
Авторы
Даты
2022-08-29—Публикация
2018-07-23—Подача