Настоящим изобретением обеспечивается молекула нуклеиновой кислоты, которая кодирует полипептид, состоящий из двух остатков метионина в качестве первого и второго N-концевых аминокислотных остатков, соединенных через пептидную связь со зрелым эукариотическим гистоном. Настоящее изобретение, кроме того, относится к вектору, содержащему указанную молекулу нуклеиновой кислоты, хозяину, трансформированному указанным вектором, полипептидам, кодируемым молекулой нуклеиновой кислоты, и фармацевтическим и диагностическим композициям. Настоящее изобретение также относится к применению молекулы нуклеиновой кислоты, векторов, хозяев и полипептида настоящего изобретения для приготовления композиции для лечения заболеваний. Кроме того, настоящее изобретение относится к способу проверки присутствия молекулы нуклеиновой кислоты или полипептида в образце и к набору.
По всему этому описанию приводится множество документов. Раскрывающее суть содержание указанных документов, в том числе инструкций производителей, полностью включено сюда посредством ссылки.
В настоящее время существует огромный экономический интерес к продукции на высоком уровне таких рекомбинантных белков, как гистоны. Продукция больших количеств рекомбинантных белков представляет интерес не только с целью обеспечения достаточного количества белка для исследований их свойств и функций, но также для обеспечения больших количеств белка для терапевтического применения.
Огромное количество параметров должно быть учтено для успешных продукций на высоком уровне и очистки рекомбинантных белков. Важные параметры включают условия экспрессии, регуляцию трансляции и стабильность мРНК, направленную доставку и деструкцию белка (Makrides, S., Microbiological Reviews, 1996: 512).
Одним из подходов для улучшения продукции, выявления и очистки рекомбинантных белков является использование широкого выбора партнеров по слиянию (Makrides, S., Microbiological Reviews, 1996: 512). Были детально разработаны методы для включения аффинных меток для очистки и выявления рекомбинантных белков. В таких аффинных метках объединены выгодные способности делать возможной более эффективную очистку и в то же самое время также делать возможным легкое выявление рекомбинантного белка на основе метки. Однако во многих случаях добавление довольно большой аффинной метки может быть невыгодным из-за нежелательных эффектов на трансляцию, укладку и активность белка. Особенно при употреблении для терапевтических применений часто необходимо последующее удаление аффинной метки, что тем самым ослабляет некоторые положительные эффекты (например, легкое выявление), которые аффинная метка придает белку (Gellissen, G. “Production of Recombinant Proteins”, 2005, WILEY-VCH Verlag GmbH&Co., KgaA, Weinheim).
Включение остатка метионина на N-конце каждого полипептида в процессе возникновения является частью универсального сигнала инициации трансляции, используемого прокариотами, а также эукариотами. У E.coli удаление этого N-концевого остатка метионина успешно выполняется цитоплазматическим ферментом метионин-аминопептидазой (map) (Hirel et al., Biochemistry, 1998, 86: 8247).
Установлено, что эффективное отщепление N-концевого остатка метионина рекомбинантных эукариотических белков, продуцируемых в прокариотах, например в E.coli, зависит от смежной с метионином аминокислоты. Хотя существуют противоречивые данные для некоторых аминокислот, кажется, согласны, что вероятность отщепления является наибольшей для небольших и незаряженных аминокислотных остатков Ala, Gly, Pro, Ser, Val, Cys и Thr. По-видимому, большие боковые цепи неблагоприятны для отщепления метионина (Hirel et al., Biochemistry, 1989, 86: 8247; Frottin et al., Mol. & Cell Proteomics, 2006, 12: 2336; Gellissen, G. “Production of recombinant Protein”, 2005, WILEY-VCH Verlag GmbH&Co., KgaA, Weinheim).
Полагают, что отщепление N-концевого метионина играет важную роль в стабильности белка (Giglione et al., EMBO J., 2003, 1: 13), а также в правильном функционировании белка, как установлено, например, для MEF-2C, гемоглобина человека, интерлейкина-2, гомологов РНКазы A или рибонуклеазы лягушки (Meierhans and Allemann, J. Biol. Chem. 1998, 273: 26052; Adachi, K. et al., Protein Expr. Purif., 2000, 20; 37; Endo, S. et al., Biochemistry, 2001, 40: 914; Boix, E. et al., J. Mol. Biol., 1996, 257: 992; Liao, Y.D. et al., Nucleic Acids Res., 2003, 31: 5247; Varshavsky, A., Proc. Natl. Acad. Sci., 1996, 93: 12142). Дополнительная доктрина, касающаяся того, почему природа сохранила такую специализированную ферментативную систему для удаления остатка метионина, состоит в повторном использовании клеточного пула метионинов для экономного расходования этой незаменимой аминокислоты (Hirel et al., Biochemistry. 1989, 86: 8247).
В ЕР1254166 описывается рекомбинантная продукция белков гистонов в E.coli. Такая рекомбинантная продукция белков человека считается преимущественной для терапевтических применений, а также более эффективной и экономически эффективной по сравнению с препаратами из зобной железы человека или теленка. Кроме того, рекомбинантная продукция белков делает возможным лучший контроль качества во время процесса продукции.
Pyo и др. (Pyo, S.H. et al., Protein Expr. Purif., 2001, 1: 38) описывают продукцию рекомбинантного гистона Н1.5 в E.coli, используя сильно основные свойства гистона для разработки эффективного способа крупномасштабной очистки рекомбинантного белка.
Хотя в предшествующем уровне техники была продемонстрирована продукция на высоком уровне рекомбинантных белков, существует, тем не менее, реальная необходимость в нахождении подходящих способов выявления результирующего рекомбинантного белка. Как обсуждалось выше, применение аффинных меток, таких как His-метки, широко используется в данной области техники, но может быть проблематичным при продукции белков для терапевтического применения.
Таким образом, лежащей в основе настоящего изобретения технической проблемой было обеспечение улучшенных рекомбинантных эукариотических полипептидов, которые, например, позволяют упростить продукцию и выявление.
Решение этой технической проблемы достигается с помощью вариантов осуществления, охарактеризованных в формуле изобретения.
Соответственно, в первом варианте осуществления настоящее изобретение относится к молекуле нуклеиновой кислоты, которая (а) кодирует полипептид, состоящий из (аа) двух остатков метионина в качестве первого и второго N-концевых аминокислотных остатков, соединенных через пептидную связь со (ab) зрелым эукариотическим гистоном; (b) кодирует полипептид, состоящий из (ba) двух остатков метионина в качестве первого и второго N-концевых аминокислотных остатков, соединенных через пептидную связь со (bb) зрелым эукариотическим полипептидом, последовательность которого, по крайней мере, на 80% идентична последовательности зрелого эукариотического гистона (а) и в котором существенным образом сохраняется его биологическая активность; или (с) гибридизуется в жестких условиях с комплементарной цепью молекулы нуклеиновой кислоты, кодирующей полипептид (а) или (b), причем указанная молекула нуклеиновой кислоты кодирует полипептид, который имеет, по крайней мере, два N-концевых остатка метионина и в котором существенным образом сохраняется биологическая активность полипептида (а) или (b).
В соответствии с настоящим изобретением молекулы нуклеиновых кислот включают ДНК, например, кДНК или геномную ДНК, РНК (например, мРНК), также в синтетической или полусинтетической форме, дальнейшие синтетические или полусинтетические производные ДНК или РНК (например, ПНК или фосфоротиоаты) и сополимеры, как смысловые, так и антисмысловые цепи. Они могут содержать дополнительные неприродные или производные нуклеотидные основания, как это будет быстро понятно квалифицированным в данной области техники специалистам. В предпочтительном варианте осуществления молекулой нуклеиновой кислоты является ДНК, в том числе геномная ДНК.
Для целей настоящего изобретения пептидо-нуклеиновая кислота (ПНК) является полиамидным типом аналога ДНК, и в продаже имеются мономерные единицы для производных аденина, гуанина, тимина и цитозина (Perceptive Biosystems). Некоторые компоненты ДНК, такие как фосфор, трехокись фосфора или производные дезоксирибоз, не присутствуют в ПНК. Как описывается Nielsen и др. (Science 254: 1497 (1991)) и Egholm и др. (Nature 365: 666 (1993)), РНК связываются специфически и прочно с комплементарными цепями ДНК и не подвергаются деструкции нуклеазами. В действительности ПНК связывается сильнее с ДНК, чем сама ДНК. Это вероятно обусловлено тем, что нет электростатического отталкивания между двумя цепями, а также тем, что остов полиамида является более гибким. Из-за этого дуплексы ПНК/ДНК образуются в более широком диапазоне условий жесткости, чем дуплексы ДНК/ДНК, что делает выполнение мультиплексной гибридизации более легким. Благодаря сильному связыванию могут использоваться зонды меньшего размера, чем с ДНК. Кроме того, с большей вероятностью можно определить дефект спаривания по одному основанию при использовании гибридизации ПНК/ДНК, поскольку дефект спаривания по одному основанию в 15-мере ПНК/ДНК понижает точку плавления (T.sub.m) на 8-20° ПНК/ДНК в сравнении с 4-16° для 15-мерного дуплекса ДНК/ДНК. Также отсутствие заряженных групп в ПНК означает, что гибридизацию можно проводить при низкой ионной силе и уменьшить возможное мешающее действие соли во время анализа.
Используемым здесь термином «полипептид» характеризуется группа молекул, которые состоят из более 30 аминокислот. В соответствии с настоящим изобретением группа полипептидов включает «белки». Полипептиды могут далее образовывать димеры, тримеры и олигомеры высшего порядка, т.е. состоящие из более одной полипептидной молекулы. Полипептидные молекулы, образующие такие димеры, тримеры и т.п., могут быть идентичными или неидентичными. В результате соответствующие структуры высшего порядка называют гомо- или гетеродимерами, гомо- или гетеротримерами и т.п. Гомо- и гетеродимеры и т.п. также попадают под определение термина «белок». Полипептиды могут, кроме того, быть слитыми белками, причем партнер по слиянию присоединяют к С-концу полипептида настоящего изобретения. Эти компоненты указанных слитых белков, которые не являются последовательностями гистонов или их фрагментами или вариантами, охарактеризованными здесь выше, включают аминокислотные последовательности, которые придают желаемые свойства, такие как модифицированная/увеличенная стабильность, модифицированная/увеличенная растворимость и/или способность к направленной доставке в один или несколько специфических типов клеток, или могли бы сообщать отличную биологическую активность. Например, предусматриваются белки, слитые с антителами, специфичными для маркеров клеточной поверхности, или с узнающими антиген фрагментами таких антител. Кроме того, настоящим изобретением также охватываются пептидомиметики таких полипептидов, в которых аминокислота(ы) и/или пептидная связь(и) заменены функциональными аналогами. Такие функциональные аналоги включают все известные аминокислоты, отличные от 20 кодируемых генами аминокислот, такие как селеноцистеин. Термины «полипептид» и «белок» также относятся к природно-модифицированным полипептидам/белкам, причем модификация осуществляется, например, при гликозилировании, ацетилировании, фосфорилировании и т.п. Такие модификации широко известны в данной области техники.
Термин «метионин», в соответствии с настоящим изобретением, хорошо известен квалифицированному в данной области техники специалисту. Метионин является незаменимой аминокислотой, кодируемой кодоном AUG в соответствии со стандартным генетическим кодом. Указанный метионин, поскольку он обнаружен у эукариот, вносит вклад в предпочтительный вариант осуществления настоящего изобретения. N-формилметионин прокариот также включен в значение термина «метионин» и вносит вклад в альтернативный вариант осуществления настоящего изобретения.
Используемый здесь термин «первый и второй N-концевые аминокислотные остатки» относится к аминокислотным остаткам, обнаруживаемым в положениях 1 и 2 полипептида настоящего изобретения. Эти остатки также упоминаются в данной области техники как последний и предпоследний остатки на N-конце. Другими словами, первый остаток метионина находится в N-концевом положении исходного продукта трансляции полипептида, который сам содержит метионин на своем N-конце.
Используемый здесь термин «пептидная связь» хорошо известен квалифицированному в данной области техники специалисту и относится к химической связи, образуемой между двумя молекулами аминокислот, причем карбоксильная группа одной аминокислоты реагирует с аминогруппой другой аминокислоты.
Термин «зрелый эукариотический гистон», в соответствии с настоящим изобретением, относится к гистону, лишенному его начального N-концевого метионина. Как это хорошо известно квалифицированному в данной области техники специалисту, при трансляции полипептидов используется универсальный сигнал инициации трансляции, который приводит к включению метионина в качестве начального аминокислотного остатка на N-конце транслированного полипептида. У эукариот, и отчасти также у прокариот, этот N-концевой метионин отщепляется при «созревании» полипептида.
В соответствии с настоящим изобретением термин «гистон» относится к группе белков, включающей гистоны ядра Н2А (№ доступа в Swiss-Prot для Н2А человека - Р02261), H2B (№ доступа в Swiss-Prot для H2B человека - Р02278), Н3 (№ доступа в Swiss-Prot для Н3.1 человека - Р16106) и Н4 (№ доступа в Swiss-Prot для Н4 человека - Р02304), и семейству линкерных гистонов Н1 (смотри ниже № доступа в Swiss-Prot). Классически гистоны известны в качестве структурных компонентов клеточного ядра, в котором они действуют в качестве «катушек», на которые намотана ДНК, и играют ключевую роль в генной регуляции. Однако гистоны демонстрируют широкую многофункциональность (Reichhard, R. et al., Proc. Natl. Acad. Sci. 1985, 82: 4871; Reichhard, R. et al., FEBS 1985, 188: 63). Установлено, например, что гистоны действуют системно в качестве гормонов и регуляторных факторов, а также несут важные защитные функции.
Благодаря своей широкой многофункциональности гистоны стали важны в ряде терапевтических подходов. Например, установлено, что гистоны Н1, Н2А и Н2В стимулируют периферические здоровые лимфоциты (Cebecauer, L. et al. Rheumatologia 1991, 5: 107). Установлено, что гистон Н1 улучшает регенерацию мышечной ткани путем стимуляции пролиферации миобластов (Henriquez, J.P. et al., J. Cell Sci. 2002, 115: 2041), изменяет картину заболеваний, характеризующихся амилоидоподобными фибриллами (Duce, J.A. et al. J. Mol. Biol. 2006, 361: 493), и стимулирует стволовые клетки (Semina et al. Radiation Biology and Oncology, 1994, 34: 544). Гистон Н1 также используется для диагностирования, профилактики и лечения язвенного колита и его клинических подтипов (Braun, J. et al., патент США № 6074835). Кроме того, установлено, что гистон Н1, а также гистоны ядер способны переносить биологически активные вещества через гематоэнцефалический барьер (Pardridgem W.M. et al., J. Pharmacol. Exp. Ther. 1989, 251: 821). Кроме того, в Европейском патенте 0392315 демонстрируется гормональная или гормоноподобная активность гистона Н1 и его подтипов. Роль гистона в аутоиммунных заболеваниях, включающих, например, системную красную волчанку (SLE), установлена, например, в Европейском патенте 0532979 или заявке на патент WO 03/044054. Установлено, что функции гистонов, кроме того, включают антибиотические функции (патенты США № 6565854 и 6884423) и противовирусные функции (WO 2005/112975). Кроме того, показано применение гистонов для предотвращения агрегации тромбоцитов (WO 02/067907) и для лечения тромбоцитопении (WO 2006/119912).
Установлено, что гистоны играют основную роль при лечении рака. Vani и др. (Vani, G. et al., Chemotherapy 2003, 49: 252) демонстрируют, например, что гистон Н1 улучшает иммунный статус и иммунный ответ у животных, поддерживающих экспериментальный рак молочной железы. Также установлено, что антиоксидантный статус страдающих раком индивидуумов усиливается с помощью гистона Н1 (Vani, G. et al., Chemotherapy 2005, 51: 57). Установлено, что обработка чувствительных к эстрогенам человека клеток рака молочной железы гистоном Н1 уменьшает число рецепторов эстрогенов (Vani, G. and Devi, C.S., Mol. Cell Biochem. 2005, 272: 151). В патенте США № 5812257 демонстрируется лечение индуцированных облучением лейкоза или карциномы гистонами Н1 или Н2А:Н2В. Гистоны могут быть также потенциально полезны для лечения рака путем захвата патогенной экстраклеточной ДНК и циркуляции по всему организму патогенных нуклеосом (Le Lann-Terrisse et al. (1997) Cancer Immunol. Immunother., 43: 337).
В соответствии с настоящим изобретением молекула нуклеиновой кислоты может также кодировать полипептид, состоящий из двух остатков метионина в качестве первого и второго N-концевых аминокислотных остатков, соединенных через пептидную связь со зрелым эукариотическим полипептидом, последовательность которого идентична на, по крайней мере, 80%, более предпочтительно 85%, более предпочтительно 90% последовательности зрелого эукариотического гистона (а) и в котором существенным образом сохраняется его биологическая активность. Еще более предпочтительно, молекула нуклеиновой кислоты может кодировать полипептид, состоящий из двух остатков метионина в качестве первого и второго N-концевых аминокислотных остатков, соединенных через пептидную связь со зрелым эукариотическим полипептидом, последовательность которого идентична на, по крайней мере, 95% и наиболее предпочтительно 98% последовательности зрелого эукариотического гистона (а) и в котором существенным образом сохраняется его биологическая функция.
В соответствии с настоящим изобретением термин «идентичность последовательностей в процентах» характеризует число соответствий («совпадений») идентичных нуклеотидов/аминокислот двух или более совмещенных последовательностей нуклеиновых кислот или аминокислотных последовательностей в сравнении с числом нуклеотидов или аминокислотных остатков, составляющих полную длину последовательностей нуклеиновых кислот или аминокислотных последовательностей (или их полную сравниваемую часть). Другими словами, используя совмещение, для двух или более последовательностей или подпоследовательностей процент аминокислотных остатков или нуклеотидов, которые являются одинаковыми (например, идентичность на 80% или 85%), можно определить после сравнения и совмещения (под)последовательностей для максимального соответствия по всему окну сравнения или по всему намеченному району, как определяется с использованием алгоритма для сравнения последовательностей, известного в данной области техники, или после совмещения вручную и визуальной проверки. Это определение также применимо к комплементу проверяемой последовательности. Предпочтительными молекулами нуклеиновых кислот/полипептидами в соответствии с настоящим изобретением являются такие молекулы нуклеиновых кислот/полипептиды, в которых охарактеризованная идентичность существует по всему району, длина которого составляет, по крайней мере, приблизительно 15-25 аминокислот или нуклеотидов, более предпочтительно по всему району, длина которого составляет, по крайней мере, приблизительно 50-100 аминокислот или нуклеотидов. Квалифицированные в данной области техники специалисты знают, как определить идентичность последовательностей в процентах между последовательностями, используя, например, алгоритмы, такие как алгоритмы, основанные на компьютерной программе CLUSTALW (Thompson Nucl. Acids Res. 2 (1994), 4673-4680) или FASTA (Pearson and Lipman, Proc. Natl. Acad. Sci., 1988, 85: 2444), которые известны в данной области техники.
Хотя алгоритм FASTDB обычно не учитывает внутренние несоответствующие делеции или добавления в последовательностях, т.е. пропуски, при расчете, это можно исправить вручную во избежание переоценки идентичности последовательностей в %. Однако CLUSTALW учитывает пропуски в последовательностях при расчетах их идентичности. Отвечающими требованиям квалифицированных в данной области техники специалистов являются алгоритмы BLAST и BLAST 2.0 (Altschul, Nucl. Acids Res., 1977, 25: 3389). В программе BLASTN для последовательностей нуклеиновых кислот используется по умолчанию длина слова (W), составляющая 11, ожидание (E) - 10, М=5, N=4 и сравнение обеих цепей. Для аминокислотных последовательностей в программе BLASTP используется по умолчанию длина слова (W), составляющая 3, и ожидание (E) - 10. В матрице количественных оценок BLOSUM62 (Henikoff, Proc. Natl. Acad. Sci., 1989, 89: 10915) используется совмещение (В), составляющее 50, ожидание (E) - 10, М=5, N=4 и сравнение обеих цепей. Все эти программы могут использоваться для целей настоящего изобретения. Все вышеприведенные программы можно использовать в соответствии с настоящим изобретением.
В соответствии с настоящим изобретением активность существенным образом сохраняется, если получают, по крайней мере, 20% биологической активности соответствующего зрелого эукариотического гистона, упоминаемого в пункте (а), выше. Предпочтительно, когда сохраняется, по крайней мере, 50%, например, по крайней мере, 60%, по крайней мере, 75% или, по крайней мере, 80% активности. Более предпочтительным является сохранение, по крайней мере, 90%, например, по крайней мере, 95%, еще более предпочтительным, по крайней мере, 98%, например, 99%, биологической активности. Наиболее предпочтительным является полное, т.е. 100%, сохранение биологической активности. Также в соответствии с настоящим изобретением находятся полипептиды, обладающие увеличенной биологической активностью по сравнению с соответствующим зрелым эукариотическим гистоном, упоминаемым в пункте (а), т.е. более 100% ферментативной активности эталонного гистона. Способы оценки биологической активности (поли)пептида хорошо известны квалифицированному в данной области техники специалисту и включают, без ограничения, измерение ферментативной активности, цитотоксичности, высвобождения цитокинов, гемолиза или экспрессии биомаркеров. В частности, анализы цитотоксичности представляют собой анализы, в которых используются in vitro или in vivo культуры клеток, которые обрабатывают, например, поли(пептидом), например гистонами, и в которых определяют с помощью способов обнаружения клеток степень изменения гибели клеток после обработки. Биологическую активность можно также определить с помощью анализов ELISA, особенно в случае антител.
Используемый здесь термин «гибридизуется/гибридизующийся» относится к спариванию молекулы нуклеиновой кислоты с (частично) комплементарной цепью этой молекулы нуклеиновой кислоты, которые тем самым образую гибрид.
В данной области техники хорошо известно, как выполнить эксперименты по гибридизации молекул нуклеиновых кислот. Соответственно, квалифицированный в данной области техники специалист знает, какие условия гибридизации он должен использовать для того, чтобы сделать возможной успешную гибридизацию. В отношении создания подходящих условий гибридизации справляются в стандартных книгах-текстах, таких как Sambrook and Russell “Molecular Cloning, A Laboratory Manual”, Cold Spring Harbor Laboratory, N.Y. (2001); Ausubel, “Current Protocols in Molecular Biology”, Green Publishing Associates and Wiley Interscience, N.Y. (1989) или Higgins and Hames (Eds.) “Nucleic acid hybridization, a practical approach” IRL Press Oxford, Washington DC (1985). В одном предпочтительном варианте осуществления гибридизацию осуществляют в жестких условиях.
«Жесткие условия гибридизации» относятся к условиям, которые включают, например, инкубацию в течение ночи при 65°С в 4 × SSC (600 мМ NaCl, 60 мМ натрия цитрата) с последующей промывкой при 65°С в 0,1 × SSC в течение одного часа. Альтернативно, условия гибридизации могут включать инкубацию в течение ночи при 42°С в растворе, содержащем 50% формамида, 5 × SSC (750 мМ NaCl, 75 мМ натрия цитрат), 50 мМ натрия фосфат (рН 7,6), 5 × раствор Денхардта, 10% декстрана сульфата и 20 мкг/мл денатурированной, деградированной в результате гидродинамического сдвига ДНК из молок лососевых, с последующей промывкой фильтров в 0,1 × SSC при приблизительно 65°С. Указанные условия гибридизации также известны квалифицированному в данной области техники специалисту как «в высокой степени жесткие условия гибридизации». Также предусматриваются молекулы нуклеиновых кислот, которые гибридизуются с молекулами нуклеиновых кислот настоящего изобретения в условиях более низкой жесткости для гибридизации («условиях низкой жесткости для гибридизации»). Изменения жесткости гибридизации и обнаружения сигнала осуществляют, главным образом, через манипулирование концентрацией формамида (более низкие проценты формамида приводят к понижению жесткости), солевыми условиями или температурой. Например, условия более низкой жесткости включают инкубацию в течение ночи при 50°С в 4 × SSC или инкубацию в течение ночи при 37°С в растворе, содержащем 6 × SSPE (20 × SSPE=3M NaCl; 0,2M NaH2PO4; 0,02M EDTA, pH 7,4), 0,5% SDS, 30% формамида, 100 мкг/мл блокирующей ДНК из молок лососевых, с последующими промывками при 50°С в 1 × SSPE, 0,1 × SDS. Кроме того, для достижения еще более низкой жесткости промывки, выполняемые после жесткой гибридизации, можно проводить при более высоких концентрациях соли (например, 5 × SSC). Обратите внимание, что изменение вышеотмеченных условий можно выполнить через включение и/или замену реагентов-вариантов для блокирования, используемых для ослабления фона в экспериментах по гибридизации. Типичные реагенты для блокирования включают реагент Денхардта, BLOTTO, гепарин, денатурированную ДНК из молок лососевых и имеющиеся в продаже запатентованные композиции. При включении специфических реагентов для блокирования может потребоваться модификация описанных выше условий гибридизации из-за проблем совместимости. Такие модификации могут обычно проводиться квалифицированным специалистом незамедлительно. Гибридизационный комплекс может быть образован в растворе (например, анализ Cot или Rot) или между одной последовательностью нуклеиновой кислоты, присутствующей в растворе, и другой последовательностью нуклеиновой кислоты, иммобилизованной на твердой подложке (например, мембранах, фильтрах, чипах, балочных выводах или предметных стеклах, на которых, например, были зафиксированы клетки). Приведенный здесь выше вариант осуществления предпочтительно относится к в высокой степени жестким условиям и в альтернативном случае к условиям более низкой жесткости.
Дополнительно к отмеченному выше, термин «молекула нуклеиновой кислоты, гибридизующаяся в жестких условиях с комплементарной цепью молекулы нуклеиновой кислоты, кодирующей полипептид (а) или (b)», упоминаемой в пункте (с), предпочтительно относится к последовательностям, которые проявляют идентичность последовательностей, составляющую, по крайней мере, 70%, предпочтительно, по крайней мере, 80%, более предпочтительно, по крайней мере, 90%, еще более предпочтительно, по крайней мере, 95% и наиболее предпочтительно, по крайней мере, 97%, с нуклеотидной последовательностью, охарактеризованной выше в пунктах (а) или (b).
Как указано здесь выше, предпочтительными в соответствии с настоящим изобретением являются молекулы нуклеиновых кислот, которые способны к гибридизации с молекулами нуклеиновых кислот настоящего изобретения или их частями в (в высокой степени) жестких условиях гибридизации, т.е. которые не гибридизуются перекрестно с молекулами нуклеиновых кислот, неродственными по нуклеотидной последовательности. В соответствии с пунктом (с), выше, настоящим изобретением также охватываются молекулы нуклеиновых кислот, родственные, но не идентичные молекулам нуклеиновых кислот пунктов (а) или (b) по последовательности. Кроме того, настоящее изобретение включает в соответствии с пунктом (с) фрагменты молекулы нуклеиновой кислоты (а) или (b). Для всех вариантов осуществления, подпадающих под пункт (с), важно в соответствии с этим вариантом осуществления, чтобы кодируемый этой молекулой нуклеиновой кислоты полипептид имел, по крайней мере, два N-концевых остатка метионина и сохранял или существенным образом сохранял биологическую активность гистона (а) или (b).
Кроме того, в предпочтительном варианте осуществления настоящее изобретение также относится к молекуле нуклеиновой кислоты, последовательность которой является вырожденной по сравнению с последовательностью описанной выше молекулы нуклеиновой кислоты пункта (а) или (b). При использовании в соответствии с настоящим изобретением термин «являющаяся вырожденной вследствие генетического кода» означает, что из-за избыточности генетического кода различные нуклеотидные последовательности кодируют одну и ту же аминокислоту.
Хотя существует ряд известных в данной области техники аффинных меток, которые сливают с полипептидами для того, чтобы сделать возможными более легкие продукцию и выявление, эти метки часто необходимо удалять при употреблении в терапевтических применениях. В противоположность этим аффинным меткам, авторы настоящего изобретения с удивлением обнаружили бис-Met-полипептиды, которые демонстрируют биологические свойства, одинаковые с биологическими свойствами их природных аналогов, и, следовательно, полипептиды настоящего изобретения могут использоваться с терапевтическими целями. Поскольку функциональные возможности полипептидов настоящего изобретения явно не изменены, по крайней мере, при использовании анализов, примененных авторами настоящего изобретения, удаление остатков метионина не является необходимым. Кроме того, удаление остатков метионина не происходит во время продукции. Как очерчено выше, отщепление N-концевого остатка метионина в значительной степени зависит от размера второго аминокислотного остатка. Поскольку полипептиды настоящего изобретения содержат в качестве второго аминокислотного остатка дополнительный метионин, одним из наблюдаемых эффектов является то, что только низкий процент, т.е. в диапазоне, составляющем приблизительно 20%, двух N-концевых остатков метионина отщепляется в E.coli. В остальных приблизительно 80% случаев два N-концевых остатка метионина не отщепляются. Во время продукции полипептида настоящего изобретения в прокариотах, таких как E.coli, последний N-концевой метионин может также подвергаться формилированию. Однако авторы настоящего изобретения не получили каких-либо формилированных продуктов, как проверено с помощью масс-спектрометрии. Также не могли наблюдать отщепление только одного остатка метионина. Не желая ограничиваться какой-либо теорией, предполагают, что отщепление первого N-концевого остатка метионина приводит к быстрому удалению также второго N-концевого метионина, что дает в результате отщепление обоих остатков метионина.
Вследствие этого бис-Met-гистоны настоящего изобретения дают преимущество, заключающееся в возможности легкого обнаружения в присутствии эндогенных гистонов. Например, хотя бис-Met-гистоны могут быть не отделены от их эндогенных аналогов с помощью различных способов HPLC (RPC; SEC; IEX) или электрофореза (SDS-PAGE; CE), бис-Met-гистоны можно легко отличить с помощью масс-спектрометрии (или тандемной масс-спектрометрии) с ионизацией электрораспылением (ESI-MS), например, одной и той же фракции HPLC с обращенной фазой (смотри примеры). Это позволяет контролировать фармакокинетики терапевтических гистонов во время клинических испытаний без необходимости использования мечения изотопами или специальных антител против исследуемого лекарственного средства.
Кроме того, с удивлением было обнаружено, что гистоны, содержащие два остатка метионина в качестве первого и второго N-концевых аминокислотных остатков, проявляют выгодные свойства при рекомбинантной продукции. Так, авторы настоящего изобретения обнаружили, что значительно более высокий уровень гистона можно получить после введения двух остатков метионина. Хотя выработка в бактериальной клетке после ферментации бис-Met-гистона не была значительно выше, с удивлением было обнаружено значительно отличное поведение бис-Met-гистона в первой ключевой стадии обработки в основном направлении. В то время как бис-Met-гистон можно было элюировать при предполагаемой концентрации соли, рекомбинантный гистон, лишенный дополнительных остатков метионина, нельзя было элюировать с колонки MacroPrep High-S, за исключением очень высокой концентрации соли, и нельзя было далее очистить эффективным образом. Следовательно, бис-Met-гистон отлично ведет себя на колонке MacroPrep High-S, что делает возможным эффективный и с высоким выходом процесс очистки.
Соответственно, настоящее изобретение основано на новом факте, что присутствие двух остатков метионина на N-конце гистонов обеспечивает бис-Met-гистоны, которые дают возможность легкого обнаружения в присутствии эндогенных гистонов и делают возможной эффективную продукцию рекомбинантных белков.
В предпочтительном варианте осуществления гистон выбирают из группы, состоящей из гистона Н1.0, Н1.1, Н1.2, Н1.3, Н1.4, Н1.5 и H1t яичка.
Номерами доступа в Swiss-Prot для подтипов гистонов Н1 человека являются: Н1.0 - Р07305; Н1.1 - Q02539, H1.2 - P16403, H1.3 - P16402, H1.4 - P10412, H1.5 - Q14529 и H1t -Р22492. Последовательность нуклеиновой кислоты и аминокислотная последовательность гистона Н1.2 человека показаны в SEQ ID NO: 6 и 7. Последовательность нуклеиновой кислоты и аминокислотная последовательность гистона Н1.3 человека показаны в SEQ ID NO: 8 и 9. Последовательность нуклеиновой кислоты и аминокислотная последовательность гистона Н1.4 человека показаны в SEQ ID NO: 10 и 11. Последовательность нуклеиновой кислоты и аминокислотная последовательность гистона Н1.5 человека показаны в SEQ ID NO: 12 и 13.
В другом варианте осуществления настоящим изобретением обеспечивается молекула нуклеиновой кислоты, которая комплементарна молекуле нуклеиновой кислоты настоящего изобретения.
Молекулы нуклеиновых кислот являются «комплементарными», если они природно связываются друг с другом в содействующих солевых и температурных условиях с помощью спаривания оснований. Например, последовательность «A-G-T» связывается с комплементарной последовательностью «T-C-A». «Комплементарность» в соответствии с настоящим изобретением имеет отношение к полному спариванию оснований нуклеотидов по всей длине молекулы нуклеиновой кислоты настоящего изобретения. Таким образом, помеченная поддающейся обнаружению меткой молекула нуклеиновой кислоты, не в точности комплементарная молекуле нуклеиновой кислоты настоящего изобретения, не будет давать поддающийся обнаружению сигнал, если выбраны соответствующие условия гибридизации и промывки. Такую комплементарную молекулу нуклеиновой кислоты можно, например, использовать в качестве зондов в Норзерн- или Саузерн-блоттингах препаратов РНК или ДНК.
В другом аспекте настоящим изобретением обеспечивается антисмысловой олиго- или полинуклеотид молекулы нуклеиновой кислоты настоящего изобретения, причем олигонуклеотид включает нуклеотиды, комплементарные триплетам из нуклеотидов, кодирующим два первых N-концевых остатка метионина гистона настоящего изобретения, и имеет минимальную длину, составляющую 10 нуклеотидов.
Указанные антисмысловые олигонуклеотиды могут, например, использоваться в качестве праймеров для анализов секвенированием или в качестве зондов в Норзерн- или Саузерн-блоттингах препаратов РНК или ДНК. Антисмысловые олигонуклеотиды настоящего изобретения предпочтительно включают, по крайней мере, 10, предпочтительно, по крайней мере, 15, например, по крайней мере, 25 последовательных нуклеотидов. Более предпочтительно антисмысловые олигонуклеотиды настоящего изобретения включают, по крайней мере, 100, более предпочтительно, по крайней мере, 200 и наиболее предпочтительно, по крайней мере, 500 нуклеотидов в длину. Такую молекулу нуклеиновой кислоты можно также использовать, например, в качестве зонда в анализах методом защиты от действия РНКазы или в качестве антисмыслового зонда для ингибирования экспрессии гистонов настоящего изобретения. Квалифицированному в данной области техники специалисту хорошо известно, как приготовить и использовать такие зонды (смотри, например, Sambrook and Russel “Molecular Cloning, A Laboratory Manual”, Cold Spring Harbor Laboratory N.Y. (2001)).
В другом альтернативном варианте осуществления настоящим изобретением обеспечивается вектор, включающий молекулу нуклеиновой кислоты настоящего изобретения. Предпочтительно вектором является плазмида, космида, вирус, бактериофаг или другой вектор, используемый, например, обычно при генетической инженерии. В дальнейшем варианте осуществления настоящим изобретением обеспечивается вектор, включающий комплементарную молекулу нуклеиновой кислоты или антисмысловой олигонуклеотид настоящего изобретения.
Молекулу нуклеиновой кислоты настоящего изобретения можно встроить в отдельные имеющиеся в продаже векторы. Не ограничивающие примеры включают прокариотические плазмидные векторы, такие как ряд pUC, pBluescript (Stratagene), ряд экспрессионных векторов pET, в том числе векторы pETduet (Novagen) или pCRTOPO (Invitrogen), и векторы, совместимые с экспрессией в клетках млекопитающих, например pREP (Invitrogen), pcDNA3 (Invitrogen), pCEP4 (Invitrogen), pMC1neo (Stratagene), pXT1 (Stratagene), pSG5 (Stratagene), EBO-pSV2neo, pBPV-1, pdBPVMMTneo, pRSVgpt, pRSVneo, pSV2-dhfr, pIZD35, pLXIN, pSIR (Clontech), pIRES-EGFP (Clontech), pEAK-10 (Edge Biosystems), pTriEx-Hygro (Novagen) и pCINeo (Promega). Примеры плазмидных векторов, подходящих для Pichia pastoris, включают, например, плазмиды pAO815, pPIC9K и pPIC3.5K (все от Invitrogen).
Приведенную выше молекулу нуклеиновой кислоты настоящего изобретения можно также встроить в векторы из условия создания трансляционного слияния с другой молекулой нуклеиновой кислоты. Другая молекула нуклеиновой кислоты может кодировать белок, который может, например, увеличивать растворимость и/или облегчать очистку слитого белка. Не ограничивающие примеры включают pET32, pET41, pET43. Векторы могут также содержать дополнительную экспрессируемую молекулу нуклеиновой кислоты, кодирующую один или несколько шаперонов, облегчающих правильную укладку белков. Подходящие для экспрессии бактериальные хозяева включают, например, штаммы, происходящие из BL21 (например, BL21(DE3), BL21(DE3)PlysS, BL21(DE3)RIL, BL21(DE3)PRARE) или Rosetta®.
В отношении методов модификации векторов смотри Sambrook и др., выше. Как правило, векторы могут содержать одно или несколько начал репликации (ori) и систем наследования для клонирования или экспрессии, один или несколько маркеров для отбора в хозяине, например устойчивость к антибиотикам, и одну или несколько экспрессионных кассет. Подходящие начала репликации (ori) включают, например, начала репликации Col E1, вируса SV40 и М13.
Встраиваемые в вектор кодирующие последовательности можно, например, синтезировать с помощью стандартных способов или выделить из природных источников. Лигирование кодирующих последовательностей с регулирующими транскрипцию элементами и/или другими кодирующими аминокислоты последовательностями можно выполнить, используя широко известные способы. Регулирующие транскрипцию элементы (части экспрессионной кассеты), обеспечивающие экспрессию в прокариотах или эукариотических клетках, хорошо известны квалифицированным в данной области техники специалистам. Эти элементы включают регуляторные последовательности, обеспечивающие инициацию транскрипции (например, кодон инициации трансляции, промоторы, энхансеры и/или инсуляторы), участки внутренней посадки рибосомы (IRES) (Owens, Proc. Natl. Acad. Sci. USA 98 (2001), 1471-1476) и необязательно поли-А-сигналы, обеспечивающие терминацию транскрипции и стабилизацию транскрипта. Дополнительные регуляторные элементы могут включать энхансеры транскрипции, а также трансляции и/или природно связанные или гетерологичные промоторные области. Предпочтительно молекула нуклеиновой кислоты настоящего изобретения функционально связана с такими контролирующими экспрессию последовательностями, что делает возможной экспрессию в прокариотах или эукариотических клетках. Вектор может, кроме того, включать нуклеотидные последовательности, кодирующие сигналы для секреции в качестве дополнительных регуляторных элементов. Такие последовательности хорошо известны квалифицированному в данной области техники специалисту. Кроме того, в зависимости от используемой экспрессионной системы к кодирующей последовательности молекулы нуклеиновой кислоты настоящего изобретения можно добавить лидерные последовательности, способные направлять экспрессированный полипептид в клеточный компартмент. Такие лидерные последовательности широко известны в данной области техники.
Возможные примеры регуляторных элементов, обеспечивающих инициацию транскрипции, включают промотор цитомегаловируса (CMV), промотор SV40, промотор RSV (вируса саркомы Рауса), промотор lacZ, промотор gai10, промотор фактора элонгации 1α человека, энхансер CMV, промотор CaM-киназы, полиэдральный промотор вируса множественного ядерного полиэдроза Autographa californica (AcMNPV) или энхансер SV40. Для экспрессии в прокариотах было описано множество промоторов, включающих, например, tac-lac-промотор, промотор lacUV5 или trp. Примеры дальнейших регуляторных элементов у прокариот и в эукариотических клетках включают сигналы терминации транскрипции, такие как сайт SV40-поли-А или сайт tk-поли-А и сигналы полиэдрального полиаденилирования SV40, lacZ и AcMNPV, 3' от молекулы нуклеиновой кислоты.
Кроме того, предпочтительно, чтобы вектор настоящего изобретения включал селектируемый маркер. Примеры селектируемых маркеров включают устойчивость к неомицину, ампициллину, гигромицину, канамицину и т.п. Специально разработанные векторы позволяют перемещать по челночному принципу ДНК между различными хозяевами, такими как бактерии - клетки грибов или бактерии - клетки животных (например, система Gataway®, имеющаяся у Invitrogen).
Экспрессионный вектор в соответствии с настоящим изобретением способен управлять репликацией и экспрессией молекулы нуклеиновой кислоты и кодируемого полипептида этого изобретения. В данной области техники известны подходящие экспрессионные векторы, включающие описанные регуляторные элементы, такие как векторы для экспрессии кДНК Okayama-Berg pcDV1 (Pharmacia), pRc/CMV, pcDNA1, pcDNA3 (Invitrogen, используемые, среди прочих, в прилагаемых примерах), pSPORT1 (GIBCO BRL) или pGEMHE (Promega) или прокариотические экспрессионные векторы, такие как лямбда gt11, pJOE, ряд pBBR1-MCS, pJB861, pBSMuL, pBC2, pUCPKS, pTACT1 или предпочтительно вектор pET (Novagen).
Описанные здесь выше молекулы нуклеиновых кислот настоящего изобретения можно сконструировать для прямого введения или введения через липосомы, фаговые векторы или вирусные (например, аденовирусные, ретровирусные) векторы в клетку. Кроме того, бакуловирусные системы или системы на основе вируса коровьей оспы или вируса леса Семлики можно использовать в качестве эукариотической экспрессионной системы для молекул нуклеиновых кислот настоящего изобретения.
Типичные векторы для экспрессии в клетках млекопитающих содержат промоторный элемент, который опосредует инициацию транскрипции мРНК, кодирующую белок последовательность и сигналы, необходимые для терминации транскрипции и полиаденилирования транскрипта. Кроме того, могут быть также включены такие элементы, как начало репликации, ген устойчивости к лекарственному средству, регуляторы (в качестве части индуцибельного промотора). Промотор lac является типичным индуцибельным промотором, используемым для прокариотических клеток, который можно индуцировать, используя аналог лактозы изопропилтиол-β-D-галактозид («IPTG»). Для рекомбинантной экспрессии и секреции представляющую интерес молекулу нуклеиновой кислоты можно лигировать между, например, лидерным сигналом PelB, который направляет рекомбинантный белок в периплазму, и геном III в фагемиде, называемой pHEN4 (описанной Ghahroudi и др. в 1997, FEBS Letters 414: 521-526). Дополнительные элементы могли бы включать энхансеры, последовательности Козак и интроны, фланкированные донорным и акцепторным сайтами для сплайсинга РНК. В высокой степени эффективной транскрипции можно достичь при использовании раннего и позднего промоторов из SV40, длинных концевых повторов (LTR) из ретровирусов, например RSV, HTLVI, HIVI, и раннего промотора из цитомегаловируса (CMV). Однако можно также использовать клеточные элементы (например, промотор актина человека). Подходящие для применения для осуществления на практике настоящего изобретения экспрессионные векторы включают, например, такие векторы, как pSVL и pMSC (Pharmacia, Uppsala, Швеция), pRSVcat (ATCC 37152), pSV2dhfr (ATCC 37146) и pBC12MI (ATCC 67109). Хозяева-клетки млекопитающих, которые могли бы использоваться, включают клетки человека Hela, 293, H9 и Jurkat, клетки мыши NIH3T3 и C127, Cos 1, Cos 7 и CV1, клетки перепела QC1-3, мышиные L-клетки и клетки яичника китайского хомячка (CHO). В альтернативном случае рекомбинантный полипептид можно экспрессировать в стабильных линиях клеток, которые содержат генную конструкцию, интегрированную в хромосому. Котрансфекция селектируемым маркером, таким как dhfr, gpt, устойчивость к неомицину, гигромицину, делает возможными идентификацию и выделение трансфецированных клеток. Трансфецированную нуклеиновую кислоту можно также амплифицировать для экспрессии больших количеств кодируемого полипептида. Маркер DHFR (дигидрофолатредуктаза) полезен для разработки линий клеток, которые несут несколько сотен или даже несколько тысяч копий представляющего интерес гена. Другим полезным селектируемым маркером является фермент глутаминсинтаза (GS) (Murphy et al. 1991, Biochem J. 227: 277-279; Bebbington et al. 1992, Bio/Technology 10: 169-175). Используя эти маркеры, клетки млекопитающих выращивают в селективной питательной среде и отбирают клетки с наибольшей устойчивостью. Как указано выше, экспрессионные векторы будут предпочтительно включать, по крайней мере, один селектируемый маркер. Такие маркеры включают дигидрофолатредуктазу, устойчивость к G418 или неомицину для культуры эукариотических клеток и гены устойчивости к тетрациклину, канамицину или ампициллину для культивирования E.coli и других бактерий.
Кроме того, настоящее изобретение относится к хозяину, разработанному методами генетической инженерии с использованием молекулы нуклеиновой кислоты настоящего изобретения или вектора настоящего изобретения. Указанный хозяин может быть получен введением в хозяина указанной молекулы нуклеиновой кислоты или вектора(ов), которые при своем присутствии опосредуют экспрессию полипептида настоящего изобретения.
Хозяин может быть любым прокариотом или эукариотической клеткой. Подходящими прокариотами/бактериями являются те, которые обычно используются для клонирования, например, E.coli (например, штаммы BL21(DE3), HB101, DH5α, XL1 Blue, Y1090 и JM101 E.coli), Salmonella typhimurium, Serratia marcescens, Pseudomonas putida, Pseudomonas fluorescens, Streptomyces lividans, Lactococcus lactis, Mycobacterium smegmatis или Bacillus subtilis. Подходящим эукариотическим хозяином может быть клетка животного, такая как СНО, COS, 293 и клетки меланомы Bowes, клетка земноводного, клетка рыбы, клетка насекомого, такая как клетки дрозофилы S2 и Spodoptera Sf9, клетка гриба, клетка растения, трансгенные, не являющиеся людьми животные или трансгенные растения.
В предпочтительном варианте осуществления настоящего изобретения хозяином является бактерия, дрожжевая клетка, клетка насекомого, клетка гриба, клетка млекопитающего или клетка растения. В данной области техники широко известны подходящие среды и условия для культивирования описанных выше клеток-хозяев. В предпочтительном варианте осуществления хозяином, разработанным методами генетической инженерии с использованием молекулы нуклеиновой кислоты или вектора настоящего изобретения, является E.coli, например, штаммы, происходящие из BL21 (например, BL21(DE3), BL21(DE3)PlysS, BL21(DE3)RIL, BL21(DE3)PRARE) или Rosetta®.
В дальнейшем варианте осуществления настоящее изобретение также относится к способу получения способных экспрессировать полипептид настоящего изобретения бактерий или эукариотических клеток, включающему генетическую инженерию бактерий или эукариотических клеток с использованием вектора настоящего изобретения. Термин «генетическая инженерия» относится к способу внесения в клетку генетической информации или модификации генетической информации клетки. Это обычно выполняют путем трасфецирования или трансформирования клетки-хозяина молекулой нуклеиновой кислоты. Введение конструкции в клетку-хозяина можно выполнить с помощью трансфекции с использованием кальция фосфата, опосредованной DEAE-декстраном трансфекции, опосредованной катионными липидами трансфекции, электропорации, трансдукции, инфицирования или других способов. Такие способы описываются во многих стандартных лабораторных руководствах, таких как Sambrook и др., в цитированном месте выше. Указанная молекула нуклеиновой кислоты, вводимая в клетку-хозяина, включает открытую рамку считывания, кодирующую полипептид настоящего изобретения.
В дополнительном варианте осуществления настоящее изобретение относится к способу продуцирования полипептида настоящего изобретения, включающему культивирование хозяина настоящего изобретения в подходящих условиях и выделение продуцированного полипептида настоящего изобретения из указанного хозяина или культуры.
В данной области техники существует большое количество подходящих способов для продуцирования полипептидов в подходящих хозяевах. Если хозяин является одноклеточным организмом, таким как прокариот, клетка млекопитающего или насекомого, квалифицированный в данной области техники специалист может обратиться к ряду условий культивирования. Подходяще, если продуцированный белок получают из среды для культивирования, лизатов подвергнутых культивированию организмов или из выделенных (биологических) мембран с помощью хорошо известных методов. В случае многоклеточного организма хозяином может быть клетка, которая является частью или происходит из части организма, например, указанная клетка-хозяин может быть пригодной для заготовки частью растения. Предпочтительный способ включает рекомбинантную продукцию белка в хозяевах, как указано выше. Например, последовательности нуклеиновых кислот, включающие молекулу нуклеиновой кислоты в соответствии с настоящим изобретением, можно синтезировать с помощью ПЦР и встроить в экспрессионный вектор. Впоследствии подходящий хозяин можно трансформировать экспрессионным вектором. После этого хозяина подвергают культивированию для продуцирования желаемого полипептида, который выделяют и очищают. Такие способы широко известны в данной области техники (смотри, например, Sambrook и др., выше).
Альтернативным способом продуцирования полипептида настоящего изобретения является in vitro трансляция мРНК. Подходящие для применения в соответствии с настоящим изобретением бесклеточные экспрессионные системы включают кроличий ретикулоцитарный лизат, экстракт из пшеничных зародышей, собачьи панкреатические микросомальные мембраны, экстракт S30 из E.coli и связанные системы транскрипции/трансляции, такие как TNT-система (Promega). Эти системы позволяют экспрессировать рекомбинантные полипептиды при добавлении векторов для клонирования, фрагментов ДНК или последовательностей РНК, содержащих кодирующие области и соответствующие промоторные элементы.
Помимо рекомбинантной продукции, полипептид (белок), фрагменты белка или слитый белок настоящего изобретения можно продуцировать синтетически, например, путем прямого синтеза пептидов, используя твердофазные методы (сравни с Stewart et al. (1969) Solid Phase Peptide Synthesis; Freeman Co., San Francisco; Merrifield, J. Am. Chem. Soc. 85 (1963), 2149-2154).
Синтез синтетических белков можно выполнить, используя методы вручную, или с использованием автоматизации. Автоматический синтез можно успешно выполнить, например, используя пептидные синтезаторы Applied Biosystems 431A (Perkin Elmer, Foster City CA) в соответствии с инструкциями, предоставленными производителем. Различные фрагменты можно химически синтезировать по отдельности и объединить, используя химические способы, для получения полноразмерной молекулы. Как указано выше, можно использовать химический синтез, такой как твердофазный способ, описанный Houghton (Proc. Natl. Acad. Sci., 1985, 82: 5131). Кроме того, полипептид (белок), фрагменты белка или слитый белок настоящего изобретения можно продуцировать полусинтетически, например, путем объединения рекомбинантной и синтетической продукции. Все полипептиды (белки), имеющие два остатка метионина в качестве первого и второго N-концевых аминокислотных остатков, соединенных через пептидную связь (а) со зрелым эукариотическим гистоном; (b) со зрелым эукариотическим полипептидом, последовательность которого идентична на, по крайней мере, 80% последовательности зрелого эукариотического гистона и в котором существенным образом сохраняется его биологическая активность; или (с) с другим полипептидом настоящего изобретения, описанным выше, а также с фрагментами такого полипептида (белка) и слитыми белками, находятся в пределах объема настоящего изобретения, независимо от использованного для их получения способа продукции. Это обусловлено тем, что аминокислотная последовательность всех этих белков (также) кодируется молекулой нуклеиновой кислоты настоящего изобретения.
Выделение и очистку белков можно успешно выполнить с помощью любого из нескольких известных методов, например и без ограничения, ионообменной хроматографии, гель-фильтрации, аффинной хроматографии, жидкостной хроматографии высокого давления (HPLC), HPLC с обращенной фазой, хроматографии на основе гидрофобных взаимодействий и препаративного диск-электрофореза. Для методов выделения/очистки белков может потребоваться модификация полипептидов настоящего изобретения, используя общепринятые способы. Например, к белку можно дополнительно добавить гистидиновую метку для того, чтобы сделать возможной очистку на колонке с никелем. Другие модификации могут вызвать повышение или понижение активности, позволить продукцию белков на более высоких уровнях или упростить очистку белка.
В альтернативном варианте осуществления настоящим изобретением обеспечивается полипептид, кодируемый молекулой нуклеиновой кислоты настоящего изобретения или продуцированный с помощью способа настоящего изобретения.
Настоящим изобретением также обеспечивается композиция, содержащая молекулу нуклеиновой кислоты или вектор, или хозяин, или полипептид настоящего изобретения. В указанных композициях также, необязательно, содержится антитело, аптамер или фаг настоящего изобретения, описанные далее ниже.
Используемый в соответствии с настоящим изобретением термин «композиция» имеет отношение к композиции, которая содержит, по крайней мере, одно из приведенных соединений. Необязательно она может содержать дополнительные молекулы, способные изменять свойства соединений настоящего изобретения, тем самым, например, подавляя, стабилизируя, блокируя, модулируя и/или активируя их функцию. Композиция может быть в твердой, жидкой или газообразной форме и может быть, среди прочего, в форме порошка(ов), таблетки (таблеток), раствора(ов) или аэрозоля(ей).
В предпочтительном варианте осуществления композиция настоящего изобретения, кроме того, содержит зрелый эукариотический гистон.
Предпочтительно такая композиция содержит полипептид настоящего изобретения (бис-Met-гистон) в смеси со зрелым эукариотическим гистоном. Следовательно, композиция может содержать смесь гистонов, содержащих два остатка метионина на N-конце, и гистонов, лишенных обоих остатков метионина. Предпочтительно смесь находится в соотношении 90% полипептида настоящего изобретения к 10% зрелого эукариотического гистона. Более предпочтительно смесь находится в соотношении 80% к 20%, более предпочтительно 70% к 30%. Еще более предпочтительными соотношения смеси являются 50% к 50%, 30% к 70% или 20% к 80%. Наиболее предпочтительно, когда смесь находится в соотношении 10% полипептида настоящего изобретения к 90% зрелого эукариотического гистона. Такая смесь может быть следствием частичного отщепления метионина от бис-Met-гистона из-за недостаточной активности метионин-аминопептидазы организма хозяина. Альтернативно, для получения указанной смеси зрелый эукариотический гистон можно добавить к бис-Met-гистону настоящего изобретения. Предпочтительно гистоны в смеси являются гистонами одного и того же типа, например Н1 или Н2А.
В другом предпочтительном варианте композицией является фармацевтическая композиция, необязательно дополнительно содержащая фармацевтически приемлемый носитель и/или разбавитель.
В соответствии с настоящим изобретением термин «фармацевтическая композиция» относится к композиции для введения пациенту, предпочтительно являющемуся человеком пациенту. Фармацевтическая композиция настоящего изобретения содержит соединения, упоминаемые выше. Фармацевтическая композиция настоящего изобретения может, необязательно и дополнительно, содержать фармацевтически приемлемый носитель. Под «фармацевтически приемлемым носителем» подразумевается нетоксичный твердый, полутвердый или жидкий наполнитель, разбавитель, инкапсулирующий материал или вспомогательное вещество композиции любого типа. Примеры подходящих фармацевтических носителей хорошо известны в данной области техники и включают растворы натрия хлорида, забуференные фосфатом растворы натрия хлорида, воду, такие эмульсии, как эмульсии типа масло-в-воде, различные типы смачивающих агентов, стерильные растворы, органические растворители, включающие DMSO и т.п. Предпочтительно носителем является носитель для парентерального введения, более предпочтительно - раствор, который является изотоническим с кровью реципиента. Носители подходящим образом содержат незначительные количества добавок, таких как вещества, которые увеличивают изотоничность и химическую стабильность. Такие материалы являются нетоксичными для реципиента во всех используемых дозах и концентрациях и включают буферы, такие как фосфат, цитрат, сукцинат, уксусная кислота и другие органические кислоты или их соли; антиоксиданты, такие как аскорбиновая кислота, низкомолекулярные (менее чем приблизительно десять остатков) полипептиды, например полиаргинин или трипептиды, белки, такие как сывороточный альбумин, желатин или иммуноглобулины, гидрофильные полимеры, такие как поливинилпирролидон, аминокислоты, такие как глицин, глютаминовая кислота, аспарагиновая кислота или аргинин, моносахариды, дисахариды и другие углеводы, включающие целлюлозу или ее производные, глюкозу, маннозу или декстрины; хелатообразующие агенты, такие как EDTA, сахарные спирты, такие как маннит или сорбит, противоионы, такие как натрий, и/или неионные поверхностно-активные вещества, такие как полисорбаты, полоксамеры или PEG.
Используемый здесь термин «парентеральный» относится к способам введения, которые включают внутривенную, внутримышечную, внутрибрюшинную, подложечную, подкожную и внутрисуставную инъекцию или инфузию.
Композиции, содержащие такие носители, можно приготовить с помощью хорошо известных общепринятых способов. Как правило, композиции готовят приведением компонентов фармацевтической композиции в постоянный и непосредственный контакт с жидкими носителями или тонко измельченными твердыми носителями, или обоими. Затем, если необходимо, продукту придают форму желаемой композиции.
Эти фармацевтические композиции можно вводить субъекту в подходящей дозе. Схема назначения доз будет определяться штатным врачом и клиническими факторами. Как это хорошо известно в области медицины, доза для какого-либо одного пациента зависит от многих факторов, включающих размер пациента, площадь поверхности тела, возраст, конкретное соединение, которое должно вводиться, пол, время и путь введения, общее состояние здоровья и другие лекарственные средства, вводимые одновременно. Терапевтически эффективное количество в данной ситуации будет без труда определено с помощью обычного экспериментирования и известно обычному клиницисту или врачу и оценивается им. Как правило, схема в виде регулярного введения фармацевтической композиции должна находиться в диапазоне доз от 1 мкг до 20 г в день. Однако более предпочтительная доза могла бы находиться в диапазоне, составляющем от 0,01 мг до 100 мг, даже более предпочтительно от 0,01 мг до 50 мг и наиболее предпочтительно от 0,01 мг до 10 мг в день.
Компоненты фармацевтической композиции, используемой для терапевтического введения, должны быть стерильными. Стерильность легко достигается путем фильтрации через стерильные мембраны для фильтрации (например, мембраны с размером пор 0,2 микрон).
Компоненты фармацевтической композиции обычно будут хранить в контейнерах для однократных или многократных доз, например запаянных ампулах или пузырьках, в виде водного раствора или в виде лиофилизированной композиции для воссоздания. В качестве примера лиофилизированной композиции, 10-мл пузырьки наполняют 5 мл стерилизованного фильтрованием 1% (в отношении веса к объему) водного раствора и результирующую смесь подвергают лиофилизации. Инфузионный раствор готовят путем воссоздания лиофилизированного соединения(й), используя бактериостатическую воду для инъекции.
Также могут присутствовать консерванты и другие добавки, такие как, например, противомикробные средства, антиоксиданты, хелатообразующие агенты, инертные газы и т.п. Кроме того, фармацевтическая композиция может содержать дополнительные агенты в зависимости от предполагаемого применения фармацевтической композиции.
Фармацевтическую композицию можно, в частности, использовать для лечения заболеваний, предпочтительно заболеваний, выбираемых из описанных здесь выше заболеваний, включающих, например, рак, тромбоцитопению, инфекции, такие как бактериальные, вирусные или грибковые инфекции, аутоиммунные заболевания, такие как системная красная волчанка (SLE) или ревматоидный артрит, язвенный колит или заболевания, характеризующиеся амилоидоподобными фибриллами, такие как болезнь Альцгеймера (AD) и болезнь Паркинсона (PD), лейшманиоз, некоторые формы миопатии или сердечно-сосудистые нарушения, связанные с тромбозами.
Рак, в соответствии с настоящим изобретением, относится к классу заболеваний или нарушений, характеризующихся неконтролируемым делением клеток и их способностью к распространению, или путем прямого прорастания в смежную ткань через инвазию, или путем имплантации в удаленные места при метастазировании (в которые раковые клетки переносятся благодаря кровотоку или лимфатической системе).
Тромбоцитопения, в соответствии с настоящим изобретением, относится к присутствию относительно небольшого количества тромбоцитов в крови, тогда как нормальное число тромбоцитов, как правило, находится в диапазоне от 140000 до 400000 в мм3.
Инфекция, в соответствии с настоящим изобретением, является наносящий вред колонизацией организма хозяина чужеродным видом. При инфицировании инфицирующий организм старается использовать ресурсы хозяина для размножения (обычно за счет хозяина). Реакцией хозяина на инфицирование является воспаление.
Бактериальные инфекционные заболевания, в соответствии с настоящим изобретением, включают, но без ограничения, бактериальный менингит, холеру, дифтерию, листериоз, коклюш, пневмококковую пневмонию, сальмонеллез, столбняк, тиф, туберкулез или инфекции мочевых путей.
Вирусные инфекционные заболевания, в соответствии с настоящим изобретением, включают, но без ограничения, мононуклеоз, СПИД, ветряную оспу, насморк, цитомегаловирусную инфекцию, лихорадку денге, геморрагическую лихорадку Эбола, вирусную пузырчатку полости рта и конечностей, гепатит, грипп, эпидемический паротит, полиомиелит, бешенство, натуральную оспу, вирусный энцефалит, вирусный гастроэнтерит, вирусный энцефалит, вирусный менингит, вирусную пневмонию или желтую лихорадку.
Грибковые инфекционные заболевания, в соответствии с настоящим изобретением, включают, но без ограничения, аспергиллез, бластомикоз, кандидоз, кокцидиоидоз, криптококкоз, гистоплазмоз или дермофитию стопы.
Аутоиммунные заболевания, в соответствии с настоящим изобретением, относятся к заболеваниям, которые являются результатом сверхактивного иммунного ответа организма на вещества и ткани, обычно присутствующие в организме. Аутоиммунные заболевания хорошо известны квалифицированному в данной области техники специалисту и включают, но без ограничения, красную волчанку, острый рассеянный энцефаломиелит, апластическую анемию, аутоиммунный гепатит, сахарный диабет, рассеянный склероз, ретробульбарный неврит или ревматоидный артрит.
Красная волчанка, в соответствии с настоящим изобретением, относится к хроническому (длительному) аутоиммунному заболеванию, при котором иммунная система становится сверхактивной и оказывает агрессивное воздействие на нормальные ткани. Это агрессивное воздействие приводит к воспалению и вызывает симптомы. Красная волчанка является «не специфичным для конкретного органа» типом аутоиммунного заболевания.
Ревматоидный артрит, в соответствии с настоящим изобретением, является аутоиммунным заболеванием, которое обусловлено тем, что иммунная система организма оказывает агрессивное воздействие на костные суставы.
Язвенный колит, в соответствии с настоящим изобретением, является формой воспалительного заболевания кишечника (IBD). Язвенный колит представляет собой форму колита, заболевания кишечника, конкретно толстой кишки, который включает характерные язвы или открытые раны в толстой кишке. Основным симптомом активного заболевания обычно является понос с кровью, с постепенным началом. Язвенный колит, однако, является системным заболеванием, которое затрагивает многие части организма вне кишечника.
Заболевания, характеризующиеся амилоидоподобными фибриллами, в соответствии с настоящим изобретением, представляют собой заболевания, которые разделяют в качестве общего признака то, что обычно растворимый пептид амилоид-бета или белок альфа-синуклеин агрегирует в упорядоченные фибриллярные структуры, обычно приводящие к увеличению окислительного повреждения, эксайтотоксичности и изменению клеточного цикла. Заболевания, характеризующиеся амилоидоподобными фибриллами, включают, но без ограничения, болезнь Альцгеймера (AD) и болезнь Паркинсона (PD).
Болезнь Альцгеймера представляет собой нейродегенеративное заболевание, характеризующееся прогрессирующим ухудшением познавательного процесса вместе со снижением активностей повседневной жизни и нейропсихическими симптомами или изменениями поведения. Оно является самым частым типом деменции.
Болезнь Паркинсона представляет собой дегенеративное заболевание центральной нервной системы, которое часто ухудшает двигательные навыки и речь пациента.
Лейшманиоз представляет собой трипаносомное заболевание, вызванное родом Leishmania, организмом-паразитом класса простейших Tripanosoma. Лейшманиоз передается через некоторых видов москитов, и его симптомами являются кожные раны, а также лихорадка, поражение селезенки и печени и анемия.
Миопатии представляют собой нервно-мышечные заболевания, при которых мышечные волокна не функционируют, что приводит к мышечной слабости. Несколько классов миопатии известны и включают, но без ограничения, например, мышечные дистрофии, врожденные миопатии, хромосомные миопатии или воспалительные миопатии.
Сердечно-сосудистые нарушения, связанные с тромбозами, в соответствии с настоящим изобретением, относятся к нарушениям, включающим, но без ограничения, тромбоз глубоких вен или инфаркт миокарда. Особенно предпочтительными являются сердечно-сосудистые нарушения, связанные с тромбозами, опосредуемыми γ-тромбином.
В другом предпочтительном варианте осуществления композиция настоящего изобретения является диагностической композицией.
В соответствии с настоящим изобретением термин «диагностическая композиция» относится к композициям для диагностирования у отдельных пациентов их потенциальной реакции на фармацевтические композиции настоящего изобретения или излечимости с их помощью. Диагностическая композиция настоящего изобретения содержит упомянутые выше соединения. Диагностическая композиция может, кроме того, содержать соответствующий буфер(ы) и ферменты, такие как обратная транскриптаза, термостабильная полимераза и т.п. Диагностические композиции могут быть упакованы в контейнер или множество контейнеров.
Настоящим изобретением также обеспечивается способ лечения и/или профилактики заболевания, выбираемого из рака, тромбоцитопении, инфекций, таких как бактериальные, вирусные или грибковые инфекции, аутоиммунных заболеваний, таких как системная красная волчанка (SLE) или ревматоидный артрит, язвенного колита или заболеваний, характеризующихся амилоидоподобными фибриллами, таких как болезнь Альцгеймера (AD) и болезнь Паркинсона (PD), миопатии или сердечно-сосудистых нарушений, связанных с тромбозами, включающий введение фармацевтической композиции настоящего изобретения нуждающемуся в этом субъекту.
Настоящим изобретением также обеспечивается применение молекулы нуклеиновой кислоты или вектора, или не являющегося человеком хозяина, или полипептида настоящего изобретения для приготовления композиции для терапевтических и/или диагностических целей.
В предпочтительном варианте осуществления терапевтической целью является лечение рака, тромбоцитопении, инфекций, таких как бактериальные, вирусные или грибковые инфекции, аутоиммунных заболеваний, таких как системная красная волчанка (SLE) или ревматоидный артрит, язвенного колита или заболеваний, характеризующихся амилоидоподобными фибриллами, таких как болезнь Альцгеймера (AD) и болезнь Паркинсона (PD), миопатии или сердечно-сосудистых нарушений, связанных с тромбозами.
В дальнейшем варианте осуществления настоящим изобретением обеспечивается антитело или аптамер, или фаг, которые специфически связываются с молекулой нуклеиновой кислоты или полипептидом настоящего изобретения, но не связываются с соответствующим зрелым эукариотическим гистоном.
Указанное антитело может быть моноклональным или поликлональным антителом.
Термин «антитело» включает моноклональные антитела, поликлональные антитела, одноцепочечные антитела или их фрагменты, которые специфически связывают указанный пептид или полипептид, а также включают биспецифические антитела, синтетические антитела, фрагменты антител, такие как Fab-, F(ab2)'-, Fv- или scFv-фрагменты и т.п., или химически модифицированное производное любого из них. Моноклональные антитела можно приготовить, например, с помощью способов, первоначально описанных Kohler и Milstein в Nature 256 (1975), 495, и Galfre в Meth. Enzymol. 73 (1981), 3, которые включают слияние мышиных миеломных клеток с клетками селезенки, полученными от иммунизированных млекопитающих, с модификациями, разработанными в данной области техники. Кроме того, антитела или их фрагменты против вышеупомянутых пептидов можно получить, используя способы, которые описаны, например, Harlow и Lane в “Antibodies, A Laboratory Manual”, CSH Press, Cold Spring Harbor, 1988. Когда производные указанных антител получают с помощью метода фагового дисплея, поверхностный плазмонный резонанс, используемый в системе BIAcore, можно использовать для увеличения эффективности антител в фагах, которые связываются с эпитопом пептида или полипептида настоящего изобретения (Schier, Human Antibodies Hybridomas 7 (1996), 97-105; Malmborg, J. Immunol. Methods 183 (1995), 7-13). Продукция химерных антител описывается, например, в WO 89/09622. Дальнейшим источником антител, которые используются в соответствии с настоящим изобретением, являются так называемые ксеногенные антитела. Общий принцип продукции ксеногенных антител, таких как антитела человека в мышах, описывается, например, в WO 91/10741, WO 94/02602, WO 96/34096 и WO 96/33735. Антитела, используемые в соответствии с настоящим изобретением, или их соответствующую иммуноглобулиновую цепь(и) можно далее модифицировать, используя общепринятые методы, известные в данной области техники, например, используя делецию(и), вставку(и), замену(ы), добавление(я) аминокислоты и/или рекомбинацию(и) и/или другую модификацию(и) аминокислоты, известную в данной области техники, или отдельно, или в комбинации. Способы введения таких модификаций в последовательность ДНК, определяющей аминокислотную последовательность цепи иммуноглобулина, хорошо известны квалифицированному в данной области техники специалисту, смотри, например, Sambrook, Molecular Cloning: A Laboratory Manual, Cold Spring Harbor Laboratory, Cold Spring Harbor, NY, 1989.
Термин «моноклональное» или «поликлональное антитело» (смотри, Harlow and Lane (1988), в процитированном месте) также относится к производным указанных антител, у которых сохраняется или существенным образом сохраняется их специфичность связывания. Тогда как особенно предпочтительные варианты указанных производных определены далее здесь ниже, другими предпочтительными производными таких антител являются химерные антитела, включающие, например, мышиную или крысиную вариабельную область и константную область человека.
Термин «scFv-фрагмент» (одноцепочечный Fv-фрагмент) достаточно истолкован в данной области техники, и этот фрагмент является предпочтительным из-за его небольшого размера и возможности рекомбинантной продукции таких фрагментов.
Предпочтительно антитело, аптамер, его фрагмент или производное в соответствии с настоящим изобретением специфически связываются с мишенью - белком, полипептидом или его фрагментом или эпитопом, присутствие или отсутствие которой контролируют.
Термин «специфически связывается», используемый в соответствии с настоящим изобретением, означает, что антитело и т.п. не реагирует перекрестно или существенным образом не реагирует перекрестно с полипептидами со схожими структурами или со зрелым эукариотическим полипептидом, не имеющим двух N-концевых остатков метионина. Перекрестную реактивность исследуемой панели антител и т.п. можно проверить, например, путем оценки связывания указанной панели антител и т.п. в обычных условиях (смотри, например, Harlow and Lane (1988), в процитированном месте) с представляющим интерес полипептидом, а также с рядом более или менее (структурно и/или функционально) близкородственных полипептидов. Только те антитела, которые связываются с представляющим интерес полипептидом/белком, но не связываются или по существу не связываются с любым из других полипептидов, которые предпочтительно экспрессируются той же тканью, что и представляющий интерес полипептид, считаются специфическими для представляющего интерес полипептида/белка и отбираются для дальнейших исследований в соответствии со способом настоящего изобретения.
В особенно предпочтительном варианте осуществления способа настоящего изобретения указанное антитело или антигенсвязывающая часть являются или происходят из антитела человека или гуманизированного антитела. Термин «гуманизированное антитело» означает, в соответствии с настоящим изобретением, антитело нечеловеческого происхождения, в котором, по крайней мере, один определяющий комплементарность участок (CDR) в вариабельных областях, такой как CDR3 и предпочтительно все 6 CDR, был заменен CDR антитела человеческого происхождения, имеющего желаемую специфичность. Необязательно нечеловеческая константная область(и) антитела заменена(ы) константной областью(ями) антитела человека. Способы продуцирования гуманизированных антител описываются, например, в ЕР-А1 0239400 и WO 90/07861.
Аптамеры представляют собой молекулы ДНК или РНК, которые были отобраны из произвольных пулов на основе их способности к связыванию с другими молекулами. Были отобраны аптамеры, которые связывают нуклеиновую кислоту, белки, небольшие органические соединения и даже целые организмы. База данных аптамеров содержится на сайте http;//aptamer.icmb.utexas.edu/.
Конкретнее, аптамеры можно классифицировать как аптамеры в виде ДНК или РНК или пептидные аптамеры. Тогда как первые из двух названных аптамеров состоят из (обычно коротких) цепей олигонуклеотидов, последние из двух названных аптамеров состоят из коротких вариабельных пептидных доменов, присоединенных с обоих концов к белковому каркасу.
Аптамеры в виде нуклеиновых кислот являются разновидностями нуклеиновых кислот, которые были разработаны благодаря многократным раундам in vitro отбора или эквивалентно SELEX (систематической эволюции лигандов путем экспоненциального обогащения) для связывания с различными молекулярными мишенями, такими как небольшие молекулы, белки, нуклеиновые кислоты и даже клетки, ткани и организмы.
Пептидные аптамеры являются белками, которые разрабатывают для внесения помех во взаимодействия других белков внутри клеток. Они состоят из вариабельной пептидной петли, присоединенной с обоих концов к белковому каркасу. Эта двойная структурная связь значительно увеличивает аффинность связывания пептидного аптамера до уровней, сопоставимых с аффинностью связывания антитела (наномолярный диапазон). Длина вариабельной петли обычно составляет 10-20 аминокислот, а каркасом может быть любой белок, который обладает способностью к хорошей растворимости. В настоящее время самым используемым каркасным белком является бактериальный белок тиоредоксин-А, при этом вариабельную петлю вставляют в восстанавливающий активный сайт, который представляет собой петлю -Cys-Gly-Pro-Cys- в белке дикого типа, при этом поперечные цепи двух цистеинов способны образовывать дисульфидный мостик. Отбор пептидного аптамера можно выполнить, используя различные системы, но самой используемой системой в настоящее время является дрожжевая двухгибридная система.
Аптамеры употребляются для биотехнологических и терапевтических применений, поскольку они обеспечивают способности к молекулярному узнаванию, конкурирующие со способностями обычно используемых биомолекул, в частности антител. Помимо их способности к различающему узнаванию, аптамеры имеют преимущество над антителами, поскольку их можно сконструировать полностью в тест-пробирке, легко продуцировать с помощью химического синтеза, они обладают желаемой стабильностью при хранении и не обладают и обладают незначительной иммогенностью при терапевтических применениях.
Немодифицированные аптамеры быстро выводятся из кровотока, при этом полупериод существования составляет минуты-часы, главным образом из-за деструкции нуклеазами и клиренса из организма почками, результат существенно низкой молекулярной массы аптамеров. В настоящее время применения немодифицированных аптамеров фокусируются на лечении переходных состояний, таких как свертывание крови, или лечении таких органов, как глаз, при котором возможна местная доставка. Этот быстрый клиренс может быть преимуществом при таких применениях, как in vivo диагностическая визуализация. В распоряжении ученых имеется несколько модификаций, таких как 2'-фторзамещенные пиримидины, связывание с полиэтиленгликолем (PEG), с помощью которых полупериод существования аптамеров можно легко увеличить до временного масштаба, составляющего день или даже неделю.
Фаги в соответствии с настоящим изобретением относятся к рекомбинантным фагам и широко известны в данной области техники и описываются, например, Griffiths и др. в EMBO J. 1994, 13: 3245. Фаги могут нести фрагменты или производные иммуноглобулинов с желаемой специфичностью связывания с полипептидом настоящего изобретения в виде слитого белка на своей поверхности, причем партнером по слиянию является поверхностная молекула фага.
В предпочтительном варианте осуществления способа настоящего изобретения указанное антитело или аптамер, или фаг различимо метят. Тогда как аптамеры предпочтительно радиоактивно метят с использованием 3Н или 32Р или флуоресцентным маркером, таким как описанный выше маркер, фаг или антитело можно, например, пометить соответствующим образом (с использованием 131I в качестве предпочтительной радиоактивной метки) или пометить такой меткой, как His-метка, FLAG-метка или myc-метка.
В альтернативном варианте осуществления настоящим изобретением обеспечивается диагностическая композиция, содержащая указанное антитело, аптамер и/или фаг. Указанная композиция может, кроме того, содержать соответствующий буфер(ы) и ферменты, такие как обратная транскриптаза, термостабильная полимераза и т.п.
Указанную диагностическую композицию можно использовать для проверки присутствия полипептида настоящего изобретения, например, в иммуноанализе, используя антитело настоящего изобретения. Используемый здесь термин «иммуноанализ» включает способы, подобные, например, иммунопреципитации, иммуноблоттингу, ELISA, RIA (радиоиммуноанализу), непрямым иммунофлуоресцентным методам и т.п. Такие методы широко известны в данной области техники и описываются, например, Harlow и Lane, выше.
В альтернативном варианте осуществления настоящим изобретением обеспечивается способ проверки присутствия молекулы нуклеиновой кислоты или полипептида настоящего изобретения, включающий анализ образца, полученного от субъекта, на присутствие указанной молекулы нуклеиновой кислоты или полипептида.
Способы проверки образца на присутствие молекулы нуклеиновой кислоты настоящего изобретения включают, но без ограничения, анализы с использованием амплификации, секвенирования и гибридизации нуклеиновых кислот.
Примеры анализов с использованием амплификации нуклеиновых кислот и средств для их выполнения включают, но без ограничения, ПЦР (включающую «вложенную» ПЦР, ОТ-ПЦР, анализы удлинения с использованием ПЦР, амплификацию, основанную на последовательности нуклеиновых кислот (NASBA), ПЦР для анализа конформационного полиморфизма одноцепочечной ДНК (SSCP)), амплификационные системы для идентификации мутаций (ARMSTM) и анализы линейного удлинения с использованием амплификационной системы для идентификации мутаций (ALEXTM). Детали таких способов можно найти в области техники, смотри, например, Newton et al., Nucleic Acids Res. 17 (1989) 2503-2516; Agrawal (Ed.), “Protocols for Oligonucleotides and Analogs: Synthesis and Properties (Methods in Molecular Biology, 20)”, Humana Press, 1993; Haque et al., Diagn. Mol. Pathol. 7 (1998) 248-252; Innis et al. (Ed.), “PCR Applications: Protocols for Functional Genomics”, Academic Press, 1999; Chen and Janes (Ed.), “PCR Cloning Protocols: From Molecular Cloning to Genetic”, 2nd Edition, Humana Press, 2002; Pissardet et al., Clin. Chem. 48 (2002) 769-772; Steemers et al., Nature Meth. 3 (2006) 31-33: Kakavas et al., J. Clin. Anal. 20 (2006) 1-7.
Примеры анализов секвенирования включают, без ограничения, подходы к анализу последовательностей с помощью прямого секвенирования, флуоресцентного SSCP в автоматическом ДНК-секвенаторе и пиросеквенирование. Эти методики являются обычными в данной области техники, смотри, например, Adams et al. (Ed.), “Automated DNA Sequencing and Analysis”, Academic Press, 1994; Alphey, “DNA Sequencing: From Experimental Methods to Bioinformatics”, Springer Verlag Publishing, 1997; Ramon et al., J. Transl. Med. 1 (2003) 9; Meng et al., J. Clin. Endocrinol. Metab. 90 (2005) 3419-3422.
Примеры анализов гибридизации включают, без ограничения, Норзерн- и Саузерн-блоттинги, гетеродуплексный анализ, обнаружение мутаций с помощью гибридизации с использованием специфичных для последовательностей олигонуклеотидов, гибридизацию с использованием аллель-специфических олигонуклеотидов на ДНК-чипах, анализы, основанные на технологии Illumina's®, анализы, основанные на технологии BeadArray®, смотри, например, Barnes et al., Nucleic Acids Res. 33 (2005) 5914-5923; Fan et al., Biotechniques 39 (2005) 583-588; Shen et al., Mutat. Res.-Fund. Mol. M. 573 (2005) 70-82; Steemers and Gunderson, Pharmacogenomics, 6 (2005) 777-782.
Примеры анализов, основанных на выявлении белков, включают, без ограничения, стадии способов, такие как ионообменная хроматография, гель-фильтрация, аффинная хроматография, хроматография на основе гидрофобных взаимодействий, HPLC с обращенной фазой, диск-электрофорез, капиллярный электрофорез, Вестерн-блоттинг, иммунопреципитацию, аминокислотное секвенирование, спектроскопические способы (УФ, циркулярный дихроизм, ИК, флуоресценцию) и масс-спектрометрию (например, MS-QTOF), смотри, например, Soejima and Koda, Transfusion 45 (2005) 1934-1939; Yeh et al., Anesth. Analg. 101 (2005) 1401-1406; Chou et al., Am. J. Clin. Pathol. 124 (2005) 330-338.
Описанные выше анализы известны в данной области техники, например, из стандартных книг-текстов, таких как Lottspeich, Engel “Bioanalytik” Spektrum Akademischer Verlag (2006); Sambrook and Russell “Molecular Cloning, A Laboratory Manual”, Cold Spring Harbor Laboratory, N.Y. (2001); Ausubel, “Current Protocols in Molecular Biology”, Green Publishing Associates and Wiley Interscience, N.Y. (1989); Higgins and Hames (Eds.) “Nucleic acid hybridization, a practical approach” IRL Press Oxford, Washington DC (1985); Nollau et al., Clin. Chem. 43 (1997), 1114-1128. Использование некоторых из приведенных анализов описывается в прилагаемых примерах.
В другом предпочтительном варианте осуществления способа настоящего изобретения указанным образцом является кровь, сыворотка, плазма, ткань плода, слюна, моча, ткань слизистой оболочки, слизь, ткань влагалища, ткань плода, полученная из влагалища, кожа, волос, волосяной фолликул или другая ткань человека. Предпочтительно образцом является кровь, сыворотка, плазма, слюна, моча, ткань слизистой оболочки, слизь.
Настоящее изобретение также относится к набору, включающему молекулу нуклеиновой кислоты, вектор, не являющийся человеком хозяин, полипептид или антитело, аптамер и/или фаг настоящего изобретения в одном или нескольких контейнерах.
На фигурах демонстрируются:
Фиг.1. Схематическое представление процедуры очистки.
Фиг.2. QTOF Масс-спектр В1, клиническая экспериментальная серия M-H1A-P02.
Фиг.3. QTOF Масс-спектр В2, клиническая экспериментальная серия M-H1A-пул01.
Настоящее изобретение теперь будет описано посредством ссылки на следующие примеры, которые являются только иллюстративными и не должны толковаться как ограничение объема настоящего изобретения.
Пример 1: Клонирование конструкций hH1.3
Конструирование плазмидного вектора pEGT1-rH1.3S1
Как показано в SEQ ID NO: 1, гистоны демонстрируют сильный положительный заряд, являющийся следствием очень высокого содержания остатков лизинов. Поскольку использование кодонов для лизина сильно отличается между Escherichia coli и человеком, была произведена оптимизация кодонов для адаптации последовательности гистона Н1.3 человека к использованию кодонов в E.coli.
Получали синтетический ген, последовательность которого предоставлена как SEQ ID NO: 2. Искусственная последовательность была фланкирована двумя сайтами рестрикции, а именно для BspH1 и BamH1, для того чтобы сделать возможным последующее введение в экспрессионный вектор pEGT1. Кодон инициации трансляции ATG был включен в сайт рестрикции Nco1 CCATGG. Начальный ATG был удвоен, что обеспечивает сайт для BspH1 TCATGA, липкий конец CATG которого совместим с Nco1. Таким образом, второй остаток метионина был включен после первого остатка метионина. Дополнительный сайт для BamH1 GGATCC был введен после кодона терминации TAA. Аминокислотная последовательность, кодируемая этим искусственным геном, предоставлена в SEQ ID NO: 3.
Оптимизированный ген вырезали из содержащей его плазмиды с помощью расщепления BspH1 и BamH1 и встраивали в экспрессионный вектор pEGT1, линеаризованный с помощью Nco1 и BamH1, в соответствии со стандартными протоколами для получения плазмиды pEGT1-rH1.3S1.
Подвергнутый лигированию вектор pEGT1-rH1.3S1 вводили в электрокомпетентный штамм BL21[DE3] E.coli с помощью электропорации, используя стандартный протокол, и трансформированные клетки отбирали на чашках с LB, дополненным канамицином. Был отобран один клон, и последовательность кодирующей гистон вставки проверяли на ее точное соответствие с SEQ ID NO: 2.
Конструирование плазмидного вектора pEGT1-rH1.3S2
Для пресечения вставки второго метионина в конструкцию rH1.3S1 использовали второй синтетический ген. Второй исходный кодон ТСС, кодирующий серин, заменяли на AGC, также кодирующий серин, для обеспечения совместимости с сайтом для BspH1. Последовательность ДНК предоставлена как SEQ ID NO: 4, а рекомбинантный белок, кодируемый этим искусственным геном, предоставлен как SEQ ID NO: 5. Использовали стратегию клонирования, одинаковую со стратегией клонирования, очерченной выше для pEGT1-rH1.3S1, так как искусственный ген SEQ ID NO: 4 был фланкирован сайтом рестрикции для BspH1 TCATGA при кодоне-инициаторе и сайтом рестрикции для BamH1 CCATGG через одну пару оснований после кодона-терминатора.
Оптимизированный ген вырезали из содержащей его плазмиды с помощью расщепления BspH1 и BamH1 и встраивали в экспрессионный вектор pEGT1, линеаризованный с помощью Nco1 и BamH1, в соответствии со стандартными протоколами для получения плазмиды pEGT1-rH1.3S2.
Подвергнутый лигированию вектор pEGT1-rH1.3S2 вводили в электрокомпетентный штамм BL21[DE3] E.coli с помощью электропорации, используя стандартный протокол, и трансформированные клетки отбирали на чашках с LB, дополненным канамицином. Был отобран один клон, и последовательность кодирующей гистон вставки проверяли на ее точное соответствие с SEQ ID NO: 4.
Пример 2: Рекомбинантная продукция гистона Н1.3
Штамм
Используемой для приготовления rH1.3S бактерией является рекомбинантный штамм BL21 (DE3)/pEGT1/H1.3S Escherichia coli. Конструкции использовали для трансформации штамма BL21 (DE3) E. coli. Три клона были отобраны для проведения отбора по экспрессии, и один клон был выбран для приготовления подготовительного посевного материала (Pre-MS-05L23-H1B).
Основной посевной материал (MS-06D05-H1B) получали, используя Pre-MS-05L23-H1B), а рабочий посевной материал (WS-06D06-H1B) получали, используя основной посевной материал.
Культивирование посевного материала
Каждую из двух встряхиваемых колб на 2 литра, каждая из которых содержит 500 мл среды YES (30 г/л дрожжевого экстракта, 5 г/л NaCl), засевают 100 мкл рабочего посевного материала (WS-06D06-H1B). Культуру инкубируют при 37°С со встряхиванием при 270 об/мин в течение 5 ч (+/-0,5 ч) до достижения ОП (600 нм), составляющей более чем 1,5.
Ферментация
Ферментер на 100 литров готовят с использованием 100 литров среды NRJ18. Ферментер стерилизуют в течение 30 минут при 123°С. После стерилизации и перед инокуляцией асептически добавляют 50 мл SAG471 (пеногасителя). Ферментер засевают культурой посевного материала с достижением теоретической исходной оптической плотности при 600 нм, составляющей 8,75 × 10-7.
Рассчитанный объем посевного материала добавляют в бутыль для переноса, содержащую 500 мл среды YES.
Ферментацию проводят в течение ночи при 37°С. Во время ферментационного процесса рН поддерживают на уровне рН 7,0±0,2 с помощью периодического добавления 4 М NaOH и 2,24 М HNO3. Растворенный кислород по принципу обратной связи регулируют при встряхивании на уровне 30%.
Когда культура достигает ОП600 между 15 и 20, культуру индуцируют раствором 1 мМ IPTG (23,8 г, растворенные в 500 мл высоко очищенной воды).
После индукции в течение 1 ч 30 мин ОП600 составляет более 24, и ферментер охлаждают ниже 16°С. Регуляцию рН сохраняют на уровне рН 7,0±0,2. Во время охлаждения сохраняют постоянными другие параметры, за исключением давления, которое снижается до 400 мбар, а встряхивание до 200 об/мин.
Когда температура среды становится ниже 16°С, определяют объем культуры. Всю культуру центрифугируют с использованием 2 Beckman-центрифуг JA10, снабженных ротором JLA 8.1000 (±6 л/центрифугу): 5200 об/мин - 4°С - 20 минут.
Во время стадии центрифугирования клеточные осадки получают и хранят далее при -20°С.
Разрушение клеток в гомогенизаторе с использованием высокого давления
За день до разрушения клеток концентрированные клетки, соответствующие 100 литрам культуры, оттаивают при комнатной температуре.
В день разрушения клеточные осадки разводят до 250 г/л в 20 мМ Na2HPO4. 12H2O, pH 7,0, и температуру суспензии увеличивают до 30°С.
Суспензию затем гомогенизируют в пропеллерной мешалке Heidolph R2R100. Клетки затем лизируют в гомогенизаторе PONY с использованием высокого давления (800 бар). Суспензию клеток дважды обрабатывают посредством клеточного гомогенизатора.
Пример 3: Очистка белков
Все стадии очистки выполняют с использованием всего объема ферментера (т.е. 100 л).
1. Преципитация 2,5% хлорной кислотой и экстракция 8М мочевиной
К полученной клеточной массе добавляют 1/7 объема 20% HClO4 (конечная концентрация: 2,5%). Суспензию гомогенизируют перед третьим циклом в гомогенизаторе PONY при 250 бар. Раствор сохраняют при легком встряхивании в течение одного часа при комнатной температуре. Затем суспензию центрифугируют в течение 15 минут (12200 g - 7000 об/мин, 4°С). Супернатант собирают, доводят рН до 4,0±0,1 с помощью 10М NaOH и фильтруют через мембрану 0,45/0,22 мкм Sartopore 2 (2000 см2) в стерильный мягкий резервуар.
Добавляют мочевину с получением 8 М концентрации в двойном конечном объеме, при этом объем доводят с помощью 20 мМ буфера Na2HPO4, pH 7,0. Раствор сохраняют в течение ночи при легком встряхивании при комнатной температуре. Затем рН доводят до 4,0±0,1 с использованием 37% HCl или 10 М NaOH.
2. Анионообменная хроматография на Q-Сефарозе для быстрого потока (QSFF) - тип со знаком минус
Целью этой стадии является снижение содержания эндотоксинов и ДНК. Анионообменную хроматографию проводят с использованием Q-Сефарозы для быстрого потока (Amersham Biosciences, каталожный № 17-0510-05), которой наполнена колонка Moduline 350/500 (Millipore BioProcess Division, каталожный № 86351211).
Колонку наполняют в высокоочищенной воде со скоростью потока элюента 120 см/ч (115,4 л/ч). Размерами уплотненного слоя колонки являются: диаметр = 25 см, площадь поперечного сечения = 961 см2, слой = 18 см, наполненный объем = 17,314±0,962 л. Колонку дезинфицируют с использованием 1,5-2,5 объемов колонки (CV) 1М NaOH + 2М NaCl с продолжительностью контакта, составляющей 2 часа, при скорости потока 96,2 л/ч (100 см/ч -1603 мл/ч).
Все хроматографические стадии выполняют со скоростью линейного потока 100 см/ч (± 96,2 л/ч). рН стабилизируют с использованием 1-2 CV 50 мМ ацетата аммония + 1 М NaCl, pH 4,0. Колонку затем уравновешивают 3,5-5 CV 50 мМ ацетата аммония + 8 М мочевина, pH 4,0.
Раствор от экстракции мочевиной (смотри раздел 1) разводят приблизительно в 1,5 раза 50 мМ ацетатом аммония + 8 М мочевина, pH 4,0, для получения проводимости, составляющей менее 10 мСм/см. Только 8 CV раствора от экстракции мочевиной (до разведения) загружают в один и тот же момент времени. Белок Н1 получают в протоке, при уравновешивании - элюции, выполняемой с использованием 1,5-2,5 CV 50 мМ ацетата аммония + 8 М мочевина, pH 4,0.
После элюирования колонку очищают с использованием 1,5-2,5 CV 50 мМ ацетата аммония + 1 М NaCl, pH 4,0. Такое элюирование в 1 М NaCl позволяет элиминировать ДНК и эндотоксины. Затем колонку дезинфицируют с использованием 1,5-2,5 CV 1М NaOH + 2М NaCl (2 ч) и хранят при комнатной температуре в 20 мМ NaOH.
3. Катионообменная хроматография на MacroPrep High-S (MHS-E) - тип со знаком плюс
Катионообменную хроматографию проводят с использованием MacroPrep High-S (Bio-Rad Laboratories, каталожный № 156-0033), которой наполнена колонка Vantage 180/500 (Millipore BioProcess Division, каталожный № 87018001). Колонку наполняют в высокоочищенной воде со скоростью потока элюента 260 см/ч (66,1 л/ч). Размерами уплотненного слоя колонки являются: диаметр = 18 см, площадь поперечного сечения = 254,4 см2, слой = 36 см, наполненный объем = 9,16±0,25 л.
Колонку дезинфицируют с использованием 1,5-2,5 CV 1М NaOH + 2М NaCl с продолжительностью контакта, составляющей 2 часа, при скорости потока 40 л/ч (157 см/ч). Максимальная скорость потока может составлять 250 см/ч. рН стабилизируют с использованием 1-2 CV 50 мМ ацетата аммония + 2 М NaCl, pH 4,0. Колонку затем уравновешивают 4-5,5 CV 50 мМ ацетата аммония, pH 2,0.
рН фракции QSFF-FT (смотри раздел 2) доводят до 2,0 с помощью 37% HCl. Этот раствор загружают без предварительного разбавления со скоростью потока, составляющей 125 см/ч (±31,8 л/ч). Связывающая способность геля составляет 5-15 мг/мл матрикса. После загрузки колонку уравновешивают 2-3 CV 50 мМ ацетата аммония, pH 2,0, со скоростью потока 157 см/ч (40 л/ч). Максимальная скорость потока составляет 200 см/ч.
Элюцию проводят, используя линейный градиент проводимости в 10 CV между 25% (0,5 М NaCl) и 75% (1,5 М NaCl) с применением 50 мМ ацетата аммония, pH 2,0, и 50 мМ ацетата аммония + 2 М NaCl, pH 2,0. Элюцию проводят со скоростью потока, составляющей 157 см/ч (40 л/ч). Максимальная скорость потока составляет 200 см/ч. Пик элюции получают в 2-литровых фракциях, которые анализируют с помощью электрофореза в SDS-ПААГ до объединения. После объединения пул MHS-E хранят при -20°С до следующей стадии очистки или при 2-8°С при использовании в пределах 24 часов.
Затем колонку дезинфицируют с использованием 1,5-2,5 CV 1М NaOH + 2М NaCl (2 ч) и хранят при комнатной температуре в 20 мМ NaOH.
4. Концентрирование - диафильтрация
Концентрирование проводят с использованием двух кассет Sartocon (0,6 м2, отсечка 5 кДа) с мембранами из гидросарта (Hydrosart) Sartorius (Sartopore, каталожный № 3021442906 E-SC). Мембраны зафиксированы в держателе, соединенном с системой Proflux M13 (Millipore Bioprocess Division). Мембрану промывают водой для инъекции (WFI). Дезинфекцию проводят путем непрерывной рециркуляции 0,5 М NaOH в течение 60 минут. Затем мембрану промывают 20 мМ Na2HPO4. 12 H2O до рН фильтрата = 7,0±0,1. Затем мембрану уравновешивают PBS, pH 7,4 (8 г/л NaCl, 0,19 г/л KH2PO4, 2,38 г/л Na2HPO4) до рН фильтрата = 7,4±0,1.
Давление на входе и давление на выходе устанавливают на 1,5±0,1 бар и 1,2±0,1 бар, соответственно.
Несколько элюатов с MacroPrep High-S объединяют вместе и, в соответствии с общим количеством белка, концентрируют до объема, соответствующего теоретической концентрации 30 мг/мл. После концентрирования концентрат подвергают диафильтрации против 10 объемов PBS, pH 7,4 (8 г/л NaCl, 0,19 г/л KH2PO4, 2,38 г/л Na2HPO4). Концентрат собирают и проводят 7 промывок мембраны, каждую промывку с использованием 150 мл PBS, pH 7,4 (8 г/л NaCl, 0,19 г/л KH2PO4, 2,38 г/л Na2HPO4) в течение 3 минут, с использованием одних и тех же параметров процесса. Ряд концентратов замыкают во время промывок.
Анализ белка с использованием BSA выполняют на концентрате и каждой из отдельных фракций промывок. Концентрат объединяют с отобранными фракциями промывок для получения общей концентрации, превышающей 12 мг/мл, с выходом, превышающим 90%, если возможно.
Мембрану промывают WFI. Дезинфекцию проводят путем непрерывной рециркуляции 0,5 М NaOH в течение 60 минут. Мембрану затем хранят в 0,1 М NaOH.
5. Стерилизация фильтрованием
Стерилизацию фильтрованием концентрата + отобранных фракций промывок выполняют на фильтре 1000 см2 0,45/0,22 Sartopore 2 (Sartorius, каталожный № 544-1307-H8-00) при комнатной температуре. Мембрану промывают приблизительно 500 мл PBS, pH 7,4 (8 г/л NaCl, 0,19 г/л KH2PO4, 2,38 г/л Na2HPO4).
Фильтрацию проводят, используя перистальтический насос, со скоростью потока, составляющей приблизительно 100 мл/мин, и фильтрат собирают в стерильную и свободную от пирогенов бутыль для одного применения на 5 л или 10 л.
В соответствии с анализом с использованием BCA, выполненном на отфильтрованной массе, концентрацию устанавливают на уровне 10 мг/мл с использованием PBS, pH 7,4 (8 г/л NaCl, 0,19 г/л KH2PO4, 2,38 г/л Na2HPO4), добавляемым при фильтрации. После отбора образцов стерильную массу распределяют аликвотами в PETG 2000-мл Nalgene-бутыли (±1500 мл - 1700 мл/бутыль). Стерильную массу хранят при -20°С. Схематическая сводка стадий получения предоставлена на фиг.1.
Пример 4: Эффективность очистки hH1.3 и бис-Met-hH1.3
Культивирование BL21[DE3]-бис-Met-rH1.3 в 50-л ферментере приводило в результате к выходу в момент сбора, составляющему, по крайней мере, 600 мг/л культуры, как определено с помощью анализа электрофорезом в SDS-ПААГ серийного разведения подвергнутых лизису клеток в целом. Конечный выход после полного процесса очистки превышал 500 мг/л очищенного бис-Met-rH1.3.
Культивирование BL21[DE3]-hH1.3 в 50-л ферментере приводило в результате к выходу в момент сбора, составляющему, по крайней мере, 600 мг/л культуры, как определено с помощью анализа электрофорезом в SDS-ПААГ серийного разведения подвергнутых лизису клеток в целом. Клетки подвергали обработке посредством гомогенизации и преципитации с использованием HClO4 в соответствии со стандартным протоколом. Полученные результаты соответствовали ожиданию. Загрузку на MacroPrep High-S также проводили как обычно, однако белок rhH1.3 невозможно было элюировать с колонки, используя линейный градиент проводимости в 10 CV между 30% (0,6 М NaCl) и 75% (1,5 М NaCl) с применением 10 мМ NaCH3COO, pH 2,0, и 10 мМ NaCH3COO + 2 М NaCl, pH 2,0. Хотя белок rhH1.3 элюировался 2 М NaCl, эта стадия не позволяла эффективно очистить белок, и белок нельзя было подвергнуть дальнейшей обработке. Таким образом, очистка должна считаться неудавшейся. Эта неудача подтверждена на двух независимых опытах по очистке, начавшихся с двух независимых ферментаций.
Пример 5: Эффект бис-Met-гистона H1.3 in vitro
Анализ зоны ингибирования
Для измерения эффекта рекомбинантного гистона в качестве противомикробного и антивирусного агента проводили анализ зоны ингибирования в соответствии со стандартными способами. Кроме того, проверяли эффект рекомбинантного гистона в качестве противогрибкового агента. Бактерии и грибы выращивали в присутствии бис-Met-гистона H1.3, полученного в соответствии со способами, очерченными выше, и определяли средний диаметр зоны (смотри таблицу 1).
Как грамположительные, так и грамотрицательные бактерии и грибы эффективно уничтожались, как показано в таблице 1.
Анализ зоны ингибирования
Анализ цитотоксичности
Этот клеточный анализ является выявлением токсического эффекта гистона на чувствительную к гистонам линию лейкозных клеток (например, U-937). Жизнеспособность клеток рака - лейкоза после инкубации при различных концентрациях гистона контролировали посредством исследования AlamarBlue, основанного на измерении флуоресценции индикатора окисления-восстановления, которая изменяется в ответ на жизнеспособность клетки. Противораковую активность гистона определяют по IC50, которая соответствуют концентрации гистона, при которой определяется 50% жизнеспособность раковых клеток. Экспериментальные серии, использованные для анализа цитотоксичности, а также клинических испытаний, суммированы в таблице 2. Как показано в таблице 1, все проверенные образцы демонстрируют схожую высокую цитотоксичность в отношении линии опухолевых клеток U-937, независимо от различных содержаний Н1.3 и бис-Met (сравни с таблицей 3).
Цитотоксичность экспериментальных серий, использованных в клиническом испытании
Помимо бактерий и грибов, продемонстрированных в таблице 1, можно подходящим образом проверить дополнительные бактерии, грибы и вирусы, используя известные в данной области техники способы, такие как любой из способов, очерченных здесь. Не ограничивающие примеры включают вирус Эпштейна-Барра, Staphylococcus aureus, Aspergillus niger, Enterococcus, Pseudomonas, Haemophilus influenzae и Salmonella.
Пример 6: Клинические данные
Было проведено испытание фазы I/II с увеличением дозы для оценки максимальной переносимой дозы (MTD) рекомбинантного гистона Н1.3 человека (rhH1.3) на пациентах с рецидивирующим или не поддающимся лечению острым миелобластным лейкозом (AML) и на пациентах, отказавшихся от химиотерапии, или пациентах, не подходящих для химиотерапии. Критериями для включения пациентов были подписанное информированное согласие, любая раса, оба анатомических пола, возраст, составляющий, по крайней мере, 18 лет, цитологически доказанный AML с, по крайней мере, 20% бластных клеток в костном мозге, неуспешная попытка стандартной химиотерапии, несоответствие ей или отказ от нее, адекватное общее состояние (индекс Карнофского >60%) и предполагаемая продолжительность жизни, составляющая, по крайней мере, 30 дней. Критериями, которые приводили к исключению пациентов, были значительная органная недостаточность, известное инфекционное заболевание, вызванное ВИЧ, известное инфекционное заболевание, вызванное вирусом гепатита С или вирусом гепатита В, беременность или кормление ребенка грудью, другие злокачественности, циркулирующие антитела против Н1, лечение гепарином в течение двух недель до визита 1 или во время участия в исследовании, активные заболевания, о которых известно, что они могут мешать лечению rhH1.3, такие как ревматоидный артрит или системная красная волчанка (SLE), а также злоупотребление алкоголем и/или наркотиками.
Схема исследования
Пациенты получали 3 инфузии в неделю на протяжении трех следующих друг за другом недель. Первоначальная доза составляла 38 мг/м2. Использованная схема увеличения дозы показана в таблице 3.
Схема увеличения дозы
Клиническое испытание фазы I/II было проведено в Saarland University Hospital в Homburg на пациентах с AML (острым миелобластным лейкозом). Использованными в этом испытании экспериментальными сериями лекарственного продукта были В1, В2, В3 и В4. Характеристики этих четырех экспериментальных серий и одной экспериментальной серии GLP, использованной в токсикологическом исследовании, представлены ниже в таблице 4.
Характеристики экспериментальных серий полипептида, использованных в этом исследовании
AL: предельно допустимый уровен
MS-пики: 22221 ДаН1.3без Met22481 Дабис-MetN-концевой Met-Met
6.1. Предварительная оценка
В таблице 5 суммированы предварительные клинические результаты первых 22 пациентов с AML, подвергнутых лечению рекомбинантным гистоном Н1.3 человека (rhH1.3, “Oncohist”) на уровнях увеличивающихся доз (так называемая схема Фибоначчи).
Каждый из пациентов WW13 и WW27 получал два цикла лечения (один цикл включал 3 инфузии в неделю в течение трех недель, всего 9). Для WW27 использовали увеличение дозы в каждом цикле, т.е. 5-5-6: уровень дозы 5 в течение двух недель, уровень дозы 6 на третьей недели и аналогично во втором цикле уровни дозы: 6-6-7.
Полученные при предварительной оценке клинические результаты пациентов с AML, подвергнутых лечению рекомбинантным гистоном Н1.3 человека (“Oncohist”)
PR: частичная ремиссия
TTI: временное увеличение тромбоцитов
TN: тромбоциты на нормальном уровне
TLI: временное увеличение лейкоцитов
NSE: без побочных эффектов
H1.3: зрелый рекомбинантный гистон Н1.3 человека; бис-Met: N-Met-Met-H1.3
Как видно из таблицы 5, побочные эффекты лекарственного средства встречаются только в результате загрязнения эндотоксином (смотри также таблицу 3). И встречающийся в природе гистон Н1.3, и производное «бис-Met» демонстрируют схожие свойства при рассмотрении клинических признаков эффективности.
Иммуногенность
Всех пациентов подвергали скринингу на наличие аутоантител против гистона Н1.3 до, во время и после лечения. Во время лечения аутоантитела не вырабатывались ни у одного из подвергнутых лечению пациентов, ни у тех, которых подвергли одному циклу лечения, ни у тех, которые получили два цикла. Гистон Н1 является эволюционно очень консервативным белком, и не ожидалось и не было доказано, что он иммуногенен. Клинические данные подтверждают, что иммуногенную активность можно наблюдать, используя или встречающийся в природе гистон Н1.3, или производное «бис-Met».
Терапевтические эффекты
У приблизительно 50% пациентов продемонстрировано увеличение тромбоцитов, и у части из них - также увеличение лейкоцитов, обоих очень важных биомаркеров AML. Эти пациенты имели частичную ремиссию (уменьшение опухолевых клеток до менее чем 50% первоначальной величины). Пациент WW13 продемонстрировал увеличение тромбоцитов до нормального уровня (210 × 109/л), которое продолжалось 18 месяцев. Количество тромбоцитов у него до лечения Oncohist равнялось 47 × 109/л.
6.2. Окончательная оценка клинических результатов
В таблице 6 суммированы клинические результаты, полученные после детального анализа 22 пациентов с AML, подвергнутых лечению рекомбинантным гистоном Н1.3 человека (rhH1.3, “Oncohist”) на уровнях увеличивающихся доз (по схеме Фибоначчи).
Как указано выше, каждый из пациентов WW13 и WW27 получал два цикла лечения (один цикл включал 3 инфузии в неделю в течение трех недель, всего 9). Для WW27 использовали увеличение дозы в каждом цикле, т.е. 5-5-6: уровень дозы 5 в течение двух недель, уровень дозы 6 на третьей недели и аналогично во втором цикле уровни дозы: 6-6-7.
Полученные при окончательной оценке клинические результаты пациентов с AML, подвергнутых лечению рекомбинантным гистоном Н1.3 человека (“Oncohist”)
** после одной из 9 инфузий АЕ, устраненные
*** во время последней инфузии SAE, фибрилляция предсердий у 74-летнего пациента, вызывающая сомнение связь
PR: частичная ремиссия
TI: увеличение тромбоцитов
TN: тромбоциты на нормальном уровне
LI: увеличение лейкоцитов
AE: нежелательные действия; SAE: серьезные нежелательные действия
H1.3: зрелый рекомбинантный гистон Н1.3 человека; бис-Met: N-Met-Met-H1.3
Терапевтические эффекты
В соответствии с окончательной оценкой у семи из 22 продемонстрировано увеличение тромбоцитов, и у части из них - также увеличение лейкоцитов, обоих очень важных биомаркеров AML. Эти пациенты имели частичную ремиссию (уменьшение опухолевых клеток до менее чем 6-25% с сопутствующим улучшением других показателей крови). Пациент WW13 продемонстрировал увеличение тромбоцитов до нормального уровня (210 × 109/л), которое продолжалось 18 месяцев. Количество тромбоцитов у него до лечения Oncohist равнялось 47 × 109/л.
Оценка безопасности
В отчете о клиническом исследовании демонстрируется, что rhH1.3 (Oncohist) безопасен в дозах, использованных для лечения до сих пор. Серьезных побочных эффектов не наблюдалось за исключением одной фибрилляции предсердий при инфузии rhH1.3, которая, как считают, связана, возможно, с исследуемым лекарственным средством. Семнадцать (17) пациентов завершили один курс терапии (8-9 введений), и два отвечающих пациента получили второй курс без побочных эффектов. Ограничивающие дозу токсичности не определялись, и максимальная переносимая доза не была достигнута при 628 мг/м2.
Наиболее важным является то, что чистое, без эндотоксина исследуемое лекарственное средство хорошо переносилось пациентами, т.е. без побочных эффектов, в противоположность цитостатикам. Этот результат соответствует предварительным исследованиям, демонстрирующим, что рекомбинантное производное гистона Н1.3 человека не вызывает повреждение здоровых клеток крови и не вызывает устойчивость.
Пример 7: Определение присутствия бис-Met-hH1.3 в образце
С помощью MS «бис-Met»-гистон hH1.3 легко отличить от эндогенного гистона Н1. Этот анализ можно осуществить непосредственно с использованием выявления с помощью ESI-QTOF в исходном не подвернутом обработке растворе лекарственного продукта rhH1.3 или способом RP-HPLC-ESI-MS с хроматографическим отделением с использованием HPLC с обращенной фазой (RP-HPLC) и последующим выявлением с помощью ESI-MS. Как видно на фиг.2, экспериментальная серия В1 содержит как гистон Н1.3, так и N-Met-Met-производное. На фиг.3 демонстрируется одна из трех экспериментальных серий (В2), которые состоят, главным образом, из N-Met-Met-Н1.3. Независимо от состава различные экспериментальные серии демонстрируют сравнимую цитотоксическую активность в отношении лейкозных клеток (таблица 3).
Следующие спектры были получены с помощью тандемной масс-спектрометрии (QTOF, сочетания квадрупольной и времяпролетной спектрометрий в одной приборе). Как видно на фиг.2, экспериментальная серия В1 содержит и гистон Н1.3, и N-Met-Met-производное. На фиг.3 демонстрируется одна из трех экспериментальных серий (В2), которые состоят, главным образом, из N-Met-Met-Н1.3. Независимо от состава различные экспериментальные серии демонстрируют сравнимую цитотоксическую активность в отношении лейкозных клеток (таблица 3).











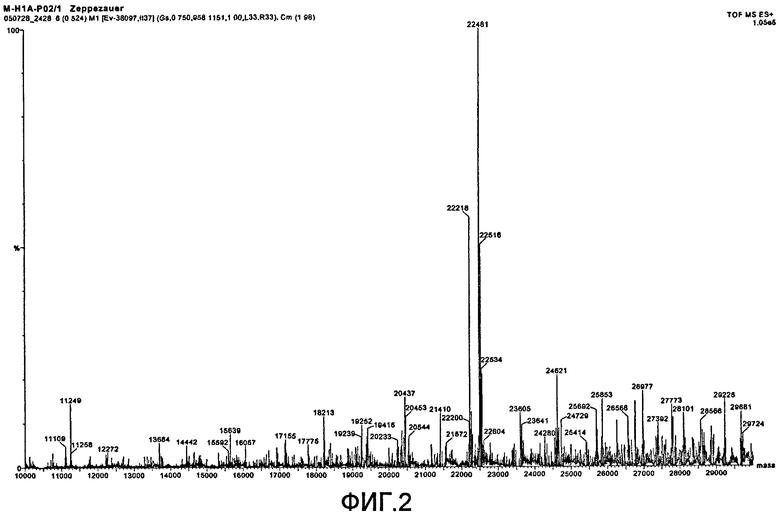
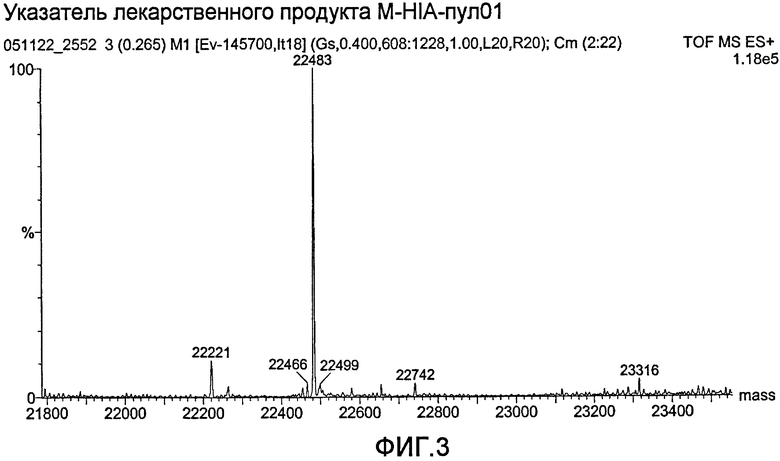
Изобретение относится к области биотехнологии, конкретно к бис-Met-гистонам, и может быть использовано в медицине. Молекула нуклеиновой кислоты кодирует полипептид, состоящий из двух остатков метионина в качестве первого и второго N-концевых аминокислотных остатков, соединенных через пептидную связь со зрелым эукариотическим гистоном. Полипептид получают путем культивирования клетки-хозяина, трансформированной вектором экспрессии, включающим указанную молекулу нуклеиновой кислоты. Полипептид используют в составе фармацевтической композиции для лечения рака, бактериальных, вирусных или грибковых инфекций. Также полипептид используют в составе композиции для диагностики пациента в отношении наличия ответа на фармацевтическую композицию, содержащую указанный полипептид, или в отношении излечимости с ее помощью. Изобретение позволяет увеличить эффективность рекомбинантной экспрессии и облегчить определение указанного полипептида в присутствии эндогенных гистонов при сохранении биологической активности зрелого эукариотического гистона. 12 н. и 5 з.п. ф-лы, 3 ил., 6 табл., 7 пр.
1. Молекула нуклеиновой кислоты, кодирующая полипептид, имеющий функцию гистона, которая
(a) кодирует полипептид, состоящий из
(aa) двух остатков метионина в качестве первого и второго N-концевых аминокислотных остатков, соединенных через пептидную связь со
(ab) зрелым эукариотическим гистоном;
(b) кодирует полипептид, состоящий из
(ba) двух остатков метионина в качестве первого и второго N-концевых аминокислотных остатков, соединенных через пептидную связь со
(bb) зрелым эукариотическим полипептидом, последовательность которого, по крайней мере, на 80% идентична последовательности зрелого эукариотического гистона (а) и существенным образом сохраняет свою биологическую активность; или
(c) гибридизуется в жестких условиях с комплементарной цепью молекулы нуклеиновой кислоты, кодирующей полипептид (а) или (b), причем указанная молекула нуклеиновой кислоты кодирует полипептид, который имеет, по крайней мере, два N-концевых остатка метионина и существенным образом сохраняет биологическую активность полипептида (а) или (b).
2. Молекула нуклеиновой кислоты по п.1, где гистон выбирают из группы, состоящей из гистона H1.0, H1.1, H1.2, Н1.3, H1.4, H1.5 и H1t.
3. Последовательность нуклеиновой кислоты, которая комплементарна молекуле нуклеиновой кислоты по п.1 или 2.
4. Антисмысловой олиго- или полинуклеотид молекулы нуклеиновой кислоты по п.1 или 2, который включает нуклеотиды, комплементарные триплетам из нуклеотидов, кодирующим два первых N-концевых остатка метионина (ab), (bb) или (с), и имеет минимальную длину, составляющую 10 нуклеотидов.
5. Вектор экспрессии, включающий молекулу нуклеиновой кислоты по п.1 или 2.
6. Клетка-хозяин, трансформированная вектором по п.5, для экспрессии полипептида, кодируемого нуклеиновой кислотой по п.1 или 2, причем клетка-хозяин не является человеком и не является человеческим эмбрионом.
7. Клетка-хозяин по п.6, которая является бактерией, дрожжевой клеткой, клеткой насекомого, клеткой гриба, клеткой млекопитающего или клеткой растения.
8. Способ продуцирования полипептида, кодируемого нуклеиновой кислотой по п.1 или 2, включающий культивирование клетки-хозяина по п.6 или 7 в подходящих условиях и выделение продуцированного полипептида.
9. Полипептид, обладающий активностью зрелого эукариотического гистона, рекомбинантно экспрессируемый с повышенной эффективностью и обнаруживаемый в присутствии эндогенных гистонов, кодируемый молекулой нуклеиновой кислоты по п.1 или 2 или продуцированный с помощью способа по п.8.
10. Фармацевтическая композиция для лечения рака, бактериальных, вирусных или грибковых инфекций, содержащая полипептид по п.9 и необязательно дополнительно содержащая фармацевтически приемлемый носитель и/или разбавитель.
11. Композиция по п.10, дополнительно содержащая зрелый эукариотический гистон.
12. Композиция для диагностики пациента в отношении наличия ответа на фармацевтическую композицию по п.10 или в отношении излечимости с ее помощью, содержащая полипептид по п.9.
13. Композиция по п.12, дополнительно содержащая зрелый эукариотический гистон.
14. Способ лечения рака, бактериальных, вирусных или грибковых инфекций, включающий введение композиции по п.10 нуждающемуся в этом субъекту.
15. Применение молекулы нуклеиновой кислоты по п.1 или 2 или вектора по п.5, или хозяина по п.6 или 7, или полипептида по п.9 в приготовлении композиции для лечения рака, бактериальных, вирусных или грибковых инфекций.
16. Способ проверки присутствия молекулы нуклеиновой кислоты по п.1 или 2 или полипептида по п.9, включающий анализ образца, полученного от субъекта, на присутствие указанной молекулы нуклеиновой кислоты или полипептида.
17. Способ по п.16, в котором указанным образцом является кровь, сыворотка, плазма, слюна, моча, ткань слизистой оболочки, слизь.
| Способ выполнения логических операций | 1962 |
|
SU151511A1 |
| HIREL P.H | |||
| et al., Extent of N-terminal methionine excision from Escherichia coli proteins is governed by the side-chain length of the penultimate amino acid, Proc | |||
| Natl | |||
| Acad | |||
| Sci | |||
| USA, 1989, v.86, n.21, р.8247-8251 | |||
| СРЕДСТВО ДЛЯ ПЕРЕНОСА НУКЛЕИНОВЫХ КИСЛОТ ИЛИ ИХ ПРОИЗВОДНЫХ В КЛЕТКИ ЧЕЛОВЕКА ИЛИ ЖИВОТНЫХ | 1992 |
|
RU2113485C1 |
Авторы
Даты
2013-11-20—Публикация
2008-04-07—Подача