Область техники, к которой относится изобретение
Изобретение относится к новым производным ацетамида, имеющим замещенную гетероциклическую группу и ряд последовательных дикарбонильных структур, например: соединения 1-пиримидинилацетамида, соединения 1-пиразинилацетамида, соединения 1-триазинилацетамида и т. д., и относится к ингибиторам протеаз типа химотрипсина, в особенности к ингибиторам химазы. Данные соединения могут быть использованы как профилактические или терапевтические средства против болезней, в развитии которых, как считается, обычно участвуют протеазы типа химотрипсина. Например, считается, что протеазы типа химотрипсина прямо или косвенно участвуют в развитии таких заболеваний, как астма, аллергия, воспаления, ревматизм, гипертония, сердечная недостаточность, инфаркт миокарда, гипертрофия сердца, повреждения сосудов, сопровождающиеся ангиогенезом и атеромой, нефрит и почечная недостаточность и т.д. Настоящее изобретение включает промежуточные соединения, которые могут быть использованы для синтеза соединений гетероциклических амидов с последовательным рядом дикарбонильных структур, способ получения соединений гетероциклических амидов и фармацевтический состав, содержащий такие соединения гетероциклических амидов в качестве активного ингредиента, и способ применения такого фармацевтического состава.
Уровень техники
Известно, что химаза относится к протеазам типа химотрипсина среди сериновых протеаз и является цитотоксичным белком, который накапливается в секреторных гранулах тучных клеток (мастоцитов) и высвобождается при стимуляции. Далее, в Circ. Res. 1994. V. 66. Р. 883 было описано, что действие химазы заключается в превращении ангиотензина I в ангиотензин II, участвующий в регуляции кровяного давления in vivo. Кроме этого, известно также, что ингибитор химазы подавляет высвобождение гистамина из мастоцитов (Arch. Biochem. Biophys. 1988. V. 38. Р. 291) и высвобождение цитотоксичного белка из эозинофилов (Arch. Biochem. Biophys. 1994. V. 312. Р. 67). Таким образом, в настоящее время вообще известно, что химаза участвует не только в цитотоксичности, но также и в высвобождении различных медиаторов in vivo.
Кроме того, действие химазы может быть различным в зависимости от типа животного, и описаны особенно большие различия в ее действии у людей в сравнении с собаками и грызунами (Proc. Natl. Acad. Sci. USA. 1987. V. 84. Р. 364).
В настоящее время среди соединений, ингибирующих химазу, известен только ингибитор химотрипсина как расщепляющего фермента, и он неудовлетворителен по ингибирующей активности и селективности ингибирования в отношении других протеаз, собственной стабильности in vivo, токсичности и т.д. и не получил применения в качестве фармацевтического состава. Поэтому существует потребность в ингибиторе химазы, имеющем высокую степень безопасности и при низкой концентрации селективно ингибирующем химазу.
Сущность изобретения
В связи с этими обстоятельствами заявители настоящего изобретения провели широкие исследования по поискам ингибиторов химазы, чтобы решить указанные выше проблемы, и в результате пришли к настоящему изобретению.
Конкретно, настоящее изобретение относится к нижеследующим пунктам с (1) по (30):
(1) Новые производные ацетамида, представленные нижеследующей химической формулой, или их фармакологически приемлемые соли.
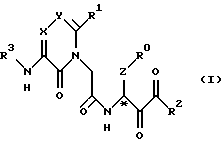
где R0 - фенильная группа, кольцо которой может содержать одну или более групп-заместителей, отобранных из группы А, определенной ниже (группа А; группа А включает галоген, нитрогруппу, гидроксильную группу, низшую алкоксигруппу, низшую алкильную группу или галогензамещенную низшую алкильную группу).
R1 - (i) арил, (ii) гетероарил или (iii) C1-6 прямоцепная, разветвленная или циклическая алкильная группа, которые могут независимо содержать одну или более групп-заместителей, определенных по отношению к группе А; или же R1 может независимо содержать одну или более групп-заместителей, отобранных из группы В, содержащей ORa, COORa, CONRbRc, NRbRc, NRbCHO, NRbCORa, SO2ORa, SO2Ra, CONRbSO2Ra, и P(O)(ORa)2, включенные в вышеуказанные группы от (i) до (iii) (среди которых группы от Ra до Rc независимо являются водородом, низшим алкилом или замещенным низшим алкилом; или же группы от Ra до Rc независимо представляют собой арил-(1-7С)-алкил, гетероарил-(1-7С)-алкил, арил и гетероарил, среди которых арильное или гетероарильное кольцо может содержать одну или более, обычно от 1 до 3, групп-заместителей, отобранных из определенной выше группы А. Замещенный низший алкил содержит от 1 до 3 атомов или групп, отобранных среди галогена, нитрогруппы или гидроксильной группы в качестве замещающей группы; или же R1 может содержать в качестве замещающей группы в составе вышеуказанных групп от (i) до (iii) одну или более циклических групп G, определенных ниже (циклическая группа G; циклическая группа G представляет собой гетероциклическую группу, представляющую собой 5- или 6-членное кольцо, содержащее от 1 до 3 атомов кислорода или азота, и может содержать группу-заместитель);
R2 представляет собой (1-8С)-алкил, арил-(1-7С)-алкил, гетероарил-(1-7С)-алкил и арил; или же R2 представляет собой определенную выше группу В или (1-8С)-алкил, содержащий группу В качестве замещающей группы; или (1-8С)-алкил, содержащий определенную выше циклическую группу G в качестве замещающей группы;
R3 - водород; или же R3 представляет собой (i) D•(СН2)0-3•СО, (ii) D•СО•Е•СО или (iii) D•SO2•E•CO в качестве ацильной группы; или же R3 представляет собой D•(CH2)0-3•SO2 или D•CO•E•SO2 в качестве сульфонильной группы (где группа D представляет собой водород, 1-6С прямоцепную, разветвленную или циклическую алкильную группу, арильную группу, галогензамещенный низший алкил, галогензамещенную низшую алкоксигруппу, аминогруппу, низшую алкоксиаминогруппу, галогензамещенную низшую алкиламиногруппу, RbRcN, RbRcN•O, RaO, Ra, RaOCO, RbRcNCO, RaSO2NRb, RaS и определенную выше группу G; а группа Е представляет собой двухвалентную сшивающую группу, содержащую от 1 до 6 атомов углерода); или R3 - группа типа мочевины, представленная группой RbRcNCO; или R3 - тиомочевина, представленная RbRcN•CS; или R3 представляет собой Ra;
Х и Y независимо представляют собой атом азота или атом углерода и могут быть замещены группами, представляющими собой группы от Ra до Rc; и
Z представляет собой полиметиленовую группу, в которой атомы водорода, имеющиеся в полиметиленовой группе, могут быть независимо замещены на Ra и Rb.
(2) Новые производные ацетамида, в соответствии с предыдущим п. (1) или их фармакологически приемлемые соли, где R2 в формуле (I) представляет собой следующее:
R2 - (1-8С)-алкил, арил-(1-7С)-алкил, гетероарил-(1-7С)-алкил и арил; или R2 - определенная выше группа В (при условии, что если в формуле (I) Y - атом азота, а Х - атом углерода, то R2 представляет собой группы, отличные от ORa или NRbRc), или (1-8С)-алкил, содержащий группу В в качестве замещающей группы; или (1-8С)-алкил, содержащий определенную выше циклическую группу G в качестве замещающей группы.
(3) Новые производные ацетамида в соответствии с приведенными выше пп. (1) или (2) или их фармакологически приемлемые соли, где циклическая группа G является группой, отобранной из группы, включающей: пиридилокси, 2-оксо-1,2-дигидропиридин-1-ил, пиримидилокси, пиразилокси, пиридазилокси, пиперазин-1-ил, могущий необязательно содержать в 4-м положении низшую алкильную группу или группу арил-низший алкил, пирролидин-1-ил, пиперидин-1-ил, 4-морфолин-4-ил и пиррол-1-ил.
(4) Новые производные ацетамида, по предшествующему п. (1) или их фармакологически приемлемые соли, где каждый соответствующий символ в формуле (I) представляет собой следующее:
R0 - фенильная группа, кольцо которой может содержать от 1 до 5 групп-заместителей, отобранных из группы А, состоящей из галогена, гидроксильной группы, низшей алкоксигруппы, низшей алкильной группы и трифторметильной группы;
R1 - фенил, тиенил, фурил, пиридил, пирролил или С1-6 прямоцепная, разветвленная или циклическая алкильная группа, которая может независимо содержать одну или более групп-заместителей, определенных выше для группы А; или же R1 может содержать одну или более групп-заместителей, отобранных из группы В, содержащей ORa, COORa, CONRbRc, NRbRc, NRbCHO, NRbCORa, SO2ORa, SO2Ra, CONRbSO2Ra и P(O)(ORa)2, включенные в вышеуказанные фенил, тиенил, фурил, пиридил, пирролил или С1-6 прямоцепную, разветвленную или циклическую алкильную группу (среди которых группы от Ra до Rc независимо являются водородом и низшим алкилом; или же группы от Ra до Rc независимо представляют собой арил-(1-7С)-алкил, гетероарил-(1-7С)-алкил, арил и гетероарил, где арильное или гетероарильное кольцо может содержать одну или более групп-заместителей, отобранных из группы А); или же R1 может содержать в качестве замещающей группы в составе вышеуказанных фенила, тиенила, фурила, пиридила, пирролила или С1-6 прямоцепной, разветвленной или циклической алкильной группы одну или более циклических групп G, отобранных из группы, содержащей пиридилокси, 2-оксо-1,2-дигидропиридин-1-ил, пиримидилокси, пиразилокси, пиридазилокси, пиперазин-1-ил, могущий необязательно содержать в 4-м положении низшую алкильную группу или группу арил-низший алкил, пирролидин-1-ил, пиперидин-1-ил, 4-морфолин-4-ил и пиррол-1-ил.
R2 представляет собой (1-4С)-алкил, арил-(1-3С)-алкил, гетероарил-(1-3С)-алкил и арил; или R2 представляет собой определенную выше группу В или (1-3С)-алкил, содержащий группу В в качестве группы-заместителя; или (1-3С)-алкил, содержащий определенную выше циклическую группу G в качестве группы-заместителя.
R3 представляет собой водород; или же R3 представляет собой (i) D•(СН2)0-3•CО, (ii) D•СО•Е•СО или (iii) D•SO2•E•CO в качестве ацильной группы; или же R3 представляет собой D•(СН2)0-3•SO2 или D•CO•E•SO2 в качестве сульфонильной группы; или R3 - тиомочевина, представленная RbRcN•CS; или R3 представляет собой Ra (где группа D представляет собой водород, С1-6 прямоцепную, разветвленную или циклическую алкильную группу, трифторметильную группу, 2,2,2-трифторэтоксигруппу, аминогруппу, метоксиаминогруппу, 2,2,2-трифторэтиламиногруппу, RbRcN, RbRcN•O, RaO, Ra, RaOCO, RbRcNCO,
RaSO2NRb, RaS или определенную выше группу G. Группа Е представляет собой двухвалентное бензольное кольцо, 1,4-пиперазин-ди-ил, и прямоцепную, разветвленную или циклическую двухвалентную алифатическую сшивающую группу);
Х и Y независимо представляют собой атом азота или атом углерода и могут быть замещены группами, являющимися группами от Ra до Rc; a
Z представляет собой -CH2-, где 2 атома водорода могут быть независимо замещены на Ra и Рb.
(5) Новые производные ацетамида в соответствии с приведенными выше пп. от (1) до (4) или их фармакологически приемлемые соли, где соответствующие символы в формуле (I) представляют собой нижеследующее:
R0 - фенильная группа, которая может содержать от 1 до 3 групп-заместителей, отобранных из галогена, гидроксильной группы, низшей алкоксигруппы, низшей алкильной группы и трифторметильной группы в качестве группы А в кольце;
R1 - фенильная группа, которая может независимо содержать в кольце одну или более определенных выше групп А; или же R1 может содержать одну или более групп-заместителей, отобранных из группы В, состоящей из ORa, COORa, CONRbRc, NRbRc, NRbCHO, NRbCORa, SO2ORa, SO2Ra, CONRbSO2Ra и P(O)(ORa)2; R2 представляет собой (1-4С)-алкил, арил-(1-3С)-алкил, гетероарил-(1-3С)-алкил и арил; или R2 представляет собой определенную выше группу В или (1-3С)-алкил, содержащий группу В в качестве группы-заместителя; или (1-3С)-алкил, содержащий определенную далее циклическую группу G в качестве группы-заместителя. Здесь группа G представляет собой циклическую группу G, включающую пиридилоксигруппу, 2-оксо-1,2-дигидропиридин-1-ил, пиримидилоксигруппу, пиразилоксогруппу, пиридазилоксогруппу, пиперазин-1-ил, необязательно содержащий в 4-м положении низшую алкильную группу или арил-(1-7С)-алкильную группу, пирролидин-1-ил, пиперидин-1-ил, 4-молфолин-1-ил и пиррол-1-ил.
R3 представляет собой водород; или же R3 представляет собой (i) D•(СН2)0-3•СО, (ii) D•СО•Е•СО или (iii) D•SO2•E•CO в качестве ацильной группы; или же D•(СН2)0-3•SO2 и D•СО•Е•SO2 в качестве сульфонильной группы (где группа D представляет собой водород, алкильную группу - с прямой 1-6С цепью, разветвленную или циклическую, трифторметильную группу, 2,2,2-трифторэтоксигруппу, 2,2,2-трифторэтиламиногруппу, COORa, CONRbRc, NRbRc, или определенную выше группу G); или же R3 - тиомочевина, представленная RbRcN•CS; или группа Е независимо представляет собой двухвалентное бензольное кольцо, двухвалентное гетероарильное кольцо, 1,4-пиперазин-ди-ил, двухвалентную циклогексильную группу и двухвалентную 1,4-циклогексадиенильную группу; или R3 представляет собой Ra.
Х и Y независимо представляют собой атом азота или незамещенный атом углерода; и
Z представляет собой -СН2-, где 2 атома водорода могут быть независимо замещены на Ra и Rb.
(6) Новые производные ацетамида в соответствии с приведенными выше пп. от (1) до (5) или их фармакологически приемлемые соли, где соответствующие символы в формуле (I) представляют собой нижеследующее:
R0 - незамещенная фенильная группа или замещенная фенильная группа с 1 или 2 группами-заместителями, отобранными из галогена, низшего алкила, гидроксильной группы, низшей алкоксигруппы и низшей ацилоксигруппы; R1 - незамещенная фенильная группа, R2 - незамещенная фенильная группа, незамещенная (1-8С)-алкильная группа или замещенная (1-8С)-алкильная группа, содержащая группу-заместитель, отобранную из карбоксильной группы, низшей ацилоксигруппы, фенильной группы, пирролидин-1-ила, пиридильной группы, пиридилоксигруппы, 2-оксо-1,2-дигидропиридин-1-ила, пиримидилоксигруппы, пиразилоксигруппы, пиридазилоксигруппы, или замещенного низшим алкилом пиперазин-1-ила, или замещенного низшим алкилом пиперазин-1-ил-карбонила, и морфолиновой группы, R3 - водород, низшая ацильная группа, формил, сульфамоил, низший алкилсульфонил, замещенный арилом низший алкилсульфонил, гетероарилсульфонил, трифторметилсульфонил или тетрагидрофуроил, Х - незамещенный атом углерода, Y - атом азота, a Z представляет собой -CH2-.
(7) Новые производные ацетамида в соответствии с приведенными выше пп. от (1) до (6) или их фармакологически приемлемые соли, где соответствующие символы в формуле (I) представляют собой нижеследующее:
R0 - незамещенная фенильная группа, R1 - незамещенная фенильная группа, R2 - незамещенная (1-8С)-алкильная группа, или (1-8С)-алкильная группа, содержащая группу-заместитель, отобранную из пирролидин-1-ила, пиридилоксигруппы, 2-оксо-1,2-дигидропиридин-1-ила, пиримидилоксигруппы, пиразилоксигруппы, пиридазилоксигруппы, замещенного низшим алкилом пиперазин-1-ила или замещенного низшим алкилом пиперазин-1-ил-карбонила, Х - незамещенный атом углерода, Y - атом азота, а Z представляет собой -CH2-.
(8) Новые производные ацетамида в соответствии с приведенными выше пп. от (1) до (7) или их фармакологически приемлемые соли, где R3 в формуле (I) представляет собой группу, отобранную среди водорода, низшего алкилкарбонила, низшего алкоксикарбонила, ацила, сульфонила и сульфамоила.
(9) Новые производные ацетамида, в соответствии с приведенным п. (1) или их фармакологически приемлемые соли, где соответствующие символы в формуле (I) представляют собой нижеследующее:
R0 - незамещенная фенильная группа или фенильная группа, замещенная низшей алкоксигруппой, R1 - незамещенная фенильная группа, R2 - низшая алкоксигруппа, R3 - водород или низший алкоксикарбонил, Х - незамещенный атом углерода, Y - атом азота, а Z представляет собой -CH2-.
(10) Новые производные ацетамида или их фармакологически приемлемые соли, где нижеследующие символы в формуле (I) представляют собой следующее:
R0 - незамещенная фенильная группа, R1 - незамещенная фенильная группа, R2 - 3-(2-оксо-1,2-дигидропиридин-1-ил)пропил, R3 - группа, отобранная среди водорода, трет-бутилоксикарбонила, формила, ацетила, низшего алкилсульфонила, замещенного арилом низшего алкилсульфонила, гетероарилсульфонила, трифторметилсульфонила, низшего алкиламиносулъфонила, замещенного арилом низшего алкиламиносульфонила, замещенного гетероарилом низшего алкиламиносульфонила и гетероариламиносульфонила, Х - незамещенный атом углерода, Y - атом азота, a Z представляет собой -CH2-.
(11) Новые производные ацетамида или их фармакологически приемлемые соли, где нижеследующие символы в формуле (I) представляют собой следующее:
R0 - незамещенная фенильная группа, R1 - незамещенная фенильная группа, R2 - 3-(2-пиридилокси)пропил, R3 - группа, отобранная среди водорода, трет-бутилоксикарбонила, формила, ацетила, низшего алкилсульфонила, замещенного арилом низшего алкилсульфонила, гетероарилсульфонила, трифторметилсульфонила, низшего алкиламиносульфонила, замещенного арилом низшего алкиламиносульфонила, замещенного гетероарилом низшего алкиламиносульфонила и гетероариламиносульфонила, Х - незамещенный атом углерода, Y - атом азота, а Z представляет собой -CH2-.
(12) 2-(5-Амино-6-оксо-2-фенил-1,6-дигидропиримидин-1-ил)-N-{2,3-диоксо-1-(3-фторфенил)метил} бутилацетамид или его фармакологически приемлемые соли.
(13) 2-(5-Амино-6-оксо-2-фенил-1,6-дигидропиримидин-1-ил)-N-{2,3-диоксо-6-(4-морфолин-4-ил)-1-фенилметил} гексилацетамид или его фармакологически приемлемые соли.
(14) 2-(5-Амино- или трет-бутилоксикарбониламино- или ацетиламино-6-оксо-2-фенил-1,6-дигидропиримидин-1-ил)-N-{ 2,3-диоксо-1-фенилметил-6-(2-оксо-1,2-дигидропиридин-1-ил)}-гексилацетамид или его фармакологически приемлемые соли.
(15) 2-(5-Амино- или трет-бутилоксикарбониламино- или бензилсульфониламино- или формиламино- или бензиламиносульфониламино- или 4-пиридилметилоксикарбониламино- или ацетиламино-6-оксо-2-фенил-1,6-диrидpoпиpимидин-1-ил)-N-{2,3-диoкco-6-(2-пиpидилoкcи)-1-фенилметил}гексилацетамид или его фармакологически приемлемые соли.
(16) (А) 2-(5-Трет-бутилоксикарбониламино-6-оксо-2-фенил-1,6-дигидропиримидин-1-ил)-N-{2-метоксикарбонил-1-(4-гидроксифенил)метил-2-оксо}этилацетамид, (В) 2-(5-трет-бутилоксикарбониламино-6-оксо-2-фенил-1,6-дигидропиримидин-1-ил)-N-{ 2-метоксикарбонил-1-(3-фтор-4-гидроксифенил)метил-2-оксо} этилацетамид, (С) 2-(5-амино-6-оксо-2-фенил-1,6-дигидропиримидин-1-ил)-N-(2-оксо-2-фенилкарбамоил-1-фенилметил)этилацетамид, (D) 2-(5-амино-6-оксо-2-фенил-1,6-дигидропиримидин-1-ил)-N-(2-бeнзилкapбaмoил-2-oкco-1-фeнилмeтил)этилaцeтaмид, (Е) 2-(5-амино-6-оксо-2-фeнил-1,6-дигидpoпиpимидин-1-ил)-N-(2-oкco-2-фeнилэтилкapбaмoил-1-фенилметил)этилацетамид, (F) 2-(5-трет-бутилоксикарбониламино-6-оксо-2-фенил-1,6-дигидропиримидин-1-ил)-N-{ 2-метоксикарбонил-1-(4-метилоксифенил)метил-2-оксо}этилацетамид, (G) 2-(5-трет-бутилоксикарбониламино-6-оксо-2-фенил-1,6-дигидропиримидин-1-ил)-N-(2-оксо-2-фенилэтилкарбамоил-1-фенилметил)этилацетамид, (Н) 2-(5-амино-6-оксо-2-фенил-1,6-дигидропиримидин-1-ил)-N-{ 2-метоксикарбонил-1-(4-метилоксифенил)метил-2-оксо}этилацетамид, или их фармакологически приемлемые соли.
(17) (А) 2-(5-Амино-6-оксо-2-фенил-1,6-дигидропиримидин-1-ил)-N-(2,3-диоксо-1-фенилметил)бутилацетамид, (В) 2-(5-амино-6-оксо-2-фенил-1,6-дигидропиримидин-1-ил)-N-(2,3-диоксо-6-фенил-1-фенилметил)гексилацетамид, (С) 2-(5-амино-6-оксо-2-фенил-1,6-дигидропиримидин-1-ил)-N-(2,3-диоксо-5-фенил-1-фенилметил)пентилацетамид, (D) 2-(5-амино-6-оксо-2-фенил-1,6-дигидропиримидин-1-ил)-N-(2,3-диоксо-1-фенилметил)гептилацетамид, (Е) 2-(5-амино-6-оксо-2-фенил-1,6-дигидропиримидин-1-ил)-N-(2,3-диоксо-3-фенил-1-фенилметил)пропилацетамид, (F) 2-(5-амино-6-оксо-2-фенил-1,6-дигидропиримидин-1-ил)-N-(6-карбоксил-2,3-диоксо-1-фенилметил)гексилацетамид, (G) 2-(5-амино-6-оксо-2-фенил-1,6-дигидропиримидин-1-ил)-N-{ 2,3-диoкco-1-(3-фтop-4-rидpoкcифeнил)мeтил} бyтилaцeтaмид, (Н) 2-(5-амино-6-оксо-2-фенил-1,6-дигидропиримидин-1-ил)-N-{ 2,3-диоксо-1-(3-фторфенил)метил} бутилацетамид, (I) 2-(5-амино-6-оксо-2-фенил-1,6-дигидропиримидин-1-ил)-N-{ 2,3-диоксо-1-(3-хлорфенил)метил} бутилацетамид, (J) 2-(5-амино-6-оксо-2-фенил-1,6-дигидропиримидин-1-ил)-N-{ 2,3-диоксо-1-(3-метилфенил)метил} бутилацетамид, (К) 2-(5-амино-6-оксо-2-фенил-1,6-дигидропиримидин-1-ил)-N-{ 2,3-диоксо-1-(4-фторфенил)метил} бутилацетамид, (L) 2-(5-амино-6-оксо-2-фенил-1,6-дигидропиримидин-1-ил)-N-{ 2,3-диоксо-1-(4-хлорфенил)метил} бутилацетамид, (М) 2-(5-амино-6-оксо-2-фенил-1,6-дигидропиримидин-1-ил)-N-{ 2,3-диоксо-6-этоксикарбонил-1-(3-фторфенил)метил} гексилацетамид, (N) 2-(5-амино-6-оксо-2-фенил-1,6-дигидропиримидин-1-ил)-N-{ 1-(3-фторфенил)метил-7-(4-метилпиперазин-1-ил)-2,3,7-триоксо} гептилацетамид, (О) 2-(5-амино-6-оксо-2-фенил-1,6-дигидропиримидин-1-ил)-N-{ 2,3-диоксо-6-(4-морфолин-4-ил)-1-фенилметил} гексилацетамид, (Р) 2-(5-амино-6-oкco-2-фeнил-1,6-дигидpoпиpимидин-1-ил)-N-{ 2,3-диoкco-6-(2-oкco-1,2-диrидpoпиpидин-1-ил)-1-фенилметил} гексилацетамид, (Q) 2-(5-амино-6-оксо-2-фенил-1,6-дигидропиримидин-1-ил)-N-{2,3-диоксо-1-фенилметил-6-(2-пиридилокси)} гексилацетамид, (R) 2-(2-амино-3-оксо-5-фенил-3,4-дигидропиразин-4-ил)-N-(2-метоксикарбонил-2-оксо-1-фенилметил} этилацетамид, (S) 2-(6-амино-5-оксо-3-фенил-4,5-дигидро- 1,2,4-триазин-4-ил)-N-(2-метоксикарбонил-2-оксо-1-фенилметил} этилацетамид, (Т) 2-(5-трет-бутилоксикарбониламино-6-оксо-2-фенил-1,6-дигидропиримидин-1-ил)-N-(2,3-диоксо-1-фенилметил)бутилацетамид, (U) 2-(5-трет-бутилоксикарбониламино-6-оксо-2-фенил-1,6-дигидропиримидин-1-ил)-N-(2,3-диоксо-1-фенилметил)гексилацетамид, (V) 2-(5-трет-бутилоксикарбониламино-6-оксо-2-фенил-1,6-дигидропиримидин-1-ил)-N-(2,3-диоксо-1-фенилметил)гептилацетамид, (W) 2-{ 5-(3-тeтpaгидpoфypoилaминo)-6-oкco-2-фeнил-1,6-дигидpoпиpимидин-1-ил} -N-(2,3-диоксо-6-фенил-1-фенилметил)гексилацетамид, (X) 2-(5-амино-6-оксо-2-фенил-1,6-дигидpoпиpимидин-1-ил)-N-{ 2,3-диoкco-1-(2-фтopфeнил)мeтил}бyтилaцeтaмид, или их фармакологически приемлемые соли.
(18) Соли новых производных ацетамида согласно вышеприведенному п. (1), где фармакологически приемлемые соли отобраны среди (А) солей щелочных металлов, солей щелочно-земельных металлов, солей алюминия, солей аммония или солей, полученных из органических оснований, образующих фармацевтически приемлемые катионы, если новые производные ацетамида в формуле (I) являются кислотными соединениями, и (В) соли с добавлением кислоты, полученные с использованием кислоты, образующей фармацевтически приемлемые анионы, если новые производные ацетамида в формуле (I) являются основными соединениями.
(19) Фармацевтический состав, содержащий новое производное ацетамида по вышеприведенным пп. от (1) до (18) или его фармакологически приемлемую соль в качестве активного ингредиента.
(20) Новый ингибитор протеаз, содержащий новое производное ацетамида по вышеприведенным пп. от (1) до (19) или его фармакологически приемлемую соль в качестве активного ингредиента.
(21) Новый ингибитор химазы, содержащий новое производное ацетамида по вышеприведенным пп. от (1) до (20) или его фармакологически приемлемую соль в качестве активного ингредиента.
(22) Новый ингибитор дегрануляции мастоцитов или новый ингибитор высвобождения мастоцитами гистамина, включающий в себя новое производное ацетамида по приведенным выше пп. от (1) до (18) или его фармакологически приемлемую соль в качестве активного ингредиента.
(23) Новый ингибитор активации эозинофилов или ингибитор высвобождения эозинофилами активного кислорода, включающий в себя новое производное ацетамида по указанным выше пп. от (1) до (18) или его фармакологически приемлемую соль в качестве активного ингредиента.
(24) Способ получения новых производных ацетамида по указанным выше пп. от (1) до (18) или их фармакологически приемлемых солей, включающий следующие этапы (А) или (В):
(A) в синтезе новых производных ацетамида формулы (I) - этап окисления спирта формулы (II)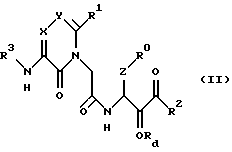
после удаления защитной для спирта группы, если она присутствует, для превращения его в новое производное ацетамида формулы (I), где Rd - водород или защитная группа для гидроксильной группы, или
(B) этап конденсации между соединением формулы (III) или соединением формулы (IV), где R3' - водород,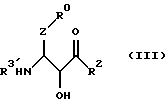
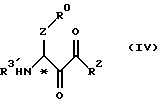
где R3' в формулах (III) или (IV) имеет тот же смысл, что и R3, определенный ранее в п. (1), и соединением формулы (V)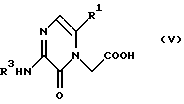
или соединением формулы (VI)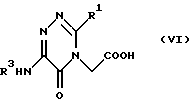
(В приведенных выше формулах R0, R1, R2, X, Y и Z имеют такой же смысл, как определенный ранее в п. (1).)
(25) Соединения формулы (II) в соответствии с вышеизложенным п. (24) и их соли, где R0, R1, R2, X, Y и Z являются группами, определенными ранее в п. (1).
(26) Соединения формулы (III) в соответствии с вышеизложенным п. (24) и их соли, где R0, R2 и Z являются группами, определенными ранее в п. (1), a R3' - группа, определенная ранее в п. (24).
(27) Соединения формулы (IV) в соответствии с вышеизложенным п. (24) и их соли, где R0, R2 и Z являются группами, определенными ранее в п. (1), a R3' - группа, определенная ранее в п. (24).
(28) Соединения формулы (V) в соответствии с вышеизложенным п. (24) и их соли, где R1, R3, X и Y являются группами, определенными ранее в п. (1).
(29) Соединения формулы (VI) в соответствии с вышеизложенным п. (24) и их соли, где R1 и R3 являются группами, определенными ранее в п. (1).
(30) 3-R3'-5-(R2СО)-2,2-ди-низший алкил-4-(R0-Z)оксазолидин, т.е. кетонное производное оксазолидина или его солей, где R0, R2 и Z являются группами, определенными в п. 1, a R3' означает то же, что группа R3, определенная в п. 1.
Предпочтительные варианты осуществления изобретения
Настоящее изобретение относится к новым производным ацетамида, имеющим замещенную гетероциклическую группу и ряд последовательных дикарбонильных структур, например: соединения 1-пиримидинилацетамида, соединения 4-пиразинилацетамида, соединения 4-триазинилацетамида и т. д., и к ингибиторам протеаз, включающим эти соединения или их соли (далее называемые "данные соединения") в качестве активного ингредиента, обладающие ингибирующим действием на активацию лейкоцитов мастоцитами, эозинофилами и т.д., а также ингибирующим действием на продукцию ангиотензина II, и, например, ожидается, что они могут быть средством для предупреждения или лечения таких заболеваний, как астма, аллергия, воспаления, ревматизм, гипертония, сердечная недостаточность, инфаркт миокарда, гипертрофия сердца, повреждения сосудов, сопровождающиеся ангиогенезом и атеромой, нефрит и почечная недостаточность.
В данном описании использованы следующие определения, если не даны иные определения:
Группа А представляет собой группу, отобранную из группы, включающей галоген, гидроксильную группу, низшую алкоксигруппу, низшую алкильную группу и замещенную галогеном низшую алкильную группу.
Группа В представляет собой группу, отобранную из группы, состоящей из ORa, COORa, CONRbRc, NRbRc, NRbCHO, NRbCORa, SC2ORa, SO2Ra, CONRbSO2Ra и P(O)(ORa)2.
Группы от Ra до Rc независимо представляют собой группу, отобранную из водорода, низшего алкила, арил-(1-7С)-алкила, гетероарил-(1-7С)-алкила, арила и гетероарила, у которых арильное или гетероарильное кольцо могут содержать одну или более групп-заместителей, отобранных из определенной выше группы А.
Циклическая группа G представляет собой гетероциклическую группу, состоящую из 5- или 6-членного кольца, содержащего от 1 до 3 атомов кислорода или азота и может содержать группу-заместитель.
Группа D - водород, 1-6С прямоцепная, разветвленная или циклическая алкильная группа, галогензамещенный низший алкил, как например трифторметил и т. д. , галогензамещенная низшая алкоксигруппа, как например 2,2,2-трифторэтоксигруппа и т.д., низшая алкоксиаминогруппа, как например метоксиаминогруппа и т. д. , галогензамещенная низшая алкиламиногруппа, как например 2,2,2-трифторэтиламиногруппа, RbRcN, RbRcN•O, RaO, Ra, RaOCO, RbRcNCO, RaSO2NRb, RaS и определенная выше группа G.
Группа Е представляет собой двухвалентную сшитую группу, содержащую от 1 до 6 атомов углерода, и может содержать от 1 до 3 гетероатомов, отобранных среди кислорода, азота и серы, например двухвалентное бензольное ядро, как фенилен, двухвалентное гетероарильное ядро, как гетероарилен, 1,4-пиперазин-ди-ил, и двухвалентная С1-6 прямоцепная или разветвленная алифатическая сшивающая группа, как метилен, диметилен, триметилен, 2-метилтриметилен, или алициклическая сшивающая группа, как циклогексилен, 1,4-циклогексадиенилен и т.д.
Галоген означает фтор, хлор, бром и йод.
Алкильная цепь в алкильной и алкоксигруппах представляет собой прямоцепной, разветвленный или циклический алкил, число атомов углерода в котором составляет предпочтительно от 1 до 20.
Низший алкил или низшая алкоксигруппа являются разветвленными или прямоцепными группами, каждая из которых содержит от 1 до 6 атомов углерода. Низшая ацилоксигруппа - это группа, в которой число атомов углерода в алкильной цепи, присоединенной к карбонильной группе, составляет от 1 до около 6. Арил представляет собой фенильную группу, или углеродные кольца и гетероуглеродные кольца, образованные 9-10 атомами, формирующими структуру кольца, причем по крайней мере одно кольцо из этих атомов, соединенных в орто-положении, является ароматическим кольцом. Гетероарил содержит от 2 до 4 гетероатомов, отобранных из группы, состоящей из углерода, кислорода, азота и серы, и представляет собой моноциклическое ароматическое кольцо, образованное 5 или 6 атомами, формирующими структуру кольца, или гетеробициклическое кольцо, образованное приблизительно 8-10 атомами, формирующими структуру кольца и соединенными в кольце в орто-положении.
Что касается атома углерода, асимметрично замещенного в положении хирального центра, обозначенного "*" в формуле (I), соединение формулы (I) существует как единичный оптический изомер, или как рацемат. Если соединение формулы (I) имеет еще один хиральный элемент, соединение формулы (I) существует как единичный диастереоизомер или как смесь диастереоизомеров. Существует возможность того, что можно выделить любое из этих соединений. Соединения формулы (I) в настоящем изобретении включают соединения, образующие ряд от индивидуального диастереоизомера до смеси диастереоизомеров и далее соединения формулы (I) включают соединения, образующие ряд от индивидуального энантиомера до смеси энантиомеров.
Как понятно специалистам в данной области, последовательные дикарбонильные структуры в формуле (I) могут существовать в виде сольвата, в особенности в виде гидрата. Соответственно, сольват соединения формулы (I) включается в настоящее изобретение.
Соединение формулы (I) может указывать, в дополнение к описанному выше сольвату, на множественный полиморфизм, например на таутомер сольвата, в дополнение к описанному выше сольвату. Поэтому настоящее изобретение включает в себя любые соединения, обладающие ингибирующим действием на фермент типа химотрипсина, независимо от того, в какой из форм полиморфизма они существуют - в виде рацемата, оптического изомера или сольвата.
В следующих пунктах группы специально иллюстрированы, но они показаны с учетом простоты иллюстрирования и это не означает, что они являются ограничительными.
Предпочтительными примерами группы А являются фтор, хлор, бром, нитрогруппа, гидроксильная, метильная, этильная группы и метоксигруппа.
Примерами Ra, Rb и Rc являются водород и такие низшие алкилы, как метил, этил, пропил, бутил, изопропил и т.д., такие арил-(1-7С)-алкилы, как бензил, фенэтил, фенилпропил и т.д., такие гетероарил-(1-7С)-алкилы, как пиридилметил, пиридилэтил, пиридилпропил, фурилметил, фурилэтил, фурилпропил и т.д. , такие арилы, как фенил, галогензамещенный фенил и т.д., и такие гетероарилы, как пиридил, пиримидил, фурил и тиенил.
Примерами ORa в группе В или группе D и т.д. являются гидрокси, метокси, этокси, пропилокси, изопропилокси, бутокси, бензилокси, пиридилметокси, фенокси, пиридилокси, пирролидинокси и другие группы.
Примерами COORa в группе В или группе D и т.д. являются метоксикарбонил, этоксикарбонил, пропилоксикарбонил, изопропилоксикарбонил, бутоксикарбонил, бензилоксикарбонил, пиримидилметилоксикарбонил, феноксикарбонил и т.д.
Примерами CONRbRc в группе В или группе D и т.д. являются диметиламинокарбонил, метилэтиламинокарбонил, диэтиламинокарбонил, дипропиламинокарбонил и т.д.
Примерами NRbRc в группе В или группе D и т.д. являются монометиламино-, диметиламино-, метилэтиламино-, диэтиламино-, дипропиламиногруппы и т.д.
Примерами NRbCHO в группе В и т.д. являются группы формиламино, формилметиламино и т. д. Примерами NRbCORa в группе В и т.д. являются группы метилкарбониламино, этилкарбониламино, пропилкарбониламино, метилкарбонилметиламино и т.д. Примерами SO2ORa в группе В и т.д. являются группа сульфокислоты и т. д. Примерами SO2Ra в группе В и т.д. являются метилсульфонил, этилсульфонил, пропилсульфонил, бутилсульфонил, трет-бутилсульфонил, бензилсульфонил, толуолсульфонил, бензолсульфонил, формаминобензолсульфонил, нитробензолсульфонил, метоксибензолсульфонил, пиридилсульфонил, пиридилметилсульфонил, трифторметилсульфонил и т.д.
Примерами CONRbSO2Ra в группе В и т.д. являются метилсульфониламинокарбонил, фенилсульфониламинокарбонил, фенилметиламиносульфонилкарбонил и т. д. Примерами P(O)(Ra)2 в группе В и т.д. являются группы диэтилфосфоно, дифенилфосфоно, дибензилфосфоно и т.д. Предпочтительными примерами группы В являются группы: метокси, этокси, пропилокси, изопропилокси, фенилметокси, фенэтилокси, фенилпропилокси, пиридилметилокси, пиридилэтилокси, пиридилпропилокси, фурилметилокси, фурилэтилокси, фурилпропилокси, пиридилоксиэтилокси и пиридилоксипропилокси.
Примерами группы G являются 5-6-членные кольцевые, содержащие гетероарил или гетероатом алициклические группы 5-6-членного кольца, и предпочтительными группами являются 4-морфолин-4-ил, 4-метилпиперазин-1-ил, пирролидин-1-ил, пиперидин-1-ил и 2-оксо-1,2-дигидропиридин-1-ил, а также 2-пиридилоксигруппа.
Предпочтительными примерами группы D являются водород, метил, циклогексил, фенил, пиридил, трифторметил, группы 2,2,2-трифторэтилокси, метилоксиамино, 2,2,2-трифторэтиламино, фенилметиламино и т.д.
D•(CH2)0-3•CO в R3 включает формил, ацетил, пропионил, циклопропанкарбонил, валерил, бутилил, циклопропилметилкарбонил, пивалоил, трифторацетил, фенилацетил, 3-фенилпропионил, пиридилкарбонил, бензоил, тетрагидро-2-фуроил, тетрагидро-3-фуроил, метоксикарбонил, этоксикарбонил, пропилоксикарбонил, изопропилоксикарбонил, бутилоксикарбонил, трет-бутилоксикарбонил, бензилоксикарбонил, 9-флуоренилоксикарбонил, 2,2,2-трихлорэтоксикарбонил, аллилоксикарбонил, гидроксиоксалил и т.д.
Ацильная группа в D•СО•Е•СО или D•SO2•E•CO в R3 включает 4-[1-(4-морфолин-1-ил)карбонил] бензолкарбонил, 4-[(1-пирролидин-1-ил)карбонил] бензолкарбонил, 4-[(1-пиперидин-1-ил)карбонил] бензолкарбонил, фенилсульфониламинокарбонил и т.д.
D•(CH2)0-3•SO2 в R3 включает, например, толуолсульфонил, бензолсульфонил, формаминобензолсульфонил, нитробензолсульфонил, метоксибензолсульфонил, пиридилсульфонил, пиридилметилсульфонил, метилсульфонил, этилсульфонил, пропилсульфонил, бутилсульфонил, трет-бутилсульфонил, бензилсульфонил, трифторметилсульфонил, фенацилсульфонил, аминосульфонил, метиламиносульфонил, этиламиносульфонил, пропиламиносульфонил, изопропиламиносульфонил, бутиламиносульфонил, трет-бутиламиносульфонил, фениламиносульфонил, бензиламиносульфонил, пиридиламиносульфонил, пиридилметиламиносульфонил и т.д.
D•СО•Е•SO2 в R3 включает бензоиламиносульфонил и т.д.
Тиомочевина, представленная в R3 группой RbRcN•CS, включает метиламинотиокарбонил, этиламинотиокарбонил, пропиламинотиокарбонил, бутиламинотиокарбонил, изопропиламинотиокарбонил, валериламинотиокарбонил, бензиламинотиокарбонил и т.д.
Предпочтительный пример R0 - фенильная группа, кольцо которой может содержать от 1 до 4 групп-заместителей, отобранных из галогена, нитрогруппы, гидроксильной группы, низшей алкоксигруппы, низшей алкильной группы, и трифторметильной группы в качестве группы А.
Предпочтительный пример R1 - фенил, фурил, тиенил или пиридил, кольцо которых может содержать 1 или 2 группы-заместителя, определенных как группа А.
Предпочтительные примеры R2 - (1-4С)-алкил, арил-(1-3С)-алкил и G (1-3C)-алкил, содержащие в качестве группы-заместителя ранее определенную группу G. Более предпочтительными примерами являются метил, этил, пропил, бутил, изопропил, бензил, фенэтил, фенилпропил, пиридилметил, пиридилэтил, пиридилпропил, фурилметил, фурилэтил, фурилпропил, пиридилоксиметил, пиридилоксиэтил, пиридилоксипропил, или группы, которые могут содержать в 4-м положении группы-заместители, отобранные из метила, этила, пропила, бутила, изопропила, бензила или пиримидилметила, такие как пиперазин-1-ил-(1-3С)-алкил, пиперидин-1-ил-(1-3С)-алкил, 4-морфолин-4-ил-(1-3С)-алкил, 2-пиридилокси-(1-3С)-алкил, пирролидин-1-ил-(1-3С)-алкил, 2-оксо-1,2-дигидропиридин-1-ил-(1-3С)-алкил, метоксикарбонил-(0-3С)-алкил, этоксикарбонил-(0-3С)-алкил, пропилоксикарбонил-(0-3С)-алкил, бутилоксикарбонил-(0-3С)-алкил, бензилоксикарбонил-(0-3С)-алкил, трет-бутоксикарбонил-(0-3С)-алкил, фенилоксикарбонил-(0-3С)-алкил, нитрофенилоксикарбонил-(0-3С)-алкил и бромфенилоксикарбонил-(0-3С)-алкил. Наиболее предпочтительные примеры - метил, этил, пропил, бутил, фенилпропил, 4-морфолин-4-ил-(1-3С)-алкил, 2-оксо-1,2-дигидропиридин-1-ил-(1-3С)-алкил, 2-пиридилокси-(1-3С)-алкил, этоксикарбонил-(0-3С)-алкил и 4-метилпиперазин-1-ил-карбонил-(1-3С)-алкил.
Предпочтительными примерами R3 являются водород, формил, ацетил, пропионил, циклопропанкарбонил, валерил, бутирил, циклопропилметилкарбонил, пивалоил, трифторацетил, фенилацетил, 3-фенилпропионил, пиридилкарбонил, бензоил, тетрагидро-2-фуроил, тетрагидро-3-фуроил, метоксикарбонил, этоксикарбонил, пропилоксикарбонил, изопропилоксикарбонил, бутилоксикарбонил, трет-бутилоксикарбонил, бензилоксикарбонил, 9-флуоренилоксикарбонил, 2,2,2-трихлорэтоксикарбонил, аллилоксикарбонил, гидроксиоксалил, 4-[1-(4-морфолин-4-ил)карбонил] бензолкарбонил, 4-[(1-пирролидин-1-ил)карбонил]бензолкарбонил, 4-[(1-пиперидин-1-ил)карбонил] бензолкарбонил, толуолсульфонил, бензолсульфонил, формаминобензолсульфонил, нитробензолсульфонил, метоксибензолсульфонил, пиридилсульфонил, пиридилметилсульфонил, метилсульфонил, этилсульфонил, пропилсульфонил, бутилсульфонил, трет-бутилсульфонил, бензилсульфонил, трифторметилсульфонил, фенацилсульфонил, аминосульфонил, метиламиносульфонил, этиламиносульфонил, пропиламиносульфонил, изопропиламиносульфонил, бутиламиносульфонил, трет-бутиламиносульфонил, фениламиносульфонил, бензиламиносульфонил, пиридиламиносульфонил, метиламинотиокарбонил, этиламинотиокарбонил, пропиламинотиокарбонил, бутиламинотиокарбонил, изопропиламинотиокарбонил, валериламинотиокарбонил, бензиламинотиокарбонил (где эти группы могут содержать в кольце одну или две галогенные группы или метильные группы, если эти группы имеют фенил или гетероарил как часть структуры), метил, этил, пропил, изопропил, бутил, трет-бутил, бензил, фенэтил, тиазолил, пиримидилметил или 5-тетразолилметил (причем если эти группы содержат фенил или гетероарил как часть структуры, то в кольце могут присутствовать одна или две галогенные группы или метильные группы).
Элемент, предпочтительный как Х и Y, - углерод или азот.
Предпочтительная группа для Z - полиметиленовая группа, содержащая от 1 до 3 атомов углерода, более предпочтительно - метиленовая группа.
Особенно предпочтительными группами для (1-8С) прямоцепного и разветвленного алкила являются метил, этил, пропил, изопропил, бутил, изобутил, амил, изоамил, гексил, гептил и октил. Особенно предпочтительными группами для циклического алкила являются циклопропил, циклобутил, циклопентил и циклогексил. Пригодными группами в качестве алкилена в арил-(1-7С)-алкиле и гетероарил-(1-7С)-алкиле являются метилен, этилен, триметилен, тетраметилен, пентаметилен, гексаметилен и гептаметилен. Особенно предпочтительной группой для арила является фенил. Наиболее пригодными группами для гетероарила являются пиридил, пиримидинил, фурил и тиенил. Предпочтительные примеры арил-(1-7С)-алкила - фенилметил, фенилэтил, фенилпропил, фенилизопропил, фенилбутил, фенилизобутил, фениламил, фенилизоамил, фенилгексил и фенилгептил, а предпочтительные примеры гетероарил-(1-7С)-алкила - те же, как и в случае фенильной группы, когда гетероарилом являются пиридил, пиримидинил, фурил или тиенил.
Особенно пригодными группами в качестве низшего алкила являются метил, этил, пропил, изопропил, бутил, изобутил и трет-бутил. Особенно предпочтительные группы в качестве низших алкоксигрупп: метокси, этокси, пропилокси, изопропилокси и бутокси. Особенно предпочтительные группы галогена: фтор, хлор и бром.
Что касается отдельных групп в соединении по формуле (I), то R0, R2, R3, X, Y и Z могут быть любой группой из описанных выше, a R1 - фенил.
Одну из особых групп среди более точно определенных соединений по формуле (I) представляет соединение, в котором каждый символ имеет нижеследующее значение.
R0 - фенильная группа, кольцо которой может содержать от 1 до 3 групп-заместителей, отобранных среди галогена, гидроксильной группы, низшей алкоксигруппы, низшей алкильной группы и трифторметильной группы в качестве группы А.
R1 - фенильная группа, кольцо которой может независимо содержать одну или более определенных выше групп А на кольце; или же R1 может содержать одну или более групп-заместителей, отобранных из группы В, состоящей из ORa, COORa, CONRbRc, NRbRc, NRbCHO, NRbCORa, SO2ORa, SO2Ra, CONRbSO2Ra, и P(O)(ORa)2.
R2 представляет собой пиридилокси-(1-4С)-алкил.
R3 - водород; или же R3 - ацильная группа в (i) D•(СН2)0-3•СО, (ii) D•СО•Е•СО или (iii) D•SO2•E•CO, или сульфонильная группа в D•(СН2)0-3•SO2 и D•CO•E•SO2 (где группа D представляет собой водород, С1-6 прямоцепную, разветвленную или циклическую алкильную группу, трифторметильную группу, 2,2,2-трифторэтоксигруппу, 2,2,2-трифторэтиламиногруппу, COORa, CONRbRc, NRbRc, или определенную выше группу G; или же R3 - тиомочевина, представленная RbRcN•CS; а группа Е независимо представляет собой фенил, гетероарил, 1,4-пиперазин-ди-ил, циклогексил, 1,4-цикпогексадиенил); или R3 представляет собой Ra.
Х и Y независимо являются атомом азота или незамещенным атомом углерода.
Z представляет собой -СН2-, где 2 атома водорода могут быть независимо замещены на Ra и Ra.
В особых группах более точно определенных соединений формулы (I) R0 представляет собой фенильную группу (фенильная группа может независимо содержать 1 или 2 группы-заместителя в виде галогенов, гидроксильных групп или метильных групп), R2 - метил, бутил, фенилпропил, 4-морфолин-4-ил-пропил, 1-(этоксикарбонил)пропил, 4-метилпиперазин-1-ил-пропил, 2-оксо-1,2-дигидропиридин-1-ил-пропил или 2-пиридилоксипропил, R3 - водород или формил, Х и Y - незамещенные углерод или азот, а Z - незамещенная метиленовая группа. Более точно, R0 - фенил, 3-фторфенил, 4-фторфенил, 3,4-дифторфенил, 3,5-дифторфенил или 3-фтор-4-гидроксифенил.
Фармакологически приемлемые соли соединения формулы (I) не особенно лимитированы, и (А) если соединение формулы (I) представляет собой, например, кислотное соединение, его фармакологически приемлемые соли представляют собой соли щелочных металлов, соли щелочно-земельных металлов, соли алюминия, соли аммония или соли, полученные из органических оснований, образующих фармацевтически приемлемые катионы, такие как низшие алкиламины (от первичных до третичных) и т.д.; (В) если соединение формулы (I) представляет собой основное соединение, его фармакологически приемлемые соли представляют собой образующиеся при добавлении кислоты соли, образующиеся при использовании такой кислоты, как соляная кислота, серная кислота, сульфокислота, фосфорная кислота и т.д., образующие фармакологически приемлемые анионы.
Соединение формулы (I) может быть получено способом, включающим известный среди химических методов этап получения структурно аналогичных гетероциклических соединений или пептидных соединений. Например, целевое соединение формулы (I) получают конденсацией между соединением формулы (V) или его производным, активированными по карбоксильной группе, и соединением формулы (III), где R3' - водород, с получением соединения формулы (II), с последующим его окислением и удалением с аминогруппы, при необходимости, защитной группы (Вос (трет-бутилоксикарбонил) в схеме 1), как показано на схеме 1 (см. в конце описания).
Конденсация между соединением формулы (V) или его производным, активированным по карбоксильной группе, и соединением формулы (III), где R3' - водород, может быть осуществлена в инертном растворителе, например в таком полярном растворителе, как диметилформамид, тетрагидрофуран или другой подобный растворитель, или в смешанном растворителе, представляющем смесь одного из них с полярным растворителем, например, при температуре от около 0 до около 80oС, предпочтительно при температуре в интервале от приблизительно 0 до 40oС, в течение приблизительно от 0,5 до 50 ч. В реакции молярное соотношение соединения формулы (V) или его производного, активированного по карбоксильной группе, и соединения формулы (III), где R3' - водород, предпочтительно выбирается таким, что соединение формулы (III) используется в избыточном количестве, немного большем теоретической величины, однако количество соединения формулы (III) можно произвольно изменять в интервале от 0,5-кратного до 5-кратного избытка на моль соединения формулы (V).
В особенности при получении соединения, в котором R3 представляет собой группу, отличную от водорода, гидроксильная группа в соединении формулы (II) защищена защитной группой Rd, чтобы получить соединение формулы (XV), а защитную группу (Вос на схеме 1) для аминогруппы удаляют, например, в растворе НСl/1,4-диоксан, чтобы получить соединение формулы (XVI), и затем вводят группу защитной группы R3 обычным способом, зависящим от типа группы, с целью получить соединение формулы (XVII). Снятие защиты с гидроксильной группы в формуле (XVIII) дает соединение формулы (XVIII), после чего производится окисление, чтобы получить целевое соединение формулы (I). Rd в формуле (XV) может быть любой защитной группой, используемой для защиты гидроксильной группы, и обычно используют ацильную группу и др., цитируемые в определении R3. Предпочтительно используют защитную группу, не удаляемую при последующем удалении защитной группы для аминогруппы.
Как очевидно для специалистов в данной области, исходные материалы могут быть синтезированы по различным путям синтеза.
Например, для соединения формулы (III) или его солей соответствующее кетонное производное оксазолидина подвергается обычным способом реакции снятия защиты аминогруппы и реакции раскрытия кольца оксазолидина, посредством чего легко можно получить соединение формулы (III) или его соли. R3' в формуле (III), независимо от R3, имеет тот же смысл, что и R3, и является предпочтительной защитной группой, такой как ацильная группа, определенная для R3, за исключением случая конденсации с соединением формулы (V) или формулы (VI). Кетонное производное указанного оксазолидина может быть синтезировано, как показано в следующих этапах от (1) до (4):
(1) В соответствии с методом, описанным R. Nishizawa et al. (J. Med. Chem. V. 20, No. 4. Р. 510-515), 3-амино-2-гидрокси-4-замещенная или незамещенная фенилмасляная кислота может быть легко синтезирована при использовании аминокислоты в качестве исходного материала.
Аминокислота, используемая в качестве исходного материала, может быть коммерческим продуктом, например, замещенным или незамещенным фенилаланином и т.д. Если нет коммерческой аминокислоты, проводят обычную реакцию синтеза аминокислоты, например реакцию конденсации коммерческого ацетамидного эфира малоновой кислоты с замещенным бензилхлоридом, а затем эфир подвергают гидролизу и последующей реакции декарбоксилирования и снимают защиту с аминогруппы, в результате чего можно получить требуемую аминокислоту: например, замещенный фенилаланин, содержащий группу-заместитель в ароматическом кольце.
(2) 3-Аминогруппу полученной 3-амино-2-гидрокси-4-замещенной или незамещенной фенилмасляной кислоты защищают такой подходящей защитной группой, как трет-бутилоксикарбонильная группа и т.д., и затем подвергают обычным способом реакции конденсации с N,O-диметилгидроксиламином или его солью, вследствие чего можно получить 3-N-защищенное амино-2-гидрокси-4-замещенное или незамещенное соединение фенилмасляная кислота-N, О-диметилгидроксиламин.
(3) Полученный амид обрабатывают обычным способом, например, каталитическим количеством п-толуолсульфокислоты в 2,2-диметоксипропане, вследствие чего легко может быть получен 3-N-защищенный-5-(N-метокси-N-метил)карбамоил-2,2-диметил-4-замещенный или незамещенный фенилметилоксазолидин.
(4) Для специалистов в данной области очевидно, что полученный амид известен как активированный амид. Поэтому он легко может быть преобразован в кетонное производное путем нижеследующей операции. Конкретно, оксазолидин, подвергнутый известной реакции, например обработке реактивом Григнарда, соответствующим группе R2, в инертном растворителе в атмосфере аргона, в соответствии с описанным выше способом, раскрытым в выложенной японской заявке 143517/1996, где N,O-диметилгидроксиламиногруппа замещена группой R2, и таким путем может быть синтезировано кетонное производное оксазолидина, содержащее введенную в него группу R2. Итоговое кетонное производное оксазолидина и его солей может быть представлено следующей химической формулой (XXV):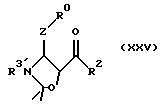
где R0, R2 и Z - группы, определенные в п. 1 формулы, a R3' имеет такое же значение, как группа R3, определенная в п. 1 формулы.
3-R3'-5-(R2CO)-2,2-ди-низший алкил-4-(R0-Z)-оксазолидин, который цитируется в данном детальном описании, имеет такой же смысл, как в формуле (XXV).
Далее, промежуточное соединение формулы (V), т.е. пиразин-3-он-4-уксусная кислота (в формуле (V) Х - азот, a Y - углерод), может быть синтезировано по пути, показанному на схеме 2 (см. в конце описания), в соответствии с одним из пригодных синтетических путей. В этой схеме Воc - трет-бутилоксикарбонильная группа, a CBZ - бензилоксикарбонильная группа.
Альдегид формулы (VII) может быть легко синтезирован по способу синтеза, описанному Rich D.H. et al. (J. Org. Chem. 1978. V. 43, N 18. Р. 3624-3626). Этот альдегид обрабатывают подходящим спиртом (в данном случае метанолом) в присутствии кислотного катализатора, в итоге может быть получено соединение формулы (VIII). Бензилоксикарбоксильную группу в формуле (VIII) подвергают гидрогенолизу обычным способом, в результате чего соединение может быть легко преобразовано в соединение формулы (IХ). Амин формулы (IХ) и моноэфир трет-бутилоксикарбониламиномалоновой кислоты подвергают конденсации обычным способом, в результате чего легко может быть получено соединение формулы (X).
Соединение формулы (X) может быть преобразовано в соединение формулы (XI) путем реакции замыкания кольца у соединения формулы (X) с использованием способа синтеза, описанного Taguchi H. et al. (Peptide Chemistry. 1995. Р. 160-172). Соединение формулы (XI) обрабатывают подходящим основанием в присутствии такого алкилирующего реагента, как аллилбромид, в результате чего может быть синтезирован 4,5-ди-замещенный-3-пиразинон-2-карбоксилат, представленный формулой (XII).
Защитную для карбоксила группу в соединении формулы (XII) гидролизуют обычным способом, в итоге чего соединение легко переводится в карбоновую кислоту. После этого карбоновую кислоту очищают или в некоторых случаях не очищают, соединение обрабатывают дифенилфосфорилазидом и подходящим основанием, таким как триэтиламин, в инертном растворителе, в результате чего может быть получен соответствующий изоцианат. В простом способе, как очевидно для специалистов в данной области, реакцию осуществляют в присутствии, например, третбутилового спирта, в результате чего легко может быть синтезировано соединение формулы (ХIII), где, например, R3 представляет собой трет-бутилоксикарбонильную группу.
Перевод соединения формулы (ХIII) в соединение формулы (V) может быть осуществлен в 3 этапа обычным способом, а именно перевод соединения формулы (XIII) в диол формулы (XIV) может быть осуществлен путем использования каталитического количества тетроксида осмия в присутствии такого соокисляющего агента, как N-метилморфолин-N-оксид. Затем соединение формулы (XIV) обрабатывают перйодатом натрия, после чего обрабатывают таким окисляющим агентом, как хлорит натрия, в результате чего легко может быть получено соединение формулы (V).
Промежуточное соединение формулы (V), т.е. пиримидин-6-он-1-уксусная кислота (в формуле (V) Х - углерод, a Y - азот), известно на основании, например, публикации 286946/1993 в списке раскрытия японских патентов, а неизвестные соединения также могут быть получены по способу, описанному в указанной литературе, или по способу, описанному выше. Промежуточное соединение формулы (VI), триазин-6-он-1-уксусная кислота, может быть синтезировано по пути, указанному на схеме 3.
Амидолазон формулы (XIX) может быть синтезирован по способу синтеза, описанному Metz H.J. and Neunhoeffer H. (Chem. Ber. 1982. V. 115. Р. 2807-2818). Этот амидолазон может быть превращен в 3,4-ди-замещенный-5-триазинон-6-карбоксилат формулы (XX) введением его без выделения и очистки в реакцию замыкания кольца с диэтилкетомалонатом в присутствии подходящего основания. Защитную группу для карбоксила в формуле (XX) гидролизуют обычным способом, так что это соединение может быть преобразовано в 3,4-ди-замещенную-5-триазинон-6-карбоновую кислоту формулы (XXI).
Карбоновая кислота формулы (XXI) может быть переведена в соединение формулы (XXII) (в этом случае R3 - трет-бутилоксикарбонильная группа) по известной реакции, например обработкой его дифенилфосфорилдазидом и пригодным основанием, таким как, например, триэтиламин, в присутствии трет-бутилового спирта. Известно, что такое превращение происходит через изоцианат, поэтому специалистам в данной области очевидно, что, если вместо трет-бутилового спирта использовать амин или подобный реагент, соединение легко можно превратить в такое соединение, где R3 - группа типа мочевины.
Преобразование соединения формулы (XXII) в соединение формулы (VI) может быть выполнено таким же образом, как и преобразование соединения формулы (XIII) в соединение формулы (V).
Этапы и промежуточные соединения для получения соединения формулы (I), описанные выше, представляют собой другие аспекты настоящего изобретения, которые раскрываются в этапах, описанных ниже. Использованные здесь группы являются группами, определенными выше.
(A) Реакция окисления спирта формулы (II) в карбонильную группу.
Окисление соединения формулы (II) может быть выполнено общепринятым способом, используемым для окисления гидроксильной группы в карбонильную группу, однако предпочтительно использовать способ, менее чреватый побочными реакциями. Обычно это может быть осуществлено окислением в инертном растворителе, предпочтительно в таком полярном растворителе, как диметилформамид или тетрагидрофуран, таком галогенсодержащем растворителе, как метиленхлорид, или в смешанном растворителе - смеси этих растворителей, предпочтительно в присутствии избытка окисляющего агента при температуре в интервале от -10oС до 100oС, предпочтительно при температуре в интервале от 10oС до 50oС или вблизи этого, более предпочтительно при комнатной температуре или вблизи этого. Предпочтительный окисляющий агент включает агент с использованием избытка диметилсульфоксида и водорастворимого карбодиимида, а в качестве катализатора - трифторацетата пиридиния; агент с использованием 3 соединений: оксалилхлорида, диметилсульфоксида и третичного амина; агент с использованием хлорохромата пиридиния в метиленхлориде и т.п.
Если аминогруппа нестабильна в условиях реакции окисления, предпочтительно или необходимо перед окислением вводить в аминогруппу защитную группу, такую как R3, и удалять защитную группу после окисления.
(B) Синтез соединения формулы (I), содержащего свободную аминогруппу.
С соответствующего соединения, содержащего обычную защитную группу для аминогруппы, эта защитная группа может быть снята традиционным методом. Традиционный метод снятия защиты включает, например, удаление защитной группы обработкой такой сильной кислотой, как соляная кислота в таком инертном растворителе, как 1,4-диоксан; или снятие защиты тепловой обработкой при одновременном присутствии п-толуолсульфокислоты в метаноле. Эти реакции можно проводить при температуре в интервале от -10oС до 100oС, предпочтительно при температуре в интервале от 10oС до 50oС или вблизи этого, более предпочтительно при комнатной температуре или вблизи этого.
Нижеследующие соединения могут быть получены конденсацией между соединением формулы (V) или его производного, активированного по карбоксильной группе, и соединения формулы (III), где R3' - водород, но они могут быть также получены в соответствии со следующими способами.
(C) Синтез соединения формулы (I), где R3 - ацильная группа.
Из соединения формулы (V), где R3 - трет-бутоксикарбонильная группа, указанную трет-бутоксикарбонильную группу удаляют следующим образом: получают соединение формулы (I), содержащее первичную аминогруппу, где R3 - водород, и указанную первичную аминогруппу ацилируют для получения целевого соединения. Простым методом является ацилирование с использованием кислого галида, соответствующего ацильной группе в инертном растворителе, таком как тетрагидрофуран. Другим пригодным способом является реакция конденсации с использованием соответствующей карбоксильной кислоты и сшивающего реагента, такого, например, как циклогексилкарбодиимид, 1-(3-диметиламинопропил)-3-этилкарбодиимид или его соль и т.д.
(D) Синтез соединения формулы (I), где R1 или R2, или R3 содержат COORa, CONRbRc.
Соединение может быть также получено ацилированием с помощью реакции конденсации между соединением, содержащим группу HORa, HNRbRc, и соединением формулы (I), содержащим в R1 или R2 группу СООН (или его активированным производным).
(Е) Синтез соединения формулы (I), где R3 - сульфонильная группа.
Соединение формулы (I), содержащее свободную аминогруппу, где R3 - водород, сульфонилируют сульфонилхлоридом в соответствии с целевым соединением, в результате чего может быть получено целевое соединение. В этом случае реакцию можно проводить при комнатной температуре или при охлаждении в ледяной бане в присутствии третичного амина в таком инертном растворителе, как тетрагидрофуран. Если нет коммерческого сульфонилхлорида, необходимый сульфонилхлорид может быть синтезирован по известному способу.
(F) Обычная реакция замещения аминосоединением формулы (I), где R3 - водород, удаляемой группы L в соединении, имеющем Ra-L, содержащем такую обычную удаляемую группу L, как галоген, метилсульфонилоксигруппу, трифторметилсульфонилоксигруппу, с целью синтезировать соединение формулы (I), где R3 представляет собой Ra, за исключением водорода.
(G) Реакция расщепления соответствующего алкил-эфира или ацилокси-эфира в соединении формулы (I), имеющем в своей арильной или гетероарилъной группе в качестве группы-заместителя низшую алкоксигруппу или в качестве группы-заместителя низшую ацилоксигруппу, с целью синтезировать соединение формулы (I), где по крайней мере одна из групп R1, R2 и R3 содержит в арильном или гетероарильном кольце гидроксильную группу в качестве группы-заместителя.
Подходящим способом является гидролиз ацилоксигруппы при кислотных или щелочных условиях и т.д.
(Н) Синтез соединения формулы (I), где R1 или R2 замещены по карбоксилу, или R2 - карбоксильная группа (Ra в группе COORa - водород).
Соединение может быть получено удалением эфирной группы с соответствующего эфирного соединения, содержащего карбоксильную группу. Эта реакция включает гидролиз такой щелочью, как гидроокись натрия, гидрогенолиз в случае бензильного эфира и разрушение трет-бутилового эфира при кислотных условиях и т.д.
(I) Синтез соединения формулы (I), где R3 - RbRcNCO или RbRcNCS, a Rc - водород.
Соединение может быть получено обычным способом путем ацилирования амногруппы в соединении формулы (I), содержащем свободную аминогруппу, изоцианатом или тиоизоцианатом, в соответствии с группой формулы RbNCO или RbNCS.
(J) Синтез соединения формулы (III), где R2 - алкил, арилалкил или гетероарилалкил.
Соединение может быть получено алкилированием соединения формулы (III), содержащего карбоксильную группу, или его активированного производного путем реакции с алкильным реагентом Григнарда, арилалкильным реагентом Григнарда или гетероарилалкильным реагентом Григнарда, имеющим группу, относящуюся к R2.
(К) Стандартный синтез соединения формулы (I) или (II).
Соединение может быть получено обычным способом путем конденсации между соединением формулы (V) или (VI) (или его производным, активированным в
группе СООН в структурной формуле) и соединением формулы (IV) или (III), где R3 - водород.
(L) Вышеприведенные пп. (С), (D), (E), (F), (G), (Н) и (I) являются реакциями для получения соединений, представленных формулой (I), и в соответствии с этими реакциями, могут быть получены соединения, представляющие собой промежуточные соединения, имеющие такие же группы, как в формулах (III), (IV), (V) и (VI). Конденсация этих промежуточных соединений может подобным же образом дать соединения формулы (I). Имеются случаи, когда желательно использовать защитную группу во всех описанных выше этапах синтеза. Эту защитную группу можно удалить на стадии, когда синтезирован конечный продукт или целевое соединение. Для специалистов в данной области очевидно, что набор стадий, приводящих к получению исходного материала и конечного продукта в настоящем изобретении, может быть модифицирован при подборе подходящего способа конденсации и способа удаления защитной группы.
Среди соединений формулы (I), полученных описанными выше способами, предпочтительные соединения включают описанные выше соединения 72, 73, 74, 75, 76, 77, 78, 79, 80 и 82 и т.д. Особенно предпочтительны 79 и 82 и т.д.
Предпочтительными примерами соединений формулы (V) являются следующие:
2-трет-бутилоксикарбониламино-3-оксо-5-фенил-3,4-дигидропиразин-4-илуксусная кислота (в формуле (V) Х - азот, Y - углерод, R3 - трет-бутилоксикарбонил, R1 - фенил),
5-трет-бутилоксикарбониламино-6-оксо-2-фенил-1,6-дигидро-1-пиримидинилуксусная кислота (в формуле (V) Х - азот, Y - углерод, R3 - трет-бутилоксикарбонил, R1 - фенил), и
6-трет-бутилоксикарбониламино-5-оксо-3-фенил-4,5-дигидро-1,2,4-триазинилуксусная кислота (в формуле (V) Х и Y - оба являются атомами азота, R3 - трет-бутилоксикарбонил, R1 - водород).
Примерами предпочтительных соединений формулы (III) являются следующие:
(A) метил-3-амино-2-гидрокси-4-(4-гидроксифенил)-бутират,
(B) метил-3-амино-2-гидрокси-4-(3-фтор-4-гидроксифенил)-бутират;
(C) 3-амино-2-гидрокси-4-фенил-пропананилид;
(D) 3-амино-2-гидрокси-4-фенил-N-фенилметил-бутиламид;
(E) 3-амино-2-гидрокси-4-фенил-N-фенилэтил-бутиламид;
(F) метил-3-амино-2-гидрокси-4-(4-метилоксифенил)-бутират.
Следующие соединения также перечисляются как предпочтительные:
(A) 2-амино-3-гидрокси-4-оксо-1 -фенилпентан;
(B) 2-амино-1,7-дифенил-3-гидрокси-4-оксогептан;
(C) 2-амино-1,6-дифенил-3-гидрокси-4-оксогексан;
(D) 2-амино-3-гидрокси-4-оксо-1 -фенилоктан;
(Е) 2-амино-1,4-дифенил-3-гидрокси-4-оксобутан;
(F) 7-амино-3-гидрокси-5-оксо-8-фенилоктанойная кислота;
(G) 2-амино-1-(3-фтор-4-гидроксифенил)-3-гидрокси-4-оксопентан;
(Н) 2-амино-1 -(3-фторфенил)-3-гидрокси-4-оксопентан;
(I) 2-амино-1 -(3-хлорфенил)-3-гидрокси-4-оксопентан;
(J) 2-амино-3-гидрокси-1-(3-метилфенил)-4-оксопентан;
(К) 2-амино-1-(4-фторфенил)-3-гидрокси-4-оксопентан;
(L) 2-амино-1 -(4-хлорфенил)-3-гидрокси-4-оксопентан;
(М) этил-2-амино-1 -(3-фторфенил)-3-гидрокси-4-оксооктаноат;
(N) 2-амино-1-(3-фторфенил)-3-гидрокси-4-оксооктан-(4-метилпиперазин)амид;
(О) 2-амино-3-гидрокси-7-(4-морфолин-4-ил)-4-оксо-1-фенилгептан;
(Р) 2-амино-7-(2-оксо-1,2-дигидропиридин-1-ил)-3-гидрокси-4-оксо-1-фенилгептан;
(Q) 2-амино-3-гидрокси-4-оксо-1 -фенил-7-(2-пиридилокси)гептан;
(R) метил-3-амино-2-гидрокси-4-фенилбутират.
Если данное соединение используется как ингибитор химазы, оно применяется само по себе или смешивается с наполнителями или носителями и вводится перорально или парентерально в виде фармацевтического состава, такого как инъекция, ингалянт, таблетки, гранулы, микрогранулы, порошок, капсулы, суппозитории, инстилляции, наклейки, мази, спреи и т.д. В качестве наполнителей или носителей выбирают фармацевтически приемлемые добавки, а их тип и состав определяют, исходя из пути введения и способа введения. Например, в случае инъекции, обычно предпочтительны хлористый натрий или такие сахариды, как глюкоза, маннитол и т. д. В случае пероральных препаратов предпочтительны крахмал, лактоза, кристаллическая целлюлоза, стеарат магния и т.д.
Содержание данного соединения в фармацевтическом составе варьирует в зависимости от препарата, но обычно оно находится в диапазоне от 0,1 до 100 весовых %, предпочтительно от 1 до 98 весовых %. Например, в случае инъекции содержание активного ингредиента находится в диапазоне обычно от 0,1 до 30 весовых %, предпочтительно от 1 до 10 весовых %. В случае перорального препарата данное соединение используется с добавками в виде таблеток, капсул, порошка, гранул, жидкости, безводного сиропа и т.д. Капсулы, таблетки, гранулы и порошок обычно содержат от 5 до 100 весовых % активного ингредиента, предпочтительно от 25 до 98 весовых %.
Хотя дозировку определяют в зависимости от возраста, веса и симптомов пациента, объекта терапии и т.д., обычно терапевтическая доза составляет от 1 до 100 мг/кг/день для парентерального введения и от 5 до 500 мг/кг/день для перорального введения.
Для данных соединений характерно, что они имеют низкую токсичность, и даже последовательное введение данных соединений не вызывает накопления токсических проявлений. Например, даже в случае введения данного соединения хомячкам перорально в дозе 100 мг/кг дважды в день в течение 3 недель, не наблюдалось никаких симптомов токсичности.
Далее настоящее изобретение описывается неограничивающими примерами. Если не указано иное, были использованы следующие методы.
(1) Раствор концентрировали при пониженном давлении (от 5 до 20 мм рт. ст.) в ротационном испарителе на водяной бане при температуре 50oС или ниже.
(2) Проводили хроматографию на силикагеле с использованием колонки BW-820 МН (Fuji Sitica); для препаративной тонкослойной хроматографии (ТСХ) использовали пластины TLC толщиной от 0,25 до 0,5 мм, в зависимости от задачи (силикагель 60F254, пластины 20х20 см) (Merck); соотношение объемов элюирующего раствора и проявляющего раствора указано как объем/объем.
(3) Точка плавления указана без поправки, и (разр.) обозначает разрушение; вещество, точка плавления которого указана, является веществом, синтезированным описанным в примерах методом, и даже если оно было синтезировано тем же самым методом, точка плавления может отличаться от приведенной величины, если вещество обладает кристаллическим полиморфизмом.
(4) Конечный продукт охарактеризован удовлетворительным спектром ядерного магнитного резонанса (ЯМР).
Для ЯМР использовали спектрометр Gemini-200 (200 МГц) фирмы Varian, химические сдвиги приведены в ппм относительно тетраметилсилана (ТМС) в качестве внутреннего стандарта; для формы детектируемых сигналов использовали общепринятые сокращения.
(5) Масс-спектры измеряли на масс-спектрометре VG Auto Spec (фирма VG Co., Ltd.) методом EI или FAB).
(6) Инфракрасные (ИК) спектры поглощения измеряли на НК спектрофотометре А-202 (Nippon Bunko) с использованием в качестве стандарта полистирольную пленку.
(7) Как правило, для мониторинга реакции применяли ТСХ; время реакции приведено только для иллюстрации, и в указании оптимального времени нет необходимости.
(8) Выход реакции приводится для объяснения, и он не должен обязательно соответствовать количеству вещества, синтезированного по оптимальному способу; если было необходимо получить значительное количество вещества, его синтез проводили повторно, пока не получали требуемое количество вещества.
Примеры
Далее настоящее изобретение детально описывается со ссылкой на примеры, которые, однако, не предназначены для ограничения настоящего изобретения. В таблицах приведены данные о соединениях формулы (I) (таблицы с 1 по 5) и соединениях формулы (II) (таблицы с 6 по 10), синтезированных в соответствии со следующими примерами.
Кетонные производные [соединение формулы (XXV)] оксазолидинона как промежуточные соединения для соединения формулы (III), использованные в примерах, показаны в таблицах 11 и 12.
Пример 1
Синтез гидрохлорида 2-(5-трет-бутилоксикарбониламино-6-оксо-1,6-дигидро-2-фенил-1-пиримидинил)-N-(2,3-диоксо-1-фенилметил)бутилацетамида (соединение N 37) и 2-(5-амино-6-оксо-1,6-дигидро-2-фенил-1-пиримидинил)-N-(2,3-диоксо-1-фенилметил)бутилацетамида (соединение 38) был выполнен, как описано ниже.
(1) (4S, 5R)-3-Трет-бутилоксикарбонил-2,2-диметил-5-(1-оксоэтил)-4-фенилметилоксазолидин (промежуточное соединение 1).
(4S, 5R)-3-Трет-бутилоксикарбонил-5-(N-метокси-N-метил)карбамоил)-2,2-диметил-4-фенилметилоксазолидин (1,50 г, 3,69 ммоль) растворяли в тетрагидрофуране (40 мл) и к нему добавляли по каплям при температуре -14oС в течение 10 мин. в атмосфере аргона раствор метил-магний-бромида в тетрагидрофуране (0,9 М раствор, 4,84 мл, 4,36 ммоль). После добавления реакционный раствор перемешивали при комнатной температуре в течение 2 ч, добавляли насыщенный водный раствор хлорида аммония и экстрагировали реакционный раствор этилацетатом. Органический слой последовательно промывали насыщенным водным раствором бикарбоната натрия и насыщенным раствором хлористого натрия, затем высушивали над безводным сульфатом натрия. Высушивающий агент удаляли фильтрацией, и фильтрат концентрировали при пониженном давлении, а полученный остаток очищали колоночной хроматографией на силикагеле (в системе гексан/этилацетат с соотношением от 8/1 до 7/1), в результате получали указанное в заглавии соединение (1,29 г, выход 98%).
1Н-ЯМР (CDCl3): 1,15-1,70 (15Н, сложный спектр), 2,00-2,20 (3Н, уширенный синглет), 2,70-3,30 (2Н, m), 4,16 (1Н, s), 4,13-4,14 (1Н, m), 7,12-7,39 (5Н, m) (примечание: m - мультиплет, s - синглет).
Промежуточные соединения (промежуточное соединение), показанные в табл. 11 и 12, были синтезированы теми же методами. Физические свойства целевых соединений следующие:
Промежуточное соединение 2. Масс-спектрометрия (МС): m/z=438 (М+1).
Промежуточное соединение 3. МС: m/z=321 (М+1).
Промежуточное соединение 4. 1Н-ЯМР (СDСl3): 0,83 (3Н, t, J=7,2 Гц), 1,11-1,33 (2Н, m), 1,32-1,57 (2Н, m), 1,10-1,60 (6Н, m), 1,58 (9Н, s), 2,15-2,52 (2Н, m), 2,70-3,11 (1Н, m), 3,22 (1Н, dd, J=2,9 и 13,2 Гц), 4,15-4,28 (1Н, m), 4,30-4,48 (1Н, m), 7,14-7,39 (5Н, m) (примечание: t - триплет, d - дублет, dd - двойной дублет).
Промежуточное соединение 5. 1Н-ЯМР (СDСl3): 1,29-1,80 (15Н, сложный спектр), 2,74-3,03 (1Н, m), 3,22-3,47 (1Н, m), 4,81 (1Н, ушир d, J=9,7 Гц), 5,01 (1Н, ушир. d, J=14,3 Гц), 7,15-7,89 (10Н, сложный спектр).
Промежуточное соединение 6. 1Н-ЯМР (СDCl3): 1,23 (3Н, t, J=7,1 Гц), 1,41-1,67 (15Н, сложный спектр), 1,80 (2Н, квинтет, J=7,1 Гц), 2,24 (2Н, t, J=7,1 Гц), 2,34-2,73 (2Н, m), 2,75-3,12 (1Н, m), 3,20 (1Н, dd, J=3,3, и 13,2 Гц), 4,10 (1Н, квинтет, J=7,1 Гц), 4,18 (1Н, ушир. s), 4,40 (1Н, ушир. s), 7,16-7,36 (5Н, m).
Промежуточное соединение 7. МС: m/z = 368 (M + 1).
Промежуточное соединение 8. 1Н-ЯМР (CDCl3): 1,12-1,66 (15Н, сложный спектр), 2,13 (3Н, s), 2,70-3,24 (2Н, сложный спектр), 4,13 (1Н, ушир. s), 4,30-4,53 (1Н, m), 6,87-7,06 (3Н, сложный спектр), 7,20-7,40 (1Н, m).
Промежуточное соединение 9. 1Н-ЯМР (СDСl3): 1,10-1,63 (15 Н, сложный спектр), 1,24 (3Н, t, J=7,1 Гц), 1,83 (2Н, квинтет, J=7,3 Гц), 2,27 (2Н, t, J=7,3 Гц), 2,35-3,25 (4Н, сложный спектр), 4,10 (2Н, q, J=7,1 Гц), 4,11-4,19 (1Н, m), 4,27-4,55 (1Н, m), 6,86-7,06 (3Н, сложный спектр), 7,19-7,34 (1Н, m) (примечание: q - квартет).
Промежуточное соединение 10. 1Н-ЯМР (СDСl3): 1,10-1,70 (15Н, сложный спектр), 1,73-1,91 (2Н, сложный спектр), 2,11-2,70 (11Н, сложный спектр), 2,74-3,24 (2Н, сложный спектр), 3,40-3,50 (2Н, сложный спектр), 3,54-3,65 (2Н, сложный спектр), 4,10-4,23 (1Н, m), 4,25-4,55 (1Н, m), 6,86-7,04 (3Н, сложный спектр), 7,20-7,36 (1Н, m).
Промежуточное соединение 11. 1Н-ЯМР (СDСl3): 1,45-1,58 (15Н, сложный спектр), 1,60-1,75 (2Н, сложный спектр), 2,18 (2Н, ушир. t), 2,32 (6Н, ушир. t, J=4,8 Гц), 3,14-3,35 (2Н, сложный спектр), 3,59 (4Н, ушир. s), 4,26 (1Н, ушир. s), 4,42 (1Н, ушир. s), 7,18-7,35 (5Н, сложный спектр).
Промежуточное соединение 12. Описано ниже.
Промежуточное соединение 13. Описано ниже.
Промежуточное соединение 14. 1Н-ЯМР (CDCl3): 1,19-1,57 (15Н, сложный спектр), 2,11 (3Н, ушир. s), 2,70-3,20 (2Н, сложный спектр), 4,05-4,18 (1Н, m), 4,30-4,50 (1Н, m), 6,94-7,06 (2Н, сложный спектр), 7,09-7,29 (3Н, сложный спектр).
Промежуточное соединение 15. 1Н-ЯМР (CDCl3): 1,18-1,59 (15Н, сложный спектр), 2,12 (3Н, ушир. s), 2,70-3,21 (2Н, сложный спектр), 4,09 (1Н, ушир. s), 4,30-4,53 (1Н, m), 7,09-7,34 (4Н, m).
Промежуточное соединение 16. 1Н-ЯМР (СDСl3): 1,19-1,57 (15Н, сложный спектр), 2,06 (3Н, ушир. s), 2,32 (3Н, s), 2,70-3,07 (1Н, m), 3,18 (1Н, dd, J= 3,0 и 13,1 Гц), 4,10-4,27 (1Н, m), 4,32-4,54 (1Н, m), 6,95-7,13 (3Н, сложный спектр), 7,13-7,25 (1Н, m).
Промежуточное соединение 17. МС: m/z = 369 (M + 1).
Промежуточное соединение 18. 1Н-ЯМР (СDСl3): 1,53 (9Н, s), 2,13 (3Н, s), 2,85 (1Н, ушир. s), 3,18 (1Н, dd, J=3,2 и 13,3 Гц), 4,09-4,17 (1Н, m), 4,42 (1Н, ушир. s), 7,21-7,33 (3Н, сложный спектр), 7,21-7,33 (1Н, m).
(2) 2-(5-Трет-бутилоксикарбониламино-6-оксо-1,6-дигидро-2-фенил-1-пиримидинил)-N-(2R,3S)-(2-гидрокси-3-оксо-1-фенилметил)бутилацетамид (соединение 1).
(4S, 5R)-3-Трет-бутилоксикарбонил-2,2-диметил-5-(1-оксоэтил)-4-фенилметилоксазолидин (1,29 г, 3,87 ммоль) растворяли в растворе 4 н. соляная кислота/1,4-диоксан (29 мл, 116 ммоль), к этому добавляли дистиллированную воду (2,9 мл) и смесь перемешивали при комнатной температуре в течение 3 ч. Реакционный раствор концентрировали при пониженном давлении, к полученному остатку добавляли диэтиловый эфир и собирали осажденное твердое вещество (950 мг). Это твердое вещество без дальнейшей очистки подвергали реакции конденсации.
Полученное в описанной выше реакции твердое вещество (950 мг) и 5-трет-бутилоксикарбониламино-6-оксо-2-фенил-1,6-дигидро-1-пиримидинилуксусную кислоту (1,42 г, 4,14 ммоль) растворяли в смешанном растворителе - смеси диметилформамида (5 мл) и тетрагидрофурана (5 мл), и затем к раствору при охлаждении в ледяной бане добавляли последовательно в следующем порядке: 1-(3-диметиламинопропил)-3-этил-карбодиимид-гидрохлорид (1,03 г, 5,38 ммоль), 1-гидроксибензтриазол•1Н2O (825 мг, 5,38 ммоль) и 4-метилморфолин (0,70 мл, 6,37 ммоль). Реакционный раствор разбавляли этилацетатом и промывали последовательно 5% водным раствором лимонной кислоты, насыщенным водным раствором бикарбоната натрия, дистиллированной водой и насыщенным водным раствором хлористого натрия. После высушивания органического слоя добавлением безводного сульфата натрия, сушащий агент удаляли фильтрацией, а фильтрат концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (хлороформ/метанол = 60/1-30/1), в итоге получали указанное в заглавии соединение (1,39 г, выход 65%).
1Н-ЯМР (СDСl3): 1,53 (9Н, s), 2,06 (3Н, s), 2,56-2,81 (2Н, s), 3,99 (1Н, d, J= 4,4 Гц), 4,33 (1Н, dd, J=2,5 и 4,4 Гц), 4,40 (1Н, d, J=15,2 Гц), 4,52 (1Н, d, J= 15,2 Гц), 4,64-4,82 (1Н, m), 6,67 (1Н, d, J=8,8 Гц), 7,05-7,57 (11Н, сложный спектр), 8,73 (1Н, s).
(3) 2-(5-Трет-бутилоксикарбониламино-6-оксо-1,6-дигидро-2-фенил-1-пиримидинил)-N-(2,3-диоксо-1-фенилметил)бутилацетамид (соединение 37).
2-(5-Трет-бутилоксикарбониламино-6-оксо-1,6-дигидро-2-фенил-1-пиримидинил)-N-(2-гидрокси-3-оксо-1-фенилметил)бутилацетамид (904,6 мг, 1,74 ммоль) растворяли в диметилсульфоксиде (6 мл), добавляли последовательно трифторацетат пиридиния (171,3 мг, 890 ммоль) и 1-(3-диметиламинопропил)-3-этилкарбодиимид-гидрохлорид (1,00 г, 5,23 ммоль) в указанном порядке и перемешивали в течение 6 ч и 20 мин. К реакционному раствору добавляли этилацетат, после чего промывали последовательно водой и насыщенным водным раствором хлористого натрия. Органический слой высушивали над безводным сульфатом натрия, затем сушащий агент удаляли фильтрацией, а фильтрат концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (хлороформ/метанол = 60/1), в итоге получали указанное в заглавии соединение (720,4 мг, выход 80%).
1Н-ЯМР (СDСl3): 1,54 (9Н, s), 2,33 (3Н, s), 2,99 (1Н, dd, J=8,0 и 14,1 Гц), 3,22 (1Н, dd, J=5,6 и 14, 1 Гц), 4,48 (2Н, s), 5,17-5,31 (1Н, m), 6,48 (1Н, d, J=6,3 Гц), 6,99-7,63 (11Н, сложный спектр), 8,71 (1Н, s); MC: m/z = 519 (M + 1).
(4) 2-(5-Амино-6-оксо-1,6-дигидро-2-фенил-1-пиримидинил)-N-(2,3-диоксо-1-фенилметил)бутилацетамид-гидрохлорид (соединение 38).
2-(5-Трет-бутилоксикарбониламино-6-оксо-1,6-дигидро-2-фенил-1-пиримидинил)-N-(2,3-диоксо-1-фенилметил)бутилацетамид (623,4 мг, 1,2 ммоль) растворяли в растворе 4 н. соляная кислота/1,4-диоксан (9 мл, 36,2 ммоль) и перемешивали при комнатной температуре в течение 3 ч. К реакционному раствору добавляли диэтиловый эфир, и полученное твердое вещество собирали фильтрацией, в результате чего получали указанное в заглавии соединение (51,8 мг, выход 9%). MC: m/z = 419 (М + 1).
Пример 2
Синтез 2-(5-трет-бутилоксикарбониламино-6-оксо-2-фенил-1,6-дигидропиримидин-1-ил)-N-2,3-диоксо-1-(3-фтор-4-гидроксифенилметил)бутилацетамида (соединение 49) проводили следующим образом.
(1) (2S, 3R)-3-Бензилоксикарбониламино-2-гидрокси-4-(3-фтор-4-гидрокси)фенилмасляной кислоты N,О-диметилгидроксиламид.
(2S,3R)-3-Бензилоксикарбониламино-2-гидрокси-4-(-4-гидрокси)фенилмасляной кислоты N, О-диметилгидроксиламид (2,15 г, 5,54 ммоль) растворяли в метиленхлориде (37 мл), к раствору добавляли вещество тетрафторборатная кислота-N-фтор-3,5-дихлорпиридиний (коммерческое название Onoda Florinate FP-B700) (2,11 г, 8,31 ммоль) и перемешивали при 50oС в течение 2 дней в атмосфере аргона. Реакционному раствору давали охладиться до комнатной температуры, разбавляли метиленхлоридом и промывали последовательно 20% водным раствором лимонной кислоты и насыщенным водным раствором бикарбоната натрия. Органический слой высушивали над безводным сульфатом натрия, затем сушащий агент удаляли фильтрацией, а фильтрат концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (гексан/этилацетат/метанол = 10/10/1), в итоге получали указанное в заглавии соединение (686,8 мг, выход 30%).
1Н-ЯМР (СDCl3): 2,73-2,98 (2Н, m), 3,15 (2Н, s), 3,46 (3Н, s), 3,67 (1Н, d, J=6,6 Гц), 4,19 (1Н, d, J=5,5 Гц), 4,31-4,47 (1Н, m), 4,97-5,12 (3Н, сложный спектр), 6,77-7,21 (3Н, m), 7,22-7,42 (5Н, m); МС: m/z = 407 (М + 1).
(2) (2S, 3R)-3-Трет-бугилоксикарбониламино-2-гидрокси-4-(3-фтор-4-гидрокси)фенилмасляной кислоты N,O-диметилгидроксиламид.
(2S, 3R)-3-Бензилоксикарбониламино-2-гидрокси-4-(3-фтор-4-гидрокси)фенилмасляной кислоты N, O-диметилгидроксиламид (674,8 мг, 1,66 ммоль) растворяли в метаноле (50 мл), к раствору добавляли раствор 4 н. соляная кислота/1,4-диоксан (0,42 мл) и палладий черный (67 мг) и перемешивали ночь в атмосфере азота. После удаления катализатора фильтрацией, реакционный раствор концентрировали при пониженном давлении, полученный остаток растворяли в 1,4-диоксане (3,3 мл), затем к раствору добавляли дистиллированную воду (1,6 мл), кислый углекислый натрий (168 мг, 1,99 ммоль) и ди-трет-бутилдикарбонат (435 мг, 1,99 ммоль) и перемешивали при комнатной температуре в течение 1 часа. Затем реакционный раствор разбавляли этилацетатом и промывали последовательно насыщенным водным раствором хлорида аммония и насыщенным водным раствором бикарбоната натрия. Органический слой высушивали над безводным сульфатом натрия, затем сушащий агент удаляли фильтрацией, а фильтрат концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (гексан/этилацетат/метанол = 10/10/1), в итоге получали указанное в заглавии соединение (557 мг, выход 90%).
1Н-ЯМР (СDCl3): 1,39 (9Н, s), 2,72-2,93 (2Н, m), 3,17 (3Н, s), 3,46 (3Н, s), 3,63 (1Н, d, J=5,9 Гц), 4,14 (1Н, d, J=5,1 Гц), 4,29-4,46 (1Н, m), 5,34 (1Н, d, J=3,4 Гц), 6,74-7,19 (3Н, m).
(3) (4R, 5S)-3-Трет-бутилоксикарбонил-5-(N-метокси-N-метил)-карбамоил-2,2-диметил-4-(3-фтор-4-гидроксифенилметил)оксазолидин.
(2S, 3R)-3-Трет-бутилоксикарбониламино-2-гидрокси-4-(3-фтор-4-гидрокси)фенилмасляной кислоты N, О-диметилгидроксиламид (512,1 мг, 1,38 ммоль) растворяли в толуоле (5,1 мл), к раствору добавляли 2,2-диметоксипропан (1,69 мл, 13,8 ммоль) и п-толуолсульфокислоту•1H2О (26 мг, 0,14 ммоль) и перемешивали в течение ночи при 80oС. Реакционный раствор разбавляли этилацетатом и промывали насыщенным водным раствором бикарбоната натрия. Органический слой высушивали над безводным сульфатом натрия, затем осушающий агент удаляли фильтрацией, а фильтрат концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (гексан/этилацетат = 1/1), в итоге получали указанное в заглавии соединение (346 мг, выход 61%).
1Н-ЯМР (СDСl3): 1,38-1,68 (15Н, сложный спектр), 2,55-2,87 (1Н, m), 3,02-3,25 (4Н, сложный спектр), 3,32-3,64 (3Н, сложный спектр), 4,54 (1Н, ушир. d), 4,64 (1Н, ушир. s), 5,37 (1Н, ушир. s), 6,83-7,04 (3Н, m).
(4) (4R, 5S)-3-Трет-бугилоксикарбонил-5-(1-оксоэтил)-2,2-диметил-4-(3-фтор-4-гидроксифенил)метилоксазолидин (промежуточное соединение 7).
(4R, 5S)-3-Трет-бутилоксикарбонил-5-(N-метокси-N-метил)карбамоил-2,2-диметил-4-(3-фтор-4-гидроксифенил)метилоксазолидин (424,4 мг, 1,03 ммоль) растворяли в тетрагидрофуране (10 мл) в атмосфере аргона и охлаждали до -30oС. К этому раствору по каплям добавляли метил-магний-бромид (0,9 М раствор в тетрагидрофуране, 3,43 мл, 3,09 ммоль). После этого давали температуре повыситься до комнатной, и через 30 мин раствор разбавляли этилацетатом и насыщенным водным раствором хлорида аммония. После раздробления органического слоя его промывали последовательно насыщенным водным раствором бикарбоната натрия и насыщенным водным раствором хлористого натрия. Органический слой высушивали над безводным сульфатом натрия, сушащий агент удаляли фильтрацией, а фильтрат концентрировали в испарителе при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (гексан/этилацетат = 2/1), в итоге получали указанное в заглавии соединение (354,3 мг, выход 94%). МС: m/z = 368 (М + 1).
(5) 2-(5-Трет-бутилоксикарбониламино-6-оксо-2-фенил-1,6-дигидропиримидин-1-ил)-N-{ (1R, 2S)-2-гидрокси-1-(3-фтор-4-гидроксифенил)метил-3-оксо}бутилацетамид (соединение 19).
(4R, 5S)-3-Трет-бутилоксикарбонил-5-(1-оксоэтил)-2,2-диметил-4-(3-фтор-4-гидроксифенил)метилоксазолидин (354,3 мг, 0,96 ммоль) растворяли в смеси 4 н. соляная кислота/1,4-диоксан (2,4 мл), к раствору добавляли дистиллированную воду (0,24 мл) и смесь перемешивали при комнатной температуре в течение 30 мин. Реакционный раствор концентрировали при пониженном давлении, к полученному остатку добавляли толуол и смесь снова концентрировали, пока не получали белое твердое вещество (256,9 мг). Это вещество использовали в последующей реакции без дальнейшей очистки.
Белое твердое вещество (256,9 мг), полученное в предыдущей реакции, и 5-трет-бутилоксикарбониламино-6-оксо-2-фенил-1,6-дигидро-1-пиримидинилуксусную кислоту (334,4 мг, 0,97 ммоль) растворяли в смешанном растворе - смеси диметилформамида (1,2 мл) и тетрагидрофурана (1,2 мл), к этому раствору добавляли 1-(3-диметиламинопропил)-3-этилкарбодиимид-гидрохлорид (243 мг, 1,27 ммоль), 1-гидроксибензтриазол•1H2O (194 мг, 1,27 ммоль) и 4-метилморфолин (0,15 мл, 1,50 ммоль) в указанном порядке, и смесь перемешивали в течение ночи при комнатной температуре. Реакционный раствор разбавляли этилацетатом и промывали последовательно 20% водным раствором лимонной кислоты, насыщенным водным раствором бикарбоната натрия, дистиллированной водой и насыщенным водным раствором хлористого натрия. После того как органический слой высушивали добавлением безводного сульфата натрия, осушающий агент удаляли фильтрацией, а фильтрат концентрировали в испарителе при пониженном давлении. Полученный остаток очищали препаративной тонкослойной хроматографией на силикагеле (гексан/этилэтилацетат/метанол = 10/10/1), в итоге получали указанное в заглавии соединение (112 мг, выход 21%).
1Н-ЯМР (СDCl3): 1,53 (9Н, m), 2,20 (3Н, s), 2,86 (2Н, d, J=7,8 Гц), 3,93 (1Н, ушир. s), 4,05 (1Н, ушир. s), 4,31 (1Н, d, J=15,4 Гц), 4,41 (1Н, d, J= 15,2 Гц), 4,62-4,76 (1Н, m), 6,45-7,00 (5Н, сложный спектр), 7,38-7,50 (6Н, сложный спектр), 8,68 (1Н, ушир. s); MC: m/z = 555 (М + 1).
(6) 2-(5-Трет-бутилоксикарбониламино-6-оксо-2-фенил-1,6-дигидропиримидин-1-ил)-N-{ (1R, 2S)-2-гидрокси-1-(4-ацетилокси-3-фторфенил)метил-3-оксо} бутилацетамид (соединение 7).
2-(5-Трет-бутилоксикарбониламино-6-оксо-2-фенил-1,6-дигидропиримидин-1-ил)-N-{ (1R, 2S)-2-гидрокси-1-(3-фтор-4-гидроксифенил)метил-3-оксо}бутилацетамид (105,3 мг, 0,19 ммоль) растворяли в 2-пропаноле (1,26 мл), к раствору добавляли при 0oС водный раствор гидроокиси натрия (7,6 мг/1,25 мл) и уксусный ангидрид (17,9 мкл, 0,19 ммоль). После перемешивания при 0oС в течение 10 мин к раствору добавляли уксусный ангидрид до момента обесцвечивания желтого реакционного раствора. Этот раствор разбавляли этилацетатом и промывали последовательно насыщенными водными растворами бикарбоната натрия и хлористого натрия. После высушивания органического слоя над безводным сульфатом натрия удаляли осушающий агент фильтрацией, а фильтрат концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (метиленхлорид/метанол = 20/1), в итоге получали указанное в заглавии соединение (98,4 мг, выход 87%).
1Н-ЯМР (СDСl3): 1,53 (9Н, m), 2,20 (3Н, s), 2,33 (3Н, s), 2,95 (2Н, d, J= 8,0 Гц), 3,83 (1Н, ушир. s), 4,05 (1Н, ушир. d), 4,32-4,57 (1Н, m), 4,64-4,79 (1Н, m), 6,24 (1Н, d, J=9,5 Гц), 6,91-7,13 (3Н, m), 7,29 (1Н, s), 7,39-7,56 (5Н, m), 8,23 (1Н, s).
(7) 2-(5-Трет-бутилоксикарбониламино-6-оксо-2-фенил-1,6-дигидропиримидин-1-ил)-N-{ 2,3-диоксо-1-(4-ацетилокси-3-фторфенил)метил} бутилацетамид (соединение 65).
Оксалилхлорид (35 мкл) добавляли к метиленхлориду (1,7 мл) при комнатной температуре в атмосфере аргона и охлаждали при -78oС. К этому раствору добавляли смешанный раствор диметилсульфоксида (0,057 мл) и метиленхлорида (0,5 мл) и через 15 мин к полученному раствору по каплям добавляли раствор 2-(5-трет-бутилоксикарбониламино-6-оксо-2-фенил-1,6-дигидропиримидин-1-ил)-N-{ (1R, 2S)-2-гидрокси-1-(4-ацетилокси-3-фторфенил)метил-3-оксо}бутилацетамида (98,9 мг, 0,17 ммоль) в метиленхлориде (1,7 мл). После добавления смесь перемешивали в течение 40 мин и затем добавляли к ней триэтиламин (0,12 мл). Реакционный раствор разбавляли метиленхлоридом и промывали последовательно дистиллированной водой и насыщенным раствором хлористого натрия. После высушивания органического слоя над безводным сульфатом натрия удаляли осушающий агент фильтрацией, а фильтрат концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (хлороформ/метанол = 80/1), в итоге получали указанное в заглавии соединение (57,8 мг, выход 59%).
1Н-ЯМР (СDСl3): 1,53 (9Н, s), 2,32 (3Н, s), 2,34 (3Н, s), 2,55-3,01 (1Н, m), 3,08-3,37 (1Н, m), 4,12-4,48 (2Н, сложный спектр), 4,70-5,12 (1Н, m), 6,82-7,11 (3Н, сложный спектр), 7,23-7,58 (6Н, сложный спектр), 8,72 (1Н, ушир. s).
(8) 2-(5-Трет-бутилоксикарбониламино-6-оксо-2-фенил-1,6-дигидропиримидин-1-ил)-N-{ 2,3-диоксо-1-(3-фтор-4-гидроксифенил)метил} бутилацетамид (соединение 49).
2-(5-Трет-бутилоксикарбониламино-6-оксо-2-фенил-1,6-дигидропиримидин-1-ил)-N-{ 2,3-диоксо-1-(4-ацетилокси-3-фторфенил)метил}бутилацетамид (54 мг, 0,091 ммоль) растворяли в смеси метанола (1,3 мл) и воды (0,65 мл), и после добавления насыщенного водного раствора бикарбоната натрия перемешивали 1 час при комнатной температуре. Реакционный раствор концентрировали при пониженном давлении, экстрагировали этилацетатом и органический слой промывали насыщенным водным раствором хлористого натрия. Органический слой высушивали над безводным сульфатом натрия, удаляли осушающий агент фильтрацией, а фильтрат концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (метиленхлорид/метанол = 20/1), в итоге получали указанное в заглавии соединение (16,1 мг, выход 32%).
1Н-ЯМР (СDCl3): 1,53 (9Н, m), 2,34 (3Н, s), 2,87 (1Н, dd, J=8,1, 14,4 Гц), 3,14 (1Н, dd, J=5,2, 14,1 Гц), 4,48 (1Н, s), 5,09-5,22 (1Н, m), 6,23-6,88 (5Н, сложный спектр), 7,21-7,56 (6Н, сложный спектр), 8,60-8,76 (1Н, ушир. s); МС: m/z = 553 (М + 1).
Пример 3.
Синтез 2-(5-трет-бутилоксикарбониламино-6-оксо-2-фенил-1,6-дигидропиримидин-1-ил)-N-(2-гидрокси-3-оксо-6-фенил-1-фенилметил)гексилацетамида (соединение 39) проводили следующим способом.
(1) (2R, 3S)-2-Амино-1,7-дифенил-3-гидрокси-4-оксопентан-п-толуолсульфонат (соль п-толуолсульфокислоты соединения формулы (III), где R0 = фенил, R2 = фенилпропил, R3' = Rd = водород, Z=метилен).
(4R, 5S)-3-Трет-бутилоксикарбониламино-5-(1-оксо-3-фенил)бутил-2,2-диметил-4-фенилметилоксазолидин (758,5 мг, 1,73 ммоль) растворяли в метаноле (9 мл), к раствору добавляли п-толуолсульфокислоту•1H2О (330 мг, 1,73 ммоль), и смесь нагревали с обратным холодильником в течение 4 ч. Реакционный раствор концентрировали при пониженном давлении и к полученному остатку добавляли гексан (10 мл) и диэтиловый эфир (10 мл). Осажденное твердое вещество собирали фильтрацией, в результате получали названный продукт (631,5 мг, выход 75%).
1Н-ЯМР (ДMCO-d6): 1,72 (2Н, квинтет, J=7,3 Гц), 2,29 (3Н, s), 2,59 (2Н, перекрывается с пиком растворителя), 2,83-2,92 (2Н, сложный спектр), 3,50-3,70 (2Н, перекрывается с пиком растворителя), 3,85 (1Н, ушир. d), 7,09-7,35 (12Н, сложный спектр), 7,51 (2Н, J=8,1 Гц), 7,78-7,88 (2Н, ушир. s).
(2) 2-(5-Трет-бутилоксикарбониламино-6-оксо-2-фенил-1,6-дигидропиримидин-1-ил)-N-(2-гидрокси-3-оксо-6-фенил-1-фенилметил)гексилацетамид (соединение 2).
5-Трет-бутилоксикарбониламино-6-оксо-2-фенил-1,6-дигидро-1-пиримидинилуксусную кислоту (447 мг, 1,30 ммоль) и (2R,3S)-2-амино-1,7-дифенил-3-гидрокси-4-оксогептан-п-толуолсульфонат (651 мг, 1,30 ммоль) растворяли в растворителе - смеси диметилформамида (2 мл) и тетрогидрофурана (1 мл) и охлаждали до 0oС. К этому раствору добавляли 1-(3-диметиламинопропил)-3-этилкарбодиимид-гидрохлорид (248 мг, 1,30 ммоль), 1-гидроксибензтриазол•1H2O (198 мг, 1,30 ммоль) и 4-метилморфолин (0,14 мл, 1,30 ммоль) в указанном порядке и смесь перемешивали в течение ночи, при этом температура сама поднималась до комнатной. Реакционный раствор разбавляли этилацетатом и промывали последовательно 20% водным раствором лимонной кислоты, насыщенным водным раствором бикарбоната натрия и насыщенным водным раствором хлористого натрия. Органический слой сушили добавлением безводного сульфата натрия, осушающий агент удаляли фильтрацией, а фильтрат концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (гексан/этилэтилацетат/метанол = 30/10/1), в итоге получали указанное в заглавии соединение (439,7 мг, выход 54%).
1Н-ЯМР (СDСl3): 1,53 (9Н, s), 1,86 (2Н, сложный спектр), 2,26-2,44 (1Н, m), 2,50-2,73 (3Н, сложный спектр), 2,94 (2Н, d, J=7,8 Гц), 3,84 (1Н, d, J= 3,7 Гц), 3,95 (1Н, ушир. d), 4,31 (1Н, d, J=15,3 Гц), 4,49 (1Н, d, J=15,3 Гц), 4,68 (1Н, ушир. dd), 6,39 (1Н, d, J=9,2), 7,06-7,47 (15Н, сложный спектр, перекрывается с пиком растворителя), 8,73 (1Н, ушир. s).
Пример 4
Синтез гидрохлорида 2-(5-амино-6-оксо-2-фенил-1,6-дигидропиримидин-1-ил)-N-{ 2,3-диоксо-6-(2-оксо-1,2-дигидропиридин-1-ил)-1-фенилметил} гексилацетамида (соединение 73) проводили следующим образом.
Гидрохлорид 2-(5-амино-6-оксо-2-фенил-1,6-дигидропиримидин-1-ил)-N-{ 2,3-диоксо-1-фенилметил-6-(2-оксо-1,2-дигидропиридин-1-ил)} гексилацетамида (соединение 73).
2-{(5-Трет-бутилоксикарбониламино-2-фенил-1,6-дигидро-6-оксо)пиримидин-1-ил} -N-{ 2,3-диоксо-6-(2-оксо-1,2-дигидропиридин-1-ил)-1-фенилметил} гексилацетамид (соединение 72) (197 мг, 0,31 ммоль) растворяли в метаноле (1 мл), к раствору добавляли раствор 4 н. соляная кислота/1,4-диоксан (2,3 мл) и смесь перемешивали при комнатной температуре в течение 2 ч. Реакционный раствор концентрировали при пониженном давлении, к полученному остатку добавляли хлороформ и собирали фильтрацией осажденное твердое вещество. В итоге получали названный продукт (167 мг, выход 93%).
1Н-ЯМР (CD3OD): 1,95-2,21 (2Н, сложный спектр), 2,53-2,96 (4Н, сложный спектр), 3,98-4,70 (5Н, сложный спектр), 6,87-8,09 (14Н, сложный спектр); МС: m/z = 540 (М + 1).
Пример 5
Синтез 2-{ 5-(3-тетрагидрофуроил)амино-6-оксо-2-фенил-1,6-дигидропиримидин-1-ил} -N-{ 2,3-диоксо-6-фенил-1-фенилметил} гексилацетамид (соединение 81) проводили следующим образом.
(1) 2-(5-Трет-бутилоксикарбониламино-6-оксо-2-фенил-1,6-дигидропиримидин-1-ил)-N-{(1R,2S)-2-ацетилокси-3-оксо-6-фенил-1-фенилметил}гексилацетамид (соединение 34).
2-(5-Трет-бутилоксикарбониламино-6-оксо-2-фенил-1,6-дигидропиримидин-1-ил)-N-{ (1R, 2S)-2-гидрокси-3-оксо-6-фенил-1-фенилметил} гексилацетамид (соединение 2) (2,65 г, 4,34 ммоль) растворяли в пиридине (5,5 мл) и добавляли к нему по каплям при охлаждении в ледяной бане уксусный ангидрид (0,82 мл, 8,68 ммоль). После добавления смесь перемешивали при комнатной температуре в течение 6 ч. Реакционный раствор разбавляли этилацетатом и затем промывали последовательно 10% лимонной кислотой, насыщенным водным раствором бикарбоната натрия и насыщенным раствором хлористого натрия. Органический слой высушивали над безводным сульфатом натрия, осушающий агент удаляли фильтрацией, а фильтрат концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (хлороформ/этилацетат = от 3/1 до 1/1), в итоге получали указанное в заглавии соединение (2,70 г, выход 95%).
1Н-ЯМР (СDCl3): 1,53 (9Н, s), 1,74-1,93 (2Н, m), 2,19 (3Н, s), 2,26-2,59 (4Н, сложный спектр), 2,81 (1Н, dd, J=8,8, 13,5 Гц), 3,12 (1Н, dd, J=6,45, 13,5 Гц), 4,38 (1Н, d, J=15,3 Гц), 4,48 (1Н, d, J=15,3 Гц), 4,75 (1Н, m), 4,91 (1Н, d, J=2,0 Гц), 6,34 (1Н, d, J=9,2 Гц), 7,09-7,35 (11Н, перекрывается с пиком растворителя), 7,35-7,45 (5Н, сложный спектр), 8,75 (1Н, s).
(2) 2-{ 5-(3-Тетрагидрофуроил)амино-6-оксо-2-фенил-1,6-дигидропиримидин-1-ил}-N-{(1R,2S)-2-ацетилокси-3-оксо-6-фенил-1-фенилметил}гексилацетамид (соединение 32).
2-(5-Трет-бутилоксикарбониламино-6-оксо-2-фенил-1,6-дигидропиримидин-1-ил)-N-{ (1R, 2S)-2-ацетилокси-3-оксо-6-фенил-1-фенилметил} гексилацетамид (2,69 г, 4,12 ммоль) растворяли в смеси 4 н. соляная кислота/1,4-диоксан (31 мл) и перемешивали при комнатной температуре в течение 3 ч. Реакционный раствор концентрировали при пониженном давлении, к полученному остатку добавляли гексан и собирали фильтрацией образовавшееся твердое вещество (2,39 г). Это твердое вещество использовали для последующей реакции без дальнейшей очистки. 3-Тетрагидрофуранкарбоновую кислоту (0,57 мл, 6,0 ммоль) растворяли в метиленхлориде (9 мл) и к раствору добавляли по каплям тионилхлорид (4,38 мл, 60,0 ммоль) при комнатной температуре в атмосфере аргона. После добавления смесь перемешивали в течение 3 ч при комнатной температуре, после чего реакционный раствор концентрировали при пониженном давлении. К полученному остатку добавляли метиленхлорид (10 мл), охлаждали в ледяной бане, добавляли последовательно предварительно полученное твердое вещество (2,39 г) и триэтиламин (3,12 мл, 22,4 ммоль) и перемешивали в течение ночи при комнатной температуре. Реакционный раствор разбавляли метиленхлоридом и промывали последовательно дистиллированной водой и 5% лимонной кислотой. Органический слой высушивали над безводным сульфатом натрия, затем осушающий агент удаляли фильтрацией, а фильтрат концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (хлороформ/метанол = 30/1), в итоге получали указанное в заглавии соединение (2,15 г, выход 86%).
1Н-ЯМР (CDCl3): 1,74-1,93 (2Н, m), 2,19 (3Н, s, перекрывается с 2Н), 2,35-2,60 (4Н, сложный спектр), 2,82 (2Н, dd, J=9,2, 13,6 Гц), 2,93-3,14 (2Н, сложный спектр), 3,78-4,05 (4Н, сложный спектр), 4,46 (2Н, s), 4,70-4,84 (1Н, m), 4,90 (1Н, d, J=1,5 Гц), 6,25 (1Н, d, J=9,4 Гц), 7,09-7,32 (11 Н, сложный спектр, перекрывается с пиком растворителя), 7,32-7,51 (5Н, сложный спектр), 8,13 (1Н, s).
(3) 2-{ 5-(3-Тетрагидрофуроил)амино-6-оксо-2-фенил-1,6-дигидропиримидин-1-ил} -N-{ (1Р,23)-2-гидрокси-3-оксо-6-фенил-1-фенилметил}гексилацетамид (соединение 33).
2-{5-(3-Тетрагидрофуроил)амино-6-оксо-2-фенил-1,6-дигидропиримидин-1-ил} -N-{(1R,2S)-2-ацетилокси-3-оксо-6-фенил-1-фенилметил}гексилацетамид (2,15 г, 3,49 ммоль) растворяли в смешанном растворителе: метанол (9 мл) и дистиллированная вода (1 мл), к нему добавляли карбонат калия (2,41 г, 17,5 ммоль) и перемешивали 1 день при комнатной температуре. Реакционный раствор концентрировали при пониженном давлении, к нему добавляли этилацетат, после чего промывали последовательно дистиллированной водой и насыщенным раствором хлористого натрия. Органический слой высушивали над безводным сульфатом натрия, затем осушающий агент удаляли фильтрацией, а фильтрат концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (хлороформ/метанол = 30/1), в итоге получали указанное в заглавии соединение (555,6 мг, выход 28%).
1Н-ЯМР (СDСl3): 1,86 (2Н, квинтет, J=7,5 Гц), 2,24 (1Н, m), 2,54-3,28 (7Н, сложный спектр), 3,85 (2Н, m), 3,99 (2Н, d, J=6,6 Гц), 4,45 (2Н, s), 5,30 (1Н, q, J=6,6 Гц), 6,40 (1Н, d, J=6,6 Гц), 6,95-7,08 (2Н, сложный спектр), 7,08-7,34 (8Н, сложный спектр), 7,46 (5H, s), 8,12 (1H, s), 9,08 (1H, s).
(4) 2-{5-(3-Тетрагидрофуроиламино-6-оксо-2-фенил-1,6-дигидропиримидин-1-ил}-N-(2,3-диоксо-6-фенил-1-фенилметил}гексилацетамид (соединение 81).
2-{5-(3-Тетрагидрофуроил)амино-6-оксо-2-фенил-1,6-дигидропиримидин-1-ил} -N-{(1R,2S)-2-гидрокси-3-oкco-6-фенил-1-фенилметил}гексилацетамид, полученный перед этим, подвергали той же процедуре, как в примере 1 (3), так что названный продукт получали реакцией окисления спирта, соответствующего формуле (II).
1Н-ЯМР (СDСl3): 1,91 (1Н, квинтет, J=7,5 Гц), 2,24 (1Н, m), 2,54-3,28 (7Н, сложный спектр), 3,85 (2Н, m), 3,99 (2Н, d, J=6,6 Гц), 4,45 (2Н, s), 5,30 (1Н, q, J=6,6 Гц), 6,40 (1Н, d, J=6,6 Гц), 6,95-7,08 (2Н, сложный спектр), 7,08-7,34 (8Н, сложный спектр), 7,46 (5H, s), 8,12 (1H, s), 9,08 (1H, s).
Пример 6
Синтез 2-трет-бутилоксикарбониламино-3-оксо-5-фенил-3,4-дигидропиразин-4-илуксусной кислоты как соединения формулы (V) проводили следующим образом.
(1) 1-Бензилоксикарбониламино-2,2-диметилокси-1-фенилэтан.
N-Бензилоксикарбонилфенилглицинал (1,38 г, 5,12 ммоль) растворяли в метаноле (2,6 мл), к раствору добавляли триметилортоформат (1,12 мл, 10,24 ммоль) и камфорсульфокислоту (59,5 мг, 0,256 ммоль) и перемешивали в течение ночи при комнатной температуре. Реакционный раствор концентрировали при пониженном давлении и очищали полученный остаток колоночной хроматографией на окиси алюминия (50 г окиси алюминия, гексан/этилацетат = 2/1), в результате получали названный продукт (1,21 г, выход 77%).
1Н-ЯМР (CDCl3): 3,35 (3Н, s), 3,41 (3Н, s), 4,40 (1Н, d, J=4,4 Гц), 4,80-4,96 (1Н, m), 5,07 (1Н, d, J=1,1 Гц), 5,53-5,74 (1Н, m); МС: m/z = 316 (М + 1).
(2) 2,2-Диметилокси-1 -фенилэтиламин-гидрохлорид.
1-Бензилкарбониламино-2,2-диметилокси-1-фенил-этан (1,21 г, 3,84 ммоль) растворяли в метаноле (38,4 мл), к нему добавляли смесь 4 н. соляная кислота/1,4-диоксан (0,96 мл, 3,84 ммоль) и палладий черный (121 мг) и проводили гидрогенолиз в течение ночи при комнатной температуре в атмосфере водорода. После удаления палладия черного фильтрацией фильтрат концентрировали при пониженном давлении и к полученному остатку добавляли метиленхлорид и диэтиловый эфир. Осажденное твердое вещество собирали фильтрацией, в результате получали указанное в заглавии вещество (760,3 мг, выход 91%).
1Н-ЯМР (CDCl3): 3,25 (3Н, s), 3,40 (3Н, s), 4,17-4,34 (1Н, m), 4,78 (1Н, d, J=6,4 Гц), 7,27-7,57 (5Н, m), 8,86 (2Н, ушир. s).
(3) N-{ (N-Трет-бутилоксикарбонил-2-этоксикарбонил)глицил} -2,2-диметилокси-1-фенилэтиламин.
(N-Трет-бутилоксикарбонил-2-этоксикарбонил)глицин (7,19 г, 29,1 ммоль) и 2,2-диметилокси-1-фенилэтиламин-гидрохлорид (6,33 г, 29,1 ммоль) растворяли в смешанном растворителе: диметилформамид (72 мл) и тетрагидрофуран (72 мл), к этому раствору добавляли 1-гидроксибензтриазол•1H2O (5,11 г, 37,8 ммоль), 1-(-диметиламинопропил)-3-этилкарбодиимид-гидрохлорид (7,25 г, 37,8 ммоль) и 4-метилморфолин (4,52 мл, 44,8 ммоль) в указанном порядке и смесь перемешивали в течение ночи при комнатной температуре. Реакционный раствор разбавляли этилацетатом и промывали последовательно дистиллированной водой и насыщенным раствором хлористого натрия. После высушивания органического слоя над безводным сульфатом натрия осушающий агент удаляли фильтрацией, а фильтрат концентрировали при пониженном давлении. К полученному остатку добавляли толуол, а затем проводили азеотропную дистилляцию. После этого полученный остаток очищали колоночной хроматографией на силикагеле (гексан/этилацетат = 1/1), в итоге получали указанное в заглавии соединение (10,6 г, выход 93%).
1Н-ЯМР (СDСl3): 1,20-1,37 (3Н, m), 1,43-1,48 (9Н, m), 3,34-3,43 (6Н, m), 4,06-4,35 (2Н, m), 4,43 (1Н, d, J=3,4 Гц), 4,81-4,93 (1Н, m), 5,03-5,14 (1Н, m), 5,68-5,82 (1Н, m), 7,24-7,38 (5Н, сложный спектр); МС: m/z = 411 (M + 1).
(4) 2-Этилоксикарбонил-3-гидрокси-5-фенилпиразин.
N-{ (N-трет-бутилоксикарбонил-2-этоксикарбонил)глицил}-2,2-диметилокси-1-фенилэтиламин (10,6 г, 25,7 ммоль) растворяли в трифторуксусной кислоте (100 мл) и перемешивали в течение ночи при комнатной температуре. Остаток, полученный концентрированием реакционного раствора при пониженном давлении, растворяли в ацетонитриле (130 мл) и снова перемешивали в течение ночи при комнатной температуре. Остаток, полученный после концентрирования реакционного раствора при пониженном давлении, очищали колоночной хроматографией на силикагеле (гексан/этилацетат/метанол = 10/10/1), в итоге получали указанное в заглавии соединение (1,93 г, выход 31%).
1Н-ЯМР (СDСl3): 1,51 (3Н, t, J=7,1 Гц), 4,58 (2Н, q, J=7,1 Гц), 7,48-7,58 (3Н, m), 8,08-8,19 (2Н, m), 8,78 (1Н, s); MC: m/z = 245 (M + 1).
(5) 4-Аллил-2-этоксикарбонил-3-оксо-5-фенил-3,4-дигидропиразин.
2-Этилоксикарбонил-3-гидрокси-5-фенилпиразин (214,4 мг, 0,88 ммоль) растворяли в диметилформамиде (2,1 мл), к раствору при охлаждении в ледяной бане добавляли гидрид натрия (60% раствор в масле, 42,1 г, 1,05 ммоль) и перемешивали в течение 30 мин. После добавления аллилбромида (0,11 мл, 1,32 ммоль) смесь перемешивали при комнатной температуре в течение 1 часа и затем при 80oС в течение 1 часа. Реакционному раствору давали остыть до комнатной температуры, после чего реакцию прекращали добавлением дистиллированной воды, и продукт экстрагировали дважды этилацетатом. Органический слой высушивали над безводным сульфатом натрия, осушающий агент удаляли фильтрацией, а фильтрат концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (гексан/этилацетат = 2/1), в итоге получали указанное в заглавии соединение (24 мг, выход 9,6%).
1Н-ЯМР (СDСl3): 1,44 (3Н, t, J=7,1 Гц), 4,46 (2Н, d, J=7,1 Гц), 4,49-4,56 (2Н, m), 4,88-5,01 (1Н, m), 5,15-5,24 (1Н, m), 5,76-5,96 (1Н, m), 7,35-7,61 (6Н, сложный спектр).
(6) 4-Аллил-2-трет-бутилоксикарбониламино-3-оксо-5-фенил-3,4-дигидропиразин.
4-Аллил-2-этилоксикарбониламино-3-оксо-5-фенил-3,4-дигидропиразин (1,09 г, 3,85 ммоль) растворяли в смешанном растворителе, состоящем из метанола (25 мл) и тетрагидрофурана (10 мл), к этому раствору добавляли при охлаждении во льду 1 н. водный раствор гидроокиси натрия (4,2 мл, 4,20 ммоль) и смесь перемешивали при комнатной температуре в течение 2 ч. Реакционный раствор нейтрализовали соляной кислотой и концентрировали при пониженном давлении. После добавления к полученному остатку дистиллированной воды смесь экстрагировали метиленхлоридом. Органический слой сушили над безводным сульфатом магния, высушивающий агент удаляли фильтрацией, а фильтрат концентрировали при пониженном давлении, в результате чего получали 1,02 г твердого вещества. Полученное твердое вещество (1,02 г) растворяли в трет-бутиловом спирте (10,2 мл), 1,4-диоксане (2,6 мл) и триэтиламине (1,11 мл), к раствору добавляли дифенилфосфорилазид (0,86 мл, 3,98 ммоль) при комнатной температуре в атмосфере аргона и перемешивали с нагреванием при 90oС в течение 8 ч. Реакционному раствору давали остыть до комнатной температуры, после чего к нему добавляли дистиллированную воду и экстрагировали продукт этилацетатом. Органический слой высушивали над безводным сульфатом натрия, затем осушающий агент удаляли фильтрацией, а фильтрат концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (гексан/этилацетат = 1/1), в итоге получали указанное в заглавии соединение (850 мг, выход 68% после 2 этапов).
1Н-ЯМР (CDСl3): 1,54 (9Н, s), 4,45-4,52 (2Н, m), 4,83-4,97 (1Н, m), 5,13-5,22 (1Н, m), 5,67-5,88 (1Н, m), 7,27 (1Н, m), 7,30-7,55 (5Н, сложный спектр), 8,32 (1Н, s); MC: m/z = 328 (M + 1).
(7) 2-Трет-бутилоксикарбониламино-3-оксо-5-фенил-4-(2,3-дигидрокси)пропил-3,4-дигидропиразин.
4-Аллил-2-трет-бутилоксикарбониламино-3-оксо-5-фенил-3,4-дигидропиразин (850 мг, 2,60 ммоль) растворяли в тетрагидрофуране (10,4 мл), к раствору добавляли 4-метилморфолин-N-оксид (1,22 мл, 5,19 ммоль) и 4% водный раствор тетроксида осмия (0,83 мл, 0,13 ммоль) и смесь перемешивали в течение ночи при комнатной температуре. Реакционный раствор разбавляли этилацетатом и после этого промывали последовательно насыщенным водным раствором тиосульфата натрия, дистиллированной водой и насыщенным раствором хлористого натрия. Органический слой высушивали над безводным сульфатом натрия, осушающий агент удаляли фильтрацией, а фильтрат концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (хлороформ/метанол = 50/1), в итоге получали указанное в заглавии соединение (750 мг, выход 80%).
1Н-ЯМР (СDСl3): 1,55 (9Н, s), 2,66 (1Н, dd, J=5,7, 7,7 Гц), 3,26-3,42 (1Н, m, перекрывается с 1Н), 3,68-3,85 (1Н, m), 4,06 (2Н, d, J=6,2 Гц), 7,14 (1Н, s), 7,29-7,53 (5Н, сложный спектр), 8,29 (1Н, s); MC: m/z = 362 (M + 1).
(8) 2-Трет-бутилоксикарбониламино-3-оксо-5-фенил-3,4-дигидропиразин-4-илуксусная кислота.
2-Трет-бутилоксикарбониламино-3-оксо-5-фенил-4-(2,3-дигидрокси)пропил-3,4-дигидропиразин (750 мг, 2,01 ммоль) растворяли в тетрагидрофуране (10 мл), к раствору добавляли водный раствор перйодата натрия (раствор 533 мг (2,49 ммоль) перйодата натрия в 6,7 мл дистиллированной воды) и смесь перемешивали при комнатной температуре в течение 4 ч. Тетрагидрофуран отгоняли при пониженном давлении, затем реакционный раствор разбавляли этилацетатом и после этого промывали последовательно дистиллированной водой и насыщенным раствором хлористого натрия. После этого органический слой высушивали над безводным сульфатом натрия, осушающий агент удаляли фильтрацией, а фильтрат концентрировали при пониженном давлении с получением бесцветного вспененного вещества (710,7 мг).
Полученное вещество (710 мг) растворяли в трет-бутаноле (10,8 мл), после чего последовательно добавляли 2-метил-2-бутан (1,01 мл, 9,50 ммоль), водный раствор двузамещенного фосфата натрия {раствор 306,3 мг (2,16 ммоль) двузамещенного фосфата натрия в 3 мл дистиллированной воды} и водный раствор хлорита натрия (раствор 683,1 мг (7,56 ммоль) хлорита натрия в 6,8 мл дистиллированной воды), и смесь перемешивали в течение ночи при комнатной температуре. Реакционный раствор разбавляли этилацетатом и затем трижды экстрагировали насыщенным водным раствором бикарбоната натрия. Водный слой подкисляли безводной лимонной кислотой и трижды экстрагировали этилацетатом. Органический слой сушили над безводным сульфатом натрия, затем осушающий агент удаляли фильтрацией, а фильтрат концентрировали при пониженном давлении с получением названного соединения (502,5 мг, выход 70% после двух этапов).
1Н-ЯМР (СDСl3): 1,53 (9Н, s), 4,53 (2Н, s), 7,15 (1Н, s), 7,30-7,54 (5Н, сложный спектр), 8,14-8,34 (1Н, m); МС: m/z = 346 (М + 1).
Примеры с 7 по 18
5-Трет-бугилоксикарбониламино-6-оксо-2-фенил-1,6-дигидро-1-пиримидинилуксусную кислоту как соединение формулы (V) и соединение формулы (III), где R3' - трет-бутилоксикарбонил, Z - метилен, a R0 и R2 - группы, определенные ниже, подвергали конденсации таким же способом, как описано в примере 1 (1) и (2), в результате чего были синтезированы соединения формулы (II), где R1 - фенил, R3 - трет-бутилоксикарбонил, Х - углерод, Y - азот, Z - метилен, R0 и R2 - группы, определенные ниже.
Соединения формулы (III) образуются в реакционной системе из их соответствующих оксазолидиновых производных.
Физические свойства целевых соединений формулы (II) следующие.
Пример 7: R0 - фенил, R2 - бутил (соединение 4):
1Н-ЯМР (СDСl3): 0,85 (3Н, t, J=7,1 Гц), 1,14-1,35 (2Н, m), 1,42-1,58 (2Н, m), 1,53 (9Н, s), 2,33 (1Н, dt, J=7,4, 17,4 Гц), 2,58 (1Н, dt, J=7,4, 17,4 Гц), 2,95 (2Н, d, J=8,0 Гц), 3,87 (1Н, d, J=3,6 Гц), 4,03 (1Н, dd, J= 1,1, 3,5 Гц), 4,31 (1Н, d, J=15,3 Гц), 4,47 (1Н, d, J=15,3 Гц), 4,70 (1Н, ddt, J= 1,4, 8,1, 8,4 Гц), 6,40 (1Н, d, J=9,5 Гц), 7,15-7,55 (1Н, сложный спектр), 8,72 (1Н, s).
Пример 8: R0 = R2 = бутил (соединение 5):
1Н-ЯМР (СDCl3): 1,53 (9Н, s), 2,98 (1Н, dd, J=9,5, 13,1 Гц), 3,08 (1Н, dd, J=6,0, 13,1 Гц), 3,95 (1Н, d, J=4,8 Гц), 4,32-4,89 (3Н, сложный спектр), 4,97 (1Н, d, J=3,7 Гц), 6,36 (1Н, d, J=9,2 Гц), 6,80-6,91 (1Н, m), 7,03-7,13 (1Н, m), 7,18-7,69 (14Н, сложный спектр), 7,98-8,07 (1Н, m), 8,65-8,77 (1Н, m).
Пример 9: R0 = фенил, R2 = 3-этоксикарбонилпропил (соединение 6):
1Н-ЯМР (СDCl3): 1,21 (3Н, t, J=7,1 Гц), 1,53 (9Н, s), 1,87 (2Н, квинтет, J=7,0 Гц), 2,28 (1Н, t, J=7,0 Гц), 2,29 (1Н, t, J=7,4 Гц), 2,40-2,49 (1Н, t, J= 7,4 Гц), 2,67-2,76 (1Н, t, J=7,1 Гц), 2,96 (2Н, d, J=7,8 Гц), 3,70-4,20 (1Н, ушир. s), 4,04 (1Н, ушир. s), 4,08 (2Н, q, J=7,1 Гц), 4,34 (1Н, d, J= 15,3 Гц), 4,44 (1Н, d, J=15,3 Гц), 4,60-4,76 (1Н, m), 6,42 (1Н, d, J=9,4 Гц), 6,87-7,07 (3Н, m), 7,19-7,33 (2Н, m), 7,39-7,50 (5Н, сложный спектр), 8,72 (1H, s).
Пример 10: R0 = 3-фторфенил, R2 = 3-этоксикарбонилпропил (соединение 9):
1Н-ЯМР (СDCl3): 1,21 (3Н, t, J=7,1 Гц), 1,53 (9Н, s), 1,87 (2Н, квинтет, J= 7,1 Гц), 2,28 (1Н, t, J=7,0 Гц), 2,29 (1Н, t, J=7,4 Гц), 2,49 (1Н, t, J= 7,4 Гц), 2,67 (1Н, t, J=7,0 Гц), 2,96 (2Н, d, J=7,8 Гц), 3,70-4,20 (1Н, ушир. s), 4,04 (1Н, ушир. s), 4,08 (2Н, q, J=7,1 Гц), 4,34 (1Н, d, J=15,3 Гц), 4,44 (1Н, d, J=15,3 Гц), 4,60-4,76 (1Н, m), 6,42 (1Н, d, J=9,4 Гц), 6,87-7,07 (3Н, m), 7,19-7,33 (2Н, m), 7,39-7,50 (2Н, сложный спектр), 8,72 (1Н, s); ИКС (КВr): 3700-2800, 1720, 1677, 1512, 1492, 1370, 1252, 1221, 1154, 1087 см-1.
Пример 11: R0 = фенил, R2 = 2-фенилэтил (соединение 3):
МС: m/z = 548 (M + 1).
Пример 12
Синтез 2-(5-трет-бутилоксикарбониламино-6-оксо-2-фенил-1,6-дигидропиримидин-1-ил)-N-{ 2-гидрокси-3-оксо-6-(2-оксо-1,2-дигидропиридин-1-ил)-1-фенилметил}гексилацетамида (соединение 12).
(1) (4R, 5S)-3-(N-трет-бутилоксикарбонил)-2,2-диметил-5-метоксикарбонил-4-фенилметилоксазолидин.
Метил-(2S, 3R)-3-трет-бутилоксикарбониламино-2-гидрокси-4-фенилбутират (43 г, 0,14 моль) суспендировали в 2,2-диметоксипропане (510 мл), к этому добавляли п-толуолсульфокислоту•1Н2O (2,6 г, 0,015 моль), затем смесь прогревали в атмосфере аргона, а реакционный раствор постепенно отгоняли. Через 6 ч, когда раствор был полностью отогнан, нагревание прекращали и давали содержимому остыть до комнатной температуры. Остаток растворяли в этилацетате и промывали последовательно насыщенным водным раствором бикарбоната натрия и насыщенным раствором хлористого натрия. Органический слой высушивали над безводным сульфатом натрия и концентрировали при пониженном давлении, затем полученный остаток очищали колоночной хроматографией на силикагеле (гексан/этилацетат = 9/1), в итоге получали указанное в заглавии соединение (43 г, выход 88%).
1Н-ЯМР (СDСl3): 1,28-1,80 (15Н, сложный спектр), 2,72-3,08 (1Н, m), 2,86 (1Н, ушир. s), 3,25 (2Н, ушир. d, J=6,3 Гц), 3,67 (3Н, s), 4,37 (1Н, d, J= 4,0 Гц), 4,50 (1Н, ушир. d, J=13,5 Гц), 7,10-7,40 (5Н, m).
(2) (4R, 5S)-3-(N-Трет-бутилоксикарбонил)-2,2-диметил-5-гидроксиметилоксазолидин.
(4R, 5S)-3-(N-Трет-бутилоксикарбонил)-2,2-диметил-5-метоксикарбонил-4-фенилметилоксазолидин (43 г, 0,12 моль) растворяли в тетрагидрофуране (610 мл), к этому добавляли при охлаждении на ледяной бане литий-алюминий-гидрид (7,0 г, 0,18 моль) и перемешивали в течение 30 мин. К этому добавляли по каплям дистиллированную воду (10 мл), 3 н. водный раствор гидроокиси натрия (10 мл) и дистиллированную воду (30 мл) в указанной последовательности, затем осажденное твердое вещество удаляли фильтрацией через целит и промывали метиленоксидом. Органический слой собирали, промывали дистиллированной водой и насыщенным раствором хлористого натрия, а затем высушивали над безводным сульфатом натрия. Органический слой концентрировали при пониженном давлении, полученный остаток очищали колоночной хроматографией на силикагеле (гексан/этилацетат = 4/1), в итоге получали указанное в заглавии соединение (35 г, выход 88%).
1Н-ЯМР (СDCl3): 1,21-1,73 (15Н, сложный спектр), 1,80 (1Н, t, J=6,3 Гц), 2,78 (1Н, ушир. s), 3,14-3,43 (2Н, сложный спектр), 3,33 (1Н, dd, J=3,2, 13,0 Гц), 3,83-4,08 (2Н, сложный спектр), 7,14-7,36 (5Н, m).
(3) (4R, 5S)-3-(N-Трет-бутилоксикарбонил)-2,2-диметил-5-формил-4-фенилметилоксазолидин.
Метиленхлорид (530 мл) и дистиллированную воду (53 мл) добавляли к смеси (4R,5S)-3-(N-трет-бутилоксикарбонил)-2,2-диметил-5-гидроксиметилоксазолидина (35 г, 0,11 моль), свободного радикала 2,2,6,6-тетраметил-1-пиперидинилокси (185 мг, 0,01 моль), бромида натрия (12 г, 0,12 моль) и кислого углекислого натрия (26 г, 0,31 моль) с образованием 2-фазной системы. После охлаждения реакционной системы во льду к ней добавляли по каплям при усиленном перемешивании 0,62 М водный раствор гидрохлорита натрия (200 мл, 0,12 моль). После этого перемешивали реакционный раствор в течение 10 мин и затем промывали последовательно 10% водным раствором кислого сернокислого калия, содержащим 0,6% водного раствора йодида калия, затем 10% водным раствором тиосульфата натрия и насыщенным раствором хлористого натрия. Органический слой сушили над безводным сульфатом натрия, затем концентрировали при пониженном давлении, и полученный остаток очищали колоночной хроматографией на силикагеле (гексан/этилацетат = 4/1), в итоге получали указанное в заглавии соединение (21 г, выход 62%).
1H-ЯМР (CDCl3): 1,10-1,80 (15Н, сложный спектр), 2,62-3,45 (2Н, m), 4,05-4,28 (1Н, m), 4,28-4,60 (1Н, ушир. d, J=4,1 Гц), 6,95-7,48 (5Н, m), 9,64 (1Н, s).
(4) (4R, 5S)-3-(N-Трет-бутилоксикарбонил)-5-(1-гидрокси-4-фенилметилоксибутил)-4-фенилметилоксазолидин.
(4R, 5S)-3-(N-Трет-бутилоксикарбонил)-2,2-диметил-5-формил-4-фенилметилоксазолидин (19 г, 0,6 моль) растворяли в тетрагидрофуране и охлаждали до -30oС, затем к этому раствору добавляли по каплям 0,63 М 3-фенилметилоксипропил-магний-бромид в тетрагидрофуране (140 мл, 0,8 моль). После добавления удаляли охлаждающую баню и перемешивали смесь при комнатной температуре в течение 2 ч. После этого к реакционному раствору добавляли водный раствор хлорида аммония, а твердый осадок удаляли фильтрацией через целит. После добавления к фильтрату этилацетата фильтрат промывали насыщенным раствором хлористого натрия. Органический слой сушили над безводным сульфатом натрия, затем концентрировали при пониженном давлении, а полученный остаток очищали колоночной хроматографией на силикагеле (гексан/этилацетат = 4/1), в итоге получали указанное в заглавии соединение (28 г, выход 90%). Это соединение представляет собой смесь стереоизомеров из-за различной конфигурации гидроксильной группы. Был определен спектр этой смеси. Ниже приводятся сигналы 25 только для основного изомера.
1H-ЯМР (CDCl3, основной изомер): 0,97-1,80 (17Н, сложный спектр), 2,51 (1Н, d, J=4,8 Гц), 2,60-3,00 (1Н, ушир. s), 3,15 (1Н, dd, J=3,0, 13,1 Гц), 3,23-3,56 (4Н, сложный спектр), 3,66-3,85 (1Н, m), 4,12-4,56 (1Н, m), 4,46 (2Н, s), 7,12-7,40 (10Н, сложный спектр); МС: m/z = 470 (М + 1).
(5) (4R, 5S)-5-(1-Трет-бутилдиметилсилилокси-4-фенилметилоксибутил)-3-(N-трет-бутилоксикарбонил)-2,2-диметил-4-фенилметилоксазолидин.
(4R, 5S)-3-(N-Трет-бутилоксикарбонил)-5-(1-гидрокси-4-фенилметилоксибутил)-4-фенилметилоксазолидин (28 г, 0,06 моль) и имидазол (10 г, 0,15 моль) растворяли в N, N-диметилформамиде (120 мл), к раствору добавляли при охлаждении во льду трет-бутилдиметилсилилхлорид (12 г, 0,08 моль), затем раствор перемешивали в течение ночи при комнатной температуре. К реакционному раствору добавляли диэтиловой эфир, после чего его промывали последовательно дистиллированной водой и насыщенным раствором хлористого натрия. Органический слой сушили над безводным сульфатом натрия и концентрировали при пониженном давлении, а полученный остаток очищали колоночной хроматографией на силикагеле (гексан/этилацетат = 9/1), в итоге получали указанное в заглавии соединение (26 г, выход 72%). Это соединение представляет собой смесь стереоизомеров из-за различной конфигурации трет-бутилдиметилсилилоксигруппы. Был определен спектр этой смеси. Ниже приводятся сигналы только для основного изомера.
1Н-ЯМР (СDСl3, основной изомер): 0,02 (6Н, s), 0,77 (9Н, s), 1,35-1,80 (19Н, сложный спектр), 2,88 (1Н, dd, J=9,4 и 12,8 Гц), 3,04 (1Н, dd, J=3,6 и 12,8 Гц), 3,45 (1Н, t, J=6,2 Гц), 3,63-3,76 (1Н, m), 3,76-3,94 (1Н, m), 4,11-4,22 (1Н, m), 4,52 (2Н, s), 6,16-7,40 (10Н, сложный спектр).
(6) (4R,5S)-5-(1-Трет-бутилдиметилсилилокси-4-гидроксибутил-3-(N-трет-бутилоксикарбонил)-2,2-диметил-4-фенилметилоксазолидин.
(4R, 5S)-5-(1-Трет-бутилдиметилсилилокси-4-фенилметилоксибутил)-3-(N-трет-бутилоксикарбонил)-2,2-диметил-4-фенилметилоксазолидин (32 г, 0,54 ммоль) растворяли в метаноле (270 мл), после этого к раствору добавляли палладий черный (1,6 г) и смесь перемешивали при комнатной температуре в течение 4 ч в атмосфере водорода. Палладий черный удаляли фильтрацией, затем фильтрат концентрировали при пониженном давлении и полученный остаток очищали колоночной хроматографией на силикагеле (гексан/этилацетат = 14/1), в итоге получали указанное в заглавии соединение (26 г, выход 98%). Это соединение представляет собой смесь стереоизомеров из-за различной конфигурации трет-бутилдиметилсилилоксигруппы. Был определен спектр этой смеси. Ниже приводятся сигналы только для основного изомера.
1Н-ЯМР (СDСl3, основной изомер): 0,02 (6Н, s), 0,76 (9Н, s), 1,38-1,85 (19Н, сложный спектр), 2,86 (1Н, dd, J=9,3 и 12,9 Гц), 3,04 (1Н, dd, J=3,9 и 12,9 Гц), 3,25-3,78 (3Н, сложный спектр), 3,85-4,00 (1Н, m), 4,08-4,21 (1Н, m), 7,15-7,34 (5Н, m).
(7) (4R, 5S)-5-{ 4-Бром-1-(1-трет-бутилдиметилсилилокси)бутил} -3-(N-трет-бутилоксикарбонил)-2,2-диметил-4-фенилметилоксазолидин.
(4R, 5S)-5-(1-Трет-бутилдиметилсилилокси-4-гидроксибутил-3-(N-трет-бутилоксикарбонил)-2,2-диметил-4-фенилметилоксазолидин (26 г, 0,052 моль) растворяли в толуоле (50 мл), после добавления к раствору при охлаждении во льду трифенилфосфина (14 г, 0,052 моль) и N-бромсукцинимида (9,3 г, 0,052 моль), температуру повышали и смесь перемешивали при комнатной температуре в течение 2 ч. Твердый осадок удаляли фильтрацией через целит, а фильтрат промывали последовательно 5% водным раствором тиосульфата натрия, 1 н. водным раствором гидроокиси натрия и насыщенным раствором хлористого натрия. Органический слой сушили над безводным сульфатом натрия, затем концентрировали при пониженном давлении, к полученному остатку добавляли гексан, осажденные твердые вещества удаляли фильтрацией, а фильтрат снова концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (гексан/этилацетат = 14/1), в итоге получали указанное в заглавии соединение (24 г, выход 82%). Это соединение представляет собой смесь стереоизомеров из-за различной конфигурации трет-бутилдиметилсилилоксигруппы. Был определен спектр этой смеси. Ниже приводятся сигналы только для основного изомера.
1Н-ЯМР (СDСl3, основной изомер): 0,02 (6Н, s), 0,76 (9Н, s), 1,40-2,00 (19Н, сложный спектр), 2,85 (1Н, dd, J=9,1 и 13,0 Гц), 3,05 (1Н, dd, J=3,9 и 13,0 Гц), 3,38 (2Н, m), 3,78 (1Н, ушир. D, J=8,5 Гц), 4,07-4,21 (1Н, m), 7,11-7,41 (5Н, m); MC: m/z = 556 (M + 1).
(8) (4R, 5S)-5-{1-Трет-бутилдиметилсилилокси-4-(2-оксо-1,2-дигидропиридин-1-ил)бутил} -3-(N-трет-бутилоксикарбонил)-2,2-диметил-4-фенилметилоксазолидин.
Гидрид натрия (0,72 г, 0,018 моль) суспендировали в N,N-диметилформамиде (45 мл) и к этому раствору добавляли по каплям с охлаждением во льду раствор 2-гидроксипиридина (1,7 г, 0,018 моль) в N,N-диметилформамиде (15 мл). После этого смесь перемешивали при комнатной температуре в течение 1 часа и реакционную систему снова охлаждали во льду. К этому раствору по каплям добавляли раствор (4R,5S)-5-{4-бром-1-(1-трет-бутилдиметилсилилокси)бутил}-3-(N-трет-бутилоксикарбонил)-2,2-диметил-4-фенилметилоксазолидина (5 г, 9 ммоль) в N,N-диметилформамиде (30 мл), и смесь перемешивали в течение ночи при комнатной температуре. Реакционный раствор разбавляли этилацетатом и промывали последовательно дистиллированной водой, 10% водным раствором лимонной кислоты и насыщенным раствором хлористого натрия. Органический слой сушили над безводным сульфатом натрия, затем концентрировали при пониженном давлении, полученный остаток очищали колоночной хроматографией на силикагеле (гексан/этилацетат = 7/1), в итоге получали указанное в заглавии соединение (3,7 г, выход 71%).
1Н-ЯМР (CDCl3): 0,04 (6Н, s), 0,71 (9Н, ушир. s), 1,34-1,89 (19Н, сложный спектр), 2,73-2,92 (1Н, m), 3,01 (1Н, dd, J=3,6 и 12,9 Гц), 3,55-3,97 (3Н, сложный спектр), 4,01-4,16 (1Н, m), 6,13 (1Н, dt, J=1,3 и 6,7 Гц), 6,50-6,59 (1Н, m), 7,10-7,35 (7Н, сложный спектр); ИКС (КВr): 2930, 1690, 1660, 1590, 1535, 1455, 1380, 1250, 1170, 1080, 1030 см-1.
В качестве сопутствующего продукта был получен (4R,5S)-5-{1-трет-бутилдиметилсилилокси-4-(2-пиридилокси)бутил} -3-(N-трет-бутилоксикарбонил)-2,2-диметил-4-фенилметилоксазолидин (1,3 г, выход 24%).
1Н-ЯМР (СDCl3): 0,00 (6Н, s, перекрывание с пиком внутреннего стандарта), 0,64-0,97 (9Н, m), 1,38-1,90 (19Н, сложный спектр), 2,77-3,16 (2Н, m), 3,66-4,34 (5Н, сложный спектр), 6,70 (1Н, d, J=8,4 Гц), 6,83 (1Н, ddd, J= 1,9, 5,1 и 8,4 Гц), 7,09-7,34 (5Н, m), 7,54 (1Н, ddd, J=0,9, 7,0 и 8,4 Гц), 8,13 (1Н, ddd, J=0,9, 1,9 и 5,1 Гц).
(9) (4R, 5S)-5-{ 1-Оксо-4-(2-оксо-1,2-дигидропиридин-1-ил)бутил}-3-(N-трет-бутилоксикарбонил)-2,2-диметил-4-фенилметилоксазолидин (промежуточное соединение 12).
(4R, 5S)-5-{ 1-Трет-бутилдиметилсилилокси-4-(2-оксо-1,2-дигидропиридин-1-ил)бутил}-3-(N-трет-бутилоксикарбонил)-2,2-диметил-4-фенилметилоксазолидин (3,8 г, 6,6 ммоль) растворяли при охлаждении во льду в 1,0 М растворе тетрабутиламмонийфторида в тетрагидрофуране (10 мл) и перемешивали в течение 4 ч. Реакционный раствор разбавляли этилацетатом и промывали последовательно 10% водным раствором лимонной кислоты и насыщенным раствором хлористого натрия. Органический слой сушили над безводным сульфатом натрия, затем концентрировали при пониженном давлении, а полученный остаток очищали колоночной хроматографией на силикагеле с получением сырого продукта.
К метиленхлориду (2,4 мл) добавляли в атмосфере аргона оксалилхлорид (1,5 мл, 17 ммоль) и охлаждали до -60oС. К этому раствору добавляли по каплям смесь диметилсульфоксида (2,4 мл, 34 ммоль) и метиленхлорида (2,4 мл). После этого смесь перемешивали в течение 15 мин и затем к ней по каплям добавляли раствор указанного выше сырого продукта в метиленхлориде (20 мл). Затем смесь перемешивали в течение 1 часа, температуру реакции повышали до -40oС и к смеси добавляли триэтиламин (9,5 мл, 68 ммоль). Реакционный раствор разбавляли метиленхлоридом и промывали дистиллированной водой. Органический слой сушили над безводным сульфатом натрия, затем концентрировали при пониженном давлении, а полученный остаток очищали колоночной хроматографией на силикагеле (хлороформ/метанол = 30/1), в результате получали указанное в заглавии соединение (2,6 г, выход 89%).
1Н-ЯМР (СDСl3): 1,17-1,65 (15Н, сложный спектр), 1,92 (2Н, dd, J=2,2 и 7,3 Гц), 2,25-2,71 (2Н, m), 2,73-3,12 (1Н, m), 3,21 (1Н, dd, J=3,0 и 13,3 Гц), 3,85 (2Н, dt, J=2,2 и 7,3 Гц), 4,21 (1Н, ушир. s), 4,30-4,50 (1Н, m), 6,13 (1Н, dt, J=1,3 и 6,7 Гц), 6,52 (1Н, d, J=9,2 Гц), 7,13-7,45 (7Н, сложный спектр).
(10) 2-(5-Трет-бутилоксикарбониламино-6-оксо-2-фенил-1,6-дигидропиримидин-1-ил)-N-{ 2-rидpoкcи-3-oкco-6-(2-oкco-1,2-дигидpoпиpидин-1-ил)-1-фенилметил}гексилацетамид (соединение 12).
(4R,5S)-5-{1-Оксо-4-(2-оксо-1,2-дигидропиридин-1-ил)бутил}-3-(N-трет-бутилоксикарбонил)-2,2-диметил-4-фенилметилоксазолидин (2,6 г, 5,8 ммоль) растворяли в метаноле (28 мл), к этому раствору добавляли п-толуолсульфокислоту•1H2О (2,4 г, 13 ммоль), смесь прогревали с обратным холодильником в течение 1,5 ч. Реакционный раствор концентрировали при пониженном давлении, полученный остаток растворяли в смеси N,N-диметилформамида (8 мл) и тетрагидрофурана (8 мл), к раствору добавляли последовательно 5-трет-бутилоксикарбониламино-6-оксо-2-фенил-1,6-дигидро-1-пиримидинилуксусную кислоту (2,4 г, 7,0 ммоль), 1-гидроксибензтриазол•1Н2O (1,3 г, 8,2 ммоль), 1-(3-диметиламинопропил)-3-этилкарбодиимид-гидрохлорид (1,6 г, 8,3 ммоль) и N-метилморфолин (1,5 мл, 14 ммоль), затем температуру повышали до комнатной и смесь перемешивали в течение ночи. Реакционный раствор разбавляли этилацетатом и промывали последовательно дистиллированной водой, насыщенным водным раствором бикарбоната натрия, 10% водным раствором лимонной кислоты и насыщенным раствором хлористого натрия. Органический слой сушили над безводным сульфатом натрия, затем концентрировали при пониженном давлении и к полученному остатку добавляли диэтиловый эфир, чтобы осадить твердые вещества. Осажденные твердые вещества собирали фильтрацией и перекристаллизовывали из смеси растворителей хлороформ/метанол/диэтиловый эфир, в итоге получали указанное в заглавии соединение (2,3 г, выход 56%).
1Н-ЯМР (СDСl3): 1,60 (9Н, s), 1,99 (2Н, квинтет, J=7,0 Гц), 2,43 (1Н, dt, J=7,0 18,1 Гц), 2,74 (1Н, dt, J=7,0 и 18,1 Гц), 2,97 (1Н, d, J=7,8 Гц), 3,88 (1Н, q, J=7,0 Гц), 4,03-4,18 (2Н, сложный спектр), 4,41 (2Н, d, J=3,3 Гц), 4,62 (1Н, q, J=7,8 Гц), 6,16 (1Н, dt, J=1,4 и 6,7 Гц), 6,45-6,54 (1Н, m), 6,70 (1Н, d, J=9,5), 7,13-7,53 (12Н), 8,68 (1Н, s).
Пример 13
Синтез 2-(5-трет-бутилоксикарбониламино-6-оксо-2-фенил-1,6-дигидропиримидин-1-ил)-N-{ 2-гидрокси-3-оксо-1-фенилметил-6-(2-пиридилокси)} гексилацетамида (соединение 13).
(1) (4R, 5S)-5-{ 1-Оксо-4-(2-пиридилокси)бутил}-3-(N-трет-бутилоксикарбонил)-2,2-диметил-4-фенилметилоксазолидин (промежуточное соединение 13).
(4R, 5S)-5-{ 1-Трет-бутилдиметилсилилокси-4-(2-пиридилокси)бутил}-3-(N-трет-бутилоксикарбонил)-2,2-диметил-4-фенилметилоксазолидин (1,3 г, 2,2 ммоль), полученный как побочный продукт в примере 12 (8), растворяли в 1,0 М растворе тетрабутиламмонийфторида в тетрагидрофуране (6,3 мл, 6,3 ммоль) при охлаждении во льду и перемешивали в течение ночи при комнатной температуре. Реакционный раствор разбавляли этилацетатом и промывали последовательно 10% водным раствором лимонной кислоты, насыщенным водным раствором бикарбоната натрия и насыщенным раствором хлористого натрия. Органический слой сушили над безводным сульфатом натрия, затем концентрировали при пониженном давлении, а полученный остаток очищали колоночной хроматографией на силикагеле (гексан/этилацетат = от 3/1 до 2/1), получая сырой продукт. К метиленхлориду (10 мл) в атмосфере аргона добавляли оксалилхлорид (0,38 мл, 4,4 ммоль) и охлаждали до -60oС. К этому раствору добавляли по каплям смесь диметилсульфоксида (0,62 мл, 8,7 ммоль) и метиленхлорида (0,62 мл). После этого реакционный раствор перемешивали в течение 15 мин, затем к нему добавляли по каплям вышеуказанный сырой продукт в метиленхлориде (20 мл). Затем смесь перемешивали в течение 15 мин, температуру реакции повышали до -40oС и к смеси добавляли триэтиламин (9,5 мл, 68 ммоль). Реакционный раствор разбавляли метиленхлоридом и промывали дистиллированной водой. Органический слой сушили над безводным сульфатом натрия, затем концентрировали при пониженном давлении, а полученный остаток очищали колоночной хроматографией на силикагеле (хлороформ/этилацетат = от 1/1 до 1/1,5), в итоге получали указанное в заглавии соединение (874 мг, выход 88%).
1Н-ЯМР (СDСl3): 1,09-1,80 (15Н, сложный спектр), 1,88-2,09 (2Н, m), 2,38-3,34 (4Н, сложный спектр), 4,14-4,34 (3Н, сложный спектр), 4,34-4,57 (1Н, m), 6,53-6,72 (1Н, m), 6,77-6,93 (1Н, m), 7,11-7,38 (5Н, m), 7,45-7,62 (1Н, m), 8,04-8,16 (1Н, m).
(2) 2-(5-Трет-бутилоксикарбониламино-6-оксо-2-фенил-1,6-дигидропиримидин-1-ил)-N-{2-гидрокси-3-оксо-1-фенилметил-6-(2-пиридилокси)}гексилацетамид (соединение 13).
(4R, 5S)-5-{ 1-Оксо-4-(2-пиридилокси)бутил} -3-(N-трет-бутилоксикарбонил)-2,2-диметил-4-фенилметилоксазолидин (867 мг, 1,9 ммоль) растворяли в метаноле (9 мл), к этому раствору добавляли п-толуолсульфокислоту•1H2О (762 мг, 4,2 ммоль) и смесь нагревали с обратным холодильником в течение 1,5 ч. Реакционный раствор концентрировали при пониженном давлении, полученный остаток растворяли в смеси N,N-диметилформамида (2,5 мл) и тетрагидрофурана (2,5 мл), к раствору при охлаждении во льду последовательно добавляли 5-трет-бутилоксикарбониламино-6-оксо-2-фенил-1,6-дигидро-1-пиримидинилуксусную кислоту (763 мг, 2,2 ммоль), 1-гидроксибензтриазол•1H2O (402 мг, 2,6 ммоль), 1-(3-диметиламинопропил)-3-этилкарбодиимид-гидрохлорид (503 мг, 2,6 ммоль) и N-метилморфолин (0,49 мл, 4,4 ммоль), затем температуру повышали до комнатной и смесь перемешивали в течение ночи. Реакционный раствор разбавляли этилацетатом и промывали последовательно дистиллированной водой, насыщенным водным раствором бикарбоната натрия, 10% водным раствором лимонной кислоты и насыщенным раствором хлористого натрия. Органический слой сушили над безводным сульфатом натрия, затем концентрировали при пониженном давлении, а полученный остаток очищали колоночной хроматографией на силикагеле (хлороформ/метанол = от 40/1 до 30/1). Твердое вещество осаждали добавлением к этому очищенному материалу диэтилового эфира и гексана. Твердый осадок собирали фильтрацией, в результате получали указанное в заглавии соединение (2,3 г, выход 56%).
1Н-ЯМР (CDCl3): 1,52 (9Н, s), 1,91-2,16 (2Н, m), 2,54 (1Н, dt, J=7,2 и 17,8 Гц), 2,79 (1Н, dt, J=7,2 и 17,8 Гц), 2,97 (2Н, d, J=8,0 Гц), 3,90 (1Н, d, J=3,4 Гц), 4,04-4,12 (1Н, m), 4,13-4,37 (3Н, сложный спектр) 4,48 (1Н, d, J=15,3 Гц), 6,40 (1Н, d, J=9,4 Гц), 6,64 (1Н, dt, J=0,9 и 8,4 Гц), 6,82 (1Н, ddd, J= 0,9, 5,1 и 7,1 Гц), 7,13-7,59 (12Н, сложный спектр), 8,07 (1Н, ddd, J=0,9, 2,2 и 5,1 Гц), 8,72 (1Н, s).
(3) В этом примере было подтверждено, что при термической обработке смеси (4R,5S)-5-{1-оксо-4-(2-пиридилокси)бутил}-3-(N-трет-бутилоксикарбонил)-2,2-диметил-4-фенилметилоксазолидина и п-толуолсульфокислоты в метаноле образуются 2 продукта. Поэтому после окончания термической обработки часть реакционного раствора обычным способом подвергали трет-бутилоксикарбонилированию. В результате было определено, что эти 2 продукта являются следующими соединениями:
(2S, 3R)-2-трет-бутилоксикарбониламино-3-гидрокси-4-оксо-1-фенил-7-(2-пиридилокси)гептан
1H-ЯМР (CDCl3): 1,38 (9Н, s), 1,79-2,12 (2Н, сложный спектр), 2,38-2,81 (4Н, сложный спектр), 4,10 (1Н, ушир. s), 4,18-4,39 (4Н, сложный спектр), 5,03 (1Н, d, J=8,4 Гц), 6,69 (1Н, dt, J=0,8 и 8,4 Гц), 6,85 (1Н, m) 7,10-7,29 (5Н, сложный спектр), 7,55 (1Н, ddd, J=2,1, 7,2 и 8,4 Гц), 8,12 (1H,m);
(2S, 3S)-2-трет-бутилоксикарбониламино-3-гидрокси-4-оксо-1-фенил-7-(2-пиридилокси)гептан
1Н-ЯМР (CDCl3): 1,35 (9Н, s), 1,96-2,12 (2Н, сложный спектр), 2,44-2,67 (1Н, m), 2,73-2,98 (3Н, сложный спектр), 3,83 (1Н, ушир. d), 4,03 (1Н, ушир. s), 4,19-4,43 (3Н, сложный спектр), 4,76 (1Н, d, J=9,9 Гц), 6,65 (1Н, ушир. d, J= 8,3 Гц), 6,83 (1Н, m), 7,24-7,53 (5Н, сложный спектр), 7,53 (1Н, ddd, J=2,0, 7,1 и 8,7 Гц), 8,09 (1Н, m).
Пример 14: R0 = 3-метилфенил, R2 = метил (соединение 17);
1Н-ЯМР (CDCl3): 1,53 (9Н, s), 2,20 (3Н, s), 2,32 (3Н, s), 2,92 (2Н, d, J= 8,0 Гц), 3,82 (1Н, d, J=3,5 Гц), 4,05 (1Н, dd, J=1,3 и 3,5 Гц), 4,31 (1Н, d, J= 15,4 Гц), 4,49 (1Н, d, J=15,4 Гц), 4,65-4,81 (1Н, m), 6,29 (1Н, d, J= 9,5 Гц), 7,01-7,12 (2Н, сложный спектр), 7,16 (1Н, d, J=7,3 Гц), 7,25-7,32 (1Н, перекрывается с пиком растворителя), 7,36-7,50 (6Н, сложный спектр), 8,73 (1Н, s).
Пример 15: R0 = 3-хлорфенил, R2 = метил (соединение 18);
1H-ЯМР (CDCl3): 1,53 (9Н, s), 2,13 (3Н, s), 2,57 (1Н, dd, J=6,1 и 14,4 Гц), 2,71 (1Н, dd, J=8,6 и 14,4 Гц), 4,13 (1Н, d, J=4,5 Гц), 4,31-4,37 (1Н, m), 4,47 (2Н, dd, J=2,3 и 15,3 Гц), 4,63-4,68 (1Н, m), 6,79 (1Н, d, J=8,8 Гц), 6,94-7,00 (1Н, m), 7,12-7,50 (9Н, сложный спектр, перекрывается с пиком растворителя), 7,43 (1Н, s).
Пример 16: R0 = 4-фторфенил, R2 = метил (соединение 15);
1Н-ЯМР (CDCl3): 1,53 (9Н, s), 2,19 (3Н, s), 2,93 (2Н, d, J=8,0 Гц), 3,85 (1Н, ушир. s), 4,02 (1Н, d, J=1,2 Гц), 4,33 (1Н, d, J=15,4 Гц), 4,46 (1Н, d, J= 15,4 Гц), 4,62-4,80 (1Н, m), 6,26 (1Н, d, J=9,5 Гц), 6,93-7,06 (2Н, m), 7,20-7,32 (5Н, сложный спектр), 7,39-7,48 (5Н, сложный спектр), 8,71 (1Н, s); MC: m/z = 539 (M + 1).
Пример 17: R0 = 4-хлорфенил, R2 = метил (соединение 16);
1Н-ЯМР (СDСl3): 1,52 (9Н, s), 2,19 (3Н, s), 2,93 (2Н, d, J=7,8 Гц), 3,87 (1Н, ушир. s), 4,02 (1Н, d, J=15,4 Гц), 4,46 (1Н, d, J=15,4 Гц), 4,64-4,79 (1Н, m), 6,29 (1Н, d, J=9,4 Гц), 7,17-7,32 (5Н, сложный спектр), 7,39-7,56 (5Н, сложный спектр), 8,72 (1Н, s); MC: m/z = 556 (М + 1).
Пример 18: R0 = 3-фторфенил, R2 = {4-(4-метилпиперазин-1-ил)-4-оксо} пропил (соединение 10);
1Н-ЯМР (СDСl3): 1,53 (9Н, s), 1,81-1,97 (3Н, сложный спектр), 2,26-2,80 (11Н, сложный спектр), 2,95 (2Н, d, J=7,6 Гц), 3,41 (2Н, ушир. dd), 3,57 (2Н, ушир. dd), 4,08 (1Н, ушир. d), 4,35 (1Н, d, J=15,4 Гц), 4,45 (1Н, d, J= 15,4 Гц), 4,65 (1Н, m), 6,59 (1Н, ушир. d), 6,87-7,51 (3Н, сложный спектр), 8,72 (1Н, s).
Пример 19: R0 = 2-фторфенил, R2 = метил (соединение 20);
1Н-ЯМР (СDСl3): 1,53 (9Н, s), 2,25 (3Н, s), 2,53 (1Н, dd, J=4,7 и 14,3 Гц), 3,20 (1 H, m), 3,93 (1Н, dd, J=4,6 и 6,3 Гц), 4,10-4,58 (3Н, сложный спектр), 4,70-4,90 (1Н, m), 6,47 (0,5Н, d, J=9,5 Гц), 6,75 (0,5Н, d, J=7,9 Гц), 6,97-7,43 (9Н, сложный спектр).
Пример 20: R0 = 3-фтор-4-гидроксифенил, R2 = метил (соединение 19);
1Н-ЯМР (СDСl3): 1,53 (9Н, m), 2,20 (3Н, s), 2,86 (2Н, d, J=7,8 Гц), 3,93 (1Н, ушир. s), 4,05 (1Н, ушир. s), 4,31 (1Н, d, J=15,4 Гц), 4,41 (1Н, d, J= 15,2 Гц), 4,62-4,76 (1Н, m), 6,45-7,00 (5Н, сложный спектр), 7,38-7,50 (6Н, сложный спектр), 8,68 (1Н, ушир. s); МС: m/z = 555 (M + 1).
Пример 21: R0 = фенил, R2 = метоксигруппа (соединение 14);
2-Трет-бутилоксикарбониламино-3-оксо-5-фенил-3,4-дигидропиразин-4-илуксусная кислота как соединение формулы (V) и соединение формулы (III), где R3' - аминогруппа, Z - метилен, R0 - фенильная группа, a R2 - метоксигруппа, подвергали конденсации по способу, описанному в примере 1 - п. (1) и п. (2), в итоге были синтезированы соединения формулы (II), где R1 - фенил, R3 -трет-бутилоксикарбонил, Х - азот, Y - углерод, Z - метилен, а R0 и R2 - группы, определенные ниже. Соединения формулы (III) образуются в реакционной системе из их соответствующих оксазолидиновых производных.
Физические свойства целевых соединений формулы (II) следующие:
R0 = фенил, R2 = метоксигруппа (соединение 14);
1Н-ЯМР (CDCl3): 1,54 (9Н, s), 2,92 (2Н, d, J=8,1 Гц), 3,34 (1Н, d, J=4,5 Гц), 3,72 (3Н, s), 4,07-4,14 (1Н, m), 4,26 (1Н, d, J=15,1 Гц), 4,39 (1Н, d, J= 15,1 Гц), 4,53-4,68 (1Н, m), 6,52 (1Н, d, J=9,2 Гц), 7,13 (1Н, s), 7,14-7,53 (11Н, сложный спектр), 8,23 (1Н, s); МС: m/z + 537(M + 1).
Примеры с 22 по 34
Такой же метод, как в примере 1 (3), был применен для реакции окисления спирта формулы (II), чтобы получить соединения формулы (I), где R1 - фенил, R3 - трет-бутилоксикарбонил, Х - углерод, Y - азот, Z - метилен, а R0 и R2 - группы, представленные ниже. Физические свойства соединений формулы (I) следующие.
Пример 22 (1): R0 = фенил, R2 = 3-фенилпропил (соединение 39);
1Н-ЯМР (СDСl3): 1,53 (9Н, s), 1,83-2,00 (2Н, m), 2,59-2,82 (4Н, сложный спектр), 2,91-3,02 (1Н, dd, J=7,8 и 14,1 Гц), 4,47 (2Н, ушир. d), 5,22-5,33 (1Н, m), 6,47 (1Н, ушир. d, J=6,6 Гц), 7,00-7,50 (16Н, сложный спектр, перекрывание с пиком растворителя), 8,72 (1H, s).
Пример 22 (2): R0 = фенил, R2 = 2-фенилэтил (соединение 41);
1Н-ЯМР (СDСl3): 1,53 (9Н, s), 2,85-3,20 (4Н, сложный спектр), 4,47 (2Н, ушир. d), 5,27 (1Н, m), 6,47 (1Н, ушир. d, J=6,2 Гц), 6,95-7,50 (16Н, сложный спектр), 8,72 (1Н, s).
Пример 23: R0 = фенил, R2 = бутил (соединение 43);
1Н-ЯМР (СDСl3): 0,92 (3Н, t, J=7,1 Гц), 1,22-1,43 (2Н, m), 1,47-1,65 (2Н, m), 1,54 (9Н, s), 2,61-2,83 (2Н, m), 2,99 (1Н, dd, J=7,8 и 14,0 Гц), 3,21 (1Н, dd, J=5,3 и 14,1 Гц), 4,48 (2Н, d, J=1,3 Гц), 5,21-5,34 (1Н, m), 6,50 (1Н, d, J=6,5 Гц), 7,01-7,54 (11Н, сложный спектр) 8,71 (1Н, s); MC: m/z = 561 (M + 1).
Пример 24: R0 = R2 =фенил (соединение 45);
1Н-ЯМР (СDCl3): 1,55 (9Н, s), 3,16 (1Н, dd, J=5,1 и 14,2 Гц), 4,42 (2Н, s), 5,13 (1Н, ddd, J=5,1, 6,4 и 8,7 Гц), 6,72 (1Н, d, J=6,4 Гц), 7,00-7,70 (14Н, сложный спектр), 7,93-8,03 (2Н, m), 8,67 (1Н, s); MC: m/z = 581 (M + 1).
Пример 25: R0 = фенил, R2 = 3-карбоксипропил (соединение 47);
1Н-ЯМР (СDСl3): 1,34 (1,5Н, s), 1,36 (1,5Н, s), 1,49 (3Н, s), 1,51 (3Н, s), 1,60-2,00 (2Н, m), 2,24-3,24 (6Н, сложный спектр), 4,10-4,29 (1Н, m), 4,38-4,68 (2Н, сложный спектр), 6,80-7,56 (10Н, сложный спектр), 8,43-8,63 (1Н, m); MC: m/z = 589 (M - Н).
Пример 26: R0 = 3-фторфенил, R2 = 3-этоксикарбонилпропил (соединение 53);
1Н-ЯМР (СDСl3): 1,25 (3Н, t, J=7,1 Гц), 1,54 (9Н, s), 1,92 (2Н, квинтет, J= 7,1 Гц), 2,34 (2Н, t, J=7,1 Гц), 2,81 (1Н, t, J=7,1 Гц), 2,82 (1Н, t, J= 7,3 Гц), 2,97 (1Н, dd, J=9,1 и 14,0 Гц), 3,22 (1Н, dd, J=5,3 и 14,1 Гц), 4,12 (2Н, q, J=7,2 Гц), 4,49 (2Н, s), 5,16-5,28 (1Н, m), 6,62 (1Н, d, J=6,2 Гц), 6,78-6,99 (3Н, m), 7,16-7,29 (2Н, m), 7,43-7,50 (5Н, m), 8,71 (1Н, s); ИКС (KBr): 3410, 2990, 1727, 1655, 1510, 1490, 1369, 1250, 1152 см-1. МС: m/z = 581 (M + Н - 56).
Пример 27: 2-(5-Трет-бутилоксикарбониламино-6-оксо-2-фенил-1,6-дигидропиримидин-1-ил)-N-{ 2,3-диoкco-6-(2-oкco-1,2-диrидpoпиpидин-1-ил)-1-фeнилмeтил}гeкcилaцeтaмид (соединение 72).
2-(5-Трет-бутилоксикарбониламино-6-оксо-2-фенил-1,6-дигидропиримидин-1-ил)-N-{ 2-гидpoкcи-3-oкco-6-(2-oкco-1,2-дигидpoпиpидин-1-ил)-1-фенилметил} гексилацетамид (115 мг, 0,18 ммоль) растворяли в диметилсульфоксиде (2 мл) в атмосфере аргона, к этому раствору добавляли 1-(3-диметиламинопропил)-3-этилкарбодиимид-гидрохлорид (103 мг, 0,54 ммоль) и трифторацетат пиридиния (17 мг, 0,1 ммоль) и смесь перемешивали в течение 3,5 ч. Реакционный раствор разбавляли этилацетатом и промывали последовательно дистиллированной водой и насыщенным раствором хлористого натрия. Органический слой сушили над безводным сульфатом натрия, затем концентрировали при пониженном давлении, а полученный остаток очищали колоночной хроматографией на силикагеле (хлороформ/метанол = 30/1), после этого добавляли к очищенному остатку гексан для осаждения твердых веществ. Твердый осадок собирали фильтрацией, в результате получали названный продукт (96 мг, выход 83%).
1Н-ЯМР (СDСl3): 1,60 (9Н, s), 1,99 (2Н, квинтет, J=7,0 Гц), 2,43 (1Н, dt, J= 7,0 и 18,1 Гц), 2,74 (1Н, dt, J=7,0 и 18,1 Гц), 2,97 (1Н, d, J=7,8 Гц), 3,88 (1Н, q, J=7,0 Гц), 4,03-4,18 (2Н, сложный спектр), 4,41 (2Н, q, J= 3,3 Гц), 4,62 (1Н, q, J=7,8 Гц), 6,16 (1Н, dt, J=1,4 и 6,7 Гц), 6,45-6,54 (1Н, m), 6,70 (1Н, d, J=9,5 Гц), 7,13-7,53 (12Н, сложный спектр), 8,68 (1H, s).
Пример 28: 2-(5-Трет-бутилоксикарбониламино-6-оксо-2-фенил-1,6-дигидропиримидин-1-ил)-N-{ 2,3-диоксо-6-(2-пиридилокси)-1-фенилметил} гексилацетамид (соединение 74).
2-(5-Трет-бутилоксикарбониламино-6-оксо-2-фенил-1,6-дигидропиримидин-1-ил)-N-{ 2-гидрокси-3-оксо-1-фенилметил-(2-пиридилокси)}гексилацетамид (823 мг, 1,28 ммоль) растворяли в диметилсульфоксиде (0,46 мл), к этому раствору добавляли 1-(3-диметиламинопропил)-3-этилкарбодиимид-гидрохлорид (740 мг, 3,85 ммоль) и трифторацетат пиридиния (123,6 мг, 0,64 ммоль) и смесь перемешивали в течение 1,5 ч. Реакционный раствор разбавляли этилацетатом и промывали последовательно дистиллированной водой и насыщенным раствором хлористого натрия. Органический слой сушили над безводным сульфатом натрия, затем концентрировали при пониженном давлении, полученный остаток очищали колоночной хроматографией на силикагеле (хлороформ/этилацетат = от 2/1 до 1/1), затем к очищенному остатку добавляли диэтиловый эфир для осаждения твердых веществ. Твердый осадок собирали фильтрацией, в итоге получали указанное в заглавии соединение (401 мг, выход 49%).
1Н-ЯМР (СDСl3): 1,52 (9Н, s), 2,07 (2Н, квинтет, J=6,5 Гц), 2,75-3,29 (4Н, сложный спектр), 4,30 (2Н, t, J=6,5 Гц), 4,41-4,53 (2Н, m), 5,22-5,38 (1Н, m), 6,63 (1Н, d, J=6,6 Гц), 6,69 (1Н, dt, J=1,0 и 8,4 Гц), 6,84 (1Н, ddd, J= 1,0, 5,1 и 7,1 Гц), 6,94-7,50 (11Н, сложный спектр), 7,55 (1Н, ddd, J=2,0, 7,1 и 8,4 Гц), 8,10 (1Н, ddd, J=1,0, 2,0 и 5,1 Гц), 8,71 (1Н, s); МС: m/z = 640 (M + 1).
Пример 29: R0 = 3-метилфенил, R2 = метил (соединение 59);
1Н-ЯМР (СDСl3): 1,54 (9Н, s), 2,29 (3Н, s), 2,33 (3Н, s), 2,94 (1Н, dd, J= 8,1 и 14,0 Гц), 3,16 (1Н, dd, J=5,4 и 14,0 Гц), 4,49 (2Н, s), 5,21 (1Н, ddd, J= 5,4, 6,1 и 8,1 Гц), 6,48 (1Н, d, J=6,1 Гц), 6,79-7,63 (10Н, сложный спектр), 8,71 (1Н, s).
Пример 30: R0 = 3-хлорфенил, R2 = метил (соединение 61);
1Н-ЯМР (СDСl3): 1,54 (9Н, s), 2,35 (3Н, s), 2,94 (1Н, dd, J=8,2 и 14,1 Гц), 3,21 (1Н, dd, J=5,1 и 14,1 Гц), 4,47 (2Н, s), 5,17 (1Н, ddd, J=5,1, 6,3 и 8,2 Гц), 6,63 (1Н, d, J=6,3 Гц), 6,89-7,05 (1Н, m), 7,11 (1Н, s), 7,15-7,24 (3Н, m), 7,24-7,59 (5Н, m), 8,72 (1Н, s).
Пример 31: R0 = 4-фторфенил, R2 = метил (соединение 55);
1Н-ЯМР (СDСl3): 1,54 (9Н, s), 2,34 (3Н, s), 2,96 (1Н, dd, J=7,8 и 14,1 Гц), 3,13-3,37 (1Н, m), 4,48 (2Н, s), 5,15-5,27 (1Н, m), 6,50 (1Н, d, J=6,6 Гц), 6,83-7,58 (10Н, сложный спектр), 8,72 (1Н, ушир. s); MC: m/z = 536 (M + 1).
Пример 32: R0 = 4-хлорфенил, R2 = метил (соединение 57);
1Н-ЯМР (СDСl3): 1,54 (9Н, s), 2,34 (3Н, s), 2,94 (1Н, dd, J=7,9 и 14,1 Гц), 3,21 (1Н, dd, J=5,3 и 14,1 Гц), 4,48 (2Н, s), 5,13-5,25 (1Н, m), 6,55 (1Н, d, J= 6,6 Гц), 6,97-7,27 (5Н, сложный спектр), 7,31-7,56 (5Н, сложный спектр), 8,72 (1Н, ушир. s); ИКС (КВr): 3400, 1718, 1658, 1509, 1490, 1414, 1389, 1365, 1250, 1219, 1150, 1082 см-1; MC: m/z = 554 (M + 1).
Пример 33: R0 = 3-фторфенил, R2 = {4-(4-метилпиперазин-1-ил)-4-оксо} пропил (соединение 68).
1Н-ЯМР (СDСl3): 1,53 (9Н, s), 1,85-2,05 (2Н, сложный спектр), 2,27-2,50 (9Н, сложный спектр), 2,75-3,27 (4Н, сложный спектр), 3,43-3,65 (4Н, сложный спектр), 4,50 (2Н, s), 5,10 (1Н, m), 6,78-7,02 (4Н, сложный спектр), 7,16-7,35 (2Н, перекрывание с пиком растворителя), 7,40-7,54 (5Н, сложный спектр), 8,70 (1Н, s).
Пример 34: R0 = 2-фторфенил, R2 = метил (соединение 63).
1Н-ЯМР (СDСl3): 1,54 (9Н, s), 2,38 (3Н, s), 3,21 (2Н, ушир, d), 4,50 (2Н, s), 5,41 (1Н, dd, J=5,8 и 7,0 Гц), 6,46 (1Н, d, J=7,0 Гц), 6,90-7,27 (4Н, сложный спектр), 7,48 (1Н, s).
Пример 35: Синтез соединения 66.
Такой же метод, как в примере 1 (3), был применен для реакции окисления спирта формулы (II), чтобы получить соединение формулы (I) (соединение 66), где R1 - фенил, R3 - трет-бутилоксикарбонил, Х - азот, Y - углерод, Z - метилен, R0 - фенильная группа, a R2 - метоксигруппа.
1Н-ЯМР (СDСl3): 1,56 (9Н, s), 2,51-3,33 (2Н, m), 3,65-3,89 (3Н, m), 4,21-5,50 (3Н, сложный спектр), 6,36-6,60 (1Н, m), 6,98-7,52 (11Н, сложный спектр), 8,12-8,27 (1Н, m); MC: m/z = 535(M + 1).
Примеры с 36 по 49
Такой же метод, как в примере 1 (4), был применен для снятия защиты соединения формулы (I), где R3 - трет-бутилоксикарбонильная группа, чтобы получить соответствующие гидрохлориды соединений формулы (I), где R3 - водород, R3 = фенил, Х - углерод, Y - азот, Z - метилен, а R0 и R2 - группы, определенные ниже.
Пример 36: R0 = 3-фтор-4-гидроксифенил, R2 = метил (соединение 50);
1Н-ЯМР (CD3OD): 2,23-2,39 (3Н, m), 3,12-3,65 (2Н, m), 4,48-5,12 (3Н, сложный спектр), 6,68-7,04 (3Н, m), 7,22-7,90 (6Н, сложный спектр).
Пример 37: R0 = фенил, R2 = бутил (соединение 44);
1Н-ЯМР (СDСl3): 0,86 (3Н, t, J=6,9 Гц), 1,17-1,58 (4Н, m), 2,40-2,78 (2Н, m), 2,80-3,18 (2Н, m), 4,30-4,80 (2Н, m), 5,12-5,53 (1Н, m), 6,84-7,82 (11Н, сложный спектр); МС: m/z = 461 (М + 1).
Пример 38: R0 = R2 = фенил (соединение 46);
1Н-ЯМР (CDCl3): 3,16 (1Н, dd, J=8,5 и 14,2 Гц), 3,38 (1Н, dd, J=5,1 и 14,2 Гц), 3,98 (2Н, ушир. s), 4,42 (2Н, s), 5,17 (1Н, ddd, J=5,1, 6,3 и 8,5 Гц), 6,88 (1Н, d, J=6,3 Гц), 7,08-7,72 (14Н, сложный спектр), 7,94-8,05 (2Н, m); МС: m/z = 481 (M + 1).
Пример 39: R0 = фенил, R2 = 3-фенилпропил (соединение 40);
MC: m/z = 560(M + 1).
Пример 40: R0 = фенил, R2 = 2-фенилэтил (соединение 42);
МС: m/z = 546 (M + 1).
Пример 41: R0 = фенил, R2 = 3-карбоксипропил (соединение 48);
1Н-ЯМР (СD3ОD): 1,73-2,05 (11Н, сложный спектр), 2,15-3,25 (6Н, сложный спектр), 3,95-4,72 (3Н, сложный спектр), 7,05-7,65 (11Н, сложный спектр); МС: m/z = 491 (M + 1).
Пример 42: R0 = 3-фторфенил, R2 = 3-этоксикарбонилпропил (соединение 54);
1Н-ЯМР (DMSO-d6): 1,17 (3Н, t, J=7,1 Гц), 1,72 (2Н, квинтет, J=7,2 Гц), 2,31 (2Н, t, J=7,4 Гц), 3,62-2,90 (3Н, m), 3,10 (1Н, dd, J=4,5 и 13,9 Гц), 4,05 (2Н, q, J=7,1 Гц), 4,36 (1Н, d, J=16,5 Гц), 4,42 (1Н, d, J=16,5 Гц), 4,82-4,93 (1Н, m), 6,86-7,10 (3Н, m), 7,21-7,65 (7Н, m), 9,01 (1Н, d, J=6,6 Гц); ИКС (КВr): 37000-2400, 1683, 1646, 1540, 1373, 1250, 1180 см-1; МС: m/z = 537 (M + 1).
Пример 43: R0 = фенил, R2 = 3-(2-пиридилокси)пропил (соединение 75);
1Н-ЯМР (DMSO-d6): 1,94 (2Н, квинтет, J=6,7 Гц), 2,58-3,20 (4Н, сложный спектр), 4,27 (2Н, t, J=6,7 Гц), 4,44 (1Н, ушир. s), 4,45 (1Н, ушир. s), 4,88-5,01 (1Н, m), 6,78-6,94 (1Н, m), 6,96-7,08 (1Н, m), 7,08-7,70 (11Н, сложный спектр), 7,70-7,86 (1Н, m), 8,10-8,20 (1Н, m), 8,90-9,05 (1Н, m); МС: m/z = 540 (M + 1).
Пример 44: R0 = 3-метилфенил, R2 = метил (соединение 60);
1Н-ЯМР (DMSO-d6): 2,09-2,36 (6Н, сложный спектр), 2,72 (1Н, dd, J=9,0 и 13,8 Гц), 3,02 (1Н, dd, J=4,8 и 13,8 Гц), 4,41 (2Н, s, перекрывание с пиком растворителя), 4,73-4,94 (1Н, m), 6,82-7,24 (4Н, m), 7,25-7,68 (5Н, m), 8,94 (1Н, d, J=6,2 Гц).
Пример 45: R0 = 3-хлорфенил, R2 = метил (соединение 62);
1Н-ЯМР (DMSO-d6): 2,07-2,34 (3Н, m), 2,75 (1Н, dd, J=9,3 и 14,0 Гц), 3,09 (1Н, dd, J=4,7 и 14,0 Гц), 3,80-5,30 (3Н, сложный спектр, перекрывание с пиком растворителя), 6,96-7,80 (9Н, сложный спектр), 9,04 (1Н, d, J=6,3 Гц).
Пример 46: R0 = 4-хлорфенил, R2 = метил (соединение 58);
1Н-ЯМР (DMSO-d6): 2,24 (3Н, s), 2,74 (1Н, dd, J=9,2 и 13,9 Гц), 3,07 (1Н, dd, J= 4,7 и 13,9 Гц), 4,40 (2Н, s), 4,10-5,20 (4Н, сложный спектр), 7,10-7,64 (10Н, сложный спектр), 8,97 (1Н, d, J=6,6 Гц); МС: m/z = 454 (M + 1).
Пример 47: R0 = 4-фторфенил, R2 = метил (соединение 56);
1Н-ЯМР (DMSO-d6): 2,23 (3Н, s), 2,74 (1Н, dd, J=9,0 и 13,9 Гц), 3,06 (1Н, dd, J= 4,9 и 13,9 Гц), 4,40 (2Н, перекрывание с пиком растворителя), 4,74-4,90 (1Н, перекрывание с пиком растворителя), 6,88-7,66 (10Н, сложный спектр), 8,95 (1Н, d, J=6,4 Гц); МС: m/z = 437 (М + 1).
Пример 48: R0 = 3-фторфенил, R2 = {4-(4-метилпиперазин-1-ил)-4-оксо} пропил (соединение 69);
МС: m/z = 691 (М + 1).
Пример 49: R0 = 2-фторфенил, R2 = метил (соединение 64);
1Н-ЯМР (СDСl3): 2,23 (3Н, s), 2,86 (1Н, dd, J=8,2 и 13,8 Гц), 4,42 (2Н, s), 4,88-4,95 (1Н, m), 7,01-7,62 (9Н, сложный спектр), 8,96 (1Н, d, J=6,5 Гц).
Пример 50
Такой же метод, как в примере 1 (4), был применен для снятия защиты соединения формулы (I), где R3 - трет-бутилоксикарбонильная группа, чтобы получить соответствующий гидрохлорид соединения (соединение 67) формулы (I), где R3 - водород, R1 = фенил, Х - азот, Y - углерод, Z - метилен, R0 - фенильная группа, a R2 - метоксигруппа.
1Н-ЯМР (СDСl3): 2,95 (1Н, dd, J=8,2 и 14,1 Гц), 3,16 (1Н, dd, J=5,7 и 14,1 Гц), 3,84 (3Н, s), 4,43 (2Н, s), 5,18-5,35 (1Н, m), 6,47-6,60 (1Н, m), 7,08-7,53 (11Н, сложный спектр), 8,59 (1Н, d, J=7,1 Гц), 9,17 (2Н, ушир. s); МС: m/z = 435 (M + 1).
Пример 51
Синтез гидрохлорида 2-(5-амино-6-оксо-2-фенил-1,6-дигидропиримидин-1-ил)-N-{ 2,3-диоксо-1-(3-фторфенил)метил} бутилацетамида (соединение 52) проводили следующим способом.
(1) 2-(5-Трет-бутилоксикарбониламино-6-оксо-2-фенил-1,6-дигидропиримидин-1-ил)-N-{1-(3-фторфенил)метил-2-гидрокси-3-оксо}бутилацетамид (соединение 8).
3-Трет-бутилоксикарбонил-2,2-диметил-5-(1-оксоэтил)-4-(3-фторфенил)метилоксазолидин (17,94 г, 51,1 ммоль) растворяли в этаноле (180 мл), к этому раствору добавляли п-толуол-сульфокислоту•1H2O (10,7 г, 56,2 ммоль) и смесь прогревали с обратным холодильником в течение 2 ч с перемешиванием. Реакционный раствор концентрировали при пониженном давлении, а полученный остаток сушили с вакуумным насосом (2 мм рт. ст.) при 50oС, в результате получали сырой 2-амино-1-(3-фторфенил)-3-гидрокси-4-оксопентан-п-толуолсульфонат (21,5 г) в виде твердого вещества. Это твердое вещество использовали без дополнительной очистки в последующей реакции конденсации.
Твердое вещество (21,5 г), полученное в описанной выше реакции, и 5-трет-бутилоксикарбониламино-6-оксо-2-фенил-1,6-дигидро-1-пиримидинилуксусную кислоту (1,42 г, 4,14 ммоль) растворяли в диметилформамиде (311 мл), после чего при охлаждении во льду последовательно добавляли 1-(3-диметиламинопропил)-3-этилкарбодиимид-гидрохлорид (12,7 г, 66,4 ммоль), 1-гидроксибензтриазол•1Н2O (10,2 г, 66,4 ммоль) и 4-метилморфолин (7,6 мл, 66,4 ммоль), смесь перемешивали в течение ночи при комнатной температуре. Реакционный раствор разбавляли этилацетатом и промывали последовательно 5% водным раствором лимонной кислоты, насыщенным водным раствором бикарбоната натрия, дистиллированной водой и насыщенным раствором хлористого натрия. После сушки органического слоя добавлением безводного сульфата натрия осушающий агент удаляли фильтрацией, а фильтрат концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (хлороформ/метанол = от 80/20 до 65/35), в итоге получали указанное в заглавии соединение (18,7 г, выход 68%).
1Н-ЯМР: 1,53 (9Н, s), 2,21 (3Н, s), 2,97 (2Н, d, J=15,4 Гц), 4,48 (1Н, d, J= 15,4 Гц), 4,67-4,82 (1Н, m), 6,35 (1Н, d, J=9,4 Гц), 6,88-7,08 (3Н, сложный спектр), 7,24-7,48 (7Н, перекрывание с пиком растворителя), 8,72 (1Н, s).
3-Трет-бутилоксикарбонил-2,2-диметил-5-(1-оксоэтил)-4-(3-фторфенил)метилоксазолидин (промежуточное соединение 8), использованный выше, получали следующим способом.
В соответствии с методом, описанным Nishizawa R. et al. (J. Med. Chem. V. 20, N 4. Р. 510-515), ацетамидный эфир малоновой кислоты и 3-фторбензилхлорид конденсировали, затем эфир продукта реакции гидролизовали, после чего проводили декарбоксилирование и снятие защиты с аминогруппы, а полученный 3-фторфенилаланин использовали как исходный материал, чтобы получить 3-амино-2-гидрокси-4-(3-фторфенил)масляную кислоту, которую затем защищали по ее 3-аминогруппе с помощью трет-бутилоксикарбонильной группы и обычным способом подвергали реакции конденсации с N,О-диметилгидроксиламином, в результате чего получали 3-трет-бутилоксикарбониламино-2-гидрокси-4-(3-фторфенил)масляной кислоты N,O-диметилгидроксиламид.
Полученный амид обрабатывали каталитическим количеством п-толуолсульфокислоты в 2,2-диметоксипропане, в результате чего легко можно было получить 3-трет-бутилоксикарбонил-2,2-диметил-5-N-метокси-N-метил-4-(3-фторфенил)оксазолидин.
Полученный оксазолидин обрабатывали реагентом Григнарда в инертном растворителе в атмосфере аргона согласно способу, описанному в примере 1 (1), в результате можно было синтезировать требуемое соединение 5-трет-бутилоксикарбонил-2,2-диметил-5-(1-оксоэтил)-4-(3-фторфенил)метилоксазолидин.
(2) 2-(5-Трет-бутилоксикарбониламино-6-оксо-2-фенил-1,6-дигидропиримидин-1-ил)-N-{2,3-диоксо-1-(3-фторфенил)метил}бутилацетамид (соединение 51).
Оксалилхлорид (5,06 мл, 58,0 ммоль) добавляли к метиленхлориду (566 мл) при комнатной температуре в атмосфере азота и охлаждали до -75oС. После добавления к этому раствору по каплям диметилсульфоксида (5,49 мл, 77,4 ммоль) к нему добавляли по каплям раствор 2-(5-трет-бутилоксикарбониламино-6-оксо-2-фенил-1,6-дигидропиримидин-1-ил)-N-{ 1-(3-фторфенил)метил-2-гидрокси-3-оксо} бутилацетамида (20,8 г, 38,7 ммоль) в метиленхлориде (900 мл). Через 20 мин к реакционной смеси добавляли по каплям триэтиламин (21,6 мл, 155 ммоль), и давали температуре реакционного раствора повыситься до комнатной. Реакционный раствор промывали последовательно 10% водным раствором лимонной кислоты и дистиллированной водой, затем органический слой сушили над безводным сульфатом натрия. Осушающий агент удаляли фильтрацией, а фильтрат затем концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (хлороформ/этилацетат = от 20/1 до 9/1), в итоге получали указанное в заглавии соединение (24,0 г, выход 58%).
1Н-ЯМР (СDСl3): 1,54 (9Н, s), 2,34 (3Н, s), 2,96 (1Н, dd, J=7,8 и 14,1 Гц) 3,13-3,37 (1Н, m), 4,48 (2Н, s), 5,15-5,27 (1Н, m), 6,50 (1Н, d, J=6,6 Гц), 6,83-7,555 (11Н, сложный спектр), 8,67-8,77 (1Н, m); MC: m/z = 537 (M + 1).
(3) Гидрохлорид 2-(5-амино-6-оксо-2-фенил-1,6-дигидpoпиpимидин-1-ил)-N-{ 1-(3-фторфенил)метил-2,3-диоксо}бутилацетамида (соединение 52).
2-(5-Трет-бутилоксикарбониламино-6-оксо-2-фенил-1,6-дигидропиримидин-1-ил)-N-{ 1-(3-фтopфeнил)мeтил-2,3-диoкco}бyтилaцeтaмид (24,0 г, 44,7 ммоль) растворяли в смеси 4 н. соляная кислота/1,4-диоксан (9 мл, 36,2 ммоль) и перемешивали при комнатной температуре в течение 1,5 ч. Реакционный раствор концентрировали при пониженном давлении, к полученному остатку добавляли диэтиловый эфир, а твердый осадок собирали фильтрацией. В результате получали указанное в заглавии соединение (21,1 г, выход 99%).
1Н-ЯМР (DMSO-d6): 2,24 (3Н, s), 2,78 (1Н, dd, J=9,1 и 13,9 Гц), 3,11 (1Н, dd, J=4,7 и 13,9 Гц), 4,40 (2Н, ушир. s), 4,79-4,92 (1Н, m), 6,93-7,09 (3Н, сложный спектр, перекрывание с 1Н), 7,20-7,65 (7Н, сложный спектр, перекрывание с 1Н), 9,06 (1Н, d, J=6,5 Гц); MC: m/z = 437 (M + 1).
Пример 52
Синтез дигидрохлорида 2-(5-амино-6-оксо-2-фенил-1,6-дигидропиримидин-1-ил)-N-{2,3-диоксо-(4-морфолин-4-ил)-1-фенилметил}гексилацетамида (соединение 71) проводили следующим способом.
(1) 2-(5-Трет-бутилоксикарбониламино-6-оксо-2-фенил-1,6-дигидропиримидин-1-ил)-N-(2R, 3S)-{ 2-гидрокси-3-оксо-6-(4-морфолин-4-ил)-1-фенилметил} гексилацетамид-трифторацетат (соединение 11).
(4S, 5R)-3-Трет-бутилоксикарбонил-2,2-диметил-5-{4-(4-морфолин-4-ил)-1-оксобутил}-4-фенилметилоксазолидин (130,3 г, 270 ммоль) растворяли в метаноле (674 мл), к этому раствору добавляли п-толуолсульфокислоту•1H2О (51,3 г, 270 ммоль) и смесь с перемешиванием прогревали в течение 6 ч с обратным холодильником. Реакционный раствор концентрировали при пониженном давлении и полученный остаток (2-амино-3-гидрокси-7-(4-морфолин-4-ил)-4-оксо-1-фенилгептан-моногидрохлорид-моно-р-толуолсульфонат) подвергали без выделения и очистки последующей реакции конденсации.
Указанный выше остаток реакции и 5-трет-бутилоксикарбониламино-6-оксо-2-фенил-1,6-дигидро-1-пиримидинилуксусную кислоту (60,1 г, 174 ммоль) растворяли в смеси растворителей - диметилформамида (145 мл) и тетрагидрофурана (290 мл), после чего последовательно добавляли при охлаждении во льду 1-(3-диметиламинопропил)-3-этилкарбодиимид-гидрохлорид (37,4 г, 191 ммоль), 1-гидроксибензтриазол•1H2О (26,6 г, 174 ммоль) и 4-метилморфолин (19,1 мл, 174 ммоль), затем смесь перемешивали в течение ночи при комнатной температуре. Реакционный раствор разбавляли этилацетатом и промывали последовательно 5% водным раствором лимонной кислоты, насыщенным водным раствором бикарбоната натрия, дистиллированной водой и насыщенным раствором хлористого натрия. После высушивания органического слоя добавлением безводного сульфата натрия осушающий агент удаляли фильтрацией, а фильтрат концентрировали при пониженном давлении. Полученный остаток растворяли в этилацетате (1500 мл) и к раствору при охлаждении во льду добавляли по каплям трифторуксусную кислоту (13,4 мл, 174 ммоль). Твердый осадок собирали фильтрацией, в результате получали названный продукт (72,7 г, выход 56%).
1Н-ЯМР (СDСl3): 1,53 (94, s), 1,60-1,76 (1Н, m), 1,77-1,92 (14, m), 2,10-2,60 (8Н, сложный спектр), 2,93-2,99 (2Н, сложный спектр), 3,55 (4Н, t, J= 4,6 Гц), 4,11 (1Н, s), 4,33 (1Н, d, J=15,3 Гц), 4,48 (1Н, d, J=15,3 Гц), 4,63-4,77 (1Н, m), 6,28 (1Н, d, J=9,5 Гц), 7,22-7,34 (6Н, сложный спектр), 7,35-7,49 (5Н, сложный спектр), 8,25 (1Н, s).
(4S, 5R)-3-Трет-бутилоксикарбонил-2,2-диметил-5-{4-(4-морфолин-4-ил)-1-оксобутил} -4-фенилметилоксазолидин (промежуточное соединение 11), использованный выше, получали следующим способом.
В соответствии с методом, описанным Nishizawa R. et al. (J. Med. Chem. V. 20, N 4. Р. 510-515), (2R,3S)-3-амино-2-гидрокси-4-фенилмасляную кислоту получали с использованием в качестве исходного материала L-фенилаланина, защищали ее 3-аминогруппу трет-бутилоксикарбонильной группой и затем подвергали обычным способом реакции конденсации с N,O-диметилгидроксиламином, в результате получали соответствующий (2R,3S)-3-трет-бутилоксикарбониламино-2-гидрокси-4-фенилмасляной кислоты N,O-диметилгидроксиламид.
Полученный амид обрабатывали обычным способом, например каталитическим количеством п-толуолсульфокислоты в 2,2-диметоксипропане, в результате чего легко может быть получен (4S,5R)-3-трет-бутилоксикарбонил-2,2-диметил-5-(N-метокси-N-метил-4-фенилметилоксазолидин.
Полученный оксазолидин обрабатывали реагентом Григнарда в инерттном растворителе в атмосфере аргона в соответствии с методом, описанным в примере 1 (1), в результате чего может быть синтезировано требуемое соединение (4S, 5R)-3-трет-бутилоксикарбонил-2,2-диметил-5-{ 4-(4-морфолин-4-ил)-1-оксобутил}-4-фенилметилоксазолидин.
(2) 2-(5-Трет-бутилоксикарбониламино-6-оксо-2-фенил-1,6-дигидропиримидин-1-ил)-N-(2,3-диоксо-6-(4-морфолин-4-ил)-1-фенилметил} гексилацетамид (соединение 70).
2-(5-Трет-бутилоксикарбониламино-6-оксо-2-фенил-1,6-дигидропиримидин-1-ил)-N-(2R,3S)-{2-rидpoкcи-3-oкco-6-(4-мopфoлин-4-ил)-1-фeнилмeтил}reкcилaмид-трифторацетат (70,3 мг, 94,1 ммоль) растворяли в смеси растворителей метиленхлорида (470 мл) и диметилсульфоксида (33,4 мл), к этому раствору добавляли при комнатной температуре трифторуксусную кислоту (3,6 мл, 47,0 ммоль), пиридин (3,8 мл, 47,0 ммоль) и 1-(3-диметиламинопропил)-3-этилкарбодиимид-гидрохлорид (55,2 г, 282 ммоль) в указанном порядке и смесь перемешивали в течение 50 мин. Реакционный раствор разбавляли метиленхлоридом и затем промывали дистиллированной водой. Органический слой сушили над безводным сульфатом натрия, затем осушающий агент удаляли фильтрацией, а раствор концентрировали при пониженном давлении, в результате чего получали указанное в заглавии соединение.
Это соединение подвергали последующей реакции снятия защиты без выделения и очистки. MC: m/z = 632 (M + 1).
(3) Дигидрохлорид 2-(5-амино-6-оксо-2-фенил-1,6-дигидропиримидин-1-ил)-N-{2,3-диоксо-6-(4-морфолин-4-ил)-1-фенилметил}гексилацетамида (соединение 71).
2-(5-Трет-бутилоксикарбониламино-6-оксо-2-фенил-1,6-дигидропиримидин-1-ил)-N-(2,3-диоксо-6-(4-морфолин-4-ил)-1-фенилметил}гексилацетамид, полученный в предыдущем эксперименте, растворяли в смешанном растворителе из этилацетата (235 мл) и смеси 4 н. соляная кислота/1,4 диоксан (235 мл) и перемешивали в течение ночи при комнатной температуре. Твердый осадок удаляли из реакционной смеси фильтрацией, в результате получали указанное в заглавии соединение (56,8 г, выход 99%).
R0 = фенил, R2 = 3-(4-морфолин-4-ил)пропил (соединение 71); МС: m/z = 532 (М + 1).
Далее описывается способ синтеза соединения формулы (I) из соединения формулы (ХIII), т.е. 2-(5-трет-бутилоксикарбониламино-6-оксо-2-фенил-1,6-дигидропиримидин-1-ил)-N-{ (1S,2R)-2-гидрокси-3-оксо-1-фенилметил-6-(2-пиридилокси)}гексилацетамида по синтетическому пути в схеме 1.
Пример 53
Далее описывается способ синтеза известного промежуточного соединения:
дигидрохлорида 2-(5-амино-6-оксо-2-фенил-1,6-дигидропиримидин-1-ил)-N-{ (1S, 2R)-2-ацетилокси-3-оксо-1-фенилметил-6-(2-пиридилокси)} гексилацетамида (соединение 23).
(1) 2-(5-Трет-бутилоксикарбониламино-6-оксо-2-фенил-1,6-дигидропиримидин-1-ил)-N-{ (1S, 2R)-2-ацетилокси-3-оксо-1-фенилметил-6-(2-пиридилокси)} гексилацетамид (соединение 22).
2-(5-Трет-бутилоксикарбониламино-6-оксо-2-фенил-1,6-дигидропиримидин-1-ил)-N-{ (1S, 2R)-2-гидрокси-3-оксо-1-фенилметил-6-(2-пиридилокси)}гексилацетамид (1 г, 1,56 ммоль) растворяли в пиридине (1,6 мл), к этому раствору добавляли при охлаждении во льду уксусный ангидрид (0,176 мл, 1,87 ммоль) и смесь перемешивали при 0oС в течение 30 мин и при комнатной температуре в течение 2 ч. После добавления насыщенного водного раствора бикарбоната натрия реакционный раствор экстрагировали этилацетатом, затем промывали насыщенным раствором хлористого натрия и сушили над безводным сульфатом натрия. Органический слой концентрировали при пониженном давлении, а полученный остаток очищали колоночной хроматографией на силикагеле (гексан/этилацетат/метанол = 10/10/1), в итоге получали в виде белого твердого вещества указанное в заглавии соединение (1,08 г, количественный выход).
1Н-ЯМР (СDСl3): 1,52 (9Н, s), 1,92-2,08 (2Н, m), 2,19 (3Н, s), 2,45-3,30 (4Н, сложный спектр), 4,24 (2Н, t, J= 6,5 Гц), 4,44 (2Н, d, J=7,6 Гц), 4,72-4,89 (1Н, m), 4,97 (1Н, d, J=2,2 Гц), 6,44 (1Н, d, J=9,4 Гц), 6,68 (1Н, d, J= 8,3 Гц), 6,82 (1Н, ddd, J=0,93, 4,0 и 7,1 Гц), 7,11-7,35 (7Н, сложный спектр), 7,36-7,58 (5Н, сложный спектр), 8,08 (1Н, ddd, J=1,0, 1,8 и 4,0 Гц), 8,72 (1Н, ушир. s), МС: m/z = 684 (M + 1), 1367 (2М + 1).
(2) Дигидрохлорид 2-(5-амино-6-оксо-2-фенил-1,6-дигидропиримидин-1-ил)-N-{ (1S, 2R)-2-ацетилокси-3-оксо-1-фенилметил-6-(2-пиридилокси)}гексилацетамида (соединение 23).
5-Трет-бутилоксикарбониламино-6-оксо-2-фенил-1,6-дигидропиримидин-1-ил)-N-{(1S,2R)-2-ацетилокси-3-оксо-1-фенилметил-6-(2-пиридилокси)}гексилацетамид (1,08 г, 1,58 ммоль) растворяли в 2 мл диоксана, к этому раствору при охлаждении во льду добавляли смесь 4 н. соляная кислота/1,4-диоксан (7,9 мл, 31,6 ммоль), смесь перемешивали при 0oС в течение 30 мин и при комнатной температуре в течение ночи. Реакционный раствор концентрировали при пониженном давлении, в итоге получали указанное в заглавии соединение в виде белого твердого вещества (1,08 г, количественный выход).
1Н-ЯМР (СD3ОD): 2,09-2,23 (2Н, m), 2,20 (3Н, s), 2,61-3,50 (4Н, сложный спектр), 4,34-4,85 (5Н, сложный спектр), 5,04 (1Н, d), 7,15-7,31 (5Н, сложный спектр), 7,43-7,67 (7Н, сложный спектр), 7,69-7,79 (1Н, m), 8,32-8,38 (1Н, m), 8,46 (1Н, ddd, J=1,7, 7,3 и 10 Гц). МС: m/z = 584 (М + 1).
Пример 54
Синтез 2-(5-бензилсульфониламино-6-оксо-2-фенил-1,6-дигидропиримидин-1-ил)-N-{2,3-диоксо-1-фенилметил-6-(2-пиридилокси)}гексилацетамида (соединение 77) проводили следующим образом.
(1) 2-(5-Бензилсульфониламино-6-оксо-2-фенил-1,6-дигидропиримидин-1-ил)-N-{(1S,2R)-2-ацетилокси-3-оксо-1-фенилметил-6-(2-пиридилокси)}гексилацетамид (соединение 24).
Известное промежуточное соединение: дигидрохлорид 2-(5-амино-6-оксо-2-фенил-1,6-дигидропиримидин-1-ил)-N-{ (1S, 2R)-2-ацетилокси-3-оксо-1-фенилметил-6-(2-пиридилокси)} гексилацетамида (760 мг, 1,16 ммоль) растворяли в пиридине (1,2 мл) и после добавления при охлаждении во льду бензилсульфонилхлорида (221 мг, 1,16 ммоль) смесь перемешивали при 0oС в течение 1 часа и при комнатной температуре в течение 1 часа. После добавления насыщенного водного раствора бикарбоната натрия реакционный раствор экстрагировали этилацетатом и органический слой промывали насыщенным раствором хлористого натрия. Органический слой, после высушивания над безводным сульфатом натрия, концентрировали при пониженном давлении, а полученный остаток очищали колоночной хроматографией на силикагеле (гексан/этилацетат/метанол = 10/20/1), в итоге получали в виде белого твердого вещества указанное в заглавии соединение (590 мг, выход 69%).
1Н-ЯМР (СDСl3): 1,85-2,02 (2Н, m), 2,29 (3Н, s), 2,42-2,75 (2Н, m), 2,82-3,07 (2Н, m), 4,07 (2Н, d, J=4,1 Гц), 4,16 (2Н, t, J=6,3 Гц), 4,75-4,92 (1Н, m), 4,94 (1Н, d, J=1,9 Гц), 6,64 (1Н, d, J=8,4 Гц), 6,72-6,86 (2Н, сложный спектр), 7,02-7,62 (16Н, сложный спектр), 8,02-8,07 (1Н, m), 8,04 (1Н, m), 8,15-8,35 (1Н, m); МС: m/z = 738 (М + 1).
(2) 2-(5-Бензилсульфониламино-6-оксо-2-фенил-1,6-дигидропиримидин-1-ил)-N-{(1S,2R)-2-гидрокси-3-оксо-1-фенилметил-6-(2-пиридилокси)}гексилацетамид (соединение 25).
2-(5-Бензилсульфониламино-6-оксо-2-фенил-1,6-дигидропиримидин-1-ил)-N-{ (1S, 2R)-2-ацетилокси-3-оксо-1-фенилметил-6-(2-пиридилокси)} гексилацетамид (590,4 мг, 0,8 ммоль) растворяли в метаноле (3,2 мл) и после добавления при охлаждении во льду водного раствора (1 мл) карбоната калия (332 мг) смесь перемешивали при 0oС в течение 30 мин и при комнатной температуре в течение 3 ч. После добавления насыщенного водного раствора хлорида аммония реакционный раствор экстрагировали этилацетатом и промывали органический слой насыщенным раствором хлористого натрия. Органический слой, после высушивания над безводным сульфатом натрия, концентрировали при пониженном давлении, а полученный остаток очищали колоночной хроматографией на силикагеле (гексан/этилацетат/метанол = 5/5/1), в итоге получали указанное в заглавии соединение в виде бледно-желтого твердого вещества (572 мг, количественный выход).
1Н-ЯМР (СDСl3): 1,85-2,07 (2Н, m), 2,50 (1Н, dt, J=7,2 и 17,9 Гц), 2,78 (1Н, dt, J= 7,1 и 17,9 Гц), 2,96-3,08 (2Н, m), 3,90 (1Н, d, J=4,6 Гц), 4,04-4,28 (5Н, сложный спектр), 4,38 (2Н, s), 4,58-4,75 (1Н, m), 6,58 (1Н, d, J= 9,5 Гц), 6,60 (1Н, d, J=8,4 Гц), 6,81 (1Н, ddd, J=0,9, 5,0 и 7,1 Гц), 7,10-7,59 (16Н, сложный спектр), 7,82-8,00 (1Н, ушир. s), 8,09-8,17 (1Н, m), 8,18 (1Н, s); MC: m/z = 696 (М + 1).
(3) 2-(5-Бензилсульфониламино-6-оксо-2-фенил-1,6-дигидропиримидин-1-ил)-N-{ 2,3-диоксо-1-фенилметил-6-(2-пиридилокси)}гексилацетамид (соединение 77).
2-(5-Бензилсульфониламино-6-оксо-2-фенил-1,6-дигидропиримидин-1-ил)-N-{ (1S, 2R)-2-гидрокси-3-оксо-1-фенилметил-6-(2-пиридилокси)} гексилацетамид (571,9 мг, 0,822 ммоль) растворяли в метиленхлориде (1 мл) и диметилсульфоксиде (0,87 мл), после чего последовательно добавляли трифторацетат пиридиния (79,4 мг, 0,41 ммоль) и 1-(3-диметиламинопропил)-3-этилкарбодиимид-гидрохлорид (474 мг, 2,47 ммоль) и смесь перемешивали при 0oС в течение 30 мин и при комнатной температуре в течение 2 ч. Затем добавляли воду, после чего реакционный раствор экстрагировали этилацетатом и сушили над безводным сульфатом натрия. Органический слой концентрировали при пониженном давлении, а полученный остаток очищали колоночной хроматографией на силикагеле (метиленхлорид/этилацетат = 1/1), в итоге получали указанное в заглавии соединение в виде бледно-желтого твердого вещества (80 мг, выход 14%).
1Н-ЯМР (СDСl3): 1,92-2,09 (2Н, m), 2,66-3,26 (4Н, сложный спектр), 4,05-4,42 (6Н, сложный спектр), 5,30-5,45 (1Н, m), 6,63 (1Н, d, J=6,6 Гц), 6,77-6,90 (1Н, m), 6,96 (1Н, d, J=7,0 Гц), 7,08-7,63 (16Н, сложный спектр), 8,01-8,13 (2Н, сложный спектр), 8,18 (1Н, s), MC: m/z = 694 (М + 1).
Пример 55
2-(5-Формиламино-6-оксо-2-фенил-1,6-дигидропиримидин-1-ил)-N-{2,3-диоксо-1-фенилметил-6-(2-пиридилокси)}гексилацетамид (соединение 79) синтезировали следующим способом.
(1) 2-(5-Формиламино-6-оксо-2-фенил-1,6-дигидропиримидин-1-ил)-N-{ (1S, 2R)-2-ацетилокси-3-оксо-1-фенилметил-6-(2-пиридилокси)} гексилацетамид (соединение 28).
К уксусному ангидриду (0,25 мл, 2,6 ммоль) добавляли при охлаждении во льду муравьиную кислоту (0,12 мл, 3,2 ммоль) и перемешивали при 60oС в течение 2 ч. После этого смесь охлаждали до -20oС и к ней добавляли раствор известного промежуточного соединения - дигидрохлорида 2-(5-амино-6-оксо-2-фенил-1,6-дигидропиримидин-1-ил)-N-{ (1S, 2R)-2-ацетилокси-3-оксо-1-фенилметил-6-(2-пиридилокси)} гексилацетамида (656 мг, 1,0 ммоль) в смешанном растворителе - смеси тетрагидрофурана (2 мл) и триэтиламина (0,29 мл, 2,1 ммоль), смесь перемешивали в течение 1 часа, и за это время температура повышалась до 0oС. Реакционный раствор концентрировали как таковой при пониженном давлении, а полученный остаток очищали колоночной хроматографией на силикагеле (гексан/этилацетат/метанол = 10/10/1), в итоге получали указанное в заглавии соединение в виде белого твердого вещества (570 мг, выход 93%).
1Н-ЯМР (СDСl3): 1,92-2,09 (2Н, m), 2,18 (3Н, s), 2,49-2,71 (2Н, m), 2,85 (14, dd, J= 8,8 и 13,5 Гц), 3,00 (1Н, dd, J=6,5 и 13,5 Гц), 4,15-4,36 (2Н, m), 4,48 (2Н, dd, J=8,4 и 15,3 Гц), 4,70-4,90 (1Н, m), 4,98 (1Н, d, J=2,2 Гц), 6,52 (1Н, d, J=9,2 Гц), 6,69 (1Н, dt, J=1,0 и 8,3 Гц), 6,84 (1Н, ddd, J=0,9, 5,1 и 7,2 Гц), 7,10-7,61 (11Н, сложный спектр), 8,08 (1Н, ddd, J=0,8, 2,0 и 5,1 Гц), 8,33 (1Н, s), 8,49 (1Н, s), 9,11 (1Н, s); MC: m/z = 612 (М + 1).
(2) 2-(5-Формиламино-6-оксо-2-фенил-1,6-дигидропиримидин-1-ил)-N-{ (1S, 2R)-2-гидрокси-3-оксо-1-фенилметил-6-(2-пиридилокси)} гексилацетамид (соединение 29).
2-(5-Формиламино-6-оксо-2-фенил-1,6-дигидропиримидин-1-ил)-N-{ (1S,2R)-2-ацетилокси-3-оксо-1-фенилметил-6-(2-пиридилокси)}гексилацетамид (570,4 мг, 0,93 ммоль) растворяли в метаноле (3,7 мл), к этому раствору добавляли водный раствор (1 мл) карбоната калия (387 мг) при охлаждении во льду и смесь перемешивали при 0oС в течение 30 мин и при комнатной температуре в течение 3 ч. После добавления насыщенного водного раствора хлорида аммония реакционный раствор экстрагировали этилацетатом, и промывали органический слой насыщенным раствором хлористого натрия. После сушки над безводным сульфатом натрия органический слой концентрировали при пониженном давлении, в итоге получали указанное в заглавии соединение (379 мг, выход 71%).
1Н-ЯМР (СDCl3): 1,96-2,12 (2Н, m), 2,55 (1Н, dt, J=7,1 и 18,0 Гц), 2,77 (1Н, dt, J=7,0 и 17,8 Гц), 2,97 (2Н, d, J=7,0 и 17,8 Гц) 3,92 (d, J=3,7 Гц) 4,05-4,12 (1Н, m), 4,14-4,48 (4Н, сложный спектр), 4,64-4,82 (1Н, m), 7,15-7,58 (11Н, сложный спектр), 8,07 (1Н, dd, J=1,8 и 5,2 Гц), 8,27 (1Н, s), 8,44 (1Н, s), 9,09 (1Н, s), m/z = 570 (М + 1).
(3) 2-(5-Формиламино-6-оксо-2-фенил-1,6-дигидропиримидин-1-ил)-N-{2,3-диоксо-1-фенилметил-6-(2-пиридилокси)}гексилацетамид (соединение 79).
2-(5-Формиламино-6-оксо-2-фенил-1,6-дигидропиримидин-1-ил)-N-{ (1S,2R)-2-гидрокси-3-оксо-1-фенилметил-6-(2-пиридилокси)} гексилацетамид (374 мг, 0,66 ммоль) растворяли в метиленхлориде (0,7 мл) и диметилсульфоксиде (0,7 мл), к этому раствору добавляли трифторацетат пиридиния (64 мг, 0,33 ммоль) и 1-(3-диметиламинопропил)-3-этилкарбодиимид-гидрохлорид (378 мг, 1,97 ммоль) и смесь перемешивали при комнатной температуре в течение 1 часа. После добавления воды реакционный раствор экстрагировали этилацетатом и сушили над безводным сульфатом натрия. Органический слой концентрировали при пониженном давлении, а полученный остаток очищали колоночной хроматографией на силикагеле (метиленхлорид/этилацетат = 1/2), в итоге получали указанное в заглавии соединение (257 мг, выход 69%).
1Н-ЯМР (СDСl3): 2,00-2,16 (2Н, m), 2,76-3,09 (3Н, сложный спектр), 3,23 (1Н, dd, J=5,4 и 14,1 Гц), 4,32 (2Н, t, J=6,4 Гц), 4,50 (2Н, d, J=1,3 Гц), 5,21-5,33 (1Н, m), 6,50 (1Н, d, J=6,6 Гц), 6,70 (1Н, d, J=8,3 Гц), 6,85 (1Н, ddd, J= 0,9, 5,1 и 7,1 Гц), 7,00-7,11 (2Н, m), 7,14-7,65 (9Н, сложный спектр), 8,10 (1Н, ddd, J=0,7, 2,0 и 5,0 Гц), 8,24 (1Н, ушир. s), 9,10 (1Н, s); MC: m/z = 568 (M + 1).
Пример 56
2-(5-Бензиламиносульфониламино-6-оксо-2-фенил-1,6-дигидропиримидин-1-ил)-N-{ 2,3-диоксо-1-фенилметил-6-(2-пиридилокси)}гексилацетамид (соединение 82) синтезировали следующим образом.
(1) 2-(5-Бензиламиносульфониламино-6-оксо-2-фенил-1,6-дигидропиримидин-1-ил)-N-{ (1S, 2R)-2-ацетилокси-3-оксо-1-фенилметил-6-(2-пиридилокси)} гексилацетамид (соединение 35).
К раствору дигидрохлорида 2-(5-амино-6-оксо-2-фенил-1,6-дигидропиримидин-1-ил)-N-{ (1S, 2R)-2-ацетилокси-3-оксо-1-фенилметил-6-(2-пиридилокси)} гексилацетамида (1,0 г, 1,52 ммоль) в тетрагидрофуране (3 мл) добавляли при охлаждении во льду 2,6-лутидин (0,62 мл, 5,32 ммоль) и 1 М раствор бензиламиносульфонилхлорида в тетрагидрофуране (1,52 мл, 1,52 ммоль), смесь перемешивали при 0oС в течение 1 ч и при комнатной температуре в течение 1 ч. После добавления насыщенного водного раствора бикарбоната натрия реакционный раствор экстрагировали этилацетатом и промывали насыщенным раствором хлористого натрия. После высушивания над безводным сульфатом натрия органический слой концентрировали при пониженном давлении, а полученный остаток очищали с использованием элюента гексан/этилацетат = от 1/1 до 0/1, в итоге получали 2-(5-бензиламиносульфониламино-6-оксо-2-фенил-1,6-дигидропиримидин-1 -ил)-N-{ (1S, 2R)-2-ацетилокси-3-оксо-1-фенилметил-6-(2-пиридилокси)} гексилацетамид (602 мг, выход 53%).
1Н-ЯМР (СDСl3): 1,91-2,02 (2Н, m), 2,05 (3Н, s), 2,44-2,71 (2Н, m), 2,75-3,03 (2Н, m), 4,14-4,29 (44, сложный спектр), 4,41 (2Н, s), 4,71-4,88 (1Н, m), 4,97 (1Н, d, J=2,1 Гц), 5,50 (1Н, t, J=5,9 Гц), 6,47 (1Н, d, J=9,4 Гц), 6,66 (1Н, d, J= 8,4 Гц), 6,78-6,86 (1Н, m), 7,08-7,62 (17Н, сложный спектр), 8,06 (1Н, dd, J=1,5 и 5,1 Гц), 8,15 (1Н, s); MC: m/z = 753 (М + 1).
(2) 2-(5-Бензиламиносульфониламино-6-оксо-2-фенил-1,6-дигидропиримидин-1-ил)-N-{(1S,2R)-2-гидрокси-3-оксо-1-фенилметил-6-(2-пиридилокси)}гексилацетамид (соединение 36).
2-(5-Бензиламиносульфониламино-6-оксо-2-фенил-1,6-дигидропиримидин-1-ил)-N-{ (1S, 2R)-2-aцeтилoкcи-3-oкco-1-фeнилмeтил-6-(2-пиpидилoкcи)}гeкcилaцeтaмид (601 мг, 0,8 ммоль) растворяли в метаноле (3,2 мл) к этому раствору с охлаждением во льду добавляли водный раствор (1 мл) карбоната калия (332 мг) и смесь перемешивали при 0oС в течение 1 ч. После добавления насыщенного водного раствора хлорида аммония реакционный раствор экстрагировали этилацетатом и промывали органический слой насыщенным раствором хлористого натрия. После высушивания над безводным сульфатом натрия органический слой концентрировали при пониженном давлении, в результате получали указанное в заглавии соединение (405 мг, выход 71%).
1Н-ЯМР (СDCl3): 1,84-2,02 (2Н, m), 2,46 (1Н, dt, J=7,2 и 18,0 Гц), 2,78 (1Н, dt, J=7,0 и 17,9 Гц), 2,95 (2Н, d, J=3,0 Гц), 4,02-4,18 (4Н, m), 4,27 (2Н, s), 4,34-4,43 (1Н, br. s), 4,50-4,75 (1H, m), 6,58 (1Н, d, J=8,3 Гц), 6,73-6,87 (2Н, сложный спектр), 7,12-7,54 (16Н, сложный спектр), 8,01 (1Н, ddd, J=0,7, 1,5 и 5,1 Гц), 8,16 (1Н, s), MC: m/z = 711 (М + 1).
(3) 2-(5-Бензиламиносульфониламино-6-оксо-2-фенил-1,6-дигидропиримидин-1-ил)-N-{ 2,3-диоксо-1-фенилметил-6-(2-пиридилокси)} гексилацетамид (соединение 82).
2-(5-Бензиламиносульфониламино-6-оксо-2-фенил-1,6-дигидропиримидин-1-ил)-N-{ (1S, 2R)-2-гидрокси-3-оксо-1-фенилметил-6-(2-пиридилокси)}гексилацетамид (405 мг, 0,57 ммоль) растворяли в метиленхлориде (0,6 мл) и диметилсульфоксиде (0,6 мл), после чего добавляли трифторацетат пиридиния (55 мг, 0,29 ммоль) и 1-(3-диметиламинопропил)-3-этилкарбодиимид-гидрохлорид (328 мг, 1,71 ммоль) и смесь перемешивали при комнатной температуре в течение 1,5 ч. После добавления воды реакционный раствор экстрагировали этилацетатом и сушили над безводным сульфатом натрия. Органический слой концентрировали при пониженном давлении, полученный остаток очищали колоночной хроматографией на силикагеле (метиленхлорид/этилацетат = 1/1), в итоге получали указанное в заглавии соединение (180 мг, выход 45%).
1Н-ЯМР (СDCl3): 1,95-2,10 (2Н, m), 2,68-2,92 (2Н, m), 2,99 (1Н, dd, J= 7,7 и 14,0 Гц), 3,18 (1Н, dd, J=5,6 и 14,1 Гц), 4,21-4,29 (4Н, сложный спектр), 4,46 (2Н, s), 5,24-5,34 (1Н, m), 5,47 (1Н, t, J=6,1 Гц), 6,64-6,72 (2Н, сложный спектр), 6,83 (1Н, ddd, J= 0,9, 5,1 и 7,2), 7,02-7,09 (1Н, m), 7,14-7,66 (16Н, сложный спектр), 8,06-8,11 (1Н, m), 8,15 (1Н, s); MC: m/z = 709 (M + 1).
Пример 57
Синтез 2-{ 6-оксо-2-фенил-5-(4-пиридилметилокси-карбониламино)-1,6-дигидропиримидин-1-ил}-N-{2,3-диоксо-1-фенилметил-6-(2-пиридилокси)}гексилацетамида (соединение 78) проводили следующим образом.
(1) 2-{ 6-Оксо-2-фенил-5-(4-пиридилметилокси-карбониламино)-1,6-дигидропиримидин-1-ил} -N-{ (1S,2R)-2-ацетилокси-3-оксо-1-фенилметил-6-(2-пиридилокси)}гексилацетамид (соединение 26).
К раствору известного промежуточного соединения - дигидрохлорида 2-(5-амино-6-оксо-2-фенил-1,6-дигидропиримидин-1-ил} -N-{(1S,2R)-2-ацетилокси-3-оксо-1-фенилметил-6-(2-пиридилокси)} гексилацетамида (656,5 мг, 1,0 ммоль) в метиленхлориде (10 мл) медленно добавляли при охлаждении во льду, в атмосфере аргона раствор трифосгена (445 мг, 1,5 ммоль) в метиленхлориде (1 мл), смесь перемешивали в течение 45 мин. Затем к смеси добавляли 4-пиридин-метанол (349 мг, 3,2 ммоль) и смесь перемешивали при 0oС в течение 1 ч и при комнатной температуре в течение ночи. После добавления насыщенного водного раствора бикарбоната натрия реакционный раствор экстрагировали этилацетатом и промывали насыщенным раствором хлористого натрия. После высушивания над безводным сульфатом натрия органический слой концентрировали при пониженном давлении и очищали полученный остаток колоночной хроматографией на силикагеле (этилацетат/метанол = 20/1), в итоге получали в виде белого твердого вещества 2-{ 6-оксо-2-фенил-5-(4-пиридилметил)оксикарбониламино-1,6-дигидропиримидин-1-ил} -N-{ (1S,2R)-2-ацетилокси-3-оксо-1-фенилметил-6-(2-пиридилокси)}гексилацетамид (544 мг, выход 76%).
1Н-ЯМР (СDСl3): 1,92-2,10 (2Н, m), 2,19 (3Н, s), 2,46-2,67 (2Н, m), 2,84 (14, dd, J=8,5 и 13,7 Гц), 2,98 (1Н, dd, J=6,6 и 13,6 Гц), 4,25 (2Н, dt, J= 1,1 и 6,2 Гц), 4,47 (2Н, d, J=3,3 Гц), 4,74-4,89 (1Н, m), 4,98 (1Н, d, J=2,1 Гц), 5,23 (2Н, s), 6,35 (1Н, d, J=9,2 Гц), 6,67 (14, d, J=8,4 Гц), 6,82 (1Н, ddd, J= 0,9, 5,2 и 7,1 Гц), 7,11-7,63 (13Н, сложный спектр), 8,04-8,11 (1Н, m), 8,62 (1Н, dd, J=1,6 и 4,5 Гц), 8,76 (1Н, ушир. s); MC: m/z = 719 (М + 1).
(2) 2-{ 6-Оксо-2-фенил-5-(4-пиридилметилокси-карбониламино)-1,6-дигидропиримидин-1-ил} -N-{ (1S, 2R)-2-гидрокси-3-оксо-1-фенилметил-6-(2-пиридилокси)}гексилацетамид (соединение 27).
Данное соединение синтезировали таким же способом, как в примере 56 (2), используя в качестве исходного материала 2-{6-оксо-2-фенил-5-(4-пиридилметилоксикарбониламино)-1,6-дигидропиримидин-1-ил} -N-{ (1S,2R)-2-ацетилокси-3-оксо-1-фенилметил-6-(2-пиридилокси)}гексилацетамид.
1Н-ЯМР (СDСlз): 1,91-2,16 (2Н, m), 2,40-2,91 (2Н, m), 2,97 (2Н, d, J=8,1 Гц), 3,88 (1Н, d, J=3,7 Гц), 4,03-4,11 (1Н, ушир. s), 4,18-4,32 (2Н, m), 4,33 (1Н, d, J=15,5 Гц), 4,48 (1Н, d, J=15,3 Гц), 4,64-4,82 (1Н, m), 5,23 (2Н, s), 6,24 (1Н, d, J=9,4 Гц), 6,62 (1Н, d, J=8,3 Гц), 6,77-6,89 (14, m), 7,15-7,65 (14Н, сложный спектр), 8,06 (1Н, dd, J=1,8 и 5,1 Гц), 8,62 (1Н, dd, J=1,6 и 4,5 Гц), 8,76 (1Н, s); MC: m/z + 677 (M + 1).
(3) 2-{ 6-Оксо-2-фенил-5-(4-пиридилметилокси-карбониламино)-1,6-дигидропиримидин-1-ил} -N-{2,3-диоксо-1-фенилметил-6-(2-пиридилокси)}гексилацетамид (соединение 78)
Данное соединение синтезировали таким же способом, как в примере 56 (3), используя в качестве исходного материала 2-{6-оксо-2-фенил-5-(4-пиридилметилоксикарбониламино)-1,6-дигидропиримидин-1-ил} -N-{ (1S,2R)-2-гидрокси-3-оксо-1-фенилметил-6-(2-пиридилокси)}гексилацетамид.
1Н-ЯМР (СDСlз): 2,01-2,16 (2Н, m), 2,74-3,09 (3Н, сложный спектр), 3,22 (1H, dd, J=5,5 и 14,0 Гц), 4,31 (2Н, t, J=6,2 Гц), 4,50 (2Н, s), 5,24 (2Н, s), 5,26-5,38 (1Н, m), 6,59 (1Н, d, J=6,8 Гц), 6,64-6,74 (1Н, m), 6,84 (1Н, ddd, J=0,9, 6,0 и 7,2 Гц), 7,00-7,69 (14 Н, сложный спектр), 8,06-8,14 (1Н, m), 8,62 (1Н, dd, J=1,6 и 4,5 Гц), 8,75 (1Н, s); MC: m/z = 675 (M + Н).
Пример 58
Синтез 2-(5-ацетиламино-6-оксо-2-фенил-1,6-дигидропиримидин-1-ил)-N-{ 2,3-диоксо-1-фенилметил-6-(2-пиридилокси)} гексилацетамида (соединение 80) проводили следующим образом.
(1) 2-(5-Ацетиламино-6-оксо-2-фенил-1,6-дигидропиримидин-1-ил)-N-{ (1S, 2R)-2-ацетилокси-3-оксо-1-фенилметил-6-(2-пиридилокси)} гексилацетамид (соединение 30).
Известное промежуточное соединение - дигидрохлорид 2-(5-амино-6-оксо-2-фенил-1,6-дигидропиримидин-1-ил)-N-{ (1S, 2R)-2-ацетилокси-3-оксо-1-фенилметил-6-(2-пиридилокси)}гексилацетамида (0,62 г, 1,0 ммоль) суспендировали в смеси растворителей тетрагидрофурана (3 мл) и метиленхлорида (2 мл), к этому раствору при охлаждении во льду добавляли триэтиламин (0,44 мл, 3,2 ммоль) и ацетилхлорид (0,08 мл, 1,1 ммоль) и перемешивали при комнатной температуре в течение 2 ч. После добавления ацетилхлорида (0,03 мл) и дополнительного перемешивания смеси в течение 1 ч реакционный раствор разбавляли этилацетатом и промывали последовательно дистиллированной водой и насыщенным раствором хлористого натрия. Органический слой сушили над безводным сульфатом натрия, затем концентрировали при пониженном давлении и очищали полученный остаток колоночной хроматографией на силикагеле (гексан/этилацетат/метанол = 10/10/1), в итоге получали указанное в заглавии соединение (506 мг, выход 81%).
1Н-ЯМР (СDСl3): 1,93-2,10 (2Н, m), 2,19 (3Н, s), 2,21 (3Н, s), 2,49-2,69 (2Н, m), 2,77-3,04 (2Н, m), 4,24 (2Н, t, J=6,3 Гц), 4,46 (2Н, d, J=4,5 Гц), 4,74-4,89 (1Н, m), 4,98 (1Н, d, J=2,2 Гц), 6,34 (1Н, d, J=9,2 Гц), 6,68 (1Н, d, J= 8,3 Гц), 6,82 (1Н, ddd, J=1,0, 5,1 и 6,0 Гц), 7,12-7,58 (11Н, сложный спектр), 8,01 (1Н, ушир. s), 8,05-8,10 (1Н, m), 9,09 (1Н, m); MC: m/z = 626(M + 1).
(2) 2-(5-Ацетиламино-6-оксо-2-фенил-1,6-дигидропиримидин-1-ил)-N-{ (1S, 2R)-2-гидрокси-3-оксо-1-фенилметил-6-(2-пиридилокси)} гексилацетамид (соединение 31).
Данное соединение синтезировали таким же способом, как в примере 56 (2), используя в качестве исходного материала 2-(5-ацетиламино-6-оксо-2-фенил-1,6-дигидропиримидин-1-ил)-N-{ (1S, 2R)-2-ацетилокси-3-оксо-1-фенилметил-6-(2-пиридилокси)}гексилацетамид.
1Н-ЯМР (СDСl3): 1,96-2,13 (2Н, m), 2,21 (3Н, s), 2,45-2,89 (2Н, m), 2,98 (2Н, d, J=8,1 Гц), 3,89 (1Н, d, J=3,8 Гц), 4,09 (1Н, d, J=3,4 Гц), 4,18-4,52 (4Н, сложный спектр), 4,65-4,80 (1Н, m), 6,24 (1Н, d, J=9,5 Гц), 6,63 (1Н, d, J=8,3 Гц), 6,83 (1Н, ddd, J=0,98, 5,1 и 6,0 Гц), 7,06-7,60 (11Н, сложный спектр), 8,01 (1Н, ушир. s), 8,04-8,10 (1Н, m), 9,09 (1Н, s); MC (FAB): m/z = 584 (M + 1).
(3) 2-(5-Aцeтилaминo-6-oкco-2-фeнил-1,6-дигидponиpимидин-1-ил)-N-{2,3-диoкco-1-фенилметил-6-(2-пиридилокси)}гексилацетамид (соединение 80).
Данное соединение синтезировали таким же способом, как в примере 54 (3), используя в качестве исходного материала 2-(5-ацетиламино-6-оксо-2-фенил-1,6-дигидропиримидин-1-ил)-N-{ (1S,2R)-2-гидрокси-3-оксо-1-фенилметил-6-(2-пиридилокси)}гексилацетамид.
1Н-ЯМР (СDСl3): 2,00-2,18 (2Н, m), 2,21 (3Н, s), 2,75-3,28 (4Н, сложный спектр), 4,31 (2Н, t, J=6,2 Гц), 4,50 (2Н, s), 5,27-5,39 (1Н, m), 6,57 (1Н, d, J=6,5 Гц), 6,69 (14, d, J=8,4 Гц), 6,85 (1Н, ddd, J=0,93, 4,0 и 7,1 Гц), 7,01-7,09 (2Н, сложный спектр), 7,15-7,30 (3Н, сложный спектр), 7,35-7,61 (6Н, сложный спектр), 7,98 (1Н, ушир. s), 8,10 (1Н, ddd, J=0,77, 2,0 и 6,0 Гц), 9,08 (1Н, s); MC: m/z = 582 (M + 1).
Пример 59
Синтез 2-(5-ацетиламино-6-оксо-2-фенил-1,6-дигидролиримидин-1-ил)-N-{ 2,3-диоксо-6-(2-оксо-1,2-дигидропиридин-1-ил)-1-фенилметил} гексилацетамида (соединение 76) проводили следующим образом.
(1) 1-Аллил-5-амино-6-оксо-2-фенил-1,6-дигидропиримидин.
К раствору 1-аллил-5-трет-бутилоксикарбониламино-6-оксо-2-фенил-1,6-дигидропиримидина (2 г, 6,11 ммоль) в метаноле (12 мл) добавляли с охлаждением во льду смесь 4 н. соляная кислота/диоксан (31 мл, 122,2 ммоль) и перемешивали при 0oС в течение 30 мин и при комнатной температуре в течение ночи. Реакционный раствор концентрировали при пониженном давлении, в результате получали указанное в заглавии соединение в виде белого твердого вещества (1,49 г, выход 93%).
1Н-ЯМР (СD3ОD): 4,62 (2Н, dt, J= 1,6 и 3,5 Гц), 4,90-5,06 (1Н, m), 5,18-5,27 (1Н, m), 5,77-5,97 (1Н, m), 7,68 (1Н, s), 7,57-7,82 (54, m).
(2) 5-Ацетиламино-1-аллил-6-оксо-2-фенил-1,6-дигидропиримидин.
Гидрохлорид 1-аллил-5-амино-6-оксо-2-фенил-1,6-дигидропиримидина растворяли в тетрагидрофуране (27 мл) и триэтиламине (1,16 мл, 8,33 ммоль), к этому раствору при охлаждении во льду добавляли ацетилхлорид (0,284 мл, 3,99 ммоль) и смесь перемешивали при 0oС в течение 30 мин и при комнатной температуре в течение 2 ч. После добавления насыщенного водного раствора бикарбоната натрия реакционный раствор экстрагировали этилацетатом и промывали насыщенным раствором хлористого натрия. После сушки над безводным сульфатом натрия органический слой концентрировали при пониженном давлении, а полученный остаток очищали колоночной хроматографией на силикагеле (гексан/этилацетат = 1/2), в итоге получали указанное в заглавии соединение (617 мг, выход 69%).
1Н-ЯМР (СDСl3): 2,24 (3Н, s), 4,59 (24, dt, J=1,6 и 5,2 Гц), 4,88-5,02 (1Н, m), 5,18-5,27 (1Н, m), 5,86 (1Н, ddt, J=5,2, 10,3 и 17,2 Гц), 7,48 (5Н, s), 8,05 (1Н, br, s), 9,07 (1Н, s); MC: m/z = 539 (2М + Н).
(3) 3-(5-Ацетиламино-6-оксо-2-фенил-1,6-дигидропиримидин-1-ил)-1,2-пропандиол.
К раствору 5-ацетиламино-1-аллил-6-оксо-2-фенил-1,6-дигидропиримидина (888,6 мг, 3,3 ммоль) в тетрагидрофуране (13 мл) добавляли 50% водный раствор N-метилморфолин-N-оксида (1,55 мл, 6,6 ммоль) и 0,157 н. водный раствор тетроксида осмия (1,06 мл, 0,165 ммоль) и смесь перемешивали при комнатной температуре в течение 2 дней. После добавления насыщенного водного раствора тиосульфата натрия реакционный раствор экстрагировали этилацетатом и органический слой промывали насыщенным раствором хлористого натрия. После сушки над безводным сульфатом натрия органический слой концентрировали при пониженном давлении, а полученный остаток очищали колоночной хроматографией на силикагеле (метиленхлорид/метанол = 10/1), в итоге получали указанное в заглавии соединение в виде белого твердого вещества (1,06 г, количественный выход).
1Н-ЯМР (СDCl3): 2,25 (3Н, s), 2,40-2,58 (1Н, m), 3,29-3,63 (3Н, сложный спектр), 3,78-3,95 (1Н, m), 4,08-4,26 (2Н, m), 7,41-7,54 (5Н, s), 8,04 (1Н, m), 9,00 (1Н, s); MC: m/z = 304 (M + 1).
(4) (5-Ацетиламино-6-оксо-2-фенил-1,6-дигидропиримидин-1-ил)ацетальдегид.
К раствору 3-(5-ацетиламино-6-оксо-2-фенил-1,6-дигидропиримидин-1-ил)-1,2-пропандиола (1,06 г, 3,50 ммоль) в тетрагидрофуране (100 мл) добавляли водный
раствор (11,2 мл) перйодата натрия (897 мг, 4,19 ммоль) и смесь перемешивали в течение ночи при комнатной температуре. Реакционный раствор концентрировали как таковой и после добавления воды трижды экстрагировали продукт этилацетатом и промывали насыщенным раствором хлористого натрия. После сушки над безводным сульфатом натрия органический слой концентрировали при пониженном давлении, в результате получали указанное в заглавии соединение в виде белого твердого вещества (800 мг, выход 84%).
1Н-ЯМР (СDСl3): 2,23 (3Н, s), 4,80 (2Н, s), 7,38-7,57 (5Н, m), 7,95 (1Н, ушир. s), 9,11 (1Н, s), 9,61 (1Н, s); MC: m/z = 272 (M + 1).
(5) (5-Ацетиламино-6-оксо-2-фенил-1,6-дигидропиримидин-1-ил)уксусная кислота.
К раствору (5-ацетиламино-6-оксо-2-фенил-1,6-дигидропиримидин-1-ил)ацетальдегида (800 мг, 2,95 ммоль) в 2-метил-2-пропаноле (14,8 мл) добавляли 2-метил-2-бутен (1,38 мл, 12,98 ммоль), водный раствор (4,2 мл) однозамещенного фосфата натрия•1H2O (419 мг, 2,95 ммоль) и водный раствор (9,3 мл) хлорита натрия (934 мг, 10,32 ммоль), смесь перемешивали в течение ночи при комнатной температуре. Реакционный раствор промывали диэтиловым эфиром, затем рН водного слоя доводили лимонной кислотой до рН 4 и экстрагировали его 6 раз метиленхлоридом. Органический слой после высушивания над безводным сульфатом натрия концентрировали при пониженном давлении, в результате чего получали в виде белого твердого вещества 5-ацетиламино-6-оксо-2-фенил-1,6-дигидро-1-пиримидилуксусную кислоту (537 мг, выход 63%).
1Н-ЯМР (СDСl3): 2,23 (3Н, s), 4,20-4,80 (1Н, ушир. s), 4,64 (2Н, s), 7,45-7,55 (5Н, ушир. s), 8,16 (1Н, s), 9,11 (1Н, s); MC: m/z = 288 (M + 1), 575 (2М + 1).
(6) Синтез 2-(5-ацетиламино-6-оксо-2-фенил-1,6-дигидропиримидин-1-ил)-N-{ (1S, 2R)-2-гидрокси-3-оксо-6-(2-оксо-1,2-дигидропиридин-1-ил)-1-фенилметил}гексилацетамида (соединение 21) проводили следующим образом.
(4R, 5S)-5-{ 1-Оксо-4-(2-оксо-1,2-дигидропиридин-1-ил)бутил}-3-(N-трет-бутилоксикарбонил)-2,2-диметил-4-фенил-метилоксазолидин (интермедиат 12) (684 мг, 1,5 ммоль) растворяли в метаноле (7,5 мл), к этому раствору добавляли п-толуолсульфокислоту•1H2O (573 мг, 3,0 ммоль) и смесь нагревали в течение 1,5 ч с обратным холодильником. Реакционный раствор концентрировали при пониженном давлении, полученный остаток растворяли в смеси растворителей N, N-диметилформамида (7.5 мл) и тетрагидрофурана (7,5 мл), после чего при охлаждении во льду последовательно добавляли (5-ацетиламино-6-оксо-2-фенил-1,6-дигидропиримидин-1-ил)уксусную кислоту (400 мг, 1,4 ммоль), 1-гидроксибензтриазол•1Н2O (245 мг, 1,8 ммоль), 1-(3-диметиламинопропил)-3-этилкарбодиимид-гидрохлорид (347 мг, 1,8 ммоль) и N-метилморфолин (0,46 мл, 4,5 ммоль), затем температуру повышали до комнатной и смесь перемешивали в течение ночи. Реакционный раствор разбавляли этилацетатом и промывали последовательно 10% водным раствором лимонной кислоты, насыщенным водным раствором бикарбоната натрия, дистиллированной водой и насыщенным раствором хлористого натрия. Органический слой сушили над безводным сульфатом натрия и концентрировали при пониженном давлении, к полученному остатку добавляли смесь этилацетат/метанол/диэтиловый эфир, в результате чего выпадал твердый осадок. Осажденное твердое вещество собирали, в результате получали указанное в заглавии вещество (536 мг, выход 66%).
1Н-ЯМР (СDСl3): 1,88-2,07 (24, m), 2,22 (3Н, s), 2,46 (1Н, dt, J=7,0 и 18,6 Гц), 2,77 (1Н, dt, J=6,8 и 18,4 Гц), 2,98 (2Н, d, J=7,7 Гц), 3,78-4,02 (2Н, m), 4,02-4,06 (1Н, m), 4,17 (1Н, d, J=4,8 Гц), 4,46 (2Н, s), 4,55-4,72 (1Н, m), 6,16 (1Н, dt, J=1,3 и 6,7 Гц), 6,48 (1Н, d, J=8,5 Гц), 6,56 (1H, d, J= 9,2 Гц), 7,16-7,55 (12Н, сложный спектр), 8,29 (1Н, s), 9,06 (1Н, s); MC: m/z = 584 (M + 1), 1167 (2М + 1).
(7) 2-(5-Ацетиламино-6-оксо-2-фенил-1,6-дигидропиримидин-1-ил)-N-{2,3-диоксо-6-(2-оксо-1,2-дигидропиридин-1-ил)-1-фенилметил} гексилацетамид (соединение 76).
Данное соединение синтезировали таким же способом, как в примере 56 (3), используя в качестве исходного материала 2-(5-ацетиламино-6-оксо-2-фенил-1,6-дигидропиримидин-1-ил)-N-{ (1S, 2R)-2-ацетилокси-3-оксо-6-(2-оксо-1,2-дигидропиридин-1-ил)-1-фенилметил} гексилацетамид {в формуле (II): R0 = фенил, R1 = фенил, R2 = (2-оксо-1,2-дигидропиридин-1-ил)пропил, R3 = ацетил, Х = углерод, Y = азот, Z = метилен}.
1Н-ЯМР (СDСl3): 1,88-2,14 (2Н, m), 2,21 (3Н, s), 2,60-2,91 (2Н, m), 3,00 (1Н, dd, J=8,1 и 13,9 Гц), 3,21 (1Н, dd, J=5,9 и 14,1 Гц), 3,89 (2Н, t, J= 7,1 Гц), 4,51 (2Н, d, J=1,9 Гц), 5,02-5,15 (1Н, m), 6,17 (1Н, dt, J=1,3 и 6,6 Гц), 6,46 (14, d, J=8,9 Гц), 7,10-7,53 (12Н, сложный спектр), 7,83 (1Н, d, J=6,6 Гц), 8,35 (1Н, s), 9,02 (1Н, s); MC: m/z = 582 (M + 1).
Пример 60
Следующие соединения синтезировали в соответствии с примером 1 или другими примерами, описанными ранее.
Конкретно, тот же самый способ, как в примере 1 (3), был осуществлен для реакции окисления соответствующего спирта формулы (II), чтобы получить соединения формулы (I), где R1 - фенил, R3 - трет-бутилоксикарбонил. Х - углерод, Y - азот, Z - метилен, R0 и R2 - нижеследующие группы. Физические свойства соединений формулы (I) приведены ниже.
(1): R0 = фенил, R2 = бензиламиногруппа (соединение M1);
1Н-ЯМР (DMSO-d6): 1,48 (94, s), 2,86 (1Н, dd, J=8,5 и 13,9 Гц), 3,10 (1Н, dd, J=4,1 и 13,9 Гц), 4,35 (1Н, d, J=6,4 Гц), 4,47 (1Н, d, J=3,3 Гц), 5,26 (1Н, ddd, J=4,1, 6,9 и 8,5 Гц), 6,98-7,57 (15Н, сложный спектр), 8,02 (1Н, s), 8,40 (1Н, s), 8,67 (1Н, d, J=6,9 Гц), 9,28 (1Н, t, J=6,4 Гц); МС: m/z = 610 (M + 1).
(2): R0 = 4-метоксифенил, R2 = метоксигруппа (соединение М2);
1Н-ЯМР (СDСl3): 1,54 (9Н, s), 3,02 (1Н, dd, J=6,4 и 14,2 Гц), 3,20 (14, dd, J= 5,9 и 14,2 Гц), 3,75 (3Н, s), 3,89 (3Н, s), 4,50 (2Н, d, J=2,2 Гц), 5,43 (14, dd, J=6,4 и 13,3 Гц), 6,49 (1Н, d, J=7,0 Гц), 6,77 (2Н, d, J=8,8 Гц), 6,97 (2Н, d, J=8,8 Гц), 7,27 (пик растворителя, перекрывающийся с 1Н), 7,46 (5Н, s), 8,72 (1Н, s).
Пример 61
Следующие соединения синтезировали в соответствии с примером 1 или другими примерами, приведенными выше.
Конкретно, такой же способ, как в примере 1 (4), был осуществлен для снятия защиты с соединений формулы (I), где R3 - трет-бутилоксикарбонильная группа, чтобы получить соответствующие гидрохлориды соединений формулы (I), где R3 - водород, R1 - фенил, Х - углерод, Y - азот, Z - метилен, R0 и R2 - нижеследующие группы.
(1) R0 = фенил, R2 = бензиламиногруппа (соединение М3);
1Н-ЯМР (CDCl3): 2,73-2,90 (1H, m), 3,04-3,16 (1Н, m), 4,28-4,50 (4Н, m), 5,20-5,35 (1Н, m), 7,01-7,51 (16Н, сложный спектр), 8,61 (1Н, d, J=7,0 Гц), 9,28 (1Н, t, J=6,3 Гц); МС: m/z = 510 (M + 1).
(2) R0 = 4-метоксифенил, R2 = метоксигруппа (соединение М4);
1Н-ЯМР (DMSO-d6): 2,77 (1Н, dd, J=8,6 и 14,1 Гц), 3,02 (1H, dd, J=5,4 и 14,1 Гц), 3,57 (3Н, s), 4,35-4,97 (пик растворителя, перекрывается с 3Н), 6,80 (2Н, d, J= 8,6 Гц), 7,50 (2Н, d, J=8,6 Гц), 7,34-7,62 (5Н, сложный спектр, перекрывается с 1Н), 9,06 (1Н, t, J=6,5 Гц).
Пример 62. Пример фармацевтического состава (инъекция)
К 30 весовым частям соединения по настоящему изобретению и 18 весовым частям хлористого натрия (100 частей по весу глюкозы) добавляют очищенную воду, чтобы получить всего 2000 весовых частей раствора, затем фильтруют его через фильтр Millipore типа GS для удаления бактерий; 2 г фильтрата переносят пипеткой во флакон и закупоривают его, чтобы получить инъекцию, содержащую 30 мг данного соединения.
Пример 63. Пример фармацевтического состава (таблетки)
10 весовых частей соединения по настоящему изобретению, 30 весовых частей картофельного крахмала, 150 весовых частей кристаллической лактозы, 108 весовых частей кристаллической целлюлозы и 2 весовых части стеарата магния смешивают в миксере V-образной формы и таблетируют в таблетки весом 60 мг, чтобы получить таблетки, каждая из которых содержит 2 мг данного соединения.
В дальнейшем конкретно описывается биологическая активность данных соединений со ссылкой на примеры тестирования.
Пример тестирования 1
(1) Ингибирующая активность в отношении химазы.
Известно, что химаза присутствует в тканях различных животных, и методы ее выделения и очистки описаны в Anal. Biochem. 1984. V. 137. Р. 449 и FEBS Letters. 1993. V. 323. Р. 119. В данном изобретении очистку химазы проводили методами, описанными в этих работах, и была испытана ингибирующая активность данных соединений в отношении к химазе, в отношении активации мастоцитов и эозинофилов, а также их фармакологическое действие на животных. Далее описаны конкретные методы.
(А) Получение химазы крысы.
Измельчали бритвенными лезвиями и скальпелем 50 г языков крыс, суспендировали в 0,1 М фосфатном буфере (рН 8,0) и разрушали в гомогенизаторе Polytron в течение 5 мин, чтобы получить раствор неочищенного фермента химазы. Этот раствор центрифугировали при 23500 g в течение 20 мин и осадки использовали как фракцию фермента химазы. Осадки промывали при двукратном повторении вышеуказанной процедуры, затем суспендировали в 0,1 М фосфатном буфере (рН 8,0), содержащем 2 М хлористый натрий и 5% сульфат аммония, и центрифугировали при 100000 g в течение 45 мин, чтобы получить супернатант в качестве фракции химазы. Супернатант наносили на колонку с октил-сефарозой 4В (40•100 мм), уравновешенную предварительно 0,1 М фосфатным буфером (рН 8,0), содержащим 2 М хлористый натрий и 5% сульфат аммония, и белок элюировали линейным градиентом концентрации хлористого натрия от 2 М до О М. Отбирали и концентрировали активную фракцию, расщепляющую сукцинил-лейцил-лейцил-валил-тирозил-метилкумариламид (далее на него ссылаются как на синтетический субстрат химазы, продукт фирмы Peptide Kenkyusho), и эту фракцию использовали как очищенную химазу крысы в последующих измерениях активности.
(B) Получение химазы человека.
Мелко измельчали бритвенными лезвиями и скальпелем 60 г человеческих миндалин, суспендировали в 0,1 М фосфатном буфере (рН 8,0) и разрушали в гомогенизаторе Potytron в течение 5 мин, чтобы получить раствор неочищенного фермента химазы. Его центрифугировали при 22000 g в течение 30 мин и осадки использовали как фракцию фермента химазы. Осадки промывали при двукратном повторении вышеуказанной процедуры, затем суспендировали в 0,1 М фосфатном буфере (рН 8,0), содержащем 2 М хлористый натрий и 5% сульфат аммония, и центрифугировали при 27000 g в течение 20 мин для получения супернатанта в качестве фракции химазы. Супернатант концентрировали с помощью ультрафильтрационной мембраны, затем наносили на колонку с G2000 SW-XL (6,0х300 мм) и элюировали 0,1 М фосфатным буфером (рН 8,0). Отбирали и концентрировали активную фракцию, расщепляющую синтетический субстрат химазы, и этот продукт использовали как очищенную химазу человека в последующих измерениях активности.
(C) Получение химазы собаки.
Мелко измельчали бритвенными лезвиями и скальпелем 60 г сердца собаки, суспендировали в 0,1 М фосфатном буфере (рН 8,0) и разрушали в гомогенизаторе Potytron в течение 5 мин, чтобы получить раствор неочищенного фермента химазы. Его центрифугировали при 22000 g в течение 15 мин и осадки использовали как фракцию фермента химазы. Осадки промывали при двукратном повторении вышеуказанной процедуры, затем суспендировали в 0,1 М фосфатном буфере (рН 8,0), содержащем 2 М хлористый натрий и 5% сульфат аммония, и центрифугировали при 27000 g в течение 40 мин для получения супернатанта в качестве фракции химазы. Для удаления макромолекулярных компонентов и концентрирования фракцию химазы пропускали через ультрафильтрационную мембрану, концентрат затем наносили на колонку Superdex 200 HR 10/30 (10•300 мм) и элюировали 0,1 М фосфатным буфером (рН 8,0). Отбирали и концентрировали активную фракцию, расщепляющую синтетический субстрат химазы, и этот продукт использовали как очищенную химазу собаки в последующих измерениях активности.
(D) Измерение ингибирующей активности в отношении химазы.
(a) Измерение с использованием синтетического субстрата.
Синтетический субстрат химазы использовали как субстрат для измерения ингибирующей активности в отношении химазы крысы, при этом на спектрофотометре измеряли флуоресценцию образующегося после реакции аминометилкумарина. Конкретно, 200 мкл 0,15 М трис-НСl буфера (рН 8,0), содержащего 0,1 мМ синтетического субстрата химазы, 0,0002 мкл раствора химазы крысы и 2 мкл соединений по данному изобретению в растворе диметилсульфоксида вносили в измерительную кювету объемом 0,5 мл и инкубировали при 37oС в течение 15 мин. После окончания реакции немедленно измеряли количество образовавшегося аминометилкумарина при длине волны возбуждения 370 нм и длине волны детектирования 460 нм, чтобы определить активность химазы, и рассчитывали концентрацию 50% ингибирования (IC50, нМ).
(b) Измерение с использованием ангиотензина I в качестве субстрата.
Ингибирующую активность в отношении химазы человека и химазы собаки измеряли с использованием в качестве субстрата, кроме указанного выше синтетического субстрата, также ангиотензина I (Peptide Kenkyusho). Конкретно, 200 мкл 0,15 М трис-НСl буфера (рН 8,0). содержащего 0,1 мМ ангиотензин I, 0,0002 мкл раствора химазы человека или собаки и 2 мкл соединений по данному изобретению в растворе диметилсульфоксида, вносили в пробирку объемом 1,5 мл и инкубировали при 37oС в течение 60 мин. После окончания реакции количество образовавшегося ангиотензина II немедленно измеряли с помощью высокоэффективной жидкостной хроматографии. чтобы определить активность химазы, с расчетом концентрации 50% ингибирования (IC50, нМ).
(Е) Измерение ингибирующей активности в отношении других протеаз, помимо химазы.
Измеряли ингибирующую активность соединений по настоящему изобретению в отношении эластазы человека, катепсина G человека, урокиназы человека, тромбина человека и фактора Ха человека, с использованием их соответствующих синтетических субстратов, таким же образом, как для химазы. Все вышеуказанные протеазы представляли собой коммерческие продукты фирмы Boehringer Mannheim или были очищены с использованием комбинации известных способов. Синтетические субстраты представляли собой субстраты, поставляемые фирмой Peptide Kenkyusho. В таблице А приведены синтетические субстраты для соответственных протеаз.
Тест проводили несколько раз. Химазу для каждого теста готовили описанным выше способом. Испытываемыми соединениями были соединения, приготовленные в соответствии с описанными выше примерами. Рассчитывали концентрацию 50% ингибирования (IC50, нМ) для каждого соединения в отношении химазы и других протеаз, результаты представлены в таблицах 13 и 14.
Как следует из таблиц 13 и 14, соединения по настоящему изобретению в низких концентрациях ингибируют химазу крысы, химазу собаки и химазу человека и, кроме того, проявляют селективность между иными протеазами и химазой. Далее, активность химазы человека и химазы собаки ингибируется подобным образом при низких концентрациях соединений, если для измерений используют также и ангиотензин I, который является одним из субстратов химазы in vivo. Кроме того, соединение 50, соединение 54, соединение 72, соединение 73, соединение 74, соединение 75, соединение 77, соединение 78, соединение 79, соединение 80 и соединение 82 обладают высокой ингибирующей активностью в отношении химазы человека, но не имеют ингибирующей активности в отношении других протеаз человека, поэтому ожидается, что они могут быть терапевтическими агентами, не обладающими побочным воздействием на тромболиз, свертывание крови и т. д. В частности, соединения, перечисленные в таблице 14, имеют особенно высокую ингибирующую активность в отношении химазы и поэтому считаются наиболее предпочтительными соединениями.
Пример тестирования 2
Ингибирующее действие на дегрануляцию мастоцитов.
(A) Получение мастоцитов.
30 Мл буферного раствора для мастоцитов (150 мМ хлористый натрий, 3,7 мМ хлористый калий, 3,0 мМ двузамещенный фосфат натрия, 3,5 мМ однозамещенный фосфат натрия, 5,6 мМ декстроза, рН 7,0) инъецировали в брюшную полость крысы (линия SD, самец, возраст 8-10 недель), отбирали клетки внутрибрюшинной полости и центрифугировали при 800 об/мин в течение 5 мин, затем отбирали в виде осадков инфильтрационные клетки брюшины. Осажденные клетки далее дважды промывали буферным раствором для мастоцитов, снова суспендировали при определенной заранее плотности и использовали в целевых экспериментах.
(B) Ингибирующее действие на дегрануляцию мастоцитов (ингибирующее действие на высвобождение гистамина из мастоцитов крысы).
Мастоциты, полученные по методике, описанной выше в (А), суспендировали при плотности 1•105 клеток в мл в буферном растворе для мастоцитов и выдерживали при 37oС. В пробирку объемом 1,5 мл, предварительно выдержанную при 37oС, добавляли 2 мкл каждого ингибитора и 200 мкл суспензии клеток и инкубировали при 37oС в течение 10 мин. После окончания инкубации к содержимому пробирки добавляли 2 мкл антител анти-IgE (продукция фирмы BETHYL Lab., Inc. ) и инкубировали еще в течение 15 мин при 37oС. После окончания реакции реакционную смесь немедленно охлаждали во льду и центрифугировали при 4oС при 4000 об/мин, в течение 5 мин, затем надосадочную жидкость отбирали и хранили. Гистамин в надосадочной жидкости модифицировали орто-фталальдегидом и его количество измеряли с помощью высокоэффективной жидкостной хроматографии для определения концентрации 50% ингибирования (IC50, мкМ). Результаты приведены в таблице 15.
Пример тестирования 3
Ингибирующая активность в отношении активации эозинофилов.
(A) Получение эозинофилов.
Полимиксин В (продукция фирмы Sigma) вводили внутрибрюшинно морской свинке (линия Hartley, самец 6-недельного возраста) в дозе 1 мг один раз в неделю в течение 6-8 недель. После последнего введения полимиксина В в брюшную полость морской свинки вводили 50 мл PBS (забуференного фосфатом раствора хлористого натрия) и извлекали клетки. Клетки центрифугировали при 800 об/мин, в течение 5 мин, собирали инфильтрационные клетки брюшины в виде осадков и суспендировали их в 1 мл 40% фикола (40% раствор фикола (продукция фирмы Pharmacia) в сбалансированном солевом растворе Хэнкса) и наслаивали поверх ступенчатого градиента плотности фикола (от 40 до 90%). Центрифугировали при 1500 об/мин в течение 40 мин и отбирали фракцию эозинофилов. В этой процедуре обычно получали эозинофилы с чистотой 99% или выше. Затем клетки дважды промывали средой RPMI 1640 (10% БСА (бычий сывороточный альбумин производства фирмы Boehringer Mannheim), снова суспендировали при заранее определенной плотности и использовали в целевом эксперименте.
(B) Ингибирующее действие на эозинофилы (ингибирующее действие на высвобождение активного кислорода из эозинофилов морской свинки).
Эозинофилы (чистотой 99% и выше), полученные методом центрифугирования в градиенте фикола, описанным выше в (А), суспендировали при плотности клеток 4•105 клеток в мл в буферном растворе (0,136 М хлористый натрий, 2,7 мМ хлористый калий, 1,8 мМ хлористый кальций, 1,0 мМ хлористый магний, 11,9 мМ двууглекислый натрий, 5,5 мМ D-глюкоза, 5,0 мМ HEPES, 0,36 мМ однозамещенный фосфат натрия, рН 7,2). Каждый ингибитор (2 мкл) и 180 мкл суспензии клеток помещали в ячейку 96-ячеечного планшета (белого цвета для измерений хемилюминесценции), предварительно выдержанного при 37oС, и инкубировали при 37oС в течение 10 мин. После окончания инкубации добавляли в каждую ячейку 20 мкл ФАТ (фактор активации тромбоцитов) (5•10-6 М) и 20 мкл раствора люминола и немедленно измеряли хемилюминесценцию (флуориметр фирмы Luminoscan Labosystem). Измеряли хемилюминесценцию в течение 5 мин для расчета концентрации 50% ингибирования (IC50, мкМ). Результаты представлены в таблице 16.
Как следует из таблиц 15 и 16, соединения по настоящему изобретению, имеющие ингибирующую активность в отношении химазы, ингибировали также в низких концентрациях активацию мастоцитов и эозинофилов, причем наблюдалось одновременное ингибирование мастоцитов и эозинофилов.
Примеры исследования токсичности заявленных соединений
Каждое из соединений 37, 54 и 79 вводили мышам внутрибрюшинно в дозе 50 мг/кг в день в течение четырех последовательных дней для исследования их соответствующей токсичности. Ни одно из исследуемых соединений не вызвало каких-либо аномальных изменений ни в общих полученных данных, ни и в весе тела мышей, и не проявило токсичности.
Каждое из соединений 52 и 71 перорально вводили хомячкам в дозе 200 мг/кг в день в течение 23 последовательных дней для того, чтобы определить обладают ли они соответствующей токсичностью, вызывающей изменения веса тела или нет. Исследования показали, что указанные соединения не вызывают заметных аномальных изменений веса тела даже на 23-й день и, таким образом, могут быть признаны высокобезопасными соединениями.
Хотя цитотоксичность не описана в Примерах тестирования 2 и 3 настоящего описания (см. с. 105-108), тем не менее, в соответствии с наблюдениями над тестируемыми клетками было выявлено, что все опытные образцы полученных соединений не обладают заметной цитотоксичностью.
Промышленная применимость
Как описано выше, соединения по настоящему изобретению, обладающие ингибирующей активностью в отношении химазы, ингибируют в низкой концентрации не только химазу крысы, но также и химазу человека, не ингибируя другие протеазы. Кроме того, соединения по настоящему изобретению ингибируют также конверсию химазой ангиотензина I в ангиотензин II и проявляют также ингибирующее действие на активацию эозинофилов, поэтому ожидается, что они могут быть лекарствами для лечения или профилактики таких болезней, как астма, аллергия, воспаления, ревматизм, гипертония, сердечная недостаточность, инфаркт миокарда, гипертрофия сердца, повреждения сосудов, сопровождающиеся ангиогенезом и атеромой, нефрит и почечная недостаточность и т.д. Т
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРОИЗВОДНЫЕ ФЕНАНТРИДИНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ОБЛАДАЮЩАЯ ПРОТИВООПУХОЛЕВОЙ АКТИВНОСТЬЮ, СПОСОБ ИНГИБИРОВАНИЯ РОСТА РАКОВЫХ КЛЕТОК | 1997 |
|
RU2183626C2 |
| СПОСОБ ПОЛУЧЕНИЯ ОПТИЧЕСКИ АКТИВНЫХ ЭФИРОВ ЭРИТРО-3-АМИНО-2-ОКСИМАСЛЯНЫХ КИСЛОТ И СООТВЕТСТВУЮЩИХ ИСХОДНЫХ КИСЛОТ | 1997 |
|
RU2169138C2 |
| АНАЛОГ 3-ФЕНИЛЦИННОЛИНА И ПРОТИВООПУХОЛЕВОЕ СРЕДСТВО НА ЕГО ОСНОВЕ | 2003 |
|
RU2324683C2 |
| СПОСОБ ИДЕНТИФИКАЦИИ ПРОТИВООПУХОЛЕВЫХ ЦЕЛЕВЫХ ФЕРМЕНТОВ | 2002 |
|
RU2319482C2 |
| ПРОИЗВОДНЫЕ 22-ТИАВИТАМИНА D, СПОСОБ ИХ ПОЛУЧЕНИЯ, СПОСОБЫ ПОЛУЧЕНИЯ СОЕДИНЕНИЙ, СОЕДИНЕНИЯ | 1995 |
|
RU2142941C1 |
| ПРОИЗВОДНЫЕ [1,2,4]ТРИАЗОЛО[1,5-a]ПИРИМИДИН-2-ИЛМОЧЕВИНЫ И ЕГО ПРИМЕНЕНИЕ | 2004 |
|
RU2348636C2 |
| ХИНОЛИНОВЫЕ И ХИНАЗОЛИНОВЫЕ ПРОИЗВОДНЫЕ | 2000 |
|
RU2256654C2 |
| Синтез карбамоилпиридоновых ингибиторов интегразы ВИЧ и промежуточных соединений | 2013 |
|
RU2638923C2 |
| ПРОИЗВОДНЫЕ 2-ТИОУРАЦИЛА, ОБЛАДАЮЩИЕ ПРОТИВОАДЕНОВИРУСНОЙ АКТИВНОСТЬЮ | 2017 |
|
RU2670204C1 |
| ПРОИЗВОДНОЕ ГИДРАЗИНА, ИНСЕКТИЦИДНАЯ КОМПОЗИЦИЯ, СПОСОБ БОРЬБЫ С ВРЕДНЫМИ НАСЕКОМЫМИ, СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНОГО ГИДРАЗИНА | 1992 |
|
RU2041220C1 |

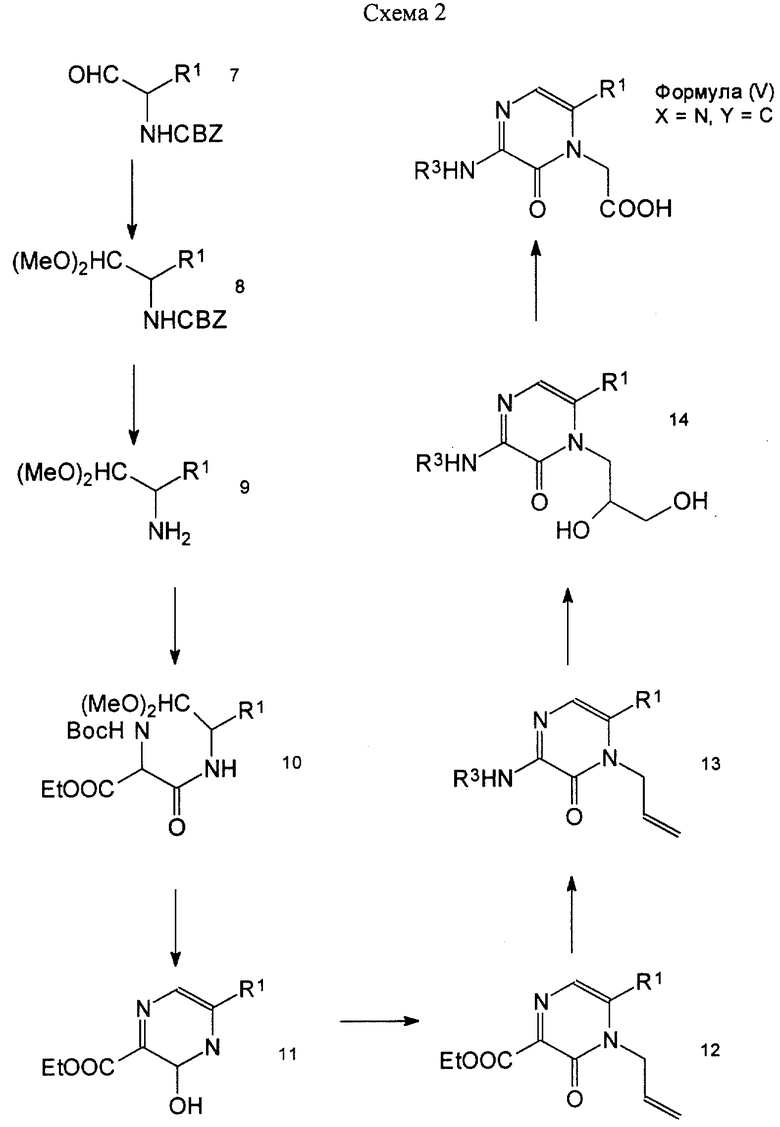
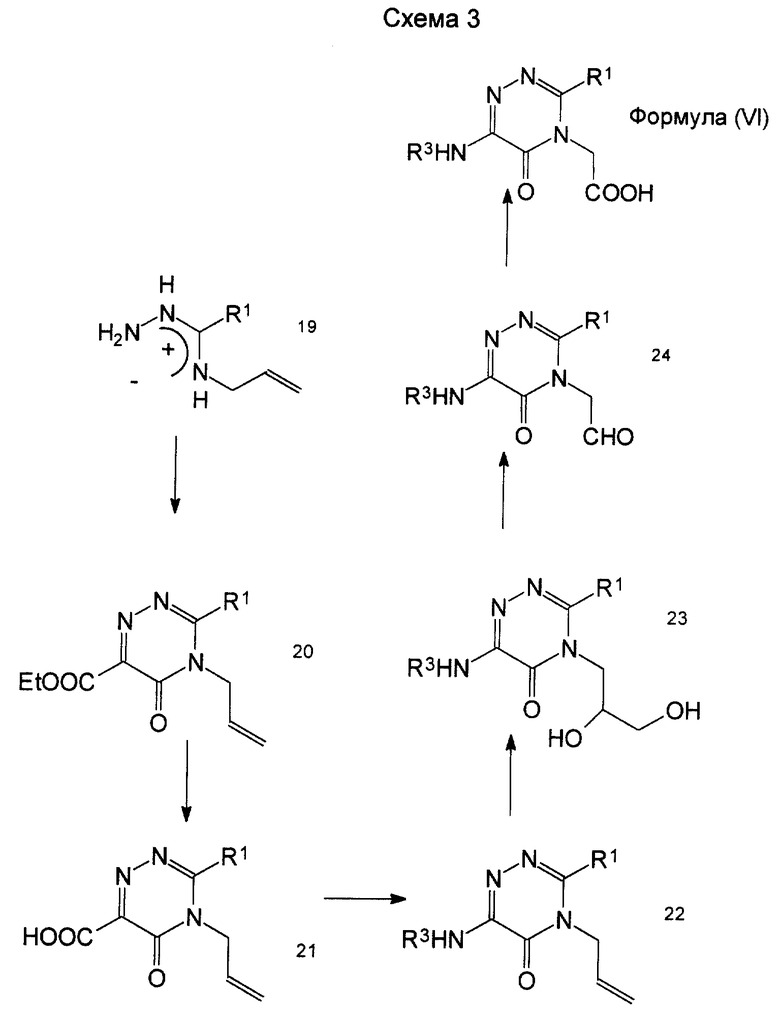
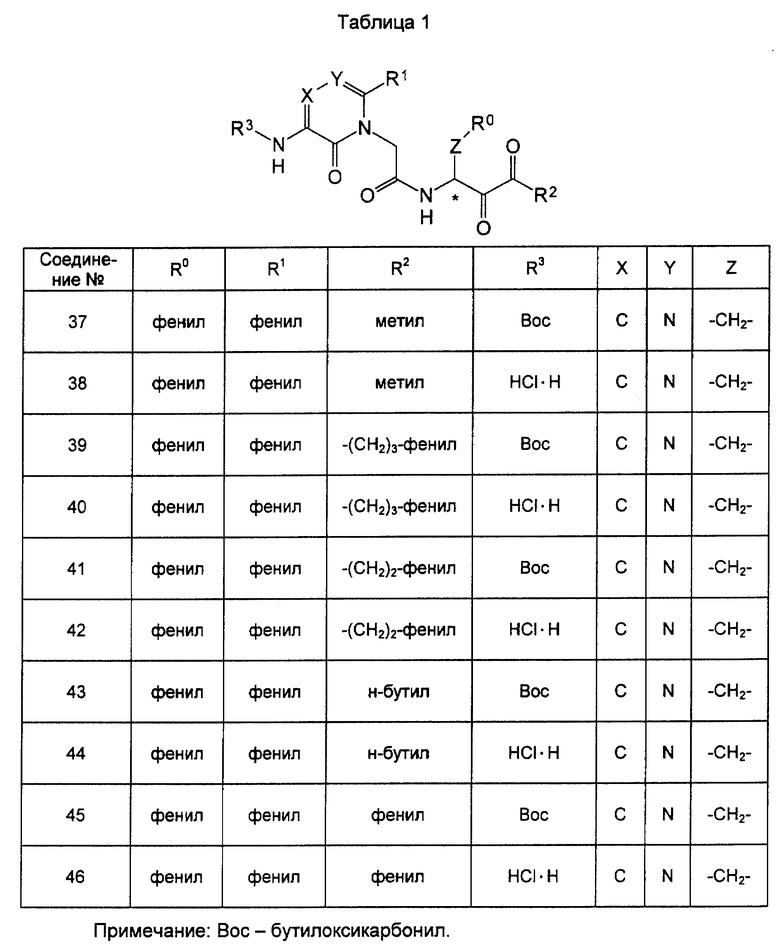
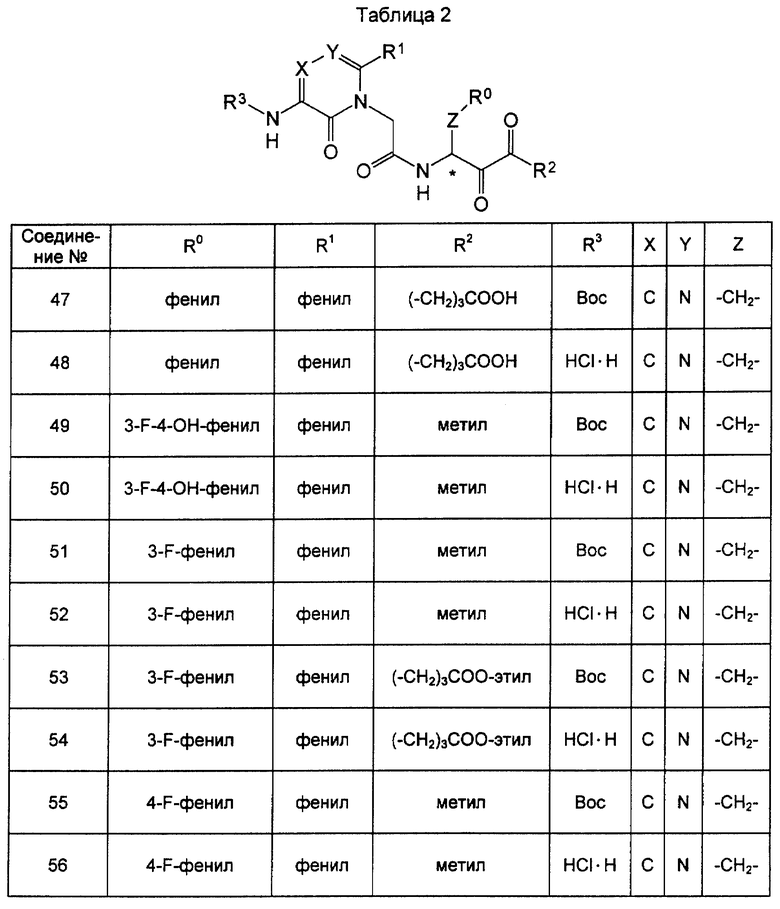

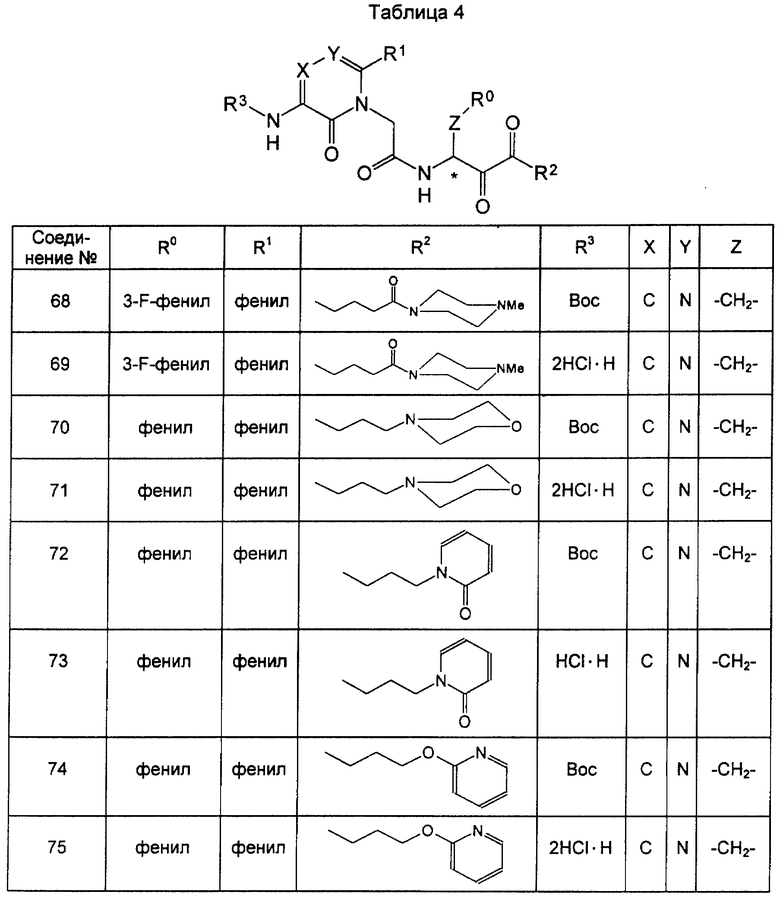
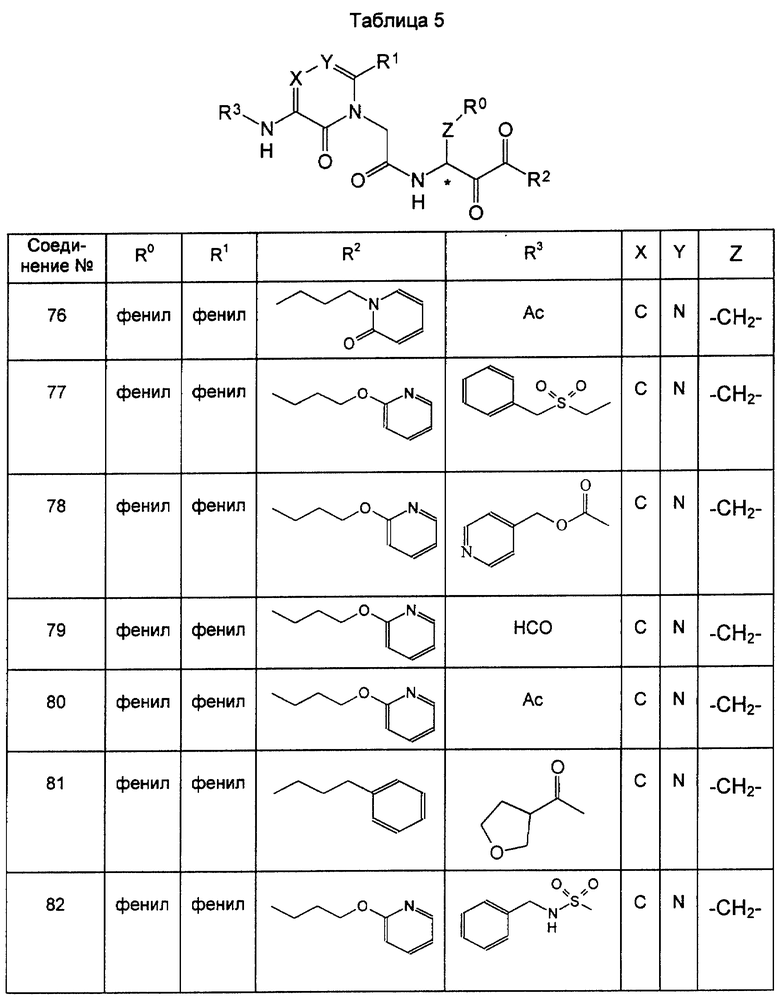

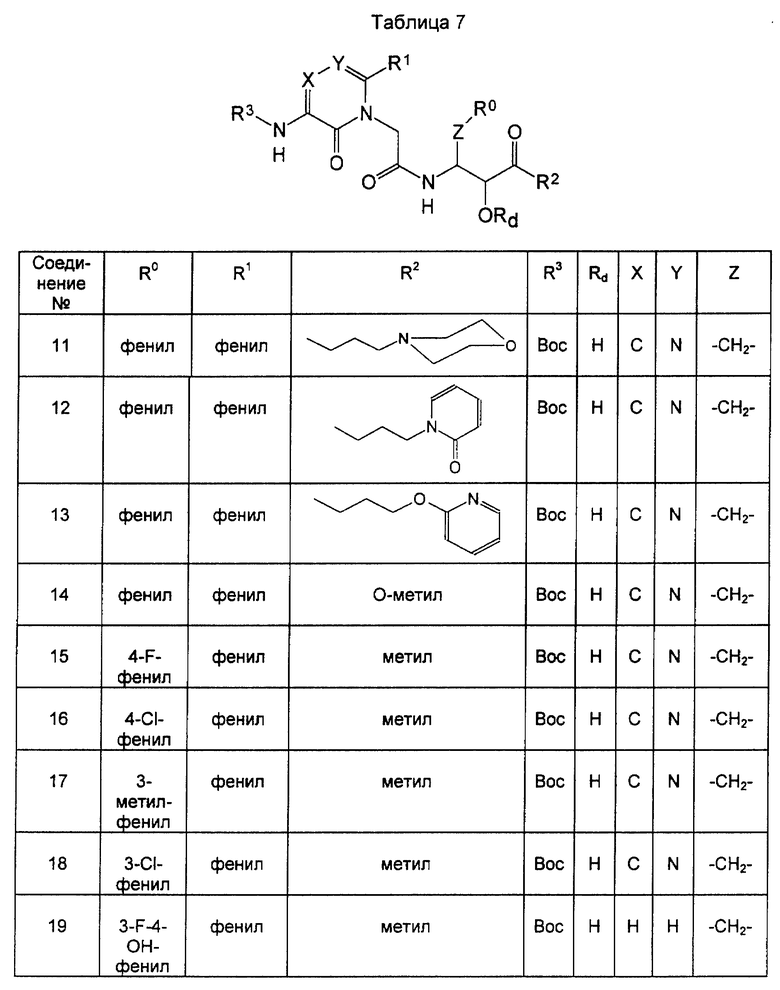
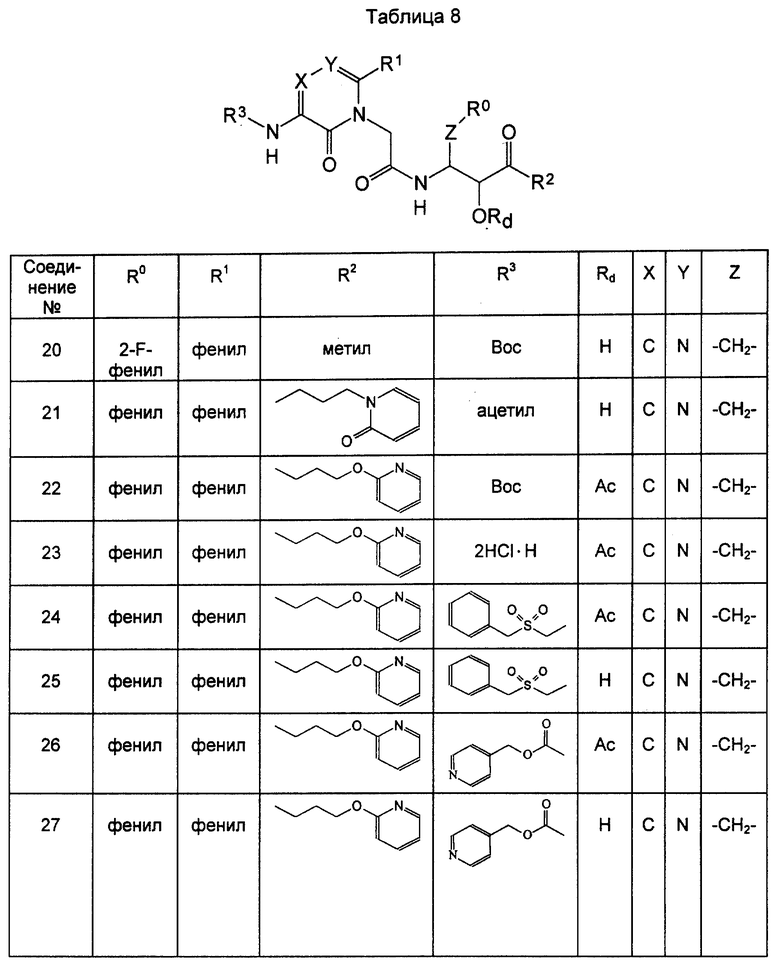
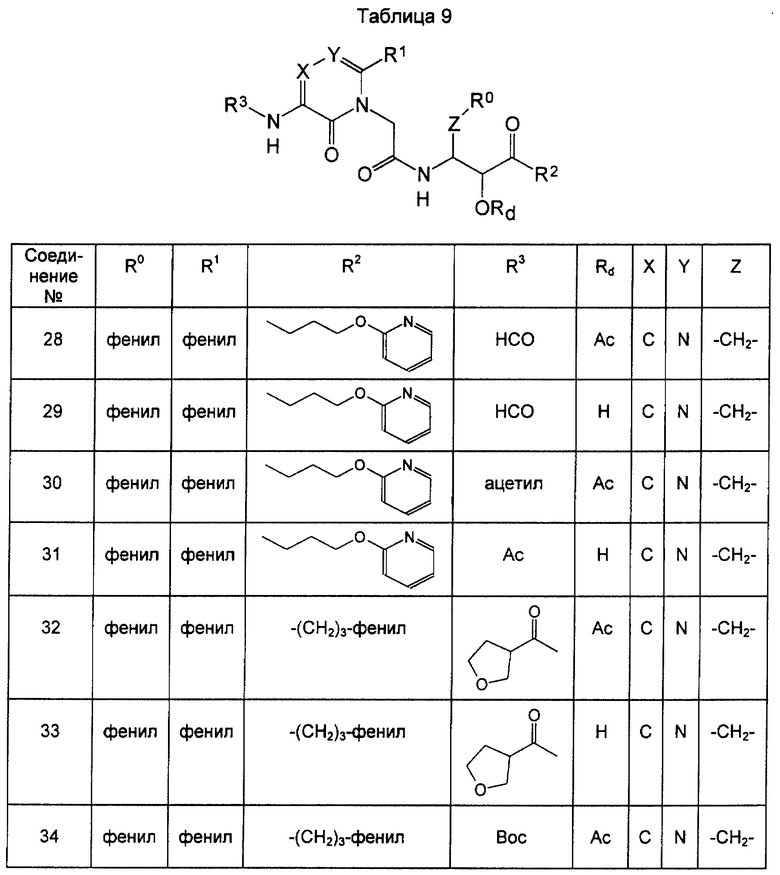
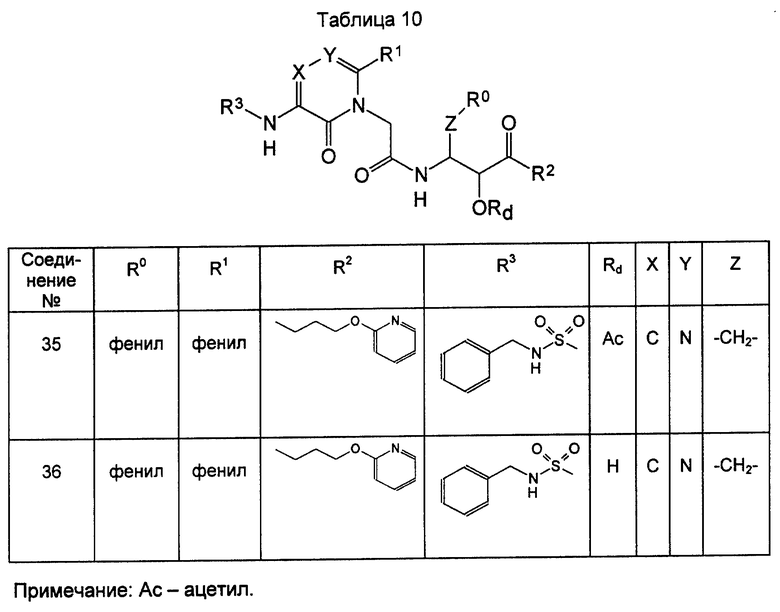
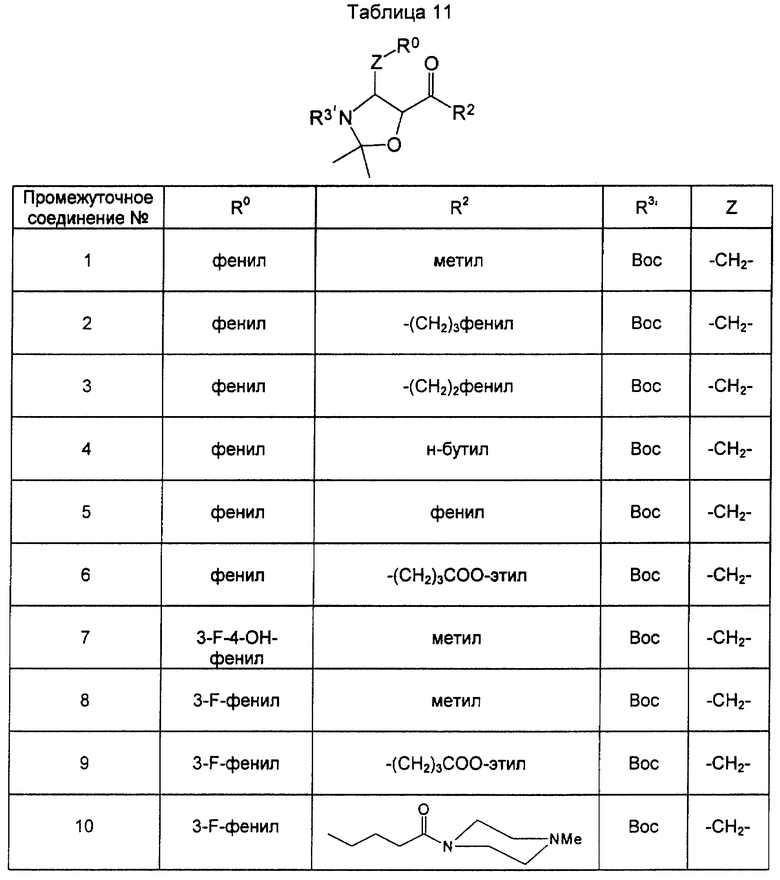
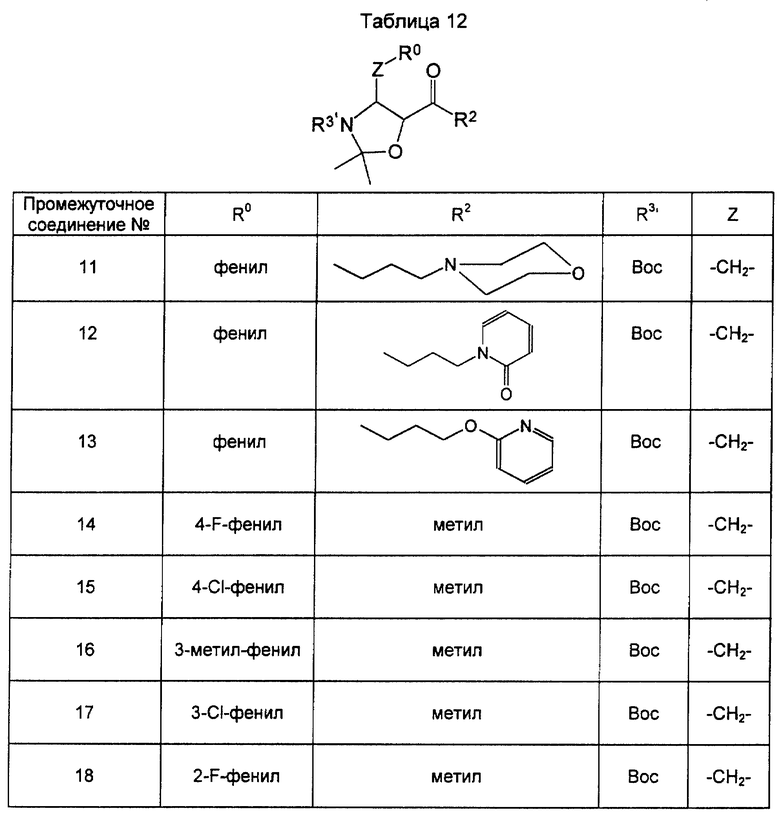
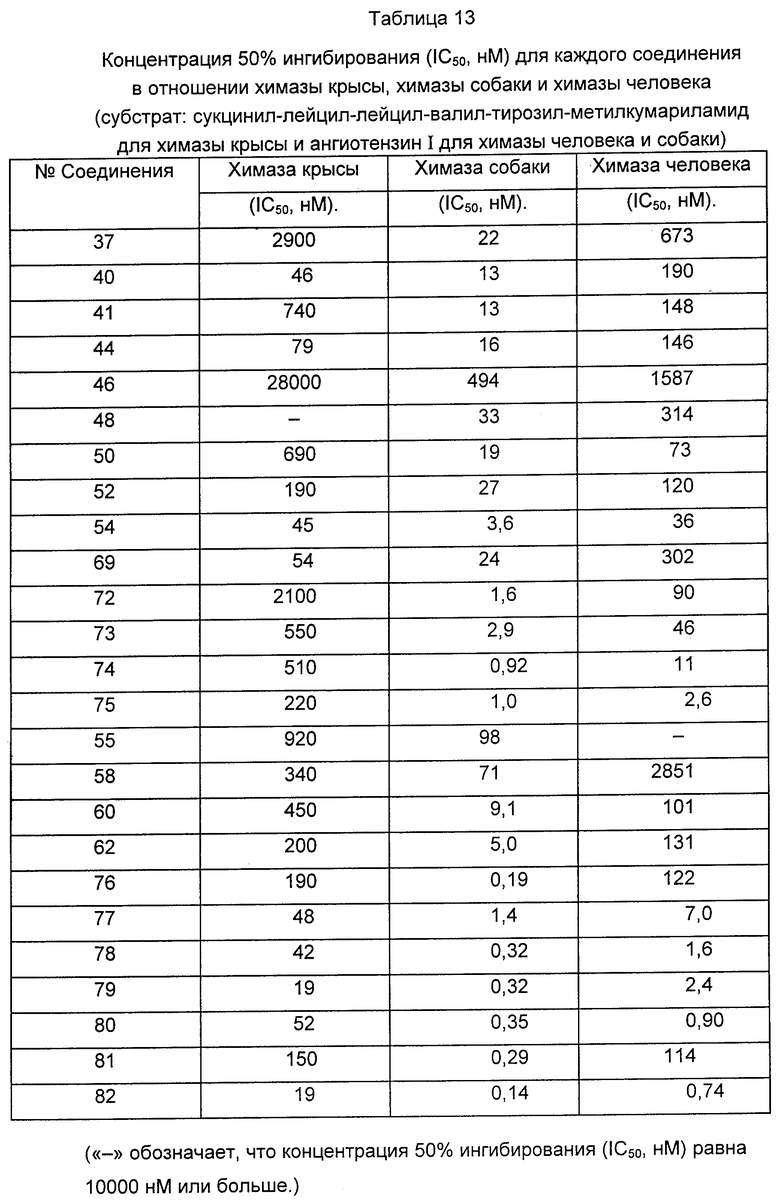
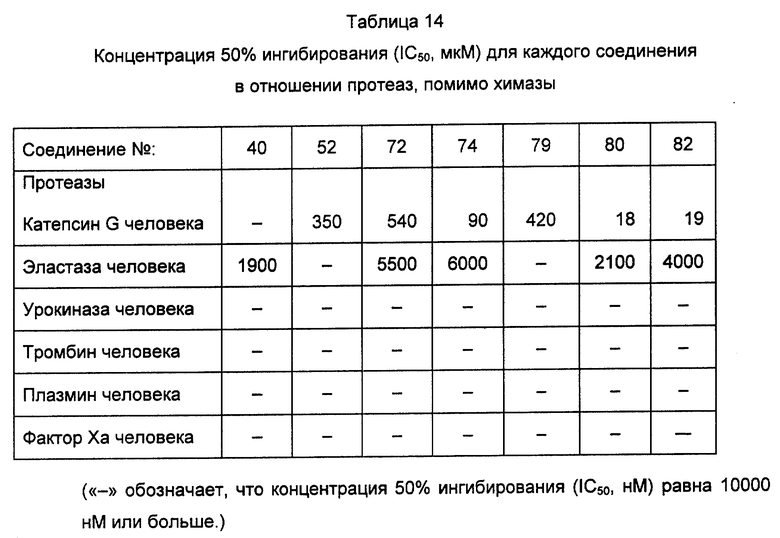

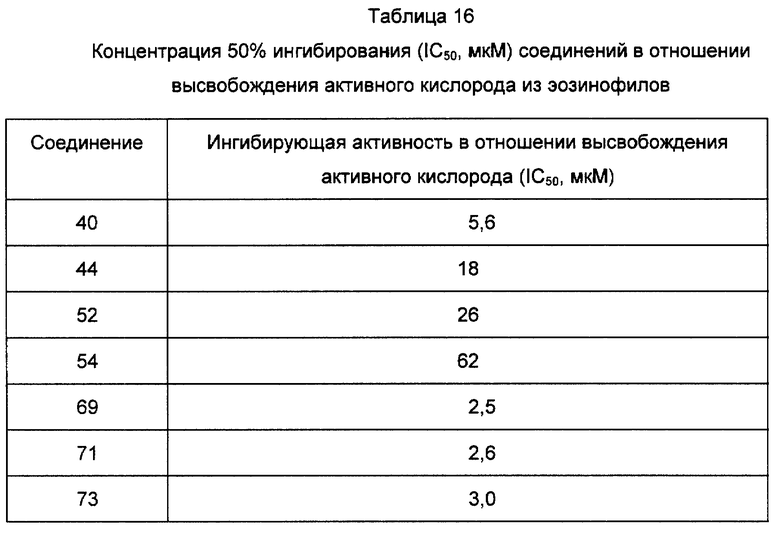

Изобретение относится к новым соединениям формулы (I), где R0 - фенил, R1 - фенил, гетероарил, низший алкил, который может быть замещенным или незамещенным, R2 - замещенный или незамещенный фенил, низший алкил, R3 - водород, ацильная группа, сульфонильная группа, Х и Y независимо представляют собой атом азота или атом углерода, Z - метиленовая группа. Эти соединения обладают ингибирующей активностью в отношении протеаз типа химотрипсина и могут быть использованы как ингибиторы указанных ферментов, особенно как ингибиторы химазы, а также в качестве активного ингредиента в фармацевтическом составе. Также настоящее изобретение относится к новому способу получения производных ацетамида формулы (I) путем окисления соединения формулы (II) после удаления защитной группы указанного соединения, если она присутствует. 10 с. и 14 з.п.ф-лы, 17 табл.
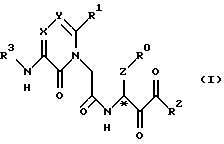
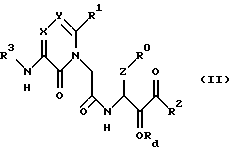
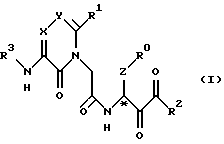
где R0 - фенильная группа, кольцо которой может содержать одну или более групп заместителей, отобранных из группы А, определенной ниже (группа А включает галоген и гидроксильную группу);
R1 представляет собой фенил, который может независимо содержать одну или более групп заместителей, отобранных из: группы В, состоящей из ORa и COORa (где Ra представляет собой водород, низший алкил, фенил-(1-7С)-алкил, гетероарил-(1-7С)-алкил, фенил и гетероарил, где гетероарильная группа представляет собой 5- или 6-членное кольцо, содержащее 1 атом кислорода или азота в качестве гетероатома), или из циклической группы G, определенной ниже;
R2 представляет собой (1-8С)-алкил, фенил-(1-7С)-алкил или фенил; или R2 представляет собой определенную выше группу В, или (1-8С)-алкил, содержащий группу В качестве замещающей группы; или (1-8С)-алкил, содержащий циклическую группу G в качестве замещающей группы (циклическая группа G представляет собой гетероциклическую группу, состоящую из 5- или 6-членного кольца, содержащего от 1 до 2 атомов азота, или 1 атом азота и 1 атом кислорода, и может содержать в качестве заместителя оксогруппу или(1-7)-алкильную группу);
R3 - водород; или R3 представляет собой: (i)D•(CH2)0-3•CO, (ii) D•СО•Е•СО или (iii) D•SO2•Е•СО в качестве ацильной группы; или R3 представляет собой D•(СН2)0-3•SO2 в качестве сульфонильной группы (где группа D представляет собой водород, С1-6 прямоцепную или разветвленную алкильную группу, фенил, RbRcN, RaO или Ra, где группы Ra, Rb и Rc независимо являются такими же, как определенная выше группа Ra; а группа Е представляет собой двухвалентную сшивающую группу, содержащую от 1 до 6 атомов углерода);
Х и Y независимо представляют собой атом азота или атом углерода; и
Z представляет собой метиленовую группу.
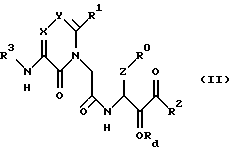
| Способ повышения стабильности светового потока люминесцентных ламп | 1974 |
|
SU528633A1 |
| Домовый номерной фонарь, служащий одновременно для указания названия улицы и номера дома и для освещения прилежащего участка улицы | 1917 |
|
SU93A1 |
| Топка с несколькими решетками для твердого топлива | 1918 |
|
SU8A1 |
| RU 94045874 А1, 10.09.1996. | |||
Авторы
Даты
2002-04-20—Публикация
1997-09-05—Подача