Предпосылки создания изобретения
Это изобретение вообще относится к способу превращения N-замещенных-N-(фосфонометил)глицинов (иногда их называют "N-замещенными глифосатами"), а также их сложных эфиров и солей в N-(фосфонометил)глицин (иногда его называют "глифосатом"), а также его сложных эфиров и солей реакцией окисления, катализируемой благородным металлом. В частности, это изобретение посвящено превращению N-замещенных глифосатов, а также их сложных эфиров и солей, имеющих единственную N-карбоксиметильную функциональную группу.
Глифосат описан Францем в патенте США 3799758 и имеет следующую формулу: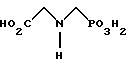
Глифосат и его соли удобны в водной рецептуре для использования в качестве послевсходового гербицида. Он является высокоэффективным и промышленно значимым гербицидом широкого спектра действия, применяемым при подавлении роста проросших семян, появившихся всходов, зрелой и укоренившейся древесной и травянистой растительности и водных растений.
В области техники известны различные способы получения глифосата из N-замещенных глифосатов. Например, в патенте США 3956370, Парри и др., разъясняется, что N-бензилглицин может быть фосфонометилирован до N-бензилглифосата и затем, при взаимодействии с бромистоводородной или йодистоводородной кислотой, бензильная группа отщепляется и в результате образуется глифосат. В патенте США 3927080, Гэйртнера, разъясняется, что N-трет-бутилглицин может быть фосфонометилирован с образованием N-трет-бутилглифосата и затем превращен в глифосат путем кислотного гидролиза. Глифосат также может быть получен из N-бензилглифосата путем гидрогенолиза, как описано, например, в заявке на Европейский патент 55695 и Л.Майером в журнале Phosphorus, Sulfur and Silicon, т. 61, с.65-67, 1991. Проблемой этих способов является то, что в них образуются нежелательные побочные продукты, такие как иэобутилен и толуол, которые создают проблемы в связи с их потенциальной токсичностью. Более того, кислотный гидролиз и гидрирование N-замещенных глифосатов были продемонстрированы только для алкильных групп, таких как трет-бутиль-ных и бензильных групп, которые, как известно, чувствительны к таким реакциям. Деалкилирование N-метил, N-изопропил и других N-замещенных глифосатов, которые не настолько восприимчивы к кислотному гидролизу или каталитическому гидрированию, не было продемонстрировано.
Другие способы получения глифосатов связаны с окислительным расщеплением N-(фосфонометил)иминодиуксусной кислоты (иногда называется ФМИДК):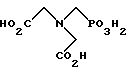
ФМИДК может быть синтезирована из трихлорида фосфора, формальдегида и водного раствора динатриевой соли иминодиуксусной кислоты, как описано Гентилкором в патенте США 4775498: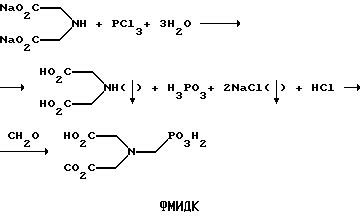
Хорошо известно из области техники, что ФМИДК может быть превращена в глифосат путем гетерогенного окисления над углеродными катализаторами, как описано, например, Францем в патенте США 3950402 и Балтазором и др. в патенте США 4654429; путем гомогенного каталитического окисления, как описано, например, Райли и др. в журналах J.Amer.Chem.Soc., т.113, с.3371-3378, 1991 и Inorq.Chem., т.30, с.4191-4197, 1991; и электрохимическим окислением с использованием угольных электродов, как описано Фразиером и др. в патенте США 3835000. Однако было показано, что эти способы окисления являются эффективными только для получения глифосата из N- (фосфонометил)иминодиуксусной кислоты, N-замещенного глифосата, имеющего две N-карбоксиметильные функциональные группы. Ни в одном из этих известных способов окисления уровня техники не было указано, что они применимы для получения глифосата из N-замещенных соединений глифосата, имеющих только одну N-карбоксиметильную функциональную группу, то есть когда R' в следующей формуле отличается от группы -CH2COOH: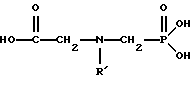
Напротив, во многих ссылках известного уровня техники предполагается, что если R1 представляет собой функциональную группу, отличающуюся от группы -СН2СООН, в этих способах уровня группа -СН2СООН будет расщепляться скорее, чем R1, и поэтому не удастся получить глифосат. Это действительно так для известных способов, которые направлены на гетерогенно-каталитическое окисление на углероде и для электрохимического окисления с использованием угольных электродов. Механизм этих процессов окисления хорошо известен из литературы, в частности для электрохимического окисления, где он известен как реакция Кольбе, описанная в различных книгах по органической электрохимии, например в книге С. Тории и X. Танака, Органическая электрохимия, с.535-580 (ред. H.Lund, M.M.Baizer, изд. Marcel Dekker, 3-е издание, 1991). Оба механизма включают окислительное разложение карбоновой кислоты до углеродного радикала и диоксида углерода: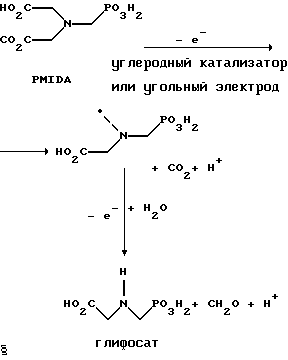
Отсутствуют предположения, что эти механизмы могут быть использованы для расщепления других функциональных групп, кроме группы -СН2СООН.
Таким образом, является желательным более общий способ окисления N-замещенных глифосатов в глифосаты. Такой способ обеспечил бы использование более широкого набора N-замещенных глицинов в качестве исходных материалов для получения глифосата. Кроме того, такой способ можно было бы использовать для получения глифосата из N-метилглифосата (иногда называется НМГ) - нежелательного побочного продукта при окислении N-(фосфонометил)иминодиуксусной кислоты (ФМИДК), катализируемого углеродом.
Краткое изложение изобретения
Таким образом, одной из целей изобретения является разработка способа получения глифосата, а также его сложных эфиров и солей путем окисления N-замещенных глифосатов, а также их сложных эфиров и солей. Более конкретно, целью этого изобретения является предоставление способа получения глифосата, а также его сложных эфиров и солей путем окисления N-замещенных глифосатов, а также их сложных эфиров и солей, имеющих единственную N-карбоксиметильную функциональную группу. Например, целью этого изобретения является предоставление способа получения глифосата путем окисления N-метилглифосата.
Следовательно, вкратце настоящее изобретение посвящено новому способу получения соединений формулы (I):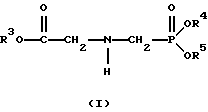
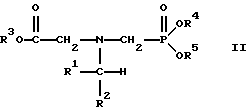
В этой формуле R3, R4 и R5 независимо представляют собой атом водорода, замещенный или незамещенный углеводородный радикал или приемлемый для сельского хозяйства катион. Это изобретение включает контактирование раствора с катализатором на основе благородного металла и введение кислорода в раствор. Этот раствор содержит N-замещенный глифосат, имеющий формулу (II):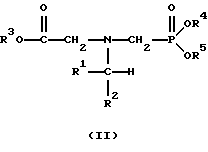
В этой формуле R1 и R2 независимо представляют собой атом водорода, атом галогена, группы -РО3Н2, -SО3Н, -NO2 или замещенный или незамещенный углеводородный радикал, отличающийся от группы -СООН. Радикалы R3, R4 и R5 такие же, как определено выше для формулы (I).
В другом варианте воплощения этого изобретения соединение (то есть вещество формулы (I)), которое может быть получено, представляет собой глифосат или его соль, a N-замещенный глифосат (т.е. вещество формулы (II)) является N-метилглифосатом или его солью. В ходе реакции раствор, имеющий температуру приблизительно от 125 до 150oС и контактирующий с N-метилглифосатом или его солью, контактирует с катализатором, содержащим благородный металл - платину. Кроме того, в ходе реакции в раствор добавляют 2,2,6,6-тетраметилпиперидин-N-оксид. Дополнительно в раствор вводят кислород со скоростью, которая обеспечивает предельную концентрацию растворенного кислорода в растворе, которая не превышает 2,0 ч./млн.
Третий вариант воплощения этого изобретения относится к катализатору окисления на основе благородного металла, на котором адсорбированы гидрофобные электроактивные молекулярные частицы.
Краткое описание чертежей
На фиг.1 показаны химические стадии, которые могут быть использованы для получения глифосата в соответствии с этим изобретением, используя различные N-замещенные глициновые предшественники.
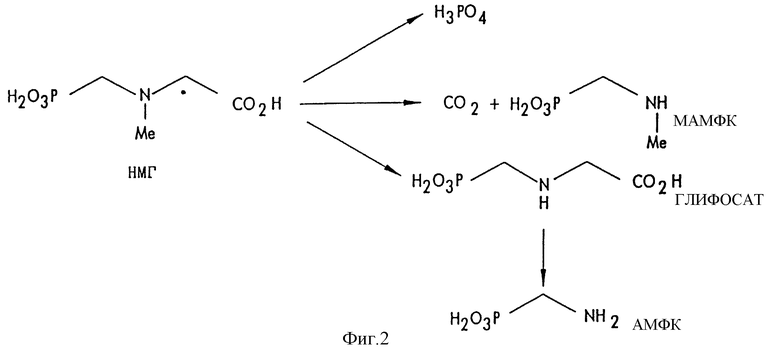
На фиг.2 обобщены различные вещества, которые могут быть получены в ходе окисления N-метилглифосата.
Подробное описание предпочтительных вариантов воплощения изобретения
Настоящее изобретение обеспечивает новый и эффективный способ получения глифосата, его солей и эфиров в водной среде, в которой N-замещенный глифосат или его соль, или эфир (обобщенно называются "N-замещенный глифосатный реагент") подвергают окислительному расщеплению кислородом над катализатором - благородным металлом. Преимущества получения глифосата из N-замещенных глифосатов с использованием этого способа включают простоту методики, низкую стоимость окислителя (например воздух или молекулярный кислород) и долговечность катализатора (т.е. незначительная дезактивация катализатора или ее отсутствие в течение нескольких циклов).
Несмотря на известные из уровня техники способы окислительного расщеплении N-замещенного глифосата, этот способ не ограничивается окислением ФМИДК (в которой имеются две N-карбоксиметильные функциональные группы). Напротив, этот способ также можно использовать для получения глифосата путем окислительного расщепления N-замещенных глифосатов, имеющих только одну N-карбоксиметильную функциональную группу. Следовательно, это изобретение существенно расширяет набор N-замещенных глифосатов, которые могут окисляться с образованием глифосата. В свою очередь, это существенно расширяет набор N-замещенных глицинов (предшественников многих N-замещенных глифосатов), которые могут служить исходным материалом для получения глифосата. Кроме того, это изобретение является ценным, так как оно обеспечивает способ получения глифосата из N-метилглифосата - нежелательного побочного продукта окисления ФМИДК, катализируемого углеродом.
N-Замещенные глифосатные реагенты настоящего изобретения имеют следующую формулу: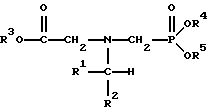
в которой предпочтительно R1 и R2 представляют собой независимо атом водорода, атом галогена, группы -РО3Н2, -SО3Н, -NO2 или замещенный или незамещенный углеводородный радикал, отличающийся от группы -СООН; и радикалы R3, R4 и R5 независимо являются атомом водорода, замещенным или незамещенным углеводородным радикалом или катионом, приемлемым для сельского хозяйства.
Используемый здесь термин "углеводородный радикал" определяется как радикал, состоящий исключительно из углерода и водорода. Этот углеводородный радикал может быть разветвленным или неразветвленным, может быть насыщенным или ненасыщенным и может содержать одно или несколько колец. Подходящие углеводородные функциональные группы включают алкильные, алкенильные, алкинильные и арильные. Они также включают алкильные, алкенильные, алкинильные и арильные функциональные группы, замещенные другими алифатическими или циклическими углеводородными группами, такими как алкарил, алкенарил и алкинарил.
Термин "замещенный углеводородный радикал" определяется как радикал, в котором по меньшей мере один атом водорода замещен атомом, отличающимся от водорода. Например, атом водорода может быть замещен атомом галогена, таким как хлор или фтор. Альтернативно, атом водорода может быть замещен атомом кислорода с образованием, например, гидроксигруппы, простого эфира, сложного эфира, ангидрида, альдегида, кетона или карбоновой кислоты (за исключением того, что ни R1, ни R2 не может быть карбоксильной группой, т.е. -СООН). Атом водорода также может быть замещен атомом азота с образованием амидной или нитрогруппы. Однако предпочтительно следует избегать замещения азотом азота с образованием аминовой или нитрильной группы. Кроме того, атом водорода может быть замещен атомом серы с образованием, например, группы -SО3Н, хотя следует избегать замещения серой с образованием тиола.
Следует признать, что R1 и R2 вместе могут образовать кольцо. Это кольцо может быть или углеводородным или гетероциклическим, причем по меньшей мере один атом водорода кольца может быть замещен, как описано выше для замещенных углеводородных функциональных групп.
В предпочтительном варианте воплощения изобретения каждый радикал R1, R3, R4 и R5 представляет собой атом водорода, а R2 представляет собой линейный, разветвленный или циклический углеводородный радикал, содержащий приблизительно до 19 атомов углерода. В более предпочтительном варианте изобретения каждый радикал R3, R4 и R5 представляет собой атом водорода и -CHR1R2 является метилом (т.е. R1 и R2 являются атомами водорода), изопропилом (т.е. R1 и R2 являются метилами), бензилом (т.е. R1 - атом водорода и R2 - фенил) или н-пентилом (т.е. R1 - атом водорода и R2 является углеводородным радикалом с 4 атомами углерода и нормальной цепочкой).
Многие N-замещенные глифосатные реагенты могут быть получены путем фосфонометилирования соответствующих N-замещенных глицинов, их солей или их амидов, например, по следующей реакции: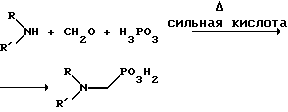
Фосфонометилирование вторичных аминов хорошо известно из уровня техники и подробно обсуждается в работе D.Redmore, Topics in Phosphorous Chem., т. 8, с. 515-585 (ред. Griffiths & Grayson, изд-во J.Wiley & Sons, 1976); и в разделе, озаглавленном "альфа-Замещенные фосфонаты" в книге P.Mastalerz "Справочник по фосфорорганической химии", с.277-375 (ред. Р. Энгел, изд-во Марсел Деккер, 1992).
Для приготовления N-замешенных глицинов и их солей и амидов можно использовать различные способы. В одном варианте этого изобретения N-замещенный глицин получают путем конденсации цианистого водорода, формальдегида и N-замещенных аминов с последующим гидролизом до N-замещенного глицина или его соли: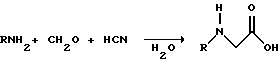
Эта реакция известна как синтез Штрекера. Синтез Штрекера хорошо известен в этой области химии и описан Г.Дайкером в журнале Angew.Chimie (межд. издание на англ. яз.), том 36, 16, с.1700-1702 (1997). Образовавшийся N-замещенный глицин может быть превращен в N-замещенный глифосат путем взаимодействия с формальдегидом и фосфористой кислотой (Н3РО3) в присутствии сильной кислоты.
В другом варианте воплощения этого изобретения N-замещенный глицин получают дегидрированием N-замещенного этаноламина в присутствии основания (предпочтительно гидроксида натрия) с образованием солей N-замещенных глицинов: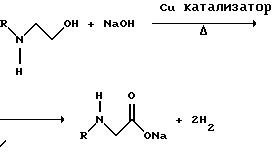
Эта реакция описана Франциком в патентах США 5292936 и 5367112 и Эбнером и др. в патенте США 5627125. N-замещенный этаноламиновый предшественник может быть приготовлен по меньшей мере двумя способами. В первом способе кетоны могут конденсироваться с моноэтаноламином в присутствии водорода, растворителя и катализатора - благородного металла. Эта реакция описана А.С. Соре и E.M.Hancock, J.Am.Chem.Soc., т.64, с.1503-1506 (1942). N-замещенные этаноламины также могут быть приготовлены путем взаимодействия монозамещенного амина (такого как метиламин) с оксидом этилена с образованием монозамещенных этаноламинов. Эту реакцию описал Йошида в заявке на патент Японии 95-141575. Образовавшуюся соль N-замещенного глицина можно превратить в N-замещенный глифо-сат путем взаимодействия с треххлористым фосфором (PCl3) в воде, затем соль отфильтровывают и добавляют формальдегид.
В альтернативном варианте этого изобретения N-замещенный глицин получают путем конденсации N-замещенных амидов, формальдегида и оксида углерода в присутствии кобальтового катализатора: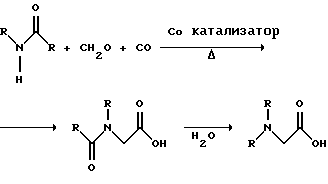
Эта реакция (т.е. карбоксиметилирование) описана Беллером и др. в заявке на Европейский патент 0680948; и Книфтоном, Applied Homogeneous Catalysis, 159-168 (ред. Cornils и др., VCH, Weinheim, Германия 1996). Продуктом этой реакции является N-ацетильное производное N-замещенного глицина, которое может быть подвергнуто гидролизу в N-замещенный глицин. Затем N-замещенный глицин может быть превращен в соответствующий N-замещенный глифосат путем взаимодействия с формальдегидом и фосфористой кислотой в присутствии сильной кислоты с последующим удалением карбоновой кислоты общеизвестными способами, такими как дистилляция или мембранное разделение.
В другом варианте этого изобретения N-замещенный глицин получают восстановительным алкилированием глицина, которое осуществляют путем взаимодействия карбонильных соединений с глицином и водородом в присутствии катализатора: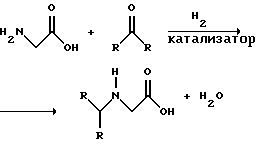
Эта реакция описана Сартори и др. в патенте США 4525294. N-замещенный глицин может быть превращен в N-замещенный глифосат путем взаимодействия с формальдегидом и фосфористой кислотой в присутствии сильной кислоты.
Кроме того, это изобретение обеспечивает новый и эффективный способ превращения N-замещенных глифосатов, которые получены не путем фосфонометилирования N-замещенных глицинов. Например, этот способ является особенно эффективным при получении глифосата из N-метилглифосата, нежелательного побочного продукта окисления ФМИДК, катализируемого углеродом.
На фиг.1 обобщены способы получения глифосата из рассмотренных выше материалов. Использованные на фиг.1 символы имеют обычные значения, известные специалистам в этой области техники.
Для того, чтобы окислить N-замещенный глифосатный реагент, его сначала предпочтительно смешивают с водой и затем подают в реактор вместе с кислородсодержащим газом или жидкостью, содержащей растворенный кислород. В присутствии катализатора - благородного металла N-замещенный глифосатный реагент подвергается окислительному превращению в глифосат и различные побочные продукты: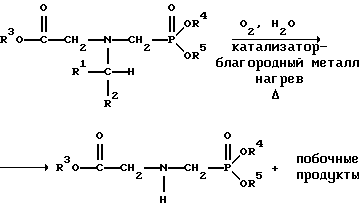
где R1, R2, R3, R4 и R5 такие, как определено выше.
В предпочтительном варианте катализатор в последующем отделяется фильтрацией, и затем глифосат может быть выделен осаждением, например путем испарения части воды и охлаждения.
Количество N-замещенного глифосатного реагента в водной среде обычно составляет приблизительно от 1 до 80 вес.% ([масса N-замещенного глифосатного реагента/общая реакционная масса] • 100%). Более предпочтительно, количество N-замещенного глифосатного реагента составляет приблизительно от 5 до 50 вес.% и наиболее предпочтительно, приблизительно от 20 до 40 вес.%.
Предпочтительно эту реакцию осуществляют при температуре приблизительно от 50 до 200oС. Более предпочтительно, реакцию осуществляют при температуре приблизительно от 70 до 150oС и наиболее предпочтительно при температуре приблизительно от 125 до 150oС.
В ходе окисления давление в реакторе, в основном, зависит от используемой температуры. Предпочтительно, достаточным является давление, при котором предотвращается кипение реакционной смеси. Если в качестве источника кислорода используется кислородсодержащий газ, то также предпочтительным является давление, которое способствует растворению кислорода в реакционной смеси со скоростью, достаточной для поддержания желаемой скорости реакции. Предпочтительно, давление по меньшей мере равно атмосферному. Предпочтительно, давление изменяется приблизительно от 30 до 200 фунт/кв. дюйм (от 0,21 до 1,4 МПа). Более предпочтительно, когда температура находится в наиболее предпочтительном интервале приблизительно от 125 до 150oС, давление составляет приблизительно от 0,28 до 0,7 МПа.
Источником кислорода для реакции окисления может быть любой кислородсодержащий газ или жидкость, содержащая растворенный кислород. Предпочтительно, источником кислорода является кислородсодержащий газ. Используемый здесь термин "кислородсодержащий газ" представляет собой любую газовую смесь, содержащую молекулярный кислород, который необязательно может содержать один или несколько разбавителей, которые не реагируют с кислородом, или реагентом, или продуктом в условиях реакции. Примерами таких газов является воздух, чистый молекулярный кислород или молекулярный кислород, разбавленный гелием, аргоном, неоном, азотом или другими газами, не содержащими молекулярный кислород. Предпочтительно, по меньшей мере приблизительно 20% объема кислородсодержащего газа составляет молекулярный кислород, и более предпочтительно, по меньшей мере приблизительно 50% объема кислородсодержащего газа составляет молекулярный кислород.
Кислород может быть введен в реакционную среду с помощью любого традиционного средства таким образом, чтобы поддержать концентрацию кислорода, растворенного в реакционной смеси, на желаемом уровне. Если используется кислородсодержащий газ, то предпочтительно его вводят в реакционную смесь таким образом, чтобы обеспечить максимальный контакт газа с реакционным раствором. Такой контакт может быть достигнут, например, путем диспергирования газа через диффузор, такой как пористая стеклянная пластина, или путем спекания, встряхивания или другими способами, известными специалистам в этой области техники.
Предпочтительно, кислород подают в реакционную смесь со скоростью, которая достаточна для поддержания концентрации растворенного кислорода на предельном уровне. Более предпочтительно, кислород подают в реакционную смесь со скоростью, которая достаточна для поддержания концентрации растворенного кислорода не более, чем приблизительно 2 ч./млн, но при достаточно высокой концентрации, чтобы обеспечить желаемую скорость реакции. Необходимо отметить, что парциальное давление кислорода в реакторе влияет на скорость подачи кислорода в реакционную смесь и предпочтительно оно составляет приблизительно от 0,5 до 10 атм (от 0,05 до 1,0 МПа).
Используемый в этом изобретении катализатор включает благородный металл, предпочтительно платину (Pt), палладий (Pd), родий (Rh), иридий (Ir), осмий (Оs) или золото (Au). Вообще, более предпочтительными являются платина и палладий, и наиболее предпочтительной является платина. Так как в настоящее время платина является наиболее предпочтительной, последующее обсуждение, в основном, будет посвящено использованию платины. Однако необходимо понимать, что такое же обсуждение будет, в целом, применимо для других благородных металлов и их сочетаний.
Катализатор - благородный металл может быть ненанесенным, например платиновая чернь, промышленно доступная из различных источников, таких как фирмы Олдрич Кемикал Ко. Инк., Милуоки, шт. Висконсин; Энгельгард Корп., Айзелин, шт. Нью-Джерси; и Дегусса Корп., Риджефилд Парк, шт. Нью-Джерси. Альтернативно, катализатор - благородный металл может быть нанесен на поверхность носителя, такого как углерод, оксид алюминия (Аl2О3), диоксид кремния (SiO2), диоксид титана (TiO2), диоксид циркония (ZrO2), силоксан или сульфат бария (BaSO4), предпочтительно диоксид кремния, диоксид титана или сульфат бария. Нанесенные металлы являются обычными в этой области техники и могут быть получены в промышленном объеме из различных источников, например, 5% платины на активированном угле - от фирмы Олдрич, по каталогу 20593-1; платина на порошкообразном оксиде алюминия - Олдрич, по каталогу 31132-4; палладий (восстановленный) на сульфате бария - Олдрич, по каталогу 27799-1; и 5% палладия на активированном угле -Олдрич, по каталогу 20568-0.
Что касается углеродных носителей, то обычно предпочтительны графитовые носители, поскольку такие носители обладают повышенной селективностью по глифосату.
Концентрация катализатора - благородного металла на поверхности носителя может изменяться в широких пределах. Предпочтительно, она находится в интервале приблизительно от 0,5 до 20 вес.% ([масса благородного металла/общая масса катализатора] • 100%), более предпочтительно, приблизительно от 2,5 до 10 вес. %, и наиболее предпочтительно, приблизительно от 3 до 7,5 вес.% При концентрации больше, чем приблизительно 20 вес.%, имеется тенденция к образованию слоев и комков благородного металла. Таким образом, имеется меньше поверхностных атомов металла от общего количества применяемого благородного металла. Это приводит к снижению активности катализатора и неэкономному использованию дорогостоящего благородного металла.
Весовое отношение благородного металла к N-замещенному глифосатному реагенту в реакционной смеси предпочтительно составляет приблизительно от 1: 500 до 1:5. Более предпочтительно, это отношение составляет приблизительно от 1:200 до 1:10 и наиболее предпочтительно, приблизительно от 1:50 до 1:10.
В предпочтительном варианте воплощения на катализаторе - благородном металле адсорбируются электроактивные молекулярные частицы (т.е. молекулярные частицы, которые могут обратимо окисляться и восстанавливаться за счет перехода электронов). В соответствии с этим изобретением было установлено, что селективность и/или превращение для катализатора - благородного металла могут быть улучшены в присутствии электроактивных молекулярных частиц, в частности, когда катализатор будет использоваться для осуществления окисления N-метилглифосата с образованием глифосата. В этом случае электроактивные молекулярные частицы предпочтительно являются гидрофобными и имеют окислительный потенциал (E1/2), по меньшей мере равный приблизительно 0,3 В относительно насыщенного каломельного электрода. В литературе можно найти много веществ с таким окислительным потенциалом. Хорошую подборку окислительных потенциалов обратимых процессов для большого числа электроактивных молекулярных частиц можно найти в Энциклопедии электрохимии элементов (ред. A. Bard и H.Lund, изд-во Марсел Деккер, Нью-Йорк, даты публикации изменяются в зависимости от тома). Конкретные ссылки, демонстрирующие окислительные потенциалы для электроактивных молекулярных частиц, приведены ниже: для трифенилметана - J.Perichon и др.. Энциклопедия электрохимии элементов, т. 11, с. 163 (ред. A.Bard и H.Lund, изд-во Марсел Деккер, Нью-Йорк, 1978); для N-гидроксифталимида - M.Masui и др., J.Chem.Soc. Chem.Comm., с.479-480 (1983); для трис(4-бромфенил)амина -S.Dapperheld и др., Chem.Ber., т.124, с.2557-2567 (1991); для 2,2,6,6-тетраметилпиперидин-N-оксида - M.Semmelhack и др., т. 105, с. 4492-4494 (1983); для 5,10,15,20-тетракис-(пентафторфенил)-21Н, 23Н-порфин хлорида железа(III) - D.Dolphin и др., Acc.Chem.Res., т.30, с. 251-259 (1997); и для различных порфиринов - J.H.Fuhrhop. Порфирины и Металлопорфирины, 593 (ред. К.Смит, изд. Эльзевир, Нью-Йорк, 1975).
Электроактивные молекулярные частицы также применяются в связи с окислением N-изопропилглифосата с образованием глифосата. В этой связи электроактивные молекулярные частицы предпочтительно адсорбируются на катализаторе - благородном металле, нанесенном на графитизированный углерод (углерод в виде графита). Было установлено, что в присутствии графитизированного углеродного носителя электроактивные молекулярные частицы увеличивают селективность катализатора - благородного металла в отношении глифосата.
Примеры в целом подходящих электроактивных молекулярных частиц включают трифенилметан; N-гидроксифталимид; 5,10,15,20-тетракис(пентафторфенил)-21Н, 23Н-порфин хлорид железа(III) (сокращенно Fe(III)TPFPP хлорид); 2,4,7-трихлорфлуорен; трис-(4-бромфенил)амин; 2,2,6,6-тетраметилпиперидин-N-оксид (иногда называется ТЕМПО); 5,10,15,20-тетрафенил-21Н,23Н-порфин железа(III) хлорид (иногда называется Fe(III)TPP хлорид); 4,4'-дифторбензофенон; 5,10,15,20-тетрафенил-21Н,23Н-порфин никеля(II) (иногда называется Ni(II)TPP); и фенотиазин. Когда катализатор - благородный металл используется для каталитического окисления N-метилглифосата в глифосат, наиболее предпочтительные электроактивные молекулярные частицы включают N-гидроксифталимид, трис(4-бромфенил)амин; 2,2,6,6-тетраметилпиперидин-N-оксид; 5,10,15,20-тетрафенил-21Н, 23Н-порфин железа (III) хлорид; и 5,10,15,20-тетрафенил-21Н,23Н-порфин никеля(II).
Электроактивные молекулярные частицы могут адсорбироваться на катализаторе - благородном металле с использованием различных способов, общеизвестных в этой области техники. Электроактивные молекулярные частицы могут быть добавлены непосредственно в реакционную смесь окисления, отдельно от катализатора - благородного металла. Например 2,2,6,6-тетраметилпиперидин-N-оксид может быть добавлен в реакционную смесь без предварительной адсорбции на катализаторе - благородном металле, как показано в Примере 13. Используя этот способ, электроактивные молекулярные частицы адсорбируются на катализаторе - благородном металле, находясь в реакционной смеси. Альтернативно, электроактивные молекулярные частицы адсорбируются на катализаторе - благородном металле до добавления в реакционную смесь окисления. Обычно электроактивные молекулярные частицы могут адсорбироваться на катализаторе с использованием, например, осаждения из жидкой фазы или из газовой фазы. Пример 8 иллюстрирует использование осаждения из жидкой фазы для адсорбции электроактивных молекулярных частиц.
Предпочтительно реакцию окисления проводят в реакторе с однократной загрузкой таким образом, что реакционная смесь может находиться в реакторе до полного ее превращения в глифосат. Однако также можно использовать другие типы реакторов (например реакторы-резервуары с непрерывным перемешиванием), хотя предпочтительно: 1) должен быть достаточный контакт между кислородом, N-замещенным глифосатным реагентом и катализатором; и 2) необходимо обеспечить соответствующее время пребывания реакционной смеси для существенного превращения N-замещенного глифосатного реагента в глифосат.
Следует отметить, что в этом изобретении имеется возможность окисления N-замещенных глифосатов в присутствии других химических веществ, которые могут появляться в процессе приготовления глифосата уже известными способами. Например, в этом изобретении имеется возможность окисления N-метилглифосата в присутствии фосфористой кислоты или фосфонометилированных частиц, которые представляют собой побочные продукты окисления ФМИДК, катализируемого углеродом, таких как аминометилфосфоновая кислота (АМФК), N-метиламинометилфосфоновая кислота (МАМФК) и глифосат.
Кроме того, необходимо признать, что этот способ превращения можно осуществлять, когда в реакционной смеси присутствует основание в суб-стехиометрическом количестве (т.е. менее одного эквивалента). Однако наличие основания может оказывать вредное воздействие на селективность процесса в некоторых условиях.
ПРИМЕРЫ
Общие сведения
В большей части приведенных ниже примеров описано окисление N-метилглифосата с образованием глифосата. Кроме глифосата, также могут образоваться N-метиламинометилфосфоновая кислота и фосфорная кислота (Н3РО4). Кроме того, глифосатный продукт может далее окисляться с образованием аминометил-фосфоновой кислоты. Эти реакции обобщены на фиг.2.
Для анализа продуктов, образовавшихся в ходе реакций, рассматриваемых в следующих примерах, используется жидкостная хроматография высокого давления (ЖХВД). Используется ионообменное разделение, и продукты анализа детектируют, используя детектор УФ видимого излучения, после взаимодействия продукта из колонки с образованием фосфомолибдатного комплекса. Этим способом можно различить N-метилглифосат, глифосат и фосфорную кислоту, но аминометилфосфоновая кислота (АМФК) и N-метиламинометилфосфоновая кислота (МАМФК) элюируются совместно. Поскольку АМФК и МАМФК имеют, в расчете на моль, одинаковый фактор отклика, можно надежно определить сумму концентраций АМФК и МАМФК. Эта величина приведена ниже в примерах как (М)АМФК.
ПРИМЕР 1.
Этот пример иллюстрирует типичный синтез N-метилглифосата. Приблизительно 89,9 г саркозина (1,0 моль), 82,0 г фосфористой кислоты (1,0 моль) и 110 г концентрированной соляной кислоты смешивают и кипятят с обратным холодильником в масляной бане с температурой 130oС. Затем по каплям добавляют в течение 20 минут 89,3 г 37%-го формалина (1,1 моль) и реакцию продолжают еще в течение 85 минут. В этот момент по данным ЯМР в смеси имеются следующие продукты (в расчете на моли): 89,9% N-метилглифосата, 2,1% фосфористой кислоты, 1,9% фосфорной кислоты, 0,4% гидроксиметилфосфористой кислоты и 5,7% неизвестного продукта (в спектре ЯМР: триплет, 8,59 м.д.). После охлаждения до комнатной температуры добавляют 40 г гидроксида натрия и затем 250 г воды. Это приводит к образованию белого осадка, который затем выделяют путем фильтрации и анализируют методом ЖХВД. Общий выход выделенного N-метилглифосата составляет 70,5% в расчете на взятое количество саркозина и фосфористой кислоты.
Аналогичным образом также можно получить другие N-алкилглифосаты.
ПРИМЕР 2.
Этот пример иллюстрирует превращение N-метилглифосата в глифосат с использованием платинового катализатора и кислорода.
Приблизительно 10,0 г N-метилглифосата, 140 г воды и 1,0 г платиновой черни (Олдрич Кемикал Ко. Инк., Милуоки, шт. Висконсин) смешивают в круглодонной колбе, снабженной водоохлаждаемым обратным холодильником и погруженной в масляную баню с температурой 150oС. Раствор перемешивают и в течение 4 ч через него барботируют кислород. В конце этого периода по данным ЖХВД в смеси имеются следующие продукты (в расчете на моли): 86,4% глифосата, 8,7% N-метилглифосата, 2,2% (М)АМФК и 2,7% фосфорной кислоты. Глифосат осаждается из раствора после его охлаждения до комнатной температуры.
Во втором опыте смесь 10,0 г N-метилглифосата, 2,0 г платиновой черни и достаточное количество воды, чтобы довести общий объем смеси до 200 мл, перемешивают 2 ч и 40 минут при температуре 80oС и в то же время в смесь барботируют кислород при атмосферном давлении. Анализ реакционной смеси показал наличие следующих продуктов (в расчете на моли): 85,4% глифосата, 8,1% фосфорной кислоты и 6,5% неизвестных компонентов. N-метилглифосат не был обнаружен.
ПРИМЕР 3.
Этот пример иллюстрирует превращение N-изопропилглифосата в глифосат с использованием платинового катализатора и кислорода. Приблизительно 1,0 г N-изопропилглифосата, 10 г воды и 0,3 г платиновой черни (Олдрич Кемикал Ко. Инк. , Милуоки, шт. Висконсин) смешивают в круглодонной колбе, снабженной водоохлаждаемым обратным холодильником и погруженной в масляную баню с температурой 80oС. Раствор перемешивают и в течение 18 часов у поверхности реакционной смеси вводят поток кислорода. В конце этого периода по данным 31Р-ЯМР в смеси имеются следующие продукты (в расчете на моли): 91% глифосата, 1% аминофосфоновой кислоты, 6% фосфорной кислоты и 2% неизвестного продукта (в спектре ЯМР: 15,0 м.д.). Глифосат осаждается из раствора после его охлаждения до комнатной температуры.
ПРИМЕР 4.
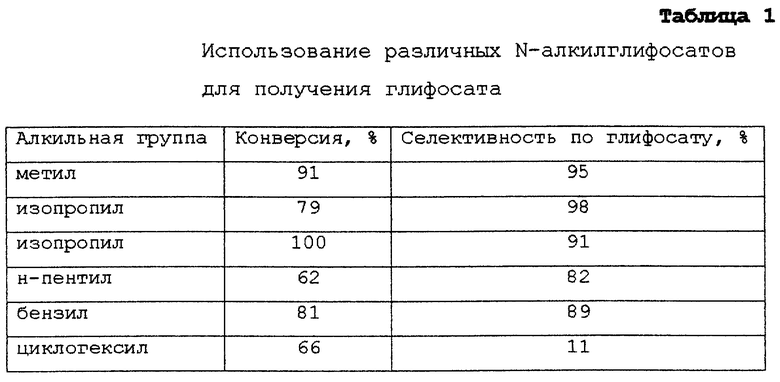
Используются различные N-алкилглифосаты в тех же самых условиях, что описаны в Примере 3, чтобы получить глифосат. Иными словами, единственным варьируемым параметром является радикал R1 в следующей формуле: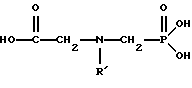
В таблице 1 приведены использованные алкильные группы (т.е. R1), а также величины конверсии и селективности по глифосату.
Пример 5.
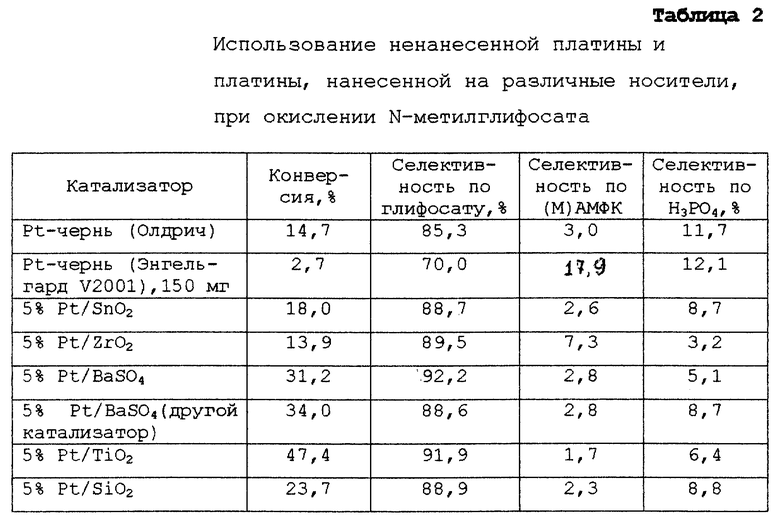
Этот пример иллюстрирует превращение N-метилглифосата в глифосат с использованием ненанесенной платины и различных катализаторов, в которых платина диспергирована на неутлеродном носителе.
Приблизительно 1,0 г N-метилглифосата, 10 г воды и 2,0 г катализатора - 5% платины на сульфате бария смешивают в круглодонной колбе (набжена водяным обратным холодильником), погруженной в масляную баню с температурой 95oС. Раствор перемешивают и в течение 23 ч, через него барботируют кислород. В конце этого периода по данным ЖХВД в смеси имеются следующие продукты (в расчете на моли): 78,2% глифосата, 2,4% N-метилглифосата, 9,4% (М)АМФК и 10,0% фосфорной кислоты. Глифосат осаждается из раствора после его охлаждения до комнатной температуры.
В отдельном опыте получают данные, приведенные в Таблице 2, путем нагревания до кипения с обратным холодильником смеси, содержащей 1,0 г N-метилглифосата, 20 мл воды и достаточное количество катализатора, чтобы содержание металлической платины в круглодонной колбе, снабженной водяным обратным холодильником и магнитной мешалкой, составляло 5 мг. В смесь в течение 5 ч барботируют кислород, используя иглу. Затем катализатор удаляют посредством фильтрации и фильтрат анализируют методом ЖХВД.
Как видно из таблицы 2, испытаны два катализатора в виде платиновой черни. Катализатор фирмы Энгельгард V2001 (Энгельгард Корп., Айзелин, шт. Нью-Джерси) имеет гораздо меньшую площадь поверхности, чем платиновая чернь фирмы Олдрич (Олдрич Кемикал Ко. Инк., Милуоки, шт. Висконсин). Как видно из таблицы 2, катализатор Энгельгард V2001 с меньшей площадью поверхности обладает пониженной селективностью и конверсией, даже при использовании в количестве в 30 раз больше (т.е. 150 мг), чем катализатор фирмы Олдрич (т.е. 5 мг).
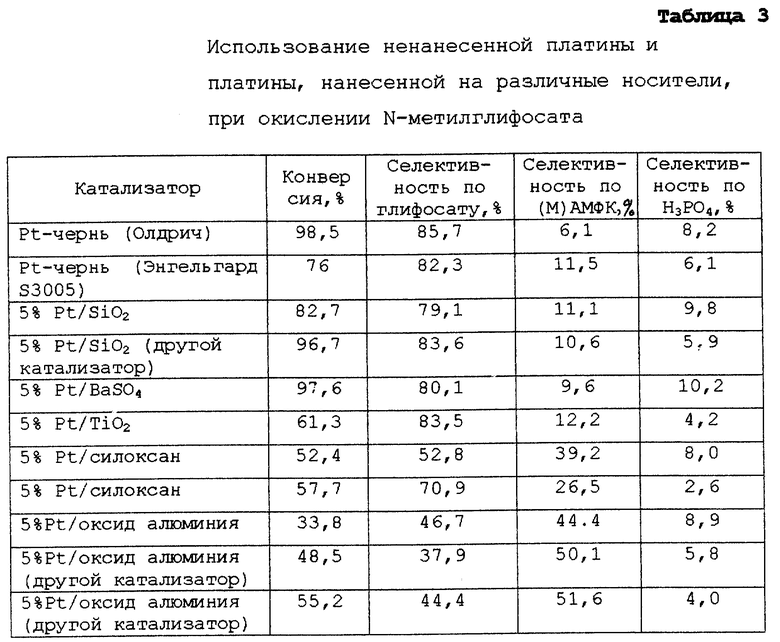
Был проведен третий опыт, который иллюстрирует, что оксид алюминия и силоксаны (Делоксан, Дегусса Корп. , Ридже-филд Парк, шт. Нью-Джерси) могут применяться в качестве носителей для металлических катализаторов. Следующие опыты были проведены в течение ночи при 95oС и атмосферном давлении, используя достаточное количество катализатора, эквивалентное 0,1 г металлической платины, 1 г N-метилглифосата и 10 мл воды. Кислород вводят через иглу со скоростью 50 мл (стандартных) в минуту. Образовавшийся раствор фильтруют и анализируют методом ЖХВД, а концентрацию растворенной платины определяют методом масс-спектрометрии с индуктивно сопряженной плазмой. Данные приведены в таблице 3.
ПРИМЕР 6.
Этот пример иллюстрирует применение палладия вместо платины в качестве катализатора окисления N-метилглифосата в глифосат. Раствор, содержащий 3,0 г N-метилглифосата, 57 г воды и 0,3 г палладиевой черни, в среде воздуха кипятят с обратным холодильником, охлаждаемым водой, с вечера пятницы до понедельника. По данным анализа ЯМР в смеси имеются следующие продукты: 97,2% N-метилглифосата, 2,8% глифосата и 0,05% фосфорной кислоты.
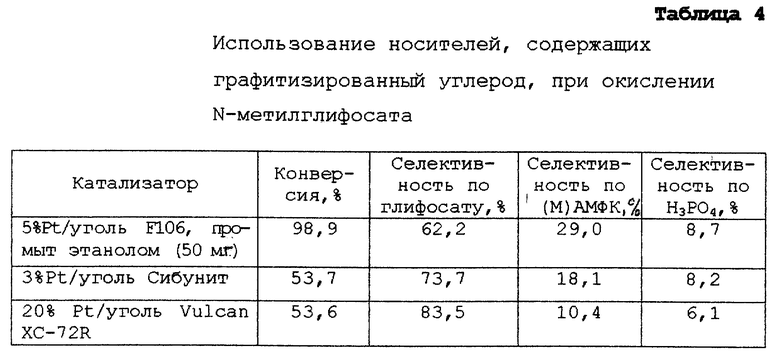
ПРИМЕР 7.
Этот пример демонстрирует, что катализаторы, содержащие графитизированные углеродные носители, пропитанные платиной, обладают повышенной селективностью по глифосату по сравнению с катализаторами, содержащими неграфитизированные углеродные носители, пропитанные платиной. Кроме того, в этом примере продемонстрировано, что образуется меньше МАМФК и АМФК при использовании катализаторов, содержащих графитизированные углеродные носители, пропитанные платиной.
В следующем примере описаны результаты окисления N-метилглифосата, используя катализаторы, содержащие платину, диспергированную на промышленно доступных углеродных носителях. Уголь F 106 и катализатор "платина на угле F 106" доступны от фирмы Дегусса Корп. (Риджефилд Парк, шт. Нью-Джерси). Уголь Сибунит производится, как описано Суровикиным и др. в патенте США 4978649, и может быть поставлен из Боресковского Института катализа (Новосибирск, Россия) как консервированные платиновые катализаторы, нанесенные на уголь Сибунит. Однако катализатор, использованный в этом примере, готовят из самого угля путем пропитки солями платины с последующим восстановлением боргидридом натрия, который является обычным при получении нанесенных платиновых катализаторов. Общие сведения о приготовлении платины на угольном носителе хорошо известны из уровня техники и описаны, например, в книге А.Б. Стайлза, Каталитические носители и нанесенные катализаторы. Теоретические и прикладные концепции (Баттеруортс, Бостон, шт. Массачузетс, 1987) и в разделе Р.Л. Mоcca, Experimental Methods in Catalytic Research, т.2, глава 2, с. 43-94 (ред. Anderson и Dawson, Академик Пресс, Нью-Йорк, 1976). Катализатор 20% платины на угле Vulcan XC-72R производится на фирме Джонсон-Мэттей и может быть поставлен через фирму Альфа/Аэзар (Ward Hill, шт. Массачузетс). Эти три вида углерода соответственно являются неграфитизированными, отчасти графитизированными и почти полностью графитизированными.
Приблизительно 100 мг катализатора (за исключением указанного ниже), 10 мл воды и 1,0 г N-метилглифосата кипятят с обратным холодильником 5 часов и в то же время барботируют кислород через иглу. Реакционную смесь фильтруют и анализируют методом ЖХВД. Данные приведены в таблице 4.
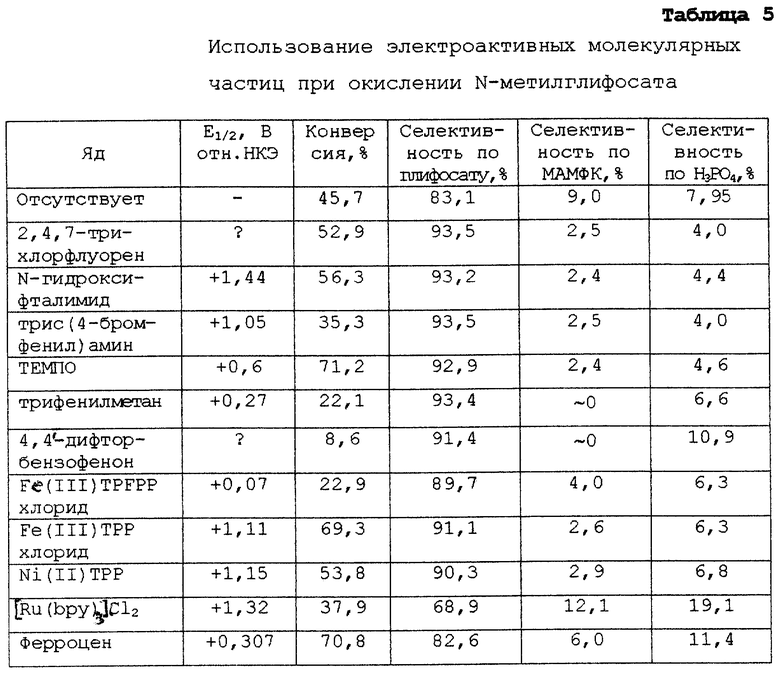
ПРИМЕР 8
Этот пример демонстрирует улучшение селективности, которое может быть достигнуто при адсорбции электроактивных молекулярных частиц на катализаторе - благородном металле. Все электроактивные молекулярные частицы, адсорбированные в этом примере, претерпевают окисление и восстановление в результате переноса электронов. Таким образом, здесь приведен пример обработки платинусодержащих катализаторов электроактивными молекулярными частицами, а также их окислительными предшественниками.
Этот опыт осуществляют путем нагревания до кипения смеси, содержащей 1,0 г N-метилглифосата, 20 мл воды и 50 мг металлической платины, в круглодонной колбе, снабженной водяным обратным холодильником и магнитной мешалкой. В смесь в течение 5 ч барботируют кислород, используя иглу. Затем катализатор удаляют посредством фильтрации и фильтрат анализируют методом ЖХВД.
Для приготовления катализаторов, обработанных органическими веществами, добавляют 0,5 г платиновой черни (Олдрич Кемикал Ко. Инк., Милуоки, шт. Висконсин) в раствор 25 мг яда (т.е. электроактивных молекулярных частиц) в 50 мл безводного ацетонитрила. Эту смесь закупоривают крышкой в колбе Эрленмейера на 4 суток, за исключением 4,4'-дифторбензофенона, раствором которого обрабатывают катализатор в течение суток. В последующем катализатор выделяют фильтрацией, промывают ацетонитрилом и диэтиловым эфиром и сушат на воздухе в течение ночи.
2,4,7-Трихлорфлуореновый катализатор готовят, используя 0,3 г платиновой черни и 30 мл раствора, содержащего 834,5 ч./млн 2,4,7-трихлорфлуорена в растворе 1% дихлорметана в ацетонитриле (используется для облегчения растворения электроактивных молекулярных частиц); растворителям дают испариться при комнатной температуре. В последующем катализатор выделяют фильтрацией, промывают ацетонитрилом и этанолом и сушат на воздухе.
Для приготовления катализаторов, обработанных неорганическими веществами, смешивают 0,5 г платиновой черни, 50 мл тетрагидрофурана и либо 256 мг, либо 100 мг неорганических электроактивных молекулярных частиц. Эту смесь перемешивают ночью при комнатной температуре и закупоривают в колбе Эрленмейера емкостью 125 мл. Катализатор выделяют фильтрацией, промывают диэтиловым эфиром и сушат на воздухе в течение ночи.
Все применяемые неорганические вещества, доступные от фирмы Олдрич Кемикал (Милуоки, шт. Висконсин), указаны ниже:
1. 5,10,15,20-тетракис(пентафторфенил)-21Н,23Н-порфин железа(III) хлорид (сокращенно Fe(III)TPFPP хлорид в табл.5). Для приготовления катализатора используют приблизительно 25 мг.
2. 5,10,15,20-тетрафенил-21Н, 23Н-порфин железа(III) хлорид (сокращенно Fe(III)TPP хлорид в табл. 5). Для приготовления катализатора используют приблизительно 25 мг.
3. 5,10,15,20-тетрафенил-21Н,23Н-порфин никеля(II) (сокращенно Ni(II)TPP в табл.5). Для приготовления катализатора используют приблизительно 25 мг.
4. Рутений-трис(2,2'-бипиридин)дихлорид (сокращенно Ru(bру)3Сl2 в табл. 5). Для приготовления катализатора используют приблизительно 100 мг.
5. Ферроцен. Для приготовления катализатора используют приблизительно 100 мг.
При наличии литературных данных об окислительном потенциале (E1/2) для электроактивных молекулярных частиц они приведены в табл. 5. Этот пример иллюстрирует, что электроактивные молекулярные частицы, которые имеют относительную растворимость в воде (например ферроцен и Ru(bру)3Сl2), менее эффективно повышают селективность по глифосату. В этом примере также продемонстрировано, что гидрофобные электроактивные молекулярные частицы, имеющие окислительный потенциал более отрицательный, чем приблизительно 0,3 В относительно насыщенного каломельного электрода, обычно снижают конверсию. Таким образом, предпочтительные электроактивные молекулярные частицы, повышающие селективность и конверсию при окислении N-метилглифосата, могут быть органическими или неорганическими, но должны быть гидрофобными и иметь окислительный потенциал более положительный, чем приблизительно 0,3 В относительно насыщенного каломельного электрода (НКЭ).
ПРИМЕР 9.
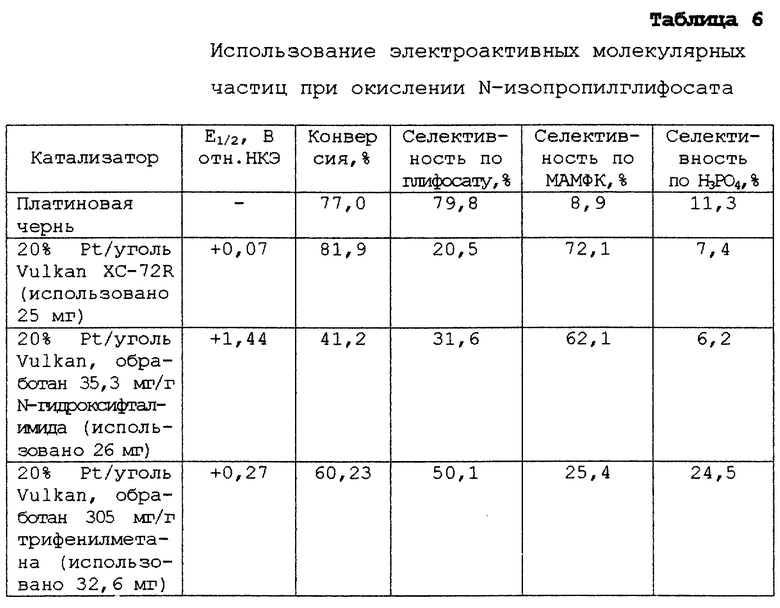
Этот пример иллюстрирует влияние электроактивных молекулярных частиц на катализируемое платиной окисление N-иэо-пропилглифосата, используя промышленно доступный катализатор - 20% платины на угле Vulcan XC-72R (производится на фирме Джонсон-Мэттей и может быть поставлен через фирму Альфа/Аэзар (Ward Hill, шт. Массачузетс)). Промышленный катализатор испытывают наряду с катализатором, который был пропитан двумя видами электроактивных молекулярных частиц: N-гидроксифталимид и трифенилметан.
Эти катализаторы используются для окисления N-изопропилглифосата по способу, описанному в предыдущем примере. Вместо N-метилглифосата используют 1 г N-изопропилглифосата. Результаты, приведенные в табл. 6, показывают, что электроактивные молекулярные частицы улучшают селективность катализаторов "платина на угле" в этой реакции. Оказалось, что модификаторы с менее положительным окислительным потенциалом, такие как трифенилметан, являются более эффективными, чем модификаторы с более положительным окислительным потенциалом, такие как N-гидроксифталимид. В этом примере также продемонстрировано, что применение графитизированных носителей для платины менее эффективно для подавления нежелательных побочных реакций при окислении N-изопропилглифосата, чем в случае N-метилглифосата.
ПРИМЕР 10.
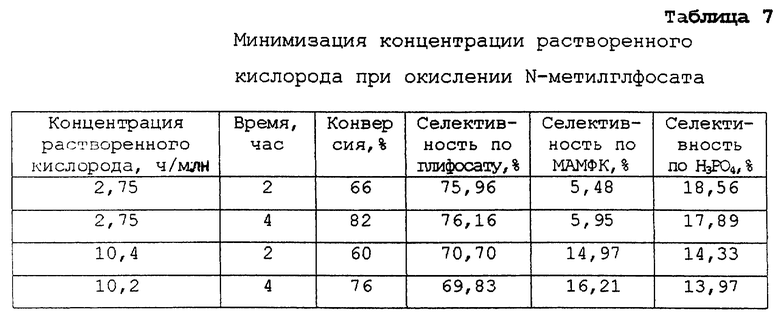
В этом примере продемонстрировано, что показатели селективности, а также конверсии, могут быть улучшены за счет снижения концентрации растворенного кислорода.
В реакторе-автоклаве из нержавеющей стали 316 (емкость 300 мл) смешивают 4,4 г N-метилглифосата с 1 г платиновой черни в 145 г деионизированной воды. Реакционную смесь нагревают до 70oС при давлении 420 кПа (60 ф/дм2) и барботируют через нее смесь азота и кислорода 4 ч при интенсивном перемешивании. Концентрацию растворенного кислорода измеряют, используя датчик растворенного кислорода - Орбисфер, откалиброванный до показания 26,4 ч./млн кислорода при насыщении воздухом в условиях 70oС и давлении 420 кПа, и регулируют, изменяя отношение азот/кислород в смеси. Проводят 2 опыта при концентрации растворенного кислорода на уровне 2-3 ч./млн и 10 ч./млн. При анализе реакционной смеси через 2 и 4 часа методом ЖХВД получены результаты, приведенные в табл.7.
ПРИМЕР 11.
Этот пример иллюстрирует катализируемое платиной окисление N-замещенных глифосатов, в которых заместитель при атоме азота содержит атомы, отличающиеся от углерода или водорода. В частности, описано окисление глифозина (-НО2-ССН2N(СН2РО3Н2)2) и N-гидроксиэтилглифосата, которые получают фосфонометилированием глицина и N-гидроксиэтилглицина, соответственно путем взаимодействия с формальдегидом и фосфористой кислотой при нагреве в присутствии сильной кислоты, как в общем описано в работе D.Redmore, Topics in Phosphorous Chemistry, т. 8, с.515-585 (ред. Гриффит и Грейсон, изд-во Дж.Уилей и сыновья, 1976) и в разделе, озаглавленном "альфа-Замещенные фосфонаты", в Справочнике по фосфорорганической химии, P.Mastalerz, с.277-375 (ред. Р. Энгел, изд-во Марсел Деккер, 1992). Приблизительно 1,0 г субстрата, 20 мл воды и 50 мг платиновой черни смешивают в круглодонной колбе. Окисление проводят по той же методике, которая использована при окислении N-метилглифосата в Примере 8. Распределение продуктов анализируют методом 31Р-ЯМР. Степень окисления глифозина равна 74,9% при селективности по глифосату 50,2%. Другим основным продуктом является бис(фосфонометил)амин, (-HN-(СН2РО3Н2)2), который составляет 39,1% продуктов окисления глифосина. Кроме того, обнаружены небольшие количества АМФК и неидентифицированных продуктов. Использование катализатора - платиновой черни, обработанной трис(4-бромфенил)амином, описанного в Примере 8, приводит к увеличению конверсии до 86,8%, но селективность не изменяется.
Окисление N-гидроксиэтилглифосата приводит к превращению субстрата, равному 46,7% и распределению продуктов: 61,2% глифосата, 22,4% N-гидроксиэтиламинометилфосфоновой кислоты и 16,3% фосфорной кислоты.
ПРИМЕР 12.
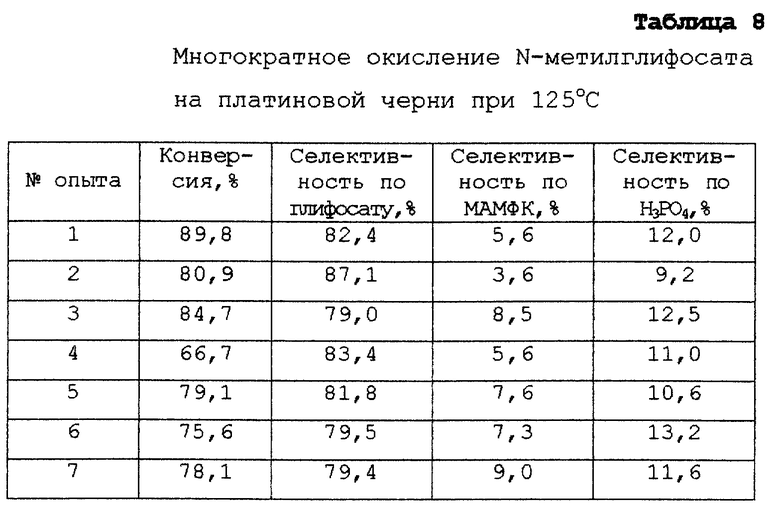
Этот пример иллюстрирует скорость и селективность окисления N-метилглифосата, которые достигаются при повышенной температуре на платиновой черни. Отмечен факт отсутствия заметной деактивации катализатора в течение 7 циклов.
Стеклянный реактор (300 мл), рассчитанный на повышенное давление, оборудован термопарой и двумя фильтрами - пористыми пластинами. Один из фильтров, расположенный почти на 13 мм выше центра дна реактора, используется для диспергирования газа. Второй фильтр, расположенный приблизительно в 25 мм от дна, но не по центру, используется для выхода жидкости. Также предусмотрена линия выхода газа, связанная с обратным регулятором давления, который установлен для поддержания давления на уровне 350 кПа (50 ф/дм2). В реактор загружают приблизительно 60 г N-метилглифосата, наряду с 3 г платиновой черни от фирмы Олдрич Кемикал (Милуоки, шт.Висконсин) и 180 мл воды, вместе с перемешивающим устройством. Реактор погружают в масляную баню, смесь перемешивают магнитной мешалкой и нагревают в медленном потоке азота, пока температура смеси не достигнет 125oС, образуя гомогенный раствор. Затем через реакционную смесь барботируют кислород и азот, со скоростью 1,5 и 0,5 нормальных литров в минуту (нл/мин), соответственно, в течение 30 минут, и затем дополнительно 30 минут реакцию осуществляют при скоростях потоков кислорода и азота равных по 1 нл/мин, и после этого последние 30 минут азот и кислород подают со скоростями 1,5 и 0,5 нл/мин. При постоянном перемешивании смесь оставалась гомогенной в течение всего периода 90 минут. Затем устанавливают медленный поток азота для поддержания давления. Содержимое реактора выводят через пористую пластину для выхода жидкости, при этом катализатор остается в реакторе. Вводят приблизительно 100 мл воды через пористую пластину и затем удаляют ее остатки из реакционной смеси. Затем реактору дают охладиться. Вновь добавляют 60 г N-метилглифосата и 180 мл воды и цикл повторяют. Проводят 7 таких циклов и получают результаты, приведенные в табл. 8.
Концентрация платины в растворе в конце опыта изменяется от 0,3 до 1,1 ч. /млн после первого цикла, что найдено методом масс-спектрометрии с индуктивно сопряженной плазмой. Хотя в течение первого цикла в раствор переходит повышенное количество платины (т.е. концентрация растворенной платины равна 4,2 ч. /млн), полагают, что наибольшая часть потерянной платины представляет собой первоначально невосстановленную платину на поверхности платиновой черни.
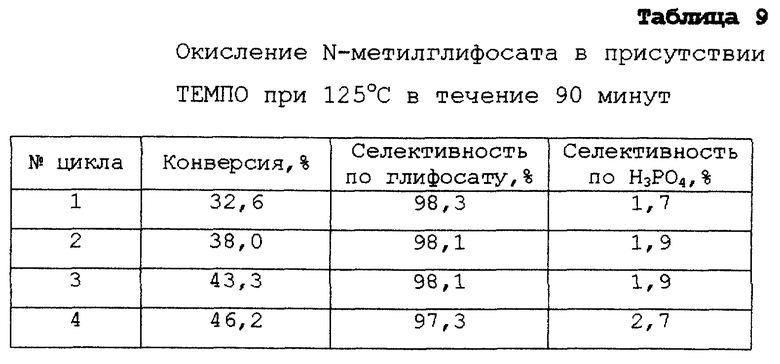
ПРИМЕР 13.
В этом примере продемонстрирована селективность, которая может быть достигнута при окислении N-алкилглифосатов при малых скоростях подачи кислорода и умеренной конверсии, если в реакционную смесь добавлены электроактивные молекулярные частицы, такие как 2,2,6,6-тетраметилпиперидин-N-оксид (ТЕМПО). Не требуется никакой предварительной обработки катализатора. Этот пример также демонстрирует, что конверсия увеличивается в течение нескольких первых циклов, когда электроактивные молекулярные частицы добавлены в раствор. Окончательно в этом примере продемонстрировано, что электроактивные молекулярные частицы снижают потери благородного металла.
В реакторе повышенного давления, описанном в Примере 12, смешивают приблизительно 60 г N-метилглифосата, 3 г платиновой черни (Олдрич Кемикал, Милуоки, шт. Висконсин), 180 мл воды и 40 мг ТЕМПО, растворенного в 1 мл ацетонитрила. Смесь нагревают до 125oС при перемешивании под давлением азота 350 кПа (50 ф/дм2) и образуется гомогенная смесь, через которую барботируют смесь азота и кислорода (75% азота и 25% кислорода по объему) в течение 90 минут со скоростью потока 1 сантил/мин, поддерживая давление равным 350 кПа. Затем реакционную смесь выводят через пластинчатый фильтр, оставляя катализатор в реакторе. Последовательно добавляют в реактор еще 60 г N-метилглифосата, 180 мл воды и 40 мг ТЕМПО в 1 мл ацетонитрила и цикл повторяют. Всего проводят 4 цикла. Во всех случаях концентрация (М)АМФК была ниже количественного уровня, обнаружены только следы. Единственным определяемым количественно побочным продуктом является фосфорная кислота. Значения конверсии и селективности в конце каждого из четырех циклов показаны в табл.9.
Как и в Примере 12, в конце каждого опыта измеряют концентрацию растворенной платины методом масс-спектрометрии с индуктивно сопряженной плазмой. Эта концентрация растворенной платины составляет менее 0,1 ч./млн в циклах 2, 3 и 4. Это ниже, чем потери платины, отмеченные в Примере 12. Как и в Примере 12, повышенное количество платины переходит в раствор в ходе первого цикла (где концентрация растворенной платины равна 8,3 ч./млн). Однако полагают, что наибольшая часть потерянной платины представляет собой в первую очередь невосстановленную платину на поверхности платиновой черни.
ПРИМЕР 14.
Этот пример иллюстрирует селективность, достигаемую в случае получения N-метилглифосата путем непосредственного фосфонометилирования амидов саркозина, таких как N-ацетил- и N-пропионилсаркозин или ангидрид саркозина, а не самого саркозина.
Смешивают приблизительно 20,0 г N-ацетилсаркозина (152,5 ммоль), 12,5 г фосфористой кислоты (152,4 ммоль) и 37,6 г концентрированной соляной кислоты и кипятят с обратным холодильником в масляной бане с температурой 120oС. В течение 20 минут по каплям добавляют 13,6 г 37%-го формалина (167,6 ммоль). Реакция продолжается еще в течение 19 часов. По данным анализа ЖХВД установлено, что выход N-метилглифосата составляет 99% мол. в расчете на загрузку.
В тех же условиях 20,0 г N-пропионилсаркозина (137,8 ммоль) превращают в N-метилглифосат, используя 11,3 г фосфористой кислоты (137,8 ммоль), 10,0 г концентрированной соляной кислоты и 12,3 г 37%-го формалина (152,1 ммоль). По данным анализа ЖХВД установлено, что выход N-метилглифосата составляет 96,6% мол. в расчете на загрузку N-пропионилсаркозина.
Также в аналогичных условиях 2,06 г ангидрида саркозина (14,5 ммоль) превращают в N-метилглифосат, используя 2,38 г фосфористой кислоты (29,02 ммоль), 5,7 г концентрированной соляной кислоты и 2,6 г 37%-го формалина (32,02 ммоль). По данным анализа ЖХВД установлено, что выход N-метилглифосата составляет 97,2% мол. в расчете на загрузку ангидрида саркозима.
В дополнительном опыте смешивают 2,0 г N-ацетилсаркозина (15,3 ммоль) и 1,25 г фосфористой кислоты (15,3 ммоль) с 3,1 г концентрированной серной кислоты и 1,7 г воды и затем кипятят с обратным холодильником в масляной бане с температурой 120oС. В течение 20 минут по каплям добавляют приблизительно 1,4 г 37%-го формалина (16,7 ммоль). Реакция продолжается еще в течение 18 часов. По данным анализа 31P-ЯМР установлено, что выход N-метилглифосата составляет 98 мол.% в расчете на загрузку N-ацетилсаркозина.
ПРИМЕР 15.
Этот пример иллюстрирует окисление N-метилглифосатом в условиях, которые весьма близки условиям в Примере 12, за исключением того, что в реакционной смеси присутствует основание в суб-стехиометрическом количестве.
В реакторе, описанном в Примере 12, смешивают приблизительно 60 г N-метилглифосата, 9,6 г гидроксида аммония (28-30%, 0,25 эквивалента) и 170 мл воды и перемешивают 1 час при температуре внутри смеси 125oС, и в то же время через смесь барботируют чистый кислород (0,75 нл/мин) под давлением, равным 350 кПа. По данным анализа ЖХВД установлено, что 23,5% N-метилглифосата окисляются с селективностью по глифосату 65,7%. Значения селективностей по (М)АМФК и фосфорной кислоте составляют 21,1% и 13,2%, соответственно.
Из этих результатов следует, что окисление N-метилглифосата протекает, хотя значения конверсии и селективности ниже по сравнению с теми же показателями для реакции, осуществляемой в отсутствие основания.
ПРИМЕР 16.
Этот пример демонстрирует, что N-метилглифосат можно селективно окислять до глифосата в присутствии глифосата и аналогичных веществ. Смешивают 1 г платиновой черни с 300 г раствора, содержащего приблизительно 6% N-метилглифосата и меньшие количества глифосата, АМФК, МАМФК, формальдегида, муравьиной кислоты и хлористого натрия. Смесь нагревают до 150oС в течение 4 ч и в то же время через смесь барботируют кислород под давлением, равным 350 кПа. В конце реакции по данным анализов ЯМР и ЖХВД установлено, что большая часть N-метилглифосата превращается в глифосат.
Приведенное выше описание предпочтительных вариантов предназначено только для ознакомления специалистов в этой области техники с изобретением, его принципами и практическим приложением для того, чтобы эти специалисты могли приспособить и применить это изобретение в его различных видах наилучшим возможным образом в соответствии с требованиями конкретного применения. Поэтому настоящее изобретение не ограничивается указанными выше вариантами и может быть различным образом модифицировано.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ N-ФОСФОНОМЕТИЛГЛИЦИНА И ЕГО СОЛЕЙ | 1997 |
|
RU2192425C2 |
| КАТАЛИЗАТОР НА НОСИТЕЛЕ, СПОСОБ ПОЛУЧЕНИЯ КАТАЛИЗАТОРА И СПОСОБ ПОЛУЧЕНИЯ СОЛЕЙ КАРБОНОВЫХ КИСЛОТ | 1995 |
|
RU2157727C2 |
| СПОСОБ ПОЛУЧЕНИЯ ЗАМЕЩЕННЫХ АРОМАТИЧЕСКИХ АМИНОВ | 1994 |
|
RU2144914C1 |
| СПОСОБ СИНТЕЗА N-(ФОСФОНОМЕТИЛ)ГЛИЦИНА | 2013 |
|
RU2674023C9 |
| Способ получения N-(фосфонометил)-глицина | 2016 |
|
RU2641897C2 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ ФЕНИЛЗАМЕЩЕННОГО ПИРАЗОЛА | 1995 |
|
RU2154637C2 |
| Способ получения моно- или дисолей -фосфонометилглицина | 1977 |
|
SU692563A3 |
| Способ получения фосфонометилглицина | 1975 |
|
SU588923A3 |
| СПОСОБЫ ПОЛУЧЕНИЯ N-ГИДРОКСИАЛКИЛАМИНОМЕТИЛФОСФОНОВОЙ КИСЛОТЫ, N-ФОСФОНОМЕТИЛАМИНОКАРБОНОВОЙ КИСЛОТЫ И N-ФОСФОНОМЕТИЛГЛИЦИНА ИЛИ ИХ СОЛЕЙ | 1995 |
|
RU2152397C1 |
| ГЕРБИЦИДНЫЕ КОМПОЗИЦИИ, СПОСОБ УНИЧТОЖЕНИЯ ИЛИ ПОДАВЛЕНИЯ СОРНЯКОВ ИЛИ НЕЖЕЛАТЕЛЬНЫХ РАСТЕНИЙ | 1996 |
|
RU2190329C2 |
Изобретение относится к способу получения глифосата реакцией окисления, катализируемой благородным металлом. Глифосат и его соли удобны для использования в качестве послевсходового гербицида. Описывается способ получения глифосата, его соли или сложного эфира, включающий контактирование раствора, содержащего N-замещенный глифосат, с кислородом в присутствии катализатора на основе благородного металла, выбранного из группы, включающей платину, палладий, рутений, родий, иридий и осмий, для увеличения количества глифосата, его соли или сложного эфира в растворе, где N-замещенный глифосат имеет формулу (II)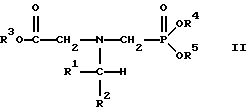
R1 и R2 независимо представляют собой атом водорода, группы -РО3Н2, углеводородный радикал или замещенный углеводородный радикал, за исключением того, что R1 и R2 отличны от группы -СООН, и радикалы R3, R4 и R5 независимо представляют собой атом водорода, углеводородный радикал, замещенный или незамещенный углеводородный радикал или сельскохозяйственно-приемлемый катион. Технический результат - создание спосoба получения глифосата, а также его сложных эфиров и солей путем окисления N-замещенных глифосатов, а также их сложных эфиров и солей, имеющих единственную N-карбоксиметильную группу. Также описывается катализатор окисления на основе благородного металла, выбранного из металлов VIII группы Периодической таблицы Менделеева. 2 c. и 31 з.п. ф-лы, 2 ил., 9 табл.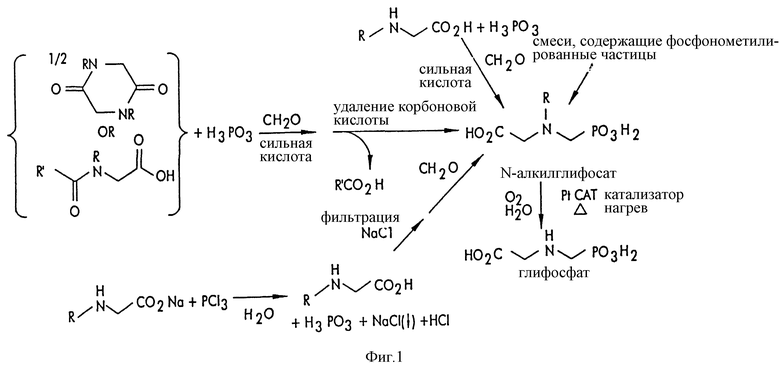
R1 и R2 независимо представляют собой атом водорода, группы - РО3Н2, углеводородный радикал или замещенный углеводородный радикал, за исключением того, что R1 и R2 отличны от группы -СООН;
радикалы R3, R4 и R5 независимо представляют собой атом водорода, углеводородный радикал, замещенный или незамещенный углеводородный радикал или сельскохозяйственно-приемлемый катион.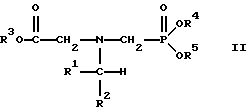
R1 и R2 представляют атом водорода;
R3, R4 и R5 независимо представляют атом водорода или сельскохозяйственно-приемлемый катион.
| US 3950402 А, 13.04.1976 | |||
| US 3927080 А, 16.12.1975 | |||
| Способ получения моно- или дисолей -фосфонометилглицина | 1977 |
|
SU692563A3 |
Авторы
Даты
2002-06-27—Публикация
1998-02-12—Подача