Настоящее изобретение относится к классу гетероциклических и карбоциклических замещенных бензойных кислот и к способам их получения из соответствующих метилфенилгетероциклических и карбоциклических соединений. Бензойные кислоты этого типа, полученные прямым окислением с помощью молекулярного кислорода, являются пригодными в качестве промежуточных соединений при получении соединений, используемых в сельском хозяйстве и медицине, в особенности в качестве промежуточных соединений для активного класса арилгалогеналкилпиразольных и арилалкилсульфонилпиразольных гербицидов.
Предшествующий уровень техники
Из предшествующего уровня техники в данной области известно получение множества окисленных производных алифатическизамещенных ароматических соединений путем окисления алифатического(их) заместителя(ей). Например моно- и многоядерные ароматические соединения, такие как бензол, дифенил, нафталин, антрацен, фенантрен и т.д., имеющие одну или несколько моно- или дифункциональных алифатических групп, могут быть частично окислены до производных, например, таких как спирты, альдегиды, кетоны, пероксиды и т.д. Моно- и поликарбоновые ароматические кислоты также получают путем окисления соответствующего алифатического замещенного ароматического соединения.
Способы окисления вышеприведенного типа раскрыты в патенте США N 2833816 и выложенной патентной заявке Японии N 59-27850 (Кокаи) N 1, ароматические углеводороды, содержащие только С1-4-алкильные группы и/или галогены, окисляют до соответствующих окисленных производных посредством жидкофазной реакции ароматического углеводородного субстрата с молекулярным кислородом в присутствии комбинированного катализатора, содержащего бром и катализатор окисления из тяжелого металла.
Кроме того, известны превращения метилпиразолов, содержащих множество заместителей, в пиразолкарбоновые кислоты посредством жидкофазной реакции с молекулярным кислородом (патент США N 5053517) и соответствующими катализаторами на основе солей металлов.
Другие способы окисления, известные из предшествующего уровня и их кислотные продукты относятся к относительно новым замещенным фенилпиразолам, которые полезны в качестве промежуточных продуктов при производстве других производных, которые являются гербицидноэффективными в отношении важных для сельского хозяйства культур, в особенности следует отметить определенные замещенные 3-арил-5-замещенные пиразольные соединения. Примеры таких гербицидных соединений раскрыты в патенте США N 5032165, где основным отличительным признаком является то, что 3-арил-5-пиразольное соединение имеет замещение -AR5 группой в 5-положении пиразольного радикала, где A является О или S, и R5 представляет водород или низший (галоген) алкил. Ранее опубликованной является параллельная патенту США '165 заявка ЕР, N ЕР 0361114, опубликованная 4 апреля 1990 г. Другие способы получения таких соединений представлены в заявке Японии N 06073015-A.
Замещенные 3-арил-5-AR пиразольные соединения в упомянутом патенте США '165 и заявке ЕР '114 получают путем многостадийного процесса, включающего:
(1) галогенирование метильной группы в 5-положении 3-фенил-5-AR5 пиразольного субстрата для образования соответствующего 5-галогенметильного соединения; (2) взаимодействие последнего с ариламином и формальдегидом в гексамине (реакция Соммлета), с последующим кислотным гидролизом для замещения формальдегидной группы на галогенметильный радикал в 5-положении фенильного радикала и (3) окисление формальдегидной группы в радикал карбоновой кислоты. Полученное соединение является пригодным в качестве промежуточного соединения для образования конечного продукта, имеющего в фенильном кольце 5-сложноэфирную группу этерификацией 5-СООН группы спиртом.
Другие 3-арил-5-замещенные пиразольные соединения, имеющие улучшенную гербицидную эффективность, представлены в родственной заявке N 07/763762 (в настоящее время патенте США N 5281571), в частичном продолжении заявки N 07/600031, в настоящее время аннулированы, и в патенте Южной Африки N 6197 (параллельной заявке США N 07/735091, теперь аннулированной). В названном патенте США '571 соединения характеризуются наличием галогеналкильного заместителя в 5-положении пиразольной группы, в то время как в патенте Южной Африки N 6197 5-положение пиразольной группы замещено алкилсульфонильным радикалом. Для того, чтобы получить радикал бензойной кислоты, соединения, представленные в вышеназванных патентах, получают многостадийным способом.
В предшествующей области не раскрыты способы прямого окисления арильных соединений, имеющих в качестве заместителей как алкильную(ые) группу (ы), так и, кроме того, карбоциклическую или гетероциклическую группу, как показано выше, для образования конечного сложного эфира, необходимы многостадийные процессы.
Поэтому целью этого изобретения является обеспечение новых карбоциклически-замещенных бензойных кислот и гетероциклически-замещенных 3-бензойных кислот, например 5-[замещенный пиpaзол]-галоген-(не) замещенных бензойных кислот, пригодных в качестве промежуточных соединений или предшественников для получения соответствующих сложноэфирных соединений, которые являются полезными гербицидными соединениями.
Еще одной целью этого изобретения является обеспечение нового способа прямого окисления арильных соединений, замещенных алкильными (предпочтительно C1-4) группами и карбоциклическими или гетероциклическими группами, для получения соответствующих карбоциклических или гетероциклических арилкислотных соединений.
Особой целью этого изобретения является обеспечение новых 5-[замещенный пиразол] -галогензамещенных бензойных кислот и способа прямого окисления соответствующего алкилзамещенного соединения предшественника.
Особенной целью этого изобретения является обеспечение нового соединения 5-[4-бром-1-метил-5-(трифторметил)- 1Н-пиразол-3-ил)-2-хлор-4-фторбензойной кислоты и ее синтеза прямым окислением соответствующего алкилфенилпиразола. Посредством этерификации упомянутой кислоты обеспечиваются также сложные эфиры упомянутой бензойной кислоты, главным образом сложный изопропиловый эфир.
Краткая сущность изобретения
По одному аспекту настоящее изобретение относится к новым производным бензойной кислоты формулы 1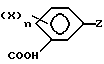
и их солям и сложным эфирам, где X является галогеном, C1-6- полигалогеналкилом, C6-10-арилокси, C6-10-алкокси или алкилсульфонилом, С4-10-трет-алкилом, NO2 или CN;
n равно 0-4;
Z представляет (не)замещенное карбоциклическое или гетероциклическое кольцо, имеющее до 8-ми кольцевых членов, причем гетероциклическое кольцо содержит один или несколько атомов О, N или S, а заместители углерода в кольце могут быть одним или несколькими X-группами, а заместителями кольцевых гетероатомов N могут быть C1-6-(галоген)алкил, водород или X-группа.
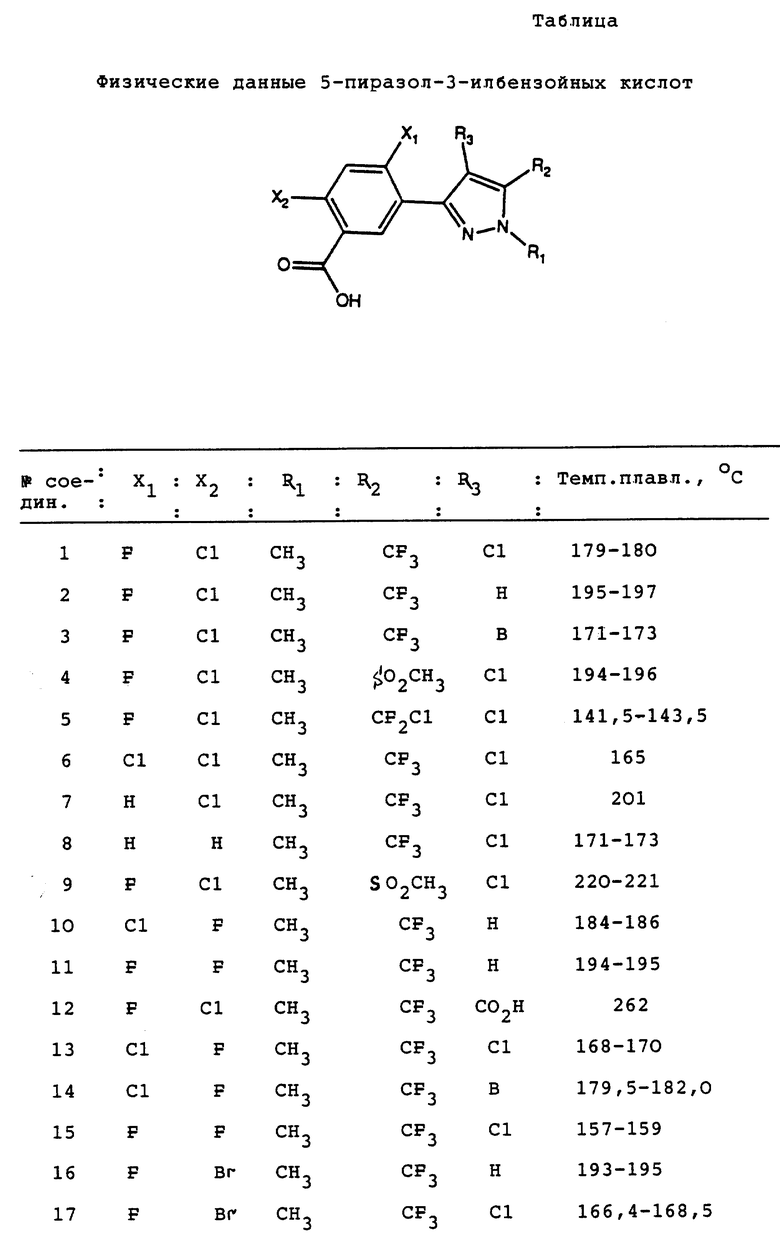
Предпочтительными соединениями формулы 1 являются такие, в которых X-группы представляют галоген и Z является замещенным 3- или 5- пиразолильным радикалом.
Более предпочтительными соединениями формулы 1 являются такие соединения, которые входят в подкласс пиразолов бензойной кислоты формулы II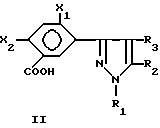
и их солей и сложных эфиров, где:
X1, и X2 являются галогеном или водородом;
R1 является C1-8-алкилом;
R2 является C1-6-галогеналкилом или алкилсульфонилом;
R3 является водородом или галогеном.
Еще более предпочтительными соединениями в соответствии с формулой II являются такие, в которых:
Х1 является фтором;
X2 является хлором или бромом;
R1 является метилом;
R2 является -CF3, -CF2Cl, C2F5 или -CF2H;
R3 является водородом, бромом или хлором.
Предпочтительными видами соединений формулы II являются:
5-[4-хлор-1-метил-5-(трифторметил)-1H-пиразол-3-ил] -2-хлор-4- фторбензойная кислота;
5-[4-бром-1-метил-5-(трифторметил)-1H-пиразол-3-ил] -2-хлор-4- фторбензойная кислота;
н-пропиловый эфир 5-[4-хлор-1-метил-5-(трифторметил)-1Н-пиразол-3-ил] -2-хлор-4-фторбензойной кислоты;
изопропиловый эфир 5-[4-хлор-1-метил-5-(трифторметил)-1H-пиразол-3-ил] -2-хлор-4-фторбензойной кислоты;
н-пропиловый эфир 5-[4-бром-1-метил-5-(трифторметил)-1Н-пиразол-3-ил]-2-хлор-4-фторбензойной кислоты;
изопропиловый эфир 5-[4-бром-1-метил-5-(трифторметил)-1H-пиразол- 3-ил] -2-хлор-4-фторбензойной кислоты.
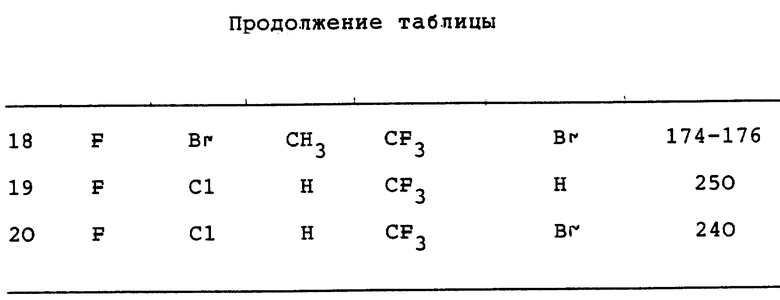
По другому аспекту это изобретение относится к новому способу получения соединений формул I и II, который включает прямое окисление соединений в соответствии c формулой III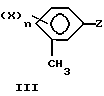
в которой X, n и Z являются такими, как они определены ранее.
В предпочтительных вариантах соединение в соответствии с формулой III, в которой оба X в орто- и параположениях являются галогеном и Z представляет 3- или 5-пиразолильное соединение, окисляют в жидкой фазе молекулярным кислородом или кислородсодержащим газом в присутствии катализатора окисления. Диапазон температур реакции составляет примерно 0oC-300oC, а значения давлений находятся в диапазоне от ниже окружающего до значений >70,3 кг/см2.
Подробное описание изобретения
Пиразолилбензойные кислоты получают из метилфенилпиразолов путем окисления молекулярным кислородом в подходящем растворителе в присутствии катализатора или смеси катализаторов и других вспомогательных веществ в диапазоне температур от 0oC до 300oC, предпочтительно от 50oC до 150oC. Может быть применен любой подходящий растворитель, который не препятствует протеканию реакции, при этом предпочтительным растворителем является уксусная кислота. Источник кислорода может состоять из чистого кислорода, воздуха или смеси кислорода или воздуха в других носителях. На скорость реакции может благоприятно влиять применение давления и в зависимости от оборудования и желательной скорости реакции могут быть использованы любые давления от около 1 кг/см2 до > 70,3 кг/см2 (от одной атмосферы до более чем 1000 фунтов/дюйм2). Применение давлений выше 1 кг/см2 оказывает благоприятное воздействие на скорость реакции; однако при этом не исключается применение более высоких или более низких давлений.
Для благоприятного воздействия на скорость окисления используют катализаторы или смесь катализаторов. Могут быть использованы смеси катализаторов на основе солей металлов, содержащие любую соль или комбинацию солей, включающую соли кобальта, соли марганца, соли никеля, соли цезия и соли циркония, но при этом не ограничиваются только ими. Примерами таких солей являются соли алифатических кислот, ацетат кобальта (II), формиат кобальта, гексилат кобальта, ацетат марганца (II), ацетат цезия (III) и т.д., хелатные соединения, например ацетилацетонат кобальта, ацетилацетонат циркония (IV) и т. д. , и соли металлов, например хлорид кобальта, карбонат кобальта, хлорид никеля, хлорид марганца, хлорид циркония и т.д. Другие катализаторы включают галогениды щелочного металла, алкилгалогенид, соли лития, бромидные соли, карбоксилатные соли и т. д., включая бромистый водород, бромистый натрий, бромуксусную кислоту, бромид аммония, ацетат натрия и т.д., но при этом не ограничиваются только ими. Количество катализатора или каждого катализатора в смеси может независимо изменяться от менее чем 1 мол.% до приблизительно одного молярного эквивалента относительно соединения формулы III.
В качестве вспомогательных веществ могут быть также использованы промежуточные галогенированные или окисленные соединения, полученные дериватизацией соединения формулы III. Так, к реакционной смеси для благоприятного воздействия на скорость реакции могут быть добавлены производные бензилбромида, полученные путем бромирования метилфенильной группы, или бензальдегиды, полученные путем частичного окисления метилфенильной группы. Для инициирования или усиления окисления можно также использовать пероксиды, например пероксид водорода, которые являются в особенности подходящими для инициирования или усиления окислений, происходящих при атмосферном давлении, главным образом перед завершением, когда окисление замедляется. Количества вспомогательных веществ, в частности, не ограничены и их можно применять в любых количествах, необходимых для получения желательных скоростей реакции. Предпочтительные количества одиночных вспомогательных веществ или смесей вспомогательных веществ составляют независимо от менее чем от 0,1 мол.% до 10 мол.%.
Может быть использован любой подходящий растворитель, который является стойким к реакционным условиям, или реакцию можно проводить в отсутствие растворителя. Предпочтительные растворители включают алифатические карбоновые кислоты и ангидриды, например уксусную кислоту и уксусный ангидрид, но при этом не ограничиваются только ими. Количество используемого растворителя не ограничено, однако скорости реакции можно увеличить путем применения ограниченного количества растворителя.
Общие выходы и простоту проведения способа можно благоприятно улучшить путем сочетания стадий галогенирования и окисления, как это приведено ниже в случае метилфенил-4-гидропиразола формулы IV, который превращают в 4-галогенпиразолилбензойную кислоту (соединение формулы II, в которой R3 является галогеном), в виде одной стадии без выделения промежуточного соединения. Двухстадийные реакции в этом способе можно осуществлять в любом из двух возможных порядков; окисление с последующим галогенированием или галогенирование с последующим окислением. Предпочтительной последовательностью является галогенирование с последующим окислением.
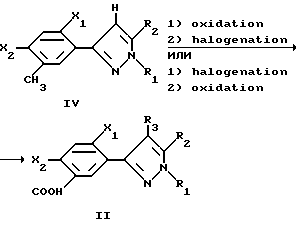
Соединения формулы II, полученные этим способом, являются в особенности пригодными для получения арилпиразольных гербицидов, которые описаны ранее. Для получения ряда производных гербицидного сложного эфира, амида, тиоэфира, тиоамида и т. д. способами, известными в данной области, можно дериватизировать карбоновую группу.
Для этерификации СООН-группы, как показано ниже, в примере 6, могут быть использованы, например, подходящие спирты, например пропиловый или изопропиловый спирт.
Последующие примеры 1-6 описывают конкретные рабочие варианты получения характерных соединений в соответствии с этим изобретением. Примеры 1-3 описывают конкретные рабочие варианты одностадийного окисления соединений формулы IV.
Пример I.
Получение 2-хлор-5-[4-хлор-1-метил-5-(трифторметил)-1Н- пиразол-3-ил]-4-фторбензойной кислоты (соединение N 1).
В 5 л круглодонной колбе приготовили раствор 700 г (2,14 моля) 4-хлор-3-(4-хлор-2-фтор-5-метилфенил)-1-метил-5- (трифторметил)-1H-пиразола в 1000 мл ледяной уксусной кислоты и обработали каталитической смесью, состоящей из 5,25 г тетра- гидрата ацетата кобальта (II), 0,55 г тетрагидрата ацетата марганца (II) и 4,2 г бромида натрия. Содержимое колбы нагрели до 95oC и в перемешанную реакционную смесь ввели воздушный поток (20,9% кислорода). После нагревания в течение двух дней смесь обработали 2,5 л холодной воды, затем обеспечили охлаждение до комнатной температуры. Фильтрацией собрали полученное твердое вещество, которое сушили на воздухе, при этом получили 745 г (97,4%) белого твердого вещества. Аналитическую пробу перекристаллизовали из смеси простого эфира и гексана:
температура плавления 179oC - 181oC; 1H ЯМР (CDCl3 + DMSO) δ 11,84 (S, широк. 1Н), 8,09 (d, j = 8H, 1Н), 7,21 (d, j = 10 H, 1H), 3,96 (S, 3H); 19 F ЯМР (CDCl3 + DMSO) δ -63,9 (S, 3F), -110,4 (m, 1F).
Аналитически вычислено для C13H6N2O2F4Cl2 : C 40,36; H 1,69; N 7,84.
Найдено: C 40,49; H 1,74; N 7,77.
Пример 2.
Получение 2-хлор-5-[1-метил-5-(трифторметил)-1Н-пиразол-3-ил]-4-фторбензойной кислоты (соединение N 2).
Смесь, состоящую из 40,6г 3-(4-хлор-2-фтор-5-метилфенил)- 1-метил-5-(трифторметил)-1Н-пиразола в 70 мл ледяной уксусной кислоты, 0,34 г тетрагидрата ацетата кобальта (II), 0,033 г тетрагидрата ацетата марганца (II), 0,28 г бромида натрия и 0,1 г 2-хлор-5-(4-хлоро-1-метил-5-трифторметил)-1Н-пиразол-3-ил)-4- фторбензальдегида поместили в 300 мл автоклав Парра (Hastaloy), снабженный перемешивающим приспособлением, в автоклаве создали повышенное давление с помощью газа кислорода, равное 7,0 кг/см2. Сосуд нагрели до 145oC и путем добавления некоторого количества кислорода поддерживали давление кислорода равным 10,5 кг/см3. После того, как поглощение кислорода снизилось (203 часа), смесь поддерживали при 145oC-150oC/10,5 кг/см3 (150 фунтов/дюйм2) в течение еще 90 минут. Затем автоклав охладили, понизили давление и содержимое добавили к 400 мл холодной воды. Суспензию фильтровали, твердое промыли холодной водой и сушили на воздухе, при этом получили 42,2 г (94,3%) белого твердого вещества. Путем перекристаллизации из этилацетата получили аналитическую пробу:
температура плавления 195oC-197oC;
1H ЯМР (CDCl3) 4,01 (S, 3H), 6,93 (S, 1Н), 7,18 (d, 1Н), 8,67 (d, 1H).
Аналитически вычислено для C12H7ClF4N2O2 : С 44,67; Н 2,19; N 8,68.
Найдено: С 44,67; Н 2,18; N 8,63.
Пример 3.
Получение 2-хлор-5-[1-метил-5-(трифторметил)-1Н-пиразол-3-ил] -4-фторбензойной кислоты (соединение N 2).
В 1 л колбе типа колбы Мортона приготовили раствор из 100 г (0,34 моля) 3-(4-хлор-2-фтор-5-метилфенил)-1-метил-5- (трифторметил)-1Н-пиразола в 400 мл ледяной уксусной кислоты и обработали каталитической смесью, состоящей из 0,85 г тетрагидрата ацетата кобальта (II), 0,10 г тетрагидрата ацетата марганца (II) и 1,05 г бромида натрия. Содержимое колбы нагрели до 109oC и при скорости потока 150 мл/мин в перемешанную реакционную смесь ввели воздушный поток (20,9% кислорода). Для инициирования реакции добавили пять капель 50% пероксида водорода. Как только реакция была запущена, содержание кислорода в воздушном потоке, выходящем из реакционной смеси, упало с 20,9% до 8,9%. Через 22 часа смесь обработали 750 мл холодной воды и обеспечили охлаждение до комнатной температуры. Полученное твердое собрали фильтрацией, промыли 1 л холодной воды и сушили на воздухе, при этом получили 104 г (97,4%) бледно-рыжеватого твердого вещества. Из этилацетата перекристаллизовали аналитическую пробу: температура плавления 195oC-197oC.
Примеры 4 и 5 описывают конкретные рабочие варианты объединенной последовательности окисление-галогенирование для получения соединений формулы II, в которой R3 является галогеном.
Пример 4.
Получение 2-хлор-5-[4-хлор-1-метил-5-(трифторметил)-1Н- пиразол-3-ил]-4-фторбензойной кислоты (соединение N 1).
В 1 л колбе типа колбы Мортона приготовили раствор 100 г (0,34 моля) 3-(4-хлор-2-фтор-5-метилфенил)-1-метил-5- (трифторметил)-1H-пиразола в 400 мл ледяной уксусной кислоты и обработали каталитической смесью, состоящей из 0,85 г тетрагидрата ацетата кобальта (II), 0,10 г тетрагидрата ацетата марганца (II) и 1,65 г бромида натрия. Содержимое колбы нагрели до 105oC и в перемешанную смесь со скоростью потока 150 мл/мин ввели воздушный поток (20,9% кислорода). Для инициирования реакции добавили пять капель 50% пероксида водорода. Через 24 часа обеспечили охлаждение смеси до комнатной температуры, в результате чего получили суспензию, содержащую бензойную кислоту (соединение N 2). К перемешанной суспензии в течение 10 минут добавили 25,5 г (0,34 моля) хлора. Смесь поддерживали при 30oC в течение всей ночи и затем обработали 700 мл холодной воды. При фильтрации суспензии получили твердое, которое трижды промыли 500 мл воды и после воздушной сушки получили 114 г (93,7%) белого твердого вещества: температура плавления 179-181oC.
Пример 5.
Получение 5-[4-бром-1-метил-5-(трифторметил)-1Н-(пиразол- 3-ил] -2-хлор-4-фторбензойной кислоты (соединение N 3).
В 1 л колбе типа колбы Мортона приготовили раствор 100 г (0,34 моля) 3-(4-хлор-2-фтор-5-метилфенил)-1-метил-5- (трифторметил)-IH-пиразола в 400 мл ледяной уксусной кислоты и обработали каталитической смесью, состоящей из 0,85 г тетрагидрата ацетата кобальта (II), 0,10 г тетрагидрата ацетата марганца (II) и 1,65 г бромида натрия. Содержимое колбы нагрели до 105oC и в перемешанную смесь со скоростью потока 150 мл/мин ввели воздушный поток (20,9% кислорода). Для инициирования реакции добавили пять капель 50% пероксида водорода. Через 24 часа обеспечили охлаждение смеси до 50oC, в результате чего получили суспензию, содержащую бензойную кислоту (соединение N 2). К перемешанной суспензии добавили 100 г (0,63 мол) брома и смесь нагрели до 65oC. Через 6 часов смесь обработали 25 мл воды и через 12 часов еще 25 мл воды и затем добавили 3,5 г брома. После протекания реакции в целом в течение 24 часов смесь обработали 185 мл 23% раствора сульфита натрия для уничтожения избытка брома. Для установления температуры 26oC полученную смесь обработали 150 мл льда. При фильтрации суспензии получили твердое, которое промыли холодной водой и затем сушили на воздухе, получив при этом 127,9 г (93,3%) белого порошка:
температура плавления 171-173oC; 1H ЯМР (CDCl3) δ 4,22 (S, 3H), 7,49 (d, 1Н); 8,39 (d, 1Н).
Аналитически вычислено для C12H6BrClF4N2O2 : С 35,87; H 1,50; N 6,97.
Найдено: С 35,79; H 1,64; N 6,90.
Пример 6 описывает конкретный рабочий вариант превращения соединения формулы II в производное арилпиразола.
Пример 6.
Получение 1-метилэтил-5-[4-бром-1-метил-5-(трифторметил) - 1Н-пиразол-3-ил]-2-хлор-4-фторбензоата.
Приготовили раствор 100 г (0,25 моля) 5-[4-бpoм-l-мeтил-5- (трифторметил)-IH-пиразол-3-ил] -2-хлор-4-фторбензойной кислоты в 580 мл толуола и обработали 1 г диметилформамида (DMF). Перемешанную смесь нагрели до 45oC, обработали 30 г (0,252 моля) тионилхлорида и затем нагрели в течение одного часа до 60oC-65oC. После охлаждения до 40oC сразу же добавили раствор 30 г (0,50 моля) изопропанола и 27,6 г (0,35 моля) пиридина. Смесь перемешали и в течение 30 минут для завершения превращения промежуточного хлорангидридного соединения в целевой продукт нагрели до 55oC. Путем обработки 650 мл воды и 45 г ацетона получили два прозрачных слоя. Удалили водный слой, а органическую порцию промыли водой, насыщенным рассолом, сушили MgSO4 и концентрировали до получения вязкого масла. Путем растворения масла в 250 г нагретого изопропанола, охлаждения смеси до комнатной температуры и медленной обработки 600 мл холодной воды получили твердое. Полученный осадок собрали фильтрацией, промыли водой и сушили на воздухе, при этом получили 105 г (94,7%) белого твердого вещества:
температура плавления 79,5oC - 80,5oC. 1H ЯМР (CDCl3) δ 1,49 (d, 6Н), 4,21 (S, 3H), 5,38 (m, 1Н), 7,43 (d, IH), 8,14 (d, 1H).
Аналитически вычислено для С15H12BrClF4N2O2 : С 40,59; H 2,71; N 6,31.
Найдено: С 40,60; H 2,73; N 6,29.
В приведенной ниже таблице показаны примеры соединений формулы II, полученных вышеприведенными способами.
Гетероциклические или карбоциклические замещенные кислоты настоящего изобретения являются пригодными в качестве промежуточных соединений для получения или производства химических препаратов для сельского хозяйства и медицины, главным образом для получения гербицидов типа замещенного фенилпиразола. Этот способ позволяет осуществить непосредственное введение функциональной группы бензойной кислоты в 5'- положение фенильного кольца арилпиразола для последующего превращения в различные производные сложного эфира и амида. Кроме того, как галогенирование гетероциклического кольца, так и окисление метильной группы в фенильном кольце можно осуществлять в виде одностадийного процесса, при этом устраняется стадия выделения промежуточного продукта.
Для специалистов в данной области являются очевидными различные эквивалентные модификации описанного здесь изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРОИЗВОДНЫЕ ПИРАЗОЛА, СПОСОБЫ ИХ ИСПОЛЬЗОВАНИЯ, ГЕРБИЦИДНАЯ КОМПОЗИЦИЯ И СПОСОБ БОРЬБЫ | 1991 |
|
RU2137761C1 |
| СОЕДИНЕНИЯ ОКСАЗОЛИДИНДИГАЛОАЦЕТАМИДА И СПОСОБ УМЕНЬШЕНИЯ ФИТОТОКСИЧЕСКОГО ДЕЙСТВИЯ ГЕРБИЦИДОВ | 1988 |
|
RU2093029C1 |
| СОЕДИНЕНИЕ, КОМПОЗИЦИЯ ДЛЯ БОРЬБЫ С НАСЕКОМЫМИ, СПОСОБЫ БОРЬБЫ С НАСЕКОМЫМИ | 2002 |
|
RU2298007C2 |
| СПОСОБ ПОЛУЧЕНИЯ 3-ГАЛОГЕН-4,5-ДИГИДРО-1Н-ПИРАЗОЛОВ | 2003 |
|
RU2326877C2 |
| ПИРАЗОЛИЛЗАМЕЩЕННЫЙ БЕНЗОЛСУЛЬФОНАМИД ИЛИ ЕГО ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМАЯ СОЛЬ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СПОСОБ ЛЕЧЕНИЯ ОТ ВОСПАЛЕНИЯ ИЛИ СВЯЗАННОГО С ВОСПАЛЕНИЕМ ЗАБОЛЕВАНИЯ | 1994 |
|
RU2139281C1 |
| СРЕДСТВО ДЛЯ ПРОФИЛАКТИКИ ИЛИ ЛЕЧЕНИЯ НЕВРОПАТИИ | 2003 |
|
RU2337682C2 |
| ХИНАЗОЛИН(ДИ)ОНЫ, КОМПОЗИЦИЯ ДЛЯ БОРЬБЫ С НАСЕКОМЫМИ-ВРЕДИТЕЛЯМИ, СПОСОБ БОРЬБЫ С НАСЕКОМЫМИ-ВРЕДИТЕЛЯМИ, ПРОМЕЖУТОЧНОЕ СОЕДИНЕНИЕ | 2003 |
|
RU2315765C2 |
| КОНДЕНСИРОВАННОЕ ГЕТЕРОЦИКЛИЧЕСКОЕ СОЕДИНЕНИЕ | 2005 |
|
RU2389731C2 |
| Способ борьбы с нежелательной растительностью | 1988 |
|
SU1814516A3 |
| ИНСЕКТИЦИДНЫЕ АНТРАНИЛАМИДЫ | 2001 |
|
RU2278852C2 |
Описывается способ получения новых производных фенилзамещенного пиразола формулы (II) и их солей и сложных эфиров, где Х1 и Х2 являются галогеном или водородом; R1 является C1-6-алкилом; R2 является C1-6-галогеналкилом или алкилсульфонилом и R3 является H или галогеном, отличающийся тем, что окисляют соединение формулы (III), в которой X является таким, как он определен ранее, кислородом или кислородсодержащим газом в присутствии катализатора окисления в инертном растворителе. Технический результат - обеспечение новых карбоциклических (гетероциклических) замещенных бензойных кислот, пригодных в качестве промежуточных соединений или предшественников для получения соответствующих сложноэфирных соединений, которые являются полезными гербицидными соединениями. 7 з.п.ф-лы, 1 табл.
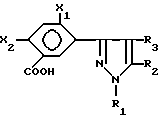
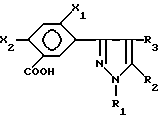
и их солей и сложных эфиров, где
Х1 и Х2 является галогеном или водородом;
R1 является С1-6 - алкилом;
R2 является С1-6 - галогеналкилом или алкилсульфонилом, и
R3 является Н или галогеном,
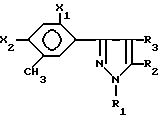
отличающийся тем, что окисляют соединение формулы III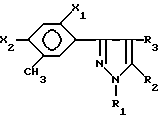
в которой Х является таким, как он определен ранее,
кислородом или кислородсодержащим газом в присутствии катализатора окисления в инертном растворителе.
| WO 9206962 A, 30.04.1992 | |||
| Способ получения производных пиразола или их фитологически приемлемых солей | 1985 |
|
SU1440343A3 |
| WO 9202509 A, 20.02.1992 | |||
| ЛОГИЧЕСКИЙ ЭЛЕМЕНТ «И—ИЛИ-НЕ» | 0 |
|
SU350176A1 |
Авторы
Даты
2000-08-20—Публикация
1995-07-14—Подача