Настоящее изобретение относится к лекарственным средствам, содержащим в качестве действующего начала по крайней мере одно соединение формулы (I)
или один из его стереоизомеров или одну из его солей, к новым соединениям формулы (I), их стереоизомерам и их солям и способу их получения. В формуле (I):
либо (А) каждый из R9 и R10 означает радикал -СН2ОН и либо
а) R5 означает метилен, R4 означает радикал -СНОН- и один из радикалов R1, R3, R5 и R6 означает карбонил, метилен, -CHF-, -CH(NHR7)- или -CH(OR8)-, а каждый из других означает радикал -СНОН-;
б) каждый из R2 и R5 означает радикал -СНОН-, R3 означает метилен и R1, R4 и R5 являются одинаковыми и каждый означает карбонил, метилен, -CHF-, -CH(NHR7)- или -СН(OR8)-;
в) каждый из R1 и R6 означает радикал -СНОН-, R3 означает метилен и R2, R4 и R5 являются одинаковыми и каждый означает карбонил, метилен, -CHF-, -CH(NHR7)- или -CH(OR8)-;
г) каждый из R1, R4, R5 и R6 означает радикал -СНОН- и -R3-R5- означает радикал -СН=СН-;
либо (Б) каждый из R1, R2, R4, R5 и R6 означает радикал -СНОН-, R3 означает метилен, R9 означает радикал -CH2F или -СН2ОН, R10 означает радикал -CH2F или -СН2OН, причем R9 и R10 оба одновременно не означают радикал -СН2ОН;
R7 означает атом водорода или алкил, -СО-алк, -СО-Аr или -СО-Гет;
R8 означает алкил, алк-СООН или -алк-ОН;
алк означает алкил;
Ar означает фенил или фенил, замещенный одним или несколькими заместителями, выбираемыми из группы, состоящей из атома галогена, алкила, алкокси, алкоксикарбонила, амино, моноалкиламино или диалкиламино;
Гет означает насыщенный или ненасыщенный моно-, ди- или тригетероцикл, содержащий 1-9 атомов углерода и один или несколько гетероатомов, выбираемых из группы, состоящей из атомов кислорода, серы и азота.
В указанных выше и приводимых ниже определениях алкильные и алкоксильные радикалы и алкильные и алкоксильные части содержат 1-6 атомов углерода в линейной или разветвленной цепи, и атомами галогена являются атомы хлора, фтора, иода и брома.
Соединения формулы (I), включающие несколько асимметрических атомов углерода, имеют стереоизомерные формы. Эти различные стереоизомеры составляют часть изобретения. Кроме того, соединения, в которых -R2-R3- означает радикал -СН=СН-, могут находиться в цис- или транс-форме; эти формы также составляют часть изобретения.
Предпочтительно Гет означает гетероцикл, выбираемый из циклов: 2-, 3- или 4-пиридил, имидазолил, тиазолил и оксазолил.
Иными словами, соединения формулы (I) отвечают следующим формулам: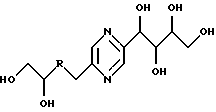
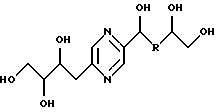
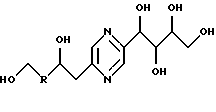
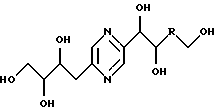
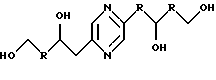
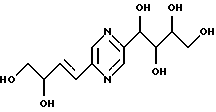
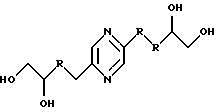

в которых R означает карбонил, метилен, -СНF-, -CH(NHR7)- или -CH(OR8)-, R7, R8, R9 и R10 имеют вышеуказанные значения; их стереоизомерные формы и цис- и транс-формы соединений, включающих цепь -СН=СН-.
Предпочтительными лекарственными средствами являются такие, которые содержат в качестве действующего начала по крайней мере одно соединение формулы (I), выбираемое из следующих соединений:
1-[5-(3R,4-дигидрокси-2-оксобутил)пиразин-2-ил]бутан-1R,23,3R,4-тетраол;
1-[5-(3S,4-дигидроксибутил)пиразин-2-ил]бутан-1R,2S,3R,4-тетраол;
1-[5-(2S-фтор-3R, 4-дигидроксибутил)пиразин-2-ил] бутан-1R, 2S,3R,4-тетраол;
1-[5-(2R-фтор-3R, 4-дигидроксибутил)пиразин-2-ил] бутан-1R,2S,3R, 4-тетраол;
1-[5-(2S-aмино-3S, 4-дигидроксибутил)пиразин-2-ил] бутан-1R,2S,3R,4-тетраол;
1-[5-(2R-aминo-3S, 4-дигидроксибутил)пиразин-2-ил] бутан-1R,2S,3R,4-тетраол;
1-[5-(2S-(N-метил)aмино-3S, 4-дигидроксибутил)пиразин-2-ил] бутан-1R,2S, 3R,4-тетраол;
1-[5-(2R-(N-метил)aмино-3S, 4-дигидроксибутил)пиразин-2-ил] бутан-1R,2S, 3R,4-тетраол;
1-[5-(2S-(N-этил)aмино-3S,4-дигидроксибутил)пиразин-2-ил]бутан-1R,2S,3R, 4-тетраол;
1-[5-(2R-(N-этил)aмино-3S,4-дигидроксибутил)пиразин-2-ил]бутан-1R,2S,3R, 4-тетраол;
1-[5-(2S-(N-н-бутил)амино-3S,4-дигидроксибутил)пиразин-2-ил]бутан-1R,2S, 3R,4-тетраол;
1-[5-(2R-(N-н-бутил)амино-3S,4-дигидроксибутил)пиразин-2-ил]бутан-1R,2S, 3R,4-тетраол;
1-[5-(2S-(N-бензил)амино-3S, 4-дигидроксибутил)пиразин-2-ил]бутан-1R,2S, 3R,4-тетраол;
1-[5-(2R-(N-бензил)амино-3S, 4-дигидроксибутил)пиразин-2-ил]бутан-1R,2S, 3R,4-тетраол;
1-[5-(2S-(N-ацетил)амино-3S, 4-дигидроксибутил)пиразин-2-ил]бутан-1R,2S, 3R,4-тетраол;
1-[5-(2R-(N-ацетил)амино-3S, 4-дигидроксибутил)пиразин-2-ил]бутан-1R,2S, 3R,4-тетраол;
1-[5-(2S-(N-бутаноил)амино-3S, 4-дигидроксибутил)пиразин-2-ил] бутан-1R, 2S,3R,4-тетраол;
1-[5-(2R-(N-бутаноил)амино-3S, 4-дигидроксибутил)пиразин-2-ил] бутан-1R, 2S,3R,4-тетраол;
1-[5-(2S-(N-бензоил)амино-3S,4-дигидроксибутил)пиразин-2-ил]бутан-1R,2S, 3R,4-тетраол;
1-[5-(2R-(N-бензоил)амино-3S,4-дигидроксибутил)пиразин-2-ил]бутан-1R,2S, 3R,4-тетраол;
1-[5-(2S-метокси-3R,4-дигидроксибутил)пиразин-2-ил]бутан-1R,2S,3R,4-тетраол;
1-[5-(2R-метокси-3R,4-дигидроксибутил)пиразин-2-ил]бутан-1R,2S,3R,4-тетраол;
1-[5-(2S-этокси-3R, 4-дигидроксибутил)пиразин-2-ил]бутан-1R,2S,3R,4-тетраол;
1-[5-(2R-этокси-3R, 4-дигидроксибутил)пиразин-2-ил]бутан-1R,2S,3R,4-тетраол;
1-[5-(2S-н-бутокси-3S, 4-дигидроксибутил)пиразин-2-ил]бутан-1R,2S,3R,4-тетраол;
1-[5-(2R-н-бутокси-3R, 4-дигидроксибутил)пиразин-2-ил]бутан-1R,2S,3R,4-тетраол;
1-[5-(2S-(2-гидроксиэтил)окси-3R, 4-дигидроксибутил)пиразин-2-ил] бутан-1R,2S,3R,4-тетраол;
1-[5-(2R-(2-гидроксиэтил)окси-3R, 4-дигидроксибутил)пиразин-2-ил]бутан-1R, 2S,3R,4-тетраол;
1-[5-(2S-(3-гидрокси-н-пропил)окси-3R,4-дигидроксибутил)пиразин-2-ил]бутан-1R,2S,3R,4-тетраол;
1-[5-(2R-(3-гидрокси-н-пропил)окси-3R,4-дигидроксибутил)пиразин-2-ил]бутан-1R,2S,3R,4-тетраол;
1-[5-(2S-(карбоксиметил)окси-3R,4-дигидроксибутил)пиразин-2-ил]бутан-1R, 2S,3R,4-тетраол;
1-[5-(2R-(карбоксиметил)окси-3R,4-дигидроксибутил)пиразин-2-ил]бутан-1R, 2S,3R,4-тетраол;
1-[5-(2S-(3-карбокси-н-пропил)окси-3R,4-дигидроксибутил)пиразин-2-ил]бутан-1R,2S,3R,4-тетраол;
1-[5-(2R-(3-карбокси-н-пропил)окси-3R,4-дигидроксибутил)пиразин-2-ил]бутан-1R,2S,3R,4-тетраол;
1-[5-(2S,4-дигидрокси-3-оксобутил)пиразин-2-ил]бутан-1R,2S,3R,4-тетраол;
1-[5-(2S,4-дигидроксибутил)пиразин-2-ил]бутан-1R,2S,3R,4-тетраол;
1- [5-(3R-фтоp-2S, 4-дигидроксибутил)пиразин-2-ил] бутан-1R, 2S, 3R,4-тетраол;
1-[5-(3S-фтор-2S, 4-дигидроксибутил)пиразин-2-ил] бутан-1R, 2S,3R,4-тетраол;
1-[5-(3R-амино-2R, 4-дигидроксибутил)пиразин-2-ил] бутан-1R,2S,3R,4-тетраол;
1-[5-(3S-амино-2R, 4-дигидроксибутил)пиразин-2-ил] бутан-1R,2S,3R,4-тетраол;
1-[5-(3R-(N-метил)амино-2R, 4-дигидроксибутил)пиразин-2-ил]-бутан-1R,2S, 3R,4-тетраол;
1-[5-(3S-(N-метил)амино-2R, 4-дигидроксибутил)пиразин-2-ил] бутан-1R,2S, 3R,4-тетраол;
1-[5-(3R-(N-этил)амино-2R,4-дигидроксибутил)пиразин-2-ил]бутан-1R,2S,3R, 4-тетраол;
1-[5-(3S-(N-этил)амино-2R,4-дигидроксибутил)пиразин-2-ил]бутан-1R,2S,3R, 4-тетраол;
1-[5-(3R-(N-н-бутил)амино-2R,4-дигидроксибутил)пиразин-2-ил]бутан-1R,2S, 3R,4-тетраол;
1-[5-(3S-(N-н-бутил)амино-2R,4-дигидроксибутил)пиразин-2-ил]бутан-1R,2S, 3R,4-тетраол;
1-[5-(3R-(N-бензил)амино-2R, 4-дигидроксибутил)пиразин-2-ил]бутан-1R,2S, 3R,4-тетраол;
1-[5-(3S-(N-бензил)амино-2R, 4-дигидроксибутил)пиразин-2-ил]бутан-1R,2S, 3R,4-тетраол;
1-[5-(3R-(N-ацетил)амино-2R, 4-дигидроксибутил)пиразин-2-ил]бутан-1R,2S, 3R,4-тетраол;
1-[5-(3S-(N-ацетил)амино-2R, 4-дигидроксибутил)пиразин-2-ил]бутан-1R,2S, 3R,4-тетраол;
1-[5-(3R-(N-бутаноил)амино-2R, 4-дигидроксибутил)пиразин-2-ил] бутан-1R, 2S,3R,4-тетраол;
1-[5-(3S-(N-бутаноил)амино-2R, 4-дигидроксибутил)пиразин-2-ил] бутан-1R, 2S,3R,4-тетраол;
1-[5-(3R-(N-бензоил)амино-2R,4-дигидроксибутил)пиразин-2-ил]бутан-1R,2S, 3R,4-тетраол;
1-[5-(3S-(N-бензоил)амино-2R,4-дигидроксибутил)пиразин-2-ил]бутан-1R,2S, 3R,4-тетраол;
1-[5-(3R-метокси-2S, 4-дигидроксибутил)пиразин-2-ил] бутан-1R, 2S,3R,4-тетраол;
1-[5-(3S-метокси-2S, 4-дигидроксибутил)пиразин-2-ил] бутан-1R, 2S,3R,4-тетраол;
1-[5-(3R-этокси-2S, 4-дигидроксибутил)пиразин-2-ил] бутан-1R, 2S, 3R,4-тетраол;
1-[5-(3S-этокси-2S, 4-дигидроксибутил)пиразин-2-ил] бутан-1R, 2S, 3R,4-тетраол;
1-[5-(3R-н-бутокси-2S, 4-дигидроксибутил)пиразин-2-ил]бутан-1R,2S,3R,4-тетраол;
1-[5-(3S-н-бутокси-2S, 4-дигидроксибутил)пиразин-2-ил]бутан-1R,2S,3R,4-тетраол;
1-[5-(3R-(2-гидроксиэтил)окси-2S, 4-дигидроксибутил)пиразин-2-ил]бутан-1R,2S,3R,4-тетраол;
1-[5-(3S-(2-гидроксиэтил)окси-2S, 4-дигидроксибутил)пиразин-2-ил]бутан-1R,2S,3R,4-тетраол;
1-[5-(3R-(3-гидрокси-н-пропил)окси-2S,4-дигидроксибутил)пиразин-2-ил]бутан-1R,2S,3R,4-тетраол;
1-[5-(3S-(3-гидрокси-н-пропил)окси-2S,4-дигидроксибутил)пиразин-2-ил]бутан-1R,2S,3R,4-тетраол;
1-[5-(3R-(карбоксиметил)окси-2S,4-дигидроксибутил)пиразин-2-ил]бутан-1R, 2S,3R,4-тетраол;
1-[5-(3S-(карбоксиметил)окси-2S,4-дигидроксибутил)пиразин-2-ил]бутан-1R, 2S,3R,4-тетраол;
1-[5-(3R-(3-карбокси-н-пропил)окси-2S,4-дигидроксибутил)пиразин-2-ил]бутан-1R,2S,3R,4-тетраол;
1-[5-(3S-(3-карбокси-н-пропил)окси-2S,4-дигидроксибутил)пиразин-2-ил]бутан-1R,2S,3R,4-тетраол;
4-[5-(2S, 3R,4-тригидроксибутил)пиразин-2-ил]-1,3S,4R-тригидроксибутан-2-он;
1-[5-(2S,3R,4-тригидроксибутил)пиразин-2-ил]бутан-1R,2R,4-триол;
1-[5-(2S,3R,4-тригидроксибутил)пиразин-2-ил]-3R-фторбутан-1R,2S,4-триол;
1-[5-(2S,3R,4-тригидроксибутил)пиразин-2-ил]-3S-фторбутан-1R,2S,4-триол;
1-[5-(2S, 3R,4-тригидроксибутил)пиразин-2-ил]-3R-аминобутан-1R,2R,4-триол;
1-[5-(2S, 3R,4-тригидроксибутил)пиразин-2-ил]-3S-аминобутан-1R,2R,4-триол;
1-[5-(2S, 3R,4-тригидроксибутил)пиразин-2-ил]-3R-(N-метил)аминобутан-1R, 2R,4-триол;
1-[5-(2S, 3R,4-тригидроксибутил)пиразин-2-ил]-3S-(N-метил)аминобутан-1R, 2R,4-триол;
1-[5-(2S, 3R, 4-тригидроксибутил)пиразин-2-ил]-3R-(N-этил)аминобутан-1R, 2R,4-триол;
1-[5-(2S, 3R, 4-тригидроксибутил)пиразин-2-ил]-3S-(N-этил)аминобутан-1R, 2R,4-триол;
1-[5-(2S, 3R,4-тригидроксибутил)пиразин-2-ил]-3R-(N-н-бутил)аминобутан-1R,2R,4-триол;
1-[5-(2S, 3R,4-тригидроксибутил)пиразин-2-ил]-3S-(N-н-бутил)аминобутан-1R,2R,4-триол;
1-[5-(2S,3R,4-тригидроксибутил)пиразин-2-ил]-3R-(N-бензил)аминобутан-1R, 2R,4-триол;
1-[5-(2S,3R,4-тригидроксибутил)пиразин-2-ил]-3S-(N-бензил)аминобутан-1R, 2R,4-триол;
1-[5-(2S,3R,4-тригидроксибутил)пиразин-2-ил]-3R-(N-ацетил)аминобутан-1R, 2R,4-триол;
1-[5-(2S,3R,4-тригидроксибутил)пиразин-2-ил]-3S-(N-ацетил)аминобутан-1R, 2R,4-триол;
1-[5-(2S,3R,4-тригидроксибутил)пиразин-2-ил]-3R-(N-бутаноил)аминобутан-1R,2R,4-триол;
1-[5-(2S,3R,4-тригидроксибутил)пиразин-2-ил]-3S-(N-бутаноил)аминобутан-1R,2R,4-триол;
1-[5-(2S, 3R,4-тригидроксибутил)пиразин-2-ил]-3R-(N-бензоил)аминобутан-1R,2R,4-триол;
1-[5-(2S, 3R,4-тригидроксибутил)пиразин-2-ил]-3S-(N-бензоил)аминобутан-1R,2R,4-триол;
1-[5-(2S, 3R, 4-тригидроксибутил)пиразин-2-ил]-3R-метоксибутан-1R,2S,4-триол;
1-[5-(2S, 3R, 4-тригидроксибутил)пиразин-2-ил]-3S-метоксибутан-1R,2S,4-триол;
1-[5-(2S, 3R, 4-тригидроксибутил)пиразин-2-ил] -3R-этоксибутан-1R,2S,4-триол;
1-[5-(2S, 3R, 4-тригидроксибутил)пиразин-2-ил] -3S-этоксибутан-1R,2S,4-триол;
1-[5-(2S, 3R, 4-тригидроксибутил)пиразин-2-ил] -3R-н-бутоксибутан-1R,2S, 4-триол;
1-[5-(2S, 3R, 4-тригидроксибутил)пиразин-2-ил] -3S-н-бутоксибутан-1R,2S, 4-триол;
1-[5-(2S,3R,4-тригидроксибутил)пиразин-2-ил]-3R-(2-гидроксиэтил)оксибутан-1R,2S,4-триол;
1-[5-(2S,3R,4-тригидроксибутил)пиразин-2-ил]-3S-(2-гидроксиэтил)оксибутан-lR,2S,4-триол;
1-[5-(2S, 3R, 4-тригидроксибутил)пиразин-2-ил] -3R-(3-гидрокси-н-пропил)оксибутан-1R,2S,4-триол;
1-[5-(2S, 3R, 4-тригидроксибутил)пиразин-2-ил] -3S-(3-гидрокси-н-пропил)оксибутан-1R,2S,4-триол;
1-[5-(2S,3R,4-тригидроксибутил)пиразин-2-ил]-3R-(карбоксиметил)оксибутан-1R,2S,4-триол;
1-[5-(2S,3R,4-тригидроксибутил)пиразин-2-ил]-3S-(карбоксиметил)оксибутан-1R,2S,4-триол;
1-[5-(2S, 3R, 4-тригидроксибутил)пиразин-2-ил] -3R-(3-карбокси-н-пропил)оксибутан-1R,2S,4-триол;
1-[5-(2S, 3R, 4-тригидроксибутил)пиразин-2-ил] -3S-(3-карбокси-н-пропил)оксибутан-1R,2S,4-триол;
1-[5-(2S, 3R,4-тригидроксибутил)пиразин-2-ил]-1R,3R,4-тригидроксибутан-2-он;
1-[5-(2S,3R,4-тригидроксибутил)пиразин-2-ил]бутан-1R,3R,4-триол;
1-[5-(2S,3R,4-тригидроксибутил)пиразин-2-ил]-2R-фторбутан-1R,3R,4-триол;
1-[5-(2S,3R,4-тригидроксибутил)пиразин-2-ил]-2S-фopбyтaн-1R,3R,4-триол;
1-[5-(2S, 3R, 4-тригидроксибутил)пиразин-2-ил] -2R-аминобутан-1S, 3S,4-триол;
1-[5-(2S, 3R, 4-тригидроксибутил)пиразин-2-ил] -2S-aминобyтaн-1S, 3S,4-триол;
1-[5-(2S, 3R,4-тригидроксибутил)пиразин-2-ил]-2R-(N-метил)аминобутан-1S, 3S,4-триол;
1-[5-(2S, 3R,4-тригидроксибутил)пиразин-2-ил]-2S-(N-метил)аминобутан-1S, 3S,4-триол;
1-[5-(2S, 3R, 4-тригидроксибутил)пиразин-2-ил]-2R-(N-этил)аминобутан-1S, 3S,4-триол;
1-[5-(2S, 3R, 4-тригидроксибутил)пиразин-2-ил]-2S-(N-этил)аминобутан-1S, 3S,4-триол;
1-[5-(2S, 3R,4-тригидроксибутил)пиразин-2-ил]-2R-(N-н-бутил)аминобутан-1S,3S,4-триол;
1-[5-(2S, 3R,4-тригидроксибутил)пиразин-2-ил]-2S-(N-н-бутил)аминобутан-1S,3S,4-триол;
1-[5-(2S,3R,4-тригидроксибутил)пиразин-2-ил]-2R-(N-бензил)аминобутан-1S, 3S,4-триол;
1-[5-(2S,3R,4-тригидроксибутил)пиразин-2-ил]-2S-(N-бензил)аминобутан-1S, 3S,4-триол;
1-[5-(2S,3R,4-тригидроксибутил)пиразин-2-ил]-2R-(N-ацетил)аминобутан-1S, 3S,4-триол;
1-[5-(2S,3R,4-тригидроксибутил)пиразин-2-ил]-2S-(N-ацетил)аминобутан-1S, 3S,4-триол;
1-[5-(2S,3R,4-тригидроксибутил)пиразин-2-ил]-2R-(N-бутаноил)аминобутан-1S,3S,4-триол;
1-[5-(2S,3R,4-тригидроксибутил)пиразин-2-ил]-2S-(N-бутаноил)аминобутан-1S,3S,4-триол;
1-[5-(2S, 3R,4-тригидроксибутил)пиразин-2-ил]-2R-(N-бензоил)аминобутан-1S,3S,4-триол;
1-[5-(2S, 3R,4-тригидроксибутил)пиразин-2-ил]-2S-(N-бензоил)аминобутан-1S,3S,4-триол;
1-[5-(2S, 3R, 4-тригидроксибутил)пиразин-2-ил]-2R-метоксибутан-1R,3R,4-триол;
1-[5-(2S, 3R, 4-тригидроксибутил)пиразин-2-ил]-2S-метоксибутан-1R,3R,4-триол;
1-[5-(2S, 3R, 4-тригидроксибутил)пиразин-2-ил] -2R-этоксибутан-1R,3R,4-триол;
1-[5-(2S, 3R, 4-тригидроксибутил)пиразин-2-ил] -2S-этоксибутан-1R,3R,4-триол;
1-[5-(2S, 3R, 4-тригидроксибутил)пиразин-2-ил] -2R-н-бутоксибутан-1R,3R, 4-триол;
1-[5-(2S, 3R, 4-тригидроксибутил)пиразин-2-ил] -2S-н-бутоксибутан-1R,3R, 4-триол;
1-[5-(2S,3R,4-тригидроксибутил)пиразин-2-ил]-2R-(2-гидроксиэтил)оксибутан-1R,3R,4-триол;
1-[5-(2S,3R,4-тригидроксибутил)пиразин-2-ил]-2S-(2-гидроксиэтил)оксибутан-1R,3R,4-триол;
1-[5-(2S, 3R, 4-тригидроксибутил)пиразин-2-ил] -2R-(3-гидрокси-н-пропил)оксибутан-1R,3R,4-триол;
1-[5-(2S, 3R, 4-тригидроксибутил)пиразин-2-ил] -2S-(3-гидрокси-н-пропил)оксибутан-1R,3R,4-триол;
1-[5-(2S,3R,4-тригидроксибутил)пиразин-2-ил]-2R-(карбоксиметил)оксибутан-1R,3R,4-триол;
1-[5-(2S,3R,4-тригидроксибутил)пиразин-2-ил]-2S-(карбоксиметил)оксибутан-1R,3R,4-триол;
1-[5-(2S, 3R, 4-тригидроксибутил)пиразин-2-ил] -2R-(3-карбокси-н-пропил)оксибутан-1R,3R,4-триол;
1-[5-(2S, 3R, 4-тригидроксибутил)пиразин-2-ил] -2S-(3-карбокси-н-пропил)оксибутан-1R,3R,4-триол;
1-[5-(2S, 4-дигидрокси-3-оксобутил)пиразин-2-ил] -2S,4-дигидроксибутан-1,3-дион;
4-[5-(2S,4-дигидроксибутил)пиразин-2-ил]бутан-1,3S-диол;
4-[5-(3R-фтор-2S, 4-дигидроксибутил)пиразин-2-ил] -2R, 4R-дифторбутан-1,3S-диол;
4-[5-(3S-фтор-2S, 4-дигидроксибутил)пиразин-2-ил] -2S, 4S-дифторбутан-1,3S-диол;
1-[5-(3R-амино-2S, 4-дигидроксибутил)пиразин-2-ил] -2R,4R-диаминобутан-1,3S-диол;
1-[5-(3S-амино-2S, 4-дигидроксибутил) пиразин-2-ил]-2S,4S-диаминобутан-1,3S-диол;
1-[5-(3R-(N-метил)амино-2S, 4-дигидроксибутил)пиразин-2-ил]-2R,4R-ди(N-метил)аминобутан-1,3S-диол;
1-[5-(3S-N-метил)амино-2S,4-дигидроксибутил)пиразин-2-ил]-2S,4S-ди(N-метил)аминобутан-1,3S-диол;
1-[5-(3R-(N-этил)амино-2S,4-дигидроксибутил)пиразин-2-ил]-2R,4R-ди(N-этил)аминобутан-1,3S-диол;
1-[5-(3S-(N-этил)амино-2S,4-дигидроксибутил)пиразин-2-ил]-2S,4S-ди(N-этил)аминобутан-1,3S-диол;
1-[5-(3R-(N-н-бутил)амино-2S, 4-дигидроксибутил)пиразин-2-ил] -2R, 4R-ди(N-н-бутил)аминобутан-1,3S-диол;
1-[5-(3S-(N-н-бутил)амино-2S, 4-дигидроксибутил)пиразин-2-ил] -2S, 4S-ди(N-н-бутил)аминобутан-1,3S-диол;
1-[5-(3R-(N-бензил)амино-2S, 4-дигидроксибутил)пиразин-2-ил1-2R, 4R-ди(N-бензил)аминобутан-1,3S-диол;
1-[5-(3S-(N-бензил)амино-2S, 4-дигидроксибутил)пиразин-2-ил] -2S, 4S-ди(N-бензил)аминобутан-1,3S-диол;
1-[5-(3R-(N-ацетил)амино-2S, 4-дигидроксибутил)пиразин-2-ил] -2R, 4R-ди(N-ацетил)аминобутан-1,3S-диол;
1-[5-(3S-(N-ацетил)амино-2S, 4-дигидроксибутил)пиразин-2-ил] -2S, 4S-ди(N-ацетил)аминобутан-1,3S-диол;
1-[5-(3R-(N-бутаноил)амино-2S, 4-дигидроксибутил)пиразин-2-ил] -2R, 4R-ди(N-бутаноил)аминобутан-1,3S-диол;
1-[5-(3S-(N-бутаноил)амино-2S, 4-дигидроксибутил)пиразин-2-ил] -2S, 4S-ди(N-бутаноил)аминобутан-1,3S-диол;
1-[5-(3R-(N-бензоил)амино-2S, 4-дигидроксибутил)пиразин-2-ил] -2R, 4R-ди(N-бензоил)аминобутан-1,3S-диол;
1-[5-(3S-(N-бензоил)амино-2S, 4-дигидроксибутил)пиразин-2-ил] -2S, 4S-ди(N-бензоил)аминобутан-1,3S-диол;
1-[5-(3R-метокси-2S, 4-дигидроксибутил) пиразин-2-ил] -2R,4R-диметоксибутан-1,3S-диол;
1-[5-(3S-метокси-2S, 4-дигидроксибутил)пиразин-2-ил] -2S,4S-диметоксибутан-1,3S-диол;
1-[5-(3R-этокси-2S, 4-дигидроксибутил)пиразин-2-ил] -2R, 4R-диэтоксибутан-1,3S-диол;
1-[5-(3S-этокси-2S, 4-дигидроксибутил)пиразин-2-ил] -2S, 4S-диэтоксибутан-1,3S-диол;
1-[5-(3R-н-бутокси-2S, 4-дигидроксибутил)пиразин-2-ил]-2R,4R-ди-н-бутоксибутан- 1,3S-диол;
1-[5-(3S-н-бутокси-2S, 4-дигидроксибутил)пиразин-2-ил]-2S,4S-ди-н-бутоксибутан-1,3S-диол;
1-[5-(3R-(2-гидроксиэтил)окси-2S, 4-дигидроксибутил)пиразин-2-ил] -2R, 4R-ди(2-гидроксиэтил)оксибутан-1,3S-диол;
1-[5-(3S-(2-гидроксиэтил)окси-2S, 4-дигидроксибутил)пиразин-2-ил] -2S, 4S-ди(2-гидроксиэтил)оксибутан-1,3S-диол;
1-[5-(3R-(3-гидрокси-н-пропил)окси-2S, 4-дигидроксибутил)пиразин-2-ил] -2R,4R-ди(3-гидрокси-н-пропил)оксибутан-1,3S-диол;
1-[5-(3S-(3-гидрокси-н-пропил)окси-2S, 4-дигидроксибутил)пиразин- 2-ил] -2S,4S-ди(3-гидрокси-н-пропил)оксибутан-1,3S-диол;
1-[5-(3R-(карбоксиметил)окси-2S, 4-дигидроксибутил)пиразин-2-ил]-2R,4R-ди(карбоксиметил)оксибутан-1,3S-диол;
1-[5-(3S-(карбоксиметил)окси-2S, 4-дигидроксибутил)пиразин-2-ил]-2S,4S-ди(карбоксиметил)оксибутан-1,3S-диол;
1-[5-(3R-(3-карбокси-н-пропил)окси-2S, 4-дигидроксибутил)пиразин-2-ил] -2R,4R-ди(3-карбокси-н-пропил)оксибутан-1,3S-диол;
1-[5-(3S-(3-карбокси-н-пропил)окси-2S, 4-дигидроксибутил)пиразин-2-ил] -2S,4S-ди(3-карбокси-н-пропил)оксибутан-1,3S-диол;
1-[5-(3R, 4-дигидрокси-2-оксобутил)пиразин-2-ил] -3R,4-дигидроксибутан-1,2-дион;
4-[5-(2S,4-дигидроксибутил)пиразин-2-ил]бутан-1,3S-диол;
4-[5-(3R-фтор-2S, 4-дигидроксибутил)пиразин-2-ил] -2R, 4R-дифторбутан-1,3S-диол;
4-[5-(3S-фтор-2S, 4-дигидроксибутил)пиразин-2-ил] -2S, 4S-дифторбутан-1,3S-диол;
4-[5-(3R-амино-2S, 4-дигидроксибутил)пиразин-2-ил] -2R,4R-диаминобутан-1,3S-диол;
4-[5-(3S-амино-2S, 4-дигидроксибутил)пиразин-2-ил] -2S,4S-диаминобутан-1,3S-диол;
4-[5-(3R-(N-метил)амино-2S, 4-дигидроксибутил)пиразин-2-ил]-2R,4R-ди(N-метил)-аминобутан-1,3S-диол;
4-[5-(3S-(N-метил)амино-2S, 4-дигидроксибутил)пиразин-2-ил]-2S,4S-ди(N-метил)аминобутан-1,3S-диол;
4-[5-(3R-(N-этил)амино-2S, 4-дигидроксибутил)пиразин-2-ил] -2R,4R-ди(N-этил)аминобутан-1,3S-диол;
4-[5-(3S-(N-этил)амино-2S, 4-дигидроксибутил)пиразин-2-ил] -2S,4S-ди(N-этил)аминобутан-1,3S-диол;
4-[5-(3R-(N-н-бутил)амино-2S, 4-дигидроксибутил)пиразин-2-ил] -2R, 4R-ди(N-н-бутил)аминобутан-1,3S-диол;
4-[5-(3S-(N-н-бутил)амино-2S, 4-дигидроксибутил)пиразин-2-ил] -2S, 4S-ди(N-н-бутил)аминобутан-1,3S-диол;
4-[5-(3R-(N-бензил)амино-2S, 4-дигидроксибутил)пиразин-2-ил] 2R, 4R-ди(N-бензил)аминобутан-1,3S-диол;
4-[5-(3S-(N-бензил)амино-2S, 4-дигидроксибутил)пиразин-2-ил] - 2S, 4S-ди(N-бензил)аминобутан-1,3S-диол;
4-[5-(3R-(N-ацетил)амино-2S, 4-дигидроксибутил)пиразин-2-ил] -2R, 4R-ди(N-ацетил)аминобутан-1,3S-диол;
4-[5-(3S-(N-ацетил)амино-2S, 4-дигидроксибутил)пиразин-2-ил] -2S, 4S-ди(N-ацетил)аминобутан-1,3S-диол;
4-[5-(3R-(N-бутаноил)амино-2S, 4-дигидроксибутил)пиразин-2-ил] -2R, 4R-ди(н-бутаноил)аминобутан-1,3S-диол;
4-[5-(3S-(N-бутаноил)амино-2S, 4-дигидроксибутил)пиразин-2-ил] -2S, 4S-ди(N-бутаноил)аминобутан-1,3S-диол;
4-[5-(3R-(N-бензоил)амино-2S, 4-дигидроксибутил)пиразин-2-ил] -2R, 4R-ди(N-бензоил)аминобутан-1,3S-диол;
4-[5-(3S-(N-бензоил)амино-2S, 4-дигидроксибутил)пиразин-2-ил] -2S, 4S-ди(N-бензоил)аминобутан-1,3S-диол;
4-[5-(3R-метокси-2S, 4-дигидроксибутил)пиразин-2-ил] -2R,4R-диметоксибутан-1,3S-диол;
4-[5-(3S-метокси-2S, 4-дигидроксибутил)пиразин-2-ил] -2S,4S-диметоксибутан-1,3S-диол;
4-[5-(3R-этокси-2S, 4-дигидроксибутил)пиразин-2-ил] -2R, 4R-диэтоксибутан-1,3S-диол;
4-[5-(3S-этокси-2S, 4-дигидроксибутил)пиразин-2-ил] -2S, 4S-диэтоксибутан-1,3S-диол;
4-[5-(3R-н-бутокси-2S, 4-дигидроксибутил)пиразин-2-ил]-2R,4R-ди-н-бутоксибутан-1,3S-диол;
4-[5-(3S-н-бутокси-2S, 4-дигидроксибутил)пиразин-2-ил]-2S,4S-ди-н-бутоксибутан-1,3S-диол;
4-[5-(3R-(2-гидроксиэтил)окси-2S, 4-дигидроксибутил)пиразин-2-ил] -2R, 4R-ди(2-гидроксиэтил)оксибутан-1,3S-диол;
4-[5-(3S-(2-гидроксиэтил)окси-2S, 4-дигидроксибутил)пиразин-2-ил] -2S, 4S-ди(2-гидроксиэтил)оксибутан-1,3S-диол;
4-[5-(3R-(3-гидрокси-н-пропил)окси-2S, 4-дигидроксибутил)пиразин-2-ил] -2R,4R-ди(3-гидрокси-н-пропил)оксибутан-1,3S-диол;
4-[5-(3S-(3-гидрокси-н-пропил)окси-2S, 4-дигидроксибутил)пиразин-2-ил] -2S,4S-ди(3-гидрокси-н-пропил)оксибутан-1,3S-диол;
4-[5-(3R-(карбоксиметил)окси-2S, 4-дигидроксибутил)пиразин-2-ил]-2R,4R-ди(карбоксиметил)оксибутан-1,3S-диол;
4-[5-(3S-(карбоксиметил)окси-2S, 4-дигидроксибутил)пиразин-2-ил]-2S,4S-ди(карбоксиметил)оксибутан-1,3S-диол;
4-[5-(3R-(3-карбокси-н-пропил)окси-2S, 4-дигидроксибутил)пиразин- 2-ил] -2R,4R-ди(3-карбокси-н-пропил)оксибутан-1,3S-диол;
4-[5-(3S-(3-карбокси-н-пропил)окси-2S, 4-дигидроксибутил)пиразин-2-ил] -2S,4S-ди(3-карбокси-н-пропил)оксибутан-1,3S-диол;
1-[5-(3S,4-дигидрокси-1Е-бутенил)пиразин-2-ил]бутан-1R,2S,3R,4-тетраол;
4-фтор-1-[5-(2S,3R,4-тригидроксибутил)пиразин-2-ил]бутан-1R,2S,3S-триол;
1-[5-(4-фтоp-2S, 3S-дигидpoкcибyтил)пиразин-2-ил]бутан-1R,2S,3R,4-тетраол,
и их солей с фармацевтически приемлемой неорганической или органической кислотой.
Особенно предпочтительными являются лекарственные средства, которые содержат в качестве действующего начала по крайней мере одно соединение формулы (I), в которой:
либо (А) каждый из R9 и R10 означает радикал -СН2ОН и либо
а) R3 означает метилен, R4 означает радикал -СНОН- и один из радикалов R1, R2, R5, и R6 означает радикал -СНF- или -CH(OR8)-, а каждый из других означает радикал -СНОН-;
б) каждый из R2 и R5 означает радикал -СНОН-, R3 означает метилен и R1, R4 и R6 являются одинаковыми и каждый означает радикал -CH(OR8)-;
в) каждый из R1 и R6 означает радикал -СНОН-, R3 означает метилен и R2, R4 и R5 являются одинаковыми и каждый означает радикал -CH(OR8)-;
г) каждый из R1, R4, R5 и R6 означает радикал -СНОН- и -R2-R3- означает радикал -СН=СН-;
либо (Б) каждый из R1, R2, R4, R5 и R6 означает радикал -СНОН-, R3 означает метилен, R9 означает радикал -СН2ОН, R10 означает радикал -CH2F;
R8 означает алкил;
их стереоизомеры, цис- и транс-формы соединений, в которых -R2-R3- означает цепь -СН=СН-, и их соли с фармацевтически приемлемой неорганической или органической кислотой.
Еще более предпочтительными лекарственными средствами являются такие, которые содержат в качестве действующего начала по крайней мере одно соединение формулы (I), выбираемое из следующих соединений:
1-[5-(3S,4-дигидроксибутил)пиразин-2-ил]бутан-1R,2S,3R,4-тетраол;
1-[5-(3S,4-дигидрокси-1Е-бутенил)пиразин-2-ил]бутан-1R,2S,3R,4-тетраол;
1-[5-(2S-метокси-3R, 4-дигидроксибутил)пиразин-2-ил] бутан-1R, 2S,3R,4-тетраол;
1-[5-(2R-фтор-3R, 4-дигидроксибутил)пиразин-2-ил] бутан-1R, 2S,3R,4-тетраол;
1-[5-(2S,4-дигидрокси-3R-метоксибутил)пиразин-2-ил]бутан-1R,2S,3R,4-тетраол;
4-[5-(3R, 4-дигидрокси-2S-метоксибутил)пиразин-2-ил] -3R,4R-диметоксибутан-1,2-диол;
4-фтор-1-[5-(2S,3R,4-тригидроксибутил)пиразин-2-ил]бутан-1R,2S,3R-триол,
и их соли с неорганической или органической фармацевтически приемлемой кислотой.
Соединение формулы (А)
известно (Carbohydr. Res. , 77, 205 [1979] ), но для него не описано никакого фармакологического свойства.
Другие соединения формулы (I), их стереоизомеры и их соли являются новыми и в качестве таковых составляют часть изобретения.
Предпочтительными соединениями формулы (I) являются соединения, указанные в перечне предпочтительных лекарственных средств за исключением соединения формулы (А).
Соединения формулы (I), в которых каждый из R9 и R10 означает радикал -СН2ОН и либо R3 означает метилен, R4 означает радикал -СНОН- и один из радикалов R1, R2, R5 и R6 означает карбонил, а каждый из других означает радикал -СНОН-, либо каждый из R1 и R6 означает радикал -СНОН-, R3 означает метилен и R2, R4 и R5 являются одинаковыми и каждый означает карбонил, либо каждый из R2 и R5 означает радикал -СНОН-, R3 означает метилен и R1, R4 и R6 являются одинаковыми и каждый означает карбонил, могут быть получены путем окисления производного, выбираемого из соединений формул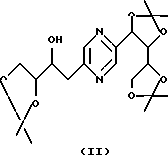
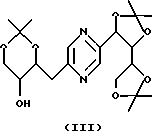
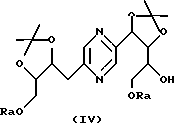
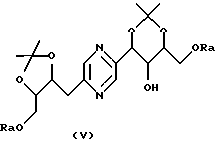
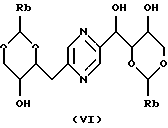
в которых Ra означает триалкилсилил, алкилдифенилсилил или диалкилфенилсилил, Rb означает фенил, незамещенный или замещенный по крайней мере одним алкоксилом, и Rc означает алкил или фенил, или стереоизомера такого производного с последующим удалением защитных для гидроксильных функций групп.
Предпочтительными триалкилсилильными, алкилдифенилсилильными или диалкилфенилсилильными радикалами являются триметилсилил, трет-бутилдифенилсилил и диметилфенилсилил.
Реакцию окисления осуществляют любым известным способом окисления спиртовых функций и особенно способами, описанными D. SWERN и др., Synthesis, 165 (1981) и Т.Т. TIDWELL, Synthesis, 857 (1990). Предпочтительно это окисление осуществляют в диметилсульфоксиде в присутствии оксалилхлорида и триэтиламина при температуре в диапазоне от -78 до 0oС.
Удаление защитных для гидроксильных функций групп осуществляют любым известным способом удаления защитных групп и особенно способами, описанными T. W. GREENE, Protective Groups in Organic Synthesis, J. Wiley-Interscience Publication (1991), или S.V. LEY и др., Tetrahedron, 46, 4995 (1990). Предпочтительно используют трифторуксусную кислоту при температуре в диапазоне от 0 до 100oС или тетра-(н-бутил)аммонийфторид в тетрагидрофуране при температуре около 25oС.
Производные формул (II) и (III) могут быть получены путем воздействия 2,2-диметоксипропана на 2-(1,2,3,4-тетрагидроксибутил)-5-(2,3,4-тригидроксибутил)пиразин или один из его стереоизомеров и разделения производных формул (II) и (III).
Эту реакцию обычно проводят в реакционных условиях, описанных T.W. GREENE, Protective Groups in Organic Synthesis, J. Wiley-Interscience Publication (1991). Предпочтительно работают в присутствии кислоты, такой как п-толуолсульфокислота, в инертном растворителе, таком как диметилформамид, при температуре в диапазоне от 0 до 100oС.
Производные формул (IV) и (V) могут быть получены путем воздействия 2,2-диметоксипропана на 2-(1,2,3,4-тетрагидроксибутил)-5-(2,3,4-тригидроксибутил)пиразин, гидроксильные группы которого на конце цепи предварительно блокированы с помощью триалкилсилилхлорида или алкилдифенилсилилхлорида, или диалкилфенилсилилхлорида, или стереоизомер такого производного, затем разделения производных формул (IV) и (V).
Эту реакцию обычно проводят в реакционных условиях, описанных T.W. GREENE, Protective Groups in Organic Synthesis, J. Wiley-Interscience Publication (1991). Предпочтительно работают в присутствии кислоты, такой как п-толуолсульфокислота, в инертном растворителе, таком как диметилформамид, при температуре в диапазоне от 0 до 100oС.
Защиту концевых гидроксильных групп обычно осуществляют в реакционных условиях, описанных T.W. GREENE, Protective Groups in Organic Synthesis, J. Wiley-Interscience Publication (1991). Предпочтительно работают в пиридине, при температуре в диапазоне от 0 до 30oС.
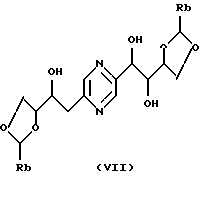
Производные формул (VI) и (VII) могут быть получены путем воздействия бензальдегида, фенильная группа которого незамещена или замещена по крайней мере алкоксилом, или бензальдегиддиалкилацеталя, фенильная группа которого незамещена или замещена по крайней мере алкоксилом (как, например, бензальдегиддиметилацеталь), на 2-(1,2,3,4-тетрагидроксибутил)-5-(2,3,4-тригидроксибутил)пиразин или один из его стереоизомеров.
Эту реакцию обычно проводят в реакционных условиях, описанных R.S. COLEMAN и др. , J. Org. Chem., 57, 3732 (1992). Предпочтительно работают в присутствии кислоты, такой как D-камфорсульфокислота, в инертном растворителе, таком как диметилформамид, при температуре в диапазоне от 0 до 100oС.
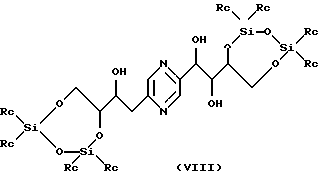
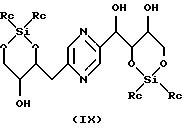
Производные формул (VIII) и (IX) соответственно могут быть получены путем воздействия 1, 3-дихлор-1,1,3,3- тетраалкилдисилоксана или 1,3-дихлор-1,1,3,3-тетрафенилдисилоксана, с одной стороны, или диалкилсилилдихлорида, или диалкилсилилбис(трифторметансульфоната), или дифенилсилилдихлорида, или дифенилсилилбис(трифторметансульфоната), с другой стороны, на 2-(1,2,3,4-тетрагидроксибутил)-5-(2,3,4-тригидроксибутил)пиразин или один из его стереоизомеров, обычно в реакционных условиях, описанных T.W. GREENE, Protective Groups in Organic Synthesis, J. Wiley-Interscience Publication (1991). Предпочтительно работают в пиридине в присутствии соответственно 1,3-дихлор-1,1,3,3-тетраизопропилдисилоксана или диизопропилсилилбис(трифторметансульфоната) при температуре в диапазоне от 0 до 30oС.
2-(1,2,3,4-Тетрагидроксибутил)-5-(2, 3, 4-тригидроксибутил)пиразин и его стереоизомеры могут быть получены либо из одной или двух аминоальдоз ОНС-СН(NH2) -(СНОН)3-СН2OН, или одного из ее стереоизомеров в кислой среде и более предпочтительно в уксуснокислой среде, и предпочтительно работая при температуре в диапазоне от 15 до 100oС; либо из одной или двух кетоз НОСН2-СО-(СНОН)3-СН2ОН, или одного из ее стереоизомеров путем воздействия формиата аммония и работая предпочтительно при температуре в диапазоне от 15 до 100oС, и предпочтительно в водной среде.
Аминоальдоза ОНС-СН(NН2) - (СНОН)3-СН2OН и ее стереоизомеры являются продажными продуктами или могут быть получены путем использования или адаптации способов, описанных, например, в:
(а) Methods Carbohydr. Chem., 7, 29 (1976), которые состоят в превращении альдегидной функции соответствующей альдозы в нитроэтиленовую группу с помощью нитрометана в основной среде (как, например, этилат натрия), затем в обработке полученного продукта последовательно насыщенным раствором гидроксида аммония при температуре 20-30oС, гидроксидом бария в водном растворе при температуре 20-30oС и, наконец, разбавленной (10-15%-ной) серной кислотой при температуре 20-30oС;
(б) "The Amino Sugar", изд. R.W.JeanIoz, Academic Press, New York, 1969, с. 1, или "The Carbohydrates", изд. W. Pigman и D. Horton, Academic Press, New-York, том IB, 1980, с. 664, которые состоят в превращении альдегидной функции соответствующей альдозы в иминогруппу из первичного ароматического амина (например, анилина), затем во введении во взаимодействие последовательно с цианистоводородной кислотой при температуре 0-20oС и водородом в присутствии палладия в растворителе, таком как простой эфир (например, тетрагидрофуран) или алифатический спирт (например, этанол или метанол), при температуре 20-50oС.
Кетоза НОСН2-СО-(СНОН)3-СН2ОН и ее стереоизомеры являются продажными продуктами или могут быть получены путем использования или адаптации способов, описанных, например, в:
(a) Adv. Carbohydr. Chem., 13, 63 (1958), которые состоят во введении во взаимодействие соответствующей альдозы либо с основанием, таким как гидроксид кальция, гидроксид натрия, пиридин, хинолин, либо с кислотой, такой как серная кислота, в водном растворе или без растворителя при температуре 20-50oС;
(б) Tetrahedron Asymmetry, 7 (8), 2185 (1996); J. Am. Chem. Soc., 118 (33), 7653 (1996); J. Org. Chem., 60 (13), 4294 (1995); Tetrahedron Lett., 33 (36), 5157 (1992); J. Am. Chem. Soc., 113 (17), 6678 (1991); Angew. Chem. , 100 (5), 737 (1988); J. Org. Chem., 57, 5S99 (1992), которые состоят, например, в конденсации либо гидроксипирувальдегида, 1,3-дигидроксиацетона, 1,3-дигидроксиацетонмонофосфата или гидроксипирувиновой кислоты с 2-гидроксиацетальдегидом, замещенным в положении 2, в случае необходимости, оптически чистым, в присутствии, в случае необходимости, фермента, такого как транскетолаза. Эту реакцию обычно проводят в водном растворе при температуре 20-50oС, в случае необходимости, в присутствии основания (как, например, гидроксид натрия), хлорида бария, хлорида магния или хлорида цинка. Производные, включающие 2-гидроксиацетальдегидную группу, являются продажными продуктами или могут быть получены из альдоз путем использования или адаптации способов, описанных Р. Collins, R. Ferrier, Monosaccharides, their Chemistry and their Roles in Natural Products, изд. J. Wiley (1995); M. Bois, Carbohydrate Building Bloks, изд. J. Wiley (1996).
Соответствующие альдозы и их стереоизомеры являются продажными продуктами или могут быть получены:
а) из имеющихся в продаже альдоз:
- путем реакций эпимеризации при использовании или адаптации способов, описанных в Adv. Carbohydr. Chem., 13, 63 (1958), особенно в основной среде, с помощью водного разбавленного (0,03-0,05%-ного) раствора гидроксида натрия при температуре 20-40oС;
- путем реакций удлинения цепи при использовании или адаптации способов, описанных в "The Carbohydrates", изд. W. Pigman и D. Horton, Academic Press, New-York, том 1А, 133 (1972), и особенно путем образования циангидрина исходной альдозы (например, путем воздействия цианида натрия в водном растворе при температуре 10-30oС и в присутствии гидроксида натрия при рН, составляющем около 9), затем гидролиза таким образом полученной цианогруппы до соответствующей кислоты путем использования или адаптации способов, описанных в "Organic Synthesis", том I, с. 436, и том III, с. 85 (например, с помощью соляной кислоты или концентрированной серной кислоты, в водном растворе при температуре от 20oС до температуры кипения реакционной среды), затем путем восстановления карбоксильной функции в соответствующий альдегид при использовании или адаптации способов, описанных в J. Am. Chem. Soc., 71, 122 (1949), особенно с помощью боргидрида щелочного металла (например, боргидрида натрия), в водном растворе при температуре от 20oС до температуры кипения реакционной среды;
- путем реакций укорачивания цепей при использовании или
адаптации способов, описанных в "The Carbohydrates", изд. W. Pigman и D. Horton, Academic Press, New-York, том IВ, 1980, с. 929, или Chem. Ber., 83, 559 (1950), и особенно путем превращения альдегидной функции альдозы в соответствующий гидроксиламин при использовании или адаптации способов, описанных в "Organic Synthesis", том II, с. 314 (например, с помощью гидроксиламингидрохлорида, в водном растворе и в присутствии основания, такого как карбонат натрия, при температуре 20-50oС), затем воздействия 3,4-динитрофторбензола в присутствии диоксида углерода и основания, такого как гидрокарбонат натрия, в водном растворе и алифатического спирта (например, изопропанола), при температуре 50-80oС;
б) из соответствующих аллиловых спиртов путем использования или адаптации способов, описанных в Science, 220, 949 (1983), и особенно с помощью трет-бутилгидропероксида в присутствии комплекса титана(IV), такого как комплекс изопропилата титана(IV) с оптически чистым диалкилтартратом (например, диэтилтартратом), с последующим последовательным воздействием тиофенолята натрия, п-хлорнадбензойной кислоты в уксусном ангидриде и диизопропилалюминийгидрида.
Соединения формулы (I), в которых каждый из R9 и R10 означает радикал -СН2ОН и либо R3 означает метилен, R4 означает радикал -СНОН- и один из радикалов R1, R2, R5, и R6 означает метилен, а каждый из других означает радикал -СНОН-, либо каждый из R1 и R6 означает радикал -СНОН-, R3 означает метилен и R2, R4 и R6 являются одинаковыми и каждый означает метилен, либо каждый из R2 и R5 означает радикал -СНОН- и каждый из R1, R3, R4 и R6 означает метилен, могут быть получены путем реакции конденсации алкилхлортионокарбоната или фенилхлортионокарбоната с производным формулы (II), (III), (IV), (V), (VI), (VII), (VIII) или (IX), в которых Ra означает триалкилсилил, алкилдифенилсилил или диалкилфенилсилил, Rb означает фенил, незамещенный или замещенный по крайней мере алкоксилом, и Rc означает алкил или фенил, или со стереоизомером такого производного, затем восстановления полученного продукта и удаления защитных для гидроксильных функций групп.
Реакции конденсации и восстановления обычно осуществляют в реакционных условиях, описанных D.H.R. BARTON, J. Chem. Soc. Perkin, I, 1574 (1975), и Н. PAULSEN и др., Liebigs Ann. Chem., 735 (1992). В случае реакции конденсации предпочтительно работают в инертном растворителе, таком как хлорсодержащий растворитель (например, дихлорметан), простой эфир (например, диэтиловый эфир, тетрагидрофуран, диоксан), в присутствии акцептора кислоты, такого как органическое основание, как пиридин или 4-диметиламинопиридин, при температуре около 20oС, а в случае реакции восстановления предпочтительно работают с помощью трибутилоловогидрида и азобис(2-метилпропионитрила), в инертном растворителе, таком как ароматический растворитель (например, бензол, толуол), при температуре 80-110oС. Удаление защитных групп осуществляют, как указано выше.
Соединения формулы (I), в которых (А) каждый из R9 и R10 означает радикал -СН2ОН и либо R3 означает метилен, R4 означает радикал -СНОН- и один из радикалов R1, R2, R5, и R6 означает радикал -СНF-, а каждый из других означает радикал -СНОН-, либо каждый из R1и R6 означает радикал -СНОН-, R3 означает метилен и R2, R4 и R5 являются одинаковыми и каждый означает радикал -CHF-, либо каждый из R2 и R5 означает радикал -СНОН-, R3 означает метилен и R1, R4 и R6, являются одинаковыми и каждый означает радикал -CHF- или (Б) каждый из R1, R2, R4, R5 и R6 означает радикал -СНОН-, R3 означает метилен, R9 означает радикал -CH2F или -СНОН, R10 означает радикал -CH2F или -СН2ОН, причем R9 и R10 оба одновременно не означают радикал -СН2ОН, могут быть получены путем фторирования производного формулы (II), (III), (IV), (V), (VI), (VII), (VIII) или (IX), в которых Ra означает триалкилсилил, алкилдифенилсилил или диалкилфенилсилил, Rb означает фенил, незамещенный или замещенный по крайней мере одним алкоксилом и Rc означает алкил или фенил, или стереоизомера такого производного, с последующим удалением защитных для гидроксильных функций групп. Соединения, в которых каждый из R1, R2, R4, R5 и R6 означает радикал -СНОН-, R3 означает метилен, R9 означает радикал -CH2F или -СН2ОН, R10 означает радикал -CH2F или -СН2ОН, но R9 и R10 оба одновременно не означают радикал -СН2ОН, получают в виде смеси с соединениями, получаемыми из промежуточного продукта формулы (IV).
Это фторирование обычно осуществляют в рабочих условиях, описанных W.J. MIDDLETON, J. Org. Chem., 40, 574 (1975). Предпочтительно фторирование осуществляют с помощью диалкиламиносульфидтрифторида (как, например, диэтиламиносульфидтрифторид), в инертном растворителе, таком как хлорсодержащий растворитель (например, дихлорметан) или простой эфир (например, тетрагидрофуран), при температуре от -78 до 20oС. Удаление защитных групп осуществляют, как указано выше.
Соединения формулы (I), в которых каждый из R9 и R10 означает радикал -СН2ОН и либо R3 означает метилен, R4 означает радикал -СНОН- и один из радикалов R1, R2, R5 и R6 означает радикал -CH(NHR7)-, а каждый из других означает радикал -СНОН-, либо каждый из R1 и R6 означает радикал -СНОН-, R3 означает метилен и R2, R4 и R5 являются одинаковыми и каждый означает радикал -CH(NHR7)-, либо каждый из R2 и R5 означает радикал -СНОН-, R3 означает метилен и R1, R4 и R6 являются одинаковыми и каждый означает радикал -CH(NHR7)-, могут быть получены путем восстановления производного, выбираемого из соединений формул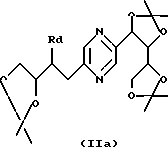
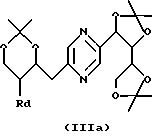
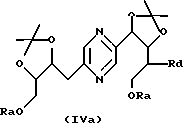
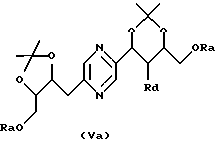

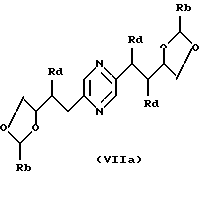
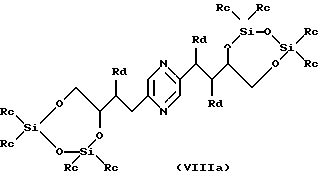
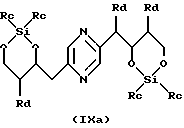
в которых Ra означает триалкилсилил, алкилдифенилсилил или диалкилфенилсилил, Rb означает фенил, незамещенный или замещенный по крайней мере одним алкоксилом, Rc означает алкил или фенил и Rd означает азидогруппу, или стереоизомера такого производного, затем, в случае необходимости, осуществления реакции с производным формулы ГалR7, где R7 имеет такие же значения, как в формуле (I), за исключением водорода, и Гал означает атом галогена, и последующего удаления защитных для гидроксильных функций групп.
Восстановление проводят обычно в реакционных условиях, описанных R.C. LAROCK, Comprehensive Organic Transformations, VCH Publication (1989). Предпочтительно работают с помощью водорода в присутствии катализатора, такого как палладий, в инертном растворителе, таком как алифатический спирт с 1-4 атомами углерода (например, метанол), при температуре около 20oС или же с помощью гидрида щелочного металла (боргидрида щелочного металла, как боргидрид натрия), алюмогидрида лития, в инертном растворителе, таком как простой эфир (например, тетрагидрофуран, диэтиловый эфир), при температуре в диапазоне от -78 до 100oС.
Реакцию с производным ГалR7 обычно проводят в реакционных условиях, описанных R. C. LAROCK, Comprehensive Organic Transformations, VCH Publication (1989). Предпочтительно работают в присутствии органического основания, как амин (триалкиламин, такой как триэтиламин, пиридин), или металлоорганического основания, как диалкиламид щелочного металла (например, натрия, лития), или гидрида щелочного металла (например, гидрида натрия) или неорганического основания, такого как гидроксид щелочного металла (например, гидроксид натрия, гидроксид калия), в инертном растворителе, таком как простой эфир (например, диэтиловый эфир, тетрагидрофуран, диоксан), алифатический спирт с 1-4 атомами углерода (например, метанол, этанол), хлорсодержащий растворитель (например, дихлорметан), диметилформамид или диметилсульфоксид, при температуре от 0oС до температуры кипения реакционной среды.
Удаление защитных групп осуществляют, как указано выше.
Производные формул (IIа), (IIIa), (IVa), (Va), (VIa), (VIIa), (VIIIa) и (IXa), в которых Ra означает триалкилсилил, алкилдифенилсилил или диалкилфенилсилил, Rb означает фенил, незамещенный или замещенный по крайней мере одним алкоксилом, Rc означает алкил или фенил и Rd означает азидогруппу, или их стереоизомеры могут быть получены путем воздействия азида щелочного металла (предпочтительно натрия) на производное формулы (IIа), (IIIa), (IVa), (Va), (VIa), (VIIa), (VIIIa) или (IXa), в которой Ra означает триалкилсилил, алкилдифенилсилил или диалкилфенилсилил, Rb означает фенил, незамещенный или замещенный по крайней мере одним алкоксилом, Rc означает алкил или фенил и Rd означает радикал -OSO2-Re, где Re означает метил, трифторметил или 4-метилфенил, или на стереоизомер такого производного.
Эту реакцию обычно проводят в рабочих условиях, описанных А.С. RICHARDSON, Methods Carbohydr. Chem. , 6, 218 (1972). Предпочтительно работают в инертном растворителе, таком как диметилформамид, при температуре 0-100oС.
Производные формул (IIа), (IIIa), (IVa), (Va), (VIa), (VIIa), (VIIIa) и (IXa), в которых Ra означает триалкилсилил, алкилдифенилсилил или диалкилфенилсилил, Rb означает фенил, незамещенный или замещенный по крайней мере одним алкоксилом, Rc означает алкил или фенил и Rd означает радикал -OSO2-Re, и их стереоизомеры могут быть получены путем воздействия производного CISO2-Re или (ReSO2)2О, в которых Re имеет вышеуказанные значения, на производное формулы (II), (III), (IV), (V), (VI), (VII), (VIII) или (IX), в которых Ra означает триалкилсилил, алкилдифенилсилил или диалкилфенилсилил, Rb означает фенил, незамещенный или замещенный по крайней мере одним алкоксилом, и Rc означает алкил или фенил, или на стереоизомер такого производного.
Эту реакцию обычно проводят в рабочих условиях, описанных А.С. RICHARDSON, Methods Carbohydr. Chem. , 6, 218 (1972), и Н. PAULSEN, Liebigs Ann. Chem. , 735 (1992). Предпочтительно работают в инертном растворителе, таком как хлорсодержащий растворитель (например, дихлорметан), в присутствии органического основания, такого как пиридин, при температуре в диапазоне от -20 до 20oС.
Соединения формулы (I), в которых каждый из R9 и R10 означает радикал -СН2ОН и либо R3 означает метилен, R4 означает радикал -СНОН- и один из радикалов R1, R2, R5 и R6 означает радикал -CH(OR8)-, а каждый из других означает радикал -СНОН-, либо каждый из R1 и R6 означает радикал -СНОН-, R3 означает метилен и R2, R4 и R5 являются одинаковыми и каждый означает радикал -CH(OR8)-, либо каждый из R1 и R5 означает радикал -СНОН-, R3 означает метилен и R1, R4 и R6 являются одинаковыми и каждый означает радикал -CH(OR8)-, могут быть получены путем взаимодействия производного формулы (II), (III), (IV), (V), (VI), (VII), (VIII) или (IX) или стереоизомера такого производного с производным ГалR8, где R8 имеет такие же значения, как в формуле (I).
Эту реакцию обычно проводят в реакционных условиях, описанных R.C. LAROCK, Comprehensive Organic Transformations, VCH Publication (1989). Предпочтительно работают в присутствии органического основания, как амин (триалкиламин, такой как триэтиламин, пиридин), или металлоорганического основания, как диалкиламид щелочного металла (например, диизопропиламид лития), или гидрида щелочного металла (например, гидрид натрия) или неорганического основания (гидроксида щелочного металла (как, например, гидроксид натрия или гидроксид калия), в инертном растворителе, таком как простой эфир (например, тетрагидрофуран, диэтиловый эфир), алифатический спирт (например, метанол, этанол), хлорсодержащий растворитель (например, дихлорметан), диметилформамид или диметилсульфоксид, при температуре от 0oС до температуры кипения реакционной среды.
Удаление защитных групп осуществляют, как указано выше.
Соединения формулы (I), в которых каждый из R1, R4, R5 и R6 означает радикал -СНОН-, R9 и R10 означают -CH2OH и -R2-R3- означает радикал -СН=СН-, могут быть получены путем дегидратации производного формулы (IIа), в которой Rd означает радикал -ОН или -OSO2-Re, где Re означает метил, трифторметил или 4-метил-фенил, или стереоизомера такого производного, затем удаления защитных для гидроксильных функций групп.
Эту реакцию обычно проводят в реакционных условиях, описанных R.C. LAROCK, Comprehensive Organic Transformations, VCH Publication (1989). Предпочтительно работают с помощью органического основания, такого как амин (триалкиламин, такой как триэтиламин или 1,8-диазабицик-ло[5,4,0]ундец-7-ен), металлоорганического основания (алкоголята щелочного металла, такого как этилат натрия) или диалкиламида щелочного или щелочноземельного металла (как, например, диизопропиламид лития) или неорганического основания, такого как гидроксид щелочного металла (например, гидроксид натрия или калия), в инертном растворителе, таком как алифатический спирт с 1-4 атомами углерода (например, метанол, этанол), простой эфир (например, диэтиловый эфир, тетрагидрофуран), хлорсодержащий растворитель (например, дихлорметан) или диметилформамид, при температуре в диапазоне от 0oС до температуры кипения реакционной среды. Эту реакцию также можно проводить в реакционных условиях, описанных О. MITSUNOBU, Synthesis, p1 (1981). Предпочтительно работают в органической среде, в инертном растворителе, таком как простой эфир (например, диэтиловый эфир, тетрагидрофуран), в присутствии триалкилфосфина (например, трифенилфосфина) и диалкилазодикарбоксилата (как, например, диэтилазокарбоксилат), при температуре от 0oС до температуры кипения реакционной среды.
Различные стереоизомеры соединений формулы (I) получают из соответствующих стереоизомеров различных промежуточных соединений формул (II), (III), (IV), (V), (VI), (VII), (VIII) или (IX). Специалист знает, что для осуществления вышеописанных способов согласно изобретению может оказаться необходимым введение защитных групп для аминных, гидроксильных и карбоксильных функций, чтобы избежать вторичных реакций. Этими группами являются такие, которые можно удалять, не затрагивая остальной части молекулы. В качестве примеров защитных для аминной функции групп можно назвать трет-бутил- или метилкарбаматы, которые могут быть регенерированы с помощью иодтриметилсилана. В качестве примеров защитных для гидроксильной функции групп можно назвать триалкилсилил (например, триэтилсилил), бензил. В качестве защитных для карбоксильных функций групп можно назвать сложные эфиры (например, сложный метоксиметиловый эфир, сложный тетрагидропираниловый эфир, сложный бензиловый эфир), оксазолы и 2-алкил-1,3-оксазолины. Другие защитные группы, используемые в этих способах, также описываются W. GREENE и др., Protection Groups in Organic Synthesis, второе издание, 1991, John Wiley and Sons, и P. J. KOCIENSKI, Protecting Groups, изд. Thieme Verlag (1994).
Реакционные смеси, полученные различными вышеописанными способами, обрабатывают при использовании классических физических методов (как, например, выпаривание, экстракция, перегонка, хроматография, кристаллизация) или химических методов (например, образование солей).
Соединения формулы (I) в случае необходимости также могут быть превращены в соли присоединения с неорганической или органической кислотой путем воздействия такой кислоты в органическом растворителе, таком как спирт, кетон, простой эфир или хлорсодержащий растворитель.
Соединения формулы (I), включающие кислотный остаток, в случае необходимости могут быть превращены в соли металлов или в соли присоединения с азотсодержащими основаниями согласно само по себе известным способам. Эти соли могут быть получены путем воздействия металлического основания (например, основания щелочного или щелочноземельного металла), аммиака, амина или соли амина на соединение формулы (I), в растворителе. Образовавшуюся соль выделяют обычными способами.
Эти соли также составляют часть изобретения.
В качестве примеров фармацевтически приемлемых солей можно назвать соли присоединения с неорганическими или органическими кислотами (такие, как ацетат, пропионат, сукцинат, бензоат, фумарат, малеат, оксалат, метансульфонат, изоэтионат, теофиллинацетат, салицилат, метилен-бис-β-оксинафтоат, гидрохлорид, сульфат, нитрат и фосфат), соли со щелочными металлами (натрием, калием, литием) или со щелочноземельными металлами (кальцием, магнием), соль аммония, соли азотсодержащих оснований (как этаноламин, триметиламин, метиламин, бензиламин, N-бензил-β-фенетиламин, холин, аргинин, лейцин, лизин, N-метилглюкамин).
Следующие примеры иллюстрируют изобретение.
Пример 1
К 349 мг 2-[2,2-диметил[1,3]диоксолан-4S-илэтил]-5-[2,2,2',2'-тетраметил-[4R, 4'R] би[[1,3] диоксоланил]-5S-ил]пиразина добавляют 50 см3 водного 80%-ного раствора трифторуксусной кислоты. Реакционную смесь перемешивают при температуре около 25oС в течение 4 часов. После концентрирования при пониженном давлении (2,7 кПа) при температуре 50oС остаточное масло обрабатывают с помощью 10 см3 толуола и снова концентрируют в тех же условиях. Полученное масло обрабатывают с помощью 2 см3 абсолютного этанола и помещают в баню со льдом на 2 часа. Полученный осадок отфильтровывают через фильтр из пористого стекла, отжимают, затем высушивают в эксикаторе при пониженном давлении (2,7 кПа) при температуре 25oС. Получают твердое вещество бежевого цвета, которое перекристаллизуют из смеси воды с абсолютным этанолом в объемном соотношении 1:8. Кристаллы отфильтровывают при использовании фильтра из пористого стекла, промывают с помощью 0,2 см3 абсолютного этанола, отжимают, затем высушивают при пониженном давлении (2,7 кПа) при температуре 40oС. Таким образом выделяют 158 мг 1-[5-(3S,4-дигидроксибутил)пиразин-2-ил] бутан-1R,2S,3R,4-тетраола в виде кристаллического порошка цвета слоновой кости, плавящегося при температуре 171oС.
1H-ЯМР-спектр (400 МГц, гексадейтеродиметилсульфоксид) δ в м. д. (миллионные доли): 1,63 и 1,88 (2 м, 1Н каждый: CH2 в 5β); 2,79 и 2,86 (2м, 1Н каждый: СН2 в 5α); 3,20-3,70 (м, 7Н: СН в 2β - СН в 2γ - СН в 5γ -СН2, в 2δ и СН2O в 5δ); 4,38 и 4,51 (соответственно, уш.т и т, J=6 Гц, 1Н каждый: ОН в 2β и ОН в 5δ); 4,43 (д, J=7,5 Гц, 1Н:ОН); 4,5S (д, J=5 Гц, 1Н:ОН); 4,65 (д, J=5 Гц, 1Н:ОН); 4,95 (уш.д, J=6 Гц, 1Н:СН в 2α); 5,31 (д, J=6 Гц, 1Н:ОН в 2α); 8,43 (с, 1Н:СН в 6); 8,63 (с, 1Н:=СН в 3).
α
2-[2,2-Диметил[1,3] диоксолан-4S-илэтил]-5-[2,2,2',2'-тетраметил[4R,4'R] би[[1,3]диоксоланил]-5S-ил]пиразин получают по следующей методике:
К раствору 0,72 г 1S-2,2-диметил[1,3]диоксолан-4R-ил)-2-[5-(2,2,2',2'-тетраметил[4R, 4'R] би[[1,3] диоксоланил]-5S-ил)пиразин-2-ил]этилфенилтионокарбоната в 56 см3 толуола в атмосфере аргона добавляют раствор 1,1 см3 трибутилоловогидрида и 13 мг 2,2'-азобис(2-метилпропионитрила) в 14 см3 толуола. Реакционную смесь нагревают при температуре 80oС в течение 45 минут, затем кипятят с обратным холодильником при температуре около 110oС в течение 70 часов. После отфильтровывания через бумажный фильтр смесь концентрируют при пониженном давлении (2,7 кПа) при температуре 40oС. Остаточное масло хроматографируют на колонке с диоксидом кремния (0,020-0,045 мм), элюируя смесью этилацетата с циклогексаном в объемном соотношении 1:4 при давлении около 1,5•105 Па. Содержащие целевой продукт фракции объединяют и концентрируют при пониженном давлении (2,7 кПа) при температуре 40oС. Таким образом получают 0,36 г 2-[2,2-диметил[1,3]диоксолан-4S-илэтил]-5-[2,2,2', 2'-тетраметил[4R,4'R]би [1,3]диоксоланил]-5S-ил]пиразина в виде желтого масла; Rf= 0,5 (тонкослойная хроматография на силикагеле; элюирование смесью этилацетата с циклогексаном в объемном соотношении 1:1).
1S-2,2-Диметил[1,3] диоксолан-4R-ил)-2-[5-(2,2,2', 2'-тетраметил[4R,4'R] би[[1,3]диоксоланил]-5S-ил)пиразин-2-ил]этилфенилтионокарбонат получают согласно следующей методике:
К раствору 0,72 г 1S-2,2-диметил[1,3]диоксолан-4R-ил)-2-[5-(2,2,2',2'-тетраметил[4R, 4'R] би[[1,3]диоксоланил]-5S-ил)пиразин-2-ил]этанола в 50 см3 дихлорметана добавляют последовательно 2 см3 пиридина, 0,021 г 4-диметиламинопиридина и 0,35 см3 фенилхлортионокарбоната. Реакционную смесь перемешивают при температуре около 25oС в течение 1 дня, затем ее разбавляют с помощью смеси 20 см3 воды с 20 см3 дихлорметана. После декантации органическую фазу промывают трехкратно по 20 см3 водой, сушат над сульфатом магния, затем концентрируют при пониженном давлении (2,7 кПа) при температуре около 45oС. Остаточное масло хроматографируют на колонке с диоксидом кремния (0,020-0,045 мм), элюируя смесью этилцетата с циклогексаном в объемном соотношении 1: 4 при давлении около 1,5•105 Па. Содержащие целевой продукт фракции объединяют и концентрируют при пониженном давлении (2,7 кПа) при температуре 40oС. Таким образом получают 0,74 г 1S-2,2-диметил[1,3]диоксолан-4R-ил)-2-[5-(2,2,2', 2'-тетраметил[4R, 4'R] би[[1,3] диоксоланил]-5S-ил)пиразин-2-ил] этилфенилтионокарбона-та в виде желтого масла; Rf=0,2 (тонкослойная хроматография на силикагеле; элюирование смесью этилацетата с циклогексаном в объемном соотношении 1:4).
1S-2,2-Диметил[1,3] диоксолан-4R-ил)-2-[5-(2,2,2', 2'-тетраметил[4R,4'R] би[[1,3] диоксоланил] -5S-ил)пиразин-2-ил]этанол получают согласно следующей методике:
К раствору 10 г дезоксифруктозазина в 250 см3 диметилформамида при перемешивании добавляют 81 см3 2,2-диметоксипропана, затем 0,3 г п-толуолсульфокислоты. Реакционную смесь перемешивают при температуре около 25oС в течение 20 часов, затем добавляют 10 см3 2,2-диметоксипропана и перемешивание продолжают в течение трех часов. Смесь затем нагревают при температуре 50oС в течение 21 часа. После концентрирования при пониженном давлении (2,7 кПа) при температуре 60oС остаточное масло растворяют в 300 см3 дихлорметана и промывают двукратно по 100 см3 5%-ным водным раствором гидрокарбоната натрия, затем двукратно по 200 см3 водой. Органическую фазу сушат над сульфатом магния, затем концентрируют при пониженном давлении (2,7 кПа) при температуре 40oС. Полученное масло хроматографируют на колонке с диоксидом кремния (0,020-0,045 мм), элюируя смесью этилацетата с циклогексаном в объемном соотношении 1: 1 при давлении около 1,5•105 Па. Содержащие целевые продукты фракции объединяют и концентрируют при пониженном давлении (2,7 кПа) при температуре 40oС. Таким образом получают 5,2 г 1S-2,2-диметил[1,3]диоксолан-4R-ил)-2-[5-(2,2,2', 2'-тетраметил[4R, 4'R] би[[1,3] диоксоланил] -5S-ил)пиразин-2-ил] этанола в виде твердого вещества белого цвета, также, как 2,4 г того же самого продукта с примесью. Этот последний перекристаллизуют из смеси воды с абсолютным этанолом в объемном соотношении 5:1. Таким образом выделяют 0,6 г 1S-2,2-диметил[1,3]диоксолан-4R-ил)-2-[5-(2,2,2',2'-тетраметил[4R, 4'R] би[[1,3] диоксоланил] -5S-ил)пиразин-2-ил]этанола в виде белых кристаллов, плавящихся при температуре 74oС.
1H-ЯМР-спектр (400 МГц, гексадейтеродиметилсульфоксид) δ в м.д.: 1,04-1,20-1,28-1,33 и 1,44 (5с соответственно 3Н-3Н-3Н-3Н и 6Н:6 СН3); 2,79 (дд, J=13 и 9 Гц, 1Н:1Н от CH2 в 5α); 3,06 (дд, J=13 и 2,5 Гц, 1Н:другой Н от CH2 в 5α); 3,79 (массив, 1Н:СН в 5β); 3,80-3,90 (м, 2Н:1Н от СН2 в 2δ и 1Н от СН2 в 5δ); 3,91 (м, 1Н:СН в  4,00 (т, J=7 Гц, 1Н:другой Н от CH2 в 5δ); 4,06 (т, J=7,5 Гц, 1Н:другой Н от СН2 в 2δ); 4,28 (м, 1Н:СН в 2γ); 4,33 (т, J= 7 Гц, 1Н:СН в 2β); 4,99 (д, J=7,5 Гц, 1Н:СН в 2α); 5,07 (уш. д, J=5 Гц, 1Н:ОН в 55β); 8,54 (с, 1Н:=СН в 6); 8,66 (с, 1Н:=СН в 3).
4,00 (т, J=7 Гц, 1Н:другой Н от CH2 в 5δ); 4,06 (т, J=7,5 Гц, 1Н:другой Н от СН2 в 2δ); 4,28 (м, 1Н:СН в 2γ); 4,33 (т, J= 7 Гц, 1Н:СН в 2β); 4,99 (д, J=7,5 Гц, 1Н:СН в 2α); 5,07 (уш. д, J=5 Гц, 1Н:ОН в 55β); 8,54 (с, 1Н:=СН в 6); 8,66 (с, 1Н:=СН в 3).
α
Из этой колонки также выделяют 1,4 г 2,2-диметил-4S-[5-(2,2,2',2'-тетраметил[4R,4'R]би[1,3]диоксоланил]-5S-ил)пиразин-2-илметил][1,3]диоксан-5К-ола в виде желтого масла.
1H-ЯМР-спектр (400 МГц, гексадейтеродиметилсульфоксид) δ в м.д.: 0,95-1,18-1,28 и 1,44 (4с соответственно 3Н-6Н-3Н и 6Н:6 СH3); 2,83 (дд, J=13 и 9 Гц, 1Н: 1Н от CH2 в 5α); 3,29 (дд, J=13 и 2,5 Гц, 1Н:другой Н от СН2 в 5α); 3,30-3,40 (м, 1Н:СН в 5γ); 3,53 (т, J=11 Гц, 1Н:1Н от СН2 в 5δ); 3,74 (дд, J=11 и 5,5 Гц, 1Н: другой Н от СН2 в 5δ); 3,84 (дд, J=9 и 4 Гц, 1Н:1Н от СН2 в 2δ); 3,95-4,15 (м, 2Н: другой Н от СН2 в 2δ и СН в 5β); 4,20-4,35 (м, 2Н: СН в 2β и СН в 2γ); 4,98 (д, J=7 Гц, 1Н:СН в 2α); 5,20 (д, J=6 Гц, 1Н:ОН в 5γ); 8,53 (с, 1Н:=СН в 6); 8,66 (с, 1Н:=СН в 3).
α
Дезоксифруктозазин может быть получен по способу, описанному К. Sumoto и др., Chem. Pharm. Bull, 39, 792 (1991).
Пример 2
К 0,72 г 2-(2,2,2',2'-тетраметил[4R,4'R]би[1,3]диоксоланил]-5S-ил)-5-(2-[2,2-диметил[1,3] диоксолан-4S-ил] -Е-этенил)пиразина добавляют 100 см3 водного 80%-ного раствора трифторуксусной кислоты. Реакционную смесь перемешивают при температуре около 25oС в течение 2,5 часов. После концентрирования при пониженном давлении (2,7 кПа) при температуре 50oС остаточную пасту каштанового цвета обрабатывают смесью 10 см3 этанола и 1 см3 воды и перекристаллизуют. Полученный осадок отфильтровывают на фильтре из пористого стекла, промывают той же холодной смесью, отжимают, затем высушивают в эксикаторе при пониженном давлении (2,7 кПа) при температуре около 60oС. Таким образом выделяют 200 мг 1-[5-(3S,4-дигидрокси-1Е-бутенил)пиразин-2-ил]бутан-1R,2S,3R,4-тетраола в виде кристаллов нечистого белого цвета, плавящихся при температуре 192oС.
1H-ЯМР-спектр (400 МГц, гексадейтеродиметилсульфоксид) δ в м.д.: 3,20-3,50 (м, 3Н:1Н от СН2О в 2δ и СН2О 5δ); 3,55-3,70 (м, 3Н:другой Н от Н2O в 2δ-CH в 2β и СН в 2γ); 4,23 (м, 1Н:СН в 5γ); 4,39 (т, J=6 Гц, 1Н: ОН в 2δ); 4,46 (д, J=7 Гц, 1Н:ОН); 4,66 (д, J=4 Гц, 1Н:ОН); 4,75 (т, J=6 Гц, 1Н:ОН в 5δ); 4,96 (уш. д, J=6,5 Гц, 1Н:СН в 2α); 5,12 (д, J=5 Гц, 1Н:ОН в 5γ); 5,34 (д, J=6,5 Гц, 1Н:ОН в 2α); 6,74 (уш. д, J=16 Гц, 1Н:=СН в 5α); 6,91 (дд, J= 16 и 4,5 Гц, 1Н:=СН в 5β); 8,58 (с, 1Н:=СН в 6); 8,66 (с, 1Н:=СН в 3).
α
2-(2,2,2', 2'-Tетраметил[4R, 4'R] би[1,3]диоксоланил]-5S-ил)-5-(2-[2,2-диметил[1,3] диоксолан-4S-ил] -Е-этенил)пиразин получают согласно следующей методике:
К раствору 0,5 г 1S-(2,2-диметил[1,3]диоксолан-4R-ил)-2-[5-(2,2,2',2'-тетраметил[4R, 4'R] би[1,3] диоксоланил]-5S-ил)пиразин-2-ил]этанола в 9,6 см тетрагидрофурана последовательно добавляют 132 мг сукцинимида и 340 мг трифенилфосфина. Затем добавляют по каплям 0,62 см3 40%-ного раствора диэтилазодикарбоксилата в толуоле и реакционную смесь перемешивают при температуре около 25oС в течение 4 часов, по истечении которых добавляют 396 мг сукцинимида, 1,02 г трифенилфосфина и 1,87 см3 40%-ного раствора диэтилазодикарбоксилата в толуоле. После перемешивания в течение 48 часов реакционную смесь концентрируют при пониженном давлении (2,7 кПа) при температуре около 45oС. Полученный остаток хроматографируют на колонке с диоксидом кремния (0,020-0,045 мм), элюируя смесью этилацетата с циклогексаном в объемном соотношении 1: 4, затем 1: 2,3, при давлении около 1,5•105 Па. Содержащие целевой продукт фракции объединяют и концентрируют при пониженном давлении (2,7 кПа) при температуре 45oС. Таким образом получают 340 мг 2-(2,2,2', 2'-тетраметил[4R, 4'R]би[1,3]диоксоланил]-5S-ил)-5-(2-[2,2-диметил[1,3]диоксолан-4S-ил] -Е-этенил)пиразина в виде вязкого беловатого масла. Rf=0,7 (тонкослойная хроматография на силикагеле; элюирование этилацетатом).
Пример 3
К 0,45 г 2- (2,2,2',2'-тетраметил-[4R,4'R]би[1,3]диоксоланил]-5S-ил)-5-(2S-[2,2-диметил[1,3] диоксолан-4R-ил]-2-метоксиэтил)пиразина добавляют 62 см3 водного 80%-ного раствора трифторуксусной кислоты. Реакционную смесь перемешивают при температуре около 25oС в течение двух часов. После концентрирования при пониженном двлении (2,7 кПа) при температуре 65oС, остаточный лак каштанового цвета обрабатывают трехкратно диэтиловым эфиром, затем снова концентрируют при пониженном давлении (2,7 кПа) при температуре 45oС. Остаточную пасту обрабатывают с помощью 4 см3 этанола и перекристаллизуют. Полученный осадок отфильтровывают на фильтре из пористого стекла, промывают этанолом, отжимают, затем высушивают при пониженном давлении (2,7 кПа) при температуре 40oС. Таким образом выделяют 100 мг 1-[5-(2S-метокси-3R, 4-дигидроксибутил)пиразин-2-ил] бутан-1R, 2S, 3R,4-тетраола в виде кристаллического порошка белого цвета, плавящегося при температуре 144oС.
1Н-ЯМР-спектр (400 МГц, гексадейтеродиметилсульфоксид) δ в м.д.: 2,92 и 3,02 (2 дд соответственно J=14 и 8 Гц и J=14 и 4 Гц, 1Н каждый:СН2 в 5α); 3,14 (с, 3Н:ОСН3 в 5β); 3,30-3,50 и 3,50-3,60 (2 м соответственно 2Н и 6Н:СН в 2β-CH в 2γ-СН2О в 2δ-СН в 5β-СН в 5γ и СН2О в 5δ); 4,39 и 4,53 (2 т, J=5,5 Гц, 1Н каждый: ОН в 2δ и ОН в 5β); 4,45 (д, J=7,5 Гц, 1Н:ОН); 4,65 (уш. д, J= 5 Гц, 1Н: ОН); 4,70 (д, J=5 Гц, 1Н:ОН); 4,95 (д, J=6,5 Гц, 1Н:СН в 2α); 5,31 (д, J=6,5 Гц, 1Н: ОН в 2α); 8,43 (уш. с, 1Н:=СН в 6); 8,65 (уш. с, 1Н:= СН в 3).
2-(2,2,2', 2'-Тетраметил[4R, 4'R]би[1,3]диоксоланил]-5S-ил)-5-(2S-[2,2-диметил[1,3] диоксолан-4R-ил] -2-метоксиэтил)пиразин получают согласно следующей методике:
К раствору 1,0 г 1S-(2,2-диметил[1,3]диоксолан-4R-ил)-2-[5-(2,2,2',2'-тетраметил[4R, 4'R] би[[1,3] диоксоланил]-5S-ил)пиразин-2-ил]этанола в 5 см3 диметилформамида добавляют суспензию 104 мг гидрида натрия (60%-ная в масле) в 5 см3 диметилформамида. Реакционную смесь перемешивают при температуре около 25oС в течение 30 минут, затем добавляют 0,15 см3 метилиодида. После перемешивания в течение 48 часов реакционную смесь обрабатывают с помощью 25 см3 воды и 25 см3 этилацетата, затем декантируют. Водную фазу экстрагируют двукратно по 25 см3 этилацетатом и органические экстракты объединяют, сушат над сульфатом магния, затем концентрируют при пониженном давлении (2,7 кПа) при температуре около 45oС. Полученный остаток хроматографируют на колонке с диоксидом кремния (0,020-0,045 мм), элюируя смесью этилацетата с циклогексаном в объемном соотношении 1:2,3. Содержащие целевой продукт фракции объединяют и концентрируют при пониженном давлении (2,7 кПа) при температуре около 50oС. Таким образом получают 0,45 г 2-(2,2,2',2'-тетраметил[4R,4'R]би[1,3] диоксоланил] -5S-ил)-5-(2S-[2,2-диметил[1,3] диоксолан-4R-ил]-2-метоксиэтил)пиразина в виде твердого вещества бежевого цвета.
Rf= 0,6 (тонкослойная хроматография на силикагеле; элюирование смесью этилацетата с циклогексаном в объемном соотношении 1:1).
Пример 4
К 0,58 г 2-(2,2,2',2'-тетраметил[4R,4'R]би[1,3]диоксоланил]-5S-ил)-5-(2R-[2,2-диметил[1,3] диоксолан-4R-ил]-2-фторэтил)пиразина добавляют 100 см3 водного 80%-ного раствора трифторуксусной кислоты. Реакционную смесь перемешивают при температуре около 25oС в течение 16 часов. После концентрирования при пониженном давлении (2,7 кПа) при температуре 50oС остаточное масло хроматографируют на колонке с диоксидом кремния (0,020-0,045 мм), элюируя смесью этанола с н-бутанолом и водным раствором аммиака в объемном соотношении 8:1:1. Содержащие целевые продукты фракции объединяют и концентрируют при пониженном давлении (2,7 кПа) при температуре 50oС. Таким образом получают 1-[5-(2R-фтор-3R, 4-дигидроксибутил)пиразин-2-ил]бутан-1R,2S,3R,4-тетраол в виде твердого вещества песочного цвета, которое обрабатывают смесью 1,2 см3 этанола и 0,2 см3 воды и перекристаллизуют. Полученный осадок отфильтровывают на фильтре из пористого стекла, промывают диэтиловым эфиром, отжимают, затем высушивают при пониженном давлении (2,7 кПа) при температуре 60oС. Таким образом выделяют 62 мг 1-[5-(2R-фтор-3R, 4-дигидроксибутил)пиразин-2-ил] бутан-1R, 2S,3R,4-тетраола в виде кристаллов белого цвета, плавящихся при температуре 172oС.
1H-ЯМР-спектр (400 МГц, гексадейтеродиметилсульфоксид, при температуре 30oС) δ в м.д.: 3,00-3,40 (м, 2Н:СН2 в 5α); 3,40-3,70 (м, 7Н:СН в 2β-СН в 2γ-СН2О в 2δ-СН в 5γ и СН2O В 5δ); 4,38 и 4,73 (уширенные 2 т, J=5 Гц, 1Н каждый: ОН в 2δ и ОН в 5δ); 4,46 (д, J=7 Гц, 1Н:ОН); 4,66 (д, J=5 Гц, 1Н: ОН); 4,96 (уш. д, J=5,5 Гц, 1Н:СН в 2α); 5,02 (разделенный д, JHF=44 Гц, 1Н: СН в 5β); 5,35 (д, J=5,5 Гц, 1Н:ОН в 2α); 8,47 (уш. с, 1Н:=СН в 6); 8,69 (уш. с, 1Н:=СН в 3).
2-(2,2,2', 2'-Тетраметил[4R, 4'R]би[1,3]диоксоланил]-5S-ил)-5-(2R-[2,2-диметил[1,3] диоксолан-4R-ил]-2-фторэтил)пиразин получают согласно следующей методике:
К раствору 2,0 г 1S-(2,2-диметил[1,3]диоксолан-4R-ил)-2-[5-(2,2,2',2'-тетраметил[4R, 4'R] би[[1,3]диоксоланил]-5S-ил)пиразин-2-ил]этанола в 40 см3 тетрагидрофурана, охлажденному до температуры около -78oС и в атмосфере азота, добавляют по каплям 1,25 см3 диметиламиносульфидтрифторида. Реакционную смесь оставляют нагреваться до температуры около -10oС. После выдерживания в течение 4 часов при этой температуре (-10oС) реакционную смесь обрабатывают с помощью 60 см3 метанола, затем перемешивают в течение 30 минут и концентрируют при пониженном давлении (2,7 кПа) при температуре около 40oС. Остаточное масло каштанового цвета хроматографируют на колонке с диоксидом кремния (0,020-0,045 мм), элюируя смесью этилацетата с циклогексаном в объемном соотношении 1:3. Содержащие целевые продукты фракции объединяют и концентрируют при пониженном давлении (2,7 кПа) при температуре около 40oС. Таким образом получают 0,67 г смеси 2- (2,2,2',2'-тетраметил[4R,4'R]би[1,3] диоксоланил] -5S-ил)-5-(2R-[2,2-диметил[1,3] диоксолан-4R-ил] -2-фторэтил)пиразина и 2-(2,2,2',2'-тетраметил[4R,4'R]би[1,3]диоксоланил]-5S-ил)-5-{ 2S-[2,2-диметил[1,3] диоксолан-4R-ил]-2-(4-фторбутокси)этил}пиразина в приблизительном соотношении 1:1 в виде бесцветного масла.
Rf= 0,3 для обоих продуктов (тонкослойная хроматография на силикагеле; элюирование смесью этилацетата с циклогексаном в объемном соотношении 1:1).
Пример 5
К 0,36 г 2-(2,2,2',2'-тетраметил-[4R,4'R]би[1,3]диоксоланил] -5S-ил)-5-([5К-метокси-2,2-диметил[1,3]диоксан-4S-ил]метил)пиразина добавляют 51 см3 водного 80%-ного раствора трифторуксусной кислоты. Реакционную смесь перемешивают при температуре около 25oС в течение 18 часов. После концентрирования при пониженном давлении (2,7 кПа) при температуре около 60oС остаточное масло оранжевого цвета обрабатывают с помощью 4 см3 этанола и перекристаллизуют. Полученный осадок отфильтровывают на фильтре из пористого стекла, промывают этанолом, отжимают, затем высушивают при пониженном давлении (2,7 кПа) при температуре около 40oС. Таким образом выделяют 88 мг 1-[5-(2S,4-дигидрокси-3R-метоксибутил)пиразин-2-ил] бутан-1R, 2S, 3R, 4-тетраола в виде кристаллического порошка бежевого цвета, плавящегося при температуре 96oС.
1H-ЯМР-спектр (400 МГц, гексадейтеродиметилсульфоксид с добавлением нескольких капель тетрадейтероуксусной кислоты) δ в м.д.: 2,79 и 2,97 (2 дд соответственно J=14 и 9 Гц и J=14 и 3 Гц, 1Н каждый:СН2 в 5α); 3,10 (м, 1Н: СН в 5γ); 3,38 (с, 3Н:ОСН3 в 5γ); 3,40-3,70 (м, 4Н:СН в 2β-СН в 2γ и СН2O в 2δ); 3,50 и 3,64 (соответственно дд, J=5 и 12 Гц, и м, 1Н каждый:СН2О в 5δ); 3,93 (м, 1Н:СН в 5β); 4,95 (уш. с, 1Н:СН в 2α); 8,40 (с, 1Н:=СН в 6); 8,64 (с, 1Н:=СН в 3).
2-(2,2,2', 2'-Тетраметил[4R, 4'R] би[1,3] диоксоланил]-5S-ил)-5-([5К-метокси-2,2-диметил[1,3] диоксан-4S-ил] метил)пиразин получают согласно следующей методике:
К суспензии 0,14 г гидрида натрия (60%-ная в масле) в 10 см3 диметилформамида, охлажденной до температуры около 0oС и в атмосфере азота, добавляют раствор 1,24 г 2,2-диметил-4S-[5-(2,2,2',2'-тетраметил[4R, 4'R]би[1,3]диоксоланил]-5S-ил)пиразин-2-илметил][1,3]диоксан-5К-ола в 15 см3 диметилформамида. Реакционную смесь перемешивают при температуре около 0oС в течение 30 минут, затем добавляют 0,19 см3 метилиодида. Реакционную смесь оставляют нагреваться до температуры около 25oС. После перемешивания в течение 16 часов реакционную смесь обрабатывают с помощью 25 см3 воды и 25 см3 этилацетата, затем декантируют. Водную фазу экстрагируют двукратно по 25 см3 этилацетатом и органические экстракты объединяют, сушат над сульфатом магния, затем концентрируют при пониженном давлении (2,7 кПа) при температуре 50oС. Полученный остаток хроматографируют на колонке с диоксидом кремния (0,020-0,045 мм), элюируя смесью этилацетата с циклогексаном в объемном соотношении 1: 2,3. Содержащие целевой продукт фракции объединяют и концентрируют при пониженном давлении (2,7 кПа) при температуре 50oС. Таким образом получают 0,36 г 2-(2,2,2',2'-Тетраметил[4R,4'R]би[1,3]диоксоланил] -5S-ил)-5-([5R-метокси-2,2-диметил[1,3] диоксан-4S-ил] метил)пиразина в виде бесцветного масла.
Rf= 0,5 (тонкослойная хроматография на силикагеле; элюирование смесью этилацетата с циклогексаном в объемном соотношении 1:1).
Пример 6
I. К 573 мг 2-(1R,2S)-2[(2R)-1,4-диоксаспиро[4,5]дец-2-ил]-1,2-диметоксиэтил-5-(2S)-2-[(2R)-1,4-диоксаспиро[4,5] -дец-2-ил] -2-метоксиэтилпиразина добавляют 12,5 см3 водного 80%-ного раствора трифторуксусной кислоты. Реакционную смесь перемешивают при температуре около 25oС в течение 5,5 часов. После концентрирования при пониженном давлении (2,7 кПа) при температуре 45oС остаточное масло обрабатывают с помощью 10 см3 толуола и снова концентрируют в тех же условиях. Полученное масло хроматографируют на колонке с диоксидом кремния (0,040-0,063 мм), элюируя смесью дихлорметана с метанолом в объемном соотношении 95: 5, затем смесью этанола с н-бутанолом и водным раствором аммиака в объемном соотношении 8:2:1, при давлении 1,6•105 Па. Содержащие целевой продукт фракции объединяют и концентрируют при пониженном давлении (2,7 кПа) при температуре 50oС. Таким образом полученное масло обрабатывают этанолом, растворитель выпаривают, затем остаток порошкуют несколько раз в дихлорметане, потом обрабатывают толуолом. Растворитель выпаривают и осадок отфильтровывают, получая твердое вещество желтоватого цвета, которое снова порошкуют в дихлорметане. Таким образом получают 135 мг 4-[5-(3R, 4-дигидрокси-2S-метоксибутил)пиразин-2-ил] -3R, 4R-диметоксибутан-1,2-диола в виде твердого вещества бледно-желтого цвета, которое плавится при температуре 84oС.
1H-ЯМР-спектр (400 МГц, гексадейтеродиметилсульфоксид) δ в м.д.: 2,82-3,08 и 3,33 (3 с, 3Н каждый: ОСН3); 2,93 и 3,05 (2 дд соответственно J=14 и 9 Гц и J=14 и 4 Гц, 1Н каждый: CH2 в 5α); 3,30-3,50 (м:3Н, соответствующие СН2О в 5δ и СН в 2β); 3,50-3,70 (м, 5Н:СН в 2γ-СН2O в 2δ-СН в 5β и СН в 5γ); 4,46 (т, J=5,5 Гц, 1Н:ОН в 2δ); 4,55 (т, J=5,5 Гц, 1Н:ОН в 5δ); 4,62 (д, J= 2,5 Гц, 1Н:СН в 2α); 4,81 (м, 2Н:ОН в 2γ и ОН в 5γ); 8,52 (с, 1Н:=СН в 6); 8,56 (с, 1Н:=СН в 3).
2-(1R, 2S)-2[(2R)-1,4-Диоксаспиро[4,5] дец-2-ил] -1,2-диметоксиэтил-5-(2S)-2-[(2R)-1,4-диоксаспиро[4,5] дец-2-ил] -2-метоксиэтилпиразин может быть получен следующим образом:
К суспензии 150 мг гидрида натрия в 5 см3 диметилформамида, в атмосфере аргона и при температуре 0oС добавляют раствор 0,5 г 2-(1R,2S)-2-[(2R)-1,4-диоксаспиро[4,5] дец-2-ил] -1,2-дигидроксиэтил-5-(2S)-2-[(2R)-1,4-диоксаспиро[4,5] дец-2-ил] -2-гидроксиэтилпиразина в 7 см3 диметилформамида. Суспензию желтоватого цвета выдерживают таким образом при перемешивании в течение 0,5 часа, затем медленно добавляют 0,21 см3 метилиодида. Затем температуру повышают до 15oС и добавляют по каплям 25 см3 воды. Реакционную смесь экстрагируют трехкратно по 25 см3 этилацетатом. Органическую фазу сушат над сульфатом магния, отфильтровывают, затем концентрируют при пониженном давлении (2,7 кПа) при температуре 45oС. Таким образом получают 0,58 г 2-(1R,2S)-2[(2R)-1,4-диоксаспиро[4,5]дец-2-ил]-1,2-диметоксиэтил-5-(2S)-2-[(2R)-1,4-диоксаспиро[4,5] дец-2-ил] -2-метоксиэтилпиразина в виде желтого масла, используемого таким, какое есть, в следующей стадии.
2-(1R, 2S)-2[(2R)-1,4-Диоксаспиро[4,5] дец-2-ил] -1,2-дигидроксиэтил-5-(2S)-2-[(2R)-1,4-диоксаспиро[4,5] дец-2-ил]-2-гидроксиэтилпиразин может быть получен следующим образом:
К 500 мг 2-[(1R,2S,3R)-(1,2,3,4-тетрагидроксибутил)]-5-[(2'S,3'R)-(2', 3', 4'-тригидроксибутил)]пиразина в виде суспензии в 12 см3 диметилформамида при температуре около 20oС последовательно добавляют 2,54 см3 циклогексанона и 31 мг моногидрата п-толуолсульфокислоты. Полученный раствор, после перемешивания в течение 15 минут при температуре около 20oС, снова перемешивают в течение 2,5 часов при температуре около 20oС. Затем добавляют сульфат магния и реакционную среду перемешивают в течение дополнительных 16 часов при температуре около 20oС. После этого среду нагревают при температуре около 60oС в течение нескольких минут и она становится белой, молочного цвета. Реакционную среду оставляют стоять для повышения температуры примерно до 20oС и разбавляют смесью 10 см3 дистиллированной воды и 10 см3 этилацетата. Органическую фазу, после декантации, промывают двукратно по 10 см3 дистиллированной водой. Водные фазы объединяют и экстрагируют однократно с помощью 10 см3 этилацетата. Объединенные органические фазы сушат над сульфатом магния, фильтруют через фильтр из пористого стекла, затем концентрируют досуха при пониженном давлении (0,27 кПа) при температуре около 30oС. Таким образом получают 910 мг меренги бледно-желтого цвета, которую обрабатывают с помощью 10 см3 диэтилового эфира. После перемешивания в течение 10 минут при температуре около 20oС нерастворимую часть отфильтровывают на фильтре из пористого стекла, промывают с помощью 5 см3 диэтилового эфира, получая хлопьевидный продукт белого цвета, который высушивают при температуре около 40oС при пониженном давлении (0,27 кПа). Таким образом получают 417 мг 2-(1R,2S)-2[(2R)-1,4-диоксаспиро[4,5] дец-2-ил] -1,2-дигидроксиэтил-5-(2S)-2-[(2R)-1,4-диоксаспиро[4,5]-дец-2-ил]-2-гидроксиэтилпиразина в виде твердого вещества белого цвета.
1H-ЯМР-спектр (400 МГц, гексадейтеродиметилсульфоксид) δ в м.д.: 1,25-1,65 (массив, 2OН:10 CH2 двух циклогексилов); 2,76 (дд, J=14 и 9 Гц, 1Н:1Н от СН2 в 5α); 3,04 (дд, J=14 и 3,5 Гц, 1Н:другой Н от CH2 в 5α); 3,61 (дт, J= 7 и 1,5 Гц, 1Н:СН в 2β); 3,77 (м, 1Н:СН в 5β); 3,80-3,95 и 3,95-4,10 (2 м соответственно 3Н и 2Н:СН в 5γ-СН2O в 2δ и CH2O в 5δ); 4,18 (м, 1Н:СН в 2γ); 4,80 (м, 2Н:СН в 2α и ОН в 2β); 5,02 (д, J=7 Гц, 1Н:ОН в 5δ); 5,54 (д, J=6, 5 Гц, 1Н:ОН в 2α); 8,43 (с, 1Н:=СН в 6); 8,65 (с, 1Н:=СН в 3).
II. 4-[5-(3R,4-Дигидрокси-2S-метоксибутил)пиразин-2-ил]-3R,4R-диметоксибутан-1,2-диол также может быть получен подобным способом, но исходя из 1-{ 5-[2(S)-гидрокси-2-(2,2,4,4-тетраизопропил[1,3,5,2,4] триоксадисилепан-6(R)-ил)этил] пиразин-2-ил}-2-(2,2,4,4-тетраизопропил[1,3,5,2,4]триоксадисилепан-6(R)-ил)этан-1(R),2(S)-диола.
1-{ 5-[2(S)-Гидрокси-2-(2,2,4,4-тетраизопропил[1,3,5,2,4] триоксадисилепан-6(R)-ил)этил] пиразин-2-ил}-2-(2,2,4,4-тетраизопропил[1,3,5,2,4]триоксадисилепан-6(R)-ил)этан-1(R),2(S)-диол может быть получен следующим образом:
К раствору 1 г дезоксифруктозазина в 27 см3 пиридина при перемешивании и в атмосфере азота добавляют 2,3 см3 1,3-дихлор-1,1,3,3-тетраизопропилдисилоксана. Реакционную смесь перемешивают при температуре около 25oС в течение 41 часа. После концентрирования при пониженном давлении (2,7 кПа) при температуре около 60oС остаточное масло обрабатывают трехкратно по 30 см3 пентаном, затем снова концентрируют в тех же условиях. Полученный твердый остаток растворяют в 50 см3 дихлорметана и промывают последовательно двукратно по 30 см3 1 н. водным раствором соляной кислоты, двукратно по 30 см3 водой, затем двукратно по 30 см3 водным насыщенным раствором хлорида натрия. Органическую фазу сушат над сульфатом магния, затем концентрируют при пониженном давлении (2,7 кПа) при температуре 40oС. Полученное масло хроматографируют на колонке с диоксидом кремния (0,020-0,045 мм), элюируя смесью
этилацетата с циклогексаном при градиенте в объемном соотношении от 1:4 до 1: 2, при давлении около 1,5•105 Па. Содержащие целевой продукт фракции объединяют и концентрируют при пониженном давлении (2,7 кПа) при температуре 40oС. Таким образом получают 1,5 г 1-{5-[2(S)-гидрокси-2-(2,2,4,4-тетраизопропил[1,3,5,2,4]триоксадисилепан-6(R)ил)этил]пиразин-2-ил}-2-(2,2,4,4-тетраизопропил[1,3,5,2,4] триоксадисилепан-6(R)ил)этан-1(R), 2(S)-диола в виде меренги белого цвета, плавящейся при температуре 87oС.
1Н-ЯМР-спектр (250 МГц, гексадейтеродиметилсульфоксид) δ в м.д.: 0,80-1,30 (м, 56Н: 8 СН(СН3)2); 2,78 (дд, J=14 и 9 Гц, 1Н:1Н от СН, в 5α); 3,17 (дд, J= 14 и 3,5 Гц, 1Н:другой Н от СН2 в 5α); 3,53 (уш. т, J=9 Гц, 1Н:СН в 2β); 3,60-3,70 (м, 4Н:СН в 5β-СН в 5γ-1Н от СН2O в 2δ и 1Н от СН2O в 5δ); 4,05-4,30 (м, 3Н: СН в 2γ-другой Н от СН2О в 2δ и другой Н от СН2O в 5δ); 4,82 (д, J=8 Гц, 1Н:ОН в 2β); 4,90-5,05 (м, 2Н:СН в 2α и ОН в 5β); 5,46 (д, J=6 Гц, 1Н:ОН в 2α); 8,43 (с, 1Н:=СН в 6); 8,66 (с,1Н: =СН в 3).
α
III. 4-[5-(3R, 4-Дигидрокси-2S-метоксибутил)пиразин-2-ил] -3R,4R-диметоксибутан-1,2-диол может быть получен подобным способом, но исходя из 1-[5-(3,4-О-бензилиден-2S, 3R, 4-тригидроксибутил)пиразин-2-ил] бутан-3,4-О-бензилиден-1R,2S,3R,4-тетраола.
1-[5-(3,4-О-Бензилиден-2S, 3R, 4-тригидроксибутил)пиразин- 2-ил]бутан-3,4-О-бензилиден-1R,2S,3R,4-тетраол может быть получен следующим образом:
К раствору 2,0 г дезоксифруктозазина в 24 см3 диметилформамида при температуре около 20oС и в атмосфере аргона добавляют 20 мг D-камфорсульфокислоты. Суспензию белого цвета нагревают до температуры 50oС, получая бесцветный раствор, затем добавляют 5 см3 бензальдегиддиметилацеталя. Раствор желтого цвета выдерживают при температуре 50oС и при перемешивании в течение 20 часов, затем оставляют охлаждаться до комнатной температуры и добавляют 60 см3 воды. Смесь экстрагируют этилацетатом (2 раза) и промывают с помощью 20 см3 насыщенного раствора гидрокарбоната натрия, затем сушат над сульфатом магния и отфильтровывают. Органические фазы концентрируют при пониженном давлении (2,7 кПа) при температуре 40oС, получая маслянистый остаток оранжевого цвета, который хроматографируют на колонке с диоксидом кремния (0,040-0,063 мм), элюируя смесью дихлорметана с метанолом в объемном соотношении 95: 5. Содержащие целевой продукт фракции объединяют и концентрируют при пониженном давлении (2,7 кПа) при температуре 40oС, получая 1,2 г чистого 1-[5-(3,4-О-бензилиден-2S, 3R, 4-тригидроксибутил)пиразин-2-ил]бутан-3,4-О-бензилиден-1R,2S,3R,4-тетра-ола в виде смеси диастереомеров в соотношении 4: 6 в форме бледно-желтого масла. Это последнее дает твердый продукт белого цвета, который плавится при температуре 70oС после порошкования в диэтиловом эфире.
1H-ЯМР-спектр (400 МГц, гексадейтеродиметилсульфоксид) δ в м.д.: авторы наблюдают смесь двух диастереоизомеров в приблизительных пропорциях 40/60: 2,34 (уш. дд, J=14 и 10 Гц, 1Н:1Н от СН2 в 5α); 3,09 (уш. д, J=14 Гц, 1Н: другой Н от СН2 в 5α); 3,70-4,50 (мультиплеты, 8Н:СН в 2β-СН в 2γ-СН2О в 2δ-СН в 5β-СН в 5γ и СН2О в 5δ); 4,83 (уш. с, 1Н;СН в 2α); 5,00 (уш. д, J=5 Гц, 1Н: ОН в 2γ); 5,21 (уш. д, J=3 Гц, 1Н:ОН в 5β); 5,69 (м, 1Н:ОН в 2α); 5,77-5,79 и 5,90 (3 с, 2Н в целом: 2 ОСНО); 8,46 и 8,49 (2 с, 1Н в целом:=СН в 6); 8,70 (с, 1Н:=СН в 3).
Другой ряд фракций в результате хроматографирования дает 1-[5-(2,4-О-бензилиден-2S, 3R,4-тригидроксибутил)пиразин-2-ил]бутан-2,4-О-бензилиден-1R, 2S,3R,4-тетраол.
Пример 7
Следуя методикам предыдущих примеров, но исходя из (2,2-диизопропил[1,3,2]диоксасилинан-5R-ол-4S-ил)-{5-[(2,2-диизопропил[1,3,2]диоксасилинан-5R-ол-4S-ил)метил] пиразин-2-ил}метан-1R-ола, получают 4-[5-(3R-метокси-2S,4-дигидроксибутил)пиразин-2-ил]-2R,4R-диметоксибутан-1,3S-диол.
(2,2-Диизопропил[1,3,2] диоксасилинан-5К-ол-4S-ил)-{ 5-[(2,2-диизопропил[1,3,2] диоксасилинан-5R-ол-4S-ил)метил] пиразин-2-ил} метан-1R-ол может быть получен следующим образом:
К раствору 1 г дезоксифруктозазина в 27 см3 пиридина при перемешивании и в атмосфере азота добавляют 2,1 см3 диизо-пропилсилилбис(трифторметансульфоната). Реакционную смесь перемешивают при температуре около 25oС в течение 71 часа. После концентрирования при пониженном давлении (2,7 кПа) при температуре 50oС остаточное масло обрабатывают трехкратно по 30 см3 пентаном, затем снова концентрируют в тех же условиях. Полученное остаточное масло растворяют в 50 см3 дихлорметана и промывают последовательно двукратно по 30 см3 1 н. водным раствором соляной кислоты, двукратно по 30 см3 водой, затем двукратно по 30 см3 водным насыщенным раствором хлорида натрия. Органическую фазу сушат над сульфатом магния, затем концентрируют при пониженном давлении (2,7 кПа) при температуре 40oС. Полученную меренгу хроматографируют на колонке с диоксидом кремния (0,020-0,045 мм), элюируя смесью этилацетата с циклогексаном в объемном соотношении 1:1, при давлении около 1,5•105 Па. Содержащие целевой продукт фракции объединяют и концентрируют при пониженном давлении (2,7 кПа) при температуре 40oС. Таким образом выделяют 60 мг (2,2-диизопропил[1,3,2]диоксасилинан-5R-ол-4S-ил)-{5-[(2,2-диизопропил[1,3,2] диоксасилинан-5R-ол-4S-ил)метил]пиразин-2-ил}метан-1R-ола в виде меренги белого цвета, плавящейся при температуре 54oС.
1Н-ЯМР-спектр (400 МГц, гексадейтеродиметилсульфоксид) δ в м.д.: 0,65-1,15 (м, 28Н: 4 СН(СН3)2); 2,80 (дд, J=14 и 9 Гц, 1Н:1Н от СН2 в 5α); 3,28 (м, другой Н от СН2 в 5α); 3,40 (м, 1Н:СН в 5γ); 3,68 (м, 2Н:1Н от СН2О в 2δ и 1Н от СН2O в 5δ); 3,83 (м, 1Н:СН в 2γ); 3,90-4,05 (м, 3Н:СН в 2β-другой Н от СН2O в 2δ и другой Н от СН2О в 5δ); 4,13 (уш. т, J=9,5 Гц, 1Н:СН в 5β); 4,99 (уш. д, J=6,5 Гц, 1Н:СН в 2α); 5,22 (д, J=6,5 Гц, 1Н:ОН в 2γ); 5,34 (д, J= 6 Гц, 1Н:ОН в 5γ); 5,39 (д, J=6,5 Гц, 1Н:ОН в 2α); 8,41 (с, 1Н:=СН в 6); 8,70 (с, 1Н:=СН в 3).
α
Пример 8
К 54 мг 2-фтор-1S-[5R-(5-{[5R-(гидроксиметил)-2,2-диметил[1,3]диоксолан-4S-ил] метил}пиразин-2-ил)-2,2-диметил[1,3]диоксолан-4R-ил]этанола добавляют 8 см3 водного 80%-ного раствора трифторуксусной кислоты. Реакционную смесь перемешивают в течение 1,5 часов при температуре около 25oС. После концентрирования при пониженном давлении (2,7 кПа) при температуре 45oС остаток обрабатывают толуолом, затем снова концентрируют в тех же условиях (операцию повторяют один раз). Остаточное коричневое масло растворяют в 5 cм3 метанола, фильтруют через бумажный фильтр, затем снова концентрируют в тех же условиях. Остаточное масло желтого цвета обрабатывают с помощью 0,4 см3 этанола и перекристаллизуют. Полученный осадок отфильтровывают на фильтре из пористого стекла, промывают с помощью 0,1 см3 этанола, отжимают, затем высушивают при пониженном давлении (2,7 кПа) при температуре 25oС. Таким образом выделяют 31 мг 4-фтор-1-[5-(2S,3R,4-тригидроксибутил)пиразин-2-ил] бутан-1R, 2S,3R-триола в виде кристаллического порошка бежевого цвета, плавящегося при температуре 141oС.
1H-ЯМР-спектр (400 МГц, гексадейтеродиметилсульфоксид) δ в м.д.: 2,76 и 3,08 (2 дд соответственно J=14 и 9 Гц и J=14 и 2 Гц, 1Н каждый: СН2 в 5α); 3,30-3,45 (м, 2Н: 1Н от СН2О в 5δ и СН в 5γ); 3,50-3,70 (м, 1Н:другой Н от Н2О в 5δ); 3,64 (уш. д, J=9 Гц, 1Н:СН в 2β); 3,80 (м, 1Н:СН в 5β); 3,70-3,90 (м, 1Н:СН в 2γ); 4,35-4,70 (м, JNF=48 Гц, 2H:CH2F в 2δ); 4,97 (уш. с, 1Н:СН в 2α); 8,44 (уш. с, 1Н:=СН в 6); 8,67 (уш.с,1Н:=СН в 3).
2-Фтор-1S-[5R-(5-{ [5R-(гидроксиметил)-2,2-диметил[1,3] диоксолан-4S-ил] метил}пиразин-2-ил)-2,2-диметил[1,3]диоксолан-4R-ил]этанол получают согласно следующей методике:
К раствору 210 мг 2-фтор-1S-[5R-(5-{[5R-(трет-бутилдифенилсиланилоксиметил)-2,2-диметил[1,3] диоксолан-4S-ил]метил}пиразин-2-ил)-2,2-диметил[1,3] диоксолан-4R-ил]этанола в 20 см3 тетрагидрофурана в атмосфере аргона добавляют по каплям 0,84 см3 1,0 М раствора тетра(н-бутил)аммонийфторида в тетрагидрофуране. Реакционную смесь перемешивают при температуре около 25oС в течение 1,5 часов. После концентрирования при пониженном давлении (2,7 кПа) при температуре около 40oС остаточное масло янтарного цвета хроматог-рафируют на колонке с диоксидом кремния (0,040-0,063 мм), элюируя смесью этилацетата с циклогексаном в объемном соотношении 9:1, при давлении около 1,5•105 Па. Содержащие целевой продукт фракции объединяют и концентрируют при пониженном давлении (2,7 кПа) при температуре 40oС. Таким образом выделяют 54 мг 2-фтор-1S-[5R-(5-{ [5R-(гидроксиметил)-2,2-диметил[1,3] диоксолан-4S-ил]метил} пиразин-2-ил)-2,2-диметил[1,3] диоксолан-4R-ил] этанола в виде масла желтого цвета.
Rf= 0,2 (тонкослойная хроматография на силикагеле; элюирование смесью этилацетата с циклогексаном в объемном соотношении 9:1).
2-Фтор-1S-[5R-(5-{ [5R-(трет-бутилдифенилсиланилоксиметил)-2,2-диметил[1,3]диоксолан-4S-ил]метил}пиразин-2-ил)-2,2-диметил[1,3]диоксолан-4R-ил] этанол получают согласно следующей методике:
К раствору 1,0 г 2-(трет-бутилдифенилсиланилокси)-1R-(5R-{5-[5R-(трет-бутилдифенилсиланилоксиметил)-2,2-диметил[1,3] диоксолан-4S-илметил] пиразин-2-ил} -2,2-диметил[1,3]диоксолан-4S-ил)этанола в 6 см3 тетрагидрофурана, охлажденному до температуры -45oС, и в атмосфере аргона добавляют по каплям 0,32 см3 диэтиламиносульфидтрифторида. Реакционную смесь перемешивают при температуре -45oС в течение двух часов, затем ее обрабатывают по каплям с помощью 0,2 см3 метанола. После этого смесь оставляют нагреваться до температуры 25oС, затем концентрируют при пониженном давлении (2,7 кПа) при температуре 40oС. Остаточное масло коричневого цвета растворяют в 50 см3 дихлорметана и экстрагируют трехкратно по 5 см3 водой. Органическую фазу сушат над сульфатом магния, затем концентрируют при пониженном давлении (2,7 кПа) при температуре 40oС. Остаточное масло коричневого цвета хроматографируют на колонке с диоксидом кремния (0,020-0,045 мм), элюируя смесью этилацетата с циклогексаном в объемном соотношении 1: 9, при давлении около 1,5•105 Па. Содержащие целевой продукт фракции объединяют и концентрируют при пониженном давлении (2,7 кПа) при температуре 40oС. Таким образом получают 0,17 г 2-фтор-1S-[5R-(5-{[5R-(трет-бутилдифенилсиланилоксиметил)-2,2-диметил[1,3] диоксолан-4S-ил]метил}пиразин-2-ил)-2,2-диметил[1,3]диоксолан-4R-ил]этанола в виде желтого вязкого масла.
Rf= 0,3 (тонкослойная хроматография на силикагеле; элюирование смесью этилацетата с циклогексаном в объемном соотношении 1 : 2,3.
2-(трет-Бутилдифенилсиланилокси)-1R-(5R-{ 5-[5R-(трет-бутилдифенилсиланилоксиметил)-2,2-диметил[1,3] диоксолан-4S-илметил] пиразин-2-ил}-2,2-диметил[1,3]диоксолан-4S-ил)этанол получают согласно следующей методике:
К раствору 1 г 1-[5-(4-трет-бутилдифенилсиланилокси)-2S,3R-дигидроксибутил)пиразин-2-ил]-4-[трет-бутилдифенилсиланилокси]бутан-1R,2S,3R-триола в 50 см3 диметилформамида при перемешивании добавляют 5 см3 2,2-диметоксипропана, затем 0,01 г п-толуолсульфокислоты. Реакционную смесь перемешивают при температуре 60oС в течение 42 часов. После концентрирования при пониженном давлении (2,7 кПа) при температуре 60oС остаточное масло растворяют в 60 см3 дихлорметана и промывают двукратно по 20 см3 водным 5%-ным раствором гидрокарбоната натрия, затем двукратно по 20 см3 водой. Органическую фазу сушат над сульфатом магния, затем концентрируют при пониженном давлении (2,7 кПа) при температуре 40oС. Полученное масло хроматографируют на колонке с диоксидом кремния (0,020-0,045 мм), элюируя смесью этилацетата с циклогексаном в объемном соотношении 1:9, при давлении около 1,5•105 Па. Содержащие целевые продукты фракции объединяют и концентрируют при пониженном давлении (2,7 кПа) при температуре 40oС. Таким образом получают 0,3 г 2-(трет-бутилдифенилсиланилокси)-1R-(5R-{ 5-[5R-(трет-бутилдифенилсиланилоксиметил)-2,2-диметил[1,3]диоксолан-4S-илметил]пиразин-2-ил}-2,2-диметил[1,3]диоксолан-4S-ил)этанола в виде вязкого желтого масла.
1Н-ЯМР-спектр (400 МГц, гексадейтеродиметилсульфоксид) δ в м.д.: 0,90 и 1,01 (2с, 9Н каждый: 2 C(CH3)2); 1,22-1,35-1,44 и 1,46 (4 с, 3Н каждый: 4 CH3); 3,08 (дд, J=14 и 9 Гц, 1Н:1Н от CH2 в 5α); 3,15 (дд, J=14 и 3,5 Гц, 1Н:другой Н от CH2 в 5α); 3,60 (АВ огранич., 2Н:CH2O в 2δ); 3,71 (дд, J=11 и 5 Гц, 1Н:1Н от СH2O в 5δ); 3,80-3,95 (м, 2Н:другой Н от CH2 в 5δ и СН в 2γ); 4,32 (к, J= 5 Гц, 1Н:СН в 5γ); 4,48 (дд, J=7 и 5 Гц, 1Н:СН в 2β); 4,70 (м, 1Н: СН в 5β); 5,14 (д, J=7 Гц, 1Н:СН в 2α); 5,19 (д, J=5 Гц, 1Н:ОН в 2γ); 7,35-7,80 (м, 20Н: Н ароматические четырех фенилов); 8,53 (с, 1Н:=СН в 6); 8,68 (с, 1Н:=СН в 3).
α
Rf= 0,30 (тонкослойная хроматография на силикагеле; элюирование смесью этилацетата с циклогесаном в объемном соотношении 1:4).
Из этой колонки также выделяют 0,2 г 4R-(трет-бутилдифенилсиланилоксиметил)-6R-{5-[5R-(трет-бутилдифенилсиланилоксиметил)-2,2-диметил[1,3]диоксолан-4S-илметил] пиразин-2-ил} -2,2-диметил[1,3]диоксан-5S-ола в виде желтого масла.
1Н-ЯМР-спектр (400 МГц, гексадейтеродиметилсульфоксид) δ в м.д.: 1,01 и 1,05 (2 с, 9Н каждый:2 С(СН3)2); 1,24-1,36 и 1,50 (3 с соответственно 3Н-6Н и 3Н:4 СН3); 3,03 (дд, J=14 и 9 Гц, 1Н:1Н от СН2 в 5α); 3,12 (дд, J=14 и 3, 5 Гц, 1Н: другой Н от СН2 в 5α); 3,70 (дд, J=11 и 5,5 Гц, 1Н:1Н от СН2O в 5δ); 3,75-3,95 (м, 4Н:СН в 2γ-СН2O в 2δ и другой Н от СН2О в 5δ); 4,03 (м, 1Н:СН в 2β); 4,32 (м, 1Н:СН в 5γ); 4,70 (м, 1Н:СН в 5β); 4,95-5,05 (м, 2Н:СН в 2α и ОН в 2β); 7,35-7,55 и 7,60-7,80 (2м соответственно 12Н и 8Н:Н ароматические четырех фенилов); 8,46 (с, 1Н:=СН в 6); 8,53 (с, 1Н:=СН в 3).
α
1-[5-(4-трет-Бутилдифенилсиланилокси)-2S, 3R-дигидроксибутил)пиразин-2-ил] -4-[трет-бутилдифенилсиланилокси] бутан-1R,2S,3R-триол получают согласно следующей методике:
К раствору 2 г дезоксифруктозазина в 55 см3 пиридина при перемешивании добавляют 4,3 см3 трет-бутилдифенилхлорсилана. Реакционную смесь перемешивают при температуре около 25oС в течение 68 часов, затем добавляют 0,5 см3 трет-бутилдифенилхлорсилана и продолжают перемешивание в течение 8 дней. После концентрирования при пониженном давлении (2,7 кПа) при температуре 60oС остаточное масло растворяют в 100 см3 дихлорметана и промывают трехкратно по 30 см3 водой. Органическую фазу сушат над сульфатом магния, затем концентрируют при пониженном давлении (2,7 кПа) при температуре 40oС. Полученное масло хроматографируют на колонке с диокcидом кремния (0,020-0,045 мм), элюируя смесью метанола с дихлорметаном в объемном соотношении 1:49, при давлении около 1,5•105 Па. Содержащие целевые продукты фракции объединяют и концентрируют при пониженном давлении (2,7 кПа) при температуре 40oС. Таким образом получают 4 г 1-[5-(4-трет-бутилдифенилсиланилокси)-2(S),3(R)-дигидроксибутил)пиразин-2-ил] -4-[трет-бутилдифенилсиланилокси] бутан-1(R), 2(S), 3(R)-триола в виде меренги желтого цвета.
Rf= 0,13 (тонкослойная хроматография на силикагеле; элюирование смесью метанола с дихлорметаном в объемном соотношении 1:19).
Соединения формулы (I) обладают ценными фармакологическими свойствами. Они являются веществами, понижающими содержание глюкозы в крови.
Гипогликемизирующую активность соединений формулы (I) определяют по гипергликемической ответной реакции на введение глюкозы перорально мыши с нормальным содержанием глюкозы в крови согласно следующему протоколу.
Мышей Swiss albinos массой от 22 до 26 г выдерживают натощак в течение двух часов. По окончании этого периода определяют содержание глюкозы в крови и тотчас после вводят перорально дозу глюкозы (2 г/кг). Спустя тридцать минут еще раз определяют содержание глюкозы в крови. Мышей, которые дают ответную реакцию путем гипергликемии выше 170 мг/дл, отбирают и используют для определения гипогликемизирующей активности соединений согласно изобретению.
Таким образом отобранных мышей распределяют по группам, включающим по крайней мере по 10 животных. Отдельные группы получают раствор 3-50 мг/кг испытуемого продукта в эксципиенте, таком как вода или смесь метилцеллюлозы и/или твина и воды, или эксципиента один раз в день путем катетеризма желудка. Обработка длится 4 дня. На четвертый день, после последней обработки, животные получают дозу глюкозы (2 г/кг) и спустя 20-40 минут определяют содержание глюкозы в крови. Процент ингибирования гипергликемической ответной реакции на введение глюкозы рассчитывают по отношению к ответной реакции, определяемой в группе, обработанной эксципиентом.
В этом тесте соединения согласно изобретению показывают процент ингибирования гликемии, выше или равный 10%.
Соединения общей формулы (I) согласно изобретению обладают слабой токсичностью. Их ЛД50 составляет величину выше 2000 мг/кг перорально в случае мыши.
В терапии человека эти продукты пригодны для профилактики и лечения диабета и особенно диабета типа II (инсулиннезависимый диабет), диабета "тучных", диабета "пятидесятилетних", метаплеторического диабета, старческого диабета и лабильного диабета. Их можно использовать в дополнение к инсулинотерапии при инсулинзависимом диабете, где они позволяют постепенно снижать дозу инсулина, при нестабильном диабете, инсулинорезистентном диабете, в дополнение к сульфамидным гипогликемизирующим средствам, когда они не вызывают достаточного снижения содержания глюкозы в крови. Эти продукты также могут быть использованы при осложнениях диабета, таких как гиперлипемии, нарушения липидного метаболизма, дислипемии, ожирение. Они также пригодны для профилактики и лечения атеросклерозных поражений и их осложнений (как коронопатии, инфаркт миокарда, кардиомиопатии, развитие этих трех осложнений до левожелудочковой недостаточности, различные артериопатии, артерииты нижних конечностей с прихрамыванием и развитие до язв и гангрены, васкулярная церебральная недостаточность и ее осложнения, импотенция васкулярного происхождения), диабетической ретинопатии и всех ее симптомов (повышение капиллярной проницаемости, расширение и тромбоз капилляров, микроаневризмы, артерио-венозный шунт, расширение вен, пунктированные и макулярные кровотечения, экссудаты, макулярные отеки, проявления пролиферирующей ретинопатии: вновь образуемые сосуды в поврежденной ткани во время регенерации, рубцы пролиферирующего ретинита, геморрагии стекловидного тела, отслаивание сетчатки), диабетической катаракты, диабетической невропатии во всех ее различных формах (периферические полиневропатии и их симптомы, такие как парестезии, гиперестезии и боли, мононевропатии, радикулопатии, автономные невропатии, диабетические амиотрофии), симптомов диабетической ступни (язвы нижних конечностей и ступней), диабетической нефропатии в двух ее формах - диффузной и узелковой, - атероматоза (повышение уровня липопротеинов высокой плотности [HDL] , благоприятствующее удалению холестерина из атероматозных бляшек; понижение уровня липопротеинов низкой плотности [LDL], уменьшение соотношения LDL/HDL, ингибирование окисления LDL, уменьшение тромбоцитарной адгезивности), гиперлипемий и дислипемий (гиперхолестеринемии, гипертриглицеридемии, нормализация доли жирных кислот, нормализация урикемии, нормализация апопротеинов А и В), катаракты, артериальной гипертензии и ее последствий.
Лекарственные средства согласно изобретению образованы соединением согласно изобретению или комбинацией этих продуктов, как таковых или в виде композиции, в которой соединение согласно изобретению соединено с любым другим фармацевтически приемлемым продуктом, который может быть инертным или физиологически активным. Лекарственные средства согласно изобретению можно применять перорально, парентеральено, ректально или локально.
В качестве твердых композиций для введения перорально могут быть использованы таблетки, пилюли, порошки (желатиновые капсулы, крахмальные облатки) или гранулы. В этих композициях действующее начало согласно изобретению смешано, в токе аргона, с одним или несколькими инертными разбавителями, такими как крахмал, целлюлоза, сахароза, лактоза или диоксид кремния. Эти композиции также могут содержать другие вещества, чем разбавители, например одну или несколько смазок, таких как стеарат магния или тальк, краситель, средство для покрытия защитной оболочкой (драже) или лак.
В качестве жидких композиций для введения перорально можно использовать фармацевтически приемлемые растворы, суспензии, эмульсии, сиропы и эликсиры, содержащие инертные разбавители, такие как вода, этанол, глицерин, растительные масла или парафиновое масло. Эти композиции могут включать другие вещества, чем разбавители, например смачиватели, подсластители, загустители, ароматизаторы или стабилизаторы.
Стерильные композиции для введения перентерально предпочтительно могут представлять собой водные или неводные растворы, суспензии или эмульсии. В качестве растворителя или эксципиента можно использовать воду, пропиленгликоль, полиэтиленгликоль, растительные масла, в особенности оливковое масло, сложные органические эфиры для инъекций, как, например, этилолеат, или другие пригодные органические растворители. Эти композиции могут также содержать добавки, в частности смачиватели, изотонизирующие компоненты, эмульгаторы, диспергаторы и стабилизаторы. Стерилизацию можно осуществлять несколькими способами, например путем асептизирующей фильтрации, включая в композицию стерилизующие средства, путем облучения или путем нагревания. Их можно также приготовлять в виде твердых стерильных композиций, которые в момент употребления могут быть растворены в стерильной воде или любой другой стерильной среде для инъекции.
Композиции для введения ректально представляют собой свечи или ректальные капсулы, которые содержат, кроме активного продукта, эксципиенты, такие как масло какао, полусинтетические глицериды или полиэтиленгликоли.
Композиции для локального применения могут представлять собой, например, кремы, лосьоны, примочки для глаз, жидкости для полоскания полости рта и аппликации на десна, капли в нос или аэрозоли.
Дозы зависят от желаемого эффекта, продолжительности лечения и используемого пути введения; обычно они составляют 150-600 мг в день перорально для взрослого с разовыми дозами от 50 мг до 200 мг активного вещества.
В общем, врач определяет соответствующую дозировку в зависимости от возраста, массы и всех других факторов, присущих излечиваемому субъекту.
Следующие примеры иллюстрируют композиции согласно изобретению.
Пример А
Обычным способом приготовляют желатиновые капсулы с дозами по 50 мг активного продукта, имеющие следующий состав:
Активный продукт - 50 мг
Целлюлоза - 18 мг
Лактоза - 55 мг
Коллоидальный диоксид кремния - 1 мг
Натриевая соль карбоксиметилкрахмала - 10 мг
Тальк - 10 мг
Стеарат магния - 1 мг
Пример Б
Обычным способом приготовляют таблетки с дозами по 50 мг активного продукта, имеющие следующий состав:
Активный продукт - 50 мг
Лактоза - 104 мг
Целлюлоза - 40 мг
Поливидон - 10 мг
Натриевая соль карбоксиметилкрахмала - 22 мг
Тальк - 10 мг
Стеарат магния - 2 мг
Коллоидальный диоксид кремния - 2 мг
Смесь гидроксиметилцеллюлозы, глицерина, диоксида титана (72-3,5-24,5) до общей массы одной готовой таблетки в целлофановой упаковке - 245 мг
Пример В
Готовят раствор для инъекции, содержащий 50 мг активного продукта и имеющий следующий состав:
Активный продукт - 50 мг
Бензойная кислота - 80 мг
Бензиловый спирт - 0,06 мл
Бензоат натрия - 80 мг
95%-ный этанол - 0,4 мл
Гидроксид натрия - 24 мг
Пропиленгликоль - 1,6 мл
Вода до общего объема - 4 мл
Изобретение также относится к использованию соединений общей формулы (I) для получения фармацевтических композиций, пригодных для лечения или профилактики диабета и осложнений диабета.
Описывается гипогликемическое лекарственное средство, содержащее в качестве действующего начала по меньшей мере один полигидроксибутилпиразин формулы I, в которой либо (А) каждый из R9 и R10 означает радикал -СН2ОН, либо а) R3 означает метилен, R4 означает радикал -СНОН- и один из радикалов R1, R2, R5, R6 означает метилен, -CHF- или -CH(OR8)-, а каждый из других -СНОН-; б) каждый из R2 и R5 означает -СНОН-, R3 означает метилен и R1 R4 и R6 являются одинаковыми и каждый означает -CH(OR8)-; в) каждый из R1 и R6 означает -СНОН-, R3 означает метилен и R2, R4 и R5 являются одинаковыми и каждый означает -СН(OR8)-; г) каждый из R1, R4, R5 и R6 означает радикал -СНОН- и -R2-R3- означает радикал -СН=СН-; либо (Б) каждый из R1, R2 R4, R5 и R6 означает радикал -СНОН-, R3 - метилен, R9 означает радикал -СН2ОН, R10 означает -CH2F, R8 означает алкил с 1-6 атомами углерода в линейной или разветвленной цепи, один из его стереоизомеров или одну из его солей. Также описываются полигидроксибутилпиразины формулы I, способы получения полигидроксибутилпиразинов формулы I и применение полигидроксибутилпиразина формулы А в качестве действующего начала лекарственного средства, пригодного для лечения или профилактики диабета и осложнений диабета. 10 с. и 2 з.п. ф-лы.
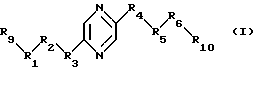
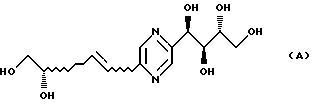
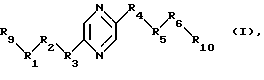
в которой либо (А) каждый из R9 и R10 означает радикал -СН2ОН; и либо а) R3 означает метилен, R4 означает радикал -СНОН- и один из радикалов R1, R2, R5, R6 означает метилен, -СНF- или -CH(OR8)-, а каждый из других -СНОН-; б) каждый из R2 и R5 означает -СНОН-, R3 означает метилен и R1, R4 и R6 являются одинаковыми и каждый означает -CH(OR8)-; в) каждый из R1 и R6 означает -СНОН-, R3 означает метилен и R2, R4 и R5 являются одинаковыми и каждый означает -CH(OR8)-; г) каждый из R1, R4, R5 и R6 означает радикал -СНОН- и -R2-R3-означает радикал -СН-СН=;
либо (Б) каждый из R1, R2, R4, R5 и R6 означает радикал -СНОН-, R3 метилен, R9 означает радикал -СН2ОН, R10 означает -СН2F, R8 означает алкил с 1-6 атомами углерода в линейной или разветвленной цепи,
один из его стереоизомеров или одну из его солей.
1-[5-(3S,4-дигидроксибутил)пиразин-2-ил]бутан-1R,2S,3R,4-тетраол;
1-[5-(3S,4-дигидрокси-1Е-бутенил)пиразин-2-ил]бутан-1R,2S,3R,4-тетраол;
1-[5-(2S-метокси-3R, 4-дигидроксибутил)пиразин-2-ил] бутан-lR, 2S,3R,4-тетраол;
1-[5-(2R-фтор-3R, 4-дигидроксибутил)пиразин-2-ил] бутан-1R, 2S,3R,4-тетраол;
1-[5-(2S,4-дигидрокси-3R-метоксибутил)пиразин-2-ил]бутан-1R,2S,3R,4-тетраол;
4-[5-(3R, 4-дигидрокси-2S-метоксибутил)пиразин-2-ил] -3R,4R-диметоксибутан-1,2-диол;
4-фтор-1-(5-(2S,3R,4-тригидроксибутил)пиразин-2-ил]бутан-1R,2S,3R-триол;
и их солей с фармацевтически приемлемой неорганической или органической кислотой.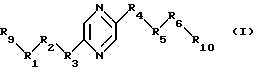
в которой либо (А) каждый из R9 и R10 означает радикал -СН2ОН; и либо а) R3 означает метилен, R4 означает радикал -СНОН- и один из радикалов R1, R2, R5, R6 означает метилен, -СНF- или -CH(OR8)-, а каждый из других -СНОН-; б) каждый из R2 и R5 означает -СНОН-, R3 означает метилен и R1, R4 и R6 являются одинаковыми и каждый означает -CH(OR8)-; в) каждый из R1 и R6 означает -СНОН-, R3 означает метилен и R2, R4 и R5 являются одинаковыми и каждый означает -CH(OR8 )-;
либо (Б) каждый из R1, R2, R4, R5 и R6 означает радикал -СНОН-, R3-метилен, R9 означает радикал -СН2ОН, R10 означает -CH2F, R8 означает алкил с 1-6 атомами углерода в линейной или разветвленной цепи,
один из его стереоизомеров или одну из его солей.
где каждый из R9 и R10 означает радикал -СН2ОН и R3 означает метилен, R4 означает радикал -СНОН- и один из радикалов R1, R2, R5, R6 означает метилен, а каждый из других -СНОН-, отличающийся тем, что фенилхлортионокарбонат конденсируют с производным формулы II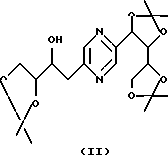
в присутствии органического основания, затем восстанавливают полученный продукт с помощью трибутилоловогидрида и азобис(2-метилпропионитрила) и удаляют защитные для гидроксильных функций группы путем обработки полученного соединения трифторуксусной кислотой, целевой продукт выделяют и в случае необходимости превращают его в соль.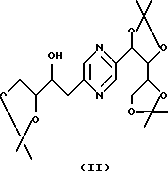
затем удаляют защитные для гидроксильных функций группы путем обработки трифторуксусной кислотой.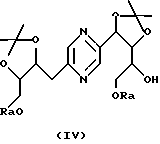
где Ra означает алкилдифенилсилил,
затем удаляют защитные для гидроксильных функций группы путем обработки трифторуксусной кислотой.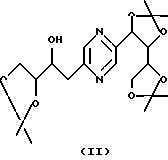
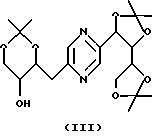
вводят во взаимодействие с производным ГaлR8, где R8 означает алкил с 1-6 атомами углерода в линейной или разветвленной цепи, Гал означает атом галогена, в присутствии гидрида щелочного металла, затем удаляют защитные для гидроксильных функций группы путем обработки трифторуксусной кислотой.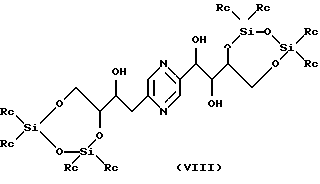
вводят во взаимодействие с производным ГалR8, где R8 означает алкил с 1-6 атомами углерода в линейной или разветвленной цепи, Гал означает атом галогена, в присутствии гидрида щелочного металла, затем удаляют защитные для гидроксильных функций группы путем обработки трифторуксусной кислотой.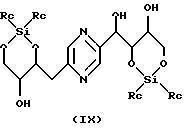
где Rc означает алкил с 1-6 атомами углерода в линейной или разветвленной цепи,
вводят во взаимодействие с производным ГалR8, где R8 означает алкил с 1-6 атомами углерода в линейной или разветвленной цепи, Гал означает атом галогена, в присутствии гидрида щелочного металла, затем удаляют зищитные для гидроксильных функций группы путем обработки трифторуксусной кислотой.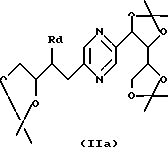
где Rd означает -ОН,
в присутствии трифенилфосфина и диалкилазодикарбоксилата, затем удаляют защитные для гидроксильных функций группы путем обработки трифторуксусной кислотой, целевой продукт выделяют и в случае необходимости превращают его в соль.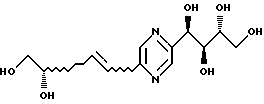
в качестве действующего начала лекарственного средства, пригодного для лечения или профилактики диабета и осложнений диабета.
| RU 94015265 А1, 20.02.1997 | |||
| WO 8704158 А2, 16.07.1987 | |||
| S.EITELMAN et al | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| CARBOHYDRATE RESEARCH, v | |||
| Спускная труба при плотине | 0 |
|
SU77A1 |
| Станок для изготовления из дерева круглых палочек | 1915 |
|
SU207A1 |
Авторы
Даты
2002-08-10—Публикация
1998-07-15—Подача