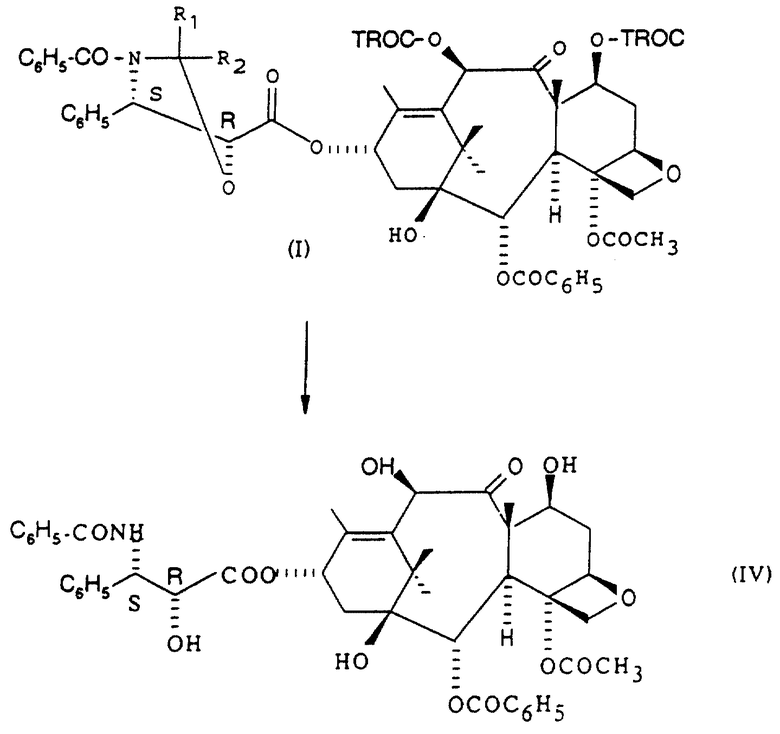
Изобретение касается производных таксана общей формулы (I)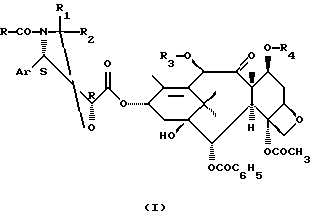
которые представляют особый интерес как промежуточные соединения при получении таксола, Таксотера и их аналогов, обладающих противоопухолевыми и противолейкемическими свойствами.
В общей формуле (I)
Аr представляет собой арил,
R представляет собой фенил или радикал R5-0-, в котором R5 представляет собой
линейный или разветвленный алкил, содержащий от 1 до 8 атомов углерода, за исключением трет-бутила, алкенил, содержащий от 2 до 8 атомов углерода, алкинил, содержащий от 3 до 8 атомов углерода, или циклоалкил, содержащий от 3 до 6 атомов углерода, циклоалкенил, содержащий от 4 до 6 атомов углерода, или бициклоалкил, содержащий от 7 до 11 атомов углерода, при этом названные радикалы могут быть замещены одним или несколькими заместителями, выбранными среди атомов галогена и групп гидрокси, алкокси, содержащего от 1 до 4 атомов углерода, диалкиламино, алкильная часть которого содержит от 1 до 4 атомов углерода, пиперидино, морфолино, 1-пиперазинила (возможно замещенного в положении 4 алкилом, содержащим от 1 до 4 атомов углерода, или фенилалкилом, алкильная часть которого содержит от 1 до 4 атомов углерода), циклоалкила, содержащего от 3 до 6 атомов углерода, циклоалкенила, содержащего от 4 до 6 атомов углерода, фенилциано, карбокси или алкоксикарбонил, алкильная часть которого содержит от 1 до 4 атомов углерода, или
R5 представляет собой фенил, возможно замещенный одним или несколькими атомами или радикалами, выбранными среди атомов галогена и радикалов алкильных, содержащих от 1 до 4 атомов углерода, или алкокси, содержащих от 1 до 4 атомов углерода, или
R5 представляет собой насыщенный или ненасыщенный азотсодержащий гетероцикл, содержащий от 4 до 6 звеньев, возможно замещенный одним или несколькими алкилами, содержащими от 1 до 4 атомов углерода, при этом циклоалкил, циклоалкенил или бициклоалкил могут быть замещены одним или несколькими алкилами, содержащими от 1 до 4 атомов углерода,
R1 и R2 имеют одинаковые или различные значения и представляют собой атом водорода, алкил, фенилалкил, фенил, алкоксифенил или диалкоксифенил, или же
R1 и R2 вместе образуют с атомом углерода, с которым они связаны, цикл, содержащий от 4 до 7 звеньев,
R3 представляет собой ацетил или защитную группу гидроксильной функции,
R4 представяет собой защитную группу гидроксильной функции.
Более конкретно, Аr представляет собой фенил или α - или β -нафтил, возможно замещенный одним или несколькими атомами или радикалами, имеющими одинаковые или различные значения, выбранными среди атомов галогена (фтор, хлор, бром, иод) и радикалов: алкил, алкенил, алкинил, арил, аралкил, алкокси, алкилтио, арилокси, арилтио, гидрокси, оксиалкил, меркапто, формил, ацил, ациламино, ароиламино, алкоксикарбониламино, амино, алкиламино, диалкиламино, карбокси, алкоксикарбонил, карбамоил, диалкилкарбамоил, циано, нитро и трифторметил, при этом разумеется, что алкилы и алкильные части других радикалов содержат от 1 до 4 атомов углерода, а алкенил и алкинил содержат от 3 до 8 атомов углерода, а арил представляет собой фенил или α - или β -нафтил, или же Аr представляет собой ароматический гетероцикл, содержащий 5 звеньев и включающий один или несколько атомов, имеющих одинаковое или различное значение, выбранных среди атомов азота, кислорода или серы, возможно замещенный одним или несколькими заместителями, имеющими одинаковые или различные значения, выбранными среди атомов галогена (фтор, хлор, бром, иод) и радикалов: алкил, содержащий от 1 до 4 атомов углерода, арил, содержащий от 6 до 10 атомов углерода, алкокси, содержащий от 1 до 4 атомов углерода, арилокси, содержащий от 6 до 10 атомов углерода, амино, алкиламино, содержащий от 1 до 4 атомов углерода, диалкиламино, алкильная часть которого содержит от 1 до 4 атомов углерода, ациаламино, ацильная часть которого содержит от 1 до 4 атомов углерода, алкоксикарбониламино, содержащий от 1 до 4 атомов углерода, ацил, содержащий от 1 до 4 атомов углерода, арилкарбонил, арильная часть которого содержит от 6 до 10 атомов углерода циано, карбокси, карбамоил, алкилкарбамоил, алкильная часть которого содержит от 1 до 4 атомов углерода, диалкилкарбамоил, алкильная часть которого содержит от 1 до 4 атомов углерода, или алкоксикарбонил, алкокси которого содержит от 1 до 4 атомов углерода.
Более конкретно, Аr представляет собой фенил, 2- или 3-тиенил или 2- или 3-фурил, возможно замещенные одним или несколькими атомами или радикалами, имеющими одинаковые или различные значения, выбранными из атомов галогена и радикалов алкил, алкокси, амино, диалкиламино, ациламино, алкоксикарбониламино и трифторметил.
Еще более конкретно, Аr представляет собой фенил, возможно замещенный атомом хлора или фтора или алкилом (метил), группами алкокси (метокси), диалкиламино (диметиламино), ациламино (ацетиламино) или алкоксикарбониламино (трет-бутоксикарбониламино) или 2-тиенил или 3-тиенил, или 2-фурил или 3-фурил.
Более конкретно, R3 представляет собой ацетил или защитную группу функциональной гидроксигруппы, выбранную из следующих радикалов: (2,2,2-трихлорэтокси)карбонил, (2-трихлорметилизопропокси)карбонил, триалкилсилил, диалкиларилсилил, алкилдиарилсилил или триарилсилил, в которых алкилы содержат от 1 до 4 атомов углерода, а арилы являются, в основном, фенилами, а R4 представляет собой защитную группу функциональной гидроксигруппы, выбранную из следующих радикалов: (2,2,2-трихлорэтокси)карбонил, (2-трихлорметилизопропокси)карбонил, бензил, 4-метоксибензил, 2,4-диметоксибензил, триалкилсилил, диалкиларилсилил, алкилдиарилсилил или триарилсилил, в которых алкилы содержат от 1 до 4 атомов углерода, а арилы являются, в основном, фенилами.
В международной заявке РСТ/WO 9209589 описано получение соединений общей формулы (I) путем этерификации защищенного баккатина 111 или защищенного 10-дизацетилбаккатина 111 общей формулы
где R3 и R4 имеют значения, указанные выше,
осуществляемой с помощью кислоты общей формулы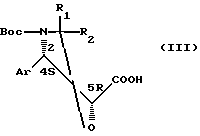
где Аr, R1 и R2 имеют значения, указанные выше, а
Воc представляет собой трет-бутоксикарбонил,
с превращением полученных соединений в таксол, Таксотер или их производные общей формулы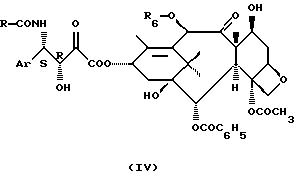
где Аr имеет значения, указанные выше,
R6 представляет собой атом водорода или ацетил, а
R представляет собой фенил или R5-О-, где R5 имеет значения, указанные выше, через получение на промежуточной стадии соединения общей формулы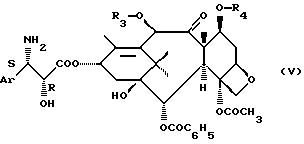
где R3 и R4 значения, указанные выше.
Согласно ранее известным способам было необходимо для получения соединений общей формулы (IV), в которой абсолютная конфигурация бокового звена определяет противоопухолевые свойства соединений, использовать кислоту общей формулы (III), в которой атомы углерода, находящиеся в положении 4 и 5, имеют соответственно конфигурацию S и конфигурацию R.
Заявителем разработан способ получения соединений общей формулы (I) при 100%-ной стереоселективности, заключающийся в том, что этерифицируют защищенный баккатин 111 или защищенный 10-дезацетилбаккатин 111 с помощью кислоты общей формулы
где Аr, R, R1 и R2 имеют значения,
указанные выше, и атомы углерода которой, находящиеся в положении 4 и 5, имеют каждый конфигурацию S, или с помощью активированного производного этой кислоты.
Способ позволяет стереоселективно получать соединение общей формулы (I), используя кислоту общей формулы (VI), которая может быть использована в смеси с кислотой общей формулы (III).
Этерификацию защищенного баккатина 111 или защищенного 10-дезацетилбаккатина 111 кислотой общей формулы (VI) осуществляют в присутствии агента конденсации, например, такого как имид, а именно дициклогексилкарбодиимида, или реакционноспособного карбоната, а именно 2-дипиридилкарбоната, и агента активации, например аминопиридина, а именно 4 диметиламинопиридина или 4-пирролидинопиридина, используя органический растворитель, выбранный среди таких простых эфиров, как тетрагидрофуран, диизопропиловый эфир, метил трет-бутиловый эфир или диоксан, таких кетонов, как метилизобутилкетон, таких сложных эфиров, как этилацетат, изопропилацетат или н-бутилацетат, нитрилов, алифатических углеводородов, таких как пентан, гексан или гептан, галогенсодержащих алифатических углеводородов таких, как дихлорметан или 1,2-дихлорметан, и ароматических углеводородов, таких как бензол, толуол, ксилол, этилбензол, изопропилбензол или хлорбензол, при температуре от 0 до 90oС.
Этерификация может быть осуществлена при использовании кислоты общей формулы (VI) в форме ангидрида общей формулы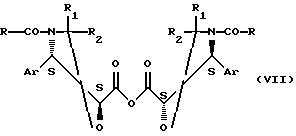
где Аr, R, R1 и R2 имеют значения, аналогичные указанным выше,
в присутствии агента активации, например аминопиридина, а именно 4-диметиламинопиридина или 4-пирролидинпиридина, в органическом растворителе, выбранном среди таких простых эфиров, как тетрагидрофуран, диизопропиловый эфир, метил-трет-бутиловый эфир или диоксан, таких кетонов, как метилизобутилкетон, таких сложных эфиров, как этилацетат, изопропилацетат или н-бутилацетат, таких нитрилов, как ацетонитрил, таких алифатических углеводородов, как пентан, гексан, гептан, таких галогенсодержащих алифатических углеводородов, как дихлорметан или 1,2-дихлорэтан, и таких ароматических углеводородов, как бензол, толуол, ксилол, этилбензол, изопропилбензол или хлорбензол, при температуре от 0 до 90oС.
Этерификация может быть также осуществлена при использовании кислоты общей формулы (VI) в форме галогенида или смешанного ангидрида общей формулы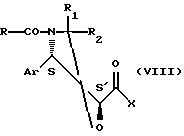
где Аr, R, R1 и R2 имеют значения, указанные выше, а
Х представляет собой атом галогена или радикал ацилокси или ароилокси,
возможно приготовленного in situ в присутствии основания, которым преимущественно является азотсодержащее органическое основание, например алифатический третичный амин, пиридин или аминопиридин, а именно 4-диметиламинопиридин или 4-пирролидинопиридин, работая в инертном органическом растворителе, выбранном среди таких простых эфиров, как тетрагидрофуран, диизопропиловый эфир, метил трет-бутиловый эфир или диоксан, кетонов, например метил- трет-бутилкетона, сложных эфиров, например этилацетата, изопропилацетата или н-бутилацетата, нитрилов, например ацетонитрила, алифатических углеводородов, например пентана, гексана или гептана, галогенсодержащих алифатических углеводородов, например дихлорметана или 1, 2-дихлорэтана, и ароматических углеводородов, например бензола, толуола, ксилола, этилбензола, изопропилбензола или хлорбензола, при температуре от 0 до 90oС.
Кислота общей формулы (VI) может быть получена путем омыления сложного эфира общей формулы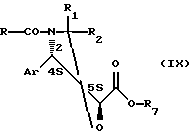
где Аr, R, R1 и R2 имеют значения указанные выше, а
R7 представляет собой алкил, содержащий от 1 до 4 атомов углерода, возможно замещенный одним или несколькими фенилами.
В основном, омыление осуществляют в водной среде, возможно в присутствии алифатического спирта, содержащего от 1 до 4 атомов углерода (метанол, этанол, изопропанол, трет-бутанол), в присутствии минерального основания, выбранного среди гидроксидов, карбонатов или бикарбонатов щелочных металлов или щелочноземельных металлов, при температуре от 0 до 50oС, а предпочтительно равной приблизительно 20oС.
Сложный эфир общей формулы (IX) может быть получен путем воздействия альдегида или кетона общей формулы
где R1 и R2 имеют значения указанные выше,
возможно в форме диалкилацеталя или енольного алкилового эфира, на сложный эфир общей формулы
где Аr, R и R7 имеют значения, указанные выше,
осуществляя реакцию в инертном органическом растворителе в присутствии сильной минеральной кислоты, например серной кислоты, или органической кислоты, например пара-толуолсульфокислоты, возможно в форме соли пиридиния, при температуре от 0oС до температуры кипения реакционной смеси.
Особо подходящими растворителями являются ароматические углеводороды, а именно толуол.
Сложный эфир общей формулы (XI) может быть получен путем воздействия бензоилхлорида или соединения общей формулы
R5-О-CO-Y,
где R5 имеет значения, указанные выше, а Y представляет собой атом галогена или радикал O-R5, или -О-CO-R5, на сложный эфир общей формулы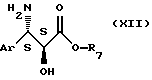
где Аr и R7 имеют значения, указанные выше,
осуществляя реакцию в органическом растворителе, например алифатическом эфире, а именно этилацетате, или галогенсодержащем алифатическом углеводороде, а именно дихлорметане, возможно в присутствии минерального основания, например бикарбоната натрия, или в присутствии органического основания, например триэтиламина. В основном, реакцию осуществляют при температуре, равной 0 - 50oС, а предпочтительно, близкой 20oС.
Сложный эфир общей формулы (XII) может быть получен в соответствии со способом, описанным в E. Kamandi et coll. , Arch. Pharmaz., 308 135-141 (1975).
Ангидрид общей формулы (VII) может быть получен путем обработки агентом дегидратации, например, дициклогексилкарб-одиимидом, кислоты общей формулы (VI), осуществляемой в органическом растворителе, выбранном из простых эфиров, таких как тетрагидрофуран, диизопропиловый эфир, метил-трет-бутиловый эфир или диоксан, кетонов, таких как метилизобутилкетон, сложных эфиров, таких как этилацетат, изопропилацетат или н-бутилацетат, нитрилов, таких как ацетонитрил, алифатических углеводородов, таких как пентан, гексан, гептан, галогенсодержащих алифатических углеводородов, таких как дихлорметан или 1,2-дихлорэтан, и ароматических углеводородов, таких как бензол, толуол ксилол, этилбензол или хлорбензол, и при температуре от 0 до 30oС.
Активированная кислота общей формулы (VIII) может быть получена путем воздействия галогенида сульфурила, предпочтительно хлорида сульфурила, или соединения общей формулы
R8-CO-Z (XIII),
где R8 представляет собой алкил, содержащий от 1 до 4 атомов углерода, или фенил, возможно замещенный 1-5 атомами или радикалами, имеющими одинаковое или различное значения, выбранными из атомов галогена и радикалов нитро, метил или метокси, a Z представляет собой атом галогена, а предпочтительноатом хлора, на кислоту общей формулы (VI), осуществляемого в подходящем органическом растворителе, например в тетрагидрофуране, в присутствии органического основания, такого как трет-амин, а именно триэтиламин, и при температуре от 0 до 30oС.
Кислота общей формулы (VI) может быть также получена путем окисления соединения общей формулы
где Аr, R, R1 и R2 имеют значения, указанные выше.
Обычно окисление осуществляют с помощью периодата щелочного металла (периодата натрия) в присутствии каталитического количества соли рутения (RuCl3) и бикарбоната натрия, действуя в водно-органической среде, например в смеси ацетонитрил-тетрахлорметан-вода. В основном, реакцию осуществляют при температуре, близкой 20oС.
Соединение общей формулы (ХIV) может быть получено путем воздействия альдегида или кетона общей формулы (X), возможно в виде диалкилацеталя или сложного енольного эфира на соединение общей формулы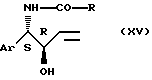
где Аr и R имеют значения, указанные выше,
осуществляемого в инертном органическом растворителе в присутствии сильной минеральной кислоты, например серной кислоты, или в присутствии органической кислоты, например пара-толуолсульфокислоты, возможно в виде соли пиридиния при температуре от 0oС до температуры кипения реакционной смеси. Особо подходящими растворителями являются ароматические углеводороды.
Соединение общей формулы (ХV) может быть получено в условиях, описанных в ЕР-А-0530385.
Сложный эфир общей формулы (IX), где Аr и R7 имеют значения, аналогичные указанным выше, a R1 представляет собой атом водорода, R2 представляет собой фенил, алкоксифенил или диалкоксифенил, может быть получен также путем циклизации соединения общей формулы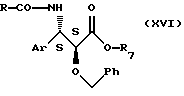
где Аr, R и R7 имеют значения, указанные выше,
Ph представляет собой фенил, алкоксифенил или диалкоксифенил,
осуществляемой предпочтительно в безводной среде в органическом растворителе, выбранном среди простых эфиров, сложных эфиров, кетонов, нитрилов, возможно галогенсодержащих алифатических углеводородов, ароматических углеводородов, возможно содержащих галоген, в присутствии агента окисления, например дихлордицианобензохинона, при температуре от 0oС до температуры кипения реакционной смеси. Предпочтительно циклизацию осуществлять в галогенсодержащем алифатическом углеводороде, например в дихлорметане или ацетонитриле, при температуре, близкой 20oС.
Циклизация приводит к образованию смеси эпимеров 2R и 2S соединения общей формулы (IX), которые могут быть разделены в соответствии с известными методиками. Особо целесообразно получение преимущественно эпимера 2R для приготовления таксола, Таксотера или их производных из соединений общей формулы (I).
Производные таксана общей формулы (I), полученные при использовании способа, согласно изобретению, могут быть превращены в таксол, в Таксотер или их аналоги в соответствии со способами, описанными в международной заявке РСТ WO 9209589, при этом, когда R1 и R2 представляют собой каждый алкил или фенилалкил с получением на промежуточной стадии соединения формулы (V), либо осуществляют обработку в кислой среде (соляная кислота, серная кислота, уксусная кислота, метансульфокислота, трифторметансульфокислота, пара-толуолсульфокислота) при использовании органического растворителя (спирт, простой эфир, сложный эфир, алифатический углеводород, галогенсодержащий алифатический углеводород, ароматический углеводород, нитрил) при температуре от -10 до 60oС, а когда R1 представляет собой атом водорода, а R2 представляет собой фенил, алкоксифенил или диалкоксифенил, с получением на промежуточной стадии соединения общей формулы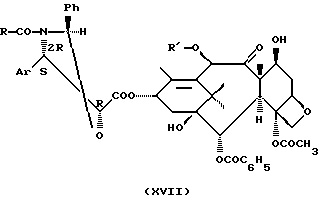
где Аr, R и Ph имеют значения, указанные выше,
а R' представляет собой атом водорода или ацетил,
после замены защитных групп R4 и возможно R3 на атомы водорода в соответствии с известной методикой.
Нижеследующие примеры иллюстрируют настоящее изобретение.
Пример 1.
В колбу емкостью 10 см3, снабженную системой магнитного перемешивания, вводят в атмосфере аргона 28 мг (0,087 ммоля) 3-трет-бутосикарбонил-2,2-диметил-4-фенил-1,3-оксазолидин-5-карбоновой-(4S, 5S) кислоты, растворенной в 1,5 см3 безводного толуола. Затем прибавляют 18 мг (0,087 ммоля) перегнанного дициклогексилкарбодиимида. Смесь оставляют для взаимодействия на 5 минут при температуре, близкой 20oС, после чего прибавляют в один прием смесь 3,5 мг (0,029 ммоля) 4-N,N-диметиламинопиридина и 26 мг (0,029 ммоля) 4-ацетокси-2α-бензоилокси-5β, 20-эпокси-1,13α-диокси-9-оксо-7β, 10β-бис-(2,2,2-трихлорэтоксикарбонилокси)-11-таксена. Смесь оставляют для взаимодействия в течение 5 минут при температуре, близкой 20oС, затем ее нагревают в течение 16 часов при температуре 72oС. После охлаждения при температуре, близкой 20oС, прибавляют 40 см3 этилацетата. Органическую фазу промывают 5 см3 дистиллированной воды, 2 раза 5 см3 насыщенного водного раствора бикарбоната натрия, затем 5 см3 насыщенного водного раствора хлорида натрия и, наконец, сушат на безводном сульфате натрия. После фильтрования и выпаривания растворителей при пониженном давлении получают остаток (твердое вещество), который очищают путем препаративной хроматографии на тонком слое двуокиси кремния, используя в качестве элюента смесь эфир-гексан-дихлорметан (5:20:75 по объему). Таким образом получают (выход 86%) 30 мг (0,025 ммоля) 3-трет-бутоксикарбонил-2,2-диметил-4-фенил-1,3-оксазолидин-5-карбоксилата-(4S, 5R)-4-ацетокси-2α-бензоилокси-5β, 20-эпокси-1-окси-9-oкco-7β, 10β-бис(2,2,2-трихлорэтоксикарбонил)окси-11-таксен-13α-ила, имеющего следующие характеристики.
Инфракрасный спектр (пленка): основные характеристические полосы поглощения при 3450, 2970, 2910, 1760, 1720, 1700, 1600, 1580, 1450, 1375, 1360, 1245, 1170, 1135, 1100, 1080, 1060, 1020, 995, 975, 960, 900, 820, 765 и 720 см1.
Спектр ядерно-магнитного резонанса протона (300 МГц, CDCl3, химический сдвиг в ррм, константы сочетания J в Гц): 1,18 (с, 12Н); 1,27 (с, 3Н); 1,6-2,0 (м, 1Н); 1,76 (с, 3Н); 1,81 (с, 3Н); 1,83 (с, 3Н); 1,95 (с, 3Н); 2,05 (с, 3Н),2,20 (д, J=9, 2Н); 2,55-2,65 (м, 1Н); 3,90 (д, J=7, 1Н); 4,20 (ABq, JAB= 8,5 δA-δB = 47,2, 2Н); 4,47 (д, J=6,4, 1H); 4,75 (ABq, JAB=12 δA-δB = 92,2, 2Н); 4,78 (с, 2Н); 4,91 (д, J = 12, 1H); 5,12 (с, широкий, 1Н); 5,58 (дд, J=7,1 и 10,6, 1Н); 5,67 (д, J=7, 1Н); 6,25(с, 1Н); 6,28 (т, J= 9, 1Н); 7,2-7,4 (м, 5Н ароматические); 7,47-7,52 (м, 2Н ароматические); 7,61-7,66 (м, 1Н ароматические); 8,03-8,05 (м, 2Н ароматические).
Масс-спектр (FАВ (+)-матрица NВА) молекулярный ион (массив): M+ (1198).
3-трет-Бутоксикарбонил-2,2-диметил-4-фенил-1,3-оксазолидин-5-карбоновая-(4S,5S) кислота может быть получена следующим образом.
В колбу емкостью 25 см3, снабженную системой магнитного перемешивания, последовательно вводят 40 мг (0,12 ммоля) 3-трет-бутоксикарбонил-2,2-диметил-4-фенил-5-метоксикарбонил-1,3-оксазолидина (4S, 5S), 5 см3 метанола, 2 см3 дистиллированной воды и 50 мг (0,36 ммоля) твердого карбоната калия. Реакционную смесь перемешивают в течение 40 часов при температуре, близкой 20oС, затем выпаривают метанол при пониженном давлении. Прибавляют 13 см3 воды, затем полученную водную фазу трижды промывают 20 см3 этилового эфира. Основную водную фазу охлаждают до 0oС, затем подкисляют в присутствии 20 см3 дихлорметана при сильном перемешивании путем прибавления 2М водного раствора соляной кислоты. Органическую фазу отделяют путем декантации, после чего водную фазу экстрагируют 6 раз с помощью 30 см3 дихлорметана. Собранные органические фазы промывают 3 раза 5 см3 дистиллированной воды, затем 1 раз 5 см3 насыщенного водного раствора хлорида натрия, после чего, наконец, сушат на безводном сульфате магния. После фильтрования и концентрирования насухо при пониженном давлении получают (выход 99%) 38 мг (0,12 ммоля) 3-трет-бутоксикарбонил-2,2-диметил-4-фенил-1,3-оксазолидин-5-карбоновой-(4S, 5R) кислоты, имеющей следующие характеристики.
Инфракрасный спектр (пленка): основные характеристические полосы поглощения при 3650-2200, 2970, 2920, 1760, 1740, 1700, 1470, 1450, 1370, 1250, 1215, 1165, 1135, 1110, 1065, 875 и 690 см-1.
Спектр ядерно-магнитного резонанса протона (200 МГц, СDСl3, химический сдвиг в ррм, константы сочетания J в Гц): 1,20 (осн.) и 1,43 (неосн.) (2с, широкие, 9Н), 1,64 (с, 3Н); 1,94 (с, 3Н); 3,0 (с, очень широкий, 1Н); 4,97 (д, искаженный, J=7, 1Н); 5,0-5,25 (м, 1Н); 7,2-7,4 (м, 5Н ароматические).
Масс-спектр (i. c. NН3 + изобутан): 339 (МН+), 322 (МН+-ОН), 283, 266, 222, 206, 158, 124, 110.
3-трет-Бутоксикарбонил-2,2-диметил-4-фенил-5-метоксикарбонил-1,3-оксазолидин (4S, 5S) может быть получен следующим образом.
В колбу емкостью 10 см3, снабженную системой магнитного перемешивания, вводят в атмосфере аргона 147,5 мг (0,50 ммоля) метил-3-трет-бутоксикарбониламино-3-фенил-2-оксипропионата-(2S, 3S) и 2,5 см3 безводного толуола. Затем к полученной суспензии прибавляют 10 гранул цеолита размером  188,5 мкл (144,2 мг, 2,0 ммоля) 2-метоксипропилена и 12,5 мг (0,05 ммоля) пара-толуолсульфоната пиридиния. Реакционную смесь оставляют в течение 1 часа при температуре, близкой 20oС, после чего нагревают до 120oС и оставляют для взаимодействия на 2 часа. Реакционную смесь, которая приобретает темно-коричневый цвет, охлаждают при температуре, близкой 20oС. Прибавляют 60 см3 дихлорметана. Органическую фазу промывают 5 см3 насыщенного водного раствора бикарбоната натрия, 3 раза 5 см3 воды, а затем 1 раз 5 см3 водного насыщенного раствора хлорида натрия. Органическую фазу сушат на безводном сульфате натрия. После фильтрования и концентрирования насухо при пониженном давлении получают остаток, который подвергают хроматографии на колонке с силикагелем, используя в качестве элюента смесь этиловый эфир-гексан (15:85 по объему). Получают (выход 36%) 60 мг (0,18 ммоля) 3-трет-бутоксикарбонил-2,2-диметил-4-фенил-5-метоксикарбонил-1,3-оксазолидина-(4S,5S), имеющего следующие характеристики.
188,5 мкл (144,2 мг, 2,0 ммоля) 2-метоксипропилена и 12,5 мг (0,05 ммоля) пара-толуолсульфоната пиридиния. Реакционную смесь оставляют в течение 1 часа при температуре, близкой 20oС, после чего нагревают до 120oС и оставляют для взаимодействия на 2 часа. Реакционную смесь, которая приобретает темно-коричневый цвет, охлаждают при температуре, близкой 20oС. Прибавляют 60 см3 дихлорметана. Органическую фазу промывают 5 см3 насыщенного водного раствора бикарбоната натрия, 3 раза 5 см3 воды, а затем 1 раз 5 см3 водного насыщенного раствора хлорида натрия. Органическую фазу сушат на безводном сульфате натрия. После фильтрования и концентрирования насухо при пониженном давлении получают остаток, который подвергают хроматографии на колонке с силикагелем, используя в качестве элюента смесь этиловый эфир-гексан (15:85 по объему). Получают (выход 36%) 60 мг (0,18 ммоля) 3-трет-бутоксикарбонил-2,2-диметил-4-фенил-5-метоксикарбонил-1,3-оксазолидина-(4S,5S), имеющего следующие характеристики.
Инфракрасный спектр (пленка): основные характеристические полосы поглощения при 3060, 3025, 2975, 2920, 1775, 1740, 1700, 1490, 1480, 1450, 1440, 1365, 1250, 1210, 1165, 1110, 1070, 1050, 1030, 890, 760, 720 и 695 cм-1.
Спектр ядерно-магнитного резонанса протона (200 МГц, СDCl3, химический сдвиг в ррм, константы сочетания J в Гц): 1,20 (макс.) и 1,43 (мин.) (2с, широкие, 9Н); 1,63 (с, 3Н); 1,90 (мин) и 1,95 (макс.) (2с, широкие, 3Н); 3,32 (с, 3Н); 4,95-5,20 (м, 1Н); 4,97 (д, искаженный, J=7, 1Н); 7,15-7,40 (м, 5Н ароматические).
Масс-спектр (i. c. , NH3 + изобутан): 353 (М+NH4 +); 336 (МН+); 320 (M+-CH3); 297; 280; 239; 236; 222; 220.
Метил-3-трет-бутоксикарбониламино-3-фенил-2-оксипропионат-(2S, 3S) может быть получен следующим образом.
К суспензии 6,5 г фенилглицидата-(2S,3R)-α-метилбензиламина в 20 см3 толуола и 10 см3 воды прибавляют в течение 5 минут водный 4 н. pacтвоp гидроксида натрия. После 2 часов перемешивания при температуре, близкой 20oС, отделившуюся водную фазу экстрагируют 2 раза 7 см3 толуола. Водную фазу вводят в автоклав. После прибавления 97,5 см3 32%-ного водного раствора гидроксида аммония и 1,22 г хлорида аммония автоклав закрывают, затем нагревают при перемешивании в течение 6 часов при температуре 60oС (автогенное давление 3 бара). После охлаждения до температуры, близкой 20oС, прибавляют 6 см3 водного 4 н. раствора гидроксида натрия. В течение 30 минут осуществляют перемешивание, затем удаляют аммиак при пониженном давлении, после чего концентрируют досуха при пониженном давлении (45 мм рт.ст., 6 кПа) при температуре 45oС. Полученный остаток растворяют в 75 см3 метанола. К образованной суспензии прибавляют в течение 35 минут при температуре 20oС метанольный раствор серной кислоты, образованный 4,83 г концентрированной серной кислоты в 20 см3 метанола. Реакционную смесь нагревают при температуре 50oС в течение 3 часов 30 минут. После охлаждения до 0oС прибавляют раствор 27 г карбоната натрия в 20 см3 воды. После прекращения выделения углекислого газа реакционную смесь охлаждают до 23oС в течение 30 минут. Затем в течение 30 минут прибавляют раствор 6,1 г ди-трет-бутилкарбоната в 7 см3 метанола. В течение 4 часов перемешивают, а затем, после выпаривания 50 см3 метанола, прибавляют 60 см3 воды, затем выпаривают весь метанол. Соединение, выпавшее в осадок, отделяют фильтрованием, затем промывают его 2 раза 25 см3 воды и сушат до постоянного веса. Таким образом получают (выход 30%) 2 г метил 3-трет- бутоксикарбониламино-3-фенил-2-оксипропионата-(2S,3S), имеющего следующие характеристики: точка плавления 135,5-136oС; вращающая способность: [α] D25 = +29,6o (с = 0,5, хлороформ).
Инфракрасный спектр (пленка): основные характеристические полосы поглощения при 3380, 3350, 3000, 2970, 2930, 1720, 1690, 1510, 1435, 1385, 1360, 1310, 1285, 1230, 1205, 1170, 1105, 1005, 860, 770, 750, 730 и 690 см-1.
Спектр ядерно-магнитного резонанса протона (200 МГц, СDС13, химический сдвиг в ррм, константы сочетания J в Гц): 1,43 (с, 9Н); 2,84 (д, J=7, 1H); 3,71 (с, 3Н); 4,60 (дд, J=3,5 и 7, 1H); 5,10 (д искажен., J=8, 1Н); 7,20-7,37 (м, 5Н аромат.).
Спектр ядерно-магнитного резонанса протона (360 МГц, DМСО-d6, 298oК, химический сдвиг в ррм, константы сочетания J в Гц): 1,31 (с широкий, 9Н); 3,55 (с, 3Н), 4,14 (д, J=7,7, 1H); 4,71 (дд, 1H); 5,65 (с широкий, 1H); 7,18 (д, J=7, 1H); 7,15-7,3 (м, 5Н).
Пример 2.
В одногорлую колбу емкостью 5 см3, снабженную системой магнитного перемешивания, вводят 9 мг (0,028 ммоля) 3-бензоил-2,2-диметил-4-фенил-1,3-оксазолидин-5-карбоновой-(4S, 5S) кислоты, растворенной в 0,46 см3 безводного толуола. Затем прибавляют 5,7 мг (0,028 ммоля) дициклогексилкарбодиимида. Реакционную смесь, ставшую мутной, оставляют для реагирования в течение 5 минут при температуре, близкой 20oС, затем добавляют смесь 6,4 мг (0,009 ммоля) 4,10β-диацетокси-2α-бензоилокси-5β,20-эпокси-1,13α-диокси-9-оксо-7β-триэтилсилилокси-11-таксена и 1,1 мг (0,009 ммоля) 4-N,N-диметиламинопиридина. Реакционную смесь оставляют для реагирования в течение 5 минут при температуре, близкой 20oС, затем нагревают ее в течение 16 часов при 72oС. После охлаждения до температуры, близкой 20oС, реакционную смесь разбвляют, прибавляя к ней 40 см3 этилацетата. Органическую фазу промывают 2 раза 5 см3 водного насыщенного раствора бикарбоната натрия, 3 раза 5 см3 воды, а затем 1 раз 5 см3 водного насыщенного раствора хлорида натрия и, наконец, сушат на безводном сульфате натрия. После фильтрования и удаления растворителей при пониженном давлении полученный остаток (21 мг) очищают путем хроматографии на тонком слое двуокиси кремния, используя в качестве элюента смесь этиловый эфир-дихлорметан (8: 92 по объему). Хроматографию осуществляют дважды. Таким образом получают (выход 91%) 8,4 мг (0,008 ммоля) 3-бензоил-2,2-диметил-4-фенил-1,3-оксазолидин-5-карбоксилат-(4S, 5R)-4,10β-диацетокси-2α-бензоилокси-5β,20-эпокси-1-окси-9-оксо-7β-триэтилсилилокси-11-таксен-13α-ила, имеющего следующие характеристики.
Инфракрасный спектр (пленка): характеристические основные полосы поглощения при 3400, 2930, 2850, 1730, 1720, 1630, 1590, 1570, 1440, 1360, 1340, 1230, 1195, 1065, 1015, 1005, 980 и 810 см-1.
Спектр ядерно-магнитного резонанса протона (400 МГц, СDС13, химический сдвиг в ррм, константы сочетания J в Гц): 0,54-0,61 (м, 6Н), 0,92 (т, J=8, 9Н); 1,20 (с, 3Н); 1,22 (с, 3Н), 1,65 (с, 3Н), 1,86 (с, 3Н); 1,93 (с, широкий, 3Н); 2,00 (с, 3Н); 2,08 (с, 3Н); 2,19 (с, 3Н); 1,82-2,15 (м, 3Н); 2,46-2,54 (м, 1Н); 3,77 (д, J=7,2, 1Н); 4,16 (АВq JAB=8,4, δA-δB = 59,4, 2H); 4,46(дд, J= 6,6 и 10,5, 1Н); 4,56 (д, J=6,8, 1Н); 4,88 (д, J= 8, 1H); 5,27 (д, J= 6, 1H); 5,64 (д, J=7,2, 1H); 6,24 (т, J= 9, 1H); 6,45 (с, 2Н); 6,94 (с широкий, 2Н ароматич.); 7,11-7,26 (м, 8Н ароматич.); 7,44-7,48 (м, 2Н ароматич.); 7,59-7,61 (м, 1H, ароматич.); 8,00-8,02 (м, 2Н ароматич.).
Спектр магнитного резонанса 13С (100 МГц, СDC13): 5,20, 6,69, 9,99, 14,26, 20,82, 21,07, 21,62, 26,42, 35,27, 37,04, 43,18, 46,69, 58,28, 65,97, 71,68, 72,06, 74,79, 74,85, 76,32, 78,93, 80,74, 84,09, 93,43, 102,65, 126,11, 126,86, 127,83, 128,02, 128,50, 128,69, 129,14, 129,43, 130,00, 133,67, 133,82, 138,81, 139,90, 166,93, 169,13, 169,85, 201,60.
Масс-спектр (FAB (+)-матрица NBA+KC1): 1046, 1008 (МН+), 948, 930.
3-Бензоил-2,2-диметил-4-фенил-1,3-оксазолидин-5-карбоновая-(4S, 5S) кислота может быть получена следующим образом.
В одногорлую колбу емкостью 2 см3, снабженную системой магнитного перемешивания, вводят 12,5 мг (0,04 ммоля) 5-винил-3-бензоил-2,2-диметил-4-фенил-1,3-оксазолидина-(4S, 5R), растворенного в 80 мкл ацетонитрила. Затем последовательно прибавляют 80 мкл тетрахлорметана, 120 мкл воды и 22 мг (0,26 ммоля) чистого бикарбоната натрия. Затем при интенсивном перемешивании в реакционную смесь вводят маленькими дозами 47 мг (0,22 ммоля) периодата натрия. Реакционную массу оставляют для взаимодействия на 5 минут при температуре, близкой 20oС, после чего прибавляют в один прием 2,4 мг трихлорида рутения. Образующуюся гетерогенную смесь черного цвета интенсивно перемешивают при температуре 20oС в течение 72 часов.
Реакционную смесь разбавляют 10 см3 воды. Полученную основную органическую фазу промывают 3 раза 10 см3 простого эфира. Основную водную фазу охлаждают до 0oС, затем подкисляют при интенсивном перемешивании и в присутствии 20 см3 дихлорметана с помощью водного 2М раствора соляной кислоты до рН=1. После декантации кислую водную фазу экстрагируют 6 раз 15 см3 дихлорметана. Собранную органическую фазу промывают 3 раза 5 см3 воды, затем 1 раз 5 см3 водного насыщенного раствора хлорида натрия. После высушивания на безводном сульфате натрия и фильтрования органическую фазу концентрируют досуха при пониженном давлении. Таким образом получают (выход 77%) 10,0 мг (0,031 ммоля) 3-бензоил-2,2-диметил-4-фенил-1,3-оксазолидин-5-карбоновой-(4S,5S) кислоты, имеющей следующие характеристики.
Инфракрасный спектр (пленка): характеристические основные полосы поглощения при 3700-2300, 2970, 2940, 2930, 2900, 2825, 1740, 1600, 1590, 1570, 1420-1400, 1370, 1360, 1190, 1180, 1150, 1120, 1090 и 855 см-1.
Спектр ядерно-магнитного резонанса протона (200 МГц, СDС13, химический сдвиг в ррм): 1,81 (с, 3Н); 2,11 (с, 3Н); 4,90-5,06 (м, 2Н); 6,78-6,93 (м, 4Н ароматич.); 7,07-7,30 (м, 6Н ароматич.).
5-Винил-3-бензоил-2,2-диметил-4-фенил-1,3-оксазолидин-(4S,5R) может быть получен следующим образом.
В одногорлую колбу емкостью 10 см3, снабженную системой магнитного перемешивания и холодильником, вводят в атмосфере аргона 32 мг (0,12 ммоля) 1-фенил-1-бензоиламино-2-окси-3-бутена-(1S, 2R) в виде суспензии в 0,64 см3 безводного толуола. Затем прибавляют 226 мкл (173 мг, 2,4 ммоля) 2-метоксипропилена, 6,0 мг (0,024 ммоля) пара-толуолсульфоната пиридиния и 8 гранул цеолита размером  Образующуюся реакционную смесь оставляют для взаимодействия при температуре, близкой 15oС, в течение 2,5 часов, затем осуществляют ее нагревание до 100oС в течение 2 часов. После охлаждения до температуры, близкой 15oС, реакционную смесь разбавляют 40 см3 дихлорметана. Органическую фазу промывают 1 раз 5 см3 насыщенного раствора бикарбоната натрия, 3 раза 5 см3 воды и 1 раз водным насыщенным раствором хлорида натрия, затем высушивают на безводном сульфате натрия. После фильтрования и концентрирования насухо при пониженном давлении полученный остаток очищают путем хроматографии на силикагеле, используя в качестве элюента первый раз смесь этиловый эфир-дихлорметан (2: 98 по объему), а затем смесь этилацетат-гексан (10: 90 по объему). Таким образом получают (выход 38%) 14 мг (0,0456 ммоля) 5-винил-3-бензоил-2,2-диметил-4-фенил-1,3-оксазолидина-(4S, 5R), имеющего следующие характеристики.
Образующуюся реакционную смесь оставляют для взаимодействия при температуре, близкой 15oС, в течение 2,5 часов, затем осуществляют ее нагревание до 100oС в течение 2 часов. После охлаждения до температуры, близкой 15oС, реакционную смесь разбавляют 40 см3 дихлорметана. Органическую фазу промывают 1 раз 5 см3 насыщенного раствора бикарбоната натрия, 3 раза 5 см3 воды и 1 раз водным насыщенным раствором хлорида натрия, затем высушивают на безводном сульфате натрия. После фильтрования и концентрирования насухо при пониженном давлении полученный остаток очищают путем хроматографии на силикагеле, используя в качестве элюента первый раз смесь этиловый эфир-дихлорметан (2: 98 по объему), а затем смесь этилацетат-гексан (10: 90 по объему). Таким образом получают (выход 38%) 14 мг (0,0456 ммоля) 5-винил-3-бензоил-2,2-диметил-4-фенил-1,3-оксазолидина-(4S, 5R), имеющего следующие характеристики.
Инфракрасный спектр (пленка): характеристические основные полосы поглощения при 3050, 3010, 2980, 2920, 1635, 1595, 1570, 1490, 1385, 1370, 1355, 1245, 1215, 1145, 1065, 1030, 1020, 935, 850 и 690 см-1.
Спектр ядерно-магнитного резонанса протона (400 МГц, СDС13, химический сдвиг в ррм, константы сочетания J в Гц):
1,78 (с, 3Н); 2,01 (с, 3Н); 4,59 (д, J= 6,4, 1Н); 4,79 (pst, J=6,4, 1Н); 4,97-5,10 (м, 2Н); 5,21-5,26 (м, 1Н); 6,78-6,94 (м, 4Н ароматич.); 7,04-7,30 (м, 6Н ароматич.).
Пример 3.
В одногорлую колбу емкостью 5 см3, снабженную системой магнитного перемешивания, вводят в атмосфере аргона 23 мг (0,058 ммоля) 3-трет-бутоксикарбонил-2-(4-метоксифенил)-4-фенил-1,3-оксазолидин-5-карбоновой-(2R, 4S, 5S) кислоты в 1 см3 безводного толуола, затем прибавляют 11,9 мг (0,058 ммоля) дициклогексилкарбодиимида. Реакционную массу оставляют для взаимодействия в течение 5 минут при температуре, близкой 25oС, затем прибавляют смесь 2,3 мг (0,019 ммоля) 4-N, N -диметиламинопиридина и 17 мг (0,019 ммоля) 4-ацетокси-2α-бензилокси-5β, 20-эпокси-1,13α-диокси-9-оксо-7β,10β-бис-(2,2,2-трихлорэтоксикарбонилокси)-11-таксена. Реакционную массу оставляют для реагирования на 5 минут при температуре 25oС, после чего нагревают в течение 24 часов при температуре 74oС. После выпаривания толуола при пониженном давлении полученный остаток (74 мг) очищают путем хроматографии на тонком слое силикагеля, используя в качестве элюента смесь этиловый эфир-дихлорметан (5: 95 по объему). Таким образом получают 23,4 мг (0,012 ммоля) 3-трет-бутоксикарбонил-2-(4-метоксифенил)-4-фенил-1,3-оксазолидин-5-карбоксилат-(2R, 4S, 5R)-4-ацетокси-2α-бензоилокси-5β,20-эпокси-1-окси-9-оксо-7β,10β-бис-(2,2,2-трихлорэтоксикарбонилокси)-11-таксен-13α-ила, загрязненного 15% 3-трет-бутоксикарбонил-2-(4-метоксифенил)-4-фенил-1,3-окса-золидин-5-карбоксилат-(2R, 4S, 5S)-4-ацетокси-2α-бензоилокси-5β, 20-эпокси-1-окси-9-оксо-7β, 10β-бис-(2,2,2-трихлорэтоксикарбонилокси)-11-таксен-13α-ила.
3-трет-Бутоксикарбонил-2-(4-метоксифенил)-4-фенил-1,3-оксазолидин-5-карбоксилат-(2R, 4S, 5R)-4-ацетокси-2α-бензоилокси-5β,20-эпокси-1-окси-9-оксо-7β, 10β-бис-(2,2,2-трихлорэтоксикарбонилокси)-11-таксен-13α-ил имеет следующие характеристики: точка плавления 164-167oС.
Инфракрасный спектр (пленка): характеристические основные полосы поглощения при 3500, 2950, 2900, 1760, 1730, 1720, 1700, 1605, 1580, 1505, 1380, 1375, 1360, 1240, 1140, 1060, 815, 760 и 710 см-1.
Спектр ядерно-магнитного резонанса протона (500 МГц, СDС13, химический сдвиг в ррм, константы сочетания J в Гц): 1,05 (с, 9Н); 1,16 (с, 3Н); 1,24 (с, 3Н); 1,64 (с, 3Н); 1,80 (с, 3Н); 1,85 (с, шир., 3Н); 1,98-2,05 (м, 1H), 2,07-2,14 (м, 1Н); 2,18-2,26 (м, 1Н); 2,53-2,64 (м, 1H); 3,81 (д, J=7,0, 1H); 3,82 (с, 3Н); 4,18 (АBq, JAВ =8,5, δA-δB = 80,7, 2Н); 4,58 (с, 1Н); 4,74 (ABq, JAB= 11,8, δA-δB = 150,6, 2Н); 4,77 (ABq, JAв=11,8 δA-δB = 7,7, 2Н); 4,88 (д искаж., J=9,3, 1Н); 5,41 (с, шир., 1Н), 5,50 (дд, J=7,2 и 10,7, 1H); 5,64 (д, J=7,0, 1Н); 6,10 (т, J=8,8, 1H); 6,14 (с, 1H); 6,40 (с, шир., 1H); 6,93 (д, J=8,8, 2Н ароматич.); 7,26-7,44 (м, 7Н ароматич.); 7,48-7,52 (м, 2Н ароматич.); 7,62-7,65 (м, 1H ароматич.); 8,01-8,03 (м, 2Н ароматич.).
В одногорлую колбу емкостью 5 см3, снабженную системой магнитного перемешивания, вводят 13 мг (0,01 ммоля) сложного эфира, полученного выше (смесь двух эпимеров), в растворе в 0,75 см3 метанола, затем прибавляют 0,75 см3 ледяной
уксусной кислоты. Содержимое колбы нагревают при температуре 65oС в течение 5 минут, после чего прибавляют 65 мг ассоциации цинк-медь (полученной из 20 г цинка и 3 г моногидратного сульфата меди). Гетерогенную смесь черного цвета перемешивают при 65oС в течение 30 минут. После охлаждения до температуры, близкой 25oС, реакционную смесь разбавляют 30 см3 дихлорметана. Осуществляют фильтрование на целите, затем промывание твердого вещества 3 раза 10 см3 дихлорметана. Растворители удаляют при пониженном давлении. Полученный остаток очищают путем хроматографии на тонком слое силикагеля, используя в качестве элюента смесь метанол-дихлорметан (5:95 по объему). Таким образом получают (выход 60%) 5,6 мг (0,006 ммоля)3-трет-бутоксикарбонил-2-(4-метоксифенил)-4-фенил-1,3-оксазолидин-5-карбоксилат-(2R, 4S, 5R)-4-ацетокси-2α-бензоилокси-5β, 20-эпокси-9-оксо-1,7β, 10β - триокси-11-таксен-13α-ила, загрязненного 15-20% 3-трет-бутоксикарбонил-2-(4-метоксифенил)-4-фенил-1,3-оксазолидин-5-карбоксилат-(2R, 4S, 5S)-4-ацетокси-2α-бензоилокси-5β,20-эпокси-9-оксо-1,7β, 10β-триокси-11-таксен-13α-ила.
3-трет-Бутоксикарбонил-2-(4-метоксифенил)-4-фенил-1,3-оксазолидин-5-карбоксилат-(2R, 4S, 5R)-4-ацетокси-2α-бензоилокси-5β,20-эпокси-9-оксо-1,7β, 10β-триокси-11-таксен-13α-ил имеет следующие характеристики.
Инфракрасный спектр (пленка): характеристические полосы поглощения при 3430, 2960, 2880, 2840, 1730, 1720, 1700, 1685, 1605, 1580, 1505, 1440, 1380, 1360, 1340, 1265, 1240, 1170, 1130, 1060, 1015, 975, 905, 720 и 695 см-1.
Спектр ядерно-магнитного резонанса протона (400 МГц, СDС13, химический сдвиг в ррм, константы сочетания J в Гц): 1,05 (с, 9Н), 1,09 (с, 3Н); 1,20 (с, 3Н); 1,57 (с, 3Н); 1,70 (с, 3Н); 1,73-1,90 (м, 1Н); 1,85 (с шир., 3Н); 2,02-2,19 (м, 2Н); 2,47-2,60 (м, 1Н); 3,81 (д, J=7, 1H); 3,82 (с, 3Н); 4,15 (д, J=1,5, 1Н); 4,18 (АВq, JAB=8,5, δA-δB = 55,6, 2H); 4,56 (д, J=5,0, 1H); 4,87 (дд искажен. , J=8, 1Н); 5,10 (д, J=1,5, 1H); 5,42 (с шир., 1Н); 5,62 (д, J=4, 1H); 6,13 (т, J=8, 1H); 6,39 (с шир., 1H); 6,92 (м, 2Н ароматич.), 7,30-7,44 (м, 7Н ароматич.); 7,47-7,51 (м, 2Н ароматич.); 7,59-7,64 (м, 1H ароматич.); 8,01-8,05 (м, 2Н ароматич.).
Масс-спектр (FAB (+)-матрица NВА + КС1): 1276 (М+).
Элементарный анализ (C57H61O19NCl6):
Вычислено, %: С 53,62, Н 4,81, N 1,10.
Найдено, %: С 53,22, Н 4,82, N 1,16.
В одногорлую колбу емкостью 5 см3, снабженную магнитным перемешивателем, вводят 4,4 мг (0,0047 ммоля) соединения, полученного выше. Содержимое колбы охлаждают до 0oС, затем прибавляют 64 мкл раствора этилацетата, содержащего 0,28 мкл 33%-ной соляной кислоты. Образовавшуюся гомогенную смесь оставляют для реагирования в течение 5 минут при температуре 0oС, а затем в течение 5 часов при температуре, близкой 25oС. Реакционную смесь разбавляют 20 см3 этилацетата, после чего обрабатывают органическую фазу 5 см3 водного насыщенного раствора бикарбоната натрия. Органическую фазу, отделенную путем декантации, промывают 3 раза 5 см3 воды и 1 раз 5 см3 водного насыщенного раствора хлорида натрия, после чего сушат на безводном сульфате натрия. После фильтрования и концентрирования досуха при пониженном давлении полученный остаток очищают путем хроматографии на тонком слое силикагеля, используя в качестве элюента смесь метанол-дихлорметан (5:95 по объему). Таким образом получают (выход 78%) 3,0 мг (0,0037 ммоля) чистого 3-трет-бутоксикарбониламино-3-фенил-2-оксипропионат-(2R, 3S)-4-ацетокси-2α-бензоилокси-5β, 20-эпокси-9-оксо-1,7β,10β-триокси-11-таксен-13α-ила (или Таксотера), который не содержит никаких следов 3-трет-бутоксикарбониламино-3-фенил-2-оксипропионат-(2S,3S)-4-ацетокси-2α-бензоилокси-5β,20-эпокси-9-оксо-1,7β, 10β-триокси-12-таксен-13α-ила.
Рекуперируют 0,8 мг (0,0009 ммоля) 3-трет-бутоксикаронил-2-(4-метоксифенил)-4-фенил-1,3-оксазолидин-5-карбоксилат-(2R, 4S, 5S)-4-ацетокси-2α-бензоилокси-5β, 20-эпокси-9-оксо-1,7β, 10β-триокси-11-таксен-13α-ила,
у которого не удалены защитные группы в используемых условиях.
Полученный таким образом Таксотер имеет следующие характеристики.
Инфракрасный спектр (пленка): основные характеристические полосы поглощения при 3450, 3100, 3050, 2950, 2920, 2890, 2850, 1730, 1710, 1600, 1580, 1490, 1450, 1390, 1370, 1315, 1270, 1245, 1160, 1105, 1095, 1070, 1020, 980, 910, 730 и 710 см-1.
Спектр ядерно-магнитного резонанса протона (300 МГц, СDС13, химический сдвиг в ррм, константы сочетания J в Гц): 1,13 (с, 3Н); 1,24 (с, 3Н); 1,34 (с, 9Н); 1,76 (с, 3Н); 1,85 (с, 3Н); 1,74-1,85 (м, 1Н); 2,26-2,29 (м, 2Н); 2,37 (с, 3Н); 2,54-2,66 (м, 1Н); 3,31 (д искажен., J=4,4, 1Н); 3,92 (д, J=7, 1Н), 4,18-4,30 (м, 1Н), 4,18 (с, 1Н), 4,25 (ABq, JAв=8,3, δA-δB = 35,3, 2Н), 4,62 (с шир., 1Н), 4,94 (д, J= 8,5, 1H), 5,20 (с, 1Н), 5,26 (с, шир., искажен., 1Н), 5,41 (д, искажен., J=9,4, 1H), 5,68 (д, J=7, 1H), 6,21 (т, J=8,0 и 8,8, 1H), 7,31-7,40 (м, 5Н ароматич.), 7,47-7,52 (м, 2Н ароматич.), 7,59-7,64 (м, 1H ароматич.), 8,09-8,12 (м, 2Н ароматич.).
3-трет-Бутоксикарбонил-2-(4-метоксифенил)-4-фенил-1,3-оксазолидин-5-карбоновая-(2R, 4S, 5S) кислота может быть получена следующим образом.
В колбу емкостью 50 см3, снабженную системой магнитного перемешивания, вводят в атмосфере аргона 33 мг (0,08 ммоля) 3-трет-бутоксикарбонил-2-(4-метоксифенил)-4-фенил-5-метоксикарбонил-1,3-оксазолидина-(2R, 4S, 5S) в виде суспензии в 15 см3 метанола. Затем прибавляют 5 см3 воды и 33 мг (0,24 ммоля) карбоната калия. Содержимое колбы оставляют для реагирования в течение 96 часов при температуре, близкой 25oС. Реакционная смесь становится гомогенной. При пониженном давлении удаляют метанол. Основную водную фазу разбавляют 10 см3 воды, затем экстрагируют 3 раза 15 см3 эфира. Водную фазу охлаждают до 0oС, затем подкисляют в режиме интенсивного перемешивания в присутствии 20 см3 дихлорметана с помощью водного 4М раствора соляной кислоты до рН ниже 1. Кислую водную фазу экстрагируют 8 раз 20 см3 дихлорметана. Собранную органическую фазу промывают 3 раза 5 см3 воды, затем 1 раз 5 см3 водного насыщенного раствора хлорида натрия. Органическую фазу сушат на безводном сульфате натрия. После фильтрования и концентрирования насухо при пониженном давлении получают (выход 94%) 30,0 мг (0,075 ммоля) 3-трет-бутоксикарбонил-2-(4-метоксифенил)-4-фенил-1,3-оксазолидин-5-карбоновой-(2R, 4S, 5S) кислоты, имеющей следующие характеристики: точка плавления 148,5-150,5oС; вращающая способность [α]D25 = +46,4o (с=1,0, хлороформ).
Инфракрасный спектр (пленка): характеристические основные полосы поглощения при 3700-2300, 2950, 2900, 2820, 1755, 1700, 1605, 1580, 1505, 1385, 1360, 1300, 1285, 1240, 1215, 1165, 1130, 1075, 1065, 1020, 930, 850, 820 и 685 см-1.
Спектр ядерно-магнитного резонанса протона в форме 2 ротамеров (200 МГц, СDСl3), химический сдвиг в ррм, константы сочетания J в Гц): 1,11 (с, 9Н); 3,82 (с, 3Н); 4,2 (с очень шир., 1Н); 4,99 (д, J=6,4, 1Н); 5,18 (осн. д искажен., J=6,4) и 5,36 (неосн. с шир., 1Н); 6,46 (неосн.) и 6,66 (осн. с, 2Н); 6,94 (д, J=8,6, 2Н ароматич.); 7,20-7,46 (м, 7Н ароматич.).
Масс-спектр (i. c. NH3 + изобутан): 417 (МН++NН3), 400 (МН+), 361, 344, 300, 264, 225, 192, 177, 137.
3-трет-Бутоксикарбонил-2-(4-метоксифенил)-4-фенил-5-метоксикарбонил-1,3-оксазолидин-(2R, 4S, 5S) может быть получен согласно одной из следующих методик.
1) В одногорлую колбу емкостью 2 см3, снабженную системой магнитного перемешивания, вводят в атмосфере аргона 10 мг (0,034 ммоля) метил-3-трет-бутоксикарбонил-3-фенил-2-оксипропионата-(2S,3S) в виде суспензии в 0,5 см3 безводного толуола. Затем прибавляют 1 мг (0,004 ммоля) пара-толуолсульфонатпиридиния. Образующуюся реакционную смесь нагревают при температуре 115oС. Через 5 минут выдерживания при этой температуре прибавляют 13 мкл (13,9 мг, 0,076 ммоля) пара-метоксибензальдегиддиметилацеталя. Реакционную смесь, ставшую гомогенной, нагревают при рефлюксе растворителя в течение 5 минут. После охлаждения до температуры, близкой 20oС, реакционную смесь разбавляют 30 см3 дихлорметана. Органическую фазу обрабатывают 1 раз 5 см3 водного насыщенного раствора бикарбоната натрия, затем промывают 2 раза 5 см3 воды и 1 раз 5 см3 водного насыщенного раствора хлорида натрия. После высушивания на безводном сульфате натрия, фильтрования и концентрирования насухо при пониженном давлении полученный остаток очищают путем хроматографии на тонком слое силикагеля, используя в качестве элюента смесь этиловый эфир-гексан (6: 4 по объему). Таким образом получают 13,9 мг (0,0336 ммоля) смеси 3-трет-бутоксикарбонил-2-(4-метоксифенил)-4-фенил-5-метоксикарбонил-1,3-оксазолидина-(2R, 4S,5S) и 3-трет-бутоксикарбонил-2-(4-метоксифенил)-4-фенил-5-метоксикарбонил-1,3-оксазолидина-(2S, 4S, 5S) в соотношении 40/60. Общий выход составляет 99%.
Эти сложные эфиры могут быть разделены путем хроматографии на колонке с силикагелем, используя в качестве элюента смесь этиловый эфир-гексан (2:8 по объему).
3-трет-Бутоксикарбонил-2-(4-метоксифенил)-4-фенил-5-метоксикарбонил-1,3-оксазолидин-(2R, 4S, 5S) имеет следующие характеристики:
точка плавления 208-208,5oС;
вращающая способность [α]D25=+53o (с=1,1, хлороформ).
Инфракрасный спектр (пленка): 2950, 1725, 1680, 1600, 1575, 1500, 1380, 1350, 1280, 1260, 1240, 1200, 1160, 1120, 1065, 1050, 1030 и 1010 см-1.
Спектр ядерно-магнитного резонанса протона в форме 2 ротамеров (200 МГц, СDС13, химический сдвиг в ррм, константы сочетания J в Гц): 1,12 (с, 9Н) ; 3,32 (с, 3Н), 3,82 (с, 3Н); 5,00 (д, J=6,5, 1Н); 5,16 (осн., д искажен., J= 5,6) и 5,34 (неосн., с широкий, 1Н); 6,48 (неосн.) и 6,68 (осн.) (2с, 1Н); 6,93 (д, J=8,4, 2Н ароматич.); 7,20-7,50 (м, 7Н ароматич.).
Масс-спектр (D/IС, NН3 + изобутан): 414 (МН+), 356, 314, 312, 250, 222, 206, 179, 177, 162, 151, 134, 119.
3-трет-Бутоксикарбонил-2-(4-метоксифенил)-4-фенил-5-метоксикарбонил-1,3-оксазолидин-(2S, 4S, 5S) имеет следующие характеристики.
Инфракрасный спектр (пленка): характеристические основные полосы поглощения при 2950, 2900, 1760, 1730, 1695, 1600, 1580. 1505, 1450, 1430, 1380, 1360, 1335, 1290, 1240, 1210, 1160, 1150, 1080, 1030, 1020, 920, 810 и 680 см-1.
Спектр ядерно-магнитного резонанса протона (200 МГц, СDC13, химический сдвиг в ррм, константы сочетания J в Гц): 1,26 (с, 9Н); 3,37 (с, 3Н); 3,82 (с, 3Н); 5,01 (д, J=7,1, 1Н); 5,27 (д, J=7,1, 1H); 6,05 (с, 1Н); 6,91 (д, J= 8 4, 2Н ароматич.); 7,26-7,56 (м, 5Н ароматич.); 7,49 (д, J=8,4 2Н ароматич. ).
Масс-спектр (D/IС NН3 + изобутан): 414 (МН+), 356, 339, 314, 312, 296, 250, 224, 222, 206, 177, 162, 151, 135, 121.
2) В колбу емкостью 2 см3, снабженную системой магнитного перемешивания, вводят в атмосфере аргона 5,0 мг (0,017 ммоля) метил-3-трет-бутоксикарбониламино-3-фенил-2-оксипропионата-(2S, 3S) в виде суспензии в 0,25 см3 безводного толуола. Затем прибавляют 10,0 мкл (10,7 мг, 0,059 ммоля) пара-метоксибензальдегиддиметилацеталя. Получившуюся реакционную смеcь нагревают при температуре 95oС, затем прибавляют 1 мг пара-толуолсульфонатпиридиния полимер. Нагревание продолжают в течение 24 часов при температуре 95oС. После охлаждения до температуры, близкой 20oС, реакционную смесь разбавляют 30 см3 дихлорметана. Органическую фазу обрабатывают 1 раз 5 см3 водного насыщенного раствора бикарбоната натрия, затем промывают 3 раза 5 см3 воды и 1 раз 5 см3 водного насыщенного раствора хлорида натрия. После высушивания на безводном сульфате натрия, фильтрования и концентрирования насухо получают (после очистки путем хроматографии на тонком слое силикагеля при использовании в качестве элюента смеси этиловый эфир : гексан (1:1 по объему, 2 пропускания) при выходе 93% 6,5 мг (0,016 ммоля) смеси 3-трет-бутоксикарбонил-2-(4-метоксифенил)-5-метоксикарбонил-1,3-оксазолидина-(2R, 4S, 5S) и 3-трет-бутоксикарбонил-2-(4-метоксифенил)-4-фенил-5-метоксикарбонил-1,3-оксазолидина-(2S,4S,5S) в соотношении 30/70.
3) В одногорлую колбу емкостью 2 см3, снабженную системой магнитного перемешивания, вводят в атмосфере аргона 10,0 мг (0,034 ммоля) метил-3 трет-бутоксикарбониламино-3-фенил-2-оксипропионата-(2S,3S) в виде суспензии в 0,5 см3 безводного толуола. Затем прибавляют 13,0 мкл (13,9 мг, 0,076 ммоля) пара-метоксибензальдегиддиметилацеталя. Получившуюся реакционную смесь нагревают при температуре 74oС в течение 5 минут, затем прибавляют 2,5 мг пара-толуолсульфокислоты (моногидрат). Нагревание продолжают при температуре 74oС в течение 17 часов. После охлаждения реакционную смесь разбавляют 30 см3 дихлорметана. Органическую фазу обрабатывают 1 раз см3 водного насыщенного раствора бикарбоната натрия, затем промывают 2 раза 5 см3 воды и 1 раз 5 см3 водного насыщенного раствора хлорида натрия. После высушивания на безводном сульфате натрия, фильтрования и концентрирования насухо при пониженном давлении получают (после очистки, осуществленной путем хроматографии на тонком слое силикагеля, при использовании в качестве элюанта смеси этиловый эфир : гексан (1:1 по объему) при выходе 45% 6,3 мг (0,015 ммоля) смеси 3-трет-бутоксикарбонил-2-(4-метоксифенил)-4-фенил-5-метоксикарбонил-1,3-оксазолидина (2R, 4S, 5S) и 3-трет- бутоксикарбонил-2-(4-метоксифенил)-4-фенил-5-метоксикарбонил-1,3-оксазолидина-(2S, 4S,5S) в отношении 61/39.
4) В одногорлую колбу емкостью 2 см3, снабженную системой магнитного перемешивания, вводят в атмосфере аргона 5,0 мг (0,017 ммоля) метил-3-трет-бутоксикарбониламино-3-фенил-2-оксипропионата-(2S, 3S) в виде суспензии в 0,25 см3 безводного толуола. Затем прибавляют 6,5 мкл (695 мг, 0,038 ммоля) пара-метоксибензальдегиддиметилацеталя. Получившуюся реакционную смесь нагревают при температуре 76oС в течение 5 минут, затем прибавляют 0,5 мг (0,002 ммоля) камфорсульфокислоты. Продолжают нагревание при температуре 76oС. После 4 часов взаимодействия компонентов реакционной смеси в нее вводят 4,0 мкл (2,43 мг, 0,076 ммоля) метанола и реакционную смесь выдерживают при температуре 76oС еще 44 часа. После охлаждения реакционную смесь разбавляют 30 см3 дихлорметана. Органическую фазу обрабатывают 1 раз 5 см3 водного насыщенного раствора бикарбоната натрия, затем ее промывают 2 раза см3 воды и 1 раз 5 см3 водного насыщенного раствора хлорида натрия. После высушивания на безводном сульфате натрия, фильтрования и концентрирования досуха при пониженном давлении получают (после очистки, осуществленной путем хроматографии на тонком слое силикагеля при использовании в качестве элюента смеси этиловый эфир : гексан (3:2 по объему) 3,7 мг (0,009 ммоля) (выход 53%) смеси 3-трет-бутоксикарбонил-2-(4-метоксифенил)-4-фенил-5-метоксикарбонил-1,3-оксазолидина-(2R, 4S, 5S) и 3-трет-бутоксикарбонил-2-(4-метоксифенил)-4-фенил-5-метоксикарбонил-1,3-оксазолидина-(2S, 4S, 5S) в соотношении 74/26.
Пример 4.
К раствору 1,6 г 3-трет-бутоксикарбонил-2,2-диметил-4-фенил-5-оксазолидинкарбоновой кислоты (4S, 5S) в 5 см3 безводного метиленхлорида добавляют при перемешивании при температуре около 20oС и в атмосфере аргона 0,206 г дициклогексилкарбодиимида. Реакционную смесь перемешивают в течение 35 минут.
Полученную дициклогексилмочевину отделяют фильтрацией и полученный раствор добавляют к раствору, состоящему из 1,5 г 4-ацетокси-2α-бензоилокси-5β, 20-эпокси-1,13α-дигидрокси-9-оксо-7β, 10β - бис(2,2,2-трихлорэтокси)карбонилокси-11-таксена с концентрацией 95% и 0,045 г 4-диметиламинопи ридина в 5 см3 безводного толуола при 75oС.
Перемешивают еще 2 часа после окончания добавления. Охлаждают до температуре около 20oС и дициклогексилмочевину отделяют фильтрацией. Фильтрат концентрируют досуха и остаток поглощают 10 см3 циклогексана. После полного растворения при 60oС раствор выливают в 25 см3 гептана, охлажденного до температуры 1-5oС. Полученный осадок отделяют фильтрацией, промывают холодным гептаном, затем сушат при пониженном давлении. Получают 1,8 г слегка бежевого продукта, который согласно анализу ВЭЖХ содержит 1,2 г 4-ацетокси-2α-бензоилокси-5β, 20-эпокси-1-гидрокси-9-оксо-7β, 10β - бис(2,2,2-трихлорэтокси)карбонилокси-11-таксен-13α-ила (4S, 5R)-3-трет-бутоксикарбониламино-2,2 -диметил-4-фенил-1,3-оксазолидин-5-карбоксилата, содержащего 15% эпимера 4S,5S.
Пример 5.
В реактор емкостью 50 см3 вводят в инертной атмосфере при температуре около 20oС 0,321 г 5-карбокси-2,2-диметил-4-фенил-3-(трет-бутоксикарбонил)-1,3-оксазолидин (4S, 5S), 0,244 г 2,4,6- трихлорбензоилхлорида, 8 см3 безводного толуола и 0,101 г триэтиламина. Реакционную смесь оставляют на 2 часа при перемешивании и при температуре около 20oС. Затем добавляют 0,896 г 4-ацетокси-2α-бензоилокси-5β, 20-эпокси-1β, 13α-дигидрокси-9-оксо-7β, 10β-бис (2,2,2-трихлор-этоксикарбонилокси)-11-таксена и 0,122 г 4-диметиламинопиридина. После перемешивания в течение 20 часов при температуре около 20oС полученный хлоргидрат триэтиламина отделяют фильтрацией и промывают толуолом. Толуоловую фазу промывают дважды 10 см3 воды, сушат над сульфатом натрия, затем концентрируют досуха при пониженном давлении. Анализ с помощью ВЭЖХ показал, что выход 4-ацетокси-2α-бензоилокси-5β, 20-эпокси-1β-гидрокси-9-оксо-7 , 10β-бис-(2,2,2-трихлорэтоксикарбонилокси)-11-таксен-13α-ил-(4S, 5R)-2,2-диметил-4-фенил-3-(трет-бутоксикарбонил)-1,3-оксазолидин-5-карбоксилата составляет 77% по отношению к преобразованному спирту и 63% по отношению к использованному спирту.
, 10β-бис-(2,2,2-трихлорэтоксикарбонилокси)-11-таксен-13α-ил-(4S, 5R)-2,2-диметил-4-фенил-3-(трет-бутоксикарбонил)-1,3-оксазолидин-5-карбоксилата составляет 77% по отношению к преобразованному спирту и 63% по отношению к использованному спирту.
Сравнительный пример 6 иллюстрирует исходное соединение, которое не содержит заместитель Вос, а содержит, например, бензоильный радикал, в котором получают целевые соединения без промежуточной стадии.
Сравнительный пример 6.
7,10-Ди(2,2,2-трихлорэтоксикарбонил)-10 -деацетил-13-О-[(4S, 5R)-N-бензоил-2, 2-диметил-4-фенил-1,3-оксазолидин-5-карбонил] -баккатин (52 мг) растирают с 1 мл муравьиной кислоты при комнатной температуре в течение 4 часов.
Кислоту испаряют в вакууме и сырой продукт реакции обрабатывают метанолом (1 мл), уксусной кислотой (1 мл) и порошковым цинком (40 мг) при 60oС в течение 1 часа. Получают 30 мг 10-деацетилтаксола с выходом 80% (см. схему).
Изобретение относиться к новым производным таксана общей формулы I
где Ar представляет собой фенил, R представляет собой фенил или радикал R5-O-, в котором R5 представляет собой прямой или разветвленный алкил, содержащий от 1 до 8 атомов углерода, за исключением трет-бутила, R1 и R2 имеет одинаковые или различные значения и представляют собой атом водорода, радикал алкил, фенилалкил, фенил, алкоксифенил или диалкоксифенил, R3 представляет собой ацетил или защитную группу функциональной гидроксигруппы, R4 представляет собой защитную группу функциональной гидроксигруппы, которые могут быть использованы в качестве промежуточных соединений при получении таксола, таксотера или их аналогов, обладающих противоопухолевыми или противолейкемическими свойствами. Технический результат - новые производные таксана, позволяющие получать биологически активные соединения.
Производные таксана общей формулы I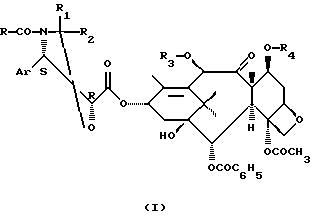
где Аr представляет собой фенил;
R представляет собой фенил или радикал R5-O-, в котором R5 представляет собой прямой или разветвленный алкил, содержащий от 1 до 8 атомов углерода, за исключением трет-бутила;
R1 и R2 имеет одинаковые или различные значения и представляют собой атом водорода, радикал алкил, фенилалкил, фенил, алкоксифенил или диалкоксифенил;
R3 представляет собой ацетил или защитную группу функциональной гидроксигруппы;
R4 представляет собой защитную группу функциональной гидроксигруппы.
| US 4924012 А, 08.05.1990 | |||
| МАССА ДЛЯ ИЗГОТОВЛЕНИЯ ЭЛЕКТРОДОВ | 0 |
|
SU336840A1 |
| МАССА ДЛЯ ИЗГОТОВЛЕНИЯ ЭЛЕКТРОДОВ | 0 |
|
SU336841A1 |
| RU 95110687 A1, 05.10.1992. | |||
Авторы
Даты
2002-08-27—Публикация
1993-10-28—Подача