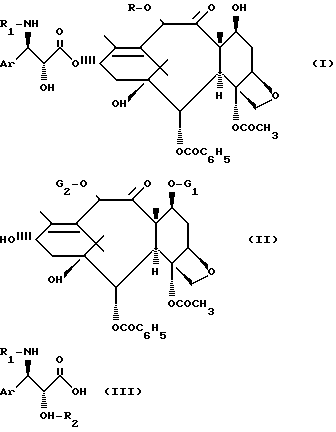
Изобретение относится к новому способу получения производных таксана общей формулы [I]: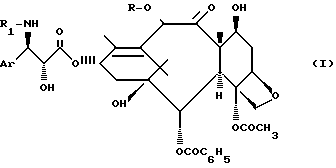
в которой Ar означает фенильный радикал;
R обозначает атом водорода или ацетильный радикал;
R1 обозначает бензоильный или трет-бутосикарбонильный радикал, которые обладают замечательными противоопухолевыми свойствами.
Известны способы получение производных таксана [1,2] общей формулы /I/ путем этерификации до сложного эфира производного баккатина III или 10-дизацетил-баккатина III общей формулы /II/: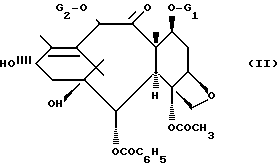
в которой G1 обозначает защитную группу для гидроксильноЙ функции, такую как 2,2,2-трихлор-этоксикарбонильный радикал или триалкилсилильный радикал, каждая алкильная часть которого содержит 1-4 атома углерода;
G2 обозначает ацетильный радикал или защитную группу для гидроксильноЙ функции, такую как 2,2,2-трихлор-этоксикарбонильный радикал,
с помощью кислоты общей формулы /III/: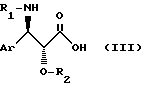 ,
,
в которой Ar и R1 имеют вышеуказанные значения, а R2 обозначает защитную группу для гидроксильной функции, такую как метоксиметильный, 1-этоксиэтильный, бензилоксиметильный, [β-триметилсилилэтокси]-метильный, тетрагидропиранильный, 2,2,2-трихлор-этоксиметильный или 2,2,2-трихлор-этоксикарбонильный радикал, с последующей заменой защитных групп G1, G2 и R2 в полученном продукте атомами водорода.
Этерификацию с получением сложного эфира осуществляют в присутствии конденсирующего агента, такого как карбодиимид, как дициклогексилкарбодиимид или реакционноспособный карбонат, как 2-дипиридилкарбонат, и активирующего агента, такого как диалкиламинопиридин, как 4-диметиламинопиридин, работая в ароматическом органическом растворителе, таком как бензол, толуол, ксилолы, этилбензол, изопропилбензол или хлорбензол, при температуре 60-90oC.
Замена защитных групп атомами водорода осуществляется с помощью цинка в уксусной кислоте или путем гидролиза в кислой среде.
В настоящее время найдено, и это составляет предмет настоящего изобретения, что этерификация спирта общей формулы /II/ с помощью кислоты общей формулы /III/ может быть осуществлена при температуре от -10oC до 60oC (не выше 60oC), предпочтительно при 20-35oC, при работе в органическом растворителе, выбираемом среди простых эфиров, таких как тетрагидрофуран, диизопропиловый эфир, метил-третбутиловый эфир или диоксан; кетонов, таких как метилизобутилкетон; нитрилов, таких как ацетонитрил; сложных эфиров, таких как этилацетат, изопропилацетат или н-бутилацетат; алифатических углеводородов, таких как пентан, гексан или гептан; хлорированных алифатических углеводородов, таких как дихлорметан или 1,2-дихлорэтан; и ароматических углеводородов, таких как бензол, толуол или ксилолы. Совершенно особенный интерес представляют собой сложные эфиры и ароматические углеводороды.
Обычно этерификацию до получения сложного эфира осуществляют в присутствии конденсирующего агента, такого как карбодиимид, дициклогексилкарбодиимид, и активирующего агента, такого как аминопиридин, как 4-диметиламинопиридин или 4-пирролидинопиридин.
Предпочтительно проводить этерификацию (до получения сложного эфира), используя избыток кислоты общей формулы /III/ по отношению к спирту общей формулы /II/, но однако можно также проводить, используя стехиометрическое количество кислоты общей формулы /III/ и спирта общей формулы /II/. Конденсирующий агент обычно используют в стехиометрическом количестве по отношению к кислоте общей формулы /III/, а активирующий агент берется в стехиометрическом или уменьшенном количестве по отношению к спирту общей формулы /II/.
Способ согласно изобретению, поскольку его осуществляют при температуре более низкой, чем по известным способам, позволяет получать более высокие выходы сложных эфиров вследствие лучшей стабильности кислоты общей формулы /III/ в реакционной смеси и уменьшения вторичных реакций.
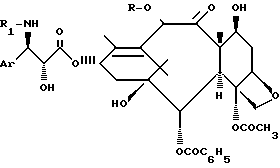
Пример 1. В колбу Эрленмейера емкостью 20 см3 вводят 1,0045 г 96%-ного 4-ацетокси-2α-бензоилокси-5β, 20-эпокси-1,13α-дигидрокси-9-оксо-7β,10β-бис-(2,2,2-трихлорэтокси)карбонилокси-11-таксена (или 1,08 ммоль); 1,1545 г 100%-ной (2R, 3S)-2-(1-этокси-этокси)-3-третбутоксикарбониламино-3-фенилпропионовой кислоты (или 3,3 моль); 0,6669 г 99%-ного дициклогексилкарбодиимида (или 3,2 ммоль); 0,0742 г 98%-ного 4-пирролидинопиридина (или 0,49 ммоль) и 6 см3 безводного толуола. Интенсивно перемешивают в течение 72 ч, поддерживая температуру -10oC.
Количественный анализ реакционной среды с помощью высокоэффективной жидкостной хроматографии показывает, что среда содержит 1,1370 г (2R,3S)-{4-ацетокси-2α-бензоилокси-5β, 20-эпокси-1-гидрокси-9-оксо-7β,10β-бис-(2,2,2-трихлорэтокси)-карбонилокси-11-таксен- 13α-ил} -3'-третбутоксикарбониламино-3'-фенил-2'-гидроксипропионата (или 0,91 ммоль) и 0,1705 г (2S,3S)-{4-ацетокси- 2α-бензоилокси-5β, 20-эпокси-1-гидрокси-9-оксо-7β,10β-бис-(2,2,2-трихлорэтокси)-карбонилокси-11-таксен-13α-ил} -3-третбутоксикарбониламино-3-фенил-2-гидроксипропионата (или 0,14 ммоль).
Общий выход составляет 97% со степенью эпимеризации 12,7%.
Пример 2. В стеклянный реактор с двойной рубашкой емкостью 500 см, снабженный вводом азота, температурным зондом и холодильником, вводят 50,011 г 96%-ного 4-ацетокси-2α-бензоилокси-5β, 20-эпокси-1,13α-дигидрокси-9-оксо-7β,
10β-бис-(2,2,2-трихлорэтокси)-карбонилокси-11-таксена (или 53,6 ммоль); 56,81 г 100%-ной (2R,3S)-2-[1-этокси-этокси]-3-третбутоксикарбониламино-3-фенилпропионовой кислоты (или 160,7 ммоль); 33,54 г 99%-ного дициклогексилкарбодиимида (или 160,9 ммоль); 1,79 г 98%-ного 4-пирролидинопиридина (или 11,8 ммоль) и 299 см3 безводного толуола. Интенсивно перемешивают в течение 12 ч, поддерживая температуру около 25oC.
Количественный анализ реакционной среды с помощью высокоэффективной жидкостной хроматографии показывает, что среда содержит 57,00 г (2R,3S)-{4-ацетокси-2α-бензоилокси-5β, 20-эпокси-1-гидрокси-9-оксо-7β,10β-бис-(2,2,2-трихлорэтокси)-карбонилокси-11-таксен- 13α-ил} -3'-третбутоксикарбониламино-3'-фенил-2'-гидроксипропионата (или 45,7 ммоль) и 8,52 г (2S,3S)-{4-ацетокси-2α-бензоилокси-5β, 20-эпокси-1-гидрокси-9-оксо-7β, 10β-бис-(2,2,2-трихлорэтокси)-карбонилокси-11-таксен-13α-ил} -3-третбутоксикарбониламино-3-фенил-2-гидроксипропионата (или 6,8 ммоль).
Общий выход составляет 98% со степенью эпимеризации 13,0%.
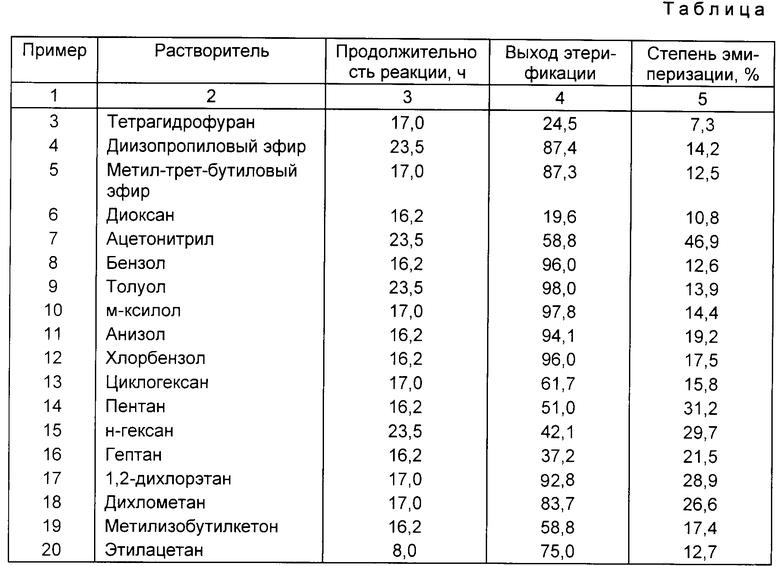
Примеры 3-19. В колбу Эрленмейера емкостью 10 см3 вводят 250 мг 96%-ного 4-ацетокси-2α-бензоилокси-5β, 20-эпокси-1,13α-дигидрокси-9-оксо-7β,10β-бис-(2,2,2-трихлорэтокси)-карбонилокси-11-таксена (или 0,27 ммоль); 284 мг 100%-ной (2R, 3R)-2-[1-этокси-этокси] -3-третбутоксикарбониламино-3-фенилпропионовой кислоты (или 0,80 ммоль); 190 мг 99%-ного дициклогексилкарбодиимида (или 0,91 ммоль); 9 мг 98%-ного 4-диметиламинопиридина (или 0,07 ммоль) и 3 см3 растворителя.
Интенсивно перемешивают, поддерживая реакционную среду при температуре около 30oC.
После перемешивания в течение 16-24 ч количественный анализ реакционной среды с помощью высокоэффективной жидкостной хроматографии позволяет рассчитать выход этерификации и степень эпимеризации.
Полученные с разными растворителями результаты представлены в таблице.
Пример 21. В колбу Эрленмейера емкостью 10 см3 загружают 503,6 мг 96%-ного 4-этокси-2α-бензоилокси-5β, 20-эпокси-1,13α-дигидрокси-9-оксо-7β, 10β-бис-(2,2,2-трихлорэтокси)-карбонил-11-таксена (или 0,54 ммоль); 579,0 мг 99%-ной (2R, 3S)-2-[1-этокси-этокси]-2-третбутоксикарбониламино-3-фенилпропионовой кислоты (или 1,62 ммоль); 357,8 мг 99%-ного дициклогексилкарбодиимида (или 1,72 ммоль); 45,5 мг 98%-ного 4-пирролидинопиридина (или 0,30 ммоль) и 3 см3 безводного толуола. Интенсивно перемешивают в течение 5 ч 20 мин, поддерживая температуру 45oC.
Количественный анализ реакционной среды путем жидкостной высокоэффективной хроматографии показывает, что среда содержит 559,5 мг (2R,3S)-{4-ацетокси- 2α)-бензоилокси-5β, 20-эпокси-1-гидрокси-9-оксо-7β,10β-бис-(2,2,2-трихлорэтокси)-карбонилокси-11-таксен-13α-ил} -3-третбутоксикарбониламино-3-фенил-2-гидроксипропионата (или 0,45 ммоль) и 90,8 мг (2S,3S)-{4-ацетокси-2α-бензоилокси-5β, 20-эпокси-2-гидрокси-9-оксо-7β, 10β-бис-(2,2,2-трихлорэтокси)-карбонилокси-11-таксен-13α-ил} -3-третбутоксикарбониламино-3-фенил-2-гидроксипропионата (или 0,07 ммоль).
Общий выход составляет 97% со степенью эпимеризации 13,9%.
Способ получения производных таксана общей формулы /I/ путем этерификации (с получением сложного эфира) при температуре от -10oC до 60oC производного баккатина III или 10-дезацетил-баккатина III общей формулы /II/ с помощью кислоты общей формулы /III/, с последующей заменой защитных групп G1, G2 и R2 в полученном продукте атомами водорода. В формулах /I/, /II/, /III/: Ar обозначает фенильный радикал; R обозначает водород или ацетил; R1 обозначает бензоил или трет.- бутоксикарбонил; G1 обозначает защитную группу для гидроксильной функции; G2 обозначает ацетильный радикал или защитную группу для гидроксильной функции и R2 обозначает защитную группу для гидроксильной функции.
7 з.п. ф-лы, 1 табл.
где Ar фенил;
R атом водорода или ацетил;
R1 бензоильный или трет.бутоксикарбонильный радикал,
путем этерификации до сложного эфира производного баккатина III или 10-дезацетилбаккатина III общей формулы II
где G1 защитная группа для гидроксильной функции, такая как 2,2,2-трихлор-этоксикарбонильный радикал или триалкилсилильный радикал, каждая алкильная часть которого содержит 1 4 атома углерода;
G2 ацетильный радикал или защитная группа для гидроксильной функции, такая как 2,2,2-трихлор-этоксикарбонильный радикал,
кислотой общей формулы III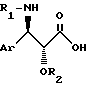
где Ar и R1 имеют указанные значения;
R2 защитная группа для гидроксильной функции, такая как метоксиметильный, 1-этоксиэтильный, бензилоксиметильный, β--триметилсилилэтокси)-метильный, тетрагидропиранильный, 2,2,2-трихлорэтоксиметильный или 2,2,2-трихлор-этоксикарбонильный радикал,
с последующей заменой защитных групп G1, G2 и R2 в полученном продукте атомами водорода, или в случае необходимости, соединение формулы I, где R атом водорода, переводят в соединение формулы I, где R - ацетил, отличающийся тем, что этерификацию осуществляют при температуре от -10 до 60oС (не включая 60oС).
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| US, патент, 4924011, кл | |||
| Способ восстановления хромовой кислоты, в частности для получения хромовых квасцов | 1921 |
|
SU7A1 |
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| US, патент, 4924012, кл | |||
| Способ восстановления хромовой кислоты, в частности для получения хромовых квасцов | 1921 |
|
SU7A1 |
Авторы
Даты
1998-01-27—Публикация
1993-02-04—Подача