Изобретение относится к способу получения пригодного для внутривенного применения раствора иммуноглобулина (Иг). В качестве исходного материала используют получаемую из крови человека или животного протеиновую фракцию, которая содержит иммуноглобулины в концентрированной форме.
Как известно, иммуноглобулины играют важную роль в иммунной системе человека и млекопитающего при защите от инфекций. Иммуноглобулины подразделяют на различные классы (например, ИгГ, ИгА, ИгМ, ИгД и ИгЕ) с различными биохимическими и физиологическими свойствами. Вплоть до 1980 г. был выделен только ИгГ и использован в качестве приемлемого для внутривенного применения продукта для профилактики и терапии. В заявках на европейские патенты 0013901, 0413187 и 0352500 описываются препараты на основе ИгМ, которые становятся приемлемыми для внутривенного применения главным образом за счет обработки с помощью β-пропиолактона. В заявке на европейский патент 0413188 описывается способ, в котором достигают приемлемости для внутривенного применения за счет анионообменной хроматографической обработки с селективным элюированием внутривенно приемлемой фракции.
Целью настоящего изобретения является получение пригодного для внутривенного введения концентрата ИгМ высокой степени чистоты для терапии и профилактики. Продукт должен обладать низкой антикомплементарной активностью (АСА) и вызывать незначительное падение артериального давления в случае крыс в качестве модели, однако молекулы ИгМ не должны быть химически модифицированы. Этой цели неожиданно достигают путем обработки содержащего ИгМ иммуноглобулинового раствора с помощью протеазы.
Предметом изобретения, следовательно, является указанный в пункте 1 формулы изобретения способ.
Предпочтительно обработка протеазой представляет собой осуществляемую при повышенной температуре инкубацию в присутствии пепсина, папаина, плазмина или термолизина. Протеазы могут быть также химически модифицированы, иммобилизированы на носителе и/или получены путем генной технологии. Полученный по предлагаемому согласно изобретению способу препарат можно переводить во внутривенно вводимый раствор. Этот раствор показывает уменьшение АСА, падения кровяного давления в случае крыс в качестве модели и активности связывания C1q.
В качестве исходных материалов для способа согласно настоящему изобретению пригодны содержащие иммуноглобулин растворы, как, например, плазма; осадок А или Б, получаемый при фракционировании по методу Кистлера-Нитшманна; фракция Коэна I/II/III; II/III; III или другие, содержащие ИгМ фракции из плазмы человека или животного. Например, содержащую иммуноглобулин фракцию, как осадок Б по Кистлеру-Нитшманну, можно растворять в буферах и удалять наибольшую часть примесей путем осаждения с помощью 0,5-5%-ной октановой кислоты при рН-значении от 4 до 6, предпочтительно при рН 5. Затем раствор с низкой ионной силой при добавлении, по крайней мере, 50 ЕД/г, предпочтительно 600 ЕД/г, пепсина инкубируют в течение 1-48 ч, предпочтительно в течение 9 ч, при температуре 20-50oС, предпочтительно при 37oС.
Для дальнейшей очистки раствор можно подвергать адсорбции, например, с помощью содержащего диэтиламиноэтильные группы геля в ванне или по способу с использованием колонки. Если в целевом продукте далее нужно повысить концентрацию ИгМ, то содержащий ИгМ раствор подвергают обработке с помощью ионообменника (например, TMAE-Fractogel®). Путем селективного элюирования, например, с помощью градиентов соли или рН, можно выделить фракцию ИгМ. Путем ультра- и диафильтрации соответственно гельфильтрации, раствор можно концентрировать и устанавливать содержание электролита в окончательной, приемлемой для внутривенного применения препаративной форме. Концентрация протеина может составлять 1-20%, предпочтительно 3-6%. Продукт может содержать дополнительно протеины, предпочтительно альбумин, а также сахар, предпочтительно глюкозу или сахарозу, или аминокислоты.
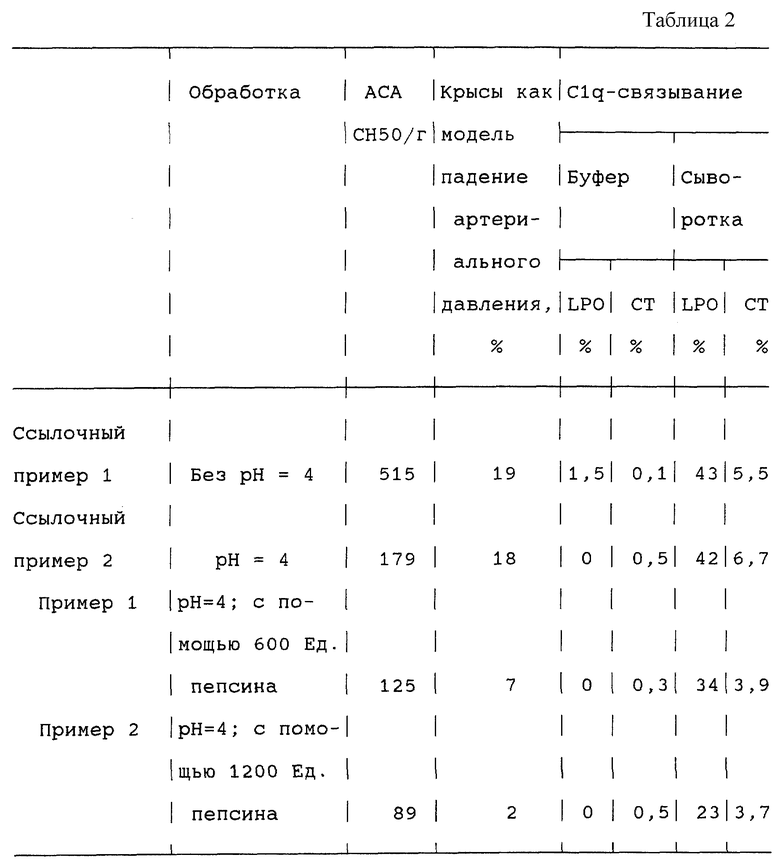
Для оценки внутривенной приемлемости иммуноглобулиновых препаратов обычно используют такой параметр, как антикоиплементарная активность (АСА). Для определения АСА определенное количество испытуемого продукта инкубируют с определенным количеством комплемента морской свинки и оттитровывают остающееся количество комплемента. АСА указывают как расход СН50 на г иммуноглобулина. Указанные результаты АСА далее определяют по методу, опубликованному М. Мауеr (М. М. Мауеr "Комплемент и фиксация комплемента", в руководстве "Экспериментальная иммунохимия", второе изд. 1961, с. 133-240, С. Thomas, Springfield, II). В качестве ориентировочного значения для внутривенно применимых ИгГ-продуктов указывается АСА <1000 СН50 на г протеина.
Для оценки внутривенной приемлемости далее можно использовать связывание компонента комплемента C1q с иммуноглобулином. Для определения инкубируют определенное количество испытуемого продукта вместе с определенным количеством очищенного, радиоактивно меченого Clq-комплемента в буфере и в сыворотке. Активность связывания Clq испытуемого продукта определяют путем преципитации в присутствии полиэтиленгликоля. Чем выше радиоактивность в осадке, тем больше активность связывания Clq-продукта. Более достоверной информации о роде Clq-связывания и вместе с тем о качестве продукта можно достигать в том случае, если Clq радиоактивно метят с помощью двух различных способов; с одной стороны, по возможности в мягких окислительных условиях с помощью лактопероксидазы (LPO) и, с другой стороны, в сильно окислительных условиях с помощью хлорамина Т (СТ). Исследования далее осуществляют по методу, опубликованному Р. Späth (P.J. Späth, A. Corvetta, U.E. Nydegger, R. Büttler: An Extended Clq-Binding Assay Using Lactoperoxidase- and Chloramin-T-Iodinated Clq; Scand. 3. Immunol. , 18, 319-328 [1983]). От интактного внутривенно приемлемого препарата ожидают, чтобы активность связывания Clq была по возможности незначительной. В качестве модели для испытания внутривенной приемлемости иммуноглобулинов используют крыс согласно Bleeker и др. (W.K. Bleeker, J. Аgterberg, G. Rigter, A. de Vries-van Rossen, J.С. Bakker: An animal model for the detection of hypotensive side effects of immunoglobulin preparations. Vox. Sang. , 52, 281-290 [1987]). Параметром приемлемости в этой модели является кровяное давление. Неприемлемые для внутривенного применения продукты приводят к отчетливому снижению кровяного давления.
Примеры
Ссылочный пример 1
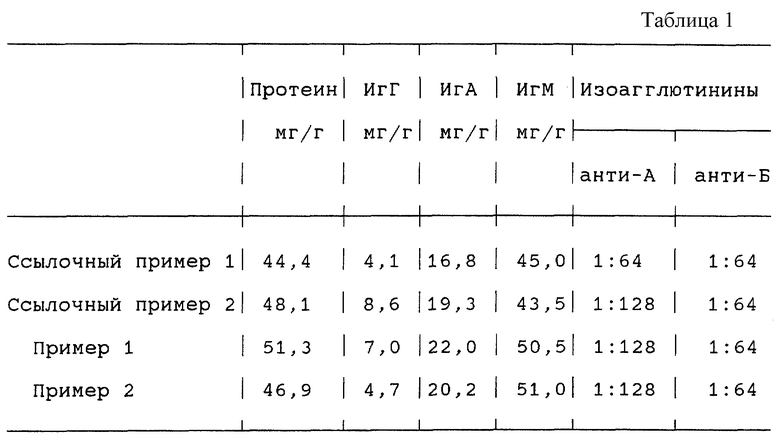
1 кг осадка Б по Кистлеру-Нитшманну суспендируют в 4 кг 0,1 М ацетатного буфера, рН 5,1 и при комнатной температуре смешивают с 2% октановой кислоты. На 1 г октановой кислоты добавляют 0,15 г трикальцийфосфата и осадок отфильтровывают. Фильтрат подвергают диафильтрации против раствора с 20 ммоль/л пиперазина, 60 ммоль/л хлорида натрия, рН=5,8. Полученный после диафильтрации раствор обрабатывают с помощью 75 мг диэтиламиноэтил-сефадекса® на 1 г протеина. Затем устанавливают концентрацию протеина при значении 20 мг/мл и раствор обрабатывают в течение 8 часов при температуре 25oС с помощью 1% Tвина® 80 и 0,3% три-н-бутилфосфата. После этого раствор вносят в колонку, содержащую TMAE-Fractogel®, и элюируют фракцию ИгМ с помощью элюента, содержащего 20 ммоль пиперазина, 160 ммоль хлорида натрия, рН 5,8. Целевой продукт концентрируют до содержания протеина 5% и устанавливают рН-значение, равное 4,5.
Ссылочный пример 2
1 кг осадка Б по Кистлеру-Нитшманну суспендируют в 4 кг 0,1 М ацетатного буфера, рН 5,1 и при комнатной температуре смешивают с 2% октановой кислоты. На 1 г октановой кислоты добавляют 0,15 г трикальцийфосфата и осадок отфильтровывают. Фильтрат подвергают диафильтрации против раствора с 20 ммоль/л хлорида натрия и полученный после диафильтрации раствор доводят до содержания протеина 20 мг/мл. Устанавливают рН-значение равным 4,0 с помощью 0,2 М соляной кислоты и раствор инкубируют в течение 9 ч при температуре 37oС. После охлаждения до температуры 20oС устанавливают рН-значение равным 5,8 и добавляют пиперазин до концентрации 20 ммоль/л и хлорид натрия до концентрации 60 ммоль/л. Раствор затем обрабатывают в течение 8 ч при температуре 25oС с помощью 1% Tвина® 80 и 0,3% три-н-бутилфосфата. После этого раствор вносят в колонку, содержащую TMAE-Fractogel®, и элюируют фракцию ИгМ с помощью элюента, содержащего 20 ммоль пиперазина, 160 ммоль хлорида натрия, рН 5,8. Конечный продукт концентрируют до содержания протеина 5% и устанавливают рН-значение, равное 4,5.
Пример 1
1 кг осадка Б по Кистлеру-Нитшманну суспендируют в 4 кг 0,1 М ацетатного буфера, рН 5,1 и при комнатной температуре смешивают с 2% октановой кислоты. На 1 г октановой кислоты добавляют 0,15 г трикальцийфосфата и осадок отфильтровывают. Фильтрат подвергают диафильтрации против раствора с 20 ммоль/л хлорида натрия и полученный после диафильтрации раствор доводят до содержания протеина 20 мг/мл. Устанавливают рН-значение равным 4,0 с помощью 0,2 М соляной кислоты и добавляют 600 ЕД пепсина на 1 г протеина. Затем раствор инкубируют в течение 9 ч при температуре 37oС. После охлаждения до температуры 20oС устанавливают рН-значение равным 5,8 и добавляют пиперазин до концентрации 20 ммоль/л и хлорид натрия до концентрации 60 ммоль/л. Раствор затем обрабатывают в течение 8 ч при температуре 25oС с помощью 1% Tвина® 80 и 0,3% три-н-бутилфосфата. После этого раствор вносят в колонку, содержащую TMAE-Fractogel®, и элюируют фракцию ИгМ с помощью элюента, содержащего 20 ммоль пиперазина, 160 ммоль хлорида натрия, рН 5,8. Конечный продукт концентрируют до содержания протеина 5% и устанавливают рН-значение, равное 4,5.
Пример 2
1 кг осадка Б обрабатывают по методике ссылочного примера 2, причем, однако, вместо 600 ЕД пепсина на 1 г протеина добавляют раствор 1200 Ед. пепсина на 1 г протеина перед инкубацией при рН-значении, равном 4.
Характеристика экспериментально полученных продуктов
Иммуноглобулины ИгГ, ИгА и ИгМ определяют нефелометрически с помощью антисывороток. Общее содержание протеина определяют по методу Кьельдаля (см. табл.1).
Табл.2 параметров приемлемости приведена в конце описания.
Добавление пепсина вызывает снижение АСА, уменьшение падения артериального давления у крыс в качестве модели, а также снижение активности связывания C1q.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ КОМПОЗИЦИИ ИММУНОГЛОБУЛИНОВ | 2011 |
|
RU2612899C2 |
| ПРЕПАРАТЫ АНТИТЕЛ | 2011 |
|
RU2617532C2 |
| СПОСОБ ПОЛУЧЕНИЯ КОМПОЗИЦИИ ИММУНОГЛОБУЛИНОВ | 2011 |
|
RU2765738C2 |
| ПРЕПАРАТЫ АНТИТЕЛ | 2011 |
|
RU2749732C2 |
| СПОСОБ ПОЛУЧЕНИЯ ИММУНОГЛОБУЛИНОВ ДЛЯ ВНУТРИВЕННОГО ВВЕДЕНИЯ И ДРУГИЕ ИММУНОГЛОБУЛИНОВЫЕ ПРОДУКТЫ | 1999 |
|
RU2197500C2 |
| ПРЕПАРАТ ИММУНОГЛОБУЛИНА ДЛЯ ВНУТРИВЕННОГО ВВЕДЕНИЯ И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 1996 |
|
RU2122864C1 |
| Способ производства иммуноглобулина для внутривенного введения | 2019 |
|
RU2742655C1 |
| СПОСОБ ПОЛУЧЕНИЯ ИММУНОГЛОБУЛИНА ДЛЯ ВНУТРИВЕННОГО ВВЕДЕНИЯ, ОБОГАЩЕННОГО ИММУНОГЛОБУЛИНОМ М, И ПРЕПАРАТ, ПОЛУЧЕННЫЙ ЭТИМ СПОСОБОМ | 2010 |
|
RU2470664C2 |
| ПРЕПАРАТ ИММУНОГЛОБУЛИНА ЧЕЛОВЕКА ПРОТИВ ЦИТОМЕГАЛОВИРУСА ДЛЯ ВНУТРИВЕННОГО ВВЕДЕНИЯ И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2009 |
|
RU2404250C1 |
| Способ очистки фибриногена, продукт фибриногена и средство для очистки или производства продукта фибриногена | 2013 |
|
RU2663792C2 |
Изобретение относится к области медицины, точнее к иммуногематологии. Сущность изобретения заключается в создании способа получения иммуноглобулинового препарата с содержанием иммуноглобулина M (JgM) более чем 5 маc.%. Для этого фракцию плазмы, содержащей JgМ, обрабатывают протеазой при определенном режиме рН, температуры и т.п. Техническим результатом изобретения является расширение арсенала способов получения JgМ, применяемых для коррекции иммуной системы. 9 з.п. ф-лы, 2 табл.
| US 4371520 A, 01.02.1983 | |||
| Способ армирования деталей, работающих в условиях абразивного износа, гранулами твердых или сверхтвердых карбидов | 1956 |
|
SU123029A1 |
| АППАРАТ ДЛЯ ОЧИСТКИ И ТЕПЛОВЛАЖНОСТНОЙ ОБРАБОТКИВОЗДУХА | 0 |
|
SU303088A1 |
| СПОСОБ БЕСПАЙКОВОГО ФОРМИРОВАНИЯ ПЛАСТИН СВИИЦОВО-КИСЛОТНОГО АККУМУЛЯТОРА | 0 |
|
SU345543A1 |
Авторы
Даты
2002-10-20—Публикация
1997-10-14—Подача