Область техники
Изобретение относится к новому трициклическому производному пиразола или его фармацевтически приемлемой соли. Данное изобретение относится также к фармацевтической композиции, которая включает трициклическое производное пиразола или его соль и фармацевтически приемлемый носитель, в частности, фармацевтической композиции, которая полезна в качестве лекарственного средства для предотвращения и лечения заболеваний центральной нервной системы, таких как сексуальные расстройства, нарушения аппетита, беспокойство или страх, депрессия и нарушения сна.
Предпосылки
С прогрессированием старения общества с учетом усовершенствования и улучшения условий жизни для стареющих людей, внимание было сконцентрировано на предотвращении и лечении заболеваний, которые до сих пор не рассматривались как заболевания (например, сексуальные расстройства и т.п.).
Хотя роль рецептора 5-НТ2с, который в основном распределен в центральной нервной системе, не была достаточно выяснена, считают, что этот рецептор связан с заболеваниями центральной нервной системы, такими как сексуальные расстройства, нарушение аппетита, беспокойство или страх, депрессия, нарушение сна и т.п. (Curr. Opin. Invest. Drugs, 2 (4), 317 (1993)). В результате считают, что лиганд рецептора 5-НТ2с эффективен для предотвращения или лечения вышеупомянутых заболеваний, в частности, заболеваний, которые до сих пор не рассматривались как заболевания и для которых нет эффективного терапевтического способа (например, сексуальные расстройства и т.п.).
Что касается трициклических производных пиразола, которые являются агонистами рецептора 5-НТ2с, было сообщение только о трициклическом производном пиразола, сконденсированном с бензольным кольцом (ЕР 700905-А) и т.п. , но не известны сообщения о трициклическом производном пиразола, которое сконденсировано с ненасыщенным гетероциклическим кольцом. Кроме того, о соединении, имеющем трициклическое ядро пиразола, которое сконденсировано с кольцом пиразина, кольцом пиридина, кольцом тиофена, кольцом фурана или кольцом пиррола, сообщалось в Международной Публикации WO 96/13478, и в соединении, имеющем трициклическое пиразольное ядро, сконденсированное с ароматическим гетероциклическим кольцом и имеющем также заместители на атоме углерода пиразольного кольца в этом ядре, сообщалось в International Publication WO 95/07893. Эти ссылки, однако, не описывают соединение, в котором амин связан с положением 1 трициклического пиразольного ядра через алкиленовую цепь, и также не описывают взаимосвязи между сообщенными соединениями и рецепторами 5-HT2c.
Описание изобретения
В результате интенсивных исследований, проведенных на соединениях, имеющих 5-НТ2с-рецепторную активность, авторы данного изобретения обнаружили новое трициклическое производное, обладающее высокой селективностью и высокой активностью в отношении 5-НТ2с-рецептора, и на основе данной находки завершили данное изобретение.
Таким образом, данное изобретение относится к новому трициклическому производному пиразола, представленному следующей общей формулой (I), которое обнаруживает высокую селективность и высокое сродство в отношении 5-НТ2с-рецептора, или его фармацевтически приемлемой соли.
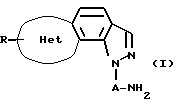
(каждый символ в приведенной выше формуле обозначает следующее:
кольцо Het: 5-членное ненасыщенное гетероциклическое кольцо, содержащее 1-3 гетероатома, каждый из которых выбран из группы, состоящей из атома азота, атома кислорода и атома серы,
А: прямая или разветвленная низшая алкиленовая группа, и
R: атом водорода, низшая алкильная группа, атом галогена, гидроксильная группа или низшая алкоксигруппа).
Соединение (I) данного изобретения характеризуется его химической структурой, в которой амин соединен с положением 1 трициклического пирозального ядра, сконденсированного с 5-членным ненасыщенным гетероциклическим кольцом, всегда через алкиленовую цепь.
Среди соединений (I) данного изобретения, соединения, в которых А представляет этиленовую группу или пропиленовую группу, являются предпочтительными, и особенно предпочтительными являются (S)-2-(lH-фуро[2,3-g]индазол-l-ил)-1-метилэтиламин, 2-(7-бром-1Н-тиено[2,3-g]индазол-1-ил) этиламин, 2(7-йод-1Н-тиено[2, 3-g] индазол-1-ил) этиламин, 2-(7-метокси-1Н-тиено[2,3-g] индазол-1-ил)этиламин, 2-(1Н-фуро[2,3-g]индазол-1-ил)этиламин или их фармацевтически приемлемые соли.
Данное изобретение относится также к фармацевтической композиции, которая включает трициклическое производное пиразола или его соль и фармацевтически приемлемый носитель. В частности, оно относится к фармацевтической композиции, которая является лигандом 5-НТ2с и полезна в качестве лекарственного средства для предотвращения и лечения заболеваний центральной нервной системы, таких как сексуальные нарушения, нарушения аппетита, тревога (или беспокойство или страх), депрессия, нарушение сна и т.п.
Соединение (I) данного изобретения далее будет описано подробно.
Термин "лиганд 5-НТ2с-рецептора" обозначает соединение, которое обладает сродством в отношении 5-НТ2с-рецептора и проявляет агонизм или антагонизм.
В определении общей формулы, в применении к данной заявке, если нет других указаний, термин "низший" обозначает прямую или разветвленную цепь углерода, имеющую 1-6 атомов углерода.
Иллюстративные примеры "низшей алкиленовой группы" включают метилен, этилен, триметилен, пропилен, тетраметилен, этилэтилен, пентаметилен, гексаметилен и т.п., из которых предпочтительными являются этилен и пропилен.
Иллюстративные примеры "низшей алкильной группы" включает метил, этил, пропил, изопропил, бутил, изобутил, втор-бутил, трет-бутил, пентил(амил), изопентил, неопентил, трет-пентил, гексил, изогексил и т.п., из которых предпочтительными являются алкильные группы, имеющие 1-4 атома углерода и особенно предпочтительной является метильная группа.
Примеры "атома галогена" включают атом фтора, атом хлора, атомы брома и йода, из которых предпочтительными являются атомы брома и йода.
Термин "низшая алкоксигруппа" обозначает оксигруппу, замещенную вышеупомянутой низшей алкильной группой.
Иллюстративные примеры "5-членного ненасыщенного гетероциклического кольца, содержащего 1-3 гетероатома, каждый из которых выбран из группы, состоящей из атома азота, кислорода и атома серы", включает тиофен, фуран, пиррол, имидазол, пиразол, тиазол, оксазол, изотиазол, изоксазол, триазол, тиадиазол, оксадиозол и т.п., из которых предпочтительными являются тиофен и фуран.
Соединение (I) данного изобретения может содержать асимметрический атом в зависимости от типов групп. Вследствие этого, в понятие соединение (I) данного изобретения включены также смесь или выделенная форма оптических изомеров.
Соединение (I) данного изобретения может образовывать кислотно-аддитивные соли. Эти соли также включены в понятие соединение данного изобретения. Иллюстративные примеры солей включают кислотно-аддитивные соли с неорганическими кислотами (например, хлористоводородной кислотой, бромистоводородной кислотой, йодистоводородной кислотой, серной кислотой, азотной кислотой, фосфорной кислотой и т.п.), с органическими кислотами (например, муравьиной кислотой, уксусной, пропионовой, щавелевой, малоновой, янтарной, фумаровой, малеиновой, молочной, винной, лимонной, метансульфоновой кислотой, этансульфоновой кислотой и т.п.), и с кислыми аминокислотами (например, аспарагиновой кислотой, глутаминовой кислотой и т.п.).
Кроме того, соединение (I) данного изобретения или его фармацевтически приемлемая соль могут быть выделены в виде гидратов, различных типов сольватов (например, этанольный сольват и т.п.) или их полиморфных форм, и эти различные гидраты, сольваты и полиморфные формы также включены в понятие соединение данного изобретения.
(Способ получения)
Соединение (I) данного изобретения может быть получено путем применения различных синтетических способов на основе использования характерных свойств его основного ядра или заместителей. Типичные способы получения описаны далее.
Способ получения 1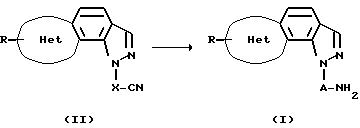
(В представленной выше схеме реакций кольцо Het, R и А имеют данные выше значения, а Х обозначает алкиленовую группу, имеющую число атомов углерода на один атом меньше, чем число атомов углерода А).
Соединение (I) данного изобретения может быть получено восстановлением нитрильного соединения, представленного общей формулой (II).
Данная реакция может осуществляться при охлаждении или при нагревании, предпочтительно при комнатной температуре, с использованием подходящего восстанавливающего агента в присутствии или в отсутствие подходящего инертного растворителя, такого как диэтиловый эфир, трет-бутилметиловый эфир, тетрагидрофуран, диоксан, 1,2-диметоксиэтан, метиленхлорид, бензол или толуол, предпочтительно в простых эфирах (например, тетрагидрофуране и т.п. ), и, если необходимо, в присутствии подходящей кислоты Льюиса. В качестве кислоты Льюиса может использоваться хлорид алюминия или аналогичные, в качестве восстанавливающего агента может использоваться комплексный гидрид, такой как литийалюминийгидрид или т.п.
Альтернативно, реакцию можно проводить каталитическим гидрированием на содержащем металл катализаторе, предпочтительно на катализаторе палладий-уголь, оксид платины, никель Ренея или т.п., с использованием подходящего растворителя, такого как этилацетат, спирт, тетрагидрофуран, диоксан, уксусная кислота или их смеси.
Способ получения 2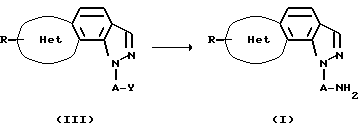
(В приведенной выше схеме реакций, кольцо Het, R и А имеют определенные выше значения и Y обозначает защищенную аминогруппу, такую как азидогруппа, ацетамидогруппа или аналогичные.
Соединение (I) данного изобретения может быть получено восстановлением или удалением защиты соединения (III).
Когда Y представляет азидо группу и т.п., восстановление можно проводить в условиях от охлаждения до условий нагревания, предпочтительно при комнатной температуре, с использованием подходящего восстанавливающего агента в присутствии или в отсутствие того же соответствующего инертного растворителя, который использовали в способе получения 1, предпочтительно в эфирах (например, тетрагидрофуране и т.п.), и, если необходимо, в присутствии подходящей кислоты Льюиса, такой как хлорид алюминий и т.п. В качестве восстанавливающего агента или восстановителя можно использовать комплексный гидрид, такой как литийалюминийгидрид и т.п.). Альтернативно, данную реакцию можно проводить каталитическим гидрированием на катализаторе-металле, предпочтительно на катализаторе палладий-уголь, оксид платины, никель Ренея или аналогичные с использованием подходящего растворителя, такого как этилацетат, спирт, тетрагидрофуран, диоксан, уксусная кислота или их смесь, или с использованием трифенилфосфина.
Когда Y представляет собой ацетамидо группу и т.п., можно использовать способ, подобный описанному в Protecting Groups in Organic Synthesis, John Wiley and Sons, Inc. Предпочтительно, реакцию можно проводить в условиях от охлаждения до нагревания, предпочтительно при нагревании в подходящем растворителе, таком как вода, этиленгликоль, диоксан, тетрагидрофуран, ацетонитрил, 1,2-диметоксиэтан или спирт (например, метанол, этанол, пропанол, изопропанол и т.п.), в присутствии подходящего основания, такого как гидроксид калия, гидроксид натрия, гидроксид лития, карбонат калия, карбонат натрия, карбонат лития, аммиак, метоксид натрия, этоксид натрия и т.п., предпочтительно в присутствии оксида металла, такого как гидроксид калия, гидроксид натрия или аналогичные.
Исходные соединения каждого из вышеупомянутых способов получения 1 и 2 могут быть легко получены с использованием способов ссылочных примеров и примеров, которые будут описаны ниже, непосредственно или с их модификацией или с применением их.
Соединение данного изобретения, полученное таким образом, выделяют в его свободной форме или в виде его соли. Соль соединения данного изобретения может быть получена подтверждением соединения данного изобретения в форме свободного основания обычной реакции образования соли.
Соединение (I) данного изобретения или его соль могут быть также выделены и очищены в виде гидрата или сольвата или в их полиморфной форме. Выделение и очистка могут проводиться обычно с использованием химических способов, таких как экстракция, концентрирование, выпаривание, кристаллизация, фильтрование, перекристаллизация, и различных хроматографических приемов.
Различные типы изомеров могут быть разделены путем отбора соответствующего исходного соединения или с использованием различия в физических свойствах изомеров. Например, оптические изомеры могут быть получены в виде стереохимически чистых изомеров с помощью отбора соответствующего материала или могут быть разделены проведением рацемического разделения рацемического соединения (например, с помощью способа, в котором соединение преобразуют в диастереомерные соли с обычной оптически активной кислотой и затем подвергают оптическому разделению).
Промышленная применимость
Поскольку соединение данного изобретения обладает высоким сродством и избирательностью в отношении 5-HT2c-рецептора и является эффективным на животных моделях, оно полезно для лечения заболеваний центральной нервной системы, таких как сексуальные расстройства (например, импотенция и т.п.), ожирение, нарушения аппетита (например, гиперфагия, гипофагия), тревога, депрессия и нарушение сна.
Избирательность и сродство соединения данного изобретения в отношении 5-НТ2с-рецептора и его оценка на животной модели с использованием крыс подтверждались следующими способами.
А. Тест связывания
5-НТ2с-рецепторы и 5-НТ2А-рецепторы: выполняли при помощи теста связывания [3Н] -5-НТ согласно способу A. Pazos et. al. , Eur.J. Pharmacol., 106,539-546 (1985) или S.Havlik and S.J. Peroutka, Brain Res., 584, 191-196 (1992).
При помощи вышеуказанного способа вычисляли концентрацию лекарственного средства, которая ингибирует 50% связывания рецептора с лигандом (величину IC50) и получали величину Ki, которая представляет сродство в отношении рецептора, по следующей формуле.
Ki = IC50/(1 + [L]/[K])
[L]: концентрация лиганда, [Kd]: константа диссоциации.
Результаты представлены в таблице 1.
Таким образом, соединение данного изобретения показало высокое сродство в отношении 5-HT2c-рецептора и приблизительно в 20 раз более высокую селективность в сравнении с селективностью в отношении 5-НТ2А-рецептора.
В. Тест in vivo с использованием крыс
Индукция эрекции полового члена у крыс: Известно, что эрекция полового члена индуцируется стимуляцией 5-HT2c-рецептора (Berendsen and Broekkamp, Eur. J. Pharmacol., 135, 179-184 (1987)). Тест-соединение вводили крысам и частоту эрекции полового члена в течение 30 минут после введения измеряли для получения минимальной эффективной дозы, при которой наблюдали статистически значимую реакцию.
Результаты представлены в таблице 2.
Таким образом, соединение данного изобретения эффективно на животной модели с использованием крыс и, следовательно, полезно для лечения заболеваний центральной нервной системы, таких как сексуальные расстройства (например, импотенция и т.п.).
Фармацевтическую композицию, которая содержит одно или несколько соединений (I) данного изобретения, их фармацевтически приемлемые соли, гидраты, сольваты и т.п. в качестве активного ингредиента, готовят в виде таблеток, порошков, мелких гранул, капсул, пилюль, растворов, инъекций, суппозиториев, мазей, адгезивных препаратов и т.п. с использованием фармацевтических носителей, наполнителей и других добавок и вводимых перорально (включая (подъязычное) сублингвальное введение) или парентерально.
Клиническая доза соединения (I) данного изобретения для человека определяется факультативно с учетом симптомов, веса, возраста, пола и т.п. каждого получающего лечение пациента, а также пути введения и т.п., и перорально соединение может вводиться обычно в дозе от 10 мг до 1000 мг, предпочтительно от 50 мг до 200 мг, в день для взрослого пациента и суточная доза может быть разделена на 1 до нескольких доз в день, или оно может вводиться с помощью внутривенной инъекции обычно в дозе от 1 мг до 500 мг, предпочтительно от 5 мг до 100 мг в день для взрослого человека, и суточная доза может быть разделена на 1 до нескольких доз в день, или вводиться внутривенным капельным вливанием на протяжении от 1 часа до 24 часов в день. Поскольку эта доза варьируется в зависимости от различных условий, как описано выше, во многих случаях может быть достаточной более низкая доза, чем указанный выше интервал.
Твердую композицию для применения при пероральном введении согласно данному изобретению используют в форме таблеток, порошков, гранул и т.п. В такой твердой композиции один или несколько активных веществ смешаны, по меньшей мере, с одним инертным разбавителем, таким как лактоза, маннит, глюкоза, гидроксипропилцеллюлоза, микрокристаллическая целлюлоза, крахмал, поливинилпирролидон или силикат алюминия-магния. Обычно композиция может содержать другие добавки, кроме инертного разбавителя, такие как стеарат магния или аналогичное смазочное вещество, гликолят кальция-целлюлозы или аналогичный дезинтегрирующий агент, лактозу или аналогичный стабилизирующий агент и глутаминовую кислоту, аспарагиновую кислоту или аналогичный способствующий солюбилизации агент. Если необходимо, таблетки или пилюли могут быть покрыты сахарным покрытием или пленкой желудочного или энтерического вещества, такого как сахароза, желатин, гидроксипропилцеллюлоза, фталат гидроксипропилметил-целлюлозы или аналогичные.
Жидкая композиция для применения при пероральном введении включает фармацевтически приемлемые эмульсии, растворы, суспензии, сиропы, эликсиры и т. п. и содержит обычно используемый инертный разбавитель, такой как очищенная вода или этиловый спирт. Кроме инертного разбавителя, эта композиция может также содержать вспомогательные средства (например, солюбилизирующий или способствующий солюбилизации агент, увлажняющий агент, суспендирующий агент и т.п.), а также подслащивающие вещества, улучшающие вкус и запах вещества, ароматические вещества и антисептики.
Инъекционные препараты для применения при парентеральном введении включают асептические водные или неводные растворы, суспензии и эмульсии. Примеры разбавителя для использования в водных растворах и суспензиях включают дистиллированную воду для инъекций и физиологический солевой раствор. Примеры разбавителя для применения в неводных растворах и суспензиях включают пропиленгликоль, полиэтиленгликоль, оливковое масло или аналогичное растительное масло, этанол или аналогичный спирт, полисорбат 80 (торговое наименование) и т.п. Такая композиция может дополнительно содержать добавочные агенты, такие как агент тоничности, антисептик, увлажняющий агент, эмульгатор, диспергатор, стабилизирующий агент (например, лактозу) и солюбилизирующий или способствующий солюбилизации агент. Эти композиции стерилизуются фильтрованием через удерживающий бактерии фильтр, смешиванием с гермицидом или облучением. Альтернативно, они могут использоваться путем приготовления сначала стерильных твердых композиций с последующим растворением их в стерильной воде или стерильном растворителе для инъекций перед их применением.
Наилучший способ проведения изобретения
Примеры данного изобретения приведены ниже для иллюстрации, но не для ограничения. В этой связи исходные соединения для использования в примерах описаны в виде ссылочных примеров.
Ссылочный пример 1
К раствору тетрагидрофурана (80 мл), содержащему 7,29 г третбутоксида калия, добавляли по каплям и при охлаждении льдом раствор тетрагидрофурана (40 мл), содержащий 4,42 г 6,7-дигидро-5Н-бензофуран-4-она и 10,47 мл этилформиата и смесь перемешивали в течение 1 часа. Затем к реакционному раствору добавляли 6,97 мл гидразиноэтанола, добавляли 1 н. хлористоводородную кислоту для доведения величины рН до ~9 и затем смесь перемешивали при комнатной температуре в течение 17 часов. Реакционный раствор подщелачивали добавлением водного раствора гидроксида натрия и затем экстрагировали хлороформом. Органические слои объединяли, промывали солевым раствором и затем сушили над безводным сульфатом магния. После выпаривания растворителя полученный остаток очищали колоночной хроматографией на силикагеле (элюент: хлороформ/метанол = 95/5) с получением 4,67 г 2-(4,5-дигидро-1Н-фуро [2,3-g] индазол-1-ил)этанола в виде бледно-желтого твердого вещества.
Ссылочный пример 2
Так же, как описано в ссылочном примере 1, получали 1,2-(4,5-дигидро-1Н-фуро[2,3-g] индазол-1-ил)этанол.
Ссылочный пример 3
К раствору тетрагидрофурана (20 мл), содержащему 2,95 г третбутоксидакалия, добавляли по каплям и при охлаждении льдом раствор в тетрагидрофуране (10 мл), содержащий 2,00 г 4-оксо-4,5,6,7-тетрабензо[b]тиофена и 3,89 мл этилформиата, и смесь перемешивали в течение 30 минут. После завершения реакции добавляли 26 мл 1 н. хлористоводородной кислоты. Затем добавляли при охлаждении льдом 3,16 г гидразиноэтанола и смесь перемешивали при комнатной температуре в течение 2 часов. Реакционный раствор экстрагировали метиленхлоридом. Органические слои объединяли, промывали солевым раствором и затем сушили над безводным сульфатом магния. После удаления осушающего агента фильтрованием полученный фильтрат концентрировали при пониженном давлении с получением 1,56 г 2-(4,5-дигидро-1Н-тиено [2,3-g]индазол-1-ил)этанола в виде бледно-желтого твердого вещества.
Соединение ссылочных примеров 4-7 получали так же, как описано в ссылочном примере 3.
Ссылочный пример 4: 2-(7-Бром-4,5-дигидро-1Н-тиено[2,3-g]индазол-1-ил)этанол
Ссылочный пример 5: 2-(4,5-Дигидро-7-йод-4,5-дигидро-1Н-тиено[2,3-g]индазол-1-ил)этанол
Ссылочный пример 6: 2-(7-Хлор-4,5-дигидро-1Н-тиено[2,3-g]индазол-1-ил)этанол
Ссылочный пример 7: 2-(7-Метокси-4,5-дигидро-1Н-тиено[2,3-g]индазол-1-ил)этанол
Ссылочный пример 8:
2,04 г 2-(4,5-дигидро-1Н-тиено[2,3-g]индазол-1-ил)этанолa растворяли в 40 мл метиленхлорида и добавляли 4,18 мл триэтиламина и 1,16 мл метансульфонилхдорида и смесь перемешивали при комнатной температуре в течение 2 часов. Реакционный раствор выливали в воду со льдом и экстрагировали хлороформом. Органические слои объединяли, промывали солевым раствором и затем сушили над безводным сульфатом магния. После удаления осушающего агента фильтрованием полученный фильтрат концентрировали при пониженном давлении с получением 3,23 г 2-(4,5-дигидро-1Н-тиено[2,3-g]индазол-1-ил)этилметансульфоната.
Ссылочный пример 9:
3,23 г 2-(4, 5-дигидро-1Н-фуро[2,3-g] индазол-l-ил)этилметансульфоната растворяли в 20 мл диметилформамида, добавляли 1,95 мл азида натрия и смесь перемешивали при 70oС в течение 17 часов. Реакционный раствор охлаждали, выливали в воду со льдом и затем экстрагировали эфиром. Органические слои объединяли, промывали солевым раствором и затем сушили над безводным сульфатом магния. После удаления осушающего агента фильтрованием растворитель концентрировали при пониженном давлении и полученный остаток очищали колоночной хроматографией на силикагеле (элюент:гексан/этилацетат = 2/1) с получением 1,64 г 1-(2-азидоэтил)-4,5-дигидро-1Н-фуро[2,3-g]индазола
Ссылочный пример 10:
1,35 г 2-(4,5-дигидро-1Н-фуро[3,2-g]индазол-1-ил)этанола растворяли в 20 мл метиленхлорида, добавляли 2,76 мл триэтиламина и 0,77 мл метансульфонилхдорида и смесь перемешивали при комнатной температуре в течение 1 часа. Реакционный раствор выливали в смесь воды со льдом и затем экстрагировали хлороформом. Органические слои объединяли, промывали солевым раствором и затем сушили над безводным сульфатом магния. После удаления осушающего агента фильтрованием растворитель концентрировали при пониженном давлении, полученный остаток растворяли в 20 мл диметилформамида. Затем добавляли 1,29 г азида натрия и смесь перемешивали при 80oС в течение 5 часов. После охлаждения реакционный раствор выливали в воду со льдом и затем экстрагировали эфиром. Органические слои объединяли, промывали солевым раствором и затем сушили над безводным сульфатом магния. После удаления осушающего агента фильтрованием растворитель концентрировали при пониженном давлении с получением 1,30 г 1-(2-азидоэтил)-4,5-дигидро-lH-фуро[3,2-g]индазола.
Ссылочный пример 11:
5,10 г 2-(4,5-дигидро-1Н-тиено [2,3-g]индазол-1-ил)этанола растворяли в 50 мл 1,2-дихлорэтана, добавляли при 0oС 7,74 мл триэтиламина и 2,15 мл метансульфонилхлорида, и смесь перемешивали в течение 2 часов. Реакционный раствор выливали в смесь воды со льдом и затем экстрагировали хлороформом. Органические слои объединяли и затем сушили над безводным сульфатом магния. После удаления осушающего агента фильтрованием растворитель концентрировали при пониженном давлении, и полученный остаток растворяли в 30 мл диметилформамида. Затем добавляли 3,01 г азида натрия и смесь перемешивали при 80oС в течение 3 часов. Реакционный раствор охлаждали, выливали в воду со льдом и затем экстрагировали этилацетатом. Органические слои объединяли, промывали водой и солевым раствором в указанном порядке и затем сушили над безводным сульфатом магния. После удаления осушающего агента фильтрованием растворитель концентрировали при пониженном давлении и полученный остаток очищали колоночной хроматографией на силикагеле (элюент:толуол/этилацетат = 5) с получением 3,39 г 1-(2-азидоэтил)-4,5-дигидро-1Н-тиено[2,3-g]индазола в виде желтого масла.
Ссылочный пример 12:
1,00 г 1-(2-азидоэтил)-4,5-дигидро-1Н-тиено[2,3-g]индазола растворяли в 30 мл диоксана, добавляли при комнатной температуре 2,80 г 2,3-дихлор-5,6-дициано-1,4-бензохинона и смесь нагревали с обратным холодильником в течение 8 часов. Реакционный раствор охлаждали, выливали в водный раствор бикарбоната натрия и затем экстрагировали хлороформом. Органические слои объединяли и сушили над безводным сульфатом магния. После удаления осушающего агента фильтрованием растворитель концентрировали при пониженном давлении и полученный остаток очищали колоночной хроматографией на силикагеле (элюент:толуол/этилацетат = 6) с получением 0,73 г 1-(2-азидоэтил)-1Н-тиено[2,3-g]индазола в виде бледно-коричневого масла.
Ссылочный пример 13:
Таким же образом, как описано в ссылочном примере 10, получали 1-(2-азидоэтил)-7-бром-4,5-дигидро-1Н-тиено[2,3-g]-индазол.
Ссылочный пример 14:
Таким же образом, как описано в ссылочном примере 12, получали 1-(2-азидоэтил)-7-бром-1Н-тиено[2,3-g]индазол.
Ссылочный пример 15:
Таким же образом, как описано в ссылочном примере 10, получали 1-(2-азидоэтил)-4,5-дигидро-7-йод-1Н-тиено[2,3-g]-индазол.
Ссылочный пример 16:
Таким же образом, как описано в ссылочном примере 12, получали 1-(2-азидоэтил)-7-йод-1Н-тиено[2,3-g]индазол.
Соединения ссылочных примеров 17 и 18 получали так же, как описано в ссылочном примере 10.
Ссылочный пример 17: 1-(2-Азидоэтил)-7-хлор-4,5-дигидро-1Н-тиено[2,3-g] индазол.
Ссылочный пример 18: 1-(2-Азидоэтил)-7-метокси-4,5-дигидро-1Н-тиено[2,3-g]индазол.
Ссылочный пример 19:
0,51 г литийалюминийгидрида суспендировали в 20 мл тетрагидрофурана в атмосфере аргона. При охлаждении льдом к суспензии добавляли 1,55 г 1-(2-азидоэтил)-4,5-дигидро-1Н-фуро [2,3g]индaзoлa и смесь перемешивали в течение 1 часа. Для разрушения избытка литийалюминийгидрида к реакционному раствору добавляли метанол и затем добавляли 0,51 мл воды, 0,51 мл 15% водного раствора гидроксида натрия и 1,53 мл воды в такой последовательности. Полученную смесь перемешивали в течение 30 минут, добавляли безводный сульфат натрия и целит и затем смесь перемешивали еще в течение 30 минут. Полученный нерастворимый материал удаляли фильтрованием через целит, полученный фильтрат концентрировали и полученный остаток очищали колоночной хроматографией на силикагеле (элюент: хлороформ/метанол = 9/1) с получением 1,26 г 2-(4,5-дигидро-1Н-фуро[2,3-g] индазол-1-ил)этиламина. 0,11 г 2-(4,5-дигидро-1Н-фуро[2,3-g] индазол-1-ил) этиламина растворяли в смеси этанола и этилацетата. Затем добавляли 4 н. хлористоводородную кислоту в этилацетате и полученный осадок собирали фильтрованием и сушили при пониженном давлении с получением 0,092 г гидрохлорида 2-(4,5-дигидро-1Н-фуро[2,3-g]индазол-l-ил) этиламина.
Ссылочный пример 20:
Таким же образом, как описано в ссылочном примере 19, получали 2-(4,5-дигидро-1Н-фуро[2,3-g] индазол-1-ил)-этиламина.
Ссылочный пример 21:
1,15 г 2-(4,5-дигидро-1Н-фуро[2,3-g]индазол-1-ил)этиламина растворяли в 40 мл метиленхлорида, добавляли 0,64 мл уксусного ангидрида, 1,91 мл триэтиламина и 30 мг диметиламинопиридина и смесь перемешивали при комнатной температуре в течение 18 часов. Растворитель выпаривали и полученный остаток очищали колоночной хроматографией на силикагеле (элюент:хлороформ/метанол = 98/2) с получением 1,28 г N[2-(4,5-дигидро-1Н-фуро[2,3-g]индазол-1-ил)этил] -ацетамида.
Ссылочный пример 22:
Так же, как описано в ссылочном примере 21, получали N-[2-(4,5-дигидро-1Н-фуро[3,2-g]индазол-1-ил)этил]ацетамид.
Ссылочный пример 23:
1,24 г N-[2-(4,5-дигидро-1Н-фуро[2,3-g] индазол-1-ил)этил] ацетамида растворяли в 20 мл диоксана, добавляли 1,16 г 2,3-дихлор-5,6-дициано-1,4-бензохинона и смесь нагревали с обратным холодильником в течение 4 часов.
Затем добавляли 0,58 г 2,3-дихлор-5,6-дициано-1,4-бензохинона и смесь дополнительно нагревали с обратным холодильником в течение 17 часов. Реакционный раствор охлаждали, выливали в водный раствор бикарбоната натрия и затем экстрагировали этилацетатом. Органические слои объединяли, промывали солевым раствором и затем сушили над безводным сульфатом магния. После удаления осушающего агента фильтрованием растворитель концентрировали при пониженном давлении и полученный остаток очищали колоночной хроматографией на силикагеле (элюент: гексан/этилацетат = 1/4) с получением 0,53 г N-[2-lH-фуро[2,3-g]индазол-1-ил)этил]ацетамида.
Ссылочный пример 24:
0,44 г литийалюминийгидрида суспендировали в 50 мл тетрагидрофурана в атмосфере аргона, добавляли по каплям раствор в тетрагидрофуране (10 мл), содержащий 2,60 г (1Н-фуро[2,3-g]индазол-1-ил)этилацетата, и смесь перемешивали при комнатной температуре в течение 1 часа. При охлаждении льдом к реакционному раствору добавляли метанол для разрушения избытка литийалюминийгидрида и затем добавляли 0,44 мл воды, 0,44 мл 15% водного раствора гидроксида натрия и 1,30 мл воды в указанной последовательности. Полученную смесь перемешивали в течение 30 минут, добавляли безводный сульфат магния и целит, и затем смесь перемешивали дополнительно в течение 30 минут. После удаления нерастворимого материала фильтрованием через целит, полученный фильтрат концентрировали при пониженном давлении с получением 1,82 г 2-(1Н-фуро[2,3-g]индазол-1-ил)этанола.
Ссылочный пример 25:
Раствор в диметилсульфоксиде (15 мл), содержащий 4,20 мл триэтиламина и 4,74 г комплекса SО3-пиридин, добавляли к раствору в диметилсульфоксиде, содержащему 1,80 г 2-(1Н-фуро[2,3-g]индазол-1-ил)этанола, и смесь перемешивали при комнатной температуре в течение 30 минут. Реакционный раствор выливали в воду, подкисляли 1 н. хлористоводородной кислотой и затем экстрагировали этилацетатом. Органические слои объединяли, промывали солевым раствором и затем сушили над безводным сульфатом магния. После удаления осушающего агента фильтрованием растворитель концентрировали при пониженном давлении и полученный остаток очищали колоночной хроматографией на силикагеле (элюент: гексан/этилацетат = 1) с получением 0,89 г (lH-фуро[2,3-g]индазол-1-ил)ацетальдегида.
Ссылочный пример 26:
При охлаждении льдом раствор в диметилформамиде (5 мл), содержащий 1,00 г 1Н-фуро[2,3-g]индазола, добавляли по каплям к раствору в диметилформамиде (10 мл), содержащему 0,27 г гидрида натрия, в атмосфере аргона и смесь перемешивали в течение 30 минут. К реакционному раствору при охлаждении льдом добавляли 0,52 мл пропиленоксида и смесь перемешивали при комнатной температуре в течение 41 часа. Реакционный раствор выливали в смесь воды со льдом и экстрагировали этилацетатом. Органические слои объединяли, промывали солевым раствором и затем сушили над безводным сульфатом магния. После выпаривания растворителя полученный остаток очищали колоночной хроматографией на силикагеле (элюент: гексан/этилацетат = 2) с получением 0,59 г 1-(1H-фуро[2,3-g]индазол-1-ил)пропан-2-ола.
Ссылочный пример 27:
В атмосфере аргона 5 мл 1,0 М раствора этилмагнийбромида в тетрагидрофуране разбавляли 5 мл тетрагидрофурана, добавляли по каплям раствор в тетрагидрофуране (5 мл) 0,30 г (1H-фуро[2,3-g]индазол-1-ил)ацетальдегида и смесь перемешивали при комнатной температуре в течение 3 дней. Реакционный раствор выливали в водный раствор хлорида аммония и экстрагировали этилацетатом. Органические слои объединяли, промывали солевым раствором и затем сушили над безводным сульфатом магния. После выпаривания растворителя полученный остаток очищали колоночной хроматографией на силикагеле (элюент: гексан/этилацетат = 1) с получением 0,29 г 1-(1H-фуро[2,3-g] индазол-1-ил)бутанола.
Соединения ссылочных примеров 28 и 29 получали так же, как описано в ссылочном примере 27.
Ссылочный пример 28: 1-(lH-Фуро[2,3-g]индазол-l-ил)пентанол.
Ссылочный пример 29: 1-(1H-Фуро [2,3-g]индазол-1-ил)-3-метил-2-бутанол.
Соединений ссылочных примеров 30-32 получали так же, как описано в ссылочном примере 8.
Ссылочный пример 30: 2-(1H-Фуро[2,3-g]индазол-1-ил)-1-метилэтилметансульфонат
Ссылочный пример 31: 1-(1H-Фуро[2,3-g]индазол-1-илметил)бутилметансульфонат
Ссылочный пример 32: 1-(lH-фуро[2,3-g]индазол-1-илметил) -2-метилпропилметансульфонат
Ссылочный пример 33:
Так же, как описано в ссылочном примере 9, получали 1-(2-азидопропил)-1H-фуро[2,3-g]индазол.
Ссылочный пример 34:
Так же, как описано в ссылочном примере 10, получали 1-(2-азидобутил)-lH-фуро[2,3-g] индазол.
Ссылочный пример 35:
Так же, как описано в ссылочном примере 3, получали 2-(8-метил-4,5-дигидро-1Н-пиразоло [3,4-е]бензизоксазол-1-ил) этанол.
Ссылочный пример 36:
Так же, как описано в ссылочном примере 10, получали 1-(2-азидоэтил)-8-метил-4,5-дигидро-1H-пиразоло[3,4-е] [1,2]бензизоксазол.
Ссылочный пример 37:
Так же, как описано в ссылочном примере 12, получали 1-(2-азидоэтил)-8-метил-1H-пиразоло[3,4-е][1,2]бензизоксазол.
Ссылочный пример 38:
0,14 г гидрида натрия промывали гексаном в атмосфере аргона и добавляли 5 мл диметилформамида. При охлаждении льдом постепенно добавляли 0,50 г 1H-фуро[2,3-g]индазол в 5 мл диметилформамида и смесь перемешивали в течение 1 часа. К реакционному раствору при охлаждении льдом добавляли 0,33 мл 2-бромпропиононитрила и смесь перемешивали при комнатной температуре в течение 2 часов. Реакционный раствор выливали в смесь воды со льдом и экстрагировали этилацетатом. Органические слои объединяли, промывали солевым раствором и затем сушили над безводным сульфатом магния. После выпаривания растворителя полученный остаток очищали колоночной хроматографией на силикагеле (элюент: гексан/этилацетат = 4) с получением 0,45 г 2-(1H-фуро[2,3-g]индазол-1-ил)пропиононитрила.
Ссылочный пример 39:
Так же, как описано в ссылочных примерах 26 и 10, получали (S)-1-(2-азидопропил)-1H-фуро[2,3-g]индазол.
Пример 1
1,60 г гидроксида калия добавляли к раствору в этиленгликоле (20 мл), содержащему 0,51 г N-[2-(1H-фуро[2,3-g]индазол-1-ил)этил]ацетамида, и смесь перемешивали при 170oС в течение 2 часов. Реакционный раствор охлаждали, разбавляли водой и затем экстрагировали этилацетатом. Органические слои объединяли, промывали водой и солевым раствором и затем сушили над безводным сульфатом магния. После удаления осушающего агента фильтрованием полученный фильтрат концентрировали и полученный остаток очищали колоночной хроматографией на силикагеле (элюент:хлороформ/метанол = 95/5) с получением 2-(1H-фуро[2,3-g] индазол-1-ил)этиламина. Полученный 2-(1H-фуро[2,3-g] индазол-1-ил)этиламин растворяли в смеси этанола и этилацетата, к полученному раствору добавляли 4 н. хлористоводородную кислоту в этилацетате и полученный осадок собирали фильтрованием и сушили при пониженном давлении с получением 0,06 г гидрохлорида 2-(1H-фуро [2,3-g]индазол-1-ил)этиламина.
Пример 2
0,94 г N-[2-(4,5-дигидро-1Н-фуро[3,2-g] индазол-l-ил)этил] ацетамида растворяли в 20 мл диоксана, добавляли 0,86 г 2,3-дихлор-5,6-дициано-1,4-бензохинона и смесь нагревали с обратным холодильником в течение 4 часов. Затем добавляли 0,86 г 2,3-дихлор-5,6-дициано-1,4-бензохинона и смесь нагревали с обратным холодильником в течение 17 часов. Реакционную смесь охлаждали, выливали в водный раствор бикарбоната натрия и затем экстрагировали этилацетатом. Органические слои объединяли, промывали солевым раствором и затем сушили над безводным сульфатом магния. После удаления осушающего агента фильтрованием полученный фильтрат концентрировали при пониженном давлении и полученный остаток очищали колоночной хроматографией на силикагеле (элюент: этилацетат/гексан = 4) с получением 0,075 г N-[2-(1H-фуро[3,2-g]индазол-1-ил)этил] ацетамида. Его растворяли в 10 мл этиленгликоля, добавляли 0,40 г гидроксида калия и смесь перемешивали при 170oС в течение 2 часов. Реакционный раствор охлаждали, разбавляли водой и затем экстрагировали этилацетатом. Органические слои объединяли, промывали водой и солевым раствором и затем сушили над безводным сульфатом магния. После удаления осушающего агента фильтрованием полученный фильтрат концентрировали и полученный остаток очищали колоночной хроматографией на силикагеле (элюент:хлороформ/метанол = 95/5) с получением 2-(1H-фуро[3,8] индазол-1-ил)этиламина. Полученный 2-(1H-фуро[3,8]индазол-1-ил)этиламин растворяли в смеси этанола и этилацетата, к полученному раствору добавляли 4 н. хлористоводородную кислоту в этилацетате и полученный осадок собирали фильтрованием и сушили при пониженном давлении с получением 0,03 г гидрохлорида 2-(1H-фуро [3,2-g] индазол-1-ил)этиламина.
Соединение примеров 3 и 4 получили так же, как описано в ссылочном примере 19.
Пример 3: Гидрохлорид 2-(1H-фуро[2,3-g]индазол-1-ил)-1-метилэтиламина
Исходное соединение: 1-(2-Азидопропил)-1H-фуро[2,3-g]индазол
Пример 4: Гидрохлорид 1-этил-2-(1H-фуро[2,3-g]индазол-1-ил)этиламина
Исходное соединение: 1-(2-Азидобутил)-(1H-фуро[2,3-g]индазол
Пример 5:
0,045 г азида натрия добавляли к 0,088 г 1-(1H-фуро[2,3-g]индазол-1-илметил)бутилметансульфоната в 5 мл диметилформамида и смесь перемешивали при 80oС в течение 16 часов. Реакционный раствор охлаждали, выливали в смесь воды со льдом и затем экстрагировали эфиром. Органические слои объединяли, промывали солевым раствором и затем сушили над безводным сульфатом магния. После удаления осушающего агента фильтрованием полученный фильтрат концентрировали при пониженном давлении с получением 0,063 г 1-(2-азидопентил)-1H-фуро[2,3-g]индазола. В атмосфере аргона 0,018 г литийалюминийгидрида суспендировали в 5 мл тетрагидрофурана, к полученной суспензии при охлаждении льдом добавляли раствор в тетрагидрофуране (5 мл), содержащий 0,063 г 1-(2-азидопентил)-1H-фуро[2,3-g] индазола, и полученную смесь перемешивали в течение 30. минут. К реакционному раствору добавляли метанол для разрушения избытка литийалюминийгидрида. Затем добавляли 0,018 мл воды, 0,018 мл 15% водного раствора гидроксида натрия в указанной последовательности и полученную смесь перемешивали в течение 30 минут. Затем добавляли безводный сульфат натрия и целит и смесь дополнительно перемешивали в течение 30 минут. Полученный нерастворимый материал удаляли фильтрованием через целит, полученный фильтрат концентрировали и затем полученный остаток очищали колоночной хроматографией на силикагеле (элюент:хлороформ/метанол = 95/5) с получением 1-(1H-фуро [2,3-g]индазол-1-илметил)бутиламина. Полученный 1-(1H-фуро[2,3-g]индазол-1-илметил)бутиламин растворяли в смеси этанола и этилацетата, к полученному раствору добавляли 4 н. хлористоводородную кислоту в этилацетате и полученный осадок собирали фильтрованием и сушили при пониженном давлении с получением 0,04 г гидрохлорида 1-(1H-фуро[2,3-g]индазол-1-илметил)бутиламина.
Пример 6
Так же, как описано в примере 5, получали гидрохлорид 1-(1H-фуро [2,3-g] индазол-1-илметил) -2-метилпропиламина из 1-(1H-фуро[2,3-g]индазол-1-илметил)-2- метилпропилметансульфоната.
Пример 7
Так же, как описано в ссылочном примере 19, получали гидрохлорид 2-(1H-тиено[2,3-g] индазол-1-ил)этиламина из 1-(2-азидоэтил)-1H-тиено[2,3-g] индазола.
Пример 8
0,91 г трифенилфосфина добавляли к 0,93 г 1-(2-азидоэтил)-7-бром-1H-тиено[2,3-g] индазола, растворенного в 20 мл тетрагидрофурана, и раствор нагревали с обратным холодильником в течение 1,5 часов. Затем добавляли 0,08 г воды и смесь нагревали с обратным холодильником в течение 3 часов. Реакционную смесь охлаждали, концентрировали при пониженном давлении и затем разбавляли смесью метанола и метиленхлорида. Полученный раствор подкисляли добавлением 1 н. хлористоводородной кислотой, промывали хлороформом и полученный водный слой подщелачивали 40% водным раствором гидроксида натрия и опять экстрагировали хлороформом. Органические слои объединяли и сушили над безводным сульфатом магния. После удаления осушающего агента фильтрованием полученный фильтрат концентрировали при пониженном давлении и полученный остаток очищали колоночной хроматографией на силикагеле (элюент:хлороформ/метанол/насыщенный водный аммиак = 20/1/0,1-10/1/0,1) с получением 0,73 г 2-(7-бром-1H-тиено[2,3-g]индазол-1-ил)этиламина в виде бледно-желтого масла. Полученный 2-(7-бром-1H-тиено[2,3-g]индазол-1-ил)этиламин растворяли в 8 мл этанола, к полученному раствору добавляли 0,6 мл 4 н. хлористоводородной кислоты в этилацетате и полученный осадок собирали фильтрованием и сушили при пониженном давлении с получением 0,59 г гидрохлорида 2-(7-бром-1H-тиено[2,3-g]индазол-1-ил)этиламина.
Пример 9
Так же, как описано в примере 8, гидрохлорид 2-(7-йод-1H-тиено [2,3-g] индазол-1-ил)этиламина получали из 1-(2-азидоэтил)-(7-йод-1H-тиено[2,3-g] индазола.
Пример 10
1,48 г 1-(2-азидоэтил)-7-метокси-4,5-дигидро-1H-тиено[2,3-g] индазол растворяли в 20 мл диоксана, добавляли при комнатной температуре 3,66 г 2,3-дихлор-5,6-дициано-1,4-бензохинона и полученную смесь нагревали с обратным холодильником в течение 8 часов. Реакционным раствор охлаждали и выливали в водный раствор бикарбоната натрия, полученный нерастворимый материал удаляли фильтрованием через целит и затем полученный фильтрат экстрагировали этилацетатом. Органические слои объединяли, промывали солевым раствором, смешивали с активированным углем и затем сушили над безводным сульфатом магния. После удаления нерастворимого материала фильтрованием полученный фильтрат концентрировали при пониженном давлении, полученный остаток растворяли в 4 мл тетрагидрофурана. Затем добавляли 0,85 г трифенилфосфина и смесь нагревали при 50oС в течение 30 минут. Затем добавляли 0,18 г воды и смесь дополнительно нагревали при 50oС в течение 1 часа. После охлаждения к полученному раствору добавляли 1 мл 4 н. хлористоводородной кислоты и полученный осадок собирали фильтрованием и сушили при пониженном давлении. Полученный продукт перекристаллизовывали из этанола с получением гидрохлорида 2-(7-метокси-1Н-фуро[2,3-g]индазол-1-ил) этиламина в виде белого порошка.
Пример 11
Так же, как описано в примере 10, получали гидрохлорид 2-(7-хлор-1Н-тиено[2,3-g] индазол-1-ил)этиламина из 1-(2-азидоэтил)-7-хлор-4,5-дигидро-1Н-тиено[2,3-g]индазола.
Пример 12
Так же, как описано в примере 8, гидрохлорид 2-(8-метил-1Н-пиразоло[3,4-е] [1,2] бензизооксазол-1-ил) этиламина получали из 1-(2-азидоэтил)-8-метил-1Н-пиразоло[3,4-е][1,2]бензизооксазола.
Пример 13
В атмосфере аргона 0,08 г литийалюминийгидрида суспендировали в 20 мл тетрагидрофурана, добавляли при охлаждении льдом 0,29 г хлорида алюминия и смесь перемешивали в течение 15 минут. К суспензии добавляли раствор в тетрагидрофуране (5 мл) 0,42 г 2-(lH-фуро[2,3-g]индазол-1-ил)пропиононитрила при охлаждении льдом и смесь перемешивали при комнатной температуре в течение 30 минут. К реакционному раствору добавляли метанол для разрушения избытка реагента, добавляли 10 мл 40% водного раствора гидроксида натрия и затем смесь перемешивали в течение 10 минут. Полученный нерастворимый материал удаляли фильтрованием через целит и затем органические слои объединяли и сушили над безводным сульфатом магния. После удаления осушающего агента фильтрованием растворитель выпаривали и полученный остаток очищали колоночной хроматографией на силикагеле (элюент:хлороформ/метанол/насыщенный водный аммиак = 10/1/0,1) с получением 0,39 г 2-(1Н-фуро[2,3-g]индазол-1-ил) пропиламина. Полученный 2-(1Н-фуро[2,3-g]индазол-1-ил)пропиламин растворяли в этаноле, к полученному раствору добавляли 4 н. хлористоводородную кислоту в этилацетате и полученный осадок собирали фильтрованием и сушили при пониженном давлении с получением 0,22 г гидрохлорида 2-(1Н-фуро[2,3-g]индазол-1-ил)пропиламина в виде белого твердого вещества.
Пример 14
Так же, как описано в ссылочном примере 19, гидрохлорид (S)-2-(1Н-фуро[2,3-g] индазол-1-ил) метилэтиламина получали из (S)-1-(2-азидопропил)-1Н-фуро[2,3-g]индазола.
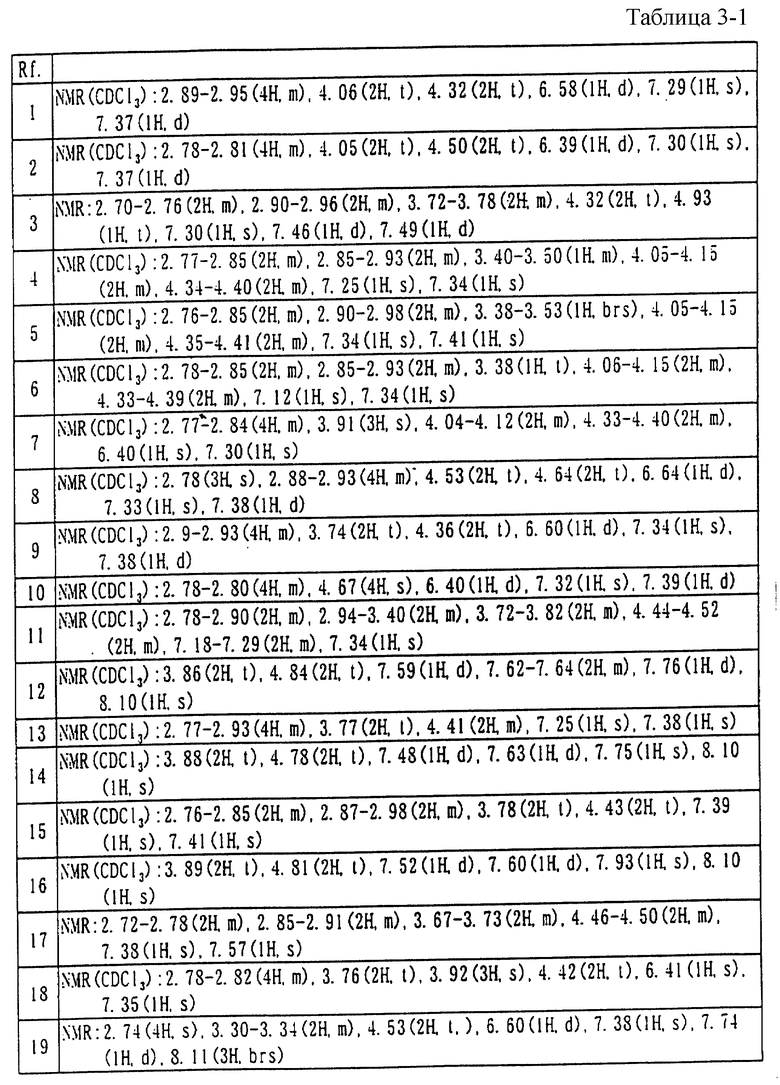
Химическая структурная формула (формулы) и физико-химические свойства соединений, полученных в ссылочных примерах и в примерах, показаны в следующих далее таблицах.
Каждый из символов использованных в таблицах, обозначает следующее:
Rf.: ссылочный пример
Ex.: пример
NMR: Спектр ядерного магнитного резонанса (DMSO-dg и TMS внутренний стандарт, если нет других указаний) δ:
S - синглет,
d - дублет,
dd - двойной дублет,
t - триплет,
m - мультиплет,
bzs - широкий синглет,
m/z Данные масс-спектрометрия (m/z),
Me: Метильная группа,
Et: Этильная группа,
Рг: Пропильная группа,
iPr: Изопропильная группа.
Пример готовой препаративной формы композиции
Композиция 3 мг таблеток
Соединение настоящего изобретения - 3 мг
D-маннит - 89,8 мг
Кукурузный крахмал - 22,4 мг
Гидроксипропилцеллюлоза - 3,6 мг
Стеарат магния - 1,2 мг
Всего - 120 мг
Способ получения 3 мг таблеток
С использованием устройства для получения гранул с покрытием псевдоожиженным слоем тщательно смешивают соединение настоящего изобретения (15 г), D-маннит (449 г) и кукурузный крахмал (112 г). Затем опрыскивают 10% водным раствором гидроксипропилцеллюлозы, и смесь гранулируют. После сушки гранулы просеивают через сито 20 меш, добавляют стеарат магния (6 г), и смесь таблетируют с использованием роторной таблетирующей машины с пуансоном 7 мм х 8,4 R, получая таблетки, каждая из которых содержит 3 мг соединения настоящего изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| КОНДЕНСИРОВАННОЕ ПРОИЗВОДНОЕ БЕНЗАЗЕПИНА, ПРОМЕЖУТОЧНОЕ СОЕДИНЕНИЕ ДЛЯ ЕГО ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1994 |
|
RU2129123C1 |
| ПРОИЗВОДНЫЕ АЗОЛА, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ, ПРОМЕЖУТОЧНЫЕ СОЕДИНЕНИЯ | 1995 |
|
RU2161612C2 |
| ПРОИЗВОДНЫЕ ПИПЕРАЗИНА | 1994 |
|
RU2124511C1 |
| ПРОИЗВОДНОЕ БЕНЗАЗЕПИНА, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ПРОИЗВОДНОЕ ДИФТОРБЕНЗАЗЕПИНА И ПРОИЗВОДНОЕ (ЗАМЕЩЕННОГО) АМИНОБЕНЗОИЛДИФТОРБЕНЗАЗЕПИНА | 1994 |
|
RU2137760C1 |
| НОВЫЕ ПРОИЗВОДНЫЕ ХИНУКЛИДИНА И МЕДИЦИНСКИЕ КОМПОЗИЦИИ, СОДЕРЖАЩИЕ ИХ | 1995 |
|
RU2143432C1 |
| ПРОИЗВОДНОЕ СКОНДЕНСИРОВАННОГО ПИРАЗИНА | 1991 |
|
RU2095352C1 |
| НОВЫЕ АМИДНЫЕ ПРОИЗВОДНЫЕ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ПРОМОТИРУЮЩАЯ СЕКРЕЦИЮ ИНСУЛИНА И УСИЛИВАЮЩАЯ ВОСПРИИМЧИВОСТЬ К ИНСУЛИНУ | 1998 |
|
RU2191177C2 |
| СПИРОСОЕДИНЕНИЕ ИЛИ ЕГО СОЛИ, СПОСОБ ЕГО ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ЕГО ОСНОВЕ, ОБЛАДАЮЩАЯ ПРОТИВОМИКРОБНОЙ АКТИВНОСТЬЮ | 1989 |
|
RU2094432C1 |
| ПРОИЗВОДНЫЕ БЕНЗОДИАЗЕПИНА, СПОСОБ ИХ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1993 |
|
RU2139282C1 |
| 1,2,3,4-ТЕТРАГИДРОХИНОКСАЛИНДИОНОВЫЕ ПРОИЗВОДНЫЕ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1995 |
|
RU2149873C1 |


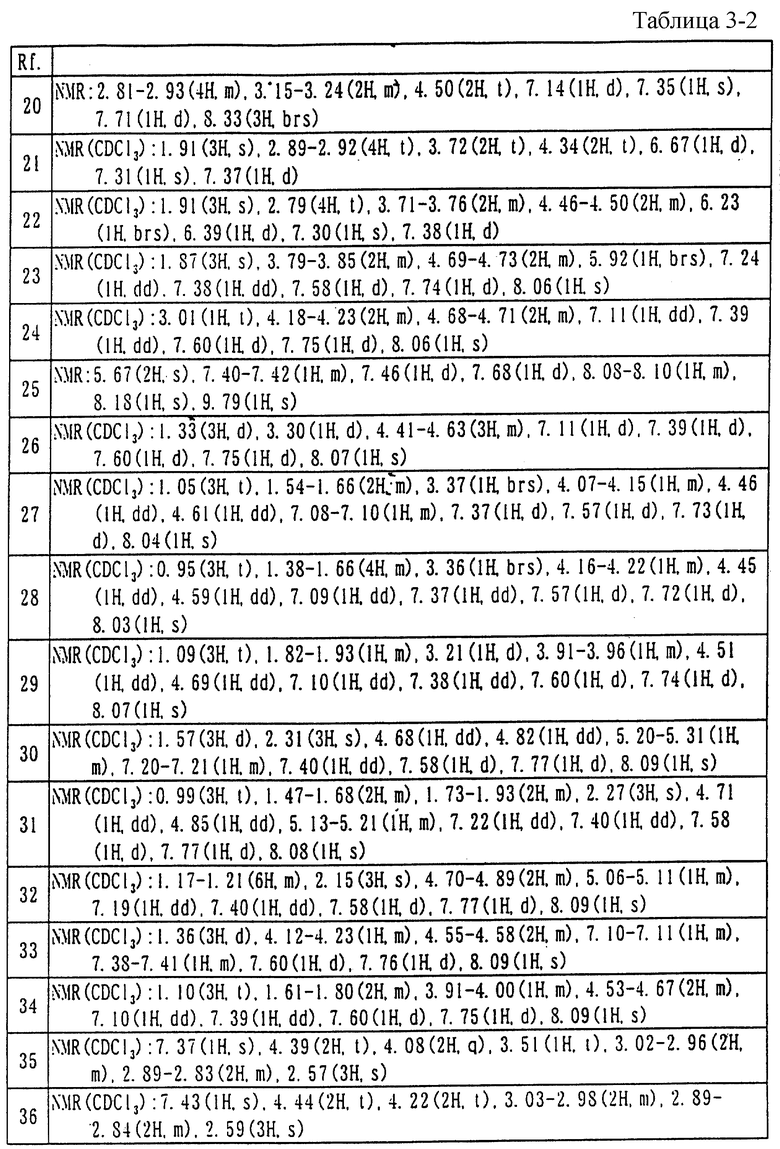
Описывается трициклическое производное пиразола, представленное общей формулой I, или его фармацевтически приемлемая соль, Het - 5-членное ненасыщенное гетероциклическое кольцо, содержащее гетероатом, который выбран из группы, состоящей из атома серы или атома кислорода, или Het - изоксазол; А - прямая или разветвленная низшая алкиленовая группа, R - атом водорода, низшая алкильная группа, атом галогена или низшая алкоксигруппа. Соединения обнаруживают высокое сродство и селективность в отношении 5-НТ2С-рецептора и полезны для лечения заболеваний центральной нервной системы (например, сексуальных расстройств, нарушений аппетита, тревоги, депрессии, нарушений сна и т.п.). 2 с. и 2 з.п. ф-лы, 4 табл.
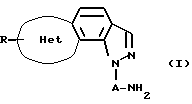
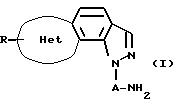
в которой Het представляет 5-членное ненасыщенное гетероциклическое кольцо, содержащее гетероатом, выбранный из атома серы или кислорода, или Het представляет изоксазол;
А представляет прямую или разветвленную алкиленовую группу;
R представляет атом водорода, низшую алкильную группу, атом галогена или низшую алкоксигруппу,
или его фармацевтически приемлемая соль.
| Приспособление в пере для письма с целью увеличения на нем запаса чернил и уменьшения скорости их высыхания | 1917 |
|
SU96A1 |
| Многоячейковый резонансный инвертор | 1978 |
|
SU700905A1 |
| Прибор для очистки паром от сажи дымогарных трубок в паровозных котлах | 1913 |
|
SU95A1 |
| ТРИНУС Ф.П | |||
| Фармакотерапевтический справочник | |||
| - Киев, Здоровья, 1989, с.273. | |||
Авторы
Даты
2002-10-20—Публикация
1998-06-11—Подача