Изобретение относится к бактерицидным спиросоединениям, которые являются ценными в качестве лекарств для людей, ветеринарных лекарств или лекарств для использования в рыборазведении или в качестве антисептиков, и к бактерицидным композициям, содержащим одно или более этих соединений в качестве активных ингредиентов.
Известно множество производных синтетических бактерицидных соединений. Однако многие из высокоактивных производных не поглощаются достаточно хорошо при оральном применении.
Заявитель изобретения добился разработки производных хинолина, которые обладают высокой бактерицидной активностью и показывают достаточную оральную скорость поглощения.
Изобретение относится к спиросоединениям общей формулы 1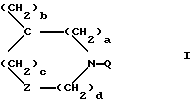
где a означает целое число, равное 0 или 1, b означает целое число, равное 2 5 включительно, c означает целое число, равное 0 или 1, и d означает целое число, равное 0 2 включительно; Z означает 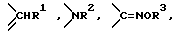 атом кислорода или серы, где R1 означает атом водорода, аминогруппу, моноалкиламиногруппу из 1 6 атомов углерода, диалкиламиногруппу, содержащую 1 6 атомов углерода на алкильную группу, гидроксильную группу, алкоксигруппу из 1 6 атомов углерода или гидроксиалкильную группу из 1 6 атомов углерода; R2 означает атом водорода, алкильную группу из 1 6 атомов углерода, гидроксиалкильную группу из 1 6 атомов углерода, галоалкильную группу из 1 6 атомов углерода, формильную группу или алкилкарбонильную группу из 2 7 атомов углерода R3 означает атом водорода или алкильную группу из 1 6 атомов углерода; Q представляет собой структурный фрагмент формулы II
атом кислорода или серы, где R1 означает атом водорода, аминогруппу, моноалкиламиногруппу из 1 6 атомов углерода, диалкиламиногруппу, содержащую 1 6 атомов углерода на алкильную группу, гидроксильную группу, алкоксигруппу из 1 6 атомов углерода или гидроксиалкильную группу из 1 6 атомов углерода; R2 означает атом водорода, алкильную группу из 1 6 атомов углерода, гидроксиалкильную группу из 1 6 атомов углерода, галоалкильную группу из 1 6 атомов углерода, формильную группу или алкилкарбонильную группу из 2 7 атомов углерода R3 означает атом водорода или алкильную группу из 1 6 атомов углерода; Q представляет собой структурный фрагмент формулы II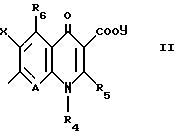
где R4 означает алкильную группу из 1 6 атомов углерода, алкенильную группу из 2 6 атомов углерода, галоалкильную группу из 1 6 атомов углерода, замещенную или незамещенную циклоалкильную группу из 3 6 атомов углерода, замещенную или незамещенную арильную группу, замещенную или незамещенную гетероарильную группу, алкоксигруппу из 1 6 атомов углерода или алкиламиногруппу из 1 6 атомов углерода; R5 означает атом водорода, замещенную или незамещенную аминогруппу, гидроксильную группу, алкоксигруппу из 1 -6 атомов углерода или атом галогена; A означает атом азота или 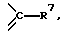 где R7 означает атом водорода, алкильную группу из 1 6 атомов углерода, атом галогена, алкоксигруппу из 1 -6 атомов углерода, галоалкильную группу из 1 6 атомов углерода или цианогруппу; R4 может, взятый вместе с R5 и/или R7, образовать замещенное или незамещенное кольцо, которое может включать атом кислорода, азота или серы, где заместителем является алкильная группа из 1 6 атомов углерода или галоалкильная группа из 1 6 атомов углерода; X означает атом галогена, предпочтительно атом фтора; Y означает атом водорода, алкильную группу из 1 6 атомов углерода, алкоксиалкильную группу из 1 6 атомов углерода, фенилалкильную группу, содержащую 1 6 атомов углерода в ее алкильном фрагменте, группу дигалоидного бора, фенильную группу, ацетоксиметильную группу, пивалоилоксиметильную группу, этоксикарбонилоксигруппу, холиновую группу, диметиламиноэтильную группу, 5-инданильную группу, фталидинильную группу, 5-замещенную-2-оксо-1,3-диоксазол-4-илметильную группу или 3-ацетокси-2-оксобутильную группу, и солям этих соединений. Более конкретно, изобретение относится к спиросоединениям общей формулы 1, где a означает 1, b означает 2, c равно 0, d означает 1 и Z означает
где R7 означает атом водорода, алкильную группу из 1 6 атомов углерода, атом галогена, алкоксигруппу из 1 -6 атомов углерода, галоалкильную группу из 1 6 атомов углерода или цианогруппу; R4 может, взятый вместе с R5 и/или R7, образовать замещенное или незамещенное кольцо, которое может включать атом кислорода, азота или серы, где заместителем является алкильная группа из 1 6 атомов углерода или галоалкильная группа из 1 6 атомов углерода; X означает атом галогена, предпочтительно атом фтора; Y означает атом водорода, алкильную группу из 1 6 атомов углерода, алкоксиалкильную группу из 1 6 атомов углерода, фенилалкильную группу, содержащую 1 6 атомов углерода в ее алкильном фрагменте, группу дигалоидного бора, фенильную группу, ацетоксиметильную группу, пивалоилоксиметильную группу, этоксикарбонилоксигруппу, холиновую группу, диметиламиноэтильную группу, 5-инданильную группу, фталидинильную группу, 5-замещенную-2-оксо-1,3-диоксазол-4-илметильную группу или 3-ацетокси-2-оксобутильную группу, и солям этих соединений. Более конкретно, изобретение относится к спиросоединениям общей формулы 1, где a означает 1, b означает 2, c равно 0, d означает 1 и Z означает 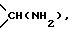 и солям этих соединений. Изобретение также относится к спиросоединениям общей формулы 1, где a означает 1:b означает 3, c равно 0 и d равно 1. и Z означает
и солям этих соединений. Изобретение также относится к спиросоединениям общей формулы 1, где a означает 1:b означает 3, c равно 0 и d равно 1. и Z означает 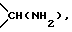 и солям этих соединений. Изобретение относится к спиросоединениям общей формулы 1, где a означает 1, b означает 2, c равно 0 и d означает 2 и означает
и солям этих соединений. Изобретение относится к спиросоединениям общей формулы 1, где a означает 1, b означает 2, c равно 0 и d означает 2 и означает  и солям этих соединений. Более конкретно изобретение относится к спиросоединениям общей формулы 1, где указанные спиросоединения являются оптически чистыми. Более конкретно, изобретение относится к 7-(7-амино-5-азаспиро[2,4] гептан-5-ил)-1-циклопропил-6,8-дифтор-1,4-дигидро-4-оксохинолин-3-карбоновой кислоте, 7-(7-амино-5-азаспиро[2,4]гептан-5-ил)-8-хлор-1-циклопропил-6-фтор- 1,4-дигидро-4- оксохинолин-3- карбоновой кислоте, 7-(7-амино-5-азаспиро[2,4] гептан-5-ил)-1-циклопропил-6-фтор-1,4 -дигидро-4-оксохинолин-3-карбоновой кислоте, 7-(7-амино-5-азаспиро[2,4]гептан-5-ил)-6-фтор-1-(2,4-дифторфенил)-1,4-дигидро-4-оксохинолин-3-карбоновой кислоте, 7-(7-амино-5-азаспиро[2,4] гептан-5-ил)-1-циклопропил-6-фтор-1,4-дигидро-4-оксо-1,8-нафтиридин-3-карбоновой кислоте, 10-(7-амино-5-азаспиро [2,4]гептан-5-ил)-9-фтор-2,3-дигидро-3(S)-метил-7-оксо-2H-пиридо[1,2,3-de] [1,4]бензоксазин-6-карбоновой кислоте, 1-циклопропил-7-(4,7-диапаспиро[2,5]октан-7-ил)-6-фтор-1,4-дигидро-4-оксохинолин-3-карбоновой кислоте, 7-(7-амино-5-азаспиро[2,4] гептан-5-ил)-1-циклопропил-6-фтор-8-метил-1,4-дигидро-4-оксохинолин-3-карбоновой кислоте, 7-(7-гидрокси-5-азаспиро[2,4]гептан-5-ил)-8-хлор-1-циклопропил-6-фтор-1,4-дигидро-4-оксохинолин-3-карбоновой кислоте, 7-(7-амино-5-азаспиро[2,4]гептан-5-ил)-1-(2-метил-2-пропил)-6-фтор-1,4-дигидро-4-оксо-1,8-нафтиридин-3-карбоновой кислоте, 7-(7-гидроксиламино-5-азаспиро[2,4] гептан-5-ил)-8-хлор-1-циклопропил-6-фтор-1,4-дигидро-4-оксохинолин-3-карбоновой кислоте, 1-циклопропил-6,8-дифтор-7-(8-гидроксиметил-6-азаспиро[3,4] октан-6-ил)-4-оксо-1,4-дигидрохинолин-3-карбоновой кислоте, 1-циклопропил-6,8-дифтор-7-(4-гидроксиметил-2-азаспиро[4,4]нонан-2-ил)-4-оксо-1,4-дигидрохинолин-3-карбоновой кислоте, 1-циклопропил-6,8-дифтор-7-(4-гироксиметил-2-азаспиро[4,5] декан-2-ил)-4-оксо-1,4-дигидрохинолин-3-карбоновой кислоте, 7-(8-амино-6-азаспиро[3,5] октан-6-ил)-1-циклопропил-6,8 -дифтор-4-оксо-1,4-дигидрохинолин-3-карбоновой кислоте, 10-(8-амино-6-азаспиро[3,4] октан-6-ил)-9-фтор-2,3-дигидро-3-(S)-метил-7-оксо-7H-пиридо[1,2,3-de] [1,4] бензоксазин-6-карбоновой кислоте или 7-(4-амино-2-азаспиро[4,4] нонан-2-ил)-1-циклопропил-6,8-дифтор-4-оксо-1,4-дигидрохинолин-3-карбоновой кислоте. В дальнейшем аспекте изобретение относится к бактерицидной композиции, содержащей соединение общей формулы I в качестве активного ингредиента.
и солям этих соединений. Более конкретно изобретение относится к спиросоединениям общей формулы 1, где указанные спиросоединения являются оптически чистыми. Более конкретно, изобретение относится к 7-(7-амино-5-азаспиро[2,4] гептан-5-ил)-1-циклопропил-6,8-дифтор-1,4-дигидро-4-оксохинолин-3-карбоновой кислоте, 7-(7-амино-5-азаспиро[2,4]гептан-5-ил)-8-хлор-1-циклопропил-6-фтор- 1,4-дигидро-4- оксохинолин-3- карбоновой кислоте, 7-(7-амино-5-азаспиро[2,4] гептан-5-ил)-1-циклопропил-6-фтор-1,4 -дигидро-4-оксохинолин-3-карбоновой кислоте, 7-(7-амино-5-азаспиро[2,4]гептан-5-ил)-6-фтор-1-(2,4-дифторфенил)-1,4-дигидро-4-оксохинолин-3-карбоновой кислоте, 7-(7-амино-5-азаспиро[2,4] гептан-5-ил)-1-циклопропил-6-фтор-1,4-дигидро-4-оксо-1,8-нафтиридин-3-карбоновой кислоте, 10-(7-амино-5-азаспиро [2,4]гептан-5-ил)-9-фтор-2,3-дигидро-3(S)-метил-7-оксо-2H-пиридо[1,2,3-de] [1,4]бензоксазин-6-карбоновой кислоте, 1-циклопропил-7-(4,7-диапаспиро[2,5]октан-7-ил)-6-фтор-1,4-дигидро-4-оксохинолин-3-карбоновой кислоте, 7-(7-амино-5-азаспиро[2,4] гептан-5-ил)-1-циклопропил-6-фтор-8-метил-1,4-дигидро-4-оксохинолин-3-карбоновой кислоте, 7-(7-гидрокси-5-азаспиро[2,4]гептан-5-ил)-8-хлор-1-циклопропил-6-фтор-1,4-дигидро-4-оксохинолин-3-карбоновой кислоте, 7-(7-амино-5-азаспиро[2,4]гептан-5-ил)-1-(2-метил-2-пропил)-6-фтор-1,4-дигидро-4-оксо-1,8-нафтиридин-3-карбоновой кислоте, 7-(7-гидроксиламино-5-азаспиро[2,4] гептан-5-ил)-8-хлор-1-циклопропил-6-фтор-1,4-дигидро-4-оксохинолин-3-карбоновой кислоте, 1-циклопропил-6,8-дифтор-7-(8-гидроксиметил-6-азаспиро[3,4] октан-6-ил)-4-оксо-1,4-дигидрохинолин-3-карбоновой кислоте, 1-циклопропил-6,8-дифтор-7-(4-гидроксиметил-2-азаспиро[4,4]нонан-2-ил)-4-оксо-1,4-дигидрохинолин-3-карбоновой кислоте, 1-циклопропил-6,8-дифтор-7-(4-гироксиметил-2-азаспиро[4,5] декан-2-ил)-4-оксо-1,4-дигидрохинолин-3-карбоновой кислоте, 7-(8-амино-6-азаспиро[3,5] октан-6-ил)-1-циклопропил-6,8 -дифтор-4-оксо-1,4-дигидрохинолин-3-карбоновой кислоте, 10-(8-амино-6-азаспиро[3,4] октан-6-ил)-9-фтор-2,3-дигидро-3-(S)-метил-7-оксо-7H-пиридо[1,2,3-de] [1,4] бензоксазин-6-карбоновой кислоте или 7-(4-амино-2-азаспиро[4,4] нонан-2-ил)-1-циклопропил-6,8-дифтор-4-оксо-1,4-дигидрохинолин-3-карбоновой кислоте. В дальнейшем аспекте изобретение относится к бактерицидной композиции, содержащей соединение общей формулы I в качестве активного ингредиента.
Соединения изобретения характеризуются тем, что каждое из них является соединением циклического амина, имеющим спирокольцо, а также тем, что к нему присоединена производная хинолина через "7-эквивалентое положение". Термин "7-эквивалентное положение" производной хинолина означает, например, 7-положение соединений необязательно замещенной 4-оксохинолин-3-карбоновой кислоты и 4-оксо-1,8-нафтиридин-3-карбоновой кислоты, 10-положение 7-окспопиридо [1,2,3-de] [1,4]-бензоксазин-6-карбоновой кислоты или 8-положение бензо[ij] хинолизин-2-карбоновой кислоты.
Спирокольцо должно быть в интервале от 3-членного до 6-членного колец, из которых предпочтительными являются 3-членное и 4-членное.
Размер кольца циклического амина, исключая спирокольцо, должен быть в интервале от 4- до 8-членных колец, из которых 5-членное и 6-членное кольца являются предпочтительными. Циклический амин присоединен через его атом азота к "7-эквивалентному положению" производной хинолина.
Этот циклический амин может дополнительно содержать один или более гетероатом, такой как кислород, сера и азот, из которых предпочтительным является азот. Этот атом азота может быть замещен, например, алкильной группой из 1-6 атомов углерода, гидроксиалкильной группой из 1-6 атомов углерода, галоалкильной группой из 1-6 атомов углерода, формильной группой и алкилкарбонильной группой из 2-7 атомов углерода.
Ниже приведены некоторые примеры структур циклического амина, несущих спироциклическое кольцо; 5-азаспиро[2,4] гептановая структура, 6-азаспиро[3,4] октановая структура, 2-азаспиро[4,4]нонановая структура, 2-азаспиро[4,5] декановая структура, 5-азаспиро[2,5]октановая структура, 6-азаспиро[2,5] октановая структура, 6-азаспиро[3,5]нонановая структура, 7-азаспиро[3,5] нонановая структура, 7-азаспиро[4,5]декановая структура, 8-азаспиро[4,5] декановая структура, 2-азаспиро[5,5]ундекановая структура, 3-азаспиро[5,5] ундекановая структура, 4,7-диазаспиро[2,5]октановая структура, 5,8-диазаспиро[3,5] нонановая структура, 6,9-диазоспиро[4,5]декановая структура, 7,10-диазаспиро[5,5] ундекановая структура, 7-аза-4-оксаспиро[2,5]окстановая структура, 8-аза-5- оксаспиро[3,5] нонановая структура, 9-аза-6-оксаспиро[4,5] декановая структура, 7-аза-4-тиаспиро [2,5]октановая структура, 8-аза-5-тиаспиро[3,5] нонановая структура, 9-аза-6-тиаспиро[4,5] декановая структура, 7-аза-4-тиаспиро[2,5]октан-4-оксидная структура, 8-аза-5-тиаспиро[3,5] нонан-5-оксидная структура и 9-аза-6-тиаспиро[4,5]декан-6-оксидная структура.
Если в кольце указанного циклического амина существует дополнительный гетероатом, такой как кислород, сера или азот, или особенно, если такой гетероатом не находится там, то могут существовать группы полярных заместителей на кольце амина, такие, например как аминогруппа, моноалкиламиногруппа из 1-6 атомов углерода, диалкиламиногруппы, содержащие 1-6 атомов углерода на алкильную группу, аминоалкильные группы из 1-6 атомов углерода, аминный фрагмент которых замещен или незамещен алкильной группой из 1-6 атомов углерода или гидроксиалкильной группой из 1-6 атомов углерода, гидроксильная группа, гидроксиалкильная группа из 1-6 атомов углерода, гидроксииминогруппа и алкоксигруппа из 1-6 атомов углерода. Предпочтительными являются аминогруппы.
Эти заместители на спирозамещенном циклическом амине защищены или незащищены соответствующими защищающими группами. Такие защищающие группы могут быть выбраны из групп, которые обычно используются для этого. Например, подходящие защищающие группы включают алкокси-карбонильные группы, такие как трет-бутоксикарбонил, и 2,2,2-трихлорэтоксикарбонил, аралкилоксикарбонильные группы, такие как бензилоксикарбонильная группа, пара-метоксибензилоксикарбонильная группа, ацильные группы, такие как ацетильная группа, метоксиацетильная группа, трифторацетильная группа, хлорацетильная группа, пивалоильная группа, формильная группа и бензоильная группа, алкильные или аралкильные группы, такие как трет-бутильная группа, бензильная группа, паранитробензильная группа, параметоксибензильная группа и трифенилметильная группа, эфирные группы, такие как метоксиметильная группа, трет-бутоксиметильная группа, тетрагидропиранильная группа, и 2,2,2-трихлорэтоксиметильная группа, и силильные группы, такие как триметилсилильная группа, изопропилдиметилсилильная группа, трибензилсилильная группа и трет-бутилдифенилсилильная группа.
Если заместитель иной, чем спирокольцо, существует на спирозамещенном циклическом амине и атом углерода, к которому присоединен заместитель, является асимметричным атомом углерода, то существуют стереоизомеры циклического амина. Если такой циклический амин используют как смесь стереоизомеров в качестве заместителя для "7-эквивалентного положения", то получающееся спиросоединение 1 может быть смесью диастереомеров, если в спиросоединении существует второй асимметричный атом углерода. Смесь диастереомеров является смесью соединений, различающихся физическими константами, и не может быть использована в качестве лекарства. В таких случаях циклический амин следует отфракционировать на изомеры перед реакцией.
Если продукт спиросоединения 1 является рецемическим соединением, то рацемат может быть использован. Однако, есть случаи, в которых оптически активная форма является биологически более полезной, чем рацемат. В таких случаях рацемат должен быть подвержен оптическому разделению.
Например, что касается бактерицидной активности двух энантиомеров, имеющих 7-амино-5-азаспиро[2,4] гептановую структуру, то один из них обладает повышенной бактерицидной активностью по сравнению с другим. Обнаружено, что производная 7-(S)-амино-5-азаспиро[2,4] гептана является более активным энантиомером. Этот факт был подтвержден рентгенографическим кристаллографическим анализом одного из изомеров 7-(7-трет-бутоксикарбониламино-5-азаспиро[2,4] гептан-5-ил)-8-хлор-1-циклопропил-6-фтор-1,4-дигидро-оксохинолин-3-карбоновой кислоты, который дает более активный изомер 7-(7-амино-5-азаспиро[2,4] гептан-5-ил)-8-хлор-1-циклопропил-6-фтор-1,4-дигидро-4-оксохинолин-3-карбоновой кислоты.
Циклический амин, замещенный спирокольцом, может быть синтезирован следующим образом:
Если в качестве примера взять 7-амино-5-азаспиро[2,4]гептан, то сначала проводят реакцию этилацетоацетата с 1,2-диброметаном в присутствии основания с получением этил-1-ацетил-1- цикопропанкарбоксилата. Затем с помощью брома ацетильную группу этого соединения бромируют с получением этил 1-бромацетил-1-циклопропанкарбоксилата. Это бромацетильное соединение затем циклизуют с бензиламином с получением 5-бензил-4,7-диоксо-5- азаспиро[2,4]гептана. Если проводят реакцию этого соединения с гидроксиламингидрохлоридом, то кетон в 7-положении превращается в оксим с получением 5-бензил-7-(гидроксиимино)-4-оксо-5-азаспиро[2,4] гептана. Этот оксим восстанавливают литийалюминийгидридом с получением спирокольца, содержащего соединения аминопирролидина, а именно 7-амино-5-бензил-5-азаспиро[2,4]-гептана. Если бензильную группу этого соединения элиминируют по обычной методике, такой как каталитический гидрогенолиз, то получают 7-амино-5-азаспиро[2,4]гептан, который является рацемическим соединением. Если происходит отщепление бензильной группы, то после того, как аминогруппу защищают по реакции с 2-(третбутоксикарбониламино)-2- фенилацетонитрилом), далее для краткости называемом BOC-ON, получают 7-трет-бутоксикарбониламино-5-азаспиро[2,4]гептан.
Оптические изомеры 7-амино-5-азаспиро[2,4] гептана могут быть получены следующим образом.
Сначала проводят реакцию 7-амино-5-бензил-5-азаспиро[2,4] гептана с (R)-N-пара-толуолсульфонилпропилхлоридом с получением 7-[(R)- N-пара-толуолсульфонилпропил]амино-5-бензил-5-азаспиро[2,4]гептана. Эатем проводят реакцию этого соединения с бензилхлоркарбонатом с получением 7-[(R)-N-пара-толуолсульфонилпропил] амино-5-бензилоксикарбонил-5-азаспиро[2,4] гептана. Этот продукт может быть фракционирован на оптически активные соединения с помощью жидкостной хроматографии высокого давления (далее для кратности называемой HPLC). После разделения каждое соединение обрабатывается 2 нормальной гидроокисью натрия, в процессе которого отщепляются пролиновый фрагмент и бензилоксикарбонильная группа с получением соответствующего оптически активного 7-амино-5- азаспиро[2,4]гептана.
Также было найдено, что когда циклизацию этил-1-бромацетил-1-циклопропанкарбоксилата проводят с использованием оптически активного 1-фенэтиламина вместо бензиламина, то последующее оптическое разделение рацемического соединения облегчается.
Следующая методика является альтернативным синтезом, исходя из 1-ацетил-1-циклопропанкарбонового сложного эфира. Вначале сложноэфирную группу 1-ацетил-1-циклопропанкарбонового сложного эфира расщепляют кислотным или основным гидролизом или каталитическим гидрогенированием. Проводят реакцию этой свободной кислоты с R-/+/-1-фенилэтиламином с получением N-[1-(R)-фенилэтил] -1-ацетил-1- циклопропилкарбоксамида, производной амида. Затем карбонильный фрагмент ацетильной группы этого среднения превращают в кетальную группу и, таким образом, получают N-[1-(R)-фенилэтил]-1-(1,1-этилендиоксиэтил)-1-циклопропанкарбоксиамид. Метильную группу, примыкающую к кетальной группе этого соединения, затем галогенируют, например N-[1-(R)-фенилэтил]-1-(1,1-этилендиоксиэтил)-1-циклопропанкарбоксиамид превращают в N-[1-(R)-фенилэтил] -1-(2-бром-1,1-этилендиоксиэтил)-1- циклопропанкарбоксамид. Это галометильное соединение циклизуют в присутствии основания в 4,7-диоксо-5-[1-(R)-фенилэтил] -5-азаспиро[2,4] гептан-4-этиленацеталь, который является производной пирролидона, несущей спироциклическое кольцо и кетальную функцию. Кетальная функция этого соединения может быть отделена с помощью известной методики гидролиза с получением 4,7-диоксо-5-азаспиро[2,4]гептана. Это соединение можно привести к спироциклическому амину с помощью вышеописанной методики.
Ниже обсужден синтез 4,7-диазаспиро[2,5]октана. Сначала проводят реакцию циклопропан-1,1-диамина с бромом и основанием с получением циклопропан-1,1-дибромамида, который, в свою очередь, обрабатывают алкоксидом с получением спирогидантоина, а, именно, 4,6-диазаспиро[2,4]гептан-5,7-диона. Затем проводят реакцию этого соединения со щелочью с получением 1-аминоциклопропанокарбоновой кислоты. Аминогруппу этого соединения защищают трет-бутоксикарбонильной группой с получением 1-(трет-бутоксикарбониламино)-1-циклопропанкарбоновой кислоты, в которую затем конденсируют с глицинэтиловым сложным эфиром в присутствии дициклогексилкарбодиимида с получением этил(1-трет-бутоксикарбониламино-1- циклопропилкарбониламино)ацетата. После удаления аминозащищающей группы вышеуказанное соединение циклизуют при нагревании с получением спирокольцосодержащего дикетопиперазинового соединения, а, именно, 4,7-диазаспиро[2,5]октан-5,8-диона. Это соединение восстанавливают литийалюминийгидридом с получением спирокольцо-содержащего пиперазинового соединения, а именно 4,7-диазаспиро[2,5]октана.
Синтез производной циклического амина, несущей спироциклическое кольцо, может быть осуществлен по способу, пример которого приведен ниже. Конденсация дисложного эфира циклического алкильного кетона и малоновой кислоты в присутствии тетрагидрохлорида титана дает дисложный эфир циклоалкилиденмалоновой кислоты. Реакция этого дисложног эфира циклоалкилиденмалоновой кислоты и нитрометана в присутствии основания дает аддукт Майкла (например, дисложный эфир (1-нитрометил-1-циклоалкил) малоновой кислоты. Восстановительная циклизация дисложного эфира (1-нитрометил-1-циклоалкил) малоновой кислоты дает сложный эфир пирролидонкарбоновой кислоты, несущий спироциклическое кольцо, например, если спироциклическим кольцом является 4-членное кольцо, то получается сложный эфир 7-оксо-6-азаспиро[3,4]октан-8-карбоновой кислоты. Для восстановительной циклизации более удобным является каталитическое восстановление. Однако, другие химические восстановительные методы также являются приемлемыми. Этот сложный эфир пирролидонкарбоновой кислоты может быть превращен в производную циклического амина, несущую спироциклическое кольцо и трет-бутоксикарбониламинозаместитель по реакции Крутиуса в трет-бутаноле свободной карбоновой кислоты, которую получают расщеплением сложного эфира известным способом, таким как гидролиз или гидрогенолиз. Восстановление пирролидона, несущего спироциклическое кольцо и аминозаместитель после удаления трет-бутоксикарбонильной группы, приводит к получению производной пирролидона, имеющей спироциклическое кольцо и аминозаместитель. Восстановление сложного эфира пирролидонкарбоновой кислоты гидридами металла, такими как литийалюминий гидрид, дает производную пирролидина, несущую спироциклическое кольцо и гидроксиметильный заместитель.
Производное хинолина, которое присоединено к такому спирокольцосодержащему циклическому амину, включают бициклические соединения, такие как 1,4-дигидро-4-оксохинолин-3-карбоновая кислота, и 1,4-дигидро-4-оксо-1,8-нафтиридин-3-карбоновая кислота, и трициклические соединения, такие как 2,3-дигидро-7-оксо-7Н-пиридо[1,2,3-de] [1,4] бензоксазин-6-карбоновую кислоту, 6,7-дигидро-1,7- диоксо-1Н, 5Н-бензо[ij] хинолизин-2-карбоновую кислоту, и 6,7-дигидробензо[ij]хинолизин-2-карбоновую кислоту, тетрациклическое соединение, такое как 9,1-эпоксиметано-5-оксо-5Н-тиазоло[3,2-а]хинолин-4- карбоновую кислоты. Структурные фрагменты показаны на фиг. 1.
Что касается соединений 1,4-дигидро-4-оксохинолин-3-карбоновой кислоты и 1,4-дигидро-4-оксо-1,8-нафтиридин-3-карбоновой кислоты, то заместителем в 1-положении может быть, например низшая алкильная группа из 1-6 атомов углерода, такая как этильная группа, изопропильная группа и трет-бутильная группа, галоалкильная группа из 1-6 атомов углерода, такая как 2-фторэтильная группа, низшая алкенильная группа из 2-6 атомов углерода, таких как винильная группа, изопропенильная группа, циклоалкильная группа из 3-6 атомов углерода, которая является замещенной или незамещенной, такая как циклопропильная группа, цис-2-митилциклопропильная группа и 2-гем-дигалоциклопропильная группа, арильная или гетероарильная группа, которая является замещенной или незамещенной, такая как 4-фторфенильная группа, 2,4-дифторфенильная группа и 2-фтор-4-пиридильная группа, алкоксигруппа, или алкиламиногруппа из 1-6 атомов углерода, такая как метиламиногруппа и этиламиногруппа. Среди этих групп заместителей предпочтительными являются этильная группа, 2-фтор-этильная группа, винильная группа, циклопропильная группа, цис-2-метилциклопропильная группа, 4-фторфенильная группа, 2,4-дифторфенильная группа, 2-фтор-4-пиридильная группа, метоксигруппа и метиламиногруппа.
Заместитель во 2-положении предпочтительно означает атом водорода или алкильную группу из 1- 6 атомов углерода, такую как метильная группа, этильная группа и пропильная группа.
Предпочтительным заместителем в 5-положении является атом водорода, аминогруппа, незамещенная моно-C1-С6алкиламиногруппа или ди-C1-C6алкиламиногруппа, такая как метиламиногруппа, этиламиногруппа, изопропиламиногруппа, диметиламиногруппа и диэтиламиногруппа, гидроксильная группа, гало-C1-C6-алкильная группа, C1-C6алкоксигруппа, такая как метоксигруппа и этоксигруппа, или атом галогена.
6-положение предпочтительно замещено на атом галогена, особенно на фтор или хлор.
8-положение производной хинолина является замещенным или незамещенным. Подходящие заместители включают атом галогена C1-C6алкильную группу, C1-C6алкоксигруппу, гало-C1-C6алкильную группу и цианогруппу. Предпочтительные заместители означают хлор, фтор, метильную и метоксигруппы.
Что касается структуры хинолина, она может быть не только бициклической структурой, но также трициклической или тетрациклической структурой, образованной между 1-положением и либо 8-положением, либо 2-положением, или между 1-положением и каждым из 8- и 2-положений хинолинового кольца. Кольцо, образуемое в таких случаях, находится предпочтительно в интервале от 4-членного до 7-членного колец и более желательно в виде 5-членного или 6-членного колец.
Образуемое таким образом кольцо может включать атомы азота, кислорода и серы. Более того, могут содержаться не только обычные связи, но также и двойные связи, и кольцо может быть ароматическим. Кроме того, такие кольца являются замещенными или незамещенными C1-C6алкильными группами или гало-C1-C6алкильными группами.
Что касается производных трициклического хинолина, то беря в качестве примера 2,3-дигидро-7-оксо-7Н-пиридо[1,2,3-de] [1,4]бензоксазин-6-карбоновую кислоту, 3-положение может быть замещено алкильной группой из 1-6 атомов углерода, которая предпочтительно находится в S-конфигурации. 9-положение предпочтительно замещено атомом галогена, который предпочтительно означает фтор или хлор. Вышеуказанный статус замещения может быть эквивалентно применен к другим производным трициклического хинолина, таким как 2,3-дигидро-7-оксо-7H-пиридо[1,2,3-de] [1,4]бензотиазин-6-карбоновая кислота и 6,7-дигидро-1H, 5H-бензо[ij] хинолизин-2-карбоновая кислота. В случае 3-алкил-7-оксо-2,3-дигидро-7H-пиридо[3,2,1-ij]-1,3,4-бензоксадиазин-6-карбоновой кислоты, 9-положение предпочтительно замещено атомом галогена, который означает предпочтительно фтор или хлор.
Предпочтительными производными хинолина, которые могут быть присоединены к указанному спирокольцосодержащему циклическому амину, являются соединения 1,4-дигидро-4-оксохинолин-3-карбоновой кислоты.
Спирокольцосодержащий циклический амин может быть введен в такую производную хинолина по способам, описанным в Европейском патенте (EP)-A-167763, EP-A-195841, EP-A-160578 и EP-A-206283.
Способы получения настоящих соединений описаны ниже с помощью схемы реакции, где a, b, c, d, z, A, R4, R5, R6, Y и X принимают определенные выше значения; X' означает атом галогена, предпочтительно атом фтора. Таким образом, когда проводят реакцию спирокольцосодержащего циклического амина с 7-галохинголинпроизводной, то атом азота пирролидинового кольца присоединяется к 7-положению хинолонового кольца с получением целевой производной хинолона.
В исходном соединении производной хинолона, например 1-циклопропил-6-фтор-7-гало-1,4-дигидро-4-оксохинолин-3-карбоновой кислоты, атом галогена в 7-положении может быть хлором или фтором. Эти исходные соединения могут быть синтезированы по способам, описанным в EP-A-167763 и EP-A-195841. Другие соединения хинолона могут быть также синтезированы известными способами.
(Например, 7-хлор-6-фтор-1-этил-1,4-дигидро-4-оксо-1,8-нафтиридин-3-карбоновая кислота, EP-A-27752; 9,10-дифтор-3-метил-7-оксо-2,3-дигидро-7H-пиридо[3,2,1-ij] -1,3,4-бензоксадиазин-6- карбоновая кислота, заявка Японии (Japan Kokai) 88-132891; 9,1-эпотксиметано-7,8-дифтор-5-оксо-5H-тиазоло[3,2-a] хинолин-4-карбоновая кислота, заявка Японии (Japan Kokai) 89-117888; 7,8-дифтор-5-оксо-5H-тиазоло[3,2-a] хинолин-3-карбоновая кислота, патент США 4450104; 7-галогено-6-фтор-1-метил-4-оксо-4H-[1,3]-тиазэто[3,2-a] хинолин-3-карбоновая кислота, заявка Японии (Japan Kokai) 88-107990; 9,10-дифтор-3-метил-2,3-дигидро-7-оксо-7H-пиридо[1,2,3-de] [1,4]бензоксазин-6-карбоновая кислота, EP-A-47005).
В способе, описанном в EP-A-195841, интермедиатное соединение 3-хлор-2,4,5-трифторбензойной кислоты синтезируют в 10 реакционных стадий. В противоположность этому, заявитель настоящего изобретения предложил способ синтеза вышеуказанного соединения в одну стадию, исходя из 3-амино-2,4,5-трифторбензойной кислоты, и нашел, что этот способ применим также для других производных бензойной кислоты.

Кроме того, в качестве исходного вещества для реакции со спирокольцосодержащим амином возможно использование производной хинолона, карбоксильная группа которой в 3-положении (или 3-эквивалентном положении) этерифицирована замещенным соединением бора. Этот сложный эфир, например, является соединением, имеющим следующую группу-заместитель в 3-положении (или 3-эквивалентном положении) хинолонового ядра, образующую хелат с карбонильной группой в 4-положении или (4-эквивалентном положении) кольца хинолона.
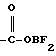
Вышеуказанный атом фтора может быть различным атомом галогена или ацетоксигруппой.
Дигалогенированное соединение бора может быть легко получено из производной свободной карбоновой кислоты и соответствующего соединения тригалогенированного бора, такого как трифторид бора эфирный комплекс.
Таким образом, производную карбоновой кислоты суспендируют или растворяют в эфире, таком как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран или диоксан, и добавляют избыток комплекса трифторид бора диэтиловый эфир. Смесь перемешивают при комнатной температуре. Реакция может быть проведена при комнатной температуре, но при необходимости и при нагреванием вплоть до 100oC. Реакция завершается через интервал времени от 30 мин до 24 ч. Так как продукт реакции обычно осаждается, то осадок отбирают, промывают инертным растворителем, таким как эфир, и сушат при пониженном давлении (EP-A-206283).
Производные, в которых карбоксильный фрагмент в 3-положении (или 3-эквивалентном положении) этерифицирован, являются полезными синтетическими интермедиатами или предшественниками лекарств. Например, сложные эфиры такие как, алкильные сложные эфиры, бензильные сложные эфиры, алкоксиалкильные сложные эфиры, фенилалкильные сложные эфиры или фенильные сложные эфиры, являются полезными в качестве синтетических интермедиатов.
Реакцию введения спирокольцосодержащего циклического амина обычно проводят в присутствии кислотного акцептора. В то время как кислотным акцептором может быть органическое основание или неорганическое основание, обычно предпочтительно использовать органическое основание.
Предпочтительные органические основания включают третичные амины, включая триалкиламины, такие как триэтиламин, трипропиламин, N,N-диизопропилэтиламин и трибутиламин, анилиновые соединения, такие как N,N-диметиланилин и N,N-диэтиланилин, и гетероциклическое соединение, такие как N-метилморфолин, пиридин и N,N-диметиламинопиридин.
Примеры неорганических оснований включают гидроокиси, карбонаты и бикарбонаты щелочных металлов, таких как литий, натрий и калий. Конкретно могут быть упомянуты гидроокись лития, гидроокись натрия, гидроокись калия, карбонат натрия, карбонат калия, бикарбонат натрия и бикарбоант калия.
Также возможно использование стехиометрического избытка исходного соединения спирокольцосодержащего циклического амина, так что оно может служить как реагентом, так и кислотным акцептором.
Реакционным растворителем может служить растворитель любого типа, который является инертным к реакции. Подходящие растворители включают ацетонитрил, амиды, такие как N,N-диметилфтормамид, N-метил-2-пирролидон и N,N-диметилацетамид, ароматические углеводороды, такие как бензол, толуол и ксилол, апротонные полярные растворители, такие как диметилсульфоксид и сульфолан, низшие спирты, такие как метанол, этанол, пропанол, бутанол, амиловый спирт, изоамиловый спирт, циклогексиловый спирт и 3-метоксибутанол, и эфиры, такие как диоксан, диметилцеллозольв, диэтилцеллозольв и диглим. Если растворитель является водорастворимым, то он может быть использован в смеси с водой. В этом случае указанный акцептор кислоты предпочтительно является органическим основанием.
Реакция может быть проведена в температурной области от 50 до 180oC, предпочтительно от 80 до 130oC.
Время реакции составляет от 10 мин до 48 ч и обычно достаточно для проведения реакции от 30 мин до 30 ч.
Если спирокольцосодержащий циклический амин используется в реакции после защиты группы-заместителя его ядра, то последующее удаление его защищающей группы из продукта реакции может быть осуществлено известным методом, таким как гидролиз, гидрогенолиз.
Если карбоксильный фрагмент в 3-положении (или в 3-эквивалентном положении) не является свободной гидроксильной группой, то производная может быть превращена в свободную карбоновую кислоту с помощью известной методики, приемлемой в каждом конкретном случае. Например, если производная является сложным эфиром, то может быть применена стандартная реакция гидролиза с использованием гидроокиси щелочного металла в водной среде. В случае соединения бора может быть использован метод, использующий протонное вещество, такое как спирт. В этом случае в реакционной системе может находится акцептор кислоты. Например, можно упомянуть обработку этанолом в присутствии триэтиламина.
Целевое спиросоединение 1 может быть очищено любым приемлемым методом или их комбинацией перекристаллизации, переосаждения, обработки активированным углем, хроматографией или другими известными методиками.
Следующие соединения являются некоторыми примерами новых соединений, включенных в настоящее изобретение:
7-(7-амино-5-азаспиро[2,4] гептан-5-ил-1-циклопропил-6,8-дифтор-1,4-дигидро-4-оксохинолин-3-карбоновая кислота;
7-(7-амино-5-азаспиро[2,4] гептан-5-ил)8 хлор-1-циклопропил-6-фтор-1,4-дигидро-4-оксохинолин-3-карбоновая кислота;
7-(7-амино-5-азаспиро[2,4] гептан-5-ил)-1-циклопропил-6-фтор-1,4-дигидро-4-оксохинолин-3-карбоновая кислота,
7-(7-амино-5-азаспиро[2,4] гептан-5-ил)-1-циклопропил-6-фтор-1,4-дигидро-4-оксо-1,8-нафтиридин-3-карбоновая кислота;
7-(7-амино-5-азаспиро[2,4] гептан-5-ил)-6,8-дифтор-1-(2-фторэтил)-1,4-дигидро-4-оксохинолин-3-карбоновая кислота;
7-(7-амино-5-азаспиро[2,4] гептан-5-ил)-8-хлор-6-фтор-1-(2-фторэтил)-1,4-дигидро-4-оксохинолин-3-карбоновая кислота;
7-(7-амино-5-азаспиро[2,4] гептан-5-ил)-6-фтор-1-(2-фторэтил)-1,4-дигидро-4-оксохинолин-3-карбоновая кислота;
7-(7-амино-5-азаспиро[2,4] гептан-5-ил)-6-фтор-1-(2-фторэтил)-1,4-дигидро-4-оксо-1,8-нафтиридин-3-карбоновая кислота;
7-(7-амино-5-азаспиро[2,4] гептан-5-ил)-1-6,8-дифтор-1,4-дигидро-4-оксохинолин-3-карбоновая кислота;
7-(7-амино-5-азаспиро[2,4] гептан-5-ил)-8-хлор-1-этил-6-фтор-1,4-дигидро-4-оксохинолин-3-карбоновая кислота;
7-(7-амино-5-азаспиро[2,4] гептан-5-ил)-1-этил-6-фтор-1,4-дигидро-4-оксохинолин-3-карбоновая кислота;
7-(7-амино-5-азаспиро[2,4] гептан-5-ил)-1-этил-6-фтор-1,4-дигидро-4-оксо-1,8-нафтиридин-3-карбоновая кислота;
7-(7-амино-5-азаспиро[2,4] гептан-5-ил)-6,8-дифтор(1-)2,4-дифторфенил)-1,4-дигидро-4-оксохинолин-3-карбоновая кислота;
7-(7-амино-5-азаспиро[2,4] гептан-5-ил)-8-хлор-6-фтор-1-(2,4-дифторфенил)-1,4-дигидро-4-оксохинолин-3-карбоновая кислота;
7-(7-амино-5-азаспиро[2,4] гептан-5-ил)-6-фтор-1-(2,4- дифторфенил)-1,4-дигидро-4-оксохинолин-3-карбоновая кислота;
7-(7-амино-5-азаспиро[2,4] гертан-5-ил)-6-фтор-1-(2,4- дифторфенил)-1,4-дигидро-4-оксо-1,8-нафтиридин-3-карбоновая кислота;
7-(7-амино-5-азаспиро[2,4] гептан-5-ил)-6,8-дифтор-1-винил-1,4-дигидро-4-оксохинолин-3-карбоновая кислота;
7-(7-амино-5-азаспиро[2,4] гептан-5-ил)-8-хлор-6-фтор-1-винил-1,4-дигидро-4-оксохинолин-3-карбоновая кислота;
7-(7-амино-5-азаспиро[2,4]гептан-5-ил)-6- фтор-1-винил-1,4-дигидро-4-оксохинолин-3-карбоновая кислота;
7-(7-амино-5-азаспиро[2,4] гептан-5-ил)-6-фтор-1-винил-1,4-дигидро-4-оксо-1,8-нафтиридин-3-карбоновая кислота;
1-циклопропил-7-(4,7-диазаспиро[2,5] октан-7-ил)-6,8-дифторо-1,1,4-дигидро-4-оксохинолин-3-карбоновая кислота;
8-хлор-1-циклопропил-7(4,7-диазаспиро[2,5] октан-7-ил)-6-фтор-1,4-дигидро-4-оксохинолин-3-карбоновая кислота;
1-циклопропил-7-(4,7-диазаспиро[2,5] октан-7-ил)-6-фтор-1,4-дигидро-4-оксохинолин-3-карбоновая кислота;
1-циклопропил-7-(4,7-диазаспиро[2,5] октан-7-ил)-6-фтор-1,4-дигидро-4-оксо-1,8-нафтиридин-3-карбоновая кислота;
7-(4,7-диазаспиро[2,5] октан-7-ил)-6,8-дифтор-1-(2-фторэтил)-1,4-дигидро-4-оксохинолин-3-карбоновая кислота;
8-хлор-7-(4,7-диазаспиро[2,5]октан-7-ил)-6-фтор-1-(2-фторэтил)-1,4-дигидро-4-оксохинолин-3-карбоновая кислота;
7-(4,7-диазаспиро[2,5] октан-7-ил)-6-фтор-1-(2-фторэтил)-1,4-дигидро-4-оксохинолин-3-карбоновая кислота;
7-(4,7-диазаспиро[2,5] октан-7-ил)-6-фтор-1-(2-фторэтил)-1,4-дигидро-4-оксо-1,8-нафтиридин-3-карбоновая кислота;
7-(4,7-диазаспиро[2,5] октан-7-ил)-1-этил-6,8-дифтор-1,4-дигидро-4-оксохинолин-3-карбоновая кислота;
8-хлор-7-(4,7-диазаспиро[2,5] октан-7-ил)-1-этил-6-фтор-1,4-дигидро-4-оксохинолин-3-карбоновая кислота;
7-(4,7-диазаспиро[2,5] октан-7-ил)-1-этил-6-фтор-1,4-дигидро-4-оксохинолин-3-карбоновая кислота;
7-(4,7-диазаспиро[2,5] октан-7-ил)-1-этил-6-фтор-1,4-дигидро-4-оксо-1,8-нафтиридин-3-карбоновая кислота;
7-(4,7-диазаспиро[2,5] октан-7-ил)-6,8-дифтор-1-(2,4-дифторфенил)-1,4-дигидро-4-оксохинолин-3-карбоновая кислота;
8-хлор-7-(4,7-диазаспиро[2,5] октан-7-ил)-6- фтор-1(2,4-дифторфенил)-1,4-дигидро-4-оксохинолин-3-карбоновая кислота;
7-(4,7-диазаспиро[2,5] октан-7-ил)-6-фтор-1-(2,4-дифторфенил)-1,4-дигидро-4-оксохинолин-3-карбоновая кислота;
7-(4,7-диазаспиро[2,5] октан-7-ил)-6-фтор-1-(2,4-дифторфенил)-1,4-дигидро-4-оксо-1,8-нафтиридин-3-карбоновая кислота;
7-(4,7-диазаспиро[2,5] октан-7-ил)-6,8-дифтор-1-винил-1,4-дигидро-4-оксохинолин-3-карбоновая кислота,
8-хлор-7-(4,7-диазаспиро[2,5] октан-7-ил)-6-фтор-1-винил-1,4-дигидро-4-оксохинолин-3-карбоновая кислота;
7-(4,7-диазаспиро[2,5] октан-7-ил)-6-фтор-1-винил-1,4-дигидро-4-оксохинолин-3-карбоновая кислота;
7-(4,7-диазаспиро[2,5] октан-7-ил)-6-фтор-винил-1,4-дигидро-4-оксо-1,8-нафтиридин-3-карбоновая кислота;
10-(7-амино-5-азаспиро[2,4] гептан-5-ил)-9- фтор-3-(S)-метил-2,3-дигидро-7-оксо-7H-пиридо[1,2,3-de][1,4]бензоксазин-6-карбоновая кислота;
10-(4,7-диазаспиро[2,5] октан-7-ил)-9-фтор-3-(S)-метил-2,3-дигидро-7-оксо-7H-пиридо[1,2,3-de] [1,4]бензоксазин-6-карбоновая кислота;
8-(3-амино-5-азаспиро[2,4] гептан-5-ил)-9-фтор-5-(S)-метил-6,7-дигидро-1,7-диоксо-1H,5H-бензо[ij]хинолизин-2-карбоновая кислота;
8-(4,7-диазаспиро[2,5] оксан-7-ил)-9-фтор-5-(S)-метил-6,7-дигидро-1,7-диоксо-1H,5H-бензо[ij]хинолизин-2-карбоновая кислота;
10-(7-амино-5-азаспиро[2,4] гептан-5-ил)-9-фтор-3-(S)-метил-2,3-дигидро-7-оксо-7H-пиридо[1,2,3-de][1,4]бензотиазин-6-кабоновая кислота;
10-(4,7-диазаспиро[2,5] октан-7-ил)-9-фтор-3-(S)-метил-2,3-дигидро-7-оксо-7H-пиридо[1,2,3-de] [1,4]бензотиазин-6-карбоновая кислота;
5-амино-7-(7-амино-5-азаспиро[2,4]гептан-5-ил)-1-циклопропил-6,8-дифтор-1,4-дигидро-4-оксохинолин-3-карбоновая кислота;
5-амино-7-(7-амино-5-азаспиро[2,4] гептан-5-ил)8-хлор-1-циклопропио-6-фтор-1,4-дигидро-4-оксохинолин-3-карбоновая кислота;
5-амино-7-(7-амино-5-азаспиро[2,4] гептан-5-ил)-6,8-дифтор-1-(2-фторэтил)-1,4-дигидро-4-оксохинолин-3-карбоновая кислота;
5-амино-7-(7-амино-5-азаспиро[2,4] гептан-5-ил)-8-хлор-6-фтор-1-(2-фторэтил)-1,4-дигидро-4-оксохинолин-3-карбоновая кислота;
5-амино-7-(7-амино-5-азаспиро[2,4] гептан-5-ил)-1-этил-6,8-дифтор-1,4-дигидро-4-оксохинолин-3-карбоновая кислота;
5-амино-7-(7-амино-5-азаспиро[2,4] гептан-5-ил)-8-хлор-1-этил-6-фтор-1,4-дигидро-4-оксохинолин-3-карбоновая кислота;
5-амино-7-(7-амино-5-азаспиро[2,4] гептан-5-ил)-6,8-дифтор-1-(2,4-дифторфенил)-1,4-дигидро-4-оксохинолин-3-карбоновая кислота;
5-амино-7-(7-амино-5-азаспиро[2,4] гептан-5-ил)-8-хлор-6-фтор-1-(2,4-дифторфенил)-1,4-дигидро-4-оксохинолин-3-карбоновая кислота;
5-амино-1-циклопропил-7-(4,7-диазаспиро[2,5] октан-7-ил)-6,8-дифтор-1,4-дигидро-4-оксохинолин-3-карбоновая кислота;
5-амино-8-хлор-7-(4,7-диазаспиро[2,5] октан-7-ил)-1-циклопропил-6-фтор-1,4-дигидро-4-оксохинолин-3-карбоновая кислота;
5-амино-7-(4,7-диазаспиро[2,5] октан-7-ил)-6,8-дифтор-1-(2-фторэтил)-1,4-дигидро-4-оксохинолин-3-карбоновая кислота;
5-амино-8-хлор-7-(4,7-диазаспиро[2,5] октан-7-ил)6- фтор-1-(2-фторэфтил)-1,4-дигидро-4-оксохинолин-3-карбоновая кислота;
5-амино-7-(4,7-диазаспиро[2,5] октан-7-ил)-1-этил-6,8-дифтор-1,4-дигидро-4-оксохинолин-3-карбоновая кислота;
5-амино-8хлор-7-(4,7-диазаспиро[2,5] октан-7-ил)-1-этил-6-фтор-1,4-дигидро-4-оксохинолин-3-карбоновая кислота;
5-амино-7(4,7-диазаспиро[2,5] октан-7-ил)-6,8-дифтор-1-(2,4-дифторфенил)-1,4-дигидро-4-оксохинолин-3-карбоновая кислота;
5-амино-8-хлор-7-(4,7-диазаспиро[2,5]октан-7-ил)-6-фтор-1-(2,4-дифторфенил)-1,4-дигидро-4-оксохинолин-3-карбоновая кислота;
5-амино-7-(7-амино-5-азаспиро[2,4] гептан-5-ил)-6,8-дифтор-1-винил-1,4-дигидро-4-оксохинолин-3-карбоновая кислота;
5-амино-7-(7-амино-5-азаспиро[2,4] гептан-5-ил)-8-хлор-6-фтор-1-винил-1,4-дигидро-4-оксохинолин-3-карбоновая кислота;
5-амино-7-(4,7-диазаспиро[2,5] октан-7-ил)-6,8-дифтор-1-винил-1,4-дигидро-4-оксохинолин-3-карбоновая кислота;
5-амино-8-хлор-7-(4,7-диазаспиро[2,5] октан-7-ил)-6-фтор-1-винил-1,4-дигидро-4-оксохинолин-3-карбоновая кислота;
7-(7-амино-5-азаспиро[2,5] гептан-5-ил)-1-циклопропил-6-фтор-8-метокси-1,4-дигидро-4-оксохинолин-3-карбоновая кислота;
7-(7-амино-5-азаспиро[2,5] гептан-5-ил)-6-фтор-1-(2-фторэтил)-8-метокси-1,4-дигидро-4-оксохинолин-3-карбоновая кислота;
7-(7-амино-5-азаспиро[2,5] гептан-5-ил)-1-этил-6-фтор-8-метокси-1,4-дигидро-4-оксохинолин-3-карбоновая кислота;
7-(7-амино-5-азаспиро[2,5] гептан-5-ил)-6-фтор-1-(2,4-дифторфенил)-8-метокси-1,4-дигидро-4-оксохинолин-3-карбоновая кислота;
7-(7-амино-5-азаспиро[2,5] гептан-5-ил)-6-фтор-8-метокси-1-винил-1,4-дигидро-4-оксохинолин-3-карбоновая кислота;
7-(7-амино-5-азаспиро[2,5] гептан-5-ил)-1-циклопропил-6-фтор-8-метил-1,4-дигидро-4-оксохинолин-3-карбоновая кислота;
7-(7-амино-5-азаспиро[2,5] гептан-5-ил)-6-фтор-1-(2-фторэтил)-8-метил-1,4-дигидро-4-оксихинолин-3-карбоновая кислота;
7-(7-амино-5-азаспиро[2,5] гептан-5-ил)-1-этитл-6-фтор-8-метил-1,4-дигидро-4-оксохинолин-3-карбоновая кислота;
7-(7-амино-5-азаспиро[2,5] гептан-5-ил)-6-фтор-1-(2,4-дифторфенил)-8-метил-1,4-дигидро-4-оксохинолин-3-карбоновая кислота;
7-(7-амино-5-азаспиро[2,5] гептан-5-ил)-6-фтор-8-метил-1-винил-1,4-дигидро-4-оксохинолин-3-карбоновая кислота;
1-циклопропил-7-(4,7-диазаспиро[2,5] октан-7-ил)-6-фтор-8-метокси-1,4-дигидро-4-оксохинолин-3-карбоновая кислота;
7-(4,7-диазаспиро[2,5] октан-7-ил)-6-фтор-1-(2-фторэтил)-8-метокси-1,4-дигидро-4-оксохинолин-3-карбоновая кислота;
7-(4,7-диазаспиро[2,5] октан-7-ил)-1-этил-6-фтор-8-метокси-1,4-дигидро-4-оксохинолин-3-карбоновая кислота;
7-(4,7-диазаспиро[2,5] октан-7-ил)-1-(2,4-дифторфенил)-6-фтор-8-метокси-1,4-дигидро-4-оксохинолин-3-карбоновая кислота;
7-(4,7-диазаспиро[2,5] октан-7-ил)-6-фтор-8-метокси-1-винил-1,4-дигидро-4-оксохинлолин-3-карбоновая кислота;
1-циклопропил-7-(4,7-диазаспиро[2,5] октан-7-ил)-6-фтор-8-метил-1,4-дигидро-4-оксохинолин-3-карбоновая кислота;
7-(4,7-диазаспиро[2,5] октан-7-ил)-6-фтор-1-(2-фторэтил)-8-метил-1,4-дигидро-4-оксохинолин-3-карбоновая кислота;
7-(4,7-диазаспиро[2,5] октан-7-ил)-1-этил-6-фтор-8-метил-1,4-дигидро-4-оксохинолин-3-карбоновая кислота;
7-(4,7-диазаспиро[2,5] октан-7-ил)-1-(2,4-дифторфенил)-6-фтор-8-метил-1,4-дигидро-4-оксохинолин-3-карбоновая кислота;
7-(4,7-диазаспиро[2,5] октан-7-ил)-6-фтор-8-метил-1-винил-1,4-дигидро-4-оксохинолин-3-карбоновая кислота;
7-(8-амино-6-азаспиро[3,4] октан-6-ил)-1-циклопропил-6,8-дифтор-1,4-дигидро-4-оксохинолин-3-карбоновая кислота;
7-(8-амино-6-азаспиро[3,4] октан-6-ил)-8-хлор-1-циклопропил-6-фтор-1,4-дигидро-4-оксохинолин-3-карбоновая кислота;
7-(8-амино-6-азаспиро[3,4] октан-6-ил)-6,8-дифтор-1-(2-фторэтил)-1,4-дигидро-4-оксохинолин-3-карбоновая кислота;
7-(8-амино-6-азаспиро[3,4] октан-6-ил)-8-хлор-6-фтор-1-(2-фторэтил)-1,4-дигидро-4-оксохинолин-3-карбоновая кислота;
7-(8-амино-6-азаспиро[3,4] октан-6-ил)-1-этил-6,8-дифтор-1,4-дигидро-4-оксохинолин-3-карбоновая кислота;
7-(8-амино-6-азаспиро[3,4] октан-6-ил)-8-хлор-1-этил-6-фтор-1,4-дигидро-4-оксохинолин-3-карбоновая кислота;
7-(8-амино-6-азаспиро[3,4] октан-6-ил)-6,8-дифтор-1-(2,4-дифторфенил)-1,4-дигидро-4-оксохинолин-3-карбоновая кислота;
7-(8-амино-6-азаспиро[3,4] октан-6-ил)-8-хлор-6-фтор-1-(2,4-дифторфенил)-1,4-дигидро-4-оксохинолин-3-карбоновая кислота;
7-(8-амино-6-азаспиро[3,4] октан-6-ил)-6,8-дифтор-1-винил-1,4-дигидро-4-оксохинолин-3-карбоновая кислота;
7-(8-амино-6-азаспиро[3,4] октан-6-ил)-8-хлор-6-фтор-1-винил-1,4-дигидро-4-оксохинолин-3-карбоновая кислота;
10-(8-амино-6-азаспиро[3,4] октан-6-ил)-9-фтор-3-(S)-метил-2,3-дигидро-7-оксо-7H-пиридо[1,2,3-de] [1,4]бензоксазин-6-карбоновая кислота;
8-(8-амино-6-азаспиро[3,4] октан-6-ил)-9-фтор-5-(S)-метил-6,7-дигидро-1,7-диоксо-1H,5H-бензо[ij]хинолизин-2-карбоновая кислота;
1-циклопропил-7-/5,8-диазаспиро[3,5] нонан-8-ил)-6,8-дифтор- 1,4-дигидро-4-оксохинолин-3-карбоновая кислота;
8-хлор-1-циклопропил-7-(5,8-дазаспиро[3,5] нонан-8-ил)-6-фтор-1,4-дигидро-4-оксохинолин-3-карбоновая кислота;
7-(5,8-диазаспиро[3,5] нонан-8-ил)-6,8-дифтор-1-(2-фторэтил)-1,4-дигидро-4-оксохинолин-3-карбоновая кислота;
8-хлор-7-(5,8-диазаспиро[3,5]нонан-8-ил)-6-фтор-1-(2-фторэтил)-1,4-дигидро-4-оксохинолин-3-карбоновая кислота;
7-(5,8-диазаспиро[3,5] нонан-8-ил)-1-этил-6,8-дифтор-1,4-дигидро-4-оксохинолин-3-карбоновая кислота;
8-хлор-7-(5,8-диазаспиро[3,5] нонан-8-ил)-1-этил-6-фтор-1,4-дигидро-4-оксохинолин-3-карбоновая кислота;
7-(5,8-диазаспиро[3,5] нонан-8-ил)-6,8-дифтор-1-(2,4-дифторфенил)-1,4-дигидро-4-оксохинолин-3-карбоновая кислота;
8-хлор-7-(5,8-диазаспиро[3,5] нонан-8-ил)-6-фтор-1-(2,4-дифторфенил)-1,4-дигидро-4-оксохинолин-3-карбоновая кислота;
7-(5,8-диазаспиро[3,5] нонан-8-ил)-6,8-дифтор-1-винил-1,4-дигидро-4-оксохинолин-3-карбоновая кислота;
8-хлор-7-(5,8-диазаспиро[3,5] нонан-8-ил)-6-фтор-1-винил-1,4-дигидро-4-оксохинолин-3-карбоновая кислота;
10-(5,8-диазаспиро[3,5] нонан-8-ил)-9-фтор-3-(S)-метил-2,5-дигидро-7-оксо-1Н-пиридо[1,2,3-de] [1,4]-бензоксазин-6-карбоновая кислота;
10-(5,8-диазаспиро[3,5] нонан-8-ил)-9-фтор-3-(S)-метил-2,3-дигидро-7-оксо-7H-[1,2,3-de][1,4] бензтиазин-6-карбоновая кислота;
8-(5,8-диазаспиро[3,5] нонан-8-ил)-9-фтор-5-(S)метил-6,7-дигидро-1,7-диоксо-1H,5H-бензо[ij] хинолизин-2-карбоновая кислота;
7-(7-метиламитно-5-азаспиро[2,4] гептан-5-ил)-1-циклопропил-6,8-дифтор-1,4-дигидро-4-оксохинолин-3-карбоновая кислота;
7-(7-диметиламино-5-азаспиро[2,4] гептан-5-ил)-1-цикропропил-6,8-дифтор-1,4-дигидро-4-оксохинолин-3-карбоновая кислота и
8-хлор-1-циклопропил-7-(4-метил-4,7-диазаспиро[2,5] октан-7-ил)-6-фтор-1,4-дигидро-4-оксохинолин-3-карбоновая кислота.
Эти производные хинолина, имеющие спирокольцо-содержащий фрагмент циклического амина, являются более липофильными, чем соответствующие производные хинолина, не имеющие спирокольца, и, как ожидается, лучше поглощаются после орального применения и проявляют бактерицидную активность.
Производные пиридонкарбоновой кислоты согласно изобретению могут быть использованы в качестве свободных соединений, кислотных составных солей или солей карбоксильных групп этих соединений. Примеры таких кислотных составных солей включают неорганические составные соли, такие как гидрохлорид, сульфат, нитрат, гидробромид, гидрохлорид и фосфат, и органические составные соли, такие как ацетат, метансульфонат, бензолсульфонат, толуолсульфонат, цитрат, малеат, фумарат и лактат.
Примеры указанных солей карбоксильных групп включают неорганические и органические соли, например соли щелочных металлов, такие как соль лития, соль натрия, соль калия, соли щелочноземельных металлов, такие как соль магния и соль кальция, соль аммония, соль триэтиламина, N-метилглукамат и трис(гидроксиметил) аминометановая соль.
Эти свободные соединения, кислотные составные соли и соли карбоксильных групп производных пиридонкарбоновой кислоты могут существовать в виде гидратов.
С другой стороны, производные хинолона, карбоксильные фрагменты которых являются сложными эфирами, оказываются полезными в качестве предшественников лекарств или синтетических интермедиатов.
Сложные эфиры, которые используются в качестве предшественников лекарств, являются сложными эфирами, которые легко расщепляются в теле пациента с получением свободных карбоновых кислот. Таким образом, например, подходящими являются ацетоксиметиловый сложный эфир, пивалоилоксиметиловый сложный эфир, этоксикарбонил-окси сложный эфир, холиновый сложный эфир, диметиламиноэтиловый сложный эфир, 5-инданиловый сложный эфир, фталидиниловый сложный эфир, 5-замещенный-2-оксо-1,3-диоксо-4-илметиловый сложный эфир и различные оксоалкиловые сложные эфиры, такие как 3-ацетокси-2-оксобутиловый сложный эфир.
Соединения изобретения проявляют хорошую бактерицидную активность и таким образом могут быть использованы в качестве лекарств для человека, ветеринарных лекарств, лекарств для рыб, сельскохозяйственных химикалий и пищевых антисептиков.
Доза соединения настоящего изобретения в качестве активного ингредиента лекарства для применения на человеке находится в диапазоне от 50 мг до 1 г для взрослого пациента в день, и предпочтительно 100 300 мг для взрослого человека в день. Доза для лекарства в использовании для животных находится в диапазоне от 1 до 200 мг на кг живого веса в день, и предпочтительно от 5 до 100 мг на кг живого веса в день. Ежедневная доза должна быть приведена в соответствии с такими факторами, как предназначение (терапевтическое или превентивное), тип, размер и возраст человека или животного, которое подвергается лечению, род патогонных организмов, подлежащих обработке и симптомы заболевания и т.д.
Ежедневная доза, представленная выше, может быть разделена на 1 4 раза в день. Может возникнуть необходимость отклоняться от указанных выше количеств согласно вызывающим заболевание организма или множества проявляемых симптомов.
Соединения согласно настоящего изобретению являются активными против широкого спектра микроорганизмов и делают возможным предохранить, облегчить и/или вылечить заболевания, вызванные таким потогенами. Примеры чувствительных бактерий или бактерийподобных микроорганизмов включают Staphylococcus sp. Streptococcus pyogenes, гемолитические стрептококки, ентерококки, Streptococcus pneumonia, Neisseria gonorrhoeae Escherichia coli, Citrobacter sp. Shigella sp. Klebsiella pneumoniae, Enterobacter sp. Serriata sp. Proteus sp. Pseudomonas aeruginosa, Haemophilus influenzae, Acinetobacter sp. Campylobacter sp/ u Chlamidiae.
Примеры заболеваний, которые могут быть предохранены, облегчены и/или вылечены с помощью соединений настоящего изобретения, включают пневмонию, хронические бронхиты, диффузные панбронхиолиты, бронхиктазы с инфекцией, вторичные инфекции хронических респираторных заболеваний, фаринголарингиты, тонзилиты, острые бронхиты, пиелонефриты, цитизы, простатиты, эпидидимиты, гонококкальные уретриты, нонгоноккокальные уретриты, фолликулиты, фурункулы, фурункулез, карбункул, рожу, флегмоны, лимфангиты/лимфадениты, фелон, подкожные абсцессы, спирадентиты, акне конглобата, инфекционую атерому, перианальный абсцесс, мустадентит, поверхностные вторичные инфекции после травмы, родов или хирургической травмы, холециститы, холангиты, отитные области, синуситы, блефариты, хордеолум, дактриоциститы, тарсадениты, каратохелкоциты, бациллярную дизентерию и энтериты.
Примеры чувствительных микроорганизмов, которые вызывают ветеринарные заболевания, включают Escherichia sp. Salmonella sp. Pasteurella sp. Haemophysalis sp. Bordetella sp. Staphylococcus sp. u Mycoplasma sp. Ниже приведены некоторые примеры ветеринарных заболеваний: заболевания домашней птицы включают колибациллозы, пуллорозные заболевания, птичьи паратифозы, холеру домашней птицы, инфекционные катары верхних дыхательных путей, стафилококковые инфекции и микоплазменные заболевания; заболевания свиней включают колибациллозы, сальмонеллезы, пастереллезы, гемофильную инфекцию, атрофические риниты, экдудавивные эпидермиты и микоплазменные заболевания; заболевания крупного рогатого скота включают колибациллозы, мальмонеллезы, геморрагическую септицемию, микоплазменные заболевания, бычью инфекционную плевропневманию и бычьи маститы; заболевания собак включают сепсис колиформы, сальмонеллез, геморрагическую септицемию, гнойный эндометрит и циститы; заболевания кошек включают геморрагический плеврит, цистит, хронический ринит; заболевания котят включают бактериальный энтрит и микоплазменные заболевания.
Фармацевтические препараты, содержащие одно или более соединений настоящего изобретения в качестве активного ингредиента могут быть приготовлены согласно стандартным методам приготовления. Примеры фармацевтических препаратов для орального применения включают таблетки, порошки, гранулы, капсулы, растворы, сиропы, элексиры и маслянные или водные суспензии.
Твердые препараты могут содержать активное соединение или соединения настоящего изобретения вместе с обычными эксципиентами, такими как наполнителя, разбавители, связующие, увлажнители абсорбции, смачивающие агенты, адсорбенты и лубриканты. Жидкие препараты могут включать растворы, суспензии или эмульсии. Они могут содержать в дополнение к активному соединению или соединениям, обычные эксципиенты, такие как солюбилизирующие агенты, эмульгаторы, стабилизаторы или предохранительные средства. Растворы соединения (соединений) настоящего изобретения, которые могут содержать эти ингредиенты, помещают в контейнер, такой как ампулы или пузырьки и, кроме того, такой раствор может быть отвержден с помощью лиофилизации. Лиофилизованную композицию разбавляют разбавителем при применении. Контейнер может содержать либо одну дозу, либо множество доз.
Примеры типичных препаратов включают растворы, суспензии, эмульсии, мази, гели, кремы, лосьоны и жидкости для пульверизации.
Соединение настоящего изобретения может также быть применено к животным в качестве орального или неорального ветеринарного лекарства. И такие лекарства могут быть применены в виде смеси с кормом или водой. Препараты для ветеринарных лекарств или добавок могут быть получены согласно обычному методу в этой области и такие препараты включают порошки, тонкие гранулы, солюбилизованные порошки, сиропы, растворы и инъекции.
Ниже представлены примеры композиций, которые носят иллюстративный характер и не должны быть интерпретированы как ограничивающие.
Пример композиции 1.
Каждая капсула содержит, в мг:
Соединение 32b 100,0
Пшеничный крахмал 23,0
Карбоксиметилцеллюлозу кальция 22,5
Гидроксипропилметилцеллюлозу 3,0
Стеарат магния 1,5
Итого 150,0
Пример композиции 2.
Раствор содержит, г:
Соединение 31b 1-10
Уксусную кислоту или гидроокись натрия 0,5-1
Этил пара-гидроксикарбонат 0,1
Очищенная вода 88,9-98,4
Итого 100,0
Пример композиции 3.
Порошок для примешивания к корму содержит, г:
Соединение 55b 1-10
Пшеничный крахмал 98,5-89,5
Легкую безводную кремниевую кислоту 0,5
Итого 100,0
Хотя описание иллюстрирует и описывает предпочтительные воплощения изобретения следует понимать, что это не является ограничением изобретения.
Следующие примеры далее иллюстрируют настоящее изобретение, но это не означает, что они рассматриваются как ограничивающие его сферу притязаний.
Испытания на бактерицидную активность были проведены по методу, указанному Японским Обществом Хемотерапии (Chemotherapy 29/1/, 76 1981). Таблица с бактерицидной активностью следует после реакционных схем для синтеза различных спирокольцо-содержащих производных циклических аминов, соединений интермедиатов для синтеза хинолоновых колец и синтеза различных спиросоединений.
Справочный пример 1. Синтез 7-амино-5-азаспиро[2,4]гептана.
1. Этил-ацетил-1-циклопропанкарбоксилат (соединение 2).
К 10,4 г этилацетоацетата добавили 15 г 1,2-дибромэтана, 23 г карбоната калия и 150 мл N,N-диметилформамида (ДМФ) и смесь перемешивали при комнатной температуре в течение 2 дней. После отфильтрования нерастворимой части, фильтрат концентрировали досуха при пониженном давлении и к остатку добавили воду. Смесь экстрагировали хлороформом. Экстракт сушили над безводным сульфатом натрия и растворитель удаляли при пониженном давлении. Светло-желтый маслообразный остаток затем подвергали вакуумной дистилляции с получением 7,5 г целевого соединения 2 в виде фракции, кипящей при температуре 70-71oC/ 2-3 мм ртутного столба.
1H-ЯМР/СDСl3/ δ ч/мин: 1,30/3Н, триплет, J=7 Гц/, 1,48/4Н, синглет/, 2,49/3H, синглет/, 4,24/2Н, квардуплет, J=7 Гц/.
2. 5-Бензил-4,7-диоксо-5-азаспиро[2,4]гептан (соединение 4).
В 50 мл этанола растворяли 7 г соединения 2 и затем 8,0 г брома добавляли по каплям к смеси при перемешивании при комнатной температуре. После 2 ч перемешивания при этой температуре избыток брома и растворителя удаляли при пониженном давлении с получением этил-1-бромацетил-1-циклопропанкарбоксилата (соединение 3). Этот продукт растворяли без очистки в 50 мл этанола и к раствору добавляли по каплям 12 г бензиламина при перемешивании в условиях охлаждения льдом. Затем смесь перемешивали при комнатной температуре в течении 24 ч, после чего растворитель удаляли при пониженном давлении. Остаток растворяли в 200 мл хлороформа и раствор промывали 1 нормальной соляной кислотой и насыщенным водным раствором хлорида натрия для последовательно и сушили над безводным сульфатом натрия. Затем растворитель удаляли и остаток подвергали хроматографии на силикагеле с использованием в качестве элюента 2% метанол-хлороформа. Методика приводила к получению 2,3 г целевого соединений 4 в виде светло-желтых кристаллов.
1H-ЯМР/СDСl3/ d ч/млн: 1,6-1,8/4Н, мультиплет/, 3,78/2Н, синглет/, 4,68/2Н, синглет/, 7,2-7,45/5Н, широкий синглет/.
3. 5-Бензил-7-(гидроксимино)-4-оксо-5-азаспиро[2,4] гептан (соединение 5).
К 670 мг соединения 4 добавили 700 мг гидроксиламингидрохлорида, 200 мг триэтиламина и 10 мл этанола. Смесь перемешивали при комнатной температуре в течение ночи. Растворитель затем удаляли при пониженном давлении и остаток растворили в 10%-ной водной лимонной кислоте и экстрагировали хлороформом. Слой хлороформа экстрагировали 1 нормальной водной гидроокисью натрия и водный слой подкисляли концентрированной соляной кислотой и экстрагировали хлороформом. Экстракт сушили над безводным сульфатом натрия и растворитель затем отгоняли при пониженном давлении с получением 490 мг целевого соединения 5 в виде бесцветных кристаллов.
1H-ЯМР /С1Сl3/ d ч/млн: 1,3-1,7/4Н, мультиплет/, 3,80x и 4,10x/2H, синглет/, 4,60xx и 4,70xx/2H, синглет/, 7,38/5Н, мультиплет/(x, xx: смесь син- и антиизомеров).
4. 7-Амино-5-азаспиро[2,4]гептан (соединение 7).
В 80 мл сухого тетрагидрофурана растворили 490 мг соединения 5, после чего добавили 500 мг литийалюминий гидрида и смесь кипятили с обратным холодильником в течении 8 ч. Затем при комнатной температуре 0,5 мл воды, 0,5 мл 15%-ной водной гидроокиси натрия и 1,5 мл воды последовательно добавили к смеси и нерастворимые вещества отфильтровали. Фильтрат концентрировали при пониженном давлении с получением 7-амино-5-бензил-5-азаспиро-2,4-гептана (соединение 6). Этот продукт растворили без очистки в 20 мл этанола и после добавления 10% палладия на угле провели каталитическое гидрогенирование при давлении 4,5 кг/см2 и 50oC. После 6 ч реакции катализатор отфильтровали и фильтрат концентрировали при пониженном давлении при температуре не выше, чем комнатная температура. Вышеописанная методика привела к получению целевого соединения 7 в виде неочищенного продукта. Это соединение 7 было использовано без очистки в различных реакциях.
5. 7-[(R)-N-пара-толуолсульфонилпропил]амино-5-бензил-5-азаспипро[2,4] гептан (соединение 8).
Смесь 2,8 г соединения 6, 1,5 г триэтиламина и 50 мл метиленхлорида была приготовлена и к смеси по каплям добавили в течение 10 мин в условиях охлаждения льдом и при перемешивании раствор (R)-N-пара-толуолсульфонилпропилхлорида, (полученный из 4 г (R)-N-пара-толуолсульфонилпронила и избыточного количества тионилхлорида) в 10 мл метиленхлорида. Затем смесь перемешивали при комнатной температуре в течение 3 ч. Реакционную смесь промыли насыщенным водным раствором бикарбоната натрия и насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом натрия. Растворитель удалили при пониженном давлении и остаток подвергли флаш-колоночной хроматографии (силикагель 80 г). Из этилацетатной фракции было получено 3,5 г целевого соединения 8 в виде сиропа.
6. 7-[(R)-N-пара-толуолсульфонилпропил]амино-5-бензилоксикарбонил-5-азаспиро[2,4]гептан (соединение 9) и оптические изомеры (соединение 9а и соединение 9b).
К 4 мл сухого метиленхлорида добавили 3,5 г соединения 8 и 2,5 мл бензилхлоркарбоната и смесь перемешивали при комнатной температуре в течение 12 ч. После этого дополнительно добавили 4 мл бензилхлоркарбоната и смесь перемешивали в течение 5 ч. Затем, хлороформ добавили к реакционной смеси. Смесь промыли насыщенным водным раствором бикарбоната натрия и насыщенным водным раствором хлорида натрия в указанной последовательности и сушили над безводным сульфатом натрия. Затем растворитель удаляли при пониженном давлении и остаток подвергали флаш-колоночной хроматографии (силикагель 85 г). Из фракции этилацетат-гексан (2: 1 4:1 объем/объем) было получено целевое соединение 9 в виде светло-желтого масла. Это масло сразу же подвергали жидкостной хроматографии HR1 C с получением 1,40 г соединения 9а и 1,45 г (соединение 9b).
Колонка: Nucleosil® 50 5 (20 х 250 мм)
Элюент: этилацетат
Скорость потока: 11 мл/мин
Время удерживания: 9a 19,5 мин; 9b 21 мин
9a:[α]D + 133,6o (c 0,75, хлороформ)
9b:[α]D + 76,0o (с 0,85, хлороформ).
7. Оптически активный 7-амино-5-азаспиро [2,4]гептан (соединение 7а и соединение 7b)
1,4 г соединения 9a растворили в 20 мл этанола, после чего добавили 15 мл 2 нормального водного раствора гидроокиси натрия. Смесь кипятили с обратным холодильником в течение 19 ч. Реакционную смесь затем подкисляли концентрированной соляной кислотой и промывали дважды хлорофором и один раз этилацетатом. Водный слой затем концентрировали при пониженном давлении с получением бесцветного твердого остатка. К этому бесцветному остатку добавили 10 мл 50%-ной водной гидроокиси натрия и смесь дистиллировали при пониженном давлении с получением водного раствора, содержащего соединение 7а. Этот дистиллят был использован без дополнительной очистки в следующей реакции.
Другое соединение 7b было также получено из соединения 9b таким же способом.
8. 7-Трет-бутоксикарбониламино-5- азаспиро[2,4]гептан (соединение 11).
В 30 мл тетрагидрофурана растворили 800 мг соединения 6, после чего добавили 1,2 г 2-(трет- бутоксикарбонилоксиимино)-2-фенилацетониьрила (BOC-ON) при комнатной температуре и смесь перемешивали при такой температуре в течение 2 ч. Затем растворитель удаляли при пониженном давлении и к остатку добавили хлороформ. Смесь экстрагировали 10%-ным водным раствором лимонной кислоты. Экстракт лимонной кислоты доводили до pH ≥ 10 с помощью 1 нормальной гидроокиси натрия и экстрагировали хлороформом. Экстракт сушили над безводным сульфатом натрия и растворитель удаляли при пониженном давлении с получением 900 мг 7-трет-бутоксикарбониламино-5-бензил-5-азаспиро [2,4] гептана (соединение 10). 870 мг этого соединения 10 растворили в 15 мл этанола и проводили каталитическое гидрогенирование при 40oC и 4,5 кг/см2 в присутствии 500 мг 10% палладия на угле в течение 2 ч. Затем катализатор отфильтровывали и фильтрат концентрировали при пониженном давлении с получением целевого соединения 11. Этот продукт был использован без очистки в последующей реакции.
Справочный пример 2. Синтез оптически активного 7-амино-5-азаспиро[2,4] гептана.
1. 5-[(1R)-фенилэтил]-4,7-диоксо-5-азаспиро[2,4]гептан (соединение 12).
35,7 г соединения 2 растворили в 200 мл этанола и затем по каплям добавили 40 г брома при перемешивании и при комнатной температуре. Реакционную смесь перемешивали в течение 2 ч при комнатной температуре, после чего избыток брома и растворитель удалили при пониженном давлении с получением этил-1-бромацетил-1-циклопропанкарбоксилата (соединение 3). Этот продукт растворили без очистки в 200 мл этанола и в условиях охлаждения льдом и перемешивания и одновременно по каплям добавляли в течение 1 ч 33 г R-(+)-1-фенитлэтиламина и 27 г триэтиламина. Затем при комнатной температуре смесь перемешивали в течение 2 дн. После этого нерастворимые вещества отфильтровывали и этанол удаляли при пониженном давлении. Остаток растворяли в 300 мл этилацетата и раствор промыли последовательно 1 нормальной соляной кислотой, насыщенным водным раствором бикарбоната натрия и насыщенным водным раствором хлорида натрия. Органический слой сушили над безводным сульфатом натрия. Затем растворитель удаляли при пониженном давлении и остаток подвергали хроматографии на колонке с силикагелем (200 г) с использованием в качестве элюентной системы хлороформ-2% метанол/хлороформ. Методика привела к получению целевого соединения 12 в виде бесцветных кристаллов. Т. пл. 98 - 103oC.
1H-ЯМР /CDCl3/ δ ч/мин: 1,4 1,8/4H, мультиплет/, 1,62/3H, дуплет, J 7,2 Гц/, 3,5/1H, дуплет, J 18 Гц/, 3,9/1H, дуплет, J 18 Гц/, 5,82/1H, квардуплет, J 7,2 Гц/, 7,36/5H, синглет/.
2. 5-[(1R)-фенилэтил] -7-гидроксиамино-4-оксо-5-азаспиро[2,4] гептан (соединение 13).
К 3,35 г соединения 12 добавили 1,6 г гидроксиламина гидрохлорида, 2,3 г триэтиламина и 80 мл этанола и смесь перемешивали при комнатной температуре в течение 2 ч. Затем растворитель удалили при пониженном давлении и остаток экстрагировали хлороформом. Экстракт промывали 10%-ным водным раствором лимонной кислоты и насыщенным водным раствором натрия и растворитель удаляли при пониженном давлении. Методика привела к получению 3,5 г целевого соединения 13 в в де бесцветных кристаллов. Т. пл. 188-194oC.
1H-ЯМР /CDCl3/ d ч/млн: 1,2-1,4/2H, мультиплет/,1,5/3H, дуплет, J 7,2 Гц и 2Н, мультиплет/, 3,8/1H, дуплет, J 18 Гц/ 4,16/1H, дуплет, J 18 Гц/, 5,63/1H, квардуплет, J 7,2 Гц/, 7,32/5H, синглет/.
3. 7-амино-4-оксо-5-[(1R)-фенилэтил] -5-азаспиро[2,4]гептан (соединение 14a и соединение 14b).
К 150 мл метанола добавили 3,5 г соединения 13 и 7,5 мл никеля Ренея. Каталитическое гидрогенирование проводили при комнатной температуре в течение 12 ч. После отфильтровывания катализатора растворитель удалили при пониженном давлении и остаток подвергли хроматографии на колонке с силикагелем (100 г) с использованием в качестве элюента 5% метанол/хлороформ. Методика привела к получению 1 г соединения 14b, (полученного из фракции, элюированной раннее), и 0,8 г соединения 14a в виде бесцветных масел.
14b: 1H-ЯМР /CDCl3/ d ч/млн: 0,8-1,4 /4Н, мультиплет/, 1,52/3H, дуплет, J 7 Гц/, 2,87/1H, двойной дуплет, J 10 Гц, 3 Гц/ 3,3-3,9/2H, мультиплет/, 4,27/2H, широкий синглет/, 5,42/1H, квардуплет, J 7Гц/ 7,29/5H, синглет/
14a: 1Н-ЯМР CDCl3/d ч/млн: 0,6-1,3/4H, мультиплет/, 1,40/2H, синглет/, 1,53/3H, дуплет, J 7,2 Гц/, 2,99/1Н, двойной дуплет, J 12,8 Гц, 7,2 Гц/, 3,15-3,45/2H, мультиплет/. 5,52/1H, квардуплет, J 7,2 Гц/, 7,30/5H, синглет/.
4. 7-Амино-5[(1R)-фенилэтил] -5-азаспиро[2,4] гептан (соединение 15а и соединение 15b).
К 50 мл сухого тетрогидрофурана добавили 1,0 г соединения 14b и 500 мг литийалюминий гидрида и смесь кипятили с обратным холодильником в течение 17 ч. После охлаждения к реакционной смеси последовательно добавили 0,5 мл воды, 0,5 мл 15% -ной водной гидроокиси натрия, 1,5 мл воды и смесь далее перемешивали при комнатной температуре в течение 30 мин. Затем нерастворимое вещество удалили фильтрованием и промыли тетрагидрофураном. Промывочные растворы и фильтрат объединили и сушили. Наконец растворитель удалили при пониженном давлении с получением 940 мг целевого соединения 15b в виде светло-желтого масла. Подобно этому было получено 755 мг соединения 15а из 800 мг соединения 14а.
15b: 1H-ЯМР /CDCl3 d ч/млн: 0,2-0,8/4H, мультиплет/, 1,35/3H, дуплет, J 6,6 Гц/, 1,6-2,0/2H, широкий мультиплет/, 2,2-3,1/4H, мультиплет/, 3,24/1H, квардуплет, J=6,6 Гц/, 3,5-3,9/1H, мультиплет/, 7,28/5Г, широкий синглет/.
15а: 1H-ЯМР /CDCl3/ d ч/млн:0,3-0,9/4H, мультиплет/, 1,36/3H, дуплет, J= 6,7 Гц/, 1,8-2,2/2H, мультиплет/, 2,2-3,2/4H, мультиплет/, 3,24/1H, квардуплет, J=6,7 Гц/, 3,6-3,9/1H, мультиплет/, 7,28/5H, широкий синглет/.
5. 7-(Трет-бутоксикарбониламино)-5-[(1R)- фенилэтил] -5-азаспиро-2,4 гептан (соединение 16а и соединение 16b).
К 20 мл сухого тетрагидрофурана добавили 764 мг соединения 15b и 1,3 г BOC-CN. Смесь перемешивали при комнатной температуре в течение 4 ч. Реакционную смесь разбавили этилацетатом, промыли 1 нормальным водным раствором гидроокиси натрия дважды и один раз водой и экстрагировали 10%-ной водной лимонной кислотой. После того, как водный слой один раз промыли этилацетатом, его подщелочили 15%-ной водной гидроокисью натрия в условиях охлаждения и затем экстрагировали 3-я порциями хлороформа. Органические слои объединили, промыли насыщенным водным раствором хлористого натрия, сушили и растворитель удалили. Остаток подвергали хроматографии на колонке с силикагелем (20 г) с использованием в качестве элюента смесь хлороформ-метанол (20:1, 10: 1). Методика привела к получению 690 мг целевого соединения 16b. При стоянии этот продукт кристаллизовался. Кристаллы промыли н-гексаном. Таким же способом было приготовлено целевое соединение 16а.
16b: бесцветные кристаллы, т. пл. 103-105oC, [α]д-15,2° (с=1,475, хлороформ).
1H-ЯМР/CDCl3/ δ ч/млн: 0,4-0,9/4H, мультиплет/, 1,36/3H, дуплет, J=7,2 Гц/, 1,44/9H, синглет/, 2,42/2H, AB квардуплет, J=10,2 Гц, 2,79/2H, дуплет, J= 5,6 Гц/, 3,24/1H, квардуплет, J=7,2 Гц/, 3,6-4,0/1H, мультиплет/, 4,6-5,1/1H, широкий квардуплет/, 7,28/5H, синглет/.
Элементный анализ: для C19H28N2O2
Рассчитано: C 72,12 H 8,92 N 8,85
Найдено: C 71,63 H 9,07 N 8,64
16a: бесцветные кристаллы, температура плавления 95-97oC [α]д+47,6° (с 0,89, хлороформ)
1H-ЯМР/CDCl3/ δ ч/млн: 0,4-0,9/4H, мультиплет/, 1,33/3H, дуплет, J=6,6 Гц/, 1,40/9H, минглет, 2,29/1H, дуплет, J=9 Гц/, 2,44/1H, двойной дуплет, J= 10,8 Гц, 3,6 Гц/, 2,77/1H, дуплет, J=9 Гц/, 2,88/1H, двойной дуплет, J=10,8 Гц, 5,3 Гц/,3,22/1H, квардуплет, J=6,6 Гц/, 3,6-3,9/1H, мультиплет/, 4,7-5,2/1H, широкий дуплет/, 7,27/5H, синглет/.
Элементный анализ для C19H28N2O2:
Рассчитано: C 72,12 H 8,92 N 8,85
Найдено: C 71,86 H 9,36 N 8,68
6. 7-Трет-бутоксикарбониламино-5- азаспиро[2,4]гептан (соединение 11а и соединение 11b, оптический изомер соединения 11).
К 30 мл этанола добавили 650 мг соединения 16b и 500 мг палладия на угле (50% воды) и каталитическое восстановление проводили при давлении 4,2 атм и реакционный сосуд нагревали вольфрамовой лампой. Реакцию восстановления проводили в течение 6 ч. Катализатор затем отфильтровывали и маточную жидкость концентрировали досуха при пониженном давлении. Получающийся маслообразный остаток разбавили этилацетатом и экстрагировали 10%-ной водной лимонной кислотой дважды. Водный слой подщелачивали 15%-ной водной гидроокисью натрия и экстрагировали 3-я порциями хлороформа. Слои хлороформа объединили, промыли водой, сушили и растворитель удаляли с получением 440 мг целевого соединения 11b в виде неочищенного продукта. Целевое соединение 11а было также приготовлено таким же способом. 1H-ЯМР спектры соединений 11b и 11а находились в полном соответствии.
17b: 1H-ЯМР /CDCl3/ d ч/млн: 0,4-1,0/4H, мультиплет/, 1,42/9H, синглет/, 2,71/1H, дуплет, J= 10,2 Гц/, 2,92/1H, двойной дуплет, J=10,8, 3,6 Гц/, 3,01/1H, дуплет, J= 10,2 Гц/, 3,33/1H, двойной дуплет, J=10,8 Гц, 5,4 Гц/, 3,5-3,9/1 H, мультиплет/, 5,0-5,4/1H, широкий дуплет/.
Справочный пример 3. Синтез 4,7-диазаспиро[2,5]октана
1. Циклопропан-1,1-дибромамид (соединение 18).
14,0 Г циклопропан-1,1-диамида 17 суспендировали в 35 г брома и при перемешивании при комнатной температуре по каплям добавили 130 мл водной гидроокиси калия, полученной с использованием 14 г гидрата окиси калия. После 1 часа перемешивания реакционную смесь охладили льдом и получающиеся кристаллы отделили фильтрованием, промыли водой со льдом и сушили на воздухе. Затем кристаллы сушили при пониженном давлении при 66oC в течение 2 часов с получением 28,6 г целевого соединения 18.
2. 4,6-диазоспиро[2,4]гептан-5,7-дион-/соединение 19/.
К раствору метоксида натрия, полученного из 9,1 г металлического натрия и сухого метанола, добавили 26 г соединения 18 в условиях охлаждения льдом и при перемешивании. После удаления ледяной бани далее перемешивали до тех пор, пока температура внутри не увеличилась на 5o и затем после 20oC резко нагрели до температуры кипения метанола. Реакционную смесь кипятили с обратным холодильником в течение 10 минут и затем охладили до комнатной температуры. Затем реакционную смесь концентрировали досуха при пониженном давлении и к остатку добавили ацетон. Кристаллы отделили фильтрованием и промывали ацетоном. Промывочные растворы и фильтрат объединили и концентрировали при пониженном давлении. Методика привела к получению целевого соединения 19 в виде неочищенного продукта. Этот продукт был использован без очистки в следующей реакции.
3. 1-Аминоциклопропанкарбоновая кислота 20 и 1-трет-бутокси-карбониламиноциклопропанкарбоновая кислота (соединение 21).
Вышеполученное соединение 19 растворили в 60 мл воды, после чего добавили 15 г гидроокиси бария. Смесь нагревали в автоклаве из нержавеющей стали при внешней температуре 170oC в течение 2 ч. Затем реакционной смеси позволяли стоять в течение ночи и отделенный карбонат бария отфильтровывали. Затем к фильтрату добавили карбонат аммония и осажденный карбонат бария отфильтровывали. Фильтрат концентрировали с получением целевого аминосоединения 20 в виде неочищенного продукта. Это соединение 20 подвергали без очистки трет-бутоксикарбонилированию с BOC-ON с получением 2,5 г целевого соединения 21.
1H-ЯМР/CDCl3/d ч/млн: 1,85/2H, триплет/, 2.15 /2H, триплет/.
4. Этил (1-трет-бутоксикарбониламино-1- циклопропилкарбониламино/ацетат (соединение 22).
700 мг соединения 21 растворили в 50 мл диоксана, после чего добавили 800 мг дициклогексикарбодиимида и 600 мг глицин этилового сложного эфира гидрохлорида. Затем, при перемешивании этилового сложного эфира гидрохлорида. Затем при перемешивании при комнатной температуре постепенно по каплям добавили 10 мл диоксанового раствора 400 мг триэтиламина и смесь дополнительно перемешивали в течение 3 ч. Затем растворитель удалили при пониженном давлении и остаток подвергали хроматографии на колонке с силикагелем с использованием в качестве элюента 5% метанол-хлороформа. Методика привела к получению 700 мг целевого соединения 22.
5. Этил (1-Амино-1-циклопропилкарбониламино)ацетат (соединение 23).
К 680 мг соединение 22 добавили 10 мл трифторуксусной кислоты и 0,5 г анизола. Смесь перемешивали при комнатной температуре в течение 2 ч. Растворитель удалили при пониженном давлении. К остатку добавили водный карбонат калия и pH довели до 10. Смесь насыщали хлористым натрием и экстрагировали хлороформом. Слой хлороформа сушили над безводным сульфатом натрия и растворитель удаляли при пониженном давлении. Методика привела к получению 410 мг соединения 23.
1H-ЯМР /CDCl3/d ч/млн: 0,85/2H, триплет/, 1,28/3H, триплет/, 1,46/2H, триплет, J= 4 Гц/, 1,68/2H, широкий синглет/, 4,21/2H, триплет, J7 Гц/, 4,40/2H, дуплет, J=7 Гц/.
6. 4,7-Диазаспиро[2,5]октан-5,8-дион (соединение 24).
Если 500 мг соединения 23 нагревали на масляной бане при температуре 220oC, то оно пенилось и затем отверждалось. Нагревание продолжали в течение 20 мин, после чего реакционную систему охладили до комнатной температуры. Методика привела к получению целевого соединения 24 в виде неочищенного продукта.
1H-ЯМР /DMSO-d6/d ч/млн: 0,96 /2H, триплет/, 1,17/2H, триплет, J=4 Гц/, 3,86/2H, J=3 Гц/, 8,0, 8,25/каждый 1H, широкий синглет/.
7. 4,7-Диазаспиро[2,5]октан (соединение 25)
З50 мг соединения 24 суспендировали в 200 мл сухого тетрагидрофурана, после чего добавляли 0,6 г литийалюминий гидрида. Смесь кипятили с обратным холодильником в течение 14 ч. К этой реакционной смеси затем добавили 0,6 г воды, 0,6 г 15%-ной водной гидроокиси натрия и 1,8 воды в указанной последовательности в условиях охлаждения льдом и получающийся осадок удаляли фильтрованием. Осадок тщательно промыли тетрагидрофураном и эфиром и промывные растворы и фильтрат объединили. Затем растворитель удалили при пониженном давлении с получением целевого соединения 4,7-диазаспиро-2,5- октана (соединение 25) в виде неочищенного продукта. Этот продукт подвергали без очистки последующей реакции.
Справочный пример 4. Синтез производных бензойной кислоты.
1. 3-Хлор-2,4,5-трифторбензойная кислота (соединение 27).
9,3 г безводного хлорида меди и 8,8 г трет-бутилнитрата добавили к 150 мл ацетонитрила и при перемешивании и нагревании при 60oC добавили 11 г 3-амино-2,4,5-трифторбензойной кислоты 26 (промышленный продукт). Смесь перемешивали в течение 20 мин. После охлаждения добавили 500 мл 15%-ной соляной кислоты и смесь экстрагировали этилацетатом. Экстракт сушили над безводным сульфатом натрия и растворитель затем удаляли при пониженном давлении. Наконец, остаток подвергали хроматографии на колонке с силикагелем (199 г) с использованием в качестве элюента хлороформа. Методика привела к получению 8,4 г 3-хлор-2,4,5-трифторбензойной кислоты 27 в виде бесцветных игл. Т. пл. 114 115oC.
Элементный анализ C7H2ClF3O2
Рассчитано: C 39,93, H 0,96
Найдено: C 39,87, H 1,04
1H-ЯМР /CDCl3/d ч/млн: 7,76/1H, тройной дуплет, J=6,5 Гц, 8,5 Гц, 9,9 Гц/, 8,6 9,2/1H, широкий синглет/.
2. 2,4,5-Трифтор-3-иодобензойная кислота (соединение 28).
10 г иодида меди и 8,8 г трет-бутилнитрита добавили к 150 мл ацетонитрила и при перемешивании при 60oC добавили 11 г 3-амино-2,4,5-трифторбензойной кислоты. Перемешивание продолжали в течение 20 мин и после охлаждения добавили 500 мл 15%-ной соляной кислоты. Затем смесь экстрагировали этилацетатом. Органический слой сушили над безводным сульфатом натрия и растворитель удаляли при пониженном давлении. Остаток хроматографировали на 100 г силикагеля с элюированием хлороформом. Отбирали фракции, содержащие целевое соединение, и растворитель отгоняли при пониженном давлении. Наконец остаток перекристаллизовывали из н-гексана с получением 8,4 г целевого соединения 28 в виде бесцветных кристаллов. Т. пл. 121 122oC. Элементный анализ для C7H2F3IO2•1/4H2O
Рассчитано: C 28,26, H 0,51
Найдено: C 28,19, H 0,76
MSm/z: 302 /M+/
С использованием бромида меди по вышеописанному способу синтезировали 3-бром-2,4,5-трифторбензойную кислоту (соединение 29). Т.пл. 124 -125oC.
3. 2,4,5-Трифторбензойная кислота (соединение 30).
3-1. Непосредственное деаминирование. 1,8 г трет-бутилнитрита растворяли в 5 мл сухого диметилформамида и при перемешивании при 60oC к смеси добавили 2,0 г 3-амино-2,4,5-трифторбензойную кислоту. Смесь дополнительно перемешивали в течение 20 мин. Реакционную смесь затем влили в 50 мл воды и экстрагировали диэтиловым эфиром. Органический слой сушили над безводным сульфатом натрия и концентрировали досуха при пониженном давлении. Остаток подвергали хроматографии на колонке с силикагелем с использованием в качестве элюента хлороформа. Методика привела к получению 1,1 г кристаллов целевого соединения 30.
3-2. Восстановление бром-соединения.
Смесь, содержащую 5,0 г 3-бром-2,4,5-трифторбензойной кислотой 29, 30 мл уксусной кислоты, 2,0 г ацетата натрия и 1,0 г 5%-ного палладия на угле подвергали реакции восстановления в атмосфере водорода в течение 4 ч. Затем катализатор отфильтровали и фильтрат концентрировали досуха при пониженном давлении. Остаток экстрагировали этилацетатом и экстракт промывали водой и сушили над безводным сульфатом натрия. Наконец, растворитель удаляли при пониженном давлении с получением 3,2 г целевого соединения 30 в виде бесцветных кристаллов.
30: 1Н-ЯМР/CDCl3/d ч/мин: 7,10/1H, тройной дуплет J= 6,5, 9,9 Гц/, 7,96/1H, тройной дуплет, J= 6,3 Гц, 8,5 Гц, 9,8 Гц/, 9,2 9,6/1H, широкий синглет/.
Пример 1. 7-(7-амино-5-азаспиро[2,4] гептан-5-ил)-1-циклопропил-6,8-дифтор-1,4-дигидро-4-оксохинолин-3-карбоновая кислота (соединение 31)
300 мг 7-амино-5-азаспиро2,4-гептана 7 и 250 мг 1-циклопропил-6,7,8-трифтор-1,4-дигидро-4-оксохинолин-3-карбоновой кислоты добавили к 5 мл диметилсульфоксида. Смесь нагревали при 100oC в течение 30 мин. После охлаждения растворитель отгоняли при пониженном давлении и остаток кристаллизовывали с добавлением этанола. Получающиеся неочищенные кристаллы отбирали фильтрованием, суспендировали в этаноле и растворяли путем добавления 28%-ного водного аммиака. К этому раствору добавили 50 мг активированного угля и смесь отфильтровывали. Фильтрат концентрировали путем нагревания и получающиеся кристаллы отбирали фильтрованием. Методика привела к получению 170 мг целевого соединения 31. Т.пл. 238 245oC.
Элементный анализ для C19H19F2O3•1/2H2O
Рассчитано: C 59,37, H 5,24, N 10,93
Найдено: C 59,63, H 5,71, N 10,85
Пример 2. Синтез оптического изомера (соединение 31a и соединение 31b) соединения 31.
140 мг 1-циклопропил-6,7,8-трифтор-1,4-дигидро-4-окосохинолин-3-карбоновой кислоты суспендировали в 2 мл диметилсульфоксида, после чего добавляли 66 мг триэтиламина и далее избыточное количество водного раствора оптически активного аминосоединения 7a. Смесь нагревали при 120oC в течение 3 ч. Затем растворитель удаляли при пониженном давлении и остаток очищали с помощью препаративной тонкослойной хроматографии (T1 C), (проявляемой с нижнего слоя хлороформ-метанол-воды 7:3:1). Получающиеся кристаллы перекристиллизовывали из смеси этанол 28 водный аммоний с получением 40,5 мг соединения 31a в виде светло-желтых микрористаллов.
С использованием соединения 7b таким же способом было получено 34 мг соединения 31b.
/+/-7-(7-амино-5-азаспиро[2,4] гептан-5-ил)-1-циклопропил-6,8-дифтор-1,4-дигидро-4-оксохинолин-3-карбоновая кислота
31а: Т. пл. 221-235oC (разложение). [α]д+116,2° (с 0,575, концентрированный водный аммиак)
Элементный анализ для: C19H19F2O3•1/2H2O
Рассчитано: C 59,37, H 5,24, N 10,93
Найдено: C 59,31, H 5,02, N 10,93
/-/-7/ 7-амино-5-азаспиро[2,4] гептан-5-ил)-1-циклопропил-6,8-дифтор-1,4-дигидро-4-оксохинолин-3-карбоновая кислота.
31b: Т.пл. 227-240oC (разложение).
[α]д-106,3° (с 0,365, концентрированный водный аммиак)
Элементный анализ для C19H19F2N3O3•1/2H2O
Рассчитано: C 59,37, H 5,24, N 10,93
Найдено: C 59,33, H 4,90, N 10,65
Пример 3. 7-(7-Амино-5-азаспиро[2,4]гептан-5-ил)-8-хлор-1-циклопропил-6-фтор-1,4-дигидро-4-оксохинолин-3-карбоновая кислота (соединение 32).
200 мг 8-хлор-1-циклопропил-6,7-дифтор-1,4-дигидро-4-оксохинолин-3-карбоновой кислоты, 150 мг соединения 11 и 70 мг триэтиламина добавили к 5 мл ацетонитрила и смесь кипятили с обратным холодильником в течении 24 ч. После охлаждения растворитель удалили при пониженном давлении и к остатку добавили воду. Остаток отбирали фильтрованием и промывали последовательно водой, ацетонитрилом, этанолом, эфиром и сушили. Методика приводила к получению 245 мг 7-(7-трет-бутоксикарбониламино-5-азаспиро[2,4]гептан-5-ил) -8-хлор-1-циелопропил-6-фтор-1,4-дигидро-4-оксохинолин-3-карбоновой кислоты с т. пл. 205-207oC.
К 200 мг этой карбоновой кислоты добавили 0,3 мл анизола 5 мл трифторуксусной кислоты. Смесь перемешивали при комнатной температуре в течение 30 мин. Растворитель удаляли при пониженном давлении и к остатку добавляли воду. Смесь подщелачивали с помощью 1 нормальной водной гидроокиси натрия. Смесь промывали хлороформом дважды, нейтрализовали (pH 7,1)/ с помощью 10% -ной водной лимонной кислоты. Смесь экстрагировали 3-я порциями хлоформа. Экстракт промывали водой и сушили над безводным сульфатом натрия. Затем растворитель удаляли при пониженном давлении и остаток перекристаллизовывался из системы этанол -концентрированный водный аммиак. Методика привела к получению 105 мг целевого соединения 32. Т.пл. 235-240oC (разложение).
Элементарный анализ для C19H 19ClFN3O3•1/4H2O
Рассчитано: C 57,58, H 4,96, N 10,60
Найдено: C 57,64, H 5,33, N 10,37
Пример 4. 7-(7-Амино-5-азаспиро[2,4]гептан-5-ил)-1-циклопропил-6-фтор-1,4-дигидро-4-оксохинолин-3-карбоновая кислота (соединение 33).
250 мг 1-циклопропил-6,7-дифтор-2,3-дигидро-4-оксохинолин-3-карбоновой кислоты и 250 мг соединения 11 добавили к 4 мл диметилсульфоксида и смесь нагревали при 120oC в течении 2 ч. После охлаждения растворитель удаляли при пониженном давлении и остаток кристаллизовали путем добавления этанола. Кристаллы отбирали фильтрованием. Методика привела к получению 7-(7- трет-бутоксикарбонил-амино-5-азаспиро[2,4] гептан-5-ил)-1-иклопропил-6-фтор-1,4-дигидро-4-оксихинолин -3-карбоновой кислоты в виде неочищенного продукта.
5 мл трифторуксусной кислоты было добавлено к этому продукту и смесь перемешивали при комнатной температуре в течение 30 мин для удаления трет-бутоксикарбонильной группы. Затем растворитель удаляли при пониженном давлении и остаток растворяли в 1 нормальной водной гидроокиси натрия. Раствор промывали хлороформом и доводили до pH 7,0 с помощью 1 нормальной соляной кислоты, при этом выделялись кристаллы. Кристаллы отбирали фильтрованием и перекристаллизовывали из смеси этанол концентрированный водный аммиак с получением 200 мг целевого соединения 33. Т.пл. 249-252oC.
Элементарный анализ для: C19 H20FN3O3
Рассчитано: C 63,85, H 5,64, N 11,76
Найдено: С 63,61, Н 5,94, N 11,71
Примеры 5 и 6. По способу примера 4 были синтезированы 7-(7-амино-5-азаспиро[2,4] гептан-5-ил)-6-фтор-1-(2,4-дифторфенил)-1,4-дигидро-4-оксохинолин-3-карбоновая кислота (соединение 34) с т. пл. 226-228oC, и 7-(7-амино-5-азаспиро[2,4] гептан-5-ил)-1-циклопропил-6-фтор-1,4-дигидро-1,8-нафтиридин-3-карбоновая кислота (соединение 35) с т. пл. 256-257oC.
Пример 7. 10-(7-Амино-5-азаспиро[2,4]гептан -5-ил)-9-фтор-2,3-дигидро-3-(S)-метил-7-оксо-7Н-пиридо[1,2,3-de] [1,4]бензоксазин-6-карбоновая кислота (соединение 36).
300 мг 9,10-дифтор-2,3-дигидро-3-(S)-метил-7-оксо-7Н-пиридо[1,2,3-de] [1,4] бензоксазин-6-карбоновой кислоты BF2-хелата и 250 мг соединения 11 добавили к 5 мл диметилацетамида и смесь перемешивали при комнатной температуре в течение 3 ч. Растворитель затем удаляли при пониженном давлении и 1 мл триэтиламина и 30 мл 95%-ного метанола добавляли к остатку. Смесь кипятили с обратным холодильником в течении 6 ч. После охлаждения растворитель удаляли при пониженном давлении и остаток перетирали с этанолом. Получающие кристаллы отбирали фильтрованием и обрабатывали как описано в примере 4 для удаления трет-бутоксикарбонильной группы. Методика привела к получению 170 мг целевого соединения 36 в виде неочищенного продукта. Этот продукт растворили в системе этанол - концентрированный водный аммиак, обработали углем и перекристаллизовывали с получением 110 мг целевого соединения 36. Т.пл. 236-237oC.
Пример 8. 1-Циклопропил-7-(4,7-диазаспиро[2,5]октан-7-ил)-6-фтор-1,4-дигидро-4-оксохинолин-3-карбоновая кислота (соединение 37).
200 мг 1-циклопропил-6,7-дифтор-1,4-дигидро-4-оксихинолин-3-карбоновой кислоты и 200 мг неочищенного 4,7-диазаспиро-2,5-октана 25 добавили к 10 мл диметилсульфоксида, после чего добавили 0,3 мл триэтиламина. Смесь нагревали на бане при 120oC в течении 2 ч. Затем растворитель удаляли при пониженном давлении, остаток подвергали хроматографии на колонке с силикагелем, элюируя смесью хлороформ-метанол-вода 15:3:1, объем/объем. Неочищенный продукт, полученный на фракции, содержащей целевое соединение, перекристаллизовывали из смеси этанол -концентрированный водный аммиак с получением 160 мг целевого соединения 37. Т.пл. 243-245oC (разложение).
Элементный анализ для: C19H20N3O3F•1/4H2O
Рассчитано: C 63,03, H 5,71, N 11,61
Найдено: C 62,88, H 5,99, N 11,74
1H-ЯМР /NaOD-DSS/ δ ч/млн: 0,97/2Н, триплет, J=6 Гц/, 1,12/2Н, мультиплет/, 1,36/2Н, широкий триплет/, 1,48/3Н, широкий триплет, J=6 Гц/, 7,64/1Н, дуплет, J=8 Гц/, 7,92/1Н, дуплет, J=14 Гц/, 8,52 /1Н, синглет/.
Пример 9. 7-(7-ацетокси-5-азаспиро[2,4]гептан-5-ил)-8-хлор-1-дициклопропил-6-фтор-1,4-дигидро-4-оксохинолин-3-карбоновая кислота (соединение 38).
360 мг 8-хлор-1-циклопропил-6,7-дифтор-3-оксо-3,4-дигидрохинолин-3-карбоновой кислоты и 1 мл триэтиламина добавили к раствору из 900 мг 7-ацетокси-5-азаспиро 2,4 гептана (соединение 69) в 10 мл сухого ацетонитрила и смесь кипятили с обратным холодильником в течении 2,5 дн. (После 3 ч дополнительно добавляли 400 мг вышеуказанного азоспирогептана). Реакционную смесь разбавили хлороформом и органический слой промыли 10%-ной водной лимонной кислотой и сушили. Растворитель затем удаляли при пониженном давлении.
Остаток подвергали хроматографии на колонке с силикагелем (20 г), элюируя хлороформом и смесью 3%-ный метанол-хлороформ.
Отобрали фракции, содержащие целевое соединение и растворитель при пониженном давлении. К остатку добавили небольшое количество этанола и смесь немного подогрели и оставили стоять. Получающиеся кристаллы обобрали фильтрованием и промыли диизопропиловым эфиром с получением 174 мг целевого соединения 38. Т.пл. 179-182oC.
1H-ЯМР /CDCl3/ d ч/млн: 0,72-1,00/4Н, мультиплет/, 1,00-1,40 /4Н, мультиплет/, 2,10/3Н, синглет/, 7,95 /1Н, дуплет/, 8,87/1Н, синглет/.
Пример 10. 7-(7-гидрокси-5-азаспиро[2,4]гептан-5-ил)-8-хлор-1-циклопропил-6-фтор-1,4-дигидро-4-оксохинолин-3-карбоновая кислота (соединение 39).
174 мг 7-(7-ацетокси-5-азаспиро[2,4]гептан-5-ил)-8-хлор-1-циклопропил-1-фтор-1,4-дигидро-4-оксохинолин-3-карбоновой кислоты 38 суспендировали с 8 мл этанола, после чего добавили 1,5 мл 1 нормальной водной гидрокси натрия. Смесь перемешивали при комнатной температуре в течение 10 мин. Затем растворитель удаляли при пониженном давлении и к остатку добавляли хлороформ. Смесь промыли водой. Водный слой подкислили 1 нормальной соляной кислотой и экстрагировали хлороформом. Экстракт сушили и растворитель удаляли при пониженном давлении. Наконец остаток перекристаллизовывали из смеси водный аммиак -этанол с получением 127 мг целевого соединения 39. Т.пл. 242-244oC.
1H-ЯМР /1 N NaOD/d ч/млн: 0,53-1,17/8Н, мультиплет/, 2,98, 3,35 и 3,74/ каждый 1Н/, 4,09-4,13/3Н, мультиплет/, 7,59/1Н, дуплет/, 8,45/1Н, синглет/.
Элементный анализ для C19H18N2O4ClF
Рассчитано: C 58,10, H 4,62, N 7,13
Найдено: C 58,39, H 4,65, N 7,27
Пример 11. 7-(7-Гидроксиимино-5-азаспиро[2,4]гептан-5-ил)-8-хлор-1-циклопропил-6-фтор-1,4-дигидро-4-оксохинолин-3-карбоновая кислота (соединение 40).
0,5 мл анизола добавили к 678 мг 5-трет-бутоксикарбонил-7-гидроксиимно-5-азаспиро[2,4]гептана (соединения 67), после чего добавили 5 мл трифторуксусной кислоты в условиях охлаждения льдом. Смесь перемешивали при такой же температуре в течении 30 мин. Затем растворитель удалили при пониженном давлении и 100 мл сухого ацетонитрила добавили к остатку. Затем 300 мг 8 -хлор-1-циклопропил-6,7-дифтор-4-оксо-3,4-дигидрохинолин-3-карбоновой кислоты и 1 мл триэтиламина добавили к смеси и смесь кипятили с обратным холодильником в течение 9 ч. Затем растворитель удалили при пониженном давлении, к остатку добавили метанол и нерастворимое вещество отфильтровали. Маточной жидкости давали отстояться в течении 2 дн и получающиеся кристаллы отбирали фильтрованием и перекристаллизовывали из смеси водный аммиак этанол с получением 58 мг целевого соединения 40. Т.пл. 239-242oC.
1H-ЯМР /1N NaOD/d ч/млн: 0,70-1,05/8Н, мультиплет/, 3,50/2Н, синглет/, 4,09-4,12/1Н, мультиплет/, 4,29/2Н, синглет/, 7,65/1Н, дуплет, J=15 Гц/, 8,46/1Н, синглет/.
Элементный анализ для C19H17N3O4FCl
Рассчитано: C 56,24, H 4,22, N 10,35
Найдено: C 56,34, H 4,34, N 10,32.
Пример 12. /-/-10(7-Амино-5-азаспиро[2,4]гептан-5-ил)9-фтор-2,3-дигидро-3-(S)-метил-7-оксо-7Н-пиридо[1,2,3-de] [1,4]бензоксазин-3-карбоновая кислота (соединение 36b).
280 мг/-/-9,10-дифтор-2,3-дигидро-3-(S)-метил-7-оксо-7Н-пиридо[1,2,3-de] [1,4]бензоксазин-3-карбоновой кислоты BF2-хелата суспендировали в 4 мл сухого диметилсульфоксида, после чего добавили 450 мг соединения 68b и 520 мг триэтиламина при комнатной температуре. Смесь перемешивали в течение 45 мин. Затем в условиях охлаждения льдом медленно к реакционной смеси добавили воду и получающиеся кристаллы отбирали фильтрованием. 30 мл 90%-ного метанола и 2 мл триэтиламина добавили к кристаллам и смесь кипятили в обратном холодильнике в течение 17 ч. Растворитель удаляли при пониженном давлении и остаток перекристаллизовывали из смеси водный аммиак-этанол с получением 73 мг целевого соединения 36b. Т.пл. 217-238oC.
[α]д-209,22° (c 0,683, 1 нормальная гидроокись натрия)
1H-ЯМР /1N NaOD/δ ч/млн: 0,38-0,68/4Н, мультиплет/, 1,31/3Н, дуплет, J= 5 Гц/, 2,91-4,39/8Н, мультиплет/, 7,28/1Н, дуплет, J=15 Гц, 8,17/1Н, синглет/.
Элементный анализ для C19Н20N3O4F•1/4H2O
Рассчитано: C 57,64, H 5,73, N 10,61
Найдено: C 57,64, H 5,21, N 10,81.
Пример 13. /-/-7(7-Амино-5-азаспиро[2,4]гептан-5-ил)-1-циклопропил-6-фтор-4-оксо-1,4-дигидро-1,8-нафтиридин-3-карбоновая кислота (соединение 35b).
282,5 мг 7-хлор-1-циклопропил-6-фтор-4-оксо-1,4-дигидро-1,8-нафтиридин-3-карбоновой кислоты, 200 мг соединения 68 b и 1 г триэтиламина добавили к 6 диметилсульфоксида. Смесь перемешивали при 110oC в течении 1 ч. Растворитель удалили при пониженном давлении и к остатку добавили диэтиловый эфир. Получающийся осадок отбирали фильтрованием и к нему добавляли 1 нормальную соляную кислоту. Смесь промывали хлороформом. Водный раствор подщелачивали с помощью 1 нормальной водной гидроокиси натрия и вновь промывали хлороформом. Затем щелочной раствор доводили до pH 7,1 концентрированной соляной кислотой в условиях охлаждения льдом и получающиеся бесцветные кристаллы отбирали фильтрованием, промывали водой, этанолом, эфиром и сушили. Затем кристаллы перекристаллизовывали из смеси концентрированный водный аммиак этанол с получением 283 мг целевого соединения 35b в виде бесцветных тонких игл. Т.пл. 240-250oC (разложение).
[α]д-13,6° (с=0,66, 1 нормальная гидроокись натрия)
Элементный анализ для C18H19 N4O3F•1/4H2O
Рассчитано: C 59,58, H 5,42, N 15,44
Найдено: C 59,68, H 5,40, N 15,36
Пример 14. 7-(7-Амино-5-азаспиро[2,4]гептан-5 ил)-1,4-дигидро-6-фтор-1-(2-метил-2-пропил)-4-оксо-1,8-нафтиридин-3-карбоновая кислота (соединение 41b).
200 мг соединения 68b суспендировали в 15 мл ацетонитрила, после чего добавили 3 мл триэтиламина и при кипячении с обратным холодильником малыми порциями добавили 327 мг этил-7-хлор-1,4-дигидро-6-фтор-1-(2-метил-2-пропил)-4-оксо-1,8-нафтиридин-3-карбоксилата. После 1 ч кипячения растворитель удаляли при пониженном давлении и к остатку добавляли воду. Смесь экстрагировали хлороформом и н-бутанолом. Органические слои объединяли и растворители удаляли. К остатку добавили диэтиловый эфир и получающийся осадок отбирали фильтрованием с получением 516 мг бесцветного порошка.
1H-ЯМР /DMSO-d6/δ ч/млн: 0,77-1,05/4Н, мультиплет/, 1,27/3Н, триплет, J= 7 Гц/, 1,82/9Н, синглет/, 2,86-3,36/4Н, мультиплет/, 4,20/1Н, мультиплет/, 4,21/2Н, квардуплет, J=7 Гц/, 7,91/1Н, дуплет, J=13 Гц/, 8,68/1Н, синглет/.
510 мг вышеуказанного бесцветного порошка суспендировали в 2 мл воды, после чего добавили 2 мл 1 нормальной водной гидроокиси натрия и смесь кипятили с обратным холодильником в течение 40 мин. К реакционной смеси добавили 5 мл воды и pH довели до pH 7,5 с помощью 0,25 нормальной соляной кислоты. Получающиеся кристаллы отбирали фильтрованием и промывали водой. Кристаллы сушили и перекристаллизовывали из этанола с получением 171 мг целевого соединения 41в в виде бесцветного порошка. Т.пл. 243-247oC (разложение).
[α]д-16,6° (с=0,504, 1 нормальная гидроокись натрия)
1H-ЯМР /DMSO-d6/δ ч/млн: 0,45-0,82/4Н, мультиплет/, 1,87/9Н, синглет/, 2,80-3,80/4Н, мультиплет/, 4,00/1Н, мультиплет/, 7,98/1Н, дуплет, J=13 Гц/, 8,82/1Н, синглет/.
Элементный анализ для C19H23N4O3F•1/2H2O
Рассчитано: C 59,52, H 6,31, N 14,61
Найдено: C 59,17, H 6,17, N 14,49.
Справочный пример 5. Синтез 2,4,5-трифтор-3- метилбензойной кислоты 1. Диметил 3,5,6-трифтор-4-нитрометилфталат (соединение 42).
200 г диметилтетрафторфталата растворили в 400 мл нитрометана (Ishikawa, Suzukia Tanabe: Nippon Kogaku Kaishi 1976, 200) и раствор охладили на ледяной бане. При внутренней температуре 15 20oC по каплям добавили 171 г 1,8-диазабицикло- 5,4,0,7-ундецена в течение 30 мин. После завершения добавления по каплям смесь дополнительно перемешивали при внутренней температуре 10oC в течение 30 мин, затем смесь влили в смесь 1,5 л 1 нормальной соляной кислоты и 1 л льда.
Реакционную смесь экстрагировали бензолом и органический слой промывали водой и сушили над безводным сульфатом натрия. Затем растворитель выпаривали при номинальном давлении и остаток подвергали хроматографии на колонке с силикагелем (500 г), элюируя бензолом. Методика привела к получению 195 г целевого соединения 42 в виде желтого масла.
1H-ЯМР /CDCl3/d ч/млн: 3,88/3H, синглет/, 3,94/3H, синглет/, 5,60/2H, триплет, J 2 Гц/.
2. Диметил 4-диметиламинометил-3,5,6-трифторфталат (соединение 43).
При атмосферном давлении смесь 5,0 г соединения 42, 20 мл никеля Ренея, 15 мл формалина и 70 мл этанола подвергали реакции восстановления в течение 22 ч.
Затем катализатор отфильтровывали и фильтрат концентрировали при пониженном давлении. Остаток растворяли в хлороформе и раствор промывали водой и сушили над безводным сульфатом натрия. Затем растворитель удаляли при пониженном давлении с получением 5,2 г целевого соединения 43 в виде светло-желтого масла.
1H-ЯМР /CDCl3/d2,32/6H, синглет/, 3,70 /2H, триплет, J 2 Гц/, 3,96/3H, синглет/, 3,98/3H, синглет/.
3. 2,5,6-Трифтор-3,4-ди(метоксикарбонил)фенил-метилентриметиламмоний иодид (соединение 44).
5,2 г соединения 42 растворяли в 50 мл этанола, после чего добавили 5 мл метилиодида и смесь оставляли стоять в течение 1,5 ч. Получающиеся кристаллы отбирали фильтрованием. Методика привела к получению 3,6 г бесцветных кристаллов целевого соединения 44. Т.пл. 186 190oC (разложение).
4. Диметил 3,5,6-трифтор-4-метилфталат (соединение 45).
а) Смесь 4,6 г соединения 42, 6,8 г гидрида трибутилолова, 300 мг a,α′-азобисизобутиронитрила и 70 мл бензола кипятили с обратным холодильником в течение 4 ч. Реакционную смесь затем концентрировали при пониженном давлении и остаток подвергали хроматографии на колонке с силикагелем (50 г) с элюированием бензолом. Методика привела к получению 2,45 г целевого соединения 45 в виде светло-желтого масла.
b) Смесь 17,0 г соединения 44, 30 мл никеля Ранея и 350 мл этанола подвергали реакции восстановления при атмосферном давлении в условиях облучения вольфрамовой лампой в течение 25,4 ч. Затем катализатор отфильтровывали и фильтрат концентрировали при пониженном давлении. К остатку добавили воду и экстрагировали хлороформом. Органический слой сушили над безводным сульфатом натрия. Растворитель затем удаляли при пониженном давлении с получением 9,62 г целевого соединения 45 в виде желтого масла.
1H-ЯМР /CDCl3/δ 2,29/3H, триплет, J 2 Гц/, 3,91/3H, синглет/, 3,93/3H, синглет/.
5. 3,5,6-Трифтор-4-метилфталевая кислота (соединение 46).
Смесь 2,45 г соединения 45, 10 мл уксусной кислоты и 20 мл концентрированной соляной кислоты кипятили с обратным холодильником в течение 12 ч. Реакционную смесь затем концентрировали при пониженном давлении и остаток экстрагировали диэтиловым эфиром. Экстракт сушили над безводным сульфатом натрия. Затем растворитель удаляли при пониженном давлении с получением 2,1 г целевого соединения 46 в виде бесцветных кристаллов. Т.пл. 155 160oC.
6. 2,4,5-Трифтор-3-метилбензойная кислоты (соединение 47).
10,1 г соединения 46 растворили в 40 мл воды и смесь нагревали в закрытой пробирке на бане при температуре 200oC в течение 4 дн. Реакционную смесь затем экстрагировали хлороформом и экстракт сушили над безводным сульфатом натрия. Наконец растворитель удаляли при пониженном давлении с получением 6,2 г целевого соединения 47 в виде светло-желтых кристаллов. Т.пл. 89 90oC.
1H-ЯМР /CDCl3/ d2,29/3H, триплет, J 2Гц/, 7,56 - 7,84/1H, мультиплет/, 8,1 8,6/1H, широкий/.
Справочный пример 6. Этил 2,4,5-трифтор-3-метилбензоилацетат (соединение 48).
9,89 г 2,4,5-трифтор-3-метилбензойной кислоты 47 растворили в 200 мл бензола, после чего добавили 40 мл тионилхлорида и смесь кипятили с обратным холодильником в течение 14 ч. Реакционную смесь затем концентрировали досуха при пониженном давлении и 200 мл бензола добавили к остатку. Смесь вновь концентрировали досуха при пониженном давлении и получающийся неочищенный хлорид кислоты растворили в 200 мл диэтилового эфира.
Смесь 1,26 г магния, 250 мл этанола и 6 мл тетрахлорида углерода перемешивали при комнатной температуре в течение 1 ч и в конце этого времени по каплям добавили 50 мл раствора 8,34 г диэтилмалоната в диэтиловом эфире. Затем смесь перемешивали при комнатной температуре в течение 1 ч. Реакционную смесь затем концентрировали досуха при пониженном давлении и остаток растворили в 300 мл диэтилового эфира. К этому раствору добавили вышеприготовленный диэтиловый раствор хлорида кислоты по каплям в течение 10 мин и смесь перемешивали при комнатной температуре в течение 4 дн. После этого 100 мл 1 нормальной соляной кислоты добавили к смеси и после перемешивания отделяли слой эфира, промывали водой и сушили над безводным сульфатом натрия. Растворитель затем удалили при пониженном давлении. К остатку добавили 500 мл воды и 500 мл пара-толуолсульфокислоты и смесь кипятили с обратным холодильником в течение 7 ч. Реакционную смесь затем экстрагировали хлороформом, органический слой сушили над безводным сульфатом натрия и растворитель удаляли при пониженном давлении. Остаток подвергали хроматографии на колонке с силикагелем с использованием бензола в качестве элюента. Методика привела к получению 6,1 г целевого соединения 48 в виде бесцветного масла. При стоянии это масло частично кристаллизуется.
Справочный пример 7. Этил 2-циклопропиламинометилен-3-оксо-3,2,4,5-трифтор-3-метил/фенилпропионат (соединение 49).
Смесь 1,57 г соединения 48, 6 мл этил хлороформата и 6 мл уксусного ангидрида нагревали при 120oC при перемешивании в течение 3 ч. Затем реакционную смесь концентрировали досуха при пониженном давлении. Остаток растворили в 25 мл 1,2-дихлорметана, после чего добавляли 10 мл раствора, полученного растворением 400 мг циклопропиламина в 1,2-дихлорметане. Смесь перемешивали при комнатной температуре в течение 14 ч. Реакционную смесь затем концентрировали досуха при пониженном давлении с получением 2 г целевого соединения 49 в виде бесцветных кристаллов с т. пл. 61-64oC.
Справочный пример 8. Этил 1-циклопропил-6,7-дифтор-8-метил-4-оксо-1,4-дигидрохинолин-3-карбоксилат (соединение 50).
1,97 г соединения 49 растворили в 30 мл сухого диоксана, после чего добавили 360 мг 60%-ного гидрида натрия и смесь перемешивали при комнатной температуре в течение 18 ч. После этого добавили 10 мл 1 нормальной соляной кислоты и реакционную смесь концентрировали при пониженном давлении и к остатку добавили воду. Получающиеся кристаллы отбирали фильтрованием и промывали водой и небольшими количествами этанола и диэтилового эфира. Методика привела к получению 1,35 г целевого соединения 50 в виде бесцветных кристаллов с т. пл. 204 210oC.
Справочный пример 9. 1-Циклопропил-6,7-дифтор-8-метил-4-оксо-1,4-дигидрохинолин-3-карбоновая кислота (соединение 51).
Смесь 1,30 г соединения 50 и 10 мл концентрированной соляной кислоты кипятили с обратным холодильником в течение 3 ч и конце этой процедуры к реакционной смеси добавили 50 мл воды. Получающиеся кристаллы отбирали фильтрованием и промывали водой и этанолом с получением 1,12 г целевого соединения 51. Т.пл. 241-242oC.
Справочный пример 10. 1-Циклопропил-6,7-дифтор-8-метил-4-оксо-1,4-дигидрохинолин-3-карбоновая кислота BF2-хелат (соединение 52).
420 г соединения 50 суспендировали в 30 мл диэтилового эфира, после чего добавили 2 мл комплекса трифторид борадиэтиловый эфир и смесь перемешивали при комнатной температуре в течение 24 ч.
Получающиеся кристаллы отбирали фильтрованием и промывали диэтиловым эфиром. Методика привела к получению 487 мг целевого соединения 52 в виде желтых кристаллов с т. пл. 275-278oC.
Пример 15.1 /-/-7-(7-Амино-5-азаспиро[2,3]гептан-5-ил)-1-циклопропил-6-фтор-8-метил-4-оксо-1,4-дигидрохинолин-3-карбоновая кислота. (соединение 55b).
Смесь 340 мг соединения 52, 330 мг 7-трет- бутоксикарбониламино-5-азаспиро-2,3-гептана (соединение 11b), 150 мг триэтиламина и 5 мл диметилсульфоксида перемешивали при комнатной температуре в течение 5 дн. Реакционную смесь затем растворили в 100 мл хлороформа и раствор промыли водой. Органический слой сушили над безводным сульфатом натрия и растворитель удалили при пониженном давлении.
Остаток подвергали хроматографии на колонке с силикагелем (30 г), элюируя смесью хлороформ-метанол (95:5). Получающийся 7-(7-трет-бутоксикарбониламино-5-азаспирогептан-5-ил)-1-циклопропил-6-фтор-8-метил-4-оксо-1,4-дигидрохинолин-3-карбоновая кислота BF2-хелат растворили в 30 мл 70%-ного метанола, после чего добавили 1 мл триэтиламина и смесь кипятили с обратным холодильником в течение 3 ч.
Реакционную смесь затем концентировали при пониженном давлении и 20 мл 10% -ной лимонной кислоты добавили к остатку. Смесь экстрагировали хлороформом и органический слой сушили над безводным сульфатом натрия. Затем растворитель удалили при пониженном давлении. К остатку добавили 10 мл трифторуксусной кислоты и смесь перемешивали при комнатной температуре в течение 20 мин и затем концентировали досуха при пониженном давлении. К остатку добавили соляную кислоту и смесь промыли хлороформом. В условиях охлаждения льдом pH водного слоя довели до pH 12 с помощью водной гидроокиси натрия и промыли хлороформом. Водный слой довели до pH 7,5 и экстрагировали хлороформом. Органический слой сушили над безводным сульфатом натрия и растворитель удаляли. Остаток перекристаллизовывали дважды из смеси водный аммиак этанол с получением 52 мг целевого соединения 55b в виде бесцветных кристаллов. Т.пл. 180-182oC.
[α]д-128,0° (c 0,125, 1 нормальная гидроокись натрия)
1H-ЯМР /CDCl3/δ 0,61-0,63 /1H, мультиплет/, 0,64-0,74 /2H, мультиплет/, 0,84-0,88 /1H, мультиплет/, 0,90-0,97 /2H, мультиплет/, 1,19-1,28 /2H, мультиплет/, 2,62 /3H, синглет/, 3,19-3,21 /1H, мультиплет/, 3,29 /1H, дуплет, J 9 Гц/, 3,36-3,39 /1H, мультиплет/, 3,84 /1H, дуплет, J 9 Гц/, 3,99-4,03 /1H, мультиплет/, 4,05-4,08 /1H, мультиплет/, 7,85 /1H, дуплет, J 13,5 Гц/, 8,86 /1H, синглет/.
Пример 16. Оптически активная 7-[7-(трет-бутоксикарбониламино)-5-азаспиро[2,4] -гептан-5-ил)-8-хлор-1-циклопропил-6-фтор-1,4-дигидро-4-оксохинолин-3-карбоновая кислота (соединение 56a и соединение 56b).
500 мг 8-хлор-1-циклопропил-6,7-дифтор-1,4-дигидро-4-оксохинолин-3-карбоновой кислоты, 440 мг соединения 11b и 2 мл триэтиламина растворили в 20 мл ацетонитрила и раствор кипятили с обратным холодильником в течение ночи. После охлаждения растворитель удалили при пониженном давлении и получающийся осадок отбирали фильтрованием, промывали последовательно водой, ацетонитрилом, этанолом и эфиром и сушили при пониженном давлении. Методика привела к получению 560 мг целевого соединения 56b в виде светло-желтых кристаллов. По такому же способу с использованием соединения 11a было синтезировано также соединение 56a.
56b: светло-желтые кристаллы с т. пл. 216-217oC [α]д-134,7° (c 1,653, хлороформ)
1H-ЯМР /CDCl3/δ ч/млн: 0,4-1,6 /8H, мультиплет/, 1,45 /9H, синглет/, 3,33 /1H, дуплет, J 9 Гц/, 3,60 /1H, дуплет, J 9 Гц/, 3,7-4,5 /4H, мультиплет/, 4,7-5,1 /1Hh, широкий дуплет/, 7,95 /1H, дуплет, J 12,9 Гц/, 8,87 /1H, синглет/;
Элементный анализ для C24H 27N3O5ClF
Рассчитано: C 58,60, H 5,53, N 8,54
Найдено: C 58.43, H 5.59, N 8.40
56b: светло-желтые кристаллы с температурой плавления 215-216oC [α]д+131,4° /c 0.77, хлороформ/
Элементный анализ для C24H 27N3O5ClF
Рассчитан: C 58.60, H 5.53, N 8.544
Найдено: C 58,37, H 5,58, N 8,44
ЯМР спектр 56a полностью соответствовал спектру 56b.
Пример 17. Оптически активная 7-(7-амино-5-азаспиро[2,4]гептан-5-ил)-8-хлор-1-циклопропил-6-фтор-1,4-дигидро-4-оксохинолин-3-карбоновая кислота (соединение 32a и соединение 32b)
0,5 мл анизола и 10 мл трифторуксусной кислоты добавили к 520 мг соединения 56b в условиях охлаждения льдом. Затем при комнатной температуре смесь перемешивали в течение 30 мин. Затем растворитель удалили при пониженном давлении и к остатку добавили воду, pH смеси довели до pH 11-12 с помощью 1 нормальной водной гидроокиси натрия в условиях охлаждения льдом. Водный раствор дважды промыли хлороформом и pH довели до pH 7 с помощью концентрированной соляной кислоты и 10%-ной лимонной кислоты. Раствор экстрагировали хлороформом 3 раза и экстракт промыли водой и сушили. Затем растворитель отгоняли при пониженном давлении и твердый остаток перекристаллизовывали из смеси этанол водный аммиак с получением 328 мг целевого соединения 32b в виде светло-желтых кристаллов. Подобно этому из соединения 56a было синтезировано соединение 32a.
Соединение 32b: светло-желтые кристаллы, т. пл. 166-170oC; [α]д-112,6° (c 0,43, 1 нормальная гидроокись натрия).
1H-ЯМР /CDCl3 500 МГц/δ ч/млн: 0,6-1,25 /8H, мультиплет/, 3,08 /1H, триплет, J 4,4 Гц/, 3,30 /1H, дуплет, J 10,3 Гц/, 3,41 /1H, дуплет, J 9,5 Гц/ 3,96 /1H, дуплет, J 9,5 Гц/, 4,11 /1H, мультиплет/, 4,24 /1H, мультиплет/, 7,75 /1H, дуплет, J 13,5 Гц/ 8,55 /1H, синглет/
Элементный анализ для C19H19N3O3ClF•1-2H2O
Рассчитано: C 56,93, H 5,03, N 10,48
Найдено: C 57,16, H 5,44, N 10,46.
Соединение 32a: светло-желтые кристаллы, т. пл. 160-165oC (разложение).
[α]д+110,3° /c 0,435, 1 нормальная гидроокись натрия).
Элементный анализ для C19H19N3O3ClF•1/2H2O
Рассчитано: C 56,93, H 5,03, N 10,48
Найдено: C 56,87, H 5,37, N 10,32.
ЯМР-спектр соединения 32a был полностью идентичен спектру соединения 32b.
Справочный пример 11. 8-Хлор-1-циклопропил-6,7-дифтор-1,4-дигиро-4-оксохинолин-3-карбоновая кислота BF2-хелат (соединение 57).
15 мл комплекса трифторид бора диэтиловый эфир добавили к суспензии 3 г 8-хлор-1-циклопропил-6,7-дифтор-1,4-дигидро-4-оксохинолин-3-карбоновой кислоты в 30 мл диэтилового эфира. Смесь перемешивали при комнатной температуре в течение 2 ч. Осадок отделяли фильтрованием, затем промывали несколько раз эфиром и сушили при пониженном давлении с получением 3,35 г целевого соединения 57 в виде бесцветного порошка с т. пл. 245 260oC (разложение).
Элементный анализ для C13H7NO3BClF4:
Рассчитано: C 44,94, H 2,03, N 4,03
Найдено: C 45,07, H 2,21, N 4,12
Пример 18. /-/-7-[7-амино-5-азаспиро[2,4]гептан-5-ил]-8-хлор-1-циклопропил-6-фтор-1,4-дигидро-4-оксохинолин-3-карбоновая кислота (соединение 32a).
Смесь 700 мг соединения 57, 450 мг 7-амино-азаспиро(2,4]гептан дигидрохлорида (соединение 68b), 610 мг триэтиламина и 7 мл диметилсульфоксида перемешивали при комнатной температуре в течение 24 ч. К смеси добавили воды и желтый осадок отделяли фильтрованием и сушили. 50 мл 95%-ного метанола и 1 мл триэтиламина добавили к осадку. Смесь перемешивали при комнатной температуре в течение 1 ч. Растворитель удалили при пониженном давлении и 1 нормальную соляную кислоту добавили к остатку. Смесь промывали хлороформом и водный слой подщелачивали 1 нормальной гидроокисью натрия. Водный слой промыли хлороформом снова, pH щелочного водного раствора довели до рН 7,1 с помощью концентрированной соляной кислоты при охлаждении. Водный раствор экстрагировали хлороформом три раза. Экстракт промывали насыщенным водным раствором хлористого натрия, затем сушили. Растворитель удаляли при пониженном давлении. Остаток перекристаллизовывали из концентрированного аммиака, воды и этанола с получением целевого соединения 32a в виде бесцветных кристаллов.
Справочный пример 12. Альтернативный синтез 4,7-диоксо-5-[1-(R)-фенилэтил]-5-азаспиро [2,4]гептана 12.
1. 1-Ацетилциклопропан-1-карбоновая кислота (соединение 58).
К раствору 268,6 г соединения 2 в 400 мл этанола по каплям добавили при комнатной температуре водный раствор 75,67 г гидроксида натрия в 200 мл воды в течение 20 мин. Смесь перемешивали при комнатной температуре в течение 2 ч. 1500 мл дихлорметана и 500 мл воды добавили к смеси. Смесь встряхивали, затем водный слой отделяли. Водный слой промывали два раза по 500 мл дихлорметана. Водный слой довели до pH 2 с помощью концентрированной соляной кислоты, при охлаждении смесь экстрагировали 1500 мл дихлорметана. Водный слой экстрагировали 500 мл дихлорметана и экстракты соединяли. Объединенный органический слой промывали водой и сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении. Остаток дистиллировали при пониженном давлении с получением 232 г целевого соединения 58 в виде бесцветного масла.
1H-ЯМР /CDCl 3/δ ч/млн: 1,6 2,0/4H, мультиплет/, 2,21/3H, синглет/,
2. N-[1-(R)-фенилэтил] -1-ацетил-1-циклопропанкарбоксамид (соединение 59).
Раствор 232 г соединения 58, 1500 мл хлороформа и 250,8 мл триэтиламина охладили на бане с сухим льдом и ацетоном до внутренней температуры -40oC. К раствору в течение 20 мин добавили по каплям 215,9 г этилхлорформата. Смесь перемешивали при охлаждении, поддерживая внутреннюю температуру при -30oC, в течение 40 мин. Смесь охладили до внутренней температуры -40oC и к смеси добавили 241,1 г P- /+/-1-фенилэтиламина. Смесь перемешивали в течение 1,5 ч. Смесь промывали 1 нормальной соляной кислотой, водой, насыщенным водным раствором бикарбоната натрия и водой. Слой хлороформа сушили над безводным сульфатом натрия. Растворитель отгоняли при пониженном давлении с получением 489,3 г целевого соединения 59 в виде бесцветного масла.
1H-ЯМР /CDCl3/d ч/млн: 1,50/3H, дуплет, J=7,2 Гц/, 1,4-1,6 и 1,7-1,9/2H, каждый мультиплет/, 1,95/3H, синглет/, 5,10/1H, квадруплет, J=7,2 Гц/, 7,50/5H, синглет/.
3. N-[1-(R)-фенилэтил] -1-(1,1 - этилендиоксиэтил)-1-циклопропанкарбоксамид (соединение 60).
Смесь 248,4 г соединения 59, 800 мл бензола, 230 мл этиленгликоля и 10,0 г пара-толуолсульфокислоты моногидрата кипятили с обратным холодильником в течение 24 ч. Образуемую в ходе реакции воду удаляли. После охлаждения к смеси добавили 500 мл воды и 50 мл бензола. Затем смесь встряхивали. Органический слой отделяли и промывали насыщенным водным раствором бикарбоната натрия и водой. Органический слой сушили над безводным сульфатом натрия и растворитель уделяли при пониженном давлении с получением 227,8 г целевого соединения 60.
1H-ЯМР /CDCl 3/d ч/млн: 0,7 0,95 и 1,0-1,2 /2H, каждый мультиплет/, 1,48/3H, синглет/, 1,47/3H, дуплет, J=7,2 Гц/, 3,98/4H, синглет/, 5,11/1H, квардуплет, J=7,2 Гц/, 7,31/5H, синглет/, 7,75/1H, широкий синглет/.
4. N-[1-(R)-фенилэтил] -1-2-бром-1,1- этилендиоксиэтил)-1-циклопропан-карбоксамид (соединение 61).
145,4 г брома добавили по каплям к 436 мл диоксана при комнатной температуре в течение 30 мин. Смесь перемешивали при комнатной температуре в течение 30 мин и к смеси добавили раствор 227,8 г соединение 60 в 2000 мл дихлорметана. Смесь перемешивали при комнатной температуре в течение 2 ч. Смесь промыли водным раствором тиосульфата натрия и водой. Органический слой сушили над без водным сульфатом натрия и растворитель удаляли при пониженном давлении с получением 326,0 г целевого соединения 61.
1H-ЯМР /CDCl3/d ч/млн: 0,7 1,0 и 1,0 1,25/2H каждый, мультиплет/, 1,49/3H, дуплет, J= 7,2 Гц/, 3,69/2H, синглет/, 3,8-4,3/4 H, мультиплет/, 5,08/1H, квардуплет, J=7,2 Гц/, 7,30 /5 H, синглет/, 7,6/1H, широкий синглет/.
5. 4,7-Диоксо-5-1-(R)-фенилэтил-5- азаспиро[2,4]гептан-7-этиленацеталь (соединение 62).
43 г 60% -ного гидрида натрия добавили тремя порциями к раствору 293 г соединения 61 в 1500 мл N,N-диметилформамида при комнатной температуре в течение 1,5 ч. Во время добавления гидрида натрия смесь охлаждали, поддерживая температуру внутри при 30oC. Смесь перемешивали при комнатной температуре в течение 18 ч. Смесь влили в лед и экстрагировали этилацетатом. Органический слой отделили и промыли водой. Органический слой сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении с получением 203,3 г целевого соединения 62 в виде темного масла.
1H-ЯМР /CDCl3/d ч/мин: 0,98-1,38/4H, мультиплет/, 1,50/3H, дуплет, J=7,2 Гц/, 3,07 и 7,41/1H каждый, дуплет, J=10,2 Гц/. 3,83/4H, синглет/, 5,61/1H, квардуплет, J=7,2 Гц/, 7,30/5H, синглет/.
6. 4,7-Диоксо-5-[1-(R)-фенилэтил] -5- азаспиро[2,4] гептан (соединение 12).
Смесь 203,3 г соединение 62, 300 мл 1 нормальной соляной кислоты и 1000 мл ацетона кипятили с обратным холодильником в течение 1,5 ч. Затем растворитель удалили при пониженном давлении и остаток экстрагировали этилацетатом. Экстракт промывали водой и сушили над безводным сульфатом натрия. Экстракт обесцвечивали активированным углем и растворитель удаляли при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем (1300 г) с элюированием хлороформом, содержащим 0-10% этилацетата, с получением 65,7 г целевого соединения 12 в виде бесцветных кристаллов.
1H-ЯМР /CDCl3/d ч/млн: 1,61/3H, дуплет, J=7,2. Гц/, 1,4-1,75/4H, мультиплет/, 3,48 и 3,88/2H каждый, J=17,7 Гц/, 5,81/1H, квардуплет, J=7,2 Гц/, 7,34/5H, синглет/.
Справочный пример 13. Синтез 5-трет-бутоксикарбонил-7-гидроксиимино-5-азаспиро[2,4]гептана (соединение 67).
1. 7,7-Этилентиокси-5-[1-(R)-фенилэтил]-5-азаспиро[2,4]гептан (соединение 63).
2,5 г литийалюминий гидрида добавили к раствору 7,1 г соединения 62 150 мл безводного тетрагидрофурана и смесь кипятили с обратным холодильником в течение 3,5 ч. Смесь охладили льдом и к смеси добавили последовательно 2,5 мл воды, 2,5 мл 15%-ного водного раствора гидроокиси натрия и 7,5 мл воды. Нерастворимые вещества удалили фильтрованием и растворитель удалили из фильтрата. Остаток очищали хроматографией на колонке с силикагелем (100 г), элюируя смесью н-гексана и этилацетата (3:2) с получением 5,67 г целевого соединения 63.
1H-ЯМР /CDCl3/ d ч/млн: 0,40-0,60 /2H, мультиплет/ 0,76-0,96 /2H, мультиплет/, 1,36 /3H, дуплет, J 7,2 Гц/, 2,40-2,88 /4H, мультиплет/, 3,77 /4H, синглет/, 7,18-7,50 /5H, мультиплет/.
2. 7,7-Этилендиокси-5-азаспиро[2,4]гептан (соединение 64).
Смесь 3,89 г соединения 63, 50 мл этанола и 4 г 5%-ного палладия на угле встряхивали в атмосфере водорода при давлении 4 атм. Реакционный сосуд нагревали с помощью внешнего облучения вольфрамовой лампой в течение реакции восстановления. Реакцию восстановления продолжили в течение 3 ч. Катализатор удаляли фильтрованием с получением 2 г целевого соединения 64.
1H-ЯМР /CDCl3/d ч/млн: 0,44-0,64 /2H, мультиплет/, 0,72-0,92 /2H, мультиплет/, 3,03 и 3,05 /2H каждый, синглет/, 3,86 /4H, синглет/.
3. 5-Трет-бутоксикарбонил-7,7-этилендиокси-5-азаспиро[2,4] гептан (соединение 65).
1,515 г триэтиламина и 3,05 г дитрет-бутил дикарбоната добавили к охлажденному льдом раствору 1,98 г соединения 64 в 25 мл безводного дихлорметана. Смесь перемешивали при комнатной температуре в течение 30 мин. Растворитель удалили при пониженном давлении. Остаток экстрагировали хлороформом и экстракт промыли водой. Растворитель удалили при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем (50 г), элюируя смесью н-гексана и этилацетата (3:1), с получением 3,21 г целевого соединения 65.
4. 5-Трет-бутоксикарбонил-7-оксо-5-азаспиро[2,4]гептан (соединение 66).
Смесь 3,15 г соединения 65, 30 мл ацетона и 5 мл 1 нормальной соляной кислоты кипятили с обратным холодильником в течение 30 мин. Растворитель удалили при пониженном давлении. Остаток экстрагировали хлороформом и экстракт сушили. Растворитель удаляли при пониженном давлении с получением 1,94 г целевого соединения 66.
1H-ЯМР /CDCl3/ d ч/млн: 1,00-1,20 и 1,30-1,50 /2H каждый, мультиплет/, 4,49 /9H, синглет/, 3,78 /2H, мультиплет/, 3,95 /2H, синглет/.
5. 5-Трет-бутоксикарбонил-7-гидроксиимино-5-азаспиро[2,4] гептан (соединение 67).
1,25 г гидроксиламин гидрохлорида и 1,8 г триэтиламина добавили к раствору 1,9 г соединения 66. Смесь перемешивали при комнатной температуре в течение 1 дн. Растворитель удалили при пониженном давлении и к остатку добавили 10%-ный водный раствор лимонной кислоты. Смесь экстрагировали хлороформом и экстракт промыли водой. Экстракт сушили и растворитель удаляли при пониженном давлении с получением 1,86 г целевого соединения 67 с т. пл. 117-119oC.
1H-ЯМР /CDCl3/ d ч/млн: 0,90-1,10 и 1,14-1,34 /2H, каждый, мультиплет/, 1,45 /9H, синглет/, 3,36 /2H, синглет/, 4,29 /2H, синглет/.
Справочный пример 14. 7-Амино-5-азаспиро[2,4] гептан дигидрохлорид (соединение 68b).
Смесь 630 мг соединения 15b, 10 мл 1 нормальной соляной кислоты, 20 мл этанола и 800 мг 5%-ного палладия на угле встряхивали в атмосфере водорода при давлении 4 атм. Реакционный сосуд нагревали внешним облучением вольфрамовой лампы в течение реакции восстановления. Реакцию восстановления продолжали в течение 3,5 часа. Катализатор удалили фильтрованием и удалили растворитель с получением 350 мг целевого соединения 68b [α]д-41,5° (c 1.616, вода), т. пл. 230-240oC (разложение, разложение начинается с 190oC).
Элементный анализ для C6H14N2Cl2•1/2H2O
Рассчитано: C 37,13, H 7,79, N 14,43
Найдено: C 37,49, H 7,32, N 14,59
MS: m/z: 149 (M+ -HCl)
1H-ЯМР /D2O/ δ ч/млн: 0,79-1,60 /4H, мультиплет/, 3,08 /1H, дуплет, J 12 Гц/, 3,48-3,67 /3H, мультиплет/ 3,93 /1H, двойной дуплет, J 7 и 13,5 Гц/.
Справочный пример 15. 7-Трет-бутоксикарбониламино-5-азаспиро[2,4]гептан (соединение 11b).
Смесь 11,8 г соединения 166, 200 мл этанола и 11 г 5%-ного палладия на угле встряхивания в атмосфере водорода при давлении 4 атм. Реакционный сосуд нагревали внешним облучением вольфрамовой лампы в течение реакции восстановления. Реакцию восстановления проводили в течение 6 ч. Катализатор удаляли фильтрованием и растворитель удаляли при пониженном давлении из фильтрата. Остаток растворили в этилацетате и раствор экстрагировали 10%-ным водным раствором лимонной кислоты. Водный слой промыли этилацетатом. Водный слой подщелочили гидроокисью натрия (водный раствор) и экстрагировали хлороформом. Экстракт сушили и растворитель удалили при пониженном давлении с получением 7,6 г целевого соединения 11b, с т. пл. 56-59oC.
[α]д-68,54° (c 1.742, CHCl3).
Справочный пример 16.
1. Диэтил циклобутиленденмалонат (соединение 70).
Раствор 15,68 мл тетрахлорида титана в 35,7 мл четыреххлористого углерода добавили по каплям быстро при перемешивании к 285 мл тетрагидрофурана, который охлаждали до -30oC, 5 г циклобутанона и 10,83 г диэтилмалоната добавили к смеси. Затем добавили по каплям раствор 23,1 мл пиридина в 50 мл тетраридрофурана в течение 1 ч, в то время как температуру реакции поддерживали при -10oC. Смесь перемешивали в течение 18 ч, поддерживая температуру смеси при 0oC. К смеси добавили воду и смесь экстрагировали диэтиловым эфиром. Эфирный слой отделили и водный слой экстрагировали диэтиловым эфиром. Объединенные органические слои промыли насыщенным водным раствором хлористого натрия, насыщенным водным раствором бикарбоната натрия и затем насыщенным водным раствором хлористого натрия. Органический слой сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении с получением 17,265 г целевого соединения 70 в виде бесцветного масла.
1H-ЯМР /CDCl 3/ δ ч/млн: 1,29 /6H, 6, J 7,3 Гц/, 1,7-2,4 /2H, мултиплет/, 3,15 /4H, триплет, J 7,7 Гц/, 4,22 /4H, квардуплет, J 7,3 Гц/.
Таким же образом были получены диэтил циклопентилиденмалонат (соединение 71)
1H-ЯМР /CDCl3/ d ч/млн: 1/29 /6H, триплет, C 7 Гц/ 1,6-2,0 /4H, мультиплет/, 2,6-2,8 /4H, мультиплет/, 2,24 /4H, квардуплет, J 7 Гц/
и диэтил циклогексилиденмалоат (соединение 72)
1H-ЯМР /CDCl3/ d ч/млн: 1,28 /6H, триплет, J 7,2 Гц/, 1,4-1,85 /6H, широкий/, 2,3-2,6 /4Н, широкий/, 4,22 /4H, квардуплет, J 7,2 Гц/.
2. Диэтил(1-нитрометил-1-циклобутил)малонат (соединение 73).
Смесь 15,32 г соединения 70, 59 мл нитрометана и 4,5 мл тетраметилгуанидина перемешивали при комнатной температуре в течение 16 ч. К смеси добавили 10-ный водный раствор лимонной кислоты и смесь встряхивали. Органический слой отделили и промыли насыщенным водным раствором хлористого натрия и сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении с получением 19,03 г целевого соединения 73 в виде желтого масла.
1H-ЯМР /CDCl3/ d ч/млн: 1,28 /6H, триплет, J 7,1 Гц/, 1,8-2,4 /6H, мультиплет/, 3,80 /1H, синглет/, 4,20 /4H, квардуплет, J 7,1 Гц/, 4,82 /2H, синглет/.
Таким же способом были получены диэтил(1- нитрометил-1-циклопентил/малонат) (соединение 74).
1H-ЯМР/CDCl3/ d ч/ млн: 1,27/6H, триплет, J 7,0 Гц/, 1,6-2,0/8H, мультиплет/, 3,79/1H,синглет/, 4,20/4H, квардуплет, J7 Гц/, 4,71/2H, синглет/
и диэтил(1-нитрометил-1-циклогексил/малонат) (соединение 75)
1H-ЯМР/ CDCl3/ d ч/млн: 1,27/6H, триплет, J 7 Гц/, 1,4-1,8/10H, мультиплет/, 3,88/1H, синглет/, 4,20/4H, квадруалет, J 7 Гц/, 4,96/2H, синглет/.
3. Этил 7-оксо-6-азаспиро[3,4]октан-8- карбоксилат (соединение 76).
30 мл никеля Ренея промыли водой и этанолом и добавили к раствору 19,03 г соединения 73 в 400 мл этанола. Каталитическое восстановление проводили в течение 2 дн. Катализатор удаляли фильтрованием и растворитель удаляли при пониженном давлении. К остатку добавили этилацетат и 1 нормальную соляную кислоту и смесь встряхивали. Органический слой сушили над безводным сульфатом натрия и растворитель удаляли при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем (100г), элюируя хлороформом, содержащим 0-3% метанола, с получением 2,97 г целевого соединения 76. Слой соляной кислоты нейтрализовали бикарбонатом натрия и смесь экстрагировали этилацетатом. Органический слой сушили над безводным сульфатом натрия и растворитель удаляли при пониженном давлении с получением 1,58 г целевого соединения 76. Наконец общее количество в 4,56 г целевого соединения 76 было получено.
1H-ЯМР /CDCl3/ d ч/млн: 1,28/3H, триплет, J7 Гц/, 1,8-2,2/6H, мультиплет/, 3,21/1H, синглет/, 3,41/1H, двойной дуплет, J 9,7 и 1,4 Гц/, 3,60/1H, дуплет, J 9,7 Гц/, 4,20/2H, квардуплет, J 7,1 Гц/, 7,21/1H, широкий/.
Таким же способом были получены этил-3-оксо-2-азаспиро-4,4-нонан-4-карбоксилат (соединение 77)
1H-ЯМР /CDCl3/ d ч/млн: 1,28/3H, триплет, J 7,3 Гц/, 2,6-2,8/8H, широкий/, 3,07/1H, синглет/, 3,01/1H, двойной дуплет, J9,3 и 1,3 Гц/, 3,45/1H, дуплет, J 9,3 Гц/, 4,20/2H, квардуплет, J 7,3 Гц/, 7,30/1H, широкий/
и этил 3-оксо-2-азаспиро-4,5-декан-4- карбоксила (соединение 78)
1H -ЯМР/ CDCl3/ d ч/млн: 1,29/3H, триплет, C 7,3 Гц/, 1,3-1,7/10H, широкий/, 3,05/1H, синглет/, 3,17/11H, двойной дуплет, J 9,9 и 1,4 Гц/, 4,20/2H, квардуплет, J 7,3 Гц/, 7,30/1H, широкий/.
4. 7-Оксо-6-азаспиро[3,4]октан-8-карбоновая кислота (соединение 79).
20 мл воды и 0,8 г гидроксида натрия добавили к раствору из 1,97 г соединения 76 в 20 мл этанола. Смесь кипятили с обратным холодильником в течение 2 ч. Этанол удаляли при пониженном давлении и водный слой промыли хлороформом. Водный слой нейтрализовали с помощью 1 нормальной соляной кислоты в условиях охлаждения льдом. Водный слой экстрагировали 2-бутаноном и экстракт сушили над безводным сульфатом магния. Растворитель удаляли с получением 1,57 г целевого соединения 79 в виде бесцветных кристаллов.
1H-ЯМР /CDCl3/ d ч/млн: 1,6-2,7/6H, мультиплет/, 3,15/1H, синглет/, 3,40/1H, дуплет, J=7,2 Гц/, 3,60/1H, дуплет, 9,2 Гц/, 6,2/1H, широкий/.
Таким же способом получили 3-оксо-2-заспиро-[4,4]-нонан-4-карбоновую кислоту (соединение 80)
1H-ЯМР/CDCl3/ d ч/млн: 1,5-2,3/8H, мультиплет/, 3,15/1H, дуплет, J 9,5 Гц/, 3,28/2H, синглет/, 3,33/1H, дуплет, J 9,5 Гц/, 6,45/1H, широкий/
и 3-оксо-2-азаспиро[4,5]декан-4-карбоновую кислоту (соединение 81)
1H-ЯМР /CDCl3/ d ч/млн: 1,2-2,0/1H, мультиплет/, 3,06/1H, синглет/, 3,11/1H, дуплет, J9,8 Гц/, 3,48/1H, дуплет, J 9,8Гц/, 6,47/1H, широкий/.
5. 8-Трет-бутоксикарбониламино-7-оксо-6-азасприро[3,4]октан (соединение 82).
2,2 мл дифенил фосфорилазида и 1,55 мл триэтиламина добавили к суспензии 1,57 г соединения 79 в 20 мл бензола при перемешивании. Смесь кипятили с обратным холодильником в течение 1,5 ч. Затем 4,4 мл трет-бутанола добавили к смеси и смесь кипятили с обратным холодильником в течение 16 ч. Растворитель удалили при пониженном давлении. Остаток экстрагировали этилалацетатом и экстракт промывали насыщенным водным раствором бикарбоната натрия, насыщенным водным раствором хлористого натрия, 10%-ным водным раствором лимонной кислоты и насыщенным водным раствором хлористого натрия. Промывные воды экстрагировали этилацетатом и объединенные экстракты сушили над безводным сульфатом натрия. Растворитель удалили при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем (50г), элюируя хлороформом, содержащим 0-3% метанола, с получением 0,56 г целевого соединения 82.
1H-ЯМР /CDCl 3 /d ч/млн: 1,48/9H, синглет/, 1,5-2,5/6H, мультиплет/, 3,27/1H, дуплет, J 9,9 Гц/, 3,44/1H, дуплет, J 9,9 Гц/, 4,18/1H, дуплет, J 7,7 Гц/, 5,20/1H,дуплет, J=7,7 Гц/, 7,13/1H, широкий синглет/.
Таким же способом были получены 4-трет- бутоксикарбониламино-3-оксо-2-азаспиро-4,4-нонан (соединение 83)
1H-ЯМР/ CDCl3/ d ч/млн: 1,45/9H, синглет/, 1,2-1,8/8H, мультиплет/, 3,13/2H, синглет/, 4,35/1H, дуплет, J 7,9 Гц/, 5,15/1H, дуплет, J 7,9 Гц/, 7,21/1H, широкий синглет/
и 4-трет-бутоксикарбониламино-3-оксо-2-азаспиро[4,5] декан (соединение 84)
1H -ЯМР /CDCl 3/ d ч/млн: 1,46/9H, синглет/, 1,0-1,8/10H, мутиплет/, 2,9-3,4/2H, мультиплет/, 4,15/1H, дуплет, J8,6 Гц/, 4,89/1H, дуплет, J8,6 Гц/, 6,71/1H, широкий синглет/.
6. 6-Трет-бутоксикарбонил-8- третбутоксикарбониламино-6-азаспиро[3,4] октан (соединение 87).
15 мл трифторуксусной кислоты добавили к 560 мг охлаждаемого льдом соединения 82 при перемешивании. Смесь затем перемешивали в течение 1,5 ч при комнатной температуре. Трифторуксусную кислоту удалили при пониженном давлении и остаток растворили в 30 мл безводного тетрагидрофурана. Раствор охладили льдом и 884 мг литийалюминий гидрида добавили к смеси. Смесь кипятили с обратным холодильником в течение 16 ч. Смесь охладили льдом и затем при перемешивании добавили воду. Нерастворимые вещества удалили фильтрованием и промыли тетрагидрофураном. Фильтрат и промывные растворы объдинили и добавили 1,02 г дитрет-бутил дикарбонат. Смесь перемешивали при комнатной температуре в течение 16 ч. Растворитель удалили при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем (50 г), элюируя смесью этилацетат и н-гексана (1:10), с получением 273 мг целевого соединения 87.
1H ЯМР/CDCl3 /d ч/млн: 1,45/18H, синглет/, 1,7-2,1/6H, мультиплет/, 3,0-3,6/4H, мультиплет/, 3,8-4,2/1H, мультиплет/, 5,1/1H, широкий дуплет/.
Таким же способом были получены 2-трет-бутоксикарбонил-4-трет-бутоксикарбониламино-2-азаспиро[4,4]нонан (соединение 90)
1H-ЯМР /CDCl3/ d ч/млн: 1,45/18H, синглет/, 1,3-1,8/8H, мультиплет/, 3,0-3,3/3H, мультиплет/, 3,4-3,7/1H, мультиплет/, 3,7-4,1/1H, мультиплет/, 4,55/1H, широкий дуплет/
и 2-трет-бутоксикарбонил-4-трет-бутоксикарбониламино-2-азаспиро[4,5]декан (соединение 93)
1H-ЯМР/CDCl3/ d / ч/млн: 1,0-1,9/28H, мультиплет/, 2,9-4,1/5H, мультиплет/, 4,51/1H, широкий дуплет/.
Пример 19. 7-(8-Амино-6-азаспиро[3,4] октан-6-ил)-1-циклопропил-6,8-дифтор-4-оксо-1,4-дигидрохинолин-3-карбоновая кислота (соединение 94).
2,7 мл трифторуксусной кислоты добавили к 173 мг охлаждаемого льдом соединения 87 при перемешивании. Трифторуксусную кислоту удалили при пониженном давлении. Остаток растворили в 10 мл ацетонитрила и к раствору добавили 100 мг 1-циклопропил-6,7,8-трифтор-4-оксо-1,4-дигидрохинолин-3-карбоновой кислоты и 0,98 мл триэтиламина. Смесь кипятили с обратным холодильником в течение 16 ч. Растворитель удаляли при пониженном давлении. К остатку добавили диэтиловый эфир. После охлаждения образовался осадок. Осадок отбирали фильтрованием и перкристаллизовывали из этанола и аммиачной воды с получением 125 мг целевого соединения 94. Т.пл. 260 263oC.
Элементный анализ для C20H 21N3O3F2:
Рассчитано: C 58,19, H 5,76, N 10,18
Найдено: C 58,10, H 5,38, N 10,13.
1-ЯМР/0,1N NaOD-D 2O/ d ч/млн: 1,05/2H, широкий синглет/, 1,13-1,20/2H, мультиплет/, 1,85-2,01/6H, мультиплет/, 2,15-2,22/1H, мультиплет/, 3,25-3,95/6H, мультиплет/, 7,56/1H, дуплет, J 15 Гц/, 8,41/1H, синглет/.
Таким же способом были получены 7-(4-амино-2-азаспиро[4,4]нонан-2-ил)-1-циклопропил-6,8-дифтор-1,4-дигидрохинилин-3-карбоновая кислота (соединение 95) и 7-(4-амино-2-азаспиро[4,5]декан-2-ил)-1-циклопропил-6,8-дифтор-4-оксо-1,4-гидрохинолин-3-карбоновая кислоты (соединение 96), 7-(4-амино-2-азаспиро[4,4] нонан-2-ил)-1-циклопропил-6,8-дифтор-4-оксо-1,4-дигидрохинолин-3-карбоновая кислота 95. Т.пл. 249-253oC.
Элементный анализ для C21H23N3O3F2•0.7H2O
Рассчитано: C 60,63, H 5,91, N 10,10
Найдено: C 60,63, H 5,69, N 9,94
1H-ЯМР /0,1 N NaOD-D2O/ d ч/млн: 1,00/2H, широкий синглет/, 1,11-1,15/2H, мультиплет/, 1,4-1-7/8H, мультиплет/, 3,1-3,9/6H, мультиплет/, 7,49/1H, дуплет, J 13,5 Гц/, 8,38/1H, синглет
7-(4-амино-2-азаспиро [4,5] декан-2-ил)-1 циклопропил-6,8-дифтор-4-оксо-1,4-дигидрохинолин-3-карбоновая кислота 96. Т.пл. 247-274oC
Элементный анализ для C22H25N3O3F2
Рассчитано: C 63,30, H 6,04, N 10,07
Найдено: C 63,14, H 6,08, N 10,02
1H-ЯМР/0,1N NaOD-D 2O/ d ч/млн: 1,00/2H, широкий синглет/, 1,10-1,16/2H, мультиплет/, 1,20-1,63/10H, мультиплет/, 2,99-3,90/6H, мультиплет/, 7,50/1H, дуплет, J 14,5 Гц/, 8,38/1H, синглет/.
Пример 20. 10-(8-Амино-6-азаспиро[3,4]октан-6-ил)-9-фтор-2,3-дигидро-3-(S)-метил-4-оксо-7H-пиридо[1,2,3-de] [1,4]бензоксазин-6-карбоновая кислота (соединение 98).
Смесь 120 мг соединения 87 в 2 мл трифторуксусной кислоты перемешивали при комнатной температуре в течение 2 ч, затем трифторуксусную кислоту удалили при пониженном давлении. К остатку добавили 85 мг 9,10-дифтор-2,3-дигидро-3-(S)-метил-7-оксо-7H, -пиридо[1,2,3-de] [1,4] бензоксазин-6-карбоновой кислоты BF2-хелата, 15 мл диметилсульфоксида и 1 мл триэтиламина. Смесь перешивали при комнатной температуре в течение ночи. Растворитель удалили при пониженном давлении. 20 мл 95%-ного метанола и 1,2 мл триэтиламина добавили к остатку и смесь кипятили с обратным холодильником в течение 5 ч. Растворитель удалили при пониженном давлении и к остатку добавили диэтиловый эфир. Получающийся кристаллический продукт отбирали фильтрованием и перекристаллизовывали из аммиачной воды и этанола с получением 50 мг целевого соединения 98. Т.пл. 229-231oC.
Элементный анализ для C20H 22N3O4F•1/2H2O
Рассчитано: C 57,96, H 6,08, N 10,14
Найдено: C 57,66, H 5,84, N 10,24
1H-ЯМР /0,1N NaOD-D2O /d ч/млн: 1,28/3H, синглет/, 1,6Л-1,82/5H, мультиплет/, 1,95-2,04/1H, мультиплет/, 2,95-3,02/1H, мультиплет/, 3,08-3,17/1H, мультиплет/, 3,34-3,46/1H, мультиплет/, 3,58-3,70/2H, мультиплет/, 4,00-4,08/1H, мультиплет/, 4,18-4,24/ /1H, мультиплет/, 4,29-4,36/1H, мультиплет/, 7,18/1H, дуплет, J 19,8 Гц/, 8,13/1H, синглет/.
Справочный пример 17.
1. Трет-бутил-7-оксо-6-азаспиро[3,4]октан-7-карбоксилат (соединение 99).
2 г соединения 7 растворили в 30 мл трет-бутанола при нагревании и перемешивании. К раствору добавили 2,8 мл дифенил фосфорилазида и 1,97 мл триэтиламина и смесь кипятили с обратным холодильником в течение 16 ч. Растворитель удалили при пониженном давлении. Остаток экстрагировали этилацетатом и экстракт промывали насыщенным водным раствором бикарбоната натрия, насыщенным водным раствором хлористого натрия, 10%-ным водным раствором лимонной кислоты и насыщенным водным раствором хлористого натрия. Промывные растворы экстрагировали этилацетатом и экстракты промыли аналогичным методом. Органический слой сушили над безводным сульфатом натрия и растворитель удаляли при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем (75г), элюируя хлороформом, содержащим 0-2% метанола, с получением 1,97 г целевого соединения 99.
1H-ЯМР /CDCl3/ d ч/мин: 1,46/9H, синглет/, 1,7-2,4/6H, мультиплет/, 3,09/1H, синглет/, 3,41/1H, дуплет, J=10 Гц/, 3,62/1H, дуплет, J 10 Гц/, 6,90/1H, широкий/.
Таким же способом были получены трет-бутил-3- оксо-2-азаспиро[4,4]нонан-4-карбоксилат (соединение 100)
1H-ЯМР /CDCl3/ d ч/ млн: 1,47/9H, синглет/, 1,70/8H, широкий синглет/, 2,98/1H, синглет/, 3,10/1H, дуплет, J 9,77 Гц/, 3,43/1H, дуплет, J 9,7 Гц/, 7,50/1H, широкий синглет
и трет-бутил-3-оксо-2-азаспиро[4,5]декан-1-карбоксилат (соединение 101)
1H -ЯМР /CDCl3/ d ч/млн: 1,45 /19H, широкий синглет/, 2,93/1H, синглет/, 3,13/1H, дуплет, J=11 Гц/, 3,32/1H, дуплет, J=11 Гц/, 6,90/1H, широкий синглет/.
2. 6-Трет-бутоксикарбонил-8-гидроксиметил-6-азаспиро[3,4]октан (соединение 103).
20 мл охлаждаемой льдом трифторуксусной кислоты добавили к 1,94 г охлаждаемого льдом соединения 99 при перемешивании. Смесь перемешивали при комнатной температуре в течение 1 ч и трифторуксусную кислоту удаляли при пониженном давлении. Остаток растворяли в 100 мл безводного тетрагидрофурана и раствор охлаждали на бане со льдом. К раствору медленно добавили 3,11 г литийалюминий гидрида и смесь кипятили с обратным холодильником в течение 18 ч. Смесь охладили и к раствору медленно добавили 10 мл воды. Смесь перемешивали при комнатной температуре в течение 30 мин. Нерастворимые вещества удалили фильтрованием и промывали тетрагидрофураном. Объединенный фильтрат и промывочные растворы конденсировали при пониженном давлении до объема 50 мл. К раствору добавили ди-трет-бутил дикарбонат и смесь перемешивали при комнатной температуре в течение 18 ч. Растворитель удалили при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем (150 г), элюируя смесью н-гексана и этилацетата (3:2), с получением 420 мг целевого соединения 103.
1H-ЯМР /CDCl 3/ d ч/млн: 1,46 /9H, синглет/, 1,7-2,3 /8H, мультиплет/, 3,2-3,9 5H, мультиплет/.
Таким же способом были получены 2-трет- бутоксикарбонил-4-гидроксиметил-2-азаспиро[4, 4]нонан (соединение 105)
1H-ЯМР /CDCl3/ d ч/млн: 1,46 /9H, синглет/, 1,61 /8H, синглет/, 3,0-3,9 /7H, мультиплет/ и 2-трет-бутоксикарбонил-4-гидроксиметил-2-азаспиро [4,5] декан (соединение 107)
1H-ЯМР /CDCl3 / d ч/млн: 1,46/9H, синглет/, 1,1-1,7/10H, мультиплет/, 3,0-3,8/5H, мультиплет/.
Пример 21. 1-Циклопропил-6,8-дифтор-7-(8-гидроксиметил-6-азаспиро[3,4] октан-6-ил)-4-оксо-1,4-гидрохинолин-3-карбоновая кислота (соединение 108).
2,7 мл охлаждаемой льдом трифторуксусной кислоты добавляли к 120 мг охлаждаемого льдом соединения 103 по каплям при перемешивании. Смесь перемешивали при комнатной температуре в течение 1 ч. Трифторуксусную кислоту удалили при пониженном давлении. Остаток растворили в 10 мл ацетонитрила и к раствору добавили 100 мг 1-циклопропил-6,7,8-трифтор-4-оксо-1,4-гидрохинолин-3-карбоной кислоты и 0,22 мл триэтиламино. Смесь затем кипятили с обратным холодильником в течение 18 ч. Растворитель удалили при пониженном давлении и к остатку добавили концентрированную соляную кислоту и хлороформ. Смесь встряхивали и водный слой отделяли. Водный слой промыли хлороформом и промывочные растворы экстрагировали небольшим количеством концентрированной соляной кислоты. Объединенный водный слой охлаждали льдом и pH доводили до pH 13 с помощью гидроокиси натрия. Водный слой промывали хлороформом. Затем pH водного слоя доводили до pH 7,4 с помощью концентрированной соляной кислоты и насыщенного водного бикарбоната натрия. Водный слой экстрагировали хлороформом и экстракт сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении. Остаток перекристаллизовывали из этанола и аммиачной воды с получением 52 мг целевого соединения 108 в виде желтых игл. Т.пл. 273 274oC.
Элементный анализ для C21H 22N2O4F2
Рассчитано: C 62,37, H 5,48, N 6,93
Найдено: C 62,31, H 5,39, N 6,96
1H-ЯМР /CDCl3 / d ч/млн: 1,11-1,31 /4H, мультиплет/, 1,89- 2,31 7H, мультиплет/, 3,63 3,99 /7H, мультиплет/, 7,75 /1H, двойной дуплет, J=13,5 и 1,6 Гц/, 8,62 /1H, синглет/.
Аналогичным способом были получены 1- циклопропил-6,8-дифтор-7-(4-гидроксиметил-2-азаспиро[4,4]нонан-2-ил)-4-оксо-1,4-дигидрохинолин-3-карбоновая кислота (соединение 109) и 1-циклопропил-6,8-дифтор-7-(4-гидроксиметил-2-азаспиро[4,5] декан-2-ил)-4-оксо-1,4-дигидрохинолин-3-карбоновая кислота (соединение 110).
1-циклопропил-6,8-дифтор-7-(4-гидроксиметил-2-азаспиро[4,4] -нонан-2-ил)-4-оксо-1,4-дигидрохинолин-3-карбоновая кислота (соединение 109). Т.пл. 249 252oC.
Элементный анализ для C22H24N2O4F2
Рассчитано: C 63,15, H 5,78, N 6,70
Найдено: C 62,74, H 5,76, N 6,46
1H-ЯМР /CDCl3/ d ч/млн: 1,11 1,31 /4H, мультиплет/, 1,50 1,77 /8H, мультиплет/, 2,18 2,22 /1H, мультиплет/, 3,47 4,03 /7H, мультиплет/, 7,73 /1H, двойной дуплет, J=13,5 и 1,6 Гц/, 8,60 /1H, синглет/.
1-Циклопропил-6,8-дифтор-7-(4-гидроксиметил-2-азаспиро[4,5] декан-2-ил)-4-оксо-1,4-дигидрохинолин-3-карбоновая кислота) (соединение 110). Т.пл. 231 -234oC.
Элементный анализ для C23H26N2O4F2•1/2H2O
Рассчитано: C 62,58, H 6,17, N 6,35
Найдено: C 62,92, H 6,17, N 6,25
1H-ЯМР /CDCl3/ d ч/млн: 1,13 1,18 /2H, мультиплет/, 1,24 1,28 /2H, мультиплет/, 1,30 1,69 /11H, мультиплет/, 3,51 4,02 /7H, мультиплет/, 7,80 /1H, двойной дуплет, J=13,5 и 1,6 Гц/, 8,70 /1H, синглет/.
Справочный пример 18. Синтез 7-ацетокси-5-азаспиро[2,4]гептан (соединение 69).
Суспензию 1,5 г соединения 12 и 500 мг литийалюминий гидрида в 30 мл тетрагидрофурана кипятили с обратным холодильником в течение 16 ч. К смеси добавили последовательно 0,5 мл воды, 0,5 мл 15%-ной водной гидроокиси натрия и 1,5 мл воды, и смесь перемешивали при комнатной температуре в течение 30 минут. Нерастворимые вещества удалили фильтрованием и фильтрат концентрировали досуха с получение 1,4 г 7-гидроокиси-5-[1-(R)-фенилэтил]-5-азаспиро[2,4] -гептана в виде бледно-желтого масла. 5 мл уксусного ангидрида и 5 мл пиридина добавили к 1,4 г 7-гидрокси-5-[1-(R)-фенилэтил]-5-азаспиро- 2,4-гептана, который охлаждали на водяной бане. Смесь перемешивали при комнатной температуре в течение 3 ч. К смеси добавили этилацетат и раствор промыли насыщенным водным раствором бикарбоната натрия и водой, затем сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении с получением 1,6 г 7-ацетоки-5-[1-(R)-фенилэтил]-5-азаспиро[2,4]гептана в виде желтого масла. Смесь 1,6 г 7-ацетокси-5-[1-(R)-фенилэтил]-5-азаспиро[2,4]гептана и 1,2 г палладия на угле (увлажненного до 50% водой) в 20 мл этанола встряхивали при давлении 3,8 атм водорода в течение 5 ч. В ходе реакции восстановления реакционный сосуд прогревали вольфрамовой лампой. Катализатор удаляли фильтрованием и растворитель удаляли при пониженном давлении с получением 880 мг целевого соединения 69 в виде масла.
В дополнение к вышеуказанным соединениям были синтезированы следующие соединения. Физические данные соответствующих соединений также представлены.
1: /-/-7-[7-(S)-амино-5-азаспиро[2,3] гептан-5-ил] -1-циклопропил-6-фтор-1,4-дигидро-4-оксохинолин-3-карбоновая кислота 33b, т. пл. 259 261oC.
2: /-/-7-[7-(S)-амино-5-азаспиро[2,3] гептан-5-ил)-6-фтор-1-(2,4-дифторфенил)-1,4-дигидро-4-оксо-1,8-нафтиридин-3-карбоновая кислота, 111b, т. пл. 232 235oC [α]д-20,54° (c=73, CHCl3).
Пример 22. 7-[7-(S)-амино-5-азаспиро[4,2]гептан-5-ил]-1-циклопропил-6-фторо-8-метокси-1,4-дигидро-4-оксохинолин-3-карбоновая кислота (112).
Смесь 1,20 г хелата дифторбора и 7-[7-(S)-амино-5-азаспиро[4,2]гептен-5-ил] -1-циклопропил-6-фторо-8-метокси-1,4-дигидро-4-оксохинолин-3-карбоной кислоты, 1,48 г 7-(S)-т-бутоксикарбонил- амино-5-азаспиро[4,2]гептана, 1,06 г триэтиламино и 10 мл диметилформамида перемешивают при комнатной температуре в течение 1,5 ч. К смеси добавляют 20 мл воды и образовавшийся желтый кристалл отделяют с помощью фильтрации. Смесь кристалла в триэтиламине в водном 90% -ном метанола кипятят с обратным холодильником в течение 3,5 ч. Растворитель удаляют при пониженном давлении. Остаток экстрагируют 80 мл хлороформа. Экстракт промывают 10%-ным водным раствором лимонной кислоты, водой, затем сушат над безводным сульфатом натрия. Растворитель удаляют при пониженном давлении. Остаток перекристаллизовывают из водного этанола, получая 1,35 г слабо-желтого кристаллического т-бутоксикарбониламинопроизводного. Т.пл. 176 - 178oC
[α]д-134,8° (c 1,08, хлороформ)
Анализ для C25H30 FN3O6
Рассчитано: C 61,59, H 6,20, N 8,62
Найдено: C 61,70, H 6,26, N 8,62
В охлаждаемых льдом 11 мл трифторуксусной кислоты растворяют 1,10 г полученного выше т-бутоксикарбониламинопроизводного. Раствор перемешивают при 0oC в течение 15 мин, затем при комнатной температуре в течение 1 ч. Смесь концентрируют до сухого остатка. Остаток растворяют в водном растворе гидроксида натрия. К смеси добавляют 1N соляную кислоту до тех пор, пока pH не достигнет 7,5. Смесь экстрагируют тремя 50 мл порциями хлороформа. Экстракт сушат над безводным сульфатом натрия и растворитель удаляют при пониженном давлении. Остаток перекристаллизовывают на этаноле, получая 642 мг названного соединения. Т.пл. 208 211oC.
[α]д-102,8° (c 0,825, 0,1N NaOH).
Пример 23. 5-Амино-7-[7-(S)-амино-5-азаспиро[4,2]гептан-5-ил]-1-циклопропил-6,8-дифторо-1,4-дигидро-4-оксохинолин-3-карбоновая кислота гидрохлорид гидрат (113).
Смесь 150 мг 5-амино-1-циклопропил-6,7,8-трифторо-1,4-дигидро-4-оксохинолин-3-карбоновой кислоты, 121 мг дигидрохлорида 7-(S)-амино-5-азаспиро[4,2] гептана, 305 мг триэтиламина и 10 мл ацетонитрила кипятят с обратным холодильником в течение 6 ч. После охлаждения образовавшийся кристалл отделяют фильтрацией. Его перекристаллизовывают из смеси 28%-ного водного аммиака и этанола, получая 104 мг с названного соединения. Т. пл. 291 298oC
[α]д-121° (c 0,465, 1N NaOH).
Анализ для C19H20F 2N4O3•HСl•H2O
Рассчитано: C 51,30, H 5,21, N 12,59, Cl 7,97
Найдено: C 50,93, H 4,80, N 12,88, Cl 7,67
1-ЯМР (0,1N NaOD D2O) δ 0,63 0,70 (4H, м), 0,81 - 0,84 (1H, м), 0,95 1,05 (1H, м), 1,05 1,15 (2H, м), 3,05 3,07 (1Н, м), 3,37 (1H, д, J=10 Гц), 3,49-3,51 (1H, м,), 3,82-3,87 (1H, м), 3,99 (1Н, д, J=10 Гц), 4,11 4,13 (1H, м), 8,27 (1H, с).
Пример 24. 7-[7-(S)-амино-5-азаспиро[4,2]гептан-5-ил]-1-циклопропил-6,8-дифторо-5-метил-1,4-дигидро-4-оксохинолин-3-карбоновая кислота (114).
Смесь 400 мг 1-циклопропил-6,7,8-трифторо-5-метил-1,4-дигидро-4-оксохинолин-3-карбоновой кислоты, 571 мг 7-(S)-т-бутоксикарбониламино-5-азаспиро[4,2]гептана и 10 мл диметилсульфоксида перемешивают при 120oC в течение 1 ч. После охлаждения смесь концентрируют досуха и к остатку добавляют воду. Образовавшийся кристалл отделяют с помощью фильтрации и сушат. В охлаждаемые льдом 10 мл трифторуксусной кислоты добавляют кристалл и смесь перемешивают при комнатной температуре в течение 1 ч. Трифторуксусную кислоту удаляют при пониженном давлении, и остаток растворяют а IN NaOH. Раствор нейтрализуют IN соляной кислотой, смесь экстрагируют хлороформом. Экстракт сушат над безводным сульфатом натрия и растворитель удаляют при пониженном давлении. Остаток перекристаллизовывают из смеси этанола и 28%-ного водного аммиака, получая 209 мг названного соединения в виде желтого порошка. Т.пл. 196 198oC.
[α]д-98,93° (c=1,011, IN NaOH)
Анализ для C20H21F2 N3O3
Рассчитано C 61,69, H 5,44, N 10,79
Найдено: C 61,44, H 5,36, N 10,54
Пример 25. 10-[7-(S)-амино-5-азаспиро[4,2]гептан-5-ил]-9-фторо-2,3-дигидро-3-(S)-метил-8-метил-7-оксо-7H-пиридо[1,2,3-de] [1,4] бензоксазин-6-карбоновая кислота (115).
Смесь 300 мг 9,10-дифторо-2,3-дигидро-3-(S)-метил-8-метил-7-оксо-7H-пиридо[1,2,3-de] [1,4] бензоксазин-6-карбоновой кислоты, 431 мг 7-(S)-т-бутоксикарбониламино-5-азаспиро[4,2] гептана в 5 мл безводного диметилсульфоксида нагревают при 100oC при перемешивании в течение 30 мин. После охлаждения, смесь концентрируют досуха и к остатку добавляют воду. Образовавшийся желтый кристалл отделяют путем фильтрации.
К 5 мл охлаждаемой льдом трифторуксусной кислоты добавляют кристалл в течение 30 мин. Трифторуксусную кислоту удаляют при пониженном давлении. Остаток растворяют в IN NaOH При охлаждении льдом, раствор нейтрализуют путем доавбления IN соляной кислоты. Смесь экстрагируют хлороформом и экстракт сушат над безводным сульфатом натрия. Растворитель удаляют и остаток перекристаллизовывают из смеси этанола и 28%-ного водного аммиака, получая 151 мг названного соединения в виде желтых игольчатых кристаллов. Т.пл. 199 - 200oC
[α]д-122,63° (c=1,001, IN NaOH)
Анализ для C20 H22 FН3O4
Рассчитано: C 60,60, H 5,84, N 10,60
Найдено: C 60,31, H 5,57, N 10,46
Пример 26. 10-[8-Амино-6-азаспиро[3,4]октан-6-ил]-9-фторо-2,3-дигидро-3-(S)-метил-8-метил-7-оксо-7H-пиридо[1,2,3-de] [1,4]бензоксазин-6-карбоновая кислота (116).
Смесь 300 мг 9,10-дифторо-2,3-дигидро-3-(S)-метил -8-метил-7-оксо-7H-пиридо [1,2,3-de] [1,4]бензоксазин-6-карбоновой кислоты, 460 мг 8-т-бутоксикарбониламино-6-азаспиро[4,2] гептана в 7,5 мл безводного диметилсульфоксида нагревают при 90oC при перемешивании в течение 1 ч. После охлаждения смесь концентрируют досуха и к остатку добавляют воду. Образовавшийся желтый кристалл отделяют с помощью фильтрации.
К 7,5 мл охлаждаемой льдом трифторуксусной кислоты добавляют кристалл при перемешивании и смесь перемешивают при комнатной температуре в течение 30 мин. Трифторуксусную кислоту удаляют при пониженном давлении. Остаток растворяют в IN NaOH при охлаждении льдом, раствор нейтрализуют путем добавления IN соляной кислоты. Смесь экстрагируют хлороформом и экстракт сушат над безводным сульфатом натрия. Растворитель удаляют и остаток очищают с помощь препаративной тонкослойной хроматографии (проявляющий растворитель: хлороформ: метанол: вода= 7:3:1 (об/об)). Полученный сырой продукт перекристаллизовывают из смеси этанола и 28%-ного водного аммиака. Кристалл сушат при пониженном давлении при 60oC в течение ночи, получая 100 мг названного соединения в виде бледно-желтого порошка. Т.пл. 201 203oC (разл.).
[α]д-121,11° (c=0,650, IN NaOH).
Анализо для C21H 24FN3O4•3/4H2O
Рассчитано: C 60,79, H 6,15, N 10,13
Найдено: C 60,51, H 6,22, N 10,31
Бактерицидная активность полученных соединений приведена в таблице.
Схемы полученных заявленных соединений. Приведены на фиг. 2 9. Хотя изобретение описано детально и с указанием конкретных воплощений изобретения, специалистам в этой области науки очевидно, что могут быть сделаны различные изменения и модификации без нарушения духа и сферы притязаний изобретения.

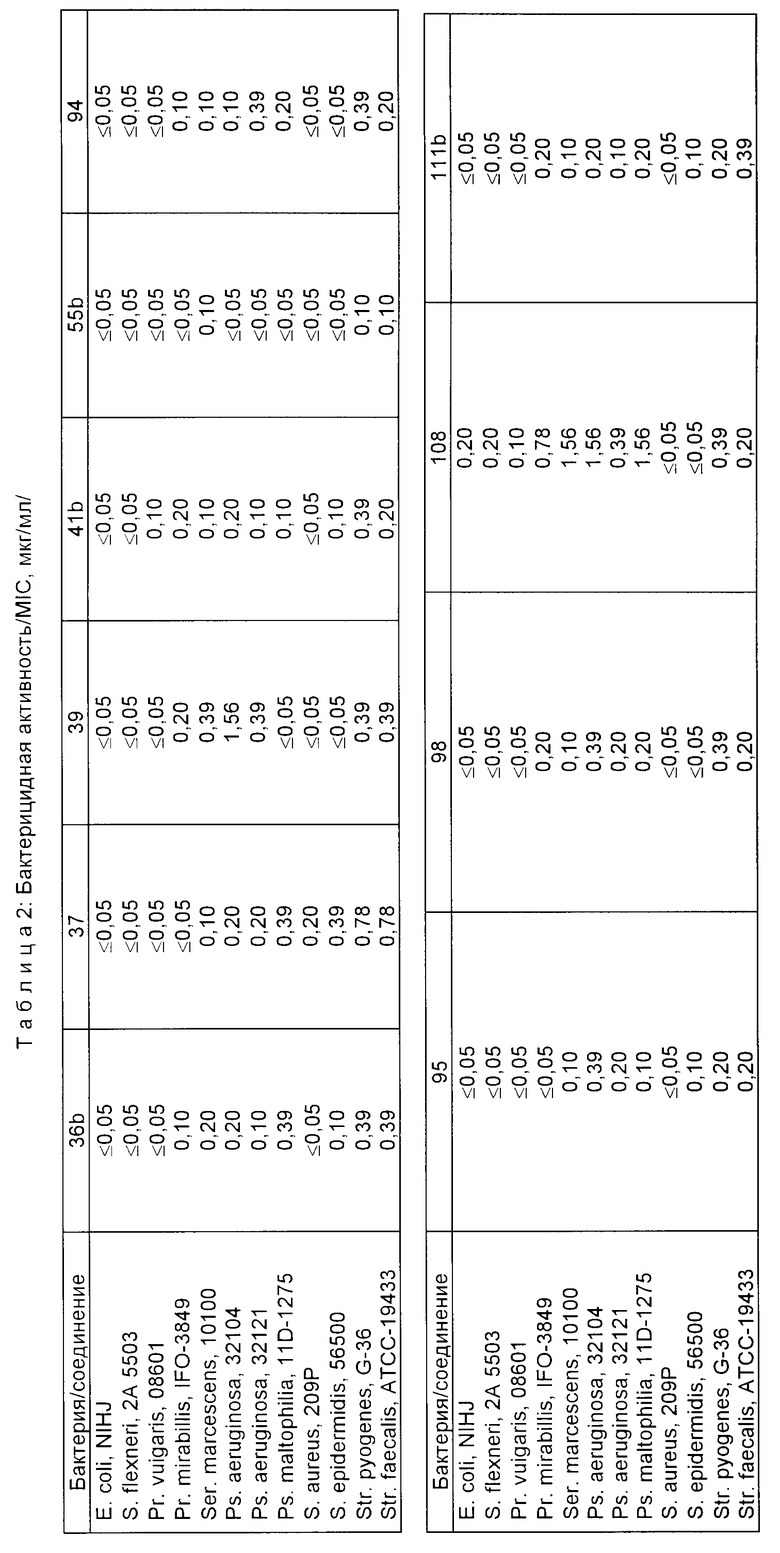
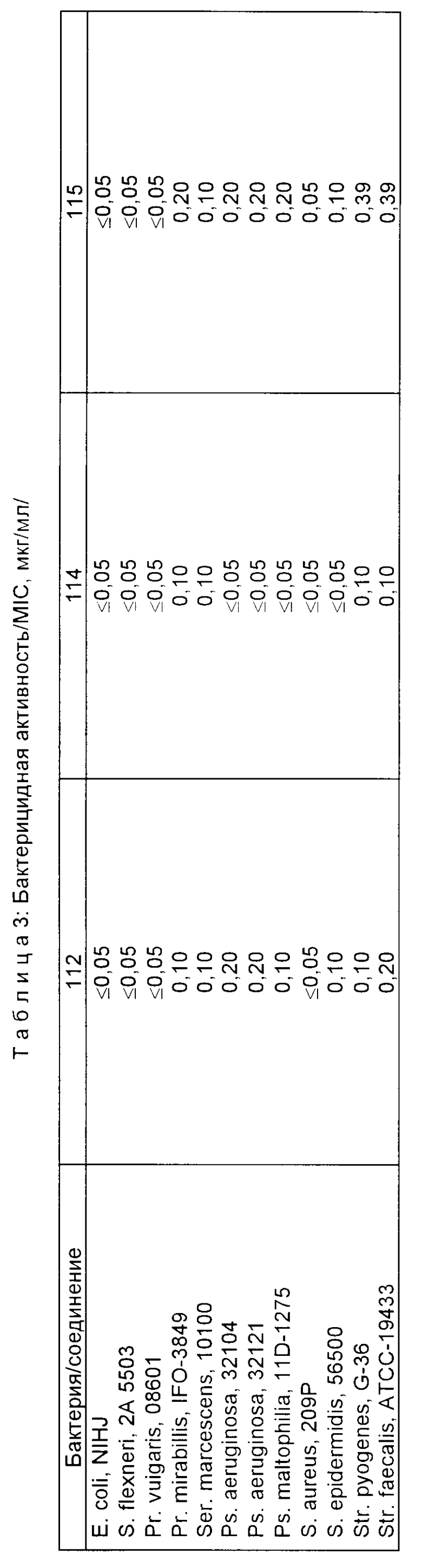

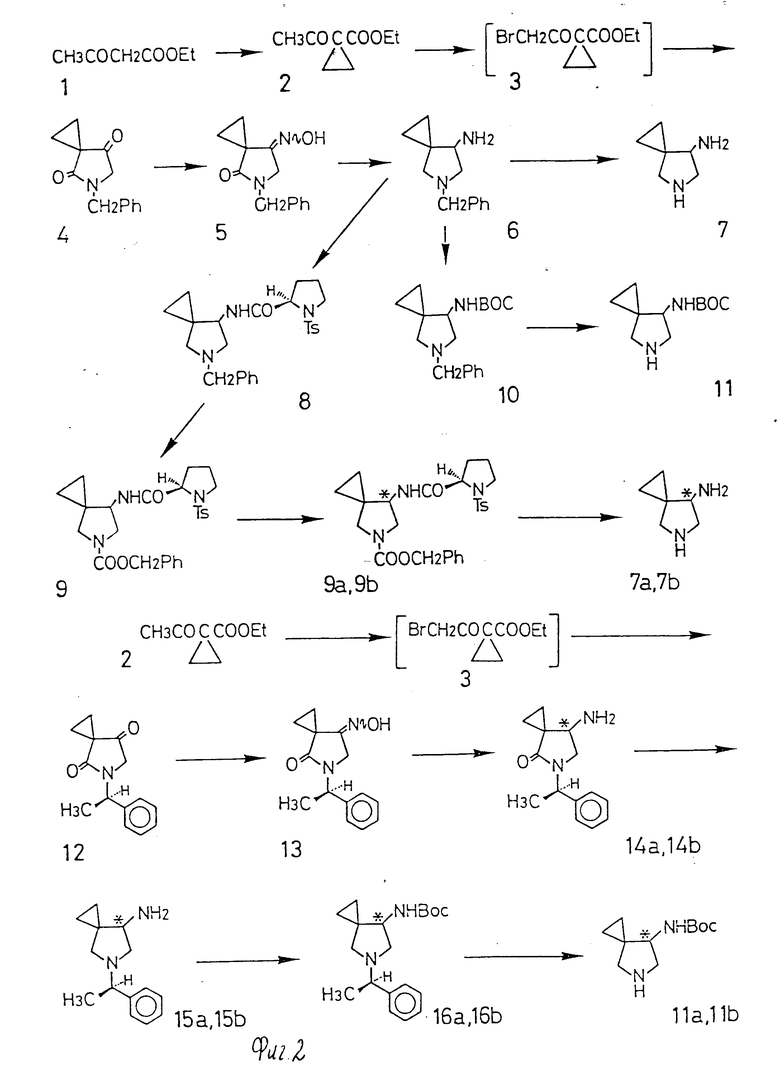
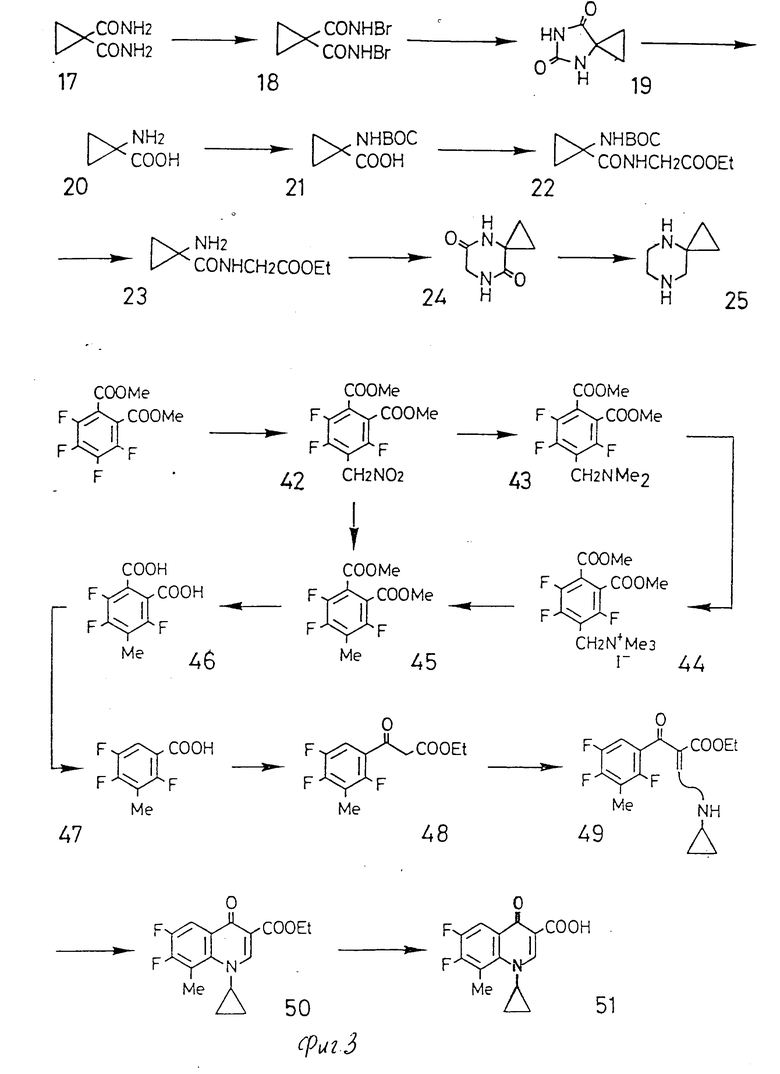
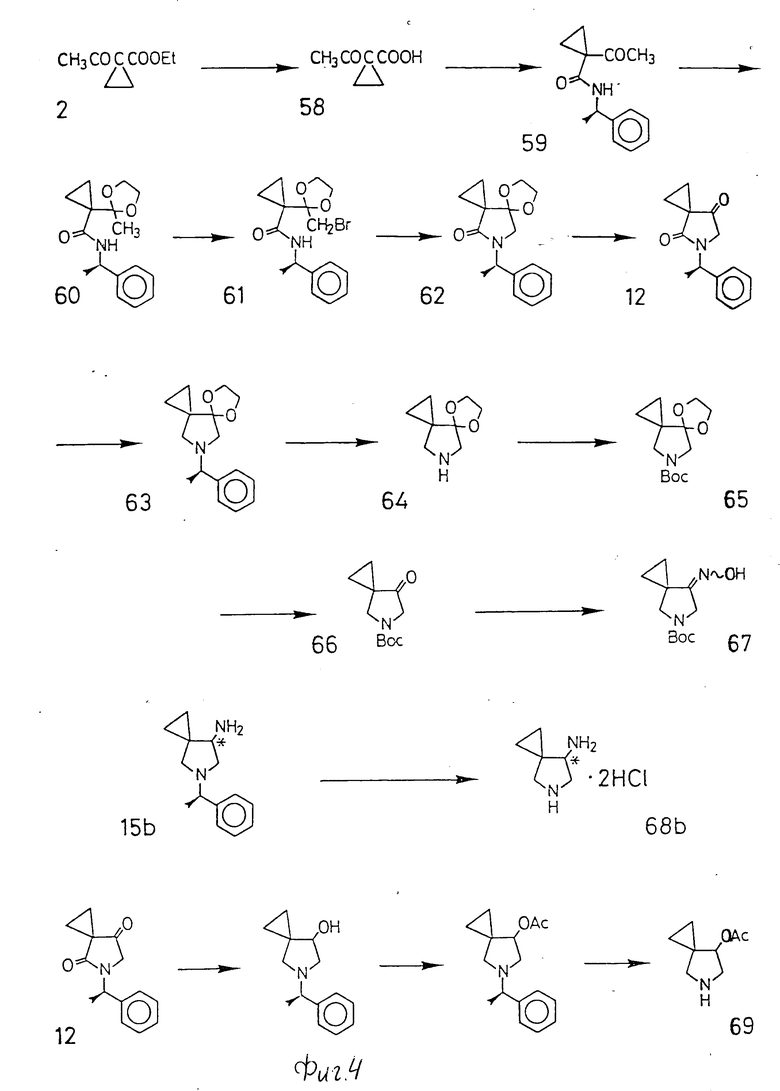
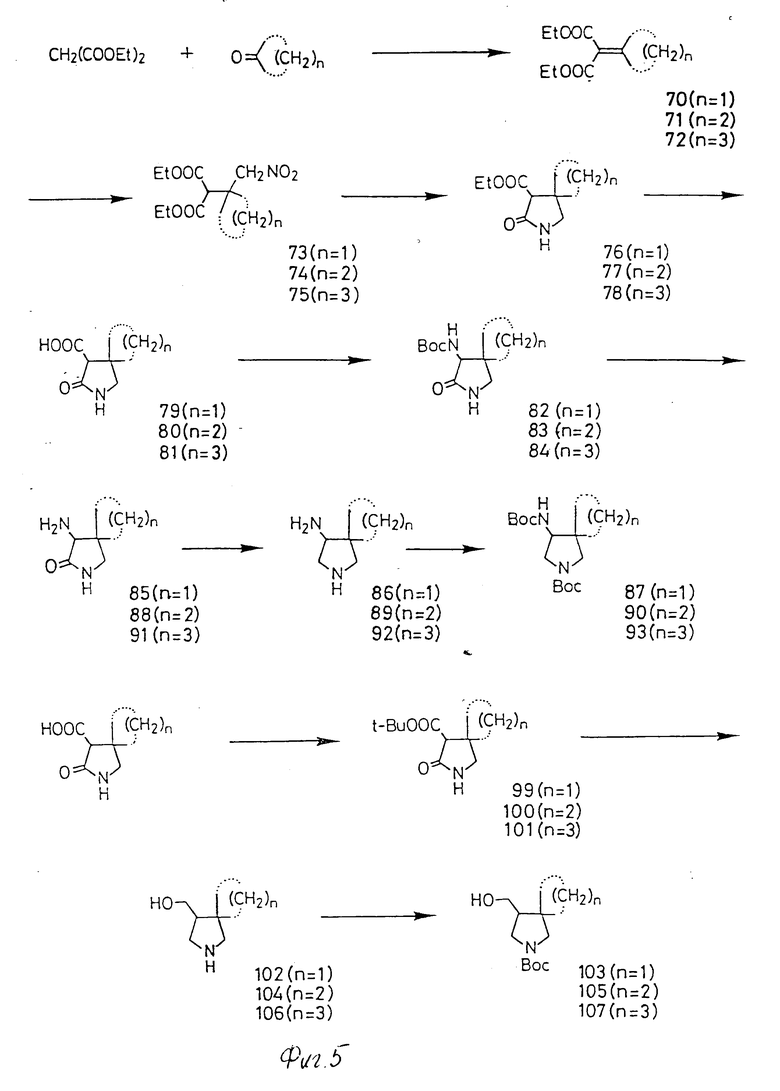
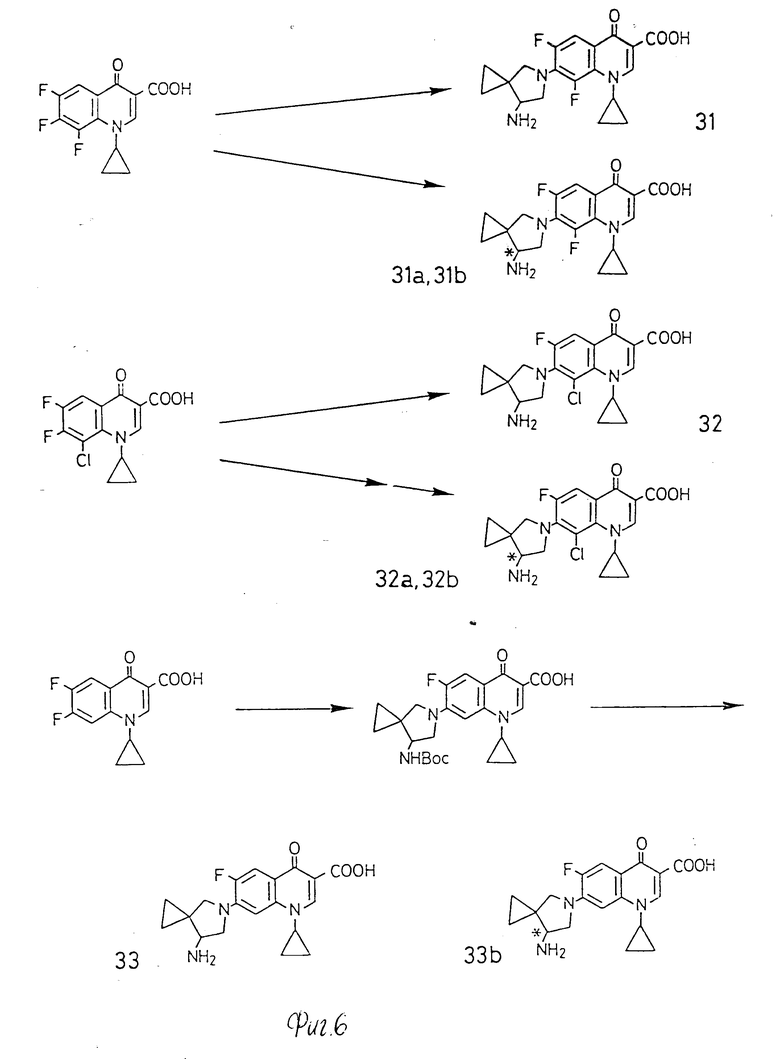
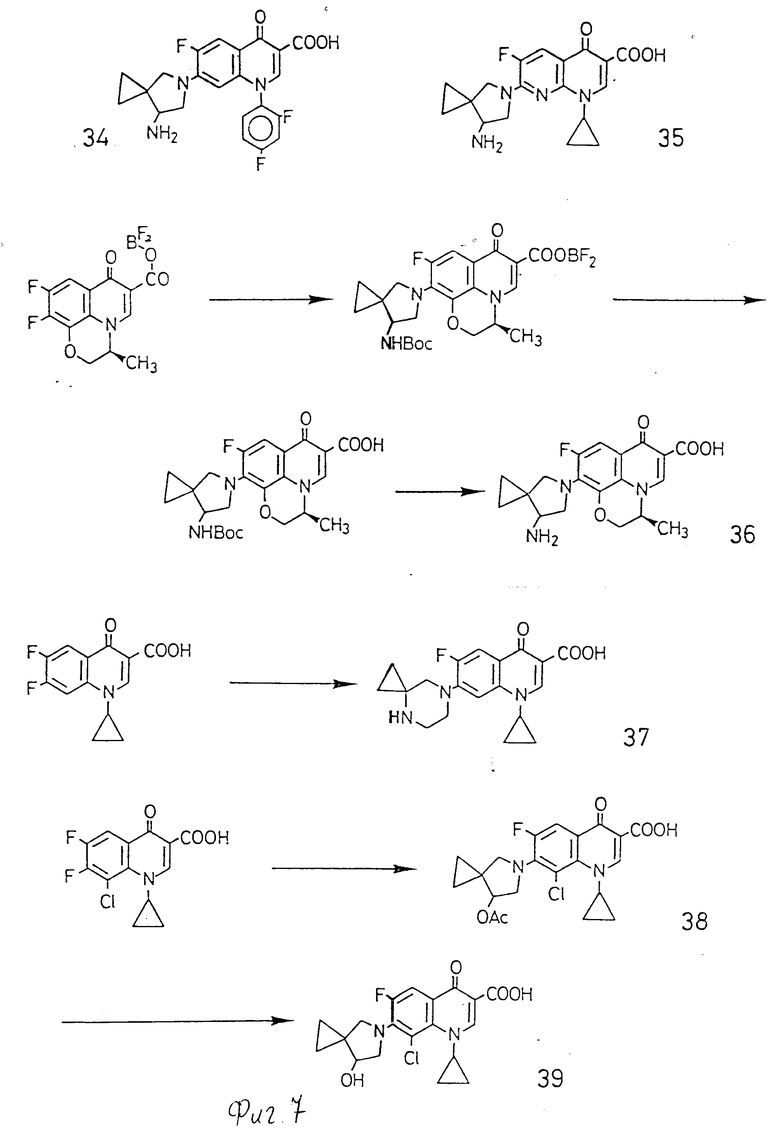
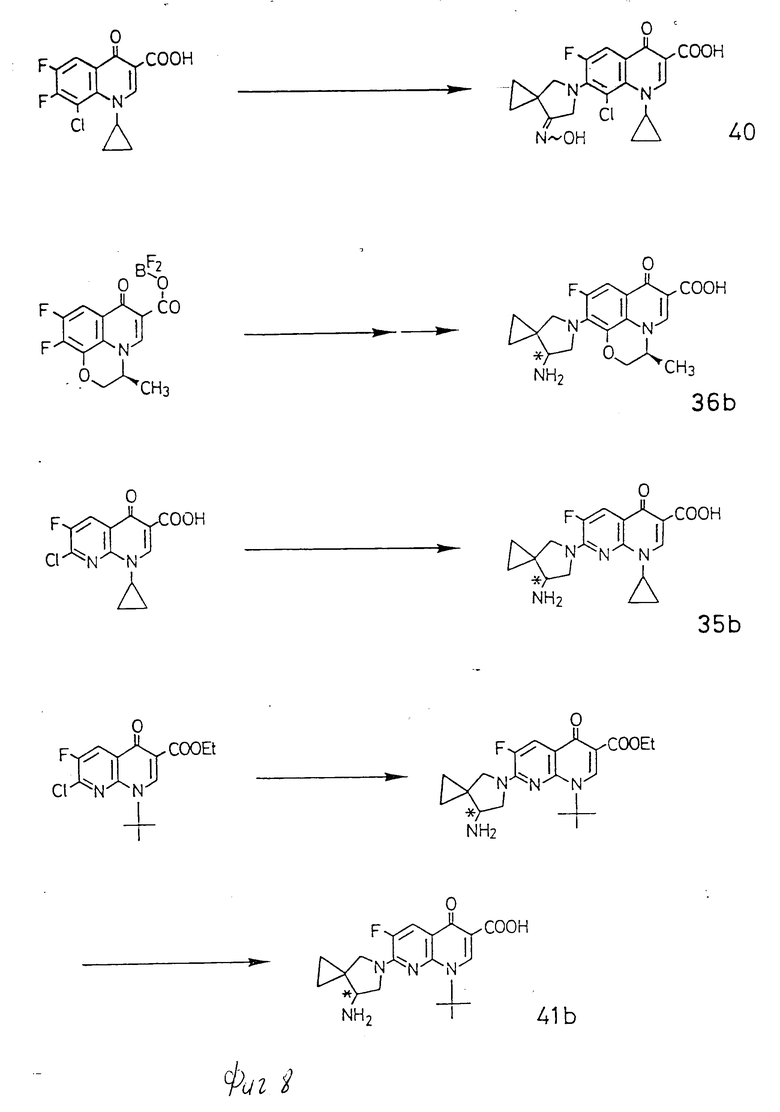
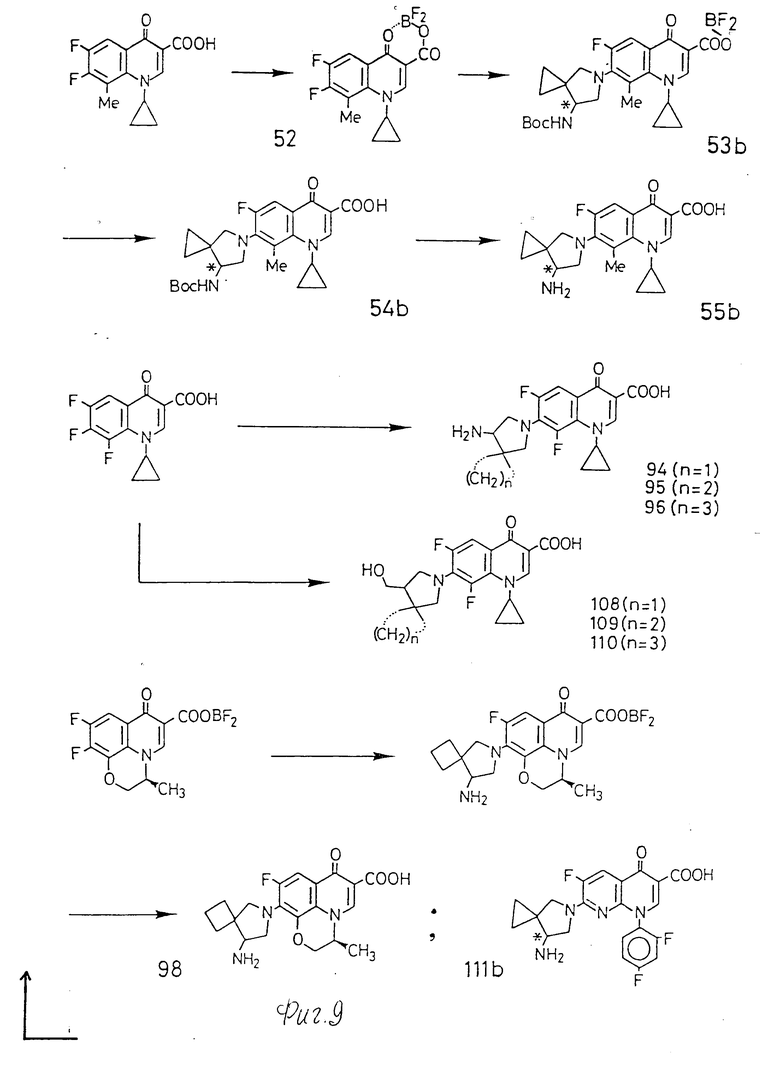
Использование: в качестве соединений, обладающих антимикробной активностью. Сущность изобретения: продукт формулы I, где а - 1, b - 2, с - 1-2;  гидроксигруппа, гидроксиалкил C1 - C6; R2-H, алкил C1-С6; и Q - группа формулы 2, где R3-алкил C1-C6, замещенный или незамещенный циклоалкильной группой с 3 - 6 атомами углерода, 2,4-дифторфенильной группой; А - атом азота или группа формулы 3, где R4-H, алкил C1-C6 или атом галоида, R3+R4 - трициклическое кольцо формулы 4, где X - атом галогена, y-H, алкил C1 - C6. Реагент 1: спироциклическое кольцо формулы 5. Реагент 2: соединение формулы 6 или 7. Структура соединений формул 1 - 7 соответственно:
гидроксигруппа, гидроксиалкил C1 - C6; R2-H, алкил C1-С6; и Q - группа формулы 2, где R3-алкил C1-C6, замещенный или незамещенный циклоалкильной группой с 3 - 6 атомами углерода, 2,4-дифторфенильной группой; А - атом азота или группа формулы 3, где R4-H, алкил C1-C6 или атом галоида, R3+R4 - трициклическое кольцо формулы 4, где X - атом галогена, y-H, алкил C1 - C6. Реагент 1: спироциклическое кольцо формулы 5. Реагент 2: соединение формулы 6 или 7. Структура соединений формул 1 - 7 соответственно: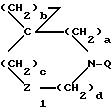
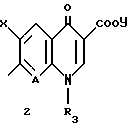
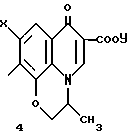
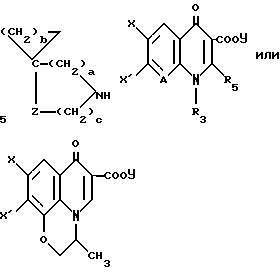
3 с. и 5 з.п. ф-лы, 9 ил. 1 табл.
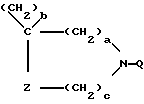
где а 1;
b 2 5, целое число;
с 1 и 2;
Z -
кислород или сера, где R1 аминогруппа, гидроксильная группа или гидроксиалкильная группа с 1 6 атомами углерода, R2 водород или алкильная группа с 1 6 атомами углерода;
Q структурный фрагмент формулы II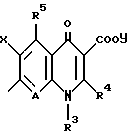
или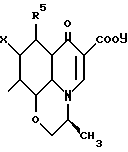
где R3 алкильная группа с 1 6 атомами углерода, замещенная или незамещенная циклоалкильная группа с 3 6 атомами углерода или 2,4-дифторфенильная группа;
R4 водород;
R2 водород, аминогруппа или алкильная группа с 1 6 атомами углерода;
А азот или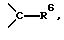
где R6 водород, алкильная группа с 1 6 атомами углерода, галоген или алкоксигруппа с 1 6 атомами углерода;
Х галоген;
Y водород, алкильная группа с 1 6 атомами углерода или дигалоидборная группа,
или его соли. или его соль.
или его соль.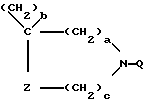
где значения Z, Q, a, b, c указаны в п. 1,
отличающийся тем, что осуществляют взаимодействие циклического амина общей формулы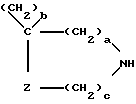
где А, в, с, и Z имеют указанные значения,
с галоидированными производными хинолина общей формулы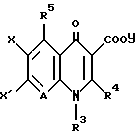
или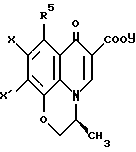
где A, R3, R4, R5, Y и Х имеют указанные в п. 1 значения;
Х1 галоген.
Приоритет по признакам:
31.08.88 при a 1, b 2 5, c 1 2, Z 
кислород или сера, где R1 аминогруппа, гидроксильная группа или гидроаксильная группа с 1 6 атомами углерода, R2 водород или алкильная группа с 1 6 атомами углерода,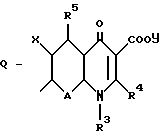
или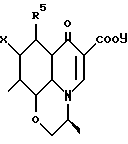
где R3 С1 С6-алкил, замещенная или незамещенная циклоалкильная группа С3 С6 или 2,4-дифторфенильная группа, R4 водород, R5 водород, аминогруппа или С1 С6-алкил, А азот или 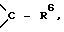
где R6 водород, С1 С6-алкил, галоген или алкоксигруппа с 1 6 атомами углерода, R3, взятый вместе с R6, образует трициклическую систему, где R5 имеет указанные значения, Х - галоген, Y водород;
14.09.88 при Y С1 С6-алкил, дигалоидборная группа.
| US, патент, 4517182, кл | |||
| Устройство для сортировки каменного угля | 1921 |
|
SU61A1 |
Авторы
Даты
1997-10-27—Публикация
1989-08-30—Подача