Изобретение относится к производным пиперазина или его солям, которые используются в качестве лечебных агентов при заболеваниях органов кровообращения и области мозга.
Некоторые производные пиперазина проявляют активность в отношении центральной нервной системы, такую как противотревожную активность и противоконвульсивную активность, как описано в патенте США 3362956. Известно также, что некоторые из производных пиперазина обладают ингибирующей кальмодулин активностью, как описано в Azzneim-Forsch. , Vol. 37(4), стр. 498 - 502 (1987).
Производные пиперазина, представленные формулой I, согласно настоящему изобретению являются новыми соединениями, о физиологической активности которых еще не сообщалось.
В последние годы заболевания органов кровообращения или церебральной области, такие как гипертония, сердечная недостаточность, грудная ангина, апоплексия, церебральный инфаркт, болезнь Альцгеймера или болезнь Паркинсона, возросли, и были разработаны различные препараты для профилактики и лечения этих заболеваний. С другой стороны, соединения с ингибирующей кальмодулин активностью были описаны и у некоторых из них обнаружено, что они обладают антигипертензивной активностью и вазодилаторной активностью.
Объектом настоящего изобретения является соединение, используемое в качестве лечебного агента при различных заболеваниях органов кровообращения или церебральной области, особенно таких заболеваний, которые вызваны избыточной активацией кальмодулина.
В результате интенсивных исследований настоящим заявителям удалось получить новые производные пиперазина, представленные формулой I, показанные ниже, и их соли и установить, что эти соединения обладают ингибирующей кальмодулин активностью, антигипоксической активностью, ингибиторной активностью в отношении замедленного отмирания нейронов в гиппокампусе (Meriones shawi) и улучшающей активностью церебральной эдемы. Таким образом, соединения формулы I обладают не только ингибирующей кальмодулин активностью, но сильной защищающей церебральной активностью.
Настоящее изобретение относится к производному пиперазина общей формулы I: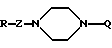
где
Q представляет фенильную, нафтильную, пиридильную, пиримидильную, изохинолильную, фурильную, бензофуранильную, дигидробензофуранильную, бензильную, дифенилметильную группу, при этом указанные группы могут быть замещены одним или более заместителями, выбранными из алкильной группы, имеющей от 1 до 6 атомов углерода, алкоксильной группы, имеющей от 1 до 6 атомов углерода, трифторметильной группы, диалкиламиногруппы, имеющей от 1 до 6 атомов углерода в каждой ее алкильной части, атома галогена, цианогруппы и этилендиоксигруппы, причем указанные заместители на дифенилметильной группе находятся на фенильном ядре, или циклоалкильную группу, имеющую от 3 до 8 атомов углерода;
R представляет группы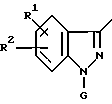
или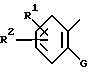
где
R1 и R2 независимо представляют алкоксильную группу, имеющую от 1 до 6 атомов углерода, или метилендиоксигруппу;
G представляет циклоалкильную группу, содержащую 3 - 6 атомов углерода, замещенную или незамещенную фенильную группу, бензоил, где фенильный фрагмент замещен или не замещен, бензилкарбонил, где фенильный фрагмент замещен или не замещен, альфа-гидроксибензильную группу, в которой фенильная часть замещена или не замещена, замещенную или незамещенную пирролильную группу, где атом азота имеет атом водорода, или алкильную группу, имеющую от 1 до 6 атомов углерода, или участвует в связывании с R, алкильную группу, замещенную гетероциклической группой, состоящей из замещенной или незамещенной тиенильной группы, замещенной или незамещенной имидазолильной группы, замещенной или незамещенной пиридильной группы и C1-C3 алкиленовой группы, алканоиламиногруппу, имеющую от 2 до 7 атомов углерода, морфолиноалкильную группу, состоящую из морфолиновой группы и C1-C3 алкиленовой группы, 1-алкилиндол-2-ильную группу, имеющую от 1 до 6 атомов углерода в алкильной части, где индольная часть может быть дополнительно замещена, фенилалкильную группу, состоящую из замещенной или незамещенной фенильной группы и C1-C6 алкиленовой группы; и атом водорода, причем, когда заместитель G имеет заместители, последние являются членами, выбранными из алкильной группы, имеющей от 1 до 6 атомов углерода, алкоксильной группы, имеющей от 1 до 6 атомов углерода, алкилтиогруппы, имеющей от 1 до 6 атомов углерода, алкилсульфонильной группы, имеющей от 1 до 6 атомов углерода, атома галогена и метилендиоксигруппы;
Z представляет C1-C3 алкиленовую группу, C2-C4 алкиленовую группу, C1-C3 алкиленовую группу, имеющую одну гидроксильную группу, или алкиленовую группу, содержащую карбонильную группу на одном конце или в середине углеродной цепи, или соль соединения.
Предпочтительными соединениями по изобретению являются соединения формулы I, где заместитель R имеет структуру, представленную следующей формулой: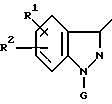
Предпочтительными соединениями являются также соединения формулы I, где заместитель R имеет структуру, представленную следующей формулой: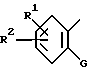
Предпочтительны соединения формулы I, где заместитель Q является фенильной группой, имеющей по крайней мере один заместитель в мета-положении по отношению к месту присоединения фенильной группы к пиперазиновой части.
К предпочтительным соединениям формулы I относятся соединения, где мета-заместитель фенильной группы в заместителе Q является атомом галогена.
Наиболее предпочтительны соединения формулы I, где Q является 2-метил-3-хлорфенильной группой.
К предпочтительным далее относится соединение формулы I, где Z является алкиленовой группой, имеющей от 2 до 3 атомов углерода.
Более предпочтительно соединение формулы I, где Z является алкиленовой группой, имеющей 2 атома углерода.
Предпочтительным соединением является соединение формулы I, где заместитель R представляет собой 5,6-диметокси-1H-индазольную часть, а также соединение формулы I, где заместитель R представляет собой 5,6-метилендиокси-1H-индазольную часть.
К более предпочтительным относится соединение формулы I, где заместитель G в R выбран из группы, включающей 3,4-диметоксибензильную группу, 4-имидазолилметильную группу, 2-пиридилметильную группу, 3-пиридилметильную группу и 4-пиридилметильную группу.
Предпочтительными являются соединения формулы I, где заместитель R представляет собой 2-замещенную 4,5-диметоксифенильную часть, и соединения формулы I, где заместитель R представляет собой 2-замещенную 4,5-метилендиоксифенильную часть.
Соли соединения формулы I обычно включают соли присоединения кислоты. Кислоты для получения солей присоединения кислот соединения формулы I могут быть органическими и неорганическими и включают соляную, серную, азотную, фосфорную кислоту, карбоновые кислоты (например, уксусную, пропионовую, молочную и фумаровую кислоту) и сульфоновые кислоты (например, метансульфоновая, бензолсульфоновая и толуолсульфоновая кислота). Для курса лечения соединение формулы I может назначаться человеку в форме соли присоединения кислоты в том случае, когда кислота, образующая соль, безвредна для человека.
В том случае, когда соединение изобретения формулы I имеет кислотный заместитель, такое соединение может быть преобразовано в соль с органическими или неорганическими основаниями.
Соединение по изобретению или его соли могут образовывать гидрат(ы).
Примерами предпочтительных соединений являются:
3-[2-[4-(3-хлор-2-метилфенил)-1-пиперазинил] этил-5,6-диметокси- 1-(3,4-диметоксибензил)-1H-индазол и его соль;
3-[2-[4-(3-хлор-2-метилфенил)-1-пиперазинил] этил-5,6- метилендиокси-1-(3,4-диметоксибензил)-1H-индазол и его соль;
3-[2-[4-(3-хлор-2-метилфенил)-1-пиперазинил] этил-5,6- диметокси-1-(4-имидазолилметил)-1H-индазол и его соль;
3-[2-[4-(3-хлор-2-метилфенил)-1-пиперазинил] этил-5,6- метилендиокси-1-(4-имидазолилметил)-1H-индазол и его соль;
3-[2-[4-(3-хлор-2-метилфенил)-1-пиперазинил] этил-5,6- диметокси-1-(2-пиридилметил)-1H-индазол и его соль;
3-[2-[4-(3-хлор-2-метилфенил)-1-пиперазинил] этил-5,6- метилендиокси-1-(2-пиридилметил)-1H-индазол и его соль;
3-[2-[4-(3-хлор-2-метилфенил)-1-пиперазинил] этил-5,6- диметокси-1-(3-пиридилметил)-1H-индазол и его соль;
3-[2-[4-(3-хлор-2-метилфенил)-1-пиперазинил] этил-5,6- метилендиокси-1-(3-пиридилметил)-1H-индазол и его соль;
3-[2-[4-(3-хлор-2-метилфенил)-1-пиперазинил] этил-5,6- диметокси-1-(4-пиридилметил)-1H-индазол и его соль;
3-[2-[4-(3-хлор-2-метилфенил)-1-пиперазинил] этил-5,6- метилендиокси-1-(4-пиридилметил)-1H-индазол и его соль;
3-[2-[4-(3-хлор-6-метоксифенил)-1-пиперазинил] этил-5,6- диметокси-1-(3,4-диметоксибензил)-1H-индазол и его соль;
3-[2-[4-(3-хлор-6-метоксифенил)-1-пиперазинил] этил-5,6- метилендиокси-1-(3,4-диметоксибензил)-1H-индазол и его соль;
3-[2-[4-(3-трифторметилфенил)-1-пиперазинил] этил-5,6- диметокси-1-(3,4-диметоксибензил)-1H-индазол и его соль;
3-[2-[4-(3-трифторметилфенил)-1-пиперазинил] этил] -5,6- метилендиокси-1-(3,4-диметоксибензил)-1H-индазол и его соль;
5,6-диметокси-2-[[4,5-диметокси-2-[4-(2-метоксифенил)-1- пиперазинил]этил]фенил]-1-метилиндол или его соль;
5,6-диметокси-2-[[4,5-метилендиокси-2-[4-(2-метоксифенил)-1- пиперазинил]этил]фенил]-1-метилиндол или его соль;
1-(3-хлор-2-метилфенил)-4-[2-[[4,5-диметокси-2-(3,4- диметоксифенил)]фенил]этил]пиперазин или его соль;
1-(3-хлор-2-метилфенил)-4-[2-[[4,5-метилендиокси-2-(3,4- диметоксифенил)]фенил]этил]пиперазин или его соль;
3-[2-[4-(3-хлор-2-метилфенил)-1-пиперазинил] пропил] -5,6- диметокси-1-(3,4-диметоксибензил)-1H-индазол и его соль;
3-[2-[4-(3-хлор-2-метилфенил)-1-пиперазинил] пропил] -5,6- метилендиокси-1-(3,4-диметоксибензил)-1H-индазол и его соль;
3-[2-[4-(3-хлор-2-метилфенил)-1-пиперазинил] пропил] -5,6- диметокси-1-(4-имидазолилметил)-1H-индазол и его соль;
3-[2-[4-(3-хлор-2-метилфенил)-1-пиперазинил] пропил] -5,6- метилендиокси-1-(4-имидазолилметил)-1H-индазол и его соль;
3-[2-[4-(3-хлор-2-метилфенил)-1-пиперазинил] пропил] -5,6- диметокси-1-(2-пиридилметил)-1H-индазол и его соль;
3-[2-[4-(3-хлор-2-метилфенил)-1-пиперазинил] пропил] -5,6- метилендиокси-1-(2-пиридилметил)-1H-индазол и его соль;
3-[2-[4-(3-хлор-2-метилфенил)-1-пиперазинил] пропил] -5,6- диметокси-1-(3-пиридилметил)-1H-индазол и его соль;
3-[2-[4-(3-хлор-2-метилфенил)-1-пиперазинил] пропил] -5,6- метилендиокси-1-(3-пиридилметил)-1H-индазол и его соль;
3-[2-[4-(3-хлор-2-метилфенил)-1-пиперазинил] пропил] -5,6- диметокси-1-(4-пиридилметил)-1H-индазол и его соль;
3-[2-[4-(3-хлор-2-метилфенил)-1-пиперазинил] пропил] -5,6- метилендиокси-1-(4-пиридилметил)-1H-индазол и его соль;
3-[2-[4-(3-хлор-6-метоксифенил)-1-пиперазинил] пропил] -5,6- диметокси-1-(3,4-диметоксибензил)-1H-индазол и его соль;
3-[2-[4-(3-хлор-6-метоксифенил)-1-пиперазинил] пропил]-5,6- метилендиокси-1-(3,4-диметоксибензил)-1H-индазол и его соль;
3-[2-[4-(3-трифторметилфенил)-1-пиперазинил] пропил] -5,6- диметокси-1-(3,4-диметоксибензил)-1H-индазол и его соль;
3-[2-[4-(3-трифторметилфенил)-1-пиперазинил] пропил] -5,6- метилендиокси-1-(3,4-диметоксибензил)-1H-индазол и его соль;
5,6-диметокси-2-[[4,5-диметокси-2-[4-(2-метоксифенил)-1- пиперазинил] пропил]фенил]-1-метилиндол или его соль;
5,6-диметокси-2-[[4,5-метилендиокси-2-[4-(2-метоксифенил)-1- пиперазинил]пропил]фенил]-1-метилиндол или его соль;
1-(3-хлор-2-метилфенил)-4-[2-[[4,5-диметокси-2-(3,4- диметоксифенил)]фенил]пропил]пиперазин или его соль и
1-(3-хлор-2-метилфенил)-4-[2-[[4,5-метилендиокси-2-(3,4- диметоксифенил)]фенил]пропил]пиперазин или его соль.
Соединения формулы I согласно изобретению могут быть получены, например, процессами A - E, представленными в конце описания.
Процесс A. Производное карбоновой кислоты II, которое получают согласно известному способу, как описано здесь дальше, и производное пиперазина III конденсируют с получением соединения амида IV. Реакцию конденсации проводят в присутствии конденсирующего агента, такого как дихлоргексилкарбодиимид, карбодиимидазол, пиридил дисульфидтрифенилфосфин и т.д. Амид соединения IV затем восстанавливают с получением соединения I. Реакцию восстановления обычно проводят, используя гидрид металла, такого как литийалюминийгидрид, натрий бис(2-метоксиэтокси)алюминий гидрид, натрий борогидридлитий бромид, боран или боран-тетрагидрофурановый комплекс, в инертном растворителе, таком как эфир (например, диэтиловый эфир, тетрагидрофуран, диоксан или 1,2-диметоксиэтан) или ароматический углеводород (например, бензол), при комнатной температуре или, если необходимо, при температуре от -20oC до точки кипения используемого растворителя.
Процесс B. Карбоновую кислоту II преобразуют в хлорангидрид кислоты V и хлорангидрид кислоты V подвергают взаимодействию с производным пиперазина III с получением амида IV, который затем восстанавливают в соединение I.
Реакцию получения хлорангидрида кислоты V осуществляют с использованием тионилхлорида или оксалилхлорида в присутствии инертного растворителя, такого как галогеналкан (например, дихлорметан или дихлорэтан) или ароматический углеводород, или температуре от -20oC до точки кипения используемого растворителя.
Реакцию между хлорангидридом кислоты V и производным пиперазина III проводят в инертном растворителе, таком как галогеналкан (например, дихлорметан или дихлорэтан), эфир (например, диэтиловый эфир, тетрагидрофуран, диоксан или 1,2-диметоксиэтан), амид (например, ацетамид, диметилформамид или N-метил-2-пирролидон), ацетонитрил или ароматический углеводород, при температуре от -20oC до температуры кипения с обратным холодильником используемого растворителя. Восстановление амида IV проводят по методике процесса A.
Процесс C. Соединение VI, где L представляет удаляемую группу, выбранную из атома галогена и замещенной сульфонильной группы, такой как алкилсульфонильная группа (например, мезилоксигруппа) или арилсульфонильная группа (например, тозилоксигруппа), алкильная или арильная часть которой может быть замещена атомом галогена, алкильной группой и т.д., которое получают согласно известному способу, как описано здесь дальше, подвергают взаимодействию с производным пиперазина III.
Реакцию предпочтительно проводят в присутствии органического или неорганического основания. Подходящие неорганические основания включают карбонат, гидрокарбонат и т.д. щелочного металла, такой как карбонат калия, карбонат натрия, карбонат лития, гидрокарбонат калия, гидрокарбонат натрия или гидрокарбонат лития. Подходящие органические основания включают третичные амины, такие как триалкиламины (например, триэтиламин, трибутиламин и диэтилизопропиламин), ароматические амины, такие как диалкиланилины (например, N, N-диметиланилин и N,N-диэтиланилин), и гетероциклические соединения, такие как насыщенные или ароматические гетероциклические соединения (например, N-алкилпиперазин, N-алкилморфолин, пиридин и 4-диметиламинопиридин).
Вместо основания реакцию можно проводить с использованием избытка производного пиперазина III, например, 2 или более молярных эквивалентов по отношению к соединению IV.
Взаимодействие между соединением IV и производным пиперазина III обычно проводят в инертном растворителе, таком как галогеналкан (например, дихлорметан или дихлорэтан), амид, (например, ацетамид, диметилформамид или N-метил-2-пирролидон), диалкилкетон (например, ацетон или метилэтилкетон), ацетонитрил или ароматический углеводород, при температуре от -20oC до точки кипения используемого растворителя.
Процесс D. Аминопроизводное VII, которое получено известным способом, как описано здесь далее, подвергают взаимодействию с бис(2-хлорэтил)аминопроизводным.
Взаимодействие осуществляют в основной среде, например, в присутствии органического или неорганического основания, как описано в процессе C, или с использованием избытка соединения VII.
Взаимодействие осуществляют в инертном растворителе, предпочтительно в присутствии NaI и т.д., при температуре от -20oC до точки кипения используемого растворителя. Подходящие растворители включают галогеналканы, например дихлорметан и дихлорэтан, амиды, например ацетамид, диметилформамид или N-метил-2-пирролидон, диалкилкетоны, например ацетон или метилэтилкетон, ацетонитрил, ароматические углеводороды, и галогенбензол, например хлорбензол.
Процесс E. Соединение формулы I может быть также синтезировано путем предварительного получения соединения VIII или X с последующим введением желаемого заместителя, как это представлено для G.
Соединение VIII подвергают взаимодействию с G-L, где L представляет удаляемую группу, выбранную из атома галогена или замещенной сульфонильной группы, такой как алкилсульфонильная группа (например, мезилоксигруппа) или арилсульфонильная группа (например, тозилоксигруппа), алкильная или арильная часть которой может быть замещена атомом галогена, алкильной группой и т.д. в присутствии подходящего основания, такого как гидрид натрия, метоксид натрия, карбонат калия, гидроксид натрия, метилат лития, бутиллитий или гидроксид калия, с получением соединения IX.
Реакцию можно проводить в присутствии инертного растворителя, такого как амид (например, ацетамид, диметилформамид или N-метил-2-пирролидон), диалкилкетон (например, ацетон или метилэтилкетон), эфир (например, диэтиловый эфир, тетрагидрофуран, диоксан или 1,2-диметоксиэтан), ацетонитрил или диметилсульфоксид. Температура реакции - от -20oC до температуры кипения с обратным холодильником используемого растворителя.
Когда G является остатком замещенного производного бензола, соединение IX может быть получено по методу M.A.Khan et al., описанному в Chemical аnd Pharmaceutical Bullettin, Vol.25, N 11, pp.3110-3114 (1977). Так, соединение VIII подвергают взаимодействию с галогенированным производным бензола, таким как бромбензол или иодбензол производное, в присутствии подходящего соединения меди, такого как соль меди (например, бромид меди или хлорид меди) или оксид меди. Реакцию проводят в присутствии или в отсутствии карбоната калия, в растворителе или без него, таком как амид (например, ацетамид, диметилформамид или N-метил-2-пирролидон), диметилсульфоксид, гексаметилфосфорамид, пиридин или хинолин, при температуре от комнатной температуры до точки кипения используемого растворителя.
Когда начинают с соединения X, в котором удаляемой группой L является атом галогена (например, бром или иод), замещенная фенильная группа и замещенная фенольная группа может быть введена в качестве G реакцией Ульмана с использованием порошка меди или подходящего соединения меди, такого как соль меди.
Введение ацетиленовой части цепи может быть осуществлено, используя ацетиленид меди, синтезированный по способу J.R.Carson et al., описанному в J. Med. Chem., Vol. 31, pp. 630-636 (1988). Реакцию проводят в растворителе или без него, таком как пиридин, хинолин, диметилформамид, диметилсульфоксид или гексаметилфосфорамид, при температуре от комнатной до температуры кипения с обратным холодильником используемого растворителя.
Когда удаляемой группой L является атом галогена (например, бром, иод или хлор), галогенированное производное бензола подвергают взаимодействию с производным металлического лития, таким как бутиллитий или LDA, в подходящем растворителе, таком как тетрагидрофуран или диэтиловый эфир, при температуре от -100oC до температуры кипения с обратным холодильником используемого растворителя, далее подвергают взаимодействию продукт реакции с производным альдегида G-CHO и последующей обработке, сочетая основные синтезы.
Когда L в соединении X является протоном, введение заместителя ацильного типа проводят в подходящем растворителе, таком как дихлорметан, дихлорэтан или нитробензол, в присутствии кислоты Льюиса, такой как алюминий хлорид, хлорид цинка, хлорид олова или трифторид бора, или протонной кислоты, такой как серная кислота или полифосфорная кислота, при температуре от -20oC до температуры кипения с обратным холодильником используемого растворителя.
Хотя для иллюстрации соединения VIII - XI, представленные выше, относительно процесса E имеют два заместителя (R1 и R2) в имидазольном или фенильном кольце, это не ограничивает число заместителей двумя.
Структурная часть R в соединениях формулы I может быть получена различными способами. Типичные способы будут описаны ниже.
Процесс 1. Соединения I, имеющие имидазольный скелет в R, могут быть синтезированы, как следует далее. 1-Замещенную имидазол-3-карбоновую кислоту синтезируют по способу G. Corsi et al., описанному в Journal of Medicinal Chemistry, Vol. 19, pp. 778-783, 1976. Это соединение, полученное после добавления одного или двух атомов углерода к остатку карбоновой кислоты известными химическими способами, может привести к соединению I любым процессом от A до E или их сочетанием.
3-Хлорметил-1H-имидазол, полученный способом, описанным в Synthetic Communication, Vol. 18, pp. 259-264 (1988), может также привести к соединению I любым из процессов от A до E или их комбинацией.
Производное пиперазина, имеющее имидазольный скелет, также может быть получено способом, описанным в опубликованной рассмотренной заявке Японии JP-B-41-9779. Кроме того, желаемый заместитель G может быть введен согласно процессу E.
Процесс 2. Соединения, имеющие индольный скелет в R, могут быть синтезированы, применяя способ M.E.Speeter et al., описанный в Journal of American Chemical Society, Vol. 76, pp. 6208-6210 (1954), для индольных производных, синтезируемых известным способом, взаимодействием полученного производного индола с оксалилхлоридом и производным пиперазина III в растворителе, таком как диэтиловый эфир или тетрагидрофуран, при температуре от -100oC до температуры кипения растворителя с обратным холодильником, используемого в синтезе дикетонного соединения, и восстановлением дикетонного соединения с использованием литийалюминийгидрида и т.д. в растворителе, таком как диэтиловый эфир или тетрагидрофуран, при температуре от -20oC до температуры кипения используемого растворителя с обратным холодильником.
Полученное производное индола может быть затем подвергнуто процессу E для получения соединения I.
Процесс 3. Соединения, имеющие скелет индолона в R, могут быть синтезированы при применении способа, описанного в рассмотренной опубликованной заявке Японии JP-A-2-73062. Соединения, имеющие алкоксильную группу в 5- или 6-положении скелета индолона, могут быть получены, например, взаимодействием 3,4-диметоксифенилацетонитрила с этиленоксидом в присутствии амида натрия для образования 1-гидрокси- 3-(3,4-диметокси)бутиронитрила, переводом 1-гидрокси-3-(3,4-диметокси)бутиронитрила в кислоту гидролизом и лактонизацией, введением нитрогруппы в лактон с последующим каталитическим гидрированием (в присутствии оксида платины и т.д.) и циклизацией для получения 5,6-диметокси-3-гидрокси-2-оксоиндола и превращением 5,6-диметокси-3-гидрокси-2-оксоиндола в соединение I любым из процессов от A до E или их комбинацией.
Процесс 4. Соединения, имеющие бисарильный скелет в R, могут быть синтезированы применением способа, описанного в Tetrahedron Letters, Vol. 13, pp. 1665-1668 (1990), а именно поперечным связыванием арильной группы, имеющей радикал алкилборной кислоты, с использованием палладиевого катализатора.
Затем ортометоксифенилоксазолиновое производное, описанное в Journal of Organic Chemistry, Vol. 34, pp. 1372-1379 (1978), подвергают взаимодействию с арильным реактивом Гриньяра для синтеза бисарильного производного, которое далее обрабатывают комбинацией известных химических приемов.
Процесс 5. Из соединений, имеющих структуру части R, показанную для соединения X, те, которые имеют деоксибензойный тип заместителя в виде Z, могут быть синтезированы введением диоксибензойного типа заместителя в этилфенилацетатное производное в присутствии кислоты Льюиса, такой как хлорид алюминия, в присутствии или в отсутствии растворителя, такого как дихлорметан или дихлорэтан, реакцией Фриделя-Крафтса и, если необходимо, защитой карбоксильной группы, переводя полученное соединение в соединение I комбинацией известных химических методов и любым из процессов от A и E.
При получении соединения формулы I, где исходное соединение содержит карбоксильную группу, аминогруппу, NH-группу, гидроксильную группу, тиольную группу или подобный функциональный заместитель, рекомендуется в некоторых случаях предварительно защитить функциональную группу подходящей защитной группой, после завершения необходимой(ых) реакции(ий) защитную группу удалить. Указанные функциональные группы не нуждаются в защите до тех пор, пока они неактивны в реакции.
Производные пиперазина формулы I, синтезированные таким образом, и их соли и/или гидраты обладают замечательной ингибирующей кальмодулин активностью. Производные пиперазина I проявляют свое действие при оральном или неоральном применении, поэтому они могут быть назначены оральным или неоральными путями.
Дозу соединения определяют как подходящую в соответствии с симптомами, возрастом и весом тела пациента. Оральная доза колеблется от 1 до 1000 мг, предпочтительно от 10 до 500 мг, в день для взрослого в единичной или разбитой на несколько приемов дозе. Оральные дозировочные формы включают таблетки, капсулы, порошки и гранулы. Эти дозировочные формы получают с использованием обычных добавок, таких как растворители, смазывающие и связующие вещества, обычными методиками. Для неорального назначения используются подкожная инъекция, внутривенная инъекция или внутривенное вливание при общей дозе, колеблющейся от 1 до 2000 мг, предпочтительно от 10 до 500 мг в день для взрослого.
При комбинации с другими лекарственными препаратами у производного пиперазина формулы I ожидается проявление дополнительного эффекта или синергического эффекта по профилактике или лечению различных заболеваний. Подходящие лекарственные препараты, с которыми соединение по настоящему изобретению может быть скомбинировано, включают лекарственные препараты для улучшения церебрального кровообращения (например, Синепразид малеат), препараты для улучшения церебрального метаболизма (например, Идебенон, Инделоксазин), психотропные препараты (например, Тимиперон, Имипрамин и Диазепам), внутричерепные антигипертензивные агенты (например, Глицерол), антигипертензивные агенты, вазодилаторы (например, Трапидил), антипиретики, аналгетики, противовоспалительные агенты, противотромбоцитные препараты (например, Тиклопидин), антикоагулянты (например, Гепарин), препараты для стимулирования фибринолиза (например, активатор тканевого плазминогена), диуретики, антигиперлипемические агенты (например, Пробукол), лечебные агенты для язв органов пищеварения, заменителей крови и агенты против злокачественных опухолей.
Соединения изобретения и их фармакологически приемлемые соли обладают значительной ингибирующей кальмодулин активностью и также замечательной антигипоксической активностью. Дополнительно, соединения показывают замечательное действие на моделях различных заболеваний при уровнях доз, вызывающих незначительное центральное ингибирующее действие при оральном или неоральном назначении (например, ингибирующее действие в отношении замедленного отмирания нейронов гиппокампуса и противоотечное действие).
Таким образом, соединения по изобретению и их фармакологически приемлемые соли высокополезны в качестве лекарственных препаратов для ингибирования внутриклеточных кальциевых физиологических активностей, в которых принимает участие кальмодулин. Таким образом, они используются в качестве профилактического и лечебного агента при различных заболеваниях, вызванных избыточной активацией кальмодулина, особенно гипертонии, ишемических заболеваниях мозга, сердца, почек и т.д. (например, церебральный инфаркт, церебральная эмболия, скоротечный церебральный ишемический приступ, церебральный тромбоз, кардио инфаркт, легочная ангина, сердечная недостаточность, острая почечная недостаточность и нефриты), заболевании в области мозга (например, болезнь Альцгеймера, болезнь Паркинсона и слабоумие по Бинсвангеру), химическом отравлении, газовом отравлении, травматических церебральных заболеваниях и симптомах, основанных на этих заболеваниях (например, уменьшение спонтанности, депрессии и расстройства памяти).
Изобретение будет проиллюстрировано более детально с отсылками к ссылочным примерам, примерам и примерам испытаний, но изобретение не может рассматриваться, как ограниченное ими. В примерах все отношения смесей в смешанных растворителях, таких как растворитель для проявления при хроматографии, даны по объему, если не указано противного.
Испытательный пример 1. Ингибирующая кальмодулин (CaM) активность.
Ингибирующую кальмодулин активность соединения оценивают, используя его действие по ингибированию кальмодулинзависящей циклической нуклеотидной фосфодиэстеразы (PDE) в качестве показателя. Испытание PDE ингибирующей активности проводят методом, описанным Thompson (Advances in Cyclic Nucleotide Research, 10, 69, 1979) с модификацией. Первую стадию инкубации проводят при 30oC в течение 10 мин со следующей реакционной смесью: 50 мМ трис-HCl буфера (pH 7,5), 5 мМ MgCl2, 1 мг/мл сыворотки бычьего альбумина, CaM из бычьего мозга [3H] -cGMP, 1 мМ CaCl2 или 1 мМ EGTA, PDE из бычьего мозга и испытуемое соединение в общем объеме 0,5 мл. После инкубации смесь нагревают на кипящей водяной бане 1 мин. Затем к реакционной смеси добавляют 50 мкл змеиного яда (1 мг/мл) и всю смесь инкубируют при 30oC в течение 10 мин. После инкубации к смеси добавляют 0,5 мл смолы AGI-X2 (суспензия в воде 1:1) и центрифугируют при 3000 оборотах/минуту в течение 20 мин. Радиоактивность поверхностного раствора измеряют жидким сцинцилляционным счетчиком. Значение IC50 определяют в виде концентрации, показывающей 50%-ное ингибирование PDE активности потенциированной CaM. Полученные результаты показаны в табл.1.
Испытательный пример 2. Активность на модели азот-индуцированной гипоксии у мышей.
Каждой мыши в группе из девяти-десяти мышей дают орально 30 мг испытуемого соединения. Через 60 мин после введения каждую мышь помещают в 500 мл по объему прозрачный контейнер, имеющий выходную дыру, и вводят газообразный азот в контейнер со скоростью 5000 мл/мин. Измеряют время от начала ввода азота до остановки дыхания и получают скорость увеличения времени по сравнению с контрольной группой (100%). Полученные результаты показаны в табл.2.
Пример 1. 5,6-Диметокси-1-(3,4-диметоксифенил)-3-[2-[4-[2- метоксифенил] -1-пиперазинил]этил]индол.
Раствор 1,0 г 5,6-диметоксииндола в 120 мл безводного этилового эфира добавляют по каплям к 0,49 мл оксалилхлорида при 0oC с последующим перемешиванием 20 мин. К смеси добавляют 1,08 г 2-метоксифенилпиперазина и смесь затем перемешивают при этой температуре 30 мин. После завершения реакции добавляют воду и смесь экстрагируют этилацетатом. Экстракт высушивают над безводным сульфатом натрия и растворитель упаривают с получением 1,5 г сырого кристаллического амидосоединения.
Кристаллы высушивают и затем добавляют к суспензии 260 мг литийалюминийгидрида в 50 мл тетрагидрофурана при нагревании с обратным холодильником. После завершения реакции к реакционной смеси последовательно добавляют 0,26 мл воды, 0,26 мл 10%-ного водного раствора гидроксида натрия и 0,78 мл воды. Нерастворимый материал удаляют фильтрацией, используя Целит, и высушивают над безводным сульфатом натрия. Растворитель упаривают и остаток очищают колоночной хроматографией на силикагеле. Из элюированной этилацетатом фракции выделяют 820 мг производного пиперазина.
Полученное производное пиперазина (820 мг) добавляют к суспензии 124 мг 60%-ного гидрида натрия в диметилформамиде. После перемешивания при комнатной температуре в течение 30 минут добавляют 960 мг 3,4-диметоксибензилхлорида с последующим перемешиванием при комнатной температуре в течение 1 ч. После реакции к реакционной смеси добавляют воду с последующей экстракцией этилацетатом. Экстракт промывают последовательно водой и насыщенным водным раствором хлорида натрия, высушивают над безводным сульфатом натрия и растворитель упаривают. Остаток очищают колоночной хроматографией на силикагеле. Из элюированной этилацетатом фракции получают 600 мг указанного в заголовке соединения в виде желтого маслянистого вещества.
ИК (KBr) νmax (см-1): 1503, 1464, 1242, 1137, 1026.
1H-ЯМР (CDCl3) δ м.д.: 2,7-3,0 (6H, м), 3,9-3,3 (4H, м), 3,78 (3H, с), 3,84 (3H, с), 3,86 (3H, с), 3,93 (3H, с), 3,7-4,0 (2H, м), 5,14 (2H, с), 6,6-7,1 (10H, м).
Ссылочный пример 1. 4,5-Диметокси-2-амино-α-хлорацетофенон.
В 40 мл 1,1,2,2-тетрахлорэтана растворяют 4,0 г 3,4-диметоксианалина и к раствору добавляют 28 ммоль трихлорида бора в атмосфере аргона при охлаждении льдом. К реакционной смеси добавляют затем 2,3 г хлорацетонитрила с последующим нагреванием с обратным холодильником в течение 1,5 ч.
После охлаждения к реакционной смеси добавляют 20 мл 2 н. соляной кислоты. После перемешивания при 80oC в течение 30 мин всплывший сироп удаляют декантацией. Остаток экстрагируют дихлорметаном. Остаток собирают, нейтрализуют водным раствором гидроксида натрия, фильтруют с использованием Целита и опять экстрагируют дихлорметаном. Органический слой высушивают над безводным сульфатом натрия и растворитель упаривают. Остаток очищают колоночной хроматографией на силикагеле (гексан:этилацетат 3:1) с получением 809 мг указанного в заголовке соединения.
1H-ЯМР (CDCl3) δ м.д.: 3,82 (3H, с), 3,87 (3H, с), 4,70 (2H, с), 6,12 (1H, с), 7,03 (1H, с).
Пример 2. 5,6-Диметокси-3-[[4-[2-метоксифенил]-1-пиперазинил]метил]-1H-индазол.
В 20 мл концентрированной соляной кислоты растворяют 800 мг 4,5-диметокси-2-амино-α-хлорацетофенона и туда добавляют раствор 264 мг (3,8 ммоль) нитрата натрия в 4,0 мл воды при -10oC с последующим перемешиванием в течение 1 ч. Затем добавляют три эквивалента хлорида олова и 110 мл концентрированной соляной кислоты с последующим перемешиванием в течение 1 ч. Образующийся при этом осадок собирают фильтрацией, промывают один раз водой и высушивают на воздухе. Твердый продукт растворяют в диметилсульфоксиде и к раствору добавляют 700 мг N-(2-метоксифенил)пиперазина и 3,0 г карбоната калия. Спустя 3 мин добавляют этилацетат и раствор три раза промывают водой и один раз насыщенным водным раствором хлорида натрия. Органический слой высушивают и растворитель упаривают. Очистка остатка колоночной хроматографией (этилацетат:этанол 6:1) на силикагеле дает 594 мг указанного в заголовке соединения.
Точка плавления: 192oC.
ИК (KBr) νmax (см-1): 3376, 1503, 1488, 1317, 1242, 1209.
1H-ЯМР (CDCl3) δ м.д.: 2,6-2,8 (4H, м), 2,9-3,2 (5H, м), 3,84 (3H, м), 3,93 (6H, шир.с.), 6,8-7,0 (5H, м), 7,26 (1H, с).
Пример 3. 5,6-Диметокси-1-(3,4-диметоксифенил)метил-3-[[4-[2- метоксифенил]-1-пиперазинил]метил]-1H-индазол.
В диметилформамиде суспендируют 61,6 мг гидрида натрия при 0oC и туда добавляют 590 мг 5,6-диметокси-3-[[4-[2-метоксифенил]-1-пиперазинил]-метил] -1H- индазола с последующим перемешиванием в течение 30 мин. К смеси добавляют 290 мг 3,4-диметоксифенилхлорида. После 1,5 ч к реакционной смеси добавляют 2,0 мл воды с последующим упариванием растворителя.
Остаток очищают колоночной хроматографией на силикагеле (хлороформ: этанол 20:1) и перекристаллизовывают из этанола с получением 654 мг указанного в заголовке соединения.
Точка плавления: 149 - 150oC.
ИК (см-1): 1506, 1473, 1257, 1158, 1140, 1029.
1H-ЯМР (CDCl3) δ м.д.: 7,26 (с, 1H), 7,0-6,5 (м, 8H), 5,45 (с, 2H), 3,95 (с, 2H), 3,92 (с, 3H), 3,86 (с, 3H), 3,84 (с, 6H), 3,76 (с, 3H), 3,2-3,0 (м, 4H), 2,8-2,6 (м, 4H).
Ссылочный пример 2. N-(3,4-Диметоксифенетил)-2-(4,5- диметоксифенетил)ацетамид.
Сухой дихлорметановый раствор (1000 мл) 3,4-диметоксифенилацетилхлорида, приготовленный из 325 г 3,4-диметоксифенилуксусной кислоты и 300 мл тионилхлорида, медленно добавляют к двухфазному раствору, содержащему 300 г 3,4-диметоксифенетиламина, 850 мл 2 н. гидроксида натрия и 2000 мл дихлорметана при перемешивании при охлаждении льдом. К смеси добавляют хлороформ для растворения выпавшего осадка. Водный слой удаляют и органический слой промывают насыщенным водным раствором гидрокарбоната натрия, высушивают и растворитель упаривают. К остатку добавляют метанол и дают остыть, и образованный таким образом осадок собирают фильтрацией с получением 570 г указанного в заголовке соединения.
Ссылочный пример 3. 1-(3,4-Диметоксибензил)-3,4-дигидро-6,7-диметоксиизохинолин гидрохлорид.
Раствор 570 г N-(3,4-диметоксифенетил)-2-(4,5-диметоксифенил)ацетамида и 500 мл оксихлорида фосфора в 3500 мл ацетонитрила нагревают с обратным холодильником в течение 0,5 ч. Раствор упаривают и к остатку добавляют этанол, после чего дают стоять. Выделенные таким образом кристаллы собирают фильтрацией с получением 590 г указанного в заголовке соединения.
1H-ЯМР (d6-DMSO) δ: 7,63 (с, 1H), 7,26 (с, 1H), 7,11 (с, 1H), 7,0-6,8 (м, 2H), 4,58 (с, 2H), 3,88 (с, 3H), 3,83 (с, 3H), 3,74 (с, 3H), 3,70 (с, 3H), 4,0-3,8 (м, 2H), 3,1-2,9 (широк. Т., J = 7 Гц, 2H).
Ссылочный пример 4. Транс-2-ацетил-7,7-диметокси-1-(4,5-диметоксибензилиден)- 1,2,3,4-тетрагидроизохинолин.
К 600 г 1-(4,5-диметоксибензил)-3,4-дигидоро-6,7- диметоксиизохинолин гидрохлорида добавляют 2000 мл уксусного ангидрида и смесь кипятят с обратным холодильником 6 ч, и затем позволяют остыть в течение ночи. Выделившийся таким образом кристаллический осадок собирают фильтрацией и перекристаллизовывают из этанола с получением 500 г указанного в заголовке соединения.
ИК (см-1): 1632, 1518, 1263, 1245.
1H-ЯМР (CDCl3) δ м.д.: 7,13 (с, 1H), 7,05 (с, 1H), 6,90 (с, 1H), 6,71 (с, 1H), 6,62 (с, 1H), 5,05 (д, J=9 Гц, 1H), 3,97 (с, 3H), 3,89 (с, 9H), 3,8-2,5 (м, 4H), 1,81 (с, 3H).
Ссылочный пример 5. 2-(2-Ацетамидоэтил)-4,4',5,5'- тетраметоксидеоксибензоин.
К 500 г транс-2-ацетил-7,7-диметокси-1-(4,5-диметоксибензилиден) -1,2,3,4-тетрагидроизохинолина добавляют 1000 мл 10%-ной соляной кислоты и 500 мл метанола и смесь кипятят с обратным холодильником. Реакционную смесь выливают в водный раствор карбоната натрия и экстрагируют метиленхлоридом. Растворитель удаляют из экстракта при пониженном давлении. Перекристаллизация осадка из этанола дает 270 г указанного в заголовке соединения.
ИК (см-1): 1680, 1638, 1515, 1128.
1H-ЯМР (CDCl3) δ м.д.: 7,26 (с, 1H), 6,9-6,75 (м, 4H), 6,7-6,5 (шир., 1H), 4,15 (с, 2H), 3,91 (с, 3H), 3,89 (с, 3H), 3,86 (с, 3H), 3,85 (с, 3H), 3,6-3,4 (м, 2H), 2,92 (т, J = 7,2 Гц, 2H), 1,89 (с, 3H).
Ссылочный пример 6. 2-(2-Ацетамидоэтил)-2'-нитро-4,4',5,5'- тетраметоксидеоксибензоин.
К раствору 200 г 2-(2-ацетамидоэтил)-4,4',5,5'- тетраметоксидеоксибензоина в 2000 мл уксусной кислоты медленно добавляют 60 мл 70%-ной азотной кислоты при 0oC. Немедленно после добавления смесь выливают в воду и экстрагируют метиленхлоридом. Экстракт нейтрализуют водным раствором гидрокарбоната натрия и промывают насыщенным водным раствором хлорида натрия. Растворитель удаляют при пониженном давлении и остаток перекристаллизовывают из этанола с получением 196 г указанного в заголовке соединения.
Точка плавления: 142-144oC.
ИК (см-1): 1524, 1272, 1128.
1H-ЯМР (CDCl3) δ м.д.: 7,79 (с, 1H), 7,36 (с, 1H), 6,80 (с, 1H), 6,76 (с, 1H), 6,4 (шир., 1H), 4,60 (с, 2H), 4,0 (шир., 12H), 3,45 (к, J = 7,2 Гц, 2H), 2,94 (т, J = 7,2 Гц, 2H), 1,85 (с, 3H).
Ссылочный пример 7. 2-[2-(2-Ацетамидоэтил)-4,5-диметоксифенил]-5,6-диметоксииндол.
К раствору в 80%-ной уксусной кислоте 4,60 г 2-(2-ацетамидоэтил)-2'-нитро-4,4', 5,5'-тетраметоксидеоксибензоина медленно добавляют 4,7 г цинка при 85oC. Реакционную смесь фильтруют, промывают этанолом и растворитель упаривают. К остатку добавляют водный раствор гидроксида аммония и смесь экстрагируют этилацетатом. Растворитель упаривают и остаток очищают колоночной хроматографией на силикагеле (этилацетат) с получением 1,84 г указанного в заготовке соединения.
1H-ЯМР (CDCl3) δ м.д.: 8,10 (с, 2H), 8,08 (с, 1H), 8,06 (с, 1H), 7,72 (с, 1H), 7,44 (с, 1H), 6,80 (шир., 1H), 3,92 (с, 6H), 3,88 (с, 6H), 3,5-3,3 (м, 2H), 3,0-2,8 (м, 2H), 1,92 (с, 3H).
Ссылочный пример 8. 2-[2-(2-Ацетамидоэтил)-4,5-диметоксифенил]-5,6-диметокси-1-метилиндол.
В диметилсульфоксиде медленно суспендируют 480 мг 35%-ного гидрида калия и к суспензии добавляют 1,37 г 2-[2-(2-ацетамидоэтил)-4,5-диметоксифенил]-5,6-диметоксииндола с последующим перемешиванием в течение 10 мин. К смеси затем добавляют 700 мг диметилсульфата с последующим перемешиванием в течение 30 мин. Реакционную смесь выливают в воду и экстрагируют метиленхлоридом. Экстракт последовательно промывают водой и насыщенным водным раствором хлорида натрия и растворитель удаляют при пониженном давлении. Перекристаллизация осадка из этанола дает 1,20 г указанного в заголовке соединения.
ИК (см-1): 3376, 1168, 1486, 1222.
1H-ЯМР (CDCl3) δ м.д.: 7,11 (с, 1H), 6,87 (с, 2H), 6,81 (с, 1H), 6,34 (с, 1H), 5,5 (шир., 1H), 3,97 (с, 3H), 3,93 (с, 6H), 3,84 (с, 3H), 3,48 (с, 3H), 3,4-3,0 (м, 2H), 2,65 (т, J = 7,2 Гц, 2H), 1,84 (с, 3H).
Ссылочный пример 9. 2-[2-(2-Аминоэтил)-4,5-диметоксифенил]-5,6-диметокси-1-метилиндол гидрохлорид.
Раствор 53 г 2-[2-(2-ацетамидоэтил)-4,5 диметоксифенил]-5,6-диметокси-1-метилиндола в 2 н. соляной кислоте кипятят с обратным холодильником 17 ч. Реакционную смесь подвергают азеотропной перегоне при пониженном давлении с этанолом и бензолом и осадок перекристаллизовывают из этанола с получением 48 г указанного в заголовке соединения.
ИК (см-1): 3272, 2832, 1504, 1454, 1244, 1010.
1H-ЯМР (CDCl3) δ м. д. : 6,98 (шир., 3H), 7,06 (с, 1H), 7,00 (с, 1H), 6,9-6,7 (м, 2H), 6,35 (с, 1H), 3,94 (с, 3H), 3,90 (с, 3H), 3,87 (с, 3H), 3,80 (с, 3H), 3,45 (с, 3H), 3,0-2,7 (шир., 4H).
Пример 4. 5,6-Диметокси-2-[[4,5-диметокси-2-[4-(2-метоксифенил)-1-пиперазинил]этил]фенил]-1-метилиндол.
Раствор 47 г гидрохлорида 2-[2-(2-аминоэтил)-4,5-диметоксифенил]-5,6-диметокси-1-метилиндола, 30,7 г о-бис(2-хлорэтил)аминоанизола, 37,2 г иодида натрия и 34,0 г карбоната калия в 200 мл диметилформамида нагревают при 80oC 1 ч. К раствору добавляют 17 г карбоната калия, 3 ч спустя, добавляют еще 17 г карбоната калия с последующим нагреванием в течение 15 ч. Растворитель удаляют при пониженном давлении и остаток растворяют в воде и экстрагируют метиленхлоридом. Экстракт очищают колоночной хроматографией на силикагеле (этилацетат) и перекристаллизовывают из этанола с получением 32 г (51%) указанного в заголовке соединения.
Точка плавления: 171 - 173oC.
ИК (см-1): 1500, 1486, 1236, 1212.
1H-ЯМР (CDCl3) δ м.д.: 7,10 (с, 1H), 7,0-6,8 (м, 7H), 3,98 (с, 3H), 3,94 (с, 3H), 3,84 (с, 3H), 3,82 (с, 3H), 2,94 (с, 3H), 3,1-2,9 (м, 4H), 2,8-2,4 (м, 8H).
Ссылочный пример 10. 4,5-Диметокси-2-(1-пирролил)бензолметанол.
В 100 мл тетрагидрофурана растворяют 14,5 г метил 4,5-диметокси-2-(1-пирролил)бензоилкарбоксилата и туда по каплям добавляют 24,5 мл (3,4 М) натрия бис(2- метоксиэтокси)алюминий гидрида при перемешивании с охлаждением льдом. После добавления смесь подогревают до комнатной температуры и нагревают в течение 6 ч. После завершения реакции 0,63 мл насыщенного водного раствора гидрокарбоната натрия и 1,55 мл воды добавляют в указанном порядке и осадок удаляют фильтрацией. Фильтрат упаривают и остаток подвергают хроматографии на колонке на силикагеле. Из фракции, элюированной хлороформом, выделяют 10,3 г коричневой маслянистой субстанции. Перекристаллизация из этилового эфира дает указанное в заголовке соединение в виде бесцветных кристаллов.
Точка плавления: 92 - 93oC.
ИК (см-1): 3530, 2960, 2930, 1610, 1520 (KBr).
1H-ЯМР (CDCl3) δ м.д.: 3,86 (3H, с), 3,95 (3H, с), 4,45 (2H, д, J = 5,3 Гц), 6,30 (2H, т, J = 2,1 Гц), 6,84 (2H, т, J = 2,1 Гц), 7,04 (1H, с).
Ссылочный пример 11. Диэтил-[2-[4,5-диметокси-2-(1-пирролил)фенил]этил] малонат.
В 15 мл этилового эфира растворяют 3,0 г 4,5-диметокси-2-(1-пирролил)бензолметанола и туда добавляют 15 мл концентрированной соляной кислоты с последующим перемешиванием при комнатной температуре в течение 1 ч. К реакционной смеси добавляют 50 мл воды и смесь нейтрализуют насыщенным водным раствором карбоната натрия и экстрагируют хлороформом. Экстракт высушивают над безводным сульфатом натрия и растворитель удаляют при пониженном давлении с получением коричневой маслянистой субстанции. Отдельно растворяют 460 мг металлического натрия в 25 мл этанола и туда добавляют 6,18 г этилмалоната для приготовления раствора. К этому раствору добавляют раствор в тетрагидрофуране (25 мл) вышеприготовленного коричневого маслянистого вещества. После перемешивания при комнатной температуре в течение 3 ч растворитель удаляют при пониженном давлении. К остатку добавляют воду и смесь подкисляют концентрированной соляной кислотой и затем экстрагируют хлороформом. Органический слой высушивают над безводным сульфатом натрия и растворитель удаляют при пониженном давлении. Очистка осадка хроматографией на колонке с силикагелем (хлороформ) дает 3,10 г указанного в заголовке соединения в виде коричневого маслянистого продукта.
1H-ЯМР (CDCl3) δ м. д. : 1,16 (6H, т, J = 7,0 Гц), 3,00-3,25 (2H, м), 3,70-3,90 (1H, м), 3,83, 3,88 (3H, с), 4,08 (4H, к, J = 7,0 Гц), 6,30 (2H, т, J = 2,0 Гц), 6,77 (2H, с).
Ссылочный пример 12. Этил-3-(4,5-диметокси-2-(1-пирролил)фенил)пропионат.
В 50 мл этанола растворяют 3,1 г диэтил [2-[4,5-диметокси-2-(1-пирролил)фенил] этил] малоната и к раствору добавляют 5,0 мл 35%-ного гидроксида натрия с последующим нагреванием с обратным холодильником в течение 3 ч. Растворитель удаляют при пониженном давлении и к остатку добавляют воду. Осадок подкисляют концентрированной соляной кислотой и экстрагируют хлороформом. Экстракт высушивают над безводным сульфатом натрия и растворитель удаляют при пониженном давлении с получением бледно-коричневого порошка. Порошок нагревают при 150oC в течение 10 мин, дают остыть и очищают колоночной хроматографией на силикагеле (хлороформ-метанол) с получением 2,1 г бледно-коричневого порошка. Перекристаллизация из смеси хлороформ-этиловый эфир дает указанное в заголовке соединение в виде бесцветных кристаллов.
Точка плавления: 170 - 173oC.
1H-ЯМР (CDCl3) δ м.д.: 2,83 (2H, т, J = 7,8 Гц), 2,77 (2H, т, J = 7,8 Гц), 3,84, 3,90 (3H, с), 6,30, 6,74 (2H, т, J = 2,0 Гц), 6,78 (2H, с).
Пример 5. 1-(3-(4,5-диметокси-2-(1-пирролил)фенил)-1-оксопропил)- 4-(2-метоксифенил)пиперазин.
В 20 мл тетрагидрофурана растворяют 1,20 г N,N-карбонилдиимидазола и раствор 2,0 г этил 3-(4,5-диметокси-2-(1-пирролил)фенил)пропионата в 40 мл тетрагидрофурана добавляют к раствору при комнатной температуре при перемешивании. Перемешивание продолжают дополнительно 1 ч и добавляют 2,98 г 1-(2-метоксифенил)пиперазина с последующим перемешиванием при 40-60oC в течение 6 ч. Растворитель удаляют при пониженном давлении и остаток очищают колоночной хроматографией на силикагеле (хлороформ-метанол) с получением 1,9 г бесцветного маслянистого вещества. Перекристаллизация из этанола дает указанное в заголовке соединение в виде кристаллов.
Точка плавления: 141 - 142oC.
ИК (KBr, см-1): 2940, 2840, 1630, 1590, 1520.
1H-ЯМР (CDCl3) δ м.д.: 1,15-1,45 (2H, м), 2,70-3,15 (6H, м), 3,15-3,90 (4H, м), 3,83, 3,84, 3,91 (кажд. 3H, с), 6,27 (2H, т, J = 2,2 Гц), 6,60-7,05 (8H, м).
Элементный анализ для C26H31N3O4:
Рассчитано, %: C 69,47; H 6,95; N 9,35;
Найдено, %: C 69,37; H 6,88; N 9,14.
Пример 6. 1-(3-(4,5-диметокси-2-(1-пирролил)фенил)пропил)- 4-(2-метоксифенил)пиперазин дигидрохлорид гемигидрат.
К 100 мл тетрагидрофурана добавляют 18 мл 1,0 М комплекса боран-тетрагидрофурана и 1,14 г 1-(3-(4,5-диметокси-2-(1-пирролил)фенил- 1-оксопропил)-4-(2-метоксифенил)пиперазина при комнатной температуре и смесь нагревают с обратным холодильником в течение 27 ч. Так как обнаружено, что реакция проходит не полностью, далее добавляют 10 мл боран-тетрагидрофуранового комплекса и кипячение с обратным холодильником продолжают дополнительно 9 ч. После охлаждения до комнатной температуры к реакционной смеси добавляют 10 мл воды и растворитель удаляют при пониженном давлении. К остатку добавляют 35 мл 5%-ной соляной кислоты с последующим нагреванием от 50 до 60oC в течение 2 ч. Реакционную смесь высушивают над безводным сульфатом натрия и растворитель упаривают. Остаток очищают колоночной хроматографией на силикагеле (хлороформ) с выходом 780 мг бледно-желтого маслянистого вещества, которое растворяют в 15 мл этанола, добавляют 1,0 мл концентрированной соляной кислоты и растворитель удаляют при пониженном давлении. Перекристаллизация осадка из этанолэтилового эфира дает 500 г указанного в заголовке соединения в виде бесцветных призматических кристаллов.
Точка плавления: 210 - 212oC.
ИК (KBr, см-1): 2950, 2750-2000, 1600, 1510.
1H-ЯМР (CDCl3) δ м.д.: 1,65-2,10 (2H, м), 2,50-3,15 (4H, м), 3,15-3,8 (4H, м), 3,86, 3,94, 4,08 (3H, с), 4,00-4,60 (2H, м), 4,90-5,40 (2H, м), 6,28 (2H, т, J = 2,0 Гц), 6,78 (4H, с), 7,00-7,80 (3H, м), 8,25 (1H, д, J = 7,8 Гц).
Элементный анализ для C26H33N3O3• 2HCl•1/2H2O:
Рассчитано, %: C 60,35; H 7,01; N 8,12;
Найдено, %: C 60,61; H 6,95; N 8,02.
Ссылочный пример 13. м-Меконин.
Смесь 250 г вератровой кислоты, 275 мл формальдегида (40%) и 1000 мл концентрированной соляной кислоты нагревают при 60 - 70oC в течение 12 ч при перемешивании. К реакционной смеси добавляют равный объем ледяной воды и смесь энергично перемешивают на ледяной бане. Нерастворимый материал удаляют фильтрацией и фильтрату дают стоять при от 5oC до комнатной температуры в течение 24 ч, в течение которых осаждаются сырые кристаллы, которые собирают фильтрованием, промывают водным раствором сульфата натрия и перекристаллизовывают из этанола с получением 50 г м-меконина.
Точка плавления: 155oC.
1H-ЯМР (CDCl3) δ м. д.: 3,98, 3,94 (каждый 3H, с), 6,90, 7,31 (каждый 1H), 5,23 (2H).
Ссылочный пример 14. м-Гемипиниковая кислота.
Смесь 7,8 г м-меконина, 80 мл воды и 1 н. гидроксида натрия перемешивают при 50-70oC в течение около 1 ч на водяной бане для гидролиза. После охлаждения на водяной бане добавляют 3,36 г гидрокарбоната натрия и затем через 5 мин добавляют 160 мл 1/3 М перманганата калия. Спустя 10 мин ледяную баню отставляют. Через 30 мин спадает выделение тепла, и реакция завершается. Реакционную смесь отфильтровывают, фильтрат подкисляют концентрированной соляной кислотой и после концентрирования при пониженном давлении получают 5,3 г м-гемипиниковой кислоты, имеющей точку плавления 180oC.
Ссылочный пример 15. м-Гемипиниковый ангидрид.
Два грамма м-гемипиниковой кислоты дегидратируют и сублимируют при 180-200oC в сублимационно очищающей установке с получением 1,6 г м-гемипиникового ангидрида, имеющего точку плавления 174 - 176oC.
ИК (KBr, см-1): 1764.
Пример 7. 5,6-Диметокси-1,3-диоксо-N-2-(4-(2-метоксифенил)-1-пиперазанил)этилизоиндол.
Смесь 1-(2-амино)этил-4-(2-метоксифенил)пиперазина (640 мг) и 723 мг м-гемипиникового ангидрида в 10 мл толуола после выдерживания при комнатной температуре кипятят с обратным холодильником в течение 5 ч, во время чего осаждаются кристаллы, которые собирают фильтрованием. Маточный раствор очищают колоночной хроматографией на силикагеле и перекристаллизовывают из толуола с получением бесцветных кристаллов. Общий выход 700 мг.
Точка плавления: 206oC.
1H-ЯМР (CDCl3) δ м.д.: 4,00 (6H, с), 3,85 (3H, с), 7,31 (2H, с), 6,8-7,0 (4H, м).
Получают гидрохлорид соединения.
Точка плавления: 237 - 242oC.
Элементный анализ для C23H27N3O5• 2HCl•1/2H2O:
Рассчитано, %: C 54,44; H 5,98; N 8,28;
Найдено, %: C 54,83; H 5,94; N 8,64.
Пример 8. 5,6-Диметокси-1-оксо-N-2-(4-(2-метоксифенил)- 1-пиперазанил)этилизоиндол.
5,6-Диметокси-1,3-диокси-N-2-(4-(2-метоксифенил)- 1-пиперазанил)этилизоиндол (900 кг) кипятят с обратным холодильником в 34 мл уксусной кислоты в присутствии 1,8 г цинка в течение 200 мин. Реакционную смесь фильтруют, концентрируют при пониженном давлении и очищают колоночной хроматографией на силикагеле (дихлорметан : метанол 30:1) с получением 600 мг аморфного соединения. Полученное соединение растворяют в небольшом количестве этанола и добавляют избыток 3%-ного хлористого водорода в этаноле с получением гидрохлорида указанного в заголовке соединения.
Точка плавления: 267 - 269oC.
Элементный анализ для C23H29N3O4• 2HCl•H2O:
Рассчитано, %: C 54,98; H 6,62; N 8,36;
Найдено, %: C 54,48; H 6,78; N 8,18.
Ссылочный пример 16. 5,6-Диметокси-3-бензилиденфталид.
В 25 мл-овую колбу помещают 4,0 г м-гемипиникового ангидрида, 4,54 г гомовератровой кислоты и ацетат натрия и колбу прогревают на песочной бане при 235-240oC, оставляют смесь взаимодействовать в течение 6 ч. Реакционную смесь очищают колоночной хроматографией на силикагеле (дихлорметан) с получением указанного в заголовке соединения в виде бесцветного аморфного соединения.
1H-ЯМР (CDCl3) δ м.д.: 3,9 - 4,0 (каждый 3H x 4), 6,24 (н, с), 6,89 (1H, д, J = 9,0 Гц), 7,09, 7,29 (1H x 2, c x 2), 7,32 (1H, дд, J = 1,8, 9,0 Гц), 7,50 (1H, д, J = 1,8 Гц).
Ссылочный пример 17. 4,5-Диметокси-2-(3,4-диметоксифенил)ацетил- N-2-(4-(2-метоксифенил)-1-пиперазанил)этилбензамид.
Смесь 5,6-диметокси-3-бензилиденфталида (3,0 г) и 3,0 г 1-(2-амино)этил-4-(2-метоксифенил)пиперазина в этанолтолуоле (1:1) кипятят с обратным холодильником 5 ч. После завершения реакции растворитель концентрируют и остаток очищают колоночной хроматографией на силикагеле (дихлорметан : метанол 40:1) с получением 5,2 г в виде бесцветного аморфного соединения.
Пример 9. 5,6-Диметокси-1-(3,4-диметокси)бензилиден-3-оксо-2-(4-(2-метоксифенил)-1-пиперазанил)этилизоиндол дигидрохлорид секвигидрат.
Смесь 1,06 г 4,5-диметокси-2-(3,4-диметоксифенил)ацетил-N-2- (4-(2-метоксифенил)-1-пиперазанил)этилбензамида в уксусном ангидриде кипятят с обратным холодильником в течение 1 ч. Уксусный ангидрид удаляют при пониженном давлении и остаток очищают колоночной хроматографией на силикагеле (дихлорметан:метанол 40:1). Перекристаллизация из метанола дает 850 мг бесцветных кристаллов с получением 5,2 г в виде бесцветного аморфного соединения.
Точка плавления: 127 - 128oC.
1H-ЯМР (CDCl3) δ м.д.: 6,55 (1H, шир. с), 4,05 (2H, м), 2,8 (2H, щ.с.), 2,9 (4H, щ.с.), 3,2 (4H, шир.с).
Полученные кристаллы растворяют в небольшом количестве этанола и добавляют избыток 3%-ного хлористого водорода в этаноле. Перекристаллизация из этанола дает указанное в заголовке соединение в виде бесцветных кристаллов.
Точка плавления: 240 - 241oC.
Элементный анализ для C32H37N3O6• 2HCl•3/2H2O:
Рассчитано, %: C 58,27: H 6,42: N 6,37;
Найдено, %: C 58,47; H 6,45; N 6,25.
Пример 10. 5,6-Диметокси-1-(3,4-диметокси)бензил-3-оксо-2-(4-(2- метоксифенил)-1-пиперазанил)этилизоиндол дигидрохлорид секвигидрат.
5,6-Диметокси-1-(3,4-диметокси)бензилиден-3-оксо-2-(4-(2- метоксифенил)-1-пиперазанил)этилизоиндол каталитически восстанавливают в этаноле в присутствии 5% палладия на углероде. Катализатор удаляют фильтрацией, к фильтрату добавляют 3%-ный хлористый водород в этаноле, растворитель удаляют при пониженном давлении и к осадку добавляют ацетон, а гидрохлорид собирают фильтрацией.
Точка плавления: 159 - 165oC (с разложением).
Элементный анализ для C32H39N3O6 •2HCl•1/2H2O:
Рассчитано, %: C 59,72; H 6,58; N 6,53;
Найдено, %: C 59,67; H 6,67; N 6,62.
Ссылочный пример 18. Ацетиленид 3,4-диметоксифенилмеди.
В 15 мл водного аммиака растворяют 0,39 г иодида меди и раствор добавляют к раствору 0,33 г 3,4-диметоксифенилацетилена в 20 мл этанола при комнатной температуре. Смесь перемешивают 1 ч, фильтруют, промывают пять раз водой, один раз этанолом и один раз этиловым эфиром, и высушивают при пониженном давлении при 40oC с получением 110 мг указанного в заголовке соединения.
Пример 11. 1-(2-(2-(3,4-Диметоксифенил)этинил)-4,5-диметоксифенил)этил-4-(2-метоксифенил)пиперазин дигидрохлорид моногидрат.
В 50 мл пиридина растворяют 1,58 г (1-(2-иод-4,5- диметоксифенил)этил-4-(2-метоксифенил)пиперазин и добавляют 0,80 г ацетиленида 3,4-диметоксифенилмеди. Смесь нагревают при 120oC в атмосфере азота в течение 24 ч. Реакционную смесь выливают в воду и экстрагируют этилацетатом. Двухфазную (органическая и водная) жидкость фильтруют, используя Целит, и затем опять разделяют на две фазы. Органический слой промывают насыщенным водным раствором хлорида натрия, высушивают над сульфатом натрия, фильтруют и упаривают с получением 3,75 г маслянистого осадка. Очистка осадка колоночной хроматографией на силикагеле дает 0,75 г аморфного 1-(2-(2-(3,4-диметоксифенил)этинил)-4,5-диметоксифенил)этил-4-(2-метоксифенил) пиперазина, который затем преобразуют в гидрохлорид и перекристаллизовывают из этанола с получением 0,70 г указанного в заголовке соединения в виде бесцветных кристаллов.
Точка плавления: 164 - 167oC.
ИК (см-1): 2210.
Масс-спектр (EI): 516 (M+, 5,28).
1H-ЯМР (CDCl3) δ м.д.: 2,96 (4H, м), 3,36 (6H, м), 3,80 - 3,96 (2H, м), 3,84 (3H, с), 3,89 (3H, с), 3,91 (6H, с), 3,92 (6H, с), 6,86 - 7,20 (4H, м), 7,35 (3H, м), 7,53 (2H, м).
Элементный анализ для C31H36N2O5 •2HCl•H2O:
Рассчитано, %: C 61,28; H 6,64: N 4,61;
Найдено, %: C 61,37; H 6,78; N 4,55.
Пример 12. 1-[2-[4,5-Диметокси-2-[(3,4-диметоксифенил) гидроксиметил]] фенил]этил-4-(2-метоксифенил)пиперазин.
К тетрагидрофурановому раствору 1,80 г 1-[2-[2-бром-4,5- диметоксифенил] этил] -4-(2-метоксифенил)пиперазина добавляют 15%-ный гексановый раствор 5,0 ммоль бутиллития при -78oC. После перемешивания в течение некоторого времени добавляют 830 мг вератрового альдегида и смесь нагревают до 0oC. К реакционной смеси добавляют воду и затем экстрагируют этилацетатом. Растворитель удаляют из экстракта выпариванием и остаток очищают колоночной хроматографией на силикагеле с получением 1,62 г указанного в заголовке соединения.
1H-ЯМР (CDCl3) δ м.д.: 7,05 - 6,8 (м, 7H), 6,70 (с, 1H), 6,60 (с, 1H), 5,93 (шир, 1H), 3,89 (с, 6H), 3,85 (с, 6H), 3,71 (с, 3H), 3,4 - 2,4 (м, 13H).
Пример 13. 1-[2-[4,5-Диметокси-2-[(3,4-диметоксифенил)метил]] фенил]этил-4-(2-метоксифенил)пиперазин.
Уксуснокислый раствор 1-[2-[4,5-диметокси-2-[(3,4- диметоксифенил)гидроксиметил]]фенил]этил-4-(2-метоксифенил) пиперазина подвергают гидрированию в присутствии катализатора палладия на угле. После реакции катализатор удаляют фильтрацией и растворитель подвергают азеотропной отгонке с бензолом с получением 1,60 г указанного в заголовке соединения.
1H-ЯМР (CDCl3) δ м.д.: 7,1 - 6,6 (м, 9H), 3,93 (с, 2H), 3,89 (с, 3H), 3,86 (с, 3H), 3,85 (с, 3H), 3,82 (с, 3H), 3,81 (с, 3H), 3,3 - 2,7 (м, 14H).
Пример 14. 1-[2-[4,5-Диметокси-2-[(3,4-диметоксифенил)ацетил]] фенил]этил-4-(2-метоксифенил)пиперазин.
К тетрагидрофурановому раствору 5,80 г 1-[2-[2-бром-4,5- диметоксифенил] этил] -4-(2-метоксифенил)пиперазина добавляют 9,44 мл 15%-ного гексанового раствора бутиллития при -78oC. После перемешивания в течение некоторого времени температуру поднимают при пониженном давлении для удаления газов. К раствору добавляют 1,92 г пивалоилхлорида при -78oC.
Отдельно 10,2 мл 15%-ного гексанового раствора бутиллития и 2,98 г этил 3,4-диметоксифенилацетата добавляют к тетрагидрофурановому раствору 1,6 г диизопропиламина при -78oC с последующим перемешиванием в течение 30 мин. Полученный раствор добавляют по каплям к вышеприготовленному раствору. Температуру поднимают до 0oC и смесь перемешивают 2 ч. Затем добавляют воду и смесь экстрагируют этилацетатом, экстракт промывают насыщенным водным раствором хлорида натрия, высушивают над сульфатом натрия и растворитель упаривают. Осадок сначала очищают колоночной хроматографией на силикагеле. Затем добавляют 4 н. соляную кислоту и нагревают при 100oC в течение 15 мин с получением прозрачного раствора. Раствор охлаждают, нейтрализуют насыщенным водным раствором гидрокарбоната натрия и экстрагируют метиленхлоридом. Экстракт очищают колоночной хроматографией на силикагеле (гексан, этилацетат) с получением 490 мг указанного в заголовке соединения в виде аморфного порошка.
1H-ЯМР (CDCl3) δ/ м.д.: 7,1 - 6,7 (м, 9H), 4,13 (с, 2H), 3,92 (с, 3H), 3,87 (с, 6H), 3,86 (с, 3H), 3,85 (с, 3H), 3,3 - 2,6 (м, 12H).
Ссылочный пример 19. 1-[(2-Амино-4,5-диметокси)фенил]ацетил-4-(2-метоксифенил)пиперазин.
Метиленхлоридный раствор, содержащий 15 г (4,5-диметокси-2-нитро)фенилуксусной кислоты, 12 г 2-метоксифенилпиперазина и 13 г дихлоргексилкарбодиимида перемешивают при комнатной температуре 3 ч. Осадок удаляют фильтрацией и растворитель выпаривают. Остаток промывают этилацетатом с последующей фильтрацией с получением 19,7 г твердого продукта. К твердому продукту добавляют 400 мл этилацетата и 1,0 г оксида платины и проводят гидрирование в течение ночи. Реакционную смесь фильтруют, растворитель упаривают и осадок кристаллизуют из этилацетата с получением 7,5 г указанного в заголовке соединения.
Точка плавления: 113 - 116oC.
ИК (см-1): 3348, 1606, 1520, 1500, 1462, 1240, 1212, 1038.
1H-ЯМР (CDCl3) δ м.д.: 7,1-6,8 (м, 4H), 6,96 (с, 1H), 6,91 (с, 1H), 3,87 (с, 3H), 3,82 (с, 3H), 3,79 (с, 3H), 3,62 (с, 2H), 3,3-2,7 (м, 8H).
Ссылочный пример 20. 1-[[2-(4-Хлорбутириламино)-5,6-диметокси]фенил]этил-4-(2-метоксифенил)пиперазин.
К тетрагидрофурановой суспензии 300 мг литийалюминийгидрида при кипячении с обратным холодильником добавляют 1,5 г 1-[(2-амино-4,5-диметокси)фенил] ацетил-4-(2- меткосифенил)пиперазина. Добавляют насыщенный водный раствор сульфата натрия и смесь экстрагируют этилацетатом. Растворитель подвергают азеотропной отгонке с бензолом и к остатку сразу добавляют 50 мл метиленхлорида, 1,0 мл триэтиламина и 5,50 г 4-хлорбутирилхлорида. Добавляют водный раствор гидрокарбоната натрия и смесь экстрагируют метиленхлоридом. Растворитель упаривают и остаток очищают колоночной хроматографией на силикагеле (этилацетат) с получением 700 мг указанного в заголовке соединения.
1H-ЯМР (CDCl3) δ м.д.: 7,57 (с, 1H), 7,25 (с, 1H), 7,1-6,8 (м, 4H), 6,62 (с, 1H), 3,85 (с, 9H), 3,66 (т, 2H, J = 7 Гц), 3,2-3,0 (м, 4H), 2,8-2,0 (м, 10H), 2,0-1,5 (м, 2H).
Пример 15. N-[2-[2-[4-(2-Метоксифенил)пиперазинил]этил]-4,5- диметокси] фенил]пирролидон.
К диметилформамидному раствору 110 мг гидрида натрия добавляют 660 мг 1-[[2-(4-хлорбутириламино)-5,6-диметокси] фенил] этил-4-(2- метоксифенил)пиперазина и смесь нагревают при 80oC. После завершения реакции реакционную смесь экстрагируют метиленхлоридом и растворитель подвергают азеотропной отгонке с водой и бензолом при пониженном давлении. Очищение колоночной хроматографией на силикагеле (3% этанол/хлороформ) дает 463 мг указанного в заголовке соединения.
1H-ЯМР (CDCl3) δ м.д.: 7,24 (с, 1H), 7,0-6,8 (м, 4H), 6,61 (с, 1H), 3,88 (с, 3H), 3,87 (с, 3H), 3,84 (с, 3H), 3,8-3,6 (м, 2H), 3,2-3,0 (м, 4H), 2,8-2,5 (м, 10H), 2,3-2,2 (м, 2H), 1,3-1,1 (м, 2H).
Ссылочный пример 21. Этил 5,6-диметокси-1-(3,4-диметоксибензил)- 1H-индазол-3-карбоксилат.
В 5000 мл диметилсульфоксида, высушенного над молекулярным ситом 4A (Molecular Sieve 4A), суспендируют 250,2 г этил-5,6-диметокси-1H-индазол-3-карбоксилата и добавляют 38,0 г метилата лития. После перемешивания при комнатной температуре в течение 1 часа добавляют по каплям 185,6 г 3,4-диметоксибензилхлорида (полученного из 336,4 г 3,4-диметоксибензилового спирта, 300 мл концентрированной соляной кислоты и 500 мл этилового эфира) при комнатной температуре 10 мин. После перемешивания при комнатной температуре в течение 1 ч добавляют 55,6 г 3,4-диметоксибензилхлорида с последующим перемешиванием при комнатной температуре в течение 1 ч. К смеси добавляют затем 55,6 г 3,4-диметоксибензилхлорида с последующим перемешиванием при комнатной температуре в течение 1 ч. Реакционную смесь выливают в 30000 мл ледяной воды при перемешивании. Всплывшую на поверхность жидкость сбрасывают декантацией и к остатку добавляют 15000 мл воды с последующим перемешиванием при комнатной температуре в течение ночи. Всплывшую на поверхность жидкость удаляют декантацией и остаток растворяют в 10000 мл хлороформа. Раствор высушивают над сульфатом натрия и фильтруют, и растворитель удаляют при пониженном давлении. Остаток, весящий 497,0 г, очищают колоночной хроматографией на силикагеле (2 кг • 9), используя смесь хлороформ : четыреххлористый углерод : этилацетат 5:5:1, и затем на силикагеле (2 кг • 4), используя смесь этилацетат : гексан 2:1. Получаемый элюат перекристаллизовывают из этилацетата с получением 205,0 г указанного в заголовке соединения в виде бесцветных призматических кристаллов.
Точка плавления: 138 - 141oC.
ИК (KBr) см-1: 1728, 1496, 1266, 1216, 1204, 1138, 1022.
1H-ЯМР (CDCl3) δ м.д.: 1,49 (3H, т, J = 6,8 Гц), 3,78 (3H, с), 3,85 (6H, с), 3,95 (3H, с), 4,53 (2H, к, J = 6,8 Гц), 5,58 (2H, с), 6,63 (1H, с), 6,76 (1H, с), 6,80 (2H, с), 7,56 (1H, с).
Элементный анализ для C21H24N2O6:
Рассчитано,%: C 62,99; H 6,04; N 7,00;
Найдено,%: C 62,83; H 5,99; N 6,93.
Ссылочный пример 22. 5,6-Диметокси-1-(3,4-диметоксибензил)-1H- индазол-3-метанол.
В 1500 мл тетрагидрофурана суспендируют 205,0 г этил 5,6-диметокси-1-(3,4-диметоксибензил)-1H-индазол-3-карбоксилата, размолотого в ступке до порошка, при комнатной температуре и добавляют 96,8 г боргидрида натрия с последующим перемешиванием при комнатной температуре. К смеси добавляют по каплям 300 мл метанола в течение более 30 мин. После добавления реакционную смесь подогревают до 50oC и перемешивают в течение 5 ч. К смеси затем добавляют 19,4 г боргидрида натрия и 60 мл метанола. Реакционную смесь медленно выливают в смесь 200 мл концентрированной соляной кислоты, 5000 мл воды и 1 кг льда при перемешивании. К водному слою добавляют насыщенный водный раствор гидрокарбоната натрия при комнатной температуре при перемешивании до установления pH около 8, при этом начинает высаживаться бесцветный твердый продукт. Твердый продукт собирают фильтрацией, промывают водой двумя порциями по 500 мл, растворяют в 10000 мл хлороформа, высушивают над сульфатом натрия, фильтруют и упаривают растворитель с получением 185,2 г бесцветного твердого продукта. Твердый продукт используют в последующей реакции без последующей очистки.
Отдельно небольшое количество твердого продукта, полученного как описано выше, перекристаллизовывают из этанола с получением бесцветных кристаллических призм, имеющих точку плавления 187 - 188oC.
ИК (KBr) см-1: 3272, 1520, 1470, 1438, 1418, 1318, 1284, 1256, 1210, 1166, 1140, 1062, 1026, 870, 834.
1H-ЯМР (CDCl3) δ м.д.: 3,77 (3H, с), 3,82 (3H, с), 3,87 (3H, с), 3,92 (3H, с), 4,97 (2H, с), 5,40 (2H, с), 6,62 (1H, с), 6,69 (1H, м), 6,75 (2H, м), 7,13 (1H, с).
Ссылочный пример 23. 3-Хлорметил-5,6-диметокси-1-(3,4-диметоксибензил)-1H-индазол.
В 1500 мл дихлорметана растворяют 184,0 г 5,6-диметокси-1-(3,4-диметоксибензил)-1H-индазола при комнатной температуре с последующим перемешиванием при охлаждении льдом. К раствору добавляют по каплям 75,4 мл тионилхлорида в течение более 20 мин. Минуту спустя, пятно исходного материала на тонкослойной хроматографии (этилацетат : гексан 2:1) исчезает. Реакционную смесь подогревают до комнатной температуры и добавляют 3500 мл дихлорметана. Смесь промывают 1000 мл насыщенным водным раствором гидрокарбоната натрия, фильтруют и упаривают растворитель с получением 189,7 г бесцветного твердого продукта. Этот продукт используют в последующей реакции без дополнительной очистки.
1H-ЯМР (CDCl3) δ м.д.: 3,78 (3H, с), 3,84 (3H, с), 3,88 (3H, с), 3,95 (3H, с), 4,95 (2H, с), 5,44 (2H, с), 6,65 (1H, с), 6,71 (3H, м), 7,10 (1H, с).
Ссылочный пример 24. 5,6-Диметокси-1-(3,4-диметоксибензил)-1H- индазол-3-ацетонитрил.
В 1000 мл диметилсульфоксида растворяют 187,0 г 3-хлорметил-5,6-диметокси-1-(3,4-диметоксибензил)-1H-индазола с последующим перемешиванием при комнатной температуре. К раствору добавляют 134,0 г цианида калия, размолотого в ступке до порошка, с последующим перемешиванием при 50oC в течение 2 ч. Реакционную смесь охлаждают до комнатной температуры, выливают в 15000 мл воды и перемешивают 1 ч. Выделившийся осадок собирают, промывают водой тремя порциями по 1000 мл, растворяют в 5000 мл хлороформа, высушивают над сульфатом натрия, фильтруют и растворитель упаривают. Остаток очищают колоночной хроматографией, используя 2 кг силикагеля и смесь хлороформ : этанол 50:1 и затем 2 кг силикагеля и смесь этилацетат : гексан 36:1, с получением 111,0 г бледно-коричневого твердого продукта. Этот продукт используют в последующей реакции без дополнительной очистки.
1H-ЯМР (CDCl3) δ м.д.: 3,80, (3H, с), 3,84 (3H, с), 3,89 (3H, с), 3,94 (3H, с), 4,02 (2H, с), 5,43 (2H, с), 6,66 (1H, c), 6,72 (2H, м), 6,69 (1H, м), 7,06 (1H, м).
Ссылочный пример 25. 5,6-Диметокси-1-(3,4-диметоксибензил)-1H- индазол-3-укусусная кислота.
В 1000 мл этанола суспендируют 111,0 г 5,6-диметокси-1-(3,4- диметоксибензил)-1H-индазол-3-ацетонитрила при комнатной температуре и перемешивании. К суспензии добавляют 10 н. водный раствор гидроксида натрия и затем нагревают с обратным холодильником в течение 2 ч. Реакционную смесь охлаждают до комнатной температуры и упаривают для удаления растворителя. К остатку добавляют 2000 мл воды и затем перемешивают при комнатной температуре в течение ночи. Любой нерастворимый материал удаляют фильтрацией и к фильтрату добавляют 500 мл этилового эфира. Органический растворитель - растворимый материал удаляют и водный слой доводят до pH 4 - 5 с помощью концентрированной соляной кислоты. Осадок собирают фильтрацией и фракционная кристаллизация из этанола дает 41,0 г указанного в заголовке соединения. Это соединение используют в последующей реакции без дополнительной перекристаллизации.
1H-ЯМР (CDCl3) δ м.д.: 3,77 (3H, с), 3,84 (3H, с), 3,88 (3H, с), 3,91 (3H, с), 4,03 (2H, с), 5,44 (2H, с), 6,64 (1H, с), 6,72 (2H, м), 6,77 (1H, м), 6,96 (1H, с).
Пример 16. 1-((5,6-Диметокси-1-(3,4-диметоксибензил)-1H-индазол- 3-ил)ацетил)-4-(3-хлор-2-метилфенил)пиперазин.
В 500 мл дихлорметана суспендируют 41,0 г 5,6-диметокси-1-(3,4-диметоксибензил)-1H-индазол-3-уксусной кислоты и к смеси добавляют 24,5 г дисульфида 2,2-дипииридила и 30,0 г трифенилфосфина с последующим перемешиванием при комнатной температуре. К смеси добавляют по каплям раствор 23,5 г (3-хлор-2-метилфенил)пиперазина в 200 мл дихлорметана в течение более 5 мин с последующим перемешиванием при комнатной температура в течение 30 мин. После подтвержденного исчезновения пятна исходного материала на тонкослойной хроматограмме (этилацетат : гексан 2:1) к реакционной смеси добавляют 1000 мл дихлорметана и реакционную смесь промывают водой. Органический слой высушивают над сульфатом натрия, фильтруют и растворитель упаривают. Остаток очищают колоночной хроматографией на силикагеле (этилацетат : гексан 2:1; силикагель: 2 кг) с получением 61,5 г бесцветного твердого продукта, который используют в последующей реакции без дополнительной перекристаллизации.
Небольшое количество твердого продукта перекристаллизовывают из этанола с получением бесцветных кристаллических призм, имеющих точку плавления 165 - 169oC.
ИК (KBr) см-1: 1652, 1516, 1264, 1236.
1H-ЯМР (CDCl3) δ м.д.: 1,24 (1,5H, т. J = 7,3 Гц, Me из EtOH), 1,65 (4H, с), 2,55 (2H, м), 2,75 (2H, м), 3,72 (1H, м, CH2 из EtOH), 3,76 (3H, с), 3,78 (3H, с), 3,89 (3H, с), 3,94 (3H, с), 4,09 (2H, с), 5,41 (2H, с), 6,65 (1H, с), 6,69 (2H, м), 6,73 (1H, с), 7,03 (1H, т, J = 7,8 Гц), 7,09 (1H, д, J = 6,8 Гц), 7,19 (1H, с).
Пример 17. 3-(2-(4-(3-Хлор-2-метилфенил)-1-пиперазинил)этил)-5,6-диметокси-1-(3,4-диметоксибензил)-1H-индазол.
В 1000 мл тетрагидрофурана суспендируют 60,5 г 1-((5,6-диметокси-1-(3,4-диметоксибензил)-1H-индазол-3-ил)ацетил)-4- (3-хлор-2-метилфенил)пиперазина и добавляют 500 мл тетрагидрофуранового раствора, содержащего 1,0 моль комплекса боран-тетрагидрофуран, с последующим нагреванием с обратным холодильником 2 ч. Реакционную смесь охлаждают до комнатной температуры и добавляют 30 мл воды для разложения избытка реагента. Тетрагидрофуран удаляют при пониженном давлении и к остатку добавляют 300 мл концентрированной соляной кислоты с последующим перемешиванием при 50oC в течение 1 ч. Водный слой охлаждают до комнатной температуры, подщелачивают карбонатом калия и экстрагируют 3000 мл хлороформа. Органический слой высушивают над сульфатом натрия, фильтруют и растворитель удаляют при пониженном давлении. Остаток очищают колоночной хроматографией на силикагеле (хлороформ : этанол 40: 1) с получением 50,0 г бесцветного твердого продукта. Перекристаллизация из этанола дает 48,3 г в виде бесцветных кристаллических призм.
Точка плавления: 148 - 150oC.
ИК (KBr) см-1: 1518, 1466, 1454, 1260, 1236, 1140, 1022, 1004.
1H-ЯМР (CDCl3) δ м.д.: 2,35 (3H, c), 2,85 (2H, м), 3,02 (4H, м), 3,26 (2H, м), 3,78 (3H, с), 3,83 (3H, с), 3,87 (3H, с), 3,94 (3H, с), 5,43 (2H, с), 6,62 (1H, с), 6,72 (2H, с), 6,78 (1H, м), 6,96 (1H, м), 7,11 (3H, м).
Элементный анализ для C31H37N4O4Cl:
Рассчитано, %: C 65,89; H 6,60; N 9,91; Cl 6,27;
Найдено, %: C 65,65; H 6,59; N 9,58; Cl 6,36.
Пример 18. 5,6-Диметокси-1-(3,4-диметоксифенилметил)-3-(2-(4-(2- метоксифенил)-1-пиперазинил)этил)-1H-индазол дигидрохлорид моногидрат.
В 100 мл дихлорметана растворяют 2,2 г 5,6-диметокси-1-(3,4-диметоксиметилфенил)-1H-индазол-3-уксусной кислоты и к раствору добавляют 1,5 г трифенилфосфина, 1,26 г дисульфида 2,2-дипиридила и 1,1 г 2-метоксифенилпиперазина с последующим перемешиванием при комнатной температуре в течение 1 ч. Реакционную смесь выливают в воду и экстрагируют дихлорметаном. Органический слой высушивают над сульфатом натрия и растворитель удаляют при пониженном давлении. Остаток очищают колоночной хроматографией на силикагеле (этилацетат : гексан 2:1) с получением 2,6 г бесцветного масла. Масло (2,6 г) растворяют в 40 мл тетрагидрофурана и добавляют 40 мл 1,0 н. раствора комплекса боран-тетрагидрофуран с последующим перемешиванием при комнатной температуре в течение 8 ч. К раствору добавляют 5,0 мл воды при охлаждении льдом и смесь перемешивают, и растворитель упаривают. К остатку добавляют 20 мл концентрированной соляной кислоты с последующим перемешиванием при 60oC в течение 30 мин. Раствор выливают в насыщенный водный раствор карбоната натрия для придания ему основности и экстрагируют хлороформом. Органический слой высушивают над сульфатом натрия и растворитель удаляют при пониженном давлении. Остаток очищают колоночной хроматографией на силикагеле (дихлорметан : этанол 20:1) с получением 2,4 г бесцветного масла. Масло растворяют в этаноле и к раствору добавляют 10 мл 1 н. соляной кислоты с последующим перемешиванием. Перекристаллизация осадка из смеси этилацетат-этанол дает 2,7 г указанного в заголовке соединения в виде бесцветных кристаллов.
Точка плавления: 190 - 193oC.
ИК (KBr) см-1: 3348, 2940, 2836, 1632, 1516, 1466, 1262, 1160, 1024, 862, 752.
1H-ЯМР (CDCl3) δ м.д.: 8,05 (1H, м), 7,42 (1H, т), 7,25 (1H, с), 7,04 (2H, м), 6,84 (2H, м), 6,76 (1H, м), 6,65 (1H, с), 5,45 (2H, м), 4,85 (2H, м), 4,27 (2H, м), 4,06, 3,98, 3,90, 3,84, 3,83 (каждый 3H, с), 3,70 (2H, с), 3,88 - 3,56 (4H, м).
Элементный анализ для C31H38N4O5Cl2:
Рассчитано, %: C 58,40; H 6,64; N 8,79; Cl 11,12;
Найдено: %: C 58,55; H 6,50; N 8,64; Cl 11,40.
Ссылочный пример 26. 1-Гидрокси-3-(3,4-диметоксифенил)бутиронитрил.
К сухому бензольному раствору, содержащему 45 г амида натрия, медленно добавляют 177 г 3,4-диметоксифенилацетонитрила при охлаждении на ледяной бане. Смесь нагревают с обратным холодильником 30 мин с последующим охлаждением до комнатной температуры. В реакционную смесь медленно вдувают 50 мл этиленоксида с последующим перемешиванием в течение ночи. Добавляют воду и смесь подкисляют 10%-ной соляной кислотой. Экстрагированный бензольный слой очищают колоночной хроматографией на силикагеле (гексан : ацетон от 2:1 до 1:1) с получением 48 г указанного в заголовке соединения.
1H-ЯМР (CDCl3) δ м. д.: 7,0 - 6,8 (м, 3H), 4,05 (т, 1H, J = 7,3 Гц), 3,90 (с, 3H), 3,89 (с, 3H), 3,9 - 3,7 (м, 2H), 2,3 - 2,0 (м, 2H).
Ссылочный пример 27. α- 47(3,4-Диметоксифенил)бутиролактон.
Раствор (100 мл) 35 г 1-гидрокси-3-(3,4- диметоксифенил)бутиронитрила в смеси 1:1 изопропилового спирта и концентрированной соляной кислоты нагревают с обратным холодильником в течение ночи. Реакционную смесь экстрагируют три раза метиленхлоридом. Органический слой промывают последовательно насыщенным водным раствором гидрокарбоната натрия и насыщенным водным раствором хлорида натрия, высушивают над сульфатом натрия и растворитель упаривают. Остаток очищают колоночной хроматографией на силикагеле (гексан : ацетон 2:1 до 1:1) с получением 28,3 г указанного в заголовке соединения.
1H-ЯМР (CDCl3) δ м. д.: 6,9 - 6,8 (м, 3H), 4,5 - 4,4 (м, 1H), 4,4 - 4,3 (м, 1H), 3,89 (с, 3H), 3,87 (с, 3H), 3,77 (дд, 1H, J = 8,8, 10,2 Гц), 2,8 - 2,6 (м, 1H), 2,5 - 2,3 (с, 1H).
Ссылочный пример 28. α-(2-Нитро-4,5-диметоксифенил)бутиролактон.
Концентрированную соляную кислоту (3,0 моль) добавляют к раствору α-(3,4-диметоксифенил)бутиролактона в 30 мл смеси уксусная кислота/уксусный ангидрид 2: 1. Реакционную смесь выливают в водный раствор гидрокарбоната натрия и три раза экстрагируют метиленхлоридом. Органический слой промывают насыщенным водным раствором хлорида натрия и высушивают над сульфатом натрия. Растворитель упаривают и остаток кристаллизуют из этанола с получением 3,36 г указанного в заголовке соединения.
Точка плавления: 144 - 147oC.
1H-ЯМР (CDCl3) δ м. д.: 7,70 (с, 1H), 6,76 (с, 1H), 4,6 - 4,4 (м, 2H), 3,97 (с, 3H), 3,96 (с, 3H), 2,95 - 2,8 (м, 1H), 2,5 - 2,3 (м, 1H).
Ссылочный пример 29. 5,6-Диметокси-3-гидроксиэтил-1,3- дигидро-2(2H)-индолон.
Этилацетатный раствор, содержащий 2,0 г α-(2-нитро-4,5- диметоксифенил)бутиролактона и 500 мг оксида платины перемешивают при 2,0 атм в атмосфере водорода. К реакционной смеси добавляют этанол с последующей фильтрацией. Растворитель упаривают с получением 1,76 г указанного в заголовке соединения.
1H-ЯМР (CDCl3) δ м. д.: 9,1 - 9,0 (широкий, 1H), 6,83 (с, 1H), 6,54 (с, 1H), 4,75 - 4,4 (м, 1H), 3,87 (с, 3H), 3,86 (с, 3H), 3,9 - 3,5 (м, 2H), 2,3 - 2,0 (м, 2H).
Ссылочный пример 30. 5,6-Диметокси-3-метилтио-3-гидроксиэтил-1,3-дигидро-2(2H)-индолон.
К 50 мл диметилформамида добавляют 360 мг гидрида натрия и туда же добавляют 1,76 г 5,6-диметокси-3-гидроксиэтил-1,3-дигидро-2(2H)- индолона и 706 мг диметил дисульфида. К реакционной смеси добавляют водный раствор гидрокарбоната натрия и растворитель упаривают. Остаток экстрагируют три раза метиленхлоридом и органический слой высушивают над сульфатом натрия. Растворитель упаривают и остаток очищают колоночной хроматографией на силикагеле (этилацетат) с получением 1,21 г указанного в заголовке соединения.
1H-ЯМР (CDCl3) δ м. д.: 9,1 - 9,0 (широкий, 1H), 6,85 (с, 1H), 6,55 (с, 1H), 3,88 (с, 6H), 3,8 - 3,5 (м, 2H), 2,5 - 2,0 (м, 2H), 1,85 (с, 3H).
Ссылочный пример 31. 5,6-Диметокси-3-[2-[4-(2-метоксифенил)-1-пиперазинил]этил]-3-метилтио-1,3-дигидро-2(2H)-индолон.
К метиленхлоридному раствору 330 мг 5,6-диметокси-3-метилтио-3- гидроксиэтил-1,3-дигидро-1(2H)-индолона и 0,5 мл триэтиламина добавляют 2,2 эквивалента мезилхлорида при охлаждении льдом. К реакционной смеси добавляют водный раствор гидрокарбоната натрия и смесь три раза экстрагируют этилацетатом. Органический слой промывают насыщенным водным раствором хлорида натрия и высушивают над сульфатом натрия. Растворитель упаривают и остаток очищают колоночной хроматографией на силикагеле (этилацетат). Продукт растворяют в диметилформамиде и к раствору добавляют 300 мг (2-метоксифенил)пиперазина, 200 мг карбоната калия и 200 мг иодида натрия с последующим перемешиванием в течение ночи. Добавляют водный раствор гидрокарбоната натрия и реакционную смесь три раза экстрагируют метиленхлоридом. Органический слой промывают насыщенным водным раствором хлорида натрия, высушивают над сульфатом натрия и растворитель упаривают. Остаток очищают колоночной хроматографией на силикагеле (этилацетат) с получением 140 мг указанного в заголовке соединения.
1H-ЯМР (CDCl3) δ м. д.: 9,5 - 9,4 (широкий, 1H), 7,0 - 6,7 (м, 5H), 6,58 (с, 1H), 3,89 (с, 3H), 3,88 (с, 3H), 3,79 (с, 3H), 3,8 - 1,9 (м, 12H), 1,80 (с, 3H).
Пример 19. 5,6-Диметокси-1-[(3,4-диметоксифенил)метил]-3-[2-[4-(2-метоксифенил)пиперазинил]этил]-2-оксоиндол.
В диметилформамиде суспендируют 38 мг гидрида натрия. К суспензии добавляют 285 мг 5,6-диметокси-3-[2-[4-(2-метоксифенил)- 1-пиперазинил]этил] -3-метилтио-1,3-дигидро-2(2H)-индолона и 140 мг 3,4-диметоксибензилхлорида. К реакционной смеси добавляют водный раствор гидрокарбоната натрия и смесь три раза экстрагируют этилацетатом. Органический слой промывают насыщенным водным раствором хлорида натрия и высушивают над сульфатом натрия. Растворитель упаривают и остаток растворяют в этаноле. Отдельно ацетоновый раствор, содержащий 2,0 г никеля Ренея, нагревают с обратным холодильником и растворитель удаляют декантацией. Остаток добавляют к приготовленному как описано выше этанольному раствору с последующим нагреванием с обратным холодильником в течение 15 мин. Осадок удаляют фильтрацией, растворитель упаривают и остаток очищают колоночной хроматографией на силикагеле (гексан : этилацетат от 1:2 до 0:1) с получением 201 мг указанного в заголовке соединения.
1H-ЯМР (CDCl3) δ м. д.: 7,0 - 6,7 (м, 8H), 6,38 (с, 1H), 4,13 (д, 1H, J = 6,9 Гц), 4,10 (д, 1H, J = 7,3 Гц), 3,85 (с, 3H), 3,85 (с, 6H), 3,83 (с, 3H), 3,78 (с, 3H), 3,7 - 3,5 (м, 1H), 3,2 - 2,2 (м, 12H).
Ссылочный пример 32. 1-[7-(2,3-дигидробензофуранил)]пиперазин.
В 10 мл уксусной кислоты растворяют 884,0 мг 1-(7-бензофуранил)пиперазина и добавляют 56,7 мг катализатора Пирмана (Pearman). Смесь перемешивают при 65oC в токе водорода в течение 4 ч. После окончания реакции катализатор удаляют фильтрацией с использованием Целита. Растворитель упаривают и остаток подвергают колоночной хроматографии на силикагеле. Из фракции, элюированной 10% (по объему) смесью хлороформ/метанол, получают сырое 2,3-дигидробензофурановое соединение, которое используют в последующей реакции без дополнительной очистки.
Пример 20. 3-[2-[4-[7-(2,3-Дигидробензофуранил)]-1- пиперазинил]этил]-5,6-диметокси-1-(3,4-диметоксибензил)-1H-индазол.
В 15 мл безводного дихлорметана растворяют 1,28 г 5,6-диметокси-1-(3,4-диметоксибензил)-1H-индазолуксусной кислоты. К раствору добавляют последовательно 868,6 мг трифенилфосфина, 729,4 мг дисульфида 2,2-дипиридила и 729,4 мг 1-[7-(2,3- дигидробензофуранил)]пиперазина с последующим перемешиванием при комнатной температуре в течение 10 мин. После завершения реакции добавляют воду и смесь экстрагируют дихлорметаном. Экстракт высушивают над безводным сульфатом натрия, растворитель упаривают и остаток подвергают колоночной хроматографии на силикагеле (этилацетат) с получением 1,16 г амидного соединения в виде бесцветного маслянистого вещества. Маслянистый продукт растворяют в 20 мл безводного тетрагидрофурана и добавляют 8,1 мл 1,0 М раствора комплекса боран-тетрагидрофуран с последующим нагреванием с обратным холодильником в течение 1 ч. После завершения реакции добавляют 10 мл 10%-ной соляной кислоты с последующим дальнейшим нагреванием с обратным холодильником в течение 1 ч. После охлаждения добавляют порошок гидрокарбоната натрия для нейтрализации и смесь экстрагируют хлороформом. Экстракт высушивают над безводным сульфатом натрия и растворитель упаривают и остаток очищают колоночной хроматографией на силикагеле (этилацетат) с получением 729,3 г указанного в заголовке соединения в виде бесцветного маслянистого вещества.
ИК (KBr) см-1: 1514, 1486, 1260, 1028.
1H-ЯМР (CDCl3) δ м.д.: 3,70-3,77 (4H, м), 3,79, 3,83, 3,88, 3,94 (каждый 3H, с) 5,43 (2H, с), 6,62-7,61 (8H, м).
Элементный анализ для C32H38N4O5 • 1/2 H2O:
Рассчитано, %: C 67,70; H 6,92; N 9,86;
Найдено, %: C 67,62; H 6,59; N 9,24.
Ссылочный пример 33. 1-[(2-Метоксикарбонил-4,5-диметокси)фенил]этил-4-(2-метоксифенил)пиперазин.
К тетрагидрофурановому раствору 3,8 г 1-[(2-бром-4,5-диметокси) фенил] этил-4-(2-метоксифенил)пиперазина добавляют 6,4 мл 15%-ного гексанового раствора н-бутиллития при -78oC. После перемешивания в течение некоторого времени добавляют 0,5 г твердого диоксида углерода. Растворитель удаляют упариванием. К остатку добавляют метанол и затем около 1 мл концентрированной соляной кислоты с последующим нагреванием с обратным холодильником в течение ночи. Реакционную смесь осторожно нейтрализуют водным раствором гидрокарбоната натрия и добавляют этилацетат. Органический слой отделяют. Водный слой подкисляют, экстрагируют метиленхлоридом и опять подвергают этерификации. Полученный органический слой упаривают и остаток кристаллизуют из этанола с получением 530 мг указанного в заголовке соединения.
Точка плавления: 118oC.
1H-ЯМР (CDCl3) δ м.д.: 7,52 (с, 1H), 7,05-6,75 (м, 5H), 3,93 (с, 3H), 3,91 (с, 3H), 3,89 (с, 3H), 3,88 (с, 3H), 3,4-2,6 (м, 12H).
Пример 21. 1-[2-[4,5-Диметокси-2-(2-пиридил)ацетил]фенил]этил-4-(2-метоксифенил)пиперазин дигидрохлорид дигидрат.
К тетрагидрофурановому раствору 158 г диизопропиламина последовательно добавляют 1,0 мл 15% гексанового раствора н-бутиллития и 145 мг 2-пиколина при -78oC с последующим перемешиванием некоторое время. К раствору добавляют 650 мг 1-[(2-метоксикарбонил-4,5-диметокси)фенил] этил-4- (2-метоксифенил)пиперазина. Температуру постепенно поднимают до комнатной температуры, при которой смесь перемешивают 20 мин. К реакционной смеси добавляют насыщенный водный раствор хлорида аммония и реакционную смесь экстрагируют три раза этилацетатом. Органический слой промывают насыщенным водным раствором хлорида натрия, высушивают над сульфатом натрия и растворитель упаривают. Остаток очищают колоночной хроматографией на силикагеле (этилацетат : этанол 10:1) с получением 360 мг указанного в заголовке соединения.
Точка плавления: 179-181oC (расплавляется и затем опять отверждается).
ИК (см-1): 2500, 1682, 1520, 1504, 1344, 1272, 1246, 1124.
1H-ЯМР (эквивалентная смесь кетоформы : енольной формы 2:1) δ м.д.: 8,56 (д, J = 4,9 Гц, 2/3H), 8,28 (д, J = 4,5 Гц, 1/3H), 7,7-7,15 (м, 3H), 7,05-6,75 (м, 6H), 5,62 (с, 1/3H), 4,42 (с, 2/3H), 3,92 (с, 2/3•3H), 3,91 (с, 1/3•3H), 3,90 (с, 2/3•3H), 3,99 (с, 1/3•3H), 3,87 (с, 2/3•3H), 3,85 (1/3•3H), 3,3-2,6 (м, 12H).
Ссылочный пример 34. Этил 5,6-диметокси-1-(1-тритил-4-имидазолил)метил-1H-индазол-3-карбоксилат.
В 5000 мл диметилсульфоксида суспендируют 250,2 г этил 5,6-диметоксииндазол-3-карбоксилата и у суспензии добавляют 40,2 г метоксида лития с последующим перемешиванием при комнатной температуре в течение 1 ч. Добавляют по каплям раствор 447,8 г 4-хлорметил-1-тритилимидазола в 2000 мл диметилсульфоксида при комнатной температуре в течение более 10 мин. После перемешивания при комнатной температуре в течение 2 ч далее добавляют 4,2 г метоксида лития и 44,8 г 4-хлорметил-1-тритилимидазола с последующим перемешиванием при комнатной температуре в течение 1 ч. Реакционную смесь выливают в 30000 мл ледяной воды при перемешивании. Выпавшие кристаллы собирают, промывают три раза водой порциями по 2000 мл и сушат. Твердый продукт растворяют в 10000 мл хлороформа и растворитель высушивают над сульфатом натрия, фильтруют и растворитель упаривают. Остаток очищают колоночной хроматографией на силикагеле (хлороформ : этанол 50:1) и перекристаллизовывают из смеси хлороформ/изопропиловый спирт с получением 222,0 г указанного в заголовке соединения в виде бесцветных кристаллических призм.
Точка плавления: 184 - 186oC.
ИК (KBr) см-1: 1704, 1496, 1268, 1146, 1132, 1092, 748, 700.
1H-ЯМР (CDCl3) δ м.д.: 1,21 (6H, J = 5,9 Гц, Me из изо-PrOH), 1,46 (3H, т, J = 7,3 Гц), 3,93 (3H, с), 3,97 (3H, с), 4,01 (1H, м, CH из изо-PrOH), 4,49 (2H, к, J = 7,3 Гц), 5,61 (2H, с), 6,79 (1H, с), 7,03 (5H, м), 7,13 (1H, с), 7,28 (10H, м), 7,47 (1H, с), 7,51 (1H, с).
Элементный анализ для C35H32N4O4 • C3H8O:
Рассчитано, %: C 72,13; H 6,37; N 8,85;
Найдено %: C 71,53; H 6,37; N 8,70.
Ссылочный пример 35. 5,6-Диметокси-1-(1-тритил-4-имидазолил)метил-1H-индазол-3-метанол.
В 1300 мл тетрагидрофурана суспендируют 222,0 г этил 5,6-диметокси-1-(1-тритил-4-имидазолил)метил-1H-индазол-3- карбоксилата, размолотого в ступке до порошка, при комнатной температуре и суспензию охлаждают ледяной водой. К суспензии добавляют около 250,0 мл 3,4 М толуольного раствора бисметоксиэтоксиалюминийгидрида в течение более 15 мин с последующим перемешиванием при охлаждении льдом в течение 30 минут. К реакционной смеси добавляют перенасыщенный водный раствор сульфата натрия. После перемешивания в течение 1 часа добавляют сульфат натрия с последующей фильтрацией. Сульфат натрия на фильтре промывают пятью порциями по 500 мл горячего хлороформа. Фильтрат и промывочные жидкости объединяют и растворитель упаривают с получением 220,1 г бесцветного твердого продукта. Перекристаллизация продукта из хлороформа дает 181,0 г указанного в заголовке соединения в виде бесцветных кристаллических призм.
Точка плавления: 115 - 120oC (с разложением).
ИК (KBr) см-1: 3216, 3172, 3008, 2936, 1510, 1488, 1472, 1444, 1302, 1260, 1172, 1156, 1128, 1102, 1036, 1014, 836, 764, 702, 678, 666, 636.
1-H-ЯМР (CDCl3) δ м.д.: 3,91 (3H, с), 3,92 (3H, с), 4,92 (2H, с), 5,44 (2H, с), 6,76 (1H, с), 6,95 (1H, с), 7,05 (5H, м), 7,26 (1H, с, CHCl3), 7,28 (1H, с), 7,31 (10H, м), 7,46 (1H, с).
Элементный анализ для C33H30N4O3 •CHCl3:
Рассчитано, %: C 62,83; H 4,81; N 8,62;
Найдено, %: C 62,50; H 4,63; N 8,42.
Ссылочный пример 36. 3-Хлорметил-5,6-диметокси-1-(1-тритил-4-имидазолил)метил-1H-индазол.
В 1700 мл дихлорметана суспендируют 180,0 г 5,6-диметокси-1- (1-тритил-4-имидазолил)метил-1H-индазол-3-метанола, размолотого в ступке до порошка, при комнатной температуре с последующим перемешиванием при охлаждении льдом. К реакционной смеси добавляют по каплям 48,6 мл тионилхлорида в течение более 5 мин. Минуту спустя, пятно исходного материала на тонкослойной хроматограмме (хлороформ : этанол 30:1) исчезает. Реакционную смесь выливают в 2000 мл насыщенного водного раствора гидрокарбоната натрия и экстрагируют 5000 мл хлороформа. Экстракт высушивают над сульфатом натрия, фильтруют и растворитель упаривают с получением 165,1 г бесцветного твердого продукта. Этот продукт используют в последующей реакции без дополнительной очистки.
1H-ЯМР (CDCl3) δ м.д.: 3,95 (3H, с), 4,09 (3H, с), 4,83 (2H, с), 5,67 (2H, с), 7,02 (8H, м), 7,37 (10H, м), 7,88 (1H, широкий).
Ссылочный пример 37. 5,6-Диметокси-1-(1-тритил-4-имидазолил)метил-1H-индазол-3-ацетонитрил.
В 1200 мл диметилсульфоксида суспендируют 165,0 г 3-хлорметил-5,6-диметокси-1- (1-тритил-4-имидазолил)-метил-1H-индазола с последующим перемешиванием при комнатной температуре. К суспензии добавляют 43,6 г цианида калия, размолотого в ступке до порошка, и смесь перемешивают при 70oC в течение 1 ч. Реакционную смесь охлаждают до комнатной температуры и выливают в 15000 мл воды с энергичным перемешиванием с последующим перемешиванием в течение 1 ч. Выпавший продукт собирают, промывают три раза водой порциями по 1000 мл и растворяют в 5000 мл хлороформа. Раствор высушивают над сульфатом натрия, фильтруют и растворитель выпаривают. Колоночная хроматография на силикагеле (этилацетат) осадка дает 108,7 г бледно-коричневого твердого продукта, который используют в последующей реакции как таковой.
1H-ЯМР (CDCl3) δ м.д.: 3,92 (3H, с), 3,94 (3H, c), 3,97 (2H, с), 5,42 (2H, с), 6,79 (1H, с), 7,00 (1H, с), 7,02 (1H, с), 7,06 (5H, м), 7,30 (10H, м), 7,46 (1H, с).
Ссылочный пример 38. 5,6-Диметокси-1-(1-тритил-4-имидазолил)метил-1H-индазол-3-уксусная кислота.
В 1000 мл этанола суспендируют 107,0 г 5,6-диметокси-1-(1-тритил-4-имидазолил)метил-1H-индазол-3-ацетонитрила при комнатной температуре и добавляют 10 н. водный раствор гидроксида натрия, полученного из 40,0 г гидроксида натрия и 100 мл воды, с последующим нагреванием с обратным холодильником в течение 6 ч. Реакционную смесь охлаждают до комнатной температуры и выливают в 5000 мл воды. Доводят до pH 3 - 4 с помощью 10% соляной кислоты и бесцветный твердый продукт, который собирают фильтрацией, промывают тремя порциями воды по 500 мл и растворяют в 5000 мл хлороформа. Раствор высушивают над сульфатом натрия, фильтруют и растворитель выпаривают с получением 134,0 г указанного в заголовке соединения, которое используют в последующей реакции как таковое.
1H-ЯМР (CDCl3) δ м.д.: 3,84 (3H, с), 3,87 (3H, с), 3,89 (2H, с), 5,43 (2H, с), 6,76 (1H, с), 6,88 (1H, с), 6,93 (1H, с), 7,03 (5H, м), 7,28 (10H, м), 7,48 (1H, с).
Пример 22. 4-(3-Хлор-2-метилфенил)-1-(5,6-диметокси-1-(1-тритил-4-имидазолил) метил-1H-индазол-3-ил)ацетил)пиперазин.
В 1000 мл дихлорметана суспендируют 134,0 г 5,6-диметокси-1-(1-тритил-4-имидазолил)метил-1H-индазол-3-уксусной кислоты. К суспензии добавляют 63,5 г дисульфида 2,2-дипиридила и 75,6 г трифенилфосфина с последующим перемешиванием при комнатной температуре, в течение которого суспензия превращается в однородный прозрачный раствор. Добавляют раствор 60,7 г 4-(3-хлор-2-метилфенил)пиперазина в 200 мл дихлорметана в течение более 5 мин и смесь перемешивают при комнатной температуре в течение 5 ч. Растворитель удаляют при пониженном давлении и к остатку добавляют горячий этилацетат с последующим перемешиванием. Выпавший твердый продукт собирают фильтрацией, промывают двумя порциями по 500 мл этилацетата и сушат с получением 140,4 г бесцветного твердого продукта. Твердый продукт очищают колоночной хроматографией на силикагеле (хлороформ : этанол 30:1) с получением 134,9 г бесцветного твердого продукта. Перекристаллизация из этанола дает 120,0 г бесцветных кристаллических призм.
Точка плавления: 103 - 105oC.
ИК (KBr) см-1: 1646, 1628, 1508, 1466, 1450, 1430, 1260, 750, 702.
1H-ЯМР (CDCl3) δ м.д.: 1,23 (1,2H, т, J = 6,8 Гц, Me из EtOH), 2,28 (3H, с), 2,55 (2H, м), 2,73 (2H, м), 3,67 (4H, м), 3,71 (0,8H, к, J = 6,8 Гц, CH2 из EtOH), 3,90 (3H, с), 3,93 (3H, с), 4,03 (2H, с), 5,43 (2H, с), 6,68 (1H, с), 6,72 (1H, к, J = 8,3 Гц), 6,90 (1H, с), 7,03 (7H, м), 7,14 (1H, с), 7,27 (10H, м), 7,41 (1H, с).
Элементный анализ для C45H43N6O3Cl • 4EtOH • H2O:
Рассчитано, %: C 70,10; H 5,70; N 10,70; Cl 4,72;
Найдено, %: C 70,02; H 5,78; N 10,60; Cl 5,11.
Пример 23. 3-(2-(4-(3-Хлор-2-метилфенил)-1-пиперазинил)этил)-5,6-диметокси-1-(4-имидазолилметил)-1H-индазол.
В 1000 мл тетрагидрофурана суспендируют 120,0 г 4-(3-хлор-2-метилфенил)-1-(5,6-диметокси-1-(1-тритил-4-имидазолил)метил-1H- индазол-3-ил)ацетил)пиперазина. К суспензии добавляют 800 мл 1,0 М комплекса боран-тетрагидрофуран с последующим нагреванием с обратным холодильником 90 мин. Реакционную смесь охлаждают до комнатной температуры и добавляют 30 мл воды для разложения избытка реагента. Тетрагидрофуран удаляют при пониженном давлении и к остатку добавляют 150 мл концентрированной соляной кислоты, 200 мл воды и 40 мл этанола с последующим перемешиванием при 50oC в течение 1 ч. Водный слой охлаждают до комнатной температуры, подщелачивают карбонатом калия и экстрагируют 3000 мл хлороформа. Органический слой высушивают над сульфатом натрия, фильтруют и растворитель упаривают. Остаток очищают колоночной хроматографией на силикагеле (хлороформ : этанол 40:1) с получением бесцветного твердого продукта, который затем перекристаллизовывают из смеси изопропиловый спирт/изопропиловый эфир с получением 71,0 г указанного в заголовке соединения в виде бесцветных кристаллических призм.
Точка плавления: 143 - 144,5oC.
ИК (KBr) см-1: 1510, 1464, 1432, 1272, 1238, 1206, 1006.
1H-ЯМР (CDCl3) δ м.д.: 2,34 (3H, с), 2,78 (4H, м), 2,90 (2H, м), 2,97 (4H, м), 3,17 (2H, м), 3,90 (3H, с), 3,91 (3H, с), 5,45 (2H, с), 6,83 (1H, с), 6,84 (1H, с), 6,92 (1H, м), 7,00 (1H, с), 7,09 (2H, м), 7,52 (1H, с).
Элементный анализ для C26H31N6O2Cl:
Рассчитано, %: C 63,09; H 6,31; N 16,98; Cl 7,16;
Найдено, %: C 62,93; H 6,30; N 16,88; Cl 7,16.
Ссылочный пример 39. 1-Бензилоксикарбонил-4-(3-(2-этоксикарбонил)этил)карбониламино-2-метилфенил) пиперазин.
В 50 мл метиленхлорида растворяют 5,15 г 4-(3-амино-2-метилфенил)-1-бензилоксикарбонилпиперазина и 3,08 г этилсукцинилхлорида и добавляют 5,17 г карбоната калия с последующим нагреванием с обратным холодильником в течение 2 ч. Реакционную смесь охлаждают до комнатной температуры и добавляют метиленхлорид. Смесь промывают водой, сушат над сульфатом натрия, фильтруют и растворитель упаривают. Остаток очищают колоночной хроматографией на силикагеле (этилацетат : гексан 1:2) с получением 5,32 г указанного в заголовке соединения.
1H-ЯМР (CDCL3) δ м.д.: 1,27 (3H, т, J = 6,8 Гц), 2,23 (3H, с), 2,71 (2H, м), 2,75 (2H, м), 2,83 (4H, м), 3,66 (4H, м), 4,14 (2H, к, J = 6,8 Гц), 5,17 (2H, с), 6,84 (1H, к, J = 7,8 Гц), 7,16 (1H, т, J = 8,3 Гц), 7,37 (5H, м), 7,53 (1H, к, J = 7,8 Гц).
Пример 24. 5,6-Диметокси-1-(3,4-диметоксибензил)-3-(2-(4-(2-этил-3-(1-сукцинимидил) фенил)-1-пиперазинил)этил)-1H-индазол.
В 50 мл метанола растворяют 1,50 г 1-бензилоксикарбонил-4-(3-(2-этоксикарбонилэтил)карбониламино-2-метилфенил) пиперазина и добавляют 1,0 г 10% палладия на угле с последующим перемешиванием при комнатной температуре в атмосфере водорода в течение 2 ч. Реакционную смесь отфильтровывают и растворитель упаривают с получением 0,99 г 3-(2-этоксикарбонилэтил)карбониламино-2-метилфенилпиперазина, который используют в последующей реакции без дополнительной очистки.
В 30 мл метиленхлорида растворяют 800 мг 5,6-диметокси-1-(3,4-диметоксибензил)-1H-индазол-3-этанола и 270 мг мезилхлорида. К раствору добавляют 1,0 мл триэтиламина при перемешивании и охлаждении льдом в течение 30 мин. К реакционной смеси добавляют метиленхлорид и реакционную смесь промывают водой, высушивают над сульфатом натрия, фильтруют и растворитель выпаривают. Остаток растворяют в 30 мл диметилформамида и к раствору добавляют 990 мг приготовленного как описано выше 3-(2-этоксикарбонилэтил)карбониламино-2-метилфенилпиперазина и 3,0 г карбоната калия. Смесь перемешивают при 60oC в течение 2 ч. Диметилформамид удаляют при пониженном давлении и остаток экстрагируют этилацетатом. Экстракт промывают водой, высушивают над сульфатом натрия, фильтруют и растворитель упаривают. Остаток очищают колоночной хроматографией на силикагеле (этилацетат) и полученный твердый продукт перекристаллизовывают из изопропилового спирта с получением 520 мг 5,6-диметокси-1-(3,4-диметоксибензил)-3-(2-(4-(2-этил-3-(1-сукцинимидил) фенил)-1-пиперазинил)этил)-1H-индазола гемигидрата.
Точка плавления: 99,5 - 103,5oC.
Масс-спектр (FAB): M++1: 628.
ИК (KBr) см-1: 1780.
1H-ЯМР (CDCl3) δ м.д.: 2,08 (3H, с), 2,76 (4H, м), 2,93 (6H, м), 3,00 (4H, м), 3,19 (2H, м), 3,79 (3H, с), 3,83 (3H, с), 3,87 (3H, с), 3,93 (3H, с), 5,43 (2H, с), 6,62 (1H, с), 6,77 (4H, м), 7,03 (1H, с), 7,14 (1H, м), 7,27 (1H, м).
Элементный анализ для C35H41N5O6 • 1/2H2O:
Рассчитано, %: C 66,02; H 6,65; N 10,09;
Найдено, %: C 65,98; H 6,95; N 10,08.
Ссылочный пример 40. 4,4-Диметил-2-(2,4,5-триметоксифенил)-2-оксазолин.
К 30 г триметоксибензойной кислоты добавляют 30 мл тионилхлорида и раствор нагревают с обратным холодильником в течение 12 ч. Тионилхлорид удаляют при пониженном давлении. К остатку добавляют 50 мл метиленхлоридного раствора, содержащего 25 г 2-амино-2-метил-1-пропанола, при охлаждении льдом с последующим перемешиванием в течение ночи. Осадок удаляют фильтрацией и растворитель удаляют при пониженном давлении с получением маслянистого амидного соединения. К полученному амидному соединению добавляют по каплям 10 мл тионилхлорида с последующим перемешиванием и добавляют этиловый эфир. Осадок собирают фильтрацией, нейтрализуют водным раствором гидроксида натрия и экстрагируют метиленхлоридом. Растворитель упаривают и оставшиеся кристаллы промывают гексаном с получением 22,4 г указанного в заголовке соединения.
Точка плавления: 84 - 86oC.
1H-ЯМР (CDCl3) δ м.д.: 7,30 (с, 1H), 7,26 (с, 1H), 6,53 (с, 1H), 4,11 (с, 2H), 3,92 (с, 3H), 3,90 (с, 3H), 3,87 (с, 3H), 1,42 (с, 6H).
Ссылочный пример 41. 2-[4,5-Диметокси-2-(3,4-диметоксифенил]-4,4-диметил-2-оксазолин.
Диметоксифенилмагний бромид, полученный из бромвератрола, медленно прибавляют к тетрагидрофурановому раствору 2,65 г 4,4-диметил-2-(2,4,5-триметоксифенил-2-оксазолина с последующим перемешиванием в течение ночи, добавляют водный раствор хлорида аммония и смесь экстрагируют метиленхлоридом. Экстракт очищают колоночной хроматографией на силикагеле (гексан : этилацетат 2:1 - этилацетат). Перекристаллизация из гексана дает 1,9 г указанного в заголовке соединения.
Точка плавления: 109 - 110oC.
1H-ЯМР (CDCl3): δ м. д.: 7,27 (с, 1H), 6,9-6,8 (м, 4H), 3,97 (с, 3H), 3,92 (с, 6H), 3,89 (с, 3H), 3,80 (с, 2H), 1,31 (с, 6H).
Ссылочный пример 42. 4,5-Диметокси-2-(3,4-диметоксифенил)бензойная кислота.
Раствор 2,6 г 2-[4,5-диметокси-2-(3,4-диметоксифенил)]-4,4- диметил-2-оксазолина в метиленхлориде перемешивают в течение ночи с получением 3,0 г осадка. К осадку добавляют 20%-ный водный раствор гидроксида натрия с последующим нагреванием с обратным холодильником в течение ночи. Реакционную смесь нейтрализуют 5 н. соляной кислотой и экстрагируют метиленхлоридом. Растворитель упаривают и полученные кристаллы промывают этанолом с получением 1,51 г указанного в заголовке соединения.
ИК (KBr) см-1: 1692, 1508, 1256, 1176, 1026.
1H-ЯМР (CDCl3) δ м.д.: 9,7 (широкий, 1H), 7,52 (с, 1H), 6,9-6,8 (м, 4H), 3,94 (с, 3H), 3,91 (с, 6H), 3,85 (с, 3H).
Ссылочный пример 43. 4-Хлорметил-1,2-диметокси-5-(3,4-диметоксифенил)бензол.
Нагревают с обратным холодильником тетрагидрофурановую суспензию 1,5 г литийалюминийгидрида и к ней добавляют 2,43 г 4,5-диметокси-2-(3,4-диметоксифенил)бензойной кислоты. Дают остыть и медленно добавляют перенасыщенный водный раствор сульфата натрия. Осадок удаляют фильтрацией. Растворитель упаривают и остаток растворяют в метиленхлориде. К раствору добавляют концентрированную соляную кислоту и смесь перемешивают 2 ч с последующей экстракцией. Очистка экстракта колоночной хроматографией на силикагеле (гексан : этилацетат от 5:1 до 1:1) дает 820 мг указанного в заголовке соединения.
1H-ЯМР (CDCl3) δ м.д.: 7,1-6,9 (м, 4H), 6,78 (с, 1H), 4,52 (с, 2H), 3,95 (с, 3H), 3,93 (с, 3H), 3,92 (с, 3H), 3,89 (с, 3H).
Ссылочный пример 44. [[4,5-Диметокси-2-(3,4-диметоксифенил]фенил]уксусная кислота.
Диметилформамидный раствор, содержащий 1,4 г 4-хлорметил-1,2- диметокси-5-(3,4-диметоксифенил)бензола и 565 мг цианида калия, перемешивают один день при 50oC. Растворитель удаляют при пониженном давлении и к остатку добавляют этилацетат. Раствор последовательно промывают водой и насыщенным водным раствором хлорида натрия. Растворитель упаривают и к остатку добавляют 40 мл 20%-ного водного раствора гидроксида натрия и 15 мл этанола с последующим нагреванием с обратным холодильником в течение ночи. После охлаждения добавляют воду и реакционную смесь промывают этиловым эфиром. Водный слой подкисляют соляной кислотой и экстрагируют метиленхлоридом. Растворитель удаляют при пониженном давлении с получением 1,16 г указанного в заголовке соединения в виде маслянистого вещества.
1H-ЯМР (CDCl3) δ м.д.: 6,9-6,8 (м, 4H), 6,8 (с, 1H), 3,91 (с, 6H), 3,87 (с, 3H), 3,85 (с, 3H), 3,57 (с, 2H).
Пример 25. 1-[2-[[4,5-Диметокси-2-(3,4-диметоксифенил)]фенил]ацетил]-4-(2-метоксифенил)пиперазин.
Одну каплю диметилформамида добавляют к тионилхлоридному раствору 517 мг [[4,5-диметокси-2-(3,4-диметоксифенил)] фенил]уксусной кислоты. Тионилхлорид удаляют азеотропной перегонкой с бензолом. К метиленхлоридному раствору остатка добавляют 2-метоксифенилпиперазин. После перемешивания в течение некоторого времени органический слой экстрагируют и очищают колоночной хроматографией на силикагеле (гексан : этилацетат 1:1 - этилацетат) с получением 599 мг указанного в заголовке соединения.
1H-ЯМР (CDCl3) δ м.д.: 7,0-6,7 (м, 9H), 3,91 (с, 6H), 3,87 (с, 6H), 3,85 (с, 3H), 3,9-3,6 (м, 2H), 3,4-3,2 (м, 2H), 3,0-2,8 (м, 2H), 2,8-2,6 (м, 2H).
Пример 26. 1-[2-[[4,5-Диметокси-2-(3,4-диметоксифенил)]фенил]этил]-4-(2-метоксифенил)пиперазин.
К тетрагидрофурановой суспензии 150 мг литийалюминийгидрида при кипячении с обратным холодильником добавляют 593 мг 1-[2-[[4,5-диметокси-2-(3,4-диметоксифенил]фенил]ацетил]-4-[2- метоксифенил]пиперазина. Дают остыть и к реакционной смеси добавляют перенасыщенный водный раствор сульфата натрия с последующей экстракцией этилацетатом. Растворитель упаривают и остаток кристаллизуют из изопропилового спирта с получением 415 мг указанного в заголовке соединения.
Точка плавления: 111 - 113oC.
ИК (KBr) см-1: 1504, 1464, 1252, 1174, 1340, 1026.
1H-ЯМР (CDCl3) δ м.д.: 8,0-7,7 (м, 9H), 3,92 (широкий с, 9H), 3,84 (с, 6H), 3,2-2,9 (широкий, 4H), 2,9-2,4 (м, 8H).
Пример 27. 1-(3-Хлор-2-метилфенил)-4-[2-[[4,5-диметокси-2-(3,4-диметоксифенил)]фенил]ацетил]пиперазин.
Указанное в заголовке соединение синтезируют с выходом 748 мг тем же способом, что описан выше, за исключением того, что используют 645 мг [[4,5-диметокси-2-(3,4-диметоксифенил)] фенил] уксусной кислоты, 2,0 мл тионилхлорида и 500 мг (3-хлор-2-метилфенил)пиперазина.
1H-ЯМР (CDCl3) δ м.д.: 7,1-7,0 (м, 2H), 6,9-6,7 (м, 6H), 3,92 (с, 6H), 3,87 (с, 6H), 3,63 (с, 2H), 3,8-3,6 (м, 2H), 3,4-3,2 (м, 2H), 2,8-2,6 (с, 2H), 2,6-2,4 (м, 2H), 2,32 (с, 3H).
Пример 28. 1-(3-Хлор-2-метилфенил)-4-[2-[[4,5-диметокси-2-(3,4- диметоксифенил)]фенил]этил]пиперазин.
Указанное в заголовке соединение синтезируют с выходом 540 г тем же способом, что описан выше, за исключением того, что используют 740 мг 1-(3-хлор-2-метилфенил)-4-[2-[[4,5-диметокси-2-(3,4- диметоксифенил)] фенил] ацетил]пиперазина и 170 мг литийалюминийгидрида.
Точка плавления: 137 - 139oC.
ИК (см-1): 1504, 1464, 1250, 1136, 1008.
1H-ЯМР (CDCl3) δ м. д. : 8,2-7,7 (м, 8H), 3,93 (с, 9H), 3,87 (с, 3H), 3,2-2,5 (м, 12H), 2,30 (с, 3H).
Примеры 29 - 99. Соединения, имеющие формулу, показанную ниже, в которой символы R1, R2, K, G, Z и Q определены в табл. 3 (см. в конце описания), синтезируют теми же способами, что и по предшествующим примерам. Соединения, где K - это "C", являются индольными соединениями, и где K - это "N", являются индазольными соединениями. В этих соединениях G является 3,4-диметоксибензильной группой, если в таблице не указано другое. В тех соединениях, где R1 и R2 оба представляют метоксигруппу, метоксигруппа находится в 5- и 6-положениях, за исключением особо указанных случаев.
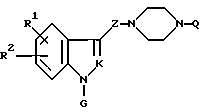
Примеры 100 - 118. Соединения, имеющие формулу, показанную ниже, в которой символы R1, R2, G, Z и Q определены в табл. 4 (см. в конце описания), синтезируют теми же способами, что и по предшествующим примерам. В тех соединениях, где R1 и R2 оба представляют метоксигруппу, метоксигруппа находится в 5- и 6-положениях, за исключением особо указанных случаев.
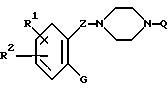
Пример 119. 5,6-Диметокси-1-(4-имидазолилметил)-3-[2-[1-[4-(3-хлор-2-метилфенил)пиперазинил]]этил]-1H-индазол•2HCl•3,5H2O.
Смесь 4,95 г 5,6-диметокси-1-(4-имидазолилметил)-3-[2-[1-[4-(3-хлор- 2-метилфенил)пиперазинил] ] этил] -1H-индазола и 20 мл 1 н. соляной кислоты перемешивают и к смеси добавляют воду до достижения общего объема 49,5 мл. Суспензию нагревают с обратным холодильником до тех пор, пока смесь не станет прозрачной. После охлаждения до комнатной температуры раствор перемешивают при этой температуре в течение ночи. Выпавшие кристаллы собирают фильтрацией. Кристаллы сушат при атмосферном давлении в течение 2 дней с получением 5,5 г указанного в заголовке соединения в виде бесцветных призм.
Точка плавления: 166 - 167oC.
ИК (KBr) см-1: 3400, 2850, 1625, 1505, 1460, 1425, 1245, 1150, 1010, 840.
1H-ЯМР (d6-DMSO) δ/ м.д.: 2,39 (3H, с), 3,30-3,80 (20H, м), 5,74 (2H, с), 7,15 (1H, дд), 7,28 (1H, с), 7,30 (1H, дд), 7,43 (1H, с), 7,52 (1H, с), 7,69 (1H, с), 9,13 (1H, с), 11,80 (1H, шир), 14,80 (1H, шир).
Элементный анализ для C26H31N6O2Cl• 2HCl•3,5H2O:
Рассчитано, %: C 49,41; H 6,54; N 13,30; Cl 16,83;
Найдено, %: C 49,15; H 6,44; N 13,29; Cl 16,99.
Ссылочный пример 45. 5,6-Диметокси-1-[4-(1-тритилимидазолил)метил]индазол-3-пропионовая кислота.
К охлаждаемому льдом раствору диметилмалоната (2,25 г) в тетрагидрофуране (50 мл) добавляют гидрид натрия (0,56 г) и смесь перемешивают 15 мин. К смеси добавляют по каплям раствор 3-хлорметил-5,6-диметокси-1-[4-(1-тритилимидазолил)метил] индазола (7,70 г) в тетрагидрофуране (50 мл). После перемешивания смеси в течение 1 ч смесь разбавляют этилацетатом. Смесь промывают водой и высушивают над безводным сульфатом натрия. Растворитель упаривают и остаток (5,5 г диэфирное производное), 1H-ЯМР (400 МГц, м.д., CDCl3) δ: 1,14 (6H, т, J = 6,8 Гц), 3,46 (2H, т, J = 7,8 Гц), 3,87 (3H, с), 3,90 (1H, т, J = 7,8 Гц), 3,92 (3H, с), 4,09 (4H, к, J = 6,8 Гц), 5,38 (2H, с), 6,64 (1H, с), 6,83 (1H, с), 6,97 (1H, с), 7,06 (6H, м), 7,29 (9H, м), 7,36 (1H, с), растворяют в смеси воды и этанола (1:1, по объему). К раствору добавляют гидроксид калия (1,32 г) и смесь нагревают с обратным холодильником в течение 1 ч. Смесь охлаждают до комнатной температуры и устанавливают pH 2,5 с помощью 1 н. соляной кислоты. Выпавший твердый продукт собирают фильтрацией и сушат (производное дикарбоновой кислоты, 4,40 г), 1H-ЯМР (400 МГц, м.д., CDCl3) δ : 3,54 (2H, т, J = 5,9 Гц), 3,65 (1H, т, J = 5,4 Гц), 3,68 (3H, с), 3,90 (3H, с), 5,09 (2H, с), 6,30 (1H, с), 6,43 (1H, с), 6,98 (7H, м), 7,30 (9H, м), 7,74 (1H, с), затем нагревают при 120oC в течение 30 мин с получением 4,00 г указанного в заголовке соединения.
1H-ЯМР (CDCl3, 400 МГц) δ м.д.: 2,81 (2H, т, J = 7,3 Гц), 3,17 (2H, т, J = 7,3 Гц), 3,85 (3H, с), 3,89 (3H, с), 5,32 (2H, с), 6,67 (1H, с), 6,75 (1H, с), 6,93 (1H, с), 7,05 (6H, м), 7,29 (9H, м), 7,74 (1H, с).
Ссылочный пример 46. 4-(3-Хлор-2-метилфенил)-1-[[5,6-диметокси-1-[4-(1-тритилимидазолил)метил]-1H-индазол-3-ил]пропил]пиперазин.
К смеси 5,6-диметокси-1-[4-(1-тритилимидазолил)метил]индазол- 3-пропионовой кислоты (3,6 г) в дихлорметане (30 мл) добавляют дисульфид 2,2'-дипиридила (1,66 г) и трифенилфосфина (1,98 г). Затем в течение 1 мин к смеси добавляют раствор 4-(3-хлор-2-метилфенил)пиперазина (1,60 г) в дихлорметане (30 мл). Смесь перемешивают дополнительно 1 ч и затем разбавляют дихлорметаном. Смесь промывают водой, высушивают над безводным сульфатом натрия и растворитель удаляют при пониженном давлении. Остаток хроматографируют на силикагеле с использованием этилацетата в качестве элюента с получением 4,3 г указанного в заголовке соединения.
1H-ЯМР (CDCl3, 400 МГц) δ м.д: 2,32 (3H, с), 2,57 (2H, м), 2,72 (2H, м), 2,83 (2H, т, J = 7,8 Гц), 3,25 (2H, т, J = 7,8 Гц), 3,49 (2H, м), 3,74 (2H, м), 3,87 (3H, с), 3,92 (3H, с), 5,40 (2H, с), 6,69 (1H, с), 6,77 (1H, д, J = 7,8 Гц), 6,84 (1H, с), 7,01 (1H, с), 7,05 (6H, м), 7,12 (2H, м), 7,29 (9H, м), 7,35 (1H, м).
Пример 120. 5,6-Диметокси-1-(4-имидазолилметил)-3-[2-[1-[4-(3-хлор-2-метилфенил)пиперазинил]]пропил]-1H-индазол.
К раствору 4-(3-хлор-2-метилфенил)-1-[[5,6-диметокси- 1-[4-(1-тритилимидазолил)метил]-1H-индазол-3-ил]пропил]пиперазина (4,3 г) в тетрагидрофуране (100 мл) добавляют 1,0 М раствор комплекса боран-тетрагидрофуран (56 мл) и смесь нагревают с обратным холодильником в атмосфере газа аргона 90 мин. Смесь охлаждают до комнатной температуры и к смеси добавляют воду. Тетрагидрофуран удаляют при пониженном давлении и к смеси добавляют концентрированную соляную кислоту (10 мл), воду (10 мл) и этанол (20 мл). Смесь перемешивают при 50oC в течение 1 ч, затем охлаждают до комнатной температуры. Смесь подщелачивают, затем экстрагируют хлороформом. Экстракт высушивают над безводным сульфатом натрия, фильтруют и растворитель выпаривают. Остаток хроматографируют на силикагеле с использованием смеси хлороформ : этанол (40:1 по объему) в качестве элюента.
Сырой продукт собирают и перекристаллизовывают из смеси изопропанол/изопропиловый эфир с получением 2,8 г указанного в заголовке соединения в виде бесцветных призм.
Точка плавления: 85 - 89oC.
1H-ЯМР (CDCl3, 400 МГц) δ м.д.: 2,03 (2H, м), 2,32 (3H, с), 2,53 (2H, т, J = 7,8 Гц), 2,63 (4H, м), 2,91 (6H, м), 3,91 (3H, с), 3,92 (3H, с), 5,45 (2H, с), 6,85 (1H, с), 6,92 (1H, м), 6,96 (1H, с), 7,08 (2H, м), 7,54 (1H, д, J = 1,0 Гц).
Элементный анализ для C27H33N6O2Cl:
Рассчитано, %: C 61,53; H 6,69; N 15,94; Cl 6,73;
Найдено, %: C 61,44; H 6,98; N 15,66; Cl 6,59.
Пример 121. 5,6-Диметокси-1-(4-морфолинсульфонамидобензил)-3-[2-[1-[4-(3-хлор-2-метилфенил)пиперазинил]]этил]-1H-индазол.
К смеси 3-[2-[1-[4-(3-хлор-2-метилфенил)пиперазинил]]этил]-1H-индазола (700 мг) в диметилсульфоксиде (10 мл) добавляют метилат лития (140 мг) и смесь перемешивают при комнатной температуре 15 мин. Затем к раствору за 1 мин добавляют раствор 4-морфолиносульфонамидобензилбромида (1570 мг, 68%-ная чистота, содержащий 32% 4-морфолиносульфонамидобензилового спирта) в диметилсульфоксиде (10 мл). Смесь перемешивают при 50oC в течение 1 ч. Смесь выливают в воду и выпавший твердый продукт собирают и промывают водой, затем высушивают. Продукт растворяют в хлороформе и раствор высушивают над безводным сульфатом натрия. Растворитель упаривают и остаток хроматографируют на силикагеле с использованием смеси хлороформ : этанол (100:1 по объему) с получением 0,84 г указанного в заголовке соединения в виде белого твердого продукта.
ИК (KBr) см-1: 2952, 2824, 1590, 1512, 1466, 1434, 1352, 1262, 1166, 1114, 1094, 1004, 944, 730.
1H-ЯМР (CDCl3, 400 МГц) δ м.д.: 2,35 (3H, с), 2,77 (4H, м), 2,97 (10H, м), 3,21 (2H, м), 3,73 (4H, м), 3,90 (3H, с), 3,95 (3H, с), 5,58 (2H, с), 6,60 (1H, с), 6,95 (1H, м), 7,09 (3H, м), 7,24 (2H, м), 7,67 (2H, м).
Пример 122. 5,6-Диметокси-1-(4-пиридилметил)-3-[2-[1-[4-(3-хлор-2-метилфенил)пиперазинил]]этил]-1H-индазол.
К смеси 3-[2-[1-[4-(3-хлор-2-метилфенил)пиперазинил]]этил]-1H-индазола (1 г) в диметилсульфоксиде (10 мл) добавляют метилат лития (200 мг) и смесь перемешивают при 50oC в течение 15 мин. Затем к раствору добавляют раствор гидрохлорида 4-хлорметилпиридина (433 мг) и смесь перемешивают при 50oC в течение 1 ч. Смесь выливают в воду и выпавший твердый продукт собирают, промывают водой и высушивают. Продукт растворяют в хлороформе и раствор высушивают над безводным сульфатом натрия.
Растворитель упаривают и остаток хроматографируют на силикагеле смесью хлороформ : этанол (15:1 по объему) с получением 235 г указанного в заголовке соединения в виде бесцветных игл.
Точка плавления: 117 - 118,5oC.
ИК (KBr) см-1: 2820, 1512, 1464, 1432, 1416, 1270, 1238, 1212, 1162, 1132, 1038, 1006.
1H-ЯМР (CDCl3, 400 МГц) δ м.д.: 2,35 (3H, с), 2,76-2,91 (4H, м), 2,93-2,97 (6H, м), 3,17-3,21 (2H, м), 3,87 (3H, с), 3,94 (3H, с), 5,50 (2H, с), 6,56 (1H, с), 6,94-6,97 (3H, м), 7,07-7,10 (3H, м), 8,52 (2H, д, J = 4,40 Гц).
Элементный анализ для C28H32N5O2Cl:
Рассчитано, %: C 66,46; H 6,37; N 13,84; Cl 7,01;
Найдено, %: C 66,43; H 6,42; N 13,74; Cl 7,26.
Пример 123. 3-[2-[1-[4-(3-хлор-2-метилфенил)пиперазинил]]этил]-1-(4-имидазолилметил)-5,6-метилендиокси-1H-индазол.
1,0 М раствор комплекса боран-тетрагидрофуран (10 мл) добавляют к 4-(3-хлор-2-метилфенил)-1-[[5,6-диметокси-1-[4-(1-тритилимидазолил)метил] -1H-индазол-3-ил] этил] пиперазину (1,91 г) в тетрагидрофуране (10 мл) и нагревают с обратным холодильником в атмосфере аргона в течение 90 мин. Реакционную смесь охлаждают до комнатной температуры и затем добавляют воду для разложения избытка реагентов. После упаривания тетрагидрофурана к этой смеси добавляют концентрированную соляную кислоту (1,0 мл), воду (1,0 мл) и этанол (2,0 мл) с последующим перемешиванием при 50oC в течение 1 ч. Реакционную смесь охлаждают до комнатной температуры и подщелачивают, затем экстрагируют хлороформом. Органический слой высушивают над безводным сульфатом натрия и фильтруют, и растворитель упаривают. Остаток хроматографируют на силикагеле смесью хлороформ : этанол (25:1) и перекристаллизовывают из смеси изопропиловый спирт/изопропиловый эфир с получением 3-[2-[1-[4-(3-хлор-2-метилфенил)пиперазинил] ] этил]-1-(4-имидазолилметил)- 5,6-метилендиокси-1H-индазола в виде бесцветных кристаллов (820 мг).
Точка плавления: 176 - 177oC.
ИК (KBr) см-1: 2944, 2900, 2832, 1462, 1374, 1274, 1244, 1004, 938, 838.
1H-ЯМР (CDCl3, 400 МГц) δ м.д.: 2,34 (3H, с), 2,73 (4H, м), 2,82-2,86 (2H, м), 2,93-2,95 (4H, м), 3,08-3,12 (2H, м), 5,40 (2H, с), 5,97 (2H, с), 6,79-6,96 (2H, м), 6,94 (1H, с), 7,06-7,10 (1H, м), 7,09 (1H, с), 7,54 (1H, с), 9,62 (1H, с).
Материал и методика эксперимента
1. Исследуемые соединения.
Соединение примера 18.
Структура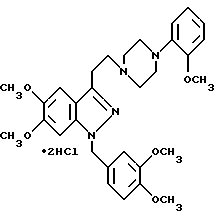
Соединение примера 101
Структура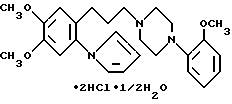
2. Испытания на животных.
Использовали восемьдесят самцов мышей линии Slc:ddY возраста 4-5 недель (22,5-27,4 г по весу). Этих мышей подвергали предварительным экспериментам в течение 6 дней, после чего из них отбирали здоровых мышей. В каждой группе испытаний использовали по пять особей равного веса, после чего их подвергали голодной выдержке в течение ночи перед введением проб.
3. Введение.
3.1. Доза.
Испытывали три различные дозы (200 мг/кг, 400 мг/кг и 800 мг/кг).
3.2. Методика.
Все пробы принудительно вводили при дозе 10 мг/кг с помощью зонда после их суспендирования в 0,5% водном растворе метилцеллюлозы.
5. Наблюдения.
Наблюдения над испытуемыми мышами проводили в течение 10 суток, включая первый день введения.
6. Оценка LD50.
Величины LD50 грубо оценивались, исходя из жизни и смерти (испытуемых особей).
Испытание на мышах токсичности единичной дозы (PO) представлено в табл. 5 (см. в конце описания).
Эффект ингибирования ФДЭ, зависящего от CaM
I. Методика испытания.
(1) В стеклянную трубку (в ледяной воде) помещали следующую реакционную смесь:
50 мМ ТРИС-HCl (pH 7,5) 175 мкл,
50 мМ MgCl2 50 мкл,
1 мМ CaCl2 (используемого для измерения Ca2+-зависящей активности) или 10 мМ ЭДТК (используемой для измерения активности, не зависящей от Ca2+) 0,2 ед/мл ФДЭ 50 мкл,
Раствор CaM 10 ед/мл или в различных концентрациях (содержащий мг/мл БСА) 50 мкл,
Раствор пробы/ДМСО/50 мМ ТРИС 25 мкл.
(2) Раствор [3H]-цГМФ добавляли к 250 мкМ раствора цГМФ в количестве от 2000 до 3000 числ.расп.мин/мл с получением раствора субстрата (1 мкл горяч. /1 мл раствора).
(3) 100 мкл полученного раствора субстрата вносили в стеклянную трубку, перемешивали и затем инкубировали при 30oC в течение 10 мин.
(4) После нагрева в течение 1 мин в кипящей воде реакцию прекращали.
(5) После добавления 50 мкл водного раствора змеиного яда в стеклянную трубку смесь перемешивали и затем инкубировали при 30oC в течение 10 мин.
(6) К системе добавляли 500 мкл суспензии смолы и ее оставляли выстаиваться в течение 15 мин в ледяной воде при периодическом перемешивании.
(7) Полученный раствор центрифугировали при 1600 об/мин при 4oC в течение 20 мин.
(8) После отбора пробы 500 мкл супернатанта полученный таким образом супернатант смешивали с 10 мл сцинтилляционной смеси ASC-11 и с помощью жидкостного сцинтилляционного счетчика считывали ее радиоактивность.
II. Расчет ингибиторной активности по отношению к ФДЭ, %.
(1) Расчет зависящей от CaM активности ФДЭ.
Зависящую от Ca2+/CaM активность рассчитывали по следующему уравнению для каждой концентрации пробы:
(зависящая от Ca2+/CaM активность) = (радиоактивность трубки для измерения Ca2+-зависящей активности) - (радиоактивность трубки для измерения не зависящей от Ca2+-активности).
(2) Активность в присутствии каждой пробы рассчитывали в процентном отношении на основе активности (100%) разбавителя.
III. Расчет ингибиторной активности по отношению к ФДЭ (индекса ингибирования).
(1) Расчет концентрации 50% активации для CaM против ФДЭ.
Концентрацию 50% активации CaM (величина EC50) была рассчитана в присутствии пробы и разбавителя (5% DNSO).
(2) Расчет индекса ингибирования.
Индекс ингибирования рассчитывали по следующему уравнению: (индекс ингибирования) = (EC50 для CaM в присутствии пробы)/(EC50 для CaM в присутствии разбавителя).
IV. Реагент:
(1) раствор [3H]-цГМФ: NEM,
Циклический гуанозин-3'5'-фосфат-[3H]
(2) 50 мМ ТРИС-HCl (pH 7,5).
Следующие реагенты (за исключением змеиного яда и смолы) были приготовлены с 50 мМ ТРИС-HCl:
(3) 50 мМ MgCl2,
(4) 1 мМ CaCl2,
(5) 10 мМ EGTA,
(6) 1 мг/мл БСА,
(7) 10 ед/мл кальмодулина (CaM):Sigma
3'5'-циклический нуклеотид-активатор фосфодиэтеразы из мозга быка
2500 ед/пузырек/2,5 мл 1 мг/мл БСА в ТРИС
50 мкл 1000 ед/мл + 4,95 мл БСА 1 мг/мл = 10 ед/мл,
(8) 0,2 ед/мл ФДЭ: (Sigma, Lot 71H9520)
3'5'-циклический нуклеотид фосфодиэстеразы из мозга быка
1 ед/пузырек/5 мл 50 мМ ТРИС = 0,2 ед/мл,
(9) 250 мкМ цГМФ: 3', 5'-циклический гуанозинмонофосфат (Sigma, Lot 121H0549)
9,5 мл 50 мМ ТРИС-HCl добавляли к 0,5 мл 5 мМ цГМФ,
(10) 1 мг/мл водного раствора змеиного яда
фосфодиэстераза 1, Тип V из Bothrops atrox (Sigma, Lot 100H0074),
(11) Суспензия анионообменной смолы в метаноле (1:5 в/о).
После активации хлоридной формы AG1-X8 (200-400 меш) (Sigma, Lot 35492) с помощью 0,01 н. NaOH конечный раствор промывали чистой водой до нейтральной реакции, а затем сушили.
(12) Сцинтилляционная смесь ACS-11.
V. Результаты.
Результаты приведены в табл. 6 (см. в конце описания).
Хотя изобретение описано подробно и со ссылками на конкретные его примеры, специалист может использовать различные варианты и модификации изобретения, не выходя за объем его притязаний.
| название | год | авторы | номер документа |
|---|---|---|---|
| КРИСТАЛЛИЧЕСКИЙ ДИГИДРОХЛОРИД 3-[2-[4-(3-ХЛОР-2-МЕТИЛФЕНИЛ)-1-ПИПЕРАЗИНИЛ]ЭТИЛ]-5,6-ДИМЕТОКСИ-1- (4-ИМИДАЗОЛИЛМЕТИЛ)-1Н-ИНДАЗОЛА И ЕГО 3,5-ГИДРАТ, СПОСОБЫ ИХ ПОЛУЧЕНИЯ | 1995 |
|
RU2152941C1 |
| ПРОИЗВОДНЫЕ ПИПЕРАЗИНА И СПОСОБ ИХ ПОЛУЧЕНИЯ | 1997 |
|
RU2146254C1 |
| ПРОИЗВОДНЫЕ ПИРИМИДИНИЛПИРАЗОЛА И ПРОТИВООПУХОЛЕВОЕ СРЕДСТВО | 1995 |
|
RU2146675C1 |
| ЛЕКАРСТВЕННЫЙ ПРЕПАРАТ ДЛЯ НЕЙРОПРОТЕКЦИИ (ВАРИАНТЫ) | 1994 |
|
RU2135162C1 |
| ПРОИЗВОДНЫЕ ПИРАЗОЛА | 2004 |
|
RU2332412C2 |
| ПРОИЗВОДНЫЕ ПИРАЗОЛА, МЕДИЦИНСКИЕ КОМПОЗИЦИИ, СОДЕРЖАЩИЕ ИХ, ИХ ПРИМЕНЕНИЕ В МЕДИЦИНЕ И ПРОМЕЖУТОЧНЫЕ СОЕДИНЕНИЯ ДЛЯ ИХ ПОЛУЧЕНИЯ | 2003 |
|
RU2369613C2 |
| ПРОИЗВОДНЫЕ ПИПЕРАЗИНА И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ | 1996 |
|
RU2126001C1 |
| ПРОИЗВОДНЫЕ ПИПЕРИДИНА И СРЕДСТВО, СОДЕРЖАЩЕЕ ПРОИЗВОДНОЕ ПИПЕРИДИНА В КАЧЕСТВЕ АКТИВНОГО ИНГРЕДИЕНТА | 2001 |
|
RU2275359C2 |
| КОНДЕНСИРОВАННОЕ ГЕТЕРОЦИКЛИЧЕСКОЕ ПРОИЗВОДНОЕ, СОДЕРЖАЩАЯ ЕГО ЛЕЧЕБНАЯ КОМПОЗИЦИЯ И ЕЕ ПРИМЕНЕНИЕ В МЕДИЦИНЕ | 2006 |
|
RU2418803C2 |
| ГЕТЕРОЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ ИЛИ ИХ ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМАЯ СОЛЬ, ПРОМЕЖУТОЧНЫЕ СОЕДИНЕНИЯ | 1994 |
|
RU2176640C2 |
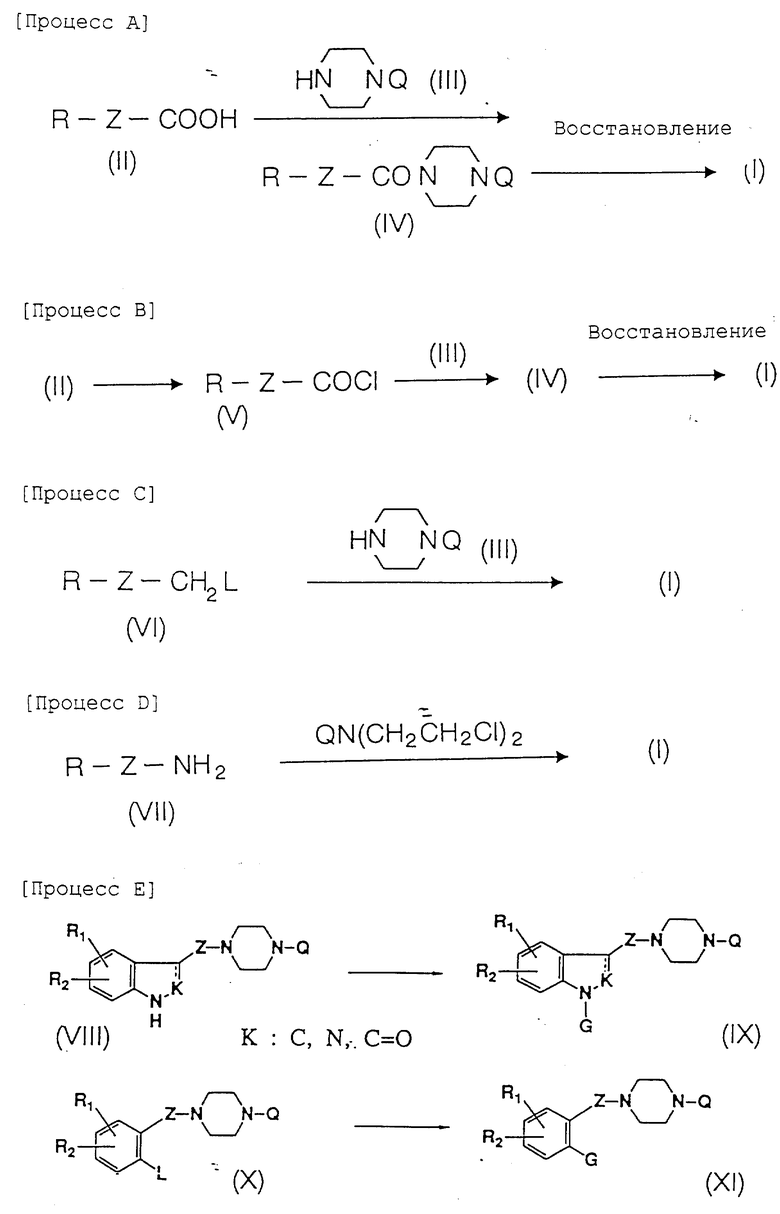


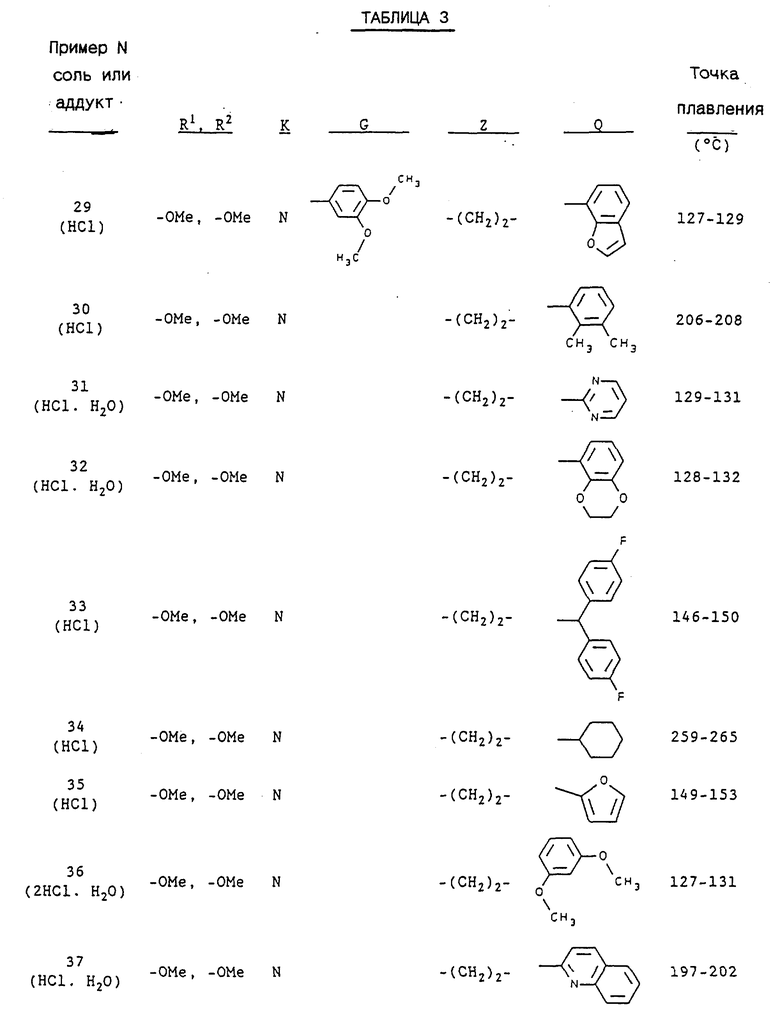
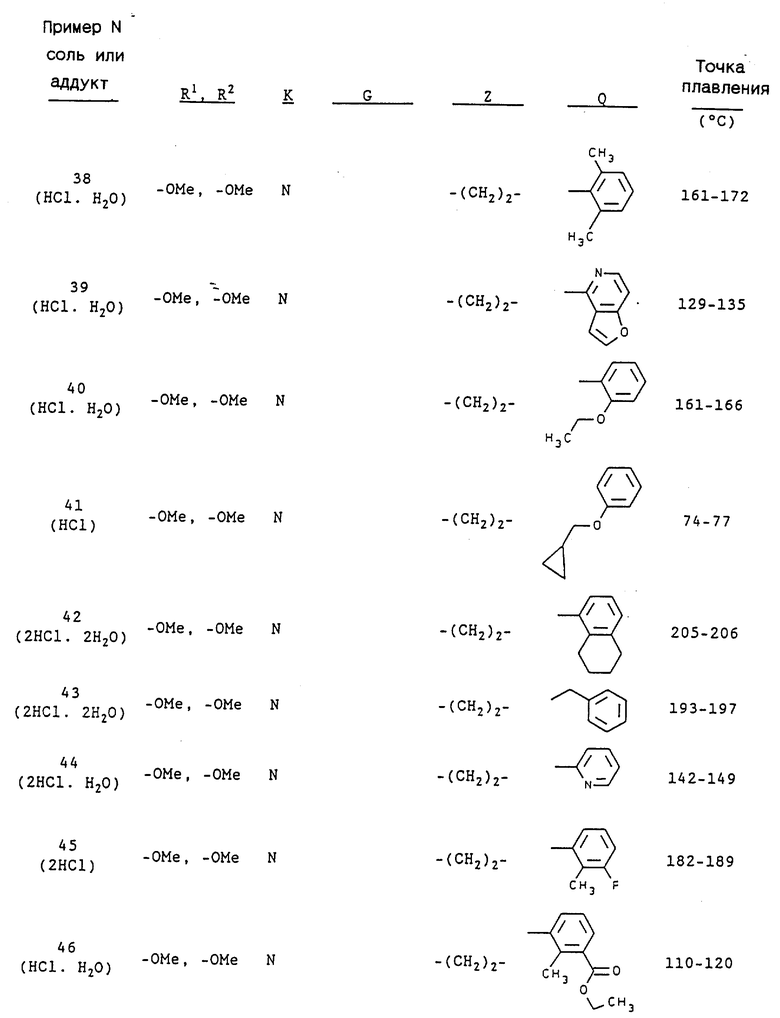
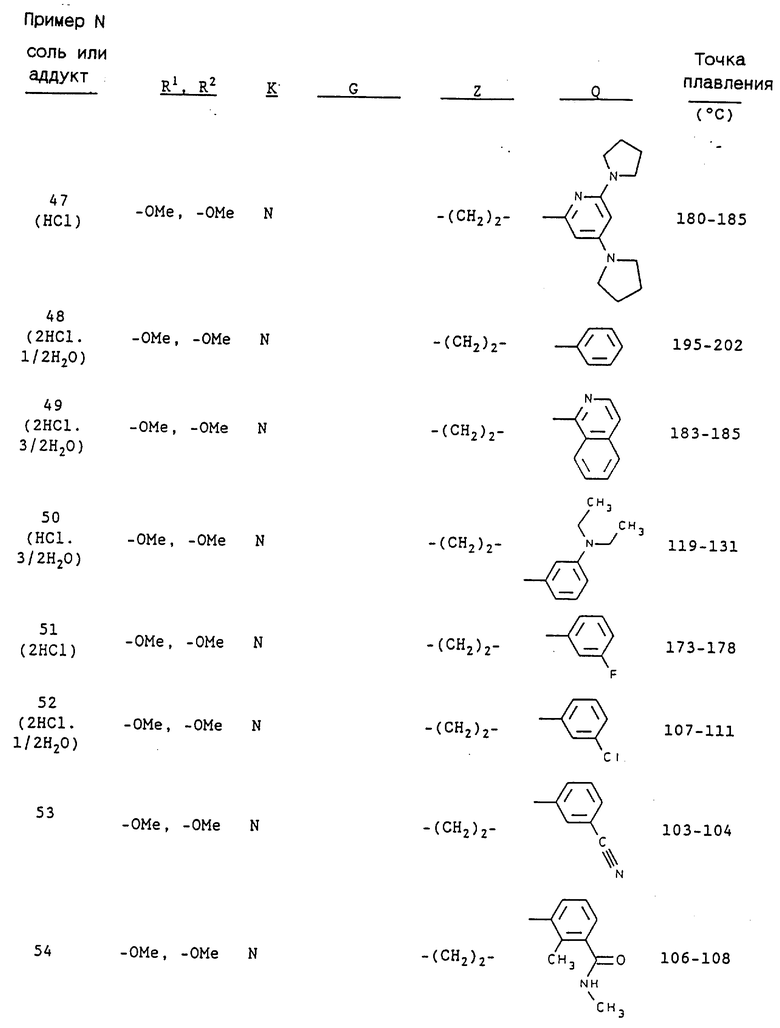
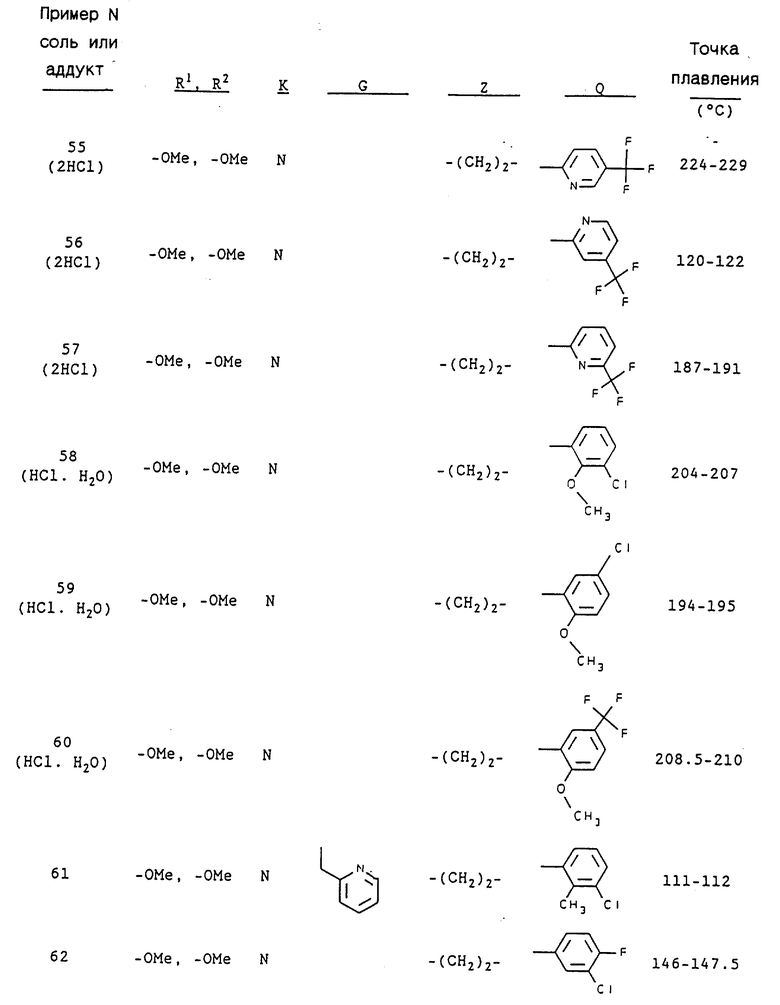
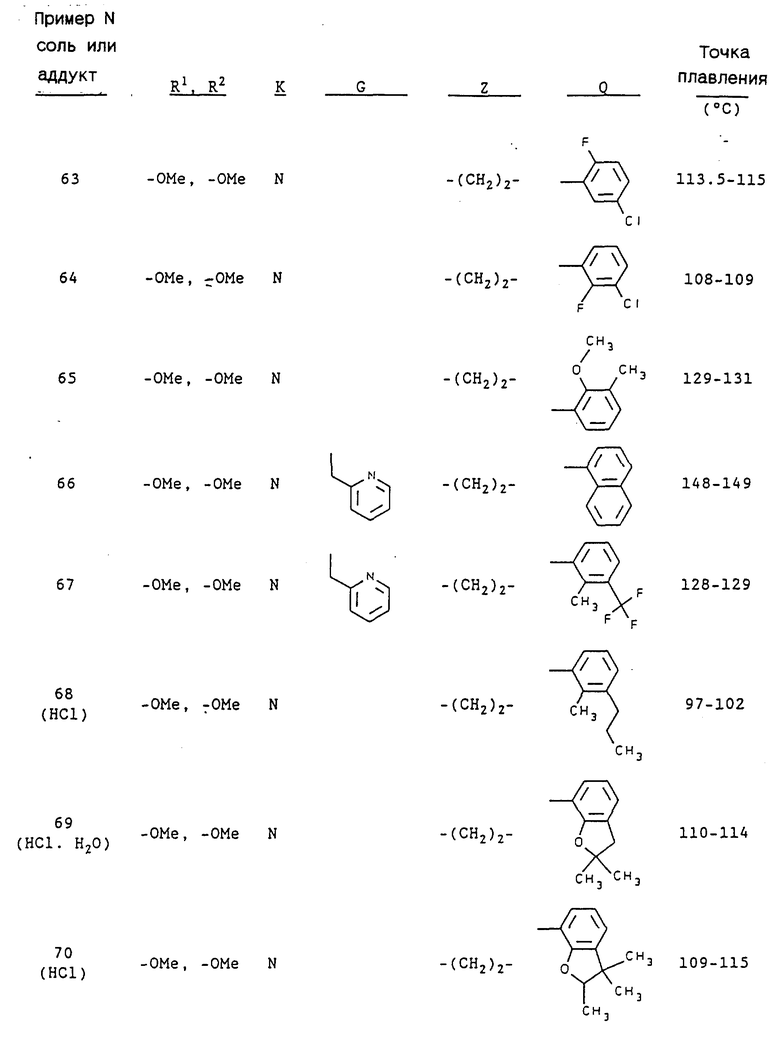
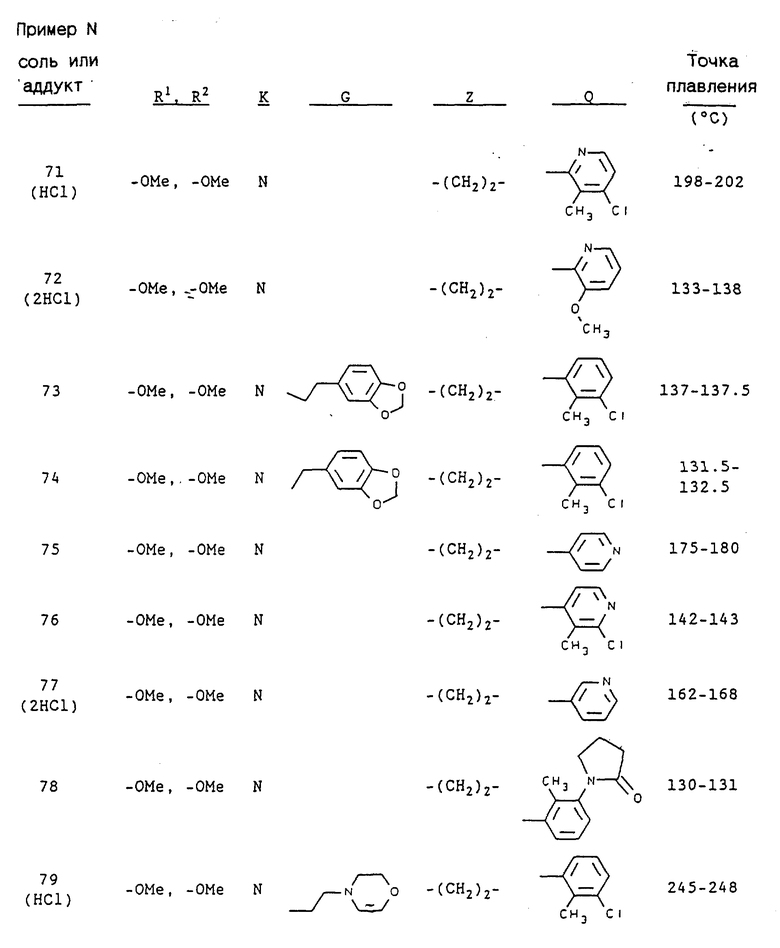
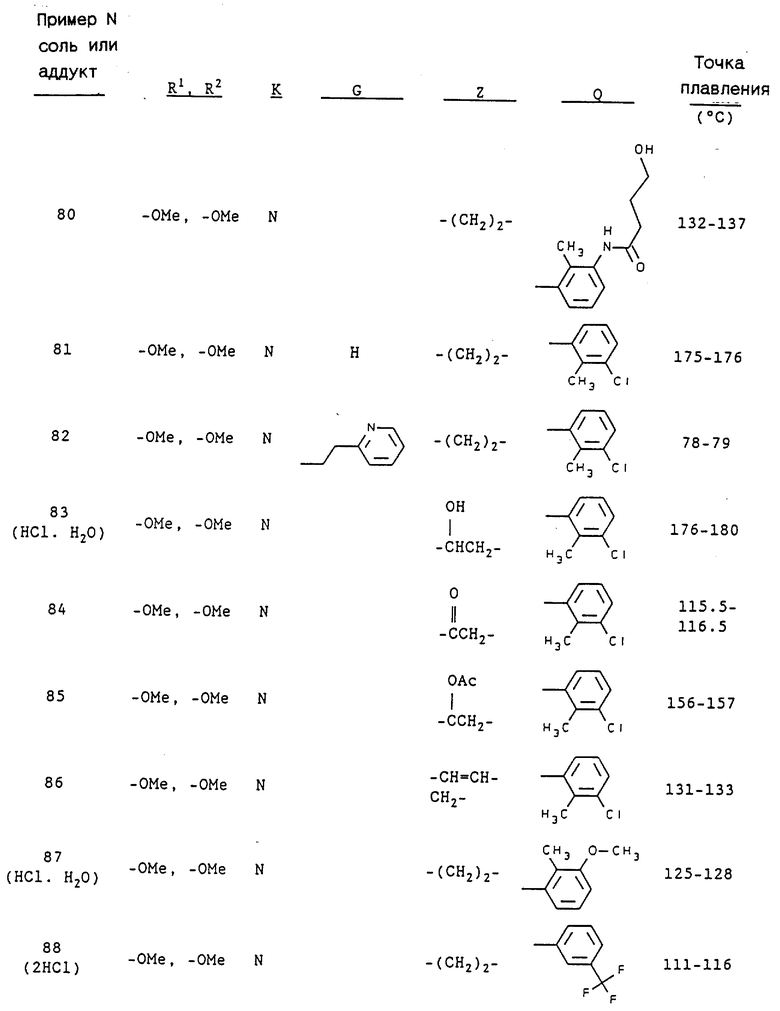
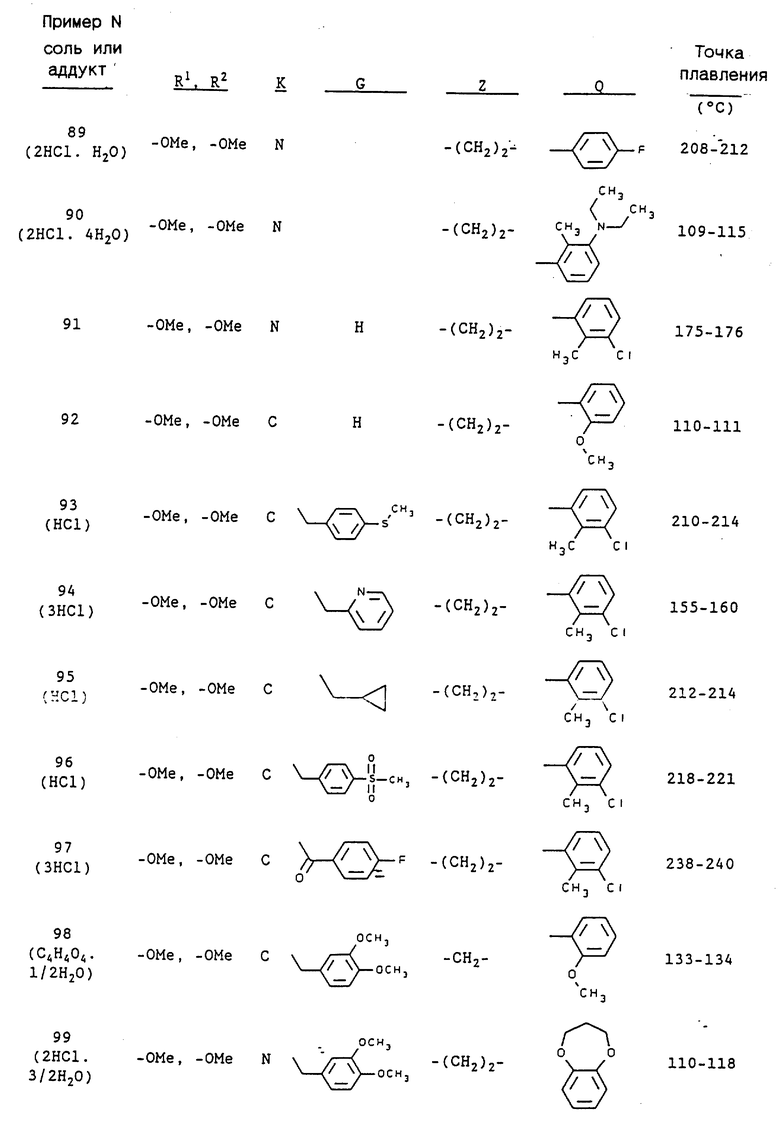
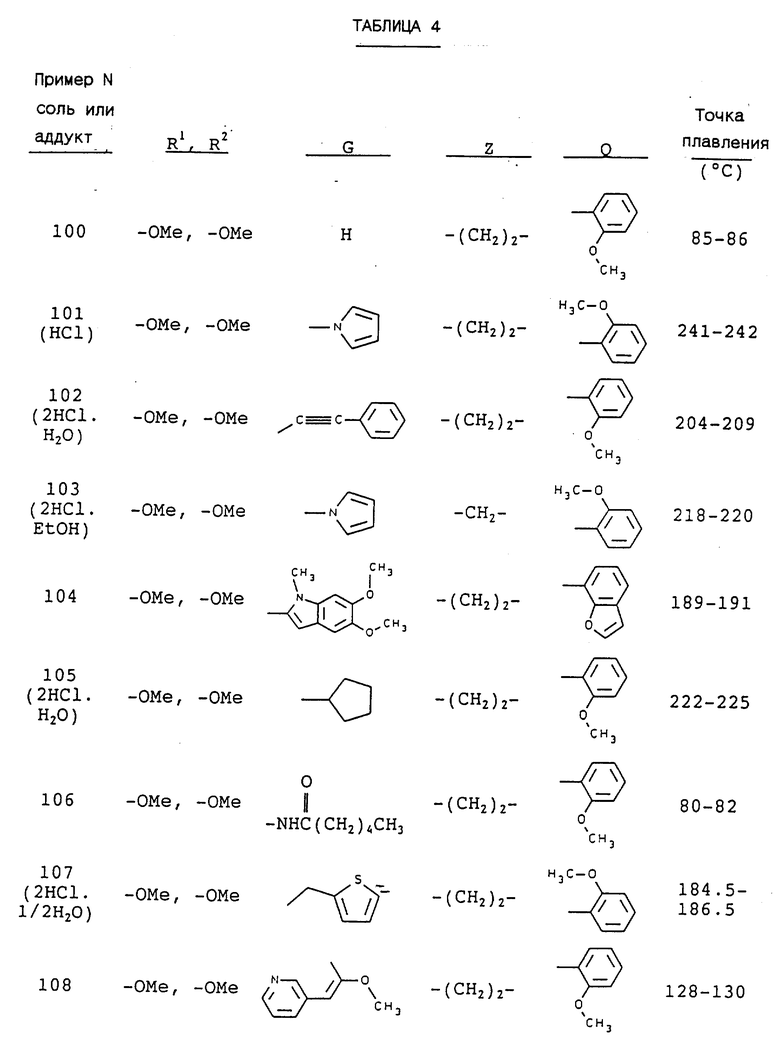
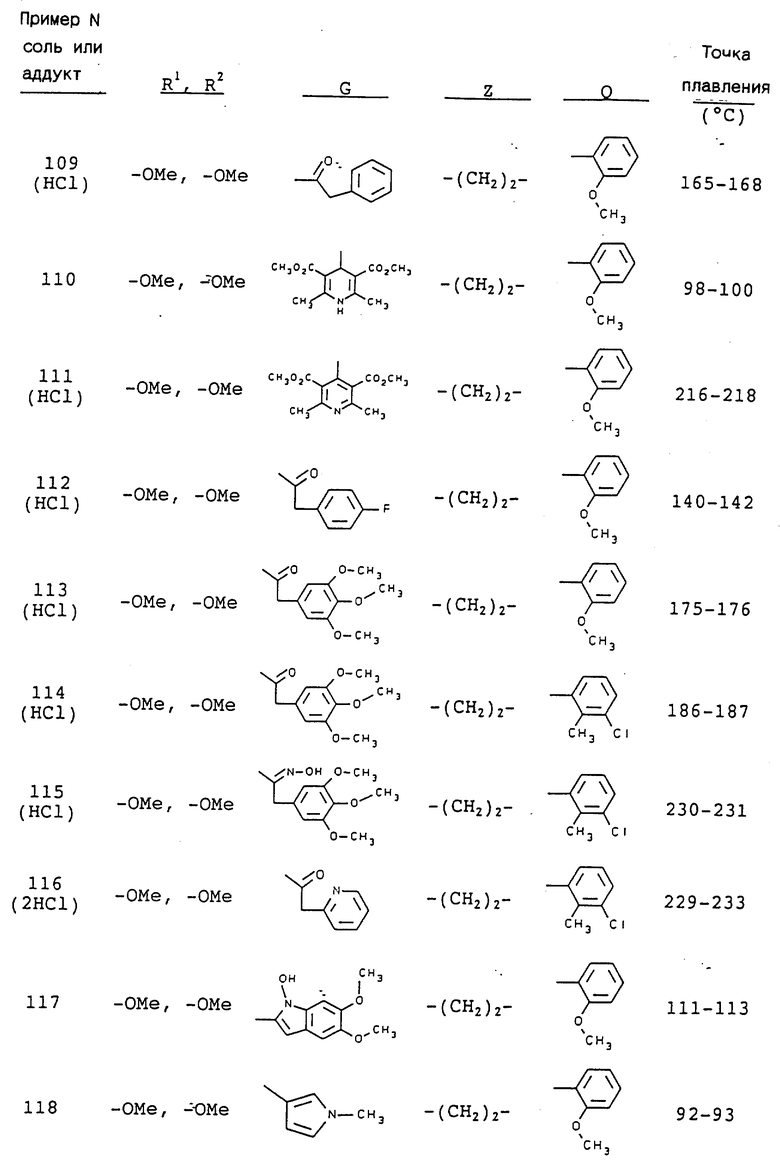
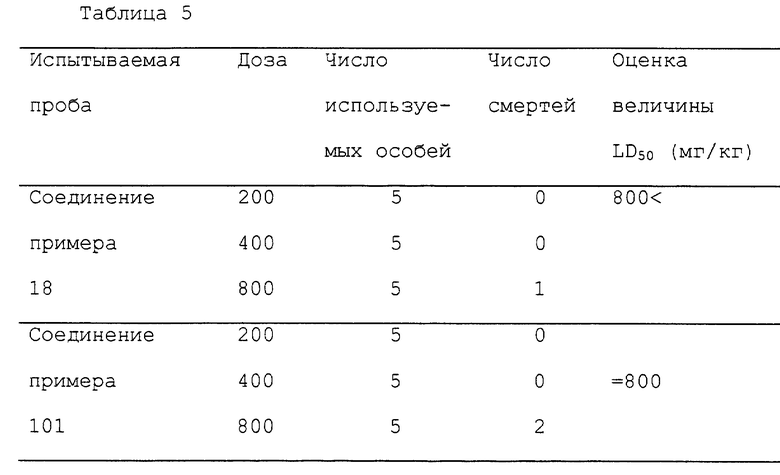

Производные пиперазина формулы I, где Q - фенил, нафтил, пиридил, пиримидил, изохинолинил, фурил, бензофуранил, дигидробензофуранил, бензил, дифенилметил, возможно замещенные 1 или более заместителями, выбранными из алкила, алкоксила, трифторметила, диалкиламино, галогена, циано и этилендиоксигруппы; R - группы (а) и (б), где R1 и R2 - C1-C6-алкоксил или метилендиоксигруппа; G - C3-C6-циклоалкил, фенил, бензоил, бензилкарбонил, альфа-гидроксибензил, пирролил, где атом азота имеет атом водорода или алкил или участвует в связывании с R, алкильная группа, замещенная гетероциклической группой (тиенил, имидазолил); алканоиламиногруппа, морфолиноалкил, 1-алкилиндол-2-ильная группа, фенилалкил. Соединения формулы I могут быть использованы в качестве лечебного агента при различных заболеваниях органов кровообращения или церебральной области, особенно таких заболеваний, которые вызваны избыточной активацией кальмодулина. 12 з.п. ф-лы, 6 табл., 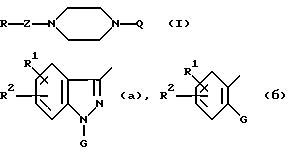
где Q представляет фенильную, нафтильную, пиридильную, пиримидильную, изохинолильную, фурильную, бензофуранильную, дигидробензофуранильную, бензильную, дифенилметильную группу, при этом указанные группы могут быть замещены одним или более заместителями, выбранными из группы: алкильной группы, имеющей от 1 до 6 атомов углерода, алкоксильной группы, имеющей от 1 до 6 атомов углерода, трифторметильной группы, диалкиламиногруппы, имеющей от 1 до 6 атомов углерода в каждой ее алкильной части, атома галогена, цианогруппы и этилендиоксигруппы, причем указанные заместители на дифенилметильной группе имеют место на фенильном ядре, или циклоалкильную группу, имеющую от 3 до 8 атомов углерода;
R представляет группы
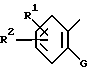
где R1 и R2 независимо представляют алкоксильную группу, имеющую от 1 до 6 атомов углерода, или метилендиоксигруппу;
G представляет циклоалкильную группу, содержащую 3-6 атомов углерода; замещенную или незамещенную фенильную группу, бензоил, где фенильный фрагмент замещен или незамещен; бензилкарбонил, где фенильный фрагмент замещен или незамещен; альфа-гидроксибензильную группу, в которой фенильная часть замещена или незамещена; замещенную или незамещенную пирролильную группу, где атом азота имеет атом водорода или алкильную группу, имеющую от 1 до 6 атомов углерода, или участвует в связывании с R, алкильную группу, замещенную гетероциклической группой, состоящую из замещенной или незамещенной тиенильной группы, замещенной или незамещенной имидазолильной группы, замещенной или незамещенной пиридильной группы и C1-C3 алкиленовой группы; алканоиламиногруппу, имеющую от 2 до 7 атомов углерода; морфолиноалкильную группу, состоящую из морфолиновой группы и C1-C3 алкиленовой группы; 1-алкилиндол-2-ильную группу, имеющую от 1 до 6 атомов углерода в алкильной части, где индольная часть может быть дополнительно замещена; фенилалкильную группу, состоящую из замещенной или незамещенной фенильной группы и C1-C6 алкиленовой группы; и атом водорода, причем, когда заместитель G имеет заместители, последние являются членами, выбранными из алкильной группы, имеющей от 1 до 6 атомов углерода, алкоксильной группы, имеющей от 1 до 6 атомов углерода, алкилтиогруппы, имеющей от 1 до 6 атомов углерода, алкилсульфонильной группы, имеющей от 1 до 6 атомов углерода, атома галогена и метилендиоксигруппы;
Z представляет C1-C3 алкиленовую группу, C2-C4 алкениленовую группу, C1-C3 алкиленовую группу, имеющую одну гидроксильную группу, или алкиленовую группу, содержащую карбонильную группу на одном конце или в середине углеродной цепи,
или соль соединения.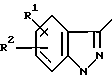
3. Соединение по п.1, где заместитель R имеет структуру, представленную следующей формулой: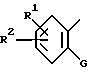
4. Соединение по пп. 1,2 или 3, где заместитель Q является фенильной группой, имеющей по крайней мере один заместитель в мета-положении по отношению к месту присоединения фенильной группы к пиперазиновой части.
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Способ изготовления керамического многослойного огнеупора | 1976 |
|
SU637391A1 |
| US 4761411, 1988 | |||
| GB 1554275, 1979 | |||
| DE 3507983, 1985 | |||
| Приспособление для передвижения железнодорожных повозок | 1933 |
|
SU39190A1 |
| US 4775673, 1988. | |||
Авторы
Даты
1999-01-10—Публикация
1994-05-12—Подача