Изобретение относится к новым нитрометилкетонам, к их получению и их применению в качестве лекарственных средств, прежде всего при лечении и профилактике осложнений при диабете.
Диабет характеризуется высокой концентрацией глюкозы в крови. В условиях нормального метаболизма на первой стадии гликолиза эта глюкоза под действием фермента гексокиназы подвергается превращению, ведущему к расщеплению до пирувата. Когда концентрация глюкозы оказывается слишком высокой, происходит насыщение гексокиназы, и превращение глюкозы проходит по второму пути, который представляет собой полиоловый путь, включающий последовательное действие двух ферментов, т.е. альдозоредуктазы, которая превращает глюкозу в сорбит, и сорбитдегидрогеназы, которая превращает сорбит во фруктозу. В случае диабета избыток глюкозы ускоряет образование сорбита, который проявляет тенденцию к накоплению. Результатом этого являются серьезные нарушения обмена веществ, такие, как, например, повышение осмотического давления, которое может привести к перерождению ткани. Таким образом, для лечения или профилактики некоторых осложнений, вызванных диабетом, могут быть использованы ингибиторы альдозоредуктазы.
В литературе описано множество таких продуктов, как ингибиторы альдозоредуктазы, которые проявляют действие как in vitro, так и in vivo.
Они представляют собой главным образом производные гидантоинов, сукцинимидов и производных уксусной кислоты, а более поздние - производные сульфонилнитрометанов.
Настоящее изобретение относится к нитрометилкетоновым производным и к их аддитивным солям с физиологически приемлемыми основаниями, соответствующим общей формуле (I):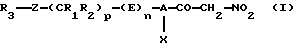
в которой А обозначает С6-С10арил или необязательно ароматический трехдесятичленный гетероцикл, содержащий от одного до четырех одинаковых или различных гетероатомов, выбранных из О, S и N,
Х обозначает галоген, цианогруппу, С1-С7алкил, трифторметил, С2-С7алкокси- или трифторметоксигруппу,
R1 и R2 могут быть одинаковыми или различными и каждый из них обозначает водород, С1-С7алкил, С3-С12циклоалкил, трифторметил или С1-С7алкоксигруппу или же R1 и R2 совместно образуют алкиленовую цепь типа -(СН2)r-, где значения r выбирают из 2, 3 и 4,
р выбирают из 0, 1, 2, 3, 4 и 5,
Z обозначает связь, двухвалентный радикал -CO-NH-, в котором карбонильная группа связана с R3, двухвалентный радикал -SO2-NH-, в котором сульфонильная группа связана с R3, С2-С7алкениленовый радикал, атом серы, сульфинильную группу или сульфонильную группу,
R3 обозначает водород, галоген, три(С1-С7алкил)силил, С1-С7алкил, необязательно замещенный одним или несколькими одинаковыми или различными радикалами Y, С6-С10арил, необязательно замещенный одним или несколькими одинаковыми или различными радикалами Y, С6-С10арилоксигруппу, необязательно замещенную одним или несколькими одинаковыми или различными радикалами Y, С3-С12циклоалкил, необязательно замещенный одним или несколькими одинаковыми или различными радикалами Y, необязательно ароматический трех-десятичленный гетероцикл, содержащий от одного до четырех одинаковых или различных гетероатомов, выбранных из О, S и N, причем этот гетероцикл необязательно замещен одним или несколькими одинаковыми или различными радикалами Y, или R3 обозначает инданил, 1,3-дигидро-1,3-диоксо-2Н-изоиндол-2-ил, 1,3-бензодиоксолил, 2-оксопиперидинил или 2-[(4-нитрометилкарбонил-3-хлорфенил)аминокарбонил]-1-(фенил)этил,
Y обозначает галоген, С1-С7алкил, С1-С7алкоксигруппу, трифторметил, карбокси, карбамоил, С1-С7алкилкарбамоил, ди(С1-С7)алкилкарбамоил, С1-С7алкоксикарбонил, амино-, С1-С7алкиламино-, ди(С1-С7)алкиламино-, нитро-, цианогруппу, гидроксил, трифторметоксигруппу, С3-С12-циклоалкил, сульфо-, С1-С7алкилтиогруппу, С1-С7алкилсульфинил, С1-С7алкилсульфонил, С2-С8алкилкарбонил, С2-С8алкилтиокарбонил, С2-С8алкилкарбониламиногруппу или С6-С10арил,
Е обозначает двухвалентный радикал, выбранный из группы, включающей
(I) радикал -CO-NR4-, у которого карбонильная группа связана с -(CR1R2)p-, a R4 обозначает радикал -(CH2)qR5, где значения q выбирают из 0 и 1 и где R5 обозначает водород, или включающей далее С1-C7алкил, С6-С10арил или необязательно ароматический трех- десятичленный гетероцикл, содержащий от одного до четырех одинаковых или различных гетероатомов, выбранных из О, N и S, или R5 и R3 совместно образуют связь,
(II) радикал -SO2-NR4-, у которого сульфонильная группа связана с -(CR1R2)p-, а значения R4 указаны выше,
(III) радикал -NR4-, у которого значения R4 указаны выше,
(IV) радикал -CH=N-, у которого азотный атом связан с А, и
(V) кислород,
n обозначает 0 или 1,
при условии, что -A(X)-(E)n-(CR1R2)p-Z-R3 не обозначает галоидфенил, метилфенил, дихлорфенил, диметилфенил, 4-этокси-2-метиламинофенил, метилиндолил, диметилиндолил, 2-гидроксифенил, замещенный группой X, 2-метоксифенил, замещенный группой X, и необязательно замещенный 2-фторфенил, как указано выше, и при условии, что когда А обозначает пиридил, Х обозначает метил, значение n равно 1, а Е не обозначает радикал -NR4-.
Эти соединения являются ингибиторами фермента альдозоредуктазы и могут быть использованы при лечении или профилактике осложнений при диабете, неврологических, периферических и автономных осложнений, почечных осложнений и глазных болезней, таких как катаракта и ретинопатия.
Физиологически приемлемые соли соединений формулы (I) включают соли, образуемые металлами (такими, как натрий, калий, кальций, магний, алюминий), основаниями, такими как гидроксид аммония и замещенные амины (например, диэтиламин, триэтиламин, пиперидин, пиперазин, морфолин), основными аминокислотами (такими, как лизин, аргинин), озаминами (такими, как меглумин) или аминоспиртами (такими, как 3-аминобутанол, 2-аминоэтанол).
Термином "арил" обозначают ароматическую моно- или бициклическую группу, включающую 6-10 углеродных атомов, такую как фенил или нафтил.
Термином "гетероцикл" обозначают моно- или бициклическое кольцо ароматического или иного характера, содержащее 3-10 кольцевых атомов углерода, 1-4 из которых заняты одинаковыми или различными гетероатомами, выбранными из кислорода, серы и азота, такое, как, например, азиридинил, оксиранил, оксазолил, фурил, тетрагидрофуранил, тиенил, имидазолил, пиридил, пиразинил, бензотиенил, бензопиранил, бензофурил, бензотиазолил, пиримидинил, пиридазинил, пиперидинил, хинолил, тетрагидрохинолил, тетразолил, фталазинил, пуринил, индолил, хроменил, хроманил, изохроманил и пирролил.
Термин "циклоалкил" служит для обозначения насыщенных углеводородных групп, содержащих 3-12 углеродных атомов, предпочтительно 3-8, таких, как циклопропил, циклобутил, циклопентил, циклогексил, циклогептил, циклооктил, циклононил, циклодецил, циклоундецил и циклододецил.
Термин "галоген" служит для обозначения атома фтора, хлора, брома или иода.
Термин "алкил" используют для обозначения линейного или разветвленного углеводородного радикала, такого как метил, этил, пропил, изопропил, бутил, трет-бутил, изобутил, пентил, гексил, гептил.
Термином "алкоксигруппа" обозначают алкильную группу, связанную с кислородным атомом. Ее примерами являются метокси-, этокси-, изопропилокси-, бутокси-, гексилоксирадикалы.
Подобным же образом термином "арилоксигруппа" обозначают арильный радикал, как он определен выше, связанный с кислородным атомом, такой, как фенокси- и нафтилоксирадикал.
В контексте настоящего изобретения под термином "алкениленовый" радикал понимается, помимо прочего, двухвалентный углеводородный радикал, несущий одну или несколько этиленовых двойных связей, такой, как, например, -СН= СН-СН2- или -СН=СН-СН=СН-.
Понятием "карбамоильный" радикал обозначают одновалентный радикал формулы -CO-NH2. Радикалом "(С1-С7)алкилкарбамоил" называют карбамоиловый радикал, замещенный при атоме азота С1-С7алкильной группой, а под радикалом "ди(С1-С7)алкилкарбамоил" подразумевают карбамоильный радикал, замещенный при атоме азота двумя С1-С7алкильными группами.
Радикалом "(С1-С7)алкоксикарбонил" называют радикал R-O-CO-, у которого R обозначает С1-С7алкильную группу.
Радикалом "(С1-С7)алкиламин" называют аминогруппу, замещенную при атоме азота С1-С7алкильным радикалом, а под радикалом "ди(С1-С7)алкиламин" подразумевают аминогруппу, при атоме азота замещенную двумя (C1-С7)алкильными радикалами.
Терминами "алкилтиогруппа", "алкилсульфинил" и "алкилсульфонил" обозначают алкильную группу, связанную с атомом серы, который соответственно является неокисленным, моноокисленным или диокисленным, такую, как метилтиогруппа, метилсульфинил или метилсульфонил.
Некоторые соединения этого типа известны. Так, например, в DE 2415350 описаны противоаллергические соединения формулы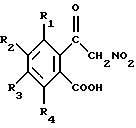
где R1, R2, R3 и R4 могут быть одинаковыми или различными и каждый может обозначать атом водорода или галогена, алкил, алкокси-, арильную или арилалкильную группу, гетероцикл или попарно карбоцикл или гетероцикл.
В DE 2741011 описаны антигистамино-противоаллергические соединения общей формулы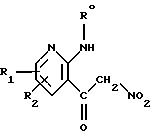
в которой Ro обозначает водород, (С1-С6)алкил, (С3-С6)циклоалкил, (С3-С6)циклоалкил(С1-С2)алкил, (С3-С6)алкенил или (С3-С6)алкинил или радикал формулы
В ЕР 0574231 описаны обладающие антибиотическим действием нитрометилкетоновые производные, связанные с полизамещенными нафтиридинами и хинолинами.
В литературе описаны и другие нитрометилкетоновые производные, например, в качестве промежуточных продуктов синтеза, но в ранее опубликованных источниках отсутствуют сведения о возможности терапевтического применения этих соединений. При этом можно упомянуть, например, работы J. SETER, Israel J. Chem. (1966) 4, 7-22, BAKER D.C. и PUTT S.R., Synthesis (1978) 678-9, FIELD G. F. и ZALLY W.J., Synthesis (1979) 295-6, и HAMADA Yasumasa и др., Chem. Pharm. Bull. (1981) 29, 259-61.
Известные нитрометилкетоновые производные не соответствуют формуле (I), которой отвечают соединения по изобретению. Более того, не описано ни одно из этих соединений как обладающее каким-либо ингибирующим воздействием на альдозоредуктазу.
Предпочтительными соединениями по изобретению являются те, у которых в формуле (I):
А обозначает фенил, n и р обозначают 0, Z обозначает связь, а R3 обозначает водород, или
А обозначает фенил, n обозначает 1, а Е обозначает группу -CO-NR4-, в частности, те, у которых p обозначает 1, R1 и R2 обозначают водород, а Z обозначает связь, или
А обозначает фенил, n обозначает 1, Е обозначает группу -SO2-NR4-, или
А обозначает фенил, n равно 1, Е обозначает группу -CO-NR4-, p равно 0, а Z обозначает группу -SO2-NH-, или
А обозначает ароматический гетероцикл, такой как бензотиенил или тиенил, или
А обозначает нафтил, или
n обозначает 1, а Е обозначает кислород.
Другая группа предпочтительных соединений включает соединения формулы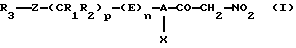
в которой
А обозначает фенил, нафтил, бензотиенил или тиенил,
Х обозначает галоген, цианогруппу, С1-С7алкил, трифторметил, С2-С7алкокси- или трифторметоксигруппу,
R1 и R2 каждый обозначает водород или R1 и R2 совместно образуют алкиленовую цепь типа -(СН2)r-, где значения r выбирают из 2, 3 и 4,
p выбирают из 0, 1, 2 и 3,
Z обозначает связь, двухвалентный радикал -CO-NH-, в котором карбонильная группа связана с R3, или двухвалентный радикал -SO3-NH-, в котором сульфонильная группа связана с R3,
R3 обозначает водородный атом, С1-С7алкил, необязательно замещенный одним или несколькими одинаковыми или различными радикалами Y, фенил, необязательно замещенный одним или несколькими одинаковыми или различными радикалами Y, феноксигруппу, необязательно замещенную одним или несколькими одинаковыми или различными радикалами Y, С3-С12циклоалкильную группу, необязательно замещенную одним или несколькими одинаковыми или различными радикалами Y, бензотиенил, бензофурил, или R3 обозначает 1,3-дигидро-1,3-диоксо-2Н-изоиндол-2-ил или 2-оксопиперидинил,
Y обозначает галоген, С1-С7алкокосигруппу, трифторметил, карбокси-, трифторметоксигруппу или фенил,
Е обозначает двухвалентный радикал, выбранный из группы, включающей
(I) радикал -CO-NR4-, у которого карбонильная группа связана с -(CR1R2)p-, a R4 обозначает радикал -(CH2)qR5, где значения q выбирают из 0 и 1, a R5 обозначает водород, а также включающей С1-С7алкильную или фенильную группы,
(II) радикал -SO2-NR4-, у которого сульфонильная группа связана с -(CR1R2)p-, а значения R4 указаны выше,
(III) радикал -NR4-, у которого значения R4 указаны выше,
(IV) радикал -CH=N-, у которого атом азота связан с А, и
(V) водород,
n обозначает 0 или 1,
при условии, что -A(X)-(E)n-(CR1R2)p-Z-R3 не обозначает галоидфенил, метилфенил, дихлорфенил, диметилфенил, 4-этокси-2-метиламинофенил, метилиндолил, диметилиндолил, 2-гидроксифенил, замещенный группой X, 2-метоксифенил, замещенный группой X, и необязательно замещенный 2-фторфенил, как указано выше, и при условии, что когда А обозначает пиридил, Х обозначает метил, значение n равно 1, а Е не обозначает радикал -NR4-, а также их аддитивные соли фармацевтически приемлемых оснований.
Среди предпочтительных соединений по изобретению можно упомянуть
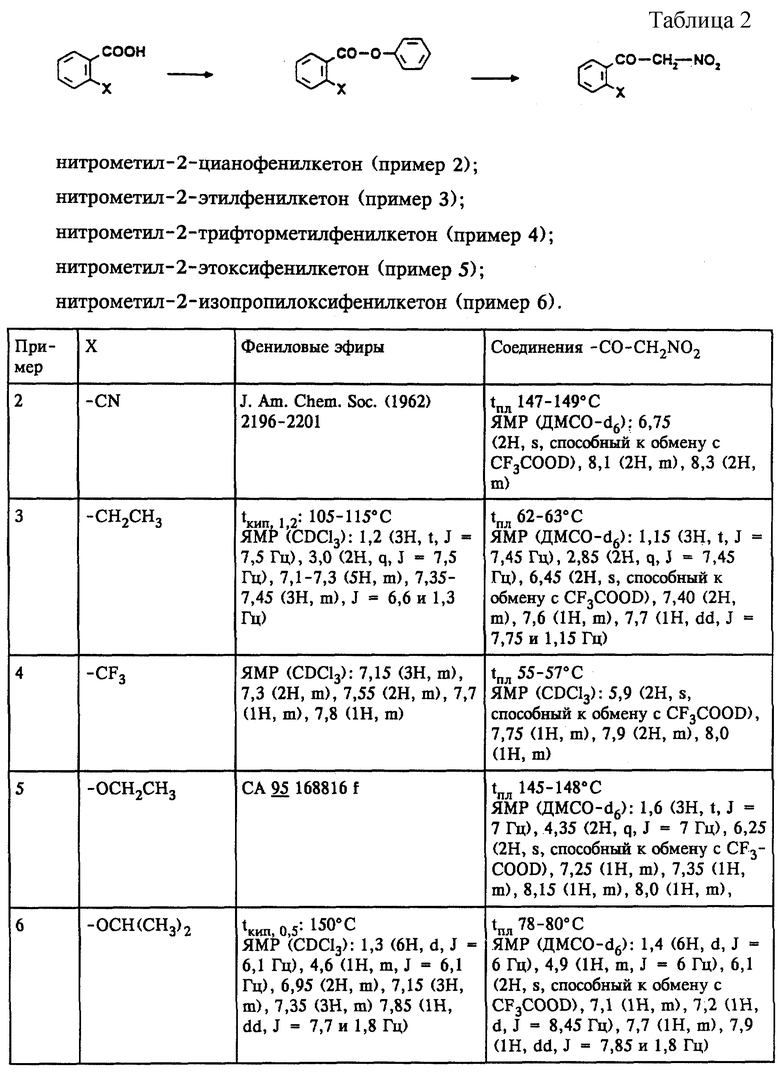
(1) нитрометил-2-трифторметоксифенилкетон;
(2) нитрометил-2-цианофенилкетон;
(3) нитрометил-2-этилфенилкетон;
(4) нитрометил-2-трифторметилфенилкетон;
(5) нитрометил-2-этоксифенилкетон;
(6) нитрометил-2-изопропилоксифенилкетон;
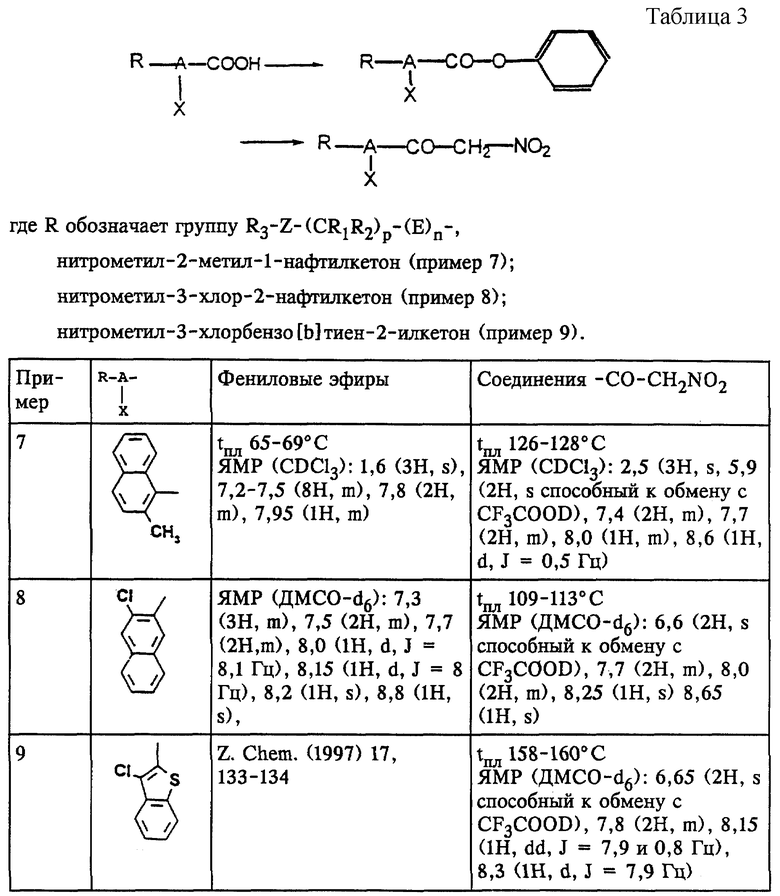
(7) нитрометил-2-метил-1-нафтилкетон;
(8) нитрометил-3-хлор-2-нафтилкетон;
(9) нитрометил-3-хлорбензо[b]тиен-2-илкетон;
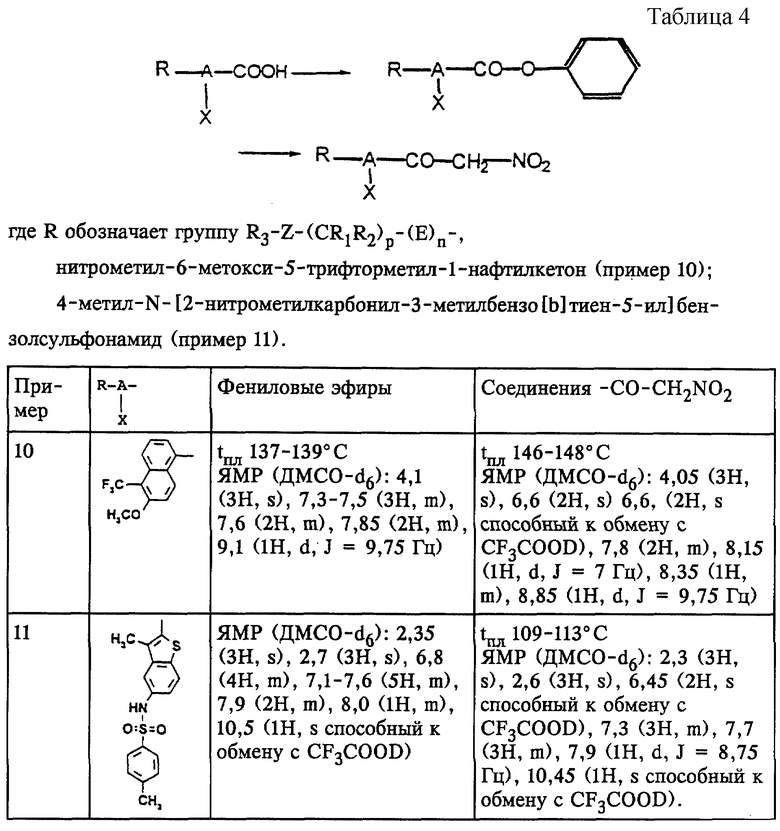
(10) нитрометил-6-метокси-5-трифторметил-1-нафтилкетон;
(11) 4-метил-N-[2-нитрометилкарбонил-3-метилбензо[b] тиен-5-ил]-бензолсульфонамид;
(12) N-(3-хлор-4-нитрометилкарбонилфенил)ацетамид;
(13) нитрометил-4-амино-2-хлорфенилкетон;
(14) N-(3-хлор-4-нитрометилкарбонилфенил)бензамид;
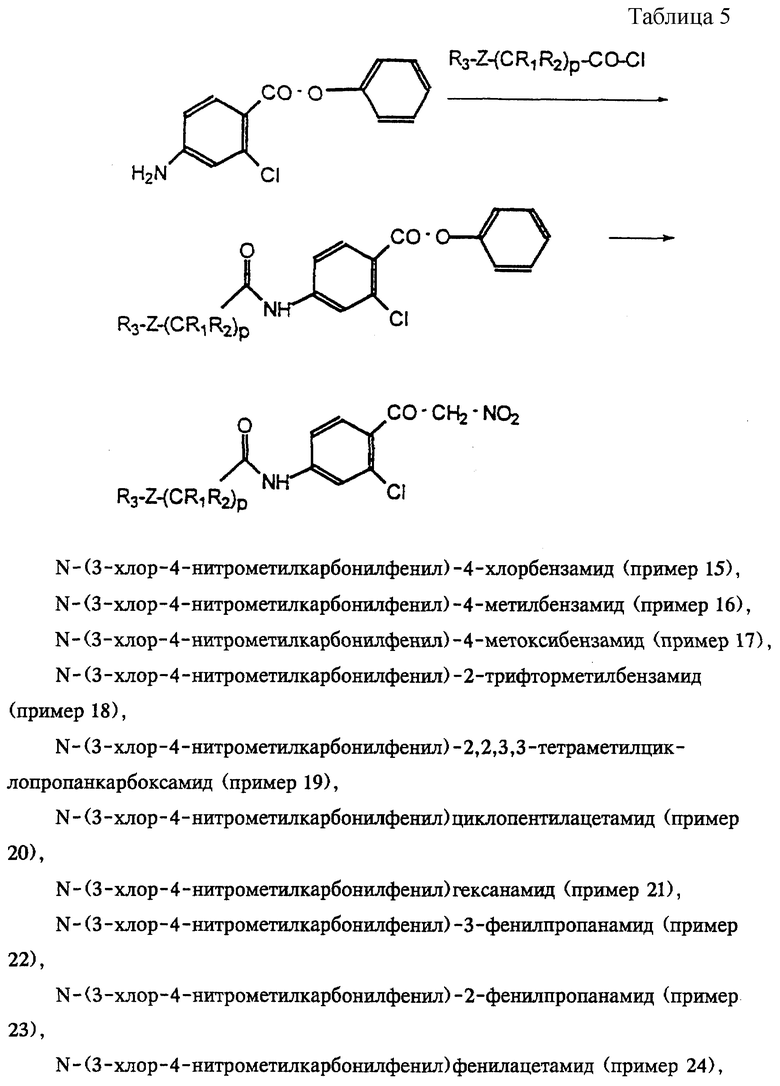
(15) N-(3-хлор-4-нитрометилкарбонилфенил)-4-хлорбензамид;
(16) N-(3-хлор-4-нитрометилкарбонилфенил)-4-метилбензамид;
(17) N-(3-хлор-4-нитрометилкарбонилфенил)-4-метоксибензамид;
(18) N-(3-хлор-4-нитрометилкарбонилфенил)-2-трифторметилбензамид;
(19) N-(3-хлор-4-нитрометилкарбонилфенил)-2,2,3,3-тетраметилциклопропанкарбоксамид;
(20) N-(3-хлор-4-нитрометилкарбонилфенил)гексанамид;
(21) N-(3-хлор-4-нитрометилкарбонилфенил)циклопентилацетамид;
(22) N-(3-хлор-4-нитрометилкарбонилфенил)-3-фенилпропанамид;
(23) N-(3-хлор-4-нитрометилкарбонилфенил)-2-фенилпропанамид;
(24) N-(3-хлор-4-нитрометилкарбонилфенил)фенилацетамид;
(25) N-(3-хлор-4-нитрометилкарбонилфенил)бензо[b]тиенил-2-карбоксамид;
(26) N-(3-хлор-4-нитрометилкарбонилфенил)бензофурил-2-карбоксамид;
(27) N-(3-хлор-4-нитрометилкарбонилфенил)-4-хлорфеноксиацетамид;
(28) 2-хлор-N-(3-хлор-4-нитрометилкарбонилфенил)фенилацетамид;
(29) N-(3-хлор-4-нитрометилкарбонилфенил)-1-(4-хлорфенил)-циклопропилкарбоксамид;
(30) N-(3-хлор-4-нитрометилкарбонилфенил)-2-трифторметилфенилацетамид;
(31) N-(3-хлор-4-нитрометилкарбонилфенил)-4-хлорбензолсульфонамид;
(32) N-(3-хлор-4-нитрометилкарбонилфенил)бензолсульфонамид;
(33) нитрометил-4-[N,N-ди(фенилметил)амино]-2-хлорфенилкетон;
(34) N-(2-хлор-3-нитрометилкарбонилфенил)ацетамид;
(35) N-(2-хлор-3-нитрометилкарбонилфенил)-2-метилфенилацетамид;
(36) N-(4-хлор-3-нитрометилкарбонилфенил)ацетамид;
(37) N-(4-хлор-3-нитрометилкарбонилфенил)-2-метилфенилацетамид;
(38) N-(4-хлор-3-нитрометилкарбонилфенил)бензолсульфонамид;
(39) 2-[(3-хлор-4-нитрометилкарбонилфенил)аминокарбонилметиламинокарбонил]бензойную кислоту;
(40) N-(3-хлор-4-нитрометилкарбонилфенил)-1,3-дигидро-1,3-диоксо-2Н-изоиндол-2-илацетамид;
(41) 1-(3-хлор-4-нитрометилкарбонилфенил)-3-фенилсульфонилмочевину;
(42) нитрометил-3-метил-2-тиенилкетон;
(43) N-(3-хлор-4-нитрометилкарбонилфенил)-2-метилфенилацетамид;
(44) N-(3-хлор-4-нитрометилкарбонилфенил)-2-оксопиперидин;
(45) N-(3-хлор-4-нитрометилкарбонилфенил)-1-(4-хлорфенил)-циклопентанкарбоксамид;
(46) N-(3-хлор-4-нитрометилкарбонилфенил)индан-2-илацетамид;
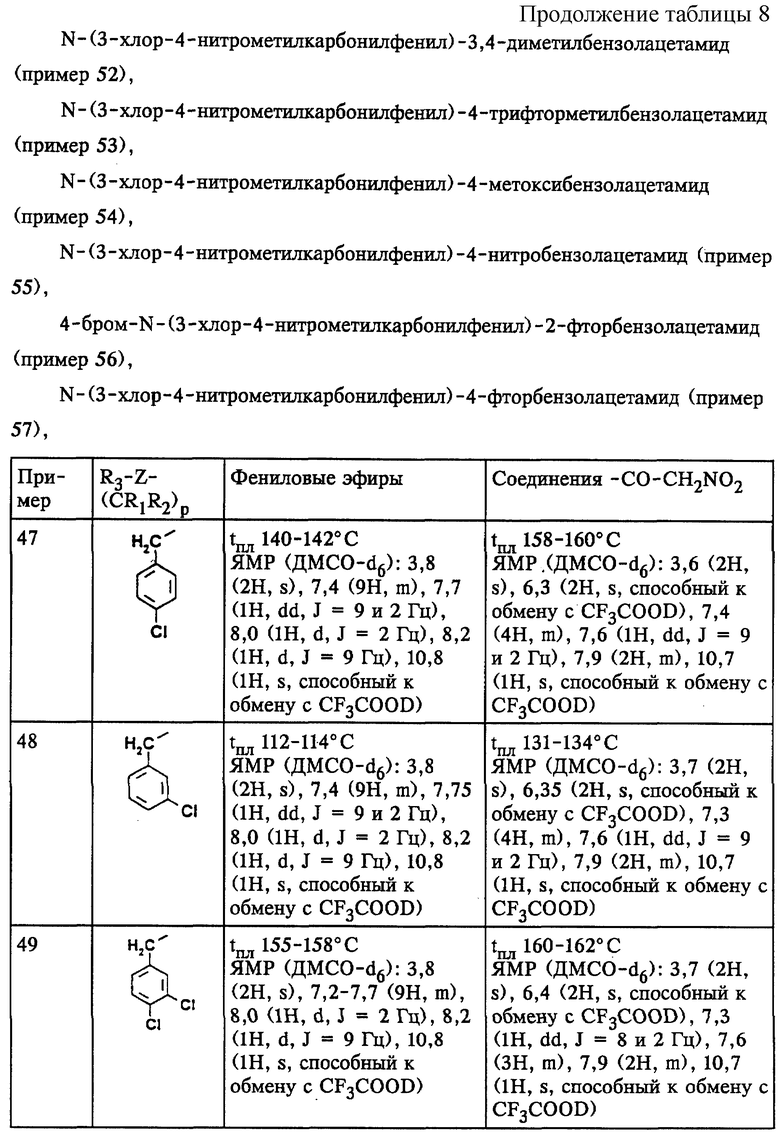
(47) N-(3-хлор-4-нитрометилкарбонилфенил)-4-хлорфенилацетамид;
(48) N-(3-хлор-4-нитрометилкарбонилфенил)-3-хлорфенилацетамид;
(49) N-(3-хлор-4-нитрометилкарбонилфенил)-3,4-дихлорфенилацетамид;
(50) N-(3-хлор-4-нитрометилкарбонилфенил)-4-метилфенилацетамид;
(51) N-(3-хлор-4-нитрометилкарбонилфенил)-3-метилфенилацетамид;
(52) N-(3-хлор-4-нитрометилкарбонилфенил)-3,4-диметилфенилацетамид;
(53) N-(3-хлор-4-нитрометилкарбонилфенил)-4-трифторметилфенилацетамид;
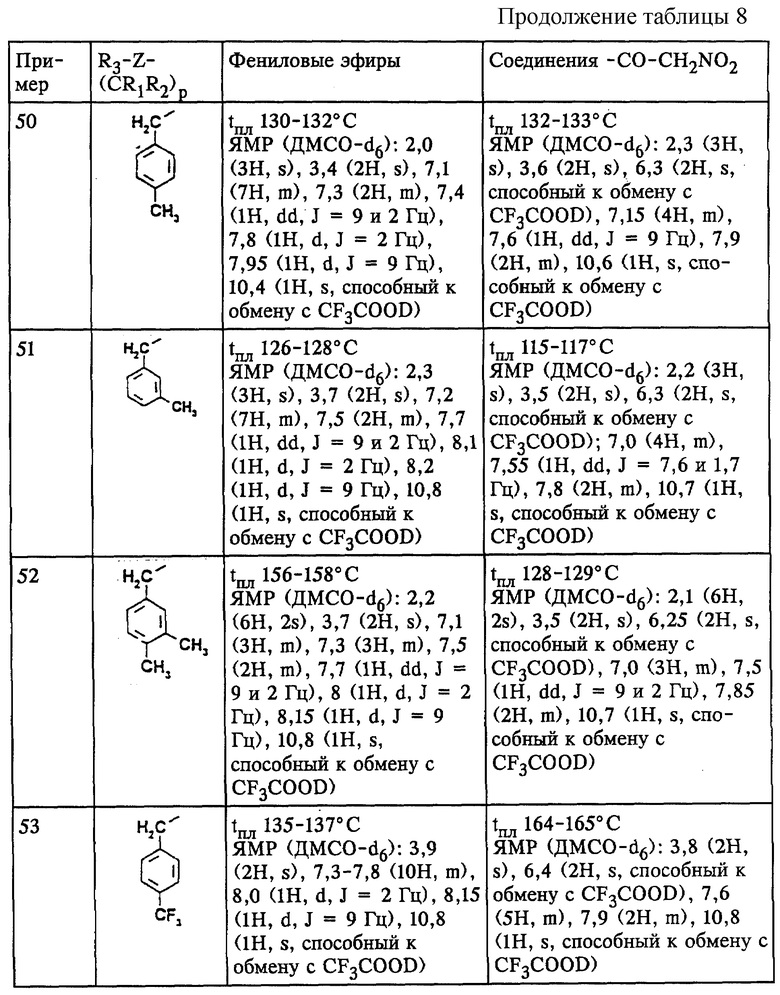
(54) N-(3-хлор-4-нитрометилкарбонилфенил)-4-метоксифенилацетамид;
(55) N-(3-хлор-4-нитрометилкарбонилфенил)-4-нитрофенилацетамид;
(56) N-(3-хлор-4-нитрометилкарбонилфенил)-2-фтор-4-бромфенилацетамид;
(57) N-(3-хлор-4-нитрометилкарбонилфенил)-4-фторфенилацетамид;
(58) N-(3-xлop-4-нитpoмeтилкapбoнилфeнил)-3-фeнил-2-пpoпeнaмид;
(59) N-(3-метил-4-нитрометилкарбонилфенил)-2-метилфенилацетамид;
(60) N-(2-бром-4-нитрометилкарбонилфенил)-2-метилфенилацетамид;
(61) нитрометил-2-хлор-4-метоксифенилкетон;
(62) нитрометил-2-изопропилфенилкетон;
(63) N-(4-хлор-2-нитрометилкарбонилфенил)-2-метилфенилацетамид;
(64) нитрометил-2-хлор-4-фенилтиофенилкетон;
(65) N-(3-хлор-4-нитрометилкарбонилфенил)-4-(3-хлор-4-нитрометилкарбонилфениламинокарбонил)-3-фенилбутанамид;
(66) нитрометил-2-хлор-4-фенилсульфинилфенилкетон;
(67) нитрометил-4-хлор-2-трифторметоксифенилкетон;
(68) N-[2-(3-хлор-4-нитрометилкарбонилфенилэтил)] -2-метил-бензолсульфонамид;
(69) N-(3-бром-4-нитрометилкарбонилфенил)-2-метилфенилацетамид;
(70) N-(3-хлор-4-нитрометилкарбонилфенил)-N-изопропилбензолсульфонамид.
Соединения по изобретению получают, например, в соответствии со следующими вариантами (А) и (Б) способа.
(А) Продукты формулы (I) могут быть получены из карбоновых кислот формулы (II)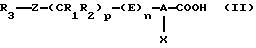
в результате взаимодействия ди(С1-С7)алкилцианофосфоната и нитрометана в присутствии основания в растворителе, который инертен в отношении компонентов реакционной смеси, предпочтительно в полярном апротонном растворителе, таком как диметилформамид и тетрагидрофуран. Приемлемое молярное соотношение между карбоновой кислотой формулы (II) и нитрометаном варьируют в пределах от 0,6: 1 до 2:1, предпочтительно в пределах от 0,8:1 до 1,2:1. Предпочтительным используемым основанием является амин, алкиллитий, гидрид щелочного металла, карбонат щелочного металла, гидроксид щелочного металла или алкоголят щелочного металла, в особенности триэтиламин, пиридин, бутиллитий, гидрид натрия, карбонат калия, гидроксид калия или трет-бутоксид калия, при соотношении между карбоновой кислотой формулы (II) и основанием в пределах от 0,2:1 до 0,5:1, предпочтительно при соотношении 0,4:1.
Обычно реакционная температура находится в пределах от -78oС до точки кипения растворителя (с обратным холодильником), предпочтительно в пределах от -5 до 80oС. Обычно продолжительность реакции составляет 2-72 ч, предпочтительно 2-18 ч.
(Б) В качестве варианта продукт формулы (I) может быть получен из карбоновых кислот формулы (II) путем предварительного превращения фенилового эфира формулы (III) в соответствии со схемой реакций 1 (см. в конце описания).
а) Процесс получения фениловых эфиров (III) можно осуществлять проведением последовательных или одновременных реакций с SOCl2 или РОСl3 и фенолом в отсутствии или в среде растворителя, который инертен в отношении компонентов реакционной смеси. Когда используют растворитель, то им в предпочтительном варианте служит апротонный растворитель, такой как дихлорметан, бензол или толуол. На этой первой стадии предпочтительное молярное соотношение между SOCl2 или соответственно РОСl3 и карбоновой кислотой формулы (II) составляет от 1/1 до 50/1, более предпочтительно составляет 10/1. Равным образом предпочтительное молярное соотношение между карбоновой кислотой и фенолом составляет от 1/0,9 до 1/1,2, более предпочтительно составляет 1/1,05. Реакцию предпочтительно проводить при температуре в пределах от -78oС до температуры кипения растворителя (с обратным холодильником), предпочтительно в пределах от 0oС до температуры кипения растворителя. Продолжительность этой реакции равна 1-48 ч, предпочтительно 1-8 ч.
б) Далее полученные таким образом фениловые эфиры формулы (III) обрабатывают нитрометаном в присутствии основания при температуре в пределах от 20oС до температуры кипения растворителя, предпочтительно в пределах от 20 до 40oС. Продолжительность реакции целесообразно варьировать в пределах 2-72 ч, предпочтительно в пределах 2-48 ч. На этой стадии создаваемое молярное соотношение между соединением формулы (III) и нитрометаном обычно составляет от 1/1 до 1/5, причем в предпочтительном варианте это соотношение равно 1/3. В качестве приемлемого основания обычно используют, например, гидроксид щелочного металла, карбонат щелочного металла, гидрид щелочного металла, алкиллитий, амин или алкоголят щелочного металла. Таким образом, основание можно выбирать, например, из трет-бутоксида калия, гидроксида натрия, гидроксида калия, карбоната калия, гидрида натрия, бутиллития и пиридина. Предпочтительное молярное соотношение между фениловым эфиром формулы (III) и основанием обычно находится в пределах от 1/1 до 1/5, причем в более предпочтительном варианте это молярное соотношение равно 1/3.
Соединения формулы (I) могут быть получены и другими способами.
Когда в вышеприведенной формуле (I) значение n равно 1, а Е обозначает группу -CO-NR4-, соединения по изобретению могут быть получены реакцией галоидангидрида кислоты формулы R3-Z-(CR1R2)p-CO-hal, где R1, R2, R3, Z и p имеют вышеуказанные значения, a hal обозначает атом галогена, с амином формулы (IV)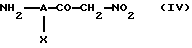
в которой А и Х имеют значения, указанные выше.
Этот способ осуществляют в присутствии основания, предпочтительно амина, такого как пиридин, триэтиламин и диметиламинопиридин, в растворителе, предпочтительно в апротонном растворителе, при температуре от -20oС до точки кипения растворителя (с обратным холодильником), например, в пределах от 0 до 40oС. Продолжительность реакции составляет 2-48 ч.
Примерами предпочтительных растворителей являются дихлорметан, тетрагидрофуран, бензол или толуол.
Когда в вышеприведенной формуле (I) значение n равно 1, а Е обозначает группу -SO2-NR4-, соединения по изобретению могут быть получены реакцией сульфонилгалогенида формулы R3-Z-(CR1R2)p-SO2-hal, где R1, R2, R3, Z и p имеют вышеуказанные значения, a hal обозначает атом галогена, с амином формулы (IV), которая представлена выше. В данном случае способ также осуществляют в присутствии основания в растворителе и при температуре от -20oС до точки кипения растворителя (с обратным холодильником). Предпочтительные условия проведения процесса аналогичны указанным для взаимодействия галоидангидрида с амином приведенной выше формулы (IV).
В качестве варианта в первом случае возможны синтез бензилового эфира формулы (III)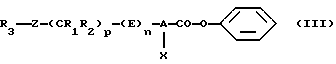
в соответствии с одной из реакционных стадий (I)-(VI), которые приведены ниже, а затем обработка бензилового эфира формулы (III) взаимодействием с нитрометаном в присутствии основания, как это представлено выше:
- на стадии (I), когда n равно 1, а Е обозначает -CO-NR4-, проводят реакцию галоидангидрида кислоты формулы R3-Z-(CR1R2)p-CO-hal, где R1, R2, R3, Z и p имеют вышеуказанные значения, a hal обозначает атом галогена, с амином формулы (V)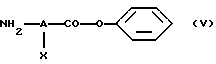
в которой А и Х имеют значения, указанные выше,
- на стадии (II), когда n равно 1, а Е обозначает группу -SO2-NR4-, проводят реакцию сульфонилгалогенида формулы R3-Z-(CR1R2)p-SO2-hal, где R1,
R2, R3, Z и p имеют вышеуказанные значения, а hal обозначает атом галогена, с амином формулы (V), который представлен выше,
- на стадии (III), когда n равно 1, а Е обозначает -NR4-, проводят реакцию соединения формулы R3-Z-(CR1R2)p-hal, где R1, R2, R3, Z и p имеют вышеуказанные значения, а hal обозначает атом галогена, с амином формулы (V), который представлен выше,
- на стадии (IV), когда значение n равно 1, а Е обозначает -CH=N-, проводят реакцию альдегида формулы R3-Z-(CR1R2)p-CHO, где R1, R2, R3, Z и p имеют вышеуказанные значения, с амином формулы (V), который представлен выше,
- на стадии (V), когда n равно 1, а Е обозначает -О-, проводят реакцию соединения формулы R3-Z-(CR1R2)p-hal, где R1, R2, R3, Z и p имеют вышеуказанные значения, а hal обозначает атом галогена, со спиртом формулы (VI)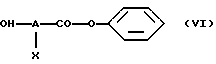
в которой А и Х имеют значения, указанные выше,
- на стадии (VI), когда n равно 1, а Е обозначает -CO-NR4-, p обозначает О, а Z обозначает группу -SO2-NH-, проводят реакцию изоцианата формулы R3-SO2-NH= C= O, где R3 имеет вышеуказанные значения, с амином формулы (V), который представлен выше,
- на стадии (VII), когда n равно 1, а Е обозначает -CO-NR4-, проводят реакцию кислоты формулы R3-Z-(CR1R2)p-COOH, где R1, R2, R3, Z и p имеют вышеуказанные значения, с амином формулы (V), который представлен выше.
Некоторые соединения формулы (I) могут быть получены из соединений формулы (I) осуществлением простых стадий превращения.
Так, например, соединения формулы (I), в которых n равно 1, Е обозначает группу -CO-NH-, p обозначает 1, R1 и R2 обозначают водород, Z обозначает связь, a R3 обозначает 1,3-дигидро-1,3-диоксо-2Н-изоиндол-2-ил, могут быть получены из соответствующих соединений (в которых А и Х имеют одинаковые значения), у которых n равно 1, Е обозначает группу -CO-NH-, p обозначает 1, R1 и R2 обозначают водород, Z обозначает группу -CO-NH-, a R3 обозначает 2-карбоксифенил, реакцией с соляной кислотой.
Подобным же образом соединения, у которых n обозначает 1, Е обозначает группу -CO-NH-, -(CR1R1)p- обозначает СН3, а R3 обозначает 2-[(4-нитро-метилкарбонил-3-хлорфенил)аминокарбонил] -1-(фенил)этил, могут быть получены реакцией с дихлоридом формулы
Cl-СО-СН2-СН(С6Н5)-СН2-СО-Cl
с двумя эквивалентами сложного эфира формулы
NH2-A(X)-COOC6H5
в присутствии основания, а затем обработкой полученного соединения нитрометаном в присутствии основания.
Соединения формулы (IV) легко могут быть синтезированы из коммерчески доступных соединений по методам, которые в данной области техники известны.
Так, например, соединения формулы (IV) могут быть получены из соответствующих аминов формулы (VII)
NH2-A(X)COOPh (VII)
в соответствии со способом, включающим следующие стадии:
- защиту аминогруппы защитной группой, такой как (С1-С7)алкилкарбонильная группа, например ацетильная,
- взаимодействие защищенного таким образом амина с ди(С1-С7)-алкилцианофосфонатом и нитрометаном в присутствии основания, а затем
- удаление группы, защищающей аминогруппу, например, воздействием гидроксидом натрия, когда защитной группой служит ацетильная группа.
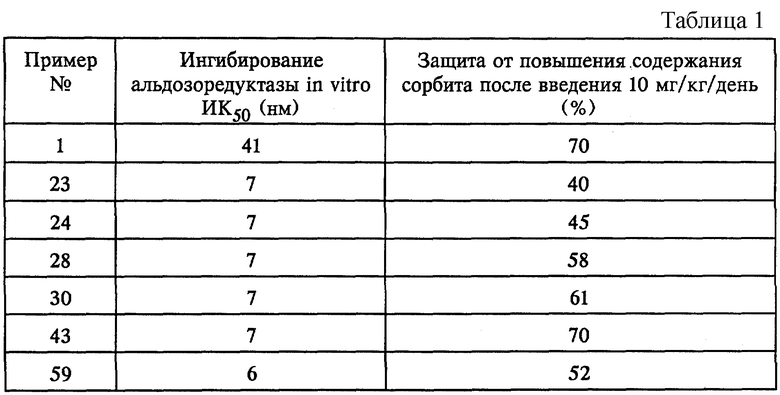
Способность соединений по изобретению ингибировать фермент альдозоредуктазу и предотвращать накопление сорбита может быть подтверждена результатами представленных ниже стандартных лабораторных испытаний.
1) Исследование in vitro: ингибирование альдозоредуктазы
Используемую альдозоредуктазу получают из хрусталиков самцов крысы линии Wistar в соответствии с модифицированным методом S. HAYMAN и др. (Journal of Biological Chemistry 240. стр.877, 1965). Ферментный экстракт разбавляют фосфатным буфером в присутствии никотинамидадениндинуклеотидфосфата и тестируемых продуктов в различной концентрации. L-глицеральдегидом инициируют реакцию и скорость реакции определяют по данным наблюдений за исчезновением никотинамидадениндинуклеотидфосфата с помощью спектрофотометра при 340 нм. Скорость такой реакции рассчитывают для каждой концентрации продукта, а затем путем линейной интерполяции определяют концентрацию, необходимую для 50%-ного снижения скорости реакции (ИК50). Полученные в этом опыте результаты представлены в таблице 1 ниже.
2) Исследование in vivo: уменьшение количества накапливаемого сорбита
У самцов крысы линии Wistar весом 200-250 г внутривенной инъекцией стрептозотоцина (при дозе 60 мг/кг) вызывают диабет. Далее по истечении 4, 30 и 50 ч после инъекции стрептозотоцина крысам перорально вводят тестируемые продукты в форме суспензии. Через восемнадцать часов после последнего перорального введения лекарственного средства животных оглушают и обезглавливают, после чего у них удаляют седалищный нерв. После экстракции в соответствии с ферментативным методом, описанным H.U. BERGMEYER (Methods of enzymatic analysis. , под ред. H.U. BERGMEYER, Academic Press, Нью-Йорк, 3, стр.1323, 1974) определяют содержание сорбита в нерве.
Процентную степень защиты с помощью каждого продукта для группы страдающих диабетом животных рассчитывают, принимая во внимание содержание сорбита в седалищном нерве животных, не страдающих диабетом.
В качестве примера в табл.1 представлены результаты, полученные для некоторых из испытываемых продуктов.
Соединения по изобретению могут быть использованы в качестве лекарственных средств как ингибиторы альдозоредуктазы, причем они особенно эффективны при лечении осложнений при диабете, таких как катаракта и ретинопатия, заболевание нервной системы, нефропатия и некоторые сосудистые заболевания. Ежедневную дозу можно варьировать в интервале 5-200 мг активного вещества.
Эти лекарственные вещества можно вводить перорально в форме таблеток, желатиновых капсул или гранул с немедленным или регулируемым высвобождением активного вещества, внутривенными инъекциями в форме раствора для инъекций, чрескожно в форме адгезивного средства для чрескожного введения, локально в форме примочки для глаз, раствора, крема или геля.
Твердое лекарственное средство для перорального введения, включающее в качестве активного вещества соединение по изобретению, готовят добавлением к этому соединению наполнителя и при необходимости связующего вещества, разрыхлителя, смазывающего вещества, красителя, корригента и изготовлением из такой смеси таблетки, таблетки с покрытием, гранулы, порошка или капсулы.
Примеры наполнителей включают лактозу, кукурузный крахмал, сахарозу, глюкозу, сорбит, кристаллическую целлюлозу и диоксид кремния, а примеры связующего вещества включают поливиниловый спирт, простой поливиниловый эфир, этилцеллюлозу, метилцеллюлозу, акациевую и трагакантовую камедь, желатину, шеллак, гидроксипропилцеллюлозу, гидроксипропилметилцеллюлозу, цитрат кальция, декстрин и пектин. Примеры смазывающих веществ включают стеарат магния, тальк, полиэтиленгликоль, диоксид кремния и отвержденные растительные масла. Красителем может служить любой из разрешенных для применения в составе лекарственных средств. Примеры корригентов включают какао-порошок, мяту в виде травы, в виде порошка растений с пряным запахом, мяту в форме масла, борнеол и порошок корицы. На таблетку или гранулу можно, как очевидно, соответствующим образом наносить покрытие из сахара, желатина и т.п.
Средство в приемлемой для инъекций форме, содержащее в качестве активного вещества соединение по настоящему изобретению, готовят, когда это уместно, смешением этого соединения с регулятором рН, буфером, суспендирующим агентом, солюбилизатором, стабилизатором, тонизирующей добавкой и/или консервантом и переводом этой смеси в форму, пригодную для инъекций внутривенным, подкожным и внутримышечным путем, в соответствии с известным методом. При необходимости перевод в форму, пригодную для инъекций, можно осуществлять сушкой, вымораживанием по известному методу.
Примеры суспендирующих агентов включают метилцеллюлозу, полисорбат 80, гидроксиэтилцеллюлозу, гуммиарабик, порошкообразную трагакантовую камедь, натрийкарбоксиметилцеллюлозу и полиоксиэтилированный сорбитанмонолаурат.
Примеры солюбилизатора включают касторовое масло, отвержденное полиоксиэтиленом, полисорбат 80, никотинамид, полиоксиэтилированный сорбитанмонолаурат и этиловые эфиры жирных кислот касторового масла.
Примеры стабилизаторов включают сульфит натрия, метасульфит натрия и диэтиловый эфир, а примерами консервантов являются метил-п-гидроксибензоат, этил-п-гидроксибензоат, сорбиновая кислота, фенол, крезол и хлоркрезол.
Ниже в качестве неограничивающих примеров приведено несколько фармацевтических композиций:
- композиция в виде таблетки с немедленным высвобождением: активное вещество 100 мг, добавки: лактоза, пшеничный крахмал, поливинилпирролидон, тальк, стеарат магния;
- композиция в виде таблетки с регулируемым высвобождением: активное вещество 100 мг, добавки: лактоза, поливинилпирролидон, тальк, стеарат магния, полимер (целлюлоза, акриловое, метакриловое, виниловое или глицеридное производное);
- композиция желатиновой капсулы: активное вещество 100 мг, добавки: лактоза, пшеничный крахмал, тальк, стеарат магния;
- композиция раствора для инъекций в ампуле: активное вещество 200 мг, добавки: маннит, вода для инъекций;
- композиция крема (композиция для 100 г крема): активное вещество 2 г, добавки: полуэмульгируемый цетилстеариловый спирт, цетиларилоктаноат, нипазол, сорбиновая кислота, пропиленгликоль, карбапол;
- композиция примочки для глаз: активное вещество 15 мг, добавки: хлорид натрия, бензалконийхлорид, вода для инъекций.
Ниже изобретение проиллюстрировано на примерах, не ограничивающих его объем.
При указании данных ядерно-магнитного резонанса (ЯМР) использованы следующие аббревиатуры: s для синглета, d для дублета, t для триплета, q для квадруплета и m для неразрешенного комплекса сигналов, химические сдвиги δ выражены в частях на миллион, tпл обозначает температуру плавления, а tкип обозначает температуру кипения.
Пример 1
Нитоометил-2-трифторметоксифенилкетон
а) Фенил-2-(трифторметоксифенил)бензоат
Смесь, включающую 10 г (48,5 ммоля) 2-(трифторметокси)бензойной кислоты, 50 мл тионилхлорида и каплю диметилформамида, выдерживают при температуре кипения с обратным холодильником в течение 1,5 ч. После охлаждения и концентрирования реакционной смеси под вакуумом получают остаток, который перемешивают в течение 2 ч при 100oС в присутствии 4,75 г (50 ммолей) фенола. После охлаждения реакционную смесь растворяют в дихлорметане, промывают насыщенным раствором NaHCO3 и затем водой, сушат над Na2SO4 и концентрируют. После перегонки получают 11 г бесцветной жидкости (выход: 80%).
tкип 100-110oС (под остаточным давлением 1 мм рт.ст.)
ЯМР (CDCl3): 7,15-7,4 (7Н, m), 7,55 (1Н, m), 8,05 (1Н, dd, J=7,8 и 1,8 Гц).
б) Нитрометил-2-трифторметоксифенилкетон
4,2 мл (75 ммолей) нитрометана вводят в раствор, который включает 8,5 г (75 ммолей) трет-бутоксида калия и 115 мл диметилсульфоксида и температуру которого поддерживают на уровне 15oС. Смесь перемешивают в течение 1 ч при 15oС, после чего по каплям добавляют 7 г (25 ммолей) фенилового эфира, полученного на описанной выше стадии а). После перемешивания в течение 3 ч при 15-20oС с перемешиванием добавляют 68 мл охлажденной льдом воды и 6,8 мл концентрированной соляной кислоты, а затем выливают в 500 мл смеси воды со льдом. Образовавшийся осадок осушают, промывают водой и гексаном с последующей сушкой. После перекристаллизации из смеси этилацетата с гексаном получают 3 г белого как вата твердого вещества (выход: 48%), tпл 35-36oС.
ЯМР (ДМСО-d6): 6,3 (2Н, s, способный к обмену с CF3COOD), 7,55 (2Н, m), 7,8 (1H, m), 7,95 (1H, dd, J=7,7 и 1,6 Гц).
Примеры 2-6
Аналогично примеру 1 (а и б) в примерах 2-6 получают соединения, представленные в табл.2.
Примеры 7-9
Аналогично примеру 1 (а и б) в примерах 7-9 получают соединения, представленные в табл.3.
Примеры 10 и 11
Аналогично примеру 1 (а и б) в примерах 10 и 11 получают соединения, представленные в табл.4.
Пример 12
N-(3-хлор-4-нитрометилкарбонилфенил)ацетамид
а) Фенил-4-амино-2-хлорбензоат
30 г фенил-2-хлор-4-нитробензоата, полученного в соответствии с методом, описанным у Makoto Suzuki, Yakugaku Zasshi (1959) 79. 286-90 (СА 53 14991f), вводят в смесь 800 мл воды, 60 мл уксусной кислоты и 96,5 г (1,728 моля) железа. Реакционную смесь выдерживают в течение 1 ч при температуре кипения с обратным холодильником. После охлаждения реакционную смесь фильтруют и выделенный твердый материал промывают этилацетатом. Водную фазу насыщают NaCl с последующей экстракцией этилацетатом. Объединенные органические фазы концентрируют и очищают хроматографией в колонке с диоксидом кремния с использованием СН2Сl2 (выход: 82%), tпл 127-128oС.
ЯМР (ДМСО-d6): 6,35 (2Н, s, способный к обмену с СF3СООD), 6,55 (1Н, dd, J= 8,6 и 2,2 Гц), 6,7 (1Н, d, J=2,2 Гц), 7,1-7,3 (3Н, m), 7,45 (2Н, m), 7,9 (1Н, d, J=8,6 Гц)
б) Фенил-4-(ацетиламино)-2-хлорбензоат
37 мл (266 ммолей) триэтиламина вводят в смесь, включающую 60 г (242 ммоля) амина, полученного на вышеописанной стадии а), и 280 мл дихлорметана, а затем добавляют 20,6 мл (290 ммолей) ацетилхлорида. После перемешивания в течение 2 ч при комнатной температуре смесь выдерживают при температуре кипения с обратным холодильником в течение 2 ч. После охлаждения реакционную смесь быстро выливают на смесь льда с соляной кислотой. Органическую фазу удаляют декантацией, а водную фазу экстрагируют дихлорметаном. Объединенные органические фазы промывают водой, сушат над Na2SO4 и концентрируют, получая продукт в виде масла, которое кристаллизуется (выход - количественный), tпл 84-86oС.
ЯМР (ДМСО-d6): 2,15 (3Н, s), 7,35 (3Н, m), 7,5 (2Н, m), 7,7 (1Н, dd, J= 8,7 и 2 Гц), 8,05 (1Н, d, J=2 Гц), 8,2 (1Н, d, J=8,7 Гц), 10,5 (1Н, s, способный к обмену с СF3СООD).
в) N-(3-хлор-4-нитрометилкарбонилфенил)ацетамид
Указанное в заголовке соединение получают аналогично примеру 1б из соединения, полученного на стадии б).
tпл 196oС (с разложением).
ЯМР (ДМСО-d6): 2,3 (3Н, s), 6,55 (2Н, s, способный к обмену с СF3СООD), 7,8 (1Н, dd, J=8,7 и 1,8 Гц), 8,1 (2Н, m), 10,7 (1Н, s, способный к обмену с СF3СООD).
Пример 13
Нитрометил-4-амино-2-хлорфенилкетон
Смесь 12,2 г (47,5 ммоля) N-(3-хлор-4-нитрометилкарбонилфенил)ацетамида, полученного в примере 12, 11 г (274 ммоля) таблетированного гидроксида натрия и 161 мл воды выдерживают при 80oС в течение 1 ч. После охлаждения реакционную смесь разбавляют 900 мл воды и добавлением уксусной кислоты подкисляют до рН 5. Образующийся осадок выделяют, промывают водой и сушат на воздухе с последующей перекристаллизацией из этилацетата (выход: 27%), tпл 131-133oС.
ЯМР (ДМСО-d6): 6,1 (2Н, s, способный к обмену с СFзСООD), 6,45 (3Н, m, из которых 2Н способны к обмену с СF3СООD), 6,55 (1Н, d, J=2 Гц), 7,5 (1Н, d, J=8,75 Гц).
Пример 14
N-(3-хлор-4-нитрометилкарбонилфенил)бензамид
а) Фенил-2-хлор-4-[(бензоил)аминобензоат]
Раствор 2,27 г (16,1 ммоля) бензоилхлорида в 30 мл дихлорметана по каплям вводят в смесь, которая включает 4 г (16,1 ммоля) соединения, полученного в примере 12а, 2,26 мл (17,7 ммоля) триэтиламина и 40 мл дихлорметана и которую выдерживают при 0oС. Реакционную смесь перемешивают в течение 1 ч при 0oС, а затем в течение 48 ч при комнатной температуре. Дихлорметан выпаривают. Остаток растворяют в воде, твердый материал отфильтровывают, промывают водой и сушат под вакуумом при 80oС с получением 5 г не совсем белого порошка (выход: 89%), tпл 126-128oС.
ЯМР (ДМСО-d6): 7,3 (3Н, m), 7,5-7,7 (5Н, m), 8,0 (3Н, m), 8,2 (2Н, m), 10,8 (2Н, s, способный к обмену с СF3СООD).
б) N-(3-хлор-4-нитрометилкарбонилфенил)бензамид
Получают аналогично примеру 1б (выход: 57%).
tпл 165-167oC.
ЯМР (ДМСО-d6): 6,6 (2Н, s, способный к обмену с СFзСООD), 7,7-7,8 (3Н, m), 8,1 (4Н, m), 8,3 (1Н, d, J=0,8 Гц), 10,9 (1Н, s, способный к обмену с СF3СООD).
Примеры 15-27
Из амина, полученного в примере 12а, в примерах 15-27 получают соединения, представленные в табл.5, при этом процесс проводят аналогично примеру 14.
Пример 28
2-хлор-N-(3-хлор-4-нитрометилкарбонилфенил)фенилацетамид
а) Фенил-2-хлор-4-[(2-хлорбензил)карбониламино]бензоат
1,54 г (8 ммолей) 1-(3-диметиламинопропил)-3-этилкарбодиимидгидрохлорида вводят в суспензию 2 г (8 ммолей) соединения, полученного в примере 12а, 1,28 г (10,4 ммоля) 4-диметиламинопиридина и 80 мл дихлорметана. Приготовленный раствор перемешивают в течение 15 мин при комнатной температуре, после чего добавляют 1,45 г (8,4 ммоля) 2-хлорфенилуксусной кислоты в 20 мл дихлорметана. Раствор перемешивают в течение 18 ч при комнатной температуре. Далее добавляют 200 мл воды и 20 мл концентрированной НСl. Декантированную органическую фазу промывают 1н. раствором НСl, а затем раствором гидроксида натрия и водой до нейтральной реакции с последующими сушкой над Nа2S04 и концентрированием. Остаток кристаллизуют из этанола (95o) с получением 1,4 г белого порошка (выход: 43%), tпл 160-163oC.
ЯМР (ДМСО-d6): 3,95 (2Н, s), 7,3-7,4 (5Н, m), 7,5 (4Н, m), 7,7 (1Н, dd, J=8,7 и 2,1 Гц), 8,05 (1Н, d, J=2,1 Гц), 8,2 (1H, d, J=8,7 Гц), 10,8 (1Н, s, способный к обмену с CF3СООD).
б) 2-хлор-N-(3-хлор-4-нитрометилкарбонилфенил)фенилацетамид
Это соединение получают аналогично примеру 1б.
tпл 154-156oС.
ЯМР (ДМСО-d6): 3,95 (2Н, s), 6,4 (2Н, s, способный к обмену с CF3СООd), 7,35 (2Н, m), 7,45 (2Н, m), 7,7 (1Н, dd, J=8,7 и 1,9 Гц), 7,95 (2Н, m), 10,8 (1Н, s, способный к обмену с CF3СООD).
Примеры 29 и 30
В примерах 29 и 30, работая аналогично примеру 28, с использованием в качестве исходного вещества амина, полученного в примере 12а, получают соединения, представленные в табл.6.
Пример 31
N-(3-хлор-4-нитрометилкарбонилфенил)-4-хлорбензолсульфонамид
Смесь, включающую 2 г (9,3 ммоля) амина, полученного в примере 13, 1,5 мл (18,5 ммоля) пиридина, 2,95 г (13,9 ммоля) хлорангидрида 4-хлорбензолсульфоновой кислоты и 80 мл ТГФ, в течение 16 ч выдерживают при 40oС. После охлаждения добавляют 100 мл воды и 5 мл концентрированной соляной кислоты с последующей экстракцией этилацетатом. Органическую фазу промывают разбавленным раствором гидроксида натрия. Далее водную фазу подкисляют НС1 и экстрагируют этилацетатом, а экстракт промывают водой до нейтральной реакции, сушат над Na2SO4 и концентрируют под вакуумом. Остаток очищают хроматографией в колонке с диоксидом кремния с использованием смеси дихлорметан/метанол в соотношении 98:2.
ЯМР (ДМСО-d6): 6,25 (2Н, s, способный к обмену с CF3СООD), 7,0-7,3 (3Н, m), 7,6-7,9 (4Н, m), 11,2 (1H, широкий s, способный к обмену с CF3СООD).
Пример 32
N-(3-хлор-4-нитрометилкарбонилфенил)бензолсульфонамид
а) Фенил-2-хлор-4-(фенилсульфониламино)бензоат
Смесь, включающую 10 г (40,4 ммоля) амина, полученного в примере 12а, 6,5 мл (80,4 ммоля) пиридина, 10,7 г (60,5 ммоля) бензолсульфоновой кислоты и 200 мл ТГФ, при комнатной температуре перемешивают в течение 2 ч, а затем выдерживают при 40oС в течение 14 ч. После охлаждения добавляют 200 мл воды и 5 мл концентрированной НСl. Реакционную смесь экстрагируют дихлорметаном, который затем промывают водой до нейтральной реакции, сушат над Na2SO4 и концентрируют под вакуумом. В результате очистки остатка хроматографией в колонке с диоксидом кремния с использованием дихлорметана получают 14,5 г светло-оранжевого порошка (выход: 92%), tпл 130-140oС.
ЯМР (ДМСО-d6): 7,2-7,4 (5Н, m), 7,5 (2Н, m), 7,65 (3Н, m), 7,8 (2Н, dd, J= 7,5 и 0,8 Гц), 8,1 (1Н, d, J=7,5 Гц), 11,25 (1Н, s, способный к обмену с CF3СООD).
б) N-(3-хлор-4-нитрометилкарбонилфенил)бензолсульфонамид
Это соединение получают аналогично примеру 1б.
ЯМР (ДМСО-d6): 6,4 (2Н, s, способный к обмену с CF3СОOD), 7,25 (2Н, m), 7,7 (3Н, m), 7,9 (3Н, m), 11,2 (1Н, широкий s, способный к обмену с CF3СОOD).
Пример 33
Нитрометил-2-хлор-4-[N,N-ди(фенилметил)амино]фенилкетон
а) Фенил-2-хлор-4-[N,N-ди(фенилметил)амино]бензоат
Смесь 2,5 г (10 ммолей) амина, полученного в примере 12а, 2,7 г (20 ммолей) карбоната калия, 6,8 г (40 ммолей) бензилбромида, нескольких кристаллов иодида калия и 100 мл диметилформамида выдерживают при 80oС в течение 6 ч. После охлаждения реакционную смесь выливают в 300 мл воды и экстрагируют этилацетатом, после чего экстракт промывают водой, сушат над Na2SO4 и концентрируют. Полученный в виде масла остаток растирают в гексане и выделяющийся твердый материал кристаллизуют из этанола с получением 1,6 г не совсем белого твердого вещества (выход: 37%), tпл 133-135oС.
ЯМР (ДМСО-d6): 4,8 (4Н, s), 6,7-6,85 (2Н, m), 7,1-7,5 (15Н, m), 7,9 (1Н, m).
б) Нитрометил-2-хлор-4-[N,N-ди(фенилметил)амино]фенилкетон
Это соединение получают аналогично примеру 1б (выход: 40%).
tпл 116-118oС.
ЯМР (ДМСО-d6): 4,9 (4Н, s), 6,25 (2Н, s, способный к обмену с CF3СОOD), 6,8-6,9 (2Н, m), 7,2-7,5 (10Н, m), 7,7 (1Н, d, J=9 Гц).
Пример 34
N-(2-хлор-3-нитрометилкарбонилфенил)ацетамид
а) Фенил-3-амино-2-хлорбензоат
Это соединение получают из фенил-2-хлор-3-нитробензоата аналогично примеру 12а (выход: 97%).
tпл 46-48oС.
ЯМР (ДМСО-d6): 5,5 (2Н, s, способный к обмену с CF3СООD), 6,85 (1Н, dd, J=7,45 и 2,3 Гц), 7,0 (2Н, m), 7,1 (3Н, m), 7,3 (2Н, m).
б) Фенил-3-ацетиламино-2-хлорбензоат
Это соединение получают аналогично примеру 12б (выход: 60%).
tпл 120-122oС.
ЯМР (ДMCO-d6): 2,2 (3Н, s), 7,4 (3Н, m), 7,55 (3Н, m), 7,9 (1Н, m), 8,0 (1H, m), 9,8 (1H, s, способный к обмену с CF3СООD).
в) N-(2-хлор-3-нитрометилкарбонилфенил)ацетамид
Это соединение получают из фенил-2-хлор-3-нитробензоата аналогично примеру 1б.
tпл 140-142oС.
ЯМР (ДМСО-d6): 2,2 (3Н, s), 6,5 (2Н, s, способный к обмену с CF3СООD), 7,6 (1H, m), 7,8 (1H, dd, J=8 и 1,3 Гц), 8,1 (1H, dd, J=8 и 1,3 Гц), 9,8 (1H, s, способный к обмену с CF3СООD).
Пример 35
N-(2-хлор-3-нитрометилкарбонилфенил)-2-метилфенилацетамид
а) Фенил-2-хлор-3-[(2-метилбензоил)карбониламино]бензоат
Это соединение получают из фенил-3-амино-2-хлорбензоата и хлорангидрида (2-метилфенил) уксусной кислоты аналогично примеру 14а (выход: 78%).
tпл 123-125oС.
ЯМР (CDCl3): 2,3 (3Н, s), 3,75 (2Н, s), 7,1-7,4 (10Н, m), 7,65 (1Н, m), 7,8 (1H, широкий s, способный к обмену с CF3СООD), 8,6 (1Н, dd, J=8,3 и 1,55 Гц).
б) N-(2-хлор-3-нитрометилкарбонилфенил)-2-метилфенилацетамид
Это соединение получают аналогично примеру 1б (выход: 45%).
tпл 130-132oС.
ЯМР (ДМСО-d6): 2,25 (3Н, s), 3,8 (2Н, s), 6,4 (2Н, s, способный к обмену с CF3СОOD), 7,1 (3Н, m), 7,2 (1H, m), 7,45 (1H, m), 7,6 (1H, dd, J=7,75 и 1,4 Гц), 7,9 (1H, dd, J=8,1 и 1,3 Гц), 9,8 (1H, широкий s, способный к обмену с CF3СООD).
Пример 36
N-(4-хлор-3-нитрометилкарбонилфенил)ацетамид
а) Фенил-2-хлор-5-нитообензоат
Это соединение получают из 2-хлор-5-нитробензойной кислоты аналогично примеру 1а (выход: 92%).
tпл 83-85oC.
ЯМР (ДMCO-d6): 7,4 (3Н, m), 7,55 (2Н, m), 8,0 (1H, d, J=8,8 Гц), 8,5 (1H, dd, J=8,8 и 2,7 Гц), 8,95 (1H, d, J=2,7 Гц).
б) Фенил-5-амин-2-хлорбензоат
18 г никеля Ренея добавляют в раствор 59 г (212 ммолей) соединения, полученного на стадии а), в 600 мл диоксана. Смесь гидрогенизуют под давлением 70 кг/кв. см и при 65oС. После отфильтровывания катализатора и концентрирования удалением растворителя остаток очищают хроматографией в колонке с диоксидом кремния с использованием дихлорметана, а затем смеси дихлорметан/гексан в соотношении 1: 1, получая 29,3 г желтого твердого вещества (выход: 55%), tпл 84-86oС.
ЯМР (CDCl3): 3,8 (2Н, широкий s, способный к обмену с CF3СООD), 6,7 (1H, m), 7,2 (5Н, m), 7,35 (2Н, m).
в) Фенил-5-ацетиламино-2-хлорбензоат
Это соединение получают из амина, полученного на стадии б), аналогично примеру 12б (выход: 69%).
tпл 141-143oC.
ЯМР (ДMCO-d6): 1,95 (3Н, s), 7,2 (3Н, m), 7,35 (2Н, m), 7,5 (1H, d, J= 8,7 Гц), 7,75 (1H, dd, J=8,7 и 2,6 Гц), 8,25 (1H, d, J=2,6 Гц), 10,25 (1H, широкий s, способный к обмену с CF3COOD).
г) N-(4-хлор-3-нитрометилкарбонилфенил)ацетамид
Это соединение получают аналогично примеру 1б (выход: 15%).
tпл 122-124oС.
ЯМР (ДМСО-d6): 2,2 (3Н, s), 6,45 (2Н, s, способный к обмену с CF3COOD), 7,7 (1H, d, J=8,7 Гц), 7,9 (1H, dd, J=8,7 и 2,5 Гц), 8,2 (1H, d, J=2,5 Гц), 10,5 (1H, s, способный к обмену с CF3COOD).
Пример 37
N-(4-хлор-3-нитрометилкарбонилфенил)-2-метилфенилацетамид
а) Фенил-2-хлор-5-[(2-метилбензил)карбониламино]бензоат
Это соединение получают из амина, полученного в примере 36б, и хлорангидрида (2-метилфенил)уксусной кислоты аналогично примеру 14а (выход: 94%).
tпл 102-104oС.
ЯМР (CDCl3): 2,25 (3Н, s), 3,75 (2Н, s), 7,1-7,25 (9Н, m, из которых 1H способен к обмену с CF3СООD), 7,35 (3Н, m), 7,7 (1H, dd, J=8,7 и 2,2 Гц), 7,85 (1H, d, J=2,2 Гц).
б) N-(4-хлор-3-нитрометилкарбонилфенил)-2-метилфенилацетамид
Это соединение получают аналогично примеру 1б (выход: 38%).
tпл 148-150oС.
ЯМР (ДMCO-d6): 2,3 (3Н, s), 3,8 (2Н, s), 6,4 (2Н, s, способный к обмену с CF3СООD), 7,2 (4Н, m), 7,6 (1H, d, J=8,7 Гц), 7,8 (1H, dd, J=8,7 и 2,5 Гц), 8,2 (1H, d, J=2,5 Гц), 10,6 (1H, s, способный к обмену с CF3СООD).
Пример 38
N-(4-хлор-3-нитрометилкарбонилфенил)бензолсульфонамид
а) Фенил-5-(бензолсульфониламино)-2-хлорбензоат
Это соединение получают из амина, полученного в примере 36б, аналогично примеру 32а (выход: 97%).
tпл примерно 50oС.
ЯМР (ДМСО-d6): 7,3-7,7 (10Н, m), 7,8 (3Н, m), 10,8 (1Н, s, способный к обмену с CF3COOD).
б) N-(4-хлор-3-нитрометилкарбонилфенил)бензолсульфонамид
Это соединение получают аналогично примеру 1б.
tпл 152-154oC.
ЯМР (ДМСО-d6): 6,2 (2Н, s, способный к обмену с CF3COOD), 7,2 (1Н, m), 7,35-7,65 (5Н, m), 7,75 (2Н, m), 10,8 (1Н, s, способный к обмену с CF3COOD).
Пример 39
2-[(3-хлор-4-нитрометилкарбонилфенил)аминокарбонилметиламинокарбонил] бензойная кислота
а) Фенил-2-хлор-4-[(1,3-дигидро-1,3-диоксо-2Н-изоиндол-2-ил)метилкарбониламино]бензоат
Это соединение получают из амина, полученного в примере 12а, и хлорангидрида(1,3-дигидро-1,3-диоксо-2Н-изоиндиол-2-ил)уксусной кислоты (полученного из соответствующей кислоты и SOCl2, tпл 80-83oС) аналогично примеру 14а (выход: 54%).
tпл 220-222oС.
ЯМР (ДМСО-d6): 4,55 (2Н, s), 7,25 (3Н, m), 7,4 (2Н, m), 7,6 (1Н, m), 7,8-8,0 (5Н, m), 8,1 (1Н, d, J=8,6 Гц), 10,9 (1Н, s, способный к обмену с CF3COOD).
б) 2-[(3-хлор-4-нитрометилкарбонилфенил)аминокарбонилметиламинокарбонил] бензойная кислота
1,49 мл нитрометана вводят в раствор, включающий 2,9 г (25,5 ммоля) трет-бутоксида калия и 50 мл ДМСО, выдерживаемого при температуре ниже 20oС. Смесь перемешивают в течение одного часа при температуре ниже 20oС, а затем по каплям добавляют 3,7 г (8,5 ммоля) сложного фенилового эфира, полученного на стадии а) b растворенного в 90 мл ДМСО. После перемешивания в течение 16 ч при комнатной температуре реакционную смесь выливают в 750 мл воды. Водную фазу промывают этилацетатом и подкисляют НСl. Образующийся осадок отфильтровывают, промывают водой и сушат под вакуумом с последующей перекристаллизацией из ацетонитрила, получая 2,2 г белого порошка (выход: 61%), tпл 206-209oС.
ЯМР (ДМСО-d6): 4,0 (2Н, d, J=5,6 Гц, с CF3COOD преобразуется в синглет), 6,3 (2Н, s, способный к обмену с CF3COOD), 7,4-8,0 (7Н, m), 8,75 (1H, t, J= 5,6 Гц, способный к обмену с CF3СООD), 10,3 (1Н, s, способный к обмену с CF36СООD), 13,1 (способный к обмену с CF3СООD).
Пример 40
N-(3-хлор-4-нитрометилкарбонилфенил)-(1,3-дигидро-1,3-диоксо-2Н-изоиндол-2-ил)ацетамид
Газообразный НСl в течение 1,5 ч барботируют через суспензию, включающую 2 г (4,8 ммоля) соединения, полученного в примере 39б, и 30 мл метанола. Выдержка смеси при примерно 60oС обеспечивает растворение твердого материала. После охлаждения образующийся осадок отфильтровывают и перекристаллизовывают из ацетонитрила с получением 0,4 г не совсем белого порошка (выход: 19%), tпл 121oС (с разложением).
ЯМР (ДМСО-d6): 4,5 (2Н, s), 6,3 (2Н, s, способный к обмену с CF3COOD), 7,55 (1H, dd, J=8,7 и 2 Гц), 7,8-8,0 (6Н, m), 10,9 (1H, s, способный к обмену с CF3COOD).
Пример 41
1-(3-хлор-4-нитрометилкарбонилфенил)-3-(фенилсульфонил)мочевина
а) Фенил-2-хлор-4-(фенилсульфониламинокарбониламино)бензоат
1,5 г (8,2 ммоля) фенилсульфонилизоцианата в 20 мл дихлорметана по каплям вводят в суспензию 2,08 г (8,4 ммоля) амина, полученного в примере 12а, в 40 мл дихлорметана. При добавлении первых капель достигают полной солюбилизации с последующим образованием густого осадка. После перемешивания в течение 16 ч при комнатной температуре осадок отфильтровывают, промывают дихлорметаном и сушат при 80oС под вакуумом с получением 2,2 г белого порошка (выход: 62%), tпл 183-185oС.
ЯМР (ДМСО-d6): 7,0-7,9 (13Н, m), 9,3 (1H, s, способный к обмену с CF3СООD), 11,0 (1H, s, способный к обмену с CF3СООD).
б) 1-(3-хлор-4-нитрометилкарбонилфенил)-3-(фенилсульфонил)мочевина
Это соединение получают аналогично примеру 1б (выход: 49%).
tпл 168-169oС.
ЯМР (ДМСО-d6): 6,35 (2Н, s, способный к обмену с CF3СООD), 7,35 (1H, m), 7,5-7,7 (4Н, m), 7,8 (1H, d, J=8,7 Гц), 8,0 (2Н, m), 9,5 (1H, s, способный к обмену с CF3COOD), 11,3 (1H, широкий s, способный к обмену с CF3COOD).
Пример 42
Нитрометил-3-метил-2-тиенилкетон
Раствор, включающий 10 г (70 ммолей) 3-метил-2-тиофенкарбоновой кислоты, 3,4 г (56 ммолей) нитрометана и 115 мл ДМФ, охлаждают до 0oС. В него последовательно добавляют 11,9 г (72,8 ммоля) диэтилцианофосфоната в 56 мл ДМФ и затем 18,2 г (180 ммолей) триэтиламина в 56 мл ДМФ. Далее смесь перемешивают в течение 2 ч при 0oС и в течение 21 ч при комнатной температуре. Реакционную смесь выливают в 1 л смеси толуол/этилацетат в соотношении 1:1 и экстрагируют водой. Водную фазу, подкисленную 40 мл уксусной кислоты, экстрагируют смесью толуол/этилацетат в соотношении 1:1. Органические экстракты промывают водой и затем насыщенным раствором NaCl в воде с последующей сушкой над Na2SO4 и концентрируют. В результате очистки остатка хроматографией в колонке с диоксидом кремния с использованием дихлорметана, а затем перекристаллизации из смеси этилацетат/гексан получают 2 г бледно-желтого твердого вещества (выход: 19%), tпл 59-61oC.
ЯМР ((CDCl3)): 2,6 (3Н, s), 5,7 (2Н, s, способный к обмену с CF3СООD), 7,1 (1H, d, J=4,9 Гц), 7,6 (1H, d, J=4,9 Гц).
Пример 43
N-(3-хлор-4-нитрометилкарбонилфенил)-2-метилфенилацетамид
а) 2-хлор-4-[(2-метилбензил)карбониламино]бензойная кислота
19,56 г (116 ммолей) хлорангидрида (2-метилфенил) уксусной кислоты в течение 1 ч вводят в смесь 20 г (116 ммолей) 4-амино-2-хлорбензойной кислоты, 12,9 г (127 ммолей) триэтиламина и 150 мл ДМФ, высушенного пропусканием через молекулярное сито. После перемешивания в течение 16 ч при комнатной температуре ДМФ удаляют выпариванием под вакуумом. Остаток промывают водой и дихлорметаном, получая после сушки 19 г не совсем белого порошка (выход: 53%), tпл 214-218oC.
ЯМР (ДМСО-d6): 2,25 (3Н, s), 3,8 (2Н, s), 7,1-7,25 (4Н, m), 7,55 (1Н, dd, J=8,6 и 2 Гц), 7,8 (1Н, d, J=8,6 Гц), 7,9 (1Н, d, J=2 Гц), 10,6 (1Н, s, способный к обмену с CF3COOD), 13,1 (1Н, широкий s, способный к обмену с CF3СООD).
б) N-(3-хлор-4-нитрометилкарбонилфенил)-2-метилфенилацетамид
Это соединение получают аналогично примеру 42 с использованием в качестве исходного материала 19 г (62,5 ммоля) 2-хлор-4-[(2-метилбензил)карбониламино] бензойной кислоты, полученной на стадии а), 3,18 г нитрометана, 11 г (67,6 ммоля) диэтилцианофосфоната и 16,8 г (167 ммолей) триэтиламина в 205 мл ДМФ, высушенного пропусканием через молекулярное сито. После хроматографии в колонке с диоксидом кремния (элюент: дихлорметан/метанол в соотношении 95:5) и перекристаллизации из смеси гексан/этилацетат получают 0,2 г (выход: 1%) бледно-желтого порошка, tпл 133-135oС.
ЯМР (ДМСО-d6): 2,3 (3Н, s), 3,8 (2Н, s), 6,45 (2Н, s, способный к обмену с CF3СООD), 7,2-7,3 (4Н, m), 7,75 (1Н, dd, J=8,7 и 2 Гц), 7,9 (2Н, m), 10,8 (1Н, s, способный к обмену с CF3СООD).
Удаление промывных жидкостей позволяет выделить 5,2 г (общий выход: 30%) продукта, идентичного первой порции продукта.
Это соединение получают также из амина, приготовленного в примере 12а, аналогично примеру 28.
Сложный фениловый эфир как промежуточный продукт (tпл 120-123oС, выход: 56%) превращают в соединение -CO-CH2-NO2 [tпл 141-143oC (ацетонитрил)] с выходом 43%.
Пример 44
N-(3-хлор-4-нитрометилкарбонилфенил)-2-оксопиперидин
а) Фенил-2-хлор-4-(5-хлорпентаноиламино)бензоат
Это соединение получают аналогично примеру 14а с использованием в качестве исходного материала соединения, полученного в примере 12а, и хлорангидрида 5-хлорпентановой кислоты.
ЯМР (ДМСО-d6): 1,8 (4Н, m), 2,5 (2Н, t, J=6,7 Гц), 3,75 (2Н, t, J=6,7 Гц), 7,3-7,6 (5Н, m), 7,7 (1H, dd, J=8,7 и 2 Гц), 8,1 (1H, d, J=2 Гц), 8,2 (1H, d, J=8,7 Гц), 10,5 (1H, s, способный к обмену с CF3COOD).
б) N-(3-хлор-4-нитрометилкарбонилфенил)-2-оксопиперидин
Это соединение получают аналогично примеру 1б (выход: 67%).
tпл 119-120oС.
ЯМР (ДМСО-d6): 1,85 (4Н, m), 2,45 (2Н, t, J=6,3 Гц), 3,7 (2Н, t, J=5,5 Гц), 6,4 (2Н, s, способный к обмену с CF3СООD), 7,5 (1H, dd, J=8,5 и 2 Гц), 7,7 (1H, d, J=2 Гц), 7,9 (1H, d, J=8,5 Гц).
Примеры 45 и 46
С использованием в качестве исходного вещества амина, полученного в примере 12а, получают соединения, представленные в табл.7, причем способ осуществляют аналогичного примеру 14.
Примеры 47-57
С использованием в качестве исходного вещества амина, полученного в примере 12а, получают соединения, представленные в табл.8, причем способ осуществляют аналогичного описанному в примере 28.
Пример 58
N-(3-хлор-4-нитрометилкарбонилфенил)-2-пропенамид
Это соединение получают аналогично примеру 31, используя в качестве исходного материала амин, полученный в примере 13, в присутствии триэтиламина и дихлорметана, tпл 140-144oС.
ЯМР (ДМСО-d6): 6,35 (2Н, s, способный к обмену с CF3COOD), 6,8 (1Н, d, J= 12 Гц), 7,4 (3Н, m), 7,65 (4Н, m), 7,9 (1Н, d, J=9 Гц), 8,1 (1Н, d, J=2 Гц), 10,8 (1Н, s, способный к обмену с CF3СООD).
Пример 59
N-(3-метил-4-нитрометилкарбонилфенил)-2-метилфенилацетамид
а) Фенил-2-метил-4-нитробензоат
Это соединение получают аналогично примеру 1а, используя в качестве исходного материала 2-метил-4-нитробензойную кислоту.
б) Фенил-4-амино-2-метилбензоат
Смесь, включающую 3,5 г (13,6 ммоля) нитропроизводного, полученного в примере 59а, 1 г никеля Ренея и 35 мл диоксана, подвергают обработке водородом под давлением примерно 100 атм. в течение 2,5 ч при 80oС. После охлаждения, фильтрования реакционной смеси и концентрирования получают 2,7 г пастообразного твердого вещества.
ЯМР (ДМСО-d6): 2,5 (3Н, s), 6,1 (2Н, s, способный к обмену с CF3СООD), 6,5 (2Н, m), 7,2 (3Н, m), 7,4 (2Н, m), 7,8 (1Н, d, J=8,3 Гц).
в) Фенил-2-метил-N-[(2-метилфенил)карбониламино]бензоат
Это соединение получают аналогично примеру 14а, используя в качестве исходного материала амин, полученный в примере 59б, и хлорангидрид (2-метил) фенилуксусной кислоты (выход: 86%).
ЯМР (ДМСО-d6): 2,3 (3Н, s), 2,6 (3Н, s), 3,7 (2Н, s), 7,1-7,7 (11Н, m), 8,1 (1H, d, J=9 Гц), 10,5 (1H, s, способный к обмену с CF3СООD).
г) N-(3-метил-4-нитрометилкарбонилфенил)-2-метилфенилацетамид
Это соединение получают аналогично примеру 1б, используя в качестве исходного материала фениловый эфир, полученный в примере 59в, tпл 159-160oС.
ЯМР (ДМСО-d6): 2,1 (3Н, s), 2,25 (3Н, s), 3,5 (2Н, s), 6,15 (2Н, s, способный к обмену с CF3СООD), 7,0 (4Н, m), 7,3 (1Н, d, J=1,6 Гц), 7,45 (1Н, dd, J=8,5 и 1,6 Гц), 7,6 (1Н, d, J=8,5 Гц), 10,4 (1Н, s, способный к обмену с CF3СООD).
Пример 60
N-(2-бром-4-нитрометилкарбонилфенил)-2-метилфенилацетамид
а) 3-бром-4-[(2-метилфенил)карбониламино]бензойная кислота
Это соединение получают аналогично примеру 43а, используя в качестве исходного материала 4-амино-3-бромбензойную кислоту и хлорангидрид 2-метилфенилуксусной кислоты (выход: 86%).
ЯМР (ДМСО-d6): 2,1 (3Н, s), 3,6 (2Н, s), 6,9 (3Н, m), 7,0 (1Н, m), 7,75 (1Н, m), 7,9 (1Н, d, J=1,3 Гц), 9,3 (1Н, s, способный к обмену с CF3СООD), 13,0 (1Н, широкий s, способный к обмену с CF3СООD).
б) Фенил-3-бром-4-[(2-метилфенил)карбониламино]бензоат
Это соединение получают аналогично примеру 1а (выход: 98%).
tпл 139-141oС.
ЯМР (ДМСО-d6): 2,4 (3Н, s), 3,9 (2Н, s), 7,2-7,5 (9Н, m), 8,1 (2Н, m), 8,3 (1Н, d, J=1,8 Гц), 9,7 (1Н, s, способный к обмену с CF3СООD).
в) N-(2-бром-4-нитрометилкарбонилфенил)-2-метилфенилацетамид
Это соединение получают аналогично примеру 1б (выход: 41%).
tпл 125-127oС.
ЯМР (ДMCO-d6): 2,2 (3Н, s), 3,7 (2Н, s), 6,3 (2Н, s, способный к обмену с CF3СООD), 7,1 (4Н, m), 7,8 (1Н, dd, J=9 и 2 Гц), 7,9 (1Н, m), 8,1 (1Н, d, J=2 Гц), 9,5 (1Н, s, способный к обмену с CF3СООD).
Пример 61
Нитрометил-2-хлор-4-метоксифенилкетон
а) Фенил-2-хлор-4-метоксибензоат
Это соединение получают аналогично примеру 1а, используя в качестве исходного материала 2-хлор-4метоксибензойную кислоту (выход: 77%).
ЯМР (CDCl3): 3,8 (3Н, s), 6,8 (1Н, dd, J=9 и 2,5 Гц), 6,95 (1Н, d, J=2,5 Гц), 7,15 (3Н, m), 7,3 (2Н, m), 8,0 (1Н, d, J=9 Гц).
б) Нитрометил-2-хлор-4-метоксифенилкетон
Это соединение получают аналогично примеру 1б.
ЯМР (ДМСО-d6): 3,9 (3Н, s), 6,4 (2Н, s, способный к обмену с CF3СООD), 7,1 (1Н, dd, J=9 и 2,5 Гц), 7,2 (1Н, d, J=2,5 Гц), 7,9 (1Н, d, J=9 Гц).
Пример 62
Нитрометил-2-изопропилфенилкетон
а) Фенил-2-изопропилбензоат
Это соединение получают аналогично примеру 1а, используя в качестве исходного материала 2-(1-метилэтил)бензойную кислоту (выход: 85%).
ЯМР (CDCl3): 1,2 (6Н, m), 3,8 (1Н, m), 7,1-7,25 (4Н, m), 7,3-7,5 (4Н, m), 7,9 (1Н, dd, J=8 и 1,5 Гц).
б) Нитрометил-2-изопропилфенилкетон
Это соединение получают аналогично примеру 1б (жидкость).
ЯМР (CDCl3): 1,5 (6Н, m), 3,4 (1Н, m), 5,7 (1Н, s, способный к обмену с CF3COOD), 7,2-7,5 (4Н, m).
Пример 63
N-(4-хлор-2-нитрометилкарбонилфенил)-2-метилфенилацетамид
а) 5-хлор-2-[(2-метилфенил)карбониламино]бензойная кислота
Это соединение получают аналогично примеру 43а, используя в качестве исходного материала 2-амино-5-хлорбензойную кислоту и хлорангидрид 2-метилфенилуксусной кислоты (выход: 75%).
tпл 224-226oС.
ЯМР (ДMCO-d6): 2,3 (3Н, s), 3,8 (2Н, s), 7,2 (4Н, m), 7,7 (1Н, dd, J=9 и 2,5 Гц), 7,9 (1Н, d, J=2,5 Гц), 8,7 (1Н, d, J=9 Гц), 11,1 (1Н, s, способный к обмену с CF3СООD), 14,0 (1Н, широкий s, способный к обмену с CF3СООD).
б) Фенил-5-хлор-2-[(2-метилфенил)карбониламино]бензоат
Это соединение получают аналогично примеру 1а (выход: 38%).
в) N-(4-хлор-2-нитрометилкарбонилфенил)-2-метилфенилацетамид
Это соединение получают аналогично примеру 1б.
tпл 128-130oC.
ЯМР (ДМСО-d6): 2,4 (3Н, s), 3,9 (2Н, s), 6,5 (2Н, s, способный к обмену с CF3COOD), 7,4 (4Н, m), 7,9 (1Н, dd, J=9 и 2 Гц), 8,1 (1Н, d, J=2 Гц), 8,3 (1Н, d, J=9 Гц), 10,9 (1H, s, способный к обмену с CF3СООD).
Пример 64
Нитрометил-2-хлор-4-фенилтиофенилкетон
a) Фенил-2-хлор-4-(фенилтио)бензоат
Раствор 4,15 г (60,5 ммоля) нитрита натрия в 20 мл воды при 0oС вводят в суспензию 15 г (60,5 ммоля) амина, полученного в примере 12а, в 12,1 мл 10 н. соляной кислоты. После перемешивания в течение одного часа при 0oС смесь нейтрализуют насыщенным раствором ацетата натрия. Конечную смесь в течение 15 мин выливают в раствор, температура которого составляет 70-80oС, включающий 8 г (72,6 ммоля) тиофенола, 3,85 г (96 ммолей) гидроксида натрия и 25 мл воды. По завершении добавления реакционную смесь выдерживают в течение 1 ч при 95oС. После охлаждения реакционную смесь экстрагируют этилацетатом. После промывки органической фазы разбавленным раствором гидроксида натрия, а затем водой ее сушат над Na2SO4 и концентрируют под вакуумом. Остаток очищают экспресс-хроматографией на диоксиде кремния (с использованием гексана), получая оранжево-желтую жидкость (выход: 31%).
ЯМР (ДMCO-d6): 7,3-7,7 (12Н, m), 8,1 (1H, m).
б) Нитрометил-2-хлор-фенилтиофенилкетон
Это соединение получают аналогично примеру 1б.
tпл 77-78oC.
ЯМР (ДMCO-d6): 6,5 (2Н, s), 7,3 (2Н, m), 7,7 (5Н, m), 7,95 (1H, d, J=8,5 Гц).
Пример 65
N-(3-хлор-4-нитрометилкарбонилфенил)-4-[(3-хлор-4-нитрометилкарбонилфенил)аминокарбонил]-3-фенилбутанамид
а) Фенил-2-хлор-4-{ {[[3-хлор-4-(феноксикарбонил)фенил]амино]-1,5-диоксо-3-фенилпентил}амино}бензоат
Это соединение получают аналогично примеру 14, используя в качестве исходного материала амин, полученный в примере 12а, и 0,5 экв. дихлорангидрида 3-фенилглутаровой кислоты.
ЯМР (ДМСО-d6): 2,8 (4Н, m), 3,8 (1H, m), 7,1-7,6 (17H, m), 7,9 (2H, d, J=2 Гц), 8,1 (2H, d, J=9 Гц), 10,4 (2H, s, способный к обмену с CF3СООD).
б) N-(3-хлор-4-нитрометилкарбонилфенил)-4-[(3-хлор-4-нитрометилкарбонилфенил)аминокарбонил]-3-фенилбутанамид
Это соединение получают аналогично примеру 1б.
tпл 195-196oС.
ЯМР (ДМСО-d6): 2,8 (4Н, m), 3,8 (1H, m), 6,4 (4Н, s, способный к обмену с CF3СООD), 7,3 (5Н, m), 7,5 (2H, dd, J=9 и 2 Гц), 7,9 (4Н, m), 10,5 (s, способный к обмену с CF3СООD).
Пример 66
Нитрометил-2-хлор-4-фенилсульфинилфенилкетон
а) Фенил-2-хлор-4-(фенилсульфинил)бензоат
5 мл (40 ммолей) 70%-ного раствора гидроперекиси трет-бутила в воде вводят в суспензию 2 г (5,9 ммоля) соединения, полученного в примере 64а, в 60 мл воды. Реакционную смесь выдерживают при 70oС в течение 32 ч. После охлаждения перекиси разрушают добавлением раствора 10 г метабисульфита натрия в 100 мл воды. После перемешивания в течение 2 ч и получения отрицательного результата анализа на перекиси реакционную смесь экстрагируют дихлорметаном. Органическую фазу промывают насыщенным раствором NaCl в воде и сушат над Na2SO4. После концентрирования удалением дихлорметана и очистки экспресс-хроматографией в колонке с диоксидом кремния (с использованием гексана/этилацетата в соотношении 4:1) в виде бесцветного масла получают 0,1 г продукта (выход: 4%).
ЯМР (ДМСО-d6): 7,1 (3Н, m), 7,2-7,4 (5Н, m), 7,7 (3Н, m), 7,8 (1H, d, J= 1,6 Гц), 8,0 (1H, m).
б) Нитрометил-2-хлор-4-фенилсульфинилфенилкетон
Это соединение получают аналогично примеру 1б (в виде масла).
ЯМР (ДМСО-d6): 6,4 (2H, s, способный к обмену с CF3СООD), 6,8 (3Н, m), 7,2 (2H, m), 7,6 (3Н, m).
Пример 67
Нитрометил-4-хлор-2-трифторметоксифенилкетон
а) Фенил-4-хлор-2-трифторметоксибензоат
В герметично закрытом стальном сосуде при 175oС в течение 6 ч выдерживают смесь, включающую 21,5 г (112 ммолей) хлорангидрида 4-хлор-2-гидроксибензойной кислоты, 59,8 г (336 ммолей) трифторида сурьмы, 3,2 г пентафторида сурьмы и 258 мл CCl4. После охлаждения реакционную смесь растворяют в примерно 3 л дихлорметана. Органическую фазу промывают водой. Образующийся осадок промывают дихлорметаном. Объединенные органические фазы сушат над Na2SO4 и концентрируют с получением 19,2 черной жидкости, которую используют без дополнительной очистки.
19,2 г соединения, полученного на предыдущей стадии, смешивают с 90 мл толуола, 75 мл тионилхлорида и несколькими каплями ДМФ и перемешивают в течение 2 ч при комнатной температуре. Далее реакционную смесь концентрируют под вакуумом. Полученный остаток разбавляют 200 мл дихлорметана, после чего добавляют в смесь 9,8 г фенола, 16,2 г триэтиламина и 100 мл дихлорметана. После перемешивания в течение 16 ч при комнатной температуре реакционную смесь выливают на смесь льда с НСl. Конечную смесь экстрагируют дихлорметаном, после чего экстракт промывают разбавленным раствором гидроксида натрия и водой, а затем сушат над Na2SO4 и концентрируют. Остаток очищают хроматографией на диоксиде кремния (с использованием гексана/этилацетата в соотношении 4:1), получая 9,2 г окрашенной в оранжевую окраску жидкости (выход: 37%).
б) Нитрометил-4-хлор-2-трифторметоксифенилкетон
Это соединение получают аналогично примеру 1б в виде пастообразного твердого вещества.
ЯМР (CDCl3): 5,7 (2Н, s, способный к обмену с CF3СООD), 7,3-7,5 (2Н, m), 8,0 (1Н, d, J=9 Гц).
Пример 68
N-[2-(3-хлор-4-нитрометилкарбонилфенил)этил]-2-метилбензол-сульфонамид
а) Этил-2-хлор-4-(цианометил)бензоат
3,1 г (11,2 ммоля) этил-4-(бромметил)-2-хлорбензоата по каплям вводят в раствор, включающий 0,94 г (14,3 ммоля) цианида калия, 3,75 мл воды и 8,8 мл этанола, нагретого до кипения (с обратным холодильником). После кипячения с обратным холодильником в течение 3 ч смесь выливают в 200 мл воды и экстрагируют этилацетатом. Органическую фазу промывают разбавленным раствором НСl, а затем промывают насыщенным водным раствором NaCl. Продукт в виде масла, полученный после концентрирования органической фазы, очищают экспресс-хроматографией на диоксиде кремния (с использованием гексана/этилацетата с градиентом соотношения от 1:0 до 1:1). Получают 0,4 г коричневого твердого вещества (выход: 16%), tпл 60oС.
ЯМР (CDCl3): 1,4 (3Н, t, J=7 Гц), 3,8 (2Н, s), 4,5 (2Н, q, J=7 Гц), 7,1 (1H, m), 7,5 (1H, d), 7,9 (1H, d).
6) Этил-4-(2-аминоэтил)-2-хлорбензоат
Смесь, включающую 1,9 г (8,5 ммоля) этил-2-хлор-4-(цианометил)бензоата и 0,5 г никеля Ренея в 70 мл метанола, содержащего несколько миллилитров жидкого аммиака, подвергают обработке водородом под давлением примерно 60 кг/см2 при 50oС в течение 5 ч, а затем при 80oС в течение 4,5 ч. После фильтрования реакционной смеси в виде масла получают 1,5 г продукта (выход: 77%).
ЯМР (CDCl3): 1,3 (3Н, t, J=7 Гц), 1,7 (2Н, широкий s, способный к обмену с CF3СООD), 2,6-3,0 (4Н, m), 4,3 (2Н, q, J=7 Гц), 7,0 (1H, m), 7,2 (1H, m), 7,6 (1H, d, J=6,3 Гц).
в) Этил-2-хлор-4-[2-(2-метилфенилсульфониламино)этил]бензоат
Это соединение получают аналогично примеру 32в (выход: 43%) (в виде масла).
ЯМР (CDCl3): 1,3 (3Н, t, J=7 Гц), 2,4 (3Н, s), 2,7 (2Н, m), 3,1 (2Н, m), 4,3 (2Н, q, J=7 Гц), 4,4 (1H, широкий s, способный к обмену с CF3СООD), 6,9 (1Н, m), 7,0 (1H, m), 7,1-7,4 (3H, m), 7,7 (1H, m), 7,8 (1H, dd, J=8 и 1,25 Гц).
г) 2-хлор-4-[2-(2-метилфенилсульфониламино)этил]бензойная кислота
Смесь, включающую 1 г (2,6 ммоля) предварительно полученного сложного этилового эфира, 18 мл метанола, 18 мл воды и 0,2 г (5,2 ммоля) таблетированного NaOH, выдерживают в течение 4 ч при 40oС. После концентрирования удалением метанола и добавления 30 мл воды смесь промывают СН2Сl2. Далее водную фазу подкисляют с получением 0,675 г белого осадка (выход: 72%), tпл 122-124oС.
ЯМР (ДМСО-d6): 2,3 (3H, s), 2,7 (2Н, m), 3,0 (2Н, m), 7,0-7,8 (8Н, m, из которых 1H способен к обмену с CF3СООD), 13,1 (1H, широкий s, способный к обмену с CF3СООD).
д) Фенил-2-хлор-4-[2-(2-метилфенилсульфониламино)этил]бензоат
Это соединение получают аналогично примеру 1а (выход: 61%) (в виде масла).
ЯМР (CDCl3): 2,4 (3H, s), 2,7 (2Н, m), 3,2 (2Н, m), 4,1 (1H, m, способный к обмену на D2O), 7,0-8,0 (12Н, m).
е) N-[2-(3-хлор-4-нитрометилкарбонилфенил)этил]-2-метилбензолсульфонамид
Это соединение получают аналогично примеру 1б (в виде масла).
ЯМР (CDCl3): 2,5 (3H, s), 2,7 (2Н, t, J=5 Гц), 3,2 (2Н, t, J=5 Гц), 4,4 (1H, широкий s, способный к обмену с CF3COOD), 5,8 (2Н, s, способный к обмену с CF3СООD), 7,0-7,5 (5Н, m), 7,6 (1H, m), 7,9 (1H, m).
Пример 69
N-(3-бром-4-нитрометилкарбонилфенил)-2-метилфенилацетамид
а) 2-бром-4-[(2-метилбензил)карбониламино]бензойная кислота
Это соединение получают аналогично примеру 43, используя в качестве исходного материала 4-амино-2-бромбензойную кислоту (выход: 23%), tпл разложения при 205oС.
ЯМР (ДМСО-d6): 2,4 (3H, s), 3,9 (2Н, s), 7,2 (4Н, m), 7,6 (1H, dd, J=9 и 2 Гц), 7,9 (1H, d, J=9 Гц), 8,2 (1H, d, J=2 Гц), 10,7 (1H, s, способный к обмену с CF3СООD), 13,0 (1H, широкий s, способный к обмену с CF3СООD).
б) Фенил-2-бром-4-[(2-метилбензил)карбониламино]бензоат
Это соединение получают аналогично примеру 14а (выход: количественный) (в виде масла).
ЯМР (ДМСО-d6): 2,0 (3Н, s), 3,7 (2Н, s), 6,8-7,3 (9Н, m), 7,5 (1Н, dd, J=8 и 2 Гц), 7,8 (1H, d, J=8 Гц), 8,0 (1H, d, J=2 Гц), 10,5 (1H, s, способный к обмену с CF3СООD).
в) N-(3-бром-4-нитрометилкарбонилфенил)-2-метилфенилацетамид
Это соединение получают аналогично примеру 1б (в виде масла).
ЯМР (ДМСО-d6): 2,4 (3Н, s), 3,8 (2Н, s), 6,5 (2Н, s, способный к обмену с CF3СООD), 7,2-7,6 (4Н, m), 7,8 (1H, dd, J=9 и 2 Гц), 8,0 (1H, d, J=9 Гц), 8,3 (1H, d, J=2 Гц), 10,9 (1H, s, способный к обмену с CF3СООD).
Пример 70
N-(3-хлор-4-нитрометилкарбонилфенил)-N-изопропилбензолсульфонамид
а) Фенил-2-хлор-4-[(изопропил)(фенилсульфонил)амино]бензоат
10,1 г (25,5 ммоля) гидрида натрия (55%-ного в масле) вводят в раствор 9,9 г (25,5 ммоля) соединения, полученного в примере 32а, в 100 мл ДМФ. После перемешивания в течение 1 ч при комнатной температуре добавляют 9,4 г (76,5 ммоля) 2-бромпропана и смесь перемешивают при комнатной температуре в течение 16 ч с последующей выдержкой при 60oС в течение 34 ч. Далее добавляют 5,1 мл (51 ммоль) 2-иодпропана. Затем реакционную смесь выдерживают при 60oС в течение 4 ч, после чего выливают на смесь воды со льдом и НСl. Смесь экстрагируют этилацетатом с последующими сушкой и концентрированием экстракта, получая продукт в виде масла. В результате очистки хроматографией в колонке с диоксидом кремния (с использованием CH2Cl2) получают 1,9 г не совсем белых кристаллов (выход: 17%), tпл 120oС.
ЯМР (ДМСО-d6): 1,0 (6Н, d, J=6,5 Гц), 4,4 (1H, m), 7,1-7,9 (12Н, m), 8,0 (1H, d, J=8 Гц).
б) N-(3-хлор-4-нитрометилкарбонилфенил)-N-изопропилбензолсульфонамид
Это соединение (в виде масла) получают аналогично примеру 1б с использованием в качестве исходного материала фенилового эфира, полученного в примере 65а.
ЯМР (CDCl3): 1,0 (6Н, d, J= 7 Гц), 4,5 (1Н, q, J=7 Гц), 5,8 (2Н, s, способный к обмену с CF3СООD), 7,0 (1Н, dd, J=9 и 2 Гц), 7,15 (1Н, m), 7,35-7,7 (6Н, m).
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРОИЗВОДНЫЕ НИТРОМЕТИЛТИОБЕНЗОЛА, СПОСОБ ИХ ПОЛУЧЕНИЯ (ВАРИАНТЫ) И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1997 |
|
RU2184110C2 |
| ПРОИЗВОДНЫЕ ХИНАЗОЛИНОНА В КАЧЕСТВЕ ИНГИБИТОРОВ PARP | 2013 |
|
RU2650107C2 |
| МАКРОЦИКЛИЧЕСКИЕ ПРОИЗВОДНЫЕ ПИРИДАЗИНОНА | 2014 |
|
RU2660435C2 |
| 3-АМИНОЦИКЛОПЕНТАНКАРБОКСАМИДНЫЕ ПРОИЗВОДНЫЕ | 2013 |
|
RU2641913C2 |
| ПРОИЗВОДНЫЕ ХИНОЛИН-2-ОНА В КАЧЕСТВЕ ИНГИБИТОРОВ КИНАЗЫ C-KIT | 2016 |
|
RU2754858C2 |
| ИНДАЗОЛИЛИЗОКСАЗОЛЬНЫЕ ПРОИЗВОДНЫЕ ДЛЯ ЛЕЧЕНИЯ ЗАБОЛЕВАНИЙ, ТАКИХ КАК ЗЛОКАЧЕСТВЕННОЕ НОВООБРАЗОВАНИЕ | 2020 |
|
RU2836662C2 |
| 4-(ИМИДАЗО[1,2-а]ПИРИДИН-3-ИЛ)-ПИРИМИДИНОВЫЕ ПРОИЗВОДНЫЕ | 2020 |
|
RU2822388C2 |
| α-(1-ПИПЕРАЗИНИЛ)АЦЕТАМИДОПРОИЗВОДНЫЕ АРЕНКАРБОНОВОЙ КИСЛОТЫ, СПОСОБ ИХ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ, СПОСОБЫ ЛЕЧЕНИЯ | 1998 |
|
RU2198881C2 |
| ПРОИЗВОДНЫЕ 4-(1-ПИПЕРАЗИНИЛ)БЕНЗОЙНОЙ КИСЛОТЫ, СПОСОБ ИХ ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1997 |
|
RU2178786C2 |
| ПРОИЗВОДНЫЕ ПИПЕРИДИНМОЧЕВИНЫ | 2014 |
|
RU2666894C2 |
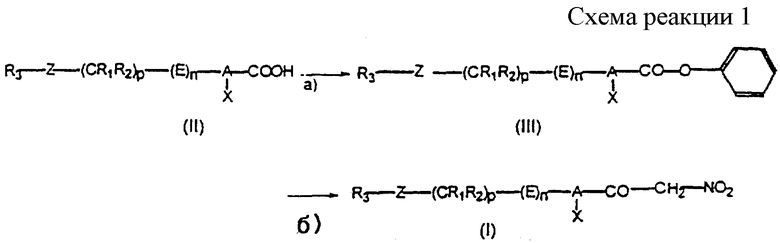


Изобретение относится к новым нитрометилкетонам формулы (I)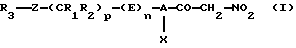
в которой A обозначает C6-C10арил, тиенил, бензотиенил; X обозначает галоген, цианогруппу, C1-C7алкил, трифторметил, C2-C7алкокси, или трифторметоксигруппу; p выбирают из 0, 1, 2, 3, 4 или 5; Z обозначает связь, -CO-NH-, SO2-NH-, атом серы, сульфинильную группу или C2-C7алкениленовый радикал; R1, R2, R3 и E указаны в п.1. Также описаны способ получения этих соединений и фармацевтическая композиция для ингибирования альдозоредуктазы на их основе. Технический результат - получены новые соединения, обладающие полезными биологическими свойствами. 7 с. и 10 з.п. ф-лы, 8 табл.
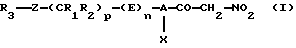
в которой А обозначает С6-С10арил, тиенил, бензотиенил;
Х обозначает галоген, цианогруппу, С1-С7алкил, трифторметил, С2-С7алкокси или трифторметоксигруппу,
R1 и R2 могут быть одинаковыми или различными и каждый обозначает водород, С1-С7алкил, С3-С12циклоалкил,
р = 0, 1, 2, 3, 4 или 5;
Z обозначает связь, двухвалентный радикал -СО-NH-, в котором карбонильная группа связана с R3, двухвалентный радикал -SO2-NH-, в котором сульфонильная группа связана с R3, атом серы, сульфинильную группу или С2-С7алкениленовый радикал;
R3 обозначает водород, галоген, С1-С7алкил, С6-С10арил, необязательно замещенный одним или несколькими одинаковыми или различными радикалами Y, С6-С10арилоксигруппу, необязательно замещенную одним или несколькими одинаковыми или различными радикалами Y, С3-С12циклоалкил, необязательно замещенный одним или несколькими одинаковыми или различными радикалами Y, бензотиенил, бензофурил, 1,3-дигидро-1,3-диоксо-2Н-изоиндол-2-ил, 2-оксопиперидинил, 2-[(4-нитрометилкарбонил-3-хлорфенил)аминокарбонил] -1-(фенил)этил;
Y - обозначает галоген, С1-С7алкил, С1-С7алкоксигруппу, трифторметил, карбокси, нитро-, С6-С10арил,
Е обозначает двухвалентный радикал - СО-NR4-, у которого карбонильная группа связана с -(СR1R2)p-, -SO2-NR4-, у которого сульфонильная группа связана с -(СR1R2)p-, -NR4-, кислород, а R4 означает радикал -(СН2)qR5, где q= 0, а R5 обозначает водород, С1-С7алкил; n = 0 или 1,
за исключением 3,5-диметил-1-нитроацетилпиразол,
а также аддитивные соли фармацевтически приемлемых оснований.
N-(3-хлор-4-нитрометилкарбонилфенил)-2-метилфенилацетамид,
N-(3-хлор-4-нитрометилкарбонилфенил)-2-трифторметилфенилацетамид,
N-(3-хлор-4-нитрометилкарбонилфенил)фенилацетамид,
N-(3-хлор-4-нитрометилкарбонилфенил)-2-хлорфенилацетамид,
N-(3-хлор-4-нитрометилкарбонилфенил)-4-хлорбензамид,
N-(3-хлор-4-нитрометилкарбонилфенил)-4-хлорбензолсульфонамид,
N-(4-хлор-3-нитрометилкарбонилфенил)бензолсульфонамид,
N-(3-хлор-4-нитрометилкарбонилфенил)-бензолсульфонамид,
1-(3-хлор-4-нитрометилкарбонилфенил)-3-(фенилсульфонил)мочевину,
нитрометил-2-трифторметоксифенилкетон,
нитрометил-3-метил-2-тиенилкетон,
4-метил-N-[2-нитрометилкарбонил-3-метилбензо[b] тиен-5-ил] бензолсульфонамид,
нитрометил-2-метил-1-нафтилкетон,
нитрометил-3-хлор-2-нафтилкетон,
нитрометил-6-метокси-5-трифторметил-1-нафтилилкетон.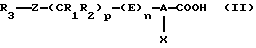
в которой R1, R2, R3, Z, E, n, p, A и Х имеют значения, указанные в п. 1,
смесью нитрометана и ди (С1-С7) алкилцианофосфоната в присутствии основания.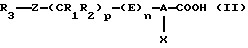
в которой R1, R2, R3, Z, E, n, p, A и Х имеют значения, указанные в п. 1,
тионилхлоридом или фосфорилхлоридом в присутствии фенола с получением соответствующего фенилового эфира формулы (III)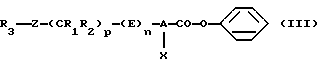
в которой R1, R2, R3, Z, E, n, p, A и Х имеют значения, указанные выше,
последующей (II) обработкой фенилового эфира, полученного на стадии (I), нитрометаном в присутствии основания с получением соединения формулы (I).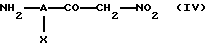
в которой А и Х имеют значения, указанные в п. 1,
или (II) когда значение n = 1, а Е обозначает группу -SO2-NR4-, проводят взаимодействие сульфонилгалогенида формулы R3-Z-(CR1R2)р-SO2-hal, где R1,
R2, R3, Z и р имеют значения, указанные в п. 1, а hal обозначает атом галогена, с амином формулы (IV), который представлен выше.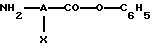
в которой А и Х имеют значения, указанные в п. 1,
с последующей (б) обработкой фенилового эфира, полученного на стадии (а), нитрометаном в присутствии основания с получением соединения формулы (I).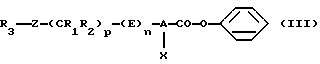
в соответствии с одной из следующих стадий (I)-(V):
(I) когда n = 1, а Е обозначает -СО-NR4-, проводят взаимодействие галоидангидрида кислоты формулы R3-Z-(CR1R2)p-CO-hal, где R1, R2, R3, Z и р имеют значения, указанные в п. 1, а hal обозначает атом галогена, с амином формулы (V)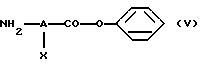
в которой А и Х имеют значения, указанные в п. 1,
или
(II) когда n = 1, а Е обозначает группу -SО2-NR4-, проводят взаимодействие сульфонилгалогенида формулы R3-Z-(CR1R2)p-SO2-hal, где R1, R2, R3, Z и р имеют значения, указанные в п. 1, а hal обозначает атом галогена, с амином формулы (V), который представлен выше, или
(III) когда n = 1, а Е обозначает -NR4-, проводят взаимодействие соединения формулы R3-Z(CR1R2)p-hal, где R1, R2, R3, Z и р имеют значения, указанные в п. 1, а hal обозначает атом галогена, с амином формулы (V), который представлен выше, или
(IV) когда n = 1, а Е обозначает -СН= N-, проводят взаимодействие альдегида формулы R3-Z-(CR1R2)pCHO, где R1, R2, R3, Z и р имеют значения, указанные в п. 1, с амином формулы (V), который представлен выше, или
(V) когда n = 1, а Е обозначает -О-, проводят взаимодействие соединения формулы R3-Z-(CR1R2)p-hal, где R1, R2, R3, Z и р имеют значения, указанные в п. 1, а hal обозначает атом галогена, со спиртом формулы (VI)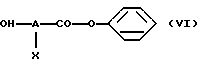
в которой А и Х имеют значения, указанные в п. 1,
или
(VI) когда n = 1, а Е обозначает -СО-NR4-, проводят взаимодействие кислоты формулы R3-Z-(CR1R2)p-СООН-, где R1, R2, R3, Z и р имеют значения, указанные выше, с амином формулы (V), который представлен выше, с последующей (б) обработкой фенилового эфира, полученного на стадии (а), нитрометаном в присутствии основания с получением соединения формулы (I).
| ФЕНИЛАЦЕТИЛЬНЫЕ ПРОИЗВОДНЫЕ (4-АМИНО-2,6-ДИМЕТИЛФЕНИЛСУЛЬФОНИЛ)НИТРОМЕТАНА ИЛИ ИХ ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫЕ СОЛИ В КАЧЕСТВЕ ИНГИБИТОРОВ ФЕРМЕНТА АЛЬДОЗОРЕДУКТАЗЫ, И КОМПОЗИЦИЯ, ОБЛАДАЮЩАЯ СВОЙСТВОМ ИНГИБИТОРА ФЕРМЕНТА АЛЬДОЗОРЕДУКТАЗЫ | 1991 |
|
RU2068409C1 |
| УСТРОЙСТВО для ПОШТУЧНОЙ ВЫДАЧИ из стопы | 0 |
|
SU304190A1 |
| СПОСОБ ПОЛУЧЕНИЯ ФАРМАЦЕВТИЧЕСКИ АКТИВНЫХ РЕКОМБИНАНТНЫХ БЕЛКОВ | 2002 |
|
RU2227745C2 |
| Сепаратор покускового обогащения минерального сырья | 1972 |
|
SU574231A1 |
| US 3983156 А, 28.09.1976 | |||
| ОБРАТИМЫЙ ТЕРМОХИМИЧЕСКИЙ ЦВЕТОВОЙ ИНДИКАТОР | 2020 |
|
RU2741011C1 |
Авторы
Даты
2002-12-10—Публикация
1998-04-21—Подача