Изобретение относится к фармацевтической композиции, обладающей улучшенным противоопухолевым действием и/или сниженными побочными эффектами.
Подавляющее большинство противоопухолевых агентов (цитостатиков) разрушают клетки опухоли, действуя частично через ингибирование синтеза ДНК и РНК, и частично через разрушение синтезированной ДНК. Известные противоопухолевые агенты могут серьезно повреждать гены здоровых клеток, приводя к мутациям или выпадениям как в митохондриальном, так и в ядерном геноме. Помимо своего основного противоопухолевого действия, противоопухолевые агенты часто приводят к общему повреждению клетки. Вследствие этого побочные эффекты часто делают продолжение лечения невозможньм и даже приводят к смерти пациента. Поэтому наиболее критическим моментом противоопухолевого лечения является чувствительность пациента к серьезньм побочным эффектам цитостатиков.
Из-за возникновения проблем, описанных выше, важное значение имеет создание фармацевтической композиции, которая будет обладать противоопухолевой активностью цитостатиков или увеличивать их противоопухолевую активность без побочных эффектов или, по крайней мере, со сниженным побочным действием.
Целью изобретения является получение фармацевтической композиции, в которой действие известной активной противоопухолевой субстанции или улучшено, или это действие сохранено, но при этом одновременно побочные эффекты известной активной субстанции уменьшены.
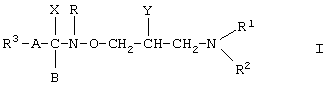
Производные гидроксамовой кислоты формулы (I)
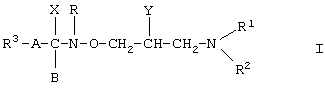
где R1 является атомом водорода или С1-5 алкильной группой;
R2 является атомом водорода; С1-5 алкильной группой С3-8 циклоалкильной группой или фенильной группой, которая может быть замещена гидроксильной или фенильной группой, или
R1 и R2 совместно со смежным атомом азота образуют кольцо, от пятичленного до восьмичленного, которое может содержать один или более дополнительный(ых) атом(ов) азота, кислорода или серы, и это кольцо может быть соединено с другим алициклическим или гетероциклическим кольцом, предпочтительно с бензольным, нафталиновым, хинолиновым, изохинолиновым, пиридиновым или пиразолиновым кольцом; более того, если желательно и это возможно, гетероатом(ы) азота и/или серы представлены в форме оксида или диоксида;
R3 является атомом водорода, фенильной группой, нафтильной группой или пиридильной группой, которая может быть замещена одним или более атомом(ами) галогена или С1-4 алкоксильной(ыми) группой(ами);
Y является атомом водорода; гидроксильной группой; С1-24 алкоксильной группой, которая может быть замещена аминогруппой; С2-24 полиалкеноксильной группой, содержащей от 1 до 6 двойной(ых) связи(ей); С1-25 насыщенной ацильной группой; С3-9 ненасыщенной ацильной группой; или группой формулы R7COO-, где R7 является С2-30 полиненасыщенной группой, содержащей от 1 до 6 двойной(ых) связи(ей);
Х является атомом галогена; аминогруппой; С1-4 алкоксильной группой или
Х вместе с В являются одним атомом кислорода; или
Х и Y вместе со смежными атомами углерода и расположенной между ними группой -NR-O-CH2- образуют кольцо формулы (а)
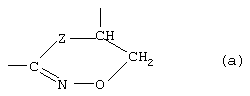
где Z является атомом кислорода или атомом азота;
R является атомом водорода или
R и В вместе образуют химическую связь;
А является С1-4 алкиленовой группой или химической связью; или группой формулы (b)
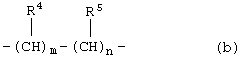
где R4 является атомом водорода; С1-5алкильной группой; С3-8циклоалкильной группой или фенильной группой, предпочтительно замещенной атомом галогена, C1-4алкоксильной группой или С1-5алкильной группой;
R5 является атомом водорода; С1-4алкильной группой или фенильной группой;
m имеет значение 0,1 или 2;
n имеет значение 0,1 или 2
известны в данной области развития техники.
US-P No.4308399 раскрывает соединения, принадлежащие к области производных гидроксамовой кислоты формулы (I), которые применяются для лечения диабетической ангиопатии.
EP-PS No.417210 описывает галогенпроизводные гидроксамовой кислоты, также попадающие в область соединений по формуле (I), которые проявляют селективное действие β-блокаторов и применяются для лечения диабетической ангиопатии.
HU-PS, опубликованный под No. T/66350, раскрывает ряд других производных гидроксамовой кислоты, находящихся внутри области соединений формулы (I). Эти известные соединения применяются в терапии васкулярных деформаций, особенно при сахарном диабете.
Известно из заявки РСТ, опубликованной под No. WO 97/13504, что производные гидроксамовой кислоты формулы (I) применяются для предотвращения и лечения заболеваний митохондриального происхождения.
Целью настоящего изобретения является получение фармацевтической композиции, обладающей действием известных цитостатических агентов, но проявляющей их побочные эффекты в меньшей степени.
Было обнаружено, что вышеупомянутая цель может быть достигнута с помощью фармацевтической композиции по изобретению, которая включает в себя известный цитостатический агент или, если желательно и возможно, его терапевтически применимую кислотную аддитивную соль или его терапевтически приемлемую соль и производное гидроксамовой кислоты формулы (I), где R, R1, R2, R3, А, В, Х и Y такие, как указано выше, или его терапевтически приемлемую кислотную аддитивную соль вместе с одним или более общепринятым наполнителем. В соответствии с настоящим изобретением рассматриваются цитостатические агенты за исключением препаратов платины, аналогов пиримидина и производных такс-11-ен-9-она.
Согласно изобретению заместители, определяемые в соответствии с формулой (I), являются следующими:
- С 1-5 алкильной группой является, например, метильная, этильная, н-пропильная, изопропильная, н-бутильная или н-пентильная группа, предпочтительно метильная или этильная группа;
- С3-8 циклоалкильной группой является, например, циклопропильная, циклопентильная, циклогексильная, циклогептильная или циклооктильная группа, предпочтительно циклопентильная или циклогексильная группа;
- кольцом, от пятичленного до восьмичленного, может быть, например, пиррол, пиразолин, имидазол, оксазол, тиазол, пиридин, пиридазин, пиримидин, пиперазин, морфолин, индол или хинолин или подобное кольцо;
- C1-24 алкоксильной группой, является, например, метокси, этокси, н-пропокси, трет-бутокси, н-пентокси, децилокси, додецилокси, октадецилокси и др. группа;
- С1-25 насыщенной ацильной группой является, например, формильная, ацетильная, пропионильная, бутирильная, калроильная, пальмитильная, стеарильная и др. группа;
- С3-9 ненасыщенной ацильной группой является, например, акрилоильная, пентеноильная, гексеноильная, гептеноильная, октеноильная и др. группа;
- С1-4 алкиленовой группой является, например, метиленовая, этиленовая, пропиленовая или бутиленовая группа;
- атомом галогена является, например, атом фтора, хлора, брома или иода, предпочтительно атом хлора или брома.
Y в качестве R7-COO- группы является, например, линоленоильной, линолеильной, докозагексаноильной, эйкозапентаноильной, арахидоноильной и др. группой.
Подразумевается, что физиологически (терапевтически) приемлемыми кислотными аддитивными солями соединений формулы (I) являются кислотные аддитивные соли, образованные с терапевтически приемлемыми неорганическими кислотами, например, соляной или серной кислотой и подобными, или с терапевтически приемлемыми органическими кислотами, например уксусной, фумаровой или молочной кислотой и подобньми.
Среди соединений формулы (I) предпочтительная подгруппа состоит из производных гидроксамовой кислоты формулы (II)
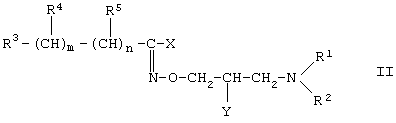
где R1, R2, R3, R4, R5, m и n такие, как определено по формуле (I), X означает атом галогена или аминогруппу и Y является гидроксильной группой.
Соединения формулы (II), где R1 и R2 вместе с примыкающим атомом азота образуют пиперидиновую группу; R3 является пиридильной группой и m, и n равны нулю; Х как определено выше, особенно предпочтительны. Из них O-(3-пиперидино-2-гидроксил-1-пропил)никотиновой кислоты амидоксим дигидрохлорид (соединение L) особенно предпочтительно.
Другая предпочтительная группа соединений формулы (I) состоит из соединений формулы (III)
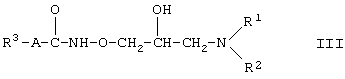
где R1, R2, R3 и А такие, как определено для формулы (I).
Третья предпочтительная подгруппа производных гидроксамовой кислоты формулы (I) включают в себя циклические соединения формулы (IV)
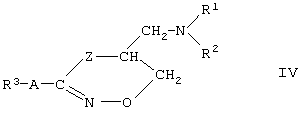
где R1, R2, R3 и А такие, как определено для формулы (I), a Z является атомом азота или кислорода.
Еще одна предпочтительная подгруппа производных гидроксамовой кислоты формулы (I) состоит из соединений формулы (V)
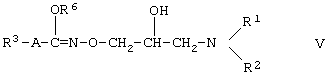
где R1, R2, R3 и А такие, как определено в формуле (I), a R6 является С1-4алкильной группой.
Соединения формулы (I) могут быть получены с использованием способа, известного из US-PS No.4308399, EP-PS No.417210; так же, как и из опубликованной заявки на Венгерский Патент No. T/66350.
Согласно современным представлениям об активности известный цитостатический агент (субстанция) - это такой активный агент, который посредством прямого или непрямого воздействия ингибирует синтез ДНК и/или транскрипцию (синтез РНК) и/или трансляцию клетки опухоли; или повреждает синтезированную ДНК.
Известное фармацевтическое соединение с противоопухолевой активностью является соединением, которое посредством прямого или непрямого воздействия ингибирует синтез ДНК и/или транскрипцию (синтез РНК) и/или трансляцию, и повреждает синтезированную ДНК в раковой клетке.
Более детально, известное фармацевтическое соединение с противооопухолевой активностью ингибирует:
- аденозиндеаминазу,
- биосинтез пуриновых оснований и трансформацию нуклеотидов,
- биосинтез пиримидиновых оснований,
- восстановление рибонуклеотидов,
- синтез тимидина монофосфата,
- синтез РНК,
- завершение ДНК,
- синтез ДНК,
- повреждение ДНК,
- синтез пуриновых оснований и восстановление дигидрофолата,
- синтез белка и дезаминирование аспарагина,
- функцию размножения.
Согласно современным представлениям о химической структуре известные цитостатики могут быть:
- алкилирующими агентами, содержащими нитропроизводные горчицы, производные этиленимина и метилмеламина; алкилсульфонатами; нитрозомочевиной; азеридинами; триазенами и подобньши соединениями;
- антиметаболитами, в их числе аналогами фолиевой кислоты, аналогами пиримидина. аналогами пурина и подобньми соединениями;
- натуральными субстанциями, включая алкалоиды барвинка, подофиллотоксин, антибиотики и подобные соединения;
- гормонами, включая адренокортикостероиды, эстрогены, андрогены, антиэстрогены и подобные соединения; и
- другими субстанциями, такими как комплексформирующие агенты.
Из известных цитостатических активных агентов, например, предпочтительными алкилирующими агентами являются следующие:
Хлорметин: 2-хлоро-N-(2-хлорэтил)-N-метилэтанмин гидрохлорид,
Мехлорэтаминоксид: 2-хлоро-N-(2-хлороэтил)-N-метилэтанаминN-оксид,
Циклофосфамид: N,N-bis(2-хлороэтил)-тетрагидро-2Н-1,2,3-оксазафосфорин-2-амин-2-оксид,
Ифосфамид: N,3-bis(2-хлороэтил)-тетрагидро-2Н-1,2,3-оксазафосфорин-2-амин-2-оксид,
Мелфалан: 4-[bis(2-хлороэтил)амино]-L-фенилаланин,
Хлорамбуцил: 4-[bis(2-хлороэтил)амино]-фенилбутановая кислота,
Тиотепа: триэтилентиофосфорной кислоты амид,
Бусульфан: 1,4-бутандиолдиметансульфонат,
Кармустин: 1,3-bis(2-хлороэтил)-1-нитрозомочевина,
Ломустин: 1-(2-хлороэтил)-3-циклогексил-1-нитрозомочевина,
Семустин: 1-(2-хлороэтил)-3-(4-метилциклогексил)-1-нитрозомочевина,
Импросульфан: N,N-bis(3-метилсульфонилоксипропил)-амин,
Пипосульфан: 1,4-bis(3-метансульфонилокси-1-оксопропил)-пиперазин,
Бензодепа: bisz(1-азиридинил)фосфинилкарбаминовой кислоты фенилметиловый эфир,
Метуредепа: bis(2,2-диметил-1-азиридинил)фосфинилкарбаминовой кислоты этиловый эфир,
Уредепа: bis(1-азиридинил)фосфинилкарбаминовой кислоты этиловый эфир,
Карбоквон: 2-[(2-аминокарбонилокси)-1-метоксиэтил]-3,6-bis(1-азиридинил)-5-метил-2,5-циклогексадиен-1,4-дион,
Альтретамин: N,N,N',N',N'',N''-гексаметил-1,2,3-триазин-2,4,6-триамин,
Триэтиленфосфорамид: tris(1'-азиридинил)фосфин оксид,
Триметиломеламин: 2,4,6-tris(метилоламино)-1,3,5-триазин,
Хлорнафтазин: N,N-bis(2-хлороэтил)-2-нафтиламин,
Циклофосфамид: N'N-bis(2-хлороэтил)-тетрагидро-2Н-1,3,2-оксазафосфорин-2-амин 2-оксид,
Эстрамустин: эстра-1,3,5(10)-триен-3,17-диол-3-[bis(2-хлороэтил)карбамат],
Новембихин: 2-хлоро-N,N-bis(2-хлороэтил)пропанамин гидрохлорид,
Фенестерин: Холест-5-ен-3β-ол-4-[bis(2-хлороэтил)-амино]-фенил ацетат,
Преднимустин: 21-{4-[4-[bis(2-хлороэтил)амино]фенил]-1-оксо-бутокси}-11,17-дигидроксипрегна-1,4-диен-3,20-дион,
Трофосфамид: N,N,3-tris(2-хлороэтил)-тетрагидро-2Н-1,3,2-оксазафосфорин-2-амин 2-оксид,
Урацил-мустард: 5-[bis(2-[хлороэтил)амино]-2,4(1Н,3Н)-пиримидиндион,
Хлорозотоцин: 2-[(2-хлороэтил)-нитрозоаминокарбониламино]-2-дезокси-D-глюкоза,
Фотемустин: [1-[(2-хлороэтил)-нитрозоаминокарбониламино]этил]фосфиновой кислоты диэтиловый эфир,
Нимустин: N'-[(4-амино-2-метил-5-пиримидинил)-метил]-N-(2-хлороэтил)-N-нитрозомочевина,
Ранимустин: метил-6-[(2-хлороэтил)-нитрозаминокарбониламино]-6-дезокси-D-глюкопиранозид,
Манномустин: 1,6-bis(2-хлороэтиламино)-1,6-дидезокси-D-маннит дигидрохлорид,
Митобронитол: 1,6-дибромо-1,6-дидезокси-D-маннит,
Митолактол: 1,6-дибромо-1,6-дидезоксигалактит,
Пипоброман: 1,4-bis(3-бромооксопропил)-пиперазин,
Декарбазин: 5-(3,3-диметил-1-триазено)имидазол-4-карбоксамид.
Предпочтительными антиметаболитами являются, например, следующие:
Метотрексат: N-[4-[2,4-диамино-6-птеридинил)метил-метиламино]бензоил]-L-глутаминовая кислота или ее натриевая соль,
Триметрексат: 5-метил-6-[(3,4,5-триметоксифенил)-аминометил]-2,4-хиназолиндиамин,
Флоксуридин: 5-фтор-2'-дезоксиуридин,
Идоксуридин: 5-иодо-2'-дезоксиуридин,
Доксифлюридин: 5-дезокси-5-фторуридин,
Цитарабин: 4-амино-1β-D-арабинофуранозил-2(1Н)-пиримидинон,
Азацитидин: 4-амино-1β-D-рибофуранозил-1,3.5-триазин-2(1Н)-он,
Гемцитабин: 2',2'-дифтородезоксицитидин,
Меркаптопурин: 6-меркаптопурин,
Тиогуанин: 6-тиогуанин,
Флударабин фосфат: 9β-D-арабинофуранозил-2-фторо-9Н-пурин-6-амин фосфат,
Пентостатин: (R)-3-(2-дезокси-бета-D-эритро-пентофуранозил)-3,6,7,8-тетрагидроимидазо [4,5-d] [1,3]диазепин-8-ол,
Кладрибин: 2-хлородезоксиаденозин,
Тиамиприн: 6-(1-метил-4-нитро-1Н-имидазол-5-илтио)-1Н-пурин-2-амин,
Анцитабин: 2,3,3а,9а-тетрагидро-3-гидрокси-6-имино-6Н-фуро[2',3':4,5]оксазоло[3,2-а]пиримидин-2-метанол,
Азацитидин: 4-амино-1-бета-D-рибофуранозил-1,3,5-триазин-2(1Н)-он,
6-Азуридин: 2бета-D-рибофуранозил-1,2,4-триазин-3,5-(2Н,4Н)-дион,
Кармофур: 5-фторо-N-гексил-3,4-дигидро-2,4-диоксо-1(2Н)-пиримидин карбоксамид,
Эноцитабин: N-(1бета-D-арабинофуранозил-1,2-дигидро-2-оксо-4-пиримидинил)докозанамид,
Тегафур: 5-фтор-1-(тетрагидро-2-фуранил)-2,4-(1Н, 3Н)пиримидиндион.
Из известных активных цитостатических агентов, например, следующие вещества натурального происхождения являются предпочтительными:
Винбластин сульфат: Винкалейкобластин сульфат,
Винкристин сульфат: 22-оксовинкалейкобластин сульфат,
Виндесин: 3-(аминокарбонил)-0-4-деацетил-3-де-(метоксикарбонил)-винкалейкобластин сульфат,
Этопозид: [5R-[5 альфа, 5 альфа бета, 8а альфа, 9бета-(R)]-[9-(4,6-0-этилиден-бета-D-глюкопиранозилокси)-5,8,8а,9-тетрагидро-5-(4-гидрокси-3,5-диметоксифенил)-фуро [3',4':6,7]нафто[2,3-d]-1,3-диоксол-6-(5аН)-он,
Тенипозид: [5R-[5 альфа, 5 альфа бета, 8а альфа, 9бета-(R)]-[5,8,8а,9-тетрагидро-5-(4-гидрокси-3,5-диметоксифенил)-9-[4,6-0-(2-тиенилметилен)-бета-D-глюкопиранозилокси[фуро 3',4':6,7]нафто[2,3-d]-1,3-диоксол-6-(5аН)-он,
Дактиномицин: актиномицин D,
Даунорубицин: (8S-cis)-8-ацетил-10-(3-амино-2,3,6-тридезоксиальфа-L-ликсо-гексопиранозилокси)-7,8,9,10-тетрагидро-6,8,11-тригидрокси-1-метокси-5,12-нафтацендион,
Доксорубицин: (8S-сis)-8-(гидроксиацетил)-10-(3-амино-2,3,6-тридезокси-альфа-L-ликсогексопиранозилокси)-7,8,9,10-тетрагидро-6,8,11-тригидрокси-1-метокси-5,12-нафтацендион,
Эпирубицин: 8S-cis)-10-(3-амино-2,3,6-тридезокси-альфа-L-арабино-гексопиранозилокси)-7,8,9,10-тетрагидро-6,8,11-тригидрокси-8-(гидроксиацетил)-1-метокси-5,12-нафтасендион,
Идарубицин: (7S-сis)-9-ацетил-7-(3-амино-2,3,6-тридеокси-альфа-L-ликсо-гексопиранозилокси)-7,8,9,10-тетрагидро-6,9,11-тригидрокси-5,12-нафтацендион,
Митоксантрон: 1,4-дигидрокси-5,8-bis[2-(2-гидроксиэтил)аминоэтиламино]-9,10-антрацендион или его дигидрохлорид,
Блеомицин (А2, В2): смесь гликопептидных антибиотиков, выделенных из вида Streptomyces verticillus, преимущественно в форме сульфата или гидрохлорида,
Пликамицин: антибиотик, продуцируемый Streptomyces argillaceus, Streptomyces tanashiensis и Streptomyces plicatus,
Митомицин: [1aR-(1a альфа,8 бета, 8а альфа, 8б альфа)]-6-амино-8-аминокарбонилоксаметил)-1,1а,2,8,8а,8b-гексагидро-8а-метокси-5-метил-азирино[2',3':3,4]пирроло [1,2-а]индол-4,7-дион,
Аклациномицин (А и В): антибиотик, принадлежащий к группе антрацилина, продуцируемый Streptomyces galileus,
Антрамицин: 3-(5,10,11,11а-тетрагидро-9,11-дигидрокси-8-метил-5-оксо-1Н-пирроло[2,1-с][1,4]бензодиазепин-2-ил)-2-пропенамид,
Азасерин: О-диазоацетил-L-серин,
Карубицин: 8-ацетил-10-(3-амино-2,3,6-тридезокси-альфа-L-ликсо-гексопиранозилокси)-7,8,9,10-тетрагидро-1,6,8,11-тетрагидрокси-5,12-нафтацендион,
Кактиномицин: актиномицин С, антибиотик, продуцируемый Streptomyces chrisomallus,
Карцинофилин: антибиотик, продуцируемый Streptomyces sahachiroi,
Хромомицин: антибиотик, продуцируемый Streptomyces griseus,
Оливомицин: антибиотик, продуцируемый Streptomyces olivoreticuli,
Ногаламицин: [2R-(2 альфа, 3 бета, 3 бета, 4 альфа, 5 бета, 6 альфа, 11 бета, 13 бета, 14 альфа)]-11-(6-дезокси-3-С-метил-2,3,4-три-0-метил-альфа-L-маннопиранозилокси)-4-диметиламино-3,4,5,6,11,12,13,14,16-декагидро-3,5,8,10,13-пентагидрокси-6,13-диметил-9,16-диоксо-2,6-эпокси-2Н-нафтацено[1,2-b]оксоцин-14-карбоксильной кислоты метиловый эфир,
Пепломицин: N'-[3-(1-фенилэтил)аминопропил]-блеомицин амид,
Порфиромицин: 6-амино-8-(аминокарбонилоксиметил)-1,1а,2,8,8а,8b-гексагидро-8а-метокси-1,5-диметилазирино [2',3':3,4]пирроло[1,2-а]индол-4,7-дион,
Стрептонигрин: 5-амино-6-(7-амино-5,8-дигидро-6-метокси-5,8-диоксо-2-хинолинил)-4-(2-гидрокси-3,4-диметоксифенил)-3-метил-2-пиридинкарбоксильная кислота,
Стрептозоцин: 2-дезокси-2-(метилнитрозоаминокарбониламино)-D-глюкопираноза,
Туберцидин: 7бета-D-рибофуранозил-7Н-пирроло[2,3-d]пиримидин-4-амин,
Убенимекс: [2S,3R]-3-амино-2-гидрокси-4-фенилбутаноил]-L-лейцин,
Зорубицин: бензойной кислоты [1-[4-(3-амино-2,3,6-три-дезокси-альфа-L-ликсо-гексопиранозилокси)-1,2,3,4,6,11-гексагидро-2,5,12-тригидрокси-7-метокси-6,11-диоксо-2-нафтаценил]-этилиден]-гидразин.
Из известных активных цитостатических агентов следующие гормоны являются предпочтительными:
Преднизолон: (11бета)-11,17,21-тригидроксипрегна-1,4-диен-3,20-дион,
Гидроксипрогестерон: 17-гидроксипрегн-4-ен-3,20-дион или его капроат,
Медроксипрогестерон: (6 альфа)17-гидрокси-6-метилпрегн-4-ен-3,20-дион или его ацетат,
Мегестрол: 17-гидрокси-6-метилпрегна-1,4-диен-3,20-дион или его ацетат,
Диэтилстильбестрол: (Е)-4,4'-(1,2-диэтил-1,2-этендиил)-бис-(фенол),
Этинилэстрадиол: (17 альфа)-19-норпрегна-1,3,5(10)-триен-20-ин-3,17-диол,
Тамоксифен: (Z)-2-[4-(1,2-дифенил-1-бутенил)фенокси]-N,N-диметилэтанамин или его цитрат,
Тестостеронс: (17бета)-17-(1-оксопропокси)-андрост-4-ен-3-он или его пропионат,
Флюоксиместрон: (11бета, 17 бета)-9-фторо-11,17-дигидрокси-17-метиландрост-4-ен-3-он.
Из известных активных цитостатических агентов предпочтительными веществами других классов являются, например:
L-Аспарагиназа: энзим, продуцируемый, например, Escherichia coli,
Прокарбазин: N-(1-метилэтил)-4-(2-гидразинометил)бензамид,
Митотан: 1-хлоро-2-[2,2-дихлоро-1-(4-хлорофенил)этил]бензол,
Флутамид: 2-метил-N-(4-нитро-3-трифторометилфенил)пропанамид,
Лейпрорелин: 5-оксо-L-пролил-L-гистидил-L-триптофил-L-серил-L-тирозил-D-лейцил-L-лейцил-L-аргинил-N-этил-L-пролин амид или его ацетат.
Известный цитостатический активный агент может также быть использован в форме его терапевтически приемлемой кислотной аддитивной соли, в том случае, если его химическая структура позволяет получить кислотную аддитивную соль. Подобным образом известный цитостатический активный агент может быть использован в виде его терапевтически приемлемой соли, например металлической соли, аммонийной соли или соли, образованной органическими основаниями, если его химическая структура допускает приготовление этих солей.
Цитостатическая фармацевтическая композиция согласно изобретению содержит предпочтительно цисплатин в качестве цитостатического (противоопухолевого) активного агента и O-(3-пиперидино-2-гидрокси-1-пропил)никотиновой кислоты амидоксим или его терапевтически приемлемая аддитивная соль в качестве производного гидроксамовой кислоты формулы (I).
Фармацевтическая композиция согласно изобретению обычно содержит активные агенты (ингредиенты) в количествах от 0,1 до 95 вес.%, желательно от 1 до 50 вес.%, предпочтительно от 5 до 30 вес.% вместе с общепринятым(и) наполнителем(лями) фармацевтической композиции.
В фармацевтической композиции согласно изобретению весовое соотношение двух активных ингредиентов (агентов) является предпочтительно (от 1 до 50):(от 50 до 1), особенно предпочтительно (от 1 до 10):(от 10 до 1).
Фармацевтическая композиция по изобретению может быть твердой или жидкой композицией, применяемой для орального, парентерального или ректального назначения или для наружного применения.
Твердые фармацевтические композиции для орального применения могут быть порошками, капсулами, таблетками, таблетками, покрытыми пленками, микрокапсулами и подобными; они могут содержать в качестве наполнителя(ей) связующие, например желатин, сорбит, поливинилпирролидон и подобные; наполняющие материалы, например лактозу, глюкозу, крахмал, фосфат кальция и подобные; вспомогательные таблетирующие вещества, такие как стеарат магния, тальк, полиэтиленгликоль, диоксид кремния и подобные; смачивающие агенты, например лаурилсульфат натрия и подобные.
Жидкие фармацевтические композиции для орального применения представляют собой растворы, суспензии или эмульсии, содержащие в качестве наполнителя, например, суспендирующие агенты, такие как желатин, карбоксиметилцеллюлозу и подобные; эмульгирующие агенты, например сорбилмоноолеат; растворители, такие как вода, масла, глицерин, пропиленгликоль, этиловый спирт; консерванты, такие как метил или пропил-п-гидроксибензоат и подобные.
Фармацевтические композиции для парентерального введения обычно используются в виде стерильных растворов активных агентов.
Дозировочные формы (единицы дозирования), подробно описанные выше, как и другие формы дозирования, известны per se, см. например, руководство под названием: "Remington's Parmaceutical Sciences", Edition 18, Mack Publishing Co., Easton, USA (1990).
В большинстве случаев фармацевтические композиции по изобретению содержат дозировочную единицу. Для взрослых характеристическая ежедневная доза составляет от 0,1 до 1000 мг известного активного цитостатического агента и от 0,1 до 1000 мг соединения формулы (I), которые могут быть назначены на один прием или несколько субдоз. Наиболее подходящая доза зависит от нескольких факторов и определяется лечащим врачом.
Фармацевтическая композиция по изобретению приготовляется смешиванием активных агентов (ингредиентов) с одним или более наполнителей с получением затем смеси, представляющей собой фармацевтическую композицию, способом, известным per se. Приемлемые способы известны из общего развития техники, например, из руководства Remington's Parmaceutical Sciences, упоминаемого выше.
Фармакологическое соединение по изобретению, как оказалось, является очень надежным (необыкновенно нетоксичным даже для пораженных опухолью животных) и может быть использовано для увеличения эффективности и уменьшения побочных эффектов противоопухолевого лечения раковых больных, на протяжении которого пациент лечится известным противоопухолевым препаратом или его фармацевтически приемлемой кислотной аддитивной солью и дополнительно производным гидроксамовой кислоты по формуле I или его фармацевтически приемлемой кислотной аддитивной солью в соотношении (1-50):(1-50) мас.%.
Далее приведены примеры композиций данного изобретения и данные биологических испытаний применения композиций с антибиотиками, имеющими противоопухолевый эффект.
Пример 1
Раствор для вливаний
0,8 г блеомицина сульфата и 2 г O-(3-пиперидино-2-гидрокси-1-пропил)никотинамидоксима моногидрохлорида растворяют в 400 мл дистиллированной воды, рН раствора доводят до 7 добавлением раствора гидроксида натрия. Добавляют 0,1 г трис(гидроксиметил)аминометана, объем раствора доводят до 1000 мл физиологическим раствором, полученный раствор фильтруют через подходящий микропористый фильтр для получения стерильного раствора, который можно использовать для вливаний.
Пример 2
Раствор для инъекций
10 г доксорубицина гидрохлорида и 20 г О-(3-пиперидино-2-гидрокси-1-пропил)никотинамидоксима моногидрохлорида растворяют в 200 мл дистиллированной воды, рН раствора доводят до 7 добавлением раствора гидроксида натрия. Добавляют 0,2 г трис(гидроксиметил)аминометана, объем раствора доводят до 350 мл дистиллированной водой, полученный раствор фильтруют через подходящий микропористый фильтр для получения стерильного раствора, которым наполняют стерильные ампулы объемом 5 мл, наполненные ампулы запаивают.
Пример 3
Твердые желатиновые капсулы
40 г даунорубицина гидрохлорида смешивают с 15 г микрокристаллической целлюлозы, затем эту смесь добавляют к смеси 20 г О-(3-пиперидино-2-гидрокси-1-пропил)никотинамидоксима моногидрохлорида и 25 г карбоксиметилцеллюлозы. После гомогенизации смесь помещают в твердые желатиновые капсулы. Каждая капсула содержит 0,5 г даунорубицина гидрохлорида и 0,25 г О-(3-пиперидино-2-гидрокси-1-пропил)никотинамидоксима моногидрохлорида.
Пример 4
Твердые желатиновые капсулы
80 г блеомицина сульфата смешивают с 25 г микрокристаллической целлюлозы, затем эту смесь добавляют к смеси 2 г О-(3-пиперидино-2-гидрокси-1-пропил)никотинамидоксима моногидрохлорида и 12 г стеарата магния. После гомогенизации смесь помещают в твердые желатиновые капсулы. Каждая капсула содержит 0,8 г блеомицина сульфата и 0,02 г О-(3-пиперидино-2-гидрокси-1-пропил)никотинамидоксима моногидрохлорида.
Пример 5
Твердые желатиновые капсулы
2 г блеомицина сульфата смешивают с 10 г микрокристаллической целлюлозы, затем эту смесь добавляют к смеси 80 г О-(3-пиперидино-2-гидрокси-1-пропил)никотинамидоксима моногидрохлорида и 30 г стеарата магния. После гомогенизации смесь помещают в твердые желатиновые капсулы. Каждая капсула содержит 0,02 г блеомицина сульфата и 0,1 г О-(3-пиперидино-2-гидрокси-1-пропил)никотинамидоксима моногидрохлорида.
Биологические испытания
Предотвращение легочной гипертензии, вызванной лечением блеомицином
Блеомицин часто применяют для лечения опухоли яичков и лимфомы, однако как побочный эффект такого лечения часто развивается легочная гипертензия. Наблюдаемые побочные эффекты являются фактором, определяющим снижение доз, т.е. дозы блеомицина необходимо уменьшать, что приводит к неудовлетворительному терапевтическому эффекту. В следующих экспериментах на крысах исследована легочная гипертензия, вызванная блеомицином.
В экспериментах использовали самцов крыс породы Sprague-Dawley. Одной группе животных давали принимать ежедневно только физиологический раствор, двум группам вводили внутривенно блеомицин в дозах 5 мг/кг в начале эксперимента и через две недели. Одной группе, пролеченной блеомицином, вводили ежедневно перорально соединение L в течение четырех недель. Четвертой группе вводили ежедневно 50 мг/кг соединения L перорально в течение четырех недель. Каждая группа животных включала 8 особей.
После завершения периода лечения и провокации животным вводили анестезирующее средство пентобарбитал (35 мг/кг, подкожно). В течение этой хирургической анестезии легочная артерия с одной стороны и левая яремная вена были экстериоризованы и канюлированы. Венозный катетер был введен в основной ствол легочной артерии. Артериальный катетер достиг дуги аорты. Системное и легочное давления измеряли постоянно в ходе эксперимента и оценивали систолическое и диастолическое давление.
После введения артериального катетера измеряли системное давление, причем животное под анестезией пребывало в нормальном состоянии, сердечно-сосудистые функции были в норме. Однако в некоторых случаях введение венозного катетера в легочную артерию вызывало нарушение сердечного ритма и падение системного давления крови. Но эти изменения имели временный эффект и можно было определить давление в правом желудочке. Полученные результаты приведены в таблице.
Из таблицы видно, что лечение соединением L, взятым отдельно, не влияет на значения кровяного давления. Лечение блеомицином вызвало значительное увеличение кровяного давления по отношению к контрольной группе. Однако комбинированное лечение блеомицином и соединением L дало значения кровяного давления, которые являются такими же, как у контрольной группы.
Таким образом, вышеприведенные данные свидетельствуют о том, что комбинированное лечение блеомицином и производными по изобретению снижает побочный эффект, который наблюдается, если применять блеомицин отдельно.
Изобретение относится к области медицины и касается фармацевтической композиции, включающей в себя известный антибиотик, имеющий противоопухолевую активность, и производное гидроксамовой кислоты формулы I, в которой весовое соотношение двух активных агентов составляет (1-50):(50-1). Композиция снижает побочные эффекты и обладает улучшенным противоопухолевым действием. 2 н. и 2 з.п. ф-лы, 1 табл.
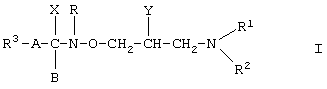
где R1 и R2 совместно со смежным атомом азота образуют пиперидиновую группу,
R3 является пиридильной группой,
А является химической связью,
R и В вместе образуют химическую связь,
Х является аминогруппой,
Y является гидроксильной группой,
или его физиологически приемлемую кислотную аддитивную соль в смеси с одним или более общепринятым(ыми) наполнителем(ями), в которой весовое соотношение двух активных агентов составляет (1-50):(50-1).

где R1, R2, R3, A, R, В, Х и Y такие, как указано в п.1, или его физиологически приемлемой кислотной аддитивной соли для приготовления фармацевтической композиции, обладающей противоопухолевым действием со сниженным(и) побочным(и) эффектом(ами), содержащей известный антибиотик, имеющий противоопухолевую активность, или его фармацевтически приемлемую кислотную аддитивную соль.
| RU 95106673 A1, 10.01.1997 | |||
| RU 93048339 А, 27.04.1996. |
Авторы
Даты
2005-06-20—Публикация
1998-06-22—Подача