Изобретение относится к области клинической кардиологии, в частности к лечению больных инфарктом миокарда (ИМ), и может быть использовано в кардиологических центрах, госпиталях, больницах, санаториях, поликлиниках, а также на кафедрах кардиологии медицинских ВУЗов.
Проблема лечения крупноочагового ИМ является одной из ведущих в современной кардиологии, что обусловлено, с одной стороны, сохраняющейся высокой летальностью и инвалидизацией больных, с другой - большой частотой распространения этого заболевания (Чазов Е.И. с соавт., 1987; Оганов Р.Г., 1990; Рональд В.Ф. Кэмпбелл с соавт., 1997; Barbagelata A. еt al., 1997).
Прогнозирование развития осложнений ИМ необходимо для выявления пациентов, у которых определенные медицинские вмешательства могут улучшить клинические исходы. Поэтому оценка риска возникновения осложнений у конкретного больного - важнейший компонент клинической тактики (Макаров И.М. с соавт., 1997; Гельфанд И.М. с соавт., 1997; Виноградов А.В. с соавт., 1999; Bisi et al. , 1996; Pеterson E.D. et al., 1997). Первое впечатление врача о вероятности развития осложнений ИМ формируется на основании анамнеза, собранного при поступлении, результатов обследования больного и ЭКГ. Данные различных диагностических исследований дополняют эту информацию. О прогнозе многих пациентов можно судить достаточно точно не ранее пятых суток от начала заболевания. И только комплексная оценка клинических, лабораторных и инструментальных данных с применением современных методов медицинской статистики может позволить с высокой достоверностью прогнозировать развитие осложнений ИМ в первые сутки болезни (Ардашев В.Н., 1990; Murakami Т. et al., 1996; vom-Dahl J. et al., 1996; Peterson E.D. et al., 1997). Дифференцированная терапия выделенных в начале заболевания групп пациентов с благоприятным клиническим исходом с одной стороны и высоким риском развития различных осложнений с другой позволяет повысить эффективность лечения, добиться максимальной экономической целесообразности использования медицинских средств и ресурсов (Руда М. Я. , 1993; Braunwald E., 1989; Харрисон Т.Р. с соавт., 1995).
Наиболее близким медико-техническим решением, выбранным в качестве способа-прототипа лечения ИМ, является известный способ терапии крупноочагового ИМ, изложенный в работе /3/. Этот способ прогнозирования осложнений больного инфарктом миокарда включает оценку ближайшего исхода инфаркта по клиническим данным больного, поступившего в стационар, начала острого приступа, со сформировавшимися на электрокардиограмме патологическими зубцами Q или QS не позднее первых трех суток после госпитализации, оценку сердечной недостаточности и характера ангинозных болей с использованием построения структурных единиц недостаточности сердца в остром периоде инфаркта, выбор прогностического правила прогноза осложнений и исхода инфаркта на основе структурных единиц сердечной недостаточности и ангинозных болей в остром периоде. Он включает также составление алгоритмов неблагоприятного, относительно благоприятного и благоприятного прогноза ближайшего исхода инфаркта, оценку результатов прогноза состояния пациента на первом уровне формализации заболевания и количественных показателей и признаков на втором, компьютерном уровне при влиянии получаемых пациентом лекарственных средств на его физиологические параметры - частоту сердечных сокращений, частоту дыхания, артериальное давление и другие.
Способ-прототип имеет следующие недостатки:
1). В нем недостаточно разработаны правила, позволяющие уже в первые сутки заболевания прогнозировать исход ИМ и вероятность развития тех или иных осложнений на стационарном этапе лечения.
2). Предложенные ранее прогностические правила, как и известного способа-прототипа, устарели, так как не учитывают внедрения в клиническую практику новых медицинских средств, включая тромболитическую терапию (ТЛТ) (Сыркин А. Л. с соавт., 1993; Herlitz J. et al., 1996; Khattar R.S. et al., 1996; Poldermans D. et al., 1997). Поэтому и сейчас исследования, посвященные прогнозированию осложнений ИМ, не утратили своей актуальности, а реальные условия, в которых работает большинство кардиологов в нашей стране, заставляют при разработке прогностических правил использовать традиционные клинические и лабораторно-инструментальные признаки (Сыркин АЛ. с соавт., 1997; Шевченко Ю.Л. с соавт., 1998).
3). Использование в прототипе ТЛТ при лечении больных ИМ позволило существенно снизить частоту осложнений и внутригоспитальную летальность при данном заболевании (Kaji Y. et al., 1996; Yusuf S. et al., 1996; William R. Nathway et al., 1998). Однако в отдаленном периоде ИМ выживаемость больных не зависела от результатов тромболизиса (Голиков А.П. с соавт., 1992; Малая Л. Т. с соавт., 1995; Господаренко А.Л., 1998). У пациентов, получивших ТЛТ, отмечается увеличение частоты развития рецидивирующих расстройств коронарного кровообращения (РРКК) по сравнению с пациентами, которым это лечение не проводилось (Хараш И.М. с соавт.,1998, Basu S. et al., 1996).
4). Для снижения частоты развития острой сердечной недостаточности (ОСН) и внутригоспитальной летальности в прототипе применяют в остром периоде ИМ ингибиторы ангиотензинпревращающего фермента (АПФ). Однако существуют различные мнения относительно критериев отбора больных, которым необходимо назначать эти препараты в остром периоде ИМ, противоречивы взгляды и на целесообразность назначения ингибиторов АПФ с первых суток заболевания (Лазарев И. А. с соавт., 1996; Preffer M.A. et al., 1992; Galcera-Tomas J. et al., 1993; Erhardt L., 1996; Ferrari R. et al., 1996; van-Gilst et al., 1996; Kober L., et al., 1997).
5). При прогнозировании осложнений инфаркта миокарда способ-прототип не использует групповых медицинских компьютерных видеоконференций между специалистами-кардиологами центра функциональной диагностики госпиталя и других ведущих медицинских учреждений и лечащими врачами отделений реанимации и интенсивной терапии кардиологического центра госпиталя.
6). В прототипе не решена актуальная проблема кардиологии по раннему прогнозированию развития осложнений крупноочагового ИМ, что позволило бы проводить превентивную терапию и снизить внутригоспитальную летальность. В отечественной литератуpe мы не нашли работ, посвященных выявлению клинических предикторов и прогнозу осложнений крупноочагового ИМ после применения ТЛТ.
7). В известном способе не ведется учет особенностей лечения инфаркта миокарда и хирургических операций на сердце, аорте и коронарных сосудах в условиях искусственного кровообращения, при этом не предусматривают ввод и хранение в кардиологических базах данных информации о паспортных и антропометрических параметрах каждого больного, под номером его истории болезни не регистрируют диагноз, данные об осложнениях, характере поражения коронарных сосудов, длительность искусственного кровообращения, время пережатая аорты, анализы крови, особенности операции и послеоперационного периода.
8). Способ-прототип не обеспечивает одновременную передачу аудио-, видео- и цифровых данных по одному каналу с использованием интеграции сетевых технологий и локальных вычислительных сетей, при этом в нем отсутствует прогноз с помощью нейронно-сетевого компьютерного пакета опасного повышения артериального давления и отклонения других параметров от нормы у каждого пациента.
9). Развитие рецидивирующих расстройств коронарного кровообращения удлиняет сроки стационарного лечения больных, увеличивает внутригоспитальную летальность. Уменьшая объем некроза миокарда в зоне инфарктсвязанной коронарной артерии, ТЛТ не устраняет ни ее резидуальный стеноз, ни стенозирующие изменения других артерий сердца, что обуславливает высокий риск повторных коронарных катастроф у этой группы пациентов. Однако способ-прототип не осуществляет прогноза развития РРКК.
10). Основным недостатком способа-прототипа является то, что прогнозирование исхода ИМ приводится для больных, уже переживших острый период болезни после первых 3-4 суток, а не в первые или вторые сутки после ИМ, т.е. исход прогнозируется в сроки 4-6 недель после острого приступа ИМ. Это прогнозирование полезно только для больных, которые выписываются домой или направляются в реабилитационный госпиталь (санаторий).
Задача изобретения - повышение эффективности лечения больных инфарктом миокарда путем выделения групп пациентов с предполагаемым неосложненным и осложненным инфарктом миокарда, прогнозирования развития его отдельных осложнений и исходов по признакам первых суток болезни за счет комплексной оценки клинических, лабораторных, инструментальных данных и использования компьютерных технологий.
Поставленная задача решается так, что в первые сутки инфаркта миокарда после применения тромболитической терапии выделяют признаки-предикторы неосложненного течения заболевания, определяют диагностическую и лечебную тактику, а начиная со вторых суток, выявляют взаимосвязанные комплексы симптомов, количественные значения показателей, параметров индивидуально для каждого пациента и с их помощью оценивают риск летального исхода и вероятность развития в остром периоде нарушений сердечного ритма и проводимости, острой сердечной недостаточности, рецидивирующих расстройств коронарного кровообращения. При этом определяют острую аневризму сердца, прогнозируют летальный исход в остром и отдаленном периодах инфаркта с помощью клинических, инструментальных, лабораторных данных и использования медицинских компьютерных технологий, статистических вычислительных программ, дискриминантного и регрессионного анализа.
Течение крупноочагового инфаркта миокарда в настоящее время имеет клинические особенности, требующие новых подходов к диагностике и прогнозированию осложнений заболевания. Поэтому использование предложенных предикторов развития неосложненного течения инфаркта миокарда после применения тромболитической терапии позволяет выделить больных с низким риском развития осложнений.
На основании разработанных в заявляемом способе математических моделей прогнозируют развитие осложнений и исход заболевания у больных инфарктом миокарда после применения тромболитической терапии и проводят превентивное лечение.
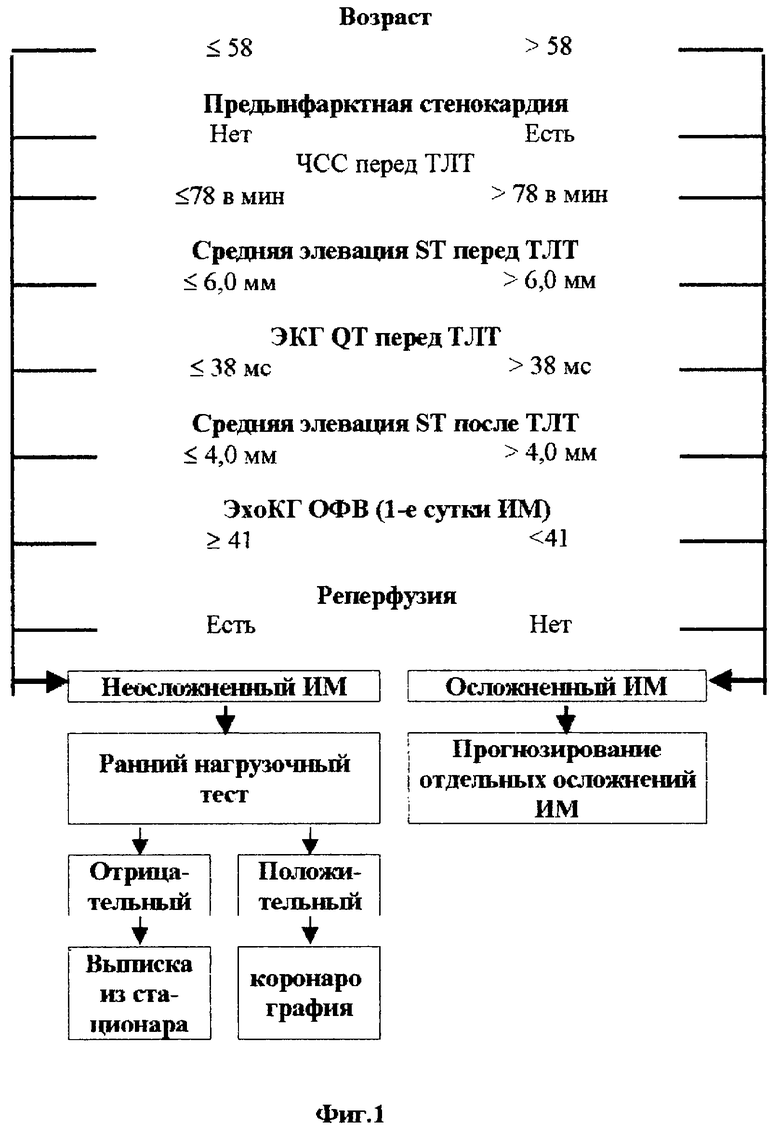
На фиг.1 приведен алгоритм диагностической тактики при выделении больных с неосложненным ИМ. На фиг.2 изображен алгоритм лечебно-диагностической тактики у больных инфарктом миокарда при оценке вероятности развития рецидивирующих расстройств коронарного кровообращения.
Заявляемый способ осуществляют следующим образом. Восстановление сердечно-сосудистой системы каждого больного ИМ включает в себя взаимосвязанные комплексные технологии медицинской, физической и психологической реабилитации. К медицинской реабилитации относят диагностику, прогнозирование, предупреждение и лечение коронарной и сердечной недостаточности, нарушений сердечного ритма и проводимости, сопутствующих заболеваний, а также профилактику прогрессирования атеросклероза. Прежде всего осуществляют оценку общего функционального состояния больного и отдаленных последствий ею лечения, стабилизацию нарушений гемодинамики, функции внешнего дыхания, контрольное проведение первых ступеней физической реабилитации, обеспечение психологической реадаптации. С помощью физической и психологической реабилитации осуществляют улучшение функционального состояния системы кровообращения путем стимуляции экстракорпоральных механизмов с одновременной тренировкой сердца и коронарного кровообращения, восстанавливают и развивают полноценное дыхание, способствуют ликвидации и предупреждению осложнений, повышают общую двигательную активность, воздействуют на общий и эмоциональный тонус, способствуют улучшению функционального состояния нервной системы и мозгового кровообращения, прививают навыки самоконтроля с целью сознательного участия больного в восстановлении своего здоровья.
Сначала выделяют первую группу больных с неосложненным течением инфаркта или низким риском развития его осложнений и для определения превентивной терапии выбирают алгоритм диагностической тактики, основанный на сравнении с нормой следующих предикторов неосложненного инфаркта в первые сутки заболевания - возраст менее 58 лет, отсутствие прединфарктной, за месяц до инфаркта, нестабильной стенокардии, частота сердечных сокращений перед тромболитической терапией менее и равна 78 уд/мин, средняя элевация сегмента ST перед тромболитической терапией менее или равно 6,0 мм и после ТЛТ менее или равно 4,0 мм, величина интервала зубцов QT электрокардиограммы перед ТЛТ менее или равно 38 мс, наличие реперфузии миокарда, значение общей фракции выброса в первые сутки инфаркта более или равно 41%. При этом с вероятностью неосложненного инфаркта, равной не менее 95%, каждого пациента, имеющего все восемь признаков ниже заданных порогов, включают в первую группу низкого риска развития осложнений. Затем у больных первой группы оценивают вероятность развития осложнений и риск летального исхода в остром периоде заболевания, а во вторую группу включают пациентов с осложненным инфарктом, у которых предикторы развития инфаркта в первые сутки находятся в отличие от вышеуказанной нормы. При выявлении коронарной недостаточности сердечно-сосудистой системы назначают прерывистый прием нитратов средней продолжительности действия - сустак-форте и/или сусттонит-форте в разовых дозах 6,4 мг, нитронг-форте 6,5 мг, нитросорбид (изодинит) 10, 20 мг, а в случаях развития толерантности к нитратам препарат отменяют на 3-5 дней и заменяют его на коринфар (кордафен), молсидомин (корватон). При неэффективности нитратов пролонгированного действия и сопутствующей гипертонической болезни, особенно при гиперкинетическом типе гемодинамики, назначают бета-адреноблокаторы - обзидан или анаприн в дозе 40-120 мг/сут и более, предукал - 40-60 мг/сут, а при сопутствующих хронических заболеваниях респираторной системы, сахарном диабете, нарушениях атриовентрикуляторной проводимости осуществляют прием кардиоселективных бета-адреноблокаторов - корданума по 200-400 мг/сут, беталока - 100-300 мг/сут. При выявлении нарушений ритма сердца и проводимости больного для лечения желудочковых экстрасистолий применяют антиаритмические препараты кордарон - 600 мг/сут (доза насыщения) до получения клинического эффекта с дальнейшим снижением дозы до поддерживающей 100-200 мг/сут или соталол 40-80 мг/cyт в сочетании с седативными препаратами - валерианой, пустырником, валокардином, тазепамом. Причем подбирают 1-2 резервных препарата, эффективных для данного больного, в связи с возможным развитием толерантности к препаратам при их длительном применении.
Лечение острой сердечной недостаточности кровообращения осуществляют в реанимационном отделении с использованием адреномиметиков, периферических вазодилаторов - препаратов нитроглицерина и изосорбида динитрата пролонгированного действия, ингибиторов АКФ. При недостаточности кровообращения второй стадии применяют блокаторы типа каптоприл, акупро, престариум, а также препараты изосорбида динитрата - нитросорбид, изокет и др., а при их неэффективности назначают сердечные гликозиды в поддерживающих дозах, которые уменьшают при появлении резко выраженной синусовой брадикардии, менее 50 ударов в 1 мин, в сочетании с тиазидными диуретиками - гипотиазидом в дозе 50-150 мг/сут в два приема или нетиазидными сульфаниламидами - бринальдинс 20-60 мг/сут в один прием, в сочетании с калийсберегающими диуретиками - верошпироном - 12-150 мг/сут, триампуром - 100-120 мг/сут, а при неэффективности данной терапии назначают более мощные диуретики - фуросемид - 40-200 мг/сут или урегит - 50-200 мг/сут, прием всей дозы однократно, утром натощак, при добавлении эуфиллина или теофиллина, улучшающих почечный кровоток. У больного ИM с артериальной гипертензией - основным фактором риска острой и хронической форм нарушений мозгового кровообращения, - оценивают состояние мозговой гемодинамики с помощью реоэнцефалографии, причем наиболее положительный гемодинамический и клинический эффекты наблюдают у больных с ангиоспастическим типом мозговой гемодинамики, дифференцированно назначая им физиотерапевтические процедуры в зависимости от типа нарушений мозговой гемодинамики. Причем при ангиоспастическом типе увеличивают пульсовое кровонаполнение мозга, снимают избыточное повышение тонуса мозговых артерий путем комплексного воздействия силы переменного магнитного поля, иглорефлексотерапии, хвойно-жемчужных ванн, лечебной физкультуры и индивидуальных лекарственных препаратов гомеопатической терапии, а при смешанном типе нарушений церебральной гемодинамики, когда на фоне снижения артериального притока затрудняется венозный отток, назначают электрофорез с эуфиллином на воротниковую зону, массаж воротниковой зоны, информационно-волновую терапию, лечебную физкультуру и гомеотерапию в комбинации с обычными кардиологическими препаратами, как средство вспомогательного ряда.
При этом подбор гомеопатических препаратов осуществляют как по классической методике Ганемана, так и с использованием диагностики по Фолю.
Статистическую обработку результатов экспериментальных исследований при анализе клинической картины крупноочагового инфаркта миокарда у пациентов, получивших тромболитическую терапию, проводят с использованием более 140 признаков, показателей и измеряемых параметров, информативность которых оценивают по эффективности или проценту относительной общей величины различий каждого показателя в группах сравнения и прогнозируемым тяжестям осложнений инфаркта. Последние определяют с помощью пакета вычислительных программ типа Statistica 5.1 for Windows-98 и математических моделей прогноза осложнений и исхода инфаркта, построенных в виде решающих правил с использованием дискриминантного и регрессионного анализа.
При этом осуществляют непараметрический корреляционный анализ независимых признаков и определяют прогнозируемую тяжесть рецидивирующих расстройств коронарного кровообращения по десятибалльной шкале для каждого больного инфарктом миокарда (ИM) с помощью решаемого на ЭВМ правила в виде дискриминантного регрессионного уравнения. Причем непараметрический корреляционный анализ клинических предикторов развития РРКК проводят у больных ИМ трех групп сравнения. У этих больных выявляют прямую связь рецидивирующих расстройств коронарного кровообращения с прединфарктной стенокардией (коэффициент корреляции r=0,74, р<0,001), также с уровнем балльной оценки болевого синдрома перед ТЛТ (r=0,58, р<0,001), нетрансмуральным некрозом миокарда (r=0,40, р<0,03), с сахарным диабетом (r=0,36, р<0,03), гипертонической болезнью (r= 0,33, р<0,05), которую достоверно чаще отмечают у пациентов 3 труппы с рецидивом ИМ. При этом определяют 7 выбранных независимых признаков и рассчитывают прогнозируемую тяжесть осложнения в баллах с вероятностью 80%, в результате для 1 группы пациентов без РРКК получают прогнозируемую тяжесть осложнения в (2,4 - 5,4) балла, для 2 группы пациентов, у которых течение ИМ осложнилось развитием постинфарктной стенокардии, получают тяжесть РРКК в (5,8-6,8) балла, а для 3 группы - в (9,0-9,8) балла с эффективностью объясненной дисперсии прогнозируемой тяжести РРКК не менее 54%, превышающей информативность всех отдельных признаков в 2 раза и достоверностью математической модели по совпадающим прогнозам осложнений РРКК в 78%.
Затем оценивают вероятность развития осложнений и риск летального исхода в остром периоде заболевания у пациентов с вероятным, но не обязательным развитием осложнений, у которых отсутствует хотя бы один из признаков, прогнозирующих неосложненное течение ИМ. Для чего распределяют больных на группы с благоприятным и неблагоприятным течением заболевания и определяют им дополнительные диагностические и лечебные процедуры. При этом используют математическую модель прогнозирования по данным первых суток ИМ с учетом самого неблагоприятного признака - артериальной гипотонии перед ТЛТ, а также инсульта в анамнезе, одышки в 1-е сутки при частоте дыхания до 2-х в мин, менее или более 26 дыханий в мин, с учетом развития полной атриовентрикулярной и внутрижелудочковой блокады в 1-е сутки ИМ, средней элевации сегмента ST после ТЛТ и величины постоянного члена регрессионного уравнения. Причем, если при решении полученных дискриминантных уравнений, достоверность или общий процент корректности которых составил 95,6%, значение первого уравнения для выживших пациентов будет больше, то с вероятностью 96,8% определяют, что данный больной переживет острый период заболевания, а если будет больше значение второго уравнения, то с вероятностью 78,6% прогнозируют, что наступит летальный исход в остром периоде ИМ. Для этого проводят пошаговый дискриминантный анализ всех изученных признаков и применяют решающее правило прогнозирования летального исхода острого периода ИМ по данным первых суток ИМ (фиг. 2). Артериальная гипотония перед ТЛТ - это самый неблагоприятный прогностический признак при определении вероятности летального исхода в остром периоде заболевания. Если при решении полученных дискриминантных уравнений будет больше значение первого уравнения, то с вероятностью 96,8% больной острый период заболевания переживет, если второго - то с вероятностью 78,6% наступит летальный исход в остром периоде ИМ. Общий процент корректности дискриминантных уравнений составил 95,6%.
Основными предикторами развития ОАС у больных ИМ после применения ТЛТ выбирают: отсутствие реперфузии миокарда, среднюю элевацию сегмента ST через 24 часа от начала заболевания более 3,9 мм, выявление зон акинезии в области ИМ при ЭхоКГ. При определении высокого риска развития ОАС назначают ингибиторы АПФ с первых суток ИМ.
После этого выделяют шесть существенных признаков прогнозирования летального исхода в отдаленном периоде, в течение 3-х лет после первого инфаркта - наличие или отсутствие отека легких, повторный ИМ, фибрилляция желудочков, прием бэта-блокаторов и сердечных гликозидов, возраст. Затем проводят дискриминантный анализ определяемых во время острого периода стационарного лечения признаков проспективного прогноза летального исхода в отдаленном периоде ИМ. Для чего решают полученные регрессионные уравнения и при большем значении 1-го уравнения с вероятностью 94,7% определяют, что отдаленный прогноз будет благоприятным, а при большем значении 2-го уравнения с вероятностью 78,6% определяют, что наступит летальный исход в отдаленном периоде заболевания. Причем получают достоверность математической модели по совпадающим прогнозам, равную не менее 93,4%, при этом при выписке больных из стационара определяют группу пациентов, которым необходимо тщательное амбулаторное наблюдение, обследование и лечение в поликлинике.
В течение всего лечебно-диагностического процесса осуществляют одновременную передачу аудио-, видео- и цифровых данных по одному каналу с использованием интеграции сетевых технологий АPП - сети (асинхронный режим передачи информации) и локальных вычислительных сетей Gigabit Ethernet с пропускной способностью 1000 Мбит/с. При этом прогнозируют с помощью нейронно-сетевого компьютерного пакета опасное повышение артериального давления каждого пациента с достоверностью не менее 98% и повышение недостаточности кровоснабжения сердца каждого пациента с достоверностью не менее 90%.
В качестве интеграции информационных ресурсов для лечебно-диагностического процесса при прогнозировании осложнений инфаркта миокарда осуществляют групповые медицинские компьютерные видеоконференции между специалистами-кардиологами центра функциональной диагностики госпиталя и других ведущих медицинских учреждений и лечащими врачами отделений реанимации и интенсивной терапии кардиологического центра госпиталя с помощью телекоммуникационного оборудования, устройств съема первичной информации, цифрового интерфейса, средств подключения к сети ISDN, АРП - сети и беспроводного широкополосного доступа к сети Интернет при совместимости форматов видеоизображений и операционных систем. При этом во время видеоконференций передают и обсуждают данные эхокардиограмм, схемы операций и пороков сердечной мышцы, фрагменты заключений, данных диагностики, статические и динамические видеоматериалы данных катетеризации полостей сердца и собственно операций на сердце, а по каналам связи передают также данные ЭКГ, ЭЭГ, компьютерной томографии и магниторезонансной съемки.
Для учета особенностей лечения инфаркта миокарда и хирургических операций на сердце, аорте и коронарных сосудах в условиях искусственного кровообращения предусматривают ввод и хранение в кардиологических базах данных информации о паспортных и антропометрических параметрах каждого больного, под номером его истории болезни регистрируют диагноз, данные об осложнениях, характере поражения коронарных сосудов, длительность искусственного кровообращения, время пережатия аорты, анализы крови, особенности операции и послеоперационного периода. При этом фиксируют параметры искусственной вентиляции легких, дозы инотропной поддержки, использованных в ходе лечения лекарственных средств, причем используют комплексную оценку гемодинамики и газообмена, объективизируют врачебный контроль и своевременно корректируют превентивную терапию с использованием аппаратно-программных средств.
Для решения поставленных задач мы проанализировали результаты лечения 271 больного (все мужчины) крупноочаговым ИМ, которые поступили в 1992-1997г. в ГВКГ им. Н.Н. Бурденко. Диагноз ИМ подтвержден на основании клинической картины, ЭКГ-данных, повышения кардиоспецифических ферментов сыворотки крови. Все пациенты получили ТЛТ.
Рассмотрены клинические особенности течения крупноочагового ИM после применения ТЛТ, построены математические модели, прогнозирующие развитие осложнений и исход заболевания, на основании ретроспективной оценки клинического массива данных 215 больных (основная группа) в возрасте от 41 до 84 лет (средний возраст 63,0±2,8 лет), поступивших в стационар через 4,1±0,8 часов от начала заболевания. Разработанные модели клинического течения крупноочагового инфаркта миокарда верифицированы на независимой выборке из 56 пациентов (контрольная группа), обследованных по аналогичной диагностической схеме и по клиническому состоянию, не отличавшихся от основной группы. Средний возраст больных контрольной группы составил 63,7±3,9 лет, время поступления от начала ИМ - 3,9±1,4 часов.
Клиническая характеристика больных ИМ представлена в табл.1. Эффективность ТЛТ оценивалась с учетом комплекса клинико-электрокардиографических и лабораторных данных. Признаки реперфузии миокарда после применения ТЛТ отмечены у 133 (61,9%) больных основной группы.
Для диагностики ОСН применялась классификация Киллипа.
Критерием ПС мы считали появление повторных приступов ангинозных болей, возникших не ранее чем через 24 часа от начала заболевания на стационарном этапе лечения и сопровождающихся ЭКГ-динамикой, а повышение кардиоспецифических ферментов сыворотки крови после ангинозного приступа расценивалось нами как рецидив ИМ.
При регистрации желудочковой экстрасистолии использовалась классификация Bigger-осложнение диагностировалось только тогда, когда число экстрасистол превышало 10 в час. Желудочковая тахикардия диагностировалась, когда отмечался пароксизм продолжительностью не менее 5 комплексов. Развитие желудочковых аритмий определяли через 2 часа после окончания ТЛТ. Возникновение нарушений сердечного ритма до этого времени расценивалось как реперфузионные аритмии.
Развитие ОАС подтверждалось на основании электрокардиографической картины - "застывший" подъем сегмента ST в 2-х и более отведениях при выписке из стационара, сохранение зон дискинезии и акинезии при повторной ЭхоКГ.
В основной группе 38 (17,7%) чел. получили актилизе (Boehringer Ingelheim, Германия): 34 (15,8%) больных - 100 мг за 3 часа при системном и 4 (1,9%) пациентов - 50 мг со скоростью 0,83 мг/час при внутрикоронарном введении. У 177 (82,3%) чел. применялась стрептокиназа (авелизии, Arzneimittelwerk Dresden GmbH, Германия). При системной ТЛТ в течение часа вводились различные дозы препарата: у 33 (15,3%) чел. - 1,0 млн. ЕД, у 70 (32,6%) чел. - 1,5 млн. ЕД и у 51 (23,7%) чел. - 2,0 млн. ЕД. При внутрикоронарной ТЛТ у 23 (10,7%) чел. - 250.000 ЕД авелизина со скоростью 4 тыс. ЕД/час.
После завершения ТЛТ у 212 (98,6%) чел. проводилась внутривенная инфузия гепарина со скоростью 1000 ЕД/ч в течение 2-5 суток, затем препарат вводился подкожно по 5 тыс. ЕД 3 раза в сутки в течение 10-14 суток. У 212 (98,6%) пациентов с первых суток заболевания назначался аспирин 250 мг/сутки внутрь до выписки из стационара. У всех больных проводилась внутривенная инфузия 20%-гаммаоксимасляной кислоты со скоростью 0,33 г/час в течение 2-5 суток, у 199 (92,6%) чел. - внутривенная инфузия нитроглицерина со скоростью 2-4 мг/ч в течение 2-5 суток, после завершения парентерального введения препарата назначали нитросорбид по 20 мг через 4 часа. У 92 (42,8%) чел. в первые сутки ИМ проводилась внутривенная инфузия пропранолола со скоростью 1 мг/ч, с последующим переходом на пероральный прием по 10-20 мг•3 раза в сутки. У 68 (31,6%) чел. с первых суток ИМ назначался капотен внутрь по 6,5 мг 3 раза в день, у 9 (4,2%) чел. (с 14 -20 суток ИМ) - дигоксин внутрь по 0,125 мг 2 раза в сутки.
Болевой синдром оценивали по разработанной нами балльной шкале, учитывающей длительность ангинозного приступа, его рецидивирующий характер, эффективность применения наркотических анальгетиков.
Всем больным проводили регистрацию ЭКГ в 12 общепринятых отведениях. Оценивали динамику средней элевации сегмента ST до ТЛТ, сразу после лечения, на 1 сутки, 3 сутки и 5 сутки после ТЛТ (суммировался подъем сегмента ST в миллиметрах во всех отведениях, где он был, и полученное значение делилось на это число отведений).
Мониторное наблюдение за нарушениями ритма сердца осуществлялось при помощи компьютерной системы "Sirecust"-121 С (Siemens, Германия). Анализ и регистрацию аритмий проводили в автоматическом режиме на протяжении всего периода лечения больного в отделении реанимации и интенсивной терапии. У 99 пациентов на 22,3±3,4 сутки ИМ изучена толерантность к физической нагрузке по общепринятой методике нагрузочной многоступенчатой велоэргометрии. Суточное мониторирование ЭКГ проведено у 48 больных после перевода в коечное отделение на аппарате Medilog EXCEL фирмы "Oxford". Всем пациентам при поступлении была выполнена рентгенография грудной клетки. ЭхоКГ проводилась на аппарате Sequoia 512 фирмы "Acuson" дважды за время нахождения больного в стационаре - в первые сутки и на 15-30 сутки заболевания (в среднем на 22,5±1,8 сутки). У 65 пациентов на 3-5 сутки после ТЛТ выполнена радиоизотопная вентрикулография на аппарате "GMS-5500" с компьютерной системой фирмы "IМAG" (Франция). Для оценки состояния коронарного русла у 53 чел. на 6,1±1,1 сутки проведена коронароангиография (КАГ) по методике M.Judkins, включающей левую и правую полипозиционную КАГ.
Динамику некротических процессов в сердечной мышце изучали у всех больных, проводя исследование активности креатинфосфокиназы (КФК) и ее МВ-фракции, аланинаминотрансферазы (АЛТ), аспартатаминотрансферазы (ACT) до ТЛТ, через 6 и 12 часов, на 1-е, 3-и и 5-е сутки после лечения, а также при возникновении ангинозных приступов. Общую КФК и ее МВ-фракцию, АЛТ, ACT определяли на аппарате "СПЕКТРУМ" (Abbot, США).
Методом расслоенных выборок проанализировано влияние капотена и пропранолола на частоту развития отдельных осложнений ИМ и внутригоспитальную летальность (при этом больные с кардиогенным шоком были исключены).
Статистическая обработка материала (141 признак) проводилась с использованием пакета программ Statistica 5.1 for Windows-95. Информативность показателей оценивалась по проценту объясненной дисперсии (относительная общая величина различий параметра в группах сравнения), которая отражает информативность показателя в выявлении различий групп. Решающие правила прогнозирования осложнений и исхода ИМ (математические модели) были разработаны при помощи регрессионного и дискриминантного анализа.
Линейные регрессионные уравнения решались путем подстановки числовых значений признаков, вошедших в уравнение, которые умножались на разработанные для каждого из них коэффициенты. Затем все полученные результаты и constanta складывались. При решении регрессионных уравнений может быть получено число от 1 до 10 (десятибалльная шкала). В зависимости от полученного результата больной относился к той или иной группе прогнозируемых состояний.
Линейные дискриминантные уравнения представлялись в виде таблицы, где одна колонка - вошедшие в это правило признаки, две другие - коэффициенты (весовая оценка признака), рассчитанные для двух состояний (есть осложнение или нет осложнения). Уравнения решались подстановкой числовых значений признаков, вошедших в решающее правило прогнозирования, и умножением их на коэффициенты, представленные в этой таблице. Затем все полученные результаты и constanta складывались отдельно в каждой колонке. Таким образом получались решения двух дискриминантных уравнений, где одно прогнозирует развитие осложнения, а второе - его отсутствие. При этом наибольшее числовое значение соответствовало прогнозируемому состоянию (будет осложнение или нет).
При анализе клинической картины крупноочагового ИМ у пациентов, получивших ТЛТ, выявлено, что у части больных за период стационарного лечения не отмечено развития осложнений (результаты оценивались при выписке пациентов из стационара). Для выявления особенностей, присущих этому наиболее благоприятному варианту течения заболевания, мы распределили больных на две группы: 1 группа - 67 (31,2%) чел. с неосложненным ИМ, 2 группа - 148 (68,8%) чел. с осложненным течением заболевания.
При оценке эффективности ТЛТ отмечено, что у больных с неосложненным ИМ признаки реперфузии миокарда регистрировались достоверно чаще - в 82,1% случаев, в то время как во 2 группе - в 55,9% (р<0,001).
У 47,8% больных с неосложненным течением ИМ диагностировано трансмуральное поражение сердечной мышцы, в то время как в группе пациентов с осложненным ИМ - у 68,9% чел. (р<0,01). У больных с неосложненным течением ИМ отмечалась достоверно меньшая средняя элевация сегмента ST перед ТЛТ, сразу после ТЛТ и через 24 часа от начала ИМ: 6,0±0,5 мм, 3,3±0,6 мм и 1,7±0,5 мм по сравнению с 6,7±0,1 мм, 4,3±0,2 мм и 2,9±0,1 мм, соответственно, во 2 группе (р<0,05).
У пациентов с неосложненным ИМ в первые сутки заболевания ОФВ была достоверно больше - 42,7±1,2%, в то время как у пациентов 2 группы - 38,5±0,6% (р<0,01). При выписке у пациентов с неосложненным ИМ отмечался прирост ОФВ до 46,1±1,5%, в то время как у больных 2 группы увеличение ОФВ было менее 1% - до 39,4±0,9% (р<0,001).
Предикторами развития неосложненного ИМ являлись: реперфузия (r=0,46, р<0,001), возраст менее 58 лет (r=0,41, р<0,001), отсутствие ПрС (ПрС - это нестабильная стенокардия, появившаяся не ранее чем за месяц до развития ИМ) (r= 0,40, р<0,03), ЧСС перед ТЛТ менее 78 в минуту (r=0,40, р<0,001), значение ОФВ в первые сутки ИМ более 41% (r=0,40, р<0,001), средняя элевация сегмента ST перед ТЛТ менее 6,0 мм (r=0,40, р<0,001) и после ТЛТ менее 4,0 мм (r= 0,40, р<0,001), величина интервала QT перед ТЛТ менее 38 мс (r=0,39, р<0,001).
Разработанный комплекс предикторов неосложненного течения ИМ верифицирован на контрольной группе. В том случае, когда у больного определялись все восемь вышеперечисленных признаков, то вероятность неосложненного ИМ составляла 95% и этот пациент включался в группу низкого риска развития осложнений.
Таким образом, на основании результатов исследования выявлены признаки первых суток ИМ, служившие предикторами неосложненного течения заболевания у больных, получивших ТЛТ. Алгоритм диагностической тактики представлен на фиг.1. Раннее выявление пациентов с низким риском развития осложнений ИМ позволяет сократить проведение им дополнительных исследований, больные могут быть быстрее переведены из блока интенсивной терапии и раньше выписаны из стационара без ухудшения результатов лечения, что ведет к существенной экономии материальных средств.
Использование алгоритма диагностической тактики для выявления больных с неосложненным ИМ (фиг.1) одновременно позволяет выделить пациентов с вероятным (но не обязательным) развитием осложнений - это больные, у которых oтсутствует хотя бы один из вышеперечисленных признаков, прогнозирующих неосложненное течение ИМ. У таких пациентов необходимо оценить вероятность развития осложнений и риск летального исхода в остром периоде заболевания. Осложненное течение ИМ после применения ТЛТ наблюдалось у 68,8% больных.
Наиболее частым осложнением в остром периоде заболевания были нарушения сердечного ритма и проводимости: разнообразные желудочковые аритмии. Вторым по частоте осложнением ИМ была ОСН, возникшая, в общей сложности, у 87 (40,6%) пациентов (ОСН 2 класса по Киллипу была у 73 (34,0%) чел., отек легких развился у 10 (4,7%) чел., а кардиогенный шок - у 4 (1,9%) чел.).
Третье место по частоте развития среди осложнений ИМ заняли РРКК, которые отмечались у 63 (29,3%) чел. Причем приступы ПС осложнили течение заболевания у 49 (22,8%) чел., рецидив ИМ - у 14 (6,5%) чел. (из них у 78,6% перед этим была ПС, у 21,4% пациентов сразу развился рецидив ИМ).
ОАС диагностирована у 41 (19,1%) больного, внешний разрыв миокарда - у 7 (3,3%) чел., тромбоэмболические осложнения отмечены у 2 (0,9%) чел.
Внутригоспитальная летальность составила 9-8%. Из 21 умершего в остром периоде заболевания пациента причиной смерти у 12 (57,1%) больных послужила ОСН, у 7 (33,3%) пациентов - разрыв сердечной мышцы, у 2 (9,6%) больных - рецидив ИМ. Для решения поставленной задачи мы распределили больных на три группы: 1 группа - 152 (70,7%) чел. (без РРКК), 2 группа - 49 (22,8%) чел. (течение ИМ осложнилось развитием ПС), 3 группа - 14 (6,5%) чел. (развился рецидив ИМ).
Анализ эффективности ТЛТ показал, что частота реперфузии миокарда статистически не различалась в группах сравнения. При проведении непараметрического корреляционного анализа клинических показателей с развитием РРКК выявлена прямая достоверная связь с: ПрС (r=0,74, р<0,001), уровнем балльной оценки болевого синдрома перед ТЛТ (r=0,58, р<0,001), нетрансмуральным некрозом миокарда (r=0,40, р<0,03), сахарным диабетом (r=0,36, р<0,03), гипертонической болезнью (r=0,33, р<0,05). Гипертоническая болезнь достоверно чаще отмечалась у пациентов с рецидивом ИМ - у 85,7% больных, в то время как у пациентов с ПС - у 66,7% чел., а у больных без РРКК - у 52,2% чел. (р<0,05). Сахарный диабет был у 42,9% пациентов в 3 группе, по сравнению с 9,5% и 7,5% человек во 2 и 1 группах, соответственно (р<0,03). Приступы ПрС выявлены у 78,6% больных во 2 и 3 группах сравнения, тогда как в 1 группе - у 18,2% пациентов (р<0,01). Доля объясненной дисперсии у ПрС, как клинического признака, связанного с развитием РРКК, составила 30,0%. У больных с ПС балльная оценка болевого синдрома составила, в среднем, 2,52±0,3 балла, у пациентов с рецидивом ИМ - 2,57±0,3 балла, тогда как у больных без РРКК - 1,83±0,1 балла (р<0,01). Доля объясненной дисперсии у балльной оценки болевого синдрома, как клинического признака, связанного с развитием РРКК - 11,8%. Развитие приступов ПС чаще наблюдалось у больных с нетрансмуральным ИМ - в 32,8% случаев, тогда как у пациентов с трансмуральным ИМ - в 14,7% (р<0,03).
В 1-е сутки ИМ общая фракция выброса (ОФВ), определяемая при ЭхоКГ, была меньше у больных 3 группы - 38,9+2,7%, по сравнению с 41,7+1,3% и 42,8±0,7% в 1 и 2 группах. Активность ACT через 12 часов после ТЛТ во 2 группе составила 211,2±16,3 МЕ/л, по сравнению со 152,4±15,5 МЕ/л в 1 группе (р<0,05) и 133,9±19,0 ME/л в 3 группе (р<0,01).
В качестве исходных переменных для регрессионного анализа были заданы все показатели клинико-инструментального обследования. В результате выделено 7 независимых признаков и разработано решающее правило прогнозирования РРКК:
Y=1,424хХ1-0,017хХ2+0,829хХ3+0,03хХ4-0,646хХ5+0,058хХ6+0,683хХ7 -0,875,
где Y - прогнозируемая тяжесть осложнения в баллах, X1 - наличие ПрС*, Х2 - ЧСС перед ТЛТ, Х3 - глубина ИМ**, Х4 - активность ACT через 12 часов после ТЛТ, Х5 - локализация ИМ***, Х6 - ОФВ в первые сутки ИМ, Х7 - балльная оценка болевого синдрома перед ТЛТ****. *есть - 1, нет - 0, **трансмуральный ИМ - 1, нетрансмуральный ИМ - 2, *** передний ИМ - 1, задний ИМ - 2, **** рецидивирующий характер болей (нет - 0, да - 1) + продолжительность ангинозного приступа (до 2 часов - 0, более 2 часов - 1) + купирование болей после введения наркотических анальгетиков (полное - 0, остаточные боли - 1).
Для каждого пациента из основной группы рассчитаны значения регрессионного уравнения, что позволило разработать десятибалльную шкалу тяжести, прогнозирующую развитие РРКК с 80% вероятности. В 1 группе средний балл составил 3,9±1,5 балла, во 2 группе - 6,3±0,5 баллов, в 3 группе - 9,4±0,4 балла. Процент объясненной дисперсии разработанного параметра (прогнозируемой тяжести РРКК) был 54,5%, что в 2 раза превышает информативность всех отдельных признаков. Построенная математическая модель верифицирована на контрольной группе. Результаты оценки диагностических свойств модели показали, что уровень ее информативности составил 78% совпадающих прогнозов.
Состояние коронарного русла изучено у 53 чел., из которых у 36 больных отмечались приступы РРКК, у 17 пациентов - они отсутствовали. Отмечено, что у больных с РРКК резидуальный стеноз инфарктсвязанной КА отмечался достоверно чаще - у 33 из 36 (91,7%) чел., в то время как при отсутствии РРКК лишь у 9 из 17 (52,9%) чел. (р<0,01). Частота поражения других КА достоверно не различалась в группах сравнения. У больных с РРКК количество измененных стенозирующим процессом КА было достоверно больше - 2,78±0,22, по сравнению с 1,53±0,37 у пациентов без РРКК (р<0,05). При анализе влияния препаратов на частоту развития РРКК выявлено, что достоверного снижения частоты развития осложнений у больных, получавших капотен, не отмечено. У больных, принимавших пропранолол, достоверно реже развивались приступы ПС - у 7,5% чел., по сравнению с 45,9% чел. у пациентов, которым препарат не назначался (р<0,05).
У больных с РРКК применялись современные методы лечения, включающие хирургическую реваскуляризацию миокарда у 19 (8,8%) чел. в остром периоде ИМ. АКШ на стационарном этапе лечения ИМ было выполнено у 17 (7,9%) больных. Причем, у пациентов с РРКК операция выполнялась достоверно чаще - у 16 (28,6%) чел. , по сравнению с 1 (0,6%) чел. в группе больных без РРКК (р<0,01). AKШ проводилось, в среднем, на 27,5±3,5 сутки ИМ. На стационарном этапе лечения из 17 пациентов, которым было проведено хирургическое лечение, не умер ни один. Чрескожная транслюминальная коронарная ангиопластика проведена у 2 (0,9%) больных, из них у одного пациента в первые сутки ИМ по поводу кардиогенного шока, у второго - на 5-е сутки ИМ по поводу ПС. За трехлетний период проспективного наблюдения выявлено, что после выписки из стационара АКШ было выполнено у 8,0% всех опрошенных больных. У пациентов, у которых на госпитальном этапе лечения ИМ отмечались РРКК, в течение трехлетнего периода наблюдения АКШ проводилось достоверно чаще - у 22,2% чел., в то время как у больных без РРКК в остром периоде заболевания - у 4,6% чел. (р<0,05).
Таким образом, частота РРКК у пациентов, получавших ТЛТ, достигает почти 30%. Резидуальный стеноз инфарктсвязанной КА отмечается более чем у 90% больных с РРКК, что является основным механизмом развития ПС и рецидива ИМ после применения ТЛТ. Разработанная математическая модель, в которую вошли признаки первых суток ИМ, позволяет выделять больных с высоким риском возникновения РРКК. Рекомендуемый алгоритм диагностической тактики у больных ИМ при оценке вероятности развития РРКК представлен на фиг.2. У пациентов с прогнозируемой тяжестью РРКК больше или равно 5,8 баллов необходимо выполнять КАГ в остром периоде ИМ для оценки состояния коронарного русла и определения показаний к оперативному вмешательству.
Для определения клинических особенностей течения инфаркта миокарда, осложненного острой аневризмой, распределили больных на две группы: 1 группа - 41 (19,1%) чел. (больные с ОАС), 2 группа - 174 (80,9%) чел. (пациенты, у которых ОАС не было).
При изучении эффективности ТЛТ в группах сравнения выявлено, что в группе больных с ОАС реперфузия отмечалась достоверно реже - у 39,4% пациентов, по сравнению с 70,2% у пациентов без ОАС (р<0,001).
При проведении непараметрического корреляционного анализа клинических показателей с развитием ОАС выявлена достоверная связь с: реперфузией (r=-0,51, р<0,001), средней элевацией сегмента ST через 24 часа от начала заболевания (r=0,39, р<0,001), стенозом ПМЖВ (r=0,38, р<0,05), выявлением при ЭхоКГ в области инфаркта зон акинезии (r=0,35, р<0,01), ОФВ в первые сутки ИМ (r=-0,30, р<0,001), передним ИМ (r=0,28, р<0,001).
Средний возраст больных с ОАС был больше - 66,5±1,3 лет, по сравнению с 62,2±0,8 лет в 1 группе (р<0,02). У пациентов с ОАС отмечалась более выраженная средняя элевация сегмента ST перед ТЛТ, сразу после тромболизиса, через 24 часа от начала ИМ - 7,6±0,4 мм, 5,1±0,3 мм и 4,2±0,3 мм, по сравнению с 6,3±0,2 мм, 3,7±0,1 мм и 2,1±0,1 мм, соответственно, в 1 группе (р<0,001). Чаще ОАС формировалась у больных с передним ИM - у 26,8% чел., тогда как при заднем ИМ - у 10,8% (р<0,001).
У больных с ОСН, получавших капотен, частота развития ОАС была достоверно меньше - 9,8%, в то время как у пациентов, которым ингибиторы АПФ не назначались - 59,5% (р<0,05). Достоверного уменьшения частоты развития ОАС у пациентов, получавших пропранолол, не отмечено.
Для прогнозирования исхода ИМ уже в первые сутки его развития пациентов распределяют на группы с благоприятным и неблагоприятным течением заболевания для определения больных, которым необходимо проведение дополнительных диагностических и лечебных процедур. Для этого распределили больных на две группы - 1 группа (194 чел.) - выжившие в остром периоде, 2 группа (21 чел.) - умершие в остром периоде ИМ.
При изучении эффективности ТЛТ в группах сравнения, выявлено, что в группе умерших больных достоверно реже отмечалась реперфузия миокарда - у 33% пациентов, по сравнению с 65% в 1 группе (р<0,004).
При проведении непараметрического корреляционного анализа отмечено, что с развитием летального исхода в остром периоде ИМ наиболее тесно коррелируют трансмуральное поражение миокарда (r=0,68, р<0,001), артериальная гипотония перед ТЛТ (r= 0,62, р<0,001), развитие полной АВ-блокады в первые сутки ИМ (r= 0,41, р<0,001), величина ОФВ в первые сутки заболевания (г=-0,38, р<0,001), развитие в первые сутки ИМ внутрижелудочковых блокад (r=0,36, р<0,002).
Артериальная гипотония перед ТЛТ была у 48% пациентов 2 группы, в то время как в 1 группе - только у 11% (р<0,001). У больных 1 группы достоверно реже отмечались клинические признаки недостаточности кровообращения до ИМ - у 82 (42,3%) человек по сравнению с 19 (90,5%) во 2 группе (р<0,048). Ишемический инсульт до ИМ перенесли 5 (23,8%) пациентов 2 группы, в то время как в 1 - 3 (1,5%) чел. (r=0,30, р<0,001). Достоверно чаще у больных 2 группы диагностировался передний ИМ - у 80,0% чел., в то время как в 1 группе у 50% чел. (р<0,05). У больных 2 группы средний балл ОСН по Киллипу составил 2,2±0,4, по сравнению с 1,4±0,2 в 1 группе (р<0,01). В первые сутки ИМ одышка была у 42,9% чел. во 2 группе, тогда как в 1 группе - у 17,0% (r=0,28, р<0,03). Во 2 группе фибрилляция желудочков отмечалась у 52% больных, в то время как в 1 группе - у 5% чел. (р<0,001).
У больных 2 группы отмечалась более выраженная средняя элевация сегмента ST после ТЛТ - 6,0±0,5 мм, по сравнению с 3,8±0,1 мм в 1 группе (r=0,34, р<0,001). У пациентов 2 группы в 1-е сутки ИМ ОФВ была 34,0±1,4%, в то время как в 1 группе - 40,2±0,4% (р<0,001).
Разработанная математическая модель верифицирована на контрольной группе. Результаты оценки диагностических свойств модели показали, что уровень ее информативности колеблется от 75 до 92% совпадающих прогнозов.
Для выявления признаков острого периода ИМ, которые могут влиять на летальный исход в отдаленном периоде заболевания, мы провели проспективное исследование. Из стационара выписано 194 пациента из 215 чел. По разработанному протоколу опрошено 187 пациентов или их родственников. Срок наблюдения после выписки составил от 2 до 6 лет, в среднем 3,2±0,9 года.
За период наблюдения повторный ИМ развился у 31 (16,6%) чел. Умерло после выписки из стационара - 14 (7,5%) больных, из них 65% - от повторного ИМ, 20% - от злокачественных опухолей, у 15% - причина смерти не известна.
Больные были распределены на две группы: 1 группа (173 чел.) - выжившие пациенты, 2 группа (14 чел.) - умершие больные.
При анализе эффективности ТЛТ отмечено, что частота реперфузии миокарда статистически не различалась в группах сравнения.
При проведении непараметрического корреляционного анализа обнаружено, что с летальным исходом в отдаленном периоде ИМ наиболее тесно коррелируют: отек легких (r=0,41, р<0,001) и желудочковые тахиаритмии (r=0,39, р<0,002), наблюдавшиеся в остром периоде заболевания, повторный ИМ (r=0,38, р<0,002) и возраст (r=0,38, р<0,001).
При анализе групп сравнения выявлено, что во 2 группе достоверно был выше средний возраст пациентов - 71,1±4,2 лет, но сравнению с 61,4±2,1 лет в 1 группе (р<0,05). У пациентов 2 группы при поступлении в стационар при ЭхоКГ определялась более низкая ОФВ, которая составила 37,1±2,1%, по сравнению с 40,8±0,7% в 1 группе (р<0,024). В период стационарного лечения у пациентов 2 группы осложненное течение ИМ отмечалось у 93% чел., в то время как среди больных 1 группы - у 60% чел. (р<0,015). У пациентов 2 группы был выше средний балл ОСН по Киллипу - 1,86±0,3, по сравнению с 1,35±0,1 в 1 группе (р<0,001). Желудочковая тахикардия отмечалась у 50% больных 2 группы и только у 8% чел. - в 1 (р<0,002). Во 2 группе β-блокаторы получали 14% чел., в 1 - 50% чел. (р<0,01), сердечные гликозиды - 14% пациентов во 2 группе и 3% больных - в 1 группе (р<0,04). Мы провели пошаговый дискриминантный анализ всех изученных признаков и разработали решающее правило прогнозирования летального исхода в отдаленном периоде ИМ по признакам, определяемым во время стационарного лечения болезни (табл.2). Из табл.3 видно, что развитие отека легких в остром периоде ИМ в наибольшей степени повышает вероятность летального исхода заболевания в отдаленном периоде. Имеют значение особенности проводимой терапии на стационарном этапе лечения: если пациент получал в стационаре β-блокаторы - это благоприятный признак, но если больному назначались сердечные гликозиды (из-за развития тяжелой застойной сердечной недостаточности) - риск летального исхода в отдаленном периоде возрастает. При решении полученных дискриминантных уравнений при большем значении первого уравнения с вероятностью 94,7% отдаленный прогноз будет благоприятным, а при большем значении второго уравнения с вероятностью 78,6% наступит летальный исход в отдаленном периоде заболевания (в течение трех лет после ИМ). Общий процент корректности модели 93,4%. Полученная модель верифицирована на контрольной группе. Результаты оценки диагностических свойств модели показали, что уровень ее информативности колеблется от 78 до 95% совпадающих прогнозов.
Итак, выявлены "скрытые" взаимосвязанные комплексы признаков, позволяющие прогнозировать течение крупноочагового инфаркта миокарда после проведения тромболитической терапии в первые сутки заболевания. Предложены оригинальные математические модели, позволяющие определить риск развития осложнений крупноочагового инфаркта миокарда после применения тромболитической терапии.
Разработана клинико-диагностическая система, включающая: анализ комплекса симптомов, выделение устойчивых взаимосвязанных признаков, оценку полученной информации, определение тяжести осложнений, с последующим выбором тактики лечения. Выявлены прогностические признаки острого периода инфаркта миокарда после применения тромболитической терапии, определяющие отдаленный прогноз заболевания. Разработанная математическая модель позволяет в первые сутки ИМ выделять больных с высоким риском летального исхода в остром периоде заболевания, у которых необходимо увеличить сроки нахождения в блоке интенсивной терапии, расширить объем обследования и проводить усиленное динамическое наблюдение за основными показателями гемодинамики. На основании результатов исследования разработана математическая модель, прогнозирующая летальный исход в отдаленном периоде ИМ на основании признаков острого периода заболевания. Наиболее неблагоприятными факторами, увеличивающими риск летального исхода в отдаленном периоде, является развитие во время лечения в стационаре отека легких и желудочковых тахиаритмий. Предложенное прогностическое правило позволяет уже при выписке больных из стационара определять группу пациентов, которым необходимо более тщательное амбулаторное наблюдение, обследование и лечение. Уточнены данные о влиянии капотена и пропранолола на течение крупноочагового инфаркта миокарда, осложненного острой сердечной недостаточностью, после применения тромболитической терапии.
Таким образом, использование в клинической практике результатов проведенного исследования позволяет в первые сутки инфаркта миокарда выделить больных с неосложненным течением заболевания, прогнозировать развитие осложнений и исход инфаркта миокарда в остром периоде, осуществлять дифференцированный подход к проведению диагностических мероприятий и проводить превентивное лечение, направленное на снижение частоты развития осложнений инфаркта миокарда и внутригоспитальной летальности после применения тромболитической терапии. Результаты научной работы внедрены в практическую деятельность кардиологического центра Главного военного клинического госпиталя им. акад. Н. Н. Бурденко, 7-го Центрального военного клинического авиационного госпиталя, 2-го Центрального военного клинического госпиталя, в учебном процессе на кафедрах терапии и кардиологии Государственного института усовершенствования врачей МО РФ.
Источники информации
1. А. Л. Господаренко, В. М. Клюжев, А.М. Литвинов, В.А. Чернецов. - Способ лечения крупноочагового инфаркта миокарда //Приоритетная справка на выдачу патента на изобретение / гос. регистрации 98119265 от 10.10.1998, М., ФИПС, Роспатент.
2. В. А. Чернецов, А.М. Литвинов, А.А. Мещеряков и др. - Способ реабилитации больных инфарктом миокарда //Приоритетная справка на выдачу патента на изобретение / гос. регистрации 2000101789 от 21.01.2000, М., ФИПС, Роспатент.
3. И. М. Гельфанд. М.Л. Извеков, Е.И. Каспаров, А.Л. Сыркин. - Структурные единицы в задаче прогноза исхода трансмурального инфаркта миокарда // Информатика и медицина. - М.: Наука. - 1997. -208 с. (прототип).
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ЛЕЧЕНИЯ ЖЕЛУДОЧКОВОЙ ЭКСТРАСИСТОЛИИ ПРИ ИНФАРКТЕ МИОКАРДА | 2000 |
|
RU2197241C2 |
| СПОСОБ ЛЕЧЕНИЯ БОЛЬНОГО КРУПНООЧАГОВЫМ ИНФАРКТОМ МИОКАРДА | 1998 |
|
RU2197230C2 |
| СПОСОБ ЛЕЧЕНИЯ СТЕНОКАРДИИ | 1996 |
|
RU2155086C2 |
| СПОСОБ ПРОСТАТЭКТОМИИ | 1997 |
|
RU2171634C2 |
| СПОСОБ ДИАГНОСТИКИ ТРАВМ ПОЧЕК | 1999 |
|
RU2170055C2 |
| СПОСОБ КОНСЕРВАТИВНОГО ЛЕЧЕНИЯ ДОБРОКАЧЕСТВЕННОЙ ГИПЕРПЛАЗИИ ПРЕДСТАТЕЛЬНОЙ ЖЕЛЕЗЫ | 1997 |
|
RU2158619C2 |
| СПОСОБ АДЕНОМЭКТОМИИ ПРЕДСТАТЕЛЬНОЙ ЖЕЛЕЗЫ | 1997 |
|
RU2177263C2 |
| СПОСОБ СЕРТИФИКАЦИИ ГЕМОРЕОЛОГИЧЕСКИХ НАРУШЕНИЙ ПРИ ХИРУРГИЧЕСКОМ ЛЕЧЕНИИ ИШЕМИЧЕСКОЙ БОЛЕЗНИ СЕРДЦА | 1997 |
|
RU2155348C2 |
| СПОСОБ ЛЕЧЕНИЯ МОЧЕВЫХ СВИЩЕЙ | 1997 |
|
RU2162001C2 |
| СПОСОБ ЛЕЧЕНИЯ БОЛЬНЫХ НЕФРОЛИТИАЗОМ | 1998 |
|
RU2177354C2 |
Изобретение относится к медицине, кардиологии. В первые сутки инфаркта миокарда после применения тромболитической терапии выделяют признаки-предикторы неосложненного течения заболевания. Определяют диагностическую и лечебную тактику. Начиная со вторых суток, выявляют взаимосвязанные комплексы симптомов, количественные значения показателей, параметров индивидуально для каждого пациента. С их помощью оценивают риск летального исхода и вероятность развития в остром периоде нарушений сердечного ритма и проводимости, острой сердечной недостаточности, рецидивирующих расстройств коронарного кровообращения. Определяют желудочковые тахоаритмии и острую аневризму сердца. Прогнозируют летательный исход в остром и отдаленном периодах инфаркта с помощью клинических, инструментальных, лабораторных данных и использования медицинских компьютерных технологий, статистических вычислительных программ, дискриминантного и регрессионного анализа. Способ позволяет прогнозировать развитие осложнений инфаркта миокарда и его исхода по признакам первых суток болезни за счет комплексной оценки клинических, лабораторных, инструментальных данных и использования компьютерных технологий. 2 ил., 3 табл.
Способ прогнозирования осложнений больного инфарктом миокарда, включающий оценку сердечной недостаточности и характера ангинозных болей, отличающийся тем, что в первые сутки инфаркта в первую группу низкого развития осложнений включают больных с возрастом менее 58 лет, отсутствием предынфарктной, за месяц до инфаркта, нестабильной стенокардии, с частотой сердечных сокращений перед тромболитической терапией менее или равной 78 уд/мин, средней элевацией сегмента SТ перед тромболитической терапией (ТЛТ) менее или равной 6 мм и после ТЛТ менее или равной 4 мм, величиной интервала зубцов QT электрокардиограммы перед ТЛТ менее или равной 38 мс, наличием реперфузии миокарда, значением общей фракции выброса в первые сутки инфаркта более или равной 41%, а всех остальных больных - во вторую группу с осложненным инфарктом, у всех больных определяют прогностическую тяжесть рецидивирующих расстройств коронарного кровообращения (РРКК) Y по десятибалльной шкале по 7 независимым признакам по уравнению
Y= 1,424•X1-0,017•X2+0,829•X3+0,03•X4-0,64•X5+0,058•X6+0,683•X7-0,875, где Y - прогностическая тяжесть осложнений в баллах;
Х1 - наличие приступов предынфарктной нестабильной стенокардии*;
Х2 - частота сердечных сокращений перед ТЛТ;
Х3 - глубина инфаркта миокарда**;
Х4 - активность АСТ через 12 ч после ТЛТ;
Х5 - локализация инфаркта миокарда***;
Х6 - общая фракция выброса в первые сутки инфаркта миокарда;
Х7 - балльная оценка болевого синдрома перед ТЛТ****,
для решения уравнений регрессии значение каждой из этих характеристик, определяют как *: есть - 1 балл, нет - 0, **трансмуральный инфаркт миокарда - 1, нетрансмуральный инфаркт - 2, ***передний инфаркт - 1, задний инфаркт - 2, ****рецидивирующий характер болей (нет - 0, есть - 1) + продолжительность ангинозного приступа (до 2 ч - 0, более 2 ч - 1) + купирование болей после введения наркотических анальгетиков (полное - 0, остаточные боли - 1), при этом если тяжесть РРКК меньше 5,8 балла, то проводят стресс ЭхоКГ или сцинтиграфию, затем оценивают признаки жизнеспособности миокарда и при их наличии назначают коронарографию, проводят пошаговый дискриминантный анализ всех исследуемых признаков, оценивают риск летального исхода в остром периоде заболевания у пациентов с вероятным, но не обязательным развитием осложнений, у которых отсутствует хотя бы один из признаков, прогнозирующих неосложненное течение инфаркта миокарда, причем прогноз осуществляют по сравнению значений результатов уравнений регрессии для групп выживших и умерших, при этом анализируются следующие характеристики для каждого пациента: артериальная гипотония перед ТЛТ* (1), инсульт в анамнезе* (2), одышка в 1-е сутки инфаркта миокарда (ОД) (3), развитие полной атриовентрикулярной блокады в 1-е сутки ИМ* (4), развитие внутрижелудочковой блокады в 1-е сутки ИМ* (5), абсолютное значение средней элевации сегмента ST после ТЛТ (6), для решения уравнений регрессии значение каждой из этих характеристик, определяют как *: есть - 1 балл, нет - 0, а для ОД при частоте дыхания до 20 в мин - 1 балл, при частоте дыхания от 21 до 26 в мин - 2 балла, более 26 в мин - 3 балла, умножают это значение на коэффициенты для групп выживших и умерших, соответственно на 1,2 и 5,1 для (1), на 5,1 и 15,6 для (2), на 11,3 и 18,8 для (3), на 1,0 и 4,2 для (4), на 3,9 и 7,0 для (5), на 1,2 и 1,9 для (6) с учетом постоянного члена регрессионного уравнения, равного минус 11,518 для 1-й группы (выжившие) и минус 32,114 - для второй (умершие), и если для данного больного результат уравнения регрессии для группы выживших больше, чем для группы умерших, то прогнозируют выживание, а в случае превышения этого значения в группе умерших над группой выживших прогнозируют летальный исход в остром периоде инфаркта миокарда, прогноз летального исхода в отдаленном периоде осуществляют в острый период заболевания путем сравнения значений результатов уравнений регрессии для групп выживших и умерших, при этом анализируют следующие характеристики для каждого пациента: отсек легких (7), повторный ИМ (8), фибрилляция желудочков (9), прием бета-блокаторов (10), возраст менее или равный 61,4+2,1 (11), назначение сердечных гликозидов вследствие развития тяжелой застойной сердечной недостаточности (12), каждую из этих характеристик оценивают в 1 балл при их наличии и в 0 баллов при их отсутствии, если возраст больше 61,4+2,1, то характеристику (11) не учитывают, умножают полученное значение на коэффициенты для групп выживших и умерших, соответственно на 8,2 и 20,8 для (7), на минус 4,6 и плюс 2,5 для (8), на минус 5,7 и плюс 2,6 для (9), на 4,3 и 1,9 для (10), на 0,6 и 0,8 для (11), на минус 6,1 и на минус 1,5 для (12) с учетом постоянного члена регрессионного уравнения, равного минус 46,123 для 1-й группы и минус 61,731 - для второй, и если для данного больного результат уравнения регрессии для группы выживших больше, чем для группы умерших, то прогнозируют выживание, а в случае превышения этого значения в группе умерших над группой выживших, прогнозируют летальный исход в отдаленном периоде инфаркта миокарда, в течение 3 лет после первого инфаркта миокарда.
| ГЕЛЬФАНД И.М | |||
| и др | |||
| Структурные единицы в задаче прогноза исхода трансмурального инфаркта миокарда | |||
| Информатика и медицина | |||
| - М.: Наука, 1997, с.208 | |||
| СПОСОБ ПРОГНОЗИРОВАНИЯ ТЕЧЕНИЯ ПОСТИНФАРКТНОГО СОСТОЯНИЯ | 1993 |
|
RU2088933C1 |
| Эпидемиология и факторы риска ишемической болезни сердца/Под ред | |||
| А.Н | |||
| Климова | |||
| - Л.: Медицина, 1989, с | |||
| Нефтяной конвертер | 1922 |
|
SU64A1 |
| РУДА М.Я., ЗЫСКО А.П | |||
| Инфаркт миокарда | |||
| - М.: Медицина, 1977, с | |||
| Железобетонный фасонный камень для кладки стен | 1920 |
|
SU45A1 |
| СУМАРОКОВ А.В., МОИСЕЕВ В.С | |||
| Клиническая кардиология, М., 1995, с | |||
| Видоизменение пишущей машины для тюркско-арабского шрифта | 1923 |
|
SU25A1 |
| MOSER M | |||
| Heart rate variability as a prognostic tool in cardiology | |||
| Circulation | |||
| Способ и аппарат для получения гидразобензола или его гомологов | 1922 |
|
SU1998A1 |
| Пожарный двухцилиндровый насос | 0 |
|
SU90A1 |
| Чугунный экономайзер с вертикально-расположенными трубами с поперечными ребрами | 1911 |
|
SU1978A1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ СРОКА ЭКСТРАКЦИИ КАТАРАКТЫ НА ПАРНОМ ГЛАЗУ ПРИ ДВУХСТОРОННЕЙ КАТАРАКТЕ | 1997 |
|
RU2130186C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ ТЕЧЕНИЯ ИШЕМИЧЕСКОЙ БОЛЕЗНИ СЕРДЦА | 1998 |
|
RU2153284C2 |
Авторы
Даты
2003-01-27—Публикация
2000-10-09—Подача